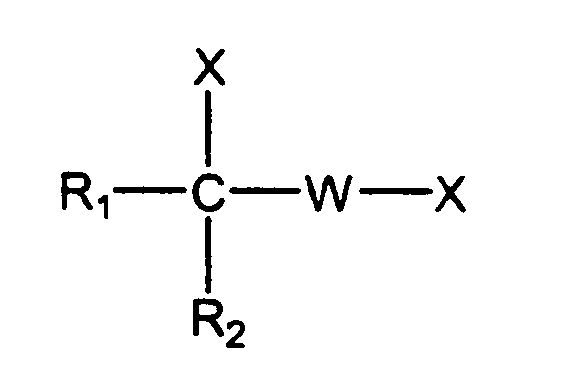RU2300373C2 - Карбаматы для предотвращения или лечения нейродегенеративных нарушений - Google Patents
Карбаматы для предотвращения или лечения нейродегенеративных нарушений Download PDFInfo
- Publication number
- RU2300373C2 RU2300373C2 RU2003128982/14A RU2003128982A RU2300373C2 RU 2300373 C2 RU2300373 C2 RU 2300373C2 RU 2003128982/14 A RU2003128982/14 A RU 2003128982/14A RU 2003128982 A RU2003128982 A RU 2003128982A RU 2300373 C2 RU2300373 C2 RU 2300373C2
- Authority
- RU
- Russia
- Prior art keywords
- formula
- group
- alkyl
- phenyl
- enantiomer
- Prior art date
Links
- 208000015122 neurodegenerative disease Diseases 0.000 title abstract description 37
- 238000011282 treatment Methods 0.000 title description 12
- 150000004657 carbamic acid derivatives Chemical class 0.000 title description 4
- 238000011321 prophylaxis Methods 0.000 title 1
- 150000001875 compounds Chemical class 0.000 claims abstract description 34
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims abstract description 25
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 19
- 206010008118 cerebral infarction Diseases 0.000 claims abstract description 12
- 229910052801 chlorine Inorganic materials 0.000 claims abstract description 10
- 239000000460 chlorine Substances 0.000 claims abstract description 10
- 201000006474 Brain Ischemia Diseases 0.000 claims abstract description 8
- 206010008120 Cerebral ischaemia Diseases 0.000 claims abstract description 8
- 125000005843 halogen group Chemical group 0.000 claims abstract description 8
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 claims abstract description 8
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 claims abstract description 7
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 claims abstract description 7
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 claims abstract description 7
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 claims abstract description 7
- 229910052794 bromium Inorganic materials 0.000 claims abstract description 7
- 125000004093 cyano group Chemical group *C#N 0.000 claims abstract description 7
- 229910052731 fluorine Inorganic materials 0.000 claims abstract description 7
- 239000011737 fluorine Substances 0.000 claims abstract description 7
- 206010028851 Necrosis Diseases 0.000 claims abstract description 5
- 238000004519 manufacturing process Methods 0.000 claims abstract description 5
- 230000017074 necrotic cell death Effects 0.000 claims abstract description 5
- 239000000203 mixture Substances 0.000 claims description 20
- 229910052739 hydrogen Inorganic materials 0.000 claims description 15
- 239000001257 hydrogen Substances 0.000 claims description 15
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 13
- 210000002569 neuron Anatomy 0.000 claims description 10
- 125000001424 substituent group Chemical group 0.000 claims description 9
- 229910052736 halogen Inorganic materials 0.000 claims description 7
- 150000002367 halogens Chemical class 0.000 claims description 7
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 7
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical compound II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 claims description 5
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 claims description 4
- 125000001309 chloro group Chemical group Cl* 0.000 claims description 4
- 208000028867 ischemia Diseases 0.000 abstract description 9
- 230000004770 neurodegeneration Effects 0.000 abstract description 8
- 239000003814 drug Substances 0.000 abstract description 5
- 230000000694 effects Effects 0.000 abstract description 3
- 239000000126 substance Substances 0.000 abstract description 3
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical group [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 abstract description 2
- 125000004435 hydrogen atom Chemical group [H]* 0.000 abstract description 2
- 208000024891 symptom Diseases 0.000 abstract description 2
- 125000004178 (C1-C4) alkyl group Chemical group 0.000 abstract 3
- 125000000229 (C1-C4)alkoxy group Chemical group 0.000 abstract 1
- 125000003277 amino group Chemical group 0.000 abstract 1
- 230000007721 medicinal effect Effects 0.000 abstract 1
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 35
- 238000000034 method Methods 0.000 description 33
- 201000010099 disease Diseases 0.000 description 28
- 210000004027 cell Anatomy 0.000 description 21
- 230000006378 damage Effects 0.000 description 21
- 230000001154 acute effect Effects 0.000 description 13
- 230000001684 chronic effect Effects 0.000 description 13
- -1 alkyl carbamate Chemical compound 0.000 description 12
- 210000002966 serum Anatomy 0.000 description 11
- 125000004432 carbon atom Chemical group C* 0.000 description 10
- 208000014674 injury Diseases 0.000 description 9
- 206010012289 Dementia Diseases 0.000 description 8
- 201000001119 neuropathy Diseases 0.000 description 8
- 230000007823 neuropathy Effects 0.000 description 8
- 208000027418 Wounds and injury Diseases 0.000 description 7
- 208000035475 disorder Diseases 0.000 description 7
- 239000003937 drug carrier Substances 0.000 description 7
- 206010021143 Hypoxia Diseases 0.000 description 6
- 241001465754 Metazoa Species 0.000 description 6
- 238000004458 analytical method Methods 0.000 description 6
- 208000029028 brain injury Diseases 0.000 description 6
- 230000030833 cell death Effects 0.000 description 6
- 208000026106 cerebrovascular disease Diseases 0.000 description 6
- 230000002124 endocrine Effects 0.000 description 6
- 230000002265 prevention Effects 0.000 description 6
- 230000004083 survival effect Effects 0.000 description 6
- 239000003826 tablet Substances 0.000 description 6
- 241000700159 Rattus Species 0.000 description 5
- 125000000217 alkyl group Chemical group 0.000 description 5
- 210000004556 brain Anatomy 0.000 description 5
- 230000034994 death Effects 0.000 description 5
- 230000006870 function Effects 0.000 description 5
- 239000002609 medium Substances 0.000 description 5
- 208000018737 Parkinson disease Diseases 0.000 description 4
- 201000004810 Vascular dementia Diseases 0.000 description 4
- 230000009692 acute damage Effects 0.000 description 4
- 230000002567 autonomic effect Effects 0.000 description 4
- 239000000969 carrier Substances 0.000 description 4
- 230000006835 compression Effects 0.000 description 4
- 238000007906 compression Methods 0.000 description 4
- 230000007850 degeneration Effects 0.000 description 4
- 208000015181 infectious disease Diseases 0.000 description 4
- 239000007788 liquid Substances 0.000 description 4
- 230000003961 neuronal insult Effects 0.000 description 4
- 230000000750 progressive effect Effects 0.000 description 4
- 201000002212 progressive supranuclear palsy Diseases 0.000 description 4
- 230000001953 sensory effect Effects 0.000 description 4
- 230000001148 spastic effect Effects 0.000 description 4
- 208000011580 syndromic disease Diseases 0.000 description 4
- 208000024827 Alzheimer disease Diseases 0.000 description 3
- 208000000044 Amnesia Diseases 0.000 description 3
- 208000002569 Machado-Joseph Disease Diseases 0.000 description 3
- 208000026139 Memory disease Diseases 0.000 description 3
- 208000006011 Stroke Diseases 0.000 description 3
- 239000004480 active ingredient Substances 0.000 description 3
- VREFGVBLTWBCJP-UHFFFAOYSA-N alprazolam Chemical compound C12=CC(Cl)=CC=C2N2C(C)=NN=C2CN=C1C1=CC=CC=C1 VREFGVBLTWBCJP-UHFFFAOYSA-N 0.000 description 3
- 239000002775 capsule Substances 0.000 description 3
- BQYRVMAWJCIIKI-UHFFFAOYSA-N carbamic acid;1-phenylethane-1,2-diol Chemical class NC(O)=O.OCC(O)C1=CC=CC=C1 BQYRVMAWJCIIKI-UHFFFAOYSA-N 0.000 description 3
- 210000003169 central nervous system Anatomy 0.000 description 3
- 239000003795 chemical substances by application Substances 0.000 description 3
- 230000003412 degenerative effect Effects 0.000 description 3
- QLTXKCWMEZIHBJ-PJGJYSAQSA-N dizocilpine maleate Chemical compound OC(=O)\C=C/C(O)=O.C12=CC=CC=C2[C@]2(C)C3=CC=CC=C3C[C@H]1N2 QLTXKCWMEZIHBJ-PJGJYSAQSA-N 0.000 description 3
- 239000002552 dosage form Substances 0.000 description 3
- 239000000796 flavoring agent Substances 0.000 description 3
- 230000007574 infarction Effects 0.000 description 3
- 239000004615 ingredient Substances 0.000 description 3
- 238000007917 intracranial administration Methods 0.000 description 3
- 230000006984 memory degeneration Effects 0.000 description 3
- 208000023060 memory loss Diseases 0.000 description 3
- 208000005264 motor neuron disease Diseases 0.000 description 3
- 210000000653 nervous system Anatomy 0.000 description 3
- 230000016273 neuron death Effects 0.000 description 3
- 230000000144 pharmacologic effect Effects 0.000 description 3
- 239000000843 powder Substances 0.000 description 3
- 238000002360 preparation method Methods 0.000 description 3
- 150000003254 radicals Chemical class 0.000 description 3
- 230000010410 reperfusion Effects 0.000 description 3
- 239000007909 solid dosage form Substances 0.000 description 3
- 239000000725 suspension Substances 0.000 description 3
- 230000001225 therapeutic effect Effects 0.000 description 3
- 201000011452 Adrenoleukodystrophy Diseases 0.000 description 2
- 208000018126 Adrenomyeloneuropathy Diseases 0.000 description 2
- 208000019901 Anxiety disease Diseases 0.000 description 2
- 206010003591 Ataxia Diseases 0.000 description 2
- 206010003594 Ataxia telangiectasia Diseases 0.000 description 2
- 206010003694 Atrophy Diseases 0.000 description 2
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 2
- 206010006542 Bulbar palsy Diseases 0.000 description 2
- 206010068597 Bulbospinal muscular atrophy congenital Diseases 0.000 description 2
- 206010008111 Cerebral haemorrhage Diseases 0.000 description 2
- 206010058842 Cerebrovascular insufficiency Diseases 0.000 description 2
- 208000010693 Charcot-Marie-Tooth Disease Diseases 0.000 description 2
- 206010057645 Chronic Inflammatory Demyelinating Polyradiculoneuropathy Diseases 0.000 description 2
- 208000030939 Chronic inflammatory demyelinating polyneuropathy Diseases 0.000 description 2
- 208000033647 Classic progressive supranuclear palsy syndrome Diseases 0.000 description 2
- 208000011990 Corticobasal Degeneration Diseases 0.000 description 2
- 208000019736 Cranial nerve disease Diseases 0.000 description 2
- 208000020406 Creutzfeldt Jacob disease Diseases 0.000 description 2
- 208000003407 Creutzfeldt-Jakob Syndrome Diseases 0.000 description 2
- 208000010859 Creutzfeldt-Jakob disease Diseases 0.000 description 2
- 206010013654 Drug abuse Diseases 0.000 description 2
- 206010073681 Epidural haemorrhage Diseases 0.000 description 2
- 208000001730 Familial dysautonomia Diseases 0.000 description 2
- 208000024412 Friedreich ataxia Diseases 0.000 description 2
- 208000035895 Guillain-Barré syndrome Diseases 0.000 description 2
- 206010019196 Head injury Diseases 0.000 description 2
- 208000023105 Huntington disease Diseases 0.000 description 2
- 206010061218 Inflammation Diseases 0.000 description 2
- 208000027747 Kennedy disease Diseases 0.000 description 2
- 208000034693 Laceration Diseases 0.000 description 2
- 201000010743 Lambert-Eaton myasthenic syndrome Diseases 0.000 description 2
- 208000034800 Leukoencephalopathies Diseases 0.000 description 2
- 201000011442 Metachromatic leukodystrophy Diseases 0.000 description 2
- 206010049567 Miller Fisher syndrome Diseases 0.000 description 2
- 208000007101 Muscle Cramp Diseases 0.000 description 2
- 206010028289 Muscle atrophy Diseases 0.000 description 2
- 206010033799 Paralysis Diseases 0.000 description 2
- 206010036590 Premature baby Diseases 0.000 description 2
- 208000032319 Primary lateral sclerosis Diseases 0.000 description 2
- 208000024777 Prion disease Diseases 0.000 description 2
- 201000001638 Riley-Day syndrome Diseases 0.000 description 2
- 208000037065 Subacute sclerosing leukoencephalitis Diseases 0.000 description 2
- 206010042297 Subacute sclerosing panencephalitis Diseases 0.000 description 2
- 208000032851 Subarachnoid Hemorrhage Diseases 0.000 description 2
- 208000002667 Subdural Hematoma Diseases 0.000 description 2
- 206010042364 Subdural haemorrhage Diseases 0.000 description 2
- 206010046298 Upper motor neurone lesion Diseases 0.000 description 2
- 206010063661 Vascular encephalopathy Diseases 0.000 description 2
- 208000006269 X-Linked Bulbo-Spinal Atrophy Diseases 0.000 description 2
- 239000013543 active substance Substances 0.000 description 2
- 239000000654 additive Substances 0.000 description 2
- 208000013968 amyotrophic lateral sclerosis-parkinsonism-dementia complex Diseases 0.000 description 2
- 239000001961 anticonvulsive agent Substances 0.000 description 2
- 230000036506 anxiety Effects 0.000 description 2
- 230000006907 apoptotic process Effects 0.000 description 2
- 238000003556 assay Methods 0.000 description 2
- 230000037444 atrophy Effects 0.000 description 2
- 239000011230 binding agent Substances 0.000 description 2
- 230000006931 brain damage Effects 0.000 description 2
- 231100000874 brain damage Toxicity 0.000 description 2
- 239000007894 caplet Substances 0.000 description 2
- 229910052799 carbon Inorganic materials 0.000 description 2
- 238000004113 cell culture Methods 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 230000009514 concussion Effects 0.000 description 2
- 230000006735 deficit Effects 0.000 description 2
- 230000003111 delayed effect Effects 0.000 description 2
- 208000017004 dementia pugilistica Diseases 0.000 description 2
- 230000003210 demyelinating effect Effects 0.000 description 2
- 239000003085 diluting agent Substances 0.000 description 2
- 239000007884 disintegrant Substances 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 230000003073 embolic effect Effects 0.000 description 2
- 230000013020 embryo development Effects 0.000 description 2
- 230000001037 epileptic effect Effects 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 239000012091 fetal bovine serum Substances 0.000 description 2
- 235000019634 flavors Nutrition 0.000 description 2
- 239000012737 fresh medium Substances 0.000 description 2
- 210000001652 frontal lobe Anatomy 0.000 description 2
- 239000007903 gelatin capsule Substances 0.000 description 2
- 230000002641 glycemic effect Effects 0.000 description 2
- 239000008187 granular material Substances 0.000 description 2
- 208000008675 hereditary spastic paraplegia Diseases 0.000 description 2
- 230000001146 hypoxic effect Effects 0.000 description 2
- 208000026278 immune system disease Diseases 0.000 description 2
- 230000002458 infectious effect Effects 0.000 description 2
- 230000004054 inflammatory process Effects 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 208000020658 intracerebral hemorrhage Diseases 0.000 description 2
- 238000007912 intraperitoneal administration Methods 0.000 description 2
- 230000000302 ischemic effect Effects 0.000 description 2
- 206010023497 kuru Diseases 0.000 description 2
- 201000010901 lateral sclerosis Diseases 0.000 description 2
- 230000003902 lesion Effects 0.000 description 2
- 239000008297 liquid dosage form Substances 0.000 description 2
- 239000007937 lozenge Substances 0.000 description 2
- 239000000314 lubricant Substances 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 208000030159 metabolic disease Diseases 0.000 description 2
- 230000002503 metabolic effect Effects 0.000 description 2
- 230000009456 molecular mechanism Effects 0.000 description 2
- 210000002161 motor neuron Anatomy 0.000 description 2
- 201000006417 multiple sclerosis Diseases 0.000 description 2
- 230000020763 muscle atrophy Effects 0.000 description 2
- 201000000585 muscular atrophy Diseases 0.000 description 2
- 208000031225 myocardial ischemia Diseases 0.000 description 2
- 239000003158 myorelaxant agent Substances 0.000 description 2
- 210000001577 neostriatum Anatomy 0.000 description 2
- 208000020469 nerve plexus disease Diseases 0.000 description 2
- 208000031237 olivopontocerebellar atrophy Diseases 0.000 description 2
- 238000001543 one-way ANOVA Methods 0.000 description 2
- 230000036542 oxidative stress Effects 0.000 description 2
- 238000007911 parenteral administration Methods 0.000 description 2
- 230000035515 penetration Effects 0.000 description 2
- 230000009984 peri-natal effect Effects 0.000 description 2
- 230000002093 peripheral effect Effects 0.000 description 2
- 208000033808 peripheral neuropathy Diseases 0.000 description 2
- 239000000546 pharmaceutical excipient Substances 0.000 description 2
- 208000028591 pheochromocytoma Diseases 0.000 description 2
- 239000006187 pill Substances 0.000 description 2
- 201000006380 plexopathy Diseases 0.000 description 2
- 208000032207 progressive 1 supranuclear palsy Diseases 0.000 description 2
- 201000002241 progressive bulbar palsy Diseases 0.000 description 2
- 201000000196 pseudobulbar palsy Diseases 0.000 description 2
- 230000005855 radiation Effects 0.000 description 2
- 239000000243 solution Substances 0.000 description 2
- 208000020431 spinal cord injury Diseases 0.000 description 2
- 208000011117 substance-related disease Diseases 0.000 description 2
- 239000000829 suppository Substances 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- 230000001732 thrombotic effect Effects 0.000 description 2
- 210000001519 tissue Anatomy 0.000 description 2
- 231100000331 toxic Toxicity 0.000 description 2
- 230000002588 toxic effect Effects 0.000 description 2
- 239000003053 toxin Substances 0.000 description 2
- 231100000765 toxin Toxicity 0.000 description 2
- 108700012359 toxins Proteins 0.000 description 2
- 201000010875 transient cerebral ischemia Diseases 0.000 description 2
- 230000008733 trauma Effects 0.000 description 2
- YWARNRIBWGHMIS-UHFFFAOYSA-N 2-[3-[2-(4,5-dimethyl-1,3-thiazol-2-yl)-3-(4-sulfophenyl)-1h-tetrazol-5-yl]phenoxy]acetic acid Chemical compound S1C(C)=C(C)N=C1N1N(C=2C=CC(=CC=2)S(O)(=O)=O)N=C(C=2C=C(OCC(O)=O)C=CC=2)N1 YWARNRIBWGHMIS-UHFFFAOYSA-N 0.000 description 1
- 102000013455 Amyloid beta-Peptides Human genes 0.000 description 1
- 108010090849 Amyloid beta-Peptides Proteins 0.000 description 1
- 102000007371 Ataxin-3 Human genes 0.000 description 1
- 102100022548 Beta-hexosaminidase subunit alpha Human genes 0.000 description 1
- YDNKGFDKKRUKPY-JHOUSYSJSA-N C16 ceramide Natural products CCCCCCCCCCCCCCCC(=O)N[C@@H](CO)[C@H](O)C=CCCCCCCCCCCCCC YDNKGFDKKRUKPY-JHOUSYSJSA-N 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 1
- 102000011727 Caspases Human genes 0.000 description 1
- 108010076667 Caspases Proteins 0.000 description 1
- 206010051290 Central nervous system lesion Diseases 0.000 description 1
- 206010008089 Cerebral artery occlusion Diseases 0.000 description 1
- 206010010904 Convulsion Diseases 0.000 description 1
- 201000010374 Down Syndrome Diseases 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 206010021118 Hypotonia Diseases 0.000 description 1
- 206010061216 Infarction Diseases 0.000 description 1
- 206010024229 Leprosy Diseases 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- CRJGESKKUOMBCT-VQTJNVASSA-N N-acetylsphinganine Chemical compound CCCCCCCCCCCCCCC[C@@H](O)[C@H](CO)NC(C)=O CRJGESKKUOMBCT-VQTJNVASSA-N 0.000 description 1
- 108010025020 Nerve Growth Factor Proteins 0.000 description 1
- 102000015336 Nerve Growth Factor Human genes 0.000 description 1
- 206010029350 Neurotoxicity Diseases 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- 102000029797 Prion Human genes 0.000 description 1
- 108091000054 Prion Proteins 0.000 description 1
- 239000012980 RPMI-1640 medium Substances 0.000 description 1
- 208000013738 Sleep Initiation and Maintenance disease Diseases 0.000 description 1
- 208000005392 Spasm Diseases 0.000 description 1
- 208000036834 Spinocerebellar ataxia type 3 Diseases 0.000 description 1
- 238000000692 Student's t-test Methods 0.000 description 1
- 208000022292 Tay-Sachs disease Diseases 0.000 description 1
- 206010044221 Toxic encephalopathy Diseases 0.000 description 1
- 208000030886 Traumatic Brain injury Diseases 0.000 description 1
- 206010044688 Trisomy 21 Diseases 0.000 description 1
- APERIXFHHNDFQV-UHFFFAOYSA-N [2-[2-[2-[bis(carboxymethyl)amino]-5-methylphenoxy]ethoxy]-4-[3,6-bis(dimethylamino)xanthen-9-ylidene]cyclohexa-2,5-dien-1-ylidene]-bis(carboxymethyl)azanium;chloride Chemical compound [Cl-].C12=CC=C(N(C)C)C=C2OC2=CC(N(C)C)=CC=C2C1=C(C=1)C=CC(=[N+](CC(O)=O)CC(O)=O)C=1OCCOC1=CC(C)=CC=C1N(CC(O)=O)CC(O)=O APERIXFHHNDFQV-UHFFFAOYSA-N 0.000 description 1
- ZHAFUINZIZIXFC-UHFFFAOYSA-N [9-(dimethylamino)-10-methylbenzo[a]phenoxazin-5-ylidene]azanium;chloride Chemical compound [Cl-].O1C2=CC(=[NH2+])C3=CC=CC=C3C2=NC2=C1C=C(N(C)C)C(C)=C2 ZHAFUINZIZIXFC-UHFFFAOYSA-N 0.000 description 1
- 238000002835 absorbance Methods 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 230000006978 adaptation Effects 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 125000001931 aliphatic group Chemical group 0.000 description 1
- 125000003545 alkoxy group Chemical group 0.000 description 1
- 102000003802 alpha-Synuclein Human genes 0.000 description 1
- 108090000185 alpha-Synuclein Proteins 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- 239000003708 ampul Substances 0.000 description 1
- 206010002026 amyotrophic lateral sclerosis Diseases 0.000 description 1
- 210000002551 anterior cerebral artery Anatomy 0.000 description 1
- 230000001773 anti-convulsant effect Effects 0.000 description 1
- 230000003556 anti-epileptic effect Effects 0.000 description 1
- 229960003965 antiepileptics Drugs 0.000 description 1
- 230000009925 apoptotic mechanism Effects 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 230000017531 blood circulation Effects 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 244000309464 bull Species 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 125000001951 carbamoylamino group Chemical group C(N)(=O)N* 0.000 description 1
- 210000004004 carotid artery internal Anatomy 0.000 description 1
- 239000006143 cell culture medium Substances 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 230000007248 cellular mechanism Effects 0.000 description 1
- 229940106189 ceramide Drugs 0.000 description 1
- ZVEQCJWYRWKARO-UHFFFAOYSA-N ceramide Natural products CCCCCCCCCCCCCCC(O)C(=O)NC(CO)C(O)C=CCCC=C(C)CCCCCCCCC ZVEQCJWYRWKARO-UHFFFAOYSA-N 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 239000003240 coconut oil Substances 0.000 description 1
- 235000019864 coconut oil Nutrition 0.000 description 1
- 239000000084 colloidal system Substances 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 235000012343 cottonseed oil Nutrition 0.000 description 1
- 239000002385 cottonseed oil Substances 0.000 description 1
- 210000004748 cultured cell Anatomy 0.000 description 1
- 231100000433 cytotoxic Toxicity 0.000 description 1
- 230000001472 cytotoxic effect Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- 235000005911 diet Nutrition 0.000 description 1
- 230000037213 diet Effects 0.000 description 1
- 239000000539 dimer Substances 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 239000006196 drop Substances 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 239000008157 edible vegetable oil Substances 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 230000037149 energy metabolism Effects 0.000 description 1
- 206010015037 epilepsy Diseases 0.000 description 1
- 230000003492 excitotoxic effect Effects 0.000 description 1
- 231100000063 excitotoxicity Toxicity 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 201000006061 fatal familial insomnia Diseases 0.000 description 1
- 239000012054 flavored emulsion Substances 0.000 description 1
- 235000020375 flavoured syrup Nutrition 0.000 description 1
- 239000008394 flocculating agent Substances 0.000 description 1
- 235000013355 food flavoring agent Nutrition 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 102000006602 glyceraldehyde-3-phosphate dehydrogenase Human genes 0.000 description 1
- 108020004445 glyceraldehyde-3-phosphate dehydrogenase Proteins 0.000 description 1
- 239000003979 granulating agent Substances 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- OAKJQQAXSVQMHS-UHFFFAOYSA-N hydrazine Substances NN OAKJQQAXSVQMHS-UHFFFAOYSA-N 0.000 description 1
- 150000002431 hydrogen Chemical class 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 125000002768 hydroxyalkyl group Chemical group 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 206010022437 insomnia Diseases 0.000 description 1
- 230000000968 intestinal effect Effects 0.000 description 1
- 238000000185 intracerebroventricular administration Methods 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000010255 intramuscular injection Methods 0.000 description 1
- 239000007927 intramuscular injection Substances 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 238000007914 intraventricular administration Methods 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 238000002483 medication Methods 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 210000003657 middle cerebral artery Anatomy 0.000 description 1
- 201000007309 middle cerebral artery infarction Diseases 0.000 description 1
- 230000002438 mitochondrial effect Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 230000004660 morphological change Effects 0.000 description 1
- 230000036640 muscle relaxation Effects 0.000 description 1
- 208000010125 myocardial infarction Diseases 0.000 description 1
- VMGAPWLDMVPYIA-HIDZBRGKSA-N n'-amino-n-iminomethanimidamide Chemical compound N\N=C\N=N VMGAPWLDMVPYIA-HIDZBRGKSA-N 0.000 description 1
- 229960004927 neomycin Drugs 0.000 description 1
- 229940053128 nerve growth factor Drugs 0.000 description 1
- 230000001537 neural effect Effects 0.000 description 1
- 230000009223 neuronal apoptosis Effects 0.000 description 1
- 239000004090 neuroprotective agent Substances 0.000 description 1
- 231100000189 neurotoxic Toxicity 0.000 description 1
- 230000002887 neurotoxic effect Effects 0.000 description 1
- 231100000228 neurotoxicity Toxicity 0.000 description 1
- 230000007135 neurotoxicity Effects 0.000 description 1
- 239000002581 neurotoxin Substances 0.000 description 1
- 231100000618 neurotoxin Toxicity 0.000 description 1
- VVGIYYKRAMHVLU-UHFFFAOYSA-N newbouldiamide Natural products CCCCCCCCCCCCCCCCCCCC(O)C(O)C(O)C(CO)NC(=O)CCCCCCCCCCCCCCCCC VVGIYYKRAMHVLU-UHFFFAOYSA-N 0.000 description 1
- 229940005483 opioid analgesics Drugs 0.000 description 1
- 239000006186 oral dosage form Substances 0.000 description 1
- 239000002357 osmotic agent Substances 0.000 description 1
- 230000008756 pathogenetic mechanism Effects 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- 229940124531 pharmaceutical excipient Drugs 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 239000013641 positive control Substances 0.000 description 1
- 210000003388 posterior cerebral artery Anatomy 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000002685 pulmonary effect Effects 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- BOLDJAUMGUJJKM-LSDHHAIUSA-N renifolin D Natural products CC(=C)[C@@H]1Cc2c(O)c(O)ccc2[C@H]1CC(=O)c3ccc(O)cc3O BOLDJAUMGUJJKM-LSDHHAIUSA-N 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 239000000932 sedative agent Substances 0.000 description 1
- 230000001624 sedative effect Effects 0.000 description 1
- 239000012679 serum free medium Substances 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 239000002356 single layer Substances 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 239000008174 sterile solution Substances 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 238000012353 t test Methods 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 238000011200 topical administration Methods 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 230000002936 tranquilizing effect Effects 0.000 description 1
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 1
- 230000009529 traumatic brain injury Effects 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
- 230000003442 weekly effect Effects 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/21—Esters, e.g. nitroglycerine, selenocyanates
- A61K31/27—Esters, e.g. nitroglycerine, selenocyanates of carbamic or thiocarbamic acids, meprobamate, carbachol, neostigmine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/325—Carbamic acids; Thiocarbamic acids; Anhydrides or salts thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/08—Antiepileptics; Anticonvulsants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
Landscapes
- Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pharmacology & Pharmacy (AREA)
- Engineering & Computer Science (AREA)
- Chemical & Material Sciences (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Neurology (AREA)
- Biomedical Technology (AREA)
- Neurosurgery (AREA)
- Epidemiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Physical Education & Sports Medicine (AREA)
- Cardiology (AREA)
- Psychology (AREA)
- Emergency Medicine (AREA)
- Vascular Medicine (AREA)
- Pain & Pain Management (AREA)
- Pulmonology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Psychiatry (AREA)
- Hospice & Palliative Care (AREA)
- Urology & Nephrology (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Hydrogenated Pyridines (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
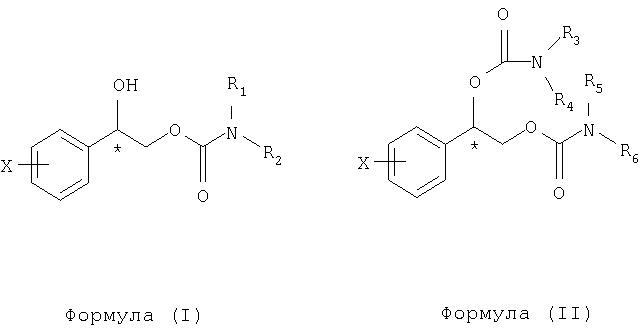
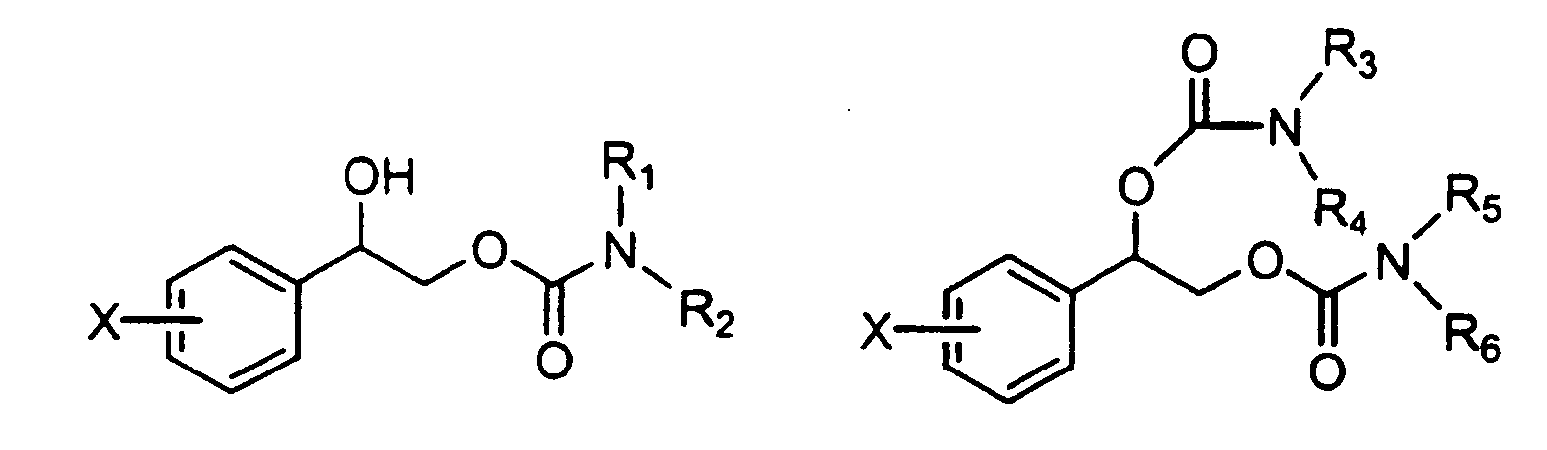
Изобретение относится к медицине, в частности к психофармакологии, и касается применения соединения, выбранного из группы, состоящей из формулы (I) и формулы (II), их энантиомеров или смеси энантиомеров:
где фенил в положении Х замещен атомами галогенов, выбранными из группы, состоящей из фтора, хлора, брома или йода, в количестве от одного до пяти, и R1, R2, R3, R4, R5 и R6 независимо выбраны из группы, состоящей из водорода и C1-C4алкила, где С1-С4алкил необязательно замещен фенилом, где фенил необязательно содержит заместители, независимо выбранные из группы, состоящей из галогена, C1-C4алкила, C1-C4алкокси, амино, нитро и циано, для производства фармацевтической композиции для защиты нервных клеток от церебральной ишемии и некроза. Фармацевтическая композиция предназначена для использования при широком спектре нейродегенеративных заболеваний, сопровождающихся явлениями церебральной ишемии и некроза 2 н. и 4 з.п. ф-лы, 2 табл.
Description
Перекрестная ссылка на связанные заявки.
Данная заявка притязает на приоритет предварительной заявки Serial Number 60/271682, поданной 27 февраля 2001 года, которая включена посредством ссылки.
Область изобретения
Данное изобретение относится к способу применения карбаматы для предотвращения или лечения нейродегенеративных нарушений. Более конкретно данное изобретение относится к способу применения галогенированных 2-фенил-1,2-этандиолмонокарбаматов или дикарбаматов для предотвращения или лечения нейродегенеративных нарушений.
Предпосылки изобретения
Острые и хронические нейродегенеративные нарушения связаны с гибелью нервных клеток или нарушением их функций (McDonald ES., Windebank AJ, Mechanisms of neurotoxic injury and cell death, Neurol. Clin., 2000, Aug, 18(3), 525-40; Nagy Z, Mechanisms of neuronal death in Down's syndrome, J. Neural. Transm. Suppl., 1999, 57, 233-45; Kilpatrick TJ, Soilu-Hanninen M, Molecular mechanisms regulating motor neuron development and degeneration, Mol. Neurobiol., 1999, Jun, 19(3), 205-28; Rubin LL, Neuronal cell death: an updated view, Prog. Brain. Res., 1998, 117, 3-8; Saha AR, Ninkina NN, Hanger DP, Anderton BH, Davies AM, Buchman VL, Induction of neuronal death by alpha-synuclein, Eur. J. Neurosci., 2000, Aug, 12(8), 3073-3077; Varadarajan S, Yatin S, Aksenova M, Butterfield DA, Review: Alzheimer's amyloid beta-peptide-associated free radical oxidative stress and neurotoxicity, J. Struct. Biol., 2000, Jun, 130(2-3), 184-208, Clarke G, Collins RA, Leavift BR, Andrews DF, Hayden MR, Lumsden CJ, Mclnnes RR, A one-hit model of cell death in inherited neuronal degenerations, Nature, 2000, Jul, 13, 406(6792), 195-9; Foley P, Riederer P, Influence of neurotoxins and oxidative stress on the onset and progression of Parkinson's disease, J. Neurol., 2000, Apr, 247 Suppl 2, 1182-94; Nicotera P, Caspase requirement for neuronal apoptosis and neurodegeneration, IUBMB Life, 2000, May, 49(5), 421-5; Mattson MP, Pedersen WA, Duan W, Culmsee C, Camandola S, Cellular and molecular mechanisms underlying perturbed energy metabolism and neuronal degeneration in Alzheimer's and Parkinson's diseases, Ann. N.Y. Acad. Sci., 1999, 893, 154-75; Martin LJ, Al-Abdulla NA, Brambrink AM, Kirsch JR, Sieber FE, Portera-Cailliau C, Neurodegeneration in excitotoxicity, global cerebral ischemia, and target deprivation: A perspective on the contributions of apoptosis and necrosis, Brain Res. Bull., 1998, Jul 1, 46(4), 281-309; McIntosh TK, Saatman KE, Raghupathi R, Graham DI, Smith DH, Lee VM, Trojanowski JQ, The Dorothy Russell Memorial Lecture; The molecular and cellular sequelae of experimental traumatic brain injury: pathogenetic mechanisms, Neuropathol. Appl. Neurobiol., 1998, Aug, 24(4), 251-67). Для лечения и острых и хронических нейродегенеративных нарушений необходимо предотвращение гибели нервных клеток.
Острые нейродегенеративные нарушения представляют собой нарушения, связанные с внезапным повреждением, включая в качестве неограничивающих примеров острую травму, гипоксию-ишемию или их комбинацию, приводящие к гибели нервных клеток или нарушению их функций. Острая травма включает в качестве неограничивающих примеров травму головного мозга, очаговую травму головного мозга, диффузное повреждение мозга, травму спинного мозга, внутричерепные или внутрипозвоночные повреждения (включая в качестве неограничивающих примеров повреждения в виде контузии, пенетрации, сдвига, компрессии или разрыва) или синдром встряхивания младенца. Гипоксия-ишемия включает в качестве неограничивающих примеров цереброваскулярную недостаточность, церебральную ишемию или церебральный инфаркт (включая церебральные ишемии или инфаркты, происходящие от эмболической окклюзии и тромбозной окклюзии), реперфузию, следующую за острой ишемией, перинатальное гипоксически-ишемическое повреждение, остановку сердца или внутричерепное кровоизлияние любого типа (включая в качестве неограничивающих примеров эпидуральное, субдуральное, субарахноидальное или внутримозговое кровоизлияния).
Хронические нейродегенеративные нарушения представляют собой нарушения, связанные с постепенной гибелью нервных клеток или нарушением их функций в течение периода времени, включающие в качестве неограничивающих примеров болезнь Альцгеймера, болезнь Пика, болезнь диффузного тела Леви, прогрессирующий супрануклеарный паралич (синдром Стила-Ричардсона), мультисистемную дегенерацию (синдром Шай-Драгера), хронические эпилептические состояния, связанные с нейродегенерацией, болезни моторных нейронов (боковой амиотрофический склероз), рассеянный склероз, дегенеративные атаксии, кортико-базальную дегенерацию, комплекс Гуама (комплекс амиотрофический боковой склероз - паркинсонизм - деменция), подострый склерозирующий панэнцефалит, болезнь Гентингтона, болезнь Паркинсона, синуклеопатии (включая множественную системную атрофию), первичную прогрессирующую афазию, стриатонигральную дегенерацию, болезнь Мачадо-Жозефа или спиноцеребеллярную атаксию типа 3 и оливопонтоцеребеллярные дегенерации, бульбарный или псевдобульбарный параличи, спинальную и спинобульбарную мышечную атрофию (болезнь Кеннеди), первичный боковой склероз, семейную спастическую параплегию, болезнь Верднига-Хоффмана, болезнь Кугельберга-Веландера, болезнь Тая-Сакса, болезнь Сандхофа, семейная спастическая болезнь, болезнь Вольфарта-Кугельберга-Веландера, спастический парапарез, прогрессирующую мультифокальную лейкоэнцефалопатию, семейную дизавтономию (синдром Райли-Дея) или прионные заболевания (включая в качестве неограничивающих примеров болезнь Крейцфельда-Якоба, болезнь Герштманна-Штройсслера-Шейнкера, болезнь Куру или фатальная семейная бессонница).
Другие острые или хронические нейродегенеративные нарушения, связанные с потерей памяти, включают в качестве неограничивающих примеров нейродегенеративные нарушения, связанные с возрастной деменцией, сосудистой деменцией, диффузным заболеванием белого вещества (болезнь Бинсвангера), деменцию эндокринного или метаболического происхождения, деменцию после травмы головы и диффузные повреждения мозга, "деменцию боксеров" или деменцию при повреждении лобной доли. Другие острые или хронические нейродегенеративные нарушения, связанные с нейрональным поражением, включают в качестве неограничивающих примеров нейродегенеративные нарушения, связанные с химическим, токсическим, инфекционным или радиационным поражением нервной системы, повреждением в течение эмбрионального развития, недоношенность к моменту рождения, аноксическая ишемия, повреждения гепатогенного, гликемического, уремического, электролитического и эндокринного происхождения, повреждения психиатрического происхождения (включая в качестве неограничивающих примеров психопатологию, депрессию или беспокойство), повреждения из-за периферических заболеваний и плексопатий (включая паралич сплетения) или повреждения из-за нейропатии (включая нейропатии, отобранные из мультифокальных, сенсорных, моторных, сенсорно-моторных, вегетативных, сенсорно-вегетативных или демиелинизирующих нейропатий (включая в качестве неограничивающих примеров синдром Гийена-Барре или хроническую воспалительную демиелинизирующую полирадикулоневропатию) или такие нейропатии, происходящие из-за инфекций, воспалений, иммунных нарушений, злоупотреблений лекарственными средствами, фармакологических воздействий, токсинов, травмы (включающих в качестве неограничивающих примеров компрессию, раздавливание, рваные или сегментированные травмы), метаболические нарушения (включающих в качестве неограничивающих примеров эндокринные или паранеопластические), болезнь Шарко-Мари-Тута (включающую в качестве неограничивающих примеров типы 1a, 1b, 2, 4a или 1-X связанный), атаксию Фридрейха, метахроматическую лейкодистрофию, болезнь Рефзама, адреномиелонейропатию, атаксию-телеангиэктазию, болезнь Дежерина-Сотта (включающую в качестве неограничивающих примеров типы A и B), синдром Ламберта-Итона или нарушения черепных нервов.
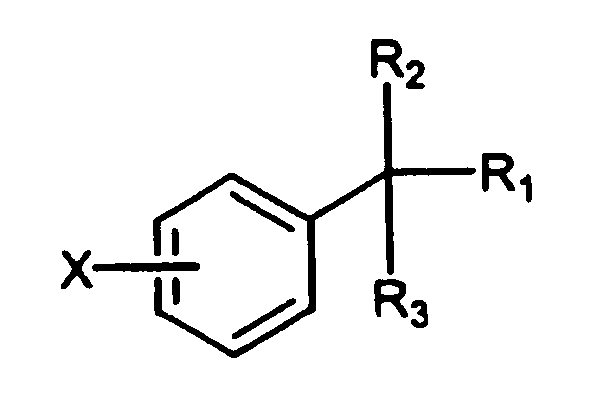
В патенте США № 3265728, Bossinger et al (включенному в описании в качестве ссылки) описаны как пригодные для лечения центральной нервной системы, обладающие транквилизирующими, седативными свойствами и свойствами расслаблять мышцы, замещенные соединения фенилалкилкарбамата формулы:
где R1 представляет собой или карбамат или алкилкарбамат, содержащий от 1 до 3 углеродных атомов в алкильной группе; R2 представляет собой или водород, гидроксид, алкил или гидроксиалкил, содержащий от 1 до 2 атомов углерода, R3 представляет собой или водород или алкил, содержащий от 1 до 2 атомов углерода и X может представлять собой галоген, метил, метокси, фенил, нитро или амино.
В патенте США № 3313692 Bossinger et al (включенному в описание посредством ссылки) описан способ, индуцирующий успокоение и мышечную релаксацию при помощи карбаматов посредством введения соединения формулы:
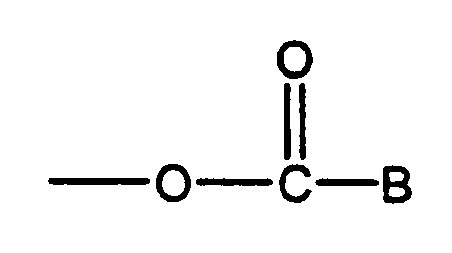
в которой W представляет собой алифатический радикал, содержащий менее чем 4 атома углерода, где R1 представляет собой ароматический радикал, R2 представляет собой водород или алкильный радикал, содержащий менее чем 4 атома углерода, и X представляет собой водород или гидроксил или аклоксил или алкильные радикалы, содержащие менее чем 4 атома углерода или радикал:
в котором B представляет собой радикал органического амина группы, состоящей из гетероциклических, уреидо и гидразиновых радикалов и радикала -N(R3)2, где R3 представляет собой водород или алкильный радикал, содержащий менее чем 4 атома углерода.
В патенте США № 6103759, Choi et al (включенному в описание посредством ссылки) описаны как эффективные для лечения и предотвращения нарушений центральной нервной системы, включая судороги, эпилепсию, удар или мышечный спазм, и как пригодные для лечения заболеваний центральной нервной системы, в частности как противосудорожные, противоэпилептические, нейропротективные средства и мышечные релаксанты центрального действия оптически чистые формы галогензамещенных 2-фенил-1,2-этандиолмонокарбаматов и -дикарбаматов формул:
где преобладает один энантиомер и где фенильное кольцо в положении X замещено атомами галогенов, выбранными из атомов фтора, хлора, брома или йода, в количестве от одного до пяти, и каждый из R1, R2, R3, R4, R5 и R6 выбран из водорода и неразветвленных или разветвленных алкильных групп, содержащих от одного до четырех атомов углерода, необязательно замещенных фенильной группой, заместители которой выбраны из группы, состоящей из водорода, галогена, алкила, алкилокси, амино, нитро или циано. Для соединений, представленных формулами выше, описаны чистые энантиомерные формы и энантиомерные смеси, где в смеси преобладает один из энантиомеров; предпочтительно один из энантиомеров преобладает в пределах примерно 90% или выше и, более предпочтительно примерно 98% или выше.
Галогензамещенные соединения 2-фенил-1,2-этандиолкарбамата формулы (I) или формулы (II) не описаны ранее как пригодные для предотвращения или лечения нейродегенеративных нарушений. Недавние предклинические испытания выявили ранее неизвестные фармакологические свойства, которые означают, что соединение формулы (I) или формулы (II) является пригодным для предотвращения или лечения нейродегенеративных нарушений. Следовательно, целью данного изобретения является предоставление способа применения соединения формулы (I) или формулы (II) для предотвращения или лечения нейродегенеративных нарушений.
Сущность изобретения
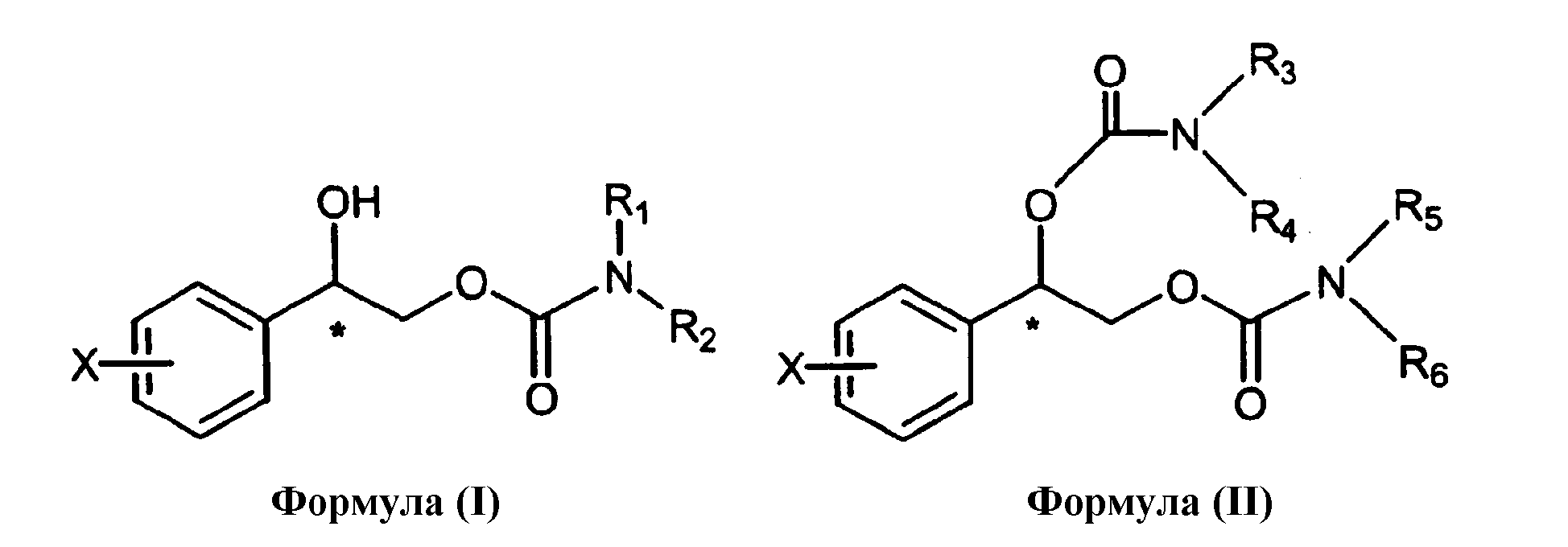
В настоящем изобретении описан способ предотвращения или лечения нейродегенеративных нарушений, включающий введение нуждающемуся в этом субъекту терапевтически эффективного количества соединения, выбранного из группы, состоящей из формулы (I) и формулы (II):
где фенил в положении X замещен атомами галогенов, выбранными из группы, состоящей из фтора, хлора, брома или йода, в количестве от одного до пяти, и
R1, R2, R3, R4, R5 и R6 независимо выбраны из группы, состоящей из водорода и С1-С4 алкила, где С1-С4 алкил необязательно замещен фенилом (где фенил необязательно содержит заместители, независимо выбранные из группы, состоящей из галогена, С1-С4 алкила, С1-С4 алкокси, амино, нитро и циано).
Вариант изобретения включает способ предотвращения или лечения нейродегенеративных нарушений, включающий введение нуждающемуся в этом субъекту терапевтически эффективного количества фармацевтической композиции, включающей фармацевтически приемлемый носитель и соединение, выбранное из группы, состоящей из формулы (I) и формулы (II).
Вариант изобретения включает применение соединения, выбранного из группы, состоящей из формулы (I) и формулы (II) для получения лекарственного средства для предотвращения или лечения нейродегенеративных заболеваний у нуждающегося в этом субъекта.
Вариант способа включает применение энантиомера, выбранного из группы, состоящей из формулы (I) и формулы (II), или энантиомерной смеси, где преобладает один энантиомер, выбранный из группы, состоящей из формулы (I) и формулы (II). Для энантиомерных смесей, где преобладает один энантиомер, выбранный из группы, состоящей из формулы (I) и формулы (II), предпочтительно один энантиомер, выбранный из группы, состоящей из формулы (I) и формулы (II), преобладает в пределах примерно 90% или выше. Более предпочтительно один энантиомер, выбранный из группы, состоящей из формулы (I) и формулы (II), преобладает в пределах примерно 98% или выше.
Подробное описание изобретения
В настоящем изобретении описан способ предотвращения или лечения нейродегенеративных нарушений, включающий введение нуждающемуся в этом субъекту терапевтически эффективного количества соединения, выбранного из группы, состоящей из формулы (I) и формулы (II):
где фенил в положении X замещен атомами галогенов, выбранными из группы, состоящей из фтора, хлора, брома или йода, в количестве от одного до пяти, и
R1, R2, R3, R4, R5 и R6 независимо выбраны из группы, состоящей из водорода и С1-С4 алкила, где С1-С4 алкил необязательно замещен фенилом (где фенил необязательно содержит заместители, независимо выбранные из группы, состоящей из галогена, С1-С4 алкила, С1-С4 алкокси, амино, нитро и циано).
Настоящий способ включает применение соединения, выбранного из группы, состоящей из формулы (I) и формулы (II), где X представляет собой хлор; предпочтительно X замещен в орто-положении фенильного кольца.
Настоящий способ включает применение соединения, выбранного из группы, состоящей из формулы (I) и формулы (II), где R1, R2, R3, R4, R5 и R6 предпочтительно выбраны из водорода.
Вариант настоящего способа включает применение энантиомера, выбранного из группы, состоящей из формулы (I) и формулы (II), или энантиомерной смеси, где преобладает один энантиомер, выбранный из группы, состоящей из формулы (I) и формулы (II), где X представляет собой хлор; предпочтительно X замещен в орто-положении фенильного кольца.
Настоящий способ также включает применение энантиомера, выбранного из группы, состоящей из формулы (I) и формулы (II), или энантиомерной смеси, где преобладает один энантиомер, выбранный из группы, состоящей из формулы (I) и формулы (II), где R1, R2, R3, R4, R5 и R6 предпочтительно выбраны из водорода.
Для энантиомерных смесей, где преобладает один энантиомер, выбранный из группы, состоящей из формулы (I) и формулы (II), предпочтительно энантиомер, выбранный из группы, состоящей из формулы (I) и формулы (II), преобладает в пределах примерно 90% или выше. Более предпочтительно один энантиомер, выбранный из группы, состоящей из формулы (I) и формулы (II), преобладает в пределах примерно 98% или выше.
Осуществление настоящего способа включает применение энантиомера, выбранного из группы, состоящей из формулы (Ia) и формулы (IIa), или энантиомерной смеси, где преобладает один энантиомер, выбранный из группы, состоящей из формулы (Ia) и формулы (IIa):
где фенил в положении X замещен атомами галогенов, выбранными из группы, состоящей из фтора, хлора, брома или йода, в количестве от одного до пяти, и
R1, R2, R3, R4, R5 и R6 независимо выбраны из группы, состоящей из водорода и С1-С4 алкила, где С1-С4 алкил необязательно замещен фенилом (где фенил необязательно содержит заместители, независимо выбранные из группы, состоящей из галогена, С1-С4 алкила, С1-С4 алкокси, амино, нитро или циано).
Настоящий способ включает применение энантиомера, выбранного из группы, состоящей из формулы (Ia) и формулы (IIa), или энантиомерной смеси, где преобладает один энантиомер, выбранный из группы, состоящей из формулы (Ia) и формулы (IIa), где X представляет собой хлор; предпочтительно X замещен в орто-положении фенильного кольца.
Настоящий способ также включает применение энантиомера, выбранного из группы, состоящей из формулы (Ia) и формулы (IIa), или энантиомерной смеси, где преобладает один энантиомер, выбранный из группы, состоящей из формулы (Ia) и формулы (IIa), где R1, R2, R3, R4, R5 и R6 предпочтительно выбраны из водорода.
Для энантиомерных смесей, где преобладает один энантиомер, выбранный из группы, состоящей из формулы (Ia) и формулы (IIa), предпочтительно энантиомер, выбранный из группы, состоящей из формулы (Ia) и формулы (IIa), преобладает в пределах примерно 90% или выше. Более предпочтительно один энантиомер, выбранный из группы, состоящей из формулы (Ia) и формулы (IIa), преобладает в пределах примерно 98% или выше.
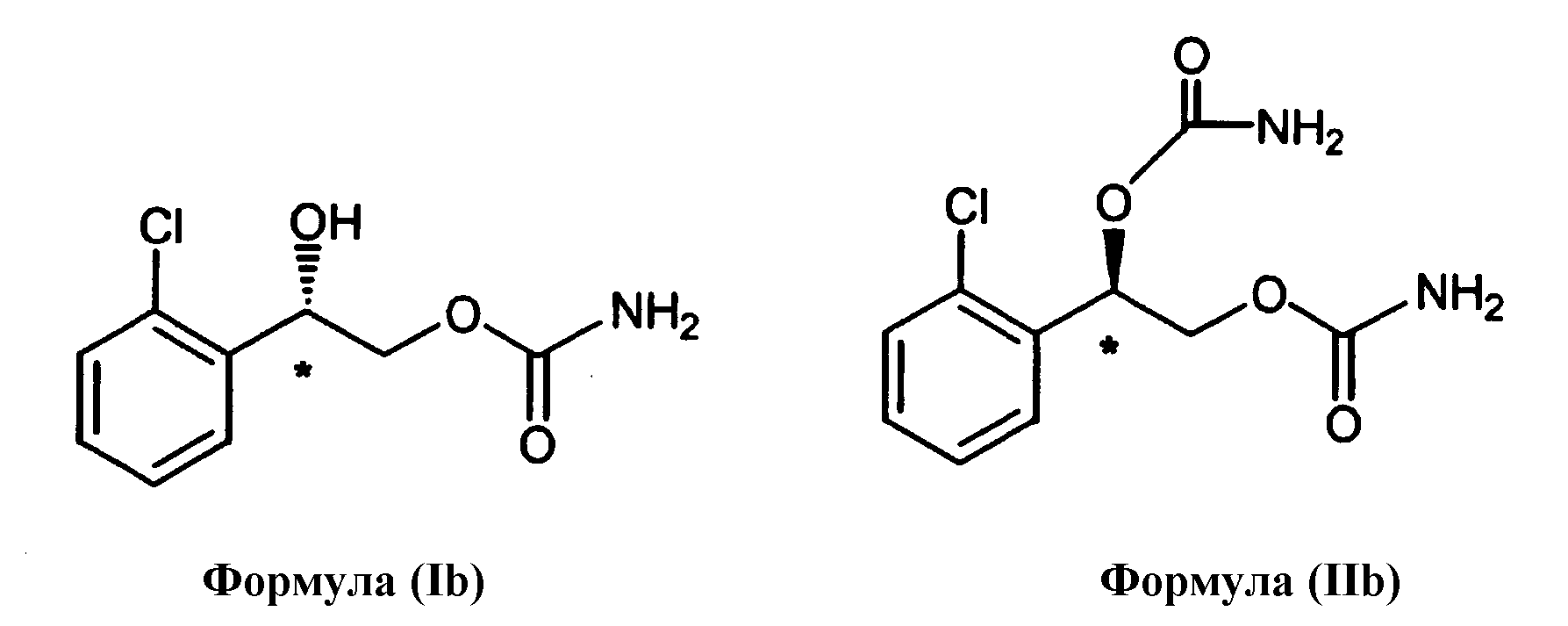
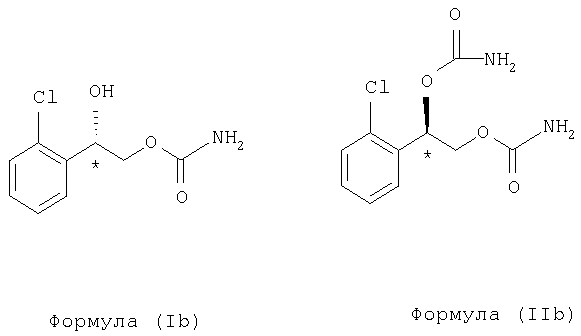
Осуществление настоящего способа включает способ предотвращения или лечения нейродегенеративных нарушений, включающий введение нуждающемуся в этом субъекту терапевтически эффективного количества энантиомера, выбранного из группы, состоящей из формулы (Ib) и формулы (IIb), или энантиомерной смеси, где преобладает один энантиомер, выбранный из группы, состоящей из формулы (Ib) и формулы (IIb):
Для энантиомерных смесей, где преобладает один энантиомер, выбранный из группы, состоящей из формулы (Ib) и формулы (IIb), предпочтительно энантиомер, выбранный из группы, состоящей из формулы (Ib) и формулы (IIb), преобладает в пределах примерно 90% или выше. Более предпочтительно один энантиомер, выбранный из группы, состоящей из формулы (Ib) и формулы (IIb), преобладает в пределах примерно 98% или выше.
Могут существовать другие кристаллические формы по настоящему изобретению и, по существу, подразумеваются то, что они относятся к настоящему изобретению.
Для специалистов в данной области очевидно, что соединения по изобретению присутствуют в виде рацематов, энантиомеров и их энантиомерных смесей. Энантиомер карбамата выбран из группы, состоящей из формулы (I), формулы (II), формулы (Ia), формулы (IIa), формулы (Ib) и формулы (IIb), содержащих асимметричный хиральный атом углерода в бензильной позиции, представляющий собой алифатический атом углерода, расположенный рядом с фенильным кольцом (отмеченный посредством звездочки в структурной формуле).
Соединения по настоящему изобретению можно получить, как описано в патенте '728, Bossinger (включен посредством ссылки), патенте '692, Bossinger (включен посредством ссылки), и патенте '759, Choi (включен посредством ссылки), на которые ссылались ранее.
Подразумевается, что определение любого заместителя или переменного в конкретном положении в молекуле является независимым от его определений в другом положении в данной молекуле. Понятно, что специалист в данной области может выбрать профили заместителей и замен у соединений по настоящему изобретению для получения химически стабильных соединений, которые можно легко синтезировать посредством известных в данной области способов, а также посредством таких способов, приведенных в описании.
Настоящее изобретение относится к способу предотвращения или лечения нейродегенеративных нарушений у нуждающегося в этом субъекта. Нейродегенеративные нарушения включают в качестве неограничивающих примеров острые нейродегенеративные нарушения, хронические нейродегенеративные нарушения, другие острые или хронические нейродегенеративные нарушения, связанные с потерей памяти, или другие острые или хронические нейродегенеративные нарушения, связанные с нейрональным повреждением.
Острые нейродегенеративные нарушения представляют собой нарушения, связанные с внезапным повреждением, включая в качестве неограничивающих примеров острую травму, гипоксию-ишемию или их комбинацию, приводящие к гибели нервных клеток или нарушению их функций. Острая травма включает в качестве неограничивающих примеров травму головного мозга, очаговую травму головного мозга, диффузное повреждение мозга, травму спинного мозга, внутричерепные или внутрипозвоночные повреждения (включая в качестве неограничивающих примеров повреждения в виде контузии, пенетрации, сдвига, компрессии или разрыва) или синдром встряхивания младенца. Гипоксия-ишемия включает в качестве неограничивающих примеров цереброваскулярную недостаточность, церебральную ишемию или церебральный инфаркт (включая церебральные ишемии или инфаркты, происходящие от эмболической окклюзии и тромбозной окклюзии), реперфузию, следующую за острой ишемией, перинатальное гипоксически-ишемическое повреждение, остановку сердца или внутричерепное кровоизлияние любого типа (включая в качестве неограничивающих примеров эпидуральное, субдуральное, субарахноидальное или внутримозговое кровоизлияния).
Хронические нейродегенеративные нарушения представляют собой нарушения, связанные с постепенной гибелью нервных клеток или нарушением их функций в течение периода времени, включающие в качестве неограничивающих примеров болезнь Альцгеймера, болезнь Пика, болезнь диффузного тела Леви, прогрессирующий супрануклеарный паралич (синдром Стила-Ричардсона), мультисистемную дегенерацию (синдром Шай-Драгера), хронические эпилептические состояния, связанные с нейродегенерацией, болезни двигательных нейронов (боковой амиотрофический склероз), рассеянный склероз, дегенеративные атаксии, кортико-базальную дегенерацию, комплекс Гуама (комплекс амиотрофический боковой склероз - паркинсонизм - и деменция), подострый склерозирующий панэнцефалит, болезнь Гентингтона, болезнь Паркинсона, синуклеопатии (включая множественную системную атрофию), первичную прогрессирующую афазию, стриатонигральную дегенерацию, болезнь Мачадо-Жозефа или спиноцеребеллярную атаксию типа 3 и оливопонтоцеребеллярные дегенерации, бульбарный или псевдобульбарный параличи, спинальную и спинобульбарную мышечную атрофию (болезнь Кеннеди), первичный боковой склероз, семейную спастическую параплегию, болезнь Верднига-Хоффмана, болезнь Кугельберга-Веландера, болезнь Тая-Сакса, болезнь Сандхофа, семейная спастическая болезнь, болезнь Вольфарта-Кугельберга-Веландера, спастический парапарез, прогрессирующую мультифокальную лейкоэнцефалопатию, семейную дизавтономию (синдром Райли-Дея) или прионные заболевания (включая в качестве неограничивающих примеров болезнь Крейцфельда-Якоба, болезнь Герштманна-Штройсслера-Шейнкера, болезнь Куру или фатальная семейная бессонница).
Другие острые или хронические нейродегенеративные нарушения, связанные с потерей памяти, включают в качестве неограничивающих примеров нейродегенеративные нарушения, связанные с возрастной деменцией, сосудистой деменцией, диффузным заболеванием белого вещества (болезнь Бинсвангера), деменцию эндокринного или метаболического происхождения, деменцию после травмы головы и диффузные повреждения мозга, "деменцию боксеров" или деменцию при повреждении лобной доли. Другие острые или хронические нейродегенеративные нарушения, связанные с нейрональным поражением, включают в качестве неограничивающих примеров нейродегенеративные нарушения, связанные с химическим, токсическим, инфекционным или радиационным поражением нервной системы, повреждением в течение эмбрионального развития, недоношенность к моменту рождения, аноксическую ишемию, повреждения гепатогенного, гликемического, уремического, электролитического и эндокринного происхождения, повреждения психиатрического происхождения (включая в качестве неограничивающих примеров психопатологию, депрессию или беспокойство), повреждения из-за периферических заболеваний и плексопатий (включая паралич сплетения) или повреждения из-за нейропатии (включая нейропатии, выбранные из мультифокальных, сенсорных, моторных, сенсорно-моторных, вегетативных, сенсорно-вегетативных или демиелинизирующих нейропатий (включая в качестве неограничивающих примеров синдром Гийена-Барре или хроническую воспалительную демиелинизирующую полирадикулоневропатию) или такие нейропатии, происходящие из-за инфекций, воспалений, иммунных нарушений, злоупотреблений лекарственными средствами, фармакологических воздействий, токсинов, травмы (включающих в качестве неограничивающих примеров компрессию, раздавливание, рваные или сегментированные травмы), метаболические нарушения (включающих в качестве неограничивающих примеров эндокринные или паранеопластические), болезнь Шарко-Мари-Тута (включающую в качестве неограничивающих примеров типы 1a, 1b, 2, 4a или 1-X связанный), атаксию Фридрейха, метахроматическую лейкодистрофию, болезнь Рефзама, адреномиелонейропатию, атаксию-телеангиэктазию, болезнь Дежерина-Сотта (включающую в качестве неограничивающих примеров типы A и B), синдром Ламберта-Итона или нарушения черепных нервов).
Пример способа по настоящему изобретению включает введение субъекту терапевтически эффективного количества соединения, выбранного из группы, состоящей из формулы (I) и формулы (II) в фармацевтической композиции, содержащей фармацевтически приемлемый носитель и соединение, выбранное из группы, состоящей из формулы (I) и формулы (II). Способ по настоящему изобретению также включает применение соединения, выбранного из группы, состоящей из формулы (I) и формулы (II) для получения лекарственного средства для предотвращения или лечения нейродегенеративных нарушений.
Другой пример способа по настоящему изобретению включает введение субъекту терапевтически эффективного количества соединения, выбранного из группы, состоящей из формулы (I) и формулы (II) или его фармацевтической композиции в комбинации с одним или несколькими средствами, пригодными для предотвращения или лечения нейродегенеративных нарушений.
Соединение, выбранное из группы, состоящей из формулы (I) и формулы (II), или его фармацевтическую композицию можно вводить посредством любого традиционного пути введения, включая в качестве неограничивающих примеров оральный, легочный, интраперитонеальный (ip), внутривенный (iv), внутримышечный (im), подкожный (sc), трансдермальный, буккальный, назальный, сублингвальный, окулярный, ректальный и вагинальный. В дополнение введение непосредственно в нервную систему может включать в качестве неограничивающих примеров интрацеребральный, интравентрикулярный, интрацеребровентрикулярный, интратекальный, интрацистернальный, интраспинальный или периспинальный пути введения посредством доставки с помощью интракраниальных или интравертебральных игл или катетеров с помпами или без. Специалистам в данной области понятно, что для применения в данном изобретении подходят любая доза или частота введения, которые обеспечат описанный терапевтический эффект.
Терапевтически эффективным количеством соединения, выбранного из группы, состоящей из соединений формулы (I) и формулы (II) или его фармацевтической композиции, может являться примерно от 0,01 мг/кг/дозу до примерно 100 мг/кг/дозу. Предпочтительно терапевтически эффективным количеством может являться примерно от 0,01 мг/кг/дозу до примерно 25 мг/кг/дозу. Более предпочтительно терапевтически эффективным количеством может являться примерно от 0,01 мг/кг/дозу до примерно 10 мг/кг/дозу. Наиболее предпочтительно терапевтически эффективным количеством может являться примерно от 0,01 мг/кг/дозу до примерно 5 мг/кг/дозу. Следовательно, терапевтически эффективным количеством активного ингредиента, содержащегося в единице дозирования (например, таблетке, капсуле, порошке, препарате для инъекции, суппозитории, чайной ложке и т.п.), например, для субъекта со средним весом 70 кг может являться примерно от 1 мг/сутки до примерно 7000 мг/сутки.
Однако дозировки в зависимости от потребности субъекта (включая факторы, связанные с конкретным субъектом, подлежащим лечению, включая возраст субъекта, вес и диету, концентрацию препарата, прогресс состояния заболевания и способ и время введения) и применения конкретного соединения формулы (I) или формулы (II) или его фармацевтической композиции.
Специалист в данной области может легко определить оптимальные дозировки для введения, что приведет к необходимости корректировать дозу для соответствующего терапевтического уровня. Можно применять или ежедневное введение или постпериодическое дозирование. Предпочтительно соединение формулы (I) или формулы (II) или его фармацевтическую композицию для предотвращения или лечения нейродегенеративных нарушений вводят орально или парентерально.
В соответствии со способом по настоящему изобретению, описанное соединение формулы (I) или формулы (II) или его фармацевтическую композицию можно вводить раздельно, в различное время в течение курса лечения или одновременно в разделенных комбинированных формах или единых комбинированных формах. Преимущественно соединение формулы (I) и формулы (II) или его фармацевтическую композицию можно вводить одной суточной дозой или полную суточную дозу можно ввести посредством непрерывной доставки или в раздельных дозах два, три или четыре раза в сутки. Следовательно, настоящее изобретение необходимо понимать как объединение всех таких способов и режимов непрерывного, одновременного или чередующегося введения, а термин "введение" необходимо интерпретировать соответственно.
Термин "субъект" относится к животному, предпочтительно к млекопитающему, более предпочтительно к человеку, являющемуся объектом лечения, наблюдения или эксперимента.
Термин "терапевтически эффективное количество" означает количество активного соединения или фармацевтического средства, которое вызывает искомый исследователем, ветеринаром, лечащим врачом или другим клиницистом биологический или медицинский ответ в тканевой системе, у животного или человека, который включает ослабление симптомов заболевания или нарушения, подлежащего лечению.
Термин "композиция" предназначен для описания продуктов, содержащих конкретные ингредиенты в конкретных количествах, а также к любому продукту, прямо или косвенно являющемуся результатом комбинации конкретных ингредиентов в конкретных количествах.
Для получения фармацевтической композиции по настоящему изобретению соединение формулы (I) или формулы (II) в качестве активного ингредиента смешивают с фармацевтическим носителем, который может принимать обширное множество форм в зависимости от формы препарата, требуемого для введения (например, орального или парентерального), согласно традиционным способам получения фармацевтических препаратов. Подходящие фармацевтически приемлемые носители хорошо известны в данной области. Описания некоторых этих фармацевтически приемлемых носителей можно найти в The Handbook of Pharmaceutical Excipients, опубликованной the American Pharmaceutical Association and the Pharmaceutical Society of Great Britain.
Способы составления фармацевтических композиций описаны в многочисленных публикациях, таких как Pharmaceutical Dosage Forms: Tablets, Second Edition, Revised and Expanded, Volumes 1-3, edited by Lieberman et al; Pharmaceutical Dosage Forms: Parenteral Medications, Volumes 1-2, edited by Avis et al и Pharmaceutical Dosage Forms: Disperse Systems, Volumes 1-2, edited by Lieberman et al; published by Marcel Dekker, Inc.
Предпочтительно фармацевтическая композиция находится в форме единицы дозирования, такой как таблетка, пилюля, капсула, каплета, желатиновая капсула, лепешка, гранула, порошок, стерильный раствор или суспензия для парентерального введения, дозированный аэрозоль или жидкий спрей, капля, ампула, устройство для аутоинъекции или суппозиторий для орального, интраназального, сублингвального, интраокулярного, трансдермального, парентерального, ректального, вагинального способов, ингаляции или вдувания. Альтернативно композицию можно представить в форме, подходящей для еженедельного или ежемесячного введения, или можно адаптировать для предоставления препарата для внутримышечной инъекции.
Подходящие носители и добавки для приготовления фармацевтической композиции с твердой формой дозировки для орального введения, такой как таблетка, пилюля, капсула, каплета, желатиновая капсула, лепешка, гранула или порошок (включая для каждой формы композиции с непосредственным высвобождением, отсроченным высвобождением и замедленным высвобождением) включают в качестве неограничивающих примеров разбавители, гранулирующие средства, смазывающие агенты, связующие средства, средства для скольжения, дезинтегрирующие средства и т.п. При желании, таблетки можно покрыть сахарной, желатиновой, пленочной или кишечной оболочками посредством стандартных способов.
Для получения твердых форм дозирования основной активный ингредиент смешивают с фармацевтическим носителем (например, традиционные таблетирующие ингредиенты, такие как разбавители, связывающие средства, адгезивные средства, дезинтегрирующие средства, смазывающие средства, препятствующие связыванию средства и средства для скольжения). Для твердых жевательных форм можно добавить подсластители и вкусовые вещества для улучшения вкуса оральной формы дозирования. Дополнительно для простоты идентификации или в эстетических целях к твердой форме дозирования можно добавить или нанести на нее красители или покрытия. Данные носители составляют с фармацевтически активным средством для получения точной соответствующей дозы фармацевтически активного средства с терапевтическим профилем высвобождения.
Для получения фармацевтической композиции с жидкой формой дозирования для орального, местного и парентерального введения можно применять любой из обычных фармацевтических сред или наполнителей. Таким образом, подходящие носители и добавки для жидких форм единиц дозирования, таких как суспензии (например, коллоиды, эмульсии или дисперсии) и растворы, включают в качестве неограничивающих примеров, можно применять фармацевтически приемлемые смачивающие средства, диспергирующие средства, флоккулирующие средства, загустители, средства контроля pH (например, буферы), осмотические средства, красители, вкусовые вещества, ароматизаторы, консерванты (например, для контроля роста микробов и т.п.) и жидкие носители. Для каждой жидкой формы дозирования будут необходимы не все указанные выше компоненты. Жидкие формы, в которые можно включать новые композиции по настоящему изобретению для орального введения или введения посредством инъекции, включают в качестве неограничивающих примеров водные растворы, подходящие ароматизированные сиропы, водные или масляные суспензии и ароматизированные эмульсии со съедобными маслами, такими как хлопковое масло, кунжутное масло, кокосовое масло или арахисовое масло, а также эликсиры и подобные фармацевтические носители.
Примеры биологических экспериментов
Активности соединения формулы (I) и формулы (II) при использовании для предотвращения или лечения нейродегенеративных нарушений оценивают в следующем экспериментальном примере, который предназначен служить способом иллюстрации, но не ограничения данного изобретения.
Пример 1
Модель с изъятием сыворотки на культуре клеток PC12
Изъятие сыворотки является цитотоксическим изменением среды, приводящим к гибели клеток в культивируемых клеточных линиях, так же как и первичных клеток из различных тканевых источников, включая нервные клетки. В частности, клетки феохромоцитомы (PC) 12 широко применяют в качестве модели нервных клеток для широкого ряда нейродегенеративных нарушений или нарушений, связанных с гибелью клеток (Muriel, et al, Mitochondrial free calcium levels (Rhod-2 fluorescence) and ultrastructural alterations in neuronally differentiated PC12 cells during ceramide-dependent cell death, J. Comp. Neurol., 2000, 426(2), 297-315; Dermitzaki, et al, Opioids transiently prevent activation of apoptotic mechanisms following short periods of serum withdrawal, J. Neurochem., 2000, 74(3), 960-969; Carlile, et al, Reduced apoptosis after nerve growth factor and serum withdrawal: conversion of tetrameric glyceraldehyde-3-phosphate dehydrogenase to a dimer, Mol Pharmacol., 2000, 57(1), 2-12).
Клетки PC12 культивировали в стерильной среде (RPMI 1640), дополненной 10% лошадиной сывороткой, инактивированной нагреванием, и 5% эмбриональной бычьей сывороткой (FBS). Культуральная среда содержала также 1 X пенициллин-стрептомицин-неомициновый антибиотик (50 мкг, 50 мкг, 100 мкг соответственно). Среду меняли через день, а клетки пересевали в логарифмической фазе почти при достижении монослоя.
Контрольные клетки культивировали в обычной среде без обработки. Энантиомер формулы (Ib) или формулы (IIb) (10 мкМ) хорошо смешивали со средой и добавляли к клеткам. Для анализа длительностью 2 суток энантиомер формулы (Ib) или формулы (IIb) (10 мкМ) добавляли к клеткам только однократно во время изъятия сыворотки. Для анализа длительностью 7 суток энантиомер формулы (Ib) или формулы (IIb) (10 мкМ) добавляли к клеткам во время изъятия сыворотки и впоследствии каждые 48 час, когда среду для клеток заменяли на новую свежую среду без сыворотки. В группе с изъятием сыворотки клетки культивировали в среде без сыворотки, без добавления энантиомера формулы (Ib) или формулы (IIb). Выживаемость клеток определяли анализом с использованием внутренней соли 3-(4,5-диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфофенил)-2Н-тетразола (MTS-анализ) на 2 или 7 сутки после изъятия сыворотки.
В конце эксперимента клетки промывали свежей средой и инкубировали с раствором MTS в увлажненном инкубаторе при 37°С и 5% CO2 1,5 часа. По истечении периода инкубации клетки немедленно анализировали с использованием программы Softmax (Molecular Devices). MTS-анализ представляет собой калориметрический метод для определения числа жизнеспособных клеток при данной экспериментальной установке. Анализ основан на превращении клетками соли тетразола, MTS, в формазан, который растворим в культуральной среде для клеток и измеряется напрямую при 490 нм в 96-луночных планшетах для анализа. Поглощение прямо пропорционально числу жизнеспособных клеток в культуре. Произвольную оптическую плотность, измеряемую в контрольных клетках, выражали как 100% уровень выживаемости.
В таблице 1 приведены данные, демонстрирующие эффект энантиомера формулы (Ib) и формулы (IIb) на уровень выживаемости клеток на модели с изъятием сыворотки на культуре клеток РС12 (значение 1p=0,01; значение 2p=<0,01).
| ТАБЛИЦА 1% выживаемости клеток |
||
| 2 суток % выживаемости | 7 суток % выживаемости | |
| контроль | 100 | 100 |
| без сыворотки | 49,6±2,6 | 23,8±2,6 |
| формула (Ib) | 69,4±1,71 | 79,9±14,02 |
| формула (IIb) | 66,4±5,41 | 85,2±0,62 |
Пример 2
Модель транзиторной церебральной ишемии у крыс
Энантиомер формулы (Ib) исследовали на модели транзиторной церебральной ишемии при окклюзии средней мозговой артерии у крыс (MCAO) (как описано у Nagasawa H. and Kogure K., Stroke, 1989, 20, 1037; and, Zea Longa E., Weinstein P. R., Carlson S. and Cummins R., Stroke, 1989, 20, 84), используя самцов крыс Wistar 10 и 100 мг/кг (внутривенно). В качестве положительного контроля (3 мг/кг, интраперитонеально) применяли MK 801 (Дизоцилпина малеат; регистрационный номер CAS 77086-22-7, коммерчески доступная композиция).
Крыс (n=12) случайным образом распределяли в одну из четырех экспериментальных групп и анестезировали. В ходе данной процедуры блокировали ток крови из внутренней каротидной артерии, передней церебральной артерии и задней церебральной артерии в среднюю церебральную артерию. Через час после блокады животных обрабатывали в течение часа носителем (вводимым внутривенно в течение часа), контрольным средством (введенным как разовая интраперитонеальная доза в начале одночасового периода) и двумя дозами энантиомера формулы (Ib) (вводимыми внутривенно в течение одночасового периода). Через два часа после блокады проводили реперфузию.
Животных умерщвляли и получали корональные срезы толщиной 20 мм из мозга каждого. По одному из каждых сорока срезов (т.е. каждые 800 нМ) от передней до затылочной коры головного мозга использовали для определения количества поражений мозга. Предметные стекла получали с использованием срезов, окрашенных (согласно процедуре Nissl) крезиловым фиолетовым и исследовали с применением светового микроскопа.
Региональные ишемические поверхностные области на корональных срезах индивидуальных крыс определяли по присутствию клеток с морфологическим изменениями. Измеряли области нейронального повреждения или инфаркта и затем суммировали. Для каждого животного вычисляли объем коры и полосатого тела (общая площадь ишемической поверхности × 0,8 мм (толщина)).
Анализ модели MCAO
Для каждого животного из случайным образом распределенных по четырем экспериментальным группам сравнивали средние объемы (±S.E.M.) с использованием однофакторного ANOVA (однофакторный ANOVA представляет собой статистический метод, который сравнивает 3 или более несогласованных групп) с последующим t-тестом Dunnett's (оба метода включены в программное обеспечение Statview 512+, BarinPower, Calabasas, Calif., USA).
Как показано в таблице 2, результаты считали статистически достоверными, когда значение p составляло <0,05 по сравнению с группой с введенным носителем (1p<0,01; 2p<0,05).
| Таблица 2 Средний объем инфаркта±S.E.M.(мм3) |
||||
| Воздействие | N | Кора | полосатое тело | суммарный объем |
| Носитель, 10 мл/кг | 12 | 275,5±27,1 | 79,4±3,6 | 354,9±29,9 |
| MK 801, 3 мг/кг | 12 | 95,8±24,51 | 56,1±5,32 | 151,9±28,71 |
| Формула (Ib), 10 мг/кг | 12 | 201,0±23,9 | 75,9±2,6 | 276,9±25,4 |
| Формула (Ib), 100 мг/кг | 12 | 98,8±29,51 | 63,0±5,92 | 161,9±34,31 |
В то время как в описании изобретения изложены принципы настоящего изобретения, с примерами, предоставленными с иллюстративными целями, понятно, что на практике изобретение включает все обычные вариации, адаптации и/или модификации по мере их возникновения в объеме следующей формулы изобретения и ее эквивалентов.
Claims (6)
1. Применение соединения, выбранного из группы, состоящей из формулы (I) и формулы (II)
где фенил в положении Х замещен атомами галогенов, выбранными из группы, состоящей из фтора, хлора, брома или йода, в количестве от одного до пяти, и
R1, R2, R3, R4, R5 и R6 независимо выбраны из группы, состоящей из водорода и С1-С4алкила, где C1-C4алкил необязательно замещен фенилом, где фенил необязательно содержит заместители, независимо выбранные из группы, состоящей из галогена, C1-C4алкила, C1-C4алкокси, амино, нитро и циано,
для производства фармацевтической композиции для защиты нервных клеток от церебральной ишемии и некроза.
2. Применение по п.1, где Х представляет собой хлор.
3. Применение по п.1, где Х представляет собой заместитель в ортоположении фенильного кольца.
4. Применение по п.1, где R1, R2, R3, R4, R5 и R6 выбраны из водорода.
5. Применение энантиомера, выбранного из группы, состоящей из энантиомеров формулы (I) и формулы (II) или энантиомерной смеси, где преобладает один энантиомер, выбранный из группы, состоящей из формулы (I) и формулы (II)
где фенил в положении Х замещен атомами галогенов, выбранными из группы, состоящей из фтора, хлора, брома или йода, в количестве от одного до пяти, и
R1, R2, R3, R4, R5 и R6 независимо выбраны из группы, состоящей из водорода и C1-C4алкила, где С1-С4алкил необязательно замещен фенилом, где фенил необязательно содержит заместители, независимо выбранные из группы, состоящей из галогена, C1-C4алкила, C1-C4алкокси, амино, нитро и циано,
для производства фармацевтической композиции для защиты нервных клеток от церебральной ишемии и некроза.
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US27168201P | 2001-02-27 | 2001-02-27 | |
| US60/271,682 | 2001-02-27 | ||
| US10/081,764 US20020165273A1 (en) | 2001-02-27 | 2002-02-21 | Carbamate compounds for use in preventing or treating neurodegenerative disorders |
| US10/081,764 | 2002-02-21 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2003128982A RU2003128982A (ru) | 2005-03-10 |
| RU2300373C2 true RU2300373C2 (ru) | 2007-06-10 |
Family
ID=26765943
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2003128982/14A RU2300373C2 (ru) | 2001-02-27 | 2002-02-21 | Карбаматы для предотвращения или лечения нейродегенеративных нарушений |
Country Status (26)
| Country | Link |
|---|---|
| US (3) | US20020165273A1 (ru) |
| EP (1) | EP1383489B1 (ru) |
| JP (1) | JP4276840B2 (ru) |
| KR (1) | KR100910928B1 (ru) |
| CN (1) | CN1235579C (ru) |
| AR (1) | AR035756A1 (ru) |
| AT (1) | ATE361745T1 (ru) |
| BR (1) | BR0207645A (ru) |
| CA (1) | CA2439295C (ru) |
| CY (1) | CY1106753T1 (ru) |
| CZ (1) | CZ301203B6 (ru) |
| DE (1) | DE60220043T2 (ru) |
| DK (1) | DK1383489T3 (ru) |
| ES (1) | ES2284845T3 (ru) |
| HU (1) | HUP0303264A3 (ru) |
| IL (2) | IL157591A0 (ru) |
| MX (1) | MXPA03007718A (ru) |
| MY (1) | MY138156A (ru) |
| NO (1) | NO20033798L (ru) |
| NZ (1) | NZ527990A (ru) |
| PL (1) | PL364680A1 (ru) |
| PT (1) | PT1383489E (ru) |
| RS (1) | RS51055B (ru) |
| RU (1) | RU2300373C2 (ru) |
| TW (1) | TWI312679B (ru) |
| WO (1) | WO2002067925A1 (ru) |
Families Citing this family (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7514461B2 (en) * | 2003-09-19 | 2009-04-07 | Edison Pharmaceuticals, Inc. | Chroman derivatives |
| US20060194873A1 (en) * | 2004-09-16 | 2006-08-31 | Choi Yong M | Methods of treating epileptogenesis and epilepsy |
| SG142306A1 (en) * | 2004-10-15 | 2008-05-28 | Janssen Pharmaceutica Nv | Methods for neuroprotection |
| US20070021500A1 (en) * | 2005-07-12 | 2007-01-25 | Twyman Roy E | Methods for neuroprotection |
| CN101272776B (zh) * | 2005-07-26 | 2012-10-03 | 詹森药业有限公司 | 氨基甲酸酯在制备治疗物质滥用相关疾病药物中的用途 |
| BRPI0718131A2 (pt) * | 2006-10-06 | 2013-11-05 | Transform Pharmaceuticals Inc | Cristal de carbamato de (s)-(+)-2-(2-clorofenil)-hidróoxi-etila |
| EA200970436A1 (ru) * | 2006-10-30 | 2009-12-30 | Янссен Фармацевтика, Н.В. | Соединения карбамата для лечения депрессии |
| AU2007313911A1 (en) * | 2006-10-31 | 2008-05-08 | Janssen Pharmaceutica, N.V. | Treatment of Pervasive Developmental Disorders |
| CN104628603B (zh) * | 2010-07-02 | 2017-08-15 | 比皮艾思药物研发有限公司 | 苯基氨基甲酸酯化合物及含有苯基氨基甲酸酯化合物的肌肉松弛剂 |
| US9018253B2 (en) | 2010-07-02 | 2015-04-28 | Bio-Pharm Solutions Co., Ltd. | Phenylcarbamate compound and muscle relaxant containing the same |
| US8609849B1 (en) | 2010-11-30 | 2013-12-17 | Fox Chase Chemical Diversity Center, Inc. | Hydroxylated sulfamides exhibiting neuroprotective action and their method of use |
| US20130060024A1 (en) * | 2011-09-07 | 2013-03-07 | Satori Pharmaceuticals, Inc. | Compounds useful for treating neurodegenerative disorders |
| BR112014015482A8 (pt) * | 2011-12-27 | 2017-07-04 | Bio Pharm Solutions Co Ltd | compostos carbamato de fenila para uso no alívio ou tratamento de dor e dor neuropática |
| KR20160004260A (ko) | 2013-03-12 | 2016-01-12 | (주)바이오팜솔루션즈 | 페닐카바메이트 화합물 및 이를 포함하는 신경보호용 조성물 |
| CN105228604A (zh) * | 2013-03-12 | 2016-01-06 | 比皮艾思药物研发有限公司 | 用于预防或治疗小儿癫痫和癫痫相关综合征的苯基氨基甲酸酯化合物 |
| JP6807941B2 (ja) * | 2016-02-29 | 2021-01-06 | バイオ−ファーム ソリューションズ カンパニー リミテッド | スルファメート誘導体化合物、その製造方法および用途 |
| US11147798B2 (en) | 2016-12-14 | 2021-10-19 | Sk Biopharmaceuticals Co., Ltd. | Use of carbamate compound for prevention, alleviation, or treatment of demyelinating disease |
| TWI856977B (zh) * | 2018-09-21 | 2024-10-01 | 南韓商愛思開生物製藥股份有限公司 | 胺基甲酸酯化合物及包括該化合物之組合於預防、緩解或治療急性壓力症或創傷後壓力症之用途 |
| WO2022045824A1 (en) | 2020-08-31 | 2022-03-03 | Bio-Pharm Solutions Co., Ltd. | Phenyl alkyl carbamate compounds for use in preventing or treating neurodegenerative disease |
| US11896593B2 (en) | 2020-09-10 | 2024-02-13 | Bio-Pharm Solutions Co., Ltd. | Sulfamate derivative compounds for use in treating or alleviating a psychiatric disorder |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3278380A (en) * | 1962-02-06 | 1966-10-11 | Armour Pharma | Methods of calming employing diphenyl hydroxy carbamate compounds |
| RU2136670C1 (ru) * | 1994-02-03 | 1999-09-10 | Синтелябо | Производные 3-(2-аминоэтил)-4-[3-(трифторметил)бензоил]-3,4-дигидро-2h-1,4- бензоксазина, способ их получения и содержащий их фармацевтический состав |
| US6103759A (en) * | 1996-01-16 | 2000-08-15 | Sk Corporation | Halogen substituted carbamate compounds from 2-phenyl-1, 2-ethanediol |
Family Cites Families (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3313692A (en) * | 1958-04-21 | 1967-04-11 | Armour Pharma | Method of inducing calming and muscle relaxation with carbamates |
| US3265728A (en) * | 1962-07-18 | 1966-08-09 | Armour Pharma | Substituted phenethyl carbamates |
| US5474990A (en) * | 1989-10-20 | 1995-12-12 | Olney; John W. | Barbiturates as safening agents in conjunction with NMDA antagonists |
| US5492930A (en) * | 1994-04-25 | 1996-02-20 | Schering Corporation | Method and formulation for treating CNS disorders |
| US5728728A (en) * | 1996-04-10 | 1998-03-17 | Kozachuk; Walter E. | Methods of providing neuroprotection |
| US6232434B1 (en) * | 1996-08-02 | 2001-05-15 | Duke University Medical Center | Polymers for delivering nitric oxide in vivo |
| EP1411917B1 (en) * | 2001-02-27 | 2007-08-08 | Ortho-McNeil Pharmaceutical, Inc. | Carbamate compounds for use in preventing or treating movement disorders |
| RU2300372C2 (ru) * | 2001-02-27 | 2007-06-10 | Орто-Макнейл Фармасьютикал, Инк. | Карбаматы для применения для предотвращения или лечения биполярного расстройства |
| DK1401424T3 (da) * | 2001-02-27 | 2007-02-26 | Ortho Mcneil Pharm Inc | Carbamatforbindelser til anvendelse ved forebyggelse eller behandling af psykotiske forstyrrelser |
-
2002
- 2002-02-21 DE DE60220043T patent/DE60220043T2/de not_active Expired - Lifetime
- 2002-02-21 PL PL02364680A patent/PL364680A1/xx unknown
- 2002-02-21 PT PT02714977T patent/PT1383489E/pt unknown
- 2002-02-21 HU HU0303264A patent/HUP0303264A3/hu unknown
- 2002-02-21 BR BR0207645-4A patent/BR0207645A/pt not_active Application Discontinuation
- 2002-02-21 NZ NZ527990A patent/NZ527990A/en unknown
- 2002-02-21 AT AT02714977T patent/ATE361745T1/de active
- 2002-02-21 RU RU2003128982/14A patent/RU2300373C2/ru not_active IP Right Cessation
- 2002-02-21 IL IL15759102A patent/IL157591A0/xx unknown
- 2002-02-21 DK DK02714977T patent/DK1383489T3/da active
- 2002-02-21 RS YUP-674/03A patent/RS51055B/sr unknown
- 2002-02-21 CZ CZ20032313A patent/CZ301203B6/cs not_active IP Right Cessation
- 2002-02-21 MX MXPA03007718A patent/MXPA03007718A/es active IP Right Grant
- 2002-02-21 KR KR1020037011302A patent/KR100910928B1/ko not_active Expired - Fee Related
- 2002-02-21 US US10/081,764 patent/US20020165273A1/en not_active Abandoned
- 2002-02-21 JP JP2002567292A patent/JP4276840B2/ja not_active Expired - Fee Related
- 2002-02-21 EP EP02714977A patent/EP1383489B1/en not_active Expired - Lifetime
- 2002-02-21 CN CNB028087178A patent/CN1235579C/zh not_active Expired - Fee Related
- 2002-02-21 WO PCT/US2002/005541 patent/WO2002067925A1/en not_active Ceased
- 2002-02-21 ES ES02714977T patent/ES2284845T3/es not_active Expired - Lifetime
- 2002-02-21 CA CA2439295A patent/CA2439295C/en not_active Expired - Fee Related
- 2002-02-27 MY MYPI20020697A patent/MY138156A/en unknown
- 2002-02-27 TW TW091103504A patent/TWI312679B/zh active
- 2002-02-27 AR ARP020100697A patent/AR035756A1/es unknown
-
2003
- 2003-08-26 NO NO20033798A patent/NO20033798L/no not_active Application Discontinuation
- 2003-08-26 IL IL157591A patent/IL157591A/en not_active IP Right Cessation
-
2004
- 2004-03-10 US US10/797,795 patent/US20040171679A1/en not_active Abandoned
-
2007
- 2007-07-24 CY CY20071100982T patent/CY1106753T1/el unknown
-
2008
- 2008-09-10 US US12/207,816 patent/US20090005442A1/en not_active Abandoned
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3278380A (en) * | 1962-02-06 | 1966-10-11 | Armour Pharma | Methods of calming employing diphenyl hydroxy carbamate compounds |
| RU2136670C1 (ru) * | 1994-02-03 | 1999-09-10 | Синтелябо | Производные 3-(2-аминоэтил)-4-[3-(трифторметил)бензоил]-3,4-дигидро-2h-1,4- бензоксазина, способ их получения и содержащий их фармацевтический состав |
| US6103759A (en) * | 1996-01-16 | 2000-08-15 | Sk Corporation | Halogen substituted carbamate compounds from 2-phenyl-1, 2-ethanediol |
Non-Patent Citations (2)
| Title |
|---|
| АЛЬТШУЛЕР В.Б. и др. Стандарты (модели протоколов) диагностики и лечения наркологических больных. Приказ №140 МЗ РФ от 28.04.1998 Найдено из Интернет: <URL: http://medi.net.ru/pract/standart/s01_a.shtml. CHEN D.M. Effects of sodium diethyldithiocarbamate on ischemia-reperfusion-induced brain injury in Mongolian gerbil. Zhongguo Yao Li Xue Bao. 1994 Sep; 15(5): 469-72. * |
| МАНЕЕЛОВ Л.С.Начальные проявления недостаточности кровоснабжения мозга (лечение, профилактика, трудоспособность). «Лечащий врач», 2000, №5-6. Найдено из Интернет: <URL: http://hghltd.yandex.com/. * |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2300373C2 (ru) | Карбаматы для предотвращения или лечения нейродегенеративных нарушений | |
| DE60107435T2 (de) | 2-adamantylethylamine und deren verwendung bei der behandlung von abnormalitäten in der glutamat transmission | |
| DE60221670T2 (de) | Carbamatverbindungen zur vorbeugung und behandlung von bewegungsstörungen | |
| RU2300372C2 (ru) | Карбаматы для применения для предотвращения или лечения биполярного расстройства | |
| DE60210960T2 (de) | Carbamat-verbindungen zur prävention oder behandlung von angstzuständen | |
| RU2302240C2 (ru) | Производные карбаматов для предотвращения или лечения психотических нарушений | |
| SK1962003A3 (en) | Carbamate compounds for use in preventing or treating neuropathic pain and cluster and migraine headache-associated pain | |
| EP1420772A2 (de) | Verwendung von beta-adrenozeptor-agonisten zur behandlung von neurodegenerativen erkrankungen | |
| MX2007004491A (es) | Compuestos de carbamato para utilizar en el tratamiento de padecimientos neurodegenerativos. | |
| AU2002247203B2 (en) | Carbamate compounds for use in preventing or treating neurodegenerative disordrers | |
| RU2303445C2 (ru) | Карбаматные соединения для применения для предотвращения или лечения невропатической боли и боли, связанной с кластерной и мигреневой головной болью | |
| DE60217493T2 (de) | Verwendung von carbamat-verbindungen zur prävention oder behandlung von neuropathischen schmerzen und migräneartigen kopfschmerzen | |
| HK1060516B (en) | Carbamate compounds for use in preventing or treating neurodegenerative disorders | |
| AU2002247203A1 (en) | Carbamate compounds for use in preventing or treating neurodegenerative disordrers | |
| WO2005049042A1 (en) | Combinations comprising ampa receptor antagonists for the treatment of tinnitus | |
| HK1065486B (en) | Carbamate compounds for use in preventing or treating neurodegenerative disorders |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20120222 |