RU2242991C2 - Способ лечения церебральных ишемий, а также применение эритропоэтина или производных эритропоэтина для лечения церебральных ишемий - Google Patents
Способ лечения церебральных ишемий, а также применение эритропоэтина или производных эритропоэтина для лечения церебральных ишемийInfo
- Publication number
- RU2242991C2 RU2242991C2 RU2001116077/14A RU2001116077A RU2242991C2 RU 2242991 C2 RU2242991 C2 RU 2242991C2 RU 2001116077/14 A RU2001116077/14 A RU 2001116077/14A RU 2001116077 A RU2001116077 A RU 2001116077A RU 2242991 C2 RU2242991 C2 RU 2242991C2
- Authority
- RU
- Russia
- Prior art keywords
- erythropoietin
- administered
- use according
- cerebral ischemia
- daily dose
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/22—Hormones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/18—Growth factors; Growth regulators
- A61K38/1816—Erythropoietin [EPO]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Zoology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Epidemiology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Immunology (AREA)
- Gastroenterology & Hepatology (AREA)
- Heart & Thoracic Surgery (AREA)
- Cardiology (AREA)
- Vascular Medicine (AREA)
- Neurosurgery (AREA)
- Neurology (AREA)
- Biomedical Technology (AREA)
- Urology & Nephrology (AREA)
- Endocrinology (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Saccharide Compounds (AREA)
- Steroid Compounds (AREA)
Abstract
Изобретение относится к области медицины, а именно к неврологии для лечения церебральных ишемий, а также к средству для лечения церебральных ишемий. Эритропоэтин вводят периферически в дозе от 5000 МЕ до 100000 МЕ. При этом в качестве эритропоэтина вводят нативный или рекомбинантный человеческий или животный эритропоэтин либо их производное. Способ позволяет снизить осложнения, что достигается за счет исключения травматического пути введения. 3 н. и 18 з.п. ф-лы, 2 ил.
Description
Настоящее изобретение относится к способу лечения церебральных ишемий, а также к средству для лечения церебральных ишемий у млекопитающих, в частности у человека, например, при их проявлении у пациентов, перенесших удар.
При ишемическом инфаркте мозга различают поврежденные области в зоне центра ишемии, а также в зоне полутени, так называемой Penumbra, окружающей центр. Размер центра ишемии плюс Penumbra определяют величину повреждения после ишемического инсульта.
Эритропоэтин, также обозначаемый сокращенно как “ЕРО”, представляет собой собственный гликопротеин организма с молекулярной массой от 30000 Дальтон (W.Jelkmann, “Eritropoietin: Structure, Control of Production, and Function”, Physiological Reviews, 1992, Band 72, Seiten 449-489). Он является существенным фактором роста для продукции эритроцитов и был впервые выделен еще в 1977 году.
Эритропоэтин уже в течение многих лет используют в клинической практике лечения пациентов с почечной анемией при нефродиализе, для получения увеличенного количества собственной крови перед запланированными операциями, а также он встречался в газетных заголовках как допинг.
Вместе с тем эритропоэтин, как обнаружено, оказался хорошо переносимым. В качестве существенных побочных действий можно назвать, в частности, часто терапевтически желаемую стимуляцию гемопоэза при эритроцитозе, а также изредка наблюдаемую артериальную гипертонию. Оба действия следует ожидать, главным образом, после продолжительного введения эритропоэтина. В случае необходимости их относительно легко можно устранить посредством медикаментозного лечения или кровопускания. Непереносимость или анафилактические реакции на эритропоэтин относятся к редким явлениям.
До настоящего времени не существует эффективной терапии церебральных ишемий, например, для лечения пациентов, перенесших удар, без операции на области головы пациента.
Sanaka M. et al. сообщают (PNAS 1998, Band 95, nr.8, S.4635-4640), что центральное введение эритропоэтина подопытным животным оказывает протективное действие на нейроны головного мозга. Поскольку известно, что более крупные белки не могут преодолевать гематоэнцефалический барьер, во всех опытах введение эритропоэтина проводили непосредственно центрально в латеральный желудочек. Однако такого рода непосредственное внутрижелудочковое введение эритропоэтина, то есть непосредственная инфузия эритропоэтина в ткань мозга для людей исключена из-за высоких рисков, которые связаны с установлением и поддержанием временного дренажа желудочка, например, инфекций или кровотечений.
DelMastro L. et al. сообщают (Oncologist 1998, 3/5, S.314-318), что профилактическое введение эритропоэтина предотвращает анемию у онкологических больных, подвергавшихся химиотерапевтическому лечению, и тем самым профилактически может снизить риск у таких пациентов в отношении церебральной ишемии как последствия анемии, вызванной химиотерапевтическим лечением. Терапия уже имеющейся церебральной ишемии, в частности, у пациентов, не подвергавшихся химиотерапевтическому лечению, в данном источнике информации не раскрыта.
Задача настоящего изобретения заключается в том, чтобы предложить способ лечения церебральных ишемий, средство для применения при лечении церебральных ишемий, а также средство для изготовления лекарства для лечения церебральных ишемий, которые являются простыми в применении и, по возможности, свободными от побочных действий и рисков.
Данная задача решается посредством способа по п.1, применения для изготовления лекарства по п.9, а также применения по п.17. Предпочтительные воплощения способа и применения по изобретению даны в соответствующих зависимых пунктах.
Дополнительным аспектом способа по изобретению и применения эритропоэтина по изобретению является то, что после наступившей ишемии, например, после удара, поврежденные церебральные ткани, в особенности Penumbra, нужно восстановить как можно раньше и как можно больше. Было обнаружено, что периферическое введение эритропоэтина оказывает выраженный протективный эффект на церебральную ткань, затронутую ишемией. Эритропоэтин действует при этом так, что область поврежденной церебральной ткани, особенно в Penumbra, интенсивно уменьшается по сравнению с традиционными процедурами, применяемыми при церебральной ишемии, без введения эритропоэтина.
Такое неожиданное действие периферически введенного эритропоэтина, восстанавливающего ткани при церебральной ишемии человека, не является очевидным уже потому, что эритропоэтин, как известно, является более крупным белком с молекулярной массой около 30000 Дальтон, который не в состоянии преодолеть гематоэнцефалический барьер. Непосредственное внутрижелудочковое введение эритропоэтина, то есть непосредственная инфузия эритропоэтина в ткань мозга для людей исключена из-за рисков, которые связаны с установлением и поддержанием временного дренажа желудочка, таких как инфекций и кровотечений.
Преимуществом настоящего изобретения является открытие и использование того факта, что неожиданно для лечения наступившей церебральной ишемии непосредственно после повреждающего события можно периферически вводить эритропоэтин в качестве лекарства, после чего он переходит в поврежденную область мозга и становится активным.
Периферическое введение эритропоэтина, то есть по эту сторону гематоэнцефалического барьера, предпочтительно осуществлять внутримышечно или в сосудистую систему. Для того чтобы доставить эритропоэтин к поврежденной церебральной ткани в высокой дозе за короткое время, то есть настолько быстро, насколько это возможно после повреждающего события, предложено прямо непосредственное введение в сосудистую систему, которое следует осуществлять известными предпочтительными для лекарств способами, в большинстве случаев внутривенно.
Отсюда следует, что эритропоэтин может преодолевать гематоэнцефалический барьер в поврежденной области непосредственно после повреждения ткани мозга ишемией. Поэтому можно вводить лекарство, содержащее эритропоэтин, например, пациентам, перенесшим удар, при этом эритропоэтин действительно достигает поврежденной ткани мозга.
Таким образом, впервые предложено эффективное лекарственное средство для церебральной ишемии у млекопитающих, в частности у человека, например, при ударе.
Кроме того, еще одним преимуществом является то, что интактный гематоэнцефалический барьер в неповрежденной области церебральных тканей активно препятствует проникновению не нужного там эритропоэтина, и поэтому область тканей, не затронутых ишемическим инфарктом, не подвергается терапии, таким образом, побочные действия могут проявляться либо в значительно меньшей степени, либо не проявляться совсем.
Предпочтительно эритропоэтин применяют как лекарство в дозировке от 5000 до 100000 единиц, оптимально от 35000 единиц на одно введение, по возможности одно введение в день в первые дни, а в первый раз по возможности в пределах 8 часов после удара. При этом, чтобы добиться терапевтического эффекта, достаточно нескольких введений эритропоэтина. Еще одним преимуществом является то, что побочные действия и риски, наблюдаемые, главным образом, при продолжительном непрерывном лечении иных картин болезни, согласно описанному выше уровню техники, при применении эритропоэтина для лечения церебральной ишемии или не проявляются вовсе, или они незначительны.
Эритропоэтин известен из уровня техники. Человеческий эритропоэтин впервые был выделен из мочи (Т.Miyake et al. 1977, J.Biol.Chem., Bd.252, S.5558-5564). В настоящее время его получают путем технологии рекомбинантной ДНК. Этим способом его можно получать в значительных количествах и применять согласно данному изобретению. Для применения по изобретению можно использовать также дополнительные варианты эритропоэтина с измененными аминокислотными последовательностями или структурами либо также фрагменты с участками последовательности, функционально релевантными биологической функции эритропоэтина, и они также будут подпадать под понятие "эритропоэтин", как оно используется в этой заявке. Кроме того, разнообразные варианты эритропоэтина, применяемого по изобретению, получают в результате превращений при гликозилировании эритропоэтина.
Поэтому, к эритропоэтину, применяемому по изобретению, можно отнести в том числе и человеческий эритропоэтин, такой как получаемый естественным образом, а также продукты эритропоэтина или аналоги эритропоэтина (в общем случае варианты или производные эритропоэтина), которые являются результатом превращений природного человеческого эритропоэтина, например, модификациями последовательности, такими как делеции или замены, а также изменением углеводного состава. Продукты эритропоэтина подобного рода могут быть получены различными способами. Такие способы получения вариантов эритропоэтина, производных эритропоэтина или аналогов эритропоэтина, предназначенных для способа по изобретению, описаны, например, в заявках на патент WO 86/03520, WO 85/02610, WO 90/11354, WO 91/06667, WO 91/09955, WO 93/09222, WO 94/12650, WO 95/31560 и WO 95/05465, раскрытие которых полностью включено в настоящую заявку на патент путем ссылки на них и должно быть включено в настоящую заявку.
Далее приведены примеры способа по настоящему изобретению и применений по настоящему изобретению.
Фиг.1 демонстрирует появление эритропоэтина в сыворотке и цереброспинальной жидкости после удара, а фиг.2 иллюстрирует размер повреждения после церебральной ишемии.
На фиг.1А приведено среднее значение концентрации в сыворотке, то есть периферической концентрации эритропоэтина через несколько дней, у четырех пациентов с ударом, которым приблизительно через 8 часов, приблизительно через 24 часа и еще раз приблизительно через 48 часов после удара каждый раз внутривенно вводили дозу 35000 ME (международных единиц) человеческого рекомбинантного эритропоэтина (препарат “Neorecormon” фирмы Hoffmann-LaRoche AG). Видно, что концентрация в сыворотке в течение первого дня достигает своего максимума и затем снова резко падает.
На фиг.2Б представлены концентрации эритропоэтина у шести пациентов контрольной группы с неишемическими неврологическими заболеваниями (“контроли неврологических заболеваний”) после инфузии эритропоэтина, у двух не подвергавшихся лечению пациентов, перенесших удар (“контроли удара”), без инфузии эритропоэтина, а также у четырех пациентов, перенесших удар (“ЕРО-пациенты”), после инфузии эритропоэтина, как и у пациентов контрольной группы. При этом представлено среднее значение концентрации эритропоэтина в цереброспинальной жидкости, как оно было определено в среднем через 6,4 часа после первой инфузии 35000 ME человеческого рекомбинантного эритропоэтина (препарат “Neorecormon” фирмы Hoffmann-LaRoche AG). Речь идет о тех же четырех пациентах, перенесших удар (ЕРО-пациенты), как и на фиг.1А.
Принимая во внимание использованную логарифмическую шкалу изображения на фиг.1Б, сразу понятно, что концентрация эритропоэтина в цереброспинальной жидкости у пациентов, перенесших удар (“ЕРО-пациенты”), приблизительно в 100 раз выше, чем концентрация эритропоэтина у подвергнутых лечению таким же образом пациентов контрольной группы (“контроли неврологических заболеваний”), а также не подвергнутых лечению пациентов, перенесших удар (“контроли удара”).
Преимуществом настоящего изобретения является то, что в случае церебральной ишемии гематоэнцефалический барьер становится проницаемым для эритропоэтина, так что для лечения церебральной ишемии непосредственно после повреждающего события эритропоэтин периферически как лекарство переходит в поврежденную область мозга и становится активным.
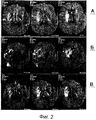
На фиг.2 показана область повреждения после удара у 73-летнего пациента. Представленные снимки получены посредством ядерно-магнитной резонансной спектроскопии (“диффузионно-взвешенная ЯМР-томография”).
Приблизительно через 8 часов после удара пациенту внутривенно вводили 35000 ME человеческого рекомбинантного эритропоэтина (препарат “Neorecormon” фирмы Hoffmann-LaRoche”). Приблизительно через 24 часа и 48 часов после удара, соответственно, вводили дополнительные равные высокие дозы эритропоэтина.
На фиг.2А показаны в разрезе три вида снизу головного мозга пациента в течение периода лечения, приблизительно через 7 часов после удара.
Поврежденные ударом области можно отчетливо увидеть по выделяющей их белой окраске.
На фиг.2Б поврежденные области приблизительно через 3 дня после удара можно также увидеть по их беловатой окраске (с темным центром).
На фиг.2В показаны в разрезе те же виды после 18 дней. Отчетливо можно увидеть, что произошло заметное восстановление первичного повреждения. Это восстановление ишемической области инфаркта нужно приписать, среди прочего, лечению эритропоэтином.
Claims (21)
1. Способ лечения церебральных ишемий у млекопитающего после удара, отличающийся тем, что эритропоэтин вводят периферически.
2. Способ по п.1, отличающийся тем, что осуществляют введение в сосудистую систему.
3. Способ по п.2, отличающийся тем, что осуществляют внутривенное введение.
4. Способ по одному из пп.1-3, отличающийся тем, что эритропоэтин вводят в разовой и/или суточной дозе от 5000 до 100000 МЕ.
5. Способ по одному из пп.1-4, отличающийся тем, что эритропоэтин вводят в разовой и/или суточной дозе от 35000 МЕ.
6. Способ по одному из пп.1-5, отличающийся тем, что в качестве эритропоэтина вводят нативный или рекомбинантный человеческий или животный эритропоэтин либо их производное.
7. Способ по одному из пп.1-6, отличающийся тем, что в качестве млекопитающего лечат человека.
8. Применение эритропоэтина для изготовления периферически вводимого лекарства для лечения церебральных ишемий у млекопитающих после удара.
9. Применение по п.8 для изготовления лекарства, вводимого в сосудистую систему.
10. Применение по п.9 для изготовления лекарства, вводимого внутривенно.
11. Применение по одному из пп.8-10 в разовой и/или суточной дозе от 5000 до 100000 МЕ.
12. Применение по одному из пп.8-11 в разовой и/или суточной дозе от 35000 МЕ.
13. Применение по одному из пп.8-12, отличающееся тем, что в качестве эритропоэтина используют нативный или рекомбинантный человеческий или животный эритропоэтин либо их производное.
14. Применение по одному из пп.8-13, отличающееся тем, что млекопитающее представляет собой человека.
15. Применение эритропоэтина в качестве периферически вводимого средства для лечения церебральных ишемий у млекопитающего после удара.
16. Применение по п.15 в качестве средства, вводимого в сосудистую систему.
17. Применение по п.16 в качестве средства, вводимого внутривенно.
18. Применение по одному из пп.15-17 в разовой и/или суточной дозе от 5000 до 100000 МЕ.
19. Применение по одному из пп.15-18 в разовой и/или суточной дозе от 35000 МЕ.
20. Применение по одному из пп.15-19, отличающееся тем, что в качестве эритропоэтина используют нативный или рекомбинантный человеческий или животный эритропоэтин либо их производное.
21. Применение по одному из пп.15-20, отличающееся тем, что млекопитающее представляет собой человека.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE19857609.9 | 1998-12-14 | ||
| DE19857609A DE19857609A1 (de) | 1998-12-14 | 1998-12-14 | Verwendung von Erythropoietin zur Behandlung von cerebralen Ischämien des Menschen |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2001116077A RU2001116077A (ru) | 2003-05-20 |
| RU2242991C2 true RU2242991C2 (ru) | 2004-12-27 |
Family
ID=7891015
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2001116077/14A RU2242991C2 (ru) | 1998-12-14 | 1999-12-13 | Способ лечения церебральных ишемий, а также применение эритропоэтина или производных эритропоэтина для лечения церебральных ишемий |
Country Status (26)
| Country | Link |
|---|---|
| US (1) | US7514072B1 (ru) |
| EP (1) | EP1140139B2 (ru) |
| JP (2) | JP4750947B2 (ru) |
| KR (1) | KR100774827B1 (ru) |
| CN (1) | CN1187085C (ru) |
| AT (1) | ATE253932T1 (ru) |
| AU (1) | AU766216C (ru) |
| BG (1) | BG65417B1 (ru) |
| BR (1) | BR9916197A (ru) |
| CA (1) | CA2353553C (ru) |
| DE (2) | DE19857609A1 (ru) |
| DK (1) | DK1140139T4 (ru) |
| ES (1) | ES2211218T5 (ru) |
| HK (1) | HK1042655B (ru) |
| HU (1) | HUP0104709A3 (ru) |
| ID (1) | ID29107A (ru) |
| IL (2) | IL143579A0 (ru) |
| MX (1) | MXPA01005971A (ru) |
| NO (1) | NO330079B1 (ru) |
| NZ (1) | NZ541591A (ru) |
| PL (1) | PL202483B1 (ru) |
| PT (1) | PT1140139E (ru) |
| RO (1) | RO121409B1 (ru) |
| RU (1) | RU2242991C2 (ru) |
| WO (1) | WO2000035475A2 (ru) |
| ZA (1) | ZA200104626B (ru) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2446834C2 (ru) * | 2010-06-15 | 2012-04-10 | Елена Александровна Лебедева | Способ лечения пострадавших с сочетанной черепно-мозговой травмой |
Families Citing this family (32)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE19857609A1 (de) | 1998-12-14 | 2000-06-15 | Hannelore Ehrenreich | Verwendung von Erythropoietin zur Behandlung von cerebralen Ischämien des Menschen |
| US7345019B1 (en) | 1999-04-13 | 2008-03-18 | The Kenneth S. Warren Institute, Inc. | Modulation of excitable tissue function by peripherally administered erythropoietin |
| US7309687B1 (en) | 1999-04-13 | 2007-12-18 | The Kenneth S. Warren Institute, Inc. | Methods for treatment and prevention of neuromuscular and muscular conditions by peripherally administered erythropoietin |
| NZ533098A (en) * | 1999-04-13 | 2006-04-28 | Kenneth S | Modulation of excitable tissue function by peripherally administered erythropoietin at high doses |
| US7078376B1 (en) | 2000-08-11 | 2006-07-18 | Baxter Healthcare S.A. | Therapeutic methods for treating subjects with a recombinant erythropoietin having high activity and reduced side effects |
| DE10043457A1 (de) * | 2000-09-04 | 2002-03-28 | Hannelore Ehrenreich | Verfahren zur Behandlung von Schizophrenie und verwandten Psychosen sowie Verwendung von Erythropoietin oder Erythropoietinderivaten zur Behandlung von Schizophrenien und verwandten Psychosen |
| PA8536201A1 (es) * | 2000-12-29 | 2002-08-29 | Kenneth S Warren Inst Inc | Protección y mejoramiento de células, tejidos y órganos que responden a la eritropoyetina |
| US6531121B2 (en) | 2000-12-29 | 2003-03-11 | The Kenneth S. Warren Institute, Inc. | Protection and enhancement of erythropoietin-responsive cells, tissues and organs |
| US20030072737A1 (en) | 2000-12-29 | 2003-04-17 | Michael Brines | Tissue protective cytokines for the protection, restoration, and enhancement of responsive cells, tissues and organs |
| US7767643B2 (en) | 2000-12-29 | 2010-08-03 | The Kenneth S. Warren Institute, Inc. | Protection, restoration, and enhancement of erythropoietin-responsive cells, tissues and organs |
| AU2002325712C1 (en) | 2001-08-30 | 2008-07-31 | Stem Cell Therapeutics Inc. | Differentiation of neural stem cells and therapeutic use theeof |
| AR036401A1 (es) | 2001-09-14 | 2004-09-08 | Stem Cell Therapeutics Inc | Incremento de la cantidad de celulas madre neuronales inducido por prolactina. |
| DE10219545A1 (de) * | 2002-04-26 | 2003-11-06 | Lang Florian | Regulation der Apoptose |
| JP2005534650A (ja) * | 2002-06-11 | 2005-11-17 | ザ バーナム インスティテュート | エリスロポイエチンおよびインスリン様増殖因子の神経保護的相乗作用 |
| DE10234192B4 (de) | 2002-07-26 | 2009-11-26 | Epoplus Gmbh Co.Kg | Verwendung von Erythropoetin |
| NZ542092A (en) * | 2003-03-27 | 2008-04-30 | Janssen Pharmaceutica Nv | Use of erythropoietin (EPO) in stroke recovery wherein the EPO is formulated for administration for a particular dosage regime |
| US7718363B2 (en) | 2003-04-25 | 2010-05-18 | The Kenneth S. Warren Institute, Inc. | Tissue protective cytokine receptor complex and assays for identifying tissue protective compounds |
| US20070111932A1 (en) * | 2003-07-31 | 2007-05-17 | Stem Cell Therapeutics Inc. | Method of enhancing and/or inducing neuronal migration using erythropoietin |
| EP1670492A4 (en) | 2003-09-29 | 2009-07-08 | Warren Pharmaceuticals Inc | FABRIC PROTECTION CYTOKINES FOR THE TREATMENT AND PREVENTION OF SEPTICEMIA AND THE FORMATION OF ADHESIONS |
| CN1870980B (zh) | 2003-10-23 | 2010-06-23 | 大冢制药株式会社 | 控释无菌阿立哌唑注射剂和方法 |
| CA2556266A1 (en) | 2004-02-13 | 2005-08-25 | Stem Cell Therapeutics Corp. | Use of luteinizing hormone (lh), and chorionic gonadotropin (hcg) for proliferation of neural stem cells and neurogenesis |
| US9988427B2 (en) | 2005-05-13 | 2018-06-05 | Charite Universitaetsmedizen-Berlin | Erythropoietin variants |
| EP1736481A1 (en) | 2005-05-13 | 2006-12-27 | Charite Universitätsmedizin-Berlin | Erythropoietin variants |
| EP1933814A2 (en) * | 2005-09-15 | 2008-06-25 | Elan Pharma International Limited | Nanoparticulate aripiprazole formulations |
| AU2006297041A1 (en) | 2005-09-27 | 2007-04-05 | Stem Cell Therapeutics Corp. | Oligodendrocyte precursor cell proliferation regulated by prolactin |
| JP2009530234A (ja) * | 2006-03-17 | 2009-08-27 | ステム セル セラピューティクス コーポレイション | 神経変性疾患の治療のためのlhまたはhcg、およびepoについての投与レジメン |
| WO2007142288A1 (ja) * | 2006-06-07 | 2007-12-13 | The University Of Tokushima | エリスロポエチンを用いた虚血性疾患の治療 |
| BRPI0815382A2 (pt) * | 2007-07-31 | 2015-02-10 | Otsuka Pharma Co Ltd | Métodos para a produção de suspensão de aripiprazol e formulação de secagem por congelamento |
| US9956265B2 (en) | 2011-04-26 | 2018-05-01 | Ajou University Industry-Academic Cooperation Foundation | Composition for aiding surgical procedures for treating ischemic vascular diseases |
| RU2495688C1 (ru) * | 2012-03-28 | 2013-10-20 | Государственное бюджетное учреждение здравоохранения Центр организации специализированной медицинской помощи "Челябинский государственный институт лазерной хирургии" | Способ лечения ишемии головного мозга в эксперименте |
| US9610444B2 (en) | 2013-03-15 | 2017-04-04 | Pacesetter, Inc. | Erythropoeitin production by electrical stimulation |
| KR20190052855A (ko) | 2017-11-09 | 2019-05-17 | 대한제당 주식회사 | 페길레이션된 에리스로포이에틴을 포함하는 허혈성 뇌질환 치료용 조성물 |
Family Cites Families (22)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| NZ210501A (en) | 1983-12-13 | 1991-08-27 | Kirin Amgen Inc | Erythropoietin produced by procaryotic or eucaryotic expression of an exogenous dna sequence |
| JPS6197229A (ja) | 1984-10-18 | 1986-05-15 | Chugai Pharmaceut Co Ltd | 安定なエリトロポエチン製剤 |
| IL77081A (en) | 1984-12-04 | 1999-10-28 | Genetics Inst | AND sequence encoding human erythropoietin, a process for its preparation and a pharmacological preparation of human erythropoietin |
| US5013718A (en) * | 1986-11-21 | 1991-05-07 | Amgen, Inc. | Method for treating iron overload using EPO |
| FR2646438B1 (fr) | 1989-03-20 | 2007-11-02 | Pasteur Institut | Procede de remplacement specifique d'une copie d'un gene present dans le genome receveur par l'integration d'un gene different de celui ou se fait l'integration |
| EP0747485B1 (en) | 1989-11-06 | 1998-12-02 | Cell Genesys, Inc. | Production of proteins using homologous recombination |
| ES2151463T5 (es) | 1989-12-22 | 2012-10-29 | Merck Serono Sa | Constructos de ADN para la activación y la modificación de la expresión de genes endógenos |
| US5750376A (en) | 1991-07-08 | 1998-05-12 | Neurospheres Holdings Ltd. | In vitro growth and proliferation of genetically modified multipotent neural stem cells and their progeny |
| US5641670A (en) | 1991-11-05 | 1997-06-24 | Transkaryotic Therapies, Inc. | Protein production and protein delivery |
| PT101031B (pt) | 1991-11-05 | 2002-07-31 | Transkaryotic Therapies Inc | Processo para o fornecimento de proteinas por terapia genetica |
| JP3537151B2 (ja) * | 1991-12-26 | 2004-06-14 | 中外製薬株式会社 | 脳機能障害による疾患の予防・治療薬 |
| US5614184A (en) | 1992-07-28 | 1997-03-25 | New England Deaconess Hospital | Recombinant human erythropoietin mutants and therapeutic methods employing them |
| US5661125A (en) | 1992-08-06 | 1997-08-26 | Amgen, Inc. | Stable and preserved erythropoietin compositions |
| TW402639B (en) | 1992-12-03 | 2000-08-21 | Transkaryotic Therapies Inc | Protein production and protein delivery |
| HUT73876A (en) | 1993-04-29 | 1996-10-28 | Abbott Lab | Erythropoietin analog compositions and methods |
| IL110669A (en) | 1993-08-17 | 2008-11-26 | Kirin Amgen Inc | Erythropoietin analogs |
| SE520730C2 (sv) | 1995-01-20 | 2003-08-19 | Eskil Elmer | Behandling av hjärnischemi och hjärnskador med ett neuroprotektivt läkemedel |
| US6121246A (en) * | 1995-10-20 | 2000-09-19 | St. Elizabeth's Medical Center Of Boston, Inc. | Method for treating ischemic tissue |
| US6165783A (en) | 1997-10-24 | 2000-12-26 | Neuro Spheres Holdings Ltd. | Erythropoietin-mediated neurogenesis |
| DE19857609A1 (de) | 1998-12-14 | 2000-06-15 | Hannelore Ehrenreich | Verwendung von Erythropoietin zur Behandlung von cerebralen Ischämien des Menschen |
| NZ533098A (en) | 1999-04-13 | 2006-04-28 | Kenneth S | Modulation of excitable tissue function by peripherally administered erythropoietin at high doses |
| US20030072737A1 (en) | 2000-12-29 | 2003-04-17 | Michael Brines | Tissue protective cytokines for the protection, restoration, and enhancement of responsive cells, tissues and organs |
-
1998
- 1998-12-14 DE DE19857609A patent/DE19857609A1/de not_active Ceased
-
1999
- 1999-12-13 US US09/868,089 patent/US7514072B1/en not_active Expired - Fee Related
- 1999-12-13 AT AT99966958T patent/ATE253932T1/de active
- 1999-12-13 ES ES99966958T patent/ES2211218T5/es not_active Expired - Lifetime
- 1999-12-13 CA CA2353553A patent/CA2353553C/en not_active Expired - Fee Related
- 1999-12-13 KR KR1020017007421A patent/KR100774827B1/ko not_active IP Right Cessation
- 1999-12-13 JP JP2000587794A patent/JP4750947B2/ja not_active Expired - Fee Related
- 1999-12-13 CN CNB998160474A patent/CN1187085C/zh not_active Expired - Fee Related
- 1999-12-13 NZ NZ541591A patent/NZ541591A/en not_active IP Right Cessation
- 1999-12-13 EP EP99966958A patent/EP1140139B2/de not_active Expired - Lifetime
- 1999-12-13 AU AU22831/00A patent/AU766216C/en not_active Ceased
- 1999-12-13 PT PT99966958T patent/PT1140139E/pt unknown
- 1999-12-13 WO PCT/EP1999/009864 patent/WO2000035475A2/de not_active Application Discontinuation
- 1999-12-13 RO ROA200100684A patent/RO121409B1/ro unknown
- 1999-12-13 PL PL349335A patent/PL202483B1/pl not_active IP Right Cessation
- 1999-12-13 MX MXPA01005971A patent/MXPA01005971A/es active IP Right Grant
- 1999-12-13 IL IL14357999A patent/IL143579A0/xx active IP Right Grant
- 1999-12-13 HU HU0104709A patent/HUP0104709A3/hu unknown
- 1999-12-13 DE DE59907752T patent/DE59907752D1/de not_active Expired - Lifetime
- 1999-12-13 ID IDW00200101535A patent/ID29107A/id unknown
- 1999-12-13 BR BR9916197-4A patent/BR9916197A/pt not_active Application Discontinuation
- 1999-12-13 DK DK99966958T patent/DK1140139T4/da active
- 1999-12-13 RU RU2001116077/14A patent/RU2242991C2/ru not_active IP Right Cessation
-
2001
- 2001-06-05 IL IL143579A patent/IL143579A/en not_active IP Right Cessation
- 2001-06-06 ZA ZA200104626A patent/ZA200104626B/en unknown
- 2001-06-07 BG BG105575A patent/BG65417B1/bg unknown
- 2001-06-12 NO NO20012896A patent/NO330079B1/no not_active IP Right Cessation
-
2002
- 2002-06-17 HK HK02104485.2A patent/HK1042655B/zh not_active IP Right Cessation
-
2010
- 2010-12-20 JP JP2010283105A patent/JP2011079860A/ja not_active Withdrawn
Non-Patent Citations (1)
| Title |
|---|
| SAKANAKA М. et. al. In vivo evidence that erithopoietin hrotects neurons from ischemia damage" in Proc. Natl. Acad. Sci USA. - 1998, Apr 14; 98(8):4635-40 найдено: http: //www.ncbi.nlm. gov/е.../query.fcgi? cmd=Retieve & db=PabMed & listuids=9539790 & dort=Abstrac 16.06.2003. * |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2446834C2 (ru) * | 2010-06-15 | 2012-04-10 | Елена Александровна Лебедева | Способ лечения пострадавших с сочетанной черепно-мозговой травмой |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2242991C2 (ru) | Способ лечения церебральных ишемий, а также применение эритропоэтина или производных эритропоэтина для лечения церебральных ишемий | |
| US20040209812A1 (en) | Use of erythropoietin in stroke recovery | |
| EP0814828B1 (en) | Method of preparation a therapeutic agent for the regeneration of oligodendrocytes | |
| MXPA05002617A (es) | Eritropoyetinas de accion prolongada que mantienen la actividad protectora de tejidos de la eritropoyetina endogena. | |
| US20060166885A1 (en) | Treatment and prevention of decubitus | |
| US5830857A (en) | Method of treating epilepsy | |
| EP0878200B1 (en) | Therapeutic agent for ophthalmic diseases | |
| JPH03190823A (ja) | エリスロポエチン皮下又は筋肉投与剤 | |
| CN109865127B (zh) | 经修饰的胸腺素β4在治疗糖尿病周围神经病变方面的用途 | |
| US6210697B1 (en) | Medicament for hypothermia treatment | |
| CN115944713A (zh) | 一种神经营养因子和穿透肽组合物及其应用 | |
| EP1737484A1 (en) | Combination dosing regimen for erythropoietin | |
| ZA200508695B (en) | Use of erythropoietin in stroke recovery |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20121214 |