RU2234937C2 - Способ клеточной адгезии и заживления ран - Google Patents
Способ клеточной адгезии и заживления ран Download PDFInfo
- Publication number
- RU2234937C2 RU2234937C2 RU2002133463/15A RU2002133463A RU2234937C2 RU 2234937 C2 RU2234937 C2 RU 2234937C2 RU 2002133463/15 A RU2002133463/15 A RU 2002133463/15A RU 2002133463 A RU2002133463 A RU 2002133463A RU 2234937 C2 RU2234937 C2 RU 2234937C2
- Authority
- RU
- Russia
- Prior art keywords
- βig
- fas
- cell
- domain
- cells
- Prior art date
Links
- 206010052428 Wound Diseases 0.000 title claims abstract description 50
- 208000027418 Wounds and injury Diseases 0.000 title claims abstract description 50
- 238000000034 method Methods 0.000 title claims abstract description 20
- 230000035876 healing Effects 0.000 title abstract description 8
- 230000001413 cellular effect Effects 0.000 title abstract description 3
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 claims abstract description 53
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 claims abstract description 53
- 108090000623 proteins and genes Proteins 0.000 claims abstract description 32
- 102000004169 proteins and genes Human genes 0.000 claims abstract description 30
- 241000588724 Escherichia coli Species 0.000 claims abstract description 11
- 239000013598 vector Substances 0.000 claims abstract description 4
- 125000003275 alpha amino acid group Chemical group 0.000 claims abstract 10
- 210000004027 cell Anatomy 0.000 claims description 74
- 101000802895 Dendroaspis angusticeps Fasciculin-1 Proteins 0.000 claims description 59
- 230000029663 wound healing Effects 0.000 claims description 44
- 239000013604 expression vector Substances 0.000 claims description 13
- 239000007787 solid Substances 0.000 claims description 7
- 241000672609 Escherichia coli BL21 Species 0.000 claims description 5
- 239000011248 coating agent Substances 0.000 claims description 4
- 238000000576 coating method Methods 0.000 claims description 4
- 241000124008 Mammalia Species 0.000 claims description 3
- 102000014914 Carrier Proteins Human genes 0.000 claims description 2
- 108010078791 Carrier Proteins Proteins 0.000 claims description 2
- 210000004962 mammalian cell Anatomy 0.000 claims description 2
- 239000000203 mixture Substances 0.000 claims 1
- 230000000694 effects Effects 0.000 abstract description 68
- 108090000765 processed proteins & peptides Proteins 0.000 abstract description 15
- 230000007480 spreading Effects 0.000 abstract description 14
- 238000003892 spreading Methods 0.000 abstract description 14
- 102000004196 processed proteins & peptides Human genes 0.000 abstract description 11
- 239000003814 drug Substances 0.000 abstract description 3
- 238000000926 separation method Methods 0.000 abstract description 3
- 230000008901 benefit Effects 0.000 abstract description 2
- 239000000126 substance Substances 0.000 abstract 1
- 230000021164 cell adhesion Effects 0.000 description 51
- 230000004956 cell adhesive effect Effects 0.000 description 41
- 235000018102 proteins Nutrition 0.000 description 28
- 150000001413 amino acids Chemical class 0.000 description 25
- IYMAXBFPHPZYIK-BQBZGAKWSA-N Arg-Gly-Asp Chemical compound NC(N)=NCCC[C@H](N)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(O)=O IYMAXBFPHPZYIK-BQBZGAKWSA-N 0.000 description 24
- 108010067306 Fibronectins Proteins 0.000 description 23
- 102000016359 Fibronectins Human genes 0.000 description 23
- 238000012360 testing method Methods 0.000 description 22
- 108010044426 integrins Proteins 0.000 description 19
- 102000006495 integrins Human genes 0.000 description 19
- 229940024606 amino acid Drugs 0.000 description 17
- 235000001014 amino acid Nutrition 0.000 description 17
- 108010035532 Collagen Proteins 0.000 description 16
- 102000008186 Collagen Human genes 0.000 description 16
- 229920001436 collagen Polymers 0.000 description 16
- 230000015572 biosynthetic process Effects 0.000 description 15
- 108700006666 betaIG-H3 Proteins 0.000 description 14
- 241000700159 Rattus Species 0.000 description 13
- 239000000835 fiber Substances 0.000 description 13
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 11
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 11
- 239000003883 ointment base Substances 0.000 description 11
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 11
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 10
- 230000006870 function Effects 0.000 description 10
- 239000002674 ointment Substances 0.000 description 10
- 229920001661 Chitosan Polymers 0.000 description 9
- 229960000310 isoleucine Drugs 0.000 description 9
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 9
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 8
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 8
- 235000003704 aspartic acid Nutrition 0.000 description 8
- 229960005261 aspartic acid Drugs 0.000 description 8
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 8
- 238000001962 electrophoresis Methods 0.000 description 8
- 239000012634 fragment Substances 0.000 description 8
- 238000004458 analytical method Methods 0.000 description 7
- 210000002950 fibroblast Anatomy 0.000 description 7
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 7
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 6
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 6
- 102000008300 Mutant Proteins Human genes 0.000 description 6
- 108010021466 Mutant Proteins Proteins 0.000 description 6
- 150000001768 cations Chemical class 0.000 description 6
- 239000002299 complementary DNA Substances 0.000 description 6
- 230000003247 decreasing effect Effects 0.000 description 6
- 238000002474 experimental method Methods 0.000 description 6
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 6
- 230000002401 inhibitory effect Effects 0.000 description 6
- 239000000463 material Substances 0.000 description 6
- 230000001404 mediated effect Effects 0.000 description 6
- 230000003287 optical effect Effects 0.000 description 6
- 102000005962 receptors Human genes 0.000 description 6
- 108020003175 receptors Proteins 0.000 description 6
- 238000006467 substitution reaction Methods 0.000 description 6
- 210000001519 tissue Anatomy 0.000 description 6
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 5
- 102000004190 Enzymes Human genes 0.000 description 5
- 108090000790 Enzymes Proteins 0.000 description 5
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 5
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 5
- 102000007547 Laminin Human genes 0.000 description 5
- 108010085895 Laminin Proteins 0.000 description 5
- 108010031318 Vitronectin Proteins 0.000 description 5
- 102100035140 Vitronectin Human genes 0.000 description 5
- 239000000872 buffer Substances 0.000 description 5
- 239000002131 composite material Substances 0.000 description 5
- 230000001419 dependent effect Effects 0.000 description 5
- 238000009826 distribution Methods 0.000 description 5
- 239000003446 ligand Substances 0.000 description 5
- 239000011780 sodium chloride Substances 0.000 description 5
- 239000000243 solution Substances 0.000 description 5
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 4
- 102000000844 Cell Surface Receptors Human genes 0.000 description 4
- 108010001857 Cell Surface Receptors Proteins 0.000 description 4
- 102000012422 Collagen Type I Human genes 0.000 description 4
- 108010022452 Collagen Type I Proteins 0.000 description 4
- 241000195493 Cryptophyta Species 0.000 description 4
- 102100037765 Periostin Human genes 0.000 description 4
- 101710199268 Periostin Proteins 0.000 description 4
- 230000033115 angiogenesis Effects 0.000 description 4
- 229940098773 bovine serum albumin Drugs 0.000 description 4
- 230000024245 cell differentiation Effects 0.000 description 4
- 239000003153 chemical reaction reagent Substances 0.000 description 4
- 230000007423 decrease Effects 0.000 description 4
- 238000010586 diagram Methods 0.000 description 4
- 230000002500 effect on skin Effects 0.000 description 4
- 210000005081 epithelial layer Anatomy 0.000 description 4
- 210000000981 epithelium Anatomy 0.000 description 4
- 239000003102 growth factor Substances 0.000 description 4
- 238000011534 incubation Methods 0.000 description 4
- 238000005259 measurement Methods 0.000 description 4
- 239000013612 plasmid Substances 0.000 description 4
- 230000004936 stimulating effect Effects 0.000 description 4
- 239000000758 substrate Substances 0.000 description 4
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 108060003393 Granulin Proteins 0.000 description 3
- 102000002268 Hexosaminidases Human genes 0.000 description 3
- 108010000540 Hexosaminidases Proteins 0.000 description 3
- 108010072255 Integrin alpha3beta1 Proteins 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- 229920002684 Sepharose Polymers 0.000 description 3
- 230000001070 adhesive effect Effects 0.000 description 3
- 108010072041 arginyl-glycyl-aspartic acid Proteins 0.000 description 3
- 238000003556 assay Methods 0.000 description 3
- 210000004899 c-terminal region Anatomy 0.000 description 3
- 230000010261 cell growth Effects 0.000 description 3
- 230000004663 cell proliferation Effects 0.000 description 3
- 210000002510 keratinocyte Anatomy 0.000 description 3
- 230000007246 mechanism Effects 0.000 description 3
- 108020004999 messenger RNA Proteins 0.000 description 3
- 230000037311 normal skin Effects 0.000 description 3
- 229920000642 polymer Polymers 0.000 description 3
- 239000011347 resin Substances 0.000 description 3
- 229920005989 resin Polymers 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- CPKVUHPKYQGHMW-UHFFFAOYSA-N 1-ethenylpyrrolidin-2-one;molecular iodine Chemical compound II.C=CN1CCCC1=O CPKVUHPKYQGHMW-UHFFFAOYSA-N 0.000 description 2
- VZSRBBMJRBPUNF-UHFFFAOYSA-N 2-(2,3-dihydro-1H-inden-2-ylamino)-N-[3-oxo-3-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)propyl]pyrimidine-5-carboxamide Chemical compound C1C(CC2=CC=CC=C12)NC1=NC=C(C=N1)C(=O)NCCC(N1CC2=C(CC1)NN=N2)=O VZSRBBMJRBPUNF-UHFFFAOYSA-N 0.000 description 2
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 2
- SLXKOJJOQWFEFD-UHFFFAOYSA-N 6-aminohexanoic acid Chemical compound NCCCCCC(O)=O SLXKOJJOQWFEFD-UHFFFAOYSA-N 0.000 description 2
- 102000004127 Cytokines Human genes 0.000 description 2
- 108090000695 Cytokines Proteins 0.000 description 2
- 241000257465 Echinoidea Species 0.000 description 2
- 101800003838 Epidermal growth factor Proteins 0.000 description 2
- 102400001368 Epidermal growth factor Human genes 0.000 description 2
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 2
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 2
- 229930182566 Gentamicin Natural products 0.000 description 2
- CEAZRRDELHUEMR-URQXQFDESA-N Gentamicin Chemical compound O1[C@H](C(C)NC)CC[C@@H](N)[C@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](NC)[C@@](C)(O)CO2)O)[C@H](N)C[C@@H]1N CEAZRRDELHUEMR-URQXQFDESA-N 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 239000007995 HEPES buffer Substances 0.000 description 2
- 101500025419 Homo sapiens Epidermal growth factor Proteins 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- 108090000723 Insulin-Like Growth Factor I Proteins 0.000 description 2
- 101100131080 Mycobacterium bovis (strain ATCC BAA-935 / AF2122/97) mpb70 gene Proteins 0.000 description 2
- 206010028980 Neoplasm Diseases 0.000 description 2
- 206010072170 Skin wound Diseases 0.000 description 2
- PXIPVTKHYLBLMZ-UHFFFAOYSA-N Sodium azide Chemical compound [Na+].[N-]=[N+]=[N-] PXIPVTKHYLBLMZ-UHFFFAOYSA-N 0.000 description 2
- 102000013275 Somatomedins Human genes 0.000 description 2
- 102000046299 Transforming Growth Factor beta1 Human genes 0.000 description 2
- 102000011117 Transforming Growth Factor beta2 Human genes 0.000 description 2
- 101800002279 Transforming growth factor beta-1 Proteins 0.000 description 2
- 101800000304 Transforming growth factor beta-2 Proteins 0.000 description 2
- 108090000097 Transforming growth factor beta-3 Proteins 0.000 description 2
- 102000056172 Transforming growth factor beta-3 Human genes 0.000 description 2
- 229920004890 Triton X-100 Polymers 0.000 description 2
- 239000013504 Triton X-100 Substances 0.000 description 2
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 2
- 108010073929 Vascular Endothelial Growth Factor A Proteins 0.000 description 2
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 2
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 230000001154 acute effect Effects 0.000 description 2
- 230000001464 adherent effect Effects 0.000 description 2
- 239000000853 adhesive Substances 0.000 description 2
- 125000000539 amino acid group Chemical group 0.000 description 2
- 238000000540 analysis of variance Methods 0.000 description 2
- 230000019552 anatomical structure morphogenesis Effects 0.000 description 2
- 108010009111 arginyl-glycyl-glutamic acid Proteins 0.000 description 2
- 229940064804 betadine Drugs 0.000 description 2
- 230000000903 blocking effect Effects 0.000 description 2
- 239000004202 carbamide Substances 0.000 description 2
- 238000004113 cell culture Methods 0.000 description 2
- 230000003399 chemotactic effect Effects 0.000 description 2
- 230000001684 chronic effect Effects 0.000 description 2
- 108091036078 conserved sequence Proteins 0.000 description 2
- 238000004925 denaturation Methods 0.000 description 2
- 230000036425 denaturation Effects 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 230000018109 developmental process Effects 0.000 description 2
- 238000010828 elution Methods 0.000 description 2
- 230000003511 endothelial effect Effects 0.000 description 2
- 229940116977 epidermal growth factor Drugs 0.000 description 2
- 210000002919 epithelial cell Anatomy 0.000 description 2
- DEFVIWRASFVYLL-UHFFFAOYSA-N ethylene glycol bis(2-aminoethyl)tetraacetic acid Chemical compound OC(=O)CN(CC(O)=O)CCOCCOCCN(CC(O)=O)CC(O)=O DEFVIWRASFVYLL-UHFFFAOYSA-N 0.000 description 2
- 210000002744 extracellular matrix Anatomy 0.000 description 2
- 229960002518 gentamicin Drugs 0.000 description 2
- 229940116978 human epidermal growth factor Drugs 0.000 description 2
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 2
- 230000003993 interaction Effects 0.000 description 2
- 235000014705 isoleucine Nutrition 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- GVUGOAYIVIDWIO-UFWWTJHBSA-N nepidermin Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)NC(=O)CNC(=O)[C@@H](NC(=O)[C@@H](NC(=O)[C@H](CS)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CS)NC(=O)[C@H](C)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CCSC)NC(=O)[C@H](CS)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CS)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CS)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O)C(C)C)[C@@H](C)CC)C(C)C)C(C)C)C1=CC=C(O)C=C1 GVUGOAYIVIDWIO-UFWWTJHBSA-N 0.000 description 2
- GLDOVTGHNKAZLK-UHFFFAOYSA-N octadecan-1-ol Chemical compound CCCCCCCCCCCCCCCCCCO GLDOVTGHNKAZLK-UHFFFAOYSA-N 0.000 description 2
- 230000011164 ossification Effects 0.000 description 2
- YBYRMVIVWMBXKQ-UHFFFAOYSA-N phenylmethanesulfonyl fluoride Chemical compound FS(=O)(=O)CC1=CC=CC=C1 YBYRMVIVWMBXKQ-UHFFFAOYSA-N 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 210000001626 skin fibroblast Anatomy 0.000 description 2
- 230000000638 stimulation Effects 0.000 description 2
- 210000002536 stromal cell Anatomy 0.000 description 2
- 230000017423 tissue regeneration Effects 0.000 description 2
- 210000004881 tumor cell Anatomy 0.000 description 2
- VBEQCZHXXJYVRD-GACYYNSASA-N uroanthelone Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CS)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)C(C)C)[C@@H](C)O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CCSC)NC(=O)[C@H](CS)NC(=O)[C@@H](NC(=O)CNC(=O)CNC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CS)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CS)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O)C(C)C)[C@@H](C)CC)C1=CC=C(O)C=C1 VBEQCZHXXJYVRD-GACYYNSASA-N 0.000 description 2
- OHVLMTFVQDZYHP-UHFFFAOYSA-N 1-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)-2-[4-[2-[[3-(trifluoromethoxy)phenyl]methylamino]pyrimidin-5-yl]piperazin-1-yl]ethanone Chemical compound N1N=NC=2CN(CCC=21)C(CN1CCN(CC1)C=1C=NC(=NC=1)NCC1=CC(=CC=C1)OC(F)(F)F)=O OHVLMTFVQDZYHP-UHFFFAOYSA-N 0.000 description 1
- 208000010507 Adenocarcinoma of Lung Diseases 0.000 description 1
- 229920000936 Agarose Polymers 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- 102000009027 Albumins Human genes 0.000 description 1
- 206010003210 Arteriosclerosis Diseases 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 102000004506 Blood Proteins Human genes 0.000 description 1
- 108010017384 Blood Proteins Proteins 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 102000009016 Cholera Toxin Human genes 0.000 description 1
- 108010049048 Cholera Toxin Proteins 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- 241000699802 Cricetulus griseus Species 0.000 description 1
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 1
- 239000006145 Eagle's minimal essential medium Substances 0.000 description 1
- 244000182691 Echinochloa frumentacea Species 0.000 description 1
- 235000008247 Echinochloa frumentacea Nutrition 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 102000018233 Fibroblast Growth Factor Human genes 0.000 description 1
- 108050007372 Fibroblast Growth Factor Proteins 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- SXRSQZLOMIGNAQ-UHFFFAOYSA-N Glutaraldehyde Chemical compound O=CCCCC=O SXRSQZLOMIGNAQ-UHFFFAOYSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 1
- 241000238631 Hexapoda Species 0.000 description 1
- 101000894525 Homo sapiens Transforming growth factor-beta-induced protein ig-h3 Proteins 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- 102000004877 Insulin Human genes 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- 102100032817 Integrin alpha-5 Human genes 0.000 description 1
- 108010055795 Integrin alpha1beta1 Proteins 0.000 description 1
- 108010041014 Integrin alpha5 Proteins 0.000 description 1
- 102000012355 Integrin beta1 Human genes 0.000 description 1
- 108010022222 Integrin beta1 Proteins 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 241000699666 Mus <mouse, genus> Species 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- AFCARXCZXQIEQB-UHFFFAOYSA-N N-[3-oxo-3-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)propyl]-2-[[3-(trifluoromethoxy)phenyl]methylamino]pyrimidine-5-carboxamide Chemical compound O=C(CCNC(=O)C=1C=NC(=NC=1)NCC1=CC(=CC=C1)OC(F)(F)F)N1CC2=C(CC1)NN=N2 AFCARXCZXQIEQB-UHFFFAOYSA-N 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 108010015078 Pregnancy-Associated alpha 2-Macroglobulins Proteins 0.000 description 1
- 108010076504 Protein Sorting Signals Proteins 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- 102000040739 Secretory proteins Human genes 0.000 description 1
- 108091058545 Secretory proteins Proteins 0.000 description 1
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 1
- LEHOTFFKMJEONL-UHFFFAOYSA-N Uric Acid Chemical compound N1C(=O)NC(=O)C2=C1NC(=O)N2 LEHOTFFKMJEONL-UHFFFAOYSA-N 0.000 description 1
- TVWHNULVHGKJHS-UHFFFAOYSA-N Uric acid Natural products N1C(=O)NC(=O)C2NC(=O)NC21 TVWHNULVHGKJHS-UHFFFAOYSA-N 0.000 description 1
- 241000195615 Volvox Species 0.000 description 1
- 238000002835 absorbance Methods 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 238000001042 affinity chromatography Methods 0.000 description 1
- 229960002684 aminocaproic acid Drugs 0.000 description 1
- 208000011775 arteriosclerosis disease Diseases 0.000 description 1
- 125000000613 asparagine group Chemical group N[C@@H](CC(N)=O)C(=O)* 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- 230000031018 biological processes and functions Effects 0.000 description 1
- 238000001574 biopsy Methods 0.000 description 1
- 210000004204 blood vessel Anatomy 0.000 description 1
- 210000000988 bone and bone Anatomy 0.000 description 1
- 239000007975 buffered saline Substances 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- 210000000845 cartilage Anatomy 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 239000006285 cell suspension Substances 0.000 description 1
- 230000019522 cellular metabolic process Effects 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 230000035605 chemotaxis Effects 0.000 description 1
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 1
- 210000001612 chondrocyte Anatomy 0.000 description 1
- 239000007979 citrate buffer Substances 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 230000008602 contraction Effects 0.000 description 1
- 210000004351 coronary vessel Anatomy 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- 239000013578 denaturing buffer Substances 0.000 description 1
- 230000008021 deposition Effects 0.000 description 1
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 1
- 229960003957 dexamethasone Drugs 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 230000029087 digestion Effects 0.000 description 1
- 239000012153 distilled water Substances 0.000 description 1
- 230000002900 effect on cell Effects 0.000 description 1
- 210000002257 embryonic structure Anatomy 0.000 description 1
- 210000002889 endothelial cell Anatomy 0.000 description 1
- 210000003038 endothelium Anatomy 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 210000003560 epithelium corneal Anatomy 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 201000010934 exostosis Diseases 0.000 description 1
- 108010037639 fasciclin I Proteins 0.000 description 1
- 239000012091 fetal bovine serum Substances 0.000 description 1
- 230000001605 fetal effect Effects 0.000 description 1
- 229940126864 fibroblast growth factor Drugs 0.000 description 1
- 230000019305 fibroblast migration Effects 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 229960002897 heparin Drugs 0.000 description 1
- 229920000669 heparin Polymers 0.000 description 1
- 238000009396 hybridization Methods 0.000 description 1
- 201000010930 hyperostosis Diseases 0.000 description 1
- 238000010191 image analysis Methods 0.000 description 1
- 210000003000 inclusion body Anatomy 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 208000014674 injury Diseases 0.000 description 1
- 229940125396 insulin Drugs 0.000 description 1
- 125000000741 isoleucyl group Chemical group [H]N([H])C(C(C([H])([H])[H])C([H])([H])C([H])([H])[H])C(=O)O* 0.000 description 1
- 210000002439 juxtaglomerular apparatus Anatomy 0.000 description 1
- 229930027917 kanamycin Natural products 0.000 description 1
- 229960000318 kanamycin Drugs 0.000 description 1
- SBUJHOSQTJFQJX-NOAMYHISSA-N kanamycin Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CN)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O2)O)[C@H](N)C[C@@H]1N SBUJHOSQTJFQJX-NOAMYHISSA-N 0.000 description 1
- 229930182823 kanamycin A Natural products 0.000 description 1
- 230000029774 keratinocyte migration Effects 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 201000005249 lung adenocarcinoma Diseases 0.000 description 1
- 239000012139 lysis buffer Substances 0.000 description 1
- 229920002521 macromolecule Polymers 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 239000002609 medium Substances 0.000 description 1
- 201000001441 melanoma Diseases 0.000 description 1
- 238000001000 micrograph Methods 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 230000035772 mutation Effects 0.000 description 1
- GOQYKNQRPGWPLP-UHFFFAOYSA-N n-heptadecyl alcohol Natural products CCCCCCCCCCCCCCCCCO GOQYKNQRPGWPLP-UHFFFAOYSA-N 0.000 description 1
- 239000013642 negative control Substances 0.000 description 1
- 210000002569 neuron Anatomy 0.000 description 1
- 210000000963 osteoblast Anatomy 0.000 description 1
- 210000001672 ovary Anatomy 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- 239000008188 pellet Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 239000013641 positive control Substances 0.000 description 1
- 230000026341 positive regulation of angiogenesis Effects 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 238000001243 protein synthesis Methods 0.000 description 1
- 210000000512 proximal kidney tubule Anatomy 0.000 description 1
- 230000002685 pulmonary effect Effects 0.000 description 1
- 239000008213 purified water Substances 0.000 description 1
- 238000004445 quantitative analysis Methods 0.000 description 1
- 238000003259 recombinant expression Methods 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 230000021014 regulation of cell growth Effects 0.000 description 1
- 230000012121 regulation of immune response Effects 0.000 description 1
- 230000008521 reorganization Effects 0.000 description 1
- 230000010076 replication Effects 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 230000003248 secreting effect Effects 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 238000012163 sequencing technique Methods 0.000 description 1
- 239000004017 serum-free culture medium Substances 0.000 description 1
- 230000011664 signaling Effects 0.000 description 1
- 210000003491 skin Anatomy 0.000 description 1
- 210000004927 skin cell Anatomy 0.000 description 1
- 206010040882 skin lesion Diseases 0.000 description 1
- 231100000444 skin lesion Toxicity 0.000 description 1
- 210000002460 smooth muscle Anatomy 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 238000012453 sprague-dawley rat model Methods 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 210000000130 stem cell Anatomy 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 230000036962 time dependent Effects 0.000 description 1
- 230000025366 tissue development Effects 0.000 description 1
- 238000001890 transfection Methods 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 230000014616 translation Effects 0.000 description 1
- 230000008733 trauma Effects 0.000 description 1
- 230000004614 tumor growth Effects 0.000 description 1
- 238000002604 ultrasonography Methods 0.000 description 1
- 229940116269 uric acid Drugs 0.000 description 1
- 230000008728 vascular permeability Effects 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 238000005303 weighing Methods 0.000 description 1
- 239000003357 wound healing promoting agent Substances 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/78—Connective tissue peptides, e.g. collagen, elastin, laminin, fibronectin, vitronectin or cold insoluble globulin [CIG]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Zoology (AREA)
- Gastroenterology & Hepatology (AREA)
- General Chemical & Material Sciences (AREA)
- Dermatology (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Toxicology (AREA)
- Molecular Biology (AREA)
- Epidemiology (AREA)
- Immunology (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
- Materials For Medical Uses (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Medicinal Preparation (AREA)
Abstract
Изобретение относится к медицине и касается пептидов, которые могут быть использованы для клеточной адгезии и заживления ран. Способ адгезии включает использование рекомбинантных белков, содержащих одну или более копий 2-го и/или 4-го внутренних доменов βig-h3 с аминокислотной последовательностью 237-377 и 498-637 соответственно. Изобретение также включает экспрессирующие векторы и штаммы Е.coli, трансформированные соответствующими экспрессирующими векторами. Преимущество изобретения заключается в получении пептидов, которые содержат консервативные аминокислотые последовательности, необходимые для активности по прикреплению, распластыванию, отделению клеток и заживлению ран. 8 н. и 1 з.п. ф-лы, 3 табл., 25 ил.
Description
Область техники, к которой относится изобретение
Настоящее изобретение относится к пептидам, которые могут быть использованы для клеточной адгезии и заживления ран. Более конкретно, настоящее изобретение относится к использованию для клеточной адгезии и заживления ран пептидов, содержащих одну или более копий 2-го и/или 4-го доменов fas-1 белка βig-h3, где указанные 2-й и 4-й домены имеют высокую степень гомологии в двух аминокислотах, аспарагиновой кислоте и изолейцине, которые необходимы для связывания с интегрином, и таким образом опосредуют клеточную адгезию. Настоящее изобретение также относится к системе экспрессии пептидов, которые могут быть использованы для клеточной адгезии и заживления ран.
Предшествующий уровень техники
βig-h3 представляет собой белок внеклеточного матрикса, экспрессия которого индуцируется в различных клеточных линиях, включая клетки меланомы человека, эпителиальные клетки млекопитающего, кератиноциты и фибробласты легких, после передачи сигнала активным ТGF-β (Skonier, J. et al., DNA Cell Biol. 13, 571, 1994). Ген βig-h3 был впервые выделен путем скрининга методом дифференциальной гибридизации кДНК-библиотеки, созданной из клеточной линии аденокарциномы легких человека, которая была обработана ТGF-β. Ген βig-h3 кодирует белок из 683 аминокислот, который является в высокой степени консервативным у различных видов. Он содержит N-концевой секреторный сигнальный пептид и мотив Arg-Gly-Asp (RGD) у С-конца. Мотив RGD был обнаружен во многих белках внеклеточного матрикса, модулирующих клеточную адгезию, и служит в качестве лиганд-распознающей последовательности для некоторых интегринов (Stonier, J. et al., DNA Cell Biol. 11, 511, 1992).
Согласно некоторым исследованиям известно, что βig-h3 участвует в росте и пролиферации клеток, в заживлении ран и в клеточной адгезии, хотя механизм, лежащий в основе этих функций, пока не известен. Однако очевидно, что βig-h3 играет важную роль в морфогенезе и во взаимодействиях с клетками и белками внеклеточного матрикса в различных тканях.
В нескольких исследованиях были получены некоторые данные относительно роли βig-h3 в опосредовании прикрепления и отделения клеток. Так, например, было обнаружено, что очищенный белок βig-h3 стимулирует прикрепление и распределение фибробластов кожи, ингибируя, тем самым, адгезию клеток А549, НеLa и Wi-38 в бессывороточных средах. В частности, известно, что βig-h3 обладает ингибирующей активностью, направленной против роста опухолевых клеток, и влияет на образование колоний и на морфологию клеток. Ингибирующая активность была продемонстрирована в работе, где указывается, что трансфекция βig-h3-экспрессирующих плазмид в СНО (клетки яичника китайского хомячка) способствует заметному снижению пролиферации клеток и способности таких клеток образовывать опухоли у “голых” (безтимусных) мышей. Кроме того, на основе обнаружения того факта, что применение фармацевтически эффективного количества βig-h3 в рану позволяет клеткам, а в частности фибробластам, распределяться по поверхности раны и прикрепляться к ее участку, был разработан метод заживления ран. Следовательно, клеточно-адгезивная молекула βig-h3, индуцированная ТGF-β в различных клеточных линиях, играет очень важную роль в росте клеток, дифференцировке клеток, заживлении ран, морфогенезе и в клеточной адгезии (Rawe I.M. et al., Invest. Ophtalmol. Vis. Sci. 38, 893, 1997; Lebaron R.G. et al., J.Invest. Dermatol. 104, 844, 1995).
βig-h3 содержит четыре повтора из 140 аминокислот с внутренней гомологией, а именно в доменах fas-1. Домены с внутренними повторами имеют в высокой степени консервативные последовательности, обнаруженные в секреторных белках и в мембранных белках различных организмов, включая млекопитающих, насекомых, морских ежей, растений, дрожжей и бактерий. Примерами белков, содержащих указанную консервативную последовательность, являются периостин, фасциклин 1, HLC-2 морского ежа, САМ водорослей и МРВ70 микобактерии. Консервативный домен в этих белках (обозначаемый далее “fas-1”) состоит примерно из 110-140 аминокислот с двумя высококонсервативными ветвями, Н1 и Н2, каждая из которых имеет примерно 10 аминокислот (Kawamoto, T. et al., Biochem. Biophys. Acta. 1395, 288, 1998).
Четыре домена fas-1 были обнаружены в βig-h3, периостине и в фасциклине I, два домена fas-1 были обнаружены в HLC-2, и только один домен fas-1 был обнаружен в МРВ70. Хотя функции этих белков точно не выяснены, однако, известно, что некоторые из них действуют как клеточно-адгезивные молекулы. Так, например, сообщалось, что βig-h3, периостин и фасциклин 1 опосредуют адгезию фибробластов, остеобластов и нервных клеток соответственно. Также сообщалось, что САМ водорослей представляет собой клеточно-адгезивную молекулу, присутствующую в эмбрионах водорослей Volvox (LeBaron, R.G. et al., J.Invest. Dermatol. 104, 844, 1995; Horiuchi, K. et al., J.Bone Miner. Res. 14, 1239, 1999; Huber O. et al., EMBO J. 13, 4212, 1994).
Во-первых, считалось, что клеточно-адгезивная активность βig-h3 должна опосредоваться С-концевым мотивом RGD. Однако результаты некоторых исследований показали, что мотив RGD необязательно стимулирует распластывание (распределение по поверхности) хондроцитов, и что зрелый растворимый белок βig-h3, у которого мотив RGD был делетирован в результате карбокси-концевого процессинга, способен ингибировать клеточную адгезию, что позволяет сделать вывод, что мотив RGD белка βig-h3 не является обязательным для опосредования активности βig-h3, обеспечивающей адгезию клеток. Кроме того, недавно сообщалось, что βig-h3 стимулирует распластывание фибробластов посредством интегрина α1β1, а мотив RGD βig-h3 не является обязательным для опосредования клеточно-адгезивной способности βig-h3.
Недавно сообщалось, что βig-h3 специфически связывается с интегрином, что приводит к усилению адгезии и распластывания клеток независимо от мотива RGD (Ohno S. et al., Biochem. Biophys. Acta 1451, 196, 1999). Кроме того, было обнаружено, что консервативные пептиды Н1 и Н2 βig-h3 не влияют на βig-h3-опосредованную клеточную адгезию. В целом, эти результаты указывают на то, что аминокислоты, которые необходимы для обеспечения клеточно-адгезивной активности βig-h3, присутствуют не только на участках Н1 и Н2, но и на других участках. Компьютерный поиск, проведенный на основе гомологии не только среди повторяющихся доменов fas-1 βig-h3, но также и среди доменов fas-1 других белков, выявил, что, помимо пептидов Н1 и Н2, имеется несколько высококонсервативных кислот, что позволяет предположить о возможном участии этих консервативных аминокислотных последовательностей в адгезии клеток.
Известно, что из доменов βig-h3, которые играют важную роль в клеточной адгезии, либо 2-й, либо 4-й домен идентифицируется как минимальный домен, необходимый для клеточной адгезии молекулы настоящего изобретения. На основе этих данных, рекомбинантные белки настоящего изобретения, содержащие необходимые функциональные домены, были также идентифицированы как белки, эффективные для заживления ран.
Недавно исследования по заживлению ран стали проводиться как методами клеточной биологии, так и методами молекулярной биологии, и стимуляция заживления ран находит все большее применение в различных областях клинической медицины. Однако механизмы заживления ран как с точки зрения клеточной биологии, так и с точки зрения молекулярной биологии остаются пока неизвестными. В соответствии с данными, полученными до настоящего времени, заживление раны является ответом ткани на травму, приводящим к восстановлению ткани посредством сложных биологических процессов, включая хемотаксис, дифференцировку и репликацию клеток, синтез матриксных белков, ангиогенез и заживление ран (Steed D.L. et al., Clin. Plast. Surg. 25, 397, 1998).
Факторы роста представляют собой репрезентативные материалы, которые появляются на ранней стадии процесса заживления раны и регулируют последующий процесс заживления раны. Оказывая сильное влияние на все стадии заживления раны, факторы роста действуют как регуляторы роста, дифференцировки и метаболизма клеток, и способствуют реорганизации окружения раны благодаря своим хемотаксическим свойствам, обеспечивающим миграцию в область раны клеток различных типов, участвующих в воспалении и репарации ткани, в пролиферации клеток, в стимуляции ангиогенеза и в синтезе и деградации внеклеточного матрикса. PDGF фактор роста тромбоцитов обеспечивает миграцию фибробластов в рану и стимулирует их пролиферацию, а трансформирующий фактор роста-β (ТGF-β) стимулирует образование ими коллагена. PDGF обладает хемотаксическими свойствами для большинства клеток, участвующих в заживлении ран, стимулирует ангиогенез, ремодуляцию и сокращение, и активирует клетки, способствующие заживлению ран (Mustoe T.A. et al., J. Clin. Invest. 87, 694, 1991; Lepisto, J. et al., Surg. Res. 53, 596, 1992). EGF (эпидермальный фактор роста) стимулирует миграцию кератиноцитов, ангиогенез и развитие гранулированной ткани и активирует митогенез кератиноцитов и фибробластов (Franklin, J.D. et al., Plast. Recsonst. Surg. 64, 766, 1979; Buckly, A. et al., Proc. Natl. Acad. Sci. USA, 82, 7340, 1985). bFGF (основный фактор роста фибробластов) стимулирует ангиогенез, эпителизацию и отложение коллагеновых волокон и ассоциируется с гепарином в различных формах для осуществления соответствующих функций (Tsuboi, R. et al., J. Exp. Med. 172, 245, 1990; Kinsnorth, A.N. et al., Br. J. Surg. 77, 409, 1990). IGF (инсулино-подобный фактор роста) усиливает дифференцировку клеток. VEGF (васкулярный эндотелиальный фактор роста) повышает проницаемость сосудов и стимулирует эндотелиальный митогенез.
Из факторов роста и цитокинов, участвующих в заживлении ран, наиболее репрезентативным является ТGF-β. Этот цитокин, который существует в трех формах (ТGF-β1, ТGF-β2 и ТGF-β3) у млекопитающих, играет важную роль в росте и дифференцировке различных клеток и обладает различными сложными функциями, включая регуляцию роста клеток, регуляцию иммунных ответов, стимуляцию остеогенеза, индуцирование специфических макромолекул хряща и стимуляцию заживления ран (Bennett, N.T. et al., Am. J. Surg. 165, 728, 1993). Считается, что ТGF-β, обнаруживаемый в эпителии во время заживления раны, стимулирует экспрессию интегрина в кератиноцитах в процессе реэпителизации.
В недавних исследованиях, касающихся экспрессии ТGF-β, было выявлено, что мРНК ТGF-β3 экспрессируется в эпителии нормальной кожи и в эпителии острых и хронических ран, тогда как мРНК ТGF-β1 не экспрессируется ни в нормальной коже, ни в хронических ранах, но экспрессируется в эпителиальном слое, регенерированном из острых ран, а мРНК ТGF-β2 не экспрессируется нигде (Schmid P. et al., J. Pathol. 171, 191, 1993). Исходя из этих эффектов, даже если их механизмы точно не установлены, можно предположить, что ТGF-β играет важную роль в реэпителизации.
Экспрессия βig-h3 активируется ТGF-β, что дает основание предположить, что βig-h3 участвует в опосредовании некоторых сигналов ТGF-β. Сообщалось, что клетки СНО (яичника китайского хомячка), трансформированные βig-h3-экспрессирующими плазмидами, обладают пониженной онкогенностью (Skonier J. et al., DNA Cell. Biol. 13, 571, 1994). В противоположность этому, экспрессия βig-h3 ингибируется в обработанных дексаметазоном стволовых клетках, в некоторых опухолевых клетках и фибробластах, культивированных в участках поражения кожи, вызванного локализованным гиперостозом или мелореостозом. Также сообщалось, что βig-h3 служит в качестве ингибитора остеогенеза (Genini M. et al., Int. J. Cancer 66, 571, 1996; Schenker T. et al., Exp. Cell. Res. 239, 161, 1998; Kim J. et al., J. Cell. Biochem. 77, 169, 2000). Помимо этих функций, βig-h3, известный как клеточно-адгезивная молекула, стимулирует прикрепление и распластывание фибробластов в коже.
В исследованиях, касающихся распределения βig-h3 в глазных тканях, сообщалось, что эта адгезивная молекула экспрессируется в эпителии роговицы у здоровых взрослых людей, в фетальных внутрироговичных стромальных клетках и в эндотелиальных и стромальных клетках в процессе заживления раны. Кроме того, βig-h3 экспрессируется в юкстагломерулярном аппарате и в проксимальных канальцах почек, и его экспрессия усиливается при сахарном диабете. Кроме того, он был обнаружен в субэндотелиальной ткани гладкой мышцы коронарных артерий у здорового человека, а в случае артериосклероза его количество увеличивается в эндотелии кровеносных сосудов. Однако пока еще не установлено, происходит ли экспрессия βig-h3 в нормальных кожных тканях и в кожных ранах. (Klintworth G.K. et al., Am. J. Pathol. 152, 743, 1998; Munier F.L. et al., Nature Genetics 15, 247, 1997; Streeten B.W. et al., Arch. Ophtalmol. Vis. Sci. 38, 893, 1997). Как приведено выше, распределение и экспрессия βig-h3 в тканях здорового человека остаются пока неясными. В частности, пока не сообщалось каких-либо данных относительно характера экспрессии βig-h3 в кожных ранах. Однако некоторые исследователи сообщали, что функции βig-h3 заключаются в стимулировании адгезии и распределении кожных фибробластов, а поэтому предполагается, что они участвуют в стимуляции заживления ран.
Краткое описание изобретения
Исходя из предшествующего уровня техники было проведено интенсивное и тщательное исследование βig-h3-опосредованной клеточной адгезии, которое было положено в основу настоящего изобретения, и которое привело к обнаружению того факта, что среди доменов fas-1 βig-h3 и среди доменов fas-1 других пептидов, проанализированных посредством компьютерного поиска, существуют, помимо мотивов Н1 и Н2, высококонсервативные аминокислотные последовательности, и, в частности, последовательности, в которых была обнаружена высокая гомология в остатках аспарагиновой кислоты и изолейцина в положениях, близких к области Н2. Кроме того, было обнаружено, что каждый из 2 и 4 доменов βig-h3, содержащих консервативные аминокислотные остатки, индуцирует клеточную адгезию через интегрин α3β1. Кроме того, рекомбинантные белки, которые были сконструированы так, чтобы они имели 2-й и/или 4-й домен fas-1 βig-h3, были идентифицированы как белки, идентичные белку βig-h3 дикого типа в отношении активности, стимулирующей адгезию и распластывание клеток и заживление ран.
Поэтому целью настоящего изобретения является получение пептидов, которые содержат консервативные аминокислотные последовательности, необходимые для активности по прикреплению, распластыванию и отделению клеток и заживления ран.
Другой целью настоящего изобретения является использование этих пептидов для обеспечения клеточной адгезии и заживления ран.
Еще одной целью настоящего изобретения является получение экспрессирующей системы для этих пептидов.
Другой целью настоящего изобретения является разработка способа пpикрепления клеток.
Еще одной целью настоящего изобретения является разработка способа заживления ран.
В соответствии с одним из аспектов, настоящее изобретение относится к рекомбинантному белку, включающему часть доменов βig-h3, которые могут быть использованы для прикрепления клеток млекопитающих.
В соответствии с другим аспектом, настоящее изобретение относится к экспрессирующим векторам рβig-h3 D-II, рβig-h3 D-IV и рβig-h3 D-IV 4Х, способным экспрессировать 2-й и 4-й домен fas-1 βig-h3, соответствующий аминокислотам 237-377 и 498-637 соответственно.
В соответствии с другим аспектом, настоящее изобретение относится к новым штаммам E.coli, трансформированным экспрессирующими векторами рβig-h3 D-II, рβig-h3 D-IV и рβig-h3 D-IV 4Х, идентифицированными как E.coli BL21/Hisβ-g (регистрационный номер № КСТС 0905ВР), E.coli BL21/Hisβ-е (регистрационный номер № КСТС 0904ВР) и E.coli BL21/Hisβ-е4х (регистрационный номер № КСТС 0906ВР) соответственно.
В соответствии с другим аспектом, настоящее изобретение относится к способу прикрепления клеток, включающему стадии: получения рекомбинантного белка, содержащего одну или более копий 2-го и/или 4-го домена βig-h3 с использованием экспрессирующего вектора; покрытия рекомбинантным белком твердого носителя; и нанесения клеток на покрытый белком твердый носитель.
В соответствии с другим аспектом, настоящее изобретение относится к использованию рекомбинантного белка для прикрепления клеток.
В соответствии с другим аспектом, настоящее изобретение относится к использованию рекомбинантного белка для заживления ран.
В соответствии с еще одним своим аспектом, настоящее изобретение относится к способу заживления ран, включающему стадии: покрытия твердого носителя рекомбинантным белком, содержащим одну или более копий 2-го и/или 4-го домена βig-h3; прикрепления клеток кожи к твердому носителю и нанесения указанного твердого носителя на раны.
Краткое описание графического материала
На фиг.1 схематически представлена диаграмма, иллюстрирующая рекомбинантные белки βigh3-WT и βigh3-ΔRGD, где консервативные области показаны и , а мотив RGD показан ®.
На фиг.2 представлена фотография, иллюстрирующая результаты электрофореза в ДСН-ПААГ рекомбинантных белков βigh3-WT и βigh3-ΔRGD.
На фиг.3 представлена микрофотография, иллюстрирующая влияние рекомбинантных белков βigh3-WT и βigh3-ΔRGD на адгезию и распластывание клеток НСЕ после окрашивания кристаллическим фиолетовым.
На фиг.4 представлены кривые, которые иллюстрируют зависимые от концентрации активности рекомбинантных белков βigh3-WT и βigh3-ΔRGD, стимулирующих адгезию и распластывание клеток НСЕ, как было измерено по количеству (А) и площади поверхности (В) прикрепленных клеток.
На фиг.5 представлены гистограммы, в которых сравниваются активности рекомбинантных белков βigh3-WT и βigh3-ΔRGD, стимулирующих адгезию клеток НСЕ, как было определено по количеству (А) и площади поверхности (В) прикрепленных клеток.
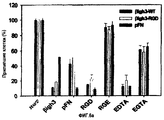
На фиг.6а представлена гистограмма, иллюстрирующая влияние различных соединений на активности рекомбинантных белков βigh3-WT и βigh3-ΔRGD, стимулирующих адгезию клеток НСЕ.
На фиг.6b представлена гистограмма, иллюстрирующая влияние двухвалентных катионов на активность рекомбинантного белка βigh3-WT, стимулирующего адгезию клеток НСЕ.
На фиг.6с представлена гистограмма, иллюстрирующая ингибирующее действие моноклонального антитела против интегрина на активность рекомбинантного белка βigh3-WT, стимулирующего адгезию клеток НСЕ.
На фиг.6d представлена гистограмма, иллюстрирующая ингибирующее действие моноклонального антитела против интегрина на активность различных белков, стимулирующих адгезию клеток НСЕ.
На фиг.6е представлена гистограмма, иллюстрирующая адгезионную специфичность клеток К562 по отношению к рекомбинантному белку βigh3-WT и матриксным белкам.
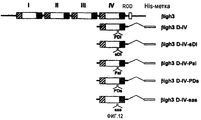
На фиг.7 представлена диаграмма, иллюстрирующая рекомбинантные белки, каждый из которых имеет домены fas-1 βig-h3.
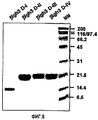
На фиг.8 представлена фотография, иллюстрирующая электрофорез в ДСН-ПААГ рекомбинантных белков, содержащих домены fas-1 βig-h3.
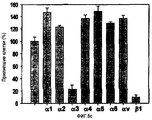
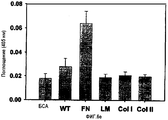
На фиг.9 представлена гистограмма, иллюстрирующая активность рекомбинантных белков, содержащих домены fas-1 βig-h3, в отношении адгезии клеток НСЕ.
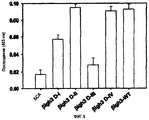
На фиг.10 представлена гистограмма, иллюстрирующая ингибирующее действие антител против интегрина на активности рекомбинантных белков, содержащих домены fas-1 βig-h3, в отношении адгезии клеток НСЕ.
На фиг.11 представлены части аминокислотных последовательностей различных матриксных белков, содержащих домены fas-1.
На фиг.12 представлена диаграмма, иллюстрирующая мутанты, имеющие замены в 4-ом домене βig-h3.
На фиг.13 представлена фотография, иллюстрирующая результаты электрофореза в ДСН-ПААГ рекомбинантных мутантов, имеющих замены в 4-ом домене βig-h3.
На фиг.14 представлена гистограмма, иллюстрирующая клеточно-адгезивную активность мутантов, имеющих замены в 4-ом домене βig-h3.
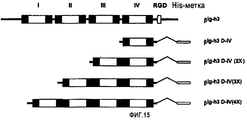
На фиг.15 представлена диаграмма, иллюстрирующая рекомбинантные белки βigh3-D-IV, βigh3-D-IV 2Х, 3Х и 4Х, содержащие одну, две, три и четыре копии 4-го домена βig-h3.
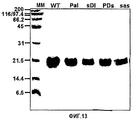
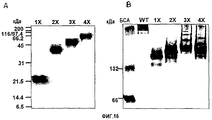
На фиг.16 представлены фотографии, иллюстрирующие рекомбинантные белки βigh3-D-IV, βigh3-D-IV 2Х, 3Х, и 4Х, которые были подвергнуты электрофорезу в 10% ДСН-ПААГ (А) и в 8% неденатурирующем ПААГ (В) и которые были очищены на агарозной смоле Ni-NТА.
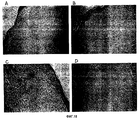
На фиг.17 представлены полученные на оптическом микроскопе фотографии ран, на которые наносили только мазевую основу (А) и мазевую основу в комбинации с фибронектином (В), His-β-b (С) и βig-h3-D-IV (D).
На фиг.18 представлены микрофотографии ран, которые находятся на стадии реэпителизации после обработки только мазевой основой (А) и мазевой основой в комбинации с фибронектином (В), His-β-b (С) и βig-h3-D-IV (D).
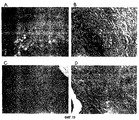
На фиг.19 представлены полученные на оптическом микроскопе фотографии ран, которые имели коллагеновые волокна, образованные после обработки только мазевой основой (А) и мазевой основой в комбинации с фибронектином (В), His-β-b (С) и βig-h3-D-IV (D).
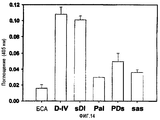
На фиг.20 представлена гистограмма, иллюстрирующая адгезивные активности рекомбинантных белков βigh3-D-IV, βigh3-D-IV 2Х, 3Х и 4Х, содержащих, по крайней мере, одну копию 4-го домена βig-h3 по отношению к клеткам НСЕ.
На фиг.21 представлены полученные на оптическом микроскопе фотографии ран, площади которых уменьшались после обработки только хитозановой основой (А) и хитозановой основой в комбинации с фибронектином (В), βig-h3 3Х (С) и βig-h3 4Х (D).
Подробное описание изобретения
В соответствии с настоящим изобретением, рекомбинантные белки получают на основе 2-го и 4-го доменов fas-1 βig-h3 и используют как отдельно, так и в комбинации, для достижения адгезии и распластывания клеток. Для отбора 2-го и 4-го доменов идентифицировали домены βig-h3, которые обладают активностью в отношении адгезии и распластывания клеток. В этих целях С-концевую последовательность Arg-Gly-Asp (RGD), известную как лиганд-распознающую последовательность для некоторых интегринов, оценивали на ее влияние на клеточно-адгезивную способность βig-h3. Активность прикрепления клеток измеряли по числу и площади поверхности прикрепленных клеток. В результате этого было обнаружено, что βig-h3 стимулирует адгезию и распластывание клеток независимо от мотива RGD.
На основании этих данных были использованы химические реагенты для исследования специфичности клеточно-адгезивной активности βig-h3 и для получения дополнительной информации, которая послужила бы ключом для выявления природы поверхностного клеточного рецептора для βig-h3. Данные, полученные благодаря использованию таких химических реагентов, дают основание предположить, что поверхностным клеточным рецептором для βig-h3, опосредующим клеточно-адгезивную активность βig-h3, может быть один из RGD-зависимых интегринов, которым для взаимодействия с βig-h3 требуется присутствие двухвалентных катионов.
Затем, для идентификации минимальных доменов, имеющих важное значение для клеточно-адгезивной функции βig-h3, была проведена оценка способности каждого домена fas-1 опосредовать клеточную адгезию.
Эту оценку проводили на основании того факта, что домены fas-1 были обнаружены в различных клеточно-адгезивных молекулах, таких как βig-h3, периостин, фасциклин I, HLC-2 и САМ водорослей, а число доменов fas-1, присутствующих в таких адгезивных молекулах, варьируется для различных белков. Этот факт позволяет сделать вывод, что для клеточно-адгезивной активности βig-h3 не требуется присутствия всех четырех доменов fas-1, а в исключительном случае клеточно-адгезивную активность βig-h3 может опосредовать лишь один домен fas-1. В соответствии с настоящим изобретением было выявлено, что для обеспечения клеточно-адгезивной функции βig-h3 достаточно присутствия 2-го или 4-го домена fas-1 βig-h3. Эти результаты приводят к заключению, что последовательности Н1 и Н2, которые являются общими в данных четырех доменах βig-h3, не имеют важного значения для опосредования клеточно-адгезивной активности βig-h3. Кроме того, было обнаружено, что две аминокислоты, то есть аспарагиновая кислота и изолейцин, находящиеся в положениях, близких к области Н2 во 2-м и 4-м доменах fas-1, являются в высокой степени консервативными, что указывает на то, что такие аминокислотные остатки составляют мотив, ассоциированный с клеточной адгезией. Необходимость присутствия двух консервативных аминокислот для клеточной адгезии была установлена с использованием мутантов, имеющих замены в 4-ом домене fas-1 βig-h3.
В другом варианте осуществления, настоящее изобретение относится к способу заживления ран, в котором используются 2-й и 4-й домены fas-1 βig-h3, отдельно или в комбинации.
Было проведено сравнение влияния на заживление ран мутантных белков βig-h3, содержащих лишь домены, которые являются активными в отношении клеточной адгезии, и домены βig-h3 дикого типа (βigh3-WT), которые содержат часть данных доменов. Для этого рекомбинантые белки, содержащие домены, которые являются активными в отношении клеточной адгезии, были введены крысам.
При использовании рекомбинантного белка, содержащего 4-й домен fas-1 βig-h3, в качестве фармацевтически эффективного ингредиента для мази, наблюдалось затягивание раны, а также реэпителизация и образование коллагеновых волокон. И наконец, эти результаты свидетельствуют о том, что один 2-й или 4-й домен fas-1 βig-h3, в котором присутствуют консервативные аспарагиновая кислота и изолейцин, может быть использован для лечения ран, а следовательно, он может быть использован для разработки терапевтических средств для лечения ран.
Кроме того, превосходная клеточная адгезия и заживление ран были достигнуты с использованием рекомбинантного белка, содержащего 2-й домен fas-1 βig-h3 или 2-й и 4-й домены.
По сравнению с белком, содержащим все такие домены, рекомбинантные белки, содержащие часть таких доменов, имеют то преимущество, что они могут быть продуцированы в больших количествах, поскольку они синтезируются в водорастворимых формах, а поэтому не подвергаются денатурации.
Примеры
Для лучшего понимания настоящего изобретения ниже приводятся примеры, которые представлены лишь для иллюстрации и не ограничивают объема настоящего изобретения.
Пример 1
Идентификация клеточно-адгезивной активности RGD-независимых белков βig-h3
1-1: Продуцирование рекомбинантного белка βig-h3
Для выявления доменов βig-h3, которые фактически обладают активностью, обеспечивающей адгезию и распластывания клеток, С-концевую последовательность Arg-Gly-Asp (RGD), известную как лиганд-распознающая последовательность для некоторых интегринов, оценивали на ее влияние на клеточно-адгезивную способность βig-h3. Для этого получали RGD-делетированный рекомбинантный белок βig-h3 (βigh3-ΔRGD) и рекомбинантный белок βig-h3 дикого типа (βigh3-WT).
Сначала полноразмерную кДНК βig-h3 человека, клонированную в рBluescript (рВsβig-h3), расщепляли ферментами NdeI и BglII. ДНК-фрагмент субклонировали в EcoRV-EcoRI-сайт рЕТ-29b(+) (Novagen Inc.). βigh3-WT получали путем введения NcoI-фрагмента длиной 1351 п.н., вырезанного из кДНК βig-h3, в NcoI-сайт этого клона. βigh3-ΔRGD получали из βigh3-WT путем вырезания 3’-фрагмента плазмиды βigh3-WT ферментами АоСI и NotI с последующим затуплением концов и самолигированием, как показано на фиг.1.
После трансформации каждой рекомбинантной плазмиды E.coli BL 21 DE3 культивировали в среде LB, содержащей 50 мкг/мл канамицина при 37°С до достижения оптической плотности (OD) 0,5-0,6 при 595 нм. Рекомбинантные белки βig-h3 индуцировали с использованием 1 мМ изопропил-β-D-(-)-тиогалактопиранозида (IPTG) при 37оС в течение 3 часов. Полученный таким образом осадок ресуспендировали в буфере для лизиса (50 мМ Трис-HCl (рН 8,0), 100 мМ NаСl, 1 мМ EDTA, 1% тритон Х-100, 1 мМ РМSF, 0,5 мМ DТТ), а затем обрабатывали ультразвуком. Тельца включения растворяли в денатурирующем буфере, содержащем 8М мочевины с 20 мМ, а затем денатурированные белки очищали на смоле Ni-NТА (Qiagen). Рекомбинантные белки элюировали 200 мМ раствором имидазола, а затем последовательно диализовали, начиная с высоких и кончая низкими концентрациями мочевины в 20 мМ Трис-HCl-буфере, содержащем 50 мМ NаСl. Эти рекомбинантные белки анализировали с помощью электрофореза в ДСН-ПААГ, как показано на фиг.2.
1-2: Анализ на клеточно-адгезивную активность рекомбинантных белков в домене fas-1 βig-h3
Эпителиальные клетки роговицы человека (НСЕ), используемые в данном анализе, культивировали в среде DMEM (ЕМЕМ/F-12, Gibco ВRL), в которую добавляли 15% фетальную бычью сыворотку, гентамицин (40 мкг/мл), инсулин (5 мкг/мл), холерный токсин (0,1 мкг/мл) и эпидермальный фактор роста человека (hEGF) при 37°С в 5% CO2.
Анализ на клеточную адгезию осуществляли следующим образом.
Сначала обеспечивали адгезию рекомбинантных белков βig-h3 или других белков внеклеточного матрикса ко дну 96-луночного микротитрационного планшета (Falcon) путем инкубирования при 37°С в течение 1 часа и блокировали с использованием PBS, содержащем 0,2% БСА (ВSA). Белками внеклеточного матрикса для покрытия дна были витронектин плазмы человека (Promega), очищенный фибронектин плазмы человека (рFN), куриный коллаген типов I и II (Chemicon International Inc.), бычий коллаген типов IV и VI (Chemicon), мышиный ламинин (Chemicon) и бычий сывороточный альбумин (ВSA)(Sigma). Клетки трипсинизировали и суспендировали в культуральных средах при плотности 2×105 клеток на 1 мл. В каждую лунку планшетов, покрытых рекомбинантными белками, добавляли 0,1 мл клеточной суспензии.
После инкубирования при 37°С в течение 1 часа неприкрепленные клетки удаляли путем промывки PBS. Прикрепленные клетки инкубировали в течение 1 часа при 37°С в 50 мМ цитратном буфере, рН 5,0, содержащем 3,75 мМ п-нитрофенол-N-ацетил-1-β-D-глизозаминида в качестве субстрата для гексозаминидазы и 0,25% тритона Х-100, а затем добавляли 50 мМ глицинового буфера, рН 10,4, содержащего 5 мМ EDTA для блокирования ферментативной активности. Измерения оптической плотности при 405 нМ проводили в микропланшет-ридере Multiscan МСС/340.
Для определения площади клеточной поверхности как показателя клеточно-адгезивной активности 4×104 клеток наносили на субстраты в 48-луночных планшетах для культивирования. Прикрепленные клетки фиксировали 8% глутаральдегидом (Sigma), а затем окрашивали 0,25% кристаллическим фиолетовым (Sigma) в 20% метаноле. Измерения площади клеточной поверхности осуществляли с помощью программы Image-Pro плюс (Media Cybernetics). Эксперименты проводили с тремя повторностями с 200 или 300 измерениями на один участок для каждого эксперимента. Данные выражали как среднюю площадь в определенные промежутки времени ± стандартная ошибка среднего.
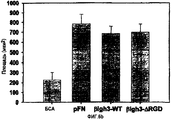
Результаты измерений активности в отношении адгезии и распластывания клеток с использованием βigh3-WT и βigh3-ΔRGD показали, что число и площадь поверхности клеток НСЕ, прикрепленных к βigh3-WT, явно превышали число и площадь поверхности клеток, прикрепленных к альбумину, служащему в качестве негативного контроля, и эти параметры были сравнимыми с параметрами для клеток, прикрепленных к фибронектину, как показано на фиг.3. Активность βig-h3, по клеточной адгезии и распластыванию, была зависимой от концентрации, как показано на фиг.4А и 4В. βigh3-ΔRGD, у которого отсутствовал мотив RGD, обнаруживал почти аналогичную эффективность в отношении адгезии и распластывании клеток (фиг.5А и 5В). В целом, эти результаты подтверждают, что βig-h3 способствует адгезии и распластыванию клеток независимо от мотива RGD.
Экспериментальный пример 1
Идентификация клеточного поверхностного рецептора βig-h3, опосредующего клеточно-адгезивную активность βig-h3
1-1: Идентификация клеточно-адгезивной активности с использованием матриксного пептида и реагента
Для идентификации клеточных поверхностных рецепторов, опосредующих клеточно-адгезивную активность белка βig-h3 осуществляли анализ на ингибирование с использованием различных реагентов.
Сначала пластиковые чашки для культивирования покрывали 10 мкг/мл фибронектина, βigh3-WT или βigh3-ΔRGD. Клетки НСЕ предварительно инкубировали в течение 30 минут в средах, содержащих 5 мМ EDTA, 100 мкг/мл βigh3-WT, 100 мкг/мл βigh3-ΔRGD, 1 мМ RGD, 1мМ RGЕ или 100 мкг/мл фибронектина, либо не содержащих ни одного из этих компонентов, а затем анализировали на клеточную адгезию, как описано в примере 1.
Адгезия клеток к βig-h3 значительно ингибировалась самим βig-h3, пептидом RGD и EDTA и частично ингибировалась фибронектином и EGTA, но не ингибировалась пептидом RGЕ. Адгезия клеток к фибронектину также значительно ингибировалась самим фибронектином, пептидом RGD и EDTA и частично ингибировалась βig-h3 и EGTA, но не ингибировалась пептидом RGЕ, как показано на фиг.6А. Эти результаты показали, что клеточным поверхностным рецептором для βig-h3, опосредующим клеточно-адгезивную активности βig-h3 может быть один из RGD-зависимых интегринов.
1-2: Влияние двухвалентных катионов на клеточно-адгезивную активность
Для анализа чувствительности βig-h3-опосредованной адгезии к двухвалентному катиону клетки суспендировали в HEPES-забуференном физиологическом растворе (НВS) (150 мМ NаСl, 25 мМ HEPES, 2 мМ EDTA, рН 7,4) при плотности 2×105 клеток/мл и инкубировали при 37°С в течение 30 мин. Затем их дважды промывали в НВS и ресуспендировали в том же буфере. Аликвоты клеток (50 мкл) добавляли в лунки планшетов для микрокультивирования и инкубировали в течение 30 мин при 37°С в 5% CO2-атмосфере повышенной влажности с 50 мкл аликвот НВS, содержащего двухвалентные катионы (MnCl2, MgCl2 или CaCl2) при концентрации, в два раза превышающей конечную концентрацию. Затем клетки высевали на покрытые лигандом чашки для проведения анализа на адгезию.
Адгезия клеток к βig-h3 сильно стимулировалась Mn2+ и в меньшей степени Mg2+, но лишь маргинально Ca2+, как показано на фиг.6В. В целом, эти результаты продемонстрировали, что клеточный поверхностный рецептор для βig-h3 представляет собой рецептор типа RGD-зависимого интегрина, который для взаимодействия с βig-h3 требует присутствия двухвалентных катионов.
1-3: Идентификация клеточного поверхностного рецептора βig-h3 с использованием моноклонального антитела против интегрина
Для идентификации рецепторов для βig-h3 блокирующие функцию моноклональные антитела против субъединиц интегрина оценивали на их влияние на адгезию клеток НСЕ к поверхности, покрытой βig-h3. Для этого сначала НСЕ (3×105 клеток/мл) предварительно инкубировали при 37°С в течение 30 мин в инкубационном растворе в присутствии каждого из моноклональных антител (5 мкг/мл) против интегринов различных типов. Предварительно инкубированные клетки переносили на планшеты, предварительно покрытые белками βig-h3, а затем дополнительно инкубировали при 37°С в течение 1 часа и проводили количественный анализ на связывание βig-h3 с субстратом для гексозаминидазы. Величины выражали как процент числа клеток, прикрепленных к βig-h3, в отсутствии моноклональных антител.
Адгезия к βig-h3-покрытой поверхности специфически ингибировалась антителом против субъединицы α3. Поскольку субъединица α3 интегрина, как известно, связывается с субъединицей β1 интегрина, то антитело против β1 значительно блокирует адгезию клеток к βig-h3, как показано на фиг.6С. Аналогичные результаты были получены с использованием клеток НТ1080.
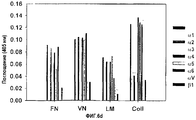
В контрольном эксперименте для блокирующих функцию антител, в качестве субстратов использовали фибронектин, витронектин, ламинин и коллаген типа I. Клетки НСЕ предварительно инкубировали с блокирующими функцию моноклональными антителами против субъединиц интегрина, а затем переносили на лунки, покрытые 10 мкг/мл фибронектина, витронектина, коллагена типа I или ламинина. После инкубирования анализировали число прикрепленных клеток.
Было показано, что адгезия клеток к фибронектину явно ингибируется антителами против интегринов α3 и α5. Адгезия к витронектину и коллагену типа I блокировалась антителами против интегринов αv и α2 соответственно, тогда как адгезия клеток к ламинину ингибировалась антителами против интегринов α3 и α6, как показано на фиг.6D. С другой стороны, антитело против интегрина β1 эффективно ингибировало адгезию клеток ко всем приведенным выше лигандам.
Для другого контрольного эксперимента были использованы клетки К562, которые, как известно, экспрессируют интегрин α5, но не α3. Клетки К562 инокулировали на планшеты, покрытые βigh3-WT, фибронектином, ламинином или коллагеном типа I, и инкубировали в течение 1 часа, а затем проводили анализ на гексозаминидазу. Клетки К562 не прикреплялись к βig-h3, но прикреплялись к фибронектину и витронектину. В целом, эти результаты позволяют предположить, что α3β1-интегрин является специфическим рецептором для βig-h3 в клетках НСЕ, как показано на фиг.6Е.
Пример 2
Идентификация доменов, необходимых для клеточно-адгезивной активности
В попытке идентифицировать аминокислоты, необходимые для клеточно-адгезивной активности βig-h3, были проведены исследования для того, чтобы определить, способен ли каждый повторяющийся домен опосредовать клеточную адгезию.
Было получено четыре рекомбинантных белка, соответствующих четырем повторяющимся доменам: четыре фрагмента кДНК βig-h3, кодирующих аминокислоты 129-241, 237-377, 368-506 и 498-637 соответственно, были амплифицированы посредством ПЦР и клонированы в EcoRV-XhoI-сайт рЕТ-29b(+), и полученные четыре экспрессирующих вектора, обозначенных рβig-h3 D-I, рβig-h3 D-II, рβig-h3 D-III и рβig-h3 D-IV, использовали для получения рекомбинантных белков, как показано на фиг.7. Трансформанты E.coli с экспрессирующими векторами рβig-h3 D-II и рβig-h3 D-IV были обозначены E.coli BL21/Hisβ-g и E.coli BL21/Hisβ-е и депонированы в Корейской коллекции типовых культур Корейского научно-исследовательского института биологических наук и биотехнологии (KRIВВ) под регистрационными номерами КТСТ 0905ВР и КТСТ 0904ВР, соответственно, 4 декабря 2000 г.
Экспрессию и очистку рекомбинантных белков βig-h3 D-I, βig-h3 D-II, βig-h3 D-III и βig-h3 D-IV осуществляли в соответствии с процедурой, описанной в примере 1-1, и их идентификацию проводили методом электрофореза в ДСН-ПААГ, как показано на фиг.8.
Что касается опосредования клеточной адгезии, то 2-й и 4-й домены fas-1 обладали активностью, аналогичной активности βig-h3 дикого типа, тогда как 1-й домен fas-1 имел слабую активность, а 3-й домен fas-1 вообще не обладал такой активностью, как показано на фиг.9.
В экспериментах с блокирующими функцию антителами против субъединиц интегрина клеточная адгезия, опосредованная 2-м и 4-м доменом fas-1, почти полностью блокировалась антителами против α3- и β1-интегринов, что позволяет предположить, что 2-й и 4-й домены fas-1 имеют аминокислоты, необходимые для взаимодействия с α3β1-интегрином, как показано на фиг.10. Эти результаты также позволяют сделать вывод, что последовательности Н1 и Н2 не опосредуют клеточно-адгезивную активность βig-h3, поскольку 1-й и 3-й домены fas-1 не обладают клеточно-адгезивной активностью, хотя они содержат последовательности Н1 или Н2.
Пример 3
Идентификация консервативной аминокислотной последовательности, необходимой для клеточно-адгезивной активности βig-h3
3-1: Идентификация консервативного мотива путем сопоставления аминокислотных последовательностей
Для обнаружения аминокислотной последовательности, ответственной за клеточную адгезию, во 2-м и 4-м доменах fas-1 βig-h3, которые независимо обладают клеточно-адгезивной активностью, проводили основанный на гомологии компьютерный поиск не только среди повторяющихся доменов fas-1 βig-h3, но также и среди доменов fas-1 других белков. В результате этого было обнаружено, что две аминокислоты, аспарагиновая кислота и изолейцин, расположенные возле области Н2, являются в высокой степени консервативными для различных белков, как показано на фиг.11. Кроме того, было обнаружено, что аспарагиновая кислота и изолейцин являются консервативными во 2-м и 4-м доменах fas-1 βig-h3, которые обладают высокой клеточно-адгезивной активностью, хотя в 1-м домене fas-1 консервативной является только аспарагиновая кислота, которая обнаруживает промежуточную клеточно-адгезивную активность. Что касается 3-го домена fas-1, который не обнаруживает клеточно-адгезивной активности, то он не содержит ни одной из двух данных аминокислот. Этот факт, кроме того, свидетельствует о том, что остатки аспарагиновой кислоты и изолейцина, находящиеся возле области Н2, необходимы для опосредования активности, способствующей прикреплению и распластыванию клеток.
3-2: Идентификация клеточно-адгезивной активности консервативной аминокислотной последовательности с использованием мутантов, имеющих замены
Для дополнительного подтверждения того, что указанные две аминокислоты необходимы для клеточной адгезии, рекомбинантный белок, содержащий 4-й домен fas-1 βig-h3, был мутирован путем замены, как показано на фиг.12. Имеющий замены мутант βig-h3 D-II получали посредством ПЦР, и его последовательность подтверждали путем секвенирования оснований. Мутантный белок выделяли и очищали, как описано в примере 1-1, и подтверждали с помощью электрофореза в ДСН-ПААГ, как показано на фиг.13.
Проводили оценку клеточно-адгезивной активности мутантных белков, где Pro616, Asp617 и Ile618 βigh3 D-IV были, в совокупности, заменены на Ser, Ala и Ser соответственно. Было обнаружено, что мутантный белок, имеющий Ala вместо Asp617 и обозначенный D617А (βigh3 D-IV-РаI), и мутантный белок, имеющий Ser вместо Ile618 и обозначенный I618S (βigh3 D-IV-РDs), значительно блокировали клеточную адгезию, тогда как мутантный белок, имеющий Ser вместо Pro616 и обозначенный Р616S (βigh3 D-IV-sDI), не оказывал влияния на клеточно-адгезивную активность. Что касается мутантного белка, в котором были мутированы три аминокислоты и который был обозначен Р616S/D617А/I618S (βigh3 DIV-sas), то он также блокировал клеточную адгезию, как показано на фиг.14.
Почти полная потеря клеточно-адгезивной активности, опосредуемой 1-м доменом fas-1, в 1-м домене fas-1, имеющем мутацию в Asp617 и Ile618, подтверждает, что аспарагиновая кислота в положении 617 и изолейцин в положении 618 играют очень важную роль в опосредовании клеточно-адгезивной активности βig-h3.
Пример 4
Идентификация доменов βig-h3, влияющих на заживление ран
4-1: Экспрессия и очистка рекомбинантного белка βig-h3
Для того, чтобы определить, только ли домены βig-h3, которые обладают клеточно-адгезивной активностью, обнаруживают ту же самую эффективность в заживлении ран, что и нативный βig-h3, содержащий все четыре домена fas-1, были получены различные рекомбинантные белки βig-h3, показанные на фиг.15:
His-β-b, содержащий все 4 домена fas-1; βigh3 D-IV, содержащий только 4-й домен; и βigh3 D-IV 2Х, 3Х и 4Х, каждый из которых включал, по крайней мере, один 4-й домен. Убедившись в том, что они имеют такую же клеточно-адгезивную активность, как и βigh3-WT, полученный в примере 1, получали рекомбинантный белок βig-h3, обозначенный His-β-b, из рекомбинантного экспрессирующего вектора рЕТ-29β, у которого в EcoRV-EcoRI-сайте находился Asp718-BglII-фрагмент, полученный путем делеции определенной амино-концевой области из кДНК βig-h3. Рекомбинантные белки His-β-b и βigh3 D-IV экспрессировали и очищали способами, описанными в примерах 1-1 и 3.
Рекомбинантные белки, содержащие, по крайней мере, один 4-й домен, такой как βigh3 D-IV 2Х, 3Х и 4Х, получали следующим образом. ДНК-фрагмент, кодирующий аминокислоты 498-637, соответствующие 4-му домену, получали с помощью ПЦР, и ПЦР-продукты затупляли по концам ферментом Кленова. Затупленный по концам кДНК-фрагмент встраивали в EcoRV-сайт рβig-h3 D-IV, который содержал 4-й домен βig-h3, и полученный экспрессирующий вектор обозначали рβI-h3 D-IV 2Х. Вставку рβig-h3 D-IV 2Х вырезали путем расщепления ферментами EcoRV и XhoI, и затупляли по концам путем обработки ферментом Кленова, а затем затупленный по концам фрагмент встраивали в EcoRV-сайты рβig-h3 D-IV и рβig-h3 D-IV 2Х. Полученные экспрессирующие векторы обозначали рβig-h3 D-IV 3Х и рβig-h3 D-IV 4Х.
Экспрессию всех рекомбинантных белков индуцировали в течение 3 часов в присутствии 1 мМ IPTG и выделяли с использованием смолы Ni-NТА (Qiagen). Выделенные рекомбинантные белки очищали путем элюирования 20 мМ Трис-HCl, содержащим 50 мМ NаСl и 300 мМ имидазола. βig-h3 D-IV 2Х, 3Х и 4Х могут быть продуцированы в больших количествах, поскольку они были синтезированы в растворимых формах, в отличие от рекомбинантных белков βig-h3, содержащих все четыре домена и не подвергнутых денатурации, как показано на фиг.16А. Электрофорез с использованием неденатурирующего геля выявил, что βig-h3 D-IV не образует полимеров, тогда как 2Х частично образует полимеры, а 3Х и 4Х легко образуют полимеры, как показано на фиг.16В.
E.coli BL21/Hisβ-е 4Х, который несет экспрессирующий вектор рβig-h3 D-IV 4Х, содержащий четыре копии 4-го домена βig-h3, был депонирован в Корейской коллекции типовых культур Корейского научно-исследовательского института биологических наук и биотехнологии (KRIВВ) под регистрационным номером КТСТ 0906ВР 4 декабря 2000 г.
Фибронектин, служащий в качестве позитивного контроля, очищали из цитратсодержащей крысиной плазмы с помощью аффинной хроматографии с использованием желатина-сефарозы 4В. Плазму фильтровали при комнатной температуре через незамещенную сефарозу 4В и элюат загружали на желатин-сефарозу 4В, уравновешенную 0,05 М Трис-HCl, содержащим 0,05 М ЕАСА (ε-аминокапроновая кислота), 0,02М цитрат натрия и 0,02% азида натрия. После элюирования большинство белков плазмы промывали буфером, содержащим 1М хлорид натрия. После этого абсорбированный фибронектин элюировали изотоническим буфером с 3М мочевой кислотой, а затем последовательно диализовали против PBS, pH 7,2, в течение 48 часов для очистки фибронектина. Его концентрацию определяли по УФ-поглощению при 280 нм и лиофилизовали, а затем хранили при -20°С.
4-2: Анализ на заживляющую раны активность βigh3 D-IV, содержащего 4-й домен
Для сравнения заживляющей раны активности рекомбинантного βig-h3, обозначенного His-β-b, который, подобно нативному белку βig-h3 содержит все четыре домена fas-1, и рекомбинантного βig-h3, обозначенного βigh3-D-IV, который содержит только 4-й домен, анализировали основы для мазей, содержащие указанные рекомбинантные белки, описанные ниже.
На спинках крыс делали четыре раны в неповрежденном дермальном слое, каждая диаметром 2 см, и крыс распределяли по тест-группам 1-А, 1-В, 1-С и 1-D в соответствии с наносимой на них мазью.
1-А: покрывали в дозе 1 г в день мазевой основой, не содержащей никаких материалов.
1-В: покрывали мазью в дозе 1 г в день, которая содержала фибронектин в концентрации 100 мкг/мл в сочетании с мазевой основой.
1-С: покрывали мазью в дозе 1 г в день, которая содержала белок Hisβ-b в концентрации 100 мкг/мл в сочетании с мазевой основой.
1-D: покрывали мазью в дозе 1 г в день, которая содержала белок βigh3 D-IV в концентрации 100 мкг/мл в сочетании с мазевой основой.
Спинки обработанных эфиром крыс выбривали, а затем выбритый участок стерилизовали раствором бетадина. В тест-группе 1 спинку каждой крысы надрезали лезвием хирургического скальпеля №15 с образованием четырех круглых ран диметром 2 см, которые проникали во внутрь цельных дермальных слоев. Мази для тест-групп 1-А, 1-В, 1-С и 1-D наносили в количестве примерно 1 г на рану, на которую затем накладывали синтетическую повязку (Tegaderm® 3М) и слегка стягивали. Нанесение мазей осуществляли ежедневно один раз в день.
Что касается основы из водного материала (основа SamA), то каждая из мазей содержала на 1 г 38 мг спермацетов, 116 мг стеарилового спирта, 38 мг полиэтиленгликоля, 192 мг концентрированного глицерина, 23 мг этанола, 1 мг лаурилсульфата натрия, 0,87 мг этилпараоксибензоата, 0,12 мг бутилпараоксибензоата и очищенную воду.
Сначала наблюдали морфологию ран. Возле каждой раны была установлена та же самая шкала и изображения делали на одном и том же расстоянии от раны. Изображения сканировали на компьютере и использовали для измерения площади ран с помощью системы анализа изображения NIH (Bio-Optics). Для получения изображения мышцы крыс подвергали полной релаксации путем обработки крыс эфиром. Измерения проводили через день вплоть до 22-го дня. Для сравнения тест-групп измеренные величины анализировали в соответствии c анализом ANOVA и критерием Шеффе.
Во всех тест-группах наблюдалось постепенное уменьшение площади ран сразу после их образования. Было отмечено, что у тест-групп, которые были обработаны фибронектином и рекомбинантным белком βig-h3, площадь раны уменьшалась быстрее, чем у тест-групп, которые были обработаны мазевой основой. Значительное уменьшение площади раны наблюдалось через 7 дней после нанесения мази. Статистически, наблюдались значимые различия (р<0,05) между ранами группы 1-А и другими группами, которые не обнаруживали значимых различий.
Результаты представлены в табл.1 и на фиг.17.
Гистологический анализ проводили с помощью оптического микроскопа. Биопсию раневых участков брали на дни 3, 7, 10, 14 и 20, фиксировали в 10% формалине и отверждали парафином. Перед наблюдением под микроскопом 6 мкм-срезы образцов окрашивали гематоксилином-эозином (Н&E) и трихромом Мессона. Зависимое от времени заживляющее действие на раны для каждого тестируемого материала оценивали по реэпитализации и образованию коллагеновых волокон. В случае реэпитализации, образование эпителия подвергали полуколичественной оценке, где оценка “ноль” соответствовала отсутствию образования эпителиальных слоев, оценка 1+ соответствовала инициации эпитализации, оценка 2+ соответствовала неполной структуре эпителиального слоя, а оценка 3+ соответствовала полной структуре эпителиального слоя. Что касается сравнения тест-групп и временных различий для каждой группы, то был проведен статистический анализ измеренных величин в соответствии с критерием ANOVA и критерием Шеффе. Что касается образования коллагенового волокна, то его оценивали по шкале, где 1+ означает незначительное образование коллагеновых волокон, наблюдаемое при использовании трихромового красителя, 2+ означает разрозненные коллагеновые волокна, а 3+ означает плотные коллагеновые волокна.
Как наблюдалось с помощью оптического микроскопа, реэпитализация начиналась в дни 7-10 в тест-группах 1-В, 1-С и 1-D, и завершалась на день 20. С другой стороны, в случае контрольной группы 1-А, реэпитализация не начиналась даже на день 14 и не завершалась на день 20. Результаты представлены в табл.2 и на фиг.18.
Результаты образования коллагеновых волокон представлены в табл.3. Как показано в табл.3, в тест-группах 1-А и 1-D не наблюдалось значительного образования коллагеновых волокон вплоть до 7-го дня, что соответствовало оценке +1, тогда как тест-группы 1-В и 1-С соответствовали оценке 2+. Однако все тест-группы имели оценку 2+ на день 10, что соответствовало относительно большому количеству коллагеновых волокон. На день 14 наблюдалось образование коллагеновых волокон с высокой плотностью, что точно соответствовало оценке +3, как показано на фиг.19. Само собой разумеется, что более плотные коллагеновые волокна соответствуют лучшему заживлению ран.
4-3: Заживляющее действие на раны рекомбинантных белков βigh3-D-IV, βigh3-D-IV 2Х, 3Х и 4Х, содержащих, по крайней мере, один 4-й домен
Исходя из обнаружения того факта, что βigh3 D-IV, содержащий только 4-й домен, является эффективным для заживления ран, получали βigh3 D-IV 2Х, 3Х и 4Х, которые содержали два, три и четыре 4-х домена, соответственно, для анализа на заживляющую раны активность.
Рекомбинантные белки анализировали на активность, способствующую адгезии клеток НСЕ, способом, описанным в примере 1-2. Результаты представлены на фиг.20. Как было показано, все рекомбинантные белки βigh3 D-IV 2Х, 3Х и 4Х эффективно индуцировали адгезию клеток НСЕ.
Для оценки заживляющего действия на раны рекомбинантных белков проводили нижеследующие эксперименты.
Взрослые крысы линии Sprague-Dawley весом 250-300 г получали стандартный корм и содержались в условиях постоянной температуры и влажности.
На спинке каждой крысы в тест-группе 2 делали четыре круглые раны в неповрежденном дермальном слое и покрывали хитозановой основой, объединенной с нужными материалами:
2-А: рану покрывали только хитозановой основой.
2-В: рану покрывали хитозановой основой в комбинации с 500 мкг/мл фибронектина.
2-Е: рану покрывали хитозановой основой в комбинации с 500 мкг/мл белка βig-h3 D-IV 3Х.
2-F: рану покрывали хитозановой основой в комбинации с 500 мкг/мл белка βig-h3 D-IV 4Х.
Композиты на основе хитозана получали следующим образом.
1 г водорастворимого хитозана (поли(1-4)-2-амино-2-дезокси-β-D-гликана) с молекулярной массой 600000 Да растворяли в 100 мл стерильной дистиллированной воды и полученный 1% раствор распределяли по аликвотам 2 мл в 12-луночный планшет (Corning, USA), а затем добавляли 100 мкг гентамицина на лунку. После этого отдельно добавляли фибронектин, βigh3-D-IV 3Х и βigh3-D-IV 4Х до концентрации 500 мкг/мл и замораживали при -70°С, а затем лиофилизовали в сублимационной сушилке (Ilshin) в течение 12 часов с получением композитов в форме дисков.
Спинки обработанных эфиром крыс выбривали, а затем выбритый участок стерилизовали раствором бетадина. На спинке каждой крысы формировали четыре круглые раны диметром 7 мм, которые проникали во внутрь цельных дермальных слоев. Раны покрывали композитами, используемыми для тест-групп 2-А, 2-В, 2-Е и 2-F соответственно, а затем накладывали повязку Tegaderm® (3М) и слегка стягивали. Композиты меняли каждые три дня.
Заживляющее действие на раны определяли путем оценки внешнего вида ран, как описано в примере 4-2.
Высокоэффективное заживляющее действие на раны наблюдалось с использованием композита, содержащего рекомбинантный белок βigh3-D-IV 3Х или 4Х.
Все крысы, за исключением всех членов тест-группы 2-А, одного члена тест-группы 2-В и двух членов тест-группы 2-Е и 2-F, полностью восстанавливались после ран на дни 12-15. Площади всех ран уменьшались в размере сразу после образования раны. Что касается тест-группы 2-А, то у крыс этой группы наблюдалось относительно медленное уменьшение площади ран на протяжении всего периода заживления раны. В других тест-группах размеры ран значительно уменьшались в первые три дня, затем постепенно уменьшались до 9-го дня, а затем снова быстро уменьшались. При сравнении ран для всего 15-дневного периода наблюдались более значимые отличия (р<0,05) в тест-группах 2-В, 2-Е и 2-F, чем в тест-группе 2-А, как показано в табл.4 и на фиг.21.
Следовательно, рекомбинантные белки настоящего изобретения, которые содержат 2-й и 4-й домены βig-h3, взятые отдельно или в комбинации друг с другом или в нескольких копиях, являются эффективными для клеточной адгезии и заживлении ран, и в конечном счете могут быть использованы в целях получения агентов для культивированию клеток и заживления ран.
Промышленное применение
Настоящее изобретение относится к рекомбинантным белкам, содержащим, по крайней мере, 2-й и 4-й домены βig-h3, где одна аспарагиновая кислота и один изолейцин, которые, как известно, необходимы для связывания с интегрином, являются в высокой степени консервативными. Кроме того, рекомбинантные белки сами могут быть использованы для клеточной адгезии и заживления ран, что может способствовать разработке методов культивирования клеток и получению агентов для заживления ран.
Настоящее изобретение описано на иллюстративных примерах, но при этом, следует отметить, что используемая терминология имеет лишь описательный, а не ограничивающий характер. Исходя из вышепривиденного описания, в настоящее изобретение может быть внесено множество модификаций и изменений. Поэтому, очевидно, что настоящее изобретение может быть реализовано способами, описанными в настоящей заявке, или иными способами, не выходящими за рамки объема формулы изобретения.
Claims (9)
1. Способ прикрепления клетки млекопитающего к рекомбинантному белку, включающему одну или более копий 2-го и/или 4-го домена fas-1 βig-h3, при этом 2-й домен fas-1 включает аминокислотную последовательность 237-377 βig-h3 и 4-й домен fas-1 включает аминокислотную последовательность 498-637 βig-h3, включающий следующие стадии: 1) получение рекомбинантного белка, включающего одну или более копий 2-го и/или 4-го домена fas-1 βig-h3; 2) покрытие рекомбинантным белком твердого носителя и 3) нанесение клеток на покрытый белком твердый носитель.
2. Способ по п.1, отличающийся тем, что рекомбинантный белок включает аминокислотную последовательность 498-637 βig-h3 в четырех копиях.
3. Экспрессирующий вектор pβig-h3 D-11, кодирующий аминокислотную последовательность 237-377 βig-h3 и способный экспрессировать 2-й домен fas-1 βig-h3.
4. Штамм E.coli, трансформированный экспрессирующим вектором по п.3, обозначенный как E.coli BL21/Hisβ-g (регистрационный номер КСТС 0905ВР).
5. Экспрессирующий вектор pβig-h3 D-IV, кодирующий аминокислотную последовательность 498-637 βig-h3 и способный экспрессировать 4-й домен fas-1 βig-h3.
6. Штамм E.coli, трансформированный экспрессирующим вектором по п.5, обозначенный как E.coli BL21/Hisβ-e (регистрационный номер КСТС 0904ВР).
7. Экспрессирующий вектор pβig-h3 D-IV 4Х, экспрессирующий рекомбинантный белок, включающий аминокислотную последовательность 498-637 βig-h3 в четырех копиях.
8. Штамм E.coli, трансформированный экспрессирующим вектором по п.7, обозначенный как E.coli BL21/Hisβ-е 4х (регистрационный номер КСТС 0906ВР).
9. Способ заживления ран у млекопитающего с помощью рекомбинантного белка, включающего одну или более копий 2-го и/или 4-го домена fas-1 βig-h3, при этом 2-й домен fas-1 включает аминокислотную последовательность 237-377 βig-h3 и 4-й домен fas-1 включает аминокислотную последовательность 498-637 βig-h3, включающий следующие стадии: 1) получение рекомбинантного белка, включающего одну или более копий 2-го и/или 4-го домена fas-1 βig-h3; 2) смешивание рекомбинантного белка с основанием и 3) нанесение смеси на раны.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR2000/25662 | 2000-05-13 | ||
| KR10-2000-0025662A KR100385293B1 (ko) | 2000-05-13 | 2000-05-13 | βig-h3의 일부 도메인을 이용한 세포 부착 및 창상치유 방법 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2002133463A RU2002133463A (ru) | 2004-03-27 |
| RU2234937C2 true RU2234937C2 (ru) | 2004-08-27 |
Family
ID=19668565
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2002133463/15A RU2234937C2 (ru) | 2000-05-13 | 2000-12-08 | Способ клеточной адгезии и заживления ран |
Country Status (12)
| Country | Link |
|---|---|
| US (2) | US7396682B2 (ru) |
| EP (1) | EP1282434B1 (ru) |
| JP (1) | JP3795805B2 (ru) |
| KR (1) | KR100385293B1 (ru) |
| CN (1) | CN1209165C (ru) |
| AT (1) | ATE446765T1 (ru) |
| AU (2) | AU2027001A (ru) |
| CA (1) | CA2409506A1 (ru) |
| DE (1) | DE60043238D1 (ru) |
| IL (2) | IL152410A0 (ru) |
| RU (1) | RU2234937C2 (ru) |
| WO (1) | WO2001087327A1 (ru) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2458069C2 (ru) * | 2007-01-05 | 2012-08-10 | Хеликс Байомедикс Инк. | Выделенный пептид для усиления ранозаживляющей активности кератиноцитов, композиция для заживления ран у млекопитающего и лекарственное средство для применения при заживлении ран у млекопитающего |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8258260B2 (en) * | 1970-02-11 | 2012-09-04 | Immatics Biotechnologies Gmbh | Tumor-associated peptides binding promiscuously to human leukocyte antigen (HLA) class II molecules |
| KR100378949B1 (ko) * | 2000-05-13 | 2003-04-08 | 주식회사 리젠 바이오텍 | 세포 부착, 확산 및 탈착 활성을 나타내는 펩타이드 및그의 유도체 |
| JP2005527813A (ja) * | 2002-04-19 | 2005-09-15 | リージェン バイオテック インコーポレーテッド | βig−h3蛋白質の定量方法及びこれを利用した診断キット |
| WO2005099743A1 (en) * | 2004-04-13 | 2005-10-27 | Kyungpook National University Industry-Academic Cooperation Foundation | Novel use of a polypeptide comprising fas-1 domain |
| KR100635540B1 (ko) * | 2004-10-12 | 2006-10-18 | 경북대학교 산학협력단 | 신규한 염증성 질환의 예방 또는 치료용 약학적 조성물 |
| JP2012012344A (ja) * | 2010-07-01 | 2012-01-19 | Japan Health Science Foundation | 創傷治癒剤 |
| CN108586584A (zh) * | 2018-05-03 | 2018-09-28 | 杭州史迪姆生物科技有限公司 | 功能多肽及其用途 |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4983581A (en) * | 1988-05-20 | 1991-01-08 | Institute Of Molecular Biology, Inc. | Wound healing composition of IGF-I and TGF-β |
| ES2178633T3 (es) * | 1990-05-30 | 2003-01-01 | Harvard College | Utilizacion concomitante del factor -i de crecimiento similar a insulina (en lo sucesivo "fci-i") y el factor de crecimiento transformante beta (en la sucesivo "fct-beta") para la fabricacion de un medicamento para la regeneracion de huesos en mamiferos. |
| HUT67319A (en) * | 1991-08-30 | 1995-03-28 | Life Medical Sciences Inc | Compositions for treating wounds |
| US5444164A (en) * | 1992-02-05 | 1995-08-22 | Bristol-Myers Squibb Company | TGF-β induced gene |
| US5599788A (en) * | 1994-07-01 | 1997-02-04 | Advanced Tissue Sciences | Method for accelerating skin wound healing with H3 protein |
| KR100378949B1 (ko) * | 2000-05-13 | 2003-04-08 | 주식회사 리젠 바이오텍 | 세포 부착, 확산 및 탈착 활성을 나타내는 펩타이드 및그의 유도체 |
-
2000
- 2000-05-13 KR KR10-2000-0025662A patent/KR100385293B1/ko not_active IP Right Cessation
- 2000-12-08 RU RU2002133463/15A patent/RU2234937C2/ru not_active IP Right Cessation
- 2000-12-08 CA CA002409506A patent/CA2409506A1/en not_active Abandoned
- 2000-12-08 IL IL15241000A patent/IL152410A0/xx unknown
- 2000-12-08 AU AU2027001A patent/AU2027001A/xx not_active Withdrawn
- 2000-12-08 EP EP00983525A patent/EP1282434B1/en not_active Expired - Lifetime
- 2000-12-08 CN CNB008195307A patent/CN1209165C/zh not_active Expired - Fee Related
- 2000-12-08 US US10/276,479 patent/US7396682B2/en not_active Expired - Fee Related
- 2000-12-08 AT AT00983525T patent/ATE446765T1/de not_active IP Right Cessation
- 2000-12-08 DE DE60043238T patent/DE60043238D1/de not_active Expired - Lifetime
- 2000-12-08 AU AU2001220270A patent/AU2001220270B2/en not_active Ceased
- 2000-12-08 JP JP2001583794A patent/JP3795805B2/ja not_active Expired - Fee Related
- 2000-12-08 WO PCT/KR2000/001428 patent/WO2001087327A1/en active Application Filing
-
2008
- 2008-03-31 US US12/060,056 patent/US20100331253A9/en not_active Abandoned
-
2009
- 2009-07-29 IL IL200132A patent/IL200132A0/en unknown
Non-Patent Citations (1)
| Title |
|---|
| OHNO S. et al. Biochem. Biophys. Acta. - 1999, v.196, р.1451. * |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2458069C2 (ru) * | 2007-01-05 | 2012-08-10 | Хеликс Байомедикс Инк. | Выделенный пептид для усиления ранозаживляющей активности кератиноцитов, композиция для заживления ран у млекопитающего и лекарственное средство для применения при заживлении ран у млекопитающего |
Also Published As
| Publication number | Publication date |
|---|---|
| EP1282434A1 (en) | 2003-02-12 |
| US7396682B2 (en) | 2008-07-08 |
| US20040052767A1 (en) | 2004-03-18 |
| ATE446765T1 (de) | 2009-11-15 |
| RU2002133463A (ru) | 2004-03-27 |
| EP1282434A4 (en) | 2004-12-08 |
| AU2001220270B2 (en) | 2004-09-30 |
| IL152410A0 (en) | 2003-05-29 |
| DE60043238D1 (de) | 2009-12-10 |
| CN1452493A (zh) | 2003-10-29 |
| JP3795805B2 (ja) | 2006-07-12 |
| JP2004521605A (ja) | 2004-07-22 |
| US20100331253A9 (en) | 2010-12-30 |
| CA2409506A1 (en) | 2001-11-22 |
| KR100385293B1 (ko) | 2003-05-23 |
| WO2001087327A1 (en) | 2001-11-22 |
| KR20010104176A (ko) | 2001-11-24 |
| CN1209165C (zh) | 2005-07-06 |
| AU2027001A (en) | 2001-11-26 |
| EP1282434B1 (en) | 2009-10-28 |
| IL200132A0 (en) | 2010-04-15 |
| US20080214463A1 (en) | 2008-09-04 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Younai et al. | Modulation of collagen synthesis by transforming growth factor-β in keloid and hypertrophic scar fibroblasts | |
| US20100331253A9 (en) | Method for cell adhesion and wound healing | |
| AU652744B2 (en) | Method and compositions for inhibiting angiogenesis | |
| JPH06506470A (ja) | TGF−β1/β2:新規なキメラトランスフォーミング増殖因子−β | |
| EP0550296A2 (en) | Vascular endothelial cells growth factor | |
| Kuzuya et al. | Reorganization of endothelial cord‐like structures on basement membrane complex (Matrigel): involvement of transforming growth factor β1 | |
| US7250400B2 (en) | Peptides and derivatives thereof showing cell attachment, spreading and detachment activity | |
| US20020048577A1 (en) | Methods and devices to modulate the wound response | |
| AU2001220270A1 (en) | Method for cell adhesion and wound healing | |
| JP4406013B2 (ja) | 細胞の接着・伸展を促進するペプチド、その断片及びその誘導体 | |
| AU2001220262A1 (en) | Peptides and derivatives thereof showing cell attachment, spreading and detachment activity | |
| KR100568755B1 (ko) | Yh 모티프를 포함하는 펩타이드를 유효성분으로함유하는 혈관신생 억제제 | |
| CN101489572A (zh) | 治疗和抑制纤维化疾病和瘢痕疙瘩的方法 | |
| KR20010104177A (ko) | 창상 치료를 위한 βig-h3 단백질 또는 그의 일부도메인을 포함하는 약학적 조성물 | |
| JP3375997B2 (ja) | 血管内皮細胞増殖促進剤 | |
| Ågren et al. | Differential expression of platelet‐derived growth factor receptors in porcine fibroblasts cultured from skin and granulation tissue | |
| WO2000076456A2 (en) | Modulators of fibrosis | |
| JP2000239299A (ja) | 新規蛋白質及びその製造方法 | |
| JP2003093064A (ja) | ラミニンα3鎖の改変体 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20101209 |