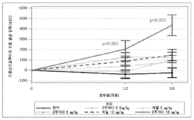
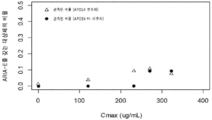
KR20210039402A - 알츠하이머병의 치료 및 예방 방법 - Google Patents
알츠하이머병의 치료 및 예방 방법 Download PDFInfo
- Publication number
- KR20210039402A KR20210039402A KR1020217005322A KR20217005322A KR20210039402A KR 20210039402 A KR20210039402 A KR 20210039402A KR 1020217005322 A KR1020217005322 A KR 1020217005322A KR 20217005322 A KR20217005322 A KR 20217005322A KR 20210039402 A KR20210039402 A KR 20210039402A
- Authority
- KR
- South Korea
- Prior art keywords
- subject
- months
- administration
- composition
- disease
- Prior art date
Links
- 208000024827 Alzheimer disease Diseases 0.000 title claims abstract description 704
- 238000000034 method Methods 0.000 title claims abstract description 304
- 238000011282 treatment Methods 0.000 title claims description 78
- 230000002265 prevention Effects 0.000 title description 6
- 230000007423 decrease Effects 0.000 claims abstract description 1003
- 239000000203 mixture Substances 0.000 claims abstract description 941
- 108010060159 Apolipoprotein E4 Proteins 0.000 claims abstract description 342
- 210000004556 brain Anatomy 0.000 claims abstract description 194
- 239000000902 placebo Substances 0.000 claims description 749
- 229940068196 placebo Drugs 0.000 claims description 749
- 230000002829 reductive effect Effects 0.000 claims description 577
- 230000009467 reduction Effects 0.000 claims description 421
- 208000010877 cognitive disease Diseases 0.000 claims description 253
- 206010012289 Dementia Diseases 0.000 claims description 208
- 208000027061 mild cognitive impairment Diseases 0.000 claims description 198
- 210000001175 cerebrospinal fluid Anatomy 0.000 claims description 165
- 239000003814 drug Substances 0.000 claims description 156
- 230000037396 body weight Effects 0.000 claims description 102
- 230000000007 visual effect Effects 0.000 claims description 79
- 230000008859 change Effects 0.000 claims description 74
- 229940124597 therapeutic agent Drugs 0.000 claims description 63
- 208000024891 symptom Diseases 0.000 claims description 58
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 43
- 102000001775 Neurogranin Human genes 0.000 claims description 41
- 108010015301 Neurogranin Proteins 0.000 claims description 41
- 101000979333 Homo sapiens Neurofilament light polypeptide Proteins 0.000 claims description 39
- 102100023057 Neurofilament light polypeptide Human genes 0.000 claims description 39
- 108010064539 amyloid beta-protein (1-42) Proteins 0.000 claims description 39
- 229940079593 drug Drugs 0.000 claims description 36
- 229940126077 BACE inhibitor Drugs 0.000 claims description 35
- 230000002490 cerebral effect Effects 0.000 claims description 34
- 238000004519 manufacturing process Methods 0.000 claims description 17
- 239000003795 chemical substances by application Substances 0.000 claims description 15
- 230000003247 decreasing effect Effects 0.000 claims description 15
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 15
- 239000003112 inhibitor Substances 0.000 claims description 15
- 108010047041 Complementarity Determining Regions Proteins 0.000 claims description 14
- 201000010099 disease Diseases 0.000 claims description 14
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 14
- 239000003540 gamma secretase inhibitor Substances 0.000 claims description 12
- 229940125373 Gamma-Secretase Inhibitor Drugs 0.000 claims description 10
- 229940124648 γ-Secretase Modulator Drugs 0.000 claims description 10
- 238000012544 monitoring process Methods 0.000 claims description 9
- 238000012423 maintenance Methods 0.000 claims description 5
- AACUJFVOHGRMTR-DPXNYUHVSA-N n-[3-[(4as,5r,7as)-2-amino-5-methyl-4,4a,5,7-tetrahydrofuro[3,4-d][1,3]thiazin-7a-yl]-4-fluorophenyl]-5-(difluoromethyl)pyrazine-2-carboxamide Chemical group C=1C=C(F)C([C@]23CO[C@@H]([C@H]2CSC(N)=N3)C)=CC=1NC(=O)C1=CN=C(C(F)F)C=N1 AACUJFVOHGRMTR-DPXNYUHVSA-N 0.000 claims description 5
- 208000005145 Cerebral amyloid angiopathy Diseases 0.000 claims description 4
- 208000004051 Chronic Traumatic Encephalopathy Diseases 0.000 claims description 3
- 201000010374 Down Syndrome Diseases 0.000 claims description 3
- 208000009829 Lewy Body Disease Diseases 0.000 claims description 3
- 201000002832 Lewy body dementia Diseases 0.000 claims description 3
- 208000017004 dementia pugilistica Diseases 0.000 claims description 3
- 229950009694 elenbecestat Drugs 0.000 claims description 3
- 208000014644 Brain disease Diseases 0.000 claims description 2
- 125000003275 alpha amino acid group Chemical group 0.000 claims 12
- VHNYOQKVZQVBLC-RTCGXNAVSA-N (4r,7e,9as)-7-[[3-methoxy-4-(4-methylimidazol-1-yl)phenyl]methylidene]-4-(3,4,5-trifluorophenyl)-1,3,4,8,9,9a-hexahydropyrido[2,1-c][1,4]oxazin-6-one Chemical compound C1([C@@H]2COC[C@@H]3CC\C(C(N32)=O)=C/C=2C=C(C(=CC=2)N2C=C(C)N=C2)OC)=CC(F)=C(F)C(F)=C1 VHNYOQKVZQVBLC-RTCGXNAVSA-N 0.000 claims 2
- 102100021257 Beta-secretase 1 Human genes 0.000 claims 2
- 101000894895 Homo sapiens Beta-secretase 1 Proteins 0.000 claims 2
- 238000002600 positron emission tomography Methods 0.000 description 210
- 230000006999 cognitive decline Effects 0.000 description 50
- 230000015556 catabolic process Effects 0.000 description 27
- 238000006731 degradation reaction Methods 0.000 description 27
- 102000013498 tau Proteins Human genes 0.000 description 20
- 108010026424 tau Proteins Proteins 0.000 description 20
- 239000000969 carrier Substances 0.000 description 17
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 15
- 238000004458 analytical method Methods 0.000 description 15
- ADEBPBSSDYVVLD-UHFFFAOYSA-N donepezil Chemical compound O=C1C=2C=C(OC)C(OC)=CC=2CC1CC(CC1)CCN1CC1=CC=CC=C1 ADEBPBSSDYVVLD-UHFFFAOYSA-N 0.000 description 14
- 230000000694 effects Effects 0.000 description 13
- 230000002411 adverse Effects 0.000 description 12
- ASUTZQLVASHGKV-JDFRZJQESA-N galanthamine Chemical compound O1C(=C23)C(OC)=CC=C2CN(C)CC[C@]23[C@@H]1C[C@@H](O)C=C2 ASUTZQLVASHGKV-JDFRZJQESA-N 0.000 description 12
- 238000002595 magnetic resonance imaging Methods 0.000 description 12
- 238000012216 screening Methods 0.000 description 12
- 150000001413 amino acids Chemical group 0.000 description 11
- 230000001149 cognitive effect Effects 0.000 description 11
- 239000002131 composite material Substances 0.000 description 11
- 238000011156 evaluation Methods 0.000 description 11
- 238000005259 measurement Methods 0.000 description 11
- 239000000090 biomarker Substances 0.000 description 10
- 238000003384 imaging method Methods 0.000 description 10
- 206010072599 Amyloid related imaging abnormalities Diseases 0.000 description 9
- 206010061818 Disease progression Diseases 0.000 description 9
- 230000008901 benefit Effects 0.000 description 9
- 230000005750 disease progression Effects 0.000 description 9
- 239000000700 radioactive tracer Substances 0.000 description 9
- 239000001509 sodium citrate Substances 0.000 description 9
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 9
- 238000006243 chemical reaction Methods 0.000 description 8
- 231100000673 dose–response relationship Toxicity 0.000 description 8
- 238000001802 infusion Methods 0.000 description 8
- 239000000178 monomer Substances 0.000 description 8
- 238000012879 PET imaging Methods 0.000 description 7
- 230000002596 correlated effect Effects 0.000 description 7
- 230000001054 cortical effect Effects 0.000 description 7
- 229960003530 donepezil Drugs 0.000 description 7
- BUGYDGFZZOZRHP-UHFFFAOYSA-N memantine Chemical compound C1C(C2)CC3(C)CC1(C)CC2(N)C3 BUGYDGFZZOZRHP-UHFFFAOYSA-N 0.000 description 7
- 229960004640 memantine Drugs 0.000 description 7
- 239000011780 sodium chloride Substances 0.000 description 7
- 208000028185 Angioedema Diseases 0.000 description 6
- 208000028698 Cognitive impairment Diseases 0.000 description 6
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 6
- XSVMFMHYUFZWBK-NSHDSACASA-N Rivastigmine Chemical compound CCN(C)C(=O)OC1=CC=CC([C@H](C)N(C)C)=C1 XSVMFMHYUFZWBK-NSHDSACASA-N 0.000 description 6
- 229950001863 bapineuzumab Drugs 0.000 description 6
- 229960003980 galantamine Drugs 0.000 description 6
- ASUTZQLVASHGKV-UHFFFAOYSA-N galanthamine hydrochloride Natural products O1C(=C23)C(OC)=CC=C2CN(C)CCC23C1CC(O)C=C2 ASUTZQLVASHGKV-UHFFFAOYSA-N 0.000 description 6
- 238000001990 intravenous administration Methods 0.000 description 6
- 230000036470 plasma concentration Effects 0.000 description 6
- 229920001184 polypeptide Polymers 0.000 description 6
- 229960004136 rivastigmine Drugs 0.000 description 6
- 241000880493 Leptailurus serval Species 0.000 description 5
- 241001074085 Scophthalmus aquosus Species 0.000 description 5
- 230000003920 cognitive function Effects 0.000 description 5
- 230000034994 death Effects 0.000 description 5
- 231100000517 death Toxicity 0.000 description 5
- 230000006870 function Effects 0.000 description 5
- 230000036541 health Effects 0.000 description 5
- 230000008449 language Effects 0.000 description 5
- 230000000670 limiting effect Effects 0.000 description 5
- 230000007774 longterm Effects 0.000 description 5
- 230000007570 microbleeding Effects 0.000 description 5
- 108010051242 phenylalanylserine Proteins 0.000 description 5
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 5
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 5
- 229940068968 polysorbate 80 Drugs 0.000 description 5
- 229920000053 polysorbate 80 Polymers 0.000 description 5
- 238000012360 testing method Methods 0.000 description 5
- 230000001225 therapeutic effect Effects 0.000 description 5
- 108010090849 Amyloid beta-Peptides Proteins 0.000 description 4
- 102000013455 Amyloid beta-Peptides Human genes 0.000 description 4
- 108010071619 Apolipoproteins Proteins 0.000 description 4
- 238000012286 ELISA Assay Methods 0.000 description 4
- NXRNRBOKDBIVKQ-CXTHYWKRSA-N Ile-Tyr-Tyr Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)N[C@@H](CC2=CC=C(C=C2)O)C(=O)O)N NXRNRBOKDBIVKQ-CXTHYWKRSA-N 0.000 description 4
- BRTVHXHCUSXYRI-CIUDSAMLSA-N Leu-Ser-Ser Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(O)=O BRTVHXHCUSXYRI-CIUDSAMLSA-N 0.000 description 4
- GILLQRYAWOMHED-DCAQKATOSA-N Lys-Val-Ser Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@@H](N)CCCCN GILLQRYAWOMHED-DCAQKATOSA-N 0.000 description 4
- SRSPTFBENMJHMR-WHFBIAKZSA-N Ser-Ser-Gly Chemical compound OC[C@H](N)C(=O)N[C@@H](CO)C(=O)NCC(O)=O SRSPTFBENMJHMR-WHFBIAKZSA-N 0.000 description 4
- HNDMFDBQXYZSRM-IHRRRGAJSA-N Ser-Val-Phe Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O HNDMFDBQXYZSRM-IHRRRGAJSA-N 0.000 description 4
- 229950008995 aducanumab Drugs 0.000 description 4
- VREFGVBLTWBCJP-UHFFFAOYSA-N alprazolam Chemical compound C12=CC(Cl)=CC=C2N2C(C)=NN=C2CN=C1C1=CC=CC=C1 VREFGVBLTWBCJP-UHFFFAOYSA-N 0.000 description 4
- 230000002354 daily effect Effects 0.000 description 4
- 108010078144 glutaminyl-glycine Proteins 0.000 description 4
- 108010017391 lysylvaline Proteins 0.000 description 4
- 208000015122 neurodegenerative disease Diseases 0.000 description 4
- 238000009522 phase III clinical trial Methods 0.000 description 4
- 230000004044 response Effects 0.000 description 4
- 229950007874 solanezumab Drugs 0.000 description 4
- 230000002739 subcortical effect Effects 0.000 description 4
- 238000002198 surface plasmon resonance spectroscopy Methods 0.000 description 4
- 230000003442 weekly effect Effects 0.000 description 4
- 210000004885 white matter Anatomy 0.000 description 4
- NFGXHKASABOEEW-UHFFFAOYSA-N 1-methylethyl 11-methoxy-3,7,11-trimethyl-2,4-dodecadienoate Chemical compound COC(C)(C)CCCC(C)CC=CC(C)=CC(=O)OC(C)C NFGXHKASABOEEW-UHFFFAOYSA-N 0.000 description 3
- 108700028369 Alleles Proteins 0.000 description 3
- 208000037259 Amyloid Plaque Diseases 0.000 description 3
- HUZGPXBILPMCHM-IHRRRGAJSA-N Asn-Arg-Phe Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O HUZGPXBILPMCHM-IHRRRGAJSA-N 0.000 description 3
- DXVMJJNAOVECBA-WHFBIAKZSA-N Asn-Gly-Asn Chemical compound NC(=O)C[C@H](N)C(=O)NCC(=O)N[C@@H](CC(N)=O)C(O)=O DXVMJJNAOVECBA-WHFBIAKZSA-N 0.000 description 3
- OHLLDUNVMPPUMD-DCAQKATOSA-N Cys-Leu-Val Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](C(C)C)C(=O)O)NC(=O)[C@H](CS)N OHLLDUNVMPPUMD-DCAQKATOSA-N 0.000 description 3
- VUBIPAHVHMZHCM-KKUMJFAQSA-N Leu-Tyr-Ser Chemical compound CC(C)C[C@H](N)C(=O)N[C@H](C(=O)N[C@@H](CO)C(O)=O)CC1=CC=C(O)C=C1 VUBIPAHVHMZHCM-KKUMJFAQSA-N 0.000 description 3
- QLFAPXUXEBAWEK-NHCYSSNCSA-N Lys-Val-Asp Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(O)=O)C(O)=O QLFAPXUXEBAWEK-NHCYSSNCSA-N 0.000 description 3
- CGBYDGAJHSOGFQ-LPEHRKFASA-N Pro-Ala-Pro Chemical compound C[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@@H]2CCCN2 CGBYDGAJHSOGFQ-LPEHRKFASA-N 0.000 description 3
- IHCXPSYCHXFXKT-DCAQKATOSA-N Pro-Arg-Glu Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(O)=O IHCXPSYCHXFXKT-DCAQKATOSA-N 0.000 description 3
- RCYUBVHMVUHEBM-RCWTZXSCSA-N Pro-Pro-Thr Chemical compound [H]N1CCC[C@H]1C(=O)N1CCC[C@H]1C(=O)N[C@@H]([C@@H](C)O)C(O)=O RCYUBVHMVUHEBM-RCWTZXSCSA-N 0.000 description 3
- YDTUEBLEAVANFH-RCWTZXSCSA-N Pro-Val-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@@H]1CCCN1 YDTUEBLEAVANFH-RCWTZXSCSA-N 0.000 description 3
- UIGMAMGZOJVTDN-WHFBIAKZSA-N Ser-Gly-Ser Chemical compound OC[C@H](N)C(=O)NCC(=O)N[C@@H](CO)C(O)=O UIGMAMGZOJVTDN-WHFBIAKZSA-N 0.000 description 3
- ZUDXUJSYCCNZQJ-DCAQKATOSA-N Ser-His-Val Chemical compound CC(C)[C@@H](C(=O)O)NC(=O)[C@H](CC1=CN=CN1)NC(=O)[C@H](CO)N ZUDXUJSYCCNZQJ-DCAQKATOSA-N 0.000 description 3
- BMKNXTJLHFIAAH-CIUDSAMLSA-N Ser-Ser-Leu Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(O)=O BMKNXTJLHFIAAH-CIUDSAMLSA-N 0.000 description 3
- JAWUQFCGNVEDRN-MEYUZBJRSA-N Thr-Tyr-Leu Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)N[C@@H](CC(C)C)C(=O)O)N)O JAWUQFCGNVEDRN-MEYUZBJRSA-N 0.000 description 3
- WYOBRXPIZVKNMF-IRXDYDNUSA-N Tyr-Tyr-Gly Chemical compound C([C@H](N)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)NCC(O)=O)C1=CC=C(O)C=C1 WYOBRXPIZVKNMF-IRXDYDNUSA-N 0.000 description 3
- 238000010521 absorption reaction Methods 0.000 description 3
- 108010052670 arginyl-glutamyl-glutamic acid Proteins 0.000 description 3
- 108010047857 aspartylglycine Proteins 0.000 description 3
- 230000006399 behavior Effects 0.000 description 3
- 230000008021 deposition Effects 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 229940120402 donepezil and memantine Drugs 0.000 description 3
- 230000002349 favourable effect Effects 0.000 description 3
- 238000009472 formulation Methods 0.000 description 3
- 230000000971 hippocampal effect Effects 0.000 description 3
- 229910052742 iron Inorganic materials 0.000 description 3
- 230000004770 neurodegeneration Effects 0.000 description 3
- 230000007170 pathology Effects 0.000 description 3
- 230000002688 persistence Effects 0.000 description 3
- 230000019612 pigmentation Effects 0.000 description 3
- 229920000136 polysorbate Polymers 0.000 description 3
- 229950008882 polysorbate Drugs 0.000 description 3
- 108010031719 prolyl-serine Proteins 0.000 description 3
- 238000012552 review Methods 0.000 description 3
- 238000002560 therapeutic procedure Methods 0.000 description 3
- 108010015385 valyl-prolyl-proline Proteins 0.000 description 3
- 108010073969 valyllysine Proteins 0.000 description 3
- CXRCVCURMBFFOL-FXQIFTODSA-N Ala-Ala-Pro Chemical compound C[C@H](N)C(=O)N[C@@H](C)C(=O)N1CCC[C@H]1C(O)=O CXRCVCURMBFFOL-FXQIFTODSA-N 0.000 description 2
- SVBXIUDNTRTKHE-CIUDSAMLSA-N Ala-Arg-Glu Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(O)=O SVBXIUDNTRTKHE-CIUDSAMLSA-N 0.000 description 2
- KUDREHRZRIVKHS-UWJYBYFXSA-N Ala-Asp-Tyr Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O KUDREHRZRIVKHS-UWJYBYFXSA-N 0.000 description 2
- MNZHHDPWDWQJCQ-YUMQZZPRSA-N Ala-Leu-Gly Chemical compound C[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)NCC(O)=O MNZHHDPWDWQJCQ-YUMQZZPRSA-N 0.000 description 2
- MDNAVFBZPROEHO-UHFFFAOYSA-N Ala-Lys-Val Natural products CC(C)C(C(O)=O)NC(=O)C(NC(=O)C(C)N)CCCCN MDNAVFBZPROEHO-UHFFFAOYSA-N 0.000 description 2
- IPZQNYYAYVRKKK-FXQIFTODSA-N Ala-Pro-Ala Chemical compound C[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](C)C(O)=O IPZQNYYAYVRKKK-FXQIFTODSA-N 0.000 description 2
- WQKAQKZRDIZYNV-VZFHVOOUSA-N Ala-Ser-Thr Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(O)=O WQKAQKZRDIZYNV-VZFHVOOUSA-N 0.000 description 2
- ARHJJAAWNWOACN-FXQIFTODSA-N Ala-Ser-Val Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(O)=O ARHJJAAWNWOACN-FXQIFTODSA-N 0.000 description 2
- GCTANJIJJROSLH-GVARAGBVSA-N Ala-Tyr-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H](CC1=CC=C(C=C1)O)NC(=O)[C@H](C)N GCTANJIJJROSLH-GVARAGBVSA-N 0.000 description 2
- 102100034112 Alkyldihydroxyacetonephosphate synthase, peroxisomal Human genes 0.000 description 2
- 102100029470 Apolipoprotein E Human genes 0.000 description 2
- 102000007592 Apolipoproteins Human genes 0.000 description 2
- VKKYFICVTYKFIO-CIUDSAMLSA-N Arg-Ala-Glu Chemical compound OC(=O)CC[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CCCN=C(N)N VKKYFICVTYKFIO-CIUDSAMLSA-N 0.000 description 2
- BECXEHHOZNFFFX-IHRRRGAJSA-N Arg-Ser-Tyr Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O BECXEHHOZNFFFX-IHRRRGAJSA-N 0.000 description 2
- XRNXPIGJPQHCPC-RCWTZXSCSA-N Arg-Thr-Val Chemical compound CC(C)[C@H](NC(=O)[C@@H](NC(=O)[C@@H](N)CCCNC(N)=N)[C@@H](C)O)C(O)=O XRNXPIGJPQHCPC-RCWTZXSCSA-N 0.000 description 2
- ULBHWNVWSCJLCO-NHCYSSNCSA-N Arg-Val-Glu Chemical compound OC(=O)CC[C@@H](C(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@@H](N)CCCN=C(N)N ULBHWNVWSCJLCO-NHCYSSNCSA-N 0.000 description 2
- XYOVHPDDWCEUDY-CIUDSAMLSA-N Asn-Ala-Leu Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(O)=O XYOVHPDDWCEUDY-CIUDSAMLSA-N 0.000 description 2
- SLKLLQWZQHXYSV-CIUDSAMLSA-N Asn-Ala-Lys Chemical compound NC(=O)C[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCCN)C(O)=O SLKLLQWZQHXYSV-CIUDSAMLSA-N 0.000 description 2
- GXMSVVBIAMWMKO-BQBZGAKWSA-N Asn-Arg-Gly Chemical compound NC(=O)C[C@H](N)C(=O)N[C@H](C(=O)NCC(O)=O)CCCN=C(N)N GXMSVVBIAMWMKO-BQBZGAKWSA-N 0.000 description 2
- MKJBPDLENBUHQU-CIUDSAMLSA-N Asn-Ser-Leu Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(O)=O MKJBPDLENBUHQU-CIUDSAMLSA-N 0.000 description 2
- QNNBHTFDFFFHGC-KKUMJFAQSA-N Asn-Tyr-Lys Chemical compound C1=CC(=CC=C1C[C@@H](C(=O)N[C@@H](CCCCN)C(=O)O)NC(=O)[C@H](CC(=O)N)N)O QNNBHTFDFFFHGC-KKUMJFAQSA-N 0.000 description 2
- MRQQMVZUHXUPEV-IHRRRGAJSA-N Asp-Arg-Phe Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O MRQQMVZUHXUPEV-IHRRRGAJSA-N 0.000 description 2
- MNQMTYSEKZHIDF-GCJQMDKQSA-N Asp-Thr-Ala Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C)C(O)=O MNQMTYSEKZHIDF-GCJQMDKQSA-N 0.000 description 2
- XWKPSMRPIKKDDU-RCOVLWMOSA-N Asp-Val-Gly Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](C(C)C)C(=O)NCC(O)=O XWKPSMRPIKKDDU-RCOVLWMOSA-N 0.000 description 2
- ZUNMTUPRQMWMHX-LSJOCFKGSA-N Asp-Val-Val Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](C(C)C)C(O)=O ZUNMTUPRQMWMHX-LSJOCFKGSA-N 0.000 description 2
- 206010067277 Cerebral microhaemorrhage Diseases 0.000 description 2
- 208000032862 Clinical Deterioration Diseases 0.000 description 2
- GEEXORWTBTUOHC-FXQIFTODSA-N Cys-Arg-Ser Chemical compound C(C[C@@H](C(=O)N[C@@H](CO)C(=O)O)NC(=O)[C@H](CS)N)CN=C(N)N GEEXORWTBTUOHC-FXQIFTODSA-N 0.000 description 2
- VIRYODQIWJNWNU-NRPADANISA-N Cys-Glu-Val Chemical compound CC(C)[C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)O)NC(=O)[C@H](CS)N VIRYODQIWJNWNU-NRPADANISA-N 0.000 description 2
- BBQIWFFTTQTNOC-AVGNSLFASA-N Cys-Phe-Gln Chemical compound C1=CC=C(C=C1)C[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)O)NC(=O)[C@H](CS)N BBQIWFFTTQTNOC-AVGNSLFASA-N 0.000 description 2
- 238000002965 ELISA Methods 0.000 description 2
- OYTPNWYZORARHL-XHNCKOQMSA-N Gln-Ala-Pro Chemical compound C[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CCC(=O)N)N OYTPNWYZORARHL-XHNCKOQMSA-N 0.000 description 2
- JXFLPKSDLDEOQK-JHEQGTHGSA-N Gln-Gly-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H](N)CCC(N)=O JXFLPKSDLDEOQK-JHEQGTHGSA-N 0.000 description 2
- IULKWYSYZSURJK-AVGNSLFASA-N Gln-Leu-Lys Chemical compound NC(=O)CC[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(O)=O IULKWYSYZSURJK-AVGNSLFASA-N 0.000 description 2
- ZEEPYMXTJWIMSN-GUBZILKMSA-N Gln-Lys-Ser Chemical compound NCCCC[C@@H](C(=O)N[C@@H](CO)C(O)=O)NC(=O)[C@@H](N)CCC(N)=O ZEEPYMXTJWIMSN-GUBZILKMSA-N 0.000 description 2
- FQCILXROGNOZON-YUMQZZPRSA-N Gln-Pro-Gly Chemical compound NC(=O)CC[C@H](N)C(=O)N1CCC[C@H]1C(=O)NCC(O)=O FQCILXROGNOZON-YUMQZZPRSA-N 0.000 description 2
- LKDIBBOKUAASNP-FXQIFTODSA-N Glu-Ala-Glu Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(O)=O LKDIBBOKUAASNP-FXQIFTODSA-N 0.000 description 2
- JJKKWYQVHRUSDG-GUBZILKMSA-N Glu-Ala-Lys Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCCN)C(O)=O JJKKWYQVHRUSDG-GUBZILKMSA-N 0.000 description 2
- CKOFNWCLWRYUHK-XHNCKOQMSA-N Glu-Asp-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CC(=O)O)NC(=O)[C@H](CCC(=O)O)N)C(=O)O CKOFNWCLWRYUHK-XHNCKOQMSA-N 0.000 description 2
- CLROYXHHUZELFX-FXQIFTODSA-N Glu-Gln-Asp Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(O)=O)C(O)=O CLROYXHHUZELFX-FXQIFTODSA-N 0.000 description 2
- HUFCEIHAFNVSNR-IHRRRGAJSA-N Glu-Gln-Tyr Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@H](C(O)=O)CC1=CC=C(O)C=C1 HUFCEIHAFNVSNR-IHRRRGAJSA-N 0.000 description 2
- CGWHAXBNGYQBBK-JBACZVJFSA-N Glu-Trp-Tyr Chemical compound C([C@H](NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CCC(O)=O)N)C(O)=O)C1=CC=C(O)C=C1 CGWHAXBNGYQBBK-JBACZVJFSA-N 0.000 description 2
- YQPFCZVKMUVZIN-AUTRQRHGSA-N Glu-Val-Gln Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(N)=O)C(O)=O YQPFCZVKMUVZIN-AUTRQRHGSA-N 0.000 description 2
- ZYRXTRTUCAVNBQ-GVXVVHGQSA-N Glu-Val-Lys Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCCCN)C(=O)O)NC(=O)[C@H](CCC(=O)O)N ZYRXTRTUCAVNBQ-GVXVVHGQSA-N 0.000 description 2
- PMNHJLASAAWELO-FOHZUACHSA-N Gly-Asp-Thr Chemical compound [H]NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O PMNHJLASAAWELO-FOHZUACHSA-N 0.000 description 2
- INLIXXRWNUKVCF-JTQLQIEISA-N Gly-Gly-Tyr Chemical compound NCC(=O)NCC(=O)N[C@H](C(O)=O)CC1=CC=C(O)C=C1 INLIXXRWNUKVCF-JTQLQIEISA-N 0.000 description 2
- NNCSJUBVFBDDLC-YUMQZZPRSA-N Gly-Leu-Ser Chemical compound NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(O)=O NNCSJUBVFBDDLC-YUMQZZPRSA-N 0.000 description 2
- MIIVFRCYJABHTQ-ONGXEEELSA-N Gly-Leu-Val Chemical compound [H]NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(O)=O MIIVFRCYJABHTQ-ONGXEEELSA-N 0.000 description 2
- PDUHNKAFQXQNLH-ZETCQYMHSA-N Gly-Lys-Gly Chemical compound NCCCC[C@H](NC(=O)CN)C(=O)NCC(O)=O PDUHNKAFQXQNLH-ZETCQYMHSA-N 0.000 description 2
- RVGMVLVBDRQVKB-UWVGGRQHSA-N Gly-Met-His Chemical compound CSCC[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)NC(=O)CN RVGMVLVBDRQVKB-UWVGGRQHSA-N 0.000 description 2
- WNZOCXUOGVYYBJ-CDMKHQONSA-N Gly-Phe-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CC1=CC=CC=C1)NC(=O)CN)O WNZOCXUOGVYYBJ-CDMKHQONSA-N 0.000 description 2
- HAOUOFNNJJLVNS-BQBZGAKWSA-N Gly-Pro-Ser Chemical compound NCC(=O)N1CCC[C@H]1C(=O)N[C@@H](CO)C(O)=O HAOUOFNNJJLVNS-BQBZGAKWSA-N 0.000 description 2
- SOEGEPHNZOISMT-BYPYZUCNSA-N Gly-Ser-Gly Chemical compound NCC(=O)N[C@@H](CO)C(=O)NCC(O)=O SOEGEPHNZOISMT-BYPYZUCNSA-N 0.000 description 2
- XHVONGZZVUUORG-WEDXCCLWSA-N Gly-Thr-Lys Chemical compound NCC(=O)N[C@@H]([C@H](O)C)C(=O)N[C@H](C(O)=O)CCCCN XHVONGZZVUUORG-WEDXCCLWSA-N 0.000 description 2
- FULZDMOZUZKGQU-ONGXEEELSA-N Gly-Val-His Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)NC(=O)CN FULZDMOZUZKGQU-ONGXEEELSA-N 0.000 description 2
- 101000799143 Homo sapiens Alkyldihydroxyacetonephosphate synthase, peroxisomal Proteins 0.000 description 2
- QQFSKBMCAKWHLG-UHFFFAOYSA-N Ile-Phe-Pro-Pro Chemical compound C1CCC(C(=O)N2C(CCC2)C(O)=O)N1C(=O)C(NC(=O)C(N)C(C)CC)CC1=CC=CC=C1 QQFSKBMCAKWHLG-UHFFFAOYSA-N 0.000 description 2
- JCGMFFQQHJQASB-PYJNHQTQSA-N Ile-Val-His Chemical compound N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC1=CNC=N1)C(=O)O JCGMFFQQHJQASB-PYJNHQTQSA-N 0.000 description 2
- 108010065920 Insulin Lispro Proteins 0.000 description 2
- PWWVAXIEGOYWEE-UHFFFAOYSA-N Isophenergan Chemical compound C1=CC=C2N(CC(C)N(C)C)C3=CC=CC=C3SC2=C1 PWWVAXIEGOYWEE-UHFFFAOYSA-N 0.000 description 2
- PMGDADKJMCOXHX-UHFFFAOYSA-N L-Arginyl-L-glutamin-acetat Natural products NC(=N)NCCCC(N)C(=O)NC(CCC(N)=O)C(O)=O PMGDADKJMCOXHX-UHFFFAOYSA-N 0.000 description 2
- DBVWMYGBVFCRBE-CIUDSAMLSA-N Leu-Asn-Asn Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O DBVWMYGBVFCRBE-CIUDSAMLSA-N 0.000 description 2
- FQZPTCNSNPWHLJ-AVGNSLFASA-N Leu-Gln-Lys Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCCN)C(O)=O FQZPTCNSNPWHLJ-AVGNSLFASA-N 0.000 description 2
- AXZGZMGRBDQTEY-SRVKXCTJSA-N Leu-Gln-Met Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCSC)C(O)=O AXZGZMGRBDQTEY-SRVKXCTJSA-N 0.000 description 2
- HPBCTWSUJOGJSH-MNXVOIDGSA-N Leu-Glu-Ile Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O HPBCTWSUJOGJSH-MNXVOIDGSA-N 0.000 description 2
- FEHQLKKBVJHSEC-SZMVWBNQSA-N Leu-Glu-Trp Chemical compound C1=CC=C2C(C[C@H](NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](N)CC(C)C)C(O)=O)=CNC2=C1 FEHQLKKBVJHSEC-SZMVWBNQSA-N 0.000 description 2
- NRFGTHFONZYFNY-MGHWNKPDSA-N Leu-Ile-Tyr Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@H](C(O)=O)CC1=CC=C(O)C=C1 NRFGTHFONZYFNY-MGHWNKPDSA-N 0.000 description 2
- KIZIOFNVSOSKJI-CIUDSAMLSA-N Leu-Ser-Cys Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CS)C(=O)O)N KIZIOFNVSOSKJI-CIUDSAMLSA-N 0.000 description 2
- AMSSKPUHBUQBOQ-SRVKXCTJSA-N Leu-Ser-Lys Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCCN)C(=O)O)N AMSSKPUHBUQBOQ-SRVKXCTJSA-N 0.000 description 2
- SBANPBVRHYIMRR-UHFFFAOYSA-N Leu-Ser-Pro Natural products CC(C)CC(N)C(=O)NC(CO)C(=O)N1CCCC1C(O)=O SBANPBVRHYIMRR-UHFFFAOYSA-N 0.000 description 2
- AIQWYVFNBNNOLU-RHYQMDGZSA-N Leu-Thr-Val Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(O)=O AIQWYVFNBNNOLU-RHYQMDGZSA-N 0.000 description 2
- AIMGJYMCTAABEN-GVXVVHGQSA-N Leu-Val-Glu Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(O)=O)C(O)=O AIMGJYMCTAABEN-GVXVVHGQSA-N 0.000 description 2
- KCXUCYYZNZFGLL-SRVKXCTJSA-N Lys-Ala-Leu Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(O)=O KCXUCYYZNZFGLL-SRVKXCTJSA-N 0.000 description 2
- NTBFKPBULZGXQL-KKUMJFAQSA-N Lys-Asp-Tyr Chemical compound NCCCC[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(O)=O)CC1=CC=C(O)C=C1 NTBFKPBULZGXQL-KKUMJFAQSA-N 0.000 description 2
- GQZMPWBZQALKJO-UWVGGRQHSA-N Lys-Gly-Arg Chemical compound [H]N[C@@H](CCCCN)C(=O)NCC(=O)N[C@@H](CCCNC(N)=N)C(O)=O GQZMPWBZQALKJO-UWVGGRQHSA-N 0.000 description 2
- FGMHXLULNHTPID-KKUMJFAQSA-N Lys-His-Lys Chemical compound NCCCC[C@H](N)C(=O)N[C@H](C(=O)N[C@@H](CCCCN)C(O)=O)CC1=CN=CN1 FGMHXLULNHTPID-KKUMJFAQSA-N 0.000 description 2
- LUTDBHBIHHREDC-IHRRRGAJSA-N Lys-Pro-Lys Chemical compound NCCCC[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCCCN)C(O)=O LUTDBHBIHHREDC-IHRRRGAJSA-N 0.000 description 2
- SQXZLVXQXWILKW-KKUMJFAQSA-N Lys-Ser-Phe Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O SQXZLVXQXWILKW-KKUMJFAQSA-N 0.000 description 2
- SPSSJSICDYYTQN-HJGDQZAQSA-N Met-Thr-Gln Chemical compound CSCC[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@H](C(O)=O)CCC(N)=O SPSSJSICDYYTQN-HJGDQZAQSA-N 0.000 description 2
- IHRFZLQEQVHXFA-RHYQMDGZSA-N Met-Thr-Lys Chemical compound CSCC[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@H](C(O)=O)CCCCN IHRFZLQEQVHXFA-RHYQMDGZSA-N 0.000 description 2
- SITLTJHOQZFJGG-UHFFFAOYSA-N N-L-alpha-glutamyl-L-valine Natural products CC(C)C(C(O)=O)NC(=O)C(N)CCC(O)=O SITLTJHOQZFJGG-UHFFFAOYSA-N 0.000 description 2
- HOKKHZGPKSLGJE-GSVOUGTGSA-N N-Methyl-D-aspartic acid Chemical compound CN[C@@H](C(O)=O)CC(O)=O HOKKHZGPKSLGJE-GSVOUGTGSA-N 0.000 description 2
- ZLZUHACSRMOLLV-RAALSFIWSA-N NC=1SC[C@H]2[C@@](N1)(CO[C@H](C2)C)C=2SC=C(N2)NC(=O)C2=NC=C(C=C2)OC(F)F Chemical compound NC=1SC[C@H]2[C@@](N1)(CO[C@H](C2)C)C=2SC=C(N2)NC(=O)C2=NC=C(C=C2)OC(F)F ZLZUHACSRMOLLV-RAALSFIWSA-N 0.000 description 2
- JOXIIFVCSATTDH-IHPCNDPISA-N Phe-Asn-Trp Chemical compound C1=CC=C(C=C1)C[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)N[C@@H](CC2=CNC3=CC=CC=C32)C(=O)O)N JOXIIFVCSATTDH-IHPCNDPISA-N 0.000 description 2
- NPLGQVKZFGJWAI-QWHCGFSZSA-N Phe-Gly-Pro Chemical compound C1C[C@@H](N(C1)C(=O)CNC(=O)[C@H](CC2=CC=CC=C2)N)C(=O)O NPLGQVKZFGJWAI-QWHCGFSZSA-N 0.000 description 2
- QARPMYDMYVLFMW-KKUMJFAQSA-N Phe-Pro-Glu Chemical compound C([C@H](N)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCC(O)=O)C(O)=O)C1=CC=CC=C1 QARPMYDMYVLFMW-KKUMJFAQSA-N 0.000 description 2
- MCIXMYKSPQUMJG-SRVKXCTJSA-N Phe-Ser-Ser Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(O)=O MCIXMYKSPQUMJG-SRVKXCTJSA-N 0.000 description 2
- FGWUALWGCZJQDJ-URLPEUOOSA-N Phe-Thr-Ile Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O FGWUALWGCZJQDJ-URLPEUOOSA-N 0.000 description 2
- JMVQDLDPDBXAAX-YUMQZZPRSA-N Pro-Gly-Gln Chemical compound NC(=O)CC[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H]1CCCN1 JMVQDLDPDBXAAX-YUMQZZPRSA-N 0.000 description 2
- RMODQFBNDDENCP-IHRRRGAJSA-N Pro-Lys-Leu Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(O)=O RMODQFBNDDENCP-IHRRRGAJSA-N 0.000 description 2
- MKGIILKDUGDRRO-FXQIFTODSA-N Pro-Ser-Ser Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H]1CCCN1 MKGIILKDUGDRRO-FXQIFTODSA-N 0.000 description 2
- YQHZVYJAGWMHES-ZLUOBGJFSA-N Ser-Ala-Ser Chemical compound OC[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@@H](CO)C(O)=O YQHZVYJAGWMHES-ZLUOBGJFSA-N 0.000 description 2
- QEDMOZUJTGEIBF-FXQIFTODSA-N Ser-Arg-Asp Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(O)=O QEDMOZUJTGEIBF-FXQIFTODSA-N 0.000 description 2
- HBOABDXGTMMDSE-GUBZILKMSA-N Ser-Arg-Val Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C(C)C)C(O)=O HBOABDXGTMMDSE-GUBZILKMSA-N 0.000 description 2
- FTVRVZNYIYWJGB-ACZMJKKPSA-N Ser-Asp-Glu Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(O)=O FTVRVZNYIYWJGB-ACZMJKKPSA-N 0.000 description 2
- ZOHGLPQGEHSLPD-FXQIFTODSA-N Ser-Gln-Glu Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(O)=O ZOHGLPQGEHSLPD-FXQIFTODSA-N 0.000 description 2
- FMDHKPRACUXATF-ACZMJKKPSA-N Ser-Gln-Ser Chemical compound OC[C@H](N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CO)C(O)=O FMDHKPRACUXATF-ACZMJKKPSA-N 0.000 description 2
- BPMRXBZYPGYPJN-WHFBIAKZSA-N Ser-Gly-Asn Chemical compound [H]N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CC(N)=O)C(O)=O BPMRXBZYPGYPJN-WHFBIAKZSA-N 0.000 description 2
- YMTLKLXDFCSCNX-BYPYZUCNSA-N Ser-Gly-Gly Chemical compound OC[C@H](N)C(=O)NCC(=O)NCC(O)=O YMTLKLXDFCSCNX-BYPYZUCNSA-N 0.000 description 2
- SFTZWNJFZYOLBD-ZDLURKLDSA-N Ser-Gly-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H](N)CO SFTZWNJFZYOLBD-ZDLURKLDSA-N 0.000 description 2
- XXXAXOWMBOKTRN-XPUUQOCRSA-N Ser-Gly-Val Chemical compound [H]N[C@@H](CO)C(=O)NCC(=O)N[C@@H](C(C)C)C(O)=O XXXAXOWMBOKTRN-XPUUQOCRSA-N 0.000 description 2
- UIPXCLNLUUAMJU-JBDRJPRFSA-N Ser-Ile-Ser Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(O)=O UIPXCLNLUUAMJU-JBDRJPRFSA-N 0.000 description 2
- QYSFWUIXDFJUDW-DCAQKATOSA-N Ser-Leu-Arg Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O QYSFWUIXDFJUDW-DCAQKATOSA-N 0.000 description 2
- KCGIREHVWRXNDH-GARJFASQSA-N Ser-Leu-Pro Chemical compound CC(C)C[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CO)N KCGIREHVWRXNDH-GARJFASQSA-N 0.000 description 2
- PPNPDKGQRFSCAC-CIUDSAMLSA-N Ser-Lys-Asp Chemical compound NCCCC[C@H](NC(=O)[C@@H](N)CO)C(=O)N[C@@H](CC(O)=O)C(O)=O PPNPDKGQRFSCAC-CIUDSAMLSA-N 0.000 description 2
- FKYWFUYPVKLJLP-DCAQKATOSA-N Ser-Pro-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@@H]1CCCN1C(=O)[C@@H](N)CO FKYWFUYPVKLJLP-DCAQKATOSA-N 0.000 description 2
- PYTKULIABVRXSC-BWBBJGPYSA-N Ser-Ser-Thr Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(O)=O PYTKULIABVRXSC-BWBBJGPYSA-N 0.000 description 2
- SNXUIBACCONSOH-BWBBJGPYSA-N Ser-Thr-Ser Chemical compound OC[C@H](N)C(=O)N[C@@H]([C@H](O)C)C(=O)N[C@@H](CO)C(O)=O SNXUIBACCONSOH-BWBBJGPYSA-N 0.000 description 2
- SIEBDTCABMZCLF-XGEHTFHBSA-N Ser-Val-Thr Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O SIEBDTCABMZCLF-XGEHTFHBSA-N 0.000 description 2
- KRPKYGOFYUNIGM-XVSYOHENSA-N Thr-Asp-Phe Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)O)N)O KRPKYGOFYUNIGM-XVSYOHENSA-N 0.000 description 2
- CYVQBKQYQGEELV-NKIYYHGXSA-N Thr-His-Gln Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)N[C@@H](CCC(=O)N)C(=O)O)N)O CYVQBKQYQGEELV-NKIYYHGXSA-N 0.000 description 2
- AMXMBCAXAZUCFA-RHYQMDGZSA-N Thr-Leu-Arg Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O AMXMBCAXAZUCFA-RHYQMDGZSA-N 0.000 description 2
- VRUFCJZQDACGLH-UVOCVTCTSA-N Thr-Leu-Thr Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O VRUFCJZQDACGLH-UVOCVTCTSA-N 0.000 description 2
- CYCGARJWIQWPQM-YJRXYDGGSA-N Thr-Tyr-Ser Chemical compound C[C@@H](O)[C@H]([NH3+])C(=O)N[C@H](C(=O)N[C@@H](CO)C([O-])=O)CC1=CC=C(O)C=C1 CYCGARJWIQWPQM-YJRXYDGGSA-N 0.000 description 2
- KZTLZZQTJMCGIP-ZJDVBMNYSA-N Thr-Val-Thr Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O KZTLZZQTJMCGIP-ZJDVBMNYSA-N 0.000 description 2
- MBLJBGZWLHTJBH-SZMVWBNQSA-N Trp-Val-Arg Chemical compound C1=CC=C2C(C[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCN=C(N)N)C(O)=O)=CNC2=C1 MBLJBGZWLHTJBH-SZMVWBNQSA-N 0.000 description 2
- JJNXZIPLIXIGBX-HJPIBITLSA-N Tyr-Ile-Cys Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CS)C(=O)O)NC(=O)[C@H](CC1=CC=C(C=C1)O)N JJNXZIPLIXIGBX-HJPIBITLSA-N 0.000 description 2
- AUZADXNWQMBZOO-JYJNAYRXSA-N Tyr-Pro-Arg Chemical compound C([C@H](N)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCN=C(N)N)C(O)=O)C1=CC=C(O)C=C1 AUZADXNWQMBZOO-JYJNAYRXSA-N 0.000 description 2
- XFEMMSGONWQACR-KJEVXHAQSA-N Tyr-Thr-Met Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CCSC)C(=O)O)NC(=O)[C@H](CC1=CC=C(C=C1)O)N)O XFEMMSGONWQACR-KJEVXHAQSA-N 0.000 description 2
- NUQZCPSZHGIYTA-HKUYNNGSSA-N Tyr-Trp-Gly Chemical compound C1=CC=C2C(=C1)C(=CN2)C[C@@H](C(=O)NCC(=O)O)NC(=O)[C@H](CC3=CC=C(C=C3)O)N NUQZCPSZHGIYTA-HKUYNNGSSA-N 0.000 description 2
- SQUMHUZLJDUROQ-YDHLFZDLSA-N Tyr-Val-Asp Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(O)=O)C(O)=O SQUMHUZLJDUROQ-YDHLFZDLSA-N 0.000 description 2
- BMGOFDMKDVVGJG-NHCYSSNCSA-N Val-Asp-Lys Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)N[C@@H](CCCCN)C(=O)O)N BMGOFDMKDVVGJG-NHCYSSNCSA-N 0.000 description 2
- LHADRQBREKTRLR-DCAQKATOSA-N Val-Cys-Leu Chemical compound CC(C)C[C@@H](C(=O)O)NC(=O)[C@H](CS)NC(=O)[C@H](C(C)C)N LHADRQBREKTRLR-DCAQKATOSA-N 0.000 description 2
- OXVPMZVGCAPFIG-BQFCYCMXSA-N Val-Gln-Trp Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)N[C@@H](CC1=CNC2=CC=CC=C21)C(=O)O)N OXVPMZVGCAPFIG-BQFCYCMXSA-N 0.000 description 2
- HGJRMXOWUWVUOA-GVXVVHGQSA-N Val-Leu-Gln Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)O)NC(=O)[C@H](C(C)C)N HGJRMXOWUWVUOA-GVXVVHGQSA-N 0.000 description 2
- KISFXYYRKKNLOP-IHRRRGAJSA-N Val-Phe-Ser Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CO)C(=O)O)N KISFXYYRKKNLOP-IHRRRGAJSA-N 0.000 description 2
- KRAHMIJVUPUOTQ-DCAQKATOSA-N Val-Ser-His Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)N KRAHMIJVUPUOTQ-DCAQKATOSA-N 0.000 description 2
- PZTZYZUTCPZWJH-FXQIFTODSA-N Val-Ser-Ser Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)O)N PZTZYZUTCPZWJH-FXQIFTODSA-N 0.000 description 2
- DVLWZWNAQUBZBC-ZNSHCXBVSA-N Val-Thr-Pro Chemical compound C[C@H]([C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](C(C)C)N)O DVLWZWNAQUBZBC-ZNSHCXBVSA-N 0.000 description 2
- HTONZBWRYUKUKC-RCWTZXSCSA-N Val-Thr-Val Chemical compound CC(C)[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(O)=O HTONZBWRYUKUKC-RCWTZXSCSA-N 0.000 description 2
- QPJSIBAOZBVELU-BPNCWPANSA-N Val-Tyr-Ala Chemical compound C[C@@H](C(=O)O)NC(=O)[C@H](CC1=CC=C(C=C1)O)NC(=O)[C@H](C(C)C)N QPJSIBAOZBVELU-BPNCWPANSA-N 0.000 description 2
- OWFGFHQMSBTKLX-UFYCRDLUSA-N Val-Tyr-Tyr Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)N[C@@H](CC2=CC=C(C=C2)O)C(=O)O)N OWFGFHQMSBTKLX-UFYCRDLUSA-N 0.000 description 2
- 230000002159 abnormal effect Effects 0.000 description 2
- 108010081404 acein-2 Proteins 0.000 description 2
- 108010008685 alanyl-glutamyl-aspartic acid Proteins 0.000 description 2
- 108010069020 alanyl-prolyl-glycine Proteins 0.000 description 2
- 108010086434 alanyl-seryl-glycine Proteins 0.000 description 2
- 230000006933 amyloid-beta aggregation Effects 0.000 description 2
- 230000003941 amyloidogenesis Effects 0.000 description 2
- 238000000848 angular dependent Auger electron spectroscopy Methods 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- 108010008355 arginyl-glutamine Proteins 0.000 description 2
- 108010009111 arginyl-glycyl-glutamic acid Proteins 0.000 description 2
- 230000001174 ascending effect Effects 0.000 description 2
- VLLFGVHGKLDDLW-SFHVURJKSA-N atabecestat Chemical compound C=1C(NC(=O)C=2N=CC(=CC=2)C#N)=CC=C(F)C=1[C@]1(C)C=CSC(N)=N1 VLLFGVHGKLDDLW-SFHVURJKSA-N 0.000 description 2
- 229950009582 atabecestat Drugs 0.000 description 2
- 238000009534 blood test Methods 0.000 description 2
- 210000005013 brain tissue Anatomy 0.000 description 2
- 210000001638 cerebellum Anatomy 0.000 description 2
- 239000000544 cholinesterase inhibitor Substances 0.000 description 2
- 150000001875 compounds Chemical class 0.000 description 2
- 108010060199 cysteinylproline Proteins 0.000 description 2
- 230000003111 delayed effect Effects 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 229940126534 drug product Drugs 0.000 description 2
- 230000008029 eradication Effects 0.000 description 2
- 230000007717 exclusion Effects 0.000 description 2
- 108010063718 gamma-glutamylaspartic acid Proteins 0.000 description 2
- 108010013768 glutamyl-aspartyl-proline Proteins 0.000 description 2
- 108010000434 glycyl-alanyl-leucine Proteins 0.000 description 2
- 108010067216 glycyl-glycyl-glycine Proteins 0.000 description 2
- XKUKSGPZAADMRA-UHFFFAOYSA-N glycyl-glycyl-glycine Natural products NCC(=O)NCC(=O)NCC(O)=O XKUKSGPZAADMRA-UHFFFAOYSA-N 0.000 description 2
- 108010010096 glycyl-glycyl-tyrosine Proteins 0.000 description 2
- 108010050475 glycyl-leucyl-tyrosine Proteins 0.000 description 2
- 108010089804 glycyl-threonine Proteins 0.000 description 2
- 108010015792 glycyllysine Proteins 0.000 description 2
- 108010018006 histidylserine Proteins 0.000 description 2
- 229940102223 injectable solution Drugs 0.000 description 2
- 108010044311 leucyl-glycyl-glycine Proteins 0.000 description 2
- 108010073472 leucyl-prolyl-proline Proteins 0.000 description 2
- 108010057821 leucylproline Proteins 0.000 description 2
- 108010003700 lysyl aspartic acid Proteins 0.000 description 2
- 238000009115 maintenance therapy Methods 0.000 description 2
- 238000002483 medication Methods 0.000 description 2
- VQSRKMNBWMHJKY-YTEVENLXSA-N n-[3-[(4ar,7as)-2-amino-6-(5-fluoropyrimidin-2-yl)-4,4a,5,7-tetrahydropyrrolo[3,4-d][1,3]thiazin-7a-yl]-4-fluorophenyl]-5-methoxypyrazine-2-carboxamide Chemical compound C1=NC(OC)=CN=C1C(=O)NC1=CC=C(F)C([C@@]23[C@@H](CN(C2)C=2N=CC(F)=CN=2)CSC(N)=N3)=C1 VQSRKMNBWMHJKY-YTEVENLXSA-N 0.000 description 2
- NIDRNVHMMDAAIK-YPMLDQLKSA-N n-[3-[(4as,7as)-2-amino-4,4a,5,7-tetrahydrofuro[3,4-d][1,3]thiazin-7a-yl]-4-fluorophenyl]-5-fluoropyridine-2-carboxamide Chemical compound C=1C=C(F)C([C@@]23N=C(SC[C@@H]2COC3)N)=CC=1NC(=O)C1=CC=C(F)C=N1 NIDRNVHMMDAAIK-YPMLDQLKSA-N 0.000 description 2
- DVMUZHLUMHPCGZ-QGZVFWFLSA-N n-[3-[(4r)-2-amino-5,5-difluoro-4-methyl-6h-1,3-oxazin-4-yl]-4-fluorophenyl]-5-cyanopyridine-2-carboxamide Chemical compound C=1C(NC(=O)C=2N=CC(=CC=2)C#N)=CC=C(F)C=1[C@@]1(C)N=C(N)OCC1(F)F DVMUZHLUMHPCGZ-QGZVFWFLSA-N 0.000 description 2
- 230000000626 neurodegenerative effect Effects 0.000 description 2
- 239000000825 pharmaceutical preparation Substances 0.000 description 2
- 230000003285 pharmacodynamic effect Effects 0.000 description 2
- 108010024654 phenylalanyl-prolyl-alanine Proteins 0.000 description 2
- 239000002504 physiological saline solution Substances 0.000 description 2
- 108010020755 prolyl-glycyl-glycine Proteins 0.000 description 2
- 108010077112 prolyl-proline Proteins 0.000 description 2
- 108010029020 prolylglycine Proteins 0.000 description 2
- 230000000069 prophylactic effect Effects 0.000 description 2
- 108090000623 proteins and genes Proteins 0.000 description 2
- 108010069117 seryl-lysyl-aspartic acid Proteins 0.000 description 2
- 239000000243 solution Substances 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 108010071097 threonyl-lysyl-proline Proteins 0.000 description 2
- 108010079202 tyrosyl-alanyl-cysteine Proteins 0.000 description 2
- 108010071635 tyrosyl-prolyl-arginine Proteins 0.000 description 2
- 108010003137 tyrosyltyrosine Proteins 0.000 description 2
- 108010052774 valyl-lysyl-glycyl-phenylalanyl-tyrosine Proteins 0.000 description 2
- 108010027345 wheylin-1 peptide Proteins 0.000 description 2
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 1
- 101150037123 APOE gene Proteins 0.000 description 1
- DPNZTBKGAUAZQU-DLOVCJGASA-N Ala-Leu-His Chemical compound C[C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)N DPNZTBKGAUAZQU-DLOVCJGASA-N 0.000 description 1
- MEFILNJXAVSUTO-JXUBOQSCSA-N Ala-Leu-Thr Chemical compound C[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O MEFILNJXAVSUTO-JXUBOQSCSA-N 0.000 description 1
- SUHLZMHFRALVSY-YUMQZZPRSA-N Ala-Lys-Gly Chemical compound NCCCC[C@H](NC(=O)[C@@H](N)C)C(=O)NCC(O)=O SUHLZMHFRALVSY-YUMQZZPRSA-N 0.000 description 1
- OINVDEKBKBCPLX-JXUBOQSCSA-N Ala-Lys-Thr Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)O)C(O)=O OINVDEKBKBCPLX-JXUBOQSCSA-N 0.000 description 1
- WQLDNOCHHRISMS-NAKRPEOUSA-N Ala-Pro-Ile Chemical compound [H]N[C@@H](C)C(=O)N1CCC[C@H]1C(=O)N[C@@H]([C@@H](C)CC)C(O)=O WQLDNOCHHRISMS-NAKRPEOUSA-N 0.000 description 1
- YJHKTAMKPGFJCT-NRPADANISA-N Ala-Val-Glu Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(O)=O)C(O)=O YJHKTAMKPGFJCT-NRPADANISA-N 0.000 description 1
- 101710137189 Amyloid-beta A4 protein Proteins 0.000 description 1
- 101710151993 Amyloid-beta precursor protein Proteins 0.000 description 1
- 102100022704 Amyloid-beta precursor protein Human genes 0.000 description 1
- 101710095339 Apolipoprotein E Proteins 0.000 description 1
- 108010025628 Apolipoproteins E Proteins 0.000 description 1
- 102000013918 Apolipoproteins E Human genes 0.000 description 1
- PNQWAUXQDBIJDY-GUBZILKMSA-N Arg-Glu-Glu Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(O)=O PNQWAUXQDBIJDY-GUBZILKMSA-N 0.000 description 1
- FRBAHXABMQXSJQ-FXQIFTODSA-N Arg-Ser-Ser Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(O)=O FRBAHXABMQXSJQ-FXQIFTODSA-N 0.000 description 1
- ZJBUILVYSXQNSW-YTWAJWBKSA-N Arg-Thr-Pro Chemical compound C[C@H]([C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CCCN=C(N)N)N)O ZJBUILVYSXQNSW-YTWAJWBKSA-N 0.000 description 1
- ZUVMUOOHJYNJPP-XIRDDKMYSA-N Arg-Trp-Gln Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC1=CNC2=C1C=CC=C2)C(=O)N[C@@H](CCC(N)=O)C(O)=O ZUVMUOOHJYNJPP-XIRDDKMYSA-N 0.000 description 1
- SRUUBQBAVNQZGJ-LAEOZQHASA-N Asn-Gln-Val Chemical compound CC(C)[C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)N)NC(=O)[C@H](CC(=O)N)N SRUUBQBAVNQZGJ-LAEOZQHASA-N 0.000 description 1
- WONGRTVAMHFGBE-WDSKDSINSA-N Asn-Gly-Gln Chemical compound C(CC(=O)N)[C@@H](C(=O)O)NC(=O)CNC(=O)[C@H](CC(=O)N)N WONGRTVAMHFGBE-WDSKDSINSA-N 0.000 description 1
- WQLJRNRLHWJIRW-KKUMJFAQSA-N Asn-His-Tyr Chemical compound C1=CC(=CC=C1C[C@@H](C(=O)O)NC(=O)[C@H](CC2=CN=CN2)NC(=O)[C@H](CC(=O)N)N)O WQLJRNRLHWJIRW-KKUMJFAQSA-N 0.000 description 1
- HPBNLFLSSQDFQW-WHFBIAKZSA-N Asn-Ser-Gly Chemical compound NC(=O)C[C@H](N)C(=O)N[C@@H](CO)C(=O)NCC(O)=O HPBNLFLSSQDFQW-WHFBIAKZSA-N 0.000 description 1
- HNXWVVHIGTZTBO-LKXGYXEUSA-N Asn-Ser-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O HNXWVVHIGTZTBO-LKXGYXEUSA-N 0.000 description 1
- PUUPMDXIHCOPJU-HJGDQZAQSA-N Asn-Thr-Lys Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CCCCN)C(=O)O)NC(=O)[C@H](CC(=O)N)N)O PUUPMDXIHCOPJU-HJGDQZAQSA-N 0.000 description 1
- MJIJBEYEHBKTIM-BYULHYEWSA-N Asn-Val-Asn Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)O)NC(=O)[C@H](CC(=O)N)N MJIJBEYEHBKTIM-BYULHYEWSA-N 0.000 description 1
- SNDBKTFJWVEVPO-WHFBIAKZSA-N Asp-Gly-Ser Chemical compound [H]N[C@@H](CC(O)=O)C(=O)NCC(=O)N[C@@H](CO)C(O)=O SNDBKTFJWVEVPO-WHFBIAKZSA-N 0.000 description 1
- DPNWSMBUYCLEDG-CIUDSAMLSA-N Asp-Lys-Ser Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CO)C(O)=O DPNWSMBUYCLEDG-CIUDSAMLSA-N 0.000 description 1
- DONWIPDSZZJHHK-HJGDQZAQSA-N Asp-Lys-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CC(=O)O)N)O DONWIPDSZZJHHK-HJGDQZAQSA-N 0.000 description 1
- CUQDCPXNZPDYFQ-ZLUOBGJFSA-N Asp-Ser-Asp Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(O)=O)C(O)=O CUQDCPXNZPDYFQ-ZLUOBGJFSA-N 0.000 description 1
- JSNWZMFSLIWAHS-HJGDQZAQSA-N Asp-Thr-Leu Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)O)NC(=O)[C@H](CC(=O)O)N)O JSNWZMFSLIWAHS-HJGDQZAQSA-N 0.000 description 1
- ITGFVUYOLWBPQW-KKHAAJSZSA-N Asp-Thr-Val Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(O)=O ITGFVUYOLWBPQW-KKHAAJSZSA-N 0.000 description 1
- 238000010207 Bayesian analysis Methods 0.000 description 1
- WKDNQONLGXOZRG-HRNNMHKYSA-N CO[C@H]1CC[C@@]2(Cc3ccc(cc3[C@@]22N=C(C)C(N)=N2)-c2cncc(c2)C#CC)CC1 Chemical compound CO[C@H]1CC[C@@]2(Cc3ccc(cc3[C@@]22N=C(C)C(N)=N2)-c2cncc(c2)C#CC)CC1 WKDNQONLGXOZRG-HRNNMHKYSA-N 0.000 description 1
- 101100512078 Caenorhabditis elegans lys-1 gene Proteins 0.000 description 1
- YMBAVNPKBWHDAW-CIUDSAMLSA-N Cys-Asp-Lys Chemical compound C(CCN)C[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)O)NC(=O)[C@H](CS)N YMBAVNPKBWHDAW-CIUDSAMLSA-N 0.000 description 1
- KSMSFCBQBQPFAD-GUBZILKMSA-N Cys-Pro-Pro Chemical compound SC[C@H](N)C(=O)N1CCC[C@H]1C(=O)N1[C@H](C(O)=O)CCC1 KSMSFCBQBQPFAD-GUBZILKMSA-N 0.000 description 1
- NDNZRWUDUMTITL-FXQIFTODSA-N Cys-Ser-Val Chemical compound [H]N[C@@H](CS)C(=O)N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(O)=O NDNZRWUDUMTITL-FXQIFTODSA-N 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- DHNWZLGBTPUTQQ-QEJZJMRPSA-N Gln-Asp-Trp Chemical compound C1=CC=C2C(=C1)C(=CN2)C[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)O)NC(=O)[C@H](CCC(=O)N)N DHNWZLGBTPUTQQ-QEJZJMRPSA-N 0.000 description 1
- NVEASDQHBRZPSU-BQBZGAKWSA-N Gln-Gln-Gly Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)NCC(O)=O NVEASDQHBRZPSU-BQBZGAKWSA-N 0.000 description 1
- XKBASPWPBXNVLQ-WDSKDSINSA-N Gln-Gly-Asn Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)NCC(=O)N[C@@H](CC(N)=O)C(O)=O XKBASPWPBXNVLQ-WDSKDSINSA-N 0.000 description 1
- XUMFMAVDHQDATI-DCAQKATOSA-N Gln-Pro-Arg Chemical compound NC(=O)CC[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCCN=C(N)N)C(O)=O XUMFMAVDHQDATI-DCAQKATOSA-N 0.000 description 1
- HMIXCETWRYDVMO-GUBZILKMSA-N Gln-Pro-Glu Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCC(O)=O)C(O)=O HMIXCETWRYDVMO-GUBZILKMSA-N 0.000 description 1
- SXFPZRRVWSUYII-KBIXCLLPSA-N Gln-Ser-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(=O)N)N SXFPZRRVWSUYII-KBIXCLLPSA-N 0.000 description 1
- FITIQFSXXBKFFM-NRPADANISA-N Gln-Val-Ser Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CO)C(O)=O FITIQFSXXBKFFM-NRPADANISA-N 0.000 description 1
- OAGVHWYIBZMWLA-YFKPBYRVSA-N Glu-Gly-Gly Chemical compound OC(=O)CC[C@H](N)C(=O)NCC(=O)NCC(O)=O OAGVHWYIBZMWLA-YFKPBYRVSA-N 0.000 description 1
- MWMJCGBSIORNCD-AVGNSLFASA-N Glu-Leu-Leu Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O MWMJCGBSIORNCD-AVGNSLFASA-N 0.000 description 1
- QDMVXRNLOPTPIE-WDCWCFNPSA-N Glu-Lys-Thr Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)O)C(O)=O QDMVXRNLOPTPIE-WDCWCFNPSA-N 0.000 description 1
- AAJHGGDRKHYSDH-GUBZILKMSA-N Glu-Pro-Gln Chemical compound C1C[C@H](N(C1)C(=O)[C@H](CCC(=O)O)N)C(=O)N[C@@H](CCC(=O)N)C(=O)O AAJHGGDRKHYSDH-GUBZILKMSA-N 0.000 description 1
- BPCLDCNZBUYGOD-BPUTZDHNSA-N Glu-Trp-Glu Chemical compound C1=CC=C2C(C[C@H](NC(=O)[C@H](CCC(O)=O)N)C(=O)N[C@@H](CCC(O)=O)C(O)=O)=CNC2=C1 BPCLDCNZBUYGOD-BPUTZDHNSA-N 0.000 description 1
- WGYHAAXZWPEBDQ-IFFSRLJSSA-N Glu-Val-Thr Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O WGYHAAXZWPEBDQ-IFFSRLJSSA-N 0.000 description 1
- GWCRIHNSVMOBEQ-BQBZGAKWSA-N Gly-Arg-Ser Chemical compound [H]NCC(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(O)=O GWCRIHNSVMOBEQ-BQBZGAKWSA-N 0.000 description 1
- BUEFQXUHTUZXHR-LURJTMIESA-N Gly-Gly-Pro zwitterion Chemical compound NCC(=O)NCC(=O)N1CCC[C@H]1C(O)=O BUEFQXUHTUZXHR-LURJTMIESA-N 0.000 description 1
- UQJNXZSSGQIPIQ-FBCQKBJTSA-N Gly-Gly-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)CNC(=O)CN UQJNXZSSGQIPIQ-FBCQKBJTSA-N 0.000 description 1
- GMTXWRIDLGTVFC-IUCAKERBSA-N Gly-Lys-Glu Chemical compound [H]NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(O)=O GMTXWRIDLGTVFC-IUCAKERBSA-N 0.000 description 1
- JSLVAHYTAJJEQH-QWRGUYRKSA-N Gly-Ser-Phe Chemical compound NCC(=O)N[C@@H](CO)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 JSLVAHYTAJJEQH-QWRGUYRKSA-N 0.000 description 1
- FFJQHWKSGAWSTJ-BFHQHQDPSA-N Gly-Thr-Ala Chemical compound [H]NCC(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C)C(O)=O FFJQHWKSGAWSTJ-BFHQHQDPSA-N 0.000 description 1
- CQMFNTVQVLQRLT-JHEQGTHGSA-N Gly-Thr-Gln Chemical compound [H]NCC(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCC(N)=O)C(O)=O CQMFNTVQVLQRLT-JHEQGTHGSA-N 0.000 description 1
- SYOJVRNQCXYEOV-XVKPBYJWSA-N Gly-Val-Glu Chemical compound [H]NCC(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(O)=O)C(O)=O SYOJVRNQCXYEOV-XVKPBYJWSA-N 0.000 description 1
- MAABHGXCIBEYQR-XVYDVKMFSA-N His-Asn-Ala Chemical compound C[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)N)NC(=O)[C@H](CC1=CN=CN1)N MAABHGXCIBEYQR-XVYDVKMFSA-N 0.000 description 1
- FYVHHKMHFPMBBG-GUBZILKMSA-N His-Gln-Asp Chemical compound C1=C(NC=N1)C[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)N[C@@H](CC(=O)O)C(=O)O)N FYVHHKMHFPMBBG-GUBZILKMSA-N 0.000 description 1
- HIAHVKLTHNOENC-HGNGGELXSA-N His-Glu-Ala Chemical compound [H]N[C@@H](CC1=CNC=N1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(O)=O HIAHVKLTHNOENC-HGNGGELXSA-N 0.000 description 1
- TTYKEFZRLKQTHH-MELADBBJSA-N His-Lys-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CCCCN)NC(=O)[C@H](CC2=CN=CN2)N)C(=O)O TTYKEFZRLKQTHH-MELADBBJSA-N 0.000 description 1
- HZWWOGWOBQBETJ-CUJWVEQBSA-N His-Thr-Cys Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CS)C(=O)O)NC(=O)[C@H](CC1=CN=CN1)N)O HZWWOGWOBQBETJ-CUJWVEQBSA-N 0.000 description 1
- CSTDQOOBZBAJKE-BWAGICSOSA-N His-Tyr-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CC1=CC=C(C=C1)O)NC(=O)[C@H](CC2=CN=CN2)N)O CSTDQOOBZBAJKE-BWAGICSOSA-N 0.000 description 1
- MKWSZEHGHSLNPF-NAKRPEOUSA-N Ile-Ala-Val Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](C)C(=O)N[C@@H](C(C)C)C(=O)O)N MKWSZEHGHSLNPF-NAKRPEOUSA-N 0.000 description 1
- DFJJAVZIHDFOGQ-MNXVOIDGSA-N Ile-Glu-Lys Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCC(=O)O)C(=O)N[C@@H](CCCCN)C(=O)O)N DFJJAVZIHDFOGQ-MNXVOIDGSA-N 0.000 description 1
- JHNJNTMTZHEDLJ-NAKRPEOUSA-N Ile-Ser-Arg Chemical compound CC[C@H](C)[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCN=C(N)N)C(O)=O JHNJNTMTZHEDLJ-NAKRPEOUSA-N 0.000 description 1
- VGSPNSSCMOHRRR-BJDJZHNGSA-N Ile-Ser-Lys Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCCN)C(=O)O)N VGSPNSSCMOHRRR-BJDJZHNGSA-N 0.000 description 1
- TYYLDKGBCJGJGW-UHFFFAOYSA-N L-tryptophan-L-tyrosine Natural products C=1NC2=CC=CC=C2C=1CC(N)C(=O)NC(C(O)=O)CC1=CC=C(O)C=C1 TYYLDKGBCJGJGW-UHFFFAOYSA-N 0.000 description 1
- WSGXUIQTEZDVHJ-GARJFASQSA-N Leu-Ala-Pro Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](C)C(=O)N1CCC[C@@H]1C(O)=O WSGXUIQTEZDVHJ-GARJFASQSA-N 0.000 description 1
- OIARJGNVARWKFP-YUMQZZPRSA-N Leu-Asn-Gly Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)NCC(O)=O OIARJGNVARWKFP-YUMQZZPRSA-N 0.000 description 1
- PVMPDMIKUVNOBD-CIUDSAMLSA-N Leu-Asp-Ser Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CO)C(O)=O PVMPDMIKUVNOBD-CIUDSAMLSA-N 0.000 description 1
- BTNXKBVLWJBTNR-SRVKXCTJSA-N Leu-His-Asn Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC1=CNC=N1)C(=O)N[C@@H](CC(N)=O)C(O)=O BTNXKBVLWJBTNR-SRVKXCTJSA-N 0.000 description 1
- YOKVEHGYYQEQOP-QWRGUYRKSA-N Leu-Leu-Gly Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)NCC(O)=O YOKVEHGYYQEQOP-QWRGUYRKSA-N 0.000 description 1
- UHNQRAFSEBGZFZ-YESZJQIVSA-N Leu-Phe-Pro Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N2CCC[C@@H]2C(=O)O)N UHNQRAFSEBGZFZ-YESZJQIVSA-N 0.000 description 1
- DPURXCQCHSQPAN-AVGNSLFASA-N Leu-Pro-Pro Chemical compound CC(C)C[C@H](N)C(=O)N1CCC[C@H]1C(=O)N1[C@H](C(O)=O)CCC1 DPURXCQCHSQPAN-AVGNSLFASA-N 0.000 description 1
- XOWMDXHFSBCAKQ-SRVKXCTJSA-N Leu-Ser-Leu Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@H](C(O)=O)CC(C)C XOWMDXHFSBCAKQ-SRVKXCTJSA-N 0.000 description 1
- LINKCQUOMUDLKN-KATARQTJSA-N Leu-Thr-Cys Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CS)C(=O)O)NC(=O)[C@H](CC(C)C)N)O LINKCQUOMUDLKN-KATARQTJSA-N 0.000 description 1
- ILDSIMPXNFWKLH-KATARQTJSA-N Leu-Thr-Ser Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CO)C(O)=O ILDSIMPXNFWKLH-KATARQTJSA-N 0.000 description 1
- YQFZRHYZLARWDY-IHRRRGAJSA-N Leu-Val-Lys Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@H](C(O)=O)CCCCN YQFZRHYZLARWDY-IHRRRGAJSA-N 0.000 description 1
- WSXTWLJHTLRFLW-SRVKXCTJSA-N Lys-Ala-Lys Chemical compound NCCCC[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCCN)C(O)=O WSXTWLJHTLRFLW-SRVKXCTJSA-N 0.000 description 1
- MWVUEPNEPWMFBD-SRVKXCTJSA-N Lys-Cys-Lys Chemical compound NCCCC[C@H](N)C(=O)N[C@@H](CS)C(=O)N[C@H](C(O)=O)CCCCN MWVUEPNEPWMFBD-SRVKXCTJSA-N 0.000 description 1
- ODUQLUADRKMHOZ-JYJNAYRXSA-N Lys-Glu-Tyr Chemical compound C1=CC(=CC=C1C[C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)O)NC(=O)[C@H](CCCCN)N)O ODUQLUADRKMHOZ-JYJNAYRXSA-N 0.000 description 1
- RFQATBGBLDAKGI-VHSXEESVSA-N Lys-Gly-Pro Chemical compound C1C[C@@H](N(C1)C(=O)CNC(=O)[C@H](CCCCN)N)C(=O)O RFQATBGBLDAKGI-VHSXEESVSA-N 0.000 description 1
- OIQSIMFSVLLWBX-VOAKCMCISA-N Lys-Leu-Thr Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O OIQSIMFSVLLWBX-VOAKCMCISA-N 0.000 description 1
- YTJFXEDRUOQGSP-DCAQKATOSA-N Lys-Pro-Ser Chemical compound [H]N[C@@H](CCCCN)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CO)C(O)=O YTJFXEDRUOQGSP-DCAQKATOSA-N 0.000 description 1
- CTJUSALVKAWFFU-CIUDSAMLSA-N Lys-Ser-Cys Chemical compound C(CCN)C[C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CS)C(=O)O)N CTJUSALVKAWFFU-CIUDSAMLSA-N 0.000 description 1
- YKBSXQFZWFXFIB-VOAKCMCISA-N Lys-Thr-Lys Chemical compound NCCCC[C@H](N)C(=O)N[C@@H]([C@H](O)C)C(=O)N[C@@H](CCCCN)C(O)=O YKBSXQFZWFXFIB-VOAKCMCISA-N 0.000 description 1
- PNDCUTDWYVKBHX-IHRRRGAJSA-N Met-Asp-Tyr Chemical compound CSCC[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(O)=O)CC1=CC=C(O)C=C1 PNDCUTDWYVKBHX-IHRRRGAJSA-N 0.000 description 1
- RKIIYGUHIQJCBW-SRVKXCTJSA-N Met-His-Glu Chemical compound [H]N[C@@H](CCSC)C(=O)N[C@@H](CC1=CNC=N1)C(=O)N[C@@H](CCC(O)=O)C(O)=O RKIIYGUHIQJCBW-SRVKXCTJSA-N 0.000 description 1
- FWAHLGXNBLWIKB-NAKRPEOUSA-N Met-Ile-Ser Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H]([C@@H](C)CC)NC(=O)[C@@H](N)CCSC FWAHLGXNBLWIKB-NAKRPEOUSA-N 0.000 description 1
- 241001529936 Murinae Species 0.000 description 1
- LLGTYVHITPVGKR-RYUDHWBXSA-N Phe-Gln-Gly Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CCC(N)=O)C(=O)NCC(O)=O LLGTYVHITPVGKR-RYUDHWBXSA-N 0.000 description 1
- JDMKQHSHKJHAHR-UHFFFAOYSA-N Phe-Phe-Leu-Tyr Natural products C=1C=C(O)C=CC=1CC(C(O)=O)NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)CC1=CC=CC=C1 JDMKQHSHKJHAHR-UHFFFAOYSA-N 0.000 description 1
- JLLJTMHNXQTMCK-UBHSHLNASA-N Phe-Pro-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@@H]1CCCN1C(=O)[C@@H](N)CC1=CC=CC=C1 JLLJTMHNXQTMCK-UBHSHLNASA-N 0.000 description 1
- ZJPGOXWRFNKIQL-JYJNAYRXSA-N Phe-Pro-Pro Chemical compound C([C@H](N)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(O)=O)C1=CC=CC=C1 ZJPGOXWRFNKIQL-JYJNAYRXSA-N 0.000 description 1
- SJRQWEDYTKYHHL-SLFFLAALSA-N Phe-Tyr-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CC2=CC=C(C=C2)O)NC(=O)[C@H](CC3=CC=CC=C3)N)C(=O)O SJRQWEDYTKYHHL-SLFFLAALSA-N 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- UAYHMOIGIQZLFR-NHCYSSNCSA-N Pro-Gln-Val Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](C(C)C)C(O)=O UAYHMOIGIQZLFR-NHCYSSNCSA-N 0.000 description 1
- KIPIKSXPPLABPN-CIUDSAMLSA-N Pro-Glu-Asn Chemical compound NC(=O)C[C@@H](C(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H]1CCCN1 KIPIKSXPPLABPN-CIUDSAMLSA-N 0.000 description 1
- UIMCLYYSUCIUJM-UWVGGRQHSA-N Pro-Gly-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H]1CCCN1 UIMCLYYSUCIUJM-UWVGGRQHSA-N 0.000 description 1
- FMLRRBDLBJLJIK-DCAQKATOSA-N Pro-Leu-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H]1CCCN1 FMLRRBDLBJLJIK-DCAQKATOSA-N 0.000 description 1
- MHHQQZIFLWFZGR-DCAQKATOSA-N Pro-Lys-Ser Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CO)C(O)=O MHHQQZIFLWFZGR-DCAQKATOSA-N 0.000 description 1
- HWLKHNDRXWTFTN-GUBZILKMSA-N Pro-Pro-Cys Chemical compound C1C[C@H](NC1)C(=O)N2CCC[C@H]2C(=O)N[C@@H](CS)C(=O)O HWLKHNDRXWTFTN-GUBZILKMSA-N 0.000 description 1
- FDMKYQQYJKYCLV-GUBZILKMSA-N Pro-Pro-Ser Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@@H]1CCCN1C(=O)[C@H]1NCCC1 FDMKYQQYJKYCLV-GUBZILKMSA-N 0.000 description 1
- GMJDSFYVTAMIBF-FXQIFTODSA-N Pro-Ser-Asp Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(O)=O)C(O)=O GMJDSFYVTAMIBF-FXQIFTODSA-N 0.000 description 1
- KHRLUIPIMIQFGT-AVGNSLFASA-N Pro-Val-Leu Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O KHRLUIPIMIQFGT-AVGNSLFASA-N 0.000 description 1
- 206010039966 Senile dementia Diseases 0.000 description 1
- YUSRGTQIPCJNHQ-CIUDSAMLSA-N Ser-Arg-Glu Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(O)=O YUSRGTQIPCJNHQ-CIUDSAMLSA-N 0.000 description 1
- HZWAHWQZPSXNCB-BPUTZDHNSA-N Ser-Arg-Trp Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC1=CNC2=C1C=CC=C2)C(O)=O HZWAHWQZPSXNCB-BPUTZDHNSA-N 0.000 description 1
- VAUMZJHYZQXZBQ-WHFBIAKZSA-N Ser-Asn-Gly Chemical compound OC[C@H](N)C(=O)N[C@@H](CC(N)=O)C(=O)NCC(O)=O VAUMZJHYZQXZBQ-WHFBIAKZSA-N 0.000 description 1
- UGJRQLURDVGULT-LKXGYXEUSA-N Ser-Asn-Thr Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O UGJRQLURDVGULT-LKXGYXEUSA-N 0.000 description 1
- QPFJSHSJFIYDJZ-GHCJXIJMSA-N Ser-Asp-Ile Chemical compound CC[C@H](C)[C@@H](C(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@@H](N)CO QPFJSHSJFIYDJZ-GHCJXIJMSA-N 0.000 description 1
- UQFYNFTYDHUIMI-WHFBIAKZSA-N Ser-Gly-Ala Chemical compound OC(=O)[C@H](C)NC(=O)CNC(=O)[C@@H](N)CO UQFYNFTYDHUIMI-WHFBIAKZSA-N 0.000 description 1
- XNCUYZKGQOCOQH-YUMQZZPRSA-N Ser-Leu-Gly Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)NCC(O)=O XNCUYZKGQOCOQH-YUMQZZPRSA-N 0.000 description 1
- YUJLIIRMIAGMCQ-CIUDSAMLSA-N Ser-Leu-Ser Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(O)=O YUJLIIRMIAGMCQ-CIUDSAMLSA-N 0.000 description 1
- MUJQWSAWLLRJCE-KATARQTJSA-N Ser-Leu-Thr Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O MUJQWSAWLLRJCE-KATARQTJSA-N 0.000 description 1
- XKFJENWJGHMDLI-QWRGUYRKSA-N Ser-Phe-Gly Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)NCC(O)=O XKFJENWJGHMDLI-QWRGUYRKSA-N 0.000 description 1
- RHAPJNVNWDBFQI-BQBZGAKWSA-N Ser-Pro-Gly Chemical compound OC[C@H](N)C(=O)N1CCC[C@H]1C(=O)NCC(O)=O RHAPJNVNWDBFQI-BQBZGAKWSA-N 0.000 description 1
- OZPDGESCTGGNAD-CIUDSAMLSA-N Ser-Ser-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CO OZPDGESCTGGNAD-CIUDSAMLSA-N 0.000 description 1
- FLMYSKVSDVHLEW-SVSWQMSJSA-N Ser-Thr-Ile Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O FLMYSKVSDVHLEW-SVSWQMSJSA-N 0.000 description 1
- ZKOKTQPHFMRSJP-YJRXYDGGSA-N Ser-Thr-Tyr Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O ZKOKTQPHFMRSJP-YJRXYDGGSA-N 0.000 description 1
- AXKJPUBALUNJEO-UBHSHLNASA-N Ser-Trp-Asn Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC1=CNC2=C1C=CC=C2)C(=O)N[C@@H](CC(N)=O)C(O)=O AXKJPUBALUNJEO-UBHSHLNASA-N 0.000 description 1
- RCOUFINCYASMDN-GUBZILKMSA-N Ser-Val-Met Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCSC)C(O)=O RCOUFINCYASMDN-GUBZILKMSA-N 0.000 description 1
- 108010090804 Streptavidin Proteins 0.000 description 1
- KGKWKSSSQGGYAU-SUSMZKCASA-N Thr-Gln-Thr Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)N[C@@H]([C@@H](C)O)C(=O)O)N)O KGKWKSSSQGGYAU-SUSMZKCASA-N 0.000 description 1
- SXAGUVRFGJSFKC-ZEILLAHLSA-N Thr-His-Thr Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC1=CNC=N1)C(=O)N[C@@H]([C@@H](C)O)C(O)=O SXAGUVRFGJSFKC-ZEILLAHLSA-N 0.000 description 1
- FQPDRTDDEZXCEC-SVSWQMSJSA-N Thr-Ile-Ser Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(O)=O FQPDRTDDEZXCEC-SVSWQMSJSA-N 0.000 description 1
- FIFDDJFLNVAVMS-RHYQMDGZSA-N Thr-Leu-Met Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCSC)C(O)=O FIFDDJFLNVAVMS-RHYQMDGZSA-N 0.000 description 1
- JMBRNXUOLJFURW-BEAPCOKYSA-N Thr-Phe-Pro Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N2CCC[C@@H]2C(=O)O)N)O JMBRNXUOLJFURW-BEAPCOKYSA-N 0.000 description 1
- XKWABWFMQXMUMT-HJGDQZAQSA-N Thr-Pro-Glu Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCC(O)=O)C(O)=O XKWABWFMQXMUMT-HJGDQZAQSA-N 0.000 description 1
- MROIJTGJGIDEEJ-RCWTZXSCSA-N Thr-Pro-Pro Chemical compound C[C@@H](O)[C@H](N)C(=O)N1CCC[C@H]1C(=O)N1[C@H](C(O)=O)CCC1 MROIJTGJGIDEEJ-RCWTZXSCSA-N 0.000 description 1
- ZESGVALRVJIVLZ-VFCFLDTKSA-N Thr-Thr-Pro Chemical compound C[C@H]([C@@H](C(=O)N[C@@H]([C@@H](C)O)C(=O)N1CCC[C@@H]1C(=O)O)N)O ZESGVALRVJIVLZ-VFCFLDTKSA-N 0.000 description 1
- UDCHKDYNMRJYMI-QEJZJMRPSA-N Trp-Glu-Ser Chemical compound [H]N[C@@H](CC1=CNC2=C1C=CC=C2)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(O)=O UDCHKDYNMRJYMI-QEJZJMRPSA-N 0.000 description 1
- XGFGVFMXDXALEV-XIRDDKMYSA-N Trp-Leu-Asn Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)O)NC(=O)[C@H](CC1=CNC2=CC=CC=C21)N XGFGVFMXDXALEV-XIRDDKMYSA-N 0.000 description 1
- QYSBJAUCUKHSLU-JYJNAYRXSA-N Tyr-Arg-Val Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C(C)C)C(O)=O QYSBJAUCUKHSLU-JYJNAYRXSA-N 0.000 description 1
- QARCDOCCDOLJSF-HJPIBITLSA-N Tyr-Ile-Ser Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CO)C(=O)O)NC(=O)[C@H](CC1=CC=C(C=C1)O)N QARCDOCCDOLJSF-HJPIBITLSA-N 0.000 description 1
- GZUIDWDVMWZSMI-KKUMJFAQSA-N Tyr-Lys-Cys Chemical compound NCCCC[C@@H](C(=O)N[C@@H](CS)C(O)=O)NC(=O)[C@@H](N)CC1=CC=C(O)C=C1 GZUIDWDVMWZSMI-KKUMJFAQSA-N 0.000 description 1
- NHOVZGFNTGMYMI-KKUMJFAQSA-N Tyr-Ser-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC1=CC=C(O)C=C1 NHOVZGFNTGMYMI-KKUMJFAQSA-N 0.000 description 1
- PWKMJDQXKCENMF-MEYUZBJRSA-N Tyr-Thr-Leu Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(O)=O PWKMJDQXKCENMF-MEYUZBJRSA-N 0.000 description 1
- KSGKJSFPWSMJHK-JNPHEJMOSA-N Tyr-Tyr-Thr Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H]([C@@H](C)O)C(O)=O KSGKJSFPWSMJHK-JNPHEJMOSA-N 0.000 description 1
- RMRFSFXLFWWAJZ-HJOGWXRNSA-N Tyr-Tyr-Tyr Chemical compound C([C@H](N)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(O)=O)C1=CC=C(O)C=C1 RMRFSFXLFWWAJZ-HJOGWXRNSA-N 0.000 description 1
- GNWUWQAVVJQREM-NHCYSSNCSA-N Val-Asn-His Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)N GNWUWQAVVJQREM-NHCYSSNCSA-N 0.000 description 1
- UEHRGZCNLSWGHK-DLOVCJGASA-N Val-Glu-Val Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C(C)C)C(O)=O UEHRGZCNLSWGHK-DLOVCJGASA-N 0.000 description 1
- OACSGBOREVRSME-NHCYSSNCSA-N Val-His-Asn Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](Cc1cnc[nH]1)C(=O)N[C@@H](CC(N)=O)C(O)=O OACSGBOREVRSME-NHCYSSNCSA-N 0.000 description 1
- HQYVQDRYODWONX-DCAQKATOSA-N Val-His-Ser Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)N[C@@H](CO)C(=O)O)N HQYVQDRYODWONX-DCAQKATOSA-N 0.000 description 1
- XTDDIVQWDXMRJL-IHRRRGAJSA-N Val-Leu-His Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)NC(=O)[C@H](C(C)C)N XTDDIVQWDXMRJL-IHRRRGAJSA-N 0.000 description 1
- SYSWVVCYSXBVJG-RHYQMDGZSA-N Val-Leu-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C(C)C)N)O SYSWVVCYSXBVJG-RHYQMDGZSA-N 0.000 description 1
- HJSLDXZAZGFPDK-ULQDDVLXSA-N Val-Phe-Leu Chemical compound CC(C)C[C@@H](C(=O)O)NC(=O)[C@H](CC1=CC=CC=C1)NC(=O)[C@H](C(C)C)N HJSLDXZAZGFPDK-ULQDDVLXSA-N 0.000 description 1
- VCIYTVOBLZHFSC-XHSDSOJGSA-N Val-Phe-Pro Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N2CCC[C@@H]2C(=O)O)N VCIYTVOBLZHFSC-XHSDSOJGSA-N 0.000 description 1
- SSYBNWFXCFNRFN-GUBZILKMSA-N Val-Pro-Ser Chemical compound CC(C)[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CO)C(O)=O SSYBNWFXCFNRFN-GUBZILKMSA-N 0.000 description 1
- KSFXWENSJABBFI-ZKWXMUAHSA-N Val-Ser-Asn Chemical compound [H]N[C@@H](C(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(O)=O KSFXWENSJABBFI-ZKWXMUAHSA-N 0.000 description 1
- SDHZOOIGIUEPDY-JYJNAYRXSA-N Val-Ser-Trp Chemical compound C1=CC=C2C(C[C@H](NC(=O)[C@H](CO)NC(=O)[C@@H](N)C(C)C)C(O)=O)=CNC2=C1 SDHZOOIGIUEPDY-JYJNAYRXSA-N 0.000 description 1
- NZYNRRGJJVSSTJ-GUBZILKMSA-N Val-Ser-Val Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(O)=O NZYNRRGJJVSSTJ-GUBZILKMSA-N 0.000 description 1
- BZDGLJPROOOUOZ-XGEHTFHBSA-N Val-Thr-Cys Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CS)C(=O)O)NC(=O)[C@H](C(C)C)N)O BZDGLJPROOOUOZ-XGEHTFHBSA-N 0.000 description 1
- BGTDGENDNWGMDQ-KJEVXHAQSA-N Val-Tyr-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CC1=CC=C(C=C1)O)NC(=O)[C@H](C(C)C)N)O BGTDGENDNWGMDQ-KJEVXHAQSA-N 0.000 description 1
- ZLNYBMWGPOKSLW-LSJOCFKGSA-N Val-Val-Asp Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(O)=O)C(O)=O ZLNYBMWGPOKSLW-LSJOCFKGSA-N 0.000 description 1
- LLJLBRRXKZTTRD-GUBZILKMSA-N Val-Val-Ser Chemical compound CC(C)[C@@H](C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CO)C(=O)O)N LLJLBRRXKZTTRD-GUBZILKMSA-N 0.000 description 1
- JVGDAEKKZKKZFO-RCWTZXSCSA-N Val-Val-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](C(C)C)NC(=O)[C@H](C(C)C)N)O JVGDAEKKZKKZFO-RCWTZXSCSA-N 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 108010087924 alanylproline Proteins 0.000 description 1
- 108010050025 alpha-glutamyltryptophan Proteins 0.000 description 1
- 229940024606 amino acid Drugs 0.000 description 1
- DZHSAHHDTRWUTF-SIQRNXPUSA-N amyloid-beta polypeptide 42 Chemical compound C([C@@H](C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(=O)NCC(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCCN)C(=O)NCC(=O)N[C@@H](C)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](C(C)C)C(=O)NCC(=O)NCC(=O)N[C@@H](C(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C)C(O)=O)[C@@H](C)CC)C(C)C)NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@@H](NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CC(O)=O)C(C)C)C(C)C)C1=CC=CC=C1 DZHSAHHDTRWUTF-SIQRNXPUSA-N 0.000 description 1
- 108010092854 aspartyllysine Proteins 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 239000012472 biological sample Substances 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 210000004900 c-terminal fragment Anatomy 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 210000003710 cerebral cortex Anatomy 0.000 description 1
- 238000003759 clinical diagnosis Methods 0.000 description 1
- 230000019771 cognition Effects 0.000 description 1
- 230000006998 cognitive state Effects 0.000 description 1
- 230000002860 competitive effect Effects 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 230000006866 deterioration Effects 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 239000000539 dimer Substances 0.000 description 1
- 208000035475 disorder Diseases 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 229940088598 enzyme Drugs 0.000 description 1
- 230000003203 everyday effect Effects 0.000 description 1
- YNDIAUKFXKEXSV-CRYLGTRXSA-N florbetapir F-18 Chemical compound C1=CC(NC)=CC=C1\C=C\C1=CC=C(OCCOCCOCC[18F])N=C1 YNDIAUKFXKEXSV-CRYLGTRXSA-N 0.000 description 1
- 230000008717 functional decline Effects 0.000 description 1
- 108010006664 gamma-glutamyl-glycyl-glycine Proteins 0.000 description 1
- 108010049041 glutamylalanine Proteins 0.000 description 1
- XBGGUPMXALFZOT-UHFFFAOYSA-N glycyl-L-tyrosine hemihydrate Natural products NCC(=O)NC(C(O)=O)CC1=CC=C(O)C=C1 XBGGUPMXALFZOT-UHFFFAOYSA-N 0.000 description 1
- 108010010147 glycylglutamine Proteins 0.000 description 1
- 108010050848 glycylleucine Proteins 0.000 description 1
- 210000004884 grey matter Anatomy 0.000 description 1
- 239000012216 imaging agent Substances 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 238000009169 immunotherapy Methods 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 108010044374 isoleucyl-tyrosine Proteins 0.000 description 1
- 108010053037 kyotorphin Proteins 0.000 description 1
- 229940069634 lanabecestat Drugs 0.000 description 1
- 108010091871 leucylmethionine Proteins 0.000 description 1
- IXHBTMCLRNMKHZ-LBPRGKRZSA-N levobunolol Chemical group O=C1CCCC2=C1C=CC=C2OC[C@@H](O)CNC(C)(C)C IXHBTMCLRNMKHZ-LBPRGKRZSA-N 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 239000008297 liquid dosage form Substances 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 108010064235 lysylglycine Proteins 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 230000008897 memory decline Effects 0.000 description 1
- 230000003340 mental effect Effects 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 230000000877 morphologic effect Effects 0.000 description 1
- 238000010172 mouse model Methods 0.000 description 1
- YHYKUSGACIYRML-KRWDZBQOSA-N n-[3-[(5r)-3-amino-2,5-dimethyl-1,1-dioxo-6h-1,2,4-thiadiazin-5-yl]-4-fluorophenyl]-5-fluoropyridine-2-carboxamide Chemical compound C1S(=O)(=O)N(C)C(N)=N[C@]1(C)C1=CC(NC(=O)C=2N=CC(F)=CC=2)=CC=C1F YHYKUSGACIYRML-KRWDZBQOSA-N 0.000 description 1
- 210000002682 neurofibrillary tangle Anatomy 0.000 description 1
- 238000010606 normalization Methods 0.000 description 1
- 230000008506 pathogenesis Effects 0.000 description 1
- 230000007310 pathophysiology Effects 0.000 description 1
- 239000008194 pharmaceutical composition Substances 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 108010073101 phenylalanylleucine Proteins 0.000 description 1
- 108010073025 phenylalanylphenylalanine Proteins 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 230000000750 progressive effect Effects 0.000 description 1
- 108010070643 prolylglutamic acid Proteins 0.000 description 1
- 108010090894 prolylleucine Proteins 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 230000007026 protein scission Effects 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 230000001698 pyrogenic effect Effects 0.000 description 1
- 239000002464 receptor antagonist Substances 0.000 description 1
- 229940044551 receptor antagonist Drugs 0.000 description 1
- 238000011808 rodent model Methods 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 238000003118 sandwich ELISA Methods 0.000 description 1
- 108010048397 seryl-lysyl-leucine Proteins 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 230000001954 sterilising effect Effects 0.000 description 1
- 238000004659 sterilization and disinfection Methods 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 238000011820 transgenic animal model Methods 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 230000001960 triggered effect Effects 0.000 description 1
- 108010044292 tryptophyltyrosine Proteins 0.000 description 1
- 108010051110 tyrosyl-lysine Proteins 0.000 description 1
- 229950003000 verubecestat Drugs 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/54—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one sulfur as the ring hetero atoms, e.g. sulthiame
- A61K31/542—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one sulfur as the ring hetero atoms, e.g. sulthiame ortho- or peri-condensed with heterocyclic ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/46—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans from vertebrates
- G01N2333/47—Assays involving proteins of known structure or function as defined in the subgroups
- G01N2333/4701—Details
- G01N2333/4709—Amyloid plaque core protein
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Organic Chemistry (AREA)
- Neurosurgery (AREA)
- Epidemiology (AREA)
- Neurology (AREA)
- Biomedical Technology (AREA)
- Immunology (AREA)
- Hospice & Palliative Care (AREA)
- Psychiatry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Microbiology (AREA)
- Endocrinology (AREA)
- Mycology (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Investigating Or Analysing Biological Materials (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Peptides Or Proteins (AREA)
Abstract
초기 알츠하이머병을 갖는 대상체에서의 임상적 저하의 감소 방법, 초기 알츠하이머병을 갖는 아밀로이드 양성 대상체의 아밀로이드 음성으로의 전환 방법, 대상체에서의 뇌 아밀로이드 수준의 감소 방법 및 알츠하이머병의 예방 방법이 본원에 제공되며, 상기 방법은 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물을 투여하는 단계를 포함한다. 일부 구현예에서, 대상체는 ApoE4-양성이다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
Description
본 출원은 2018년 7월 24일자 출원된 미국 가출원 제62/702,659호; 2018년 10월 23일자 출원된 미국 가출원 제62/749,614호; 2019년 3월 26일자 출원된 미국 가출원 제62/824,162호; 2019년 5월 13일자 출원된 미국 가출원 제62/846,902호; 및 2019년 7월 16일자 출원된 미국 가출원 제62/874,684호에 대한 우선권의 이익을 주장하며; 각각의 전체 내용은 본원에 참조로 포함된다.
알츠하이머병(AD)은 병인이 알려져 있지 않은 진행성 신경변성 장애이며, 노인층에서 가장 흔한 형태의 치매이다. 2006년도에, 세계적으로 2,660만건의 AD(범위: 1,140만 내지 5,940만) 사례가 확인된 동시에(문헌[Brookmeyer, R., et al., Forecasting the global burden of Alzheimer's Disease. Alzheimer Dement. 2007; 3:186-91]), 미국에서 500만명 초과의 인구가 AD에 걸린 채로 살고 있는 것이 보고되었다(문헌[(Alzheimer's Association. Alzheimer's Association report. 2010 Alzheimer's disease facts and figures. Alzheimer Dement. 2010;6:158-94]). 2050년도까지, AD의 전세계적 유병률은 1억 680만명(범위: 4,720만명 내지 2억 2,120만명)으로 증가할 것으로 예상되고, 미국 단독의 유병률은 1,100만명 내지 1,600만명에 이를 것으로 추정된다(상기 문헌[Brookmeyer] 및 상기 문헌[2010 Alzheimer's disease facts and figures]).
질병은 일반적으로 서서히 진행되고, 말기 환자를 병석에 누워 있게 하는 인지 기능의 전반적인 저하(decline)를 수반한다. AD 환자는 전형적으로 증상 발병 후 오직 3 내지 10년 동안만 생존하지만, 2년 및 20년의 극단적인 경우도 알려져 있다. (문헌[Hebert, L.E., et al., Alzheimer disease in the U.S. population: prevalence estimates using the 2000 census. Arch Neurol. 2003; 60:1119-1122].) 사망 진단서에서 사망의 원인을 AD 때문인 것으로 보는 것이 드물기 때문에, AD로 인한 사망률이 크게 과소평가되어 있다는 사실에도 불구하고, AD는 미국에서의 모든 사망 원인 중 7번째 주요 원인이며, 65세 초과의 미국인에 대해서는 5번째 주요 원인이다. (문헌[Alzheimer's Association. Alzheimer's Association report. 2010 Alzheimer's disease facts and figures. Alzheimer Dement. 2010; 6:158-94].)
AD는 의료 시스템과 정부 지출뿐 아니라 환자와 그들의 가족에 상당한 영향을 갖는다는 점에서, 선진국에 유의한 경제적 부담을 안긴다. 미국에서만, 2010년도의 총 지출금은 메디케어(Medicare) 및 메디케이드(Medicaid)에 대한 1,230억 달러를 포함하여, 1,720억 달러로 추정되었다.
본 발명자들이 아는 한, 현재는 AD에 대한 치유법이 없으며, 이 질병의 진행을 둔화시킬 방법이 없다. AD의 치료를 위한 현재의 치료제는 대증 요법, 예컨대, 아세틸콜린에스테라제 저해제(AChEI), 예컨대, 도네페질(donepezil) 및 N-메틸-D-아스파르테이트(NMDA)-수용체 길항제, 예컨대, 메만틴(memantine)을 포함한다. 이들 작용제는 AD의 증상, 예컨대, 인지 저하, 및 일상 생활 동작 및 거동의 저하를 개선시킬 수 있지만, 그들은 질병의 진행을 변경시키는 것에 대해서는 보고된 바 없다. 따라서, AD의 진행의 치료 및/또는 예방 방법에 대한 충족되지 않은 요구가 존재한다.
일부 구현예에서, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물을 투여하는 단계를 포함하는, 초기 알츠하이머병을 갖는 대상체에서의 임상적 저하의 감소 방법이 본원에 제공된다. 일부 구현예에서, 대상체는 ApoE4 보유자이다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체, 예컨대, BAN2401은 플라크가 뇌에서 발생하기 시작하기 이전에 Aβ 침착을 예방한다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체, 예컨대, BAN2401은 뇌 내의 프로토피브릴 및 기존의 플라크를 감소시킨다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체, 예컨대, BAN2401은 플라크가 발생하기 이전에 Aβ 침착을 예방하고, 뇌 내의 프로토피브릴 및 기존의 플라크를 감소시킨다.
일부 구현예에서, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물을 투여하는 단계를 포함하는 아밀로이드 양성의 초기 알츠하이머병을 갖는 대상체에서 아밀로이드 음성의 초기의 알츠하이머병을 갖는 대상체로의 전환 방법이 본원에 제공된다. 일부 구현예에서, 대상체는 ApoE4 보유자이다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물을 투여하는 단계를 포함하는, 초기 알츠하이머병을 갖는 대상체에서의 뇌 아밀로이드 수준의 감소 방법이 본원에 제공된다. 일부 구현예에서, 대상체는 ApoE4 보유자이다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, ApoE4-양성 대상체에서의 알츠하이머병의 예방 방법이 본원에 제공된다. 일부 구현예에서, 상기 방법은 대상체의 투여전 뇌 아밀로이드 수준을 결정하는 단계 및 대상체의 뇌 아밀로이드 수준이 미리 결정된 제1 수준 초과이면, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 투여하는 단계를 포함한다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
도 1은 ADCOMS에 의해 결정되는 바와 같은, 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 2는 ADCOMS에 의해 결정되는 바와 같은, 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 3은 ADCOMS에 의해 결정되는 바와 같은, 알츠하이머병 치매로 인한 경증 인지 장애 - 중등의 가능성을 갖는 대상체에서의 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 4는 ADCOMS에 의해 결정되는 바와 같은, 경증 알츠하이머병 치매를 갖는 대상체에서의 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 5는 ADCOMS에 의해 결정되는 바와 같은, ApoE4-양성 대상체에서의 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 6은 ADCOMS에 의해 결정되는 바와 같은, ApoE4-음성 대상체에서의 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 7은 ADAS-cog에 의해 결정되는 바와 같은, 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 8은 ADAS-cog에 의해 결정되는 바와 같은, 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 9는 CDR-SB에 의해 결정되는 바와 같은, 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 10은 CDR-SB에 의해 결정되는 바와 같은, 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 11은 PET에 의해 결정되는 바와 같은, 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한, 18개월에 걸친 전체 소뇌 참조값에 비한 전체 피질 평균으로서 뇌 내의 아밀로이드의 감소를 보여준다.
도 12는 뇌 Aβ 아밀로이드에 대한 방사성추적자의 결합을 사용한 영상화에 의해 결정되고, PET로 가시화되는 바와 같은, 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한, 18개월에 걸친 뇌 내의 아밀로이드의 감소를 보여준다.
도 13은 시각적 판독에 의해 결정되는 바와 같은, 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한, 12개월 및 18개월의 처리 후의 아밀로이드 양성 대상체로부터 아밀로이드 음성 대상체로의 전환을 보여준다.
도 14는 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 Aβ1-42의 뇌척수액 수준의 변화를 보여준다.
도 15는 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 전체 tau의 뇌척수액 수준의 변화를 보여준다.
도 16은 ADCOMS에 의해 결정되는 바와 같은, ApoE4-양성 대상체에서의 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 17은 ADCOMS에 의해 결정되는 바와 같은, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 ApoE4-양성 대상체에서의 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 18은 ADCOMS에 의해 결정되는 바와 같은, 경증 알츠하이머병 치매를 갖는 ApoE4-양성 대상체에서의 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 19는 ADAS-cog에 의해 결정되는 바와 같은, ApoE4-양성 대상체에서의 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 20은 ADAS-cog에 의해 결정되는 바와 같은, ApoE4-양성 대상체에서의 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 21은 ADAS-cog에 의해 결정되는 바와 같은, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 ApoE4-양성 대상체에서의 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 22는 ADAS-cog에 의해 결정되는 바와 같은, 경증 알츠하이머병 치매를 갖는 ApoE4-양성 대상체에서의 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 23은 CDR-SB에 의해 결정되는 바와 같은, ApoE4-양성 대상체에서의 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 24는 CDR-SB에 의해 결정되는 바와 같은, ApoE4-양성 대상체에서의 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 25는 CDR-SB에 의해 결정되는 바와 같은, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 ApoE4-양성 대상체에서의 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 26은 CDR-SB에 의해 결정되는 바와 같은, 경증 알츠하이머병 치매를 갖는 ApoE4-양성 대상체에서의 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 27은 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같은, ApoE4-양성 대상체에서의 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 전체 소뇌 참조값에 비한 전체 피질 평균으로서 뇌 내의 아밀로이드의 감소를 보여준다.
도 28은 뇌 Aβ 아밀로이드에 대한 방사성추적자의 결합을 사용한 영상화에 의해 결정되고, PET로 가시화되는 바와 같은, ApoE4-양성 대상체에서의 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한, 18개월에 걸친 뇌 내의 아밀로이드의 감소를 보여준다.
도 29는 12개월 및 18개월의 처리 후의, 아밀로이드 양성, ApoE4-양성 대상체로부터 아밀로이드 음성, ApoE4-양성 대상체로의 전환을 보여준다.
도 30은 ApoE4-양성 대상체에서의 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 Aβ1-42의 뇌척수액 수준의 변화를 보여준다.
도 31은 ApoE4-양성 대상체에서의 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 전체 tau의 뇌척수액 수준의 변화를 보여준다.
도 32는 ADCOMS에 의해 결정되는 바와 같은, ApoE4-음성 대상체에서의 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 33은 ADCOMS에 의해 결정되는 바와 같은, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 ApoE4-음성 대상체에서의 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 34는 ADCOMS에 의해 결정되는 바와 같은, 경증 알츠하이머병 치매를 갖는 ApoE4-음성 대상체에서의 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 35는 ADAS-cog에 의해 결정되는 바와 같은, ApoE4-음성 대상체에서의 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 36은 ADAS-cog에 의해 결정되는 바와 같은, ApoE4-음성 대상체에서의 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 37은 ADAS-cog에 의해 결정되는 바와 같은, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 ApoE4-음성 대상체에서의 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 38은 ADAS-cog에 의해 결정되는 바와 같은, 경증 알츠하이머병 치매를 갖는 ApoE4-음성 대상체에서의 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 39는 CDR-SB에 의해 결정되는 바와 같은, ApoE4-음성 대상체에서의 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 40은 CDR-SB에 의해 결정되는 바와 같은, ApoE4-음성 대상체에서의 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 41은 CDR-SB에 의해 결정되는 바와 같은, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 ApoE4-음성 대상체에서의 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 42는 CDR-SB에 의해 결정되는 바와 같은, 경증 알츠하이머병 치매를 갖는 ApoE4-음성 대상체에서의 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 43은 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같은, ApoE4-음성 대상체에서의 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한, 18개월에 걸친 전체 소뇌 참조값에 비한 전체 피질 평균으로서 뇌 내의 아밀로이드의 감소를 보여준다.
도 44는 뇌 Aβ 아밀로이드에 대한 방사성추적자의 결합을 사용한 영상화에 의해 결정되고, PET로 가시화되는 바와 같은, ApoE4-음성 대상체에서의 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한, 18개월에 걸친 뇌 내의 아밀로이드의 감소를 보여준다.
도 45는 12개월 및 18개월의 처리 후의, 아밀로이드 양성, ApoE4-음성 대상체로부터 아밀로이드 음성, ApoE4-음성 대상체로의 전환을 보여준다.
도 46은 ApoE4-음성 대상체에서의 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 Aβ1-42의 뇌척수액 수준의 변화를 보여준다.
도 47은 ApoE4-음성 대상체에서의 매달 10 ㎎/㎏ 용량 및 2주마다 10 ㎎/㎏ 용량에 대한 18개월에 걸친 전체 tau의 뇌척수액 수준의 변화를 보여준다.
도 48은 ADCOMS, ADAS-Cog 또는 CDR-SB에 의해 결정되는 바와 같은, ApoE4-양성 및 ApoE4-음성 대상체에서의, 그리고 유전형과 관계없이 모든 대상체에 대한, 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 제18개월에서의 위약에 비한 인지 저하의 둔화를 보여준다.
도 49는 ADCOMS, ADAS-Cog 또는 CDR-SB에 의해 결정되는 바와 같은, 알츠하이머병 치매로 인한 경증 인지 장애 - 중등의 가능성 또는 경증 알츠하이머병 치매를 갖는 대상체에서의, 그리고 질병 유형 또는 상태와 관계없이 모든 대상체에 대한, 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 제18개월에서의 위약에 비한 인지 저하의 둔화를 보여준다.
도 50은 ADCOMS, ADAS-Cog 또는 CDR-SB에 의해 결정되는 바와 같은, BAN2401 이외의 적어도 하나의 알츠하이머병 의약(medication)을 동시 투여한 대상체 및 BAN2401 이외의 적어도 하나의 알츠하이머병 의약을 동시 투여하지 않은 대상체에서의, 그리고 대상체에게 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되는지 여부와 관계없이 모든 대상체에 대한, 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 제18개월에서의 위약에 비한 인지 저하의 둔화를 보여준다.
도 51은 PET에 의해 결정되는 바와 같은, 하기의 하위집단에서의 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한, 제18개월에서의 위약에 비한 뇌 아밀로이드의 제거를 보여준다: ApoE4-양성 대상체; ApoE4-음성 대상체; 알츠하이머병 치매로 인한 경증 인지 장애 - 중등의 가능성을 갖는 대상체; 경증 알츠하이머병 치매를 갖는 대상체; BAN2401 이외의 적어도 하나의 알츠하이머병 의약을 동시 투여한 대상체; 및 BAN2401 이외의 적어도 하나의 알츠하이머병 의약을 동시 투여하지 않은 대상체.
도 52는 ADCOMS에 의해 결정되는 바와 같은, 하기의 하위집단에서의 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 제18개월에서의 위약에 비한 인지 저하의 둔화를 보여준다: ApoE4-양성 대상체; ApoE4-음성 대상체; 알츠하이머병 치매로 인한 경증 인지 장애 - 중등의 가능성을 갖는 대상체; 경증 알츠하이머병 치매를 갖는 대상체; BAN2401 이외의 적어도 하나의 알츠하이머병 의약을 동시 투여한 대상체; 및 BAN2401 이외의 적어도 하나의 알츠하이머병 의약을 동시 투여하지 않은 대상체.
도 53은 2주마다 10 ㎎/㎏의 BAN2401 또는 매달 10 ㎎/㎏의 BAN2401의 용량을 제공받은 대상체에 대한 평균으로서, 위약에 비한 제18개월에서의 뉴로그라닌(neurogranin)의 뇌척수액 수준의 변화를 보여준다.
도 54는 2주마다 10 ㎎/㎏의 BAN2401 또는 매달 10 ㎎/㎏의 BAN2401의 용량을 제공받은 대상체에 대한 평균으로서, 위약에 비한 제18개월에서의 포스포-Tau의 뇌척수액 수준의 변화를 보여준다.
도 55는 2주마다 10 ㎎/㎏의 BAN2401 또는 매달 10 ㎎/㎏의 BAN2401의 용량을 제공받은 대상체에 대한 평균으로서, 위약에 비한 제18개월에서의 신경필라멘트(neurofilament) 경쇄의 뇌척수액 수준의 변화를 보여준다.
도 56은 ADCOMS 및 PET에 의해 결정되는 바와 같은, 2주마다 10 ㎎/㎏의 BAN2401 또는 매달 10 ㎎/㎏의 BAN2401의 용량에 대한 제18개월에서의 위약에 비한 인지 저하의 둔화를 보여준다.
도 57은 ADCOMS, ADAS-Cog 및 CDR-SB에 의해 결정되는 바와 같은, 뇌 내의 아밀로이드의 감소와 임상적 개선의 증가 간의 상관관계를 보여준다.
도 58은 BAN2401을 투여하지 않았던 ApoE4-양성 및 ApoE4-음성 대상체가 유사한 질병 진행 비를 경험하였음을 보여준다.
도 59는 ADCOMS에 의해 결정되는 바와 같은 질병 진행에 대한 다양한 인자의 영향을 보여준다.
도 60은 매달 10 ㎎/㎏의 BAN2401 및 2주마다 10 ㎎/㎏의 BAN2401의 용량의 투여 이후 시간의 함수로서 BAN2401의 농도의 변화를 보여준다.
도 61은 Aβ 펩티드의 단량체, 이량체 및 올리고머와 비교시 더 큰 Aβ 프로토피브릴에 우선적으로 결합하는 BAN2401을 도시한 것이다.
도 62는 BAN2401의 최대 혈장 농도의 함수로서 ARIA-E 사례를 경험한 대상체의 비율을 보여준다.
도 63은 BAN2401의 투여가 모든 용량에 걸쳐 아밀로이드 PET 값을 유의미하게 감소시키는 것을 보여준다.
도 64는 알츠하이머병의 조기의 개입 및 예방을 위한 연구 설계의 개요를 보여준다.
도 65는 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 위약에 비한 18개월에 걸친 포스포-Tau의 뇌척수액 수준의 기준선으로부터의 보정 평균 변화(최소 제곱 평균, "LSM")를 보여준다.
도 66은 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 위약에 비한 18개월에 걸친 뉴로그라닌의 뇌척수액 수준의 기준선으로부터의 보정 평균 변화(LSM)를 보여준다.
도 67은 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 위약에 비한 18개월에 걸친 신경필라멘트 경쇄의 뇌척수액 수준의 기준선으로부터의 보정 평균 변화(LSM)를 보여준다.
도 68은 조합된 10 ㎎/㎏ 용량의 BAN2401(매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏)에 대한, 위약에 비한 18개월에 걸친 포스포-Tau의 뇌척수액 수준의 기준선으로부터의 보정 평균 변화(LSM)를 보여준다.
도 69는 ApoE4-양성 대상체에서의 조합된 10 ㎎/㎏ 용량의 BAN2401(매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏)에 대한, 위약에 비한 18개월에 걸친 포스포-Tau의 뇌척수액 수준의 기준선으로부터의 보정 평균 변화(LSM)를 보여준다.
도 70은 ApoE4-음성 대상체에서의 조합된 10 ㎎/㎏ 용량의 BAN2401(매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏)에 대한, 위약에 비한 18개월에 걸친 포스포-Tau의 뇌척수액 수준의 기준선으로부터의 보정 평균 변화(LSM)를 보여준다.
도 71은 조합된 10 ㎎/㎏ 용량의 BAN2401(매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏)에 대한, 위약에 비한 18개월에 걸친 뉴로그라닌의 뇌척수액 수준의 기준선으로부터의 보정 평균 변화(LSM)를 보여준다.
도 72는 ApoE4-양성 대상체에서의 조합된 10 ㎎/㎏ 용량의 BAN2401(매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏)에 대한, 위약에 비한 18개월에 걸친 뉴로그라닌의 뇌척수액 수준의 기준선으로부터의 보정 평균 변화(LSM)를 보여준다.
도 73은 ApoE4-음성 대상체에서의 조합된 10 ㎎/㎏ 용량의 BAN2401(매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏)에 대한, 위약에 비한 18개월에 걸친 뉴로그라닌의 뇌척수액 수준의 기준선으로부터의 보정 평균 변화(LSM)를 보여준다.
도 74는 조합된 10 ㎎/㎏ 용량의 BAN2401(매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏)에 대한, 위약에 비한 18개월에 걸친 신경필라멘트 경쇄의 뇌척수액 수준의 기준선으로부터의 보정 평균 변화(LSM)를 보여준다.
도 75는 ApoE4-양성 대상체에서의 조합된 10 ㎎/㎏ 용량의 BAN2401(매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏)에 대한, 위약에 비한 18개월에 걸친 신경필라멘트 경쇄의 뇌척수액 수준의 기준선으로부터의 보정 평균 변화(LSM)를 보여준다.
도 76은 ApoE4-음성 대상체에서의 조합된 10 ㎎/㎏ 용량의 BAN2401(매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏)에 대한, 위약에 비한 18개월에 걸친 신경필라멘트 경쇄의 뇌척수액 수준의 기준선으로부터의 보정 평균 변화(LSM)를 보여준다.
도 77은 위약 및 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 제12개월 및 제18개월에서의 PET 표준 섭취 계수비(standard uptake value ratio)(전체 소뇌 마스크(whole cerebellum mask)에 대하여 정규화됨)와 ADCOMS에 의해 결정되는 바와 같은 인지 결과의 기준선으로부터의 변화 간의 상관관계를 보여준다.
도 78은 위약 및 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 제12개월 및 제18개월에서의 PET 표준 섭취 계수비(전체 소뇌 마스크에 대하여 정규화됨)와 CDR-SB에 의해 결정되는 바와 같은 인지 결과의 기준선으로부터의 변화 간의 상관관계를 보여준다.
도 79는 위약 및 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 제12개월 및 제18개월에서의 PET 표준 섭취 계수비(전체 소뇌 마스크에 대하여 정규화됨)와 ADAS-Cog에 의해 결정되는 바와 같은 인지 결과의 기준선으로부터의 변화 간의 상관관계를 보여준다.
도 80은 위약 및 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 제12개월 및 제18개월에서의 PET 표준 섭취 계수비(피질하 백질에 대하여 정규화됨)와 ADCOMS에 의해 결정되는 바와 같은 인지 결과의 기준선으로부터의 변화 간의 상관관계를 보여준다.
도 81은 위약 및 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 제12개월 및 제18개월에서의 PET 표준 섭취 계수비(피질하 백질에 대하여 정규화됨) 및 CDR-SB에 의해 결정되는 바와 같은 인지 결과의 기준선으로부터의 변화 간의 상관관계를 보여준다.
도 82는 위약 및 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 제12개월 및 제18개월에서의 PET 표준 섭취 계수비(피질하 백질에 대하여 정규화됨)와 ADAS-Cog에 의해 결정되는 바와 같은 인지 결과의 기준선으로부터의 변화 간의 상관관계를 보여준다.
도 2는 ADCOMS에 의해 결정되는 바와 같은, 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 3은 ADCOMS에 의해 결정되는 바와 같은, 알츠하이머병 치매로 인한 경증 인지 장애 - 중등의 가능성을 갖는 대상체에서의 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 4는 ADCOMS에 의해 결정되는 바와 같은, 경증 알츠하이머병 치매를 갖는 대상체에서의 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 5는 ADCOMS에 의해 결정되는 바와 같은, ApoE4-양성 대상체에서의 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 6은 ADCOMS에 의해 결정되는 바와 같은, ApoE4-음성 대상체에서의 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 7은 ADAS-cog에 의해 결정되는 바와 같은, 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 8은 ADAS-cog에 의해 결정되는 바와 같은, 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 9는 CDR-SB에 의해 결정되는 바와 같은, 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 10은 CDR-SB에 의해 결정되는 바와 같은, 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 11은 PET에 의해 결정되는 바와 같은, 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한, 18개월에 걸친 전체 소뇌 참조값에 비한 전체 피질 평균으로서 뇌 내의 아밀로이드의 감소를 보여준다.
도 12는 뇌 Aβ 아밀로이드에 대한 방사성추적자의 결합을 사용한 영상화에 의해 결정되고, PET로 가시화되는 바와 같은, 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한, 18개월에 걸친 뇌 내의 아밀로이드의 감소를 보여준다.
도 13은 시각적 판독에 의해 결정되는 바와 같은, 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한, 12개월 및 18개월의 처리 후의 아밀로이드 양성 대상체로부터 아밀로이드 음성 대상체로의 전환을 보여준다.
도 14는 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 Aβ1-42의 뇌척수액 수준의 변화를 보여준다.
도 15는 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 전체 tau의 뇌척수액 수준의 변화를 보여준다.
도 16은 ADCOMS에 의해 결정되는 바와 같은, ApoE4-양성 대상체에서의 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 17은 ADCOMS에 의해 결정되는 바와 같은, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 ApoE4-양성 대상체에서의 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 18은 ADCOMS에 의해 결정되는 바와 같은, 경증 알츠하이머병 치매를 갖는 ApoE4-양성 대상체에서의 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 19는 ADAS-cog에 의해 결정되는 바와 같은, ApoE4-양성 대상체에서의 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 20은 ADAS-cog에 의해 결정되는 바와 같은, ApoE4-양성 대상체에서의 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 21은 ADAS-cog에 의해 결정되는 바와 같은, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 ApoE4-양성 대상체에서의 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 22는 ADAS-cog에 의해 결정되는 바와 같은, 경증 알츠하이머병 치매를 갖는 ApoE4-양성 대상체에서의 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 23은 CDR-SB에 의해 결정되는 바와 같은, ApoE4-양성 대상체에서의 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 24는 CDR-SB에 의해 결정되는 바와 같은, ApoE4-양성 대상체에서의 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 25는 CDR-SB에 의해 결정되는 바와 같은, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 ApoE4-양성 대상체에서의 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 26은 CDR-SB에 의해 결정되는 바와 같은, 경증 알츠하이머병 치매를 갖는 ApoE4-양성 대상체에서의 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 27은 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같은, ApoE4-양성 대상체에서의 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 전체 소뇌 참조값에 비한 전체 피질 평균으로서 뇌 내의 아밀로이드의 감소를 보여준다.
도 28은 뇌 Aβ 아밀로이드에 대한 방사성추적자의 결합을 사용한 영상화에 의해 결정되고, PET로 가시화되는 바와 같은, ApoE4-양성 대상체에서의 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한, 18개월에 걸친 뇌 내의 아밀로이드의 감소를 보여준다.
도 29는 12개월 및 18개월의 처리 후의, 아밀로이드 양성, ApoE4-양성 대상체로부터 아밀로이드 음성, ApoE4-양성 대상체로의 전환을 보여준다.
도 30은 ApoE4-양성 대상체에서의 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 Aβ1-42의 뇌척수액 수준의 변화를 보여준다.
도 31은 ApoE4-양성 대상체에서의 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 전체 tau의 뇌척수액 수준의 변화를 보여준다.
도 32는 ADCOMS에 의해 결정되는 바와 같은, ApoE4-음성 대상체에서의 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 33은 ADCOMS에 의해 결정되는 바와 같은, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 ApoE4-음성 대상체에서의 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 34는 ADCOMS에 의해 결정되는 바와 같은, 경증 알츠하이머병 치매를 갖는 ApoE4-음성 대상체에서의 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 35는 ADAS-cog에 의해 결정되는 바와 같은, ApoE4-음성 대상체에서의 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 36은 ADAS-cog에 의해 결정되는 바와 같은, ApoE4-음성 대상체에서의 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 37은 ADAS-cog에 의해 결정되는 바와 같은, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 ApoE4-음성 대상체에서의 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 38은 ADAS-cog에 의해 결정되는 바와 같은, 경증 알츠하이머병 치매를 갖는 ApoE4-음성 대상체에서의 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 39는 CDR-SB에 의해 결정되는 바와 같은, ApoE4-음성 대상체에서의 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 40은 CDR-SB에 의해 결정되는 바와 같은, ApoE4-음성 대상체에서의 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 41은 CDR-SB에 의해 결정되는 바와 같은, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 ApoE4-음성 대상체에서의 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 42는 CDR-SB에 의해 결정되는 바와 같은, 경증 알츠하이머병 치매를 갖는 ApoE4-음성 대상체에서의 매달 10 ㎎/㎏ 용량의 BAN2401 및 2주마다 10 ㎎/㎏ 용량에 대한 18개월에 걸친 위약에 비한 인지 저하의 둔화를 보여준다.
도 43은 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같은, ApoE4-음성 대상체에서의 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한, 18개월에 걸친 전체 소뇌 참조값에 비한 전체 피질 평균으로서 뇌 내의 아밀로이드의 감소를 보여준다.
도 44는 뇌 Aβ 아밀로이드에 대한 방사성추적자의 결합을 사용한 영상화에 의해 결정되고, PET로 가시화되는 바와 같은, ApoE4-음성 대상체에서의 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한, 18개월에 걸친 뇌 내의 아밀로이드의 감소를 보여준다.
도 45는 12개월 및 18개월의 처리 후의, 아밀로이드 양성, ApoE4-음성 대상체로부터 아밀로이드 음성, ApoE4-음성 대상체로의 전환을 보여준다.
도 46은 ApoE4-음성 대상체에서의 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 18개월에 걸친 Aβ1-42의 뇌척수액 수준의 변화를 보여준다.
도 47은 ApoE4-음성 대상체에서의 매달 10 ㎎/㎏ 용량 및 2주마다 10 ㎎/㎏ 용량에 대한 18개월에 걸친 전체 tau의 뇌척수액 수준의 변화를 보여준다.
도 48은 ADCOMS, ADAS-Cog 또는 CDR-SB에 의해 결정되는 바와 같은, ApoE4-양성 및 ApoE4-음성 대상체에서의, 그리고 유전형과 관계없이 모든 대상체에 대한, 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 제18개월에서의 위약에 비한 인지 저하의 둔화를 보여준다.
도 49는 ADCOMS, ADAS-Cog 또는 CDR-SB에 의해 결정되는 바와 같은, 알츠하이머병 치매로 인한 경증 인지 장애 - 중등의 가능성 또는 경증 알츠하이머병 치매를 갖는 대상체에서의, 그리고 질병 유형 또는 상태와 관계없이 모든 대상체에 대한, 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 제18개월에서의 위약에 비한 인지 저하의 둔화를 보여준다.
도 50은 ADCOMS, ADAS-Cog 또는 CDR-SB에 의해 결정되는 바와 같은, BAN2401 이외의 적어도 하나의 알츠하이머병 의약(medication)을 동시 투여한 대상체 및 BAN2401 이외의 적어도 하나의 알츠하이머병 의약을 동시 투여하지 않은 대상체에서의, 그리고 대상체에게 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되는지 여부와 관계없이 모든 대상체에 대한, 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 제18개월에서의 위약에 비한 인지 저하의 둔화를 보여준다.
도 51은 PET에 의해 결정되는 바와 같은, 하기의 하위집단에서의 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한, 제18개월에서의 위약에 비한 뇌 아밀로이드의 제거를 보여준다: ApoE4-양성 대상체; ApoE4-음성 대상체; 알츠하이머병 치매로 인한 경증 인지 장애 - 중등의 가능성을 갖는 대상체; 경증 알츠하이머병 치매를 갖는 대상체; BAN2401 이외의 적어도 하나의 알츠하이머병 의약을 동시 투여한 대상체; 및 BAN2401 이외의 적어도 하나의 알츠하이머병 의약을 동시 투여하지 않은 대상체.
도 52는 ADCOMS에 의해 결정되는 바와 같은, 하기의 하위집단에서의 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 제18개월에서의 위약에 비한 인지 저하의 둔화를 보여준다: ApoE4-양성 대상체; ApoE4-음성 대상체; 알츠하이머병 치매로 인한 경증 인지 장애 - 중등의 가능성을 갖는 대상체; 경증 알츠하이머병 치매를 갖는 대상체; BAN2401 이외의 적어도 하나의 알츠하이머병 의약을 동시 투여한 대상체; 및 BAN2401 이외의 적어도 하나의 알츠하이머병 의약을 동시 투여하지 않은 대상체.
도 53은 2주마다 10 ㎎/㎏의 BAN2401 또는 매달 10 ㎎/㎏의 BAN2401의 용량을 제공받은 대상체에 대한 평균으로서, 위약에 비한 제18개월에서의 뉴로그라닌(neurogranin)의 뇌척수액 수준의 변화를 보여준다.
도 54는 2주마다 10 ㎎/㎏의 BAN2401 또는 매달 10 ㎎/㎏의 BAN2401의 용량을 제공받은 대상체에 대한 평균으로서, 위약에 비한 제18개월에서의 포스포-Tau의 뇌척수액 수준의 변화를 보여준다.
도 55는 2주마다 10 ㎎/㎏의 BAN2401 또는 매달 10 ㎎/㎏의 BAN2401의 용량을 제공받은 대상체에 대한 평균으로서, 위약에 비한 제18개월에서의 신경필라멘트(neurofilament) 경쇄의 뇌척수액 수준의 변화를 보여준다.
도 56은 ADCOMS 및 PET에 의해 결정되는 바와 같은, 2주마다 10 ㎎/㎏의 BAN2401 또는 매달 10 ㎎/㎏의 BAN2401의 용량에 대한 제18개월에서의 위약에 비한 인지 저하의 둔화를 보여준다.
도 57은 ADCOMS, ADAS-Cog 및 CDR-SB에 의해 결정되는 바와 같은, 뇌 내의 아밀로이드의 감소와 임상적 개선의 증가 간의 상관관계를 보여준다.
도 58은 BAN2401을 투여하지 않았던 ApoE4-양성 및 ApoE4-음성 대상체가 유사한 질병 진행 비를 경험하였음을 보여준다.
도 59는 ADCOMS에 의해 결정되는 바와 같은 질병 진행에 대한 다양한 인자의 영향을 보여준다.
도 60은 매달 10 ㎎/㎏의 BAN2401 및 2주마다 10 ㎎/㎏의 BAN2401의 용량의 투여 이후 시간의 함수로서 BAN2401의 농도의 변화를 보여준다.
도 61은 Aβ 펩티드의 단량체, 이량체 및 올리고머와 비교시 더 큰 Aβ 프로토피브릴에 우선적으로 결합하는 BAN2401을 도시한 것이다.
도 62는 BAN2401의 최대 혈장 농도의 함수로서 ARIA-E 사례를 경험한 대상체의 비율을 보여준다.
도 63은 BAN2401의 투여가 모든 용량에 걸쳐 아밀로이드 PET 값을 유의미하게 감소시키는 것을 보여준다.
도 64는 알츠하이머병의 조기의 개입 및 예방을 위한 연구 설계의 개요를 보여준다.
도 65는 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 위약에 비한 18개월에 걸친 포스포-Tau의 뇌척수액 수준의 기준선으로부터의 보정 평균 변화(최소 제곱 평균, "LSM")를 보여준다.
도 66은 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 위약에 비한 18개월에 걸친 뉴로그라닌의 뇌척수액 수준의 기준선으로부터의 보정 평균 변화(LSM)를 보여준다.
도 67은 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 위약에 비한 18개월에 걸친 신경필라멘트 경쇄의 뇌척수액 수준의 기준선으로부터의 보정 평균 변화(LSM)를 보여준다.
도 68은 조합된 10 ㎎/㎏ 용량의 BAN2401(매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏)에 대한, 위약에 비한 18개월에 걸친 포스포-Tau의 뇌척수액 수준의 기준선으로부터의 보정 평균 변화(LSM)를 보여준다.
도 69는 ApoE4-양성 대상체에서의 조합된 10 ㎎/㎏ 용량의 BAN2401(매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏)에 대한, 위약에 비한 18개월에 걸친 포스포-Tau의 뇌척수액 수준의 기준선으로부터의 보정 평균 변화(LSM)를 보여준다.
도 70은 ApoE4-음성 대상체에서의 조합된 10 ㎎/㎏ 용량의 BAN2401(매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏)에 대한, 위약에 비한 18개월에 걸친 포스포-Tau의 뇌척수액 수준의 기준선으로부터의 보정 평균 변화(LSM)를 보여준다.
도 71은 조합된 10 ㎎/㎏ 용량의 BAN2401(매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏)에 대한, 위약에 비한 18개월에 걸친 뉴로그라닌의 뇌척수액 수준의 기준선으로부터의 보정 평균 변화(LSM)를 보여준다.
도 72는 ApoE4-양성 대상체에서의 조합된 10 ㎎/㎏ 용량의 BAN2401(매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏)에 대한, 위약에 비한 18개월에 걸친 뉴로그라닌의 뇌척수액 수준의 기준선으로부터의 보정 평균 변화(LSM)를 보여준다.
도 73은 ApoE4-음성 대상체에서의 조합된 10 ㎎/㎏ 용량의 BAN2401(매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏)에 대한, 위약에 비한 18개월에 걸친 뉴로그라닌의 뇌척수액 수준의 기준선으로부터의 보정 평균 변화(LSM)를 보여준다.
도 74는 조합된 10 ㎎/㎏ 용량의 BAN2401(매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏)에 대한, 위약에 비한 18개월에 걸친 신경필라멘트 경쇄의 뇌척수액 수준의 기준선으로부터의 보정 평균 변화(LSM)를 보여준다.
도 75는 ApoE4-양성 대상체에서의 조합된 10 ㎎/㎏ 용량의 BAN2401(매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏)에 대한, 위약에 비한 18개월에 걸친 신경필라멘트 경쇄의 뇌척수액 수준의 기준선으로부터의 보정 평균 변화(LSM)를 보여준다.
도 76은 ApoE4-음성 대상체에서의 조합된 10 ㎎/㎏ 용량의 BAN2401(매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏)에 대한, 위약에 비한 18개월에 걸친 신경필라멘트 경쇄의 뇌척수액 수준의 기준선으로부터의 보정 평균 변화(LSM)를 보여준다.
도 77은 위약 및 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 제12개월 및 제18개월에서의 PET 표준 섭취 계수비(standard uptake value ratio)(전체 소뇌 마스크(whole cerebellum mask)에 대하여 정규화됨)와 ADCOMS에 의해 결정되는 바와 같은 인지 결과의 기준선으로부터의 변화 간의 상관관계를 보여준다.
도 78은 위약 및 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 제12개월 및 제18개월에서의 PET 표준 섭취 계수비(전체 소뇌 마스크에 대하여 정규화됨)와 CDR-SB에 의해 결정되는 바와 같은 인지 결과의 기준선으로부터의 변화 간의 상관관계를 보여준다.
도 79는 위약 및 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 제12개월 및 제18개월에서의 PET 표준 섭취 계수비(전체 소뇌 마스크에 대하여 정규화됨)와 ADAS-Cog에 의해 결정되는 바와 같은 인지 결과의 기준선으로부터의 변화 간의 상관관계를 보여준다.
도 80은 위약 및 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 제12개월 및 제18개월에서의 PET 표준 섭취 계수비(피질하 백질에 대하여 정규화됨)와 ADCOMS에 의해 결정되는 바와 같은 인지 결과의 기준선으로부터의 변화 간의 상관관계를 보여준다.
도 81은 위약 및 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 제12개월 및 제18개월에서의 PET 표준 섭취 계수비(피질하 백질에 대하여 정규화됨) 및 CDR-SB에 의해 결정되는 바와 같은 인지 결과의 기준선으로부터의 변화 간의 상관관계를 보여준다.
도 82는 위약 및 2주마다 2.5 ㎎/㎏, 매달 5 ㎎/㎏, 2주마다 5 ㎎/㎏, 매달 10 ㎎/㎏ 및 2주마다 10 ㎎/㎏ 용량의 BAN2401에 대한 제12개월 및 제18개월에서의 PET 표준 섭취 계수비(피질하 백질에 대하여 정규화됨)와 ADAS-Cog에 의해 결정되는 바와 같은 인지 결과의 기준선으로부터의 변화 간의 상관관계를 보여준다.
"아밀로이드 가설"
"아밀로이드 가설"은 아밀로이드 β(Aβ) 펩티드가 AD의 발병에서 주요한 역할을 수행하는 것을 제안한다. 구체적으로, AD에서 신경변성은 Aβ 생성과 Aβ 제거 간의 불균형으로 인한 뇌 조직 내의 Aβ 플라크의 침착에 의해, tau 단백질을 함유하는 신경섬유 다발(neurofibrillary tangle)의 형성을 야기함으로써 유발될 수 있다는 것이 가정된다. Aβ 펩티드는 일반적으로 연속적인 입체형태적 동적 상태로 존재하여, 종이 단량체 Aβ로부터 저 분자량 올리고머 내지 더 높은 분자량의 프로토피브릴의 범위를 포함하는 가용성 Aβ 어셈블리로, 그리고 마지막으로는 불용성 피브릴(플라크)로 진행되는 경향이 있도록 한다. 뇌 내에 침착되는 불용성 Aβ 피브릴의 양을 감소시키려는 의도를 갖는 다수의 면역요법이 개발된 바 있다. 그러나, 불용성 아밀로이드 플라크의 양 및 점진적 축적과 AD의 임상 경과 간의 단순 상관관계는 결정된 바 없다. 치료적 전략이 계속 불용성 아밀로이드 플라크의 제거에 집중하고 있지만, 치료법에 대한 추가의 접근법은 AD의 신경 변성 특징에 기여할 수 있는 독성 Aβ 응집물, 예컨대, 프로토피브릴을 감소시키는 것을 포함할 수 있다. (예를 들어, 문헌[Dodort, J.-C. and May, P., "Overview on rodent models of Alzheimer's disease." Curr. Protocols Neurosci. 2005; 9.22-1-9.22-6]; 문헌[Englund, H. et al., "Sensitive ELISA detection of amyloid-β protofibrils in biological samples." J. Neurochem. 2007; 103:334-45]; 및 문헌[Gotz, J. et al., "Transgenic animal models of Alzheimer's disease and related disorders: histopathology, behavior and therapy." Mol. Psychiat. 2004; 9:664-83]을 참조한다.)
아밀로이드가 뇌 내에 침착되었지만, 아밀로이드 침착에 의해 촉발될 것으로 여겨지는 하류 신경변성 캐스케이드는 여전히 그의 경과가 상대적으로 여전히 초기인 경우(즉, 제한된 뇌 조직 소실이 야기되었으며, 관련 임상적 결손이 최소로 존재하는 경우), BAN2401 및 다른 항-Aβ 프로토피브릴 항체를 사용하여 초기 질병 단계에 있는 대상체에서 AD 진행을 둔화시킬 수 있는 것이 가정되었다. 본원에 개시된 바와 같이, BAN2401을 예시적인 항-Aβ 프로토피브릴 항체로서 사용하여, 본 발명자들은 아밀로이드 양성 초기 AD 대상체에서 뇌 아밀로이드 수준을 감소시키는 신규한 방법을 발견하였다. 또한, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물을 투여하는 단계를 포함하여, 아밀로이드 양성 초기 AD 대상체에서 아밀로이드 음성으로 전환하는 신규한 방법이 본원에 개시된다. 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물을 투여하는 단계를 포함하여, 아밀로이드 양성 초기 AD 대상체에서 임상적 저하를 감소시키는 방법이 또한, 본원에 개시된다. 논의될 바와 같이, 대상체가 ApoE4 양성인 경우, 예측 가능하지 않게 유리한 결과가 달성되었다.
놀랍게도, 그리고 예측 가능하지 않게, 본 발명자들은 또한 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물을 투여하는 단계를 포함하는, 초기 AD 대상체에서의 AD의 발병의 예방 및/또는 지연 방법을 발견하였다. 일부 구현예에서, 대상체는 ApoE4 양성이다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
정의
하기는 본 출원에 사용되는 용어의 정의이다.
본원에 사용되는 바와 같이, 단수형 용어 부정관사 "a", "an" 및 정관사 "the"는 문맥에서 명백하게 다르게 나타내지 않는 한 복수의 언급대상을 포함한다.
본원에 사용되는 바와 같이, 어구 "및/또는"은 그렇게 연접된 요소 중 "어느 하나 또는 둘 모두", 즉, 일부 경우에는 함께 존재하고, 다른 경우에는 분리되어 존재하는 요소를 의미한다. 따라서, 비제한적인 예로서, "A 및/또는 B"는 개방된 언어, 예컨대, "포함하는"과 함께 사용되는 경우, 일부 구현예에서, 오직 A만(선택적으로 B 이외의 요소를 포함함); 다른 구현예에서, 오직 B만(선택적으로 A 이외의 요소를 포함함); 또 다른 구현예에서, A 및 B 둘 모두(선택적으로 다른 요소를 포함함) 등을 지칭할 수 있다.
본원에 사용되는 바와 같이, "적어도 하나"는 요소의 목록 내의 요소 중 하나 이상을 의미하지만, 요소의 목록 내에 구체적으로 열거된 각각의 및 모든 요소 중 적어도 하나를 반드시 포함하는 것은 아니며, 요소의 목록 내의 요소의 임의의 조합을 배제하는 것이 아니다. 이러한 정의는 또한 어구 "적어도 하나"가 지칭하는 요소의 목록 내에서 구체적으로 확인되는 요소 이외의 요소가, 구체적으로 확인된 그들 요소와 관련이 있는지 관련이 없는지와 관계없이, 선택적으로 존재할 수 있는 것을 허용한다. 따라서, 비제한적인 예로서, "A 및 B 중 적어도 하나"(또는 동등하게, "A 또는 B 중 적어도 하나" 또는, 동등하게 "A 및/또는 B 중 적어도 하나")는, 일 구현예에서, B가 존재하지 않고, 선택적으로 하나 초과의 A를 포함하는 적어도 하나의 A(및 선택적으로 B 이외의 요소를 포함함); 또 다른 구현예에서, A가 존재하지 않고, 선택적으로 하나 초과의 B를 포함하는 적어도 하나의 B(및 선택적으로 A 이외의 요소를 포함함); 또 다른 구현예에서, 선택적으로 하나 초과의 A를 포함하는 적어도 하나의 A, 및 선택적으로 하나 초과의 B를 포함하는 적어도 하나의 B(및 선택적으로 다른 요소를 포함함) 등을 지칭할 수 있다.
수가 열거되는 경우, 단독으로 또는 수 범위의 일부로서, 수치가 언급된 값의 10%의 분산만큼 언급된 값을 초과하여 그리고 그 미만으로 달라질 수 있음을 이해해야 한다.
값의 범위가 본원에 열거되는 경우, 상기 범위 내의 각각의 값 및 하위-범위를 포함하는 것으로 의도된다. 예를 들어, "2.5 ㎎/㎏ 내지 10 ㎎/㎏"은 예를 들어, 2.5 ㎎/㎏, 3 ㎎/㎏, 3.5 ㎎/㎏, 4 ㎎/㎏, 4.5 ㎎/㎏, 5 ㎎/㎏, 5.5 ㎎/㎏, 6 ㎎/㎏, 6.5 ㎎/㎏, 7 ㎎/㎏, 7.5 ㎎/㎏, 8 ㎎/㎏, 8.5 ㎎/㎏, 9 ㎎/㎏, 9.5 ㎎/㎏, 10 ㎎/㎏, 2.5 ㎎/㎏ 내지 3 ㎎/㎏, 2.5 ㎎/㎏ 내지 4.5 ㎎/㎏, 3 ㎎/㎏ 내지 4.5 ㎎/㎏, 4.5 ㎎/㎏ 내지 8 ㎎/㎏, 2.5 ㎎/㎏ 내지 9 ㎎/㎏ 등을 포함하는 것으로 의도된다.
본원에 사용되는 바와 같이, "초기 AD" 또는 "초기 알츠하이머병"은 AD로 인한 경증 인지 장애 - 중등의 가능성으로부터 경증 알츠하이머병 치매까지의 연속적인 AD 중증도이다. 초기 AD를 갖는 대상체는 본원에 정의된 바와 같은 경증 알츠하이머병 치매를 갖는 대상체 및 본원에 정의된 바와 같은 AD로 인한 MCI - 중등의 가능성을 갖는 대상체를 포함한다. 일부 구현예에서, 초기 AD를 갖는 대상체는 22 내지 30의 MMSE 및 CDR 전체 범위 0.5 내지 1.0을 갖는다.
본원에 사용되는 바와 같이, "경증 알츠하이머병 치매"를 갖는 대상체는 문헌[McKhann, G.M. et al., "The diagnosis of dementia due to Alzheimer's disease: Recommendations from the National Institute on Aging - Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease." Alzheimer Dement. 2011; 7:263-9]에서의 가능한 알츠하이머병 치매에 대한 NIA-AA 핵심 임상 기준을 충족하는 대상체이다. 또한, 선별 및 기준선에서, 0.5 내지 1.0의 CDR 점수 및 0.5 이상의 메모리 박스(Memory Box) 점수를 갖는 대상체가 본원에 포함된다.
본원에 사용되는 바와 같이, "AD로 인한 MCI - 중등의 가능성"을 갖는 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성에 대한 NIA-AA 핵심 임상 기준에 따라 그와 같이 확인된 대상체이다(상기 문헌[McKhann] 참조). 예를 들어, 본원에 정의된 ADCOMS 복합 임상 점수에 의해 측정되는 바와 같은 인지 및 기능 저하에서 경증 알츠하이머병 치매 대상체와 더욱 유사하고, 그들을 덜 이질적이게 만드는 뇌 아밀로이드 병적이상의 증거를 갖는, 증상이 있지만 치매가 아닌 AD 대상체. 또한, 선별 및 기준선에서 0.5의 CDR 점수 및 0.5 이상의 메모리 박스 점수를 갖는 대상체가 포함된다. 추가로, 정보 제공자에 의해 제공되는 선별 이전의 지난 1년에 걸친 점진적인 발병과 느린 진행과 함께 주관적인 기억력 저하의 이력을 보고한 대상체가 또한 본원에 포함된다.
본원에 사용되는 바와 같이, "MMSE"는 30점 척도를 갖는 AD 임상 시험에서 선별 목적을 위해 흔히 사용될 뿐 아니라, 종종 종적으로 측정되는 인지 도구인 간이-정신 상태 검사(Mini-Mental State Examination)를 지칭하며, 점수가 높을수록 더 적은 장애를 나타내며, 점수가 낮을수록 더 큰 장애를 나타낸다. 본원에 사용되는 바와 같이, 시간과 장소에 대한 지남력(orientation), 기억등록(registration), 회상(recall), 주의집중(attention), 언어(language) 및 그리기(drawing)를 측정하는 7가지 항목을 평가하였다. (문헌[Folstein, M.F. et al., "Mini-mental state. A practical method for grading cognitive state of patients for clinician." J. Psychiatr. Res. 1975;12:189-98].)
본원에 사용되는 바와 같이, "ADAS-cog"는 알츠하이머병 평가 척도-인지력을 지칭한다. ADAS-cog는 기억(단어 회상, 지연된 단어 회상 및 단어 재인), 추론(reasoning)(명령 수행), 언어(이름대기(naming), 이해), 지남력, 관념 실행(편지를 봉투에 넣기) 및 구성 실행(기하학적 모양 모방)을 평가하는 구조화된 척도를 갖는 알츠하이머병 시험에서 널리 사용되는 인지력 척도이다. (문헌[Rosen, W.G. et al., "A new rating scale for Alzheimer's disease." Am. J. Psychiatry 1984; 141:1356-64].) 음성 언어, 언어 이해, 단어 찾기 어려움, 시험 명령 기억 능력, 미로 및 숫자 지우기의 등급을 또한 수득하였다. 본원에서 사용되는 변형된 버전은 0 내지 90점으로 점수화되며, 점수 0은 장애가 없음을 나타내고, 점수 90은 최대 장애를 나타낸다.
본원에 사용되는 바와 같이, "CDR-SB"는 임상적 치매 등급 - 박스의 합계를 지칭한다. CDR은 기억력, 지남력, 판단력 및 문제해결력, 사회 활동, 집안생활 및 취미, 및 개인 관리를 포함하는 6가지 범주의 기능의 각각에 대한 수행의 5가지 장애 정도를 설명하는 임상적 척도이다. (문헌[Berg, L. et al., "Mild senile dementia of Alzheimer type: 2. Longitudinal assessment." Ann. Neurol. 1988; 23:477-84].) 6가지 범주의 기능의 각각에 대하여 수득되는 장애 정도의 등급을 1개의 치매 CDR 점수의 전체 등급으로 종합한다(0 내지 3 범위). 박스 점수의 합은 변화의 추가의 척도를 제공하며, 각각의 범주는 3점의 가능한 최대 점수를 갖고, 총 점수는 범주 점수의 합이며, 이는 0 내지 18의 가능한 총 점수를 제공하고, 점수가 더 클수록 더 큰 장애를 나타낸다. 전체 점수는 치매의 중증도의 임상적 척도로서 사용될 수 있다.
본원에 사용되는 바와 같이, "ADCOMS"는 실시예 및 문헌[Wang, J. et al., "ADCOMS: a composite clinical outcome for prodromal Alzheimer's disease trials." J. Neurol. Neurosurg. Psychiatry. 2016; 87:993-999]에 논의된 바와 같이, 4가지 ADAS-Cog 항목(지연된 단어 회상, 지남력, 단어 재인 및 단어 찾기 어려움), 2가지 MMSE 항목(시간에 대한 지남력 및 그리기) 및 6가지 모든 CDR-SB 항목(개인 관리, 사회 활동, 집안생활 및 취미, 기억력, 지남력 및 판단력 및 문제해결력)의 분석에 기초한 복합 임상 점수인 알츠하이머병 복합 점수를 지칭한다. ADCOMS는 초기 AD 단계 동안의 질병 진행, 즉, 전구 증상 및 경증 AD에 특히 민감하도록 개발되었다.
본원에 사용되는 바와 같이, "ApoE4-양성" 대상체 및 "ApoE4 보유자"는 아포지질단백질 유전자의 ε4 변이체를 보유하는 대상체를 지칭한다. ε4 변이체는 아포지질단백질 유전자의 몇가지 주요 대립형질 중 하나이다. 유전자는 일반적으로 지방의 대사를 담당한다. 아포지질단백질 ε4의 보유자가 비-보유자와 비교하는 경우 유의미하게 더 큰 아밀로이드 보유율을 보이는 것이 밝혀진 바 있다. (문헌[Drzezga, A. et al, "Effect of APOE genotype on amyloid plaque load and gray matter volume in Alzheimer disease." Neurology. 2009; 72:1487-94].) 일부 구현예에서, 대상체는 아포지질단백질 E ε4 유전자 대립형질의 이형접합성 보유자이다. 일부 구현예에서, 대상체는 아포지질단백질 E ε4 유전자 대립형질의 동형접합성 보유자이다.
본원에 사용되는 바와 같이, 초기 AD 대상체가 "아밀로이드-양성"인지 "아밀로이드-음성"인지는 뇌 내로의 아밀로이드 영상화제 흡수의 종적 PET 평가 및/또는 마커, 예컨대, Aβ1-42의 평가를 사용한 아밀로이드 병적이상의 존재의 CSF 평가(가용성 CSF 바이오마커 분석)에 의해 나타나는 바와 같이 환자가 양성 아밀로이드 부하(load)를 갖는지 그렇지 않은지에 기초하여 결정된다. 일부 구현예에서, PET 스캔의 정성적 시각적 판독을 사용하여, 대상체를 PET 영상 패턴에 기초하여 "정상" 또는 "비정상" 흡수를 갖는 것으로서 범주화함으로써 아밀로이드 양성 및 아밀로이드 음성을 결정할 것이다. 판독자가 비정상 또는 정상 흡수 패턴을 갖는 뇌 PET 영상을 인식하도록 훈련받고 인증을 받을 것이거나, 아밀로이드의 검출을 반-정량적 또는 정량적 접근법을 통해 행한다.
본원에 사용되는 바와 같이, 용어 "치료하다"는 치료될 기저 질환의 또는 그와 관련된 생리학적 증상 중 하나 이상의 근절 또는 개선을 의미하는 치료적 이익을 포함하지만 이에 제한되지 않는 유리한 또는 원하는 결과를 수득하는 것을 지칭한다.
본원에 사용되는 바와 같이, 용어 "예방하다"는 예방적 이익을 포함하지만 이에 제한되지 않는 유리한 또는 원하는 결과를 수득하는 것을 지칭한다. 예방적 이익을 위하여, 조성물은 알츠하이머병을 갖는다는 임상적 진단이 이루어진 바 없더라도, 알츠하이머병의 발생 위험이 있는 대상체에게, 하나 이상의 전임상 증상을 갖지만 알츠하이머병의 임상 증상을 갖지 않는 대상체에게 또는 알츠하이머병의 생리학적 증상 중 하나 이상을 보고한 대상체에게 투여될 수 있다. 본원에 사용되는 바와 같이, "예방"은 치료될 기저 질환의 또는 그와 관련된 생리학적 증상 중 하나 이상의 근절 또는 개선을 의미하는 치료적 이익을 추가로 포함할 수 있다.
알츠하이머병의 발생을 암시할 수 있는 예비(pre)-AD 바이오마커 수준은 뇌 아밀로이드 수준, Aβ1-42의 뇌척수액 수준, 전체 tau의 뇌척수액 수준, 뉴로그라닌의 뇌척수액 수준 및 신경필라멘트 경쇄의 뇌척수액 수준을 포함하지만, 이에 제한되지 않는다. 예를 들어, 1.4 내지 1.9의 아밀로이드 기준선 PET 표준 섭취 계수비(SUVr 값)를 가졌던, BACE 저해제인, 엘렌베세스타트(elenbecestat)(E2609)로 처리된 대상체가 치료 동안 인지 저하의 가장 큰 둔화를 나타내었음이 밝혀진 바 있다. 문헌[Lynch, S. Y. et al. "Elenbecestat, a BACE inhibitor: results from a Phase 2 study in subjects with mild cognitive impairment and mild-to-moderate dementia due to Alzheimer's disease." Poster P4-389, Alzheimer's Association International Conference, July 22-26, 2018, Chicago, IL, USA]을 참조한다. 유사하게, 1.2 미만의 기준선 플로베타피르(florbetapir) 아밀로이드 PET SUVr 수준을 갖는 대상체가 검출 가능하기에 충분한 인지 저하를 나타내지 않지만, 1.6 초과의 SUVr 수준을 갖는 대상체가 아밀로이드 수준이 포화 수준에 도달하고 치료가 인지 척도의 변화를 초래하지 않는 고원 효과와 상호 관련이 있는 것으로 보이는 것이 밝혀진 바 있다. 문헌[Dhadda, S. et al., "Baseline florbetapir amyloid PET standard update value ratio (SUVr) can predict clinical progression in prodromal Alzheimer's disease (pAD)." Poster P4-291, Alzheimer's Association International Conference, July 22-26, 2018, Chicago, IL, USA]을 참조한다.
본원에 사용되는 바와 같이, 용어 "심각한 유해 사례" 또는 "SAE"는 본원에 기재된 조성물의 투여 후에 관찰되는 (1) 사망을 초래하고/하거나; (2) 생명을 위협하고/하거나; (3) 입원환자 입원 또는 기존 입원의 연장을 필요로 하고/하거나; (4) 지속적인 또는 상당한 장애/불능을 초래하고/하거나; (5) 선천적 이상/선천적 결손인 사례를 의미한다.
심각한 유해 사례의 중증도는 해당 분야에 사용되는 일정한 척도에 기초하여 평가될 수 있다. 예를 들어, 대상체의 심각한 유해 사례의 중증도는 국립 암 연구소의 "유해 사례에 대한 공통 용어 기준(Common Terminology Criteria for Adverse Event)" 또는 "CTCAE"에 따라 평가될 수 있다. 다양한 CTCAE 유해 사례 등급에 대한 설명은 하기에 제시되어 있다:
- 등급 1: 경증; 무증상 또는 경증 증상; 단지 임상적 또는 진단적 관찰; 개입이 지시되지 않음.
- 등급 2: 중등도; 최소, 국소 또는 비침습적 개입이 지시됨; 연령-적절한 일상 생활의 도구 활동을 제한함.
- 등급 3: 중증이거나 의학적으로 상당하지만, 즉시 생명을 위협하지 않음; 입원 또는 입원 연장이 지시됨; 장애 야기; 일상 생활의 자기 관리 활동을 제한함.
- 등급 4: 생명을 위협하는 결과; 응급 개입이 지시됨.
- 등급 5: 유해 사례와 관련된 사망.
본원에 사용되는 바와 같이, 용어 "엘렌베세스타트"는 화합물 N-[3-((4aS,5R,7aS)-2-아미노-5-메틸-4a,5,7,7a-테트라하이드로-4H-플루오로[3,4-d][1,3]티아진-7a-일)-4-플루오로페닐]-5-디플루오로메틸피라진-2-카복사미드 또는 그의 약제학적으로 허용 가능한 염을 지칭한다. 엘렌베세스타트는 베타-부위 아밀로이드 전구체 단백질 절단 효소 1(BACE1) 저해제이며(예를 들어, 미국 특허 제8,158,620호 및 제8,426,584호 참조), E2609로도 알려져 있다.
적어도 하나의 항-Aβ 프로토피브릴 항체
본원에 사용되는 바와 같이, 적어도 하나의 항-Aβ 프로토피브릴 항체는 예를 들어, Aβ 단량체에 비하여 큰 가용성 아밀로이드 β(Aβ) 올리고머 및/또는 응집체(프로토피브릴로도 지칭됨)에 우선적으로 결합하는 모노클로널 항체(mAb)로부터 선택된다. 예를 들어, 도 61을 참조한다. 본원에 사용되는 바와 같이, 용어 "우선적으로 결합하다"는 다른 형태의 Aβ 펩티드(예를 들어, 각각 피브릴 및 단량체)에 결합하는 그의 효력보다 적어도 10배, 적어도 20배, 적어도 30배, 적어도 40배, 적어도 50배, 적어도 60배, 적어도 70배, 적어도 80배, 적어도 90배, 적어도 100배, 적어도 125배, 적어도 150배, 적어도 175배, 적어도 200배, 적어도 225배, 적어도 250배, 적어도 275배, 적어도 300배, 적어도 325배, 적어도 350배, 적어도 375배, 적어도 400배, 적어도 425배, 적어도 450배, 적어도 475배, 적어도 500배, 적어도 550배, 적어도 600배, 적어도 650배, 적어도 700배, 적어도 750배, 적어도 800배, 적어도 850배, 적어도 900배, 적어도 950배, 적어도 1000배 또는 적어도 1050배 더 큰 효력으로 Aβ 올리고머 및/또는 프로토피브릴에 결합하는 항체를 지칭한다. 다양한 형태의 Aβ에 결합하는 효력은 해당 분야에 널리 알려져 있는 방법, 예를 들어, ELISA 검정 및 표면 플라스몬 공명(SPR)에 의해 결정될 수 있다.
일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체의 선택성은 ELISA 검정에 의해 측정된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체의 우선적인 결합은 표면 플라스몬 공명에 의해 측정된다.
일부 구현예에서, BAN2401의 우선적인 결합은 ELISA 검정에 의해 측정된다. 일부 구현예에서, BAN2401의 선택성은 표면 플라스몬 공명에 의해 측정된다.
예를 들어, BAN2401이 Aβ 단량체보다 200 내지 1000배 더 큰 효력으로 Aβ 프로토피브릴에 결합하며, BAN2401이 Aβ 피브릴보다 40배 초과의 효력으로 Aβ 프로토피브릴에 결합하는 것이 밝혀진 바 있다. 국제 특허 출원 공개 제WO 2007/108756 A1호, 13페이지 및 도 2를 참조하며; 또한, 문헌[Lord, A. et al., "An amyloid-β protofibril-selective antibody prevents amyloid formation in a mouse model of Alzheimer's disease." 2009; 26: 425-34]; 및 문헌[Swanson, C. J. et al. "Pharmacology of BAN2401: A Monoclonal Antibody Selective for Aβ Protofibrils." Poster P4-286, Alzheimer's Association International Conference, July 13-18, 2013]을 참조한다. 이 효력의 차이를 샌드위치 ELISA 검정에 의해 결정하였으며, 여기서, BAN2401을 웰 플레이트의 웰 상에 코팅하고, 상이한 Aβ 형태를 증가하는 농도로 웰에 첨가하였다. 상기 문헌을 참조한다. 비오티닐화된 mAb158 및 HRP-표지된 스트렙트아비딘을 첨가함으로써 결합된 Aβ 형태의 측정을 이루었으며, 발색을 제조처의 절차에 따라 측정하였다. 유사하게, BAN2401이 Aβ 단량체 및 Aβ 펩티드의 N-말단 부분에 대하여 약한 친화성을 가지며, Aβ의 C-말단 단편으로의 결합이 관찰되지 않았음이 밝혀진 바 있다. 상기 문헌을 참조한다. 경쟁적 ELISA 검정을 사용함으로써 친화성을 결정하였으며, 여기서, ELISA 플레이트를 인간 Aβ 프로토피브릴로 코팅하였으며, 이후에 BAN2401을 증가하는 양의 상이한 Aβ 형태와 인큐베이션시켰다. 상기 문헌을 참조한다. 인큐베이션 믹스(mix)를 마이크로타이터(microtiter) 플레이트 웰에 첨가하고, 유리 항체가 웰 내의 고정화된 프로토피브릴에 결합되게 하였으며, 결합된 BAN2401 항체를 이차 항체에 의해 측정하였다. 상기 문헌을 참조한다.
일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 SEQ ID NO: 5(HCDR1), SEQ ID NO: 6(HCDR2) 및 SEQ ID NO: 7(HCDR3)의 아미노산 서열을 포함하는 3개의 중쇄 상보성 결정 영역(HCDR1, HCDR2 및 HCDR3); 및 SEQ ID NO: 8(LCDR1), SEQ ID NO: 9(LCDR2) 및 SEQ ID NO: 10(LCDR3)의 아미노산 서열을 포함하는 3개의 경쇄 상보성 결정 영역(LCDR1, LCDR2 및 LCDR3)을 포함한다.
각각의 도메인에 대한 아미노산의 지정은 일반적으로 문헌[SEQUENCES OF PROTEINS OF IMMUNOLOGICAL INTEREST (Kabat et al., 5th ed., U.S. Department of Health and Human Services, NIH Publication No. 91-3242, 1991, 이후에 "카바트 보고(Kabat report)"로 지칭됨)]의 정의에 따른다.
일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 인간 불변 영역을 포함한다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체의 인간 불변 영역은 카바트 보고에 개시된 바와 같은 IgG1, IgG2, IgG3, IgG4, IgM, IgA, IgE 및 그의 임의의 대립형질 변이로부터 선택되는 중쇄 불변 영역을 포함한다. 이러한 서열 중 임의의 하나 이상은 본 개시에서 사용될 수 있다. 일부 구현예에서, 중쇄 불변 영역은 IgG1 및 그의 대립형질 변이로부터 선택된다. 인간 IgG1 불변 영역의 아미노산 서열은 해당 분야에 알려져 있으며, SEQ ID NO: 3에 제시되어 있다.
일부 구현예에서, 적어도 하나의 항-Aβ 항체의 인간 불변 영역은 카바트 보고에 논의된 바와 같은 κ-λ-쇄 불변 영역 및 그의 임의의 대립형질 변이로부터 선택되는 경쇄 불변 영역을 포함한다. 이러한 서열 중 임의의 하나 이상은 본 개시에서 사용될 수 있다. 일부 구현예에서, 경쇄 불변 영역은 κ 및 그의 대립형질 변이로부터 선택된다. 인간 κ 쇄 불변 영역의 아미노산 서열은 해당 분야에 알려져 있으며, SEQ ID NO: 4에 제시되어 있다.
일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 인간 중쇄 및 경쇄 가변 영역 프레임워크를 포함한다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 SEQ ID NO: 1의 아미노산 서열을 포함하는 중쇄 가변 영역 및 SEQ ID NO: 2의 아미노산 서열을 포함하는 경쇄 가변 영역을 포함한다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 인간 IgG1 중쇄 불변 영역 및 인간 Ig 카파 경쇄 불변 영역을 포함한다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 SEQ ID NO: 3의 아미노산 서열을 포함하는 중쇄 불변 영역 및 SEQ ID NO: 4의 아미노산 서열을 포함하는 경쇄 불변 영역을 포함한다.
일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다. BAN2401은 mAb158의 인간화된 IgG1 모노클로널 버전이며, 이는 프로토피브릴을 표적화하도록 야기된 쥣과 모노클로널 항체이며, 제WO 2007/108756호 및 문헌[Journal of Alzheimer's Disease 43: 575-588 (2015)]에 개시되어 있다. BAN2401은 적어도 하나의 항-Aβ 프로토피브릴 항체이며, 이는 Aβ 단량체에 대한 낮은 친화성을 나타내는 한편, 가용성 Aβ 응집체 종에 대하여 높은 선택성으로 결합한다. 예를 들어, BAN2401은 각각 Aβ 단량체 또는 Aβ-불용성 피브릴보다 가용성 Aβ 프로토피브릴에 대하여 대략 1000배 및 5배 내지 10배 더 높은 선택성을 나타내는 것으로 보고된 바 있다.
BAN2401은 (a) SEQ ID NO:1의 아미노산 서열을 포함하는 중쇄 가변 도메인 및 (b) SEQ ID NO:2의 아미노산 서열을 포함하는 경쇄 가변 도메인을 포함한다. BAN2401의 전장 서열은 SEQ ID NO: 11에 제시되어 있으며, 제WO 2007/108756호 및 문헌[Journal of Alzheimer's Disease 43:575-588 (2015)]에 기재되어 있다.
본 개시에서 적어도 하나의 항-Aβ 프로토피브릴 항체로서 사용하기 위하여 적합한 항체의 다른 비제한적인 예는 제WO 2002/003911호, 제WO 2005/123775호, 제WO 2007/108756호, 제WO 2011/001366호, 제WO 2011/104696호 및 제WO 2016/005466호에 개시된 것들을 포함한다.
치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체
본 개시의 방법은 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물을 대상체에게 투여하는 단계를 포함한다. 본원에 사용되는 바와 같이, 용어 "치료적 유효량"은 원하는 치료적 효과를 야기하기에 충분한 화합물 또는 약제학적 조성물의 양을 지칭한다.
당업자는 대상체에게 투여되는 적어도 하나의 항-Aβ 프로토피브릴 항체의 치료적 유효량이 약력학적 특징, 투여 경로, 치료 빈도 및 치료할 대상체의 건강, 연령 및 체중을 포함하는 다수의 인자에 좌우될 수 있음을 이해할 것이며, 본원에 개시된 정보를 사용하여, 각각의 대상체에 대한 적절한 양을 결정할 수 있을 것이다.
일부 구현예에서, 치료적 유효량은 효능을 개선시키고/시키거나 효능을 유지하고/하거나 안전성 및 내약성 중 적어도 하나를 개선시키기 위해 선택되는 용량이다. 일부 구현예에서, 치료적 유효량은 적어도 하나의 부작용을 낮추고, 동시에 효능을 개선시키고/시키거나 효능을 유지하도록 선택된다.
일부 구현예에서, 대상체의 체중에 비하여 0.5 ㎎/㎏ 내지 45 ㎎/㎏, 0.5 ㎎/㎏ 내지 40 ㎎/㎏, 0.5 ㎎/㎏ 내지 35 ㎎/㎏, 0.5 ㎎/㎏ 내지 30 ㎎/㎏, 0.5 ㎎/㎏ 내지 25 ㎎/㎏, 0.5 ㎎/㎏ 내지 20 ㎎/㎏, 0.5 ㎎/㎏ 내지 15 ㎎/㎏, 0.5 ㎎/㎏ 내지 10 ㎎/㎏, 0.5 ㎎/㎏ 내지 5 ㎎/㎏ 또는 0.5 ㎎/㎏ 내지 2.5 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체가 대상체에게 투여된다.
일부 구현예에서, 대상체의 체중에 비하여 2.5 ㎎/㎏ 내지 45 ㎎/㎏, 2.5 ㎎/㎏ 내지 40 ㎎/㎏, 2.5 ㎎/㎏ 내지 35 ㎎/㎏, 2.5 ㎎/㎏ 내지 30 ㎎/㎏, 2.5 ㎎/㎏ 내지 25 ㎎/㎏, 2.5 ㎎/㎏ 내지 20 ㎎/㎏, 2.5 ㎎/㎏ 내지 15 ㎎/㎏, 2.5 ㎎/㎏ 내지 10 ㎎/㎏ 또는 2.5 ㎎/㎏ 내지 5 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체가 대상체에게 투여된다.
일부 구현예에서, 대상체의 체중에 비하여 5 ㎎/㎏ 내지 45 ㎎/㎏, 5 ㎎/㎏ 내지 40 ㎎/㎏, 5 ㎎/㎏ 내지 35 ㎎/㎏, 5 ㎎/㎏ 내지 30 ㎎/㎏, 5 ㎎/㎏ 내지 25 ㎎/㎏, 5 ㎎/㎏ 내지 20 ㎎/㎏, 5 ㎎/㎏ 내지 15 ㎎/㎏ 또는 5 ㎎/㎏ 내지 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체가 대상체에게 투여된다.
일부 구현예에서, 대상체의 체중에 비하여 7.5 ㎎/㎏ 내지 45 ㎎/㎏, 7.5 ㎎/㎏ 내지 40 ㎎/㎏, 7.5 ㎎/㎏ 내지 35 ㎎/㎏, 7.5 ㎎/㎏ 내지 30 ㎎/㎏, 7.5 ㎎/㎏ 내지 25 ㎎/㎏, 7.5 ㎎/㎏ 내지 20 ㎎/㎏, 7.5 ㎎/㎏ 내지 15 ㎎/㎏ 또는 7.5 ㎎/㎏ 내지 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체가 대상체에게 투여된다.
일부 구현예에서, 대상체의 체중에 비하여 0.5 ㎎/㎏, 1 ㎎/㎏, 2 ㎎/㎏, 3 ㎎/㎏, 4 ㎎/㎏, 5 ㎎/㎏, 6 ㎎/㎏, 7 ㎎/㎏, 8 ㎎/㎏, 9 ㎎/㎏, 10 ㎎/㎏, 11 ㎎/㎏, 12 ㎎/㎏, 13 ㎎/㎏, 14 ㎎/㎏, 15 ㎎/㎏, 16 ㎎/㎏, 17 ㎎/㎏, 18 ㎎/㎏, 19 ㎎/㎏, 20 ㎎/㎏ 이상의 적어도 하나의 항-Aβ 프로토피브릴 항체가 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 20 ㎎/㎏, 19 ㎎/㎏, 18 ㎎/㎏, 17 ㎎/㎏, 16 ㎎/㎏, 15 ㎎/㎏, 14 ㎎/㎏, 13 ㎎/㎏, 12 ㎎/㎏, 11 ㎎/㎏, 10 ㎎/㎏, 9 ㎎/㎏, 8 ㎎/㎏, 7 ㎎/㎏, 6 ㎎/㎏, 5 ㎎/㎏, 4 ㎎/㎏, 3 ㎎/㎏, 2 ㎎/㎏, 1 ㎎/㎏ 또는 0.5 ㎎/㎏ 이하의 적어도 하나의 항-Aβ 프로토피브릴 항체가 대상체에게 투여된다.
일부 구현예에서, 대상체의 체중에 비하여 0.5 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체가 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 1 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체가 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 2 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체가 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 2.5 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체가 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 3 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체가 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 4 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체가 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 5 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체가 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 6 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체가 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 7 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체가 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 7.5 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체가 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 8 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체가 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 9 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체가 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체가 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 11 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체가 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 12 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체가 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 12.5 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체가 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 13 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체가 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 14 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체가 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 15 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체가 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 16, 17, 18, 19 또는 20 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체가 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 21, 22, 23, 24 또는 25 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체가 대상체에게 투여된다.
일부 구현예에서, 대상체의 체중에 비하여 27.5 ㎎/㎏, 30 ㎎/㎏, 32.5 ㎎/㎏, 35 ㎎/㎏, 37.5 ㎎/㎏, 40 ㎎/㎏, 42.5 ㎎/㎏, 45 ㎎/㎏, 47.5 ㎎/㎏ 또는 50 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체가 대상체에게 투여된다.
언급된 바와 같이, 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다. 따라서, 일부 구현예에서, 대상체의 체중에 비하여 0.5 ㎎/㎏ 내지 45 ㎎/㎏, 0.5 ㎎/㎏ 내지 40 ㎎/㎏, 0.5 ㎎/㎏ 내지 35 ㎎/㎏, 0.5 ㎎/㎏ 내지 30 ㎎/㎏, 0.5 ㎎/㎏ 내지 25 ㎎/㎏, 0.5 ㎎/㎏ 내지 20 ㎎/㎏, 0.5 ㎎/㎏ 내지 15 ㎎/㎏, 0.5 ㎎/㎏ 내지 10 ㎎/㎏, 0.5 ㎎/㎏ 내지 5 ㎎/㎏ 또는 0.5 ㎎/㎏ 내지 2.5 ㎎/㎏의 BAN2401이 대상체에게 투여된다.
일부 구현예에서, 대상체의 체중에 비하여 2.5 ㎎/㎏ 내지 45 ㎎/㎏, 2.5 ㎎/㎏ 내지 40 ㎎/㎏, 2.5 ㎎/㎏ 내지 35 ㎎/㎏, 2.5 ㎎/㎏ 내지 30 ㎎/㎏, 2.5 ㎎/㎏ 내지 25 ㎎/㎏, 2.5 ㎎/㎏ 내지 20 ㎎/㎏, 2.5 ㎎/㎏ 내지 15 ㎎/㎏, 2.5 ㎎/㎏ 내지 10 ㎎/㎏ 또는 2.5 ㎎/㎏ 내지 5 ㎎/㎏의 BAN2401이 대상체에게 투여된다.
일부 구현예에서, 대상체의 체중에 비하여 5 ㎎/㎏ 내지 45 ㎎/㎏, 5 ㎎/㎏ 내지 40 ㎎/㎏, 5 ㎎/㎏ 내지 35 ㎎/㎏, 5 ㎎/㎏ 내지 30 ㎎/㎏, 5 ㎎/㎏ 내지 25 ㎎/㎏, 5 ㎎/㎏ 내지 20 ㎎/㎏, 5 ㎎/㎏ 내지 15 ㎎/㎏ 또는 5 ㎎/㎏ 내지 10 ㎎/㎏의 BAN2401이 대상체에게 투여된다.
일부 구현예에서, 대상체의 체중에 비하여 7.5 ㎎/㎏ 내지 45 ㎎/㎏, 7.5 ㎎/㎏ 내지 40 ㎎/㎏, 7.5 ㎎/㎏ 내지 35 ㎎/㎏, 7.5 ㎎/㎏ 내지 30 ㎎/㎏, 7.5 ㎎/㎏ 내지 25 ㎎/㎏, 7.5 ㎎/㎏ 내지 20 ㎎/㎏, 7.5 ㎎/㎏ 내지 15 ㎎/㎏ 또는 7.5 ㎎/㎏ 내지 10 ㎎/㎏의 BAN2401이 대상체에게 투여된다.
일부 구현예에서, 대상체의 체중에 비하여 0.5 ㎎/㎏, 1 ㎎/㎏, 2 ㎎/㎏, 3 ㎎/㎏, 4 ㎎/㎏, 5 ㎎/㎏, 6 ㎎/㎏, 7 ㎎/㎏, 8 ㎎/㎏, 9 ㎎/㎏, 10 ㎎/㎏, 11 ㎎/㎏, 12 ㎎/㎏, 13 ㎎/㎏, 14 ㎎/㎏, 15 ㎎/㎏, 16 ㎎/㎏, 17 ㎎/㎏, 18 ㎎/㎏, 19 ㎎/㎏, 20 ㎎/㎏ 이상의 BAN2401이 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 20 ㎎/㎏, 19 ㎎/㎏, 18 ㎎/㎏, 17 ㎎/㎏, 16 ㎎/㎏, 15 ㎎/㎏, 14 ㎎/㎏, 13 ㎎/㎏, 12 ㎎/㎏, 11 ㎎/㎏, 10 ㎎/㎏, 9 ㎎/㎏, 8 ㎎/㎏, 7 ㎎/㎏, 6 ㎎/㎏, 5 ㎎/㎏, 4 ㎎/㎏, 3 ㎎/㎏, 2 ㎎/㎏, 1 ㎎/㎏ 또는 0.5 ㎎/㎏ 이하의 BAN2401이 대상체에게 투여된다.
일부 구현예에서, 대상체의 체중에 비하여 0.5 ㎎/㎏의 BAN2401이 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 1 ㎎/㎏의 BAN2401이 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 2 ㎎/㎏의 BAN2401이 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 2.5 ㎎/㎏의 BAN2401이 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 3 ㎎/㎏의 BAN2401이 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 4 ㎎/㎏의 BAN2401이 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 5 ㎎/㎏의 BAN2401이 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 6 ㎎/㎏의 BAN2401이 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 7 ㎎/㎏의 BAN2401이 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 7.5 ㎎/㎏의 BAN2401이 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 8 ㎎/㎏의 BAN2401이 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 9 ㎎/㎏의 BAN2401이 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 10 ㎎/㎏의 BAN2401이 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 11 ㎎/㎏의 BAN2401이 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 12 ㎎/㎏의 BAN2401이 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 12.5 ㎎/㎏의 BAN2401이 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 13 ㎎/㎏의 BAN2401이 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 14 ㎎/㎏의 BAN2401이 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 15 ㎎/㎏의 BAN2401이 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 16, 17, 18, 19 또는 20 ㎎/㎏의 BAN2401이 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 21, 22, 23, 24 또는 25 ㎎/㎏의 BAN2401이 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 27.5 ㎎/㎏, 30 ㎎/㎏, 32.5 ㎎/㎏, 35 ㎎/㎏, 37.5 ㎎/㎏, 40 ㎎/㎏, 42.5 ㎎/㎏, 45 ㎎/㎏, 47.5 ㎎/㎏ 또는 50 ㎎/㎏의 BAN2401이 대상체에게 투여된다.
일부 구현예에서, 대상체의 체중에 비하여 2.5 ㎎/㎏ 내지 10 ㎎/㎏의 BAN2401이 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 5 ㎎/㎏ 내지 10 ㎎/㎏의 BAN2401이 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 2.5 ㎎/㎏의 BAN2401이 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 5 ㎎/㎏의 BAN2401이 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 7.5 ㎎/㎏의 BAN2401이 대상체에게 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 10 ㎎/㎏의 BAN2401이 대상체에게 투여된다.
적어도 하나의 항-Aβ 프로토피브릴 항체에 대한 투여 섭생법
본 개시의 방법은 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물을 대상체에게 투여하는 단계를 포함한다. 당업자는 치료적 유효량의 상기 개시된 적어도 하나의 항-Aβ 프로토피브릴 항체 중 임의의 것이 하나 이상의 투여 섭생법에 따라 1회 이상 투여될 수 있음을 이해할 것이다. 당업자는 약력학적 특징, 투여 경로, 용량, 치료할 대상체의 건강, 연령 및 체중을 포함하는 수많은 인자에 따라, 그리고 본원에 개시된 정보를 사용하여, 각각의 대상체에 적절한 투여 섭생법(들)을 결정할 수 있을 것이다.
일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물은 매일, 격일로, 3일마다, 매주 1회, 2주마다 1회("2주마다"), 4주마다 1회("4주 간격"), 매달 1회, 6주마다 1회, 8주마다 1회, 2개월마다 1회, 10주마다 1회, 12주마다 1회, 3개월마다 1회, 14주마다 1회, 16주마다 1회, 4개월마다 1회, 18주마다 1회, 20주마다 1회, 5개월마다 1회, 22주마다 1회, 24주마다 1회, 6개월마다 1회, 8개월마다 1회, 7개월마다 1회, 8개월마다 1회, 9개월마다 1회, 10개월마다 1회, 11개월마다 1회, 12개월마다 1회, 13개월마다 1회, 13개월마다 1회, 14개월마다 1회, 15개월마다 1회, 16개월마다 1회, 17개월마다 1회 또는 18개월마다 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물은 매일, 격일로, 3일마다, 매주 1회, 2주마다 1회("2주마다"), 4주마다 1회("4주 간격") 또는 매달 1회 투여된다. 일부 구현예에서, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물은 2주마다 1회 또는 4주마다 1회 투여된다. 일부 구현예에서, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물은 2주마다 1회 투여된다. 일부 구현예에서, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물은 4주마다 1회 투여된다.
일부 구현예에서, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물은 매주 1회 투여된다. 일부 구현예에서, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물은 2주마다 1회 투여된다. 일부 구현예에서, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물은 3주마다 1회 투여된다. 일부 구현예에서, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물은 4주마다 1회 투여된다. 일부 구현예에서, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물은 매달 1회 투여된다.
일부 구현예에서, 치료적 유효량의 BAN2401을 포함하는 조성물은 매주 1회 투여된다. 일부 구현예에서, 치료적 유효량의 BAN2401을 포함하는 조성물은 2주마다 1회 투여된다. 일부 구현예에서, 치료적 유효량의 BAN2401을 포함하는 조성물은 3주마다 1회 투여된다. 일부 구현예에서, 치료적 유효량의 BAN2401을 포함하는 조성물은 4주마다 1회 투여된다. 일부 구현예에서, 치료적 유효량의 BAN2401을 포함하는 조성물은 매달 1회 투여된다.
일부 구현예에서, 대상체의 체중에 비하여 2.5 ㎎/㎏, 5 ㎎/㎏, 7.5 ㎎/㎏ 또는 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물이 대상체에게 매주 1회 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 2.5 ㎎/㎏, 5 ㎎/㎏, 7.5 ㎎/㎏ 또는 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물이 대상체에게 2주마다 1회 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 2.5 ㎎/㎏, 5 ㎎/㎏, 7.5 ㎎/㎏ 또는 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물이 대상체에게 3주마다 1회 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 2.5 ㎎/㎏, 5 ㎎/㎏, 7.5 ㎎/㎏ 또는 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물이 대상체에게 4주마다 1회 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 2.5 ㎎/㎏, 5 ㎎/㎏, 7.5 ㎎/㎏ 또는 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물이 대상체에게 매달 1회 투여된다.
일부 구현예에서, 대상체의 체중에 비하여 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물이 대상체에게 2주마다 1회 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물이 대상체에게 매달 1회 투여된다.
일부 구현예에서, 대상체의 체중에 비하여 2.5 ㎎/㎏, 5 ㎎/㎏, 7.5 ㎎/㎏ 또는 10 ㎎/㎏의 BAN2401을 포함하는 조성물이 대상체에게 매주 1회 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 2.5 ㎎/㎏, 5 ㎎/㎏, 7.5 ㎎/㎏ 또는 10 ㎎/㎏의 BAN2401을 포함하는 조성물이 대상체에게 2주마다 1회 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 2.5 ㎎/㎏, 5 ㎎/㎏, 7.5 ㎎/㎏ 또는 10 ㎎/㎏의 BAN2401을 포함하는 조성물이 대상체에게 3주마다 1회 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 2.5 ㎎/㎏, 5 ㎎/㎏, 7.5 ㎎/㎏ 또는 10 ㎎/㎏의 BAN2401을 포함하는 조성물이 대상체에게 4주마다 1회 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 2.5 ㎎/㎏, 5 ㎎/㎏, 7.5 ㎎/㎏ 또는 10 ㎎/㎏의 BAN2401을 포함하는 조성물이 대상체에게 매달 1회 투여된다.
일부 구현예에서, 대상체의 체중에 비하여 10 ㎎/㎏의 BAN2401을 포함하는 조성물이 대상체에게 2주마다 1회 투여된다. 일부 구현예에서, 대상체의 체중에 비하여 10 ㎎/㎏의 BAN2401을 포함하는 조성물이 대상체에게 매달 1회 투여된다.
적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물
일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체가 조성물에 포함된다. 일부 구현예에서, 조성물은 적어도 하나의 항-Aβ 프로토피브릴 항체로 이루어진다. 일부 구현예에서, 조성물은 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 적어도 하나의 추가의 성분을 추가로 포함한다. 적어도 하나의 추가의 성분은 인간 및/또는 수의학적 이용에 적합한 생리학적으로 허용 가능한 부형제로부터 선택될 수 있다.
본 개시의 조성물은 정제, 환제, 캡슐, 용액의 형태 및/또는 당업자에 의해 적절한 것으로 여겨지는 임의의 다른 적합한 형태일 수 있다. 본 개시의 조성물의 투여 경로는 정맥내, 피하, 경구 및 비강을 포함하는 임의의 적합한 경로일 수 있다. 일부 구현예에서, 조성물은 정맥내 투여를 위한 멸균성, 비발열원 액체로서 제형화된다. 일부 구현예에서, 조성물은 염수 용액이다.
일부 구현예에서, 조성물 중 적어도 하나의 추가의 성분은 완충제로부터 선택된다. 일부 구현예에서, 조성물 중 적어도 하나의 추가의 성분은 유화제로부터 선택된다. 일부 구현예에서, 조성물 중 적어도 하나의 추가의 성분은 시트르산나트륨, 염화나트륨 및 폴리소르베이트 80으로부터 선택된다. 일부 구현예에서, 시트르산나트륨은 1 mM 내지 150 mM 범위의 농도로 존재할 수 있다. 일부 구현예에서, 시트르산나트륨은 25 mM의 농도로 존재할 수 있다. 일부 구현예에서, 염화나트륨은 25 mM 내지 250 mM 범위의 농도로 존재할 수 있다. 일부 구현예에서, 시트르산나트륨은 125 mM의 농도로 존재할 수 있다. 일부 구현예에서, 폴리소르베이트 80은 0.001%(w/v) 내지 2%(w/v) 범위의 농도로 존재할 수 있다. 일부 구현예에서, 폴리소르베이트 80은 0.02%(w/v)의 농도로 존재할 수 있다.
일부 구현예에서, 조성물은 적어도 하나의 항-Aβ 프로토피브릴 항체, 예컨대, BAN2401을 포함하고, 예를 들어, 시트르산나트륨, 염화나트륨 및 폴리소르베이트 80을 추가로 포함하는 액체 투여형이다. 일부 구현예에서, 조성물은 10 ㎎/㎖의 적어도 하나의 항-Aβ 프로토피브릴 항체, 예컨대, BAN2401, 25 mM 시트르산나트륨, 125 mM 염화나트륨 및 0.2%(w/v) 폴리소르베이트 80을 포함하며, pH 5.7을 갖는다.
치료적 효과
임상적 저하의 감소
치료적 유효량의 본원에 개시된 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물을 상기 대상체에게 투여하는 단계를 포함하는, 초기 알츠하이머병을 갖는 대상체에서의 임상적 저하의 감소 방법이 본원에 제공된다. 일부 구현예에서, 초기 알츠하이머병을 갖는 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받고/받거나, 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 초기 알츠하이머병을 갖는 대상체는 ApoE4-양성이다.
본원에 개시된 항-Aβ 프로토피브릴 항체, 그의 치료적으로 허용 가능한 양, 그에 대한 투여 섭생법 및 이를 포함하는 조성물 중 임의의 것은 초기 알츠하이머병을 갖는 대상체에서의 임상적 저하의 감소 방법에서 사용될 수 있다. 예를 들어, 일부 구현예에서, 대상체의 체중에 비하여 2.5 ㎎/㎏, 5 ㎎/㎏, 7.5 ㎎/㎏ 또는 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체, 예컨대, BAN2401을 포함하는 조성물은 대상체에게 매주 1회, 2주마다 1회, 3주마다 1회, 4주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45% 또는 적어도 46% 감소된다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 20% 내지 35% 감소된다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 20% 내지 30% 감소된다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 27% 내지 35% 감소된다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 20% 감소된다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 35% 감소된다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 적어도 20% 감소된다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 적어도 30% 감소된다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 45% 감소된다. 일부 구현예에서, 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 35% 감소된다. 일부 구현예에서, 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 30% 감소된다. 일부 구현예에서, 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 46% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51% 또는 적어도 52% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 28% 내지 33% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 20%, 예컨대, 25% 또는 적어도 28% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 25%, 예컨대, 적어도 30% 또는 적어도 33% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 25%, 예컨대, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 45%, 적어도 50% 또는 적어도 52% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 52% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 30% 감소된다. 일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 25% 감소된다. 일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 30% 감소된다. 일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 52% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32% 또는 적어도 33% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 28% 내지 38% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 20%, 예컨대, 25%, 적어도 28% 또는 적어도 33% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 25%, 예컨대, 적어도 30% 또는 적어도 33% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 33% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 33% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77% 또는 적어도 78% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 20% 내지 80% 감소되며, 대상체는 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 35% 내지 78% 감소되며, 대상체는 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 35% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 50%, 예컨대, 적어도 52% 또는 적어도 53% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 70%, 예컨대, 적어도 75% 또는 적어도 78% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 70% 감소된다. 일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 50% 감소된다. 일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 30% 감소된다. 일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 52% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34% 또는 적어도 35% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 28% 내지 38% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 20%, 예컨대, 25%, 적어도 28% 또는 적어도 35% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 25%, 예컨대, 적어도 30% 또는 적어도 35% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 35% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 35% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 100%, 적어도 110%, 적어도 120%, 적어도 130%, 적어도 140% 또는 적어도 150% 감소된다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 40% 내지 150% 감소된다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 45% 내지 145% 감소된다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 45% 내지 55% 감소된다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 30% 감소된다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 35% 감소된다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 적어도 40% 감소된다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 적어도 45% 감소된다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 적어도 47% 감소된다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 100%, 예컨대, 적어도 120% 또는 적어도 140% 감소된다. 일부 구현예에서, 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 40%, 예컨대, 적어도 45% 감소된다. 일부 구현예에서, 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 40%, 예컨대, 적어도 45% 감소된다. 일부 구현예에서, 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 47% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 56%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57% 또는 적어도 58% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 50% 내지 70% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 50%, 예컨대, 52%, 적어도 55% 또는 적어도 58% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 58% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 58% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40% 또는 적어도 41% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 30% 내지 50% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 35%, 예컨대, 38%, 적어도 40% 또는 적어도 41% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 41% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 41% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39% 또는 적어도 40% 감소된다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 20% 내지 60% 감소된다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 25% 내지 60% 감소된다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 25% 내지 50% 감소된다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 20% 감소된다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 30% 감소된다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 적어도 25%, 예컨대, 적어도 26% 또는 적어도 28% 감소된다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 적어도 30%, 예컨대, 적어도 35% 또는 적어도 38% 감소된다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 30%, 예컨대, 적어도 35% 또는 적어도 40% 감소된다. 일부 구현예에서, 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 30%, 예컨대, 적어도 35% 또는 적어도 45% 감소된다. 일부 구현예에서, 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 20%, 예컨대, 적어도 25% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13% 또는 적어도 14% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 10% 내지 20% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 5%, 예컨대, 10%, 적어도 12% 또는 적어도 14% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 14% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 14% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50% 또는 적어도 51% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 40% 내지 60% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 45%, 예컨대, 48%, 적어도 50% 또는 적어도 51% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 51% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 51% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 2개월, 3개월, 4개월, 5개월, 6개월, 7개월, 8개월, 9개월, 10개월, 11개월, 12개월, 13개월, 14개월, 15개월, 16개월, 17개월, 18개월, 19개월, 20개월, 21개월, 22개월, 23개월, 24개월, 30개월, 36개월, 42개월, 48개월, 54개월, 60개월, 63개월, 66개월 및/또는 72개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 60개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 BAN2401을 포함하는 조성물의 투여 후에 결정된다.
일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 BAN2401을 포함하는 조성물의 투여 1개월, 2개월, 3개월, 4개월, 5개월, 6개월, 7개월, 8개월, 9개월, 10개월, 11개월, 12개월, 13개월, 14개월, 15개월, 16개월, 17개월, 18개월, 19개월, 20개월, 21개월, 22개월, 23개월, 24개월, 30개월, 36개월, 42개월, 48개월, 54개월, 60개월, 63개월, 66개월 및/또는 72개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 BAN2401을 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 BAN2401을 포함하는 조성물의 투여 1개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 BAN2401을 포함하는 조성물의 투여 6개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 BAN2401을 포함하는 조성물의 투여 12개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 BAN2401을 포함하는 조성물의 투여 18개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 BAN2401을 포함하는 조성물의 투여 60개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 BAN2401을 포함하는 조성물의 투여 63개월 후에 결정된다.
일부 구현예에서, 대상체는 ApoE4-양성이다.
일부 구현예에서, 임사적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73% 또는 적어도 74% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 60% 내지 80%, 예컨대, 63% 내지 74% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 60%, 예컨대, 적어도 63% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 65%, 예컨대, 적어도 67% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 70%, 예컨대, 적어도 74% 감소되며, 대상체는 ApoE4-양성이다.
일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 70% 감소된다. 일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 60% 감소된다. 일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 50%, 예컨대, 적어도 55% 또는 적어도 60% 감소된다. 일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 63% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99%, 적어도 100%, 적어도 101%, 적어도 102%, 적어도 103%, 적어도 104%, 적어도 105%, 적어도 106%, 적어도 107%, 적어도 108%, 적어도 109%, 적어도 110%, 적어도 115%, 적어도 120%, 적어도 125%, 적어도 130%, 적어도 135%, 적어도 140%, 적어도 145%, 적어도 150%, 적어도 155%, 적어도 160%, 적어도 165%, 적어도 170%, 적어도 175%, 적어도 180%, 적어도 185%, 적어도 190%, 적어도 195%, 적어도 200%, 적어도 205%, 적어도 210%, 적어도 215%, 적어도 220%, 적어도 225%, 적어도 230%, 적어도 235%, 적어도 240%, 적어도 245%, 적어도 250%, 적어도 255%, 적어도 260%, 적어도 265%, 적어도 270%, 적어도 275%, 적어도 280%, 적어도 290%, 적어도 295%, 적어도 300%, 적어도 305%, 적어도 310%, 적어도 315%, 적어도 320%, 적어도 325%, 적어도 330% 또는 적어도 331% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 70% 내지 400%, 예컨대, 80% 내지 350% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 70%, 예컨대, 적어도 75% 또는 적어도 80% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 80%, 예컨대, 적어도 90% 또는 적어도 100% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 300%, 예컨대, 적어도 330% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 300% 감소된다. 일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 80%, 예컨대, 적어도 90% 또는 적어도 100% 감소된다. 일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 70%, 예컨대, 적어도 75%, 적어도 80% 또는 적어도 84% 감소된다. 일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 84% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86% 또는 적어도 87% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 35% 내지 150%, 예컨대, 40% 내지 100% 또는 45% 내지 90% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 35%, 예컨대, 적어도 40% 또는 적어도 45% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 50%, 예컨대, 적어도 55% 또는 적어도 60% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 70%, 예컨대, 적어도 80% 또는 적어도 85% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 35%, 예컨대, 적어도 40% 또는 적어도 45% 감소된다. 일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 70%, 예컨대, 적어도 75% 또는 적어도 80% 감소된다. 일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 50%, 예컨대, 적어도 55% 또는 적어도 60% 감소된다. 일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 60% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58% 또는 적어도 59% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 30% 내지 70%, 예컨대, 38% 내지 59% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 30%, 예컨대, 적어도 35% 또는 적어도 38% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 45%, 예컨대, 적어도 50% 또는 적어도 53% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 50%, 예컨대, 적어도 55% 또는 적어도 59% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 50%, 예컨대, 적어도 55% 감소된다. 일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 30%, 예컨대, 적어도 35% 감소된다. 일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 45%, 예컨대, 적어도 50% 또는 적어도 55% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99%, 적어도 100%, 적어도 101%, 적어도 102%, 적어도 103%, 적어도 104%, 적어도 105%, 적어도 106%, 적어도 107%, 적어도 108%, 적어도 109%, 적어도 110%, 적어도 115%, 적어도 120%, 적어도 125%, 적어도 130%, 적어도 135%, 적어도 140%, 적어도 145%, 적어도 150%, 적어도 155%, 적어도 160%, 적어도 165%, 적어도 170%, 적어도 175%, 적어도 180%, 적어도 185%, 적어도 190%, 적어도 195%, 적어도 200%, 적어도 205%, 적어도 210% 또는 적어도 211% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 100%, 예컨대, 적어도 110% 감소된다. 일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 100%, 예컨대, 적어도 110% 감소된다. 일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 65%, 예컨대, 적어도 70% 또는 적어도 75% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99%, 적어도 100%, 적어도 101%, 적어도 102%, 적어도 103%, 적어도 104%, 적어도 105%, 적어도 106%, 적어도 107%, 적어도 108%, 적어도 109%, 적어도 110%, 적어도 115%, 적어도 120%, 적어도 125%, 적어도 130%, 적어도 135%, 적어도 140%, 적어도 145%, 적어도 150%, 적어도 155%, 적어도 160%, 적어도 165%, 적어도 170%, 적어도 175%, 적어도 180%, 적어도 185%, 적어도 190%, 적어도 195%, 적어도 200%, 적어도 205%, 적어도 210% 또는 적어도 211% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 40% 내지 300%, 예컨대, 45% 내지 250% 또는 50% 내지 250% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 40%, 예컨대, 적어도 45% 또는 적어도 50% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 60, 예컨대, 적어도 70%, 적어도 75% 또는 적어도 80% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 100%, 예컨대, 적어도 150% 또는 적어도 200% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 100%, 예컨대, 적어도 150% 또는 적어도 200% 감소된다. 일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 40%, 예컨대, 적어도 45% 또는 적어도 50% 감소된다. 일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 50%, 예컨대, 적어도 60%, 적어도 70% 또는 적어도 75% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44% 또는 적어도 45% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 20% 내지 90%, 예컨대, 25% 내지 80% 또는 30% 내지 75% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 25%, 예컨대, 적어도 30% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 30%, 예컨대, 적어도 35% 또는 40% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 35%, 예컨대, 적어도 40% 또는 45% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 CDR-SB 조성물에 의해 결정되는 바와 같이 위약에 비하여 적어도 35%, 예컨대, 적어도 40% 또는 적어도 45% 감소된다. 일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 20%, 예컨대, 적어도 25% 또는 적어도 30% 감소된다. 일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 35%, 예컨대, 적어도 40% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99%, 적어도 100%, 적어도 101%, 적어도 102%, 적어도 103%, 적어도 104%, 적어도 105%, 적어도 106%, 적어도 107%, 적어도 108%, 적어도 109%, 적어도 110%, 적어도 111%, 적어도 112%, 적어도 113%, 적어도 114%, 적어도 115%, 적어도 116%, 적어도 117%, 적어도 118% 또는 적어도 119% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 76% 내지 119% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 76% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 113% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 119% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99%, 적어도 100%, 적어도 101%, 적어도 102%, 적어도 103%, 적어도 104%, 적어도 105%, 적어도 106%, 적어도 107%, 적어도 108%, 적어도 109%, 적어도 110%, 적어도 111%, 적어도 112%, 적어도 113%, 적어도 114%, 적어도 115%, 적어도 116%, 적어도 117%, 적어도 118%, 적어도 119%, 적어도 120%, 적어도 121%, 적어도 122%, 적어도 123%, 적어도 124%, 적어도 125%, 적어도 126%, 적어도 127%, 적어도 128%, 적어도 129%, 적어도 130%, 적어도 131%, 적어도 132%, 적어도 133%, 적어도 134%, 적어도 135%, 적어도 136%, 적어도 137%, 적어도 138%, 적어도 139%, 적어도 140%, 적어도 141%, 적어도 142%, 적어도 143%, 적어도 144%, 적어도 145%, 적어도 146%, 적어도 147%, 적어도 148%, 적어도 149%, 적어도 150%, 적어도 151%, 적어도 152%, 적어도 153%, 적어도 154%, 적어도 155%, 적어도 156%, 적어도 157%, 적어도 158%, 적어도 159%, 적어도 160%, 적어도 161%, 적어도 162%, 적어도 163%, 적어도 164%, 적어도 165%, 적어도 166%, 적어도 167%, 적어도 168%, 적어도 169%, 적어도 170%, 적어도 171%, 적어도 172%, 적어도 173%, 적어도 174%, 적어도 175%, 적어도 176%, 적어도 177%, 적어도 178%, 적어도 179%, 적어도 180%, 적어도 190%, 적어도 200%, 적어도 210%, 적어도 220%, 적어도 230%, 적어도 240%, 적어도 250%, 적어도 275%, 적어도 300%, 적어도 325%, 적어도 350%, 적어도 375%, 적어도 400%, 적어도 425%, 적어도 450%, 적어도 475%, 적어도 500%, 적어도 550%, 적어도 600%, 적어도 650%, 적어도 700%, 적어도 750%, 적어도 800%, 적어도 850%, 적어도 900%, 적어도 950%, 적어도 1000%, 적어도 1001%, 적어도 1002%, 적어도 1003%, 적어도 1004%, 적어도 1005%, 적어도 1006%, 적어도 1007%, 적어도 1008%, 적어도 1009%, 적어도 1010%, 적어도 1011%, 적어도 1012%, 적어도 1013%, 적어도 1014%, 적어도 1015%, 적어도 1016%, 적어도 1017%, 적어도 1018%, 적어도 1019%, 적어도 1020%, 적어도 1021%, 적어도 1022% 또는 적어도 1023% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 58% 내지 1023% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 58% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 171% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 1023% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99%, 적어도 100%, 적어도 101%, 적어도 102%, 적어도 103%, 적어도 104%, 적어도 105%, 적어도 106%, 적어도 107%, 적어도 108%, 적어도 109%, 적어도 110%, 적어도 111%, 적어도 112%, 적어도 113%, 적어도 114%, 적어도 115%, 적어도 116%, 적어도 117%, 적어도 118%, 적어도 119%, 적어도 120%, 적어도 121%, 적어도 122%, 적어도 123%, 적어도 124%, 적어도 125%, 적어도 126%, 적어도 127%, 적어도 128%, 적어도 129%, 적어도 130%, 적어도 131%, 적어도 132%, 적어도 133%, 적어도 134%, 적어도 135%, 적어도 136%, 적어도 137%, 적어도 138%, 적어도 139%, 적어도 140%, 적어도 141%, 적어도 142%, 적어도 143%, 적어도 144%, 적어도 145%, 적어도 146%, 적어도 147%, 적어도 148%, 적어도 149%, 적어도 150%, 적어도 151%, 적어도 152%, 적어도 153%, 적어도 154%, 적어도 155%, 적어도 156%, 적어도 157%, 적어도 158%, 적어도 159%, 적어도 160%, 적어도 161%, 적어도 162%, 적어도 163%, 적어도 164%, 적어도 165%, 적어도 166%, 적어도 167%, 적어도 168%, 적어도 169%, 적어도 170%, 적어도 171%, 적어도 172%, 적어도 173% 또는 적어도 174% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 70% 내지 200%, 예컨대, 75% 내지 180% 또는 82% 내지 174% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 70%, 예컨대, 적어도 80% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 75%, 예컨대, 적어도 80% 또는 적어도 85% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 150%, 예컨대, 적어도 160% 또는 170% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 CDR-SB 조성물에 의해 결정되는 바와 같이 위약에 비하여 적어도 70%, 예컨대, 적어도 75%, 적어도 80% 또는 적어도 85% 감소된다. 일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 130%, 예컨대, 적어도 140%, 적어도 150%, 적어도 160% 또는 적어도 170% 감소된다. 일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 65%, 예컨대, 적어도 70%, 적어도 75% 또는 적어도 80% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 대상체는 ApoE4-음성이다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11% 또는 적어도 12% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 5% 내지 15% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 5%, 예컨대, 적어도 7% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 10%, 예컨대, 적어도 12% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, ApoE4-음성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 -2% 감소된다. 일부 구현예에서, ApoE4-음성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 10% 감소된다. 일부 구현예에서, ApoE4-음성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 5%, 예컨대, 적어도 7% 감소된다. 일부 구현예에서, ApoE4-음성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 7% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71% 또는 적어도 72% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 40% 내지 80% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 35%, 예컨대, 적어도 40% 또는 적어도 43% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 40%, 예컨대, 적어도 45% 또는 적어도 46% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 65%, 예컨대, 적어도 70% 또는 적어도 72% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 43% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 7%, 6%, 5%, 5%, 3%, 2% 또는 1% 증가되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2% 또는 적어도 3% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 3% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25% 또는 적어도 26% 감소되며, 대상체는 ApoE4-음성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 15% 내지 26% 감소되며, 대상체는 ApoE4-음성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 15% 감소되며, 대상체는 ApoE4-음성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 26% 감소되며, 대상체는 ApoE4-음성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99%, 적어도 100%, 적어도 101%, 적어도 102%, 적어도 103%, 적어도 104%, 적어도 105%, 적어도 106%, 적어도 107%, 적어도 108%, 적어도 109%, 적어도 110%, 적어도 115%, 적어도 120%, 적어도 125%, 적어도 130%, 적어도 135%, 적어도 140%, 적어도 145%, 적어도 150%, 적어도 155%, 적어도 160%, 적어도 165% 또는 적어도 166% 감소되며, 대상체는 ApoE4-음성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 50% 내지 200%, 예컨대, 60% 내지 180% 또는 65% 내지 170% 감소되며, 대상체는 ApoE4-음성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 50%, 예컨대, 적어도 55% 또는 적어도 65% 감소되며, 대상체는 ApoE4-음성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 70%, 예컨대, 적어도 75% 또는 적어도 80% 감소되며, 대상체는 ApoE4-음성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 150%, 예컨대, 적어도 160% 감소되며, 대상체는 ApoE4-음성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, ApoE4-음성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 150%, 예컨대, 적어도 160% 감소된다. 일부 구현예에서, ApoE4-음성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 70%, 예컨대, 적어도 75% 또는 적어도 80% 감소된다. 일부 구현예에서, ApoE4-음성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 50%, 예컨대, 적어도 60% 또는 적어도 65% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4% 또는 적어도 5% 감소되며, 대상체는 ApoE4-음성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 5% 감소되며, 대상체는 ApoE4-음성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12% 감소되며, 대상체는 ApoE4-음성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 10%, 예컨대, 적어도 12% 감소되며, 대상체는 ApoE4-음성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
아밀로이드 양성에서 아밀로이드 음성으로의 대상체의 전환
또한, 아밀로이드-양성 대상체에서 아밀로이드-음성 대상체로의 전환 방법이 본원에 제공된다. 일부 구현예에서, 상기 방법은 본원에 개시된 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물을 상기 대상체에게 투여하는 단계를 포함한다. 일부 구현예에서, 초기 알츠하이머병을 갖는 상기 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받고/받거나 경증 알츠하이머병 치매를 갖는 것으로 진단받는다.
본원에 개시된 항-Aβ 프로토피브릴 항체, 그의 치료적으로 허용 가능한 양, 그에 대한 투여 섭생법 및 이를 포함하는 조성물 중 임의의 것은 아밀로이드-양성 대상체에서 아밀로이드-음성 대상체로의 전환 방법에서 사용될 수 있다. 예를 들어, 일부 구현예에서, 대상체의 체중에 비하여 2.5 ㎎/㎏, 5 ㎎/㎏, 7.5 ㎎/㎏ 또는 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체, 예컨대, BAN2401을 포함하는 조성물은 대상체에게 매주 1회, 2주마다 1회, 3주마다 1회, 4주마다 1회 또는 매달 1회 투여된다.
일부 구현예에서, 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80% 또는 적어도 81%의 대상체가 아밀로이드 양성에서 아밀로이드 음성으로 전환되도록 초래한다.
일부 구현예에서, 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이 50% 내지 100%, 예컨대, 60% 내지 90%의 대상체의, 아밀로이드 양성에서 아밀로이드 음성으로의 전환을 초래한다. 일부 구현예에서, 조성물의 투여는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이 적어도 55%, 예컨대, 적어도 60% 또는 적어도 65%의 대상체가 아밀로이드 음성이 되도록 초래한다. 일부 구현예에서, 조성물의 투여는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이 적어도 70%, 예컨대, 적어도 75% 또는 적어도 80%의 대상체가 아밀로이드 음성이 되도록 초래한다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99% 또는 100%의 대상체가 아밀로이드 음성이 되도록 초래하며, 대상체는 ApoE4-양성이다.
일부 구현예에서, 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이 75% 내지 100%, 예컨대, 80% 내지 100% 또는 85% 내지 100%의 대상체가 아밀로이드 음성이 되도록 초래하며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이 적어도 75%, 예컨대, 적어도 80% 또는 적어도 85%의 대상체가 아밀로이드 음성이 되도록 초래하며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이 100%의 대상체가 아밀로이드 음성이 되도록 초래하며, 대상체는 ApoE4-양성이다.
일부 구현예에서, 적어도 75%, 예컨대, 적어도 80% 또는 적어도 85%의 ApoE4-양성 대상체는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이 아밀로이드 음성이다. 일부 구현예에서, 적어도 75%, 예컨대, 적어도 80%, 적어도 85%, 적어도 90% 또는 적어도 95%의 ApoE4-양성 대상체는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이, 아밀로이드 음성이다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78% 또는 적어도 79%의 대상체가 아밀로이드 음성이 되도록 초래하며, 대상체는 ApoE4-음성이다.
일부 구현예에서, 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이 50% 내지 100%, 예컨대, 55% 내지 90%의 대상체가 아밀로이드 음성이 되도록 초래하며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이 적어도 50%의 대상체가 아밀로이드 음성이 되도록 초래하며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이 적어도 70%의 대상체가 아밀로이드 음성이 되도록 초래하며, 대상체는 ApoE4-음성이다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 35% 내지 50% 감소되며, 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 35%, 예컨대, 38%, 적어도 40% 또는 적어도 41% 감소되며, 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 41% 감소되며, 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 BAN2401 이외의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 41% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58% 또는 적어도 59% 감소되며, 대상체에는 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 50% 내지 70% 감소되며, 대상체에는 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 50%, 예컨대, 55%, 적어도 57% 또는 적어도 59% 감소되며, 대상체에는 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 59% 감소되며, 대상체에는 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 59% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44% 또는 적어도 45% 감소되며, 대상체에는 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 50% 내지 70% 감소되며, 대상체에는 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 35%, 예컨대, 40%, 적어도 42% 또는 적어도 45% 감소되며, 대상체에는 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 45% 감소되며, 대상체에는 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 45% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
적어도 하나의 항-Aβ 프로토피브릴 항체 및 BAN2401 이외의 적어도 하나의 알츠하이머병 의약의 동시 투여
일부 구현예에서, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체 및 치료적 유효량의 BAN2401 이외의 적어도 하나의 알츠하이머병 의약을 동시 투여하는 단계를 포함하는, 초기 알츠하이머병을 갖는 대상체에서의 임상적 저하의 감소 방법이 본원에 제공된다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22% 또는 적어도 23% 감소된다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 15% 내지 30% 감소된다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 15%, 예컨대, 20%, 적어도 21% 또는 적어도 23% 감소된다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 23% 감소된다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체 및 치료적 유효량의 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되는 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 23% 감소된다. 일부 구현예에서, 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체는 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다. 일부 구현예에서, 적어도 하나의 알츠하이머병 의약은 엘렌베세스타트, 도네페질, 갈란타민(galantamine), 메만틴 및 리바스티그민(rivastigmine)으로부터 선택된다. 일부 구현예에서, 적어도 하나의 알츠하이머병 의약은 도네페질 및 메만틴의 조합이다.
일부 구현예에서, 도네페질은 그의 승인된 용량으로 투여될 수 있다. 일부 구현예에서, 갈란타민은 그의 승인된 용량으로 투여될 수 있다. 일부 구현예에서, 메만틴은 그의 승인된 용량으로 투여될 수 있다. 일부 구현예에서, 리바스티그민은 그의 승인된 용량으로 투여될 수 있다.
일부 구현예에서, 엘렌베세스타트는 5 ㎎/일 내지 100 ㎎/일, 10 ㎎/일 내지 75 ㎎/일, 5 ㎎/일 내지 50 ㎎/일 또는 15 ㎎/일 내지 50 ㎎/일 범위의 용량으로 투여될 수 있다. 일부 구현예에서, 엘렌베세스타트는 약 5 ㎎/일 내지 약 100 ㎎/일, 약 10 ㎎/일 내지 약 75 ㎎/일, 약 5 ㎎/일 내지 약 50 ㎎/일 또는 약 15 ㎎/일 내지 약 50 ㎎/일 범위의 용량으로 투여될 수 있다. 일부 구현예에서, 엘렌베세스타트는 5 ㎎/일, 10 ㎎/일, 15 ㎎/일, 20 ㎎/일, 25 ㎎/일, 30 ㎎/일 또는 50 ㎎/일 투여량의 용량으로 투여될 수 있다. 일부 구현예에서, 엘렌베세스타트는 5 ㎎/일의 용량으로 투여될 수 있다. 일부 구현예에서, 엘렌베세스타트는 15 ㎎/일의 용량으로 투여될 수 있다. 일부 구현예에서, 엘렌베세스타트는 50 ㎎/일의 용량으로 투여될 수 있다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40% 또는 적어도 41% 감소된다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38% 또는 적어도 39% 감소되며, 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여된다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 30% 내지 50% 감소되며, 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여된다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 30%, 예컨대, 적어도 35%, 적어도 37% 또는 적어도 39% 감소되며, 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여된다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 39% 감소되며, 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여된다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 적어도 하나의 알츠하이머병 의약이 동시 투여되는 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 39% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다. 일부 구현예에서, 적어도 하나의 알츠하이머병 의약은 엘렌베세스타트, 도네페질, 갈란타민, 메만틴 및 리바스티그민으로부터 선택된다. 일부 구현예에서, 적어도 하나의 알츠하이머병 의약은 도네페질 및 메만틴의 조합이다.
일부 구현예에서, 도네페질은 그의 승인된 용량으로 투여될 수 있다. 일부 구현예에서, 갈란타민은 그의 승인된 용량으로 투여될 수 있다. 일부 구현예에서, 메만틴은 그의 승인된 용량으로 투여될 수 있다. 일부 구현예에서, 리바스티그민은 그의 승인된 용량으로 투여될 수 있다.
일부 구현예에서, 엘렌베세스타트는 5 ㎎/일 내지 100 ㎎/일, 10 ㎎/일 내지 75 ㎎/일, 5 ㎎/일 내지 50 ㎎/일 또는 15 ㎎/일 내지 50 ㎎/일 범위의 용량으로 투여될 수 있다. 일부 구현예에서, 엘렌베세스타트는 약 5 ㎎/일 내지 약 100 ㎎/일, 약 10 ㎎/일 내지 약 75 ㎎/일, 약 5 ㎎/일 내지 약 50 ㎎/일 또는 약 15 ㎎/일 내지 약 50 ㎎/일 범위의 용량으로 투여될 수 있다. 일부 구현예에서, 엘렌베세스타트는 5 ㎎/일, 10 ㎎/일, 15 ㎎/일, 20 ㎎/일, 25 ㎎/일, 30 ㎎/일 또는 50 ㎎/일 투여량의 용량으로 투여될 수 있다. 일부 구현예에서, 엘렌베세스타트는 5 ㎎/일의 용량으로 투여될 수 있다. 일부 구현예에서, 엘렌베세스타트는 15 ㎎/일의 용량으로 투여될 수 있다. 일부 구현예에서, 엘렌베세스타트는 50 ㎎/일의 용량으로 투여될 수 있다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19% 또는 적어도 20% 감소되며, 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여된다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 10% 내지 30% 감소되며, 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여된다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 10%, 예컨대, 적어도 15%, 적어도 17% 또는 적어도 20% 감소되며, 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여된다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 20% 감소되며, 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여된다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 적어도 하나의 알츠하이머병 의약이 동시 투여되는 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 20% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다. 일부 구현예에서, 적어도 하나의 알츠하이머병 의약은 엘렌베세스타트, 도네페질, 갈란타민, 메만틴 및 리바스티그민으로부터 선택된다. 일부 구현예에서, 적어도 하나의 알츠하이머병 의약은 도네페질 및 메만틴의 조합이다.
일부 구현예에서, 도네페질은 그의 승인된 용량으로 투여될 수 있다. 일부 구현예에서, 갈란타민은 그의 승인된 용량으로 투여될 수 있다. 일부 구현예에서, 메만틴은 그의 승인된 용량으로 투여될 수 있다. 일부 구현예에서, 리바스티그민은 그의 승인된 용량으로 투여될 수 있다.
일부 구현예에서, 엘렌베세스타트는 5 ㎎/일 내지 100 ㎎/일, 10 ㎎/일 내지 75 ㎎/일, 5 ㎎/일 내지 50 ㎎/일 또는 15 ㎎/일 내지 50 ㎎/일 범위의 용량으로 투여될 수 있다. 일부 구현예에서, 엘렌베세스타트는 약 5 ㎎/일 내지 약 100 ㎎/일, 약 10 ㎎/일 내지 약 75 ㎎/일, 약 5 ㎎/일 내지 약 50 ㎎/일 또는 약 15 ㎎/일 내지 약 50 ㎎/일 범위의 용량으로 투여될 수 있다. 일부 구현예에서, 엘렌베세스타트는 5 ㎎/일, 10 ㎎/일, 15 ㎎/일, 20 ㎎/일, 25 ㎎/일, 30 ㎎/일 또는 50 ㎎/일 투여량의 용량으로 투여될 수 있다. 일부 구현예에서, 엘렌베세스타트는 5 ㎎/일의 용량으로 투여될 수 있다. 일부 구현예에서, 엘렌베세스타트는 15 ㎎/일의 용량으로 투여될 수 있다. 일부 구현예에서, 엘렌베세스타트는 50 ㎎/일의 용량으로 투여될 수 있다.
뇌 아밀로이드 수준의 감소
또한, 치료적 유효량의 본원에 개시된 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물을 투여하는 단계를 포함하는 뇌 아밀로이드 수준의 감소를 필요로 하는 대상체에서의 뇌 아밀로이드 수준의 감소 방법이 본원에 제공된다.
일부 구현예에서, 대상체는 초기 알츠하이머병을 갖는다. 일부 구현예에서, 대상체는 알츠하이머병, 다운 증후군, 만성 외상성 뇌병증, 뇌 아밀로이드 혈관병증, 루이소체 치매, 또는 Aβ 펩티드-함유 가용성 및/또는 불용성 Aβ 응집체를 갖는 또 다른 뇌 질병 또는 질환을 갖는다.
당업자는 알츠하이머병을 갖는 대상체에 더하여, Aβ 플라크 침착이 다른 신경변성 질병 및 질환을 갖는 대상체의 뇌에 존재하는 것과, 이에 따라 본원에 개시된 방법이 이러한 신경변성 질병 및/또는 질환을 갖는 대상체에 대하여 유리할 것임을 이해할 것이다. 이러한 질병 및 질환은 예를 들어, 다운 증후군, 만성 외상성 뇌병증, 뇌 아밀로이드 혈관병증 및 루이소체 치매를 포함하는 것으로 알려져 있다. (예를 들어, 문헌[Catafau et al., "Amyloid PET imaging: applications beyond Alzheimer's disease," Clin. Transl. Imaging 3(1): 39-55 (2015)]; 및 문헌[Banerjee, G. et al., "The increasing impact of cerebral amyloid angiopathy: essential new insights for clinical practice," J. Neurol. Neurosurg. Psychiatry 88: 982-994 (2017)] 참조.)
일부 구현예에서, 초기 알츠하이머병을 갖는 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받고/받거나 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 초기 알츠하이머병을 갖는 대상체는 ApoE4-양성이다.
본원에 개시된 항-Aβ 프로토피브릴 항체, 그의 치료적으로 허용 가능한 양, 그에 대한 투여 섭생법 및 이를 포함하는 조성물 중 임의의 것은 초기 알츠하이머병을 갖는 대상체에서의 뇌 아밀로이드 수준의 감소 방법에 사용될 수 있다. 예를 들어, 일부 구현예에서, 대상체의 체중에 비하여 2.5 ㎎/㎏, 5 ㎎/㎏, 7.5 ㎎/㎏ 또는 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체 예컨대, BAN2401을 포함하는 조성물은 대상체에게 매주 1회, 2주마다 1회, 3주마다 1회, 4주마다 1회 또는 매달 1회 투여된다.
일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 상기 방법은 투여 이후에 상기 투여 이전의 뇌 아밀로이드 수준에 비하여 감소된 뇌 아밀로이드 수준을 초래한다. 일부 구현예에서, 뇌 아밀로이드 수준은 상기 투여 이전의 뇌 아밀로이드 수준에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99% 또는 100% 감소된다. 일부 구현예에서, 상기 열거된 뇌 아밀로이드 수준의 감소는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되며, PET 표준 섭취 계수비(SUVr 값)로서 표현된다.
아밀로이드 양전자 방출 단층촬영(PET) 영상화를 사용하여 연구의 선별 단계에서 초기 AD 대상체의 뇌 내의 아밀로이드 병적이상의 존재를 확인하고/하거나 전체 뇌 분석(예를 들어, 평균 5 내지 6개의 피질 영역) 및 뇌 영역 분석 둘 모두에 의하여 뇌 내의 아밀로이드 수준에 대한 적어도 하나의 항-AB 항체의 영향을 평가할 수 있다. 일부 구현예에서, 대상체의 PET SUVr 값에서의 기준선으로부터의 보정 평균 변화는 기준선에 비하여 적어도 -0.10, 적어도 -0.15, 적어도 -0.20, 적어도 -0.25, 적어도 -0.30, 적어도 -0.35, 적어도 -0.40, 적어도 -0.45, 적어도 -0.50, 적어도 -0.55, 적어도 -0.60, 적어도 -0.65, 적어도 -0.70, 적어도 -0.75, 적어도 -0.80, 적어도 -0.85, 적어도 -0.90 또는 적어도 -0.95 감소된다. 일부 구현예에서, 대상체의 PET SUVr 값에서의 기준선으로부터의 보정 평균 변화는 -0.20 내지 -0.30 감소된다.
일부 구현예에서, 전체 피질 평균을 전체 소뇌 참조값에 대하여 비교하여, 대상체의 PET SUVr 값에서의 기준선으로부터의 보정 평균 변화는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 적어도 -0.20, 예컨대, 적어도 -0.25 감소된다. 일부 구현예에서, 대상체의 PET SUVr 값에서의 기준선으로부터의 보정 평균 변화는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 적어도 -0.25, 예컨대, 적어도 -0.30 감소된다.
일부 구현예에서, 뇌 내의 아밀로이드의 감소는 뇌 Aβ 아밀로이드에 대한 방사성추적자의 결합을 사용한 영상화에 의해 결정되고, PET로 가시화된다. 일부 구현예에서, 기준선으로부터의 보정 평균 변화의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 적어도 -50, 예컨대, 적어도 -55 또는 적어도 -59 센틸로이드(centiloid)이다. 일부 구현예에서, 기준선으로부터의 보정 평균 변화의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 적어도 -60, 예컨대, 적어도 -65 또는 적어도 -70 센틸로이드이다.
일부 구현예에서, 상기 방법은 상기 투여 이전의 뇌척수액 Aβ1-42 수준에 비하여 감소된 뇌척수액 Aβ1-42 수준을 초래한다. 일부 구현예에서, 상기 방법은 상기 투여 이전의 뇌척수액 Aβ1-42 수준에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99% 또는 100%의 뇌척수액 Aβ1-42 수준의 감소를 초래한다.
일부 구현예에서, 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이 -0.20 내지 -0.45, 예컨대, -0.25 내지 -0.35의 뇌 아밀로이드 수준 감소를 초래하며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이 적어도 -0.25의 뇌 아밀로이드 수준 감소를 초래하며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이 적어도 0.30의 뇌 아밀로이드 수준 감소를 초래하며, 대상체는 ApoE4-양성이다.
일부 구현예에서, 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이 위약에 비하여 적어도 -0.01, 적어도 -0.02, 적어도 -0.03, 적어도 -0.04, 적어도 -0.05, 적어도 -0.06, 적어도 -0.07, 적어도 -0.08, 적어도 -0.09, 적어도 -0.10, 적어도 -0.11, 적어도 -0.12, 적어도 -0.13, 적어도 -0.14, 적어도 -0.15, 적어도 -0.16, 적어도 -0.17, 적어도 -0.18, 적어도 -0.19, 적어도 -0.20, 적어도 -0.21, 적어도 -0.22, 적어도 -0.23, 적어도 -0.24, 적어도 -0.25, 적어도 -0.26, 적어도 -0.27, 적어도 -0.28 또는 적어도 -0.29의 뇌 아밀로이드 수준 감소를 초래하며, 대상체는 ApoE4-음성이다.
일부 구현예에서, 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이 -0.10 내지 -0.40의 뇌 아밀로이드 수준 감소를 초래하며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이 적어도 -0.20의 뇌 아밀로이드 수준 감소를 초래하며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이 적어도 -0.25의 뇌 아밀로이드 수준 감소를 초래하며, 대상체는 ApoE4-음성이다.
바이오마커 변화
뉴로그라닌의 뇌척수액 수준
일부 구현예에서, 대상체로의 치료적 유효량의 본원에 개시된 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 대상체에서 뉴로그라닌의 뇌척수액 수준의 감소를 초래한다. 일부 구현예에서, 대상체로의 치료적 유효량의 본원에 개시된 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 기준선에 비하여 뉴로그라닌의 뇌척수액 수준의 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9% 또는 적어도 10%의 감소를 초래한다.
일부 구현예에서, 대상체로의 치료적 유효량의 본원에 개시된 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 뉴로그라닌의 뇌척수액 수준의 감소를 초래한다. 일부 구현예에서, 대상체로의 치료적 유효량의 본원에 개시된 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 조성물의 투여 18개월 후에 기준선에 비하여 뉴로그라닌의 뇌척수액 수준의 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9% 또는 적어도 10%의 감소를 초래한다.
일부 구현예에서, 대상체로의 치료적 유효량의 본원에 개시된 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 기준선에 비하여 뉴로그라닌의 뇌척수액 수준의 적어도 약 25 pg/㎖, 적어도 약 30 pg/㎖, 적어도 약 35 pg/㎖, 적어도 약 40 pg/㎖, 적어도 약 45 pg/㎖, 적어도 약 50 pg/㎖, 적어도 약 55 pg/㎖, 적어도 약 60 pg/㎖ 또는 적어도 약 65 pg/㎖의 감소를 초래한다. 일부 구현예에서, 대상체로의 치료적 유효량의 본원에 개시된 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 기준선에 비하여 뉴로그라닌의 뇌척수액 수준의 적어도 약 65 pg/㎖의 감소를 초래한다.
일부 구현예에서, 대상체로의 치료적 유효량의 본원에 개시된 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 기준선에 비하여 뉴로그라닌의 뇌척수액 수준의 적어도 약 25 pg/㎖, 적어도 약 30 pg/㎖, 적어도 약 35 pg/㎖, 적어도 약 40 pg/㎖, 적어도 약 45 pg/㎖, 적어도 약 50 pg/㎖, 적어도 약 55 pg/㎖, 적어도 약 60 pg/㎖ 또는 적어도 약 65 pg/㎖의 감소를 초래한다. 일부 구현예에서, 대상체로의 치료적 유효량의 본원에 개시된 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 조성물의 투여 18개월 후에 기준선에 비하여 뉴로그라닌의 뇌척수액 수준의 적어도 65 pg/㎖의 감소를 초래한다.
일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체의 치료적 유효량은 10 ㎎/㎏이다. 일부 구현예에서, 치료적 유효량의 본원에 개시된 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물은 2주마다 또는 매달 투여된다. 일부 구현예에서, 10 ㎎/㎏의 BAN2401을 포함하는 조성물은 2주마다 투여된다. 일부 구현예에서, 10 ㎎/㎏의 BAN2401을 포함하는 조성물은 매달 투여된다.
신경필라멘트 경쇄의 뇌척수액 수준
일부 구현예에서, 대상체로의 치료적 유효량의 본원에 개시된 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 위약에 비하여 신경필라멘트 경쇄의 뇌척수액 수준의 감소를 초래한다. 일부 구현예에서, 대상체로의 치료적 유효량의 본원에 개시된 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 위약에 비하여 신경필라멘트 경쇄의 뇌척수액 수준의 적어도 5%, 적어도 10%, 적어도 15%, 적어도 20%, 적어도 25%, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 45% 또는 적어도 50%의 감소를 초래한다.
일부 구현예에서, 대상체로의 치료적 유효량의 본원에 개시된 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 조성물의 투여 18개월 후에 위약에 비하여 신경필라멘트 경쇄의 뇌척수액 수준의 감소를 초래한다. 일부 구현예에서, 대상체로의 치료적 유효량의 본원에 개시된 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 조성물의 투여 18개월 후에 위약에 비하여 신경필라멘트 경쇄의 뇌척수액 수준의 기준선에 비한 적어도 5%, 적어도 10%, 적어도 15%, 적어도 20%, 적어도 25%, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 45% 또는 적어도 50%의 감소를 초래한다.
일부 구현예에서, 대상체로의 치료적 유효량의 본원에 개시된 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 기준선에 비하여 신경필라멘트 경쇄의 뇌척수액 수준의 약 35 pg/㎖, 약 40 pg/㎖, 약 45 pg/㎖, 약 50 pg/㎖, 약 55 pg/㎖, 약 60 pg/㎖, 약 65 pg/㎖, 약 70 pg/㎖, 약 75 pg/㎖ 초과의 생성을 초래한다. 일부 구현예에서, 대상체로의 치료적 유효량의 본원에 개시된 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 기준선에 비하여 신경필라멘트 경쇄의 뇌척수액 수준의 약 75 pg/㎖ 이하의 생성을 초래한다.
일부 구현예에서, 대상체로의 치료적 유효량의 본원에 개시된 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 조성물의 투여 18개월 후에 기준선에 비하여 신경필라멘트 경쇄의 뇌척수액 수준의 약 35 pg/㎖, 약 40 pg/㎖, 약 45 pg/㎖, 약 50 pg/㎖, 약 55 pg/㎖, 약 60 pg/㎖, 약 65 pg/㎖, 약 70 pg/㎖, 약 75 pg/㎖ 초과의 생성을 초래한다. 일부 구현예에서, 대상체로의 치료적 유효량의 본원에 개시된 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 조성물의 투여 18개월 후에 기준선에 비하여 신경필라멘트 경쇄의 뇌척수액 수준의 약 75 pg/㎖ 이하의 생성을 초래한다.
일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 본원에 개시된 적어도 하나의 항-Aβ 프로토피브릴 항체의 치료적 유효량은 10 ㎎/㎏이다. 일부 구현예에서, 치료적 유효량의 본원에 개시된 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물은 2주마다 또는 매달 투여된다. 일부 구현예에서, 10 ㎎/㎏의 BAN2401을 포함하는 조성물은 2주마다 투여된다. 일부 구현예에서, 10 ㎎/㎏의 BAN2401을 포함하는 조성물은 매달 투여된다.
포스포-Tau의 뇌척수액 수준
일부 구현예에서, 대상체로의 치료적 유효량의 본원에 개시된 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 포스포-Tau의 뇌척수액 수준의 감소를 초래한다. 일부 구현예에서, 대상체로의 치료적 유효량의 본원에 개시된 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 기준선에 비하여 포스포-Tau의 뇌척수액 수준의 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12% 또는 적어도 13%의 감소를 초래한다.
일부 구현예에서, 대상체로의 치료적 유효량의 본원에 개시된 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 조성물의 투여 18개월 후에 포스포-Tau의 뇌척수액 수준의 감소를 초래한다. 일부 구현예에서, 대상체로의 치료적 유효량의 본원에 개시된 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 기준선에 비하여 포스포-Tau의 뇌척수액 수준의 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12% 또는 적어도 13%의 감소를 초래한다.
일부 구현예에서, 대상체로의 치료적 유효량의 본원에 개시된 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 기준선에 비하여 포스포-Tau의 뇌척수액 수준의 적어도 약 65 pg/㎖, 적어도 약 70 pg/㎖, 적어도 약 75 pg/㎖, 적어도 약 80 pg/㎖, 적어도 약 85 pg/㎖, 적어도 약 90 pg/㎖ 또는 적어도 약 95 pg/㎖의 감소를 초래한다. 일부 구현예에서, 대상체로의 치료적 유효량의 본원에 개시된 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 기준선에 비하여 포스포-Tau의 뇌척수액 수준의 적어도 약 95 pg/㎖의 감소를 초래한다.
일부 구현예에서, 대상체로의 치료적 유효량의 본원에 개시된 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 기준선에 비하여 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 포스포-Tau의 뇌척수액 수준의 적어도 약 65 pg/㎖, 적어도 약 70 pg/㎖, 적어도 약 75 pg/㎖, 적어도 약 80 pg/㎖, 적어도 약 85 pg/㎖, 적어도 약 90 pg/㎖ 또는 적어도 약 95 pg/㎖의 감소를 초래한다. 일부 구현예에서, 대상체로의 치료적 유효량의 본원에 개시된 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 기준선에 비하여 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 포스포-Tau의 뇌척수액 수준의 적어도 95 pg/㎖의 감소를 초래한다.
일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체의 치료적 유효량은 10 ㎎/㎏이다. 일부 구현예에서, 치료적 유효량의 본원에 개시된 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물은 2주마다 또는 매달 투여된다. 일부 구현예에서, 10 ㎎/㎏의 BAN2401을 포함하는 조성물은 2주마다 투여된다. 일부 구현예에서, 10 ㎎/㎏의 BAN2401을 포함하는 조성물은 매달 투여된다.
알츠하이머병의 치료 방법
임상적 저하의 감소
치료적 유효량의 본원에 개시된 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물을 초기 알츠하이머병을 갖는 대상체에게 투여하는 단계를 포함하는 초기 알츠하이머병을 갖는 대상체의 치료 방법이 본원에 제공되며, 대상체의 임상적 저하는 조성물의 투여 6개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 35%, 조성물의 투여 12개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 30% 및/또는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 25% 감소된다. 일부 구현예에서, 초기 알츠하이머병을 갖는 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받고/받거나 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 초기 알츠하이머병을 갖는 대상체는 ApoE4-양성이다.
본원에 개시된 항-Aβ 프로토피브릴 항체, 그의 치료적으로 허용 가능한 양, 그에 대한 투여 섭생법 및 이를 포함하는 조성물 중 임의의 것은 초기 알츠하이머병을 갖는 대상체에서의 임상적 저하의 감소 방법에 사용될 수 있다. 예를 들어, 일부 구현예에서, 대상체의 체중에 비하여 2.5 ㎎/㎏, 5 ㎎/㎏, 7.5 ㎎/㎏ 또는 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체, 예컨대, BAN2401을 포함하는 조성물이 대상체에게 매주 1회, 2주마다 1회, 3주마다 1회, 4주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45% 또는 적어도 46% 감소된다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 20% 내지 35% 감소된다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 20% 내지 30% 감소된다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 27% 내지 35% 감소된다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 20% 감소된다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 35% 감소된다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 적어도 20% 감소된다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 적어도 30% 감소된다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 45% 감소된다. 일부 구현예에서, 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 35% 감소된다. 일부 구현예에서, 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 30% 감소된다. 일부 구현예에서, 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 46% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51% 또는 적어도 52% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 28% 내지 33% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 20%, 예컨대, 25% 또는 적어도 28% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 25%, 예컨대, 적어도 30% 또는 적어도 33% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 25%, 예컨대, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 45%, 적어도 50% 또는 적어도 52% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 52% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 30% 감소된다. 일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 25% 감소된다. 일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 30% 감소된다. 일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 52% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32% 또는 적어도 33% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 28% 내지 38% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 20%, 예컨대, 25%, 적어도 28% 또는 적어도 33% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 25%, 예컨대, 적어도 30% 또는 적어도 33% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 33% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 33% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77% 또는 적어도 78% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 20% 내지 80% 감소되며, 대상체는 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 35% 내지 78% 감소되며, 대상체는 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 35% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 50%, 예컨대, 적어도 52% 또는 적어도 53% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 70%, 예컨대, 적어도 75% 또는 적어도 78% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 70% 감소된다. 일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 50% 감소된다. 일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 30% 감소된다. 일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 52% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34% 또는 적어도 35% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 28% 내지 38% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 20%, 예컨대, 25%, 적어도 28% 또는 적어도 35% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 25%, 예컨대, 적어도 30% 또는 적어도 35% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 35% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 35% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 100%, 적어도 110%, 적어도 120%, 적어도 130%, 적어도 140% 또는 적어도 150% 감소된다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 40% 내지 150% 감소된다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 45% 내지 145% 감소된다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 45% 내지 55% 감소된다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 30% 감소된다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 35% 감소된다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 적어도 40% 감소된다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 적어도 45% 감소된다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 적어도 47% 감소된다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 100%, 예컨대, 적어도 120% 또는 적어도 140% 감소된다. 일부 구현예에서, 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 40%, 예컨대, 적어도 45% 감소된다. 일부 구현예에서, 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 40%, 예컨대, 적어도 45% 감소된다. 일부 구현예에서, 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 47% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 56%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57% 또는 적어도 58% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 50% 내지 70% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 50%, 예컨대, 52%, 적어도 55% 또는 적어도 58% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 58% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 58% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40% 또는 적어도 41% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 30% 내지 50% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 35%, 예컨대, 38%, 적어도 40% 또는 적어도 41% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 41% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 41% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39% 또는 적어도 40% 감소된다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 20% 내지 60% 감소된다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 25% 내지 60% 감소된다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 25% 내지 50% 감소된다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 20% 감소된다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 30% 감소된다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 적어도 25%, 예컨대, 적어도 26% 또는 적어도 28% 감소된다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 적어도 30%, 예컨대, 적어도 35% 또는 적어도 38% 감소된다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 30%, 예컨대, 적어도 35% 또는 적어도 40% 감소된다. 일부 구현예에서, 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 30%, 예컨대, 적어도 35% 또는 적어도 45% 감소된다. 일부 구현예에서, 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 20%, 예컨대, 적어도 25% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13% 또는 적어도 14% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 10% 내지 20% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 5%, 예컨대, 10%, 적어도 12% 또는 적어도 14% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 14% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 14% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50% 또는 적어도 51% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 40% 내지 60% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 45%, 예컨대, 48%, 적어도 50% 또는 적어도 51% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 51% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 51% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 2개월, 3개월, 4개월, 5개월, 6개월, 7개월, 8개월, 9개월, 10개월, 11개월, 12개월, 13개월, 14개월, 15개월, 16개월, 17개월, 18개월, 19개월, 20개월, 21개월, 22개월, 23개월, 24개월, 30개월, 36개월, 42개월, 48개월, 54개월, 60개월, 63개월, 66개월 및/또는 72개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 60개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 BAN2401을 포함하는 조성물의 투여 후에 결정된다.
일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 BAN2401을 포함하는 조성물의 투여 1개월, 2개월, 3개월, 4개월, 5개월, 6개월, 7개월, 8개월, 9개월, 10개월, 11개월, 12개월, 13개월, 14개월, 15개월, 16개월, 17개월, 18개월, 19개월, 20개월, 21개월, 22개월, 23개월, 24개월, 30개월, 36개월, 42개월, 48개월, 54개월, 60개월, 63개월, 66개월 및/또는 72개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 BAN2401을 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 BAN2401을 포함하는 조성물의 투여 1개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 BAN2401을 포함하는 조성물의 투여 6개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 BAN2401을 포함하는 조성물의 투여 12개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 BAN2401을 포함하는 조성물의 투여 18개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 BAN2401을 포함하는 조성물의 투여 60개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 BAN2401을 포함하는 조성물의 투여 63개월 후에 결정된다.
일부 구현예에서, 대상체는 ApoE4-양성이다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73% 또는 적어도 74% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 60% 내지 80%, 예컨대, 63% 내지 74% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 60%, 예컨대, 적어도 63% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 65%, 예컨대, 적어도 67% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 70%, 예컨대, 적어도 74% 감소되며, 대상체는 ApoE4-양성이다.
일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 70% 감소된다. 일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 60% 감소된다. 일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 50%, 예컨대, 적어도 55% 또는 적어도 60% 감소된다. 일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 63% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99%, 적어도 100%, 적어도 101%, 적어도 102%, 적어도 103%, 적어도 104%, 적어도 105%, 적어도 106%, 적어도 107%, 적어도 108%, 적어도 109%, 적어도 110%, 적어도 115%, 적어도 120%, 적어도 125%, 적어도 130%, 적어도 135%, 적어도 140%, 적어도 145%, 적어도 150%, 적어도 155%, 적어도 160%, 적어도 165%, 적어도 170%, 적어도 175%, 적어도 180%, 적어도 185%, 적어도 190%, 적어도 195%, 적어도 200%, 적어도 205%, 적어도 210%, 적어도 215%, 적어도 220%, 적어도 225%, 적어도 230%, 적어도 235%, 적어도 240%, 적어도 245%, 적어도 250%, 적어도 255%, 적어도 260%, 적어도 265%, 적어도 270%, 적어도 275%, 적어도 280%, 적어도 290%, 적어도 295%, 적어도 300%, 적어도 305%, 적어도 310%, 적어도 315%, 적어도 320%, 적어도 325%, 적어도 330% 또는 적어도 331% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 70% 내지 400%, 예컨대, 80% 내지 350% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 70%, 예컨대, 적어도 75% 또는 적어도 80% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 80%, 예컨대, 적어도 90% 또는 적어도 100% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 300%, 예컨대, 적어도 330% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 300% 감소된다. 일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 80%, 예컨대, 적어도 90% 또는 적어도 100% 감소된다. 일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 70%, 예컨대, 적어도 75%, 적어도 80% 또는 적어도 84% 감소된다. 일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 84% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86% 또는 적어도 87% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 35% 내지 150%, 예컨대, 40% 내지 100% 또는 45% 내지 90% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 35%, 예컨대, 적어도 40% 또는 적어도 45% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 50%, 예컨대, 적어도 55% 또는 적어도 60% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 70%, 예컨대, 적어도 80% 또는 적어도 85% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 35%, 예컨대, 적어도 40% 또는 적어도 45% 감소된다. 일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 70%, 예컨대, 적어도 75% 또는 적어도 80% 감소된다. 일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 50%, 예컨대, 적어도 55% 또는 적어도 60% 감소된다. 일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 60% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58% 또는 적어도 59% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 30% 내지 70%, 예컨대, 38% 내지 59% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 30%, 예컨대, 적어도 35% 또는 적어도 38% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 45%, 예컨대, 적어도 50% 또는 적어도 53% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 50%, 예컨대, 적어도 55% 또는 적어도 59% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 50%, 예컨대, 적어도 55% 감소된다. 일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 30%, 예컨대, 적어도 35% 감소된다. 일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 45%, 예컨대, 적어도 50% 또는 적어도 55% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99%, 적어도 100%, 적어도 101%, 적어도 102%, 적어도 103%, 적어도 104%, 적어도 105%, 적어도 106%, 적어도 107%, 적어도 108%, 적어도 109%, 적어도 110%, 적어도 115%, 적어도 120%, 적어도 125%, 적어도 130%, 적어도 135%, 적어도 140%, 적어도 145%, 적어도 150%, 적어도 155%, 적어도 160%, 적어도 165%, 적어도 170%, 적어도 175%, 적어도 180%, 적어도 185%, 적어도 190%, 적어도 195%, 적어도 200%, 적어도 205%, 적어도 210% 또는 적어도 211% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 100%, 예컨대, 적어도 110% 감소된다. 일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 100%, 예컨대, 적어도 110% 감소된다. 일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 65%, 예컨대, 적어도 70% 또는 적어도 75% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99%, 적어도 100%, 적어도 101%, 적어도 102%, 적어도 103%, 적어도 104%, 적어도 105%, 적어도 106%, 적어도 107%, 적어도 108%, 적어도 109%, 적어도 110%, 적어도 115%, 적어도 120%, 적어도 125%, 적어도 130%, 적어도 135%, 적어도 140%, 적어도 145%, 적어도 150%, 적어도 155%, 적어도 160%, 적어도 165%, 적어도 170%, 적어도 175%, 적어도 180%, 적어도 185%, 적어도 190%, 적어도 195%, 적어도 200%, 적어도 205%, 적어도 210% 또는 적어도 211% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 40% 내지 300%, 예컨대, 45% 내지 250% 또는 50% 내지 250% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 40%, 예컨대, 적어도 45% 또는 적어도 50% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 60, 예컨대, 적어도 70%, 적어도 75% 또는 적어도 80% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 100%, 예컨대, 적어도 150% 또는 적어도 200% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 100%, 예컨대, 적어도 150% 또는 적어도 200% 감소된다. 일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 40%, 예컨대, 적어도 45% 또는 적어도 50% 감소된다. 일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 50%, 예컨대, 적어도 60%, 적어도 70% 또는 적어도 75% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44% 또는 적어도 45% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 20% 내지 90%, 예컨대, 25% 내지 80% 또는 30% 내지 75% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 25%, 예컨대, 적어도 30% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 30%, 예컨대, 적어도 35% 또는 40% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 35%, 예컨대, 적어도 40% 또는 45% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 CDR-SB 조성물에 의해 결정되는 바와 같이 위약에 비하여 적어도 35%, 예컨대, 적어도 40% 또는 적어도 45% 감소된다. 일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 20%, 예컨대, 적어도 25% 또는 적어도 30% 감소된다. 일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 35%, 예컨대, 적어도 40% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99%, 적어도 100%, 적어도 101%, 적어도 102%, 적어도 103%, 적어도 104%, 적어도 105%, 적어도 106%, 적어도 107%, 적어도 108%, 적어도 109%, 적어도 110%, 적어도 111%, 적어도 112%, 적어도 113%, 적어도 114%, 적어도 115%, 적어도 116%, 적어도 117%, 적어도 118% 또는 적어도 119% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 76% 내지 119% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 76% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 113% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 119% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99%, 적어도 100%, 적어도 101%, 적어도 102%, 적어도 103%, 적어도 104%, 적어도 105%, 적어도 106%, 적어도 107%, 적어도 108%, 적어도 109%, 적어도 110%, 적어도 111%, 적어도 112%, 적어도 113%, 적어도 114%, 적어도 115%, 적어도 116%, 적어도 117%, 적어도 118%, 적어도 119%, 적어도 120%, 적어도 121%, 적어도 122%, 적어도 123%, 적어도 124%, 적어도 125%, 적어도 126%, 적어도 127%, 적어도 128%, 적어도 129%, 적어도 130%, 적어도 131%, 적어도 132%, 적어도 133%, 적어도 134%, 적어도 135%, 적어도 136%, 적어도 137%, 적어도 138%, 적어도 139%, 적어도 140%, 적어도 141%, 적어도 142%, 적어도 143%, 적어도 144%, 적어도 145%, 적어도 146%, 적어도 147%, 적어도 148%, 적어도 149%, 적어도 150%, 적어도 151%, 적어도 152%, 적어도 153%, 적어도 154%, 적어도 155%, 적어도 156%, 적어도 157%, 적어도 158%, 적어도 159%, 적어도 160%, 적어도 161%, 적어도 162%, 적어도 163%, 적어도 164%, 적어도 165%, 적어도 166%, 적어도 167%, 적어도 168%, 적어도 169%, 적어도 170%, 적어도 171%, 적어도 172%, 적어도 173%, 적어도 174%, 적어도 175%, 적어도 176%, 적어도 177%, 적어도 178%, 적어도 179%, 적어도 180%, 적어도 190%, 적어도 200%, 적어도 210%, 적어도 220%, 적어도 230%, 적어도 240%, 적어도 250%, 적어도 275%, 적어도 300%, 적어도 325%, 적어도 350%, 적어도 375%, 적어도 400%, 적어도 425%, 적어도 450%, 적어도 475%, 적어도 500%, 적어도 550%, 적어도 600%, 적어도 650%, 적어도 700%, 적어도 750%, 적어도 800%, 적어도 850%, 적어도 900%, 적어도 950%, 적어도 1000%, 적어도 1001%, 적어도 1002%, 적어도 1003%, 적어도 1004%, 적어도 1005%, 적어도 1006%, 적어도 1007%, 적어도 1008%, 적어도 1009%, 적어도 1010%, 적어도 1011%, 적어도 1012%, 적어도 1013%, 적어도 1014%, 적어도 1015%, 적어도 1016%, 적어도 1017%, 적어도 1018%, 적어도 1019%, 적어도 1020%, 적어도 1021%, 적어도 1022% 또는 적어도 1023% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 58% 내지 1023% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 58% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 171% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 1023% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99%, 적어도 100%, 적어도 101%, 적어도 102%, 적어도 103%, 적어도 104%, 적어도 105%, 적어도 106%, 적어도 107%, 적어도 108%, 적어도 109%, 적어도 110%, 적어도 111%, 적어도 112%, 적어도 113%, 적어도 114%, 적어도 115%, 적어도 116%, 적어도 117%, 적어도 118%, 적어도 119%, 적어도 120%, 적어도 121%, 적어도 122%, 적어도 123%, 적어도 124%, 적어도 125%, 적어도 126%, 적어도 127%, 적어도 128%, 적어도 129%, 적어도 130%, 적어도 131%, 적어도 132%, 적어도 133%, 적어도 134%, 적어도 135%, 적어도 136%, 적어도 137%, 적어도 138%, 적어도 139%, 적어도 140%, 적어도 141%, 적어도 142%, 적어도 143%, 적어도 144%, 적어도 145%, 적어도 146%, 적어도 147%, 적어도 148%, 적어도 149%, 적어도 150%, 적어도 151%, 적어도 152%, 적어도 153%, 적어도 154%, 적어도 155%, 적어도 156%, 적어도 157%, 적어도 158%, 적어도 159%, 적어도 160%, 적어도 161%, 적어도 162%, 적어도 163%, 적어도 164%, 적어도 165%, 적어도 166%, 적어도 167%, 적어도 168%, 적어도 169%, 적어도 170%, 적어도 171%, 적어도 172%, 적어도 173% 또는 적어도 174% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 70% 내지 200%, 예컨대, 75% 내지 180% 또는 82% 내지 174% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 70%, 예컨대, 적어도 80% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 75%, 예컨대, 적어도 80% 또는 적어도 85% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 150%, 예컨대, 적어도 160% 또는 170% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 CDR-SB 조성물에 의해 결정되는 바와 같이 위약에 비하여 적어도 70%, 예컨대, 적어도 75%, 적어도 80% 또는 적어도 85% 감소된다. 일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 130%, 예컨대, 적어도 140%, 적어도 150%, 적어도 160% 또는 적어도 170% 감소된다. 일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 65%, 예컨대, 적어도 70%, 적어도 75% 또는 적어도 80% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 대상체는 ApoE4-음성이다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11% 또는 적어도 12% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 5% 내지 15% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 5%, 예컨대, 적어도 7% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 10%, 예컨대, 적어도 12% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, ApoE4-음성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 -2% 감소된다. 일부 구현예에서, ApoE4-음성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 10% 감소된다. 일부 구현예에서, ApoE4-음성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 5%, 예컨대, 적어도 7% 감소된다. 일부 구현예에서, ApoE4-음성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 7% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71% 또는 적어도 72% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 40% 내지 80% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 35%, 예컨대, 적어도 40% 또는 적어도 43% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 40%, 예컨대, 적어도 45% 또는 적어도 46% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 65%, 예컨대, 적어도 70% 또는 적어도 72% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 43% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 7%, 6%, 5%, 5%, 3%, 2% 또는 1% 증가되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2% 또는 적어도 3% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 3% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99%, 적어도 100%, 적어도 101%, 적어도 102%, 적어도 103%, 적어도 104%, 적어도 105%, 적어도 106%, 적어도 107%, 적어도 108%, 적어도 109%, 적어도 110%, 적어도 115%, 적어도 120%, 적어도 125%, 적어도 130%, 적어도 135%, 적어도 140%, 적어도 145%, 적어도 150%, 적어도 155%, 적어도 160%, 적어도 165% 또는 적어도 166% 감소되며, 대상체는 ApoE4-음성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 50% 내지 200%, 예컨대, 60% 내지 180% 또는 65% 내지 170% 감소되며, 대상체는 ApoE4-음성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 50%, 예컨대, 적어도 55% 또는 적어도 65% 감소되며, 대상체는 ApoE4-음성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 70%, 예컨대, 적어도 75% 또는 적어도 80% 감소되며, 대상체는 ApoE4-음성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 150%, 예컨대, 적어도 160% 감소되며, 대상체는 ApoE4-음성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, ApoE4-음성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 150%, 예컨대, 적어도 160% 감소된다. 일부 구현예에서, ApoE4-음성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 70%, 예컨대, 적어도 75% 또는 적어도 80% 감소된다. 일부 구현예에서, ApoE4-음성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 50%, 예컨대, 적어도 60% 또는 적어도 65% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4% 또는 적어도 5% 감소되며, 대상체는 ApoE4-음성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 5% 감소되며, 대상체는 ApoE4-음성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12% 감소되며, 대상체는 ApoE4-음성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 10%, 예컨대, 적어도 12% 감소되며, 대상체는 ApoE4-음성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 35% 내지 50% 감소되며, 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 35%, 예컨대, 38%, 적어도 40% 또는 적어도 41% 감소되며, 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 41% 감소되며, 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 BAN2401 이외의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 41% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58% 또는 적어도 59% 감소되며, 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 50% 내지 70% 감소되며, 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 50%, 예컨대, 55%, 적어도 57% 또는 적어도 59% 감소되며, 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 59% 감소되며, 대상체에는 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 59% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44% 또는 적어도 45% 감소되며, 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 50% 내지 70% 감소되며, 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 35%, 예컨대, 40%, 적어도 42% 또는 적어도 45% 감소되며, 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 45% 감소되며, 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 45% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
치료 이전의 중증도에 비하여 증상의 중증도의 감소를 초래하는 초기 알츠하이머병을 갖는 대상체의 치료
치료적 유효량의 본원에 개시된 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물을 초기 알츠하이머병을 갖는 대상체에게 투여하는 단계를 포함하는, 초기 알츠하이머병을 갖는 대상체의 치료 방법이 본원에 제공되며, 알츠하이머병과 연관된 적어도 하나의 증상의 중증도는 치료 이전의 동일한 대상체에서의 동일한 증상의 중증도에 비하여 적어도 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% 또는 95% 감소된다. 일부 구현예에서, 초기 알츠하이머병을 갖는 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받고/받거나 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 초기 알츠하이머병을 갖는 대상체는 ApoE4-양성이다.
일부 구현예에서, 알츠하이머병과 연관된 적어도 하나의 증상의 중증도는 적어도 1% 감소된다. 일부 구현예에서, 알츠하이머병과 연관된 적어도 하나의 증상의 중증도는 적어도 10% 감소된다. 일부 구현예에서, 알츠하이머병과 연관된 적어도 하나의 증상의 중증도는 적어도 20% 감소된다. 일부 구현예에서, 알츠하이머병과 연관된 적어도 하나의 증상의 중증도는 적어도 30% 감소된다. 일부 구현예에서, 알츠하이머병과 연관된 적어도 하나의 증상의 중증도는 적어도 40% 감소된다. 일부 구현예에서, 알츠하이머병과 연관된 적어도 하나의 증상의 중증도는 적어도 50% 감소된다. 일부 구현예에서, 알츠하이머병과 연관된 적어도 하나의 증상의 중증도는 적어도 60% 감소된다. 일부 구현예에서, 알츠하이머병과 연관된 적어도 하나의 증상의 중증도는 적어도 70% 감소된다. 일부 구현예에서, 알츠하이머병과 연관된 적어도 하나의 증상의 중증도는 적어도 80% 감소된다. 일부 구현예에서, 알츠하이머병과 연관된 적어도 하나의 증상의 중증도는 적어도 90% 감소된다. 일부 구현예에서, 알츠하이머병과 연관된 적어도 하나의 증상의 중증도는 적어도 95% 감소된다.
일부 구현예에서, 상기 열거된 중증도의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 알츠하이머병과 연관된 적어도 하나의 증상의 중증도는 ADCOMS, PET, MMSE, CDR-SB 및/또는 ADAS-Cog에 의해 결정된다.
일부 구현예에서, 알츠하이머병과 연관된 적어도 하나의 증상은 임상적 저하 및 뇌 아밀로이드 수준으로부터 선택된다.
본원에 개시된 항-Aβ 프로토피브릴 항체, 그의 치료적으로 허용 가능한 양, 그에 대한 투여 섭생법 및 이를 포함하는 조성물 중 임의의 것은 초기 알츠하이머병을 갖는 대상체의 치료 방법에서 사용될 수 있다. 예를 들어, 일부 구현예에서, 대상체의 체중에 비하여 2.5 ㎎/㎏, 5 ㎎/㎏, 7.5 ㎎/㎏ 또는 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체, 예컨대, BAN2401을 포함하는 조성물은 대상체에게 매주 1회, 2주마다 1회, 3주마다 1회, 4주마다 1회 또는 매달 1회 투여된다.
일부 구현예에서, 알츠하이머병과 연관된 적어도 하나의 증상은 임상적 저하이다.
일부 구현예에서, 알츠하이머병과 연관된 적어도 하나의 증상은 뇌 아밀로이드 수준이다.
일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 BAN2401을 포함하는 조성물의 투여 1개월, 2개월, 3개월, 4개월, 5개월, 6개월, 7개월, 8개월, 9개월, 10개월, 11개월, 12개월, 13개월, 14개월, 15개월, 16개월, 17개월, 18개월, 19개월, 20개월, 21개월, 22개월, 23개월, 24개월, 30개월, 36개월, 42개월, 48개월, 54개월, 60개월, 63개월, 66개월 및/또는 72개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 BAN2401을 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 BAN2401을 포함하는 조성물의 투여 1개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 BAN2401을 포함하는 조성물의 투여 6개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 BAN2401을 포함하는 조성물의 투여 12개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 BAN2401을 포함하는 조성물의 투여 18개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 BAN2401을 포함하는 조성물의 투여 60개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 BAN2401을 포함하는 조성물의 투여 63개월 후에 결정된다.
일부 구현예에서, 대상체는 ApoE4-양성이다.
일부 구현예에서, 대상체는 ApoE4-음성이다.
위약-치료된 대상체에서의 증상의 중증도에 비하여 증상의 중증도의 감소를 초래하는 초기 알츠하이머병을 갖는 대상체의 치료
치료적 유효량의 본원에 개시된 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물을 초기 알츠하이머병을 갖는 대상체에게 투여하는 단계를 포함하는, 초기 알츠하이머병을 갖는 대상체의 치료 방법이 본원에 제공되며, 알츠하이머병과 연관된 적어도 하나의 증상의 중증도는 위약을 제공받는 대상체에서의 동일한 증상의 중증도에 비하여 적어도 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% 또는 95% 감소된다. 일부 구현예에서, 초기 알츠하이머병을 갖는 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받고/받거나 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 초기 알츠하이머병을 갖는 대상체는 ApoE4-양성이다.
일부 구현예에서, 알츠하이머병과 연관된 적어도 하나의 증상의 중증도는 적어도 1% 감소된다. 일부 구현예에서, 알츠하이머병과 연관된 적어도 하나의 증상의 중증도는 적어도 10% 감소된다. 일부 구현예에서, 알츠하이머병과 연관된 적어도 하나의 증상의 중증도는 적어도 20% 감소된다. 일부 구현예에서, 알츠하이머병과 연관된 적어도 하나의 증상의 중증도는 적어도 30% 감소된다. 일부 구현예에서, 알츠하이머병과 연관된 적어도 하나의 증상의 중증도는 적어도 40% 감소된다. 일부 구현예에서, 알츠하이머병과 연관된 적어도 하나의 증상의 중증도는 적어도 50% 감소된다. 일부 구현예에서, 알츠하이머병과 연관된 적어도 하나의 증상의 중증도는 적어도 60% 감소된다. 일부 구현예에서, 알츠하이머병과 연관된 적어도 하나의 증상의 중증도는 적어도 70% 감소된다. 일부 구현예에서, 알츠하이머병과 연관된 적어도 하나의 증상의 중증도는 적어도 80% 감소된다. 일부 구현예에서, 알츠하이머병과 연관된 적어도 하나의 증상의 중증도는 적어도 90% 감소된다. 일부 구현예에서, 알츠하이머병과 연관된 적어도 하나의 증상의 중증도는 적어도 95% 감소된다.
일부 구현예에서, 상기 열거된 중증도의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 알츠하이머병과 연관된 적어도 하나의 증상의 중증도는 ADCOMS, PET, MMSE, CDR-SB 및/또는 ADAS-Cog에 의해 결정된다.
일부 구현예에서, 알츠하이머병과 연관된 적어도 하나의 증상은 임상적 저하 및 뇌 아밀로이드 수준으로부터 선택된다.
본원에 개시된 항-Aβ 프로토피브릴 항체, 그의 치료적으로 허용 가능한 양, 그에 대한 투여 섭생법 및 이를 포함하는 조성물 중 임의의 것은 초기 알츠하이머병을 갖는 대상체의 치료 방법에서 사용될 수 있다. 예를 들어, 일부 구현예에서, 대상체의 체중에 비하여 2.5 ㎎/㎏, 5 ㎎/㎏, 7.5 ㎎/㎏ 또는 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체, 예컨대, BAN2401을 포함하는 조성물은 대상체에게 매주 1회, 2주마다 1회, 3주마다 1회, 4주마다 1회 또는 매달 1회 투여된다.
일부 구현예에서, 알츠하이머병과 연관된 적어도 하나의 증상은 임상적 저하이다.
일부 구현예에서, 알츠하이머병과 연관된 적어도 하나의 증상은 뇌 아밀로이드 수준이다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45% 또는 적어도 46% 감소된다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 20% 내지 35% 감소된다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 20% 내지 30% 감소된다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 27% 내지 35% 감소된다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 20% 감소된다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 35% 감소된다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 적어도 20% 감소된다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 적어도 30% 감소된다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 45% 감소된다. 일부 구현예에서, 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 35% 감소된다. 일부 구현예에서, 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 30% 감소된다. 일부 구현예에서, 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 46% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51% 또는 적어도 52% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 28% 내지 33% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 20%, 예컨대, 25% 또는 적어도 28% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 25%, 예컨대, 적어도 30% 또는 적어도 33% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 25%, 예컨대, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 45%, 적어도 50% 또는 적어도 52% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 52% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 30% 감소된다. 일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 25% 감소된다. 일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 30% 감소된다. 일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 52% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32% 또는 적어도 33% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 28% 내지 38% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 20%, 예컨대, 25%, 적어도 28% 또는 적어도 33% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 25%, 예컨대, 적어도 30% 또는 적어도 33% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 33% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 33% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77% 또는 적어도 78% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 20% 내지 80% 감소되며, 대상체는 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 35% 내지 78% 감소되며, 대상체는 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 35% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 50%, 예컨대, 적어도 52% 또는 적어도 53% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 70%, 예컨대, 적어도 75% 또는 적어도 78% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 70% 감소된다. 일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 50% 감소된다. 일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 30% 감소된다. 일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 52% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34% 또는 적어도 35% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 28% 내지 38% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 20%, 예컨대, 25%, 적어도 28% 또는 적어도 35% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 25%, 예컨대, 적어도 30% 또는 적어도 35% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 35% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 35% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 100%, 적어도 110%, 적어도 120%, 적어도 130%, 적어도 140% 또는 적어도 150% 감소된다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 40% 내지 150% 감소된다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 45% 내지 145% 감소된다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 45% 내지 55% 감소된다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 30% 감소된다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 35% 감소된다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 적어도 40% 감소된다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 적어도 45% 감소된다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 적어도 47% 감소된다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 100%, 예컨대, 적어도 120% 또는 적어도 140% 감소된다. 일부 구현예에서, 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 40%, 예컨대, 적어도 45% 감소된다. 일부 구현예에서, 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 40%, 예컨대, 적어도 45% 감소된다. 일부 구현예에서, 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 47% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 56%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57% 또는 적어도 58% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 50% 내지 70% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 50%, 예컨대, 52%, 적어도 55% 또는 적어도 58% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 58% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 6장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 58% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40% 또는 적어도 41% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 30% 내지 50% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 35%, 예컨대, 38%, 적어도 40% 또는 적어도 41% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 41% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 41% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39% 또는 적어도 40% 감소된다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 20% 내지 60% 감소된다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 25% 내지 60% 감소된다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 25% 내지 50% 감소된다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 20% 감소된다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 30% 감소된다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 적어도 25%, 예컨대, 적어도 26% 또는 적어도 28% 감소된다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이, 적어도 30%, 예컨대, 적어도 35% 또는 적어도 38% 감소된다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 30%, 예컨대, 적어도 35% 또는 적어도 40% 감소된다. 일부 구현예에서, 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 30%, 예컨대, 적어도 35% 또는 적어도 45% 감소된다. 일부 구현예에서, 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 20%, 예컨대, 적어도 25% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13% 또는 적어도 14% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 10% 내지 20% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 5%, 예컨대, 10%, 적어도 12% 또는 적어도 14% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 14% 감소되며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 14% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%,적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50% 또는 적어도 51% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 40% 내지 60% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 45%, 예컨대, 48%, 적어도 50% 또는 적어도 51% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 51% 감소되며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 51% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 2개월, 3개월, 4개월, 5개월, 6개월, 7개월, 8개월, 9개월, 10개월, 11개월, 12개월, 13개월, 14개월, 15개월, 16개월, 17개월, 18개월, 19개월, 20개월, 21개월, 22개월, 23개월, 24개월, 30개월, 36개월, 42개월, 48개월, 54개월, 60개월, 63개월, 66개월 및/또는 72개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 60개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 BAN2401을 포함하는 조성물의 투여 후에 결정된다.
일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 BAN2401을 포함하는 조성물의 투여 1개월, 2개월, 3개월, 4개월, 5개월, 6개월, 7개월, 8개월, 9개월, 10개월, 11개월, 12개월, 13개월, 14개월, 15개월, 16개월, 17개월, 18개월, 19개월, 20개월, 21개월, 22개월, 23개월, 24개월, 30개월, 36개월, 42개월, 48개월, 54개월, 60개월, 63개월, 66개월 및/또는 72개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 BAN2401을 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 BAN2401을 포함하는 조성물의 투여 1개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 BAN2401을 포함하는 조성물의 투여 6개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 BAN2401을 포함하는 조성물의 투여 12개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 BAN2401을 포함하는 조성물의 투여 18개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 BAN2401을 포함하는 조성물의 투여 60개월 후에 결정된다. 일부 구현예에서, 임상적 저하의 감소는 치료적 유효량의 BAN2401을 포함하는 조성물의 투여 63개월 후에 결정된다.
일부 구현예에서, 대상체는 ApoE4-양성이다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73% 또는 적어도 74% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 60% 내지 80%, 예컨대, 63% 내지 74% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 60%, 예컨대, 적어도 63% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 65%, 예컨대, 적어도 67% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 70%, 예컨대, 적어도 74% 감소되며, 대상체는 ApoE4-양성이다.
일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 70% 감소된다. 일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 60% 감소된다. 일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 50%, 예컨대, 적어도 55% 또는 적어도 60% 감소된다. 일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 63% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99%, 적어도 100%, 적어도 101%, 적어도 102%, 적어도 103%, 적어도 104%, 적어도 105%, 적어도 106%, 적어도 107%, 적어도 108%, 적어도 109%, 적어도 110%, 적어도 115%, 적어도 120%, 적어도 125%, 적어도 130%, 적어도 135%, 적어도 140%, 적어도 145%, 적어도 150%, 적어도 155%, 적어도 160%, 적어도 165%, 적어도 170%, 적어도 175%, 적어도 180%, 적어도 185%, 적어도 190%, 적어도 195%, 적어도 200%, 적어도 205%, 적어도 210%, 적어도 215%, 적어도 220%, 적어도 225%, 적어도 230%, 적어도 235%, 적어도 240%, 적어도 245%, 적어도 250%, 적어도 255%, 적어도 260%, 적어도 265%, 적어도 270%, 적어도 275%, 적어도 280%, 적어도 290%, 적어도 295%, 적어도 300%, 적어도 305%, 적어도 310%, 적어도 315%, 적어도 320%, 적어도 325%, 적어도 330% 또는 적어도 331% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 70% 내지 400%, 예컨대, 80% 내지 350% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 70%, 예컨대, 적어도 75%, 적어도 80% 또는 적어도 84% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 84% 감소된다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 80%, 예컨대, 적어도 90% 또는 적어도 100% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 300%, 예컨대, 적어도 330% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 300% 감소된다. 일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 80%, 예컨대, 적어도 90% 또는 적어도 100% 감소된다. 일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 70%, 예컨대, 적어도 75%, 적어도 80% 또는 적어도 84% 감소된다. 일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 84% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86% 또는 적어도 87% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 35% 내지 150%, 예컨대, 40% 내지 100% 또는 45% 내지 90% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 35%, 예컨대, 적어도 40% 또는 적어도 45% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 50%, 예컨대, 적어도 55% 또는 적어도 60% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 70%, 예컨대, 적어도 80% 또는 적어도 85% 감소되며, 대상체는 ApoE4-양성이다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 35%, 예컨대, 적어도 40% 또는 적어도 45% 감소된다. 일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 70%, 예컨대, 적어도 75% 또는 적어도 80% 감소된다. 일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 50%, 예컨대, 적어도 55% 또는 적어도 60% 감소된다. 일부 구현예에서, ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 60% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58% 또는 적어도 59% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 30% 내지 70%, 예컨대, 38% 내지 59% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 30%, 예컨대, 적어도 35% 또는 적어도 38% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 45%, 예컨대, 적어도 50% 또는 적어도 53% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 50%, 예컨대, 적어도 55% 또는 적어도 59% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 50%, 예컨대, 적어도 55% 감소된다. 일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 30%, 예컨대, 적어도 35% 감소된다. 일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 45%, 예컨대, 적어도 50% 또는 적어도 55% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99%, 적어도 100%, 적어도 101%, 적어도 102%, 적어도 103%, 적어도 104%, 적어도 105%, 적어도 106%, 적어도 107%, 적어도 108%, 적어도 109%, 적어도 110%, 적어도 115%, 적어도 120%, 적어도 125%, 적어도 130%, 적어도 135%, 적어도 140%, 적어도 145%, 적어도 150%, 적어도 155%, 적어도 160%, 적어도 165%, 적어도 170%, 적어도 175%, 적어도 180%, 적어도 185%, 적어도 190%, 적어도 195%, 적어도 200%, 적어도 205%, 적어도 210% 또는 적어도 211% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 100%, 예컨대, 적어도 110% 감소된다. 일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 100%, 예컨대, 적어도 110% 감소된다. 일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 65%, 예컨대, 적어도 70% 또는 적어도 75% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99%, 적어도 100%, 적어도 101%, 적어도 102%, 적어도 103%, 적어도 104%, 적어도 105%, 적어도 106%, 적어도 107%, 적어도 108%, 적어도 109%, 적어도 110%, 적어도 115%, 적어도 120%, 적어도 125%, 적어도 130%, 적어도 135%, 적어도 140%, 적어도 145%, 적어도 150%, 적어도 155%, 적어도 160%, 적어도 165%, 적어도 170%, 적어도 175%, 적어도 180%, 적어도 185%, 적어도 190%, 적어도 195%, 적어도 200%, 적어도 205%, 적어도 210% 또는 적어도 211% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 40% 내지 300%, 예컨대, 45% 내지 250% 또는 50% 내지 250% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 40%, 예컨대, 적어도 45% 또는 적어도 50% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 60, 예컨대, 적어도 70%, 적어도 75% 또는 적어도 80% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 100%, 예컨대, 적어도 150% 또는 적어도 200% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 100%, 예컨대, 적어도 150% 또는 적어도 200% 감소된다. 일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 40%, 예컨대, 적어도 45% 또는 적어도 50% 감소된다. 일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 50%, 예컨대, 적어도 60%, 적어도 70% 또는 적어도 75% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44% 또는 적어도 45% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 20% 내지 90%, 예컨대, 25% 내지 80% 또는 30% 내지 75% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 25%, 예컨대, 적어도 30% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 30%, 예컨대, 적어도 35% 또는 40% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 35%, 예컨대, 적어도 40% 또는 45% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 CDR-SB 조성물에 의해 결정되는 바와 같이 위약에 비하여 적어도 35%, 예컨대, 적어도 40% 또는 적어도 45% 감소된다. 일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 20%, 예컨대, 적어도 25% 또는 적어도 30% 감소된다. 일부 구현예에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 35%, 예컨대, 적어도 40% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99%, 적어도 100%, 적어도 101%, 적어도 102%, 적어도 103%, 적어도 104%, 적어도 105%, 적어도 106%, 적어도 107%, 적어도 108%, 적어도 109%, 적어도 110%, 적어도 111%, 적어도 112%, 적어도 113%, 적어도 114%, 적어도 115%, 적어도 116%, 적어도 117%, 적어도 118% 또는 적어도 119% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 76% 내지 119% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 76% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 113% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 119% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99%, 적어도 100%, 적어도 101%, 적어도 102%, 적어도 103%, 적어도 104%, 적어도 105%, 적어도 106%, 적어도 107%, 적어도 108%, 적어도 109%, 적어도 110%, 적어도 111%, 적어도 112%, 적어도 113%, 적어도 114%, 적어도 115%, 적어도 116%, 적어도 117%, 적어도 118%, 적어도 119%, 적어도 120%, 적어도 121%, 적어도 122%, 적어도 123%, 적어도 124%, 적어도 125%, 적어도 126%, 적어도 127%, 적어도 128%, 적어도 129%, 적어도 130%, 적어도 131%, 적어도 132%, 적어도 133%, 적어도 134%, 적어도 135%, 적어도 136%, 적어도 137%, 적어도 138%, 적어도 139%, 적어도 140%, 적어도 141%, 적어도 142%, 적어도 143%, 적어도 144%, 적어도 145%, 적어도 146%, 적어도 147%, 적어도 148%, 적어도 149%, 적어도 150%, 적어도 151%, 적어도 152%, 적어도 153%, 적어도 154%, 적어도 155%, 적어도 156%, 적어도 157%, 적어도 158%, 적어도 159%, 적어도 160%, 적어도 161%, 적어도 162%, 적어도 163%, 적어도 164%, 적어도 165%, 적어도 166%, 적어도 167%, 적어도 168%, 적어도 169%, 적어도 170%, 적어도 171%, 적어도 172%, 적어도 173%, 적어도 174%, 적어도 175%, 적어도 176%, 적어도 177%, 적어도 178%, 적어도 179%, 적어도 180%, 적어도 190%, 적어도 200%, 적어도 210%, 적어도 220%, 적어도 230%, 적어도 240%, 적어도 250%, 적어도 275%, 적어도 300%, 적어도 325%, 적어도 350%, 적어도 375%, 적어도 400%, 적어도 425%, 적어도 450%, 적어도 475%, 적어도 500%, 적어도 550%, 적어도 600%, 적어도 650%, 적어도 700%, 적어도 750%, 적어도 800%, 적어도 850%, 적어도 900%, 적어도 950%, 적어도 1000%, 적어도 1001%, 적어도 1002%, 적어도 1003%, 적어도 1004%, 적어도 1005%, 적어도 1006%, 적어도 1007%, 적어도 1008%, 적어도 1009%, 적어도 1010%, 적어도 1011%, 적어도 1012%, 적어도 1013%, 적어도 1014%, 적어도 1015%, 적어도 1016%, 적어도 1017%, 적어도 1018%, 적어도 1019%, 적어도 1020%, 적어도 1021%, 적어도 1022% 또는 적어도 1023% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 58% 내지 1023% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 58% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 171% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 1023% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99%, 적어도 100%, 적어도 101%, 적어도 102%, 적어도 103%, 적어도 104%, 적어도 105%, 적어도 106%, 적어도 107%, 적어도 108%, 적어도 109%, 적어도 110%, 적어도 111%, 적어도 112%, 적어도 113%, 적어도 114%, 적어도 115%, 적어도 116%, 적어도 117%, 적어도 118%, 적어도 119%, 적어도 120%, 적어도 121%, 적어도 122%, 적어도 123%, 적어도 124%, 적어도 125%, 적어도 126%, 적어도 127%, 적어도 128%, 적어도 129%, 적어도 130%, 적어도 131%, 적어도 132%, 적어도 133%, 적어도 134%, 적어도 135%, 적어도 136%, 적어도 137%, 적어도 138%, 적어도 139%, 적어도 140%, 적어도 141%, 적어도 142%, 적어도 143%, 적어도 144%, 적어도 145%, 적어도 146%, 적어도 147%, 적어도 148%, 적어도 149%, 적어도 150%, 적어도 151%, 적어도 152%, 적어도 153%, 적어도 154%, 적어도 155%, 적어도 156%, 적어도 157%, 적어도 158%, 적어도 159%, 적어도 160%, 적어도 161%, 적어도 162%, 적어도 163%, 적어도 164%, 적어도 165%, 적어도 166%, 적어도 167%, 적어도 168%, 적어도 169%, 적어도 170%, 적어도 171%, 적어도 172%, 적어도 173% 또는 적어도 174% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 70% 내지 200%, 예컨대, 75% 내지 180% 또는 82% 내지 174% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 70%, 예컨대, 적어도 80% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 75%, 예컨대, 적어도 80% 또는 적어도 85% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 150%, 예컨대, 적어도 160% 또는 170% 감소되며, 대상체는 ApoE4-양성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 CDR-SB 조성물에 의해 결정되는 바와 같이 위약에 비하여 적어도 70%, 예컨대, 적어도 75%, 적어도 80% 또는 적어도 85% 감소된다. 일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 130%, 예컨대, 적어도 140%, 적어도 150%, 적어도 160% 또는 적어도 170% 감소된다. 일부 구현예에서, 경증 알츠하이머병 치매를 갖는 것으로 진단받은 ApoE4-양성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 65%, 예컨대, 적어도 70%, 적어도 75% 또는 적어도 80% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 대상체는 ApoE4-음성이다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11% 또는 적어도 12% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 5% 내지 15% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 5%, 예컨대, 적어도 7% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 10%, 예컨대, 적어도 12% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, ApoE4-음성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 -2% 감소된다. 일부 구현예에서, ApoE4-음성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 10% 감소된다. 일부 구현예에서, ApoE4-음성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 5%, 예컨대, 적어도 7% 감소된다. 일부 구현예에서, ApoE4-음성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 7% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71% 또는 적어도 72% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 40% 내지 80% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 35%, 예컨대, 적어도 40% 또는 적어도 43% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 40%, 예컨대, 적어도 45% 또는 적어도 46% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 65%, 예컨대, 적어도 70% 또는 적어도 72% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 43% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 7%, 6%, 5%, 5%, 3%, 2% 또는 1% 증가되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2% 또는 적어도 3% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 3% 감소되며, 대상체는 ApoE4-음성이다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25% 또는 적어도 26% 감소되며, 대상체는 ApoE4-음성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 15% 내지 26% 감소되며, 대상체는 ApoE4-음성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 15% 감소되며, 대상체는 ApoE4-음성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 26% 감소되며, 대상체는 ApoE4-음성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99%, 적어도 100%, 적어도 101%, 적어도 102%, 적어도 103%, 적어도 104%, 적어도 105%, 적어도 106%, 적어도 107%, 적어도 108%, 적어도 109%, 적어도 110%, 적어도 115%, 적어도 120%, 적어도 125%, 적어도 130%, 적어도 135%, 적어도 140%, 적어도 145%, 적어도 150%, 적어도 155%, 적어도 160%, 적어도 165% 또는 적어도 166% 감소되며, 대상체는 ApoE4-음성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 50% 내지 200%, 예컨대, 60% 내지 180% 또는 65% 내지 170% 감소되며, 대상체는 ApoE4-음성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 50%, 예컨대, 적어도 55% 또는 적어도 65% 감소되며, 대상체는 ApoE4-음성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 70%, 예컨대, 적어도 75% 또는 적어도 80% 감소되며, 대상체는 ApoE4-음성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 임상적 저하는 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 150%, 예컨대, 적어도 160% 감소되며, 대상체는 ApoE4-음성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, ApoE4-음성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 6개월 후에 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 150%, 예컨대, 적어도 160% 감소된다. 일부 구현예에서, ApoE4-음성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 70%, 예컨대, 적어도 75% 또는 적어도 80% 감소된다. 일부 구현예에서, ApoE4-음성 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 50%, 예컨대, 적어도 60% 또는 적어도 65% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4% 또는 적어도 5% 감소되며, 대상체는 ApoE4-음성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 5% 감소되며, 대상체는 ApoE4-음성이며, 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12% 감소되며, 대상체는 ApoE4-음성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 10%, 예컨대, 적어도 12% 감소되며, 대상체는 ApoE4-음성이며, 대상체는 경증 알츠하이머병 치매를 갖는 것으로 진단받는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 35% 내지 50% 감소되며, 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 35%, 예컨대, 38%, 적어도 40% 또는 적어도 41% 감소되며, 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는다. 일부 구현예에서, 임상적 저하는 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 41% 감소되며, 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 BAN2401 이외의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 41% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58% 또는 적어도 59% 감소되며, 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 50% 내지 70% 감소되며, 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 50%, 예컨대, 55%, 적어도 57% 또는 적어도 59% 감소되며, 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는다. 일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 59% 감소되며, 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 59% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44% 또는 적어도 45% 감소되며, 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, 임상적 저하는 ADAS-cog에 의해 결정되는 바와 같이 위약에 비하여 50% 내지 70% 감소되며, 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 35%, 예컨대, 40%, 적어도 42% 또는 적어도 45% 감소되며, 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는다. 일부 구현예에서, 임상적 저하는 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 45% 감소되며, 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는다. 일부 구현예에서, 상기 열거된 임상적 저하의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 1개월, 6개월, 12개월, 18개월, 60개월 및/또는 63개월 후에 결정된다.
일부 구현예에서, BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는 대상체에서의 임상적 저하는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 45% 감소된다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
알츠하이머병의 예방 및/또는 이의 발병의 지연
또한, ApoE4-양성 대상체에서의 알츠하이머병의 예방 및/또는 이의 발병의 지연 방법이 본원에 제공된다. 일부 구현예에서, 상기 방법은 대상체의 뇌 아밀로이드 수준을 결정하는 단계 및 그 다음, 대상체의 뇌 아밀로이드 수준이 미리 결정된 제1 수준 초과이면, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물을 투여하는 단계를 포함한다.
일부 구현예에서, 당해 방법은 대상체의 투여-후 뇌 아밀로이드 수준을 측정하는 단계를 추가로 포함한다.
일부 구현예에서, 당해 방법은 Aβ1-42의 뇌척수액 수준 및/또는 뇌척수액 전체 tau 수준을 결정하는 단계를 추가로 포함한다.
일부 구현예에서, 당해 방법은 뉴로그라닌의 뇌척수액 수준을 결정하는 단계를 추가로 포함한다.
일부 구현예에서, 당해 방법은 신경필라멘트 경쇄의 뇌척수액 수준을 결정하는 단계를 추가로 포함한다.
일부 구현예에서, 상기 방법은 투여-후 뇌 아밀로이드 수준이 미리 결정된 제2 수준 초과이면, 조성물을 투여하는 단계를 추가로 포함한다.
일부 구현예에서, 상기 방법은 투여 후에 대상체의 뇌 아밀로이드 수준이 미리 결정된 제1 수준 미만이 될 때까지 대상체의 뇌 아밀로이드 수준을 모니터링하는 단계를 추가로 포함한다.
일부 구현예에서, 상기 방법은 Aβ1-42의 투여-후 뇌척수액 수준 및/또는 뇌척수액 전체 tau 수준이 미리 결정된 수준 초과이면, 조성물을 투여하는 단계를 추가로 포함한다.
일부 구현예에서, 상기 방법은 뉴로그라닌의 투여-후 뇌척수액 수준이 미리 결정된 수준 초과이면, 조성물을 투여하는 단계를 추가로 포함한다.
일부 구현예에서, 상기 방법은 투여-후 신경필라멘트 경쇄가 미리 결정된 수준 초과이면, 조성물을 투여하는 단계를 추가로 포함한다.
일부 구현예에서, 상기 방법은 적어도 하나의 추가의 치료제를 투여하는 단계를 추가로 포함한다. 일부 구현예에서, 적어도 하나의 추가의 치료제는 BACE 저해제, 감마 세크레타제 저해제, 감마 세크레타제 조절제, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체 이외의 Aβ 펩티드 생성 저해제, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체 이외의 Aβ 펩티드 수준을 낮추는 작용제 및 그의 조합으로부터 선택된다. 일부 구현예에서, 적어도 하나의 추가의 치료제는 BACE 저해제이다. 일부 구현예에서, BACE 저해제는 CNP520, BI-1181181, LY2886721, LY3202626, PF-06751979, RG7129, 아타베세스타트(atabecestat), 엘렌베세스타트(elenbecestat), 라나베세스타트(lanabecestat) 및 베루베세스타트(verubecestat)로부터 선택된다. 일부 구현예에서, BACE 저해제는 엘렌베세스타트이다.
본원에 개시된 항-Aβ 프로토피브릴 항체, 그의 치료적으로 허용 가능한 양, 그에 대한 투여 섭생법 및 이를 포함하는 조성물 중 임의의 것은 초기 알츠하이머병을 갖는 대상체에서의 뇌 아밀로이드 수준의 감소 방법에 사용될 수 있다. 예를 들어, 일부 구현예에서, 대상체의 체중에 비하여 2.5 ㎎/㎏, 5 ㎎/㎏, 7.5 ㎎/㎏ 또는 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체, 예컨대, BAN2401을 포함하는 조성물은 대상체에게 매주 1회, 2주마다 1회, 3주마다 1회, 4주마다 1회 또는 매달 1회 투여된다.
일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2041이다.
일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99% 또는 100%의 대상체가 아밀로이드 음성이 되도록 초래한다.
일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이 75% 내지 100%, 예컨대, 80% 내지 100% 또는 85% 내지 100%의 대상체가 아밀로이드 음성이 되도록 초래한다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이 적어도 75%, 예컨대, 적어도 80% 또는 적어도 85%의 대상체가 아밀로이드 음성이 되도록 초래한다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이 100%의 대상체가 아밀로이드 음성이 되도록 초래한다.
일부 구현예에서, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이 적어도 75%, 예컨대, 적어도 80% 또는 적어도 85%의 대상체가 아밀로이드 음성이다. 일부 구현예에서, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이 적어도 75%, 예컨대, 적어도 80%, 적어도 85%, 적어도 90% 또는 적어도 95%의 대상체가 아밀로이드 음성이다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 당해 방법은 투여 이후에, 투여 이전의 뇌 아밀로이드 수준에 비하여 감소된 뇌 아밀로이드 수준을 초래한다. 일부 구현예에서, 뇌 아밀로이드 수준은 상기 투여 이전의 뇌 아밀로이드 수준에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99% 또는 100% 감소된다. 일부 구현예에서, 상기 열거된 뇌 아밀로이드 수준의 감소는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되며, PET 표준 섭취 계수비(SUVr 값)로서 표현된다.
일부 구현예에서, 대상체의 PET SUVr 값의 보정 평균 변화는 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 이전의 뇌 아밀로이드 수준에 비하여 적어도 -0.10, 적어도 -0.15, 적어도 -0.20, 적어도 -0.25, 적어도 -0.30, 적어도 -0.35, 적어도 -0.40, 적어도 -0.45, 적어도 -0.50, 적어도 -0.55, 적어도 -0.60, 적어도 -0.65, 적어도 -0.70, 적어도 -0.75, 적어도 -0.80, 적어도 -0.85, 적어도 -0.90 또는 적어도 -0.95 감소된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 이전의 뇌 아밀로이드 수준으로부터의 대상체의 PET SUVr 값의 보정 평균 변화는 -0.20 내지 -0.30 감소된다.
일부 구현예에서, 전체 피질 평균을 전체 소뇌 참조값에 대하여 비교하여, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 이전의 뇌 아밀로이드 수준으로부터의 대상체의 PET SUVr 값의 보정 평균 변화는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 적어도 -0.20, 예컨대, 적어도 -0.25 감소된다. 일부 구현예에서, 대상체의 PET SUVr 값의 보정 평균 변화는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에, 투여 이전의 대상체의 PET SUVr 값에 비하여 적어도 -0.25, 예컨대, 적어도 -0.30 감소된다.
일부 구현예에서, 뇌 내의 아밀로이드의 감소는 뇌 Aβ 아밀로이드에 대한 방사성추적자의 결합을 사용한 영상화에 의해 결정되고, PET로 가시화된다. 일부 구현예에서, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 이전의 대상체의 수준으로부터의 보정 평균 변화의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 적어도 -50, 예컨대, 적어도 -55 또는 적어도 -59 센틸로이드이다. 일부 구현예에서, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 이전의 대상체의 수준으로부터의 보정 평균 변화의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 적어도 -60, 예컨대, 적어도 -65 또는 적어도 -70 센틸로이드이다.
일부 구현예에서, 당해 방법은 투여 이전의 뇌척수액 Aβ1-42 수준에 비하여 감소된 뇌척수액 Aβ1-42 수준을 초래한다. 일부 구현예에서, 당해 방법은 투여 이전의 뇌척수액 Aβ1-42 수준에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99% 또는 100%의 뇌척수액 Aβ1-42 수준의 감소를 초래한다.
일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 이전의 뇌 아밀로이드 수준에 비하여 -0.20 내지 -0.45, 예컨대, -0.25 내지 -0.35의 뇌 아밀로이드 수준 감소를 초래한다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 이전의 뇌 아밀로이드 수준에 비하여 적어도 -0.25의 뇌 아밀로이드 수준 감소를 초래한다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 이전의 뇌 아밀로이드 수준에 비하여 적어도 0.30의 뇌 아밀로이드 수준 감소를 초래한다.
또한, ApoE4-양성 대상체에서 알츠하이머병을 예방하고/하거나 이의 발병을 지연시키는 또 다른 방법이 본원에 제공된다. 일부 구현예에서, 상기 방법은 대상체의 뇌 아밀로이드 수준을 결정하는 단계, 및 그 다음, 대상체의 뇌 아밀로이드 수준이 미리 결정된 제1 수준 초과이면, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물, 및 치료적 유효량의, BACE 저해제, 감마 세크레타제 저해제, 감마 세크레타제 조절제, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체 이외의 Aβ 펩티드 생성 저해제 및 상기 적어도 하나의 항-Aβ 프로토피브릴 항체 이외의 Aβ 펩티드 수준을 낮추는 작용제로부터 선택되는 적어도 하나의 치료제를 포함하는 조성물을 투여하는 단계를 포함한다.
일부 구현예에서, 당해 방법은 대상체의 투여-후 뇌 아밀로이드 수준을 측정하는 단계를 추가로 포함한다.
일부 구현예에서, 당해 방법은 Aβ1-42의 뇌척수액 수준 및/또는 뇌척수액 전체 tau 수준을 결정하는 단계를 추가로 포함한다.
일부 구현예에서, 당해 방법은 뉴로그라닌의 뇌척수액 수준을 결정하는 단계를 추가로 포함한다.
일부 구현예에서, 당해 방법은 신경필라멘트 경쇄의 뇌척수액 수준을 결정하는 단계를 추가로 포함한다.
일부 구현예에서, 상기 방법은 투여-후 뇌 아밀로이드 수준이 미리 결정된 제2 수준 초과이면, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물, 및 치료적 유효량의, BACE 저해제, 감마 세크레타제 저해제, 감마 세크레타제 조절제, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체 이외의 Aβ 펩티드 생성 저해제 및 상기 적어도 하나의 항-Aβ 프로토피브릴 항체 이외의 Aβ 펩티드의 수준을 낮추는 작용제로부터 선택되는 적어도 하나의 치료제를 포함하는 조성물을 투여하는 단계를 추가로 포함한다.
일부 구현예에서, 상기 방법은 투여-후 Aβ1-42의 뇌척수액 수준 및/또는 뇌척수액 전체 tau 수준이 미리 결정된 수준 초과이면, 조성물을 투여하는 단계를 추가로 포함한다.
일부 구현예에서, 상기 방법은 뉴로그라닌의 투여-후 뇌척수액 수준이 미리 결정된 수준 초과이면, 조성물을 투여하는 단계를 추가로 포함한다.
일부 구현예에서, 상기 방법은 신경필라멘트 경쇄의 투여-후 뇌척수액 수준이 미리 결정된 수준 초과이면, 조성물을 투여하는 단계를 추가로 포함한다.
일부 구현예에서, 상기 방법은 투여 후에, 대상체의 뇌 아밀로이드 수준이 미리 결정된 제1 수준 미만이 될 때까지 대상체의 뇌 아밀로이드 수준을 모니터링하는 단계를 추가로 포함한다.
일부 구현예에서, 상기 방법은 적어도 하나의 추가의 치료제를 투여하는 단계를 추가로 포함한다. 일부 구현예에서, 적어도 하나의 추가의 치료제는 BACE 저해제, 감마 세크레타제 저해제, 감마 세크레타제 조절제, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체 이외의 Aβ 펩티드 생성 저해제, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체 이외의 Aβ 펩티드 수준을 낮추는 작용제 및 그의 조합으로부터 선택된다.
일부 구현예에서, 적어도 하나의 추가의 치료제는 BACE 저해제이다. 일부 구현예에서, BACE 저해제는 엘렌베세스타트이다.
본원에 개시된 항-Aβ 프로토피브릴 항체, 그의 치료적으로 허용 가능한 양, 그에 대한 투여 섭생법 및 이를 포함하는 조성물 중 임의의 것은 초기 알츠하이머병을 갖는 대상체에서의 뇌 아밀로이드 수준의 감소 방법에서 사용될 수 있다. 예를 들어, 일부 구현예에서, 대상체의 체중에 비하여 2.5 ㎎/㎏, 5 ㎎/㎏, 7.5 ㎎/㎏ 또는 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체, 예컨대, BAN2401을 포함하는 조성물은 대상체에게 매주 1회, 2주마다 1회, 3주마다 1회, 4주마다 1회 또는 매달 1회 투여된다.
일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2041이다.
일부 구현예에서, 적어도 하나의 치료제는 BACE 저해제이다. 일부 구현예에서, BACE 저해제는 엘렌베세스타트이다.
일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이, 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99% 또는 100%의 대상체가 아밀로이드 음성이 되도록 초래한다.
일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이, 75% 내지 100%, 예컨대, 80% 내지 100% 또는 85% 내지 100%의 대상체가 아밀로이드 음성이 되도록 초래한다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이, 적어도 75%, 예컨대, 적어도 80% 또는 적어도 85%의 대상체가 아밀로이드 음성이 되도록 초래한다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이, 100%의 대상체가 아밀로이드 음성이 되도록 초래한다.
일부 구현예에서, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여 12개월 후에 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이, 적어도 75%, 예컨대, 적어도 80% 또는 적어도 85%의 대상체가 아밀로이드 음성이다. 일부 구현예에서, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여 18개월 후에 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이, 적어도 75%, 예컨대, 적어도 80%, 적어도 85%, 적어도 90% 또는 적어도 95%의 대상체가 아밀로이드 음성이다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 당해 방법은 투여 이후에, 투여 이전의 뇌 아밀로이드 수준에 비하여 감소된 뇌 아밀로이드 수준을 초래한다. 일부 구현예에서, 뇌 아밀로이드 수준은 상기 투여 이전의 뇌 아밀로이드 수준에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99% 또는 100% 감소된다. 일부 구현예에서, 상기 열거된 뇌 아밀로이드 수준의 감소는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되며, PET 표준 섭취 계수비(SUVr 값)로서 표현된다.
일부 구현예에서, 대상체의 PET SUVr 값의 보정 평균 변화는 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여 이전의 뇌 아밀로이드 수준에 비하여 적어도 -0.10, 적어도 -0.15, 적어도 -0.20, 적어도 -0.25, 적어도 -0.30, 적어도 -0.35, 적어도 -0.40, 적어도 -0.45, 적어도 -0.50, 적어도 -0.55, 적어도 -0.60, 적어도 -0.65, 적어도 -0.70, 적어도 -0.75, 적어도 -0.80, 적어도 -0.85, 적어도 -0.90 또는 적어도 -0.95 감소된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여 이전의 뇌 아밀로이드 수준으로부터의 대상체의 PET SUVr 값의 보정 평균 변화는 -0.20 내지 -0.30 감소된다.
일부 구현예에서, 전체 피질 평균을 전체 소뇌 참조값에 대하여 비교하여, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여 이전의 뇌 아밀로이드 수준으로부터의 대상체의 PET SUVr 값의 보정 평균 변화는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여 12개월 후에 적어도 -0.20, 예컨대, 적어도 -0.25 감소된다. 일부 구현예에서, 대상체의 PET SUVr 값의 보정 평균 변화는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여 18개월 후에, 투여 이전의 대상체의 PET SUVr 값에 비하여 적어도 -0.25, 예컨대, 적어도 -0.30 감소된다.
일부 구현예에서, 뇌 내의 아밀로이드의 감소는 뇌 Aβ 아밀로이드에 대한 방사성추적자의 결합을 사용한 영상화에 의해 결정되며, PET로 가시화된다. 일부 구현예에서, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여 이전의 대상체의 수준으로부터의 보정 평균 변화의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여 12개월 후에 적어도 -50, 예컨대, 적어도 -55 또는 적어도 -59 센틸로이드이다. 일부 구현예에서, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 이전의 대상체 수준으로부터의 보정 평균 변화의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여 18개월 후에 적어도 -60, 예컨대, 적어도 -65 또는 적어도 -70 센틸로이드이다.
일부 구현예에서, 당해 방법은 투여 이전의 뇌척수액 Aβ1-42 수준에 비하여 감소된 뇌척수액 Aβ1-42 수준을 초래한다. 일부 구현예에서, 당해 방법은 투여 이전의 뇌척수액 Aβ1-42 수준에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99% 또는 100%의 뇌척수액 Aβ1-42 수준의 감소를 초래한다.
일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여 이전의 뇌 아밀로이드 수준에 비하여 -0.20 내지 -0.45, 예컨대, -0.25 내지 -0.35의 뇌 아밀로이드 수준 감소를 초래한다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 이전의 뇌 아밀로이드 수준에 비하여 적어도 -0.25의 뇌 아밀로이드 수준 감소를 초래한다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여 이전의 뇌 아밀로이드 수준에 비하여 적어도 0.30의 뇌 아밀로이드 수준 감소를 초래한다.
알츠하이머병의 예방 및/또는 이의 발병의 지연
또한, 대상체에서의 알츠하이머병의 예방 및/또는 이의 발병의 지연 방법이 본원에 제공된다. 일부 구현예에서, 대상체는 ApoE4-양성이다. 일부 구현예에서, 대상체는 ApoE4-음성이다. 일부 구현예에서, 당해 방법은 대상체의 뇌 아밀로이드 수준을 결정하는 단계 및 그 다음, 대상체의 뇌 아밀로이드 수준이 미리 결정된 제1 수준 초과이면, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물을 투여하는 단계를 포함한다.
일부 구현예에서, 당해 방법은 대상체의 투여-후 뇌 아밀로이드 수준을 측정하는 단계를 추가로 포함한다.
일부 구현예에서, 당해 방법은 Aβ1-42의 뇌척수액 수준 및/또는 뇌척수액 전체 tau 수준을 결정하는 단계를 추가로 포함한다.
일부 구현예에서, 당해 방법은 뉴로그라닌의 뇌척수액 수준을 결정하는 단계를 추가로 포함한다.
일부 구현예에서, 당해 방법은 신경필라멘트 경쇄의 뇌척수액 수준을 결정하는 단계를 추가로 포함한다.
일부 구현예에서, 상기 방법은 투여-후 뇌 아밀로이드 수준이 미리 결정된 제2 수준 초과이면, 조성물을 투여하는 단계를 추가로 포함한다.
일부 구현예에서, 상기 방법은 투여 후에, 대상체의 뇌 아밀로이드 수준이 미리 결정된 제1 수준 미만이 될 때까지 대상체의 뇌 아밀로이드 수준을 모니터링하는 단계를 추가로 포함한다.
일부 구현예에서, 상기 방법은 투여-후 Aβ1-42의 뇌척수액 수준 및/또는 뇌척수액 전체 tau 수준이 미리 결정된 수준 초과이면, 조성물을 투여하는 단계를 추가로 포함한다.
일부 구현예에서, 상기 방법은 뉴로그라닌의 투여-후 뇌척수액 수준이 미리 결정된 수준 초과이면, 조성물을 투여하는 단계를 추가로 포함한다.
일부 구현예에서, 상기 방법은 투여-후 신경필라멘트 경쇄가 미리 결정된 수준 초과이면, 조성물을 투여하는 단계를 추가로 포함한다.
일부 구현예에서, 상기 방법은 적어도 하나의 추가의 치료제를 투여하는 단계를 추가로 포함한다. 일부 구현예에서, 적어도 하나의 추가의 치료제는 BACE 저해제, 감마 세크레타제 저해제, 감마 세크레타제 조절제, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체 이외의 Aβ 펩티드 생성 저해제, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체 이외의 Aβ 펩티드 수준을 낮추는 작용제 및 그의 조합으로부터 선택된다. 일부 구현예에서, 적어도 하나의 추가의 치료제는 BACE 저해제이다. 일부 구현예에서, BACE 저해제는 CNP520, BI-1181181, LY2886721, LY3202626, PF-06751979, RG7129, 아타베세스타트, 엘렌베세스타트, 라나베세스타트 및 베루베세스타트로부터 선택된다. 일부 구현예에서, BACE 저해제는 엘렌베세스타트이다.
본원에 개시된 항-Aβ 프로토피브릴 항체, 그의 치료적으로 허용 가능한 양, 그에 대한 투여 섭생법 및 이를 포함하는 조성물 중 임의의 것은 초기 알츠하이머병을 갖는 대상체에서의 뇌 아밀로이드 수준의 감소 방법에서 사용될 수 있다. 예를 들어, 일부 구현예에서, 대상체의 체중에 비하여 2.5 ㎎/㎏, 5 ㎎/㎏, 7.5 ㎎/㎏ 또는 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체, 예컨대, BAN2401을 포함하는 조성물은 대상체에게 매주 1회, 2주마다 1회, 3주마다 1회, 4주마다 1회 또는 매달 1회 투여된다.
일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2041이다.
일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이, 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99% 또는 100%의 대상체가 아밀로이드 음성이 되도록 초래한다.
일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이, 75% 내지 100%, 예컨대, 80% 내지 100% 또는 85% 내지 100%의 대상체가 아밀로이드 음성이 되도록 초래한다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이, 적어도 75%, 예컨대, 적어도 80% 또는 적어도 85%의 대상체가 아밀로이드 음성이 되도록 초래한다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이, 100%의 대상체가 아밀로이드 음성이 되도록 초래한다.
일부 구현예에서, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이, 적어도 75%, 예컨대, 적어도 80% 또는 적어도 85%의 대상체가 아밀로이드 음성이다. 일부 구현예에서, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이, 적어도 75%, 예컨대, 적어도 80%, 적어도 85%, 적어도 90% 또는 적어도 95%의 대상체가 아밀로이드 음성이다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 당해 방법은 투여 이후에, 투여 이전의 뇌 아밀로이드 수준에 비하여 감소된 뇌 아밀로이드 수준을 초래한다. 일부 구현예에서, 뇌 아밀로이드 수준은 상기 투여 이전의 뇌 아밀로이드 수준에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99% 또는 100% 감소된다. 일부 구현예에서, 상기 열거된 뇌 아밀로이드 수준의 감소는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되며, PET 표준 섭취 계수비(SUVr 값)로서 표현된다.
일부 구현예에서, 대상체의 PET SUVr 값의 보정 평균 변화는 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 이전의 뇌 아밀로이드 수준에 비하여 적어도 -0.10, 적어도 -0.15, 적어도 -0.20, 적어도 -0.25, 적어도 -0.30, 적어도 -0.35, 적어도 -0.40, 적어도 -0.45, 적어도 -0.50, 적어도 -0.55, 적어도 -0.60, 적어도 -0.65, 적어도 -0.70, 적어도 -0.75, 적어도 -0.80, 적어도 -0.85, 적어도 -0.90 또는 적어도 -0.95 감소된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 이전의 뇌 아밀로이드 수준으로부터의 대상체의 PET SUVr 값의 보정 평균 변화는 -0.20 내지 -0.30 감소된다.
일부 구현예에서, 전체 피질 평균을 전체 소뇌 참조값에 대하여 비교하여, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 이전의 뇌 아밀로이드 수준으로부터의 대상체의 PET SUVr 값의 보정 평균 변화는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 적어도 -0.20, 예컨대, 적어도 -0.25 감소된다. 일부 구현예에서, 대상체의 PET SUVr 값의 보정 평균 변화는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에, 투여 이전의 대상체의 PET SUVr 값에 비하여 적어도 -0.25, 예컨대, 적어도 -0.30 감소된다.
일부 구현예에서, 뇌 내의 아밀로이드의 감소는 뇌 Aβ 아밀로이드에 대한 방사성추적자의 결합을 사용한 영상화에 의해 결정되며, PET로 가시화된다. 일부 구현예에서, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 이전의 대상체의 수준으로부터의 보정 평균 변화의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 12개월 후에 적어도 -50, 예컨대, 적어도 -55 또는 적어도 -59 센틸로이드이다. 일부 구현예에서, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 이전의 대상체의 수준으로부터의 보정 평균 변화의 감소는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 18개월 후에 적어도 -60, 예컨대, 적어도 -65 또는 적어도 -70 센틸로이드이다.
일부 구현예에서, 당해 방법은 투여 이전의 뇌척수액 Aβ1-42 수준에 비하여 감소된 뇌척수액 Aβ1-42 수준을 초래한다. 일부 구현예에서, 당해 방법은 투여 이전의 뇌척수액 Aβ1-42 수준에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99% 또는 100%의 뇌척수액 Aβ1-42 수준의 감소를 초래한다.
일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 이전의 뇌 아밀로이드 수준에 비하여 -0.20 내지 -0.45, 예컨대, -0.25 내지 -0.35의 뇌 아밀로이드 수준 감소를 초래한다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 이전의 뇌 아밀로이드 수준에 비하여 적어도 -0.25의 뇌 아밀로이드 수준 감소를 초래한다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 이전의 뇌 아밀로이드 수준에 비하여 적어도 0.30의 뇌 아밀로이드 수준 감소를 초래한다.
또한, 대상체에서 알츠하이머병을 예방하고/하거나 이의 발병을 지연시키는 또 다른 방법이 본원에 제공된다. 일부 구현예에서, 대상체는 ApoE4-양성이다. 일부 구현예에서, 대상체는 ApoE4-음성이다. 일부 구현예에서, 상기 방법은 대상체의 뇌 아밀로이드 수준을 결정하는 단계, 및 그 다음, 대상체의 뇌 아밀로이드 수준이 미리 결정된 제1 수준 초과이면, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물, 및 치료적 유효량의, BACE 저해제, 감마 세크레타제 저해제, 감마 세크레타제 조절제, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체 이외의 Aβ 펩티드 생성 저해제 및 상기 적어도 하나의 항-Aβ 프로토피브릴 항체 이외의 Aβ 펩티드의 수준을 낮추는 작용제로부터 선택되는 적어도 하나의 치료제를 포함하는 조성물을 투여하는 단계를 포함한다.
일부 구현예에서, 당해 방법은 대상체의 투여-후 뇌 아밀로이드 수준을 측정하는 단계를 추가로 포함한다.
일부 구현예에서, 당해 방법은 Aβ1-42의 뇌척수액 수준 및/또는 뇌척수액 전체 tau 수준을 결정하는 단계를 추가로 포함한다.
일부 구현예에서, 당해 방법은 뉴로그라닌의 뇌척수액 수준을 결정하는 단계를 추가로 포함한다.
일부 구현예에서, 당해 방법은 신경필라멘트 경쇄의 뇌척수액 수준을 결정하는 단계를 추가로 포함한다.
일부 구현예에서, 상기 방법은 투여-후 뇌 아밀로이드 수준이 미리 결정된 제2 수준 초과이면, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물, 및 치료적 유효량의, BACE 저해제, 감마 세크레타제 저해제, 감마 세크레타제 조절제, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체 이외의 Aβ 펩티드 생성 저해제 및 상기 적어도 하나의 항-Aβ 프로토피브릴 항체 이외의 Aβ 펩티드의 수준을 낮추는 작용제로부터 선택되는 적어도 하나의 치료제를 포함하는 조성물을 투여하는 단계를 추가로 포함한다.
일부 구현예에서, 상기 방법은 투여-후 Aβ1-42의 뇌척수액 수준 및/또는 뇌척수액 전체 tau 수준이 미리 결정된 수준 초과이면, 조성물을 투여하는 단계를 추가로 포함한다.
일부 구현예에서, 상기 방법은 뉴로그라닌의 투여-후 뇌척수액 수준이 미리 결정된 수준 초과이면, 조성물을 투여하는 단계를 추가로 포함한다.
일부 구현예에서, 상기 방법은 신경필라멘트 경쇄의 투여-후 뇌척수액 수준이 미리 결정된 수준 초과이면, 조성물을 투여하는 단계를 추가로 포함한다.
일부 구현예에서, 상기 방법은 투여 이후에, 대상체의 뇌 아밀로이드 수준이 미리 결정된 제1 수준 미만이 될 때까지 대상체의 뇌 아밀로이드 수준을 모니터링하는 단계를 추가로 포함한다.
일부 구현예에서, 상기 방법은 적어도 하나의 추가의 치료제를 투여하는 단계를 추가로 포함한다. 일부 구현예에서, 적어도 하나의 추가의 치료제는 BACE 저해제, 감마 세크레타제 저해제, 감마 세크레타제 조절제, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체 이외의 Aβ 펩티드 생성 저해제, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체 이외의 Aβ 펩티드 수준을 낮추는 작용제 및 그의 조합으로부터 선택된다.
일부 구현예에서, 적어도 하나의 추가의 치료제는 BACE 저해제이다. 일부 구현예에서, BACE 저해제는 엘렌베세스타트이다.
본원에 개시된 항-Aβ 프로토피브릴 항체, 그의 치료적으로 허용 가능한 양, 그에 대한 투여 섭생법 및 이를 포함하는 조성물 중 임의의 것은 초기 알츠하이머병을 갖는 대상체에서의 뇌 아밀로이드 수준의 감소 방법에서 사용될 수 있다. 예를 들어, 일부 구현예에서, 대상체의 체중에 비하여 2.5 ㎎/㎏, 5 ㎎/㎏, 7.5 ㎎/㎏ 또는 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체, 예컨대, BAN2401을 포함하는 조성물은 대상체에게 매주 1회, 2주마다 1회, 3주마다 1회, 4주마다 1회 또는 매달 1회 투여된다.
일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2041이다.
일부 구현예에서, 적어도 하나의 치료제는 BACE 저해제이다. 일부 구현예에서, BACE 저해제는 엘렌베세스타트이다.
일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이, 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99% 또는 100%의 대상체가 아밀로이드 음성이 되도록 초래한다.
일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이, 75% 내지 100%, 예컨대, 80% 내지 100% 또는 85% 내지 100%의 대상체가 아밀로이드 음성이 되도록 초래한다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이, 적어도 75%, 예컨대 적어도 80% 또는 적어도 85%의 대상체가 아밀로이드 음성이 되도록 초래한다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이, 100%의 대상체가 아밀로이드 음성이 되도록 초래한다.
일부 구현예에서, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여 12개월 후에 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이, 적어도 75%, 예컨대, 적어도 80% 또는 적어도 85%의 대상체가 아밀로이드 음성이다. 일부 구현예에서, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여 18개월 후에 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이, 적어도 75%, 예컨대, 적어도 80%, 적어도 85%, 적어도 90% 또는 적어도 95%의 대상체가 아밀로이드 음성이다. 일부 구현예에서, 조성물은 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체는 BAN2401이다.
일부 구현예에서, 당해 방법은 투여 이후에, 투여 이전의 뇌 아밀로이드 수준에 비하여 감소된 뇌 아밀로이드 수준을 초래한다. 일부 구현예에서, 뇌 아밀로이드 수준은 상기 투여 이전의 뇌 아밀로이드 수준에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99% 또는 100% 감소된다. 일부 구현예에서, 상기 열거된 뇌 아밀로이드 수준의 감소는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되며, PET 표준 섭취 계수비(SUVr 값)로 표현된다.
일부 구현예에서, 대상체의 PET SUVr 값의 보정 평균 변화는 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여 이전의 뇌 아밀로이드 수준에 비하여 적어도 -0.10, 적어도 -0.15, 적어도 -0.20, 적어도 -0.25, 적어도 -0.30, 적어도 -0.35, 적어도 -0.40, 적어도 -0.45, 적어도 -0.50, 적어도 -0.55, 적어도 -0.60, 적어도 -0.65, 적어도 -0.70, 적어도 -0.75, 적어도 -0.80, 적어도 -0.85, 적어도 -0.90 또는 적어도 -0.95 감소된다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여 이전의 뇌 아밀로이드 수준으로부터의 대상체의 PET SUVr 값의 보정 평균 변화는 -0.20 내지 -0.30 감소된다.
일부 구현예에서, 전체 피질 평균을 전체 소뇌 참조값에 대하여 비교하여, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여 이전의 뇌 아밀로이드 수준으로부터의 대상체의 PET SUVr 값의 보정 평균 변화는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여 12개월 후에 적어도 -0.20, 예컨대, 적어도 -0.25 감소된다. 일부 구현예에서, 대상체의 PET SUVr 값의 보정 평균 변화는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여 18개월 후에 투여 이전의 대상체의 PET SUVr 값에 비하여 적어도 -0.25, 예컨대, 적어도 -0.30 감소된다.
일부 구현예에서, 뇌 내의 아밀로이드의 감소는 뇌 Aβ 아밀로이드에 대한 방사성추적자의 결합을 사용한 영상화에 의해 결정되며, PET로 가시화된다. 일부 구현예에서, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여 12개월 후에, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여 이전의 대상체의 수준으로부터의 보정 평균 변화의 감소는 적어도 -50, 예컨대, 적어도 -55 또는 적어도 -59 센틸로이드이다. 일부 구현예에서, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여 18개월 후에, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 이전의 대상체의 수준으로부터의 보정 평균 변화의 감소는 적어도 -60, 예컨대, 적어도 -65 또는 적어도 -70 센틸로이드이다.
일부 구현예에서, 당해 방법은 투여 이전의 뇌척수액 Aβ1-42 수준에 비하여 감소된 뇌척수액 Aβ1-42 수준을 초래한다. 일부 구현예에서, 당해 방법은 투여 이전의 뇌척수액 Aβ1-42 수준에 비하여 적어도 1%, 적어도 2%, 적어도 3%, 적어도 4%, 적어도 5%, 적어도 6%, 적어도 7%, 적어도 8%, 적어도 9%, 적어도 10%, 적어도 11%, 적어도 12%, 적어도 13%, 적어도 14%, 적어도 15%, 적어도 16%, 적어도 17%, 적어도 18%, 적어도 19%, 적어도 20%, 적어도 21%, 적어도 22%, 적어도 23%, 적어도 24%, 적어도 25%, 적어도 26%, 적어도 27%, 적어도 28%, 적어도 29%, 적어도 30%, 적어도 31%, 적어도 32%, 적어도 33%, 적어도 34%, 적어도 35%, 적어도 36%, 적어도 37%, 적어도 38%, 적어도 39%, 적어도 40%, 적어도 41%, 적어도 42%, 적어도 43%, 적어도 44%, 적어도 45%, 적어도 46%, 적어도 47%, 적어도 48%, 적어도 49%, 적어도 50%, 적어도 51%, 적어도 52%, 적어도 53%, 적어도 54%, 적어도 55%, 적어도 56%, 적어도 57%, 적어도 58%, 적어도 59%, 적어도 60%, 적어도 61%, 적어도 62%, 적어도 63%, 적어도 64%, 적어도 65%, 적어도 66%, 적어도 67%, 적어도 68%, 적어도 69%, 적어도 70%, 적어도 71%, 적어도 72%, 적어도 73%, 적어도 74%, 적어도 75%, 적어도 76%, 적어도 77%, 적어도 78%, 적어도 79%, 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99% 또는 100%의 뇌척수액 Aβ1-42 수준의 감소를 초래한다.
일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여 이전의 뇌 아밀로이드 수준에 비하여 -0.20 내지 -0.45, 예컨대, -0.25 내지 -0.35의 뇌 아밀로이드 수준 감소를 초래한다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 이전의 뇌 아밀로이드 수준에 비하여 적어도 -0.25의 뇌 아밀로이드 수준 감소를 초래한다. 일부 구현예에서, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여는 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이, 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 적어도 하나의 치료제를 포함하는 조성물의 투여 이전의 뇌 아밀로이드 수준에 비하여 적어도 0.30의 뇌 아밀로이드 수준 감소를 초래한다.
유해 사례
일부 구현예에서, 본원에 제공되는 방법은 하나 이상의 심각한 유해 사례의 발생을 초래하지 않는다. 일부 구현예에서, 본원에 제공되는 방법은 등급 5보다 중증도가 더 낮고/낮거나, 등급 4보다 중증도가 더 낮고/낮거나, 등급 3보다 중증도가 더 낮고/낮거나, 등급 2보다 중증도가 더 낮고/낮거나, 등급 1보다 중증도가 더 낮은 하나 이상의 심각한 유해 사례를 초래한다. 일부 구현예에서, 대상체는 유해 사례가 등급 1 미만의 중증도이기 때문에, 하나 이상의 유해 사례를 보고하지 않는다.
일부 구현예에서, 본원에 기재된 방법은 1% 미만, 2% 미만, 3% 미만, 4% 미만, 5% 미만, 6% 미만, 7% 미만, 8% 미만, 9% 미만, 10% 미만, 11% 미만, 12% 미만, 13% 미만, 14% 미만, 15% 미만, 16% 미만, 17% 미만, 18% 미만, 19% 미만 또는 20% 미만의 대상체가 심각한 유해 사례를 경험하게 한다.
일부 구현예에서, 본원에 기재된 방법은 1% 미만, 2% 미만, 3% 미만, 4% 미만, 5% 미만, 6% 미만, 7% 미만, 8% 미만, 9% 미만 또는 10% 미만의 대상체가 혈관성 부종을 경험하게 한다.
일부 구현예에서, 본원에 기재된 방법은 1% 미만, 2% 미만, 3% 미만, 4% 미만, 5% 미만, 6% 미만, 7% 미만, 8% 미만, 9% 미만, 10% 미만, 12% 미만, 13% 미만, 14% 미만 또는 15% 미만의 ApoE4-양성 대상체가 혈관성 부종을 경험하게 한다.
일부 구현예에서, 본원에 기재된 방법은 15% 미만의 ApoE4-양성 대상체가 혈관성 부종을 경험하게 한다.
일부 구현예에서, 본원에 기재된 방법은 1% 미만, 2% 미만, 3% 미만, 4% 미만, 5% 미만, 6% 미만, 7% 미만, 8% 미만, 9% 미만 또는 10% 미만의 ApoE4-음성 대상체가 혈관성 부종을 경험하게 한다.
일부 구현예에서, 본원에 기재된 방법은 10% 미만의 ApoE4-음성 대상체가 혈관성 부종을 경험하게 한다.
본원에 참조된 논문 및 특허 문서의 내용은 그들의 전문이 본원에 참조로 포함된다.
실시예
실시예 1: 초기 알츠하이머병을 갖는 대상체의 치료
알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성 및/또는 경증 알츠하이머병 치매를 갖는 연령이 50세 내지 90세 범위인 남성 및 여성 둘 모두의 대상체를 치료에 적격하도록 선별하였다. 854명의 대상체를 치료를 위하여 무작위 배정하였다.
연구는 사전 무작위 배정 단계 및 무작위 배정 단계로 이루어진다.
사전 무작위 배정 단계
이 단계는 최대 60일 지속되었으며, 선별 기간 및 기준선 기간으로 이루어진다. 선별 기간 동안, 대상체를 적격성 기준에 기초하여 평가하였다. 대상체가 적격한 것으로 여겨지면, 대상체를 기준선 기간으로 진행시킨다.
기준선 기간 동안, 대상체가 동의하면, 임상적 검사(예를 들어, 혈액 검사(예를 들어, ApoE4 상태를 결정하기 위함) 등), 안전성 자기 공명 영상화(MRI) 분석, 아밀로이드 PET 평가(예를 들어, 아밀로이드 PET 영상의 시각적 판독) 및 뇌척수액(바이오마커 분석을 위함)을 포함하는 수많은 분석을 수행하였다. 대상체의 추가의 임상적 검사는 MMSE, CDR, ADAS-Cog 및 FAQ를 포함하였다.
무작위 배정 단계
무작위 배정 단계는 18개월 치료 기간 및 3개월 추적 기간으로 이루어진다. 대상체를 하기의 섭생법 중 하나로 무작위 배정하였다:
- 위약;
- 2.5 ㎎/㎏ BAN2401을 포함하는 조성물, 2주마다 1회;
- 5 ㎎/㎏ BAN2401을 포함하는 조성물, 2주마다 1회;
- 10 ㎎/㎏ BAN2401을 포함하는 조성물, 2주마다 1회;
- 5 ㎎/㎏ BAN2401을 포함하는 조성물, 매달 1회; 또는
- 10 ㎎/㎏ BAN2401을 포함하는 조성물, 매달 1회.
모든 대상체에게 2주마다 대략 60분 정맥내 주입을 투여하였다. BAN2401을 말단 0.22 ㎛ 인-라인 필터를 함유하는 주입 시스템을 사용하여 60분 정맥내 주입으로서 생리 식염수 중에서 투여하였다. 모든 대상체에게 주입을 2주마다 제공하였으며, BAN2401을 매달 투여한 대상체에는 BAN2401과 교대로 위약을 주입하였다.
대상체가 이러한 분석에 동의한다면, 모든 대상체를 인지 기능, 안전성, 약동학적 파라미터, 안전성 MRI, 용적측정 MRI 및 뇌척수액 분석에 기초하여 평가하였다. 추가의 임상적 평가는 MMSE, CDR, ADAS-cog 및 FAQ를 포함하였다.
제18개월 후반에, 대상체에 의한 요청, 주치의 및/또는 데이터 안전 검토 위원회의 요청 및/또는 치료의 중단을 타당하게 만드는 하나 이상의 유해 사례의 출현으로 치료를 종료하였다.
치료의 종료 후에, 대상체를 기준선 기간 및 무작위 배정 기간 동안과 같이 평가하였다.
제형
BAN2401을 일회용 10 ㎖ 바이얼 내에, 10 ㎎/㎖를 함유하는 투명한 멸균 주사용 용액으로서 공급하였다(총 100 ㎎/바이얼). 약물 제품을 25 mM 시트르산나트륨, 125 mM 염화나트륨, 0.02%(w/v) 폴리소르베이트 80 중에 제형화하였으며, pH는 5.7인 것으로 결정되었다.
연구 종점
일차 연구 목표는 (1) 알츠하이머병으로 인한 경증 인지 장애(MCI) - 중등의 가능성 또는 경증 알츠하이머병 치매로서 정의된 초기 알츠하이머병(EAD)을 갖는 대상체에서 치료 제12개월에 알츠하이머병 복합 점수(ADCOMS)에서 BAN2401에 대한 ED90(프로토콜에 정의된 바와 같음)을 확립함으로써 BAN2401의 효능을 위약에 비하여 평가하고; (2) 초기 알츠하이머병을 갖는 대상체에서 BAN2401의 3회 용량 및 2회 용량의 섭생법의 안전성 및 내약성을 평가하는 것을 포함하였다.
주요 이차 목표는 하기를 포함하였다:
· PET에 의해 측정되는 바와 같이 초기 알츠하이머병을 갖는 대상체에서 치료 제18개월에 뇌 아밀로이드 병리생리학에 대한 BAN2401의 영향을 위약에 비하여 평가하는 것;
· 초기 알츠하이머병을 갖는 대상체에서 치료 제18개월에 ADCOMS에 대한 BAN2401의 효능을 위약에 비하여 평가하는 것;
· 초기 알츠하이머병을 갖는 대상체에서 치료 제18개월에 임상적 치매 등급 - 박스의 합(Clinical Dementia Rating - Sum of Boxes; CDR-SB)에 대한 BAN2401의 효능을 위약에 비하여 평가하는 것;
· 제18개월에 EAD를 갖는 대상체에서 알츠하이머병 평가 척도 - 인지 하위척도(Alzheimer Disease Assessment Scale - Cognitive Subscale; ADAS-cog)에 대한 BAN2401의 효능을 위약에 비하여 평가하는 것;
· 하기의 평가에 있어서 MCI 및 경증 AD 치매를 갖는 대상체 내에서 개별적으로 임상적 상태에 대한 BAN2401의 영향을 제18개월에 위약에 비하여 평가하는 것: ADCOMS, CDR-SB 및 ADAS-cog;
· 초기 알츠하이머병을 갖는 대상체에서 치료 제18개월에 뇌척수액 바이오마커(Aβ1-42, t-tau 및 p-tau)에 대한 BAN2401의 영향을 위약에 비하여 평가하는 것; 및
· 초기 알츠하이머병을 갖는 대상체에서 치료 제18개월에 용적측정 자기 공명 영상화(vMRI)를 사용하여 총 해마 용적에 대한 BAN2401의 영향을 위약에 비하여 평가하는 것.
종점
일차 종점은 ADCOMS를 사용하여 베이지안(Bayesian) 분석과 함께 12개월 내내의 종단 데이터를 사용하여 임상적 결과 평가를 측정하였다.
이차 종점(제12개월 및 제18개월 시점)은 PET SUVr의 기준선으로부터의 변화(아밀로이드 로드); 아밀로이드 양성에서 음성으로의 전환(시각적 판독); ADCOMS의 기준선으로부터의 변화; ADAS-cog의 기준선으로부터의 변화; CDR-SB의 기준선으로의 변화; CSF 척도(Aβ1-42, 전체-Tau 등)의 기준선으로부터의 변화를 포함하였다.
결과
인지 결과
전체 대상체 집단에서, 인지 및 기능의 임상 결과 척도에 대한 용량-의존적이고, 임상적으로 의미있고, 통계적으로 유의미한 더 둔화된 저하가 18개월 후에 관찰되었으며, ADCOMS는 최고 용량에서 30% 더 낮은 저하를 갖고; ADAS-cog는 최고 용량에서 47% 더 낮은 저하를 가졌으며; 제18개월에 용량-의존적이며, 임상적으로 의미있는 더 둔화된 저하가 관찰되었으며, CDR-SB는 최고 용량에서 26% 더 낮은 저하를 가졌다.
표 5 및 표 6은 ADCOMS에 의해 결정되는 바와 같이 BAN2401의 투여 12개월 후에 기준선으로부터의 변화를 제공한다.
유사하게, 표 7 및 표 8은 ADCOMS에 의해 결정되는 바와 같은, 다양한 용량의 BAN2401의 투여 18개월 후의 기준선으로부터의 변화를 제공한다. 또한, 도 56도 참조한다.
표 9 및 표 10은 CDR-SB에 의해 결정되는 바와 같은, 다양한 용량의 BAN2401의 투여 12개월 후의 기준선으로부터의 변화를 제공한다. 도 9 및 도 10에 나타낸 바와 같이, 매달 10 ㎎/㎏의 용량 및 2주마다 10 ㎎/㎏의 용량은 CDR-SB에 의해 결정되는 바와 같이 치료적 유효량의 BAN2401을 포함하는 조성물을 사용한 치료 12개월 및 18개월 후에 위약에 비하여 인지 저하의 둔화를 초래한다. 통계적 분석 방법으로서 ADAS-cog를 사용하는 경우 유사한 경향이 관찰된다. 도 7 및 도 8을 참조한다.
표 11 및 표 12는 CDR-SB에 의해 결정되는 바와 같은, 다양한 용량의 BAN2401의 투여 18개월 후의 기준선으로부터의 변화를 제공한다.
ApoE4-양성 대상체에서의 결과
하기에 보고된 바와 같이, 대상체가 ApoE4 양성인 경우, ApoE4의 비-보유자인 대상체에 비하여 예측 가능하지 않게 유리한 결과가 달성되었다. 이것은 적어도 다른 항-Aβ 항체를 사용하여 수행된 연구의 이전에 보고된 결과를 고려하면 놀라운 것이다.
예를 들어, 본 개시의 범주 밖의 또 다른 항-Aβ 항체인 아두카누맙(aducanumab)을 사용한 단계 Ib 시험에서, 아두카누맙-치료 환자에서의 아밀로이드 PET SUVR 복합 점수의 감소가 ApoE4 보유자 및 비-보유자에서 유사한 것으로 보고되었다(문헌[Sevigny, J. et al., "The antibody aducanumab reduces Aβ plaques in Alzheimer's disease," Nature 537:50-56, 50-51 (Sept. 1, 2016), citing Extended Data Fig. 2b.]). 그러나, 확장 데이터 도 2b에서의 결과는 ApoE4 보유자와 비교시 ApoE4 비-보유자의 치료에 대한 더 나은 결과를 반영한다.
경증 내지 중등도 알츠하이머병의 치료에서, 본 개시의 범주 밖의 항-Aβ 항체인 바피뉴주맙(bapineuzumab)의 단계 II 시험에서, 결과는 일부 임상적 척도에 대한 ApoE4 보유자 상태에 의한 가능한 차이를 나타내며, 잠재적인 치료 차이는 비보유자에 유리하다. (문헌[Salloway et al., "A phase 2 multiple ascending dose trial of bapineuzumab in mild to moderate Alzheimer disease," Neurology 73:2061-2070, 2067 (December 15, 2009)] 참조.) 따라서, 바피뉴주맙의 2가지 상이한 단계 III 임상 시험을 행하였으며, 하나는 ApoE4-양성 보유자에서 행하였고, 하나는 경증 내지 중등도 알츠하이머병을 갖는 ApoE4 비-보유자에서 행하였다. 단계 II 지시에도 불구하고, 단계 III 결과는 2가지 ApoE4 유전형을 구분하지 못했을 뿐 아니라, 임상적 결과에 관하여 바피뉴주맙의 이익을 나타내지 못하였다. (문헌[Salloway et al., "Two Phase 3 Trials of Bapineuzumab in Mild-to-Moderate Alzheimer's Disease," N. Engl. J. Med. 370:322-33 (2014)].) 유사하게, 본 개시의 범주 밖의 또 다른 항-Aβ 항체인 솔라네주맙(solanezumab)을 사용한 2가지 단계 III 임상 시험도 또한 경증 내지 중증도 알츠하이머병을 갖는 환자에서 일차 임상 결과에 관하여 이익을 보이지 않았다. (문헌[Salloway et al., N. Engl. J. Med. 370:322-33, 332 (2014)]; 문헌[Doody, R.S. et al., "Phase 3 trials of solanezumab for mild-to-moderate Alzheimer's disease," N. Engl. J. Med. 370:311-21 (2014)].)
하기에 논의된 것들과 같은 결과에 기초하여, ApoE4의 비-보유자에 비하여 ApoE4 양성 대상체가 갖는 본원에 보고된 통계적으로 유의미한 결과는 예상하지 못했을 뿐 아니라, 예측 가능하지 않았다.
ApoE4-양성 대상체가 갖는 예측 가능하지 않고 예상되지 않는 결과
일반적으로, ApoE4 양성 대상체는 ApoE4의 비-보유자보다 BAN2401 치료에 대하여 더 나은 반응을 보였다. 일부 구현예에서, 그들 차이는 임상적으로 의미있는 것이었으며, 통계적으로 유의미하였다.
도 5 및 도 16은 위약을 투여한 대상체에 비하여, 다양한 용량의 BAN2401을 투여한 ApoE4-양성 대상체에서 ADCOMS에 의해 결정되는 바와 같이, 제6개월에 시작하는, 인지 저하의 용량 의존적 둔화를 보여준다. 또한, 도 48도 참조한다. 도 6 및 도 30은 ApoE4-음성 대상체로의 투여 후에 더욱 온건한 인지 저하를 보여준다. 또한, 도 48도 참조한다. 인지 저하가 ADCOMS(ApoE4-양성: 도 5 및 도 16; ApoE4-음성: 도 6 및 도 30)에 의해 결정되든지, ADAS-cog(ApoE4-양성: 도 19 및 도 20; ApoE4-음성: 도 35 및 도 36)에 의해 결정되든지, 또는 CDR-SB(ApoE4-양성: 도 23 및 도 24; ApoE4-음성: 도 39 및 도 40)에 의해 결정되든지와 관계없이, ApoE4-대상체와 ApoE4-음성 대상체 간의 반응의 차이가 관찰되었다.
예를 들어, 10 ㎎/㎏ BAN2401의 2주마다의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 ApoE4-음성 대상체에서 임상적 저하의 7% 감소가 관찰된 한편, 10 ㎎/㎏ BAN2401의 2주마다의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 ApoE4-양성 대상체에서 임상적 저하의 63% 감소가 관찰되었다.
예를 들어, 10 ㎎/㎏ BAN2401의 2주마다의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 ApoE4-음성 대상체에서 임상적 저하의 43% 감소가 관찰된 한편, 10 ㎎/㎏ BAN2401의 2주마다의 투여 18개월 후에 ADAS-cog에 의해 결정되는 바와 같이 ApoE4-양성 대상체에서 임상적 저하의 84% 감소가 관찰되었다.
예를 들어, 10 ㎎/㎏ BAN2401의 2주마다의 투여 18개월 후에 CDR-SB에 의해 결정되는 바와 같이 ApoE4-음성 대상체에서 임상적 저하의 -7% 감소가 관찰된 한편, 10 ㎎/㎏ BAN2401의 2주마다의 투여 18개월 후에 CDR-SB에 의해 결정되는 바와 같이 ApoE4-양성 대상체에서 임상적 저하의 60% 감소가 관찰되었다.
알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 대상체 및 경증 알츠하이머병 치매를 갖는 대상체
알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 대상체 및 경증 알츠하이머병 치매를 갖는 대상체의 반응도 또한 비교하였다. 종합하여, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 대상체 및 경증 알츠하이머병 치매를 갖는 대상체는 BAN2401을 포함하는 조성물을 사용한 치료에 대하여 잘 반응하였다. (예를 들어, 도 3, 도 4 및 도 49를 참조한다.)
그러나, 경증 알츠하이머병 치매를 갖는 ApoE4-양성 대상체는 ADCOMS(도 17 및 도 18 참조)에 의해, ADAS-cog(도 21 및 도 22 참조)에 의해, 그리고 CDR-SB(도 25 및 도 26 참조)에 의해 결정되는 바와 같이, 알츠하이머병 치매로 인한 경증 인지 장애를 갖는 대상체보다 BAN2401을 사용한 치료에 대하여 더 나은 반응을 보였다. 경증 알츠하이머병 치매를 갖는 ApoE4-양성 대상체는 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 ApoE4-양성 대상체보다 BAN2401을 포함하는 조성물을 사용한 치료에 대하여 더 나은 반응을 보였다.
ApoE4-음성 대상체 내에서, 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 대상체 및 경증 알츠하이머병 치매를 갖는 대상체가 치료에 반응하였다. (도 33 및 도 34(ADCOMS); 도 37 및 도 38(ADAS-cog); 및 도 41 및 도 42(CDR-SB)를 참조한다.)
뇌 아밀로이드 수준 결과
표 13 및 표 14는 PET(표준 섭취 계수비(SUVR))에 의해 결정되는 바와 같은, 다양한 용량의 BAN2401의 투여 12개월 후의 모든 대상체에서의 뇌 아밀로이드 수준의 기준선으로부터의 변화를 제공하며, 참조 영역은 전체 소뇌 마스크(whole cerebellum mask)이다.
표 15 및 표 16은 PET(아밀로이드 PET 영상의 시각적 판독; 표준 섭취 계수비(SUVR))에 의해 결정되는 바와 같은, 다양한 용량의 BAN2401의 투여 12개월 후의 뇌 아밀로이드 수준의 기준선으로부터의 변화를 제공하며, 참조 영역은 전체 소뇌 마스크이다. ADCOMS 및 CDR-SB에 의해 결정되는 바와 같은 기준선으로부터의 변화는 PET(SUVR)에 의해 결정되는 바와 같은 아밀로이드 제거와 통계적으로 유의미한 방식으로 양의 상관관계가 있으며, 참조 영역은 전체 소뇌 마스크이다. 도 77 및 도 78을 참조한다. ADCOMS, CDR-SB 및 ADAS-Cog에 의해 결정되는 바와 같은 기준선으로부터의 변화는 PET(SUVR)에 의해 결정되는 바와 같은 아밀로이드 제거와 통계적으로 유의미한 방식으로 양의 상관관계가 있으며, 참조 영역은 피질하 백질이다. 도 80 내지 도 82를 참조한다.
도 11 및 도 12는 12개월 및 18개월 후에 2주마다 2.5 ㎎/㎏의 BAN2401, 매달 5 ㎎/㎏의 BAN2401, 2주마다 5 ㎎/㎏의 BAN2401, 매달 10 ㎎/㎏의 BAN2401 또는 2주마다 10 ㎎/㎏의 BAN2401의 투여 후의 뇌 아밀로이드 수준의 용량-의존적 감소를 보여준다. 또한, 도 51도 참조한다.
알 수 있는 바와 같이, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴을 포함하는 조성물의 투여로 인하여, 뇌 아밀로이드 수준의 통계적으로 유의미한 감소가 초기 알츠하이머병을 갖는 대상체에서 관찰되었다. 예를 들어, 2주마다 10 ㎎/㎏의 BAN2401의 18개월의 투여는 -70 감소를 초래하였다(p <0.0001). (예를 들어, 도 12를 참조한다(센틸로이드).)
유사하게, ApoE4-양성 대상체(도 27(18개월 후에 2주마다 10 ㎎/㎏의 용량에 대하여 -0.32 감소) 및 도 28(18개월 후에 2주마다 10 ㎎/㎏의 용량에 대하여 -76 감소)) 및 ApoE4-음성 대상체(도 43(18개월 후에 2주마다 10 ㎎/㎏의 용량에 대하여 -0.29 감소) 및 도 44(18개월 후에 2주마다 10 ㎎/㎏의 용량에 대하여 -68 감소))로의 다양한 용량의 BAN2401의 투여는 그들 대상체에서 뇌 아밀로이드 수준의 감소를 초래하였다. 또한, 뇌 아밀로이드 수준의 감소가 인지 저하의 둔화와 상관관계가 있는 것이 관찰되었다. 도 57을 참조한다.
아밀로이드 양성에서 아밀로이드 음성으로의 전환 결과
표 17 및 표 18은 다양한 용량의 BAN2401을 투여한 후에 아밀로이드 음성이 된 대상체를 보여준다. 도 13은 PET의 플로르베타피르(florbetapir) 추적자 시각적 판독에 의해 결정되는 바와 같은, 12개월 및 18개월 후의 2주마다 2.5 ㎎/㎏의 BAN2401, 매달 5 ㎎/㎏의 BAN2401, 2주마다 5 ㎎/㎏의 BAN2401, 매달 10 ㎎/㎏의 BAN2401 또는 2주마다 10 ㎎/㎏의 BAN2401의, BAN2401의 투여 후의 PET 양성 대상체의 비율을 보여준다.
알 수 있는 바와 같이, 유의미한 비율의 초기 알츠하이머병을 갖는 아밀로이드 양성 대상체는 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴을 포함하는 조성물의 투여로 인하여 아밀로이드 음성으로 전환되었다. 예를 들어, 2주마다 10 ㎎/㎏의 BAN2401의 투여 18개월 후에, 81%(p <0.0001)의 아밀로이드 양성 대상체가 아밀로이드 음성으로 전환되었다. (예를 들어, 표 17 및 도 13을 참조한다.)
유의미한 비율의 초기 알츠하이머병을 갖는 ApoE4-양성(도 28) 및 ApoE4-음성(도 42) 아밀로이드 양성 대상체가 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴을 포함하는 조성물의 투여로 인하여 아밀로이드 음성으로 전환되었다. 그러나, ApoE4-음성 대상체보다 더 높은 비율의 ApoE4-양성 대상체가 아밀로이드 음성으로 전환되었다. 예를 들어, 매달 10 ㎎/㎏의 BAN2401의 투여 18개월 후에, 79%(p<0.0001)의 ApoE4-음성 아밀로이드 양성 대상체가 아밀로이드 음성으로 전환된 한편(예를 들어, 도 31 참조), 100%(p<0.0001)의 ApoE4-양성 아밀로이드 양성 대상체가 아밀로이드 음성으로 전환되었다. (예를 들어, 도 47을 참조한다.)
본원에 상기 논의된 바와 같이, 바이오마커도 또한 측정하였다. 예를 들어, Aβ1-42의 뇌척수액 수준 및 전체 tau의 뇌척수액 수준을 측정하였다. 측정한 추가의 바이오마커는 뉴로그라닌 및 신경필라멘트 경쇄의 뇌척수액 수준을 포함한다.
Aβ1-42의 뇌척수액 수준에 대한 용량 의존적이며 통계적으로 유의미한 효과 및 전체 tau의 뇌척수액 수준에서 통계적으로 유의미한 종적 감소가 관찰되었다.
전반적으로(도 14), 그리고 각각의 하위군(도 30 - ApoE4-양성 대상체; 도 46 - ApoE4-음성 대상체)에서, BAN2401을 포함하는 조성물의 투여는 Aβ1-42의 뇌척수액 수준의 증가를 야기하였다. 어떠한 이론에도 결부되지 않고, 이것은 Aβ1-42의 뇌척수액 수준의 정상화 때문인 것으로 예상되며, 이는 플라크 제거 때문에 뇌척수액 내의 가용성 Aβ1-42가 Aβ 플라크로 더 적게 격리되는 것을 반영한다. 이들 결과는 BAN2401이 그의 표적과 상호작용하는 것을 뒷받침한다.
유사하게, 모든 분석군의 환자는 뇌척수액 전체 tau의 감소를 경험하였다. (도 15, 도 31, 도 47, 도 54, 도 65 및 도 68 내지 도 70을 참조한다.)
위약에 비하여 뉴로그라닌의 뇌척수액 수준의 감소 및 더 적은 양의 신경필라멘트 경쇄가 BAN2401의 투여 후에 관찰되었다. (도 53, 도 55, 도 66, 도 67 및 도 71 내지 도 76을 참조한다.) 2주마다 또는 매달 10 ㎎/㎏의 BAN2401의 투여는 위약에 비하여 뉴로그라닌의 10% 감소(기준선에 비함)(도 53 참조) 및 50% 더 적은 신경필라멘트 경쇄의 생성(도 55 참조)을 초래하였다.
안전성 결과
표 19는 치료 관련 유해 사례의 요약을 제공한다.
표 20은 가장 빈번한 치료 관련 유해 사례의 요약을 제공한다.
표 21은 혈관성 부종(ARIA-E)의 발병률의 요약을 제공한다.
ApoE4-양성 대상체에서의 결과
하기에 논의된 바와 같이, 대상체가 ApoE4 양성인 경우, ApoE4의 비-보유자인 대상체에 비하여 예측 가능하지 않게 유리한 결과가 달성되었다. 이것은 적어도 다른 항-Aβ 항체를 사용하여 수행된 연구의 이전에 보고된 결과를 고려하면 놀라운 것이다.
예를 들어, 또 다른 항-Aβ 항체인 아두카누맙을 사용한 단계 Ib 시험에서, 아두카누맙-치료 환자에서의 아밀로이드 PET SUVr 복합 점수의 감소가 ApoE4 보유자 및 비-보유자에서 유사한 것으로 보고되었다(문헌[Sevigny, J. et al., "The antibody aducanumab reduces Aβ plaques in Alzheimer's disease," Nature 537:50-56, 50-51 (Sept. 1, 2016), citing Extended Data Fig. 2b].) 그러나, 확장 데이터 도 2b에서의 결과는 ApoE4 보유자에 비하여 ApoE4 비-보유자의 치료에 대한 더 나은 결과를 반영한다.
경증 내지 중등도 알츠하이머병의 치료에서, 본 개시의 범주 밖의 항-Aβ 항체인 바피뉴주맙의 단계 II 시험에서, 결과는 일부 임상적 척도에 대한 ApoE4 보유자 상태에 의한 가능한 차이를 나타내며, 잠재적인 치료 차이는 비보유자에 유리하다. (문헌[Salloway et al., "A phase 2 multiple ascending dose trial of bapineuzumab in mild to moderate Alzheimer disease," Neurology 73:2061-2070, 2067 (December 15, 2009)]을 참조한다.) 따라서, 바피뉴주맙의 2가지 상이한 단계 III 임상 시험을 행하였으며, 하나는 ApoE4-양성 보유자에서 행하였고, 하나는 경증 내지 중등도 알츠하이머병을 갖는 ApoE4 비-보유자에서 행하였다. 단계 II 지시에도 불구하고, 단계 III 결과는 2가지 ApoE4 유전형을 구분하지 못했을 뿐 아니라, 임상적 결과에 관하여 바피뉴주맙의 이익을 나타내지 못하였다. (문헌[Salloway et al., "Two Phase 3 Trials of Bapineuzumab in Mild-to-Moderate Alzheimer's Disease," N. Engl. J. Med. 370:322-33 (2014)].) 유사하게, 본 개시의 범주 밖의 또 다른 항-Aβ 항체인 솔라네주맙을 사용한 2가지 단계 III 임상 시험도 또한 경증 내지 중증도 알츠하이머병을 갖는 환자에서 일차 임상 결과에 관하여 이익을 보이지 않았다. (문헌[Salloway et al., N. Engl. J. Med. 370:322-33, 332 (2014)]; 문헌[Doody, R.S. et al., "Phase 3 trials of solanezumab for mild-to-moderate Alzheimer's disease," N. Engl. J. Med. 370:311-21 (2014)].)
상기 논의된 것들과 같은 결과에 기초하여, ApoE4의 비-보유자에 비하여 ApoE4-양성 대상체가 갖는 본원에 보고된 통계적으로 유의미한 결과는 예상치 못했을 뿐 아니라, 예측 가능하지 않았다.
약동학적 프로파일
대상체의 약동학적 프로파일의 분석은 BAN2401을 포함하는 조성물의 투여가 선형 용량 반응을 초래하는 것을 보여주었다. 예를 들어, 도 60을 참조한다.
각각의 용량에 대한 평균 정상 상태 혈장 농도가 표 22에 나타나 있다. ADCOMS, ADAS-cog 및 CDR-SB에 의해 결정되는 바와 같은 질병 진행 속도의 둔화가 BAN2401의 평균 정상 상태 혈장 농도와 양의 상관관계에 있는 것이 관찰되었다. 예를 들어, 도 1, 도 7 및 도 9(용량은 질병 진행의 둔화와 양의 상관관계임) 및 표 22(용량은 평균 정상 상태 혈장 농도와 양의 상관관계임)를 참조한다.
표 23은 BAN2401의 투여 후의 집단 약동학 파라미터를 보여준다.
또한, ARIA-E 사례를 경험한 ApoE4-양성 대상체의 비율이 모든 연구된 용량에서 BAN2401의 최대 혈장 농도와 양의 상관관계에 있는 것이 관찰되었다. 도 62를 참조한다. 대조적으로, ARIA-E 사례를 경험하고, BAN2401을 약 230 ㎍/㎖ 이하의 최대 혈장 농도를 초래하는 용량으로 투여한 ApoE4-음성 대상체의 비율은 위약을 투여한 ApoE4-음성 대상체의 비율과 대략 유사하였다. 상기 문헌을 참조한다.
BAN2401 이외의 적어도 하나의 알츠하이머병 의약의 동시 투여
대상체는 그들에게 BAN2401 이외의 적어도 하나의 알츠하이머병 의약을 동시 투여하든지 아니든지와 관계없이, 본원에 상기 기재된 바와 같이 BAN2401을 투여하였다. 놀랍게도, BAN2401 이외의 적어도 하나의 알츠하이머병 의약을 동시 투여하지 않은 대상체가 BAN2401 및 BAN2401 이외의 적어도 하나의 알츠하이머병 의약을 동시 투여한 대상체보다 기준선에 비하여 인지 저하의 더 큰 둔화를 보였음을 발견하였다. 이들 발견은 분석에 걸쳐 일치하였다: ADCOMS(BAN2401 이외의 적어도 하나의 알츠하이머병 의약을 동시 투여한 대상체에 대하여 인지 저하의 23% 둔화 대 상기 투여가 없는 경우 41%); ADAS-cog(BAN2401 이외의 적어도 하나의 알츠하이머병 의약을 동시 투여한 대상체에 대하여 인지 저하의 39% 둔화 대 상기 투여가 없는 경우 59%); 및 CDR-SB(BAN2401 이외의 적어도 하나의 알츠하이머병 의약을 동시 투여한 대상체에 대하여 인지 저하의 20% 둔화 대 상기 투여가 없는 경우 45%). 도 50을 참조한다.
질병 진행에 대한 위험 인자
대상체의 ApoE4 상태는 질병 진행을 결정하는데 통계적으로 유의미한 위험 인자가 아님이 관찰되었다. 그러나, 다른 인자, 예를 들어, 질병의 임상적 단계, BAN2401 이외의 적어도 하나의 알츠하이머병 의약의 동시의 투여 및 기준선 ADCOMS 점수는 통계적으로 유의미한 위험 인자인 것이 관찰되었다. 도 58 및 도 59를 참조한다.
예측예 A: ApoE4-양성 대상체에서의 알츠하이머병의 예방
대상체를 성별과 상관없이 ApoE4 보유자 상태에 대하여 선별한다. 대상체는 연령, 예를 들어, 50세 이상, 알츠하이머병의 위험 및/또는 다른 기준에 기초하여 선별을 위하여 선택될 수 있다.
선별에 의해 대상체가 ApoE4-양성인 것이 결정되면, 대상체의 뇌 아밀로이드 수준을 예를 들어, 상기 논의된 바와 같은 아밀로이드 PET 영상의 시각적 판독 또는 당업자에게 알려져 있는 또 다른 기법에 의해 측정한다. 또한, 대상체의 뇌척수액 Aβ1-42- 수준 및/또는 뇌척수액 전체 tau 수준을 측정할 수 있다.
대상체의 뇌 아밀로이드 수준이 미리 결정된 수준 초과, 예컨대, 1.1 초과, 예컨대, 1.2 초과, 1.3 초과, 1.4 초과, 1.5 초과 또는 1.6 초과의 PET SUVr 값이면, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물을 대상체에게 투여한다. 일부 구현예에서, 대상체의 뇌 아밀로이드 수준이 미리 결정된 수준 초과, 예컨대, 1.3 초과, 1.4 초과, 1.5 초과, 1.6 초과, 1.7 초과, 1.8 초과 또는 1.9 초과의 PET SUVr 값이면, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물을 대상체에게 투여한다. 조성물을 본원에 기재된 바와 같은 양으로 그리고 투여 섭생법 및 경로, 예컨대 실시예 1에 개시된 것들에 따라 투여할 수 있다.
대상체의 뇌 아밀로이드 수준이 상기 참조된 미리 결정된 수준 미만이면, 대상체를 후일, 예를 들어, 6개월 이후에 모니터링하고/하거나 뇌 아밀로이드 수준을 결정할 수 있다.
대상체로의 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 후에, 대상체의 뇌 아밀로이드 수준을 다시 측정한다. 대상체의 뇌 아밀로이드 수준이 미리 결정된 수준 초과이면, 조성물의 투여를 반복한다. 대상체의 뇌 아밀로이드 수준이 미리 결정된 수준 미만이면, 대상체를 후일, 예를 들어, 6개월 이내에 모니터링하고/하거나 뇌 아밀로이드 수준을 결정할 수 있다.
이후의 결정 동안, 대상체의 뇌 아밀로이드 수준이 미리 결정된 수준 초과이면, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물을 대상체에게 투여한다.
대상체를 모니터링하는 동안, 대상체의 뇌 아밀로이드 수준이 예를 들어, PET 또는 뇌척수액 척도에 따라 미리 결정된 수준 초과로 증가하면, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여를 재개할 것이다. 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 후에 뇌 아밀로이드 수준을 다시 측정할 것이다.
조성물의 투여 후에, 적어도 하나의 유지 요법 작용제, 예컨대 BACE 저해제를 선택적으로 대상체에게 투여한다. 일부 구현예에서, BACE 저해제는 엘렌베세스타트일 수 있다.
뇌 아밀로이드 수준의 측정 및 고려사항에 더하여, 뇌척수액 Aβ1-42 수준 및/또는 뇌척수액 전체 tau 수준, 대상체의 건강의 다른 척도를 예를 들어, MMSE, ADAS-cog, CDR 및 FAQ에서 측정하고/하거나 모니터링한다.
예측예 B: 초기 알츠하이머병을 갖는 대상체의 치료
알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성 및/또는 경증 알츠하이머병 치매를 갖는 연령이 50세 내지 90세 범위인 남성 및 여성 둘 모두의 대상체를 치료에 적격하도록 선별한다. 총 990명의 대상체를 하기 기재된 바와 같이 2가지 치료군에 걸쳐, BAN2401을 투여하는 2명의 대상체마다 위약을 투여하는 1명의 대상체의 비로 무작위 배정한다.
연구는 사전 무작위 배정 단계 및 무작위 배정 단계로 이루어진다.
사전 무작위 배정 단계
이 단계는 최대 60일간 지속되며, 선별 기간 및 기준선 기간으로 이루어진다. 선별 기간 동안, 적격성 기준에 기초하여 대상체를 평가한다. 대상체가 적격한 것으로 간주되면, 대상체를 기준선 단계로 진행시킨다.
기준선 기간 동안, 대상체가 동의하면, 임상적 검사(예를 들어, 혈액 검사(예를 들어, ApoE4 상태를 결정하기 위함) 등), 안전성 자기 공명 영상화(MRI) 분석, 아밀로이드 PET 평가(예를 들어, 아밀로이드 PET 영상의 시각적 판독) 및 뇌척수액(바이오마커 분석을 위함)을 포함하는 다수의 분석을 수행한다. 대상체의 추가의 임상적 검사는 MMSE, CDR, ADAS-Cog 및 FAQ를 포함한다.
무작위 배정 단계
무작위 배정 단계는 18개월 치료 기간 및 3개월 추적 기간으로 이루어진다. 대상체를 무작위 배정하고, 위약 또는 10 ㎎/㎏ BAN2401을 포함하는 조성물 중 어느 하나를 2주마다 1회 투여한다.
모든 대상체에게 2주마다 대략 60분 정맥내 주입을 투여한다. BAN2401을 생리적 식염수 중에 60분 정맥내 주입으로서 투여하였다.
대상체가 이러한 분석에 동의하면, 모든 대상체를 인지 기능, 안전성, 약동학적 파라미터, 안전성 MRI, PET 영상화, 용적측정 MRI 및 뇌척수액 분석에 기초하여 평가한다. 추가의 임상적 평가는 MMSE, CDR, ADAS-cog, FAQ 및 아밀로이드 측정을 포함한다. 이들 측정치를 정규 간격으로, 예를 들어, 기준선 기간 동안, 치료의 개시 3개월, 6개월, 9개월, 12개월, 15개월 및/또는 18개월 후에 취한다.
치료를 제18개월 후반에 대상체에 의한 요청, 주치의 및/또는 데이터 안전 검토 위원회의 요청 및/또는 치료의 중단을 타당하게 만드는 하나 이상의 유해 사례의 출현으로 종료한다.
치료의 종료 후에, 대상체를 기준선 기간 및 무작위 배정 기간 동안과 같이 평가한다. 연장 단계(하기 기재됨)에 참여하지 않는 대상체는 3개월 추적 방문에 참석하며, 무작위 배정 단계 동안 측정된 것들과 유사한 파라미터를 측정/평가한다.
연장 단계
무작위 배정 단계를 완료한 대상체는 연장 단계에 참여하는 선택권을 갖는다. 이 단계 동안 대상체는 무작위 배정 기간 동안과 동일한 치료를 유지한다. 유사하게, 무작위 배정 단계에 대하여 기재된 바와 같은 증상 및 다른 파라미터의 모니터링을 또한 연장 단계 동안 측정할 것이다. 연장 단계는 대상체의 요청, 주치의 및/또는 데이터 안전 검토 위원회의 요청, 치료의 중단을 타당하게 만드는 하나 이상의 유해 사례의 출현, BAN2401의 상업적 이용 가능성 및/또는 양의 위험-이익 관계를 입증하지 못하는 연구 결과에 의한 종료 시까지 계속할 것이다. 3개월 추적 방문은 마지막 용량의 연구 약물 이후에 일어나며, 무작위 배정 단계 동안 측정된 것들과 유사한 파라미터를 측정/평가한다.
제형
BAN2401을 일회용 10 ㎖ 바이얼 내에, 10 ㎎/㎖을 함유하는 투명한 멸균 주사용 용액으로서 공급한다(총 100 ㎎/바이얼). 약물 제품을 25 mM 시트르산나트륨, 125 mM 염화나트륨, 0.02%(w/v) 폴리소르베이트 80 중에 제형화하였으며, pH는 5.7인 것으로 결정된다. BAN2401을 말단 0.22 μM 인-라인 필터를 함유하는 주입 시스템을 통해 투여한다.
연구 종점
일차 연구 종점은 제18개월에 알츠하이머병 복합 점수(ADCOMS)의 기준선으로부터의 변화를 결정하는 것이다. 주요 이차 종점은 제18개월에 뇌 아밀로이드 수준에 대한 아밀로이드 PET SUVr 복합 점수의 기준선으로부터의 변화 및 제18개월에 ADAS-cog 점수의 기준선으로부터의 변화를 측정하는 것을 포함한다.
이차 종점은 제18개월에 CDR-SB 점수의 기준선으로부터의 변화 및 제18개월에 CDR-SB 점수의 악화까지의 시간을 포함한다.
바이오마커 종점은 뇌 아밀로이드 수준에 대한 제6개월 및 제12개월에서의 아밀로이드 PET SUVr 복합 점수의 기준선으로부터의 변화; 제12개월 및 제18개월에서의 뇌척수액 뉴로그라닌, 신경필라멘트 경쇄, Aβ1-42 및 전체 Tau의 기준선으로부터의 변화; 및 vMRI를 사용한 제6개월, 제12개월 및 제18개월에서의 형태측정 MRI 측정치(해마 용적 포함)의 기준선으로부터의 변화를 포함한다.
OLE 예측예 C에 적격한 대상체: 하기 예측예 C에서의 치료에 적격한 대상체는 초기 AD에서 알츠하이머병 복합 점수(ADCOMS)를 사용하여 치료 제12개월 및 제18개월에 BAN2401의 임상적 안전성 및 효능을 평가하고, 그의 용량 반응을 탐색한, 다국가, 다기관, 이중 맹검, 위약 대조, 평행군, 18개월 연구에서 치료하였던 초기 AD를 갖는 대상체(AD로 인한 MCI 및 경증 AD 치매 대상체)이다. 이 연구에서, 위약 또는 5가지 진행 군의 BAN2401에 걸쳐 반응 조정 무작위 배정을 사용하는 베이지안 설계를 제12개월에 ADCOMS에서 초기 AD를 갖는 대상체에 사용하였다. 초기 AD 대상체에서의 더욱 둔화된 저하는 ADCOMS(30%-더 낮은 저하), ADAS-cog(47%-더 낮음), MMSE(19%-더 낮음) 및 CDR-SB(26%-더 낮음)에 있어서, 2주마다 10 ㎎/㎏ 용량의 BAN2401을 사용하여 제12개월 및 제18개월 둘 모두에서 관찰되었다. 이들 임상적 척도에 대하여 차이가 제6개월 만큼 조기에 관찰되었다. 임상적 결과는 정량적 아밀로이드 PET에 의해 측정되는 바와 같이 모든 용량에 걸쳐 뇌 아밀로이드의 강력한 용량 의존적 감소를 동반하였다. 예를 들어, 도 63을 참조한다.
예측예 C: BAN2401의 개방 표지 연장 연구: 초기 알츠하이머병을 갖는 대상체의 치료
상기 논의된 바와 같은 적격한 대상체를 2주마다 10 ㎎/㎏의 용량의 BAN2401을 사용하여 최대 24개월 동안 개방 표지 연장 연구(OLE)에서 치료한다. OLE에서, BAN2401의 장기간 안전성 및 내약성을 평가하고, 하기에 요약된 바와 같은 이전의 연구에 참여한 대상체에서의 뇌 아밀로이드에 대한 BAN2401의 영향을 평가한다.
남성 및 여성 둘 모두의 상기 논의된 바와 같은 대략 200 내지 250명의 적격한 대상체는 ApoE 상태와 관계없이, 하기 제시된 포함 및 배제 기준에 기초하여 OLE 연구에 허용될 수 있다.
OLE에 대한 포함 기준은 하기를 포함한다:
· 하기로 인한 적어도 79주 동안 또는 79주 미만 동안 이전의 연구에서의 이전의 치료:
i. ARIA-E 사례 경험;
ii. ARIA-H 사례(예를 들어, 표재성 철색소침착증, 미세출혈 및/또는 증후성 미세출혈) 경험;
iii. 이전의 BAN2401 치료 동안 금지되었지만, 더 이상 금지되지 않는 의약 복용; 및/또는
iv. BAN2401 치료와 관련되지 않고, 중증이거나 생명을 위협하는 것으로 여겨지지 않는 임의의 유해 사례를 포함하여, 금지된 의약과 관련되지 않은 임의의 이유;
· 의료진/정보 제공자가 대상체에 관한 치료-관련 상세사항을 제공할 수 있음;
· 사전 동의를 제공할 수 있음; 및
· 임상 방문에 참석할 수 있음.
OLE에 대한 배제 기준은 하기를 포함한다:
· 하기를 제외한 이유로 79주 미만 후에 중단된 이전의 연구에서의 이전의 치료:
i. ARIA-E 사건 경험;
ii. ARIA-H 사건(예를 들어, 표재성 철색소침착증, 미세출혈 및/또는 증후성 미세출혈) 경험;
iii. 이전의 BAN2401 치료 동안 금지되었지만, 더 이상 금지되지 않는 의약 복용; 및/또는
iv. ApoE4-양성이고, 2주마다 10 ㎎/㎏ 용량의 BAN2401을 사용한 치료를 제공받음; 및/또는
v. 연구 약물(위약 또는 BAN2401)과 관련되지 않은 것으로 여겨지고, 중증이거나 생명을 위협하지 않는 유해 사례 경험;
· 수유 중인 여성 또는 임신일 수 있거나 임신을 할 위험이 있는 가임 여성; 및/또는
· BAN2401의 투여를 방해하거나, 그와 관련해 안전성 문제가 제기될 수 있는 이전의 연구에서의 치료 후 질환의 발생.
본 발명의 OLE에서 BAN2401의 투여 이전에, 참여 대상체를 평가하여, 기준선 특징, 예컨대 인지 기능, 안전성 파라미터, 약동학적 파라미터, 안전성 MRI, PET 영상화 및 용적측정 MRI를 결정한다. 추가의 임상적 평가는 MMSE, CDR, ADAS-cog, FAQ 및 아밀로이드 측정을 포함할 수 있다.
본 발명의 OLE 예측예에서의 치료는 적격한 대상체로의 최대 24개월 동안의 2주마다 10 ㎎/㎏ 용량의 BAN2401의 투여를 포함한다.
BAN2401을 예를 들어, 25 mM 시트르산나트륨, 125 mM 염화나트륨, 0.02%(w/v) 폴리소르베이트 80을 포함하며 5.7의 pH를 갖는 일회용 10 ㎖ 바이얼 내에, 10 ㎎/㎖을 함유하는 투명한 멸균 주사용 용액으로서 인간 대상체로의 투여에 적합한 임의의 제형으로서 공급한다(총 100 ㎎/바이얼). BAN2401을 말단 0.22 μM 인-라인 필터를 함유하는 주입 시스템을 통해 투여할 수 있다.
OLE에서 치료 동안, 다양한 시간 간격(3개월, 6개월, 9개월, 12개월, 18개월 및/또는 24개월)에, 그리고 OLE에서 치료의 완료 시에, 대상체를 하나 이상의 평가 기법, 예컨대 기준선 및/또는 임상적 평가 기법에 의해 평가한다. 적합한 평가는 인지 기능, 안전성 파라미터, 약동학적 파라미터, 안전성 MRI, PET 영상화, 용적측정 MRI, MMSE, CDR, ADAS-cog, FAQ 및 아밀로이드 측정을 포함할 수 있다.
OLE에서 치료 동안, 대상체에 무증상 ARIA-H 뇌 미세출혈, 다발성 무증상 뇌 미세출혈, 무증상 표재성 철색소침착증, 단일의 무증상 미세출혈 및/또는 무증상 또는 방사선사진에 의한 경증 또는 중등도 ARIA-E가 발생하는 경우에도, 대상체는 중단 없이 BAN2401로 계속 치료한다. 대상체에 증상성 ARIA-H 및/또는 무증상 또는 방사선사진에 의한 중등도 내지 중증의 ARIA-E가 발생하면, ARIA-H 또는 ARIA-E가 방사성사진에 의해 안정화되거나, 해소되고, 임상적 특징이 해소될 때까지 BAN2401 투여를 연기하고, 그 후 BAN2401 투여를 동일한 용량 및 섭생법으로 재개할 수 있다. OLE에서 치료를 2회 넘게 재개해야 한다면, 대상체를 연구에서 제외한다.
OLE 연구 평가 및 종점
2주마다 10 ㎎/㎏의 BAN2401을 사용한 초기 알츠하이머병을 갖는 대상체의 치료의 장기간 안전성 및 내약성을 OLE에서 평가한다. 평가는 ARIA-H, ARIA-E 및 비-ARIA-H/비-ARIA-E 유해 사례의 발생률 및 중증도를 포함한다.
뇌 아밀로이드 수준(예를 들어, PET 영상화에 의해 결정되는 바와 같음)을 이전의 연구 이전에 및/또는 그의 종료 시에, BAN2401을 사용한 본 발명의 OLE 치료 예측예 이전에, 그리고 선택적으로 그 동안 및 그 이후에 결정하여, BAN2401을 사용한 치료로 인한 뇌 내의 아밀로이드의 제거 및/또는 그의 부재의 유지를 평가한다. 뇌 아밀로이드 수준(예를 들어, 종적 PET 영상화에 의함)을 예를 들어, 상기 논의된 바와 같은 이전의 연구 이후의 뇌 아밀로이드의 기준선으로부터의 변화에 관하여, BAN2401을 사용한 본 발명의 예측적 OLE 치료 3개월, 6개월, 12개월, 18개월 및/또는 24개월 후에 평가한다. 예를 들어, 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같은 아밀로이드 양성 대상체의 비율도 또한 OLE에서 시간이 지남에 따라 평가한다.
예를 들어, ADCOMS, CDR-SB, ADAS-Cog 및 MMSE에 의해 결정되는 바와 같은 이 OLE 연구 동안 대상체의 인지 평가는 BAN2401을 사용한 치료의 장기간 인지 효과에 관한 통찰력을 제공할 수 있다. 평가는 장기간 질병 진행 및 이전의 연구 동안 관찰되는 인지 저하 속도의 임의의 둔화의 지속성에 관한 통찰력을 제공할 수 있다.
약동학, 해마 용적 및 다른 바이오마커와 같은 파라미터를 측정할 것이기 때문에, 이 OLE 연구는 BAN2401을 사용한 치료의 장기간 효과에 관한 통찰력을 제공할 수 있다.
본 발명의 예측적 OLE 프로토콜은 이전의 프로토콜과 달리, 중증도가 치료 종결을 지시하지 않는 한, ARIA-E 및/또는 ARIA-H 사건을 경험하더라도, BAN2401을 사용한 대상체의 치료를 계속하기 때문에, ARIA-E 및 ARIA-H 사건의 관리에 관한 정보는 이 OLE 연구로부터 제공될 수 있다.
휴약일 후의 아밀로이드 감소의 지속성(예를 들어, BAN2401 치료를 중단한 후 감소가 얼마나 오래 지속되는지), 아밀로이드 수준 증가 및/또는 침착의 시간 경과, 및/또는 아밀로이드 제거의 시간 경과(아밀로이드가 BAN2401 치료에 의해 얼마나 신속하게 제거되는지)에 대한 추가의 통찰력도 또한 본 발명의 예측적 OLE 연구로부터 수득될 수 있다.
초기 결과
OLE 연구에서 등록이 진행 중이다. 기준선 아밀로이드 PET 데이터는 OLE 연구에 등록된 56명의 대상체로부터 입수 가능하며, 이는 연구 약물의 평균 중단 기간이 21개월인(9개월 내지 52개월 범위의 연구 약물 중단) 이전 연구에서 BAN2401로 치료받았던 39명의 대상체로부터의 데이터를 포함한다. 이전에 아밀로이드 양성이었으며, BAN2401(18개월 동안 매달 또는 2주마다 10 ㎎/㎏)로 치료된 대상체의 85%(33/39)는 9개월 내지 52개월의 연구 약물 중단 후에 여전히 아밀로이드 음성인 것으로 결정되었다. 18개월 후에 이전의 연구에서 아밀로이드 음성이었던 OLE 연구에 참여한 모든 대상체는 또한, 이전의 연구에서의 처리군과 상관 없이, OLE 연구의 기준선 측정에서 아밀로이드 음성이었다. 따라서, 이들 초기 결과는 대상체가 9개월 내지 52개월 동안 치료를 중단함에도 불구하고, PET에 의해 결정되는 바와 같이, 아밀로이드 음성으로의 대상체의 BAN2401-매개의 복귀가 이전의 연구의 종료로부터 OLE 연구의 기준선 측정까지 지속되었음을 예상치 않게 보여준다.
일부 구현예에서, 본원에 개시된 방법은 아밀로이드의 감소를 초래한다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 9개월 내지 52개월 지속된다.
일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 적어도 1개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 적어도 2개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 적어도 3개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 적어도 4개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 적어도 5개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 적어도 6개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 적어도 7개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 적어도 8개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 적어도 9개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 적어도 10개월 동안 지속된다.
일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 적어도 15개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 적어도 20개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 적어도 25개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 적어도 30개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 적어도 35개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 적어도 40개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 적어도 45개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 적어도 50개월 동안 지속된다.
일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 9개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 10개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 11개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 12개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 13개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 14개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 15개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 16개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 17개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 18개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 19개월 동안 지속된다.
일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 20개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 21개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 22개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 23개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 24개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 25개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 26개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 27개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 28개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 29개월 동안 지속된다.
일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 30개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 31개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 32개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 33개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 34개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 35개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 36개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 37개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 38개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 39개월 동안 지속된다.
일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 40개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 41개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 42개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 43개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 44개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 45개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 46개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 47개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 48개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 49개월 동안 지속된다.
일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 50개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 51개월 동안 지속된다. 일부 구현예에서, 아밀로이드의 감소는 PET에 의해 결정되는 바와 같이, BAN2401의 투여 후 52개월 동안 지속된다.
예측예 D: 알츠하이머병의 예방
대상체를 연령, 예를 들어, 50세 이상, 알츠하이머병의 위험 및/또는 다른 기준에 기초하여 선별을 위하여 선택할 수 있다. 대상체의 ApoE4 보유자 상태를 결정하지만, 그것은 연구에 참여하는 대상체의 적격성에 영향을 미치지 않는다.
대상체의 뇌 아밀로이드 수준을 예를 들어, 상기 논의된 바와 같은 아밀로이드 PET 영상의 시각적 판독 또는 당업자에게 알려져 있는 또 다른 기법에 의해 측정한다. 대상체의 뇌척수액 Aβ1-42- 수준 및/또는 뇌척수액 전체 tau 수준도 또한 측정할 수 있다.
대상체의 뇌 아밀로이드 수준이 미리 결정된 수준 초과, 예컨대 1.1 초과, 예컨대, 1.2 초과, 1.3 초과, 1.4 초과, 1.5 초과 또는 1.6 초과의 PET SUVr 값이면, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물을 대상체에게 투여한다. 일부 구현예에서, 대상체의 뇌 아밀로이드 수준이 미리 결정된 수준 초과, 예컨대, 1.3 초과, 예컨대 1.4 초과, 1.5 초과, 1.6 초과, 1.7 초과, 1.8 초과 또는 1.9 초과의 PET SUVr 값이면, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물을 대상체에게 투여한다. 조성물을 본원에 기재된 바와 같은 양으로 그리고 투여 섭생법 및 경로, 예컨대 실시예 1에 개시된 것들에 따라 투여할 수 있다.
대상체의 뇌 아밀로이드 수준이 상기 참조된 미리 결정된 수준 미만이면, 대상체를 후일, 예를 들어, 6개월 이후에 모니터링하고/하거나 뇌 아밀로이드 수준을 결정할 수 있다.
대상체로의 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 후에, 대상체의 뇌 아밀로이드 수준을 다시 측정한다. 대상체의 뇌 아밀로이드 수준이 미리 결정된 수준 초과이면, 조성물의 투여를 반복한다. 대상체의 뇌 아밀로이드 수준이 미리 결정된 수준 미만이면, 대상체를 후일, 예를 들어, 6개월 이내에 모니터링하고/하거나 뇌 아밀로이드 수준을 결정할 수 있다.
이후의 결정 동안, 대상체의 뇌 아밀로이드 수준이 미리 결정된 수준 초과이면, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물을 대상체에게 투여한다.
대상체를 모니터링하는 동안, 대상체의 뇌 아밀로이드 수준이 예를 들어, PET 또는 뇌척수액 측정에 따라 미리 결정된 수준 초과로 증가하면, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여를 재개할 것이다. 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물의 투여 후에 뇌 아밀로이드 수준을 다시 측정할 것이다.
조성물의 투여 후에, 적어도 하나의 유지 요법 작용제, 예컨대 BACE 저해제를 선택적으로 대상체에게 투여한다. 일부 구현예에서, BACE 저해제는 엘렌베세스타트일 수 있다.
뇌 아밀로이드 수준의 측정 및 고려사항에 더하여, 뇌척수액 Aβ1-42 수준 및/또는 뇌척수액 전체 tau 수준, 대상체의 건강의 다른 척도를 예를 들어, MMSE, ADAS-cog, CDR 및 FAQ에서 측정하고/하거나 모니터링한다. 예를 들어, 도 64를 참조한다.
서열 목록
SEQ ID NO: 11
중쇄:
경쇄:
SEQUENCE LISTING
<110> EISAI R&D MANAGEMENT CO., LTD.
<120> METHODS OF TREATMENT AND PREVENTION OF ALZHEIMER'S DISEASE
<130> 08061.0039-00304
<140> PCT/US2019/043067
<141> 2019-07-23
<150> 62/874,684
<151> 2019-07-16
<150> 62/846,902
<151> 2019-05-13
<150> 62/824,162
<151> 2019-03-26
<150> 62/749,614
<151> 2018-10-23
<150> 62/702,659
<151> 2018-07-24
<160> 12
<170> PatentIn version 3.5
<210> 1
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 1
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ser Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Ser Gly Ser Ser Thr Ile Tyr Tyr Gly Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Phe
65 70 75 80
Leu Gln Met Ser Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Gly Tyr Tyr Tyr Gly Arg Ser Tyr Tyr Thr Met Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 2
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 2
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Ala Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Arg Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Ile Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Pro Thr Phe Gly Pro Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 3
<211> 330
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 3
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
225 230 235 240
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 4
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 4
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 5
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 5
Ser Phe Gly Met His
1 5
<210> 6
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 6
Tyr Ile Ser Ser Gly Ser Ser Thr Ile Tyr Tyr Gly Asp Thr Val Lys
1 5 10 15
Gly
<210> 7
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 7
Glu Gly Gly Tyr Tyr Tyr Gly Arg Ser Tyr Tyr Thr Met Asp Tyr
1 5 10 15
<210> 8
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 8
Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu
1 5 10 15
<210> 9
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 9
Lys Val Ser Asn Arg Phe Ser
1 5
<210> 10
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 10
Phe Gln Gly Ser His Val Pro Pro Thr
1 5
<210> 11
<211> 454
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 11
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ser Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Ser Gly Ser Ser Thr Ile Tyr Tyr Gly Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Phe
65 70 75 80
Leu Gln Met Ser Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Gly Tyr Tyr Tyr Gly Arg Ser Tyr Tyr Thr Met Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys
115 120 125
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
130 135 140
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
145 150 155 160
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
165 170 175
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
180 185 190
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
195 200 205
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro
210 215 220
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
225 230 235 240
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
245 250 255
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
260 265 270
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
275 280 285
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
290 295 300
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
305 310 315 320
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
325 330 335
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
340 345 350
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
355 360 365
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
370 375 380
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
385 390 395 400
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
405 410 415
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
420 425 430
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
435 440 445
Ser Leu Ser Pro Gly Lys
450
<210> 12
<211> 219
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 12
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Ala Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Arg Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Ile Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Pro Thr Phe Gly Pro Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
Claims (179)
- 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물을 투여하는 단계를 포함하는, 초기 알츠하이머병을 갖는 대상체에서의 임상적 저하(clinical decline)의 감소 방법.
- 제1항에 있어서, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체가 SEQ ID NO: 5(HCDR1), SEQ ID NO: 6(HCDR2) 및 SEQ ID NO: 7(HCDR3)의 아미노산 서열을 포함하는 3개의 중쇄 상보성 결정 영역(HCDR1, HCDR2 및 HCDR3); 및 SEQ ID NO: 8(LCDR1), SEQ ID NO: 9(LCDR2) 및 SEQ ID NO: 10(LCDR3)의 아미노산 서열을 포함하는 3개의 경쇄 상보성 결정 영역(LCDR1, LCDR2 및 LCDR3)을 포함하는 방법.
- 제1항에 있어서, 상기 초기 알츠하이머병을 갖는 대상체가 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받고/받거나 경증 알츠하이머병 치매를 갖는 것으로 진단받은 방법.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 상기 대상체가 ApoE4-양성인 방법.
- 제1항 내지 제4항 중 어느 한 항에 있어서, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체가 BAN2401인 방법.
- 제5항에 있어서, 상기 조성물이 대상체의 체중에 비하여 5 ㎎/㎏ 내지 10 ㎎/㎏의 BAN2401을 포함하는 방법.
- 제5항에 있어서, 상기 조성물이 대상체의 체중에 비하여 10 ㎎/㎏의 BAN2401을 포함하는 방법.
- 제1항 내지 제7항 중 어느 한 항에 있어서, 상기 조성물이 2주마다 1회 또는 매달 1회 투여되는 방법.
- 제1항 내지 제8항 중 어느 한 항에 있어서, 상기 임상적 저하가 조성물의 투여 6개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 45% 감소되는 방법.
- 제1항 내지 제9항 중 어느 한 항에 있어서, 상기 임상적 저하가 상기 조성물의 투여 12개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 35% 감소되는 방법.
- 제1항 내지 제10항 중 어느 한 항에 있어서, 상기 임상적 저하가 상기 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 30% 감소되는 방법.
- 제1항 내지 제11항 중 어느 한 항에 있어서, 상기 임상적 저하가 상기 조성물의 투여 18개월 후에 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 47% 감소되는 방법.
- 제1항 내지 제12항 중 어느 한 항에 있어서, 상기 임상적 저하가 상기 조성물의 투여 18개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 26% 감소되는 방법.
- 제11항에 있어서, 상기 초기 알츠하이머병을 갖는 대상체가 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받고, 상기 임상적 저하가 상기 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 33% 감소되는 방법.
- 제11항에 있어서, 상기 초기 알츠하이머병을 갖는 대상체가 경증 알츠하이머병 치매를 갖는 것으로 진단받고, 상기 임상적 저하가 상기 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 35% 감소되는 방법.
- 제9항 내지 제15항 중 어느 한 항에 있어서, 상기 조성물이 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여되는 방법.
- 제16항에 있어서, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체가 BAN2401인 방법.
- 제9항 내지 제17항 중 어느 한 항에 있어서, 상기 대상체가 ApoE4-양성인 방법.
- 제18항에 있어서, 상기 임상적 저하가 상기 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 63% 감소되는 방법.
- 제18항에 있어서, 상기 임상적 저하가 상기 조성물의 투여 18개월 후에 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 84% 감소되는 방법.
- 제18항에 있어서, 상기 임상적 저하가 상기 조성물의 투여 18개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 60% 감소되는 방법.
- 제1항 내지 제17항 중 어느 한 항에 있어서, 상기 대상체가 ApoE4-음성인 방법.
- 제1항 내지 제22항 중 어느 한 항에 있어서, 상기 투여가 Aβ1-42, 전체 tau, 포스포-tau 및/또는 뉴로그라닌(neurogranin)의 뇌척수액 수준의 감소를 초래하는 방법.
- 제1항 내지 제23항 중 어느 한 항에 있어서, 상기 투여가 신경필라멘트(neurofilament) 경쇄의 뇌척수액 수준의 증가의 둔화를 초래하는 방법.
- 제1항 내지 제24항 중 어느 한 항에 있어서, 상기 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되는 방법.
- 제1항 내지 제24항 중 어느 한 항에 있어서, 상기 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는 방법.
- 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물을 투여하는 단계를 포함하는, 초기 알츠하이머병을 갖는 아밀로이드 양성 대상체의 아밀로이드 음성으로의 전환 방법.
- 제27항에 있어서, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체가 SEQ ID NO: 5(HCDR1), SEQ ID NO: 6(HCDR2) 및 SEQ ID NO: 7(HCDR3)의 아미노산 서열을 포함하는 3개의 중쇄 상보성 결정 영역(HCDR1, HCDR2 및 HCDR3); 및 SEQ ID NO: 8(LCDR1), SEQ ID NO: 9(LCDR2) 및 SEQ ID NO: 10(LCDR3)의 아미노산 서열을 포함하는 3개의 경쇄 상보성 결정 영역(LCDR1, LCDR2 및 LCDR3)을 포함하는 방법.
- 제27항에 있어서, 상기 초기 알츠하이머병을 갖는 대상체가 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받고/받거나 경증 알츠하이머병 치매를 갖는 것으로 진단받은 방법.
- 제27항 내지 제29항 중 어느 한 항에 있어서, 상기 대상체가 ApoE4-양성인 방법.
- 제27항 내지 제30항 중 어느 한 항에 있어서, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체가 BAN2401인 방법.
- 제27항 내지 제31항 중 어느 한 항에 있어서, 상기 조성물이 대상체의 체중에 비하여 5 ㎎/㎏ 내지 10 ㎎/㎏의 BAN2401을 포함하는 방법.
- 제32항에 있어서, 상기 조성물이 대상체의 체중에 비하여 10 ㎎/㎏의 BAN2401을 포함하는 방법.
- 제27항 내지 제33항 중 어느 한 항에 있어서, 상기 조성물이 2주마다 1회 또는 매달 1회 투여되는 방법.
- 제27항 내지 제31항 중 어느 한 항에 있어서, 상기 조성물의 투여는 상기 조성물의 투여 6개월 후에 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이 50% 내지 100%의 대상체가 아밀로이드 음성이 되도록 초래하는 방법.
- 제27항 내지 제31항 중 어느 한 항에 있어서, 상기 조성물의 투여는 상기 조성물의 투여 12개월 후에 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이 적어도 55%의 대상체가 아밀로이드 음성이 되도록 초래하는 방법.
- 제27항 내지 제31항 중 어느 한 항에 있어서, 상기 조성물의 투여는 상기 조성물의 투여 18개월 후에 아밀로이드 PET 영상의 시각적 판독에 의해 결정되는 바와 같이 적어도 70%의 대상체가 아밀로이드 음성이 되도록 초래하는 방법.
- 제35항 내지 제37항 중 어느 한 항에 있어서, 상기 조성물이 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하고, 2주마다 1회 또는 매달 1회 투여되는 방법.
- 제35항 내지 제38항 중 어느 한 항에 있어서, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체가 BAN2401인 방법.
- 제35항 내지 제39항 중 어느 한 항에 있어서, 상기 대상체가 ApoE4-양성인 방법.
- 제35항 내지 제39항 중 어느 한 항에 있어서, 상기 대상체가 ApoE4-음성인 방법.
- 제35항 내지 제41항 중 어느 한 항에 있어서, 상기 투여가 Aβ1-42, 전체 tau, 포스포-tau 및/또는 뉴로그라닌의 뇌척수액 수준의 감소를 초래하는 방법.
- 제35항 내지 제42항 중 어느 한 항에 있어서, 상기 투여가 신경필라멘트 경쇄의 뇌척수액 수준의 증가의 둔화를 초래하는 방법.
- 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물을 투여하는 단계를 포함하는, 뇌 아밀로이드 수준의 감소를 필요로 하는 대상체에서의 뇌 아밀로이드 수준의 감소 방법.
- 제44항에 있어서, 상기 항체가 SEQ ID NO: 5(HCDR1), SEQ ID NO: 6(HCDR2) 및 SEQ ID NO: 7(HCDR3)의 아미노산 서열을 포함하는 3개의 중쇄 상보성 결정 영역(HCDR1, HCDR2 및 HCDR3); 및 SEQ ID NO: 8(LCDR1), SEQ ID NO: 9(LCDR2) 및 SEQ ID NO: 10(LCDR3)의 아미노산 서열을 포함하는 3개의 경쇄 상보성 결정 영역(LCDR1, LCDR2 및 LCDR3)을 포함하는 방법.
- 제44항 또는 제45항에 있어서, 상기 대상체가 알츠하이머병, 다운 증후군, 만성 외상성 뇌병증, 뇌 아밀로이드 혈관병증, 루이소체 치매, 또는 Aβ 펩티드-함유 가용성 및/또는 불용성 Aβ 응집체를 갖는 또 다른 뇌 질병 또는 질환을 갖는 방법.
- 제46항에 있어서, 상기 알츠하이머병이 초기 알츠하이머병인 방법.
- 제47항에 있어서, 상기 초기 알츠하이머병을 갖는 대상체가 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받고/받거나 경증 알츠하이머병 치매를 갖는 것으로 진단받은 방법.
- 제44항 내지 제48항 중 어느 한 항에 있어서, 상기 대상체가 ApoE4-양성인 방법.
- 제44항 내지 제49항 중 어느 한 항에 있어서, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체가 BAN2401인 방법.
- 제50항에 있어서, 상기 조성물이 대상체의 체중에 비하여 2.5 ㎎/㎏ 내지 10 ㎎/㎏의 BAN2401을 포함하는 방법.
- 제51항에 있어서, 상기 조성물이 대상체의 체중에 비하여 10 ㎎/㎏의 BAN2401을 포함하는 방법.
- 제44항 내지 제52항 중 어느 한 항에 있어서, 상기 조성물이 2주마다 1회 또는 매달 1회 투여되는 방법.
- 제44항 내지 제53항 중 어느 한 항에 있어서, 대상체의 PET SUVr 값의 기준선으로부터의 보정 평균 변화가 상기 조성물의 투여 12개월 후에 적어도 -0.20 감소되는 방법.
- 제44항 내지 제53항 중 어느 한 항에 있어서, 대상체의 PET SUVr 값의 기준선으로부터의 보정 평균이 상기 조성물의 투여 18개월 후에 적어도 -0.25 감소되는 방법.
- 제44항 내지 제55항 중 어느 한 항에 있어서, 상기 조성물이 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여되는 방법.
- 제44항 내지 제55항 중 어느 한 항에 있어서, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체가 BAN2401인 방법.
- 제44항 내지 제57항 중 어느 한 항에 있어서, 상기 대상체가 ApoE4-양성인 방법.
- 제44항 내지 제53항 중 어느 한 항에 있어서, 상기 대상체가 ApoE4-음성인 방법.
- 제44항 내지 제59항 중 어느 한 항에 있어서, 상기 투여가 Aβ1-42, 전체 tau, 포스포-tau 및/또는 뉴로그라닌의 뇌척수액 수준의 감소를 초래하는 방법.
- 제44항 내지 제60항 중 어느 한 항에 있어서, 상기 투여가 신경필라멘트 경쇄의 뇌척수액 수준의 증가의 둔화를 초래하는 방법.
- 대상체의 뇌 아밀로이드 수준을 측정하는 단계;
상기 대상체의 뇌 아밀로이드 수준이 미리 결정된 제1 수준 초과이면, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물을 투여하는 단계,
상기 대상체의 투여-후 뇌 아밀로이드 수준을 측정하는 단계,
상기 투여-후 뇌 아밀로이드 수준이 미리 결정된 제2 수준 초과이면, 상기 조성물을 투여하는 단계,
상기 대상체의 뇌 아밀로이드 수준이 미리 결정된 제1 수준 미만이 될 때까지, 투여 후의 상기 대상체의 뇌 아밀로이드 수준을 모니터링하는 단계,
BACE 저해제, 감마 세크레타제(secretase) 저해제, 감마 세크레타제 조절제, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체 이외의 Aβ 펩티드 생성 저해제, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체 이외의 Aβ 펩티드 수준을 낮추는 작용제 및 그의 조합으로부터 선택되는, 미리 결정된 뇌 아밀로이드 수준의 유지에 적합한 적어도 하나의 추가의 치료제를 선택적으로 투여하는 단계
를 포함하는 대상체에서의 알츠하이머병의 예방 방법. - 제62항에 있어서, 투여-전 및/또는 투여-후 뇌 아밀로이드 수준 결정이 Aβ1-42, 전체 tau, 포스포-tau, 뉴로그라닌 및/또는 신경필라멘트 경쇄의 투여-전 뇌척수액 수준을 결정하는 것을 추가로 포함하는 방법.
- 제62항 또는 제63항에 있어서, Aβ1-42, 전체 tau, 포스포-tau, 뉴로그라닌 및/또는 신경필라멘트 경쇄의 투여-후 뇌척수액 수준이 미리 결정된 수준 초과이면, 상기 조성물을 투여하는 단계를 추가로 포함하는 방법.
- 제62항 내지 제64항 중 어느 한 항에 있어서, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체가 BAN2401인 방법.
- 제65항에 있어서, 상기 조성물이 대상체의 체중에 비하여 2.5 ㎎/㎏ 내지 10 ㎎/㎏의 BAN2401을 포함하는 방법.
- 제66항에 있어서, 상기 조성물이 대상체의 체중에 비하여 10 ㎎/㎏의 BAN2401을 포함하는 방법.
- 제62항 내지 제67항 중 어느 한 항에 있어서, 상기 조성물이 2주마다 1회 또는 매달 1회 투여되는 방법.
- 제62항 내지 제68항 중 어느 한 항에 있어서, 뇌 아밀로이드 수준이 상기 투여 이후에, 상기 투여 이전의 뇌 아밀로이드 수준에 비하여 감소되는 방법.
- 제62항 내지 제69항 중 어느 한 항에 있어서, 뇌 아밀로이드 수준이 상기 투여 이전의 뇌 아밀로이드 수준에 비하여 적어도 10%, 적어도 20%, 적어도 30%, 적어도 40%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 80%, 적어도 90% 또는 100% 감소되면, 상기 투여를 중단하는 방법.
- 제62항 내지 제70항 중 어느 한 항에 있어서, 뇌 아밀로이드 수준이 아밀로이드 PET 영상의 시각적 판독에 의해 평가되는 방법.
- 제62항 내지 제71항 중 어느 한 항에 있어서, Aβ1-42의 뇌척수액 수준이 상기 투여 이후에, 상기 투여 이전의 Aβ1-42의 뇌척수액 수준에 비하여 감소되는 방법.
- 제62항 내지 제72항 중 어느 한 항에 있어서, 전체 tau의 뇌척수액 수준이 상기 투여 이후에, 상기 투여 이전의 전체 tau의 뇌척수액 수준에 비하여 감소되는 방법.
- 제62항 내지 제73항 중 어느 한 항에 있어서, 포스포-tau의 뇌척수액 수준이 상기 투여 이후에, 상기 투여 이전의 포스포-tau의 뇌척수액 수준에 비하여 감소되는 방법.
- 제62항 내지 제74항 중 어느 한 항에 있어서, 뉴로그라닌의 뇌척수액 수준이 상기 투여 이후에, 상기 투여 이전의 뉴로그라닌의 뇌척수액 수준에 비하여 감소되는 방법.
- 제62항 내지 제75항 중 어느 한 항에 있어서, 신경필라멘트 경쇄의 뇌척수액 수준 증가의 속도가 상기 투여 이후에, 상기 투여 이전의 뇌척수액 수준 증가의 속도에 비하여 더 낮은 방법.
- 제62항 내지 제76항 중 어느 한 항에 있어서, 선택적으로 투여되는 미리 결정된 뇌 아밀로이드 수준의 유지에 적합한 적어도 하나의 추가의 치료제가 BACE 저해제인 방법.
- 제77항에 있어서, BACE 저해제가 엘렌베세스타트(elenbecestat)인 방법.
- 제62항 내지 제78항 중 어느 한 항에 있어서, 상기 대상체가 ApoE4-양성인 방법.
- 대상체의 뇌 아밀로이드 수준을 측정하는 단계;
상기 대상체의 뇌 아밀로이드 수준이 미리 결정된 제1 수준 초과이면, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 BACE 저해제, 감마 세크레타제 저해제, 감마 세크레타제 조절제, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체 이외의 Aβ 펩티드 생성 저해제 및 상기 적어도 하나의 항-Aβ 프로토피브릴 항체 이외의 Aβ 펩티드의 수준을 낮추는 작용제로부터 선택되는 적어도 하나의 치료제를 포함하는 조성물을 투여하는 단계,
상기 대상체의 투여-후 뇌 아밀로이드 수준을 측정하는 단계,
상기 투여-후 뇌 아밀로이드 수준이 미리 결정된 제2 수준 초과이면, 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물 및 치료적 유효량의 BACE 저해제, 감마 세크레타제 저해제, 감마 세크레타제 조절제, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체 이외의 Aβ 펩티드 생성 저해제 및 상기 적어도 하나의 항-Aβ 프로토피브릴 항체 이외의 Aβ 펩티드의 수준을 낮추는 작용제로부터 선택되는 적어도 하나의 치료제를 포함하는 조성물을 투여하는 단계,
상기 대상체의 뇌 아밀로이드 수준이 미리 결정된 제1 수준 미만이 될 때까지, 투여 후의 상기 대상체의 뇌 아밀로이드 수준을 모니터링하는 단계,
BACE 저해제, 감마 세크레타제 저해제, 감마 세크레타제 조절제, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체 이외의 Aβ 펩티드 생성 저해제 및 상기 적어도 하나의 항-Aβ 프로토피브릴 항체 이외의 Aβ 펩티드의 수준을 낮추는 작용제로부터 선택되는, 미리 결정된 뇌 아밀로이드 수준의 유지에 적합한 적어도 하나의 추가의 치료제를 투여하는 단계
를 포함하는 대상체에서의 알츠하이머병의 예방 방법. - 제80항에 있어서, 상기 투여-전 및/또는 투여-후 뇌 아밀로이드 수준 결정이 Aβ1-42, 전체 tau, 포스포-tau, 뉴로그라닌 및/또는 신경필라멘트 경쇄의 투여-전 뇌척수액 수준을 결정하는 것을 추가로 포함하는 방법.
- 제80항 또는 제81항에 있어서, Aβ1-42, 전체 tau, 포스포-tau, 뉴로그라닌 및/또는 신경필라멘트 경쇄의 투여-후 뇌척수액 수준이 미리 결정된 수준 초과이면, 조성물을 투여하는 단계를 추가로 포함하는 방법.
- 제80항 내지 제82항 중 어느 한 항에 있어서, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체가 BAN2401인 방법.
- 제80항 내지 제83항 중 어느 한 항에 있어서, 상기 적어도 하나의 치료제가 BACE 저해제인 방법.
- 제84항에 있어서, 상기 BACE 저해제가 엘렌베세스타트인 방법.
- 제80항에 있어서, 상기 조성물이 대상체의 체중에 비하여 2.5 ㎎/㎏ 내지 10 ㎎/㎏의 BAN2401을 포함하는 방법.
- 제86항에 있어서, 상기 조성물이 대상체의 체중에 비하여 10 ㎎/㎏의 BAN2401을 포함하는 방법.
- 제80항 내지 제87항 중 어느 한 항에 있어서, 상기 조성물이 2주마다 1회 또는 매달 1회 투여되는 방법.
- 제80항 내지 제88항 중 어느 한 항에 있어서, 뇌 아밀로이드 수준이 상기 투여 이후에, 상기 투여 이전의 뇌 아밀로이드 수준에 비하여 감소되는 방법.
- 제80항 내지 제89항 중 어느 한 항에 있어서, 뇌 아밀로이드 수준이 상기 투여 이전의 뇌 아밀로이드 수준에 비하여 적어도 10%, 적어도 20%, 적어도 30%, 적어도 40%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 80%, 적어도 90% 또는 100% 감소되면, 상기 투여를 중단하는 방법.
- 제80항 내지 제90항 중 어느 한 항에 있어서, 뇌 아밀로이드 수준이 아밀로이드 PET 영상의 시각적 판독에 의해 평가되는 방법.
- 제80항 내지 제91항 중 어느 한 항에 있어서, Aβ1-42의 뇌척수액 수준이 상기 투여 이후에, 상기 투여 이전의 Aβ1-42의 뇌척수액 수준에 비하여 감소되는 방법.
- 제80항 내지 제92항 중 어느 한 항에 있어서, 전체 tau의 뇌척수액 수준이 상기 투여 이후에, 상기 투여 이전의 전체 tau의 뇌척수액 수준에 비하여 감소되는 방법.
- 제80항 내지 제93항 중 어느 한 항에 있어서, 포스포-tau의 뇌척수액 수준이 상기 투여 이후에, 상기 투여 이전의 포스포-tau의 뇌척수액 수준에 비하여 감소되는 방법.
- 제80항 내지 제94항 중 어느 한 항에 있어서, 뉴로그라닌의 뇌척수액 수준이 상기 투여 이후에, 상기 투여 이전의 뉴로그라닌의 뇌척수액 수준에 비하여 감소되는 방법.
- 제80항 내지 제95항 중 어느 한 항에 있어서, 신경필라멘트 경쇄의 뇌척수액 수준 증가의 속도가 상기 투여 이후에, 상기 투여 이전의 뇌척수액 수준 증가의 속도에 비하여 더 낮은 방법.
- 제80항 내지 제96항 중 어느 한 항에 있어서, 선택적으로 투여되는 미리 결정된 뇌 아밀로이드 수준의 유지에 적합한 적어도 하나의 추가의 치료제가 BACE 저해제인 방법.
- 제97항에 있어서, 상기 BACE 저해제가 엘렌베세스타트인 방법.
- 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물을 투여하는 단계를 포함하는, 초기 알츠하이머병을 갖는 대상체의 치료 방법으로서,
상기 대상체의 임상적 저하가 상기 조성물의 투여 6개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 35% 감소되고/되거나, 상기 조성물의 투여 12개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 30% 감소되고/되거나, 상기 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 25% 감소되는 방법. - 제99항에 있어서, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체가 SEQ ID NO: 5(HCDR1), SEQ ID NO: 6(HCDR2) 및 SEQ ID NO: 7(HCDR3)의 아미노산 서열을 포함하는 3개의 중쇄 상보성 결정 영역(HCDR1, HCDR2 및 HCDR3); 및 SEQ ID NO: 8(LCDR1), SEQ ID NO: 9(LCDR2) 및 SEQ ID NO: 10(LCDR3)의 아미노산 서열을 포함하는 3개의 경쇄 상보성 결정 영역(LCDR1, LCDR2 및 LCDR3)을 포함하는 방법.
- 제99항 또는 제100항에 있어서, 상기 초기 알츠하이머병을 갖는 대상체가 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받고/받거나 경증 알츠하이머병 치매를 갖는 것으로 진단받는 방법.
- 제99항 내지 제101항 중 어느 한 항에 있어서, 상기 대상체가 ApoE4-양성인 방법.
- 제99항 내지 제102항 중 어느 한 항에 있어서, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체가 BAN2401인 방법.
- 제103항에 있어서, 상기 조성물이 대상체의 체중에 비하여 5 ㎎/㎏ 내지 10 ㎎/㎏의 BAN2401을 포함하는 방법.
- 제103항에 있어서, 상기 조성물이 대상체의 체중에 비하여 10 ㎎/㎏의 BAN2401을 포함하는 방법.
- 제99항 내지 제105항 중 어느 한 항에 있어서, 상기 조성물이 2주마다 1회 또는 매달 1회 투여되는 방법.
- 제99항 내지 제106항 중 어느 한 항에 있어서, 상기 임상적 저하가 상기 조성물의 투여 6개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 45% 감소되는 방법.
- 제99항 내지 제106항 중 어느 한 항에 있어서, 상기 임상적 저하가 상기 조성물의 투여 12개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 35% 감소되는 방법.
- 제99항 내지 제106항 중 어느 한 항에 있어서, 상기 임상적 저하가 상기 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 30% 감소되는 방법.
- 제99항 내지 제106항 중 어느 한 항에 있어서, 상기 임상적 저하가 상기 조성물의 투여 18개월 후에 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 47% 감소되는 방법.
- 제99항 내지 제106항 중 어느 한 항에 있어서, 상기 임상적 저하가 상기 조성물의 투여 18개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 26% 감소되는 방법.
- 제109항에 있어서, 상기 초기 알츠하이머병을 갖는 대상체가 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받고, 상기 임상적 저하가 상기 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 33% 감소되는 방법.
- 제109항에 있어서, 상기 초기 알츠하이머병을 갖는 대상체가 경증 알츠하이머병 치매를 갖는 것으로 진단받고, 상기 임상적 저하가 상기 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 35% 감소되는 방법.
- 제107항 내지 제109항 중 어느 한 항에 있어서, 상기 조성물이 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여되는 방법.
- 제114항에 있어서, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체가 BAN2401인 방법.
- 제99항 내지 제115항 중 어느 한 항에 있어서, 상기 대상체가 ApoE4-양성인 방법.
- 제116항에 있어서, 상기 임상적 저하가 상기 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 63% 감소되는 방법.
- 제116항에 있어서, 상기 임상적 저하가 상기 조성물의 투여 18개월 후에 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 84% 감소되는 방법.
- 제116항에 있어서, 상기 임상적 저하가 상기 조성물의 투여 18개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 60% 감소되는 방법.
- 제99항 내지 제114항 중 어느 한 항에 있어서, 상기 대상체가 ApoE4-음성인 방법.
- 제99항 내지 제120항 중 어느 한 항에 있어서, 상기 투여가 Aβ1-42, 전체 tau, 포스포-tau 및/또는 뉴로그라닌의 뇌척수액 수준의 감소를 초래하는 방법.
- 제99항 내지 제121항 중 어느 한 항에 있어서, 상기 투여가 신경필라멘트 경쇄의 뇌척수액 수준의 증가의 둔화를 초래하는 방법.
- 제99항 내지 제122항 중 어느 한 항에 있어서, 상기 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되는 방법.
- 제99항 내지 제122항 중 어느 한 항에 있어서, 상기 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는 방법.
- 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물을 투여하는 단계를 포함하는, 초기 알츠하이머병을 갖는 대상체의 치료 방법으로서,
상기 알츠하이머병과 연관된 적어도 하나의 증상의 중증도가 치료 이전의 동일한 대상체에서의 동일한 증상의 중증도에 비하여 적어도 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% 또는 95% 감소되는 방법. - 제125항에 있어서, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체가 SEQ ID NO: 5(HCDR1), SEQ ID NO: 6(HCDR2) 및 SEQ ID NO: 7(HCDR3)의 아미노산 서열을 포함하는 3개의 중쇄 상보성 결정 영역(HCDR1, HCDR2 및 HCDR3); 및 SEQ ID NO: 8(LCDR1), SEQ ID NO: 9(LCDR2) 및 SEQ ID NO: 10(LCDR3)의 아미노산 서열을 포함하는 3개의 경쇄 상보성 결정 영역(LCDR1, LCDR2 및 LCDR3)을 포함하는 방법.
- 제125항 또는 제126항에 있어서, 상기 초기 알츠하이머병을 갖는 대상체가 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받고/받거나 경증 알츠하이머병 치매를 갖는 것으로 진단받는 방법.
- 제125항 내지 제127항 중 어느 한 항에 있어서, 상기 대상체가 ApoE4-양성인 방법.
- 제125항 내지 제128항 중 어느 한 항에 있어서, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체가 BAN2401인 방법.
- 제129항에 있어서, 상기 조성물이 대상체의 체중에 비하여 5 ㎎/㎏ 내지 10 ㎎/㎏의 BAN2401을 포함하는 방법.
- 제129항에 있어서, 상기 조성물이 대상체의 체중에 비하여 10 ㎎/㎏의 BAN2401을 포함하는 방법.
- 제125항 내지 제131항 중 어느 한 항에 있어서, 상기 조성물이 2주마다 1회 또는 매달 1회 투여되는 방법.
- 제125항 내지 제132항 중 어느 한 항에 있어서, 상기 알츠하이머병과 연관된 적어도 하나의 증상이 임상적 저하이며, 상기 임상적 저하가 상기 조성물의 투여 6개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 45% 감소되는 방법.
- 제125항 내지 제132항 중 어느 한 항에 있어서, 상기 알츠하이머병과 연관된 적어도 하나의 증상이 임상적 저하이며, 상기 임상적 저하가 상기 조성물의 투여 12개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 35% 감소되는 방법.
- 제125항 내지 제132항 중 어느 한 항에 있어서, 상기 알츠하이머병과 연관된 적어도 하나의 증상이 임상적 저하이며, 상기 임상적 저하가 상기 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 30% 감소되는 방법.
- 제125항 내지 제132항 중 어느 한 항에 있어서, 상기 임상적 저하가 상기 조성물의 투여 18개월 후에 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 47% 감소되는 방법.
- 제125항 내지 제132항 중 어느 한 항에 있어서, 상기 임상적 저하가 상기 조성물의 투여 18개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 26% 감소되는 방법.
- 제135항에 있어서, 상기 초기 알츠하이머병을 갖는 대상체가 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받고, 상기 임상적 저하가 상기 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 33% 감소되는 방법.
- 제135항에 있어서, 상기 초기 알츠하이머병을 갖는 대상체가 경증 알츠하이머병 치매를 갖는 것으로 진단받고, 상기 임상적 저하가 상기 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 35% 감소되는 방법.
- 제125항 내지 제139항 중 어느 한 항에 있어서, 상기 조성물이 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여되는 방법.
- 제140항에 있어서, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체가 BAN2401인 방법.
- 제125항 내지 제141항 중 어느 한 항에 있어서, 상기 대상체가 ApoE4-양성인 방법.
- 제142항에 있어서, 상기 임상적 저하가 상기 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 63% 감소되는 방법.
- 제142항에 있어서, 상기 임상적 저하가 상기 조성물의 투여 18개월 후에 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 84% 감소되는 방법.
- 제142항에 있어서, 상기 임상적 저하가 상기 조성물의 투여 18개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 60% 감소되는 방법.
- 제125항 내지 제145항 중 어느 한 항에 있어서, 상기 알츠하이머병과 연관된 적어도 하나의 증상이 임상적 저하 및 뇌 아밀로이드 수준으로부터 선택되는 방법.
- 제125항 내지 제146항 중 어느 한 항에 있어서, 상기 투여가 Aβ1-42, 전체 tau, 포스포-tau 및/또는 뉴로그라닌의 뇌척수액 수준의 감소를 초래하는 방법.
- 제125항 내지 제147항 중 어느 한 항에 있어서, 상기 투여가 신경필라멘트 경쇄의 뇌척수액 수준의 증가의 둔화를 초래하는 방법.
- 제125항 내지 제148항 중 어느 한 항에 있어서, 상기 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되는 방법.
- 제125항 내지 제148항 중 어느 한 항에 있어서, 상기 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는 방법.
- 치료적 유효량의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하는 조성물을 투여하는 단계를 포함하는, 초기 알츠하이머병을 갖는 대상체의 치료 방법으로서,
상기 알츠하이머병과 연관된 적어도 하나의 증상의 중증도가 위약을 제공한 대상체에서의 동일한 증상의 중증도에 비하여 적어도 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% 또는 95% 감소되는 방법. - 제151항에 있어서, 상기 알츠하이머병과 연관된 적어도 하나의 증상의 중증도가 ADCOMS, PET, MMSE, CDR-SB 및/또는 ADAS-Cog에 의해 결정되는 방법.
- 제151항에 있어서, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체가 SEQ ID NO: 5(HCDR1), SEQ ID NO: 6(HCDR2) 및 SEQ ID NO: 7(HCDR3)의 아미노산 서열을 포함하는 3개의 중쇄 상보성 결정 영역(HCDR1, HCDR2 및 HCDR3); 및 SEQ ID NO: 8(LCDR1), SEQ ID NO: 9(LCDR2) 및 SEQ ID NO: 10(LCDR3)의 아미노산 서열을 포함하는 3개의 경쇄 상보성 결정 영역(LCDR1, LCDR2 및 LCDR3)을 포함하는 방법.
- 제151항에 있어서, 상기 초기 알츠하이머병을 갖는 대상체가 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받고/받거나 경증 알츠하이머병 치매를 갖는 것으로 진단받는 방법.
- 제151항 내지 제154항 중 어느 한 항에 있어서, 상기 대상체가 ApoE4-양성인 방법.
- 제151항 내지 제155항 중 어느 한 항에 있어서, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체가 BAN2401인 방법.
- 제156항에 있어서, 상기 조성물이 대상체의 체중에 비하여 5 ㎎/㎏ 내지 10 ㎎/㎏의 BAN2401을 포함하는 방법.
- 제156항에 있어서, 상기 조성물이 대상체의 체중에 비하여 10 ㎎/㎏의 BAN2401을 포함하는 방법.
- 제151항 내지 제158항 중 어느 한 항에 있어서, 상기 조성물이 2주마다 1회 또는 매달 1회 투여되는 방법.
- 제151항 내지 제159항 중 어느 한 항에 있어서, 상기 임상적 저하가 상기 조성물의 투여 6개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 45% 감소되는 방법.
- 제151항 내지 제159항 중 어느 한 항에 있어서, 상기 알츠하이머병과 연관된 적어도 하나의 증상이 임상적 저하이며, 상기 임상적 저하가 상기 조성물의 투여 12개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 35% 감소되는 방법.
- 제151항 내지 제159항 중 어느 한 항에 있어서, 상기 알츠하이머병과 연관된 적어도 하나의 증상이 임상적 저하이며, 상기 임상적 저하가 상기 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 30% 감소되는 방법.
- 제151항 내지 제159항 중 어느 한 항에 있어서, 상기 임상적 저하가 상기 조성물의 투여 18개월 후에 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 47% 감소되는 방법.
- 제151항 내지 제159항 중 어느 한 항에 있어서, 상기 임상적 저하가 상기 조성물의 투여 18개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 26% 감소되는 방법.
- 제162항에 있어서, 상기 초기 알츠하이머병을 갖는 대상체가 알츠하이머병으로 인한 경증 인지 장애 - 중등의 가능성을 갖는 것으로 진단받고, 상기 임상적 저하가 상기 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 33% 감소되는 방법.
- 제162항에 있어서, 상기 초기 알츠하이머병을 갖는 대상체가 경증 알츠하이머병 치매를 갖는 것으로 진단받고, 상기 임상적 저하가 상기 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 35% 감소되는 방법.
- 제160항 내지 제166항 중 어느 한 항에 있어서, 상기 조성물이 10 ㎎/㎏의 적어도 하나의 항-Aβ 프로토피브릴 항체를 포함하며, 2주마다 1회 또는 매달 1회 투여되는 방법.
- 제167항에 있어서, 상기 적어도 하나의 항-Aβ 프로토피브릴 항체가 BAN2401인 방법.
- 제160항 내지 제167항 중 어느 한 항에 있어서, 상기 대상체가 ApoE4-양성인 방법.
- 제169항에 있어서, 상기 임상적 저하가 상기 조성물의 투여 18개월 후에 ADCOMS에 의해 결정되는 바와 같이 위약에 비하여 적어도 63% 감소되는 방법.
- 제169항에 있어서, 상기 임상적 저하가 상기 조성물의 투여 18개월 후에 ADAS-Cog에 의해 결정되는 바와 같이 위약에 비하여 적어도 84% 감소되는 방법.
- 제169항에 있어서, 상기 임상적 저하가 상기 조성물의 투여 18개월 후에 CDR-SB에 의해 결정되는 바와 같이 위약에 비하여 적어도 60% 감소되는 방법.
- 제151항 내지 제169항 중 어느 한 항에 있어서, 상기 알츠하이머병과 연관된 적어도 하나의 증상이 임상적 저하 및 뇌 아밀로이드 수준으로부터 선택되는 방법.
- 제151항 내지 제173항 중 어느 한 항에 있어서, 상기 투여가 Aβ1-42, 전체 tau, 포스포-tau 및/또는 뉴로그라닌의 뇌척수액 수준의 감소를 초래하는 방법.
- 제151항 내지 제173항 중 어느 한 항에 있어서, 상기 투여가 신경필라멘트 경쇄의 뇌척수액 수준의 증가의 둔화를 초래하는 방법.
- 제151항 내지 제173항 중 어느 한 항에 있어서, 상기 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되는 방법.
- 제151항 내지 제173항 중 어느 한 항에 있어서, 상기 대상체에는 BAN2401 이외의 적어도 하나의 알츠하이머병 의약이 동시 투여되지 않는 방법.
- 제80항 내지 제99항 중 어느 한 항에 있어서, 상기 대상체가 ApoE4-양성인 방법.
- 제27항, 제62항 내지 제78항, 제80항 내지 제98항, 제125항 및 제151항 중 어느 한 항에 있어서, 상기 대상체가 ApoE4-음성인 방법.
Applications Claiming Priority (11)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201862702659P | 2018-07-24 | 2018-07-24 | |
| US62/702,659 | 2018-07-24 | ||
| US201862749614P | 2018-10-23 | 2018-10-23 | |
| US62/749,614 | 2018-10-23 | ||
| US201962824162P | 2019-03-26 | 2019-03-26 | |
| US62/824,162 | 2019-03-26 | ||
| US201962846902P | 2019-05-13 | 2019-05-13 | |
| US62/846,902 | 2019-05-13 | ||
| US201962874684P | 2019-07-16 | 2019-07-16 | |
| US62/874,684 | 2019-07-16 | ||
| PCT/US2019/043067 WO2020023530A2 (en) | 2018-07-24 | 2019-07-23 | Methods of treatment and prevention of alzheimer's disease |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20210039402A true KR20210039402A (ko) | 2021-04-09 |
Family
ID=67551415
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020217005322A KR20210039402A (ko) | 2018-07-24 | 2019-07-23 | 알츠하이머병의 치료 및 예방 방법 |
Country Status (13)
| Country | Link |
|---|---|
| US (1) | US20210324056A1 (ko) |
| EP (1) | EP3826674A2 (ko) |
| JP (2) | JP7541505B2 (ko) |
| KR (1) | KR20210039402A (ko) |
| CN (1) | CN112805031A (ko) |
| AU (1) | AU2019309938A1 (ko) |
| BR (1) | BR112021001272A2 (ko) |
| CA (1) | CA3107370A1 (ko) |
| IL (2) | IL310132A (ko) |
| MX (1) | MX2021000778A (ko) |
| PH (1) | PH12021500006A1 (ko) |
| TW (1) | TW202019471A (ko) |
| WO (1) | WO2020023530A2 (ko) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN115315251A (zh) * | 2020-03-20 | 2022-11-08 | 卫材R&D管理有限公司 | 高浓度抗Aβ初原纤维抗体配制品及其使用方法 |
| TW202216760A (zh) | 2020-07-23 | 2022-05-01 | 愛爾蘭商歐薩爾普羅席納有限公司 | 抗類澱粉β (ABETA)抗體 |
| US20230302009A1 (en) * | 2020-08-12 | 2023-09-28 | The Cleveland Clinic Foundation | Bace1 inhibitor treatment for suppressing cytokine storm |
| AU2022410770A1 (en) * | 2021-12-17 | 2024-06-13 | Eisai R&D Management Co., Ltd. | Methods of using an anti-amyloid beta protofibril antibody and anti-tau antibody |
| WO2023111618A1 (en) * | 2021-12-17 | 2023-06-22 | Eisai R&D Management Co., Ltd. | Methods of using an anti-amyloid beta protofibril antibody and anti-tau antibody |
| IL314581A (en) * | 2022-02-02 | 2024-09-01 | Eisai R&D Man Co Ltd | Treatment methods using P-TAU181 LEVEL |
Family Cites Families (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2414772C (en) | 2000-07-07 | 2011-06-28 | Jan Naslund | Prevention and treatment of alzheimer's disease |
| SE0401601D0 (sv) | 2004-06-21 | 2004-06-21 | Bioarctic Neuroscience Ab | Protofibril specific antibodies and uses thereof |
| DE602007011415D1 (de) * | 2006-03-23 | 2011-02-03 | Bioartic Neuroscience Ab | Verbesserte protofibrilselektive antikörper und deren verwendung |
| AU2016208353B2 (en) * | 2007-10-17 | 2017-07-20 | Janssen Alzheimer Immunotherapy | Immunotherapy regimes dependent on ApoE status |
| JO3076B1 (ar) * | 2007-10-17 | 2017-03-15 | Janssen Alzheimer Immunotherap | نظم العلاج المناعي المعتمد على حالة apoe |
| RU2476431C2 (ru) | 2008-01-18 | 2013-02-27 | Эйсай Ар Энд Ди Менеджмент Ко., Лтд. | Конденсированное производное аминодигидротиазина |
| WO2011001366A1 (en) | 2009-06-29 | 2011-01-06 | Bioartic Neuroscience Ab | N-terminal truncated amyloid beta protofibrils/ oligomers for use in therapeutic and diagnostic methods for alzheimer's disease |
| WO2011106732A1 (en) * | 2010-02-25 | 2011-09-01 | Wyeth Llc | Pet monitoring of ab-directed immunotherapy |
| EP2539366B1 (en) | 2010-02-26 | 2017-11-08 | BioArtic Neuroscience AB | Protofibril-binding antibodies and their use in therapeutic and diagnostic methods for parkinson's disease, dementia with lewy bodies and other alpha-synucleinopathies |
| ES2624288T3 (es) | 2011-01-21 | 2017-07-13 | Eisai R&D Management Co., Ltd. | Métodos y compuestos útiles en la síntesis de derivados de aminodihidrotiazina condensados |
| PL3166970T3 (pl) | 2014-07-10 | 2021-09-13 | Bioarctic Ab | Ulepszone przeciwciała wiążące protofibryle a-beta |
| MA41115A (fr) * | 2014-12-02 | 2017-10-10 | Biogen Int Neuroscience Gmbh | Procédé de traitement de la maladie d'alzheimer |
| CN114019170A (zh) * | 2016-01-20 | 2022-02-08 | 基因泰克公司 | 用于阿尔茨海默氏病的高剂量治疗 |
| DK3454904T3 (da) * | 2016-05-13 | 2023-02-06 | Pasteur Institut | Inhibering af beta-2-nikotiniske acetylcholinreceptorer til at behandle patologi ved Alzheimers sygdom |
| TWI735600B (zh) * | 2016-07-01 | 2021-08-11 | 美商美國禮來大藥廠 | 抗-N3pGlu類澱粉β肽抗體及其用途 |
| CA3042020A1 (en) * | 2016-10-27 | 2018-05-03 | Eisai R&D Management Co., Ltd. | Composition comprising an anti-abeta protofibril antibody and a beta-secretase bace1 inhibitor for the treatment of alzheimer's disease |
-
2019
- 2019-07-23 KR KR1020217005322A patent/KR20210039402A/ko unknown
- 2019-07-23 MX MX2021000778A patent/MX2021000778A/es unknown
- 2019-07-23 US US17/250,448 patent/US20210324056A1/en active Pending
- 2019-07-23 AU AU2019309938A patent/AU2019309938A1/en active Pending
- 2019-07-23 BR BR112021001272-9A patent/BR112021001272A2/pt unknown
- 2019-07-23 IL IL310132A patent/IL310132A/en unknown
- 2019-07-23 EP EP19750196.8A patent/EP3826674A2/en active Pending
- 2019-07-23 CN CN201980062781.8A patent/CN112805031A/zh active Pending
- 2019-07-23 JP JP2021503770A patent/JP7541505B2/ja active Active
- 2019-07-23 WO PCT/US2019/043067 patent/WO2020023530A2/en unknown
- 2019-07-23 CA CA3107370A patent/CA3107370A1/en active Pending
- 2019-07-23 IL IL280315A patent/IL280315B2/en unknown
- 2019-07-24 TW TW108126224A patent/TW202019471A/zh unknown
-
2021
- 2021-01-21 PH PH12021500006A patent/PH12021500006A1/en unknown
-
2024
- 2024-05-10 JP JP2024077300A patent/JP2024112859A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| JP2021532126A (ja) | 2021-11-25 |
| IL280315B1 (en) | 2024-02-01 |
| IL310132A (en) | 2024-03-01 |
| CA3107370A1 (en) | 2020-01-30 |
| WO2020023530A2 (en) | 2020-01-30 |
| IL280315A (en) | 2021-03-25 |
| WO2020023530A3 (en) | 2020-03-12 |
| EP3826674A2 (en) | 2021-06-02 |
| US20210324056A1 (en) | 2021-10-21 |
| BR112021001272A2 (pt) | 2021-04-27 |
| MX2021000778A (es) | 2021-03-31 |
| JP7541505B2 (ja) | 2024-08-28 |
| PH12021500006A1 (en) | 2021-09-13 |
| CN112805031A (zh) | 2021-05-14 |
| JP2024112859A (ja) | 2024-08-21 |
| AU2019309938A1 (en) | 2021-03-11 |
| IL280315B2 (en) | 2024-06-01 |
| TW202019471A (zh) | 2020-06-01 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20210039402A (ko) | 알츠하이머병의 치료 및 예방 방법 | |
| JP6887212B2 (ja) | Il−31アンタゴニストを有効成分として含有する、アトピー性皮膚炎の予防用及び/又は治療用医薬組成物 | |
| JP7564347B2 (ja) | 多発性硬化症を治療するためのlou064 | |
| JP2018111723A (ja) | アルツハイマー病を処置するためのil−1アンタゴニストを使用する方法 | |
| KR20190102181A (ko) | 알츠하이머병의 치료를 위한 항-a베타 원시섬유 항체 및 베타-세크레타제 bace1 억제제를 포함하는 조성물 | |
| JP6799831B1 (ja) | Il−31アンタゴニストを有効成分として含有する、透析そう痒症の予防用及び/又は治療用医薬組成物 | |
| JP5954916B1 (ja) | Il−31アンタゴニストを有効成分として含有する、アトピー性皮膚炎の予防用及び/又は治療用医薬組成物 | |
| JP2024525559A (ja) | アルツハイマー病治療用バイオマーカー | |
| MX2014006265A (es) | Administacion del anticuerpo alfa4beta7 hetero-dimero-especifico. | |
| US20240350489A1 (en) | Lou064 for treating multiple sclerosis | |
| WO2023149970A1 (en) | Methods of treatment using p-tau181 level | |
| WO2022251048A1 (en) | Anti-amyloid beta antibodies and uses thereof | |
| TW202328178A (zh) | 抗Aβ初原纖維抗體的皮下配製物及其使用方法 | |
| WO2024118665A1 (en) | Methods of treatment using a tau pet level | |
| CN116507637A (zh) | 抗转甲状腺素蛋白抗体及其使用方法 | |
| CN114746444A (zh) | 使用白介素-17(il-17)拮抗剂治疗扁平苔藓的方法 |