KR20200090742A - Il-7 및 il-21에의 il-15 기반 융합 - Google Patents
Il-7 및 il-21에의 il-15 기반 융합 Download PDFInfo
- Publication number
- KR20200090742A KR20200090742A KR1020207009046A KR20207009046A KR20200090742A KR 20200090742 A KR20200090742 A KR 20200090742A KR 1020207009046 A KR1020207009046 A KR 1020207009046A KR 20207009046 A KR20207009046 A KR 20207009046A KR 20200090742 A KR20200090742 A KR 20200090742A
- Authority
- KR
- South Korea
- Prior art keywords
- cells
- fusion protein
- protein complex
- soluble
- cell
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/52—Cytokines; Lymphokines; Interferons
- C07K14/54—Interleukins [IL]
- C07K14/5443—IL-15
-
- A—HUMAN NECESSITIES
- A21—BAKING; EDIBLE DOUGHS
- A21D—TREATMENT, e.g. PRESERVATION, OF FLOUR OR DOUGH, e.g. BY ADDITION OF MATERIALS; BAKING; BAKERY PRODUCTS; PRESERVATION THEREOF
- A21D8/00—Methods for preparing or baking dough
- A21D8/02—Methods for preparing dough; Treating dough prior to baking
- A21D8/04—Methods for preparing dough; Treating dough prior to baking treating dough with microorganisms or enzymes
- A21D8/047—Methods for preparing dough; Treating dough prior to baking treating dough with microorganisms or enzymes with yeasts
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
- A61K38/20—Interleukins [IL]
- A61K38/2086—IL-13 to IL-16
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/52—Cytokines; Lymphokines; Interferons
- C07K14/54—Interleukins [IL]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/52—Cytokines; Lymphokines; Interferons
- C07K14/54—Interleukins [IL]
- C07K14/5418—IL-7
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/715—Receptors; Cell surface antigens; Cell surface determinants for cytokines; for lymphokines; for interferons
- C07K14/7155—Receptors; Cell surface antigens; Cell surface determinants for cytokines; for lymphokines; for interferons for interleukins [IL]
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/80—Vectors or expression systems specially adapted for eukaryotic hosts for fungi
- C12N15/81—Vectors or expression systems specially adapted for eukaryotic hosts for fungi for yeasts
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/01—Fusion polypeptide containing a localisation/targetting motif
- C07K2319/02—Fusion polypeptide containing a localisation/targetting motif containing a signal sequence
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/30—Non-immunoglobulin-derived peptide or protein having an immunoglobulin constant or Fc region, or a fragment thereof, attached thereto
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y302/00—Hydrolases acting on glycosyl compounds, i.e. glycosylases (3.2)
- C12Y302/01—Glycosidases, i.e. enzymes hydrolysing O- and S-glycosyl compounds (3.2.1)
- C12Y302/01002—Beta-amylase (3.2.1.2)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y302/00—Hydrolases acting on glycosyl compounds, i.e. glycosylases (3.2)
- C12Y302/01—Glycosidases, i.e. enzymes hydrolysing O- and S-glycosyl compounds (3.2.1)
- C12Y302/01033—Amylo-alpha-1,6-glucosidase (3.2.1.33)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y302/00—Hydrolases acting on glycosyl compounds, i.e. glycosylases (3.2)
- C12Y302/01—Glycosidases, i.e. enzymes hydrolysing O- and S-glycosyl compounds (3.2.1)
- C12Y302/0106—Glucan 1,4-alpha-maltotetraohydrolase (3.2.1.60)
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Genetics & Genomics (AREA)
- Zoology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Immunology (AREA)
- Gastroenterology & Hepatology (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- Toxicology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Mycology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Epidemiology (AREA)
- Biomedical Technology (AREA)
- Wood Science & Technology (AREA)
- General Engineering & Computer Science (AREA)
- Biotechnology (AREA)
- Microbiology (AREA)
- Cell Biology (AREA)
- Physics & Mathematics (AREA)
- Plant Pathology (AREA)
- Food Science & Technology (AREA)
- Peptides Or Proteins (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
본 발명은 IL-15 또는 기능적 변이체를 포함하는 하나의 도메인 및 IL-7 또는 IL-21에 특이적인 결합 도메인을 갖는 다중 특이적 융합 단백질 복합체를 특징으로 한다.
Description
관련 출원과의 상호 참조
본 출원은 2017년 8월 28일에 출원된 미국 가명세서 특허출원 제62/551,218호의 우선권을 주장하며, 그 전체 내용은 전문이 본원에 참조로 포함된다.
본 발명은 일반적으로 다량체 융합 분자 분야에 관한 것이다.
본원에 기술된 발명이 있기 전까지만 해도 비특이적 면역 활성과 연관된 부작용이 일어나지 않으면서 다양한 효과기 분자를 질환이 발병한 부위에 표적화하여 치료적 이익을 제공하고자 하는 신규 전략 개발에 대한 필요가 절실하였다.
본 발명은 다중 특이적 인터류킨-15(IL-15) 기반 단백질 복합체가 면역 세포의 자극을 강화시키고 질환 세포에 대한 이들의 활성을 촉진시켜 결과적으로 질환을 감소 또는 예방할 수 있다는 놀라운 발견에 적어도 부분적으로 기초한다. 이러한 IL-15 기반 단백질 복합체는 또한 질환 및 표적 항원에 결합할 수 있다. 본원에는 IL-7 및 IL-21 결합 도메인을 포함하는 다중 특이적 IL-15 기반 단백질 복합체가 제공된다(도 1). 구체적으로, IL-7 및 IL-21 결합 도메인에 융합된 IL-15N72D:IL-15RαSu-Ig Fc 스캐폴드를 포함하는 단백질 복합체가 본원에 기재되어 있다. 하기에 상세히 기술되는 바와 같이, 인간 면역 세포를 사용하여 특성화 될 때, 이들 복합체는 각각의 IL-15, IL-7 및 IL-21 시토카인의 결합 및 생물학적 활성을 나타낸다. 또한, 이들 복합체는 IFN-γ의 생산 증가로 T 세포 및 자연살해 (NK) 세포 둘 다의 증식 및 활성화를 유도한다. 놀랍게도, 이들 복합체는 개별 시토카인 단독으로 또는 조합하여 관찰된 것보다 더 큰 정도로 면역 반응을 유도할 수 있었다.
이와 같이, 단일 분자로서의 복합체는 NK 및 T 세포상의 다수의 시토카인 수용체에 결합하여 이를 통해 신호를 전달하여 다수의 시토카인의 조합으로만 이전에 관찰된 반응을 제공한다. 또한, 이들 복합체는 Ig 분자의 Fc 영역을 포함하며, 이는 이량체를 형성하여 가용성 다중 폴리펩티드 복합체를 제공하고, 정제를 목적으로 단백질 A에 결합하고, NK 세포 및 대식세포상의 Fcγ 수용체와 상호 작용함으로써, 개별 시토카인의 조합에서는 존재하지 않는 이점을 복합체에 제공할 수 있다. 이들 복합체를 임상 등급 물질의 대규모 생산에 적합하게 만드는 포유 동물 세포 발현 기반의 방법이 본원에 기재되어 있다. 본 발명의 단백질 복합체에 의한 유도 후 증식하는 NK 및 T 세포를 만들고 사용하는 추가의 방법이 또한 제공된다.
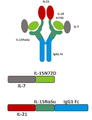
따라서, 적어도 2개의 가용성 단백질을 포함하는 단리된 가용성 융합 단백질 복합체가 제공된다. 예를 들어, 제1 단백질은 IL-15 폴리펩티드, 예를 들어 N72D 돌연변이 (IL-15N72D)를 포함하는 변이체 IL-15 폴리펩티드를 포함한다. 제2 단백질은 면역 글로불린 Fc 도메인 (IL-15RαSu/Fc)에 융합된 가용성 IL-15 수용체 알파 스시 결합 도메인 (IL-15RαSu)을 포함한다. 단리된 가용성 융합 단백질 복합체의 제3 성분은 IL-7의 결합 도메인을 포함하고, 여기서 IL-7 결합 도메인은 IL-15N72D 또는 IL-15RαSu/Fc 단백질에 융합된다. 단리된 가용성 융합 단백질 복합체의 제4 성분은 IL-21의 결합 도메인을 포함하고, 여기서 IL-21 결합 도메인은 IL-15N72D 또는 IL-15RαSu/Fc 단백질에 융합된다. 일부 경우에, IL-7 및/또는 IL-21 결합 도메인은 IL-15N72D 및 IL 15RαSu/Fc 단백질 모두에 융합된다. 다른 경우에, IL-7 또는 IL-21 결합 도메인은 IL-15N72D 또는 IL-15RαSu/Fc 단백질에 융합되고 다른 결합 도메인은 다른 단백질에 융합된다. 예시적인 융합 단백질 복합체는 IL-15N72D에 공유 결합된 IL-7 폴리펩티드 및 IL-15RαSu/Fc 융합 단백질에 공유 결합된 IL-21 폴리펩티드를 포함한다 (도 1).
예시적인 제1 단백질은 서열 번호 2 및 서열 번호 4에 제시된 아미노산 서열을 포함한다. 제1 단백질을 암호화하는 예시적인 핵산 서열은 서열 번호 1 및 서열 번호 3에 제시된 서열을 포함한다. 일 양태에서, 핵산 서열(들)은 융합 단백질을 암호화하는 서열에 작동 가능하게 결합된 촉진인자, 번역 개시 신호 및 리더 서열을 추가로 포함한다. 본원에 기재된 핵산 서열을 포함하는 DNA 벡터가 또한 제공된다. 예를 들어, 핵산 서열은 복제, 발현 또는 둘 모두를 위한 벡터에 존재한다.
또한, 제2 가용성 융합 단백질 복합체에 공유 연결된 제1 가용성 융합 단백질 복합체를 포함하는 가용성 융합 단백질 복합체가 제공된다. 예를 들어, 본 발명의 가용성 융합 단백질 복합체는 다량체화, 예를 들어, 이량체화, 삼량체화 또는 그렇지 않고 다량체화된다 (예를 들어, 사량체, 오량체 등). 예를 들어, 다량체는 동종 다량체 또는 이종 다량체이다. 가용성 융합 단백질 복합체는 공유 결합, 예를 들어 이황화 결합, 화학적 가교제에 의해 연결된다. 일부 경우에, 하나의 가용성 융합 단백질은 제1 가용성 단백질의 Fc 도메인을 제2 가용성 단백질의 Fc 도메인에 연결하는 이황화 결합에 의해 다른 가용성 융합 단백질에 공유 결합된다.
Fc 도메인 또는 이의 기능적 단편은 IgG Fc 도메인, 인간 IgG1 Fc 도메인, 인간 IgG2 Fc 도메인, 인간 IgG3 Fc 도메인, 인간 IgG4 Fc 도메인, IgA Fc 도메인, IgD Fc 도메인, IgE Fc 도메인 및 IgM Fc 도메인으로 이루어진 군으로부터 선택된 Fc 도메인; 마우스 IgG2A 도메인, 또는 이들의 임의의 조합을 포함한다. 선택적으로, Fc 도메인은 변경된 보체 또는 Fc 수용체 결합 특성 또는 변경된 이량체화 또는 당화 프로파일을 갖는 Fc 도메인을 생성하는 아미노산 변화를 포함한다. 변경된 보체 또는 Fc 수용체 결합 특성 또는 변경된 이량체화 또는 당화 프로파일을 갖는 Fc 도메인을 생성하기 위한 아미노산 변화는 당 업계에 공지되어 있다. 예를 들어, IgG1 CH2의 위치 234 및 235 (항체 컨센서스 서열에 기초한 넘버링)에서의 루신 잔기 (즉,… PELLGG…)를 알라닌 잔기 (즉,… PEAAGG…)로 치환하면 Fc 감마 수용체 결합의 손실을 가져오는 한편, IgG1 CH2의 위치 322 (항체 컨센서스 서열에 기초한 넘버링)에서 라이신 잔기를 알라닌 잔기 (즉,… KCASL…)로 치환하면 보체 활성화의 손실을 가져온다. 일부 예에서, 이러한 돌연변이는 조합된다.
일부 양태에서, IL-7 또는 IL-21 결합 도메인은 폴리펩티드 링커 서열에 의해 IL-15 폴리펩티드 (또는 이의 기능적 단편)에 공유적으로 연결된다. 유사하게, IL 7 또는 IL-21 결합 도메인은 폴리펩티드 링커 서열에 의해 IL-15Rα 폴리펩티드 (또는 이의 기능적 단편)에 공유적으로 연결된다. 임의로, IL-15Rα 폴리펩티드 (또는 이의 기능적 단편)는 폴리펩티드 링커 서열에 의해 Fc 도메인 (또는 이의 기능적 단편)에 공유적으로 연결된다. 각 폴리펩티드 링커 서열은 독립적으로 선택 될 수 있다. 임의로, 폴리펩티드 링커 서열은 동일하다. 또는 이들은 서로 다르다.
선택적으로, 가용성 융합 단백질 중 하나 이상이 하나 이상의 결합 도메인 또는 검출 가능한 라벨을 포함하는 본 발명의 가용성 융합 단백질 복합체가 제공된다. 이러한 결합 도메인은 항체, 가용성 T 세포 수용체, 리간드, 가용성 수용체 도메인 또는 이의 기능적 단편을 포함할 수 있다. 이러한 결합 도메인을 포함하는 IL-15 기반 융합 단백질 복합체는 본원에 참조로 포함된 미국 특허 번호 제8,492,118호에 이미 기술되어 있다. 검출 가능한 표지는 제한하는 것은 아니지만, 비오틴, 스트렙타비딘, 이의 효소 또는 촉매 활성 단편, 방사성 핵종, 나노 입자, 상자성 금속 이온, 또는 형광, 인광 또는 화학 발광 분자, 또는 이들의 임의의 조합을 포함한다.
본 발명은 본 발명의 가용성 융합 단백질 복합체를 제조하는 방법을 제공한다. 상기 방법은 a) 제1 단백질을 암호화하는 적절한 제어 서열을 갖는 DNA 벡터를 제1 숙주 세포에 도입하는 단계, b) 세포 또는 배지에서 제1 단백질을 발현시키기에 충분한 조건 하의 배지에서 제1 숙주 세포를 배양하는 단계; c) 숙주 세포 또는 배지로부터 제1 단백질을 정제하는 단계; d) 제2 단백질을 암호화하는 적절한 제어 서열을 갖는 DNA 벡터를 제2 숙주 세포에 도입하는 단계; e) 세포 또는 배지에서 제2 단백질을 발현하기에 충분한 조건 하의 배지에서 제2 숙주 세포를 배양하는 단계; f) 숙주 세포 또는 배지로부터 제2 단백질을 정제하는 단계; 및 g) 제1 단백질의 IL-15 도메인과 제2 단백질의 가용성 IL-15Rα 도메인 사이의 결합을 허용하기에 충분한 조건 하에서 제1 및 제2 단백질을 혼합하여 가용성 융합 단백질 복합체를 형성하는 단계를 포함한다.
일부 경우에, 방법은 발현 벡터로부터 발현된 폴리펩티드 사이에 이황화 결합의 형성을 허용하기에 충분한 조건 하에서 제1 및 제2 단백질을 혼합하는 단계를 추가로 포함한다.
대안적으로, 본 발명의 가용성 융합 단백질 복합체를 제조하는 방법은 a) 제1 단백질을 암호화하는 적절한 제어 서열을 갖는 DNA 벡터 및 제2 단백질을 암호화하는 적절한 제어 서열을 갖는 DNA 벡터를 숙주 세포에 도입하는 단계, b) 세포 또는 배지에서 단백질을 발현하고 제1 단백질의 IL-15 도메인과 제2 단백질의 가용성 IL-15Rα 도메인 사이의 회합을 허용하기에 충분한 조건 하의 배지에서 숙주 세포를 배양하여 가용성 융합 단백질 복합체를 형성하는 단계; 및 c) 숙주 세포 또는 배지로부터 가용성 융합 단백질 복합체를 정제하는 단계에 의해 실행된다.
일 양태에서, 상기 방법은 발현 벡터로부터 발현된 폴리펩티드 사이에 이황화 결합의 형성을 허용하기에 충분한 조건 하에서 제1 및 제2 단백질을 혼합하는 단계를 추가로 포함한다.
또한 가용성 융합 단백질 복합체를 만드는 방법은 a) 제1 및 제2 단백질을 암호화하는 적절한 제어 서열을 갖는 DNA 벡터를 숙주 세포에 도입하는 단계, b) 세포 또는 배지에서 단백질을 발현하고 제1 단백질의 IL-15 도메인과 제2 단백질의 가용성 IL-15Rα 도메인 사이의 회합을 허용하여 가용성 융합 단백질 복합체를 형성하고, 폴리펩티드들 사이에 이황화 결합의 형성을 허용하기에 충분한 조건 하의 배지에서 숙주 세포를 배양하는 단계; 및 c) 숙주 세포 또는 배지로부터 가용성 융합 단백질 복합체를 정제하는 단계를 포함한다.
선택적으로, 상기 방법은 발현 벡터로부터 발현된 폴리펩티드들 사이에 이황화 결합을 형성하기에 충분한 조건 하에서 제1 및 제2 단백질을 혼합하는 단계를 추가로 포함한다.
일부 경우에, 상기 방법은 임상 시약 또는 치료제로 사용하기에 적합한 순수 단백질 복합체를 생성하기에 충분한 단백질 A 친화성 크로마토그래피, 크기별 배제 크로마토그래피, 이온 교환 크로마토그래피 및/또는 다른 표준 방법 (바이러스 비활성화 및/또는 여과 포함)에 의한 복합체의 정제 단계를 더 포함한다.
본 발명의 가용성 융합 단백질 복합체에 관한 임의의 양태들에서, IL-15 폴리펩티드는 원산(native) IL-15 폴리펩티드의 아미노산 서열과 상이한 아미노산 서열을 가지는 IL-15 변이체이다. 인간 IL-15 폴리펩티드는 본원에서 huIL-15, hIL-15, huIL15, hIL15, IL-15 야생형(wt)이라 지칭되고, 이의 변이체는 원산 아미노산, 성숙 서열 중 이의 위치 및 변이체 아미노산을 이용하여 지칭된다. 예를 들어 huIL15N72D는, 72번 위치에 N → D의 치환을 포함하는 인간 IL-15를 지칭한다. 일 양태에서, IL-15 변이체는, 예컨대 원산 IL-15 폴리펩티드의 IL-15/IL-2βγC 수용체(IL-15R)와의 결합 활성보다 증가한, IL-15/IL-2βγC 수용체와의 결합 활성으로 입증되는 바와 같이, IL-15 효현제로서의 역할을 한다. 대안적으로 IL-15 변이체는, 예컨대 원산 IL-15 폴리펩티드의 IL-15R과의 결합 활성보다 감소한, IL-15R과의 결합 활성으로 입증되는 바와 같이, IL-15 길항제로서의 역할을 한다.
면역 기능을 향상시키는 방법은 a) 복수의 세포를 본 발명의 가용성 융합 단백질 복합체와 접촉시키는 단계 - 복수의 세포는 IL-15 도메인에 의해 인식되는 IL-15R 사슬, IL-7 도메인에 의해 인식된 IL-7R 사슬 또는 IL-21 도메인에 의해 인식되는 IL-21R 사슬을 갖는 면역 세포을 더 포함함 - ; 및 b) IL-15R, IL-7R 또는 IL-21R의 신호 전달을 통해 면역 세포의 증식 및 활성화를 유도하는 단계에 의해 실행된다. 일 양태에서, 면역 기능을 향상시키는 방법은 가용성 융합 단백질 복합체에 의한 IL-15R, IL-7R 및 IL-21R의 둘 이상의 조합의 신호 전달을 통해 면역 세포의 활성화를 추가로 포함한다. 면역 기능을 향상시키기 위한 예시적인 방법은 가용성 융합 단백질 복합체에 의한 IL-15R, IL-12R 및 IL-18R의 신호 전달을 통해 NK 및 T 세포의 증식 및 활성화를 유도하는 단계를 포함한다. 이러한 방법은 NK 및 T 세포의 증식 및 활성화로 인터페론 감마(IFN-γ) 생성 증가의 결과를 가져온다
표적 세포를 사멸시키는 방법은 a) 복수의 세포를 본 발명의 가용성 융합 단백질 복합체와 접촉시키는 단계 - 복수의 세포는 IL-15 도메인에 의해 인식되는 IL-15R 사슬, IL-7 도메인에 의해 인식된 IL-7R 사슬 또는 IL-21 도메인에 의해 인식되는 IL-21R 사슬을 갖는 면역 세포 및 표적 질환 세포를 추가로 포함함 - ; b) IL-15R, IL-7R 또는 IL 21R의 신호 전달을 통해 면역 세포의 증식 및 활성화를 유도하는 단계; 및 c) 활성화된 면역 세포에 의해 표적 질환 세포를 사멸시키는 단계에 의해 실행된다. 일 양태에서, 상기 방법은 가용성 융합 단백질 복합체에 의한 IL-15R, IL-7R 및 IL-21R의 둘 이상의 조합의 신호 전달을 통해 면역 세포의 증식 및 활성화를 유도하는 단계를 포함한다. 예시적인 방법은 가용성 융합 단백질 복합체에 의한 IL-15R, IL-7R 및 IL-21R의 신호 전달을 통해 NK 및 T 세포의 증식 및 활성화를 유도하는 단계를 포함한다. 이러한 방법은 NK 및 T 세포의 증식 및 활성화을 포함하므로 IFN-γ 생성의 증가의 결과를 가져온다.
본 발명은 또한 환자의 질환을 예방 또는 치료하는 방법을 제공하며, 이 방법은 a) IL-15R 체인 또는 체크포인트를 갖는 면역 세포 또는 신호 전달 분자를 본 발명의 가용성 융합 단백질 복합체와 혼합하는 단계; b) 면역 세포의 증식과 활성화를 유도하는 단계; c) 환자에게 활성화된 면역 세포를 투여 (또는 입양 전달)하는 단계; 및 d) 환자의 질환을 예방 또는 치료하기에 충분한 활성화된 면역 세포를 통해 질환 세포를 훼손 또는 사멸시키는 단계를 포함한다. 일 양태에서, 상기 방법은 가용성 융합 단백질 복합체에 의한 IL-15R, IL-7R 및 IL-21R 중 적어도 둘 또는 모두의 조합의 신호 전달을 통한 면역 세포의 증식 및 활성화를 포함한다. 예시적인 방법은 가용성 융합 단백질 복합체에 의한 IL-15R, IL-7R 및 IL-21R의 신호 전달을 통해 NK 및 T 세포의 증식 및 활성화를 유도하는 것을 포함한다. 상기 방법의 일부 양태는 키메라 항원 수용체(CAR NK 및 CAR T 세포)를 발현하는 NK 및 T 세포의 사용을 포함한다. 본 발명의 일부 구현예에서, 환자는 입양 전달 세포의 생착 또는 생존을 용이하게 하기 위해 사전 치료 또는 전제조건화된다. 전제조건의 예는 시클로포스파미드 및 플루다라빈으로의 치료를 포함한다. 추가로, 환자는 세포 전 및/또는 세포후 입양 전달된 세포의 활성화, 생존 또는 지속성을 촉진하는 제제로 치료될 수 있다. 이러한 치료의 예는 IL-2, IL-15, ALT-803 (본 명세서에서 "N-803"으로도 상호 교환하여 지칭됨) 또는 다른 면역 자극제의 사용을 포함한다. 입양 세포 요법 분야 (즉, 제한하는 것은 아니지만, 동종, 자가, 동일 단배체, DLI, 줄기 세포, NK92 기반 및 CAR NK 요법을 포함)에서 공지된 다른 치료적 접근법이 본원의 방법에 사용될 수 있다.
또한 환자의 질환을 예방하거나 치료하기 위한 방법이 제공되며, 이 방법은 a) 환자에게 본 발명의 가용성 융합 단백질 복합체를 투여하는 단계; b) 환자 내 면역 세포의 증식 및 활성화를 유도하는 단계; 및 c) 환자의 질환을 예방 또는 치료하기에 충분한 활성화된 면역 세포를 통해 질환 세포를 훼손 또는 사멸시키는 단계를 포함한다.
본 발명의 융합 단백질 복합체의 투여는 대상체 내 면역 반응을 유도한다. 예를 들어, 본 발명의 융합 단백질 복합체의 투여는 신생물형성, 감염성 질환, 노화 세포 또는 연령 관련 질환 또는 자가 면역 질환과 관련된 세포에 대한 면역 반응을 유도한다. 일 양태에서, 본 발명의 융합 단백질 복합체는 면역 세포 증식, 활성화 마커, 표적 세포에 대한 세포 독성 및/또는 염증성 시토카인의 생성을 증가시킨다.
본 발명은 포유 동물에게 본 발명의 가용성 융합 단백질 복합체의 유효량을투여함으로써 포유 동물에서 면역 반응을 자극하는 방법을 제공한다. 본 발명은 또한 본 발명의 임의의 가용성 융합 단백질 복합체의 유효량을 포유 동물에게 투여함으로써 포유 동물의 면역 반응을 억제하는 방법을 제공한다.
이를 필요로 하는 대상체에서 신생물형성, 감염성 질환, 노화 세포 또는 연령 관련 질환 또는 자가 면역 질환을 치료하는 방법은 대상체에게 확장 및 활성화된 면역 세포의 유효량 또는 본원에 기재된 가용성 융합 단백질 복합체를 포함하는 약제학적 조성물을 투여함으로써 수행된다. 예를 들어,이를 필요로하는 대상체의 고형 또는 혈액학적 악성 종양을 치료하는 방법은 대상체에게 유효량의 NK 세포 및 T 세포, 및/또는 본 발명의 단백질 복합체에 의해 생체 외 확장된 CAR NK 및 CAR T 세포를 투여함으로써 실행되어, 악성 종양을 치료할 수 있다. 예시적인 가용성 융합 단백질 복합체는 서열 번호 2 및 서열 번호 4에 제시된 아미노산 서열을 포함한다.
본원에 기재된 방법에 의한 치료에 적절한 신생물형성은 교모세포종, 전립선암, 혈액암, B 세포 신생물 형성, 다발성 골수종, B 세포 림프종, B 세포 비호지킨 림프종, 호지킨 림프종, 만성 림프구성 백혈병, 급성 골수성 백혈병, 피부 T 세포 림프종, T 세포 림프종, 고형 종양, 요로상피/방광 암종, 흑색종, 폐암, 신세포 암종, 유방암, 위 및 식도 암, 전립선암, 췌장암, 결장 직장암, 난소암, 비 소세포 폐 암종, 및 편평 세포 두경부 암종을 포함한다.
본원에 기재된 방법을 사용한 치료를 위한 예시적인 감염은 인간 면역 결핍 바이러스 (HIV) 또는 사이토메갈로 바이러스 (CMV)에 의한 감염을 포함한다. 본원에 기재된 방법은 또한 박테리아 감염 (예를 들어, 그람 양성 또는 그람 음성 박테리아)을 치료하는데 유용하다 (예를 들어, Oleksiewicz 등의 2012. Arch Biochem Biophys. 526:124-31 참조, 본원에서 참고로 포함).
본 발명의 세포 요법은 유효량의 확장 및 활성화된 면역 세포의 투여를 포함한다. 예를 들어, 유효량의 확장 및 활성화된 NK 또는 T 세포는 1 x 104 cells/kg과 1 x 1010 cells/kg 사이, 예를 들어, 1 x 104, 1 x 105, 1 x 106, 1 x 107, 1 x 108, 1 x 109, and 1 x 1010 cells/kg, 또는 백혈구 단리에 의해 단리될 수 있는 양이다. 대안적으로, 확장된 면역 세포는 고정 용량으로 또는 체표면적 (즉, m2 당) 기준으로 투여된다. 세포는 생체 외 확장 후 투여되거나 해동 후 (및 필요에 따라 세척) 극저온 보존 및 투여될 수 있다.
융합 단백질 복합체를 포함하는 약제 조성물이 유효량으로 투여된다. 예를 들어, 약제 조성물의 유효량은 약 1μg/kg와 100μg/kg 사이, 예를 들어, 1, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 또는 100μg/kg이다. 대안적으로, TxM 복합체는 고정 용량으로 또는 체표면적 (즉, m2 당) 기준으로 투여된다.
융합 단백질 복합체를 포함하는 입양 전달된 면역 세포 또는 약학 조성물은 적어도 한 달에 한 번, 예를 들어 한 달에 두 번, 일주일에 한 번, 일주일에 두 번, 하루에 한 번, 하루에 두 번, 8 시간마다, 4 시간마다 시간, 2 시간마다 또는 1 시간마다 투여된다. 입양 전달된 면역 세포에 적합한 투여 방식은 전신 투여, 정맥 내 투여 또는 국소 투여를 포함한다. 약제 조성물의 적합한 투여 방식은 전신 투여, 정맥 내 투여, 국소 투여, 피하 투여, 근육 내 투여, 종양 내 투여, 흡입 및 복강 내 투여를 포함한다.
일 양태에서, 본 개시 내용은 2 개 이상의 가용성 단백질을 포함하는 단리된 가용성 융합 단백질 복합체를 제공하며, 여기서 제1 가용성 단백질은 인터루킨-15 (IL-15) 폴리펩티드 도메인을 포함하고 제2 가용성 단백질은 면역 글로불린 Fc 도메인에 융합된 가용성 IL-15 수용체알파 스시 결합 도메인 (IL-15RαSu)를 포함한다. 여기서 제1 또는 제2 가용성 단백질 중 하나는 IL-7 결합 도메인 또는 이의 기능적 단편을 추가로 포함하며, 여기서 제1 또는 제2 가용성 단백질 중 하나는 추가로 IL-21 결합 도메인 또는 이의 기능적 단편을 포함하고, 여기서 제1 가용성 단백질의 IL-15 도메인은 제2 가용성 단백질의 IL-15RαSu 도메인에 결합하여 가용성 융합 단백질 복합체를 형성한다.
일 구현예에서, IL-15 폴리펩티드는 N72D 돌연변이 (IL-15N72D)를 포함하는 IL-15 변이체이다.
일 구현예에서, 제1 가용성 단백질은 서열 번호 2에 제시된 아미노산 서열을 포함한다.
일 구현예에서, 제2 가용성 단백질은 서열 번호 4에 제시된 아미노산 서열을 포함한다.
일 구현예에서, 제1 가용성 융합 단백질 복합체는 제2 가용성 융합 단백질 복합체에 공유 적으로 연결될 수 있다.
일 구현예에서, 제1 가용성 융합 단백질 복합체는 제1 가용성 융합 단백질 복합체의 Fc 도메인을 제2 가용성 융합 단백질 복합체의 Fc 도메인에 연결하는 이황화 결합에 의해 제2 가용성 융합 단백질 복합체에 공유 연결된다.
일 구현예에서, 제1 또는 제2 가용성 단백질은 질환 항원을 인식하는 결합 도메인을 추가로 포함한다.
일 구현예에서, 제1 또는 제2 가용성 단백질은 면역 체크포인트 또는 신호 전달 분자를 인식하는 결합 도메인을 추가로 포함한다.
일 구현예에서, 질환 항원은 신생물형성, 감염성 질환 또는 노화 세포 또는 연령 관련 질환과 관련된다.
일 구현예에서, 제1 가용성 단백질은 서열 번호 1에 제시된 핵산 서열에 의해 암호화된다.
일 구현예에서, 핵산 서열은 가용성 단백질을 암호화하는 서열에 작동 가능하게 결합된 촉진인자, 번역 개시 신호 및 리더 서열을 추가로 포함한다.
일 구현예에서, 제2 가용성 단백질은 서열 번호 3에 제시된 핵산 서열에 의해 암호화될 수 있다.
일 구현예에서, 핵산 서열은 가용성 단백질을 암호화하는 서열에 작동 가능하게 결합된 촉진인자, 번역 개시 신호 및 리더 서열을 추가로 포함한다.
일 구현예에서, DNA 벡터는 상기 열거 된 임의의 핵산 서열 중 어느 하나를 포함할 수 있다.
일 구현예에서, 면역 기능을 향상시키는 방법으로서, 이 방법은 a) 복수의 세포를 임의의 상기 가용성 융합 단백질 복합체와 접촉시키는 단계, - 복수의 세포는 IL-15 도메인, IL-7 도메인에 의해 인식되는 IL-7R 사슬 및/또는 IL-21 도메인에 의해 인식되는 IL-21R 사슬을 더 포함함 - , 및 b) IL-15R, IL-7R 및/또는 IL-21R의 신호 전달을 통해 면역 세포의 증식 및 활성화를 유도하는 단계를 포함한다.
일 양태에서, 본 개시 내용은 표적 세포를 사멸하는 방법을 제공하고, 이 방방법은 a) 복수의 세포를 임의의 상기 가용성 융합 단백질 복합체와 접촉시키는 단계 - 복수의 세포는 IL-15 도메인에 의해 인식되는 IL-15R 사슬, IL-7 도메인에 의해 인식되는 IL-7R 사슬 및/또는 IL-21 도메인에 의해 인식되는 IL-21R 사슬을 갖는 면역 세포를 더 포함함 -, b) IL-15R, IL-7R 및/또는 IL-21R의 신호 전달을 통해 면역 세포의 증식 및 활성화를 유도하는 단계, 및 c) 확장 및 활성화 된 면역 세포에 의해 표적 질환 세포를 사멸시키는 단계를 포함한다.
일 구현예에서, 표적 세포는 종양 세포 또는 감염된 세포이다.
일 양태에서, 본 개시 내용은 대상체의 면역 반응을 증진시키는 방법을 제공하며, 이 방법은 a) 복수의 세포를 임의의 상기 가용성 융합 단백질 복합체와 접촉시키는 단계 - 복수의 세포는 IL-15 도메인에 의해 인식되는 IL-15R 사슬, IL-7 도메인에 의해 인식되는 IL-7R 사슬 및/또는 IL-21 도메인에 의해 인식되는 IL-21R 사슬을 갖는 면역 세포를 더 포함함 -, b) IL-15R, IL-7R 및/또는 IL-21R의 신호 전달을 통해 면역 세포의 증식 및 활성화를 유도하는 단계, c) 환자에게 확장 및 활성화 된 면역 세포를 투여 (또는 입양 전달)하는 단계; 및 d) 환자의 면역 반응을 강화하는 단계를 포함한다..
일 양태에서, 본 개시 내용은 환자의 질환을 예방 또는 치료하는 방법을 제공하고, 이 방법은 a) 복수의 세포를 본원에 구현된 가용성 융합 단백질 복합체와 접촉시키는 단계 - 복수의 세포는 IL- IL-15 도메인에 의해 인식되는 15R 사슬, IL-7 도메인에 의해 인식되는 IL-7R 사슬 및/또는 IL-21 도메인에 의해 인식되는 IL-21R 사슬을 갖는 면역 세포를 더 포함함 -, b) IL-15R, IL-7R 및/또는 IL-21R의신호 전달을 통해 면역 세포의 증식 및 활성화를 유도하는 단계, c) 유효량의 확장 및 활성화된 면역 세포를 환자에게 투여 (또는 입양 전달)하는 단계, 및 d) 환자의 질병 세포를 손상 또는 사멸시키기에 충분히 확장된 면역 세포를 통해 질환 세포를 손상 및 사멸시키는 단계를 포함한다.
특정 구현예에서, 대상체 내 면역 반응을 자극하는 방법은, 면역 세포를 단리하는 단계; 면역 세포를 본원에 구현된 가용성 융합 단백질 복합체와 접촉시키는 단계; 면역 세포를 대상체에게 재주입하는 단계; 이에 의해, 대상체의 면역 반응을 자극하는 단계를 포함한다. 특정 구현예에서, 면역 세포는 자가, 일배체 동일성, 일배체 매칭 또는 이들의 조합을 포함한다. 특정 구현예에서, 면역 세포는 자가 또는 동종이계 줄기 세포로부터 유래된다. 특정 구현예에서, 면역 세포는 NK 세포, T 세포, 줄기 세포 기억 T 세포, 활성화된 NK (aNK) 세포, 키메라 항원 수용체 NK (CAR-NK) 세포, 키메라 항원 수용체 T (CAR-T) 세포, 또는 이들의 조합을 포함한다 특정 구현예에서, 하나 이상의 보조제는 임의로 본원에 구현된 가용성 융합 단백질 복합체와 함께 투여된다.
일 구현예에서, 질환은 신생물형성, 감염성 질환, 또는 노화 세포 또는 연령관련 질환이다.
일 양태에서, 본 개시는 유효량의 임의의 상기 가용성 융합 단백질 복합체를 대상체에게 투여하는 단계를 포함하는, 대상체 내 면역 반응을 향상시키는 방법을 제공한다.
일 양태에서, 본 개시는 대상체의 신생물형성, 감염성 질환 또는 노화 세포 또는 노화 관련 질환을 치료하는 방법을 제공하며, 이 방법은 상기 가용성 융합 단백질 복합체 중 어느 것을 포함하는 유효량의 약제 조성물을 상기 대상체에게 투여하여 상기 신생물형성, 감염성 질환 또는 노화 세포 또는 노화 관련 질환을 치료하는 단계를 포함한다.
다른 양태에서, 신생물형성, 감염성 질환 또는 노화 세포 또는 연령 관련 질환을 갖는 대상체를 치료하는 방법은 a) 면역 세포를 상기 가용성 융합 단백질 복합체와 접촉시켜 면역 세포의 증식 및 활성화를 유도하는 단계, b) 유효량의 활성화된 면역 세포를 대상체에게 투여 (또는 입양 전달)하는 단계, c) 대상체의 질환을 예방 또는 치료하기에 충분한 활성화된 면역 세포를 통해 질병 세포를 손상 또는 사멸시키는 단계를 포함한다..
일 구현예에서, 신생물형성은 교모세포종, 전립선암, 혈액암, B 세포 신생물 형성, 다발성 골수종, B 세포 림프종, B 세포 비호지킨 림프종, 호지킨 림프종, 만성 림프구성 백혈병, 급성 골수성 백혈병, 피부 T 세포 림프종, T 세포 림프종, 고형 종양, 요로상피/방광 암종, 흑색종, 폐암, 신세포 암종, 유방암, 위 및 식도 암, 전립선암, 췌장암, 결장 직장암, 난소암, 비 소세포 폐 암종, 및 편평 세포 두경부 암종으로 이루어진 그룹에서 선택된다.
다른 구현예에서, 노화 세포 또는 연령 관련 질환은 대사 (비만, 당뇨병), 신경계 (알츠하이머 및 파킨슨 병), 근육, 뼈 및 연골 관련 (사르코니아 질환 또는 장애, 골관절염, 후만증, 허리 디스크) 또는 조직 기능 장애 관련 (폐 폐기종, 심혈관 및 신장 질환 및 죽상 동맥 경화증) 질환으로 이루어진 그룹에서 선택된다.
일 구현예에서, 면역 세포는 NK 세포 또는 시토카인 유도된 메모리 유사 (CIML) NK 세포이다.
다른 구현예에서, 면역 세포는 T 세포 또는 기억 줄기 T 세포 (TSCM)이다.
일 구현예에서, 확장 및 활성화된 면역 세포의 유효량은 1 x 104 세포/kg 내지 1 x 1010 세포/kg이다.
일 구현예에서, 면역 세포는 주당 적어도 1 회 투여된다.
일 구현예에서, 유효량은 상기 융합 단백질 복합체의 약 1 내지 100 μg/kg이다.
일 구현예에서, 융합 단백질 복합체는 일주일에 적어도 1 회 투여된다.
일 구현예에서, 융합 단백질 복합체는 IFN-γ를 포함하여, 면역 세포 증식, 활성화 마커, 표적 세포에 대한 세포 독성 및/또는 전염증성 시토카인의 생성을 증가시킨다.
바람직하게는, 융합 단백질 복합체는 인터페론 감마 (IFN-γ)의 혈청 수준을 증가시키고/시키거나 CD4+ 및 CD8+ T 세포 및 NK 세포를 자극하여 대상체의 질환 세포 또는 종양 세포를 사멸시킨다.
정의
달리 정의되지 않는 한, 본원에 사용된 모든 기술 및 과학 용어는 본 발명이 속하는 기술 분야의 당업자에 의해 일반적으로 이해되는 의미를 갖는다. 본 명세서에서 사용한 용어는 단지 특정한 구현예를 설명하기 위해 사용된 것으로, 본 발명을 한정하려는 것은 아니다.
하기 참고 문헌은 당업자에게 본 발명에서 사용되는 많은 용어의 일반적인 정의를 제공한다: Singleton 등, Dictionary of Microbiology and Molecular Biology (2nd ed. 1994); 케임브리지 과학 기술 사전 (Walker ed., 1988); 유전학 용어집, 5th Ed., R. Rieger 등 (eds.), Springer Verlag (1991); and Hale & Marham, Harper Collins Dictionary of Biology (1991). 본 명세서에서 사용된 바와 같이, 다음의 용어는 달리 명시되지 않는 한 아래에 설명된 바와 같은 의미를 갖는다.
단수의 표현은 문맥 상 명백하게 다르게 뜻하지 않는 한, 복수의 표현을 포함한다. 또한, 용어 "갖는", "갖다", "구비하다", "구비한" 또는 이의 변형은 상세한 설명 및/또는 청구 범위에서 사용되는 한, 그러한 용어는 "포함하는"이라는 용어와 유사한 방식으로 포함하는 것으로 의도된다..
문맥에서 구체적으로 언급되거나 명백하지 않은 한, 본원에 사용되는 용어 단수의 표현은 단수이거나 복수일 수도 있는 것으로 이해된다. 본 명세서 및 첨부된 청구 범위에 사용된 바와 같이, 용어 "또는"은 내용이 명확하게 달리 지시하지 않는 한 "및/또는"을 포함하는 의미로 사용된다.
특별히 진술되거나, 내용으로부터 명백하지 않다면, 본원에 사용된 바와 같은 "약"이란 용어는, 당 분야에서 보통 관용되는 범위 내, 예를 들어 평균의 2 표준 편차 내에 속하는 것으로 이해된다. "약"은 진술된 값의 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0.5%, 0.1%, 0.05% 또는 0.01% 이내인 것으로 이해될 수 있다. 내용으로부터 분명하지 않다면, 본원에 제공된 모든 수치 값은 용어 "약"에 의해 수식된다.
"제제"는 펩티드, 핵산 분자 또는 소량의 화합물을 의미한다.
"ALT-803"또는 "N-803"은 이량체 IL-15RαSu/Fc 융합 단백질과 비공유적으로 관련된 IL-15N72D를 포함하고 면역 자극 활성을 갖는 복합체를 의미한다. 이 복합체는 IL-15 SA라고도 한다. 일 구현예에서, IL-15N72D 및/또는 IL-15RαSu/Fc 융합 단백질은 참조 서열에 대한 하나, 둘, 셋, 넷 또는 그 이상의 아미노산 변이를 포함한다.
"TxM"은 결합 도메인에 결합된 IL-15N72D:IL-15RαSu/Fc 스캐폴드를 포함하는 복합체를 의미한다(도 1). 예시적인 TxM은 IL-7 및 IL-21 시토카인에 대한 융합을 포함하는 IL-15N72D:IL-15RαSu 복합체이다.
"완화하다"란, 질환의 발달 또는 진행을 늦추거나, 억제하거나, 경감시키거나, 감소시키거나, 정지시키거나 또는 안정화하는 것을 의미한다.
"유사체"는 동일하지 않지만 유사한 기능적 또는 구조적 특징을 갖는 분자를 의미한다. 예를 들어, 폴리펩티드 유사체는 상응하는 자연 발생 폴리펩티드의 생물학적 활성을 유지하면서, 자연 발생 폴리펩티드에 비해 유사체의 기능을 향상시키는 특정 생화학적 변형을 갖는다. 이러한 생화학적 변형은 예를 들어 리간드 결합능을 변경시키지 않으면서 유사체의 프로테아제 내성, 막 투과성 또는 반감기를 증가시킬 수 있다. 유사체는 비 자연 발생 아미노산을 포함할 수 있다. 뉴클레오사이드와 관련하여 "유사체"는 예를 들어, 일반적으로 Scheit, Nucleotide Analogs, John Wiley, New York, 1980에 의해 기술된 변형된 염기 모이어티 및/또는 변형된 당 모이어티를 갖는 합성 뉴클레오사이드를 포함하며, 예를 들어, Scheit, Nucleotide Analogs, John Wiley, New York, 1980; Freier & Altmann, Nucl. Acid. Res., 1997, 25 (22), 4429-4443, Toulme, J.J., Nature Biotechnology 19:17-18 (2001); Manoharan M., Biochemica et Biophysica Acta 1489:117-139 (1999); Freier S.M., Nucleic Acid Research, 25:4429-4443 (1997), Uhlman, E., Drug Discovery & Development, 3:203-213 (2000), Herdewin P., Antisense & Nucleic Acid Drug Dev., 10:297 -310(2000)); 2'-O, 3'-C-연결된 [3.2.0] 비사이클로아라비노 뉴클레오사이드 (예를 들어, N.K. Christiensen 등, J. Am. Chem. Soc., 120:5458-5463 (1998) 참조). 이러한 유사체는 결합 특성, 예를 들어 이중 또는 삼중 안정성, 특이성 등을 향상시키도록 설계된 합성 뉴클레오사이드를 포함한다
본 발명은 원하는 생물학적 활성을 나타내는 한, 항체나 이러한 항체의 단편을 포함한다. 또한 인간화 항체와 같은 키메라 항체가 본 발명에 포함된다. 일반적으로, 인간의 항체는 비인간 공급원으로부터 도입된 하나 이상의 아미노산 잔기를 갖는다. 인간화는 예를 들어 인간 항체의 상응하는 영역에 대한 설치류 상보성 결정 영역의 적어도 일부를 대체함으로써, 당 업계에 기재된 방법을 사용하여 수행 될 수 있다.
"항체" 또는 "면역글로불린"이란 용어는, 폴리클로날 항체와 모노클로날 항체 둘 다를 포함하도록 의도된다. 바람직한 항체는 항원과 반응성인 모노클로날 항체이다. "항체"란 용어는 또한, 항원과 반응성인 항체 하나 초과만큼의 혼합물(예컨대 항원과 반응성인 상이한 유형들의 모노클로날 항체 칵테일)을 포함한다. "항체"란 용어는, 전 항체, 이의 생물 기능성 단편, 단일 사슬 항체, 그리고 유전자 변경된 항체, 예컨대 하나를 초과하는 종으로부터 유래하는 부분들을 포함하는 키메라 항체, 이기능성 항체, 항체 접합체, 인간화 항체 및 인간 항체를 포함하도록 또한 의도된다. 추가로 사용될 수도 있는 생물 기능성 항체 단편으로서는 항원과의 결합에 충분한 항체 유래 펩티드 단편이 있다. 본원에 사용된 바와 같은 "항체"는, 관심 에피토프, 항원 또는 항원 단편과 결합할 수 있는 전체 항체뿐만 아니라, 임의의 항체 단편(예컨대 F(ab')2, Fab', Fab, Fv)을 포함하는 의미이다.
본원에 사용된 용어 "연관된", "접합된", "연결된", "부착된" 및 "묶여진"은 2 개 이상의 모이어티와 관련하여 사용될 때, 모이어티가 구조가 사용되는 조건, 예를 들어 생리학적 상태에서 물리적으로 결합되도록 충분히 안정한 구조를 형성하기 위해서, 모이어티가 직접적으로 (예를 들어, 공유 결합) 또는 연결제로서 작용하는 하나 이상의 추가의 모이어티를 통해, 물리적으로 서로 연관되거나 연결되어 있음을 의미한다. 일부 구현예에서, 충분한 수의 약한 상호 작용은 모이어티가 다양한 상이한 조건 하에서 물리적으로 연관된 상태를 유지하기에 충분한 안정성을 제공할 수 있다.
분자에 "결합"한다는 것은 그 분자에 대한 물리 화학적인 친화성을 갖는 것을 의미한다.
용어 "결합 도메인"은 항체, 단일 사슬 항체, Fab, Fv, T 세포 수용체 결합 도메인, 리간드 결합 도메인, 수용체 결합 도메인 또는 당 업계에 공지된 다른 항원-특이적 폴리펩티드를 포함하는 것으로 의도된다.
본원에 사용된 용어 "생물학적 활성 모이어티" 또는 "효과기 분자"는 핵산 서열, 단백질, 폴리펩티드 또는 펩티드와 같은 아미노산 서열; 당 또는 다당류; 본원에 논의된 바와 같이 원하는 효과를 생성할 수 있는 지질 또는 당지질, 당 단백질 또는 지단백질을 의미한다. 효과기 분자는 또한 화학 제제를 포함한다. 생물학적 활성 또는 효과기 단백질, 폴리펩티드 또는 펩티드를 암호화하는 효과기 분자 핵산이 또한 고려된다. 따라서, 적합한 분자는 조절 인자, 효소, 항체 또는 약물뿐만 아니라 DNA, RNA 및 올리고뉴클레오티드를 포함한다. 생물학적 활성 폴리펩타이드 또는 효과기 분자는 자연적으로 발생하거나 공지된 성분, 예를 들어 재조합 또는 화학적 합성에 의해 합성될 수 있으며 이종 성분을 포함할 수 있다. 생물학적 활성 폴리펩티드 또는 효과기 분자는 일반적으로 원심 단리 또는 SDS- 폴리아크릴 아미드 겔 전기 영동과 같은 표준 분자 사이징 기술에 의해 판단할 때 약 0.1 내지 100 KD 이상에서 약 1000 KD 사이, 바람직하게는 약 0.1, 0.2, 0.5, 1, 2, 5, 10, 20, 30 내지 50 KD이다. 본 발명의 바람직한 효과는 제한하는 것은 아니지만, 예를 들어 결합 활성이 증가된 본 발명의 융합 단백질 복합체를 형성하고, 표적 세포을 사멸하고, 세포 증식 또는 세포 사멸을 유도하고, 질환 예방 및 치료시 면역 반응을 개시하고, 진단 목적을 위한 검출 분자로서 작용하는 것등을 포함한다. 이러한 검출을 위해, 예를 들어 세포를 배양하여 이를 증식시키고, 세포를 본 발명의 융합 복합체와 접촉시킨 후 융합 복합체가 세포의 추가 발달을 저해하는지 여부를 평가하는 순차적 단계를 포함하는 검정이 사용될 수 있다.
본 발명에 따라 효과기 분자를 본 발명의 융합 단백질 복합체에 공유 결합하게 되면 많은 중요한 이점을 제공한다. 공지된 구조의 펩티드를 포함하는 단일 효과기 분자를 함유하는 본 발명의 융합 단백질 복합체가 제조될 수 있다. 추가로, 다양한 효과기 분자가 유사한 DNA 벡터에서 생성될 수 있다. 즉, 상이한 효과기 분자의 라이브러리는 감염 또는 질환 세포를 인식하기 위해 융합 단백질 복합체에 결합될 수 있다. 또한, 치료상의 적용을 위해, 본 발명의 융합 단백질 복합체를 대상체에게 투여하는 대신에, 융합 단백질 복합체를 암호화한 DNA 발현 벡터가 융합 단백질 복합체의 생체 내 발현을 위해 투여될 수 있다. 이러한 접근법에 의하면 통상적으로 재조합 단백질의 제조와 관련된 고가의 정제 단계와 통상적인 접근법과 관련된 항원 흡수 및 처리의 복잡성을 방지할 수 있다.
언급한 바와 같이, 본원에 개시된 융합 단백질의 성분, 예를 들어 시토카인, 케모카인, 성장 인자, 단백질 독소, 면역 글로불린 도메인 또는 다른 생물 활성 분자 및 임의의 펩티드 링커와 같은 효과기 분자는 융합 단백질이 의도한 기능을 갖는다고 한다면 임의의 방식으로 조직될 수 있다. 특히, 융합 단백질의 각 성분은 원하는 경우 하나 이상의 적합한 펩티드 링커 서열에 의해 다른 성분과 이격될 수 있다. 추가로, 융합 단백질은 예를 들어 융합 단백질의 변형, 식별 및/또는 정제를 용이하게 하기 위해 태그를 포함할 수 있다. 보다 구체적인 융합 단백질은하기 기재된 예에서 볼 수 있다.
본원에 사용된 용어 "키메라 항원 수용체" 또는 "CAR"은 면역 세포를 활성화 또는 자극할 수 있는 세포 내 신호 전달 도메인에 융합된 항원 결합 도메인을 지칭하고, 특정 구현예에서, CAR은 또한 막 관통 도메인을 포함한다. 특정 구현예에서, CAR의 세포외 항원-결합 도메인은 뮤린 또는 인간화된 단일 클론 항체의 가변 중쇄 및 경쇄 영역을 융합시켜 유래된 단일쇄 가변 단편(scFv)으로 구성된다. 대안 적으로, (예를 들어, Fab 라이브러리로부터 얻은 항체 대신에) Fab로부터 유래된 scFv가 사용될 수 있다. 다양한 구현예에서, scFv는 막 관통 도메인에 융합된 후 세포 내 신호 전달 도메인에 융합된다. "제1 세대" CAR은 항원 결합시 CD3ζ 신호만을 제공하는 것을 포함하고, "제2 세대" CAR은 공동 자극 (예를 들어, CD28 또는 CD137) 및 활성화 (CD3ζ)를 모두 제공하는 것을 포함한다. "제3 세대" CAR은 다중 공동-자극 (예를 들어, CD28 및 CD137) 및 활성화 (CD3ζ)를 제공하는 것들을 포함한다. CAR의 제4 세대가 설명되었고, CAR 구축물을 함유하는 벡터가 시토카인 카세트를 보유하는 시토카인 사멸 (TRUCKS)을 위해 재전송된 CAR T 세포가 설명되었다. CAR이 결찰될 때, CAR T 세포는 전염증성 시토카인을 종양 병변에 침착시킨다. CAR-T 세포는 키메라 항원 수용체를 발현하는 T 세포이다. CAR-NK 세포는 키메라 항원 수용체를 발현하는 NK 세포이다. 키메라 항원 수용체 (CAR)는 세포 외 도메인에 결합된 항원-특이 적 세포 외 도메인을 가지며, 이는 세포 외 도메인에 항원의 결합시 세포가 특수화된 기능을 수행하도록 지시한다. 용어 "인공 T 세포 수용체", "키메라 T 세포 수용체" 및 "키메라 면역 수용체"는 각각 본원에서 용어 "키메라 항원 수용체"와 상호 교환적으로 사용될 수 있다. 키메라 항원 수용체는 MHC-비의존적 항원에 결합하고 그들의 세포 내 도메인을 통해 활성화 신호를 전달하는 능력에 의해 다른 항원 결합제와 구별된다.
"검출하다"란, 검출될 피분석물의 존재, 부재 또는 그 양을 동정하는 것을 의미한다.
"질환"이란, 세포, 조직 또는 장기의 정상 기능을 손상시키거나 방해하는 임의의 병태나 장애를 의미한다. 질환의 예로서는 신생물형성, 자가면역성 질환 및 바이러스 감염을 포함한다.
제제 또는 제제 성분의 "유효량" 및 "치료적 유효량"이란 용어는, 해당 제제 또는 성분이 단독으로 또는 조합하여 원하는 효과를 제공하기 충분한 양을 의미한다. 예를 들어 "유효량"이란, 치료전인 환자에 있어서 어떤 질환의 증상들에 비해 해당 질환의 증상을 완화하는데 필요한, 화합물 단독의 양 또는 다른 성분과 합한 양을 의미한다. 어떤 질환의 치료적 처치를 위하여 본 발명을 수행하는데 사용되는 활성 화합물(들)의 유효량은, 투여 방식, 대상체의 나이, 체중 및 전반적 건강 상태에 따라 달라진다. 궁극적으로 참여 전문의나 수의사가 적당한 양과 투여 계획을 결정할 것이다. 이러한 양은 "유효"량이라 지칭된다.
"단편"이란, 폴리펩티드 또는 핵산 분자의 일부를 의미한다. 이 일부는, 바람직하게 기준 핵산 분자 또는 폴리펩티드의 전체 길이의 적어도 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% 또는 90%를 함유한다. 예를 들어 단편은 10, 20, 30, 40, 50, 60, 70, 80, 90 또는 100, 200, 300, 400, 500, 600, 700, 800, 900, 또는 1000 개의 뉴클레오티드 또는 아미노산을 함유할 수 있다. 그러나, 본 발명은 또한 폴리펩티드 및 핵산 단편이 각각 전장 폴리펩티드 및 핵산의 원하는 생물 활성을 보이는 한, 이 폴리펩티드 및 핵산 단편도 포함한다. 거의 모든 길이를 가지는 핵산 단편이 사용된다. 예를 들어 총 길이가 약 10,000, 약 5,000, 약 3,000, 약 2,000, 약 1,000, 약 500, 약 200, 약 100, 약 50 개 염기쌍(이 중간 길이도 모두 포함)인 예시적 폴리뉴클레오티드 분절이 본 발명의 다수의 실시예에 포함된다. 이와 유사하게, 거의 모든 길이를 가지는 폴리펩티드 단편이 사용된다. 예를 들어 총 길이가 약 10,000, 약 5,000, 약 3,000, 약 2,000, 약 1,000, 약 5,000, 약 1,000, 약 500, 약 200, 약 100 또는 약 50 개 아미노산(이 중간 길이도 모두 포함)인 예시적 폴리펩티드 분절이 본 발명의 다수의 실시예에 포함된다.
본원에 사용된 용어 "면역 세포"는 일반적으로 골수 "면역 세포", 예를 들어 림프구 (T 세포, B 세포, 천연 킬러 (NK) 세포) 및 골수-유래 세포 (호중구, 호산구, 호염기구, 단핵구, 대식세포, 수지상 세포)에서 생성된 조혈 줄기 세포 (HSC)로부터 유래된 백혈 세포를 포함한다.
본원에 사용된 용어 "면역 효과기 세포"는 면역 반응, 예를 들어 면역 효과기 반응의 촉진에 관여하는 세포를 지칭한다. 면역 효과기 세포의 예는 T 세포, 예를 들어 알파/베타 T 세포 및 감마/델타 T 세포, B 세포, 자연살해 (NK) 세포, 자연살해 T (NK-T) 세포, 비만 세포 및 골수 유도 포식 세포를 포함한다. 본원에 사용된 용어 "면역 효과기 기능 또는 면역 효과기 반응"은 표적 세포의 면역 공격을 강화 또는 촉진하는, 예를 들어 면역 효과기 세포의 기능 또는 반응을 지칭한다. 예를 들어, 면역 효과기 기능 또는 반응은 표적 세포의 사멸 또는 성장 또는 증식의 억제를 촉진하는 T 또는 NK 세포의 특성을 지칭한다. T 세포의 경우, 일차 자극 및 공동 자극은 면역 효과기 기능 또는 반응의 예이다.
"단리된", "정제된" 또는 "생물학적으로 순수한"이란 용어는, 어떤 물질이 자체의 원산 상태로서 발견될 때 보통 수반되는 성분들로부터 다양한 정도로 벗어난 상태를 지칭한다. "단리하다"란, 원래의 공급원이나 주위환경으로부터 어느 정도 단리되는 것을 나타낸다. "정제하다"란, 단리시보다 더 높은 정도로 단리되는 것을 나타낸다.
"정제된" 또는 "생물학적으로 순수한" 단백질은, 어떠한 불순물도 해당 단백질의 생물 특성에 거의 영향을 미치지 않거나 여타의 부정적인 결과를 초래하지 않도록 다른 물질로부터 충분히 벗어나 있다. 즉 만일 본 발명의 핵산이나 펩티드가 재조합 DNA 기술에 의해 생산되었을 때 세포성 물질, 바이러스 물질 또는 배양 배지를 실질적으로 포함하지 않거나, 또는 만일 화학적으로 합성되었을 때 화학 전구체 또는 기타 화학물질을 실질적으로 포함하지 않는다면 해당 핵산이나 펩티드는 정제된 것이다. 순도와 균질성은 통상 분석 화학 기술, 예컨대 폴리아크릴아미드 겔 전기영동 또는 고성능 액체 크로마토그래피가 사용되어 측정된다. "정제된"이란 용어는, 전기영동 겔에서 핵산이나 단백질이 본질적으로 하나의 밴드를 보일 때를 가리킬 수 있다. 변형, 예를 들어 인산화 또는 당화가 일어날 수 있는 단백질의 경우, 상이한 변형은 별도로 정제될 수 있는 상이한 단리 단백질들을 생성할 수 있다.
이와 유사하게 "실질적으로 순수한"이란, 어떤 뉴클레오티드나 폴리펩티드가, 자연에서 이 뉴클레오티드나 폴리펩티드와 함께 발생하는 성분들로부터 단리된 경우를 의미한다. 통상적으로 뉴클레오티드 및 폴리펩티드가, 자연에서 이것과 결합되어 존재하는 단백질 및 자연 발생 유기 분자로부터 적어도 60 중량%, 70 중량%, 80 중량%, 90 중량%, 95 중량% 또는 심지어 99% 중량% 단리되어 있다면, 해당 뉴클레오티드 및 폴리펩티드는 실질적으로 순수한 것이다.
"단리된 핵산"이란, 어떤 핵산의 기원이 된 유기체의 자연 발생 게놈 내 이 핵산에 측접하는 유전자로부터 벗어난 핵산을 의미한다. 이 용어는, 예를 들어 (a) 자연 발생 게놈 DNA 분자의 일부이긴 하지만, 유기체 게놈 내 자연 발생되는 DNA 분자의 해당 일부와 측접하는 핵산 서열이 양쪽으로 측접되어 있지 않은 DNA; (b) 생성될 분자가 임의의 자연 발생 벡터 또는 게놈 DNA와 동일하지 않게 되는 방식으로 원핵생물 또는 진핵생물 게놈 DNA 내 또는 벡터 내에 통합된 핵산; (c) 별도의 분자, 예컨대 cDNA, 게놈 단편, 중합효소 연쇄 반응(PCR)에 의해 생성된 단편, 또는 제한 단편; 그리고 (d) 하이브리드 유전자, 즉 융합 단백질을 암호화하는 유전자의 일부인 재조합 뉴클레오티드 서열을 아우른다. 본 발명에 따른 단리 핵산 분자는 합성에 의해 생산된 분자뿐만 아니라, 화학적으로 변경되었고/변경되었거나 변형 골격을 가지는 임의의 핵산들을 추가로 포함한다. 예를 들어 단리된 핵산은 정제 cDNA 또는 RNA 폴리뉴클레오티드이다. 단리된 핵산 분자는 또한 전령 리보핵산(mRNA) 분자를 포함하기도 한다.
"단리된 폴리펩티드"란, 자연에서 함께 발생하는 성분들로부터 단리된 본 발명의 폴리펩티드를 의미한다. 통상적으로 본 폴리펩티드는, 그것이 자연에서 결합하고 있는 단백질 및 자연 발생 유기 분자로부터 적어도 60 중량% 벗어났을 때 단리된 것이다. 바람직하게 본 제제는 본 발명의 폴리펩티드 적어도 75 중량%, 더욱 바람직하게는 적어도 90 중량%, 그리고 가장 바람직하게는 적어도 99 중량%이다. 본 발명의 단리된 폴리펩티드는, 예를 들어 자연 공급원으로부터의 추출, 이러한 폴리펩티드를 암호화하는 재조합 핵산의 발현, 또는 단백질의 화학 합성에 의해 수득될 수 있다. 순도는 적당한 임의의 방법, 예를 들어 컬럼 크로마토그래피, 폴리아크릴아미드 겔 전기영동 또는 HPLC 분석에 의해 측정될 수 있다.
"마커"란, 어떤 질환이나 장애와 연관된 발현 수준 또는 활성이 변경된 임의의 단백질 또는 폴리뉴클레오티드를 의미한다.
"신생물형성"이란, 과도한 증식 또는 감소한 세포자멸에 의해 특징지어지는 질환이나 장애를 의미한다. 본 발명이 사용될 수 있는 예시적 신생물형성으로서는 백혈병(예컨대 급성 백혈병, 급성 림프구성 백혈병, 급성 골수성 백혈병, 급성 골수아구성 백혈병, 급성 전골수성 백혈병, 급성 골수단핵구성 백혈병, 급성 단핵구성 백혈병, 급성 적백혈병, 만성 백혈병, 만성 골수성 백혈병, 만성 림프구성 백혈병), 진성 다혈구증, 림프종(호지킨 질환, 비호지킨 질환), 발덴스트롬 매크로글로불린혈증, 증쇄병 및 고형 종양, 예컨대 육종 및 암종(예컨대 섬유육종, 점액육종, 지방육종, 연골육종, 골원성 육종, 척색종, 혈관육종, 내피육종, 림프관육종, 림프관내피모세포종, 활막종, 중피종, 유잉 종양, 평활근육종, 횡문근육종, 결장 암종, 췌장암, 유방암, 난소암, 전립선암, 평평세포 암종, 기저세포 암종, 선암종, 한선암종, 피지선암종, 유두갑상선암종, 유두갑상선선암종, 낭샘암종, 수질암종, 기관지원성암종, 신세포암종, 간세포암, 담관암종, 융모막암종, 정상피종, 태생성암종, 빌름 종양, 자궁경부암, 자궁암, 고환암, 폐암종, 소세포 폐암종, 방광 암종, 상피암종, 신경교종, 다형성신경교종, 성상세포종, 수모세포종, 두개인두종, 상의세포종, 송과체부종양, 혈관모세포종, 청신경종, 핍지교종, 신경초종, 뇌수막종, 흑색종, 신경아세포종 및 망막모세포종)을 포함하나, 이에 한정되는 것은 아니다. 특정 구현예들에서, 신생물형성은 다발성 골수종, 베타 세포 림프종, 요로상피/방광 암종 또는 흑색종이다. 본원에 사용된 바와 같이 "제제를 수득하는 것"에서와 같이"수득하는 것"은, 해당 제제를 합성, 구매 또는 취득하는 것을 포함한다.
본원에 사용된 용어 "핵산 서열", "폴리뉴클레오티드" 및 "유전자"는 명세서 전체에 걸쳐 상호 교환적으로 사용되며, 상보적 DNA (cDNA), 선형 또는 원형 올리고머 또는 천연 및/또는 변형된 단량체 또는 결합의 중합체, 데옥시리보뉴클레오 사이드, 리보뉴클레오사이드, 이의 치환 및 알파-아노머 형태, 펩타이드 핵산 (PNA), 잠금 핵산 (LNA), 포스포로티오에이트, 메틸포스포네이트 등을 포함한다. 폴리뉴클레오티드는 통상의 클로닝 기술 및 PCR ™ 등을 사용하여, 재조합 수단, 즉 재조합 라이브러리 또는 세포 게놈으로부터의 핵산 서열의 클로닝을 제한없이 포함하는, 관련 기술 분야에서 이용 가능한 임의의 수단에 의해 수득되는 모든 핵산 서열을 포함한다.
핵산 서열은 "키메라", 즉 상이한 영역으로 구성될 수 있다. 본 발명의 맥락에서, "키메라" 화합물은 2개 이상의 화학적 영역, 예를 들어 DNA 영역(들), RNA 영역(들), PNA 영역(들) 등을 함유하는 올리고뉴클레오티드이다. 각 화학 영역은 하나 이상의 단량체 단위, 즉 뉴클레오티드로 이루어진다. 이들 서열은 전형적으로 하나 이상의 원하는 특성을 나타내도록 서열이 변형된 하나 이상의 영역을 포함한다.
본 발명의 방법에 유용한 핵산 분자는 본 발명의 폴리펩티드 또는 이의 단편을 암호화하는 임의의 핵산 분자를 포함한다. 이러한 핵산 분자는 내부 핵산 서열과 100% 동일할 필요는 없지만, 통상 실질적인 동일성을 보일 것이다. 내부 서열과의 "실질적 동일성"을 가지는 폴리뉴클레오티드는, 통상 이중 가닥 핵산 분자의 적어도 한 가닥과 잡종화될 수 있다. 본 발명의 방법에 유용한 핵산 분자는 본 발명의 폴리펩티드 또는 이의 단편을 암호화하는 임의의 핵산 분자를 포함한다. 이러한 핵산 분자는 내부 핵산 서열과 100% 동일할 필요는 없지만, 통상 실질적인 동일성을 보일 것이다. 내부 서열과 "실질적 동일성"을 가지는 폴리뉴클레오티드는, 통상 이중 가닥 핵산 분자의 적어도 한 가닥과 잡종화될 수 있다. "잡종화하다"란, 다양한 엄중도 조건(stringency condition) 하에 쌍을 이루어 상보성 폴리뉴클레오티드 서열들(예컨대 본원에 기술된 유전자) 또는 이의 일부들 간에 이중 가닥 분자를 형성하는 경우를 의미한다. 예를 들어 문헌(Wahl, G. M. and S. L. Berger (1987) Methods Enzymol. 152:399; Kimmel, A. R. (1987) Methods Enzymol. 152:507)을 참조한다.
예를 들어 엄중한 염 농도는 보통 약 750 mM 미만 NaCl 및 약 75 mM 미만의 시트르산삼나트륨, 바람직하게 약 500 mM 미만 NaCl 및 약 50 mM 미만의 시트르산삼나트륨, 그리고 더욱 바람직하게 약 250 mM 미만 NaCl 및 약 25 mM 미만의 시트르산삼나트륨일 것이다. 저 엄중도 잡종화는 유기 용매, 예컨대 포름아미드의 부재하에 이루어질 수 있는 반면, 고 엄중도 잡종화는 적어도 약 35%의 포름아미드, 더욱 바람직하게는 적어도 약 50%의 포름아미드의 존재 하에 이루어질 수 있다. 엄중한 온도 조건은 보통 적어도 약 30℃, 더욱 바람직하게는 적어도 약 37℃, 그리고 가장 바람직하게는 적어도 약 42℃의 온도를 포함할 것이다. 추가의 가변적 매개변수, 예컨대 잡종화 시간, 세제(예컨대 도데실황산나트륨(SDS)) 농도, 그리고 운반체 DNA의 포함 또는 배제는 당 업자들에게 널리 공지되어 있다. 다양한 엄중도 수준은 필요에 따라 다양한 조건들을 조합함으로써 달성된다. 바람직한 구현예에서, 잡종화는 30℃ 및 750 mM NaCl, 75 mM 시트르산삼나트륨 및 1% SDS 중에서 일어날 것이다. 더욱 바람직한 구현예에서, 잡종화는 37℃ 및 500 mM NaCl, 50 mM 시트르산삼나트륨 및 1% SDS, 35% 포름아미드 및 100 mu.g/ml 변성 연어 정자 DNA(ssDNA) 중에서 일어날 것이다. 가장 바람직한 구현예에서, 잡종화는 42℃ 및 250 mM NaCl, 25 mM 시트르산삼나트륨 및 1% SDS, 50% 포름아미드 및 200 μg/ml ssDNA 중에서 일어날 것이다. 이러한 조건들에 있어서 유용한 변동은 당 업자들이 용이하게 알 것이다.
대부분의 응용에 있어서, 잡종화에 뒤이어 행해지는 세척 단계도 또한 엄중도가 다양할 것이다. 세척 엄중도 조건은 염의 농도와 온도에 의해 한정될 수 있다. 상기와 같이 세척 엄중도는, 염 농도를 낮추거나 온도를 높임으로써 증가할 수 있다. 예를 들어 세척 단계에 있어 엄중한 염 농도는, 바람직하게 약 30 mM 미만의 NaCl 및 약 3 mM 미만의 시트르산삼나트륨이고, 가장 바람직하게는 약 15 mM 미만의 NaCl 및 약 1.5 mM 미만의 시트르산삼나트륨일 것이다. 세척 단계에 있어 엄중한 온도 조건은, 보통 적어도 약 25℃, 더욱 바람직하게 적어도 약 42℃, 더욱더 바람직하게는 적어도 약 68℃를 포함할 것이다. 바람직한 구현예에서, 세척 단계는 25℃ 및 30 mM NaCl, 3 mM 시트르산삼나트륨 및 0.1% SDS 중에서 진행될 것이다. 더욱 바람직한 구현예에서, 세척 단계는 42℃ 및 15 mM NaCl, 1.5 mM 시트르산삼나트륨 및 0.1% SDS 중에서 진행될 것이다. 더욱 바람직한 구현예에서, 세척 단계는 68℃ 및 15 mM NaCl, 1.5 mM 시트르산삼나트륨 및 0.1% SDS 중에서 진행될 것이다. 이러한 조건에 대한 추가의 변동은 당 업자들이 용이하게 알 것이다. 잡종화 기술은 당 업자들에게 널리 공지되어 있으며, 예를 들어 문헌(Benton and Davis (Science 196:180, 1977); Grunstein and Hogness (Proc. Natl. Acad. Sci., USA 72:3961, 1975); Ausubel 등 (Current Protocols in Molecular Biology, Wiley Interscience, New York, 2001); Berger and Kimmel (Guide to Molecular Cloning Techniques, 1987, Academic Press, New York); and Sambrook 등, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York)에 기술되어 있다.
본원에 사용된 "뉴클레오사이드"는 예를 들어 Kornberg and Baker, DNA Replication, 2nd Ed에 기재된 바와 같이 2'-데옥시 및 2'-하이드록실 형태를 포함하는 천연 뉴클레오사이드를 포함한다 (1992 년 샌프란시스코, 프리먼).
"노화 세포 관련 질환" 또는 연령 관련 질환 "은 대사 (비만, 당뇨병), 신경 학적 (알츠하이머 및 파킨슨 병), 근육, 뼈 및 연골 관련 (사르코니아 질환 또는 장애, 골관절염, 후만증, 허리 디스크) 또는 조직 기능 장애 관련 (폐 폐기종, 심혈관 및 신장 질환 및 죽상 동맥 경화증) 질환으로 이루어진 그룹에서 선택된 질환이나 장애를 의미한다.
"감소하다"란, 적어도 5%, 10%, 25%, 50%, 75% 또는 100% 만큼의 "-" 변경을 의미한다.
"기준"이란, 표준 또는 대조군인 조건을 의미한다.
"기준 서열"은, 서열 비교의 기초로서 사용되는 한정된 서열이다. 기준 서열은 지정 서열의 종속 서열 또는 전체 서열일 수 있는데; 예를 들어 전장 cDNA 또는 유전자 서열의 분절, 또는 전체 cDNA 또는 유전자 서열일 수 있다. 폴리펩티드에 있어서, 기준 폴리펩티드 서열의 길이는, 일반적으로 적어도 약 16개 아미노산, 바람직하게 적어도 약 20개 아미노산, 더욱 바람직하게 적어도 약 25개 아미노산, 그리고 더욱더 바람직하게 약 35개 아미노산, 약 50개 아미노산, 또는 약 100개 아미노산일 것이다. 핵산에 있어서, 기준 핵산 서열의 길이는, 일반적으로 적어도 약 50개 뉴클레오티드, 바람직하게 적어도 약 60개 뉴클레오티드, 더욱 바람직하게 적어도 약 75개 뉴클레오티드, 그리고 더욱더 바람직하게 약 100개 뉴클레오티드 또는 약 300개 뉴클레오티드, 또는 이 범위 정도나 이 범위 사이의 임의의 정수만큼의 개수의 뉴클레오티드일 것이다.
"특이적으로 결합한다"는 본 발명의 폴리펩티드를 인식하고 결합하지만, 본 발명의 폴리펩티드를 자연적으로 포함하는 시료, 예를 들어 생물학적 시료에서 다른 분자를 실질적으로 인식하고 결합하지 않는 화합물 또는 항체를 의미한다 .
"실질적으로 동일한"이란, 어떤 폴리펩티드 또는 핵산 분자가 기준 아미노산 서열(예를 들어 본원에 기술된 아미노산 서열들 중 임의의 하나) 또는 핵산 서열(예를 들어 본원에 기술된 핵산 서열들 중 임의의 하나)에 대해 적어도 50%의 동일성을 보이는 경우를 의미한다. 바람직하게 이러한 서열은 비교에 사용된 서열과 아미노산 수준 또는 핵산 수준에서 적어도 60%, 더욱 바람직하게는 80% 또는 85%, 더욱더 바람직하게는 90%, 95% 또는 심지어 99% 동일하다.
서열 동일성은, 통상적으로 서열 분석 소프트웨어(예를 들어 Sequencher(Gene Codes Corporation, 775 Technology Drive, Ann Arbor, MI); Vector NTI(Life Technologies, 3175 Staley Rd. Grand Island, NY)가 사용되어 측정된다. 이러한 소프트웨어는 다양한 치환, 결실 및/또는 기타 변형에 상동성의 정도를 할당함으로써 동일하거나 유사한 서열을 매칭시킨다. 보존적 치환은, 통상적으로 하기 군들, 즉 글리신, 알라닌; 발린, 이소루신, 루신; 아스파르트산, 글루탐산, 아스파라긴, 글루타민; 세린, 트레오닌; 리신, 아르기닌; 및 페닐알라닌, 티로신 내에서의 치환을 포함한다. 동일성의 정도를 측정하기 위한 예시적 접근법에 있어서, BLAST 프로그램이 사용될 수 있는데, 이 프로그램에서 확률 스코어 e-3 내지 e-100이라 함은, 두 서열이 관련성이 매우 큰 서열임을 나타낸다.
"대상체"란, 포유동물, 예컨대 인간 또는 인간 이외의 포유동물, 예컨대 소, 말, 개, 양 또는 고양이(이에 한정되는 것은 아님)를 의미한다. 대상체는, 바람직하게 B 세포 림프종 또는 이에 대한 소인의 치료를 필요로 하는 포유동물로서, 예를 들어 B 세포 림프종이라 진단되었거나 이에 대한 소인이 있는 것으로 진단된 대상체이다. 포유동물은 임의의 포유동물, 예컨대 인간, 영장류, 마우스, 래트, 개, 고양이, 말뿐만 아니라, 식용으로 기른 가축이나 동물, 예컨대 송아지, 양, 돼지, 닭 및 염소이다. 바람직한 구현예에서, 포유동물은 인간이다.
본원에 제공된 범위들은 해당 범위 내의 모든 값들에 대한 약칭인 것으로 이해된다. 예를 들어 "1 내지 50의 범위"는 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 또는 50으로 이루어진 군에 속하는 임의의 수, 수들의 조합 또는 이 범위의 종속 범위를 포함하는 것으로 이해된다.
본원에 사용된 바와 같은 "치료하는 것" 및 "치료"란 용어는, 어떤 제제(agent)나 제제(formulation)를, 불리한 병태, 장애 또는 질환이 걸린 개체로서, 임상 증상을 보이는 개체에 투여하여, 해당 증상의 중증도 및/또는 발생 빈도의 감소, 해당 증상 및/또는 이 증상의 기저 원인의 제거, 그리고/또는 손상의 개선 또는 교정의 가속화를 달성하는 것을 지칭한다. 어떤 장애나 병태를 치료하는 것은 해당 장애, 병태 또는 이러한 장애나 병태와 연관된 증상이 완전히 없어져야 하는 것은 아니지만, 그렇다고 이처럼 해당 장애, 병태 또는 이러한 장애나 병태와 연관된 증상이 완전히 없어져서는 안 될 것까지는 없음이 이해될 것이다. 치료에 이용되는 제제는 세포나 조직을 포함할 수 있다.
신생물형성을 갖는 환자의 치료는 다음 중 하나를 포함할 수 있다: 초기 치료 (예:수술)에 의해 공지된 종양이 제거된 후에 존재할 수 있는 잔류 종양 세포를 파괴하여, 가능한 아마 재발을 방지하는 보조 요법 (부가 요법 또는 부속 요법); 암을 수축시키기 위해 수술 절차 전에 제공된 신 보조 요법; 전형적으로 급성 백혈병에 대한 완화를 유도하는 유도 요법; 완화가 지속되면 완화를 지속하도록 하는 강화 요법 (증대 요법이라고도 함); 완화를 연장시키도록 하기 위해 더 적거나 덜 빈번한 복용량이 투여되는 투여 요법; 1 차 라인 요법 (표준 요법이라고도 함); 1 차 라인 요법 후에 질환이 반응하거나 재발하지 않으면 2 차 (또는 3 차, 4 차 등) 라인 요법 (인양 요법이라고도 함); 및 암을 현저하게 감소시키는 것은 기대하지 않고 증상 관리를 다루기 위한 일시적 처방 요법 (지원적 요법이라고도 함).
용어 "예방하는 것" 및 "예방"은 특정한 불리한 상태, 장애 또는 질환에 취약하거나 이의 소인이 있는 무증상 개인에게 제제 또는 조성물을 투여하는 것을 말하며, 따라서 증상 발생 및/또는 해당 증상의 기저 원인을 예방하는 것에 관한 것이다.
폴리 뉴클레오티드 서열의 맥락에서 사용될 때 용어 "변이체"는 야생형 유전자와 관련된 폴리 뉴클레오티드 서열을 포함할 수 있다. 이 정의는 또한 예를 들어 "대립 유전자", "결합", "종"또는 "다형성" 변이체를 포함할 수 있다. 스플 라이스 변이체는 참조 분자와 상당한 동일성을 가질 수 있지만, 일반적으로 mRNA 처리 동안 엑손의 교 호적 스 플라이 싱으로 인해 더 많거나 적은 수의 폴리 뉴클레오티드를 가질 것이다. 상응하는 폴리펩티드는 추가의 기능성 도메인 또는 도메인의 부재를 가질 수 있다. 종 변이체는 종마다 다른 폴리 뉴클레오티드 서열이다. 본 발명에서 특히 유용한 것은 야생형 표적 유전자 생성물의 변이체이다. 변이체는 핵산 서열에서 적어도 하나의 돌연변이에 기인할 수 있고, 구조 또는 기능이 변경되거나 변경되지 않을 수 있는 변경된 mRNA 또는 폴리펩티드를 초래할 수 있다. 임의의 주어진 천연 또는 재조합 유전자는 하나, 또는 많은 대립 유전자 형태를 갖지 않을 수 있다. 변이를 일으키는 일반적인 돌연변이 변화는 일반적으로 뉴클레오티드의 자연적 결실, 첨가 또는 치환에 기인한다. 이러한 유형의 변화 각각은 주어진 순서로 단독으로 또는 다른 조합과 함께 발생할 수 있다. 생성된 폴리펩티드는 일반적으로 서로에 대해 상당한 아미노산 동일성을 가질 것이다. 다형성 변이체는 주어진 종의 개체들 사이에서 특정 유전자의 폴리 뉴클레오티드 서열의 변이이다. 다형성 변이체는 또한 "단일 뉴클레오티드 다형성"(SNP), 또는 폴리 뉴클레오티드 서열이 하나의 염기에 의해 변하는 단일 염기 돌연변이를 포함할 수 있다. SNP의 존재는 예를 들어 질환 상태에 대한 경향이있는 감수성 대 저항성 인 특정 집단을 나타낼 수 있다.
본원에 사용된 폴리펩티드의 "변이체"는 하나 이상의 아미노산 잔기에 의해 변경된 아미노산 서열을 지칭한다. 변이체는 "보존적" 변화를 가질 수 있으며, 여기서 치환된 아미노산은 유사한 구조적 또는 화학적 특성 (예를 들어, 류신을 이소류신으로 대체)을 갖는다. 더 드물게, 변이체는 "비 보존적" 변화를 가질 수 있다 (예를 들어, 글리신을 트립토판으로 대체). 유사한 작은 변이는 또한 아미노산 결실 또는 삽입, 또는 둘 다를 포함할 수 있다. 생물학적 활성을 없애지 않고 치환, 삽입 또는 결실 될 수 있는 아미노산 잔기를 결정하는 지침은 당 업계에 잘 알려진 컴퓨터 프로그램, 예를 들어 LASERGENE 소프트웨어 (DNASTAR)를 사용하여 찾을 수 있다.
본원의 변인에 관한 임의의 정의에 있어서 화학기의 나열에 대한 설명은 해당 변인의 정의를, 임의의 단일 군 또는 나열된 군들의 조합으로서 포함한다. 본원의 변인 또는 양태에 대한 한 구현예의 설명은, 해당 구현예를 임의의 구현예 하나로서, 또는 또 다른 임의의 구현예들이나 이의 일부와의 조합으로서 포함한다.
본원에 제공된 임의의 조성물 또는 방법은, 본원에 제공된 방법 및 기타 조성물들 중 임의의 것 하나 이상과 조합될 수 있다.
"~를 포함하는(including)", "~를 함유하는" 또는 "~에 의해 특징지어지는"과 밀접한 전이적 용어 "~를 포함하는(comprising)"은 포괄적이거나 개방적인 용어로서, 언급되지 않은 추가의 요소나 방법의 단계들을 배제하지 않는다. 이와는 대조적으로, 전이적 어구 "~으로 이루어진"은, 청구항에 지정되지 않은 임의의 요소, 단계 또는 성분을 베지한다. 전이적 어구 "본질적으로 ~으로 이루어진"은, 지정된 물질이나 단계에 대한 특허청구범위와, 청구된 발명의 "기본적이고 신규한 특징(들)에 실질적으로 영향을 미치지 않는 물질이나 단계"를 한정하는 어구이다.
본원에 개시된 임의의 유전자, 유전자 이름, 유전자 산물 또는 펩티드는 본원에 개시된 조성물 및 방법이 적용될 수 있는 임의의 종으로부터의 상 동체에 상응하도록 의도된다. 따라서, 용어는 인간 및 마우스로부터의 유전자 및 유전자 산물을 포함하지만 이에 제한되지는 않는다. 특정 종으로부터의 유전자 또는 유전자 산물이 개시될 때, 본 개시는 단지 예시적인 것으로 의도되며, 그것이 명백하게 나타나는 문맥이 나타내지 않는 한 제한으로서 해석되지 않아야한다는 것이 이해된다. 따라서, 예를 들어 본원에 개시된 유전자에 대해, 일부 구현예에서 포유 동물 핵산에 관한 것이고 아미노산 서열은 상 동성 및/또는 이종상 동성 유전자 및 다른 포유 동물을 포함하지만 이에 제한되지 않는 다른 동물로부터의 유전자 산물을 포함하도록 의도된다. 양서류, 파충류 및 조류. 바람직한 구현예에서, 유전자, 핵산 서열 또는 펩티드는 인간이다.
본원에 언급된 승인 번호에 의해 표시되는 GenBank 및 NCBI 제출에 관한 사항은 본원에 참조로 인용되어 있다. 본원에 언급된 기타 공표된 모든 참고문헌, 서류, 논문 및 과학 문헌은 본원에 참조로 인용되어 있다. 상충될 경우, 용어의 정의를 포함하는 본 발명의 설명이 이를 조정할 것이다. 또한 물질, 방법 및 실시예는 오로지 예시적인 것일뿐, 본 발명을 제한하고자 하는 것은 아니다.
본 발명의 기타 특징 및 이점은 이하 본 발명의 바람직한 구현예들에 관한 설명과 특허청구범위로부터 명백할 것이다. 달리 정의되지 않는 한, 본원에 사용된 모든 기술 용어와 과학 용어는 본 발명이 속하는 분야의 당업자에 의해 보통 이해되는 바와 동일한 의미를 가진다. 비록 본원에 기술된 방법 및 물질과 유사하거나 균등한 방법 및 물질이 본 발명의 실시 또는 시험에 사용될 수 있지만, 적합한 방법과 물질이 이하에 기술되어 있다. 본원에 인용된 공개 외국 특허 및 특허출원 모두는 본원에 참조로 인용되어 있다.
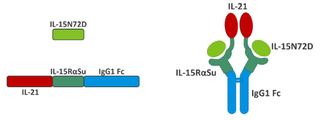
도 1은 IL-7 및 IL-21 결합 도메인(IL7-IL15N72D:IL21-IL15RαSuFc)에 융합된 IL-15N72D:IL-15RαSu/Fc 스캐폴드를 포함하는 TxM 융합 단백질 복합체를 나타내는 개략도이다. 일부 경우에, 이량체 IL-15RαSu/Fc 융합 복합체는 하나 또는 두 개의 IL-15N72D 융합 단백질 단백질을 포함한다.
도 2a는 단백질 A 수지상의 결합 및 용리 후 hIL7/IL21/TxM 단백질 함유 세포 배양 상청액의 크로마토그래피 프로파일을 보여주는 선 그래프이다. 도 2b는 예비 크기별 배제 컬럼에서 용리 후 단백질 A-정제된 hIL7/IL21/TxM 융합 단백질 복합체의 크로마토그래피 프로파일을 보여주는 선 그래프이다. 도 2c는 단백질 응집체로부터 단량체 다중 단백질 hIL7/IL21/TxM 융합 단백질 복합체의 단리를 입증하는, 분석용 크기별 배제 컬럼에서 용리 후 단백질 A/SEC-정제된 hIL7/IL21/TxM 융합 단백질 복합체의 크로마토그래피 프로파일을 보여주는 선 그래프이다.
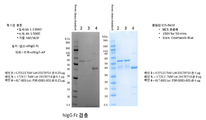
도 3a는 1) 인간 IgG Fc 도메인을 포함하는 단백질 밴드를 검출하기 위한 웨스턴 블롯 (왼쪽 패널) 및 2) 이황화 결합 환원 후 hIL7/IL21/TxM 융합 단백질 복합체의 쿠마시 블루(Coomassie Blue) 스테인드 나트륨 도데실 설페이트 폴리아크릴아미드겔 (4 내지 12 %) 전기 영동 (SDS-PAGE) 분석 (오른쪽 패널)의 사진을 보여준다. 도 3b는 1) 인간 IL-15 도메인을 함유하는 단백질 밴드를 검출하기 위한 웨스턴 블롯 (왼쪽 패널) 및 2) 이황화 결합 환원 후 hIL7/IL21/TxM 융합 단백질 복합체의 쿠마시 블루-나트륨 도데실 설페이트 폴리아크릴아미드겔 (4 내지 12 %) 전기 영동 (SDS-PAGE) 분석 (오른쪽 패널)의 사진을 보여준다. 각 유형의 분석에서, 레인 1은 Novex Sharp 단백질 표준, 레인 2 및 3은 정제된 hIL7/IL21/TxM Lot 20170714, 및 레인 4는 ALT-803 (IL-15N72D:IL-15RαSu/Fc 복합체) 대조군이다.
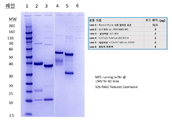
도 4는 이황화 결합 환원 후 ALT-803 (대조군) (레인 2 및 3) 및 hIL7/IL21/TxM 융합 단백질 복합체 (레인 4 및 5)의 쿠마시 블루 스테인드 SDS-PAGE 분석의 사진을 보여준다. 레인 3 및 5의 단백질 샘플은 제조사의 지시에 따라 단백질 탈당화 믹스 II (New England BioLabs)로 탈당화되었다. 레인 1은 Novex Sharp 단백질 표준, 레인 2는 ALT-803, 레인 3은 탈당화된 ALT-803, 레인 4는 hIL7/IL21/TxM Lot 20170714, 레인 5는 탈당화된 hIL7/IL21/TxM Lot 20170714 및 레인 6은 탈당화 반응 완충액 (탈당화 효소를 함유함).
도 5는 인간 IL-15 및 인간 IgG에 특이적인 항체에 대한 hIL7/IL21/TxM 융합 단백질 복합체의 결합 활성을 나타내는 선 그래프이다.
도 6은 인간 IgG (GAH) (왼쪽 위), IL15 (오른쪽 위), IL7 및 IL15 (왼쪽 아래), IL21 및 IL15 (중간 하단) 및 IL7 및 IL21 (오른쪽 하단)에 특이적인 항체에 대한 hIL7/IL21/TxM 융합 단백질 복합체의 결합 활성을 나타내는 일련의 선 그래프이다.
도 7은 ALT-803과 비교하여 hIL7/IL21/TxM 융합 단백질 복합체에 의해 매개되는 IL-15 의존적 32Dβ 세포의 증식을 나타내는 선 그래프이다.
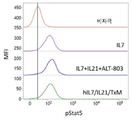
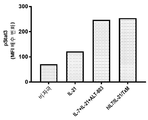
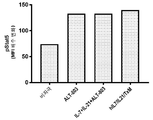
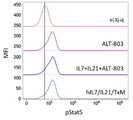
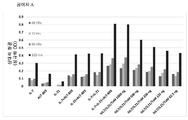
도 8a는 유세포 분석법에 의해 마우스 2E8 세포에서 Stat5의 인산화를 측정함으로써 hIL7/IL21/TxM 융합 단백질 복합체, 재조합 IL-7, IL-21 및 ALT-803의 조합 (IL-7 + IL-21 + ALT-803), 및 재조합 LI-7 단독의 IL-7 생물학적 활성을 나타내는 막대 그래프이다. 데이터는 평균 형광 강도 (MFI) 배수 변화를 나타낸다. 도 8b는 유세포 분석법에 의해 마우스 2E8 세포에서 Stat5의 인산화를 측정함으로써 배지 대조와 비교하여 hIL7/IL21/TxM 융합 단백질 복합체, 재조합 IL-17, IL-21 및 ALT-803의 조합 (IL-7 + IL-21 + ALT-803) 및 재조합 IL-7 단독의 IL-7 생물학적 활성을 보여주는 막대 그래프이다. 도 8c는 유세포 분석에 의해 정제된 인간 T 세포에서 Stat3의 인산화를 측정함으로써 hIL7/IL21/TxM 융합 단백질 복합체, 재조합 IL-7, IL-21 및 ALT-803의 조합 (IL-7 + IL-21 + ALT-803) 및 재조합 IL-21 단독의 IL-21 생물학적 활성을 나타내는 막대 그래프이다. 데이터는 MFI 배수 변화를 나타낸다. 도 8d는 유세포 분석법에 의해 정제된 인간 T 세포에서 Stat3의 산화를 측정함으로써 배지 대조와 비교하여 hIL7/IL21/TxM 융합 단백질 복합체, 재조합 IL-17, IL-21 및 ALT-803의 조합 (IL-7 + IL-21 + ALT-803) 및 재조합 IL-21 단독의 IL-21 생물학적 활성을 보여주는 막대 그래프이다. 도 8e는 유동 세포 분석법에 의해 32D? 세포에서 Stat5의 인산화를 측정함으로써 hIL7/IL21/TxM 융합 단백질 복합체, 재조합 IL-7, IL-21 및 ALT-803의 조합 (IL-7 + IL-21 + ALT-803) 및 ALT-803 단독의 IL-15 생물학적 활성을 나타내는 막대 그래프이다. 데이터는 MFI 배수 변화를 나타낸다. 도 8f는 유세포 분석에 의해 32Dβ 세포에서 Stat5의 인산화에 의한 배지 대조군와 비교하여, hIL7/IL21/TxM 융합 단백질 복합체, 재조합 IL-17, IL-21 및 ALT-803의 조합 (IL-7 + IL-21 + ALT-803) 및 ALT-803 단독의 IL-15 생물학적 활성을 보여주는 막대 그래프이다.
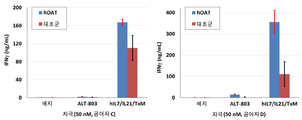
도 9는 재조합 IL-7, IL-21 및 ALT-803의 조합 (IL + IL-21 + ALT-803)에 의한 자극과 비교하여 hIL7/IL21/TxM 융합 단백질 복합체에 의한 자극 후 정제된 인간 나이브 T 세포에 의한 IFN-γ 생산을 보여주는 막대 그래프이다. IFN-γ 생산은 ELISA에 의해 측정되었다.
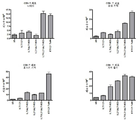
도 10a 및 10b는 배지 대조군과 비교하여, hIL7/IL21/TxM 융합 단백질 복합체 또는 재조합 IL-7, IL-21 및 ALT-803의 조합(IL-7 + IL-21 + ALT-803)으로 다양한 시간 동안 자극 후 두 명의 공여자 (공여자 A, 도 10a; 공여자 B, 도 10b)로부터 정제된 인간 나이브 T 세포의 증식을 나타내는 막대 그래프이다. 증식은 Presto Blue Assay를 사용하여 측정되었다. 도 10c는 도 10a 및 도 10b에 도시된 데이터에 대한 72 시간 시점에서의 평균 인간 T 세포 증식을 나타내는 막대 그래프이다.
도 11은 배지 대조군과 비교하여 hIL7/IL21/TxM 융합 단백질 복합체 또는 재조합 IL-7, IL-21 및 ALT-803의 조합 (IL-7 + IL-21 + ALT-803)에 의한 자극 후 정제된 CSFE- 표지된 인간 T 세포의 증식을 보여주는 점도표이다. 세포 분열 후 CFSE 신호의 희석에 의해 증식을 평가하였다.
도 12는 IL-7 + IL-21 + ALT-803, ALT-803 단독 또는 대조군 배지와 비교하여, hIL7/IL21/TxM 융합 단백질 복합체를 함유하는 배지에서 항온처리한 후 정제된 인간 CD8+ T 세포의 확장을 나타내는 막대 그래프이다. hIL7/IL21/TxM의 항온 처리가 IL-7 + IL-21 + ALT-803 조합 처리로 관찰된 것보다 CD8+ T 세포가 더 확장된 결과를 가져왔다.
도 13은 IL-7 + IL-21 + ALT-803, ALT-803 단독 또는 대조군 배지와 비교하여 hIL7/IL21/TxM 융합 단백질 복합체를 함유하는 배지에서 항온처리한 후 정제된 인간 CD8+ T 세포의 증식 및 표현형을 나타내는 밀도 플롯이다. hIL7/IL21/TxM의 항온처리가 특히 IL-7 + IL-21 + ALT-803 조합 처리로 관찰된 것보다 CD8+ T 세포의 증식이 더 큰 결과를 가져왔다.
도 14는 대조군 배지 (US), IL-7 + IL-21, IL-7 + ALT-803, IL-21 + ALT-803 또는 IL-7 + IL-21 + ALT-803 조합과 비교하여, hIL7/IL21/TxM 융합 단백질 복합체를 함유하는 배지에서 항온처리한 후 정제된 인간 CD8+ T 세포 서브 세트의 확장을 나타내는 막대 그래프를 도시한다. hIL7/IL21/TxM과의 항온처리가 배지 대조군과 비교하여 나이브, 중앙 메모리, 효과기 메모리 및 메모리 스템 CD8+ T 세포 서브 세트의 확장을 가져왔고 다른 어떤 조합의 개별 시토카인 보다 중앙 메모리 및 효과기 메모리 CD8+ T 세포 서브세트가 더 나은 확장을 가져왔다.
도 15는 대조군 배지 (US), IL-7 + IL-21, IL-7 + ALT-803, IL-21 + ALT-803 또는 IL-7 + IL-21 + ALT-803 조합과 비교하여, hIL7/IL21/TxM 융합 단백질 복합체를 함유하는 배지에서 항온처리한 후 정제된 인간 CD8+ T 세포 서브세트의 증식을 나타내는 선 그래프 (유세포 측정 히스토그램)를 도시한다. hIL7/IL21/TxM의 항온처리가 배지 대조군과 비교하여 나이브, 중앙 기억, 효과기 기억 및 기억 줄기 CD8+ T 세포 서브 세트의 증식을 초래하였다. 중앙 기억 및 효과기 기억 CD8+ T 세포 서브 세트의 더 큰 증식은 개별 시토카인의 다른 조합보다 hIL7/IL21/TxM에서 관찰되었다.
도 16은 ALT-803과 비교하여 hIL7/IL21/TxM 융합 단백질 복합체에 의해 매개된 정제된 인간 NK 세포의 증식을 나타내는 선 그래프이다. 선은 상이한 공여자로부터 단리된 NK 세포를 나타낸다.
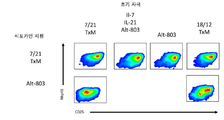
도 17은 IL-7 + IL-21 + ALT-803, ALT-803 단독 또는 hIL18/IL12/TxM 융합 단백질 복합체 함유 배지와 비교하여 hIL7/IL21/TxM 융합 단백질 복합체를 함유하는 배지에서 항온처리한 후 정제된 인간 NK 세포의 표현형을 나타내는 밀도 플롯이다.
도 18은 IL-7 + IL-21 + ALT-803, ALT-803 단독 또는 hIL18/IL12/TxM 융합 단백질 복합체 함유 배지와 비교하여 hIL7/IL21/TxM 융합 단백질 복합체를 함유하는 배지에서 항온처리한 후 정제된 인간 NK 세포에 의해 매개되는 K562 표적 세포 사멸 수준을 나타내는 막대 그래프이다.
도 19는 ALT-803 또는 대조군 배지와 비교하여, hIL7/IL21/TxM 융합 단백질 복합체에 의해 유도된 췌장 종양 세포 표적에 대한 인간 NK 세포 세포 독성 및 NK- 매개 항체 의존성 세포 세포 독성 (ADCC)의 수준을 나타내는 막대 그래프이다. 두 명의 상이한 공여자로부터 단리된 NK 세포의 데이터가 제시되어 있다.
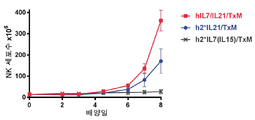
도 20은 ALT-803 또는 대조군 배지와 비교하여 hIL7/IL21/TxM 융합 단백질 복합체에 반응하여 인간 NK 세포에 의해 방출된 IFNγ의 수준을 나타내는 막대 그래프이다. 두 명의 상이한 공여자로부터 단리된 NK 세포의 데이터가 제시되어 있다.
도 21은 ALT-803 또는 대조군 배지와 비교하여 hIL7/IL21/TxM 융합 단백질 복합체에 반응하여 인간 NK 세포에 의해 발현된 그랜자임 B의 수준을 나타내는 막대 그래프이다. 두 명의 상이한 공여자로부터 단리된 NK 세포의 데이터가 제시되어 있다.
도 22는 hIL7/IL21/TxM에서 IL-15, IL-7 및 IL-21 성분의 포획 및 검출을 나타내는 일련의 그래프를 보여준다.
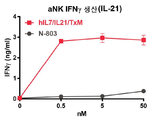
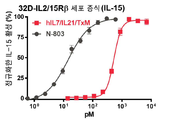
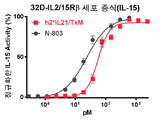
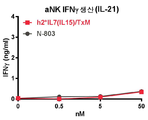
도 23a-23c는 hIL7/IL21/TxM이 IL-7 (도 23a), IL-21 (도 23b) 및 IL-15 (도 23c) 수용체의 특이적 활성화를 유도한다는 것을 보여주는 일련의 그래프이다. 도 23a: IL-7 의존성 2E8 세포 (105)를 hIL7/IL21/TxM 또는 IL-7로 2일 동안 자극하고, 세포 증식을 PrestoBlue를 사용하여 평가하였다. hIL7/IL21/TxM에서 IL-7의 EC50은 14 pM이다. 2 실험에서 n = 4. 도 23b: 활성화된 자연살해 (aNK) 세포 aNK 세포 (2x105)를 hIL7/IL21/TxM 또는 N-803으로 40 시간 동안 자극하고 IFNγ의 생산을 ELISA에 의해 측정하였다. 1 실험에서 n = 2. 도 23c: IL-2/15 의존적 32D-IL2/15Rβ 세포 (104)를 hIL7/IL21/TxM 또는 N-803으로 3 일 동안 자극하고 PrestoBlue를 사용하여 세포 증식을 평가하였다. hIL7/IL21/TxM에서 IL-15의 EC50은 530 pM이다. 2 실험에서 n = 4.
도 24는 hIL7/IL21/TxM에 의해 유도된 인간 NK 세포에서 그랜자임 B 발현의 향상을 입증하는 그래프이다. 사전 활성화된 인간 NK 세포에서의 그랜자임 B 발현 (16h, 50nM, n = 2).
도 25a 및 25b는 SW1990 췌장암 세포에 대한 hIL7/IL21/TxM 활성화 인간 NK 세포의 세포 독성 및 ADCC 활성을 나타내는 그래프이다. 신선한 NK 세포를 2:1의 E:T에서 40 시간 동안 SW1990 세포와 혼합 하였다. αTF = 0.1 nM. N-803 또는 hIL7/IL21/TxM = 50. 도 25a: NK 세포 세포 독성. 도 25b: NK 세포 세포 독성 관련 IFNγ.
도 26은 라모스 림프종 세포에 대한 hIL7/IL21/TxM- 활성화 인간 NK 세포의 세포 독성 및 ADCC 활성을 입증하는 그래프이다. 신선한 NK 세포를 1:1의 E:T에서 40 시간 동안 라모스 세포와 혼합하였다. αCD20 = 1 nM. N-803 또는 hIL7/IL21/TxM = 0.5 nM. n = 2로 표시.
도 27은 hIL7/IL21/TxM이 정제된 NK 세포의 확장에서 개별 시토카인보다 우수하다는 것을 입증하기 위해 사용된 방법의 구현예의 개략도 (왼쪽 패널)이다. 얻어진 결과는 그래프 (오른쪽 패널)로 표시된다.
도 28은 hIL7/IL21/TxM이 인간 공여자로부터 NK 세포를 확장시키는 데 있어서 개별 시토카인보다 우수함을 입증하는 일련의 그래프이다.
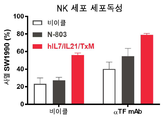
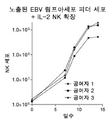
도 29a 내지 29c는 hIL7/IL21/TxM을 다른 생체 외 NK 확장 방법과 비교하는 일련의 그래프이다. 도 29a: 노출된 EBV 림프아세포 피더 세포 + IL-2 NK 확장. 도 29b: 막 결합된 IL-21 (mbIL21)을 갖는 K562 기반 활성화된 항원 제시 세포 (aAPC). 도 29c: hIL7/IL21/TxM 매개 NK 세포 확장.
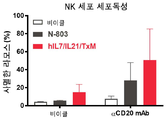
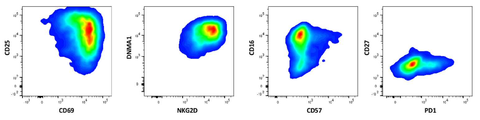
도 30은 hIL7/IL21/TxM 확장 후 NK 세포 표현형을 보여주는 일련의 밀도 플롯이다.
도 31a 내지 도 31c는 NK 세포에서 hIL7/IL21/TxM이 IFNγ (도 31a), 그랜 자임 (도 31b) 및 퍼포린 (도 31c)을 유도함을 입증하는 그래프이다. hIL7/IL21/TxM-확장된 NK 세포는 밤새 별개의 시토카인 또는 TxM에 의해 자극되었다.
도 32는 hIL7/IL21/TxM- 확장 NK 세포의 직접 및 항체-매개 세포 독성을 나타내는 그래프: 9 일. 정제된 인간 NK 세포 (0.5 x 106/ml)를 9 일 동안 20nM hIL7/IL21/TxM으로 확장하고, 1 회 세척한 후, 4 시간 동안 CD20+ Ramos Burkitt의 림프종 세포 (105)로 표지된 CellTrace Violet와 혼합한 후, 7-AAD 생존성 시약의 존재시 유세포 분석이 이어진다 .
도 33은 hIL7/IL21/TxM 처리 후 분류된 T 세포 집단의 확장을 나타내는 일련의 그래프를 도시한다. 분류된 CD8+ 나이브, 중심 기억, 효과기 기억 및 줄기 세포 기억 T 세포를 CFSE로 표지하고 총 부피 200ml, 96 well 평판 바닥 플레이트 37 ℃, 5 % CO2에서, 배지 단독 (US) 또는 IL-7/IL-21 (25ng), IL-7/N-803 (25ng/144ng), IL-21/N-803 (25ng/144ng), IL-7/IL-21/N-803 (25ng/25ng/144ng), TxM (1.4mg)으로 자극하였다.
도 34는 hIL7/IL21/TxM이 αCD3/CD28 비드에 짧은 노출 후에 분류된 CD8+ T 세포 집단을 효과적으로 확장한다는 것을 입증하는 일련의 그래프를 도시한다.
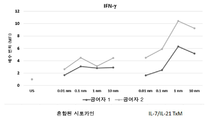
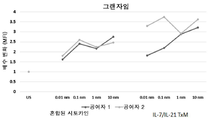
도 35는 h2 * IL21/TxM (IL15N72D:IL21-IL15RαSuFc)의 개략도이다.
도 36a 및 36b는 h2 * IL21/TxM이 IL-21 (도 36a) 및 IL-15 (도 36b) 수용체의 특이적 활성화를 유도함을 입증하는 그래프이다. 도 36a: aNK 세포 (2 x 105)를 h2 * IL21/TxM 또는 N-803으로 40 시간 동안 자극하고 IFNγ의 생성을 ELISA로 측정하였다. 1 실험에서 n = 2. 도 36b: IL-2/15 의존적 32D-IL2/15Rβ 세포 (104)를 h2 * IL21/TxM 또는 N-803으로 3 일 동안 자극하고 PrestoBlue를 사용하여 세포 증식을 평가하였다. h2 * IL21/TxM에서 IL-15의 EC50은 56 pM이다. 2 실험에서 n = 4.
도 37은 h2 * IL7 (IL15)/TxM (IL7-IL15N72D:IL15RαSuFc)의 개략도이다.
도 38a 내지 38c는 h2 * IL7 (IL15)/TxM이 IL-7 (도 38a) 및 IL-15 (도 38c) 수용체의 특이적 활성화를 유도함을 보여주는 그래프이다. 도 38a: IL-7 의존적 2E8 세포 (105)를 h2 * IL7 (IL15)/TxM 또는 IL-7로 2 일 동안 자극하였고, 세포 증식을 PrestoBlue를 사용하여 평가하였다. h2 * IL7 (IL15)/TxM에서 IL-7의 EC50은 13.3 pM이다. 2 실험에서 n = 4. 도 38b: aNK 세포 (2x105)를 h2 * IL7 (IL15)/TxM 또는 N-803으로 40 시간 동안 자극하고 IFNγ의 생성을 ELISA에 의해 측정하였다. 1 실험에서 n = 2. 도 38c: IL-2/15 의존적 32D-IL2/15Rβ 세포 (104)를 h2 * IL7 (IL15)/TxM 또는 N-803으로 3 일 동안 자극하였고 PrestoBlue를 사용하여 세포 증식을 평가하였다. h2 * IL7 (IL15)/TxM에서 IL-15의 EC50은 81.3 pM이다. 2 실험에서 n = 4.
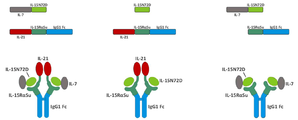
도 39는 hIL7/IL21/TxM 대 h2 * IL21/TxM 대 h2 * IL7 (IL15)/TxM의 구조를 비교한 모식도이다.
도 40은 hIL7/IL21/TxM 대 h2 * IL21/TxM 대 h2 * IL7 (IL15)/TxM이 환원된 (왼쪽 겔) 및 비 환원된 (오른쪽 패널) 조건 하에서 겔상에서 진행하는 것을 나타낸다.
도 41은 hIL7/IL21/TxM 대 h2 * IL21/TxM 대 h2 * IL7 (IL15)/TxM으로 자극된 NK 세포 확장을 나타내는 그래프이다. 정제된 인간 NK 세포는 19.4nM hIL7/IL21/TxM, h2 * IL21/TxM, 또는 hIL7 (IL15)/TxM으로 자극되었고, 세포 수는 0.5-2 x 106/ml 사이에서 유지되었다. Vi-CELL XR로 세포 수를 평가하였다. 1 실험에서 n = 2.
도 42는 수퍼카인 (hIL7IL15//IL21/TxM 융합 단백질 복합체의 존재 하에서 향상된 항원 특이적 CD8 T 세포 반응을 나타낸 그래프이다. T 세포는 비 부착성 PBMC로부터 선택되고, 이어서 TCR 자극 (CD2/3/28 효현제 Abs, 2d)으로 배양되고, TCR 자극으로 세정되고, 이어서 IL-7/15/21 수퍼카인으로 배양된다. T 세포 확장 후, T 세포를 자가 수지상 세포 (DC)에 첨가하였고, 이는 PBMC의 부착성 일부로 유도되었다. T/DC 배양에는 아무것도 추가하지 않거나, (CMV로부터) pp65를 발현하지 않는 BL21 대장균을 추가하거나 pp65를 발현하는 BL21을 추가하였다. 배양물을 밤새 자극한 다음, ELISPOT이 스팟 형성 세포의 수 (IFN-γ)를 나타내도록 개발되었다.
도 2a는 단백질 A 수지상의 결합 및 용리 후 hIL7/IL21/TxM 단백질 함유 세포 배양 상청액의 크로마토그래피 프로파일을 보여주는 선 그래프이다. 도 2b는 예비 크기별 배제 컬럼에서 용리 후 단백질 A-정제된 hIL7/IL21/TxM 융합 단백질 복합체의 크로마토그래피 프로파일을 보여주는 선 그래프이다. 도 2c는 단백질 응집체로부터 단량체 다중 단백질 hIL7/IL21/TxM 융합 단백질 복합체의 단리를 입증하는, 분석용 크기별 배제 컬럼에서 용리 후 단백질 A/SEC-정제된 hIL7/IL21/TxM 융합 단백질 복합체의 크로마토그래피 프로파일을 보여주는 선 그래프이다.
도 3a는 1) 인간 IgG Fc 도메인을 포함하는 단백질 밴드를 검출하기 위한 웨스턴 블롯 (왼쪽 패널) 및 2) 이황화 결합 환원 후 hIL7/IL21/TxM 융합 단백질 복합체의 쿠마시 블루(Coomassie Blue) 스테인드 나트륨 도데실 설페이트 폴리아크릴아미드겔 (4 내지 12 %) 전기 영동 (SDS-PAGE) 분석 (오른쪽 패널)의 사진을 보여준다. 도 3b는 1) 인간 IL-15 도메인을 함유하는 단백질 밴드를 검출하기 위한 웨스턴 블롯 (왼쪽 패널) 및 2) 이황화 결합 환원 후 hIL7/IL21/TxM 융합 단백질 복합체의 쿠마시 블루-나트륨 도데실 설페이트 폴리아크릴아미드겔 (4 내지 12 %) 전기 영동 (SDS-PAGE) 분석 (오른쪽 패널)의 사진을 보여준다. 각 유형의 분석에서, 레인 1은 Novex Sharp 단백질 표준, 레인 2 및 3은 정제된 hIL7/IL21/TxM Lot 20170714, 및 레인 4는 ALT-803 (IL-15N72D:IL-15RαSu/Fc 복합체) 대조군이다.
도 4는 이황화 결합 환원 후 ALT-803 (대조군) (레인 2 및 3) 및 hIL7/IL21/TxM 융합 단백질 복합체 (레인 4 및 5)의 쿠마시 블루 스테인드 SDS-PAGE 분석의 사진을 보여준다. 레인 3 및 5의 단백질 샘플은 제조사의 지시에 따라 단백질 탈당화 믹스 II (New England BioLabs)로 탈당화되었다. 레인 1은 Novex Sharp 단백질 표준, 레인 2는 ALT-803, 레인 3은 탈당화된 ALT-803, 레인 4는 hIL7/IL21/TxM Lot 20170714, 레인 5는 탈당화된 hIL7/IL21/TxM Lot 20170714 및 레인 6은 탈당화 반응 완충액 (탈당화 효소를 함유함).
도 5는 인간 IL-15 및 인간 IgG에 특이적인 항체에 대한 hIL7/IL21/TxM 융합 단백질 복합체의 결합 활성을 나타내는 선 그래프이다.
도 6은 인간 IgG (GAH) (왼쪽 위), IL15 (오른쪽 위), IL7 및 IL15 (왼쪽 아래), IL21 및 IL15 (중간 하단) 및 IL7 및 IL21 (오른쪽 하단)에 특이적인 항체에 대한 hIL7/IL21/TxM 융합 단백질 복합체의 결합 활성을 나타내는 일련의 선 그래프이다.
도 7은 ALT-803과 비교하여 hIL7/IL21/TxM 융합 단백질 복합체에 의해 매개되는 IL-15 의존적 32Dβ 세포의 증식을 나타내는 선 그래프이다.
도 8a는 유세포 분석법에 의해 마우스 2E8 세포에서 Stat5의 인산화를 측정함으로써 hIL7/IL21/TxM 융합 단백질 복합체, 재조합 IL-7, IL-21 및 ALT-803의 조합 (IL-7 + IL-21 + ALT-803), 및 재조합 LI-7 단독의 IL-7 생물학적 활성을 나타내는 막대 그래프이다. 데이터는 평균 형광 강도 (MFI) 배수 변화를 나타낸다. 도 8b는 유세포 분석법에 의해 마우스 2E8 세포에서 Stat5의 인산화를 측정함으로써 배지 대조와 비교하여 hIL7/IL21/TxM 융합 단백질 복합체, 재조합 IL-17, IL-21 및 ALT-803의 조합 (IL-7 + IL-21 + ALT-803) 및 재조합 IL-7 단독의 IL-7 생물학적 활성을 보여주는 막대 그래프이다. 도 8c는 유세포 분석에 의해 정제된 인간 T 세포에서 Stat3의 인산화를 측정함으로써 hIL7/IL21/TxM 융합 단백질 복합체, 재조합 IL-7, IL-21 및 ALT-803의 조합 (IL-7 + IL-21 + ALT-803) 및 재조합 IL-21 단독의 IL-21 생물학적 활성을 나타내는 막대 그래프이다. 데이터는 MFI 배수 변화를 나타낸다. 도 8d는 유세포 분석법에 의해 정제된 인간 T 세포에서 Stat3의 산화를 측정함으로써 배지 대조와 비교하여 hIL7/IL21/TxM 융합 단백질 복합체, 재조합 IL-17, IL-21 및 ALT-803의 조합 (IL-7 + IL-21 + ALT-803) 및 재조합 IL-21 단독의 IL-21 생물학적 활성을 보여주는 막대 그래프이다. 도 8e는 유동 세포 분석법에 의해 32D? 세포에서 Stat5의 인산화를 측정함으로써 hIL7/IL21/TxM 융합 단백질 복합체, 재조합 IL-7, IL-21 및 ALT-803의 조합 (IL-7 + IL-21 + ALT-803) 및 ALT-803 단독의 IL-15 생물학적 활성을 나타내는 막대 그래프이다. 데이터는 MFI 배수 변화를 나타낸다. 도 8f는 유세포 분석에 의해 32Dβ 세포에서 Stat5의 인산화에 의한 배지 대조군와 비교하여, hIL7/IL21/TxM 융합 단백질 복합체, 재조합 IL-17, IL-21 및 ALT-803의 조합 (IL-7 + IL-21 + ALT-803) 및 ALT-803 단독의 IL-15 생물학적 활성을 보여주는 막대 그래프이다.
도 9는 재조합 IL-7, IL-21 및 ALT-803의 조합 (IL + IL-21 + ALT-803)에 의한 자극과 비교하여 hIL7/IL21/TxM 융합 단백질 복합체에 의한 자극 후 정제된 인간 나이브 T 세포에 의한 IFN-γ 생산을 보여주는 막대 그래프이다. IFN-γ 생산은 ELISA에 의해 측정되었다.
도 10a 및 10b는 배지 대조군과 비교하여, hIL7/IL21/TxM 융합 단백질 복합체 또는 재조합 IL-7, IL-21 및 ALT-803의 조합(IL-7 + IL-21 + ALT-803)으로 다양한 시간 동안 자극 후 두 명의 공여자 (공여자 A, 도 10a; 공여자 B, 도 10b)로부터 정제된 인간 나이브 T 세포의 증식을 나타내는 막대 그래프이다. 증식은 Presto Blue Assay를 사용하여 측정되었다. 도 10c는 도 10a 및 도 10b에 도시된 데이터에 대한 72 시간 시점에서의 평균 인간 T 세포 증식을 나타내는 막대 그래프이다.
도 11은 배지 대조군과 비교하여 hIL7/IL21/TxM 융합 단백질 복합체 또는 재조합 IL-7, IL-21 및 ALT-803의 조합 (IL-7 + IL-21 + ALT-803)에 의한 자극 후 정제된 CSFE- 표지된 인간 T 세포의 증식을 보여주는 점도표이다. 세포 분열 후 CFSE 신호의 희석에 의해 증식을 평가하였다.
도 12는 IL-7 + IL-21 + ALT-803, ALT-803 단독 또는 대조군 배지와 비교하여, hIL7/IL21/TxM 융합 단백질 복합체를 함유하는 배지에서 항온처리한 후 정제된 인간 CD8+ T 세포의 확장을 나타내는 막대 그래프이다. hIL7/IL21/TxM의 항온 처리가 IL-7 + IL-21 + ALT-803 조합 처리로 관찰된 것보다 CD8+ T 세포가 더 확장된 결과를 가져왔다.
도 13은 IL-7 + IL-21 + ALT-803, ALT-803 단독 또는 대조군 배지와 비교하여 hIL7/IL21/TxM 융합 단백질 복합체를 함유하는 배지에서 항온처리한 후 정제된 인간 CD8+ T 세포의 증식 및 표현형을 나타내는 밀도 플롯이다. hIL7/IL21/TxM의 항온처리가 특히 IL-7 + IL-21 + ALT-803 조합 처리로 관찰된 것보다 CD8+ T 세포의 증식이 더 큰 결과를 가져왔다.
도 14는 대조군 배지 (US), IL-7 + IL-21, IL-7 + ALT-803, IL-21 + ALT-803 또는 IL-7 + IL-21 + ALT-803 조합과 비교하여, hIL7/IL21/TxM 융합 단백질 복합체를 함유하는 배지에서 항온처리한 후 정제된 인간 CD8+ T 세포 서브 세트의 확장을 나타내는 막대 그래프를 도시한다. hIL7/IL21/TxM과의 항온처리가 배지 대조군과 비교하여 나이브, 중앙 메모리, 효과기 메모리 및 메모리 스템 CD8+ T 세포 서브 세트의 확장을 가져왔고 다른 어떤 조합의 개별 시토카인 보다 중앙 메모리 및 효과기 메모리 CD8+ T 세포 서브세트가 더 나은 확장을 가져왔다.
도 15는 대조군 배지 (US), IL-7 + IL-21, IL-7 + ALT-803, IL-21 + ALT-803 또는 IL-7 + IL-21 + ALT-803 조합과 비교하여, hIL7/IL21/TxM 융합 단백질 복합체를 함유하는 배지에서 항온처리한 후 정제된 인간 CD8+ T 세포 서브세트의 증식을 나타내는 선 그래프 (유세포 측정 히스토그램)를 도시한다. hIL7/IL21/TxM의 항온처리가 배지 대조군과 비교하여 나이브, 중앙 기억, 효과기 기억 및 기억 줄기 CD8+ T 세포 서브 세트의 증식을 초래하였다. 중앙 기억 및 효과기 기억 CD8+ T 세포 서브 세트의 더 큰 증식은 개별 시토카인의 다른 조합보다 hIL7/IL21/TxM에서 관찰되었다.
도 16은 ALT-803과 비교하여 hIL7/IL21/TxM 융합 단백질 복합체에 의해 매개된 정제된 인간 NK 세포의 증식을 나타내는 선 그래프이다. 선은 상이한 공여자로부터 단리된 NK 세포를 나타낸다.
도 17은 IL-7 + IL-21 + ALT-803, ALT-803 단독 또는 hIL18/IL12/TxM 융합 단백질 복합체 함유 배지와 비교하여 hIL7/IL21/TxM 융합 단백질 복합체를 함유하는 배지에서 항온처리한 후 정제된 인간 NK 세포의 표현형을 나타내는 밀도 플롯이다.
도 18은 IL-7 + IL-21 + ALT-803, ALT-803 단독 또는 hIL18/IL12/TxM 융합 단백질 복합체 함유 배지와 비교하여 hIL7/IL21/TxM 융합 단백질 복합체를 함유하는 배지에서 항온처리한 후 정제된 인간 NK 세포에 의해 매개되는 K562 표적 세포 사멸 수준을 나타내는 막대 그래프이다.
도 19는 ALT-803 또는 대조군 배지와 비교하여, hIL7/IL21/TxM 융합 단백질 복합체에 의해 유도된 췌장 종양 세포 표적에 대한 인간 NK 세포 세포 독성 및 NK- 매개 항체 의존성 세포 세포 독성 (ADCC)의 수준을 나타내는 막대 그래프이다. 두 명의 상이한 공여자로부터 단리된 NK 세포의 데이터가 제시되어 있다.
도 20은 ALT-803 또는 대조군 배지와 비교하여 hIL7/IL21/TxM 융합 단백질 복합체에 반응하여 인간 NK 세포에 의해 방출된 IFNγ의 수준을 나타내는 막대 그래프이다. 두 명의 상이한 공여자로부터 단리된 NK 세포의 데이터가 제시되어 있다.
도 21은 ALT-803 또는 대조군 배지와 비교하여 hIL7/IL21/TxM 융합 단백질 복합체에 반응하여 인간 NK 세포에 의해 발현된 그랜자임 B의 수준을 나타내는 막대 그래프이다. 두 명의 상이한 공여자로부터 단리된 NK 세포의 데이터가 제시되어 있다.
도 22는 hIL7/IL21/TxM에서 IL-15, IL-7 및 IL-21 성분의 포획 및 검출을 나타내는 일련의 그래프를 보여준다.
도 23a-23c는 hIL7/IL21/TxM이 IL-7 (도 23a), IL-21 (도 23b) 및 IL-15 (도 23c) 수용체의 특이적 활성화를 유도한다는 것을 보여주는 일련의 그래프이다. 도 23a: IL-7 의존성 2E8 세포 (105)를 hIL7/IL21/TxM 또는 IL-7로 2일 동안 자극하고, 세포 증식을 PrestoBlue를 사용하여 평가하였다. hIL7/IL21/TxM에서 IL-7의 EC50은 14 pM이다. 2 실험에서 n = 4. 도 23b: 활성화된 자연살해 (aNK) 세포 aNK 세포 (2x105)를 hIL7/IL21/TxM 또는 N-803으로 40 시간 동안 자극하고 IFNγ의 생산을 ELISA에 의해 측정하였다. 1 실험에서 n = 2. 도 23c: IL-2/15 의존적 32D-IL2/15Rβ 세포 (104)를 hIL7/IL21/TxM 또는 N-803으로 3 일 동안 자극하고 PrestoBlue를 사용하여 세포 증식을 평가하였다. hIL7/IL21/TxM에서 IL-15의 EC50은 530 pM이다. 2 실험에서 n = 4.
도 24는 hIL7/IL21/TxM에 의해 유도된 인간 NK 세포에서 그랜자임 B 발현의 향상을 입증하는 그래프이다. 사전 활성화된 인간 NK 세포에서의 그랜자임 B 발현 (16h, 50nM, n = 2).
도 25a 및 25b는 SW1990 췌장암 세포에 대한 hIL7/IL21/TxM 활성화 인간 NK 세포의 세포 독성 및 ADCC 활성을 나타내는 그래프이다. 신선한 NK 세포를 2:1의 E:T에서 40 시간 동안 SW1990 세포와 혼합 하였다. αTF = 0.1 nM. N-803 또는 hIL7/IL21/TxM = 50. 도 25a: NK 세포 세포 독성. 도 25b: NK 세포 세포 독성 관련 IFNγ.
도 26은 라모스 림프종 세포에 대한 hIL7/IL21/TxM- 활성화 인간 NK 세포의 세포 독성 및 ADCC 활성을 입증하는 그래프이다. 신선한 NK 세포를 1:1의 E:T에서 40 시간 동안 라모스 세포와 혼합하였다. αCD20 = 1 nM. N-803 또는 hIL7/IL21/TxM = 0.5 nM. n = 2로 표시.
도 27은 hIL7/IL21/TxM이 정제된 NK 세포의 확장에서 개별 시토카인보다 우수하다는 것을 입증하기 위해 사용된 방법의 구현예의 개략도 (왼쪽 패널)이다. 얻어진 결과는 그래프 (오른쪽 패널)로 표시된다.
도 28은 hIL7/IL21/TxM이 인간 공여자로부터 NK 세포를 확장시키는 데 있어서 개별 시토카인보다 우수함을 입증하는 일련의 그래프이다.
도 29a 내지 29c는 hIL7/IL21/TxM을 다른 생체 외 NK 확장 방법과 비교하는 일련의 그래프이다. 도 29a: 노출된 EBV 림프아세포 피더 세포 + IL-2 NK 확장. 도 29b: 막 결합된 IL-21 (mbIL21)을 갖는 K562 기반 활성화된 항원 제시 세포 (aAPC). 도 29c: hIL7/IL21/TxM 매개 NK 세포 확장.
도 30은 hIL7/IL21/TxM 확장 후 NK 세포 표현형을 보여주는 일련의 밀도 플롯이다.
도 31a 내지 도 31c는 NK 세포에서 hIL7/IL21/TxM이 IFNγ (도 31a), 그랜 자임 (도 31b) 및 퍼포린 (도 31c)을 유도함을 입증하는 그래프이다. hIL7/IL21/TxM-확장된 NK 세포는 밤새 별개의 시토카인 또는 TxM에 의해 자극되었다.
도 32는 hIL7/IL21/TxM- 확장 NK 세포의 직접 및 항체-매개 세포 독성을 나타내는 그래프: 9 일. 정제된 인간 NK 세포 (0.5 x 106/ml)를 9 일 동안 20nM hIL7/IL21/TxM으로 확장하고, 1 회 세척한 후, 4 시간 동안 CD20+ Ramos Burkitt의 림프종 세포 (105)로 표지된 CellTrace Violet와 혼합한 후, 7-AAD 생존성 시약의 존재시 유세포 분석이 이어진다 .
도 33은 hIL7/IL21/TxM 처리 후 분류된 T 세포 집단의 확장을 나타내는 일련의 그래프를 도시한다. 분류된 CD8+ 나이브, 중심 기억, 효과기 기억 및 줄기 세포 기억 T 세포를 CFSE로 표지하고 총 부피 200ml, 96 well 평판 바닥 플레이트 37 ℃, 5 % CO2에서, 배지 단독 (US) 또는 IL-7/IL-21 (25ng), IL-7/N-803 (25ng/144ng), IL-21/N-803 (25ng/144ng), IL-7/IL-21/N-803 (25ng/25ng/144ng), TxM (1.4mg)으로 자극하였다.
도 34는 hIL7/IL21/TxM이 αCD3/CD28 비드에 짧은 노출 후에 분류된 CD8+ T 세포 집단을 효과적으로 확장한다는 것을 입증하는 일련의 그래프를 도시한다.
도 35는 h2 * IL21/TxM (IL15N72D:IL21-IL15RαSuFc)의 개략도이다.
도 36a 및 36b는 h2 * IL21/TxM이 IL-21 (도 36a) 및 IL-15 (도 36b) 수용체의 특이적 활성화를 유도함을 입증하는 그래프이다. 도 36a: aNK 세포 (2 x 105)를 h2 * IL21/TxM 또는 N-803으로 40 시간 동안 자극하고 IFNγ의 생성을 ELISA로 측정하였다. 1 실험에서 n = 2. 도 36b: IL-2/15 의존적 32D-IL2/15Rβ 세포 (104)를 h2 * IL21/TxM 또는 N-803으로 3 일 동안 자극하고 PrestoBlue를 사용하여 세포 증식을 평가하였다. h2 * IL21/TxM에서 IL-15의 EC50은 56 pM이다. 2 실험에서 n = 4.
도 37은 h2 * IL7 (IL15)/TxM (IL7-IL15N72D:IL15RαSuFc)의 개략도이다.
도 38a 내지 38c는 h2 * IL7 (IL15)/TxM이 IL-7 (도 38a) 및 IL-15 (도 38c) 수용체의 특이적 활성화를 유도함을 보여주는 그래프이다. 도 38a: IL-7 의존적 2E8 세포 (105)를 h2 * IL7 (IL15)/TxM 또는 IL-7로 2 일 동안 자극하였고, 세포 증식을 PrestoBlue를 사용하여 평가하였다. h2 * IL7 (IL15)/TxM에서 IL-7의 EC50은 13.3 pM이다. 2 실험에서 n = 4. 도 38b: aNK 세포 (2x105)를 h2 * IL7 (IL15)/TxM 또는 N-803으로 40 시간 동안 자극하고 IFNγ의 생성을 ELISA에 의해 측정하였다. 1 실험에서 n = 2. 도 38c: IL-2/15 의존적 32D-IL2/15Rβ 세포 (104)를 h2 * IL7 (IL15)/TxM 또는 N-803으로 3 일 동안 자극하였고 PrestoBlue를 사용하여 세포 증식을 평가하였다. h2 * IL7 (IL15)/TxM에서 IL-15의 EC50은 81.3 pM이다. 2 실험에서 n = 4.
도 39는 hIL7/IL21/TxM 대 h2 * IL21/TxM 대 h2 * IL7 (IL15)/TxM의 구조를 비교한 모식도이다.
도 40은 hIL7/IL21/TxM 대 h2 * IL21/TxM 대 h2 * IL7 (IL15)/TxM이 환원된 (왼쪽 겔) 및 비 환원된 (오른쪽 패널) 조건 하에서 겔상에서 진행하는 것을 나타낸다.
도 41은 hIL7/IL21/TxM 대 h2 * IL21/TxM 대 h2 * IL7 (IL15)/TxM으로 자극된 NK 세포 확장을 나타내는 그래프이다. 정제된 인간 NK 세포는 19.4nM hIL7/IL21/TxM, h2 * IL21/TxM, 또는 hIL7 (IL15)/TxM으로 자극되었고, 세포 수는 0.5-2 x 106/ml 사이에서 유지되었다. Vi-CELL XR로 세포 수를 평가하였다. 1 실험에서 n = 2.
도 42는 수퍼카인 (hIL7IL15//IL21/TxM 융합 단백질 복합체의 존재 하에서 향상된 항원 특이적 CD8 T 세포 반응을 나타낸 그래프이다. T 세포는 비 부착성 PBMC로부터 선택되고, 이어서 TCR 자극 (CD2/3/28 효현제 Abs, 2d)으로 배양되고, TCR 자극으로 세정되고, 이어서 IL-7/15/21 수퍼카인으로 배양된다. T 세포 확장 후, T 세포를 자가 수지상 세포 (DC)에 첨가하였고, 이는 PBMC의 부착성 일부로 유도되었다. T/DC 배양에는 아무것도 추가하지 않거나, (CMV로부터) pp65를 발현하지 않는 BL21 대장균을 추가하거나 pp65를 발현하는 BL21을 추가하였다. 배양물을 밤새 자극한 다음, ELISPOT이 스팟 형성 세포의 수 (IFN-γ)를 나타내도록 개발되었다.
자연살해(NK) 세포 및 T 세포를 사용하는 요법은 이들 세포가 병든 세포를 사멸시키고 전염증성 시토카인을 방출하는 능력으로 인해 암 및 바이러스 감염에 대한 잠재적 치료법으로 등장하였다 (예를 들어, Fehniger TA 및 Cooper MA. ㅆTrends Immunol. 2016; 37:877-888; 및 Cerwenka A 및 Lanier LL. Nat Rev Immunol. 2016 16:112-23 참조). 종양 특이적 면역 반응의 유도를 위해 키메라 항원 수용체 (CAR)를 발현하도록 유전자 조작된 T 세포의 입양 전달이 특히 중요하다. CAR T 세포의 표현형에 대한 시토카인의 효과는 이전에 기술되었다. IL-2, IL-7 및 IL-15에 의한 자극은 다른 시토카인이나 사이코타인이 존재하지 않는 경우보다 보다 더 나은 CAR T 세포의 생체 외 확장을 가져왔다. (Nayar S. 등, OncoImmunology, 2014; 4:e1002720; Golubovskaya V. and Wu, L. Cancers 2016; 8:236; Sabatino M. 등, Blood. 2016; 128:519-528; Xu Y 등, Blood. 2014:123:3750-3759; 및 Gomez-Eerland R, 등 Hum Humn Ther Methods. 2014; 25:277-287).
최근의 임상 데이터는 덜 차별화된 T 세포, 특히 기억 줄기 T 세포 (TSCM)의 입양 전달이 심하고 내구성있는 종양 박멸을 유발할 수 있음을 시사한다 (예를 들어, Klebanoff CA 등, PNAS. 2005; 102 (27):9571-9576; 및 Sommermeyer D. 등, Leukemia. 2016:30 (2):492-500 참조). 순환하는 적은 수의 TSCM 세포로 인해, 입양 세포 요법을 위해 적절한 수의 임상 등급 TSCM 세포를 단리하여 생산하는 데 어려움이 있었다 (예를 들어, Gattinoni L. 등, Blood 2013; 121(4): 567-568 참조). 새로운 보고서에 따르면 전체 배양 기간에 걸쳐 CD3/CD28 공동자극 및 IL-7, IL-21 및 IL-15의 추가를 이용하여 TS3 세포의 생성 및 확장이 생체 외에서 달성될 수 있음이 밝혀졌다 (예:Alvarez-Fernabdez C 등의 J Trans Med. 2016; 14; 214; 및 Sabatino M 등의 Blood. 2016; 128(4):519-528 참조). IL-7은 CAR TSCM 세포의 증식을 증가시키는 데 가장 효과적인 것으로 나타났으며, IL-21은 줄기 세포-유사 표현형을 갖는 CAR T 세포의 확장을 지지하는 반면, IL-2는 더욱 분화된 CAR T 세포를 유도하였다. IL-2 및 IL-15 처리된 CAR T 세포는 전염증성 시토카인을 생성하고 시험관 내에서 증가된 항 종양 활성을 나타내었다. 또한, 체내 CAR T 세포로 IL-15 및 IL-21로 처리하면 종양 세포 용해 능력이 증가 하였다.
4 나선 공통 감마 사슬 시토카인의 일원인 IL-7, IL-15 및 IL-21은 자연살해 (NK) 세포의 분화, 발달, 성숙, 증식 및 활성화에 있어 중심이 된다 (Waldman T Nature Rev Immunology 2006; 6:595-601; Leonard WJ and Wan C.-K. F1000Research 2016; 5:244; Lin J. 등, Anticancer Research 2017; 37:936-968). NK 세포의 입양 전달은 암 및 감염원에 대한 유망한 면역 요법이다. NK 세포 요법의 주요 과제는 다수의 고 세포 독성 NK 세포가 요구된다는 것이다. 따라서, 생체 외 NK 세포 확장 접근법이 개발되고 있으며, 이들 배양 전략의 대부분은 최종 NK 세포 제품의 임상 적용 전에 제거되어야 하는 피더 또는 보조 세포의 사용에 기초한다 (Tong AA 등 OncoImmunology 2017; 6:e1303586; Denman CJ PLos One 7:e30264; Fujisaki H. 등, Cancer Research 2009; 69:4010-4017). 최근에, 확장 및 활성화를 위한 피더 세포의 부재 하에서 공통 감마 사슬 시토카인, 특히 IL-15 및 IL-21을 사용하는 방법이 연구되었다 (Wagner J. 등, Frontier in Immunology 2017; 8:676).
본원에 기술된 본 발명에 앞서, TSCM 세포를 생성하고 확장하기 위한 최적의 방법은 완전히 밝혀지지 않았다. 전략은 재조합 인간 IL-7, 인간 IL-21 및 인간 IL-15를 사용하였으며, 이들은 포유 동물 세포 생산 시토카인과 비교하여 당화 및 잠재적으로 다른 전사 후 변형이 상이하다. 재조합 시토카인은 또한 상이한 순도 및 안정성을 가질 수 있고 일반적으로 임상 등급 물질로서 이용 가능하지 않다. 또한, 각각의 시토카인은 독특한 수용체 결합, 내재화 및 재활용 특성을 가질 것으로 예상된다.
따라서, IL-7 및 IL-21 결합 도메인을 포함하는 다중 특이적 IL-15 기반 단백질 복합체가 본원에 기술되어 있다 (도 1). 구체적으로, IL-7 및 IL-21 결합 도메인에 융합된 IL-15N72D:IL-15RαSu-Ig Fc 스캐폴드를 포함하는 단백질 복합체가 본원에 기재되어 있다. 인간 면역 세포를 사용하여 특성화될 때, 이들 복합체는 각각의 IL-15, IL-7 및 IL-21 시토카인의 결합 및 생물학적 활성을 나타낸다. 또한, 이들 복합체는 상승된 TSCM 세포 마커를 사용하여 T 세포의 증식 및 활성화를 유도하고 IFN-γ의 생산을 향상시키는 작용을 한다. 이들 복합체는 또한 생체 외 NK 세포를 확장시키고, 확장된 NK 세포는 증강된 세포 독성을 나타낸다. 따라서, 단일 분자로서의 복합체는 T 및 NK 세포상의 다수의 시토카인 수용체에 결합하고 이를 통해 전달 전달하여 신호를 다수의 시토카인의 조합으로 이미 관찰된 상승적 반응을 제공한다. 또한, 이들 복합체는 Ig 분자의 Fc 영역을 포함하며, 이는 이량체를 형성하여 가용성 다중-폴리펩티드 복합체를 제공하고, 정제를 목적으로 단백질 A에 결합하고, NK 세포상의 Fcγ 수용체 및 마크로파지와 상호 작용하여 형질 전환을 제공함으로써 개별 시토카인의 조합에 존재하지 않는 복합체에 이점을 제공할 수 있다. 포유 동물 세포 발현 기반 방법은 이들 복합체를 보다 우수한 활성 및/또는 안정성을 가질 수 있는 당화된 단백질로서 생성한다. 이들 방법은 또한 본원에 기재된 바와 같은 임상 등급 물질의 제조에 적합하다. NK 및 T 세포의 증식 및 활성화를 유도하고 본 발명의 단백질 복합체에 의해 유도된 TSCM 세포 및 CIML NK 세포를 생성하기 위한 추가의 방법이 또한 제공된다.
인터루킨-15
인터루킨-15(IL-15)는 효과기 NK 세포와 CD8+ 기억 T 세포의 발달, 증식 및 활성화에 중요한 시토카인이다. IL-15는 IL-15 수용체α(IL-15Rα)에 결합한 후, 이를 경유하여(in trans) 효과기 세포 상 IL-2/IL-15 수용체 β- 공통 γ 사슬(IL-15Rβγc) 복합체에 제시된다. IL-15 및 IL-2는 둘 다 IL-15Rβγc와 결합하고, STAT3 및 STAT5 경로들을 통해 신호를 전달한다. 그러나 IL-2와는 달리, IL-15는 CD4+CD25+FoxP3+ 조절 T(Treg) 세포의 유지를 지원하지 않거나, 또는 활성화된 CD8+ T 세포의 세포 사멸을 유도하지 않기 때문에, 이러한 특성들은 다발성 골수종에 대한 IL-2의 치료 활성을 제한할 수 있다. 뿐만 아니라 IL-15는 항 세포자멸 신호를 효과기 CD8+ T 세포에 제공하는 것으로 알려진 유일한 시토카인이다. 단독으로 투여되거나 또는 IL-15Rα와의 복합체로서 투여된 IL-15는 실험 동물 모델에서 잘 확립된 고형 종양에 강력한 항종양 활성을 보이므로, 잠재적으로 암을 치료할 수 있었던 면역치료 약물로서 가장 촉망받는 것들 중 하나인 것으로 확인되었다.
IL-15 기반 암 치료제의 임상 개발을 가속화하기 위하여, IL-15에 비해 생물 활성이 증가한 IL-15 돌연변이체(IL-15N72D)가 동정되었다(Zhu 등, J Immunol, 183: 3598-3607, 2009). 이 IL-15 강력 효현제(IL-15N72D)의 약동학적 특성과 생물 활성은 IL-15N72D:IL-15Rα/Fc 융합 복합체(ALT-803)를 만듦으로써 더욱 향상되었으며, 그 결과 강력 효현성 복합체는 생체 내에서 원산 시토카인의 활성보다 적어도 25 배 큰 활성을 갖게 되었다(Han 등, Cytokine, 56: 804-810, 2011).
IL-15:IL-15Rα 복합체
전술한 바와 같이, IL-15:IL-15Rα 융합 단백질 복합체는 천연 IL-15Rα의 가용성 IL-15Rα 도메인에 비공유적으로 결합된 IL-15를 갖는 복합체를 지칭할 수 있다. 일부 경우에, 가용성 IL-15Rα는 생물학적 활성 폴리펩티드 및/또는 IgG Fc 도메인에 공유 결합된다. IL-15는 제2 생물학적 활성 폴리펩티드에 공유 결합된 IL-15 또는 IL-15일 수 있다. IL 15:IL 15Rα 복합체의 결정 구조는 본원에 참조로 포함된 Chirifu 등, 2007 Nat Immunol 8, 1001-1007에 제시되어 있다.
본원에 기술된 상기 양태 또는 본 발명의 임의의 다른 양태의 다양한 구현예에서, IL-15Rα 융합 단백질은 가용성 IL-15Rα, 예를 들어 생물학적 활성 폴리펩티드에 공유 결합된 Il-15Rα (예를 들어, IgG의 중쇄 불변 도메인, IgG의 중쇄 불변 도메인의 Fc 도메인, 또는 시토카인)를 포함한다. 상기 양태의 본 발명의 다른 구현예에서, IL-15는 IL-15, 예를 들어 제2 생물학적 활성 폴리펩티드, 예를 들어 시토카인에 공유 연결된 IL-15를 포함한다. 다른 구현예에서, 숙주 세포 또는 배지로부터 IL-15:IL-15Rα 복합체를 정제하는 것은 IL-15:IL-15Rα 융합 단백질 복합체에 특이적으로 결합하는 친화성 시약상에서 IL-15:IL-15Rα 복합체를 포획하는 것을 포함한다. 다른 구현예에서, IL-15Rα 융합 단백질은 IL-15Rα/Fc 융합 단백질을 함유하고 친화성 시약은 Fc 도메인에 특이적으로 결합한다. 다른 구현예에서, 친화성 시약은 단백질 A 또는 단백질 G이다. 다른 구현예에서, 친화성 시약은 항체이다. 다른 구현예에서, 숙주 세포 또는 배지로부터 IL-15:IL-15Rα 복합체를 정제하는 것은 이온 교환 크로마토그래피를 포함한다. 다른 구현예에서, 숙주 세포 또는 배지로부터 IL-15:IL-15Rα 복합체를 정제하는 것은 크기별 배제 크로마토그래피를 포함한다.
다른 구현예에서, IL-15Rα는 IL-15RαSushi (IL-15RαSu)를 포함한다. 다른 구현예에서, IL-15는 변이체 IL-15 (예를 들어, IL-15N72D)이다. 다른 구현예에서, IL-15:IL-15Rα 복합체의 IL-15 결합 부위는 완전히 점유된다. 다른 구현예에서, IL-15:IL-15RαSu/Fc 복합체의 두 IL-15 결합 부위는 완전히 점유된다. 다른 구현예에서, IL-15:IL-15Rα 복합체는 복합체 전하 또는 크기 특성에 기초하여 정제된다. 다른 구현예에서, 완전히 점유된 IL-15N72D:IL-15RαSu/Fc 융합 단백질 복합체는 복합체 전하 특성에 기초한 음이온 교환 크로마토그래피에 의해 정제된다. 다른 구현예에서, 완전히 점유된 IL-15N72D:IL-15RαSu/Fc 융합 단백질 복합체는 낮은 이온 강도의 중성 pH 완충제를 사용하는 결합 조건 및 이온 강도를 증가시키는 완충제를 사용하는 용리 조건을 갖는 4기 아민계 수지를 사용하여 정제된다.
본 발명의 가용성 융합 단백질 복합체의 특정 구현예에서, IL-15 폴리펩티드는 천연 IL-15 폴리펩티드와 상이한 아미노산 서열을 갖는 IL-15 변이체이다. 인간 IL-15 폴리펩티드는 본원에서 huIL-15, hIL-15, huIL15, hIL15, IL-15 야생형(wt)으로 지칭되고 이의 변이체는 천연 아미노산, 성숙 서열에서의 위치 및 변이체 아미노산을 이용하는 것을 지칭한다. 예를 들어, huIL15N72D는 위치 72에서 N을 D 로 치환한 것을 포함하는 인간 IL-15를 지칭한다. 특정 구현예에서, IL-15 변이체는 예를 들어 천연 IL-15 폴리펩티드와 비교하여 IL-15RβγC 수용체에 대한 결합 활성의 증가에 의해 증명되는 바와 같이 IL-15 효현제로서 기능한다. 특정 구현예에서, IL-15 변이체는 천연 IL-15 폴리펩티드와 비교하여 IL-15RβγC 수용체에 대한 결합 친화도의 감소로 증명되는 바와 같이 IL-15 효현제로 기능한다. 특정 구체예에서, IL-15 변이체는 천연 IL-15 폴리펩티드와 비교하여 IL-15RβγC 수용체에 대해 결합 친화도가 증가되거나 결합 활성이 감소된다. 특정 구현예에서, IL-15 변이체의 서열은 천연 IL-15 시퀀스과 비교하여 적어도 하나 (즉, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 이상)의 아미노산 변화를 갖는다. 아미노산 변화는 IL-15Rβ 및/또는 IL-15RγC와 상호 작용하는 IL-15의 도메인에서 하나 이상의 아미노산 치환 또는 결실을 포함할 수 있다. 특정 구현예에서, 아미노산 변화는 성숙한 인간 IL-15 서열의 위치 8, 61, 65, 72, 92, 101, 108 또는 111에서의 하나 이상의 아미노산 치환 또는 결실을 말한다. 예를 들어, 아미노산 변화는 성숙한 인간 IL-15 서열의 8번 위치에서 D가 N 또는 A로, 61번 위치에서 D를 A로, 65번 위치에서 N을 A로, 72번 위치를 N에서 R로, 또는 108번 위치에서 Q에서 A로 치환한 것이거나, 이들 치환의 임의의 조합한 것이다. 특정 구현예에서, 아미노산 변화는 성숙한 인간 IL-15 서열의 72번 위치에서 N이 D로 치환된 것이다.
ALT-803 (N-803)
ALT-803은 IL-2Rβγ에 결합하는 능력이 증가되고 생물학적 활성이 향상된 IL-15 돌연변이를 포함한다 (미국 특허 번호 8,507,222, 본원에 참고로 포함됨). IL-15의 이 강력 효현제 돌연변이는 공보 (Zu 등, 2009 J Immunol, 183:3598-3607, 본원에 참고로 포함됨)에 기재되어 있다. 가용성 IL-15α 수용체 융합 단백질 (IL-15RαSu/Fc)과 조합된 이 IL-15 강력 효현제는 시험관 내 및 생체 내에서 매우 강력한 IL-15 활성을 갖는 단백질 복합체를 가져온다 (Han 등, 2011, 시토카인, 56:804-810; Xu 등, 2013 Cancer Res. 73:3075-86, Wong 등, 2013, OncoImmunology 2:e26442). IL-15 강력 효현제 복합체 (IL-15N72D:IL-15RαSu/Fc)는 "ALT-803"으로 지칭된다.
약물 동력학 분석에 따르면, 복합체는 마우스에 정맥 내 투여된 이후 25 시간의 반감기를 갖는다. ALT-803은 면역 적격 마우스에서 공격적인 고형 및 혈액학적 종양 모델에 대한 항 종양 활성을 나타낸다. 주 2회 또는 주 1회 정맥 내 투여양을 사용한 단독 요법 또는 항체와의 복합 요법으로 투여될 수 있다. ALT-803 항 종양 반응 또한 뛰어나다. ALT-803 처치 후 치료된 종양 보유 마우스는 또한 동일한 종양 세포의 재투입에 대해 높은 내성을 보였는데, 이는 ALT-803이 재투입된 종양 세포에 대한 효과적인 면역 기억 반응을 유도함을 나타낸다.
IL-7
IL-7은 적응성 면역 세포 발달, 생존 및 증식에 필수적인 시토카인이다. IL-7은 주로 골수 및 흉선의 간질 세포에 의해 분비되지만, 수지상 세포 (DC)와 같은 다른 면역 세포도 IL-7을 생성할 수 있다. IL-7 수용체는 흉선 간질 림포포이에 틴 (TSLP)과 공유되는 IL-7Rα(CD127)와 IL-2, IL-4, IL-9, IL-15 및 IL-21와 공유되는 공통 γ 사슬(CD132)의 두 가지 사슬로 구성된 이종이량체이다. γ 사슬은 모든 조혈 세포 유형에서 발현되는 반면, IL-7Rα는 대부분 림프구에서 발현된다. IL-7Rα는 또한 선천성 림프구 세포 (ILC), 예컨대 림프 기관 발달 및 병원체에 대한 선천적 면역 반응에 중요한 장 관련 림프 조직 (GALT) 유래 LTi 세포 및 NK 세포에서 발견된다. IL-7은 또한 LTi 세포의 풀 (pool)을 제어함으로써 림프 조직 생성을 조절할 수 있다. 다른 유형의 IL-7 수용체는 가용성 IL-7R이며, 이는 세포 관련 IL-7R과 경쟁하여 IL-7R- 발현 세포에 의한 과도한 IL-7 소비를 감소시키고 시토카인이 제한될 때 IL-7의 생체 활성을 향상시킨다 (Gao J 등, Int J Mol Sci. 2015;16 (10267-10280)).
IL-7의 두 가지 주요 신호전달 경로는 Jak-Stat 및 PI3K-Akt이다. IL-7Rα는 단백질 티로신 키나아제 야누스 키나아제1 (Jak1)과 관련되고, γ 사슬의 세포질 꼬리는 Jak3과 관련된다. IL-7의 수용체에의 결합은 사이토졸에서 Jak의 활성화를 유도하여 Stat 단백질을 인산화시킨다. 이어서 이량체 인산화된 Stat 단백질은 핵으로 이동하고 유전자 발현을 유도한다. Jak3-Stat5 경로를 통해, IL-7은 항세포 자멸 유전자, Bcl-2 및 Mcl-1을 활성화시키고, Bax 및 Bak과 같은 항세포 자멸 단백질을 억제하여, 본래 및 기억 T 세포 생존을 이끈다. 이 기능은 용량 의존적이어서, IL-7의 높은 농도는 흉선 이민자 T 세포 증식을 유도하는 반면, 낮은 농도는 세포 생존을 유지한다. PI3K-Akt 경로를 활성화시킴으로써, IL-7은 세포주기 억제제 p27kip1을 하향 조절하여 세포 주기 진행을 위한 사이클린 D1의 발현을 유도한다. 또한, 그것은 세포 대사 및 크기를 긍정적으로 조절하기 위해 포도당 수송체 1 발현, 포도당 흡수 및 미토콘드리아 완전성을 촉진한다 (Gao J 등, Int J Mol Sci. 2015; 16 (10267-10280); 및 Jatiani SS 등, Genes Cancer. 2010; 1 (10):979-993).
IL-21
IL-21은 전염증 및 항염증 활성을 모두 갖고 있으며 주로 활성화된 CD4+ 및 NK T 세포에 의해 생성되는 다항성 시토카인이다. 그것은 일반적인 γ-사슬 시토카인 패밀리에 속하며 림프구 활성화, 증식, 분화 및 생존에 관여한다. IL-21은 특이적 IL-21R 및 공통 γ-사슬 수용체로 이루어진 이종이량체 수용체 신호 전달을 통해 기능한다. IL-21는 Jak-Stat, PI3K 및 MAPK 경로를 통해 신호전달한다. IL-21은 T 세포 분화에 중요한 Stat3의 강력하고 지속적인 활성화를 유도한다 (Ouyang W, 등, Immunity. 2012; 28 (4) 454-467).
IL-15 및 IL-7과 함께, IL-21은 항원 특이적 CD8+ T 세포 수의 확장 및 효과기 기능을 촉진시켜 결과적으로 종양 퇴행을 가져온다. IL-21은 또한 초기 분화 표현형의 유도에 의해 본래 및 중앙 기억 T 세포 둘 다의 발달 및 생존에 중요한 역할을 하는 것으로 나타났다. 중요하게는, IL-21로 생성된 T 세포는 실험 모델에서 체내 우수한 항 종양 효과를 나타냈다.
IL-21은 또한 NK 세포를 생성함에 있어서 IL-2, IL-15 및 Flt-3L과 상승 작용을 하는 것으로 나타났다. 최근 IL-15가 NK 세포를 확장시키는 역할을 하는 반면, IL-21은 염증성 시토카인의 탈과립화 및 분비를 증가시켜 세포 독성 활성을 유도한다고 보고되었다 (Wagner J 등, Front Immunol. 2017; 8:676).
항원 특이적 결합 도메인
항원 특이적 결합 도메인은 발병 세포상 표적들과 특이적으로 결합하는 폴리펩티드들로 이루어져 있다. 대안적으로 이러한 도메인은 병상(diseased state)을 지원하는 기타 세포상 표적, 예컨대 종양의 성장을 지원하는 기질 세포상 표적 또는 질환 매개성 면역억제를 지원하는 면역세포상 표적에 결합할 수 있다. 항원 특이적 결합 도메인은 당 분야에 공지된 항체, 단일 사슬 항체, Fab, Fv, T 세포 수용체 결합 도메인, 리간드 결합 도메인, 수용체 결합 도메인, 도메인 항체, 단일 도메인 항체, 미니바디, 나노바디, 펩티바디 또는 기타 다양한 항체 모의체(예컨대 아피머, 아피틴, 알파바디, 아트리머, CTLA4 기반 분자, 아드넥틴, 안티칼린, Kunitz 도메인 기반 단백질, 아비머, 노틴, 파이노머, 다르핀, 아피바디, 아필린, 모노바디 및 아르마딜로 반복 단백질 기반 단백질(Weidle, UH, 등, 2013. Cancer Genomics & Proteomics 10: 155-168))을 포함한다.
임의의 구현예들에서, 항원 특이적 결합 도메인에 대한 항원은 세포 표면 수용체 또는 리간드를 포함한다. 추가의 구현예에서, 항원은 CD 항원, 시토카인 또는 케모카인 수용체 또는 리간드, 성장 인자 수용체 또는 리간드, 조직 인자, 세포 부착 분자, MHC/MHC-유사 분자, Fc 수용체, Toll-유사 수용체, NK 수용체, TCR, BCR, 양성/음성 보조자극 수용체 또는 리간드, 사멸 수용체 또는 리간드, 종양 연관 항원, 또는 바이러스 암호화 항원을 포함한다.
바람직하게, 항원 특이적 결합 도메인은 종양 세포상 항원과 결합할 수 있다. 종양 특이적 결합 도메인은 암 환자 치료용으로 승인된 항체, 예컨대 리툭시맙, 오파투무맙 및 오비누투주맙(항 CD20 Ab); 트라스투주맙 및 퍼투주맙(항 HER2 Ab); 세툭시맙 및 파니투무맙(항 EGFR Ab); 그리고 알렘투주맙(항 CD52 Ab)로부터 유래할 수 있다. 이와 유사하게, 승인된 항체-효과기 분자 접합체로서, CD20에 특이적인 것(90Y-표지화 이브리투모맙 티욱세탄, 131I-표지화 토시투모맙), HER2에 특이적인 것(아도-트라스투주맙 엠탄신), CD30에 특이적인 것(브렌툭시맙 베도틴) 및 CD33에 특이적인 것(겜투주맙 오조가미신)으로부터 유래하는 결합 도메인이 사용될 수 있었다(Sliwkowski MX, Mellman I. 2013 Science 341:1192).
또한, 본 발명의 바람직한 결합 도메인은 당 분야에 공지된 기타 다양한 종양 특이적 항체 도메인을 포함할 수 있다. 암 치료를 위한 항체와 이의 각각의 표적으로서는 니볼루맙(항 PD-1 Ab), TA99(항 gp75), 3F8(항 GD2), 8H9(항 B7-H3), 아바고보맙(항 CA-125(이미타티온)), 아데카투무맙(항 EpCAM), 아푸투주맙(항 CD20), 알라시주맙 페골(항 VEGFR2), 알투모맙 펜테테이트(항 CEA), 아마툭시맙(항 메소텔린), AME-133(항 CD20), 아나투모맙 마페나톡스(항 TAG-72), 아폴리주맙(항 HLA-DR), 아르시투모맙(항 CEA), 바비툭시맙(항 포스파티딜세린), 벡투모맙(항 CD22), 벨리무맙(항 BAFF), 베실레소맙(항 CEA-관련 항원), 베바시주맙(항 VEGF-A), 비바투주맙 메르탄신(항 CD44 v6), 블리나투모맙(항 CD19), BMS-663513(항 CD137), 브렌툭시맙 베도틴(항 CD30(TNFRSF8)), 칸투주맙 메르탄신(항 뮤신 CanAg), 칸투주맙 라브탄신(항 MUC1), 카프로맙 펜데타이드(항 전립선암종세포), 카를루맙(항 MCP-1), 카투막소맙(항 EpCAM, CD3), cBR96-독소루비신 면역접합체(항 루이-Y 항원), CC49(항 TAG-72), 세델리주맙(항 CD4), Ch.14.18(항 GD2), ch-TNT(항 DNA 연관 항원), 시타투주맙 보가톡스(항 EpCAM), 식수투무맙(항 IGF-1 수용체), 클리바투주맙 테트락세탄(항 MUC1), 코나투무맙(항 TRAIL-R2), CP-870893(항 CD40), 다세투주맙(항 CD40), 다클리주맙(항 CD25), 달로투주맙(항 인슐린 유사 성장 인자 I 수용체), 다라투무맙(항 CD38(사이클릭 ADP 리보스 하이드롤라아제)), 뎀시주맙(항 DLL4), 데투모맙(항 B-림프종 세포), 드로지투맙(항 DR5), 둘리고투맙(항 HER3), 두시기투맙(항 ILGF2), 에크로멕시맙(항 GD3 강글리오사이드), 에드레콜로맙(항 EpCAM), 엘로투주맙(항 SLAMF7), 엘시리모맙(항 IL-6), 에나바투주맙(항 TWEAK 수용체), 에노티쿠맙(항 DLL4), 엔시툭시맙(항 5AC), 에피투모맙 시툭세탄(항 에피시알린), 에프라투주맙(항 CD22), 에르투막소맙(항 HER2/neu, CD3), 에타라시주맙(항 인테그린 αvβ3), 파랄리모맙(항 인터페론 수용체), 파를레투주맙(항 엽산염 수용체 1), FBTA05(항 CD20), 피클라투주맙(항 HGF), 피기투무맙(항 IGF-1 수용체), 플란보투맙(항 TYRP1(당단백질 75)), 프레솔리무맙(항 TGFβ), 푸툭시맙(항 EGFR), 갈릭시맙(항 CD80), 가니투맙(항 IGF-I), 겜투주맙 오조가미신(항 CD33), 기렌툭시맙(항 탄산무수화효소 9(CA-IX)), 글렘바투무맙 베도틴(항 GPNMB), 구셀쿠맙(항 IL13), 이발리주맙(항 CD4), 이브리투모맙 티욱세탄(항 CD20), 이크루쿠맙(항 VEGFR-1), 이고보맙(항 CA-125), IMAB362(항 CLDN18.2), IMC-CS4(항 CSF1R), IMC-TR1(TGFβRII), 임가투주맙(항 EGFR), 인클라쿠맙(항 셀렉틴 P), 인다툭시맙 라브탄신(항 SDC1), 이노투주맙 오조가미신(항 CD22), 인테투무맙(항 CD51), 이필리무맙(항 CD152), 이라투무맙(항 CD30(TNFRSF8)), KM3065(항 CD20), KW-0761(항 CD194), LY2875358(항 MET) 라베투주맙(항 CEA), 람브롤리주맙(항 PDCD1), 렉사투무맙(항 TRAIL-R2), 린투주맙(항 CD33), 리릴루맙(항 KIR2D), 로르보투주맙 메르탄신(항 CD56), 루카투무맙(항 CD40), 루밀릭시맙(항 CD23(IgE 수용체)), 마파투무맙(항 TRAIL-R1), 마르게툭시맙(항 ch4D5), 마투주맙(항 EGFR), 마브릴리무맙(항 GMCSF 수용체 α-사슬), 밀라투주맙(항 CD74), 민레투모맙(항 TAG-72), 미투모맙(항 GD3 강글리오사이드), 모가물리주맙(항 CCR4), 목세투모맙 파수도톡스(항 CD22), 나콜로맙 타페나톡스(항 C242 항원), 납투모맙 에스타페나톡스(항 5T4), 나르나투맙(항 RON), 네시투무맙(항 EGFR), 네스바쿠맙(항 안지오포이에틴 2), 니모투주맙(항 EGFR), 니볼루맙(항 IgG4), 노페투모맙 메르펜탄, 오크렐리주맙(항 CD20), 오카라투주맙(항 CD20), 올라라투맙(항 PDGF-Rα), 오나르투주맙(항 c-MET), 온툭시주맙(항 TEM1), 오포르투주맙 모나톡스(항 EpCAM), 오레고보맙(항 CA-125), 오틀레르투주맙(항 CD37), 판코맙(MUC1의 항 종양 특이적 당화), 파르사투주맙(항 EGFL7), 파스콜리주맙(항 IL-4), 파트리투맙(항 HER3), 펨투모맙(항 MUC1), 페르투주맙(항 HER2/neu), 피딜리주맙(항 PD-1), 피나투주맙 베도틴(항 CD22), 핀투모맙(항 선암종 항원), 폴라투주맙 베도틴(항 CD79B), 프리투무맙(항 비멘틴), PRO131921(항 CD20), 퀼리주맙(항 IGHE), 라코투모맙(항 N-글리콜릴뉴라민산), 라드레투맙(항 피브로넥틴 여분 도메인-B), 라무시루맙(항 VEGFR2), 리로투무맙(항 HGF), 로바투무맙(항 IGF-1 수용체), 로레두맙(항 RHD), 로벨리주맙(항 CD11 및 CD18), 사말리주맙(항 CD200), 사투모맙 펜데타이드(항 TAG-72), 세리반투맙(항 ERBB3), SGN-CD19A(항 CD19), SGN-CD33A(항 CD33), 시브로투주맙(항 FAP), 실툭시맙(항 IL-6), 솔리토맙(항 EpCAM), 손투주맙(항 에피시알린), 타발루맙(항 BAFF), 타카투주맙 테트라제탄(항 알파-태아단백질), 타플리투모맙 팝톡스(항 CD19), 텔리모맙 아리톡스, 테나투모맙(항 테나신 C), 테네릭시맙(항 CD40), 테프로투무맙(항 CD221), TGN1412(항 CD28), 티실리무맙(항 CTLA-4), 티가투주맙(항 TRAIL-R2), TNX-650(항 IL-13), 토시투모맙(항 CS20), 토베투맙(항 CD140a), TRBS07(항 GD2), 트레갈리주맙(항 CD4), 트레멜리무맙(항 CTLA-4), TRU-016(항 CD37), 투코투주맙 셀모루킨(항 EpCAM), 우블리툭시맙(항 CD20), 우렐루맙(항 4-1BB), 반틱투맙(항 프리즐드(Frizzled) 수용체), 바팔릭시맙(항 AOC3(VAP-1)), 바텔리주맙(항 ITGA2), 벨투주맙(항 CD20), 베센쿠맙(항 NRP1), 비실리주맙(항 CD3), 볼로식시맙(항 인테그린 α5β1), 보르세투주맙 마포도틴(항 CD70), 보투무맙(항 종양 항원 CTAA16.88), 잘루투무맙(항 EGFR), 자놀리무맙(항 CD4), 자툭시맙(항 HER1), 지랄리무맙(항 CD147(바시긴)), RG7636(항 ETBR), RG7458(항 MUC16), RG7599(항 NaPi2b), MPDL3280A(항 PD-L1), RG7450(항 STEAP1) 및 GDC-0199(항 Bcl-2)를 포함하나, 이에 한정되는 것은 아니다.
본 발명에 유용한 기타 항체 도메인 또는 종양 결합 단백질(예컨대 TCR 도메인)로서는 하기 항원들과 결합하는 것들을 포함하나, 이에 한정되는 것은 아니다(주의; 명시된 암의 적응증들은 비 제한적 예를 나타냄): 아미노펩티다아제 N(CD13), 어넥신 Al, B7-H3(CD276, 다수의 암), CA125(난소암), CA15-3(암종), CA19-9(암종), L6(암종), 루이 Y(암종), 루이 X(암종), 알파 태아단백질(암종), CA242(결장직장암), 태반 알칼리성 포스파타아제(암종), 전립선 특이 항원(전립선), 전립선산 포스파타아제(전립선), 표피 성장 인자(암종), CD2(호지킨병, NHL 림프종, 다발성 골수종), CD3 엡실론(T 세포 림프종, 폐암, 유방암, 위암, 난소암, 자가면역성 질환, 악성 복수), CD19(B 세포 악성종양), CD20(비호지킨 림프종, B 세포 신생물형성, 자가면역성 질환), CD21(B 세포 림프종), CD22(백혈병, 림프종, 다발성 골수종, SLE), CD30(호지킨 림프종), CD33(백혈병, 자가면역성 질환), CD38(다발성 골수종), CD40(림프종, 다발성 골수종, 백혈병(CLL)), CD51(전이성 흑색종, 육종), CD52(백혈병), CD56(소세포 폐암, 난소암, Merkel 세포 암종, 및 액상 종양, 다발성 골수종), CD66e(암종), CD70(전이성 신세포 암종 및 비호지킨 림프종), CD74(다발성 골수종), CD80(림프종), CD98(암종), CD123(백혈병), 뮤신(암종), CD221(고형 종양), CD227(유방암, 난소암), CD262(NSCLC 및 기타 암), CD309(난소암), CD326(고형 종양), CEACAM3(결장직장암, 위암), CEACAM5(CEA, CD66e)(유방암, 결장직장암, 폐암), DLL4(A-유사-4), EGFR(다수의 암), CTLA4(흑색종), CXCR4(CD 184, 혈액종양, 고형 종양), 엔도글린(CD 105, 고형 종양), EPCAM(상피 세포 부착 분자, 방광, 두부, 경부, 결장, NHL 전립선, 및 난소의 암), ERBB2(폐, 유방 및 전립선의 암), FCGR1(자가면역성 질환), FOLR(엽산염 수용체, 난소암), FGFR(암종), GD2 강글리오사이드(암종), G-28(세포 표면 항원 당지질, 흑색종), GD3 이디오타입(암종), 열충격 단백질(암종), HER1(폐암, 위암), HER2(유방, 폐 및 난소의 암), HLA-DR10(NHL), HLA-DRB(NHL, B 세포 백혈병), 인간 융모막 성선자극호르몬(암종), IGF1R(고형 종양, 혈액암), IL-2 수용체(T 세포 백혈병 및 림프종), IL-6R(다발성 골수종, RA, 캐슬만씨병, IL6 의존성 종양), 인테그린 (다수의 암에 대한 ανβ3, α5β1, α6β4, α11β3, α5β5, ανβ5), MAGE-1(암종), MAGE-2(암종), MAGE-3(암종), MAGE 4(암종), 항 트랜스페린 수용체(암종), p97(흑색종), MS4A1(막 확장성 4-도메인 아과 A 일원 1, 비호지킨 B 세포 림프종, 백혈병), MUC1(유방, 난소, 자궁경부, 기관지 및 위장관의 암), MUC16(CA125)(난소암), CEA(결장직장암), gp100(흑색종), MARTI(흑색종), MPG(흑색종), MS4A1(막 확장성 4-도메인 아과 A, 소세포 폐암, NHL), 뉴클레올린, Neu 발암유전자 생성물(암종), P21(암종), 넥틴-4(암종), 항 (N-글리콜릴뉴라민산, 유방암, 흑색종)의 파라토프, PLAP-유사 고환 알칼리성 포스파타아제(난소암, 고환암), PSMA(전립선 종양), PSA(전립선), ROB04, TAG 72(종양 연관 당단백질 72, AML, 위암, 결장직장암, 난소암), T 세포 경막 단백질(암), Tie(CD202b), 조직 인자, TNFRSF10B(종양 괴사 인자 수용체 상과 일원 10B, 암종), TNFRSF13B(종양 괴사 인자 수용체 상과 일원 13B, 다발성 골수종, NHL, 기타 암, RA 및 SLE), TPBG(세포영양막 당단백질, 신세포 암종), TRAIL-R1(종양 괴사성 세포자멸 유도 리간드 수용체 1, 림프종, NHL, 결장직장암, 폐암), VCAM-1(CD106, 흑색종), VEGF, VEGF-A, VEGF-2(CD309)(다수의 암). 기타 몇몇 종양 연관 항원 표적에 관하여도 검토된 바 있다(Gerber 등, Mabs 2009 1:247-253; Novellino 등, Cancer Immunol Immunother. 2005 54:187-207, Franke, 등, Cancer Biother Radiopharm. 2000, 15:459-76, Guo, 등, Adv Cancer Res. 2013; 119: 421-475, Parmiani 등, J Immunol. 2007 178:1975-9). 이러한 항원의 예들로서는 분화클러스터들(CD4, CD5, CD6, CD7, CD8, CD9, CD10, CD11a, CD11b, CD11c, CD12w, CD14, CD15, CD16, CDwl7, CD18, CD21, CD23, CD24, CD25, CD26, CD27, CD28, CD29, CD31, CD32, CD34, CD35, CD36, CD37, CD41, CD42, CD43, CD44, CD45, CD46, CD47, CD48, CD49b, CD49c, CD53, CD54, CD55, CD58, CD59, CD61, CD62E, CD62L, CD62P, CD63, CD68, CD69, CD71, CD72, CD79, CD81, CD82, CD83, CD86, CD87, CD88, CD89, CD90, CD91, CD95, CD96, CD100, CD103, CD105, CD106, CD109, CD117, CD120, CD127, CD133, CD134, CD135, CD138, CD141, CD142, CD143, CD144, CD147, CD151, CD152, CD154, CD156, CD158, CD163, CD166, .CD168, CD184, CDw186, CD195, CD202(a, b), CD209, CD235a, CD271, CD303, CD304), 어넥신 Al, 뉴클레올린, 엔도글린(CD105), ROB04, 아미노-펩티다아제 N, -유사-4(DLL4), VEGFR-2(CD309), CXCR4(CD184), Tie2, B7-H3, WT1, MUC1, LMP2, HPV E6 E7, EGFRvIII, HER-2/neu, 이디오타입, MAGE A3, p53 비돌연변이체, NY-ESO-1, GD2, CEA, MelanA/MARTl, Ras 돌연변이체, gp100, p53 돌연변이체, 프로티나아제 3(PR1), bcr-abl, 티로시나아제, 서바이빈, hTERT, 육종 전좌 중단점(sarcoma translocation breakpoint), EphA2, PAP, ML-IAP, AFP, EpCAM, ERG(TMPRSS2 ETS 융합 유전자), NA17, PAX3, ALK, 안드로겐 수용체, 사이클린 B l, 폴리시알산, MYCN, RhoC, TRP-2, GD3, 푸코실 GMl, 메소텔린, PSCA, MAGE Al, sLe(a), CYPIB I, PLACl, GM3, BORIS, Tn, GloboH, ETV6-AML, NY-BR-1, RGS5, SART3, STn, 탄산무수화효소 IX, PAX5, OY-TES1, 정자 단백질 17, LCK, HMWMAA, AKAP-4, SSX2, XAGE 1, B7H3, 레규마인, Tie 2, Page4, VEGFR2, MAD-CT-1, FAP, PDGFR-β, MAD-CT-2 및 Fas-관련 항원 1을 포함한다.
추가로 본 발명의 바람직한 결합 도메인으로서는, 당 분야에 공지된, 감염 세포 연관 에피토프 표적 및 항원 표적에 특이적인 것들을 포함한다. 이러한 표적들로서는 하기 관심 감염성 제제로부터 유래하는 것들을 포함하나, 이에 한정되는 것은 아니다: HIV 바이러스(구체적으로 HIV 외피 스파이크 유래 항원 및/또는 gp120 및 gp41 에피토프), 인유두종바이러스(HPV), 마이코박테리움 투베르큘로시스(Mycobacterium tuberculosis), 스트렙토코커스 아가락티아에(Streptococcus agalactiae), 메티실린 내성 스타필로코커스 아우레우스(Staphylococcus aureus), 레지오넬라 뉴모필리아(Legionella pneumophilia), 스트렙토코커스 피오제네스(Streptococcus pyogenes), 에스케리치아 콜라이(Escherichia coli), 네이세리아 고노로에아에(Neisseria gonorrhoeae), 네이세리아 메닌기티디스(Neisseria meningitidis), 뉴모코커스(Pneumococcus), 크립토코커스 네오포르만스(Cryptococcus neoformans), 히스토플라스마 캡슐라튬(Histoplasma capsulatum), - 인플루엔자 B, 트레포네마 팔리듐(Treponema pallidum), 라임병 스피로헤타, 슈도모나스 아에루기노사(Pseudomonas aeruginosa), 마이코박테리움 레프라에(Mycobacterium leprae), 브루셀라 아보르투스(Brucella abortus), 공수병 바이러스, 인플루엔자 바이러스, 거대세포바이러스, 헤르페스 심플렉스(herpes simplex) 바이러스 I, 헤르페스 심플렉스 바이러스 II, 인간 혈청 파르보 유사 바이러스, 호흡기세포융합 바이러스, 바리셀라-조스터(varicella-zoster) 바이러스, B형 간염 바이러스, C형 간염 바이러스, 홍역 바이러스, 아데노바이러스, 인간 T 세포 백혈병 바이러스, 엡스타인-바(Epstein-Barr) 바이러스, 마우스 백혈병 바이러스, 이하선염 바이러스, 수포성구내염 바이러스, 신드비스(sindbis) 바이러스, 림프구성 맥락수막염 바이러스, 사마귀 바이러스, 청설병 바이러스, 센다이(Sendai) 바이러스, 고양이 백혈병 바이러스, 레오바이러스, 소아마비 바이러스, 유인원 바이러스 40, 마우스 유방 종양 바이러스, 뎅기열 바이러스, 풍진 바이러스, 웨스트 나일(West Nile) 바이러스, 플라스모듐 팔시파륨(Plasmodium falciparum), 플라스모듐 비백스(Plasmodium vivax), 톡소플라스마 곤디이(Toxoplasma gondii), 트리파노소마 란겔리(Trypanosoma rangeli), 트리파노소마 크루지(Trypanosoma cruzi), 트리파노소마 로데시엔세이(Trypanosoma rhodesiensei), 트리파노소마 브루세이(Trypanosoma brucei), 쉬스토소마 만소니(Schistosoma mansoni), 쉬스토소마 자포니큠(Schistosoma japonicum), 바베시아 보비스(Babesia bovis), 엘메리아 테넬라(Elmeria tenella), 온코세르카 볼불루스(Onchocerca volvulus), 레이슈마니아 트로피카(Leishmania tropica), 트리키넬라 스피랄리스(Trichinella spiralis), 테일레리아 파르바(Theileria parva), 타에니아 히단티게나(Taenia hydatigena), 타에니아 오비스(Taenia ovis), 타에니아 사기나타(Taenia saginata), 에키노코커스 그래뉼로서스(Echinococcus granulosus), 메소세스토이데스 코르티(Mesocestoides corti), 마이코플라스마 아르트리티디스(Mycoplasma arthritidis), 엠.하이오리니스(M. hyorhinis), 엠.오랄레(M. orale), 엠.아르기니니(M arginini), 아콜레플라스마 라이드로이이(Acholeplasma laidlawii), 엠. 살리바리움(M. salivarium) 및 엠. 뉴모니아에(M. pneumoniae).
면역 관문 억제제 및 면역 효현제 도메인
다른 구현예에서, 결합 도메인은 면역 관문 분자나 신호전달 분자, 또는 이의 리간드에 특이적이며, 면역 관문 억제 활성의 억제제 또는 면역 자극 활성의 효현제로서 작용을 한다. 이러한 면역 관문 분자 및 신호전달 분자, 그리고 리간드로서는 PD-1, PD-L1, PD-L2, CTLA-4, CD28, CD80, CD86, B7-H3, B7-H4, B7-H5, ICOS-L, ICOS, BTLA, CD137L, CD137, HVEM, KIR, 4-1BB, OX40L, CD70, CD27, CD47, CIS, OX40, GITR, IDO, TIM3, GAL9, VISTA, CD155, TIGIT, LIGHT, LAIR-1, Siglecs 및 A2aR을 포함한다(Pardoll DM. 2012. Nature Rev Cancer 12:252-264, Thaventhiran T. 등, 2012. J Clin Cell Immunol S12:004). 또한, 본 발명의 바람직한 항체 도메인은 이필리무맙 및/또는 트레멜리무맙(항 CTLA4), 니볼루맙, 펨브롤리주맙, 피딜리주맙, TSR-042, ANB011, AMP-514 및 AMP-224(리간드-Fc 융합체)(항 PD1), 아테졸리주맙(MPDL3280A), 아벨루맙(MSB0010718C), 더발루맙(MEDI4736), MEDI0680 및 BMS-9365569(항 PDL1), MEDI6469(항 OX40 효현제), BMS-986016, IMP701, IMP731, IMP321(항 LAG3) 및 GITR 리간드를 포함할 수 있다.
T 세포 수용체(TCR)
T 세포는 기타 면역 세포 유형들(다형핵 세포, 호산구, 호염기구, 비만 세포, B 세포, NK 세포)과 함께 면역계의 세포성 성분을 이루는 세포의 하위군이다. 생리적 조건 하에서 T 세포는 면역 감시와 외래 항원 제거의 역할을 담당한다. 그러나 병리학적 조건 하에서는 T 세포가 질환의 유발과 확산에 중요한 역할을 한다는 강력한 증거가 있다. 이러한 장애에 있어서, T 세포 면역 관용성의 파괴는, 그것이 중심적인 것인지 아니면 주변적인 것인지간에 자가면역성 질환의 유발에 있어 근본적인 과정인 것이다.
TCR 복합체는, 적어도 7개의 경막 단백질로 이루어져 있다. 이황화 결합된 (αβ 또는 γδ) 이종이량체는 단형속 항원 인지 단위를 형성하는 한편, ε, η, δ, ξ 및 η 사슬들로 이루어져 있는 CD3의 불변 사슬은 신호전달 경로에 리간드 결합을 연계하여, T 세포 활성화와 세포성 면역반응을 도모하는데 관여한다. TCR 사슬의 유전자 다양성에도 불구, 공지된 모든 서브유닛들에는 2가지 구조적 특징이 공통으로 존재한다. 첫 번째 구조적 특징은 이 TCR 사슬이 (아마도 알파-나선형일) 경막 확장성 도메인 하나를 가지는 경막 단백질이라는 점이다. 두 번째 구조적 특징은, 모든 TCR 사슬들은 예측 경막 도메인 내에 하전된 아미노산을 가지는 것과 같은 일반적이지 않은 특징을 가진다는 점이다. 불변 사슬은 하나의 음전하를 가지고, 마우스와 인간 간에 보존되어 있으며, 가변 사슬은 하나의 양전하를 가지거나(TCR-β) 또는 2개의 양전하를 가진다(TCR-α). TCR-α의 경막 서열은 다수의 종들간에 매우 보존적이어서, 계통발생상 중요한 기능상의 역할을 담당할 수 있다. 친수성 아미노산 아르기닌과 리신을 함유하는 옥타펩티드 서열은 종들 간에 동일하다.
T 세포 반응은 TCR에의 항원 결합에 의해 조정된다. TCR의 일 유형은, 면역글로불린 가변 영역(V) 및 불변 영역(C)을 닮은, α 사슬 및 β 사슬로 이루어진 막 결합 이종이량체이다. TCR α 사슬은 공유 결합된 V-α 사슬 및 C-α 사슬을 포함하는 한편, TCR β 사슬은 C-β 사슬에 공유 결합된 V-β 사슬을 포함한다. V-α 사슬 및 V-β 사슬은 주 조직적합성 복합체(MHC)(인간의 경우에는 HLA 복합체로 알려짐)의 환경 중 항원 또는 초항원과 결합할 수 있는 포켓 또는 틈을 형성한다. 문헌(Davis Ann. Rev. of Immunology 3: 537(1985); Fundamental Immunology 3rd Ed., W. Paul Ed. Rsen Press LTD. New York(1993))을 참조한다.
TCR 사슬(αβ 또는 γδ)의 세포외 도메인은 또한 세포 표면상 발현을 위해 이종 경막 도메인과의 융합체로서 조작될 수 있다. 이러한 TCR은 CD3, CD28, CD8, 4-1BB 및/또는 키메라 활성화 수용체(CAR) 경막 도메인 또는 활성화 도메인과의 융합체를 포함할 수 있다. TCR은 또한 αβ 또는 γδ 사슬의 항원 결합 도메인들 중 하나 이상을 포함하는 가용성 단백질일 수 있다. 이러한 TCR은 TCR 불변 도메인들과 결합되어 있거나 결합되어 있지 않은 TCR 가변 도메인 또는 이의 기능성 단편을 포함할 수 있다. 가용성 TCR은 이종이량체이거나 단일 사슬 분자일 수 있다.
Fc 도메인
본 발명의 단백질 복합체는 Fc 도메인을 함유할 수 있다. 예를 들어 PD-L1 TxM은 항 PD-L1 scAb/huIL-15N72D:항 PD-L1 scAb/huIL-15RαSu/huIgG1 Fc 융합 복합체를 포함한다. IgG의 Fc 영역과, 또 다른 단백질(예컨대 다양한 시토카인)의 도메인 및 가용성 수용체를 합한 융합 단백질이 보고된 바 있다(예컨대 문헌(Capon 등, Nature, 337:525-531, 1989; Chamow 등, Trends Biotechnol., 14:52-60, 1996); 미국특허 제5,116,964호 및 동 제5,541,087호) 참조). 원형 융합 단백질은 IgG Fc의 힌지 영역 내 시스테인 잔기들을 통해 결합되어, 중쇄 가변 도메인과 CH1 도메인, 그리고 경쇄를 포함하지 않는, IgG 분자와 유사한 분자를 이루는 동종이량체 단백질이다. Fc 도메인을 포함하는 융합 단백질의 이량체로서의 성질은, 다른 분자와의 고차원적 상호작용(즉 2가 또는 이중 특이적 결합)을 제공함에 있어서 유리할 수 있다. 구조상의 상동성으로 말미암아, Fc 융합 단백질은, 유사한 이소타입을 보이는 인간 IgG의 생체 내 약동학적 프로필과 거의 동일한 생체 내 약동학적 프로필을 보인다. IgG군의 면역글로불린은 인간 혈액에 가장 많이 존재하는 단백질로서, 이의 혈행 반감기(circulation half-life)는 21일까지에 이를 수 있다. IL-15 또는 IL-15 융합 단벡질의 혈행 반감기를 연장시키고/연장시키거나 이의 생물 활성을 증가시키기 위한, 인간 중쇄 IgG 단백질의 Fc부에 공유 결합된 IL-15Rα와 비공유 결합하고 있는 IL-15 도메인을 함유하는 융합 단백질 복합체가 본원에 기술되어 있다.
"Fc"란 용어는, Fc 수용체라 칭하여지는 세포 표면 수용체와, 보체계의 몇몇 단백질과 상호작용하는 항체의 불변 영역인 결정화가능 단편 영역(fragment crystallizable region)을 지칭한다. 이러한 "Fc"는 이량체 형태를 가진다. 원산 Fc의 원천 면역글로불린 공급원은, 바람직하게 인간 기원 면역글로불린 중 임의의 것일 수 있지만, IgG1 및 IgG2가 바람직하다. 원산 Fc들은 공유 결합(즉 이황화 결합)과 비공유 결합에 의해 이량체 형태 또는 다량체 형태로 결합될 수 있는, 단량체 폴리펩티드들로 이루어져 있다. 원산 Fc 분자들의 단량체 서브유닛들 사이의 분자간 이황화 결합의 수는, 군(예컨대 IgG, IgA, IgE) 또는 하위군(예컨대 IgG1, IgG2, IgG3, IgA1, IgGA2)에 따라서 1개 내지 4개의 범위이다. 원산 Fc의 일례로서는 IgG의 파페인 분해에 의해 생성되는 이황화 결합 이량체가 있다(문헌(Ellison 등 (1982), Nucleic Acids Res. 10: 4071-9) 참조). 본원에 사용된 바와 같은 "원산 Fc"란 용어는, 단량체 형태, 이량체 형태 및 다량체 형태를 총칭하는 것이다. Fc 도메인은 단백질 A, 단백질 G, 다양한 Fc 수용체 및 보체 단백질에 대한 결합 부위들을 함유한다. 몇몇 구현예들에서 복합체의 Fc 도메인은 Fc 수용체와 상호작용하여, 항체 의존적 세포 매개 세포독성(ADCC) 및/또는 항체 의존적 세포성 식세포작용(ADCP)을 매개할 수 있다. 다른 응용예에서, 복합체는 ADCC 또는 ADCP를 효과적으로 매개할 수 없는 Fc 도메인(예컨대 IgG4 Fc)을 포함한다.
몇몇 구현예들에서, "Fc 변이체"란 용어는, 원산 Fc로부터 변형되었지만, 구조 수용체(salvage receptor), 즉 FcRn에 대한 결합 부위를 여전히 포함하는 분자 또는 서열을 지칭한다. 국제특허출원공보 WO 97/34631 및 WO 96/32478는, 예시적 Fc 변이체뿐만 아니라, 구조 수용체와의 상호작용을 기술하고 있으며, 이 문헌들은 본원에 참조로 인용되어 있다. 그러므로 "Fc 변이체"란 용어는, 비인간 원산 Fc로부터 유래하여 인간화된 분자 또는 서열을 포함한다. 게다가 원산 Fc는, 본 발명의 융합 분자에 불필요한 구조적 특징 또는 생물 활성을 제공함으로 말미암아 제거될 수 있는 부위들을 포함한다. 그러므로 임의의 구현예들에서, "Fc 변이체"란 용어는, (1) 이황화 결합 형성, (2) 선택된 숙주 세포와의 양립불가능, (3) 선택된 숙주 세포 내 발현시 N-말단의 이질성, (4) 당화, (5) 보체와의 상호작용, (6) 구조 수용체 이외의 Fc 수용체와의 결합, (7) 항체 의존적 세포성 세포독성(ADCC) 또는 (8) 항체 의존적 세포성 식세포작용(ADCP)에 영향을 미치거나 이에 수반되는 하나 이상의 원산 Fc 부위들 또는 잔기들이 변경된, 분자 또는 서열을 포함한다. 이러한 변경은 이와 같은 Fc의 특성들 중 임의의 것 하나 이상을 증가시킬 수 있거나 감소시킬 수 있다. Fc 변이체는 이하에 더욱 상세히 기술되어 있다.
"Fc 도메인"이란 용어는, 상기 정의된 바와 같이 원산 Fc 및 Fc 변이체 분자들 및 서열들을 포함한다. Fc 변이체 및 원산 Fc와 같이, "Fc 도메인"이란 용어는, 그것이 전 항체로부터 분해되었건, 아니면 재조합 유전자 발현 또는 기타 수단에 의해 생산되었건 간에 단량체 형태 또는 다량체 형태의 분자들을 포함한다.
링커
본 발명의 융합 복합체는 또한, 바람직하게 IL-15 또는 IL-15Rα 도메인들과 생물 활성 폴리펩티드 사이에 놓인 가요성 링커 서열을 포함하기도 한다. 링커 서열은 IL-15 또는 IL-15Rα 도메인들에 대하여 생물 활성 폴리펩티드가 효과적으로 배치되는 것을 허용함으로써, 상기 두 도메인의 기능상의 활성이 발휘될 수 있도록 만들어야 한다.
임의의 경우들에 있어서, 가용성 융합 단백질 복합체는 링커를 가지는데, 이때 제1 생물 활성 폴리펩티드는 폴리펩티드 링커 서열에 의하여 IL-15(또는 이의 기능성 단편)에 공유 결합된다. 다른 양태들에서, 본원에 기술된 바와 같은 가용성 융합 단백질 복합체는 링커를 가지는데, 이때 제2 생물 활성 폴리펩티드는 폴리펩티드 링커 서열에 의하여 IL-15Rα 폴리펩티드(또는 이의 기능성 단편)에 공유 결합된다.
링커 서열은, 바람직하게 뉴클레오티드 서열에 의해 암호화되고, 그로 말미암아 항원을 인지하기 위한 항체 분자의 결합 도메인 또는 제시되는 항원을 인지하기 위한 TCR 분자의 결합 홈(binding groove)을 효과적으로 배치할 수 있는 펩티드가 생성된다. 본원에 사용된 바와 같이 "IL-15 또는 IL-15Rα 도메인에 대하여 생물 활성 폴리펩티드를 효과적으로 배치하는 것"이란 어구 또는 기타 유사한 어구는, IL-15 또는 IL-15Rα 도메인에 결합된 생물 활성 폴리펩티드가, IL-15 또는 IL-15Rα 도메인이 서로간에 상호작용을 하여 단백질 복합체를 형성할 수 있도록 배치되는 것을 의미하도록 의도된다. 예를 들어 IL-15 또는 IL-15Rα 도메인은, 면역 세포와의 상호작용이 면역 반응을 개시 또는 억제하거나, 세포의 발달을 억제 또는 자극하는 것을 허용하도록 효과적으로 배치된다.
본 발명의 융합 복합체는 또한, 바람직하게 IL-15 또는 IL-15Rα 도메인들과 면역글로불린 Fc 도메인 사이에 놓인 가요성 링커 서열을 포함한다. 링커 서열은 Fc 도메인, 생물 활성 폴리펩티드, 그리고 IL-15 또는 IL-15Rα 도메인들의 효과적 배치를 허용함으로써, 각각의 도메인의 기능상 활성을 발휘시킬 수 있어야 한다. 예를 들어 Fc 도메인은 적절한 융합 단백질 복합체의 형성을 허용하고/허용하거나 면역 세포상 Fc 수용체 또는 보체계의 단백질과의 상호작용을 허용하여 옵소닌화, 세포 용해, 비만 세포, 호염기구 및 호산구의 탈과립화와, 기타 Fc 의존적 과정; 보체 경로의 활성화; 및 융합 단백질 복합체의 생체 내 반감기 연장을 비롯한 Fc 매개 효과를 자극하도록 효과적으로 배치된다.
링커 서열은 또한 생물 활성 폴리펩티드의 폴리펩티드 2개 이상을 결합시켜, 원하는 기능상 활성을 가지는 단일 사슬 분자를 제조하는데 사용될 수 있다.
바람직하게 링커 서열은 약 7개 아미노산 내지 약 20개 아미노산, 더욱 바람직하게 약 10개 아미노산 내지 약 20개 아미노산을 포함한다. 링커 서열은 생물 활성 폴리펩티드 또는 효과기 분자가 하나의 원치않는 형상으로 고정되지 않도록 가요성인 것이 바람직하다. 링커 서열은, 예를 들어 융합된 분자로부터 인지 부위를 이격시키는데 사용될 수 있다. 구체적으로 펩티드 링커 서열은 생물 활성 폴리펩티드와 효과기 분자 사이에 배치되어, 예컨대 이 생물 활성 폴리펩티드와 효과기 분자를 화학적으로 가교시키고, 분자 가요성을 제공할 수 있다. 링커는 가요성을 제공하기 위해, 바람직하게 주로 소형 측쇄를 가지는 아미노산, 예컨대 글리신, 알라닌 및 세린을 포함한다. 바람직하게 링커 서열 약 80% 또는 약 90%, 또는 이 이상은 글리신, 알라닌 또는 세린 잔기를 포함하며, 특히 글리신 및 세린 잔기를 포함한다.
항체의 가변 영역들을 하나로 성공적으로 결합시키는데 사용되었던 다수의 가요성 링커 디자인들 중 임의의 것을 비롯한 상이한 링커 서열이 사용될 수 있었다(문헌(Whitlow, M. 등 (1991) Methods: A Companion to Methods in Enzymology, 2:97-105) 참조).
입양 세포 요법
입양 세포 요법 (ACT) (동종 이계 및 자가 조혈 줄기 세포 이식 (HSCT) 및 재조합 세포 (즉, CAR T) 요법 포함)은 많은 악성 질환에 대한 치료법이다 (HSCT 및 입양 세포 요법 접근법에 대한 검토을 위해서는, Rager & Porter, Ther Adv Hematol (2011) 2 (6) 409-428; Roddie & Peggs, Expert Opin. Biol. Ther. (2011) 11 (4):473-487; Wang 등, Int. J. 암:(2015) 136, 1751-1768; 및 Chang, YJ 및 XJ Huang, Blood Rev, 2013. 27 (1):55-62 참조하면 된다). 이러한 입양 세포 요법은 동종 이계 및 자가 조혈 줄기 세포 이식, 공여자 백혈구 (또는 림프구) 주입 (DLI), 종양 침윤 림프구의 입양 전달, 또는 T 세포 또는 NK 세포의 입양 전달 (재조합 세포, 즉 CAR T, CAR NK를 포함)을 포함하지만, 이에 제한되지 않는다. 방사선 및 화학 요법 후 공여자 유래 세포가 조혈을 재구성할 필요성을 넘어서, 전달된 세포로부터의 면역학적 재구성은 잔류 종양 세포의 제거에 중요하다. 악성 종양의 치료 적 옵션으로서의 ACT의 효능은 공여자 세포의 기원, 조성 및 표현형 (림프구 서브 세트, 활성화 상태), 기저 질환, 이식 전 컨디셔닝 요법 및 이식 후 면역 지원 (즉, IL-2 요법) 및 이식편 내의 공여자 세포에 의해 매개되는 이식편 대 종양 (GVT) 효과를 포함한 다수의 요인에 의해 영향을 받는다. 또한, 이들 인자는 전형적으로 숙주 내에서 공여 세포의 컨디셔닝 요법 및/또는 과도한 면역 활성으로 인한, 이식 관련 사망률과 균형을 이루어야 한다 (즉, 이식 대 숙주 질환, 시토카인 발현 증후군 등).
입양 NK 세포 요법을 이용하는 접근법은 상당한 관심을 끌고있다. 자가 HSCT를 받는 환자에서, 혈액 NK 세포 수는 이식 후 매우 일찍 회복되며 NK 세포의 수준은 긍정적인 결과와 상관 관계가 있다 (Rueff 등, 2014, Biol. Blood Marrow Transplant. 20, 896-899). 자가 NK 세포 전달을 갖는 치료 전략이 다수의 요인으로 인해 제한적인 성공을 거두었지만, 생체 외 활성화된 동종 이계 (또는 일배체 동일) NK 세포의 입양 전달은 암에 대한 유망한 면역 치료 전략으로 떠오르고 있다 (Guillerey 등, 2016. Nature Immunol. 17:1025-1036). 이들 세포의 활성은 자가 NK 세포와 비교하여 자기 MHC 분자에 의해 억제될 가능성이 적다. 다수의 연구에 따르면, 종양 세포에 대한 동종 이동성을 이용하기 위해 반수체 NK 세포를 이용한 입양 요법이 안전하고 AML 환자에서 유의한 임상 활성을 매개할 수 있는 것으로 밝혀졌다. 이러한 발견을 더 취하여, 최근의 연구는 NK 세포 또는 NK 전구체 (즉, 줄기 세포) 및 이식 전 컨디셔닝 및 이식 후 면역 지원 전략; NK 세포주 또는 재조합 종양-표적화 NK 세포의 사용; 치료제 Ab, 면역 조절제 (레날리도마이드), 및 항 -KIR 및 체크 포인트 Ab와 같은 다른 제제와의 조합 요법의 평가에 대한 생체 외 활성화/확장 방법의 최적화에 초점을 맞추고 있다. 각각의 경우에, 이들 전략은 본 발명의 융합 단백질 복합체에 의해 보완될 수 있으며, 이는 NK 세포 증식 및 활성화를 증대시키는 능력을 갖는다. 본원에 나타낸 바와 같이, 본 발명의 융합 단백질 복합체와 NK 세포의 생체 외 배양은 상승된 활성화 마커, 종양 세포에 대한 증가된 세포 독성 및 IFN-γ의 증가된 생산을 나타내는 CIML NK 세포의 유도를 초래한다. 또한, 본 발명의 융합 단백질 복합체는 인간 NK 세포주를 활성화시킬 수 있다. 또한, 본 발명의 융합 단백질 복합체의 직접 투여 또는 본 발명의 융합 단백질 복합체에 의해 활성화된 면역 세포의 투여에 의해 면역 반응을 증대시키고 신 생물 및 감염 질환을 치료하는 방법이 제공된다.
자연살해 세포: 순환하는 단핵 세포의 주요 유형 중 하나는 자연 살해자 또는 NK 세포의 것이다 (M. Manoussaka 등, Journal of Immunology 158:112-119, 1997). 원래 특정 종양과 바이러스에 감염된 세포를 죽이는 능력에 기초하여 정의된 NK 세포는 이제 초기 선천 면역계의 구성 요소 중 하나로 알려져 있다. NK 세포는 그들의 세포 독성 기능 외에도, 다양한 시토카인을 방출함으로써 면역 반응의 조절자로 작용한다. 또한, 복잡한 면역 반응의 생성은 NK 세포 상에 발현된 다양한 표면 분자를 통해 NK 세포와 다른 세포와의 직접적인 상호 작용에 의해 촉진된다.
NK 세포는 골수 전구체로부터 유래된다 (O. Haller 등, Journal of Experimental Medicine 145:1411-1420, 1977). NK 세포는 T 세포와 밀접한 관련이있는 것으로 보이고, 두 세포 유형은 많은 세포 표면 마커를 공유한다 (M. Manoussaka 등, 1997). 위에서 언급한 바와 같이, 이들 세포 표면 마커는 NK 세포 활성에서 중요한 역할을 한다. 예를 들어, 뮤린 NK 세포는 표면에서 특정 항원, 예컨대 아시알로 GM1, NK1 및 NK2 항원을 발현하고 (D. Scand. J. Immunol. 46:217-224, 1997 참조), 이들 항원에 대한 항체의 투여는 체내에서 NK 세포의 고갈을 초래한다 (Id.).
세포 독성 T 림프구 (CTL)와 유사하게, NK 세포는 다양한 세포 유형을 용해시킴으로써 세포 독성 효과를 발휘한다 (Srivastava, S., Lundqvist, A. & Childs, RW 암에 대한 자연살해 세포 면역 요법:새로운 희망 Cytotherapy 10, 775?783; 2008). 여기에는 정상 줄기 세포, 감염된 세포 및 형질 전환 세포가 포함된다. 세포의 용해는 프로테아제, 뉴클레아제 및 퍼포린을 함유하는 세포질 과립의 작용을 통해 일어난다. MHC 클래스 I이 결여된 세포는 또한 NK 세포 매개 용해에 취약하다 (H. Reyburn 등, Immunol. Rev. 155:119-125, 1997). 또한, NK 세포는 비 MHC 제한 방식으로 세포 독성을 발휘한다 (E. Ciccione 등, J. Exp. Med. 172:47, 1990; A. Moretta 등, J. Exp. Med. 172:1589 및 1990; 및 E. Ciccione 등, J. Exp. Med. 175:709). NK 세포는 또한 항체-의존성 세포 세포 독성에 의해 세포를 용해시킬 수 있다.
상기 언급한 바와 같이, NK 세포는 인터페론 γ (IFN-γ), 과립구-대식세포 콜로니 자극 인자 (GM-CSF), 종양 괴사 인자 α (TNF-α), 대식세포 콜로니 자극 인자 (M-CSF), 인터루킨-3 (IL-3) 및 IL-8와 같은 시토카인의 분비를 통해 그들의 기능 중 일부를 매개한다. NK 세포 세포 독성 활성은 세포 독성 활성의 미세 조정 제어를 가능하게 하여 건강한 세포에 대한 세포 독성을 방지하면서 종양 세포에 대한 효과적인 세포 독성 용량을 유지하는 활성화 및 억제 수용체의 균형을 통해 조절된다. 실제로 여러 연구에서 NK 세포의 효과적인 암 면역 요법으로서의 가능성을 강조하면서 입양 NK 세포 전달과 임상 항암 효과의 안전성을 입증했다 (Parkhurst, MR, 등, Clin Cancer Res 17, 6287-6297 (2011) ); Ruggeri, L. 등 Science 295, 2097-2100, (2002); Miller, JS 등 Blood 105, 3051-3057, (2005; Bachanova, V. 등 al Blood 123, 3855?3863, (2014); Rubnitz, J.E. 등, J Clin Oncol 28, 955-959, (2010)). 예를 들어 IL-2, IL-12, TNF-α 및 IL-1을 포함한 시토카인은 NK 세포를 유도하여 시토카인을 생성할 수 있다. IFN-α 및 IL-2는 NK 세포 세포 독성 활성의 강력한 유도제이다 (G. Trinichieri 등, Journal of Experimental Medicine 160:1147-1169, 1984; G. Trinichieri and D. Santoli, Journal of Experimental Medicine). IL-2의 존재는 NK 세포를 자극하고 확장시킨다 (K. Oshimi, International Journal of Hematology 63:279-290, 1996). IL-12는 T와 NK 세포로부터 시토카인 생성을 유도하고 NK 세포 매개 세포 독성을 증가시키는 것으로 나타났다 (M. Kobayashi 등, Journal of Experimental Medicine 170:827-846, 1989).
NK 세포는 암 확산에 대한 내성 및 제어 둘 다에 관여한다. 암 면역 감시 개념의 출현 이후, 면역 세포, 특히 T 세포 및 자연살해 (NK) 세포의 입양 전달은 암에 대한 면역 시스템을 이용하는 표적화 방법으로 등장했다 (Kroemer, G., Senovilla, L., Galluzzi, L., Andre, F. & Zitvogel, L. 유방암의 자연 및 치료 유도 면역 감시. Nat Med 21, 1128-1138, (2015)). NK 세포는 암 치료를 위한 유망한 면역 치료제로서 큰 주목을 받고 있다. NK 세포는 악성 세포에 대한 자연적인 세포 독성 때문에 암에 대한 신체의 첫 방어선으로 중요하다 (Srivastava, S. 등, Cytotherapy 10, 775-783; 2008).
NK 세포는 말초 혈액 및 제대혈 (CB)을 포함한 여러 소스에서 확장되었다 ((Denman, C. J. 등, 막 결합 IL-21은 인간의 자연살해 세포의 지속적인 생체 외 증식을 촉진. PLoS One 7, e30264, (2012); Knorr, D. A. 등, 암 치료를 위한 인간 다능성 줄기 세포에서 자연살해 세포의 임상적 규모의 유래. Stem Cells Transl Med 2, 274-283, (2013); Shah, N. 등, 인간 제대혈의 항원 제시 세포 매개 확장은 항-골수종 활성을 갖는 자연 살해 세포의 로그-규모 확장을 제공. PLoS One 8, e76781, (2013); Woll, P. S. 등, 인간 배아 줄기 세포는 강력한 체내 항 종양 활성을 갖는 균질 자연 살해 세포 집단으로 분화. Blood 113, 6094-6101, (2009)). 생체 외 NK 세포 확장 방법은 인공 항원 제시 세포(aAPC)와 함께 시토카인을 피더 세포로 사용하여 개발되었다 ((Denman C.J. 등의 PLoS One 7, e30264, (2012); Berg, M. 등, Cytotherpy 11, 341-355, (2009); Gong W. 등의 조직 항원 76, 467-475, (2010); Zhang, H. 등, J Immunother 34, 187-195, (2011)).
노화 세포 및 연령 관련 병리에서 시토카인 기반 요법
손상된 세포는 아포프토시스 또는 노화를 겪는다. 노화 세포는 그들 자신의 증식을 방지하고 신호 전달 분자를 분비한다 - 노화 관련 분비 표현형 (SASP)으로 알려진 현상 (Coppe J.P. 등, 2010 Annu Rev Pathol 5:99-118). SASP는 면역 세포를 모아 조직 복구에 관여하도록 손상이 적은 이웃 세포를 자극하여 조직 기능을 회복시키는 것이 제안된다 (Demaria M. 등, 2014 Dev. Cell 31:722-733). 이러한 면역 세포는 노화 세포를 제거하여 SASP 매개 신호를 끊는다. 손상이 복구 능력을 초과하거나 면역 세포가 SASP의 영향에 반응하지 않으면, 노화 세포의 이상 축적이 발생한다. 결과적으로, 노화 세포는 노화 및/또는 손상된 기관에 축적되고 조직 기능 장애를 악화시킨다 (Ovadya Y. 및 Krizhanovsky V. 등, 2014 Biogerontology 15:627-642). 노화 세포의 제거는 건강한 수명을 증가시키고 마우스에서 연령 관련 질환의 중증도를 감소시키는 것으로 나타났다 (Baar M.P. 등, 2017 Cell 169:132-147; Baker DJ 2016 530:184-189).
따라서 생리적 노화는 노화 세포의 출현과 관련이 있다. 노화 세포가 조직 항상성과 기능을 손상시키고 이들의 축적이 노화 관련 병리의 발달에 기여한다는 증거가 있다 (Baker DJ 등, 2008 Nat Cell Biol 10:825-836; Baker DJ 등, 2016, 530:184-189). 수명이 짧아지는 것 외에도, 노화 세포는 신진 대사 (비만, 당뇨병), 신경계 (알츠하이머 병 및 파킨슨 병), 근육, 뼈 및 연골 관련 (사르코 니아, 골관절염, 후만증, 허리 디스크) 또는 조직 기능 장애 관련 (폐 폐기종, 심혈관 및 신장 질환 및 동맥 경화) 질환 등의 병리와 관련이 있다. 연구에 따르면, 고착화된 적응성 면역계가 노화 세포의 인식 및 제거에 관여하는 것으로 나타났다 (Soto-Gamez A. 및 Demaria M., 2017 Drug Discovery Today 22:786-795; Hazeldine J. ㅁ및 Lord, JM, 2013 Aging Research Reviews 12:1069-1078). 예를 들어, NK 세포는 과립 엑소사이토시스 경로를 통해 노화 세포를 제거하는 것으로 입증되었다. 따라서, 이러한 반응을 증가시키는 것은 노화 감시의 자연적 메커니즘을 증가시키고 노화 세포 관련 병리를 감소시킬 수 있다. 또한, 퍼포린 매개 NK 세포 세포독성이 연령에 관련해서 감소하는 것은 노화된 조직에서 노화 세포의 빈도가 증가하는 것에 일부 책임이 있다고 제안되었다 (Rukavina D. 등, Blood 92:2410-2420; Sagiv A. 등, 2012 Oncogene 1-7). 간 섬유증에서, 노화 활성화된 성상 세포의 축적은 NKG2D 수용체가 없는 마우스에서 증가되어, NK 세포의 주요 활성화 수용체가 되고 섬유증을 증가시킨다 (Sagiv A. 등, 2016 Aging 8:328-344).
본 발명의 IL-7/IL-21/TxM 복합체는 NK 및 T 세포를 포함하는 선천성 및 적응성 면역 세포 둘 다의 세포 독성을 향상시키는 강력한 활성을 갖는 것으로 입증되었다. 본원에 개시된 바와 같이, IL-7/IL-21/TxM 복합체는 노화 세포에 대한 면역 반응을 활성화 및/또는 유지하고 노화 방지 치료제로서의 잠재적인 용도를 가질 것으로 예상된다. 지시된 바와 같이, IL-7/IL-21/TxM 복합체는 NK 및 T 세포 둘 다에 보다 강력한 면역 자극을 제공하는데 있어 개별 시토카인에 비해 이점을 갖는다. 또한, IL-7/IL-21/TxM 복합체에 의해 생체 외 자극된 면역 세포는 노화 세포 및/또는 연령 관련 질환의 치료를 위한 입양 세포 이식에 사용될 수 있다. 이러한 요법은 입양 NK 또는 T 세포 요법일 수 있다. 입양 세포 이식 후 IL-7/IL-21/TxM 복합체의 투여는 또한 전달된 세포의 증식, 활성화 및 지속성을 지지하기 위해 수행 될 수 있다.
약학 치료제
본 발명은 치료제로서 사용되기 위한 융합 단백질 복합체를 포함하는 약학 조성물을 제공한다. 일 양태에서, 본 발명의 융합 단백질 복합체는, 예를 들어 약학적으로 허용 가능한 완충제, 예컨대 생리 식염수 중에 제제화되어 전신 투여된다. 환자에 본 조성물 유효 수준만큼을 연속적이면서도 지속적으로 제공하는데 바람직한 투여 경로로서는, 예를 들어 방광에의 점적 주입, 피하, 정맥내, 복막내, 근육내, 종양내 또는 피내 주사를 포함한다. 인간 환자 또는 기타 동물의 치료는, 생리적으로 허용 가능한 담체 중 본원에 동정된 치료제 치료적 유효량이 사용되어 수행된다. 적합한 담체 및 이의 제제는, 예를 들어 문헌(Remington's Pharmaceutical Sciences by E. W. Martin)에 기술되어 있다. 투여될 치료제의 양은, 투여 방식, 환자의 나이와 체중, 그리고 신생물형성의 임상 증상에 따라서 달라진다. 일반적으로 그 양은, 신생물형성, 자가면역성 질환 또는 감염성 질환과 연관된 기타 질환의 치료에 사용되는 기타 제제에 적용되는 양의 범위일 것이지만, 임의의 경우 화합물의 증가한 특이성으로 말미암아 그보다 더 적은 양이 필요할 것이다. 화합물은, 당 업자에게 공지된 방법에 의해 측정되는 바에 따르면, 대상체의 면역 반응을 증진시키거나, 신생물형성, 감염 또는 자가면역 세포의 증식, 생존 또는 침습을 감소시키는 투여량으로 투여된다.
약학 조성물의 제제화
신생물형성, 감염성 질환, 노화 세포나 연령 관련 또는 자가면역성 질환을 치료하기 위한 본 발명의 융합 단백질 복합체의 투여는, 다른 성분들과 합하여졌을 때 상기 신생물형성, 감염성 질환, 노화 세포나 연령 관련 또는 자가면역성 질환을 완화, 감소 또는 안정화하기 효과적인 치료제 농도를 달성하는데 적합한 임의의 방법에 의해 이루어진다. 본 발명의 융합 단백질 복합체는 임의의 적당량만큼 임의의 적합한 담체 물질 중에 용해되어 함유될 수 있는데, 일반적으로는 본 조성물 총 중량을 기준으로 1 중량% 내지 95 중량%의 양만큼 존재한다. 본 조성물은 비경구 투여 경로(예컨대 피하, 정맥내, 근육내, 방광내, 종양내 또는 복막내 투여 경로)에 적합한 투여형으로 제공될 수 있다. 예를 들어 본 약학 조성물은 종래의 약학 실무에 따라 제제화된다(예를 들어 문헌(Remington: The Science and Practice of Pharmacy(20th ed.), ed. A. R. Gennaro, Lippincott Williams & Wilkins, 2000 and Encyclopedia of Pharmaceutical Technology, eds. J. Swarbrick and J. C. Boylan, 1988-1999, Marcel Dekker, New York) 참조).
인간에의 투여량은 숙련자가, 동물 모델에 대한 투여량에 비준하여 인간에 대한 투여량을 맞추는 것이 통상적인 일이라 당 업자가 인지하는 바와 같이, 처음에 마우스나 인간 이외의 영장류에 적용되었던 화합물 양으로부터 외삽함으로써 결정된다. 예를 들어 투여량은 체중 1 kg당 화합물 약 1 mg 내지 체중 1 kg당 화합물 약 5000 mg; 또는 체중 1 kg당 화합물 약 5 mg 내지 체중 1 kg당 화합물 약 4000 mg; 또는 체중 1 kg당 화합물 약 10 mg 내지 체중 1 kg당 화합물 약 3000 mg; 또는 체중 1 kg당 화합물 약 50 mg 내지 체중 1 kg당 화합물 약 2000 mg; 또는 체중 1 kg당 화합물 약 100 mg 내지 체중 1 kg당 화합물 약 1000 mg; 또는 체중 1 kg당 화합물 약 150 mg 내지 체중 1 kg당 화합물 약 500 mg으로 다양할 수 있다. 예를 들어 용량은 체중 1 kg당 약 1, 5, 10, 25, 50, 75, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1,000, 1,050, 1,100, 1,150, 1,200, 1,250, 1,300, 1,350, 1,400, 1,450, 1,500, 1,600, 1,700, 1,800, 1,900, 2,000, 2,500, 3,000, 3,500, 4,000, 4,500 또는 5,000 mg이다. 대안적으로, 용량은 체중 1 kg당 화합물 약 5 mg 내지 체중 1 kg당 화합물 약 20 mg의 범위에 있다. 다른 예에서, 용량은 체중 1 kg당 약 8, 10, 12, 14, 16 또는 18 mg이다. 바람직하게 본 융합 단백질 복합체는 0.5 mg/kg 내지 약 10 mg/kg(예컨대 0.5, 1, 3, 5, 10 mg/kg)으로 투여된다. 물론 상기 투여량은, 이러한 치료 프로토콜에서 통상적으로 행하여지는 바와 같이 초기 임상 시험 결과와 특정 환자의 필요에 따라 상향 또는 하향 조정될 수 있다.
약학 조성물은 적당한 부형제와 함께 투여시 제어되는 방식으로 치료제를 방출하는 약학 조성물로 제제화된다. 그 예로서는 단일 또는 다수 단위 정제 또는 캡슐 조성물, 오일 용액, 현탁액, 에멀전, 마이크로캡슐, 미소구, 분자 복합체, 나노입자, 패치 및 리포좀을 포함한다. 바람직하게 본 융합 단백질 복합체는 비경구 투여에 적합한 부형제 중에 제제화된다.
비경구 조성물
본 발명의 융합 단백질 복합체를 포함하는 약학 조성물은 투여형, 제제로서 주사, 주입 또는 이식(피하, 정맥내, 근육내, 종양내, 방광내, 복막내)에 의해 비경구 투여되거나, 또는 종래의 약학적으로 허용 가능한 무독성 담체 및 보조제를 함유하는 적합한 전달 장치나 이식물을 통하여 비경구 투여된다. 이러한 조성물의 제제 및 제조물은 약학 제제 분야의 숙련자들에게 널리 공지되어 있다. 제제에 관하여는 문헌(Remington: The Science and Practice of Pharmacy, 상동)에서 살펴볼 수 있다.
본 발명의 융합 단백질 복합체를 포함하는 비경구 투여용 조성물은 단위 투여형(예컨대 단일 용량 앰플)으로 제공된다. 대안적으로 본 조성물은 수 회의 용량이 담겨 있으며, 적합한 보존제가 첨가될 수 있는 바이알로서 제공된다(하기 참조). 본 조성물은 용액, 현탁액, 에멀전, 주입 장치 또는 이식용 전달 장치의 형태를 가지거나, 또는 사용전 물이나 다른 적합한 비이클로 재구성될 건조 분말로서 제공된다. 신생물형성, 감염성 질환, 노화 세포나 연령 관련 또는 자가면역성 질환을 감소 또는 완화하는 활성 제제와는 별도로, 본 조성물은 비경구 투여가 허용되는 적합한 담체 및/또는 부형제를 포함한다. 활성 치료제(들)는 제어 방출을 위해 미소구, 마이크로캡슐, 나노입자, 리포좀에 혼입될 수 있다. 더욱이 본 조성물은 현탁제, 가용화제, 안정화제, pH 조정제, 긴장성 조정제 및/또는 분산제를 포함할 수 있다.
상기 명시된 바와 같이, 본 발명의 융합 단백질 복합체를 포함하는 약학 조성물은 멸균 주사에 적합한 형태를 가질 수 있다. 이러한 조성물을 제조하기 위하여, 적합한 활성 치료제(들)가 비경구 투여가 허용되는 액체 비이클에 용해 또는 현탁된다. 사용될 수 있는 허용 가능 비이클 및 용매로서는 물이 있는데, 이 물의 pH는 적당량의 염화수소산, 수산화나트륨 또는 적합한 완충제, 1,3-부탄디올, 링거 용액 및 등장성 염화나트륨 용액 및 덱스트로스 용액을 첨가함으로써 적합하게 조정된다. 수성 제제는 또한 보존제(예컨대 메틸, 에틸 또는 n-프로필 p-하이드록시벤조에이트) 하나 이상을 함유할 수 있다. 화합물들 중 하나가 물에 거의 녹지 않거나 약간만 녹는 경우, 용해촉진제 또는 가용화제가 첨가될 수 있거나, 아니면 용매는 프로필렌글리콜을 10 %w/w 내지 60 %w/w 포함할 수 있다.
본 발명은 신생물형성, 감염성 질환, 노화 세포나 연령 관련 질환이나 이의 증상들을 치료하는 방법으로서, 본원의 화학식을 가지는 화합물을 포함하는 약학 조성물 치료적 유효량만큼을 대상체(예컨대 포유동물, 예컨대 인간)에 투여하는 단계를 포함하는 방법을 제공한다. 그러므로 일 구현예는, 신생물형성, 감염성 질환, 노화 세포나 연령 관련 질환이나 이의 증상들을 앓고 있거나 이에 취약한 대상체를 치료하는 방법이다. 이 방법은 질환 또는 장애가 치료되는 조건 하에 해당 질환 또는 장애 또는 이의 증상들을 치료하기 충분한, 본원의 화합물 치료량만큼을 포유동물에 투여하는 단계를 포함한다.
본원의 방법은, 본원에 기술된 화합물 또는 본원에 기술된 조성물 유효량을 대상체(상기와 같은 치료를 필요로 하는 것으로 확인된 대상체 포함)에 투여하여 상기와 같은 효과를 얻는 단계를 포함한다. 상기와 같은 치료를 필요로 하는 대상체를 확인하는 것은, 대상체 또는 건강 관리 전문가의 판단에 의할 수 있으므로, 주관적일 수 있거나(예컨대 의견에 의할 수 있거나) 또는 객관적일 수 있다(예컨대 시험 또는 진단 방법에 의해 확인될 수 있다).
(예방적 치료를 포함하여) 본 발명의 치료 방법은, 일반적으로 본원의 화합물, 예컨대 본원의 화학식을 가지는 화합물 치료적 유효량을, 포유동물, 구체적으로 인간을 포함하여 치료를 필요로 하는 대상체(예컨대 동물, 인간)에 투여하는 단계를 포함한다. 이러한 치료는 신생물형성, 감염성 질환, 자가면역성 질환, 노화 세포나 연령 관련 질환, 장애 또는 이의 증상들을 앓고 있거나, 발병하였거나, 취약하거나 또는 발병 위험이 있는 대상체, 구체적으로는 인간에게 적합하게 수행될 것이다. 이처럼 "발병 위험이 있는" 대상체인지의 결정은 진단 시험이나, 대상체 또는 건강 관리 제공자의 의견에 따라 (예컨대 유전자 시험, 효소 또는 단백질 마커, (본원에 정의된 바와 같은) "마커(Marker)" 및 가족력 등에 따라) 임의의 객관적 결정 또는 주관적 결정에 의해 이루어질 수 있다. 본 발명의 융합 단백질 복합체는 면역 반응의 증가가 요망되는 기타 임의의 장애를 치료하는데 사용될 수 있다.
본 발명은 또한 치료 과정을 모니터링하는 방법도 제공한다. 이 방법은, 본원의 화합물이 어떤 질환 또는 이의 증상을 치료하는데 충분한 치료량만큼 투여된 대상체로서, 신생물형성과 연관된 해당 장애 또는 이의 증상을 앓고 있거나 이에 취약한 대상체를 대상으로, 진단 마커(Marker)(예컨대 본원의 화합물, 단백질 또는 이의 지표 등에 의해 조정되는, 본원에 기술된 임의의 표적)의 수준을 측정하는 단계, 또는 진단을 위한 측정 단계(예컨대 스크리닝, 검정)를 포함한다. 본 방법에서 측정된 "마커"의 수준은, 건강한 정상 대조군 또는 다른 발병 환자에 대해 공지된 "마커"수준과 비교될 수 있으며, 이로써 대상체의 질환 상태가 확립될 수 있다. 몇몇 경우들에 있어서, 대상체 내 "마커"의 2차 수준은 1차 수준의 측정 시점보다 나중의 시점에 측정되고, 이 두 가지 수준이 비교되어, 해당 질환의 경과와 치료법의 효능이 모니터링된다. 임의의 양태들에서, 대상체 내 "마커"의 치료전 수준은, 본 발명에 따른 치료를 시작하기 전에 측정되고; 추후 "마커"의 이 같은 치료전 수준은 치료 개시후 대상체 내 "마커" 수준과 비교될 수 있으며, 그 결과 치료의 효능이 확인될 수 있다.
병행 치료법
선택적으로 본 발명의 융합 단백질 복합체는 기타 임의의 표준 치료법이 수행됨과 아울러 투여되는데; 이러한 방법은 당 업자에게 공지된 방법으로서, 문헌(Remington's Pharmaceutical Sciences by E. W. Martin)에 기술되어 있다. 원한다면 본 발명의 융합 단백질 복합체는 종래의 임의 항신생물형성 치료법, 예컨대 면역요법, 치료 항체 투여, 표적 치료법, 수술, 방사선 요법 또는 화학 요법(이에 한정되는 것은 아님)이 수행됨과 아울러 투여된다.
키트 또는 약학 시스템
본 발명의 융합 단백질 복합체를 포함하는 약학 조성물은, 신생물형성, 감염성 질환 또는 노화 세포나 연령 관련 질환을 완화하는데 사용되기 위한 키트나 약학 시스템에 통합될 수 있다. 본 발명의 이러한 양태에 따른 키트 또는 약학 시스템은 내부에 하나 이상의 용기 수단, 예컨대 바이알, 튜브, 앰플 및 병 등이 빽빽하게 담겨있는 운반 수단, 예컨대 박스, 갑, 튜브를 포함한다. 본 발명의 키트나 약학 시스템은 본 발명의 융합 단백질 복합체 사용에 관련된 지침을 하나의 구성품으로서 포함할 수 있다.
재조합 단백질 발현
일반적으로 본 발명의 융합 단백질 복합체(예컨대 TxM 복합체의 성분들)의 제조는 본원에 개시된 방법과, 인지된 재조합 DNA 기술에 의해 달성될 수 있다.
일반적으로 재조합 폴리펩티드는 적합한 숙주 세포를, 폴리펩티드 암호화 핵산 분자 또는 이의 단편 전부 또는 일부를 포함하는 적합한 발현 비이클로 형질전환시킴으로써 제조된다. 분자생물학 분야의 숙련자들은, 다양한 발현계들 중 임의의 것이 재조합 단백질을 제공하는데 사용될 수 있음을 이해할 것이다. 사용된 숙주 세포가 정확히 무엇인지는 본 발명에 있어서 중요하지 않다. 재조합 폴리펩티드는 실질적으로 임의의 진핵생물 숙주(예컨대 사카로마이세스 세레비지아에(Saccharomyces cerevisiae), 곤충 세포, 예컨대 Sf21 세포, 또는 포유동물 세포, 예컨대 NIH 3T3, HeLa, 또는 바람직하게 COS 세포) 내에서 생산될 수 있다. 이러한 세포는 다양한 공급처(예컨대 미국 모식균 배양 수집소(American Type Culture Collection)(Rockland, Md.)로부터 입수 가능하다(예를 들어 문헌(Ausubel 등, Current Protocol in Molecular Biology, New York: John Wiley and Sons, 1997)도 참조). 형질감염 방법과 발현 비이클을 선택하는 것은, 선택된 숙주계에 따라 달라질 것이다. 형질전환 방법은, 예컨대 문헌(Ausubel 등 (상동))에 기술되어 있으며; 발현 비이클은, 예컨대 문헌(Cloning Vectors: A Laboratory Manual (P. H. Pouwels 등, 1985, Supp. 1987)에 제공된 것들로부터 선택될 수 있다.
다양한 발현계가 재조합 폴리펩티드의 제조를 위해 존재한다. 이러한 폴리펩티드를 제조하는데 유용한 발현 벡터로서는 염색체, 에피좀 및 바이러스 유래 벡터, 예컨대 세균 플라스미드 유래 벡터, 박테리오파아지 유래 벡터, 트랜스포존 유래 벡터, 효모 에피좀 유래 벡터, 삽입 요소 유래 벡터, 효모 염색체 요소 유래 벡터, 바큘로바이러스, 파포바 바이러스(예컨대 SV40), 백시니아 바이러스, 아데노바이러스, 계두바이러스, 위광견병 바이러스 및 레트로바이러스와 같은 바이러스 유래 벡터, 그리고 이것들의 조합으로부터 유래하는 벡터를 포함하나, 이에 한정되는 것은 아니다.
일단 재조합 폴리펩티드가 발현되면, 이 폴리펩티드는, 예컨대 친화성 크로마토그래피를 사용하여 단리된다. 일례에서, (예컨대 본원에 기술된 바와 같이 제조된) 항체로서, 이 폴리펩티드에 대해 생성된 항체는 컬럼에 부착되어, 재조합 폴리펩티드를 단리하는데 사용될 수 있다. 친화성 크로마토그래피 전 폴리펩티드를 품은 세포의 용해 및 분획화는 표준적 방법에 의해 수행될 수 있다(예컨대 문헌(Ausubel 등, 상동) 참조). 일단 단리되면, 재조합 단백질은 원할 경우, 예컨대 고성능 액체 크로마토그래피에 의해 더 정제될 수 있다(예컨대 문헌(Fisher, Laboratory Techniques In Biochemistry and Molecular Biology, eds., Work and Burdon, Elsevier, 1980) 참조).
본원에 사용된 바와 같이, 본 발명의 생물 활성 폴리펩티드 또는 효곽 분자는 시토카인, 케모카인, 성장 인자, 단백질 독소, 면역글로불린 도메인 또는 기타 생물 활성 단백질, 예컨대 효소와 같은 인자들을 포함할 수 있다. 또한 생물 활성 폴리펩티드는 다른 화합물, 예컨대 비단백질성 독소, 세포독성 제제, 화학요법제, 검출 가능한 표지, 방사성 물질 등과의 접합체를 포함할 수 있다.
본 발명의 시토카인은 다른 세포에 영향을 미치고 세포성 면역의 여러 다효성 중 임의의 것에 관여하는, 세포에 의해 생산되는 임의의 인자에 의해 한정된다. 시토카인의 예들로서는 IL-2 과, 인터페론(IFN), IL-10, IL-1, IL-17, TGF 및 TNF 시토카인 과, 그리고 IL-1 내지 IL-35, IFN-α, IFN-β, IFN-γ, TGF-β, TNF-α 및 TNF-β를 포함하나, 이에 한정되는 것은 아니다.
본 발명의 일 양태에서, 제1 단백질은 인터루킨-15(IL-15) 도메인 또는 이의 기능성 단편에 공유 결합된 제1 생물 활성 폴리펩티드를 포함한다. IL-15는 T 세포 활성화와 증식에 영향을 미치는 시토카인이다. 면역 세포 활성화 및 증식에 영향을 미치는 IL-15 활성은 어떤 면에서 IL-2의 활성과 유사하지만, 근본적인 차이점에 대해서는 특성규명이 잘 되어 있다(Waldmann, T A, 2006, Nature Rev. Immunol. 6:595-601).
본 발명의 또 다른 양태에서, 제1 단백질은, IL-15 변이체(본원에서는 IL-15 돌연변이체라고도 지칭됨)인 인터루킨-15(IL-15) 도메인을 포함한다. IL-15 변이체는, 바람직하게 원산(또는 야생형) IL-15 단백질의 아미노산 서열과 상이한 아미노산 서열을 포함한다. IL-15 변이체는, 바람직하게 IL-15Rα 폴리펩티드와 결합하여, IL-15 효현제 또는 길항제로서 작용한다. 바람직하게 효현제 활성을 가지는 IL-15 변이체는 강력 효현제 활성을 가진다. IL-15 변이체는 IL-15Rα와의 결합 여부에 의존하지 않고 IL-15 효현제 또는 길항제로서의 작용을 할 수 있다. IL-15 효현제는 야생형 IL-15의 생물 활성과 거의 동일하거나 증가한 생물 활성에 의해 실증된다. IL-15 길항제는 야생형 IL-15의 생물 활성에 비하여 감소한 생물 활성 또는 IL-15 매개 반응을 억제하는 능력에 의해 실증된다. 몇몇 예들에 있어서, IL-15 변이체는 IL-15RβγC 수용체에 증가한 활성 또는 감소한 활성으로 결합한다. 몇몇 경우들에 있어서, IL-15 변이체의 서열은 원산 IL-2 서열에 비하여 적어도 하나의 아미노산 변화, 예컨대 치환 또는 결실을 가지고, 이러한 변화는 IL-15 효현제 활성 또는 길항제 활성을 초래한다. 바람직하게 아미노산 치환/결실은, IL-15Rβ 및/또는 γC와 상호작용하는 IL-15의 도메인에서 일어난다. 더욱 바람직하게 아미노산 치환/결실은 IL-15Rα 폴리펩티드와의 결합 또는 IL-15 변이체 생산능에 영향을 미치지 않는다. IL-15 변이체를 생산하기 적합한 아미노산 치환/결실은 추정적 또는 공지의 IL-15 구조, 구조가 공지되어 있는 상동성 분자, 예컨대 IL-2와 IL-15의 비교, 합리적이거나 무작위의 돌연변이유발 및 기능 검정법(본원에 제공된 바와 같음) 또는 기타 실험 방법들을 바탕으로 동정될 수 있다. 추가로 적합한 아미노산 치환은 추가 아미노산들의 삽입과 보존적 또는 비보존적 변화일 수 있다. 바람직하게 본 발명의 IL-15 변이체는, 성숙한 인간 IL-15 서열상 6, 8, 10, 61, 65, 72, 92, 101, 104, 105, 108, 109, 111 또는 112번 위치에 1개 또는 1개 초과의 아미노산 치환/결실을 함유하고; 구체적으로 D8N("D8" 은 원산 성숙 인간 IL-15 서열의 아미노산 및 잔기 위치를 나타내고, "N"은 IL-15 변이체 내 해당 위치에 있는 치환된 아미노산 잔기를 나타냄), I6S, D8A, D61A, N65A, N72R, V104P 또는 Q108A 치환은 길항제 활성을 가지는 IL-15 변이체를 생성하고, N72D 치환은 효현제 활성을 가지는 IL-15 변이체를 생성한다.
케모카인은 시토카인과 유사하게, 다른 세포에 노출되었을 때 세포성 면역의 여러 다효성 중 임의의 것에 관여하는 임의의 화학 인자 또는 분자로서 정의된다. 적합한 케모카인으로서는 CXC, CC, C 및 CX3C 케모카인과, CCL-1 내지 CCL-28, CXC-1 내지 CXC-17, XCL-1, XCL-2, CX3CL1, MIP-1b, IL-8, MCP-1, 및 Rantes를 포함할 수 있으나, 이에 한정되는 것은 아니다.
성장 인자는 특정 세포에 노출될 때 노출된 세포의 증식 및/또는 분화를 유도하는 임의의 분자들을 포함한다. 성장 인자로서는 단백질 및 화학 분자를 포함하고, 이것들 중 몇몇은 GM-CSF, G-CSF, 인간 성장 인자 및 줄기세포 성장 인자를 포함한다. 추가의 성장 인자도 또한 본원에 기술된 용도로서 적합할 수 있다.
독소 또는 세포독성 제제로서는 세포에 노출되었을 때 성장에 치사 효과 또는 억제 효과를 보이는 임의의 물질을 포함한다. 더욱 구체적으로 효과기 분자는, 예컨대 식물이나 세균 기원의 세포 독소, 예컨대 디프테리아 독소(DT), 쉬가 독소, 아브린, 콜레라 독소, 리신, 사포린, 슈도모나스 외독소(PE), 미국자리공 항바이러스 단백질 또는 겔로닌일 수 있다. 이러한 독소의 생물 활성 단편은 당 분야에 널리 공지되어 있으며, 예컨대 DT A 사슬 및 리신 A 사슬을 포함한다. 추가로 독소는 세포 표면에서 활성인 제제, 예컨대 포스포리파아제 효소(예컨대 포스포리파아제 C)일 수 있다.
또한 효과기 분자는 화학요법 약물, 예컨대 빈데신, 빈크리스틴, 빈블라스틴, 메토트렉세이트, 아드리아마이신, 블레오마이신 또는 시스플라틴일 수 있다.
추가로, 효과기 분자는 진단 연구 또는 영상화 연구에 적합한, 검출 가능하게 표지화된 분자일 수 있다. 이러한 표지로서는 바이오틴 또는 스트렙타비딘/아비딘, 검출 가능한 나노입자 또는 결정, 효소 또는 이의 촉매 활성 단편, 형광 표지, 예컨대 녹색 형광 단백질, FITC, 피코에리트린, 사이콤, 텍사스 레드 또는 양자점; 방사성핵종, 예컨대 요오드-131, 이트륨-90, 레늄-188 또는 비스무트-212; 인광 분자, 화학발광 분자, 또는 PET, 초음파 또는 MRI에 의해 검출 가능한 표지, 예컨대 Gd-- 또는 상자성 금속 이온 기반 조영제를 포함한다. 예를 들어 문헌(Moskaug, 등, J. Biol. Chem. 264, 15709 (1989); Pastan, I. 등, Cell 47, 641, 1986; Pastan 등, Recombinant Toxins as Novel Therapeutic Agents, Ann. Rev. Biochem. 61, 331, (1992); "Chimeric Toxins" Olsnes and Phil, Pharmac. Ther., 25, 355 (1982); 공개된 PCT 특허출원공보 WO 94/29350; 공개된 PCT 특허출원공보 WO 94/04689; 공개된 PCT 특허출원공보 WO2005046449 및 미국특허 제5,620,939호(효과기 또는 태그를 포함하는 단백질을 제조 및 사용하는 것에 관하여 개시됨))을 참조한다.
본 발명의 IL-15 및 IL-15Rα 폴리펩티드는 적합하게, 그 아미노산 서열이 자연 발생 IL-15 및 IL-15Rα 분자, 예컨대 인간, 마우스 또는 기타 설치류 또는 기타 포유동물의 IL-15 및 IL-15Rα 분자의 아미노산 서열과 상응한다. 이러한 폴리펩티드 및 이를 암호화하는 핵산의 서열은, 예를 들어 인간 인터루킨 15(IL15) mRNA - GenBank: U14407.1 (본원에 참조로 인용됨), Mus 근육 인터루킨 15(IL15) mRNA - GenBank: U14332.1 (본원에 참조로 인용됨), 인간 인터루킨-15 수용체 알파 사슬 전구체(IL15RA) mRNA - GenBank: U31628.1 (본원에 참고로 인용됨), Mus 근육 인터루킨 15 수용체, 알파 사슬 - GenBank: BC095982.1 (본원에 참고로 인용됨)와 같이 문헌에 공지되어 있다.
몇몇 경우에 있어서, 예를 들어 sc-항체의 역가를 증가시키기 위해 본 발명의 단백질 융합 또는 접합 복합체를 다가로 만드는 것이 유용할 수 있다. 구체적으로 융합 단백질 복합체의 IL-15 도메인 및 IL-15Rα도메인 간 상호작용은 다가 복합체를 제조하는 수단을 제공한다. 또한, 다가 융합 단백질은, 예를 들어 표준 바이오틴-스트렙타비딘 표지화 기술을 사용하거나, 또는 적합한 고형 지지체, 예컨대 라텍스 비드에의 접합을 통해, 1개 내지 4개의 단백질(동일하거나 상이한 단백질들)을 서로 공유 결합 또는 비공유 결합시켜 제조될 수 있다. 화학 가교된 단백질(예컨대 덴드리머에 가교된 단백질)은 또한 적합한 다가 종이다. 예를 들어 단백질은, 변형될 수 있는 태그 서열, 예컨대 바이오틴화 BirA 태그, 또는 Cys 또는 His와 같이 화학 반응성 측쇄를 가지는 아미노산 잔기를 암호화하는 서열을 포함시킴으로써 변형될 수 있다. 이러한 아미노산 태그 또는 화학 반응성 아미노산은 융합 단백질 내 다양한 위치, 바람직하게는 생물 활성 폴리펩티드 또는 효과기 분자의 활성 부위로부터 멀리 떨어진 위치에 배치될 수 있다. 예를 들어 가용성 융합 단백질의 C-말단은, 이처럼 반응성 아미노산(들)을 포함하는 기타 융합 단백질 또는 태그에 공유 결합될 수 있다. 2개 이상의 융합 단백질을 적합한 덴드리머 또는 기타 나노입자에 화학적으로 결합시켜 다가 분자를 제조하기 위해서는 적합한 측쇄가 포함될 수 있다. 덴드리머는 자체의 표면에 다수의 상이한 작용기 중 임의의 것 하나를 가질 수 있는 합성 화학 중합체이다(D. Tomalia, Aldrichimica Acta, 26:91:101 (1993)). 본 발명에 따라 사용되는 예시적 덴드리머로서는, 예컨대 시스테인 잔기들을 결합시킬 수 있는 E9 불꽃형(combust) 폴리아민 덴드리머 및 E9 성상형(starburst) 폴리아민 덴드리머를 포함한다. 예시적 나노입자로서는 리포좀, 코어-외피(core-shell) 입자 또는 PLGA 기반 입자를 포함한다.
다른 양태에서, 융합 단백질 복합체의 폴리펩티드들 중 하나 또는 둘 다는 면역글로불린 도메인을 포함한다. 대안적으로 단백질 결합 도메인-IL-15 융합 단백질은 면역글로불린 도메인에 추가로 결합될 수 있다. 바람직한 면역글로불린 도메인은 다른 면역글로불린 도메인과의 상호작용을 허용하여, 상기 제공된 바와 같은 다중 사슬 단백질을 형성하도록 만들 수 있는 영역들을 포함한다. 예를 들어 면역글로불린 중쇄 영역, 예컨대 IgG1 CH2-CH3은 안정적으로 상호작용하여, Fc 영역을 형성할 수 있다. Fc 도메인을 포함하여 바람직한 면역글로불린 도메인은 또한 효과기 기능, 예컨대 Fc 수용체 또는 보체 단백질 결합 활성을 가지고/가지거나 당화 부위들을 가지는 영역들을 포함한다. 몇몇 양태들에서, 융합 단백질 복합체의 면역글로불린 도메인은, Fc 수용체 또는 보체 결합 활성 또는 당화 또는 이량체화를 감소 또는 증가시켜, 생성되는 단백질의 생물 활성에 영향을 미치는 돌연변이를 함유한다. 예를 들어 Fc 수용체와의 결합을 감소시키는 돌연변이를 함유하는 면역글로불린 도메인이, 특이 항원을 인지 또는 검출하도록 디자인된 시약에 유리할 수 있도록, Fc 수용체 보유 세포에 대한 결합 활성이 낮은 본 발명의 융합 단백질 복합체를 제조하는데 사용될 수 있었다.
핵산 및 벡터
본 발명은 핵산 서열, 구체적으로 본 융합 단백질(예컨대 TxM의 성분들)을 암호화하는 DNA 서열을 추가로 제공한다. 바람직하게 DNA 서열은 염색체 외 복제에 적합한 벡터, 예컨대 파아지, 바이러스, 플라스미드, 파지미드, 코스미드, YAC 또는 에피좀에 의해 운반된다. 구체적으로 원하는 융합 단백질을 암호화하는 DNA 벡터는, 본원에 기술된 제조 방법들을 가속화하고, 융합 단백질을 유의미한 양만큼 수득하기 위해 사용될 수 있다. DNA 서열은 적당한 발현 벡터, 즉 삽입된 단백질 암호화 서열의 전사 및 번역에 필요한 요소를 함유하는 벡터로 삽입될 수 있다. 다양한 숙주-벡터계는 단백질 암호화 서열을 발현시키는데 이용될 수 있다. 이러한 계로서는 바이러스(예컨대 백시니아 바이러스, 아데노바이러스 등)으로 감염된 포유동물 세포계; 바이러스(예컨대 바큘로바이러스)로 감염된 곤층 세포계; 미생물, 예컨대 효모 벡터를 함유하는 효모, 또는 박테리오파아지 DNA, 플라스미드 DNA 또는 코스미드 DNA로 형질전환된 세균을 포함한다. 이용된 숙주-벡터계에 따라서, 다수의 적합한 전사 요소 및 번역 요소 중 임의의 하나가 사용될 수 있다. 문헌((Sambrook 등, 상동) 및 (Ausubel 등, 상동))을 참조한다.
가용성 융합 단백질 복합체를 제조하기 위한 방법이 본 발명에 포함되는데, 이 방법은 본원에 기술된 바와 같이 제1 및 제2 단백질들을 암호화하는 DNA 벡터를 숙주 세포에 도입하는 단계, 세포나 배지 중 융합 단백질을 발현하기 충분한 조건 하에 이 숙주 세포를 배지 중에서 배양하여, 제1 단백질의 IL-15 도메인과 제2 단백질의 가용성 IL-15Rα 도메인간 결합을 허용함으로써, 가용성 융합 단백질 복합체를 형성하는 단계, 그리고 숙주 세포나 배지로부터 가용성 융합 단백질 복합체를 정제하는 단계를 포함한다.
일반적으로 본 발명에 따라 바람직한 DNA 벡터에는, 효과기 분자를 암호화하는 서열에 작동가능하도록 결합된, 생물 활성 폴리펩티드를 암호화하는 제1 뉴클레오티드 서열 도입용 제1 클로닝 부위를 5'→ 3' 방향으로 포함하는 뉴클레오티드 서열이 포스포디에스테르 결합에 의해 결합되어 포함되어 있다.
DNA 벡터에 의해 암호화된 융합 단백질 성분들은 카세트 형태로 제공될 수 있다. "카세트"란 용어는, 각각의 성분이 표준 재조합 방법에 의해 다른 성분 대신 용이하게 치환될 수 있는 구조를 의미한다. 구체적으로 카세트 형태로 구성된 DNA 벡터는, 암호화된 융합 복합체가 혈청형을 발생시킬 능력을 가질 수 있거나 가지는 병원체에 맞서 사용될 때 특히 요망된다.
융합 단백질 복합체를 암호화하는 벡터를 제조하기 위하여, 생물 활성 폴리펩티드를 암호화하는 서열은, 적합한 리가아제를 사용하여 효과기 펩티드를 암호화하는 서열에 결합된다. 제시 펩티드를 암호화하는 DNA는, 적합한 세포주와 같은 자연 공급원으로부터 DNA를 단리하거나, 또는 공지의 합성 방법, 예컨대 포스페이트 트리에스테르 방법에 의해 수득될 수 있다. 예컨대 문헌(Oligonucleotide Synthesis, IRL Press (M. J. Gait, ed., 1984))을 참조한다. 합성 올리고뉴클레오티드는 또한 시판되고 있는 자동화 올리고뉴클레오티드 합성기를 사용하여 제조될 수 있다. 생물 활성 폴리펩티드를 암호화하는 유전자가 일단 단리되면, 이 유전자는 중합효소 연쇄 반응(PCR) 또는 기타 당 분야에 공지된 방법에 의해 증폭될 수 있다. 생물 활성 폴리펩티드 유전자를 증폭시키는데 적합한 PCR 프라이머는 PCR 생성물에 제한 부위들을 부가할 수 있다. PCR 생성물은, 바람직하게 효과기 펩티드에 대한 스플라이싱 부위들과, 생물 활성 폴리펩티드-효과기 융합 복합체의 적절한 발현 및 분비에 필요한 선도 서열을 포함한다. PCR 생성물은 또한, 바람직하게 링커 서열을 암호화하는 서열이나, 또는 이러한 서열을 결찰하기 위한 제한 효소 부위를 포함한다.
본원에 기술된 융합 단백질은, 바람직하게 표준 재조합 DNA 기술에 의해 생산된다. 예를 들어 생물 활성 폴리펩티드를 암호화하는 DNA 분자가 일단 단리되면, 이 서열은 효과기 폴리펩티드를 암호화하는 또 다른 DNA 분자에 결찰될 수 있다. 생물 활성 폴리펩티드를 암호화하는 뉴클레오티드 서열은, 효과기 펩티드를 암호화하는 DNA 서열과 직접 연결될 수 있거나, 또는 더욱 통상적으로 본원에 논의된 바와 같은 링커 서열을 암호화하는 DNA 서열은, 생물 활성 폴리펩티드를 암호화하는 서열과, 효과기 펩티드를 암호화하는 서열 사이에 끼워진 후, 적합한 리가아제가 사용되어 연결될 수 있다. 생성된 하이브리드 DNA 분자는 적합한 숙주 세포 내에서 발현되어 융합 단백질 복합체로 생성될 수 있다. DNA 분자는, 결찰 후 암호화되는 폴리펩티드의 번역 틀이 변경되지 않도록 서로 5'→ 3'방향으로 결찰된다(즉 DNA 분자는 서로에 대해 틀 내(in-frame) 결찰된다). 생성된 DNA 분자는 틀 내 융합 단백질을 암호화한다.
또 다른 뉴클레오티드 서열도 또한 유전자 구조체에 포함될 수 있다. 예를 들어 효과기 펩티드에 융합된 생물 활성 폴리펩티드를 암호화하는 서열의 발현을 제어하는 촉진인자 서열, 또는 융합 단백질을 세포 표면이나 배양 배지로 안내하는 선도 서열이, 구조체에 포함될 수 있거나 또는 이 구조체가 삽입된 발현 벡터 내에 존재할 수 있다. 면역글로불린 또는 CMV 촉진인자가 특히 바람직하다.
변이체 생물 활성 폴리펩티드, IL-15, IL-15Rα 또는 Fc 도메인 암호화 서열을 수득함에 있어서, 당 업자들은 생물 활성의 소실 또는 감소가 초래되지 않은 채 폴리펩티드가 임의의 아미노산 치환, 부가, 결실 및 번역후 변형에 의해 변형될 수 있음을 인지할 것이다. 구체적으로 보존적 아미노산 치환이 일어나면, 즉 하나의 아미노산이 유사한 크기, 전하, 극성 및 형태를 가지는 또 다른 아미노산으로 치환되면, 단백질 기능은 유의미하게 변경되지 않을 것임은 널리 공지되어 있다. 단백질의 구성성분인 20개의 표준 아미노산은 넓게 보존적 아미노산으로 이루어진 군 4 가지로 하기와 같이 분류될 수 있다: 비극성(소수성) 군은 알라닌, 이소루신, 루신, 메티오닌, 페닐알라닌, 프롤린, 트립토판 및 발린을 포함하고; 극성(비하전, 중성) 군은 아스파라긴, 시스테인, 글루타민, 글리신, 세린, 트레오닌 및 티로신을 포함하며; 극성 하전(염기성) 군은 아르기닌, 히스티딘 및 리신을 포함하고; 음 하전(산성) 군은 아스파르트산 및 글루탐산을 포함한다. 어떤 단백질에 있어서 하나의 아미노산의, 동일군에 속하는 또 다른 아미노산으로의 치환은 단백질의 생물 활성에 부정적인 영향을 미치지 않을 것이다. 다른 예에서, 단백질의 생물 활성을 감소 또는 증가시키기 위해 아미노산 위치에 대한 변형이 이루어질 수 있다. 이러한 변화는 표적이 된 잔기(들)의 공지되었거나 추정되는 구조적 특성 또는 기능상 특성을 바탕으로 부위 특이적 돌연변이를 통하여 도입될 수 있거나 또는 무작위로 도입될 수 있다. 변이체 단백질이 발현된 후, 변형으로 말미암은 생물 활성 변화는 결합 또는 기능 검정을 사용하여 용이하게 평가될 수 있다.
뉴클레오티드 서열들간의 상동성은 DNA 잡종화 분석에 의해 결정될 수 있는데, 여기서 이중 가닥 DNA 하이브리드의 안정성은 일어난 염기 쌍 형성 정도에 의존적이다. 높은 온도 및/또는 낮은 염 함량의 조건은, 하이브리드의 안정성을 감소시키고, 선택된 상동성 정도에 못미치는 상동성을 가지는 서열의 어닐링(annealing)을 방지하도록 달라질 수 있다. 예를 들어 G-C 함량이 약 55%인 서열에 있어서, 40℃ ~ 50℃, 6 x SSC(염화나트륨/시트르산나트륨 완충제) 및 0.1% SDS(도데실황산나트륨)의 잡종화 및 세척 조건은 약 60% ~ 약 70%의 상동성을 초래하고, 50℃ ~ 65℃, 1 x SSC 및 0.1% SDS의 잡종화 및 세척 조건은 약 82% ~ 약 97%의 상동성을 초래하며, 52℃, 0.1 x SSC 및 0.1% SDS의 잡종화 및 세척 조건은 약 99% ~ 약 100%의 상동성을 초래한다. 뉴클레오티드와 아미노산 서열을 비교하기 위한(그리고 상동성의 정도를 측정하기 위한) 여러 컴퓨터 프로그램도 또한 입수 가능하고, 시판중인 소프트웨어와 무료 소프트웨어 둘 다의 공급처를 제공하는 목록은 문헌(Ausubel 등 (1999))에서 찾아볼 수 있다. 용이하게 입수 가능한 서열 비교 및 다중 서열 정렬 알고리즘으로서는 각각 BLAST(Basic Local Alignment Search Tool)(Altschul 등, 1997) 및 ClustalW 프로그램이 있다. BLAST는 www.ncbi.nlm.nih.gov에서 입수 가능하고, ClustalW 버전은 2.ebi.ac.uk에서 입수 가능하다.
융합 단백질의 성분들은, 각각이 의도로 하는 기능을 수행할 수 있도록 제공된 임의의 순서에 가깝게 조직될 수 있다. 예를 들어 일 구현예에서, 생물 활성 폴리펩티드는 효과기 분자의 C-말단 또는 N-말단에 위치한다.
본 발명의 바람직한 효과기 분자는 도메인들이 의도로 하는 기능을 유도하는 크기를 가질 것이다. 본 발명의 효과기 분자는 제조된 후, 널리 공지된 화학 가교 방법을 비롯한 다양한 방법에 의해 생물 활성 폴리펩티드에 융합될 수 있다. 예를 들어 문헌(Means, G. E. and Feeney, R. E. (1974), Chemical Modification of Proteins, Holden-Day. See also, S. S. Wong (1991), Chemistry of Protein Conjugation and Cross-Linking, CRC Press)을 참조한다. 그러나 일반적으로 틀 내 융합 단백질을 제조하기 위해 재조합 조작법을 사용하는 것이 바람직하다.
언급된 바와 같이, 본 발명에 따른 융합 분자 또는 접합체 분자는 몇 가지 방식으로 조직될 수 있다. 예시적 구성에 있어서, 생물 활성 폴리펩티드의 C-말단은 효과기 분자의 N-말단에 작동 가능하도록 결합된다. 이러한 결합은 원한다면 재조합 방법에 의해 달성될 수 있다. 그러나 다른 구성에 있어서, 생물 활성 폴리펩티드의 N-말단은 효과기 분자의 C-말단에 결합된다.
대안적으로 또는 추가로, 필요에 따라 하나 이상의 추가 효과기 분자가 생물 활성 폴리펩티드 또는 접합 복합체에 삽입될 수 있다.
벡터 및 발현
본 발명의 융합 단백질 복합체(예컨대 TxM)의 성분들을 발현하는데 다수의 전략이 사용될 수 있다. 예를 들어 본 발명의 융합 단백질 복합체 성분 하나 이상을 암호화하는 구조체는, 구조체 삽입을 위해 벡터를 절단하는 제한 효소를 사용하여 적합한 벡터에 통합된 다음 결찰될 수 있다. 이후 유전자 구조체를 함유하는 벡터는 융합 단백질의 발현에 적합한 숙주에 도입된다. 일반적으로 문헌(Sambrook 등, 상동)을 참조한다. 적합한 벡터의 선택은 클로닝 프로토콜에 관한 인자들을 바탕으로 실험을 통하여 이루어질 수 있다. 예를 들어 벡터는 사용되고 있는 숙주와 양립 가능하여야 하며, 이러한 숙주에 적절한 레플리콘(replicon)을 가져야 한다. 벡터는 발현될 융합 단백질 복합체를 암호화하는 DNA 서열을 수용할 수 있어야 한다. 적합한 숙주 세포로서는 진핵생물 및 원핵생물 세포, 바람직하게 용이하게 형질전환되어 배양 배지 중에서 신속한 성장을 보일 수 있는 세포를 포함한다. 특히 바람직한 숙주 세포로서는 원핵생물, 예컨대 이.콜라이, 바실러스 서브틸리스(Bacillus subtilis) 등과, 진핵생물, 예컨대 동물 세포 및 효소 균주, 예컨대 에스.세레비지아에를 포함한다. 포유동물 세포, 특히 J558, NSO, SP2-O 또는 CHO가 일반적으로 바람직하다. 기타 적합한 숙주로서는, 예를 들어 곤충 세포, 예컨대 Sf9를 포함한다. 종래의 배양 조건이 적용된다. 문헌(Sambrook, 상동)을 참조한다. 이후 안정적으로 형질전환되었거나 형질감염된 세포주가 선택될 수 있다. 본 발명의 융합 단백질 복합체를 발현하는 세포는 공지의 방법에 의해 확인될 수 있다. 예를 들어 면역글로불린에 결합된 융합 단백질 복합체의 발현은, 결합된 면역글로불린에 특이적인 ELISA 및/또는 면역 블럿팅(immunoblotting)에 의해 확인될 수 있다. IL-15 또는 IL-15Rα 도메인들에 결합된 생물 활성 폴리펩티드를 포함하는 융합 단백질의 발현을 확인하기 위한 다른 방법들이 실시예들에 개시되어 있다.
상기에서 일반적으로 언급된 바와 같이, 원하는 융합 단백질을 암호화하는 핵산을 증식시키기 위한 예비적 목적으로 숙주 세포가 사용될 수 있다. 그러므로 숙주 세포는 특별히 융합 단백질 생산이 의도되는 원핵생물 또는 진핵생물 세포를 포함할 수 있다. 따라서 숙주 세포는, 구체적으로 융합체를 암호화하는 핵산을 증식시킬 수 있는 효모, 파리, 벌레, 식물, 개구리, 포유동물 세포 및 장기를 포함한다. 사용될 수 있는 포유동물 세포주의 비제한적 예들로서는 CHO dhfr-세포(Urlaub and Chasm, Proc. Natl. Acad. Sci. USA, 77:4216 (1980)), 293 세포(Graham 등 J Gen. Virol., 36:59 (1977)) 또는 골수종 세포, 예컨대 SP2 또는 NSO(Galfre and Milstein, Meth. Enzymol., 73(B):3 (1981))를 포함한다.
원하는 융합 단백질 복합체를 암호화하는 핵산을 증식시킬 수 있는 숙주 세포는 포유동물 이외의 진핵생물 세포, 예컨대 곤충 세포(예컨대 에스피. 프루기페르다(Sp. frugiperda)), 효모(예컨대 에스.세레비지아에, 에스, 폼베(S. pombe), 피.파스토리스(P. pastoris), 케이. 락티스(K. lactis), 에이치. 폴리모르파(H. polymorpha); Fleer, R.에 의해 일반적으로 검토된 바와 같은 것들(Current Opinion in Biotechnology, 3(5):486496 (1992)), 진균 세포 및 식물 세포도 포함한다. 이. 콜리(E. coli) 및 바실리우스(Bacillus)와 같은 임의의 원핵생물도 또한 고려된다.
세포를 형질감염시키기 위한 표준 기술에 의해 원하는 융합 단백질을 암호화하는 핵산이 숙주 세포에 도입될 수 있다. "형질감염시키는 것" 또는 "형질감염"이란 용어는, 핵산을 숙주 세포에 도입하기 위한 종래의 모든 기술, 예컨대 인산칼슘 공침전법, DEAE-덱스트란 매개 형질감염, 리포펙션(lipofection), 전기영동, 미세주입, 바이러스에 의한 형질도입 및/또는 통합을 포함하는 것으로 의도된다. 숙주 세포를 형질감염시키기 적합한 방법은 문헌(Sambrook 등, 상동) 및 기타 실험 교과서에서 찾아볼 수 있다.
다수의 촉진인자(전사 개시 조절 영역)가 본 발명에 따라 사용될 수 있다. 적당한 촉진인자의 선택은 제안된 발현 숙주에 따라서 달라진다. 이종 공급원으로부터 유래하는 촉진인자는, 그것이 선택된 숙주 내에서 기능을 발휘하는 한, 사용될 수 있다.
촉진인자 선택은 또한 원하는 효능과, 펩티드 또는 단백질 생성 수준에 따라 달라진다. 유도성 촉진인자, 예컨대 tac는 종종 E. Coli 내 단백질 발현 수준을 극적으로 증가시키기 위해 사용된다. 단백질 과발현은 숙주 세포에 유해할 수 있다. 결과적으로 숙주 세포 성장이 제한될 수 있다. 유도성 촉진인자계가 사용되면, 숙주 세포는 허용 가능한 밀도로 배양된 후 유전자 발현이 유도되고, 이로써 생성물 수율이 더 높아지는 것이 가속화되는 것이다.
본 발명에 따라 다양한 신호 서열이 사용될 수 있다. 생물 활성 폴리펩티드 암호화 서열에 상동성인 신호 서열이 사용될 수 있다. 대안적으로 발현 숙주 내에서의 효율적 분비와 처리를 위해 선택 또는 디자인된 신호 서열도 또한 사용될 수 있다. 예를 들어 적합한 신호 서열/숙주 세포 쌍은 B. subilis sacB 신호 서열(비. 서브틸리스 내 분비용)과, 사카로마이세스 세레비지아에 α-메이팅 인자(mating factor) 또는 P. pastoris 산 포스파타아제 phoI 신호 서열(피. 파스토리스 내 분비용)을 포함한다. 신호 서열은 신호 펩티다아제 절단 부위를 암호화하는 서열, 또는 보통은 10개 이하의 코돈으로 이루어진 짧은 뉴클레오티드 가교를 통하여 단백질 암호화 서열에 직접 연결될 수 있는데, 이 경우 상기 가교는 하류 TCR 서열의 올바른 해독틀을 보장한다.
전사 및 번역을 증진시키기 위한 요소들이 진핵생물 단백질 발현계에 대해 동정되었다. 예를 들어 이종 촉진인자 양쪽 중 어느 한쪽으로부터 1,000 bp 떨어져 꽃양배추 모자이크 바이러스(CaMV) 촉진인자가 배치되면, 식물 세포에서 전사 수준은 10배 ~ 400배까지 증가할 수 있다. 발현 구조체는 또한 적당한 번역 개시 서열을 포함하여야 한다. 적당한 번역 개시를 위하여 Kozak 공통 서열을 포함하도록 발현 구조체가 변형되면, 번역 수준은 10배까지 증가할 수 있다.
발현 구조체의 일부일 수 있거나, 또는 이로부터 단리되어 존재할 수 있는(예를 들어 발현 벡터에 의해 운반될 수 있는) 선택 마커가 종종 사용되므로, 이러한 마커는 관심 유전자 부위와 상이한 부위에 통합될 수 있다. 그 예로서는 항생제에 대한 내성을 부여하는 마커(예컨대 bla는 E. coli 숙주 세포에 암피실린에 대한 내성을 부여하고, nptII는 다양한 원핵생물 및 진핵생물 세포에 카나마이신에 대한 내성을 부여함) 또는 숙주가 최소 배지에서 성장하는 것을 허용하는 마커(예컨대 HIS4는 P. pastoris 또는 His-S. cerevisiae가 히스티딘 부재 하에서도 성장할 수 있도록 함)를 포함한다. 선택 마커는 자체만의 전사 및 번역 개시 및 종료 조절 영역을 가져서, 마커의 독립적 발현을 허용한다. 만일 항생제 내성이 마커로서 사용되면, 선택을 위한 항생제의 농도는 항생제에 따라서 달라질 것인데, 일반적으로 항생제 농도는 배지 1 mL당 항생제10 mg 내지 600 mg의 범위이다.
발현 구조체는, 공지의 재조합 DNA 기술을 이용하여 조립된다(Sambrook 등, 1989; Ausubel 등, 1999). 제한 효소 분해 및 결찰은, 2개의 DNA 단편을 연결하는데 이용되는 기본 단계들이다. DNA 단편의 말단들은 결찰 전에 변형을 필요로 할 수 있는데, 이 변형은 돌출 말단(overhang)을 채우거나, 뉴클레아제(예컨대 ExoIII)로 단편(들)의 말단부를 결실시키거나, 부위 유도적 돌연변이 유발법에 의하거나, 또는 PCR에 의해 신규 염기쌍들을 부가함으로써 달성될 수 있다. 선택된 단편들의 연결을 돕기 위해 폴리링커(polylinker)와 어댑터(adaptor)가 사용될 수 있다. 발현 구조체는 통상적으로 이.콜라이의 제한, 결찰 및 형질전환 라운드를 이용하는 단계들에서 조립된다. 발현 구조체를 구성하는데 적합한 클로닝 벡터 다수(lZAP 및 pBLUESCRIPT SK-1(Stratagene, La Jolla, CA), pET(Novagen Inc., Madison, WI); Ausubel 등, 1999에 예시됨) 가 당 분야에 공지되어 있으며, 본 발명에 있어서 벡터에 관한 구체적인 선택은 중요하지 않다. 클로닝 벡터의 선택은 발현 구조체를 숙주 세포에 도입하기 위해 선택된 유전자 이동계에 의해 영향을 받을 것이다. 생성된 구조체는 각 단계의 말미에 제한 분석, DNA 서열 분석, 잡종화 및 PCR 분석에 의해 분석될 수 있다.
발현 구조체는 클로닝 벡터 구조체(선형 또는 환형)로서 숙주를 형질전환시킬 수 있거나, 또는 클로닝 벡터로부터 단리되어 그대로 사용되거나 전달 벡터에 도입되어 사용될 수 있다. 전달 벡터는 선택된 숙주 세포 유형 내에 발현 구조체를 도입하여 이를 유지시키는 것을 돕는다. 발현 구조체는 다수의 공지된 유전자 이동계(예컨대 자연 순응성, 화학물질 매개 형질전환, 원형질체 형질전환, 전기천공, 유전자총 형질전환, 형질감염 또는 접합) 중 임의의 것에 의해 숙주 세포에 도입된다(Ausubel 등, 1999; Sambrook 등, 1989). 선택된 유전자 이동계는 사용된 숙주 세포와 벡터계에 의존적이다.
예를 들어 발현 구조체는 원형질체 형질전환 또는 전기천공에 의해 에스. 세레비지아에 세포에 도입될 수 있다. S. cerevisiae의 전기천공은 용이하게 달성되며, 그 결과 세포벽불완전제거균(spheroplast) 형질전환과 거의 동일한 형질전환 효율을 보이게 된다.
본 발명은 또한 관심 융합 단백질을 단리하기 위한 제조 방법을 추가로 제공한다. 이 방법에 있어서, 조절 서열에 작동 가능하도록 연결된, 관심 단백질을 암호화하는 핵산이 내부에 도입된 숙주 세포(예컨대 효모, 진균, 곤충, 세균 또는 동물 세포)는 관심 융합 단백질을 암호화하는 뉴클레오티드 서열의 전사가 자극되는 배양 배지 중에서 생산 규모로 성장한다. 이후 관심 융합 단백질은 수득된 숙주 세포 또는 배양 배지로부터 단리된다. 배지 또는 수득된 세포로부터 관심 단백질을 단리하기 위해 표준 단백질 정제 기술이 사용될 수 있다. 구체적으로 정제 기술은 원하는 융합 단백질을 다양한 도구, 예컨대 회전병, 스피너 플라스크, 조직 배양 평판, 생물반응기 또는 발효조로부터 대규모로(즉 적어도 밀리그램 단위의 양만큼) 발현 및 정제하기 위해 사용될 수 있다.
발현된 단백질 융합 복합체는 공지의 방법에 의해 단리 및 정제될 수 있다. 통상적으로 배양 배지는 원심단리 또는 여과되고, 이후 상청액은 발현된 융합 복합체와 결합하는 모노클로날 항체를 사용하는 것을 포함하는 면역친화성 프로토콜, 또는 친화성 또는 면역친화성 크로마토그래피, 예컨대 단백질-A 또는 단백질-G 친화성 크로마토그래피에 의해 정제된다. 본 발명의 융합 단백질은 공지의 기술들을 적당히 병행하여 단리 및 정제될 수 있다. 이러한 방법들로서는, 예를 들어 용해도를 이용하는 방법, 예컨대 염 침전법 및 용매 침전법, 분자량의 차이를 이용하는 방법, 예컨대 투석, 한외여과, 겔여과 및 SDS-폴리아크릴아미드 겔 전기영동법, 전기적 하전량의 차이를 이용하는 방법, 예컨대 이온 교환 컬럼 크로마토그래피, 특이적 친화성을 이용하는 방법, 예컨대 친화성 크로마토그래피, 소수성의 차이를 이용하는 방법, 예컨대 역상 고성능 액체 크로마토그래피, 그리고 등전점 차이를 이용하는 방법, 예컨대 등전점 맞춤 전기영동, 금속 친화성 컬럼, 예컨대 Ni-NTA를 이용하는 방법을 포함한다. 일반적으로 이러한 방법에 관하여 개시되어 있는 문헌(Sambrook 등 (상동) 및 Ausubel 등 (상동))을 참조한다.
본 발명의 융합 단백질은 실질적으로 순수한 것이 바람직하다. 즉, 본 융합 단백질은 자연에서 이를 수반하는 세포 대체물(cell substituent)로부터 단리되고, 이로써 융합 단백질은, 바람직하게 적어도 80%(w/w) 또는 90%(w/w) 또는 95%(w/w)의 균질성을 보이며 존재한다. 적어도 98%(w/w) 내지 99%(w/w)의 균질성을 보이는 융합 단백질이 다수의 약학적 응용, 임상 응용 및 연구적 응용에 가장 바람직하다. 융합 단백질이 일단 실질적으로 정제되면, 이 단백질에는 치료적 응용을 위하여 오염물이 실질적으로 존재하지 않아야 한다. 가용성 융합 단백질이 일단 부분적으로나 실질적으로 순수한 상태로 정제되면, 이 단백질은 치료적으로 사용될 수 있거나, 또는 본원에 개시된 바와 같이 시험관 내 또는 생체 내 검정을 수행하는데 사용될 수 있다. 실질적 순도는, 다양한 표준적 기술, 예컨대 크로마토그래피 및 겔 전기영동에 의해 측정될 수 있다.
본 융합 단백질 복합체는, 암성이거나 감염되었거나 하나 이상의 질환에 의해 감염성을 보이게 될 수 있는 여러 세포와 함께 시험관 내 또는 생체 내에서 사용되기 적합하다.
인간 인터루킨-15(huIL-15)는, 항원 제시 세포상에 발현되는 인간 IL-15 수용체 α 사슬(huIL-15Rα)에 의하여 면역 효과기 세포에 경유 제시(trans-presenting)된다. IL-15Rα는, 주로 세포외 스시 도메인을 통하여 높은 친화도(38 pM)로 huIL-15와 결합한다(huIL-15RαSu). 본원에 기술된 바와 같이 huIL-15 및 huIL-15RαSu 도메인은 다중 도메인 융합 복합체를 구성하기 위한 스캐폴드로서 사용될 수 있다.
IgG 도메인, 구체적으로 Fc 단편은 승인된 생물의약품을 비롯하여 다수의 치료용 분자에 대한 이량체 스캐폴드로서 성공적으로 사용된 바 있다. 예를 들어 에타너셉트는 가용성 인간 p75 종양 괴사 인자-α(TNF-α) 수용체(sTNFR)가, 인간 IgG1의 Fc 도메인에 결합되어 있는 이량체이다. 이와 같은 이량체화는 TNF-α 활성 억제에 대해 에타너셉트로 하여금 단량체 sTNFR보다 1000배 이하로 더 강력하게 될 수 있도록 만들고, 단량체 형태의 혈청 중 반감기보다 5배 더 긴 혈청 중 반감기를 융합체에 제공한다. 결과적으로 에타너셉트는 TNF-α의 생체 내 전염증 활성을 중화하고, 다수의 상이한 자가면역성 적응증에 대한 환자의 치료결과를 개선하는데 효과적이다.
Fc 단편의 이량체화 활성에 더하여, 이 Fc 단편은 또한 보체 활성화, 그리고 자연살해(NK) 세포, 호중구, 식세포 및 수지상 세포 상에 제시되는 Fcγ 수용체와의 상호작용을 통해 세포독성 효과기 기능도 제공한다. 항암 치료 항체 및 기타 항체 도메인-Fc 융합 단백질에 관한 내용 중, 이러한 활성은 동물 종양 모델 및 암 환자에서 관찰되는 효능에 중요한 역할을 담당할 수 있을 것이다. 그러나 이와 같은 세포독성 효과기 반응은 다수의 치료적 응용에 있어 충분치 못할 수 있다. 그러므로 Fc 도메인의 효과기 활성을 개선 및 증진하고, 세포용해성 면역 반응, 예컨대 T 세포 활성을 표적화된 치료 분자를 통해 질환 부위에 보충하는 기타 수단을 개발하는 것에 상당한 관심이 모아지고 있다. IgG 도메인은 전통적인 하이브리도마 융합 기술에 의해 생성된 생성물의 품질과 양을 개선/증가시키는 이중 특이적 항체를 생성하기 위한 스캐폴드로서 사용되어 왔다. 비록 이 방법은 다른 스캐폴드의 단점들을 우회하지만, 포유동물 세포에서 이중 특이적 항체를 임상 개발 및 사용을 지원하기 충분한 수준으로 제조하는 것은 어려운 일이었다.
인간 유래 면역자극성 다량체 스캐폴드를 개발하고자 하는 노력으로, 인간 IL-15(huIL-15) 및 IL-15 수용체 도메인이 사용되었다. huIL-15는, huIL-15 수용체 α-사슬(huIL-15Rα)과 높은 결합 친화도(평형 해리 상수 (KD) 약 10-11 M)로 결합하는, 시토카인의 소형 4중 α-나선 묶음(bundle) 과의 일원이다. 생성된 복합체는 이후 T 세포 및 NK 세포 표면상에 제시되는 인간 IL-2/15 수용체 β/공통 γ 사슬(huIL-15RβγC) 복합체들에 경유 제시된다. 이 시토카인/수용체 상호작용을 통해 바이러스 감염 세포 및 악성 세포를 근절하는데 중요한 역할을 담당하는 효과기 T 세포와 NK 세포의 증식 및 활성화가 초래된다. 보통 huIL-15 및 huIL-15Rα는 수지상 세포 내에서 함께 생성되어, 추후 세포 내에 이종이량체 분자로서 분비되어 세포 표면에 제시되는 복합체를 이룬다. 그러므로 huIL-15 및 huIL-15Rα 상호작용의 특성들은, 이와 같은 사슬간 결합 도메인이 인간 유래 면역자극 스캐폴드로서 사용되어, 표적 특이적 결합이 가능한 가용성 이량체 분자를 형성함을 암시한다.
본 발명의 실시예는, 달리 명시되지 않은 한, 당 업자의 이해범위 내에서 널리 알려진 종래의 분자 생물학 기술(재조합 기술 포함), 미생물학 기술, 세포 생물학 기술, 생화학 기술 및 면역학 기술이 사용된다. 이러한 기술은 문헌(예컨대 "Molecular Cloning: A Laboratory Manual", second edition (Sambrook, 1989); "Oligonucleotide Synthesis" (Gait, 1984); "Animal Cell Culture" (Freshney, 1987); "Methods in Enzymology" "Handbook of Experimental Immunology" (Weir, 1996); "Gene Transfer Vectors for Mammalian Cells" (Miller and Calos, 1987); "Current Protocols in Molecular Biology" (Ausubel, 1987); "PCR: The Polymerase Chain Reaction", (Mullis, 1994); "Current Protocols in Immunology" (Coligan, 1991))에 상세히 설명되어 있다. 이러한 기술은 본 발명의 폴리뉴클레오티드와 폴리펩티드의 제조에 적용될 수 있으며, 마찬가지로 본 발명을 제조하고 실시하는 데에도 사용될 수 있다. 특정 구현예들에 특히 유용한 기술은 이하 문단들에서 논의될 것이다.
이하 실시예들은 본 발명의 검정, 스크리닝 및 치료 방법이 어떻게 실시되고 이용되는지에 대한 완전한 개시 및 설명을 당업자들에게 제공하기 위해 제시되는 것이지, 본 발명의 발명자들이 자신들의 발명이라고 간주하는 것에 대한 범위를 한정하고자 하는 것은 아니다.
실시예
실시예 1: IL-15, IL-7 및 IL-21 도메인을 포함하는 융합 단백질 복합체의 제조 및 특성규명
암 또는 감염성 질환을 치료하기 위한 중요한 치료 접근법은 병에 걸린 세포에 대한 면역 세포 활성을 증강시키는 것에 의존한다. 이 전략은 생체 외 면역 세포를 자극한 후, 입양 전달 및/또는 환자의 생체 내 면역 세포 수준 또는 활성을 직접적으로 증가시키는 것을 포함한다. 이들 접근법에 관여하는 면역 세포는 선천적 (즉, NK 세포) 또는 적응성 (즉, T 세포) 면역계의 세포일 수 있다.
면역 활성을 증대시키기 위한 한 가지 접근법은 면역 자극 시토카인을 면역 세포에 제공하는 것이다. 이러한 시토카인은 당 업계에 공지되어 있으며 단독으로 또는 다른 시토카인 또는 제제와 조합하여 사용될 수 있다. 아래에 상세히 기술된 바와 같이, IL-7 및 IL-21 결합 도메인에 융합된 IL-15N72D:IL-15RαSu/Fc 스캐폴드를 포함하는 융합 단백질 복합체가 생성되었다 (도 1). 이들 융합 단백질 복합체는 NK 및 T 세포에 결합하고 각각의 시토카인 수용체를 통해 세포 응답을 신호 전달하는 데에 유리하다. Ig 분자의 Fc 영역은 이량체를 형성하여 가용성 다중 폴리펩티드 복합체를 제공하고, 정제를 위해 단백질 A에 결합할 수 있고, NK 세포 및 대식세포상의 Fcγ 수용체와 상호 작용할 수 있어서, 개별 시토카인의 조합으로 존재하지 않는 융합 단백질 복합체에 이점을 제공한다. 또한, IL-15N72D 및 IL-15RαSu 도메인 사이의 상호 작용은 IL-15N72D, IL-7 및 IL-21 (및 다른 단백질 도메인 또는 제제)을 단일 면역 자극 융합 단백질 복합체에 연결하는 수단을 제공한다.
구체적으로, IL-7 및 IL-21 도메인을 IL-15N72D 및 IL-15RαSu/Fc 사슬에 연결하는 구조체를 제조하였다. 일부 경우에, IL-7 또는 IL-21 폴리펩티드는 IL-15N72D 및/또는 IL-15RαSu/Fc 사슬의 N-말단에 연결된다. 다른 경우에, IL-7 또는 IL-21 폴리펩티드는 IL-15N72D 및/또는 IL-15RαSu/Fc 사슬의 N-말단에 연결된다. IL-7 및 IL-21 결합 도메인에 융합된 IL-15N72D:IL-15RαSu/Fc 스캐폴드를 포함하는 특정 융합 단백질 복합체는 하기에 기재되어 있다.
1) IL-21/IL-15RαSu/Fc 및 IL-7/IL-15N72D 융합 단백질을 포함하는 융합 단백질 복합체가 생성되었다. 인간 IL-7 및 인간 IL-21 서열은 UniProt 웹 사이트에서 얻어졌으며,이 서열에 대한 DNA는 Genewiz에 의해 합성되었다. 구체적으로, 합성된 IL-21 서열을 중첩 PCR을 통해 IL-15RαSu/Fc의 N-말단 암호화 영역에 직접 연결시키는 구조체를 만들었다. IL-15RαSu/Fc의 N-말단에 연결된 IL-21을 포함하는 구조체의 핵산 및 단백질 서열은 하기에 제시되어 있다.
IL-21/IL-15RaSu/Fc 구조체 (신호 펩티드 서열 포함)의 핵산 서열은 다음과 같다 (서열 번호 1) :
(신호 펩티드)
atgaagtgggtgaccttcatcagcctgctgttcctgttctccagcgcctactcc
(인간 IL-21)
cagggccaggacaggcacatgatccggatgaggcagctcatcgacatcgtcgaccagctgaagaactacgtgaacgacctggtgcccgagtttctgcctgcccccgaggacgtggagaccaactgcgagtggtccgccttctcctgctttcagaaggcccagctgaagtccgccaacaccggcaacaacgagcggatcatcaacgtgagcatcaagaagctgaagcggaagcctccctccacaaacgccggcaggaggcagaagcacaggctgacctgccccagctgtgactcctacgagaagaagccccccaaggagttcctggagaggttcaagtccctgctgcagaagatgatccatcagcacctgtcctccaggacccacggctccgaggactcc
(인간 IL-15Rα 스시 도메인)
atcacgtgtcctcctcctatgtccgtggaacacgcagacatctgggtcaagagctacagcttgtactccagggagcggtacatttgtaactctggtttcaagcgtaaagccggcacgtccagcctgacggagtgcgtgttgaacaaggccacgaatgtcgcccactggacaacccccagtctcaaatgcattaga
(인간 IgG1 CH2-CH3 (Fc) 도메인)
gagccgaaatcttgtgacaaaactcacacatgcccaccgtgcccagcacctgaactcctggggggaccgtcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggagtacaagtgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaagggcagccccgagaaccacaggtgtacaccctgcccccatcccgggatgagctgaccaagaaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcaggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacgcagaagagcctctccctgtctcctggtaaa
IL-21/IL-15RaSu/Fc 구조체 (신호 펩티드 서열 포함)의 아미노산 서열은 다음과 같다 (서열 번호 2):
(신호 펩티드)
MKWVTFISLLFLFSSAYS
(인간 IL-21)
QGQDRHMIRMRQLIDIVDQLKNYVNDLVPEFLPAPEDVETNCEWSAFSCFQKAQLKSANTGNNERIINVSIKKLKRKPPSTNAGRRQKHRLTCPSCDSYEKKPPKEFLERFKSLLQKMIHQHLSSRTHGSEDS
(인간 IL-15Rα 스시 도메인)
ITCPPPMSVEHADIWVKSYSLYSRERYICNSGFKRKAGTSSLTECVLNKATNVAHWTTPSLKCIR
(인간 IgG1 CH2-CH3 (Fc) 도메인)
EPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
일부 경우에, 리더 펩티드는 성숙 폴리펩티드로부터 절단되어 가용성이거나 분비될 수 있는 성숙한 형태를 생성한다.
중첩된 PCR을 통해 합성된 IL-7 서열을 IL-15N72D의 N-말단 암호화 영역에 연결시키는 구조체를 만들었다. IL-15N72D의 N-말단에 연결된 IL-7을 포함하는 구조체의 핵산 및 단백질 서열은 다음과 같다.
IL-7/IL-15N72D 구조체 (리더 서열 포함)의 핵산 서열은 다음과 같다 (서열 번호 3):
(신호 펩티드)
atgaagtgggtgaccttcatcagcctgctgttcctgttctccagcgcctactcc
(인간 IL-7)
gattgcgacatcgagggcaaggacggcaagcagtacgagagcgtgctgatggtgtccatcgaccagctgctggacagcatgaaggagatcggctccaactgcctcaacaacgagttcaacttcttcaagcggcacatctgcgacgccaacaaggagggcatgttcctgttcagggccgccaggaaactgcggcagttcctgaagatgaactccaccggcgacttcgacctgcacctgctgaaggtgtccgagggcaccaccatcctgctgaactgcaccggacaggtgaagggccggaaacctgctgctctgggagaggcccaacccaccaagagcctggaggagaacaagtccctgaaggagcagaagaagctgaacgacctgtgcttcctgaagaggctgctgcaggagatcaagacctgctggaacaagatcctgatgggcaccaaggagcat
(인간 IL-15N72D)
aactgggttaacgtaataagtgatttgaaaaaaattgaagatcttattcaatctatgcatattgatgctactttatatacggaaagtgatgttcaccccagttgcaaagtaacagcaatgaagtgctttctcttggagttacaagttatttcacttgagtccggagatgcaagtattcatgatacagtagaaaatctgatcatcctagcaaacgacagtttgtcttctaatgggaatgtaacagaatctggatgcaaagaatgtgaggaactggaggaaaaaaatattaaagaatttttgcagagttttgtacatattgtccaaatgttcatcaacacttct
성숙 IL-7/IL-15N72D 융합 단백질 (리더 서열 포함)의 아미노산 서열은 다음과 같다 (서열 번호 4):
(신호 펩티드)
MKWVTFISLLFLFSSAYS
(인간 IL-7)
DCDIEGKDGKQYESVLMVSIDQLLDSMKEIGSNCLNNEFNFFKRHICDANKEGMFLFRAARKLRQFLKMNSTGDFDLHLLKVSEGTTILLNCTGQVKGRKPAALGEAQPTKSLEENKSLKEQKKLNDLCFLKRLLQEIKTCWNKILMGTKEH
(인간 IL-15N72D)
NWVNVISDLKKIEDLIQSMHIDATLYTESDVHPSCKVTAMKCFLLELQVISLESGDASIHDTVENLIILANDSLSSNGNVTESGCKECEELEEKNIKEFLQSFVHIVQMFINTS
일부 경우에, 리더 펩티드는 성숙 폴리펩티드로부터 절단되어 가용성이거나 분비될 수 있는 성숙한 형태를 생성한다.
IL-21/IL-15RαSu/Fc 및 IL-7/IL-15N72D 구조체는 전술한 바와 같이 발현 벡터에 클로닝되고 (실시예 1의 미국 특허 번호 8,507,222, 본원에 참고로 포함됨), 발현 벡터는 CHO 세포에 감염되었다. CHO 세포에서 2개의 구조체의 공동-발현은 가용성 IL-7/IL-15N72D:IL-21/IL-15RαSu/Fc 융합 단백질 복합체 (hIL7/IL21/TxM으로 지칭 됨)의 형성 및 분비를 허용하였다. hIL7/IL21/TxM 단백질을 단백질 A 친화성 크로마토그래피 및 크기별 배제 크로마토그래피에 의해 CHO 세포 배양 상청액으로부터 정제하여 결과적으로 IL-21/IL-15RαSu/Fc 이량체 및 IL-7/IL-15N72D 융합 단백질로 이루어진 가용성 (비집합) 융합 단백질 복합체를 얻었다 (도 2).
단백질 A 정제된 IL-7/IL-15N72D:IL-21/IL-15RαSu/Fc 융합 단백질 복합체의 감소된 SDS-PAGE 및 웨스턴 블롯 분석이 도 3에 도시되어 있다. 웨스턴 블롯 분석을 위해, 정제된 단백질은 4-12 % 비스-트리스 겔에서 환원된 SDS-PAGE에 의해 단리하였다. 분해된 단백질 밴드를 인비트로겐 iBlot2 시스템을 사용하여 겔에서 막으로 옮겼다. 멤브레인은 1) 인간 Fc 도메인을 함유하는 단백질 밴드의 검출을 위해 염소 항 hIgG Fc Ab (1 차) 및 토끼 항 염소 IgG-AP (2 차) 및 2) 인간 IL-15 도메인을 함유하는 단백질 밴드의 검출을 위해 비오티닐화된 마우스 항 hIL15 Ab (1 차) 및 스트렙타비딘-HRP (2 차)로 조사한다. Millipore SNAP i.d.2.0 단백질 검출 시스템를 사용하여 적절한 기질 (NBT/BCIP 또는 TMB)과 함께 배양한 후 프로브 시약의 결합이 감지되었다. 가용성 IL-21/IL-15RaSu/Fc 및 IL-7/IL-15N72D 단백질에 상응하는 SDS-PA 겔 및 웨스턴 블롯의 밴드가 각각 약 54 kDa 및 -38-45 kDa로 이동하는 것으로 관찰되었다 (도 3a 및 b).
IL-21/IL-15RaSu/Fc 및 IL-7/IL-15N72D 단백질의 계산된 분자 질량은 각각 약 49kDa 및 30kDa이다. 계산된 분자 질량과 관찰된 분자 질량의 차이를 평가하기 위해, 단백질 탈당화 믹스 II (New England BioLabs)를 사용하여 정제된 단백질 복합체에 대한 탈당화 연구를 수행하였다. 간단히 말하면, 1 x 탈당화 혼합 완충제 2 중 100 ㎍의 단백질 복합체를 75 ℃에서 10 분 동안 변성시켰다. 실온으로 냉각시킨 후, 5 ㎕의 단백질 탈당화 혼합물 II를 단백질 혼합물에 첨가하였다. 실온에서 30 분 동안 항온처리한 후, 단백질을 37 ℃에서 밤새 탈당화시켰다. 디글리코실화 반응 후, 샘플을 환원된 쿠마시-염색된 SDS-PAGE에서 분석할 준비가 되었다. ALT-803, 탈당화되지 않은 hIL7/IL21/TxM 단백질 및 단백질 디글리코실화 믹스 (디글리코실화 효소 효소 함유)도 대조군으로서 분석하였다. 결과는 탈당화된 IL-21/IL-15RaSu/Fc 및 IL-7/IL-15N72D 단백질에 상응하는 밴드가 계산된 분자 질량과 일치하여 각각 약 51kDa 및 30kDa로 이동한다는 것을 나타낸다 (도 4). 이러한 발견은 hIL7/IL21/TxM 복합체의 포유 동물 세포 생산 단백질이 당화되어 있음을 확인시켜 준다. ELISA 기반 방법은 hIL7/IL21/TxM 융합 단백질 복합체의 형성을 확인해 준다. 도 5에서, 형질 감염된 CHO 세포로부터의 배양 상청액에서의 IL-7/IL-15N72D:IL-21/IL-15RaSu/Fc 융합 단백질 복합체는 포획 항체, 항-인간 IL-15 항체 (MAB647, R & D Systems) 및 검출 항체, 호오스래디시 퍼옥시다아제 접합된 항 인간 IgG 항체와 함께 huIgG1/IL15 특이적 ELISA를 사용하여 검출되었다. 이것은 알려진 농도의 유사한 시토카인 TxM 융합 단백질 복합체 (hIL18/IL12/TxM)와 비교된다. hIL7/IL21/TxM 융합 단백질 복합체로부터의 신호를 융합 단백질 농도를 추정하기 위해 hIL18/IL12/TxM 대조군의 신호와 비교할 수 있다.
인간 IgG (GAH) 및 IL-15에 대한 포획 및 프로브 항체 및 IL7와 IL15, IL21와 IL15 및 IL7와 IL21에 대한 항체의 조합을 사용하여 정제된 hIL7/IL21/TxM에 대해 유사한 ELISA를 수행하였다 (도 6). 이들 검정에서, hIL18/IL12/TxM 및 ALT-803을 대조군으로 사용하였다. 이들 분석의 결과는 가용성 IL-7/IL-15N72D, IL-21/IL-15RaSu/Fc 단백질이 CHO 세포에서 생성될 수 있고 hIL7/IL21/TxM 융합 단백질 복합체가 배지를 형성하여 여기에 분비될 수 있음을 입증한다. 분비된 단백질은 정제될 수 있고 융합 단백질 복합체는 그대로 남아있다.
실시예 2:hIL7/IL21/TxM 융합 단백질 복합체의 활성의 시험관 내 특성
hIL7/IL21/TxM 융합 단백질 복합체의 IL-15 면역 자극 활성을 평가하기 위해, 마우스 조혈 세포주 인 IL-15 의존적 32Dβ 세포의 증식을 평가하였다. 증가하는 수준의 hIL7/IL21/TxM을 200μL IMDM:10 % FBS 배지에서 32Dβ 세포 (104 세포/웰)에 첨가하고 세포를 37 ℃에서 3 일 동안 배양하였다. 이어서 PrestoBlue 세포 생존능 시약 (20 ㎕/웰)을 첨가하였다. 4 시간 후, 대사 활성 세포에 의한 레사주린 계 용액인 PrestoBlue의 환원에 기초하여 세포 증식을 결정하기 위해 570 nm (정규화를 위한 600 nm 기준 파장으로)에서 흡광도를 측정하였다. IL-15N72D:IL-15RαSu/Fc 복합체 (ALT-803)의 생체 활성은 양성 대조군으로 평가되었다. 도 7에 도시된 바와 같이, hIL7/IL21/TxM은 32Dβ 세포의 세포 증식을 촉진하여 IL-15 활성을 입증할 수 있었다. hIL7/IL21/TxM의 활성은 IL-7과 IL-15N72D 도메인의 결합으로 인해, ALT-803의 활성과 비교하여 감소되었다.
각각의 시토카인 (IL-7, IL-21 및 IL-15)의 개별 활성을 입증하기 위해, 각 시토카인에 의한 수용체 신호 전달에 반응하여 독특하게 인산화된 단백질을 이용하여 유세포 분석 기반 세포내 인단백질 검정법을 개발하였다 (IL-7:Stat5, IL-21:Stat3 및 IL-15:Stat5). IL-7 활성을 시험하기 위해, 마우스 2E8 세포주를 4 mM L-글루타민, 1.5 g/L 중탄산 나트륨, 0.05 mM 2- 머캅토에탄올, 1 ng/ml 마우스 인터루킨-7 및 20 % FBS과 함께 Iscove의 변형된 둘베코 배지 (IMDM)에서 배양하였다. 포스포 흐름 세포 계측 기반 Stat5 검정법을 위해, 세포를 IMDM에서 2 회 세척하고 37 ℃, 5 % CO2 항온처리로 IL-7 없는 완전한 배지에서 밤새 0.5 x 106/ml로 배양하였다. 다음날, 세포를 IMDM에서 세척하고 계수하였다.
유세포 분석기로 포스포-Stat5를 측정하여 32Dβ 세포주에서 IL-15 활성을 측정하였다. 32Dβ 세포주를 2 ng/ml 인간 IL-2 및 10 % FBS와 함께 IMDM에서 배양 하였다. 포스포-흐름 세포 측정법 기반 Stat5 검정을 위해, 세포를 IMDM에서 2 회 세척하고 37 ℃, 5 % CO2 항온처리로 IL-7 없이 완전한 배지에서 밤새 0.5 x 106/ml로 배양하였다. 다음날, 세포를 IMDM에서 세척하고 계수하였다.
유세포 분석기로 포스포-Stat3 (727)을 측정함으로써 정제된 인간 T 세포에서 IL-21 활성을 측정하였다. 신선한 인간 백혈구를 혈액 은행으로부터 얻고 CD3+ T 세포를 RosetteSep/인간 CD3+ T 세포 시약 (StemCell Technologies)으로 단리하였다. CD3+ T 세포의 순도는 > 95 %였다. 세포를 2 mM L- 글루타민, 페니실린, 스트렙토 마이신 및 10 % FBS가 보충된 RPMI 1640에서 배양하였다.
세포 (0.25 x 106/튜브)를 FACS 튜브에 접종하여 각 시토카인의 활성을 시험 하였다. 세포를 IL-7 (100 ng), IL-21 (100 ng) 및 ALT-803 (100 ng)으로 단독으로 또는 동일한 농도로 조합하거나 또는 hIL7/IL21/TxM (1000-62.5 ng/mL)와 조합하여 37 ℃, 5 % CO2 항온처리기에서 15 분 동안 자극하였다. 최종 부피의 배지 및 시토카인을 100 μL로 조정했다. 15 분 배양 후, 파라포름알데히드 (Sigma)를 1.6 %의 최종 농도로 첨가하고 세포를 추가 10 분 동안 암실에서 실온에서 배양하였다. 이어서, 세포를 실온에서 5 분 동안 1500rpm으로 원심 단리하여 1mL의 FACS 완충액 (PBS, 0.5 % BSA, 0.1 % NaN3)으로 세척하였다. 세포 펠렛을 부드럽게 볼텍싱하여 냉각된 100 % 메탄올 100 ㎕에 재현탁시켰다. 세포를 4 ℃에서 30 분 동안 추가로 항온처리한 후 1mL의 FACS 완충액으로 세척하였다. 이어서, 세포 펠렛은 IL-7 및 IL-15 활성을 테스트하기 위해 ospho-Stat5 Alexa-Fluro-488 항체 (BD Bioscience)를 함유하고 IL-21 활성을 테스트하기 위해 Phospho-Stat3 Alexa-Fluro-488 항체 (BD Bioscience)를 함유하는 50 μl의 FAC 완충액에 재현탁시켰다. 암실에서 30 분 동안 실온에서 항온처리한 후, 세포를 1mL의 FACS 완충액으로 세척하고, 300μL의 FACS 완충액에 재현탁시키고 유세포분석으로 분석하였다.
마우스 2E8 세포 또는 정제된 인간 T 세포 (> 95 % CD3+) 또는 32Dβ 세포를 1 μg/mL (6.3 nM) hIL7/IL21/TxM로 단기 자극하게 되면 재조합 IL-7 (107 ng/mL; 6.3 nM), IL-21 (112 ng/mL; 6.3nM) 및 ALT-803 (15.12 ng/mL; 6.3 nM)의 조합에서 볼 수 있는 것과 유사한 반응이 나왔다 (도 8a-f). 이들 결과는 hIL7/IL21/TxM 융합 단백질 복합체의 각각의 시토카인 도메인이 그의 특정 면역 자극 생물학적 활성을 유지한다는 것을 입증한다.
IL-7, IL-21 및 IL-15 활성의 조합은 이들 시토카인 단독보다 나이브 T 세포에 의한 IFN-γ 생산을 유도하는데 더 효과적이라는 것이 공지되어 있다. hIL7/IL21/TxM 복합체의 조합된 시토카인 활성을 평가하기 위해, 정제된 T 세포를 hIL7/IL21/TxM 복합체 (6.3 nM), IL-7 (6.3 nM), IL-21 (6.3 nM) 및 ALT-803 (6.3 nM)의 조합 또는 각각의 시토카인 단독으로 배양하였다. 3 일 후, 배양 상청액 중의 IFN-γ 수준을 ELISA 방법으로 측정하였다. 도 9에 도시된 바와 같이, 결합된 개별 시토카인, IL-7 + IL-21 + ALT-803의 존재하에 정제된 T 세포는 IFN-γ 생산을 유도하였다. 그러나, hIL7/IL21/TxM 복합체 나이브 T 세포의 존재하에 배양될 때 높은 수준의 IFN-γ를 생성하였다. 이들 결과는 hIL7/IL21/TxM 융합 단백질 복합체가 조합된 IL-7, IL-21 및 IL-15 시토카인의 예상되는 면역 자극 활성을 나타내는 것을 입증해준다.
실시예 3: hIL7/IL21/TxM 융합 단백질 복합체로 자극 후 정제된 나이브 T 세포, CD3
+
T 세포 및 CD8
+
T 세포의 증식
이전 연구는 IL-7, IL-15 및 IL-21의 존재 하에서 T 세포 증식이 효율적으로 유도될 수 있음을 보여주었다. hIL7/IL21/TxM 융합 단백질 복합체가 T 세포의 증식을 촉진하는 능력을 평가하기 위해, 인간 나이브 T 세포를 2 명의 건강한 공여자 로부터의 혈액(1x105 세포/ml)으로부터 RosetteSep 인간 나이브 CD8+ T 세포 키트 (STEMCELL Technology)를 사용하여 정제하였다. 이들 세포 (> 85 % CD3+)를 hIL7/IL21/TxM 또는 개별 재조합 IL-7, IL-21 및 ALT-803의 조합으로 2-5 일 동안 배양하였다. 시토카인 자극된 나이브 T 세포의 증식을 Presto-Blue에 의해 평가하고 유세포분석에 의해 분석하였다. 결과는 hIL7/IL21/TxM 융합 단백질 복합체가 IL-7, IL-21 및 IL-15의 조합과 유사하거나 더 큰 정도로 정제된 나이브 T 세포의 증식을 유도할 수 있음을 나타낸다 (도 10a 및 b는 두 개의 상이한 공여자로부터의 결과를 나타내고, 도 10c는 72 시간 시점에서의 평균 결과를 보여준다). 따라서, hIL7/IL21/TxM 융합 단백질 복합체에 의한 자극은 정제된 나이브 T 세포의 증식을 유도할 수 있다.
유사하게, IL-7, IL-15 및 IL-21로 정제된 T 세포를 자극하여 T 세포의 증진된 증식을 생체 외에서 유도하였다. Te 세포의 증식을 촉진하는 hIL7/IL21/TxM의 능력을 평가하기 위해, 정제된 CFSE 표지된 인간 T 세포 (> 90 % CD3+, RosetteSep ™ 인간 CD8+ T 세포 농축 칵테일을 통해 정제됨) (1x105 세포/ml)를 hIL7/IL21/TxM 또는 별개의 재조합 IL-7, IL-21 및 ALT-803의 조합으로 7 일 동안 자극하였고 시토카인 유도된 T 세포 증식을 유세포분석기로 평가하였다. 결과는 hIL7/IL21/TxM 복합체가 IL-7, IL-21 및 IL-15의 조합보다 정제된 T 세포의 증식을 더 잘 유도할 수 있음을 나타낸다 (도 11).
추가 연구에서, 세포 추적 바이올렛 표지된 인간 CD8+ T 세포 (> 90 % CD8+, RosetteSep ™ 인간 CD8+ T 세포 농축 칵테일을 통해 정제됨) (2.5x105 세포/ml)를 hIL7/IL21/TxM 또는 별도의 재조합 IL-7, IL-21 및 ALT-803의 조합으로 자극하였다. 7 일 후, T 세포 표현형을 결정하기 위해 항체를 계수하고 염색하기 위해 세포를 수집하였다. 인간 CD8+ T 세포의 확장은 ALT-803 (10 nM), IL-7 (25 ng/mL) 및 IL-21 (25 ng/mL) (3.9 배)의 혼합물 또는 ALT-803 단독 (10 nM) (2.5 배)과 비교하여 10 nM hIL7/IL21/TxM (4.6 배)로 7 일간의 항온처리 이후 최대가 되었다 (도 12). 배지에서만 자란 세포는 확장을 보이지 않았다.
유세포 분석법을 사용하여 세포 추적 바이올렛 희석 (즉, 각 분열에 의해 세포 당 감소된 신호)에 의해 결정된 바와 같이 세포 증식을 겪고 있는 CD8 T 세포의 표현형을 평가하였다 (도 13). 결과는 폴드 확장 데이터를 확인하여, ALT-803, IL-7 및 IL-21의 혼합물 또는 ALT-803 단독에서 성장한 세포와 비교하여 hIL7/IL21/TxM에서 항온처리된 인간 CD8+ T 세포에서 더 높은 수준의 세포 증식을 보였다. 배지 단독으로 성장한 세포에서는 증식이 관찰되지 않았다. CD45RO, CCR7 및 CD95를 발현하는 CD8+ T 세포는 hIL7/IL21/TxM에서의 항온처리 이후 유의한 증식을 나타낸다. 또한, 낮은 CCR7 및 CD62L으로는 CD8+ T 세포에서 증식이 관찰되는 반면, 증가된 CD45RA이 그보다는 적게 증식된 세포는 hIL7/IL21/TxM에 의한 활성화 후 CD45RO 표현형으로 전환되었다. 결과는 CD8+ 효과기 메모리 T 세포뿐만 아니라 CD8+ 중앙 기억 T 세포의 증식이 hIL7/IL21/TxM에 의해 유도되고 ALT-803 + IL-7 + IL-21 조합에서 보여지는 것보다 더 큰 수준으로 유도되는 것을 나타낸다 .
실시예 4: hIL7/IL21/TxM 융합 단백질 복합체에 의한 인간 CD8
+
T 세포의 상이한 서브 세트의 시험관 내 확장
인간 CD8+ T 세포의 상이한 서브세트의 시험관 내 확장을 평가하기 위해, 연막을 혈액 은행으로부터 받았다. 총 CD8 T 세포를 RosetteSep ™ 인간 CD8 음성 선택 키트 (STEMCELL Technologies)로 단리하였다. CD8 T 세포의 농축 후, 나이브, 중앙 기억, 효과기 기억 및 기억 줄기 CD8 T 세포 서브세트를 하기 마커를 사용하여 유세포분석에 의해 분류하였다. 나이브 CD8+ T 세포는 살아있는 CD8+, CCR7+, CD45RO- 및 CD95- 세포로 표현형화되었다. CD8+ T 효과기 메모리 세포는 살아있는 CD8+, CCR7- 및 CD45RO+ 세포로 표현형 화되었다. CD8+ T 중앙 기억 세포를 살아있는 CD8+, CCR7+ 및 CD45RO+ 세포로 표현형화 하였다. CD8+ T 기억 줄기 세포를 살아있는 CD8+, CCR7+, CD45RO- 및 CD95+ 세포로 표현형화하였다. 분류된 세포의 순도를 확인 하였다 (즉, 세포의 > 95 %가 원하는 표현형을 갖는 경우 샘플이 순수한 것으로 간주됨).
분류된 상이한 집단 세포를 제조자의 지시에 따라 CFSE (카르복시플루오레세 인 숙신이미딜 에스테르) (Molecular Probes)로 표지하였다. CFSE 표지된 CD8+ T 세포 서브세트는 37 ℃에서 5 % CO2에서 96-웰 평평한 바닥 판에서 200 μL의 배지에서, 배지 단독, IL-7 + IL-21(각 25ng), IL7(25ng) + ALT-803(144ng), IL21(25ng) + ALT-803(144 ng), IL7(25 ng) + IL21(25 ng) + ALT-803 (144 ng) 또는 hIL7/IL21/TxM (1.4 μg)으로 자극되었다. 7 일 후, 2 % FBS-PBS로 웰을 4 회 세척하고 세척액을 튜브에 수집함으로써 웰로부터 세포를 수확하였다. 수확된 세포를 1500 RPM에서 5 분 동안 원심 단리하여 2 % FBS-PBS로 1 회 더 세척하였다. 세포를 100 ㎕의 % FBS-PBS에 재현탁시키고, 그 중 10 ㎕가 0.4 % 트리판 블루(Trypan Blue)로 1:1 희석한 후 혈구 계수기로 세포를 계수하는데 사용하였다. 시토카인 또는 hIL7/IL21/TxM 복합체로 7 일간 항온처리한 후 정제된 CD8+ T 세포 서브세트의 확장을 평가하기 위해 세포 수를 결정하였다. 결과는 hIL7/IL21/TxM 융합 복합체를 사용한 처리가 배지 단독 또는 시험된 시토카인 중 둘의 조합과 비교하면 나이브, 중앙 기억, 효과기 기억 및 기억 줄기 CD8+ T 세포 서브 세트의 확장을 증가시킬 수 있음을 나타낸다. 더욱이, hIL7/IL21/TxM 복합체는 CD8+ T 세포 중심 기억 및 효과기 기억 서브 세트의 모집단을 확장하는데 있어서 IL-7, IL-21 및 ALT-803의 조합보다 더 효과적이며 (도 14), 이는 분류되지 않은 인간 CD8+ T 세포에서 나타나는 결과와 일관된다.
확장 이외에도, 유세포분석에 의한 CSFE 희석에 기초하여 인간 CD8+ T 세포 서브 세트의 증식을 평가하였다. 이 분석을 위해, 나머지 세포를 1 ml FACS 완충액으로 1 회 세척하고 세포를 항 CD45RO, CD95, CCR7 및 CD8 항체 (FACS 완충액에서 30 분 동안 샘플 당 2 μL)로 염색하였다. 암실에서 30 분 동안 실온에서, 세포를 1mL FACS 완충액으로 세척하고 300 μL FACS 완충액에 재현탁시켰다. 상이한 집단의 서브세트에 대해 게이팅된 유세포분석에 의해 세포를 분석하였다. 나이브 CD8+ T 세포는 살아있는 CD8+, CCR7+, CD45RO- 및 CD95- 세포로 표현형화 되었다. CD8+ T 효과기 메모리 세포는 살아있는 CD8+, CCR7- 및 CD45RO+ 세포로 표현형화 되었다. CD8+ T 중앙 기억 세포를 살아있는 CD8+, CCR7+ 및 CD45RO+ 세포로 표현형화 하였다. CD8+ T 기억 줄기 세포를 살아있는 CD8+, CCR7+, CD45RO- 및 CD95+ 세포로 표현형화 하였다. CSFE 희석에 기초하여 각 집단을 증식에 대해 평가하였다. 도 15를 참조하면 된다. 이 연구는 각각의 인간 CD8 T 세포 서브세트의 증식이 배지 제어 세포에서 관찰된 증식이 거의 또는 전혀 없는 것에 비해 hIL7/IL21/TxM에 의해 유도되었음을 입증하였다. ALT-803 + IL-7 + IL-21 조합을 포함하는 다른 모든 조건과 비교하여 hIL7/IL21/TxM로의 항온처리 이후 CD8+ T 세포 중심 기억 및 효과기 기억 서브 세트에서 가장 높은 수준의 세포 증식이 관찰되었다.
실시예 5: hIL7/IL21/TxM 융합 단백질 복합체에 의한 자극 후 정제된 NK 세포의 증진된 증식, 세포 독성 및 활성화
인간 NK 세포의 증식 및 활성화에 영향을 미치는 hIL7/IL21/TxM의 능력 또한 평가되었다. NK 세포를 StemCell RosetteSep ™ Human NK 세포 농축 칵테일을 사용하여 인간 백혈구를 정제하였다. 정제된 NK 세포 (> 90 % 순도)를 50 nM hIL7/IL21/TxM, 50 nM hIL18/IL12/TxM (대조군) 또는 10 nM ALT-803 (대조군)을 함유하는 배지로 24 웰 플레이트에 2 x 106 세포/mL로 접종하였다. 3 일 후, 세포를 계수하고 10 nM hIL7/IL21/TxM 또는 10 nM ALT-803 (대조군)을 함유하는 배지를 사용하여 0.5 x 106 세포/mL로 재접종하였다. 추가 3 일 후, 세포를 10 nM hIL7/IL21/TxM 또는 10 nM ALT-803 (대조군)을 함유하는 배지로 0.5 x 106 세포/mL로 재접종하였다. 10 일째에, 세포를 수확하고, 증식 및 세포 표현형에 대해 평가하고, K562 표적 세포에 대한 세포 독성에 대해 시험하였다.
이 연구의 결과는 hIL7/IL21/TxM이 초기 자극(1 일에서 3 일째)에 사용된 시토카인에 관계없이 ALT-803보다 정제된 인간 NK 세포의 확장을 위해 더 우수한 시토카인 지원 (4 일에서 10 일째)을 제공함을 나타내므로, NK 세포 배양물의 대다수는 hIL7/IL21/TxM을 함유하는 배지에서 4 일 내지 10 일째 성장 후 10 일째까지 10 배 이상 확장을 나타냈다 (도 16). NKp46 및 CD25 항체로 염색하는 유세포분석에 기초하여, hIL7/IL21/TxM 지원 NK 세포는 hIL18/IL12/TxM에 이어서 ALT-803 시토카인으로의 단기간 항온처리에 이어 관찰된 시토카인 유도된 메모리 유사 (CIMK) NK 세포에 필적하는 활성화된 CD25+ 표현형을 보여주었다 (도 17).
이들 세포의 세포 독성 활성을 K562 표적 세포에 의한 4 시간 사멸 검정법으로 평가하였다. 간략하게, K562 표적 세포를 Celltrace violet (CVT)으로 표지한 다음, 확장된 인간 NK 효과기 세포와 2.5:1 (효과기:표적)의 비율로 4 시간 동안 공동 배양하였다. 세포를 수확 세정한 다음에 2 ㎍/mL 요오드화 프로피디움을 함유하는 RPMI에 재현탁시켰다. 요오드화 프로피디움 및 CTV의 공동 염색에 의해 종양 세포 용해를 측정하였다. 특이적 사멸 률은 NK 세포와 공동 배양되지 않은 웰로부터 측정된 K562 세포의 임의의 백그라운드 사멸을 감산함으로써 계산된다. hIL7/IL21/TxM으로 초기 3 일 자극이 제공된 후 hIL7/IL21/TxM 또는 ALT-803으로 시토카인이 지원된 인간 NK 세포는 초기 hIL18/IL12/TxM 자극을 받은 이후 hIL7/IL21/TxM 또는 ALT-803 시토카인이 지원된 것 보다 K562 세포에 대해 더 나은 세포독성을 나타내었다 (도 18). 이 결과는 이들 세포의 활성화 표현형이 CD25 염색에 기초하여 유사한 것으로 나타났기 때문에 놀라운 것이었다. 이러한 발견과 함께 hIL7/IL21/TxM이 인간 NK 세포 증식을 유도하는데 매우 효과적이어서, 이는 상승된 세포독성 활성을 갖는 표현형을 가져오는 것을 나타낸다.
인간 종양 세포에 대한 NK 세포 세포독성을 유도하는 hIL7/IL21/TxM의 능력을 추가로 특성화하기 위한 추가 연구가 수행되었다. 2 개의 상이한 공여자로부터의 정제된 인간 신선한 NK 세포를 2:1의 효과기:표적 비 (E:T)에서 40 시간 동안 CellTrace violet으로 표지된 인간 TF 양성 췌장암 SW1990 세포와 혼합하였다. 인간 NK 세포를 활성화시키기 위해 50 nM의 ALT-803 또는 hIL7/IL21/TxM을 첨가하고 배지만을 대조군으로 사용하였다. 일부 배양에서, 인간화된 항 인간 조직 인자 항체 IgG1 (hOAT)을 0.1 nM로 첨가하여 ADCC를 유도하였다. 항온처리 기간의 종료시, 죽은 바이올렛 표지된 SW1990 세포의 백분율은 요오드화 프로피디움으로 염색한 후 유세포분석에 의해 결정되었다 (도 19). hIL7/IL21/TxM 단독으로 자극한 후, 인간 NK 세포는 ALT-803 또는 대조군 배지와 비교하여 SW1990 종양 세포에 대해 상당한 세포 독성을 나타냈다. 이러한 결과는 K562 표적에 대해 hIL7/IL21/TxM 자극된 NK 세포에서 강화된 세포독성이 관찰된 것과 일치한다. 항 TF 항체를 추가하게 되면, 다시 가장 높은 세포독성을 나타내는 hIL7/IL21/TxM으로 자극된 NK 세포로, TF 양성 종양 세포의 NK 매개 ADCC를 더욱 증가시킨다. 이러한 발견은 hIL7/IL21/TxM이 인간 NK 세포의 강력한 활성화를 제공하여 결과적으로 종양 세포에 대해 향상된 자연 사멸 및 ADCC를 가져온다는 것을 나타낸다.
hIL7/IL21/TxM의 잠재적 작용 메커니즘을 평가하기 위해, IFNγ의 수준을 상기 기술된 NK 세포/SW1990 종양 세포 배양물의 상청액을 사용하여 ELISA에 의해 결정하였다. IFNγ의 증가된 수준은 hIL7/IL21/TxM을 함유하는 NK 세포/SW1990 세포 배양에서 발견되는 반면, IFNγ는 ALT-803 또는 대조군 배지 조건에서 거의 또는 전혀 관찰되지 않았다 (도 20). IFLγ 방출은 hIL7/IL21/TxM 자극된 세포에 항 TF 항체의 첨가에 의해 추가로 유도되었으나, ALT-803 또는 대조군 배지 조건에서 훨씬 더 적거나 전혀 없었다. 결과는 hIL7/IL21/TxM이 NK 세포 IFNγ 생산을 유도하는데 매우 효과적이며, 이는 ADCC 항체의 첨가에 의해 추가로 증가될 수 있음을 나타낸다.
그랜자임 B의 인간 NK 세포 발현에 대한 hIL7/IL21/TxM의 효과가 또한 평가되었다. 상이한 두 공여자로부터 정제된 인간 NK 세포 (4 x 106 세포/웰)를 50 nM hIL7/IL21/TxM, 50 nM ALT-803를 갖는 RPMI-10 배지 또는 대조군 배지에서 16 시간 동안 항온처리하였다. 이어서, NK 세포를 FITC 접합된 항 그랜자임 B 항체로 세포 내 염색하고, 그랜자임 B의 수준 (MFI 평균 형광 강도)을 유세포 분석에 의해 분석 하였다. hIL7/IL21/TxM에서의 항온처리는 NK 세포에서 그랜자임 B 수준의 2.8 내지 5.6 배 증가를 초래한 반면, ALT-803 처리된 NK 세포에서는 소량의 증가 (1.1 내지 1.4 배)만이 관찰되었다. 도 21를 참조하면 된다. 이러한 발견은 인간 NK 세포의 세포 독성 잠재력을 향상시키는 hIL7/IL21/TxM의 능력을 추가로 예시한다.
실시예 6: IL-7/IL-21/TxM 복합체의 시험관 내 및 생체 내 활성 및 노화 세포 및 노화 세포와 연령 관련 병리에 대한 IL-7/IL-21/TxM 자극 면역 세포의 입양 세포 전달
위에서 지적한 바와 같이, 장기 및 조직에서 노화 세포의 축적은 연령 관련 질환과 관련이 있다. 시험관 내 및 생체 내에서 노화 세포 및 그의 관련 병리를 감소시키기 위한 치료 전략을 평가하기 위한 방법이 개발되었다. hIL7/IL21/TxM 복합체의 활성을 평가하기 위해, 당 업계에 공지된 방법을 통해 시험관 내에서 노화 세포가 생성될 것이다. 간단히 말하면, 인간 이배체 섬유 아세포, IMR-90 및 WI38 (ATCC, 미국 버지니아 매너서스, ATCC), 인간 포피 섬유 아세포 BJ (ATCC, 미국 버지니아 매너서스) 및 일차 인간 간 근섬유 아세포 (활성 간 성상 (HS) 세포)는 표준 조건 (즉, 10 % FCS, 1 % L-글루타민 및 1 % 페니실린 스트렙토 마이신이 보충되고 7.5 % CO2로 37 ℃에서 유지된 DMEM)에서 성장시켰다. 성장하는 세포를 에토포시드 (100 μM, 시그마)로 48 시간 동안 처리함으로써 DNA 손상 유도 노화 (DIS) 세포가 생성될 것이다. 에토포시드 제거 7 일 후 세포는 노화된 것으로 간주되었다. 대안적으로, 종양 유전자 유도 노화는 mCherry-H-Rasv12 (또는 대조군으로서 mCherry)로 IMR-90 세포의 레트로바이러스 감염에 의해 달성될 것이고, 세포는 감염 종료 9 일 후에 노화로 간주되었다. IMR-90 세포는 또한 2 일 간격으로 0.1 μM 독소루비신으로 2 회 처리함으로써 노화가 유도될 수 있고 7 일 후에 분석될 수 있다. 이러한 세포는 화학 요법 유도 노화를 대표한다. 노화 세포는 시험관 내 및 조직에서 이들 세포를 검출하기 위해 면역 조직 화학 (IHC) 바이오 마커로서 검정될 수 있는 높은 수준의 베타 갈락토시다제를 발현한다 (Dimri 등, Proc. Natl. Acad. Sci. USA. 1995; 92, 9363-9367). 노화 세포의 다른 검출 가능한 바이오마커는 p16ink4a, IL-1α (초기 SASP 인자) 및 IL-6 (늦은 SASP 인자) (Baar 등, Cell. 2017; 169, 132-47)을 포함한다.
인간 NK 세포주 (즉, NK-92) 및 정제된 인간 NK 세포의 노화 세포에 대한 세포 독성 활성은 시험관 내에서 평가될 것이다. 간략하게, 성장 또는 DIS IMR-90 표적 세포 (또는 성장 또는 DIS WI38, BJ 또는 HS 세포)는 웰당 5 x 105로 12 웰 플레이트에 플레이팅될 것이고; 이어서 10 x 105 NK-92 또는 정제된 NK 세포를 각각의 웰에 첨가할 것이다. 2 시간의 공동 항온 처리 후, 제조업체의 지침에 따라 비부착 NK 세포는 부드럽게 세척되고 Presto Blue (Life Technologies, CA, USA) (또는 PI 또는 크리스탈 바이올렛 염색)를 사용하여 남아있는 부착성 표적 세포의 정량화에 기초하여 세포 독성이 측정될 것이다. 공개된 결과에 기초하여 (예를 들어, Sagiv, 등 Oncogene 2013; 32, 1971-1977 참조), DIS 세포는 E:T 비율의 범위에서 NK 세포 매개 세포 독성에 대해 성장 세포 보다 더 민감할 것으로 예상된다. 이 모델에서 면역 세포 활성에 대한 hIL7/IL21/TxM 복합체의 효과를 평가하기 위해, 인간 NK 세포주 (즉, NK-92) 및 정제된 인간 NK 세포는 다양한 농도의 hIL7/IL21/TxM 복합체 또는 IL-7, IL-21 및 ALT-803 단독 또는 조합으로 항온처리될 것이다. 이어서, 활성화된 NK 세포는 상기 기재된 바와 같이 성장 또는 DIS 표적 세포와 다양한 E:T 비로 공동 항온처리될 것이며, DIS 표적에 대한 NK 매개 세포 독성이 결정될 것이다. hIL7/IL21/TxM 복합체로 활성화된 NK 세포는 처리되지 않은 NK 세포 대조군인 DIS 세포에 대해 보다 강력한 세포독성을 나타낼 것으로 예상된다. 성장 및 DIS 표적에 대한 hIL7/IL21/TxM 처리된 NK 세포의 선택성이 또한 평가될 것이다. 이들 연구의 결과는 hIL7/IL21/TxM이 효과적인 "senolytic" 제제 (정상 세포에 대해 최소한의 해로움을 갖는 노화 세포의 수준을 감소시킬 수 있는 제제로서 정의됨)임을 입증할 것으로 예상된다. 또한, 입양 세포를 포함하여 hIL7/IL21/TxM 처리된 NK 세포는 senolytic 활성을 나타낼 것으로 예상된다. DIS 세포에 대한 면역 반응을 자극하는 hIL7/IL21/TxM 복합체의 능력을 입증하기 위해 T 세포에 의한 유사한 연구가 수행 될 것이다.
노화 세포 및 연령 관련 질환에 대한 IL-7/IL-21/TxM 복합체의 효과는 동물 모델에서 평가될 것이다. 독소루비신 치료는 마우스에서 노화를 유도하여 아스파르테이트 아미노트랜스퍼라제 (AST)의 증가된 혈장 수준에 의해 측정된 바와 같이 간에서 노화된 세포의 수준을 증가시키고 간 기능을 감소시키는 것으로 나타났다 (Baar 등, Cell. 2017; 169, 132-47). 이 모델에서 IL-7/IL-21/TxM 복합체의 효과를 평가하기 위해 10-40 주령의 C57BL6 마우스를 0 일과 10 일째에 10mg/kg 독소루비신을 복강 내 치료하여 노화와 간 손상을 유발한다. 치료되지 않은 마우스는 대조군으로 작용한다. 이어서, 마우스를 다양한 용량의 IL-7/IL-21/TxM 복합체 (마우스 또는 인간 버전) 또는 IL-7, IL-21 또는 ALT-803 단독 또는 조합하여 치료할 것이다. PBS는 대조군 치료제 역할을 한다. 치료는 24 일째에 i.v. 또는 s.c 루트로 매주 1-2 회 제공된다. 38 일째에 동물을 희생시키고 AST 활동 분석 키트 (Sigma)를 사용하여 혈장 AST 수준을 평가한다. 간 섹션은 또한 상기 기술된 바이오 마커를 사용하여 IHC에 의해 조직학 및 노화 세포의 존재에 대해 평가된다. 면역 세포 (즉, NK 및 T 세포 및 서브세트)에 대한 치료 효과는 특정 면역 세포 서브세트 및 활성화/세포독성 마커를 검출하기 위한 항체를 사용한 유세포분석 및 혈청 시토카인 수준을 검출하는 방법에 의해 혈액, 비장 및 간에서 평가된다. 노화 세포에 대한 치료 자극 면역 세포 (즉, 혈액 또는 비장)의 기능적 활성은 상기 기재된 방법을 사용하여 결정된다. PBS 대조군과 비교하여, IL-7/IL-21/TxM 복합체의 투여는 독소루비신 치료 후 마우스에서 관찰된 체중 감소를 감소시킬 것으로 예상된다. IL-7/IL-21/TxM 요법에 의해 독소루비신 치료된 마우스에서는 혈장 AST의 수준 및 간에서의 노화 세포 및 병변의 발생이 또한 감소될 것으로 예상된다. IL-7/IL-21/TxM에 의한 면역 반응의 상응하는 활성화는 면역 매개 작용 메커니즘을 제공할 것이다. IL-7, IL-21/TxM과 IL-7, IL-21 또는 ALT-803 단독 또는 조합의 치료 효과의 비교는 IL-7/IL-21/TxM 요법의 보다 강력한 항 노화 활성을 나타내는 것으로 예상된다.
직접 IL-7/IL-21/TxM 주사의 평가 외에도, 독소루비신 치료된 C57BL6 마우스 모델에서 입양 전달된 IL-7/IL-21/TxM 자극된 NK 또는 T 세포의 노화 방지 활성이 평가된다. 이 연구에서, 마우스는 상기 기술된 바와 같이 독소루비신으로 치료될 것이며, 24 일째에 IL-7/IL-21/TxM 복합체 (마우스 또는 인간 버전) 또는 IL-7, IL-21 또는 ALT-803은 단독으로 또는 조합하여 생체 외 치료된 NK 또는 T 세포가 마우스에 입양 전달될 것이다. IL-7/IL-21/TxM 또는 시토카인에 의한 마우스의 추가 치료는 일부 그룹에서 수행되어 입양 전달된 세포에 시토카인 지원을 제공할 수 있다. 면역 반응, 체중 및 독소루비신 유도 간 노화와 손상에 대한 치료 효과는 상기한 바와 같이 평가될 것이다. IL-7/IL-21/TxM- 자극된 NK 또는 T 세포의 입양 전달은 독소루비신 유도된 노화를 갖는 마우스에 상당한 치료상의 이점을 제공할 것으로 예상된다.
IL-7/IL-21/TxM 요법 및 IL-7/IL-21/TxM 자극된 NK 또는 T 세포의 입양 세포 전달에 대한 추가 연구는 자연적으로 노화된 마우스에서 수행될 것이다. IL-7/IL-21/TxM 복합체 또는 IL-7, IL-21 또는 ALT-803 단독 또는 조합은 상기 기술된 바와 같이 4 주령에서부터 115 내지 130 주령(고령) 또는 26 주령(어림) C57BL6 마우스에게 투여된다. 대안적으로, 입양 전달된 IL-7/IL-21/TxM 자극 NK 또는 T 세포의 활성은 상기 기술된 바와 같이 노령 및 어린 마우스에서 평가될 것이다. 자극에 대한 마우스의 체중, 모피 밀도 및 반응성의 변화는 전술한 바와 같이 치료 기간 내내 평가 될 것이다 (Baar 등, Cell. 2017; 169, 132-47). 또한, 우레아 및 크레아티닌의 혈장 수준은 신장 기능의 연령 관련 손실의 평가로서 치료 전후에 수집된 샘플로부터 각각 QuantiChrom Urea Assay Kit (Gentaur) 및 Creatinine Assay Kit (Sigma)로 측정될 것이다. 신장 섹션은 또한 상술한 바와 같이 노화 세포의 존재에 대해 평가될 것이다. PBS 대조군과 비교하여, IL-7/IL-21/TxM 복합체의 투여는 노화된 마우스에서 모피 밀도의 연령 관련 감소 및 비활성을 개선할 것으로 예상된다. 노화된 생쥐의 신장에서 혈장 우레아 및 크레아티닌의 수준 및 노화 세포의 발생률 또한 IL-7/IL-21/TxM 요법에 의해 감소될 것으로 예상된다. 입양 전달된 IL-7/IL-21/TxM 자극된 NK 또는 T 세포를 받는 노화된 마우스에서 유사한 치료상의 이점이 예상된다. 함께, 이들 연구의 결과는 IL-7/IL-21/TxM 복합체로의 치료 및 IL-7/IL-21/TxM 자극 NK 또는 T 세포의 입양 세포 이동이 생체 내에 senolytic 활성 및 노화 세포 및 연령 관련 병리의 감소를 나타내는 것으로 예상된다..
기타 구현예
본 발명은, 본 발명의 상세한 설명과 함께 기술되어 있지만, 전술된 기술은 본 발명의 범위를 예시하기 위한 것이지 제한하고자 하는 것은 아니며, 본 발명의 범위는 첨부된 특허청구범위에 의해 한정된다. 다른 양태들, 이점들, 그리고 변형예들은 하기 청구항들의 범위 내에 있다.
본원에 인용된 특허 문헌 및 과학 문헌은, 당 분야의 숙련자들이 이용 가능한 지식을 확립해준다. 본원에 인용된 모든 미국 특허와, 공개 또는 미공개 미국 특허 출원은 참조로 인용되어 있는 것이다. 본원에 인용된 모든 공개 외국 특허 및 특허출원은 본원에 참조로 인용되어 있는 것이다. 본원에 인용된 승인 번호로서 명시된 Genbank 및 NCBI 제출에 관한 사항도 본원에 참조로 인용되어 있는 것이다. 본원에 인용된 기타 모든 공표 참고문헌, 서류, 논문 및 과학 문헌은 본원에 참조로 인용되어 있는 것이다.
본 발명은, 본 발명의 바람직한 구현예를 참고로 하여 구체적으로 보였을 뿐만 아니라 기술되어 있긴 하지만, 그 형태와 세부사항에 대한 다양한 변화가, 첨부된 청구항들에 의해 포함되는 본 발명의 범위로부터 벗어나지 않고 내부적으로 가하여질 수 있음은 당 업자에 의해 이해될 것이다.
SEQUENCE LISTING
<110> Altor Bioscience LLC
<120> IL-15-BASED FUSIONS TO IL-7 AND IL-21
<130> 048277-533001WO
<140> PCT/US2018/048365
<141> 2018-08-28
<150> US 62/551218
<151> 2017-08-28
<160> 4
<170> PatentIn version 3.5
<210> 1
<211> 1344
<212> DNA
<213> Homo sapiens
<400> 1
atgaagtggg tgaccttcat cagcctgctg ttcctgttct ccagcgccta ctcccagggc 60
caggacaggc acatgatccg gatgaggcag ctcatcgaca tcgtcgacca gctgaagaac 120
tacgtgaacg acctggtgcc cgagtttctg cctgcccccg aggacgtgga gaccaactgc 180
gagtggtccg ccttctcctg ctttcagaag gcccagctga agtccgccaa caccggcaac 240
aacgagcgga tcatcaacgt gagcatcaag aagctgaagc ggaagcctcc ctccacaaac 300
gccggcagga ggcagaagca caggctgacc tgccccagct gtgactccta cgagaagaag 360
ccccccaagg agttcctgga gaggttcaag tccctgctgc agaagatgat ccatcagcac 420
ctgtcctcca ggacccacgg ctccgaggac tccatcacgt gtcctcctcc tatgtccgtg 480
gaacacgcag acatctgggt caagagctac agcttgtact ccagggagcg gtacatttgt 540
aactctggtt tcaagcgtaa agccggcacg tccagcctga cggagtgcgt gttgaacaag 600
gccacgaatg tcgcccactg gacaaccccc agtctcaaat gcattagaga gccgaaatct 660
tgtgacaaaa ctcacacatg cccaccgtgc ccagcacctg aactcctggg gggaccgtca 720
gtcttcctct tccccccaaa acccaaggac accctcatga tctcccggac ccctgaggtc 780
acatgcgtgg tggtggacgt gagccacgaa gaccctgagg tcaagttcaa ctggtacgtg 840
gacggcgtgg aggtgcataa tgccaagaca aagccgcggg aggagcagta caacagcacg 900
taccgtgtgg tcagcgtcct caccgtcctg caccaggact ggctgaatgg caaggagtac 960
aagtgcaagg tctccaacaa agccctccca gcccccatcg agaaaaccat ctccaaagcc 1020
aaagggcagc cccgagaacc acaggtgtac accctgcccc catcccggga tgagctgacc 1080
aagaaccagg tcagcctgac ctgcctggtc aaaggcttct atcccagcga catcgccgtg 1140
gagtgggaga gcaatgggca gccggagaac aactacaaga ccacgcctcc cgtgctggac 1200
tccgacggct ccttcttcct ctacagcaag ctcaccgtgg acaagagcag gtggcagcag 1260
gggaacgtct tctcatgctc cgtgatgcat gaggctctgc acaaccacta cacgcagaag 1320
agcctctccc tgtctcctgg taaa 1344
<210> 2
<211> 448
<212> PRT
<213> Homo sapiens
<400> 2
Met Lys Trp Val Thr Phe Ile Ser Leu Leu Phe Leu Phe Ser Ser Ala
1 5 10 15
Tyr Ser Gln Gly Gln Asp Arg His Met Ile Arg Met Arg Gln Leu Ile
20 25 30
Asp Ile Val Asp Gln Leu Lys Asn Tyr Val Asn Asp Leu Val Pro Glu
35 40 45
Phe Leu Pro Ala Pro Glu Asp Val Glu Thr Asn Cys Glu Trp Ser Ala
50 55 60
Phe Ser Cys Phe Gln Lys Ala Gln Leu Lys Ser Ala Asn Thr Gly Asn
65 70 75 80
Asn Glu Arg Ile Ile Asn Val Ser Ile Lys Lys Leu Lys Arg Lys Pro
85 90 95
Pro Ser Thr Asn Ala Gly Arg Arg Gln Lys His Arg Leu Thr Cys Pro
100 105 110
Ser Cys Asp Ser Tyr Glu Lys Lys Pro Pro Lys Glu Phe Leu Glu Arg
115 120 125
Phe Lys Ser Leu Leu Gln Lys Met Ile His Gln His Leu Ser Ser Arg
130 135 140
Thr His Gly Ser Glu Asp Ser Ile Thr Cys Pro Pro Pro Met Ser Val
145 150 155 160
Glu His Ala Asp Ile Trp Val Lys Ser Tyr Ser Leu Tyr Ser Arg Glu
165 170 175
Arg Tyr Ile Cys Asn Ser Gly Phe Lys Arg Lys Ala Gly Thr Ser Ser
180 185 190
Leu Thr Glu Cys Val Leu Asn Lys Ala Thr Asn Val Ala His Trp Thr
195 200 205
Thr Pro Ser Leu Lys Cys Ile Arg Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 3
<211> 852
<212> DNA
<213> Homo sapiens
<400> 3
atgaagtggg tgaccttcat cagcctgctg ttcctgttct ccagcgccta ctccgattgc 60
gacatcgagg gcaaggacgg caagcagtac gagagcgtgc tgatggtgtc catcgaccag 120
ctgctggaca gcatgaagga gatcggctcc aactgcctca acaacgagtt caacttcttc 180
aagcggcaca tctgcgacgc caacaaggag ggcatgttcc tgttcagggc cgccaggaaa 240
ctgcggcagt tcctgaagat gaactccacc ggcgacttcg acctgcacct gctgaaggtg 300
tccgagggca ccaccatcct gctgaactgc accggacagg tgaagggccg gaaacctgct 360
gctctgggag aggcccaacc caccaagagc ctggaggaga acaagtccct gaaggagcag 420
aagaagctga acgacctgtg cttcctgaag aggctgctgc aggagatcaa gacctgctgg 480
aacaagatcc tgatgggcac caaggagcat aactgggtta acgtaataag tgatttgaaa 540
aaaattgaag atcttattca atctatgcat attgatgcta ctttatatac ggaaagtgat 600
gttcacccca gttgcaaagt aacagcaatg aagtgctttc tcttggagtt acaagttatt 660
tcacttgagt ccggagatgc aagtattcat gatacagtag aaaatctgat catcctagca 720
aacgacagtt tgtcttctaa tgggaatgta acagaatctg gatgcaaaga atgtgaggaa 780
ctggaggaaa aaaatattaa agaatttttg cagagttttg tacatattgt ccaaatgttc 840
atcaacactt ct 852
<210> 4
<211> 284
<212> PRT
<213> Homo sapiens
<400> 4
Met Lys Trp Val Thr Phe Ile Ser Leu Leu Phe Leu Phe Ser Ser Ala
1 5 10 15
Tyr Ser Asp Cys Asp Ile Glu Gly Lys Asp Gly Lys Gln Tyr Glu Ser
20 25 30
Val Leu Met Val Ser Ile Asp Gln Leu Leu Asp Ser Met Lys Glu Ile
35 40 45
Gly Ser Asn Cys Leu Asn Asn Glu Phe Asn Phe Phe Lys Arg His Ile
50 55 60
Cys Asp Ala Asn Lys Glu Gly Met Phe Leu Phe Arg Ala Ala Arg Lys
65 70 75 80
Leu Arg Gln Phe Leu Lys Met Asn Ser Thr Gly Asp Phe Asp Leu His
85 90 95
Leu Leu Lys Val Ser Glu Gly Thr Thr Ile Leu Leu Asn Cys Thr Gly
100 105 110
Gln Val Lys Gly Arg Lys Pro Ala Ala Leu Gly Glu Ala Gln Pro Thr
115 120 125
Lys Ser Leu Glu Glu Asn Lys Ser Leu Lys Glu Gln Lys Lys Leu Asn
130 135 140
Asp Leu Cys Phe Leu Lys Arg Leu Leu Gln Glu Ile Lys Thr Cys Trp
145 150 155 160
Asn Lys Ile Leu Met Gly Thr Lys Glu His Asn Trp Val Asn Val Ile
165 170 175
Ser Asp Leu Lys Lys Ile Glu Asp Leu Ile Gln Ser Met His Ile Asp
180 185 190
Ala Thr Leu Tyr Thr Glu Ser Asp Val His Pro Ser Cys Lys Val Thr
195 200 205
Ala Met Lys Cys Phe Leu Leu Glu Leu Gln Val Ile Ser Leu Glu Ser
210 215 220
Gly Asp Ala Ser Ile His Asp Thr Val Glu Asn Leu Ile Ile Leu Ala
225 230 235 240
Asn Asp Ser Leu Ser Ser Asn Gly Asn Val Thr Glu Ser Gly Cys Lys
245 250 255
Glu Cys Glu Glu Leu Glu Glu Lys Asn Ile Lys Glu Phe Leu Gln Ser
260 265 270
Phe Val His Ile Val Gln Met Phe Ile Asn Thr Ser
275 280
Claims (60)
- 단리된 가용성 융합 단백질 복합체로서,
a) 인터루킨-15(IL-15) 폴리펩티드 도메인을 포함하는 제1 가용성 단백질, 및
b) 면역 글로불린 Fc 도메인에 융합된 가용성 IL-15 수용체 알파 스시 결합 도메인(IL-15RαSu)을 포함하는 제2 가용성 단백질
을 포함하는 적어도 2개의 가용성 단백질을 포함하고,
상기 제1 또는 제2 가용성 단백질 중 하나는 IL-7 결합 도메인 또는 이의 기능적 단편을 추가로 포함하고/하거나,
상기 제1 또는 제2 가용성 단백질 중 하나는 IL-21 결합 도메인 또는 이의 기능적 단편을 추가로 포함하고,
상기 제1 가용성 단백질의 상기 IL-15 도메인은 상기 제2 가용성 단백질의 상기 IL-15RαSu 도메인에 결합하여 가용성 융합 단백질 복합체를 형성하는, 단리된 가용성 융합 단백질 복합체. - 제1항에 있어서, 상기 제1 단백질의 상기 IL-15 도메인은 N72D 돌연변이(IL-15N72D)를 포함하는 IL-15 변이체를 포함하는, 가용성 융합 단백질 복합체.
- 제1항 또는 2항에 있어서, 제1 및/또는 제2 가용성 단백질은 생물학적 활성 모이어티와 관련이 있는, 가용성 융합 단백질 복합체.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 상기 생물학적 활성 모이어티는 시토카인, 항체 또는 이의 단편, T 세포 수용체 또는 이의 단편, 수용체 결합 분자, 수용체 도메인, 면역 체크 포인트 효현제, 면역 체크 포인트 길항제, 케모카인, 성장 인자, 독소, 세포독성 제제, 이의 기능성 단편, 또는 이들의 조합을 포함하는, 가용성 융합 단백질 복합체.
- 제1항 내지 제4항 중 어느 한 항에 있어서, 상기 생물학적 활성 모이어티는 하나 이상의 시토카인을 포함하는, 가용성 융합 단백질 복합체.
- 제1항 내지 제5항 중 어느 한 항에 있어서, 상기 하나 이상의 시토카인은 인터루킨-7(IL-7), 인터루킨-12(IL-12) 또는 이들의 조합을 포함하는, 가용성 융합 단백질 복합체.
- 제6항에 있어서, 상기 제1 가용성 단백질은 IL-7 결합 도메인 또는 이의 기능적 단편을 추가로 포함하는, 가용성 융합 단백질 복합체.
- 제7항에 있어서, 상기 제2 가용성 단백질은 IL-21 결합 도메인 또는 이의 기능적 단편을 추가로 포함하는, 가용성 융합 단백질 복합체.
- 제1항 내지 제8항 중 어느 한 항에 있어서, 상기 제1 가용성 융합 단백질 복합체는 상기 제1 가용성 융합 단백질 복합체의 상기 Fc 도메인을 상기 제2 가용성 융합 단백질 복합체의 상기 Fc 도메인에 연결하는 이황화 결합에 의해 상기 제2 가용성 융합 단백질 복합체에 공유 연결되는, 가용성 융합 단백질 복합체.
- 제1항의 제2 가용성 융합 단백질 복합체에 공유 연결된 제1항의 제1 가용성 융합 단백질 복합체를 포함하는 가용성 융합 단백질 복합체로서, 상기 제1 가용성 단백질 복합체 및 상기 제2 단백질 복합체는 동일하거나 상이한, 가용성 융합 단백질 복합체.
- 제10항에 있어서, 상기 제1 가용성 융합 단백질 복합체는 상기 제1 가용성 융합 단백질 복합체의 Fc 도메인을 상기 제2 가용성 융합 단백질 복합체의 Fc 도메인에 연결하는 이황화 결합에 의해 상기 제2 가용성 융합 단백질 복합체에 공유 연결되는, 가용성 융합 단백질 복합체.
- 제10항에 있어서, 상기 제1 또는 제2 가용성 단백질 중 하나는 질환 항원 및/또는 면역 체크 포인트 또는 신호 전달 분자를 인식하는 결합 도메인을 추가로 포함하는, 가용성 융합 단백질 복합체.
- 제12항에 있어서, 상기 질환 항원은 신생물형성 또는 감염성 질환과 관련이 있는, 가용성 융합 단백질 복합체.
- 단리된 가용성 융합 단백질 복합체로서,
a) 인터루킨-15(IL-15) 폴리펩티드 도메인을 포함하는 제1 가용성 단백질, 및
b) 면역 글로불린 Fc 도메인에 융합된 가용성 IL-15 수용체 알파 스시 결합 도메인(IL-15RαSu)을 포함하는 제2 가용성 단백질
을 포함하는 적어도 2개의 가용성 단백질을 포함하고,
상기 제1 가용성 단백질은 IL-7 결합 도메인 또는 이의 기능적 단편을 추가로 포함하고/하거나,
상기 제2 가용성 단백질은 IL-21 결합 도메인 또는 이의 기능적 단편을 추가로 포함하며,
상기 제1 가용성 단백질의 상기 IL-15 도메인은 상기 제2 가용성 단백질의 상기 IL-15RαSu 도메인에 결합하여 가용성 융합 단백질 복합체를 형성하는, 가용성 융합 단백질 복합체. - 제14항에 있어서, 상기 제1 단백질의 상기 IL-15 도메인은 N72D 돌연변이(IL-15N72D)를 포함하는 IL-15 변이체를 포함하는, 가용성 융합 단백질 복합체.
- 제14항에 있어서, 상기 제1 가용성 단백질을 암호화하는 핵산 서열은 서열 번호 3을 포함하는, 가용성 융합 단백질 복합체.
- 제14항에 있어서, 상기 제1 가용성 단백질을 암호화하는 아미노산 서열은 서열 번호 4를 포함하는, 가용성 융합 단백질 복합체.
- 제14항에 있어서, 상기 제2 가용성 단백질을 암호화하는 핵산 서열은 서열 번호 1을 포함하는, 가용성 융합 단백질 복합체.
- 제14항에 있어서, 상기 제2 가용성 단백질을 암호화하는 아미노산 서열은 서열 번호 2를 포함하는, 가용성 융합 단백질 복합체.
- 제1 가용성 단백질을 암호화하는 핵산 서열로서, 상기 핵산 서열은 서열 번호 3에 제시된 서열을 포함하는, 핵산 서열.
- 제2 가용성 단백질을 암호화하는 핵산 서열로서, 상기 핵산 서열은 서열 번호 1에 제시된 서열을 포함하는, 핵산 서열.
- 제20항 또는 제21항에 있어서, 상기 핵산 서열은 상기 가용성 단백질을 암호화하는 상기 서열에 작동 가능하게 결합된 촉진인자, 번역 개시 신호 및 리더 서열을 추가로 포함하는, 핵산 서열.
- 제20항 및/또는 제21항의 핵산 서열을 포함하는 발현 벡터.
- 면역 기능을 향상시키는 방법으로서,
면역 세포를 제1항 내지 제23항 중 어느 한 항의 가용성 융합 단백질 복합체와 접촉시킴으로써 상기 면역 세포의 면역 기능을 향상시키는 단계
를 포함하는, 방법. - 제24항에 있어서, 상기 면역 세포는: 1) 상기 가용성 융합 단백질 복합체의 IL-15 도메인에 의해 인식되는 IL-15R 사슬, 2) 상기 가용성 융합 단백질 복합체의 IL-7 도메인에 의해 인식되는 IL-7R 사슬, 및/또는 3) 상기 가용성 융합 단백질 복합체의 IL-21 도메인에 의해 인식되는 IL-21R 사슬을 포함하는, 방법.
- 제24항에 있어서, 상기 IL-15R 사슬, 상기 IL-7R 사슬 및/또는 상기 IL-21R 사슬의 신호 전달을 통해 상기 면역 세포를 활성화시키는 단계를 더 포함하는, 방법.
- 표적 세포를 사멸시키는 방법으로서,
다수의 세포를 제1 항 내지 제23 항 중 어느 한 항의 가용성 융합 단백질 복합체와 접촉시키는 단계를 포함하고,
상기 복수의 세포는 표적 질환 세포 및 면역 세포를 포함하는, 방법. - 제26항에 있어서, 상기 면역 세포가 1) 상기 가용성 융합 단백질 복합체의 상기 IL-15 도메인에 의해 인식되는 상기 IL-15R 사슬, 2) 상기 가용성 융합 단백질 복합체의 상기 IL-7 도메인에 의해 인식되는 상기 IL-7R 사슬, 및/또는 3) 상기 가용성 융합 단백질 복합체의 상기 IL-21 도메인에 의해 인식되는 상기 IL-21R 사슬을 포함하는, 방법.
- 제27항 또는 제28항에 있어서,
상기 면역 세포의 증식을 유도하는 단계;
상기 면역 세포를 활성화하는 단계; 및
상기 활성화된 면역 세포에 의해 상기 표적 질환 세포를 사멸시키는 단계
를 더 포함하는, 방법. - 제29항에 있어서, 상기 면역 세포 증식은 상기 IL-15R, 상기 IL-7R 및/또는 상기 IL-21R의 신호 전달을 통해 유도되고/거나 상기 면역 세포는 상기 IL-15R, ㅅ상기 -7R 및/또는 상기 IL-21R의 신호 전달을 통해 활성화되는, 방법.
- 제26항 내지 제29항 중 어느 한 항에 있어서, 상기 표적 세포는 종양 세포, 감염된 세포 또는 노화 세포인 방법.
- 대상체 내 면역 반응을 향상시키는 방법으로서,
a) 면역 세포를 제1항 내지 제23항 중 어느 한 항의 가용성 융합 단백질 복합체와 접촉시키는 단계,
b) 상기 면역 세포의 증식 및 활성화를 유도하는 단계,
c) 상기 활성화된 면역 세포를 상기 대상체에게 투여 (또는 입양 전달)시키는 단계
를 포함하는, 방법. - 제32항에 있어서, 상기 면역 세포는 상기 가용성 융합 단백질 복합체의 IL-15 도메인에 의해 인식되는 IL-15R 사슬, 상기 가용성 융합 단백질 복합체의 IL-7 도메인에 의해 인식되는 IL-7R 사슬, 및/또는 상기 가용성 융합 단백질 복합체의 IL-21 도메인에 의해 인식되는 IL-21R 사슬을 포함하는, 방법.
- 제32항에 있어서, 상기 면역 세포의 증식 및 활성화는 상기 IL-15R, 상기 IL-7R 및/또는 상기 IL-21R의 신호 전달을 통해 유도되는 방법.
- 제32항 내지 제34항 중 어느 한 항에 있어서, 투여 또는 입양 전달은 상기 대상체 내 면역 반응을 향상시키는 방법
- 대상체 내 질환을 예방 또는 치료하는 방법으로서,
a) 면역 세포를 제1항 내지 제23항 중 어느 한 항의 가용성 융합 단백질 복합체와 접촉시키는 단계;
b) 상기 면역 세포의 증식 및 활성화를 유도하는 단계;
c) 상기 활성화된 면역 세포의 유효량을 상기 대상체에게 투여 (또는 입양 적 전달)하는 단계; 및
d) 상기 대상체 내 상기 질환을 예방 또는 치료하기에 충분한 상기 활성화된 면역 세포를 통해 상기 질환 세포를 손상 또는 사멸하는 단계
를 포함하는 방법. - 제36항에 있어서, 상기 면역 세포는 상기 가용성 융합 단백질 복합체의 IL-15 도메인에 의해 인식되는 인터루킨-15 수용체(IL-15R) 또는 이의 기능적 단편, 상기 가용성 융합 단백질 복합체의 IL-17에 의해 인식되는 인터루킨-7 수용체(IL-7R) 또는 이의 기능성 단편, 및/또는 상기 가용성 융합 단백질 복합체의 IL-21에 의해 인식되는 인터루킨-21 수용체(IL-21R) 또는 이의 기능적 단편을 포함하는, 방법.
- 제37항에 있어서, 상기 면역 세포의 증식 및 활성화는 상기 IL-15R, 상기 IL-7R 및/또는 상기 IL-21의 신호 전달을 통해 유도되는, 방법.
- 제36항 내지 제38항 중 어느 한 항에 있어서, 상기 질환은 신생물 형성, 감염성 질환, 또는 노화 세포 또는 연령 관련 질환인, 방법.
- 대상체 내 면역 반응을 향상시키는 방법으로서, 제1항 내지 제23항 중 어느 한 항의 가용성 융합 단백질 복합체의 유효량을 대상체에게 투여하는 단계를 포함하는, 방법.
- 대상체 내 신생물 형성, 감염성 질환, 또는 노화 세포 또는 연령 관련 질환을 치료하는 방법으로서,
제1항 내지 제23항 중 어느 한 항의 가용성 융합 단백질 복합체를 포함하는 약학 조성물의 유효량을 상기 대상체에게 투여하여, 상기 신생물 형성, 상기 감염성 질환, 또는 상기 노화 세포 또는 연령 관련 질환를 치료하는 단계를 포함하는, 방법. - 제41항에 있어서, 상기 신생물형성은 교모세포종, 전립선암, 혈액 암, B 세포 신생물 형성, 다발성 골수종, B 세포 림프종, B 세포 비호지킨 림프종, 호지킨 림프종, 만성 림프구성 백혈병, 급성 골수성 백혈병, 피부 T 세포 림프종, T 세포 림프종, 고형 종양, 요로상피/방광 암종, 흑색종, 폐암, 신세포 암종, 유방암, 위 및 식도 암, 전립선암, 췌장암, 결장 직장암, 난소암, 비 소세포 폐 암종, 및 편평 세포 두경부 암종으로 이루어진 그룹에서 선택되는, 방법.
- 제41항 또는 제42항에 있어서, 상기 노화 세포 또는 연령 관련 질환은 대사성 (비만, 당뇨병), 신경계 (알츠하이머 및 파킨슨 병), 근육, 뼈 및 연골 관련 (사르코니아, 골관절염, 후만증, 탈장 디스크), 조직 기능 장애 관련 (폐기종, 심혈관 및 신장 질환, 및 죽상 경화증) 질환 또는 이들의 조합을 포함하는, 방법.
- 제24항 내지 제41항 중 어느 한 항에 있어서, 상기 면역 세포는 NK 세포, T 세포 또는 줄기 세포 기억 T 세포인, 방법.
- 제44항에 있어서, 상기 활성화된 면역 세포의 유효량은 1 x 104 세포/kg 내지 1 x 1010 세포/kg인, 방법.
- 제45항에 있어서, 상기 면역 세포는 일주일에 적어도 한 번 투여되는, 방법.
- 제24항 내지 제41항 중 어느 한 항에 있어서, 상기 유효량은 상기 융합 단백질 복합체의 약 1 내지 100 μg/kg인, 방법.
- 제47항에 있어서, 상기 융합 단백질 복합체는 일주일에 적어도 한 번 투여되는, 방법.
- 제24항 내지 제48항 중 어느 한 항에 있어서, 상기 융합 단백질 복합체는 면역 세포 증식, 활성화 마커, 표적 세포에 대한 세포 독성 및 ADCC, 그랜자임 B의 발현, 전염증성 시토카인의 생성, IFN-γ 또는 이들의 조합을 증가시키는, 방법.
- 대상체 내 면역 반응을 자극하는 방법으로서,
면역 세포를 단리하는 단계;
상기 면역 세포를 제1항 내지 제23항 중 어느 한 항의 가용성 융합 단백질 복합체와 접촉시키는 단계;
상기 면역 세포를 상기 대상체에게 재주입하는 단계; 및
이에 의해 상기 대상체 내 상기 면역 반응을 자극하는 단계
를 포함하는, 방법. - 제50항에 있어서, 상기 면역 세포는 자가, 일배체 동일, 일배체 매칭 또는 이들의 조합을 포함하는, 방법.
- 제50항에 있어서, 상기 면역 세포는 자가 또는 동종이계 줄기 세포로부터 유래되는, 방법.
- 제51항 또는 제52항에 있어서, 상기 면역 세포는 NK 세포, T 세포, 줄기 세포 기억 T 세포, 활성화된 NK(aNK) 세포, 키메라 항원 수용체 NK(CAR-NK) 세포, 키메라 항원 수용체 T(CAR-T) 세포 또는 이들의 조합을 포함하는, 방법.
- 제50항에 있어서, 하나 이상의 보조제를 투여하는 단계를 선택적으로 포함하는, 방법.
- 신생물 형성, 감염성 질환, 또는 노화 세포 또는 연령 관련 질환을 갖는 대상체를 치료하는 방법으로서,
a) 면역 세포를 제1항 내지 제23항 중 어느 한 항의 가용성 융합 단백질 복합체와 접촉시켜 상기 면역 세포의 증식 및 활성화를 유도하는 단계;
b) 상기 활성화된 면역 세포의 유효량을 상기 대상체에게 투여 (또는 입양 전달)하는 단계;
c) 상기 대상체 내 상기 질환을 예방 또는 치료하기에 충분한 상기 활성화된 면역 세포를 통해 상기 질환 세포를 손상 또는 사멸하는 단계
를 포함하는, 방법. - 제55항에 있어서, 상기 신생물 형성은 교모세포종, 전립선암, 혈액암, B 세포 신생물 형성, 다발성 골수종, B 세포 림프종, B 세포 비호지킨 림프종, 호지킨 림프종, 만성 림프구성 백혈병, 급성 골수성 백혈병, 피부 T 세포 림프종, T 세포 림프종, 고형 종양, 요로상피/방광 암종, 흑색종, 폐암, 신세포 암종, 유방암, 위 및 식도 암, 전립선암, 췌장암, 결장 직장암, 난소암, 비 소세포 폐 암종, 및 편평 세포 두경부 암종으로 이루어진 그룹에서 선택되는, 방법.
- 제55항에 있어서, 상기 노화 세포 또는 연령 관련 질환은 대사 질환, 신경계 질환, 근육, 뼈 및 연골 관련 질환, 조직 기능 장애 관련 질환 또는 이들의 조합을 포함하는, 방법.
- 제55항 또는 제56항에 있어서, 상기 면역 세포는 자가, 일배체 동일성, 일배 체형 매칭 또는 이들의 조합을 포함하는, 방법.
- 제55항에 있어서, 상기 면역 세포는 자가 또는 동종이계 줄기 세포로부터 유래되는 방법.
- 제55항 내지 제48항 중 어느 한 항에 있어서, 상기 면역 세포는 NK 세포, T 세포, 줄기 세포 기억 T 세포, 활성화된 NK(aNK) 세포, 키메라 항원 수용체 NK (CAR-NK) 세포, 키메라 항원 수용체 T(CAR-T) 세포 또는 이들의 조합을 포함하는, 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201762551218P | 2017-08-28 | 2017-08-28 | |
| US62/551,218 | 2017-08-28 | ||
| PCT/US2018/048365 WO2019046313A1 (en) | 2017-08-28 | 2018-08-28 | IL-15 BASED FUSIONS WITH IL-7 AND IL-21 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20200090742A true KR20200090742A (ko) | 2020-07-29 |
Family
ID=65526059
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020207009046A KR20200090742A (ko) | 2017-08-28 | 2018-08-28 | Il-7 및 il-21에의 il-15 기반 융합 |
Country Status (8)
| Country | Link |
|---|---|
| US (3) | US11161890B2 (ko) |
| EP (1) | EP3676289A4 (ko) |
| JP (1) | JP2020533971A (ko) |
| KR (1) | KR20200090742A (ko) |
| CN (1) | CN111655716B (ko) |
| AU (1) | AU2018323455B2 (ko) |
| CA (1) | CA3074635A1 (ko) |
| WO (1) | WO2019046313A1 (ko) |
Families Citing this family (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ES2470772T3 (es) * | 2007-05-11 | 2014-06-24 | Altor Bioscience Corporation | Moléculas de fusión y variantes de IL-15 |
| CN111655716B (zh) | 2017-08-28 | 2024-03-08 | 艾尔特生物科技公司 | 基于il-15的与il-7和il-21的融合体 |
| US11401324B2 (en) | 2018-08-30 | 2022-08-02 | HCW Biologics, Inc. | Single-chain chimeric polypeptides and uses thereof |
| JP7449292B2 (ja) | 2018-08-30 | 2024-03-13 | エイチシーダブリュー バイオロジックス インコーポレイテッド | 加齢関連障害の治療法 |
| WO2020047299A1 (en) | 2018-08-30 | 2020-03-05 | HCW Biologics, Inc. | Multi-chain chimeric polypeptides and uses thereof |
| CN111825770B (zh) * | 2019-04-16 | 2023-06-09 | 成都医学院 | 长效白介素21-Fc融合蛋白及其用途 |
| EP3987010A1 (en) | 2019-06-21 | 2022-04-27 | HCW Biologics, Inc. | Multi-chain chimeric polypeptides and uses thereof |
| GB201909144D0 (en) | 2019-06-25 | 2019-08-07 | Autolus Ltd | Culture medium |
| CN114787196A (zh) * | 2019-08-29 | 2022-07-22 | 南特生物科学公司 | 修饰的n-810及其方法 |
| AU2020406083A1 (en) | 2019-12-17 | 2022-06-16 | Ose Immunotherapeutics | Bifunctional molecules comprising an IL-7 variant |
| WO2021247003A1 (en) * | 2020-06-01 | 2021-12-09 | HCW Biologics, Inc. | Methods of treating aging-related disorders |
| KR20230031280A (ko) * | 2020-06-01 | 2023-03-07 | 에이치씨더블유 바이올로직스, 인크. | 노화 관련 장애의 치료 방법 |
| GB202008957D0 (en) | 2020-06-12 | 2020-07-29 | Autolus Ltd | Culture medium |
| EP4351320A1 (en) | 2021-06-09 | 2024-04-17 | ImmunityBio, Inc. | Methods and systems for producing a protein of interest in a plant |
| CN113549158B (zh) * | 2021-07-19 | 2022-10-21 | 广州百暨基因科技有限公司 | 包含突变型il15以及嵌合抗原受体的融合蛋白 |
| WO2023212056A2 (en) * | 2022-04-27 | 2023-11-02 | Asher Biotherapeutics, Inc. | Combination of cytokine fusion proteins with cd8 antigen binding molecules |
| WO2024040132A2 (en) * | 2022-08-16 | 2024-02-22 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Servic | Synergistic interactions for improved cancer treatment |
| CN117050178B (zh) * | 2023-10-13 | 2024-01-12 | 北京百普赛斯生物科技股份有限公司 | 特异性检测il-7的抗体及应用 |
Family Cites Families (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5116964A (en) | 1989-02-23 | 1992-05-26 | Genentech, Inc. | Hybrid immunoglobulins |
| WO1994004689A1 (en) | 1992-08-14 | 1994-03-03 | The Government Of The United States Of America, As Represented By The Secretary Of The Department Of Health And Human Services | Recombinant toxin with increased half-life |
| US5747654A (en) | 1993-06-14 | 1998-05-05 | The United States Of America As Represented By The Department Of Health And Human Services | Recombinant disulfide-stabilized polypeptide fragments having binding specificity |
| US5541087A (en) | 1994-09-14 | 1996-07-30 | Fuji Immunopharmaceuticals Corporation | Expression and export technology of proteins as immunofusins |
| US6096871A (en) | 1995-04-14 | 2000-08-01 | Genentech, Inc. | Polypeptides altered to contain an epitope from the Fc region of an IgG molecule for increased half-life |
| US5534592A (en) | 1995-09-22 | 1996-07-09 | The Goodyear Tire & Rubber Company | High performance blend for tire treads |
| DE69731289D1 (de) | 1996-03-18 | 2004-11-25 | Univ Texas | Immunglobulinähnliche domäne mit erhöhten halbwertszeiten |
| AU2004289316B2 (en) | 2003-11-10 | 2011-03-31 | Altor Bioscience Corporation | Soluble TCR molecules and methods of use |
| ES2470772T3 (es) * | 2007-05-11 | 2014-06-24 | Altor Bioscience Corporation | Moléculas de fusión y variantes de IL-15 |
| US9931386B2 (en) * | 2008-06-16 | 2018-04-03 | Atsuo Ochi | Recombinant multiple domain fusion protein mitogens and use thereof for inducing enhancement or repression of antigen-specific immunity |
| EP2918607B1 (en) * | 2010-09-21 | 2017-11-08 | Altor BioScience Corporation | Multimeric il-15 soluble fusion molecules and methods of making and using same |
| WO2017062426A1 (en) | 2015-10-06 | 2017-04-13 | The Wistar Institute Of Anatomy And Biology | Methods and compositions for treatment of metastatic and refractory cancers and tumors |
| AU2017345791B2 (en) | 2016-10-21 | 2020-10-22 | Altor Bioscience Corporation | Multimeric IL-15-based molecules |
| CN111655716B (zh) | 2017-08-28 | 2024-03-08 | 艾尔特生物科技公司 | 基于il-15的与il-7和il-21的融合体 |
-
2018
- 2018-08-28 CN CN201880070462.7A patent/CN111655716B/zh active Active
- 2018-08-28 AU AU2018323455A patent/AU2018323455B2/en active Active
- 2018-08-28 CA CA3074635A patent/CA3074635A1/en not_active Abandoned
- 2018-08-28 KR KR1020207009046A patent/KR20200090742A/ko not_active Application Discontinuation
- 2018-08-28 WO PCT/US2018/048365 patent/WO2019046313A1/en unknown
- 2018-08-28 EP EP18851494.7A patent/EP3676289A4/en active Pending
- 2018-08-28 US US16/114,870 patent/US11161890B2/en active Active
- 2018-08-28 JP JP2020511477A patent/JP2020533971A/ja not_active Withdrawn
-
2021
- 2021-10-18 US US17/504,100 patent/US11965007B2/en active Active
-
2023
- 2023-09-21 US US18/472,053 patent/US20240076340A1/en active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| WO2019046313A1 (en) | 2019-03-07 |
| CN111655716A (zh) | 2020-09-11 |
| US20240076340A1 (en) | 2024-03-07 |
| AU2018323455B2 (en) | 2022-02-03 |
| US20190300591A1 (en) | 2019-10-03 |
| US11161890B2 (en) | 2021-11-02 |
| US11965007B2 (en) | 2024-04-23 |
| EP3676289A4 (en) | 2021-05-05 |
| EP3676289A1 (en) | 2020-07-08 |
| US20220033455A1 (en) | 2022-02-03 |
| AU2018323455A1 (en) | 2020-03-19 |
| CA3074635A1 (en) | 2019-03-07 |
| CN111655716B (zh) | 2024-03-08 |
| JP2020533971A (ja) | 2020-11-26 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20200090742A (ko) | Il-7 및 il-21에의 il-15 기반 융합 | |
| US11318201B2 (en) | Multimeric IL-15-based molecules | |
| KR102625293B1 (ko) | Il-12 및 il-18로의 il-15-기반 융합 | |
| EP3464352B1 (en) | Construction and characterization of multimeric il-15-based molecules with cd3 binding domains | |
| CA3089333C (en) | Anti-pdl1, il-15 and tgf-beta receptor combination molecules | |
| TW201834683A (zh) | 與靶向4-1bb (cd137)促效劑併用之組合療法 | |
| JP7492336B2 (ja) | 多量体il-15に基づく分子 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| N231 | Notification of change of applicant | ||
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |