KR20190114403A - 폴마콕시브 및 프레가발린을 포함하는 통증 치료용 약제학적 조성물 - Google Patents
폴마콕시브 및 프레가발린을 포함하는 통증 치료용 약제학적 조성물 Download PDFInfo
- Publication number
- KR20190114403A KR20190114403A KR1020180037054A KR20180037054A KR20190114403A KR 20190114403 A KR20190114403 A KR 20190114403A KR 1020180037054 A KR1020180037054 A KR 1020180037054A KR 20180037054 A KR20180037054 A KR 20180037054A KR 20190114403 A KR20190114403 A KR 20190114403A
- Authority
- KR
- South Korea
- Prior art keywords
- pregabalin
- polmacoxib
- pharmaceutical composition
- tablet
- pain
- Prior art date
Links
- 229960001233 pregabalin Drugs 0.000 title claims abstract description 108
- AYXYPKUFHZROOJ-ZETCQYMHSA-N pregabalin Chemical compound CC(C)C[C@H](CN)CC(O)=O AYXYPKUFHZROOJ-ZETCQYMHSA-N 0.000 title claims abstract description 106
- IJWPAFMIFNSIGD-UHFFFAOYSA-N 4-[3-(3-fluorophenyl)-5,5-dimethyl-4-oxofuran-2-yl]benzenesulfonamide Chemical compound O=C1C(C)(C)OC(C=2C=CC(=CC=2)S(N)(=O)=O)=C1C1=CC=CC(F)=C1 IJWPAFMIFNSIGD-UHFFFAOYSA-N 0.000 title claims abstract description 73
- 229950006009 polmacoxib Drugs 0.000 title claims abstract description 72
- 208000002193 Pain Diseases 0.000 title claims abstract description 41
- 239000008194 pharmaceutical composition Substances 0.000 title claims abstract description 21
- 208000000094 Chronic Pain Diseases 0.000 claims abstract description 6
- 230000002757 inflammatory effect Effects 0.000 claims abstract description 6
- 208000004296 neuralgia Diseases 0.000 claims abstract description 6
- 208000005298 acute pain Diseases 0.000 claims abstract description 5
- 230000001154 acute effect Effects 0.000 claims abstract description 4
- 239000000203 mixture Substances 0.000 claims description 89
- 239000003826 tablet Substances 0.000 claims description 81
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 claims description 42
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 37
- 238000000034 method Methods 0.000 claims description 35
- 239000002775 capsule Substances 0.000 claims description 30
- 238000013268 sustained release Methods 0.000 claims description 22
- 239000012730 sustained-release form Substances 0.000 claims description 22
- 235000019359 magnesium stearate Nutrition 0.000 claims description 21
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 claims description 20
- 239000001863 hydroxypropyl cellulose Substances 0.000 claims description 20
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 claims description 20
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 claims description 18
- 239000000594 mannitol Substances 0.000 claims description 17
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 claims description 14
- 239000012729 immediate-release (IR) formulation Substances 0.000 claims description 13
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 claims description 12
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 claims description 12
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 claims description 12
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 claims description 12
- 229920003171 Poly (ethylene oxide) Polymers 0.000 claims description 11
- 229920002125 Sokalan® Polymers 0.000 claims description 9
- 235000017557 sodium bicarbonate Nutrition 0.000 claims description 9
- 229910000030 sodium bicarbonate Inorganic materials 0.000 claims description 9
- 239000000725 suspension Substances 0.000 claims description 9
- NIXOWILDQLNWCW-UHFFFAOYSA-N Acrylic acid Chemical compound OC(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 claims description 8
- 229960001631 carbomer Drugs 0.000 claims description 8
- 238000000576 coating method Methods 0.000 claims description 8
- IXPNQXFRVYWDDI-UHFFFAOYSA-N 1-methyl-2,4-dioxo-1,3-diazinane-5-carboximidamide Chemical compound CN1CC(C(N)=N)C(=O)NC1=O IXPNQXFRVYWDDI-UHFFFAOYSA-N 0.000 claims description 7
- 239000011248 coating agent Substances 0.000 claims description 7
- 235000010413 sodium alginate Nutrition 0.000 claims description 7
- 239000000661 sodium alginate Substances 0.000 claims description 7
- 229940005550 sodium alginate Drugs 0.000 claims description 7
- 208000004454 Hyperalgesia Diseases 0.000 claims description 6
- 230000002981 neuropathic effect Effects 0.000 claims description 6
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 claims description 5
- 229930195725 Mannitol Natural products 0.000 claims description 5
- 235000010355 mannitol Nutrition 0.000 claims description 5
- 208000032131 Diabetic Neuropathies Diseases 0.000 claims description 4
- 239000001856 Ethyl cellulose Substances 0.000 claims description 4
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical group CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 claims description 4
- 208000001640 Fibromyalgia Diseases 0.000 claims description 4
- 206010028980 Neoplasm Diseases 0.000 claims description 4
- 208000008765 Sciatica Diseases 0.000 claims description 4
- 235000019325 ethyl cellulose Nutrition 0.000 claims description 4
- 229920001249 ethyl cellulose Polymers 0.000 claims description 4
- 239000007942 layered tablet Substances 0.000 claims description 4
- 206010039073 rheumatoid arthritis Diseases 0.000 claims description 4
- 208000011688 Generalised anxiety disease Diseases 0.000 claims description 3
- 208000035154 Hyperesthesia Diseases 0.000 claims description 3
- 206010034464 Periarthritis Diseases 0.000 claims description 3
- 206010053552 allodynia Diseases 0.000 claims description 3
- 239000001768 carboxy methyl cellulose Substances 0.000 claims description 3
- 239000003937 drug carrier Substances 0.000 claims description 3
- 201000010603 frozen shoulder Diseases 0.000 claims description 3
- 208000029364 generalized anxiety disease Diseases 0.000 claims description 3
- 201000008482 osteoarthritis Diseases 0.000 claims description 3
- 201000002661 Spondylitis Diseases 0.000 claims description 2
- 201000011510 cancer Diseases 0.000 claims description 2
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 claims description 2
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 claims description 2
- 229920002134 Carboxymethyl cellulose Polymers 0.000 claims 1
- 235000010948 carboxy methyl cellulose Nutrition 0.000 claims 1
- 239000008112 carboxymethyl-cellulose Substances 0.000 claims 1
- 229940105329 carboxymethylcellulose Drugs 0.000 claims 1
- 229940079593 drug Drugs 0.000 abstract description 24
- 239000003814 drug Substances 0.000 abstract description 24
- 230000000694 effects Effects 0.000 abstract description 7
- 230000001684 chronic effect Effects 0.000 abstract 1
- 208000021722 neuropathic pain Diseases 0.000 abstract 1
- 239000010410 layer Substances 0.000 description 61
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 48
- 230000000052 comparative effect Effects 0.000 description 28
- 238000004519 manufacturing process Methods 0.000 description 28
- 238000004090 dissolution Methods 0.000 description 24
- 239000004615 ingredient Substances 0.000 description 24
- 239000008187 granular material Substances 0.000 description 23
- 238000007922 dissolution test Methods 0.000 description 21
- 229940071676 hydroxypropylcellulose Drugs 0.000 description 19
- 239000007884 disintegrant Substances 0.000 description 18
- 239000000314 lubricant Substances 0.000 description 18
- 239000011230 binding agent Substances 0.000 description 17
- 238000002156 mixing Methods 0.000 description 17
- 230000008569 process Effects 0.000 description 17
- 239000002994 raw material Substances 0.000 description 17
- 238000009472 formulation Methods 0.000 description 16
- 229960001855 mannitol Drugs 0.000 description 16
- 230000007246 mechanism Effects 0.000 description 14
- 239000002904 solvent Substances 0.000 description 11
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 9
- 238000010828 elution Methods 0.000 description 8
- 229940009697 lyrica Drugs 0.000 description 8
- 239000000243 solution Substances 0.000 description 7
- 238000012360 testing method Methods 0.000 description 7
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 6
- 229920002785 Croscarmellose sodium Polymers 0.000 description 6
- 238000010521 absorption reaction Methods 0.000 description 6
- VJHCJDRQFCCTHL-UHFFFAOYSA-N acetic acid 2,3,4,5,6-pentahydroxyhexanal Chemical class CC(O)=O.OCC(O)C(O)C(O)C(O)C=O VJHCJDRQFCCTHL-UHFFFAOYSA-N 0.000 description 6
- 239000004480 active ingredient Substances 0.000 description 6
- 229960001681 croscarmellose sodium Drugs 0.000 description 6
- 235000010947 crosslinked sodium carboxy methyl cellulose Nutrition 0.000 description 6
- 239000012085 test solution Substances 0.000 description 6
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 5
- 230000008859 change Effects 0.000 description 5
- 150000001875 compounds Chemical class 0.000 description 5
- BTCSSZJGUNDROE-UHFFFAOYSA-N gamma-aminobutyric acid Chemical compound NCCCC(O)=O BTCSSZJGUNDROE-UHFFFAOYSA-N 0.000 description 5
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 5
- 239000008108 microcrystalline cellulose Substances 0.000 description 5
- 229940016286 microcrystalline cellulose Drugs 0.000 description 5
- 102100038280 Prostaglandin G/H synthase 2 Human genes 0.000 description 4
- 108050003267 Prostaglandin G/H synthase 2 Proteins 0.000 description 4
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 4
- 239000000654 additive Substances 0.000 description 4
- 239000007963 capsule composition Substances 0.000 description 4
- 229920003123 carboxymethyl cellulose sodium Polymers 0.000 description 4
- 229940063834 carboxymethylcellulose sodium Drugs 0.000 description 4
- 239000002131 composite material Substances 0.000 description 4
- 201000010099 disease Diseases 0.000 description 4
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 4
- -1 have been identified Proteins 0.000 description 4
- 229940031702 hydroxypropyl methylcellulose 2208 Drugs 0.000 description 4
- 238000002360 preparation method Methods 0.000 description 4
- 206010010904 Convulsion Diseases 0.000 description 3
- 206010061218 Inflammation Diseases 0.000 description 3
- 210000004556 brain Anatomy 0.000 description 3
- 210000003169 central nervous system Anatomy 0.000 description 3
- 239000002552 dosage form Substances 0.000 description 3
- 238000002474 experimental method Methods 0.000 description 3
- 229960003692 gamma aminobutyric acid Drugs 0.000 description 3
- 210000001035 gastrointestinal tract Anatomy 0.000 description 3
- 230000004054 inflammatory process Effects 0.000 description 3
- 239000002858 neurotransmitter agent Substances 0.000 description 3
- 239000002245 particle Substances 0.000 description 3
- 238000010998 test method Methods 0.000 description 3
- OGNSCSPNOLGXSM-UHFFFAOYSA-N (+/-)-DABA Natural products NCCC(N)C(O)=O OGNSCSPNOLGXSM-UHFFFAOYSA-N 0.000 description 2
- 206010002556 Ankylosing Spondylitis Diseases 0.000 description 2
- 108091022930 Glutamate decarboxylase Proteins 0.000 description 2
- 150000008575 L-amino acids Chemical class 0.000 description 2
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 2
- 241001465754 Metazoa Species 0.000 description 2
- 208000001294 Nociceptive Pain Diseases 0.000 description 2
- 239000004372 Polyvinyl alcohol Substances 0.000 description 2
- UIIMBOGNXHQVGW-DEQYMQKBSA-M Sodium bicarbonate-14C Chemical compound [Na+].O[14C]([O-])=O UIIMBOGNXHQVGW-DEQYMQKBSA-M 0.000 description 2
- 230000001773 anti-convulsant effect Effects 0.000 description 2
- 239000001961 anticonvulsive agent Substances 0.000 description 2
- 229960003965 antiepileptics Drugs 0.000 description 2
- 230000004071 biological effect Effects 0.000 description 2
- 239000000872 buffer Substances 0.000 description 2
- 235000010980 cellulose Nutrition 0.000 description 2
- 239000001913 cellulose Substances 0.000 description 2
- 206010015037 epilepsy Diseases 0.000 description 2
- 230000002496 gastric effect Effects 0.000 description 2
- 230000005176 gastrointestinal motility Effects 0.000 description 2
- 230000003993 interaction Effects 0.000 description 2
- 230000007794 irritation Effects 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 230000007774 longterm Effects 0.000 description 2
- 229940057948 magnesium stearate Drugs 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 230000001537 neural effect Effects 0.000 description 2
- 201000001119 neuropathy Diseases 0.000 description 2
- 230000007823 neuropathy Effects 0.000 description 2
- 239000000041 non-steroidal anti-inflammatory agent Substances 0.000 description 2
- 229940021182 non-steroidal anti-inflammatory drug Drugs 0.000 description 2
- 239000008188 pellet Substances 0.000 description 2
- 208000033808 peripheral neuropathy Diseases 0.000 description 2
- 229920002451 polyvinyl alcohol Polymers 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 230000001953 sensory effect Effects 0.000 description 2
- 239000000377 silicon dioxide Substances 0.000 description 2
- 235000012239 silicon dioxide Nutrition 0.000 description 2
- 239000007974 sodium acetate buffer Substances 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 239000007939 sustained release tablet Substances 0.000 description 2
- 208000011580 syndromic disease Diseases 0.000 description 2
- 239000006188 syrup Substances 0.000 description 2
- 235000020357 syrup Nutrition 0.000 description 2
- 239000007916 tablet composition Substances 0.000 description 2
- SFLSHLFXELFNJZ-QMMMGPOBSA-N (-)-norepinephrine Chemical compound NC[C@H](O)C1=CC=C(O)C(O)=C1 SFLSHLFXELFNJZ-QMMMGPOBSA-N 0.000 description 1
- LNAZSHAWQACDHT-XIYTZBAFSA-N (2r,3r,4s,5r,6s)-4,5-dimethoxy-2-(methoxymethyl)-3-[(2s,3r,4s,5r,6r)-3,4,5-trimethoxy-6-(methoxymethyl)oxan-2-yl]oxy-6-[(2r,3r,4s,5r,6r)-4,5,6-trimethoxy-2-(methoxymethyl)oxan-3-yl]oxyoxane Chemical compound CO[C@@H]1[C@@H](OC)[C@H](OC)[C@@H](COC)O[C@H]1O[C@H]1[C@H](OC)[C@@H](OC)[C@H](O[C@H]2[C@@H]([C@@H](OC)[C@H](OC)O[C@@H]2COC)OC)O[C@@H]1COC LNAZSHAWQACDHT-XIYTZBAFSA-N 0.000 description 1
- FHVDTGUDJYJELY-UHFFFAOYSA-N 6-{[2-carboxy-4,5-dihydroxy-6-(phosphanyloxy)oxan-3-yl]oxy}-4,5-dihydroxy-3-phosphanyloxane-2-carboxylic acid Chemical compound O1C(C(O)=O)C(P)C(O)C(O)C1OC1C(C(O)=O)OC(OP)C(O)C1O FHVDTGUDJYJELY-UHFFFAOYSA-N 0.000 description 1
- 241000220479 Acacia Species 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 208000029483 Acquired immunodeficiency Diseases 0.000 description 1
- 208000007848 Alcoholism Diseases 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 208000024827 Alzheimer disease Diseases 0.000 description 1
- 208000019901 Anxiety disease Diseases 0.000 description 1
- 208000008035 Back Pain Diseases 0.000 description 1
- 108090000312 Calcium Channels Proteins 0.000 description 1
- 102000003922 Calcium Channels Human genes 0.000 description 1
- BHPQYMZQTOCNFJ-UHFFFAOYSA-N Calcium cation Chemical compound [Ca+2] BHPQYMZQTOCNFJ-UHFFFAOYSA-N 0.000 description 1
- 206010058019 Cancer Pain Diseases 0.000 description 1
- 108090000489 Carboxy-Lyases Proteins 0.000 description 1
- 108010078791 Carrier Proteins Proteins 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- 206010013710 Drug interaction Diseases 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 239000004606 Fillers/Extenders Substances 0.000 description 1
- 206010059024 Gastrointestinal toxicity Diseases 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 208000004547 Hallucinations Diseases 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 229930195714 L-glutamate Natural products 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 235000010643 Leucaena leucocephala Nutrition 0.000 description 1
- CERQOIWHTDAKMF-UHFFFAOYSA-N Methacrylic acid Chemical class CC(=C)C(O)=O CERQOIWHTDAKMF-UHFFFAOYSA-N 0.000 description 1
- 208000028389 Nerve injury Diseases 0.000 description 1
- 102100038277 Prostaglandin G/H synthase 1 Human genes 0.000 description 1
- 108050003243 Prostaglandin G/H synthase 1 Proteins 0.000 description 1
- 102000004005 Prostaglandin-endoperoxide synthases Human genes 0.000 description 1
- 108090000459 Prostaglandin-endoperoxide synthases Proteins 0.000 description 1
- 108010029485 Protein Isoforms Proteins 0.000 description 1
- 102000001708 Protein Isoforms Human genes 0.000 description 1
- 229940124639 Selective inhibitor Drugs 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 208000006011 Stroke Diseases 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- 208000007642 Vitamin B Deficiency Diseases 0.000 description 1
- 230000005856 abnormality Effects 0.000 description 1
- 239000002250 absorbent Substances 0.000 description 1
- 230000002745 absorbent Effects 0.000 description 1
- 239000008351 acetate buffer Substances 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 230000002730 additional effect Effects 0.000 description 1
- 206010001584 alcohol abuse Diseases 0.000 description 1
- 208000025746 alcohol use disease Diseases 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 229940072056 alginate Drugs 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 239000003282 amino acid receptor affecting agent Substances 0.000 description 1
- 125000004202 aminomethyl group Chemical group [H]N([H])C([H])([H])* 0.000 description 1
- 230000000202 analgesic effect Effects 0.000 description 1
- 230000033115 angiogenesis Effects 0.000 description 1
- 230000036506 anxiety Effects 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 210000000988 bone and bone Anatomy 0.000 description 1
- 229910001424 calcium ion Inorganic materials 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 229960001714 calcium phosphate Drugs 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 239000000378 calcium silicate Substances 0.000 description 1
- 229910052918 calcium silicate Inorganic materials 0.000 description 1
- 229960003340 calcium silicate Drugs 0.000 description 1
- 235000012241 calcium silicate Nutrition 0.000 description 1
- OYACROKNLOSFPA-UHFFFAOYSA-N calcium;dioxido(oxo)silane Chemical compound [Ca+2].[O-][Si]([O-])=O OYACROKNLOSFPA-UHFFFAOYSA-N 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 229920006184 cellulose methylcellulose Polymers 0.000 description 1
- 210000003710 cerebral cortex Anatomy 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 239000000306 component Substances 0.000 description 1
- 238000013270 controlled release Methods 0.000 description 1
- 230000036461 convulsion Effects 0.000 description 1
- 229940111134 coxibs Drugs 0.000 description 1
- 239000003255 cyclooxygenase 2 inhibitor Substances 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 230000007123 defense Effects 0.000 description 1
- 230000006735 deficit Effects 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 201000002342 diabetic polyneuropathy Diseases 0.000 description 1
- 231100000673 dose–response relationship Toxicity 0.000 description 1
- 230000000857 drug effect Effects 0.000 description 1
- 230000004064 dysfunction Effects 0.000 description 1
- 239000003480 eluent Substances 0.000 description 1
- 230000002996 emotional effect Effects 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 229960004667 ethyl cellulose Drugs 0.000 description 1
- 230000002964 excitative effect Effects 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 239000010419 fine particle Substances 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 235000019634 flavors Nutrition 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 231100000414 gastrointestinal toxicity Toxicity 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229940014259 gelatin Drugs 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 208000037870 generalized anxiety Diseases 0.000 description 1
- 229930195712 glutamate Natural products 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 208000027866 inflammatory disease Diseases 0.000 description 1
- 230000004941 influx Effects 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 230000036734 inhibitory postsynaptic potential Effects 0.000 description 1
- 150000002484 inorganic compounds Chemical class 0.000 description 1
- 229910010272 inorganic material Inorganic materials 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 239000002075 main ingredient Substances 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 235000010981 methylcellulose Nutrition 0.000 description 1
- LXCFILQKKLGQFO-UHFFFAOYSA-N methylparaben Chemical compound COC(=O)C1=CC=C(O)C=C1 LXCFILQKKLGQFO-UHFFFAOYSA-N 0.000 description 1
- 235000010446 mineral oil Nutrition 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 230000008764 nerve damage Effects 0.000 description 1
- 210000004126 nerve fiber Anatomy 0.000 description 1
- 230000002232 neuromuscular Effects 0.000 description 1
- 210000002569 neuron Anatomy 0.000 description 1
- 230000003955 neuronal function Effects 0.000 description 1
- 210000000929 nociceptor Anatomy 0.000 description 1
- 108091008700 nociceptors Proteins 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 210000000578 peripheral nerve Anatomy 0.000 description 1
- 239000004584 polyacrylic acid Chemical class 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 230000000770 proinflammatory effect Effects 0.000 description 1
- QELSKZZBTMNZEB-UHFFFAOYSA-N propylparaben Chemical compound CCCOC(=O)C1=CC=C(O)C=C1 QELSKZZBTMNZEB-UHFFFAOYSA-N 0.000 description 1
- 229960003415 propylparaben Drugs 0.000 description 1
- 150000003180 prostaglandins Chemical class 0.000 description 1
- 229940127293 prostanoid Drugs 0.000 description 1
- 150000003814 prostanoids Chemical class 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 239000002356 single layer Substances 0.000 description 1
- 210000000813 small intestine Anatomy 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- 229960001407 sodium bicarbonate Drugs 0.000 description 1
- 230000000392 somatic effect Effects 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 235000010356 sorbitol Nutrition 0.000 description 1
- 238000013112 stability test Methods 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 210000002784 stomach Anatomy 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 238000010971 suitability test Methods 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 210000000225 synapse Anatomy 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 235000012222 talc Nutrition 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- 230000000451 tissue damage Effects 0.000 description 1
- 231100000827 tissue damage Toxicity 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 238000000844 transformation Methods 0.000 description 1
- 230000032258 transport Effects 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- 206010044652 trigeminal neuralgia Diseases 0.000 description 1
- 210000002700 urine Anatomy 0.000 description 1
- 230000009278 visceral effect Effects 0.000 description 1
- 208000009935 visceral pain Diseases 0.000 description 1
- 229920003176 water-insoluble polymer Polymers 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 210000000707 wrist Anatomy 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/34—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having five-membered rings with one oxygen as the only ring hetero atom, e.g. isosorbide
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/195—Carboxylic acids, e.g. valproic acid having an amino group
- A61K31/197—Carboxylic acids, e.g. valproic acid having an amino group the amino and the carboxyl groups being attached to the same acyclic carbon chain, e.g. gamma-aminobutyric acid [GABA], beta-alanine, epsilon-aminocaproic acid or pantothenic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/34—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having five-membered rings with one oxygen as the only ring hetero atom, e.g. isosorbide
- A61K31/341—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having five-membered rings with one oxygen as the only ring hetero atom, e.g. isosorbide not condensed with another ring, e.g. ranitidine, furosemide, bufetolol, muscarine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/10—Dispersions; Emulsions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2009—Inorganic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2013—Organic compounds, e.g. phospholipids, fats
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2013—Organic compounds, e.g. phospholipids, fats
- A61K9/2018—Sugars, or sugar alcohols, e.g. lactose, mannitol; Derivatives thereof, e.g. polysorbates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/2027—Organic macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyvinyl pyrrolidone, poly(meth)acrylates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/2031—Organic macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyethylene glycol, polyethylene oxide, poloxamers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/205—Polysaccharides, e.g. alginate, gums; Cyclodextrin
- A61K9/2054—Cellulose; Cellulose derivatives, e.g. hydroxypropyl methylcellulose
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2072—Pills, tablets, discs, rods characterised by shape, structure or size; Tablets with holes, special break lines or identification marks; Partially coated tablets; Disintegrating flat shaped forms
- A61K9/2086—Layered tablets, e.g. bilayer tablets; Tablets of the type inert core-active coat
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2072—Pills, tablets, discs, rods characterised by shape, structure or size; Tablets with holes, special break lines or identification marks; Partially coated tablets; Disintegrating flat shaped forms
- A61K9/2086—Layered tablets, e.g. bilayer tablets; Tablets of the type inert core-active coat
- A61K9/209—Layered tablets, e.g. bilayer tablets; Tablets of the type inert core-active coat containing drug in at least two layers or in the core and in at least one outer layer
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/4841—Filling excipients; Inactive ingredients
- A61K9/4858—Organic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/4841—Filling excipients; Inactive ingredients
- A61K9/4866—Organic macromolecular compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/5005—Wall or coating material
- A61K9/5021—Organic macromolecular compounds
- A61K9/5036—Polysaccharides, e.g. gums, alginate; Cyclodextrin
- A61K9/5042—Cellulose; Cellulose derivatives, e.g. phthalate or acetate succinate esters of hydroxypropyl methylcellulose
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Biophysics (AREA)
- Molecular Biology (AREA)
- Pain & Pain Management (AREA)
- Rheumatology (AREA)
- Inorganic Chemistry (AREA)
- Dispersion Chemistry (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Abstract
본 발명은 폴마콕시브 및 프레가발린을 포함하는 복합제에 관한 것이다. 본 발명은 폴마콕시브 및 프레가발린 2가지의 활성성분에 대한 약학적 조성물 및 약제 또는 진통제, 더욱 구체적으로는 염증성 및 여러가지 요소에 기인한 중등도의 급성, 만성 또는 신경병성 통증을 치료하기 위한 약제 또는 진통제로서 그들의 효과 및 용도에 관한 것이다.
Description
본 발명은 폴마콕시브(polmacoxib)와 프레가발린(pregabalin)을 포함하는 조성물에 관한 것으로, 보다 상세하게는 우수한 안정성 및 저함량으로 우수한 효과를 보이는 비스테로이드성 항염증제로서 유용하게 사용될 수 있는 폴마콕시브와 광범위 항경련제, 신경병리학적 통증 치료에 사용되는 프레가발린을 함유하는 통증 치료용 약제학적 조성물에 관한 것이다.
통증은 실제적이거나 잠재적인 조직손상과 관련되거나 또는 그러한 손상으로 기술된 불쾌한 감각적이고 감정적인 경험으로 정의되고 있다. 통각수용기와 신경섬유로 구성된 신경로를 통하여 대뇌피질과 가장자리 계통영역과 맞닿은 부위를 자극함으로써 일어나는 통각 및 감각장애를 말하기도 한다. 이는 신체를 보호하기 위한 방어수단으로서 신체의 안이나 밖에서 이상을 전달하는 경고 반응이라고 할 수 있다. 통증 그 자체는 질병이 아니기 때문에 이것을 제거한다고 해도 원인이 되는 질병이 치료되는 것은 아니다.
원인은 크게 체성조직 또는 내장조직의 손상이나 염증으로 인한 지각적인 경우, 신경손상 후 생기는 신경병증성인 경우로 나눌 수 있다. 지각적인 경우 통증으로는 피부통각, 내장통, 체성통, 지각적 신경통, 신경근연관통, 체성연관통 등을 들 수 있으며, 신경병증성인 경우에는 말초신경 또는 중추신경 기능 이상으로 인한 통증이 있다. 통증이 장기간 지속되거나 그 자극이 너무 심한 경우에는 일상생활을 하는데 지장이 생기며, 불안과 공포를 느끼기도 한다. 이 때문에 만성 통증을 가진 사람은 우울증을 가진 경우가 많으므로 치료할 때에도 이러한 특성을 고려해야 한다.
프레가발린은 화합물 명칭 (S)-(+)-3-(아미노메틸)-5-메틸-핵산산((S)-(+)-3-(aminomethyl)-5-methyl-hexanoic acid) 및 다음의 화학식 1의 구조를 가진다.
프레가발린은 칼슘 채널의 알파-2-델타(α2δ) 서브유닛(subunit)에 결합하고, 이로 인하여 신경세포 말단의 칼슘 이온 유입이 감소되어 글루타메이트(glutamate)와 노르아드레날린(noradrenalin)을 포함하는 여러 흥분성 신경전달물질의 분비가 감소됨으로써 신경세포의 기능을 정상 수준으로 회복시키는 것으로 알려져 있다. 프레가발린은 뇌 뉴런 활성의 조절에 관여하는 내인성 신경전달물질로서 신경 처리에 관여하는 γ-아미노 부티르산(γ-amino butyric acid, GABA)의 유사물이다.
프레가발린은 L-글루탐산 탈탄산효소(L- glutamate decarboxylase, GAD)를 활성화시키는 것으로 밝혀졌으며, 발작에 대하여 투여량 의존적인 보호 효과를 가지며, CNS(central nervous system) 활성 화합물이다. 또한, 프레가발린은 GAD의 활성화로 인하여 항경련 요법에서 유용하게 사용될 수 있는데, 이는 30%의 뇌 시냅스(synapse)로 방출되는 뇌의 주된 억제 신경 전달 물질 중 하나인 GABA(gamma-aminobutyric acid)의 아미노산 신경전달 물질로서 억제성 시냅스 후 전위를 일으키기 때문이다.
이러한 프레가발린 약물은 간질, 신경병리학적 통증(neuropathological pain), 범불안장애(generalized anxiety discorders), 섬유근육통 등을 치료하는데 사용될 수 있다.
이중 신경병리학적 통증을 유발할 수 있는 원인들로는 당뇨병성 다발성신경장애, 대상포진 후 신경통, 종양, 화학용법, 삼차신경통, 알콜 남용, 비타민 B 결핍증, 환각통, 보렐리아 감염, 복합부위 통증 증후군, 손목골 증후군, 요통 및 후천성 면역결핍증 등이 있다.
프레가발린 약물은 흰색 또는 연한 노란색을 띄는 결정성 분말로서 물에 잘 용해되는 특성이 있다. 이 약물은 체내에서 빠르고 높은 흡수를 나타내어 약 1.3시간에 최대 혈중 농도를 보이고 생체이용률은 약 90%를 보인다. 또한, 대부분 신장을 통해 뇨로 배설되며 반감기는 약 5 내지 6.5시간이다. 프레가발린은 L-아미노산 수송 시스템에 의하여 흡수되므로 위장관에서 흡수가 균일하지 않고, L-아미노산 수송체(L-amino acid transporter)가 밀집된 소장 상부에서 가장 많은 흡수가 일어나기 때문에 평균 흡수 시간대는 6시간 이하이다. 이러한 이유로 인하여 현재 많은 제약사에서 생산성이 낮은 캡슐형를 벗어나 프레가발린 서방정, 위체류정 등과 같은 정제 제형을 개발 중에 있다.
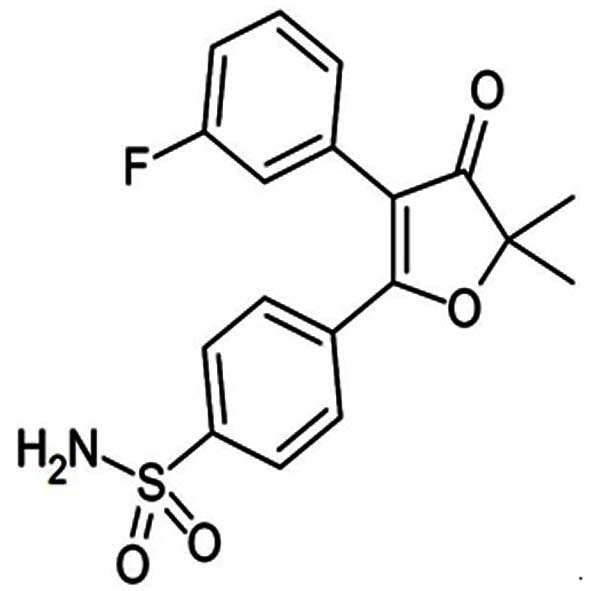
폴마콕시브는 현재 아셀렉스캡슐이라는 제품으로 판매가 이루어 지고 있는 약물로, 그 구조는 하기 화학식 2와 같다.
본 발명의 약학적 조성물에 사용된 유효성분인 폴마콕시브의 화합물 이름은 5-(4-(아미노설포닐)페닐)-2,2-디메틸-4-(3-플루오로페닐)-3(2H)-퓨라논이다. COX-2의 선택적 저해제로서, 통상적인 NSAIDs와 비교하여 경감된 위장관 독성을 가지며, 염증성 질병, 염증관련 질병, 통증, 고형암, 혈관신생 관련 질환, 알츠하이머병, 발작 및 경련, 뇌졸중, 간질 등에 효과가 있는 것으로 알려져 있다(대한민국 등록특허 제10-0495389호).
COX-2(사이클로옥시게나아제)는 프로스타글란딘(prostaglandin)의 생성을 담당한다. 두 가지 동형 단백질(isoform), COX-1 및 COX-2가 확인되며, COX-2는 프로-염증 자극에 의하여 유도된다고 보여지고 있으며, 통증, 염증 및 열과 관련된 프로스타노이드(prostanoid) 조절자의 합성에 주요한 담당을 한다고 가정되고 있는 효소의 동형 단백질이다.
이러한 작용을 하는 COX-2 저해제인 폴마콕시브와 프레가발린의 조합으로 통증치료에 기인하고자 한다.
출원의 초점은 폴마콕시브와 프레가발린의 조합이 심각한 통증 내지 중등도의 통증, 특히 염증성 요소가 있는 통증에 있어서 부가적인 효과를 얻을 수 있는 약학적 조성물에 관한 것이며 그것의 조합을 실증하는 것에 있다.
본 발명자는 폴마콕시브(polmacoxib)와 프레가발린(pregabalin) 조합의 통증에 대한 시너지 효과 및 기존 제품에 대비한 약물의 복용 편의성을 보다 증진시키기 위하여 서로 다른 2가지의 활성성분을 단일 제형으로 제제화하고자 하였다.
본 발명은, 폴마콕시브 및 프레가발린을 포함하는 통증 치료용 약제학적 조성물을 제공한다.
일구현예에 따르면, 상기 조성물은 염증성 또는 신경병증성으로 유발된 급성 또는 만성 통증 치료용으로 사용할 수 있다. 구체적으로, 당뇨병성 신경장애를 포함하는 신경성 통증(neurogenic pain), 범불안장애(generalized anxiety disorder)로 인한 통증, 섬유근육통(fibromyalgia), 통각과민증(hyperalgesia), 이질통(allodynia), 암통증(cancer pain), 골관절염(osteoarthritis), 류마티스 관절염(rheumatoid arthritis), 척추염(spondylitis), 오십견(frozen shoulder), 요통(lumbodynia) 또는 좌골신경통(sciatica)을 적응증으로 적용할 수 있다.
일구현예에 따르면, 폴마콕시브 대 프레가발린의 비율은 1:1 내지 600 중량비일 수 있다.
또한, 폴마콕시브 대 프레가발린의 비율은 1 내지 300:1 중량비일 수 있고, 2:1 내지 300 중량비를 가질 수 있다.
일구현예에 따르면, 조성물 총 중량에 대하여, 폴마콕시브 0.1 내지 10중량% 및 프레가발린 10 내지 50중량%를 포함할 수 있다.
일구현예에 따르면, 약제학적으로 허용되는 부형제를 추가로 포함할 수 있다. 구체적으로, 상기 부형제는 에틸 셀룰로오스, 히드록시 프로필 셀룰로오스, 히드록시 프로필 메틸 셀룰로오스, 카복시 메틸 셀룰로오스 나트륨, 폴리에틸렌 옥사이드, 카보머, 알긴산나트륨, 만니톨, 크로스 카멜로오스 나트륨, 탄산수소나트륨 및 스테아르산 마그네슘으로 이루어지는 군으로부터 선택되는 하나 이상을 포함할 수 있다.
일구현예에 따르면, 상기 조성물은 정제, 캡슐제 또는 현탁제의 형태로 제공될 수 있다. 구체적으로, 폴마콕시브 및 프레가발린이 혼합된 정제, 캡슐 또는 현탁제 형태일 수 있으며, 상기 정제는 이중정, 다층정 또는 단일정의 형태를 포함할 수 있다.
또한, 폴마콕시브, 프레가발린 또는 이들의 혼합물이 각기 다른 층으로 구분된 상태인 이중층 구조의 이중정 또는 다층 구조의 다층정으로 형성될 수 있다.
일구현예에 따르면, 서방층 및 속방층으로 구분되어 있는 이중층으로 형성될 수 있다. 구체적으로, 상기 서방층은 프레가발린을 포함하고, 상기 속방층은 폴마콕시브를 포함할 수 있다.
일구현예에 따르면, 약제학적으로 허용되는 코팅기제를 더 포함할 수 있다.
또한, 약제학적으로 허용되는 담체를 추가로 포함할 수 있다.
기타 본 발명의 구현예들의 구체적인 사항은 이하의 상세한 설명에 포함되어 있다.
본 발명의 폴마콕시브 및 프레가발린을 포함하는 통증 치료용 약제학적 조성물에 따르면, 상기 조성물은 시판 중인 프레가발린을 함유하는 경구 제형인 리리카캡슐 및 아셀렉스정제와 각각의 약물 방출패턴이 유사하다. 구체적으로, 폴마콕시브와 프레가발린을 하나의 단일제형으로 제제화시킴에 따라, 제형 내에서 각각의 약물 상호작용은 최소화하면서 1일 1회 또는 2회 복용만으로 각각의 약물 효과가 상호 보완적으로 지속 가능하게 발휘될 수 있다.
본 발명에 따른 조성물은 외부로부터의 물리적인 요인에 대한 안정성을 가지며, 입자의 흐름성이 뛰어나 균일성을 향상시킬 수 있으므로, 취급이 용이하여 생산성을 향상시킬 수 있다.
도 1은 실험예 1의 폴마콕시브 비교용출 패턴을 나타낸 그래프이다.
도 2는 실험예 1의 프레가발린 비교용출 패턴을 나타낸 그래프이다.
도 3은 실험예 2의 폴마콕시브 비교용출 패턴을 나타낸 그래프이다.
도 4는 실험예 2의 프레가발린 비교용출 패턴을 나타낸 그래프이다.
도 5는 실험예 3의 폴마콕시브 비교용출 패턴을 나타낸 그래프이다.
도 6은 실험예 4의 폴마콕시브 비교용출 패턴을 나타낸 그래프이다.
도 7 및 8은 실험예 5의 비교용출 패턴을 나타낸 그래프이다.
도 9 및 10은 실험예 6의 비교용출 패턴을 나타낸 그래프이다.
도 11은 실험예 7의 비교용출 패턴을 나타낸 그래프이다.
도 12는 실험예 8의 비교용출 패턴을 나타낸 그래프이다.
도 13은 실험예 9의 비교용출 패턴을 나타낸 그래프이다.
도 14는 실험예 10의 비교용출 패턴을 나타낸 그래프이다.
도 15는 실험예11의 비교용출 패턴을 나타낸 그래프이다.
도 16은 실험예 11 및 실험예 12의 프레가발린 비교용출 패턴을 나타낸 그래프이다.
도 17은 실험예 12의 폴마콕시브 비교용출 패턴을 나타낸 그래프이다.
도 2는 실험예 1의 프레가발린 비교용출 패턴을 나타낸 그래프이다.
도 3은 실험예 2의 폴마콕시브 비교용출 패턴을 나타낸 그래프이다.
도 4는 실험예 2의 프레가발린 비교용출 패턴을 나타낸 그래프이다.
도 5는 실험예 3의 폴마콕시브 비교용출 패턴을 나타낸 그래프이다.
도 6은 실험예 4의 폴마콕시브 비교용출 패턴을 나타낸 그래프이다.
도 7 및 8은 실험예 5의 비교용출 패턴을 나타낸 그래프이다.
도 9 및 10은 실험예 6의 비교용출 패턴을 나타낸 그래프이다.
도 11은 실험예 7의 비교용출 패턴을 나타낸 그래프이다.
도 12는 실험예 8의 비교용출 패턴을 나타낸 그래프이다.
도 13은 실험예 9의 비교용출 패턴을 나타낸 그래프이다.
도 14는 실험예 10의 비교용출 패턴을 나타낸 그래프이다.
도 15는 실험예11의 비교용출 패턴을 나타낸 그래프이다.
도 16은 실험예 11 및 실험예 12의 프레가발린 비교용출 패턴을 나타낸 그래프이다.
도 17은 실험예 12의 폴마콕시브 비교용출 패턴을 나타낸 그래프이다.
본 발명은 다양한 변환을 가할 수 있고 여러 가지 실시예를 가질 수 있는 바, 특정 실시예를 도면에 예시하고 상세한 설명에 상세하게 설명하고자 한다. 그러나, 이는 본 발명을 특정한 실시 형태에 대해 한정하려는 것이 아니며, 본 발명의 사상 및 기술 범위에 포함되는 모든 변환, 균등물 내지 대체물을 포함하는 것으로 이해되어야 한다. 본 발명을 설명함에 있어서 관련된 공지 기술에 대한 구체적인 설명이 본 발명의 요지를 흐릴 수 있다고 판단되는 경우 그 상세한 설명을 생략한다.
이하, 본 발명의 구현예에 따른 약제학적 조성물에 대하여 보다 상세하게 설명한다.
본 명세서에 사용되는 용어, "약제학적 조성물"은 "약학적 조성물" 및 "약학적으로 허용 가능한 조성물"과 혼용하여 기재할 수 있고, 투여 대상에게 비교적 비독성이고 무해한 유효작용을 할 수 있는 조성물로서, 상기 조성물로부터 기인하는 부작용이 약물의 효능을 저하시키지 않고, 화합물이 투여되는 대상에 심각한 자극을 유발하지 않고, 화합물의 생물학적 활성과 물성들을 손상시키지 않는 임의의 유기 또는 무기 화합물 제형을 의미할 수 있다.
본 발명에서 사용되는 용어 '투여 대상'이란, '투여 개체' 및 '투여 유기체'와 혼용하여 기재할 수 있고, 급성 또는 만성 통증이 유발되었거나, 유발될 수 있는 인간을 포함한 모든 동물을 의미할 수 있다.
본 발명은 폴마콕시브 및 프레가발린을 포함하는 통증 치료용 약제학적 조성물을 제공한다. 폴마콕시브와 프레가발린 복합제제는 다른 약제학적으로 허용 가능한 첨가제들과 혼합될 경우, 활성성분의 변형을 감소시켜 경시적 변화에 대한 안정성을 증가시키는 효과를 나타낼 수 있다.
일구현예에 따르면, 상기 조성물은 액체 또는 고체 형상일 수 있으며, 물 또는 다른 적당한 액체 매질과 함께 재구성이 적합한 태블릿, 펠렛, 과립, 캡슐, 현탁액, 에멀젼 또는 분말의 형태와 같은 어떠한 편리한 형태로 제공될 수 있다. 예를 들어, 상기 조성물은 정제, 캡슐제, 현탁제 등의 형태로 형성될 수 있다. 예를 들어, 폴마콕시브 및 프레가발린이 혼합된 태블릿, 정제, 캡슐 또는 현탁제 형태로 제조할 수 있으며, 상기 태블릿은 단층, 이중층 또는 다층 태블릿의 형태를 포함할 수 있고, 상기 정제는 이중정, 다층정 또는 단일정의 형태를 포함할 수 있다. 또한, 예를 들어 입자, 과립, 펠렛의 형태로 충진되는 캡슐 제형으로 형성될 수 있다.
구체적으로 예를 들어, 프레가발린은 원료 특성상의 이유로 제조 공정 시 외부의 물리적인 요인으로부터 영향이 적은 캡슐 제형의 형태로 제조할 수 있다. 또한, 불안정성을 개선시킬 수 있는 타정압으로 제조하여 유연물질의 생성을 최소화한 정제의 형태로 제조할 수 있다. 또한, 프레가발린 성분의 체내 흡수 기전의 특성상 위에서 장기간 머무르는 것이 약물의 흡수에 효과적으로 작용할 수 있으므로, 위체류정의 제형으로 제조할 수 있다.
또한, 일구현예에 따르면, 폴마콕시브, 프레가발린 또는 이들의 혼합물이 각기 다른 층으로 구분된 상태인 이중층 구조의 이중정 또는 다층 구조의 다층정으로 형성될 수 있다. 예를 들어, 서방층 및 속방층 구조로 이루어지는 이중층 또는 다중층으로 형성될 수 있으며, 상기 서방층은 프레가발린을 포함하고, 상기 속방층은 폴마콕시브를 포함할 수 있다. 구체적인 구현예에 따르면, 속방층에 폴마콕시브 및 프레가발린 혼합물 과립으로 층을 형성하여 다진 후, 서방층에 프레가발린 과립으로 층을 형성하여 타정기로 제조할 수 있다. 또한, 예를 들어, 속방층에 폴마콕시브 함유 층을 형성하고, 서방층에 프레가발린 층을 형성하여 타정기로 제조할 수 있다.
상기 이중층의 제조방법은 프레가발린 및 그 혼합물 과립으로 하층을 형성하여 다진 후, 폴마콕시브 및 그 혼합물 과립으로 상층을 형성하고, 타정기를 이용하여 제조될 수 있으나, 이에 한정하는 것은 아니다.
일구현예에 따르면, 내핵의 프레가발린 층에 외핵의 폴마콕시브 층을 포함하거나 내핵의 폴마콕시브 층에 외핵의 프레가발린 층을 포함하는 핵정 제형으로 형성될 수 있다. 또한, 내층의 프레가발린 층에 외층의 폴마콕시브 코팅층을 포함하거나 내층의 폴마콕시브 층에 외층의 프레가발린 층을 포함하는 마이크로 코팅 이중방출제형(DRM)으로 형성될 수 있다.
일구현예에 따르면, 폴마콕시브 대 프레가발린의 비율은 예를 들어, 1 내지 300:1 내지 600 중량비, 예를 들어 1:1 내지 300 중량비, 예를 들어 2:1 내지 300일 수 있다.
또한, 조성물 총 중량에 대하여, 예를 들어 폴마콕시브 0.1 내지 10중량% 및 프레가발린 10 내지 50중량%로 포함될 수 있다. 예를 들어 조성물 총 중량에 대하여, 폴마콕시브 0.3 내지 1.0중량% 및 프레가발린 10내지 30중량%로 포함될 수 있다. 또한, 예를 들어 조성물 내에 폴마콕시브 1 내지 5mg, 예를 들어 1 내지 2mg 및 프레가발린 75 내지 300mg, 예를 들어 75 내지 150mg이 포함될 수 있다.
일구현예에 따르면, 약제학적으로 허용되는 부형제(excipient)를 추가로 포함할 수 있다. 예를 들어, 부형제로는 에틸 셀룰로오스(ethyl cellulose), 히드록시 프로필 셀룰로오스(hydroxypropyl cellulose), 히드록시 프로필 메틸 셀룰로오스(hydroxypropyl methylcellulose), 카복시 메틸 셀룰로오스 나트륨(sodium carboxymethyl cellulose), 폴리에틸렌 옥사이드(polyethylene oxide), 카보머(carbomer), 알긴산나트륨(sodium alginate), 만니톨(mannitol), 크로스 카멜로오스 나트륨(cross carmellose sodium), 탄산수소나트륨(sodium hydrogen carbonate) 및 스테아르산 마그네슘(magnesium stearate)으로 이루어지는 군으로부터 선택되는 하나 이상을 포함할 수 있다. 그 중에서 예를 들어, 히드록시 프로필 메칠 셀룰로오스, 디-만니톨, 히드록시프로필 셀룰로오스, 크로스카르멜로오스 나트륨, 탄산수소나트륨, 스테아르산 마그네슘으로 이루어지는 군으로부터 선택되는 하나 이상을 포함할 수 있다.
구체적으로 예를 들어, 혼합물 상태의 조성물 내에서 폴마콕시브 활성성분의 혼합 균일성 및 타정성을 향상시키기 위하여 입자가 균일하고 수불용성 고분자인 만니톨 200SD를 사용할 수 있으나, 이에 한정되는 것은 아니다.
또한, 구체적으로 예를 들어 조성물이 서방층 및 속방층으로 이루어지는 이중층 제형인 경우, 서방형 메트릭스 부형제로서 히드록시 프로필 메칠 셀룰로오스, 폴리에틸렌 옥사이드(PEO), 카보머, 알긴산나트륨, 에칠셀룰로오스, 히드록시 프로필 셀룰로오스 및 카복시 메칠 셀룰로오스 나트륨 등으로 이루어지는 군으로부터 선택되는 하나 이상을 포함할 수 있으며, 예를 들어 히드록시 프로필 메칠 셀룰로오스를 포함할 수 있다. 또한, 예를 들어 약물이 일정 시간 동안 위장 내에서 부유하여 위에서 장기간 체류할 수 있도록 하기 위하여 정제 표면에 기체의 발생을 유발하여 부유성을 증가시킬 수 있으며, 이 때 탄산수소나트륨을 포함하는 부형제를 사용할 수 있다.
일구현예에 따르면, 위장운동 및 기타 서방형 약물 방출에 영향을 미치는 요인들을 고려하여, 상기 부형제와 같이 첨가되는 서방기제는 서방층 전체 중량에 대하여 10 내지 70%, 예를 들어 30 내지 50%로 포함될 수 있다. 또한, 정제의 부유성을 높이는 탄산수소나트륨은 적량 이상의 함량으로 첨가되는 경우에 오히려 정제의 붕해를 증가시켜 약물의 방출을 방해할 수 있으므로 예를 들어, 조성물 총 중량에 대하여 1 내지 15%, 예를 들어 8 내지 12%로 포함될 수 있다.
일구현예에 따르면, 상기 조성물은 빛에 민감한 특성을 가지는 폴마콕시브와 수분, 온도 등 외부 요인에 의하여 안정성에 영향을 받는 프레가발린의 장기적인 안정성 확보를 위하여 코팅기제를 포함할 수 있다. 코팅기제로는 예를 들어, 수용성 코팅기제를 사용할 수 있으며, 통상적으로 사용되는 코팅기제를 사용할 수 있다. 구체적으로 예를 들어, 폴리비닐 알코올 유도체, 메타크릴산 유도체 및 폴리아크릴산 유도체를 포함하는 코팅기제를 포함할 수 있으며, 예를 들어 Opadry®, Kollicoat® 및 히드록시 프로필 메틸 셀룰로오스(HPMC)로 이루어지는 군에서 선택되는 1종 또는 2종 이상을 이용할 수 있고, 예를 들어 수분 및 빛 차단 효과가 비교적 우수한 폴리비닐 알코올 함유 Opadry®를 이용할 수 있다.
일구현예에 따르면, 약제학적으로 허용되는 담체를 추가로 포함할 수 있다. 담체로는 통상적으로 제제시 사용되는 것을 이용할 수 있으며, 예를 들어 락토스(lactose), 덱스트로스(dextrose), 수크로스(sucrose), 솔비톨(sorbitol), 만니톨(mannitol), 전분(starch), 아카시아 고무, 인산 칼슘(calcium phosphate), 알지네이트(alginate), 젤라틴(gelatin), 규산 칼슘(calcium silicate), 미세결정성 셀룰로스, 폴리비닐피롤리돈(polyvinyl pyrrolidone), 셀룰로스(cellulose), 물, 시럽(syrup), 메틸 셀룰로스(methyl cellulose), 메틸 하이드록시 벤조에이트(methyl hydroxyl benzoate), 프로필 하이드록시 벤조에이트(propyl hydroxyl benzoate), 활석(talc), 스테아르산 마그네슘(magnesium stearate) 및 미네랄 오일(mineral oil) 등을 포함할 수 있으나, 이에 한정되는 것은 아니다.
일구현예에 따르면, 상기 성분들 이외에 충진제, 증량제, 결합제, 붕해제, 용해제, 방부제, 완충제, 활택제, 흡습제, 피막제, 착색제, 수용성 첨가제, 윤활제, 습윤제, 감미제, 향미제, 유화제, 현탁제, 보존제 등 통상적으로 사용되는 약제학적 허용 가능한 물질을 추가적인 첨가제로 포함할 수 있다. 이러한 첨가제는 본 발명에 따른 조성물의 유효 성분에 영향을 최소화하는 함량 범위 내에서 포함될 수 있으며, 예를 들어 조성물 총 중량에 대하여, 5 내지 90중량%, 예를 들어 40 내지 90중량% 포함될 수 있다.
일구현예에 따르면, 상기 조성물은 염증성 또는 신경병증성으로 유발되는 통증, 예를 들어, 급성 통증, 만성 통증에 작용할 수 있다. 구체적으로 예를 들어, 당뇨병성 신경장애를 포함하는 신경성 통증(neurogenic pain), 범불안장애(generalized anxiety disorder)로 인한 통증, 섬유근육통(fibromyalgia), 통각과민증(hyperalgesia), 이질통(allodynia), 암통증(cancer pain), 골관절염(osteoarthritis), 류마티스 관절염(rheumatoid arthritis), 강직성 척추염(ankylosing spondylitis), 오십견(frozen shoulder), 요통(lumbodynia) 또는 좌골신경통(sciatica)을 치료하기 위한 진통제로서 유효한 효과를 나타낼 수 있다. 또한, 예를 들어 류마티스 관절염, 강직성 척추염, 좌골신경통 및 오십견과 같은 염증성 요소의 심각한 통증 내지 중등도의 통증에 대한 치료 용도로 사용될 수 있다.
본 발명에 따른 약제 또는 약학적 조성물은 유아, 어린이 및 어른 동물을 포함하는 인간에게 적용이 적합한 어떠한 형태여도 무방하고, 이 분야의 지식을 가진 자들에게 알려진 표준 공정에 의하여 제조될 수 있다.
이하, 본 발명이 속하는 기술 분야에서 통상의 지식을 가진 자가 용이하게 실시할 수 있도록 본 발명의 실시예에 대하여 상세히 설명한다. 그러나 본 발명은 여러 가지 상이한 형태로 구현될 수 있으며, 이들 실시예는 단지 본 발명을 예시하기 위한 것이므로 본 발명의 범위가 이들 실시예에 의하여 제한되는 것으로 해석되지는 않는다.
실시예 1
안정성이 부족하다는 특성을 가지는 프레가발린 주성분과 배합 적합성 시험을 통하여 약물-부형제 간 상호작용이 없는 부형제를 선별하고 그 종류를 최소화하였다. 폴마콕시브와 프레가발린을 주성분으로 표 1과 같은 부형제를 이용하여 습식과립형태로 연합, 건조, 정립 및 혼합하고 캡슐 충진하였다. 메쉬망은 30메쉬(mesh)로 사용하였다.
| 폴마콕시브 - 프레가발린 복합제 (실시예1) | |||||
| 제조공정 | 배합목적 | 원료명 | 1정당(mg) | 함유율(%) | |
| 1 | 과립 | 주성분 | 폴마콕시브 | 1 | 0.5 |
| 2 | 주성분 | 프레가발린 | 75 | 34.1 | |
| 3 | 부형제 | 디-만니톨(200SD) | 114 | 51.8 | |
| 4 | 결합제 | 히드록시프로필셀룰로오스(L) | 6 | 2.7 | |
| 5 | 용매 | 에탄올 | 60 | - | |
| 6 | 후혼합 | 붕해제 | 크로스카르멜로오스 나트륨 |
20 | 9.1 |
| 7 | 활택제 | 스테아르산마그네슘 | 4 | 1.8 | |
| 혼합물 총량 | 220 | 100 | |||
| 8 | 충진 | 충진 | 캡슐기제 무게 | 75 | |
| 캡슐 총량 | 295 | ||||
실험예 1
대한민국약전 용출시험법의 제2법(패들법, 장치2) 규격에 따라, 실시예 1 제제에 대한 생체 외(in vitro) 비교용출 시험을 진행하였다. 대조약으로는 현재 시판 중인 것을 사용하였으며, 구체적으로 폴마콕시브에 대하여 현재 아사 제품인 아셀렉스 캡슐을 대조약으로 비교용출 시험을 진행하였고, 프레가발린에 대하여 리리카 캡슐 제품을 대조약으로 하여 비교용출 시험을 진행하였다.
폴마콕시브 성분에 대한 용출 시험액으로는 실시예 1과 대조약의 용출 차이가 가장 큰 용출액인 pH 1.2의 대한민국약전 제11개정 붕해시험법의 제1액을 사용하였고, 시험 온도는 37 ± 0.5℃, 회전속도는 50rpm으로 하였으며, 그 결과는 표 2 및 도 1에 나타내었다.
또한, 프레가발린 성분에 대한 용출 시험액으로는 pH 1.2의 대한민국약전 제11개정 붕해시험법의 제1액, pH 4.0의 일본약전 제17개정 0.05mol/L 아세트산·아세트산나트륨 완충액 pH 4.0, pH 6.8의 대한민국약전 제11개정 붕해시험법의 제2액 또는 물의 4가지 용출액에서 모두 유사한 패턴을 보이므로 기시용출액인 0.06 N HCL로 시험을 진행하였으며, 그 결과는 표 3 및 도 2에 나타내었다.
용출률은 평균으로 나타내었으며, 단위는 %이다.
| 구분 | 시간(분) | 0 | 5 | 10 | 15 | 30 | 45 | 60 |
| 실시예 1 | 평균 | 0 | 67.0 | 85.7 | 87.9 | 90.2 | 92.5 | 94.0 |
| 대조약 (아셀렉스캡슐) |
평균 | 0 | 37.2 | 56.8 | 72.4 | 84.3 | 88.5 | 91.7 |
| 구분 | 시간(분) | 0 | 5 | 10 | 15 | 30 | 45 | 60 |
| 실시예 1 | 평균 | 0 | 60.2 | 96.8 | 99.3 | 100.3 | 100.8 | 101.2 |
| 대조약 (리리카캡슐) |
평균 | 0 | 61.7 | 96.0 | 98.9 | 100.6 | 100.2 | 100.7 |
표 및 도면에 나타난 바와 같이, 실시예 1 조성물과 대조약의 초기 용출률에서 차이가 나타났다.
실시예 2
표 4와 같이 붕해제를 조절하여 실시예 1과 동일한 방법으로 캡슐 충진하였다.
| 폴마콕시브 - 프레가발린 복합제 (실시예2) | |||||
| 제조공정 | 배합목적 | 원료명 | 1정당(mg) | 함유율(%) | |
| 1 | 과립 | 주성분 | 폴마콕시브 | 1 | 0.5 |
| 2 | 주성분 | 프레가발린 | 75 | 34.1 | |
| 3 | 부형제 | 디-만니톨(200SD) | 114 | 51.8 | |
| 4 | 결합제 | 히드록시프로필셀룰로오스(L) | 6 | 2.7 | |
| 5 | 용매 | 에탄올 | 60 | - | |
| 6 | 후혼합 | 붕해제 | 크로스카르멜로오스 나트륨 |
10 | 9.1 |
| 7 | 활택제 | 스테아르산마그네슘 | 4 | 1.8 | |
| 혼합물 총량 | 220 | 100 | |||
| 8 | 충진 | 충진 | 캡슐기제 무게 | 75 | |
| 캡슐 총량 | 295 | ||||
실험예 2
실시예 2 제제에 대하여 실험예 1과 동일한 방법으로 비교용출 시험을 진행하였다.
폴마콕시브에 대한 시험액은 pH 1.2이며, 결과는 표 5 및 도 3에 나타내었고, 프레가발린에 대한 시험액은 pH 0.06 N HCL이며, 표 6 및 도 4에 나타내었다.
| 구분 | 시간(분) | 0 | 5 | 10 | 15 | 30 |
| 실시예 2 | 평균 | 0 | 64.9 | 94.5 | 98.0 | 101.5 |
| 대조약 (아셀렉스캡슐) |
평균 | 0 | 41.4 | 64.9 | 77.5 | 92.7 |
| 구분 | 시간(분) | 0 | 5 | 10 | 15 | 30 | 45 | 60 |
| 실시예 2 | 평균 | 0 | 34.9 | 85.4 | 91.1 | 94.8 | 95.2 | 95.4 |
| 대조약 (리리카캡슐) |
평균 | 0 | 72.7 | 96.7 | 98.3 | 98.6 | 99.3 | 99.6 |
표 및 도면에 나타난 바와 같이, 붕해제에 의하여 프레가발린과 대조약의 용출 차이가 증가하였다.
실시예 3
표 7의 조성으로 16 또는 20메쉬(mesh)의 메쉬망으로 처리한 것을 제외하고 실시예 1과 동일한 방법으로 캡슐 충진하였다.
| 폴마콕시브 - 프레가발린 복합제 (실시예3) | |||||
| 제조공정 | 배합목적 | 원료명 | 1정당(mg) | 함유율(%) | |
| 1 | 과립 | 주성분 | 폴마콕시브 | 1 | 0.5 |
| 2 | 주성분 | 프레가발린 | 75 | 34.1 | |
| 3 | 부형제 | 디-만니톨(200SD) | 114 | 51.8 | |
| 4 | 결합제 | 히드록시프로필셀룰로오스(L) | 6 | 2.7 | |
| 5 | 용매 | 에탄올 | 60 | - | |
| 6 | 후혼합 | 붕해제 | 크로스카르멜로오스 나트륨 |
20 | 9.1 |
| 7 | 활택제 | 스테아르산마그네슘 | 4 | 1.8 | |
| 혼합물 총량 | 220 | 100 | |||
| 8 | 충진 | 충진 | 캡슐기제 무게 | 75 | |
| 캡슐 총량 | 295 | ||||
실험예 3
제조 공정 중 메쉬(mesh)의 변화와 붕해제의 유무에 따른 용출 변화를 확인하기 위하여, 실시예 3의 폴마콕시브에 대하여 실험예 1과 동일한 방법으로 비교용출 시험을 진행하였다. 용출액으로는 pH 1.2를 사용하였고, 대조약으로는 아셀렉스 캡슐을 사용하였으며, 그 결과는 표 8 및 도 5에 나타내었다.
| pH1.2 | 시간 (분) |
0 | 5 | 10 | 15 | 30 | 45 | 60 | |
| 실시예 3 | 16mesh, 붕해제 x |
평균 | 0 | 35.4 | 81.1 | 86.9 | 89.2 | 90.9 | 91.6 |
| 대조약 | 평균 | 0 | 42.2 | 62.2 | 73.0 | 86.3 | 90.4 | 96.3 | |
| 실시예 3 | 16mesh, 붕해제 20mg |
평균 | 0 | 55.4 | 86.6 | 89.9 | 91.1 | 92.1 | 93.1 |
| 대조약 | 평균 | 0 | 42.2 | 62.2 | 73.0 | 86.3 | 90.4 | 96.3 | |
| 실시예 3 | 20mesh, 붕해제 x |
평균 | 0 | 27.0 | 79.9 | 88.6 | 91.0 | 92.4 | 93.1 |
| 대조약 | 평균 | 0 | 42.2 | 62.2 | 73.0 | 86.3 | 90.4 | 96.3 | |
| 실시예 3 | 20mesh, 붕해제 10mg |
평균 | 0 | 34.6 | 77.5 | 84.6 | 88.3 | 90.0 | 90.3 |
| 대조약 | 평균 | 0 | 42.2 | 62.2 | 73.0 | 86.3 | 90.4 | 96.3 | |
실시예 4
표 9의 조성에 따라 정제 형태로 제조한 것을 제외하고 실시예 3과 동일한 방법으로 제조하였다. 정제 제조 시 프레가발린의 불안정성을 고려하여 최적의 타정압을 선정하여 진행하였다.
| 폴마콕시브 - 프레가발린 복합제 (실시예4) | |||||
| 제조공정 | 배합목적 | 원료명 | 1정당(mg) | 함유율(%) | |
| 1 | 과립 | 주성분 | 폴마콕시브 | 1 | 0.5 |
| 2 | 주성분 | 프레가발린 | 75 | 34.1 | |
| 3 | 부형제 | 디-만니톨(200SD) | 114 | 51.8 | |
| 4 | 결합제 | 히드록시프로필셀룰로오스(L) | 6 | 2.7 | |
| 5 | 용매 | 에탄올 | 60 | - | |
| 6 | 후혼합 | 붕해제 | 크로스카르멜로오스 나트륨 |
20 | 9.1 |
| 7 | 활택제 | 스테아르산마그네슘 | 4 | 1.8 | |
| 혼합물 총량 | 220 | 100 | |||
실험예 4
실시예 4 제제를 경도 별로 정제로 제조하여 폴마콕시브 성분에 대하여 실험예 1과 동일한 방법으로 비교용출 시험을 진행하였다.
용출 시험액으로 pH 1.2의 대한민국약전 제11개정 붕해시험법의 제1액 또는 pH 4.0의 일본약전 제17개정 0.05 mol/L 아세트산·아세트산나트륨 완충액을 사용하였고, 대조약으로는 아셀렉스 정제를 사용하였다. 비교용출 시험 결과는 표 10 및 도 6에 나타내었다.
| 구분 | 시간 (분) |
0 | 5 | 10 | 15 | 30 | 45 | 60 | |
| 실시예 4 | 경도3kp pH1.2 |
평균 | 0 | 89.4 | 94.6 | 95.4 | 96.2 | 96.0 | 96.6 |
| 대조약 | 평균 | 0 | 45.0 | 63.2 | 73.2 | 88.0 | 93.0 | 95.3 | |
| 실시예 4 | 경도4kp pH1.2 |
평균 | 0 | 88.6 | 90.2 | 90.8 | 91.9 | 92.3 | 92.4 |
| 대조약 | 평균 | 0 | 45.0 | 63.2 | 73.2 | 88.0 | 93.0 | 95.3 | |
| 실시예 4 | 경도3kp pH4.0 |
평균 | 0 | 90.1 | 97.2 | 98.2 | 99.1 | 99.5 | 99.9 |
| 대조약 | 평균 | 0 | 49.8 | 69.9 | 79.9 | 92.8 | 96.4 | 97.3 | |
| 실시예 4 | 경도4kp pH4.0 |
평균 | 0 | 87.7 | 91.6 | 92.8 | 93.8 | 94.5 | 94.9 |
| 대조약 | 평균 | 0 | 49.8 | 69.9 | 79.9 | 92.8 | 96.4 | 97.3 | |
실험예 5
실시예 4 조성에 따라 경도별로 정제를 제조한 후 프레가발린 성분에 대하여 pH 1.2의 대한민국약전 제11개정 붕해시험법의 제1액, pH 4.0의 일본약전 제17개정 0.05 mol/L 아세트산·아세트산나트륨 완충액 pH 4.0, pH 6.8의 대한민국약전 제11개정 붕해시험법의 제2액 또는 물에서 실험예 1과 동일한 방법으로 비교용출 시험을 진행하였다. 대조약으로는 리리카 캡슐을 사용하였다. 결과는 표 11, 표 12, 도 7 및 도 8에 나타내었다.
| 구분 | 시간 (분) |
0 | 5 | 10 | 15 | 30 | 45 | 60 | |
| 실시예 4 | 경도3kp pH1.2 |
평균 | 0 | 96.2 | 97.1 | 97.5 | 97.8 | 98.1 | 98.5 |
| 대조약 | 평균 | 0 | 70.0 | 97.6 | 99.6 | 102.2 | 103.6 | 104.4 | |
| 실시예 4 | 경도4kp pH1.2 |
평균 | 0 | 97.0 | 98.0 | 97.7 | 98.2 | 98.4 | 98.5 |
| 대조약 | 평균 | 0 | 70.0 | 97.6 | 99.6 | 102.2 | 103.6 | 104.4 | |
| 실시예 4 | 경도3kp pH4.0 |
평균 | 0 | 92.2 | 98.0 | 100.5 | 100.1 | 99.6 | 100.5 |
| 대조약 | 평균 | 0 | 52.7 | 96.8 | 99.6 | 99.5 | 98.5 | 100.8 | |
| 실시예 4 | 경도4kp pH4.0 |
평균 | 0 | 98.7 | 99.0 | 98.0 | 99.2 | 98.8 | 98.8 |
| 대조약 | 평균 | 0 | 52.7 | 96.8 | 99.6 | 99.5 | 98.5 | 100.8 | |
| 구분 | 시간 (분) |
0 | 5 | 10 | 15 | 30 | 45 | 60 | |
| 실시예 4 | 경도3kp pH6.8 |
평균 | 0 | 93.7 | 98.8 | 99.1 | 99.4 | 99.9 | 99.6 |
| 대조약 | 평균 | 0 | 32.8 | 96.5 | 99.9 | 100.5 | 101.3 | 101.1 | |
| 실시예 4 | 경도4kp pH6.8 |
평균 | 0 | 97.6 | 97.1 | 97.8 | 97.7 | 98.0 | 98.2 |
| 대조약 | 평균 | 0 | 32.8 | 96.5 | 99.9 | 100.5 | 101.3 | 101.1 | |
| 실시예 4 | 경도3kp 물 |
평균 | 0 | 89.9 | 97.1 | 97.8 | 97.8 | 98.5 | 98.3 |
| 대조약 | 평균 | 0 | 42.2 | 98.6 | 101.7 | 101.8 | 101.5 | 101.4 | |
| 실시예 4 | 경도4kp 물 |
평균 | 0 | 100.2 | 100.4 | 101.0 | 100.7 | 101.3 | 101.5 |
| 대조약 | 평균 | 0 | 42.2 | 98.6 | 101.7 | 101.8 | 101.5 | 101.4 | |
실시예 5
실시예 4에 따른 제제의 제조 단위 증가 시, 생산시설에서 정제의 타정성을 향상시키기 위하여 표 13의 조성으로 한 것을 제외하고 실시예 4와 동일한 방법으로 정제를 제조하였다. 결정형의 프레가발린 함유 조성물 타정 시 캡핑(capping)현상이 발생할 수 있으므로 이를 개선하기 위하여 미분의 입자도를 갖는 미결정 셀룰로오스를 첨가하고 부형제의 양을 증가시켰으며, 후혼합에 첨가되었던 크로스 카멜로오스 나트륨을 과립에 첨가하였다.
| 폴마콕시브 - 프레가발린 복합제 (실시예5) | |||||
| 제조공정 | 배합목적 | 원료명 | 1정당(mg) | 함유율(%) | |
| 1 | 과립 | 주성분 | 폴마콕시브 | 1 | 0.4 |
| 2 | 주성분 | 프레가발린 | 75 | 29.3 | |
| 3 | 부형제 | 디-만니톨(200SD) | 66 | 25.8 | |
| 4 | 부형제 | 미결정셀룰로오스101 | 90 | 35.2 | |
| 5 | 결합제 | 히드록시프로필 셀룰로오스(L) |
10 | 3.9 | |
| 6 | 용매 | 에탄올 | 80 | - | |
| 7 | 붕해제 | 크로스카르멜로오스 나트륨 |
10 | 3.9 | |
| 8 | 후혼합 | 활택제 | 스테아르산마그네슘 | 4 | 1.6 |
| 혼합물 총량 | 256 | 100 | |||
실시예 6
실시예 5 제제로부터 타정성을 더욱 개선시키기 위하여 표 14의 조성으로 한 것을 제외하고 실시예 4와 동일한 방법으로 정제를 제조하였다. 구체적으로, 부형제의 함량을 증가시키고, 이산화규소를 첨가하였다.
| 폴마콕시브 - 프레가발린 복합제 (실시예5) | |||||
| 제조공정 | 배합목적 | 원료명 | 1정당(mg) | 함유율(%) | |
| 1 | 과립 | 주성분 | 폴마콕시브 | 1 | 0.3 |
| 2 | 주성분 | 프레가발린 | 75 | 25.9 | |
| 3 | 부형제 | 디-만니톨(200SD) | 66 | 22.8 | |
| 4 | 부형제 | 미결정셀룰로오스101 | 120 | 41.4 | |
| 5 | 결합제 | 히드록시프로필 셀룰로오스(L) |
10 | 3.4 | |
| 6 | 용매 | 에탄올 | 80 | - | |
| 7 | 붕해제 | 크로스카르멜로오스 나트륨 |
10 | 3.4 | |
| 8 | 부형제 | 이산화규소 | 4 | 1.4 | |
| 9 | 후혼합 | 활택제 | 스테아르산마그네슘 | 4 | 1.4 |
| 혼합물 총량 | 290 | 100 | |||
실험예 6
실시예 6 제제에 대하여 실험예 1과 동일한 방법으로 비교용출 시험을 진행하였다. 용출 시험액으로 pH 1.2 또는 물을 사용하였고, 폴마콕시브에 대한 대조약으로는 아셀렉스 정제를, 프레가발린에 대한 대조약으로는 리리카 캡슐을 사용하였다.
폴마콕시브 성분에 대한 비교용출 시험 결과는 표 15 및 도 9에 나타내었고, 프레가발린 성분에 대한 비교용출 시험 결과는 표 16 및 도 10에 나타내었다.
| 폴마콕시브 | 시간(분) | 0 | 5 | 10 | 15 | 30 | 45 | 60 | |
| 실시예 6 | 물 | 평균 | 0 | 92.6 | 94.0 | 93.9 | 93.8 | 94.7 | 95.2 |
| 대조약 (아셀렉스정제) |
평균 | 0 | 49.0 | 65.9 | 73.9 | 86.1 | 90.3 | 97.0 | |
| 프레가발린 | 시간(분) | 0 | 5 | 10 | 15 | 30 | 45 | 60 | |
| 실시예 6 | pH1.2 | 평균 | 0 | 97.8 | 98.3 | 98.7 | 99.7 | 99.3 | 100.4 |
| 대조약 (리리카캡슐) |
평균 | 0 | 78.4 | 94.0 | 98.8 | 99.6 | 99.4 | 98.8 | |
실시예 7
표 17에 따라 서방출성을 나타내는 프레가발린 층과 속방출을 보이는 프레가발린, 폴마콕시브층을 함유하는 2중층 복합 정제를 제조하였다. 상층인 속방층에는 주성분 폴마콕시브와 프레가발린 절반에 해당하는 양을 첨가하여 속방출성 약물 방출을 보이도록 조성물을 제조하였고, 하층인 서방층에는 프레가발린 나머지 절반에 해당하는 양을 서방출성 기제를 첨가하여 2중층 복합제를 제조하였다. 서방출성 기제로는 히드록시 프로필 메칠 셀룰로오스, 카보머 및 PEO를 사용하였다.
| 폴마콕시브 - 프레가발린 복합제 (실시예7) | ||||
| 상층 | 제조공정 | 배합목적 | 원료명 | 1정당(mg) |
| 1 | 과립 | 주성분 | 폴마콕시브 | 2 |
| 2 | 주성분 | 프레가발린 | 75 | |
| 3 | 부형제 | 디-만니톨 | 113 | |
| 4 | 결합제 | 히드록시프로필셀룰로오스 | 6 | |
| 5 | 용 매 | 에탄올 | 60 | |
| 6 | 후혼합 | 붕해제 | 크로스카르멜로오스나트륨 | 20 |
| 7 | 활택제 | 스테아르산마그네슘 | 4 | |
| 속방정 총중량 | 220 | |||
| 하층 | 제조공정 | 배합목적 | 원료명 | 1정당(mg) |
| 8 | 과립 | 주성분 | 프레가발린 | 75 |
| 9 | 부형제 | 미결정셀룰로오스102 | 60 | |
| 10 | 서방기제 | 히드록시프로필메칠셀룰로오스 2208 | 300 | |
| 11 | 결합제 | 히드록시프로필셀룰로오스 | 30 | |
| 12 | 용 매 | 에탄올 | 60 | |
| 13 | 후혼합 | 서방기제 | 카보머 | 15 |
| 14 | 서방기제 | PEO | 100 | |
| 15 | 부형제 | 탄산수소나트륨 | 80 | |
| 16 | 활택제 | 스테아르산마그네슘 | 5 | |
| 서방층 총중량 | 665 | |||
| 정제 총 중량 | 885 | |||
실시예 8
표 18의 조성에 따른 것을 제외하고 실시예 7과 동일한 방법으로 복합 정제를 제조하였다. 서방출성 기제로는 히드록시 프로필 메칠 셀룰로오스, 알긴산 나트륨 및 카복시 메칠 셀룰로오스 나트륨을 사용하였다.
| 폴마콕시브 - 프레가발린 복합제 (실시예8) | ||||
| 상층 | 제조공정 | 배합목적 | 원료명 | 1정당(mg) |
| 1 | 과립 | 주성분 | 폴마콕시브 | 2 |
| 2 | 주성분 | 프레가발린 | 75 | |
| 3 | 부형제 | 디-만니톨 | 113 | |
| 4 | 결합제 | 히드록시프로필셀룰로오스 | 6 | |
| 5 | 용 매 | 에탄올 | 60 | |
| 6 | 후혼합 | 붕해제 | 크로스카르멜로오스나트륨 | 20 |
| 7 | 활택제 | 스테아르산마그네슘 | 4 | |
| 속방정 총중량 | 220 | |||
| 하층 | 제조공정 | 배합목적 | 원료명 | 1정당(mg) |
| 8 | 과립 | 주성분 | 프레가발린 | 75 |
| 9 | 서방기제 | 알긴산나트륨 | 150 | |
| 10 | 서방기제 | 히드록시프로필메칠셀룰로오스 2208 | 270 | |
| 11 | 서방기제 | 카르복시메칠셀룰로오스나트륨 | 70 | |
| 12 | 결합제 | 히드록시프로필셀룰로오스 | 30 | |
| 13 | 용 매 | 에탄올 | 60 | |
| 14 | 후혼합 | 부형제 | 탄산수소나트륨 | 80 |
| 15 | 활택제 | 스테아르산마그네슘 | 10 | |
| 서방층 총중량 | 685 | |||
| 정제 총 중량 | 905 | |||
실험예 7
실험예 1과 동일한 방법으로 실시예 7 및 8의 정제 용출 시험을 진행하였으며, 그 결과는 표 19 및 도 11에 나타내었다.
| 구분 | 시간 (분) |
0 | 30 | 60 | 120 | 240 | 360 | 480 | 960 | 1440 | |
| 실시예7 | pH1.2 | 평균 | 0 | 59.0 | 62.1 | 66.4 | 73.0 | 78.5 | 83.9 | 100.3 | 107.4 |
| 실시예8 | 평균 | 0 | 59.0 | 61.3 | 65.2 | 72.4 | 77.7 | 82.5 | 98.0 | 104.0 | |
실험예 8
실험예 1과 동일한 방법으로 실시예 7 및 8의 용출 시험을 진행하였으며, 위장관 운동 저항성 측정을 위해 용출 패들 rpm을 50 rpm에서 100 rpm으로 증가시켜 용출시험 진행하였다.
그 결과는 표 20 및 도 12에 나타내었다.
| rpm 100 | 시간 (분) |
0 | 30 | 60 | 120 | 240 | 360 | 480 | 960 | 1440 | |
| 실시예7 | pH1.2 | 평균 | 0 | 55.9 | 61.0 | 66.5 | 72.9 | 77.6 | 82.9 | 97.4 | 103.3 |
| 실시예8 | 평균 | 0 | 52.0 | 63.2 | 68.5 | 74.3 | 75.6 | 82.6 | 93.4 | 101.2 | |
표에 나타난 바와 같이, 회전 속도의 변경에 따른 용출률의 변화는 4 내지 8%이내의 결과를 보이므로 위장관의 운동에 따른 급격한 약물 방출 현상이 발생할 가능성이 낮을 것으로 사료된다.
실험예 9
실시예 7 및 8의 조성 중 서방층 부분의 조성만으로 정제를 제조하여 실험예 1과 동일한 방법으로 용출 시험을 진행하였다. 2중층 정제의 전체적인 프레가발린 용출 결과가 서방출(sustain-release, SR) 형태가 아닌 지효성(Controlled-release, CR)의 방출 형태를 보여 하층 부분인 서방층 부분의 용출양상을 확인하기 위하여 용출시험을 진행하였다. 결과는 표 21 및 도 13에 나타내었다.
| 하층부분 | 시간 (분) |
0 | 30 | 60 | 120 | 240 | 360 | 480 | 600 | 960 | 1440 | |
| 실시예7 | pH1.2 | 평균 | 0 | 11.5 | 14.9 | 22.5 | 34.6 | 45.8 | 55.4 | 64.5 | 85.2 | 102.8 |
| 실시예8 | 평균 | 0 | 8.7 | 13.7 | 21.4 | 34.0 | 45.1 | 54.7 | 63.6 | 83.4 | 99.0 | |
실시예 9 및 10
이중층 복합제 조성물 중 프레가발린을 상, 하층의 속방층, 서방층으로 구분하여 나누지 않고 서방층 부분에 첨가하여 표 22와 같은 조성으로 정제를 제조하였다. 서방성 기제인 알긴산 나트륨은 안정성 시험 진행 시 흡습에 의하여 조성물의 성상이 변화하는 데 영향을 미칠 수 있으므로, 서방기제로서 히드록시 프로필 메칠 셀룰로오스, 카보머 및 PEO를 사용하였다.
| 폴마콕시브 - 프레가발린 복합제 | 실시예9 | 실시예10 | |||
| 상층 | 제조공정 | 배합목적 | 원료명 | 1정당(mg) | |
| 1 | 과립 | 주성분 | 폴마콕시브 | 2 | 2 |
| 2 | 부형제 | 디-만니톨 | 188 | 188 | |
| 3 | 결합제 | 히드록시프로필셀룰로오스 | 6 | 6 | |
| 4 | 용 매 | 에탄올 | 60 | 60 | |
| 5 | 후혼합 | 붕해제 | 크로스카르멜로오스나트륨 | - | - |
| 6 | 활택제 | 스테아르산마그네슘 | 4 | 4 | |
| 속방정 총중량 | 200 | 200 | |||
| 하층 | 제조공정 | 배합목적 | 원료명 | 1정당(mg) | |
| 7 | 과립 | 주성분 | 프레가발린 | 150 | 150 |
| 8 | 서방기제 | 히드록시프로필메칠셀룰로오스 2208 | 300 | 300 | |
| 9 | 결합제 | 히드록시프로필셀룰로오스 | 20 | 20 | |
| 10 | 용 매 | 에탄올 | 300 | 300 | |
| 11 | 후혼합 | 부형제 | 탄산수소나트륨 | 50 | 50 |
| 12 | 서방기제 | PEO | 30 | - | |
| 13 | 서방기제 | 카보머 | - | 30 | |
| 14 | 활택제 | 스테아르산마그네슘 | 5 | 5 | |
| 서방층 총중량 | 555 | 555 | |||
| 정제 총 중량 | 755 | 755 | |||
실험예 10
실시예 9 및 10에 따른 정제에 대하여 실험예 1과 동일한 방법으로 용출시험을 진행하였다. 결과는 표 23 및 도 14에 나타내었다.
| pH1.2 | 시간 (분) |
0 | 30 | 60 | 120 | 240 | 360 | 480 | 540 | 600 | 720 | 960 | 1440 |
| 실시예9 | 평균 | 0 | 11.5 | 17.6 | 26.0 | 38.0 | 47.1 | 57.4 | - | 66.0 | - | 82.7 | 98.0 |
| 실시예10 | 평균 | 0 | 10.9 | 17.2 | 26.6 | 37.5 | 49.1 | 56.9 | - | 64.3 | - | 81.9 | 99.3 |
실시예 11
실험예 10의 결과를 토대로 하여 최적의 조성물을 선정하였다. 용출률에 영향을 주지 않고 정제의 크기를 줄이기 위한 조성물의 제조를 위하여 표 24의 조성에 따라 정제를 제조하였다. 표의 조성과 같이, 속방층의 양을 감소시키는 동시에 서방층에 함유된 부형제의 양을 감소시킴으로써 최종적인 정제의 무게를 감소시켰다. 또한, 프레가발린 주성분이 가지는 타정압에 의한 불안정성을 개선하기 위하여 정제의 경도 별로 제제를 제조하였다. 구체적으로, 각각 5kp 및 9kp 경도의 정제를 제조하였다.
| 폴마콕시브 - 프레가발린 복합제 | 실시예11 | |||
| 상층 | 제조공정 | 배합목적 | 원료명 | 1정당(mg) |
| 1 | 과립 | 주성분 | 폴마콕시브 | 2 |
| 2 | 부형제 | 디-만니톨 | 100 | |
| 3 | 결합제 | 히드록시프로필셀룰로오스 | 5 | |
| 4 | 용 매 | 에탄올 | 50 | |
| 5 | 후혼합 | 활택제 | 스테아르산마그네슘 | 3 |
| 속방정 총중량 | 110 | |||
| 하층 | 제조공정 | 배합목적 | 원료명 | 1정당(mg) |
| 6 | 과립 | 주성분 | 프레가발린 | 150 |
| 7 | 서방기제 | 히드록시프로필메칠셀룰로오스 2208 | 230 | |
| 8 | 결합제 | 히드록시프로필셀룰로오스 | 20 | |
| 9 | 용 매 | 에탄올 | 200 | |
| 10 | 후혼합 | 부형제 | 탄산수소나트륨 | 35 |
| 11 | 서방기제 | PEO | 25 | |
| 12 | 활택제 | 스테아르산마그네슘 | 5 | |
| 서방층 총중량 | 465 | |||
| 정제 총 중량 | 575 | |||
실험예 11
프레가발린 주성분은 타정압에 의한 불안정성을 가지므로 실시예 11 제제를 경도 별로 하여 정제를 제조하여 용출시험을 진행하였다. 결과는 표 25 및 도 15에 나타내었다.
| pH1.2 | 시간 (분) |
0 | 30 | 60 | 120 | 240 | 360 | 480 | 540 | 600 | 720 | 960 | 1440 |
| 실시예11 (5kp) |
평균 | 0 | 9.1 | 15.9 | 25.7 | 40.2 | 51.2 | 61.4 | - | 70.5 | - | 90.2 | 106.4 |
| 실시예11 (9kp) |
평균 | 0 | 10.0 | 16.3 | 25.3 | 39.2 | 50.8 | 60.3 | - | 69.2 | - | 87.9 | 104.4 |
표에 나타난 바와 같이, 정제의 경도별 용출 결과 타정압에 의한 용출률은 유효한 정도의 차이가 없는 것을 확인할 수 있다. 또한, 실험예 10 및 11의 결과를 보면, 정제의 사이즈를 감소시키기 위하여 부형제를 감소시키는 것은 용출률에 큰 차이를 주지 않는다는 것을 확인할 수 있다.
실시예 12
제조 스케일을 높여 생산시설에서 정제 제조 시 폴마콕시브가 함유된 상층 조성물의 함량이 낮아 제조 후에 정제의 질량 편차 및 함량이 균일하지 않은 문제점을 개선하기 위하여 상층의 질량을 적당량 증가시켜 표 26과 같은 조성으로 정제를 제조하였다.
| 폴마콕시브 - 프레가발린 복합제 | 실시예12 | |||
| 상층 | 제조공정 | 배합목적 | 원료명 | 1정당(mg) |
| 1 | 주성분 | 폴마콕시브 | 2 | |
| 2 | 부형제 | 디-만니톨 | 130 | |
| 3 | 붕해제 | 크로스카르멜로오스나트륨 | 10 | |
| 4 | 결합제 | 히드록시프로필셀룰로오스 | 5 | |
| 5 | 용 매 | 에탄올 | 30 | |
| 6 | 후혼합 | 활택제 | 스테아르산마그네슘 | 3 |
| 속방정 총중량 | 150 | |||
| 하층 | 제조공정 | 배합목적 | 원료명 | 1정당(mg) |
| 6 | 과립 | 주성분 | 프레가발린 | 150 |
| 7 | 서방기제 | 히드록시프로필메칠셀룰로오스 2208 | 200 | |
| 8 | 결합제 | 히드록시프로필셀룰로오스 | 20 | |
| 9 | 용 매 | 에탄올 | 140 | |
| 10 | 후혼합 | 부형제 | 탄산수소나트륨 | 50 |
| 11 | 서방기제 | PEO | 50 | |
| 12 | 활택제 | 스테아르산마그네슘 | 5 | |
| 서방층 총중량 | 475 | |||
| 정제 총 중량 | 625 | |||
실험예 12
실시예 11 및 실시예 12 정제에 대하여 실험예 1과 동일한 방법으로 용출시험을 진행하였다. 프레가발린 성분에 대한 비교용출 시험 결과는 표 27 및 도 16에 나타내었고, 폴마콕시브 성분에 대한 비교용출 시험 결과는 표 28 및 도 17에 나타내었다.
| pH1.2 | 시간 (분) |
0 | 30 | 60 | 120 | 240 | 360 | 480 | 540 | 600 | 720 | 960 | 1440 |
| 실시예12 (9kp) |
평균 | 0 | 11.6 | 16.5 | 24.7 | 38.1 | 49.3 | 58.8 | - | 67.0 | - | 87.1 | 101.4 |
| 실시예11 (9kp) |
평균 | 0 | 10.1 | 16.3 | 25.3 | 39.2 | 50.8 | 60.3 | - | 69.2 | - | 87.9 | 104.4 |
| pH1.2 | 시간 (분) |
0 | 5 | 10 | 15 | 30 | 45 | 60 |
| 실시예 12 |
평균 | 0 | 45.0 | 63.2 | 73.2 | 88.0 | 93.0 | 95.3 |
| 대조약 아셀렉스정제 |
평균 | 0 | 42.0 | 73.2 | 81.6 | 88.9 | 91.4 | 92.7 |
상기한 바와 같이, 본 발명에 따른 조성물은 시판 중인 프레가발린을 함유하는 경구 제형인 리리카 캡슐 및 아셀렉스 정제와 약물 방출패턴이 유사한 것을 확인할 수 있다. 폴마콕시브와 프레가발린을 하나의 단일 제형으로 제제화함에 있어서, 단일 제형 내에서 두 약물의 상호작용이 없음을 알 수 있으며, 1일 1회 또는 2회의 복용횟수로 각각의 약물 효과가 상호 보완적으로 지속 가능하게 발휘될 수 있도록 설계할 수 있음을 확인하였다. 또한, 프레가발린은 타정압과 같은 외부의 물리적인 요인으로 유연물질이 증가함으로 인하여 안정성에 문제를 발생시킬 수 있다는 특성을 가지므로, 이를 보완하기 위하여 적정 타정압력을 적용하였으며, 캡슐 제형에 비하여 정제 형태가 제제의 생산 시 안정성 면에서 우수할 수 있음 확인하였다. 또한, 캡슐 제형의 경우 입자의 흐름성이 우수하여 충진 시 질량의 편차 없이 균일도가 비교적 우수함을 확인하였다. 또한, 단일 복합 속방정 이외에도 복용 횟수를 줄일 수 있는 프레가발린 서방정과 폴마콕시브 속방형 2중층의 제형을 갖는 복합제에 대한 가능성을 확인하였다.
이상의 설명은 본 발명의 기술 사상을 예시적으로 설명한 것에 불과한 것으로서, 본 발명이 속하는 기술 분야에서 통상의 지식을 가진 자라면 본 발명의 본질적인 특성에서 벗어나지 않는 범위에서 다양한 수정 및 변형이 가능하다. 또한, 본 발명에 개시된 실시 예들은 본 발명의 기술 사상을 한정하기 위한 것이 아니라 설명하기 위한 것이고, 이러한 실시 예에 의하여 본 발명의 기술 사상의 범위가 한정되는 것은 아니다. 본 발명의 보호 범위는 아래의 청구범위에 의하여 해석되어야 하며, 그와 동등한 범위 내에 있는 모든 기술 사상은 본 발명의 권리범위에 포함되는 것으로 해석되어야 할 것이다.
Claims (16)
- 폴마콕시브(polmacoxib) 및 프레가발린(pregabalin)을 포함하는 통증 치료용 약제학적 조성물.
- 제1항에 있어서,
상기 조성물이 염증성 또는 신경병증성으로 유발된 급성 또는 만성 통증 치료용인 것인, 약제학적 조성물. - 제1항에 있어서,
상기 조성물이 당뇨병성 신경장애를 포함하는 신경성 통증(neurogenic pain), 범불안장애(generalized anxiety disorder)로 인한 통증, 섬유근육통(fibromyalgia), 통각과민증(hyperalgesia), 이질통(allodynia), 암통증(cancer pain), 골관절염(osteoarthritis), 류마티스 관절염(rheumatoid arthritis), 척추염(spondylitis), 오십견(frozen shoulder), 요통(lumbodynia) 또는 좌골신경통(sciatica)을 적응증으로 하는 것인, 약제학적 조성물. - 제1항에 있어서,
폴마콕시브 대 프레가발린의 비율이 1 내지 300:1 내지 600 중량비인 것인, 약제학적 조성물. - 제1항에 있어서,
폴마콕시브 대 프레가발린의 비율이 1:1 내지 300 중량비인 것인, 약제학적 조성물. - 제1항에 있어서,
폴마콕시브 대 프레가발린의 비율이 2:1 내지 300 중량비인 것인, 약제학적 조성물. - 제1항에 있어서,
조성물 총 중량에 대하여, 폴마콕시브 0.1 내지 10중량% 및 프레가발린 10 내지 50중량% 포함하는 것인, 약제학적 조성물. - 제1항에 있어서,
약제학적으로 허용되는 부형제를 추가로 포함하는 것인 약제학적 조성물. - 제8항에 있어서,
상기 부형제가 에틸 셀룰로오스(ethyl cellulose), 히드록시 프로필 셀룰로오스(hydroxypropyl cellulose), 히드록시 프로필 메틸 셀룰로오스(hydroxypropyl methylcellulose), 카복시 메틸 셀룰로오스 나트륨(sodium carboxymethyl cellulose), 폴리에틸렌 옥사이드(polyethylene oxide), 카보머(carbomer), 알긴산나트륨(sodium alginate), 만니톨(mannitol), 크로스 카멜로오스 나트륨(cross carmellose sodium), 탄산수소나트륨(sodium hydrogen carbonate) 및 스테아르산 마그네슘(magnesium stearate)으로 이루어지는 군으로부터 선택되는 하나 이상을 포함하는 것인, 약제학적 조성물. - 제1항에 있어서,
정제, 캡슐제 또는 현탁제의 형태인 것인, 약제학적 조성물. - 제10항에 있어서,
폴마콕시브 및 프레가발린이 혼합된 정제, 캡슐 또는 현탁제 형태이고,
상기 정제는 이중정, 다층정 또는 단일정의 형태를 포함하는 것인, 약제학적 조성물. - 제1항에 있어서,
폴마콕시브, 프레가발린 또는 이들의 혼합물이 각기 다른 층으로 구분된 상태인 이중층 구조의 이중정 또는 다층 구조의 다층정으로 형성된 것인, 약제학적 조성물. - 제1항에 있어서,
서방층 및 속방층으로 구분되어 있는 이중층으로 형성된 것인, 약제학적 조성물. - 제13항에 있어서,
상기 서방층이 프레가발린을 포함하고, 상기 속방층이 폴마콕시브를 포함하는 것인, 약제학적 조성물. - 제1항에 있어서,
약제학적으로 허용되는 코팅기제를 더 포함하는 것인, 약제학적 조성물. - 제1항에 있어서,
약제학적으로 허용되는 담체를 추가로 포함하는 것인, 약제학적 조성물.
Priority Applications (9)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020180037054A KR102631399B1 (ko) | 2018-03-30 | 2018-03-30 | 폴마콕시브 및 프레가발린을 포함하는 통증 치료용 약제학적 조성물 |
| CA3093899A CA3093899A1 (en) | 2018-03-30 | 2019-03-20 | Pharmaceutical composition, comprising polmacoxib and pregabalin, for treatment of pain |
| EP19777560.4A EP3777849A4 (en) | 2018-03-30 | 2019-03-20 | PHARMACEUTICAL COMPOSITION, COMPRISING POLMACOXIB AND PREGABALIN, FOR THE TREATMENT OF PAIN |
| US16/982,137 US11602517B2 (en) | 2018-03-30 | 2019-03-20 | Pharmaceutical composition, comprising polmacoxib and pregabalin, for treatment of pain |
| PCT/KR2019/003225 WO2019190118A1 (ko) | 2018-03-30 | 2019-03-20 | 폴마콕시브 및 프레가발린을 포함하는 통증 치료용 약제학적 조성물 |
| JP2020545470A JP2021517115A (ja) | 2018-03-30 | 2019-03-20 | ポルマコキシブ及びプレガバリンを含む疼痛治療用薬剤学的組成物 |
| CN201980020180.0A CN111867578A (zh) | 2018-03-30 | 2019-03-20 | 包含帕马考昔及普瑞巴林的用于治疗疼痛的药剂学组合物 |
| BR112020017773-3A BR112020017773A2 (pt) | 2018-03-30 | 2019-03-20 | Composição farmacêutica compreendendo polmacoxibe e pregabalina para tratamento de dor |
| US18/155,240 US20230293476A1 (en) | 2018-03-30 | 2023-01-17 | Pharmaceutical composition, comprising polmacoxib and pregabalin, for treatment of pain |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020180037054A KR102631399B1 (ko) | 2018-03-30 | 2018-03-30 | 폴마콕시브 및 프레가발린을 포함하는 통증 치료용 약제학적 조성물 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20190114403A true KR20190114403A (ko) | 2019-10-10 |
| KR102631399B1 KR102631399B1 (ko) | 2024-02-01 |
Family
ID=68062241
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020180037054A KR102631399B1 (ko) | 2018-03-30 | 2018-03-30 | 폴마콕시브 및 프레가발린을 포함하는 통증 치료용 약제학적 조성물 |
Country Status (8)
| Country | Link |
|---|---|
| US (2) | US11602517B2 (ko) |
| EP (1) | EP3777849A4 (ko) |
| JP (1) | JP2021517115A (ko) |
| KR (1) | KR102631399B1 (ko) |
| CN (1) | CN111867578A (ko) |
| BR (1) | BR112020017773A2 (ko) |
| CA (1) | CA3093899A1 (ko) |
| WO (1) | WO2019190118A1 (ko) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR102374820B1 (ko) * | 2020-11-04 | 2022-03-16 | 전남대학교병원 | 프레가발린 및 티아넵틴을 포함하는 신경병성 통증 치료용 약학적 조성물 |
| WO2024068242A1 (en) * | 2022-09-29 | 2024-04-04 | Triviumvet Designated Activity Company | Veterinary compositions for use in the treatment of neuropathic pain |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101446601B1 (ko) * | 2014-01-29 | 2014-10-07 | 크리스탈지노믹스(주) | 5-(4-(아미노설포닐)페닐)-2,2-디메틸-4-(3-플루오로페닐)-3(2h)-퓨라논을 포함하는 약학적 조성물 및 캡슐 제형 |
Family Cites Families (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ES2253825T3 (es) * | 1997-09-08 | 2006-06-01 | Warner-Lambert Company Llc | Composiciones analgesicas que comprenden compuestos antiepilepticos y procedimientos para usar las mismas. |
| CA2364127A1 (en) | 1999-03-01 | 2000-09-08 | Ortho-Mcneil Pharmaceutical, Inc. | Composition comprising a tramadol material and a selective cox-2 inhibitor drug |
| KR100495389B1 (ko) | 1999-04-14 | 2005-06-16 | 주식회사 태평양 | 시클로옥시게네이즈-2 저해제로서의4,5-디아릴-3(2h)-퓨라논 유도체 |
| DE19927688A1 (de) | 1999-06-17 | 2000-12-21 | Gruenenthal Gmbh | Mehrschichttablette zur Verabreichung einer fixen Kombination von Tramadol und Diclofenac |
| WO2003070237A1 (en) * | 2002-02-22 | 2003-08-28 | Warner-Lambert Company Llc | Combinations of an alpha-2-delta ligand with a selective inhibitor of cyclooxygenase-2 |
| WO2004035041A1 (en) * | 2002-10-17 | 2004-04-29 | Novartis Ag | Pharmaceutical composition for treating pain comprising oxicarbazepine, or derivatives thereof, and cox2 inhibitors |
| BRPI0513695A (pt) * | 2004-07-22 | 2008-05-13 | Pharmacia Corp | composições para o tratamento de inflamação e dor que empregam uma combinação de um inibidor seletivo de cox-2 e um antagonista de receptor ltb4 |
| BRPI0612802A2 (pt) | 2005-07-07 | 2010-11-30 | Farnam Co Inc | composições farmacêuticas de liberação sustentada para medicamentos extremamente hidrossolúveis |
| CA2716424C (en) * | 2008-03-04 | 2015-04-28 | Pfizer Limited | Methods of treating chronic pain |
| EP2311446A1 (en) | 2009-10-16 | 2011-04-20 | Laboratorios Del. Dr. Esteve, S.A. | Compositions comprising Tramadol and Celecoxib in the treatment of pain |
| CN103906508A (zh) | 2011-08-26 | 2014-07-02 | 沃克哈特有限公司 | 治疗心血管疾病的方法 |
| KR20130078147A (ko) | 2011-12-30 | 2013-07-10 | 한미약품 주식회사 | 일정한 입도를 갖는 4,5―디아릴―3(2h)―퓨라논 유도체를 포함하는 약학 조성물 |
| US20160120885A1 (en) * | 2014-07-14 | 2016-05-05 | Autotelic Llc | Fixed dose combination for pain relief without edema |
| US20160008371A1 (en) * | 2014-07-14 | 2016-01-14 | Autotelic Llc | Fixed dose combination for pain relief without edema |
| US10363220B2 (en) | 2015-06-03 | 2019-07-30 | Triastek, Inc. | Compartmented pharmaceutical dosage forms |
| KR101710792B1 (ko) | 2015-07-14 | 2017-02-28 | 주식회사 유영제약 | 세레콕시브 및 트라마돌을 함유하는 약제학적 조성물 |
| KR20170135163A (ko) * | 2016-05-30 | 2017-12-08 | 크리스탈지노믹스(주) | 폴마콕시브를 포함하는 관절 내 국소 투여용 제어방출성 마이크로입자 제제 |
| EP3484456A4 (en) * | 2016-07-17 | 2020-03-18 | Mapi Pharma Limited | RETARD PHARMACEUTICAL FORMS OF PREGABALIN |
-
2018
- 2018-03-30 KR KR1020180037054A patent/KR102631399B1/ko active IP Right Grant
-
2019
- 2019-03-20 JP JP2020545470A patent/JP2021517115A/ja active Pending
- 2019-03-20 US US16/982,137 patent/US11602517B2/en active Active
- 2019-03-20 WO PCT/KR2019/003225 patent/WO2019190118A1/ko unknown
- 2019-03-20 EP EP19777560.4A patent/EP3777849A4/en not_active Withdrawn
- 2019-03-20 CA CA3093899A patent/CA3093899A1/en active Pending
- 2019-03-20 BR BR112020017773-3A patent/BR112020017773A2/pt unknown
- 2019-03-20 CN CN201980020180.0A patent/CN111867578A/zh active Pending
-
2023
- 2023-01-17 US US18/155,240 patent/US20230293476A1/en not_active Abandoned
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101446601B1 (ko) * | 2014-01-29 | 2014-10-07 | 크리스탈지노믹스(주) | 5-(4-(아미노설포닐)페닐)-2,2-디메틸-4-(3-플루오로페닐)-3(2h)-퓨라논을 포함하는 약학적 조성물 및 캡슐 제형 |
Also Published As
| Publication number | Publication date |
|---|---|
| CA3093899A1 (en) | 2019-10-03 |
| BR112020017773A2 (pt) | 2020-12-22 |
| US20230293476A1 (en) | 2023-09-21 |
| WO2019190118A1 (ko) | 2019-10-03 |
| JP2021517115A (ja) | 2021-07-15 |
| KR102631399B1 (ko) | 2024-02-01 |
| EP3777849A1 (en) | 2021-02-17 |
| CN111867578A (zh) | 2020-10-30 |
| US11602517B2 (en) | 2023-03-14 |
| US20210113515A1 (en) | 2021-04-22 |
| EP3777849A4 (en) | 2022-02-23 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP2575798B1 (en) | Gastroretentive dosage forms of gaba analogs | |
| EP2217217B1 (en) | Controlled release pharmaceutical compositions of pregabalin | |
| US20230293476A1 (en) | Pharmaceutical composition, comprising polmacoxib and pregabalin, for treatment of pain | |
| JP3631762B2 (ja) | トラマドール複式ユニット製剤 | |
| FI80829B (fi) | Foerfarande foer att framstaella nya orala instatnpreparat av dipyridamol. | |
| JP6976946B2 (ja) | 生理活性の強い、urat1のインヒビターを含む医薬組成物 | |
| US20140030323A1 (en) | Controlled release of n-acetylcysteine (nac) for reduction of systemic and/or vascular inflammation | |
| EP1849462B1 (en) | A method of alleviating signs and symptons of Spasticity | |
| JP2018500353A (ja) | 回腸−空腸薬物送達用組成物 | |
| US20210154180A1 (en) | Formulation having improved ph-dependent drug-release characteristics containing esomeprazole or pharmaceutically acceptable salt thereof | |
| EP3424499B1 (en) | A pharmaceutical composition for neuropathic pain | |
| JP2017510599A (ja) | 安定性が改善されたプレガバリンを含有する薬剤学的組成物およびその製造方法 | |
| US20180000792A1 (en) | Modified release compositions of epalrestat or a derivative thereof and methods for using the same | |
| US20140037725A1 (en) | Bilayer pharmaceutical compositions of naproxen | |
| KR101732731B1 (ko) | 라코사마이드(lacosamide) 또는 이의 약학적으로 허용 가능한 염의 용출 패턴 조절이 용이한 약학 조성물 | |
| KR20220106960A (ko) | 경구 제약 즉시 방출 조성물 및 체중 감량을 위한 치료 방법 | |
| CN111818913B (zh) | 含有拉科酰胺的药剂学缓释性组合物 | |
| EP3025707A1 (en) | A multilayer tablet comprising metformin and pioglitazone | |
| KR101438546B1 (ko) | 프레가발린을 포함하는 서방성 제제 | |
| KR101265491B1 (ko) | 사포그릴레이트염산염을 함유하는 용출률이 조절된 경구용 다층정제 및 이의 제조방법 | |
| RU2789402C1 (ru) | Фармацевтическая композиция, содержащая полмакоксиб и прегабалин, для лечения боли | |
| KR102039345B1 (ko) | 프레가발린 함유 고팽윤성 서방성 삼중정제 | |
| KR20190045026A (ko) | 안정성이 향상된 프레가발린 정제 제조 방법 | |
| EP3682876A1 (en) | Pharmaceutical composition for treating acute and chronic pain, containing polmacoxib and tramadol | |
| JP2022151841A (ja) | ビルダグリプチン製剤 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal | ||
| AMND | Amendment | ||
| E601 | Decision to refuse application | ||
| X091 | Application refused [patent] | ||
| AMND | Amendment | ||
| X701 | Decision to grant (after re-examination) |