KR20180098268A - 화학 강화 유리의 제조 방법 - Google Patents
화학 강화 유리의 제조 방법 Download PDFInfo
- Publication number
- KR20180098268A KR20180098268A KR1020187017943A KR20187017943A KR20180098268A KR 20180098268 A KR20180098268 A KR 20180098268A KR 1020187017943 A KR1020187017943 A KR 1020187017943A KR 20187017943 A KR20187017943 A KR 20187017943A KR 20180098268 A KR20180098268 A KR 20180098268A
- Authority
- KR
- South Korea
- Prior art keywords
- glass
- ion
- tempered glass
- alkali
- glass plate
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Ceased
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C03—GLASS; MINERAL OR SLAG WOOL
- C03C—CHEMICAL COMPOSITION OF GLASSES, GLAZES OR VITREOUS ENAMELS; SURFACE TREATMENT OF GLASS; SURFACE TREATMENT OF FIBRES OR FILAMENTS MADE FROM GLASS, MINERALS OR SLAGS; JOINING GLASS TO GLASS OR OTHER MATERIALS
- C03C21/00—Treatment of glass, not in the form of fibres or filaments, by diffusing ions or metals in the surface
- C03C21/001—Treatment of glass, not in the form of fibres or filaments, by diffusing ions or metals in the surface in liquid phase, e.g. molten salts, solutions
- C03C21/002—Treatment of glass, not in the form of fibres or filaments, by diffusing ions or metals in the surface in liquid phase, e.g. molten salts, solutions to perform ion-exchange between alkali ions
-
- C—CHEMISTRY; METALLURGY
- C03—GLASS; MINERAL OR SLAG WOOL
- C03C—CHEMICAL COMPOSITION OF GLASSES, GLAZES OR VITREOUS ENAMELS; SURFACE TREATMENT OF GLASS; SURFACE TREATMENT OF FIBRES OR FILAMENTS MADE FROM GLASS, MINERALS OR SLAGS; JOINING GLASS TO GLASS OR OTHER MATERIALS
- C03C15/00—Surface treatment of glass, not in the form of fibres or filaments, by etching
-
- C—CHEMISTRY; METALLURGY
- C03—GLASS; MINERAL OR SLAG WOOL
- C03C—CHEMICAL COMPOSITION OF GLASSES, GLAZES OR VITREOUS ENAMELS; SURFACE TREATMENT OF GLASS; SURFACE TREATMENT OF FIBRES OR FILAMENTS MADE FROM GLASS, MINERALS OR SLAGS; JOINING GLASS TO GLASS OR OTHER MATERIALS
- C03C21/00—Treatment of glass, not in the form of fibres or filaments, by diffusing ions or metals in the surface
-
- C—CHEMISTRY; METALLURGY
- C03—GLASS; MINERAL OR SLAG WOOL
- C03C—CHEMICAL COMPOSITION OF GLASSES, GLAZES OR VITREOUS ENAMELS; SURFACE TREATMENT OF GLASS; SURFACE TREATMENT OF FIBRES OR FILAMENTS MADE FROM GLASS, MINERALS OR SLAGS; JOINING GLASS TO GLASS OR OTHER MATERIALS
- C03C23/00—Other surface treatment of glass not in the form of fibres or filaments
- C03C23/0075—Cleaning of glass
Landscapes
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Geochemistry & Mineralogy (AREA)
- Materials Engineering (AREA)
- Organic Chemistry (AREA)
- Surface Treatment Of Glass (AREA)
Abstract
Description
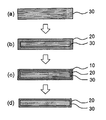
도 2는, 본 발명에 따른 화학 강화 유리의 제조 공정을 나타내는 모식도이다.
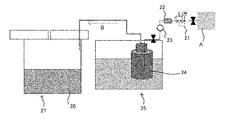
도 3은, 이온 교환을 하는 공정에서의 분위기를 형성하기 위한 실험계의 모식도이다.
2: 가압 지그
3: 받침 지그
10: 저밀도층
20: 압축 응력층
30: 중간층
21: 레귤레이터
22: 플로우 미터
23: 역지 밸브
24: 물
25: 수조
26: 용융염
27: 용융염 조
Claims (19)
- 알칼리 이온을 포함하는 유리판을 준비하는 공정과,
상기 알칼리 이온의 이온 반경보다도 큰 다른 알칼리 이온을 포함하는 무기염을 준비하는 공정과,
노점 온도가 20℃ 이상의 분위기에서, 상기 유리판의 상기 알칼리 이온과 상기 무기염의 상기 다른 알칼리 이온의 이온 교환을 하는 공정과,
상기 이온 교환된 상기 유리판의 표면의 일부를 제거하는 공정
을 포함하는 것을 특징으로 하는 화학 강화 유리의 제조 방법. - 제1항에 있어서, 상기 이온 교환을 하는 공정은, 상기 노점 온도가 30℃ 이상의 분위기에서 행해지는 것을 특징으로 하는 화학 강화 유리의 제조 방법.
- 제1항 또는 제2항에 있어서, 상기 이온 교환을 하는 공정은, 상기 노점 온도가 40℃ 이상의 분위기에서 행해지는 것을 특징으로 하는 화학 강화 유리의 제조 방법.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 상기 이온 교환을 하는 공정은, 상기 노점 온도가 50℃ 이상의 분위기에서 행해지는 것을 특징으로 하는 화학 강화 유리의 제조 방법.
- 제1항 내지 제4항 중 어느 한 항에 있어서, 상기 이온 교환을 하는 공정은, 상기 노점 온도가 상기 무기염의 온도 이하의 분위기에서 행해지는 것을 특징으로 하는 화학 강화 유리의 제조 방법.
- 제1항 내지 제5항 중 어느 한 항에 있어서, 상기 이온 교환하는 공정에서의 분위기는, 수증기 공급부로부터 상기 무기염의 상부의 공간에 수증기를 포함하는 기체가 도입됨으로써 형성되고, 상기 수증기를 포함하는 기체의 도입량은, 1㎤당의 수증기 공급량이 0.01mg/분 이상인 것을 특징으로 하는 화학 강화 유리의 제조 방법.
- 제1항 내지 제5항 중 어느 한 항에 있어서, 상기 이온 교환하는 공정에서의 분위기는, 버블링부로부터 상기 무기염 중에 수증기를 포함하는 기체가 도입됨으로써 형성되고, 상기 수증기를 포함하는 기체의 도입량은, 1㎤당의 수증기 공급량이 0.01mg/분 이상인 것을 특징으로 하는 화학 강화 유리의 제조 방법.
- 제1항 내지 제7항 중 어느 한 항에 있어서, 상기 무기염을 준비하는 공정은 K2CO3, Na2CO3, KHCO3, NaHCO3, Li2CO3, Rb2CO3, Cs2CO3, MgCO3, CaCO3 및 BaCO3으로 이루어지는 군에서 선택되는 적어도 1종의 염과 질산칼륨을 포함하는 무기염을 준비하는 것을 특징으로 하는 화학 강화 유리의 제조 방법.
- 제1항 내지 제8항 중 어느 한 항에 있어서, 상기 유리판의 표면의 일부를 제거하는 공정은, 상기 이온 교환된 상기 유리판을 산에 접촉시키는 공정을 포함하는 것을 특징으로 하는 화학 강화 유리의 제조 방법.
- 제9항에 있어서, 상기 유리판의 표면의 일부를 제거하는 공정은, 상기 산에 접촉시키는 공정 후에 상기 유리판을 알칼리에 접촉시키는 공정을 더 포함하는 것을 특징으로 하는 화학 강화 유리의 제조 방법.
- 제10항에 있어서, 상기 산에 접촉시키는 공정과 상기 알칼리에 접촉시키는 공정 사이에, 상기 유리판을 세정하는 공정을 더 포함하는 것을 특징으로 하는 화학 강화 유리의 제조 방법.
- 제1항 내지 제11항 중 어느 한 항에 있어서, 상기 이온 교환하는 공정과 상기 유리판의 표면의 일부를 제거하는 공정 사이에, 상기 유리판을 세정하는 공정을 더 포함하는 것을 특징으로 하는 화학 강화 유리의 제조 방법.
- 제10항 내지 제12항 중 어느 한 항에 있어서, 상기 알칼리에 접촉시키는 공정 후에, 상기 유리판을 세정하는 공정을 더 포함하는 것을 특징으로 하는 화학 강화 유리의 제조 방법.
- 제9항 내지 제13항 중 어느 한 항에 있어서, 상기 산에 접촉시키는 공정은, pH7 미만인 용액을 사용하는 것을 특징으로 하는 화학 강화 유리의 제조 방법.
- 제14항에 있어서, 상기 pH7 미만인 용액은, 약산인 것을 특징으로 하는 화학 강화 유리의 제조 방법.
- 제14항에 있어서, 상기 pH7 미만인 용액은, 강산인 것을 특징으로 하는 화학 강화 유리의 제조 방법.
- 제10항 내지 제16항 중 어느 한 항에 있어서, 상기 알칼리에 접촉시키는 공정은, pH7 초과인 용액을 사용하는 것을 특징으로 하는 화학 강화 유리의 제조 방법.
- 제17항에 있어서, 상기 pH7 초과인 용액은, 약염기인 것을 특징으로 하는 화학 강화 유리의 제조 방법.
- 제17항에 있어서, 상기 pH7 초과인 용액은, 강염기인 것을 특징으로 하는 화학 강화 유리의 제조 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2015256894 | 2015-12-28 | ||
| JPJP-P-2015-256894 | 2015-12-28 | ||
| PCT/JP2016/088788 WO2017115765A1 (ja) | 2015-12-28 | 2016-12-26 | 化学強化ガラスの製造方法 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20180098268A true KR20180098268A (ko) | 2018-09-03 |
Family
ID=59225084
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020187017943A Ceased KR20180098268A (ko) | 2015-12-28 | 2016-12-26 | 화학 강화 유리의 제조 방법 |
Country Status (5)
| Country | Link |
|---|---|
| JP (1) | JP6288392B2 (ko) |
| KR (1) | KR20180098268A (ko) |
| CN (1) | CN108473368B (ko) |
| TW (2) | TWI710536B (ko) |
| WO (1) | WO2017115765A1 (ko) |
Families Citing this family (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2018043361A1 (ja) * | 2016-09-02 | 2018-03-08 | 旭硝子株式会社 | 化学強化ガラスの製造方法 |
| CN113135672B (zh) | 2017-06-23 | 2023-03-24 | Agc株式会社 | 化学强化玻璃 |
| JP7247454B2 (ja) * | 2017-06-27 | 2023-03-29 | Agc株式会社 | 化学強化ガラスの製造方法及び化学強化ガラス |
| JP7024565B2 (ja) * | 2018-04-04 | 2022-02-24 | Agc株式会社 | 化学強化ガラスの製造方法 |
| JP2019199393A (ja) * | 2018-05-18 | 2019-11-21 | Agc株式会社 | 化学強化ガラスの製造方法および化学強化ガラス |
| CN109437598A (zh) * | 2018-11-02 | 2019-03-08 | 文登市文胜玻璃有限公司 | 一种钠钙硅玻璃的快速离子增强方法及钠钙硅离子增强玻璃 |
| WO2020171091A1 (ja) * | 2019-02-22 | 2020-08-27 | Agc株式会社 | 防汚層付きガラス基体および防汚層付きガラス基体の製造方法 |
| CN114787095A (zh) * | 2019-12-02 | 2022-07-22 | 康宁股份有限公司 | 利用碳酸盐减轻离子交换期间所引起的雾度的方法 |
| JP7283380B2 (ja) * | 2019-12-26 | 2023-05-30 | Agc株式会社 | 化学強化ガラスの製造方法及びリチウムイオン吸着剤 |
| KR102776052B1 (ko) * | 2020-01-03 | 2025-03-05 | 삼성디스플레이 주식회사 | 유리 제품 및 이의 제조 방법 |
| CN114538793B (zh) * | 2020-11-24 | 2025-08-12 | 日本电气硝子株式会社 | 强化玻璃的制造方法 |
| CN116715451A (zh) * | 2023-06-02 | 2023-09-08 | 河南曲显光电科技有限公司 | 报废后硝酸钾二次利用方法、含锂玻璃及其强化方法 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2015008763A1 (ja) | 2013-07-19 | 2015-01-22 | 旭硝子株式会社 | 化学強化ガラスの製造方法 |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS472634B1 (ko) * | 1970-11-17 | 1972-01-25 | ||
| JP3078281B2 (ja) * | 1998-06-30 | 2000-08-21 | ホーヤ株式会社 | 情報記録媒体用基板の製造方法及び情報記録媒体 |
| JP2010168270A (ja) * | 2008-12-26 | 2010-08-05 | Hoya Corp | ガラス基材及びその製造方法 |
| CN104203859A (zh) * | 2012-03-26 | 2014-12-10 | 旭硝子株式会社 | 能够减小化学强化时的翘曲的玻璃板 |
| WO2014104303A1 (ja) * | 2012-12-27 | 2014-07-03 | 旭硝子株式会社 | 化学強化時の反りを低減できるガラス板の製造方法及びガラス板 |
| WO2018008763A1 (ja) * | 2016-07-08 | 2018-01-11 | 味の素株式会社 | アルツハイマー型認知症の将来の発症リスクの評価方法 |
-
2016
- 2016-12-26 JP JP2017551359A patent/JP6288392B2/ja active Active
- 2016-12-26 KR KR1020187017943A patent/KR20180098268A/ko not_active Ceased
- 2016-12-26 CN CN201680076423.9A patent/CN108473368B/zh active Active
- 2016-12-26 WO PCT/JP2016/088788 patent/WO2017115765A1/ja not_active Ceased
- 2016-12-28 TW TW105143500A patent/TWI710536B/zh active
- 2016-12-28 TW TW109134801A patent/TWI725921B/zh active
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2015008763A1 (ja) | 2013-07-19 | 2015-01-22 | 旭硝子株式会社 | 化学強化ガラスの製造方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| TWI725921B (zh) | 2021-04-21 |
| TW202110768A (zh) | 2021-03-16 |
| TWI710536B (zh) | 2020-11-21 |
| JP6288392B2 (ja) | 2018-03-07 |
| TW201736310A (zh) | 2017-10-16 |
| CN108473368B (zh) | 2021-10-29 |
| WO2017115765A1 (ja) | 2017-07-06 |
| JPWO2017115765A1 (ja) | 2017-12-28 |
| CN108473368A (zh) | 2018-08-31 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20180098268A (ko) | 화학 강화 유리의 제조 방법 | |
| JP5751390B1 (ja) | 化学強化ガラス | |
| JP7276372B2 (ja) | 化学強化ガラス | |
| JPWO2016117476A1 (ja) | 化学強化ガラス及びその製造方法 | |
| CN109095789A (zh) | 化学强化玻璃的制造方法 | |
| CN106167357B (zh) | 化学强化玻璃的制造方法 | |
| CN107207335B (zh) | 玻璃基材的制造方法 | |
| KR20190065255A (ko) | 화학 강화 유리의 제조 방법 | |
| WO2016117478A1 (ja) | フロートガラス | |
| WO2018043361A1 (ja) | 化学強化ガラスの製造方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PA0105 | International application |
Patent event date: 20180625 Patent event code: PA01051R01D Comment text: International Patent Application |
|
| PG1501 | Laying open of application | ||
| A201 | Request for examination | ||
| PA0201 | Request for examination |
Patent event code: PA02012R01D Patent event date: 20211115 Comment text: Request for Examination of Application |
|
| E902 | Notification of reason for refusal | ||
| PE0902 | Notice of grounds for rejection |
Comment text: Notification of reason for refusal Patent event date: 20230817 Patent event code: PE09021S01D |
|
| E601 | Decision to refuse application | ||
| PE0601 | Decision on rejection of patent |
Patent event date: 20231201 Comment text: Decision to Refuse Application Patent event code: PE06012S01D Patent event date: 20230817 Comment text: Notification of reason for refusal Patent event code: PE06011S01I |