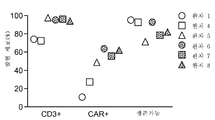
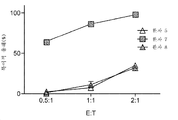
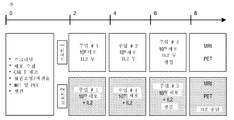
KR20180021364A - Car-t 세포의 간 동맥 주입 - Google Patents
Car-t 세포의 간 동맥 주입 Download PDFInfo
- Publication number
- KR20180021364A KR20180021364A KR1020177033070A KR20177033070A KR20180021364A KR 20180021364 A KR20180021364 A KR 20180021364A KR 1020177033070 A KR1020177033070 A KR 1020177033070A KR 20177033070 A KR20177033070 A KR 20177033070A KR 20180021364 A KR20180021364 A KR 20180021364A
- Authority
- KR
- South Korea
- Prior art keywords
- car
- cells
- cea
- leu
- ser
- Prior art date
Links
- 238000002347 injection Methods 0.000 title claims abstract description 46
- 239000007924 injection Substances 0.000 title claims abstract description 46
- 210000002767 hepatic artery Anatomy 0.000 title claims abstract description 36
- 210000004027 cell Anatomy 0.000 claims abstract description 213
- 238000000034 method Methods 0.000 claims abstract description 81
- 210000001744 T-lymphocyte Anatomy 0.000 claims abstract description 58
- 108010002350 Interleukin-2 Proteins 0.000 claims abstract description 52
- 102000036639 antigens Human genes 0.000 claims abstract description 37
- 108091007433 antigens Proteins 0.000 claims abstract description 37
- 239000000427 antigen Substances 0.000 claims abstract description 36
- 239000000203 mixture Substances 0.000 claims abstract description 18
- 206010061289 metastatic neoplasm Diseases 0.000 claims abstract description 16
- 206010027457 Metastases to liver Diseases 0.000 claims abstract description 14
- 230000001394 metastastic effect Effects 0.000 claims abstract description 12
- 239000003814 drug Substances 0.000 claims abstract description 10
- 229940124597 therapeutic agent Drugs 0.000 claims abstract description 10
- 108010019670 Chimeric Antigen Receptors Proteins 0.000 claims description 91
- 210000004185 liver Anatomy 0.000 claims description 70
- 238000001802 infusion Methods 0.000 claims description 42
- 210000002966 serum Anatomy 0.000 claims description 32
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 claims description 31
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 claims description 31
- 206010027476 Metastases Diseases 0.000 claims description 26
- 230000009401 metastasis Effects 0.000 claims description 24
- VWQVUPCCIRVNHF-OUBTZVSYSA-N Yttrium-90 Chemical compound [90Y] VWQVUPCCIRVNHF-OUBTZVSYSA-N 0.000 claims description 16
- 230000001086 cytosolic effect Effects 0.000 claims description 15
- 230000009467 reduction Effects 0.000 claims description 15
- 108010022366 Carcinoembryonic Antigen Proteins 0.000 claims description 11
- 102100025475 Carcinoembryonic antigen-related cell adhesion molecule 5 Human genes 0.000 claims description 11
- 210000004204 blood vessel Anatomy 0.000 claims description 9
- 238000002583 angiography Methods 0.000 claims description 7
- 230000002829 reductive effect Effects 0.000 claims description 5
- 230000000004 hemodynamic effect Effects 0.000 claims description 2
- 108091007741 Chimeric antigen receptor T cells Proteins 0.000 claims 1
- 206010028980 Neoplasm Diseases 0.000 abstract description 69
- 238000011282 treatment Methods 0.000 abstract description 26
- 102000000588 Interleukin-2 Human genes 0.000 description 49
- 230000002494 anti-cea effect Effects 0.000 description 27
- 201000011510 cancer Diseases 0.000 description 23
- 230000009885 systemic effect Effects 0.000 description 22
- 150000001413 amino acids Chemical class 0.000 description 18
- 230000000694 effects Effects 0.000 description 18
- 108090000623 proteins and genes Proteins 0.000 description 18
- 239000013598 vector Substances 0.000 description 18
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 17
- 230000001225 therapeutic effect Effects 0.000 description 17
- 229940024606 amino acid Drugs 0.000 description 16
- 201000010099 disease Diseases 0.000 description 15
- 102000004169 proteins and genes Human genes 0.000 description 15
- 241000282414 Homo sapiens Species 0.000 description 13
- 108700010039 chimeric receptor Proteins 0.000 description 13
- 238000000684 flow cytometry Methods 0.000 description 12
- 230000014509 gene expression Effects 0.000 description 12
- 210000001519 tissue Anatomy 0.000 description 12
- 239000000047 product Substances 0.000 description 11
- 238000001959 radiotherapy Methods 0.000 description 11
- 230000004044 response Effects 0.000 description 11
- 230000011664 signaling Effects 0.000 description 11
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 10
- 238000001574 biopsy Methods 0.000 description 10
- 238000002474 experimental method Methods 0.000 description 10
- 210000004698 lymphocyte Anatomy 0.000 description 10
- 230000001177 retroviral effect Effects 0.000 description 10
- 206010016654 Fibrosis Diseases 0.000 description 9
- 230000004761 fibrosis Effects 0.000 description 9
- 230000002440 hepatic effect Effects 0.000 description 9
- 238000002595 magnetic resonance imaging Methods 0.000 description 9
- 210000005259 peripheral blood Anatomy 0.000 description 9
- 239000011886 peripheral blood Substances 0.000 description 9
- 238000002600 positron emission tomography Methods 0.000 description 9
- 238000010361 transduction Methods 0.000 description 9
- 230000026683 transduction Effects 0.000 description 9
- 108010076504 Protein Sorting Signals Proteins 0.000 description 8
- 239000012634 fragment Substances 0.000 description 8
- 238000003306 harvesting Methods 0.000 description 8
- 239000003018 immunosuppressive agent Substances 0.000 description 8
- 239000004005 microsphere Substances 0.000 description 8
- 239000000243 solution Substances 0.000 description 8
- 238000002560 therapeutic procedure Methods 0.000 description 8
- 102000004127 Cytokines Human genes 0.000 description 7
- 108090000695 Cytokines Proteins 0.000 description 7
- 210000004899 c-terminal region Anatomy 0.000 description 7
- 229940125721 immunosuppressive agent Drugs 0.000 description 7
- 210000000265 leukocyte Anatomy 0.000 description 7
- 238000001565 modulated differential scanning calorimetry Methods 0.000 description 7
- 210000004985 myeloid-derived suppressor cell Anatomy 0.000 description 7
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 7
- 238000012360 testing method Methods 0.000 description 7
- 206010028851 Necrosis Diseases 0.000 description 6
- 238000003384 imaging method Methods 0.000 description 6
- 230000017074 necrotic cell death Effects 0.000 description 6
- 239000002331 radioactive microsphere Substances 0.000 description 6
- 108020003175 receptors Proteins 0.000 description 6
- 102000005962 receptors Human genes 0.000 description 6
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 5
- 102000004625 Aspartate Aminotransferases Human genes 0.000 description 5
- 108010003415 Aspartate Aminotransferases Proteins 0.000 description 5
- 108060003951 Immunoglobulin Proteins 0.000 description 5
- BKAYIFDRRZZKNF-VIFPVBQESA-N N-acetylcarnosine Chemical compound CC(=O)NCCC(=O)N[C@H](C(O)=O)CC1=CN=CN1 BKAYIFDRRZZKNF-VIFPVBQESA-N 0.000 description 5
- VMLONWHIORGALA-SRVKXCTJSA-N Ser-Leu-Leu Chemical compound CC(C)C[C@@H](C([O-])=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H]([NH3+])CO VMLONWHIORGALA-SRVKXCTJSA-N 0.000 description 5
- 210000001367 artery Anatomy 0.000 description 5
- 238000004364 calculation method Methods 0.000 description 5
- 210000001072 colon Anatomy 0.000 description 5
- 230000034994 death Effects 0.000 description 5
- 102000018358 immunoglobulin Human genes 0.000 description 5
- 230000001506 immunosuppresive effect Effects 0.000 description 5
- 238000009169 immunotherapy Methods 0.000 description 5
- 239000003446 ligand Substances 0.000 description 5
- 208000014018 liver neoplasm Diseases 0.000 description 5
- 150000007523 nucleic acids Chemical class 0.000 description 5
- 230000008569 process Effects 0.000 description 5
- 230000005855 radiation Effects 0.000 description 5
- 239000006228 supernatant Substances 0.000 description 5
- 210000004881 tumor cell Anatomy 0.000 description 5
- 241001430294 unidentified retrovirus Species 0.000 description 5
- 206010009944 Colon cancer Diseases 0.000 description 4
- 208000001333 Colorectal Neoplasms Diseases 0.000 description 4
- 206010061818 Disease progression Diseases 0.000 description 4
- 230000005809 anti-tumor immunity Effects 0.000 description 4
- 238000013459 approach Methods 0.000 description 4
- 230000008901 benefit Effects 0.000 description 4
- 230000005750 disease progression Effects 0.000 description 4
- 230000006870 function Effects 0.000 description 4
- 230000002401 inhibitory effect Effects 0.000 description 4
- 230000005764 inhibitory process Effects 0.000 description 4
- 230000003902 lesion Effects 0.000 description 4
- 230000000670 limiting effect Effects 0.000 description 4
- 210000004072 lung Anatomy 0.000 description 4
- 230000003211 malignant effect Effects 0.000 description 4
- 238000013507 mapping Methods 0.000 description 4
- 210000004379 membrane Anatomy 0.000 description 4
- 239000012528 membrane Substances 0.000 description 4
- 108020004707 nucleic acids Proteins 0.000 description 4
- 102000039446 nucleic acids Human genes 0.000 description 4
- 210000000056 organ Anatomy 0.000 description 4
- 230000035515 penetration Effects 0.000 description 4
- 239000008194 pharmaceutical composition Substances 0.000 description 4
- 238000009520 phase I clinical trial Methods 0.000 description 4
- 230000035755 proliferation Effects 0.000 description 4
- 210000000664 rectum Anatomy 0.000 description 4
- 239000000523 sample Substances 0.000 description 4
- 230000004083 survival effect Effects 0.000 description 4
- 208000024891 symptom Diseases 0.000 description 4
- 230000003612 virological effect Effects 0.000 description 4
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 3
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 3
- 201000009030 Carcinoma Diseases 0.000 description 3
- KVXVVDFOZNYYKZ-DCAQKATOSA-N Gln-Gln-Leu Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(C)C)C(O)=O KVXVVDFOZNYYKZ-DCAQKATOSA-N 0.000 description 3
- 206010019695 Hepatic neoplasm Diseases 0.000 description 3
- 101001057504 Homo sapiens Interferon-stimulated gene 20 kDa protein Proteins 0.000 description 3
- 101001055144 Homo sapiens Interleukin-2 receptor subunit alpha Proteins 0.000 description 3
- 102000003814 Interleukin-10 Human genes 0.000 description 3
- 108090000174 Interleukin-10 Proteins 0.000 description 3
- 102100026878 Interleukin-2 receptor subunit alpha Human genes 0.000 description 3
- RXGLHDWAZQECBI-SRVKXCTJSA-N Leu-Leu-Ser Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(O)=O RXGLHDWAZQECBI-SRVKXCTJSA-N 0.000 description 3
- UHNQRAFSEBGZFZ-YESZJQIVSA-N Leu-Phe-Pro Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N2CCC[C@@H]2C(=O)O)N UHNQRAFSEBGZFZ-YESZJQIVSA-N 0.000 description 3
- 101100519207 Mus musculus Pdcd1 gene Proteins 0.000 description 3
- 206010037660 Pyrexia Diseases 0.000 description 3
- 241000220010 Rhode Species 0.000 description 3
- 108091008874 T cell receptors Proteins 0.000 description 3
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 description 3
- 208000001871 Tachycardia Diseases 0.000 description 3
- 108700019146 Transgenes Proteins 0.000 description 3
- YQYFYUSYEDNLSD-YEPSODPASA-N Val-Thr-Gly Chemical compound CC(C)[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(O)=O YQYFYUSYEDNLSD-YEPSODPASA-N 0.000 description 3
- 230000002159 abnormal effect Effects 0.000 description 3
- 238000007792 addition Methods 0.000 description 3
- 208000009956 adenocarcinoma Diseases 0.000 description 3
- 230000000259 anti-tumor effect Effects 0.000 description 3
- 239000002246 antineoplastic agent Substances 0.000 description 3
- 108010068380 arginylarginine Proteins 0.000 description 3
- 230000036770 blood supply Effects 0.000 description 3
- 239000000872 buffer Substances 0.000 description 3
- 230000030833 cell death Effects 0.000 description 3
- 230000008859 change Effects 0.000 description 3
- 150000001875 compounds Chemical class 0.000 description 3
- 238000002591 computed tomography Methods 0.000 description 3
- 229940127089 cytotoxic agent Drugs 0.000 description 3
- 238000002784 cytotoxicity assay Methods 0.000 description 3
- 231100000263 cytotoxicity test Toxicity 0.000 description 3
- 230000006378 damage Effects 0.000 description 3
- 230000010102 embolization Effects 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 238000011156 evaluation Methods 0.000 description 3
- 108010050848 glycylleucine Proteins 0.000 description 3
- 108010015792 glycyllysine Proteins 0.000 description 3
- 230000001900 immune effect Effects 0.000 description 3
- 230000028993 immune response Effects 0.000 description 3
- 238000000338 in vitro Methods 0.000 description 3
- 238000001727 in vivo Methods 0.000 description 3
- 108010057821 leucylproline Proteins 0.000 description 3
- 208000032839 leukemia Diseases 0.000 description 3
- 238000004519 manufacturing process Methods 0.000 description 3
- 238000005259 measurement Methods 0.000 description 3
- 230000001404 mediated effect Effects 0.000 description 3
- 239000002609 medium Substances 0.000 description 3
- 238000004806 packaging method and process Methods 0.000 description 3
- 230000002093 peripheral effect Effects 0.000 description 3
- 239000000546 pharmaceutical excipient Substances 0.000 description 3
- 108010051242 phenylalanylserine Proteins 0.000 description 3
- 108090000765 processed proteins & peptides Proteins 0.000 description 3
- 108010014614 prolyl-glycyl-proline Proteins 0.000 description 3
- 108010026333 seryl-proline Proteins 0.000 description 3
- 238000010561 standard procedure Methods 0.000 description 3
- 210000002784 stomach Anatomy 0.000 description 3
- 230000006794 tachycardia Effects 0.000 description 3
- 238000001890 transfection Methods 0.000 description 3
- 210000003171 tumor-infiltrating lymphocyte Anatomy 0.000 description 3
- 238000002604 ultrasonography Methods 0.000 description 3
- YEELWQSXYBJVSV-UWJYBYFXSA-N Ala-Cys-Tyr Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CS)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O YEELWQSXYBJVSV-UWJYBYFXSA-N 0.000 description 2
- RUXQNKVQSKOOBS-JURCDPSOSA-N Ala-Phe-Ile Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O RUXQNKVQSKOOBS-JURCDPSOSA-N 0.000 description 2
- 108010088751 Albumins Proteins 0.000 description 2
- 102000009027 Albumins Human genes 0.000 description 2
- 108010051330 Arg-Pro-Gly-Pro Proteins 0.000 description 2
- XYOVHPDDWCEUDY-CIUDSAMLSA-N Asn-Ala-Leu Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(O)=O XYOVHPDDWCEUDY-CIUDSAMLSA-N 0.000 description 2
- OLGCWMNDJTWQAG-GUBZILKMSA-N Asn-Glu-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](N)CC(N)=O OLGCWMNDJTWQAG-GUBZILKMSA-N 0.000 description 2
- JEEFEQCRXKPQHC-KKUMJFAQSA-N Asn-Leu-Phe Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O JEEFEQCRXKPQHC-KKUMJFAQSA-N 0.000 description 2
- DPWDPEVGACCWTC-SRVKXCTJSA-N Asn-Tyr-Ser Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CO)C(O)=O DPWDPEVGACCWTC-SRVKXCTJSA-N 0.000 description 2
- YNQIDCRRTWGHJD-ZLUOBGJFSA-N Asp-Asn-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@H](CC(N)=O)NC(=O)[C@@H](N)CC(O)=O YNQIDCRRTWGHJD-ZLUOBGJFSA-N 0.000 description 2
- JJQGZGOEDSSHTE-FOHZUACHSA-N Asp-Thr-Gly Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(O)=O JJQGZGOEDSSHTE-FOHZUACHSA-N 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- BPYKTIZUTYGOLE-IFADSCNNSA-N Bilirubin Chemical compound N1C(=O)C(C)=C(C=C)\C1=C\C1=C(C)C(CCC(O)=O)=C(CC2=C(C(C)=C(\C=C/3C(=C(C=C)C(=O)N\3)C)N2)CCC(O)=O)N1 BPYKTIZUTYGOLE-IFADSCNNSA-N 0.000 description 2
- SWJYSDXMTPMBHO-FXQIFTODSA-N Cys-Pro-Ser Chemical compound [H]N[C@@H](CS)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CO)C(O)=O SWJYSDXMTPMBHO-FXQIFTODSA-N 0.000 description 2
- 102100039498 Cytotoxic T-lymphocyte protein 4 Human genes 0.000 description 2
- 229920001917 Ficoll Polymers 0.000 description 2
- 241000713813 Gibbon ape leukemia virus Species 0.000 description 2
- CSMHMEATMDCQNY-DZKIICNBSA-N Gln-Val-Tyr Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O CSMHMEATMDCQNY-DZKIICNBSA-N 0.000 description 2
- DMYACXMQUABZIQ-NRPADANISA-N Glu-Ser-Val Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(O)=O DMYACXMQUABZIQ-NRPADANISA-N 0.000 description 2
- 102000050627 Glucocorticoid-Induced TNFR-Related Human genes 0.000 description 2
- BAYQNCWLXIDLHX-ONGXEEELSA-N Gly-Val-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](C(C)C)NC(=O)CN BAYQNCWLXIDLHX-ONGXEEELSA-N 0.000 description 2
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 2
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 2
- JBCLFWXMTIKCCB-UHFFFAOYSA-N H-Gly-Phe-OH Natural products NCC(=O)NC(C(O)=O)CC1=CC=CC=C1 JBCLFWXMTIKCCB-UHFFFAOYSA-N 0.000 description 2
- WZUVPPKBWHMQCE-UHFFFAOYSA-N Haematoxylin Chemical compound C12=CC(O)=C(O)C=C2CC2(O)C1C1=CC=C(O)C(O)=C1OC2 WZUVPPKBWHMQCE-UHFFFAOYSA-N 0.000 description 2
- 101000889276 Homo sapiens Cytotoxic T-lymphocyte protein 4 Proteins 0.000 description 2
- 241000282620 Hylobates sp. Species 0.000 description 2
- DZMWFIRHFFVBHS-ZEWNOJEFSA-N Ile-Tyr-Phe Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)N[C@@H](CC2=CC=CC=C2)C(=O)O)N DZMWFIRHFFVBHS-ZEWNOJEFSA-N 0.000 description 2
- 206010062016 Immunosuppression Diseases 0.000 description 2
- 206010061218 Inflammation Diseases 0.000 description 2
- 108010065920 Insulin Lispro Proteins 0.000 description 2
- 108090001005 Interleukin-6 Proteins 0.000 description 2
- 102000004889 Interleukin-6 Human genes 0.000 description 2
- SBANPBVRHYIMRR-UHFFFAOYSA-N Leu-Ser-Pro Natural products CC(C)CC(N)C(=O)NC(CO)C(=O)N1CCCC1C(O)=O SBANPBVRHYIMRR-UHFFFAOYSA-N 0.000 description 2
- ZJZNLRVCZWUONM-JXUBOQSCSA-N Leu-Thr-Ala Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C)C(O)=O ZJZNLRVCZWUONM-JXUBOQSCSA-N 0.000 description 2
- YKIRNDPUWONXQN-GUBZILKMSA-N Lys-Asn-Gln Chemical compound C(CCN)C[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)N[C@@H](CCC(=O)N)C(=O)O)N YKIRNDPUWONXQN-GUBZILKMSA-N 0.000 description 2
- XMBSYZWANAQXEV-UHFFFAOYSA-N N-alpha-L-glutamyl-L-phenylalanine Natural products OC(=O)CCC(N)C(=O)NC(C(O)=O)CC1=CC=CC=C1 XMBSYZWANAQXEV-UHFFFAOYSA-N 0.000 description 2
- KZNQNBZMBZJQJO-UHFFFAOYSA-N N-glycyl-L-proline Natural products NCC(=O)N1CCCC1C(O)=O KZNQNBZMBZJQJO-UHFFFAOYSA-N 0.000 description 2
- 101100342977 Neurospora crassa (strain ATCC 24698 / 74-OR23-1A / CBS 708.71 / DSM 1257 / FGSC 987) leu-1 gene Proteins 0.000 description 2
- BTAIJUBAGLVFKQ-BVSLBCMMSA-N Phe-Trp-Val Chemical compound C([C@H](N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](C(C)C)C(O)=O)C1=CC=CC=C1 BTAIJUBAGLVFKQ-BVSLBCMMSA-N 0.000 description 2
- UPJGUQPLYWTISV-GUBZILKMSA-N Pro-Gln-Glu Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(O)=O UPJGUQPLYWTISV-GUBZILKMSA-N 0.000 description 2
- YDTUEBLEAVANFH-RCWTZXSCSA-N Pro-Val-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@@H]1CCCN1 YDTUEBLEAVANFH-RCWTZXSCSA-N 0.000 description 2
- 102000007327 Protamines Human genes 0.000 description 2
- 108010007568 Protamines Proteins 0.000 description 2
- HBZBPFLJNDXRAY-FXQIFTODSA-N Ser-Ala-Val Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C)C(=O)N[C@@H](C(C)C)C(O)=O HBZBPFLJNDXRAY-FXQIFTODSA-N 0.000 description 2
- KMWFXJCGRXBQAC-CIUDSAMLSA-N Ser-Cys-Lys Chemical compound C(CCN)C[C@@H](C(=O)O)NC(=O)[C@H](CS)NC(=O)[C@H](CO)N KMWFXJCGRXBQAC-CIUDSAMLSA-N 0.000 description 2
- CJINPXGSKSZQNE-KBIXCLLPSA-N Ser-Ile-Gln Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCC(N)=O)C(O)=O CJINPXGSKSZQNE-KBIXCLLPSA-N 0.000 description 2
- FVFUOQIYDPAIJR-XIRDDKMYSA-N Ser-Trp-Leu Chemical compound CC(C)C[C@@H](C(=O)O)NC(=O)[C@H](CC1=CNC2=CC=CC=C21)NC(=O)[C@H](CO)N FVFUOQIYDPAIJR-XIRDDKMYSA-N 0.000 description 2
- 241000700584 Simplexvirus Species 0.000 description 2
- 108091081024 Start codon Proteins 0.000 description 2
- 230000006044 T cell activation Effects 0.000 description 2
- 230000005867 T cell response Effects 0.000 description 2
- 108010092262 T-Cell Antigen Receptors Proteins 0.000 description 2
- FQPDRTDDEZXCEC-SVSWQMSJSA-N Thr-Ile-Ser Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(O)=O FQPDRTDDEZXCEC-SVSWQMSJSA-N 0.000 description 2
- VRUFCJZQDACGLH-UVOCVTCTSA-N Thr-Leu-Thr Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O VRUFCJZQDACGLH-UVOCVTCTSA-N 0.000 description 2
- 238000008050 Total Bilirubin Reagent Methods 0.000 description 2
- 101710187882 Tumor necrosis factor receptor superfamily member 18 Proteins 0.000 description 2
- 206010054094 Tumour necrosis Diseases 0.000 description 2
- BSCBBPKDVOZICB-KKUMJFAQSA-N Tyr-Leu-Asp Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(O)=O)C(O)=O BSCBBPKDVOZICB-KKUMJFAQSA-N 0.000 description 2
- MDXLPNRXCFOBTL-BZSNNMDCSA-N Tyr-Ser-Tyr Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O MDXLPNRXCFOBTL-BZSNNMDCSA-N 0.000 description 2
- LNYOXPDEIZJDEI-NHCYSSNCSA-N Val-Asn-Leu Chemical compound CC(C)C[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)N)NC(=O)[C@H](C(C)C)N LNYOXPDEIZJDEI-NHCYSSNCSA-N 0.000 description 2
- GBIUHAYJGWVNLN-UHFFFAOYSA-N Val-Ser-Pro Natural products CC(C)C(N)C(=O)NC(CO)C(=O)N1CCCC1C(O)=O GBIUHAYJGWVNLN-UHFFFAOYSA-N 0.000 description 2
- HTONZBWRYUKUKC-RCWTZXSCSA-N Val-Thr-Val Chemical compound CC(C)[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(O)=O HTONZBWRYUKUKC-RCWTZXSCSA-N 0.000 description 2
- GUIYPEKUEMQBIK-JSGCOSHPSA-N Val-Tyr-Gly Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](Cc1ccc(O)cc1)C(=O)NCC(O)=O GUIYPEKUEMQBIK-JSGCOSHPSA-N 0.000 description 2
- AEFJNECXZCODJM-UWVGGRQHSA-N Val-Val-Gly Chemical compound CC(C)[C@H]([NH3+])C(=O)N[C@@H](C(C)C)C(=O)NCC([O-])=O AEFJNECXZCODJM-UWVGGRQHSA-N 0.000 description 2
- 241000700605 Viruses Species 0.000 description 2
- 238000002679 ablation Methods 0.000 description 2
- 230000004913 activation Effects 0.000 description 2
- 230000002411 adverse Effects 0.000 description 2
- 108010087924 alanylproline Proteins 0.000 description 2
- 108010069205 aspartyl-phenylalanine Proteins 0.000 description 2
- 108010093581 aspartyl-proline Proteins 0.000 description 2
- 238000003556 assay Methods 0.000 description 2
- 210000003719 b-lymphocyte Anatomy 0.000 description 2
- 230000029918 bioluminescence Effects 0.000 description 2
- 238000005415 bioluminescence Methods 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 210000001772 blood platelet Anatomy 0.000 description 2
- 210000000481 breast Anatomy 0.000 description 2
- 150000001720 carbohydrates Chemical class 0.000 description 2
- 238000002659 cell therapy Methods 0.000 description 2
- 230000003833 cell viability Effects 0.000 description 2
- 206010009887 colitis Diseases 0.000 description 2
- 230000002596 correlated effect Effects 0.000 description 2
- 238000005138 cryopreservation Methods 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 230000018109 developmental process Effects 0.000 description 2
- 230000029087 digestion Effects 0.000 description 2
- 208000035475 disorder Diseases 0.000 description 2
- 239000002158 endotoxin Substances 0.000 description 2
- 210000003979 eosinophil Anatomy 0.000 description 2
- 239000012467 final product Substances 0.000 description 2
- 230000004927 fusion Effects 0.000 description 2
- 230000002496 gastric effect Effects 0.000 description 2
- 239000011521 glass Substances 0.000 description 2
- 108010089804 glycyl-threonine Proteins 0.000 description 2
- 238000011194 good manufacturing practice Methods 0.000 description 2
- 230000012010 growth Effects 0.000 description 2
- 239000001963 growth medium Substances 0.000 description 2
- 108010025306 histidylleucine Proteins 0.000 description 2
- 210000002865 immune cell Anatomy 0.000 description 2
- 208000015181 infectious disease Diseases 0.000 description 2
- 230000004054 inflammatory process Effects 0.000 description 2
- 230000005865 ionizing radiation Effects 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 238000012317 liver biopsy Methods 0.000 description 2
- 201000007270 liver cancer Diseases 0.000 description 2
- 239000003550 marker Substances 0.000 description 2
- 239000011159 matrix material Substances 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 210000000822 natural killer cell Anatomy 0.000 description 2
- 239000002245 particle Substances 0.000 description 2
- 229920000642 polymer Polymers 0.000 description 2
- 229920001184 polypeptide Polymers 0.000 description 2
- 102000004196 processed proteins & peptides Human genes 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 206010038038 rectal cancer Diseases 0.000 description 2
- 208000020615 rectal carcinoma Diseases 0.000 description 2
- 210000003289 regulatory T cell Anatomy 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 231100000279 safety data Toxicity 0.000 description 2
- 238000012163 sequencing technique Methods 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 238000009121 systemic therapy Methods 0.000 description 2
- 108010061238 threonyl-glycine Proteins 0.000 description 2
- 231100000419 toxicity Toxicity 0.000 description 2
- 230000001988 toxicity Effects 0.000 description 2
- 230000001052 transient effect Effects 0.000 description 2
- 108010044292 tryptophyltyrosine Proteins 0.000 description 2
- 230000035899 viability Effects 0.000 description 2
- 210000002845 virion Anatomy 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- CEHZCZCQHUNAJF-AVGNSLFASA-N (2s)-1-[2-[[(2s)-1-[(2s)-2-amino-5-(diaminomethylideneamino)pentanoyl]pyrrolidine-2-carbonyl]amino]acetyl]pyrrolidine-2-carboxylic acid Chemical compound NC(N)=NCCC[C@H](N)C(=O)N1CCC[C@H]1C(=O)NCC(=O)N1[C@H](C(O)=O)CCC1 CEHZCZCQHUNAJF-AVGNSLFASA-N 0.000 description 1
- BRPMXFSTKXXNHF-IUCAKERBSA-N (2s)-1-[2-[[(2s)-pyrrolidine-2-carbonyl]amino]acetyl]pyrrolidine-2-carboxylic acid Chemical compound OC(=O)[C@@H]1CCCN1C(=O)CNC(=O)[C@H]1NCCC1 BRPMXFSTKXXNHF-IUCAKERBSA-N 0.000 description 1
- PCDUALPXEOKZPE-DXCABUDRSA-N (2s)-2-[[(2s)-2-[[(2s)-2-[[(2s)-2-[[(2s)-2-[[(2s)-2-[[(2s)-2-amino-3-hydroxypropanoyl]amino]-3-hydroxypropanoyl]amino]-3-hydroxypropanoyl]amino]-3-hydroxypropanoyl]amino]-3-hydroxypropanoyl]amino]-3-hydroxypropanoyl]amino]-3-hydroxypropanoic acid Chemical compound OC[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(O)=O PCDUALPXEOKZPE-DXCABUDRSA-N 0.000 description 1
- PIDRBUDUWHBYSR-UHFFFAOYSA-N 1-[2-[[2-[(2-amino-4-methylpentanoyl)amino]-4-methylpentanoyl]amino]-4-methylpentanoyl]pyrrolidine-2-carboxylic acid Chemical compound CC(C)CC(N)C(=O)NC(CC(C)C)C(=O)NC(CC(C)C)C(=O)N1CCCC1C(O)=O PIDRBUDUWHBYSR-UHFFFAOYSA-N 0.000 description 1
- RLMISHABBKUNFO-WHFBIAKZSA-N Ala-Ala-Gly Chemical compound C[C@H](N)C(=O)N[C@@H](C)C(=O)NCC(O)=O RLMISHABBKUNFO-WHFBIAKZSA-N 0.000 description 1
- CXRCVCURMBFFOL-FXQIFTODSA-N Ala-Ala-Pro Chemical compound C[C@H](N)C(=O)N[C@@H](C)C(=O)N1CCC[C@H]1C(O)=O CXRCVCURMBFFOL-FXQIFTODSA-N 0.000 description 1
- LBJYAILUMSUTAM-ZLUOBGJFSA-N Ala-Asn-Asn Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O LBJYAILUMSUTAM-ZLUOBGJFSA-N 0.000 description 1
- NXSFUECZFORGOG-CIUDSAMLSA-N Ala-Asn-Leu Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(O)=O NXSFUECZFORGOG-CIUDSAMLSA-N 0.000 description 1
- KUDREHRZRIVKHS-UWJYBYFXSA-N Ala-Asp-Tyr Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O KUDREHRZRIVKHS-UWJYBYFXSA-N 0.000 description 1
- DAEFQZCYZKRTLR-ZLUOBGJFSA-N Ala-Cys-Asp Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(O)=O)C(O)=O DAEFQZCYZKRTLR-ZLUOBGJFSA-N 0.000 description 1
- IYCZBJXFSZSHPN-DLOVCJGASA-N Ala-Cys-Phe Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CS)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O IYCZBJXFSZSHPN-DLOVCJGASA-N 0.000 description 1
- RXTBLQVXNIECFP-FXQIFTODSA-N Ala-Gln-Gln Chemical compound C[C@H](N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(O)=O RXTBLQVXNIECFP-FXQIFTODSA-N 0.000 description 1
- ZDYNWWQXFRUOEO-XDTLVQLUSA-N Ala-Gln-Tyr Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O ZDYNWWQXFRUOEO-XDTLVQLUSA-N 0.000 description 1
- PAIHPOGPJVUFJY-WDSKDSINSA-N Ala-Glu-Gly Chemical compound C[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)NCC(O)=O PAIHPOGPJVUFJY-WDSKDSINSA-N 0.000 description 1
- OBVSBEYOMDWLRJ-BFHQHQDPSA-N Ala-Gly-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)CNC(=O)[C@H](C)N OBVSBEYOMDWLRJ-BFHQHQDPSA-N 0.000 description 1
- PNALXAODQKTNLV-JBDRJPRFSA-N Ala-Ile-Ala Chemical compound C[C@H](N)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C)C(O)=O PNALXAODQKTNLV-JBDRJPRFSA-N 0.000 description 1
- TZDNWXDLYFIFPT-BJDJZHNGSA-N Ala-Ile-Leu Chemical compound [H]N[C@@H](C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(C)C)C(O)=O TZDNWXDLYFIFPT-BJDJZHNGSA-N 0.000 description 1
- HHRAXZAYZFFRAM-CIUDSAMLSA-N Ala-Leu-Asn Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(O)=O HHRAXZAYZFFRAM-CIUDSAMLSA-N 0.000 description 1
- DPNZTBKGAUAZQU-DLOVCJGASA-N Ala-Leu-His Chemical compound C[C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)N DPNZTBKGAUAZQU-DLOVCJGASA-N 0.000 description 1
- CHFFHQUVXHEGBY-GARJFASQSA-N Ala-Lys-Pro Chemical compound C[C@@H](C(=O)N[C@@H](CCCCN)C(=O)N1CCC[C@@H]1C(=O)O)N CHFFHQUVXHEGBY-GARJFASQSA-N 0.000 description 1
- CYBJZLQSUJEMAS-LFSVMHDDSA-N Ala-Phe-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CC1=CC=CC=C1)NC(=O)[C@H](C)N)O CYBJZLQSUJEMAS-LFSVMHDDSA-N 0.000 description 1
- IPZQNYYAYVRKKK-FXQIFTODSA-N Ala-Pro-Ala Chemical compound C[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](C)C(O)=O IPZQNYYAYVRKKK-FXQIFTODSA-N 0.000 description 1
- MAZZQZWCCYJQGZ-GUBZILKMSA-N Ala-Pro-Arg Chemical compound [H]N[C@@H](C)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCCNC(N)=N)C(O)=O MAZZQZWCCYJQGZ-GUBZILKMSA-N 0.000 description 1
- FFZJHQODAYHGPO-KZVJFYERSA-N Ala-Pro-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)[C@@H]1CCCN1C(=O)[C@H](C)N FFZJHQODAYHGPO-KZVJFYERSA-N 0.000 description 1
- NZGRHTKZFSVPAN-BIIVOSGPSA-N Ala-Ser-Pro Chemical compound C[C@@H](C(=O)N[C@@H](CO)C(=O)N1CCC[C@@H]1C(=O)O)N NZGRHTKZFSVPAN-BIIVOSGPSA-N 0.000 description 1
- NCQMBSJGJMYKCK-ZLUOBGJFSA-N Ala-Ser-Ser Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(O)=O NCQMBSJGJMYKCK-ZLUOBGJFSA-N 0.000 description 1
- ARHJJAAWNWOACN-FXQIFTODSA-N Ala-Ser-Val Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(O)=O ARHJJAAWNWOACN-FXQIFTODSA-N 0.000 description 1
- WNHNMKOFKCHKKD-BFHQHQDPSA-N Ala-Thr-Gly Chemical compound [H]N[C@@H](C)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(O)=O WNHNMKOFKCHKKD-BFHQHQDPSA-N 0.000 description 1
- SAHQGRZIQVEJPF-JXUBOQSCSA-N Ala-Thr-Lys Chemical compound C[C@H](N)C(=O)N[C@@H]([C@H](O)C)C(=O)N[C@H](C(O)=O)CCCCN SAHQGRZIQVEJPF-JXUBOQSCSA-N 0.000 description 1
- CREYEAPXISDKSB-FQPOAREZSA-N Ala-Thr-Tyr Chemical compound [H]N[C@@H](C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O CREYEAPXISDKSB-FQPOAREZSA-N 0.000 description 1
- MTDDMSUUXNQMKK-BPNCWPANSA-N Ala-Tyr-Arg Chemical compound C[C@@H](C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)N[C@@H](CCCN=C(N)N)C(=O)O)N MTDDMSUUXNQMKK-BPNCWPANSA-N 0.000 description 1
- QRIYOHQJRDHFKF-UWJYBYFXSA-N Ala-Tyr-Ser Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)[C@@H](N)C)CC1=CC=C(O)C=C1 QRIYOHQJRDHFKF-UWJYBYFXSA-N 0.000 description 1
- 102000006306 Antigen Receptors Human genes 0.000 description 1
- 108010083359 Antigen Receptors Proteins 0.000 description 1
- GIVATXIGCXFQQA-FXQIFTODSA-N Arg-Ala-Ser Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CCCN=C(N)N GIVATXIGCXFQQA-FXQIFTODSA-N 0.000 description 1
- UXJCMQFPDWCHKX-DCAQKATOSA-N Arg-Arg-Glu Chemical compound NC(N)=NCCC[C@H](N)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CCC(O)=O)C(O)=O UXJCMQFPDWCHKX-DCAQKATOSA-N 0.000 description 1
- IASNWHAGGYTEKX-IUCAKERBSA-N Arg-Arg-Gly Chemical compound NC(N)=NCCC[C@H](N)C(=O)N[C@@H](CCCN=C(N)N)C(=O)NCC(O)=O IASNWHAGGYTEKX-IUCAKERBSA-N 0.000 description 1
- DPXDVGDLWJYZBH-GUBZILKMSA-N Arg-Asn-Arg Chemical compound NC(N)=NCCC[C@H](N)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCN=C(N)N)C(O)=O DPXDVGDLWJYZBH-GUBZILKMSA-N 0.000 description 1
- JCAISGGAOQXEHJ-ZPFDUUQYSA-N Arg-Gln-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)N)NC(=O)[C@H](CCCN=C(N)N)N JCAISGGAOQXEHJ-ZPFDUUQYSA-N 0.000 description 1
- HPKSHFSEXICTLI-CIUDSAMLSA-N Arg-Glu-Ala Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(O)=O HPKSHFSEXICTLI-CIUDSAMLSA-N 0.000 description 1
- XLWSGICNBZGYTA-CIUDSAMLSA-N Arg-Glu-Asp Chemical compound NC(N)=NCCC[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(O)=O XLWSGICNBZGYTA-CIUDSAMLSA-N 0.000 description 1
- SKTGPBFTMNLIHQ-KKUMJFAQSA-N Arg-Glu-Phe Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O SKTGPBFTMNLIHQ-KKUMJFAQSA-N 0.000 description 1
- AQPVUEJJARLJHB-BQBZGAKWSA-N Arg-Gly-Ala Chemical compound OC(=O)[C@H](C)NC(=O)CNC(=O)[C@@H](N)CCCN=C(N)N AQPVUEJJARLJHB-BQBZGAKWSA-N 0.000 description 1
- HQIZDMIGUJOSNI-IUCAKERBSA-N Arg-Gly-Arg Chemical compound N[C@@H](CCCNC(N)=N)C(=O)NCC(=O)N[C@@H](CCCNC(N)=N)C(O)=O HQIZDMIGUJOSNI-IUCAKERBSA-N 0.000 description 1
- YBZMTKUDWXZLIX-UWVGGRQHSA-N Arg-Leu-Gly Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)NCC(O)=O YBZMTKUDWXZLIX-UWVGGRQHSA-N 0.000 description 1
- SSZGOKWBHLOCHK-DCAQKATOSA-N Arg-Lys-Asn Chemical compound NC(=O)C[C@@H](C(O)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](N)CCCN=C(N)N SSZGOKWBHLOCHK-DCAQKATOSA-N 0.000 description 1
- DIIGDGJKTMLQQW-IHRRRGAJSA-N Arg-Lys-His Chemical compound C1=C(NC=N1)C[C@@H](C(=O)O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CCCN=C(N)N)N DIIGDGJKTMLQQW-IHRRRGAJSA-N 0.000 description 1
- OISWSORSLQOGFV-AVGNSLFASA-N Arg-Met-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](CCSC)NC(=O)[C@@H](N)CCCN=C(N)N OISWSORSLQOGFV-AVGNSLFASA-N 0.000 description 1
- AOHKLEBWKMKITA-IHRRRGAJSA-N Arg-Phe-Ser Chemical compound C1=CC=C(C=C1)C[C@@H](C(=O)N[C@@H](CO)C(=O)O)NC(=O)[C@H](CCCN=C(N)N)N AOHKLEBWKMKITA-IHRRRGAJSA-N 0.000 description 1
- HGKHPCFTRQDHCU-IUCAKERBSA-N Arg-Pro-Gly Chemical compound NC(N)=NCCC[C@H](N)C(=O)N1CCC[C@H]1C(=O)NCC(O)=O HGKHPCFTRQDHCU-IUCAKERBSA-N 0.000 description 1
- ATABBWFGOHKROJ-GUBZILKMSA-N Arg-Pro-Ser Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CO)C(O)=O ATABBWFGOHKROJ-GUBZILKMSA-N 0.000 description 1
- VUGWHBXPMAHEGZ-SRVKXCTJSA-N Arg-Pro-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)[C@@H]1CCCN1C(=O)[C@@H](N)CCCN=C(N)N VUGWHBXPMAHEGZ-SRVKXCTJSA-N 0.000 description 1
- ADPACBMPYWJJCE-FXQIFTODSA-N Arg-Ser-Asp Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(O)=O)C(O)=O ADPACBMPYWJJCE-FXQIFTODSA-N 0.000 description 1
- FRBAHXABMQXSJQ-FXQIFTODSA-N Arg-Ser-Ser Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(O)=O FRBAHXABMQXSJQ-FXQIFTODSA-N 0.000 description 1
- UVTGNSWSRSCPLP-UHFFFAOYSA-N Arg-Tyr Natural products NC(CCNC(=N)N)C(=O)NC(Cc1ccc(O)cc1)C(=O)O UVTGNSWSRSCPLP-UHFFFAOYSA-N 0.000 description 1
- FTMRPIVPSDVGCC-GUBZILKMSA-N Arg-Val-Cys Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CS)C(=O)O)NC(=O)[C@H](CCCN=C(N)N)N FTMRPIVPSDVGCC-GUBZILKMSA-N 0.000 description 1
- WOZDCBHUGJVJPL-AVGNSLFASA-N Arg-Val-Lys Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCCCN)C(=O)O)NC(=O)[C@H](CCCN=C(N)N)N WOZDCBHUGJVJPL-AVGNSLFASA-N 0.000 description 1
- GXMSVVBIAMWMKO-BQBZGAKWSA-N Asn-Arg-Gly Chemical compound NC(=O)C[C@H](N)C(=O)N[C@H](C(=O)NCC(O)=O)CCCN=C(N)N GXMSVVBIAMWMKO-BQBZGAKWSA-N 0.000 description 1
- KXFCBAHYSLJCCY-ZLUOBGJFSA-N Asn-Asn-Ser Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CO)C(O)=O KXFCBAHYSLJCCY-ZLUOBGJFSA-N 0.000 description 1
- OKZOABJQOMAYEC-NUMRIWBASA-N Asn-Gln-Thr Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O OKZOABJQOMAYEC-NUMRIWBASA-N 0.000 description 1
- GNKVBRYFXYWXAB-WDSKDSINSA-N Asn-Glu-Gly Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)NCC(O)=O GNKVBRYFXYWXAB-WDSKDSINSA-N 0.000 description 1
- HYQYLOSCICEYTR-YUMQZZPRSA-N Asn-Gly-Leu Chemical compound [H]N[C@@H](CC(N)=O)C(=O)NCC(=O)N[C@@H](CC(C)C)C(O)=O HYQYLOSCICEYTR-YUMQZZPRSA-N 0.000 description 1
- RAQMSGVCGSJKCL-FOHZUACHSA-N Asn-Gly-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H](N)CC(N)=O RAQMSGVCGSJKCL-FOHZUACHSA-N 0.000 description 1
- JLNFZLNDHONLND-GARJFASQSA-N Asn-Leu-Pro Chemical compound CC(C)C[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CC(=O)N)N JLNFZLNDHONLND-GARJFASQSA-N 0.000 description 1
- JWKDQOORUCYUIW-ZPFDUUQYSA-N Asn-Lys-Ile Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O JWKDQOORUCYUIW-ZPFDUUQYSA-N 0.000 description 1
- VITDJIPIJZAVGC-VEVYYDQMSA-N Asn-Met-Thr Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CCSC)C(=O)N[C@@H]([C@@H](C)O)C(O)=O VITDJIPIJZAVGC-VEVYYDQMSA-N 0.000 description 1
- RAUPFUCUDBQYHE-AVGNSLFASA-N Asn-Phe-Glu Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CCC(O)=O)C(O)=O RAUPFUCUDBQYHE-AVGNSLFASA-N 0.000 description 1
- VCJCPARXDBEGNE-GUBZILKMSA-N Asn-Pro-Pro Chemical compound NC(=O)C[C@H](N)C(=O)N1CCC[C@H]1C(=O)N1[C@H](C(O)=O)CCC1 VCJCPARXDBEGNE-GUBZILKMSA-N 0.000 description 1
- IDUUACUJKUXKKD-VEVYYDQMSA-N Asn-Pro-Thr Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N1CCC[C@H]1C(=O)N[C@@H]([C@@H](C)O)C(O)=O IDUUACUJKUXKKD-VEVYYDQMSA-N 0.000 description 1
- VHQSGALUSWIYOD-QXEWZRGKSA-N Asn-Pro-Val Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N1CCC[C@H]1C(=O)N[C@@H](C(C)C)C(O)=O VHQSGALUSWIYOD-QXEWZRGKSA-N 0.000 description 1
- JWQWPRCDYWNVNM-ACZMJKKPSA-N Asn-Ser-Gln Chemical compound C(CC(=O)N)[C@@H](C(=O)O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(=O)N)N JWQWPRCDYWNVNM-ACZMJKKPSA-N 0.000 description 1
- SNYCNNPOFYBCEK-ZLUOBGJFSA-N Asn-Ser-Ser Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(O)=O SNYCNNPOFYBCEK-ZLUOBGJFSA-N 0.000 description 1
- UXHYOWXTJLBEPG-GSSVUCPTSA-N Asn-Thr-Thr Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O UXHYOWXTJLBEPG-GSSVUCPTSA-N 0.000 description 1
- MJIJBEYEHBKTIM-BYULHYEWSA-N Asn-Val-Asn Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)O)NC(=O)[C@H](CC(=O)N)N MJIJBEYEHBKTIM-BYULHYEWSA-N 0.000 description 1
- RGKKALNPOYURGE-ZKWXMUAHSA-N Asp-Ala-Val Chemical compound N[C@@H](CC(=O)O)C(=O)N[C@@H](C)C(=O)N[C@@H](C(C)C)C(=O)O RGKKALNPOYURGE-ZKWXMUAHSA-N 0.000 description 1
- XYBJLTKSGFBLCS-QXEWZRGKSA-N Asp-Arg-Val Chemical compound NC(N)=NCCC[C@@H](C(=O)N[C@@H](C(C)C)C(O)=O)NC(=O)[C@@H](N)CC(O)=O XYBJLTKSGFBLCS-QXEWZRGKSA-N 0.000 description 1
- JUWZKMBALYLZCK-WHFBIAKZSA-N Asp-Gly-Asn Chemical compound OC(=O)C[C@H](N)C(=O)NCC(=O)N[C@@H](CC(N)=O)C(O)=O JUWZKMBALYLZCK-WHFBIAKZSA-N 0.000 description 1
- PSLSTUMPZILTAH-BYULHYEWSA-N Asp-Gly-Ile Chemical compound CC[C@H](C)[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H](N)CC(O)=O PSLSTUMPZILTAH-BYULHYEWSA-N 0.000 description 1
- QCVXMEHGFUMKCO-YUMQZZPRSA-N Asp-Gly-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H](N)CC(O)=O QCVXMEHGFUMKCO-YUMQZZPRSA-N 0.000 description 1
- PZXPWHFYZXTFBI-YUMQZZPRSA-N Asp-Gly-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H](N)CC(O)=O PZXPWHFYZXTFBI-YUMQZZPRSA-N 0.000 description 1
- QNFRBNZGVVKBNJ-PEFMBERDSA-N Asp-Ile-Gln Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)O)NC(=O)[C@H](CC(=O)O)N QNFRBNZGVVKBNJ-PEFMBERDSA-N 0.000 description 1
- ORRJQLIATJDMQM-HJGDQZAQSA-N Asp-Leu-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CC(O)=O ORRJQLIATJDMQM-HJGDQZAQSA-N 0.000 description 1
- UZFHNLYQWMGUHU-DCAQKATOSA-N Asp-Lys-Arg Chemical compound OC(=O)C[C@H](N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O UZFHNLYQWMGUHU-DCAQKATOSA-N 0.000 description 1
- CTWCFPWFIGRAEP-CIUDSAMLSA-N Asp-Lys-Asp Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(O)=O)C(O)=O CTWCFPWFIGRAEP-CIUDSAMLSA-N 0.000 description 1
- GYWQGGUCMDCUJE-DLOVCJGASA-N Asp-Phe-Ala Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](C)C(O)=O GYWQGGUCMDCUJE-DLOVCJGASA-N 0.000 description 1
- AHWRSSLYSGLBGD-CIUDSAMLSA-N Asp-Pro-Glu Chemical compound OC(=O)C[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCC(O)=O)C(O)=O AHWRSSLYSGLBGD-CIUDSAMLSA-N 0.000 description 1
- IWLZBRTUIVXZJD-OLHMAJIHSA-N Asp-Thr-Asp Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(O)=O)C(O)=O IWLZBRTUIVXZJD-OLHMAJIHSA-N 0.000 description 1
- RSMZEHCMIOKNMW-GSSVUCPTSA-N Asp-Thr-Thr Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O RSMZEHCMIOKNMW-GSSVUCPTSA-N 0.000 description 1
- GIKOVDMXBAFXDF-NHCYSSNCSA-N Asp-Val-Leu Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O GIKOVDMXBAFXDF-NHCYSSNCSA-N 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- 101100505161 Caenorhabditis elegans mel-32 gene Proteins 0.000 description 1
- 206010053567 Coagulopathies Diseases 0.000 description 1
- QLCPDGRAEJSYQM-LPEHRKFASA-N Cys-Arg-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CS)N)C(=O)O QLCPDGRAEJSYQM-LPEHRKFASA-N 0.000 description 1
- QDFBJJABJKOLTD-FXQIFTODSA-N Cys-Asn-Arg Chemical compound [H]N[C@@H](CS)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O QDFBJJABJKOLTD-FXQIFTODSA-N 0.000 description 1
- VZKXOWRNJDEGLZ-WHFBIAKZSA-N Cys-Asp-Gly Chemical compound SC[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)NCC(O)=O VZKXOWRNJDEGLZ-WHFBIAKZSA-N 0.000 description 1
- CFQVGYWKSLKWFX-KBIXCLLPSA-N Cys-Glu-Ile Chemical compound [H]N[C@@H](CS)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O CFQVGYWKSLKWFX-KBIXCLLPSA-N 0.000 description 1
- SBORMUFGKSCGEN-XHNCKOQMSA-N Cys-Glu-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CCC(=O)O)NC(=O)[C@H](CS)N)C(=O)O SBORMUFGKSCGEN-XHNCKOQMSA-N 0.000 description 1
- VIRYODQIWJNWNU-NRPADANISA-N Cys-Glu-Val Chemical compound CC(C)[C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)O)NC(=O)[C@H](CS)N VIRYODQIWJNWNU-NRPADANISA-N 0.000 description 1
- UXIYYUMGFNSGBK-XPUUQOCRSA-N Cys-Gly-Val Chemical compound [H]N[C@@H](CS)C(=O)NCC(=O)N[C@@H](C(C)C)C(O)=O UXIYYUMGFNSGBK-XPUUQOCRSA-N 0.000 description 1
- OZHXXYOHPLLLMI-CIUDSAMLSA-N Cys-Lys-Ala Chemical compound [H]N[C@@H](CS)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(O)=O OZHXXYOHPLLLMI-CIUDSAMLSA-N 0.000 description 1
- YXPNKXFOBHRUBL-BJDJZHNGSA-N Cys-Lys-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CS)N YXPNKXFOBHRUBL-BJDJZHNGSA-N 0.000 description 1
- IGXWBGJHJZYPQS-SSDOTTSWSA-N D-Luciferin Chemical compound OC(=O)[C@H]1CSC(C=2SC3=CC=C(O)C=C3N=2)=N1 IGXWBGJHJZYPQS-SSDOTTSWSA-N 0.000 description 1
- 108020004414 DNA Proteins 0.000 description 1
- CYCGRDQQIOGCKX-UHFFFAOYSA-N Dehydro-luciferin Natural products OC(=O)C1=CSC(C=2SC3=CC(O)=CC=C3N=2)=N1 CYCGRDQQIOGCKX-UHFFFAOYSA-N 0.000 description 1
- 241000702421 Dependoparvovirus Species 0.000 description 1
- 206010059866 Drug resistance Diseases 0.000 description 1
- 238000002965 ELISA Methods 0.000 description 1
- 238000012286 ELISA Assay Methods 0.000 description 1
- 102100025137 Early activation antigen CD69 Human genes 0.000 description 1
- 102100031780 Endonuclease Human genes 0.000 description 1
- 108010042407 Endonucleases Proteins 0.000 description 1
- 208000014061 Extranodal Extension Diseases 0.000 description 1
- BJGNCJDXODQBOB-UHFFFAOYSA-N Fivefly Luciferin Natural products OC(=O)C1CSC(C=2SC3=CC(O)=CC=C3N=2)=N1 BJGNCJDXODQBOB-UHFFFAOYSA-N 0.000 description 1
- 102100027581 Forkhead box protein P3 Human genes 0.000 description 1
- 206010017993 Gastrointestinal neoplasms Diseases 0.000 description 1
- NNQHEEQNPQYPGL-FXQIFTODSA-N Gln-Ala-Gln Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(N)=O)C(O)=O NNQHEEQNPQYPGL-FXQIFTODSA-N 0.000 description 1
- ZFADFBPRMSBPOT-KKUMJFAQSA-N Gln-Arg-Phe Chemical compound N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](Cc1ccccc1)C(O)=O ZFADFBPRMSBPOT-KKUMJFAQSA-N 0.000 description 1
- TWHDOEYLXXQYOZ-FXQIFTODSA-N Gln-Asn-Gln Chemical compound C(CC(=O)N)[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)N[C@@H](CCC(=O)N)C(=O)O)N TWHDOEYLXXQYOZ-FXQIFTODSA-N 0.000 description 1
- AAOBFSKXAVIORT-GUBZILKMSA-N Gln-Asn-Leu Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(O)=O AAOBFSKXAVIORT-GUBZILKMSA-N 0.000 description 1
- CKNUKHBRCSMKMO-XHNCKOQMSA-N Gln-Asn-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CC(=O)N)NC(=O)[C@H](CCC(=O)N)N)C(=O)O CKNUKHBRCSMKMO-XHNCKOQMSA-N 0.000 description 1
- LPYPANUXJGFMGV-FXQIFTODSA-N Gln-Gln-Ala Chemical compound C[C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)N)NC(=O)[C@H](CCC(=O)N)N LPYPANUXJGFMGV-FXQIFTODSA-N 0.000 description 1
- NVEASDQHBRZPSU-BQBZGAKWSA-N Gln-Gln-Gly Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)NCC(O)=O NVEASDQHBRZPSU-BQBZGAKWSA-N 0.000 description 1
- PNENQZWRFMUZOM-DCAQKATOSA-N Gln-Glu-Leu Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(O)=O PNENQZWRFMUZOM-DCAQKATOSA-N 0.000 description 1
- IULKWYSYZSURJK-AVGNSLFASA-N Gln-Leu-Lys Chemical compound NC(=O)CC[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(O)=O IULKWYSYZSURJK-AVGNSLFASA-N 0.000 description 1
- SFAFZYYMAWOCIC-KKUMJFAQSA-N Gln-Phe-Arg Chemical compound C1=CC=C(C=C1)C[C@@H](C(=O)N[C@@H](CCCN=C(N)N)C(=O)O)NC(=O)[C@H](CCC(=O)N)N SFAFZYYMAWOCIC-KKUMJFAQSA-N 0.000 description 1
- XQDGOJPVMSWZSO-SRVKXCTJSA-N Gln-Pro-Leu Chemical compound CC(C)C[C@@H](C(=O)O)NC(=O)[C@@H]1CCCN1C(=O)[C@H](CCC(=O)N)N XQDGOJPVMSWZSO-SRVKXCTJSA-N 0.000 description 1
- OSCLNNWLKKIQJM-WDSKDSINSA-N Gln-Ser-Gly Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CO)C(=O)NCC(O)=O OSCLNNWLKKIQJM-WDSKDSINSA-N 0.000 description 1
- LPIKVBWNNVFHCQ-GUBZILKMSA-N Gln-Ser-Leu Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(O)=O LPIKVBWNNVFHCQ-GUBZILKMSA-N 0.000 description 1
- SYZZMPFLOLSMHL-XHNCKOQMSA-N Gln-Ser-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CO)NC(=O)[C@H](CCC(=O)N)N)C(=O)O SYZZMPFLOLSMHL-XHNCKOQMSA-N 0.000 description 1
- BYKZWDGMJLNFJY-XKBZYTNZSA-N Gln-Ser-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(=O)N)N)O BYKZWDGMJLNFJY-XKBZYTNZSA-N 0.000 description 1
- VOUSELYGTNGEPB-NUMRIWBASA-N Gln-Thr-Asp Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(O)=O)C(O)=O VOUSELYGTNGEPB-NUMRIWBASA-N 0.000 description 1
- UBRQJXFDVZNYJP-AVGNSLFASA-N Gln-Tyr-Ser Chemical compound C1=CC(=CC=C1C[C@@H](C(=O)N[C@@H](CO)C(=O)O)NC(=O)[C@H](CCC(=O)N)N)O UBRQJXFDVZNYJP-AVGNSLFASA-N 0.000 description 1
- OGMQXTXGLDNBSS-FXQIFTODSA-N Glu-Ala-Gln Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(N)=O)C(O)=O OGMQXTXGLDNBSS-FXQIFTODSA-N 0.000 description 1
- DYFJZDDQPNIPAB-NHCYSSNCSA-N Glu-Arg-Val Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C(C)C)C(O)=O DYFJZDDQPNIPAB-NHCYSSNCSA-N 0.000 description 1
- IESFZVCAVACGPH-PEFMBERDSA-N Glu-Asp-Ile Chemical compound CC[C@H](C)[C@@H](C(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@@H](N)CCC(O)=O IESFZVCAVACGPH-PEFMBERDSA-N 0.000 description 1
- HJIFPJUEOGZWRI-GUBZILKMSA-N Glu-Asp-Lys Chemical compound C(CCN)C[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)O)NC(=O)[C@H](CCC(=O)O)N HJIFPJUEOGZWRI-GUBZILKMSA-N 0.000 description 1
- CLROYXHHUZELFX-FXQIFTODSA-N Glu-Gln-Asp Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(O)=O)C(O)=O CLROYXHHUZELFX-FXQIFTODSA-N 0.000 description 1
- CGOHAEBMDSEKFB-FXQIFTODSA-N Glu-Glu-Ala Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(O)=O CGOHAEBMDSEKFB-FXQIFTODSA-N 0.000 description 1
- BUAKRRKDHSSIKK-IHRRRGAJSA-N Glu-Glu-Tyr Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@H](C(O)=O)CC1=CC=C(O)C=C1 BUAKRRKDHSSIKK-IHRRRGAJSA-N 0.000 description 1
- QLPYYTDOUQNJGQ-AVGNSLFASA-N Glu-His-Lys Chemical compound C1=C(NC=N1)C[C@@H](C(=O)N[C@@H](CCCCN)C(=O)O)NC(=O)[C@H](CCC(=O)O)N QLPYYTDOUQNJGQ-AVGNSLFASA-N 0.000 description 1
- ITBHUUMCJJQUSC-LAEOZQHASA-N Glu-Ile-Gly Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(O)=O ITBHUUMCJJQUSC-LAEOZQHASA-N 0.000 description 1
- VMKCPNBBPGGQBJ-GUBZILKMSA-N Glu-Leu-Asn Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)O)NC(=O)[C@H](CCC(=O)O)N VMKCPNBBPGGQBJ-GUBZILKMSA-N 0.000 description 1
- DNPCBMNFQVTHMA-DCAQKATOSA-N Glu-Leu-Gln Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(O)=O DNPCBMNFQVTHMA-DCAQKATOSA-N 0.000 description 1
- YGLCLCMAYUYZSG-AVGNSLFASA-N Glu-Lys-His Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@@H](CCCCN)C(=O)N[C@H](C(O)=O)CC1=CN=CN1 YGLCLCMAYUYZSG-AVGNSLFASA-N 0.000 description 1
- GUOWMVFLAJNPDY-CIUDSAMLSA-N Glu-Ser-Met Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCSC)C(O)=O GUOWMVFLAJNPDY-CIUDSAMLSA-N 0.000 description 1
- MWTGQXBHVRTCOR-GLLZPBPUSA-N Glu-Thr-Gln Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCC(N)=O)C(O)=O MWTGQXBHVRTCOR-GLLZPBPUSA-N 0.000 description 1
- KCCNSVHJSMMGFS-NRPADANISA-N Glu-Val-Cys Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CS)C(=O)O)NC(=O)[C@H](CCC(=O)O)N KCCNSVHJSMMGFS-NRPADANISA-N 0.000 description 1
- ZYRXTRTUCAVNBQ-GVXVVHGQSA-N Glu-Val-Lys Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCCCN)C(=O)O)NC(=O)[C@H](CCC(=O)O)N ZYRXTRTUCAVNBQ-GVXVVHGQSA-N 0.000 description 1
- NTNUEBVGKMVANB-NHCYSSNCSA-N Glu-Val-Met Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCSC)C(O)=O NTNUEBVGKMVANB-NHCYSSNCSA-N 0.000 description 1
- FVGOGEGGQLNZGH-DZKIICNBSA-N Glu-Val-Phe Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 FVGOGEGGQLNZGH-DZKIICNBSA-N 0.000 description 1
- WGYHAAXZWPEBDQ-IFFSRLJSSA-N Glu-Val-Thr Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O WGYHAAXZWPEBDQ-IFFSRLJSSA-N 0.000 description 1
- JRDYDYXZKFNNRQ-XPUUQOCRSA-N Gly-Ala-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)CN JRDYDYXZKFNNRQ-XPUUQOCRSA-N 0.000 description 1
- JXYMPBCYRKWJEE-BQBZGAKWSA-N Gly-Arg-Ala Chemical compound [H]NCC(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(O)=O JXYMPBCYRKWJEE-BQBZGAKWSA-N 0.000 description 1
- OGCIHJPYKVSMTE-YUMQZZPRSA-N Gly-Arg-Glu Chemical compound [H]NCC(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(O)=O OGCIHJPYKVSMTE-YUMQZZPRSA-N 0.000 description 1
- DWUKOTKSTDWGAE-BQBZGAKWSA-N Gly-Asn-Arg Chemical compound NCC(=O)N[C@@H](CC(N)=O)C(=O)N[C@H](C(O)=O)CCCN=C(N)N DWUKOTKSTDWGAE-BQBZGAKWSA-N 0.000 description 1
- MHHUEAIBJZWDBH-YUMQZZPRSA-N Gly-Asp-Lys Chemical compound C(CCN)C[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)O)NC(=O)CN MHHUEAIBJZWDBH-YUMQZZPRSA-N 0.000 description 1
- MBOAPAXLTUSMQI-JHEQGTHGSA-N Gly-Glu-Thr Chemical compound [H]NCC(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O MBOAPAXLTUSMQI-JHEQGTHGSA-N 0.000 description 1
- QITBQGJOXQYMOA-ZETCQYMHSA-N Gly-Gly-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)CNC(=O)CN QITBQGJOXQYMOA-ZETCQYMHSA-N 0.000 description 1
- YTSVAIMKVLZUDU-YUMQZZPRSA-N Gly-Leu-Asp Chemical compound [H]NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(O)=O)C(O)=O YTSVAIMKVLZUDU-YUMQZZPRSA-N 0.000 description 1
- UHPAZODVFFYEEL-QWRGUYRKSA-N Gly-Leu-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)CN UHPAZODVFFYEEL-QWRGUYRKSA-N 0.000 description 1
- NNCSJUBVFBDDLC-YUMQZZPRSA-N Gly-Leu-Ser Chemical compound NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(O)=O NNCSJUBVFBDDLC-YUMQZZPRSA-N 0.000 description 1
- AFWYPMDMDYCKMD-KBPBESRZSA-N Gly-Leu-Tyr Chemical compound NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@H](C(O)=O)CC1=CC=C(O)C=C1 AFWYPMDMDYCKMD-KBPBESRZSA-N 0.000 description 1
- IUKIDFVOUHZRAK-QWRGUYRKSA-N Gly-Lys-His Chemical compound NCCCC[C@H](NC(=O)CN)C(=O)N[C@H](C(O)=O)CC1=CN=CN1 IUKIDFVOUHZRAK-QWRGUYRKSA-N 0.000 description 1
- FXGRXIATVXUAHO-WEDXCCLWSA-N Gly-Lys-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)CN)CCCCN FXGRXIATVXUAHO-WEDXCCLWSA-N 0.000 description 1
- MTBIKIMYHUWBRX-QWRGUYRKSA-N Gly-Phe-Asn Chemical compound C1=CC=C(C=C1)C[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)O)NC(=O)CN MTBIKIMYHUWBRX-QWRGUYRKSA-N 0.000 description 1
- HAOUOFNNJJLVNS-BQBZGAKWSA-N Gly-Pro-Ser Chemical compound NCC(=O)N1CCC[C@H]1C(=O)N[C@@H](CO)C(O)=O HAOUOFNNJJLVNS-BQBZGAKWSA-N 0.000 description 1
- GLACUWHUYFBSPJ-FJXKBIBVSA-N Gly-Pro-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)[C@@H]1CCCN1C(=O)CN GLACUWHUYFBSPJ-FJXKBIBVSA-N 0.000 description 1
- FKYQEVBRZSFAMJ-QWRGUYRKSA-N Gly-Ser-Tyr Chemical compound NCC(=O)N[C@@H](CO)C(=O)N[C@H](C(O)=O)CC1=CC=C(O)C=C1 FKYQEVBRZSFAMJ-QWRGUYRKSA-N 0.000 description 1
- NVTPVQLIZCOJFK-FOHZUACHSA-N Gly-Thr-Asp Chemical compound [H]NCC(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(O)=O)C(O)=O NVTPVQLIZCOJFK-FOHZUACHSA-N 0.000 description 1
- XHVONGZZVUUORG-WEDXCCLWSA-N Gly-Thr-Lys Chemical compound NCC(=O)N[C@@H]([C@H](O)C)C(=O)N[C@H](C(O)=O)CCCCN XHVONGZZVUUORG-WEDXCCLWSA-N 0.000 description 1
- UIQGJYUEQDOODF-KWQFWETISA-N Gly-Tyr-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)CN)CC1=CC=C(O)C=C1 UIQGJYUEQDOODF-KWQFWETISA-N 0.000 description 1
- GWCJMBNBFYBQCV-XPUUQOCRSA-N Gly-Val-Ala Chemical compound NCC(=O)N[C@@H](C(C)C)C(=O)N[C@@H](C)C(O)=O GWCJMBNBFYBQCV-XPUUQOCRSA-N 0.000 description 1
- 102000001398 Granzyme Human genes 0.000 description 1
- 108060005986 Granzyme Proteins 0.000 description 1
- 238000012752 Hepatectomy Methods 0.000 description 1
- BIAKMWKJMQLZOJ-ZKWXMUAHSA-N His-Ala-Ala Chemical compound C[C@H](NC(=O)[C@H](C)NC(=O)[C@@H](N)Cc1cnc[nH]1)C(O)=O BIAKMWKJMQLZOJ-ZKWXMUAHSA-N 0.000 description 1
- STGQSBKUYSPPIG-CIUDSAMLSA-N His-Ser-Asp Chemical compound OC(=O)C[C@@H](C(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC1=CN=CN1 STGQSBKUYSPPIG-CIUDSAMLSA-N 0.000 description 1
- FCPSGEVYIVXPPO-QTKMDUPCSA-N His-Thr-Arg Chemical compound [H]N[C@@H](CC1=CNC=N1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O FCPSGEVYIVXPPO-QTKMDUPCSA-N 0.000 description 1
- MDOBWSFNSNPENN-PMVVWTBXSA-N His-Thr-Gly Chemical compound [H]N[C@@H](CC1=CNC=N1)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(O)=O MDOBWSFNSNPENN-PMVVWTBXSA-N 0.000 description 1
- WSWAUVHXQREQQG-JYJNAYRXSA-N His-Tyr-Gln Chemical compound [H]N[C@@H](CC1=CNC=N1)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CCC(N)=O)C(O)=O WSWAUVHXQREQQG-JYJNAYRXSA-N 0.000 description 1
- PUFNQIPSRXVLQJ-IHRRRGAJSA-N His-Val-Lys Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCCCN)C(=O)O)NC(=O)[C@H](CC1=CN=CN1)N PUFNQIPSRXVLQJ-IHRRRGAJSA-N 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000934374 Homo sapiens Early activation antigen CD69 Proteins 0.000 description 1
- 101000861452 Homo sapiens Forkhead box protein P3 Proteins 0.000 description 1
- 101000998146 Homo sapiens Interleukin-17A Proteins 0.000 description 1
- 108091006905 Human Serum Albumin Proteins 0.000 description 1
- 102000008100 Human Serum Albumin Human genes 0.000 description 1
- 108700039609 IRW peptide Proteins 0.000 description 1
- HDOYNXLPTRQLAD-JBDRJPRFSA-N Ile-Ala-Ser Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](C)C(=O)N[C@@H](CO)C(=O)O)N HDOYNXLPTRQLAD-JBDRJPRFSA-N 0.000 description 1
- QYZYJFXHXYUZMZ-UGYAYLCHSA-N Ile-Asn-Asn Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)N[C@@H](CC(=O)N)C(=O)O)N QYZYJFXHXYUZMZ-UGYAYLCHSA-N 0.000 description 1
- UAVQIQOOBXFKRC-BYULHYEWSA-N Ile-Asn-Gly Chemical compound CC[C@H](C)[C@H](N)C(=O)N[C@@H](CC(N)=O)C(=O)NCC(O)=O UAVQIQOOBXFKRC-BYULHYEWSA-N 0.000 description 1
- KMBPQYKVZBMRMH-PEFMBERDSA-N Ile-Gln-Asn Chemical compound CC[C@H](C)[C@H](N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O KMBPQYKVZBMRMH-PEFMBERDSA-N 0.000 description 1
- DFFTXLCCDFYRKD-MBLNEYKQSA-N Ile-Gly-Thr Chemical compound CC[C@H](C)[C@@H](C(=O)NCC(=O)N[C@@H]([C@@H](C)O)C(=O)O)N DFFTXLCCDFYRKD-MBLNEYKQSA-N 0.000 description 1
- HUWYGQOISIJNMK-SIGLWIIPSA-N Ile-Ile-His Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)N HUWYGQOISIJNMK-SIGLWIIPSA-N 0.000 description 1
- IOVUXUSIGXCREV-DKIMLUQUSA-N Ile-Leu-Phe Chemical compound CC[C@H](C)[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 IOVUXUSIGXCREV-DKIMLUQUSA-N 0.000 description 1
- PHRWFSFCNJPWRO-PPCPHDFISA-N Ile-Leu-Thr Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)O)N PHRWFSFCNJPWRO-PPCPHDFISA-N 0.000 description 1
- AKOYRLRUFBZOSP-BJDJZHNGSA-N Ile-Lys-Ser Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CO)C(=O)O)N AKOYRLRUFBZOSP-BJDJZHNGSA-N 0.000 description 1
- WSSGUVAKYCQSCT-XUXIUFHCSA-N Ile-Met-Leu Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(C)C)C(=O)O)N WSSGUVAKYCQSCT-XUXIUFHCSA-N 0.000 description 1
- UOPBQSJRBONRON-STECZYCISA-N Ile-Met-Tyr Chemical compound CC[C@H](C)[C@H](N)C(=O)N[C@@H](CCSC)C(=O)N[C@H](C(O)=O)CC1=CC=C(O)C=C1 UOPBQSJRBONRON-STECZYCISA-N 0.000 description 1
- QQFSKBMCAKWHLG-UHFFFAOYSA-N Ile-Phe-Pro-Pro Chemical compound C1CCC(C(=O)N2C(CCC2)C(O)=O)N1C(=O)C(NC(=O)C(N)C(C)CC)CC1=CC=CC=C1 QQFSKBMCAKWHLG-UHFFFAOYSA-N 0.000 description 1
- KLJKJVXDHVUMMZ-KKPKCPPISA-N Ile-Phe-Trp Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC2=CNC3=CC=CC=C32)C(=O)O)N KLJKJVXDHVUMMZ-KKPKCPPISA-N 0.000 description 1
- QHUREMVLLMNUAX-OSUNSFLBSA-N Ile-Thr-Val Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)O)N QHUREMVLLMNUAX-OSUNSFLBSA-N 0.000 description 1
- REXAUQBGSGDEJY-IGISWZIWSA-N Ile-Tyr-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)O)N REXAUQBGSGDEJY-IGISWZIWSA-N 0.000 description 1
- ZGKVPOSSTGHJAF-HJPIBITLSA-N Ile-Tyr-Ser Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)N[C@@H](CO)C(=O)O)N ZGKVPOSSTGHJAF-HJPIBITLSA-N 0.000 description 1
- DLEBSGAVWRPTIX-PEDHHIEDSA-N Ile-Val-Ile Chemical compound CC[C@H](C)[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@H](C(O)=O)[C@@H](C)CC DLEBSGAVWRPTIX-PEDHHIEDSA-N 0.000 description 1
- APQYGMBHIVXFML-OSUNSFLBSA-N Ile-Val-Thr Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](C(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)O)N APQYGMBHIVXFML-OSUNSFLBSA-N 0.000 description 1
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 1
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 1
- 102000003816 Interleukin-13 Human genes 0.000 description 1
- 108090000176 Interleukin-13 Proteins 0.000 description 1
- 108050003558 Interleukin-17 Proteins 0.000 description 1
- 102000013691 Interleukin-17 Human genes 0.000 description 1
- 102100033461 Interleukin-17A Human genes 0.000 description 1
- 108010002386 Interleukin-3 Proteins 0.000 description 1
- 102000000646 Interleukin-3 Human genes 0.000 description 1
- 102000004388 Interleukin-4 Human genes 0.000 description 1
- 108090000978 Interleukin-4 Proteins 0.000 description 1
- FADYJNXDPBKVCA-UHFFFAOYSA-N L-Phenylalanyl-L-lysin Natural products NCCCCC(C(O)=O)NC(=O)C(N)CC1=CC=CC=C1 FADYJNXDPBKVCA-UHFFFAOYSA-N 0.000 description 1
- SITWEMZOJNKJCH-UHFFFAOYSA-N L-alanine-L-arginine Natural products CC(N)C(=O)NC(C(O)=O)CCCNC(N)=N SITWEMZOJNKJCH-UHFFFAOYSA-N 0.000 description 1
- LHSGPCFBGJHPCY-UHFFFAOYSA-N L-leucine-L-tyrosine Natural products CC(C)CC(N)C(=O)NC(C(O)=O)CC1=CC=C(O)C=C1 LHSGPCFBGJHPCY-UHFFFAOYSA-N 0.000 description 1
- TYYLDKGBCJGJGW-UHFFFAOYSA-N L-tryptophan-L-tyrosine Natural products C=1NC2=CC=CC=C2C=1CC(N)C(=O)NC(C(O)=O)CC1=CC=C(O)C=C1 TYYLDKGBCJGJGW-UHFFFAOYSA-N 0.000 description 1
- 241000880493 Leptailurus serval Species 0.000 description 1
- WNGVUZWBXZKQES-YUMQZZPRSA-N Leu-Ala-Gly Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](C)C(=O)NCC(O)=O WNGVUZWBXZKQES-YUMQZZPRSA-N 0.000 description 1
- DBVWMYGBVFCRBE-CIUDSAMLSA-N Leu-Asn-Asn Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O DBVWMYGBVFCRBE-CIUDSAMLSA-N 0.000 description 1
- TWQIYNGNYNJUFM-NHCYSSNCSA-N Leu-Asn-Val Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C(C)C)C(O)=O TWQIYNGNYNJUFM-NHCYSSNCSA-N 0.000 description 1
- YKNBJXOJTURHCU-DCAQKATOSA-N Leu-Asp-Arg Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(O)=O)CCCN=C(N)N YKNBJXOJTURHCU-DCAQKATOSA-N 0.000 description 1
- JQSXWJXBASFONF-KKUMJFAQSA-N Leu-Asp-Phe Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O JQSXWJXBASFONF-KKUMJFAQSA-N 0.000 description 1
- MMEDVBWCMGRKKC-GARJFASQSA-N Leu-Asp-Pro Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)N1CCC[C@@H]1C(=O)O)N MMEDVBWCMGRKKC-GARJFASQSA-N 0.000 description 1
- CLVUXCBGKUECIT-HJGDQZAQSA-N Leu-Asp-Thr Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O CLVUXCBGKUECIT-HJGDQZAQSA-N 0.000 description 1
- DLCXCECTCPKKCD-GUBZILKMSA-N Leu-Gln-Asn Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O DLCXCECTCPKKCD-GUBZILKMSA-N 0.000 description 1
- CQGSYZCULZMEDE-UHFFFAOYSA-N Leu-Gln-Pro Natural products CC(C)CC(N)C(=O)NC(CCC(N)=O)C(=O)N1CCCC1C(O)=O CQGSYZCULZMEDE-UHFFFAOYSA-N 0.000 description 1
- QDSKNVXKLPQNOJ-GVXVVHGQSA-N Leu-Gln-Val Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](C(C)C)C(O)=O QDSKNVXKLPQNOJ-GVXVVHGQSA-N 0.000 description 1
- BABSVXFGKFLIGW-UWVGGRQHSA-N Leu-Gly-Arg Chemical compound CC(C)C[C@H](N)C(=O)NCC(=O)N[C@H](C(O)=O)CCCNC(N)=N BABSVXFGKFLIGW-UWVGGRQHSA-N 0.000 description 1
- FMEICTQWUKNAGC-YUMQZZPRSA-N Leu-Gly-Asn Chemical compound [H]N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](CC(N)=O)C(O)=O FMEICTQWUKNAGC-YUMQZZPRSA-N 0.000 description 1
- KVOFSTUWVSQMDK-KKUMJFAQSA-N Leu-His-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)[C@@H](N)CC(C)C)CC1=CN=CN1 KVOFSTUWVSQMDK-KKUMJFAQSA-N 0.000 description 1
- XBCWOTOCBXXJDG-BZSNNMDCSA-N Leu-His-Phe Chemical compound C([C@H](NC(=O)[C@@H](N)CC(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)C1=CN=CN1 XBCWOTOCBXXJDG-BZSNNMDCSA-N 0.000 description 1
- IAJFFZORSWOZPQ-SRVKXCTJSA-N Leu-Leu-Asn Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(O)=O IAJFFZORSWOZPQ-SRVKXCTJSA-N 0.000 description 1
- SYRTUBLKWNDSDK-DKIMLUQUSA-N Leu-Phe-Ile Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O SYRTUBLKWNDSDK-DKIMLUQUSA-N 0.000 description 1
- DRWMRVFCKKXHCH-BZSNNMDCSA-N Leu-Phe-Leu Chemical compound CC(C)C[C@H]([NH3+])C(=O)N[C@H](C(=O)N[C@@H](CC(C)C)C([O-])=O)CC1=CC=CC=C1 DRWMRVFCKKXHCH-BZSNNMDCSA-N 0.000 description 1
- DPURXCQCHSQPAN-AVGNSLFASA-N Leu-Pro-Pro Chemical compound CC(C)C[C@H](N)C(=O)N1CCC[C@H]1C(=O)N1[C@H](C(O)=O)CCC1 DPURXCQCHSQPAN-AVGNSLFASA-N 0.000 description 1
- IRMLZWSRWSGTOP-CIUDSAMLSA-N Leu-Ser-Ala Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](C)C(O)=O IRMLZWSRWSGTOP-CIUDSAMLSA-N 0.000 description 1
- KZZCOWMDDXDKSS-CIUDSAMLSA-N Leu-Ser-Asn Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(O)=O KZZCOWMDDXDKSS-CIUDSAMLSA-N 0.000 description 1
- KIZIOFNVSOSKJI-CIUDSAMLSA-N Leu-Ser-Cys Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CS)C(=O)O)N KIZIOFNVSOSKJI-CIUDSAMLSA-N 0.000 description 1
- MVHXGBZUJLWZOH-BJDJZHNGSA-N Leu-Ser-Ile Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O MVHXGBZUJLWZOH-BJDJZHNGSA-N 0.000 description 1
- AMSSKPUHBUQBOQ-SRVKXCTJSA-N Leu-Ser-Lys Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCCN)C(=O)O)N AMSSKPUHBUQBOQ-SRVKXCTJSA-N 0.000 description 1
- SBANPBVRHYIMRR-GARJFASQSA-N Leu-Ser-Pro Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CO)C(=O)N1CCC[C@@H]1C(=O)O)N SBANPBVRHYIMRR-GARJFASQSA-N 0.000 description 1
- PPGBXYKMUMHFBF-KATARQTJSA-N Leu-Ser-Thr Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(O)=O PPGBXYKMUMHFBF-KATARQTJSA-N 0.000 description 1
- LINKCQUOMUDLKN-KATARQTJSA-N Leu-Thr-Cys Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CS)C(=O)O)NC(=O)[C@H](CC(C)C)N)O LINKCQUOMUDLKN-KATARQTJSA-N 0.000 description 1
- LCNASHSOFMRYFO-WDCWCFNPSA-N Leu-Thr-Gln Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@H](C(O)=O)CCC(N)=O LCNASHSOFMRYFO-WDCWCFNPSA-N 0.000 description 1
- QWWPYKKLXWOITQ-VOAKCMCISA-N Leu-Thr-Leu Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@H](C(O)=O)CC(C)C QWWPYKKLXWOITQ-VOAKCMCISA-N 0.000 description 1
- GZRABTMNWJXFMH-UVOCVTCTSA-N Leu-Thr-Thr Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O GZRABTMNWJXFMH-UVOCVTCTSA-N 0.000 description 1
- WPIKRJDRQVFRHP-TUSQITKMSA-N Leu-Trp-Trp Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC1=CNC2=C1C=CC=C2)C(=O)N[C@@H](CC1=CNC2=C1C=CC=C2)C(O)=O WPIKRJDRQVFRHP-TUSQITKMSA-N 0.000 description 1
- UCRJTSIIAYHOHE-ULQDDVLXSA-N Leu-Tyr-Arg Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)N[C@@H](CCCN=C(N)N)C(=O)O)N UCRJTSIIAYHOHE-ULQDDVLXSA-N 0.000 description 1
- WUHBLPVELFTPQK-KKUMJFAQSA-N Leu-Tyr-Asn Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC(N)=O)C(O)=O WUHBLPVELFTPQK-KKUMJFAQSA-N 0.000 description 1
- SXOFUVGLPHCPRQ-KKUMJFAQSA-N Leu-Tyr-Cys Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CS)C(O)=O SXOFUVGLPHCPRQ-KKUMJFAQSA-N 0.000 description 1
- JGKHAFUAPZCCDU-BZSNNMDCSA-N Leu-Tyr-Leu Chemical compound CC(C)C[C@H]([NH3+])C(=O)N[C@H](C(=O)N[C@@H](CC(C)C)C([O-])=O)CC1=CC=C(O)C=C1 JGKHAFUAPZCCDU-BZSNNMDCSA-N 0.000 description 1
- VQHUBNVKFFLWRP-ULQDDVLXSA-N Leu-Tyr-Val Chemical compound CC(C)C[C@H](N)C(=O)N[C@H](C(=O)N[C@@H](C(C)C)C(O)=O)CC1=CC=C(O)C=C1 VQHUBNVKFFLWRP-ULQDDVLXSA-N 0.000 description 1
- XZNJZXJZBMBGGS-NHCYSSNCSA-N Leu-Val-Asn Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(N)=O)C(O)=O XZNJZXJZBMBGGS-NHCYSSNCSA-N 0.000 description 1
- LMDVGHQPPPLYAR-IHRRRGAJSA-N Leu-Val-His Chemical compound N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC1=CNC=N1)C(=O)O LMDVGHQPPPLYAR-IHRRRGAJSA-N 0.000 description 1
- YQFZRHYZLARWDY-IHRRRGAJSA-N Leu-Val-Lys Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@H](C(O)=O)CCCCN YQFZRHYZLARWDY-IHRRRGAJSA-N 0.000 description 1
- DDWFXDSYGUXRAY-UHFFFAOYSA-N Luciferin Natural products CCc1c(C)c(CC2NC(=O)C(=C2C=C)C)[nH]c1Cc3[nH]c4C(=C5/NC(CC(=O)O)C(C)C5CC(=O)O)CC(=O)c4c3C DDWFXDSYGUXRAY-UHFFFAOYSA-N 0.000 description 1
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 1
- KCXUCYYZNZFGLL-SRVKXCTJSA-N Lys-Ala-Leu Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(O)=O KCXUCYYZNZFGLL-SRVKXCTJSA-N 0.000 description 1
- IXHKPDJKKCUKHS-GARJFASQSA-N Lys-Ala-Pro Chemical compound C[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CCCCN)N IXHKPDJKKCUKHS-GARJFASQSA-N 0.000 description 1
- UWKNTTJNVSYXPC-CIUDSAMLSA-N Lys-Ala-Ser Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CCCCN UWKNTTJNVSYXPC-CIUDSAMLSA-N 0.000 description 1
- NQCJGQHHYZNUDK-DCAQKATOSA-N Lys-Arg-Ser Chemical compound NCCCC[C@H](N)C(=O)N[C@H](C(=O)N[C@@H](CO)C(O)=O)CCCN=C(N)N NQCJGQHHYZNUDK-DCAQKATOSA-N 0.000 description 1
- SWWCDAGDQHTKIE-RHYQMDGZSA-N Lys-Arg-Thr Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(O)=O SWWCDAGDQHTKIE-RHYQMDGZSA-N 0.000 description 1
- LMVOVCYVZBBWQB-SRVKXCTJSA-N Lys-Asp-Lys Chemical compound NCCCC[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(O)=O)CCCCN LMVOVCYVZBBWQB-SRVKXCTJSA-N 0.000 description 1
- MLLKLNYPZRDIQG-GUBZILKMSA-N Lys-Cys-Gln Chemical compound C(CCN)C[C@@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(=O)N)C(=O)O)N MLLKLNYPZRDIQG-GUBZILKMSA-N 0.000 description 1
- KSFQPRLZAUXXPT-GARJFASQSA-N Lys-Cys-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CS)NC(=O)[C@H](CCCCN)N)C(=O)O KSFQPRLZAUXXPT-GARJFASQSA-N 0.000 description 1
- ULUQBUKAPDUKOC-GVXVVHGQSA-N Lys-Glu-Val Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C(C)C)C(O)=O ULUQBUKAPDUKOC-GVXVVHGQSA-N 0.000 description 1
- LCMWVZLBCUVDAZ-IUCAKERBSA-N Lys-Gly-Glu Chemical compound [NH3+]CCCC[C@H]([NH3+])C(=O)NCC(=O)N[C@H](C([O-])=O)CCC([O-])=O LCMWVZLBCUVDAZ-IUCAKERBSA-N 0.000 description 1
- UETQMSASAVBGJY-QWRGUYRKSA-N Lys-Gly-His Chemical compound NCCCC[C@H](N)C(=O)NCC(=O)N[C@H](C(O)=O)CC1=CNC=N1 UETQMSASAVBGJY-QWRGUYRKSA-N 0.000 description 1
- GQFDWEDHOQRNLC-QWRGUYRKSA-N Lys-Gly-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN GQFDWEDHOQRNLC-QWRGUYRKSA-N 0.000 description 1
- OWRUUFUVXFREBD-KKUMJFAQSA-N Lys-His-Leu Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CC1=CNC=N1)C(=O)N[C@@H](CC(C)C)C(O)=O OWRUUFUVXFREBD-KKUMJFAQSA-N 0.000 description 1
- QBEPTBMRQALPEV-MNXVOIDGSA-N Lys-Ile-Glu Chemical compound OC(=O)CC[C@@H](C(O)=O)NC(=O)[C@H]([C@@H](C)CC)NC(=O)[C@@H](N)CCCCN QBEPTBMRQALPEV-MNXVOIDGSA-N 0.000 description 1
- ZXFRGTAIIZHNHG-AJNGGQMLSA-N Lys-Ile-Leu Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC(C)C)C(=O)O)NC(=O)[C@H](CCCCN)N ZXFRGTAIIZHNHG-AJNGGQMLSA-N 0.000 description 1
- PINHPJWGVBKQII-SRVKXCTJSA-N Lys-Leu-Cys Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CS)C(=O)O)NC(=O)[C@H](CCCCN)N PINHPJWGVBKQII-SRVKXCTJSA-N 0.000 description 1
- VMTYLUGCXIEDMV-QWRGUYRKSA-N Lys-Leu-Gly Chemical compound OC(=O)CNC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCCCN VMTYLUGCXIEDMV-QWRGUYRKSA-N 0.000 description 1
- AIRZWUMAHCDDHR-KKUMJFAQSA-N Lys-Leu-Leu Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O AIRZWUMAHCDDHR-KKUMJFAQSA-N 0.000 description 1
- GOVDTWNJCBRRBJ-DCAQKATOSA-N Lys-Met-Asn Chemical compound CSCC[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)O)NC(=O)[C@H](CCCCN)N GOVDTWNJCBRRBJ-DCAQKATOSA-N 0.000 description 1
- PDIDTSZKKFEDMB-UWVGGRQHSA-N Lys-Pro-Gly Chemical compound [H]N[C@@H](CCCCN)C(=O)N1CCC[C@H]1C(=O)NCC(O)=O PDIDTSZKKFEDMB-UWVGGRQHSA-N 0.000 description 1
- LUTDBHBIHHREDC-IHRRRGAJSA-N Lys-Pro-Lys Chemical compound NCCCC[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCCCN)C(O)=O LUTDBHBIHHREDC-IHRRRGAJSA-N 0.000 description 1
- LECIJRIRMVOFMH-ULQDDVLXSA-N Lys-Pro-Phe Chemical compound NCCCC[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 LECIJRIRMVOFMH-ULQDDVLXSA-N 0.000 description 1
- JHNOXVASMSXSNB-WEDXCCLWSA-N Lys-Thr-Gly Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(O)=O JHNOXVASMSXSNB-WEDXCCLWSA-N 0.000 description 1
- DLCAXBGXGOVUCD-PPCPHDFISA-N Lys-Thr-Ile Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O DLCAXBGXGOVUCD-PPCPHDFISA-N 0.000 description 1
- CAVRAQIDHUPECU-UVOCVTCTSA-N Lys-Thr-Thr Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O CAVRAQIDHUPECU-UVOCVTCTSA-N 0.000 description 1
- QLFAPXUXEBAWEK-NHCYSSNCSA-N Lys-Val-Asp Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(O)=O)C(O)=O QLFAPXUXEBAWEK-NHCYSSNCSA-N 0.000 description 1
- HMZPYMSEAALNAE-ULQDDVLXSA-N Lys-Val-Tyr Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O HMZPYMSEAALNAE-ULQDDVLXSA-N 0.000 description 1
- 108010090054 Membrane Glycoproteins Proteins 0.000 description 1
- 102000012750 Membrane Glycoproteins Human genes 0.000 description 1
- ONGCSGVHCSAATF-CIUDSAMLSA-N Met-Ala-Glu Chemical compound CSCC[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CCC(O)=O ONGCSGVHCSAATF-CIUDSAMLSA-N 0.000 description 1
- QEVRUYFHWJJUHZ-DCAQKATOSA-N Met-Ala-Leu Chemical compound CSCC[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CC(C)C QEVRUYFHWJJUHZ-DCAQKATOSA-N 0.000 description 1
- DBOMZJOESVYERT-GUBZILKMSA-N Met-Asn-Met Chemical compound CSCC[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)N[C@@H](CCSC)C(=O)O)N DBOMZJOESVYERT-GUBZILKMSA-N 0.000 description 1
- YLLWCSDBVGZLOW-CIUDSAMLSA-N Met-Gln-Ala Chemical compound [H]N[C@@H](CCSC)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](C)C(O)=O YLLWCSDBVGZLOW-CIUDSAMLSA-N 0.000 description 1
- XKJUFUPCHARJKX-UWVGGRQHSA-N Met-Gly-His Chemical compound CSCC[C@H](N)C(=O)NCC(=O)N[C@H](C(O)=O)CC1=CNC=N1 XKJUFUPCHARJKX-UWVGGRQHSA-N 0.000 description 1
- MHQXIBRPDKXDGZ-ZFWWWQNUSA-N Met-Gly-Trp Chemical compound C1=CC=C2C(C[C@H](NC(=O)CNC(=O)[C@@H](N)CCSC)C(O)=O)=CNC2=C1 MHQXIBRPDKXDGZ-ZFWWWQNUSA-N 0.000 description 1
- SODXFJOPSCXOHE-IHRRRGAJSA-N Met-Leu-Leu Chemical compound CSCC[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O SODXFJOPSCXOHE-IHRRRGAJSA-N 0.000 description 1
- HSJIGJRZYUADSS-IHRRRGAJSA-N Met-Lys-Leu Chemical compound [H]N[C@@H](CCSC)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(O)=O HSJIGJRZYUADSS-IHRRRGAJSA-N 0.000 description 1
- DJJBHQHOZLUBCN-WDSOQIARSA-N Met-Lys-Trp Chemical compound [H]N[C@@H](CCSC)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC1=CNC2=C1C=CC=C2)C(O)=O DJJBHQHOZLUBCN-WDSOQIARSA-N 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- 241000713869 Moloney murine leukemia virus Species 0.000 description 1
- 241000699666 Mus <mouse, genus> Species 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- SITLTJHOQZFJGG-UHFFFAOYSA-N N-L-alpha-glutamyl-L-valine Natural products CC(C)C(C(O)=O)NC(=O)C(N)CCC(O)=O SITLTJHOQZFJGG-UHFFFAOYSA-N 0.000 description 1
- PESQCPHRXOFIPX-UHFFFAOYSA-N N-L-methionyl-L-tyrosine Natural products CSCCC(N)C(=O)NC(C(O)=O)CC1=CC=C(O)C=C1 PESQCPHRXOFIPX-UHFFFAOYSA-N 0.000 description 1
- 108010079364 N-glycylalanine Proteins 0.000 description 1
- 206010028813 Nausea Diseases 0.000 description 1
- 101100068676 Neurospora crassa (strain ATCC 24698 / 74-OR23-1A / CBS 708.71 / DSM 1257 / FGSC 987) gln-1 gene Proteins 0.000 description 1
- 108091028043 Nucleic acid sequence Proteins 0.000 description 1
- 206010030113 Oedema Diseases 0.000 description 1
- 102000016979 Other receptors Human genes 0.000 description 1
- 101710160107 Outer membrane protein A Proteins 0.000 description 1
- 238000012408 PCR amplification Methods 0.000 description 1
- 102000004503 Perforin Human genes 0.000 description 1
- 108010056995 Perforin Proteins 0.000 description 1
- KHGNFPUMBJSZSM-UHFFFAOYSA-N Perforine Natural products COC1=C2CCC(O)C(CCC(C)(C)O)(OC)C2=NC2=C1C=CO2 KHGNFPUMBJSZSM-UHFFFAOYSA-N 0.000 description 1
- BJEYSVHMGIJORT-NHCYSSNCSA-N Phe-Ala-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](N)CC1=CC=CC=C1 BJEYSVHMGIJORT-NHCYSSNCSA-N 0.000 description 1
- DPUOLKQSMYLRDR-UBHSHLNASA-N Phe-Arg-Ala Chemical compound NC(N)=NCCC[C@@H](C(=O)N[C@@H](C)C(O)=O)NC(=O)[C@@H](N)CC1=CC=CC=C1 DPUOLKQSMYLRDR-UBHSHLNASA-N 0.000 description 1
- UUWCIPUVJJIEEP-SRVKXCTJSA-N Phe-Asn-Cys Chemical compound C1=CC=C(C=C1)C[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)N[C@@H](CS)C(=O)O)N UUWCIPUVJJIEEP-SRVKXCTJSA-N 0.000 description 1
- IDUCUXTUHHIQIP-SOUVJXGZSA-N Phe-Gln-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CCC(=O)N)NC(=O)[C@H](CC2=CC=CC=C2)N)C(=O)O IDUCUXTUHHIQIP-SOUVJXGZSA-N 0.000 description 1
- YYKZDTVQHTUKDW-RYUDHWBXSA-N Phe-Gly-Gln Chemical compound C1=CC=C(C=C1)C[C@@H](C(=O)NCC(=O)N[C@@H](CCC(=O)N)C(=O)O)N YYKZDTVQHTUKDW-RYUDHWBXSA-N 0.000 description 1
- SPXWRYVHOZVYBU-ULQDDVLXSA-N Phe-His-Val Chemical compound CC(C)[C@@H](C(=O)O)NC(=O)[C@H](CC1=CN=CN1)NC(=O)[C@H](CC2=CC=CC=C2)N SPXWRYVHOZVYBU-ULQDDVLXSA-N 0.000 description 1
- ONORAGIFHNAADN-LLLHUVSDSA-N Phe-Ile-Pro Chemical compound CC[C@H](C)[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CC2=CC=CC=C2)N ONORAGIFHNAADN-LLLHUVSDSA-N 0.000 description 1
- OSBADCBXAMSPQD-YESZJQIVSA-N Phe-Leu-Pro Chemical compound CC(C)C[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CC2=CC=CC=C2)N OSBADCBXAMSPQD-YESZJQIVSA-N 0.000 description 1
- WEDZFLRYSIDIRX-IHRRRGAJSA-N Phe-Ser-Arg Chemical compound NC(=N)NCCC[C@@H](C(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC1=CC=CC=C1 WEDZFLRYSIDIRX-IHRRRGAJSA-N 0.000 description 1
- ILGCZYGFYQLSDZ-KKUMJFAQSA-N Phe-Ser-His Chemical compound N[C@@H](Cc1ccccc1)C(=O)N[C@@H](CO)C(=O)N[C@@H](Cc1cnc[nH]1)C(O)=O ILGCZYGFYQLSDZ-KKUMJFAQSA-N 0.000 description 1
- GMWNQSGWWGKTSF-LFSVMHDDSA-N Phe-Thr-Ala Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C)C(O)=O GMWNQSGWWGKTSF-LFSVMHDDSA-N 0.000 description 1
- BPIMVBKDLSBKIJ-FCLVOEFKSA-N Phe-Thr-Phe Chemical compound C([C@H](N)C(=O)N[C@@H]([C@H](O)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)C1=CC=CC=C1 BPIMVBKDLSBKIJ-FCLVOEFKSA-N 0.000 description 1
- ZYNBEWGJFXTBDU-ACRUOGEOSA-N Phe-Tyr-Leu Chemical compound CC(C)C[C@@H](C(=O)O)NC(=O)[C@H](CC1=CC=C(C=C1)O)NC(=O)[C@H](CC2=CC=CC=C2)N ZYNBEWGJFXTBDU-ACRUOGEOSA-N 0.000 description 1
- SJRQWEDYTKYHHL-SLFFLAALSA-N Phe-Tyr-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CC2=CC=C(C=C2)O)NC(=O)[C@H](CC3=CC=CC=C3)N)C(=O)O SJRQWEDYTKYHHL-SLFFLAALSA-N 0.000 description 1
- MHNBYYFXWDUGBW-RPTUDFQQSA-N Phe-Tyr-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CC1=CC=C(C=C1)O)NC(=O)[C@H](CC2=CC=CC=C2)N)O MHNBYYFXWDUGBW-RPTUDFQQSA-N 0.000 description 1
- OAICVXFJPJFONN-OUBTZVSYSA-N Phosphorus-32 Chemical compound [32P] OAICVXFJPJFONN-OUBTZVSYSA-N 0.000 description 1
- 208000002151 Pleural effusion Diseases 0.000 description 1
- DBALDZKOTNSBFM-FXQIFTODSA-N Pro-Ala-Asn Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](C)C(=O)N[C@@H](CC(N)=O)C(O)=O DBALDZKOTNSBFM-FXQIFTODSA-N 0.000 description 1
- LNLNHXIQPGKRJQ-SRVKXCTJSA-N Pro-Arg-Arg Chemical compound NC(N)=NCCC[C@@H](C(O)=O)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@@H]1CCCN1 LNLNHXIQPGKRJQ-SRVKXCTJSA-N 0.000 description 1
- SSSFPISOZOLQNP-GUBZILKMSA-N Pro-Arg-Asp Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(O)=O SSSFPISOZOLQNP-GUBZILKMSA-N 0.000 description 1
- VCYJKOLZYPYGJV-AVGNSLFASA-N Pro-Arg-Leu Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(O)=O VCYJKOLZYPYGJV-AVGNSLFASA-N 0.000 description 1
- UVKNEILZSJMKSR-FXQIFTODSA-N Pro-Asn-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@H](CC(N)=O)NC(=O)[C@@H]1CCCN1 UVKNEILZSJMKSR-FXQIFTODSA-N 0.000 description 1
- SFECXGVELZFBFJ-VEVYYDQMSA-N Pro-Asp-Thr Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O SFECXGVELZFBFJ-VEVYYDQMSA-N 0.000 description 1
- LSIWVWRUTKPXDS-DCAQKATOSA-N Pro-Gln-Arg Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O LSIWVWRUTKPXDS-DCAQKATOSA-N 0.000 description 1
- WGAQWMRJUFQXMF-ZPFDUUQYSA-N Pro-Gln-Ile Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O WGAQWMRJUFQXMF-ZPFDUUQYSA-N 0.000 description 1
- LHALYDBUDCWMDY-CIUDSAMLSA-N Pro-Glu-Ala Chemical compound C[C@H](NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H]1CCCN1)C(O)=O LHALYDBUDCWMDY-CIUDSAMLSA-N 0.000 description 1
- UREQLMJCKFLLHM-NAKRPEOUSA-N Pro-Ile-Ser Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(O)=O UREQLMJCKFLLHM-NAKRPEOUSA-N 0.000 description 1
- KLSOMAFWRISSNI-OSUNSFLBSA-N Pro-Ile-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)[C@H]([C@@H](C)CC)NC(=O)[C@@H]1CCCN1 KLSOMAFWRISSNI-OSUNSFLBSA-N 0.000 description 1
- FYPGHGXAOZTOBO-IHRRRGAJSA-N Pro-Leu-His Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)NC(=O)[C@@H]2CCCN2 FYPGHGXAOZTOBO-IHRRRGAJSA-N 0.000 description 1
- DRKAXLDECUGLFE-ULQDDVLXSA-N Pro-Leu-Phe Chemical compound CC(C)C[C@H](NC(=O)[C@@H]1CCCN1)C(=O)N[C@@H](Cc1ccccc1)C(O)=O DRKAXLDECUGLFE-ULQDDVLXSA-N 0.000 description 1
- ULWBBFKQBDNGOY-RWMBFGLXSA-N Pro-Lys-Pro Chemical compound C1C[C@H](NC1)C(=O)N[C@@H](CCCCN)C(=O)N2CCC[C@@H]2C(=O)O ULWBBFKQBDNGOY-RWMBFGLXSA-N 0.000 description 1
- VGVCNKSUVSZEIE-IHRRRGAJSA-N Pro-Phe-Asn Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC(N)=O)C(O)=O VGVCNKSUVSZEIE-IHRRRGAJSA-N 0.000 description 1
- JLMZKEQFMVORMA-SRVKXCTJSA-N Pro-Pro-Arg Chemical compound NC(N)=NCCC[C@@H](C(O)=O)NC(=O)[C@@H]1CCCN1C(=O)[C@H]1NCCC1 JLMZKEQFMVORMA-SRVKXCTJSA-N 0.000 description 1
- GFHOSBYCLACKEK-GUBZILKMSA-N Pro-Pro-Asn Chemical compound [H]N1CCC[C@H]1C(=O)N1CCC[C@H]1C(=O)N[C@@H](CC(N)=O)C(O)=O GFHOSBYCLACKEK-GUBZILKMSA-N 0.000 description 1
- SBVPYBFMIGDIDX-SRVKXCTJSA-N Pro-Pro-Pro Chemical compound OC(=O)[C@@H]1CCCN1C(=O)[C@H]1N(C(=O)[C@H]2NCCC2)CCC1 SBVPYBFMIGDIDX-SRVKXCTJSA-N 0.000 description 1
- GMJDSFYVTAMIBF-FXQIFTODSA-N Pro-Ser-Asp Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(O)=O)C(O)=O GMJDSFYVTAMIBF-FXQIFTODSA-N 0.000 description 1
- LNICFEXCAHIJOR-DCAQKATOSA-N Pro-Ser-Leu Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(O)=O LNICFEXCAHIJOR-DCAQKATOSA-N 0.000 description 1
- PRKWBYCXBBSLSK-GUBZILKMSA-N Pro-Ser-Val Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(O)=O PRKWBYCXBBSLSK-GUBZILKMSA-N 0.000 description 1
- HRIXMVRZRGFKNQ-HJGDQZAQSA-N Pro-Thr-Gln Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCC(N)=O)C(O)=O HRIXMVRZRGFKNQ-HJGDQZAQSA-N 0.000 description 1
- AIOWVDNPESPXRB-YTWAJWBKSA-N Pro-Thr-Pro Chemical compound C[C@H]([C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@@H]2CCCN2)O AIOWVDNPESPXRB-YTWAJWBKSA-N 0.000 description 1
- RMJZWERKFFNNNS-XGEHTFHBSA-N Pro-Thr-Ser Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CO)C(O)=O RMJZWERKFFNNNS-XGEHTFHBSA-N 0.000 description 1
- GNFHQWNCSSPOBT-ULQDDVLXSA-N Pro-Trp-Gln Chemical compound C1C[C@H](NC1)C(=O)N[C@@H](CC2=CNC3=CC=CC=C32)C(=O)N[C@@H](CCC(=O)N)C(=O)O GNFHQWNCSSPOBT-ULQDDVLXSA-N 0.000 description 1
- DLZBBDSPTJBOOD-BPNCWPANSA-N Pro-Tyr-Ala Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](C)C(O)=O DLZBBDSPTJBOOD-BPNCWPANSA-N 0.000 description 1
- FZXSYIPVAFVYBH-KKUMJFAQSA-N Pro-Tyr-Glu Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CCC(O)=O)C(O)=O FZXSYIPVAFVYBH-KKUMJFAQSA-N 0.000 description 1
- IIRBTQHFVNGPMQ-AVGNSLFASA-N Pro-Val-Lys Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCCCN)C(=O)O)NC(=O)[C@@H]1CCCN1 IIRBTQHFVNGPMQ-AVGNSLFASA-N 0.000 description 1
- FIODMZKLZFLYQP-GUBZILKMSA-N Pro-Val-Ser Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CO)C(O)=O FIODMZKLZFLYQP-GUBZILKMSA-N 0.000 description 1
- 102000001708 Protein Isoforms Human genes 0.000 description 1
- 108010029485 Protein Isoforms Proteins 0.000 description 1
- 208000015634 Rectal Neoplasms Diseases 0.000 description 1
- FIXILCYTSAUERA-FXQIFTODSA-N Ser-Ala-Arg Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O FIXILCYTSAUERA-FXQIFTODSA-N 0.000 description 1
- LVVBAKCGXXUHFO-ZLUOBGJFSA-N Ser-Ala-Asp Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(O)=O)C(O)=O LVVBAKCGXXUHFO-ZLUOBGJFSA-N 0.000 description 1
- HRNQLKCLPVKZNE-CIUDSAMLSA-N Ser-Ala-Leu Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(O)=O HRNQLKCLPVKZNE-CIUDSAMLSA-N 0.000 description 1
- YUSRGTQIPCJNHQ-CIUDSAMLSA-N Ser-Arg-Glu Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(O)=O YUSRGTQIPCJNHQ-CIUDSAMLSA-N 0.000 description 1
- UBRXAVQWXOWRSJ-ZLUOBGJFSA-N Ser-Asn-Asp Chemical compound C([C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)O)NC(=O)[C@H](CO)N)C(=O)N UBRXAVQWXOWRSJ-ZLUOBGJFSA-N 0.000 description 1
- VAUMZJHYZQXZBQ-WHFBIAKZSA-N Ser-Asn-Gly Chemical compound OC[C@H](N)C(=O)N[C@@H](CC(N)=O)C(=O)NCC(O)=O VAUMZJHYZQXZBQ-WHFBIAKZSA-N 0.000 description 1
- WXWDPFVKQRVJBJ-CIUDSAMLSA-N Ser-Asn-His Chemical compound C1=C(NC=N1)C[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)N)NC(=O)[C@H](CO)N WXWDPFVKQRVJBJ-CIUDSAMLSA-N 0.000 description 1
- DKKGAAJTDKHWOD-BIIVOSGPSA-N Ser-Asn-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CC(=O)N)NC(=O)[C@H](CO)N)C(=O)O DKKGAAJTDKHWOD-BIIVOSGPSA-N 0.000 description 1
- RDFQNDHEHVSONI-ZLUOBGJFSA-N Ser-Asn-Ser Chemical compound OC[C@H](N)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CO)C(O)=O RDFQNDHEHVSONI-ZLUOBGJFSA-N 0.000 description 1
- VAIZFHMTBFYJIA-ACZMJKKPSA-N Ser-Asp-Gln Chemical compound OC[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(O)=O)CCC(N)=O VAIZFHMTBFYJIA-ACZMJKKPSA-N 0.000 description 1
- FTVRVZNYIYWJGB-ACZMJKKPSA-N Ser-Asp-Glu Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(O)=O FTVRVZNYIYWJGB-ACZMJKKPSA-N 0.000 description 1
- OLIJLNWFEQEFDM-SRVKXCTJSA-N Ser-Asp-Phe Chemical compound OC[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 OLIJLNWFEQEFDM-SRVKXCTJSA-N 0.000 description 1
- GHPQVUYZQQGEDA-BIIVOSGPSA-N Ser-Asp-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CC(=O)O)NC(=O)[C@H](CO)N)C(=O)O GHPQVUYZQQGEDA-BIIVOSGPSA-N 0.000 description 1
- HEQPKICPPDOSIN-SRVKXCTJSA-N Ser-Asp-Tyr Chemical compound OC[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(O)=O)CC1=CC=C(O)C=C1 HEQPKICPPDOSIN-SRVKXCTJSA-N 0.000 description 1
- INCNPLPRPOYTJI-JBDRJPRFSA-N Ser-Cys-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H](CS)NC(=O)[C@H](CO)N INCNPLPRPOYTJI-JBDRJPRFSA-N 0.000 description 1
- CDVFZMOFNJPUDD-ACZMJKKPSA-N Ser-Gln-Asn Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O CDVFZMOFNJPUDD-ACZMJKKPSA-N 0.000 description 1
- ULVMNZOKDBHKKI-ACZMJKKPSA-N Ser-Gln-Asp Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(O)=O)C(O)=O ULVMNZOKDBHKKI-ACZMJKKPSA-N 0.000 description 1
- XWCYBVBLJRWOFR-WDSKDSINSA-N Ser-Gln-Gly Chemical compound OC[C@H](N)C(=O)N[C@@H](CCC(N)=O)C(=O)NCC(O)=O XWCYBVBLJRWOFR-WDSKDSINSA-N 0.000 description 1
- PVDTYLHUWAEYGY-CIUDSAMLSA-N Ser-Glu-Arg Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O PVDTYLHUWAEYGY-CIUDSAMLSA-N 0.000 description 1
- SVWQEIRZHHNBIO-WHFBIAKZSA-N Ser-Gly-Cys Chemical compound [H]N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CS)C(O)=O SVWQEIRZHHNBIO-WHFBIAKZSA-N 0.000 description 1
- WSTIOCFMWXNOCX-YUMQZZPRSA-N Ser-Gly-Lys Chemical compound C(CCN)C[C@@H](C(=O)O)NC(=O)CNC(=O)[C@H](CO)N WSTIOCFMWXNOCX-YUMQZZPRSA-N 0.000 description 1
- UIGMAMGZOJVTDN-WHFBIAKZSA-N Ser-Gly-Ser Chemical compound OC[C@H](N)C(=O)NCC(=O)N[C@@H](CO)C(O)=O UIGMAMGZOJVTDN-WHFBIAKZSA-N 0.000 description 1
- SFTZWNJFZYOLBD-ZDLURKLDSA-N Ser-Gly-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H](N)CO SFTZWNJFZYOLBD-ZDLURKLDSA-N 0.000 description 1
- YIUWWXVTYLANCJ-NAKRPEOUSA-N Ser-Ile-Arg Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O YIUWWXVTYLANCJ-NAKRPEOUSA-N 0.000 description 1
- QYSFWUIXDFJUDW-DCAQKATOSA-N Ser-Leu-Arg Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O QYSFWUIXDFJUDW-DCAQKATOSA-N 0.000 description 1
- GJFYFGOEWLDQGW-GUBZILKMSA-N Ser-Leu-Gln Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)O)NC(=O)[C@H](CO)N GJFYFGOEWLDQGW-GUBZILKMSA-N 0.000 description 1
- IUXGJEIKJBYKOO-SRVKXCTJSA-N Ser-Leu-His Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)NC(=O)[C@H](CO)N IUXGJEIKJBYKOO-SRVKXCTJSA-N 0.000 description 1
- KCGIREHVWRXNDH-GARJFASQSA-N Ser-Leu-Pro Chemical compound CC(C)C[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CO)N KCGIREHVWRXNDH-GARJFASQSA-N 0.000 description 1
- YUJLIIRMIAGMCQ-CIUDSAMLSA-N Ser-Leu-Ser Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(O)=O YUJLIIRMIAGMCQ-CIUDSAMLSA-N 0.000 description 1
- NNFMANHDYSVNIO-DCAQKATOSA-N Ser-Lys-Arg Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O NNFMANHDYSVNIO-DCAQKATOSA-N 0.000 description 1
- PPNPDKGQRFSCAC-CIUDSAMLSA-N Ser-Lys-Asp Chemical compound NCCCC[C@H](NC(=O)[C@@H](N)CO)C(=O)N[C@@H](CC(O)=O)C(O)=O PPNPDKGQRFSCAC-CIUDSAMLSA-N 0.000 description 1
- PTWIYDNFWPXQSD-GARJFASQSA-N Ser-Lys-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CCCCN)NC(=O)[C@H](CO)N)C(=O)O PTWIYDNFWPXQSD-GARJFASQSA-N 0.000 description 1
- LRZLZIUXQBIWTB-KATARQTJSA-N Ser-Lys-Thr Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)O)C(O)=O LRZLZIUXQBIWTB-KATARQTJSA-N 0.000 description 1
- XKFJENWJGHMDLI-QWRGUYRKSA-N Ser-Phe-Gly Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)NCC(O)=O XKFJENWJGHMDLI-QWRGUYRKSA-N 0.000 description 1
- RHAPJNVNWDBFQI-BQBZGAKWSA-N Ser-Pro-Gly Chemical compound OC[C@H](N)C(=O)N1CCC[C@H]1C(=O)NCC(O)=O RHAPJNVNWDBFQI-BQBZGAKWSA-N 0.000 description 1
- OVQZAFXWIWNYKA-GUBZILKMSA-N Ser-Pro-Met Chemical compound CSCC[C@@H](C(=O)O)NC(=O)[C@@H]1CCCN1C(=O)[C@H](CO)N OVQZAFXWIWNYKA-GUBZILKMSA-N 0.000 description 1
- CKDXFSPMIDSMGV-GUBZILKMSA-N Ser-Pro-Val Chemical compound [H]N[C@@H](CO)C(=O)N1CCC[C@H]1C(=O)N[C@@H](C(C)C)C(O)=O CKDXFSPMIDSMGV-GUBZILKMSA-N 0.000 description 1
- BMKNXTJLHFIAAH-CIUDSAMLSA-N Ser-Ser-Leu Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(O)=O BMKNXTJLHFIAAH-CIUDSAMLSA-N 0.000 description 1
- JURQXQBJKUHGJS-UHFFFAOYSA-N Ser-Ser-Ser-Ser Chemical compound OCC(N)C(=O)NC(CO)C(=O)NC(CO)C(=O)NC(CO)C(O)=O JURQXQBJKUHGJS-UHFFFAOYSA-N 0.000 description 1
- RXUOAOOZIWABBW-XGEHTFHBSA-N Ser-Thr-Arg Chemical compound OC[C@H](N)C(=O)N[C@@H]([C@H](O)C)C(=O)N[C@H](C(O)=O)CCCN=C(N)N RXUOAOOZIWABBW-XGEHTFHBSA-N 0.000 description 1
- SQHKXWODKJDZRC-LKXGYXEUSA-N Ser-Thr-Asn Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(O)=O SQHKXWODKJDZRC-LKXGYXEUSA-N 0.000 description 1
- ZKOKTQPHFMRSJP-YJRXYDGGSA-N Ser-Thr-Tyr Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O ZKOKTQPHFMRSJP-YJRXYDGGSA-N 0.000 description 1
- PCMZJFMUYWIERL-ZKWXMUAHSA-N Ser-Val-Asn Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(N)=O)C(O)=O PCMZJFMUYWIERL-ZKWXMUAHSA-N 0.000 description 1
- JZRYFUGREMECBH-XPUUQOCRSA-N Ser-Val-Gly Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(=O)NCC(O)=O JZRYFUGREMECBH-XPUUQOCRSA-N 0.000 description 1
- HNDMFDBQXYZSRM-IHRRRGAJSA-N Ser-Val-Phe Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O HNDMFDBQXYZSRM-IHRRRGAJSA-N 0.000 description 1
- SIEBDTCABMZCLF-XGEHTFHBSA-N Ser-Val-Thr Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O SIEBDTCABMZCLF-XGEHTFHBSA-N 0.000 description 1
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 1
- DDPVJPIGACCMEH-XQXXSGGOSA-N Thr-Ala-Gln Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(N)=O)C(O)=O DDPVJPIGACCMEH-XQXXSGGOSA-N 0.000 description 1
- NAXBBCLCEOTAIG-RHYQMDGZSA-N Thr-Arg-Lys Chemical compound NC(N)=NCCC[C@H](NC(=O)[C@@H](N)[C@H](O)C)C(=O)N[C@@H](CCCCN)C(O)=O NAXBBCLCEOTAIG-RHYQMDGZSA-N 0.000 description 1
- UCCNDUPVIFOOQX-CUJWVEQBSA-N Thr-Cys-His Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@@H](CS)C(=O)N[C@H](C(O)=O)CC1=CN=CN1 UCCNDUPVIFOOQX-CUJWVEQBSA-N 0.000 description 1
- GCXFWAZRHBRYEM-NUMRIWBASA-N Thr-Gln-Asn Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)N[C@@H](CC(=O)N)C(=O)O)N)O GCXFWAZRHBRYEM-NUMRIWBASA-N 0.000 description 1
- WLDUCKSCDRIVLJ-NUMRIWBASA-N Thr-Gln-Asp Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)N[C@@H](CC(=O)O)C(=O)O)N)O WLDUCKSCDRIVLJ-NUMRIWBASA-N 0.000 description 1
- JMGJDTNUMAZNLX-RWRJDSDZSA-N Thr-Glu-Ile Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O JMGJDTNUMAZNLX-RWRJDSDZSA-N 0.000 description 1
- XFTYVCHLARBHBQ-FOHZUACHSA-N Thr-Gly-Asn Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N[C@@H](CC(N)=O)C(O)=O XFTYVCHLARBHBQ-FOHZUACHSA-N 0.000 description 1
- AQAMPXBRJJWPNI-JHEQGTHGSA-N Thr-Gly-Glu Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N[C@@H](CCC(O)=O)C(O)=O AQAMPXBRJJWPNI-JHEQGTHGSA-N 0.000 description 1
- IMULJHHGAUZZFE-MBLNEYKQSA-N Thr-Gly-Ile Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N[C@@H]([C@@H](C)CC)C(O)=O IMULJHHGAUZZFE-MBLNEYKQSA-N 0.000 description 1
- CYVQBKQYQGEELV-NKIYYHGXSA-N Thr-His-Gln Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)N[C@@H](CCC(=O)N)C(=O)O)N)O CYVQBKQYQGEELV-NKIYYHGXSA-N 0.000 description 1
- GMXIJHCBTZDAPD-QPHKQPEJSA-N Thr-Ile-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)O)NC(=O)[C@H]([C@@H](C)O)N GMXIJHCBTZDAPD-QPHKQPEJSA-N 0.000 description 1
- GXUWHVZYDAHFSV-FLBSBUHZSA-N Thr-Ile-Thr Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(O)=O GXUWHVZYDAHFSV-FLBSBUHZSA-N 0.000 description 1
- IHAPJUHCZXBPHR-WZLNRYEVSA-N Thr-Ile-Tyr Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)O)NC(=O)[C@H]([C@@H](C)O)N IHAPJUHCZXBPHR-WZLNRYEVSA-N 0.000 description 1
- XSEPSRUDSPHMPX-KATARQTJSA-N Thr-Lys-Ser Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CO)C(O)=O XSEPSRUDSPHMPX-KATARQTJSA-N 0.000 description 1
- PZSDPRBZINDEJV-HTUGSXCWSA-N Thr-Phe-Gln Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CCC(N)=O)C(O)=O PZSDPRBZINDEJV-HTUGSXCWSA-N 0.000 description 1
- WNQJTLATMXYSEL-OEAJRASXSA-N Thr-Phe-Leu Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC(C)C)C(O)=O WNQJTLATMXYSEL-OEAJRASXSA-N 0.000 description 1
- XIHGJKFSIDTDKV-LYARXQMPSA-N Thr-Phe-Trp Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC1=CNC2=C1C=CC=C2)C(O)=O XIHGJKFSIDTDKV-LYARXQMPSA-N 0.000 description 1
- MEBDIIKMUUNBSB-RPTUDFQQSA-N Thr-Phe-Tyr Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O MEBDIIKMUUNBSB-RPTUDFQQSA-N 0.000 description 1
- NWECYMJLJGCBOD-UNQGMJICSA-N Thr-Phe-Val Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](C(C)C)C(O)=O NWECYMJLJGCBOD-UNQGMJICSA-N 0.000 description 1
- MUAFDCVOHYAFNG-RCWTZXSCSA-N Thr-Pro-Arg Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCCNC(N)=N)C(O)=O MUAFDCVOHYAFNG-RCWTZXSCSA-N 0.000 description 1
- MXDOAJQRJBMGMO-FJXKBIBVSA-N Thr-Pro-Gly Chemical compound C[C@@H](O)[C@H](N)C(=O)N1CCC[C@H]1C(=O)NCC(O)=O MXDOAJQRJBMGMO-FJXKBIBVSA-N 0.000 description 1
- ZESGVALRVJIVLZ-VFCFLDTKSA-N Thr-Thr-Pro Chemical compound C[C@H]([C@@H](C(=O)N[C@@H]([C@@H](C)O)C(=O)N1CCC[C@@H]1C(=O)O)N)O ZESGVALRVJIVLZ-VFCFLDTKSA-N 0.000 description 1
- LECUEEHKUFYOOV-ZJDVBMNYSA-N Thr-Thr-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@@H](N)[C@@H](C)O LECUEEHKUFYOOV-ZJDVBMNYSA-N 0.000 description 1
- PELIQFPESHBTMA-WLTAIBSBSA-N Thr-Tyr-Gly Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@H](C(=O)NCC(O)=O)CC1=CC=C(O)C=C1 PELIQFPESHBTMA-WLTAIBSBSA-N 0.000 description 1
- YOPQYBJJNSIQGZ-JNPHEJMOSA-N Thr-Tyr-Tyr Chemical compound C([C@H](NC(=O)[C@@H](N)[C@H](O)C)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(O)=O)C1=CC=C(O)C=C1 YOPQYBJJNSIQGZ-JNPHEJMOSA-N 0.000 description 1
- 102000006601 Thymidine Kinase Human genes 0.000 description 1
- 108020004440 Thymidine kinase Proteins 0.000 description 1
- 208000033781 Thyroid carcinoma Diseases 0.000 description 1
- 208000024770 Thyroid neoplasm Diseases 0.000 description 1
- 108091023040 Transcription factor Proteins 0.000 description 1
- 102000040945 Transcription factor Human genes 0.000 description 1
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 1
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 1
- VZBWRZGNEPBRDE-HZUKXOBISA-N Trp-Ala-Pro Chemical compound C[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CC2=CNC3=CC=CC=C32)N VZBWRZGNEPBRDE-HZUKXOBISA-N 0.000 description 1
- ADBFWLXCCKIXBQ-XIRDDKMYSA-N Trp-Asn-Leu Chemical compound CC(C)C[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)N)NC(=O)[C@H](CC1=CNC2=CC=CC=C21)N ADBFWLXCCKIXBQ-XIRDDKMYSA-N 0.000 description 1
- BOMYCJXTWRMKJA-RNXOBYDBSA-N Trp-Phe-Phe Chemical compound C1=CC=C(C=C1)C[C@@H](C(=O)N[C@@H](CC2=CC=CC=C2)C(=O)O)NC(=O)[C@H](CC3=CNC4=CC=CC=C43)N BOMYCJXTWRMKJA-RNXOBYDBSA-N 0.000 description 1
- NMOIRIIIUVELLY-WDSOQIARSA-N Trp-Val-Leu Chemical compound C1=CC=C2C(C[C@H](N)C(=O)N[C@H](C(=O)N[C@@H](CC(C)C)C(O)=O)C(C)C)=CNC2=C1 NMOIRIIIUVELLY-WDSOQIARSA-N 0.000 description 1
- 206010064390 Tumour invasion Diseases 0.000 description 1
- VCXWRWYFJLXITF-AUTRQRHGSA-N Tyr-Ala-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](N)CC1=CC=C(O)C=C1 VCXWRWYFJLXITF-AUTRQRHGSA-N 0.000 description 1
- OOEUVMFKKZYSRX-LEWSCRJBSA-N Tyr-Ala-Pro Chemical compound C[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CC2=CC=C(C=C2)O)N OOEUVMFKKZYSRX-LEWSCRJBSA-N 0.000 description 1
- IIJWXEUNETVJPV-IHRRRGAJSA-N Tyr-Arg-Ser Chemical compound C1=CC(=CC=C1C[C@@H](C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CO)C(=O)O)N)O IIJWXEUNETVJPV-IHRRRGAJSA-N 0.000 description 1
- QOIKZODVIPOPDD-AVGNSLFASA-N Tyr-Cys-Gln Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(O)=O QOIKZODVIPOPDD-AVGNSLFASA-N 0.000 description 1
- QUILOGWWLXMSAT-IHRRRGAJSA-N Tyr-Gln-Gln Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(O)=O QUILOGWWLXMSAT-IHRRRGAJSA-N 0.000 description 1
- RYSNTWVRSLCAJZ-RYUDHWBXSA-N Tyr-Gln-Gly Chemical compound OC(=O)CNC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](N)CC1=CC=C(O)C=C1 RYSNTWVRSLCAJZ-RYUDHWBXSA-N 0.000 description 1
- CKHQKYHIZCRTAP-SOUVJXGZSA-N Tyr-Gln-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CCC(=O)N)NC(=O)[C@H](CC2=CC=C(C=C2)O)N)C(=O)O CKHQKYHIZCRTAP-SOUVJXGZSA-N 0.000 description 1
- NZFCWALTLNFHHC-JYJNAYRXSA-N Tyr-Glu-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](N)CC1=CC=C(O)C=C1 NZFCWALTLNFHHC-JYJNAYRXSA-N 0.000 description 1
- CTDPLKMBVALCGN-JSGCOSHPSA-N Tyr-Gly-Val Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)NCC(=O)N[C@@H](C(C)C)C(O)=O CTDPLKMBVALCGN-JSGCOSHPSA-N 0.000 description 1
- KHCSOLAHNLOXJR-BZSNNMDCSA-N Tyr-Leu-Leu Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O KHCSOLAHNLOXJR-BZSNNMDCSA-N 0.000 description 1
- VTCKHZJKWQENKX-KBPBESRZSA-N Tyr-Lys-Gly Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CCCCN)C(=O)NCC(O)=O VTCKHZJKWQENKX-KBPBESRZSA-N 0.000 description 1
- UPODKYBYUBTWSV-BZSNNMDCSA-N Tyr-Phe-Cys Chemical compound C([C@H](N)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CS)C(O)=O)C1=CC=C(O)C=C1 UPODKYBYUBTWSV-BZSNNMDCSA-N 0.000 description 1
- VXFXIBCCVLJCJT-JYJNAYRXSA-N Tyr-Pro-Pro Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N1CCC[C@H]1C(=O)N1CCC[C@H]1C(O)=O VXFXIBCCVLJCJT-JYJNAYRXSA-N 0.000 description 1
- LUMQYLVYUIRHHU-YJRXYDGGSA-N Tyr-Ser-Thr Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(O)=O LUMQYLVYUIRHHU-YJRXYDGGSA-N 0.000 description 1
- PLVVHGFEMSDRET-IHPCNDPISA-N Tyr-Ser-Trp Chemical compound C1=CC=C2C(=C1)C(=CN2)C[C@@H](C(=O)O)NC(=O)[C@H](CO)NC(=O)[C@H](CC3=CC=C(C=C3)O)N PLVVHGFEMSDRET-IHPCNDPISA-N 0.000 description 1
- DTWMJYGOUWNWEC-IHPCNDPISA-N Tyr-Trp-Cys Chemical compound C([C@H](N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CS)C(O)=O)C1=CC=C(O)C=C1 DTWMJYGOUWNWEC-IHPCNDPISA-N 0.000 description 1
- MQUYPYFPHIPVHJ-MNSWYVGCSA-N Tyr-Trp-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CC1=CNC2=CC=CC=C21)NC(=O)[C@H](CC3=CC=C(C=C3)O)N)O MQUYPYFPHIPVHJ-MNSWYVGCSA-N 0.000 description 1
- AEOFMCAKYIQQFY-YDHLFZDLSA-N Tyr-Val-Asn Chemical compound NC(=O)C[C@@H](C(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@@H](N)CC1=CC=C(O)C=C1 AEOFMCAKYIQQFY-YDHLFZDLSA-N 0.000 description 1
- 229940127174 UCHT1 Drugs 0.000 description 1
- YFOCMOVJBQDBCE-NRPADANISA-N Val-Ala-Glu Chemical compound C[C@@H](C(=O)N[C@@H](CCC(=O)O)C(=O)O)NC(=O)[C@H](C(C)C)N YFOCMOVJBQDBCE-NRPADANISA-N 0.000 description 1
- RUCNAYOMFXRIKJ-DCAQKATOSA-N Val-Ala-Lys Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CCCCN RUCNAYOMFXRIKJ-DCAQKATOSA-N 0.000 description 1
- SLLKXDSRVAOREO-KZVJFYERSA-N Val-Ala-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](C)NC(=O)[C@H](C(C)C)N)O SLLKXDSRVAOREO-KZVJFYERSA-N 0.000 description 1
- VJOWWOGRNXRQMF-UVBJJODRSA-N Val-Ala-Trp Chemical compound C1=CC=C2C(C[C@H](NC(=O)[C@H](C)NC(=O)[C@@H](N)C(C)C)C(O)=O)=CNC2=C1 VJOWWOGRNXRQMF-UVBJJODRSA-N 0.000 description 1
- LABUITCFCAABSV-BPNCWPANSA-N Val-Ala-Tyr Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CC1=CC=C(O)C=C1 LABUITCFCAABSV-BPNCWPANSA-N 0.000 description 1
- LABUITCFCAABSV-UHFFFAOYSA-N Val-Ala-Tyr Natural products CC(C)C(N)C(=O)NC(C)C(=O)NC(C(O)=O)CC1=CC=C(O)C=C1 LABUITCFCAABSV-UHFFFAOYSA-N 0.000 description 1
- CVUDMNSZAIZFAE-UHFFFAOYSA-N Val-Arg-Pro Natural products NC(N)=NCCCC(NC(=O)C(N)C(C)C)C(=O)N1CCCC1C(O)=O CVUDMNSZAIZFAE-UHFFFAOYSA-N 0.000 description 1
- VMRFIKXKOFNMHW-GUBZILKMSA-N Val-Arg-Ser Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CO)C(=O)O)N VMRFIKXKOFNMHW-GUBZILKMSA-N 0.000 description 1
- LHADRQBREKTRLR-DCAQKATOSA-N Val-Cys-Leu Chemical compound CC(C)C[C@@H](C(=O)O)NC(=O)[C@H](CS)NC(=O)[C@H](C(C)C)N LHADRQBREKTRLR-DCAQKATOSA-N 0.000 description 1
- XJFXZQKJQGYFMM-GUBZILKMSA-N Val-Cys-Val Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](C(C)C)C(=O)O)N XJFXZQKJQGYFMM-GUBZILKMSA-N 0.000 description 1
- OXVPMZVGCAPFIG-BQFCYCMXSA-N Val-Gln-Trp Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)N[C@@H](CC1=CNC2=CC=CC=C21)C(=O)O)N OXVPMZVGCAPFIG-BQFCYCMXSA-N 0.000 description 1
- VCAWFLIWYNMHQP-UKJIMTQDSA-N Val-Glu-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)O)NC(=O)[C@H](C(C)C)N VCAWFLIWYNMHQP-UKJIMTQDSA-N 0.000 description 1
- ROLGIBMFNMZANA-GVXVVHGQSA-N Val-Glu-Leu Chemical compound CC(C)C[C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)O)NC(=O)[C@H](C(C)C)N ROLGIBMFNMZANA-GVXVVHGQSA-N 0.000 description 1
- KZKMBGXCNLPYKD-YEPSODPASA-N Val-Gly-Thr Chemical compound CC(C)[C@H](N)C(=O)NCC(=O)N[C@@H]([C@@H](C)O)C(O)=O KZKMBGXCNLPYKD-YEPSODPASA-N 0.000 description 1
- HQYVQDRYODWONX-DCAQKATOSA-N Val-His-Ser Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)N[C@@H](CO)C(=O)O)N HQYVQDRYODWONX-DCAQKATOSA-N 0.000 description 1
- APQIVBCUIUDSMB-OSUNSFLBSA-N Val-Ile-Thr Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H]([C@@H](C)O)C(=O)O)NC(=O)[C@H](C(C)C)N APQIVBCUIUDSMB-OSUNSFLBSA-N 0.000 description 1
- WBAJDGWKRIHOAC-GVXVVHGQSA-N Val-Lys-Gln Chemical compound [H]N[C@@H](C(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(N)=O)C(O)=O WBAJDGWKRIHOAC-GVXVVHGQSA-N 0.000 description 1
- DIOSYUIWOQCXNR-ONGXEEELSA-N Val-Lys-Gly Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](CCCCN)C(=O)NCC(O)=O DIOSYUIWOQCXNR-ONGXEEELSA-N 0.000 description 1
- JAKHAONCJJZVHT-DCAQKATOSA-N Val-Lys-Ser Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CO)C(=O)O)N JAKHAONCJJZVHT-DCAQKATOSA-N 0.000 description 1
- ILMVQSHENUZYIZ-JYJNAYRXSA-N Val-Met-Tyr Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)O)N ILMVQSHENUZYIZ-JYJNAYRXSA-N 0.000 description 1
- SSYBNWFXCFNRFN-GUBZILKMSA-N Val-Pro-Ser Chemical compound CC(C)[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CO)C(O)=O SSYBNWFXCFNRFN-GUBZILKMSA-N 0.000 description 1
- QSPOLEBZTMESFY-SRVKXCTJSA-N Val-Pro-Val Chemical compound CC(C)[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](C(C)C)C(O)=O QSPOLEBZTMESFY-SRVKXCTJSA-N 0.000 description 1
- DEGUERSKQBRZMZ-FXQIFTODSA-N Val-Ser-Ala Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](C)C(O)=O DEGUERSKQBRZMZ-FXQIFTODSA-N 0.000 description 1
- GBIUHAYJGWVNLN-AEJSXWLSSA-N Val-Ser-Pro Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CO)C(=O)N1CCC[C@@H]1C(=O)O)N GBIUHAYJGWVNLN-AEJSXWLSSA-N 0.000 description 1
- MNSSBIHFEUUXNW-RCWTZXSCSA-N Val-Thr-Arg Chemical compound CC(C)[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@H](C(O)=O)CCCN=C(N)N MNSSBIHFEUUXNW-RCWTZXSCSA-N 0.000 description 1
- RTJPAGFXOWEBAI-SRVKXCTJSA-N Val-Val-Arg Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@H](C(O)=O)CCCN=C(N)N RTJPAGFXOWEBAI-SRVKXCTJSA-N 0.000 description 1
- 206010047700 Vomiting Diseases 0.000 description 1
- 210000001015 abdomen Anatomy 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 239000012190 activator Substances 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 230000010398 acute inflammatory response Effects 0.000 description 1
- 108010076324 alanyl-glycyl-glycine Proteins 0.000 description 1
- 108010047495 alanylglycine Proteins 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 238000011398 antitumor immunotherapy Methods 0.000 description 1
- 108010009111 arginyl-glycyl-glutamic acid Proteins 0.000 description 1
- 108010043240 arginyl-leucyl-glycine Proteins 0.000 description 1
- 108010010430 asparagine-proline-alanine Proteins 0.000 description 1
- 108010077245 asparaginyl-proline Proteins 0.000 description 1
- 108010068265 aspartyltyrosine Proteins 0.000 description 1
- 238000003149 assay kit Methods 0.000 description 1
- 239000011324 bead Substances 0.000 description 1
- 102000023732 binding proteins Human genes 0.000 description 1
- 108091008324 binding proteins Proteins 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 210000000601 blood cell Anatomy 0.000 description 1
- 230000017531 blood circulation Effects 0.000 description 1
- 210000001185 bone marrow Anatomy 0.000 description 1
- 201000008275 breast carcinoma Diseases 0.000 description 1
- 230000009400 cancer invasion Effects 0.000 description 1
- 101150058049 car gene Proteins 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 239000006285 cell suspension Substances 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 230000004087 circulation Effects 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 208000029742 colonic neoplasm Diseases 0.000 description 1
- 201000010989 colorectal carcinoma Diseases 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 238000012937 correction Methods 0.000 description 1
- 108010069495 cysteinyltyrosine Proteins 0.000 description 1
- 210000000805 cytoplasm Anatomy 0.000 description 1
- 230000002354 daily effect Effects 0.000 description 1
- 230000007812 deficiency Effects 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 231100000371 dose-limiting toxicity Toxicity 0.000 description 1
- 210000001198 duodenum Anatomy 0.000 description 1
- 238000002592 echocardiography Methods 0.000 description 1
- 210000003162 effector t lymphocyte Anatomy 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 210000002472 endoplasmic reticulum Anatomy 0.000 description 1
- YQGOJNYOYNNSMM-UHFFFAOYSA-N eosin Chemical compound [Na+].OC(=O)C1=CC=CC=C1C1=C2C=C(Br)C(=O)C(Br)=C2OC2=C(Br)C(O)=C(Br)C=C21 YQGOJNYOYNNSMM-UHFFFAOYSA-N 0.000 description 1
- 230000008029 eradication Effects 0.000 description 1
- 210000003743 erythrocyte Anatomy 0.000 description 1
- 210000003238 esophagus Anatomy 0.000 description 1
- 210000003527 eukaryotic cell Anatomy 0.000 description 1
- 230000003203 everyday effect Effects 0.000 description 1
- 208000021045 exocrine pancreatic carcinoma Diseases 0.000 description 1
- 239000013604 expression vector Substances 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 210000004700 fetal blood Anatomy 0.000 description 1
- 239000012091 fetal bovine serum Substances 0.000 description 1
- 230000001605 fetal effect Effects 0.000 description 1
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 1
- 238000005194 fractionation Methods 0.000 description 1
- 238000004362 fungal culture Methods 0.000 description 1
- 230000005021 gait Effects 0.000 description 1
- 210000000232 gallbladder Anatomy 0.000 description 1
- 201000006585 gastric adenocarcinoma Diseases 0.000 description 1
- 206010017758 gastric cancer Diseases 0.000 description 1
- 208000010749 gastric carcinoma Diseases 0.000 description 1
- 238000012239 gene modification Methods 0.000 description 1
- 238000001415 gene therapy Methods 0.000 description 1
- 230000005017 genetic modification Effects 0.000 description 1
- 235000013617 genetically modified food Nutrition 0.000 description 1
- 108010078144 glutaminyl-glycine Proteins 0.000 description 1
- 108010073628 glutamyl-valyl-phenylalanine Proteins 0.000 description 1
- 108010079547 glutamylmethionine Proteins 0.000 description 1
- VPZXBVLAVMBEQI-UHFFFAOYSA-N glycyl-DL-alpha-alanine Natural products OC(=O)C(C)NC(=O)CN VPZXBVLAVMBEQI-UHFFFAOYSA-N 0.000 description 1
- XBGGUPMXALFZOT-UHFFFAOYSA-N glycyl-L-tyrosine hemihydrate Natural products NCC(=O)NC(C(O)=O)CC1=CC=C(O)C=C1 XBGGUPMXALFZOT-UHFFFAOYSA-N 0.000 description 1
- 108010090037 glycyl-alanyl-isoleucine Proteins 0.000 description 1
- 108010078326 glycyl-glycyl-valine Proteins 0.000 description 1
- 108010050475 glycyl-leucyl-tyrosine Proteins 0.000 description 1
- 108010048994 glycyl-tyrosyl-alanine Proteins 0.000 description 1
- 108010077515 glycylproline Proteins 0.000 description 1
- 108010087823 glycyltyrosine Proteins 0.000 description 1
- 210000003714 granulocyte Anatomy 0.000 description 1
- 230000035876 healing Effects 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 210000003958 hematopoietic stem cell Anatomy 0.000 description 1
- 210000005161 hepatic lobe Anatomy 0.000 description 1
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 1
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 1
- 108010040030 histidinoalanine Proteins 0.000 description 1
- 108010092114 histidylphenylalanine Proteins 0.000 description 1
- KJZYNXUDTRRSPN-OUBTZVSYSA-N holmium-166 Chemical compound [166Ho] KJZYNXUDTRRSPN-OUBTZVSYSA-N 0.000 description 1
- 229920001519 homopolymer Polymers 0.000 description 1
- 230000002806 hypometabolic effect Effects 0.000 description 1
- 238000011532 immunohistochemical staining Methods 0.000 description 1
- 238000003364 immunohistochemistry Methods 0.000 description 1
- 239000000367 immunologic factor Substances 0.000 description 1
- 239000002955 immunomodulating agent Substances 0.000 description 1
- 230000036046 immunoreaction Effects 0.000 description 1
- 230000004957 immunoregulator effect Effects 0.000 description 1
- 229960003444 immunosuppressant agent Drugs 0.000 description 1
- 230000001861 immunosuppressant effect Effects 0.000 description 1
- 210000005008 immunosuppressive cell Anatomy 0.000 description 1
- 230000001024 immunotherapeutic effect Effects 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 108010044374 isoleucyl-tyrosine Proteins 0.000 description 1
- 230000002147 killing effect Effects 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 210000005162 left hepatic lobe Anatomy 0.000 description 1
- 108010034529 leucyl-lysine Proteins 0.000 description 1
- 108010044056 leucyl-phenylalanine Proteins 0.000 description 1
- 108010073472 leucyl-prolyl-proline Proteins 0.000 description 1
- 108010012058 leucyltyrosine Proteins 0.000 description 1
- 108020001756 ligand binding domains Proteins 0.000 description 1
- 238000007449 liver function test Methods 0.000 description 1
- 238000000464 low-speed centrifugation Methods 0.000 description 1
- 201000005296 lung carcinoma Diseases 0.000 description 1
- 210000001165 lymph node Anatomy 0.000 description 1
- 230000002934 lysing effect Effects 0.000 description 1
- 108010003700 lysyl aspartic acid Proteins 0.000 description 1
- 108010043322 lysyl-tryptophyl-alpha-lysine Proteins 0.000 description 1
- 108010064235 lysylglycine Proteins 0.000 description 1
- 108010017391 lysylvaline Proteins 0.000 description 1
- 238000007726 management method Methods 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 208000037819 metastatic cancer Diseases 0.000 description 1
- 208000011575 metastatic malignant neoplasm Diseases 0.000 description 1
- 238000003032 molecular docking Methods 0.000 description 1
- 239000003068 molecular probe Substances 0.000 description 1
- 210000001616 monocyte Anatomy 0.000 description 1
- 210000005087 mononuclear cell Anatomy 0.000 description 1
- 230000002071 myeloproliferative effect Effects 0.000 description 1
- 210000000581 natural killer T-cell Anatomy 0.000 description 1
- 230000008693 nausea Effects 0.000 description 1
- 210000000440 neutrophil Anatomy 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- 210000000496 pancreas Anatomy 0.000 description 1
- 208000008443 pancreatic carcinoma Diseases 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 229930192851 perforin Natural products 0.000 description 1
- 230000010412 perfusion Effects 0.000 description 1
- 210000003200 peritoneal cavity Anatomy 0.000 description 1
- 108010018625 phenylalanylarginine Proteins 0.000 description 1
- 108010083476 phenylalanyltryptophan Proteins 0.000 description 1
- 229940097886 phosphorus 32 Drugs 0.000 description 1
- 239000002952 polymeric resin Substances 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 208000037821 progressive disease Diseases 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 108010031719 prolyl-serine Proteins 0.000 description 1
- 108010079317 prolyl-tyrosine Proteins 0.000 description 1
- 108010004914 prolylarginine Proteins 0.000 description 1
- 108010070643 prolylglutamic acid Proteins 0.000 description 1
- 230000000644 propagated effect Effects 0.000 description 1
- 230000001902 propagating effect Effects 0.000 description 1
- 210000002307 prostate Anatomy 0.000 description 1
- 229940048914 protamine Drugs 0.000 description 1
- 229950008679 protamine sulfate Drugs 0.000 description 1
- 238000003753 real-time PCR Methods 0.000 description 1
- 201000001275 rectum cancer Diseases 0.000 description 1
- 230000010076 replication Effects 0.000 description 1
- 230000008672 reprogramming Effects 0.000 description 1
- 238000002271 resection Methods 0.000 description 1
- 108010056030 retronectin Proteins 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 210000005163 right hepatic lobe Anatomy 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 238000010187 selection method Methods 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 108010069117 seryl-lysyl-aspartic acid Proteins 0.000 description 1
- 230000019491 signal transduction Effects 0.000 description 1
- 238000002603 single-photon emission computed tomography Methods 0.000 description 1
- 150000003384 small molecules Chemical class 0.000 description 1
- 125000006850 spacer group Chemical group 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 230000010473 stable expression Effects 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 201000000498 stomach carcinoma Diseases 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 230000001360 synchronised effect Effects 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 229920003002 synthetic resin Polymers 0.000 description 1
- 230000008685 targeting Effects 0.000 description 1
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 1
- 238000011287 therapeutic dose Methods 0.000 description 1
- 210000001541 thymus gland Anatomy 0.000 description 1
- 201000002510 thyroid cancer Diseases 0.000 description 1
- 208000013077 thyroid gland carcinoma Diseases 0.000 description 1
- 238000013518 transcription Methods 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- 230000002463 transducing effect Effects 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 230000009261 transgenic effect Effects 0.000 description 1
- 230000005945 translocation Effects 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- 230000005909 tumor killing Effects 0.000 description 1
- 108010020532 tyrosyl-proline Proteins 0.000 description 1
- 108010071635 tyrosyl-prolyl-arginine Proteins 0.000 description 1
- 108010003137 tyrosyltyrosine Proteins 0.000 description 1
- 241000701161 unidentified adenovirus Species 0.000 description 1
- 108010073969 valyllysine Proteins 0.000 description 1
- 238000012800 visualization Methods 0.000 description 1
- 230000008673 vomiting Effects 0.000 description 1
- 230000003442 weekly effect Effects 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2239/00—Indexing codes associated with cellular immunotherapy of group A61K39/46
- A61K2239/31—Indexing codes associated with cellular immunotherapy of group A61K39/46 characterized by the route of administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2239/00—Indexing codes associated with cellular immunotherapy of group A61K39/46
- A61K2239/38—Indexing codes associated with cellular immunotherapy of group A61K39/46 characterised by the dose, timing or administration schedule
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2239/00—Indexing codes associated with cellular immunotherapy of group A61K39/46
- A61K2239/46—Indexing codes associated with cellular immunotherapy of group A61K39/46 characterised by the cancer treated
- A61K2239/50—Colon
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/14—Blood; Artificial blood
- A61K35/17—Lymphocytes; B-cells; T-cells; Natural killer cells; Interferon-activated or cytokine-activated lymphocytes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
- A61K38/20—Interleukins [IL]
- A61K38/2013—IL-2
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/461—Cellular immunotherapy characterised by the cell type used
- A61K39/4611—T-cells, e.g. tumor infiltrating lymphocytes [TIL], lymphokine-activated killer cells [LAK] or regulatory T cells [Treg]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/463—Cellular immunotherapy characterised by recombinant expression
- A61K39/4631—Chimeric Antigen Receptors [CAR]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/464—Cellular immunotherapy characterised by the antigen targeted or presented
- A61K39/4643—Vertebrate antigens
- A61K39/4644—Cancer antigens
- A61K39/46448—Cancer antigens from embryonic or fetal origin
- A61K39/464482—Carcinoembryonic antigen [CEA]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/7051—T-cell receptor (TcR)-CD3 complex
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0634—Cells from the blood or the immune system
- C12N5/0636—T lymphocytes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/01—Fusion polypeptide containing a localisation/targetting motif
- C07K2319/03—Fusion polypeptide containing a localisation/targetting motif containing a transmembrane segment
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/33—Fusion polypeptide fusions for targeting to specific cell types, e.g. tissue specific targeting, targeting of a bacterial subspecies
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2510/00—Genetically modified cells
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Immunology (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Cell Biology (AREA)
- Zoology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Microbiology (AREA)
- Biomedical Technology (AREA)
- Genetics & Genomics (AREA)
- Gastroenterology & Hepatology (AREA)
- Mycology (AREA)
- Biotechnology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biochemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Wood Science & Technology (AREA)
- Oncology (AREA)
- Hematology (AREA)
- Biophysics (AREA)
- Molecular Biology (AREA)
- General Engineering & Computer Science (AREA)
- Toxicology (AREA)
- Pregnancy & Childbirth (AREA)
- Reproductive Health (AREA)
- Gynecology & Obstetrics (AREA)
- Dermatology (AREA)
- Virology (AREA)
- Developmental Biology & Embryology (AREA)
Abstract
대상체에서 간 전이의 치료를 위한 조성물 및 방법이 본 명세서에 개시된다. 상기 방법은 종양 항원, 예컨대 암배아성 항원(CEA)에 매우 특이적인 키메라 항원 수용체 변형된 T 세포(CAR-T)의 간 동맥 주입(HAI)을 포함한다. HAI 방법은 건강한 세포에 대한 노출을 최소화하면서 전이성 세포에 대한 변형된 세포의 노출을 최대화하도록 최적화된다. 상기 방법은 제2 치료제, 예컨대 IL-2의 동시투여를 포함한다.
Description
관련 출원에 대한 상호 참조
본원은 2015년 4월 15일자로 출원된 미국 가출원 제62/147,793호(이의 내용은 그 전문이 참고로 포함됨)의 이익을 주장한다.
정부 이익에 관한 성명
본 발명은 국립 보건원이 허여한 계약 K08CA160662 하에 정부 지원에 의해 이루어졌다. 정부는 본 발명에서 소정의 권한을 가진다.
서열
목록에 대한 참조
서열 목록은 2016년 4월 14일에 생성되고, 명칭이 "0962010121SequenceListing.txt"(14,034 바이트)인 텍스트 파일의 형태로 EFS를 통해 전자로 제출되고, 이의 내용은 본 명세서에 그 전문이 참고로 포함된다.
기술 분야
본 명세서에 기재된 대상은, 종양 특이적 항원에 결합하고 변형된 T 세포의 활성을 활성화하는, 수용체 단백질을 발현하는 유전적으로 변형된 또는 키메라 항원 수용체 T 세포(예를 들어, CAR-T(chimeric antigen receptor T cell))의 간 동맥 주입을 통해 간 연관 암 및 전이를 치료하는 방법에 관한 것이다.
간 전이(liver metastasis: LM)는 신체의 또 다른 부분으로부터 간으로 전이되는 암성 종양이다. 간 전이의 대부분의 사례는 결장 또는 직장암으로부터 발생하고, 결장직장암을 가지는 사람의 대략 60 내지 70%는 결국 간 종양을 발생시킨다. 간 전이는 위장 선암을 가지는 환자에서 이환율 및 사망률의 중요한 원인이다. 간 절제가 절제 가능한 간 전이를 가지는 환자에 대한 치유 표준으로 생각되지만, 많은 환자는 간 전이의 절제에 대한 후보자가 아니다. 화학치료제는 간 전이에 치유 가능하지 않아서, 큰 충족되지 않은 임상 수요를 생성한다.
종양 침윤 림프구(tumor infiltrating lymphocyte: TIL) 연구는 LM에 대한 숙주 T 세포 반응이 환자 생존과 상당히 상관된다는 것을 밝혀냈다(Katz et al., 2013, Ann Surg Oncol, 20:946-955; Katz et al., 2010, HPB (Oxford), 12:674-683; Katz et al., Ann Surg Oncol, 16:2524-2530; Wagner et al., 2008, Ann Surg Oncol, 15:2310-2317; Turcotte et al., Canc Immunol Res, 2:530-537). LM에 효과적인 면역 반응을 시작한 사람이 연장된 생존을 가지는 경향이 있지만, 압도적인 대부분의 환자는 내인성 면역 실패의 상황에서 이의 질환에 빠진다. 간내 환경의 면역억제 성질(Cantor et al., 1967, Nature, 215:744-745; Katz et al., 2005, Hepatol, 42:293-300; Katz et al., 2004, J Immunol, 173:230-235; Katz et al., 2011, J Immunol, 187:1150-1156)은 LM의 발생을 촉진하고 공격적인 질환 생물학에 기여할 수 있다.
따라서, 숙주를 촉진하거나 간 전이의 존재에 대한 면역학적 반응을 제공할 수 있는 치료학적 전략에 대한 수요가 존재한다. 튼튼한 간 TIL 반응의 양호한 효과 및 간내 공간의 고유한 억제 성질을 고려하여, LM의 치료를 위한 매우 특이적인 면역반응성 세포의 전달은 합리적인 접근법이다. 간외 독성을 제한하면서 간 전이의 치료에 대한 효능을 최적화할 수 있는 항-CEA CAR-T의 간 동맥 주입(hepatic artery infusion: HAI)을 위한 조성물 및 방법이 본 명세서에 기재되어 있다.
하기 양태 및 하기 기재되고 예시된 이의 실시형태는 예시적이고, 범위에서 제한이 아니라 예시인 것으로 의도된다.
일 양태에서, 간 전이를 가지는 것으로 진단된 대상체에서 간 전이를 치료하는 방법이 제공되고, 상기 방법은 키메라 항원 T 세포 수용체 단백질(CAR)을 발현하는 면역반응성 세포를 포함하는 대상체 조성물의 간 동맥에 주입하는 단계를 포함하고, 키메라 T 세포 수용체 단백질은 간에서 전이성 세포 상에 발현된 항원에 결합한다.
몇몇 실시형태에서, CAR를 발현하는 면역반응성 세포는 T 세포, 조혈 줄기 세포, 자연 살해 세포, 자연 살해 T 세포, B 세포 및 단핵 계통의 세포로 이루어진 군으로부터 선택된다. 특정한 실시형태에서, 면역반응성 세포는 T 세포이다.
몇몇 실시형태에서, 면역반응성 세포는 대상체에 자가조직이다. 또 다른 실시형태에서, 면역반응성 세포는 대상체에 자가조직이 아니다.
몇몇 실시형태에서, 면역반응성 세포는 T 세포이고, 상기 방법은 대상체의 혈액 혈청으로부터 세포를 수확하는 단계를 포함한다. 다른 실시형태에서, 최소 108개, 109개 또는 1010개의 세포가 대상체의 혈액 혈청으로부터 수확된다. 훨씬 다른 실시형태에서, 상기 방법은 자가조직 T 세포의 집단을 생성하기 위해 수확된 세포로부터 말초 혈액 단핵 세포(PBMC)를 단리하고 활성화하는 단계를 추가로 포함한다.
몇몇 실시형태에서, 상기 방법은 면역반응성 세포를 CAR 서열을 코딩하는 핵산 서열을 포함하는 핵산 벡터에 의해 형질감염시켜 CAR 단백질을 발현하는 면역반응성 세포의 집단을 생성하는 단계를 포함한다. 다른 실시형태에서, 상기 방법은 CAR 단백질을 발현하는 면역반응성 세포의 집단을 선택하고 증식시키는 단계를 추가로 포함한다. 몇몇 실시형태에서, 면역반응성 세포는 자가조직 T 세포의 집단이다.
몇몇 실시형태에서, 상기 방법은 약 1 내지 8주, 2 내지 8주, 2 내지 6주, 2 내지 4주, 1 내지 4주, 1 내지 3주, 1 내지 2주, 3 내지 6주, 또는 4 내지 6주의 범위의 치료 기간에 걸쳐 환자에게 CAR 단백질을 발현하는 면역반응성 세포의 용량을 주입하는 단계를 포함한다. 다른 실시형태에서, CAR을 발현하는 면역반응성 세포를 주입하는 단계는 치료 기간에 걸쳐 1주, 2주, 3주 또는 4주마다 세포를 주입하는 단계를 포함한다. 바람직한 실시형태에서, CAR을 발현하는 면역반응성 세포를 주입하는 단계는 3주 동안 주마다 1회 CEA CAR-T 세포를 주입하는 단계를 포함한다.
몇몇 실시형태에서, CAR를 발현하고(CAR-T 세포), CAR이 CEA에 결합하는 면역반응성 세포는 자가조직 T 세포이다. 대안적인 실시형태에서, CAR를 발현하고(CAR-T 세포), CAR이 CEA에 결합하는 면역반응성 세포는 비자가조직 T 세포이다.
몇몇 실시형태에서, 환자에게 주입된 면역반응성 세포의 용량은 약 107개 내지 1010개 또는 108개 내지 109개의 CAR-T 세포이다. 다른 실시형태에서, 환자에게 주입된 면역반응성 세포의 용량은 약 107개, 108개, 109개 또는 1010개의 면역반응성 세포이다. 바람직한 실시형태에서, 면역반응성 세포는 T 세포이고, CAR은 CEA에 결합한다.
몇몇 실시형태에서, 상기 방법은 면역반응성 세포 및 약학적으로 상용성 용액을 포함하는 조성물을 주입하는 단계를 포함하고, 조성물의 전체 용적은 약 25㎖ 내지 125㎖, 50㎖ 내지 75㎖, 75㎖ 내지 100㎖, 또는 50㎖ 내지 100㎖의 범위이다. 바람직한 실시형태에서, 면역반응성 세포는 T 세포이고, CAR은 CEA에 결합한다.
몇몇 실시형태에서, 조성물은 수술 기법에 의해 간 동맥으로 투여된다. 다른 실시형태에서, 조성물은 경피 기법에 의해 간 동맥으로 투여된다. 훨씬 다른 실시형태에서, 경피 기법에 의한 투여는 위십이지장 동맥 및/또는 위 동맥의 색전형성에 후행한다.
몇몇 실시형태에서, 상기 방법은 주입 과정 동안 간내 혈류역학적 통합성(intrahepatic hemodynamic integrity)을 확인하기 위해 혈관조영술을 이용하는 것을 추가로 포함한다.
몇몇 실시형태에서, 상기 방법은 경피 카테터를 통해 면역반응성 세포 및 약학적으로 상용성 용액을 포함하는 조성물을 주입하는 단계 및 비정상 해부학적 고려를 반영하도록 간 동맥 투약을 분할하도록 간 용적측정 계산을 수행하는 단계를 포함한다.
몇몇 실시형태에서, 상기 방법은 대상체의 간 동맥에 제2 치료제를 주입하는 단계를 추가로 포함한다. 다른 실시형태에서, 제2 치료제는 인터류킨-2(IL-2)이다. 다른 실시형태에서, 제2 치료제는 IL-2가 투여되지 않은 환자에서의 면역반응성 세포의 억제와 비교하여 대상체에서의 면역반응성 세포의 억제를 제어한다.
몇몇 실시형태에서, 상기 방법은, 대상체에 대한 IL-2의 투여 전의 CEA 수준과 비교하여, 혈청 CEA의 15% 내지 50%, 20% 내지 50%, 30% 내지 50%, 40% 내지 50%, 또는 19% 내지 48% 감소를 발생시킨다. 또 다른 실시형태에서, 혈청 CEA의 감소는 주입 후 1일, 2일, 3일, 4일 또는 5일에 발생한다.
몇몇 실시형태에서, IL-2는 CAR-T 치료 기간의 기간 동안 약 25,000 내지 150,000 IU/㎏/일, 25,000 내지 75,000 IU/㎏/일, 50,000 내지 100,000 IU/㎏/일의 범위의 연속 전신 용량으로 투여된다. 다른 실시형태에서, IL-2는 약 25,000, 35,000, 40,000, 50,000, 60,000, 75,000, 85,000 또는 100,000 IU/㎏/일의 연속 전신 용량으로 투여된다. 바람직한 실시형태에서, IL-2는 약 50,000 IU/㎏/일의 연속 전신 용량으로 투여된다.
몇몇 실시형태에서, 제2 치료제는 키메라 T 세포 수용체 단백질을 발현하는 면역반응성 세포의 주입 전에, 동안에 또는 후에 수행된다.
몇몇 실시형태에서, 상기 방법은 대상체의 간 동맥에 본 방사선 치료를 투여하는 단계를 추가로 포함한다. 다른 실시형태에서, 방사선 치료는 이트륨-90(90Y)을 함유하는 복수의 마이크로구의 투여를 포함한다. 훨씬 다른 실시형태에서, 방사선 치료의 투여는 약 1 내지 4 기가베크렐(GBq), 1 내지 3 GBq, 2 내지 4 GBq, 3 내지 4 GBq, 또는 2 내지 3 GBq의 방사능의 투여를 포함한다. 훨씬 다른 실시형태에서, 방사선 치료의 투여는 약 1 GBq, 1.5 GBq, 2 GBq, 2.5 GBq, 3 GBq, 3.5 GBq, 또는 4 GBq의 방사능의 투여를 포함한다.
몇몇 실시형태에서, 방사선 치료의 투여는 CAR-T 주입의 마지막 후 약 1주, 2주, 또는 3주에 방사선 치료의 투여를 포함한다.
몇몇 실시형태에서, 대상체는 간으로 국재화된 전이성 질환으로 진단된다. 다른 실시형태에서, 전이성 질환은 암이다. 훨씬 다른 실시형태에서, 암은 유방, 결장, 직장, 식도, 폐, 체장 및/또는 위에서의 원발성 종양으로부터 전이된다. 훨씬 다른 실시형태에서, 대상체는 절제 불가 전이성 간 종양으로 진단된다. 훨씬 다른 실시형태에서, 대상체는 원발성 결장직장암으로부터 절제 불가 전이성 간 종양으로 진단된다. 몇몇 실시형태에서, 대상체는 간세포 암종으로 진단된다.
몇몇 실시형태에서, 대상체는 간 전이로 진단되고, 간 전이의 악성 세포는 암배아성 항원(carcinoembryonic antigen: CEA) 단백질을 발현하는 것으로 입증되었다.
몇몇 실시형태에서, 상기 방법은 대상체의 간에서 종양 부담(tumor burden)을 감소시킨다. 다른 실시형태에서, 종양 부담의 감소는 양전자 단층촬영(positron emission tomography: PET), 자기 공명 영상화(magnetic resonance imaging: MRI) 또는 생검을 이용하여 측정된다. 훨씬 다른 실시형태에서, 종양 부담은 치료 기간 후 1주 내지 8주, 또는 약 1주, 2주, 3주, 4주, 5주, 6주, 7주 또는 8주에 측정된다. 훨씬 다른 실시형태에서, 감소는 CAR-T 세포의 용량의 주입 전에 종양 부담에 대해 측정된다.
몇몇 실시형태에서, 치료 기간 후 1주 내지 8주, 또는 약 1주, 2주, 3주, 4주, 5주, 6주, 7주 또는 8주에 측정된 종양 부담은 CAR-T 세포의 제1 용량의 주입 전에 종양 부담의 50% 이하 내지 90%이다.
몇몇 실시형태에서, 본 명세서에 기재된 바와 같은 CAR-T 세포를 대상체에게 투여하는 단계를 포함하는, 간 전이로 진단된 대상체에서 종양 부담을 감소시키는 방법이 제공된다. 다른 실시형태에서, 종양 부담은, 대상체에게 CAR-T 세포를 투여하기 전에, 종양 부담의 약 10% 미만, 20%, 30%, 40%, 50%, 60%, 70%, 80% 또는 90%인 양으로 감소한다.
몇몇 실시형태에서, 본 명세서에 기재된 바와 같은 CAR-T 세포를 대상체에게 투여하는 단계를 포함하는, 간 전이로 진단된 환자의 혈액 혈청에서 CEA의 양을 감소시키는 방법이 제공된다. 다른 실시형태에서, CEA의 양은, 대상체에게 CAR-T 세포를 투여하기 전에, 대상체에서 CEA의 양의 약 10% 미만, 20%, 30%, 40%, 50%, 60%, 70%, 80% 또는 90%인 양으로 감소한다.
몇몇 실시형태에서, 키메라 T 세포 수용체 단백질은 간에서 전이성 세포의 표면 상에 발현된 종양 항원에 특이적으로 결합하는 세포외 도메인을 포함한다. 다른 실시형태에서, 키메라 T 세포 수용체 단백질은 암배아성 항원(CEA) 단백질에 특이적으로 결합하는 세포외 도메인을 포함한다.
몇몇 실시형태에서, 키메라 T 세포 수용체 단백질은, N-말단에서 C-말단 방향으로, CEA 결합 IgG 면역글로불린 도메인, CD8 힌지 도메인, CD28 세포외 도메인, CD28 막관통 도메인, CD28 세포질 도메인 및 CD3 제타 세포질 도메인을 포함한다.
몇몇 실시형태에서, CEA 결합 IgG 면역글로불린 도메인은 서열 번호 1을 포함한다.
몇몇 실시형태에서, CD8 힌지 영역은 12개의 아미노산 길이이고, 서열 번호 2의 169 내지 180번 잔기의 서열과 적어도 75%, 83%, 91%, 또는 100% 동일한 서열을 포함한다.
몇몇 실시형태에서, CD28 세포외 도메인은 40개의 아미노산 길이이고, 서열 번호 4의 113 내지 152번 잔기의 서열과 적어도 92%, 95%, 97%, 또는 100% 동일한 서열을 포함한다.
몇몇 실시형태에서, CD28 막관통 도메인은 27개의 아미노산 길이이고, 서열 번호 4의 153 내지 179번 잔기의 서열과 적어도 88%, 92%, 96%, 또는 100% 동일한 서열을 포함한다.
몇몇 실시형태에서, CD28 신호전달 도메인은 41개의 아미노산 길이이고, 서열 번호 4의 180 내지 220번 잔기의 서열과 적어도 90%, 92%, 95%, 97%, 또는 100% 동일한 서열을 포함한다.
몇몇 실시형태에서, 제타 세포질 도메인은 113개의 아미노산 길이이고, 서열 번호 3의 52 내지 164번 잔기의 서열과 적어도 90%, 95%, 97%, 98%, 99%, 또는 100% 동일한 서열을 포함한다.
몇몇 실시형태에서, 키메라 T 세포 수용체 단백질은 T 세포 수용체 단백질의 N-말단에서의 신호 서열을 추가로 포함한다. 다른 실시형태에서, 단일 펩타이드는 서열 번호 6과 적어도 84%, 89%, 94% 또는 100% 동일하다.
몇몇 실시형태에서, 상기 방법은 HITM(등록상표) HEPATIC IMMUNOTHERAPY FOR METASTASES(전이에 대한 간 면역치료)이다.
도 1은 변형된 면역반응성 세포의 주입 전의 환자에서의 CD3+ 및 CAR+ 세포의 평균 백분율을 예시한다.
도 2는 CEA+ 표적 세포의 환자 생성물 살해를 시험하기 위한 검정의 결과를 예시한다.
도 3은 본 명세서에 기재된 바와 같은 변형된 면역반응성 세포의 치료 효능을 시험하기 위한 1상 임상 실험 프로토콜을 예시한다.
도 4는 본 명세서에 기재된 방법에 따라 치료된 환자에서의 혈청 CEA 수준을 예시한다.
도 5a 내지 도 5b는 본 명세서에 기재된 방법에 따라 치료된 환자에서의 LM 섬유증(도 5a) 및 LM 괴사(도 5b)를 예시한다.
도 6은 본 명세서에 기재된 방법에 따라 치료된 환자에서의 IFNγ 수준을 예시한다.
도 7은 본 명세서에 기재된 방법에 따라 치료된 환자에서의 피크 및 평균 IFNγ 수준을 예시한다.
도 2는 CEA+ 표적 세포의 환자 생성물 살해를 시험하기 위한 검정의 결과를 예시한다.
도 3은 본 명세서에 기재된 바와 같은 변형된 면역반응성 세포의 치료 효능을 시험하기 위한 1상 임상 실험 프로토콜을 예시한다.
도 4는 본 명세서에 기재된 방법에 따라 치료된 환자에서의 혈청 CEA 수준을 예시한다.
도 5a 내지 도 5b는 본 명세서에 기재된 방법에 따라 치료된 환자에서의 LM 섬유증(도 5a) 및 LM 괴사(도 5b)를 예시한다.
도 6은 본 명세서에 기재된 방법에 따라 치료된 환자에서의 IFNγ 수준을 예시한다.
도 7은 본 명세서에 기재된 방법에 따라 치료된 환자에서의 피크 및 평균 IFNγ 수준을 예시한다.
다양한 양태가 이제 하기 더 자세히 기재될 것이다. 그러나, 이러한 양태는 많은 상이한 형태로 구현될 수 있고, 본 명세서에 기재된 실시형태로 제한되는 것으로 해석되지 않아야 하고; 오히려, 본 개시내용이 철저하고 완전하도록 그리고 당해 분야의 당업자에게 이의 범위를 완전히 전달하도록 이 실시형태가 제공된다.
I. 정의
본 명세서에 사용된 바대로, 단수 형태 표현은, 문맥이 명확히 달리 기재하지 않는 한, 복수 지시어를 포함한다. 따라서, 예를 들어 "중합체"에 대한 언급은 단일 중합체, 및 동일하거나 상이한 중합체의 2개 이상을 포함하고, "부형제"에 대한 언급은 단일 부형제, 및 동일하거나 상이한 2개 이상의 부형제 등을 포함한다.
값의 범위가 제공되는 경우, 그 범위의 상한과 하한 사이의 각각의 개재하는 값 및 그 기재된 범위에서의 임의의 다른 기재된 또는 개재하는 값이 본 개시내용 내에 포함되는 것으로 의도된다. 예를 들어, 1㎖ 내지 8㎖의 범위가 기재된 경우, 2㎖, 3㎖, 4㎖, 5㎖, 6㎖, 및 7㎖, 및 1㎖ 이상의 값의 범위 및 8㎖ 이하의 값의 범위가 또한 명확히 개시된 것으로 의도된다.
용어 "환자", "대상체", "개체" 등은 본 명세서에서 상호교환되어 사용되고, 시험관내이든 또는 인시츄이든, 본 명세서에 기재된 방법에 수정 가능한, 임의의 동물 또는 이의 세포를 의미한다. 소정의 비제한적인 실시형태에서, 환자, 대상체 또는 개체는 인간이다.
용어 "치료학적"은, 본 명세서에 사용된 바대로 치료 및/또는 예방을 의미한다. 치료 효과는 질환 상태의 억제, 관해 또는 근절에 의해 얻어진다.
본 명세서에서 용어가 사용되는 바대로, 질환을 "치료"하는 것은 대상체가 경험한 질환 또는 장애의 적어도 하나의 징후 또는 증상의 빈도 또는 중증도를 감소시키는 것을 의미한다. 용어 "형질감염된" 또는 "형질변환된" 또는 "형질도입된"은, 본 명세서에 사용된 바대로, 외인성 핵산이 숙주 세포로 운반되거나 도입되는 과정을 의미한다. "형질감염된" 또는 "형질변환된" 또는 "형질도입된" 세포는 외인성 핵산에 의해 형질감염, 형질변환 또는 형질도입된 것이다. 세포는 일차적 해당 세포 및 이의 자손을 포함한다.
용량 또는 양에 적용되는, 본 명세서에 사용된 바대로 용어 "치료학적으로 효과적인"은, 본 개시내용의 키메라 수용체를 포함하고, 이를 요하는 대상체에 대한 투여 시 원하는 활성을 발생시키기에 충분한 약물 내성 폴리펩타이드를 추가로 포함하는, 화합물 또는 약제학적 조성물(예를 들어, 면역 세포, 예컨대 T 림프구 및/또는 NK 세포를 포함하는 조성물)의 분량을 의미한다. 본 개시내용의 맥락 내에, 용어 "치료학적으로 효과적인"은 본 개시내용의 방법에 의해 치료되는 장애의 적어도 하나의 증상의 표출을 지연시키거나, 이의 진행을 정지시키거나, 이를 경감시키거나 완화하기에 충분한 화합물 또는 약제학적 조성물의 분량을 의미한다. 활성 성분의 조합이 투여될 때, 조합의 유효량이 개별적으로 투여되는 경우 효과적인 각각의 성분의 양을 포함할 수 있거나 하지 않을 수 있다는 것에 주목한다.
본 명세서에 사용된 바대로, 표현 "종양 로드" 또는 "종양 부담"은 대상체의 신체에서 암 세포의 수, 종양의 크기 또는 암의 양을 의미한다.
용어 "키메라 수용체"는, 본 명세서에 사용된 바대로, 단일 단백질에서 함께 천연으로 발견되지 않는 조합으로, 세포외 리간드 결합 도메인, 막관통 도메인 및 하나 이상의 세포질 동시자극 신호전달 도메인을 포함하는 세포-표면 수용체로서 정의된다. 이것은 특히 세포외 도메인 및 세포질 도메인이 단일 수용체 단백질에서 함께 천연으로 발견되지 않는 수용체를 포함한다. 본 개시내용의 키메라 수용체는 T 세포 및 자연 살해(NK) 세포와 사용하도록 주로 의도된다. 본 명세서에 기재된 키메라 수용체는 본 명세서에서 키메라 항원 수용체(CAR), 키메라 리간드 수용체, 또는 키메라 T 세포 수용체라 또한 칭해질 수 있다.
본 명세서에 사용된 바대로, 키메라 T 세포 수용체와 관련하여 표현 "특이적으로 결합한다"는 키메라 T 세포 수용체가 구조적으로 상이한 단백질(들)에 결합하는 것보다 큰 친화도로 이의 표적 단백질에 결합한다는 것을 의미한다.
II. CAR-T 세포의 간 동맥 주입
연구는 튼튼한 T 세포 반응을 가지는 간 전이(LM) 환자가 상당히 개선된 결과를 가지지만, 대부분의 LM 환자가 효과적인 간내 항종양성 면역력을 시작하지 못한다는 것을 입증한다(Katz et al., 2003, Ann Surg Onc, 20:946-955). 특이적 종양 항원을 표적화하도록 설계된 매우 특이적인 면역치료학적 생성물인, 키메라 항원 수용체 변형된 T 세포(CAR-T)가 특히 절제 불가 종양으로 진단된 환자에서 필요한 항종양성 면역력을 제공하는 데 있어서 장래성을 보유한다. 항원 특이적 CAR-T 세포의 투여가 백혈병에 대한 조기 단계 임상 실험에서 장려하는 결과를 입증하였지만, 위장 암을 가지는 환자에서의 주요 사망 원인인, CEA 발현 선암 LM에 대한 CAR-T 기술의 성공적인 수정이 아직 성취되지 않았다. 따라서, CAR-T 기술이 LM의 치료에 대한 실행가능 옵션이라는 것을 보여주도록 본 명세서에 기재된 바와 같이 I상 임상 실험이 설계되고 수행되었다. 게다가, 임상 연구는 LM에 대한 CAR-T 치료의 유효성을 제한할 수 있는, 전신 주입을 통한 CAR-T의 비효과적인 간내 전달을 해소한다. LM에 대한 CAR-T의 직접적인 구역 전달이 LM을 치료하는 데 있어서 안전하고 효과적이라는 것을 보여주는 CAR-T 간 동맥 주입(HAI)을 시험하기 위한 연구가 하기 기재되어 있다. 요약하면, 데이터는 CAR-T HAI가 매우 관용성이고 종양 세포 사멸의 증거와 연관된다는 것을 입증하여서, LM에 대한 CAR-T의 간 동맥 주입(HAI)이 이를 요하는 환자에서 LM을 실제로 효과적으로 치료할 수 있다는 것을 보여준다.
키메라
항원 수용체 T 세포
매우 특이적인 종양 인식 및 사멸을 가능하게 하는 키메라 항원 수용체(CAR)에 의해 조작된 T 세포는 유망한 임상 결과에 따라 상당한 주의를 얻었다(Grupp et al., 2013, N Eng J Med, 368:1509-1518; Porter et al., 2011, N Eng J Med, 365:725-733; Sadelain et al., 2009, Curr Opin Immunol, 21:215-223). CAR 유전자에 의한 T 세포의 재프로그래밍은 종양 세포를 도킹하고 용해시키기 위한 MHC 독립적 기전을 제공한다. 이러한 변형된 T 세포는 대안적으로 "설계자 T 세포", "T-바디" 또는 "CAR-T 세포"라 칭해진다(Ma et al., 2002, Cancer Chemotherapy & Biological Response Modifiers: Elsevier Science, pp. 319-345; Park et al., 2011, Trends Biotech, 29:550-557; Ma et al., 2014, Prostate, 74:286-296). 암배아성 항원(CEA)은, 높은 수준의 CEA 발현 및 혈청에서 CEA를 측정하는 능력을 고려하여, 선암 LM의 CAR-T 치료에 대한 매력적인 표적이다(Blumenthal et al., 2007, BMC Cancer, 7:2; Midiri et al., 1985, Cancer, 55:2624-2629). 항원 인식 시, 항-CEA CAR-T는 증식하고, 사이토카인을 생성하고, 표적 세포를 사멸한다(Emtage et al., Clin Canc Res, 14:8112-8122).
키메라 항원 수용체(CAR) 단백질 및 이 단백질을 발현하는 면역 세포(예를 들어, 면역반응성 또는 T 세포)의 생성은 당해 분야에 널리 공지되어 있고, 리간드 또는 항체 또는 이의 단편의 특이성 및 표적화 기능을 면역 세포의 항종양성 활성과 조합한다. 예를 들어, 문헌[Sadelain et al., 2013, Cancer Discovery, 3:388-398]을 참조한다. 키메라 항원 수용체 단백질은 일반적으로 N-말단에서 C-말단 방향으로 이환된 표적 세포(예를 들어, 복강에 존재하는 암 세포 또는 악성 세포)의 표면 상에 발현된 단백질에 특이적으로 결합하는 표적 결합 도메인, 힌지 도메인, 막관통 도메인 및 면역조절 신호전달 도메인을 포함한다.
바람직한 실시형태에서, CAR 단백질의 표적 결합 도메인은 CEA 단백질에 결합한다. 이 CEA 결합 단백질은 인간화된 단클론성 항체로부터 생성된다(미국 특허 제6,676,924호; Akamatsu et al., 1998, Clin Cancer Res, 4:2825-2832; Nolan et al., 1999, Clin Cancer Res, 5:3928-3941). 항-CEA CAR 작제물을 생성하는 데 있어서, scFV 작제물은 당해 분야에 일상적인 방법을 이용하여 중쇄 및 경쇄 가변 도메인으로부터 생성되고, 이후 (본 명세서에서 서열 번호 1로서 개시된) scFV 단편은 현재 기재된 치료 방법에서 사용하기 위한 CAR을 생성하기 위해 다른 수용체 도메인에 융합된다.
각각의 힌지 도메인, 막관통 도메인 및 신호전달 도메인(들)에 대한 바람직한 실시형태는 하기 표 1에 제공된다. 몇몇 실시형태에서, CAR 작제물은 N-말단에서 C-말단 방향으로 CEA-결합 도메인, CD8 힌지 도메인, CD3 제타 사슬 막관통 도메인 및 CD3 제타 사슬 세포질 도메인을 포함한다. 바람직한 실시형태에서, CAR 작제물은 N-말단에서 C-말단 방향으로 CEA-결합 도메인, CD8 힌지 도메인, CD28 세포외 도메인, CD28 막관통 도메인, CD28 신호전달 도메인 및 CD3 제타 사슬 세포질 도메인을 포함한다. 몇몇 실시형태에서, 작제물은 표적 결합 도메인의 N-말단에 융합된 신호 펩타이드를 추가로 포함한다. 신호 펩타이드가 생체내 절단되면서, 이것은 투여된 면역반응성 세포 상에 발현된 CAR 단백질에서 존재하지 않는다고 이해된다.
몇몇 실시형태에서, 키메라 수용체 단백질의 표적 결합 도메인은 면역글로불린의 항원 결합 부분을 포함하고, 면역글로불린은 이환된 세포의 표면 상의 단백질에 결합한다. 항원 결합 도메인은 세포 표면 항원에 결합하는 임의의 도메인, 예컨대 수용체 또는 면역글로불린 단백질에 대한 리간드, 예컨대 단클론성 항체, 다중클론 항체, 합성 항체, 인간 항체, 인간화된 항체, 및 이의 단편(이들로 제한되지는 않음)일 수 있다. 바람직한 실시형태에서, CAR의 항원-결합 도메인은 CAR 작제물의 일부일 때 항원에 특이적으로 결합할 수 있는 항체의 가변 도메인으로부터 작제된다. 몇몇 경우에, CAR이 궁극적으로 사용되는 동일한 종으로부터 항원 결합 도메인이 유래하는 것이 유리하다. 예를 들어, 인간에서 사용하기 위해, CAR의 항원 결합 도메인이 인간 또는 인간화된 항체의 단편을 포함하는 것이 유리할 수 있다. 따라서, 몇몇 실시형태에서, CAR의 항원 결합 도메인 부분은 인간 또는 인간화된 항체의 종양 항원 결합 단편을 포함한다. 각각의 이 실시형태에서, 항체의 항원-결합 도메인, 예컨대 단쇄 가변 단편(scFV) 또는 Fab 단편은 T 세포 수용체의 막관통 도메인 및 신호전달 세포내 도메인(엔도도메인)에 융합된다. 대개, 스페이서 또는 힌지는 세포외 항원 결합 도메인과 막관통 도메인 사이에 도입되어서, 항원 인식 및 결합을 수월하게 하도록 항원-결합 도메인이 상이한 방향으로 배향되도록 허용하는 유연성을 제공한다.
몇몇 실시형태에서, 키메라 항원 T 세포 수용체의 항원 결합 모이어티 부분은 CEA 항원을 표적화하고, 세포 표면 상에 발현된 CEA에 결합하는 것으로 밝혀진 항체의 CEA-결합 도메인을 포함한다. 키메라 수용체 작제물은 보통의 당업자에게 공지된 방법 및 조성물에 따라 생성될 수 있다. 예를 들어, 하기 실시예에 사용된 CEA CAR-T 작제물은 (미국 특허 제5,874,540호(이의 내용은 그 전문이 본 명세서에 참고로 포함됨)에 기재된) 인간화된 MN14 항체의 가변 도메인의 부분을 포함한다. Fab 또는 scFv 작제물은 CEA 항체의 CEA-결합 도메인을 포함하도록 Nolan 등의 방법(1999, Clinical Canc Res, 5:3928-3941)에 따라 CEA 항체로부터 생성될 수 있다. 몇몇 실시형태에서, CEA CAR-T 작제물은 하기 표시된 서열 번호 1과 적어도 90%, 95%, 96%, 97%, 98%, 99%, 또는 100% 동일한 아미노산 서열을 포함한다:
DIQLTQSPSSLSASVGDRVTITCKASQDVGTSVAWYQQKPGKAPKLLIYWTSTRHTGVPSRFSGSGSGTDFTFTISSLQPEDIATYYCQQYSLYRSFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
(서열 번호 1)
몇몇 실시형태에서, CEA CAR-T 작제물은, CEA CAR-T 작제물의 생체내 발현 후, 작제물로부터 절단된 서열 번호 1의 N-말단에서 신호 펩타이드를 추가로 포함한다. 신호 서열은 당해 분야의 당업자에게 널리 공지되어 있고, 번역된 단백질을 세포 표면에 지시하도록 작용한다. 신호 서열은 세포 표면에 대한 CAR 단백질의 전좌 동안 소포체로부터의 통과 후 절단된다. 다른 실시형태에서, 신호 펩타이드는 서열 MGWSCIILFLVATATGVHS(서열 번호 6)를 가진다. 훨씬 다른 실시형태에서, 1개, 2개, 3개, 4개, 5개 또는 6개의 아미노산을 포함하는 링커 서열은 신호 펩타이드와 CEA-결합 도메인 사이에 존재한다.
이후, Fab 또는 scFv 도메인은 이의 C-말단에서 펩타이드 결합을 통해 힌지 도메인, 예컨대 CD8 힌지 도메인로부터의 것에 융합될 수 있다(SwissProt/GenBank 수탁 번호 P01732 참조; 서열 번호 2). 바람직한 실시형태에서, 힌지 도메인은 12개의 아미노산 길이이고 서열 번호 2의 169-180번 잔기의 서열과 적어도 83%, 91% 또는 100% 동일한 서열을 포함한다. 다른 실시형태에서, 힌지 도메인은 서열 번호 2의 111-190번 잔기에 존재하는 10개 내지 20개, 10개 내지 30개, 10개 내지 40개 또는 10개 내지 50개의 잔기의 인접 서열과 적어도 95%, 96%, 97%, 98%, 99% 또는 100% 동일한 서열을 포함한다.
이후, 힌지 도메인은 이의 C-말단에서 막관통 도메인에 융합될 수 있다. 몇몇 실시형태에서, 막관통 도메인은 CD3 제타 사슬로부터의 서열을 포함한다(GenBank/SwissProt 수탁 번호 P20963 참조; 서열 번호 3). 이 실시형태에서, 막관통 도메인은 20개 내지 30개의 아미노산 또는 20개, 21개, 22개, 23개의 아미노산 길이이고 서열 번호 3의 31-51번 잔기에 존재하는 15개 내지 25개 또는 20개 내지 30개의 잔기의 인접 서열과 적어도 85%, 90%, 95% 또는 100% 동일한 서열을 포함한다. 몇몇 실시형태에서, CD3 제타 사슬로부터의 막관통 도메인은 서열 번호 3의 31-51번 위치에서의 아미노산의 서열을 포함한다. 바람직한 실시형태에서, CAR의 막관통 도메인은 CD28 단백질(예를 들어, GenBank/SwissProt 수탁 번호 P10747; 서열 번호 4) 유래이다. 막관통 도메인은 27개의 아미노산 길이이고 서열 번호 4의 153-179번 잔기의 서열과 적어도 88%, 92% 또는 100% 동일한 서열을 포함할 수 있다. 다른 실시형태에서, 막관통 도메인은 서열 번호 4의 150-190번 잔기의 서열에 존재하는 20개 내지 30개, 20개 내지 40개, 또는 20개 내지 50개의 잔기의 인접 서열과 적어도 95%, 96%, 97%, 98%, 99% 또는 100% 동일한 서열을 포함한다. CAR 막관통 도메인이 상기 기재된 바대로 CD28 막관통 도메인일 때, CAR은 CD28 세포외 도메인을 추가로 포함할 수 있고, 세포외 도메인은 CD8 힌지 도메인과 CD28 막관통 도메인 사이에 위치한다. CD28 세포외 도메인은 35개 내지 45개, 또는 약 38개, 39개, 40개, 41개 또는 42개의 아미노산 길이이고, 서열 번호 4의 110-160번 잔기의 서열에 존재하는 35개 내지 45개의 잔기의 인접 서열과 적어도 92%, 95%, 97% 또는 100% 동일하다.
CD3 제타 사슬 세포질 도메인은 CAR 작제물의 C-말단에 존재하고, 서열 번호 3의 40-164번 잔기의 서열에 존재하는 100개 내지 120개의 아미노산의 인접 서열과 적어도 90%, 93%, 95%, 96%, 97%, 98%, 99% 또는 100% 동일한 서열을 포함한다. 바람직한 실시형태에서, 제타 사슬 도메인은 서열 번호 3의 52-164번 잔기와 적어도 97%, 98%, 99% 또는 100% 동일한 서열을 포함한다.
바람직한 실시형태에서, CAR은 막관통 도메인에 C-말단이고 CD3 제타 사슬 세포질 도메인에 N-말단인 CD28 신호전달 도메인을 추가로 포함한다. 몇몇 실시형태에서, CD28 신호전달 도메인은 서열 번호 4의 175-220번 잔기의 서열에 존재하는 35개 내지 45개의 아미노산의 인접 서열과 적어도 92%, 95% 또는 100% 동일한 서열을 포함한다. 바람직한 실시형태에서, CD28 신호전달 도메인은 서열 번호 4의 180-220번 잔기와 적어도 92%, 95% 또는 100% 동일한 서열을 포함한다.
바람직한 실시형태에서, CAR 폴리펩타이드 서열은 N-말단에서 C-말단 방향으로 서열 번호 1을 포함하는 CEA-결합 도메인, 상기 기재된 바와 같은 CD8 힌지 도메인, 상기 기재된 바와 같은 CD28 세포외 도메인, 상기 기재된 바와 같은 CD28 막관통 도메인, 상기 기재된 바와 같은 CD28 신호전달 도메인, 및 상기 기재된 바와 같은 CD3 제타 세포질 도메인을 포함한다. 일 실시형태에서, 이 CAR 서열은 N-말단에서 C-말단 도메인으로 하기 분절의 각각을 포함한다: 서열 번호 1(CEA 결합 도메인), 서열 번호 2의 169-180번 잔기(CD8 힌지), 서열 번호 4의 113-152번 잔기(CD28 세포외 도메인), 서열 번호 4의 153-179번 잔기(CD28 막관통 도메인), 서열 번호 4의 180-220번 잔기(CD28 세포질 도메인), 및 서열 번호 3의 52-164번 잔기(CD3 제타 사슬 세포질 도메인)(대안적으로 본 명세서에서 "항-CEA scfv-CD8α-CD28/CD3ζ"이라 칭함). 일상적인 방법을 이용한 CAR 작제물의 작제는, 원하는 융합 작제물을 생성하기 위한 다양한 도메인의 분해 및 결찰을 허용하지만, 키메라 작제물의 각각의 도메인 사이의 하나 이상의 아미노산을 또한 코딩할 수 있는, 제한 엔도뉴클레아제 부위의 도입에 의해 전장 유전자 서열의 PCR 증폭의 이용을 수반할 수 있다. 따라서, 몇몇 실시형태에서, CAR 서열은 결합 및 CD8 힌지 도메인 사이, 힌지 및 CD28 세포외 도메인 사이, 세포외 도메인 및 막관통 도메인 사이, 막관통 및 신호전달 도메인 사이, 막관통 및 제타 세포질 도메인 사이, 및/또는 CD28 신호전달 및 제타 세포질 도메인 사이의 1개, 2개 또는 3개의 아미노산의 링커 서열을 포함한다.
CAR-T 세포의 제조
증식 및 유전적 변형 전에, T 세포의 소스는 간 전이에 대한 치료를 요하는 대상체로부터 얻어진다. T 세포는 말초 혈액 단핵 세포, 골수, 림프절 조직, 탯줄 혈액, 흉선 조직, 감염 부위로부터의 조직, 복수, 흉수, 비장 조직, 및 종양을 포함하는 다수의 소스로부터 얻어질 수 있다. 본 개시내용의 소정의 양태에서, 당해 분야에서 이용 가능한 임의의 수의 T 세포주를 사용할 수 있다. T 세포는 당업자에게 공지된 임의의 수의 기법, 예컨대 Ficoll(상표명) 분리를 이용하여 대상체로부터 수집된 혈액의 단위로부터 얻어질 수 있다. 바람직한 실시형태에서, 개체의 순환 혈액으로부터의 세포는 성분채집술에 의해 얻어진다. 성분채집술 생성물은 통상적으로 림프구, 예컨대 T 세포, 단핵구, 과립구, B 세포, 다른 유핵 백혈구, 적혈구 및 혈소판을 함유한다. 성분채집술에 의해 수집된 세포는 세척되어서 혈장 분획을 제거하고, 후속하는 프로세싱 단계를 위해 적절한 완충제 또는 배지 중에 세포를 배치할 수 있다. 당해 분야의 당업자는 세척 단계가 제조사의 지시에 따라 당업자에게 공지된 방법에 의해, 예컨대 반자동화 통과액 원심분리를 사용함으로써 달성될 수 있다는 있다는 것을 용이하게 인식할 것이다. 세척 후, 세포는 완충제와 함께 또는 이것 없이 다양한 생체적합성 완충제, 예컨대 Ca 비함유, Mg 비함유 PBS, 또는 다른 식염수 용액 등 중에 재현탁될 수 있다. 대안적으로, 성분채집술 샘플의 바람직하지 않은 성분은 제거될 수 있고, 세포는 배양 배지 중에 직접적으로 재현탁될 수 있다.
T 세포, 예컨대 CD3+, CD28+, CD4+, CD8+, CD45RA+ 및 CD45RO+ T 세포의 특정한 하위집단은 양성 또는 음성 선택 기법에 의해 단리 및/또는 풍부화될 수 있다. 예를 들어, 몇몇 실시형태에서, T 세포는 원하는 T 세포의 양성 선택에 충분한 시간 기간 동안 항-CD3/항-CD28-접합된 비드와의 항온처리에 의해 단리된다. 당업자는 본 개시내용의 맥락에서 다수의 회차의 선택이 또한 사용될 수 있다는 것을 인식할 것이다. 소정의 양태에서, 선택 절차를 수행하고, 활성화 및 증식 과정에서 비선택된 세포를 사용하는 것이 바람직할 수 있다. 비선택된 세포는 추가의 회차의 선택에 또한 처리될 수 있다.
몇몇 실시형태에서, 하나 이상의 IFN-γ, TNFα, IL-17A, IL-2, IL-3, IL-4, GM-CSF, IL-10, IL-13, 그랜자임 B 및 페르포린, 또는 다른 적절한 분자, 예를 들어 다른 사이토카인을 발현하는 T 세포 집단을 선택할 수 있다. 세포 발현을 스크리닝하는 방법은 예를 들어 PCT 공보 WO 제2013/126712호에 기재된 방법에 의해 결정될 수 있다. T 세포는 일반적으로 예를 들어 미국 특허 제6,352,694호; 제7,232,566호; 제6,797,514호; 제6,867,041호; 및 미국 특허 출원 공보 제20060121005호에 기재된 방법을 이용하여 활성화되고 증식될 수 있다.
간 전이로 진단된 대상체를 치료하는 데 사용하기 위한 CAR-T 세포의 분리를 위해, 환자는 최소 4 x 109개의 T 세포를 수확하도록 백혈구성분채집술을 받고, 이상적인 표적은 약 6 x 109개의 T 세포이다. 백혈구성분채집술 생성물에서의 T 세포 수의 초기 평가는 2시간에 수행되고, 필요하다 생각한 바대로 이후 반복될 수 있다. 세포는, 대안적으로 본 명세서에서 림프구 농후(lymphocyte-rich: PBL)라 칭하는, 말초 혈액 단핵 세포(PBMC)를 회수하도록 정제된다. 림프구는 50ng/㎖ OKT3 및 3000 IU/㎖ IL-2에 대한 노출에 의해 활성화된다(Walker et al., 1993, 4:659-680). 활성화된 세포는 10㎍/㎖ 프로타민을 가지는 상기 기재된 바와 같은 재조합 키메라 CAR을 함유하는 레트로바이러스의 고역가 상청액에 의해 형질도입된다(Cornetta et al., 1989, 23:187-194). 다음날에, 형질도입된 세포의 분획을 증가시키도록 절차를 반복한다. 형질도입 후 2일에 전이유전자의 발현을 위해 유세포분석법에 의해 적은 분취량의 세포를 분석한다. 형질도입된 세포의 분획이 10% 미만인 경우, 세포는 2회차 초과의 형질도입을 경험하도록 허용되고, 형질도입된 세포의 백분율에 대해 유세포분석법에 의해 다시 분석될 수 있다. 적절한 수(예를 들어, 10% 초과)의 T 세포를 형질도입한 후, 세포를 활성화 조건(상기) 하에 예를 들어 1.2 내지 1.5 x 106/㎖에서 배양한다. 활성화된 세포의 나머지를 형질도입 결과가 알려질 때까지 유지시키고, 필요한 경우 제2 시도에 사용한다. 형질도입된 T 세포를 배양물 중에 증식시키고, 성장/형질도입 매개변수(배가 시간, 전체 세포수, 형질도입(%), T 세포 활성화 표시자)에 대해 모니터링한다. 세포의 동결 저장 전에, 10% DMSO, 20% 인간 혈청 및 3000 IU/㎖의 IL-2를 첨가한다. 세포를 수확할 때에 대한 결정은 충분한 전체 세포의 존재에 기초하여서, 미래의 주입에 대해 수확물이 증식된 후, 충분한 세포가 배양물 중에 남을 것이다. 통상적으로, T 세포 활성화로부터 용량 수확까지의 간격은 2주 내지 3주의 범위이다. 증식 동안, 키메라 수용체를 발현하는 T 세포의 존재를 입증하도록 유세포분석법을 수행한다. 다른 시험은 CEA+ 및 CEA-표적에 대한 생존능력, 무균성 및 표준 세포독성 검정을 포함할 것이다. 용량을 구성하도록 적절한 형질도입 효율 및 세포수를 달성하도록 환자 T 세포에 의해 3회 이하의 시도가 이루어진다. 몇몇 실시형태에서, 상이한 형질도입으로부터 증식된 세포를 혼주하여 용량을 달성한다.
치료학적 CAR-T 세포는 CAR 작제물을 코딩하는 발현 벡터에 의해 림프구의 집단을 형질감염시킴으로써 CAR 핵산 작제물을 발현하도록 조작될 수 있다. 선택된 CAR 작제물을 발현하는 림프구의 형질도입된 집단을 제조하기 위한 적절한 수단은 당업자에게 널리 공지되어 있고, 레트로바이러스, MFG 벡터, 아데노바이러스계 벡터, 아데노 연관 바이러스(adeno-associated virus: AAV) 기반 벡터, 레트로바이러스 벡터, 레트로바이러스-아데노바이러스 벡터 및 단순 포진 바이러스(herpes simplex virus: HSV)로부터 유래한 벡터를 포함하지만, 이들로 제한되지는 않는다. 하기 실시예 1은 환자에게 투여되는 CAR-T 세포를 생성하도록 사용된 방법을 기재한다.
바람직한 실시형태에서, T 세포는 원하는 CAR 작제물을 보유하는 레트로바이러스에 의해 형질감염된다. MFG 레트로바이러스 및 진핵생물 세포를 형질감염시키는 데 있어서의 이의 사용은 당해 분야의 당업자에게 널리 공지되어 있다. CAR-T 세포의 생성을 위해, CEA CAR을 코딩하는 발현 카세트를 MFG 레트로바이러스 벡터 골격의 NcoI-BamHI 부위 사이에 삽입할 수 있다. 삽입된 서열의 개시 코돈은 바이러스 env 개시 코돈의 위치에서 정확히 위치한다. MoMLV LTR이 골수증식성 바이러스로부터의 상동성 서열에 의해 대체되고, N-말단프라이머 결합 부위가 양성 스트랜드 프라이머로서 tRNApro보다는 tRNAglu를 사용하는 변이체로부터의 상동성 서열에 의해 대체된, MPSV/PBSQ라 칭하는, MFG 벡터를 사용할 수 있다. 몇몇 실시형태에서, 레트로바이러스 벡터는 선택 가능한 마커 유전자를 함유하지 않는다. 형질감염된 세포로부터의 레트로바이러스 벡터 상청액은 PG13 패키징 세포주를 사용하여 제조될 수 있다. PG13 세포주는 긴팔원숭이 유인원 백혈병 바이러스(gibbon ape leukemia virus: GALV) 헬퍼 패키징 시스템을 마우스 3T3 세포로 안정하게 도입함으로써 제조된다. 벡터 생성자 세포(vector producer cell: VPC)주는 2단계 과정에 의해 제조된다. 처음에, CAR-MFG 벡터는 GP+E86 동종지향성 패키징 세포주로 형질감염된다. 형질감염된 세포로부터의 일시적 바이러스 상청액은 수집되고 PG13 세포를 감염시키도록 사용된다. 감염 후, PG13 세포는 유세포분석법에 의해 CAR 전이유전자의 발현에 대해 평가된다. 이후, 세포는 FACS에 의해 CAR 전이유전자의 안정한 발현에 대해 분류되어서 마스터 워킹 세포 은행을 확립하고, 복제 능력 레트로바이러스(RCR)의 부재, 동일성, 무균성 및 안전성에 대해 시험된다. 형질도입된 세포는 환자 용량을 구성하는 분량으로 동결된다. 몇몇 실시형태에서, CAR-T 세포의 적절한 분량은 등장성이고 약학적으로 허용 가능한 약 50-100㎖, 75-100㎖, 75-125㎖, 또는 약 50㎖, 75㎖, 100㎖, 또는 135㎖의 용액을 함유하는 하나의 백에서 액체 질소 기상에서 저장된다. 몇몇 실시형태에서, 용액은 약 15-25%, 15%, 20% 또는 25% 알부민을 함유한다. 다른 실시형태에서, 용액은 약 5-15%, 5%, 10% 또는 15% 다이메틸 설폭사이드(DMSO)를 함유한다. 바람직한 실시형태에서, 용액 용적은 약 100㎖이고, 적절한 수의 세포, 약 20% 알부민 및 약 10% DMSO를 함유한다. 몇몇 실시형태에서, 약 400,000-500,000 IU 또는 약 450,000 IU IL-2는 투여 전에 세포 생존능력을 유지시키기 위해 냉동 전에 백에 첨가된다. 용액은 투여 전에 해동된다.
CAR-T 세포의 간 동맥 주입(
HAI
)
본 명세서에 개시된 연구 및 결과는 간 동맥 주입을 통한 CAR을 발현하는 면역반응성 세포의 투여가 간으로 전이된 암을 치료하는 데 있어서 치료 효능을 제공할 수 있다는 것을 입증한다. 간 전이를 표적화하도록 본 명세서에 기재된 바대로 변형된 세포, 구체적으로 CEA를 발현하는 전이성 세포의 투여는 예를 들어 소분자 화학치료제의 주입과 비교하여 상당히 더 복잡한 과정이다. 정상 세포, 예컨대 결장에서의 것은 CEA를 발현한다. 건강한 세포의 파괴를 최소화하거나 방지하기 위해 변형된 CAR-T 세포에 의해 정상 세포의 접촉을 최소화하거나 제거하는 것이 중요하다. CAR-T 세포는 다양한 사이토카인을 분비할 수 있는 면역학적 세포이어서, 부작용에 기여한다. 이 문제를 해결하기 위한 방법, 구체적으로, 변형된 세포와 이환된 세포의 접촉을 최적화하면서, 건강한 세포에 대한 변형된 면역반응성 세포의 노출을 최소화하기 위한 수단이 하기 기재되어 있다.
바람직한 실시형태에서, CAR을 발현하는 면역반응성 세포는 조작된 세포에 의해 치료되는 대상체로부터 얻은 T 세포를 사용하여 생성된 항-CEA CAR-T 세포이다. 간 전이로 진단된 환자를 치료하기 위한 CAR-T 세포의 HAI는, 변형된 세포가 간으로 효과적으로 지향될 때(여기서, 전이성 세포가 존재함), 가장 효과적일 것이다. CAR-T의 HAI는 CEA를 발현하는 간외 조직에 대한 면역 매개 손상을 최소화하도록 또한 선택된다. CAR-T 치료로부터 이익을 가장 얻을 것 같은 환자는 간 전이, 예컨대 결장직장암 간 전이로 진단된 사람이다. 그러나, 간 종양 세포 또는 간 전이 세포가 조작된 및 투여된 CAR-T 세포에 의해 인식된 하나 이상의 단백질을 발현하는 환자를 치료하는 데 있어서 본 명세서에 개시된 치료학적 방법이 효과적일 수 있는 것으로 이해된다. 이러한 종양 항원은 탄수화물 항원(CA)19-9, 탄수화물 항원(CA) 125 및 타이미딘 키나제를 포함하지만, 이들로 제한되지는 않는다. 바람직한 실시형태에서, CAR-T 세포의 표면 상에 발현된 키메라 수용체는 널리 공지된 암 항원 암배아성 항원을 인식하고 이에 결합한다. 암배아성 항원(CEA)은 많은 악성 세포 유형, 예컨대 결장직장, 위, 췌장, 폐, 유방 및 갑상선 수질 암종 세포(이들로 제한되지는 않음)에 의해 발현된 태아 종양 세포 표면 당단백질이다. 또 다른 장기, 예컨대 간으로 전이된 이러한 악성 세포는 CEA의 발현을 포함하는 이의 표현형을 유지시키고, 이로써 항-CEA 면역치료에 대한 표적이다. CEA는 구조 및 서열에서 널리 공지되고 널리 규명된 다수의 아이소폼을 가진다(예를 들어, GenBank 수탁 번호 NP_001171742, NP_001171744, NP_001020083 및 SwissProt 수탁 번호 P13688). 본 방법은 당해 분야에 공지된 바대로 CEA 단백질을 특이적으로 인식하는 키메라 수용체 단백질을 발현하도록 조작된 면역반응성 세포의 사용을 이용한다. 몇몇 실시형태에서, 키메라 수용체 단백질은 서열 번호 5와 적어도 90%, 95%, 98% 또는 99% 동일한 아미노산 서열을 포함하는 CEA 단백질에 특이적으로 결합한다.
CAR-T 세포에 의해 치료된 환자는 간에서 암으로 진단된다. 몇몇 실시형태에서, 환자는 검출 가능한 절제 불가 CEA-양성 간 전이 또는 검출 가능한 혈청 CEA 수준을 가진다. 다른 실시형태에서, 환자는 종래의 전신 치료제 또는 화학치료제 중 하나 이상의 라인에 실패했다. 간 MRI 및 PET 실험은 암 또는 전이의 위치 및 정도를 결정하도록 CAR-T 치료 전에 수행된다.
간 동맥에 변형된 세포를 직접적으로 주입하는 것이 대부분의 변형된 세포를 간으로 지향시키지만, 많은 세포는 40-45%만큼 많은 사람에서 관찰된 간 동맥 해부구조의 변동으로 인해 우회될 것이다. 집단의 약 80-85%에서 전체 간에 공급하는 오른쪽 및 왼쪽 간 동맥으로의 적절한 간 동맥의 분지가 보인다. 집단의 나머지에서, 예를 들어 간 동맥은 오직 오른쪽 간 동맥으로 또는 오직 왼쪽 간 동맥으로 분지될 수 있거나(각각 간의 공급 우엽 또는 좌엽), 적절한 간 동맥은 간 이외의 장기로 약간의 혈류를 우회시키는 비정상 혈관에 의해 대체될 수 있다. 따라서, HAI를 수행하기 전에 간의 우엽 또는 좌엽에 이르는 혈관을 맵핑하고, 필요할 때, 간에 이르지 않는 혈관을 폐색하는 것이 중요하다. 몇몇 실시형태에서, 주입 전에, 환자는 예를 들어 일반 대퇴 동맥 접근법을 통해 혈관조영술의 맵핑을 받는다.
신체에서 혈관을 맵핑하는 방법은 통상의 당업자에게 널리 공지되어 있다. 이러한 맵핑이 치료 전에 완료되면, 숙련자는 어느 혈관이 폐색될지를 결정할 것이다. 숙련자가 오프-표적 동맥 또는 혈관을 차단하게 허용하여서, 간으로의 변형된 세포의 전달을 최적화하는, 예를 들어 미세코일 색전술의 이용을 통해, 폐색이 달성된다. 미세코일 색전술은 CAR-T 세포를 포함하는 약제학적 조성물의 최적 주입을 수월하게 하도록 CAR-T 세포의 제1 용량을 투여하기 전에 필요한 바대로 수행될 수 있다.
기재된 방법은 간 동맥에 직접적으로 배치된 카테터를 통한 치료학적 CAR-T 세포의 투여를 수반한다. 예를 들어, 치료학적 CAR-T 세포를 포함하는 약제학적 조성물은 1㎖/초 미만, 2㎖/초 미만의 속도로, 또는 약 1 내지 2㎖/초, 1 내지 3㎖/초, 1 내지 5㎖/초, 1㎖/초, 2㎖/초, 또는 3㎖/초의 속도로 주사기를 통해 간 동맥으로 수동 주사된다. 대안적으로, 세포는 수동 주사에 의해 기재된 바대로 동일한 속도로 당해 분야에 용이하게 공지된 바대로 주입 펌프의 사용에 의해 주사된다. 치료학적 CAR-T 세포의 용량(예를 들어, 약 108개, 109개 또는 1010개의 세포)을 포함하는 약제학적 조성물은 약 25 내지 100㎖, 25 내지 75㎖, 40 내지 60㎖, 50 내지 75㎖ 또는 50 내지 100㎖의 전체 용적을 가지거나, 약 25㎖, 40㎖, 50㎖, 60㎖, 75㎖ 또는 100㎖의 전체 용적을 가진다. 본 명세서에 개시된 바와 같은 방법은, 환자에게 투여된 변형된 세포의 용량이 오른쪽 및 왼쪽 간 동맥에 지향되어서, 간에 걸쳐 치료학적 유효량을 제공하도록 보장하도록, 간 용적측정 계산을 수행하는 것을 추가로 포함할 수 있다. 간 용적측정 계산을 보통의 당업자에게 공지된 표준 방법에 따라 수행하고, 섬광조영술, 초음파, 단일광자 방출 컴퓨터 단층촬영(single-photon emission computed tomography), 컴퓨터 단층촬영(computed tomography: CT) 및 자기 공명 영상화를 포함하지만, 이들로 제한되지는 않는다. 환자에 대한 용적측정 계산이 완료되면, 우엽 및 좌엽으로 전달된 변형된 세포의 수가 각각 우엽 및 좌엽의 용적과 비례하도록, 변형된 세포의 용량 또는 수는 오른쪽 및 왼쪽 간 동맥으로의 주입을 위해 분할된다.
몇몇 실시형태에서, 전체 용적의 50%는 환자에게 주입되고, CAR-T 용액은 완전한 세포 현탁을 보장하도록 교반되고, 이후 전체 용적의 최종 50%는 환자에게 주입된다. 주입은 18게이지 침을 사용하여 수행될 수 있다.
IL-2의 동시투여
환자는 CAR-T 치료 기간의 기간 동안 예를 들어 주마다 또는 2주마다 CAR-T 주입을 받는다. CAR-T 치료 기간은 2주, 3주, 4주, 5주, 6주, 7주, 8주, 9주 또는 10주일 수 있거나, 2주 내지 10주, 4주 내지 9주, 2주 내지 8주, 2주 내지 6주, 2주 내지 4주, 3주 내지 6주, 4주 내지 8주 또는 4주 내지 6주 지속할 수 있다. CAR-T 치료 기간의 시작(0일)은 치료되는 환자(또는, 대안적으로, 치료되는 환자가 아닌 대상체)로부터 혈액 세포가 수확되는 일자이다. CAR-T 세포의 주입을 받은 환자는 IL-2가 또한 투여될 수 있다. IL-2는 주입 후 CAR-T 세포의 생존능력을 촉진하지만, 열, 구역, 구토, 및/또는 빈맥과 같은 부작용을 발생시키거나 증대시키지 않는 IL-2의 용량을 사용하는 것이 바람직하다. 몇몇 실시형태에서, IL-2는 CAR-T 치료 기간의 완전 기간 동안 연속하여 투여된다. 이러한 연속 주입은 펌프 저장소를 사용하여 수행되고, 중심 정맥 카테터 또는 환자가 보행하게 하는 다른 방법을 통해 투여될 수 있다. IL-2 주입은 CAR-T 주입 시작 전 1시간 미만, 2시간 또는 3시간에, 제1 CAR-T 주입이 시작한 시간에 또는 그 주입 동안, 또는 제1 CAR-T 주입의 완료 후 약 1시간, 2시간 또는 3시간 내에 개시될 수 있다.
CEA
CAR-
T HAI에
대한
I상
실험
1상 임상 실험을 수행하고, 여기서 간 전이(LM)를 가지는 8명의 환자가 초기에 등록하고 본 명세서에 기재된 바대로 항-CEA CAR-T 세포에 의해 치료하였다. 환자 중 6명은 프로토콜을 완료하였다. 환자를 코호트 1 및 코호트 2로 나눴다. 세포를 0일에 모든 환자로부터 수확하고, 항-CEA CAR-T 세포(항-CEA scfv-CD8α-CD28/CD3ξ CAR-T 세포)를 생성하도록 사용하였다. 14일, 28일 및 42일에, 코호트 1에서의 각각의 환자는 14일에 108개의 세포, 28일에 109개의 세포 및 42일에 1010개의 세포의 주입을 받았다. 코호트 2의 경우, 14일, 28일 및 42일에, 각각의 환자는 1010개의 세포의 주입을 받았다. 코호트 2에서의 환자는 IL-2의 75,000 IU/㎏/일의 용량의 용량을 또한 받았고, 이는 14일에 시작하고 55일 또는 56일에 종료한다. 약 56일에, 코호트 1 및 2에서의 환자의 MRI 및 PET 분석을 56일에 수행하였다. 프로토콜을 완료한 6명의 환자로부터의 데이터는 항-CEA CAR-T의 HAI가 전신 IL-2 주입의 존재 및 부재 하에 매우 관용성이라는 것을 입증한다. 전신 IL-2 투여 또는 비투여의 모든 환자에서 IFNγ에서의 스파이크는 투약 후 24 내지 48시간에 발생하는 것이 주목된다(도 6 참조). 방사선촬영상 부분 또는 완전 반응이 없지만, 6명 중 1명의 환자는 안정한 질환을 가지고, 적어도 24개월 추적관찰 동안 생존한다.
본 명세서에 기재된 연구는 전신 IL-2 지원의 존재 및 부재 하에 항-CEA CAR-T HAI의 안전성을 확립하여서, 1010개의 세포의 최대 계획된 용량에 도달하였다. 따라서, CAR-T HAI의 안전성 및 효능과 관련하여, 발견은 LM의 치료에 대한 CAR-T HAI의 사용을 지지한다. 연구 대상체에서의 CAR-T의 제한된 전신 노출은 아마도 양호한 부작용 프로파일의 이유일 것이다. 전신 IL-2 지원은, 더 심각하지만 관리 가능한 부작용을 지출하면서, 증가한 혈청 IFNγ 수준 및 개선된 CEA 반응과 연관된다. 실시예 4에 기재된 바대로, HAI는, 정상 간 및 말초 혈액과 비교하여, 6명 중 5명의 환자에서 간 전이 내에 CAR-T를 우선적으로 축적시킨다. CAR-T는 6명 중 4명의 환자 및 오직 일시적으로 환자 7 및 8에서 말초 혈액에서 관찰되지 않았다. 중요하게는, 증가한 LM 괴사 및 섬유증의 조직학적 증거가 CAR-T HAI 후 대부분의 대상체에서 보였다(도 5 참조). 이 데이터는 모두 CEA+ 종양 침착물에 대한 CEA CAR-T 세포의 효과적인 전달이 종양 사멸 및 혈청 사이토카인 서지(surge)의 조직학적 증거와 잘 상관된다는 것을 보여주어서, 간 동맥 주입을 통한 간 전이의 치료를 위한 CAR-T 세포(예를 들어, 항-CEA scfv-CD8α-CD28/CD3ξ CAR-T 세포)의 치료 효능을 지지한다.
HAI는 정상 간 및 말초 혈액과 비교하여 6명 중 5명의 HITM 환자에서 LM 내에 CAR-T를 우선적으로 축적시킨다. CAR-T는 6명 중 4명의 환자에서 및 오직 일시적으로 환자 7 및 8에서 말초 혈액에서 검출되지 않았다. 간 기능 시험 값의 보통의 상승(예를 들어, 알칼리 포스파타제, 전체 빌리루빈 및 아스파르테이트 아미노트랜스퍼라제 수치의 일시적 상승)은 아마도 임상적으로 유의미한 결과를 생성시키지 않는 CAR-T HAI와 관련될 것이다. 항-CEA CAR-T를 발현하는 T 세포의 전신 주입은 용량 제한 독성을 발생시키는 것으로 이전에 보고되었다(Parkhurst et al., 2011, Mol Ther, 19:620-626). 유사한 독성은, 특히 IL-2 지원에 의해 전신 주입될 때, 항-CEA CAR-T에 의한 본 연구에서 보였다(비도시). IL-2의 75,000 IU/㎏/일인 연속 보행 주입 용량은 다른 프로토콜에서 제공된 것보다 수배 낮다(Rosenberg et al., 1999, J Clin Oncol, 17:968-975). 이 연구에서의 IL-2의 낮은 일일 용량에도 불구하고, 2명의 환자는 IL-2 용량 감소를 요하는 등급 3 사건을 경험하였다. 이 부작용, 예컨대 중증 발열 및 결장염은, IL-2 용량 감소 시 증상이 즉각 해소된다는 사실에 기초하여, IL-2에 기인할 수 있다. 1명의 대상체에서, IL-2가, 열 및 결장염을 매개하는, 전신 순환 항-CEA CAR-T의 적은 수를 활성화할 수 있다. 전반적으로, IL-2 주입 투여는 매우 관용성이고, 부작용은 용량 감소에 의해 쉽게 관리된다.
본 개시내용의 일 양태에서, 각각의 환자에 대한 CEA CAR-T 세포의 용량 수준은 1주 1회 HAI를 통해 투여된 1010개의 세포이다. 세포의 1주 1회 주입의 치료 효능은 본 명세서에 개시된 1상 실험으로부터의 혈청 간 화학 및 사이토카인 데이터에 의해 지지된다. 2주마다 주입이 수행된 1상 연구에서, 대부분의 환자는 CEA CAR-T HAI 후 혈청 알칼리 포스파타제, 빌리루빈 및 아스파르테이트 아미노트랜스퍼라제(AST) 수치의 일시적이지만 임상적으로 유의미한 상승을 나타냈다(실시예 7 참조). 거의 모든 경우에, 수치는 3-4일 내에 정상화되었다. 마찬가지로, 환자는 CAR-T HAI 후 혈청 IFNγ 및 IL-6 수치의 서지를 나타냈고, 이것은 1주 내에 기준치 또는 거의 기준치 수준으로 돌아갔다. 이 데이터는 1주 간격이 CAR-T HAI에 대한 급성 염증성 반응의 해소를 허용하고, 안전한 반복 CAR-T를 허용하기에 충분하다는 것을 제안한다. 2주로부터 1주로의 CAR-T 간격의 변화는 또한 환자에 대한 IL-2 노출을 최소화하고, 이것이 임상적으로 표시된 사람에 대해 전신 치료로 더 신속히 돌아가게 할 것이다. 바람직한 실시형태에서, 1주 1회 CEA CAR-T 세포 주입이 투여된 환자는 50,000 IU/㎏/일의 용량에서 IL-2의 연속 전신 주입을 받는다. 몇몇 실시형태에서, 절제 불가 간 전이로 진단된 환자는 CAR-T 주입 치료 기간 동안(최종 CAR-T 주입 후 14일을 포함) 연속 정맥내 주입에 의해 28일 동안 50,000 IU/㎏/일 IL-2의 용량이 투여된다.
간 전이의 CAR-T 치료의 치료 효능은 일상적인 영상화 기법, 예컨대 자기 공명 영상화(MRI), 양전자 단층촬영(PET), 또는 초음파에 의해 결정될 수 있다. 이러한 영상화 절차는 치료 전에, 동안에 및 후에 간에서의 종양의 정도 또는 종양 부담을 측정할 수 있다. CAR-T 세포의 HAI에 대한 치료학적으로 효과적인 투약 섭생은 세포의 제1 주입 전에 약 10% 내지 100%, 10% 내지 80%, 10% 내지 60%, 10% 내지 40%, 20% 내지 40%, 20% 내지 60%, 20% 내지 80%로 종양 부담에 대한 종양 부담을 감소시킬 수 있다.
선택적 내부 방사선 치료(
SIRT
)에 의한 CAR-
T HAI
선택적 내부 방사선 치료(Selective Internal Radiation Therapy: SIRT)는 절제 불가 암으로 진단된 환자에 일반적으로 사용되는 방사선 치료의 형태이다. SIRT는 표적, 예컨대 장기, 조직 또는 종양으로 방사성 마이크로구로서 투여되어서, 그 표적에 이온화 방사선의 치료학적 용량을 효과적으로 전달하고, 이것은 그 표적 장기, 조직 또는 종양의 손상 또는 사멸을 발생시킨다.
치료학적 분야를 위한 방사성 마이크로구는 이온화 방사선을 방출하는 방사성 핵종 재료에 대한 캐리어로서 작용할 수 있는 매트릭스 재료를 통상적으로 포함한다. 특히, 다수의 베타 방사선 방출 방사성 핵종, 예컨대 인-32, 홀뮴-166 또는 이트륨-90이 치료 효과에 의해 암 환자의 혈류로의 주사를 위해 매트릭스 마이크로구, 예컨대 중합성 수지 또는 유리 마이크로구에 부착될 수 있다는 것이 이전에 밝혀졌다.
방사성 마이크로구는 일반적으로 표적 조직 또는 종양의 동맥 혈액 공급을 통해 전달된다. 이를 위해, 카테터는 순환으로 마이크로구를 주입하도록 표적 조직 또는 종양을 공급하는 혈관의 분지로 가이드된다. 방사성 마이크로구는 전체 간, 간의 절편의 동맥 혈액 공급으로, 또는 간 동맥, 간문맥, 또는 이들 혈관 중 하나의 분지로 방사성 마이크로구의 주사에 의해 치료되는 종양을 함유하는 간의 부분의 동맥 혈액 공급으로 도입될 수 있다. 방사성 마이크로구는 종양 또는 표적 조직의 모세혈관계에 포획되어서, 표적 조직 또는 종양에 대한 방사선의 용량의 선택적 전달을 제공한다.
간암의 SIRT 치료에 대해 이용 가능한 2개의 상업적으로 구입 가능한 제품은 TheraSphere(등록상표)(MDS Nordion, Inc.), 및 SIR-Spheres(등록상표)(SIRTeX(등록상표) Medical Ltd.)를 포함한다. 제품 둘 다는 이트륨-90 표지된 마이크로구인 TheraSpheres(등록상표)(직경이 25±10㎛인 유리 마이크로구); 및 SIR-Spheres(등록상표)(직경이 32±2.5㎛인 수지계 마이크로구)이다.
본 명세서에 개시된 1상 실험의 유망한 결과 및 CEA CAR-T HAI의 치료 효능에도 불구하고, 가능할 때마다 치료 효능 및 편리함을 최적화하는 것이 항상 최고이다. 조합 전략은 치유 불가 질환으로 진단된 환자에 대한 이익을 대개 최대화할 수 있다. 방사선치료는 항원 방출 및 이팩터 T 세포의 동원을 통해 면역원성 종양 세포 사멸을 유도한다. 방사선치료 단독은 효과적인 항종양성 면역력을 오직 드물게 생성할 수 있다. 그러나, 표적화된 면역치료제와 조합될 때, 방사선치료는 치료학적으로 효과적인 항종양성 면역 반응에 상당히 기여한다. "HITM-SIR" 실험은 SIR-Spheres(등록상표), 이어서 CAR-T HAI를 이용함으로써 종양 사멸의 잠재적 증가 및 안전성을 시험하도록 설계된다. HITM-SIR은 증명된 안전성을 가지는 확립된 원칙 및 접근법의 새로운 반복이다. 이 새로운 실험은 LM의 관리를 위한 파라다임 변화 데이터를 생성할 가능성을 가진다.
일 양태에서, 간 전이로 진단된 대상체를 치료하는 방법이 제공되고, 여기서 대상체는, 전신 IL-2 투여에 의해 또는 이것 없이, 이어서 SIRT의 투여에 의해 상기 기재된 바대로 CAR-T HAI에 의해 치료된다. 환자는 종양의 용적을 기준으로 90Y 활성 90Y 활성의 2GBq, 2.5GBq, 또는 3GBq에 등가인 SIR-Spheres가 투약된다. 몇몇 실시형태에서, 전체 간 용적의 25% 미만, 약 25%-50% 또는 50% 초과인 종양 용적을 가지는 환자는 각각 90Y 활성의 2GBq, 2.5GBq, 또는 3GBq에 등가인 SIR-Spheres가 제공된다. SIR-Spheres의 용량은 최종 CAR-T HAI 주입 후 약 1주, 2주, 또는 3주에 환자에게 투여된다. 바람직한 실시형태에서, SIR-Spheres의 용량은 최종 CAR-T HAI 주입 후 약 1주에 투여된다.
면역억제인자 물질
키메라 항원 수용체 T 세포 주입의 치료 효능은 면역억제, 예를 들어 종양 사멸 세포의 억제 또는 항종양성 사이토카인의 발현의 감소를 발생시키는 인자에 의해 영향을 받을 수 있을 것이다. 암종의 존재 하에 복막내 공간의 면역 환경의 효과를 고려하고, 이렇게 키메라 수용체 T 세포 치료를 받은 환자를 치료하는 것이 중요하다.
종양 미세환경 내에 면역억제 조절 T 세포(Treg)의 및 골수성 유래 억제인자 세포(MDSC)의 축적은 효과적인 항종양 면역치료의 발전에 대한 잠재적인 주요 장애를 나타낸다(Weiss et al., 2014, J Immunol., 192:5821-5829). MDSC의 제거는 종양 보유 마우스에서 및 암 환자에서 면역 반응을 상당히 개선하는 것으로 밝혀졌다(Ostrong-Rosenberg et al., 2009, J Immunol, 182:4499-4506); Talmadge, 2007, Clin Cancer Rres, 13:5243-5248). 키메라 수용체 T 세포 치료를 받은 환자에서 예를 들어 Treg 및 MDSC에 의해 면역억제를 저해하는 방법이 본 명세서에 제공되고, 여기서 환자는 면역억제 세포의 기능을 저해하는 물질이 또한 투여된다. MDSC 및 Treg 둘 다는 CAR-T 항종양성 반응 및 내인성 T 세포의 저해제로서 잘 기재되어 있다(Khaled et al., 2013, Immunol Cell Biol, 91:493-502; Burkholder et al., 2014, Biochim, Biophys Acta, 1845:182-201). IP MDSC는 또한 높은 수준의 PD-L1(프로그래밍된 사멸-1 수용체 리간드)을 발현하고, 이것은 이전에 CAR-T 억제의 중요한 중재자인 것으로 입증되었다(Burga et al., 2015, 64:817-829). 따라서, 본 개시내용의 일 양태에서, CAR-T HAI를 받은 환자는 억제인자 T 세포, 예컨대 MDSC 또는 Treg의 활성을 억제하는 면역억제제가 또한 투여된다. 몇몇 실시형태에서, 면역억제제는 Gr1(과립구성 골수성 마커 단백질)에 결합하는 MDSC 고갈 항체 또는 PD-L1 차단 항체이다.
몇몇 실시형태에서, 면역억제제는 IL-10, PD-1(프로그래밍된 사멸-1 수용체), PD-L1(프로그래밍된 사멸-1 수용체 리간드 1), PD-L2(프로그래밍된 사멸-1 수용체 리간드 2), STAT3(전사 3의 단일 전이인자 및 활성인자), GM-CSF, CD25, GITR(글루코코르티코이드 유도된 TNFR 관련 단백질), TGF-β, 또는 CTLA4에 결합하는 항체이다. 다른 실시형태에서, 면역억제제는 CAR-T 세포의 주입 전에 대상체에게 투여된다. 훨씬 다른 실시형태에서, 면역억제제는 CAR-T 세포의 주입 후에 대상체에게 투여된다. 면역억제제는 CAR-T HAI 후 수회, 예를 들어 1일마다, 2일마다, 3일마다, 4일마다, 5일마다, 6일마다 또는 주마다 1회(7일마다) 투여될 수 있다. 면역억제제는 주입과 동일한 날짜에 투여될 수 있거나, 제1 CAR-T 간 동맥 주입 전에 1일, 2일, 3일, 4일, 5일, 6일, 7일 또는 이것 초과에 투여될 수 있다. 하나 초과의 면역억제제는 환자에게 투여될 수 있고, 예를 들어 대상체는 CD25에 결합하는 항체 및 GR1에 결합하는 항체와 동시투여되거나 연속하여 투여될 수 있다.
관련 기술의 상기 예 및 이와 관련된 제한은 예시적이고 배타적이 아닌 것으로 의도된다. 관련 기술의 다른 제한은 명세서 판독 및 도면의 연구 시 당해 분야의 당업자에게 명확해질 것이다.
IV.
실시예
하기 실시예는 자연히 예시적이고, 어떤 방식으로든 제한으로 의도되지 않는다.
실시예
1
인간 CAR-T 세포 제조
하기 더 자세히 기재된 바대로, 6명의 환자(본 명세서에서 환자 번호 1, 4, 5, 6, 7 및 8이라 칭함)를 이의 표면에 CEA 항원을 발현하는 전이성 세포를 특이적으로 표적화하는 CAR-T 세포의 간 주입에 의해 치료하였다. 항-CEA scfv-CD8α-CD28/CD3ξ(탬던) 키메라 항원 수용체를 이전에 기재된 바대로 MFG 레트로바이러스 골격으로 클로닝하였다(FDA BB IND 10791)(Emtage et al., Clin Canc Res, 14:8112-8122(본 명세서에 그 전문이 참고로 포함됨)). 간단히 말하면, N-말단에서 C-말단 방향으로, CEA, CD8 힌지 분절, CD28 세포외 도메인, 막관통 도메인 및 세포질 도메인 및 ξ 세포질 도메인에 특이적으로 결합하는 단클론성 항체의 hMN14 sFv(서열 번호 1)를 분자로 융합함으로써 탠덤 분자를 생성하였다. 생성된 키메라 작제물을 레트로바이러스 벡터로 클로닝하고, 제한 분해 및 서열분석에 의해 검증하였다. PG13 세포를 사용하여 임상 레트로바이러스 벡터 상청액을 제조하여 이전에 기재된 바대로 긴팔원숭이 유인원 백혈병 바이러스 위형 바이러스 입자를 생성하였다(Beaudoin et al., 2008, J Virol Methods, 148:253-259). 모든 임상 뱃치를 인디애나 대학교 벡터 제조 설비(인디애나주 인디아나폴리스)에서 제조하고, 사용까지 -80℃에서 저장하였다.
로드아일랜드(Rhode Island) 혈액원 직원들은 로저 윌리엄스(Roger Williams Medical Center: RWMC(로드아일랜드 프로비던스))에서 백혈구성분채집술을 수행하였다. 프로세싱, 제조, 증식, 용량 수확, 표지, 저장 및 유동에 관한 표준 조작 절차(standard operating procedure: SOP)를 가지는 RWMC 세포 면역치료 및 유전자 치료(Cell Immunotherapy and Gene Therapy: CITGT) 우수 의약품 제조관리 기준(Good Manufacturing Practice: GMP) 시설에서 항-CEA CAR-T를 제조하였다. 간단히 말하면, Ficoll(Sigma(미주리주 세인트 루이스))을 사용하여 백혈구성분채집술 생성물로부터 환자 말초 혈액 단핵 세포(PBMC)를 단리하였다. 본 발명자들은 이후 5% 무균 인간 AB 혈청(Valley Biomedical(버지니아주 윈체스터)), 50ng/㎖의 항-CD3 단클론성 항체(OKT3; Ortho Biotech(펜실베니아주 호샴)) 및 3000 U/㎖의 IL-2(Prometheus(캘리포니아주 샌 디에고))가 보충된 AIM V 배지(Life Technologies(뉴욕주 그랜드 아일랜드))를 함유하는 조직 배양 플라스크(BD Falcon(뉴저지주 프랭클린 레이크스))에서 48-72시간 동안 PBMC를 활성화하였다.
원심분리접종(spinoculation) 방법(Quintas-Cardama et al., 2007, Hum Gene Ther, 18:1253-1260)을 이용하여, 실온에서 1시간 동안 저속 원심분리로 5% 인간 AB 혈청, 3000 U/㎖의 IL-2 및 황산 프로타민(MP Biomedicals)을 가지는 AIM V 배지에서 레트로넥틴(Takara Bio Inc(일본)) 코팅된 6웰 플레이트에서 환자로부터 얻은 7.2 내지 14.4 x 108개의 T 세포를 형질도입하였다. 24시간에 걸쳐 전체 3회 형질도입 단계를 수행하였다. 형질도입 후, 세포를 배지 중에 세척하고, 37℃에서 48-72시간 동안 항온처리하였다. Lifecell 조직 배양 백(Baxter(일리노이주 디어 필드))에서 10-14일 동안 CAR-T를 추가로 증식시켰다. CAR-T 성장 곡선 및 세포 생존능력을 정기적으로 검사하고, 세포 성장 배지를 필요한 바대로 대체하였다. CD3(UCHT1, Invitrogen(메릴랜드주 프레데릭)), CD4(SK3, BD Biosciences(캘리포니아주 산호세)), CD8(3B5, Invitrogen) 및 CAR 발현(WI2 항체, Immunomedics(뉴저지주 노리스 플레인스))에 대해 특이적인 형광 표지된 항체에 의해 유세포분석법에 의해 CAR-T를 검사하였다. WI2 항체를 APC 접합체(WI2-APC; Molecular Probes)로서 준비하였다. CyAn(Beckman Coulter(캘리포니아주 브레아)) 또는 LSR-II(BD Biosciences(캘리포니아주 산호세)) 기계에서 유세포분석법을 수행하였다. 생물발광 세포독성 검정에 의해 환자 생성물의 시험관내 활성을 측정하였다. 루피퍼라제를 발현하는 CEA+ 종양 세포를 96웰 둥근바닥 플레이트에서 다양한 비율로 항-CEA CAR-T와 혼합하고, 각각의 웰로부터의 생물발광의 소실을 측정하였다(Karimi et al., 2014, PLoS One, 9:e89357). 형질도입된 T 세포를 IL-2(500 IU/㎖)의 존재 하에 배양하고 증식시키고, 형질도입 후 48시간에 CAR 발현 수준을 확인하였다.
CAR-T 세포를 평가하기 위해, 항-CEA CAR 작제물에 의한 형질도입 전에 및 후에 유세포분석법에 의해 각각의 환자로부터의 백혈구성분채집술 생성물을 분석하였다. 환자 1, 4, 5, 6, 7 및 8의 경우, 백혈구성분채집술 후 CD3+ 세포의 평균 백분율은 55%(범위, 12.0-82.0)이고, 활성화 및 형질도입 후 91%(범위, 72-97)로 증가하였다(도 1). 평균 CD4:CD8 비율은 백혈구성분채집술 샘플에서 2.4(범위, 1.4-4.7)이고, 최종 생성물에서 0.8(0.2-2.2)였다(비도시). 형질도입 효율(CAR+)은 10% 내지 64%의 범위이고, 평균은 45%였다(도 1). 주입 전에 CAR+ T 세포 중에 무시할만한 FoxP3 염색을 검출하였다(비도시). 최종 생성물에서의 세포는 주입 전에 85%(범위, 71-95) 생존 가능하였다. CEA+ 표적 세포의 환자 생성물 사멸을 시험하도록 시험관내 세포독성 검정을 수행하였다. 항-CEA CAR-T 세포를 CEA+ MC38 결장직장암종 표적 세포와 배양하였다. 루시페린의 첨가 후 생물발광의 소실에 의해 표적 세포 사멸을 정량화하였다. 잔류 광자 수에 기초하여 특이적 용해를 계산하였다. 이 검정은 환자 생성물이 CEA+ 표적 세포를 특이적으로 용해시킨다는 것을 확인시켜주었다(도 2).
PlasmaLyte(Baxter), 20% 인간 소 알부민(Valley Biomedicals), 10% DMSO(Bioniche Pharma(일리노이주 레이크 포레스트)) 및 IL-2를 함유하는 냉동 배지 중에 Fenwal 세포 수확 시스템(Baxter(일리노이주 디어필드))을 사용하여 임상 용량을 준비하였다. 박테리아 및 진균 배양물을 각각 14일 및 28일 동안 모니터링하였다. LAL 내독소 검정 키트(Lonza(메릴랜드주 워커스빌))를 사용하여 박테리아 내독소에 대한 검정을 수행하였다. 임상 용량을 액체 질소 중에 저장하고, 주입 직전에 해동하였다.
실시예
2
임상 연구 설계
I상 임상 연구(NCT01373047, RWH 11-335-99)를 수행하였다. 종래의 전신 치료의 평균 2.5(범위 2-4) 라인에서 진행한 절제 불가 CEA+ 선암 LM을 가지는 8명의 환자가 연구에 등록하였다(표 2).
6명의 환자는 프로토콜을 완료하였고(도 3), 1명의 환자는 치료 전에 비연관 감염으로 인해 중단하고, 또 다른 환자는 제3의 CAR-T HAI 전에 간외 질환 진행으로 인해 중단하였다. 프로토콜을 완료한 환자 중에, 4명은 남성이고 2명은 여성이었다. 5명의 환자는 IV 병기 결장직장암종을 가지고, 1명의 환자는 췌담 팽대부 암종을 가졌다. 평균 연령은 57세(범위, 51-66)였다. 환자는 실질적인 질환 부담(가장 큰 LM의 평균 크기가 8.4㎝(범위, 1.7-14.4)임)이 제시되고, 5명의 환자는 10 LM 초과를 가졌다. 등록시 평균 CEA 수준은 807ng/㎖(범위, 2-3265)였다. 8명 중 5명의 환자는 동시성 결장직장 LM을 가지고, 평균 질환 무 간격은 비동시성 LM을 가지는 환자에 대해 27.3개월(범위, 9 내지 37)였다. 모든 추가의 분석은 연구를 완료한 오직 6명의 환자를 포함한다.
연구에서, 3명의 환자의 2개의 코호트를 전신 IL-2 지원의 부재 또는 존재 하에 항-CEA CAR-T HAI에 의해 치료하였다(도 3). 코호트 1(환자 1, 4 및 5)을 IL-2 없이 환자 내 용량 상승 방식(108개, 109개 및 1010개의 세포)으로 CAR-T HAI에 의해 치료하였다. 구체적으로, T 세포를 0일에 각각의 환자로부터 수집하고, 제1 주입은 108개의 세포가 주입되는 동안 14일이었고, 제2 주입은 109개의 세포가 주입되는 28일이었고, 제3 주입은 1010개의 세포가 주입되는 44일이었다. 코호트 2에서의 사람들(환자 6, 7 및 8)은, 14일에 제1 주입의 시간에 시작하여 6주 동안 보행 주입 펌프를 통해 75,000 U/㎏/일에 연속 전신 IL-2 주입 이외에, 14일, 28일 및 44일에 1010개의 CAR-T의 3의 HAI를 받았다.
적격 환자는 측정 가능한 절제 불가 CEA-양성 LM 또는 검출 가능한 혈청 CEA 수준을 가지고, 종래의 전신 치료의 하나 이상의 라인에 실패했다. 폐 또는 복부에서의 최소 간외 질환이 허용되었다. 기준치에서, 주입일, 및 주입 후 1일, 2일, 4일 및 7일에 임상 평가를 수행하였다. 제1 주입 전 1개월 내에 및 이후 제3의 CAR-T HAI 후 1개월 내에 간 MRI 및 PET 실험에 의한 계획된 영상화 평가를 스케줄화하였다. 연구 방사선학자(BS)는 변형된 RECIST(mRECIST) 및 면역 관련 반응 기준(Wolchok et al., 2009, Clin Cancer Res, 15:7412-7420)에 따라 반응을 등급화하였다. 명검인 병리학자는 치료 전에 및 제2 용량 후 2주에 수행된 경피 생검으로부터 슬라이드에서 종양 괴사 및 섬유증을 점수 매겼다. 프로토콜에 따라 안전성 평가를 수행하였다. 부작용의 중증도를 부작용에 대한 국립 암 위원회 일반 용어 기준(National Cancer Institute Common Terminology Criteria for Adverse Events) 3.0을 이용하여 점수 매겼다.
실시예
3
CAR-T 세포 간 동맥 주입
기준치에서, 오른쪽 일반 대퇴 동맥 접근법을 통해 혈관조영술의 맵핑을 수행하였다. 간외 관류의 다른 가능한 소스 이외에 위십이지장 및 오른쪽 위 동맥을 미세코일에 의해 색전시켰다. CAR-T 주입을 위해, 동일한 동맥 접근 절차를 수행하고, 100㏄의 전체 용적으로 2㏄/초 미만의 속도로 60㏄ 주사기를 통해 세포를 수동 주사하였다. 보정된 조영 속도를 가지는 혈관조영술을 제1의 50㏄ 후 및 CAR-T 주입의 완료 시 수행하여 보존된 동맥 흐름을 확인시켜주었다. 가능할 때 적절한 간 동맥으로 주입을 전달하였다. 오른쪽 또는 왼쪽 간 동맥이 적절한 간 동맥으로부터 생기지 않는, 비정상 간 동맥 해부구조의 경우에, 간엽 용적 계산에 기초하여 용량을 나눴다. 이러한 경우에, 분할 용량을 오른쪽 및 왼쪽 간 동맥으로 별개로 전달하여 간엽 둘 다에 CAR-T 전달을 비례관계에 있도록 보장하였다.
하기 실시예에 사용된 항-CEA scfv-CD8α-CD28/CD3ξ(탬던) 키메라 항원 수용체를 이전에 기재된 바대로 MFG 레트로바이러스 골격으로 클로닝하였다(FDA BB IND 10791)(Nolan, et al., 1999, Clin Cancer Res, 5:3928-394; Emtage et al., 2008, Clin Cancer Res, 14:8112-8122; 상기 실시예 1 참조). 간단히 말하면, 하이브리드 CD28/CD3ξ 분자를 가지는 MFG 레트로바이러스 골격에서 hMN14 sFv-CD8 힌지 분절을 코딩하는 단편을 분자로 융합함으로써 탠덤 분자를 생성하였다. 작제물을 제한 분해 및 서열분석에 의해 검증하였다. PG13 세포를 사용하여 임상 레트로바이러스 벡터 상청액을 제조하여 이전에 기재된 바대로 긴팔원숭이 유인원 백혈병 바이러스 위형 바이러스 입자를 생성하였다(Beaudoin et al., 2008, J Virol Methods, 148:253-259). 모든 임상 뱃치를 인디애나 대학교 벡터 제조 설비(인디애나주 인디아나폴리스)에서 제조하고, 사용까지 -80℃에서 저장하였다.
실시예
4
주입 후 CAR-T 세포 통행
제1의 CAR-T HAI 전에 및 최종 HAI의 시간에 LM 및 정상 간을 샘플링하기 위해 CT 가이드 된 경피 생검을 얻었다. 유세포분석법에 의해 LM 생검, 정상 간 생검 및 말초 혈액 샘플 중의 CAR-T의 비율(CAR+/전체 림프구%)을 결정하였다. 예를 들어, 환자 7로부터의 샘플은 정상 간 림프구의 1.8%가 CAR-T의 HAI 후 CAR+이고, 종양내 림프구의 7.6%가 CAR+라는 것을 나타냈다. 주입 후 LM 생검 견본에서의 CAR+ 세포가 CD3+라는 것이 확인되었다. 모든 환자에 대해 말초 혈액, 정상 간 및 LM에서의 CAR-T 집단 데이터를 결정하였다. CAR-T는 6명 중 5명의 환자에서 정상 간과 비교하여 LM에서 더 풍부하였다. 환자 5에서, CAR-T는 최종 CAR-T 주입 후 마이크로파 절제 절차 12주 동안 얻은 샘플에서의 LM 림프구의 1.4%를 포함하는 것으로 밝혀졌다. 4명의 환자에서, CAR-T는 말초 혈액에서 검출 가능하지 않고, 최종 주입의 시간에 환자 7 및 환자 8에 일시적으로 존재하고, 수준은 이후 3일에 검출 아래로 떨어졌다. 최종 주입 후 2일에 취한 말초 혈액 샘플에서 정량적 PCR을 수행하였고; 오직 환자 7은 기준치에 대해 CAR DNA의 측정 가능한 증가(1.1배)를 가졌다. CAR-T 주입 후 환자 혈청에서 항-CAR 항체가 검출되지 않았다.
실시예
5
치료 활성
마지막 추적관찰에, 실험을 완료한 6명 중 5명의, 심하게 사전 치료된 환자는 질환 진행으로 사망했다(표 3).
기준치에서 및 제3의 CAR-T HAI 후 2 내지 4주에 6명 중 5명의 환자에서 MRI 및 PET 스캔을 수행하였다. 환자 8은 조국으로 돌아간 후 최종 영상화를 얻지 못했고, 최종적으로 질환 진행으로 사망했다. 환자 5를 제외한 모든 환자는 mRECIST 및 기준에 의해 방사선촬영 질환 진행을 가지는 것으로 결정되었다. 환자 5는 MRI 및 PET에 의해 안정한 질환을 가지는 것으로 밝혀졌다. 환자 7은 새로운 병변을 발전시켰고, 약간의 이미 기존의 병변의 크기의 증가를 나타냈지만, 다른 병변은 크기가 감소했다. MRI에서 크기가 감소한 환자 7의 뒤의 섹터에서의 병변은 PET에서 실행 가능하지 않았다. MRI에서 크기가 감소한 더 안쪽의 질환은 환자 7의 경우 주입 후 PET에서 대사저하상태(hypometabolic)가 된다는 것에 주목한다.
CAR-T의 주입 후 짧은 추적관찰 종래의 영상화에 대한 제한된 이용성을 고려하여, 본 발명자들은 각각의 환자에 대한 각각의 3의 HAI 후 다수 시점에 혈청 CEA 수준을 측정하였다. 코호트 1에서의 환자 중에, 혈청 CEA의 일시적인 감소가 각각의 CAR-T HAI 후 2명의 환자(도 4, 환자 1 및 5)에서 나타났다. CEA 동역학은 혈청 CA19-9 수준의 변화와 밀접하게 아주 유사하였다(비도시). 간담도 하위유형 팽대부 암종이 제시된, 환자 4는 실험 동안 임의의 지점에서 CEA 감소가 없는 유일한 환자이고, 이 사람은 또한 더 짧은 생존 시간을 가졌다.
항-CEA CAR-T와 함께 전신 IL-2를 받은 코호트 2에서의 환자는 치료에 대해 더 양호한 CEA 반응을 가졌다. 코호트 2에서의 각각의 3명의 환자는 IL-2 중재 또는 용량 감소를 요하고, 이것은 아마도 CAR-T 기능에 영향을 미칠 것이고, 본 발명자들은 기준치에서의 CEA 수준을 IL-2 용량 변화 바로 전의 시점(도 4에서 화살표로 표시)과 비교하였다. 이 시점을 사용할 때, 코호트 2에서의 모든 3명의 환자는 혈청 CEA 농도가 감소하였다(도 4 및 표 3). 환자 7 및 8은 IL-2 용량 중재 또는 감소 전에 각각 혈청 CEA 농도의 48% 및 43% 감소를 가졌다. 실험을 완료한 6명의 환자에 대한 평균 전체 생존 시간은 15주의 중앙치로 30주(범위, 8-73)였다. 환자 5는 최종 CAR-T HAI 후 24개월에 질환에 생존하였다. HITM 실험의 완료 후, 환자 5는 안정한 질환을 가지는 것으로 결정되었고, 본 발명자들은 잔류 절제 불가 종양의 마이크로파 절제를 수행하였다.
진행된 전이성 질환을 가지는, 심하게 전치료된 환자에서 방사선촬영 반응을 검출하는 것은 도전적이고, 종양내 염증 및 부종이 표준 RECIST 기준의 관련성을 최소화할 수 있는, 면역치료에 의해 더욱 더 그렇다(Wolchok et al., 2009, Clin Canc Res, 15:7412-7420). 그러므로, 본 발명자들은 CAR-T HAI 전에 및 후에 LM 생검을 얻어서 종양내 괴사 및 섬유증의 감소를 평가하였다. 정상 간 및 간 전이 코어 침(16-게이지) 생검을 기준치에서 및 제3의 CAR-T HAI의 시간에 초음파검사 가이던스 하에 얻었다. 정상 간 및 간 전이에 대해 3개의 코어를 얻었고, 각각 세포학에 의해 확인되었다. 각각의 경우에, 4 내지 5㎜ 절편을 헤마톡시린 및 에오신(H&E)에 의해 염색하고, 추가적인 염색되지 않은 슬라이드를 항-CEA 항체(TF 3H8-1; Ventana)에 의해 염색하였다. 모든 면역조직화학 염색을 파티마 성모 병원(Our Lady of Fatima Hospital(로드아일랜드 프로비던스))에서 벤타나 의학 시스템(Ventana Medical System)에서 수행하였다. 모든 슬라이드를 맹검 방식으로 검토하고, 괴사 및 섬유증에 대해 점수 매겼다. 섬유증을 하기에 따라 점수 매겼다: 0%, 등급 0; 5% 내지 10%, 등급 1; 11% 내지 50%, 등급 2; 50% 초과, 등급 3. 괴사를 하기에 따라 점수 매겼다: 0%, 등급 0; 0% 내지 10%, 등급 1; 11% 내지 50%, 등급 2; 50% 초과, 등급 3. 상기 기재된 바대로 CAR-T 세포 및 말초 혈액에 대해 새로운 생검 조직에서 유세포분석법을 수행하였다. 맹검 병리학자에 의한 검토 후, 4명의 환자는 종양내 섬유증이 증가했고, 3명의 환자는 이들의 LM 내에 괴사의 증가를 가지는 것으로 점수 매겨졌다(도 5). 각각의 환자의 경우, 기준치 및 주입 후 점수는 도 5에서 왼쪽에서 오른쪽으로 나타난다. 환자 1, 4, 7 및 8은 섬유증의 증가를 나타냈지만, 환자 4 및 5는 괴사의 증가를 나타냈다.
실시예
6
IL-2 투여에 의한 혈청
IFNγ
농도 및
CEA
반응 상관관계
다수의 시점에 ELISA에 의해 혈청 IFNγ 수준을 측정하였다. IFNγ에서의 스파이크는 전신 IL-2를 가지거나 가지지 않는 모든 환자에서 투약 후 24-48시간에 발생하는 것이 주목된다(도 6; 점선 수직선은 CAR-T 주입 시점을 나타내고, 제1 데이터 점은 CAR-T 주입 전에 기준치 값을 나타낸다). 각각의 환자에 대해 혈청 CEA 변화를 IFNγ의 피크 변화와 비교하였다(도 7, 상부). 피크 IFNγ 수준과 CEA 비교 사이의 역의 상관관계는 유의미하였다(R = -0.94, p = 0.02). 모든 환자 HAI CAR-T 용량은 IL-2의 분량(600,000 IU)을 함유하였다. 연속 전신 IL-2 노출 및 가장 큰 CAR-T 용량을 가지는 3명의 환자(환자 번호 6, 7 및 8)는 최고의 CEA 반응 및 가장 높은 평균 IFNγ 수준을 가졌다(P = 0.03, 도 7, 바닥).
실시예
7
안전성 데이터
실험을 완료한 모든 환자에서 어떤 원인으로 인할 수 있는 임의의 등급의 부작용(AE)이 관찰되었다(표 4). 코호트 1에서의 용량은 1010ㄴ개의 세포에서 계획된 최대 HAI CAR-T 주입 수준에 도달하였다. CAR-T 용량 감소가 코호트 1에서 필요하지 않고, 따라서, 코호트 2에서의 모든 환자는 IL-2 지원에 의해 1010 수준에서 3 용량을 받았다. 등급 4 또는 5 부작용이 없었다. 발열 AE는 4명의 환자에서 관찰되었다. 환자 7은 104℉의 온도 피크로 등급 3 열 및 빈맥을 경험하였다. 열 및 빈맥은 전신 IL-2 주입의 50% 용량 감소 후 환자 7에서 해소되었다. 흥미롭게도, 환자 7은 또한 20%의 피크 및 3,740/㎖의 절대 수로 말초 호산구 수의 증가를 경험하였다. 로플러 증후군의 다른 특징에 의해 IL-2 주입과 심장 혈전증 사이의 보고된 연관성을 고려하여(Junghans et al., 2001, New Eng J Med, 344:859-860), 본 발명자들은 정상인 심초음파검사 및 심전도를 얻었다. 이 사람의 호산구 수는 특별한 중재 없이 정상 수치로 돌아갔다.
정상 간 실질 및 담낭 구조는 CAR-T HAI 후 잘 보존되었다. 정상 간으로부터의 생검은, 전신 IL-2가 투여되든 또는 아니든, CAR-T HAI 후 섬유증 또는 염증의 증가하는 수준을 나타내지 않았다. 모든 환자가 알칼리 포스파타제(alk phos), 전체 빌리루빈 및 아스파르테이트 아미노트랜스퍼라제 수치(AST)의 일시적인 상승을 경험하지만, 오직 환자 1이 등급 3 상승을 경험하고, 대부분의 값은 기준치 수준으로부터 유의미하게 벗어나지 않았다. 환자가 혈소판감소 또는 응고장애가 되지 않는 것으로 반영된 바대로, 문맥압 및 간 합성 기능은 CAR-T HAI에 의해 부정적으로 영향을 받지 않았다.
실시예
8
안전성 데이터
환자에게 HAI를 통해 1010개의 항-CEA scfv-CD8α-CD28/CD3ξ CAR-T 세포가 각각 투여된 I상 임상 연구를 수행하였다. (상기 실시예에 기재된 바대로) 수행하였다. T 세포는 0일에 각각의 환자로부터 단리되고, 형질감염되고, 항-CEA scfv-CD8α-CD28/CD3ξ 작제물을 발현하도록 선택될 것이다. 이후, 각각의 환자에게 14일, 21일 및 28일에 1010개의 세포가 투여된다. 44일에(최종 세포 주입 후 2주 휴약 후), SIR-Spheres(등록상표) 함유의 용량이 각각의 환자에게 주입된다.
SIR-Spheres(등록상표) 투약을 위해, 환자는 정상 간 용적에 대해 종양 용적의 크기에 따라 달라지는 SIR-Spheres(등록상표)의 미리 결정된 분량을 받을 것이다. 전체 간 용적의 25% 미만, 25% 내지 50% 또는 50% 초과인 종양을 가지는 환자는 90Y 활성의 2 기가베크렐(GBq), 2.5 GBq, 또는 3 GBq에 등가인 SIR-Spheres(등록상표)가 제공된다. 폐-간 돌파 스캔이, 10% 초과의 마이크로구가 간을 통해 통과하고 폐에 있다는 것을 나타낸, 환자에 대해 준비가 이루어졌다. 투여되는 90Y 활성의 양은 각각 1%에 대해 2%만큼 감소하여서, 폐-간 돌파 백분율이 10% 초과이다. 환자는 SIR-Spheres(등록상표) 치료와 동일 일자에 또는 그 다음 날에 퇴원한다.
환자는 적절한 임상 및 방사선학 연구에 의해 최종 주입 후 1개월에 완전 반응, 부분 반응, 안정한 질환 또는 진행성 질환을 가지는 것으로 평가되었다. 변형된 T 세포의 순환 수준을 유세포분석법에 의해 모니터링하여 PCR에 의해 항-CEA scfv-CD8α-CD28/CD3ξ 및 CD4/CD8을 검출하였다. LM 및 정상 간 생검 견본을 사용하여 CAR-T 종양 침윤의 정도를 결정하였다. 항-CEA scfv-CD8α-CD28/CD3ξ CAR-T의 존재를 정량화하도록 유세포분석법 및/또는 면역조직화학에 의해 생검 샘플을 분석하였다. 혈청 사이토카인 수준 및 정상 간 T 세포 집단의 변화에 대해 샘플을 채취하였다. 혈청 IL-2, IFNγ, IL6, IL17 및 IL10을 측정하도록 ELISA 검정을 수행하였다. 호중구:림프구 비율, 및 유세포분석법에 의한 간 및 말초 T 세포 집단의 상세한 평가를 CBC로부터 동일한 시점에 결정하였다. CD3, CD4, CD8, FOXP3, PD-1, CD25, CTLA4 및 CD69에 특이적인 항체에 의해 간내 및 말초 T 세포를 염색하였다.
다수의 예시적인 양태 및 실시양태가 상기 기재되어 있지만, 당해 분야의 당업자는 소정의 변형, 순열, 부가 및 이들의 하위조합을 인식할 것이다. 따라서, 소정의 첨부된 청구항 및 이하 도입된 청구항이 이의 진정한 사상 및 범위 내에 있는 모든 이러한 변형, 순열, 부가 및 이들의 하위조합을 포함하는 것으로 해석되어야 하는 것으로 의도된다.
<110> PROSPECT CHARTERCARE RWMC, LLC D/B/A ROGER WILLIAMS MEDICAL CENTER
<120> Hepatic Arterial Infusion of CAR-T Cells
<130> 2017-FPA-8400
<150> US 62/147,793
<151> 2015-04-15
<160> 6
<170> PatentIn version 3.5
<210> 1
<211> 213
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 1
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Gly Thr Ser
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Trp Thr Ser Thr Arg His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Leu Tyr Arg Ser
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala Pro
100 105 110
Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr
115 120 125
Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys
130 135 140
Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
145 150 155 160
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser
165 170 175
Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala
180 185 190
Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe
195 200 205
Asn Arg Gly Glu Cys
210
<210> 2
<211> 235
<212> PRT
<213> Homo sapiens
<400> 2
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Ser Gln Phe Arg Val Ser Pro Leu Asp Arg Thr
20 25 30
Trp Asn Leu Gly Glu Thr Val Glu Leu Lys Cys Gln Val Leu Leu Ser
35 40 45
Asn Pro Thr Ser Gly Cys Ser Trp Leu Phe Gln Pro Arg Gly Ala Ala
50 55 60
Ala Ser Pro Thr Phe Leu Leu Tyr Leu Ser Gln Asn Lys Pro Lys Ala
65 70 75 80
Ala Glu Gly Leu Asp Thr Gln Arg Phe Ser Gly Lys Arg Leu Gly Asp
85 90 95
Thr Phe Val Leu Thr Leu Ser Asp Phe Arg Arg Glu Asn Glu Gly Tyr
100 105 110
Tyr Phe Cys Ser Ala Leu Ser Asn Ser Ile Met Tyr Phe Ser His Phe
115 120 125
Val Pro Val Phe Leu Pro Ala Lys Pro Thr Thr Thr Pro Ala Pro Arg
130 135 140
Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg
145 150 155 160
Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly
165 170 175
Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr
180 185 190
Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Asn His
195 200 205
Arg Asn Arg Arg Arg Val Cys Lys Cys Pro Arg Pro Val Val Lys Ser
210 215 220
Gly Asp Lys Pro Ser Leu Ser Ala Arg Tyr Val
225 230 235
<210> 3
<211> 384
<212> PRT
<213> Homo sapiens
<400> 3
Met Lys Trp Lys Ala Leu Phe Thr Ala Ala Ile Leu Gln Ala Gln Leu
1 5 10 15
Pro Ile Thr Glu Ala Gln Ser Phe Gly Leu Leu Asp Pro Lys Leu Cys
20 25 30
Tyr Leu Leu Asp Gly Ile Leu Phe Ile Tyr Gly Val Ile Leu Thr Ala
35 40 45
Leu Phe Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr
50 55 60
Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg
65 70 75 80
Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met
85 90 95
Gly Gly Lys Pro Gln Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn
100 105 110
Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met
115 120 125
Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly
130 135 140
Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala
145 150 155 160
Leu Pro Pro Arg Met Leu Arg Leu Leu Leu Ala Leu Asn Leu Phe Pro
165 170 175
Ser Ile Gln Val Thr Gly Asn Lys Ile Leu Val Lys Gln Ser Pro Met
180 185 190
Leu Val Ala Tyr Asp Asn Ala Val Asn Leu Ser Cys Lys Tyr Ser Tyr
195 200 205
Asn Leu Phe Ser Arg Glu Phe Arg Ala Ser Leu His Lys Gly Leu Asp
210 215 220
Ser Ala Val Glu Val Cys Val Val Tyr Gly Asn Tyr Ser Gln Gln Leu
225 230 235 240
Gln Val Tyr Ser Lys Thr Gly Phe Asn Cys Asp Gly Lys Leu Gly Asn
245 250 255
Glu Ser Val Thr Phe Tyr Leu Gln Asn Leu Tyr Val Asn Gln Thr Asp
260 265 270
Ile Tyr Phe Cys Lys Ile Glu Val Met Tyr Pro Pro Pro Tyr Leu Asp
275 280 285
Asn Glu Lys Ser Asn Gly Thr Ile Ile His Val Lys Gly Lys His Leu
290 295 300
Cys Pro Ser Pro Leu Phe Pro Gly Pro Ser Lys Pro Phe Trp Val Leu
305 310 315 320
Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val
325 330 335
Ala Phe Ile Ile Phe Trp Val Arg Ser Lys Arg Ser Arg Leu Leu His
340 345 350
Ser Asp Tyr Met Asn Met Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys
355 360 365
His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser
370 375 380
<210> 4
<211> 220
<212> PRT
<213> Homo sapiens
<400> 4
Met Leu Arg Leu Leu Leu Ala Leu Asn Leu Phe Pro Ser Ile Gln Val
1 5 10 15
Thr Gly Asn Lys Ile Leu Val Lys Gln Ser Pro Met Leu Val Ala Tyr
20 25 30
Asp Asn Ala Val Asn Leu Ser Cys Lys Tyr Ser Tyr Asn Leu Phe Ser
35 40 45
Arg Glu Phe Arg Ala Ser Leu His Lys Gly Leu Asp Ser Ala Val Glu
50 55 60
Val Cys Val Val Tyr Gly Asn Tyr Ser Gln Gln Leu Gln Val Tyr Ser
65 70 75 80
Lys Thr Gly Phe Asn Cys Asp Gly Lys Leu Gly Asn Glu Ser Val Thr
85 90 95
Phe Tyr Leu Gln Asn Leu Tyr Val Asn Gln Thr Asp Ile Tyr Phe Cys
100 105 110
Lys Ile Glu Val Met Tyr Pro Pro Pro Tyr Leu Asp Asn Glu Lys Ser
115 120 125
Asn Gly Thr Ile Ile His Val Lys Gly Lys His Leu Cys Pro Ser Pro
130 135 140
Leu Phe Pro Gly Pro Ser Lys Pro Phe Trp Val Leu Val Val Val Gly
145 150 155 160
Gly Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala Phe Ile Ile
165 170 175
Phe Trp Val Arg Ser Lys Arg Ser Arg Leu Leu His Ser Asp Tyr Met
180 185 190
Asn Met Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro
195 200 205
Tyr Ala Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser
210 215 220
<210> 5
<211> 526
<212> PRT
<213> Homo sapiens
<400> 5
Met Gly His Leu Ser Ala Pro Leu His Arg Val Arg Val Pro Trp Gln
1 5 10 15
Gly Leu Leu Leu Thr Ala Ser Leu Leu Thr Phe Trp Asn Pro Pro Thr
20 25 30
Thr Ala Gln Leu Thr Thr Glu Ser Met Pro Phe Asn Val Ala Glu Gly
35 40 45
Lys Glu Val Leu Leu Leu Val His Asn Leu Pro Gln Gln Leu Phe Gly
50 55 60
Tyr Ser Trp Tyr Lys Gly Glu Arg Val Asp Gly Asn Arg Gln Ile Val
65 70 75 80
Gly Tyr Ala Ile Gly Thr Gln Gln Ala Thr Pro Gly Pro Ala Asn Ser
85 90 95
Gly Arg Glu Thr Ile Tyr Pro Asn Ala Ser Leu Leu Ile Gln Asn Val
100 105 110
Thr Gln Asn Asp Thr Gly Phe Tyr Thr Leu Gln Val Ile Lys Ser Asp
115 120 125
Leu Val Asn Glu Glu Ala Thr Gly Gln Phe His Val Tyr Pro Glu Leu
130 135 140
Pro Lys Pro Ser Ile Ser Ser Asn Asn Ser Asn Pro Val Glu Asp Lys
145 150 155 160
Asp Ala Val Ala Phe Thr Cys Glu Pro Glu Thr Gln Asp Thr Thr Tyr
165 170 175
Leu Trp Trp Ile Asn Asn Gln Ser Leu Pro Val Ser Pro Arg Leu Gln
180 185 190
Leu Ser Asn Gly Asn Arg Thr Leu Thr Leu Leu Ser Val Thr Arg Asn
195 200 205
Asp Thr Gly Pro Tyr Glu Cys Glu Ile Gln Asn Pro Val Ser Ala Asn
210 215 220
Arg Ser Asp Pro Val Thr Leu Asn Val Thr Tyr Gly Pro Asp Thr Pro
225 230 235 240
Thr Ile Ser Pro Ser Asp Thr Tyr Tyr Arg Pro Gly Ala Asn Leu Ser
245 250 255
Leu Ser Cys Tyr Ala Ala Ser Asn Pro Pro Ala Gln Tyr Ser Trp Leu
260 265 270
Ile Asn Gly Thr Phe Gln Gln Ser Thr Gln Glu Leu Phe Ile Pro Asn
275 280 285
Ile Thr Val Asn Asn Ser Gly Ser Tyr Thr Cys His Ala Asn Asn Ser
290 295 300
Val Thr Gly Cys Asn Arg Thr Thr Val Lys Thr Ile Ile Val Thr Glu
305 310 315 320
Leu Ser Pro Val Val Ala Lys Pro Gln Ile Lys Ala Ser Lys Thr Thr
325 330 335
Val Thr Gly Asp Lys Asp Ser Val Asn Leu Thr Cys Ser Thr Asn Asp
340 345 350
Thr Gly Ile Ser Ile Arg Trp Phe Phe Lys Asn Gln Ser Leu Pro Ser
355 360 365
Ser Glu Arg Met Lys Leu Ser Gln Gly Asn Thr Thr Leu Ser Ile Asn
370 375 380
Pro Val Lys Arg Glu Asp Ala Gly Thr Tyr Trp Cys Glu Val Phe Asn
385 390 395 400
Pro Ile Ser Lys Asn Gln Ser Asp Pro Ile Met Leu Asn Val Asn Tyr
405 410 415
Asn Ala Leu Pro Gln Glu Asn Gly Leu Ser Pro Gly Ala Ile Ala Gly
420 425 430
Ile Val Ile Gly Val Val Ala Leu Val Ala Leu Ile Ala Val Ala Leu
435 440 445
Ala Cys Phe Leu His Phe Gly Lys Thr Gly Arg Ala Ser Asp Gln Arg
450 455 460
Asp Leu Thr Glu His Lys Pro Ser Val Ser Asn His Thr Gln Asp His
465 470 475 480
Ser Asn Asp Pro Pro Asn Lys Met Asn Glu Val Thr Tyr Ser Thr Leu
485 490 495
Asn Phe Glu Ala Gln Gln Pro Thr Gln Pro Thr Ser Ala Ser Pro Ser
500 505 510
Leu Thr Ala Thr Glu Ile Ile Tyr Ser Glu Val Lys Lys Gln
515 520 525
<210> 6
<211> 19
<212> PRT
<213> Homo sapiens
<400> 6
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser
Claims (20)
- 대상체에서 간 전이를 치료하는 방법으로서,
키메라 항원 수용체 단백질을 발현하는 키메라 항원 수용체 T 세포(chimeric antigen receptor T cell: CAR-T cell)를 포함하는 조성물을 상기 대상체의 간 동맥에 주입하는 단계를 포함하되, 상기 키메라 항원 수용체 단백질은 상기 간에서 전이성 세포 상에 발현된 항원에 결합하는, 대상체에서 간 전이를 치료하는 방법. - 청구항 1에 있어서,
상기 주입하는 단계 전에 상기 간 동맥 및 근처의 혈관을 맵핑하도록 혈관조영술을 수행하는 단계를 더 포함하는, 대상체에서 간 전이를 치료하는 방법. - 청구항 2에 있어서,
상기 간으로 공급되지 않은 혈관을 폐색하는 단계를 더 포함하는, 대상체에서 간 전이를 치료하는 방법. - 청구항 1 내지 청구항 3 중 어느 하나의 항에 있어서,
상기 주입하는 단계 동안 혈관조영술을 수행하는 단계를 더 포함하되, 상기 혈관조영술은 상기 주입하는 단계 동안 간내 혈류역학적 통합성(intrahepatic hemodynamic integrity)을 모니터링하는, 대상체에서 간 전이를 치료하는 방법. - 청구항 1 내지 청구항 4 중 어느 하나의 항에 있어서,
상기 키메라 항원 수용체 단백질은 상기 전이성 세포의 표면 상에 발현된 암배아성 항원(carcinoembryonic antigen: CEA)에 특이적으로 결합되는, 대상체에서 간 전이를 치료하는 방법. - 청구항 1 내지 청구항 4 중 어느 하나의 항에 있어서,
상기 키메라 항원 수용체 단백질은 서열 번호 1을 포함하는, 대상체에서 간 전이를 치료하는 방법. - 청구항 1 내지 청구항 4 중 어느 하나의 항에 있어서,
상기 대상체의 상기 간 동맥에 제2 치료제를 투여하는 단계를 더 포함하는, 대상체에서 간 전이를 치료하는 방법. - 청구항 7에 있어서,
상기 제2 치료제는 IL-2인, 대상체에서 간 전이를 치료하는 방법. - 청구항 8에 있어서,
상기 제2 치료제를 투여하는 단계는 상기 면역반응성 세포를 포함하는 상기 조성물의 상기 주입 전에, 동안에 또는 후에 수행되는, 대상체에서 간 전이를 치료하는 방법. - 청구항 1 내지 청구항 4 중 어느 하나의 항에 있어서,
상기 CAR-T 세포를 포함하는 상기 조성물은 1주마다 1회, 2주마다 1회, 3주마다 1회 또는 4주마다 1회 상기 대상체의 간 동맥에 주입되는, 대상체에서 간 전이를 치료하는 방법. - 청구항 1 내지 청구항 4 중 어느 하나의 항에 있어서,
상기 CAR-T 세포를 포함하는 상기 조성물을 상기 대상체의 간 동맥에 주입하는 것은 상기 간 동맥으로 108개 내지 1010개의 CAR-T 세포를 주입하는 것을 포함하는, 대상체에서 간 전이를 치료하는 방법. - 청구항 1 내지 청구항 4 중 어느 하나의 항에 있어서,
상기 조성물을 주입하는 것은, 상기 주입 전에 혈청에서의 CEA의 수준과 비교하여, 혈청 CEA의 40% 내지 50% 감소를 유발하는, 대상체에서 간 전이를 치료하는 방법. - 대상체에서 간 전이를 치료하는 방법으로서,
키메라 항원 수용체 단백질(CAR)을 발현하는 CAR-T 세포를 포함하는 조성물을 상기 대상체의 간 동맥에 주입하는 단계를 포함하되, 상기 CAR 단백질은 CEA에 결합되는, 대상체에서 간 전이를 치료하는 방법. - 청구항 13에 있어서,
상기 키메라 항원 수용체 단백질은 서열 번호 1을 포함하는, 대상체에서 간 전이를 치료하는 방법. - 청구항 13 또는 청구항 14에 있어서,
상기 CAR은, N-말단에서 C-말단 방향으로, CEA에 결합하는 scFv, CD8 힌지 도메인, CD28 세포외 도메인, CD28 막관통 도메인, CD28 세포질 도메인 및 CD3 제타 세포질 도메인을 포함하는, 대상체에서 간 전이를 치료하는 방법. - 청구항 15에 있어서,
상기 주입하는 단계는 상기 간 동맥에 108개 내지 1010개의 CAR-T 세포를 주입하는 것을 포함하는, 대상체에서 간 전이를 치료하는 방법. - 청구항 15에 있어서,
상기 대상체에게 제2 치료제를 포함하는 조성물을 투여하는 단계를 더 포함하는, 대상체에서 간 전이를 치료하는 방법. - 청구항 17에 있어서,
상기 제2 치료제는 IL-2 또는 이트륨-90인, 대상체에서 간 전이를 치료하는 방법. - 간 전이로 진단된 대상체의 혈청에서 CEA를 감소시키는 방법으로서, 키메라 항원 수용체 단백질을 발현하는 키메라 항원 수용체 T 세포(CAR-T 세포)를 포함하는 조성물을 상기 대상체의 간 동맥에 주입하는 단계를 포함하되, 상기 키메라 항원 수용체 단백질은 상기 간에서의 전이성 세포 상에 발현된 항원에 결합하는, 간 전이로 진단된 대상체의 혈청에서 CEA를 감소시키는 방법.
- 청구항 19에 있어서,
상기 키메라 항원 수용체 단백질은 CEA에 결합되는, 간 전이로 진단된 대상체의 혈청에서 CEA를 감소시키는 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562147793P | 2015-04-15 | 2015-04-15 | |
| US62/147,793 | 2015-04-15 | ||
| PCT/US2016/027582 WO2016168493A1 (en) | 2015-04-15 | 2016-04-14 | Hepatic arterial infusion of car-t cells |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20180021364A true KR20180021364A (ko) | 2018-03-02 |
Family
ID=57126310
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020177033070A KR20180021364A (ko) | 2015-04-15 | 2016-04-14 | Car-t 세포의 간 동맥 주입 |
Country Status (13)
| Country | Link |
|---|---|
| US (2) | US10471098B2 (ko) |
| EP (1) | EP3283083A4 (ko) |
| JP (1) | JP2018513216A (ko) |
| KR (1) | KR20180021364A (ko) |
| CN (1) | CN108135937A (ko) |
| AR (1) | AR104296A1 (ko) |
| AU (1) | AU2016248090A1 (ko) |
| CA (1) | CA2982603A1 (ko) |
| HK (1) | HK1251179A1 (ko) |
| IL (1) | IL255005A0 (ko) |
| MX (1) | MX2017013247A (ko) |
| TW (1) | TWI719019B (ko) |
| WO (1) | WO2016168493A1 (ko) |
Families Citing this family (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP6979882B2 (ja) | 2015-06-24 | 2021-12-15 | ザ リージェンツ オブ ザ ユニヴァシティ オブ ミシガン | 脳組織の治療のための組織破砕療法システムおよび方法 |
| CN107056952A (zh) * | 2017-05-10 | 2017-08-18 | 常州市第人民医院 | Cea.car‑t及其制备与应用 |
| WO2019030757A1 (en) * | 2017-08-09 | 2019-02-14 | Ctg Pharma Ltd. | CHIMERIC ANTIGEN RECEPTOR FOR HER2 / NEU AND LYMPHOCYTES T THE EXPRESSANT |
| EP3704156A1 (en) * | 2017-11-03 | 2020-09-09 | Sorrento Therapeutics, Inc. | Cd38-directed chimeric antigen receptor constructs |
| US20210341483A1 (en) * | 2017-11-30 | 2021-11-04 | Singapore Health Services Pte. Ltd. | System and method for classifying cancer patients into appropriate cancer treatment groups and compounds for treating the patient |
| EP3762430A4 (en) * | 2018-03-09 | 2022-03-16 | Sorrento Therapeutics, Inc. | DIMER ANTIGEN RECEPTORS (DAR) |
| CN112739340A (zh) * | 2018-07-23 | 2021-04-30 | 美真达治疗公司 | 抗cd5抗体药物缀合物(adc)在同种异体细胞疗法中的用途 |
| CN112533953A (zh) * | 2018-08-02 | 2021-03-19 | 凯德药业股份有限公司 | 嵌合抗原受体疗法t细胞扩增动力学及其用途 |
| CN112384231A (zh) * | 2018-08-26 | 2021-02-19 | 奥伊斯细胞生物技术公司 | 用于治疗胶质母细胞瘤的方法 |
| CN113166225A (zh) * | 2018-09-13 | 2021-07-23 | 恩卡尔塔公司 | 天然杀伤细胞组合物和治疗肿瘤的免疫疗法方法 |
| WO2020113083A1 (en) | 2018-11-28 | 2020-06-04 | Histosonics, Inc. | Histotripsy systems and methods |
| EP3799881A1 (en) | 2019-10-04 | 2021-04-07 | Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V. | Single domain antibodies specifically binding globo - series glycans |
| IL293189A (en) * | 2019-11-25 | 2022-07-01 | Univ Kyoto | A primary cell bank of t cells |
| US11813485B2 (en) | 2020-01-28 | 2023-11-14 | The Regents Of The University Of Michigan | Systems and methods for histotripsy immunosensitization |
| EP4217064A4 (en) * | 2020-09-22 | 2024-08-07 | Trisalus Life Sciences Inc | CANCER THERAPY WITH TOLL-LIKE RECEPTOR AGONISTS |
| EP4263600A1 (en) | 2020-12-18 | 2023-10-25 | Century Therapeutics, Inc. | Chimeric antigen receptor systems with adaptable receptor specificity |
| TWI817350B (zh) * | 2021-02-09 | 2023-10-01 | 台灣浩鼎生技股份有限公司 | 與Globo系列抗原結合之嵌合抗原受體及其用途 |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20020165360A1 (en) * | 2000-11-30 | 2002-11-07 | Junghans Richard P. | Chimeric effector cell receptors against carcinoembryonic antigen |
| EP2389443B1 (en) * | 2009-01-23 | 2018-11-14 | Roger Williams Hospital | Retroviral vectors encoding multiple highly homologous non-viral polypeptides and the use of same |
| CN106074601A (zh) * | 2011-03-23 | 2016-11-09 | 弗雷德哈钦森癌症研究中心 | 用于细胞免疫治疗的方法和组合物 |
| CN103483452B (zh) * | 2012-06-12 | 2021-08-13 | 上海细胞治疗集团有限公司 | 双信号独立的嵌合抗原受体及其用途 |
| WO2014055668A1 (en) | 2012-10-02 | 2014-04-10 | Memorial Sloan-Kettering Cancer Center | Compositions and methods for immunotherapy |
| RS60759B1 (sr) | 2013-02-26 | 2020-10-30 | Memorial Sloan Kettering Cancer Center | Sastavi i postupci za imunoterapiju |
-
2016
- 2016-04-14 EP EP16780765.0A patent/EP3283083A4/en not_active Withdrawn
- 2016-04-14 MX MX2017013247A patent/MX2017013247A/es unknown
- 2016-04-14 AU AU2016248090A patent/AU2016248090A1/en not_active Abandoned
- 2016-04-14 JP JP2018505578A patent/JP2018513216A/ja active Pending
- 2016-04-14 US US15/099,370 patent/US10471098B2/en not_active Expired - Fee Related
- 2016-04-14 TW TW105111666A patent/TWI719019B/zh not_active IP Right Cessation
- 2016-04-14 CA CA2982603A patent/CA2982603A1/en not_active Abandoned
- 2016-04-14 WO PCT/US2016/027582 patent/WO2016168493A1/en active Application Filing
- 2016-04-14 CN CN201680035380.XA patent/CN108135937A/zh active Pending
- 2016-04-14 KR KR1020177033070A patent/KR20180021364A/ko unknown
- 2016-04-15 AR ARP160101045A patent/AR104296A1/es unknown
-
2017
- 2017-10-15 IL IL255005A patent/IL255005A0/en unknown
-
2018
- 2018-08-21 HK HK18110746.6A patent/HK1251179A1/zh unknown
-
2019
- 2019-10-09 US US16/597,798 patent/US20200138863A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| EP3283083A4 (en) | 2018-10-31 |
| WO2016168493A1 (en) | 2016-10-20 |
| CN108135937A (zh) | 2018-06-08 |
| TWI719019B (zh) | 2021-02-21 |
| HK1251179A1 (zh) | 2019-01-25 |
| CA2982603A1 (en) | 2016-10-20 |
| US10471098B2 (en) | 2019-11-12 |
| TW201708542A (zh) | 2017-03-01 |
| JP2018513216A (ja) | 2018-05-24 |
| AR104296A1 (es) | 2017-07-12 |
| US20160303166A1 (en) | 2016-10-20 |
| IL255005A0 (en) | 2017-12-31 |
| US20200138863A1 (en) | 2020-05-07 |
| MX2017013247A (es) | 2018-08-15 |
| EP3283083A1 (en) | 2018-02-21 |
| AU2016248090A1 (en) | 2017-11-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20200138863A1 (en) | Hepatic arterial infusion of car-t cells | |
| Li et al. | Chimeric antigen receptor T cell (CAR-T) immunotherapy for solid tumors: lessons learned and strategies for moving forward | |
| Cirella et al. | Novel strategies exploiting interleukin-12 in cancer immunotherapy | |
| Zhang et al. | A chimeric antigen receptor with antigen-independent OX40 signaling mediates potent antitumor activity | |
| Chuntova et al. | Genetically engineered T-cells for malignant glioma: overcoming the barriers to effective immunotherapy | |
| JP2022069603A (ja) | 免疫療法のための組成物および方法 | |
| Wu et al. | B7H6-specific bispecific T cell engagers lead to tumor elimination and host antitumor immunity | |
| Vauleon et al. | Overview of cellular immunotherapy for patients with glioblastoma | |
| KR20180030879A (ko) | 복막암을 치료하기 위한 조성물 및 방법 | |
| JP2017534280A (ja) | 腫瘍を標的にするがt細胞を標的にしないサバイビン特異的t細胞受容体 | |
| EP3184548A1 (en) | Chimeric antigen receptor with cytokine receptor activating or blocking domain | |
| Tesfaye et al. | Adoptive cell therapy in treating pediatric solid tumors | |
| US20220347214A1 (en) | Compositions and methods for tcr reprogramming using fusion proteins | |
| Kowalczyk et al. | Chimeric Antigen Receptor T Cell and Chimeric Antigen Receptor NK Cell Therapy in Pediatric and Adult High-Grade Glioma—Recent Advances | |
| WO2024055339A1 (zh) | 用于制备和扩增通用型人源化抗cd19 car-nk细胞的方法及其用途 | |
| US20210169937A1 (en) | Method for the treatment of a tumor patient with adoptive t cell immunotherapy | |
| WO2023164698A2 (en) | FOLATE RECEPTOR ALPHA -TARGETING BI-SPECIFIC T CELL ENGAGERS (BiTEs) AND USES THEREOF | |
| JPWO2018110374A1 (ja) | 殺細胞効果を有するキメラ抗原受容体遺伝子改変リンパ球 | |
| Bosch | Approaches to improve chimeric antigen receptor T-cell therapy in solid tumors. Focusing on current CAR models and the tumor microenvironment. | |
| US20240058447A1 (en) | Use of fusion constructs for il-2 independent t cell therapy | |
| US20230255978A1 (en) | Methods for treating glioblastoma | |
| Zheng | Improving CEA-Targeted CAR-T cell Therapy for Solid Tumours | |
| Cardona | Canine CAR T cell therapy for solid tumors | |
| Sanders | Modulation of the Immune Response as a Potential Therapeutic for Glioblastoma | |
| Valia | Emerging Natural Killer Cell Immunotherapy for Acute Myeloid Leukemia |