KR20180010198A - 종양 바이오마커 및 이의 용도 - Google Patents
종양 바이오마커 및 이의 용도 Download PDFInfo
- Publication number
- KR20180010198A KR20180010198A KR1020177033956A KR20177033956A KR20180010198A KR 20180010198 A KR20180010198 A KR 20180010198A KR 1020177033956 A KR1020177033956 A KR 1020177033956A KR 20177033956 A KR20177033956 A KR 20177033956A KR 20180010198 A KR20180010198 A KR 20180010198A
- Authority
- KR
- South Korea
- Prior art keywords
- methylpyridin
- amine
- naphthyridin
- methyl
- benzyl
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
- C12Q1/6883—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material
- C12Q1/6886—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material for cancer
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4427—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems
- A61K31/444—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems containing a six-membered ring with nitrogen as a ring heteroatom, e.g. amrinone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/472—Non-condensed isoquinolines, e.g. papaverine
- A61K31/4725—Non-condensed isoquinolines, e.g. papaverine containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/4985—Pyrazines or piperazines ortho- or peri-condensed with heterocyclic ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
- G01N33/57484—Immunoassay; Biospecific binding assay; Materials therefor for cancer involving compounds serving as markers for tumor, cancer, neoplasia, e.g. cellular determinants, receptors, heat shock/stress proteins, A-protein, oligosaccharides, metabolites
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/158—Expression markers
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/52—Predicting or monitoring the response to treatment, e.g. for selection of therapy based on assay results in personalised medicine; Prognosis
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Immunology (AREA)
- Engineering & Computer Science (AREA)
- Epidemiology (AREA)
- Molecular Biology (AREA)
- Organic Chemistry (AREA)
- Hematology (AREA)
- Biomedical Technology (AREA)
- Cell Biology (AREA)
- Urology & Nephrology (AREA)
- Pathology (AREA)
- Analytical Chemistry (AREA)
- Hospice & Palliative Care (AREA)
- Oncology (AREA)
- Physics & Mathematics (AREA)
- Biochemistry (AREA)
- Biotechnology (AREA)
- Microbiology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Physics & Mathematics (AREA)
- Food Science & Technology (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- General Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
Abstract
본 명세서에는 WNT 신호 전달 경로에 관련된 바이오마커뿐만 아니라 이를 포함하는 방법 및 키트에 관한 것이다. 또한, 본 개시내용은 환자 선택, 동반 진단제, 및 암의 치료에서의 바이오마커의 용도에 관한 것이다.
Description
관련 출원에 대한 상호 참조
본 출원은 미국 가특허 출원 제62/166,305호(출원일: 2015년 5월 26일)의 유익 및 이에 대한 우선권을 주장하며, 이 기초출원의 전체 개시내용은 그의 전문이 참고로 본 명세서에 병합된다.
발명의 기술분야
본 발명은 WNT 신호 전달 경로에 관한 바이오마커뿐만 아니라, 이를 포함하는 방법 및 키트에 관한 것이다. 또한, 본 발명은 환자 선택, 동반 진단제, 및 암의 치료에서의 바이오마커의 용도에 관한 것이다.
암은 전 세계적으로 사람들이 앓는 질환의 한 부류이다. 일반적으로, 양성 종양 내 세포들은 그들의 분화된 특성을 보유하고 완전하게 제어되지 않는 방식으로 분할되지 않는다. 양성 종양은 통상 국부적이며 비전이성이다.
악성 종양에서, 세포들은 미분화되어 있고, 신체의 성장제어신호에 응답하지 않으며, 제어되지 않는 방식으로 증식된다. 악성 종양은 일반적으로 1차(즉, 원발성) 및 2차의 두 범주로 나뉜다. 1차 종양들은 이들이 발견되는 조직으로부터 직접 발생한다. 2차 종양은 1차 종양으로부터 기원될 수 있거나 또는 신체 내 어느 곳에서인가 기원될 수 있으며, 원위 부위로 퍼질 수 있거나(전이될 수 있거나) 또는 전이된다. 전이를 위한 공통 경로는 인접한 구조 내로 직접 성장하거나 혈관 혹은 림프계 혹은 혈관계를 통해서 확산된다.
WNT 신호전달은 성체 동물에서의 배아발생 및 항상성 둘 다에 중요하다. WNT 경로는 일반적으로 하기 과정을 조절하는 단백질의 네트워크로 구성된다: (1) WNT 단백질의 생산 및 분비; (2) WNT의 세포 수용체와의 결합; 및 (3) 상호작용에 의해 촉발된 생화학적 반응의 세포내 전달(Mikels and Nusse, 2006; MacDonald, 2009; Moon, 2005).
WNT 단백질이 세포 표면 공-수용체 프리즐드(Frizzled) LRP5/6에 결합함으로써 촉발되는 소위 표준 WNT 경로는 핵에 도달하는 β-카테닌 양의 변화를 야기하며, 핵에서 그것은 TCF/LEF 패밀리 전사 인자와 상호작용하여 특정유전자의 전사를 촉진한다.
다른 세트의 세포내 단백질에 의해 전달되는 비-표준 WNT 경로는 곤충에서의 평면 세포 극성(planar cell polarity) 및 척추동물에서의 낭배형성(gastrulation)과 같은 몇 가지 공정을 제어한다.
WNT 신호전달은 또한 배아 및 성체 줄기 세포의 다능성 및 분화를 제어하는 역할을 하는 것으로 공지되어 있다(Nusse, 2008). 예를 들어, 낭배형성 동안 원시선(primitive streak)의 형성은 배양체(embryoid body)에서의 국지화된 WNT 활성화와 연관되었다(Ten Berge, 2008). 심장 세포, 췌장 베타 세포, 도파민작용 뉴런 그리고 배아 줄기 세포 또는 iPS 세포 유래의 간세포와 같은 많은 세포 유형의 유도체화는 WNT 조절에 의해 영향을 받는다(Yang, 2008; D'Amour, 2006; Inestrosa and Arenas, 2010; Sullivan, 2010). WNT 경로는 골 형성 및 연골형성과 같은 골격 조직 발달에서 특히 중요한 역할을 한다(Hoeppner, 2009; Chun, 2008). WNT 신호전달은 또한 성인 중추신경계의 신경재생과 연관되어 있다(Lie, 2005).
질환은 변경된 WNT 경로 활성으로부터 발생할 수 있다. 예를 들어, 표준 WNT 경로의 과활성화는 비정상적인 세포 성장을 야기할 수 있다(Reya and Clevers, 2005). 특히, 결장직장암의 90%는 WNT/β-카테닌 경로의 억제제인 선종증 결장 폴립증(APC) 유전자의 손실에 의해 개시된다(Kinzler and Vogelstein, 1996). WNT 단백질의 발현 증가 및 정상적으로 WNT 단백질 기능을 억제하는 세포외 저해제의 손실은 WNT-의존적 종양을 야기할 수 있다(Polakis, 2007). 한편, 비-표준 WNT 경로 역시 특정 암의 진행에서 역할을 하는 것으로 나타났다(Camilli and Weeraratna, 2010). 보다 최근에, WNT 신호전달은 또한 암 줄기세포와 연관되어 있다(Takahashi-Yanaga and Kahn, 2010).
증거는 Wnt-매개된 신호 전달 경로를 표적화하는 것이 광범위한 질환에서 치료적으로 유용할 것임을 제시한다(Barker and Clevers, 2006). 표준 Wnt 경로의 항시적 활성화를 초래하는 APC, 베타-카테닌 또는 악신-1(axin-1)의 돌연변이는 결장직장암, 흑색종, 간세포 암종, 위암, 난소암 등을 포함하는 다양한 인간 암에서 중요한 사건이다(Polakis, 2007). 유전적 또는 화학적 접근법을 이용하는 다양한 암에서의 Wnt 경로의 차단은 비정상적인 세포 성장을 없애는 것으로 나타났다(Herbst and Kolligs, 2007). 더욱이, 이 경로의 저해는 암 세포의 성장을 지속시키고 전이를 가능하게 하는 세포에 직접 영향을 미칠 수 있으며, 전통적인 화학요법제에 내성이 있는 것으로 여겨지는 세포에 직접 영향을 미칠 수 있다.
수용체의 하류에 있는 유전자 산물의 돌연변이에 의해 야기되는 활성화 외에도, 다른 기전에 의해 야기된 비정상적인 Wnt 경로 활성은 광범위한 암과 연관되어 왔다. 이들 암은 폐(소세포 및 비소세포), 유방, 전립선, 카르시노이드, 방광, 암종, 식도, 난소, 자궁경부, 자궁내막, 중피종, 흑색종, 육종, 골육종, 지방육종, 갑상선, 유건종, 급성 골수구성 백혈병(AML) 및 만성 골수구성 백혈병(CML)을 포함하지만 이들로 제한되는 것은 아니다. 현재 상향조절된 자가분비 또는 측분비 Wnt 신호전달에 의존적인 암 세포의 다수의 예가 있으며, 골육종, 유방암, 두경부암 및 난소암 유래의 세포주들은 자가분비 또는 측분비 Wnt 신호전달에 의해 세포자멸사로부터 보호받는 것으로 나타났다(Kansara, 2009; Bafico, 2004; Akiri, 2009; DeAlmeida, 2007; Chan, 2007; Chen, 2009; Rhee, 2002).
더욱이, 비정상적인 Wnt 경로는 섬유증의 발달과 관련되어 왔으며, 이는 폐 섬유증, 예컨대, 특발성 폐 섬유증 및 방사선-유도된 섬유증, 신장 섬유증 및 간 섬유증을 포함하지만 이들로 제한되는 것은 아니다(Morrisey, 2003; Hwang, 2009; Cheng, 2008).
비정상적인 WNT 신호전달과 연관된 다른 장애들은, 골다공증 및 골관절염과 같은 골 및 연골장애, 비만 연관된 II형 당뇨병, 그리고 알츠하이머병과 같은 신경퇴행성 질환을 포함하지만 이들로 제한되는 것은 아니다(Hoeppner, 2009; Ouchi, 2010; Blom, 2010; Boonen, 2009). WNT 신호전달은 또한 HSC의 자가-재생 및 유지에 기여하며, 기능부전성 WNT 신호전달은 백혈병 및 다양한 다른 혈액 관련 암과 같은 HSC로부터 기인하는 다양한 장애의 원인이다(Reya, 2005).
본 발명은 일반적으로 Wnt 경로와 관련된 바이오마커, 및 암과 같은 질환의 치료를 위한 환자 선택에서의 이러한 바이오마커의 용도를 제공한다.
일 양상에 있어서, 본 발명은 암으로 진단되었고 그리고 암의 치료를 필요로 하는 대상체에서 R-스폰딘 융합의 발현을 특징으로 하는 암의 치료 방법을 제공하되, 해당 방법은 치료적 유효량의 포큐파인(Porcupine)의 길항제를 포함하는 약제학적 조성물을 암으로 진단된 대상체에게 투여하는 단계를 포함하되, 상기 대상체는 R-스폰딘 융합을 지니는 것으로 결정되었다.
몇몇 실시형태에 있어서, R-스폰딘 융합은 (1) PTPRKe1-Rspo3e2 융합; (2) PTPRKe7-Rspo3e2 융합; (3) EIF3Ee1-Rspo2e2 융합; 또는 (4) EIF3Ee1-Rspo2e3 융합을 포함한다.
몇몇 실시형태에 있어서, R-스폰딘 융합은 (1) EMC2e1-Rspo2e2 융합;(2) PVT1-Rspo2e2 융합; (3) PVT1-Rspo2e3 융합; (4) HNF4G-Rspo2e2 융합; (5) PTPRKe13-Rspo3e2 융합; 또는 (6) PTPRKe6X-Rspo3e2 융합을 포함한다.
몇몇 실시형태에 있어서, 대상체는 R-스폰딘 융합을 지니지 않는 것으로 결정된 대조 대상체에서의 R-스폰딘 mRNA 발현 수준보다 더 높은 R-스폰딘 mRNA 발현 수준을 가지는 것으로 결정된다.
몇몇 실시형태에 있어서, R스폰딘 융합은 서열번호 58, 서열번호 59, 서열번호 62, 또는 서열번호 63 중 어느 하나의 접합 서열을 포함한다.
몇몇 실시형태에 있어서, EMC2e1-Rspo2e2 융합은 서열번호 64의 접합 서열을 포함한다.
몇몇 실시형태에 있어서, PVT1-Rspo2e2 융합은 서열번호 65의 접합 서열을 포함한다.
몇몇 실시형태에 있어서, PVT1-Rspo2e3 융합은 서열번호 66의 접합 서열을 포함한다.
몇몇 실시형태에 있어서, HNF4G-Rspo2e2 융합은 서열번호 67의 접합 서열을 포함한다.
몇몇 실시형태에 있어서, PTPRKe13-Rspo3e2 융합은 서열번호 61의 접합 서열을 포함한다.
몇몇 실시형태에 있어서, PTPRKe6X-Rspo3e2 융합은 서열번호 60의 접합 서열을 포함한다.
몇몇 실시형태에 있어서, R스폰딘은 Rspo2 또는 Rsp3이고, 그리고 융합 유전자는 다른 유전자에 융합되지 않은 R스폰딘과 비교해서 과발현된다.
몇몇 실시형태에 있어서, 포큐파인 길항제는 하기 화학식 (I)의 화합물 또는 이의 생리학적으로 허용 가능한 염을 포함한다:
식 중,
X1, X2, X3, X4, X5, X6, X7, X8은 독립적으로 CR4 또는 N이고;
Y1은 수소 또는 CR4이고; Y2, Y3은 독립적으로 수소, 할로 또는 CR3이며;
R2는 수소, 할로, 몰폴린일, 피페라진일, 퀴놀린일, , 아릴, C1 -6 복소환, N, O 및 S로부터 선택된 1 내지 2개의 헤테로원자를 함유하는 5 또는 6원 헤테로아릴이며;
R3은 수소, 할로, 사이아노, 임의로 할로, 아미노, 하이드록실, 알콕시 또는 사이아노로 치환된, C1 -6 알킬, C1 -6 알콕시이고;
R4는 수소, 할로, C1 - 6알콕시, -S(O)2R5, -C(O)OR5, -C(O)R5, -C(O)NR6R7, C1 -6 알킬, C2 -6 알켄일 또는 C2 -6 알킨일이되, 이들 각각은 임의로 할로, 아미노, 하이드록실, 알콕시 또는 사이아노로 치환될 수 있으며;
R5, R6 및 R7은 독립적으로 수소, C1 -6 알킬, C2 -6 알켄일 또는 C2 -6 알킨일이되, 각각은 임의로 할로, 아미노, 하이드록실, 알콕시 또는 사이아노로 치환될 수 있다.
몇몇 실시형태에 있어서, 5 또는 6원 헤테로아릴은 하기로부터 선택된다:
식 중,
R4는 수소, 할로, C1 - 6알콕시, -S(O)2R5, -C(O)OR5, -C(O)R5, -C(O)NR6R7, C1 -6 알킬, C2 -6 알켄일 또는 C2 -6 알킨일이되, 이들 각각은 임의로 할로, 아미노, 하이드록실, 알콕시 또는 사이아노로 치환될 수 있고;
R5, R6 및 R7은 독립적으로 수소, C1 -6 알킬, C2 -6 알켄일 또는 C2 -6 알킨일이되, 이들 각각은 임의로 할로, 아미노, 하이드록실, 알콕시 또는 사이아노로 치환될 수 있으며; 그리고
R8은 수소 또는 C1 -6 알킬이다.
몇몇 실시형태에 있어서, R1 및 R2는 독립적으로 1 또는 2개의 R4기로 치환된다.
몇몇 실시형태에 있어서, 화합물은 하기로부터 선택된다:
6-(2-메틸피리딘-4-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
N-(3-메틸-4-(2-메틸피리딘-4-일)벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
6-(3-플루오로페닐)-N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)아이소퀴놀린-1-아민;
2-(2-메틸피리딘-4-일)-N-(4-(2-메틸피리딘-4-일)벤질)-1,6-나프티리딘-5-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-2-페닐피리도[4,3-b]피라진-5-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리딘-4-일)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-페닐-2,7-나프티리딘-1-아민;
6-(3-클로로페닐)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
6-(3-플루오로페닐)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
6-(3-플루오로페닐)-N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)-2,7-나프티리딘-1-아민;
6-(3-플루오로페닐)-N-(4-(2-(트라이플루오로메틸)피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(3-플루오로페닐)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리미딘-5-일)-2,7-나프티리딘-1-아민;
6-(5-메틸피리딘-3-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
6-(6-메틸피리딘-3-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
3-(8-(4-(2-메틸피리딘-4-일)벤질아미노)-2,7-나프티리딘-3-일)벤조나이트릴;
4-(8-(4-(2-메틸피리딘-4-일)벤질아미노)-2,7-나프티리딘-3-일)벤조나이트릴;
6-(4-플루오로페닐)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-m-톨릴-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리딘-2-일)-2,7-나프티리딘-1-아민;
6-(2-플루오로피리딘-4-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
6-(2-플루오로페닐)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리딘-3-일)-2,7-나프티리딘-1-아민;
N-(바이페닐-4-일메틸)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
6-(2-메틸피리딘-4-일)-N-((5-페닐피리딘-2-일)메틸)-2,7-나프티리딘-1-아민;
6-(3-플루오로페닐)-N-((2'-(트라이플루오로메틸)-2,4'-바이피리딘-5-일)메틸)-2,7-나프티리딘-1-아민;
N-(3-플루오로-4-(2-플루오로피리딘-4-일)벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
6-(2-메틸피리딘-4-일)-N-((2'-(트라이플루오로메틸)-2,4'-바이피리딘-5-일)메틸)-2,7-나프티리딘-1-아민;
N-((3-플루오로-2'-(트라이플루오로메틸)-2,4'-바이피리딘-5-일)메틸)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
N-(3-플루오로-4-(2-메틸피리딘-4-일)벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
N-((2'-플루오로-2,4'-바이피리딘-5-일)메틸)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
4-(5-(((6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-일)아미노)메틸)피리딘-2-일)티오몰폴린 1,1-다이옥사이드;
6-(2-메틸피리딘-4-일)-N-(4-(피리다진-4-일)벤질)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피라진-2-일)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리다진-4-일)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-몰폴리노-2,7-나프티리딘-1-아민;
6-(4-메틸피페라진-1-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
4-(8-((4-(2-메틸피리딘-4-일)벤질)아미노)-2,7-나프티리딘-3-일)티오몰폴린 1,1-다이옥사이드;
N-(3-플루오로-4-(2-플루오로피리딘-4-일)벤질)-6-(3-플루오로페닐)-2,7-나프티리딘-1-아민;
N-(3-플루오로-4-(2-메틸피리딘-4-일)벤질)-6-(3-플루오로페닐)-2,7-나프티리딘-1-아민;
N-((3-플루오로-2'-(트라이플루오로메틸)-2,4'-바이피리딘-5-일)메틸)-6-(3-플루오로페닐)-2,7-나프티리딘-1-아민;
N-((2'-플루오로-2,4'-바이피리딘-5-일)메틸)-6-(3-플루오로페닐)-2,7-나프티리딘-1-아민;
6-(3-플루오로페닐)-N-(3-메틸-4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
4-(5-(((6-(3-플루오로페닐)-2,7-나프티리딘-1-일)아미노)메틸)피리딘-2-일)티오몰폴린 1,1-다이옥사이드;
N-(4-클로로벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
N-(4-메틸벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
6-(2-메틸피리딘-4-일)-N-(피리딘-3-일메틸)-2,7-나프티리딘-1-아민;
N-벤질-2-(3-플루오로페닐)-1,6-나프티리딘-5-아민;
2-(3-플루오로페닐)-N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)-1,6-나프티리딘-5-아민;
N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)-2-(2-메틸피리딘-4-일)-1,6-나프티리딘-5-아민;
N-((6-(3-플루오로페닐)피리딘-3-일)메틸)-2-(2-메틸피리딘-4-일)-1,6-나프티리딘-5-아민;
N-(4-(2-플루오로피리딘-4-일)벤질)-2-(2-메틸피리딘-4-일)-1,6-나프티리딘-5-아민;
2-(2-메틸피리딘-4-일)-N-(4-(2-(트라이플루오로메틸)피리딘-4-일)벤질)-1,6-나프티리딘-5-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-2-(2-메틸피리딘-4-일)-1,6-나프티리딘-5-아민;
N-(바이페닐-4-일메틸)-6-(3-플루오로페닐)아이소퀴놀린-1-아민;
N-((2-플루오로바이페닐-4-일)메틸)-6-(3-플루오로페닐)아이소퀴놀린-1-아민;
N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)-6-페닐아이소퀴놀린-1-아민;
6-(3-클로로페닐)-N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)아이소퀴놀린-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-페닐아이소퀴놀린-1-아민;
6-(2-메틸피리딘-4-일)-N-(4-(2-메틸피리딘-4-일)벤질)아이소퀴놀린-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리딘-4-일)아이소퀴놀린-1-아민;
6-(6-메틸피리딘-3-일)-N-(4-(2-메틸피리딘-4-일)벤질)아이소퀴놀린-1-아민;
6-(2-메틸피리딘-4-일)-N-(4-(2-메틸피리딘-4-일)벤질)아이소퀴놀린-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리딘-3-일)아이소퀴놀린-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피라진-2-일)아이소퀴놀린-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리다진-4-일)아이소퀴놀린-1-아민;
N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)-6-(피라진-2-일)아이소퀴놀린-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(피라진-2-일)아이소퀴놀린-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(피리딘-2-일)아이소퀴놀린-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(3-플루오로페닐)아이소퀴놀린-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(5-메틸피리딘-3-일)아이소퀴놀린-1-아민;
N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)-2-페닐피리도[4,3-b]피라진-5-아민;
2-(3-플루오로페닐)-N-(4-(2-메틸피리딘-4-일)벤질)피리도[4,3-b]피라진-5-아민;
2-(3-플루오로페닐)-N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)피리도[4,3-b]피라진-5-아민;
2-(3-플루오로페닐)-N-(3-메틸-4-(2-메틸피리딘-4-일)벤질)피리도[4,3-b]피라진-5-아민;
N-(3-플루오로-4-(2-메틸피리딘-4-일)벤질)-2-(3-플루오로페닐)피리도[4,3-b]피라진-5-아민;
2-(2-메틸피리딘-4-일)-N-(4-(2-메틸피리딘-4-일)벤질)피리도[4,3-b]피라진-5-아민;
N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)-2-(2-메틸피리딘-4-일)피리도[4,3-b]피라진-5-아민;
N-(3-메틸-4-(2-메틸피리딘-4-일)벤질)-2-(2-메틸피리딘-4-일)피리도[4,3-b]피라진-5-아민;
N-(3-플루오로-4-(2-메틸피리딘-4-일)벤질)-2-(2-메틸피리딘-4-일)피리도[4,3-b]피라진-5-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(피라진-2-일)-2,7-나프티리딘-1-아민;
6-(2-메틸몰폴리노)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
(S)-6-(2-메틸몰폴리노)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
(R)-6-(2-메틸몰폴리노)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
1-(4-(8-(4-(2-메틸피리딘-4-일)벤질아미노)-2,7-나프티리딘-3-일)피페라진-1-일)에탄온;
6-(1H-이미다졸-1-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
6-(4-메틸-1H-이미다졸-1-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(1H-테트라졸-5-일)-2,7-나프티리딘-1-아민;
6-(5-메틸-1,3,4-옥사다이아졸-2-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
6-(1-메틸-1H-피라졸-3-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(티아졸-5-일)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(옥사졸-5-일)-2,7-나프티리딘-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(5-메틸피리딘-3-일)-2,7-나프티리딘-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
N-((3-플루오로-2'-메틸-2,4'-바이피리딘-5-일)메틸)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(5-플루오로피리딘-3-일)-2,7-나프티리딘-1-아민;
N-(3-메틸-4-(2-메틸피리딘-4-일)벤질)-6-(피라진-2-일)-2,7-나프티리딘-1-아민;
N-(3-플루오로-4-(2-메틸피리딘-4-일)벤질)-6-(피라진-2-일)-2,7-나프티리딘-1-아민;
메틸 4-(8-(4-(2-메틸피리딘-4-일)벤질아미노)-2,7-나프티리딘-3-일)피페라진-1-카복실레이트;
4-(8-(4-(2-메틸피리딘-4-일)벤질아미노)-2,7-나프티리딘-3-일)피페라진-2-온;
2-(4-(8-(4-(2-메틸피리딘-4-일)벤질아미노)-2,7-나프티리딘-3-일)피페라진-1-일)아세토나이트릴;
2-메틸-4-(4-((6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-일아미노)메틸)페닐)피리딘 1-옥사이드;
6-(2-클로로피리딘-4-일)-N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-2,7-나프티리딘-1-아민;
6-(2-클로로피리딘-4-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
2-(2-메틸피리딘-4-일)-5-((6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-일아미노)메틸)벤조나이트릴;
N-(3-메톡시-4-(2-메틸피리딘-4-일)벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
N-((3-클로로-2'-메틸-2,4'-바이피리딘-5-일)메틸)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
2'-메틸-5-((6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-일아미노)메틸)-2,4'-바이피리딘-3-카보나이트릴; 및
N-(4-(2-(다이플루오로메틸)피리딘-4-일)벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민.
몇몇 실시형태에 있어서, 포큐파인 길항제는 하기 화학식 (II)의 화합물 또는 이의 생리학적으로 허용 가능한 염을 포함한다:
식 중,
X1, X2, X3 및 X4는 N 및 CR7로부터 선택되고;
X5, X6, X7 및 X8 중 하나는 N이고, 나머지는 CH이며;
X9는 N 및 CH로부터 선택되고;
Z는 페닐, 피라진일, 피리딘일, 피리다진일 및 피페라진일로부터 선택되며;
Z 중 각각의 페닐, 피라진일, 피리딘일, 피리다진일 또는 피페라진일은 임의로 R6기로 치환되고;
R1, R2 및 R3은 수소이며;
m은 1이고;
R4는 수소, 할로, 다이플루오로메틸, 트라이플루오로메틸 및 메틸로부터 선택되며;
R6은 수소, 할로 및 -C(O)R10으로부터 선택되되, R10은 메틸이고; 그리고
R7은 수소, 할로, 사이아노, 메틸 및 트라이플루오로메틸로부터 선택된다.
몇몇 실시형태에 있어서, 상기 화합물은 하기로부터 선택된다:
N-[5-(3-플루오로페닐)피리딘-2-일]-2-[5-메틸-6-(피리다진-4-일)피리딘-3-일]아세트아마이드;
2-[5-메틸-6-(2-메틸피리딘-4-일)피리딘-3-일]-N-[5-(피라진-2-일)피리딘-2-일]아세트아마이드(LGK974);
N-(2,3'-바이피리딘-6'-일)-2-(2',3-다이메틸-2,4'-바이피리딘-5-일)아세트아마이드;
N-(5-(4-아세틸피페라진-1-일)피리딘-2-일)-2-(2'-메틸-3-(트라이플루오로메틸)-2,4'- 바이피리딘-5-일)아세트아마이드;
N-(5-(4-아세틸피페라진-1 -일)피리딘-2-일)-2-(2'-플루오로-3-메틸-2,4'-바이피리딘-5-일)아세트아마이드; 및
2-(2'-플루오로-3-메틸-2,4'-바이피리딘-5-일)-N-(5-(피라진-2-일)피리딘-2-일)아세트아마이드; 및 이들의 약제학적으로 허용 가능한 염.
몇몇 실시형태에 있어서, 상기 화합물은 2-[5-메틸-6-(2-메틸피리딘-4-일)피리딘-3-일]-N-[5-(피라진-2-일)피리딘-2-일]아세트아마이드이다.
몇몇 실시형태에 있어서, 치료적 유효량의 화합물은 1일 투약량에서 체중당 약 0.01 내지 20 ㎎/㎏이다.
몇몇 실시형태에 있어서, 치료적 유효량의 화합물은 인간에 대해서 약 0.5㎎ 내지 약 1000㎎이다.
몇몇 실시형태에 있어서, 암은 결장직장암, 위암, 간암, 식도암, 장암, 담관암, 췌장암, 자궁내막암 또는 전립선암이다.
다른 양상에 있어서, 본 발명은 암을 지닌 대상체가 Wnt 활성을 저해하는 조성물로 치료되어야 할지를 결정하는 방법을 제공하되, 해당 방법은 (a) 대상체로부터 생물학적 샘플을 단리하는 단계; (b) R-스폰딘 융합의 존재 또는 부재를 확인하기 위하여 생물학적 샘플에 대한 검정을 수행하는 단계; 및 (c) 생물학적 샘플이 R-스폰딘 융합을 함유한다면 대상체가 치료적 유효량의 포큐파인의 길항제를 포함하는 조성물로 치료되어야 한다고 결정하는 단계를 포함한다.
몇몇 실시형태에 있어서, R-스폰딘 융합은 (1) PTPRKe1-Rspo3e2 융합; (2) PTPRKe7-Rspo3e2 융합; (3) EIF3Ee1-Rspo2e2 융합; 또는 (4) EIF3Ee1-Rspo2e3 융합을 포함한다.
몇몇 실시형태에 있어서, R-스폰딘 융합은 (1) EMC2e1-Rspo2e2 융합; (2) PVT1-Rspo2e2 융합; (3) PVT1-Rspo2e3 융합; (4) HNF4G-Rspo2e2 융합; (5) PTPRKe13-Rspo3e2 융합; 또는 (6) PTPRKe6X-Rspo3e2 융합을 포함한다.
몇몇 실시형태에 있어서, 대상체는 R-스폰딘 융합을 지니지 않는 것으로 결정된 대조 대상체에서의 R-스폰딘 mRNA 발현 수준보다 더 높은 R-스폰딘 mRNA 발현 수준을 가지는 것으로 결정된다.
몇몇 실시형태에 있어서, -R스폰딘 융합은 서열번호 58, 서열번호 59, 서열번호 62, 또는 서열번호 63 중 어느 하나의 접합 서열을 포함한다.
몇몇 실시형태에 있어서, EMC2e1-Rspo2e2 융합은 서열번호 64의 접합 서열을 포함한다.
몇몇 실시형태에 있어서, PVT1-Rspo2e2 융합은 서열번호 65의 접합 서열을 포함한다.
몇몇 실시형태에 있어서, PVT1-Rspo2e3 융합은 서열번호 66의 접합 서열을 포함한다.
몇몇 실시형태에 있어서, HNF4G-Rspo2e2 융합은 서열번호 67의 접합 서열을 포함한다.
몇몇 실시형태에 있어서, PTPRKe13-Rspo3e2 융합은 서열번호 61의 접합 서열을 포함한다.
몇몇 실시형태에 있어서, PTPRKe6X-Rspo3e2 융합은 서열번호 60의 접합 서열을 포함한다.
몇몇 실시형태에 있어서, R스폰딘은 Rspo2 또는 Rsp3이고, 그리고 융합 유전자는 또 다른 유전자에 융합되지 않은 R스폰딘과 비교해서 과발현된다.
몇몇 실시형태에 있어서, 포큐파인 길항제는 하기 화학식 (I)의 화합물 또는 이의 생리학적으로 허용 가능한 염을 포함한다:
식 중,
X1, X2, X3, X4, X5, X6, X7, X8은 독립적으로 CR4 또는 N이고;
Y1은 수소 또는 CR4이고; Y2, Y3은 독립적으로 수소, 할로 또는 CR3이며;
R2는 수소, 할로, 몰폴린일, 피페라진일, 퀴놀린일, , 아릴, C1 -6 복소환, N, O 및 S로부터 선택된 1 내지 2개의 헤테로원자를 함유하는 5 또는 6원 헤테로아릴이고;
R3은 수소, 할로, 사이아노, 임의로 할로, 아미노, 하이드록실, 알콕시 또는 사이아노로 치환된, C1 -6 알킬, C1 -6 알콕시이며;
R4는 수소, 할로, C1 - 6알콕시, -S(O)2R5, -C(O)OR5, -C(O)R5, -C(O)NR6R7, C1 -6 알킬, C2 -6 알켄일 또는 C2 -6 알킨일이되, 이들 각각은 임의로 할로, 아미노, 하이드록실, 알콕시 또는 사이아노로 치환될 수 있고;
R5, R6 및 R7은 독립적으로 수소, C1 -6 알킬, C2 -6 알켄일 또는 C2 -6 알킨일이되, 이들 각각은 임의로 할로, 아미노, 하이드록실, 알콕시 또는 사이아노로 치환될 수 있다.
몇몇 실시형태에 있어서, 5 또는 6원 헤테로아릴은 하기로부터 선택된다:
식 중,
R4는 수소, 할로, C1 - 6알콕시, -S(O)2R5, -C(O)OR5, -C(O)R5, -C(O)NR6R7, C1 -6 알킬, C2 -6 알켄일 또는 C2 -6 알킨일이되, 이들 각각은 임의로 할로, 아미노, 하이드록실, 알콕시 또는 사이아노로 치환될 수 있고;
R5, R6 및 R7은 독립적으로 수소, C1 -6 알킬, C2 -6 알켄일 또는 C2 -6 알킨일이되, 이들 각각은 임의로 할로, 아미노, 하이드록실, 알콕시 또는 사이아노로 치환될 수 있으며; 그리고
R8은 수소 또는 C1 -6 알킬이다.
몇몇 실시형태에 있어서, R1 및 R2는 독립적으로 1 또는 2개의 R4기로 치환된다.
몇몇 실시형태에 있어서, 상기 화합물은 하기로부터 선택된다:
6-(2-메틸피리딘-4-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
N-(3-메틸-4-(2-메틸피리딘-4-일)벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
6-(3-플루오로페닐)-N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)아이소퀴놀린-1-아민;
2-(2-메틸피리딘-4-일)-N-(4-(2-메틸피리딘-4-일)벤질)-1,6-나프티리딘-5-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-2-페닐피리도[4,3-b]피라진-5-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리딘-4-일)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-페닐-2,7-나프티리딘-1-아민;
6-(3-클로로페닐)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
6-(3-플루오로페닐)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
6-(3-플루오로페닐)-N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)-2,7-나프티리딘-1-아민;
6-(3-플루오로페닐)-N-(4-(2-(트라이플루오로메틸)피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(3-플루오로페닐)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리미딘-5-일)-2,7-나프티리딘-1-아민;
6-(5-메틸피리딘-3-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
6-(6-메틸피리딘-3-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
3-(8-(4-(2-메틸피리딘-4-일)벤질아미노)-2,7-나프티리딘-3-일)벤조나이트릴;
4-(8-(4-(2-메틸피리딘-4-일)벤질아미노)-2,7-나프티리딘-3-일)벤조나이트릴;
6-(4-플루오로페닐)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-m-톨릴-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리딘-2-일)-2,7-나프티리딘-1-아민;
6-(2-플루오로피리딘-4-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
6-(2-플루오로페닐)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리딘-3-일)-2,7-나프티리딘-1-아민;
N-(바이페닐-4-일메틸)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
6-(2-메틸피리딘-4-일)-N-((5-페닐피리딘-2-일)메틸)-2,7-나프티리딘-1-아민;
6-(3-플루오로페닐)-N-((2'-(트라이플루오로메틸)-2,4'-바이피리딘-5-일)메틸)-2,7-나프티리딘-1-아민;
N-(3-플루오로-4-(2-플루오로피리딘-4-일)벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
6-(2-메틸피리딘-4-일)-N-((2'-(트라이플루오로메틸)-2,4'-바이피리딘-5-일)메틸)-2,7-나프티리딘-1-아민;
N-((3-플루오로-2'-(트라이플루오로메틸)-2,4'-바이피리딘-5-일)메틸)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
N-(3-플루오로-4-(2-메틸피리딘-4-일)벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
N-((2'-플루오로-2,4'-바이피리딘-5-일)메틸)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
4-(5-(((6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-일)아미노)메틸)피리딘-2-일)티오몰폴린 1,1-다이옥사이드;
6-(2-메틸피리딘-4-일)-N-(4-(피리다진-4-일)벤질)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피라진-2-일)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리다진-4-일)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-몰폴리노-2,7-나프티리딘-1-아민;
6-(4-메틸피페라진-1-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
4-(8-((4-(2-메틸피리딘-4-일)벤질)아미노)-2,7-나프티리딘-3-일)티오몰폴린 1,1-다이옥사이드;
N-(3-플루오로-4-(2-플루오로피리딘-4-일)벤질)-6-(3-플루오로페닐)-2,7-나프티리딘-1-아민;
N-(3-플루오로-4-(2-메틸피리딘-4-일)벤질)-6-(3-플루오로페닐)-2,7-나프티리딘-1-아민;
N-((3-플루오로-2'-(트라이플루오로메틸)-2,4'-바이피리딘-5-일)메틸)-6-(3-플루오로페닐)-2,7-나프티리딘-1-아민;
N-((2'-플루오로-2,4'-바이피리딘-5-일)메틸)-6-(3-플루오로페닐)-2,7-나프티리딘-1-아민;
6-(3-플루오로페닐)-N-(3-메틸-4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
4-(5-(((6-(3-플루오로페닐)-2,7-나프티리딘-1-일)아미노)메틸)피리딘-2-일)티오몰폴린 1,1-다이옥사이드;
N-(4-클로로벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
N-(4-메틸벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
6-(2-메틸피리딘-4-일)-N-(피리딘-3-일메틸)-2,7-나프티리딘-1-아민;
N-벤질-2-(3-플루오로페닐)-1,6-나프티리딘-5-아민;
2-(3-플루오로페닐)-N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)-1,6-나프티리딘-5-아민;
N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)-2-(2-메틸피리딘-4-일)-1,6-나프티리딘-5-아민;
N-((6-(3-플루오로페닐)피리딘-3-일)메틸)-2-(2-메틸피리딘-4-일)-1,6-나프티리딘-5-아민;
N-(4-(2-플루오로피리딘-4-일)벤질)-2-(2-메틸피리딘-4-일)-1,6-나프티리딘-5-아민;
2-(2-메틸피리딘-4-일)-N-(4-(2-(트라이플루오로메틸)피리딘-4-일)벤질)-1,6-나프티리딘-5-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-2-(2-메틸피리딘-4-일)-1,6-나프티리딘-5-아민;
N-(바이페닐-4-일메틸)-6-(3-플루오로페닐)아이소퀴놀린-1-아민;
N-((2-플루오로바이페닐-4-일)메틸)-6-(3-플루오로페닐)아이소퀴놀린-1-아민;
N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)-6-페닐아이소퀴놀린-1-아민;
6-(3-클로로페닐)-N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)아이소퀴놀린-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-페닐아이소퀴놀린-1-아민;
6-(2-메틸피리딘-4-일)-N-(4-(2-메틸피리딘-4-일)벤질)아이소퀴놀린-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리딘-4-일)아이소퀴놀린-1-아민;
6-(6-메틸피리딘-3-일)-N-(4-(2-메틸피리딘-4-일)벤질)아이소퀴놀린-1-아민;
6-(2-메틸피리딘-4-일)-N-(4-(2-메틸피리딘-4-일)벤질)아이소퀴놀린-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리딘-3-일)아이소퀴놀린-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피라진-2-일)아이소퀴놀린-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리다진-4-일)아이소퀴놀린-1-아민;
N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)-6-(피라진-2-일)아이소퀴놀린-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(피라진-2-일)아이소퀴놀린-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(피리딘-2-일)아이소퀴놀린-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(3-플루오로페닐)아이소퀴놀린-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(5-메틸피리딘-3-일)아이소퀴놀린-1-아민;
N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)-2-페닐피리도[4,3-b]피라진-5-아민;
2-(3-플루오로페닐)-N-(4-(2-메틸피리딘-4-일)벤질)피리도[4,3-b]피라진-5-아민;
2-(3-플루오로페닐)-N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)피리도[4,3-b]피라진-5-아민;
2-(3-플루오로페닐)-N-(3-메틸-4-(2-메틸피리딘-4-일)벤질)피리도[4,3-b]피라진-5-아민;
N-(3-플루오로-4-(2-메틸피리딘-4-일)벤질)-2-(3-플루오로페닐)피리도[4,3-b]피라진-5-아민;
2-(2-메틸피리딘-4-일)-N-(4-(2-메틸피리딘-4-일)벤질)피리도[4,3-b]피라진-5-아민;
N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)-2-(2-메틸피리딘-4-일)피리도[4,3-b]피라진-5-아민;
N-(3-메틸-4-(2-메틸피리딘-4-일)벤질)-2-(2-메틸피리딘-4-일)피리도[4,3-b]피라진-5-아민;
N-(3-플루오로-4-(2-메틸피리딘-4-일)벤질)-2-(2-메틸피리딘-4-일)피리도[4,3-b]피라진-5-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(피라진-2-일)-2,7-나프티리딘-1-아민;
6-(2-메틸몰폴리노)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
(S)-6-(2-메틸몰폴리노)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
(R)-6-(2-메틸몰폴리노)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
1-(4-(8-(4-(2-메틸피리딘-4-일)벤질아미노)-2,7-나프티리딘-3-일)피페라진-1-일)에탄온;
6-(1H-이미다졸-1-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
6-(4-메틸-1H-이미다졸-1-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(1H-테트라졸-5-일)-2,7-나프티리딘-1-아민;
6-(5-메틸-1,3,4-옥사다이아졸-2-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
6-(1-메틸-1H-피라졸-3-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(티아졸-5-일)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(옥사졸-5-일)-2,7-나프티리딘-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(5-메틸피리딘-3-일)-2,7-나프티리딘-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
N-((3-플루오로-2'-메틸-2,4'-바이피리딘-5-일)메틸)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(5-플루오로피리딘-3-일)-2,7-나프티리딘-1-아민;
N-(3-메틸-4-(2-메틸피리딘-4-일)벤질)-6-(피라진-2-일)-2,7-나프티리딘-1-아민;
N-(3-플루오로-4-(2-메틸피리딘-4-일)벤질)-6-(피라진-2-일)-2,7-나프티리딘-1-아민;
메틸 4-(8-(4-(2-메틸피리딘-4-일)벤질아미노)-2,7-나프티리딘-3-일)피페라진-1-카복실레이트;
4-(8-(4-(2-메틸피리딘-4-일)벤질아미노)-2,7-나프티리딘-3-일)피페라진-2-온;
2-(4-(8-(4-(2-메틸피리딘-4-일)벤질아미노)-2,7-나프티리딘-3-일)피페라진-1-일)아세토나이트릴;
2-메틸-4-(4-((6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-일아미노)메틸)페닐)피리딘 1-옥사이드;
6-(2-클로로피리딘-4-일)-N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-2,7-나프티리딘-1-아민;
6-(2-클로로피리딘-4-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
2-(2-메틸피리딘-4-일)-5-((6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-일아미노)메틸)벤조나이트릴;
N-(3-메톡시-4-(2-메틸피리딘-4-일)벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
N-((3-클로로-2'-메틸-2,4'-바이피리딘-5-일)메틸)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
2'-메틸-5-((6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-일아미노)메틸)-2,4'-바이피리딘-3-카보나이트릴; 및
N-(4-(2-(다이플루오로메틸)피리딘-4-일)벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민.
몇몇 실시형태에 있어서, 포큐파인 길항제는 하기 화학식 (II)의 화합물 또는 이의 생리학적으로 허용 가능한 염을 포함한다:
식 중,
X1, X2, X3 및 X4는 N 및 CR7로부터 선택되고;
X5, X6, X7 및 X8 중 하나는 N이고, 나머지는 CH이며;
X9는 N 및 CH로부터 선택되고;
Z는 페닐, 피라진일, 피리딘일, 피리다진일 및 피페라진일로부터 선택되며;
Z 중 각각의 페닐, 피라진일, 피리딘일, 피리다진일 또는 피페라진일은 임의로 R6기로 치환되고;
R1, R2 및 R3은 수소이며;
m은 1이고;
R4는 수소, 할로, 다이플루오로메틸, 트라이플루오로메틸 및 메틸로부터 선택되며;
R6은 수소, 할로 및 -C(O)R10으로부터 선택되되, R10은 메틸이고; 그리고
R7은 수소, 할로, 사이아노, 메틸 및 트라이플루오로메틸로부터 선택된다.
몇몇 실시형태에 있어서, 상기 화합물은 하기로부터 선택된다:
N-[5-(3-플루오로페닐)피리딘-2-일]-2-[5-메틸-6-(피리다진-4-일)피리딘-3-일]아세트아마이드;
2-[5-메틸-6-(2-메틸피리딘-4-일)피리딘-3-일]-N-[5-(피라진-2-일)피리딘-2-일]아세트아마이드(LGK974);
N-(2,3'-바이피리딘-6'-일)-2-(2',3-다이메틸-2,4'-바이피리딘-5-일)아세트아마이드;
N-(5-(4-아세틸피페라진-1-일)피리딘-2-일)-2-(2'-메틸-3-(트라이플루오로메틸)-2,4'- 바이피리딘-5-일)아세트아마이드;
N-(5-(4-아세틸피페라진-1 -일)피리딘-2-일)-2-(2'-플루오로-3-메틸-2,4'-바이피리딘-5-일)아세트아마이드; 및
2-(2'-플루오로-3-메틸-2,4'-바이피리딘-5-일)-N-(5-(피라진-2-일)피리딘-2-일)아세트아마이드; 또는 이들의 약제학적으로 허용 가능한 염.
몇몇 실시형태에 있어서, 상기 화합물은 2-[5-메틸-6-(2-메틸피리딘-4-일)피리딘-3-일]-N-[5-(피라진-2-일)피리딘-2-일]아세트아마이드이다.
몇몇 실시형태에 있어서, 암은 결장직장암, 위암, 간암, 식도암, 장암, 담관암, 췌장암, 자궁내막암 또는 전립선암이다.
참고에 의한 편입
본 명세서에서 언급된 모든 간행물, 특허 및 특허 출원은 마치 각각 개별적인 간행물, 특허 또는 특허 출원이 참고로 편입되는 것으로 구체적으로 그리고 개별적으로 나타낸 것과 동일한 정도로 참고로 편입된다.
본 발명의 신규한 특징은 특별히 첨부된 청구범위에 기술되어 있다. 본 발명의 특징과 이점의 더 좋은 이해는 예시적인 실시형태를 기술하는 본 발명의 원리가 이용되는 이하의 상세한 설명과 첨부 도면을 참조함으로써 얻어질 것이다:
도 1은 Rspo2 나노스트링 엔카운터(Nanostring nCounter) 의사결정 차트를 나타낸 도면.
도 2는 Rspo3 나노스트링 엔카운터 의사결정 차트를 나타낸 도면.
도 3은 특성규명된 종양 조직(표 7)을 이용한 나노스트링 엔카운터 유전형 분석 검정의 검증을 나타낸 도면. 음영 부분은 특성규명된 샘플에서의 노출된 양성 신호를 강조한다. L440 샘플에서의 Rspo2 엑손1의 신호 계수치는 다른 엑손의 계수치에 근접하며, 이는 L440 종양 샘플 내 Rspo2 융합 대신에 야생형 Rspo2 전사물의 발현을 나타낸다.
도 4는 Rspo2 융합 유전자 또는 Rspo3 융합 유전자를 갖는 또는 갖지 않는 종양 샘플에서의 나노스트링 엔카운터 검정에 의한 Rspo2 및 Rspo3 전사물의 정량화를 도시한 도면.
도 5a 및 도 5b는 각종 Rspo2(표 8) 및 Rspo3(표 9) 유전자 융합의 서열을 도시한 도면.
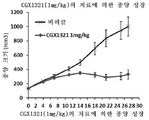
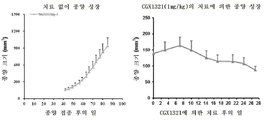
도 6a 내지 도 6c는 RSPO3 융합 유전자를 보유하는 종양 모델에서의 CGX1321의 항종양 효과를 도시한 도면. 도 6a: PTPRK의 엑손1을 Rspo3의 엑손2에 융합하는 PTPRKe1-Rspo3 유전자 융합을 가진 결장직장 종양의 CRC011 PDX 모델에 대한 CGX1321의 용량 반응. 종양이 대략 150㎣ 크기에 도달했을 때, 각종 용량의 CGX1321을 28일 동안 나타낸 바와 같이 투여하였다. 종양 크기는 각 군(n = 8 동물/군)에서 주 2회 측정하였다. 도 6b: PTPRK의 엑손7을 Rspo3의 엑손 2에 융합하는 유형 2 PTPRK-Rspo3 유전자 융합을 가진 CRC141 결장직장 종양 PDX 모델. 종양이 대략 150㎣ 크기에 도달했을 때, CGX1321을 21일 동안 경구로 7.5 ㎎/㎏ QD로 투여하였다. 종양 크기는 주 2회 측정하였다(n = 8 동물/군). 도 6c: 엑손13을 Rspo3 엑손2에 융합하는 유형3 PTPRK-Rspo3 유전자 융합을 가진 CR2506 결장직장 종양 PDX 모델. 좌측: 서비스 제공자에 의해 제공된 과거 치료 대조군으로서 12개의 독립된 실험에서 치료되지 않은 이종이식 종양 CR2506 모델의 종양 성장 곡선. 우측: 28일 동안 경구로 1㎎/㎏ QD로 CGX1321로 치료된 CR2506 모델의 종양 성장. 종양 크기는 각 군(n = 4 동물/군)에서 주 2회 측정하였다.
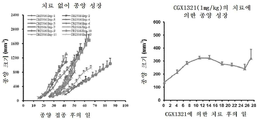
도 7a 내지 도 7c는 Rspo2 융합 유전자를 보유하는 종양 모델에서의 CGX1321의 항종양 효과를 도시한 도면. 도 7a: EMC2의 엑손1을 Rspo2의 엑손2에 융합하는 EMC2e1-Rspo2e2 유전자 융합을 가진 GA67 위 종양 PDX 모델. 종양이 대략 100㎣ 크기에 도달했을 때, CGX1321을 28일 동안 경구로 1 ㎎/㎏ QD로 투여하였다. 종양 크기는 주 2회 측정하였다(n = 6 동물/군). 도 7b: PVT1의 엑손1을 Rspo2의 엑손 2에 융합하는 PVT1e1-Rspo2e2 유전자 융합을 가진 CR3056 결장직장 종양 PDX 모델. 종양이 대략 100㎣ 크기에 도달했을 때, CGX1321은 28일 동안 경구로 1 ㎎/㎏ QD로 투여하였다. 종양 크기는 각 군에서 2회 측정하였다(n = 6 동물/군). 도 7c: HFN4G 5' 말단을 Rspo2 엑손2에 융합하는 HFN4G-Rspo2e2 유전자 융합을 가진 GA3055 위 종양 PDX 모델. (좌측: 서비스 제공자에 의해 제공된 치료되지 않은 종양 성장. 우측: 28일 동안 경구로 1㎎/㎏ QD로 CGX1321로 치료된 종양 성장. 종양 크기는 각 군(n = 4 동물/군)에서 주 2회 측정하였다.
도 1은 Rspo2 나노스트링 엔카운터(Nanostring nCounter) 의사결정 차트를 나타낸 도면.
도 2는 Rspo3 나노스트링 엔카운터 의사결정 차트를 나타낸 도면.
도 3은 특성규명된 종양 조직(표 7)을 이용한 나노스트링 엔카운터 유전형 분석 검정의 검증을 나타낸 도면. 음영 부분은 특성규명된 샘플에서의 노출된 양성 신호를 강조한다. L440 샘플에서의 Rspo2 엑손1의 신호 계수치는 다른 엑손의 계수치에 근접하며, 이는 L440 종양 샘플 내 Rspo2 융합 대신에 야생형 Rspo2 전사물의 발현을 나타낸다.
도 4는 Rspo2 융합 유전자 또는 Rspo3 융합 유전자를 갖는 또는 갖지 않는 종양 샘플에서의 나노스트링 엔카운터 검정에 의한 Rspo2 및 Rspo3 전사물의 정량화를 도시한 도면.
도 5a 및 도 5b는 각종 Rspo2(표 8) 및 Rspo3(표 9) 유전자 융합의 서열을 도시한 도면.
도 6a 내지 도 6c는 RSPO3 융합 유전자를 보유하는 종양 모델에서의 CGX1321의 항종양 효과를 도시한 도면. 도 6a: PTPRK의 엑손1을 Rspo3의 엑손2에 융합하는 PTPRKe1-Rspo3 유전자 융합을 가진 결장직장 종양의 CRC011 PDX 모델에 대한 CGX1321의 용량 반응. 종양이 대략 150㎣ 크기에 도달했을 때, 각종 용량의 CGX1321을 28일 동안 나타낸 바와 같이 투여하였다. 종양 크기는 각 군(n = 8 동물/군)에서 주 2회 측정하였다. 도 6b: PTPRK의 엑손7을 Rspo3의 엑손 2에 융합하는 유형 2 PTPRK-Rspo3 유전자 융합을 가진 CRC141 결장직장 종양 PDX 모델. 종양이 대략 150㎣ 크기에 도달했을 때, CGX1321을 21일 동안 경구로 7.5 ㎎/㎏ QD로 투여하였다. 종양 크기는 주 2회 측정하였다(n = 8 동물/군). 도 6c: 엑손13을 Rspo3 엑손2에 융합하는 유형3 PTPRK-Rspo3 유전자 융합을 가진 CR2506 결장직장 종양 PDX 모델. 좌측: 서비스 제공자에 의해 제공된 과거 치료 대조군으로서 12개의 독립된 실험에서 치료되지 않은 이종이식 종양 CR2506 모델의 종양 성장 곡선. 우측: 28일 동안 경구로 1㎎/㎏ QD로 CGX1321로 치료된 CR2506 모델의 종양 성장. 종양 크기는 각 군(n = 4 동물/군)에서 주 2회 측정하였다.
도 7a 내지 도 7c는 Rspo2 융합 유전자를 보유하는 종양 모델에서의 CGX1321의 항종양 효과를 도시한 도면. 도 7a: EMC2의 엑손1을 Rspo2의 엑손2에 융합하는 EMC2e1-Rspo2e2 유전자 융합을 가진 GA67 위 종양 PDX 모델. 종양이 대략 100㎣ 크기에 도달했을 때, CGX1321을 28일 동안 경구로 1 ㎎/㎏ QD로 투여하였다. 종양 크기는 주 2회 측정하였다(n = 6 동물/군). 도 7b: PVT1의 엑손1을 Rspo2의 엑손 2에 융합하는 PVT1e1-Rspo2e2 유전자 융합을 가진 CR3056 결장직장 종양 PDX 모델. 종양이 대략 100㎣ 크기에 도달했을 때, CGX1321은 28일 동안 경구로 1 ㎎/㎏ QD로 투여하였다. 종양 크기는 각 군에서 2회 측정하였다(n = 6 동물/군). 도 7c: HFN4G 5' 말단을 Rspo2 엑손2에 융합하는 HFN4G-Rspo2e2 유전자 융합을 가진 GA3055 위 종양 PDX 모델. (좌측: 서비스 제공자에 의해 제공된 치료되지 않은 종양 성장. 우측: 28일 동안 경구로 1㎎/㎏ QD로 CGX1321로 치료된 종양 성장. 종양 크기는 각 군(n = 4 동물/군)에서 주 2회 측정하였다.
본 발명의 수 개의 양상은 예시를 위한 실시예 적용을 참조하여 이하에 기술된다. 수많은 구체적인 상세, 관계 및 방법이 본 발명의 충분한 이해를 제공하기 위하여 제시됨이 이해되어야 한다. 그러나 관련 기술의 당업자라면, 구체적인 상세들 중 하나 이상 없이 또는 기타 방법으로 수행될 수 있음을 쉽게 인식할 것이다. 본 발명은, 몇몇 행위가 기타 행위 혹은 사건과 상이한 순서로 및/또는 동시에 일어날 수 있으므로, 행위들 혹은 사건들의 예시적인 수순으로 제한되는 것은 아니다.
게다가, 모든 예시된 행위 혹은 사건이 본 발명에 따라서 방법을 수행하는데 필요로 되는 것은 아니다.
본 명세서에서 이용되는 용어는 단지 특정 실시형태를 기술할 목적이며, 본 발명의 제한을 위해 의도된 것은 아니다. 본 명세서에서 이용되는 바와 같이, 단수 형태는, 문맥이 명백하게 달리 표시하지 않는 한, 복수 형태도 포함하도록 의도된다. 또한, 용어 "포함하는"(including), "포함하다"(includes), "갖는"(having), "갖는다"(has), "구비하는"(with) 또는 이들의 변형어가 상세한 설명 및/또는 청구범위에서 이용되는 정도까지, 이러한 용어는 용어 "포함하는"(comprising)과 유사한 방식으로 포함되도록 의도된다.
용어 "약" 또는 "대략"은 당업자에 의해 결정되는 바와 같은 특정 값에 대한 허용 가능한 오차 범위 내를 의미하며, 이는 그 값이 측정되거나 결정되는 방식, 즉, 측정 시스템의 한계에 따라서 부분적으로 좌우될 것이다. 예를 들어, "약"은 당업계의 실시에 따라서 1 또는 1 초과의 표준 편차 내를 의미할 수 있다. 대안적으로, "약"은 주어진 값의 20%까지, 바람직하게는 10%까지, 더욱 바람직하게는 5%까지, 더욱더 바람직하게는 1%까지의 범위를 의미할 수 있다. 대안적으로, 특히 생물학적 시스템 혹은 공정과 관련하여, 이 용어는 그 값의 소정 크기 차수 이내, 바람직하게는, 5배 이내, 더 바람직하게는 2배 이내를 의미할 수 있다. 특정 값이 본 출원 명세서 및 청구범위에 기술되는 경우, 달리 기술하지 않는 한, 특정 값에 대한 허용 가능한 오차 범위 내를 의미하는 용어 "약"이 가정되어야 한다.
I.
정의 및 약어
달리 정의되지 않는 한, 본 명세서에서 이용되는 모든 기술적 및 과학적 용어는 일반적으로 본 발명이 속하는 당업계에서 통상의 기술을 가진 자에 의해 통상적으로 이해되는 바와 같은 의미를 갖는다. 일반적으로, 본 명세서에서 이용되는 명명법 및 세포 배양, 분자 유전학, 유기 화학 및 핵산 화학 및 교잡에서의 실험 절차는 당업계에서 잘 알려지고 통상적으로 이용되는 것들이다. 표준 수법이 핵산 및 펩타이드 합성을 위하여 이용된다. 그 수법 및 절차는, 일반적으로 본 명세서 전체를 통해서 제공되는 각종 일반적으로 문헌 및 당업계에서의 통상적인 방법에 따라서 수행된다. 본 명세서에서 이용되는 명명법 및 분석 화학 및 이하에 기재된 유기 합성의 실험실 절차는 당업계에 충분히 알려져 있고 통상적으로 이용되는 것들이다. 표준 수법 혹은 그의 변형이 화학 합성 및 화학 분석을 위하여 이용된다.
본 명세서에서 이용되는 바와 같이, "WNT 신호전달 경로" 또는 "WNT 경로"란 WNT 단백질의 세포성 수용체에의 결합이 세포 거동의 변화를 야기하는 경로를 지칭한다. WNT 경로는 프리즐드, 디쉐벨드(Disheveled), 악신(Axin), APC, GSK3β, β-카테닌, LEF/TCF 전사 인자, 및 WNT 단백질의 합성 및 분비와 관련된 분자들을 포함하는 다양한 단백질을 포함한다. 기능성 WNT의 분비와 연관된 단백질의 예는, Wls/Evi(wwntless/evenness interrupted), 호저(Porcn) 및 Vps35p를 포함하지만 이들로 제한되는 것은 아니다. Wls/Evi는 골지체에 존재하는 7 통과 막관통(pass transmembrane) 단백질이며, Wg(초파리) MOM-2(예쁜꼬마선충(c. elegans)) 및 Wnt3A의 분비에 필요하다. 그것은 구조와 기능이 둘 다 알려져 있지 않은 보존된 구조적 모티프를 함유한다. 호저(Porcn)는 팔미토일 전이효소의 막-결합 O-아실트랜스페라제(MBOAT) 패밀리의 구성원이다. Wnt의 지방산 변형은 그의 기능에 매우 중요하다. Wnt는 하나 또는 2개의 고도로 보존된 부위 상에서 팔미토일화된다. 따라서 Porcn의 저해제는 모든 기능성 Wnt 신호전달을 차단할 수 있다. Vps35p는 세포내 단백질 수송과 관련된 레트로머 복합체로 불리는 다중단백질 복합체의 서브유닛이다. Vps35p는 소포 내로의 동원을 위해 WNT와 같은 표적 단백질에 결합하는 기능을 한다.
본 명세서에서 이용되는 바와 같은 "Wnt 저해제"는 Wnt 경로의 활성을 저감시킨다. Wnt 저해제는 Wnt 신호전달 경로를 저해할 수 있는 화합물이고, 그리고 PORCN 저해제를 포함한다. 이 저해는, 예를 들어, PORCN, 및 Wnt의 이의 팔미토일화를 저해하는 것, 및 프리즐드 및 디쉐벨드를 포함하는 Wnt 경로 성분들 사이의 회합을 저감시키는 것을 포함할 수 있다. 바람직하게는, Wnt 저해제는 PORCN 저해제이다.
용어 "WNT 경로를 저해하는 방법"은 기능성 WNT 단백질의 생산과 연관되거나 또는 WNT 단백질에 대한 세포 반응과 연관된 공지된 생화학적 사건을 저해하는 방법을 가리킨다. 본 명세서에서 논의된 바와 같이, 작은 유기 분자들은 이 정의에 따라 WNT 반응을 저해할 수 있다.
"WNT 단백질"은 표준 또는 비-표준 WNT 신호전달을 활성화하기 위해 프리즐드 및 LRP5/6 공-수용체에 결합하는 단백질이다. WNT 단백질의 구체적인 예는 하기를 포함한다: WNT-1(NM005430), WNT-2(NM003391), WNT-2B/WNT-13(NM004185), WNT-3(NM030753), WNT3a(NM033131), WNT-4(NM030761), WNT-5A(NM003392), WNT-5B(NM032642), WNT-6(NM006522), WNT-7A(NM004625), WNT-7B(NM058238), WNT-8A(NM058244), WNT-8B(NM003393), WNT-9A/WNT-14(NM003395), WNT-9B/WNT-15(NM003396), WNT-10A(NM025216), WNT-10B(NM003394), WNT-11(NM004626), WNT-16(NM016087).
"WNT 경로 장애"는 비정상적인 WNT 신호전달을 갖는 병태 또는 질환 상태이다. 일 양상에 있어서, 비정상적인 WNT 신호전달은 정상 세포 또는 조직에서의 WNT 신호전달 수준을 초과하는, 질병에 걸린 것으로 의심되는 세포 또는 조직에서의 WNT 신호전달 수준이다. 하나의 특정 양상에 있어서, WNT-매개 장애는 암 또는 섬유증을 포함한다.
용어 "암"은 조절되지 않은 세포 증식을 특징으로 하는 인간에서의 병리적 상태를 지칭한다. 그 예는 비제한적으로 암종, 림프종, 모세포종 및 백혈병을 포함한다. 암의 더욱 특별한 예는 폐(소세포 및 비소세포), 유방, 전립선, 카르시노이드, 방광, 위, 췌장, 간(간세포), 간모세포종, 결장직장, 두경부 편평상피 세포 암종, 식도, 난소, 자궁경부, 자궁내막, 중피종, 흑색종, 육종, 골육종, 지방육종, 갑상선, 유건종, 급성 골수성 백혈병(AML) 및 만성 골수성 백혈병(CML)을 포함하지만 이들로 제한되는 것은 아니다.
용어 "섬유증"은 전형적으로 섬유아세포 세포의 제어되지 않은 증식 및 조직 경화를 특징으로 하는 인간에서의 병리적 상태를 지칭한다. 구체적인 예는 비제한적으로 폐 섬유증(특발성 폐 섬유증 및 방사선-유도 섬유증), 신장 섬유증, 및 간경변증을 포함하는 간 섬유증을 포함한다.
"저해하는" 또는 "치료하는" 또는 "치료"는 감소, 치료적 처치 및 예방적 혹은 방지적 치료를 지칭하며, 여기서 목적은 목표로 하는 병리적 장애 또는 병태를 감소시키거나 예방하는 것이다. 일례에서, WNT 신호전달 저해제의 투여 후, 암 환자는 종양 크기의 감소를 경험할 수 있다. "치료" 또는 "치료하는"은 (1) 질환의 병리 또는 증상을 경험하거나 나타내는 대상에서 질환을 저해하는 것, (2) 질환의 병리 또는 증상을 경험하거나 나타내는 대상에서 질환을 개선하는 것 및/또는 (3) 질환의 병리 또는 증상을 경험하거나 나타내는 대상 또는 환자에서 어떤 측정가능한 질환의 감소에 영향을 미치는 것을 포함한다. WNT 경로 저해제가 성장을 막고/막거나 암 세포를 사멸할 수 있는 정도까지, 그것은 세포정지성 및/또는 세포독성일 수 있다.
용어 "치료적 유효량"은 대상 또는 포유동물에서 WNT 경로 장애를 "치료하는"데 효과적인 WNT 경로 저해제(예컨대, 포큐파인 길항제)의 양을 지칭한다. 암의 경우, 약물의 치료적 유효량은 암 세포의 수를 감소, 종양 크기를 감소, 말초기관 내로의 암 세포 침윤을 저해, 종양 전이를 억제, 어느 정도까지 종양 성장을 저해 및/또는 암과 연관된 하나 이상의 증상을 어느 정도 완화할 수 있다.
하나 이상의 추가의 치료제"와의 병용" 투여는 임의의 순서로 동시(병행) 및 연속적인 투여를 포함한다. 본 명세서에서 이용되는 바와 같이, 용어 "약제학적 조합"은 활성 성분들을 혼합하거나 조합하여 얻어진 생성물을 지칭하며, 활성 성분들의 고정된 조합 및 고정되지 않은 조합을 포함한다. 용어 "고정된 조합"은 활성 성분, 예컨대, 화학식 (1)의 화합물과 공동-제제가 단일체 또는 단일 복용량의 형태로 동시에 환자에게 투여되는 것을 의미한다. 용어 "고정되지 않은 조합"은 활성 성분들, 예컨대, 화학식 (1)의 화합물과 공동-제제가 별개의 독립체로서 특정 시간 제한 없이 동시에, 병행하여 또는 순차적으로 환자에게 투여되는 것을 의미하며, 여기서 이러한 투여는 환자의 체내에서 활성 성분들의 치료적 유효 수준들을 제공한다. 후자는 또한 칵테일 요법, 예컨대, 3종 이상의 활성 성분의 투여에 적용된다.
"화학치료제"는 암의 치료에 유용한 화합물이다. 예는, 비제한적으로, 젬시타빈, 이리노테칸, 독소루비신, 5-플루오로유라실, 시토신 아라비노사이드("아라-C"), 사이클로포스파마이드, 티오테파, 부설판, 사이톡신, 탁솔(TAXOL), 메토트렉세이트, 시스플라틴, 멜팔란, 빈블라스틴 및 카보플라틴을 포함한다.
자체로 혹은 다른 치환체의 일부로서의 용어 "알킬"은, 달리 기술하지 않는 한, 완전 포화되거나, 모노- 또는 폴리포화되어 있을 수 있고 지정된 탄소 원자의 개수를 가진(즉, C1-C10은 1 내지 10개의 탄소를 의미함) 2가- 및 다가 라디칼을 포함할 수 있는, 직쇄 혹은 분지쇄의, 또는 환식 탄화수소 라디칼, 또는 이들의 조합을 의미한다. 포화 탄화수소 라디칼의 예는, 메틸, 에틸, n-프로필, 아이소프로필, n-뷰틸, t-뷰틸, 아이소뷰틸, sec-뷰틸, 사이클로헥실, (사이클로헥실)메틸, 사이클로프로필메틸, 예를 들어, n-펜틸, n-헥실, n-헵틸, n-옥틸 등의 동족체 및 이성질체를 포함하지만 이들로 제한되는 것은 아니다. 불포화 알킬기는 1개 이상의 이중 결합 또는 삼중 결합을 가진 것이다. 불포화 알킬기의 예는, 비닐, 2-프로펜일, 크로틸, 2-아이소펜텐일, 2-(뷰타다이엔일), 2,4-펜타다이엔일, 3-(1,4-펜타다이엔일), 에티닐, 1- 및 3-프로핀일, 3-뷰틴일, 및 기타 고차의 동족체 및 이성질체를 포함하지만 이들로 제한되는 것은 아니다. 용어 "알킬은", 달리 표시하지 않는 한, 또한 이하에 더욱 상세히 정의되는 알킬의 유도체, 예컨대, "헤테로알킬"을 포함하는 것을 의미한다. 탄화수소기로 제한되는 알킬기는, "호모알킬"이라 지칭된다.
자체로 혹은 다른 치환체의 일부로서의 용어 "알킬렌"은 -CH2CH2CH2CH2-로 예시되지만 이로 제한되지 않는, 알칸으로부터 유도되는 2가 라디칼을 의미하며, "헤테로알킬렌"으로서 이하에 기재된 기들을 더 포함한다. 전형적으로, 알킬(또는 알킬렌)기는 1 내지 24개의 탄소 원자를 가질 것이며, 10개 이하의 탄소 원자를 갖는 기들이 본 발명에서 바람직하다. "저급 알킬" 또는 "저급 알킬렌"은, 일반적으로 8개 이하의 탄소 원자를 가진 단쇄 알킬 혹은 알킬렌기이다.
용어 "알콕시," "알킬아미노" 및 "알킬티오"(또는 티오알콕시)는 그들의 통상의 의미로 사용되며, 각각 산소 원자, 아미노기 혹은 황 원자를 통해서 분자의 나머지 부분에 부착된 알킬기를 지칭한다.
용어 "헤테로알킬"은, 자체로 혹은 다른 용어와 조합하여, 달리 기술하지 않는 한, O, N, Si 및 S로 이루어진 군으로부터 선택된 적어도 하나의 헤테로원자와 기술된 개수의 탄소 원자로 이루어진, 안정한 직쇄 혹은 분지쇄, 또는 환식 탄화수소 라디칼, 또는 이들의 조합을 의미하며, 여기서 질소 및 황 원자는 선택적으로 산화될 수 있고, 질소 헤테로원자는 선택적으로 4차화될 수 있다. 헤테로원자(들) O, N 및 S 그리고 Si는 헤테로알킬기의 임의의 내부 위치에 또는 알킬기가 분자의 나머지 부분에 부착되는 위치에 배치될 수 있다. 그 예는 -CH2-CH2-O-CH3, -CH2-CH2-NH-CH3, -CH2-CH2-N(CH3)-CH3, -CH2-S-CH2-CH3, -CH2-CH2, -S(O)-CH3, -CH2-CH2-S(O)2-CH3, -CH=CH-O-CH3, -Si(CH3)3, -CH2-CH=N-OCH3 및 -CH=CH-N(CH3)-CH3를 포함하지만 이들로 제한되는 것은 아니다. 2개까지의 헤테로원자는, 예를 들어, -CH2-NH-OCH3 및 -CH2-O-Si(CH3)3 등과 같이 연속적일 수 있다. 마찬가지로, 자체로 혹은 다른 치환체의 일부로서의 용어 "헤테로알킬렌"은 헤테로알킬로부터 유래되는 2가 라디칼을 의미하며, 제한적이지 않지만, 예로서 -CH2-CH2-S-CH2-CH2- 및 -CH2-S-CH2-CH2-NH-CH2-를 들 수 있다. 헤테로알킬렌기에 대해서, 헤테로원자는 또한 사슬 말단 중 한쪽 혹은 양쪽을 점유할 수 있다(예컨대, 알킬렌옥시, 알킬렌다이옥시, 알킬렌아미노, 알킬렌다이아미노 등). 또한 알킬렌 및 헤테로알킬렌 연결기에 대해서, 연결기의 무 배향은 그 연결기의 화학식이 기재되는 방향으로 표시된다. 예를 들어, 화학식 -C(O)2R'-은 -C(O)2R'- 및 -R'C(O)2- 둘 다를 나타낸다.
일반적으로 "아실 치환체"는 또한 위에 기재된 기로부터 선택된다. 본 명세서에서 이용되는 바와 같이, 용어 "아실 치환체"는 본 발명의 화합물의 다환식 핵에 직접 또는 간접적으로 부착된 카보닐 탄소의 원자가를 충족시키는, 상기 다환식 핵에 부착된 기를 지칭한다.
용어 "사이클로알킬" 및 "헤테로사이클로알킬"은, 그들 자체로 혹은 다른 용어와 조합하여, 달리 기술하지 않는 한, 각각 "알킬" 및 "헤테로알킬"의 환식 버전을 의미한다. 부가적으로, 헤테로사이클로알킬에 대해서, 헤테로원자는 헤테로사이클(즉, 복소환)이 분자의 나머지 부분에 부착되는 위치를 점유할 수 있다. 사이클로알킬의 예는, 사이클로펜틸, 사이클로헥실, 1-사이클로헥센일, 3-사이클로헥센일, 사이클로헵틸 등을 포함하지만 이들로 제한되는 것은 아니다. 헤테로사이클로알킬의 예는 1-(1,2,5,6-테트라하이드로피리딜), 1-피페리딘일, 2-피페리딘일, 3-피페리딘일, 4-몰폴린일, 3-몰폴린일, 테트라하이드로퓨란-2-일, 테트라하이드로퓨란-3-일, 테트라하이드로티엔-2-일, 테트라하이드로티엔-3-일, 1-피페라진일, 2-피페라진일 등을 포함하지만 이들로 제한되는 것은 아니다.
용어 "할로" 또는 "할로겐"은, 이들 자체로 혹은 다른 치환체의 일부로서, 달리 기술하지 않는 한, 플루오르, 염소, 브로민 또는 요오드 원자를 의미한다. 부가적으로, "할로알킬" 등과 같은 용어는 모노할로알킬 및 폴리할로알킬을 포함하도록 의미한다. 예를 들어, 용어 "할로(C1-C4)알킬"은, 제한적이지 않지만, 트라이플루오로메틸, 2,2,2-트라이플루오로에틸, 4-클로로뷰틸, 3-브로모프로필 등을 포함하도록 의미한다.
용어 "아릴"은, 달리 기술하지 않는 한, 함께 축합되거나 공유 결합되는, 단일 고리 혹은 다수의 고리(바람직하게는 1 내지 3개의 고리)일 수 있는 다중불포화, 방향족, 탄화수소 치환체를 의미한다. 용어 "헤테로아릴"은, N, O 및 S로부터 선택된 1 내지 4개의 헤테로원자를 함유하는 아릴기(또는 고리)를 지칭하며, 여기서 질소 및 황 원자는 선택적으로 산화되고, 질소 원자(들)는 선택적으로 4차화된다. 헤테로아릴기는 헤테로원자를 통해서 분자의 나머지 부분에 부착될 수 있다. 아릴 및 헤테로아릴기의 비제한적인 예는 페닐, 1-나프틸, 2-나프틸, 4-바이페닐, 1-피롤릴, 2-피롤릴, 3-피롤릴, 3-피라졸릴, 2-이미다졸릴, 4-이미다졸릴, 피라진일, 2-옥사졸릴, 4-옥사졸릴, 2-페닐-4-옥사졸릴, 5-옥사졸릴, 3-아이소옥사졸릴, 4-아이소옥사졸릴, 5-아이소옥사졸릴, 2-티아졸릴, 4-티아졸릴, 5-티아졸릴, 2-퓨릴, 3-퓨릴, 2-티엔일, 3-티엔일, 2-피리딜, 3-피리딜, 4-피리딜, 2-피리미딜, 4-피리미딜, 5-벤조티아졸릴, 퓨린일, 2-벤즈이미다졸릴, 5-인돌릴, 1-아이소퀴놀릴, 5-아이소퀴놀릴, 2-퀴녹살린일, 5-퀴녹살린일, 3-퀴놀릴 및 6-퀴놀릴을 포함한다. 위에서 언급된 아릴 및 헤테로아릴 고리계의 각각에 대한 치환체는 이하에 기재된 허용 가능한 치환체의 군으로부터 선택된다.
간략화를 위하여, 용어 "아릴"은, 다른 용어와 조합하여 이용될 경우(예컨대, 아릴옥시, 아릴티옥시, 아릴알킬), 위에서 정의된 바와 같은 아릴 고리와 헤테로아릴 고리를 둘 다 포함한다. 이와 같이 해서, 용어 "아릴알킬"은, 아릴기가 알킬기에 부착된 라디칼(예컨대, 벤질, 페네틸, 피리딜메틸 등), 예를 들어, 탄소 원자(예컨대, 메틸렌기)가 예를 들어 산소 원자에 의해 교체된 알킬기를 포함하는 것들(예컨대, 페녹시메틸, 2-피리딜옥시메틸, 3-(1-나프틸옥시)프로필 등)을 포함하도록 의미한다.
상기 용어(예컨대, "알킬," "헤테로알킬," "아릴" 및 "헤테로아릴")의 각각은 표시된 라디칼의 치환된 형태와 비치환 형태 둘 다를 포함한다. 각 유형의 라디칼에 대한 바람직한 치환체가 이하에 제공된다.
알킬, 및 헤테로알킬 라디칼에 대한 치환체들(알킬렌, 알켄일, 헤테로알킬렌, 헤테로알켄일, 알킨일, 사이클로알킬, 헤테로사이클로알킬, 사이클로알켄일 및 헤테로사이클로알켄일로서 흔히 지칭되는 기들을 포함함)은 각각 일반적으로 "알킬 치환체" 및 "헤테로알킬 치환체"로 지칭되며, 이들은, 제한적이지 않지만, 0 내지 (2m'+1)(여기서 m'은 이러한 라디칼 내 탄소 원자의 총 수임) 범위의 개수의 -OR', =O, =NR', =N-OR', -NR'R", -SR', -할로겐, -SiR'R"R"', -OC(O)R', -C(O)R', -CO2R', -CONR'R", -OC(O)NR'R", -NR"C(O)R', -NR'-C(O)NR"R"', -NR"C(O)2R', -NR-C(NR'R"R'")=NR"", -NR-C(NR'R")=NR'", -S(O)R', -S(O)2R', -S(O)2NR'R", -NRSO2R', -CN 및 -NO2로부터 선택된 다양한 기 중 하나 이상일 수 있다. R', R", R"' 및 R""은 각각 바람직하게는 독립적으로 수소, 치환 또는 비치환 헤테로알킬, 치환 또는 비치환 아릴, 예컨대, 1 내지 3개의 할로겐으로 치환된 아릴, 치환 또는 비치환 알킬, 알콕시 또는 티오알콕시기, 또는 아릴알킬기를 지칭한다. 본 발명의 화합물이 하나보다 많은 R기를 포함할 경우, 예를 들어, R기의 각각은 이들 기 중 하나 보다 많은 기가 존재할 경우 각각의 R', R", R'" 및 R""기가 되도록 독립적으로 선택된다. R' 및 R"이 동일한 질소 원자에 부착된 경우, 이들은 질소 원자와 조합하여 5-, 6- 또는 7-원 고리를 형성할 수 있다. 예를 들어, -NR'R"은, 제한적이지 않지만, 1-피롤리딘일 및 4-몰폴린일을 포함하는 것을 의미한다. 치환체들의 이상의 논의로부터, 당업자라면, 용어 "알킬"이 수소 이외의 다른 기에 결합된 탄소 원자를 포함하는 기, 예를 들어, 할로알킬(예컨대, -CF3 및 -CH2CF3) 및 아실(예컨대, -C(O)CH3, -C(O)CF3, -C(O)CH2OCH3 등)을 포함하도록 의미하는 것을 이해할 것이다.
알킬 라디칼에 대해서 기재된 치환체와 마찬가지로, 아릴 치환체 및 헤테로아릴 치환체는 각각 일반적으로 "아릴 치환체" 및 "헤테로아릴 치환체"로서 지칭되고, 방향족 고리계 상의 개방 원자가(open valence)의 0 내지 총 개수 범위의 수의, 예를 들어, 할로겐, -OR', =O, =NR', =N-OR', -NR'R", -SR', -할로겐, -SiR'R"R"', -OC(O)R', -C(O)R', -CO2R', -CONR'R", -OC(O)NR'R", -NR"C(O)R', -NR'-C(O)NR"R"', -NR"C(O)2R', -NR-C(NR'R")=NR'", -S(O)R', -S(O)2R', -S(O)2NR'R", -NRSO2R', -CN 및 -NO2, -R', -N3, -CH(Ph)2, 플루오로(C1-C4)알콕시, 및 플루오로(C1-C4)알킬로부터 선택되고 다양하며; 여기서 R', R", R"' 및 R""은 바람직하게는 독립적으로 수소, (C1-C8)알킬 및 헤테로알킬, 비치환 아릴 및 헤테로아릴, (비치환 아릴)-(C1-C4)알킬, 및 (비치환 아릴)옥시-(C1-C4)알킬로부터 선택된다. 본 발명의 화합물이 1개 초과의 R기를 포함할 경우, 예를 들어, R기의 각각은 이들 기 중 하나보다 많은 기가 존재할 경우 각 R', R", R'" 및 R""기가 되도록 독립적으로 선택된다.
아릴 또는 헤테로아릴 고리의 인접한 원자들 상의 아릴 치환체들 중 2개는 선택적으로 화학식 -T-C(O)-(CRR')q-U-의 치환체로 교체될 수 있고, 여기서 T 및 U는 독립적으로 -NR-, -O-, -CRR'- 또는 단일 결합이며, q는 0 내지 3의 정수이다. 대안적으로, 아릴 또는 헤테로아릴 고리의 인접한 원자들 상의 치환체들 중 2개는 선택적으로 화학식 -A-(CH2)r-B-의 치환체로 교체될 수 있고, 여기서 A 및 B는 독립적으로 -CRR'-, -O-, -NR-, -S-, -S(O)-, -S(O)2-, -S(O)2NR'- 또는 단일 결합이고, r은 1 내지 4의 정수이다. 그와 같이 형성된 새로운 고리의 단일 결합들 중 하나는 선택적으로 이중 결합으로 교체될 수 있다. 대안적으로, 아릴 또는 헤테로아릴 고리의 인접한 원자들 상의 치환체들 중 2개는 선택적으로 화학식 -(CRR')s-X-(CR"R'")d-의 치환체로 교체될 수 있으며, 여기서, s 및 d는 독립적으로 0 내지 3의 정수이고, X는 -O-, -NR'-, -S-, -S(O)-, -S(O)2- 또는 -S(O)2NR'-이다. 치환체 R, R', R" 및 R'"은 바람직하게는 독립적으로 수소 또는 치환 또는 비치환 (C1-C6) 알킬로부터 선택된다.
본 명세서에서 이용되는 바와 같이, 용어 "헤테로원자"는 산소(O), 질소(N), 황(S), 인(P) 및 규소(Si)를 포함한다.
II.
조성물
일 양상에 있어서, 본 발명은, Wnt 저해제와 실질적으로 유사한 생물학적 활성을 가진 약물 또는 Wnt 저해제를 이용하는 요법에 대해서 (예컨대, 치료적 유익으로) 반응할 공산이 큰 환자를 결정 또는 예측할 뿐만 아니라, Wnt 저해제를 이용하는 치료에 반응하지 않을 공산이 큰 환자를 결정 또는 예측하는 방법 및 조성물을 제공한다.
몇몇 실시형태에 있어서, Wnt 저해제는 인간에서 이용하기에 적합한 포큐파인 저해제이다. Wnt 저해제는 IWP-2, IWP-3 또는 IWP-4와 같은 공지의 포큐파인 저해제와 유사한 기능을 가진 포큐파인 저해제일 수 있고, 이것은 문헌[Chen B et al. (2009) Nature Chem. Biol. 5: 100-107]에 기재되어 있고 스테몰리큘(Stemolecule)(상표명) Wnt 저해제 IWP-2(#130-095-584), 스테몰리큘(상표명) Wnt 저해제 IWP-3(#130-095-585) 및 스테몰리큘(상표명) Wnt 저해제 IWP-4로서 밀테니이 바이오테크사(Miltenyi Biotech)로부터 상업적으로 입수 가능하다. 스테몰리큘(상표명) IWP-2, 스테몰리큘(상표명) IWP-3 및 스테몰리큘(상표명) IWP-4는 막-결합 O-아세틸트랜스퍼라제인 포큐파인(PORCN)에 의한 Wnt 단백질의 팔미틸화를 방지한다.
대안적으로, Wnt 저해제는 약물 설계의 산물일 수 있고, 당업계에 공지된 각종 방법을 이용해서 제조될 수 있다. 이에 대해서는 특허 출원 공개 WO2010/101849(공개일 2010년 월 10일) 참조. 본 발명에 유용한 설계 모방체 또는 기타 화합물에 유용한 각종 약물 설계 방법은 문헌[Maulik ef al. (1997) Molecular Biotechnology: Therapeutic Applications and Strategies. Wiley-Liss, Inc.](이의 전문이 참고로 편입됨)에 개시되어 있다. Wnt 저해제는 분자 다양성 전략(대형의 화학적으로 다양한 분자 라이브러리의 신속한 구축을 허용하는 관련된 전략들의 조합), 특히 화학적 또는 조합적 라이브러리(즉, 서열 또는 크기가 다르지만 유사한 빌딩 블록을 갖는 화합물들의 라이브러리)로부터의 천연 또는 합성 화합물의 라이브러리로부터 또는 합리적인, 지향된 또는 랜덤한 약물 설계에 의해 얻어질 수 있다. 예를 들어, 문헌[Maulik et al. (1997) Molecular Biotechnology: Therapeutic Applications and Strategies. Wiley-Liss, Inc.] 참조. 분자 다양성 전략에 있어서, 대형 화합물 라이브러리는, 예를 들어, 생물학적, 효소적 또는 화학적 접근법을 이용해서, 펩타이드, 올리고뉴클레오타이드, 천연 또는 합성 스테로이드성 화합물, 탄수화물 또는 천연 또는 합성 유기 및 비-스테로이드성 분자로부터 합성된다. 분자 다양성 전량을 개발함에 있어서의 임계적 파라미터는 소단위 다양성, 분자 크기 및 라이브러리 다양성을 포함한다. 이러한 라이브러리를 선별하는 일반적인 목표는 목적하는 표적에 대한 고친화성 리간드를 얻기 위하여 조합 선택의 순차적 적용을 이용하고, 이어서 랜덤 또는 지향적 설계 전략에 의해 선두 분자를 최적화시키는 것이다. 분자 다양성의 방법은 문헌[Maulik et al. (1997) Molecular Biotechnology: TherapeuticApplications and Strategies. Wiley-Liss, Inc.]에 상세히 기재되어 있다.
다른 양상에 있어서, 본 발명은 포큐파인 길항제 또는 저해제로서의 화합물을 제공한다.
본 명세서에서 "PORCN"이란, Wnt 전사후 변형을 위하여 요구되는 막-결합된 아실트랜스퍼라제인 포큐파인을 의미한다. 달리 구체적으로 기술되지 않는 한, 본 명세서에서 이용되는 바와 같은 PORCN은, 인간 PORCN-수탁 번호 NM_017617.3/NP_060087을 지칭한다.
몇몇 실시형태에 있어서, 포큐파인 저해제는 하기 화학식 (I)의 구조를 갖는다:
식 중,
X1, X2, X3, X4, X5, X6, X7, X8은 독립적으로 CR4 또는 N이고;
Y1은 수소 또는 CR4이며;
Y2, Y3은 독립적으로 수소, 할로 또는 CR3이고;
R2는 수소, 할로, 몰폴린일, 피페라진일, 퀴놀린일, , 아릴, C1 -6 헤테로사이클, N, O 및 S로부터 선택된 1 내지 2개의 헤테로원자를 함유하는 5 또는 6원 헤테로아릴이고;
여기서 5 또는 6원 헤테로아릴은 이하의 선택된 기들을 포함하지만 이들로 제한되는 것은 아니며:
R1 및 R2는 1 내지 2개의 R4기로 독립적으로 그리고 선택적으로 치환될 수 있고;
R3은 수소, 할로, 사이아노, 임의로 할로, 아미노, 하이드록실, 알콕시 또는 사이아노로 치환된, C1 -6 알킬, C1 -6 알콕시이며;
R4는 수소, 할로, C1 - 6알콕시, -S(O)2R5, -C(O)OR5, -C(O)R5, -C(O)NR6R7, C1 -6 알킬, C2 -6 알켄일 또는 C2 -6 알킨일이되, 이들 각각은 할로, 아미노, 하이드록실, 알콕시 또는 사이아노로 선택적으로 치환될 수 있고;
R5, R6 및 R7은 독립적으로 수소, C1 -6 알킬, C2 -6 알켄일 또는 C2 -6 알킨일이되, 이들 각각은 할로, 아미노, 하이드록실, 알콕시 또는 사이아노로 선택적으로 치환될 수 있으며; 그리고
R8은 수소 또는 C1 -6 알킬이다.
본 명세서에서 이용되는 바와 같이, 임의의 치환체기들(예컨대, CH2) 중 H 원자는 모든 적절한 동위원소 변종, 예컨대, H, 2H 및 3H를 포함한다.
본 명세서에서 이용되는 바와 같이, 임의의 치환체기들 중 다른 원자는 11C, 13C, 14C, 15N, 17O, 18O, 35S, 18F, 36I 및/또는 123I를 포함하지만 이들로 제한되는 것은 아닌 모든 적절한 동위원소 변종을 포함한다.
몇몇 실시형태에 있어서, 본 발명의 화합물의 예는 하기를 포함하지만 이들로 제한되는 것은 아니다:
6-(2-메틸피리딘-4-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
N-(3-메틸-4-(2-메틸피리딘-4-일)벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
6-(3-플루오로페닐)-N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)아이소퀴놀린-1-아민;
2-(2-메틸피리딘-4-일)-N-(4-(2-메틸피리딘-4-일)벤질)-1,6-나프티리딘-5-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-2-페닐피리도[4,3-b]피라진-5-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리딘-4-일)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-페닐-2,7-나프티리딘-1-아민;
6-(3-클로로페닐)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
6-(3-플루오로페닐)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
6-(3-플루오로페닐)-N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)-2,7-나프티리딘-1-아민;
6-(3-플루오로페닐)-N-(4-(2-(트라이플루오로메틸)피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(3-플루오로페닐)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리미딘-5-일)-2,7-나프티리딘-1-아민;
6-(5-메틸피리딘-3-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
6-(6-메틸피리딘-3-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
3-(8-(4-(2-메틸피리딘-4-일)벤질아미노)-2,7-나프티리딘-3-일)벤조나이트릴;
4-(8-(4-(2-메틸피리딘-4-일)벤질아미노)-2,7-나프티리딘-3-일)벤조나이트릴;
6-(4-플루오로페닐)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-m-톨릴-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리딘-2-일)-2,7-나프티리딘-1-아민;
6-(2-플루오로피리딘-4-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
6-(2-플루오로페닐)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리딘-3-일)-2,7-나프티리딘-1-아민;
N-(바이페닐-4-일메틸)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
6-(2-메틸피리딘-4-일)-N-((5-페닐피리딘-2-일)메틸)-2,7-나프티리딘-1-아민;
6-(3-플루오로페닐)-N-((2'-(트라이플루오로메틸)-2,4'-바이피리딘-5-일)메틸)-2,7-나프티리딘-1-아민;
N-(3-플루오로-4-(2-플루오로피리딘-4-일)벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
6-(2-메틸피리딘-4-일)-N-((2'-(트라이플루오로메틸)-2,4'-바이피리딘-5-일)메틸)-2,7-나프티리딘-1-아민;
N-((3-플루오로-2'-(트라이플루오로메틸)-2,4'-바이피리딘-5-일)메틸)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
N-(3-플루오로-4-(2-메틸피리딘-4-일)벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
N-((2'-플루오로-2,4'-바이피리딘-5-일)메틸)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
4-(5-(((6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-일)아미노)메틸)피리딘-2-일)티오몰폴린 1,1-다이옥사이드;
6-(2-메틸피리딘-4-일)-N-(4-(피리다진-4-일)벤질)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피라진-2-일)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리다진-4-일)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-몰폴리노-2,7-나프티리딘-1-아민;
6-(4-메틸피페라진-1-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
4-(8-((4-(2-메틸피리딘-4-일)벤질)아미노)-2,7-나프티리딘-3-일)티오몰폴린 1,1-다이옥사이드;
N-(3-플루오로-4-(2-플루오로피리딘-4-일)벤질)-6-(3-플루오로페닐)-2,7-나프티리딘-1-아민;
N-(3-플루오로-4-(2-메틸피리딘-4-일)벤질)-6-(3-플루오로페닐)-2,7-나프티리딘-1-아민;
N-((3-플루오로-2'-(트라이플루오로메틸)-2,4'-바이피리딘-5-일)메틸)-6-(3-플루오로페닐)-2,7-나프티리딘-1-아민;
N-((2'-플루오로-2,4'-바이피리딘-5-일)메틸)-6-(3-플루오로페닐)-2,7-나프티리딘-1-아민;
6-(3-플루오로페닐)-N-(3-메틸-4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
4-(5-(((6-(3-플루오로페닐)-2,7-나프티리딘-1-일)아미노)메틸)피리딘-2-일)티오몰폴린 1,1-다이옥사이드;
N-(4-클로로벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
N-(4-메틸벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
6-(2-메틸피리딘-4-일)-N-(피리딘-3-일메틸)-2,7-나프티리딘-1-아민;
N-벤질-2-(3-플루오로페닐)-1,6-나프티리딘-5-아민;
2-(3-플루오로페닐)-N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)-1,6-나프티리딘-5-아민;
N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)-2-(2-메틸피리딘-4-일)-1,6-나프티리딘-5-아민;
N-((6-(3-플루오로페닐)피리딘-3-일)메틸)-2-(2-메틸피리딘-4-일)-1,6-나프티리딘-5-아민;
N-(4-(2-플루오로피리딘-4-일)벤질)-2-(2-메틸피리딘-4-일)-1,6-나프티리딘-5-아민;
2-(2-메틸피리딘-4-일)-N-(4-(2-(트라이플루오로메틸)피리딘-4-일)벤질)-1,6-나프티리딘-5-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-2-(2-메틸피리딘-4-일)-1,6-나프티리딘-5-아민;
N-(바이페닐-4-일메틸)-6-(3-플루오로페닐)아이소퀴놀린-1-아민;
N-((2-플루오로바이페닐-4-일)메틸)-6-(3-플루오로페닐)아이소퀴놀린-1-아민;
N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)-6-페닐아이소퀴놀린-1-아민;
6-(3-클로로페닐)-N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)아이소퀴놀린-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-페닐아이소퀴놀린-1-아민;
6-(2-메틸피리딘-4-일)-N-(4-(2-메틸피리딘-4-일)벤질)아이소퀴놀린-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리딘-4-일)아이소퀴놀린-1-아민;
6-(6-메틸피리딘-3-일)-N-(4-(2-메틸피리딘-4-일)벤질)아이소퀴놀린-1-아민;
6-(2-메틸피리딘-4-일)-N-(4-(2-메틸피리딘-4-일)벤질)아이소퀴놀린-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리딘-3-일)아이소퀴놀린-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피라진-2-일)아이소퀴놀린-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리다진-4-일)아이소퀴놀린-1-아민;
N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)-6-(피라진-2-일)아이소퀴놀린-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(피라진-2-일)아이소퀴놀린-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(피리딘-2-일)아이소퀴놀린-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(3-플루오로페닐)아이소퀴놀린-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(5-메틸피리딘-3-일)아이소퀴놀린-1-아민;
N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)-2-페닐피리도[4,3-b]피라진-5-아민;
2-(3-플루오로페닐)-N-(4-(2-메틸피리딘-4-일)벤질)피리도[4,3-b]피라진-5-아민;
2-(3-플루오로페닐)-N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)피리도[4,3-b]피라진-5-아민;
2-(3-플루오로페닐)-N-(3-메틸-4-(2-메틸피리딘-4-일)벤질)피리도[4,3-b]피라진-5-아민;
N-(3-플루오로-4-(2-메틸피리딘-4-일)벤질)-2-(3-플루오로페닐)피리도[4,3-b]피라진-5-아민;
2-(2-메틸피리딘-4-일)-N-(4-(2-메틸피리딘-4-일)벤질)피리도[4,3-b]피라진-5-아민;
N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)-2-(2-메틸피리딘-4-일)피리도[4,3-b]피라진-5-아민;
N-(3-메틸-4-(2-메틸피리딘-4-일)벤질)-2-(2-메틸피리딘-4-일)피리도[4,3-b]피라진-5-아민;
N-(3-플루오로-4-(2-메틸피리딘-4-일)벤질)-2-(2-메틸피리딘-4-일)피리도[4,3-b]피라진-5-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(피라진-2-일)-2,7-나프티리딘-1-아민;
6-(2-메틸몰폴리노)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
(S)-6-(2-메틸몰폴리노)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
(R)-6-(2-메틸몰폴리노)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
1-(4-(8-(4-(2-메틸피리딘-4-일)벤질아미노)-2,7-나프티리딘-3-일)피페라진-1-일)에탄온;
6-(1H-이미다졸-1-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
6-(4-메틸-1H-이미다졸-1-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(1H-테트라졸-5-일)-2,7-나프티리딘-1-아민;
6-(5-메틸-1,3,4-옥사다이아졸-2-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
6-(1-메틸-1H-피라졸-3-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(티아졸-5-일)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(옥사졸-5-일)-2,7-나프티리딘-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(5-메틸피리딘-3-일)-2,7-나프티리딘-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
N-((3-플루오로-2'-메틸-2,4'-바이피리딘-5-일)메틸)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(5-플루오로피리딘-3-일)-2,7-나프티리딘-1-아민;
N-(3-메틸-4-(2-메틸피리딘-4-일)벤질)-6-(피라진-2-일)-2,7-나프티리딘-1-아민;
N-(3-플루오로-4-(2-메틸피리딘-4-일)벤질)-6-(피라진-2-일)-2,7-나프티리딘-1-아민;
메틸 4-(8-(4-(2-메틸피리딘-4-일)벤질아미노)-2,7-나프티리딘-3-일)피페라진-1-카복실레이트;
4-(8-(4-(2-메틸피리딘-4-일)벤질아미노)-2,7-나프티리딘-3-일)피페라진-2-온;
2-(4-(8-(4-(2-메틸피리딘-4-일)벤질아미노)-2,7-나프티리딘-3-일)피페라진-1-일)아세토나이트릴;
2-메틸-4-(4-((6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-일아미노)메틸)페닐)피리딘 1-옥사이드;
6-(2-클로로피리딘-4-일)-N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-2,7-나프티리딘-1-아민;
6-(2-클로로피리딘-4-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
2-(2-메틸피리딘-4-일)-5-((6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-일아미노)메틸)벤조나이트릴;
N-(3-메톡시-4-(2-메틸피리딘-4-일)벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
N-((3-클로로-2'-메틸-2,4'-바이피리딘-5-일)메틸)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
2'-메틸-5-((6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-일아미노)메틸)-2,4'-바이피리딘-3-카보나이트릴; 및 N-(4-(2-(다이플루오로메틸)피리딘-4-일)벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민; 또는 이들의 생리학적으로 허용 가능한 염.
몇몇 실시형태에 있어서, 본 발명의 화합물의 예는 실시예 1 내지 5 및 표 1에서 제공되는 화합물을 포함하지만 이들로 제한되는 것은 아니다. 당업자라면 기타 화합물이 실시예 1 내지 5와 같은 전략에 의해 제조될 수 있다는 것을 명백하게 이해하고 알 수 있다.
몇몇 실시형태에 있어서, 본 명세서에 기재된 바와 같은 치료를 위하여 이용되는 포큐파인 길항제 또는 저해제는 WO2010/101849 A1(PCT/US10/025813)에 개시된 바와 같은 임의의 적합한 화합물, 바람직하게는, 하기 화학식 (II)의 화합물 또는 이의 생리학적으로 허용 가능한 염이다:
식 중,
X1, X2, X3 및 X4는 N 및 CR7로부터 선택되고;
X5, X6, X7 및 X8 중 하나는 N이고, 나머지는 CH이며;
X9는 N 및 CH로부터 선택되고;
Z는 페닐, 피라진일, 피리딘일, 피리다진일 및 피페라진일로부터 선택되며;
Z 중 각각의 페닐, 피라진일, 피리딘일, 피리다진일 또는 피페라진일은 임의로 R6기로 치환되고;
R1, R2 및 R3은 수소이며;
m은 1이고;
R4는 수소, 할로, 다이플루오로메틸, 트라이플루오로메틸 및 메틸로부터 선택되며;
R6은 수소, 할로 및 -C(O)R10으로부터 선택되되, R10은 메틸이고; 그리고
R7은 수소, 할로, 사이아노, 메틸 및 트라이플루오로메틸로부터 선택된다.
몇몇 실시형태에 있어서, 상기 화합물은 하기로부터 선택된다:
N-[5-(3-플루오로페닐)피리딘-2-일]-2-[5-메틸-6-(피리다진-4-일)피리딘-3-일]아세트아마이드;
2-[5-메틸-6-(2-메틸피리딘-4-일)피리딘-3-일]-N-[5-(피라진-2-일)피리딘-2-일]아세트아마이드(LGK974);
N-(2,3'-바이피리딘-6'-일)-2-(2',3-다이메틸-2,4'-바이피리딘-5-일)아세트아마이드;
N-(5-(4-아세틸피페라진-1-일)피리딘-2-일)-2-(2'-메틸-3-(트라이플루오로메틸)-2,4'- 바이피리딘-5-일)아세트아마이드;
N-(5-(4-아세틸피페라진-1 -일)피리딘-2-일)-2-(2'-플루오로-3-메틸-2,4'-바이피리딘-5-일)아세트아마이드; 및
2-(2'-플루오로-3-메틸-2,4'-바이피리딘-5-일)-N-(5-(피라진-2-일)피리딘-2-일)아세트아마이드; 또는 이들의 약제학적으로 허용 가능한 염.
몇몇 실시형태에 있어서, 상기 화합물은 2-[5-메틸-6-(2-메틸피리딘-4-일)피리딘-3-일]-N-[5-(피라진-2-일)피리딘-2-일]아세트아마이드이다.
III.
의료 및 약제학적 용도
본 발명의 화합물은 약제로서 표시된다. 본 발명의 추가의 양상에 따르면, 약제로서 이용하기 위하여, 이상에서 기재된 바와 같이(하지만 적용 가능하다면, 어떠한 단서 없이도), 본 발명의 화합물이 제공된다. 또한 약제로서 이용하기 위하여, (하지만 적용 가능하다면, 어떠한 단서 없이도) 본 발명의 화합물의 합성 형태가 제공된다.
의심할 여지를 없애기 위하여, 본 발명의 화합물이 약리 활성을 지닐 수 있지만, 본 발명의 화합물의 소정의 약제학적으로-허용 가능한(예컨대 "보호된") 유도체가 존재하거나 제조될 수 있어 그러한 활성을 지니지 않을 수 있지만, 비경구적으로 혹은 경구적으로 투여될 수 있고 그 후 본 발명의 화합물을 형성하도록 체내에서 대사될 수도 있다. 그러한 화합물(일부 약리 활성을 지닐 수 있음, 단 이러한 활성은 대사되는 "활성" 화합물의 것보다 현저하게 낮음)은 따라서 본 발명의 화합물의 "전구약물"로서 기재될 수 있다.
"본 발명의 화합물의 전구약물"이란, 실험적으로 검출 가능한 양으로, 경구 혹은 비경구 투여 후에 미리 결정된 시간(예컨대, 약 1시간) 내에 본 발명의 화합물을 형성하는 화합물을 포함한다. 본 발명의 화합물의 모든 전구약물은 본 발명의 범주 내에 포함된다.
또한, 본 발명의 소정의 화합물은 그와 같이 최소의 약리 활성을 지니거나 전혀 지니지 않을 수 있지만, 비경구로 혹은 경구로 투여될 수 있고, 그 후 그와 같이 약리 활성을 지니는 본 발명의 화합물을 형성하도록 체내에서 대사될 수 있다. 그러한 화합물(또한 일부 약리 활성을 지닐 수 있지만 그 활성은 대사되는 본 발명의 "활성" 화합물의 것보다 현저하게 낮은 화합물을 포함함)은 또한 "전구약물"로 기재될 수 있다.
이와 같이 해서, 본 발명의 화합물들은 이들이 약리 활성을 지니고/지니거나 약리 활성을 지니는 화합물을 형성하기 위하여 경구 혹은 비경구 투여 후 신체에서 대사되기 때문에 유용하다.
본 발명의 화합물(단서(들) 없이 위에서 정의된 바와 같음)은 암의 치료에서 유용할 수 있다. "암"이란, 세포의 제어되지 않은 성장(예컨대, 비제어된 분할), 침습(예컨대 이웃하는 조직 내로의 직접직인 성장) 또는 전이로부터 발생하는 임의의 질환을 의미한다. "비제어된 성장"이란, 암 세포의 수 및/또는 크기의 증가(본 명세서에서는 "증식"이라고도 지칭됨)를 포함한다. "전이"란 대상체의 신체 내의 원시 종양 부위로부터 대상체의 신체 내의 하나 이상의 영역(여기서 세포가 이어서 2차 종양을 형성함)으로의 암세포의 이동 혹은 이전(예컨대 침습)을 의미한다. 이와 같이 해서, 일 실시형태에 있어서, 본 발명은 암을 가진 대상체에서 2차 종양의 형성을 부분적으로 혹은 전체적으로 저해하기 위한 화합물 또는 방법을 제공한다.
유리하게는, 본 발명의 화합물은 암 세포의 증식 및/또는 전이를 선택적으로 저해할 수 있다.
"선택적으로"란 본 발명의 화합물이 비-암 세포의 기능(예컨대 증식)을 조절하는 것보다 큰 정도로 암 세포의 증식 및/또는 전이를 저해할 수 있는 것을 의미한다. 바람직하게는, 본 발명의 화합물은 암 세포의 증식 및/또는 전이만을 저해한다.
다른 양상에 있어서, 본 발명은 본 발명의 화합물 및 적어도 1종의 약제학적으로 허용 가능한 담체 또는 희석제를 포함하는 약제학적 조성물을 제공하되, 상기 화합물은 유리 형태 혹은 약제학적으로 허용 가능한 염 형태이다. 이러한 조성물은 경구 조성물, 주사가능한 조성물 또는 좌제일 수 있다. 그리고 조성물은 혼합, 과립화 혹은 코팅 방법에 의해 통상의 방법으로 제조될 수 있다.
본 발명의 일 실시형태에 있어서, 조성물은 경구 조성물이고, 이것은 정제 또는 젤라틴 캡슐일 수 있다. 바람직하게는, 경구 조성물은 a) 희석제, 예컨대, 락토스, 덱스트로스, 수크로스, 만니톨, 솔비톨, 셀룰로스 및/또는 글라이신; b) 윤활제, 예컨대, 실리카, 활석, 스테아르산, 이의 마그네슘염 또는 칼슘염 및/또는 폴리에틸렌글라이콜와 함께; 정제를 위하여, c) 결착제, 예컨대, 마그네슘 알루미늄 실리케이트, 전분 페이스트, 젤라틴, 트라가메이쓰, 메틸셀룰로스, 나트륨 카복시메틸셀룰로스 및 또는 폴리비닐피롤리돈; 그리고 필요한 경우, d) 붕해제, 예컨대, 전분, 한천, 알킨산 또는 이의 나트륨염, 또는 발포성 혼합물; 및/또는 e) 첨가제, 예컨대, 흡수제, 착색제, 향미제 및 감미제와 함께 본 발명의 화합물을 포함한다.
본 발명의 다른 실시형태에 있어서, 조성물은 주사가능한 조성물이고, 수성 등장성 용액 또는 현탁액일 수 있다.
본 발명의 또 다른 실시형태에 있어서, 조성물은 좌제이고 지방 에멀전 또는 현탁액으로부터 제조될 수 있다.
바람직하게는, 조성물은 멸균화되고/되거나 애주번트를 함유한다. 이러한 애주번트는 안정제, 습윤제 혹은 유화제, 용액 촉진제, 삼투압 조절용 염, 완충제 및/또는 이들의 임의의 조합물일 수 있다.
대안적으로 또는 부가적으로, 조성물은 가용화제, 안정제, 긴장성 증강제, 완충제 및/또는 보존제와 같이 상이한 용도용의 기타 치료상 가치있는 물질을 더 함유할 수 있다.
본 발명의 일 실시형태에 있어서, 조성물은 경피 적용을 위하여 적합한 제형일 수 있다. 이러한 제형은 유효량의 본 발명의 화합물 및 담체를 포함한다. 바람직하게는, 담체는 숙주의 피부를 통한 통과를 돕기 위하여 흡수성의 약리적으로 허용 가능한 용매를 포함할 수 있다. 제형을 수용하는 경피 기구가 또 사용될 수 있다. 경피 기구는 배킹 부재(backing member), 화합물을 선택적으로 담체와 함께 수용하는 저장소, 선택적으로 제어된 미리 결정된 속도로 연장된 시간 기간에 걸쳐서 숙주의 피부에 화합물을 전달하기 위한 속도 제어 배리어 및 피부에 해당 기구룰 고정하는 수단을 포함하는 밴드 형태일 수 있다. 다르게는, 매트릭스 경피 제형이 또한 이용될 수 있다.
본 발명의 다른 실시형태에 있어서, 조성물은 피부 및 눈 등에 국소 적용을 위하여 적합한 제형일 수 있고, 당업계에 충분히 공지된 수용액, 연고, 크림 또는 겔일 수 있다.
다른 양상에 있어서, 본 발명은 세포로부터의 WNT 분비를 저해하는 방법을 제공한다.
일 실시형태에 있어서, 세포는 포유동물 내에 포함되어 있고, 투여량은 치료적 유효량이다. 다른 실시형태에 있어서, WNT 신호전달의 저해는 세포의 성장의 저해를 더욱 초래한다. 추가의 실시형태에 있어서, 세포는 암 세포이다. 또 다른 실시형태에 있어서, 세포는 섬유생성 세포이다.
세포 증식은 당업자에게 공지된 방법을 이용해서 측정된다. 예를 들어, 세포 증식을 측정하기 위한 편리한 검정은 프로메가사(Promega)(위스콘신주의 매디슨시)로부터 상업적으로 입수 가능한 셀타이터-글로(CellTiter-Glo)(상표명) 검정이다. 검정 절차는 다수 웰 접시 상에서 배양된 세포에 셀타이터-글로(CellTiter-Glo)(상표명) 시약을 첨가하는 것을 포함한다. 발광광도계(luminometer) 또는 영상화 장치(imaging device)에 의해 측정된 발광 신호는 존재하는 ATP의 양에 비례하고 이는 배양액에 존재하는 생균수에 직접 비례한다. 게다가, 세포 증식은 당업계에 공지된 콜로니 형성 검정을 이용해서 측정될 수 있다.
본 발명은 또한 유효량의 본 발명의 화합물을 이용한 WNT 신호전달 경로와 관련된 암 또는 섬유증을 치료하는 방법을 제공한다. 당업자는 당업계에 공지된 수개의 수법 중 하나를 이용해서 암 세포를 분석함으로써 암이 Wnt 경로와 관련되는지의 여부를 용이하게 결정할 수 있다. 예를 들어, 당업자는 면역 및 핵산 검출 방법을 이용해서 Wnt 신호전달에 내포된 단백질 또는 mRNA의 수준의 일탈에 대해서 암 세포를 조사할 수 있었다.
Wnt 경로와 관련된 암 또는 섬유증은 Wnt 신호전달 경로의 하나 이상의 성분의 활성이 기준 수준으로부터 상향 조절되는 것들을 포함한다. 일 실시형태에 있어서, Wnt 경로를 저해하는 것은 Wnt 분비를 저해하는 것을 포함할 수 있다. 다른 예로서, Wnt 경로를 저해하는 것은 세포 표면 수용체의 하류 성분을 저해하는 것을 포함할 수 있다. 다른 실시형태에 있어서, Wnt 분비를 저해하는 것은 기능적 WNT의 분비에 연루된 단백질들 중 어느 하나의 활성을 저해하는 것을 포함할 수 있다.
또한, 본 발명은 치료적 유효량의 WNT 저해제를 대상체에게 투여함으로써 WNT 경로 장애로 고통받고 있는 대상체에서 해당 장애를 치료하는 방법을 제공한다. 일 실시형태에 있어서, 장애는 WNT 신호전달의 일탈적인, 예컨대, 증가된 활성과 연관된 세포 증식 장애이다. 다른 실시형태에 있어서, 장애는 증가된 양의 WNT 단백질에 기인한다. 또 다른 실시형태에 있어서, 세포 증식 장애는 암이며, 그 예로는 폐(소세포 및 비소세포)암, 유방암, 전립선암, 유암종, 방광암, 위암, 췌장암, 간(간세포)암, 간모세포종, 결장직장암, 두부암 및 경부 편평 세포암종, 식도암, 난소암, 자궁경부암, 자궁내막암, 중피종, 흑색종, 육종, 골육종, 지방육종, 갑상선암, 급성 골수성 백혈병(AML) 및 만성 골수성 백혈병(CML)을 포함하지만 이들로 제한되는 것은 아니다. 또 다른 실시형태에 있어서, 세포 증식 장애는 섬유증이고, 그 예로는 폐 섬유증, 예컨대, 특발성 폐 섬유증 및 방사선-유도 섬유증, 신장 섬유증 및 간 경화증을 포함하는 간 섬유증을 포함하지만 이들로 제한되는 것은 아니다. 또 다른 실시형태에 있어서, 장애는 골관절염, 파킨슨병, 망막증, 황반 변성이다.
치료적 용도를 위하여, 본 발명의 화합물은 단독으로 당업계에 공지된 임의의 허용가능한 방식을 통해서 치료적 유효량으로 투여될 수 있었다. 본 명세서에서 이용되는 바와 같이, 치료적 유효량은 질환의 중증도, 대상체의 연령과 상대적 건강, 이용되는 화합물의 역가 및 기타 인자에 따라서 광범위하게 변할 수 있다. 일반적으로, 만족스러운 결과는 0.03 내지 2.5 ㎎/㎏(대상체의 체중)의 1일 용량으로 전신으로 얻어지는 것을 나타낸다. 일 실시형태에 있어서, 인간보다 큰 포유류용의 표시된 1일 용량은 약 0.5㎎ 내지 약 100㎎의 범위 내이다. 바람직하게는, 화합물은 1일 4회까지의 분할된 용량으로 혹은 지연 형태(retard form)로 투여된다. 다른 실시형태에 있어서, 경구 투여를 위한 적절한 단위 투약 용량은 약 1 내지 100㎎ 활성 성분을 포함한다.
대안적으로, 본 발명의 화합물은 약제학적 조합물 등과 같은 1종 이상의 치료제와 조합하여 활성 성분으로서 치료적 유효량으로 투여될 수 있다. 본 발명의 화합물이 당업계에 공지된 화학요법제와 함께 이용될 경우 상승 효과가 있을 수 있다. 공동-투여된 화합물의 투약량은 이용되는 공동 약물, 이용되는 특정 약물, 치료 중인 병태 등의 유형에 따라서 다양할 수 있었다.
본 발명의 화합물 또는 이의 조성물은 임의의 통상의 경로에 의해 투여될 수 있다. 일 실시형태에 있어서, 정제 혹은 캡슐의 형태로 장을 통해, 예컨대, 경구로 투여된다. 다른 실시형태에 있어서, 주사가능한 용액 또는 현탁액의 형태로 비경구적으로 투여된다. 또 다른 실시형태에 있어서, 국소적으로, 그리고 로션, 겔, 연고 혹은 크림의 형태로, 또는 비강 또는 좌제 형태로 투여된다.
다른 양상에 있어서, 본 발명은 또한, a) 유리 형태 혹은 약제학적으로 허용 가능한 염 형태의 본 명세서에 개시된 바와 같은 본 발명의 화합물인 제1 제제 및 b) 적어도 1종의 공동-제제를 포함하는, 약제학적 조합물, 바람직하게는, 키트를 제공한다. 게다가, 키트는 그의 투여를 위한 설명서를 포함할 수 있다.
본 발명의 조합물은 시험관내 혹은 생체내에서 이용될 수 있다. 바람직하게는, 투여의 바람직한 치료적 유익은, 세포, 조직 혹은 유기체를, 본 발명의 화합물 및 1종 이상의 제제를 포함하는 단일 조성물 혹은 약리 제형과 접촉시킴으로써, 또는 세포를 2종 이상의 개별의 조성물 혹은 제형과 접촉시킴으로써 달성될 수 있으며, 여기서 하나의 조성물은 하나의 제제를 포함하고 다른 하나의 조성물은 다른 제제를 포함한다. 이 조합물의 제제들은 동시에 혹은 소정 시간 기간 내에 개별적으로 투여될 수 있다. 바람직하게는, 개별적인 투여는 바람직한 치료적 유익을 초래할 수 있다. 본 발명의 화합물은 다른 제제에 선행, 다른 제제와 동시에 및/또는 수 분 내지 수 주 범위의 간격만큼 다른 제제를 뒤따를 수 있다. 당업자라면, 일반적으로 각 전달 시간 간격을 확실하게 할 수 있었으며, 여기서 개별적으로 투여되는 제제들은 여전히 세포, 조직 또는 유기체에 유리하게 병용 효과를 발휘할 수 있었다. 일 실시형태에 있어서, 세포, 조직 혹은 유기체를 후보 약물로서 실질적으로 동시에 2, 3, 4 또는 그 이상의 양상과, 즉, 약 1분 미만에 접촉시킬 수 있는 것이 상정된다. 다른 실시형태에 있어서, 하나 이상의 제제는 약 1분 내지 14일 투여될 수 있다.
다른 양상에 있어서, 본 발명은 본 발명의 화합물 또는 이의 염 혹은 유도체를 제조하는 방법을 제공한다.
일 실시형태에 있어서, 화학식 (I)의 화합물은 이하의 실시예에 기재된 합성 방법들 중 하나에 따라서 제조될 수 있다. 기재된 반응에 있어서, 반응성 작용기, 예를 들어 하이드록시, 아미노, 이미노, 티오 또는 카복시기(여기서 이들은 최상 산물에서 바람직함)는, 반응에서 그들의 바람직하지 않은 관여를 피하기 위하여 보호될 수 있다. 통상의 보호기는 표준 관행에 따라서 이용될 수 있다(예컨대, 문헌[T.W. Greene and P. G. M. Wuts in "Protective Groups in Organic Chemistry", John Wiley and Sons, 1991] 참조). 기재된 합성 방법에서 이용하기 위한 적절한 이탈기는 할로겐 이탈기 및 당업계에 공지된 기타 통상의 이탈기를 포함한다. 바람직하게는, 이탈기는 클로로 또는 브로모이다.
다른 실시형태에 있어서, 본 발명의 화합물 또는 이의 염은 또한 수화물의 형태로 얻어질 수 있거나, 또는 그들의 결정이 예를 들어 결정화를 위하여 이용되는 용매(용매화물로서 존재)를 포함한다. 염은 통상 적절한 염기성 제제로, 바람직하게는, 알칼리 금속 탄산염, 알칼리 금속수소 탄산염 또는 알칼리 금속수산화물로, 더욱 바람직하게는 탄산칼륨 또는 수산화나트륨으로 처리함으로써 유리 형태로 화합물로 전환될 수 있다. 염기성 부가염의 형태의 본 발명의 화합물은 염산 등과 같은 적절한 산으로 처리함으로써 대응하는 유리 산으로 전환될 수 있다. 유리 형태의 신규한 화합물과 그들의 염(예를 들어 신규한 화합물의 정제 혹은 식별에 있어서 중간생성물로서 이용될 수 있는 염들을 포함함) 간의 밀접한 관계에 비추어, 유리 화합물이란 임의의 언급은 적절하게는 대응하는 염을 또한 지칭하는 것으로 이해되어야 한다.
염-형성기를 가진 본 화합물의 염은 당업계에 공지된 방법으로 제조될 수 있다. 이와 같이 해서 화학식 (I)의 화합물의 산 부가염은 산 혹은 적절한 음이온 교환 시약에 의한 처리에 의해 얻어질 수 있다. 본 발명의 화합물의 약제학적으로 허용 가능한 염은 유기 혹은 무기 산과 함께 염기성 질소 원자를 지니는 화학식 (I)의 화합물로부터 산 부가염으로서 형성될 수 있다.
바람직하게는, 적절한 무기 산은, 염산, 황산 또는 인산 등과 같은 할로겐 산을 포함하지만 이들로 제한되는 것은 아니다.
바람직하게는, 적절한 유기 산은 카복실산, 인산, 설폰산 또는 설팜산, 예를 들어, 아세트산, 프로피온산, 옥탄산, 데칸산, 도데칸산, 글라이콜산, 락트산, 푸마르산, 숙신산, 아디프산, 피멜산, 수베르산, 아젤라산, -말산, 타르타르산, 시트르산, 아미노산, 예컨대, 글루탐산 또는 아스파르트산, 말레산, 하이드록시말레산, 메틸말레산, 사이클로헥산카복실산, 아다만탄카복실산, 벤조산, 살리실산, 4 아미노살리실산, 프탈산, 페닐아세트산, 만델산, 신남산, 메탄- 또는 에탄-설폰산, 2-하이드록시에탄설폰산, 에탄-1,2-다이설폰산, 벤젠설폰산, 2-나프탈렌설폰산, 1,5-나프탈렌-다이설폰산, 2-, 3- 또는 4-메틸벤젠설폰산, 메틸황산, 에틸황산, 도데실황산, N-사이클로헥실설팜산, N-메틸-, N-에틸- 또는 N-프로필-설팜산, 또는 기타 유기 프로톤산, 예컨대, 아스코르브산을 포함하지만 이들로 제한되는 것은 아니다.
대안적으로, 또한 단리 혹은 정제를 위하여 약제학적으로 허용 불가능한 염, 예를 들어, 피크르산염 또는 과염소산염을 이용하는 것이 가능하다. 치료적 용도를 제외하고, 단지 약제학적으로 허용 가능한 염 또는 유리 화합물이 이용되며, 적합하다면, 약제학적 제제의 형태이다.
또 다른 실시형태에 있어서, 비산화된 형태의 본 발명의 화합물은 0 내지 80℃에서 적절한 불활성 유기 용매 중에서 환원제로 처리함으로써 본 발명의 화합물의 N-옥사이드로부터 제조될 수 있다. 바람직하게는, 환원제는 황, 이산화황, 트라이페닐 포스핀, 수소화붕소리튬, 수소화붕소나트륨, 삼염화인, 삼브로민화물 등이다. 바람직하게는, 비활성 유기 용매는 아세토나이트릴, 에탄올, 수성 다이옥산 등이다.
또 다른 실시형태에 있어서, 본 발명의 화합물의 전구약물 유도체는 당업계에 공지된 방법에 의해 제조될 수 있다(추가의 상세에 대해서는, 문헌[Saulnier et al., (1994), Bioorganic and Medicinal Chemistry Letters, Vol. 4, p. 1985] 참조). 바람직한 실시형태에 있어서, 적절한 전구약물은 본 발명의 비유도체화 화합물을 1,1-아실옥시알킬 카바노클로리데이트, 파라-나이트로페닐 카보네이트 등과 같은 적절한 카바밀화제와 반응시킴으로써 제조될 수 있다.
또 다른 실시형태에 있어서, 본 발명의 화합물의 보호된 유도체는 당업계에 공지된 수단에 의해 제조될 수 있다. 보호기의 작성 및 이의 제거에 적용가능한 수법의 상세한 설명은 문헌[T. W. Greene, "Protecting Groups in Organic Chemistry", 3rd edition, John Wiley and Sons, Inc., 1999]에서 발견될 수 있다.
또 다른 실시형태에 있어서, 본 발명의 화합물은 이의 개별적인 입체이성질체로서 제조될 수 있다. 그 방법은 화합물의 라세미 혼합물을 광학적으로 활성인 분할제와 반응시켜 1쌍의 부분입체이성질체 화합물을 형성하고, 이 부분입체이성질체들을 분리하여 광학적으로 순수한 거울상이성질체를 회수하는 것을 포함한다. 거울상이성질체들의 분할은 본 발명의 화합물의 공유적 입체이성질체 유도체를 이용해서 혹은 결정성 입체이성질체염 등과 같은 해리성 복합체를 이용함으로써 수행될 수 있다. 부분입체이성질체는 융점, 비점, 용해도, 반응성 등에 의해 제시된 별개의 물성을 지니며, 이들 차이점을 이용해서 용이하게 분리될 수 있다. 부분입체이성질체는 분별 결정화, 크로마토그래피에 의해 또는 용해도차에 기초한 분리/분할 수법에 의해 분리될 수 있다. 광학적으로 순수한 거울상이성질체는 이어서, 분리시약과 함께, 라세미화를 초래하지 않는 임의의 실질적인 수단에 의해 회수된다. 화합물의 입체이성질체의 그들의 라세미 혼합물로부터의 분리에 적용 가능한 수법의 더욱 상세한 설명은, 문헌[Jean Jacques, Andre Collet, Samuel H. Wilen, "Enantiomers, Racemates and Resolutions", John Wiley And Sons, Inc., 1981]에서 찾을 수 있다.
결론적으로, 본 발명의 화합물은 실시예들에 기재된 공정에 의해 제조될 수 있었고; 선택적으로 약제학적으로 허용 가능한 염은 본 발명의 화합물로부터 전환될 수 있으며; 선택적으로 약제학적으로 허용 가능한 N-옥사이드는 본 발명의 화합물의 산화되지 않은 형태로부터 전환될 수 있고; 선택적으로 본 발명의 화합물의 개별적인 이성질체는 이성질체들의 혼합물로부터 분해되며; 그리고 선택적으로 약제학적으로 허용 가능한 전구약물 유도체는 본 발명의 비유도된 화합물로부터 전환될 수 있다.
출발 물질의 생성이 특별히 기재되지 않는 한, 화합물은 공지이거나 또는 이하의 실시예에서 개시된 바와 같이 혹은 당업계에 공지된 방법과 유사하게 제조될 수 있다. 당업자라면 상기 변형은 본 발명의 화합물의 제조를 위한 단지 대표적인 방법일 뿐이며 기타 충분히 공지된 방법이 마찬가지로 이용될 수 있다는 것을 이해할 것이다.
IV.
환자 선택 및 암의 치료
다른 양상에 있어서, 본 발명은 R-스폰딘의 과발현 및/또는 R-스폰딘 융합을 지니는 것으로 진단되어 그러한 치료를 필요로 하는 대상체에서 R-스폰딘의 과발현 및/또는 R-스폰딘 융합의 발현을 특징으로 하는 암의 치료를 위한 조성물 및 방법을 제공한다.
R-스폰딘(RSPO)은 단일 트롬보스폰딘 제I형 반복(TSR) 도메인을 함유하는 4종의 시스테인-풍부 분비 단백질의 계열이다. Rspo 유전자 계열은 진화적으로 보존되어 있고, 반색동물문인 사코글로수스 코와레브스키(Saccoglossus kowalevskii)(의삭류), 척색동물인 유령멍게(Ciona intestinalis)(투니케이트(tunicate)) 및 극피동물을 포함하는 모든 신구 동물(deuterostome)의 게놈 및 전사물 데이터베이스에서 찾을 수 있다. 상이한 척추동물 종으로부터의 RSPO는 표준적인 WNT 신호전달 활성인자의 특성을 나타낸다. RSPO 단백질의 CR 도메인은 주로 WNT/β-카테닌 신호전달 경로의 활성화를 매개하는 역할을 한다. TSR 도메인 및 BR 도메인은, TSR 도메인 및 BR 도메인을 결여하는 RSPO 단백질이 표준적인 WNT 신호전달을 효과적으로 더 적게 활성화하기 때문에, 표준적인 WNT 신호전달에 대한 RSPO 활성의 강도를 조절하도록 제안되어 있다[Yoon, J. K.&Lee, J. S. Cellular signaling and biological functions of R-spondins. Cell. Signal. 24, 369-377 (2012)].
여기서 "R-스폰딘 융합"이란 Rspo 유전자들(Rspo2 유전자 및 Rspo3 유전자를 포함하지만 이들로 제한되는 것은 아님) 중 하나와 PTPRK, EIF3E, EMC2, PVT1 및 HNF4G 유전자를 포함하지만 이들로 제한되는 것은 아닌 다른 유전자("융합 파트너 유전자") 간의 융합을 의미한다. 융합은 결실 또는 역전에 기인할 수 있다. 5' 파트너 유전자에의 Rspo 유전자의 융합은 일반적으로 상이한 유전자(예컨대, 융합 파트너 유전자)의 촉진자의 제어 하에 Rspo 유전자(융합 유전자 산물의 일부로서의 부분 혹은 전장)의 발현을 초래하고 이는 mRNA 수준 및/또는 단백질 수준에서 Rspo 유전자(예컨대, 융합 유전자)의 발현 수준(예컨대, 상승된 발현)의 변화를 초래한다. Rspo 융합 유전자는 기능성 또는 비기능성 Rspo 단편으로 생성될 수 있다.
암 및 돌연변이체 R-스폰딘 폴리뉴클레오타이드 및 폴리펩타이드와 관련하여 "를 특징으로 하는"이란, 유전자 결실 및/또는 R-스폰딘을 포함하는 발현된 융합 폴리펩타이드가 존재하지 않는 암과 비교해서 이러한 유전자 결실 또는 전좌 및/또는 융합 폴리펩타이드가 존재하는 암을 의미한다. 돌연변이체 폴리펩타이드의 존재는 이러한 암의 성장과 생존을 전체적으로 혹은 부분적으로 촉진시킬 수 있다.
본 명세서에서 제공된 조성물은, 결장직장암, 위암, 간암, 식도암, 장암, 담관암, 췌장암, 자궁내막암 및 전립선암과 같은 Rspo 융합을 포함하는 각종 암을 치료하는데 이용된다.
WNT 경로의 활성화를 얻기 위하여 결장직장 종양 및 전립선 종양과 같은 소정의 종양을 위한 기전은, WNT 리간드의 인핸서를 암호화하는 2가지 유전자인 R 스폰딘-2 및 R 스폰딘-3이, 다른 유전자, 예컨대, PTPRK, EIF3E, EMC2, PVT1 및 HNF4G 유전자에 대한 융합에 의해 전사 활성화되는 것이다. 이에 대해서는 본 명세서에서 제공되는 실시예들 및 문헌[Seshagiri S, et al. Recurrent R-spondin fusions in colon cancer. Nature. 2012 Aug 30;488(7413):660-4 및 Robinson et al, Integrative Clinical Genomics of Advanced Prostate Cance, Cell 161, 1215-1228 May 21, 2015](이들은 그들의 전문이 참고로 편입됨)을 참고하면 된다. Rspo 융합 유전자는 기능성 또는 비기능성 Rspo 단백질 단편을 초래할 수 있다. 기능성 Rspo가 발생되는 경우, 이것은 Wnt 경로의 활성인자로서 작용할 수 있고, 이는 종양 세포의 증식을 유발할 수 있다.
본 발명은 본 명세서에서 제공되고/되거나 당업계에 공지된 방법을 이용해서 Rspo 융합을 가진 암 환자를 선별하고, 선택적으로 이러한 환자를 본 명세서에서 제공되는 Wnt 저해제로 치료하기 위한 방법 및 조성물을 제공한다.
Rspo 유전자는 게놈 DNA 수준, mRNA 수준 또는 단백질 수준에서 검출될 수 있다. 시험을 필요로 하는 대상체로부터의 생물학적 샘플은 당업계에 공지된 방법을 이용해서 얻어진다. 생물학적 샘플은 단백질, RNA 및/또는 DNA를 얻기 위하여 선택적으로 처리되고, 이들은 이어서 Rspo 융합을 검출하기 위한 검정에서 이용된다.
A. 생물학적 샘플
여기서 "생물학적 샘플"이란, Rspo 융합 폴리뉴클레오타이드 또는 이의 폴리펩타이드 혹은 단편(Rspo-PTPRK 및 Rspo-EIF3E 융합 폴리뉴클레오타이드 및 폴리펩타이드를 포함함)을 함유하는 것으로 의심되는 임의의 생물학적 샘플을 의미하며, 세포, 세포로부터의 염색체(예컨대, 메타상 염색체의 확산물), 게놈 DNA(예를 들어 서던 분석(Southern analysis)을 위하여 용액 중 또는 고체 지지체에 결합됨), RNA(예를 들어 노던 분석(Northern analysis)을 위하여 용액 중, 또는 고체 지지체에 결합됨), cDNA(용액 중, 또는 고체 지지체에 결합됨), 세포, 혈액, 소변, 골수 또는 조직 등으로부터의 추출물을 포함할 수 있다.
본 발명의 방법의 실시에서 유용한 생물학적 샘플은 Rspo3-PTPRK 또는 Rspo2-EIF3E 융합 폴리펩타이드의 발현을 특징으로 하는 암이 존재하거나 발달 중인 임의의 포유류로부터 얻어질 수 있다. 일 실시형태에 있어서, 포유류는 인간이고, 인간은 암, 예컨대 결장암, 위암 및 식도암의 치료를 위한 Wnt-저해 치료를 위한 후보자일 수 있다. 인간 후보자는 본 명세서에서 제공된 것들과 같은 Wnt 저해제에 의한 치료를 위하여 상정되거나 이것으로 현재 치료 중인 환자일 수 있다. 다른 실시형태에 있어서, 포유류는 예컨대 말 또는 소 등과 같은 커다란 동물인 반면, 다른 실시형태에서는, 포유류는 예컨대 개 혹은 고양이 등과 같은 작은 동물이며, 이들은 모두 결장암, 위암 및 식도 암종을 비롯한 암을 발달시키는 것으로 알려져 있다.
포유류 암으로부터의 세포(또는 세포의 추출물)를 포함하는 임의의 생물학적 샘플은 본 발명의 방법에서 이용하기에 적합하다. 순환 종양 세포는 또한 종양 마커, 사이토케라틴 단백질 마커 또는 (문헌[Ma et al., Anticancer Res. 23(1 A): 49-62 (2003)] 참조)에 기재된 바와 같은 음성적 선택의 기타 방법을 이용해서 혈청으로부터 얻어질 수 있다. 혈청 및 골수 샘플은 백혈병 환자에 대해서 특히 바람직할 수 있다. 고체 종양, 예컨대, 육종 및 암종을 포함하는 암에 대해서, 생물학적 샘플은 종양 생검으로부터 얻어진 세포를 포함할 수 있고, 이것은 표준 임상 수법에 따라서 얻어질 수 있다.
순환 종양 세포("CTC")는, 예를 들어, 비타렉스사(Vitatex, LLC)(존슨 앤드 존슨 코포레이션)로부터 상업적으로 입수 가능한 상표명 비타-아세이즈(Vita- Assays)(상표명), 비타-캡(Vita-Cap)(상표명) 및 셀서치(CellSearch)(등록상표) 하에 판매되는 키트 및 시약을 이용해서 정제될 수 있다. CTC를 단리시키기 위한 기타 방법이 기재되어 있다(예를 들어, PCT 공개 제WO/2002/020825호, 문헌들[Cristofanilli et al., New Engl. J. of Med. 351 (8):781-791 (2004), 및 Adams et al., J. Amer. Chem. Soc. 130(27): 8633-8641 (July 2008)] 참조). 특정 실시형태에 있어서, 순환 종양 세포("CTC")는 폐, 또는 결장, 위, 식도로부터 유래되는 것으로 단리되고 확인될 수 있다.
B.
Rspo
융합
폴리펩타이드의
검출
몇몇 실시형태에 있어서, Rspo 융합은 면역검정에 의해 검출된다. Rspo 융합 단백질 또는 펩타이드는 Rspo 융합 단백질에 대해 특이적인 항체들(단클론성 또는 다클론성)을 생산하도록 발생된다. 이러한 항체들은 이어서 Rspo 융합의 존재를 검출하기 위하여 검정에서 이용된다.
Rspo 융합은 일반적으로 Rspo 융합-특이적 시약을 이용해서 검출된다. 여기에서 "Rspo 융합 폴리펩타이드-특이적 시약"은 생물학적 샘플에서의 발현된 Rspo 융합 폴리펩타이드에 결합, 이의 존재/수준을 검출 및/또는 정량화할 수 있는 생물학적 혹은 화학적인 임의의 시약을 의미한다. 이 용어는 이하에 논의된 바람직한 항체 및 시약을 포함하지만 이들로 제한되는 것은 아니며, 그 등가 시약은 본 발명의 범위 내이다.
본 발명의 방법의 실시에서 이용하기에 적합한 시약은 PTPRK-Rspo3 융합 폴리펩타이드-특이적 항체 및/또는 EIF3E-Rspo2 융합 폴리펩타이드-특이적 항체 또는 본 명세서에서 제공되는 바와 같은 기타 Rspo2 또는 Rspo3 융합 단백질을 포함한다. 본 발명의 융합-특이적 항체는 본 발명의 PTPRK-Rspo3 융합 폴리펩타이드(예컨대, 본 명세서에서 제공되는 PTPRK-Rspo3 융합 서열에 대응하는 펩타이드 또는 본 명세서에서 제공되는 바와 같은 기타 Rspo2 또는 Rspo3 융합 단백질)에 구체적으로 결합하지만 야생형 Rspo 또는 야생형 PTPRK에 실질적으로 결합하지 않거나, 또는 본 명세서에 기재된 EIF3E-Rspo2 융합 폴리펩타이드(예컨대, 본 명세서에서 제공되는 Rspo2-EIF3E 융합 서열에 대응하는 펩타이드)에 결합하지만 야생형 Rspo 또는 야생형 EIF3E에 실질적으로 결합하지 않는 단리된 항체 혹은 항체들이다.
인간 PTPRK Rspo3 또는 EIF3E-Rspo2 융합 폴리펩타이드(본 명세서에서 제공되는 바와 같은 기타 Rspo2 또는 Rspo3 융합 단백질)-특이적 항체들은 또한 기타 포유류 종, 예를 들어 쥣과 또는 토끼 내의 고도로 상동성이고 등가의 에피토프 펩타이드 서열에 결합될 수 있고, 그 역일 수도 있다. 본 발명의 방법을 실시함에 있어서 유용한 항체들은 (a) 단클론성 항체들, (b) 표적 폴리펩타이드(예컨대, Rspo3-PTPRK 융합 폴리펩타이드 또는 Rspo2-EIF3E 융합 폴리펩타이드 또는 본 명세서에서 제공되는 바와 같은 기타 Rspo2 또는 Rspo3 융합 단백질의 융합 접합)에 구체적으로 결합하는 정제된 다클론성 항체들, (c) 기타 비인간종(예컨대, 마우스, 래트)에서의 등가의 고도의 상동성 에피토프 또는 인산화 부위에 결합하는 상기 (a) 내지 (b)에 기재된 바와 같은 항체들, 및 (d) 본 명세서에 개시된 예시적인 항체들에 의해 결합되는 항원(또는 더욱 바람직하게는 에피토프)에 결합하는 상기 (a) 내지 (c)의 단편을 포함한다.
본 명세서에서의 "항체" 또는 "항체들"은 IgG, IgM, IgA, IgD 및 IgE를 포함하는 모든 유형의 면역글로불린을 의미한다. 항체들은 단클론성 또는 다클론성일 수 있고, (예를 들어) 마우스, 래트, 토끼, 말 또는 인간을 비롯한 임의의 종의 기원일 수 있거나, 또는 키메라 항체들일 수 있다. 이에 대해서는, 예컨대, 문헌[M. Walker et al., Molec. Immunol. 26: 403-11 (1989); Morrision et al., Proc. Nat'l. Acad. Sci. 81: 6851 (1984); Neuberger et al., Nature 312: 604 (1984)]을 참조하면 된다. 항체들은 미국 특허 제4,474,893호(Reading) 또는 미국 특허 제4,816,567호(Cabilly et al.)에 개시된 방법에 따라 생산된 재조합 단클론성 항체들일 수 있다. 항체들은 또한 미국 특허 제4,676,980호(Segel et al.)에 개시된 방법에 따라서 만들어진 화학적으로 작제된 특이적 항체들일 수 있다.
본 발명은 항체들의 이용으로 제한되지는 않고, 본 발명의 방법에서 유용한 Rspo3-PTPRK 또는 Rspo2-EIF3E 융합 폴리펩타이드-특이적 항체가 결합하는 본질적으로 동일한 에피토프에, 융합-단백질 또는 절두된-단백질 특이적 방법으로, 결합하는 단백질 결합 도메인 또는 핵산 앱타머(aptamer) 등과 같은 등가 분자를 포함한다. 이에 대해서는, 예컨대, 문헌[Neuberger et al., Nature 312: 604 (1984)]을 참조하면 된다. 이러한 등가의 비-항체 시약은 이하에 추가로 기재되는 본 발명의 방법에서 적절하게 이용될 수 있다.
본 발명의 방법을 실시함에 있어서 유용한 다클론성 항체들은, 바람직한 융합-단백질 특이적 에피토프(예컨대 본 명세서에 기재된 Rspo 융합 단백질의 융합 접합)를 포함하는 항원으로 적절한 동물(예컨대, 토끼, 염소 등)을 면역화시키고, 이 동물로부터 면역 혈청을 수집하고, 그 면역 혈청으로부터 다클론성 항체들을 분리하고, 목적으로 하는 특이성을 지니는 다클론성 항체들을 공지된 절차에 따라서 정제시킴으로써 표준 수법에 따라서 생산될 수 있다. 항원은, 충분히 공지된 수법에 따라서 선택되고 구축된 목적으로 하는 에피토프 서열을 포함하는 합성 펩타이드 항원일 수 있다. 이에 대해서는, 예컨대, 문헌[ANTIBODIES: A LABORATORY MANUAL, Chapter 5, p. 75-76, Harlow & Lane Eds., Cold Spring Harbor Laboratory (1988); Czernik, Methods In Enzymology, 201: 264-283 (1991); Merrifield, J. Am. Chem. Soc. 85: 21-49 (1962)]을 참조하면 된다). 본 명세서에 기재된 바와 같이 생성된 다클론성 항체들은 이하에 추가로 기재된 바와 같이 선별되고 단리될 수 있다.
단클론성 항체들은 또한 본 발명의 방법에서 유리하게 이용될 수 있고, 그리고 문헌들[Kohler and Milstein. Nature 265: 495-97 (1975); Kohler and Milstein, Eur. J. Immunol. 6: 511 (1976); 또한 CURRENT PROTOCOLS IN MOLECULAR BIOLOGY, Ausubel et al. Eds. (1989) 참조]의 잘 알려진 수법에 따라서 하이브리도마 세포주에서 생산될 수 있다. 그와 같이 생산된 단클론성 항체들은 고도로 특이적이고, 본 발명에 의해 제공된 검정 방법의 선택성 및 특이성을 개선시킨다. 예를 들어, 적절한 항원(예컨대, Rspo3-PTPRK 또는 Rspo2-EIF3E 융합 폴리펩타이드의 융합 접합을 포함하는 합성 펩타이드)을 함유하는 용액을 마우스에게 주입할 수 있고, 충분한 시간(통상의 수법으로 유지) 후에 마우스를 희생시키고 비장 세포를 얻는다. 비장 세포는 이어서 전형적으로 폴리에틸렌 글라이콜의 존재 중에서 이를 골수종 세포에 융해시킴으로써 불멸화시켜, 하이브리도마 세포를 생산한다. 토끼 융합 하이브리도마는, 예를 들어, 미국 특허 제5,675,063호(K. Knight, 공고일: 1997년 10월 7일)에 기재된 바와 같이 생산될 수 있다. 하이브리도마 세포는 이어서 하이포잔틴-아미노프테린-티미딘(HAT) 등과 같은 적절한 선택 배지에서 성장되고, 그 상청액은 이하에 기재된 바와 같이 소망의 특이성을 지니는 단클론성 항체들을 위하여 선별된다. 분비된 항체는 석출, 이온교환 또는 친화도 크로마토그래피 등과 같은 통상의 방법에 의해 조직 배양 상청액으로부터 회수될 수 있다.
단클론성 Fab 단편은 또한 당업자에게 공지된 재조합 수법에 의해 에스케리키아 콜라이(Escherichia coli)에서 생산될 수 있다. 이에 대해서는, 예컨대, 문헌[W. Huse, Science 246: 1275-81 (1989); Mullinax et al., Proc. Nat'lAcad. Sci. 87: 8095 (1990)]을 참조하면 된다. 하나의 아이소형의 단클론성 항체들이 특정 용도를 위하여 바람직하다면, 특정 아이소형은, 교차전환 변이체를 단리시키기 위하여 친계 선발 수법을 이용해서 상이한 아이소형의 단클론성 항체를 분비하는 모계 하이브리도마로부터 부차적으로 제조되거나 초기 융합으로부터 선택함으로써 직접 제조될 수 있다(Steplewski, et al., Proc . Nat'l . Acad . Sci ., 82: 8653 (1985); Spira et al., J. Immunol . Methods, 74: 307 (1984)). 단클론성 항체의 항원 조합 부위는 파지-표시 재조합 항체들로서 생산된 PCR 및 단쇄 항체 또는 가용성 항체들 이 콜라이(E. coli)에 의해 클로닝될 수 있다(예컨대, 문헌[ANTIBODY ENGINEERING PROTOCOLS, 1995, Humana Press, Sudhir Paul editor] 참조).
또한, 미국 특허 제5,194,392호(Geysen (1990))는 관심 대상 항체의 특정 파라토프(항원 결합 부위)에 상보적인 에피토프(즉, "미모톱(mimotope)")의 위상적 등가물인 단량체(아미노산 또는 기타 화합물)의 서열을 검출 혹은 결정하는 일반적인 방법을 기술한다. 더욱 일반적으로, 이 방법은 관심 대상 특정 수용체의 리간드 결합 부위에 상보적인 리간드의 위상적 등가물인 단량체의 서열을 검출 또는 결정하는 것을 포함한다. 마찬가지로, 미국 특허 제5,480,971호(Houghten et al. (1996))는 선형 C1-C-알킬 퍼알킬화 올리고펩타이드 그리고 이러한 펩타이드의 세트 및 라이브러리뿐만 아니라, 관심 대상 수용체 분자에 우선적으로 결합하는 퍼알킬화 올리고펩타이드의 서열을 결정하기 위한 이러한 올리고펩타이드 세트 및 라이브러리를 이용하기 위한 방법을 개시한다. 이와 같이 해서, 본 발명의 에피토프-보유 펩타이드의 비펩타이드 유사체는 또한 이들 방법에 의해 관례대로 제조될 수 있다.
본 발명의 방법에 유용한 항체들은, 다클론성이든 단클론성이든지 간에, 표준 수법에 따라서 에피토프 및 융합 단백질 특이성에 대해서 선별될 수 있다. 이에 대해서는, 예컨대, 문헌[Czernik et al., Methods in Enzymology, 201: 264-283 (1991)]을 참조하면 된다. 예를 들어, 항체들은 바람직한 항원을 위하여 그리고 필요한 경우 예컨대 야생형 Rspo3 또는 야생형 PTPRK가 아니라 본 발명의 Rspo3-PTPRK 융합 폴리펩타이드와의 반응성을 위하여 특이성을 확보하도록 ELISA에 의한 펩타이드 라이브러리에 대해서 선별될 수 있다. 항체들은 또한 단지 목적으로 하는 표적과의 반응성을 확인하고 그리고 Rspo를 포함하는 다른 융합 단백질에 대한 적용 가능한 결합을 확보하기 위하여 표적 단백질을 함유하는 세포 제제에 대한 웨스턴 블로팅에 의해 시험될 수 있다. 융합 단백질-특이적 항체들의 생산, 선별 및 용도는 당업자에게 공지되어 있고, 기술되어 있다. 이에 대해서는, 예컨대, 미국 특허 공개 제20050214301호(공개일: 2005년 9월 29일, Wetzel et al.)를 참조하면 된다.
본 발명의 방법에 유용한 융합 폴리펩타이드-특이적 항체들은 융합 접합부를 형성하는 야생형 Rspo, 야생형 PTPRK 및 야생형 EIF3E 내의 에피토프와 또는 다른 융합 단백질 내의 유사한 융합 에피토프와 일부 제한된 교차반응성을 나타낼 수 있다. 이것은, 대부분의 항체가 어느 정도의 교차반응성을 나타내고, 항-펩타이드 항체들이 흔히 면역화 펩타이드와 높은 상동성 혹은 동일성을 지니는 에피토프와 교차반응할 것이라고 예상되지 않는다. 예컨대, 이에 대해서는 문헌[Czernik, 상기 참조]을 참조하면 된다. 다른 융합 단백질과의 교차반응성은 공지의 분자량의 마커와 함께 웨스턴 블로팅에 의해 용이하게 특성규명된다. 교차반응 단백질의 아미노산 서열은 항체가 결합하는 Rspo3-PTPRK 또는 Rspo2-EIF3E 융합 폴리펩타이드 서열과 고도로 상동성이거나 동일성인 부위들을 확인하기 위하여 검사될 수 있다. 바람직하지 않은 교차반응성은 펩타이드 칼럼 상의 항체 정제를 이용하는(예컨대 야생형 Rspo, 야생형 PTPRK, 및/또는 야생형 EIF3E와 결합하는 항체들을 선별해내는) 음성적 선택에 의해 제거될 수 있다.
본 명세서에 개시된 방법을 실시함에 있어서 유용한 본 발명의 Rspo3-PTPRK 또는 Rspo2-EIF3E 융합 폴리펩타이드 특이적 항체들은 이상적으로는 인간 융합 폴리펩타이드에 특이적이지만, 인간 종 그 자체에 결합하는 것만으로 제한되지 않는다. 본 발명은 기타 포유류 종(예컨대, 마우스, 래트, 원숭이)에서 보존적 및 고도로 상동성 혹은 동일성 에피토프들과 또한 결합하는 항체들의 생산 및 이용을 포함한다. 기타 종에서의 고도로 상동성 혹은 동일성 서열은 인간 Rspo3-PTPRK 또는 Rspo2-EIF3E 융합 폴리펩타이드와, BLAST를 이용하는 등과 같은 표준 서열 비교에 의해 용이하게 확인될 수 있다.
본 발명의 방법에서 이용되는 항체들은 특정 검정 방식, 예를 들어, 유세포분석(FC), 면역조직화학(IHC) 및/또는 면역세포화학(ICC)에서의 이용을 더욱 특징으로 할 수 있고 그러한 이용을 위하여 검증될 수 있다. 항체들은 또한 다른 신호 전달(포스포-AKT, 포스포-Erk 1/2) 및/또는 세포 마커(사이토케라틴) 항체들과 함께 다중 변수 분석에서 이용하기 위하여, 양자점(quantum dot) 등과 같은 라벨 또는 형광 염료(예컨대 Alexa488, PE)에 유리하게 컨쥬게이트될 수 있다.
C.
Rspo
융합
폴리뉴클레오타이드의
검출
본 발명에 의해 제공된 융합-특이적 시약은, 또한 Rspo3-PTPRK 또는 Rspo2-EIF3E 융합 폴리뉴클레오타이드, 또는 본 명세서에서 제공되는 바와 같은 기타 Rspo2 또는 Rspo3 융합 폴리뉴클레오타이드의 검출에 적합한 핵산 프로브 및 프라이머를 포함한다. 이러한 프로브는, 바람직하게는, 무엇보다도, 융합을 일으키는 야생형 Rspo 및/또는 야생형 PTPRK 유전자, 또는 야생형 Rspo 및/또는 야생형 EIF3E 유전자의 중단점(breakpoint)의 양 측에 대응하는 중단점 프로브를 포함한다. 형광 동소 교잡법(fluorescence in-situ hybridization: FISH) 또는 중합효소 연쇄 반응(polymerase chain reaction: PCR) 증폭 등과 같은 검정에서의 이러한 프로브의 구체적인 사용이 본 명세서에 기술되어 있다.
몇몇 실시형태에 있어서, Rspo 융합은 주기적 PCR, 실시간 PCR(Q-PCR) 또는 디지털 PCR 등과 같은 PCR에 의해 검출된다. 1쌍의 프라이머는 융합 유전자를 증폭시키는데 이용된다. 프라이머는 증폭될 융합 유전자 서열에 기초하여 설계된다. 바람직하게는, 하나의 프라이머는 Rspo 유전자의 제1 서열에 교잡하고, 제2 프라이머는 융합 파트너 유전자의 제2 서열에 교잡한다. PCR은, 당업계에 공지된 바와 같이 최적화될 수 있는 조건 하에서, cDNA(생물학적 샘플을 이용하는 RNA로부터 제조된 바와 같은 것) 또는 게놈 DNA 상에서 수행될 수 있다.
몇몇 실시형태에 있어서, FISH가 이용되고([Verma et al. HUMAN CHROMOSOMES: A MANUAL OF BASIC TECHNIQUES, Pergamon Press, New York, N.Y. (1988)]에 기재된 바와 같음), 기타 물리적 염색체 맵핑 수법 및 유전자 맵 데이터와 상관이 있을 수 있다. 유전자 맵 데이터의 예는 문헌[1994 Genome Issue of Science (265: 1981f)]에서 찾을 수 있다. 물리적 염색체 상의 Rspo3-PTPRK 또는 Rspo2-EIF3E 융합 폴리펩타이드를 암호화하는 유전자의 위치와 특정 질환, 또는 특정 질환에 대한 소인 간의 상관은 그 유전자 질환과 연관된 DNA의 영역의 범위를 정하는 것을 도울 수 있다. 본 발명의 뉴클레오타이드 서열은 정상의 보균자 혹은 병든 개체들 간의 유전자 서열의 차이를 검출하는데 이용될 수 있다.
몇몇 실시형태에 있어서, 제1 프로브는 Rspo 전자 서열과 교잡되어 제1 색(예컨대, 적색)으로 표지되고, 제2 프로브는 융합 파트너 유전자 서열에 교잡되어 제2 색(예컨대, 녹색)으로 표지된다. Rspo 융합의 경우에, 두 프로브는 융합 유전자에 교잡되어 서로 이웃하게 된다. 그 결과, 두 프로브의 화상이 합성될 것이고, 그 결과 다른 색(예컨대, 황색)이 얻어지게 된다.
본 발명의 Rspo3-PTPRK 또는 Rspo2-EIF3E 융합 폴리뉴클레오타이드를 검출하는 방법들(예컨대, PCR 및 FISH) 모두가 돌연변이체 Rspo 폴리뉴클레오타이드 또는 돌연변이체 Rspo 폴리펩타이드를 검출하는 다른 방법과 조합될 수 있다는 것이 이해되어야 한다. 예를 들어, 생물학적 샘플(예컨대, 순환 종양 세포)의 유전자 재료 내 Rspo3-PTPRK 또는 Rspo2-EIF3E 융합 폴리뉴클레오타이드의 검출은 Rspo3-PTPRK 또는 Rspo2-EIF3E 융합 폴리뉴클레오타이드가 생물학적 샘플 내 Rspo3-PTPRK 또는 Rspo2-EIF3E 융합 폴리펩타이드로서 실질적으로 발현되는지의 여부를 결정하기 위하여 샘플의 단백질의 웨스턴 블로팅 분석 또는 면역조직화학(IHC) 분석에 이어 수반될 수 있다. 이러한 웨스턴 블로팅 혹은 IHC 분석은 구체적으로 검출된 Rspo3-PTPRK 또는 Rspo2-EIF3E 융합 폴리뉴클레오타이드에 의해 암호화된 폴리펩타이드에 결합되는 항체를 이용해서 수행될 수 있거나 또는 분석은 전장 Rspo(예컨대, 단백질의 N-말단에 결합)에 또는 전장 PTPRK(예컨대, PTPRK의 키나제 도메인 내의 에피토프에 결합)에 결합하는 항체들을 이용해서 수행될 수 있다. 이러한 검정은 당업계에 공지되어 있다(예컨대, 미국 특허 제7,468,252호 참조).
다른 예에서, Dako의 CISH 기술은 동일한 조직 단면 상의 면역 조직화학과 함께 발색성 동소 교잡(chromatogenic in-situ hybridization)을 허용한다.
몇몇 실시형태에 있어서, Rspo 융합은 Rspo 유전자와 융합 파트너 유전자 둘 다로부터의 서열을 포함하는 프로브를 이용하는 서던 블롯 검정에서의 교잡에 의해 검출된다.
몇몇 실시형태에 있어서, Rspo 융합은, 마이크로어레이, 분지된 DNA(콴티젠(QuantiGene)(등록상표)), 뷰RNA(ViewRNA)(등록상표) 또는 RNA스코프(RNAscope)(등록상표) 등과 같은 기타 교잡 기반 방법에 의해 검출된다.
몇몇 실시형태에 있어서, Rspo 융합은 관례적인 융합 유전자 마이크로어레이가 암 시편으로부터 Rspo 융합 전사물을 검출하는데 이용되는 마이크로어레이를 이용하는 교잡에 의해 검출된다. 올리고는 개별적인 융합 파트너의 엑손-방식 측정과 키메라 전사 접합의 조합된 측정을 가능하게 하도록 설계된다. 이에 대해서는, 문헌[Skotheim, RI; Thomassen, GO; Eken, M; Lind, GE; Micci, F; Ribeiro, FR; Cerveira, N; Teixeira, MR et al. A universal assay for detection of oncogenic fusion transcripts by oligo microarray analysis. Molecular Cancer 8: 5. (2009)]을 참조하면 된다.
몇몇 실시형태에 있어서, Rspo 융합은 분지된 DNA 검정을 이용한 교잡에 의해 검출된다. 이들 실시형태에 있어서, 관례적 교잡 및 신호 증폭 검정, 예컨대, 분지된 DNA 검정(콴티젠(QuantiGene)(등록상표))은 암 시편으로부터의 용균 용액 중 Rspo 융합 전사물을 검출하는데 이용된다. 캡처 익스텐더 프로브 및 라벨 익스텐더 프로브의 서열은 실시예 9에 예시된 것들과 같은 Rspo 유전자 및 융합 파트너 유전자(예컨대, Rspo3용의 PTPRK, Rspo2용의 EIF3E)의 엑손 서열로부터 유래된다. 이에 대해서는 문헌[Lu B., et al. Detection of TMPRSS2-ERG fusion gene expression in prostate cancer specimens by a novel assay using branched DNA. Urology 74(5): 1156-61 (2009)]을 참조하면 된다.
몇몇 실시형태에 있어서, Rspo 융합은 동소 교잡에 의해 검출된다. 관례적 동소 교잡 및 신호 증폭 검정, 예컨대, RNA뷰(RNAview)(등록상표) 또는 RNA스코프(RNAscope)(등록상표)가 암 시편으로부터 포르말린 고정 파라핀 포매(formalin fixed paraffin embedded: FFPE) 또는 동결 조직 상의 Rspo 융합 전사물을 검출하는데 이용된다. 캡처 익스텐더 프로브 및 라벨 익스텐더 프로브의 서열은 실시예 9에 예시된 것들과 같은 Rspo 유전자 및 융합 파트너 유전자(예컨대, Rspo3용의 PTPRK, Rspo2용의 EIF3E)의 엑손 서열로부터 유래된다. 이에 대해서는 문헌[Wang F, Flanagan J, Su N, Wang LC, Bui S, Nielson A, Wu X, Vo HT, Ma XJ, Luo Y. RNAscope: a novel in situ RNA analysis platform for formalin-fixed, paraffin-embedded tissues. J Mol Diagn. 14(1):22-9 (2012)]을 참조하면 된다.
몇몇 실시형태에 있어서, Rspo 융합은, 예컨대, 상거(Sanger) 서열분석 또는 차세대 서열분석 등과 같은 서열분석에 의해 검출된다.
서열분석 프라이머를 연장시키는 것에 의한 혹은 연장 산물을 연장시키는 것에 의한 서열분석은 각종 방법을 이용해서 수행될 수 있다. 예를 들어, 서열분석은 표지된 가역적 종결자를 이용해서 혹은 표지된 올리고뉴클레오타이드에 의한 결찰에 의해 수행될 수 있다. 서열분석은, 일루미나사(Illumina, Inc.)(캘리포니아주의 샌디에이고시) 및 라이프 테크놀로지즈사(Life Technologies)(이온 토렌트(Ion Torrent))로부터 상업적으로 입수 가능한 가역적 종결자 기반 서열분석방법 등과 같은 임의의 상업적으로 입수 가능한 방법을 이용해서 수행될 수 있다.
몇몇 실시형태에 있어서, 고처리량 서열분석은 로슈사(Roche)/454 라이프사이언시스사(454 Lifesciences, Inc.)(코네티컷주의 브렌포드시)로부터 입수 가능한 수법의 이용을 포함한다. 비드 증폭에 이어 섬유 광학 검출을 이용하는 방법은 문헌[Marguiles, M., et al. "Genome sequencing in microfabricated high-density picolitre reactors", Nature, doi: 10.1038/nature03959]뿐만 아니라; 미국 특허 출원 공개 제20020012930호, 제20030058629호, 제20030100102호, 제20030148344호, 제20040248161호, 제20050079510호, 제20050124022호 및 제20060078909호에도 기술되어 있다.
몇몇 실시형태에 있어서, 고처리량 서열분석은 클론 단일 분자 어레이(Clonal Single Molecule Array(솔렉사사(Solexa, Inc)/일루미나사(Illumina, Inc.)) 또는 가역적 종결자 화학(reversible terminator chemistry)을 이용한 합성에 의한 서열분석(sequencing-by-synthesis: SBS)을 이용해서 수행된다. 이들 수법은, 예컨대, 미국 특허 제6,969,488호; 제6,897,023호; 제6,833,246호; 제6,787,308호; 및 미국 특허 출원 공개 제20040106130호, 제20030064398호, 제20030022207호 및 문헌[Constans, A., The Scientist 2003, 17(13):36]에 일부 기재되어 있다.
몇몇 실시형태에 있어서, 본 명세서에서 제공되는 방법은 (1) PTPRKe1-Rspo3e2 융합; (2) PTPRKe7-Rspo3e2 융합; (3) EIF3Ee1-Rspo2e2 융합; 또는 (4) EIF3Ee1-Rspo2e3 융합인 R-스폰딘 융합을 검출한다.
몇몇 실시형태에 있어서, 본 명세서에서 제공된 상기 방법은 (1) EMC2e1-Rspo2e2 융합; (2) PVT1-Rspo2e2 융합; (3) PVT1-Rspo2e3 융합; (4) HNF4G-Rspo2e2 융합; 또는 (5) PTPRKe13-Rspo3e2 융합인 R-스폰딘 융합을 검출한다.
R-스폰딘 융합은 일반적으로 PTPRK, EIF3E, EMC2, PVT1, 또는 HNF4G 유전자와 같은 융합 파트너의 촉진자에 의해 구동되는 R-스폰딘 유전자의 발현을 초래한다.
각종 R스폰딘 유전자 융합의 접합은 표 8(도 5a) 및 표 9(도 5b)에서 제공된다. 또한 각종 유전자 융합의 접합의 서열이 제공된다. 생물학적 샘플로부터의 서열분석에 의해 결정되는 바와 같은 접합부를 포함하는 임의의 서열은 표 8(도 5a) 및 표 9(도 5b)에 나타낸 서열의 일부 또는 전부를 포함할 수 있다는 것은 당업자에게 명백할 것임에 틀림없다.
D. R-
스폰딘
과발현의 검출
다른 양상에 있어서, 본 발명은 R-스폰딘 과발현의 검출을 위한 조성물 및 방법을 제공한다. R-스폰딘의 과발현은 Wnt의 과발현 또는 활성화와 공존할 수 있거나 공존하지 않을 수 있다.
R-스폰딘 과발현은 R-스폰딘 mRNA 또는 폴리펩타이드 중 어느 한쪽, 또는 둘 다의 과발현일 수 있다. R-스폰딘은, 야생형이거나 R-스폰딘의 변이체, 예컨대, 본 명세서에 개시된 R-스폰딘 융합(예컨대, Rspo3-PTPRK 또는 Rspo2-EIF3E 융합)일 수 있다.
R-스폰딘 과발현은, 기준선 발현 수준과 관련하여 결정되며, 이는 정상 세포 혹은 정상 대상체 모집단(예컨대, 정상 인간 모집단)에서의 R-스폰딘(mRNA 또는 폴리펩타이드)의 발현 수준을 측정함으로써 결정된다.
R-스폰딘 mRNA 수준의 발현 수준은 노던 블롯, RT-PCR, 실시간 PCR과 조합된 RT-PCT, 디지털 PCR, DNA 어레이, 고처리량 서열분석 또는 동소 교잡, 나노스트링 엔카운터 등과 같은 당업계에 공지된 방법을 이용해서 측정된다.
mRNA 수준 또는 단백질 수준에서, R-스폰딘의 발현 수준은 웨스턴 블롯, 단백질 어레이, 면역조직학 염색 등과 같은 당업계에 공지된 방법을 이용해서 측정된다.
상기 방법들 중 어느 하나의 몇몇 실시형태에 있어서, 상승된 발현은 참조 샘플, 참조 세포, 참조 조직, 대조 샘플, 대조 세포 또는 대조 조직과 비교해서, 본 명세서에 기재된 것과 같은 당해 분야의 공지된 표준 방법에 의해서 검출된, 바이오마커(예컨대, 단백질 또는 핵산(예컨대, 유전자 또는 mRNA))의 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% 또는 그 이상 중 대략 어느 하나의 전체적인 증가를 지칭한다. 소정의 실시형태에 있어서, 상승된 발현은 샘플 내 바이오마커의 발현 수준/양의 증가를 지칭하되, 여기서 증가는 참조 샘플, 참조 세포, 참조 조직, 대조 샘플, 대조 세포 또는 대조 조직에서의 각각의 바이오마커의 발현 수준/양의 1.5X, 1.75X, 2X, 3X, 4X, 5X, 6X, 7X, 8X, 9X, 10X, 25X, 50X, 75X, 또는 100X 중 적어도 대략 어느 하나이다. 몇몇 실시형태에 있어서, 상승된 발현은 참조 샘플, 참조 세포, 참조 조직, 대조 샘플, 대조 세포, 대조 조직 또는 내부 대조군(예컨대, 하우스키핑 유전자)와 비교해서 약 1.5배, 약 1.75배, 약 2배, 약 2.25배, 약 2.5배, 약 2.75배, 약 3.0배, 또는 약 3.25배 초과의 전반적인 증가를 지칭한다.
E.
나노스트링
엔카운터를
이용한
Rspo
과발현 및/또는
Rspo
융합 유전자의 검출
다른 양상에 있어서, R-스폰딘 유전자 융합 및/또는 R-스폰딘 과발현은 엔카운터(nCounter)(등록상표) 분석 시스템(나노스트링 테크놀로지즈사(Nanostring Technologies), 워싱턴주의 시애틀시에 소재)을 이용해서 검출 또는 결정된다. 이 시스템은 국제 특허 출원 공개 번호 WO 08/124,847 및 미국 특허 제8,415,102호(이들 각각은 이 시스템의 교시에 대한 그들의 전문이 참고로 본 명세서에 편입됨)에 기재되어 있다.
나노스트링은 RNA의 증폭을 필요로 하지 않고, 낮은 샘플 요건을 가지며 그리고 FFPE 샘플, 예컨대, 종양 FFPE 샘플 내의 유전자 발현의 수준을 평가하는데 효과적이다. 또한, 나노스트링은 유전자 발현을 검출하기 위한 다중화된 방법이며, 전사 또는 증폭을 사용하지 않고 mRNA의 직접 측정을 위한 방법을 제공한다. 포르말린 고정된 종양 시편으로부터 추출된 RNA는 매우 불량한 품질일 수 있고 최근까지 이러한 분석은 가능하지 않았다. 그러나, 나노스트링은, 이들 시편의 분석을 가능하게 한다. 500 아토몰(attomolar)의 감도에 의해 나노스트링은 입력으로서 100나노그램의 총 RNA를 이용해서 세포당 RNA의 1 복제물과 같은 미량을 검출할 수 있다.
엔카운터(등록상표) 분석 시스템의 기준은 검정될 각 핵산 표적에 할당된 고유한 코드이다. 코드는 검정될 각 표적에 대해서 고유한 바코드를 생성하는 순서화된 일련의 착색된 형광 스팟으로 구성된다. 한 쌍의 프로브가 각 DNA 또는 RNA 표적, 바이오틴화된 캡처 프로브 및 형광 바코드를 보유하는 리포터 프로브에 대해서 설계된다. 이 시스템은 또한 본 명세서에서 나노리포터 코드 시스템으로서 지칭된다.
특정 리포터 및 캡처 프로브는 각 표적에 대해서 합성된다. 요약하면, 서열-특이적 DNA 올리고뉴클레오타이드 프로브가 코드-특이적 리포터 분자에 부착된다. 바람직하게는, 각 서열 특이적 리포터 프로브는 관심대상인 하나 이하의 유전자(예컨대 Rspo2, Rspo3, 또는 그들의 융합 유전자 상대방 중 하나)에 혼성화 가능한 표적 특이적 서열을 포함하고 임의로 적어도 2개, 적어도 3개 또는 적어도 4개의 표지 부착 영역을 포함하며, 이 부착 영역들은 광을 방출하는 하나 이상의 표지 단량체를 포함한다. 캡처 프로브는 바이오틴을 함유하는 범용 올리고뉴클레오타이드에 각 표적을 위한 제2 서열-특이적 DNA 올리고뉴클레오타이드를 결찰시킴으로써 만들어진다. 리포터 프로브 및 캡처 프로브는 단일의 혼성화 혼합물인 "프로브 라이브러리" 내로 모두 합쳐진다. 바람직하게는, 프로브 라이브러리는 본 명세서에서 제공되는 바와 같은 관심대상 유전자의 각각에 대해서 프로브쌍(캡처 프로브 및 리포터)을 포함한다.
각 표적의 상대 존재비는 단일의 다중화된 혼성화 반응에서 측정된다. 이 방법은 생물학적 샘플을 프로브 라이브러리와 접촉시키는 것을 포함하며, 이때의 라이브러리는 관심 대상 유전자에 대한 프로브쌍을 포함하므로, 샘플 내 표적의 존재가 프로브 쌍 및 표적 복합체를 생성한다. 이어서 복합체는 정제된다. 더욱 구체적으로, 샘플은 프로브 라이브러리와 조합되고, 혼성화가 용액 중에서 일어난다. 혼성화 후, 3가지로 이루어진 혼성화된 복합체(프로브쌍과 표적)는 캡처 및 리포터 프로브에 존재하는 범용 서열과 상보적인 올리고뉴클레오타이드에 연결된 자성 비드를 이용해서 2-단계 절차로 정제된다. 이 이중 정제 과정은, 혼성화 반응이 대량의 표적-특이적 프로브와의 완료를 위하여 구동될 수 있고, 이들은 궁극적으로 제거되므로, 따라서 샘플의 결합 및 영상화를 간섭하지 않는다. 모든 혼성화후 단계는 맞춤 액체-취급 로봇(프렙 스테이션(Prep Station), 나노스트링 테크놀로지즈사(NanoString Technologies)) 상에서 로봇에 의해 취급된다.
정제된 반응은 샘플 카트리지의 개별의 흐름 셀 내로 프렙 스테이션에 의해 침착되어, 캡처 프로브를 통해서 스트렙타비딘-코팅된 표면에 결합되고, 리포터 프로브를 연장시키도록 전기영동되고, 그리고 고정화된다. 처리 후, 샘플 카트리지는 전체적으로 자동화된 영상화 및 데이터 수집 디바이스(디지털 애널라이저(Digital Analyzer), 나노스트링 테크놀로지즈사)로 이송된다. 표적의 발현 수준은 각 샘플을 영상화하고 그 표적에 대한 코드가 검출될 때의 횟수를 계수함으로써 측정된다. 데이터는 샘플당 표적당의 계수의 횟수를 나열하는 단순한 스프레드시트 형식으로 출력된다.
이 시스템은 나노리포터와 함께 사용될 수 있다. 나노리포터에 대한 추가의 개시내용은 국제 공개 번호 WO 07/076,129 및 WO 07/076,132, 그리고 미국 특허 공개 제2010/0015607 호 및 제2010/0261026호(이들의 내용은 그들의 전문이 본 명세서에 편입됨)에서 찾을 수 있다. 또한 용어 핵산 프로브 및 나노리포터는 국제 공개 번호 WO 2010/019826 및 미국 특허 공개 제2010/0047924호(이들은 전문이 참고로 본 명세서에 편입됨)에 기재된 합리적으로 설계된 (예컨대 합성 서열)을 포함할 수 있다.
엔카운터 시스템의 하나의 이점은 단일 검정에서 유전자 융합과 유전자 과발현 둘 다를 측정하는 능력이다. 엔카운터 엘리먼트 화학 검정(nCounter Element Chemistry assay)은 단일 반응에서 200개의 발현된 유전자 및 유전자 융합에 대해서 검출 및 판정 가능한 다중 검정을 가능하게 한다. 공지의 유전자 융합은 융합 접합 서열을 표적화하는 특정 프로브쌍으로 특성 규명될 수 있다. 파트너 유전자의 지식이 없는 신규한 융합 유전자형은 5' 및 3' 엑손 불균형에 의해 확인될 수 있다. 융합 접합의 5' 상류 및 3' 하류의 엑손 발현 비는 서열 특이적 프로브로 양호하게 평가될 수 있다. 따라서, 1로부터 벗어나는 5'/3' 발현의 비는 융합 사건이 일어난 것을 나타낸다. 암 줄기 세포 내의 5' 융합 파트너 유전자에 의해 구동되는 증가된 Rspo2 및 Rspo3 발현은 융합 사건에 대한 추가의 강력한 표지자이다. 문헌[Lira ME, Kim TM, Huang D, Deng S, Koh Y, Jang B, Go H, Lee SH, Chung DH, Kim WH, Schoenmakers EF, Choi YL, Park K, Ahn JS, Sun JM, Ahn MJ, Kim DW, Mao M. Multiplexed gene expression and fusion transcript analysis to detect ALK fusions in lung cancer. J Mol Diagn 2013 15(1):51-61. Lira ME, Choi YL, Lim SM, Deng S, Huang D, Ozeck M, Han J, Jeong JY, Shim HS, Cho BC, Kim J, Ahn MJ, Mao M. A single-tube multiplexed assay for detecting ALK, ROS1, and RET fusions in lung cancer. J Mol Diagn 2014 16(2):229-243] 참조.
나노스트링 및 이의 양상들은 문헌[Geiss et al., "Direct multiplexed measurement of gene expression with color-coded probe pairs" Nature Biotechnology 26, 317 - 325 (2008)]; 미국 특허 제7,473,767호, 제7,941,279호 및 제7,919,237호, 및 미국 특허 출원 공개 제2010/0112710호(이들 각각의 전체 내용은 참고로 본 명세서에 편입됨)에 기재되어 있다. 나노스트링은 또한 문헌[Payton et al., "High throughput digital quantification of mRNA abundance in primary human acute myeloid leukemia samples" The Journal of Clinical Investigation 119(6): 1714-1726 (2009); 및 Vladislav et al. "Multiplexed measurements of gene signatures in different analytes using the NanoStringnCounter Assay System" BMC Research Notes 2: 80 (2009](이들 각각의 전체 내용은 참고로 본 명세서에 편입됨)에 또한 기재되어 있다.
R-스폰딘의 유전자 발현은 일반적으로 WNT경로 활성화와 상관되고 그리고 비활성화된 WNT 신호전달을 가진 가장 분화된 조직에서 최소이다. Rspo2 및 Rspo3 부호화 유전자가 활성적으로 전사된 유전자의 3' 말단에 융합될 경우, 이들의 발현은 상당히 상승되고 잠재적으로 종양생성을 구동한다. 도 4는 100ng의 총 RNA의 종양 내 Rspo2 및 Rspo3 전사물의 나노스트링 엔카운터 정량화를 도시한다. 종양 보유 Rspo2 또는 Rspo3 융합 유전자 내 Rspo2 또는 Rspo3 전사물은 융합 없는 종양 내의 것에 비해서 100배 초과이다. 부가적으로, 5'-말단 엑손은 Rspo2 및 Rspo3가 그들의 파트너에 융합된 경우 존재하지 않아, 5' 및 3' 엑손의 불균형을 초래한다. 따라서, 5'-말단 엑손의 양은, 그들의 파트너 유전자에 융합되는 Rspo2 및 Rspo3 mRNA 내 3' 엑손의 양보다 현저하게 낮다.
몇몇 실시형태에 있어서, Rspo2 및/또는 Rspo3 융합의 과발현은 융합이 없는 종양(또는 정상 조직)에서보다 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100배 또는 그보다 많다.
F.
Rspo 과발현 및/또는 Rspo 융합 유전자를 이용한 대상체의 선별 및 치료
다른 양상에 있어서, 본 발명은, 암을 가진 대상체가, 프로큐파인 길항제 또는 저해제로서 사용되는, Wnt 활성을 저해하는 조성물로 치료되어야 할지의 여부를 결정하는 방법을 제공하되, 해당 방법은 (a) 대상체로부터 생물학적 샘플을 단리시키는 단계; (b) Rspo mRNA 또는 폴리펩타이드의 발현을 결정하기 위하여 및/또는 R-스폰딘 융합의 존재 유무를 확인하기 위하여 생물학적 샘플에 대한 검정을 수행하는 단계; 및 (c) 생물학적 샘플이 Rspo mRNA 또는 폴리펩타이드 과발현 및/또는 R-스폰딘 융합을 함유한다면 대상체가 프로큐파인 활성을 저해하는 조성물로 치료되어야 한다고 결정하는 단계를 포함하며, 여기서 상기 조성물은 본 명세서에서 제공된 프로큐파인 저해제를 포함한다.
몇몇 실시형태에 있어서, 상기 방법은 본 명세서에서 제공된 조성물로 대상체를 치료하는 단계를 더 포함한다.
본 발명의 바람직한 실시형태들이 본 명세서에 표시되고 기술되었지만, 당업자에게는 이러한 실시형태들이 단지 예로서 제공된 것임이 명백할 것이다. 많은 변형, 변화 및 치환이 이제 본 발명으로부터 벗어나는 일 없이 당업자에게 떠오를 것이다. 본 명세서에 기재된 본 발명의 실시형태에 대한 각종 대안이 본 발명을 실시함에 있어서 이용될 수 있다는 것이 이해되어야 한다. 이하의 청구범위가 본 발명의 범위를 정의하고 이에 따라서 이들 청구범위의 범주 내의 방법 및 구조 그리고 그들의 등가물이 커버되는 것이 의도된다.
IV.
Rspo
과발현 및/또는
Rspo
융합 유전자를 지닌
대상체의
선별을 위한 검정 및
키트
다른 양상에 있어서, 본 발명은 Rspo2 및/또는 Rspo3 유전자 융합s 및/또는 과발현에 대해서 대상체(예컨대, 인간 환자)를 선별하기 위한 키트를 제공한다.
본 발명의 검정 키트 및 방법은 특정 Wnt 저해제에 반응성이 되도록 예측되는 환자, 세포 또는 조직을 확인하는데 이용될 수 있다. 이러한 동반 진단 키트의 사용은 승인된 약물과 함께 사용하기 위한 정부 약물 규제 기관에 의해 승인된 기타 동반 진단 시험과 유사할 것이다. 예를 들어, ALK4-돌연연이된 폐암의 치료용의 크리조티닙 및 BRAF-돌연변이된 흑색종에 대한 베뮤라페닙의 2011년 미국 식품의약품청에 의한 승인 참조.
본 발명의 검정 키트 및 방법은 또한 Wnt 저해제에 대해서 내성인 암 세포의 반응성을 개선시킬 수 있는 치료를 확인하고 그리고 Wnt 저해제의 반응성을 증진시키는 보조 치료를 개발하는데 유용할 수 있다.
본 발명의 검정 키트 및 방법은, 또는 췌장암 또는 결장암과 같은, Wnt 저해제로 치료될 수 있는 임의의 암, 또는 유방 암종, 선암종 또는 흑색종과 같은, Wnt 저해제에 의해 성장이 늦춰질 수 있는 임의의 종양을 지닌 환자에게 유용하다. 이러한 환자는, 본 명세서에서 제공된 방법의 결과로서, 이들이 Rspo2 또는 Rspo2 유전자 융합 및/또는 과발현을 지니지 않는 사건에서 비효율적인 요법의 부작용 및 금융 비용을 모면할 수 있다. 본 발명의 검정 키트 및 방법은 또한 그들의 종양의 분자 특징에 대한 정보에 기초하여 특정 환자에 대해서가 아니라 Wnt 저해제 요법을 권장할 수 있는 의사에게 유용할 수 있다. 본 발명의 검정 키트 및 방법은 또한 아직 개발되지 않은 뉴클레오타이드 프로브와 함께 입수 가능하게 될 효과적인 인간 R스폰딘 검정의 개발에 대한 수요를 유용하게 증가시킬 것이다.
일 실시형태에 있어서, 본 발명은 Wnt 저해제의 치료적 투여로부터 유익하지 않지만, 유익하게 될 것으로 예측되는 암 환자를 선별하기 위한 검정 키트를 제공한다. 이 검정 키트는 다음을 포함한다:
(a) (i) Rspo 2 및/또는 Rspo 3 유전자 융합; 또는 (ii) Rspo2 및/또는 Rspo 3 유전자의 발현 수준으로부터 선택된 바이오마커의 수준 또는 바이오마커의 조합을 종양 샘에서 검출하기 위한 수단 또는 시스템.
(b) (i) Wnt 저해제에 대한 민감도를 검출하기 위한 대조 샘플; (ii) Wnt 저해제에 대한 내성을 검출하기 위한 대조 샘플; (iii) Wnt 저해제에 대한 민감도와 상관이 있었던 바이오마커의 미리 결정된 대조 수준(control level)을 포함하는 정보; 또는 (iv) Wnt 저해제에 대한 내성과 상관이 있었던 바이오마커의 미리 결정된 대조 수준을 포함하는 정보로부터 선택된 대조부(control).
일 실시형태에 있어서, 키트는 Rspo2 유전자 또는 Rspo3 유전자의 융합을 검출하기 위한 수단 또는 시스템을 더 포함할 수 있다.
일 실시형태에 있어서, 돌연변이를 검출하기 위한 수단은 Rspo2 유전자 또는 Rspo33 유전자의 일부를 혼성화시키는 뉴클레오타이드 프로브이다. 특정 실시형태에 있어서, 검출하기 위한 수단은 형광 동소 교잡(FISH) 프로브이다. 검출하기 위한 수단의 임의의 것은 검출 가능한 표지를 함유할 수 있다. 검출하기 위한 수단의 임의의 것은 기질 상에 고정될 수 있다.
검정 키트는 또한 하나 이상의 대조부를 포함할 수 있다. 대조부는 (i) 환자에서 사용하기 위하여 평가 중인 Wnt 저해제에 대한 민감도를 검출하기 위한 대조 샘플; (ii) Wnt 저해제에 대한 저항을 검출하기 위한 대조 샘플; (iii) Wnt 저해제 민감도 또는 저항에 관하여 측정될 특정 바이오마커의 미리 결정된 대조 수준(예컨대, Rspo2 및/또는 Rspo3 유전자 융합의 미리 결정된 대조 수준 및/또는 Wnt 저해제에 대한 민감도 또는 Wnt 저해제에 대한 저항과 상관이 있었던 과발현 수준)을 포함하는 정보를 포함할 수 있었다.
키트는 또한 예컨대, 본 명세서에서 이미 기재된 바이오마커의 존재를 검출하기 위한 방법에 의해서 일반적으로 샘플 내 공지된 마커의 존재를 (핵산 또는 단백질 수준에서) 검출하기 위한 방법에서 이용될 수 있는 임의의 유형의 시약일 수 있는 샘플링된 세포 유형의 특징인 대조 마커를 검출하기 위한 수단을 포함할 수 있다. 구체적으로는, 상기 수단은 세포 유형을 적극적으로 확인하는 분석 중인 세포 유형의 특정 마커를 확인하는 것을 특징으로 한다. 예를 들어, 폐 종양 검정에서, 바이오마커 발현 또는 생물학적 활성의 수준을 위한 폐 상피세포를 선별하는 것이 바람직하다. 따라서, 대조 마커를 검출하기 위한 수단은 상피세포, 바람직하게는 폐 상피세포의 특징인 마커를 확인하므로, 그 세포가 다른 세포 유형, 예컨대, 결합 조직 또는 염증 세포와 구별된다. 이러한 수단은 본 발명의 검정의 정확성 및 특이성을 증가시킨다. 대조 마커를 검출하기 위한 이러한 수단은 단백질 마커를 암호화하는 핵산 분자에 엄격한 혼성화 조건 하에 혼성화시키는 프로브; 이러한 핵산 분자를 증폭하는 PCR 프라이머; 표적 분자 상의 형태적으로 구별되는 부위에 특이적으로 결합하는 앱타머; 또는 항체 또는 이의 항원 결합 단편, 또는 샘플에서 대조 마커에 선택적으로 결합하는 항원 결합 펩타이드를 포함하지만, 이들로 제한되는 것은 아니다. 많은 세포 마커용의 핵산 및 아미노산 서열은 당업계에 공지되어 있고, 검출을 위한 이러한 시약을 생성하기 위하여 이용될 수 있다.
몇몇 실시형태에 있어서, 검정 또는 키트는 엔카운터 시스템은 엔카운터 시스템의 프로브 및 기타 필요한 시약을 포함한다. 나노스트링 엔카운터 검정은 융합 접합을 검출함에 있어서 그리고 유전자 발현을 평가함에 있어서 다중 설계로 수행될 수 있다: (1) 코드세트 설계는 용액 중 혼성화되는 mRNA당 2개의 대략 50 염기 프로브를 이용한다. 리포터 프로브는 신호를 보유하고; 캡처(Capture) 프로브는 데이터 수집을 위하여 복합체가 고정화되는 것을 허용하며; (2) 엘리먼트 태그셋(Element Tagset) GRP 설계는 사용자가 그 자체의 검정을 조립을 허용하게 하는 나노스트링의 특허된 기술에 기초한 디지털 분자 바코팅 화학을 이용하고; 그리고 3) 범용 접합 서열 설계는 고도로 특이적인 검출을 가능하게 하도록 발판(toehold) 교환 기술을 이용한다.
참고문헌:
실시예들
본 발명은 본 발명의 화합물의 제조를 예시하는 이하의 실시예들에 의해 더욱 예시되지만, 이들로 제한되지 않는다.
약어
정의 또는 설명
DCM
다이클로로메탄
DIEA
N,N'-다이아이소프로필에틸아민
DMF
N,N-다이메틸폼아마이드
eq.
당량
TEA
트라이에틸아민
THF
테트라하이드로퓨란
RT
실온
EA
에틸 아세테이트
Pd2(dba)3
트리스(다이벤질리덴아세톤)다이팔라듐(0)
s-Phos
2-다이사이클로헥실포스피노-2',6'-다이메톡시바이페닐
Pd(PPh3)4
테트라키스(트라이페닐포스핀)팔라듐
실시예 1
N-(4-(2-
메틸피리딘
-4-일)벤질)-6-(2-
메틸피리딘
-4-일)-2,7-
나프티리딘
-1-
아민(화합물 번호 1)의
합성
단계 1:
2-사이아노아세트아마이드(50g, 601.8 m㏖) 및 에틸 아세토아세테이트(75㎖, 601.8 m㏖)를 MeOH에 용해시켰다. KOH(37.0g, 1.1 eq)를 MeOH에 용해시키고, 이 혼합물에 적가 방식으로 첨가하자, 일부 백색 고체가 발생하였다. 이 혼합물을 오일욕에서 8시간 동안 환류 하에 가열시키고 나서, 실온까지 냉각시켰다. 얻어진 고체를 여과시키고 나서, 온수에 재용해시키고, 그 후 재차 여과시켰다. 이 여과액에 6N HCl을 첨가하여 pH<7까지 중화시켰다. 백색 고체가 재차 생성되었고, 여과시켰다. 얻어진 고체를 MeOH, 물 및 MeOH로 더욱 세척하고 나서, 진공에 의해 건조시켜 최종 생성물 3-에티닐-4-메틸피리딘-2,6-다이올(수율 대략 41%)을 얻었다.
단계 2:
3-에티닐-4-메틸피리딘-2,6-다이올(28.0g, 195.2 m㏖)을 POCl3(60.0㎖)에 용해시켰다. 이 반응 혼합물을 압력관 내에 밀봉하고 180℃까지 6시간 동안 가열하였다. 이 반응물을 실온까지 냉각시킨 후, 과잉의 POCl3를 진공 하에 제거하였다. 이 혼합물에 서서히 쇄빙(crushed ice)을 첨가하자, 고체가 생성되었다. 고체를 여과하고 진공 하에 건조시켜 최종 생성물 2,6-다이클로로-4-메틸피리딘-3-카보나이트릴(수율 대략 92%)을 추가의 정제 없이 얻었다.
단계 3:
아이소프로필 알코올 200㎖ 중 2,6-다이클로로-4-메틸피리딘-3-카보나이트릴(20.0g, 107.5m㏖)을 N,N-다이메틸폼아마이드 다이메틸아세틸(12.82g, 107.5m㏖)에 첨가하고, 이 반응물을 65℃에서 18시간 동안 교반하였다. 이 반응물을 실온까지 냉각시킨 후, 석출물을 여과에 의해 수집하고, 아이소프로필 알코올을 50㎖로 세척하고 나서, 공기 건조시켜, 생성물인 2,6-다이클로로-4-((E)-2-(다이메틸아미노)비닐)피리딘-3-카보나이트릴(수율 대략 26%)을 추가의 정제 없이 얻었다.
단계 4:
2,6-다이클로로-4-((E)-2-(다이메틸아미노)비닐)피리딘-3-카보나이트릴(4.0g, 16.6m㏖)을 밀봉관 내 진한 HCl 20㎖에 첨가하였다. 이 반응물을 45℃에서 18시간 동안 교반하였다. 이 반응물을 실온까지 냉각시킨 후, 이 용액에 빙수를 첨가하여 진한 황색 슬러리를 얻었다. 석출물을 여과에 의해 수집하고, 냉수, 에터 및 에틸 아세테이트로 세척하고 나서, 진공 하에 건조시켜 밝은 황색 고체 6,8-다이클로로-2,7-나프티리딘-1(2H)-온(수율 대략 80%)을 얻었다. MS m/z 215.0 (M + 1). 1HNMR (300 ㎒, DMSO-d6): δ 11.75 (s, 1H), 7.76 (s, 1H), 7.50 (t, J=6.6㎐, 1H), 6.52 (d, J=6.6㎐, 1H).
단계 5:
6,8-다이클로로-2,7-나프티리딘-1(2H)-온(3.0g, 13.96 m㏖)을 iPrOH(120㎖)에 용해시켜 일종의 현탁액을 형성하였다. 이 용액을 빙욕에서 0℃로 냉각시키고 나서 하이드라진 용액(5.6g, 80%, 10eq)을 적가 첨가하였다. 이 혼합물을 실온에서 15분 동안 교반하고 나서, 오일욕에서 55℃에서 하룻밤 동안 교반하였다. 반응 혼합물을 실온까지 냉각시킨 후, 여과시켜 고체를 직접 얻었고, 이어서 이 고체를 MeOH 70㎖로 세척하고 진공 건조시켰다. 생성물인 6-클로로-8-하이드라진일-2,7-나프티리딘-1(2H)-온(수율 대략 98%)은 추가의 정제 없이 그대로 다음 단계의 반응에서 이용하였다.
단계 6:
6-클로로-8-하이드라진일-2,7-나프티리딘-1(2H)-온(1.50g, 7.12 m㏖)을 MeCN(90㎖)에 용해시켜 일종의 현탁액을 형성하였다. 1N NaOH(17.80㎖, 2.5 eq)를 첨가하고 나서, 이 혼합물에 동등량의 물(107.80㎖)을 첨가하였다. 반응 혼합물을 50℃까지 가열하고, 맑은 용액이 될 때까지 교반하였다. 이 용액을 0℃까지 재차 냉각시키고, NaOCl(11.05g, 12% 용액, 2.5 eq)을 적가 첨가하고 나서, 이 반응물을 실온에서 하룻밤 동안 교반하였다. 반응이 수행된 후, 이 용액을 0℃까지 냉각시키고 나서, 1N HCl에 첨가하여 중화시켰다(pH 대략 6). 석출물을 수집하고, 여과액을 100㎖ x 2 EA로 추출하였다. 유기 층을 합하여 Na2SO4 상에서 건조시키고, 증발시켜 추가의 조질의 생성물을 얻었다. 합한 고체 물질인 6-클로로-2,7-나프티리딘-1(2H)-온(수율 대략 93%)은 추가의 정제 없이 다음 반응에 이용하였다. MS m/z 181.1 (M + 1).
단계 7:
6-클로로-2,7-나프티리딘-1(2H)-온(400㎎, 2.2 m㏖)을 압력관 속에서 POCl3(20.0㎖)에 첨가하였다. 이 반응 혼합물을 160℃까지 4시간 동안 가열하여 맑은 용액을 얻었다. 이 용액을 실온까지 냉각시키고, DCM에 부은 후, 쇄빙을 서서히 첨가하였다. 이 혼합물에 포화 NaHCO3를 첨가하여 반응에서 생성된 HCl을 중화시켰다. DCM을 진공 중 제거하고, 남은 수용액을 100㎖ x 2 EA에 의해 추출하였다. 유기 층을 합하여 염수로 한번 세척하고, Na2SO4에 의해 건조시키고 나서 진공 하에 증발시켜 고체 1,6-다이클로로-2,7-나프티리딘(수율 대략 73%)을 얻고, 이것을 추가의 정제 없이 다음 반응 단계에 이용하였다. MS m/z 199.0 (M + 1).
단계 8:
(4-브로모페닐)메탄아민(1.00g, 5.37 m㏖) 및 2-메틸피리딘-4-일-4-보론산(883.30㎎, 6.45 m㏖)을 BuOH(10.0㎖) 및 물(2.0㎖)에 용해시켰다. K3PO4(2.28g, 10.75 m㏖), Pd2(dba)3(120.20㎎, 0.27 m㏖) 및 S-phos(220.70㎎, 0.54 m㏖)를 N2 하에 첨가하였다. 반응 혼합물을 압력관 내에 밀봉하고 125℃까지 1시간 동안 가열하였다. 이 반응물을 실온까지 냉각시킨 후, 이 혼합물을 물속에 붓고, 100㎖ x 3 EA로 추출하였다. 유기 층을 합하여 염수로 세척하고, Na2SO4 상에서 건조시키고 나서, 진공 하에 농축시켜 조질의 생성물을 얻었다. 얻어진 고체를 DCM 중 10% MeOH(대략 2N NH3를 함유)를 이용하는 실리콘 겔 칼럼에 의해 정제시켜 순수한 (4-(2-메틸피리딘-4-일)페닐)메탄아민(수율 대략 89%)을 얻었다. MS m/z 199.1 (M + 1).
단계 9:
1,6-다이클로로-2,7-나프티리딘(160㎎, 0.80 m㏖) 및 (4-(2-메틸피리딘-4-일)페닐)메탄아민(239.10㎎, 1.21 m㏖)을 BuOH(5.0㎖)에 용해시키고 115℃까지 하룻밤 동안 가열하였다. 이 반응물을 실온까지 냉각시킨 후, 유기 용매를 진공 하에 제거하였다. 조질의 생성물을 EA/헥산(1:1)을 이용하는 실리콘 겔 플래쉬 크로마토그래피에 의해 정제시켜 고체 N-(4-(2-메틸피리딘-4-일)벤질)-6-클로로-2,7-나프티리딘-1-아민(수율 대략 90%)을 얻었다. MS m/z 361.1 (M + 1).
단계 10:
N-(4-(2-메틸피리딘-4-일)벤질)-6-클로로-2,7-나프티리딘-1-아민(50.00㎎, 0.14 m㏖) 및 2-메틸피리딘-4-일-4-보론산(56.90㎎, 0.42 m㏖)을 BuOH(3.0㎖) 및 물(0.6㎖)에 용해시켰다. K3PO4(88.20㎎, 0.028 m㏖), Pd2(dba)3(6.20㎎, 0.014 m㏖) 및 S-phos(11.40㎎, 0.011 m㏖)를 N2 하에 이 혼합물에 첨가하였다. 이 반응물을 압력관 내에 밀봉시키고, 105℃까지 하룻밤 동안 가열하였다. 이 반응물을 실온까지 냉각시킨 후, 이 혼합물을 물에 붓고, EA로 3회 추출하였다. 유기 층을 합하여 염수로 세척하고, Na2SO4에 의해 건조시키고 나서, 진공 하에 농축시켰다. 조질의 생성물을 DCM 중 5% MeOH를 이용하는 분취-TLC에 의해 더욱 정제시켜 최종 생성물 N-(4-(2-메틸피리딘-4-일)벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민(수율 대략 70%)을 얻었다. MS m/z 418.2 (M + 1). 1HNMR (300 ㎒, CDCl3): δ 2.46 (s, 3H), 2.63 (s, 3H), 4.94 (d, J = 5.10 ㎐, 2H), 5.94 (br, 1H), 6.97 (d, J = 5.70 ㎐, 1H), 7.31 (d, J = 4.20 ㎐, 1H), 7.36 (s, 1H), 7.54 (d, J = 8.10 ㎐, 2H), 7.63 (d, J = 8.40 ㎐, 2H), 7.90 (s, 1H), 8.19 (d, J = 6.00 ㎐, 1H), 8.22 (s, 1H), 8.51 (m, 2H), 9.08 (s, 1H), 9.30 (s, 1H).
실시예 2
N-(3-
메틸
-4-(2-
메틸피리딘
-4-일)벤질)-6-(2-
메틸피리딘
-4-일)-2,7-
나프티리딘
-1-
아민(화합물 번호 2)의
합성
단계 1:
6-클로로-2,7-나프티리딘-1(2H)-온(200㎎, 1.10 m㏖) 및 2-메틸피리딘-4-일-4-보론산(227.60㎎, 1.66 m㏖)을 BuOH(5.0㎖) 및 물(1.0㎖)에 용해시켰다. K3PO4(705.20g, 3.32 m㏖), Pd2(dba)3(49.60㎎, 0.22 m㏖) 및 S-phos(91.00㎎, 0.11 m㏖)를 N2 하에 첨가하였다. 압력 내의 반응 혼합물을 130℃까지 1시간 동안 가열하였다. 이 반응물을 실온까지 냉각시킨 후, 이 혼합물을 물에 붓고, EA로 3회 추출하였다. 유기 층을 합하여 염수로 세척하고, Na2SO4 상에서 건조시키고 나서, 진공 하에 농축시켜 조질물을 얻었다. 이 조질의 생성물을 DCM 중 5% MeOH를 이용하는 칼럼에 의해 정제시켜 최종 화합물 6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1(2H)-온(수율 대략 61%)을 얻었다. MS m/z 238.1 (M + 1).
단계 2:
6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1(2H)-온(150㎎, 0.63 m㏖)을 POCl3(15.0㎖)에 용해시키고, 압력관을 밀봉하고 나서 160℃까지 4시간 동안 가열하였다. 이 반응물을 실온까지 냉각시킨 후, 과잉의 POCl3를 진공 하에 제거하였다. 이 혼합물에 쇄빙을 서서히 첨가하고 나서, pH 대략 7.5까지 중화되도록 NaHCO3에 첨가하였다. 이 용액을 EA로 3회 추출하고, 유기 층을 합하여 염수로 세척하고, Na2SO4 상에서 건조시키고 나서, 진공 하에 농축시켰다. 얻어진 조질물을 EA/헥산(1:1)을 이용하는 칼럼에 의해 정제시켜 화합물 1-클로로-6-(2-메틸피리딘-4-일)-2,7-나프티리딘(수율 대략 55%)을 얻었다. MS m/z 256.1 (M + 1).
단계 3:
1-클로로-6-(2-메틸피리딘-4-일)-2,7-나프티리딘(10.00㎎, 0.039 m㏖) 및 (3-메틸-4-(2-메틸피리딘-4-일)페닐)메탄아민(10.00㎎, 0.047 m㏖)을 톨루엔(1.0㎖)에 용해시켰다. KOtBu(8.80㎎, 0.078 m㏖), Pd(OAc)2(0.90㎎, 0.0039 m㏖) 및 BINAP(4.90㎎, 0.0078 m㏖)를 이 혼합물에 N2 하에 첨가하였다. 이 반응물을 100℃까지 하룻밤 동안 가열하였다. 이 반응물을 실온까지 냉각시킨 후, 이 혼합물을 물에 붓고, EA로 3회 추출하였다. 유기 층을 합하여 염수로 세척하고, Na2SO4 상에서 건조시키고 나서, 진공 하에 농축시켰다. 조질의 생성물을 EA/헥산(4:1)에 의한 분취-TLC에 의해 정제시켜 N-(3-메틸-4-(2-메틸피리딘-4-일)벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민(8.8㎎, 수율 대략 52%)을 얻었다. 1H NMR (300 ㎒, CDCl3): δ 2.31 (s, 3H), 2.63 (s, 3H), 2.70 (s, 3H), 4.91 (d, J = 5.10 ㎐, 2H), 5.88 (br, 1H), 7.00 (d, J = 5.40 ㎐, 1H), 7.08 (d, J = 5.10 ㎐, 1H), 7.12 (s, 1H), 7.22 (d, J = 7.50 ㎐, 1H), 7.36 (m, 2H), 7.77 (d, J = 4.50 ㎐, 1H), 7.88 (s, 1H), 7.98 (s, 1H), 8.24 (d, J = 6.00 ㎐, 1H), 8.53 (d, J = 4.80 ㎐, 1H), 8.64 (d, J = 5.40 ㎐, 1H), 9.31 (s, 1H). MS m/z 432.2 (M + 1).
실시예 3
6-(3-
플루오로페닐
)-N-((6-(2-
메틸피리딘
-4-일)피리딘-3-일)
메틸
)
아이소퀴놀린
-1-
아민(화합물 번호 3)의
합성
단계 1:
6-브로모아이소퀴놀린(1.80g, 8.66 m㏖)을 DCM(40㎖)에 용해시키고 나서, 이 반응물을 0℃로 냉각시켰다. m-CPBA(2.30g, 1.3 eq, 77% 최대)를 조금씩 서서히 첨가하였다. 이 반응물을 실온까지 가온시켜 일종의 백색 현탁액을 얻었다. 4시간째에, DCM 100㎖를 이 용액에 첨가하고, 포화 Na2CO3 용액, 물 및 염수로 세척하였다. 분리된 유기 층을 Na2SO4 상에서 건조시키고 진공 하 제거하여 황색 고체 N-옥사이드 6-브로모아이소퀴놀린을 추가의 정제 없이 얻었다(1.82g, 수율 대략 93%).
단계 2:
N-옥사이드 6-브로모아이소퀴놀린(1.82g, 8.12 m㏖)을 건조 DCM(80㎖)에 용해시키고, POCl3(1.12㎖, 1.5 eq)를 실온에서 적가방식으로 첨가하였다. 이 반응물을 45℃까지 2시간 동안 가열하였다. 이 반응물을 실온까지 냉각시킨 후, DCM 및 과잉의 POCl3를 진공 하에 제거하였다. 얻어진 조질물을 DCM 100㎖에 재용해시키고, 포화 Na2CO3, 물 및 염수로 세척하였다. 분리된 유기 층을 Na2SO4 상에서 건조시키고, 농축시켜 갈색 고체를 얻었다. 얻어진 조질물을 DCM 중 2% MeOH를 이용하는 플래쉬 칼럼에 의해 정제시켜 담황색 고체 6-브로모-1-클로로아이소퀴놀린(1.27g, 수율 대략 65%)을 얻었다. MS m/z 242.0 (M + 1).
단계 3:
(6-클로로피리딘-3-일)메탄아민(300㎎, 2.1 m㏖) 및 2-메틸피리딘-4-일보론산(345㎎, 2.52 m㏖)을 n-부탄올(10㎖) 및 물(2㎖)을 구비한 압력관 내에서 용해시켰다. K3PO4(893㎎, 4.2m㏖), Pd2(dba)3(96.3㎎, 0.105 m㏖) 및 S-phos(86.4㎎, 0.21m㏖)를 질소 보호 하에 첨가하였다. 이 반응물을 125℃까지 30분 동안 가열하고 나서 실온까지 냉각시켰다. 이 용액을 물에 붓고 EA로 3회 추출하였다. 유기 층을 합하여 염수로 세척하고 Na2SO4 상에서 건조시키고 나서, 진공 하에 농축시켰다. 이 조질물을 DCM 중 10% MeOH(대략 2N NH3를 함유)를 이용하는 플래쉬 크로마토그래피에 의해 더욱 정제시켜 순수한 (6-(2-메틸피리딘-4-일)피리딘-3-일)메탄아민(0.19g, 수율 대략 45%)을 얻었다. MS m/z 200.1 (M + 1).
단계 4:
6-브로모-1-클로로아이소퀴놀린(100㎎, 0.41m㏖) 및 (6-(2-메틸피리딘-4-일)피리딘-3-일)메탄아민(165㎎, 0.82m㏖)을 밀봉된 관속에서 n-BuOH 0.5㎖ 중에 용해시켰다. 이 반응물을 160℃까지 6시간 동안 가열하고 실온까지 냉각시켰다. 얻어진 조질물을 DCM 중 8% MeOH(대략 2N NH3를 함유)를 이용하는 플래쉬 크로마토그래피에 의해 정제시켜 순수한 6-브로모-N-((6-(2-메틸피리딘-4-일)피리딘-3-일)메틸)아이소퀴놀린-1-아민(116㎎, 대략 70%)을 얻었다. MS m/z 405.2 (M + 1).
단계 5:
6-브로모-N-((6-(2-메틸피리딘-4-일)피리딘-3-일)메틸)아이소퀴놀린-1-아민(20㎎, 0.05m㏖), 3-플루오로페닐보론산(10.5㎎, 0.075m㏖), Na2CO3(21㎎, 0.2m㏖) 및 테트라키스(트라이페닐포스핀)팔라듐(5.8㎎, 0.005m㏖)을 압력관에 첨가하였다. 이 관에 다이옥산/물(3:1, 2㎖)을 첨가하고, 125℃까지 10분 동안 가열하였다. 이 반응물을 실온까지 냉각시킨 후, 이 용액을 물 50㎖로 희석시키고, EA로 3회 추출하였다. 유기 층을 합하여 Na2SO4 상에서 건조시키고, 진공 하에 농축시켰다. 얻어진 조질물을 DCM 중 10% MeOH(대략 2N NH3를 함유)를 이용하는 플래쉬 크로마토그래피에 의해 더욱 정제시켜 순수한 6-(3-플루오로페닐)-N-((6-(2-메틸피리딘-4-일)피리딘-3-일)메틸)아이소퀴놀린-1-아민(15.8㎎, 대략 75%)을 얻었다. 1H NMR (400 ㎒, CDCl3): δ 2.71 (s, 3H), 5.00 (d, J=5.6㎐, 2H), 7.32-7.38 (m, 2H), 7.59-7.65 (m, 1H), 7.75-7.83 (m, 3H), 8.10 (d, J=8.4㎐, 1H), 8.21 (d, J=8.8㎐, 1H), 8.27-8.31 (m, 2H), 8.39 (s, 2H), 8.72 (d, J=8.8㎐, 1H), 8.79 (d, J=6.0㎐, 1H), 8.91 (d, J=1.6㎐, 1H), 10.02 (s, 1H). MS m/z 421.2 (M + 1).
실시예 4
N-(4-(2-
메틸피리딘
-4-일)벤질)-2-(2-
메틸피리딘
-4-일)-1,6-
나프티리딘
-5-
아민(화합물 번호 4)의
합성
단계 1:
1,6-나프티리딘-5(6H)-온(2.9g, 19.84 m㏖)을 POCl3(40㎖)에 용해시키고, 100℃까지 24시간 동안 가열하였다. 이 반응물을 실온까지 냉각 후, 과잉의 POCl3를 진공 하에 제거하였다. 포화 Na2CO3 용액 중 소량의 쇄빙을 서서히 첨가하고, 많은 기포 및 고체가 발생되었다. 얻어진 고체를 여과시키고, 이 용액을 EA로 3회 추출하였다. 유기 층을 합하여 Na2SO4 상에서 건조시키고, 진공 하에 농축시켰다. 합한 고체를 진공 하에 더욱 건조시켜 추가의 정제 없이 5-클로로-1,6-나프티리딘(2.6g, 수율 대략 80%)을 얻었다. MS m/z 165.1 (M + 1).
단계 2:
5-클로로-1,6-나프티리딘(1.5g, 9.11 m㏖)을 DCM(45㎖)에 용해시키고, 빙욕에 의해 냉각시키고, m-CPBA(3.7g, 2 eq, 77% 최대)를 조금씩 서서히 첨가하였다. 이 반응물을 실온까지 가온시키고, 3시간 동안 지속시켰다. 추가의 DCM 100㎖를 이 용액에 첨가하고, 포화 Na2CO3 용액, 물 및 염수로 세척하였다. 유기 층을 Na2SO4 상에서 건조시키고, 진공 하에 농축시켜 황색 고체 N-옥사이드 5-클로로-1,6-나프티리딘(1.25g, 수율 대략 76%)을 얻었다.
단계 3:
N-옥사이드 5-클로로-1,6-나프티리딘(1.2g, 6.64m㏖)을 건조 DCM(30㎖)에 용해시키고, Et3N(1.85㎖, 13.29m㏖)을 첨가하고 나서 건조 DCM 5㎖ 중 POCl3(0.93㎖, 9.97 m㏖)를 적가 첨가하였다. 이 반응물을 48℃까지 2시간 동안 가열하였다. 추가의 DCM 100㎖를 이 용액에 첨가하고, 포화 Na2CO3 용액, 물 및 염수로 세척하였다. 유기 층을 Na2SO4 상에서 건조시키고 나서, 진공 하에 농축시켜 황색 고체를 얻었다. 조질물을 EA/헥산(1:4)을 이용하는 실리콘 칼럼에 의해 더욱 정제시켜 백색 고체 2,5-다이클로로-1,6-나프티리딘(0.6g, 수율 대략 45%)을 얻었다. MS m/z 199.0 (M + 1)
단계 4:
2,5-다이클로로-1,6-나프티리딘(200㎎, 1.0m㏖), 2-메틸피리딘-4-일-4-보론산(137㎎, 1.0m㏖), Na2CO3(424㎎, 4.0m㏖) 및 테트라키스(트라이페닐포스핀)팔라듐(116㎎, 0.1m㏖)을 플라스크에 첨가하고, 다이옥산 16㎖ 및 물 4㎖를 더욱 첨가하였다. 이 반응물을 매우 잘 교반하고, 90℃까지 4시간 동안 가열하였다. 이 반응물을 실온까지 냉각시킨 후, 이 용액을 물 100㎖로 희석시키고, EA로 3회 추출하였다. 유기 층을 합하여 Na2SO4 상에서 건조시키고, 진공 하에 농축시켰다. 얻어진 조질물을 EA/헥산(1:1)을 이용하는 플래쉬 크로마토그래피에 의해 더욱 정제시켜 고체 5-클로로-2-(2-메틸피리딘-4-일)-1,6-나프티리딘(143㎎, 수율 대략 56%)을 얻었다. MS m/z 256.1 (M + 1)
단계 5:
5-클로로-2-(2-메틸피리딘-4-일)-1,6-나프티리딘(20.00㎎, 0.078 m㏖) 및 (4-(2-메틸피리딘-4-일)페닐)메탄아민(25㎎, 0.118 m㏖)을 톨루엔(2.0㎖)에 용해시켰다. KOtBu(13.2㎎, 0.118 m㏖), Pd(OAc)2(2.7㎎, 0.012 m㏖) 및 BINAP(15.0㎎, 0.024 m㏖)를 이 혼합물에 N2 하에 첨가하였다. 이 반응물을 100℃까지 하룻밤 동안 가열하였다. 이 반응물을 실온까지 냉각시킨 후, 이 혼합물을 물에 붓고, EA로 3회 추출하였다. 유기 층을 합하여 염수로 세척하고, Na2SO4 상에서 건조시키고 나서, 진공 하에 농축시켰다. 조질의 생성물을 DCM 중 8% MeOH에 의한 분취-TLC에 의해 정제시켜 N-(4-(2-메틸피리딘-4-일)벤질)-2-(2-메틸피리딘-4-일)-1,6-나프티리딘-5-아민(31㎎, 수율 대략 61%)을 얻었다. 1H NMR (400 ㎒, DMSO-d6): δ 9.12 (d, J=8.8㎐, 1H), 8.77-8.83 (m, 2H), 8.49 (d, J=8.4㎐, 1H), 8.40 (s, 1H), 8.31 (d, J=6.4㎐, 1H), 8.21 (s, 1H), 8.11 (d, J=5.6㎐, 1H), 8.06 (d, J=6.4㎐, 1H), 7.99 (d, J=8.4㎐, 2H), 7.65 (d, J=8.4㎐, 2H), 7.23 (d, J=6.4㎐, 1H), 5.76 (s, 1H), 4.93 (d, J=5.6㎐, 2H), 2.72 (s, 6H). MS m/z 432.2 (M + 1).
실시예 5
N-(4-(2-
메틸피리딘
-4-일)벤질)-2-
페닐피리도[4,3-b]피라진
-5-
아민(화합물 번호 5)의
합성
단계 1:
에탄올 20㎖에 페닐 글라이옥살 1수화물(940㎎, 6.99m㏖) 및 2-클로로-3,4-다이아미노피리딘(1000㎎, 6.99m㏖)을 첨가하였다. 이 혼합물을 하룻밤 동안 환류시켰다. 이 반응물을 냉각시킨 후, 조질의 석출된 생성물을 여과시키고, 에탄올 15㎖로 세척하고 나서, 진공 하에 건조시켜 5-클로로-2-페닐피리도[3,4-b]피라진을 추가의 정제 없이 얻었다(1.28g, 수율 대략 76%), MS m/z 241.0 (M + 1); 1H NMR (300 ㎒, DMSO-d6): δ 9.82 (s, 1H), 8.64 (d, J=6.0㎐, 1H), 8.38-8.43 (m, 2H), 8.07 (d, J=6.0㎐, 1H), 7.64-7.68 (m, 3H).
단계 2:
N-(4-(2-메틸피리딘-4-일)벤질)-2-페닐피리도[3,4-b]피라진-5-아민(50㎎, 0.21m㏖) 및 (4-(2-메틸피리딘-4-일)페닐)메탄아민(42㎎, 0.21m㏖)을 톨루엔(4.0㎖)에 용해시켰다. KOtBu(24㎎, 0.21 m㏖), Pd(OAc)2(4.5㎎, 0.021 m㏖) 및 BINAP(26.4㎎, 0.042 m㏖)를 이 혼합물에 N2 하에 첨가하였다. 이 반응물을 100℃까지 하룻밤 동안 가열하였다. 이 반응물을 실온까지 냉각시킨 후, 이 혼합물을 물에 붓고, EA로 3회 추출하였다. 유기 층을 합하여 염수로 세척하고, Na2SO4 상에서 건조시키고 나서, 진공 하에 농축시켰다. 조질의 생성물을 DCM 중 7% MeOH를 이용하는 플래쉬 크로마토그래피에 의해 정제시켜 N-(4-(2-메틸피리딘-4-일)벤질)-2-페닐피리도[4,3-b]피라진-5-아민(61㎎, 수율 대략 72%)을 얻었다. MS m/z=404.2 (M+1); 1H NMR (400㎒, DMSO-d6) δ 9.53 (s, 1H), 8.77 (d, J=6.4㎐, 1H), 8.35-8.39 (m, 2H), 8.21 (s, 1H), 8.11 (d, J=6.0㎐, 1H), 8.07 (d, J=6.4㎐, 1H), 7.96 (d, J=8.4㎐, 2H), 7.60-7.65 (m, 5H), 7.14 (d, J=6.0㎐, 1H), 5.76 (s, 1H), 4.90 (d, J=6.4㎐, 2H), 2.71 (s, 3H).
실시예 6
RNA 추출 및
SYBR
녹색 실시간 RT-
PCR
총 RNA는 제조사의 지시에 따라서 RNAeasy 추출 키트(퀴아겐사(QIAGEN))를 사용해서 동결된 종양 조직으로부터 단리시키고, 1차 cDNA로 역전사켰다. Rspo2 순방향 프라이머 5'-AGAGGCCGTTGCTTTGATGA-3'(서열번호 1) 및 역방향 프라이머 5'-TCCCCATTCGCTCCAATGAC-3'(서열번호 2). GAPDH 순방향 프라이머 5'-GAAGGTGAAGGTCGGAGT-3'(서열번호 3) 및 역방향 프라이머 5'-GAAGATGGTGATGGGATTTC-3'(서열번호 4). 1:200 희석된 cDNA 주형을 GAPDH 증폭에 이용하였다. Rspo2, Rspo3 및 GAPDH에 대한 PCR 증폭 프로파일은 94℃에서 10분의 1사이클에 이어서 94℃에서 15초 및 60℃에서 1분의 2단계로 40 사이클이었다. 산물의 형광 강도는 각 사이클의 말기에 측정되었고, PCR-후 용융 곡선 분석은 프라이머-다이머 또는 다른 비특이적 산물을 검출하고 그리고 표적의 특이성을 확인하기 위하여 수행되었다. 증폭, 데이터 획득 및 분석은 어플라이드 바이오시스템즈(Applied Biosystems) 7500 실시간 PCR 기기(라이프 테크놀로지즈사, 캘리포니아주 포스터시티에 소재)를 사용해서 수행되었다. 특이적 프라이머로 각 샘플의 3회 복제는 양성 대조군 및 음성 대조군과 함께 96-웰 플레이트에서 수행되었다. 양성 대조군 및 음성 대조군은 종양 조직으로부터의 총 RNA였으며, 여기서 Rspo2 및 Rspo3 발현은 미리 특성규명되었다. Rspo2 및 Rspo3의 상대치는 ΔCt에 의해 결정되었으며, 여기서 ΔCt = Ct(Rspo2 또는 Rspo3) - Ct(GAPDH).
5' RACE,
클로닝
및 서열분석
총 RNA는 제조사의 지시에 따라서 SMARTer(등록상표) RACE 5'/3' 키트(클론테크 라보라토리즈사(Clontech Laboratories), 캘리포니아주 마운틴뷰시에 소재)를 이용해서 인간 Rspo2 또는 Rspo3 mRNA의 5' 말단을 증폭시키는데 사용되었다.
Rspo2 엑손 2 유전자 특이적 프라이머 5'-GATTACGCCAAGCTTCGTCTCC ATCGGTTGCCTTGGCAGTGGC-3'(서열번호 5), 엑손3 유전자 특이적 프라이머 5'-GATTACGCCAAGCTTGCAGGCACTCTCCATACTGGCGCATCCC-3'(서열번호 6), 엑손 3 네스티드 프라이머 5'-GATTACGCCAAGCTTGGGCTCGGTGTCCATAGTACCC GGATGGG-3'(서열번호 7). The Rspo3 엑손 3 유전자 특이적 프라이머 5'-GATTACG CCAAGCTTGGTTGTTGGCTTCCAACCCTTCTGGGC-3'(서열번호 8) 및 엑손3 네스티드 유전자 특이적 프라이머 5'-GATTACGCCAAGCTTGGACCCGTGTTTCAGTCCC TCTTTTGAAGCC-3'(서열번호 9). 15nt 융합내 클로닝 프라이머(밑줄 없음)는 SMARTer(등록상표) RACE 5'/3' 키트(클론테크 라보라토리즈사, 캘리포니아주 마운틴뷰시에 소재)를 사용해서 RACE 산물 클로닝에 대해서 5' 말단에서 포함되었다.
5' RACE 산물은 In-융합 벡터 내로 클로닝되었다. 10개 클론의 삽입물이 M13 프라이머에 의해 서열분석되었고, NCBI 뉴클레오타이드 BLAST(http://blast.ncbi.nlm.nih.gov/Blast.cgi)에 의해 분석되었다.
나노스트링
엔카운터
엘리먼트
화학 기술
엔카운터 검정은 제조사의 프로토콜(나노스트링사, 워싱턴주의 시애틀시에 소재)에 따라서 맞춤화 설계된 엘리먼트 화학 프로브로 수행되었다. 요약하면, 150ng의 총 RNA를 엔카운터 프로브 세트에 67℃에서 17.75시간 동안 혼성화시키고, 약 3시간 동안 4℃로 감소시켰다. 샘플은 자동화 엔카운터 샘플 프렙 스테이션(automated nCounter Sample Prep Station)(나노스트링 테크놀로지즈사, 워싱턴주의 시애틀시에 소재)을 사용해서 처리하였다. 고정화되고 정렬된 리포터 복합체를 수용하는 카트리지는 엔카운터 디지털 애널라이저(nCounter Digital Analyzer)(나노스트링 테크놀로지즈사) 상에서 순차로 영상화되었다. 리포터 계수치는 나노스트링의 엔솔버 분석 소프트웨어(NanoString's nSolver analysis software) 2.0을 이용해서 수집하고, 정규화하고, 그리고 양성 대조군 및 하우스키핑 유전자로 분석하였다.
5' 융합 유전자에 의한
Rspo2
및
Rspo3
의
증가된
발현
Rspo2 및 Rspo3 전사물의 양은 약 5% 및 8%의 종양 샘플(n=192)에서 증가되었다. 5' RACE 및 DNA 서열분석은 Rspo2 및 Rspo3 전사물의 상향 조절이 이들의 5' 융합 유전자 발현에 의해 구동된 것을 확인하였다.
| 샘플 | GAPDH | RSPO2 | ΔCT |
| GAPF108 | 23.2 | 38.4 | 15.3 |
| ESPF001 | 21.9 | 36.5 | 14.5 |
| LUPF016 | 25.6 | 40.0 | 14.4 |
| LIPF236 | 22.8 | 26.3 | 3.6 |
| PAPF179 | 23.2 | 26.8 | 3.5 |
| LIPF088 | 21.5 | 25.0 | 3.5 |
| PAPF004 | 21.2 | 23.7 | 2.4 |
| PAPF310 | 21.9 | 24.2 | 2.2 |
| ESPF014 | 22.2 | 23.4 | 1.2 |
| PAPF199 | 24.2 | 25.4 | 1.1 |
| PAPF029 | 22.5 | 22.6 | 0.1 |
| PAPF157 | 26.8 | 26.9 | 0.1 |
| GAPF3055 | 23.7 | 23.5 | -0.2 |
| GAPF67 | 22.4 | 19.7 | -2.7 |
| CRPF3056 | 23.4 | 19.7 | -3.7 |
| CRPF2506 | 27.6 | 23.6 | -4.0 |
| GLPF0440 | 26.6 | 21.2 | -5.4 |
확인된
신규한
Rspo2
및
Rspo3
전사물
각종 신규한 Rspo2 및 Rspo3 유전자 융합 전사물이 확인되었다.
| 5' 유전자 | Rspo2 | 프레임내 | |
| EMC2 | 엑손1 | 엑손2 | 있음 |
| PVT1 | 엑손1 | 엑손2 | 있음 |
| PVT1 | 엑손1 | 엑손2 | 없음 |
| HNF4G | 엑손2 | 있음 | |
| 5' 유전자 | Rspo3 | 프레임내 | |
| PTPRK | 엑손6x | 엑손2 | 있음 |
| PTPRK | 엑손13 | 엑손2 | 있음 |
나노스트링
엔카운터
검정에 의한 융합 유전자의 특성규명
Rspo2 또는 Rspo3 융합 유전자를 보유하는 종양 조직은 나노스트링 엔카운터 유전형 분석 검정을 검증하는데 사용되었다(도 3, 표 7). 융합 접합 프로브는 5' RACE 및 서열분석을 특징으로 하는 융합 유전자형을 표적화를 위하여 구체적으로 설계되었다. 기지의 또는 신규한 Rspo2/Rspo3 융합 유전자형에 대한 의사결정 단계는 도 1 및 도 2에 예시되어 있다.
Rspo2 발현은 엑손 2, 엑손 5 및 엑손 6을 표적화하는 프로브에 의해 평가되었다. 개시 코돈 ATG는 엑손 2에 있고, 융합 유전자로부터 전장 rspo2 단백질을 생산한다. Rspo2 엑손1은 임의의 Rspo2 융합 유전자형에서 관찰되지 않았지만, 야생형 Rspo2 전사물에서만 존재하는 것으로 확인되었다.
Rspo3 발현은 엑손3/4 및 엑손5를 표적화하는 프로브에 의해 평가되었다. 오픈 리딩 프레임(open reading frame) Rspo3은 이의 5' 융합 유전자의 프레임내 서열에 좌우된다.
특성 규명된 신규한 Rspo2 융합 유전자형을 가진 5가지 종양 조직과 Rspo3 융합 유전자형을 가진 하나의 샘플이 나노스트링 엔카운터 유전형 분석 검정에 의해 그들의 융합 접합으로 정확하게 확인되었다. 이에 대응하여, Rspo2 또는 Rspo3 발현이 이들 샘플에서 관찰되었다. L440의 증가된 Rspo2 신호가 엑손1, 2, 5 및 6 프로브에서 발견되었다. 5' RACE 및 서열분석은, L440이 완전한 Rspo2 mRNA를 우선적으로 보유하고 이의 발현이 융합 유전자에 의해 구동되지 않았던 것을 확인하였다.
| 샘플 데이터 | 프로브 |
| 하우스키핑 | ACTB |
| GAPDH | |
| Rspo2 발현 | RSPO2-1(엑손1) |
| RSPO2-2a (엑손2) | |
| RSPO2-3 (엑손5) | |
| RSPO2-4 (엑손6) | |
| Rspo2 융합 접합 | EIF3Eex1-RSPO2ex2 |
| EIF3Eex1-RSPO2ex3 | |
| EMC2ex1-RSPO2ex2 | |
| EMC2ex1-RSPO2ex3 | |
| HNF4G-RSPO2 | |
| PVT1-RSPO2ex2 | |
| PVT1-RSPO2ex3 | |
| Rspo3 발현 | RSPO3-1 (엑손1) |
| RPSO3-2 (엑손3/4) | |
| RPSO3-3 (엑손5) | |
| Rspo3 융합 접합 | PTPRKe1-RSPO3e2 |
| PTPRKe13-RSPO3e2 | |
| PTPRKe7-RSPO3e2 | |
| PTPRKe6X-RSPO3e2 |
실시예 7
Rspo2
/3 융합 모델에 대한
PDx
효율 연구
CGX1321의 항암 활성은 마우스 이종이식 모델에서 Rspo2 또는 Rspo3 융합 유전자를 가진 결장직장 종양 및 위 종양에서 조사하였다. 8 내지 10주령의 나이에서의 BALB/c 누드 마우스에게 종양 발달을 위하여 2 x 2 x 2㎜의 종양 단편을 우측 옆구리에 피하 접종하였다. 종양 발달은 평균 용적이 대략 100 내지 150㎣에 도달할 때까지 방해되지 않도록 방치되었다. 마우스는 이어서 대조군과 치료군으로 무작위 추출되었다. CGX1321을 미리 결정된 요법에서 21 내지 28일 동안 경구로 종양-보유 마우스에게 투여하였다. 종양 측정은 캘리퍼로 주 2회 수행하였고 종양 용적(㎣)은 식: TV = a × b2/2(식 중, a 및 b는 각각 종양의 긴 직경 및 짧은 직경임)를 이용해서 추정되었다. 체중은 종양 측정과 동시에 평가되었다.
SEQUENCE LISTING
<110> Curegenix Corporation
<120> Tumor Biomarkers and Use Thereof
<130> 1402518-00035
<150> US 62/166,305
<151> 2015-05-26
<160> 72
<170> PatentIn version 3.5
<210> 1
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Rspo2 forward primer
<400> 1
agaggccgtt gctttgatga 20
<210> 2
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Rspo2 reverse primer
<400> 2
tccccattcg ctccaatgac 20
<210> 3
<211> 18
<212> DNA
<213> Artificial Sequence
<220>
<223> GAPDH forward primer
<400> 3
gaaggtgaag gtcggagt 18
<210> 4
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> GAPDH reverse primer
<400> 4
gaagatggtg atgggatttc 20
<210> 5
<211> 43
<212> DNA
<213> Artificial Sequence
<220>
<223> Rspo2 exon 2 gene specific primer
<400> 5
gattacgcca agcttcgtct ccatcggttg ccttggcagt ggc 43
<210> 6
<211> 43
<212> DNA
<213> Artificial Sequence
<220>
<223> Rspo2 exon3 gene specific primer
<400> 6
gattacgcca agcttgcagg cactctccat actggcgcat ccc 43
<210> 7
<211> 44
<212> DNA
<213> Artificial Sequence
<220>
<223> Rspo2 exon 3 nested primer
<400> 7
gattacgcca agcttgggct cggtgtccat agtacccgga tggg 44
<210> 8
<211> 42
<212> DNA
<213> Artificial Sequence
<220>
<223> Rspo3 exon 3 gene specific primer
<400> 8
gattacgcca agcttggttg ttggcttcca acccttctgg gc 42
<210> 9
<211> 46
<212> DNA
<213> Artificial Sequence
<220>
<223> Rspo3 exon3 nested gene specific primer
<400> 9
gattacgcca agcttggacc cgtgtttcag tccctctttt gaagcc 46
<210> 10
<211> 85
<212> DNA
<213> Artificial Sequence
<220>
<223> NM_001101.2:1010_T001 capture probe
<400> 10
gatcttgatc ttcattgtgc tgggtgccag ggcagtgatc tccttctgca cctcaagacc 60
taagcgacag cgtgaccttg tttca 85
<210> 11
<211> 74
<212> DNA
<213> Artificial Sequence
<220>
<223> NM_002046.3:972_T002 capture probe
<400> 11
aagtggtcgt tgagggcaat gccagcccca gcgtcaaagc atcctcttct tttcttggtg 60
ttgagaagat gctc 74
<210> 12
<211> 85
<212> DNA
<213> Artificial Sequence
<220>
<223> NM_004655.3:527_T003 capture probe
<400> 12
tcggaacagg taagcaccgt cttgatcgcc caataaggag tgtaaggact cacaattctg 60
cgggttagca ggaaggttag ggaac 85
<210> 13
<211> 85
<212> DNA
<213> Artificial Sequence
<220>
<223> NM_003667.3:3414_T004 capture probe
<400> 13
gaaaaccctt attttcctaa ttcccccaac aacctcttga gtttgtgggt ctgttgagat 60
tattgagctt catcatgacc agaag 85
<210> 14
<211> 79
<212> DNA
<213> Artificial Sequence
<220>
<223> NM_178565.4:150_T005 capture probe
<400> 14
ttcctgcgct ttctccacgg tcacttcaca gctaagattt ctttcaaaga cgcctatctt 60
ccagtttgat cgggaaact 79
<210> 15
<211> 85
<212> DNA
<213> Artificial Sequence
<220>
<223> NM_178565.4:641_T006 capture probe
<400> 15
gatgagggca aaggagaaaa ggcgaaactg catctgggcg gtcgggcggg cgaacctaac 60
tcctcgctac attcctattg ttttc 85
<210> 16
<211> 85
<212> DNA
<213> Artificial Sequence
<220>
<223> NM_178565.4:1060_T007 capture probe
<400> 16
ctccaatgac caacttcaca tccttccaca cattccatgg tttcttctaa ccaatttggt 60
tttactcccc tcgattatgc ggagt 85
<210> 17
<211> 85
<212> DNA
<213> Artificial Sequence
<220>
<223> NM_178565.4:2289_T008 capture probe
<400> 17
gttgtgtttc atcaaagtca tcacatctta gactcaaagg cagtttgggc ctttcgggtt 60
atatctatca tttacttgac accct 85
<210> 18
<211> 85
<212> DNA
<213> Artificial Sequence
<220>
<223> Fusion_0622.1:69_T009 capture probe
<400> 18
cctcctttac agagagaaat tcaagaagcg gaaagactag atgccgatcc caacagccac 60
tttttttcca aattttgcaa gagcc 85
<210> 19
<211> 85
<212> DNA
<213> Artificial Sequence
<220>
<223> Fusion_0623.1:33_T010 capture probe
<400> 19
ccacgaacct tcccaagtga catcgtaaag ctctgagacc ttcgccatct caccgtgtgg 60
acggcaactc agagataacg catat 85
<210> 20
<211> 85
<212> DNA
<213> Artificial Sequence
<220>
<223> Fusion_0625.1:77_T011 capture probe
<400> 20
aaggctgtgg tagggaacgg agtctatatt tgtagagaag agtagaatca cctggagttt 60
atgtattgcc aacgagtttg tcttt 85
<210> 21
<211> 70
<212> DNA
<213> Artificial Sequence
<220>
<223> Fusion_0624.1:155_T012 capture probe
<400> 21
aactggaggg cagatctggc cgtgtctcca caggtcagat aaggttgtta ttgtggagga 60
tgttactaca 70
<210> 22
<211> 85
<212> DNA
<213> Artificial Sequence
<220>
<223> NM_032784.4:173_T013 capture probe
<400> 22
taaaatatat gtaggtgtta ggcgtatata gacagtgccc gagcagcggg cttccttcct 60
gtgttccagc tacaaactta gaaac 85
<210> 23
<211> 85
<212> DNA
<213> Artificial Sequence
<220>
<223> NM_032784.4:634_T014 capture probe
<400> 23
cttctgggca attgtcaagg cactttccaa ggtgtaagta aaatccactt cataaaattg 60
gttttgcctt tcagcaattc aactt 85
<210> 24
<211> 85
<212> DNA
<213> Artificial Sequence
<220>
<223> NM_032784.4:1520_T015 capture probe
<400> 24
ctcccggtca aaacaacact gtcctttgaa ggatgtttct cttccctgaa ctggtcaaga 60
cttgcatgag gacccgcaaa ttcct 85
<210> 25
<211> 84
<212> DNA
<213> Artificial Sequence
<220>
<223> Fusion_0169.1:1_T016 capture probe
<400> 25
cttggggcat ctcgggtggt agataatgag gctcttgagc actaacatgc tttcgttggg 60
acgcttgaag cgcaagtaga aaac 84
<210> 26
<211> 85
<212> DNA
<213> Artificial Sequence
<220>
<223> Fusion_0736.1:0_T017 capture probe
<400> 26
cacaaggata actcagtact tggatgtcat caatggcaat ataaccactt ccagcagacc 60
tgcaatatca aagttataag cgcgt 85
<210> 27
<211> 84
<212> DNA
<213> Artificial Sequence
<220>
<223> Fusion_0170.1:1_T018 capture probe
<400> 27
ctctcacaat aagttgagca aaattggaca caccggaacc tcgttctgac ctgccaatgc 60
actcgatctt gtcatttttt tgcg 84
<210> 28
<211> 84
<212> DNA
<213> Artificial Sequence
<220>
<223> Fusion_0737.1:0_T019 capture probe
<400> 28
catcttcatc agtttgaata attgtctctt cactctcctt ccttccctcc aaactggaga 60
gagaagtgaa gacgatttaa ccca 84
<210> 29
<211> 70
<212> DNA
<213> Artificial Sequence
<220>
<223> Fusion_0524.1:0_T020 capture probe
<400> 29
ctgcggagaa ctggccttgg gccgatccca ggagacgatt gctgcattcc gctcaacgct 60
tgaggaagta 70
<210> 30
<211> 75
<212> DNA
<213> Artificial Sequence
<220>
<223> Fusion_0525.1:0_T021 capture probe
<400> 30
ctgcacattt tgttctggtg attagtggag gtcctgggag ctgaggctgt taaagctgta 60
gcaactcttc cacga 75
<210> 31
<211> 85
<212> DNA
<213> Artificial Sequence
<220>
<223> Fusion_0526.1:0_T022 capture probe
<400> 31
cttttgtagc aatgcgtacg cactgggttt tagtttcctt ctccacactg ctaggacgca 60
aatcacttga agaagtgaaa gcgag 85
<210> 32
<211> 85
<212> DNA
<213> Artificial Sequence
<220>
<223> Fusion_0684.1:0_T023 capture probe
<400> 32
ctccttttca cttgtcattt cagtaactgc aggccttttc tgcggagaac ccacgcgatg 60
acgttcgtca agagtcgcat aatct 85
<210> 33
<211> 85
<212> DNA
<213> Artificial Sequence
<220>
<223> Fusion_0738.1:0_T024 capture probe
<400> 33
ctgagatatt ggtggtgaca ttgatggctg tggctggacc aaagcctttg catttggaat 60
gatgtgtact gggaataaga cgacg 85
<210> 34
<211> 75
<212> DNA
<213> Artificial Sequence
<220>
<223> NM_001101.2:1010_ProbeB reporter probe
<400> 34
cgaaagccat gacctccgat cactcaggat ggagccgccg atccacacgg agtacttgcg 60
ctcaggagga gcaat 75
<210> 35
<211> 75
<212> DNA
<213> Artificial Sequence
<220>
<223> NM_002046.3:972_ProbeB reporter probe
<400> 35
cgaaagccat gacctccgat cactcccctg ttgctgtagc caaattcgtt gtcataccag 60
gaaatgagct tgaca 75
<210> 36
<211> 75
<212> DNA
<213> Artificial Sequence
<220>
<223> NM_004655.3:527_ProbeB reporter probe
<400> 36
cgaaagccat gacctccgat cactcgcaaa ccagaagtct aaggtatcca cgcatttctc 60
cctctccagg aaagt 75
<210> 37
<211> 75
<212> DNA
<213> Artificial Sequence
<220>
<223> NM_003667.3:3414_ProbeB reporter probe
<400> 37
cgaaagccat gacctccgat cactctagaa tgaaatccca tggatcacag cctctaccta 60
gcaatgtagg tcatt 75
<210> 38
<211> 62
<212> DNA
<213> Artificial Sequence
<220>
<223> NM_178565.4:150_ProbeB reporter probe
<400> 38
cgaaagccat gacctccgat cactccgctc acactctctg cctccctaac caattgtgtc 60
gc 62
<210> 39
<211> 68
<212> DNA
<213> Artificial Sequence
<220>
<223> NM_178565.4:641_ProbeB reporter probe
<400> 39
cgaaagccat gacctccgat cactcatcgg ttgccttggc agtggctgta atccatgcag 60
ttcagaat 68
<210> 40
<211> 75
<212> DNA
<213> Artificial Sequence
<220>
<223> NM_178565.4:1060_ProbeB reporter probe
<400> 40
cgaaagccat gacctccgat cactccccat ttaaatccac atgtgcgatt atttctgcta 60
caagttcccc attcg 75
<210> 41
<211> 75
<212> DNA
<213> Artificial Sequence
<220>
<223> NM_178565.4:2289_ProbeB reporter probe
<400> 41
cgaaagccat gacctccgat cactcggcct gtgaaactgg ctacaagtga ctggatatag 60
tccctcatgt tttca 75
<210> 42
<211> 63
<212> DNA
<213> Artificial Sequence
<220>
<223> Fusion_0622.1:69_ProbeB reporter probe
<400> 42
cgaaagccat gacctccgat cactccggtc agttcagcgc gatcagcatc tctccgccac 60
gaa 63
<210> 43
<211> 61
<212> DNA
<213> Artificial Sequence
<220>
<223> Fusion_0623.1:33_ProbeB reporter probe
<400> 43
cgaaagccat gacctccgat cactccgcac cggtcagttc agcgcgatca gcatctctcc 60
g 61
<210> 44
<211> 64
<212> DNA
<213> Artificial Sequence
<220>
<223> Fusion_0625.1:77_ProbeB reporter probe
<400> 44
cgaaagccat gacctccgat cactccggtc agttcagcgc gatcagcatc tctccgccac 60
gaac 64
<210> 45
<211> 61
<212> DNA
<213> Artificial Sequence
<220>
<223> Fusion_0624.1:155_ProbeB reporter probe
<400> 45
cgaaagccat gacctccgat cactccggtc agttcagcgc gatcagcatc tctccgccac 60
g 61
<210> 46
<211> 75
<212> DNA
<213> Artificial Sequence
<220>
<223> NM_032784.4:173_ProbeB reporter probe
<400> 46
cgaaagccat gacctccgat cactctccct tcctttctcc tctttctttt gattgttaat 60
tatatttaat gtttt 75
<210> 47
<211> 75
<212> DNA
<213> Artificial Sequence
<220>
<223> NM_032784.4:634_ProbeB reporter probe
<400> 47
cgaaagccat gacctccgat cactcacagt gcacaatact gacacactcc atagtatggt 60
tgttggcttc caacc 75
<210> 48
<211> 75
<212> DNA
<213> Artificial Sequence
<220>
<223> NM_032784.4:1520_ProbeB reporter probe
<400> 48
cgaaagccat gacctccgat cactcaaatc ctgtgattcc aaatgccagg ccctaattct 60
gagcactctc tagat 75
<210> 49
<211> 64
<212> DNA
<213> Artificial Sequence
<220>
<223> Fusion_0169.1:1_ProbeB reporter probe
<400> 49
cgaaagccat gacctccgat cactccacag cctccttggc agccttgact aacgttagga 60
tgca 64
<210> 50
<211> 64
<212> DNA
<213> Artificial Sequence
<220>
<223> Fusion_0736.1:0_ProbeB reporter probe
<400> 50
cgaaagccat gacctccgat cactccacag cctccttggc agccttgact aacgttagga 60
tgca 64
<210> 51
<211> 64
<212> DNA
<213> Artificial Sequence
<220>
<223> Fusion_0170.1:1_ProbeB reporter probe
<400> 51
cgaaagccat gacctccgat cactccacag cctccttggc agccttgact aacgttagga 60
tgca 64
<210> 52
<211> 64
<212> DNA
<213> Artificial Sequence
<220>
<223> Fusion_0737.1:0_ProbeB reporter probe
<400> 52
cgaaagccat gacctccgat cactccacag cctccttggc agccttgact aacgttagga 60
tgca 64
<210> 53
<211> 64
<212> DNA
<213> Artificial Sequence
<220>
<223> Fusion_0524.1:0_ProbeB reporter probe
<400> 53
cgaaagccat gacctccgat cactccacag cctccttggc agccttgact aacgttagga 60
tgca 64
<210> 54
<211> 64
<212> DNA
<213> Artificial Sequence
<220>
<223> Fusion_0525.1:0_ProbeB
<400> 54
cgaaagccat gacctccgat cactccacag cctccttggc agccttgact aacgttagga 60
tgca 64
<210> 55
<211> 64
<212> DNA
<213> Artificial Sequence
<220>
<223> Fusion_0526.1:0_ProbeB reporter probe
<400> 55
cgaaagccat gacctccgat cactccacag cctccttggc agccttgact aacgttagga 60
tgca 64
<210> 56
<211> 64
<212> DNA
<213> Artificial Sequence
<220>
<223> Fusion_0684.1:0_ProbeB reporter probe
<400> 56
cgaaagccat gacctccgat cactccacag cctccttggc agccttgact aacgttagga 60
tgca 64
<210> 57
<211> 64
<212> DNA
<213> Artificial Sequence
<220>
<223> Fusion_0738.1:0_ProbeB reporter probe
<400> 57
cgaaagccat gacctccgat cactccacag cctccttggc agccttgact aacgttagga 60
tgca 64
<210> 58
<211> 100
<212> DNA
<213> Artificial Sequence
<220>
<223> PTPRKe1-Rspo3e2 gene fusion
<400> 58
cctctctcct tggcctctcc tgggatcggc ccaaggccag ttctccgcag tgcatcctaa 60
cgttagtcaa ggctgccaag gaggctgtgc aacatgctca 100
<210> 59
<211> 100
<212> DNA
<213> Artificial Sequence
<220>
<223> PTPRKe7-Rspo3e2 gene fusion
<400> 59
tggaacgggg ctcccaggac ctccactaat caccagaaca aaatgtgcag tgcatcctaa 60
cgttagtcaa ggctgccaag gaggctgtgc aacatgctca 100
<210> 60
<211> 100
<212> DNA
<213> Artificial Sequence
<220>
<223> PTPRKe6X-Rspo3e2 gene fusion
<400> 60
gttctccgca gaaaaggcct gcagttactg aaatgacaag tgaaaaggag tgcatcctaa 60
cgttagtcaa ggctgccaag gaggctgtgc aacatgctca 100
<210> 61
<211> 100
<212> DNA
<213> Artificial Sequence
<220>
<223> PTPRKe13-Rspo3e2 gene fusion
<400> 61
cagtgtggag aaggaaacta aaacccagtg cgtacgcatt gctacaaaag tgcatcctaa 60
cgttagtcaa ggctgccaag gaggctgtgc aacatgctca 100
<210> 62
<211> 100
<212> DNA
<213> Artificial Sequence
<220>
<223> EIF3Ee1-Rspo2e2 gene fusion
<400> 62
ggatcggcat ctagtctttc cgcttcttga atttctctct gtaaaggagg ttcgtggcgg 60
agagatgctg atcgcgctga actgaccggt gcggcccggg 100
<210> 63
<211> 100
<212> DNA
<213> Artificial Sequence
<220>
<223> EIF3Ee1-Rspo2e3 gene fusion
<400> 63
tggatcggca tctagtcttt ccgcttcttg aatttctctc tgtaaaggag ctagttatgt 60
atcaaatccc atttgcaagg gttgtttgtc ttgttcaaag 100
<210> 64
<211> 100
<212> DNA
<213> Artificial Sequence
<220>
<223> EMC2e1-Rspo2e2 gene fusion
<400> 64
agatggcgaa ggtctcagag ctttacgatg tcacttggga aggttcgtgg cggagagatg 60
ctgatcgcgc tgaactgacc ggtgcggccc gggggtgagt 100
<210> 65
<211> 100
<212> DNA
<213> Artificial Sequence
<220>
<223> PVT1-Rspo2e2 gene fusion
<400> 65
ttggcggtcc ctgtgacctg tggagacacg gccagatctg ccctccagtt cgtggcggag 60
agatgctgat cgcgctgaac tgaccggtgc ggcccggggg 100
<210> 66
<211> 97
<212> DNA
<213> Artificial Sequence
<220>
<223> PVT1-Rspo2e3 gene fusion
<400> 66
ttggcggtcc ctgtgacctg tggagacacg gccagatctg ccctccacta gttatgtatc 60
aaatcccatt tgcaagggtt gtttgtcttg ttcaaag 97
<210> 67
<211> 100
<212> DNA
<213> Artificial Sequence
<220>
<223> HNF4G-Rspo2e2 gene fusion
<400> 67
tgattctact cttctctaca aatatagact ccgttcccta ccacagcctt gttcgtggcg 60
gagagatgct gatcgcgctg aactgaccgg tgcggcccgg 100
<210> 68
<211> 132
<212> DNA
<213> Artificial Sequence
<220>
<223> PTPRKex2-RSPO3ex2 gene fusion
<400> 68
atgatgactt tgaatgggtg catgttagtg ctcaagagcc tcattatcta ccacccgaga 60
tgccccaagt gcatcctaac gttagtcaag gctgccaagg aggctgtgca acatgctcag 120
attacaatgg at 132
<210> 69
<211> 126
<212> DNA
<213> Artificial Sequence
<220>
<223> PTPRKex4-RSPO3ex2 gene fusion
<400> 69
tctcaggagg gagaagtggt tatattgcca ttgatgacat ccaagtactg agttatcctt 60
gtgtgcatcc taacgttagt caaggctgcc aaggaggctg tgcaacatgc tcagattaca 120
atggat 126
<210> 70
<211> 127
<212> DNA
<213> Artificial Sequence
<220>
<223> PTPRKex6-RSPO3ex2 gene fusion
<400> 70
cgctgtgtaa ctcagtcaga acgaggttcc ggtgtgtcca attttgctca acttattgtg 60
agagtgcatc ctaacgttag tcaaggctgc caaggaggct gtgcaacatg ctcagattac 120
aatggat 127
<210> 71
<211> 124
<212> DNA
<213> Artificial Sequence
<220>
<223> PTPRKex8-RSPO3ex2 gene fusion
<400> 71
ctaaccaatc cagagggaag gaaggagagt gaagagacaa ttattcaaac tgatgaagat 60
gtgcatccta acgttagtca aggctgccaa ggaggctgtg caacatgctc agattacaat 120
ggat 124
<210> 72
<211> 126
<212> DNA
<213> Artificial Sequence
<220>
<223> PTPRKex10-RSPO3ex2 gene fusion
<400> 72
gagccagcac ggtcaaaggc tttggtccag ccacagccat caatgtcacc accaatatct 60
cagtgcatcc taacgttagt caaggctgcc aaggaggctg tgcaacatgc tcagattaca 120
atggat 126
Claims (42)
- 암으로 진단되었고 그리고 암의 치료를 필요로 하는 대상체에서 R-스폰딘 융합의 발현을 특징으로 하는 암의 치료 방법으로서,
치료적 유효량의 포큐파인(Porcupine)의 길항제를 포함하는 약제학적 조성물을 암으로 진단된 대상체에게 투여하는 단계를 포함하되,
상기 대상체는 R-스폰딘 융합을 지니는 것으로 결정된, 암의 치료 방법. - 제1항에 있어서, 상기 R-스폰딘 융합은 하기를 포함하는, 암의 치료 방법:
(1) PTPRKe1-Rspo3e2 융합;
(2) PTPRKe7-Rspo3e2 융합;
(3) EIF3Ee1-Rspo2e2 융합; 또는
(4) EIF3Ee1-Rspo2e3 융합. - 제1항에 있어서, 상기 R-스폰딘 융합은 하기를 포함하는, 암의 치료 방법:
(1) EMC2e1-Rspo2e2 융합;
(2) PVT1-Rspo2e2 융합;
(3) PVT1-Rspo2e3 융합;
(4) HNF4G-Rspo2e2 융합;
(5) PTPRKe13-Rspo3e2 융합; 또는
(6) PTPRKe6X-Rspo3e2 융합. - 제1항 내지 제3항 중 어느 한 항에 있어서, 상기 대상체는 R-스폰딘 융합을 지니지 않는 것으로 결정된 대조 대상체에서의 R-스폰딘 mRNA 발현 수준보다 더 높은 R-스폰딘 mRNA 발현 수준을 가지는 것으로 결정되는, 암의 치료 방법.
- 제2항에 있어서, 상기 R스폰딘 융합은 서열번호 58, 서열번호 59, 서열번호 62, 또는 서열번호 63 중 어느 하나의 접합 서열을 포함하는, 암의 치료 방법.
- 제3항에 있어서, 상기 EMC2e1-Rspo2e2 융합은 서열번호 64의 접합 서열을 포함하는, 암의 치료 방법.
- 제3항에 있어서, 상기 PVT1-Rspo2e2 융합은 서열번호 65의 접합 서열을 포함하는, 암의 치료 방법.
- 제3항에 있어서, 상기 PVT1-Rspo2e3 융합은 서열번호 66의 접합 서열을 포함하는, 암의 치료 방법.
- 제3항에 있어서, 상기 HNF4G-Rspo2e2 융합은 서열번호 67의 접합 서열을 포함하는, 암의 치료 방법.
- 제3항에 있어서, 상기 PTPRKe13-Rspo3e2 융합은 서열번호 61의 접합 서열을 포함하는, 암의 치료 방법.
- 제3항에 있어서, 상기 PTPRKe6X-Rspo3e2 융합은 서열번호 60의 접합 서열을 포함하는, 암의 치료 방법.
- 제1항 내지 제11항 중 어느 한 항에 있어서, 상기 R스폰딘은 Rspo2 또는 Rsp3이고, 그리고 상기 융합 유전자는 다른 유전자에 융합되지 않은 R스폰딘과 비교해서 과발현되는, 암의 치료 방법.
- 제1항 내지 제12항 중 어느 한 항에 있어서, 상기 포큐파인 길항제는 하기 화학식 (I)의 화합물 또는 이의 생리학적으로 허용 가능한 염을 포함하는, 암의 치료 방법:
식 중,
X1, X2, X3, X4, X5, X6, X7, X8은 독립적으로 CR4 또는 N이고;
Y1은 수소 또는 CR4이고; Y2, Y3은 독립적으로 수소, 할로 또는 CR3이며;
R1은 몰폴린일, 피페라진일, 퀴놀린일, , 아릴, C1 -6 복소환, N, O 및 S로부터 선택된 1 내지 2개의 헤테로원자를 함유하는 5 또는 6원 헤테로아릴이고;
R2는 수소, 할로, 몰폴린일, 피페라진일, 퀴놀린일, , 아릴, C1 -6 복소환, N, O 및 S로부터 선택된 1 내지 2개의 헤테로원자를 함유하는 5 또는 6원 헤테로아릴이고;
R3은 수소, 할로, 사이아노, 임의로 할로, 아미노, 하이드록실, 알콕시 또는 사이아노로 치환된, C1 -6 알킬, C1 -6 알콕시이며;
R4는 수소, 할로, C1 - 6알콕시, -S(O)2R5, -C(O)OR5, -C(O)R5, -C(O)NR6R7, C1 -6 알킬, C2 -6 알켄일 또는 C2 -6 알킨일이되, 이들 각각은 임의로 할로, 아미노, 하이드록실, 알콕시 또는 사이아노로 치환될 수 있고;
R5, R6 및 R7은 독립적으로 수소, C1 -6 알킬, C2 -6 알켄일 또는 C2 -6 알킨일이되, 이들 각각은 임의로 할로, 아미노, 하이드록실, 알콕시 또는 사이아노로 치환될 수 있다. - 제13항에 있어서, 상기 5 또는 6원 헤테로아릴은 하기로부터 선택되는, 암의 치료 방법:
식 중,
R4는 수소, 할로, C1 - 6알콕시, -S(O)2R5, -C(O)OR5, -C(O)R5, -C(O)NR6R7, C1 -6 알킬, C2 -6 알켄일 또는 C2 -6 알킨일이되, 이들의 각각은 임의로 할로, 아미노, 하이드록실, 알콕시 또는 사이아노로 치환된 수소일 수 있고;
R5, R6 및 R7은 독립적으로 수소, C1 -6 알킬, C2 -6 알켄일 또는 C2 -6 알킨일, 이들 각각은 임의로 할로, 아미노, 하이드록실, 알콕시 또는 사이아노로 치환될 수 있으며; 그리고
R8은 수소 또는 C1 -6 알킬이다. - 제13항 또는 제14항에 있어서, R1 및 R2는 독립적으로 1 또는 2개의 R4기로 치환되는, 암의 치료 방법.
- 제13항 내지 제15항 중 어느 한 항에 있어서, 상기 화합물은 하기로부터 선택되는, 암의 치료 방법:
6-(2-메틸피리딘-4-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
N-(3-메틸-4-(2-메틸피리딘-4-일)벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
6-(3-플루오로페닐)-N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)아이소퀴놀린-1-아민;
2-(2-메틸피리딘-4-일)-N-(4-(2-메틸피리딘-4-일)벤질)-1,6-나프티리딘-5-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-2-페닐피리도[4,3-b]피라진-5-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리딘-4-일)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-페닐-2,7-나프티리딘-1-아민;
6-(3-클로로페닐)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
6-(3-플루오로페닐)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
6-(3-플루오로페닐)-N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)-2,7-나프티리딘-1-아민;
6-(3-플루오로페닐)-N-(4-(2-(트라이플루오로메틸)피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(3-플루오로페닐)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리미딘-5-일)-2,7-나프티리딘-1-아민;
6-(5-메틸피리딘-3-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
6-(6-메틸피리딘-3-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
3-(8-(4-(2-메틸피리딘-4-일)벤질아미노)-2,7-나프티리딘-3-일)벤조나이트릴;
4-(8-(4-(2-메틸피리딘-4-일)벤질아미노)-2,7-나프티리딘-3-일)벤조나이트릴;
6-(4-플루오로페닐)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-m-톨릴-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리딘-2-일)-2,7-나프티리딘-1-아민;
6-(2-플루오로피리딘-4-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
6-(2-플루오로페닐)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리딘-3-일)-2,7-나프티리딘-1-아민;
N-(바이페닐-4-일메틸)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
6-(2-메틸피리딘-4-일)-N-((5-페닐피리딘-2-일)메틸)-2,7-나프티리딘-1-아민;
6-(3-플루오로페닐)-N-((2'-(트라이플루오로메틸)-2,4'-바이피리딘-5-일)메틸)-2,7-나프티리딘-1-아민;
N-(3-플루오로-4-(2-플루오로피리딘-4-일)벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
6-(2-메틸피리딘-4-일)-N-((2'-(트라이플루오로메틸)-2,4'-바이피리딘-5-일)메틸)-2,7-나프티리딘-1-아민;
N-((3-플루오로-2'-(트라이플루오로메틸)-2,4'-바이피리딘-5-일)메틸)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
N-(3-플루오로-4-(2-메틸피리딘-4-일)벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
N-((2'-플루오로-2,4'-바이피리딘-5-일)메틸)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
4-(5-(((6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-일)아미노)메틸)피리딘-2-일)티오몰폴린 1,1-다이옥사이드;
6-(2-메틸피리딘-4-일)-N-(4-(피리다진-4-일)벤질)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피라진-2-일)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리다진-4-일)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-몰폴리노-2,7-나프티리딘-1-아민;
6-(4-메틸피페라진-1-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
4-(8-((4-(2-메틸피리딘-4-일)벤질)아미노)-2,7-나프티리딘-3-일)티오몰폴린 1,1-다이옥사이드;
N-(3-플루오로-4-(2-플루오로피리딘-4-일)벤질)-6-(3-플루오로페닐)-2,7-나프티리딘-1-아민;
N-(3-플루오로-4-(2-메틸피리딘-4-일)벤질)-6-(3-플루오로페닐)-2,7-나프티리딘-1-아민;
N-((3-플루오로-2'-(트라이플루오로메틸)-2,4'-바이피리딘-5-일)메틸)-6-(3-플루오로페닐)-2,7-나프티리딘-1-아민;
N-((2'-플루오로-2,4'-바이피리딘-5-일)메틸)-6-(3-플루오로페닐)-2,7-나프티리딘-1-아민;
6-(3-플루오로페닐)-N-(3-메틸-4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
4-(5-(((6-(3-플루오로페닐)-2,7-나프티리딘-1-일)아미노)메틸)피리딘-2-일)티오몰폴린 1,1-다이옥사이드;
N-(4-클로로벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
N-(4-메틸벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
6-(2-메틸피리딘-4-일)-N-(피리딘-3-일메틸)-2,7-나프티리딘-1-아민;
N-벤질-2-(3-플루오로페닐)-1,6-나프티리딘-5-아민;
2-(3-플루오로페닐)-N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)-1,6-나프티리딘-5-아민;
N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)-2-(2-메틸피리딘-4-일)-1,6-나프티리딘-5-아민;
N-((6-(3-플루오로페닐)피리딘-3-일)메틸)-2-(2-메틸피리딘-4-일)-1,6-나프티리딘-5-아민;
N-(4-(2-플루오로피리딘-4-일)벤질)-2-(2-메틸피리딘-4-일)-1,6-나프티리딘-5-아민;
2-(2-메틸피리딘-4-일)-N-(4-(2-(트라이플루오로메틸)피리딘-4-일)벤질)-1,6-나프티리딘-5-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-2-(2-메틸피리딘-4-일)-1,6-나프티리딘-5-아민;
N-(바이페닐-4-일메틸)-6-(3-플루오로페닐)아이소퀴놀린-1-아민;
N-((2-플루오로바이페닐-4-일)메틸)-6-(3-플루오로페닐)아이소퀴놀린-1-아민;
N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)-6-페닐아이소퀴놀린-1-아민;
6-(3-클로로페닐)-N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)아이소퀴놀린-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-페닐아이소퀴놀린-1-아민;
6-(2-메틸피리딘-4-일)-N-(4-(2-메틸피리딘-4-일)벤질)아이소퀴놀린-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리딘-4-일)아이소퀴놀린-1-아민;
6-(6-메틸피리딘-3-일)-N-(4-(2-메틸피리딘-4-일)벤질)아이소퀴놀린-1-아민;
6-(2-메틸피리딘-4-일)-N-(4-(2-메틸피리딘-4-일)벤질)아이소퀴놀린-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리딘-3-일)아이소퀴놀린-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피라진-2-일)아이소퀴놀린-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리다진-4-일)아이소퀴놀린-1-아민;
N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)-6-(피라진-2-일)아이소퀴놀린-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(피라진-2-일)아이소퀴놀린-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(피리딘-2-일)아이소퀴놀린-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(3-플루오로페닐)아이소퀴놀린-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(5-메틸피리딘-3-일)아이소퀴놀린-1-아민;
N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)-2-페닐피리도[4,3-b]피라진-5-아민;
2-(3-플루오로페닐)-N-(4-(2-메틸피리딘-4-일)벤질)피리도[4,3-b]피라진-5-아민;
2-(3-플루오로페닐)-N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)피리도[4,3-b]피라진-5-아민;
2-(3-플루오로페닐)-N-(3-메틸-4-(2-메틸피리딘-4-일)벤질)피리도[4,3-b]피라진-5-아민;
N-(3-플루오로-4-(2-메틸피리딘-4-일)벤질)-2-(3-플루오로페닐)피리도[4,3-b]피라진-5-아민;
2-(2-메틸피리딘-4-일)-N-(4-(2-메틸피리딘-4-일)벤질)피리도[4,3-b]피라진-5-아민;
N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)-2-(2-메틸피리딘-4-일)피리도[4,3-b]피라진-5-아민;
N-(3-메틸-4-(2-메틸피리딘-4-일)벤질)-2-(2-메틸피리딘-4-일)피리도[4,3-b]피라진-5-아민;
N-(3-플루오로-4-(2-메틸피리딘-4-일)벤질)-2-(2-메틸피리딘-4-일)피리도[4,3-b]피라진-5-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(피라진-2-일)-2,7-나프티리딘-1-아민;
6-(2-메틸몰폴리노)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
(S)-6-(2-메틸몰폴리노)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
(R)-6-(2-메틸몰폴리노)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
1-(4-(8-(4-(2-메틸피리딘-4-일)벤질아미노)-2,7-나프티리딘-3-일)피페라진-1-일)에탄온;
6-(1H-이미다졸-1-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
6-(4-메틸-1H-이미다졸-1-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(1H-테트라졸-5-일)-2,7-나프티리딘-1-아민;
6-(5-메틸-1,3,4-옥사다이아졸-2-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
6-(1-메틸-1H-피라졸-3-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(티아졸-5-일)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(옥사졸-5-일)-2,7-나프티리딘-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(5-메틸피리딘-3-일)-2,7-나프티리딘-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
N-((3-플루오로-2'-메틸-2,4'-바이피리딘-5-일)메틸)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(5-플루오로피리딘-3-일)-2,7-나프티리딘-1-아민;
N-(3-메틸-4-(2-메틸피리딘-4-일)벤질)-6-(피라진-2-일)-2,7-나프티리딘-1-아민;
N-(3-플루오로-4-(2-메틸피리딘-4-일)벤질)-6-(피라진-2-일)-2,7-나프티리딘-1-아민;
메틸 4-(8-(4-(2-메틸피리딘-4-일)벤질아미노)-2,7-나프티리딘-3-일)피페라진-1-카복실레이트;
4-(8-(4-(2-메틸피리딘-4-일)벤질아미노)-2,7-나프티리딘-3-일)피페라진-2-온;
2-(4-(8-(4-(2-메틸피리딘-4-일)벤질아미노)-2,7-나프티리딘-3-일)피페라진-1-일)아세토나이트릴;
2-메틸-4-(4-((6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-일아미노)메틸)페닐)피리딘 1-옥사이드;
6-(2-클로로피리딘-4-일)-N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-2,7-나프티리딘-1-아민;
6-(2-클로로피리딘-4-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
2-(2-메틸피리딘-4-일)-5-((6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-일아미노)메틸)벤조나이트릴;
N-(3-메톡시-4-(2-메틸피리딘-4-일)벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
N-((3-클로로-2'-메틸-2,4'-바이피리딘-5-일)메틸)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
2'-메틸-5-((6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-일아미노)메틸)-2,4'-바이피리딘-3-카보나이트릴; 및 N-(4-(2-(다이플루오로메틸)피리딘-4-일)벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민, 또는 이들의 생리학적으로 허용 가능한 염. - 제1항 내지 제12항 중 어느 한 항에 있어서, 상기 포큐파인 길항제는 하기 화학식 (II)의 화합물 또는 이의 생리학적으로 허용 가능한 염을 포함하는, 암의 치료 방법:
식 중,
X1, X2, X3 및 X4는 N 및 CR7로부터 선택되고;
X5, X6, X7 및 X8 중 하나는 N이고, 나머지는 CH이며;
X9는 N 및 CH로부터 선택되고;
Z는 페닐, 피라진일, 피리딘일, 피리다진일 및 피페라진일로부터 선택되며;
Z 중 각각의 페닐, 피라진일, 피리딘일, 피리다진일 또는 피페라진일은 임의로 R6기로 치환되고;
R1, R2 및 R3은 수소이며;
m은 1이고;
R4는 수소, 할로, 다이플루오로메틸, 트라이플루오로메틸 및 메틸로부터 선택되며;
R6은 수소, 할로 및 -C(O)R10으로부터 선택되되, R10은 메틸이고; 그리고
R7은 수소, 할로, 사이아노, 메틸 및 트라이플루오로메틸로부터 선택된다. - 제17항에 있어서, 상기 화합물은 하기로 이루어진 군으로부터 선택된, 암의 치료 방법:
N-[5-(3-플루오로페닐)피리딘-2-일]-2-[5-메틸-6-(피리다진-4-일)피리딘-3-일]아세트아마이드;
2-[5-메틸-6-(2-메틸피리딘-4-일)피리딘-3-일]-N-[5-(피라진-2-일)피리딘-2-일]아세트아마이드(LGK974);
N-(2,3'-바이피리딘-6'-일)-2-(2',3-다이메틸-2,4'-바이피리딘-5-일)아세트아마이드;
N-(5-(4-아세틸피페라진-1-일)피리딘-2-일)-2-(2'-메틸-3-(트라이플루오로메틸)-2,4'- 바이피리딘-5-일)아세트아마이드;
N-(5-(4-아세틸피페라진-1 -일)피리딘-2-일)-2-(2'-플루오로-3-메틸-2,4'-바이피리딘-5-일)아세트아마이드; 및
2-(2'-플루오로-3-메틸-2,4'-바이피리딘-5-일)-N-(5-(피라진-2-일)피리딘-2-일)아세트아마이드; 또는 이들의 약제학적으로 허용 가능한 염. - 제18항에 있어서, 상기 화합물은 2-[5-메틸-6-(2-메틸피리딘-4-일)피리딘-3-일]-N-[5-(피라진-2-일)피리딘-2-일]아세트아마이드인, 암의 치료 방법.
- 제1항 내지 제19항 중 어느 한 항에 있어서, 상기 치료적 유효량의 상기 화합물은 1일 투약량에서 체중당 약 0.01 내지 20 ㎎/㎏인, 암의 치료 방법.
- 제20항에 있어서, 상기 치료적 유효량의 상기 화합물은 인간에 대해서 약 0.5㎎ 내지 약 1000㎎인, 암의 치료 방법.
- 제1항 내지 제19항 중 어느 한 항에 있어서, 상기 암은 결장직장암, 위암, 간암, 식도암, 장암, 담관암, 췌장암, 자궁내막암 또는 전립선암인, 암의 치료 방법.
- 암을 지닌 대상체가 Wnt 활성을 저해하는 조성물로 치료되어야 할지를 결정하는 방법으로서,
(a) 상기 대상체로부터 생물학적 샘플을 단리하는 단계;
(b) R-스폰딘 융합의 존재 또는 부재를 확인하기 위하여 상기 생물학적 샘플에 대한 검정을 수행하는 단계; 및
(c) 상기 생물학적 샘플이 R-스폰딘 융합을 함유한다면 상기 대상체가 치료적 유효량의 포큐파인의 길항제를 포함하는 조성물로 치료되어야 한다고 결정하는 단계를 포함하는, 방법. - 제23항에 있어서, 상기 R-스폰딘 융합은,
(1) PTPRKe1-Rspo3e2 융합;
(2) PTPRKe7-Rspo3e2 융합;
(3) EIF3Ee1-Rspo2e2 융합; 또는
(4) EIF3Ee1-Rspo2e3 융합을 포함하는, 방법. - 제23항에 있어서, 상기 R-스폰딘 융합은,
(1) EMC2e1-Rspo2e2 융합;
(2) PVT1-Rspo2e2 융합;
(3) PVT1-Rspo2e3 융합;
(4) HNF4G-Rspo2e2 융합;
(5) PTPRKe13-Rspo3e2 융합; 또는
(6) PTPRKe6X-Rspo3e2 융합을 포함하는, 방법. - 제23항 내지 제25항 중 어느 한 항에 있어서, 상기 대상체는 R-스폰딘 융합을 지니지 않는 것으로 결정된 대조 대상체에서의 R-스폰딘 mRNA 발현 수준보다 더 높은 R-스폰딘 mRNA 발현 수준을 가지는 것으로 결정되는, 방법.
- 제24항에 있어서, 상기 -R스폰딘 융합은 서열번호 58, 서열번호 59, 서열번호 62, 또는 서열번호 63 중 어느 한 항의 접합 서열을 포함하는, 방법.
- 제25항에 있어서, 상기 EMC2e1-Rspo2e2 융합은 서열번호 64의 접합 서열을 포함하는, 방법.
- 제25항에 있어서, 상기 PVT1-Rspo2e2 융합은 서열번호 65의 접합 서열을 포함하는, 방법.
- 제25항에 있어서, 상기 PVT1-Rspo2e3 융합은 서열번호 66의 접합 서열을 포함하는, 방법.
- 제25항에 있어서, 상기 HNF4G-Rspo2e2 융합은 서열번호 67의 접합 서열을 포함하는, 방법.
- 제25항에 있어서, 상기 PTPRKe13-Rspo3e2 융합은 서열번호 61의 접합 서열을 포함하는, 방법.
- 제25항에 있어서, 상기 PTPRKe6X-Rspo3e2 융합은 서열번호 60의 접합 서열을 포함하는, 방법.
- 제23항 내지 제33항 중 어느 한 항에 있어서, 상기 R스폰딘은 Rspo2 또는 Rsp3이고, 그리고 상기 융합 유전자는 다른 유전자에 융합되지 않은 R스폰딘과 비교해서 과발현되는, 방법.
- 제23항 내지 제34항 중 어느 한 항에 있어서, 상기 포큐파인 길항제는 하기 화학식 (I)의 화합물 또는 이의 생리학적으로 허용 가능한 염을 포함하는, 암의 치료 방법:
식 중,
X1, X2, X3, X4, X5, X6, X7, X8은 독립적으로 CR4 또는 N이고;
Y1은 수소 또는 CR4이고; Y2, Y3은 독립적으로 수소, 할로 또는 CR3이며;
R1은 몰폴린일, 피페라진일, 퀴놀린일, , 아릴, C1 -6 복소환, N, O 및 S로부터 선택된 1 내지 2개의 헤테로원자를 함유하는 5 또는 6원 헤테로아릴이고;
R2는 수소, 할로, 몰폴린일, 피페라진일, 퀴놀린일, , 아릴, C1-6 복소환, N, O 및 S로부터 선택된 1 내지 2개의 헤테로원자를 함유하는 5 또는 6원 헤테로아릴이며;
R3은 수소, 할로, 사이아노, 임의로 할로, 아미노, 하이드록실, 알콕시 또는 사이아노로 치환된, C1 -6 알킬, C1 -6 알콕시이고;
R4는 수소, 할로, C1 - 6알콕시, -S(O)2R5, -C(O)OR5, -C(O)R5, -C(O)NR6R7, C1 -6 알킬, C2 -6 알켄일 또는 C2 -6 알킨일이되, 이들 각각은 임의로 할로, 아미노, 하이드록실, 알콕시 또는 사이아노로 치환될 수 있으며;
R5, R6 및 R7은 독립적으로 수소, C1 -6 알킬, C2 -6 알켄일 또는 C2 -6 알킨일이되, 이들 각각은 임의로 할로, 아미노, 하이드록실, 알콕시 또는 사이아노로 임의로 치환될 수 있다. - 제35항에 있어서, 상기 5 또는 6원 헤테로아릴은 하기로부터 선택되는, 방법:
식 중,
R4는 수소, 할로, C1 - 6알콕시, -S(O)2R5, -C(O)OR5, -C(O)R5, -C(O)NR6R7, C1 -6 알킬, C2 -6 알켄일 또는 C2 -6 알킨일이되, 이들 각각은 임의로 할로, 아미노, 하이드록실, 알콕시 또는 사이아노로 치환될 수 있고;
R5, R6 및 R7은 독립적으로 수소, C1 -6 알킬, C2 -6 알켄일 또는 C2 -6 알킨일이되, 이들 각각은 임의로 할로, 아미노, 하이드록실, 알콕시 또는 사이아노로 치환될 수 있으며; 그리고
R8은 수소 또는 C1 -6 알킬이다. - 제35항 또는 제36항에 있어서, R1 및 R2는 독립적으로 1 또는 2개의 R4기로 치환되는, 방법.
- 제35항 내지 제37항 중 어느 한 항에 있어서, 상기 화합물은 하기로부터 선택되는, 방법:
6-(2-메틸피리딘-4-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
N-(3-메틸-4-(2-메틸피리딘-4-일)벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
6-(3-플루오로페닐)-N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)아이소퀴놀린-1-아민;
2-(2-메틸피리딘-4-일)-N-(4-(2-메틸피리딘-4-일)벤질)-1,6-나프티리딘-5-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-2-페닐피리도[4,3-b]피라진-5-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리딘-4-일)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-페닐-2,7-나프티리딘-1-아민;
6-(3-클로로페닐)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
6-(3-플루오로페닐)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
6-(3-플루오로페닐)-N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)-2,7-나프티리딘-1-아민;
6-(3-플루오로페닐)-N-(4-(2-(트라이플루오로메틸)피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(3-플루오로페닐)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리미딘-5-일)-2,7-나프티리딘-1-아민;
6-(5-메틸피리딘-3-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
6-(6-메틸피리딘-3-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
3-(8-(4-(2-메틸피리딘-4-일)벤질아미노)-2,7-나프티리딘-3-일)벤조나이트릴;
4-(8-(4-(2-메틸피리딘-4-일)벤질아미노)-2,7-나프티리딘-3-일)벤조나이트릴;
6-(4-플루오로페닐)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-m-톨릴-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리딘-2-일)-2,7-나프티리딘-1-아민;
6-(2-플루오로피리딘-4-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
6-(2-플루오로페닐)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리딘-3-일)-2,7-나프티리딘-1-아민;
N-(바이페닐-4-일메틸)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
6-(2-메틸피리딘-4-일)-N-((5-페닐피리딘-2-일)메틸)-2,7-나프티리딘-1-아민;
6-(3-플루오로페닐)-N-((2'-(트라이플루오로메틸)-2,4'-바이피리딘-5-일)메틸)-2,7-나프티리딘-1-아민;
N-(3-플루오로-4-(2-플루오로피리딘-4-일)벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
6-(2-메틸피리딘-4-일)-N-((2'-(트라이플루오로메틸)-2,4'-바이피리딘-5-일)메틸)-2,7-나프티리딘-1-아민;
N-((3-플루오로-2'-(트라이플루오로메틸)-2,4'-바이피리딘-5-일)메틸)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
N-(3-플루오로-4-(2-메틸피리딘-4-일)벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
N-((2'-플루오로-2,4'-바이피리딘-5-일)메틸)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
4-(5-(((6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-일)아미노)메틸)피리딘-2-일)티오몰폴린 1,1-다이옥사이드;
6-(2-메틸피리딘-4-일)-N-(4-(피리다진-4-일)벤질)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피라진-2-일)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리다진-4-일)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-몰폴리노-2,7-나프티리딘-1-아민;
6-(4-메틸피페라진-1-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
4-(8-((4-(2-메틸피리딘-4-일)벤질)아미노)-2,7-나프티리딘-3-일)티오몰폴린 1,1-다이옥사이드;
N-(3-플루오로-4-(2-플루오로피리딘-4-일)벤질)-6-(3-플루오로페닐)-2,7-나프티리딘-1-아민;
N-(3-플루오로-4-(2-메틸피리딘-4-일)벤질)-6-(3-플루오로페닐)-2,7-나프티리딘-1-아민;
N-((3-플루오로-2'-(트라이플루오로메틸)-2,4'-바이피리딘-5-일)메틸)-6-(3-플루오로페닐)-2,7-나프티리딘-1-아민;
N-((2'-플루오로-2,4'-바이피리딘-5-일)메틸)-6-(3-플루오로페닐)-2,7-나프티리딘-1-아민;
6-(3-플루오로페닐)-N-(3-메틸-4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
4-(5-(((6-(3-플루오로페닐)-2,7-나프티리딘-1-일)아미노)메틸)피리딘-2-일)티오몰폴린 1,1-다이옥사이드;
N-(4-클로로벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
N-(4-메틸벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
6-(2-메틸피리딘-4-일)-N-(피리딘-3-일메틸)-2,7-나프티리딘-1-아민;
N-벤질-2-(3-플루오로페닐)-1,6-나프티리딘-5-아민;
2-(3-플루오로페닐)-N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)-1,6-나프티리딘-5-아민;
N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)-2-(2-메틸피리딘-4-일)-1,6-나프티리딘-5-아민;
N-((6-(3-플루오로페닐)피리딘-3-일)메틸)-2-(2-메틸피리딘-4-일)-1,6-나프티리딘-5-아민;
N-(4-(2-플루오로피리딘-4-일)벤질)-2-(2-메틸피리딘-4-일)-1,6-나프티리딘-5-아민;
2-(2-메틸피리딘-4-일)-N-(4-(2-(트라이플루오로메틸)피리딘-4-일)벤질)-1,6-나프티리딘-5-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-2-(2-메틸피리딘-4-일)-1,6-나프티리딘-5-아민;
N-(바이페닐-4-일메틸)-6-(3-플루오로페닐)아이소퀴놀린-1-아민;
N-((2-플루오로바이페닐-4-일)메틸)-6-(3-플루오로페닐)아이소퀴놀린-1-아민;
N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)-6-페닐아이소퀴놀린-1-아민;
6-(3-클로로페닐)-N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)아이소퀴놀린-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-페닐아이소퀴놀린-1-아민;
6-(2-메틸피리딘-4-일)-N-(4-(2-메틸피리딘-4-일)벤질)아이소퀴놀린-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리딘-4-일)아이소퀴놀린-1-아민;
6-(6-메틸피리딘-3-일)-N-(4-(2-메틸피리딘-4-일)벤질)아이소퀴놀린-1-아민;
6-(2-메틸피리딘-4-일)-N-(4-(2-메틸피리딘-4-일)벤질)아이소퀴놀린-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리딘-3-일)아이소퀴놀린-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피라진-2-일)아이소퀴놀린-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(피리다진-4-일)아이소퀴놀린-1-아민;
N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)-6-(피라진-2-일)아이소퀴놀린-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(피라진-2-일)아이소퀴놀린-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(피리딘-2-일)아이소퀴놀린-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(3-플루오로페닐)아이소퀴놀린-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(5-메틸피리딘-3-일)아이소퀴놀린-1-아민;
N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)-2-페닐피리도[4,3-b]피라진-5-아민;
2-(3-플루오로페닐)-N-(4-(2-메틸피리딘-4-일)벤질)피리도[4,3-b]피라진-5-아민;
2-(3-플루오로페닐)-N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)피리도[4,3-b]피라진-5-아민;
2-(3-플루오로페닐)-N-(3-메틸-4-(2-메틸피리딘-4-일)벤질)피리도[4,3-b]피라진-5-아민;
N-(3-플루오로-4-(2-메틸피리딘-4-일)벤질)-2-(3-플루오로페닐)피리도[4,3-b]피라진-5-아민;
2-(2-메틸피리딘-4-일)-N-(4-(2-메틸피리딘-4-일)벤질)피리도[4,3-b]피라진-5-아민;
N-((2'-메틸-2,4'-바이피리딘-5-일)메틸)-2-(2-메틸피리딘-4-일)피리도[4,3-b]피라진-5-아민;
N-(3-메틸-4-(2-메틸피리딘-4-일)벤질)-2-(2-메틸피리딘-4-일)피리도[4,3-b]피라진-5-아민;
N-(3-플루오로-4-(2-메틸피리딘-4-일)벤질)-2-(2-메틸피리딘-4-일)피리도[4,3-b]피라진-5-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(피라진-2-일)-2,7-나프티리딘-1-아민;
6-(2-메틸몰폴리노)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
(S)-6-(2-메틸몰폴리노)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
(R)-6-(2-메틸몰폴리노)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
1-(4-(8-(4-(2-메틸피리딘-4-일)벤질아미노)-2,7-나프티리딘-3-일)피페라진-1-일)에탄온;
6-(1H-이미다졸-1-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
6-(4-메틸-1H-이미다졸-1-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(1H-테트라졸-5-일)-2,7-나프티리딘-1-아민;
6-(5-메틸-1,3,4-옥사다이아졸-2-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
6-(1-메틸-1H-피라졸-3-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(티아졸-5-일)-2,7-나프티리딘-1-아민;
N-(4-(2-메틸피리딘-4-일)벤질)-6-(옥사졸-5-일)-2,7-나프티리딘-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(5-메틸피리딘-3-일)-2,7-나프티리딘-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
N-((3-플루오로-2'-메틸-2,4'-바이피리딘-5-일)메틸)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-6-(5-플루오로피리딘-3-일)-2,7-나프티리딘-1-아민;
N-(3-메틸-4-(2-메틸피리딘-4-일)벤질)-6-(피라진-2-일)-2,7-나프티리딘-1-아민;
N-(3-플루오로-4-(2-메틸피리딘-4-일)벤질)-6-(피라진-2-일)-2,7-나프티리딘-1-아민;
메틸 4-(8-(4-(2-메틸피리딘-4-일)벤질아미노)-2,7-나프티리딘-3-일)피페라진-1-카복실레이트;
4-(8-(4-(2-메틸피리딘-4-일)벤질아미노)-2,7-나프티리딘-3-일)피페라진-2-온;
2-(4-(8-(4-(2-메틸피리딘-4-일)벤질아미노)-2,7-나프티리딘-3-일)피페라진-1-일)아세토나이트릴;
2-메틸-4-(4-((6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-일아미노)메틸)페닐)피리딘 1-옥사이드;
6-(2-클로로피리딘-4-일)-N-((2',3-다이메틸-2,4'-바이피리딘-5-일)메틸)-2,7-나프티리딘-1-아민;
6-(2-클로로피리딘-4-일)-N-(4-(2-메틸피리딘-4-일)벤질)-2,7-나프티리딘-1-아민;
2-(2-메틸피리딘-4-일)-5-((6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-일아미노)메틸)벤조나이트릴;
N-(3-메톡시-4-(2-메틸피리딘-4-일)벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
N-((3-클로로-2'-메틸-2,4'-바이피리딘-5-일)메틸)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민;
2'-메틸-5-((6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-일아미노)메틸)-2,4'-바이피리딘-3-카보나이트릴; 및 N-(4-(2-(다이플루오로메틸)피리딘-4-일)벤질)-6-(2-메틸피리딘-4-일)-2,7-나프티리딘-1-아민. - 제24항 내지 제34항 중 어느 한 항에 있어서, 상기 포큐파인 길항제는 하기 화학식 (II)의 화합물 또는 이의 생리학적으로 허용 가능한 염을 포함하는, 방법:
식 중,
X1, X2, X3 및 X4는 N 및 CR7로부터 선택되고;
X5, X6, X7 및 X8 중 하나는 N이고, 나머지는 CH이며;
X9는 N 및 CH로부터 선택되고;
Z는 페닐, 피라진일, 피리딘일, 피리다진일 및 피페라진일로부터 선택되며;
Z 중 각각의 페닐, 피라진일, 피리딘일, 피리다진일 또는 피페라진일은 임의로 R6기로 치환되고;
R1, R2 및 R3은 수소이며;
m은 1이고;
R4는 수소, 할로, 다이플루오로메틸, 트라이플루오로메틸 및 메틸로부터 선택되며;
R6은 수소, 할로 및 -C(O)R10으로부터 선택되되, R10은 메틸이고; 그리고
R7은 수소, 할로, 사이아노, 메틸 및 트라이플루오로메틸로부터 선택된다. - 제39항에 있어서, 상기 화합물은 하기로부터 선택되는, 방법:
N-[5-(3-플루오로페닐)피리딘-2-일]-2-[5-메틸-6-(피리다진-4-일)피리딘-3-일]아세트아마이드;
2-[5-메틸-6-(2-메틸피리딘-4-일)피리딘-3-일]-N-[5-(피라진-2-일)피리딘-2-일]아세트아마이드(LGK974);
N-(2,3'-바이피리딘-6'-일)-2-(2',3-다이메틸-2,4'-바이피리딘-5-일)아세트아마이드;
N-(5-(4-아세틸피페라진-1-일)피리딘-2-일)-2-(2'-메틸-3-(트라이플루오로메틸)-2,4'- 바이피리딘-5-일)아세트아마이드;
N-(5-(4-아세틸피페라진-1 -일)피리딘-2-일)-2-(2'-플루오로-3-메틸-2,4'-바이피리딘-5-일)아세트아마이드; 및
2-(2'-플루오로-3-메틸-2,4'-바이피리딘-5-일)-N-(5-(피라진-2-일)피리딘-2-일)아세트아마이드; 또는 이들의 약제학적으로 허용 가능한 염. - 제39항에 있어서, 상기 화합물은 2-[5-메틸-6-(2-메틸피리딘-4-일)피리딘-3-일]-N-[5-(피라진-2-일)피리딘-2-일]아세트아마이드인, 방법.
- 제24항 내지 제41항 중 어느 한 항에 있어서, 상기 암은 결장직장암, 위암, 간암, 식도암, 장암, 담관암, 췌장암, 자궁내막암 또는 전립선암인, 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562166305P | 2015-05-26 | 2015-05-26 | |
| US62/166,305 | 2015-05-26 | ||
| PCT/US2016/034245 WO2016191525A1 (en) | 2015-05-26 | 2016-05-26 | Tumor biomarkers and use thereof |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20180010198A true KR20180010198A (ko) | 2018-01-30 |
Family
ID=57394192
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020177033956A KR20180010198A (ko) | 2015-05-26 | 2016-05-26 | 종양 바이오마커 및 이의 용도 |
Country Status (9)
| Country | Link |
|---|---|
| US (2) | US20180112273A1 (ko) |
| EP (1) | EP3302479A4 (ko) |
| JP (2) | JP2018522062A (ko) |
| KR (1) | KR20180010198A (ko) |
| CN (1) | CN107708699A (ko) |
| AU (1) | AU2016267142B2 (ko) |
| CA (1) | CA2985813A1 (ko) |
| HK (1) | HK1251171A1 (ko) |
| WO (1) | WO2016191525A1 (ko) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2016518328A (ja) | 2013-03-12 | 2016-06-23 | キュアジェニックス インコーポレイテッド | 癌治療のための化合物 |
| US20200306244A1 (en) * | 2016-06-22 | 2020-10-01 | Novartis Ag | Wnt inhibitors for use in the treatment of fibrosis |
| US11649505B2 (en) | 2016-12-21 | 2023-05-16 | Agency For Science, Technology And Research | Kit for identifying malignancy, and uses thereof |
| CN107441045B (zh) | 2017-07-21 | 2018-10-19 | 广州源生医药科技有限公司 | 用于递送Wnt信号通路抑制剂的脂质体制剂及其制备方法 |
| CN108685923A (zh) * | 2018-06-07 | 2018-10-23 | 广州源生医药科技有限公司 | Wnt信号通路抑制剂在治疗LGR5阳性癌症中的应用 |
| CA3121202A1 (en) | 2018-11-30 | 2020-06-04 | Nuvation Bio Inc. | Pyrrole and pyrazole compounds and methods of use thereof |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| UA103918C2 (en) * | 2009-03-02 | 2013-12-10 | Айерем Элелси | N-(hetero)aryl, 2-(hetero)aryl-substituted acetamides for use as wnt signaling modulators |
| UY33469A (es) * | 2010-06-29 | 2012-01-31 | Irm Llc Y Novartis Ag | Composiciones y metodos para modular la via de señalizacion de wnt |
| CN102558173B (zh) * | 2010-12-31 | 2015-05-20 | 广州源生医药科技有限公司 | 抑制wnt信号传导的化合物、组合物及其应用 |
| US20130209473A1 (en) * | 2012-02-11 | 2013-08-15 | Genentech, Inc. | R-spondin translocations and methods using the same |
| CN104302782A (zh) * | 2012-02-28 | 2015-01-21 | 诺华股份有限公司 | 利用rnf43突变状态选择wnt信号转导抑制剂给药的癌症患者 |
| JP2016518328A (ja) * | 2013-03-12 | 2016-06-23 | キュアジェニックス インコーポレイテッド | 癌治療のための化合物 |
| KR20160070136A (ko) * | 2013-10-18 | 2016-06-17 | 제넨테크, 인크. | 항-rspo2 및/또는 항-rspo3 항체 및 그의 용도 |
-
2016
- 2016-05-26 CA CA2985813A patent/CA2985813A1/en not_active Abandoned
- 2016-05-26 AU AU2016267142A patent/AU2016267142B2/en not_active Ceased
- 2016-05-26 WO PCT/US2016/034245 patent/WO2016191525A1/en active Application Filing
- 2016-05-26 CN CN201680029836.1A patent/CN107708699A/zh active Pending
- 2016-05-26 JP JP2018513736A patent/JP2018522062A/ja active Pending
- 2016-05-26 KR KR1020177033956A patent/KR20180010198A/ko not_active Application Discontinuation
- 2016-05-26 EP EP16800691.4A patent/EP3302479A4/en not_active Withdrawn
- 2016-05-26 US US15/575,780 patent/US20180112273A1/en not_active Abandoned
-
2018
- 2018-08-20 HK HK18110677.9A patent/HK1251171A1/zh unknown
-
2020
- 2020-11-09 US US17/092,653 patent/US20210054466A1/en not_active Abandoned
-
2021
- 2021-05-28 JP JP2021089708A patent/JP2021130694A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| US20210054466A1 (en) | 2021-02-25 |
| CA2985813A1 (en) | 2016-12-01 |
| HK1251171A1 (zh) | 2019-01-25 |
| CN107708699A (zh) | 2018-02-16 |
| WO2016191525A1 (en) | 2016-12-01 |
| AU2016267142A1 (en) | 2017-11-30 |
| AU2016267142B2 (en) | 2020-12-24 |
| EP3302479A1 (en) | 2018-04-11 |
| JP2018522062A (ja) | 2018-08-09 |
| JP2021130694A (ja) | 2021-09-09 |
| EP3302479A4 (en) | 2019-01-09 |
| US20180112273A1 (en) | 2018-04-26 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US10660889B2 (en) | Compounds for treatment of cancer | |
| US20210054466A1 (en) | Tumor biomarkers and use thereof | |
| DK2850082T3 (en) | 1- (3,3-dimethyl-butyl) -3- (2-fluoro-4-methyl-5- (7-methyl-2- (methylamino) pyrido (2,3-d) pyrimidin-6-yl) phenyl) urea as a Raf kinase inhibitor for the treatment of cancer | |
| KR102453519B1 (ko) | 인간 ezh2의 억제제 및 이의 사용 방법 | |
| JP6901394B2 (ja) | 癌の処置に有用な変異型idh1阻害剤 | |
| WO2017161269A1 (en) | Inhibitors of ret receptor tyrosine kinases | |
| TWI716686B (zh) | N-(氮雜芳基)環內醯胺-1-甲醯胺衍生物及其製備方法和應用 | |
| JP6794514B2 (ja) | Fgfr4阻害剤としての縮環二環式ピリジル誘導体の使用 | |
| CN109311888A (zh) | 新的哌啶基衍生物,其制备方法和含有它们的药物组合物 | |
| CN104814970A (zh) | 抑制egfr导致的癌症中细胞增殖的方法 | |
| KR20080027775A (ko) | 피롤(2,3-b)피리딘 유도체 단백질 키나제 억제제 | |
| KR20080090381A (ko) | 테라뮤틴 조절물질 | |
| CN116406271A (zh) | 双环类化合物 | |
| KR20180011089A (ko) | Ttk 억제제 화학요법을 위한 예후 바이오마커 | |
| KR20210135521A (ko) | 피롤로피라졸 유도체 | |
| JP2023513448A (ja) | 複素環式化合物およびその使用 | |
| EP4289427A1 (en) | Dihydro[1,8]naphthyridin-7-one and pyrido[3,2-b][1,4]oxazin-3-one for use in treating cancer, and metastases in particular. | |
| CN101501040A (zh) | 氨基-咪唑啉以及它们作为治疗认知缺损、阿尔茨海默病、神经变性和痴呆的药物的用途 | |
| TW201625565A (zh) | 用於治療癌症之化合物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal |