KR20160078956A - 취약 x 증후군 및 관련 장애의 치료 방법 - Google Patents
취약 x 증후군 및 관련 장애의 치료 방법 Download PDFInfo
- Publication number
- KR20160078956A KR20160078956A KR1020167009040A KR20167009040A KR20160078956A KR 20160078956 A KR20160078956 A KR 20160078956A KR 1020167009040 A KR1020167009040 A KR 1020167009040A KR 20167009040 A KR20167009040 A KR 20167009040A KR 20160078956 A KR20160078956 A KR 20160078956A
- Authority
- KR
- South Korea
- Prior art keywords
- mice
- metadoxine
- fmr1
- metadoxin
- treatment
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4415—Pyridoxine, i.e. Vitamin B6
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/4015—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil having oxo groups directly attached to the heterocyclic ring, e.g. piracetam, ethosuximide
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
- G01N33/6893—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids related to diseases not provided for elsewhere
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/52—Predicting or monitoring the response to treatment, e.g. for selection of therapy based on assay results in personalised medicine; Prognosis
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Biomedical Technology (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Urology & Nephrology (AREA)
- Molecular Biology (AREA)
- Immunology (AREA)
- Hematology (AREA)
- Biotechnology (AREA)
- Food Science & Technology (AREA)
- Pathology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- General Physics & Mathematics (AREA)
- Cell Biology (AREA)
- Biochemistry (AREA)
- Analytical Chemistry (AREA)
- Microbiology (AREA)
- Physics & Mathematics (AREA)
- Neurosurgery (AREA)
- Neurology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Investigating Or Analysing Biological Materials (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Medicinal Preparation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Steroid Compounds (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Oxygen Or Sulfur (AREA)
Abstract
본 발명은 취약 X 증후군 및 관련 장애, 예컨대 자폐 범주성 장애의 징후 또는 증상의 완화 방법을 제공한다.
Description
관련 출원
본원은 그 내용 전체가 각각 본원에 참고로 포함된, 2013년 9월 9일 출원된 미국 특허 가출원 USSN 61/875,384, 2013년 9월 26일 출원된 미국 특허 가출원 USSN 14/038258, 및 2014년 5월 9일 출원된 미국 특허 가출원 USSN 61/991,351을 기초로 한 우선권 및 이익을 주장한다.
발명의 분야
본 발명은 일반적으로 취약 X 증후군 및 관련 장애의 증상의 치료 또는 완화 방법에 관한 것이다.
그 명칭이 암시하는 바와 같이 취약 X 증후군 (FXS)은 지도 위치 Xq 27.3에서 중기 염색체 내의 동위염색분체 갭 (isochromatid gap)으로서 발현되는 취약 부위와 연관된다. 취약 X 증후군은 X 염색체 상에 위치하는 취약 X 정신 지체 1 (FMR1) 유전자의 5'-비번역 영역의 돌연변이에 의해 야기되는 유전 질환이다. FXS를 일으키는 돌연변이는 취약 X 정신 지체 유전자 FMR1 내의 CGG 반복체와 연관된다. 대부분의 건강한 개체에서, CGG 반복체의 총수는 10 내지 40 미만이고, 평균 약 29이다. 취약 X 증후군에서, CGG 서열은 200 내지 1,000회 초과까지 반복된다. 대상체가 약 200개 초과의 CGG 반복체를 보유하면, 취약 X 유전자가 과메틸화되고, 이는 유전자를 침묵시킨다. 그 결과, 취약 X 정신 지체 단백질 (FMRP)은 생산되지 않거나 감소한 수준으로 생산되고, 대상체는 FXS의 소견을 보인다.
FMR1 유전자의 전돌연변이 팽창 (premutation expansion) (55-200개의 CGG 반복체)은 일반적인 인구집단에서 빈번하여, 추정 유병률은 259명의 여성 중 1명 및 812명의 남성 중 1명이다. 전돌연변이 보유자는 대개 정상 IQ를 갖지만, 불안증과 같은 정서 문제는 흔하다. 보다 고령의 남성 전돌연변이 보유자 (50세 이상)는 진행성 활동 떨림 (intention tremor) 및 운동실조를 발병한다. 이들 운동 장애는 종종, 기억 상실, 불안증, 및 실행 기능 결핍, 은둔 또는 과민한 행동, 및 치매를 비롯한 진행성 인지 및 행동 문제를 동반한다. 상기 장애는 취약 X-염색체 연관 떨림/운동실조 증후군 (FXTAS)으로 지정되었다. FXTAS이 있는 대상체에서 자기 공명 영상화는 중간 소뇌 다리 및 인접한 소뇌 백색질에서 T2-가중 신호 강도의 증가를 보인다.
FXS는 발현성 감퇴를 갖는 X-연관 우성 장애로서 구분한다. 취약 X 돌연변이를 보유하는 경우 두 성별 모두 지적 장애를 보일 수 있고, 중증도는 가변적이다. FXS가 있는 아동 및 성인은 자폐-유사 특징 및 경향을 비롯한 다양한 정도의 지적 장애 또는 학습 장애와 행동 및 정서 문제를 갖는다. FXS가 있는 어린 아동은 종종 앉고 걷고 말하는 방법 학습과 같은 발달 이정표가 지연된다. 이환된 아동은 빈번한 짜증, 주의 집중 곤란, 빈번한 발작 (예를 들어, 측두엽 발작)을 일으킬 수 있고, 종종 매우 불안하고, 쉽게 당황하고, 감각 과다각성 장애, 위장 장애가 있을 수 있고, 언어 문제 및 이상한 행동, 예컨대 손 퍼덕이기 및 손 물어뜯기가 있을 수 있다.
FXS는 대상체의 샘플 (예를 들어, 혈액 샘플, 구강 샘플)에 대해 수행한 확립된 유전자 시험에 의해 진단될 수 있다. 시험은 CGG 반복체의 수에 기반하여 대상체의 FMR1 유전자 내에 돌연변이 또는 전돌연변이가 존재하는지 여부를 결정한다.
FXS가 있는 대상체는 또한 자폐증이 있을 수 있다. 자폐증으로 진단된 모든 아동의 약 5%에서는 FMR1 유전자 내에 돌연변이가 있고, 또한 취약 X 증후군 (FXS)이 있다. 자폐 범주성 장애 (ASD)는 FXS가 있는 남성의 약 30%와 여성의 약 20%에서 보이고, FXS 개체의 추가의 30%는 ASD 진단 없이 자폐 증상을 보인다. 지적 장애가 FXS의 전형적인 특징이지만, FXS가 있는 대상체는 종종 경증에서 수줍음, 눈 마주치기 어려움, 및 사회적 불안증부터 중증에서 손 퍼덕이기, 손 물어뜯기 및 집착 언어에 이르는 자폐 특징을 보인다. FXS가 있는 대상체는 자폐증과 연관된 다른 증상, 예컨대 주의력 결핍 및 과잉행동, 발작, 감각 자극에 대한 과민성, 강박 행동 및 변경된 위장 기능을 보인다. FMR1 돌연변이는 단일 단백질 (FMRP)의 발현을 방지하거나 크게 감소시킨다. FMRP 부재 하에서의 뇌 발달이 FXS의 주요 증상을 일으키는 것으로 생각된다.
핵심 증상에 추가로, FXS가 있는 아동은 종종 심각한 행동 장애, 예컨대 자극과민성, 공격 및 자해 행동이 있다. FXS이 있는 남성 (연령 8-24)의 최근 연구에서, 2개월의 관찰 기간 동안 자해 행동은 대상체의 79%에서 및 공격적 행동은 75%에서 보고되었다.
FXS이 있는 인간에 대한 현재 이용가능한 치료 요법은 예를 들어, 행동 수정, 및 항우울제와 항정신병 약물을 포함한 일정 범위의 의약 (FXS 치료에 대해 FDA에서 승인받지 않은)을 사용한 치료를 포함한다. FXS 및 자폐증이 있는 개체에서 언어 및 사회화를 개선하기 위해 인지 행동 요법이 사용되어 왔다. 최근에, 비전형적 항정신병약인 리스페리돈을 사용하는 약물학적 치료가 자폐증이 있는 개체의 치료에서 비-약물학적 방안을 증대시키기 위해 일반적으로 사용되고 있다. 자폐 아동에서 리스페리돈의 무작위 위약-대조 시험은 이상 행동 척도 (Aberrant Behavior Checklist) 및 임상 총괄 평가 척도-개선 (Clinical Global Impressions-Improvement)의 자극과민성 하위척도에 대한 유의한 개선을 입증하였다 (McCracken, J.T., et al., N. Engl. J. Med. 347:314-321 (2002)). 그러나, 유해 사례는 체중 증가, 식욕 증가, 피로, 졸림, 어지러움, 및 침흘림을 포함한다. 사회적 고립 및 의사소통은 리스페리돈의 투여에 의해 개선되지 않았고, 추체외로 증상 및 운동 장애와 같은 유해한 부작용이 자폐 아동에서 리스페리돈 사용과 연관된 바 있었다. 현재 치료 요법은 종종 효과적이지 않거나 특히 항정신병 약물의 경우에 장기 사용시 바람직하지 않은 부작용을 일으킬 수 있으므로, 새로운 치료제의 개발이 필요하다.
발명의 개요
다양한 측면에서, 본 발명은 치료를 필요로 하는 대상체에게 메타독신을 포함하는 조성물을 투여함으로써, 취약 X 증후군 또는 관련 장애의 증상을 치료하거나 완화하는 방법을 제공한다. 증상은 예를 들어, 학습 장애 또는 사회성 장애이다. 대상체는 취약 X 증후군 또는 자폐 범주성 장애가 있다. 관련 장애는 자폐 범주성 장애이다.
일부 측면에서, 100 - 3000 mg의 메타독신 총 1일 용량을 투여한다. 메타독신은 매일, 격일 또는 매주 투여한다.
임의로, 메타독신은 1일에 1, 2, 또는 3개의 투여 형태로 투여한다. 일부 실시양태에서, 메타독신은 지속 방출 경구 투여 형태로 투여되고, 여기서 메타독신은 서방성 (slow release) 형태 및 속방성 (immediate release) 형태의 조합물로서 제제화된다.
예를 들어, 서방성 형태는 적어도 8시간 동안 메타독신의 지속 방출을 제공한다. 서방성 메타독신 대 속방성 메타독신의 상대적인 비율은 약 60:40 내지 80:20이다. 바람직하게는, 서방성 메타독신 대 속방성 메타독신의 상대적인 비율은 약 65:35이다.
달리 규정되지 않으면, 본원에서 사용되는 모든 기술 및 학술 용어는 본 발명이 속하는 기술 분야의 통상의 기술자에 의해 통상적으로 이해되는 바와 동일한 의미를 갖는다. 본원에서 설명된 것과 유사하거나 동등한 방법 및 물질이 본 발명의 실시에 사용될 수 있지만, 적합한 방법 및 물질을 아래에 설명한다. 본원에 언급된 모든 간행물, 특허 출원, 특허, 및 다른 인용문은 명시적으로 그 전체가 참조로 포함된다. 충돌이 있는 경우에, 정의를 포함한 본 명세서가 우선할 것이다. 또한, 본원에 설명되는 물질, 방법 및 실시예는 단지 예시적이고, 제한하는 것으로 의도되지 않는다.
본 발명의 다른 특징 및 이점은 다음 상세한 설명 및 청구항으로부터 명확해지고 그에 의해 포괄될 것이다.
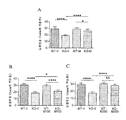
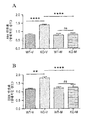
도 1은 환경적 공포 조건화 (contextual fear conditioning)에 대한 2개월령 Fmr1 낙아웃 (knockout) (KO) 또는 야생형 (WT) 마우스에서 비히클 (V) 또는 메타독신 (M) (100, 150, 또는 200 mg/kg)의 7일의 1일 1회 복강내 (ip) 투여의 효과를 보여준다. 구체적으로, 패널 A는 비히클 또는 150 mg/kg의 메타독신의 효과를 보여준다. 패널 B는 비히클 또는 100 mg/kg의 메타독신의 효과를 보여준다. 패널 C는 비히클 또는 200 mg/kg의 메타독신의 효과를 보여준다. 제시된 데이타는 평균 ± 평균의 표준 오차 (sem)이고, N = 10마리 마우스/군이다. *p<0.05, ****p<0.0001, NS = 유의하지 않음.
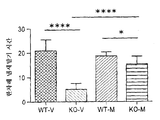
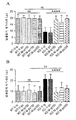
도 2는 사회적 접근 행동에 대한 2개월령 Fmr1 낙아웃 (KO) 또는 야생형 (WT) 마우스에서 비히클 (V) 또는 150 mg/kg 메타독신 (M)의 7일의 1일 1회 복강내 투여의 효과를 보여준다. 제시된 데이타는 평균 ± sem이고, N = 10마리 마우스/군이다. *p<0.05 및 ****p<0.0001.
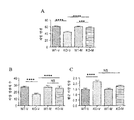
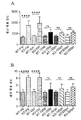
도 3은 2개월령 Fmr1 낙아웃 (KO) 또는 야생형 (WT) 마우스에서 Y형 미로 (Y-maze) 자발 변경 (패널 A), Y형 미로 보상된 변경 (패널 B) 또는 Y형 미로 수조 미로 공간 변별 (패널 C)에 대한 비히클 (V) 또는 150 mg/kg 메타독신 (M)의 7일의 1일 1회 복강내 투여의 효과를 보여준다. 제시된 데이타는 평균 ± sem이고, N = 10마리 마우스/군이다. ***p<0.001, ****p<0.0001, NS = 유의하지 않음.
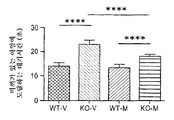
도 4는 2개월령 Fmr1 낙아웃 (KO) 또는 야생형 (WT) 마우스에서 T형 미로 (T-maze) 보상된 변경에 대한 비히클 (V) 또는 150 mg/kg 메타독신 (M)의 7일의 1일 1회 복강내 투여의 효과를 보여준다. 제시된 데이타는 평균 ± sem이고, N = 10마리 마우스/군이다. ****p<0.0001.
도 5는 N = 10마리 야생형 (WT) 또는 Fmr1 낙아웃 (KO) 2개월령 마우스의 군에서 연속 주로 (successive alley) 과제에서 행동에 대한 비히클 (V) 또는 150 mg/kg 메타독신 (M)의 7일의 1일 1회 치료의 효과를 보여준다. 장치의 연속 주로는 마우스를 탐구하기 위해 진행적으로 보다 불안유발성 환경을 제공하였다. 따라서, 주로 아래로의 운동은 불안증을 평가하였다. 추가로, 전체 활동 수준을 또한 이 장치 내에서 정량할 수 있다.
도 6은 2개월령 Fmr1 낙아웃 (KO) 또는 야생형 (WT) 마우스에서 ERK (ERK 활성을 표시함) (패널 A) 및 Akt (Akt 활성을 표시함) (패널 B)의 인산화의 전체 뇌 수준에 대한 비히클 (V) 또는 150 mg/kg 메타독신 (M)의 7일의 1일 1회 복강내 투여의 효과를 보여준다. 제시된 데이타는 평균 ± sem이고, N = 5마리 마우스/군이다. **p<0.01, ***p<0.001, ****p<0.0001, NS = 유의하지 않음.
도 7은 환경적 공포 조건화에 대한 6개월령 Fmr1 낙아웃 (KO) 또는 야생형 (WT) 마우스에서 7일 동안 비히클 (V) 또는 150 mg/kg 메타독신 (M)의 1일 1회 ip 투여의 효과를 보여준다. 제시된 데이타는 평균 ± sem이고, N = 10마리 마우스/군이다. ****p<0.0001 및 ns = 유의하지 않음.
도 8은 한차례 냄새맡기 (sniffing bout)의 수 또는 냄새맡기의 지속시간에 의해 측정할 때, 6개월령 Fmr1 낙아웃 (KO) 또는 야생형 (WT) 마우스에서 사회적 접근 (패널 A 및 C) 및 사회적 기억 (패널 B 및 D) 행동에 대한 7일 동안 비히클 (V) 또는 150 mg/kg 메타독신 (M)의 1일 1회 ip 투여의 효과를 보여준다. 제시된 데이타는 평균 ± sem이고, N = 10마리 마우스/군이다. *p<0.05, ****p<0.0001, 및 ns = 유의하지 않음.
도 9는 6개월령 Fmr1 낙아웃 (KO) 또는 야생형 (WT) 마우스에서 ERK (패널 A) 및 Akt (패널 B)의 인산화의 전체 뇌 수준에 대한 7일 동안 비히클 (V) 또는 150 mg/kg 메타독신 (M)의 1일 1회 ip 투여의 효과를 보여준다. 제시된 데이타는 평균 ± sem이고, N = 10마리 마우스/군이다. *p<0.05, **p<0.01, ****p<0.0001, 및 ns = 유의하지 않음.
도 10은 2개월령 Fmr1 낙아웃 (KO) 또는 야생형 (WT) 마우스에서 환경적 공포 조건화에 대한 7일 동안 1일 1회 150 mg/kg의 메타독신 (M) ip, 또는 비히클 (V) 또는 150 및 300 mg/kg의 메타독신의 경구 투여 (po)의 효과를 보여준다. 제시된 데이타는 평균 ± sem이고, N = 10마리 마우스/군이다. 구체적으로, 패널 A는 Fmr1 낙아웃 및 야생형 마우스에서 비히클을 사용한 ip 및 경구 치료를 보여준다. 패널 B는 야생형 마우스에서 메타독신을 사용한 ip 및 경구 치료를 보여준다. 패널 C는 Fmr1 낙아웃 마우스에서 메타독신을 사용한 ip 및 경구 치료를 보여준다. **p<0.01, ****p<0.0001, 및 ns = 유의하지 않음.
도 11은 2개월령 Fmr1 낙아웃 (KO) 또는 야생형 (WT) 마우스에서 사회적 접근 (패널 A) 및 사회적 기억 (패널 B)에 대한 7일 동안 비히클 (V) 또는 150 또는 300 mg/kg의 메타독신 (M)의 1일 1회 ip 또는 경구 투여 (po)의 효과를 보여준다. 제시된 데이타는 평균 ± sem이고, N = 10마리 마우스/군이다. **p<0.01, ****p<0.0001, 및 ns = 유의하지 않음.
도 12는 2개월령 Fmr1 낙아웃 (KO) 및 야생형 (WT) 마우스에서 유동 세포측정법을 사용하여 측정할 때 림프구 바이오마커 (biomarker)에 대한 7일 동안 비히클 (V) 또는 150 또는 300 mg/kg의 메타독신 (M)의 1일 1회 ip 또는 경구 투여 (po)의 효과를 보여준다. 제시된 바이오마커는 Fmr1 낙아웃 및 야생형 마우스에서 pAkt (패널 A) 및 pERK (패널 B)이다. 제시된 데이타는 평균 ± sem이고, N = 10마리 마우스/군이다. ****p<0.0001, 및 ns = 유의하지 않음.
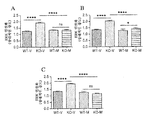
도 13은 2개월령 야생형 (WT) 및 Fmr1 낙아웃 (KO) 마우스의 뇌 영역에서 pERK 수준에 대한 7일 동안 비히클 (V) 또는 150 mg/kg 메타독신 (M)의 1일 1회 ip의 효과를 보여준다. 분석된 영역은 Fmr1 낙아웃 또는 야생형 마우스에서 해마 (패널 A), 전전두 (pre-frontal) 피질 (패널 B), 및 선조체 (패널 C)이었다. 제시된 데이타는 평균 ± sem이고, N = 10마리 마우스/군이다. ****p<0.0001, 및 ns = 유의하지 않음.
도 14는 2개월령 야생형 (WT) 및 Fmr1 낙아웃 (KO) 마우스의 뇌 영역에서 pAkt 수준에 대한 7일 동안 비히클 (V) 또는 150 mg/kg 메타독신 (M)의 1일 1회 ip 투여의 효과를 보여준다. 분석된 영역은 Fmr1 낙아웃 또는 야생형 마우스에서 해마 (패널 A), 전전두 피질 (패널 B), 및 선조체 (패널 C)이었다. 제시된 데이타는 평균 ± sem이고, N = 10마리 마우스/군이다. ****p<0.0001, 및 ns = 유의하지 않음.
도 15는 Fmr1 낙아웃 (KO) 또는 야생형 (WT) 마우스로부터 뉴런 (neuron) 해마 배양액에서 사상위족 (filopodia) 밀도 (패널 A), 길이 (패널 B), 및 폭 (패널 C)에 대한 시험관 내 비히클 (V) 또는 300 μΜ 메타독신 (M)을 사용한 5시간 치료의 효과를 보여준다. 제시된 데이타는 평균 ± sem이다 (야생형, N = 20개의 뉴런, 및 Fmr1 낙아웃 마우스, N = 20개 뉴런). **p<0.01, ***p<0.001, ns = 유의하지 않음.
도 16은 Fmr1 낙아웃 (KO) 또는 야생형 (WT) 마우스로부터 400 μM 해마 절편 (slice)에서 기초 드 노보 (de novo) 단백질 합성에 대한 비히클 (V) 또는 300 μΜ 메타독신 (M)을 사용한 시험관 내 치료 효과를 보여준다. 제시된 데이타는 평균 ± sem이고, N = 6개 절편/군이다. *p<0.001 및 ****p<0.0001.
도 2는 사회적 접근 행동에 대한 2개월령 Fmr1 낙아웃 (KO) 또는 야생형 (WT) 마우스에서 비히클 (V) 또는 150 mg/kg 메타독신 (M)의 7일의 1일 1회 복강내 투여의 효과를 보여준다. 제시된 데이타는 평균 ± sem이고, N = 10마리 마우스/군이다. *p<0.05 및 ****p<0.0001.
도 3은 2개월령 Fmr1 낙아웃 (KO) 또는 야생형 (WT) 마우스에서 Y형 미로 (Y-maze) 자발 변경 (패널 A), Y형 미로 보상된 변경 (패널 B) 또는 Y형 미로 수조 미로 공간 변별 (패널 C)에 대한 비히클 (V) 또는 150 mg/kg 메타독신 (M)의 7일의 1일 1회 복강내 투여의 효과를 보여준다. 제시된 데이타는 평균 ± sem이고, N = 10마리 마우스/군이다. ***p<0.001, ****p<0.0001, NS = 유의하지 않음.
도 4는 2개월령 Fmr1 낙아웃 (KO) 또는 야생형 (WT) 마우스에서 T형 미로 (T-maze) 보상된 변경에 대한 비히클 (V) 또는 150 mg/kg 메타독신 (M)의 7일의 1일 1회 복강내 투여의 효과를 보여준다. 제시된 데이타는 평균 ± sem이고, N = 10마리 마우스/군이다. ****p<0.0001.
도 5는 N = 10마리 야생형 (WT) 또는 Fmr1 낙아웃 (KO) 2개월령 마우스의 군에서 연속 주로 (successive alley) 과제에서 행동에 대한 비히클 (V) 또는 150 mg/kg 메타독신 (M)의 7일의 1일 1회 치료의 효과를 보여준다. 장치의 연속 주로는 마우스를 탐구하기 위해 진행적으로 보다 불안유발성 환경을 제공하였다. 따라서, 주로 아래로의 운동은 불안증을 평가하였다. 추가로, 전체 활동 수준을 또한 이 장치 내에서 정량할 수 있다.
도 6은 2개월령 Fmr1 낙아웃 (KO) 또는 야생형 (WT) 마우스에서 ERK (ERK 활성을 표시함) (패널 A) 및 Akt (Akt 활성을 표시함) (패널 B)의 인산화의 전체 뇌 수준에 대한 비히클 (V) 또는 150 mg/kg 메타독신 (M)의 7일의 1일 1회 복강내 투여의 효과를 보여준다. 제시된 데이타는 평균 ± sem이고, N = 5마리 마우스/군이다. **p<0.01, ***p<0.001, ****p<0.0001, NS = 유의하지 않음.
도 7은 환경적 공포 조건화에 대한 6개월령 Fmr1 낙아웃 (KO) 또는 야생형 (WT) 마우스에서 7일 동안 비히클 (V) 또는 150 mg/kg 메타독신 (M)의 1일 1회 ip 투여의 효과를 보여준다. 제시된 데이타는 평균 ± sem이고, N = 10마리 마우스/군이다. ****p<0.0001 및 ns = 유의하지 않음.
도 8은 한차례 냄새맡기 (sniffing bout)의 수 또는 냄새맡기의 지속시간에 의해 측정할 때, 6개월령 Fmr1 낙아웃 (KO) 또는 야생형 (WT) 마우스에서 사회적 접근 (패널 A 및 C) 및 사회적 기억 (패널 B 및 D) 행동에 대한 7일 동안 비히클 (V) 또는 150 mg/kg 메타독신 (M)의 1일 1회 ip 투여의 효과를 보여준다. 제시된 데이타는 평균 ± sem이고, N = 10마리 마우스/군이다. *p<0.05, ****p<0.0001, 및 ns = 유의하지 않음.
도 9는 6개월령 Fmr1 낙아웃 (KO) 또는 야생형 (WT) 마우스에서 ERK (패널 A) 및 Akt (패널 B)의 인산화의 전체 뇌 수준에 대한 7일 동안 비히클 (V) 또는 150 mg/kg 메타독신 (M)의 1일 1회 ip 투여의 효과를 보여준다. 제시된 데이타는 평균 ± sem이고, N = 10마리 마우스/군이다. *p<0.05, **p<0.01, ****p<0.0001, 및 ns = 유의하지 않음.
도 10은 2개월령 Fmr1 낙아웃 (KO) 또는 야생형 (WT) 마우스에서 환경적 공포 조건화에 대한 7일 동안 1일 1회 150 mg/kg의 메타독신 (M) ip, 또는 비히클 (V) 또는 150 및 300 mg/kg의 메타독신의 경구 투여 (po)의 효과를 보여준다. 제시된 데이타는 평균 ± sem이고, N = 10마리 마우스/군이다. 구체적으로, 패널 A는 Fmr1 낙아웃 및 야생형 마우스에서 비히클을 사용한 ip 및 경구 치료를 보여준다. 패널 B는 야생형 마우스에서 메타독신을 사용한 ip 및 경구 치료를 보여준다. 패널 C는 Fmr1 낙아웃 마우스에서 메타독신을 사용한 ip 및 경구 치료를 보여준다. **p<0.01, ****p<0.0001, 및 ns = 유의하지 않음.
도 11은 2개월령 Fmr1 낙아웃 (KO) 또는 야생형 (WT) 마우스에서 사회적 접근 (패널 A) 및 사회적 기억 (패널 B)에 대한 7일 동안 비히클 (V) 또는 150 또는 300 mg/kg의 메타독신 (M)의 1일 1회 ip 또는 경구 투여 (po)의 효과를 보여준다. 제시된 데이타는 평균 ± sem이고, N = 10마리 마우스/군이다. **p<0.01, ****p<0.0001, 및 ns = 유의하지 않음.
도 12는 2개월령 Fmr1 낙아웃 (KO) 및 야생형 (WT) 마우스에서 유동 세포측정법을 사용하여 측정할 때 림프구 바이오마커 (biomarker)에 대한 7일 동안 비히클 (V) 또는 150 또는 300 mg/kg의 메타독신 (M)의 1일 1회 ip 또는 경구 투여 (po)의 효과를 보여준다. 제시된 바이오마커는 Fmr1 낙아웃 및 야생형 마우스에서 pAkt (패널 A) 및 pERK (패널 B)이다. 제시된 데이타는 평균 ± sem이고, N = 10마리 마우스/군이다. ****p<0.0001, 및 ns = 유의하지 않음.
도 13은 2개월령 야생형 (WT) 및 Fmr1 낙아웃 (KO) 마우스의 뇌 영역에서 pERK 수준에 대한 7일 동안 비히클 (V) 또는 150 mg/kg 메타독신 (M)의 1일 1회 ip의 효과를 보여준다. 분석된 영역은 Fmr1 낙아웃 또는 야생형 마우스에서 해마 (패널 A), 전전두 (pre-frontal) 피질 (패널 B), 및 선조체 (패널 C)이었다. 제시된 데이타는 평균 ± sem이고, N = 10마리 마우스/군이다. ****p<0.0001, 및 ns = 유의하지 않음.
도 14는 2개월령 야생형 (WT) 및 Fmr1 낙아웃 (KO) 마우스의 뇌 영역에서 pAkt 수준에 대한 7일 동안 비히클 (V) 또는 150 mg/kg 메타독신 (M)의 1일 1회 ip 투여의 효과를 보여준다. 분석된 영역은 Fmr1 낙아웃 또는 야생형 마우스에서 해마 (패널 A), 전전두 피질 (패널 B), 및 선조체 (패널 C)이었다. 제시된 데이타는 평균 ± sem이고, N = 10마리 마우스/군이다. ****p<0.0001, 및 ns = 유의하지 않음.
도 15는 Fmr1 낙아웃 (KO) 또는 야생형 (WT) 마우스로부터 뉴런 (neuron) 해마 배양액에서 사상위족 (filopodia) 밀도 (패널 A), 길이 (패널 B), 및 폭 (패널 C)에 대한 시험관 내 비히클 (V) 또는 300 μΜ 메타독신 (M)을 사용한 5시간 치료의 효과를 보여준다. 제시된 데이타는 평균 ± sem이다 (야생형, N = 20개의 뉴런, 및 Fmr1 낙아웃 마우스, N = 20개 뉴런). **p<0.01, ***p<0.001, ns = 유의하지 않음.
도 16은 Fmr1 낙아웃 (KO) 또는 야생형 (WT) 마우스로부터 400 μM 해마 절편 (slice)에서 기초 드 노보 (de novo) 단백질 합성에 대한 비히클 (V) 또는 300 μΜ 메타독신 (M)을 사용한 시험관 내 치료 효과를 보여준다. 제시된 데이타는 평균 ± sem이고, N = 6개 절편/군이다. *p<0.001 및 ****p<0.0001.
발명의 상세한 설명
본 발명은 메타독신이 취약 X 증후군에 대한 타당한 동물 모델에서 인지 및 사회적 기능을 유의하게 개선한다는 발견에 관한 것이다.
구체적으로, 메타독신은 환경적 공포 패러다임 동안 기억 및 학습을 용량-의존 방식으로 유의하게 개선하였고, 2개의 최고 용량 수준 (150 및 200 mg/kg)은 Fmr1 KO 마우스 학습 및 기억 결핍을 WT 마우스 수준과 유사한 정도로 완전히 구제하였다. 또한, 150 mg/kg 메타독신으로 치료한 Fmr1 KO 마우스에서 기억의 유의한 개선이, 인지 성과에서 유의한 개선을 보여주는 T형 미로와 같은 행동 시험에서 밝혀졌다. 이들 발견은 150 mg/kg의 메타독신으로 치료한 KO 마우스의 개선된 사회적 상호작용에 의해 보충되었다. 중요하게는, 취약 X의 타당한 마우스 모델에서 메타독신을 사용한 치료 후에 개선된 인지 실행 기능, 작업 기억 및 사회적 상호작용은 신경 신호전달 경로 및 산화 스트레스를 반영하는 생화학적 마커의 정상화와 상호관련된다.
취약 X 증후군은 자폐증의 남아들 사이에서 가장 광범위한 단일-유전자 원인 및 정신 지체의 유전적 원인이다. FMR1 유전자 돌연변이가 있는 사람은 누구라도 이 돌연변이를 그의 아이에게 전달할 수 있다. 미국 질병관리본부 (Centers for Disease Control and Prevention: CDC)에 따르면, 4,000명의 남성 중 약 1명 및 8,000명의 여성 중 약 1명이 취약 X 증후군을 갖는다. 돌연변이가 있는 모든 사람이 취약 X 증후군의 징후 또는 증상을 보이는 것은 아니고, 장애는 경증부터 중증까지 다양하고, 또한 신체적 특징, 예컨대 긴 얼굴, 크거나 튀어나온 귀, 큰 고환 (거대고환증), 및 행동적 특징, 예컨대 정형성 운동 (예를 들어 손 퍼덕이기), 및 사회적 불안증으로 다양할 것이다. 취약 X 증후군은 X 염색체 상에서 발견되는, 취약 X 정신 지체 1 (FMR1) 유전자 내의 변화 또는 돌연변이로부터 야기된다. 상기 유전자는 정상적으로 취약 X 정신 지체 단백질, FMRP로 불리는 단백질을 만든다. 이 단백질은 뇌 및 신경계 내에서 세포들 사이에 연결을 생성하고 유지하기 위해 중요하다. 상기 돌연변이는 신체가 상기 단백질을 단지 적게 만들거나 전혀 만들지 못하게 하고, 이것은 종종 취약 X 증후군의 증상을 일으킨다.
취약 X 증후군 (FXS)은 종종 자폐 범주성 장애와 같은 다른 병태와 함께 발생한다. 자폐 범주성 장애 (ASD)는 심각한 사회적, 의사소통 및 행동 문제를 일으킬 수 있는 일군의 발달 장애이다. ASD가 있는 사람은 그들의 뇌에서 정보를, 다른 사람과 다르게 취급한다.
ASD는 "범주 (spectrum) 장애"이다. 이것은 ASD가 각각의 사람에게 상이한 방식으로 영향을 미치고, 매우 경증부터 중증까지 다양할 수 있음을 의미한다. ASD가 있는 사람은 몇몇 유사한 증상, 예컨대 사회적 상호작용의 문제를 공유한다. 그러나, 증상이 시작할 때 얼마나 중증인지, 및 증상의 정확한 성질에서 차이가 존재한다. ASD는 자폐 장애 (또한 "고전적" 자폐증으로도 불림), 아스퍼거 (Asperger) 증후군 및 전반적 발달 장애 (Pervasive Developmental Disorder)를 포함한다,
현재, 미국 식품의약국 (Food and Drug Administration: FDA)에서는 특정적으로 취약 X 또는 그의 증상의 치료를 위해 어떠한 약물도 승인하지 않았다. 취약 X 증후군의 특정 증상을 치료하기 위해 승인외 용도(off label)로 사용되는 의약이 존재하지만, 결과는 환자마다 매우 다양하고, 이들 의약 중 일부는 심각한 위험을 보유하고, 처음에 증상을 악화시킬 수 있거나 효과를 보이기 위해 수주가 소요될 수 있다. 본 발명은 취약 X 또는 그의 증상을 치료하기 위한 약물에 대한 미충족 요구를 제공한다.
따라서, 본 발명은 대상체에게 메타독신을 포함하는 조성물을 투여함으로써, 취약 X 증후군 및/또는 자폐 범주성 장애의 징후 또는 증상을 치료, 예방 또는 완화하는 방법을 제공한다.
일반적으로, 취약 X의 증후 또는 증상은 5개의 카테고리로 분류된다: 예를 들어 취약 X와 일반적으로 연관되거나 특색을 공유하는 지능 및 학습; 신체, 사회 및 정서적, 말 및 언어 및 감각 장애. 취약 X가 있는 개체는 손상된 지적 기능, 사회적 불안증, 언어 곤란 및 특정 감각에 대한 민감성이 있다. 메타독신을 사용하는 치료는 취약 X 증후군이 있는 대상체에서 학습을 개선하고 사회성을 증가시킨다.
자폐 범주성 장애는 취약 X 증후군이 있는 개체와 흔히 연관된다. 자폐증의 징후 또는 증상은 심각한 언어 지연, 사회적 및 의사소통 문제, 및 이상한 행동 및 관심을 포함한다. 자폐 장애가 있는 많은 사람이 또한 지적 장애를 갖는다. 아스퍼거 증후군의 개체는 대체로 자폐 장애의 몇몇 보다 경증 증상을 갖는다. 예를 들어, 이들은 사회적 문제 및 이상한 행동 및 관심을 가질 수 있다. 전반적 발달 장애 (PDD-NOS)가 있는 개체는 자폐 장애 또는 아스퍼거 증후군에 대한 일부 기준을 만족하지만, 전부가 PDD-NOS으로 진단될 수 있는 것은 아니다. PDD-NOS가 있는 사람은 대체로 자폐 장애가 있는 사람보다 증상이 더 적고 더 경증이다. 상기 증상은 단지 사회적 및 의사소통 문제만 일으킬 수도 있다. 메타독신을 사용한 치료는 자폐증의 증상을 개선한다.
메타독신은 피롤리돈 카르복실레이트 (PCA)와 피리독신 (비타민 B6) 사이의 이온-쌍이고, 상기 2가지 화합물은 염화에 의해 단일 생성물로 연결된다. PCA와의 쌍 형성은 피리독신의 약물 활성을 상승적으로 증가시킨다 (예를 들어, 미국 특허 4,313,952 참조). 메타독신은 물 및 위액 내에 잘 용해된다. 약물의 경구 흡수는 빠르고, 높은 생체이용률 (60-80%)을 갖는다. 인간 혈청 내의 메타독신의 반감기는 짧고 (40-60분), 경구 및 정맥내 투여 사이에 큰 차이는 없다 ([Addolorato et al., 상기 문헌]; [Lu Yuan et al., Chin. Med. 1 2007 120(2) 160-168]).
메타독신은 500 mg 정제 및 300 mg 주사제 형태로 처방 약물로서 여러 국가에서 시판되고 있다. 정제는 500 mg의 메타독신, 미정질 셀룰로스 및 스테아르산마그네슘을 함유한다. 앰플은 300 mg의 메타독신, 메타중아황산나트륨, EDTA 소듐, 메틸-p-히드록시벤조에이트 및 물을 함유한다.
특정 실시양태에서, 전체적으로 또는 부분적으로 지속 또는 제어 방출을 위해 제제화된 본 발명의 메타독신 조성물은 취약 X 증후군 및 그와 관련된 병태/장애, 예컨대 자폐 범주성 장애의 징후 또는 증상의 치료, 예방 및/또는 완화 시에 메타독신의 보다 효율적인 사용을 가능하게 한다.
상기 설명된 본 발명의 특정 방법에서, 메타독신 또는 그의 허용되는 유도체는 대상체에게 투여시에 즉시 방출을 위해 제제화될 수 있다. 상기 설명된 본 발명의 특정 방법에서, 메타독신 또는 그의 허용되는 유도체는 지속 및/또는 제어 방출을 위해 제제화될 수 있고, 임의로 대상체에게 투여시에 즉시 방출 및 지속 및/또는 제어 방출 특성을 모두 갖도록 제제화될 수 있다. 특정 실시양태에서, 메타독신 또는 그의 생리학상 허용되는 유도체는 비-만성 투여를 위해 제제화된다. 본 발명의 방법에 유용한 메타독신 제제를 아래에 보다 상세히 설명한다.
특정 실시양태에서, 본 발명은 취약 X 증후군 및/또는 그와 관련된 병태/장애, 예컨대 자폐 범주성 장애의 징후 또는 증상의 개선, 치료, 예방 및/또는 완화를 위해 대상체에게 투여될 때 지속 및/또는 제어 방출을 위해 제제화된 메타독신 또는 그의 유도체를 포함하는 조성물을 제공한다.
특정 실시양태에서, 본 발명은 취약 X 증후군 및/또는 그와 관련된 병태/장애, 예컨대 자폐 범주성 장애의 징후 또는 증상의 개선, 치료, 예방 및/또는 완화를 위해 대상체에게 투여될 때 메타독신 또는 유도체의 일부가 지속 및/또는 제어 방출을 위해 제제화되고 메타독신 또는 유도체의 일부는 즉시 방출을 위해 제제화된 메타독신 또는 그의 유도체를 포함하는 조성물을 제공한다.
특정 실시양태에서, 활성 성분의 유효 혈청 수준은 메타독신 또는 메타독신 유도체 투여 약 10 내지 약 20 또는 30 또는 40 또는 50 또는 60, 90분, 2h, 3h, 4h, 5h, 6h, 7h, 8h, 9h, 10h 내에 달성된다. 특정 실시양태에서, 상기 대상체에서 활성 성분의 유효 혈청 수준은 메타독신 또는 메타독신 유도체 투여 후 약 5 내지 약 20 또는 30 또는 40 또는 50 또는 60, 90분, 2h, 3h, 4h, 5h, 6h, 7h, 8h, 9h, 10h 내에 달성된다. 특정 실시양태에서, 활성 성분의 유효 혈청 수준은 메타독신 또는 메타독신 유도체 투여 후 약 20 내지 약 20 또는 30 또는 40 또는 50 또는 60, 90분, 2h, 3h, 4h, 5h, 6h, 7h, 8h, 9h, 10h 내에 달성된다. 특정 실시양태에서, 활성 성분의 유효 혈청 수준은 약 5, 10, 15, 20, 30, 40, 50 또는 60, 90분, 2h, 3h, 4h, 5h, 6h, 7h, 8h, 9h, 10h 내에 달성된다.
본 발명자들은 장 (소화관을 통한) 및/또는 비경구 (소화관 이외의 다른 경로) 경로 (그 전체 내용이 본원에 참고로 포함된 W02009/004629)를 기초로 한 메타독신 또는 메타독신 유도체의 투여를 위한 혁신적인 방법을 개발하였다. 이들 방법은 관심 있는 전달 시스템을 위해 활성 성분을 포획하는 담체, 예를 들어 적절한 계면활성제/보조-계면활성제 조성물 또는 미세/나노 입자 (예컨대 리포좀 또는 나노-리포좀), 또는 다른 첨가제 또는 부형제의 세심한 선택을 기초로 하여 요구되는 특성을 갖는 전달 시스템의 합리적인 설계를 제공한다. 장 전달 시스템은 경구 투여 (정제, 향낭 (sachet), 로젠지, 캡슐, 젤캡 (gelcap), 점적제, 또는 다른 맛 좋은 형태) 또는 직장 투여 (좌제 또는 (미니) 관장 형태)를 위해 설계될 수 있다. 또한, 관심 있는 전달 시스템은 액체 형태, 예를 들어 점적 용액, 시럽일 수 있다. 또한, 관심 있는 전달 시스템은 음료 또는 식품의 형태일 수 있다. 따라서, 본 발명에 의해 사용되는 활성 성분은 음료, 특히 청량 음료, 예를 들어 쥬스, 넥타 (nectar), 물, 소다수 및 다른 스파클링 음료 (sparkling drink), 쉐이크 (shake), 우유 쉐이크 및 다른 우유 기반 음료 등 내에 포함될 수 있다. 액체 제제는 또한 물 또는 소다수로 희석하기 위한 농축 시럽의 형태일 수 있다. 별법으로, 활성 성분(들)은 식품, 예컨대 스낵바 (snack bar), 헬쓰바 (health bar), 비스킷, 쿠키, 사탕, 과자류, 아이스크림, 얼음 과자 (ice lolly) 등에 포함될 수 있다.
추가로, 전달 시스템은 생리학상 활성 피리독신 유도체, 특히 피리독솔 L,2-피롤리돈-5 카르복실레이트 (메타독신)를 포함하는 식품 또는 음료일 수 있다. 특정 실시양태에서, 본 발명의 식품 또는 음료의 소비는 그의 소비 후 약 10 내지 약 40-60분 내에 활성 성분의 혈청 수준의 달성을 유도할 수 있다. 그 예는 사탕, 초콜렛, 캔디 및 캔디바 (candy bar), 에너지바 (energy bar), 아이스크림, 페이스트리 (pastry) 제품 등일 수 있다.
비경구 투여 방식은 피하, 전이 (온전한 피부를 통한 확산), 경점막 (점막을 통한 확산), 설하, 구강 (잇몸선 근처의 뺨을 통해 흡수됨) 투여, 또는 흡입에 의한 투여를 포함한다. 특정 실시양태에서, 본 발명에 의해 사용되는 조성물은 침습적 치료 방식으로 투여되지 않는다 (즉, 비-침습적임). 특정 실시양태에서, 메타독신 또는 메타독신 유도체 조성물은 정맥내 주사에 의해 투여되지 않는다.
특정 실시양태에서, 본 발명에 의해 사용되는 조성물은 분무에 적합한 미정질 분말 또는 용액; 질내 또는 직장내 투여를 위한 페서리 (pessary), 좌제, 크림 또는 포움으로서 전달된다. 바람직한 제제는 경구 투여용 제제이다. 또 다른 바람직한 제제는 국소 투여용이다. 또 다른 바람직한 제제는 경점막 투여, 설하, 구강 (잇몸선 근처의 뺨을 통해 흡수됨) 투여, 흡입에 의한 투여 또는 예를 들어 점안제에 의한 안내 투여용이다.
의료용으로서 메타독신 또는 메타독신 유도체의 투여는 안전한 및 효율적인 전달 시스템을 필요로 한다. 본 발명은 그의 특수한 물리화학적 특징, 특히 비-침습적 수단에 의한 직접적인 흡수, 및 그에 따른 부작용 방지 때문에 다양한 물질의 안전한 전달을 위한 전달 시스템을 제공한다. 전달 시스템은 보다 낮은 농도 또는 양의 활성 물질이 생물학상 활성 형태로 대상체에게 전달되도록 할 수 있는 그의 특유한 물리화학적 특징을 기초로 하여 메타독신 또는 메타독신 유도체 흡수의 효율 및 품질을 유의하게 향상시킨다. 본 발명의 전달 시스템은 조직에 대한 활성 물질의 직접적인 접근을 제공하고, 따라서 치료되는 대상체에게 메타독신 또는 메타독신 유도체의 즉각적인 또는 거의 즉각적인 효과를 제공한다. 따라서, 특정 실시양태에서, 본 발명은 활성 성분으로서 생리학상 활성 피리독신을 적합한 담체 내에 포함하는, 생리학상 활성 피리독신, 특히 피리독솔 L,2-피롤리돈-5 카르복실레이트 (메타독신), 또는 그의 생리학상 허용되는 유도체의 개선된 투여를 위한 비-침습적 제약 전달 시스템을 이용한다. 특정 실시양태에서, 활성 성분의 혈청 수준은 투여 후 약 10 내지 약 40-60분 내에 달성된다. 또 다른 실시양태에서, 본 발명은 활성 성분으로서 피리독신 유도체를 적합한 담체 내에 포함하는, 인지 행동의 개선을 필요로 하는 대상체에서 인지 행동의 개선에 사용하기 위한, 생리학상 활성 피리독신 유도체, 특히 피리독솔 L,2-피롤리돈-5 카르복실레이트 (메타독신)의 개선된 투여를 위한 비-침습적 제약 전달 시스템을 이용한다. 특정 실시양태에서, 상기 활성 성분의 혈청 수준은 투여 후 약 10 내지 약 40-60분 내에 달성된다.
특정 실시양태에서, 본 발명에서 사용되는 약물 전달 시스템은 경구, 코, 눈, 직장, 피하, 전이, 경점막, 설하, 구강 또는 흡입 투여를 위해 설계될 수 있다. 약물 전달 시스템은 활성 물질을 제어 방출 방식으로 제공할 수 있다. 특정 실시양태에서, 본 발명의 약물 전달 시스템은 적어도 하나의 추가의 제약상 활성제를 추가로 포함할 수 있다. 본 발명에 의해 사용되는 전달 시스템은 일반적으로 그의 오스몰 농도를 조정하는 완충제, 및 임의로, 관련 기술 분야에 알려진 하나 이상의 제약상 허용되는 담체, 부형제 및/또는 첨가제를 포함할 수 있다. 추가의 제약상 허용되는 활성 성분이 또한 조성물 내에 혼입될 수 있다. 담체는 예를 들어, 물, 에탄올, 폴리올 (예를 들어, 글리세롤, 프로필렌 글리콜, 및 액체 폴리에틸렌 글리콜 등), 이들의 적합한 혼합물, 및 식물성 오일을 함유하는 용매 또는 분산 매질일 수 있다. 적절한 유동성은 예를 들어 코팅, 예컨대 레시틴의 사용에 의해, 분산의 경우 요구되는 입자 크기의 유지에 의해 및 계면활성제의 사용에 의해 유지될 수 있다. 본원에서 사용되는 바와 같이, "제약상 허용되는 담체"는 임의의 및 모든 용매, 분산매, 코팅, 항박테리아제 및 항진균제 등을 포함한다. 제약상 활성 물질에 대한 상기 매질 및 작용제의 사용은 관련 기술 분야에 잘 알려져 있다. 임의의 통상적인 매질 또는 작용제가 활성 성분과 비상용성인 것을 제외하고, 그의 치료 조성물에서의 사용이 고려된다. 활성제는 임의의 제약상 허용되는 경로에 의해 및 임의의 제약상 허용되는 투여 형태로 전달될 수 있음이 고려된다. 경구 형태는 정제, 캡슐, 알약, 향낭, 로젠지, 점적제, 분말, 과립, 엘릭서 (elixir), 팅크제 (tincture), 현탁액, 시럽, 및 에멀젼을 포함하나 이로 제한되지 않는다. 또한, 경구 신속-방출, 시간 제어-방출, 및 지연-방출 제약 투여 형태가 포함된다. 활성 약물 성분은 단일 투여 형태로 또는 함께 또는 독립적으로 투여되는 별개의 투여 형태로 투여될 수 있다. 활성 약물 성분은 적합한 제약 희석제, 부형제 또는 담체 (본원에서 "담체"로 총칭됨), 의도하는 투여 형태에 대해 적합하게 선택된 물질과 혼합되어 투여될 수 있다. 전달 시스템이 경구 투여용이고 정제 또는 캡슐 등의 형태인 경우, 활성 약물 성분은 비-독성 제약상 허용되는 불활성 담체, 예컨대 락토스, 전분, 수크로스, 글루코스, 변형 당, 변형 전분, 메틸셀룰로스 및 그의 유도체, 인산이칼슘, 칼슘 술페이트, 만니톨, 소르비톨, 및 다른 환원 및 비-환원 당, 스테아르산마그네슘, 스테아르산, 소듐 스테아릴 푸마레이트, 글리세릴 베헤네이트, 스테아르산칼슘 등과 조합될 수 있다. 액체 형태의 경구 투여를 위해, 활성 약물 성분은 비-독성 제약상 허용되는 불활성 담체, 예컨대 에탄올, 글리세롤, 물 등과 조합될 수 있다. 요구되거나 또는 필요한 경우, 적합한 결합제, 윤활제, 붕해제 및 착색 및 향미제가 또한 혼합물 내에 혼입될 수 있다. 안정화제, 예컨대 항산화제, 프로필 갈레이트, 아스코르브산나트륨, 시트르산, 메타중아황산칼슘, 히드로퀴논, 및 7-히드록시쿠마린이 또한 투여 형태를 안정화하기 위해 첨가될 수 있다. 다른 적합한 화합물은 젤라틴, 감미제, 천연 및 합성 검, 예컨대 아카시아, 트라가칸트, 또는 알기네이트, 카르복시메틸셀룰로스, 폴리에틸렌, 글리콜, 왁스 등을 포함할 수 있다.
상기 제약 조성물에 사용될 수 있는 추가의 적합한 제약상 허용되는 담체는 이온 교환기, 알루미나, 스테아르산알루미늄, 스테아르산마그네슘, 레시틴, 혈청 단백질, 예컨대 인간 혈청 알부민, 완충제 물질, 예컨대 포스페이트, 글리신, 소르브산, 소르브산칼륨, 포화 식물성 지방산의 부분적인 글리세리드 혼합물, 물, 염 또는 전해질, 예컨대 프로타민 술페이트, 인산수소이나트륨, 인산수소칼륨, 염화나트륨, 아연 염, 콜로이드성 실리카, 삼규산마그네슘, 폴리비닐 피롤리돈, 셀룰로스계 물질, 폴리에틸렌 글리콜, 소듐 카르복시메틸셀룰로스, 폴리아크릴레이트, 왁스, 폴리에틸렌-폴리옥시프로필렌-블록 중합체, 폴리에틸렌 글리콜 및 양모 지방을 포함하나 이로 제한되지 않는다. 일부 실시양태에서, 제약상 허용되는 담체는 스테아르산마그네슘이다. 통상 허용되고 사용되는 추가의 제약 부형제는 예를 들어 문헌 [Remington's Pharmaceutical Sciences (Gennaro, A., ed., Mack Pub., 1990)]에서 볼 수 있다.
비경구 투여를 위해, 적합한 오일, 예컨대 참기름 또는 땅콩기름 내의 또는 수성 프로필렌 글리콜 내의 용액 및 대응하는 수용성 염의 멸균 수용액이 사용될 수 있다. 상기 수용액은 필요한 경우 완충되고, 액체 희석제는 먼저 충분한 염수 또는 글루코스로 등장성으로 만든다. 이들 수용액은 정맥내, 근내, 피하 및 복강내 주사를 위해 특히 적합하다. 이와 관련하여, 사용되는 멸균 수성 매질은 모두 관련 기술 분야의 통상의 기술자에게 잘 알려진 표준 기술에 의해 쉽게 얻을 수 있다. 특정 양의 활성 성분을 갖는 다양한 제약 조성물의 제조 방법은 알려져 있거나, 본 개시내용에 비추어 관련 기술 분야의 통상의 기술자에게 자명할 것이다. 인간 혈청 내의 메타독신의 반감기는 매우 짧다. 문헌 [Lu Yuan et al. (Chin. Med. J 2007 120(2) 160-168)]은 약 0.8시간의 평균 반감기를 제시하였다. 활성 모이어티 (moiety)의 혈청 수준을 연장하는 방법은 물질을 지속-방출 제제로 투여하는 것이다. 메타독신은 물 및 다양한 생물학적 유체에서 잘 용해되고, 그의 방출을 지속시키고 그의 흡수 시간을 연장하는 것이 어렵다. 따라서, 지속 방출이 달성될 수 있음은 예상되지 않았다. 메타독신 또는 메타독신 유도체의 제어 방출 투여 형태는 생물학적 유체 내의 활성 성분의 미리 결정된 점진적인 방출을 기초로 할 수 있고, 이에 의해 연장된 기간에 걸쳐 혈장 수준의 변동이 작은 상태에서 지속적인 작용이 가능하다.
특정 실시양태에서, 본 발명에 의해 사용되는 전달 시스템은 제어 방출 제제로 투여될 수 있다. 특정 실시양태에서, 투여 방법은 대상체의 상태 및 필요 사항의 평가 후에 담당의 또는 관련 기술 분야의 다른 통상의 기술자에 의해 결정될 것이다. 본 발명의 방법의 실시양태는 본원에서 설명되는 치료 화합물을 지속 방출 형태로 투여하는 것이다. 관련 기술 분야의 통상의 기술자에게 알려진 임의의 제어 또는 지속 방출 방법, 예컨대 문헌 [Langer, Science 249(4976):1527-33 (1990)]에 기재된 방법은 본 발명의 조성물 및 방법과 함께 사용될 수 있다. 상기 방법은 본 발명의 조성물의 치료 유효 용량이 상기 방법의 대상체에게 지속적으로 전달되도록 지속-방출 조성물, 좌제, 또는 코팅된 이식가능 의료 장비를 투여하는 것을 포함한다. 지속 방출은 또한 그 목적을 위해 설계되고 제제화된 패치를 사용하여 달성될 수 있다. 본 발명의 조성물은 일정 시간에 걸쳐 작용제의 지속-방출을 허용하는 캡슐을 통해 전달될 수 있다. 제어 또는 지속-방출 조성물은 친지질성 데포 (depot) (예를 들어, 지방산, 왁스, 오일) 내의 제제를 포함한다. 또한, 중합체 (예를 들어, 폴록사머 또는 폴록사민)로 코팅된 미립자 조성물이 본 발명에 포함된다. 지속 방출 제제 또는 장치, 또는 임의의 국소 제제는 조성물을 안정화하거나 또는 생리적 장벽, 예컨대 피부 또는 점막을 투과하기 위한 조성물을 추가로 포함할 수 있다. 예시적인 추가의 성분은 임의의 생리학상 허용되는 세제 또는 용매, 예컨대, 예를 들어, 디메틸술폭시드 (DMSO)를 포함할 수 있다.
본 발명의 모든 실시양태에서, 본 발명의 방법 및 용도는 단일 용량으로 제제화된, 본 발명에 의해 규정되는 염 애덕트 (adduct)를 포함하는 조성물을 사용할 수 있다. 상기 단일 용량 제제는 속방성 제제, 버스트 (burst) 제제, 연장 방출 제제, 지속 방출 제제 또는 관련 기술 분야의 통상의 기술자에게 알려진 임의의 다른 제어 방출 제제일 수 있다.
본 발명의 방법 및 용도의 다른 실시양태에서, 본 발명에 의해 규정되는 염 애덕트를 포함하는 조성물은 상이한 종류의 제제가 대상체에게 투여되는 조합 투여 제제, 즉 속방성 제제, 버스트 제제, 연장 방출 제제, 지속 방출 제제 또는 관련 기술 분야의 통상의 기술자에게 알려진 임의의 다른 제어 방출 제제의 임의의 조합일 수 있고, 이는 단일 용량으로 또는 별개로, 공동으로 또는 순차적으로 투여될 경우 별개의 용량으로 투여되고, 별개의 투여량의 투여 사이의 시간 간격은 병태 및 대상체의 질환 또는 장애의 중증도 또는 상기 대상체의 신체 상태를 기초로 하여 규정된다.
일부 실시양태에서, 본 발명의 방법에 의해 사용되는 조성물은 조합 투여 형태로서 제제화되고, 여기서 본 발명에 의해 규정되는 염 애덕트의 적어도 하나의 투여는 즉시 방출 형태이고, 본 발명에 의해 규정되는 염 애덕트 (속방성 제제에서 제제화된 염 애덕트와 동일하거나 상이함)의 적어도 하나의 투여 형태는 제어 (서방성 및/또는 지속) 방출 제제로서 제제화된다. 다른 실시양태에서, 상기 적어도 하나의 속방성 제제 및 적어도 하나의 제어 방출 제제에 포함되는 본 발명에 의해 규정되는 염 애덕트의 중량비는 1:1, 1:2, 2:1, 3:2, 2:3, 1:3, 3:1, 4:1, 1:4, 5:2, 2:5, 1:5, 5:1일 수 있다. 본 발명의 방법 또는 용도에서 상기 조합 투여 형태를 사용할 때, 상기 규정된 염 애덕트의 상기 적어도 하나의 속방성 형태 및 적어도 하나의 제어 방출 형태는 대상체에게 별개로, 공동으로, 순차적으로, 동시에, 연속적으로 등으로 투여될 수 있다. 일부 실시양태에서, 상기 적어도 하나의 속방성 형태가 초기에 투여된다. 다른 실시양태에서, 상기 적어도 하나의 제어 방출 제제가 초기에 투여된다.
특정 실시양태에서, 본 발명의 조성물 내의 메타독신 또는 메타독신 유도체는 적어도 0.5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 또는 12시간에 걸친 지속 또는 제어 방출을 위해 제제화될 수 있다. 특정 실시양태에서, 본 발명에 의해 사용되는 조성물 내의 메타독신 또는 메타독신 유도체는 약 0.5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 또는 12시간에 걸친 지속 또는 제어 방출을 위해 제제화될 수 있다. 특정 실시양태에서, 본 발명에 의해 사용되는 조성물 내의 메타독신 또는 메타독신 유도체는 약 0.5 또는 1 또는 2 또는 3 또는 4시간 내지 약 5, 6, 7, 8, 9, 10, 11 또는 12시간에 걸친 지속 또는 제어 방출을 위해 제제화될 수 있다. 특정 실시양태에서, 본 발명에 의해 사용되는 조성물 내의 메타독신 또는 메타독신 유도체는 약 5 또는 6 또는 7 또는 8시간 내지 약 9, 10, 11 또는 12시간에 걸친 지속 또는 제어 방출을 위해 제제화될 수 있다.
특정 실시양태에서, 본 발명에 의해 사용되는 조성물 내의 메타독신 또는 메타독신 유도체는 즉시, 신속 또는 버스트 방출 형태로 존재할 수 있다.
특정 실시양태에서, 본 발명에 의해 사용되는 조성물 내의 메타독신 또는 메타독신 유도체는 약 0.5, 1, 2, 3, 4, 5, 6, 7 또는 8시간 내에 총 메타독신 또는 메타독신 유도체의 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 99, 99.5% 또는 100%까지 방출하도록 제제화될 수 있다. 특정 실시양태에서, 본 발명에 의해 사용되는 조성물 내의 메타독신 또는 메타독신 유도체는 약 0.5, 1, 2, 3, 4, 5, 6, 7 또는 8시간 내에 총 메타독신 또는 메타독신 유도체의 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 99, 99.5% 이상 또는 100% 방출하도록 제제화될 수 있다.
특정 실시양태에서, 발명에 의해 사용되는 조성물 내의 메타독신 또는 메타독신 유도체는 지속 또는 서방성 및 즉시 또는 신속 방출 형태의 조합으로 존재할 수 있다. 특정 실시양태에서, 지속 또는 서방성 메타독신 또는 메타독신 유도체 대 즉시 또는 신속 방출 메타독신 또는 메타독신 유도체의 상대적인 비율은 예를 들어, 1 대 99, 5 대 95, 10 대 90, 15 대 85, 20 대 80, 25 대 75, 30 대 70, 35 대 65, 40 대 60, 45 대 55, 50 대 50, 55 대 45, 60 대 40, 65 대 35, 70 대 30, 75 대 25, 80 대 20, 85 대 15, 90 대 10, 95 대 5, 또는 99 대 1이다.
특정 실시양태에서, 중합체 물질은 메타독신 또는 메타독신 유도체의 방출을 지속시키거나 제어하기 위해 사용된다. 특정 실시양태에서, 중합체 물질의 종류 및 그의 사용량은 본 발명의 생성물로부터 메타독신 또는 메타독신 유도체의 방출 속도에 큰 영향을 받는다. 중합체의 예는 소수성 및 친수성 중합체를 모두 포함한다. 소수성 중합체의 예는 에틸 셀룰로스 및 다른 셀룰로스 유도체, 지방, 예컨대 글리세롤 팔미토-스테아레이트, 밀랍, 글리코왁스 (glycowax), 피마자왁스 (castorwax), 카르나우바왁스 (carnaubawax), 글리세롤 모노스테아레이트 또는 스테아릴 알콜, 소수성 폴리아크릴 아미드 유도체 및 소수성 메타크릴산 유도체, 및 이들 중합체의 혼합물을 포함하나 이로 제한되지 않는다. 친수성 중합체는 친수성 셀룰로스 유도체, 예컨대 메틸 셀룰로스, 히드록시프로필메틸 셀룰로스, 히드록시에틸셀룰로스, 히드록시프로필 셀룰로스, 카르복시메틸 셀룰로스, 소듐 카르복시메틸셀룰로스 및 히드록시에틸 메틸-셀룰로스 폴리비닐 알콜, 폴리에틸렌, 폴리프로필렌, 폴리스티렌, 폴리아크릴아미드, 에틸렌 비닐 아세테이트 공중합체, 폴리아크릴레이트, 폴리-우레탄, 폴리비닐피롤리돈, 폴리메틸메타크릴레이트, 폴리비닐 아세테이트, 폴리히드록시에틸 메타크릴레이트, 및 이들 중합체의 혼합물을 포함하나 이로 제한되지 않는다. 또한, 하나 이상의 소수성 중합체 및 하나 이상의 친수성 중합체의 임의의 혼합물이 임의로 사용될 수 있다.
특정 실시양태에서, 본 발명의 조성물 또는 본 발명에 의해 사용되는 조성물 내에 사용할 중합체 물질은 미정질 셀룰로스, 예컨대 에프엠씨 바이오폴리머 (FMC BioPolymer)에서 제조된 "아비셀 (AVICEL) PH 101"이다.
특정 실시양태에서, 본 발명의 조성물 또는 본 발명에 의해 사용되는 조성물 내에 사용할 중합체 물질은 히드록시프로필 메틸-셀룰로스, 예컨대 신-에츠 케미컬 코. (Shin-Etsu Chemical Co.)에 의해 생산된 "메톨로스 (METHOLOSE)"이다.
특정 실시양태에서, 본 발명의 조성물 또는 본 발명에 의해 사용되는 조성물 내에 사용할 중합체 물질은 에틸 셀룰로스, 예컨대 더 다우 케미컬 컴퍼니 (The Dow Chemical Company)에서 제조된 "에토셀(ETHOCEL)™"이다.
특정 실시양태에서, 본 발명의 조성물 또는 본 발명에 의해 사용되는 조성물 내에 사용할 중합체 물질은 아크릴릭 중합체, 예컨대 롬 게엠베하 (Rohm GmbH)에서 제조된 "유드라기트(EUDRAGIT) RS™"이다.
특정 실시양태에서, 본 발명의 조성물 또는 본 발명에 의해 사용되는 조성물 내에 사용할 중합체 물질은 콜로이드성 이산화규소, 예컨대 데구사 (Degussa)에서 제조된 "에어로실(AEROSIL)™"이다.
특정 실시양태에서, 본 발명의 조성물 또는 본 발명에 의해 사용되는 조성물 내에 사용할 중합체 물질은 폴리(비닐 아세테이트), 예컨대 바스프 (BASF)에서 제조된 "콜리코트 (KOLLICOAT) SR"이다.
특정 실시양태에서, 본 발명의 조성물 또는 본 발명에 의해 사용되는 조성물 내에 사용할 중합체 물질은 에틸 아세테이트 및 비닐 아세테이트 용액, 예컨대 델라스코 더마톨로직 랩 & 서플라이, 인크. (Delasco Dermatologic Lab & Supply, Inc.)에서 제조된 "듀로-타크 (DURO-TAK)"이다.
특정 실시양태에서, 본 발명의 조성물 또는 본 발명에 의해 사용되는 조성물은 약 50, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 또는 900 mg 내지 약 1000, 1500, 2000, 2500 또는 3000 mg 메타독신 또는 메타독신 유도체를 포함하거나 본질적으로 그로 이루어진다. 특정 실시양태에서, 본 발명의 조성물 또는 본 발명에 의해 사용되는 조성물은 약 5, 100, 500, 또는 1000 mg 내지 약 2000, 4000, 10,000, 15,000, 또는 20,000 mg 아비셀 PH 101™를 포함하거나 본질적으로 그로 이루어진다. 특정 실시양태에서, 본 발명의 조성물 또는 본 발명에 의해 사용되는 조성물은 약 25, 50, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550 또는 600 mg 내지 약 650, 700, 750, 800, 850, 900, 950, 1000, 5000, 10,000, 15,000 또는 20,000 mg의 중합체 물질을 포함하거나 본질적으로 그로 이루어진다. 특정 실시양태에서, 중합체 물질은 메톨로스, 에토셀 E10™ 또는 유드라기트 RS™이다. 특정 실시양태에서, 메톨로스는 1 내지 90%의 제제, 바람직하게는 5 내지 70%를 포함하거나 본질적으로 그로 이루어진다. 특정 실시양태에서, 에토셀™은 1 내지 30%의 제제, 바람직하게는 2 내지 20%를 포함하거나 본질적으로 그로 이루어진다. 특정 실시양태에서, 유드라기트™는 1 내지 90%의 제제, 바람직하게는 5 내지 70%를 포함하거나 본질적으로 그로 이루어진다.
특정 실시양태에서, 본 발명의 전달 시스템 또는 본 발명에 의해 사용되는 전달 시스템은 전달 장치를 포함한다. 특정 실시양태에서, 본 발명의 조성물 또는 본 발명에 의해 사용되는 조성물은 삼투 펌프에 의한 것과 같이, 제어된 속도로 삼투 과정에 의해 전달된다. 시스템은 삼투 활성제를 속도 제어 반투과성 멤브레인 (membrane)으로 코팅함으로써 구성될 수 있다. 상기 멤브레인은 작용제가 전달될 임계 크기의 구멍을 포함할 수 있다. 투여형은 수성 유체와 접촉하게 된 후에, 멤브레인의 유체 투과도 및 코어 제제의 삼투압에 의해 결정된 속도로 물을 흡수한다. 물의 상기 삼투성 흡수는 코어 내에 활성 물질의 포화 용액을 형성시키고, 이것은 멤브레인 내의 전달 구멍으로부터 제어된 속도로 분배된다.
특정 실시양태에서, 본 발명의 조성물 또는 본 발명에 의해 사용되는 조성물은 생분해성 미세입자를 사용하여 전달된다. 특정 실시양태에서, 미세입자를 제조하기 위한 시스템은 수성상 내에 유화된, 용해된 중합체 및 캡슐화시킬 물질을 갖는 휘발성 용매로 구성된 유기상으로 이루어진다. 특정 실시양태에서, 미세입자 매트릭스에 사용할 수 있는 생분해성 중합체는 폴리락트산 (PLA), 또는 락트산 및 글리콜산의 공중합체 (PLAGA)를 포함한다. PLAGA 중합체는 시간 경과에 따라 가수분해에 의해 그의 단량체 성분으로 분해되고, 이것은 자연 대사를 통해 신체로부터 쉽게 제거된다.
본 발명의 제제 또는 본 발명에 의해 사용되는 제제는 또한 흡수 향상제 및 다른 선택적인 성분을 함유할 수 있다. 흡수 향상제의 예는 시클로덱스트린, 인지질, 키토산, DMSO, 트윈 (Tween), Brij, 글리코콜레이트, 사포닌, 푸시데이트 및 에너지 기반 흡수 향상 장치를 포함하나 이로 제한되지 않는다.
투여형 내에 존재하는 선택적인 성분은 희석제, 결합제, 윤활제, 계면활성제, 착색제, 향미제, 완충제, 보존제, 안정화제 등을 포함하나 이로 제한되지 않는다.
"충전제"로도 불리는 희석제는 예를 들어, 인산이칼슘 이수화물, 황산칼슘, 락토스, 셀룰로스, 카올린, 만니톨, 염화나트륨, 건조 전분, 가수분해 전분, 이산화규소, 콜로이드성 실리카, 티탄 산화물, 알루미나, 탈크, 미정질 셀룰로스, 및 분말 설탕을 포함한다. 액체형의 투여를 위해, 희석제는 예를 들어 에탄올, 소르비톨, 글리세롤, 물 등을 포함한다.
결합제는 제제에 응집 품질을 부여하기 위해 사용된다. 적합한 결합제 물질은 전분 (옥수 전분 및 예비젤라틴화 전분 포함), 젤라틴, 당 (수크로스, 글루코스, 덱스트로스, 락토스 및 소르비톨 포함), 폴리에틸렌 글리콜, 왁스, 천연 및 합성 검, 예를 들어, 아카시아, 트라가칸트, 알긴산나트륨, 셀룰로스 및 비검 (Veegum), 및 합성 중합체, 예컨대 폴리메타크릴레이트 및 폴리비닐피롤리돈을 포함하나 이로 제한되지 않는다.
윤활제는 제조의 용이성을 위해 사용되고; 적합한 윤활제의 예는 예를 들어, 스테아르산마그네슘, 스테아르산칼슘, 스테아르산, 글리세릴 베헤네이트, 및 폴리에틸렌 글리콜을 포함한다.
계면활성제는 음이온성, 양이온성, 양쪽성 또는 비이온성 표면 활성제일 수 있고, 여기서 음이온성 계면활성제가 바람직하다. 적합한 음이온성 계면활성제는 나트륨, 칼륨 및 암모늄 이온과 같은 양이온과 회합된 카르복실레이트, 술포네이트 및 술페이트 이온을 함유하는 것을 포함하나 이로 제한되지 않는다. 특히 바람직한 계면활성제는 장쇄 알킬 술포네이트 및 알킬 아릴 술포네이트, 예컨대 소듐 도데실벤젠 술포네이트; 디알킬 소듐 술포숙시네이트, 예컨대 소듐 비스-(2-에틸헥실)-술포숙시네이트; 및 알킬 술페이트, 예컨대 소듐 라우릴 술페이트를 포함하나 이로 제한되지 않는다.
안정화제, 예컨대 항산화제는 프로필 갈레이트, 아스코르브산나트륨, 시트르산, 메타중아황산칼슘, 히드로퀴논, 및 7-히드록시쿠마린을 포함하나 이로 제한되지 않는다.
요구되는 경우, 본 발명의 조성물 또는 본 발명에 의해 사용되는 조성물은 또한 소량의 비독성 보조 물질, 예컨대 습윤제 또는 유화제, 보존제 등을 함유할 수 있다.
본 발명의 임의의 조성물 또는 본 발명에 사용되는 조성물은 인지 행동의 개선을 위해 단독으로 또는 하나 이상의 추가의 치료제와 함께 사용될 수 있다. 추가의 치료제의 예는 다음과 같다: 암페타민, 메틸페니데이트 HCl, 덱스메틸페니데이트 염산염, 아토목세틴, 레복세틴, 플루옥사틴, 설트랄린, 파록세틴, 플루오록사민, 시탈로프람, 벤라팍신, 부프로피온, 네파조돈 및 미르타자핀.
단일 투여 형태를 생산하기 위해 담체 물질과 함께 사용할 수 있는 화합물 및 추가의 치료제 모두의 양은 치료받는 숙주 및 특정 투여 방식에 따라 변할 것이다. 바람직하게는, 본 발명의 조성물은 0.1-1 g/kg 체중/일, 바람직하게는 0.1-300 mg/kg 체중의 용량이 투여될 수 있도록 제제화되어야 한다. 화합물의 용량은 환자의 병태와 병, 및 목적하는 일일 용량에 따라 결정된다. 인간 치료에서, 경구 일일 용량은 10-3000 mg 또는 바람직하게는 100-3000 mg이다. 예를 들어, 일일 용량은 10, 25, 50 100, 150, 200, 250, 300, 350, 400, 500, 600, 700, 800, 900, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900, 또는 3000 mg이다. 이들 용량은 단위 투여 형태로 투여되고, 이것은 특정 경우에 매일 단일 일일 용량으로 또는 2-3개의 보다 적은 용량으로 분할하여 투여될 수 있다.
특정 실시양태에서, 본 발명의 조성물들은 서로 조합하여 상승적으로 작용할 수 있고, 추가의 치료제의 존재 하에 추가로 상승적으로 작용할 수 있다. 따라서, 상기 조성물 내의 화합물(들) 및 추가의 치료제(들)의 양은 그 치료제만을 사용하는 단제요법에서 요구되는 것보다 더 적을 것이다. 상기 조성물에서, 0.1-1 g/kg 체중/일의 추가의 치료제의 용량이 투여될 수 있다.
정의
편의상, 본원 명세서, 실시예, 및 첨부되는 실시양태에서 사용되는 특정 용어는 여기서 종합된다. 달리 규정되지 않으면, 본원에서 사용되는 모든 기술 및 학술 용어는 본 발명이 속하는 기술 분야의 통상의 기술자에 의해 통상적으로 이해되는 바와 동일한 의미를 갖는다.
부정관사 ("a" 및 "an")는 본원에서 관사의 하나 또는 하나 초과 (즉, 적어도 하나)의 문법적 대상을 지칭하기 위해 사용된다. 예를 들어, "요소"는 하나의 요소 또는 하나 초과의 요소를 의미한다.
용어 "포함하는"은 문구 '포함하나 이로 제한되지 않는"을 의미하기 위해 본원에서 사용되고, 상기 문구와 교환가능하게 사용된다.
용어 "또는"은 문맥상 분명하게 다른 의미를 나타내지 않는 한, 용어 "및/또는"을 의미하기 위해 본원에서 사용되고, 상기 문구와 교환가능하게 사용된다.
용어 "예컨대"는 문구 "비제한적인 예를 들어"를 의미하도록 본원에서 사용되고 상기 문구와 교환가능하게 사용된다.
용어 "예방적" 또는 "치료적" 처치는 본 발명의 하나 이상의 조성물을 대상체에게 투여하는 것을 의미한다. 조성물이 원치 않는 병태 (예를 들어, 숙주 동물의 임상 또는 다른 원치 않는 상태)의 임상 소견 전에 투여될 경우, 처치는 예방적이고, 즉, 원치 않는 병태의 발생의 억제, 즉 대상체의 보호에 기여하는 반면, 원치 않는 병태의 소견 후에 투여될 경우, 처치는 치료적이다 (즉, 처치는 원치 않는 병태의 진행 또는 그로 인한 부작용을 감소, 완화 또는 억제하는 것이 의도된다).
용어 "치료 효과"는 동물, 특히 포유동물, 보다 특히 인간에서 약물 활성 물질 또는 물질에 의해 야기되는 국소 또는 전신 효과를 의미한다. 상기 용어는 따라서 동물 또는 인간에서 질환의 진단, 치유, 경감, 치료 또는 예방 또는 바람직한 신체 또는 정신 발달 및 상태의 향상에 사용하기 위해 의도되는 임의의 물질을 의미한다. 용어 "치료 유효량"은 임의의 치료에 적용가능한 합리적인 이익/위험 비에서 일부의 요구되는 국소 또는 전신 효과를 생성하는 상기 물질의 양을 의미한다. 특정 실시양태에서, 화합물 또는 조성물의 치료 유효량은 그의 치료 지수, 용해도 등에 따라 결정될 것이다. 예를 들어, 본 발명의 특정 메타독신 또는 메타독신 유도체는 통상의 기술자에 의해 결정될 수 있는, 선택된 치료제에 적용가능한 합리적인 이익/위험 비를 생성하기에 충분한 양으로 투여될 수 있다.
용어 "유효량"은 대상체에게 적절한 용량 및 요법으로 투여될 때 적어도 하나의 목적하는 결과를 생성하는 치료 시약의 양을 의미한다.
본 발명의 방법에 의해 치료할 "대상체" 또는 "환자"는 인간 또는 비-인간 동물, 바람직하게는 포유동물을 의미할 수 있다. 본원에서 사용되는 용어 "대상체"는 건강한 개체, 또는 취약 X 증후군 또는 자폐 범주성 장애를 앓고 있는 대상체를 나타낼 수 있다. 대체 실시양태에서, 본원에서 사용되는 용어 "대상체" 및 "건강한 대상체" 및 "필요로 하는 대상체" 및 "필요로 하는 환자"는 임의의 형태의 알콜 섭취 후 알콜 영향 하의 대상체, 알콜중독자 (알콜 중독), 및 단주 알콜중독자를 제외한다.
본원에서 사용되는 바와 같이, 용어 "염 애덕트"는 2 이상의 별개의 이온의 직접 부가의 염 생성물을 포함하는 의미이고, 여기서 염 애덕트의 총 전하는 0이다. 특정 실시양태에서, 염 애덕트는 단일 양 전하 관능기를 갖는 하나의 양으로 하전된 모이어티 (즉, 양으로 하전된 모이어티는 +1 순 전하로 하전됨) 및 단일 음 전하 관능기를 갖는 하나의 음으로 하전된 모이어티 (즉, 음으로 하전된 모이어티는 -1 순 전하로 하전됨)를 포함한다. 특정 실시양태에서, 염 애덕트는 동일하거나 상이할 수 있는 2개의 양으로 하전된 관능기를 갖는 하나의 양으로 하전된 모이어티 (즉, 양으로 하전된 모이어티는 +2 순 전하로 하전됨) 및 동일하거나 상이할 수 있고 각각 단일 음으로 하전된 관능기를 갖는 2개의 음으로 하전된 모이어티 (즉, 각각의 음으로 하전된 모이어티는 -1 순 전하로 하전됨)를 포함한다. 특정 실시양태에서, 염 애덕트는 각각 하나의 양으로 하전된 모이어티를 갖는 동일하거나 상이할 수 있는 2개의 양으로 하전된 모이어티 (즉, 각각의 양으로 하전된 모이어티는 +1 순 전하로 하전됨) 및 동일하거나 상이할 수 있는 2개의 음으로 하전된 관능기를 갖는 하나의 음으로 하전된 모이어티 (즉, 음으로 하전된 모이어티는 -2 순 전하로 하전됨)를 포함한다. 특정 실시양태에서, 염 애덕트는 +n 순 전하 (동일하거나 상이할 수 있는 하나 이상의 양으로 하전된 관능기로부터 기원하는)로 하전된 양으로 하전된 모이어티, 및 -n (동일하거나 상이할 수 있는 하나 이상의 음으로 하전된 관능기로부터 기원하는) 순 전하를 갖는 음 전하 모이어티를 포함하고, 여기서 n은 1, 2, 3, 4, 5 또는 6일 수 있는 정수이다.
본원에서 사용되는 바와 같이, 본 발명의 "염 애덕트의 양으로 하전된 모이어티"는 피리독신, 또는 그의 임의의 유도체의 대응하는 산이다. 특정 실시양태에서, 양으로 하전된 모이어티의 양 전하는 피리독신 (예를 들어 화합물 (2)에서처럼) 또는 그의 임의의 유도체 (예를 들어 화학식 I의 화합물)의 양성자화된 염기 질소 원자로부터 유래한다. 특정 실시양태에서, 양으로 하전된 피리독신 유도체는 일부의 실시양태에서 피리딘 고리 내의 양으로 하전된 양성자화된 염기성 방향족 질소 원자에 추가로 존재할 수 있는 양으로 하전된 관능기, 예를 들어 -NH3 +, -CH2NH3 +, NH2R+, -NHR2 + (여기서, 각각의 R은 독립적으로 C1-C6 알킬임)로 치환된다.
본 발명의 염 애덕트의 모이어티는 각각 적어도 하나의 키랄 중심 (chiral center)을 함유할 수 있고, 따라서 에난티오머, 디아스테레오머 또는 라세미체 혼합물을 포함하나 이로 제한되지 않는 이들의 임의의 혼합물을 포함하는 그의 임의의 입체이성질체로서 존재하고 단리될 수 있음이 이해되어야 한다. 본 발명은 임의의 가능한 입체이성질체 (예를 들어 에난티오머, 디아스테레오머), 본 발명의 염 애덕트의 임의의 개별적인 모이어티의 라세미체 혼합물을 포함하나 이로 제한되지 않는 이들의 임의의 혼합물을 포함한다. 본 발명의 염 애덕트의 각각의 모이어티의 제조를 위한 본원엔서 설명되는 방법이 입체이성질체의 혼합물을 생성하는 경우, 이들 이성질체는 통상적인 기술, 예컨대 분취용 크로마토그래피에 의해 분리될 수 있다. 본 발명의 염 애덕트의 모이어티는 각각 그의 라세미체 혼합물을 포함하나 이로 제한되지 않는 그의 가능한 입체이성질체의 임의의 혼합물로 제조될 수 있거나, 또는 개별적인 입체이성질체 (예를 들어 에난티오머, 디아스테레오머)는 에난티오머 특이적 (enantiospecific) 합성에 의해 또는 라세미체의 키랄 크로마토그래피 분리에 의해 제조될 수 있다. 아미노산을 언급할 때, 본 발명은 천연 및 비-천연 아미노산 또는 그의 임의의 유도체를 포함하는 것으로 이해되어야 한다.
명세서 전체에 걸쳐서 단어 "포함하다" 또는 변형 표현, 예컨대 "포함한다" 또는 "포함하는"은 언급된 정수 또는 정수의 군의 포함을 의미하고, 임의의 다른 정수 또는 정수의 군의 배제를 의미하지 않음이 이해될 것이다.
용어 "생체이용성"은 특정 화합물의 적어도 일부의 양이 전신 순환계에 존재함을 의미한다. 경구 생체이용률의 공식 계산은 F 값의 면에서 설명된다 ("Fundamentals of Clinical Pharmacokinetics," John G. Wegner, Drug Intelligence Publications; Hamilton, I11. 1975). F 값은 정맥내 투여 후 전신 순환계 (예를 들어, 혈장) 내의 모 약물의 농도 대 비-정맥내 경로 (예를 들어, 경구) 투여 후 전신 순환계 내의 모 약물의 농도의 비로부터 유도된다. 따라서, 본 발명의 범위에서 경구 생체이용률은 정맥내 투여에 비해 경구 투여 후 혈장 내에 검출가능한 모 약물의 양의 비 또는 F 값을 고려한다.
용어 "치료하는" 또는 "치료"는 적어도 인간과 같은 포유동물에서 병태, 질환 또는 장애의 증상의 경감, 개선, 감소 또는 완화, 또는 병태, 질환 또는 장애와 연관된 확인가능한 측정치의 개선을 의미한다. 본원에서 사용되는 치료는 또한 건강한 개체의 치료를 포함한다.
메타독신 또는 메타독신 유도체에 관하여 용어 "허용되는 유도체"는 대상체에게 투여시에 (직접 또는 간접적으로) 메타독신 또는 그의 대사산물 또는 기능성 잔기, 또는 측정가능한 메타독신 활성을 제공할 수 있는, 메타독신의 임의의 염, 접합체, 에스테르, 복합체 또는 다른 화학적 유도체 또는 이를 포함하는 임의의 모이어티를 의미한다. 용어 "생리학상 적합한 메타독신 유도체"는 본원에서 용어 "허용되는 유도체"와 교환가능하게 사용될 수 있고, 메타독신의 기능적, 활성, 제약상 허용되는 유도체를 의미한다.
용어 "부형제"는 제제 내의 활성 성분을 위한 담체로서 사용된 불활성 물질을 의미한다.
용어 "제어 방출"은 연장된 시간 동안 작용제를 제어된 속도로 전달하고 목족하는 작용제 수준 프로파일을 달성하도록 설계된 임의의 제제를 의미한다.
용어 "지속 방출"은 연장된 기간에 걸쳐 활성 물질의 점진적 방출을 제공하는 제제를 의미하도록 그의 통상적인 의미로 사용되고, 특정 실시양태에서 상기 제제는 또한 연장된 기간에 걸쳐 실질적으로 일정한 혈액 수준을 추가로 야기할 수 있다 (즉, 제어 방출).
용어 "속방성"은 투여시에 활성 물질의 비-지연 또는 제어 방출을 제공하는 제제를 의미하도록 그의 통상적인 의미로 사용된다.
용어 물질의 "반감기"는 물질이 그의 약물학, 생리학 또는 다른 활성의 절반을 상실하는데 소요되는 시간이다. 생물학적 반감기는 중요한 약동학적 파라미터이고, 대체로 약어 t1/2로 표시된다.
용어 "비-침습적"은 피부를 찌르지 않는 치료 방식을 의미한다.
용어 "비-만성 투여"는 본원에서 용어 "급성 투여"와 교환가능하게 사용될 수 있고, 비-정기적으로 대상체에게 의약의 측정된 또는 비-측정된 양 또는 일부를 제공하는 것을 의미한다. 비-만성 투여는 단일 용량 치료 또는 다중 용량 치료일 수 있고, 임의로 일정 시간에 걸쳐 제공될 수 있다. 항상은 아니지만 대개, 비-만성 투여는 비-만성 병태의 치료 또는 예방을 위해 제공된다. 특정 만성 병태에는 또한 본원에서 설명되는 메타독신 또는 메타독신 유도체 조성물의 비-만성 투여가 유익할 수 있다.
용어 "만성 투여"는 대상체에게 정기적으로 의약의 측정된 양을 제공하는 것을 의미한다. 일부 실시양태에서, 만성 투여는 하나 이상의 만성 병태, 문제 또는 질환의 치료 또는 예방을 위한 것이다. 만성 질환은 다음 특징 중 하나 이상을 갖는다: 질환은 영구적이고, 잔류성 장애를 남기고, 비가역적 병리학적 변경에 의해 야기되고, 사회복귀를 위해 환자의 특수한 훈련을 요구하고, 장기간의 감독, 관찰 또는 가료를 필요로 할 것으로 예상될 수 있다.
용어 "단일 용량 치료"는 한 번에 복용할 의약의 측정된 양을 제공하는 것을 의미한다. 이는 개인의 필요에 따라 비정기적으로 비-만성 병태의 치료를 위해 제공된다.
용어 "tmax"는 피크 농도에 도달하는 시간을 의미한다. 단일 용량 투여 후 최대 농도가 발생하는 시간의 계산은 다음 식에 따라 수행한다:
여기서, λα 및 λz는 각각 겉보기 흡수 및 제거 속도 상수이다.
실시예
실시예
1: 일반적인 방법
본원에 기재된 실시예는 아래 일반적으로 설명하는 시약 및 방법을 사용하여 수행하였다.
실험 동물
Fmr1 낙아웃 마우스 (KO2) 마우스 (The Dutch-Belgium Fragile X Consortium, 1994)를 초기에 잭슨 래보래토리 (Jackson Laboratory)로부터 입수하고, 야생형 (WT) 한배자손을 C57BL/6J 배경에서 생성하고, 8세대 초과 동안 C57BL/6J 배경에 대해 반복적으로 역교배하였다. Fmr1 낙아웃 마우스를 동일한 유전자형의 군으로, 12h 명암 사이클을 갖는 온도 및 습도 제어실 내에 수용하였다 (오전 7시부터 오후 7시까지 조명; 시험은 조명기 동안 수행하였다). 사료 및 물을 자유롭게 (ad libitum) 이용가능하도록 하면서 수용실 내에서 실내 온도 및 습도를 연속적으로 기록하였다. 행동 실험 동안 2 또는 6개월령의 건강한 Fmr1 낙아웃 마우스 및 그들의 야생형 한배자손 (N = 10마리 마우스/치료군)에 대해 시험을 수행하였다. 마우스를 시판 플라스틱 케이지 내에 수용하고, 영국 동물에 관한 과학적 실험 법안 (UK Animals (Scientific Procedures) Act, 1986)의 요건에 따라 실험을 수행하였다. 유전자형 및 약물 치료에 대해 모르는 실험자가 모든 실험을 수행하였다. 임의의 실험을 수행하기 전에 동물에게 1주의 최소 적응 기간을 허용하였다. 적응 기간 동안 예방 또는 치료적 처치를 투여하지 않았다.
약물
연구 1 (실시예 2)을 위해, 메타독신을 염수에 용해시키고, 7일 동안 1일 1회 100, 150, 또는 200 mg/kg의 용량으로 복강내 투여하였다. 연구 2 (실시예 3, 생체내 시험)를 위해, 메타독신을 염수에 용해시키고, 7일 동안 1일 1회 150 mg/kg/일의 복강내 용량 또는 150 또는 300 mg/kg/일 (0.1 ml의 부피)의 경구 용량으로 투여하였다. 연구 2 (시험관 내 시험)를 위해, 메타독신을 5시간 동안 300 μΜ의 농도로 투여하였다. 모든 경우에, 염수를 비히클 (대조군)로서 사용하였다.
행동 시험
사회적 상호작용 및 사회적 인지 기억: 마우스는 접근하기, 따라다니기, 냄새맡기, 몸단장하기, 공격적 만남, 성적 상호작용, 육아 행동, 보금자리 짓기 (nesting), 및 한 무리 (group huddle)로의 수면을 비롯한, 쉽게 점수 매겨지는 사회적 행동에 참여하는 사회적 종이다. 마우스에서 사회적 접근은 새로운 마우스를 향한 냄새맡기 지속시간에 의해 평가하였다.
마우스를 바닥에 신선한 나뭇조각을 깔아놓은, 성체의 가정용 케이지과 동일한 크기의 시험 무대/케이지 (40x23x12 cm 케이지, 마우스를 쉽게 보도록 퍼스펙스 (Perspex) 덮개가 있는)에 넣었다. 배경 마우스 냄새는 시험에 앞서 일부 비-실험 마우스를 장치 내에 넣음으로써 생성하였다. 마우스를 시험 10-15 min 전에 실험실로 옮겼다. 시험 대상체 및 준성체 (juvenile)를 시험 케이지 내에 동시에 넣었다. 시험한 마우스에 의한 자극 준성체를 향한 냄새맡기 및 가까이 따라다니기 (꼬리로부터 <2 cm)로서 정의된 사회적 조사의 총 지속시간 및 한차례 조사의 수를 3 min 동안 평가하였다. 30 min 후에, 동일한 자극 준성체를 사용하여 시험을 반복하였다. 수집한 데이타 파라미터는 습득 및 인식을 위한 한차례 냄새맡기의 총 지속시간 및 총수였다. 시험 2/시험 1+2로서 정의한 사회적 기억 비를 유도하였다. 따라서, 기억 없음 (예를 들어 20/(20+20)) =0.5이고, 기억 (예를 들어 10/(20+10)) =<0.5이다.
Y형 미로 변경: 2개의 과제를 실행하였다. 제1 과제는 아암 (arm) 입장 사이에 자발 변경의 비학습 평가이었다. 제2 과제는 공간 참조 기억 과제이고, 여기서 동물은 2개의 아암 중 어느 것에 사료 보상의 미끼가 있는지 학습하였다. 훈련 시작 전날에, 마우스가 5 min 동안 미로를 자유롭게 탐색하도록 하였다. 이어서, 이들을 2개의 시험으로 실험하였고, 하나는 사료가 좌측 아암에 놓이는 것이고, 다른 하나는 사료가 우측 아암에 배치되는 것이다. 상기 절차는 아암 중 하나에 대한 선호의 발생을 방지하였다.
Y형 미로 수조 미로: 투명한 퍼스펙스 Y형 미로를 20℃에서 2 cm 물로 채웠다. 이것은 마우스가 하나의 아암의 먼 단부에서 출구 튜브로 헤엄친 후 미로를 떠나도록 동기화하였다. 미로를 눈에 잘 띄는 시각적 단서로 둘러싸인 방의 중간에 놓았다.
보상된 T형 미로 변경: T형의 상승되거나 닫힌 장치 (수평으로 놓인)를 사용하였다. 마우스를 T자형의 기부에 놓고, 줄기의 다른 단부에 인접하는 목표 아암 중 하나를 선택하도록 허용하였다. 2회의 시험을 연달아 수행하였다: 제2 시험에서는 마우스가 이전에 방문하지 않은 아암을 선택하도록 요구하였고, 이것은 제1 선택의 기억을 반영한다 (자발 변경). 동물을 굶기고 변경한 경우에 원하는 사료로 보상함으로써 상기 경향을 강화시켰다. 구체적으로, T형 미로에서 4일의 적응 기간 후에, 보상으로서 달콤한 농축 우유를 받기 위해 마우스가 아암 선택을 변경하도록 훈련시켰다.
연속 주로: 장치는 도색한 목재로 제조한 4개의 연속적인, 직선으로 배열된, 점증적인 불안유발성 주로로 이루어졌다 (각각의 이어지는 주로는 선행 주로보다 더 밝은 색상으로 도색하고/하거나 벽이 더 낮고/낮거나 더 좁았다). 각각의 구역 또는 주로는 길이가 25 cm이었다. 주로 1은 25 cm 높이 벽을 갖고, 폭은 8.5 cm이고, 흑색으로 도색하였다. 0.5 cm 계단이 주로 2로 이어지고, 이것은 폭은 다시 8.5 cm이지만, 1.3 cm 높이 벽을 갖고 회색이었다. 1.0 cm 계단이 주로 3으로 이루어지고, 이것은 폭이 3.5 cm이고 0.8 cm 높이 벽을 갖고 백색이었다. 0.4 cm 계단이 주로 4로 이어지고, 이것은 또한 백색이지만, 폭이 1.2 cm 이고 0.2 cm 높이 벽을 가졌다. 주로 1의 후면이 50 cm 높이로 서있도록 고정함으로써 장치를 상승시켰다. 마우스가 추락하는 경우를 위해 아암 3 및 4 아래에 패딩 (padding)을 제공하였다. 각각의 마우스를 벽을 대면하는 주로 1의 닫힌 단부에 놓았다. 1) 전체 시험 길이 (5 min) + 각각의 아암에 들어가는 대기시간 (latency), 및 2) 주로 1에서 보낸 시간 동안 타이머 (timer)를 시작하였다. 마우스가 4개의 모든 발을 다음 주로에 놓을 때, 주로에 들어간 것으로 간주하였다. 각각의 주로에서 보낸 총 시간 (4개의 모든 발)을 기록하였다.
환경적 공포 조건화: 공포 조건화 실험에서, 마우스를 새로운 환경 (어두운 방)에 넣고, 힌트와 전기 충격 (electric footshock) (0.2 mA, 1초 (연구 1) 또는 0.7 mA, 0.5 sec (연구 2))을 짝을 지어 인가하였다. 후속적으로, 원래 훈련 환경에서 시험할 때, 마우스는 동결반응 (freezing) (Blanchard, 1969) 또는 환경적 공포 조건화로 불리는 자연 방어 반응을 보였다. 동결반응 시간은 마우스가 호흡을 제외한 불가동 행동으로 보낸 시간으로서 정의하였다. 데이타를 시험 기간의 백분율로서 표현하였다. 훈련 기간의 24시간 후에, 마우스를 5 min 동안 훈련실에서 충격 제시 없이 시험하고, 동결반응 행동에 대해 관찰하였다,
통계학: 다변량 분산 분석을 이용하여 데이타를 가로질러 군 차이를 평가하였다. 반복 측정치 ANOVA를 행동 데이타에 대해 수행하였다. 각각의 ANOVA에서 통계학상 유의한 효과는 뉴먼-클스 (Newman-Keuls) 검정 (연구 1) 또는 터키 (Tukey) 검정 (연구 2)를 이용하여 사후 (post hoc) 비교에 따랐다. 0.05 미만의 p 값을 유의한 것으로 간주하였다.
생화학적 시험
인산화된 ERK 및 Akt: Ras-Mek-ERK 및 PI3K-Akt-mToR 신호전달 경로는 시냅스 가소성 (synaptic plasticity)의 변화의 근거가 되는 유전자 전사의 활동 의존적 변경을 매개하는데 관여한다 (Klann and Dever, 2004). 인산화된 ERK 및 Akt 단백질 발현은 이전에 문헌 (Lopez Verrilli et al., 2009)에 설명된 바와 같이 웨스턴 블롯 (western blot) 분석에 의해 측정하였다. 사용된 항체는 Akt (1/1000) 및 키나제 (ERK)1/2 (1/2000)에 대한 항-포스포특이적 항체 (셀 시그널링 테크놀로지 (Cell Signaling Technology, 미국 매사추세츠주 댄버)이었다. 포스포-ERK에 대한 항체는 포스포-ERK1/2 (Thr202/Tyr204)에서 인산화를 검출하는 반면, 포스포-Akt에 대한 항체는 포스포-Akt (Thr308)에서 인산화를 검출한다. 총 Akt 및 ERK1/2 단백질 함량과 인산화된 ERK 및 Akt는, 멤브레인을 항포스포-Akt (1/1000) 및 항포스포-ERK 항체 (1/2000) (셀 시그널링 테크놀로지, 미국 매사추세츠주 댄버)로 블로팅함으로써 평가하였다. Akt 또는 ERK 인산화를 동일한 샘플에서 단백질 함량으로 정규화하고, 기초 수준을 100%로서 간주하여 기초 조건에 관한 변화 %로서 표현하였다. 단백질 부하는 멤브레인을 벗겨내고 β-액틴 항체 (1/1000) (시그마-알드리치 (Sigma-Aldrich), 미국 미주리주 세인트루이스)로 재-블로팅함으로써 평가하였다. 혈액 림프구 내에서 인산화된 ERK 및 Akt 단백질 발현을 유동 세포측정법에 의해 측정하였다. 림프구 바이오마커 결정을 위해, 488 nm로 조정한 여기 레이저를 갖는 FACStar 플러스 (벡톤 디킨슨 (Becton Dickinson))을 사용하였고, FITC (GST)로부터 초록 형광을 515-545 nm 대역 (bandpass) 필터를 통해 수집하였다. 평균 FITC 형광 강도를 참조 세포의 형광에 관하여 계산하였다. 평균 세포 형광 강도 (MFI)는 세포당 결합된 Ab 분자의 평균 수에 정비례한다.
뉴런 형태학: 재태 17.5의 배아일 (E17.5)의 야생형 및 Fmr1 KO 태아 마우스로부터 해마 세포 배양액을 제조하였다. 마우스를 경추 탈골로 치사시키고, 분리시킨 해마 세포를 15 mm 다중웰 용기 (팔콘 프리마리아 (Falcon Primaria)) 내에 플레이팅하였다. 시험관 내에서 5d 후에, 약물 치료 후 가지돌기 형태형성을 쉽게 모니터링하기 위해 초록 형광 단백질 (GFP)로 형질감염시켰다 ([Ethell and Yamaguchi, 1999]; [Ethell et al., 2001], [Henkemeyer et al., 2003]). 가지 돌기는 시험관 내에서 약 16일 (DIV)에 형성되었다. 배양액을 시험관 내 제17일에 메타독신으로 300 μΜ 농도에서 5 hr 동안 처리하였다.
GFP 형질감염된 뉴런의 사상위족 밀도는 스택형 (stacked) 자이스 (Zeiss) 공초점 생성된 영상 (40x 대물렌즈, 20x0.2 ㎛의 스택)의 숄 (Sholl) 분석을 수행함으로써 정량하였다. 메타몰프 (Metamorph) 소프트웨어를 사용하여, 동일한 간격의 동심원 (20 ㎛마다)을 각각의 뉴런의 세포 몸체의 둘레에 그리고, 후속적으로 원마다 사상위족의 양을 계수하였다. 계수의 평균을 짝이없는 양측 스튜던트 (unpaired two-tailed Student) T-검정을 이용하여 비교하였다.
GFP 형질감염된 뉴런의 가시 (spine) 성숙도는 메타몰프 소프트웨어 (몰레큘라 디바이시즈 (Molecular Devices), 미국 캘리포니아주 서니베일)를 사용하여 분석하였다. 가시 형태측정 분석을 위해 뉴런마다 70-100 ㎛의 2개의 말단 가지돌기 절편을 선택하였다. 각각의 가시에 대해, 길이 및 폭을 측정하였다. 길이는 기부로부터 돌출부의 끝까지 거리로서 정의한 반면; 폭은 가시의 장축에 수직인 최대 거리로서 정의하였다. 측정치를 짝이없는 양측 스튜던트 T-검정을 이용하여 비교하고, 다중 비교를 위해 ANOVA 교정하였다.
드 노보 해마 단백질 합성: 횡단 해마 절편 (400 ㎛)를 6주령 Fmr1 낙아웃 및 WT 마우스로부터 수득하였다. 단백질 합성 검정은 비-방사성 형광-활성화 세포 분류-기반 검정, 표면 감지 번역 (surface sensing of translation (SUnSET)) 방법을 사용하여 이전에 설명된 바와 같이 수행하였고, 상기 방법은 개별 포유동물 세포에서 및 불균질 세포 집단에서 전반적 단백질 합성의 모니터링 및 정량을 허용한다 (Hoeffer, 2011). 본 연구에 사용된 메타독신의 농도는 300 μΜ이었다.
실시예
2: 취약 X 증후군의
Fmr1
낙아웃
마우스 모델 (연구
1)에서
학습 및 기억 결핍 및 생화학적 이상에 대한
메타독신
(100 대
200 mg
/kg) 치료의 효과
행동 분석
환경적 공포 조건화: 초기 실험은 N = 10마리 WT 및 Fmr1 낙아웃 마우스의 군에서 환경적 공포 조건화에 대한 7일 동안 1일 1회 비히클 또는 150 mg/kg 메타독신의 복강내 투여의 효과를 시험하였다. 비히클-치료 Fmr1 낙아웃 마우스는 시험 기간 동안 동결반응 감소로 반영되는 바와 같이 환경적 공포 조건화 패러다임에서 학습의 결핍을 보였다 (도 1의 패널 A (p<0.0001)). 메타독신 투여는 Fmr1 낙아웃 마우스에서 학습 결핍 효과를 역전시켰고, 여기서 상기 역전은 부분적이고, 따라서 메타독신-치료 동물은 메타독신-치료 WT 동물과 상이하였다 (p<0.05). 상기 실험의 반복은 N = 10마리 WT 및 Fmr1 낙아웃 마우스의 군에서 환경적 공포 조건화에 대한 7일 동안 1일 1회의 비히클, 100 또는 200 mg/kg 메타독신의 복강내 투여의 용량-의존 효과를 조사하였다 (도 1의 패널 B 및 C). 본 실험에서, 비히클-치료 Fmr1 낙아웃 마우스는 비히클-치료 WT 마우스에 비해 학습 결핍을 보였고 (p<0.0001), 이것은 제1 실험을 반복한다. 100 mg/kg 메타독신은 Fmr1 낙아웃 마우스에서 결핍의 역전을 일으켰지만 (p<0.05), 메타독신-치료 Fmr1 낙아웃 마우스가 메타독신-치료 야생형 마우스와 상이하기 때문에 (p<0.0001) 이것은 부분적인 역전이었다. Fmr1 낙아웃 마우스에서 보이는 학습 결핍은 200 mg/kg i.p. 메타독신을 사용한 치료 후에 완전히 역전되었다 (치료된 Fmr1 마우스는 비히클-치료 Fmr1 낙아웃 마우스와 상이하였지만 (P<0.0001), 메타독신-치료 WT 마우스와 상이하지 않았다). 메타독신 치료는 두 실험에서 WT 마우스에 대해 효과가 없었다 (도 1의 패널 A-C).
사회적 접근: 비히클-치료 Fmr1 낙아웃 마우스는 한차례 냄새맡기에 의해 표시되는 바와 같이 더 적은 사회적 접근을 보여주었다 (도 2 (p<0.0001)). 7일 동안 150 mg/kg 메타독신을 사용한 1일 1회 복강내 치료는 Fmr1 낙아웃 마우스에서 사회적 접근을 증가시켰다 (비히클 치료 Fmr1 낙아웃 마우스에 비해 p<0.0001). 메타독신으로 치료한 Fmr1 낙아웃 마우스는 메타독신 치료 WT 마우스와 상이하였지만 (p<0.05), WT 마우스의 효과에 접근하는 경향이 있었다. 메타독신 치료는 WT 마우스에 대해 효과가 없었다.
Y형 미로 자발 변경: N = 10마리 WT 또는 Fmr1 낙아웃 마우스의 군에서 자발 변경에 대한 비히클 또는 150 mg/kg 메타독신의 7일의 1일 1회 치료의 효과를 도 3의 패널 A에 제시한다. 비히클-치료 Fmr1 낙아웃 마우스는 비히클 치료 WT 마우스보다 더 적은 자발 변경을 보였다 (p<0.0001). 메타독신 치료는 Fmr1 낙아웃 마우스에서 비히클 치료에 비해 자발 변경을 증가시켰지만 (p<0.0001), 메타독신-치료 Fmr1 낙아웃 마우스는 메타독신-치료 WT 마우스에 비해 결핍을 보였다 (p<0.01). 따라서, 메타독신은 Fmr1 낙아웃 마우스에서 보이는 결핍의 부분적 역전을 일으켰다.
Y형 미로 참조 기억 과제: N = 10마리 WT 또는 Fmr1 낙아웃 마우스의 군에서 보상된 참조 기억 학습에 대한 비히클 또는 150 mg/kg 메타독신을 사용한 7일의 1일 1회 치료의 효과를 도 3의 패널 B에 제시한다. 비히클-치료 Fmr1 낙아웃 마우스는 비히클-치료 WT 마우스보다 더 적은 적절한 아암 입장을 보였다 (p<0.0001). 메타독신 치료는 비히클-치료 Fmr1 낙아웃 마우스에 비해 상기 결핍을 감소시켰고 (p<0.0001), 따라서, 메타독신-치료 Fmr1 낙아웃 마우스는 메타독신-치료 WT 마우스와 상이하지 않았다. 메타독신 치료는 WT 마우스에 대해 효과가 없었다.
Y형 미로 수조 미로 좌측 우측 변별: N = 10마리 WT 또는 Fmr1 낙아웃 마우스의 군에서 혐오로 동기화된 공간 변별 학습에 대한 비히클 또는 150 mg/kg 메타독신을 사용하는 7일의 1일 1회 치료의 효과를 도 3의 패널 C에 제시한다. 비히클-치료 Fmr1 낙아웃 마우스는 비히클-치료 WT 마우스보다 더 많은 수의 부정확한 아암 입장을 보였다. 상기 결핍은 메타독신을 사용한 치료에 의해 감소하였다.
T형 미로 보상된 변경 과제: N = 10마리 WT 또는 Fmr1 낙아웃 마우스의 군에서 보상된 변경 작업 기억에 대한 비히클 또는 150 mg/kg 메타독신을 사용한 7일의 1일 1회 치료의 효과를 도 4에 제시한다. 비히클-치료 Fmr1 낙아웃 마우스는 비히클-치료 WT 마우스보다 정확한 아암에 도달하는데 더 긴 대기시간을 보였다 (p<0.0001). 메타독신 치료는 Fmr1 낙아웃 마우스에서 비히클 치료에 비해 상기 결핍을 감소시켰고 (p<0.0001), 여기서 메타독신-치료 Fmr1 낙아웃 마우스는 WT 마우스보다 더 느리게 반응하였으므로 (p<0.0001) 상기 역전은 부분적이었다.
연속 주로: N = 10마리 WT 또는 Fmr1 낙아웃 마우스의 군에서 연속 주로 과제에서 행동에 대한 비히클 또는 150 mg/kg 메타독신을 사용한 7일의 1일 1회 치료의 효과를 도 5에 도시하고, 아래에 추가로 설명한다.
연속 주로 시험은 불안증 (주로 1에 들어가는 대기시간) 및 과잉행동 (주로 2 내지 4)을 효과적으로 측정하였다. 주로 1에서부터 연속 주로 2, 3, 및 4를 통한 진행은 벽이 점증적으로 더 낮고 더 좁고 보다 노출된 열린 아암을 갖는 점증적으로 밝게 도색한 환경에의 노출과 연관되었다. 열린 아암 상에서 소모한 시간 및 열린 아암 내로의 입장 불안증을 지시하고; 이와 반대로, 보다 열린 아암 내에서 소모한 시간의 증가는 과잉행동을 반영하였다. 이들 요인은 과잉행동과 함께 불안증-유사 행동의 범위를 포괄하는 민감한 시험을 허용하였다.
주로 1: Fmr1 낙아웃 마우스는 WT 마우스보다 더 많은 불안증을 보였다 (p<0.001). 메타독신으로 처리된 Fmr1 낙아웃 마우스는 비히클 치료 Fmr1 낙아웃 마우스에 비해 불안증의 완화를 보였고 (p<0.001), 따라서 완전한 정상화가 일어났다. 메타독신-치료 Fmr1 낙아웃 마우스 및 메타독신-치료 WT 마우스 사이에 차이가 존재하지 않았다. 또한, 메타독신 치료는 WT 마우스에 대해 효과가 없었다.
주로 2: WT 마우스는 Fmr1 낙아웃 마우스에 비해 주로 2에서 더 적은 활동을 보였다 (p<0.0001). 메타독신을 사용한 치료는 Fmr1 낙아웃 마우스에서 과잉행동을 감소시켰지만 (p<0.001), 메타독신-치료 Fmr1 낙아웃 마우스 및 WT 마우스가 상이하였으므로 (p<0.001) 상기 과잉행동 역전은 부분적이었다. 메타독신 치료는 WT 마우스에 대해 효과가 없었다.
주로 3: Fmr1 낙아웃 마우스는 WT 마우스에 비해 과잉행동을 보였다 (p<0.0001). 메타독신-치료 Fmr1 낙아웃 마우스가 비히클-치료 Fmr1 낙아웃 마우스와 상이하지 않았으므로, 상기 과잉행동은 메타독신에 의해 역전되지 않았다. 메타독신 치료는 WT 마우스에 대해 효과가 없었다.
주로 4: Fmr1 낙아웃 마우스는 WT 마우스에 비해 과잉행동을 보였다 (p<0.01). 메타독신-치료 Fmr1 낙아웃 마우스가 비히클-치료 Fmr1 낙아웃 마우스보다 더 적은 활동을 보였으므로 (p<0.01), 메타독신 치료는 상기 과잉행동을 역전시켰다. 메타독신-치료 Fmr1 낙아웃 마우스가 메타독신-치료 WT 마우스와 상이하지 않았으므로, 상기 효과는 정상화를 반영하였다. 메타독신 치료는 WT 마우스에 대해 효과가 없었다.
종합하면, 이론에 매이기를 바라지 않지만, 연속 주로 시험은 WT 마우스에 비해 Fmr1 낙아웃 마우스가 불안증 및 과잉행동이 증가하였음을 보여주었다. 메타독신 치료는 WT 마우스에 영향을 미치지 않으면서 Fmr1 낙아웃 마우스에서 상기 불안증 및 과잉행동을 감소시켰다.
생화학적 분석
ERK 및 Akt의 인산화: 뇌 내의 ERK 또는 Akt의 전체 뇌 인산화에 대한, N = 5마리 Fmr1 낙아웃 또는 WT 마우스에서 비히클 또는 150 mg/kg 메타독신을 사용하는 7일의 1일 1회 복강내 치료의 효과를 도 6에 제시한다. 인산화 수준은 인산화된 ERK 대 총 ERK의 비로서 평가하였다. 상기 비의 증가는 ERK의 활성화를 지시하였다. ERK의 인산화는 비히클 대조군보다 비히클-치료 Fmr1 낙아웃 마우스에서 증가하였다 (p<0.001) - 상기 효과는 취약 X 증후군이 있는 인간 대상체에서 보이는 ERK의 이상 활성화를 복제하였다 (Wang et al., 2012). 상기 효과는 메타독신 치료에 의해 감소하였고 (p<0.01), 따라서, 메타독신-치료 WT 마우스에 비해 차이가 없었다. 메타독신은 WT 마우스에서 ERK의 인산화 또는 임의의 마우스에서 총 ERK 수준에 대해 효과가 없었다. 인산화된 Akt 대 총 AKT의 비는 비히클-치료 WT 마우스보다 비히클-치료 Fmr1 낙아웃 마우스에서 또한 증가하였다 (p<0.0001). 메타독신을 사용한 치료는 Fmr1 낙아웃 마우스에서 인산화된 Akt의 상대적인 수준을 감소시켰고 (p<0.01), 따라서, Fmr1 낙아웃 마우스는 대조군과 상이하지 않았다. 메타독신 치료는 WT 마우스에 대해, 또는 임의의 마우스의 총 Akt 수준에 대해 효과가 없었다.
실시예
3:
Fmr1
낙아웃
취약 X 마우스 모델에서
메타독신의
평가 (연구 2)
6개월령
Fmr1
낙아웃
마우스에서
메타독신의
행동 효과
환경적 공포 조건화: 초기 실험은 N = 10마리의 6개월령 WT 및 Fmr1 낙아웃 마우스의 군에서 환경적 공포 조건화에 대한 7일 동안 1일 1회 비히클 또는 150 mg/kg 메타독신의 복강내 투여의 효과를 시험하였다. 비히클-치료 Fmr1 낙아웃 마우스 (KO-V)는 시험 기간 동안 동결반응의 감소 (도 7 (p <0.0001))로 반영되는 바와 같이 비히클-치료 WT 마우스 (WT-V)에 비교할 때 환경적 공포 조건화 패러다임에서 학습의 결핍을 보였다. 메타독신 투여는 Fmr1 낙아웃 마우스에서 학습 결핍 효과를 역전시켰다 (p<0.0001 KO-M-150 대 KO-V). 이것은 완전한 역전이었고, 따라서, 메타독신-치료 KO 마우스는 메타독신-치료 WT 마우스와 상이하지 않았다.
사회적 접근 및 사회적 기억: 사회적 접근 데이타 (초기 시험 1)을 도 8의 패널 A (한차례 냄새맡기의 수) 및 패널 C (냄새맡기의 지속 시간)에 제시한다. 사회적 기억 데이타 (시험 2, 시험 1의 24시간 후)를 도 8의 패널 B (한차례 냄새맡기의 수) 및 패널 D (냄새맡기의 지속 시간)에 제시한다. 이들 결과를 아래에서 추가로 논의한다.
시험 1 동안, Fmr1 낙아웃 마우스는 WT 마우스에 비해 한차례 냄새맡기의 수의 증가 (p<0.0001) (도 8의 패널 A 참조) 및 냄새맡기의 지속시간의 감소 (p<0.0001) (도 8의 패널 C 참조)를 보여주었다. 이들 사회적 상호작용 결핍은 Fmr1 낙아웃 마우스에서 다른 연구자들이 보고한 것과 일치한다 (Thomas et al., 2011). 한차례 냄새맡기의 수 및 냄새맡기의 지속시간 둘 모두에 대해, 메타독신을 사용하는 치료는 Fmr1 낙아웃 마우스에서 이상의 역전을 일으켰고 (각각에 대해 p<0.0001 KO-M-150 대 KO-V), 따라서, 메타독신-치료 Fmr1 낙아웃 마우스는 한차례 냄새맡기의 수 측정치에 대해 메타독신-치료 WT 마우스와 상이하지 않았다. 냄새맡기의 지속시간 측정치에 대해 구제가 보이지만, Fmr1 낙아웃 마우스는 메타독신 치료 후에 WT 마우스에 비해 상이하게 남았기 때문에 (p<0.05) 상기 효과는 부분적이었다. 메타독신은 WT 마우스에 대해 효과가 없었다. 이들 데이타는 Fmr1 낙아웃 마우스에서 비정상 사회적 접근 행동이 메타독신에 의해 구제되었음을 보여준다.
시험 2 동안, Fmr1 낙아웃 마우스는 야생형 마우스에 비해 한차례 냄새맡기의 수의 증가 및 냄새맡기의 지속시간의 증가를 보여주었다 (각각의 측정치에 대해 p<0.0001, 각각 도 8의 패널 B 및 D). 이것은 적응의 실패, 및 따라서 사회적 기억 결핍을 반영하였다. 메타독신 치료는 이들 차이를 감소시켰다 (KO-M-150 대 KO-V에 대해 p<0.0001). 메타독신-치료 Fmr1 낙아웃 마우스 및 메타독신-치료 WT 마우스 사이에 차이가 남았기 때문에 (p<0.05), 한차례 냄새맡기의 수에 대한 역전은 부분적이었다. 메타독신-치료 Fmr1 낙아웃 마우스 및 메타독신-치료 WT 마우스 사이에서 차이가 관찰되지 않았으므로, 냄새맡기 지속시간에 대한 메타독신에 의한 역전은 완전하였다. 메타독신 치료는 WT 마우스에 대해 효과가 없었다. 이들 데이타는 메타독신이 Fmr1 낙아웃 마우스에서 사회적 기억 손상을 감소시켰음을 보여준다. 상기 사회적 기억 결핍의 감소는 사회적 기억 비의 계산 (실시예 1에 설명된)에 의해 아래에 예시된다:
사회적 기억 비는 한차례 냄새맡기의 지속시간으로서 정의하였다: 시험 2/시험 1+2. 따라서, 기억 없음의 예는 (예를 들어 20/(20+20)) =0.5인 한편, 기억의 예는 (예를 들어 10/(20+10)) =<0.5이었다.
계산된 사회적 기억 비는 다음과 같았다:
WT-V 시험 2/시험 1 + 시험 2: 12.4 / 12.4 + 26.8 = 0.3, <0.5 기억
KO-V 시험 2/시험 1 + 시험 2: 325 / 325 + 24.1 = 0.9, 기억 없음
WT-M 시험 2/시험 1 + 시험 2: 12.5 / 38.5 + 12.5 = 0.2, <0.5 기억
KO-M 시험 2/시험 1 + 시험 2: 12.7 / 28.4 + 12.7 = 0.3, <0.5 기억
6개월령
Fmr1
낙아웃
마우스에서
메타독신의
생화학적 효과
상기 설명된 행동 시험 이후 뇌 내의 전체 뇌 pERK (도 9의 패널 A) 및 pAkt (도 9의 패널 B)에 대한, N = 10마리 Fmr1 낙아웃 또는 WT 마우스에서 비히클 또는 150 mg/kg 메타독신을 사용한 7일의 1일 1회 ip 치료의 효과를 도 9에 제시한다. 구체적으로, 도 9의 패널 A는 pAkt의 뇌 수준을 보여주고, 이것은 선행 실험에서 보이는 바와 같이 WT 마우스보다 Fmr1 낙아웃 마우스에서 증가하였다 (P<0.0001). 메타독신을 사용한 치료는 뇌 pAkt의 상기 증가를 역전시켰고 (KO-M-150 대 KO-V에 대해 p<0.0001), 따라서, 메타독신-치료 Fmr1 낙아웃 마우스는 메타독신-치료 WT 마우스와 상이하지 않았다. 도 9의 패널 B는 pERK의 뇌 수준을 보여주고, 이것은 선행 실험에서 보이는 바와 같이 WT 마우스에 비해 Fmr1 낙아웃 마우스에서 증가하였다 (KO-M-150 대 KO-V에 대해 p<0.0001). 상기 증가는 메타독신 치료에 의해 역전되었고 (p<0.0001), 따라서, 메타독신-치료 Fmr1 낙아웃 마우스는 메타독신-치료 WT 마우스와 상이하지 않았다.
2개월령
마우스의 행동에 대한
복강내
또는 경구 투여 후의
메타독신의
효과
도 10은 2개월령 Fmr1 낙아웃 및 WT 마우스에서 환경적 공포 조건화에 대한 7일 동안 150 mg/kg ip, 또는 150 및 300 mg/kg 경구의 용량으로 1일 1회 메타독신의 투여의 효과를 보여준다. 구체적으로, 도 10의 패널 A는 비히클을 사용한 ip 및 경구 치료 후에 Fmr1 낙아웃 및 WT 마우스로부터 환경적 공포 조건화 데이타를 보여준다. 비히클의 투여 경로에 관한 차이는 없었다. Fmr1 낙아웃 마우스는 ip 및 경구 경로를 통한 비히클 치료 후에 WT 마우스에 비해 동결반응 행동의 감소를 보여주었다 (각각의 경우에 p<0.0001). 도 10의 패널 B는 WT 마우스에서 두 투여 경로를 통한 메타독신 치료의 효과를 보여준다. 효과는 보이지 않았다. 도 10의 패널 C는 Fmr1 낙아웃 마우스에서 ip 150 mg/kg 및 경구 150 및 300 mg/kg의 메타독신 치료가 Fmr1 낙아웃 마우스에서 보이는 동결반응 행동의 감소를 역전시켰음을 보여준다 (KO-M-ip, KO-M-po 150, 및 KO-M-po 300 대 KO-V-ip 및 KO-V po에 대해 각각 p<0.01, p<0.0001, 및 p<0.0001). 150 mg po 메타독신을 사용한 투여의 효과는 300 mg/kg po 메타독신의 투여의 효과와 상이하지 않았다. Fmr1 낙아웃 마우스에서 150 및 300 mg/kg 경구 메타독신의 효과는 150 mg/kg ip 메타독신의 효과와 상이하지 않았다. 각각의 경우에, 메타독신-치료 Fmr1 낙아웃 마우스가 메타독신-치료 WT 마우스와 상이하지 않았으므로 역전은 완전하였다.
도 11은 Fmr1 낙아웃 및 WT 마우스에서 사회적 접근 및 사회적 기억에 대한 7일 동안 150 mg/kg ip 또는 150 및 300 mg/kg 경구의 용량으로 1일 1회 메타독신의 투여의 효과를 보여준다. 구체적으로, 도 11의 패널 A는 Fmr1 낙아웃 또는 WT 마우스에서 사회적 접근 행동에 대한 비히클 또는 150 mg/kg ip 또는 150 및 300 mg/kg 경구의 메타독신의 효과를 보여준다. 비히클을 사용한 ip 또는 경구 치료 후에, Fmr1 낙아웃 마우스에서 냄새맡기 행동의 지속시간은 WT 마우스에 비해 감소하였다 (각각 p<0.0001). 임의의 용량의 메타독신 치료는 WT 마우스에 대해 효과가 없었다. 그러나, 150 mg/kg ip, 150 mg/kg, 및 300 mg/kg 경구의 메타독신 치료는 Fmr1 낙아웃 마우스에서 보이는 사회적 접근 결핍을 역전시켰다 (KO-M-po 150 및 KO-M-po 300 대 KO-V po에 대해 각각 p<0.0001). 경구 메타독신의 효과는 150 및 300 mg/kg 사이에서 용량 의존적이 아니었다. 메타독신-치료 Fmr1 낙아웃 마우스는 메타독신-치료 WT 마우스와 상이하지 않았으므로, 상기 역전은 완전하였다. Fmr1 낙아웃 마우스에서 150 mg/kg ip 메타독신의 효과는 150 mg/kg 경구 또는 300 mg/kg 경구 메타독신의 효과와 상이하지 않았다. 도 11의 패널 B는 Fmr1 낙아웃 또는 WT 마우스에서 사회적 기억에 대한 비히클 또는 150 mg/kg ip 또는 150 및 300 mg/kg 경구의 메타독신의 효과를 보여준다. 비히클을 사용한 ip 또는 경구 치료 후에, Fmr1 낙아웃 마우스에서 냄새맡기 행동의 지속시간은 WT 마우스에 비해 증가하였다 (각각에 대해 p<0.0001). 임의의 용량의 메타독신 치료는 WT 마우스에 대해 효과가 없었다. 그러나, 150 mg/kg ip, 150 mg/kg 경구, 및 300 mg/kg 경구의 메타독신 치료는 Fmr1 낙아웃 마우스에서 보이는 사회적 접근 결핍을 역전시켰다 (KO-M-ip 150, KO-M-po 150, 및 KO-M-po 300 대 KO-V-ip 및 KO-V po에 대해 각각 p<0.0001, p<0.05, 및 p<0.01). 메타독신-치료 Fmr1 낙아웃 마우스는 메타독신-치료 WT 마우스와 상이하지 않았으므로, 상기 역전은 완전하였다. Fmr1 낙아웃 마우스에서 150 mg/kg ip 메타독신의 효과는 150 mg/kg 경구 또는 300 mg/kg 경구 메타독신의 효과와 상이하지 않았다. 또한, 150 mg/kg 및 300 mg/kg 사이에서 경구 메타독신 치료의 효과에 대한 용량 의존성은 없었다.
2개월령
마우스에서
복강내
또는 경구 투여 이후 생화학적
마커에
대한 메타독신의 효과
말초 림프구: 도 12는 2개월령 Fmr1 낙아웃 및 WT 마우스에서 유동 세포측정법에 의해 결정할 때, 림프구 pAkt (도 12의 패널 A) 및 pERK (도 12의 패널 B)에 대한 7일 동안 150 mg/kg ip 또는 150 mg/kg 및 300 mg/kg 경구 용량의 1일 1회 메타독신의 투여의 효과를 보여준다. 구체적으로, 도 12의 패널 A는 비히클-치료 Fmr1 낙아웃 마우스가 동등한 비히클 치료를 받은 WT 마우스에 비해 림프구 Akt의 인산화 증가를 보였음을 보여준다 (ip 및 경구 투여 모두에 대해 p<0.0001). 7일 동안 150 mg/kg ip 또는 150 mg/kg 또는 300 mg/kg의 경구 용량으로 1일 1회 메타독신을 사용한 치료는 과다활성화된 Akt를 정상화하였고, 따라서, pAkt 수준은 메타독신-치료 Fmr1 낙아웃 마우스 및 동일한 치료를 받은 WT 마우스 사이에서 상이하지 않았다. 도 12의 패널 B는 비히클-치료 Fmr1 낙아웃 마우스가 동등한 비히클 치료를 받은 WT 마우스에 비해 림프구 ERK의 인산화 증가를 보였음을 보여준다 (ip 및 경구 투여 모두에 대해 p<0.0001). 7일 동안 150 mg/kg ip, 또는 150 mg/kg 또는 300 mg/kg의 경구 용량의 1일 1회 메타독신을 사용한 치료는 과다활성화된 ERK를 정상화시켰고, 따라서, pERK 수준은 메타독신-치료 Fmr1 낙아웃 마우스 및 동일한 치료를 받은 WT 마우스 사이에서 상이하지 않았다.
뇌 영역: 도 13은 해마, 전전두 피질, 및 선조체에서 pERK 수준에 대한 7일 동안 150 mg/kg 메타독신의 투여의 효과를 보여준다. pERK 수준은 3개의 모든 뇌 영역에서 WT 마우스에 비해 Fmr1 낙아웃 마우스에서 증가하였다 (모든 경우에 p<0.0001). pERK 수준은 비히클-치료 Fmr1 낙아웃 마우스에 비해 메타독신-치료 Fmr1 낙아웃 마우스에서 감소하였다 (모든 경우에 p<0.0001). 해마 및 선조체에서 KO-M 및 WT-M 군 사이에서 차이는 없었고, 이것은 ERK의 활성화의 완전한 역전을 보여준다. 전전두 피질에서 효과는 부분적이고, KO-V 및 KO-M 군은 상이하게 남았다 (p<0.05). 메타독신은 WT 마우스에 대해 효과가 없었다.
도 14는 해마, 전전두 피질 및 선조체에서 pAkt 수준에 대한 7일 동안 150 mg/kg 메타독신의 투여의 효과를 보여준다. pAkt 수준은 3개의 모든 뇌 영역에서 WT 마우스에 비해 Fmr1 낙아웃 마우스에서 증가하였다 (모든 경우에 p<0.0001). pAkt 수준은 3개의 모든 뇌 영역에서 비히클-치료 Fmr1 낙아웃 마우스에 비해 메타독신-치료 Fmr1 낙아웃 마우스에서 감소하였다 (모든 경우에 p<0.0001). 모든 경우에, KO-M 및 WT-M 군 사이에 차이는 없었고, 이것은 Akt의 활성화의 완전한 역전을 보여준다. 메타독신은 WT 마우스에 대해 효과가 없었다. 인산화된 ERK 및 Akt의 뇌 및 혈액 수준 상승의 감소는 Fmr1 낙아웃 마우스의 개선된 행동 성과와 상호관련되고, 이것은 인산화 수준이 메타독신 치료 반응의 바이오마커임을 제안한다.
시험관 내에서
Fmr1
낙아웃
마우스로부터 일차 해마 뉴런 내의
가지돌기
사상위족 밀도 및
성숙화에
대한
메타독신의
효과
도 15 (패널 A-C)는 300 μM 메타독신을 사용하는 5시간 동안 치료의 효과를 보여준다. 가지돌기를 각각 몸체로부터 거리에 기반하여 (근위부에서 원위부로, 좌측에서 우측으로) 10 ㎛의 10개 절편으로 나누었다. 가시 밀도는 절편 3에서 WT 마우스로부터 뉴런에 비해 Fmr1 낙아웃 마우스로부터 뉴런에서 증가하였다. 구체적으로, 도 15의 패널 A는 뉴런 사상위족의 밀도를 보여준다. Fmr1 낙아웃 마우스로부터 일차 해마 뉴런은 사상위족 밀도의 증가를 보여주었다 (p<0.001). 300 μΜ 메타독신을 사용한 치료는 Fmr1 낙아웃 마우스에서 뉴런 사상위족 밀도의 이상 증가를 감소시켰다 (p<0.001). Fmr1 낙아웃 마우스로부터 뉴런은 보다 길고 (도 15의 패널 B (p<0.01)) 보다 좁은 (도 15의 패널 C (p<0.01)) 미성숙의 특징을 갖는 사상위족을 보여주었다. 메타독신을 사용한 치료는 상기 사상위족 길이의 증가를 역전시키고 (도 15의 패널 B (p<0.01)), 폭의 감소를 역전시켰다 (도 15의 패널 C (p<0.001)).
시험관 내에서
Fmr1
낙아웃
마우스에서 드
노보
해마 단백질 합성에 대한
메타독신의
효과
도 16은 Fmr1 낙아웃 또는 WT 마우스로부터 400 ㎛ 해마 절편에서 기초 드 노보 단백질 합성에 대한 비히클 또는 300 μΜ 메타독신을 사용한 치료의 효과를 보여준다. 단백질 합성은 비히클-치료 WT 대조 해마보다 Fmr1 낙아웃 마우스로부터 비히클-치료 해마에서 더 높았다 (p<0.0001). 메타독신 치료는 Fmr1 낙아웃 마우스 해마에서 단백질 합성 속도를 감소시켰다. Fmr1 낙아웃 마우스로부터 해마는 WT 마우스로부터 메타독신-치료 해마보다 더 높은 단백질 합성 속도를 보유하였으므로 (p<0.001), 상기 효과는 부분적이었다.
<표 1>
Claims (10)
- 취약 X 증후군 또는 관련 장애의 증상을 치료 또는 완화를 필요로 하는 대상체에게 메타독신을 포함하는 조성물을 투여하는 것을 포함하는, 취약 X 증후군 또는 관련 장애의 증상을 치료하거나 완화하는 방법.
- 제1항에 있어서, 100 - 3000 mg의 메타독신의 총 일일 용량을 투여하는 것을 포함하는 방법.
- 제1항에 있어서, 메타독신이 매일, 격일 또는 매주 투여되는 것인 방법.
- 제1항에 있어서, 메타독신이 1일에 1, 2, 또는 3개의 투여 형태로 투여되는 것인 방법.
- 제1항에 있어서, 메타독신이 지속 방출 경구 투여 형태로 투여되고, 여기서 메타독신은 서방성 형태 및 속방성 형태의 조합물로서 제제화되는 것인 방법.
- 제5항에 있어서, (a) 서방성 형태는 적어도 8시간 동안 메타독신의 지속 방출을 제공하고,
(b) 서방성 메타독신 대 속방성 메타독신의 상대적인 비율이 약 60:40 내지 80:20인 방법. - 제6항에 있어서, 서방성 메타독신 대 속방성 메타독신의 상대적인 비율이 약 65:35인 방법.
- 제1항에 있어서, 증상이 학습 장애 또는 사회성 장애인 방법.
- 제1항에 있어서, 대상체에 취약 X 증후군 또는 자폐 범주성 장애가 존재하는 것인 방법.
- 제1항에 있어서, 관련 장애가 자폐 범주성 장애인 방법.
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361875384P | 2013-09-09 | 2013-09-09 | |
| US61/875,384 | 2013-09-09 | ||
| US14/038,258 | 2013-09-26 | ||
| US14/038,258 US20150073023A1 (en) | 2013-09-09 | 2013-09-26 | Method Of Treating Fragile X Syndrome And Related Disorders |
| US201461991351P | 2014-05-09 | 2014-05-09 | |
| US61/991,351 | 2014-05-09 | ||
| PCT/IB2014/002398 WO2015033224A2 (en) | 2013-09-09 | 2014-09-09 | Methods of treating fragile x syndrome and related disorders |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20160078956A true KR20160078956A (ko) | 2016-07-05 |
Family
ID=52629036
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020167009042A KR20160086818A (ko) | 2013-09-09 | 2014-09-09 | 요법에 대한 반응의 결정 방법 |
| KR1020167009040A KR20160078956A (ko) | 2013-09-09 | 2014-09-09 | 취약 x 증후군 및 관련 장애의 치료 방법 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020167009042A KR20160086818A (ko) | 2013-09-09 | 2014-09-09 | 요법에 대한 반응의 결정 방법 |
Country Status (12)
| Country | Link |
|---|---|
| EP (2) | EP3043792A2 (ko) |
| JP (2) | JP2016530291A (ko) |
| KR (2) | KR20160086818A (ko) |
| CN (2) | CN105917225A (ko) |
| AU (2) | AU2014316779A1 (ko) |
| CA (2) | CA2923421A1 (ko) |
| EA (2) | EA201690557A1 (ko) |
| IL (2) | IL244343A0 (ko) |
| MX (2) | MX2016003006A (ko) |
| SG (2) | SG11201601605YA (ko) |
| TW (2) | TW201605443A (ko) |
| WO (2) | WO2015035402A1 (ko) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2019203509A1 (ko) * | 2018-04-18 | 2019-10-24 | 건국대학교 글로컬산학협력단 | 아그마틴 및 이의 약학적으로 허용 가능한 염을 포함하는 취약 x 증후군 예방 또는 치료용 약학조성물 |
| WO2021141426A1 (ko) * | 2020-01-08 | 2021-07-15 | 건국대학교 글로컬산학협력단 | 리수리드 화합물을 유효성분으로 포함하는 취약 x 증후군 또는 관련 발달 장애 치료용 조성물 |
| WO2021158059A1 (ko) * | 2020-02-07 | 2021-08-12 | 건국대학교 글로컬산학협력단 | 릴메니딘 화합물을 유효성분으로 포함하는 취약 x 증후군 또는 관련 발달 장애 치료용 조성물 |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR102226202B1 (ko) * | 2013-07-31 | 2021-03-12 | 유디씨 아일랜드 리미티드 | 발광 디아자벤즈이미다졸 카르벤 금속 착물 |
| US20150073023A1 (en) | 2013-09-09 | 2015-03-12 | Alcobra Ltd. | Method Of Treating Fragile X Syndrome And Related Disorders |
| CN108538365A (zh) * | 2017-03-24 | 2018-09-14 | 华东师范大学 | 一种基于数据分析技术的自闭症社交能力评估系统 |
| EP3773538A1 (en) * | 2018-04-13 | 2021-02-17 | Healx Limited | Treatment of fragile x syndrome |
| PL3813816T3 (pl) * | 2018-06-07 | 2023-07-31 | Ovid Therapeutics Inc. | Zastosowanie kwasu (s)-3-amino-4-(difluorometylenylo)cyklopentano-1-eno-1-karboksylowego i związków pokrewnych, kwasu (1s,3s)-3-amino-4-(difluorometylideno)cyklopentano-1-karboksylowego w leczeniu zespołu łamliwego chromosomu x lub zespołu drżenia/ataksji związanego z zespołem łamliwego chromosomu x |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| IT1131856B (it) | 1980-06-30 | 1986-06-25 | Baldacci Lab Spa | Composizione farmaceutica per il trattamento di intossicazioni alcooliche |
| WO2002043507A2 (en) * | 2000-11-30 | 2002-06-06 | The Health Research Institute | Nutrient supplements and methods for treating autism and for preventing the onset of autism |
| IL187159A0 (en) | 2007-07-03 | 2009-02-11 | Gur Megiddo | Use of metadoxine in relief of alcohol intoxication |
| EA023758B1 (ru) * | 2009-06-25 | 2016-07-29 | Алкобра Лтд. | Применение метадоксина для лечения синдрома дефицита внимания/гиперактивности (adhd/add) |
-
2014
- 2014-09-05 TW TW103130856A patent/TW201605443A/zh unknown
- 2014-09-05 TW TW103130859A patent/TW201606304A/zh unknown
- 2014-09-09 CA CA2923421A patent/CA2923421A1/en not_active Abandoned
- 2014-09-09 CN CN201480060722.4A patent/CN105917225A/zh active Pending
- 2014-09-09 MX MX2016003006A patent/MX2016003006A/es unknown
- 2014-09-09 CA CA2922901A patent/CA2922901A1/en not_active Abandoned
- 2014-09-09 AU AU2014316779A patent/AU2014316779A1/en not_active Abandoned
- 2014-09-09 JP JP2016539645A patent/JP2016530291A/ja active Pending
- 2014-09-09 WO PCT/US2014/054816 patent/WO2015035402A1/en active Application Filing
- 2014-09-09 AU AU2014315026A patent/AU2014315026A1/en not_active Abandoned
- 2014-09-09 SG SG11201601605YA patent/SG11201601605YA/en unknown
- 2014-09-09 SG SG11201601830PA patent/SG11201601830PA/en unknown
- 2014-09-09 WO PCT/IB2014/002398 patent/WO2015033224A2/en active Application Filing
- 2014-09-09 JP JP2016540930A patent/JP2016530536A/ja active Pending
- 2014-09-09 KR KR1020167009042A patent/KR20160086818A/ko not_active Application Discontinuation
- 2014-09-09 CN CN201480049671.5A patent/CN105517546A/zh active Pending
- 2014-09-09 MX MX2016003002A patent/MX2016003002A/es unknown
- 2014-09-09 EP EP14830858.8A patent/EP3043792A2/en not_active Withdrawn
- 2014-09-09 EA EA201690557A patent/EA201690557A1/ru unknown
- 2014-09-09 EP EP14776939.2A patent/EP3044589A1/en not_active Withdrawn
- 2014-09-09 KR KR1020167009040A patent/KR20160078956A/ko not_active Application Discontinuation
- 2014-09-09 EA EA201690559A patent/EA201690559A1/ru unknown
-
2016
- 2016-02-29 IL IL244343A patent/IL244343A0/en unknown
- 2016-03-06 IL IL244453A patent/IL244453A0/en unknown
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2019203509A1 (ko) * | 2018-04-18 | 2019-10-24 | 건국대학교 글로컬산학협력단 | 아그마틴 및 이의 약학적으로 허용 가능한 염을 포함하는 취약 x 증후군 예방 또는 치료용 약학조성물 |
| WO2021141426A1 (ko) * | 2020-01-08 | 2021-07-15 | 건국대학교 글로컬산학협력단 | 리수리드 화합물을 유효성분으로 포함하는 취약 x 증후군 또는 관련 발달 장애 치료용 조성물 |
| WO2021158059A1 (ko) * | 2020-02-07 | 2021-08-12 | 건국대학교 글로컬산학협력단 | 릴메니딘 화합물을 유효성분으로 포함하는 취약 x 증후군 또는 관련 발달 장애 치료용 조성물 |
Also Published As
| Publication number | Publication date |
|---|---|
| CN105517546A (zh) | 2016-04-20 |
| TW201606304A (zh) | 2016-02-16 |
| JP2016530536A (ja) | 2016-09-29 |
| CN105917225A (zh) | 2016-08-31 |
| EP3043792A2 (en) | 2016-07-20 |
| WO2015033224A2 (en) | 2015-03-12 |
| EA201690557A1 (ru) | 2016-07-29 |
| CA2923421A1 (en) | 2015-03-12 |
| CA2922901A1 (en) | 2015-03-12 |
| KR20160086818A (ko) | 2016-07-20 |
| IL244453A0 (en) | 2016-04-21 |
| AU2014316779A1 (en) | 2016-03-17 |
| AU2014315026A1 (en) | 2016-03-24 |
| EP3044589A1 (en) | 2016-07-20 |
| SG11201601830PA (en) | 2016-04-28 |
| WO2015035402A1 (en) | 2015-03-12 |
| MX2016003002A (es) | 2016-09-08 |
| WO2015033224A3 (en) | 2015-07-02 |
| JP2016530291A (ja) | 2016-09-29 |
| MX2016003006A (es) | 2016-06-10 |
| EA201690559A1 (ru) | 2016-08-31 |
| IL244343A0 (en) | 2016-04-21 |
| SG11201601605YA (en) | 2016-04-28 |
| TW201605443A (zh) | 2016-02-16 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20160078956A (ko) | 취약 x 증후군 및 관련 장애의 치료 방법 | |
| JP6884703B2 (ja) | 障害を治療するための5ht作動薬 | |
| RU2281764C2 (ru) | Лекарственные средства для лечения осложнений, связанных с диабетом, и невропатии и их применения | |
| JP5875191B2 (ja) | Cmt及び関連障害を処置するための新たな組成物 | |
| TWI452039B (zh) | 抗神經變性疾病用劑 | |
| JP2010504338A (ja) | 筋萎縮性側索硬化症(ALS)の治療のための水素化ピリド[4,3−b]インドール | |
| EA024465B1 (ru) | ПРИМЕНЕНИЕ ЛЕВОСИМЕНДАНА ИЛИ ЕГО СОЛЕЙ ДЛЯ ПРИГОТОВЛЕНИЯ МЕДИКАМЕНТА ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА И РОДСТВЕННЫХ РАССТРОЙСТВ ИЛИ ДЛЯ ЗАЩИТЫ ЭНДОТЕЛИАЛЬНЫХ И/ИЛИ НЕРВНЫХ КЛЕТОК ОТ Аβ ТОКСИЧНОСТИ И СПОСОБ ЛЕЧЕНИЯ УКАЗАННЫХ ЗАБОЛЕВАНИЙ | |
| JP2019523286A (ja) | 中枢神経系障害治療用のベンゾエート化合物とタンニン酸を含む組成物 | |
| US20200030301A1 (en) | Combination of ibudilast and riluzole and methods of using same | |
| JP7296472B2 (ja) | プリドピジンを使用したミトコンドリア関連疾患および障害(それらの症状を含む)の治療 | |
| US20210330611A1 (en) | Therapy for neurological diseases/disorders | |
| UA109540C2 (uk) | Сполуки для пригнічення розладу периферійних нервів, викликаного протираковим агентом | |
| US20210161886A1 (en) | Methods of treating depressive disorders | |
| US9851354B2 (en) | Methods of treating fragile X syndrome and related disorders | |
| CA2724386A1 (en) | Methods and compositions for improving cognitive function | |
| WO2020165802A1 (en) | Compositions and methods relating to use of agonists of alpha5-containing gabaa receptors | |
| EP3661492A1 (en) | Methods and compositions for treating neurological conditions | |
| US20220265672A1 (en) | Use of aprepitant for treating alzheimer's disease | |
| EP2517701B1 (en) | Vicinal dithioglycol for use in preventing pathological processes induced by alcohol consumption | |
| CN117479931A (zh) | 用于治疗孤独症谱系障碍(asd)的方法 | |
| AU2024200581A1 (en) | Method of using human spheroids for drug discovery | |
| US20150366847A1 (en) | Combination of geranylgeranylacetone and ibudilast and methods of using same |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |