KR20160070106A - Plk-4 억제제의 염 및 결정체들 - Google Patents
Plk-4 억제제의 염 및 결정체들 Download PDFInfo
- Publication number
- KR20160070106A KR20160070106A KR1020167012155A KR20167012155A KR20160070106A KR 20160070106 A KR20160070106 A KR 20160070106A KR 1020167012155 A KR1020167012155 A KR 1020167012155A KR 20167012155 A KR20167012155 A KR 20167012155A KR 20160070106 A KR20160070106 A KR 20160070106A
- Authority
- KR
- South Korea
- Prior art keywords
- compound
- salt
- fumaric acid
- acid salt
- weight
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing three or more hetero rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/415—1,2-Diazoles
- A61K31/416—1,2-Diazoles condensed with carbocyclic ring systems, e.g. indazole
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5375—1,4-Oxazines, e.g. morpholine
- A61K31/5377—1,4-Oxazines, e.g. morpholine not condensed and containing further heterocyclic rings, e.g. timolol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/13—Crystalline forms, e.g. polymorphs
Abstract
하기 구조식으로 나타내는 하기 화합물(I)의 푸마르산염 및 말레산염뿐만 아니라 이들의 상응하는 약학적 조성물들이 기재된다. 1:1로 혼합된 상기 화합물(I)과 푸마르산염 및 1:1로 혼합된 상기 화합물(I)과 말레산염의 특정 단일 결정체들은 다양한 물성 및 물리적 측정 방법에 의해 특징지어진다. 또한, 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염 및 상기 1:1로 혼합된 상기 화합물(I)과 말레산염의 특정 결정체들을 제조하는 방법들이 기재된다. 또한, 본 발명은 암이 있는 피험자를 치료하는 방법들을 제공한다.
Description
관련 출원들
본 출원은 2013년 10월 18일자 미국 임시특허출원 제61/892,564호에 기초한 우선권의 이익을 주장하며, 해당 미국 임시특허출원서의 문헌에 개시된 모든 내용은 본 명세서의 일부로서 포함된다.
세린(serine)/트레오닌(threonine) 키나아제 중 폴로형 키나아제(polo-like kinase, PLK) 그룹은 다음과 같은 알려진 적어도 4개의 군을 포함한다: PLK1, PLK2(Snk로도 알려짐), PLK3(Fnk 또는 Prk로도 알려짐), 및 PLK4(Sak로도 알려짐). PLK4를 억제하는 제제들은 암 치료 가능성을 가진다. 잠재적인 PLK4 억제제의 개수는 미국특허 제8,263,596호, 제8,481,525호, 및 제8,481,533호에 기재되어 있다(본 인용문헌의 전체 내용이 본 발명에 참조로서 포함된다). 이러한 특허문헌에 기재된 하나의 억제제의 구조는 하기 화합물(I)로서 도시된다:
대량생산이 가능한 결정체이거나 대량생산이 가능한 물리적 특성을 갖는 상기 화합물의 염의 형태에 대한 요구가 있다. 또한, 이러한 후보 약물이 안정화되고 환자에게 효율적으로 투약될 수 있는 약학적 제형에 대한 요구가 있다.
본 발명의 목적은 PLK-4 억제제의 염 및 결정체들을 제공하는 것이다.
화합물(I)과 1:1의 비율로 혼합된 푸마르산염 및 1:1의 비율로 혼합된 말레산염은 잘 알려진 조건들에서 결정화되어 비흡습성(non-hygroscopic) 결정체들을 형성하는 것이 알려졌다. 본 명세서에서, "1:1"은 상기 산과(푸마르산 또는 말레산) 상기 화합물(I) 간의 몰비를 의미한다. 상기 푸마르산 및 말레산 상의 두 개의 카르복실산 기들(carboxylic acid groups)로 인해, 상기 산과(푸마르산 또는 말레산) 상기 화합물(I) 간의 몰비가 1:2인 상기 화합물(I)과 1:2의 비율로 혼합된 푸마르산염 및 1:2의 비율로 혼합된 말레산염을 형성하는 것도 가능하다. 상기 화합물(I)과 1:1의 비율로 혼합된 푸마르산염은 본 명세서에서 "상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염(1:1 compound(I) fumarate)"으로 언급되고, 상기 화합물(I)과 1:1의 비율로 혼합된 1:1 말레산염은 "상기 1:1로 혼합된 상기 화합물(I)과 말레산염(1:1 compound(I) maleate)"으로 언급된다.
상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염 및 상기 1:1로 혼합된 상기 화합물(I)과 말레산염은 상기 화합물(I)의 다른 염들과 비교할 때 몇 가지의 유익한 물성들을 갖는다. 실시예 1 및 2에 도시된 것처럼, 염산염(hydrochloride salt), 인산염(phosphate), 황산염(sulfate), 및 구연산염을 포함하는 상기 화합물(I)의 수많은 염을 결정형태로서 수득할 수 없다. 특히, 1:2의 상기 화합물(I)과 푸마르산염 및 1:2의 상기 화합물(I)과 말레산염 또한 결정체로서 수득할 수 없다. 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염 및 상기 1:1로 혼합된 상기 화합물(I)과 말레산염은 모두 비흡습성이고, 유리 염기(free base) 및 다른 염들보다 제형하는 것이 더 용이하다. 따라서, 이러한 유리한 물성들은 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염 및 상기 1:1로 혼합된 상기 화합물(I)과 말레산염의 대량생산 및 이들의 후보 약물로서 제형화를 가능하게 한다.
하나의 양태에서, 본 발명은 상기 화합물(I)과 푸마르산 간의 몰비가 1:1인 것을 특징으로 하는 상기 화합물(I)의 푸마르산염을 제공한다. 상기에서 주지된 것처럼, 이러한 염은 본 명세서에서 "상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염"으로도 언급된다.
또 다른 양태에서, 본 발명은 상기 화합물(I)과 말레산 간의 몰비가 1:1인 것을 특징으로 하는 상기 화합물(I)의 말레산염을 제공한다. 상기에서 주지된 것처럼, 이러한 염은 본 명세서에서 "상기 1:1로 혼합된 상기 화합물(I)과 말레산염"으로도 언급된다.
또 다른 양태에서, 본 발명은 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염(또는 상기 1:1로 혼합된 상기 화합물(I)과 말레산염) 및 약학적으로 허용 가능한 담체 또는 희석제을 포함하는 약학적 조성물을 제공한다.
또 다른 양태에서, 본 발명은 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염 또는 상기 1:1로 혼합된 상기 화합물(I)과 말레산염을 유효한 용량으로 피험자에게 투여하는 단계를 포함하는 것을 특징으로 하는 암이 있는 피험자를 치료하는 방법을 제공한다.
본 발명은 상기 화합물(I)과 푸마르산염 또는 상기 1:1로 혼합된 상기 화합물(I)과 말레산염을 유효한 용량으로 피험자에게 투여하는 단계를 포함하는 것을 특징으로 하는 PLK4 활성 억제가 필요한 피험자의 PLK4 활성을 억제하는 방법을 제공한다.
또한, 본 발명은 약물치료에 사용되는 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염 또는 상기 1:1로 혼합된 상기 화합물(I)과 말레산염을 제공한다. 하나의 구체예로, 상기 약물치료는 암이 있는 피험자를 치료하는데 사용된다. 또는, 상기 치료는 PLK4 활성 억제가 필요한 피험자의 PLK4 활성을 억제하는데 사용된다.
본 발명의 또 다른 양태는 암이 있는 피험자를 치료하기 위한 약제를 제조하는데 있어서 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염 또는 상기 1:1로 혼합된 상기 화합물(I)과 말레산염의 사용에 관한 것이다.
본 발명의 또 다른 양태는 암이 있는 피험자의 치료용도인 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염 또는 상기 1:1로 혼합된 상기 화합물(I)과 말레산염에 관한 것이다.
본 발명의 또 다른 양태는 PLK4 활성 억제가 필요한 피험자의 PLK4 활성을 억제하기 위한 약제를 제조하는데 있어서 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염 또는 상기 1:1로 혼합된 상기 화합물(I)과 말레산염의 사용에 관한 것이다.
본 발명의 또 다른 양태는 PLK4 활성 억제가 필요한 피험자의 PLK4 활성 억제용인 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염 또는 상기 1:1로 혼합된 상기 화합물(I)과 말레산염에 관한 것이다.
본 발명에 따르면 PLK-4 억제제의 염 및 결정체들이 제공된다.
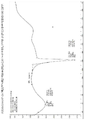
도 1은 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염의 A형에 대한 시차주사열량 열분석도(differential scanning calorimetry(DSC) analysis thermogram) 를 도시한다.
도 2는 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염의 B형에 대한 DSC 열분석도를 도시한다.
도 3은 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염의 C형에 대한 DSC 열분석도를 도시한다.
도 4는 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염의 D형에 대한 DSC 열분석도를 도시한다.
도 5 는 상기 1:1로 혼합된 상기 화합물(I)과 말레산염의 A형에 대한 DSC 열분석도를 도시한다.
도 6은 상기 화합물(I)의 인산염에 대한 DSC 열분석도를 도시한다.
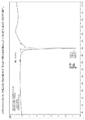
도 7은 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염의 A형에 대한 X선 분말 회절패턴(X-ray powder diffraction(XRPD) pattern)을 도시한다.
도 8 은 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염의 B형에 대한 XRPD 패턴을 도시한다.
도 9는 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염의 C형에 대한 XRPD 패턴을 도시한다.
도 10은 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염의 D형에 대한 XRPD 패턴을 도시한다.
도 11은 상기 1:1로 혼합된 상기 화합물(I)과 말레산염의 A형에 대한 XRPD 패턴을 도시한다.
도 2는 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염의 B형에 대한 DSC 열분석도를 도시한다.
도 3은 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염의 C형에 대한 DSC 열분석도를 도시한다.
도 4는 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염의 D형에 대한 DSC 열분석도를 도시한다.
도 5 는 상기 1:1로 혼합된 상기 화합물(I)과 말레산염의 A형에 대한 DSC 열분석도를 도시한다.
도 6은 상기 화합물(I)의 인산염에 대한 DSC 열분석도를 도시한다.
도 7은 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염의 A형에 대한 X선 분말 회절패턴(X-ray powder diffraction(XRPD) pattern)을 도시한다.
도 8 은 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염의 B형에 대한 XRPD 패턴을 도시한다.
도 9는 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염의 C형에 대한 XRPD 패턴을 도시한다.
도 10은 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염의 D형에 대한 XRPD 패턴을 도시한다.
도 11은 상기 1:1로 혼합된 상기 화합물(I)과 말레산염의 A형에 대한 XRPD 패턴을 도시한다.
본 발명은 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염, 상기 1:1로 혼합된 상기 화합물(I)과 말레산염, 이들의 특이적인 결정체들, 및 이들의 상응하는 약학적 조성물들을 제공한다. 또한, 본 발명은 암이 있는 피험자를 치료하는 방법들을 제공한다. 또한, 본 발명은 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염 및 상기 1:1로 혼합된 상기 화합물(I)과 말레산염의 특이적인 결정체들을 제조하는 방법들을 제공한다.
상기 1:1로 혼합된 상기 화합물(I)과
푸마르산염
및 상기 1:1로 혼합된 상기 화합물(I)과 말레산염의 결정체들
하나의 상세한 구체예로, 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염 또는 상기 1:1로 혼합된 상기 화합물(I)과 말레산염의 적어도 소정의 중량 백분율은 결정체이다. 상기 소정의 중량 백분율은 70%, 72%, 75%, 77%, 80%, 82%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99.5%, 또는 99.9% 또는 70% 내지 75%, 75% 내지 80%, 80% 내지 85%, 85% 내지 90%, 90% 내지 95%, 95% 내지 100%, 70 내지 80%, 80 내지 90%, 또는 90 내지 100%의 중량 백분율을 포함한다. 예를 들어, 하나의 구체예에서, 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염 또는 상기 1:1로 혼합된 상기 화합물(I)과 말레산염의 적어도 80 중량%(예, 적어도 90% 또는 99%)는 결정체이다. 이러한 수치 및 범위 내의 모든 수치들은 본 발명에 포함되도록 의도된 것으로 해석하여야 한다.
또 다른 상세한 구체예로, 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염 및 상기 1:1로 혼합된 상기 화합물(I)과 말레산염의 적어도 소정의 중량 백분율은 단일 결정체이다. 상기 소정의 중량 백분율은 70%, 72%, 75%, 77%, 80%, 82%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99.5%, 또는 99.9% 또는 70% 내지 75%, 75% 내지 80%, 80% 내지 85%, 85% 내지 90%, 90% 내지 95%, 95% 내지 100%, 70 내지 80%, 80 내지 90%, 또는 90 내지 100%의 중량 백분율을 포함한다. 예를 들어, 하나의 구체예에서, 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염 및 상기 1:1로 혼합된 상기 화합물(I)과 말레산염의 적어도 80 중량%(예, 적어도 90% 또는 99%)는 단일 결정체이다. 이러한 수치 및 범위 내의 모든 수치들은 본 발명에 포함되도록 의도된 것으로 해석하여야 한다.
본 명세서에서 사용되는 것처럼, 용어 "결정체"는 개개의 분자들이 매우 균일하고 규칙적인 고정된 화학적 구성을 갖는 결정구조를 갖는 고체를 의미한다. 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염의 결정체 및 상기 1:1로 혼합된 상기 화합물(I)과 말레산염의 결정체는 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염 및 상기 1:1로 혼합된 상기 화합물(I)과 말레산염의 단일 결정체의 결정들이거나, 또는 상이한 단일 결정체들의 결정들의 혼합물일 수 있다. 단일 결정체는 하나의 결정 또는 각각의 결정이 동일한 결정형태를 갖는 복수 개의 결정들로 이루어진 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염 또는 상기 1:1로 혼합된 상기 화합물(I)과 말레산염을 의미한다.
상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염(또는 상기 1:1로 혼합된 상기 화합물(I)과 말레산염)의 소정의 중량 백분율이 단일 결정체일 때, 상기 푸마르산염(또는 상기 1:1로 혼합된 상기 화합물(I)과 말레산염)의 비정질 푸마르산염(또는 상기 1:1로 혼합된 상기 화합물(I)과 말레산염) 및/또는 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염(또는 상기 1:1로 혼합된 상기 화합물(I)과 말레산염)의 하나 이상의 다른 결정체(단일 결정체는 제외함)의 일부 조합이다. 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염(또는 결정체 상기 1:1로 혼합된 상기 화합물(I)과 말레산염)의 결정체가 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염(또는 상기 1:1로 혼합된 상기 화합물(I)과 말레산염)의 하나의 특정한 결정체의 소정의 백분율로 정의될 때, 잔여물은 비정질 형태 및/또는 상기 구체화된 하나 이상의 특정한 형태 외의 다른 결정체들로 이루어진다. 단일 결정체의 예로서, 본 명세서에서 논의되는 하나 이상의 물성에 의해 특징지어지는 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염(또는 상기 1:1로 혼합된 상기 화합물(I)과 말레산염)의 A형이 포함된다.
상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염(또는 상기 1:1로 혼합된 상기 화합물(I)과 말레산염)은 다른 입체이성체들에 대하여(즉, 모든 입체이성체들에 중량에 대한 상기 입체이성체의 중량비) 적어도 60%, 70%, 80%, 90%, 99% 또는 99.9 중량%의 순도를 갖는다.
상기 1:1로 혼합된 상기 화합물(I)과
푸마르산염
및 상기 1:1로 혼합된 상기 화합물(I)과
말레산염의
결정체들의 제조
상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염 또는 상기 1:1로 혼합된 상기 화합물(I)과 말레산염의 특정 고체들은, 예를 들어, 느린 증발(slow evaporation), 서냉(slow cooling), 및 항용매 침전(anti-solvent precipitation)에 의해 제조될 수 있다.
본 명세서에서 사용되는 것처럼, 용어 "항용매"는 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염 또는 상기 1:1로 혼합된 상기 화합물(I)과 말레산염이 낮은 용해도를 가지며, 상기 푸마르산염 또는 말세산염이 미세한 분말 또는 결정의 형태로 용액으로부터 침전되는 용매를 의미한다.
또는, 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염 또는 상기 1:1로 혼합된 상기 화합물(I)과 말레산염은 이후에 씨결정(seed crystal)을 첨가함으로써 또는 상기 씨결정의 첨가 없이 적절한 용매로부터 재결정화될 수 있다.
상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염 또는 상기 1:1로 혼합된 상기 화합물(I)과 말레산염의 특정 고체들 각각의 제조는 후술되는 실험 단락에서 설명된다.
상기 1:1로 혼합된 상기 화합물(I)과
푸마르산염
및 상기 1:1로 혼합된 상기 화합물(I)과
말레산염의
결정체들의 특징 설명
시료들은 40 kV/30 mA에서 작동되는 X선 튜브를 이용하여 구리 K-알파 X선들(copper K-alpha X-rays)로 조사된다. 하나의 구체예로, 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염은 A형인 단일 결정체이다. 특정 구체예로, 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염의 A형태는 도 7에 도시된 X선 분말 회절패턴(X-ray powder diffraction pattern)에 의해 특징지어진다. 좀 더 상세한 구체예로, 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염의 A형태는 하기 각에서의(2θ 각들) 피크들을 포함하는 X선 분말 회절패턴에 의해 특징지어진다:
a) 2θ에서 9.7°, 16.7°, 및 20.1° ± 0.2(주요 피크들); 또는
b) 2θ에서 8.2°, 9.7°, 16.7°, 및 20.1° ± 0.2; 또는
c) 2θ에서 8.2°, 9.7°, 10.7°, 11.5°, 14.9°, 16.7°, 20.1°, 및 23.5° ± 0.2; 또는
d) 2θ에서 8.2°, 9.7°, 10.7°, 11.5°, 13.6°, 14.9°, 16.7°, 18.1°, 18.8°, 20.1°, 23.5°, 및 24.5° ± 0.2.
여기에서 설명되는 주된 피크들은 상기 A형에서 50% 이상의 상대적 강도를 갖는다. 구체화된 2θ 각도는 구체화된 수치 ± 0.2°를 의미하는 것으로 해석되어야 한다.
또 다른 상세한 구체예로, 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염 A형은 112 ℃ 및 158 ℃의 시차주사열량계(differential scanning calorimeter, DSC) 피크 상 전이온도들(peak phase transition temperatures)로 특징지어진다.
또 다른 구체예로, 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염은 B형인 단일 결정체이다. 특정 구체예로, 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염의 B형은 도 8에 도시된 X선 분말 회절패턴에 의해 특징지어진다. 좀 더 상세한 구체예로, 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염의 B형은 하기 각도에서의 피크들을 포함하는 X선 분말 회절패턴에 의해 특징지어진다:
a) 2θ에서 11.9° 및 14.9°± 0.2(주요 피크들); 또는
b) 2θ에서 11.9°, 14.9°, 18.7°, 및 21.5° ± 0.2; 또는
c) 2θ에서 5.5°, 5.9°, 11.9°, 14.9°, 16.7°, 17.4°, 18.7°, 21.5°, 및 23.4° ± 0.2.
여기에서 설명되는 주된 피크들은 상기 B형에서 75% 이상의 상대적 강도를 갖는다.
또 다른 상세한 구체예로, 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염의 B형은 58 ℃ 및 162 ℃의 시차주사열량계(DSC) 피크 상 전이온도들로 특징지어진다.
또 다른 구체예로, 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염은 C형인 단일 결정체이다. 특정 구체예로, 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염의 C형은 도 9에 도시된 단일 결정체의 X선 분말 회절패턴에 의해 특징지어진다. 좀 더 상세한 구체예로, 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염의 C형은 하기 각도에서의 피크들을 포함하는 X선 분말 회절패턴에 의해 특징지어진다:
a) 2θ에서 16.8°, 16.9°, 및 19.9° ± 0.2(주요 피크들); 또는
b) 2θ에서 9.8°, 16.8°, 16.9°, 19.9°, 및 23.5° ± 0.2; 또는
c) 2θ에서 9.7°, 9.8°, 11.7°, 15.1°, 16.8°, 16.9°, 19.9°, 23.5°, 및 23.7° ± 0.2.
여기에서 설명되는 주된 피크들은 상기 C형에서 75% 이상의 상대적 강도를 갖는다.
또 다른 상세한 구체예로, 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염의 C형은 62 ℃ 및 156 ℃의 시차주사열량계(DSC) 피크 상 전이온도들로 특징지어진다.
또 다른 구체예로, 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염은 D형인 단일 결정체이다. 특정 구체예로, 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염의 D형은 도 10에 도시된 X선 분말 회절패턴으로 특징지어진다. 좀 더 상세한 구체예로, 상기 D형의 X선 회절패턴은 하기 각도에서의 피크들을 포함한다:
a) 2θ에서 9.6°, 12.8°, 16.0°, 및 22.0° ± 0.2(주요 피크들); 또는
b) 2θ에서 9.6°, 12.8°, 16.0°, 16.9°, 21.2°, 및 22.0° ± 0.2; 또는
c) 2θ에서 9.6°, 12.8°, 16.0°, 16.9°, 20.8°, 21.2°, 21.5°, 및 22.0° ± 0.2; 또는
d) 2θ에서 9.6°, 11.7°, 12.0°, 12.8°, 16.0°, 16.6°, 16.9°, 18.1° 19.2°, 19.8°, 20.7°, 20.8°, 21.2°, 21.5°, 22.0°, 22.5°, 24.0°, 26.0°, 및 29.8° ± 0.2.
여기에서 설명되는 주된 피크들은 상기 D형에서 85% 이상의 상대적 강도를 갖는다.
또 다른 상세한 구체예로, 적어도 90 중량%의 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염의 D형은 219℃의 시차주사열량계(DSC) 피크 상 전이온도로 특징지어진다.
또 다른 구체예로, 상기 1:1로 혼합된 상기 화합물(I)과 말레산염은 A형의 단일 결정체이다. 특정 구체예로, 상기 1:1로 혼합된 상기 화합물(I)과 말레산염의 A형은 도 11에 도시된 X선 분말 회절패턴으로 특징지어진다. 좀 더 상세한 구체예로, 상기 1:1로 혼합된 상기 화합물(I)과 말레산염의 A형은 하기 각도에서의 피크들을 포함하는 X선 분말 회절패턴에 의해 특징지어진다:
a) 2θ에서 11.5°, 12.6°, 14.9°, 및 15.1° ± 0.2; 또는
b) 2θ에서 10.8°, 11.5°, 12.4°, 12.6°, 14.9°, 15.1°, 및 17.1° ± 0.2; 또는
c) 2θ에서 5.8°, 10.8°, 11.5°, 12.4°, 12.6°, 14.9°, 15.1°, 17.1°, 18.6°, 23.5°, 및 26.1° ± 0.2; 또는
d) 2θ에서 5.5°, 5.8°, 10.8°, 11.5°, 12.4°, 12.6°, 14.1°, 14.9°, 15.1°, 16.7°, 17.1°, 17.8°, 18.6°, 19.5°, 19.9°, 21.9°, 22.2°, 23.0°, 23.3°, 23.5°, 23.9°, 및 26.1° ± 0.2.
여기에서 설명되는 주된 피크들은 상기 A형에서 90% 이상의 상대적 강도를 갖는다.
또 다른 상세한 구체예로, 상기 1:1로 혼합된 상기 화합물(I)과 말레산염 A형은 219℃의 시차주사열량계(DSC) 피크 상 전이온도로 특징지어진다.
본 명세서에서 설명되는 상기 화합물(I)의 푸마르산염 또는 상기 화합물(I)의 말레산염은 비정질 형태 또는 결정체이다. 본 발명에서 설명되는 상기 화합물(I)의 푸마르산염 또는 상기 화합물(I)의 말레산염은 비용매화물(unsolvated form) 및 용매화물(solvate form) 모두를 포함한다.
용어 "용매화물"은 용매가 고체 또는 결정체의 일부로서 명확한 비율(예, 1:1 또는 1:2의 몰비)로 조합된 상기 화합물(I)의 푸마르산염 또는 상기 화합물(I)의 말레산염의 고체 또는 결정체를 의미한다.
용어 "비용매화물"은 용매분자와 상기 화합물(I)의 푸마르산염 또는 상기 화합물(I)의 말레산염 간에 어떤 명확한 비율이 없는 것을 의미하며, 상기 용매분자가 실질적으로 상기 화합물(I)의 푸마르산염 또는 상기 화합물(I)의 말레산염에 존재하지 않음을 의미한다(예, 10 중량% 미만). 잘 알려진 용매분자의 예는 물, 메탄올, 에탄올, n-프로판올, 및 이소프로판올을 포함한다.
본 발명에서, 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염의 A형은 상기 화합물(I)과 푸마르산염과 이소프로판올 간의 몰비가 2:1인 이소프로판올 용매화합물이다. 여기에서 설명되는 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염의 B 내지 D형 및 상기 1:1로 혼합된 상기 화합물(I)과 말레산염의 A형은 용매화합물이 아니고, 즉, 이들 각각은 비용매화물이다.
상기 화합물(I)과
푸마르산염
및 상기 화합물(I)
말세산염을
사용한 치료방법
상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염 및 상기 1:1로 혼합된 상기 화합물(I)과 말레산염은 PLK4를 포함하는 다양한 키나아제를 억제할 수 있다. 따라서, 본 발명의 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염 및 상기 1:1로 혼합된 상기 화합물(I)과 말레산염은 이러한 키나아제와 관련된 질병 또는 상태를 치료하는데 유용하다. 예를 들어, PLK4는 세포의 유사분열과 관련된 것으로 생각된다. 따라서, 이러한 효소의 작은 분자인 억제제들은 잠재적인 항암제일 수 있다.
특정 구체예로, 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염 및 상기 1:1로 혼합된 상기 화합물(I)과 말레산염은 PLK4 억제제이고 이러한 키나아제와 관련된 암과 같은 질병들을 치료하는데 유용하다.
본 발명의 또 다른 양태는 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염 및 상기 1:1로 혼합된 상기 화합물(I)과 말레산염의 유효한 용량을 피험자에게 투여하는 단계를 포함하는 것을 특징으로 하는 암이 있는 피험자를 치료하는 방법에 관한 것이다. 하나의 구체예로, 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염 및 상기 1:1로 혼합된 상기 화합물(I)과 말레산염은 암의 증식을 억제한다. 구체적으로, 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염 및 상기 1:1로 혼합된 상기 화합물(I)과 말레산염은 PLK4를 과다발현하는 암의 성장을 억제한다. 또 다른 구체예로, 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염 및 상기 1:1로 혼합된 상기 화합물(I)과 말레산염은 암세포의 노화를 유도하거나 암세포의 증식을 억제함으로써 암증식을 억제한다.
본 발명의 방법들에 의해 치료되거나 예방될 수 있는 암의 예는 폐암, 유방암, 대장암, 뇌종양, 신경아세포종(neuroblastoma), 전립선암, 흑색종, 다형성교아종(glioblastoma multifrom), 난소암, 림프종, 백혈병, 흑색종, 육종(sarcoma), 림프계 종양(paraneoplasia), 골육종(osteosarcoma), 배아세포종(germinoma), 신경교종(glioma), 및 중피종(mesothelioma)을 포함한다. 상세한 구체예로, 상기 암은 폐암, 유방암, 대장암, 신경아세포종, 전립선암, 흑색종(melanoma), 다형성신경교아증(glioblastoma multiform), 난소암, 림프종(lymphoma), 백혈병, 골육종(osteosarcoma), 배아세포종(germinoma), 신경교종(glioma), 섬유육종(fibrosarcoma), 위암(gastrointestinal sarcoma), 섬유성조직구종(fibrous histiocytoma), 원형세포육종(round cell sarcoma), 활막육종(synovial sarcoma), 자궁경부암(cervical cancer), 항문생식기암(anogenital cancer), 두경부암(head and neck cancer), 및 구인두암(oropharyngeal cancer)이다. 상세한 구체예로, 상기 암은 폐암, 대장암, 뇌종양, 신경아세포종, 전립선암, 흑색종, 다형성신경교아증, 또는 난소암이다. 또 다른 상세한 구체예로, 상기 암은 폐암, 유방암, 대장암, 뇌종양, 신경아세포종, 전립선암, 흑색종, 다형성교아종 또는 난소암이다. 또 다른 상세한 구체예로, 상기 암은 폐암, 유방암, 및 대장암이다. 또 다른 상세한 구체예로, 상기 암은 유방암이다. 또 다른 상세한 구체예로, 상기 암은 기저세포 모양 아형 유방암(basal sub-type breast cancer) 또는 내강형 B 아형 유방암(luminal B sub-type breast cancer)이다. 하나의 구체예로, 상기 기저 세포 모양 아형 유방암은 에스트로젠 수용체(estrogen receptor, ER), HER2, 및 프로게스테론 수용체(progesterone receptor, PR)에 음성인 유방암이다. 또 다른 상세한 구체예로, 상기 암은 연조직(soft tissue) 암이다. 용어 "연조직 암"은 당분야에서 잘 알려진 용어로 신체의 모든 연조직 유래의 종양을 포함한다. 이러한 연조직은 비제한적인 예로 민무늬근, 골격근, 건(tendons), 섬유성 조직(fibrous tissues), 지방조직, 혈관 및 림프관, 혈관주위(perivascular) 조직, 신경, 중간엽 세포(mesenchymal cells), 및 활액 조직(synovial tissues)를 포함하는 신체의 다양한 구성 및 기관을 연결하거나, 지지하거나, 둘러싼다. 따라서, 연조직 암은 지방조직, 근육조직, 신경조직, 관절조직, 혈관, 림프관, 및 섬유성 조직의 암일 수 있다. 연조직 암은 양성 또는 악성일 수 있다. 일반적으로, 악성 연조직 암은 육종 또는 연조직 육종으로 언급된다. 지방종, 지방아세포종(lipoblastoma), 동면선종(hibernoma), 지방육종(liposarcoma), 평활근종(leiomyoma), 평할근육종(leiomyosarcoma), 횡문근종(rhabdomyoma), 횡문근육종(rhabdomyosarcoma), 신경섬유종(neurofibroma), 신경초종(schwannoma 또는 neurilemoma), 신경종(neuroma), 악성 신경초종, 신경섬유육종(neurofibrosarcoma), 신경원성 육종(neurogenic sarcoma), 결절성 건초염(nodular tenosynovitis), 활막육종(synovial sarcoma), 혈관종(hemangioma), 사구종양(glomus tumor), 혈관주위세포종(hemangiopericytoma), 혈관내피종(hemangioendothelioma), 혈관육종(angiosarcoma), 카포시 육종(Kaposi sarcoma), 림프관종(lymphangioma), 섬유종(fibroma), 탄력섬유종(elastofibroma), 천층 섬유종증(superficial fibromatosis), 섬유성조직구종(fibrous histiocytoma), 섬유육종(fibrosarcoma), 섬유종증(fibromatosis), 융기성피부섬유육종(dermatofibrosarcoma protuberans, DFSP), 악성 섬유성조직구종(malignant fibrous histiocytoma, MFH), 점액종(myxoma), 과립세포종양(granular cell tumor), 악성 간엽세포종(malignant mesenchymomas), 포상 연부 육종(alveolar soft-part sarcoma), 유상피 육종(epithelioid sarcoma), 투명세포육종(clear cell sarcoma), 및 결합조직성 소원형세포종양(desmoplastic small cell tumor)을 포함하는 수 많은 형태의 연조직 종양이 있다. 하나의 상세한 구체예로, 상기 연조직 암은 섬유육종, 위암, 평할근육종, 탈분화 지방육종(dedifferentiated liposarcoma), 다형성 지방육종(pleomorphic liposarcoma), 악성 섬유성조직구종, 원형세포육종, 및 활막육종으로 이루어진 군으로부터 선택되는 육종이다.
또한, 본 발명은 피험자에서의 PLK4 활성을 감소시키는데 효과적인 용량으로 본 명세서에 기재된 화합물을 피험자에게 투여하는 단계를 포함하는 것을 특징을 하는 암세포를 가진 환자를 치료하는 방법에 관한 것이다.
용어 "유효한 용량"은 피험자에게 투여될 때, 대조군과 비교하여, 예를 들어, 피험자의 암을 억제하거나 감소시키는 임상적인 결과들을(예, 임상적인 증상 또는 암세포의 양에 의해 결정된 결과들) 포함하는 유익한 또는 바람직한 결과들로 귀결되는 용량을 의미한다.
본 명세서에서 사용되는 것처럼, "암이 있는 피험자를 치료하는 것"은, 부분적으로 또는 실질적으로, 이하 나열된 것들 중 하나 또는 그 이상을 달성하는 하는 것을 포함한다: 암의 증식을 억제하는 것, 암의 범위를 줄이는 것(예, 종양 크기를 줄이는 것), 암의 증식속도를 낮추는 것, 암과 관련된 임상증상 또는 표지(조직 또는 혈청 성분과 같은)를 개선하거나 피험자의 수명을 연장하는 것; 및 암의 재발 가능성을 줄이는 것.
본 명세서에서 사용되는 것처럼, 용어 "암의 재발 가능성을 줄이는 것"은 병의 차도가 보인 기간 후에 원발 부위(primary site) 및/또는 기타 부위(secondary site)에 또는 이들의 근처 부위에서의 암의 재발을 억제하거나 지연시키는 것을 의미한다. 또한, 상기 용어는 본 발명에서 설명되는 치료로 암의 재발률이 치료가 이루어지지 않을 때와 비교하여 더 낮은 것을 의미한다.
본 명세서에서 사용되는 것처럼, 용어 "병의 차도"는 전형적으로 피험자가 항암 치료로 성공적으로 치료된 후에 암과 관련된 임상적인 증상들 또는 표지들이 사라지거나 발견되지 않는 암의 상태를 의히한다.
일반적으로, 본 발명의 화합물의 유효한 상기 제공되는 약물 또는 화합물, 상기 약학적 제형, 투 경로, 질병 또는 질환의 종류, 치료되는 피험자 또는 숙주의 신원 등과 같은 다양한 인자에 따라 다양하지만, 당업자에 의해서 관례로 결정될 수 있다. 본 발명의 화합물의 유효한 용량은 당 분야에서 알려진 일반적인 방법들에 의해서 당업자에 의해서 용이하게 결정될 수 있다.
하나의 구체예로, 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염 및 상기 1:1로 혼합된 상기 화합물(I)과 말레산염의 유효한 용량은 약 0.01 내지 약 1000 mg/1 kg의 체중, 또는 약 0.05 내지 약 500 mg/1 kg의 체중, 또는 약 0.1 내지 약 100 mg/1 kg의 체중, 또는 약 0.1 내지 약 15 mg/1 kg의 체중, 또는 약 1 내지 약 5 mg/1 kg의 체중의 범위 내이다. 또 다른 구체예로, 상기 용량은 약 2 내지 약 3 mg/1 kg의 체중의 범위 내이다. 당업자는 어떤 인자들이 암으로 고통 중인 피험자를 효과적으로 치료하는데 필요한 투약량에 영향을 주고, 이러한 인자들은, 비제한적인 예로, 질병 또는 질환의 심각도, 기존의 치료, 피험자의 일반적인 건강상태 및/또는 연령, 및 또 다른 질병들을 포함함을 이해할 것이다.
게다가, 본 발명의 화합물의 유효한 용량으로 피험자를 "치료"하기 위한 처방은 단독 투여로 이루어지거나 연속적인 투여를 포함할 수 있다. 예를 들어, 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염 및 상기 1:1로 혼합된 상기 화합물(I)과 말레산염은 적어도 매주 1 회 투여될 수 있다. 그러나, 또 다른 구체예로, 상기 화합물은 주어진 치료를 위하여 약 매주 1 회 내지 매일 1 회의 빈도로 피험자에게 투여될 수 있다. 치료기간은 질병의 심각도, 환자의 연령, 본 발명의 화합물의 농도 및 활성, 또는 이들의 조합에 따라 상이하다. 또한, 치료 또는 예방을 위해 사용되는 화합물의 효과적인 용량은 특정 치료 또는 예방을 위한 처방기간 동안 증가하거나 감소할 수 있음을 이해할 수 있을 것이다. 용량 변경은 당 분야에서 알려진 표준진단분석에 의해 이루어질 수 있고 명확하게 될 수 있다. 일부 경우에서, 장기간의 투여가 필요할 수 있다.
용어 "피험자"는 포유동물을 의미하여, 바람직하게는 인간을 의미하지만, 동물 치료가 요구될 때에서 동물(예, 반려동물들(예, 개, 고양이, 등), 농장동물들(예, 소, 양, 돼지, 말, 등), 및 실험실 동물들(예, 래트(rats), 실험쥐, 기니피그(guinea pigs), 등))일 수 있다.
본 발명의 상기 화합물들은 선택되는 투여 방법에 따라 다양한 형태로 환자들에게 투약될 수 있으며, 이는 당업자에 의해 이해될 것이. 본 발명의 상기 화합물들은, 예를 들어, 경구, 비 경구적으로, 구강으로, 설하로, 비강으로, 직장으로, 패치를 사용하여, 펌프 또는 경피를 이용한 투여, 및 본 발명에 따라 제형화된 상기 약학적 조성물들로 투여될 것이다. 상기 비 경구적 투여는 정맥주사, 복강 내 주사, 피하주사, 근육주사, 경상피(transepithelial)에 의한 투여, 비강에 의한 투여, 폐 내로 투여, 척추 내 투여, 직장으로 투여, 및 국소적인 투여방법들을 포함한다. 상기 비 경구적 투여는 선택된 기간 동안 연속적인 주입에 의해 이루어질 수 있다.
상기 1:1로 혼합된 상기 화합물(I)과
푸마르산염
및 상기 1:1로 혼합된 상기 화합물(I)과
말레산염을
포함하는 약학적 조성물들
상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염 또는 상기 1:1로 혼합된 상기 화합물(I)과 말레산염 또는 본 명세서에 기재된 결정 형태들 중 어느 하나 또는 그 이상은 피험자로 투여하기 위하여 약학적 조성물들로 적절히 제형화될 수 있다.
하나의 구체예로, 본 발명은 전술된 것처럼 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염 또는 상기 1:1로 혼합된 상기 화합물(I)과 말레산염을 포함하는 약학적 조성물 및 약학적으로 허용 가능한 담체 또는 희석제를 제공하고, 상기 염의 적어도 80 중량%(바람직하게는 90%, 더 바람직하게는 99%)은 결정체이다.
본 발명의 상기 약학적 조성물들은 선택적으로 락토오스(lactose), 녹말(starch), 셀룰로오스(cellulose), 및 덱스트로오스(dextrose)와 같은 하나 또는 그 이상의 이들의 약학적으로 허용 가능한 담체들 및/또는 희석제들을 포함한다. 향미료; 감미료; 및 메틸, 에틸, 프로필, 및 부틸 파라벤(parabens)과 같은 방부제들이 포함될 수도 있다. 적절한 첨가제들의 좀 더 완벽한 목록들을 다음 문헌에서 확인할 수 있다: Handbook of Pharmaceutical Excipients(제 5판, Pharmaceutical Press, 2005년). 당업자는 다양한 투여방법들에 대하여 적절한 제형들을 제조하는 방법들을 알 수 있을 것이다. 적절한 제형의 선택 및 제조를 위한 종래의 방법들 및 성분들이 예로서 다음 문헌들에 설명되어 있다: Remington's Pharmaceutical Sciences(2003년, 제20판) 및 The National Formulary(USP 24 NF19, 1999년, The United States Pharmacopeia에 의해 출간됨). 상기 담체들, 희석제들 및/또는 첨가제들은 상기 약학적 조성물의 다른 성분들과 병용되고 피험자에게 무해하다는 의미에서 "허용가능"하다.
전형적으로, 경구투여를 위하여, 본 발명의 화합물은 첨가제와 함께 병용될 수 있으며, 삼킬 수 있는 정제, 버컬정(buccal tablets), 트로키제(troches), 캡슐(capsules), 엘릭시르(elixirs), 부형제(suspensions), 시럽(syrups), 웨이퍼(wafers), 등의 형태로 사용될 수 있다.
전형적으로, 비 경구적 투여를 위하여, 본 발명의 화합물의 용액들은 일반적으로 히드록시프로필 셀룰로오스(hydroxypropyl cellulose)와 같은 계면 활성제와 적절히 혼합된 물로 제조될 수 있다. 또한, 분산제들은, 알코올을 포함하거나 포함하지 않고, 글리세롤(glycerol), 액상 폴리에틸렌 글리콜(liquid polyethylene glycol), DMSO, 및 이들의 혼합물, 및 오일로 제조될 수 있다. 저장 또는 사용을 위한 일반적인 조건들하에서, 이러한 제형들은 미생물의 성장을 억제하는 방부제를 포함한다.
전형적으로, 주사에 의한 투여를 위하여, 멸균된 주사 용액의 임기 조제(extemporaneous preparation)를 위하여 본 명세서에서 설명된 화합물의 멸균된 수용액 또는 분산제 및 멸균된 분말이 적절하다.
비강투여를 위하여, 본 발명의 상기 화합물들은 에어로졸(aerosols), 유적(drops), 젤(gels), 분말로 제형화될 수 있다. 에어로졸 제형은 전형적으로 생리학적으로 허용 가능한 수용매(aqueous solvent) 또는 비수용매(non-aqueous solvent) 내의 활성물질의 용액 또는 미세한 부형제를 포함하고, 항상 밀봉된 용기 내에서 멸균된 상태로 1 회 투약용량 또는 복수회의 투약용량으로 제공되며, 상기 밀봉된 용기는 카트리지 형태이거나 약제 미립화 장치와 함께 사용될 수 있도록 재충전될 수 있다. 또는, 상기 밀봉된 용기는 사용 후 폐기되는, 미터링 밸브(metering valve)가 장착된 1 회용 비강 흡입기 또는 에어로졸 용기와 같은 일원화된 장치일 수 있다. 상기 투약용기가 에어로졸 용기를 포함할 경우, 상기 투약용기는 추진제를 포함할 수 있으며, 상기 추진제는 압축된 공기와 같은 압축된 가스 또는 플루오로클로로하이드로카본(fluorochlorohydrocarbon)과 같은 유기 추진제일 수 있다. 상기 에어로졸은 펌프-분무기 형태(pump-atomizer)를 취할 수도 있다.
구강 또는 설하 투여를 위하여, 본 발명의 상기 화합물들은 설탕, 아카시아(acacia), 트래거캔스 고무(tragacanth), 또는 젤라틴(gelatin), 및 글리세린(glycerine)과 같은 담체를 사용하여 정제(tablets), 함당정제(lozenges), 또는 향정(pastilles)으로 제형화될 수 있다.
직장 투여를 위하여, 본 명세서에 설명되는 상기 화합물들은 코코아 버터와 같은 종래의 좌제 기제(suppository base)를 함유하는 좌약의 형태로 제형화될 수 있다.
본 발명은 하기 실시예들에 의해 상세히 설명될 것이나, 본 발명이 이들로 한정되지는 않는다.
실험
약어:
BSA: 벤젠술폰산(benzene sulfonic acid)
d: 일자
EtOAc: 에틸 아세테이트(ethyl acetate)
EtOH: 에탄올
h: 시간
HPLC: 고성능 액체크로마토그래피(high performance liquid chromatography)
IPA: 이소프로판올(isopropanol)
IBAc: 이소부틸아세테이트(isobutyl acetate)
MeOH: 메탄올
MIBK: 메틸이소부틸케톤(methyl isobutyl ketone)
min: 분
MTBE: 메틸 터트-부틸에테르
(methyl tert-butylether)
NMR: 핵자기공명(nuclear magnetic resonance)
pTSA: 파라톨루엔술폰산(para toluenesulfonic acid)
RBF: 둥근바닥 플라스크(round bottom flask)
RH: 상대습도
Rel. Int.: 상대적 강도
rt: 실온
temp: 온도
TGA: 열중량 측정분석(thermogravimetric analysis)
THF: 테트라히드로푸란(tetrahydrofuran)
wt%: 중량%
XRPD: X선 분말회절
분석 조건들
시차주사열량분석(DSC)
DSC 분석은 Mettler 822e 시차주사열량계 또는 TA instruments Q2000 상에서 수행되었다. 시료들의 무게를 알루미늄 팬(aluminum pan)으로 측정하고 구멍 난 뚜껑으로 덮은 후, 클림핑하였다. 분석 조건들은 10 ℃/min의 속도로 상승하는 30 내지 120℃, 30 내지 200℃, 30 내지 300 ℃, 및 40 내지 300 ℃였다.
열중량 분석(TGA)
TGA 분석은 Mettler 851e SDTA 열중량 분석기 상에서 수행되었다. 시료 무게를 알루미나 도가니(alumina crucible)에서 측정하고 10 ℃/min의 속도로 30 내지 230℃, 30 내지 300℃, 및 30 내지 350 ℃에서 분석하였다.
X선
분말회절
(
XRPD
)
시료들을 Panalytical CubiX-Pro X선 분말 회절계 또는 Bruker AXS/Siemens D5000 회절계 상에서 분석하였다.
파나리티컬(panalytical) 조건들: 시료들을 실리콘 제로-리턴 울트라-마이크로 샘플 홀더(silicon zero-return ultra-micro sample holder)상에 두었다. 상기 시료들은 40 kV/30 mA에서 작동하는 X선 튜브를 사용하여 구리 K-알파 X선으로 조사되었다. 상기 시료들은 3 ° 내지 45°의 범위에서 연속적인 모드로 스캔되었다.
Bruker AXS/Siemens D5000 조건들: 50 kV/35 mA에서 작동하는 고전압 Cu-타겟이 사용되었다. 두 번째 빔은 고체상 Kevex 탐지기를 사용하여 단색파로 적용되었다. 상기 시료들은 대부분의 유기 결정체 화합물의 대표적인 피크들이 발생하는 2 내지 35°(2σ)의 범위에서 스캔되었다.
중량식 흡습(Gravimetric Moisture Sorption)
중량식 흡습 실험은 첫 번째로 당량(equilibrium weight)이 도달되거나 최대 4 시간 동안 40% RH 및 25 ℃에서 시료를 유지함으로써 Hiden 동적수증기흡수분석기(Hiden dynamic vapour sorption analyzer) 상에서 수행되었다. 이후, 상기 시료는 10%의 간격으로 40 내지 90% RH에서 등온(25 ℃) 흡착 스캔되었다. 상기 시료는 최대 4 시간 동안 각 시점에서 접근 중량(asymptotic weight)으로 평형화되었다. 흡착 후, 또다시 최대 4 시간 동안 접근 중량으로 평형화하면서 85 내지 5% RH(25 ℃)에서 흡착 스캔이 +10%의 간격으로 수행되었다. 이후, 흡착 스캔은 +10% RH의 간격으로 0% RH 내지 40% RH에서 수행되었다.
라만 분광(Raman Spectroscopy)
라만 분석을 위한 시료들은 PhAT 프로브(probe)가 포함된 Kaiser RXN1 매크로현미경(macroscope)을 사용하여 분석되었다. 96 웰 플레이트(well plate) 결정체들로부터 수득된 고체들은 하기 조건들을 사용하여 분석되었다:
라만 광원(Raman Source): 785 nm 레이저
현미경 대물렌즈: 1.2 mm
단일 노출시간: 12 sec
Co 첨가(co-additions): 12
이용 가능한 노출 옵션들: 코스믹 레이 필터링(Cosmic Ray filtering), 다크프레임 차감(dark subtraction), 강도교정(intensity calibration)
광학 현미경 검사(Optical Microscopy)
시료들은 디지털 카메라(1600 × 1200 해상도)가 장착된 Leica DMRB 편광 현미경을 사용하여 관찰되었다. 적은 용량의 시료들을 커버 슬립이 있는 유리 슬라이드 상의 미네랄 오일 내에 분산하고 100x 배율 또는 그 이상의 배율로 관찰하였다.
복굴절(Birefringence)
복굴절 분석을 위한 시료들을 Coleman Technologies사의 복굴절 영상기를 사용하여 분석하였다. 96 웰 플레이트 결정체들로부터 수득된 고체들을 하기 조건들을 사용하여 분석하였다:
조명: 37
노출: 57.9
편광: 0.0
웰 마스크(well mask) 직경: 6.2
타겟 강도: 80
타겟 백분위수(percentile): 90.0
최대 평균강도: 100
핵자기공명
양성자 NMR를 위한 시료들을 Bruker 400 MHz 분광계를 사용하여 분석하였다.
실시예 1: 조합적 염 스크린(Combinatorial Salt Screen)
염 스크린은 6 개의 용매(IPA, THF, 아세톤(acetone), 아세토니트릴(acetonitrile), EtOH, 및 EtOAc) 및 28 개의 약학적으로 허용 가능한 산(HCl, HBr, H3PO4, H2SO4, CH3SO3H, pTSA, BSA, 나프탈렌 술폰산(naphthalene sulfonic acid), 에탄 술폰산(ethane sulfonic acid), 메탄 술폰산(methane sulfonic acid), 아디핀산(adipic acid), 에탄 디술폰산(ethane disulfonic acid), 말레산(maleic acid), 벤조산(benzoic acid), L-말산(L-malic acid), 시트르산(citric acid), L-락산(L-lactic acid), 히푸르산(hippuric acid), L-피로글루탐산(L-pyroglutamic acid), 숙신산(succinic acid), L-타르타르산(L-tartaric acid), 포름산(formic acid), 푸마르산(fumaric acid), 글루타르산(glutaric acid), L-아스코르빈산(L-ascorbic acid), 소르브산(sorbic acid), 벤조산(benzoic acid), 및 말론산(malonic acid))을 사용하여 수행하였다. MeOH에 20 mg/mL의 용량으로 존재하는 상기 화합물(I) 용액의 200 ㎕을 96-웰 플레이트의 각 웰로 투입하였다. 이후, 상기 용매는 질소 유동 하에서 증발되어 각 웰에 약 4 mg의 출발물질이 잔여 하였다. 이후, 원하는 첫 번째 용매를 각각의 웰(500 ㎕)에 투입하였다. 상기 플레이트들을 50 ℃로 가열하고 A형의 완벽한 용해가 이루어지도록 10 분 동안 자기로(magnetically) 교반하였다. 이후, 각각의 웰은 각각의 산의 1.05 당량에 상응하는 부피에서 지정된 반대이온 용액으로 충전되고, 10 분 동안 온도에서 평형되었다. 이후, 상기 플레이트들을 20 ℃/h 내지 25 ℃로 냉각되었고, 이때 각각의 웰의 200 ㎕ 을 증발 플레이트로 옮김으로써 마스터 플레이트(master plate)를 준비하였다. 이후, 상기 플레이트들을 주변 온도로 냉각하고, 5 ℃에서 하룻밤 동안 유지하고, 고체 생성을 확인하였다. 이후, 상기 마스터 플레이트들의 용매는 흡수지를 사용하여 제거하였다. 이후, 상기 마스터 플레이트들 및 증발 플레이트들을 하룻밤 동안 질소 대기 하에서 건조하였다. 이후, 고체 물질을 함유하고 있는 웰들에 대한 복굴절, 고유한 라만 스펙트럼(Raman spectrum), 및 임계 용해도(threshold solubility)를 측정하고 등급화하였다. 이후, 적절한 용매 및 반대이온 조합물들은 증가된 규모에서 A형과의 염 형성에 대하여 재평가되었다.
실시예 2: 중간 규모의 염형성
약 40 mg의 상기 화합물(I)의 중량은 교반용 자석막대를 포함하는 8 mL 바이얼(vial)에서 측정되었다. 상기 바이얼로, 상승된 온도에서 용해가 이루어지도록 1차 용매를 첨가하였다. 용해 후에, 1.05 당량의 산을 0.125 M, 0.25 M, 또는 0.5 M 농도의 용액으로 적가로 첨가하였다. 모든 혼합물을 15 분 동안 상승된 온도에서 교반한 후, 10 ℃/h의 속도로 실온에서 냉각하고 하룻밤 동안 교반하였다. 냉각 후 침전을 보이지 않는 시료들을 핵형성(nucleation)을 유도하기 위하여 스팻툴라(spatula) 를 사용하여 긁어서 -10 내지 -20 ℃의 냉동기에 보관하였다. 상기 바이얼들은 1 시간 후에 결정 성장 여부를 확인하기 위하여 관찰되었다. 고체가 형성된 조건의 시료들을 원심분리하거나, 여과하거나, 질소 하에서 증발되도록 하였다. 다른 모든 시료들은 72 시간 동안 -20 ℃에서 평형되었다. 이후, 침전을 보이지 않는 바이얼들을 질소 하에서 건조하였다. 이후, 생성된 고체들은 5 일 동안 IPA를 사용하여 슬러리화 하였다. 이러한 실험들로부터, 단지 비정질 고체들이 푸마르산염을 제외한 모든 반대이온들에 대하여 확인되었다. 상기 화합물(I)의 푸마르산염의 고유한 다형태들이 하기에 설명된다.
상기 화합물(I)의 결정체 염들의 제조
실시예 3: 상기 1:1로 혼합된 상기 화합물(I)과 푸마르산염의 A형의 제조
상기 화합물(I)(42 mg, 0.078 mmol)를 아세토니트릴(0.5 mL)에 용해하고 50 ℃로 가열하였다. 푸마르산(IPA 내의 0.25 M 용액 0.33 mL)를 첨가하고 혼합물을 15 분 동안 교반하였다. 침전물을 여과하고, 관찰되는 복굴절의 결핍으로 인하여 비정질인지를 확인하였다. 이후, 비정질 고체는 5 일 동안 IPA(0.5 mL)를 사용하여 슬러리화 되었다. 상기 슬러리로부터 수득된 고체는 복굴절을 나타내었으며, XRPD, DSC, 1H NMR, 및 TGA에 의해 IPA 용매화합물로 간주되었고, 푸마르산염 A형로 나타내었다.
| 2θ 각도 | 상대적 강도(%) |
| 8.17 | 43% |
| 9.69 | 100% |
| 10.69 | 33% |
| 11.51 | 30% |
| 13.63 | 25% |
| 14.89 | 36% |
| 16.73 | 61% |
| 18.09 | 27% |
| 18.83 | 23% |
| 20.05 | 50% |
| 23.49 | 34% |
| 24.45 | 26% |
실시예
4: 상기 1:1로 혼합된 상기 화합물(I)과
푸마르산염의
B형의 제조
2 일 동안 60 ℃ 에서의 진공 건조에 의한 푸마르산염 A형의 탈용매화로 인해 상기 B형의 DSC 열분석도 및 XRPD을 가진 결정체 물질이 생성되었다. 또한, 상기 B형은 EtOAc에 비정질 모노푸마르산염(monofumarate salt)을 용해하고 B형 결정들을 분산시킴으로써 직접적으로 제조될 수 있다. 중량식 흡습은 상기 염 형태가 흡습성이고 90% RH에서 4수화물을 형성하는 것을 나타낸다.
| 2θ 각도 | 상대적 강도( % ) |
| 5.51 | 39.5 |
| 5.91 | 38.7 |
| 11.91 | 100.0 |
| 14.93 | 83.5 |
| 16.71 | 40.2 |
| 17.35 | 40.4 |
| 18.73 | 42.8 |
| 21.53 | 41.0 |
| 23.41 | 43.3 |
실시예
5: 상기 1:1로 혼합된 상기 화합물(I)과
푸마르산염의
C형의 제조
제3 푸마르산염 다형체는 비정질 푸마르산염을 THF에 용해하고 푸마르산염의 B형 결정들을 분산함으로써 수득될 수 있다. 상기 용매를 상기 B형과는 상이한 XRPD 패턴 및 라만 스펙트럼을 나타내는 백색 고체가 형성될 때까지 천천히 증발시키고, C형 푸마르산염으로 나타내었다.
| 2θ 각도 | 상대적 강도(%) |
| 9.71 | 68.1 |
| 9.83 | 70.2 |
| 11.71 | 59.5 |
| 15.05 | 60.1 |
| 16.83 | 88.7 |
| 16.87 | 84.7 |
| 19.93 | 100.0 |
| 23.45 | 70.7 |
| 23.65 | 69.6 |
실시예
6: 상기 1:1로 혼합된 상기 화합물(I)과
푸마르산염의
D형의 제조
10 일 동안 실온에서 아세토니트릴을 사용하여 상기 C형 푸마르산염을 슬러리화함으로써 상기 C형 푸마르산염은 D형으로 언급되는 새로운 결정형태로 전이되었다. 상기 D형 푸마르산염은 뚜렷한 라만 스펙트럼 및 XRPD 패턴을 나타내었다. DSC에 의한 상 전이는 다른 형태들보다 훨씬 높았으며 확인된 4 개의 다형체들 중 가장 높은 안정성을 나타내었다. 상기 D형은 하기 방법에 따라 직접적으로 제조될 수 있다: 교반 막대가 구비된 250 mL 삼구 플라스크를 상기 화합물(I)(6.01 g, 11 mmol) 및 푸마르산(1.41 g, 12 mmol)으로 채웠다. 아세톤(50 mL)을 첨가하였고, 슬러리를 용액이 투명해질 때까지 50 ℃로 가열하였다. 침전물은 10 분 후에 관찰되었으며, 추가적인 30 분 동안 교반을 지속하였다. MTBE(25 mL)를 첨가하고 상기 용액을 실온에서 냉각하고 하룻밤 동안 교반하였다. 상기 고체들을 여과하고 60 ℃에서 2 일 동안 진공하에서 건조하여 백색 고체(6.65 g, 91%)인 상기 화합물(I)을 제조하였다.
1H NMR(400 MHz, CD 3 OD) δ 8.00(d, J = 8.4 Hz, 1H), 7.68(d, J = 8.0 Hz, 2H), 7.50-7.45(m, 5H), 7.03(d, J = 8.1 Hz, 1H), 6.83(d, J = 8.4 Hz, 1H), 6.73(s, 2H), 6.60(dd, J = 8.4, 2.5 Hz, 1H), 5.58(s, 1H), 4.00(s, 2H), 3.82-3.78(m, 2H), 3.36(t, J = 8.4 Hz, 1H), 3.26(s, 3H), 3.13-3.10(m, 2H), 2.34(t, J = 11.4 Hz, 2H), 2.25-2.16(m, 2H), 1.01(d, J = 6.0 Hz, 6H).
| 2θ 각도 | 상대적 강도(%) |
| 9.59 | 97.3 |
| 11.69 | 39.2 |
| 12.03 | 53.4 |
| 12.83 | 100.0 |
| 15.95 | 92.6 |
| 16.55 | 47.2 |
| 16.93 | 73.3 |
| 18.13 | 47.8 |
| 19.23 | 59.0 |
| 19.81 | 55.4 |
| 20.67 | 59.1 |
| 20.79 | 61.9 |
| 21.23 | 71.5 |
| 21.49 | 66.6 |
| 21.97 | 97.2 |
| 22.53 | 42.1 |
| 23.97 | 53.9 |
| 24.03 | 46.2 |
| 26.03 | 32.5 |
| 29.75 | 41.6 |
상기 푸마르산염은 다양한 조건들 하에서 D형으로 생성될 수 있다. 결정형태는 표 5에 도시된 상기 B형 또는 D형의 결정들과의 분산(seeding)을 통해 제조될 수 있다. 상기 염은, 도 6에 도시된 것처럼, 모화합물인 상기 화합물(I)을 에틸 아세테이트, 아세톤, 또는 에탄올과 같은 극성 용매들에 용해하고 메탄올, 에탄올, THF, 이소프로판올과 같은 극성 용매들에서 푸마르산을 부가함으로써 직접적으로 결정화될 수 있다. 수율은 일반적으로 MTBE와 항용매를 첨가함으로써 개선된다. 상기 D형이 형성되지 않는 경우의 예는 상기 화합물(I)을 아세토니트릴(acetonitrile), 2-메틸 테트라히드로푸란(2-methyltetrahydrofuran), 및 메틸이소부틸 케톤(methylisobutyl ketone)과 같은 극성이 낮은 용매에서 용해시키는 경우를 포함한다. 또한, 항용매와 같은 헥센(hexane)의 첨가는 상기 결정형태 D의 형성을 촉진하지 못한다.
또한, 상기 D형의 바람직한 형태는, 도 7에 도시된 것처럼, 메탄올, 에탄올, THF, 또는 아세톤과 같은 적절한 용매에 상기 화합물(I)을 용해하고 고체인 푸마르산을 직접적으로 부가함으로써 생성될 수도 있다. 수율은 MTBE 또는 IBAc와 같은 항용매가 부가될 때 개선된다. 1차 용매의 극성이 에틸 아세테이트 및 MTBE 처럼 낮을 때, 상기 D형은 본 방법에 의해 형성되지 않는다.
2:1의 비율로 혼합된 상기 화합물(I)/푸마르산 결정체 염은 생성될 수 없다. 2 당량의 상기 화합물(I)을 EtOAc, EtOH, THF, IPA과 같은 1 차 용매에 용해하고, 1 당량의 푸마르산을 고체 상태 또는 IPA 또는 EtOH를 포함하는 용액 상태에서 첨가한다. 생성된 용액을 50 ℃에서 30 분 동안 가열하고 실온에서 냉각시킨다. MTBE를 첨가하고, 혼합물을 24 시간 동안 슬러리화 한다. 1H NMR에 의해 상기 고체 및 여과물을 분석한 결과 단지 1:1로 혼합된 상기 화합물(I)/ 푸마르산염이 수득된 것으로 확인되었다.
| 1차 용매 | 전달용매 (delivery solvent) | 당량 | 온도(℃) | 시드(seed) 첨가 | 수율(%) | 형태 |
| EtOAc | EtOH | 1.05 | 50 | B | 77 | D |
| EtOAc | EtOH | 1.05 | 50 | D | 67 | D |
| 1차 용매 | 전달용매 | 당량 | 온도(℃) | 항용매 | 수율( % ) | 형태 |
| EtOAc | MeOH | 1.05 | 50 | MTBE | 54 | D |
| EtOAc | EtOH | 1.05 | 50 | MTBE | 51 | D |
| EtOAc | THF | 1.05 | 50 | MTBE | 53 | D |
| EtOAc | IPA | 1.05 | 50 | MTBE | 50 | D |
| EtOAc | THF | 1.05 | 50 | Hexane | - | - |
| 2-MeTHF | MeOH | 1.05 | 50 | MTBE | - | - |
| 2-MeTHF | EtOH | 1.05 | 50 | MTBE | - | - |
| 2-MeTHF | THF | 1.05 | 50 | MTBE | - | - |
| 아세톤 | MeOH | 1.05 | 50 | MTBE | 75 | D |
| 아세톤 | EtOH | 1.05 | 50 | No | 40 | D |
| 아세톤 | THF | 1.05 | 50 | MTBE | 72 | D |
| 아세톤 | THF | 1.05 | 50 | Hexane | - | - |
| MIBK | THF | 1.05 | 50 | MTBE | - | - |
| EtOH | THF | 1.05 | 50 | MTBE | 69 | D |
| EtOH | THF | 1.05 | 50 | Hexane | - | - |
| THF | THF | 1.05 | 50 | Hexane | - | - |
| 1차 용매 | 당량 | 온도(℃) | 항용매 | 수율(%) | 형태 |
| MeOH | 1.01 | 50 | No | 43 | D |
| EtOH | 1.14 | 50 | No | 61 | D |
| EtOH | 1.05 | 50 | MTBE | 74 | D |
| EtOH | 1.05 | 50 | IBAc | 74 | D |
| THF | 1.01 | 50 | MTBE | 64 | D |
| 아세톤 | 0.99 | 50 | No | 53 | D |
| 아세톤 | 1.05 | 50 | MTBE | 82 | D |
| 아세톤 | 1.05 | 50 | IBAc | 81 | D |
| EtOAc | 1.01 | 50 | No | - | - |
| MTBE | 1.01 | 50 | No | - | - |
조합적 염 스크린 결과들의
재점수화
상기 초기 조합적 공정으로부터, 상기 푸마르산염 만이 결정체로 확인되었다. 고속 스크린에 의한 결과들을 재평가하여 각각의 반대이온에 대한 용매와는 무관한 새로운 점수들을 얻었다. 이러한 재점수화는 모든 용매들에 대하여 기존의 점수(시각에 의한 고체형성 확인, 복굴절, 라만 스펙트럼 및 임계 용해도에 의한 고유성)를 조합하고 마스트 플레이트와 증발 플레이트 모두에 대하여 점수들을 요약함으로써 상이한 염들에 대하여 이루어졌다.
두 개의 가장 높은 점수를 갖는 산들, 즉, 말레산 및 메탄 술폰산에 대한 평가는 추가적인 용매 및 항용매 조건하에서 추가적으로 이루어졌다. 메탄 술폰산으로부터 수득된 염들은 흡습성을 나타내었다. 그러나, 말레산을 가진 결정체 염이 확인되었다. 화합물 A의 말레산염의 제조 및 특징은 후술된다.
실시예
7: 상기 1:1로 혼합된 상기 화합물(I)과
말레산염의
A형의 제조
교반 막대가 장착된 250 mL의 삼구 둥근바닥 플라스크를 상기 화합물(I)(4.96 g, 9.3 mmol)로 채웠다. 아세톤(55 mL)을 첨가하고 50 ℃로 가열하였다. 말레산(아세톤 내의 0.5 M 농도의 용액 20 mL)을 첨가하여 투명한 용액이 생성되었으며, 상기 용액은 1 분 후에 탁하게 변화였다. 상기 용액을 실온으로 냉각시키고, 높은 점도의 슬러리 상태로 24 시간 동안 교반하였다. 상기 고체들을 여과하고, MTBE로 세척하고, 60 ℃에서 30 시간 동안 건조하여 백색 고체(5.52 g, 91%)가 생성되었다. 상기 염은 XRPD 에 의해 결정체인 것으로 확인되었고, A형으로 명명되었다.
1H NMR(CD 3 OD) d: 8.04(d, J = 8.5 Hz, 1H), 7.77(d, J = 8.0 Hz, 2H), 7.45 - 7.61(m, 5H), 7.07(d, J = 8.8 Hz, 1H), 6.84(d, J = 8.5 Hz, 1H), 6.62(dd, J = 8.5, 2.5 Hz, 1H), 6.27(s, 2H), 5.59(d, J = 2.5 Hz, 1H), 4.30(s, 2H), 3.86-3.82(m, 2H), 3.34-3.43(m, 2H), 3.27(s, 3H), 2.74-2.68(m, 2H), 2.32-2.10(m, 2H), 1.23(d, J = 6.3 Hz, 6H).
| 2θ 각도 | 상대적 강도 |
| 5.45 | 28.2 |
| 5.75 | 54.4 |
| 10.83 | 70.9 |
| 11.49 | 111.9 |
| 12.37 | 79.3 |
| 12.59 | 103.2 |
| 14.05 | 38.1 |
| 14.91 | 96.1 |
| 15.07 | 100.0 |
| 16.73 | 29.6 |
| 17.05 | 75.9 |
| 17.83 | 20.6 |
| 18.55 | 51.7 |
| 19.51 | 34.8 |
| 19.91 | 30.7 |
| 21.89 | 25.9 |
| 22.15 | 34.6 |
| 23.03 | 39.4 |
| 23.31 | 45.3 |
| 23.51 | 56.1 |
| 23.89 | 33.3 |
| 26.09 | 60.3 |
상기 A형 말레산염은, MTBE와 같은 비-극성 항용매와 함께 또는 상기 비-극성 항용매없이, EtOH, 아세톤, 이소프로필 아세테이트, 에틸 아세테이트, 이소프로판올, 또는 THF와 같은 극성 용매로부터 생성될 수 있다. 2:1의 비율로 혼합된 상기 화합물(I)/말레산 결정체 염은 생성되지 않았다.
상기 화합물(I)의 비정질 염들의 제조
실시예
8: 상기 화합물(I)의 HCl 염의 제조
상기 화합물(I)(6.7 g, 12.5 mmol)을 THF(25 mL)에 용해하고, 에테르 내의(13.8 mL, 13.8 mmol) 1 M HCl을 실온에서 첨가하고, 제조된 용액을 에테르(200 mL)로 희석하였다. 생성된 혼합물을 실온에서 1 시간 동안 보관하고, 생성된 고체를 여과하였다. 상기 고체는 가만히 두었을 때 겔을 형성하였고, 물(100 mL)에 용해되었고, 황색분말로(5.8 g, 81%) 동결건조되었다.
1H NMR(400 MHz, CD 3 OD) d 7.75(d, J = 8.4 Hz, 1H), 7.57(d, J = 8.0 Hz, 2H), 7.46(d, J = 8.0 Hz, 2H), 7.42(s, 1H), 7.35(d, J = 16.8 Hz, 1H), 7.30(d, J = 16.4 Hz, 1H), 6.82(d, J = 9.2 Hz, 1H), 6.80(d, J = 8.8 Hz, 1H), 6.51(d, J = 8.4 Hz, 1H), 5.19(s, 1H), 4.28(s, 2H), 3.92-3.80(m, 2H), 3.40-3.30(m, 2H), 3.27(t, J = 8.4 Hz, 1H), 3.15(s, 3H), 2.70(t, J = 11.4 Hz, 2H), 2.15-2.05(m, 2H), 1.18(d, J = 6.0 Hz, 6H).
실시예
9: 상기 화합물(I)의 인산염의 제조
상기 화합물(I)(148 mg, 0.27 mmol)을 EtOAc(0.5 mL)에 용해하였고, EtOAc(0.58 mL, 0.28 mmol)에 있는 0.5 M 인산(phosphoric acid)을 50 ℃에서 첨가하고, 상기 용액을 15 분 동안 교반하고 실온으로 냉각하였다. 상기 고체들을 여과하고 60 ℃에서 4 일 동안 건조하여 백색 고체(149 mg, 85%)인 상기 화합물(I)을 수득하였다.
1H NMR(CD 3 OD) d 8.00(d, J = 8.5 Hz, 1H), 7.72(d, J = 8.2 Hz, 2H), 7.49-7.58(m, 5H), 7.04(d, J = 8.0 Hz, 1H), 6.84(d, J = 8.5 Hz, 1H), 6.61(dd, J = 8.5, 2.5 Hz, 1H), 5.58(d, J = 2.5 Hz, 1H), 4.21(s, 2H), 3.97-3.89(m, 2H), 3.34 - 3.39(m, 1H), 3.26(s, 3H), 2.55(t, J = 11.8 Hz, 2H), 2.16-2.26(m, 2H), 1.19(d, J = 6.0 Hz, 6H).
용해성 테스트 및 약동학적 분석
방법:
상기 화합물(I)의 HCl 염, 상기 D형 푸마르산염, 및 상기 A형 말세산염의 용액 및 캡슐 내의 분말 상태인 1 회분의 경구용 투약량을 5 mg/kg의 용량으로 암컷 스프래그 다우리(Sprague-Dawley) 래트들에게 투여하였다. 리튬 헤파린(lithium heparin)의 존재하에 혈액 시료를 수거하였고 혈장이 형성되도록 원심분리하였다. 이후, 상기 혈장은 LC/MS에 의해 상기 화합물(I)의 혈장 수치 확인을 위해 분석되었다.
래트에
캡슐 투약을 위한 시제품 제조:
투약 계획과 연관된 모든 동물들의 체중을 측정하고 번호를 할당하였다. 투약되는 각각의 동물에 대한 모든 캡슐들(사이즈가 9인 돼지 경질 젤라틴 캡슐, Torpac)을 끝부분이 뾰족한 사르피에(Sharpie)를 사용하여 조심스럽게 번호를 매겼다. 작은 플라스틱 중량측정용 접시를 눈금자 상에 두고, 캡슐 뚜껑 한 개는 상기 접시 상에 두고, 다른 하나의 캡슐 부분과 함께 캡슐 적재기의 기재를 저장기 내에 두었다. 용기 무게는 공제하였다. 깔대기를 캡슐 적재용 장치 최상부에 두고, 전체 질량을 조심스럽게 기재하였다. 4" × 4" 크기의 파라핀지(wax paper) 한 장을 반으로 접어 중앙에 주름을 만들었다. 미세하게 분쇄된 적은 용량의 화합물을(필요한 경우 막자사발 및 막자를 사용하여 분쇄함) 상기 파라핀지 주름 부분에 놓고 종이를 접었다. 상기 접힌 파라핀지를 상기 캡슐 적재용 깔때기 장치에 조심스럽게 각을 맞추어 두었다. 정밀한 스팻툴라를 사용하여 주름부분의 화합물 분말의 일정용량을 상기 깔때기로 옮겨 적재 부분 및 궁극적으로 캡슐로 흘러가도록 하였다. 총 질량과의 질량차이를 기재하였다. 상기 캡슐 적하용 깔때기를 제거하고 캡슐 내의 화합물의 절대적 중량을 확인하기 위하여 저울의 문을 닫았다. 상기 깔때기를 상기 캡슐 적하용 장치에 다시 두고, 캡슐 내에 원하는 용량의 약물이 적재될 때까지 적재를 지속하였다. 주의: 캡슐에 적은 용량을 적재할 때, 깔때기 상에 있는 미세분말 약물을 단순히 붓질함으로써 상기 적재용 칼럼으로 적재하였다. 상기 깔때기를 제거하고 중량을 기록하였다. 실제 약물 중량은 측량된 물질의 중량에 당량비를 곱함으로써 계산되었다. 실제 약물의 용량을 기록하였다. 중량측정용 접시 상의 상기 캡슐 뚜껑은 딱 들어맞을 때까지 캡슐을 단단히 닫는데 사용되었다.
모든 동물들은(n= 3/각 그룹) 5 mL/kg의 부피용량으로 경구 투여되었다. 투약 후, 각각의 래트로부터 지정된 각각의 시점에서 혈액을 채취하였다. 대조군 동물에서도 동일한 절차에 의해 채혈이 이루어졌다. 혈액은 측면 복재정맥(lateral saphenous vein)으로부터 채취되었다. 혈액 부분표본들(aliquots)(~50 ㎕)을 리튬 헤파린으로 코팅된 튜브에 담고 조심스럽게 혼합한 후, 얼음에 두고, 채혈한 지 1 시간 내에 실온에서 15 분 동안 2,500 xg의 속도로 원심분리하였다. 형성된 혈장층을 모아서 얼음에 두었다. 상기 혈장층은 다음 공정 전까지 -80 ℃에서 냉동상태로 유지하였다.
생물(바이오)분석 방법들
HPLC/탠덤 사중극자 질량분석기(HPLC/tandem quadruple mass spectrometry, HPLC-MS)를 이용하여 생물분석 정량화를 수행하였다. 혈장 농도 및 T1/2를 계산하고 기록하였다.
혈장 분석:
DMSO 내의 5 mg/mL의 표준용액을 100 배 희석한 후 50% DMSO에서 연속적으로 희석하였다. 상기 연속 희석물의 부분 표본들을(2 ㎕) 표준곡선으로 사용되는 18 mL의 대조군 혈장(총 20 mL)과 혼합하였다. 이후, 혈장시료들(20 ㎕) 및 표준시료들을 내부표준(internal standard)으로 100 ng/mL의 베라파밀(verapamil)을 함유하는 얼음처럼 차가운 아세토니트릴(80%(v/v))로 5x 배율로 희석하였다. 아세토니트릴 침전물 시료들 및 표준들은 96 웰 내의 0.22 mm의 멤브레인으로 여과되었다. 이후, 여과물들은 물을 사용하여 30% 아세토니트릴로 희석하였다.
투약량
분석:
투약용액(100 ㎕)은 시료의 균질성을 제공하기 위하여 DMSO(900 ㎕)로 희석하였다. 이후, 상기 용액을 LC-MS 분석을 위해 적절한 500 ng/mL 미만의 미량의 농도가 되도록 30% 아세토니트릴(내부표준을 함유)로 3 회 희석하였다. 5 mg/mL의 DMSO 스톡(stock)에서 30% 아세토니트릴(내부표준을 함유)로의 연속적인 희석은 적절한 표준곡선을 제공한다. 시료들 및 표준들을(10 ㎕) 후술되는 것처럼 LC-MS 시스템에 주입하였다. 약물 용액의 농도는 mg/mL 단위로 기록하였다.
LC-MS 분석:
LC: 각각의 시료 및 표준의 10 ㎕을 0.6 mL/min 속도의 Waters Acquity CSH 1.7 mm 2.1x100 mm 컬럼(Acquity UPLC에 의함) 상으로 주사하였다. C18 컬럼을 10% 아세토니트릴로 평형화하였다. 화합물들은 경사 농도로 99% 아세토니트릴로 용리되었다. 모든 이동상들은 0.1%(v/v) 포름산을 함유하였다.
색층 분석 용리:
| 시간(분) | % B |
| 0 | 5 |
| 0.75 | 5 |
| 1 | 20 |
| 4.5 | 99.9 |
| 5 | 99.9 |
| 5.4 | 5 |
| 6 | 5 |
MS: 컬럼 용리액은 탠덤 사중극자 질량분석기(Waters Xevo TQ)를 사용하는 전기분무 이온화에 의해 분석되었다. 용리액 조성물은 상기 내부표준에 특이적인 3 개의 이온쌍 및 상기 분석물질에 대해 특이적인 3 개의 이온쌍에 대하여 분석되었다.
약동학적 분석
실험 시료들은 화합물 농도를 결정하기 위하여 표준곡선 시료들과 비교되었다. 평균 화합물 농도들을(mg/mL +/- 표준편차의 농도) 각각의 시점마다 기록하였다. 검출한계(Limit of Detection, LLOQ)는 미량농도의 20% 미만의 표준편차를 전시하는 최저 표준곡선 시료로서 기록하였다. PK 분석은 Excel plugin PKfit에 의해 수행되었다; Cmax는 주어진 시점에서 관찰되는 최대농도로서 결정되고, AUC 곡선 아래의 영역은 t0 내지 tlast시간에 대한 기록이다. 혈장 반감기는 3 개의 말기 시점들이 r2 >0.8로 1차 제거(first order elimination)를 나타낼 때 기록되었다.
표 10에 도시된 것처럼, 상기 화합물(I)의 결정체 염들은 비정질 인산염 및 HCl 염들과 비교하여 이온 교환수에서의 용해성이 더 낮은 것으로 나타났다. 많은 경우에서 보고된 것처럼, 상기 비정질 염들의 증가된 용해성은 더 안정한 결정체에 대한 혈장농도 증가를 야기한다(Hancock and Parks(2000) Pharm. Res. 17: 397-404; Pudipeddi and Serajuddin(2005) J. Pharm. Sci. 94: 929-39). 그러나, 비정질 및 결정체 염들의 시간의존적인 혈장농도 프로파일 및 약동학적 파라미터들을 암컷 스프래그 다우리 래트들에게 캡슐(PIC) 내의 분말 형태로 경구투여하는 경우와 비교하면, 약동학적 파라미터들에서의 차이는 미미하다(표 11).
| 반대이온 | XRPD | 상기 화합물(I):산의 비율 | DSC (℃) | TGA 손실(중량%) | 중량식 흡습 | 증류수에서의 용해성(㎍/㎖) |
| 푸마르산염 | A | 1.0:0.9 | 112, 158 | 7.2(45-160 ℃) | ||
| 푸마르산염 | B | 1.0:1.0 | 58, 162 | 2.6(40-120 ℃) | 3.7 중량% 60%RH 10.5 중량% 90%RH |
|
| 푸마르산염 | C | 1.0:1.1 | 62, 156 | 2.6(30-100 ℃) | 625 | |
| 푸마르산염 | D | 1.0:1.0 | 219 | 0.9(30-100℃) | 2.1 중량% 60%RH 4.0 중량% 90%RH |
170 |
| 말레산염 | A | 1.0:0.95 | 219 | 용해될 때까지 손실이 관찰되지 않음 | 1.3 중량%, 60%RH 2.2 중량%, 90%RH |
|
| 인산염 | 비정질 | 1.0:1.1 | 83, 179 | 1.9 | 6.1 중량% 60%RH 10.9 중량% 90%RH |
= 1 x 105 |
| HCl | 비정질 | 2.3(30-150 ℃) | = 1 x 105 |
| 염의 형태 | HCl | 푸마르산염(D형) | 말레산염(A형) |
| 경구 투약량(mg/kg) | 5.0 | 5.0 | 5.0 |
| Cmax(ng/mL) | 250 | 270 | 200 |
| AUC0 - tlast(ng.h/mL) | 2400 | 2780 | 1500 |
Claims (30)
- 제1항에 있어서, 상기 염의 적어도 80 중량%는 결정체인 것을 특징으로 하는 상기 화합물(I)의 푸마르산염.
- 제1항 또는 제2항에 있어서, 상기 염의 적어도 80 중량%는 단일 결정체인 것을 특징으로 하는 상기 화합물(I)의 푸마르산염.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 상기 염의 적어도 99 중량%는 결정체인 것을 특징으로 하는 상기 화합물(I)의 푸마르산염.
- 제1항 내지 제4항 중 어느 한 항에 있어서, 상기 염의 적어도 99 중량%는 단일 결정체인 것을 특징으로 하는 상기 화합물(I)의 푸마르산염.
- 제1항 내지 제5항 중 어느 한 항에 있어서, 상기 푸마르산염의 적어도 90 중량%는 단일 결정체(A)이고, 도 7에 도시된 단일 결정체(A)의 X선 분말 회절패턴(X-ray powder diffraction pattern)을 갖는 것을 특징으로 하는 상기 화합물(I)의 푸마르산염.
- 제1항 내지 제6항 중 어느 한 항에 있어서, 상기 푸마르산염의 적어도 90 중량%는 하기 각도에서의 피크들을 포함하는 X선 분말 회절패턴에 의해 특징지어지는 단일 결정체(A)인 것을 특징으로 하는 상기 화합물(I)의 푸마르산염:
a) 2θ에서 9.7°, 16.7°, 및 20.1° ± 0.2; 또는
b) 2θ에서 8.2°, 9.7°, 16.7°, 및 20.1° ± 0.2; 또는
c) 2θ에서 8.2°, 9.7°, 10.7°, 11.5°, 14.9°, 16.7°, 20.1°, 및 23.5° ± 0.2; 또는
d) 2θ에서 8.2°, 9.7°, 10.7°, 11.5°, 13.6°, 14.9°, 16.7°, 18.1° 18.8° 20.1°, 23.5°, 및 24.5° ± 0.2. - 제1항 내지 제5항 중 어느 한 항에 있어서, 상기 푸마르산염의 적어도 90 중량%는 단일 결정체(B)이고, 도 8에 도시된 단일 결정체(B)의 X선 분말 회절패턴을 갖는 것을 특징으로 하는 상기 화합물(I)의 푸마르산염.
- 제1항 내지 제5항 및 제8항 중 어느 한 항에 있어서, 상기 푸마르산염의 적어도 90 중량%는 하기 각도에서의 피크들을 포함하는 X선 분말 회절패턴에 의해 특징지어지는 단일 결정체(B)인 것을 특징으로 하는 상기 화합물(I)의 푸마르산염:
a) 2θ에서 11.9° 및 14.9° ± 0.2; 또는
b) 2θ에서 11.9°, 14.9°, 18.7°, 및 21.5° ± 0.2; 또는
c) 2θ에서 5.5°, 5.9°, 11.9°, 14.9°, 16.7°, 17.4°, 18.7°, 21.5°, 및 23.4° ± 0.2. - 제1항 내지 제5항 중 어느 한 항에 있어서, 상기 푸마르산염의 적어도 75 내지 80 중량%는 단일 결정체(C)이고, 도 9에 도시된 단일 결정체(C)의 X선 분말 회절패턴을 갖는 것을 특징으로 하는 상기 화합물(I)의 푸마르산염.
- 제1항 내지 제5항 및 제10항 중 어느 한 항에 있어서, 상기 푸마르산염의 적어도 75 내지 80 중량%는 하기 각도에서의 피크들을 포함하는 X선 분말 회절패턴에 의해 특징지어지는 단일 결정체(C)인 것을 특징으로 하는 상기 화합물(I)의 푸마르산염:
a) 2θ에서 16.8°, 16.9°, 및 19.9° ± 0.2; 또는
b) 2θ에서 9.8°, 16.8°, 16.9°, 19.9°, 및 23.5° ± 0.2; 또는
c) 2θ에서 9.7°, 9.8°, 11.7°, 15.1°, 16.8°, 16.9°, 19.9°, 23.5°, 및 23.7° ± 0.2. - 제1항 내지 제5항 중 어느 한 항에 있어서, 상기 푸마르산염의 적어도 90 중량%는 단일 결정체(D)이고, 도 10에 도시된 단일 결정체(D)의 X선 분말 회절패턴을 갖는 것을 특징으로 하는 상기 화합물(I)의 푸마르산염.
- 제1항 내지 제5항 및 제12항 중 어느 한 항에 있어서, 상기 푸마르산염의 적어도 90 중량%는 하기 각도에서의 피크들을 포함하는 X선 분말 회절패턴에 의해 특징지어지는 단일 결정체(D)인 것을 특징으로 하는 상기 화합물(I)의 푸마르산염:
a) 2θ에서 9.6°, 12.8°, 16.0°, 및 22.0° ± 0.2; 또는
b) 2θ에서 9.6°, 12.8°, 16.0°, 16.9°, 21.2°, 및 22.0° ± 0.2; 또는
c) 2θ에서 9.6°, 12.8°, 16.0°, 16.9°, 20.8°, 21.2°, 21.5°, 및 22.0° ± 0.2; 또는
d) 2θ에서 9.6°, 11.7°, 12.0°, 12.8°, 16.0°, 16.6°, 16.9°, 18.1° 19.2°, 19.8°, 20.7°, 20.8°, 21.2°, 21.5°, 22.0°, 22.5°, 24.0°, 26.0°및 29.8° ± 0.2. - 제1항 내지 제7항 중 어느 한 항에 있어서, 상기 푸마르산염의 적어도 90 중량%는 112 ℃ 및 158 ℃의 시차주사열량계(differential scanning calorimeter, DSC) 피크 상 전이온도들(peak phase transition temperatures)을 갖는 단일 결정체(A) 인 것을 특징으로 하는 상기 화합물(I)의 푸마르산염.
- 제1항 내지 제5항, 제8항, 및 제9항 중 어느 한 항에 있어서, 상기 푸마르산염의 적어도 90 중량%는 58 ℃및 162 ℃의 시차주사열량계(DSC) 피크 상 전이온도들을 갖는 단일 결정체(B)인 것을 특징으로 하는 상기 화합물(I)의 푸마르산염.
- 제1항 내지 제5항, 제10항, 및 제11항 중 어느 한 항에 있어서, 상기 푸마르산염의 적어도 90 중량%는 62 ℃및 156 ℃의 시차주사열량계(DSC) 피크 상 전이온도들을 갖는 단일 결정체(C)인 것을 특징으로 하는 상기 화합물(I)의 푸마르산염.
- 제1항 내지 제5항, 제12항, 및 제13항 중 어느 한 항에 있어서, 상기 푸마르산염의 적어도 90 중량%는 219 ℃의 시차주사열량계(DSC) 피크 상 전이온도를 갖는 단일 결정체(D)인 것을 특징으로 하는 상기 화합물(I)의 푸마르산염.
- 제18항에 있어서, 상기 염의 적어도 90 중량%는 결정체인 것을 특징으로 하는 상기 화합물(I)의 말레산염.
- 제18항 또는 제19항에 있어서, 상기 염의 적어도 90 중량%는 단일 결정체인 것을 특징으로 하는 상기 화합물(I)의 말레산염.
- 제18항 내지 제20항 중 어느 한 항에 있어서, 상기 염의 적어도 99 중량%는 결정체인 것을 특징으로 하는 상기 화합물(I)의 말레산염.
- 제18항 내지 제21항 중 어느 한 항에 있어서, 상기 염의 적어도 99 중량%는 단일 결정체인 것을 특징으로 하는 상기 화합물(I)의 말레산염.
- 제18항 내지 제22항 중 어느 한 항에 있어서, 상기 말레산염의 적어도 90 중량%는 단일 결정체(A)이고 상기 단일 결정체(A)의 도 11에 도시된 X선 분말 회절패턴을 갖는 것을 특징으로 하는 상기 화합물(I)의 말레산염.
- 제18항 내지 제23항 중 어느 한 항에 있어서, 상기 말레산염의 적어도 90 중량%는 하기 각도에서의 피크들을 포함하는 X선 분말 회절패턴에 의해 특징지어지는 단일 결정체(A)인 것을 특징으로 하는 상기 화합물(I)의 말레산염:
a) 2θ에서 11.5°, 12.6°, 14.9°, 및 15.1° ± 0.2; 또는
b) 2θ에서 10.8°, 11.5°, 12.4°, 12.6°, 14.9°, 15.1°, 및 17.1° ± 0.2; 또는
c) 2θ에서 5.8°, 10.8°, 11.5°, 12.4°, 12.6°, 14.9°, 15.1°, 17.1°, 18.6°, 23.5°, 및 26.1° ± 0.2; 또는
d) 2θ에서 5.5°, 5.8°, 10.8°, 11.5°, 12.4°, 12.6°, 14.1°, 14.9°, 15.1°, 16.7°, 17.1°, 17.8°, 18.6°, 19.5°, 19.9°, 21.9°, 22.2°, 23.0°, 23.3°, 23.5°, 23.9°, 및 26.1° ± 0.2. - 제18항 내지 제24항 중 어느 한 항에 있어서, 상기 말레산염의 적어도 90 중량%는 219℃의 시차주사열량계(DSC) 피크 상 전이온도를 갖는 단일 결정체(A)인 것을 특징으로 하는 상기 화합물(I)의 말레산염.
- 제1항 내지 제17항 중 어느 한 항의 푸마르산염 또는 제18항 내지 제25항 중 어느 한 항의 말레산염 및 을 포함하는 약학적 조성물 및 약학적으로 허용 가능한 담체 또는 희석제를 포함하는 약학적 조성물로, 상기 염의 적어도 80 중량%는 결정체인 것을 특징으로 함.
- 제1항 내지 제25항 중 어느 한 항에 따른 염 또는 이의 약학적 조성물을 유효한 용량으로 피험자에게 투여하는 단계를 포함하는 것을 특징으로 하는 암이 있는 피험자를 치료하는 방법.
- 제27항에 있어서, 상기 암은 폐암, 유방암, 대장암, 신경아세포종(neuroblastoma), 전립선암, 흑색종(melanoma), 다형성신경교아증(glioblastoma multiform), 난소암, 림프종(lymphoma), 백혈병, 골육종(osteosarcoma), 배아세포종(germinoma), 신경교종(glioma), 섬유육종(fibrosarcoma), 위암(gastrointestinal sarcoma), 섬유성조직구종(fibrous histiocytoma), 원형세포육종(round cell sarcoma), 활막육종(synovial sarcoma), 자궁경부암(cervical cancer), 항문생식기암(anogenital cancer), 두경부암(head and neck cancer), 및 구인두암(oropharyngeal cancer)으로 이루어진 군으로부터 선택되는 것을 특징으로 하는 암이 있는 피험자를 치료하는 방법.
- 제28항에 있어서, 상기 암은 폐암, 유방암, 및 대장암으로 이루어진 군으로부터 선택되는 것을 특징으로 하는 암이 있는 피험자를 치료하는 방법.
- 제29항에 있어서, 상기 암은 유방암인 것을 특징으로 하는 암이 있는 피험자를 치료하는 방법.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020217036751A KR102395737B1 (ko) | 2013-10-18 | 2014-10-17 | Plk-4 억제제의 염 및 결정체들 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361892564P | 2013-10-18 | 2013-10-18 | |
| US61/892,564 | 2013-10-18 | ||
| PCT/CA2014/051001 WO2015054793A1 (en) | 2013-10-18 | 2014-10-17 | Salt and crystal forms of plk-4 inhibitor |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020217036751A Division KR102395737B1 (ko) | 2013-10-18 | 2014-10-17 | Plk-4 억제제의 염 및 결정체들 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20160070106A true KR20160070106A (ko) | 2016-06-17 |
Family
ID=52827507
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020167012155A KR20160070106A (ko) | 2013-10-18 | 2014-10-17 | Plk-4 억제제의 염 및 결정체들 |
| KR1020227015022A KR20220063299A (ko) | 2013-10-18 | 2014-10-17 | Plk-4 억제제의 염 및 결정체들 |
| KR1020217036751A KR102395737B1 (ko) | 2013-10-18 | 2014-10-17 | Plk-4 억제제의 염 및 결정체들 |
Family Applications After (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020227015022A KR20220063299A (ko) | 2013-10-18 | 2014-10-17 | Plk-4 억제제의 염 및 결정체들 |
| KR1020217036751A KR102395737B1 (ko) | 2013-10-18 | 2014-10-17 | Plk-4 억제제의 염 및 결정체들 |
Country Status (26)
| Country | Link |
|---|---|
| US (5) | US9884855B2 (ko) |
| EP (1) | EP3057965B1 (ko) |
| JP (1) | JP6492072B2 (ko) |
| KR (3) | KR20160070106A (ko) |
| CN (2) | CN105764899B (ko) |
| AU (1) | AU2014336929B9 (ko) |
| CA (1) | CA2926845C (ko) |
| CY (1) | CY1121484T1 (ko) |
| DK (1) | DK3057965T3 (ko) |
| EA (1) | EA031569B1 (ko) |
| ES (1) | ES2718603T3 (ko) |
| HR (1) | HRP20190564T1 (ko) |
| HU (1) | HUE043194T2 (ko) |
| IL (1) | IL245038B (ko) |
| LT (1) | LT3057965T (ko) |
| ME (1) | ME03377B (ko) |
| MX (1) | MX359069B (ko) |
| NZ (1) | NZ718744A (ko) |
| PL (1) | PL3057965T3 (ko) |
| PT (1) | PT3057965T (ko) |
| RS (1) | RS58413B1 (ko) |
| SG (1) | SG11201602783SA (ko) |
| SI (1) | SI3057965T1 (ko) |
| TR (1) | TR201902875T4 (ko) |
| TW (1) | TWI659952B (ko) |
| WO (1) | WO2015054793A1 (ko) |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2417127B1 (en) | 2009-04-06 | 2014-02-26 | University Health Network | Kinase inhibitors and method of treating cancer with same |
| ES2603613T3 (es) | 2010-04-06 | 2017-02-28 | University Health Network | Inhibidores de quinasa y su uso en el tratamiento del cáncer |
| SI3057965T1 (sl) | 2013-10-18 | 2019-04-30 | University Health Network | Sol in kristalne oblike inhibitorja PLK-4 |
| US20210060026A1 (en) * | 2017-09-08 | 2021-03-04 | University Health Network | Combination therapies for inhibition of polo-like kinase 4 |
| AU2020264143A1 (en) * | 2019-04-24 | 2021-10-28 | University Health Network | Crystal form S4 of the PLK4 inhibitor (1R,2S)-(E)-2-(3-(4-((cis-2,6-dimethylmorpholino)methyl)styryl)- 1 H-imidazol-6- yl)-5'-methoxyspiro(cyclopropane-1,3'-indolin)-2'-one fumarate |
| CN115397429A (zh) * | 2019-12-06 | 2022-11-25 | 大学健康网络 | 急性髓性白血病或骨髓增生异常综合征治疗 |
| TW202309008A (zh) | 2021-05-11 | 2023-03-01 | 美商歐瑞克製藥公司 | 類polo激酶4抑制劑 |
Family Cites Families (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2483323A (en) * | 1945-08-01 | 1949-09-27 | Kay Fries Chemicals Inc | Method of preparing phenyl ethyl alcohol |
| WO2004037247A1 (en) | 2002-10-21 | 2004-05-06 | Irm Llc | Oxindoles with anti-hiv activity |
| DE102005005395A1 (de) * | 2005-02-03 | 2006-08-10 | Schering Aktiengesellschaft | Thiazolidinone, deren Herstellung und Verwendung als Arzneimittel |
| GB0606234D0 (en) * | 2006-03-29 | 2006-05-10 | Pliva Istrazivanje I Razvoj D | Pharmaceutically acceptable salts and polymorphic forms |
| WO2008118097A1 (en) * | 2007-03-23 | 2008-10-02 | Agency For Science, Technology And Research | Palladium catalysts |
| WO2009042711A1 (en) * | 2007-09-25 | 2009-04-02 | Takeda Pharmaceutical Company Limited | Polo-like kinase inhibitors |
| CN101970426A (zh) * | 2007-12-21 | 2011-02-09 | 大学健康网络 | 吲唑基、苯并咪唑基、苯并三唑基取代的二氢吲哚酮衍生物作为癌症治疗中有用的激酶抑制剂 |
| EP2417127B1 (en) | 2009-04-06 | 2014-02-26 | University Health Network | Kinase inhibitors and method of treating cancer with same |
| WO2010125004A1 (en) | 2009-04-29 | 2010-11-04 | Nerviano Medical Sciences S.R.L. | Cdk inhibitor salts |
| ES2603613T3 (es) | 2010-04-06 | 2017-02-28 | University Health Network | Inhibidores de quinasa y su uso en el tratamiento del cáncer |
| WO2012000103A1 (en) * | 2010-07-02 | 2012-01-05 | University Health Network | Methods of targeting pten mutant diseases and compositions therefor |
| WO2012048411A1 (en) * | 2010-10-13 | 2012-04-19 | University Health Network | Plk-4 inhibitors and method of treating cancer with same |
| US9012464B2 (en) * | 2010-11-25 | 2015-04-21 | Ratiopharm Gmbh | Salts and polymorphic forms of Afatinib |
| US9580390B2 (en) | 2011-10-12 | 2017-02-28 | University Health Network | Indazole compounds as kinase inhibitors and method of treating cancer with same |
| SI3057965T1 (sl) | 2013-10-18 | 2019-04-30 | University Health Network | Sol in kristalne oblike inhibitorja PLK-4 |
| WO2015054781A1 (en) | 2013-10-18 | 2015-04-23 | University Health Network | Treatment for pancreatic cancer |
-
2014
- 2014-10-17 SI SI201431110T patent/SI3057965T1/sl unknown
- 2014-10-17 NZ NZ718744A patent/NZ718744A/en unknown
- 2014-10-17 KR KR1020167012155A patent/KR20160070106A/ko not_active Application Discontinuation
- 2014-10-17 RS RS20190269A patent/RS58413B1/sr unknown
- 2014-10-17 KR KR1020227015022A patent/KR20220063299A/ko not_active Application Discontinuation
- 2014-10-17 SG SG11201602783SA patent/SG11201602783SA/en unknown
- 2014-10-17 ES ES14854037T patent/ES2718603T3/es active Active
- 2014-10-17 AU AU2014336929A patent/AU2014336929B9/en active Active
- 2014-10-17 LT LTEP14854037.0T patent/LT3057965T/lt unknown
- 2014-10-17 HU HUE14854037A patent/HUE043194T2/hu unknown
- 2014-10-17 MX MX2016004963A patent/MX359069B/es active IP Right Grant
- 2014-10-17 CN CN201480064037.9A patent/CN105764899B/zh active Active
- 2014-10-17 ME MEP-2019-97A patent/ME03377B/me unknown
- 2014-10-17 TR TR2019/02875T patent/TR201902875T4/tr unknown
- 2014-10-17 CA CA2926845A patent/CA2926845C/en active Active
- 2014-10-17 TW TW103135953A patent/TWI659952B/zh active
- 2014-10-17 US US15/029,373 patent/US9884855B2/en active Active
- 2014-10-17 EA EA201690755A patent/EA031569B1/ru not_active IP Right Cessation
- 2014-10-17 PT PT14854037T patent/PT3057965T/pt unknown
- 2014-10-17 JP JP2016524077A patent/JP6492072B2/ja active Active
- 2014-10-17 PL PL14854037T patent/PL3057965T3/pl unknown
- 2014-10-17 EP EP14854037.0A patent/EP3057965B1/en active Active
- 2014-10-17 DK DK14854037.0T patent/DK3057965T3/en active
- 2014-10-17 WO PCT/CA2014/051001 patent/WO2015054793A1/en active Application Filing
- 2014-10-17 CN CN202110510808.4A patent/CN113248486A/zh active Pending
- 2014-10-17 KR KR1020217036751A patent/KR102395737B1/ko active IP Right Grant
-
2016
- 2016-04-11 IL IL24503816A patent/IL245038B/en active IP Right Grant
-
2018
- 2018-02-01 US US15/886,104 patent/US10392374B2/en active Active
-
2019
- 2019-03-22 HR HRP20190564TT patent/HRP20190564T1/hr unknown
- 2019-03-22 CY CY20191100336T patent/CY1121484T1/el unknown
- 2019-04-19 US US16/389,119 patent/US10472353B2/en active Active
- 2019-11-06 US US16/675,609 patent/US10919886B2/en active Active
-
2021
- 2021-02-10 US US17/172,511 patent/US11667627B2/en active Active
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11667627B2 (en) | Salt and crystal forms of PLK-4 inhibitor | |
| AU2014336929A1 (en) | Salt and crystal forms of PLK-4 inhibitor | |
| US11878980B2 (en) | Solid forms of TTK inhibitor |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal | ||
| AMND | Amendment | ||
| E601 | Decision to refuse application | ||
| X091 | Application refused [patent] | ||
| AMND | Amendment | ||
| X601 | Decision of rejection after re-examination | ||
| A107 | Divisional application of patent | ||
| WITB | Written withdrawal of application |