KR20150132362A - Pcsk9의 소분자 조절물질 및 그것의 사용 방법 - Google Patents
Pcsk9의 소분자 조절물질 및 그것의 사용 방법 Download PDFInfo
- Publication number
- KR20150132362A KR20150132362A KR1020157029032A KR20157029032A KR20150132362A KR 20150132362 A KR20150132362 A KR 20150132362A KR 1020157029032 A KR1020157029032 A KR 1020157029032A KR 20157029032 A KR20157029032 A KR 20157029032A KR 20150132362 A KR20150132362 A KR 20150132362A
- Authority
- KR
- South Korea
- Prior art keywords
- alkyl
- substituted
- unsubstituted
- phenyl
- compound
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K5/00—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof
- C07K5/04—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof containing only normal peptide links
- C07K5/08—Tripeptides
- C07K5/0827—Tripeptides containing heteroatoms different from O, S, or N
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/06—Tripeptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/06—Antihyperlipidemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K5/00—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof
- C07K5/02—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof containing at least one abnormal peptide link
- C07K5/0205—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof containing at least one abnormal peptide link containing the structure -NH-(X)3-C(=0)-, e.g. statine or derivatives thereof
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K5/00—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof
- C07K5/04—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof containing only normal peptide links
- C07K5/08—Tripeptides
- C07K5/0802—Tripeptides with the first amino acid being neutral
- C07K5/0804—Tripeptides with the first amino acid being neutral and aliphatic
- C07K5/0806—Tripeptides with the first amino acid being neutral and aliphatic the side chain containing 0 or 1 carbon atoms, i.e. Gly, Ala
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K5/00—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof
- C07K5/04—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof containing only normal peptide links
- C07K5/08—Tripeptides
- C07K5/0802—Tripeptides with the first amino acid being neutral
- C07K5/0804—Tripeptides with the first amino acid being neutral and aliphatic
- C07K5/0808—Tripeptides with the first amino acid being neutral and aliphatic the side chain containing 2 to 4 carbon atoms, e.g. Val, Ile, Leu
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K5/00—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof
- C07K5/04—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof containing only normal peptide links
- C07K5/08—Tripeptides
- C07K5/0802—Tripeptides with the first amino acid being neutral
- C07K5/0804—Tripeptides with the first amino acid being neutral and aliphatic
- C07K5/081—Tripeptides with the first amino acid being neutral and aliphatic the side chain containing O or S as heteroatoms, e.g. Cys, Ser
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K5/00—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof
- C07K5/04—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof containing only normal peptide links
- C07K5/08—Tripeptides
- C07K5/0802—Tripeptides with the first amino acid being neutral
- C07K5/0812—Tripeptides with the first amino acid being neutral and aromatic or cycloaliphatic
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
Abstract
Description
관련
출원에 대한 교차참조
본원은 미국 가출원 일련 번호 61/792,249(2013년 3월 15일) 자체를 우선권으로 주장하는, PCT 조항 21(2) 하에서 영국에서 공개된 PCT 출원 일련 번호 PCT/CA2014/*(2014년 3월 14일 출원)의 국내 단계 진입 출원이다. 상기 모든 문서는 그 전체가 참고로 본원에 편입되어 있다.
연방 지원된 조사 또는 개발에 관한 서술
N. A.
발명의 분야
본 발명은 프로단백질 전환효소 서브틸리신-켁신 유형 9 (PCSK9)의 소분자 조절물질 및 그것의 사용 방법에 관한 것이다. 더 구체적으로, 본 발명은 저-밀도 지질단백질 (LDL)-콜레스테롤-관련된 질병 또는 장애에 관한 것이다.
심혈관 장애로부터 비롯되는 합병증은 다양한 형태의 암으로 인한 연간 ~600만명과 비교하여, 연간 ~1300만명의 개인에게 영향을 미치는 세계적인 주요 사망 원인이다. 가장 유력한 심혈관 위험 인자 중 하나는, 상승된 수준의 저밀도 지질단백(LDL) 콜레스테롤(LDL-C)이다. 심혈관 병리의 발생율은 다음 20년 내에 급격히 증가될 것으로 예상된다. 임상 시험 데이타는, LDL 콜레스테롤 수준에서의 감소가 심장 사건 비율과 관련됨을 실증하였다 (문헌 (Law 등, 2003 BMJ 326:1423-1427) 참고). 혈장 LDL 콜레스테롤 수준에서의 적절한 꾸준한(lifelong) 감소는, 심지어 비지질 관련된 심혈관 위험 인자의 높은 유병률을 갖는 집단에서 심장 사건의 발병률에서의 유의미한 감소와 실질적으로 상관되어 있는 것으로 밝혀졌다 (문헌 (Cohen 등, N. Engl . J. Med . 354:1264-1272) 참고). 따라서, LDL 콜레스테롤 수준을 조절 관리함으로써 큰 이득이 얻어질 것이다. 중요한 콜레스테롤-저하 약물은 스타틴이다 (문헌 (Briel, M., Nordmann, A. J., and Bucher, H. C. Curr . Opin . Lipidol., 16: 601-605, 2005) 참고). 대다수 환자에게 충분히 허용되었다 하더라도, 유해 부작용이 집계되고 있다 (https://www.statineffects.com/info/). 스타틴과 장 스테롤 수송체 차단제인 에제티미베의 조합체는 LDL-C를 ≤≤ 20%까지 추가로 감소시킨다.
따라서, 순환되는 LDL-C 수준을 감소시키는 대안적인 전략을 개발할 필요가 있다 (문헌 (Brown, M. S. and Goldstein, J. L. Science, 311: 1721-1723, 2006; Tall, A. R. N. Engl . J Med., 354: 1310-1312, 2006) 참고).
저밀도 지질단백 수용체(LDLR)는, 혈류 내에서 순환되는 LDL 수준을 조절하는데 있어 중요한 요소이다. 감소된 LDLR 수준은, 산업화된 도시에서 주요 사망 원인인 죽상경화증 및 관상 심장 질환의 증가된 위험과 크게 상관되는 상승된 혈장 콜레스테롤(LDL-C)과 관련된다. 이에 의해 세포 표면에서 LDLR 단백질 수준을 증가시키는 제제가 혈장 고콜레스테롤혈증을 앓는 개인에서 LDL-C를 정상화시키는 수단을 제공할 것이다. 프로단백질 전환효소 PCSK9는 엔도솜/리소좀 내에서 LDLR의 분해를 향상시킴으로써 LDLR의 수준을 감소시킨다. 다수의 임상 시험에서, 단일클론성 항체를 사용한 PCSK9-매개된 LDLR 분해의 억제는 건강한 인간 대상체에서 LDL-C를 용량-의존적으로 감소시킴이 확증되었다 (문헌 (Lambert 등, The PCSK9 Decade', J. Lipid Res. 2012, 53(12), 2515-24 및 여기서 인용된 참고문헌 참고). 비용 및 투여 편리성의 측면에서, 분비된 PCSK9의 양을 감소시키는 경구적으로 이용가능한 소분자 제제가, PCSK9 매개된 LDLR의 분해를 방해하도록 최적화된(tailored) 생물학 제제, 예컨대 항체 또는 올리고누클레오타이드의 정맥내 또는 피하 전달에 대한 바람직한 대안이 될 것이다.
발명의 요약
더 구체적으로, 본 발명에 따라, 식 (I)의 화합물 또는 그것의 약제학적으로 허용가능한 염, 수화물, 용매화물, 또는 라세미 혼합물 또는 입체이성질체가 제공된다:
여기서: R1은 -CH(OH)Ra 또는 -B(ORb)(ORc)이고;
R2은 -H, -CH2Rd, -CHRd(Re), -CH2(CH2)mC(O)Rj, -CH2(CH2)mC(O)N(Rd)Re 또는 -CH2(CH2)mS(O)nN(Rd)Re 이고;
R3, R4, R5, R6, R7 및 R8은 동일 또는 상이하고, 그리고 독립적으로 수소 또는 하기 기: C1-6 알킬, C1-6 할로알킬, C1-6 티오알킬, 알케닐, 알키닐, 아릴, 및 헤테로아릴 기 중의 하나이고, 여기서 상기 기는 1 이상의 C1-6 알킬, C3-8 사이클로알킬, C1-6 할로알킬, 아릴, 헤테로아릴, -CN, -C(O)N(Rf)Rg, -C(O)ORf, -C(Rf)(Rg)ORh, -ORf, -OC(O)ORf, -OC(O)NRf(Rg), -SRf, -S(O)nRf, S(O)nN(Rf)Rg, -S(O)nN(Rf)C(O)Rg, -N(Rf)Rg, -N(Rf)C(O)Rg, -N(Rf)C(O)ORg, -N(Rf)C(O)N(Rg)(Rh), -N(Rf)S(O)nRg, 및 -N(Rf)S(O)N(Rg)Rh 치환체로 임의로 치환되고;
(R3 및 R4) 또는 (R5 및 R6) 또는 (R7 및 R8)이 수소가 아닐 때, 괄호로 묶은 쌍은 또한, -C(O) -, -CO2-, -C(O)N(H)-, -C(O)N(Rx)- -O-, -NH-, -N(Rx)-, -S-, -S(O)n-, -S(O)nN(H)-, -S(O)nN(Rx)- 라디칼과 연결되어 사이클릭 구조를 형성할 수 있고;
R9는 RiC(O)-, RiS(O)n-, RiOC(O)-, Ri-NHC(O) -, RiNHS(O)n-, Rk(Rl)NC(O)-, Rl(Rl)NS(O)n-; 또는 1 이상의 아미노산 잔기이고;
Ra는 C1-3 알킬, C1-2 플루오로알킬 또는 사이클로프로필이고;
Rb 및 Rc은 동일 또는 상이하고, 그리고 독립적으로 H 또는 C1-6 알킬이거나, 또는 함께 연결되어 사이클릭 5- 또는 6-원 고리 구조를 형성할 수 있거나, 또는 추가의 지방족 또는 방향족 고리계와 융합될 수 있고, 상기 사이클릭 5- 또는 6-원 고리 구조 또는 지방족 또는 방향족 고리계는 1 이상의 C1-6 알킬 및/또는 C1-6 할로알킬 치환체로 치환될 수 있고;
Rd 및 Re은 동일 또는 상이하고, 그리고 독립적으로 H 또는 하기 기: C1-3 알킬, C1-3 할로알킬 또는 C3-4 사이클로알킬 기 중 하나이거나, 또는 직접적으로 또는 함께 -C(O)-, -C(O)O-, -C(O)N(Rx)- -O-, -N(Rx)-, -S-, -S(O)n-, 또는 -S(O)nN(Rx)- 라디칼과 연결되어 사이클릭 3-8 원 고리 구조를 형성할 수 있고;
Rf, Rg, Rh, Rk 및 Rl은 동일 또는 상이하고, 그리고 독립적으로 H 또는 하기 기: C1-6 알킬, C1-6 할로알킬 또는 C3-4 사이클로알킬 기 중 하나이고, 또는 직접적으로 또는 함께 -C(O)-, -C(O)O-, -C(O)N(Rx)- -O-, -N(Rx)-, -S-, -S(O)n- 또는 -S(O)nN(Rx)- 라디칼과 연결되어 사이클릭 3-8 원 고리 구조를 형성할 수 있고;
Ri는 C1-10 알킬, C3-8 사이클로알킬, C1-10 할로알킬, 헤테로사이클릴, 아릴 또는 헤테로아릴 기이고, 여기서 상기 기는 할로겐, C-1-6 아미노알킬, C1-6 헤테로알킬, C1-6 알킬, C3-8 사이클로알킬, C1-6 할로알킬, 아릴, 헤테로아릴 및 헤테로사이클릴 기 중 하나 이상으로 임의로 치환되고;
Rj는 ORd 또는 N(Rd)(Re)이고;
Rx는 H, C1-6 알킬, C1-6 할로알킬, C3-4 사이클로알킬, -C(O)Ry, -C(O)ORy, -C(O)NH2, -C(O)NH(Ry) 또는 -C(O)NHS(O)nRy이고;
Ry는 C1-6 알킬, C1-6 할로알킬 또는 C3-4 사이클로알킬이고;
m는 0 또는 1의 정수 값이고; 그리고
n는 1 또는 2의 정수 값이고,
단,
R1이 -CH(OH)Ra일 때, R2은 -CHRd(Re), -CH2(CH2)mC(O)Rj, -CH2(CH2)mC(O)N(Rd)Re 또는 -CH2(CH2)mS(O)nN(Rd)Re 이고; 그리고
R1이 -B(ORb)(ORc)일 때, R2은 -H, -CH3, -CHRd(Re), -CH2(CH2)mC(O)Rj, -CH2(CH2)mC(O)N(Rd)Re 또는 -CH2(CH2)mS(O)nN(Rd)Re이다.
더 구체적으로, 본 발명에 따라, 식 (I)의 화합물 또는 그것의 약제학적으로 허용가능한 염, 수화물, 용매화물, 또는 라세미 혼합물 또는 입체이성질체가 제공된다:
여기서:
R1은 -CH(OH)Ra 또는 -B(ORb)(ORc)이고;
R2은 -H, -CH2Rd, -CHRd(Re), -CH2(CH2)mC(O)Rj, -CH2(CH2)mC(O)N(Rd)Re 또는 -CH2(CH2)mS(O)nN(Rd)Re이고;
R3, R4, R5, R6, R7 및 R8은 동일 또는 상이하고, 그리고 독립적으로 수소 또는 하기 기 중의 하나이고: C1-6 알킬, C1-6 할로알킬, C1-6 티오알킬, C1-6 아미노알킬, 알케닐, 알키닐, 사이클로알킬, 헤테로사이클릴, 아릴, 및 헤테로아릴 기이고, 여기서 상기 기는 1 이상의 C1-6 알킬, C3-8 사이클로알킬, C1-6 할로알킬, 아릴, 헤테로아릴, -CN, -C(O)N(Rf)Rg, -C(O)ORf, -C(Rf)(Rg)ORh , -ORf, -OC(O)ORf, -OC(O)NRf(Rg), -SRf, -S(O)nRf, -S(O)nN(Rf)Rg, -S(O)nN(Rf)C(O)Rg, -N(Rf)Rg, -N(Rf)C(O)Rg, -N(Rf)C(O)ORg, -N(Rf)C(O)N(Rg)(Rh), -N(Rf)S(O)nRg, 및 -N(Rf)S(O)N(Rg)Rh 치환체로 임의로 치환되고;
(R3 및 R4) 또는 (R5 및 R6) 또는 (R7 및 R8)이 수소가 아닐 때, 괄호로 묶은 쌍은 또한, -C(O)-, -CO2-, -C(O)N(H)-, -C(O)N(Rx)-, -O-, -NH-, -N(Rx)-, -S-, -S(O)n-, -S(O)nN(H)-, -S(O)nN(Rx)- 라디칼과 연결되어 사이클릭 구조를 형성할 수 있고;
R9는 RiC(O)-, RiS(O)n-, RiOC(O)-, RiNHC(O)-, RiNHS(O)n-, Rk(Rl)NC(O)-, Rl(Rl)NS(O)n-; RmORiC(O)-, RmC(O)RiC(O)- 또는 1 이상의 아미노산 잔기이고;
Ra는 C1-3 알킬, C1-2 플루오로알킬 또는 사이클로프로필이고;
Rb 및 Rc은 동일 또는 상이하고, 그리고 독립적으로 H 또는 C1-6 알킬이거나, 또는 함께 연결되어 사이클릭 5- 또는 6-원 고리 구조를 형성할 수 있거나, 또는 추가의 지방족 또는 방향족 고리계와 융합될 수 있고, 상기 사이클릭 5- 또는 6-원 고리 구조 또는 지방족 또는 방향족 고리계는 1 이상의 C1-6 알킬 및/또는 C1-6 할로알킬 치환체로 치환될 수 있고;
Rd 및 Re은 동일 또는 상이하고, 그리고 독립적으로 H 또는 하기 기: C1-3 알킬, C1-3 할로알킬 또는 C3-4 사이클로알킬 기 중 하나이거나, 또는 직접적으로 또는 함께 -C(O)-, -C(O)O-, -C(O)N(Rx)- -O-, -N(Rx)-, -S-, -S(O)n-, 또는 -S(O)nN(Rx)- 라디칼과 연결되어 사이클릭 3-8 원 고리 구조를 형성할 수 있고;
Rf, Rg, Rh, Rk 및 Rl은 동일 또는 상이하고, 그리고 독립적으로 H 또는 하기 기: C1-6 알킬, C1-6 할로알킬 또는 C3-4 사이클로알킬 기 중 하나이고, 또는 직접적으로 또는 함께 -C(O)-, -C(O)O-, -C(O)N(Rx)- -O-, -N(Rx)-, -S-, -S(O)n- 또는 -S(O)nN(Rx)- 라디칼과 연결되어 사이클릭 3-8 원 고리 구조를 형성할 수 있고;
Ri는 C1-10 알킬, C1-10 헤테로알킬, C3-8 사이클로알킬, C1-10 할로알킬, 헤테로사이클릴, 아릴, 헤테로아릴, C1-10 알킬-C3-8 사이클로알킬, C1-10 알킬-헤테로사이클릴, C1-10 알킬-아릴, C1-10 알킬-헤테로아릴, C1-10 헤테로알킬-C3-8 사이클로알킬, C1-10 헤테로알킬-헤테로사이클릴, C1-10 헤테로알킬-아릴 또는 C1-10 헤테로알킬- 헤테로아릴 기이고, 여기서 상기 기는 할로겐, C1-6 아미노알킬, C1-6 헤테로알킬, C1-6 알킬, C3-8 사이클로알킬, C1-6 할로알킬, 아릴, 헤테로아릴 및 헤테로사이클릴 기 중 하나 이상으로 임의로 치환되고;
Rm은 C1-10 알킬, C1-10 헤테로알킬, C3-8 사이클로알킬, C1-10 할로알킬, 헤테로사이클릴, 아릴 또는 헤테로아릴 기이고, 여기서 상기 기는 할로겐, C1-6 아미노알킬, C1-6 헤테로알킬, C1-6 알킬, C3-8 사이클로알킬, C1-6 할로알킬, 아릴, 헤테로아릴 및 헤테로사이클릴 기 중 하나 이상으로 임의로 치환되고;
Rj는 ORd 또는 N(Rd)(Re)이고;
Rx는 H, C1-6 알킬, C1-6 할로알킬, C3-4 사이클로알킬, -C(O)Ry, -C(O)ORy, -C(O)NH2, -C(O)NH(Ry) 또는 -C(O)NHS(O)nRy;
Ry는 C1-6 알킬, C1-6 할로알킬 또는 C3-4 사이클로알킬이고;
m는 0 또는 1의 정수 값이고; 그리고
n는 1 또는 2의 정수 값이고,
단,
1) R1이 -CH(OH)Ra일 때, R2은 -CHRd(Re), -CH2(CH2)mC(O)Rj, -CH2(CH2)mC(O)N(Rd)Re 또는 -CH2(CH2)mS(O)nN(Rd)Re 이고; 그리고
2) R1이 -B(ORb)(ORc)일 때, R2은 -H, -CH3, -CHRd(Re), -CH2(CH2)mC(O)Rj, -CH2(CH2)mC(O)N(Rd)Re 또는 -CH2(CH2)mS(O)nN(Rd)Re이다.
식 I의 화합물의 특정 구현예에서, (i) R1이 -CH(OH)-CF3일 때, R9가 -C(O)OCH2-페닐 또는 -C(O)OCH3은 아니고; (ii) R1이 B(OH)2일 때, R9가 -C(O)OCH3 또는 -C(O)-페닐-페닐은 아니고/거나; (iii) R1이 CH(OH)CH2F일 때, R9는 not -C(O)(CH2)8CH3은 아니다.
식 I의 화합물의 특정 구현예에서, R1은 -B(ORb)(ORc), 또는 -CH(OH)Ra이고; R2는 H 또는 -CH2(CH2)mC(O)Rj이고; R3는 H이고; R4는 치환되거나 그렇지 않은 C1-6 알킬, 치환되거나 그렇지 않은 C1-6 티오알킬 또는 치환되거나 그렇지 않은 아릴이고; R5는 H이고; R6는 아릴로 치환된 C1-6 알킬이고; R7는 H이고; R8은 C1-6 알킬로 치환된 C1-6 알킬이고/거나; R9는 RiOC(O)- 또는 RiC(O)-이다.
또 하나의 식 I의 화합물의 특정 구현예에서, R1은 -B(ORb)(ORc), 또는 -CH(OH)Ra 이고; R2는 H 또는 -CH2(CH2)mC(O)Rj 이고; R3는 H이고; R4는 치환되거나 그렇지 않은 C1-6 알킬, 치환되거나 그렇지 않은 C1-6 티오알킬 또는 치환되거나 그렇지 않은 아릴이고; R5는 H이고; R6는 아릴로 치환된 C1-6 알킬이고; R7는 H이고; R8은 C1-6 알킬로 치환된 C1-6 알킬이고; 그리고 R9는 RiOC(O)- 또는 RiC(O)-이다.
또 하나의 식 I의 화합물의 특정 구현예에서, R1은 -B(ORb)(ORc), 또는 -CH(OH)Ra 이고; R2는 H 또는 -CH2(CH2)mC(O)Rj; R3는 H 또는 치환되거나 그렇지 않은 C1-6 알킬이고; R4는 H, 치환되거나 그렇지 않은 C1-6 알킬, 치환되거나 그렇지 않은 C1-6 티오알킬, 치환되거나 그렇지 않은 아릴 또는 치환되거나 그렇지 않은 사이클로알킬이고; R5는 H이고; R6는 H, 치환되거나 그렇지 않은 C1-6 알킬, 치환되거나 그렇지 않은 C1-6 티오알킬, 치환되거나 그렇지 않은 아릴, 또는 치환되거나 그렇지 않은 사이클로알칸이고; R7는 H이고; R8은 H, 치환되거나 그렇지 않은 C1-6 알킬, 치환되거나 그렇지 않은 C1-6 티오알킬, 치환되거나 그렇지 않은 아릴, 또는 치환되거나 그렇지 않은 사이클로알킬이고/거나; R9는 RiOC(O)-, RiC(O)-, RmORiC(O)-, RmC(O)RiC(O)-, 또는 RiS(O)n-이다.
또 하나의 식 I의 화합물의 특정 구현예에서, R1은 -B(ORb)(ORc), 또는 -CH(OH)Ra 이고; R2는 H 또는 -CH2(CH2)mC(O)Rj; R3는 H 또는 치환되거나 그렇지 않은 C1-6 알킬이고; R4는 H, 치환되거나 그렇지 않은 C1-6 알킬, 치환되거나 그렇지 않은 C1-6 티오알킬, 치환되거나 그렇지 않은 아릴 또는 치환되거나 그렇지 않은 사이클로알킬이고; R5는 H이고; R6는 H, 치환되거나 그렇지 않은 C1-6 알킬, 치환되거나 그렇지 않은 C1-6 티오알킬, 치환되거나 그렇지 않은 아릴, 또는 치환되거나 그렇지 않은 사이클로알칸이고; R7는 H이고; R8은 H, 치환되거나 그렇지 않은 C1-6 알킬, 치환되거나 그렇지 않은 C1-6 티오알킬, 치환되거나 그렇지 않은 아릴, 또는 치환되거나 그렇지 않은 사이클로알킬이고; 그리고 R9는 RiOC(O)-, RiC(O)-, RmORiC(O)-, RmC(O)RiC(O)-, 또는 RiS(O)n-이다.
식 I의 화합물의 특정 구현예에서, R2; R3 또는 R4; R5 또는 R6; 및/또는 R7 R8은 동일 또는 상이할 수 있고 D 또는 L 입체배치에서 프롤린을 제외한 임의의 천연 아미노산의 측쇄일 수 있다. 다른 치환체는 본원에서 정의된 바와 같다. 더 특정 구현예에서, (i) R2는 글루타민 또는 글리신의 측쇄이고; (ii) R3 또는 R4는 알라닌, 페닐알라닌, 메티오닌, 류신, 발린, 글루타민 또는 글리신의 측쇄이고; (iii) R5 또는 R6는 페닐알라닌, 글리신, 알라닌, 메티오닌, 또는 발린의 측쇄이고; (iv) R7 또는 R8은 발린, 메티오닌, 페닐알라닌, 글리신 또는 알라닌; 또는 (v) (i) 내지 (iv) 중 적어도 2개의 임의의 조합이다.
또 하나의 식 I의 화합물의 특정 구현예에서, R6는 페닐-CH2-이고/거나; R8은 (CH3)2CH-이다. 또 하나의 특정 구현예에서, R1은 -B(ORb)(ORc)이다. 또 하나의 특정 구현예에서, Rb 및 Rc는 H이다. 또 하나의 특정 구현예에서, Rb 및 Rc는 연결되어 사이클릭 5 원 고리 구조를 형성하거나 지방족 고리계와 융합된다. 또 하나의 특정 구현예에서, R1는 2,9,9-트리메틸-3,5-디옥사-4-보라트리사이클로[6.1.1.02,6]데칸-4-일이다. 또 하나의 특정 구현예에서, R1은 -CH(OH)Ra이다. 또 하나의 특정 구현예에서, Ra는 C1-2 플루오로알킬이다. 또 하나의 특정 구현예에서, Ra는 -CF3이다. 또 하나의 특정 구현예에서, Ra은 -CH2F이다. 또 하나의 특정 구현예에서, Ra는 C1-3 알킬이다. 또 하나의 특정 구현예에서, Ra은 -CH3이다. 또 하나의 특정 구현예에서, R2는 H이다. 또 하나의 특정 구현예에서, R2은 -CH2(CH2)mC(O)Rj이다. 또 하나의 특정 구현예에서, Rj는 ORd이다. 또 하나의 특정 구현예에서, Rd는 CH3이다. 또 하나의 특정 구현예에서, Rj는 NH2이다.
또 하나의 식 I의 화합물의 특정 구현예에서, R3는 H이다. 또 하나의 특정 구현예에서, R3는 치환되거나 그렇지 않은 C1-6 알킬이다. 또 하나의 특정 구현예에서, R3는 비치환된 C1-6 알킬이다. 또 하나의 특정 구현예에서, R3는 CH3 이다.
또 하나의 식 I의 화합물의 특정 구현예에서, R4는 H이다. 또 하나의 특정 구현예에서, R4는 치환되거나 그렇지 않은 C1-6 알킬이다. 또 하나의 특정 구현예에서, R4는 비치환된 C1-6 알킬이다. 또 하나의 특정 구현예에서, R4는 아릴 치환된 C1-6 알킬이다. 또 하나의 특정 구현예에서, R4는 -CH3. 또 하나의 특정 구현예에서, R4는 CH3CH2-이다. 또 하나의 특정 구현예에서, R4는 -CH2CH(CH3)2이다. 또 하나의 특정 구현예에서, R4는 아릴 치환된 C1-6 알킬이다. 또 하나의 특정 구현예에서, R4는 페닐-CH2-이다. 또 하나의 특정 구현예에서, R4는 -(CH2)2C(O)NH2이다. 또 하나의 특정 구현예에서, R4는 치환되거나 그렇지 않은 C1-6 티오알킬이다. 또 하나의 특정 구현예에서, R4는 CH3S(CH2)2-이다. 또 하나의 특정 구현예에서, R4는 치환되거나 그렇지 않은 아릴이다. 또 하나의 특정 구현예에서, R4는 페닐-이다. 또 하나의 특정 구현예에서, R4는 사이클로알킬이다.
또 하나의 특정 구현예에서, R6는 H이다. 또 하나의 특정 구현예에서, R6는 치환되거나 그렇지 않은 C1-6 알킬이다. 또 하나의 특정 구현예에서, R6는 치환된 C1-6 알킬이다. 또 하나의 특정 구현예에서, R6는 아릴 치환된 C1-6 알킬이다. 또 하나의 특정 구현예에서, R6은 -알킬-페닐이다. 또 하나의 특정 구현예에서, R6은 -CH2-페닐이다. 또 하나의 특정 구현예에서, R6은 -CH2-하이드록시페닐이다. 또 하나의 특정 구현예에서, R6은 -(CH2)2-페닐이다. 또 하나의 특정 구현예에서, R6은 -CH2-인돌이다. 또 하나의 특정 구현예에서, R6는 비치환된 C1-6 알킬이다. 또 하나의 특정 구현예에서, R6는 비치환된 C1-6 알킬이다. 또 하나의 특정 구현예에서, R6는 CH3. 또 하나의 특정 구현예에서, R6는 -CH(CH3)2이다. 또 하나의 특정 구현예에서, R6는 치환되거나 그렇지 않은 C1-6 티오알킬이다. 또 하나의 특정 구현예에서, R6는 CH3S(CH2)2-이다. 또 하나의 특정 구현예에서, R6는 치환되거나 그렇지 않은 아릴이다. 또 하나의 특정 구현예에서, R6는 페닐이다. 또 하나의 특정 구현예에서, R6는 치환되거나 그렇지 않은 사이클로알킬이다. 또 하나의 특정 구현예에서, R6는 벤조사이클로펜틸이다.
또 하나의 특정 구현예에서, R8은 H이다. 또 하나의 특정 구현예에서, R8은 치환되거나 그렇지 않은 C1-6 알킬이다. 또 하나의 특정 구현예에서, R8은 비치환된 C1-6 알킬이다. 또 하나의 특정 구현예에서, R8은 -CH(CH3)2. 또 하나의 특정 구현예에서, R8은 -CH3이다. 또 하나의 특정 구현예에서, R8은 치환된 C1-6 알킬이다. 또 하나의 특정 구현예에서, R8은 아릴 치환된 C1-6 알킬이다. 또 하나의 특정 구현예에서, R8은 -CH2-페닐이다. 또 하나의 특정 구현예에서, R8은 치환되거나 그렇지 않은 C1-6 티오알킬이다. 또 하나의 특정 구현예에서, R8은 CH3S(CH2)2-이다. 또 하나의 특정 구현예에서, R8은 치환되거나 그렇지 않은 아릴이다. 또 하나의 특정 구현예에서, R8은 비치환된 아릴이다. 또 하나의 특정 구현예에서, R8은 페닐이다. 또 하나의 특정 구현예에서, R8은 치환되거나 그렇지 않은 사이클로알킬이다. 또 하나의 특정 구현예에서, R8은 비치환된 사이클로알킬이다. R8은 사이클로펜틸이다. 또 하나의 특정 구현예에서, R8은 사이클로프로필이다.
또 하나의 특정 구현예에서, R9는 RiOC(O)-이다. 또 하나의 특정 구현예에서, Ri는 치환되거나 그렇지 않은 C1-10 알킬-이다. 또 하나의 특정 구현예에서, Ri는 비치환된 C1-10 알킬-이다. 또 하나의 특정 구현예에서, Ri는 CH3-이다. 또 하나의 특정 구현예에서, Ri는 치환된 C1-10 알킬-이다. 또 하나의 특정 구현예에서, Ri는 (CH3)3C-이다. 또 하나의 특정 구현예에서, Ri는 페닐-CH2-이다.
또 하나의 특정 구현예에서, R9는 RiC(O)-이다. 또 하나의 특정 구현예에서, Ri는 치환되거나 그렇지 않은 아릴-이다. 또 하나의 특정 구현예에서, Ri는 치환된 아릴-이다. 또 하나의 특정 구현예에서, Ri는 치환되거나 그렇지 않은 아릴 또는 치환되거나 그렇지 않은 헤테로아릴이다. 또 하나의 특정 구현예에서, Ri는 치환되거나 그렇지 않은 아릴이다. 또 하나의 특정 구현예에서, Ri는 치환된 아릴이다. 또 하나의 특정 구현예에서, Ri는 아릴-페닐-이다. 또 하나의 특정 구현예에서, Ri는 페닐-페닐-이다. 또 하나의 특정 구현예에서, Ri는 헤테로아릴-페닐-이다. 또 하나의 특정 구현예에서, Ri는 디아지린-페닐-이다. 또 하나의 특정 구현예에서, Ri는 페닐-페닐-이다. 또 하나의 특정 구현예에서, Ri는 플루오로페닐-이다. 또 하나의 특정 구현예에서, Ri는 플루오로알킬-디아지린-페닐-이다. 또 하나의 특정 구현예에서, Ri는 트리플루오로메틸-디아지린-페닐-이다. 또 하나의 특정 구현예에서, Ri는 피리딘-페닐-이다. 또 하나의 특정 구현예에서, Ri는 옥사디아졸-페닐-이다. 또 하나의 특정 구현예에서, Ri는 헤테로사이클릴-페닐-이다. 또 하나의 특정 구현예에서, Ri는 모폴린-페닐-이다. 또 하나의 특정 구현예에서, Ri는 알킬-페닐-이다. 또 하나의 특정 구현예에서, Ri는 (CH3)2CH-페닐-이다. 또 하나의 특정 구현예에서, Ri는 OHCH2-페닐-이다. 또 하나의 특정 구현예에서, Ri는 플루오로페닐이다. 또 하나의 특정 구현예에서, Ri는 비치환된 아릴이다. 또 하나의 특정 구현예에서, Ri는 페닐이다. 또 하나의 특정 구현예에서, Ri는 치환되거나 그렇지 않은 헤테로아릴이다. 또 하나의 특정 구현예에서, Ri는 치환된 헤테로아릴이다. 또 하나의 특정 구현예에서, Ri는 아릴-헤테로아릴-이다. 또 하나의 특정 구현예에서, Ri는 페닐-헤테로아릴-이다. 또 하나의 특정 구현예에서, Ri는 페닐-피라졸-이다. 또 하나의 특정 구현예에서, Ri는 페닐-메틸피라졸-이다. 또 하나의 특정 구현예에서, Ri는 페닐-티아졸-이다. 또 하나의 특정 구현예에서, Ri는 페닐-피리딘-이다. 또 하나의 특정 구현예에서, Ri는 페닐-푸라잔-이다. 또 하나의 특정 구현예에서, Ri는 헤테로아릴-헤테로아릴-이다. 또 하나의 특정 구현예에서, Ri는 피리딘-이소티아졸-이다. 또 하나의 특정 구현예에서, Ri는 비치환된 헤테로아릴이다. 또 하나의 특정 구현예에서, Ri는 피리딘이다. 또 하나의 특정 구현예에서, Ri는 피라진이다. 또 하나의 특정 구현예에서, Ri는 인돌이다. 또 하나의 특정 구현예에서, Ri는 4-[3-트리플루오로메틸)-3H-디아지린-3-일]페닐-이다. 또 하나의 특정 구현예에서, Ri는 3-[3-트리플루오로메틸)-3H-디아지린-3-일]페닐-이다. 또 하나의 특정 구현예에서, Ri는 비치환된 아릴-이다. 또 하나의 특정 구현예에서, Ri는 페닐-이다. 또 하나의 특정 구현예에서, Ri는 치환되거나 그렇지 않은 C1-10 알킬-이다. 또 하나의 특정 구현예에서, Ri는 치환된 C1-10 알킬-이다. 또 하나의 특정 구현예에서, Ri는 아릴-C1-10 알킬-이다. 또 하나의 특정 구현예에서, Ri는 페닐-C1-10 알킬-이다. 또 하나의 특정 구현예에서, Ri는 페닐-알킨-이다. 또 하나의 특정 구현예에서, Ri는 페닐-CH2-이다.
또 하나의 특정 구현예에서, Ri는 플루오로메톡시-아릴-(C1-6 알킬)-이다. 또 하나의 특정 구현예에서, Ri는 플루오로메톡시-페닐-CH2-이다. 또 하나의 특정 구현예에서, Ri는 트리플루오로메톡시 -페닐-CH2-이다. 또 하나의 특정 구현예에서, Ri는 4-(트리플루오로메톡시)페닐-CH2-이다. 또 하나의 특정 구현예에서, Ri는 플루오로알킬-디아지린-페닐-(C1-10 알킬). 또 하나의 특정 구현예에서, Ri는 트리플루오로메틸-디아지린-페닐-CH2-이다. 또 하나의 특정 구현예에서, Ri는 4-[3-트리플루오로메틸)-3H-디아지린-3-일]페닐-이다. 또 하나의 특정 구현예에서, Ri는 3-[3-트리플루오로메틸)-3H-디아지린-3-일]페닐-이다. 또 하나의 특정 구현예에서, Ri는 비치환된 C1-10 알킬-이다. 또 하나의 특정 구현예에서, Ri는 CH3(CH2)8-이다.
또 하나의 특정 구현예에서, R9는 RmORiC(O)-이다. 또 하나의 특정 구현예에서, Ri는 치환 또는 비치환된 C1-10 알킬이다. 또 하나의 특정 구현예에서, Ri는 -CH2-이다. 또 하나의 특정 구현예에서, Rm는 치환 또는 비치환된 C1-10 알킬이다. 또 하나의 특정 구현예에서, Rm는 -CH2-이다. 또 하나의 특정 구현예에서, Rm는 아릴-CH2-이다. 또 하나의 특정 구현예에서, Rm는 페닐-CH2-이다. 또 하나의 특정 구현예에서, Rm는 치환 또는 비치환된 아릴이다. 또 하나의 특정 구현예에서, Rm는 페닐이다.
또 하나의 특정 구현예에서, R9는 RmC(O)RiC(O)-이다. 또 하나의 특정 구현예에서, Rm는 헤테로아릴이다. 또 하나의 특정 구현예에서, Rm는 모폴린. 또 하나의 특정 구현예에서, Ri는 아릴이다. 또 하나의 특정 구현예에서, Ri는 페닐이다.
또 하나의 특정 구현예에서, R9는 RiS(O)n-이다. 또 하나의 특정 구현예에서, Ri는 치환 또는 비치환된 아릴이다. 또 하나의 특정 구현예에서, Ri는 치환된 아릴이다. 또 하나의 특정 구현예에서, Ri는 치환된 페닐이다. 또 하나의 특정 구현예에서, Ri는 페닐-페닐이다.
또 하나의 특정 구현예에서, 식 I의 화합물은 아래와 같다:
특정 구현예에서, 본 발명의 화합물은 화합물 1; 2; 17; 21a 및 21b; 25 및/또는 26의 혼합물이 아니다.
본 발명의 또 하나의 측면에 따르면, 본 발명의 화합물 중 적어도 하나를 포함하는 약제학적 조성물이 제공된다. 본 조성물의 특정 구현예에서, 본 조성물은 추가로, 본 발명의 적어도 하나의 다른 화합물을 포함한다. 또 하나의 특정 구현예에서, 본 조성물은 추가로, 환자의 지질 프로파일을 개선하는 적어도 하나의 다른 활성 성분을 포함한다. 또 하나의 특정 구현예에서, 본 조성물은 추가로, 약제학적 담체 또는 부형제를 포함한다.
본 발명의 또 하나의 측면에 따르면, 약제로서 사용하기 위한 본 발명의 화합물 또는 조성물이 제공된다. 특정 구현예에서, 화합물 또는 조성물은 약제의 제조를 위한 것이다. 또 하나의 특정 구현예에서, 상기 약제는 대상체에서 저밀도 지질-콜레스테롤-관련된 질환 또는 장애를 예방 또는 치료하기 위한 것이고, 단, 본 화합물은 아래의 것이 아니다:
본 화합물 또는 조성물의 또 하나의 특정 구현예에서, 저밀도 지질-콜레스테롤-관련된 질환 또는 장애는 고콜레스테롤혈증이다.
본 발명의 또 하나의 측면에 따르면, LDL-콜레스테롤-관련된 질환 또는 장애를 예방 또는 치료하는 방법이 제공되고, 이 방법은 그것이 필요한 대상체에게, 치료적으로 효과적인 양의 본 발명의 화합물 또는 조성물 (예를 들면, 본 발명의 화합물을 포함하는 조성물)을 투여하는 단계를 포함하고, 단, 본 화합물은 아래의 것이 아니다:
본 발명의 특정 구현예에서, 저밀도 지질-콜레스테롤-관련된 질환 또는 장애는 고콜레스테롤혈증이다.
본 발명의 또 하나의 측면에 따르면, 약제로서의 본 발명의 화합물 또는 조성물의 용도가 제공된다. 특정 구현예에서, 본 발명의 화합물 또는 조성물의 용도는 대상체에서 저밀도 지질-콜레스테롤-관련된 질환 또는 장애를 예방 또는 치료하기 위한 것이다, 단, 본 화합물은 아래의 것이 아니다:
특정 구현예에서, 용도는 대상체에서 저밀도 지질-콜레스테롤-관련된 질환을 예방 또는 치료하기 위한 약제의 제조를 위한 것이고, 단, 본 화합물은 아래의 것이 아니다:
용도의 또 하나의 특정 구현예에서, 저밀도 지질-콜레스테롤-관련된 질환 또는 장애는 고콜레스테롤혈증이다.
본 발명의 또 하나의 측면에 따르면, (i) 본 발명의 화합물 또는 조성물 중 적어도 하나, 및 (ii) (a) 환자의 지질 프로파일을 개선하는 적어도 하나의 다른 활성 성분; (b) 적어도 하나의 다른 본 발명의 화합물 또는 조성물; (c) 상기 화합물 및/또는 활성 성분용 용기; 및/또는 (d) 상기 대상체에서 저밀도 지질-콜레스테롤-관련된 질환 또는 장애를 예방 또는 치료하기 위한 화합물을 사용하기 위한 설명서를 포함하는, 대상체에서 저밀도 지질-콜레스테롤-관련된 질환 또는 장애를 예방 또는 치료하기 위한 키트가 제공되고, 단, 본 화합물은 아래의 것이 아니다:
키트의 특정 구현예에서, 저밀도 지질-콜레스테롤-관련된 질환 또는 장애는 고콜레스테롤혈증이다.
첨부된 도면에서,
도 1은 (a) 초기 스크리닝의 일부로서, PCSK9 분비에 대한 19 화합물의 효과를 도시한다. WT PCSK9(+V5)를 안정적으로 발현하는 HepG2 세포를 단독으로 (-), 또는 DMSO 대조군(DMSO) 또는 100 μM의 지시된 화합물을 함유하는 배양 배지 중에서 24시간 동안 인큐베이션시켰다. 회수된 배지 및 세포 분획 내 PCSK9 수준을 ELISA로 정량화하고 ng PCSK9/ml 분획으로 표시하였다. PCSK9 분비에 대한 지시된 화합물의 억제 효과를, DMSO 대조군에 대한 배지/세포 비의 감소로부터 추정하였다. 별표는 억제 활성; 및 (b) 화합물 a 내지 j의 구조를 갖는 화합물을 나타낸다.
도 2는 PCSK9 분비에 대한 3 화합물의 용량 의존적 효과를 도시한다. WT PCSK9(+V5)를 안정적으로 발현하는 HepG2 세포를 증가하는 농도의 각각의 지시된 화합물의 부재(DMSO) 또는 존재하에서 24시간 동안 인큐베이션시켰다. 배양 배지 및 세포를 회수하고, 각각의 분획 내 PCSK9 수준을 ELISA로 정량화하였다. 세포 내 PCSK9의 수준을, 바이오-라드(Bio-Rad) DC 단백질 검정에 의해 측정된 총 단백질 양에 대하여 보정하였다. 각각의 농도에서, PCSK9 분비에 대한 지시된 화합물의 억제 효과를 DMSO 대조군에 대한 배지/세포 비의 감소로부터 추정하였다.
도 3은 DMSO 대조군과 비교한 5 화합물에 대한 세포 독성 검정을 도시한다. WT PCSK9(+V5)를 안정적으로 발현하는 HepG2 세포를 증가하는 농도의 각각의 지시된 화합물의 부재(DMSO) 또는 존재하에서 24시간 동안 인큐베이션시켰다. 독성 수준을 MTT 세포 독성 검정으로 측정하였다.
도 4는 HepG2 비처리 세포의 표면에서 LDLR 수준에 대한 PCSK9 억제 화합물의 효과를 도시한다. 세포를 33.3 μM의 화합물 19의 존재 또는 부재하에서(DMSO) 20시간 동안 인큐베이션시켰다. 비-투과된 세포를 면역형광법으로 분석하였다. LDLR을 인간 LDLR Ab (녹색 표지)를 사용하여 염색시켰다. 각각의 DMSO 대조군 및 화합물 19 조건에 대하여 3개의 상이한 영역이 도시되어 있다. 화합물 19에 의해 유도된 세포 표면에서의 LDLR 증가에 주목한다.
도 5는 HepG2 비처리 세포 (a) 및 HEK293 비처리 세포 (b)에서 Dil-LDL 흡수에 의해 측정된 세포 표면 LDLR의 활성에 대한, 또는 HepG2 비처리 세포 (c)에서 웨스턴 블롯(Western blot) 분석에 의해 측정된 총 LDLR 수준에 대한, PCSK9 억제 화합물의 효과를 도시한다. 음성 대조군은 화합물 i이다. 내인성 PCSK9를 발현하는 HepG2 비처리 세포 (a), 또는 PCSK9 발현이 결핍되어 있는 HEK293 비처리 세포 (b)를, Dil-LDL를 첨가하기 전 33.3 μM의 지시된 화합물의 존재 또는 부재하에서(DMSO) 6시간 동안 인큐베이션시킨 다음, 추가 18시간 인큐베이션시켰다. 각각의 조건에 대하여, Dil-LDL 흡수 (Dil 형광 프로브의 형광성)를 총 세포 수 (시콴트(CyQuant)™ GR 염료의 형광성)에 대하여 보정하고, 이것을 DMSO 대조군의 활성 %으로 표시하였다. 데이타는 3회 수행된 평균 2 내지 5 (a) 또는 2 내지 3 (b)의 독립적 실험을 나타낸다. (c) HepG2 비처리 세포 내 총 LDLR의 웨스턴 블롯 분석물을, 증가하는 농도의 화합물 19의 존재 또는 부재하에서(Cnt_0) 24시간 동안 인큐베이션시켰다. β-액틴에 대해 표준화된 총 LDLR 수준을 대조군(Cnt) %로 각각의 조건에 대하여 플롯하였다. 단백질 밴드의 정량화는 이미지 J™ 소프트웨어를 사용하여 얻었다.
도 6은 PCSK9의 생체 내 억제를 도시한다. 선택된 억제제를, "인간화된" LDLc 프로파일 (LDLc x 2-3)을 나타내며 WT 및 Ldlr-/- 바탕(background)을 갖는 마우스를 이종교배시켜서 생성시킨 이형접합 Ldlr+/- 마우스에서 시험한다. 이들 마우스는 정상 수준의 마우스 PCSK9 (Pcsk9+/+)를 발현하고, PCSK9 (Pcsk9-/-)를 발현하지 않고/않거나, 그 자신의 인간 프로모터 (TgDY)로부터 인간 PCSK9-D374Y를 엔코딩하는 이식유전자의 1 또는 5 복제물을 발현한다. 인간 WT 형태의 PCSK9를 또한 시험한다.
도 1은 (a) 초기 스크리닝의 일부로서, PCSK9 분비에 대한 19 화합물의 효과를 도시한다. WT PCSK9(+V5)를 안정적으로 발현하는 HepG2 세포를 단독으로 (-), 또는 DMSO 대조군(DMSO) 또는 100 μM의 지시된 화합물을 함유하는 배양 배지 중에서 24시간 동안 인큐베이션시켰다. 회수된 배지 및 세포 분획 내 PCSK9 수준을 ELISA로 정량화하고 ng PCSK9/ml 분획으로 표시하였다. PCSK9 분비에 대한 지시된 화합물의 억제 효과를, DMSO 대조군에 대한 배지/세포 비의 감소로부터 추정하였다. 별표는 억제 활성; 및 (b) 화합물 a 내지 j의 구조를 갖는 화합물을 나타낸다.
도 2는 PCSK9 분비에 대한 3 화합물의 용량 의존적 효과를 도시한다. WT PCSK9(+V5)를 안정적으로 발현하는 HepG2 세포를 증가하는 농도의 각각의 지시된 화합물의 부재(DMSO) 또는 존재하에서 24시간 동안 인큐베이션시켰다. 배양 배지 및 세포를 회수하고, 각각의 분획 내 PCSK9 수준을 ELISA로 정량화하였다. 세포 내 PCSK9의 수준을, 바이오-라드(Bio-Rad) DC 단백질 검정에 의해 측정된 총 단백질 양에 대하여 보정하였다. 각각의 농도에서, PCSK9 분비에 대한 지시된 화합물의 억제 효과를 DMSO 대조군에 대한 배지/세포 비의 감소로부터 추정하였다.
도 3은 DMSO 대조군과 비교한 5 화합물에 대한 세포 독성 검정을 도시한다. WT PCSK9(+V5)를 안정적으로 발현하는 HepG2 세포를 증가하는 농도의 각각의 지시된 화합물의 부재(DMSO) 또는 존재하에서 24시간 동안 인큐베이션시켰다. 독성 수준을 MTT 세포 독성 검정으로 측정하였다.
도 4는 HepG2 비처리 세포의 표면에서 LDLR 수준에 대한 PCSK9 억제 화합물의 효과를 도시한다. 세포를 33.3 μM의 화합물 19의 존재 또는 부재하에서(DMSO) 20시간 동안 인큐베이션시켰다. 비-투과된 세포를 면역형광법으로 분석하였다. LDLR을 인간 LDLR Ab (녹색 표지)를 사용하여 염색시켰다. 각각의 DMSO 대조군 및 화합물 19 조건에 대하여 3개의 상이한 영역이 도시되어 있다. 화합물 19에 의해 유도된 세포 표면에서의 LDLR 증가에 주목한다.
도 5는 HepG2 비처리 세포 (a) 및 HEK293 비처리 세포 (b)에서 Dil-LDL 흡수에 의해 측정된 세포 표면 LDLR의 활성에 대한, 또는 HepG2 비처리 세포 (c)에서 웨스턴 블롯(Western blot) 분석에 의해 측정된 총 LDLR 수준에 대한, PCSK9 억제 화합물의 효과를 도시한다. 음성 대조군은 화합물 i이다. 내인성 PCSK9를 발현하는 HepG2 비처리 세포 (a), 또는 PCSK9 발현이 결핍되어 있는 HEK293 비처리 세포 (b)를, Dil-LDL를 첨가하기 전 33.3 μM의 지시된 화합물의 존재 또는 부재하에서(DMSO) 6시간 동안 인큐베이션시킨 다음, 추가 18시간 인큐베이션시켰다. 각각의 조건에 대하여, Dil-LDL 흡수 (Dil 형광 프로브의 형광성)를 총 세포 수 (시콴트(CyQuant)™ GR 염료의 형광성)에 대하여 보정하고, 이것을 DMSO 대조군의 활성 %으로 표시하였다. 데이타는 3회 수행된 평균 2 내지 5 (a) 또는 2 내지 3 (b)의 독립적 실험을 나타낸다. (c) HepG2 비처리 세포 내 총 LDLR의 웨스턴 블롯 분석물을, 증가하는 농도의 화합물 19의 존재 또는 부재하에서(Cnt_0) 24시간 동안 인큐베이션시켰다. β-액틴에 대해 표준화된 총 LDLR 수준을 대조군(Cnt) %로 각각의 조건에 대하여 플롯하였다. 단백질 밴드의 정량화는 이미지 J™ 소프트웨어를 사용하여 얻었다.
도 6은 PCSK9의 생체 내 억제를 도시한다. 선택된 억제제를, "인간화된" LDLc 프로파일 (LDLc x 2-3)을 나타내며 WT 및 Ldlr-/- 바탕(background)을 갖는 마우스를 이종교배시켜서 생성시킨 이형접합 Ldlr+/- 마우스에서 시험한다. 이들 마우스는 정상 수준의 마우스 PCSK9 (Pcsk9+/+)를 발현하고, PCSK9 (Pcsk9-/-)를 발현하지 않고/않거나, 그 자신의 인간 프로모터 (TgDY)로부터 인간 PCSK9-D374Y를 엔코딩하는 이식유전자의 1 또는 5 복제물을 발현한다. 인간 WT 형태의 PCSK9를 또한 시험한다.
발명의 상세한 설명
신경 아폽토시스-조절된 전환효소 1(NARC-1)로 또한 공지된 PCSK9는 인간 (NP_777596.2)에서 692 아미노산의 단백분해효소 K-Hke 서브틸라제(subtilase)이며, 단일 펩타이드 (1-30)에 이어서 프로세그먼트 (잔기 31-152), 촉매 도메인 (잔기 153-454) 및 C-말단 Cys-His 풍부 도메인 (CHRD; 잔기 455-692)을 포함한다. PCSK9는 증식 및 분화가 가능한 세포, 예컨대 간세포, 신장 중간엽 세포, 장 회장, 결장 상피 및 배아 뇌 끝뇌 뉴런에서 발현된다 (문헌 (Seidah 등, 2003, Proc . Natl. Acad. Sci. USA 100:928-933) 참고).
ER에서 전위된 후에, PCSK9의 프로세그먼트를 VFAQ152↓SIP 위치에서 자가촉매적으로 절단시킨다. PC에서, 프로세그먼트 (pro)는 대개 세포내적으로 제거되어 충분한 활성의 단백분해효소를 생성시키는 분자내 보호자(chaperone)/억제제이다. 다른 PC와는 다르게, PCSK9는 안정적인 비-공유 복합체[pro≡PCSK9]로서 분비된다. 따라서, PCSK9에 의해 유도된 LDLR의 향상된 분해는 성숙 PCSK9 형태의 촉매적 활성을 필요로 하지 않는다. 인간 및 마우스 혈장에서, 전장 PCSK9 (153-692) 및 원추형 PCSK9-△N218 (219-692) 둘 모두가 검출될 수 있다. LDLR에 대한 활성을 갖지 않는 원추형 PCSK9-△N218 (219-692)은, 이것이 RFHR218↓에서 생체 외에서 PCSK9를 절단시키기 때문에, 푸린 및/또는 PC5에 의해 생성될 것이다.
본원에 개시된 연구에서, 본 발명자들은 인간 PCSK9에 대하여 배향된 억제 화합물을 생성시키고 확인하였으며, 이러한 화합물이 PCSK9 활성 (예를 들면, 인간 간암종 유래한 세포 주, 예컨대 HepG2에서 LDLR 분해를 유도한 PCSK9 분비)을 억제함을 밝혔다.
화합물
본 발명은 식 (I)의 화합물 또는 그것의 약제학적으로 허용가능한 염, 수화물, 용매화물, 또는 라세미 혼합물 또는 입체이성질체에 관한 것이다:
여기서:
R1은 -CH(OH)Ra 또는 -B(ORb)(ORc)이고;
R2은 -H, -CH2Rd, -CHRd(Re), -CH2(CH2)mC(O)Rj, -CH2(CH2)mC(O)N(Rd)Re 또는 -CH2(CH2)mS(O)nN(Rd)Re 이고;
R3, R4, R5, R6, R7 및 R8은 동일 또는 상이하고, 그리고 독립적으로 수소 또는 하기 기 중의 하나이고: C1-6 알킬, C1-6 할로알킬, C1-6 티오알킬, C1-6 아미노알킬, 알케닐, 알키닐, 사이클로알킬, 헤테로사이클릴, 아릴, 및 헤테로아릴 기이고, 여기서 상기 기는 1 이상의 C1-6 알킬, C3-8 사이클로알킬, C1-6 할로알킬, 아릴, 헤테로아릴, -CN, -C(O)N(Rf)Rg, -C(O)ORf, -C(Rf)(Rg)ORh , -ORf, -OC(O)ORf, -OC(O)NRf(Rg), -SRf, -S(O)nRf, -S(O)nN(Rf)Rg, -S(O)nN(Rf)C(O)Rg, -N(Rf)Rg, -N(Rf)C(O)Rg, -N(Rf)C(O)ORg, -N(Rf)C(O)N(Rg)(Rh), -N(Rf)S(O)nRg, 및 -N(Rf)S(O)N(Rg)Rh 치환체로 임의로 치환되고;
(R3 및 R4) 또는 (R5 및 R6) 또는 (R7 및 R8)이 수소가 아닐 때, 괄호로 묶은 쌍은 또한, -C(O)-, -CO2-, -C(O)N(H)-, -C(O)N(Rx)-, -O-, -NH-, -N(Rx)-, -S-, -S(O)n-, -S(O)nN(H)-, -S(O)nN(Rx)- 라디칼과 연결되어 사이클릭 구조를 형성할 수 있고;
R9는 RiC(O)-, RiS(O)n-, RiOC(O)-, RiNHC(O)-, RiNHS(O)n-, Rk(Rl)NC(O)-, Rl(Rl)NS(O)n-; RmORiC(O)-, RmC(O)RiC(O)- 또는 1 이상의 아미노산 잔기이고;
Ra는 C1-3 알킬, C1-2 플루오로알킬 또는 사이클로프로필이고;
Rb 및 Rc은 동일 또는 상이하고, 그리고 독립적으로 H 또는 C1-6 알킬이거나, 또는 함께 연결되어 사이클릭 5- 또는 6-원 고리 구조를 형성할 수 있거나, 또는 추가의 지방족 또는 방향족 고리계와 융합될 수 있고, 상기 사이클릭 5- 또는 6-원 고리 구조 또는 지방족 또는 방향족 고리계는 1 이상의 C1-6 알킬 및/또는 C1-6 할로알킬 치환체로 치환될 수 있고;
Rd 및 Re은 동일 또는 상이하고, 그리고 독립적으로 H 또는 하기 기: C1-3 알킬, C1-3 할로알킬 또는 C3-4 사이클로알킬 기 중 하나이거나, 또는 직접적으로 또는 함께 -C(O)-, -C(O)O-, -C(O)N(Rx)- -O-, -N(Rx)-, -S-, -S(O)n-, 또는 -S(O)nN(Rx)- 라디칼과 연결되어 사이클릭 3-8 원 고리 구조를 형성할 수 있고;
Rf, Rg, Rh, Rk 및 Rl은 동일 또는 상이하고, 그리고 독립적으로 H 또는 하기 기: C1-6 알킬, C1-6 할로알킬 또는 C3-4 사이클로알킬 기 중 하나이고, 또는 직접적으로 또는 함께 -C(O)-, -C(O)O-, -C(O)N(Rx)- -O-, -N(Rx)-, -S-, -S(O)n- 또는 -S(O)nN(Rx)- 라디칼과 연결되어 사이클릭 3-8 원 고리 구조를 형성할 수 있고;
Ri는 C1-10 알킬, C1-10 헤테로알킬, C3-8 사이클로알킬, C1-10 할로알킬, 헤테로사이클릴, 아릴, 헤테로아릴, C1-10 알킬-C3-8 사이클로알킬, C1-10 알킬-헤테로사이클릴, C1-10 알킬-아릴, C1-10 알킬-헤테로아릴, C1-10 헤테로알킬-C3-8 사이클로알킬, C1-10 헤테로알킬-헤테로사이클릴, C1-10 헤테로알킬-아릴 또는 C1-10 헤테로알킬- 헤테로아릴 기이고, 여기서 상기 기는 할로겐, C1-6 아미노알킬, C1-6 헤테로알킬, C1-6 알킬, C3-8 사이클로알킬, C1-6 할로알킬, 아릴, 헤테로아릴 및 헤테로사이클릴 기 중 하나 이상으로 임의로 치환되고;
Rm은 C1-10 알킬, C1-10 헤테로알킬, C3-8 사이클로알킬, C1-10 할로알킬, 헤테로사이클릴, 아릴 또는 헤테로아릴 기이고, 여기서 상기 기는 할로겐, C1-6 아미노알킬, C1-6 헤테로알킬, C1-6 알킬, C3-8 사이클로알킬, C1-6 할로알킬, 아릴, 헤테로아릴 및 헤테로사이클릴 기 중 하나 이상으로 임의로 치환되고;
Rj는 ORd 또는 N(Rd)(Re)이고;
Rx는 H, C1-6 알킬, C1-6 할로알킬, C3-4 사이클로알킬, -C(O)Ry, -C(O)ORy, -C(O)NH2, -C(O)NH(Ry) 또는 -C(O)NHS(O)nRy이고;
Ry는 C1-6 알킬, C1-6 할로알킬 또는 C3-4 사이클로알킬이고;
m는 0 또는 1의 정수 값이고; 그리고
n는 1 또는 2의 정수 값이고,
단,
1) R1이 -CH(OH)Ra일 때 R2은 -CHRd(Re), -CH2(CH2)mC(O)Rj, -CH2(CH2)mC(O)N(Rd)Re 또는 -CH2(CH2)mS(O)nN(Rd)Re이고; 그리고
2) R1이 -B(ORb)(ORc)일 때, R2은 -H, -CH3, -CHRd(Re), -CH2(CH2)mC(O)Rj, -CH2(CH2)mC(O)N(Rd)Re 또는 -CH2(CH2)mS(O)nN(Rd)Re이다.
상기에서 인용된 바와 같이, 본 발명은 R9 중 추가의 아미노산 잔기를 포함한다. R9 중1 이상의 아미노산 잔기는 세포막을 가로지르는 본 발명의 화합물의 활성 수송을 용이하게 할 수 있다 (참고 Koren, E.; Torchilin, V. P. Cell Penetrating Peptides: Breaking Through to the other Side. Trends Mol . Med . 2012, 18(7), 385-93 및 본원의 참조문헌.
본 발명의 특정 구현예는, 비제한적으로 하기를 포함한다:
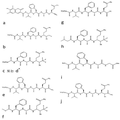
(2S)-3-메틸-N-[(1S)-2-페닐-1-{[(1S)-1-({[(1S,2S,6R,8S)-2,9,9-트리메틸-3,5-디옥사-4-보라트리사이클로[6.1.1.02,6]데칸-4-일]메틸}카바모일)에틸]카바모일}에틸]-2-(페닐포름아미도)부탄아미드; 5.
벤질 N-[(1S)-2-메틸-1-{[(1S)-2-페닐-1-{[(1S)-1-({[(1S,2S,6R,8S)-2,9,9-트리메틸-3,5-디옥사-4-보라트리사이클로[6.1.1.02,6]데칸-4-일]메틸}카바모일)에틸]카바모일}에틸]카바모일}프로필]카바메이트; 7.
tert - 부틸N-[(1S)-2-메틸-1-{[(1S)-2-페닐-1-{[(1S)-1-({[(1S,2S,6R,8S)-2,9,9-트리메틸-3,5-디옥사-4-보라트리사이클로[6.1.1.02,6]데칸-4-일]메틸}카바모일)에틸]카바모일}에틸]카바모일}프로필]카바메이트; 6.
(2S)-3-메틸-N-[(1S)-2-페닐-1-{[(1S)-1-({[(1S,2S,6R,8S)-2,9,9-트리메틸-3,5-디옥사-4-보라트리사이클로[6.1.1.02,6]데칸-4-일]메틸}카바모일)에틸]카바모일}에틸]-2-({4-[3-(트리플루오로메틸)-3H-디아지린-3-일]페닐}포름아미도)부탄아미드; 8a.
(2S)-3-메틸-N-[(1S)-2-페닐-1-{[(1S)-1-({[(1S,2S,6R,8S)-2,9,9-트리메틸-3,5-디옥사-4-보라트리사이클로[6.1.1.02,6]데칸-4-일]메틸}카바모일)에틸]카바모일}에틸]-2-({3-[3-(트리플루오로메틸)-3H-디아지린-3-일]페닐}포름아미도)부탄아미드; 8b.
(2S)-3-메틸-N-[(1S)-2-페닐-1-{[(1S)-1-({[(1S,2S,6R,8S)-2,9,9-트리메틸-3,5-디옥사-4-보라트리사이클로[6.1.1.02,6]데칸-4-일]메틸}카바모일)에틸]카바모일}에틸]-2-(2-{4-[3-(트리플루오로메틸)-3H-디아지린-3-일]페닐}아세트아미도)부탄아미드; 8c.
(2S)-3-메틸-N-[(1S)-2-페닐-1-{[(1S)-1-({[(1S,2S,6R,8S)-2,9,9-트리메틸-3,5-디옥사-4-보라트리사이클로[6.1.1.02,6]데칸-4-일]메틸}카바모일)에틸]카바모일}에틸]-2-(2-{3-[3-(트리플루오로메틸)-3H-디아지린-3-일]페닐}아세트아미도)부탄아미드; 8d.
(2S)-2-[(2-플루오로페닐)포름아미도]-3-메틸-N-[(1S)-2-페닐-1-{[(1S)-1-({[(1S,2S,6R,8S)-2,9,9-트리메틸-3,5-디옥사-4-보라트리사이클로[6.1.1.02,6]데칸-4-일]메틸}카바모일)에틸]카바모일}에틸]부탄아미드; 9.
{[(2S)-2-[(2S)-2-[(2S)-3-메틸-2-{2-[4-(트리플루오로메톡시)페닐]아세트아미도}부탄아미도]-3-페닐프로판아미도]프로판아미도]메틸}보론산; 3.
{[(2S)-2-[(2S)-2-[(2S)-2-데칸아미도아미도-3-메틸부탄아미도]-3-페닐프로판아미도]프로판아미도]메틸}보론산; 4.
{[(2S)-2-[(2S)-2-[(2S)-3-메틸-2-[(4-페닐페닐)포름아미도]부탄아미도]-3-페닐프로판아미도]프로판아미도]메틸}보론산; 2.
{[(2S)-2-[(2S)-2-[(2S)-2-[(메톡시카보닐)아미노]-3-메틸부탄아미도]-3-페닐프로판아미도]프로판아미도]메틸}보론산; 1.
[(1R/S)-3-카바모일-1-[(2S)-2-[(2S)-2-[(2S)-2-[(메톡시카보닐)아미노]-3-메틸부탄아미도]-3-페닐프로판아미도]프로판아미도]프로필]보론산; 18.
[(1R/S)-4-메톡시-1-[(2S)-2-[(2S)-2-[(2S)-2-[(메톡시카보닐)아미노]-3-메틸부탄아미도]-3-페닐프로판아미도]프로판아미도]-4-옥소부틸]보론산; 17.
메틸 N-[(1S)-1-{[(1R/S)-1-{[(1S)-1-{[(1S)-3-카바모일-1-[(1S,2S,6R,8S)-2,9,9-트리메틸-3,5-디옥사-4-보라트리사이클로[6.1.1.02,6]데칸-4-일]프로필]카바모일}에틸]카바모일}-2-페닐에틸]카바모일}-2-메틸프로필]카바메이트; 16.
메틸 (4R/S)-4-[(2S)-2-[(2S)-2-[(2S)-2-[(메톡시카보닐)아미노]-3-메틸부탄아미도]-3-페닐프로판아미도]-2-페닐아세트아미도]-4-[(1S,2S,6R,8S)-2,9,9-트리메틸-3,5-디옥사-4-보라트리사이클로[6.1.1.02,6]데칸-4-일]부타노에이트; 15.
메틸 N-[(1S)-2-메틸-1-{[(1S)-2-페닐-1-{[(S)-페닐({[(1S,2S,6R,8S)-2,9,9-트리메틸-3,5-디옥사-4-보라트리사이클로[6.1.1.02,6]데칸-4-일]메틸}카바모일)메틸]카바모일}에틸]카바모일}프로필]카바메이트; 14.
메틸 N-[(1S)-2-메틸-1-{[(1S)-1-{[(1S)-3-메틸-1-({[(1S,2S,6R,8S)-2,9,9-트리메틸-3,5-디옥사-4-보라트리사이클로[6.1.1.02,6]데칸-4-일]메틸}카바모일)부틸]카바모일}-2-페닐에틸]카바모일}프로필]카바메이트; 13.
메틸 N-[(1S)-2-메틸-1-{[(1S)-1-{[(1S)-3-(메틸설파닐)-1-({[(1S,2S,6R,8S)-2,9,9-트리메틸-3,5-디옥사-4-보라트리사이클로[6.1.1.02,6]데칸-4-일]메틸}카바모일)프로필]카바모일}-2-페닐에틸]카바모일}프로필]카바메이트; 12.
메틸 N-[(1S)-2-메틸-1-{[(1S)-2-페닐-1-{[(1S)-2-페닐-1-({[(1S,2S,6R,8S)-2,9,9-트리메틸-3,5-디옥사-4-보라트리사이클로[6.1.1.02,6]데칸-4-일]메틸}카바모일)에틸]카바모일}에틸]카바모일}프로필]카바메이트; 11.
메틸 N-[(1S)-2-메틸-1-{[(1S)-2-페닐-1-{[(1S)-1-({[(1S,2S,6R,8S)-2,9,9-트리메틸-3,5-디옥사-4-보라트리사이클로[6.1.1.02,6]데칸-4-일]메틸}카바모일)프로필]카바모일}에틸]카바모일}프로필]카바메이트; 10.
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)데칸아미도아미드; 19.
N-((2S)-1-(((2S)-1-(((2S)-1-(((3S)-6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)데칸아미도아미드; 20a.
N-((2S)-1-(((2S)-1-(((2S)-1-(((3R)-6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)데칸아미도아미드; 20b.
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1-플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)데칸아미도아미드; 21a 및 21b.
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)데칸아미도아미드; 22a 및 22b.
6,6,6-트리플루오로-5-하이드록시-4-((S)-2-((S)-2-((S)-3-메틸-2-(2-(4-(트리플루오로메톡시)페닐)아세트아미도)부탄아미도)-3-페닐프로판아미도)프로판아미도)헥산아미드; 23.
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드; 24.
벤질 ((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)카바메이트; 25.
메틸 ((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)카바메이트; 26.
tert -부틸 ((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)카바메이트; 27.
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-4-이소프로필벤즈아미드; 28.
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-4-(3-(트리플루오로메틸)-3H-디아지린-3-일)벤즈아미드; 29.
6,6,6-트리플루오로-5-하이드록시-4-((S)-2-((S)-2-((S)-3-메틸-2-(2-(4-(3-(트리플루오로메틸)-3H-디아지린-3-일)페닐)아세트아미도)부탄아미도)-3-페닐프로판아미도)프로판아미도)헥산아미드; 30.
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-3-(3-(트리플루오로메틸)-3H-디아지린-3-일)벤즈아미드; 31.
6,6,6-트리플루오로-5-하이드록시-4-((S)-2-((S)-2-((S)-3-메틸-2-(2-(3-(3-(트리플루오로메틸)-3H-디아지린-3-일)페닐)아세트아미도)부탄아미도)-3-페닐프로판아미도)프로판아미도)헥산아미드; 32.
4-((S)-2-((S)-2-((S)-2-([1,1'-바이페닐]-4-설폰아미도)-3-메틸부탄아미도)-3-페닐프로판아미도)프로판아미도)-6,6,6-트리플루오로-5-하이드록시헥산아미드; 33.
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-5-메틸-1-페닐-1H-피라졸-4-카복사마이드; 34.
6,6,6-트리플루오로-5-하이드록시-4-((S)-2-((S)-2-((S)-3-메틸-2-(2-페닐아세트아미도)부탄아미도)-3-페닐프로판아미도)프로판아미도)헥산아미드; 35.
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-6-페닐니코틴아미드; 36)
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-2-(피리딘-4-일)티아졸-4-카복사마이드; 37.
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-4-(피리딘-3-일)벤즈아미드; 38.
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-4-(하이드록시메틸)벤즈아미드; 39.
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-1-페닐-1H-피라졸-4-카복사마이드; 40.
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-4-모폴리노벤즈아미드; 41.
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-4-(모폴린-4-카보닐)벤즈아미드; 42.
6,6,6-트리플루오로-5-하이드록시-4-((S)-2-((S)-2-((S)-3-메틸-2-(3-페닐프로피오l아미도)부탄아미도)-3-페닐프로판아미도)프로판아미도)헥산아미드; 43.
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)니코틴아미드; 44.
6,6,6-트리플루오로-5-하이드록시-4-((S)-2-((S)-2-((S)-3-메틸-2-(2-페녹시아세트아미도)부탄아미도)-3-페닐프로판아미도)프로판아미도)헥산아미드; 45.
4-((6S,9S,12S)-9-벤질-6-이소프로필-12-메틸-4,7,10-트리옥소-1-페닐-2-옥사-5,8,11-트리아자tri데칸-13-아미도)-6,6,6-트리플루오로-5-하이드록시헥산아미드; 46.
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-1H-인돌-5-카복사마이드; 47.
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-5-페닐-1,3,4-옥사디아졸-2-카복사마이드; 48.
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-4-(1,3,4-옥사디아졸-2-일)벤즈아미드; 49.
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-2-페닐티아졸-4-카복사마이드; 50.
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-4'-(메틸설포닐)-[1,1'-바이페닐]-4-카복사마이드; 51.
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-4'-플루오로-[1,1'-바이페닐]-4-카복사마이드; 52.
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)피라진-2-카복사마이드; 53.
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)벤즈아미드; 54.
2S)-N 1 -(6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)-2-((S)-2-((S)-2-데칸아미도아미도-3-메틸부탄아미도)-3-페닐프로판아미도)펜탄디아미드; 55.
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-4-(메틸티오)-1-옥소부탄-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)데칸아미도아미드; 56.
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-4-메틸-1-옥소펜탄-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)데칸아미도아미드; 57)
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-3-메틸-1-옥소부탄-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)데칸아미도아미드; 58.
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)데칸아미도아미드; 59.
N-((2S)-1-(((2S)-1-(((2R)-1-(((3S)-6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)데칸아미도아미드; 60.
N-((2S)-1-(((2S)-1-(((2R)-1-(((3R)-6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)데칸아미도아미드; 61.
N-((2S)-1-(((2S)-1-(((2R)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드; 62.
N-((2S)-1-(((2S)-1-((2-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-2-옥소에틸)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드; 63.
N-((2S)-1-(((2S)-1-((1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)카바모일)사이클로프로필)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드; 64.
N-((2S)-1-(((2S)-1-(((2R)-1-(((3S)-6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드; 65.
N-((2S)-1-(((2S)-1-((1-(((3S)-6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)카바모일)사이클로부틸)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드; 66.
N-((2S)-1-(((2S)-1-((1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-2-메틸-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드; 67.
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드; 68.
N-((2S)-1-(((2R)-1-(((2R)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드; 69.
N-((2S)-1-(((2R)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드; 70.
N-((2S)-1-((2-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-2-옥소에틸)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드; 71.
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드; 72.
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-4-(메틸티오)-1-옥소부탄-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드; 73.
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드; 74.
N-((5S,8S,11S)-17-아미노-8-벤질-11-메틸-6,9,12,17-테트라옥소-14-(2,2,2-트리플루오로-1-하이드록시에틸)-2-티아-7,10,13-트리아자헵타데칸-5-일)-[1,1'-바이페닐]-4-카복사마이드; 75.
N-((2R)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드; 76.
N-((1S)-2-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-2-옥소-1-페닐에틸)-[1,1'-바이페닐]-4-카복사마이드; 77.
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)-[1,1'-바이페닐]-4-카복사마이드; 78.
N-(2-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-2-옥소에틸)-[1,1'-바이페닐]-4-카복사마이드; 79.
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-1-옥소프로판-2-일)-[1,1'-바이페닐]-4-카복사마이드; 80.
N-((5R,8S,11S)-17-아미노-8-벤질-11-메틸-6,9,12,17-테트라옥소-14-(2,2,2-트리플루오로-1-하이드록시에틸)-2-티아-7,10,13-트리아자헵타데칸-5-일)-[1,1'-바이페닐]-4-카복사마이드; 81.
N-((5R,8R,11S)-17-아미노-8-벤질-11-메틸-6,9,12,17-테트라옥소-14-(2,2,2-트리플루오로-1-하이드록시에틸)-2-티아-7,10,13-트리아자헵타데칸-5-일)-[1,1'-바이페닐]-4-카복사마이드; 82.
2-((S)-2-([1,1'-바이페닐]-4-카복사미도)-3-메틸부탄아미도)-N-((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)-2,3-디하이드로-1H-인덴-2-카복사마이드; 83.
N-((2S)-1-(((1S)-2-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-2-옥소-1-페닐에틸)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드; 84.
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-4-페닐부탄-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드; 85.
N-((2S)-1-(((2R)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-4-페닐부탄-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드; 86.
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-3-(4-하이드록시페닐)-1-옥소프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드; 87.
3-(4-(((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-3-(4-하이드록시페닐)-1-옥소프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)카바모일)페닐)피리딘-1-이움 포르메이트; 88.
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-3-(1H-인돌-3-일)-1-옥소프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드; 89.
N-(1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)카바모일)사이클로펜틸)-[1,1'-바이페닐]-4-카복사마이드; 90.
N-(1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)카바모일)사이클로프로필)-[1,1'-바이페닐]-4-카복사마이드; 91.
상기에 열거된 화합물은 번호로 (진하게) 확인된다. 이들 번호는, 각각의 상기 열거된 화합물이 추가로 기재된 구체적인 화합물을 또한 의미한다. 본 발명의 화합물에 대해 본원에서 사용된 구조 및 병칭 사이에 불일치가 있으면, 구조가 우선할 것이다.
정의:
화학 기들
본원에서 사용된 바와 같이, 용어 "알킬"은 명시된 범위에서 수많은 탄소 원자를 갖는, 1가 곧은 또는 분지된 사슬, 포화된 또는 불포화된 지방족 탄화수소 라디칼을 의미한다. 따라서, 예를 들면, "C1-6 알킬" (또는 "C1-C6 알킬")는 헥실 알킬 및 펜틸 알킬 이성질체 중 임의의 것 뿐만 아니라 n-, 이소-, sec- 및 t-부틸, n- 및 이소- 프로필, 에틸 및 메틸을 의미한다. 또 하나의 예로서, "C1-4 알킬"은 n-, 이소-, sec- 및 t-부틸, n- 및 이소프로필, 에틸 및 메틸을 의미한다. 또 하나의 예로서, "C1-3 알킬"은 n-프로필, 이소프로필, 에틸 및 메틸을 의미한다. 알킬은 알킨 (R-C=C-R) 및/또는; 알켄 (R-C=C-R)을 포함하는 불포화된 지방족 탄화수소를 포함한다.
용어 "할로겐" (또는 "할로")은 불소, 염소, 브롬 및 요오드 (대안적으로 플루오로, 클로로, 브로모, 및 아이오도로 불림)를 의미한다. 용어 "할로알킬"은, 수소 원자 중 하나 이상이 할로겐 (즉, F, Cl, Br 및/또는 I)으로 대체된 상기에서 정의된 바와 같은 알킬 기를 의미한다. 따라서, 예를 들면, "C1-6 할로알킬" (또는 "C1-C6 할로알킬")은 1 이상의 할로겐 치환체를 갖는, 상기에서 정의된 바와 같은 C1 내지 C6 선형 또는 분지형 알킬 기를 의미한다. 용어 "플루오로알킬"은 비슷한 의미를 가지며, 단, 할로겐 치환체는 플루오로로 제한된다. 적합한 플루오로알킬은 시리즈 (CH2)0- 4CF3 (즉, 트리플루오로메틸, 2,2,2-트리플루오로에틸, 3,3,3-트리플루오로-n-프로필, 등)을 포함한다.
용어 "헤테로알킬"은 당해기술에서 그것의 통상적인 의미가 주어지고 1 이상의 탄소 원자가 헤테로원자 (예를 들면, 산소, 질소, 황, 또는 그것의 유도체, 등)으로 치환된, 본원에 기재된 바와 같은 알킬 기를 의미한다. 헤테로알킬 기의 예는, 비제한적으로, 알콕시, 알킬-치환된 아미노, 티올 예컨대 메티오닌 측면 기를 포함한다. 최대 2 개의 헤테로원자는 연속될 수 있다. 접두어 예컨대 C2-6이 헤테로알킬 기를 의미하는 것으로 사용될 때, 탄소의 수 (2-6, 본 실시예에서)는 헤테로원자를 또한 포함하는 것을 의미한다.
용어 "아미노알킬"은 수소 또는 탄소 원자 중 하나 이상이 질소 또는 아미노 유도체로 치환된, 상기에서 정의된 바와 같은 알킬 기를 의미한다. 따라서, 예를 들면, "C1-6 아미노알킬" (또는 "C1-C6 아미노알킬")는 1 이상의 아미노 유도체 (예를 들면, NH, 아미드, 디아지린, 등)를 갖는 상기에서 정의된 바와 같은 C1 내지 C6 선형 또는 분지형 알킬 기를 의미한다.
용어 "티오알킬"은, 수소 또는 탄소 원자 중 하나 이상이 황 원자 또는 티올 유도체로 치환된, 상기에서 정의된 바와 같은 알킬 기를 의미한다. 따라서, 예를 들면, "C1-6 아미노알킬" (또는 "C1-C6 아미노알킬")는 1 이상의 황 원자 또는 티올 유도체 (예를 들면, S, SH, 등)를 갖는, 상기에서 정의된 바와 같은 C1 내지 C6 선형 또는 분지형 알킬 기를 의미한다.
아미노알킬 및 티오알킬은 용어 "헤테로알킬"의 특정 구현예이거나, 그것에 의해 포함되거나, 헤테로원자에 따른 치환된 알킬은 탄소 원자 또는 수소 원자를 대체한다.
용어 "사이클로알킬"은 추가의 (1-3) 지방족 (사이클로알킬) 또는 방향족 고리계와 임의로 융합된 포화된 3-8 원 고리로 구성된 포화된 지환족 탄화수소를 의미하고, 각각의 추가 고리는 3-8 원 고리이다. 비제한적으로 사이클로프로판, 사이클로부탄, 사이클로펜탄, 및 사이클로헥산을 포함한다.
용어 "헤테로사이클릴"은 하기를 의미한다: (i) N, O 및 S로부터 독립적으로 선택된 1 내지 3 개의 헤테로원자를 함유하는 4- 내지 7-원 포화된 헤테로사이클릭 고리, 또는 (ii)는 헤테로바이사이클릭 고리 (예를 들면, 벤조사이클로펜틸). 본 발명의 범위 내의 4- 내지 7-원, 포화된 헤테로사이클릭 고리의 예는, 예를 들면, 하기를 포함한다: 아제티딜, 피페리디닐, 모폴리닐, 티오모폴리닐, 티아졸리디닐, 이소티아졸리디닐, 옥사졸리디닐, 이속사졸리디닐, 피롤리디닐, 이미다졸리디닐, 피페라지닐, 테트라하이드로푸라닐, 테트라하이드로티에닐, 피라졸리디닐, 헥사하이드로피리미디닐, 티아지나닐, 티아제파닐, 아제파닐, 디아제파닐, 테트라하이드로피라닐, 테트라하이드로티오피라닐, 및 디옥사닐. 본 발명의 범위 내의 4- 내지 7-원, 불포화된 헤테로사이클릭 고리의 예는 이전 문장에서 열거된 포화된 헤테로사이클릭 고리에 상응하는 모노-불포화된 헤테로사이클릭 고리를 포함하고, 여기서 단일 결합은 이중 결합으로 대체된다 (예를 들면, 탄소-탄소 단일 결합은 탄소-탄소 이중 결합으로 대체된다).
용어 "C(O)"은 카보닐을 의미한다. 용어들 "S(O)2" 및 "SO2" 각각은 설포닐을 의미한다. 용어 "S(O)"은 설피닐을 의미한다.
용어 "아릴"은 추가의 (1-3) 지방족 (사이클로알킬) 또는 방향족 고리계와 임의로 융합된 3-8 원 고리로 구성된 방향족 (불포화된) 화합물을 의미하고, 각 추가의 고리는 3-8 원 고리로 구성된다. 특정 구현예에서, 페닐, 벤조사이클로펜틸, 또는 나프틸을 의미한다. 특정 관심의 아릴은 페닐이다. 용어 "헤테로아릴"은 하기를 의미한다: (i) N, O 및 S로부터 독립적으로 선택된 1 내지 3 개의 헤테로원자를 함유하는 3-, 4-, 5- 또는 6-원 헤테로방향족 고리, 또는 (ii)는 퀴놀리닐, 이소퀴놀리닐, 및 퀴녹살리닐으로부터 선택된 헤테로바이사이클릭 고리. 적합한 3-, 4-, 5- 및 6-원 헤테로방향족 고리는, 예를 들면, 하기를 포함한다: 디아지린, 피리딜 (또한 일명 피리디닐), 피롤릴, 디아진 (예를 들면i , 피라지닐, 피리미디닐, 피리다지닐), 트리아지닐, 티에닐, 푸라닐, 이미다졸릴, 피라졸릴, 트리아졸릴, 옥사졸릴, 이소-옥사졸릴, 옥사디아졸릴, 옥사트리아졸릴, 티아졸릴, 이소티아졸릴, 및 티아디아졸릴을 포함한다. 특정 관심의 헤테로아릴은 피롤릴, 이미다졸릴, 피리딜, 피라지닐, 퀴놀리닐 (또는 퀴놀릴), 이소퀴놀리닐 (또는 이소퀴놀릴), 및 퀴녹살리닐. 적합한 헤테로바이사이클릭 고리는 인돌릴을 포함한다.
본원에서 사용된 바와 같이, 및 달리 구체화되지 않으면, 용어들 "알킬", "할로알킬", "아미노알킬", "사이클로알킬", "헤테로사이클릴", "아릴", "헤테로알킬" 및 "헤테로아릴" 및 그것의 특정 구현예를 지적하는 용어들 (예를 들면, 부틸, 플루오로프로필, 아미노부틸, 사이클로프로판, 모폴린, 페닐, 피라졸, 등)은 이들 기의 치환된 (즉 할로알킬 및 아미노알킬의 경우에, 그것의 할로겐 및 질소 치환체, 각각 외에) 및 비치환된 구현예를 포함한다. 따라서 예를 들면, 용어 "페닐"은 비치환된 페닐 뿐만 아니라 플루오로페닐, 하이드록시페닐, 메틸설포닐 페닐 (또는 바이페닐), 트리플루오로메틸-디아지린-페닐, 이소프로필-페닐, 트리플루오로하이드록시-페닐을 포함한다. 유사하게, 용어 피라졸은, 비치환된 피라졸 뿐만 아니라 메틸피라졸을 포함한다. 1 이상의 치환체는 아민, 할로겐, 하이드록실, C1-6 아미노알킬, C1-6 헤테로알킬, C1-6 알킬, C3-8 사이클로알킬, C1-6 할로알킬, 아릴, 헤테로아릴 및 헤테로사이클릴 기 (등)일 수 있다.
상기에서 열거된 특정 고리는 본 발명에서 사용될 수 있는 고리에 대한 제한은 없는 것으로 이해된다. 이들 고리는 단지 대표적이다.
특정 맥락에서 반대로 명확히 언급되지 않으면, 본원에서 기재된 다양한 사이클릭 고리 및 고리계 중 임의의 것은 임의의 고리 원자 (즉, 임의의 탄소 원자 또는 임의의 헤테로원자)에서 화합물의 나머지에 부착될 수 있고, 단, 안정한 화합물이 생긴다.
반대로 명확히 언급되지 않으면, 본원에서 인용된 모든 범위는 포괄적이다. 예를 들면, "1 내지 4 개의 헤테로원자"를 함유하는 것으로 기재된 헤테로방향족 고리는 1, 2, 3 또는 4 개의 헤테로원자를 함유하는 고리를 의미한다. 본원에서 인용된 임의의 범위는 그 범위 내의 모든 하위 하위범위를 포함하는 것으로 또한 이해된다. 따라서, 예를 들면, "1 내지 4 개의 헤테로원자"를 함유하는 것으로 기재된 헤테로사이클릭 고리는 그것의 측면으로서, 2 내지 4 개의 헤테로원자, 3 또는 4 개의 헤테로원자, 1 내지 3 개의 헤테로원자, 2 또는 3 개의 헤테로원자, 1 또는 2 개의 헤테로원자, 1 개의 헤테로원자, 2 개의 헤테로원자, 3 개의 헤테로원자, 및 4 개의 헤테로원자를 함유하는 헤테로사이클릭 고리를 포함하는 것으로 의도된다.
또 하나의 예로서, "1 내지 4 개의 치환체"로 임의의 치환된 것과 같이 기재된 아릴 또는 헤테로아릴은 그것의 측면으로서, 1 내지 4 개의 치환체, 2 내지 4 개의 치환체, 3 내지 4 개의 치환체, 4 개의 치환체, 1 내지 3 개의 치환체, 2 내지 3 개의 치환체, 3 개의 치환체, 1 내지 2 개의 치환체, 2 개의 치환체, 및 1 개의 치환체로 치환된 아릴 또는 헤테로아릴을 포함하는 것으로 의도된다.
임의의 변수 (예를 들면, XA 또는 XB)가 임의의 구성요소에서 또는 식 I에서 또는 본 발명의 화합물을 묘사하고 기재하는 임의의 다른 식에서 1 회 초과로 발생할 때, 각 경우에 대한 그것의 정의는 모든 다른 다른 발생에서 그것의 정의에 대해 독립적이다. 또한, 치환체 및/또는 변수의 조합은, 그와 같은 조합이 안정한 화합물을 생성한다면 단지 허용된다.
반대로 명확히 언급되지 않으면, 명명된 치환체에 의한 치환은 고리(예를 들면, 사이클로알킬, 헤테로사이클릴, 아릴, 또는 헤테로아릴) 중 임의의 원자에 대해 허용되고 그와 같은 고리 치환은 화학적으로 허용되고 안정한 화합물이 생긴다는 것을 제공한다.
염, 에스테르, 수화물 및 용매화물
본 발명의 화합물은 그것의 약리적으로 허용가능한 염 및 에스테르 뿐만 아니라 그것의 수화물 또는 용매화물 및 모든 입체이성질체 형태의 참조된 화합물을 포함한다. 본 발명의 화합물 및 그것의 약리적으로 허용가능한 에스테르 필요하면 약리적으로 허용가능한 염을 형성할 수 있다.
염
용어들 "약리적으로 허용가능한 염"은, 본 발명의 화합물이 전환될 수 있고 모 화합물의 원하는 생물학적 활성을 보유하고 임의의 원하지 않는 독물학적 효과를 부여하지 않는 염을 의미한다 (참고 예를 들면, Berge, S.M. 등, 1977 J. Pharm. Sci . 66:1-19). 그와 같은 염의 예는 i 산 부가 염 및 염기 부가 염을 포함한다. 산 부가 염은 비독성 무기산, 예컨대 염산, 질산, 인산, 황산, 브롬화수소산, 요오드화수소산, 인 등으로부터 유도된 것들, 뿐만 아니라 비독성 유기산 예컨대 지방족 모노- 및 디-카복실산, 페닐-치환된 알칸산, 하이드록시 알칸산, 방향족 산, 지방족 및 방향족 설폰산 등으로부터 유도된 것들을 포함한다. 염기 부가 염은 알칼리토 금속, 예컨대 나트륨, 칼륨, 마그네슘, 칼슘 등으로부터 유도된 것들, 뿐만 아니라 비독성 유기 아민, 예컨대 N,N'-디벤질에틸렌디아민, N-메틸글루카민, 클로로프로카인, 콜린, 디에탄올아민, 에틸렌디아민, 프로카인 등으로부터 유도된 것들을 포함한다. 그와 같은 염의 바람직한 예는 하기를 포함한다: 알칼리 금속 염 예컨대 나트륨 염, 칼륨 염, 리튬 염, 마그네슘 또는 칼슘 염; 알칼리토 금속 염 예컨대 칼슘 염 및 마그네슘 염; 금속 염 예컨대 알루미늄 염, 철 염, 아연 염, 구리 염, 니켈 염 및 코발트 염; 아민 염 예컨대 암모늄 염을 포함하는 무기 염; 유기 염 또는 암모늄 염 예컨대 t-옥틸아민 염, 디벤질아민 염, 모폴린 염, 글루코사민 염, 페닐글리신 알킬 에스테르 염, 에틸렌디아민 염, N-메틸글루카민 염, 구아니딘 염, 디에틸아민 염, 트리에틸아민 염, 디사이클로헥실아민 염, N,N'-디벤질에틸렌디아민 염, 클로로프로카인 염, 프로카인 염, 디에탄올아민 염, N-벤질-펜에틸아민 염, 피페라진 염, 테트라메틸암모늄 염 및 트리스(하이드록시메틸)아미노메탄 염; 무기산 염 예컨대 할로겐화수소산 염 예컨대 하이드로플루오라이드, 하이드로클로라이드, 하이드로브로마이드 또는 하이드로아이오다이드, 니트레이트, 퍼클로레이트, 설페이트 또는 포스페이트; 저급 알칸설포네이트 예컨대 메탄설포네이트, 트리플루오로메탄설포네이트 또는 에탄설포네이트; 아릴설포네이트 예컨대 벤젠설포네이트 또는 p-톨루엔설포네이트 등, 이들은 살아있는 유기체에 대해 비독성임; 유기산 염 예컨대 아세테이트, 말레이트, 아디페이트, 푸마레이트, 석시네이트, 시트레이트, 알기네이트, 아스코르베이트, 벤조에이트, 벤젠설포네이트, 바이설페이트, 부티레이트, 캄포레이트, 캄포르설포네이트, 신나메이트, 사이클로펜탄프로피오네이트, 디글루코네이트, 도데실설페이트, 에탄설포네이트, 글루코헵타노에이트, 글리세로포스페이트, 헤미설페이트, 헵타노에이트, 헥사노에이트, 하이드로클로라이드, 하이드로브로마이드, 하이드로아이오다이드, 2-하이드록시에탄설포네이트, 이타코네이트, 락테이트, 말레에이트, 만델레이트, 설포네이트, 메탄설포네이트, 트리플루오로메탄설포네이트, 에탄설포네이트 2-나프탈렌설포네이트, 니코티네이트, 니트레이트, 옥살레이트, 파모네이트, 펙티네이트, 퍼설페이트, 3-페닐프로피오네이트, 피크레이트, 피발레이트, 프로피오네이트, 타르트레이트, 티오시아네이트, 토실레이트, 트리플루오로아세트산, 운데카노에이트, 타르트레이트, 옥살레이트 또는 말레에이트; 및 아미노산 염 예컨대 글리신 염, 라이신 염, 아르기닌 염, 오미틴 염, 히스티딘, 글루타메이트 또는 아스파르테이트 염. 추가로, 염기성 질소 함유 기는 하기와 같은 제제로 4원화될 수 있다: 저급 알킬 할라이드 예컨대 메틸, 에틸, 프로필, 및 부틸 클로라이드, 브로마이드 및 아이오다이드; 디메틸, 디에틸, 및 디부틸 설페이트를 포함하는 디알킬 설페이트; 및 디아밀 설페이트, 장쇄 할라이드 예컨대 데실, 라우릴, 미리스틸 및 스트레아릴 클로라이드, 브로마이드 및 아이오다이드, 벤질 및 펜에틸 브로마이드를 포함하는 아랄킬 할라이드, 및 다른 것들. 추가 예에 대해, 참고 S. M. Berge, 등 Pharmaceutical Salts," J. Pharm. Sci. 1977, 66, 1-19. 그와 같은 염은 표준 기술을 사용하여 당해분야의 숙련가에 의해 아주 쉽게 형성될 수 있다.
본 발명의 화합물에 존재하는 산성 기로 형성된 염의 바람직한 예는 하기를 포함한다: 금속 염 예컨대 알칼리 금속 염 (예를 들면, 나트륨 염, 칼륨 염 및 리튬 염), 알칼리 토금속 염 (예를 들면, 칼슘 염 및 마그네슘 염), 알루미늄 염 및 철 염; 아민 염 예컨대 무기 아민 염 (예를 들면, 암모늄 염) 및 유기 아민 염 (예를 들면, t-옥틸아민 염, 디벤질아민 염, 모폴린 염, 글루코사민 염, 페닐글리신알킬 에스테르 염, 에틸렌디아민 염, N-메틸글루카민 염, 구아니딘 염, 디에틸아민 염, 트리에틸아민 염, 디사이클로헥실아민 염, N,N'-디벤질에틸렌디아민 염, 클로로프로카인 염, 프로카인 염, 디에탄올아민 염. N-벤질펜에틸아민 염, 피페라진 염, 테트라메틸암모늄 염 및 트리스(하이드록시메틸)아미노메탄 염; 및 아미노산 염 예컨대 글리신 염, 라이신 염, 아르기닌 염, 오르니틴 염, 글루타메이트 및 아스파르테이트.
모든 염은 본 발명의 범위 내에 있는 약제학적 허용가능한 염인 것으로 의도되고 모든 염은 본 발명의 목적을 위해 유리 형태의 상응하는 화합물과 동등한 것으로 간주된다.
에스테르
생리적으로/약제학적으로 허용가능한 에스테르는 활성 약제로서 또한 유용하다. 용어 "약제학적으로 허용가능한 에스테르"는 본 발명의 화합물의 에스테르를 포함하고, 여기서 (예를 들면, 카복실산 중) 하이드록시 기는 상응하는 에스테르로 전환되었고 온혈 동물의 혈류에 흡수될 때 전구약물로서 작용할 수 있고, 약물 형태를 방출하는 것과 같은 방식으로 절단될 수 있고 약물이 개선된 치료적 효능을 부여하도록 한다. 그와 같은 에스테르는 하기로 형성될 수 있다: 무기 또는 유기 산 예컨대 질산, 황산, 인산, 시트르산, 포름산, 말레산, 아세트산, 석신산, 타르타르산, 메탄설폰산, p-톨루엔설폰산 등, 이들은 살아있는 유기체에 대해 비독성임. 추가 예는 지방족 또는 방향족 산 예컨대 아세트산을 갖거나 지방족 알코올 (예를 들면, 메틸, 에틸, 프로필, 이소프로필, 부틸, 이소부틸 또는 펜틸 에스테르, 등을 포함하는 알킬 에스테르) 또는 방향족 알코올 (예를 들면, 벤질 에스테르)를 갖는 에스테르이다.
에스테르는 당해분야의 숙련가에게 공지된 다양한 방법으로, 예를 들면, 먼저 산을 산 클로라이드로 전환시키고 그 다음 산 클로라이드를 적합한 알코올과 반응시켜서 그것의 상응하는 산 또는 염으로부터 제조될 수 있다. 에스테르를 제조하는 다른 적합한 방법은 아래에 기재되어 있다: Kemp 및 Vellaccio, 1980.
본 발명의 에스테르가 염기성 기, 예컨대 아미노 기를 갖는 경우, 화합물은 산과 반응하여 염으로 전환될 수 있고, 에스테르가 산성 기, 예컨대 설폰아미드 기를 갖는 경우에는, 화합물은 염기와 반응하여 염으로 전환될 수 있다. 본 발명의 화합물은 그와 같은 염을 포함한다.
본 발명의 화합물의 염 및 에스테르는 쉽게 이용가능하고/거나 본원에서 기재되어 있는 적절한 개시 물질 또는 중간체 화합물을 이용하여 공지된 방법으로 제조될 수 있다.
일반적으로, 본 발명의 화합물의 원하는 염은 당해기술에서 잘 알려진 수단에 의해 화합물의 최종 단리 및 정제 동안에 원위치에서 제조될 수 있다. 예를 들면, 원하는 염은 그것의 유리 염기 또는 유리 산 형태의 정제된 화합물을 적합한 유기 또는 무기산, 또는 적합한 유기 또는 무기 염기 각각과 반응시키고, 이렇게 형성된 염을 단리하여 제조될 수 있다. 염기성 화합물의 경우에, 예를 들면, 유리 염기는 적합한 용매 예컨대 THF, 및 하이드로클로라이드 염으로 단리된 염에서 무수 HCl로 처리된다. 산성 화합물의 경우에, 염은, 예를 들면, 유리 산의, 적합한 용매 예컨대 에테르에서 무수 암모니아에 의한 처리 그리고 암모늄 염의 차후의 단리에 의해 수득될 수 있다. 이들 방법은 종래의 것이고 당해분야의 숙련가에 쉽게 명확하다.
본 발명의 화합물은 적절한 무수물, 카복실산 또는 산 클로라이드를 본 발명의 화합물의 알코올 기와 반응시키는 것을 포함하는 다양한 종래의 절차에 의해 에스테르화될 수 있다. 적절한 무수물은 아실화를 용이하게 하기 위해 염기의 존재 하에서 알코올과 반응되고, 그 예는 1,8-비스[디메틸아미노]나프탈렌 또는 N,N-디메틸아미노피리딘이다. 또는, 적절한 카복실산은 탈수제 예컨대 디사이클로헥실카보디이미드, 1-[3-디메틸아미노프로필]-3-에틸카보디이미드 또는 물의 제거에 의해 반응을 유도하도록 사용된 다른 수용성 탈수제, 그리고, 임의로, 아실화 촉매의 존재에서 알코올과 반응될 수 있다. 에스테르화는 트리플루오로아세트산 무수물, 그리고 임의로, 피리딘의 존재에서, 또는 N,N-카보닐디이미다졸 및 피리딘의 존재에서 적절한 카복실산을 사용하여 또한 영향을 받을 수 있다. 산 클로라이드와 알코올과의 반응은 아실화 촉매 예컨대 4-DMAP 또는 피리딘으로 수행될 수 있다.
당해분야의 숙련가는 이들 뿐만 아니라 알코올의 에스테르화의 다른 공지된 방법을 성공적으로 수행하는 방법을 쉽게 알고 있다.
전구약물 및 용매화물
본 발명의 화합물의 전구약물 및 용매화물은 본원에서 또한 고려된다. 전구약물의 논의는 아래에서 제공된다: T. Higuchi and V. Stella, Pro-drugs as Novel Delivery Systems (1987) 14 of the A.C.S. Symposium Series, 및 in Bioreversible Carriers in Drug Design, (1987) Edward B. Roche, ed., American Pharmaceutical Association and Pergamon Press. 용어 "전구약물"은 본 발명의 화합물 또는 그 화합물의 약제학적으로 허용가능한 염, 수화물 또는 용매화물을 생성하기 위해 생체내에서 전환되는 화합물 (예를 들면, 약물 전구체)를 의미한다. 전환은 다양한 기전에 의해 (예를 들면, 대사성 또는 화학적 과정에 의해), 예를 들면, 혈액에서 가수분해를 통해 일어날 수 있다. 전구약물의 사용의 논의는 아래에 의해 제공된다: T. Higuchi 및 W. Stella, "Pro-drugs as Novel Delivery Systems," Vol. 14 of the A.C.S. Symposium Series, 및 in Bioreversible Carriers in Drug Design, ed. Edward B. Roche, American Pharmaceutical Association and Pergamon Press, 1987.
예를 들면, 본 발명의 화합물 또는 그 화합물의 약제학적으로 허용가능한 염, 수화물 또는 용매화물이 카복실산 작용성 기를 함유하면, 전구약물은 하기에 의한 산 기의 수소 원자의 재배치에 의해 형성된 에스테르를 포함할 수 있다: 기 예를 들면, (C1-C8)알킬, (C2-C12)알카노일옥시메틸, 4 내지 9 개의 탄소원자를 갖는 1-(알카노일옥시)에틸, 5 내지 10 탄소 원자를 갖는 1-메틸-1-(알카노일옥시)-에틸, 3 내지 6 개의 탄소 원자를 갖는 알콕시카보닐옥시메틸, 4 내지 7 개의 탄소원자를 갖는 1-(알콕시카보닐옥시)에틸, 5 내지 8 개의 탄소 원자를 갖는1-메틸-1-(알콕시카보닐옥시)에틸, 3 내지 9 개의 탄소원자를 갖는 N-(알콕시카보닐)아미노메틸, 4 내지 10 개의 탄소 원자를 갖는 1-(N-(알콕시카보닐)아미노)에틸, 3-프탈리딜, 4-크로토노락토닐, 감마-부티로락톤-4-일, 디-N,N-(C1-C2)알킬아미노(C2-C3)알킬 (예컨대 β-디메틸아미노에틸), 카바모일-(C1-C2)알킬, N,N-디(C1-C2)알킬카바모일-(C1-C2)알킬 및 피페리디노-, 피롤리디노- 또는 모폴리노(C2-C3)알킬, 등.
유사하게, 본 발명의 화합물이 알코올 작용성 기를 함유하는 경우, 전구약물은 기 예를 들면, (C1-C6)알카노일옥시메틸, 1-((C1-C6)알카노일옥시)에틸, 1-메틸-1-((C1-C6)알카노일옥시)에틸, (C1-C6)알콕시카보닐옥시메틸, N-(C1-C6)알콕시카보닐아미노메틸, 석시노일, (C1-C6)알카노일, α-아미노(C1-C4)알카닐, 아릴아실 및 α-아미노아실, 또는 α-아미노아실-α-아미노아실에 의한 알코올 기의 수소 원자의 재배치에 의해 형성될 수 있고, 여기서 각각의 α-아미노아실 기는 천연 발생 L-아미노산, P(O)(OH)2, ―P(O)(O(C1-C6)알킬)2 또는 글리코실 (헤미아세탈 형태의 탄수화물의 하이드록실 기의 제거로부터 생성된 라디칼), 등으로부터 독립적으로 선택된다.
본 발명의 화합물이 아민 작용성 기를 편입하는 경우, 전구약물은 기 예를 들면, R-카보닐, RO-카보닐, NRR'-카보닐을 갖는 아민 기에서 수소 원자의 재배치에 의해 형성될 수 있고, 여기서 R 및 R' 각각은 독립적으로 (C1-C10)알킬, (C3-C7)사이클로알킬, 벤질이거나, 또는 R-카보닐은 천연 α-아미노아실 또는 천연 α-아미노아실, ―C(OH)C(O)OY1이고, 여기서 Y1는 H, (C1-C6)알킬 또는 벤질, ―C(OY2)Y3이고, 여기서 Y2는 (C1-C4) 알킬이고 Y3는 (C1-C6)알킬, 카복시 (C1-C6)알킬, 아미노(C1-C4)알킬 또는 모노-N― 또는 디-N,N-( C1-C6)알킬아미노알킬, ―C(Y4)Y5이고, 여기서 Y4는 H 또는 메틸이고 Y5는 모노-N― 또는 디-N,N-(C1-C6)알킬아미노 모폴리노, 피페리딘-1-일 또는 피롤리딘-1-일, 등이다.
본 발명의 하나 이상의 화합물은 미용매화된 형태뿐 아니라, 약제학적으로 허용가능한 용매, 예컨대 물, 에탄올 등과 함께 용매화된 형태로 존재할 수 있으며, 본 발명은 용매화된 형태 및 미용매화된 형태 둘 모두를 포함하는 것으로 의도된다. "용매화합물"은, 본 발명의 화합물과 하나 이상의 용매 분자의 물리적 회합을 의미한다. 이 물리적 회합은 가변되는 정도의 이온 및 공유 결합, 예컨대 수소 결합을 포함한다. 어떤 예에서, 용매화합물은, 예를 들면 하나 이상의 용매 분자가 결정형 고체의 결정 격자 중에 포함되는 경우에 분리될 수 있을 것이다. "용매화합물"은 용액-상 및 분리가능한 용매화합물 둘 모두를 포함한다. 적합한 용매화합물의 비제한적인 예는 에탄올레이트, 메탄올레이트 등을 포함한다. "수소화물"은 용매 분자가 물인 경우의 용매화합물이다.
용매화합물의 제조는 일반적으로 공지되어 있다. 따라서, 예를 들면, 문헌 (M. Caira 등, J. Pharmaceutical Sci., 93(3), 601-611 (2004))에는 에틸 아세테이트 중에서뿐 아니라 물로부터 항진균제 플루코나졸의 용매화합물의 제조가 기재되어 있다. 용매화합물, 반용매화합물, 수소화물 등의 유사한 제조가 문헌 (E. C. van Tonder 등, AAPS Pharm Sci Tech., 5(1), article 12 (2004); and A. L. Bingham 등, Chem. Commun., 603-604 (2001))에 기재되어 있다. 전형적이며 비제한적인 방법은, 실온보다 높은 온도에서 본 발명의 화합물을 원하는 양의 원하는 용매 (유기 또는 물 또는 이들의 혼합물) 중에 용해시키고, 결정을 형성시키기에 충분한 속도로 용액을 냉각시킨 다음, 상기 결정을 표준 방법으로 분리하는 것을 포함한다. 분석 기술, 예컨대 I. R. 분광법은 결정 중의 용매 (또는 물)가 용매화합물 (또는 수소화물)로 존재함을 보여준다.
수소화물
본원에 사용된 용어 "약제학적으로 허용가능한 수소화물"은, 하나 이상의 물 분자와 함께 결정화되어 수소화된 형태를 형성시키는 본 발명의 화합물을 지칭한다.
입체이성질체, 부분입체이성질체, 거울상이성질체, 라세미체, 호변이성질체
본 발명의 화합물은 비대칭 탄소 원자/키랄 중심을 가지며, 치환기 및 치환기 패턴 선택의 결과로, 추가 키랄 중심을 함유할 수 있으며 따라서 입체이성질체의 혼합물 (라세미체)로, 또는 개별 부분입체이성질체로, 또는 거울상이성질체로 존재할 수 있다. 본 발명은 이러한 형태 모두를 포함한다.
부분입체이성질체(diastereomer 또는 diastereoisomer)는 거울상이성질체가 아닌 입체이성질체이다. 화합물의 둘 이상의 입체이성질체가 하나 이상 (전부는 아닌)의 동등한 (관련된) 입체중심에서 상이한 배위를 가지며 서로의 거울 상이 아닌 경우에 부분입체이성질체가 나타난다. 두 개의 부분입체이성질체는 에피머인 단 하나의 입체중심에서 서로 상이하다. 각각의 입체중심은 두 개의 상이한 배위 및 따라서 두 개의 상이한 입체이성질체를 생성시킨다.
부분입체이성질체는, 거울상이성질체가 모든 입체중심이 상이하고 따라서 서로의 거울상인 입체이성질체의 쌍이라는 점에서 거울상이성질체와 상이하다. 하나 초과의 입체중심을 갖는 화합물의 거울상이성질체는 또한 그 거울 상이 아닌 그 화합물의 나머지 입체이성질체의 부분입체이성질체이다. 부분입체이성질체는 거울상이성질체와는 달리, 상이한 물리적 특성 및 상이한 반응성을 갖는다. 본 발명의 부분입체이성질체는 토마티딘 및 예를 들면, 3 알파-하이드록시-토마티딘을 포함한다.
치환기 및 치환기 패턴에 의해 본 발명의 화합물 내 호변이성질체 (예를 들면, 케토-엔올 호변이성질체)가 존재하게 된다는 점에서, 이러한 화합물의 모든 호변이성질체 형태는 개별적으로 또는 혼합물로 존재하든지 간에 본 발명의 범위 내에 있다. 헤테로방향족 고리의 탄소 원자 상에 하이드록시 치환기를 갖는 본 발명의 화합물은 단지 하이드록시가 존재하는 화합물, 단지 호변이성질체성 케토 형태 (즉, 옥소 치환기)가 존재하는 화합물, 및 케토 및 엔올 형태 둘 모두가 존재하는 화합물을 포함하는 것으로 이해된다.
본 명세서의 목적상, "약제학적으로 허용가능한 호변이성질체"는 본 발명의 임의 화합물의 임의 호변이성질체 형태를 의미한다.
본 발명의 화합물의 이성질체 혼합물의 분리 및 거울상이성질체의 정제는 당업계에 공지된 표준 기술에 의해서 수행될 수 있다.
"안정한" 화합물은, 제조되고 분리될 수 있고, 구조 및 특성이 유지되거나 본원에 기재된 목적 (예를 들면, 대상체에게로의 치료적 또는 예방적 투여)에 대해 화합물을 사용할 수 있기에 충분한 시간 기간 동안 본질적으로 변하지 않고 남아있게 할 수 있는 화합물이다. 본 발명의 화합물은 식 I에 의해 포함된 안정한 화합물로 제한된다.
본 발명의 화합물을 제조하기 위한 합성 방법은 하기 일반 과정, 도식 및 예에 예시되어 있다. 출발 물질은 상업적으로 입수가능하거나, 당업계에 공지되어 있거나 본원에 예시된 과정에 따라서 제조될 수 있다. 본 발명의 화합물은 하기 특정 예에 의해 예시된다. 그러나, 이러한 특정 예들은 본 발명으로 간주되는 유개념(genus) 만을 형성하는 것으로 해석되지 않아야 한다. 이러한 예들은 본 발명의 화합물을 제조하기 위한 상세사항을 추가로 예시한다. 당업자는, 하기 제조 과정의 조건 및 과정의 공지된 변형이 이러한 화합물을 제조하는데 이용될 수 있음을 용이하게 이해할 것이다.
모든 온도는 섭씨 온도로 표시된다. 질량 스펙트럼(MS)은, 아질런트(Agilent) 1100TM 시리즈 HPLC 장비에 결합된 아질런트 6120 콰드라폴(Quadrapole)TM MS 상에서의 전기분무 이온-질량 분광법(ESI)으로 측정하였다. NMR 스펙트럼은 1H에 대해서는 400 MHz에서 19F에 대해서는 376 MHz에서 버라이언(Varian) 수은 분광계 상에서 기록하였다.
본 명세서의 목적상, 하기 약어는 지시된 의미를 갖는다:
AcOH = 아세트산
Alk = 알킬
Ar = 아릴
atm = 대기압
BINAP = 2,2'-비스(디페닐포스피노)-1,1'-비나프탈렌
Boc = tert-부톡시카보닐
n-BuLi = n-부틸리튬
Cbz = 카복시벤질
CH2Cl2 = 디클로로메탄
DBU = 1,8-디아자비시클로[5.4.0]운데크-7-엔
DEAD = 디에틸 아조디카복실레이트
DIPEA = N,N-디이소프로필에틸아민
DMAP = 4-(디메틸아미노)피리딘
DMF = N,N-디메틸포름아미드
DMSO = 디메틸 설폭사이드
ESI = 전기분무 이온화
Et3N = 트리에틸아민
Et2O = 디에틸에테르
EtOAc 또는 EA = 에틸 아세테이트
EtOH = 에틸 알코올
h = 시간(들)
H2 = 수소
HATU = O-(7-아자벤조트리아졸-1-일)-N,N,N',N'-테트라메틸우로늄 헥사플루오로포스페이트
HCl = 염산
HPLC = 고압 액체 크로마토그래피
iPrOH = 2-프로판올
KF = 칼륨 플루오라이드
LC-MS = 액체 크로마토그래피 질량 분광법
LiOH = 리튬 하이드록사이드
MeCN = 아세토니트릴
MeMgBr = 메틸마그네슘 브로마이드
MeOH = 메틸 알코올
MeTHF = 2-메틸테트라하이드로푸란
MgSO4 = 마그네슘 설페이트
min = 분(들)
MS = 질량 분광법
MTBE = 메틸 tert-부틸 에테르
N2 = 질소
NaBH4 = 나트륨 보로하이드라이드
NaHCO3 = 나트륨 비카보네이트
NaOH = 나트륨 하이드록사이드
Na2SO4 = 나트륨 설페이트
NH3 = 암모니아
NH4Cl = 암모늄 클로라이드
NH4OH = 암모늄 하이드록사이드
NMP = N-메틸 2-피롤리디논
NMR = 핵 자기 공명 분광법
Moc = 메톡시카보닐
P = 압력
Pd/C = 목탄(charcoal) 상 팔라듐
PG = 보호기
Ph = 페닐
Pyr = 피리딘
rbf = 둥근 바닥 플라스크
Rf = 실리카 겔 상에서의 체류 인자
rt = 실온
TBDMS = tert-부틸디메틸실릴
Ts = 톨루엔-4-설포닐
TFA = 트리플루오로아세트산
TFAA = 트리플루오로아세트산 무수물
TFA-NHS = 트리플루오로아세트산 N-하이드록시숙신이미드
THF = 테트라하이드로푸란
TLC = 박층 크로마토그래피
TMEDA = N,N,N',N'-테트라메틸에틸렌디아민
T3P = 프로필포스폰산 무수물
트리플루오로아세트산 N-하이드록시숙신이미드(TFA-NHS)의 제조는 하기 문헌에 기재되어 있다: Sohn, C. H.; Lee, J. E.; Sweredoski, M. J.; Graham, R. L. J.; Smith, G. T.; Hess, S.; Czerwieniec, G.; Loo, J. A.; Deshaies, R. J.; Beauchamp, J. L. J. Am. Chem.Soc. 2012, 134, 2672-2680.
(S)-3-tert-부톡시카보닐-4-(2-벤질옥시카보닐에틸)옥사졸리딘-5-온이 하기 문헌에 기재되어 있다: Aurelio, L.; Brownlee, R. T. C.; Hughes, A. B.; Sleebs, B. E. Aust . J. Chem . 2000, 53, 425-433. (R)-3-tert-부톡시카보닐-4-(2-벤질옥시카보닐에틸)옥사졸리딘-5-온은 또한 N-Boc-D-글루탐산 5-벤질 에스테르로부터 출발하여 유사한 방식으로 제조될 수 있다.
약제학적 조성물
또 하나의 측면에서, 본 발명은, 약제학적으로 허용가능한 담체 및/또는 부형제와 함께 제형화된 본 발명의 화합물 중 하나 또는 조합체를 함유하는 조성물, 예를 들면 약제학적 조성물을 제공한다.
본 발명의 약제학적 조성물은 또한 병용 요법, 즉 다른 제제와 조합하여 투여될 수 있다. 예를 들면, 상기 병용 요법은 적어도 하나의 다른 콜레스테롤-저하제를 포함할 수 있다. 병용 요법에 사용될 수 있는 치료제의 예가 이하에 더욱 상세하게 기재되어 있다.
본원에 사용된 "약제학적으로 허용가능한 담체" 또는 "약제학적으로 허용가능한 부형제"는, 생리적으로 상용성인 임의의 및 모든 용매, 분산 매체, 코팅, 항균제 및 항진균제, 등장화제 및 흡수 지연제 등을 포함한다. 상기 담체는 경구, 정맥내, 근육내, 피하, 비경구, 척추 또는 표피 투여 (예를 들면, 주입 또는 주사에 의한)에 적합해야 한다. 투여 경로에 따라서, 활성 화합물을 산의 작용 및 이 화합물을 불활성시킬 수 있는 다른 자연 조건으로부터 보호하도록 이 활성 화합물을 물질로 코팅시킬 수 있다.
담체/부형제
본 발명의 약제학적 조성물은 약제학적으로 허용가능한 항산화제를 포함할 수 있다. 약제학적으로 허용가능한 항산화제의 예는 하기 것들을 포함한다: 수용성 항산화제, 예컨대 아스코르브산, 시스테인 하이드로클로라이드, 나트륨 비설페이트, 나트륨 메타비설파이트, 나트륨 설파이트 등; 지용성 항산화제, 예컨대 아스코르빌 팔미테이트, 부틸화 하이드록시아니솔(BHA), 부틸화 하이드록시톨루엔(BHT), 레시틴, 프로필 갈레이트, 알파-토코페롤 등; 및 금속 킬레이트제, 예컨대 시트르산, 에틸렌디아민 테트라아세트산(EDTA), 소르비톨, 타르타르산, 인산 등.
본 발명의 약제학적 조성물에 사용될 수 있는 적합한 수성 및 비수성 담체의 예는 물, 에탄올, 폴리올 (예컨대, 글리세롤, 프로필렌 글리콜, 폴리에틸렌 글리콜 등), 및 이들의 적합한 혼합물, 식물성 오일, 예컨대 올리브 오일, 및 주사가능한 유기 에스테르, 예컨대 에틸 올레이트를 포함한다. 예를 들면, 코팅 물질, 예컨대 레시틴을 사용함으로써, 분산액의 경우에는 요구된 입자 크기를 유지함으로써, 및 계면활성제를 사용함으로써 적절한 유동성이 유지될 수 있다.
이러한 조성물은 또한 보조제, 예컨대 보존제, 습윤제, 유화제 및 분산제를 함유할 수 있다. 상기 멸균화 과정에 의해, 및 다양한 항균제 및 항진균제, 예를 들면, 파라벤, 클로로부탄올, 페놀 소르브산 등을 포함시키는 둘 모두의 방법에 의해 미생물 출현을 방지할 수 있다. 등장화제, 예컨대 당, 나트륨 클로라이드 등을 상기 조성물 내로 포함시키는 것이 또한 바람직할 수 있다. 또한, 흡수를 지연시키는 제제, 예컨대 알루미늄 모노스테아레이트 및 젤라틴을 포함시켜서 주사가능한 약제학적 형태를 오래 흡수시킬 수 있다.
약제학적으로 허용가능한 담체 또는 부형제는 멸균성 수용액 또는 분산액, 및 멸균성의 주사가능한 용액 또는 분산액의 임시처방 조제를 위한 멸균 분말을 포함한다. 약제학적 활성 물질에 대해서 상기 매체 및 제제의 사용은 당업계에 공지되어 있다. 임의의 통상적인 매체 또는 제제가 활성 화합물과 비상용성이기만 하면, 본 발명의 약제학적 조성물 내에서 이것의 사용이 고찰된다. 보충적인 활성 화합물이 또한 조성물 내로 혼입될 수 있다.
치료적 조성물은 전형적으로 제조 및 저장 조건하에서 멸균성이며 안정적이어야 한다. 상기 조성물은 높은 약물 농도에 적합한 용액, 마이크로에멀젼, 리포솜, 또는 다른 정렬된 구조물로 제형화될 수 있다. 담체는 예를 들면, 물, 에탄올, 폴리올 (예를 들면, 글리세롤, 프로필렌 글리콜, 및 액체 폴리에틸렌 글리콜 등), 및 이들의 적합한 혼합물을 함유하는 용매 또는 분산 매체일 수 있다. 예를 들면, 코팅, 예컨대 레시틴을 사용함으로써, 분산액의 경우에는 요구되는 입자 크기를 유지함으로써, 및 계면활성제를 사용함으로써 적절한 유동성이 유지될 수 있다. 많은 경우에, 등장화제, 예를 들면, 당, 폴리알코올, 예컨대 만니톨, 소르비톨, 또는 나트륨 클로라이드를 조성물 중에 포함시킬 수 있다.
조성물 중에 흡수를 지연시키는 제제, 예를 들면 모노스테아레이트 염 및 젤라틴을 포함시킴으로써 주사가능한 조성물의 오랜 흡수가 얻어질 수 있다.
요구되는 경우에 이상에서 열거된 성분 중 하나 또는 성분의 조합체와 함께 활성 화합물을 적절한 용매 중에 요구되는 양으로 혼입시킨 다음, 멸균화 미세여과시킴으로써, 멸균성의 주사가능한 용액을 제조할 수 있다. 일반적으로, 활성 화합물을, 염기성 분산 매체 및 이상의 열거된 것들로부터의 요구된 기타 성분을 함유하는 멸균 비히클 내로 혼입시켜서 분산액을 제조한다. 멸균성의 주사가능한 용액을 제조하기 위한 멸균성 분말의 경우에, 제조 방법은 진공 건조 및 동결 건조(freeze-drying or lyophilization)인데, 이 방법들로 이전의 멸균-여과된 용액으로부터 임의의 추가 원하는 성분 및 활성 성분의 분말을 생성시킨다.
경구 투여를 위한 약제학적 조제물의 예는, 체내 사용을 위한 정제 (예컨대 미코팅된 정제, 당 코팅된 정제, 코팅 정제, 장용성 코팅된 정제 및 씹어먹을 수 있는 정제), 구강 투여된 정제 (예컨대 협측 조제물, 설하 정제, 트로키(troche) 및 접착성 정제), 분말, 캡슐 (예컨대, 경질 캡슐 및 연질 캡슐), 과립 (예컨대, 코팅된 과립, 환약, 트로키, 액체 조제물 또는 약제학적으로 허용가능한 서방성 약제학적 조제물)을 포함한다. 경구 투여될 수 있는 액체 조제물의 구체적인 예는, 체내 사용을 위한 용액, 쉐이크 혼합물, 현탁액, 에멀젼, 시럽, 건식 시럽, 엘릭시르, 주입액, 및 달임물 및 레모네이드이다.
담체 물질과 조합되어 단일 투여형(single dosage form)을 생성시킬 수 있는 활성 성분의 양은 치료할 대상체 및 구체적인 투여 모드에 따라 가변될 것이다. 담체 물질과 조합되어 단일 투여형을 생성시킬 수 있는 활성 성분의 양은 일반적으로 치료 효과를 생성시키는 조성물의 그러한 양일 것이다. 일반적으로, 100% 중에서, 이 양은 약제학적으로 허용가능한 담체와 함께 약 0.01% 내지 약 99%의 활성성분, 약 0.1% 내지 약 70%, 또는 약 1% 내지 약 30%의 활성 성분의 범위일 것이다.
용량 및 투여 계획
최적의 원하는 반응 (예를 들면, 치료적 반응)을 제공하도록 투여 계획이 조정된다. 예를 들면, 단일 다량주입(single bolus)이 투여될 수 있고, 여러 개의 분할된 용량이 경시적으로 투여될 수 있거나, 치료 상황의 위급함으로 나타나듯이 용량은 비례적으로 감소되거나 증가될 수 있다. 투여의 용이함 및 투여의 균일성을 위해 비경구 조성물을 투여 단위형(dosage unit form)으로 제형화하는 것이 특히 유리하다. 본원에 사용된 투여 단위형은, 치료할 대상체에 대한 단위 투여로 적합한 물리적 개별 단위를 지칭한다; 각각의 단위는 요구된 약제학적 담체와 연합하여 원하는 치료 효과를 나타내도록 계산된 소정량의 활성 화합물을 함유한다. 본 발명의 투여 단위형에 대한 규격은, 활성 화합물의 독특한 특성 및 달성할 구체적인 치료 효과, 및 개인에서 감수성을 치료하기 위한 그러한 활성 화합물의 배합 기술에서의 본질적인 한계에 의해 지시되고, 이들에 직접적으로 의존한다.
화합물의 투여에 대해, 용량은 약 0.0001 내지 100 mg/kg 호스트 체중, 및 더욱 일반적으로는 0.01 내지 5 mg/kg 호스트 체중이다. 예를 들면, 용량은 0.3 mg/kg 체중, 1 mg/kg 체중, 3 mg/kg 체중, 5 mg/kg 체중 또는 10 mg/kg 체중 또는 1-10 mg/kg 범위 내일 수 있다. 예시적 치료 계획은 일일 1회, 매주 1회, 2주에 1회, 3주에 1회, 4주에 1회, 1개월에 1회, 3개월에 1회, 또는 3 내지 6개월에 1회 투여를 필요로 한다.
일부 방법에서, 상이한 활성을 갖는 둘 이상의 화합물이 동시에 투여되는데, 이 경우에 투여된 각각의 화합물의 용량은 지시된 범위에 있다. 상기 화합물은 대개 다수 회 투여된다. 단일 용량 사이에서의 간격은, 예를 들면, 매주, 매달, 3개월마다, 또는 매년일 수 있다. 간격은 또한 환자에서 화합물의 혈액 수준을 측정하여 나타난 대로 불규칙적일 수 있다. 일부 방법에서 약 1 내지 1000 ㎍/ml 및 일부 방법에서 약 25 내지 300 ㎍/ml의 화합물의 혈장 농도를 달성하도록 용량이 조정된다.
대안적으로, 화합물은 덜 빈번한 투여가 요구되는 서방성 제형으로서 투여될 수 있다. 용량 및 빈도는 환자에서 화합물의 반감기에 따라서 가변된다. 투여 용량 및 빈도는 치료가 예방적인지 또는 치료적인지에 따라서 가변될 수 있다. 예방적 응용예에서는, 비교적 적은 용량이 긴 시간 기간에 걸쳐서 비교적 드문 간격으로 투여된다. 일부 환자는 그들의 남은 생애 동안 계속하여 치료제를 투여받는다. 치료적 응용예에서는, 질환의 진행이 감소 또는 종결되거나 환자가 질환 증상의 부분적 또는 완전한 완화를 보일 때까지 비교적 짧은 기간에서 비교적 높은 용량이 때때로 요구된다. 직후, 환자에게 예방적 계획이 실시될 수 있다.
본 발명의 약제학적 조성물 내 활성 성분의 실제적 용량 수준은, 환자에게 독성을 나타내지 않으면서 특수한 환자, 조성물, 및 투여 모드에 대해 원하는 치료 반응 (예를 들면, 감소된 혈장 LDL/콜레스테롤 수준)을 달성하는데 효과적인 활성 성분의 양을 얻도록 가변될 수 있다. 선택된 용량 수준은 다양한 약물동력학적 인자, 예컨대 사용된 본 발명의 특수한 조성물, 또는 그 에스테르, 염 또는 아미드의 활성, 투여 경로, 투여 시간, 사용되는 특수한 화합물의 배출 속도, 사용된 특수한 조성물과 함께 사용된 치료제, 다른 약물, 화합물 및/또는 물질의 지속기간, 치료할 환자의 연령, 성별, 체중, 컨디션, 일반적 건강 및 이전의 의료 기록, 및 의료 분야에 널리 공지된 유사 인자에 따를 것이다.
본 발명의 화합물의 "치료학적 유효량" 또는 "유효량" 또는 "치료학적 유효 용량"은, 대상체에서 LDL-C 수준의 감소, 적어도 하나의 질환 증상의 중증도에서의 감소 (예를 들면, 혈장 LDL-콜레스테롤에서의 감소, 또는 LDL-콜레스테롤-관련된 장애의 증상에서의 감소), 질환 증상을 나타내지 않는 기간의 빈도 및 지속기간에서의 증가, 또는 대상체에서 나타난 질환으로 인한 손상 또는 장애의 예방을 초래할 수 있다.
투여 경로
본 발명의 조성물은, 당업계에 공지된 다양한 방법 중 하나 이상을 사용하여 하나 이상의 투여 경로에 의해 투여될 수 있다. 당업자에게 이해될 것이듯이, 투여 경로 및/또는 모드는 원하는 결과에 따라서 가변될 것이다. 본 발명의 화합물에 대한 투여 경로는, 경구, 정맥내, 근육내, 피부내, 복막내, 피하, 척추, 또는 예를 들면, 주사 또는 주입에 의한 다른 비경구 투여 경로를 포함한다. 본원에 사용된 표현 "비경구 투여"는, 장관 및 국소 투여를 제외한, 대개는 주사에 의한 투여 모드를 의미하며, 비제한적으로 정맥내, 근육내, 동맥내, 경막내, 관절낭내, 안와내, 심장내, 피부내, 복막내, 경기관, 피하, 표피하, 관절내, 관절낭아래, 지주막하, 척추내, 경막외, 및 복장내 주사 및 주입을 포함한다. 대안적으로, 본 발명의 화합물은 비경구 경로, 예컨대 국소, 표피 또는 점막 투여 경로에 의해, 예를 들면 비내, 경구, 질내, 직장, 설하 또는 국소적으로 투여될 수 있다.
활성 화합물은 신속 방출, 예컨대 조절된 방출 제형, 예컨대 이식물, 경피 패치, 및 미세캡슐화 전달 시스템에 대하여 이 화합물을 보호할 담체와 함께 조제될 수 있다. 생물분해성의 생체적합성 폴리머, 예컨대 에틸렌 비닐 아세테이트, 폴리무수물, 폴리글라이콜산, 콜라겐, 폴리오르토에스테르, 및 폴리락트산이 사용될 수 있다. 이러한 제형을 제조하는 많은 방법이 특허화되어 있거나 당업자에게 일반적으로 공지되어 있다. 예를 들어, 문헌 (Sustained and Controlled Release Drug Delivery Systems, J.R. Robinson, ed., Marcel Dekker, Inc., New York, 1978)을 참고하기 바란다. 치료 조성물은 당업계에 공지된 의료 장치를 사용하여 투여될 수 있다. 어떤 구현예에서, 본 발명의 화합물은 생체 내에서 적절한 분포를 보장하도록 제형화될 수 있다. 예를 들면, 혈뇌 장벽(BBB)에 의해서는 매우 높은 친수성의 화합물이 제외된다. 본 발명의 치료 화합물이 (필요에 따라) BBB를 가로지르게 하기 위해, 이 화합물은 예를 들면, 리포솜 중에서 제형화될 수 있다. 리포솜은 특정 세포, 조직 또는 기관 내로 선택적으로 수송되어 표적화된 약물 전달을 향상시키는 하나 이상의 모이어티를 포함할 수 있다 (예를 들면, 문헌 (V. V. Ranade, 1989 J. Clin. Pharmacol . 29:685) 참고). 일 구현예에서, 본 발명의 화합물은 간으로 (즉, 간 세포로) 전달되도록 제형화될 수 있다.
화합물의 기능 특성화
본 발명의 화합물의 기능 특성화를 시험관 내에서 및 생체 내에서 시험할 수 있다. 예를 들면, 화합물을 PCSK9 단백질분해 활성, LDLR에 대한 PCSK9-의존적 효과 (예를 들면, LDL-C의 LDLR 매개된 흡수), PCSK9-의존적 LDLR 분해, 예컨대 LDLR에 대한 PCSK9의 상호작용, 및 생체 내에서 LDL-C를 감소시키는 능력에 대하여 시험할 수 있다.
LDLR에 결합하는 PCSK9는, LDLR을 고체 지지체에 부동화시키고 LDLR에 결합하는 가용성 PCSK9를 검출함으로써 (바이아코어(BIAcore)®를 사용하는) 표면 플라스몬 공명(SPR)으로 검출될 수 있다. 대안적으로, PCSK9가 부동화될 수 있고, LDLR 결합이 검출될 수 있다. PCSK-9/LDLR 결합은 또한 ELISA에 의해 (예를 들면, 부동화된 LDLR에 결합하는 PCSK9를 검출함으로써), 형광 공명 에너지 전달(FRET) 또는 파아지 표시에 의해 분석될 수 있다. FRET를 수행하도록, 용액 중에서 LDLR에 결합하는 형광원 표지된 PCSK9가 검출될 수 있다 (예를 들면, 미국 특허 번호 5,631,169 참고). LDLR에 결합하는 PCSK9는 공동면역침전법(coimmunoprecipitation)으로 검출되었다 (문헌 (Lagace 등, 2006 J. Clin . Inv. 116(11):2995-3005) 참고). 예를 들면, 이러한 방식으로 PCSK9-LDLR 결합을 조사하기 위해, HepG2 세포를 스테롤 결핍된 배지 중에서 18시간 동안 배양시킨다. 정제된 PCSK9를 0.1 mM 클로로퀸의 존재하에서 상기 배지에 첨가하고 세포를 1시간 동안 인큐베이션시킨다. 세포를 온화한 세제 (1% 디기토닌w/vol) 중에 용해(lyse)시킨다. PCSK9 또는 LDLR을 세포 용해물로부터 면역침전시키고, SDS-PAGE로 분리하고, 각각 공동면역침전된 LDLR 또는 PCSK9의 존재를 검출하도록 면역블롯팅한다 (상기 문헌 (Lagace 등, 2006) 참고).
이러한 검정들은 더욱 높은 친화도로 LDLR에 결합하는 PCSK9의 돌연변이 형(예를 들면, hPCSK9 D374Y, 상기 문헌 (Lagace 등, 2006) 참고)을 사용하여 수행될 수 있다. 간세포는 세포 표면상에서 LDLR을 발현한다. 배양된 간세포 세포 (예를 들면, HepG2 세포, ATCC HB-8065, HuH7 세포, 1차 인간 또는 마우스 간세포)에 정제된 PCSK9를 첨가하면, 용량- 및 시간-의존적인 방식으로 LDLR 발현에서의 감소가 나타난다 (상기 문헌 (Lagace 등, 2006) 참고). 본 발명의 화합물을 간세포에서 LDLR 수준을 증가시키는 능력에 대하여 시험할 수 있다. 예를 들면, HepG2 세포를 스테롤 결핍된 배지 (100 U/ml 페니실린, 100 μg/ml 스트렙토마이신 설페이트, 및 1 g/1 글루코스, 5% (vol/vol) 갓난 송아지 지질단백-결핍 혈청(NCLPDS), 10 μM 나트륨 컴팩틴, 및 50 μM 나트륨 메발로네이트가 보충된 DMEM) 중에서 18시간 동안 배양시켜서 LDLR 발현을 유도한다. 정제된 PCSK9 (5 μg/ml)를 상기 배지에 첨가한다. PCSK9 첨가 후 0, 0.5, 1, 2, 및 4시간 째에 수확된 세포 내 LDLR 수준을 측정한다 (상기 문헌 (Lagace 등, 2006) 참고). LDLR 수준은 유세포 분석기(flow cytometry), FRET, 면역블롯팅, 또는 다른 수단에 의해 검출될 수 있다. 세포 (예를 들면, HepG2 세포, HuH7 세포)에 의한 LDL-C 흡수는 스테판 및 유라체크(Stephan and Yurachek) (문헌 (1993, J. Lipid Res. 34: 325-330) 참고)에 의해 기재된 대로 형광 표지된 LDL-C, Dil-LDL (3,3'-디옥타데실인도카보시아닌-저밀도 지질단백)를 사용하여 측정될 수 있다. 간단히, 세포를 37℃에서 2시간 동안 Dil-LDL (20-100 μg 단백질/ml)을 함유하는 배양물 중에서 인큐베이션시킨다. 세포를 세척하고, 용해시키고, 내부화된(internalized) Dil-LDL의 농도를 분광형광계를 사용하여 정량화한다. LDL-C 흡수는 (Dil-LDL이 세포 배양물 중에 존재하는 기간 전에, 및/또는 그 동안에) PCSK9 억제 화합물과 접촉된 세포에서 측정될 수 있다.
간에서 인간 PCSK9를 과발현하는 형질전환 마우스는 비-형질전환된 마우스에 비하여 증가된 수준의 혈장 LDL-C를 나타냈다 (상기 문헌 (Lagace 등, 2006) 참고). 마우스에서 아데노바이러스 수용체를 사용한 PCSK9의 과발현을 기재하고 있는 문헌 (Maxwell and Breslow, 2004 Proc . Natl . Acad . Sci. USA, 101:7100)을 또한 참고하기 바란다. PCSK9-/- 마우스를 생성시켰다 (문헌 (Rashid 등, 2005 Proc . Natl. Acad . Sci. 102(5):5374-5379) 참고). 이러한 마우스를, 마우스 또는 인간 PCSK9 이식유전자를 발현하도록 유전자적으로 변형시킬 수 있다. 화합물을 총 콜레스테롤 및/또는 LDL-C를 제거 또는 감소시키는 능력에 대하여 유전자적으로 변형시키지 않은 이러한 모델 중 임의 것 중에서 또는 동물 중에서 시험할 수 있다.
혈장으로부터 LDL 제거의 운동성은 동물에게 [125I]-표지된 LDL을 주사시키고, 주사 후 0, 5, 10, 15 및 30분에 혈액 샘플을 얻고, 샘플 중에서 [125I]-LDL을 정량화함으로써 측정될 수 있다 (상기 문헌 (Rashid 등, 2005) 참고). LDL 제거 속도는 야생형 마우스에 비하여 PCSK9-/-마우스에서 증가한다 (상기 문헌(Rashid 등, 2005) 참고). 화합물이 투여된 동물에서 LDL 제거 증가는 상기 제제가 생체 내에서 PCSK9 활성을 억제함을 나타낸다.
화합물을 사용한 치료에 반응하여 총 혈장 콜레스테롤, 혈장 트리글리세라이드, 및/또는 LDL-C에서의 감소는 PCKS9 활성에 대한 치료 효능의 지표이다. 콜레스테롤 및 지질 프로파일은 색도계, 기체-액체 크로마토그래피, 또는 상업적으로 입수가능한 키트를 사용하는 효소적 수단에 의해서 측정될 수 있다.
PCSK9 활성을 측정하는 방법/검정이 하기되어 있다. 본원에 사용된 용어 "PCSK9 활성" 및 "PCSK9 기능"은 PCSK9에 기인하는 검출가능한 (직접 또는 간접) 효소적, 생화학적 또는 세포 활성을 지칭한다. 그렇게 제한하지 않더라도, 상기 활성은 세포 표면에서 LDLR의 수준을 감소시키는 것, 혈장 LDL-C 및/또는 PCSK9 단백분해효소 활성 자체 (예를 들면, PCSK9 분비)를 감소시키는 것에 대한 PCSK9의 효과를 포함한다.
PCSK9
분비 및 프로세싱의 시험관 내 분석
분비 및/또는 프로PCSK9에서 PCSK9으로의 프로세싱은, 웨스턴 블롯에 의한 세포 및 배지 내 PCSK9의 측정을 이용하는 생합성 방법 또는 ELISA 검정을 사용하여 시험한다. 화합물의 존재하에서 PCSK9 분비 또는 반응에서의 감소는, 상기 화합물이 PCSK9 활성을 억제하는 것에 대한 지표이다. 통계학적 유의미성을 위하여, 각각의 실험을 3회로 수행한다. 화합물(들)의 "용량-의존적" 반응을 수행한다.
PCSK9
-의존적
LDLR
분해의 시험관 내 분석
화합물을 또한 마우스 또는 인간 간세포 세포 주, 예컨대 HepG2 또는 HuH7 상에서 PCSK9에 의한 LDLR 향상된 분해를 억제하는 능력에 대해 시험한다. 본 검정은, 야생형(WT), 돌연변이 또는 키메라 PCSK9를, 형질전환 후에 또는 직접적으로, 시험된 화합물의 존재 또는 부재하에 배양물 상청액에 첨가하는데 있다. 화합물(들)의 "용량-의존적" 반응을 수행한다. 통계학적 유의미성을 위해, 각각의 "용량-반응" 실험을 4 내지 6 상이한 용량에 대하여 2회 또는 3회로 실시한다.
PCSK9 활성의 억제는, 하기 방법에 의해 입증된 LDLR 단백질 발현의 증가에 의해 및/또는 세포 표면에서 입증된다:
* 총 LDLR에 대한 세포 용해물의 웨스턴 블롯 분석;
* LDLR에 대해 세포 표면에 대한 FACS 분석;
* LDLR의 세포 표면 활성을 모니터하는 형광성 Dil-LDL 혼입.
Dil-LDL 형광성 흡수 검정은 LDLR 내부화를 통한 Dil-LDL 세포 혼입의 형광성 측정 (세포 표면 LDLR 활성의 측정)에 있다. 세포를 2시간 동안 상이한 용량의 시험된 화합물의 존재 또는 부재하에서 96웰 포맷에서 인큐베이션시킨 다음, 추가 2시간 동안 Dil-LDL을 첨가하였다. PCSK9 활성의 억제는 Dil-LDL 형광성에서의 증가에 의해 검출된다.
a. WT PCSK9 . 본 검정은, 시험된 화합물의 존재 또는 부재하에서 형질전환된 세포로부터 컨디셔닝된 배지로 또는 정제된 대로, 및 배양물 상청액에 첨가된 야생형(WT) PCSK9의 첨가에 있다. 세포외에서 첨가된 PCSK9에 대해 일반적으로 선택된 용량은 1 ug/ml이다.
b. (기능 획득) 돌연변이체 PCSK9 . 시험된 화합물이 기능 획득 돌연변이의 기능을 억제할 수 있는 지를 추가로 특성화하기 위해서, 세포를 상이한 용량의 시험된 화합물의 존재 또는 부재하에서 정제된 돌연변이 단백질과 함께 인큐베이션시킨다. 정제된 PCSK9 돌연변이체는 예를 들면, (LDLR에 대해 약 25배 더 높은 친화도를 나타내는) PCSK9-D374Y 또는 (증가된 안정성의 PCSK9를 보이는) S127R이다. 세포외에서 첨가된 PCSK9 및 그 기능 획득 천연 돌연변이체 D374Y에 대해 일반적으로 선택된 용량은 1 μg/ml 및 0.2 μg/ml이다. 다른 PCSK9 돌연변이체가 유사하게 사용된다. 본 검정은 또한 기능 획득 PCSK9 돌연변이체로 형질감염된 세포로부터 수확된 배양 배지를 사용하여 실시할 수 있었다.
c. 키메라 PCSK9 . PCSK9 세포외 통로 활성에 대한 시험된 화합물의 활성을 측정하기 위해, 세포 표면 안지오텐신 전환 효소 2 (PCSK9-ACE2)의 막횡단 및 세포질 도메인을 사용한 PCSK9의 키메라 단백질 융합을 시험한다. 대안적으로, PCSK9 세포내 통로 활성에 대한 시험된 화합물의 활성을 측정하기 위해서, 단백질을 엔도솜/리소좀 (PCSK9-Lamp1)으로 직접 운반시키는 Lamp-1의 막횡단 및 세포질 도메인을 사용한 PCSK9의 키메라 단백질 융합을 시험한다. 키메라 PCSK9-ACE2 또는 PCSK9-Lamp1을 발현하는 안정한 세포는 입수가능하며, 이것을 상이한 용량의 시험된 화합물의 존재 또는 부재하에서 인큐베이션시킨다. 키메라 단백질은 또한 V5 태그와 함께 PCSK9를 포함하였다.
d. 1차 인간 간세포. 세포 표면 LDLR에 대한 PCSK9 억제 화합물의 효과를 측정하기 위해 상기 화합물을 마우스 및 인간 1차 간세포에 대해 시험한다. 상기 마우스 1차 간세포의 사용 시 이점은, 이것이 또한 각각 PCSK9 발현 또는 결핍의 야생형 또는 녹아웃 마우스의 측면에서 상기 화합물의 특이성을 측정한다는 것이다. (예를 들면, shRNA 녹다운 하에서) PCSK9를 외인적으로 더 이상 발현하지 않는 HepG2 및 HuH7 세포가 또한 유사한 약물 특이성 목적으로 사용된다.
PCSK9를 형질감염된 세포로부터 컨디셔닝된 배지 중에 함유시켰다. HEK293 세포 또는 Huh7 세포에서 과발현시켜서 인간 야생형 PCSK9 (PCSK9-WT) 및 기능 획득 (PCSK9-D374Y) 단백질을 생성시킨다. 간단히, HEK293 또는 Huh7 세포 주를 10% 소 태아 혈청 (인비트로젠(Invitrogen))을 함유하는 둘베코 변형된 이글 배지 중에서 성장시키고, 5% CO2 하 37℃에서 유지시킨다. 제조업자의 프로토콜에 따라서 HEK293 세포를 젯프라임(jetPRIME)™ (폴리플러스 트랜스펙션(Polyplus transfection))으로 형질감염시키고, Huh7 세포는 리포펙타민(Lipofectamine)™ 2000 (인비트로젠)으로 형질감염시킨다. 형질감염 후 24시간에, 세포를 세척하고 혈청 비함유 배지 중에서 인큐베이션시킨다. 분비된 인간 PCSK9-D374Y 또는 PCSK9-WT 단백질을 함유하는 컨디셔닝된 배지를 24시간 후에 수집한다. 컨디셔닝된 배지 내 PCSK9 단백질 수준을, 종래 기재된 바와 같이 (문헌 (Dubuc G, Tremblay M, Pare G, Jacques H, Hamelin J, Benjannet S, Boulet L, Genest J, Bernier L, Seidah NG, Davignon J. 2010. A new method for measurement of total plasma PCSK9: clinical applications. J Lipid Res. 51:140-149) 참고) 효소 결합 면역흡착 검정(ELISA)으로 정량화한다.
PCSK9를 안정적으로 발현하는 인간 HepG2 세포 . 인간 HepG2 세포 (ATCC, HB-8065)를 푸젠(Fugene)™ HD 형질감염 시약 (로쉐 (Roche))을 사용하여 플라스미드 작제물 (C 말단에서 V5로 태그된 인간 PCSK9)로 형질감염시켰다. 말하자면, HepG2 세포를, HepG2 세포에 대한 푸젠™ HD 최적화된 프로토콜을 사용하여 35mm 배양 접시에서 형질감염시켰다 (제조업자의 지시에 따라 7ul 푸젠™ HD에 대하여 2ug DNA). 형질감염 후 72 시간에, 세포를 트립신화시키고, 선택 배지: DMEM (고 함량 글루코스 + 나트륨 피루베이트) (위센트(Wisent))/10%FBS 및 600ug/ml G418 (위센트)를 함유하는 100mm 접시 상으로 옮긴다. 10일의 선별 후에, 관심 유전자를 발현하는 세포 풀(pool)을 얻는다. 또한, 문헌 (Seidah, NG, Benjannet, S, Wickham, L, Marcinkiewicz, J, Jasmin, SB, Stifani, S, Baska, A, Prat, A and Chretien, M. The secretory proprotein convertase neural apoptosis-regulated convertase 1 (NARC-1): liver regeneration and neuronal differentiation. Proc . Natl . Acad. Sci . U.S.A , 100:928-933, 2003; Benjannet, S., Rhainds, D., Essalmani, R., Mayne, J., Wickham, L., Jin, W., Asselin, M.C., Hamelin, J., varret, M., Allard, D., Trillard, M., Abifadel, M., Tebon, A., Attie, A.D., Rader, D.J., Boileau, C., Brissette, L., Chretien, M., Prat, A., and Seidah, N.G. NARC-1/PCSK9 and its natural mutants: zymogen cleavage and effects on the low density lipoprotein (LDL) receptor and LDL cholesterol. J. Biol . Chem., 279: 48865-48875, 2004; and Benjannet, S., Rhainds, D., Hamelin, J., Nassoury, N., and Seidah, N.G. The proprotein convertase PCSK9 is inactivated by furin and/or PC5/6A: Functional consequences of natural mutations and post-translational modifications. J. Biol . Chem., 281:30561-30572, 2006)을 참고하기 바란다.
PCSK9 분비 검정: 분비된 PCSK9의 ELISA에 의한 검출. 12웰 플레이트 (그라이너 바이오원(Greiner BioOne)TM)에서, PCSK9(+V5)를 안정적으로 발현하는 HepG2 세포를 1 x 106/웰의 밀도로 완전 배지에 파종하고, 37℃에서 20시간 동안 인큐베이션시켰다. 세포를 2 ml/웰의 D-PBS (+ 칼슘, + 마그네슘) (위센트)로 1회 세정한 다음, 다양한 농도 (11, 33, 100 μM)의 억제 화합물 또는 DMSO 대조군 (0.4% 최종)을 함유하는 0.5 ml/웰 인큐베이션 배지 (+ 0.07% BSA)를 첨가하고, 밤새 (24 시간) 인큐베이션시켰다. 24 시간 컨디셔닝된 배지를 수집하고, 5분 동안 130 x g에서 원심분리시켜서 세포 파편을 제거하고, ELISA (100 μl의 1:30 희석액)에 의한 PCSK9 정량화를 위해 상청액을 제거하였다. 세포를 얼음 냉각시킨 D-PBS (+ 칼슘, + 마그네슘) (위센트)로 1회 세척한 다음, 단백분해효소 억제제 (로쉐 어플라이드 사이언스(Roche Applied Science))의 혼합물을 함유하는 250 ul/웰의 방사성면역침전 검정 완충제 (RIPA) (50 mM 트리스-HCl, pH 7.8, 150 mM NaCl, 1% 노니덴트 P-40, 0.5% 나트륨 데옥시콜레이트, 0.1% SDS)로 얼음 상에서 30분 동안 용해(lyse)시키고, 11,300 × g에서 5분 동안 펠릿화하였다. ELISA (100 μl의 1:20 희석액)에 의한 세포 PCSK9 정량화 및 바이오-라드™ DC 단백질 검정 (바이오-라드) (2회의 4 μl 세포 용해물)에 의한 총 단백질 측정을 위해 상청액을 제거하였다 (문헌 (Dubuc G, Tremblay M, Pare G, Jacques H, Hamelin J, Benjannet S, Boulet L, Genest J, Bernier L, Seidah NG, Davignon J. 2010. A new method for measurement of total plasma PCSK9: clinical applications. J Lipid Res. 51:140-149) 참고). 세포 (C)에 대한 배지 (M)의 PCSK9 농도의 비를 측정하고, M/C를 > 30%까지 감소시킨 화합물을 활성으로 간주하였다.
웨스턴 블롯에 의한 검출 . 세포를 포스페이트-완충 식염수 (PBS) 중에서 3회 세척하고, 1x 완전 단백분해효소 억제제 혼합물 (로쉐 어플라이드 사이언스)이 보충된 완전 RIPA 완충제 (50 mM 트리스/HCl, pH 8.0, 1% (v/v) 노니데트 P40, 0.5% 나트륨 데옥시콜레이트, 150 mM NaCl 및 0.1% (v/v) SDS) 중에 용해시킨다. 8% SDS-폴리아크릴아미드 겔 전기영동으로 단백질을 분리하고, 이것을 5% 무지방 우유 분말을 함유하는 TBS-T (50 mM 트리스-HCl, pH 7.5, 150 mM NaCl, 0.1% 트윈-20) 중에서 1시간 동안 차단시킨 폴리비닐리덴 디플루오라이드 (PVDF, 퍼킨 엘머(Perkin Elmer)) 막 (지이 헬스케어(GE Healthcare)) 상에 블롯팅한다. 그 후, 막을 다클론 hPCSK9 항체 (1:2500), 인간 LDLR 항체 (1:1000, 알 앤 디 시스템스(R & D Systems)), 또는 토끼 β-액틴 항체 (1:2500, 시그마(Sigma))를 함유하는 5% 무지방 우유 중에서 3시간 동안 인큐베이션시킨다. ECL 플러스 키트 (GE 헬스케어)를 사용한 향상된 화학발광성을 갖는 검출을 위하여 적절한 서양고추냉이 과산화효소-접합된(conjugated) 2차 항체 (1:10,000, 시그마)가 사용된다.
세포 표면 LDLR 수준의 형광-활성화 세포 분류 ( FACS ) 정량화. HuH7 세포를 첨가된 화합물(들)의 존재 또는 부재하에서 다양한 PCSK9 작제물과 함께 37℃에서 4시간 또는 18시간 동안 인큐베이션시킨 다음, 0.5% 소 혈청 알부민 (시그마) 및 1 g/l 글루코스 (용액 A)를 함유하는 칼슘/마그네슘 비함유 둘베코 포스페이트 완충된 식염수 (DPBS)로 3회 세척한다. 그 후, 세포를 500 μl의 1x 버신(Versene)™ 용액 (인비트로젠)과 함께 37℃에서 5분 동안 인큐베이션시키고, 5 ml의 용액 A 상에서 층형성시켰다. 그 후, 세포를 1000 rpm에서 5분 동안 원심분리시키고, 40분 동안 인간 LDLR (mAb-C7, 산타 크루즈 바이오테크놀로지(Santa Cruz Biotechnology))에 대하여 배향된 1:100의 단일클론성 LDLR 항체 C7를 함유하는 1 ml의 용액 A 중에 재현탁시킨다. 세포를 5 ml의 용액 A로 1회 세척하고, 원심분리시키고, 1:250의 알렉사 플루오르(Alexa Fluor) 647 당나귀 항-마우스 (몰리큘러 프로브스(Molecular Probes))를 함유하는 1 ml PBS 중에 20분 동안 재현탁시킨다. 세포를 세척하고, 300 μl의 PBS 0.2% 프로피듐 아이오다이드(PI) 중에 재현탁시킨다. 그 후, 생존가능한 세포 (피아이-네거티브(PI-negative))를 FACS BD LSR (비디 바이오사이언씨즈(BD Biosciences))을 사용하여 PI 및 알렉사 플루오르 647 둘 모두에 대하여 FACS로 분석한다.
인간 Huh7 세포에서 LDLR의 면역형광성. HepG2 비처리 세포를, 24웰 배양 플레이트 중에 위치한 폴리-L-리신-코팅된 (50 ug/ml) 둥근 현미경 커버 슬립 1.12 mm 두께 (피셔브랜드(Fisherbrand) 12CIR #1) 상에 플레이팅하였다. DMEM 완전 배지 (10% FBS)에 파종을 수행하고, 24시간 후에 상기 배지를 33.3 μM의 상이한 억제제 화합물 (300 μl/웰)을 함유하는 배지 (+0.07% BSA)로 교환하였다. 억제제 화합물의 부피와 동일한 부피의 DMSO를 또한 0.07% BSA 함유 배지 중에서 희석시키고, 이것을 음성 대조군으로 사용하였다. 20시간의 인큐베이션 기간 후에, 세포를 PBS로 3회 세척한 다음, 10분 동안 3.7% 파라포름알데하이드로 고정시켰다. 인간 LDLR (녹색 표지)의 면역형광법을 비-투과성 조건 아래에서 수행하였다. PBS로 추가 3회 세척한 후에, 세포를 30분 동안 1% BSA로 차단한 다음, 4℃에서 1차 항체 (1% BSA 중의 1:200 염소 다클론 항-hLDLR, 알 & 디 시스템스)와 함께 밤새 인큐베이션시켰다. PBS로 최종적으로 3회 세척한 후에, 알렉사 플루오르-태그된 2차 항체와 함께 실온에서 1시간 동안 인큐베이션시켰더니 항원-항체 복합체가 나타났고, 이것을 프로롱 골드 안티페이드(ProLong Gold Antifade) 시약 (몰리큘러 프로브스, 인비트로젠) 중에 두었다. 공초점 현미경 (자이스(Zeiss) LSM-710))을 사용하여 면역형광 분석을 수행하였다.
PCSK9 활성에 대한 Dil -LDL 흡수 세포-기반 검정. HepG2 비처리 세포 및 HEK293 비처리 세포를 25,000 세포/웰의 밀도로 96웰 플레이트 (투명한 바닥을 갖는 셀바인드(CellBind) 블랙 플레이트 (코닝(Corning); Cat # 3340)) 내 완전 배지 (DMEM 고 함량 글루코스 (+ HepG2에 대한 나트륨 피루베이트) (위센트) + 10% FBS)에 플레이팅하였다. 20시간 후에, 세포를 30분 동안 혈청 비함유 DMEM 배지 (100 μl/웰)로 세척시키고, 상기 세척 배지를 제거하고, 이것을 다양한 농도 (11, 33, 100 μM)의 화합물 또는 DMSO 대조군 (0.4% 최종)을 함유하는 100 μl/웰의 인큐베이션 배지 (DMEM 고 함량 글루코스 (+ HepG2에 대한 나트륨 피루베이트) (위센트) + 0.07% BSA (시그마-알드리치(Sigma-Aldrich))로 교체하였다. 각각의 조건을 3개씩 준비하였다. 37℃에서 6시간의 인큐베이션 후에, Dil-LDL (바이오메디컬 테크놀로지스(Biomedical Technologies) (Cat #BT-904))을 5 μg/ml 최종 농도에서 상기 세포 배지 (5 μl)에 첨가하고, 세포를 또 다른 18 시간 동안 (화합물과 함께 총 24시간의 인큐베이션) 조직 배양 인큐베이터로 돌려보냈다. 얼음 냉각 D-PBS (위센트)로 2회 세척시키고(200 μl/웰) 최종 세척액을 흡출시킨 후에, 플레이트를 스펙트라맥스 제미니이엠(SpectraMax GeminiEM)™ 플레이트 판독기 (몰리큘러 디바이시즈) 상에서 스캐닝하였다 (바닥 판독). 각각의 웰에 대하여, 미정제(raw) Dil-LDL 흡수를, 웰 내 3 상이한 지점에서 9 판독치의 평균 형광 세기(RFU) (ex: 520 nm/ em: 575 nm, 컷오프: 550 nm)로 측정하였다. 각각의 웰에서의 Dil-LDL 흡수를 시콴트(CyQuant)™ 세포 검정 (인비트로젠; Cat # C7026)을 수행함으로써 총 세포 수에 대하여 보정하였다. 말하자면, Dil 형광을 기록한 후에, 플레이트를 -80℃에서 밤새 동결시켰다. 다음날, 플레이트를 실온에서 해동시키고, 세포를 제조업자의 프로토콜에 따라 용해시키고, 세포 핵산에 결합한 시콴트 녹색 형광 염료의 형광(RFU) (ex: 485 nm/ em: 538 nm, 컷오프: 515 nm)을 측정함으로써 웰 당 세포 수를 측정하였다. 각각의 조건에 대하여, Dil-RFU를 시콴트-RFU로 나누었다. 보정된 dil-LDL 흡수를 % DMSO 대조군으로 기록하는데, 이것은 3개 웰로부터 얻었다.
PCSK9의 형질감염, 생합성 분석, 면역침전. 이펙틴(Effectene)™ (퀴아젠) 및 총 0.5 μg의 cDNA을 사용하여 3 x 105 HEK293 세포를 형질감염시킨다. 대안적으로, 5 x 105 HuH7 또는 6 x 105 HepG2 세포를 리포펙타민™ 2000 (인비트로젠) 중에서 총 4 μg의 cDNA로 형질감염시킨다. 형질감염시키고 2일 후에, HEK293 세포를 세척한 다음, 250 μCi/ml [35S]Met/Cys (퍼킨 엘머 사이언씨즈)와 함께 다양한 시간 동안 인큐베이션시킨다. 세포를 개질시킨 RIPA 완충제 (150 mM NaCl, 50 mM Tris-HCl, pH 7.5), 1% 노니데트 P-40, 0.5% 나트륨 데옥시콜레이트, 0.1% SDS, 및 단백분해효소 억제제 혼합물 (로쉐 어플라이드 사이언스) 중에 용해시킨 후에, 용해물 및 배지를 면역침전을 위해 준비한다. 사용된 항체는 항-V5 mAb (인비트로젠, 1:500), 및 전매(proprietary) 토끼 항-PCSK9 31-454 (A-03)이다. 면역침전물을 8% 트리신 겔 상에서 SDS-PAGE에 의해 용해시키고 자가방사선촬영한다. 이 실험을 적어도 3회 반복한다. 정량화는, 이미지콴트(ImageQuant)™ 버전 5.2 소프트웨어를 사용하여 스톰 이미저(Storm Imager)™ (아머샴 바이오사이언씨즈(Amersham Biosciences)) 상에서 수행한다. 생합성은, 화합물이 세포질세망 중에서 프로PCSK9에서 PCSK9로의 활성화 및 따라서 그 프로세그먼트와 착물화된 활성 PCSK9의 배지 내로의 분비에 영향을 미치는 지를 시험할 수 있는 감수성 있는 방법이다. PCSK9 (예를 들면 PCSK9-V5) WT 또는 돌연변이된 변이체를 내인적으로 및 안정적으로 발현하도록 조작된 세포를 화합물(들)과 함께 인큐베이션시키고, 배지 및 세포 용해물 중에 존재하는 상이한 PCSK9 형태를 감수성 있는 인간 PCSK9 항체를 사용하여 웨스턴 블롯으로 분석한다.
MTT 독성 검정. hPCSK9(+V5)를 과발현하는 HepG2 안정한 세포를 1 x 105 세포/웰 (100 μl)의 밀도로 96웰 플레이트 (그라이너 바이오원) 내 10% FBS 배지 + 완전 DMEM (고 함량 글루코스 + 나트륨 피루베이트) (위센트)에 파종시키고, 20시간 동안 인큐베이션시켰다. 세포를 100 ul/웰의 혈청 비함유 DMEM 배지로 1회 세정한 다음, 다양한 농도 (11, 33, 100 μM)의 화합물 또는 DMSO 대조군 (0.4% 최종)을 함유하는 100 ㎕의 DMEM (고 함량 글루코스 + 나트륨 피루베이트) (위센트) + 0.07% BSA (시그마-알드리치) 배지를 첨가한 다음, 밤새 (24시간) 인큐베이션시켰다. MTT 검정 (프로메가(Promega))은 제조업자의 지시에 따른 20 μl/웰 MTT 시약의 첨가 및 37℃에서 45분 동안의 인큐베이션으로 구성되었다. 490 nm에서 흡광도를 기록하고, 이것을 비특이적 흡광도 (690 nm)로 인하여 바탕에 대해 보정하였다.
화합물의 사용 방법
PCSK9는, 이것이 콜레스테롤 생합성 또는 흡수에서 특정 역할을 하는 것으로 추정되기 때문에, 콜레스테롤 항상성에 관련되었다. 콜레스테롤-공급된 랫트의 연구에서, PCSK9는 콜레스테롤 생합성에 관련된 다른 유전자와 유사한 방식으로 하향조절된 것으로 보고되었다 (문헌 (Maxwell 등, 2003 J Lipid Res. 44:2109-2119) 참고). PCSK9 발현은, 약물의 콜레스테롤-저하 효과에 기인한 방식으로 스타틴에 의해 상향조절되는 것으로 밝혀졌다 (문헌 (Dubuc 등, 2004, Arterioscler Thromb Vasc Biol. 24: 1454-1459) 참고). 아데노바이러스 발현시킨 PCSK9는 저 밀도 지질단백(LDL) 콜레스테롤(LDL-C)의 순환에서 시간 의존적인 증가를 초래하고 (문헌 (Benjannet 등, 2004 J. Biol . Chem. 279:48865-48875) 참고), PCSK9 유전자 결실된 마우스는 증가된 수준의 간 LDL 수용체(LDLR)를 지니며 혈장으로부터 더욱 신속하게 LDL-C를 제거한다 (상기 문헌 (Rashid 등, 2005) 참고). PCSK9로 일시적으로 형질감염시킨 HepG2 세포로부터의 배지는, 형질감염시키지 않은 HepG2 세포로 옮긴 경우에 LDL-C의 내부화 및 세포 표면 LDLR의 양을 감소시키는 것으로 확인된다 (문헌 (Cameron 등, 2006 Human Mol . Genet. 15:1551-1558). 또한, HepG2 세포의 배지로 첨가된 정제된 PCSK9는 용량- 및 시간-의존적인 방식으로 세포-표면 LDLR의 수를 감소시켰다 (상기 문헌 (Lagace 등, 2006) 참고).
유전자 PCSK9에서 돌연변이의 수는, 조기 심혈관 부전을 일으킬 수 있는 혈장 내 LDL-C 입자의 현격한 상승에 의해 특성화되는 유전적 대사 장애인 보통염색체 우성 고콜레스테롤혈증(ADH)과 관련되었다 (예를 들면, 문헌 (Abifadel 등, 2003 Nat. Genetics 34:154-156; Tirnms 등, 2004 Hum. Genetics 114:349-353; Leren, 2004 Clin . Genet. 65:419-422) 참고).
PCSK9의 증가된 발현 또는 상향조절은 LDL-C의 증가된 혈장 수준과 관련되며, PCSK9 발현의 억제 또는 부족은 낮은 LDL-C 혈장 수준과 관련된다. PCSK9에서 서열 변화와 관련된 더욱 낮은 수준의 LDL-C는 관상 심장 질환에 대한 보호를 제공한다 (문헌 (Cohen, 등, 2006 N. Engl . J. Med . 354:1264-1272) 참고).
본원에 기재된 화합물은 시험관 내 및 생체 내에서 치료적 용도를 갖는다. 예를 들면, 이러한 분자들은 PCSK9 활성/기능과 관련된 다양한 장애를 치료, 예방 또는 진단하기 위해, 예를 들면, 시험관 내 또는 생체 외에서 배양물 내의, 또는 예를 들면, 생체 내에서 이것을 필요로 하는 대상체 내의 세포에 투여될 수 있다.
본 발명의 화합물은 상승된 콜레스테롤, 또는 상승된 콜레스테롤 (예를 들면, LDL 콜레스테롤)과 관련된 병태, 예컨대 지질 장애 (예를 들면, 고지질혈증, 고콜레스테롤혈증, 황색종증)를 앓거나 이에 대한 위험이 있는 인간 환자를 치료하는데 특히 적합하다. 본 발명의 화합물은 또한 죽상경화성 병태 (예를 들면, 죽상경화증), 관상 동맥 질환, 심혈관 질환, 뇌졸중, 허혈, 말초 혈관 질환을 갖는 인간 환자를 치료하는데, 및 예방적으로는 하나 이상의 위험 인자 (예를 들면, 고혈압, 흡연, 당뇨, 비만, 또는 고호모시스테인혈증)의 출현으로 인해 상기 장애에 대한 위험이 있는 환자에 대해서 특히 적합할 수 있다.
본원에 사용된 용어 "LDL-콜레스테롤-관련된 질환 또는 장애"는, 혈류 내에서 순환하는 LDL-콜레스테롤의 높은 수준으로부터 부분적으로 기인하는 질환 또는 병태를 지칭한다. 그렇게 제한하지 않더라도, LDL-콜레스테롤-관련된 질환 또는 장애는 고지질혈증, 고콜레스테롤혈증, 황색종증 및 심혈관 질환, 예컨대 죽상경화성 병태 (예를 들면, 죽상경화증), 관상 동맥 질환, 뇌졸중, 허혈 및 말초 혈관 질환을 포함한다.
본원에 사용된 용어 "치료하다/치료하는/치료" 및 "예방하다/예방하는/예방"은, 원하는 생물학적 반응, 즉 각각 치료 및 예방 효과를 유발시키는 것을 지칭한다. 본 발명에 따르면, 상기 치료 효과는 LDL-콜레스테롤-관련된 질환 또는 장애의 진행에서의 또는 관련된 증상의 중증도에서의 감소/감퇴, 또는 LDL-콜레스테롤-관련된 질환 또는 장애 및/또는 관련된 증상의 완전한 치유를 포함한다. 본 발명에 따르면, 예방 효과는 본 발명의 화합물 또는 조성물을 투여한 후에 LDL-콜레스테롤-관련된 질환 또는 장애, 및 관련된 증상의 발병, 진행, 또는 중증도에서의 지연 또는 감소 (예를 들면, 감소된 혈장 LDL/콜레스테롤 수준)를 포함할 수 있다. 일 구현예에서, 식 (1)의 화합물을 포함하는 본 발명의 화합물 또는 조성물은 대상체에서 LDL-콜레스테롤-관련된 질환 또는 장애를 치료 또는 예방한다. 본원에 기재된 방법, 조성물 제형 및 용도는 인간 및 동물 (예컨대 조류) 둘 모두에, 바람직하게는 포유동물에 적합하다.
병용 요법
화합물이 또 하나의 제제와 함께 투여되는 경우에, 이 두 개는 순서상 순차적으로 또는 동시에 (동일한 조성물로 또는 상이한 조성물로) 투여될 수 있다. 일부 구현예에서, 화합물을, 상기 질환/병태를 치료하는데 유용한 제2 제제 (예를 들면, 제2 콜레스테롤-저하제)를 사용한 요법이 또한 제공되는 대상체에 투여한다. 본 발명의 화합물과 함께 투여될 수 있는 활성 성분의 예는 비제한적으로 환자의 지질 프로파일을 개선시키는 다른 화합물, 예컨대 (a) HMG-CoA 환원효소 억제제, (예를 들면, 스타틴, 예컨대 로바스타틴, 심바스타틴, 플루바스타틴, 로서바스타틴, 프라바스타틴, 리바스타틴, 아토르바스타틴, 이타바스타틴, 피타바스타틴, 세리바스타틴 및 다른 스타틴). 스타틴은 콜레스테롤 생합성에서 중요 효소인 HMGCoA를 차단시킴으로써 콜레스테롤 합성을 억제한다; (b) 콜레스테롤 흡수 억제제, 예컨대 스타놀 에스테르, 베타-시토스테롤, 스테롤 글리코사이드, 예컨대 티퀘시드; 및 아제티디논, 예컨대 에제티미베; (c) 현재 임상 시험에서 HDL을 증가시키고 LDL 콜레스테롤을 감소시키는 콜레스테롤 에스테르 수송 단백질(CETP) 억제제 (예를 들면, 아나세트라피브 또는 달세트라피브); (d) 니아신 및 관련된 화합물, 예컨대 니코티닐 알코올, 니코틴아미드, 및 니코틴산 또는 그 염; (e) 담즙 산 격리제 (콜레스티라민, 콜레스티폴 (예를 들면, 콜레스티폴 하이드로클로라이드), 가교된 덱스트란의 디알킬아미노알킬 유도체, 콜레스티드(Colestid)®, 로콜레스트(LoCholest)®. 담즙 산 격리제는 장에서부터 간으로 담즙 산이 재사용되는 것을 방해한다; (f) 아실 CoA:콜레스테롤 아실전이효소(ACAT) 억제제, 예컨대 아바시미베 및 멜린아미드, 및 예컨대 선택적 ACAT-1 및 ACAT-2 억제제 및 이중 억제제; (g) PPARy 작용제, 예컨대 겜피브로질 및 페노피브르산 유도체 (피브레이트), 예컨대 클로피브레이트, 페노피브레이트, 베자피브레이트, 시프로피브레이트, 및 에토피브레이트; (h) 미소소체 트리글리세라이드 전달 단백질(MTP)/ApoB 분비 억제제; (i) 항산화성 비타민, 예컨대 비타민 C 및 E, 베타 카로틴; (j) 갑상선호르몬유사체(thyromimetics); (k) LDL 수용체 유도제, (l) 혈소판 응집 억제제, 예를 들면 당단백 Ilb/IIIa 피브리노겐 수용체 길항제 및 아스피린; (m) (시아노코발라민으로 또한 공지된) 비타민 B12; (n) 엽산 또는 그 약제학적으로 허용가능한 염 또는 에스테르, 예컨대 나트륨 염 및 메틸글루카민 염; (o) FXR 및 LXR 리간드, 예컨대 억제제 및 작용제 둘 모두; (p) ABCA1 유전자 발현을 향상시키는 제제; (q) 회장 담즙 산 수송체 및 ® 장쇄 알파, 오메고-디카복실산을 포함한다.
병용 요법 계획은 추가적일 수 있거나, 이것은 상승작용적 결과 (예를 들면, 두 개 제제의 병용 사용에 대해 예상된 것보다 큰 콜레스테롤에서의 감소)를 나타낼 수 있다. 일부 구현예에서, 화합물 및 콜레스테롤-저하제 (예를 들면, 스타틴, 피브레이트, 에제티미베 또는 그 조합체)를 사용한 병용 요법은 상승작용적 결과 (예를 들면, 콜레스테롤에서 상승작용적 감소)를 나타낸다. 일부 대상체에서는, 이에 의해 원하는 콜레스테롤 수준을 얻기 위한 콜레스테롤 저하제 용량에서의 감소가 얻어질 수 있다. 화합물은, 또 하나의 콜레스테를 저하제를 사용한 요법에 대해서는 비허용성인, 또는 또 하나의 콜레스테롤 저하제를 사용한 요법에 의해 부적절한 결과가 나타난 대상체 (예를 들면, 스타틴 요법에 대해 불충분한 LDL-C 감소를 경험한 대상체)에 유용할 수 있다.
본원에 기재된 화합물은 상승된 콜레스테롤 (예를 들면, LDL-콜레스테롤)을 갖는 대상체 (예를 들면, 200 mg/dl 또는 그 초과의 총 혈장 콜레스테롤 수준을 갖는 인간 대상체, 160 mg/dl 또는 그 초과의 LDL-C 수준을 갖는 인간 대상체)에게 투여될 수 있다.
키트
본 발명은 또한 적어도 하나의 본 발명의 화합물을 포함하는 키트를 포함한다. 예를 들면, 상기 키트는 LDL-콜레스테롤-관련된 질환 또는 장애를 예방 및/또는 치료하는 하나 이상의 화합물을 포함할 수 있다. 상기 키트는 하나 이상의 대조군 샘플 및 장치 (예를 들면, 주사기 등)를 임의로 포함할 수 있다. 상기 키트는 환자의 지질 프로파일을 개선시키는 하나 이상의 다른 활성 성분을 임의로 포함할 수 있다. 화합물 또는 성분은 적합한 용기에 포장될 수 있다. 상기 키트는 키트를 사용하기 위한 (예를 들면, 대상체에서 저 밀도 지질-콜레스테롤-관련된 질환 또는 장애를 예방 또는 치료하기 위해 상기 화합물을 사용하기 위한) 설명서를 추가로 포함할 수 있다.
본 발명을 충분히 설명하였지만, 본 발명을 예시적이며 추가 제한하는 것으로 의도되지 않는 하기 실시예 및 청구항에 의해 추가로 예시한다. 당업자는 단지 일반적인 실험을 사용하여 본원에 기재된 구체적인 과정에 대한 다수의 등가물을 인지하거나 확인할 수 있을 것이다. 그러한 등가물은 본 발명 및 청구범위의 범위 내에 있다. 본원을 통하여 인용된, 발행된 특허 및 공개된 특허 출원서를 포함한 모든 참고문헌의 내용이 본원에 참고로 포함된다.
본 발명을 수행하기 위한 방식(들)
본 발명은 하기 비-제한적인 예에 의한 추가의 세부사항에서 실증된다.
중간체 1
(S)-메틸 2-((S)-2-아미노-3-페닐프로판아미도)프로파노에이트 트리플루오로아세테이트
단계 1: DIPEA (46 mL, 260 mmol, 3.5 당량)을 10 분에 걸쳐 DMF (250 mL) 중 N-Boc-L-페닐알라닌 (20 g, 74 mmol), L-알라닌 메틸 에스테르 하이드로클로라이드 (12.6 g, 90.5 mmol, 1.2 당량) 및 HATU (42.9 g, 113 mmol, 1.5 당량)의 교반된 용액에 0 ℃에서 적가하고 그 다음 실온으로 따뜻하게 했다. 교반 18 시간 후, 반응 혼합물을 NaHCO3의 차가운 포화된 용액에 부었고 1:1 EtOAc:헥산 (2x)로 추출했다. 조합된 유기 분획을 물 및 염수로 세정하고, 건조시키고 (MgSO4), 여과하고 감압 하에서 농축했다. 잔류물을 헥산 중 증가하는 비율의 EtOAc로 용출하는 실리카겔 상에서 정제했다.
단계 2: CH2Cl2 (141 mL) 중 단계 1로부터의 생성물 (14.8 g, 42.2 mmol)의 교반된 용액을 0 ℃에서 TFA (32.5 mL, 422 mmol, 10 당량)로 적가 처리했다. 반응 혼합물을 차후에 실온으로 따뜻하게 하고 추가의 3 시간 동안 교반한 후 농축 건조했다. 잔류물을 Et2O로 분쇄하고 고형물을 여과로 수집하고 고진공 하에서 건조하여 표제 화합물을 얻었다.
중간체 2
(2S)-2-[(2S)-2-[(2S)-2-[(메톡시카보닐)아미노]-3-메틸부탄아미도]-3-페닐프로판아미도]프로판산
단계 1: 콜리딘 (3.0 mL, 23 mmol, 2.5 당량)을, 10 분에 걸쳐 DMF (30 mL) 중 N-메톡시카보닐-L-발린 (1.60 g, 9.13 mmol), 중간체 1 (3.49 g, 9.59 mmol, 1.05 당량) 및 HATU (3.82 g, 10.0 mmol, 1.1 당량)의 교반된 용액에 0 ℃에서, 이 온도에서 1 시간 동안 및 그 다음 실온에서 18 시간 동안 교반하면서 적가했다. 혼합물을 0 ℃로 재냉각하고 NaHCO3 (50 mL)의 포화된 수용액을 서서히 부가하고 그 다음 Et2O (50 mL)을 부가했다. 혼합물을 격렬하게 20 분 동안 교반하고 고형 생성물을 여과로 수집하고, 별도의 부분의 물 및 Et2O로 세정하고, 흡인 및 고진공하에서 건조시켰다.
단계 2: 1 M LiOH (10.65 mL, 10.65 mmol, 1.25 당량)을 THF (40 mL) 및 MeOH (20 mL)의 혼합물 중 단계 1로부터의 생성물 (3.47 g, 8.52 mmol)의 교반된 서스펜션에 적가하고 그 다음 몇 시간에 걸쳐 실온으로 서서히 따뜻하게 했다. 그 다음 용기 내용물을 0 ℃로 재냉각하고, 추가의 1 M LiOH (3.4 mL, 3.4 mmol, 0.4 당량)을 적가하고 혼합물을 실온에서 추가 2 시간 동안 교반한 후 0 ℃에서 1 M HCl로 pH 4로 산성화하고 에틸 아세테이트 (2x)로 추출했다. 조합된 유기 분획을 물, 반포화된 염수로 세정하고, 건조시키고 (MgSO4), 여과하고 감압 하에서 농축하여 표제 화합물을 얻었고, 이것을 추가 정제없이 사용했다.
중간체 3
2,5-디옥소피롤리딘-1-일 (2S)-2-[(2S)-2-[(2S)-2-[(메톡시카보닐)아미노]-3-메틸부탄아미도]-3-페닐프로판아미도]프로파노에이트
DIPEA (0.33 mL, 1.9 mmol, 3.0 당량)을 DMF (4.5 mL) 중 중간체 2 (0.25 g, 0.64 mmol) 및 TFA-NHS (0.40 g, 1.9 mmol, 3.0 당량)의 용액에 -78 ℃에서 부가했다. 그 다음 반응 혼합물을 0 ℃로 서서히 따뜻하게 하고 2 시간 동안 이 온도에서 교반한 후, 물 및 EtOAc 사이에서 분할했다. 층들을 분리하고 수성 층을 EtOAc (2x)로 추출했다. 조합된 유기 층들을로 세정하고 반포화된 염수로 세정하고, 건조시키고 (MgSO4), 여과하고 감압 하에서 농축하여 표제 화합물을 얻었고, 이것을 추가 정제없이 차후의 반응에서 사용했다.
중간체 4
메틸 (2S)-2-[(2S)-2-[(2S)-2-아미노-3-메틸부탄아미도]-3-페닐프로판아미도]프로파노에이트 하이드로클로라이드
단계 1: DIPEA (6.7 mL, 38 mmol, 3.5 당량)을 10 분에 걸쳐 DMF (35 mL) 중 중간체 1 (4.0 g, 11 mmol), N-Boc-L-발린 (2.62 g, 12.0 mmol, 1.1 당량) 및 HATU (5.0 g, 13 mmol, 1.2 당량)의 교반된 용액에 0 ℃에서 적가했다. 밤새 실온에서 교반한 후, 용기 내용물을 얼음 (100 mL), 포화된 수성 NaHCO3 (100 mL) 및 Et2O (200 mL)의 혼합물에 부었고 혼합물을 30 분 동안 교반했다. 고형 생성물을 여과로 수집하고, 물 및 1:1 Et2O/ 헥산으로 세정하고 흡인 및 고진공하에서 건조시켰다.
단계 2: TFA (7.3 mL, 95 mmol, 10 당량)을 CH2Cl2 (30 mL) 중 단계 1로부터의 생성물 (4.28 g, 9.52 mmol)의 교반된 용액에0 ℃에서 적가했다. 그 다음 반응 용기 내용물을 실온에서 5 시간 동안 유지한 후, 농축 건조했다. 잔류물을 Et2O로 분쇄하고 고형 생성물을 여과로 수집하고 고진공 하에서 건조했다.
단계 3: 디옥산 중 4 M HCl (14 mL, 56 mmol, 5.9 당량)을, 밤새 실온에서 교반하면서 MeOH (20 mL) 중 단계 2로부터의 생성물 (4.40 g, 9.52 mmol)의 교반된 서스펜션에 부가했다. 혼합물을 농축 건조한 후, Et2O를 20 분 동안 교반하면서 부가하고, 고형 생성물을 여과로 수집하고 고진공 하에서 건조하여 표제 화합물을 얻었다.
중간체 5
메틸 (4R/S)-4-아지도-4-[(1S,2S,6R,8S)-2,9,9-트리메틸-3,5-디옥사-4-보라트리사이클로[6.1.1.02,6]데칸-4-일]부타노에이트
반응 순서:
단계 1: DIPEA (6.2 mL, 44 mmol, 1.1 당량) 및 THF (40 mL)을 N2로 씻어낸 열-건조된 rbf에 두었다. 온도를 -78 ℃로 냉각하고 n-BuLi (헥산 중 2.5 M, 17 mL, 42 mmol, 1.0 당량)을 반응 용기에 2 분의 기간에 걸쳐 적가했다. 그 다음 반응 혼합물을 0 ℃로 따뜻하게 하고 5 분 동안 교반한 후 -78 ℃로 역냉각했다. THF (10 mL) 중 4,4,5,5,-테트라메틸-2-페닐설파닐메틸-1,3,2-디옥사보롤란 (10 mL, 42 mmol)의 용액을 반응 혼합물에 적가하고 그 다음 0 ℃에서 교반했다. 이 온도에서 1 시간 후, 반응 용기 내용물을 -78 ℃로 재냉각하고 메틸 아크릴레이트 (7.6 mL, 85 mmol, 2.0 당량)을 적가 도입했다. -78 ℃에서 6 시간 후, 반응을 200 mL의 10% 시트르산 수용액에 부어서 켄칭했다. 층들을 분리하고 수성 층을 Et2O (3x)로 추출했다. 유기물을 조합하고 반포화된 염수로 세정하고, 건조시키고 (MgSO4), 여과하고 감압 하에서 농축했다. 생성물을 헥산 중 증가하는 비의 EtOAc로 용출하는 실리카겔상 플래시 크로마토그래피로 단리했다.
단계 2: 단계 1로부터의 생성물 (1.80 g, 5.35 mmol), 아이오도메탄 (6.6 mL, 110 mmol, 20 당량) 및 아세토니트릴 (8 mL)을 N2 씻어 낸 밀봉 튜브에서 50 ℃에서 함께 가열했다. 이 온도에서 24 시간 후, 용기 내용물을 감압 하에서 농축했다. 잔류물을 직접적으로 다음 단계에서 사용했다.
단계 3: 단계 2로부터의 생성물 (1.89 g, 5.35 mmol)을 DMF (11 mL)에서 용해시키고 밤새 실온에서 교반하면서 나트륨 아자이드 (0.70 g, 11 mmol, 2.0 당량)으로 처리했다. 그 다음 반응 혼합물을 EtOAc 및 물 사이에서 분할했다. 층들을 분리하고 수성 층 EtOAc (2x)로 추출했다. 조합된 유기물을 반포화된 염수 (3x)로 세정하고, 건조시키고 (MgSO4), 여과하고 감압 하에서 농축했다. 잔류물을 직접적으로 다음 단계에서 사용했다.
단계 4: THF (21 mL) 중 단계 3으로부터의 생성물 (1.43 g, 5.35 mmol) 및 (1S,2S,3R,5S)-(+)-피난디올 (1.00 g, 5.90 mmol, 1.1 당량)의 용액을 실온에서 18 시간 동안 교반했다. 반응 용기 내용물을 농축 건조하고 잔류물을 헥산 중 증가하는 비의 EtOAc로 용출하는 실리카겔상 플래시 크로마토그래피로 정제하여 표제 화합물을 얻었다.
중간체 6
(4R/S)-4-아지도-4-[(1S,2S,6R,8S)-2,9,9-트리메틸-3,5-디옥사-4-보라트리사이클로[6.1.1.02,6]데칸-4-일]부탄아미드
중간체 5 (0.30 g, 0.94 mmol)을 42 시간 동안 실온에서 N2로 씻어 낸 밀봉 튜브에서 MeOH (4 mL, 30 mmol, 30 당량) 중7.0 M NH3와 함께 교반했다. 그 다음 용기 내용물을 감압 하에서 농축하고 잔류물을 EtOAc 중 증가하는 비의 MeOH로 용출하는 실리카겔상 플래시 크로마토그래피로 정제하여 표제 화합물을 얻었다.
중간체 7a
4-(3-(트리플루오로메틸)-3H-디아지린-3-일)벤조산
중간체 7b
3-(3-(트리플루오로메틸)-3H-디아지린-3-일)벤조산
반응 순서:
단계 1: Et3N (11 mL, 80 mmol, 1.5 당량) 및 DMAP (0.65 g, 5.3 mmol, 0.1 당량)을 0 ℃에서 CH2Cl2 (60 mL) 중 4-브로모벤질 알코올 (7a를 제조하기 위함) 또는 3-브로모벤질 알코올 (7b를 제조하기 위함) (10.00 g, 53.46 mmol)의 교반된 용액에, 그 다음 tert -부틸디메틸실릴 클로라이드 (8.86 g, 58.8 mmol, 1.1 당량)에 분배 방식으로 부가했다. 그 다음 반응 용기 내용물을 3 시간 동안 실온으로 따뜻하게 했다. 물을 부가하고 혼합물을 모든 고형물이 용해될 때까지 교반했다. 혼합물을 분별 깔때기로 이동시키고 CH2Cl2 (3x)로 추출했다. 조합된 유기 분획을 NH4Cl 및 물의 포화된 수용액으로 세정하고, 그 다음 건조시키고 (MgSO4), 여과하고 감압 하에서 농축했다. 잔류물을 직접적으로 다음 단계에서 사용했다.
단계 2: n-BuLi (헥산 중 2.5 M, 24 mL, 60 mmol, 1.1 당량)을 30 분에 걸쳐 THF (175 mL) 중 단계 1로부터의 생성물 (15.89 g, 52.74 mmol)의 교반된 용액에 -78 ℃에서 적가했다. 반응을 이 온도에서 30 분 동안 교반한 후 THF (30 mL) 중 에틸 트리플루오로아세테이트 (7.6 mL, 63 mmol, 1.2 당량)의 용액을 30 분에 걸쳐 적가 도입했다. 반응을 추가 90 분 동안 -78 ℃에서 교반한 후 EtOAc 및 NH4Cl의 포화된 용액 사이에서 분할했다. 상들을 분리하고 수성 층을 EtOAc (2x)로 추출했다. 조합된 유기 분획을 염수의 포화된 용액으로 세정하고, 건조시키고 (MgSO4), 여과하고 감압 하에서 농축했다. 잔류물을, 160-170 ℃에서 비등하는 분획을 수집하면서 고진공 (P = 10 mmHg)하에서 증류로 정제했다.
단계 3: 단계 2로부터의 생성물 (8.0 g, 25 mmol) 및 하이드록실아민 하이드로클로라이드 (1.92 g, 27.6 mmol, 1.1 당량)을 피리딘 (12 mL) 및 EtOH (6 mL)의 혼합물에서 환류에서 함께 가열했다. 3 시간 후, 용매를 감압 하에서 제거하고 잔류물을 EtOAc 및 물 사이에서 분할했다. 상들을 분리하고 수성 층을 EtOAc (2x)로 추출했다. 조합된 유기 분획을 염수의 포화된 용액으로 세정하고, 건조시키고 (MgSO4), 여과하고 감압 하에서 농축했다. 잔류물을 헥산 중 증가하는 비의 EtOAc로 실리카겔 상에서 정제했다.
단계 4: p-톨루엔설포닐 클로라이드 (3.29 g, 17.2 mmol, 1.15 당량)을 분배 방식으로 CH2Cl2 (26 mL) 중 단계 3으로부터의 생성물 (5.0 g, 15 mmol), Et3N (2.5 mL, 18 mmol, 1.2 당량) 및 DMAP (0.183 g, 1.5 mmol, 0.10 당량)의 교반된 용액에 0 ℃에서 부가했다. TLC로 판단한 바와 같이 반응의 완료 다음에, 혼합물을 감압 하에서 농축하고 잔류물을 EtOAc 및 물 사이에서 분할했다. 층들을 분리하고 유기 상을 추가의 물 및 그 다음 염수로 세정한 후 건조시키고 (MgSO4), 여과하고 감압 하에서 농축했다. 잔류물을 추가의 정제없이 다음 단계에서 사용했다.
단계 5: 농축된 NH4OH (68 mL)을 디옥산 (68 mL) 중 단계 4로부터의 생성물 (6.85 g, 14.1 mmol)의 교반된 용액에10 ℃에서 두꺼운-벽이 있는 유리관에서 교반했다. 튜브를 캡핑하고 내용물을 실온에서 48 시간 동안 교반했다. 그 다음 물 및 EtOAc를 부가하고 층들을 분리했다. 수성 층을 EtOAc (2x)로 추출하고 조합된 유기 분획을 염수의 포화된 용액으로 세정하고, 건조시키고 (MgSO4), 여과하고 감압 하에서 농축했다. 잔류물을 헥산 중 증가하는 비의 EtOAc로 실리카겔 상에서 정제했다.
단계 6: Et2O (54 mL) 중 단계 5로부터의 생성물 (1.8 g, 5.4 mmol)을 Ag2O (2.50 g, 10.9 mmol, 2 당량)와 함께 실온에서 교반했다. 4 시간 후, 제 2 부분의 Ag2O (2.50 g, 10.9 mmol, 2 당량)을 부가하고 혼합물을 실온에서 밤새 교반했다. 그 다음 헥산 (100 mL)을 부가하고 혼합물을 실리카겔 패드를 통해 여과했다. 패드를 9:1 헥산/EtOAc로 세정하고 여과물을 감압 하에서 농축했다. 잔류물을 직접적으로 다음 단계에서 사용했다.
단계 7: TBAF (THF 중 1.0 M, 6.2 mL, 6.2 mmol, 1.2 당량)을 THF (25 mL) 중 단계 6으로부터의 생성물 (1.70 g, 5.15 mmol)의 용액에 0 ℃에서 적가하고 그 다음 실온에서 1 시간 동안 교반했다. 그 다음 혼합물을 EtOAc 및 물 사이에서 분할하고 상들을 분리했다. 수성 상을 EtOAc (2x)로 추출하고 조합된 유기물을 염수의 포화된 용액으로 세정하고, 건조시키고 (MgSO4), 여과하고 감압 하에서 농축했다. 잔류물을 헥산 중 증가하는 비의 EtOAc로 실리카겔 상에서 정제했다.
단계 8: 존스 시약 (2.5 M, 0.56 mL, 1.4 mmol, 2.0 당량)을, 0 ℃에서 1 시간 동안 교반하면서 아세톤 (7.0 mL) 중 단계 6으로부터의 생성물 (0.15 g, 0.69 mmol)의 용액에 부가했다. 그 다음 혼합물을 EtOAc로 희석하고 수성 층에서 색상이 보이지 않을 때까지 분별 깔때기에서 물로 세정했다. 유기 층을 염수로 세정하고, MgSO4 상에서 건조시키고, 여과하고 감압 하에서 농축하여 표제 화합물을 얻었다.
중간체 7c
2-(4-(3-(트리플루오로메틸)-3H-디아지린-3-일)페닐)아세트산
중간체 7d
2-(3-(3-(트리플루오로메틸)-3H-디아지린-3-일)페닐)아세트산
반응 순서:
단계 1: MsCl (0.22 mL, 2.8 mmol, 1.5 당량)을, 0 ℃에서 교반하면서 이 온도에서 15 분 동안 및 그 다음 실온에서 교반하면서 Et2O (19 mL) 중 중간체 7a 또는 7b의 제조에서 단계 7로부터의 파라- 또는 메타 -생성물 (400 mg, 1.85 mmol) 및 Et3N (0.52 mL, 3.7 mmol, 2 당량)의 용액에 적가했다. 2 시간 후, 혼합물을 여과하고, 고형 물질을 에테르로 세정하고, 여과물을 진공에서 농축했다. 잔류물을 다음 단계에서 추가 정제없이 사용했다.
단계 2: 단계 1로부터의 생성물 (535 mg, 1.82 mmol) 및 NaCN (134 mg, 2.70 mmol, 1.5 당량)을 DMF (10 mL)에서 실온에서 밤새 함께 교반했다. 혼합물을 차후에 물 및 Et2O 사이에서 분할하고 층들을 분리했다. 유기 상을 물, 그 다음 염수로 세정하고, 건조시키고 (MgSO4), 여과하고 농축했다. 잔류물을 1/4 EtOAc/헥산으로 용출하는 실리카겔상 플래시 크로마토그래피로 정제했다.
단계 3: 단계 2로부터의 생성물 (200 mg, 0.89 mmol)을 EtOH (4.5 mL) 중 1 M NaOH (4.5 mL, 5 당량)와 함께 65 ℃에서 밤새 교반했다. 실온으로 냉각한 후, 반응을 1 M HCl (5 mL)의 부가로 켄칭하고 혼합물을 물 및 Et2O 사이에서 분할했다. 층들을 분리하고 수성 상을 추가의 Et2O (2x)로 추출했다. 유기물을 조합하고 염수로 세정하고, 건조시키고 (MgSO4), 여과하고 농축했다. 잔류물을 1% AcOH를 함유하는 1/9 EtOH/헥산으로 용출하는 실리카겔상 플래시 크로마토그래피로 정제하여 표제 화합물을 옅은 황색 고형물로서 얻었다.
중간체 8
4-아미노-6,6,6-트리플루오로-5-하이드록시헥산아미드 하이드로클로라이드
반응 순서:
단계 1: 트리플루오로아세트알데하이드 에틸 헤미아세탈 (90%, 15 mL, 110 mmol, 1.8 당량), 메틸 4-니트로부티레이트 (8.0 mL, 62 mmol), 플루오르화칼륨 (3.65 g, 62.8 mmol) 및 i-PrOH (20 mL)을 밀봉된 반응 용기에 두었고 혼합물을 실온에서 20 시간 동안 교반했다. 그 다음 혼합물을 EtOAc (200 mL) 및 5% (w/w) 수성 시트르산과 염수 (300 mL)의 1:1 혼합물 사이에서 분할하고 층들을 분리했다. 유기 상을 추가의 염수 (200 mL)로 세정하고 조합된 수성 층들을 EtOAc (200 mL)로 추출했다. 유기 층들을 조합하고 MgSO4 상에서 건조시키고, 여과하고 20 ℃에서 배쓰 온도를 유지하면서 회전식 증발로 감압 하에서 농축했다. 잔류물을 20% EtOAc/헥산으로 용출하여 실리카겔상 칼럼 크로마토그래피로 정제했다.
단계 2: 단계 1로부터의 생성물 (13.0 g, 52.9 mmol), 디-tert-부틸 디카보네이트 (15.0 g, 68.7 mmol, 1.3 당량) 및 10% Pd/C (4.00 g)의 혼합물을 격막-캡핑된 rbf에서 진공 하에서 두었고 탈가스된 EtOAc (100 mL)을 주사기로 도입했다. 그 다음 혼합물을 라텍스 밸룬을 통해 H2의 대기 하에서 두었고 반응 용기를 초음파 배쓰에서 2 분 동안 초음파처리하고 그 다음 실온에서 24 시간 동안 내용물을 교반했다. TLC로 판단한 바와 같이 반응의 완료 다음에, 용기를 N2로 씻어내고 CH2Cl2을 부가했다. 서스펜션을 셀라이트 패드를 통해 여과하고 패드를 EtOAc 및 CH2Cl2의 혼합물로 철저히 세정했다. 여과물을 진공에서 농축하고 잔류물을 Et2O/헵탄의 1:4 혼합물로 처리했다. 4 시간 동안 정치한 후, 고형 생성물을 흡인 여과로 수집하고 소량의 1:4 Et2O/헵탄으로 세정하여 원하는 부분입체이성질체를 >10:1 부분입체이성질체 순도로 얻었다.
단계 3: MeOH (7.0 M, 30 mL, 200 mmol, 20 당량) 중 NH3의 용액을 단계 2로부터의 생성물 (3.0 g, 9.5 mmol)에 0 ℃에서 N2 하에서 두꺼운 벽이 있는 유리관에서 부가하고 입구를 테플론 스크류 캡으로 밀봉하고 그 다음 35 ℃에서 5 일 동안 내용물을 가열했다. 그 다음 혼합물을 감압 하에서 농축하고 잔류물을 Et2O과 함께 밤새 교반했다. 고형 생성물을 흡인 여과로 수집하고 고진공 하에서 건조했다.
단계 4: 1,4-디옥산 중 HCl의 용액 (4 M, 1.2 mL, 5 mmol, 5 당량)을 CH2Cl2 (2 mL) 중 단계 3으로부터의 생성물 (0.30 g, 1.0 mmol)의 서스펜션에 0 ℃에서 적가하고 그 다음 반응이 LCMS에 의해 완료된 것으로 결정될 때까지 실온에서 교반했다 (3 h). 그 다음 반응 혼합물을 감압 하에서 농축 건조하여 표제 화합물을 얻었다. 물질을 N2 대기 하에서 -15 ℃에서 보관하고 추가 정제없이 차후의 반응에서 사용했다.
중간체 9
(4S)-4-아미노-6,6,6-트리플루오로-5-하이드록시헥산아미드 하이드로클로라이드
반응 순서:
단계 1: 건조 THF (30 mL) 중 (S)-3-tert-부톡시카보닐-4-(2-벤질옥시카보닐에틸)옥사졸리딘-5-온 (4.97 g, 14.2 mmol)의 용액을 CF3TMS (2.5 mL, 17 mmol, 1.2 당량) 및 CsF (0.34 g, 2.2 mmol, 0.15 당량)으로 N2의 대기 하에서 처리했다. 그 다음 반응 용기를 초음파 배쓰에서 초음파처리하고 반응의 진행을 TLC로 모니터링했다. 1 시간 후, 물 (2.5 mL)을 부가하고 초음파처리를 중간체 실릴 에테르의 가수분해가 TLC에 의해 완료된 것으로 판단될 때까지 계속했다 (30 분). EtOAc를 부가하고 혼합물을 물 및 염수로 세정했다. 수성 상들을 EtOAc로 추출하고 조합된 유기 층들을 Na2SO4/MgSO4 상에서 건조시키고, 여과하고 진공 하에서 농축하고 잔류물을 직접적으로 다음 단계에서 사용했다.
단계 2: THF 중 LiBH4 (2.0 M, 6.5 mL, 13 mmol, 1.05 당량)의 용액을 THF (50 mL) 중 단계 1로부터의 생성물 (5.28 g, 12.6 mmol)의 용액에, 내부 온도를 30 ℃ 미만으로 유지하는데 충분한 속도로 적가했다. TLC로 판단한 바와 같이 반응의 완료 다음에 (5 분), 반응 용기를 0 ℃로 냉각하고 반응을 빙수의 부가로 켄칭했다. 반응 용기 내용물을 EtOAc 및 물 사이에서 분할하고 층들을 분리했다. 수성 상을 추가의 EtOAc (2x)로 추출하고 조합된 유기물을 염수로 세정하고, MgSO4/Na2SO4 상에서 건조시키고, 여과하고 진공 하에서 농축하여 생성물을 부분입체이성질체의 2.2:1 혼합물로서 얻었다. 이들을 톨루엔 중 증가하는 비율의 EtOAc (0-30%)로 용출하는 반복된 실리카겔상 플래시 크로마토그래피로 분리했다. 원하는 부분입체이성질체는 더 극성인 화합물에 해당하고 반응에서 생산된 소수의 이성질체였다.
단계 3: MeOH 중NH3의 용액 (7.0 M, 15 mL, 100 mmol, 110 당량)을 단계 2로부터의 생성물 (0.38 g, 0.90 mmol)에 0 ℃에서 N2 하에서 두꺼운 벽이 있는 유리관에서 부가하고 입구를 테플론 스크류 캡으로 밀봉하고 그 다음 45 ℃에서 48 시간 동안 내용물을 가열했다. 그 다음 혼합물을 감압 하에서 농축하고 잔류물을 에테르/헵탄 (2 x)으로 공비증류한 후 Et2O로 1 시간 동안 분쇄했다. 고형 생성물을 흡인 여과로 수집하고 고진공 하에서 건조했다.
단계 4: 1,4-디옥산 중 HCl의 용액 (4 M, 0.70 mL, 2.8 mmol, 28 당량)을 CH2Cl2 (0.7 mL) 중 단계 3으로부터의 생성물 (30 mg, 0.10 mmol)의 서스펜션에 0 ℃에서 적가하고 그 다음 반응이 LCMS에 의해 완료된 것으로 결정될 때까지 실온에서 교반했다 (2시간). 그 다음 반응 혼합물을 감압 하에서 농축 건조하여 표제 화합물을 얻었다. 물질을 추가의 정제없이 차후의 반응에서 이용했다.
상기 순서는 (4R, 5S)- 및 (4R, 5R)-4-아미노-6,6,6-트리플루오로-5-하이드록시헥산아미드 하이드로클로라이드를 (R)-3-tert-부톡시카보닐-4-(2-벤질옥시카보닐에틸)옥사졸리딘-5-온으로부터 제조하기 위해 또한 이용될 수 있다.
중간체 10
4-아미노-6-플루오로-5-하이드록시헥산아미드 하이드로클로라이드
반응 순서:
단계 1: CH2Cl2 (15 mL) 중 DMSO (8.7 mL, 120 mmol, 3 당량)의 용액을 CH2Cl2 (50 mL) 중 옥살릴 클로라이드 (4.2 mL, 48 mmol, 1.2 당량)의 용액에 -78 ℃에서 서서히 부가하고, 그 다음 이 온도에서 30 분 동안 교반했다. CH2Cl2 (20 mL) 중 2-플루오로에탄올 (2.4 mL, 41 mmol)의 용액을 그 다음 적가 도입하고 혼합물을 -40 ℃로 1 시간에 걸쳐 서서히 따뜻하게 하고 그 다음 -78 ℃로 재냉각한 후 Et3N (28.5 mL, 204 mmol, 5 당량)의 적가했다. 균질성을 보장하기 위해 손으로 반응 용기를 흔드는 것이 필요한 불형성 물질의 형성을 부가의 과정에 걸쳐 유지했다. 서스펜션을 그 다음 실온으로 따뜻하게 하고 추가의 1.5 시간 동안 교반하고, 그 후 메틸 4-니트로부티레이트 (4 mL, 31.2 mmol, 0.77 당량)을, 수조에서 실온에서 냉각하면서 반응 용기에 부가했다. 혼합물을 -15 ℃에서 밤새 보관하고 그 다음 실온에서 2.5 시간 동안에 교반한 후, EtOAc (100 mL)과 10% 시트르산 및 염수로부터 제조된 수용액 사이의 혼합물을 분할했다. 수성 상을 EtOAc (100 mL)로 추출하고 조합된 유기 층들을 염수로 세정하고, MgSO4 상에서 건조시키고, 여과하고 회전식 증발로 감압 하에서 20 ℃의 배쓰 온도에서 농축했다. 잔류물에 대해 헥산 중 증가하는 비율의 EtOAc (0-50%)로 용출하는 실리카겔상 플래시 크로마토그래피를 수행하여 생성물을 부분입체이성질체의 혼합물로서 얻었다.
단계 2: 단계 1로부터의 생성물 (4.01 g, 20.0 mmol), 디-tert-부틸 디카보네이트 (5.23 g, 24.0 mmol, 1.25 당량) 및 10% Pd/C (1.00 g)을 진공 하에서 격막 캡핑된 rbf에서 두었고 탈가스된 EtOAc (50 mL)을 주사기로 도입했다. 그 다음 혼합물을 H2의 대기 하에서 라텍스 밸룬(balloon)을 통해 두었고 반응 용기 내용물을 2 분 동안 초음파처리하고 그 다음 내용물을 실온에서 24 시간 동안 교반했다. 그 다음 반응 용기 내용물의 초음파처리를 그 다음 또 2 분의 기간 동안에 반복하고 혼합물을 추가 24시간 동안 실온에서 교반했다. TLC로 판단한 바와 같이 반응의 완료 다음에, 용기를 N2로 씻어 내고 CH2Cl2을 부가했다. 서스펜션을 셀라이트 패드를 통해 여과하고 패드를 EtOAc 및 CH2Cl2의 혼합물로 철저히 세정했다. 여과물을 진공에서 농축하고 잔류물을 헥산 중 증가하는 비율의 EtOAc (10-50%)로 용출하는 실리카겔상 플래시 크로마토그래피로 정제했다. 주요 부분입체이성질체 용출된 제 1 (더 적은 극성) 및 소수의 부분입체이성질체 용출된 제 2 (더 많은 극성). 부분입체이성질체 둘 모두를 Et2O/헥산으로 분쇄하여 추가 정제하여 1H NMR로 측정된 바와 같이 생성물을 >10:1 부분입체이성질체 순도로 얻었다.
단계 3: MeOH (7.0 M, 6.0 mL, 42 mmol, 30 당량) 중 NH3의 용액을 0 ℃에서 N2 하에서 두꺼운 벽이 있는 유리관에서 단계 2에서 단리된 생성물 (400 mg, 1.43 mmol)에 부가하고 입구를 테플론 스크류 캡으로 밀봉하고 그 다음 내용물을 40 ℃에서 3 일 동안 가열했다. 그 다음 혼합물을 감압 하에서 농축 건조하고 잔류물을 Et2O로 분쇄했다. 고형 생성물을 흡인 여과로 수집하고 진공하에서 건조했다.
단계 4: 1,4-디옥산 중 HCl의 용액 (4.0 M, 1.0 mL, 4.0 mmol, 14 당량)을 CH2Cl2 (1 mL) 중 단계 3으로부터의 생성물 (75 mg, 0.28 mmol)의 서스펜션에 0 ℃에서 적가하고 그 다음 반응이 LCMS에 의해 완료된 것으로 결정될 때까지 실온에서 교반했다 (2시간). 그 다음 반응 혼합물을 감압 하에서 농축 건조하여 표제 화합물을 얻었고, 이것을 즉시 차후의 반응에서 추가 정제없이 즉시 사용했다.
중간체 11
4-아미노-5-하이드록시헥산아미드
반응 순서:
단계 1: T3P (EtOAc 중 50 wt.%, 21 mL, 35 mmol, 1.2 당량) 및 DIPEA (12.5 mL, 71.8 mmol, 2.4 당량)을 DMF (15 mL) 중 N-Cbz-L-글루탐산 (10.0 g, 29.6 mmol) 및 N,O-디메틸하이드록실아민 하이드로클로라이드 (3.46 g, 35.5 mmol, 1.2 당량)의 혼합물에 계속하여 0 ℃에서 부가하고 그 다음 실온에서 1 시간 동안 교반했다. 그 다음 반응 용기 내용물을 차가운 수성 0.5 M HCl에 부었고 EtOAc (2x)로 추출했다. 조합된 유기물을 차가운 0.5 M HCl, 그 다음 염수로 세정했다. 조합된 유기물을 MgSO4 상에서 건조시키고 실리카겔의 패드를 통해 여과했다. 패드를 추가의 EtOAc로 세정하고 여과물을 농축 건조했다. 잔류물을 직접적으로 다음 단계에서 사용했다.
단계 2: Et2O (34 mL, 100 mmol, 3.0 당량) 중 3.0 M MeMgBr의 용액을 THF (100 mL) 중 단계 1로부터의 생성물 (12.9 g, 34.0 mmol)의 용액에 -78 ℃에서. 부가의 완료 다음에, 혼합물을 실온으로 따뜻하게 하고, 반응이 LCMS에 의해 완료(2 시간)시 차가운 수성 0.5 M HCl에 부었고 EtOAc (2x)로 추출했다. 조합된 유기물을 차가운 수성 0.5 M HCl 및 염수로 세정하고, 그 다음 MgSO4 상에서 건조시키고, 여과하고 진공 하에서 농축 건조했다. 케톤 생성물을 헥산 중 증가하는 비율의 EtOAc (25-50%)로 용출하는 실리카겔상 플래시 크로마토그래피로 단리했다.
단계 3: TFA (10 mL, 130 mmol, 5.4 당량)을 CH2Cl2 (2 mL) 중 단계 2로부터의 생성물 (8.08 g, 24.1 mmol)의 교반된 용액에-30 ℃에서 적가했다. 그 다음 반응 용기 내용물을 실온으로 서서히 따뜻하게 하고 이 온도에서 3 시간 동안 교반한 후 농축 건조했다. 생성물을 함유하는 잔여물을 톨루엔 (3x)으로 공비증류하고, 고진공 하에서 건조하고 직접적으로 다음 단계에서 사용했다.
단계 4: NaBH4 (170 mg, 4.44 mmol, 2.5 당량) 및 MeOH (1 mL)을 THF (4 mL) 중 단계 3으로부터의 생성물 (500 mg, 1.79 mmol)의 용액에 -78 ℃에서 계속해서 부가하고 그 다음 이 온도에서 45 분 동안 교반하면서 0 ℃로 따뜻하게 했다. 그 다음 반응 용기 내용물을 10% (w/w) 시트르산 수용액 및 EtOAc 사이에서 분할하고, 층들을 분리했다. 수성 상을 추가의 EtOAc로 추출하고 조합된 유기물을 염수로 세정하고, Na2SO4 상에서 건조시키고, 여과하고, DIPEA (0.62 mL)로 처리하고 회전식 증발로 감압 하에서 20 ℃의 배쓰 온도에서 농축했다. 잔류물을 DMF (5 mL)에서 0 ℃에서 용해시키고 DMAP (22 mg, 0.18 mmol, 0.1 당량), HATU (817 mg, 2.15 mmol, 1.2 당량), DIPEA (1.87 mL, 10.7 mmol, 6 당량) 및 NH4Cl (481 mg, 9.0 mmol, 5 당량)으로 처리하고, 그 다음 실온으로 따뜻하게 하고 밤새 교반했다. 그 다음, 농축된 수성 NH4OH (1.8 mL, 25 mmol, 14 당량) 및 DMF (5 mL)을 실온에서 3 일 동안 계속해서 교반하면서 부가했다. 그 다음 반응 용기 내용물을 염수 (50 mL) 에 부었고 EtOAc (50 mL x 2)로 추출했다. 조합된 유기 층들을 MgSO4 상에서 건조시키고, 여과하고 농축 건조하고, 잔류물을 Et2O/EtOAc의 혼합물로 분쇄했다. 고형 생성물을 흡인 여과로 수집하고 고진공 하에서 건조했다.
단계 5: 단계 4로부터의 생성물 (0.27 g, 0.95 mmol), 10% Pd/C (100 mg)의 혼합물을 고무 격막 밀봉된 플라스크에서 고진공 하에서 두었다. 그 다음, 탈가스된 MeOH (5 mL)을 주사기로 부가하고 혼합물을 라텍스 밸룬으로 공급된 N2 대기 하에서 두었다. 반응 용기를 초음파 배쓰에 함침시키고 2 분 동안 초음파처리했다. N2 대기를 라텍스 밸룬으로H2의 전달에 의해 퍼징하고, 혼합물을 실온에서 교반했다. 5 시간 후, 반응은 TLC 분석으로 완료된 것으로 판단되었다. H2 대기를 N2으로 대체했고, CH2Cl2을 부가하고 서스펜션을 셀라이트 패드를 통해 여과하고 이것을 차후에 MeOH/CH2Cl2의 혼합물로 세정했다. 여과물을 진공에서 농축하고 EtOAc 중 MeOH로 잔류물을 분쇄하여 표제 화합물을 얻었다.
중간체 12-14의 제조
반응 순서:
중간체 12
(S)-2-((S)-2-((S)-2-데칸아미도아미도-3-메틸부탄아미도)-3-페닐프로판아미도)프로판산
단계 1: 데카노일 클로라이드 (0.73 mL, 3.6 mmol, 1.1 당량) 및 Et3N (1.6 mL, 12 mmol, 3.5 당량)을 THF (15 mL) 중 중간체 4 (1.25 g, 3.24 mmol)의 교반된 서스펜션에0 ℃에서 계속해서 적가하고, 그 다음 실온으로 서서히 따뜻하게 했다. 밤새 교반한 후, 추가의 THF (70-80 mL)을 부가하여 혼합물의 교반을 용이하게 하고 제 2 부분의 데카노일 클로라이드 (0.10 mL, 0.50 mmol, 0.15 당량)을, 반응이 LCMS에 의해 완료(24시간)된 것으로 판단될 때까지 실온에서 교반을 계속하면서 부가했다. 그 다음 반응 용기 내용물을 수성 0.5 M HCl, EtOAc 및 헥산의 차가운 혼합물에 부었다. 고형 생성물을 중력 여과로 수집하고, 물 및 1:1 Et2O/헥산으로 세정한 후 고진공 하에서 건조했다.
단계 2: 1 M LiOH (9 mL, 9 mmol, 3 당량)의 수용액을 MeOH (9 mL) 및 THF (18 mL) 중 단계 1로부터의 생성물 (1.47 g, 2.92 mmol)의 교반된 서스펜션에 0 ℃에서 부가하고 그 다음 실온으로 따뜻하게 했다. 4 시간 후, 추가의 MeOH (18 mL)을 부가하고 서스펜션을 밤새 실온에서 교반했다. LCMS 분석은, 반응이 24 시간 후 완료에 도달하지 않은 것으로 명시했다. 혼합물을 0 ℃로 재냉각하고 추가의 부분의 1 M LiOH (3 mL, 3 mmol, 1 당량)을 부가하고, 그 다음 실온에서 두 번째 24 시간의 기간 동안에 교반했다. 이 시점에서, 반응은 반응 매질 중 개시 에스테르의 낮은 용해도로 인해 완료에 여전히 도달하지 못했다. 제 3 부분의 MeOH 및 1 M LiOH (3 mL, 3 mmol, 1 당량)의 부가는 반응의 완료를 위해 필요했다. 혼합물을 차후에 여과하여 고형물을 제거하고 여과물을 1 M HCl로 pH 1로 산성화하고 그 다음 농축 건조했다. 고형 잔류물을 물에서 현탁시키고, 흡인 여과로 수집하고 물 및 Et2O로 세정했다. 흡인 및 고진공 하에서 고형물을 건조하여 표제 화합물을 제공했다.
중간체 13
(S)-2-((S)-2-((S)-3-메틸-2-(2-(4-(트리플루오로메톡시)페닐)아세트아미도)부탄아미도)-3-페닐프로판아미도)프로판산
단계 1: DIPEA (0.51 mL, 2.9 mmol, 3.5 당량)을 10 분에 걸쳐 DMF (3 mL) 중 중간체 4 (0.32 g, 0.83 mmol), 4-(트리플루오로메톡시)페닐아세트산 (0.20 g, 0.91 mmol, 1.1 당량) 및 HATU (0.38 g, 1.0 mmol, 1.2 당량)의 용액에 0 ℃에서 적가하고 그 다음 밤새 교반하면서 실온으로 서서히 따뜻하게 했다. 그 다음 반응 용기 내용물을 Et2O로 희석하고 얼음 및 포화된 수성 NaHCO3의 혼합물에 부었다. 이러한 혼합물을, 얼음이 용융될 때까지 30 분 동안 교반하고, 고형 생성물을 흡인 여과로 수집하고, 물 및 Et2O로 세정하고 고진공 하에서 건조했다.
단계 2: 1 M LiOH (3 mL, 3 mmol, 4 당량)의 수용액을 MeOH (3 mL) 및 THF (6 mL) 중 단계 1로부터의 생성물 (0.40 g, 0.73 mmol)의 빠르게 교반된 서스펜션에 0 ℃에서 부가했다. 이 온도에서 15 분 후, 반응 용기를 실온으로 따뜻하게 하고 반응의 진행을 LC-MS로 모니터링했다. 2 시간 후, 혼합물을 0 ℃로 냉각하고 추가 1 시간 동안 실온에서 교반하면서 0.05 M HCl (100 mL)의 수용액의 부가로 pH 1로 산성화했다. 고형 생성물을 흡인 여과로 수집하고, 물로 세정하고 흡인 및 고진공 하에서 건조하여 표제 화합물을 얻었다.
중간체 14
(S)-2-((S)-2-((S)-2-([1,1'-바이페닐]-4-일카복사미도)-3-메틸부탄아미도)-3-페닐프로판아미도)프로판산
단계 1: DIPEA (0.42 mL, 2.4 mmol, 3.5 당량)을 10 분에 걸쳐 DMF (3 mL) 중 중간체 4 (0.32 g, 0.83 mmol, 1.2 당량), 바이페닐-4-카복실산 (145 mg, 0.732 mmol) 및 HATU (316 mg, 0.832 mmol, 1.2 당량)의 용액에 0 ℃에서 적가하고 그 다음 실온에서 3 일 동안 교반했다. 그 다음 혼합물을 EtOAc로 희석하고, 실온에서 교반하면서 얼음 용융될 때까지 (약 30 분), 얼음 및 NaHCO3의 포화된 수용액의 혼합물에 부었다. 고형 생성물을 흡인 여과로 수집하고, 물 및 EtOAc로 연속하여 세정한 후 흡인 및 고진공하에서 건조시켰다.
단계 2: 1 M LiOH (3 mL, 3 mmol, 5 당량)의 수용액을 MeOH (3 mL) 및 THF (6 mL) 중 단계 1로부터의 생성물 (0.33 g, 0.62 mmol)의 서스펜션에 0 ℃에서 부가하고 그 다음 반응이 완료 (3 시간)된 것으로 LCMS에 의해 판단될 때까지 실온에서 빠르게 교반했다. 그 다음 반응 용기 내용물을 0 ℃로 재냉각하고 0.05 M HCl (100 mL)의 수용액의 부가로 산성화하고 그 다음 실온에서 1 시간 동안 교반했다. 고형 생성물을 흡인 여과로 수집하고, 물 및 Et2O로 세정하고, 흡인 및 고진공 하에서 건조하여 표제 화합물을 얻었다.
일반적인 순서 1:
단계 1 (RCO2H에 대해): DIPEA (3.5 eq)을, 실온으로 서서히 따뜻하게 하면서 DMF (3.0 mL) 중 중간체 4 (0.83 mmol), HATU (1.2 당량) 및 적절한 산 (1.1 당량)의 교반된 서스펜션에 0 ℃에서 부가하고, 밤새 교반했다. 그 다음, 포화된 NaHCO3 수용액 및 EtOAc을 부가하고 고형 생성물을 흡인 여과로 수집하고, 고진공 하에서 물 및 EtOAc로 세정했다.
단계 1 (RC(O)Cl에 대해): 적절한 산 클로라이드 (1.1 당량)을 CH2Cl2 (13 mL) 중 중간체 4 (1.3 mmol) 및 DIPEA (2.2 당량)의 교반된 서스펜션에 0 ℃에서 나누어서 부가하고, 그 다음 실온으로 서서히 따뜻하게 하고 밤새 교반했다. 추가의 CH2Cl2 및 물을 반응 용기에 부가하고 고형 생성물을 흡인 여과로 단리하고, CH2Cl2 및 물로 세정하고 고진공 하에서 건조했다.
단계 2: 1 M 수성 LiOH (4 당량)을 MeOH (3 mL) 및 THF (6 mL) 중 단계 1로부터의 생성물 (0.73 mmol)의 교반된 서스펜션에 0 ℃에서 적가했다. 15 분 후, 반응을 실온으로 따뜻하게 하고 추가 3 시간 동안 교반했다. 그 다음 부서진 얼음을 부가하고 혼합물을 1 M HCl로 pH 3으로 산성화했다. 추가 1 시간 동안 교반한 후, 고형 생성물을 흡인 여과로 단리하고 고진공 하에서 건조했다. 이들 조건 하에서 침전되지 못한 유사체를 EtOAc (3x)에 의한 추출성 워크업으로 단리했다. 조합된 유기물을 염수로 세정하고, 건조시키고 (Na2SO4), 여과하고 농축하고 잔류물을 직접적으로 다음 단계에서 사용했다.
단계 3: DIPEA (2.5 당량)을 DMF (1 mL) 중 단계 2로부터의 생성물 (0.14 mmol), HATU (1.1 당량) 및 아미노메틸보론산 피나콜에스테르 하이드로클로라이드 (1.1 당량) 또는 보로-Gly-(+)-피난디올 하이드로클로라이드 (1.1 당량)의 교반된 서스펜션에 0 ℃에서 부가하고 그 다음 밤새 교반하면서 실온으로 서서히 따뜻하게 했다. 그 다음 반-포화된 NaHCO3 수용액 및 EtOAc를 부가하고 혼합물을 초음파 배쓰에서 1 시간 동안 진탕했다. 고형 생성물을 흡인 여과로 단리하고 고진공 하에서 건조했다.
일반적인 순서 2:
단계 1: DIPEA (38 mmol, 3.5 당량)을 10 분에 걸쳐 DMF (35 mL) 중 중간체 1 (11 mmol), L-발린 유도체 (12 mmol, 1.1 당량) 및 HATU (13 mmol, 1.2 당량)의 용액에 0 ℃에서 적가하고 그 다음 밤새 교반하면서 실온으로 서서히 따뜻하게 했다. 그 다음 혼합물을 부서진 얼음 (100 mL), 포화된 수성 NaHCO3 (100 mL) 및 Et2O (200 mL)의 혼합물에 부었고 얼음이 용용될 때까지 30 분 동안 교반했다. 고형 생성물을 흡인 여과로 수집하고, 물 및 1:1 Et2O/ 헥산으로 세정하고, 고진공 하에서 건조했다.
단계 2: 단계 1로부터의 생성물 (3.33 mmol)을 THF (20 mL) 및 MeOH (10 mL)의 혼합물에서 현탁시키고 1 M LiOH (4.3 mL, 4.3 mmol, 1.3 당량)로 0 ℃에서 처리하고 그 다음 밤새 교반하면서 실온으로 서서히 따뜻하게 했다. 그 다음 혼합물을 0 ℃로 재냉각하고, 1 M HCl로 pH 4로 산성화하고, EtOAc (3x)로 추출했다. 조합된 유기물을 건조시키고 (MgSO4), 여과하고 농축하고 잔류물을 직접적으로 다음 단계에서 사용했다.
단계 3: DIPEA (2.0 mmol, 2.5 당량)을 DMF (4.5 mL) 중 단계 2로부터의 생성물 (0.90 mmol), 보로-Gly-(+)-피난디올 하이드로클로라이드 (1.1 mmol, 1.2 당량) 및 HATU (1.03 mmol, 1.1 당량)의 교반된 서스펜션에 0 ℃에서 적가하고 그 다음 실온으로 서서히 따뜻하게 했다. 밤새 교반한 후, 혼합물을 반포화된 NaHCO3 수용액으로 희석하고 EtOAc (3x)로 추출했다. 조합된 유기물을 반포화된 염수 (2x)로 세정하고, 건조시키고 (MgSO4), 여과하고 감압 하에서 농축했다. 잔류물을 Et2O와 함께 교반하고 고형 물질을 여과로 수집하고 고진공 하에서 건조하여 최종 생성물을 얻었다.
일반적인 순서 3
단계 1: R = Boc (0.51 mmol)을 갖는 일반적인 순서 2로부터의 최정 생성물을, 18 시간 동안 이 온도에서 교반하면서 0 ℃에서 Et2O (20 mmol, 40 당량) 중 2 M HCl의 용액으로 처리하고 그 다음 감압 하에서 농축했다. 잔류물을 직접적으로 다음 단계에서 사용했다.
단계 2 (RCO2H에 대해): DIPEA (0.27 mmol, 3.0 당량)을 DMF (0.89 mL) 중 단계 1로부터의 생성물 (0.089 mmol), HATU (0.11 mmol,1.2 당량) 및 적절한 카복실산 (1.1 당량)의 교반된 서스펜션에 0 ℃에서 적가하고 그 다음 실온으로 서서히 따뜻하게 했다. 밤새 교반한 후, EtOAc 및 반포화된 NaHCO3 수용액을 부가하고 고형 생성물을 흡인 여과로 수집하고, 물로 세정하고 고진공 하에서 건조했다.
단계 2 (for RCOCl): DIPEA (0.13 mmol, 3.0 당량)을 CH2Cl2 (0.4 mL) 중 단계 1로부터의 생성물 (0.042 mmol)의 교반된 서스펜션에 0 ℃에서 부가하고 그 다음 적절한 산 클로라이드 (0.064 mmol, 1.5 당량)을 나누어서 도입했다. 반응을 실온으로 서서히 따뜻하게 하고 밤새 교반했다. 그 후에, 반응을 EtOAc및 반포화된 NaHCO3로 희석하고 층들을 분리했다. 수성 층을 EtOAc (2x)로 추출하고 조합된 유기 층들을 반포화된 염수 (2x)로 세정하고, 건조시키고 (MgSO4), 감압 하에서 농축했다. 잔류물을 Et2O로 분쇄하고 고형 생성물을 여과로 단리하고 고진공 하에서 건조했다.
일반적인 순서 4
단계 1: HATU (11.9 g, 31.4 mmol, 1.1 당량) 및 DIPEA (14.9 mL, 85.5 mmol, 3.0 당량)을 DMF (100 mL) 중 (S)-2-((메톡시카보닐)아미노)-3-메틸부탄산 (5.00 g, 28.5 mmol) 및 L-페닐알라닌 메틸 에스테르 하이드로클로라이드 (6.15 g, 28.5 mmol, 1.0 당량)의 용액에 0 ℃에서 부가하고 그 다음 밤새 교반하면서 실온으로 서서히 따뜻하게 했다. 혼합물을 차후에 EtOAc로 희석하고 10% HCl, 포화된 NaHCO3의 수용액 및 염수로 세정했다. 유기 층을 분리하고, MgSO4 상에서 건조시키고, 여과하고 감압 하에서 농축하고 잔류물을 직접적으로 다음 단계에서 사용했다.
단계 2: 수성 1 M LiOH (60 mL)을 THF (120 mL) 및 MeOH (60 mL) 중 단계 1로부터의 생성물 (9.58 g, 28.5 mmol)의 용액에 0 ℃에서 부가했다. 실온에서 3 시간 동안 교반한 후, 혼합물을 1 M HCl로 pH 2-3로 산성화하고 EtOAc로 추출했다. 유기 층을 분리하고, 염수로 세정하고, MgSO4 상에서 건조시키고, 여과하고 감압 하에서 농축했다. 잔류물을 EtOAc 및 헥산의 혼합물로 분쇄하고 고형 생성물을 흡인 여과로 수집하고 고진공 하에서 건조했다.
단계 3: HATU (1.12 mmol, 1.2 당량) 및 DIPEA (3.7 mmol, 4.0 당량)을 순차적으로 DMF (5 mL) 중 단계 2로부터의 생성물 (0.93 mmol) 및 적절한 보호된 아미노 산 (0.93 mmol)의 교반된 혼합물에 0 ℃에서 부가하고 그 다음 실온으로 서서히 따뜻하게 하고 이 온도에서 3 시간 동안 교반했다. 그 다음 혼합물을 EtOAc 및 10% HCl 수용액 사이에서 분할했다. 유기 상을 분리하고 포화된 NaHCO3 및 염수로 세정하고, MgSO4 상에서 건조시키고, 여과하고 감압 하에서 농축했다. 잔류물을 CH2Cl2중 증가하는 비율의 MeOH로 용출하는 실리카겔상 플래시 크로마토그래피로 정제했다.
단계 4: THF (2 mL) 및 MeOH (1 mL) 중 단계 3으로부터의 생성물 (0.47 mmol)의 교반된 서스펜션에 0 ℃에서 수성 1 M LiOH (0.95 mmol, 2.0 당량)으로 처리하고, 실온으로 서서히 따뜻하게 하고 교반된 3 시간 동안 교반했다. 그 다음 혼합물을 1 M HCl로 pH 2-3로 산성화하고 EtOAc로 추출했다. 유기 층을 분리하고, 염수로 세정하고, MgSO4 상에서 건조시키고, 여과하고 감압 하에서 농축했다. 잔류물을 EtOAc 및 Et2O의 혼합물로 분쇄하고 고형 생성물을 흡인 여과로 단리하고 고진공 하에서 건조했다.
단계 5: DMF (1 mL) 중 단계 4로부터의 생성물 (0.11 mmol) 및 보로-Gly-(+)-피난디올 하이드로클로라이드 (0.12 mmol, 1.1 당량)의 교반된 서스펜션에 0 ℃에서 HATU (0.13 mmol, 1.2 당량) 및 DIPEA (0.44 mmol, 4.0 당량)으로 처리하고 그 다음 실온으로 서서히 따뜻하게 하고 밤새 교반했다. 반응 용기 내용물을 차후에 EtOAc 및 반포화된 NaHCO3 수용액 사이에서 분할했다. EtOAc 층을 분리하고 수성 층을 추가의 EtOAc (2x)로 추출했다. 조합된 유기 층들을 MgSO4 상에서 건조시키고, 여과하고 감압 하에서 농축했다. 잔류물을 물로 분쇄하고 고형 생성물을 흡인 여과로 단리하고 고진공 하에서 건조했다.
일반적인 순서 5
DIPEA (3.5 당량)을 DMF (0.1 M) 중 적절한 카복실산 (중간체 12,13 또는 14), 적절한 아민 (중간체 8, 9, 10 또는 11, 1.2-1.4 당량) 및 HATU (1.2-1.3 당량)의 교반된 서스펜션에 0 ℃에서 적가하고 그 다음 실온으로 서서히 따뜻하게 하고 밤새 교반했다. 그 다음 반응 혼합물을 EtOAc로 희석하고 빙랭, 반-포화된 NaHCO3 수용액과 함께 교반했다. 고형 아미드 생성물을 여과로 단리하고, EtOAc 및 물로 세정하고, 그 다음 흡인 및 고진공 하에서 건조했다. 생성물이EtOAc에서 가용성일 때, 층들을 분리하고 수성 상을 추가의 EtOAc로 추출했다. 조합된 유기물을 5% LiCl 및 포화된 염수의 수용액로 세정하고, 그 다음 MgSO4 상에서 건조시키고, 여과하고 감압 하에서 농축했다. 잔류물을 Et2O로 분쇄하고 고형 생성물을 여과로 수집하고 고진공 하에서 건조했다.
실시예 1 내지 24에서 기재된 화합물은 실시예 번호에 의해 확인된다. 따라서 실시예 1에서 개시된 화합물은 화합물 1로 지정된다.
실시예
1 (1)
{[(2S)-2-[(2S)-2-[(2S)-2-[(메톡시카보닐)아미노]-3-메틸부탄아미도]-3-페닐프로판아미도]프로판아미도]메틸}보론산
2,4,6-콜리딘 (0.14 mL, 1.1 mmol, 2.1 당량)을, 실온으로 서서히 따뜻하게 하고 밤새 교반하면서 DMF (2.9 mL) 중 중간체 2 (0.20 g, 0.51 mmol), HATU (0.194 g, 0.510 mmol) 및 아미노메틸보론산 피나콜 에스테르 하이드로클로라이드 (0.099 g, 0.51 mmol)의 서스펜션에 0 ℃에서 적가했다. 용기 내용물을 차후에 반-포화된 NaHCO3 수용액 및 EtOAc 사이에서 분할했다. 유기 층을 분리하고 수성 상을 EtOAc (2x)로 추출했다. 조합된 유기물을 건조시키고 (MgSO4), 여과하고 감압 하에서 농축했다. 잔류물을, 진탕 초음파 배쓰에서 1 시간 동안 진탕하면서 EtOAc/Et2O/물의 혼합물로 분쇄했다. 고형 물질을 흡인 여과로 수집하고 고진공 하에서 건조하여 표제 화합물을 얻었다.
1H NMR (메탄올-d4): δ 7.31-7.18 (5 H), 4.63 (1 H), 4.50 (1 H), 3.80 (1 H, d), 3.64 (3 H), 3.20 (1 H), 2.94 (1 H), 2.34 (2 H), 1.92 (1 H), 1.42 (3 H), 0.83-0.75 (6 H). MS ESI: 473.3 [M+Na]+
실시예 2-5는 일반적인 순서 1를 사용하여 제조되었다:
실시예
2 (2)
{[(2S)-2-[(2S)-2-[(2S)-3-메틸-2-[(4-페닐페닐)포름아미도]부탄아미도]-3-페닐프로판아미도]프로판아미도]메틸}보론산
1H NMR (메탄올-d4): δ 7.89 (2 H), 7.73 (2 H), 7.68 (2 H), 7.47 (2 H), 7.38 (1 H), 7.28-7.22 (2 H), 7.21-7.13 (2 H), 7.09 (1 H), 4.69 (1 H), 4.39 (1 H), 4.32 (1 H), 3.23 (1 H), 2.93 (1 H), 2.35-2.22 (2 H), 2.13 (1 H), 1.41-1.31 (3 H), 1.00-0.88 (6 H). MS ESI: 595.4 [M+Na]+
실시예
3 (3)
{[(2S)-2-[(2S)-2-[(2S)-3-메틸-2-{2-[4-(트리플루오로메톡시)페닐]아세트아미도}부탄아미도]-3-페닐프로판아미도]프로판아미도]메틸}보론산
1H NMR (DMSO-d6): δ 8.26 (1 H), 8.16 (1 H), 8.20-8.12 (2 H) 7.38-7.32 (2 H), 7.30-7.12 (7 H), 4.53 (1 H), 4.30 (1 H), 4.10 (1 H), 3.55 (1 H), 3.45 (1 H), 3.04 (1 H), 2.77 (1 H), 2.27 (1 H), 1.89 (1 H), 1.22-1.18 (3 H), 0.74-0.72 (6 H). MS ESI: 617.3 [M+Na]+
실시예
4 (4)
{[(2S)-2-[(2S)-2-[(2S)-2-데칸아미도아미도-3-메틸부탄아미도]-3-페닐프로판아미도]프로판아미도]메틸}보론산
1H NMR (메탄올-d4): δ 7.29-7.16 (5 H), 4.59 (1 H), 4.48 (1 H), 4.04 (1 H), 3.15 (1 H), 2.94 (1 H), 2.33 (2 H), 2.26-2.14 (2 H), 1.95 (1 H), 1.56 (2 H), 1.40 (3 H), 1.35-1.20 (12 H), 0.91-0.81 (9 H). MS ESI: 569.4 [M+Na]+
실시예
5 (5)
(2S)-3-메틸-N-[(1S)-2-페닐-1-{[(1S)-1-({[(1S,2S,6R,8S)-2,9,9-트리메틸-3,5-디옥사-4-보라트리사이클로[6.1.1.02,6]데칸-4-일]메틸}카바모일)에틸]카바모일}에틸]-2-(페닐포름아미도)부탄아미드
1H NMR (DMSO-d6): δ 8.22-8.16 (2 H), 8.11-8.03 (2 H), 7.84 (2 H), 7.55 (1 H), 7.50-7.45 (2 H), 7.26-7.09 (5 H), 4.57 (1 H), 4.29 (1 H), 4.20 (2 H), 3.05 (1 H), 2.77 (1 H), 2.37 (2 H), 2.22 (1 H), 2.10-1.99 (2 H), 1.86 (1 H), 1.80 (1 H), 1.67 (1 H), 1.28-1.17 (10 H), 0.83 (3 H), 0.79 (3 H), 0.75 (3 H). MS ESI: 653.5 [M+Na]+
실시예 6 및 7은 일반적인 순서 2를 사용하여 제조되었다:
실시예
6 (6)
tert -부틸 N-[(1S)-2-메틸-1-{[(1S)-2-페닐-1-{[(1S)-1-({[(1S,2S,6R,8S)-2,9,9-트리메틸-3,5-디옥사-4-보라트리사이클로[6.1.1.02,6]데칸-4-일]메틸}카바모일)에틸]카바모일}에틸]카바모일}프로필]카바메이트
1H NMR (DMSO-d6): δ 8.26 (1 H), 8.08 (1 H), 7.87 (1 H), 7.19-7.16 (5 H), 6.64 (1 H), 4.58 (1 H), 4.29 (1 H), 4.19 (1 H), 3.68 (1 H), 3.02 (1 H), 2.74 (1 H), 2.38 (2 H), 2.22 (1 H), 2.06 (1 H), 1.87 (1 H), 1.84-1.73 (2 H), 1.68 (1 H), 1.36 (9 H), 1.31-1.14 (10 H), 0.79 (3 H), 0.73-0.61 (6 H). MS ESI: 627.5 [M+H]+
실시예
7 (7)
벤질 N-[(1S)-2-메틸-1-{[(1S)-2-페닐-1-{[(1S)-1-({[(1S,2S,6R,8S)-2,9,9-트리메틸-3,5-디옥사-4-보라트리사이클로[6.1.1.02,6]데칸-4-일]메틸}카바모일)에틸]카바모일}에틸]카바모일}프로필]카바메이트
1H NMR (DMSO-d6): δ 8.21 (1 H), 8.09 (1 H), 7.98 (1 H), 7.40-7.29 (5 H), 7.27-7.12 (6 H), 5.02 (2 H), 4.56 (1 H), 4.29 (1 H), 4.19 (1 H), 3.80 (1 H), 3.04 (1 H), 2.76 (1 H), 2.38 (2 H), 2.22 (1 H), 2.06 (1 H), 1.89-1.76 (3 H), 1.68 (1 H), 1.30-1.15 (10 H), 0.79 (3 H), 0.72 (6 H). MS ESI: 683.4 [M+Na]+
실시예 8a, 8b, 8c, 8d 및 9는 일반적인 순서 3을 사용하여 제조되었다:
실시예
8a (8a)
(2S)-3-메틸-N-[(1S)-2-페닐-1-{[(1S)-1-({[(1S,2S,6R,8S)-2,9,9-트리메틸-3,5-디옥사-4-보라트리사이클로[6.1.1.02,6]데칸-4-일]메틸}카바모일)에틸]카바모일}에틸]-2-({4-[3-(트리플루오로메틸)-3H-디아지린-3-일]페닐}포름아미도)부탄아미드
1H NMR (DMSO-d6): δ 8.36 (1 H), 8.16 (1 H), 8.10-8.04 (2 H), 7.93 (2 H), 7.38 (2 H), 7.24-7.05 (5 H), 4.55 (1 H), 4.32-4.14 (3 H), 3.03 (1 H), 2.76 (1 H), 2.36 (2 H), 2.20 (1 H), 2.08-1.96 (2 H), 1.86 (1 H), 1.78 (1 H), 1.66 (1 H), 1.29-1.13 (10 H), 0.84-0.72 (9 H). MS ESI: 739.4 [M+H]+
실시예
8b (8b)
(2S)-3-메틸-N-[(1S)-2-페닐-1-{[(1S)-1-({[(1S,2S,6R,8S)-2,9,9-트리메틸-3,5-디옥사-4-보라트리사이클로[6.1.1.02,6]데칸-4-일]메틸}카바모일)에틸]카바모일}에틸]-2-({3-[3-(트리플루오로메틸)-3H-디아지린-3-일]페닐}포름아미도)부탄아미드
1H NMR (DMSO-d6): δ 8.46 (1 H), 8.16-8.05 (3 H), 8.00 (1 H), 7.65-7.60 (2 H), 7.55 (1 H), 7.24-7.19 (2 H), 7.17-7.05 (3 H), 4.54 (1 H), 4.31-4.15 (3 H), 3.04 (1 H), 2.76 (1 H), 2.39-2.34 (2 H), 2.20 (1 H), 2.09-1.97 (2 H), 1.86 (1 H), 1.79 (1 H), 1.67 (1H), 1.30-1.11 (10 H), 0.86-0.74 (9 H). MS ESI: 739.4 [M+H]+
실시예
8c (8c)
(2S)-3-메틸-N-[(1S)-2-페닐-1-{[(1S)-1-({[(1S,2S,6R,8S)-2,9,9-트리메틸-3,5-디옥사-4-보라트리사이클로[6.1.1.02,6]데칸-4-일]메틸}카바모일)에틸]카바모일}에틸]-2-(2-{4-[3-(트리플루오로메틸)-3H-디아지린-3-일]페닐}아세트아미도)부탄아미드
1H NMR (DMSO-d6): δ 8.14-8.04 (3 H), 7.39-7.33 (2 H,) 7.24-7.10 (8 H), 4.51 (1 H), 4.28 (1 H), 4.18 (1 H) 4.09 (1 H), 3.60-3.44 (2 H), 3.01 (1 H), 2.75 (1 H), 2.38-2.34 (2 H), 2.21 (1 H), 2.05 (1 H), 1.92-1.83 (2 H), 1.79 (1 H), 1.66 (1 H), 1.29-1.09 (10 H), 0.81-0.65 (9 H). MS ESI: 753.5 [M+H]+
실시예
8d (8d)
(2S)-3-메틸-N-[(1S)-2-페닐-1-{[(1S)-1-({[(1S,2S,6R,8S)-2,9,9-트리메틸-3,5-디옥사-4-보라트리사이클로[6.1.1.02,6]데칸-4-일]메틸}카바모일)에틸]카바모일}에틸]-2-(2-{3-[3-(트리플루오로메틸)-3H-디아지린-3-일]페닐}아세트아미도)부탄아미드
1H NMR (DMSO-d6): δ 8.15-8.03 (3 H), 7.44-7.36 (2 H), 7.23-7.09 (8 H), 4.56-4.42 (2 H), 4.30-4.07 (2 H), 3.63-3.39 (2 H), 3.02 (1 H), 2.76 (1 H), 2.38-2.33 (2 H), 2.20 (1 H), 2.04 (1 H), 1.93-1.82 (2 H), 1.78 (1 H), 1.66 (1 H), 1.28-1.09 (10 H), 0.80-0.75 (3 H), 0.75-0.67 (6 H). MS ESI: 753.4 [M+H]+
실시예
9 (9)
(2S)-2-[(2-플루오로페닐)포름아미도]-3-메틸-N-[(1S)-2-페닐-1-{[(1S)-1-({[(1S,2S,6R,8S)-2,9,9-트리메틸-3,5-디옥사-4-보라트리사이클로[6.1.1.02,6]데칸-4-일]메틸}카바모일)에틸]카바모일}에틸]부탄아미드
1H NMR (DMSO-d6): δ 8.25 (1 H), 8.14-8.08 (2 H), 8.03 (1 H), 7.64-7.51 (2 H), 7.33-7.11 (7 H), 4.60 (1 H), 4.30 (2 H), 4.18 (1 H), 3.05 (1 H), 2.75 (1 H), 2.38 (2 H), 2.20 (1 H), 2.10-1.93 (2 H), 1.87 (1 H), 1.79 (1 H), 1.67 (1 H), 1.29-1.18 (10 H), 0.82-0.74 (9 H). MS ESI: 649.4 [M+H]+
실시예 10-14는 일반적인 순서 4 를 사용하여 제조되었다:
실시예
10 (10)
메틸 N-[(1S)-2-메틸-1-{[(1S)-2-페닐-1-{[(1S)-1-({[(1S,2S,6R,8S)-2,9,9-트리메틸-3,5-디옥사-4-보라트리사이클로[6.1.1.02,6]데칸-4-일]메틸}카바모일)프로필]카바모일}에틸]카바모일}프로필]카바메이트
1H NMR (DMSO-d6): δ 8.11-8.04 (2 H), 7.98 (1 H), 7.27-7.21 (4 H), 7.17 (1 H), 7.05 (1 H), 4.58 (1 H), 4.22-4.14 (2 H), 3.77 (1 H), 3.52 (3 H), 3.02 (1 H), 2.78 (1 H), 2.37 (2 H), 2.22 (1 H), 2.06 (1 H), 1.89-1.77 (3 H), 1.71-1.61 (2 H), 1.52 (1 H), 1.31-1.24 (4 H), 1.23-1.20 (3 H), 0.85-0.77 (6 H), 0.74-0.69 (6 H). MS ESI: 599.4 [M+H]+
실시예
11 (11)
메틸 N-[(1S)-2-메틸-1-{[(1S)-2-페닐-1-{[(1S)-2-페닐-1-({[(1S,2S,6R,8S)-2,9,9-트리메틸-3,5-디옥사-4-보라트리사이클로[6.1.1.02,6]데칸-4-일]메틸}카바모일)에틸]카바모일}에틸]카바모일}프로필]카바메이트
1H NMR (DMSO-d6): δ 8.23 (1 H), 8.09 (1 H), 7.88 (1 H), 7.29-7.12 (10 H), 7.03 (1 H), 4.59-4.45 (2 H), 4.24 (1 H), 3.76 (1 H), 3.53 (3 H), 3.00-2.68 (4 H), 2.39 (2 H), 2.24 (1 H), 2.09 (1 H), 1.90 (1 H), 1.86-1.78 (2 H), 1.71 (1 H), 1.34-1.26 (4 H), 1.25-1.20 (3 H), 0.81 (3 H), 0.77-0.62 (6 H). MS ESI: 661.5 [M+H]+
실시예
12 (12)
메틸 N-[(1S)-2-메틸-1-{[(1S)-1-{[(1S)-3-(메틸설파닐)-1-({[(1S,2S,6R,8S)-2,9,9-트리메틸-3,5-디옥사-4-보라트리사이클로[6.1.1.02,6]데칸-4-일]메틸}카바모일)프로필]카바모일}-2-페닐에틸]카바모일}프로필]카바메이트
1H NMR (DMSO-d6): δ 8.13 (1 H), 8.03 (1 H), 7.95 (1 H), 7.27-7.15 (5 H), 7.06 (1 H), 4.54 (1 H), 4.34 (1 H), 4.22 (1 H), 3.77 (1 H), 3.52 (3 H), 3.02 (1 H), 2.79 (1 H), 2.47-2.32 (4 H), 2.22 (1 H), 2.06 (1 H), 2.01 (3 H), 1.93-1.74 (5 H), 1.69 (1 H), 1.30-1.21 (7 H), 0.79 (3 H), 0.72 (6 H). MS ESI: 645.4 [M+H]+
실시예
13 (13)
메틸 N-[(1S)-2-메틸-1-{[(1S)-1-{[(1S)-3-메틸-1-({[(1S,2S,6R,8S)-2,9,9-트리메틸-3,5-디옥사-4-보라트리사이클로[6.1.1.02,6]데칸-4-일]메틸}카바모일)부틸]카바모일}-2-페닐에틸]카바모일}프로필]카바메이트
1H NMR (DMSO-d6): δ 8.12 (1 H), 8.07 (1 H, s), 8.00 (1 H), 7.26-7.14 (5 H), 7.04 (1 H), 4.56 (1 H), 4.31 (1 H), 4.18 (1 H), 3.79 (1 H), 3.52 (3 H), 3.01 (1 H), 2.78 (1 H), 2.30-2.36 (2 H), 2.21 (1 H), 2.05 (1 H), 1.89-1.76 (3 H), 1.68 (1 H), 1.56 (1 H), 1.48-1.39 (2 H), 1.30-1.24 (4 H), 1.22 (3 H), 0.86 (3 H), 0.85 (3H), 0.76 (3 H), 0.72 (6 H). MS ESI: 627.5 [M+H]+
실시예
14 (14)
메틸 N-[(1S)-2-메틸-1-{[(1S)-2-페닐-1-{[(S)-페닐({[(1S,2S,6R,8S)-2,9,9-트리메틸-3,5-디옥사-4-보라트리사이클로[6.1.1.02,6]데칸-4-일]메틸}카바모일)메틸]카바모일}에틸]카바모일}프로필]카바메이트
1H NMR (DMSO-d6): δ 8.66 (0.5 H), 8.53 (0.5 H), 8.44 (0.5 H), 8.32 (0.5 H), 8.05 (0.5 H H), 7.97 (0.5 H), 7.92 (1 H), 7.42-7.00 (10 H), 5.47 (1 H), 4.68 (1 H), 4.27 (1 H), 3.77 (1 H), 3.52 (3 H), 2.95 (1 H), 2.76 (1 H), 2.58-2.42 (2 H overlapped), 2.23 (1 H), 2.07 (1 H), 1.94-1.77 (3 H), 1.65 (1 H), 1.32-1.19 (7 H), 0.79 (3 H), 0.75-0.63 (6 H). MS ESI: 647.4 [M+H]+
실시예
15 (15)
메틸 (4R/S)-4-[(2S)-2-[(2S)-2-[(2S)-2-[(메톡시카보닐)아미노]-3-메틸부탄아미도]-3-페닐프로판아미도]-2-페닐아세트아미도]-4-[(1S,2S,6R,8S)-2,9,9-트리메틸-3,5-디옥사-4-보라트리사이클로[6.1.1.02,6]데칸-4-일]부타노에이트
중간체 5 (0.027 g, 0.084 mmol), 중간체 3 (0.062 g, 0.13 mmol, 1.5 eq) 및 백금 옥사이드 (0.002 g, 0.008 mmol, 0.1 당량)을 rbf에 두었고 격막으로 밀봉했다. 플라스크를 퍼징하고 (진공, N2), 탈가스된 THF (2.5 mL)을 부가했다. 그 다음 혼합물을 라텍스 밸룬을 통해 제공된 H2 대기 (P = 1 atm) 하에서 교반했다. 18 시간 후, EtOAc 및 NaHCO3의 포화된 수용액을 부가했다. 층들을 분리하고 수성 층을 추가의 EtOAc (2x)로 추출했다. 조합된 유기 층들을 MgSO4 상에서 건조시키고, 여과하고 감압 하에서 농축했다. 잔류물을 헥산 중 증가하는 비의 EtOAc로 용출하는 실리카겔상 플래시 크로마토그래피로 정제하여 표제 화합물을 부분입체이성질체의 혼합물로서 얻었다.
1H NMR (아세톤-d6): δ 7.89 (0.5 H), 7.77 (0.5 H), 7.61-7.51 (2 H), 7.31-7.17 (5 H), 6.52 (0.5 H), 6.48 (0.5 H), 4.58 (1 H), 4.45 (1 H), 4.17 (1 H), 3.87 (1 H), 3.61-3.55 (6 H), 3.21 (2 H), 2.97 (1 H), 2.68 (1 H), 2.56-2.32 (2 H), 2.31-2.17 (2 H), 1.94-1.69 (5 H), 1.44 (1 H), 1.34-1.23 (9 H), 0.86-0.81 (9 H). MS ESI: 671.5 [M+H]+
실시예
16 (16)
메틸 N-[(1S)-1-{[(1R/S)-1-{[(1S)-1-{[(1S)-3-카바모일-1-[(1S,2S,6R,8S)-2,9,9-트리메틸-3,5-디옥사-4-보라트리사이클로[6.1.1.02,6]데칸-4-일]프로필]카바모일}에틸]카바모일}-2-페닐에틸]카바모일}-2-메틸프로필]카바메이트
중간체 6 (0.12 g, 0.39 mmol), 중간체 3 (0.30 g, 0.61 mmol, 1.6 eq) 및 백금 옥사이드 (0.009 g, 0.04 mmol, 0.1 당량)을 격막으로 밀봉된 rbf에 두었다. 플라스크를 퍼징하고 (진공 그 다음 N2), 탈가스된 THF (2.5 mL)을 부가했다. 그 다음 혼합물을 라텍스 밸룬을 통해 전달된 H2 대기 (P = 1 atm) 하에서 교반했다. 18 시간 후, 메탄올 및 실리카겔을 반응 용기에 부가하고 혼합물을 농축했다. 잔류물을 EtOAc가 미리 충전된 실리카겔 칼럼의 상부에 부었다. EtOAc 중 증가하는 비의 MeOH로 용출하는 실리카겔상 플래시 크로마토그래피를 수행하고, 원하는 물질을 함유하는 분획을 농축하고, EtOAc로 잔류물을 분쇄하고 흡인 여과로 고형 생성물을 수집하고, 그 다음 고진공 하에서 건조하여 표제 화합물을 부분입체이성질체의 혼합물로서 얻었다.
1H NMR (메탄올-d4): δ 7.30-7.18 (5 H), 4.59 (1 H), 4.49 (1 H), 4.18 (1 H), 3.77 (1 H), 3.63 (3 H), 3.20 (1 H), 2.95 (1 H), 2.64 (1 H), 2.37-2.10 (4 H), 1.97-1.70 (6 H), 1.42 (3 H), 1.37-1.31 (4 H), 1.27 (3 H), 0.86 (3 H), 0.82-0.77 (6 H). MS ESI: 656.5 [M+H]+
실시예
17 (17)
[(1R/S)-4-메톡시-1-[(2S)-2-[(2S)-2-[(2S)-2-[(메톡시카보닐)아미노]-3-메틸부탄아미도]-3-페닐프로판아미도]프로판아미도]-4-옥소부틸]보론산
실시예 15 (0.010 g, 0.015 mmol)을 18 시간 동안 실온에서1 mL의 1:1 아세토니트릴/물 중 폴리머-지지된 벤젠보론산 (3 mmol/g 로딩, 0.058 g)과 함께 교반했다. 수지를 여과로 제거하고 물 및 아세토니트릴로 세정했다. 여과물을 농축하고 추가 부분의 폴리머-지지된 벤젠보론산 (3 mmol/g, 0.058 g) 및 아세토니트릴 (5 mL)을 실온에서 18 시간 동안 교반하면서 부가했다. 제 2 부분의 수지를 여과로 제거하고 물 및 아세토니트릴로 세정했다. 진공에서 여과물을 농축하여 아세토니트릴을 제거하고, 잔류 수용액을 동결 건조하고, Et2O로 잔류물을 분쇄하여 표제 화합물을 얻었다.
1H NMR (MeOH-d4): δ 7.31-7.17 (5 H), 4.58 (1 H), 4.47 (1 H), 3.80 (1 H), 3.67-3.61 (6 H), 3.19 (1 H), 2.95 (1 H), 2.58 (1 H), 2.46-2.39 (2 H), 1.93 (1 H), 1.86-1.65 (2 H), 1.43 (3 H), 0.84-0.76 (6 H). MS ESI: 559.3 [M+Na]+
실시예
18 (18)
[(1R/S)-3-카바모일-1-[(2S)-2-[(2S)-2-[(2S)-2-[(메톡시카보닐)아미노]-3-메틸부탄아미도]-3-페닐프로판아미도]프로판아미도]프로필]보론산
실시예 16으로부터의 최종 생성물의 샘플 (0.020g, 0.030 mmol)을 Et2O (2.5 mL), 물 (1 mL) 및 EtOAc (0.5 mL)의 혼합물에서 현탁시켰다. 페닐보론산 (0.036g, 0.30 mmol, 10 당량)을 부가하고 혼합물을 실온에서 18 시간 동안 교반했다. 상들을 분리하고 수성 층을 EtOAc (5x)로 세정하고 수집된 유기물을 버렸다. 수성 층을 동결 건조시키고 잔류물을 EtOAc로 분쇄하여 표제 화합물을 얻었다.
1H NMR (DMSO-d6 + 5% H2O): δ 8.08-7.96 (2 H), 7.65 (1 H), 7.37 (1 H), 7.28-7.12 (5 H), 7.04 (1 H), 6.69 (1 H), 4.55 (1 H), 4.30 (1 H), 3.75 (1 H), 3.51 (3 H), 2.99 (1 H), 2.75 (1 H), 2.56 (1 H), 2.02-1.95 (2 H), 1.79 (1 H), 1.69-1.40 (2 H), 1.20-1.12 (3 H), 0.68 (6 H). MS ESI: 544.3 [M+Na]+
하기 실시예들은 일반적인 순서 5에 따라 제조되었다:
실시예
19 (19)
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)데칸아미도아미드
DMF (4 mL) 중 중간체 12 (0.10 g, 0.20 mmol), 중간체 8 (57 mg, 0.24 mmol, 1.2 당량), HATU (91 mg, 0.24 mmol, 1.2 당량) 및 DIPEA (0.12 mL, 0.69 mmol, 3.5 당량) 로부터 부분입체이성질체의 혼합물로서 제조됨.
1H NMR (DMSO-d6): δ 8.02-7.87 (3 H), 7.71 (1 H), 7.25-7.12 (6 H), 6.71 (1 H), 4.52 (1 H), 4.21 (1 H), 4.07 (1 H), 3.97-3.77 (2 H), 3.03 (1 H), 2.78 (1 H), 2.20-1.93 (4 H), 1.93-1.81 (2 H), 1.64 (1 H), 1.49-1.38 (2 H), 1.29-1.15 (15 H), 0.85 (3 H), 0.73 (6 H). 19F NMR (DMSO-d6): δ -74.65, -74.72. ESI-MS: 672.5 [M+H+]
실시예
20a (20a)
N-((2S)-1-(((2S)-1-(((2S)-1-(((3S)-6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)데칸아미도아미드
DMF (2 mL) 중 중간체 12 (40 mg, 0.082 mmol), 중간체 9 (23 mg, 0.1 mmol, 1.2 당량), HATU (38 mg, 0.1 mmol, 1.2 당량) 및 DIPEA (50 μL, 0.29 mmol, 3.5 당량)로부터 제조됨. 고형 생성물을 뜨거운 EtOH에서 용해로 정제하고, 활성탄으로 처리하고 셀라이트 패드를 통해 여과했다. 패드를 추가의 뜨거운 EtOH로 세정하고 여과물을 감압 하에서 농축하여 표제 화합물을 고형물로서 얻었고, 그 다음 몇 방울의 MeOH를 함유하는 EtOAc로 분쇄했다.
1H NMR (DMSO-d6): δ 8.01 (1 H), 7.98 (1 H), 7.92 (1 H), 7.72 (1 H), 7.25-7.12 (6 H), 6.71 (1 H), 6.53 (1 H), 4.52 (1 H), 4.21 (1 H), 4.07 (1 H), 3.93 (1 H), 3.82 (1 H), 3.03 (1 H), 2.78 (1 H), 2.19-1.97 (4 H), 1.97-1.81 (2 H), 1.60 (1 H), 1.49-1.39 (2 H), 1.29-1.16 (12 H), 1.18 (3 H), 0.85 (3 H), 0.73 (6 H). 19F NMR (DMSO-d6): δ -74.65. ESI-MS: 672.5 [M+H+].
실시예
20b (20b)
N-((2S)-1-(((2S)-1-(((2S)-1-(((3R)-6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)데칸아미도아미드
중간체 12 및 ent -중간체 9로부터 20a에서와 같이 제조되었다.
실시예
21a (21a), 21b (21b)
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1-플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)데칸아미도아미드
화합물 21a를, DMF (3 mL) 중 중간체 12 (100 mg, 0.20 mmol), 중간체 10 (56 mg, 0.28 mmol, 1.4 당량), HATU (100 mg, 0.26 mmol, 1.3 당량) 및 DIPEA (0.12 mL, 0.69 mmol, 3.5 당량)의 소수의 부분입체이성질체로부터 제조했다. 표제 화합물을, CH2Cl2 중 증가하는 비율의 MeOH (5% 내지 10%)로 용출하는 실리카겔상 플래시 크로마토그래피로 2 개의 부분입체이성질체의 혼합물로서 단리했다. 화합물 21b를 중간체 10의 주요 부분입체이성질체를 이용하여 유사한 방식으로 제조했다.
화합물 b (참고 도 1)는 화합물 21a 및 21b의 혼합물이다.
21a: 1H NMR (DMSO-d6): δ 8.01-7.93 (2 H), 7.74-7.62 (2 H), 7.24-7.13 (6 H), 6.69 (1 H), 5.28 (1 H), 4.52 (1 H, m), 4.44-4.03 (4 H), 3.66-3.46 (2 H), 3.03 (1 H), 2.79 (1 H), 2.19-1.82 (6 H), 1.59-1.38 (3 H), 1.30-1.16 (15 H), 0.85 (3 H), 0.74 (6 H). 19F NMR (DMSO-d6): δ 3.84, 3.18. ESI-MS: 636.5 [M+H]+
21b: 1H NMR (DMSO-d6): δ 8.04-7.95 (2 H), 7.74-7.67 (1 H), 7.55 (0.5 H), 7.48 (0.5 H), 7.26-7.12 (6 H), 6.71 (1 H), 4.52 (1 H), 4.37-4.04 (4 H), 3.80-3.67 (2 H), 3.03 (1 H), 2.78 (1 H), 2.20-1.92 (4 H), 1.87 (1 H), 1.76-1.58 (2 H), 1.50-1.40 (2 H), 1.29-1.17 (15 H), 0.85 (3 H), 0.77-0.70 (6 H). ESI-MS: 636.5 [M+H]+
실시예
22a (22a) 및 22b (2b)
N-((2S)-1-(((2S)-1-((-1-((6-아미노-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)데칸아미도아미드
DMF (3 mL) 중 중간체 12 (100 mg, 0.204 mmol), 중간체 11 (40 mg, 0.27 mmol, 1.3 당량), HATU (91 mg, 0.24 mmol, 1.2 당량) 및 DIPEA (0.12 mL, 0.69 mmol, 3.5 당량)로부터 제조됨. 2 개의 부분입체이성질체 생성물을 CH2Cl2 중 증가하는 비율의 MeOH (5% 내지 10%)로 용출하는 실리카겔상 플래시 크로마토그래피로 분리했다. 화합물 22a는 제 1 용출 (더 적은 극성) 부분입체이성질체이고 화합물 22b는 제 2 용출 (더 많은 극성) 부분입체이성질체였다. 생성물 둘 모두는 고형물로서 단리되고, 그 다음 적절한 분획을 농축하고 물 및 Et2O로 잔류물을 분쇄했다.
22a: 1H NMR (DMSO-d6): δ 8.15 (1 H), 7.96 (1 H), 7.73 (1 H), 7.45 (1 H), 7.26-7.14 (6 H), 6.69 (1 H), 4.56 (1 H), 4.40 (1 H), 4.16 (1 H), 4.10 (1 H), 3.50-3.41 (2 H), 2.95 (1 H), 2.84 (1 H), 2.20-2.02 (2 H), 2.02-1.82 (4 H), 1.56-1.40 (3 H), 1.30-1.17 (12 H), 1.07 (3 H), 0.99 (3 H), 0.85 (3 H), 0.764 (3 H), 0.748 (3 H). ESI-MS: 618.5 [M+H]+.
22b: 1H NMR (DMSO-d6): δ 8.00 (1 H), 7.93 (1 H), 7.71 (1 H), 7.52 (1 H), 7.25-7.12 (6 H), 6.68 (1 H), 4.63 (1 H), 4.53 (1 H), 4.21 (1 H), 4.07 (1 H), 3.52-3.39 (2 H), 3.03 (1 H), 2.78 (1 H), 2.19-1.81 (6 H), 1.51-1.39 (3 H), 1.29-1.18 (15 H), 0.98 (3 H), 0.85 (3 H), 0.74 (6 H). ESI-MS: 618.5 [M+H]+.
실시예
23 (23)
6,6,6-트리플루오로-5-하이드록시-4-((S)-2-((S)-2-((S)-3-메틸-2-(2-(4-(트리플루오로메톡시)페닐)아세트아미도)부탄아미도)-3-페닐프로판아미도)프로판아미도)헥산아미드
DMF (2 mL) 중 중간체 13 (108 mg, 0.20 mmol), 중간체 8 (57 mg, 0.24 mmol, 1.2 당량), HATU (91 mg, 0.24 mmol, 1.2 당량), DIPEA (0.12 mL, 0.69 mmol, 3.5 당량)로부터 제조됨. 표제 생성물을, CH2Cl2 중 증가하는 비율의 MeOH (5% 내지 10%)로 용출하는 실리카겔상 플래시 크로마토그래피로 부분입체이성질체의 혼합물로서 단리하고 그 다음 물 및 Et2O로 분쇄했다.
1H NMR (DMSO-d6): δ 8.11-8.05 (2 H), 7.99 (0.4 H), 7.92-7.90 (1.6 H), 7.36 (2 H), 7.27 (2 H), 7.24-7.11 (6 H), 6.72 (1 H), 6.50 (1 H), 4.53 (1 H), 4.22 (1 H), 4.10 (1 H), 3.96-3.78 (2 H), 3.57 (1 H), 3.46 (1 H), 3.02 (1 H), 2.77 (1 H), 2.10-1.82 (4 H), 1.64 (1 H), 1.20 (1.8 H), 1.16 (1.2 H), 0.73 (6 H). 19F NMR (DMSO-d6): δ -57.2 (부분입체이성질체 둘 모두), -74.6 (하나의 부분입체이성질체), -74.71 (다른 부분입체이성질체). ESI-MS: 720.3 [M+H+].
실시예
24 (24)
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드
DMF (1.4 mL) 중 중간체 14 (70 mg, 0.14 mmol), 중간체 8 (46 mg, 0.18 mmol, 1.3 당량), HATU (62 mg, 0.16 mmol, 1.2 당량), DIPEA (85 μL, 0.49 mmol, 3.5 당량) 로부터 부분입체이성질체의 혼합물로서 제조됨.
1H NMR (DMSO-d6): δ 8.27 (1 H), 8.11-8.00 (2 H), 7.97-7.86 (3 H), 7.78 (2 H), 7.74 (2 H), 7.50 (2 H), 7.42 (1 H), 7.26-7.09 (6 H), 6.71 (1 H), 6.52 (1 H), 4.60 (1 H), 4.26-4.19 (2 H), 3.98-3.77 (2 H), 3.05 (1 H), 2.79 (1 H), 2.12-1.82 (4 H), 1.63 (1 H), 1.23 (1.5 H), 1.19 (1.5 H), 0.84 (3 H, d), 0.762 (1.5 H), 0.752 (1.5 H). 19F NMR (DMSO-d6): δ -74.64, -74.69. ESI-MS: 698.4 [M+H+].
도식 1 내지 9 및 하기 본문은 화합물 실시예 25-91를 제조하기 위해 이용된 일반적인 실험 절차를 기재하고 있다. 수분, 대기 산소 및/또는 이산화탄소에 대해 민감한 모든 반응은 무수 질소 대기 하에서, 분자체 상에서 전-건조되고 고-진공 하에서 몇 개의 냉동-해동 사이클에 의해 탈가스된 용매에서 수행되었다. 기재된 절차에 대한 변형은, 필요한 경우, 적용되는 구체적인 예의 설명과 함께 포함된다. 최종 화합물은 베이지색 내지 무색 분말로서 단리되었다. 중간체 8로부터 제조된 화합물은, 달리 지시되지 않으면 부분입체이성질체의 1:1 혼합물로서 일반적으로 단리되었다.
HATU
,
DIPEA와
커플링하는
카복실산에
대한
아민의
일반적인 절차:
DIPEA (3.5 당량)을 적절한 아민 (1.2 당량), HATU (1.2 당량) 및 적절한 카복실산의 교반된 혼합물에 DMF 중 0.2 M의 농도에서 -20 ℃에서 적가하고, 그 다음 0 ℃로 서서히 따뜻하게 하고 실온에서 밤새 교반했다. 그 다음 반응 용기 내용물을 EtOAc로 희석하고 빙랭, 반-포화된 NaHCO3 수용액과 함께 교반했다. 고형 아미드 생성물을 여과로 단리하고, 물 및 EtOAc로 세정하고, 흡인 및 고-진공 하에서 건조했다. 생성물이 EtOAc에서 가용성인 사례에서, 층들을 분리하고 수성 상을 추가의 EtOAc로 추출했다. 조합된 유기물을 5-10% LiCl 또는 1:1 포화된 염수/물의 수용액으로 세정하고, 그 다음 MgSO4 상에서 건조시켰다. 유기물을 여과하고 감압 하에서 농축하고 잔류물을 0-50% EtOAc를 함유하는 에테르로 분쇄했다. 고형 생성물을 여과로 수집하고 고진공 하에서 건조했다. 분쇄에 의한 정제가 >90-95%의 최종 농도에 도달하는 것이 불충분한 사례에서, 단리된 물질에 대해 재결정화 또는 CH2Cl2중 증가하는 비율의 EtOAc 또는 MeOH로 용출하는 실리카겔상 플래시 크로마토그래피를 수행했다.
이소부틸
클로로포르메이트를
사용하는
카복실산
커플링에 대한
아민의
일반적인 절차:
(Shieh, Wen-Chung; Carlson, John A.; Shore, Michael E.; Tetrahedron Lett. 1999, 40, 7167-70.)
CH2Cl2 또는 THF 중 이소부틸 클로로포르메이트 (1.1 당량)의0.35 M 용액을 1 시간의 기간에 걸쳐 적절한 아민 하이드로클로라이드 (1.1 당량), N-메틸모폴린 (2.2 당량) 및 적절한 카복실산의 혼합물에, CH2Cl2 중 0.1 M의 농도에서 또는 THF 0 ℃에서 서서히 부가했다. 이 온도에서의 교반을 추가 15 분 동안 계속한 후 포화된 수성 중탄산나트륨 용액 및 EtOAc의 부가로 반응을 켄칭했다. 고형 아미드 생성물을 흡인 여과로 수집하고 물, EtOAc 및 에테르로 순차적으로 세정했다. 흡인 및 고-진공 하에서 전형적으로 건조하여 원하는 화합물을 무색 내지 베이지색 분말로서 얻었다. 가용성 생성물을 추출성 워크업 절차로 단리했다 (EtOAc (2x), 포화된 수성 NaHCO3 및 NaCl 세정, Na2SO4로 건조하여 유기 층을 얻음, 여과, 진공에서 농축). 분쇄에 의한 정제 (전형적으로 에테르에 의한 또는 1:1 EtOAc/에테르에 의한)가 >90-95%의 최종 순도에 도달하는 것이 불충분한 사례에서, 생성물을, 재결정화 (명시된 용매 혼합물에서) 재결정화에 의해 또는 헥산 중 CH2Cl2, 또는 EtOAc 중 증가하는 비율의 EtOAc 또는 MeOH로 용출하는 실리카겔상 플래시 크로마토그래피에 의해 정제했다.
리튬
하이드록사이드에
의한 에스테르
비누화의
일반적인 절차:
수성 LiOH (1 M, 1.5-2 당량)을 MeOH 및 THF의 2:1 혼합물 중0.1 M의 농도에서 0 ℃에서 적절한 메틸 또는 에틸 에스테르에 적가했다. 이 온도에서 15 분 후, 반응을 실온으로 따뜻하게 하고 반응이 LCMS 또는 TLC 분석에 의해 완료된 것으로 판단될 때까지 교반했다. 부서진 얼음을 그 다음 부가하고 혼합물을 1 M HCl로 pH 3-4로 산성화했다. 추가 1 시간 동안 교반한 후, 고형 생성물을 흡인 여과로 단리하고 고진공 하에서 건조했다. 이들 조건 하에서 침전되지 못한 생성물을 EtOAc (2x)로 추출하여 단리하고, 그 후 조합된 유기물을 염수로 세정하고, 건조시키고 (MgSO4), 여과하고 농축하고, 잔류물을 직접적으로 다음 단계에서 사용했다.
디옥산 중
4 M
HCl에 의한
Boc
탈보호의
일반적인 절차:
1,4-디옥산 (10-20 당량) 중 HCl의 4 M 용액을 CH2Cl2 중 0.5 M의 농도에서0 ℃에서 적절한 Boc-보호된 아민에 서서히 부가했다. 수득한 그 다음 혼합물을 실온에서 교반하고 반응 진행을 LCMS 또는 TLC로 모니터링했다. 필요할 때, 디옥산 중 추가의 HCl를, 완료의 완료를 유도하기 위해 부가했다. 그 다음 반응 혼합물을 감압 하에서 농축 건조하여 원하는 탈보호된 아민 하이드로클로라이드 염을 얻었고, 이것을 직접적으로 다음 반응에서 추가 정제없이 사용했다.
수소화분해를
통한
벤질
에스테르 또는
Cbz
-
탈보호의
일반적인 절차:
0.1-0.2 M의 기질 농도를 달성하기 위한 탈산소화된 MeOH의 측정된 용적을 캐뉼라를 통해 적절한 Cbz-보호된 아민 또는 벤질 에스테르 및 10% Pd/C (30 wt%)에, 격막-캡핑된 rbf에서 진공 하에서 부가했다. 그 다음 반응 용기 내용물을 라텍스 밸룬을 통해 H2의 대기 하에서 두었고 반응 용기를 초음파 배쓰에서 2 분 동안 진탕했다. 혼합물을, 반응이 LCMS 또는 TLC 분석에 의해 완료된 것으로 판단될 때까지 실온에서 교반하고, 그래서 용기를 N2로 씻어 내고 반응 혼합물을 동등 용적의 CH2Cl2로 희석했다. 서스펜션을 셀라이트 패드를 통해 여과하고 패드를 MeOH 및 CH2Cl2의 1:1 혼합물로 철저히 세정했다. 여과물을 농축하고 고-진공 하에서 건조시키고 잔류물을 직접적으로 다음 단계에서 사용했다.
아실 또는
설포닐
클로라이드를 사용하는 R9 도입의 일반적인 절차:
적절한 아실 또는 설포닐 클로라이드 (1.1 당량)을 DIPEA (2.2 당량) 또는 Et3N (2.2 당량) 및 적절한 아민 또는 아민 하이드로클로라이드의 교반된 혼합물에 CH2Cl2 중 0.1-0.2 M의 농도에서 0 ℃에서 나누어서 부가하고 그 다음 반응이 LCMS 또는 TLC 분석에 의해 완료된 것으로 판단될 때까지 교반하면서 실온으로 서서히 따뜻하게 했다. 추가의 CH2Cl2 및 희석된 수성 HCl을 반응 용기에 부가하고 고형 생성물을 흡인 여과로 단리하고, CH2Cl2 및 물로 세정하고 고진공 하에서 건조했다. 비-고형 또는 가용성 생성물을 CH2Cl2 또는 EtOAc로 추출성 워크업으로 단리하고, 그 다음 조합된 유기 추출물을 NaHCO3 및 염수의 포화된 용액으로 세정하고, MgSO4 상에서 건조시키고 감압 하에서 농축했다. Et2O로 잔류물을 분쇄하여 전형적으로 고형 생성물을 산출하고, 이것을 여과로 단리하고 고진공 하에서 건조했다.
N
-아실 아미노산의 제조에 대한 일반적인 절차:
적합한 아실 클로라이드 (1 당량)을 실온에서 적절한 아미노산을 함유하는, 수성 NaOH (1 M, 2 당량), THF 및 Et2O의3:2:6 혼합물에 한번에 부가하고 그 다음 밤새 빠르게 교반했다. 아실화된 생성물을 EtOAc (2x)로 추출하여 단리하고 그 다음 혼합물을 10% 수성 HCl로 pH 2-3으로 조정했다. 조합된 유기물을 염수로 세정하고, Na2SO4 상에서 건조시키고 농축 건조했다. CH2Cl2/Et2O로부터 잔류물의 재결정화로 원하는 N-아실 아미노산을 차후의 반응에서 사용하기에 적합한 순도로 얻었다.
도식 1
a
a
시약
및 조건: a)
HATU
,
DIPEA
,
DMF
, -
20°C
내지 실온; b)
LiOH
, H
2
O, THF,
MeOH
, 0℃ 내지 실온; c) 중간체 8, 9 또는
ent
-9,
HATU
,
DIPEA
,
DMF
, -20℃ 내지 실온; d) 디옥산 중
4 M
HCl 또는 에테르 중
2 M
HCl, 0℃ 내지 실온; e) H
2
(1 atm), 10% Pd/C,
MeOH
; f) 적절한 아실 또는
설포닐
클로라이드,
Et
3
N
또는 DIPEA,
THF
또는
DMF
, 0℃ 내지 실온 또는 적절한
카복실산
,
HATU
,
DIPEA
,
DMF
, 0℃ 내지 실온.
도식 1에 따라 제조된 화합물의 예:
실시예
25
벤질 ((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)카바메이트
1H NMR (DMSO-d6): δ 8.10 (0.5 H), 8.00 (1.5 H), 7.90 (1 H), 7.40-7.08 (12 H), 6.72 (1 H), 6.50 (1 H), 5.00 (2 H), 4.55 (1 H), 4.20 (1 H), 3.99-2.65 (3 H), 3.00 (1 H), 2.72 (1 H), 2.12-1.75 (4 H), 1.60 (1 H), 1.18 (3 H), 0.70 (6 H); 19F NMR (DMSO-d6): δ -74.65, -74.69; MS ESI: 652.4 [M+H]+
실시예
26
메틸 ((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)카바메이트
1H NMR (DMSO-d6): δ 8.12 (0.5 H), 8.05 (0.5 H); 7.94 (1 H); 7.63 (0.5 H), 7.51 (0.5 H); 7.35-7.12 (6 H), 7.03 (1 H), 6.72 (1 H), 6.56 (0.5 H), 6.52 (0.5 H), 4.56 (1 H), 4.28 (1 H), 4.15-3.98 (2 H), 3.73 (1 H), 3.50 (3 H), 3.00 (1 H), 2.75 (1 H), 2.04 (2 H), 1.82 (1 H), 1.85-1.62 (2 H), 1.20 (1.5 H), 1.17 (1.5 H), 0.72 (6 H); 19F NMR (DMSO-d6): δ -75.25, -75.37; MS ESI: 576.3 [M+H]+
실시예
27
tert -부틸 ((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)카바메이트
1H NMR (DMSO-d6): δ 8.12 (0.5 H), 8.04 (0.5 H), 7.86 (2 H), 7.24-7.08 (6 H), 6.69 (1 H), 6.62 (1 H), 6.47 (1 H), 4.58 (1 H), 4.20 (1 H), 3.96-3.75 (2 H), 3.66 (1 H), 3.00 (1 H), 2.73 (1 H), 2.10-1.80 (3 H), 1.77 (1 H), 1.61 (1 H), 1.38 (9 H), 1.18 (3 H), 0.64 (6 H); 19F NMR (DMSO-d6): δ -74.66, -74.69; MS ESI: 618.4 [M+H]+
실시예
28
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-4-이소프로필벤즈아미드
1H NMR (DMSO-d6): δ 8.14-7.93 (3 H), 7.84 (1 H), 7.75 (2 H), 7.30 (2 H), 7.25-7.01 (6 H), 6.70 (1 H), 6.46 (1 H), 4.58 (1 H), 4.25-4.12 (2 H), 3.98-3.72 (2 H), 3.02 (1 H), 2.93 (1 H), 2.74 (1 H), 2.11-1.78 (4 H), 1.60 (1 H), 1.20 (9 H), 0.80 (3 H), 0.70 (3 H); 19F NMR (DMSO-d6): δ -74.65, -74.70; MS ESI: 664.4 [M+H]+.
실시예
29
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-4-(3-(트리플루오로메틸)-3H-디아지린-3-일)벤즈아미드
1H NMR (DMSO-d6): δ 8.38 (1 H), 8.10-7.80 (5 H), 7.37 (2 H), 7.24-7.02 (6 H), 6.67 (1 H), 6.45 (1 H), 4.55 (1 H), 4.20 (2 H), 3.97-3.72 (2 H), 3.01 (1 H), 2.77 (1 H), 2.12-1.80 (4 H), 1.60 (1 H), 1.20 (3 H), 0.80 (3 H), 0.75 (3 H); 19F NMR (DMSO-d6): δ -64.90, -74.66, -74.70; MS ESI: 730.4 [M+H]+
실시예
30
6,6,6-트리플루오로-5-하이드록시-4-((S)-2-((S)-2-((S)-3-메틸-2-(2-(4-(3-(트리플루오로메틸)-3H-디아지린-3-일)페닐)아세트아미도)부탄아미도)-3-페닐프로판아미도)프로판아미도)헥산아미드
1H NMR (DMSO-d6): δ 8.08 (2 H), 7.86 (2 H), 7.37 (2 H), 7.30-7.02 (8 H), 6.68 (1 H), 6.44 (1 H), 4.50 (1 H), 4.20 (1 H), 4.10 (1 H), 3.98-3.75 (2 H), 3.36 (1 H), 3.24 (1 H), 3.00 (1 H), 2.73 (1 H), 2.12-1.80 (4 H), 1.60 (1 H), 1.18 (3 H), 0.68 (6 H); MS ESI: 744.4 [M+H]+
실시예
31
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-3-(3-(트리플루오로메틸)-3H-디아지린-3-일)벤즈아미드
1H NMR (DMSO-d6): δ 8.46 (1 H), 8.16 (1 H), 8.00 (1 H), 7.98-7.84 (2 H), 7.60 (2 H), 7.52 (1 H), 7.27-7.02 (6 H), 6.69 (1 H), 6.47 (1 H), 4.55 (1 H), 4.21 (2 H), 3.97-3.75 (2 H), 3.01 (1 H), 2.77 (1 H), 2.12-1.80 (4 H), 1.64 (1 H), 1.18 (3 H), 0.80 (6 H); MS ESI: 730.3 [M+H]+
실시예
32
6,6,6-트리플루오로-5-하이드록시-4-((S)-2-((S)-2-((S)-3-메틸-2-(2-(3-(3-(트리플루오로메틸)-3H-디아지린-3-일)페닐)아세트아미도)부탄아미도)-3-페닐프로판아미도)프로판아미도)헥산아미드
1H NMR (DMSO-d6): δ 8.20-8.05 (2 H), 8.00-7.90 (2 H), 7.40 (2 H), 7.26-7.08 (8 H), 6.71 (1 H), 6.59 (1 H), 4.51 (1 H), 4.20 (1 H), 4.09 (1 H), 3.98-3.75 (2 H), 3.60 (1 H), 3.42 (1 H), 3.00 (1 H), 2.75 (1 H), 2.10-1.80 (4 H), 1.60 (1 H), 1.18 (3 H), 0.70 (6 H); MS ESI: 744.4 [M+H]+
실시예
33
4-((S)-2-((S)-2-((S)-2-([1,1'-바이페닐]-4-설폰아미도)-3-메틸부탄아미도)-3-페닐프로판아미도)프로판아미도)-6,6,6-트리플루오로-5-하이드록시헥산아미드
최종 단계에서 추출성 워크업은 유기상으로서 9:1 CH2Cl2:MeOH에 의해 수행되었고; 최종 정제는 2-6% MeOH/CH2Cl2로 용출하는 실리카겔상 플래시 크로마토그래피로 달성되었다.
1H NMR (DMSO-d6): δ 8.10 (1 H), 7.95 (1 H), 7.90-7.75 (2 H), 7.72-7.60 (6 H), 7.47 (2 H), 7.40 (1 H), 7.23-7.07 (6 H), 6.70 (1 H), 6.46 (1 H), 4.30 (1 H), 4.18 (1 H), 3.95-3.75 (2 H), 3.53 (1 H), 2.89 (1 H), 2.63 (1 H), 2.06-1.71 (4 H), 1.58 (1 H), 1.13 (3 H), 0.70 (6 H); 19F NMR (DMSO-d6): δ -74.66, -74.71; MS ESI: 734.4 [M+H]+
실시예
34
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-5-메틸-1-페닐-1H-피라졸-4-카복사마이드
1H NMR (DMSO-d6): δ 8.20 (1 H), 8.10-7.95 (2 H), 7.90 (1 H), 7.82 (1 H), 7.60-7.40 (5 H), 7.24-7.05 (6 H), 6.70 (1 H), 6.54 (1 H), 4.57 (1 H), 4.20 (2 H), 3.98-3.76 (2 H), 3.02 (1 H), 2.80 (1 H), 2.47 (3 H), 2.13-1.80 (4 H), 1.62 (1 H), 1.20 (3 H), 0.80 (6 H); 19F NMR (DMSO-d6): δ -74.64, -74.69; MS ESI: 702.4 [M+H]+
실시예
35
6,6,6-트리플루오로-5-하이드록시-4-((S)-2-((S)-2-((S)-3-메틸-2-(2-페닐아세트아미도)부탄아미도)-3-페닐프로판아미도)프로판아미도)헥산아미드
1H NMR (DMSO-d6): δ 8.05 (1 H), 8.00-7.82 (3 H), 7.30-7.08 (11 H), 6.70 (1 H), 6.50 (1 H), 4.53 (1 H), 4.22 (1 H), 4.10 (1 H), 3.97-3.76 (2 H), 3.53 (1 H), 3.40 (1 H), 3.01 (1 H), 2.77 (1 H), 2.10-1.80 (4 H), 1.62 (1 H), 1.20 (3 H), 0.72 (6 H); 19F NMR (DMSO-d6): δ -74.64, -74.69; MS ESI: 636.4 [M+H]+
실시예
36
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-6-페닐니코틴아미드
1H NMR (DMSO-d6): δ 9.07 (1 H), 8.62 (1 H), 8.26 (1 H), 8.20-7.97 (5 H), 7.90 (1 H), 7.58-7.42 (3 H), 7.25-7.02 (6 H), 6.70 (1 H), 6.60 (1 H), 4.57 (1 H), 4.22 (2 H), 3.99-3.75 (2 H), 3.03 (1 H), 2.80 (1 H), 2.12-1.80 (4 H), 1.62 (1 H), 1.20 (3 H), 0.80 (6 H); MS ESI: 699.4 [M+H]+
실시예
37
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-2-(피리딘-4-일)티아졸-4-카복사마이드
1H NMR (DMSO-d6): δ 8.76 (2 H), 8.49 (1 H), 8.38 (1 H), 8.15-7.82 (5 H), 7.11-7.00 (6 H), 6.70 (1 H), 6.50 (1 H), 4.59 (1 H), 4.33 (1 H), 4.22 (1 H), 3.97-3.74 (2 H), 3.02 (1 H), 2.77 (1 H), 2.15-1.80 (4 H), 1.62 (1 H), 1.20 (3 H), 0.80 (6 H); 19F NMR (DMSO-d6): δ -74.64, -74.66; MS ESI: 706.3 [M+H]+
실시예
38
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-4-(피리딘-3-일)벤즈아미드
1H NMR (DMSO-d6): δ 8.97 (1 H), 8.60 (1 H), 8.31 (1 H), 8.20-7.70 (8 H), 7.50 (1 H), 7.12-7.00 (6 H), 6.70 (1 H), 6.50 (1 H), 4.60 (1 H), 4.22 (2 H), 4.07-3.71 (2 H), 3.01 (1 H), 2.79 (1 H), 2.17-1.78 (4 H), 1.61 (1 H), 1.18 (3 H), 0.79 (6 H); 19F NMR (DMSO-d6): δ -74.62, -74.65; MS ESI: 699.4 [M+H]+
실시예
39
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-4-(하이드록시메틸)벤즈아미드
1H NMR (DMSO-d6): δ 8.12 (1 H), 8.08 (1.5 H), 8.0 (0.5 H), 7.86 (1 H), 7.80 (2 H), 7.40 (2 H), 7.24-7.04 (6 H), 6.70 (1 H), 6.50 (1 H), 5.30 (1 H), 4.59 (1 H), 4.56 (2 H), 4.20 (2 H), 3.97-3.76 (2 H), 3.03 (1 H), 2.75 (1 H), 2.10-1.80 (4 H), 1.60 (1 H), 1.19 (3 H), 0.80 (3 H), 0.70 (3 H); 19F NMR (DMSO-d6): δ -74.64, -74.69; MS ESI: 652.3 [M+H]+
실시예
40
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-1-페닐-1H-피라졸-4-카복사마이드
1H NMR (DMSO-d6): δ 9.04 (1 H), 8.19 (1 H), 8.16 (1 H), 8.00-7.83 (3 H), 7.82 (2 H), 7.54 (2 H), 7.38 (1 H), 7.23-7.02 (6 H), 6.71 (1 H), 6.51 (1 H), 4.55 (1 H), 4.23-4.18 (2 H), 3.98-3.77 (2 H), 3.04 (1 H), 2.80 (1 H), 2.14-1.80 (4 H), 1.62 (1 H), 1.20 (3 H), 0.80 (6 H); 19F NMR (DMSO-d6): δ -74.65, -74.70; MS ESI: 688.3 [M+H]+
실시예
41
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-4-모폴리노벤즈아미드
1H NMR (DMSO-d6): δ 8.08-7.98 (2 H), 7.98-7.82 (2 H), 7.76 (2 H), 7.26-7.06 (6 H), 6.97 (2 H), 6.70 (1 H), 6.55 (1 H), 4.56 (1 H), 4.25-4.08 (2 H), 3.98-3.78 (2 H), 3.72 (4 H), 3.20 (4 H), 3.02 (1 H), 2.77 (1 H), 2.14-1.80 (4 H), 1.60 (1 H), 1.20 (3 H), 0.80 (3 H), 0.70 (3 H); 19F NMR (DMSO-d6): δ -74.62, -74.65; MS ESI: 707.4 [M+H]+
실시예
42
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-4-(모폴린-4-카보닐)벤즈아미드
1H NMR (DMSO-d6): δ 8.31 (1 H), 8.15-8.10 (1.5 H), 8.01 (0.5 H), 7.97-7.82 (3 H), 7.50 (2 H), 7.27-7.04 (6 H), 6.70 (1 H), 6.52 (1 H), 4.60 (1 H), 4.20 (2 H), 4.00-3.77 (2 H), 3.75-3.42 (8 H), 3.03 (1 H), 2.78 (1 H), 2.15-1.80 (4 H), 1.63 (1 H), 1.20 (3 H), 0.83 (3 H), 0.77 (3 H); 19F NMR (DMSO-d6): δ -74.64, -74.69; MS ESI: 735.4 [M+H]+
실시예
43
6,6,6-트리플루오로-5-하이드록시-4-((S)-2-((S)-2-((S)-3-메틸-2-(3-페닐프로피오l아미도)부탄아미도)-3-페닐프로판아미도)프로판아미도)헥산아미드
1H NMR (DMSO-d6): δ 8.74 (1 H), 8.14 (1 H), 8.06 (0.5 H), 8.00 (0.5 H), 7.92 (1 H), 7.59 (2 H), 7.54-7.40 (3 H), 7.27-7.17 (6 H), 6.70 (1 H), 6.52 (1 H), 4.66 (1 H), 4.31-4.11 (2 H), 3.98-3.72 (2 H), 3.02 (1 H), 2.78 (1 H), 2.12-1.80 (4 H), 1.62 (1 H), 1.18 (3 H), 0.78 (6 H); 19F NMR (DMSO-d6): δ -74.64, -74.69; MS ESI: 646.4 [M+H]+
실시예
44
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)니코틴아미드
1H NMR (DMSO-d6): δ 8.99 (1 H), 8.70 (1 H), 8.47 (1 H), 8.17 (1 H), 8.10 (1 H), 8.01 (0.5 H), 7.98 (0.5 H), 7.90 (1 H), 7.50 (1 H), 7.24-7.02 (6 H), 6.70 (1 H), 6.48 (1 H), 4.58 (1 H), 4.20 (2 H), 3.97-3.75 (2 H), 3.03 (1 H), 2.78 (1 H), 2.12-1.80 (4 H), 1.63 (1 H), 1.20 (3 H), 0.85 (3 H), 0.77 (3 H); 19F NMR (DMSO-d6): δ -74.62, -74.68; MS ESI: 623.3 [M+H]+
실시예
45
6,6,6-트리플루오로-5-하이드록시-4-((S)-2-((S)-2-((S)-3-메틸-2-(2-페녹시아세트아미도)부탄아미도)-3-페닐프로판아미도)프로판아미도)헥산아미드
1H NMR (DMSO-d6): δ 8.20 (1 H), 8.03 (0.5 H), 7.98 (0.5 H), 7.92 (1 H), 7.72 (1 H), 7.30-7.06 (8 H), 6.99-6.84 (3 H), 6.68 (1 H), 6.53 (1 H), 4.60-4.45 (3 H), 4.27-4.13 (2 H), 3.98-3.76 (2 H), 3.03 (1 H), 2.76 (1 H), 2.15-1.80 (4 H), 1.62 (1 H), 1.20 (3 H), 0.70 (6 H); 19F NMR (DMSO-d6): δ -74.60, -74.66; MS ESI: 652.4 [M+H]+
실시예
46
4-((6S,9S,12S)-9-벤질-6-이소프로필-12-메틸-4,7,10-트리옥소-1-페닐-2-옥사-5,8,11-트리아자tri데칸-13-아미도)-6,6,6-트리플루오로-5-하이드록시헥산아미드
1H NMR (DMSO-d6): δ 8.23 (1 H), 8.07 (0.5 H), 8.00 (0.5 H), 7.90 (1 H), 7.42-7.02 (12 H), 6.70 (1 H), 6.50 (1 H), 4.56 (1 H), 4.50 (2 H), 4.26-4.11 (2 H), 3.99-3.72 (4 H), 3.03 (1 H), 2.72 (1 H), 2.12-1.90 (4 H), 1.61 (1 H), 1.20 (3 H), 0.72 (6 H); 19F NMR (DMSO-d6): δ -74.64, -74.69; MS ESI:666.4 [M+H]+
실시예
47
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-1H-인돌-5-카복사마이드
1H NMR (DMSO-d6): δ 11.31 (1 H), 8.17-7.95 (4 H), 7.84 (1 H), 7.60 (1 H), 7.40 (2 H), 7.14-7.01 (6 H), 6.70 (1 H), 6.58-6.40 (2 H), 4.60 (1 H), 4.24-4.10 (2 H), 3.98-3.72 (2 H), 3.02 (1 H), 2.68 (1 H), 2.15-1.80 (4 H), 1.60 (1 H), 1.20 (3 H), 0.82 (3 H), 0.70 (3 H); 19F NMR (DMSO-d6): δ -74.62, -74.69; MS ESI:661.3 [M+H]+
실시예
48
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-5-페닐-1,3,4-옥사디아졸-2-카복사마이드
1H NMR (DMSO-d6): δ 8.87 (1 H), 8.31 (1 H), 8.15-8.00 (3 H), 7.90 (1 H), 7.70-7.52 (3 H), 7.27-6.98 (6 H), 6.70 (1 H), 6.46 (1 H), 4.60 (1 H), 4.23 (2 H), 3.98-3.72 (2 H), 3.04 (1 H), 2.73 (1 H), 2.14-1.80 (4 H), 1.60 (1 H), 1,20 (3 H), 0.82 (3 H), 0.73 (3 H); 19F NMR (DMSO-d6): δ -74.67, -74.70; MS ESI:690.3 [M+H]+
실시예
49
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-4-(1,3,4-옥사디아졸-2-일)벤즈아미드
1H NMR (DMSO-d6): δ 9.40 (1 H), 8.43 (1 H), 8.18-7.95 (5.5 H), 7.96-7.80 (1.5 H), 7.27-7.00 (6 H), 6.70 (1 H), 6.50 (1 H), 4.58 (1 H), 4.27-4.14 (2 H), 3.98-3.75 (2 H), 3.02 (1 H), 2.79 (1 H), 2.14-1.80 (4 H), 1.60 (1 H), 1.18 (3 H), 0.82 (3 H), 0.76 (3 H); 19F NMR (DMSO-d6): δ -74.63, -74.68; MS ESI:690.4 [M+H]+
실시예
50
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-2-페닐티아졸-4-카복사마이드
1H NMR (DMSO-d6): δ 8.38 (1 H), 8.32 (1 H), 8.10 (0.5 H), 8.05 (0.5 H), 8.00 (3 H), 7.92 (1 H), 7.60-7.50 (3 H), 7.23 (2 H), 7.15 (3 H), 7.05 (1 H), 6.69 (1 H), 6.50 (1 H), 4.60 (1 H), 4,53 (1 H), 4.21 (1 H), 3.97-3.72 (2 H), 3.04 (1 H), 2.77 (1 H), 2.14-1.80 (4 H), 1.60 (1 H), 1.20 (3 H), 0.80 (6 H); 19F NMR (DMSO-d6): δ -74.64, -74.68; MS ESI:705.3 [M+H]+
실시예
51
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-4'-(메틸설포닐)-[1,1'-바이페닐]-4-카복사마이드
1H NMR (DMSO-d6): δ 8.33 (1 H), 8.13-7.93 (8 H), 7.92-7.80 (3 H), 7.27-7.04 (6 H), 6.70 (1 H), 6.48 (1 H), 4.60 (1 H), 4.22 (2 H), 3.98-3.77 (2 H), 3.25 (3 H), 3.04 (1 H), 2.77 (1 H), 2.12-1.80 (4 H), 1.61 (1 H), 1.20 (3 H), 0.82 (3 H), 0.77 (3 H); 19F NMR (DMSO-d6): δ -74.64, -74.69; MS ESI:776.3 [M+H]+
실시예
52
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-4'-플루오로-[1,1'-바이페닐]-4-카복사마이드
1H NMR (DMSO-d6): δ 8.26 (1 H), 8.14-8.00 (2 H), 7.99-7.82 (3 H), 7.80-7.68 (4 H), 7.30 (2 H), 7.26-7.02 (6 H), 6.70 (1 H), 6.50 (1 H), 4.60 (1 H), 4.30-4.10 (2 H), 3.99-3.72 (2 H), 3.03 (1 H), 2.78 (1 H), 2.16-1.77 (4 H), 1.63 (1 H), 1.20 (3 H), 0.80 (3 H), 0.70 (3 H); 19F NMR (DMSO-d6): δ -74.64, -74.69, -115.0; MS ESI:716.3 [M+H]+
도식 2
a
a
시약
및 조건: a) 적절한 아실 또는
설포닐
클로라이드,
Et
3
N
,
THF
, 0℃ 내지 실온 또는 적절한
카복실산
,
HATU
,
DIPEA
,
DMF
, -20℃ 내지 실온; b)
LiOH
, H
2
O, THF,
MeOH
, 0℃ 내지 실온; c) 중간체 8, 9 또는
ent
-9,
HATU
,
DIPEA
,
DMF
, -20℃ 내지 실온.
도식 2에 따라 제조된 화합물의 예:
실시예
53
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)피라진-2-카복사마이드
1H NMR (DMSO-d6): δ 9.19 (1 H), 8.90 (1 H), 8.73 (1 H), 8.45-8.35 (2 H), 8.13 (0.5 H), 8.03 (0.5 H), 7.90 (1 H), 7.27-7.10 (5 H), 7.05 (1 H), 6.70 (1 H), 6.50 (1 H), 4.60 (1 H), 4.35 (1 H), 4.20 (1 H), 3.98-3.72 (2 H), 3.02 (1 H), 2.71 (1 H), 2.14-1.80 (4 H), 1.60 (1 H), 1.20 (3 H), 0.77 (6 H); 19F NMR (DMSO-d6): δ -74.64, -74.68; MS ESI:624.4 [M+H]+
실시예
54
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)벤즈아미드
1H NMR (DMSO-d6): δ 8.20 (1 H), 8.07 (1.5 H), 8.00 (0.5 H), 7.88 (1 H), 7.80 (2 H), 7.50 (1 H), 7.45 (2 H), 7.23-7.02 (6 H), 6.70 (1 H), 6.50 (1 H), 4.56 (1 H), 4.24-4.12 (2 H), 3.96-3.76 (2 H), 3.01 (1 H), 2.78 (1 H), 2.10-1.80 (4 H), 1.61 (1 H), 1.18 (3 H), 0.80 (3 H), 0.72 (3 H); 19F NMR (DMSO-d6): δ -74.65, -74.70; MS ESI:622.4 [M+H]+
도식 3
a
a
시약
및 조건: a)
HATU
,
DIPEA
,
DMF
, 0℃ 내지 실온; b) 디옥산 중
4 M
HCl,
CH
2
Cl
2
, 0℃ 내지 실온; c)
데카노일
클로라이드 또는 4-
페닐벤조일
클로라이드,
Et
3
N
,
THF
, 0℃ 내지 실온; d)
LiOH
, H
2
O,
THF
,
MeOH
, 0℃ 내지 실온; e) H
2
(
1 atm
), 10% Pd/C,
MeOH
; f) 중간체 8, 9 또는
ent
-9,
HATU
,
DIPEA
,
DMF
, -20℃ 내지 실온; g)
TFA
/
CH
2
Cl
2
(1:1), 0℃ 내지 실온.
도식 3에 따라 제조된 화합물의 예:
실시예
55
(2S)-N 1 -(6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)-2-((S)-2-((S)-2-데칸아미도아미도-3-메틸부탄아미도)-3-페닐프로판아미도)펜탄디아미드
화합물은 활성탄을 사용하여 탈색과 함께 에탄올/물로부터 재결정화에 의해 정제되었다.
1H NMR (DMSO-d6): δ 8.01-7.86 (3 H), 7.71 (1 H), 7.26-7.05 (7 H), 6.80-6.64 (2 H), 6.44 (1 H), 4.55 (1 H), 4.20 (1 H), 4.03 (1 H), 3.98-3.80 (2 H), 3.01 (1 H), 2.80 (1 H), 2.20-1.94 (6 H), 1.94-1.55 (5 H), 1.50-1.30 (2 H), 1.30-1.10 (12 H), 0.82 (3 H), 0.75 (6 H); 19F NMR (DMSO-d6): δ -74.61, -74.70; MS ESI: 729.5 [M+H]+
실시예
56
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-4-(메틸티오)-1-옥소부탄-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)데칸아미도아미드
1H NMR (DMSO-d6): δ 8.10-7.82 (3 H), 7.75 (1 H), 7.23-7.08 (6 H), 6.70 (1 H), 6.50 (1 H), 4.52 (1 H), 4.30 (1 H), 4.04 (1 H), 3.98-3.80 (2 H), 3.00 (1 H), 2.80 (1 H), 2.44-2.30 (2 H), 2.20-1.55 (9 H), 2.00 (3 H), 1.52-1.30 (2 H), 1.30-1.10 (12 H), 0.81 (3 H), 0.73 (6 H); MS ESI: 732.5 [M+H]+
실시예
57
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-4-메틸-1-옥소펜탄-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)데칸아미도아미드
1H NMR (DMSO-d6): δ 7.98 (1 H), 7.95 (0.5 H), 7.83 (1.5 H), 7.73 (1 H), 7.23-7.06 (6 H), 6.70 (1 H), 6.47 (1 H), 4.53 (1 H), 4.44 (1 H), 4.05 (1 H), 3.96-3.78 (2 H), 3.00 (1 H), 2.80 (1 H), 2.20-1.80 (6 H), 1.70-1.33 (6 H), 1.30-1.10 (12 H), 0.83 (9 H), 0.73 (6 H); MS ESI: 714.5 [M+H]+
실시예
58
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-3-메틸-1-옥소부탄-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)데칸아미도아미드
1H NMR (DMSO-d6): δ 8.04-7.87 (2 H), 7.79-7.70 (2 H), 7.23-7.04 (6 H), 6.70 (1 H), 6.44 (1 H), 4.55 (1 H), 4.19-4.01 (2 H), 3.90 (1 H), 3.80 (1 H), 2.98 (1 H), 2.78 (1 H), 2.20-1.76 (7 H), 1.63 (1 H), 1.50-1.32 (2 H), 1.30-1.13 (12 H), 0.80 (9 H), 0.75 (6 H); 19F NMR (DMSO-d6): δ -74.61, -74.69; MS ESI: 700.5 [M+H]+
실시예
59
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)데칸아미도아미드
1H NMR (DMSO-d6): δ 8.03 (1 H), 8.00 (1 H), 7.90 (1 H), 7.70 (1 H), 7.30-7.07 (11 H), 6.72 (1 H), 6.47 (1 H), 4.60-4.42 (2 H), 4.05 (1 H), 4.00-3.74 (2 H), 3.00-2.82 (2 H), 2.80-2.62 (2 H), 2.20-1.97 (3 H), 1.97-1.73 (3 H), 1.62 (1 H), 1.52-1.32 (2 H), 1.30-1.15 (12 H), 0.82 (3 H), 0.70 (6 H); MS ESI: 748.5 [M+H]+
실시예
60
N-((2S)-1-(((2S)-1-(((2R)-1-(((3S)-6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)데칸아미도아미드
단일 부분입체이성질체; 중간체 9를 사용하여 제조됨.
1H NMR (DMSO-d6): δ 8.07 (1 H), 7.95 (1 H), 7.78 (1 H), 7.70 (1 H), 7.25-7.10 (6 H), 6.70 (1 H), 6.40 (1 H), 4.43 (1 H), 4.17 (1 H), 4.09 (1 H), 3.96-3.79 (2 H), 2.94 (1 H), 2.81 (1 H), 2.20-1.80 (6 H), 1.68 (1 H), 1.51-1.38 (2 H), 1.30-1.14 (12 H), 1.05 (3 H), 0.83 (3 H), 0.74 (6 H); 19F NMR (DMSO-d6): δ -74.67; MS ESI: 672.5 [M+H]+
실시예
61
N-((2S)-1-(((2S)-1-(((2R)-1-(((3R)-6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)데칸아미도아미드
단일 부분입체이성질체; 중간체 ent-9를 사용하여 제조됨; EtOAc/EtOH로부터 느린 재결정화에 의해 정제됨.
1H NMR (DMSO-d6): δ 8.10 (1 H), 7.97 (1 H), 7.81 (1 H), 7.64 (1 H), 7.25-7.10 (6 H), 6.66 (1 H), 6.43 (1 H), 4.42 (1 H), 4.18 (1 H), 4.10 (1 H), 3.96-3.77 (2 H), 2.95 (1 H), 2.80 (1 H), 2.20-1.80 (6 H), 1.62 (1 H), 1.44-1.36 (2 H), 1.30-1.14 (12 H), 1.02 (3 H), 0.82 (3 H), 0.74 (6 H); 19F NMR (DMSO-d6): δ -74.62; MS ESI: 672.5 [M+H]+
실시예
62
N-((2S)-1-(((2S)-1-(((2R)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드
1H NMR (DMSO-d6): δ 8.32-8.16 (2 H), 8.03 (1 H), 7.99-7.89 (2 H), 7.83-7.62 (5 H), 7.55-7.43 (2 H), 7.40 (1 H), 7.24-7.01 (6 H), 6.70 (1 H), 6.42 (1 H), 4.50 (1 H), 4.32-4.12 (2 H), 3.99-3.77 (2 H), 2.96 (1 H), 2.81 (1 H), 2.27-1.78 (4 H), 1.62 (1 H), 1.03 (3 H), 0.81 (6 H); 19F NMR (DMSO-d6): δ -74.66, -74.69; MS ESI: 698.4 [M+H]+
실시예
63
N-((2S)-1-(((2S)-1-((2-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-2-옥소에틸)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드
1H NMR (DMSO-d6): δ 8.30-8.20 (2 H), 8.10 (1 H), 7.91 (2 H), 7.84 (1 H), 7.80-7.64 (4 H), 7.47 (2 H), 7.40 (1 H), 7.25-7.01 (6 H), 6.70 (1 H), 6.50 (1 H), 4.60 (1 H), 4.23 (1 H), 4.00-3.80 (2 H), 3.79-3.59 (2 H), 3.01 (1 H), 2.81 (1 H), 2.16-1.79 (4 H), 1.62 (1 H), 0.83 (3 H), 0.78 (3 H); 19F NMR (DMSO-d6): δ -74.63, -74.68; MS ESI: 684.4 [M+H]+
실시예
64
N-((2S)-1-(((2S)-1-((1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)카바모일)사이클로프로필)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드
부분입체이성질체의2.4:1 혼합물로서 단리됨.
1H NMR (DMSO-d6): δ 8.21 (0.7 H), 8.15 (0.3 H), 8.10 (0.3 H), 8.00 (0.7 H), 7.98 (0.3 H), 7.90 (0.7 H), 7.70-7.58 (2 H), 7.50-7.36 (4 H), 7.18 (2 H), 7.10 (2 H), 6.97-6.75 (6 H), 6.40 (0.3 H), 6.38 (0.7 H), 6.00 (1 H), 4.00 (1 H), 3.90 (1 H), 3.67-3.50 (2 H), 2.70-2.50 (2 H), 1.86-1.30 (5 H), 0.94-0.72 (1.7 H), 0.72-0.48 (6.3 H), 0.30 (0.7 H), 0.13 (0.3 H), 0.02 (1 H); 19F NMR (DMSO-d6): δ -74.62 (소수의 부분입체이성질체), -74.84 (다수의 부분입체이성질체); MS ESI: 710.4 [M+H]+
실시예
65
N-((2S)-1-(((2S)-1-(((2R)-1-(((3S)-6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드
단일 부분입체이성질체; 중간체 9를 사용하여 제조됨.
1H NMR (DMSO-d6): δ 8.30 (1 H), 8.20 (1 H), 8.03 (1 H), 7.97 (2 H), 7.81 (1 H), 7.76-7.68 (4 H), 7.50 (2 H), 7.40 (1 H), 7.24-7.05 (6 H), 6.70 (1 H), 6.40 (1 H), 4.50 (1 H), 4.33-4.16 (2 H), 3.97-3.79 (2 H), 2,95 (1 H), 2.82 (1 H), 2.10-1.78 (4 H), 1.70 (1 H), 1.05 (3 H), 0.82 (3 H), 0.78 (3 H); 19F NMR (DMSO-d6): δ -74.66; MS ESI: 698.4 [M+H]+
실시예
66
N-((2S)-1-(((2S)-1-((1-(((3S)-6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)카바모일)사이클로부틸)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드
단일 부분입체이성질체; 중간체 9를 사용하여 제조됨.
1H NMR (DMSO-d6): δ 8.40 (1 H), 8.35 (2 H), 7.97 (2 H), 7.73 (4 H), 7.50 (2 H), 7.40 (1 H), 7.30-7.12 (6 H), 7.06 (1 H), 6.70 (1 H), 6.36 (1 H), 4.43 (1 H), 4.23 (1 H), 3.92 (1 H), 3.81 (1 H), 3.06-2.88 (2 H), 2.52 (1 H), 2.24 (1 H), 2.13-1.53 (9 H), 0.90 (3 H), 0.84 (3 H) ; 19F NMR (DMSO-d6): δ -74.62; MS ESI: 724.4 [M+H]+
실시예
67
N-((2S)-1-(((2S)-1-((1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-2-메틸-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드
EtOAc 중 0-4% MeOH를 용출하는 실리카겔상 플래시 크로마토그래피에 의해 정제됨.
1H NMR (DMSO-d6): δ 8.31-8.18 (2 H), 7.99-7.88 (3 H), 7.80-7.64 (4 H), 7.47 (2 H), 7.42-7.27 (2 H), 7.25-7.00 (6 H), 6.70 (1 H), 6.36 (1 H), 4.46 (1 H), 4.24 (1 H), 3.98-3.80 (2 H), 3.01 (1 H), 2.82 (1 H), 2.18-1.80 (4 H), 1.62 (1 H), 1.32-1.20 (6 H), 0.95-0.75 (6 H); 19F NMR (DMSO-d6): δ -74.57, -74.67; MS ESI: 712.4 [M+H]+
실시예
68
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드
1H NMR (DMSO-d6): δ 8.27 (1 H), 8.13 (2 H), 8.00 (1 H), 7.94 (2 H), 7.76 (4 H), 7.50 (2 H), 7.42 (1 H), 7.28-7.02 (11 H), 6.72 (1 H), 6.55 (1 H), 4.62-4.46 (2 H), 4.23 (1 H), 3.99-3.77 (2 H), 3.05-2.88 (2 H), 2.86-2.63 (2 H), 2.13-1.74 (4 H), 1.65 (1 H), 0.83 (3 H), 0.74 (3 H); 19F NMR (DMSO-d6): δ -74.69, -74.72; MS ESI: 774.4 [M+H]+
도식 4
a
a
시약
및 조건: a) 적절한 아실 클로라이드, NaOH, H
2
O,
THF
, 0℃ 내지 실온; b)
N
-
메틸모폴린
,
i
-
BuOCOCl
,
CH
2
Cl
2
, 0℃ 또는
HATU
,
DIPEA
,
DMF
, 0℃ 내지 실온; c)
LiOH
, H
2
O,
THF
,
MeOH
, 0℃ 내지 실온; d) intermediate 8, 9 또는
ent
-9, HATU,
DIPEA
,
DMF
, -20℃ 내지 실온.
도식 4에 따라 제조된 화합물의 예:
실시예
69
N-((2S)-1-(((2R)-1-(((2R)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드
1H NMR (DMSO-d6): δ 8.42 (1 H), 8.30 (1 H), 8.14 (1 H), 7.95 (2 H), 7.80 (0.5 H), 7.73 (4.5 H), 7.46 (2 H), 7.40 (1 H), 7.24 (2 H), 7.20-7.05 (4 H), 6.70 (1 H), 6.45 (1 H), 4.56 (1 H), 4.22 (1 H), 4.17 (1 H), 3.97-3.74 (2 H), 3.12 (1 H), 2.68 (1 H), 2.10-1.80 (4 H), 1.60 (1 H), 1.35-1.20 (3 H), 0.75 (3 H), 0.58 (3 H); 19F NMR (DMSO-d6): δ -74.63, -74.75; MS ESI: 698.4 [M+H]+
도식 5
a
a
시약
및 조건: a) 적절한 아실 클로라이드, NaOH, H
2
O,
THF
, 0℃ 내지 실온; b)
N
-
메틸모폴린
,
i
-
BuOCOCl
,
CH
2
Cl
2
,
0°C
또는
HATU
,
DIPEA
,
DMF
, 0℃ 내지 실온; c)
LiOH
, H
2
O,
THF
,
MeOH
, 0℃ 내지 실온; d) 중간체 8, 9 또는
ent
-
9,
HATU
, DIPEA,
DMF
, -20℃ 내지 실온; e) H
2
(
1 atm
), 10% Pd/C,
MeOH
; f)
HATU
,
DIPEA
, DMF, 0℃ 내지 실온.
도식 5 에 따라 제조된 화합물의 예:
실시예
70
N-((2S)-1-(((2R)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드
부분입체이성질체의 4:1 혼합물로서 단리됨.
1H NMR (DMSO-d6): δ 8.48 (1 H), 8.36 (1 H), 8.05 (1 H), 7.97 (2 H), 7.88 (1 H), 7.76 (4 H), 7.50 (2 H), 7.40 (1 H), 7.23 (2 H), 7.20-7.06 (4 H), 6.70 (1 H), 6.53 (1 H), 4.52 (1 H), 4.22 (1 H), 4.17 (1 H), 3.96 (1 H), 3.83 (1 H), 3.05 (1 H), 2.76 (1 H), 2.18-1.82 (4 H), 1.61 (1 H), 1.18 (3 H), 0.78 (3 H), 0.57 (3 H); 19F NMR (DMSO-d6): δ -74.63; MS ESI: 698.4 [M+H]+
실시예
71
N-((2S)-1-((2-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-2-옥소에틸)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드
1H NMR (DMSO-d6): δ 8.44-8.30 (2 H), 8.00 (2 H), 7.90 (2 H), 7.76 (4 H), 7.48 (2 H), 7.40 (1 H), 7.18 (1 H), 6.68 (1 H), 6.53 (1 H), 4.23 (2 H), 3.99-3.80 (2 H), 3.76 (2 H), 2.20-1.80 (4 H), 1.62 (1 H), 1.20 (3 H), 0.97 (6 H); 19F NMR (DMSO-d6): δ -74.64. -74.66; MS ESI: 608.4 [M+H]+
실시예
72
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드
1H NMR (DMSO-d6): δ 8.32 (1 H), 8.18 (1 H), 8.00-7.80 (4 H), 7.72 (4 H), 7.48 (2 H), 7.40 (1 H), 7.17 (1 H), 6.68 (1 H), 6.56 (1 H), 4.30 (2 H), 4.20 (1 H), 3.98-3.73 (2 H), 2.20-1.80 (4 H), 1.60 (1 H), 1.25-1.10 (6 H), 0.93 (6 H); 19F NMR (DMSO-d6): δ -74.53, -74.54; MS ESI: 622.4 [M+H]+
실시예
73
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-4-(메틸티오)-1-옥소부탄-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드
1H NMR (DMSO-d6): δ 8.39 (1 H), 8.16 (1 H), 8.00-7.85 (4 H), 7.75 (4 H), 7.47 (2 H), 7.40 (1 H), 7.19 (0.5 H), 7.11 (0.5 H), 6.70 (1 H), 4.38 (1 H), 4.30-4.14 (2 H), 3.96-3.76 (2 H), 2.42 (2 H), 2.20-1.72 (6 H), 2.00 (3 H), 1.60 (1 H), 1.20 (3 H), 0.94 (6 H); 19F NMR (DMSO-d6): δ -74.63, -74.69; MS ESI: 682.4 [M+H]+
실시예
74
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드
1H NMR (DMSO-d6): δ 8.40 (1 H), 8.03-7.80 (5 H), 7.74 (4 H), 7.46 (2 H), 7.40 (1 H), 7.20 (0.5 H), 7.06 (0.5 H), 6.65 (1 H), 6.47 (1 H), 4.33 (1 H), 4.30-4.10 (2 H), 3.95-3.72 (2 H), 2.21-1.79 (5 H), 1.60 (1 H), 1.23-1.10 (3 H), 0.92 (6 H), 0.83 (6 H) ; 19F NMR (DMSO-d6): δ -74.66, -74.70; MS ESI: 650.4 [M+H]+
실시예
75
N-((5S,8S,11S)-17-아미노-8-벤질-11-메틸-6,9,12,17-테트라옥소-14-(2,2,2-트리플루오로-1-하이드록시에틸)-2-티아-7,10,13-트리아자헵타데칸-5-일)-[1,1'-바이페닐]-4-카복사마이드
1H NMR (DMSO-d6): δ 8.54 (1 H), 8.03 (2 H), 7.98 (2 H), 7.89 (1 H), 7.75 (4 H), 7.48 (2 H), 7.40 (1 H), 7.23-7.05 (6 H), 6.70 (1 H), 6.48 (1 H), 4.58 (1 H), 4.53 (1 H), 4.20 (1 H), 4.00-3.76 (2 H), 3.03 (1 H), 2.80 (1 H), 2.40 (2 H), 2.15-1.80 (5 H), 2.02 (3 H), 1.62 (1 H), 1.21 (3 H); 19F NMR (DMSO-d6): δ -74.64, -74.66; MS ESI: 730.4 [M+H]+
실시예
76
N-((2R)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드
1H NMR (DMSO-d6): δ 8.44 (1 H), 8.31 (1 H), 8.17 (1 H), 7.95 (2 H), 7.87 (0.5 H), 7.80 (0.5 H), 7.77 (4 H), 7.44 (2 H), 7.40 (1 H), 7.24 (2 H), 7.20-7.07 (4 H), 6.70 (1 H), 4.57 (1 H), 4.22 (1 H), 4.18 (1 H), 3.96-3.75 (2 H), 3.13 (1 H), 2.73 (1 H), 2.10-1.80 (4 H), 1.60 (1 H), 1.25 (3 H), 0.77 (3 H), 0.58 (3 H); 19F NMR (DMSO-d6): δ -74.63, -74.75; MS ESI: 698.4 [M+H]+
실시예
77
N-((1S)-2-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-2-옥소-1-페닐에틸)-[1,1'-바이페닐]-4-카복사마이드
1H NMR (DMSO-d6): δ 8.81 (1 H), 8.41 (1 H), 8.10-7.92 (3 H), 7.86 (1 H), 7.75 (4 H), 7.50 (2 H), 7.40 (1 H), 7.38-7.00 (11 H), 6.70 (1 H), 6.48 (1 H), 5.63 (1 H), 4.60 (1 H), 4.20 (1 H), 3.98-3.78 (2 H), 3.09 (1 H), 2.82 (1 H), 2.17-1.80 (3 H), 1.61 (1 H), 1.20 (3 H); 19F NMR (DMSO-d6): δ -74.64, -74.67; MS ESI: 732.4 [M+H]+
실시예
78
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)-[1,1'-바이페닐]-4-카복사마이드
1H NMR (DMSO-d6): δ 8.60 (1 H), 8.17 (2 H), 7.90 (1 H), 7.84 (2 H), 7.72 (4 H), 7.50 (2 H), 7.40 (1 H), 7.33-7.09 (11 H), 6.70 (1 H), 6.49 (1 H), 4.63 (1 H), 4.58 (1 H), 4.22 (1 H), 4.00-3.78 (2 H), 3.03 (2 H), 2.95 (1 H), 2.82 (1 H), 2.18-1.80 (3 H), 1.61 (1 H), 1.21 (3 H); 19F NMR (DMSO-d6): δ -74.62, -74.65; MS ESI: 746.4 [M+H]+
실시예
79
N-(2-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-2-옥소에틸)-[1,1'-바이페닐]-4-카복사마이드
1H NMR (DMSO-d6): δ 8.79 (1 H), 8.21-8.12 (2 H), 7.94 (2 H), 7.87-7.63 (5 H), 7.45 (2 H), 7.40 (1 H), 7.26-7.07 (6 H), 6.70 (1 H), 6.47 (1 H), 4.57 (1 H), 4.21 (1 H), 4.00-3.70 (3 H), 3.02 (1 H), 2.80 (1 H), 2.15-1.80 (4 H), 1.62 (1 H), 1.21 (3 H); 19F NMR (DMSO-d6): δ -74.62, -74.68; MS ESI: 656.4 [M+H]+
실시예
80
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)아미노)-1-옥소프로판-2-일)-[1,1'-바이페닐]-4-카복사마이드
1H NMR (DMSO-d6): δ 8.57 (1 H), 8.03-7.95 (4 H), 7.82 (1 H), 7.77 (4 H), 7.50 (2 H), 7.40 (1 H), 7.22-7.05 (6 H), 6.70 (1 H), 6.50 (1 H), 4.50 (1 H), 4.40 (1 H), 4.20 (1 H), 4.00-3.77 (2 H), 3.02 (1 H), 2.81 (1 H), 2.16-1.80 (3 H), 1.61 (1 H), 2.22 (6 H); 19F NMR (DMSO-d6): δ -74.65, -74.68; MS ESI: 670.4 [M+H]+
실시예
81
N-((5R,8S,11S)-17-아미노-8-벤질-11-메틸-6,9,12,17-테트라옥소-14-(2,2,2-트리플루오로-1-하이드록시에틸)-2-티아-7,10,13-트리아자헵타데칸-5-일)-[1,1'-바이페닐]-4-카복사마이드
1H NMR (DMSO-d6): δ 8.52 (1 H), 8.35 (1 H), 8.17 (1 H), 7.96 (2 H), 7.90 (0.5 H), 7.72 (4.5 H), 7.48 (2 H), 7.40 (1 H), 7.24-7.04 (6 H), 6.70 (1 H), 6.50 (1 H), 4.59 (1 H), 4.51 (1 H), 4.21 (1 H), 3.98-3.78 (2 H), 3.10 (1 H), 2.73 (1 H), 2.38-2.15 (2 H), 2.12-1.80 (3 H), 2,00 (3 H), 1.80-1.48 (3 H), 1.24 (3 H); 19F NMR (DMSO-d6): δ -74.62, -74.72; MS ESI: 730.4 [M+H]+
실시예
82
N-((5R,8R,11S)-17-아미노-8-벤질-11-메틸-6,9,12,17-테트라옥소-14-(2,2,2-트리플루오로-1-하이드록시에틸)-2-티아-7,10,13-트리아자헵타데칸-5-일)-[1,1'-바이페닐]-4-카복사마이드
1H NMR (DMSO-d6): δ 8.60 (0.5 H), 8.56 (0.5 H), 8.18-8.05 (2 H), 7.98 (2 H), 7.85 (0.5 H), 7.75 (4.5 H), 7.48 (2 H), 7.40 (1 H), 7.23-7.11 (6 H), 6.77 (0.5 H), 6.67 (0.5 H), 6.45 (1 H), 4.50 (2 H), 4.20 (1 H), 3.99-3.78 (2 H), 2.98 (1 H), 2.84 (1 H), 2.44 (2 H), 2.15-1.52 (6 H), 2.00 (3 H), 1.11 (3 H); 19F NMR (DMSO-d6): δ -74.62, -74.65; MS ESI: 730.3 [M+H]+
도식 6
a
a
시약
및 조건: a)
HATU
,
DIPEA
,
DMF
, -20℃ 내지 실온; b) 디옥산 중
4 M
HCl,
CH
2
Cl
2
, 0℃ 내지 실온; c) 적절한 아실 또는
설포닐
클로라이드,
Et
3
N
,
THF
, 0℃ 내지 실온, 또는 적절한
카복실산
,
HATU
,
DIPEA
,
DMF
, 0℃ 내지 실온; d) LiOH, H
2
O,
THF
,
MeOH
, 0℃ 내지 실온; e) 중간체 8, 9 또는
ent
-
9,
HATU
,
DIPEA
, DMF, -20℃ 내지 실온.
도식 6에 따라 제조된 화합물의 예:
실시예
83
2-((S)-2-([1,1'-바이페닐]-4-카복사미도)-3-메틸부탄아미도)-N-((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)-2,3-디하이드로-1H-인덴-2-카복사마이드
1H NMR (DMSO-d6): δ 8.72 (1 H), 8.48 (1 H), 7.99 (2 H), 7.75 (5 H), 7.50 (3 H), 7.40 (1 H), 7.22-7.00 (5 H), 6.70 (0.5 H), 6.63 (0.5 H), 6.45 (1 H), 4.16 (1 H), 4.01 (1 H), 3.98-3.73 (2 H), 3.58 (1 H), 3.39 (1 H), 3.24 (2 H), 2.18-1.80 (4 H), 1.62 (1 H), 1.18 (3 H), 0.94 (3 H), 0.77 (3 H); 19F NMR (DMSO-d6): δ -74.60, -74.66; MS ESI: 710.4 [M+H]+
실시예
84
N-((2S)-1-(((1S)-2-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-2-옥소-1-페닐에틸)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드
1H NMR (DMSO-d6): δ 8.42 (3 H), 7.96 (2 H), 7.85 (0.5 H), 7.76 (4.5 H), 7.50 (2 H), 7.40 (3 H), 7.36-7.20 (3 H), 7.15 (0.5 H), 7.04 (0.5 H), 6.69 (0.5 H), 6.63 (0.5 H), 6.48 (1 H), 5.58 (1 H), 4.40 (1 H), 4.22 (1 H), 3.85 (1 H), 3.75 (1 H), 2.17 (1 H), 2.05-1.75 (3 H), 1.57 (1 H), 1.20 (3 H), 0.90 (6 H); 19F NMR (DMSO-d6): δ -74.67, -74.70; MS ESI: 684.3 [M+H]+
실시예
85
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-4-페닐부탄-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드
1H NMR (DMSO-d6): δ 8.60 (1 H), 8.22 (1 H), 8.03-7.86 (4 H), 7.76 (4 H), 7.50 (2 H), 7.40 (1 H), 7.28-7.07 (6 H), 6.70 (1 H), 6.60 (1 H), 4.40-4.15 (3 H), 4.06-3.72 (2 H), 2.60 (2 H), 2.20 (1 H), 2.15-1.76 (5 H), 1.61 (1 H), 1.20 (3 H), 0.97 (6 H); 19F NMR (DMSO-d6): δ -74.64, -74.71; MS ESI: 712.4 [M+H]+
실시예
86
N-((2S)-1-(((2R)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-4-페닐부탄-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드
1H NMR (DMSO-d6): δ 8.57-8.42 (2 H), 8.00 (2 H), 7.93 (1 H), 7.84 (1 H), 7.74 (4 H), 7.49 (2 H), 7.40 (1 H), 7.25 (2 H), 7.16 (4 H), 6.70 (1 H), 6.48 (1 H), 4.22 (3 H), 3.98-3.75 (2 H), 2.61 (1 H), 2.51 (1 H), 2.21-1.72 (6 H), 1.61 (1 H), 1.20 (3 H), 1.00 (6 H); 19F NMR (DMSO-d6): δ -74.63, -74.65; MS ESI: 712.4 [M+H]+
실시예
87
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-3-(4-하이드록시페닐)-1-옥소프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드
RP-HPLC에 의해 정제됨 (고정상: Phenomenex C12 Synergi 4u Max-RP; 이동상 A: H2O 중 0.1% 포름산; 이동상 B: CH3CN 중 0.1% 포름산; A 중 구배 18-58 % B; 실시 시간 = 20분.
1H NMR (DMSO-d6): δ 9.12 (1 H), 8.29 (1 H), 8.06-7.82 (5 H), 7.75 (4 H), 7.50 (2 H), 7.40 (1 H), 7.20 (1 H), 7.00 (2 H), 6.69 (1 H), 6.62-6.44 (3 H), 4.50 (1 H), 4.20 (2 H), 4.00-3.78 (2 H), 2.92 (1 H), 2.67 (1 H), 2.18-1.80 (4 H), 1.62 (1 H), 1.20 (3 H), 0.80 (6 H); 19F NMR (DMSO-d6): δ -74.64, -74.69; MS ESI: 714.4 [M+H]+
실시예
88
3-(4-(((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-3-(4-하이드록시페닐)-1-옥소프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)카바모일)페닐)피리딘-1-이움 포르메이트
RP-HPLC에 의해 정제됨 (고정상: Phenomenex C12 Synergi 4u Max-RP 8A 50x20 mm; 이동상 A: H2O 중 0.1% 포름산; 이동상 B: CH3CN 중0.1% 포름산; A 중 구배 12-52 % B; 실시 시간 = 20분.
1H NMR (DMSO-d6): δ 9.20 (1 H), 8.94 (1 H), 8.60 (1 H), 8.50 (1 H), 8.38 (1 H), 8.14 (1 H), 8.08-7.87 (5 H), 7.83 (2 H), 7.51 (1 H), 7.19 (0.5 H), 7.15 (0.5 H), 7.00 (2 H), 6.70 (1 H), 6.62 (1 H), 6.66 (2 H), 4.48 (1 H), 4.20 (2 H), 3.96-3.74 (2 H), 2.91 (1 H), 2.57 (1 H), 2.11-1.80 (4 H), 1.61 (1 H), 1.19 (3 H), 0.85 (3 H), 0.77 (3 H); 19F NMR (DMSO-d6): δ -74.64, -74.70; MS ESI: 715.4 [M+H]+
실시예
89
N-((2S)-1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-3-(1H-인돌-3-일)-1-옥소프로판-2-일)아미노)-3-메틸-1-옥소부탄-2-일)-[1,1'-바이페닐]-4-카복사마이드
1H NMR (DMSO-d6): δ 10.79 (1 H), 8.28 (1 H), 8.13 (1 H), 8.05-7.80 (4 H), 7.75 (4 H), 7.58 (1 H), 7.50 (2 H), 7.41 (1 H), 7.30 (1 H), 7.18 (2 H), 7.04 (1 H), 6.95 (1 H), 6.73 (1 H), 6.50 (1 H), 4.61 (1 H), 4.30-4.15 (2 H), 3.99-3.77 (2 H), 3.14 (1 H), 2.98 (1 H), 2.15-1.80 (4 H), 1.65 (1 H), 1.30-1.10 (3 H), 0.87 (3 H), 0.80 (3 H); 19F NMR (DMSO-d6): δ -74.62, -74.65; MS ESI: 737.4 [M+H]+
RP-HPLC에 의해 정제됨 (고정상: Phenomenex C12 Synergi 4u Max-RP 8A 50x20 mm; 이동상 A: H2O 중 0.1% 포름산; 이동상 B: CH3CN 중 0.1% 포름산; A 중 구배 20-60 % B; 실시 시간 = 20분.
도식 7
a
a
시약
및 조건: a)
HATU
,
DIPEA
,
DMF
, -20℃ 내지 실온; b)
LiOH
, H
2
O,
THF
, MeOH, 0℃ 내지 실온; c) 중간체 8, 9 또는
ent
-9,
HATU
,
DIPEA
,
DMF
, 0℃ 내지 실온; d) 디옥산 중
4 M
HCl,
CH
2
Cl
2
, 0℃ 내지 실온; e) 적절한 아실 또는
설포닐
클로라이드,
Et
3
N
,
THF
, 0℃ 내지 실온, 또는 적절한
카복실산
,
HATU
,
DIPEA
,
DMF
, 0℃ 내지 실온.
도식 7에 따라 제조된 화합물의 예:
실시예
90
N-(1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)카바모일)사이클로펜틸)-[1,1'-바이페닐]-4-카복사마이드
1H NMR (DMSO-d6): δ 8.66 (0.5 H), 8.61 (0.5 H), 8.00 (2 H), 7.86-7.60 (6 H), 7.58-7.36 (4 H), 7.13 (6 H), 6.68 (1 H), 6.45 (1 H), 4.44 (1 H), 4.15 (1 H), 3.99-3.78 (2 H), 3.10 (1 H), 2.87 (1 H), 2.25 (1 H), 2.17-1.74 (5 H), 1.73-1.40 (6 H), 1.23 (3 H); 19F NMR (DMSO-d6): δ -74.62, -74.67; MS ESI: 710.4 [M+H]+
실시예
91
N-(1-(((2S)-1-(((2S)-1-((6-아미노-1,1,1-트리플루오로-2-하이드록시-6-옥소헥산-3-일)아미노)-1-옥소프로판-2-일)아미노)-1-옥소-3-페닐프로판-2-일)카바모일)사이클로프로필)-[1,1'-바이페닐]-4-카복사마이드
1H NMR (DMSO-d6): δ 9.10 (1 H), 8.02-7.90 (3 H), 7.85-7.66 (6 H), 7.50 (2 H), 7.40 (1 H), 7.12 (6 H), 6.70 (1 H), 6.50 (1 H), 4.53 (1 H), 4.20 (1 H), 4.00-3.78 (2 H), 3.02 (1 H), 2.90 (1 H), 2.18-1.79 (3 H), 1.61 (1 H), 1.40-1.15 (5 H), 1.03 (1 H), 0.93 (1 H); 19F NMR (DMSO-d6): δ -74.63, -74.71; MS ESI: 682.3 [M+H]+.
그 다음 본 발명의 화합물은 생물학적 PCSK9-기반 검정을 사용하여 스크리닝되었다.
실시예
92
최초 스크리닝
WT PCSK9(+V5)를 안정적으로 발현하는 HepG2 세포를 10 μM, 100 μM 또는 증가하는 농도 (11, 33, 100 μM)의 시험된 화합물의 존재 또는 부재 (DMSO) 하에서 밤새 (24 시간) 인큐베이션시켰다. 24시간-컨디셔닝된 배지를 수집하고, 원심분리하고, ELISA (100 μl의 1:30 희석액)에 의한 PCSK9 정량화를 위해 상청액을 제거하였다. 세포를, 단백분해효소 억제제의 혼합물 (로쉐 어플라이드 사이언스)을 함유하는 250 ul/웰의 방사성면역침전 검정 완충제 (RIPA) (50 mM 트리스-HCl, pH 7.8, 150 mM NaCl, 1% 노니덴트 P-40, 0.5% 나트륨 데옥시콜레이트, 0.1% SDS)로 용해시키고, 5분 동안 11,300 x g에서 펠릿화시켰다. ELISA (100 μl의 1:20 희석액)에 의한 세포 PCSK9 정량화, 및 바이오-라드 DC 단백질 검정 (바이오-라드)에 의한 총 단백질 측정을 위해 상청액을 제거하였다 (문헌 (Dubuc G, Tremblay M, Pare G, Jacques H, Hamelin J, Benjannet S, Boulet L, Genest J, Bernier L, Seidah NG, Davignon J. 2010. A new method for measurement of total plasma PCSK9: clinical applications. J Lipid Res. 51:140-149) 참고). 165 초과의 화합물에 PCSK9 분비 검정에 의해 100 μM에서 최초 스크리닝을 실시하였다.
이 검정에서 DMSO 대조군 (30% 억제)에 비하여 PCSK9-배지/세포 비를 적어도 30%까지 감소시키는 것으로 확인된 어떤 화합물을, 용량 의존적인 방식으로 PCSK9 분비를 억제하는 이들의 능력에 대해서 추가로 시험하였다. 적어도 24 화합물이 용량 의존적인 방식으로 PCSK9 분비를 억제하는 것으로 확인되었다 (실시예 1 내지 24에 기재된 화합물).
도 1 및 표 I에는 선택된 시험된 화합물이 제시되어 있다. 도 2는 33.3 μM의 용량에서 DMSO 대조군에 비하여 PCSK9-배지/세포를 30% 내지 50%로 감소시키는 선택된 시험된 화합물, 즉 19, 22a 및 23에 대한, PCSK9(+V5)를 안정적으로 발현하는 HepG2 세포에서 PCSK9 분비의 용량 의존적인 억제를 예시한다.
표 I. 10
μM
농도의 선택된
시험된
화합물에 대한
PCSK9
분비
% 활성을 하기 식을 사용하여 계산하였다:
실시예
93
세포독성 검정
최초 스크리닝 후에, 화합물의 세포독성을 제조업자의 프로토콜 (프로메가)에 따라 MTT 독성 검정 (3-[4,5-디메틸티아졸-2-일]-2,5 디페닐 테트라졸륨 브로마이드) (도 3 참고)을 사용하여 또는 세포 생존력 검정 (표 II 참고)을 사용하여 시험하였다.
MTT 독성 검정을 위해, WT PCSK9(+V5)를 과발현하는 HepG2 안정적인 세포를 96웰 플레이트 (그라이너 바이오원)에 파종시키고, 20시간 동안 인큐베이션시켰다. 간단한 세척 후에, 세포를 증가하는 농도 (11, 33, 100 μM)의 화합물의 존재하에서, 또는 DMSO (대조군)의 존재하에서 밤새 (24시간) 인큐베이션시켰다. MTT 검정 (프로메가)은 제조업자의 지시에 따라 20 μl/웰 MTT 시약의 첨가, 및 45분 동안 37℃에서의 인큐베이션으로 구성되었다. 흡광도를 490 nm에서 기록하고, 비특이적 흡광도 (690 nm)로 인하여 바탕에 대해 보정하였다. 33.3 μM 또는 그 미만에서 낮은 독성을 갖는 화합물이, 화합물 19, 22a, 23, 4 및 17에 대하여 도 3에 예시된 바와 같이 선택되었다.
세포 생존력 검정을 위해, HepG2 세포의 세포 밀도를, 실시예 92에 기재된 PCSK9 분비 검정 동안 33 μM의 화합물의 존재하에서 또는 DMSO (대조군)의 존재하에서 측정하였다. 하기 표 II에는 33.3 μM 또는 그 미만에서 낮은 독성을 갖는 화합물이 제시되어 있다.
표 II :
시험된
화합물의 부재하에서(
DMSO
) 얻어진 세포 생존력의 퍼센트로 제시된, 33
μM
농도의 선택된 화합물의 존재하에서의 세포 생존력
PCSK9 자가프로세싱 및 분비에 대한 효과에 대해서 다양한 검정, 예컨대 웨스턴 블롯 분석 및 생합성 분석을 사용하여, PCSK9에 대한 선택된 PCSK9 억제 화합물의 활성을 추가로 특성화하였다. LDLR 분해 및 분비된 PCSK9 억제 화합물의 활성에 대한 효과는, 일련의 검정, 예컨대 면역형광 검정, Dil-LDL 흡수 검정 및 세포-표면 LDLR에 대한 FACS 분석, 및 총 LDLR에 대한 웨스턴 블롯 분석을 사용하여 특성화하였다.
실시예
94
면역형광
검정
PCSK9 억제 화합물을 세포-표면 LDLR에 대하여 및 대조군으로 HepG2 비처리 세포에서 인간 트랜스퍼린 수용체에 대하여 면역형광법으로 특성화하였다. 세포를, 24웰 세포 배양 플레이트에 위치한 폴리-L-리신-코팅된 (50 ug/ml) 둥근 현미경 커버 슬립 1.12 mm 두께 (피셔브랜드 12CIR #1) 상에 플레이팅하였다. 파종 후 24시간에, 세포를 33.3 μM의 PCSK9 억제제의 부재하에서(DMSO) 또는 존재하에서 인큐베이션시켰다. 20시간의 인큐베이션 기간 후에, 세포를 3.7% 파라포름알데하이드로 고정시켰다. 인간 LDLR의 면역형광법 (녹색 표지)을 비투과성 조건 하에서 수행하였다. 세포를 1% BSA로 차단시킨 후에, 1차 항체 (1% BSA 중의 1:200 염소 다클론성 항-hLDLR, 알 & 디 시스템스)와 함께 4℃에서 밤새 인큐베이션시켰다. 알렉사 플루오르-태그된 2차 항체와 함께 실온에서 1시간 인큐베이션시켰더니 항원-항체 착물이 나타났고, 이것을 프로롱 골드 안티페이드 시약 (몰리큘러 프로브즈, 인비트로젠) 중에 두었다. 공초점 현미경 (자이스 LSM-710)을 사용하여 면역형광 분석을 수행하였다. 세포 핵은 DAPI (청색 표지)로 염색하였다. LDLR은 항-LDLR Abs (녹색 표지)로 염색시켰다. LDLR 분해에 대한 PCSK9 활성의 억제는, 화합물 19에 대해 도 4에 예시된 바와 같이, 세포 표면에서 LDLR의 증가에 의해 검출되었다.
실시예
95
Dil
-LDL 검정
PCSK9 억제 화합물을 또한 문헌 (Poirier 등, J. Biol . Chem . 284: 28856-28864, 2009)에 기재된 바와 같이 Dil-LDL 형광 흡수 검정을 사용하여 특성화하였다. 상기 방법은, 화합물의 존재 또는 부재하에서 인간 간세포 유래한 HuH7 또는 HepG2 세포 주, 또는 인간 배아 HEK293 세포에서 LDLR 내부화를 통한 Dil-LDL 세포 혼입의 형광 측정 (세포 표면 LDLR 활성의 측정)을 필요로 한다.
HepG2 비처리 세포 및 HEK293 비처리 세포를, 96웰 플레이트 (둥근 바닥을 갖는 셀바인드™ 블랙 플레이트 (코닝; Cat # 3340))에 플레이팅하였다. 파종 후 20시간에, 세포를 상이한 농도의 화합물의 부재하에서(DMSO 또는 음성 대조군) 또는 존재하에서 인큐베이션시켰다. 각각의 조건을 3개씩 준비하였다. 6시간의 인큐베이션 후에, Dil-LDL (바이오메디컬 테크놀로지스 (Cat #BT-904))을 세포 배지에 첨가하고, 세포를 또 다른 18시간 동안 조직 배양 인큐베이터로 돌려보냈다. 스펙트라맥스 제미니이엠™ 플레이트 판독기 (분자 장치(Molecular Devices)) 상에서 플레이트를 스캐닝하였다. 각각의 웰에 대하여, 미정제 Dil-LDL 흡수를 웰 내 3 상이한 지점에서의 9 판독치의 평균 형광 세기(RFU) (ex: 520 nm/ em: 575 nm, 컷오프: 550 nm)로 측정하였다. 제조업자의 지시에 따라 시콴트™ 세포 검정 (인비트로젠)을 수행하여 각각의 웰 내 Dil-LDL 흡수를 총 세포 수에 대하여 보정하였다. 보정된 Dil-LDL 흡수를 DMSO 대조군의 %로 기록하였는데, 이것은 3개 웰로부터 얻었다. LDLR 분해에 대한 PCSK9 활성의 억제는 Dil-LDL 흡수에서의 증가에 의해 검출된다 (HepG2 비처리 세포에서 화합물 19, 22a, 23, 24, 21a, 21b에 대해서는 도 5A에 예시됨). 화합물 i가 음성 대조군으로 선택되었고, 화합물 1, 17 및 2는 HepG2 세포에서의 이러한 검정에서 측정가능한 활성을 나타내지 않는다. PCSK9에 대한 화합물의 특이성이 도 5B에 예시되어 있는데, 이 도면은 PCSK9 발현이 부족한 것으로 공지된 HEK293 세포에서, 동일한 세트의 화합물이 Dil-LDL 흡수에 대해서는 효과를 나타내지 않음을 보여준다.
표 III : 선택된 화합물의 부재하에서(
DMSO
) 얻어진 퍼센트로 제시된, 10
μM
농도의 선택된 화합물의 존재하에서
HepG2
세포에서의
Dil
-LDL 흡수
이러한 화합물이 또한 PCSK9의 기능 획득 돌연변이체 D374Y의 기능을 억제할 수 있는 지를 추가로 시험하기 위해, PCSK9-D374Y를 발현하는 세포를 Dil-LDL 형광 흡수 검정을 사용하여 분석한다. 화합물의 억제 효과는 또한 Dil-LDL 흡수 검정에서 간-유래한 마우스 세포 주 FL-83B (ATCC, CRL-2390)를 사용하여 특성화된다.
실시예
96
웨스턴
블롯
화합물을, 인간 간세포 세포 주 HepG2에서 PCSK9의 LDLR 향상된 분해를 억제하는 이들의 능력에 대해 시험하였다. 세포를 시험된 PCSK9 억제 화합물의 부재 또는 존재하에서 24시간 동안 인큐베이션시켰다. 인큐베이션 후에, 세포를 RIPA에 용해시켰다. SDS-폴리아크릴아미드 겔 전기영동에 의해 단백질을 분리하고, 이것을 폴리비닐리덴 디플루오라이드 (PVDF, 퍼킨 엘머) 막 (GE 헬스케어) 상에 블롯팅하였다. 그 후, 상기 막을 인간 LDLR 항체 (1:1000, 알 & 디 시스템스) 및 β-액틴 항체 (1:2500, 시그마)의 존재하에서 인큐베이션시켰다. 적절한 서양고추냉이 과산화효소-접합된 2차 항체 (1:10,000, 시그마)를, ECL 플러스 키트 (GE 헬스케어)를 사용한 향상된 화학발광성을 갖는 검출에 대하여 사용하였다. 이 검정에서 PCSK9 기능의 억제는, 웨스턴 블롯 분석에 의해 측정된 대로 총 LDLR/β-액틴의 증가된 비에 의해 검출되었다. 단백질 밴드의 정량화는 이미지 제이(Image J)™ 소프트웨어를 사용하여 얻었다. 도 5C에는 증가하는 농도의 화합물 19의 존재하에서 또는 부재하에서 (Cnt_0) 24시간 동안 인큐베이션시킨 HepG2 비처리 세포에서 총 LDLR의 웨스턴 블롯 분석이 예시되어 있다. β-액틴에 대해 표준화된 총 LDLR 수준이 대조군 % (Cnt)로 각각의 조건에 대하여 플롯되어 있다.
실시예
97
FACS
검정
세포 표면에서 LDLR에 대한 PCSK9의 활성을 방지하는 PCSK9 억제 화합물의 능력을, 문헌 (Benjannet S. 등 J. Biol . Chem. 285: 40965-40978, 2010)에 기재된 바와 같이 유세포분석기 분석을 사용하여 또한 측정하였다. HepG2 세포 표면에서 LDLR의 수준을, 항 인간 LDLR 항체 (1:100, mAb-C7, 산타 크루즈 바이오테크놀로지) 및 2차 알렉사 플루오르 647 당나귀 항-마우스 (몰리큘러 프로브스) 항체를 사용하여 측정하였다. 그 후, 생존가능한 세포 (PI-네거티브)를, FACS BD LSR (비디 바이오사이언씨즈)을 사용하여 PI 및 알렉사 플루오르 647 둘 모두에 대한 FACS에 의해 분석하였다. 세포 표면 LDLR을 대조군 (미처리 세포)에 대하여 기록하였다. 이러한 검정에서 PCSK9 기능의 억제는 세포 표면에서 LDLR의 증가된 발현과 상관된 증가된 수의 양성 세포에 의해 검출되었다.
보다 구체적으로, 인간 간모세포종 HepG2 세포 (4 x 105 세포/웰)를 12웰 플레이트 (그라이너 바이오원) 내 완전 배지에 파종하고, 37℃에서 20시간 동안 배양시킨 다음, 37℃에서 혈청 비함유 배지에서 1시간 세척시켰다. 다음으로, 상기 세척 배지를 제거하고, 세포를 10 uM의 화합물 또는 DMSO 대조군 (0.4% 최종)을 함유하는 0.9 ml/웰 인큐베이션 배지와 함께 밤새 (24시간) 인큐베이션시켰다. 완충제 A로 1회 세정시키고 나서 EDTA 용액 (2.5mM EDTA-2Na)으로 또 한번 세정시킨 후에, 37℃에서 20분 동안 갓 제조한 EDTA 용액 (1 ml)의 존재하에서 인큐베이션시켜서 세포를 분리하였다. 세포 분리 후 모든 단계는 얼음 상에서 또는 4℃에서 수행하였다. 분리를 종결하기 위해, 세포를 3 ml의 완충제 A를 함유하는 15 ml 튜브로 옮기고, 900 rpm (100 g) (4℃)에서 5분 동안 즉시 원심분리하였다. 그 후, 세포를 1:250 인간 LDLR 항체와 함께 500 ul 완충제 A 중에 재현탁시키고, 10분 동안 얼음 상에서 인큐베이션시켰다. 세포를 5 ml 완충제 A로 1회 세척하고, 5분 동안 원심분리시키고, 1:500 알렉사 플루오르 647 2차 항체를 함유하는 500 ul 완충제 A 중에 재현탁시키고, 5분 동안 얼음 상에서 인큐베이션시켰다. 염색 후에, 세포를 5 ml 완충제 A로 1회 세척하고, 5분 동안 원심분리시키고, 1.67 ug/ml 프로피듐 아이오다이드를 함유하는 300 ul 완충제 A 중에 재현탁시켰다. 그 후, 고정된 수 (2,000 세포)의 생존가능한 세포 (프로피듐 아이오다이드 음성)를, FACS-CyAn ADP 유세포분석기 (벡맨 콜터(Beckman Coulter) (DAKO)) 및 써미트 소프트웨어 (써미트 소프트웨어 인크.)를 사용하여 알렉사 플루오르 647 (세포 표면 LDLR)에 대해서는 FACS에 의해 분석하였다.
재료:
인간 HepG2 세포 주: ATCC, HB-8065
파종 배지: 완전 배지 - EMEM (고 함량 글루코스 + 나트륨 피루베이트) (위센트) + 10% FBS
세척 배지: 혈청 비함유 배지 - EMEM (고 함량 글루코스 + 나트륨 피루베이트) (위센트)
화합물을 함유한 인큐베이션 배지: EMEM (고 함량 글루코스 + 나트륨 피루베이트) (위센트) + 0.07% BSA (시그마-알드리치)
완충제 A: 칼슘 및 마그네슘 없는 1X D-PBS (위센트 311-425-CL) + 0.5 % BSA (시그마 A7409-50ml) + 1 ug/L 글루코스 (위센트 609-036-EL).
1차 항체: 인간 LDLR 항체, 단일클론성 마우스 IgG1 클론 #472413 (MAB2148, 알 & 디 시스템스)
2차 항체: 알렉사 플루오르® 647 염소 항-마우스 IgG (H+L) *2 mg/mL* (A21235, 몰리큘러 프로브스)
프로피리듐 아이오다이드: 1mg/ml 용액 (P4864, 시그마)
결과가 표 IV에 제시되어 있다.
표 IV - 10
μM
농도의 선택된 화합물의 존재 및 부재하에서(
DMSO
)
LDLR
양성 세포의 퍼센트로 표시된
FACS
-
LDLR
PCSK9 억제 화합물을 또한 세포 표면 LDLR에 대한 이들의 효과를 측정하기 위해 마우스 및 인간 1차 간세포 상에서 시험한다. 마우스 1차 간세포 사용 시의 이점은, 이것에 의해 각각 PCSK9을 발현하거나 이것이 결핍된 야생형 또는 녹아웃 마우스의 측면에서 화합물의 특이성을 측정할 수 있다는 것이다.
실시예
98
동물 모델에서
PCSK9
-유도된
LDLR
분해 억제의 특성화
그 후, 후보 PCSK9 억제 화합물을 인간 PCSK9을 발현하는 마우스 모델에서 사용하여 생체 내에서 혈장 콜레스테롤 수준을 저하시키는 이들의 능력을 평가한다.
화합물을 인간 PCSK9를 과발현하는 마우스에서 시험한다. 그 자신의 프로모터로부터 인간 PCSK9 (WT, D374Y 낮은 또는 D374Y 높은)를 발현하는 약 ~190 kb의 인간 게놈성 DNA를 보유하는 형질전환된 주 (Herbert, B., 등 (2010) Arteriosclerosis, Thrombosis, and Vascular Biology, 30 (7):1333-1339)를 작제한다. 추가 교배에 의해 Pcsk9 -/- Ldlr +/- 바탕 (Ldlr 이형접합체)에서 인간 PCSK9 이식유전자를 발현하는 마우스 계통을 생성시킨다. 이것은 마우스 PCSK9 유전자의 내인성 발현을 통한 간섭을 제거하고, 그 LDLc 수준을 증가시킨다 (도 6). 다수회의 역교배에 의해, 이러한 모델 마우스는 분석의 균일성 및 재현성을 위해 순수한 C57BL/6 바탕에서 얻어진다. 특이성에 대한 대조군으로, Ldlr -/- 바탕에서의 이식유전자의 효과를 시험한다.
마우스 주사 : 화합물을 6 마우스/유전자형으로 WT, Pcsk9 -/- , Ldlr -/- 및 Pcsk9-Tg 마우스에 정맥내 주사한다(도 6). 총 콜레스테롤 (TC), LDLc 및 PCSK9 수준을 첫 주 동안 매일 및 다음 2주 동안은 3일마다 측정한다. 혈장 내 잔류하는 미착물화된 PCSK9의 수준을 종래 기재된 항체 (문헌 (Zaid, A., 등 (2008). Hepatology, 48(2): 646-65) 참고)를 사용하여 면역침전법으로 또한 측정한다. 또 하나의 실험 세트에서 최저 LDLc 시점에 있는 (주사 후 4 내지 7일) 6 마우스를 희생시키고, 그 FPLC 혈장 지질 프로파일 및 간 LDLR 단백질을 분석한다. 임의의 공개(overt) 독성 및/또는 이환 효과를 주의깊게 모니터한다. Pcsk9 -/- , Ldlr -/- 마우스의 대조군은 관찰된 효과가 PCSK9-의존적임을 입증하기 위해 허용된다.
스타틴 + PCSK9 억제 화합물의 효과 : 스타틴이 PCSK9 발현을 증가시키는 동시에 LDLR의 발현을 저하시키기 때문에 (문헌 (Dubuc, G., 등 (2004). Arteriosclerosis, Thrombosis, and Vascular Biology, 24(8): 1454-1459; Lakoski, S.G., 등 (2009). The Journal of Clinical Endocrinology and Metabolism, 94(7): 2537-2543), 아토르바스타틴 및 억제 화합물의 조합체를 평가하고, 이로부터 스타틴이 Pcsk9 -/- 마우스의 LDLc를 더욱 추가로 감소시킴이 밝혀졌다 (문헌 (Rmashid, S., 등 (2005). Proc Natl Acad Sci USA 102(15):5374-5379) 참고).
Claims (164)
- 식 (I)의 화합물:
또는 그것의 약제학적으로 허용가능한 염, 수화물, 용매화물, 또는 라세미 혼합물 또는 입체이성질체,
여기서:
R1은 -CH(OH)Ra 또는 -B(ORb)(ORc)이고;
R2은 -H, -CH2Rd, -CHRd(Re), -CH2(CH2)mC(O)Rj, -CH2(CH2)mC(O)N(Rd)Re 또는 -CH2(CH2)mS(O)nN(Rd)Re이고;
R3, R4, R5, R6, R7 및 R8은 동일 또는 상이하고, 그리고 독립적으로 수소 또는 하기 기 중의 하나이고: C1-6 알킬, C1-6 할로알킬, C1-6 티오알킬, C1-6 아미노알킬, 알케닐, 알키닐, 사이클로알킬, 헤테로사이클릴, 아릴, 및 헤테로아릴 기이고, 여기서 상기 기는 1 이상의 C1-6 알킬, C3-8 사이클로알킬, C1-6 할로알킬, 아릴, 헤테로아릴, -CN, -C(O)N(Rf)Rg, -C(O)ORf, -C(Rf)(Rg)ORh , -ORf, -OC(O)ORf, -OC(O)NRf(Rg), -SRf, -S(O)nRf, -S(O)nN(Rf)Rg, -S(O)nN(Rf)C(O)Rg, -N(Rf)Rg, -N(Rf)C(O)Rg, -N(Rf)C(O)ORg, -N(Rf)C(O)N(Rg)(Rh), -N(Rf)S(O)nRg, 및 -N(Rf)S(O)N(Rg)Rh 치환체로 임의로 치환되고;
(R3 및 R4) 또는 (R5 및 R6) 또는 (R7 및 R8)이 수소가 아닐 때, 괄호로 묶은 쌍은 또한,-C(O)-, -CO2-, -C(O)N(H)-, -C(O)N(Rx)-, -O-, -NH-, -N(Rx)-, -S-, -S(O)n-, -S(O)nN(H)-, -S(O)nN(Rx)- 라디칼과 연결되어 사이클릭 구조를 형성할 수 있고;
R9는 RiC(O)-, RiS(O)n-, RiOC(O)-, RiNHC(O)-, RiNHS(O)n-, Rk(Rl)NC(O)-, Rl(Rl)NS(O)n-; RmORiC(O)-, RmC(O)RiC(O)- 또는 1 이상 아미노산 잔기이고;
Ra는 C1-3 알킬, C1-2 플루오로알킬 또는 사이클로프로필이고;
Rb 및 Rc은 동일 또는 상이하고, 그리고 독립적으로 H 또는 C1-6 알킬이거나, 또는 함께 연결되어 사이클릭 5- 또는 6-원 고리 구조를 형성할 수 있거나, 또는 추가의 지방족 또는 방향족 고리계와 융합될 수 있고, 상기 사이클릭 5- 또는 6-원 고리 구조 또는 지방족 또는 방향족 고리계는 1 이상의 C1-6 알킬 및/또는 C1-6 할로알킬 치환체로 치환될 수 있고;
Rd 및 Re은 동일 또는 상이하고, 그리고 독립적으로 H 또는 하기 기: C1-3 알킬, C1-3 할로알킬 또는 C3-4 사이클로알킬 기 중 하나이거나, 또는 직접적으로 또는 함께 -C(O)-, -C(O)O-, -C(O)N(Rx)- -O-, -N(Rx)-, -S-, -S(O)n-, 또는 -S(O)nN(Rx)- 라디칼과 연결되어 사이클릭 3-8 원 고리 구조를 형성할 수 있고;
Rf, Rg, Rh, Rk 및 Rl은 동일 또는 상이하고, 그리고 독립적으로 H 또는 하기 기 중 하나이고: C1-6 알킬, C1-6 할로알킬 또는 C3-4 사이클로알킬 기, 또는 직접적으로 또는 함께 -C(O)-, -C(O)O-, -C(O)N(Rx)- -O-, -N(Rx)-, -S-, -S(O)n- 또는 -S(O)nN(Rx)- 라디칼과 연결되어 사이클릭 3-8 원 고리 구조를 형성할 수 있고;
Ri는 C1-10 알킬, C1-10 헤테로알킬, C3-8 사이클로알킬, C1-10 할로알킬, 헤테로사이클릴, 아릴, 헤테로아릴, C1-10 알킬-C3-8 사이클로알킬, C1-10 알킬-헤테로사이클릴, C1-10 알킬-아릴, C1-10 알킬-헤테로아릴, C1-10 헤테로알킬-C3-8 사이클로알킬, C1-10 헤테로알킬-헤테로사이클릴, C1-10 헤테로알킬-아릴 또는 C1-10 헤테로알킬- 헤테로아릴 기이고, 여기서 상기 기는 할로겐, C1-6 아미노알킬, C1-6 헤테로알킬, C1-6 알킬, C3-8 사이클로알킬, C1-6 할로알킬, 아릴, 헤테로아릴 및 헤테로사이클릴 기 중 하나 이상으로 임의로 치환되고;
Rm은 C1-10 알킬, C1-10 헤테로알킬, C3-8 사이클로알킬, C1-10 할로알킬, 헤테로사이클릴, 아릴 또는 헤테로아릴 기이고, 여기서 상기 기는 할로겐, C1-6 아미노알킬, C1-6 헤테로알킬, C1-6 알킬, C3-8 사이클로알킬, C1-6 할로알킬, 아릴, 헤테로아릴 및 헤테로사이클릴 기 중 하나 이상으로 임의로 치환되고;
Rj는 ORd 또는 N(Rd)(Re)이고;
Rx는 H, C1-6 알킬, C1-6 할로알킬, C3-4 사이클로알킬, -C(O)Ry, -C(O)ORy, -C(O)NH2, -C(O)NH(Ry) 또는 -C(O)NHS(O)nRy이고;
Ry는 C1-6 알킬, C1-6 할로알킬 또는 C3-4 사이클로알킬이고;
m는 0 또는 1의 정수 값이고; 그리고
n는 1 또는 2의 정수 값이고,
단,
1) R1이 -CH(OH)Ra일 때, R2은 -CHRd(Re), -CH2(CH2)mC(O)Rj, -CH2(CH2)mC(O)N(Rd)Re 또는 -CH2(CH2)mS(O)nN(Rd)Re 이고; 그리고
2) R1이 -B(ORb)(ORc)일 때, R2은 -H, -CH3, -CHRd(Re), -CH2(CH2)mC(O)Rj, -CH2(CH2)mC(O)N(Rd)Re 또는 -CH2(CH2)mS(O)nN(Rd)Re이다. - 청구항 1에 있어서,
a. R1은 -B(ORb)(ORc), 또는 -CH(OH)Ra이고;
b. R2는 H 또는 -CH2(CH2)mC(O)Rj 이고;
c. R3는 H 또는 치환되거나 그렇지 않은 C1-6 알킬이고;
d. R4는 H, 치환되거나 그렇지 않은 C1-6 알킬, 치환되거나 그렇지 않은 C1-6 티오알킬, 치환되거나 그렇지 않은 아릴 또는 치환되거나 그렇지 않은 사이클로알킬이고;
e. R5는 H이고;
f. R6는 H, 치환되거나 그렇지 않은 C1-6 알킬, 치환되거나 그렇지 않은 C1-6 티오알킬, 치환되거나 그렇지 않은 아릴, 또는 치환되거나 그렇지 않은 사이클로알칸이고;
g. R7는 H이고;
h. R8는 H, 치환되거나 그렇지 않은 C1-6 알킬, 치환되거나 그렇지 않은 C1-6 티오알킬, 치환되거나 그렇지 않은 아릴, 또는 치환되거나 그렇지 않은 사이클로알킬이고/거나;
i. R9는 RiOC(O)-, RiC(O)-, RmORiC(O)-, RmC(O)RiC(O)- 또는 RiS(O)n-인 화합물. - 청구항 1 또는 2에 있어서,
a. R1은 -B(ORb)(ORc), 또는 -CH(OH)Ra 이고;
b. R2는 H 또는 -CH2(CH2)mC(O)Rj 이고;
c. R3는 H 또는 치환되거나 그렇지 않은 C1-6 알킬이고;
d. R4는 H, 치환되거나 그렇지 않은 C1-6 알킬, 치환되거나 그렇지 않은 C1-6 티오알킬, 치환되거나 그렇지 않은 아릴 또는 치환되거나 그렇지 않은 사이클로알킬이고;
e. R5는 H이고;
f. R6는 H, 치환되거나 그렇지 않은 C1-6 알킬, 치환되거나 그렇지 않은 C1-6 티오알킬, 치환되거나 그렇지 않은 아릴, 또는 치환되거나 그렇지 않은 사이클로알칸이고;
g. R7는 H이고;
h. R8는 H, 치환되거나 그렇지 않은 C1-6 알킬, 치환되거나 그렇지 않은 C1-6 티오알킬, 치환되거나 그렇지 않은 아릴, 또는 치환되거나 그렇지 않은 사이클로알킬이고; 그리고
i. R9는 RiOC(O)-, RiC(O)-, RmORiC(O)-, RmC(O)RiC(O)-, 또는 RiS(O)n-인 화합물. - 청구항 1 내지 3 중 어느 한 항에 있어서,
a. R1은 -B(ORb)(ORc)인 화합물. - 청구항 4에 있어서,
a. Rb 및 Rc는 H인 화합물. - 청구항 4에 있어서,
a. Rb 및 Rc는 연결되어 사이클릭 5 원 고리 구조를 형성하거나 지방족 고리계와 융합되는 화합물. - 청구항 6에 있어서,
a. R1는 2,9,9-트리메틸-3,5-디옥사-4-보라트리사이클로[6.1.1.02,6]데칸-4-일인 화합물. - 청구항 1 내지 3 중 어느 한 항에 있어서,
a. R1은 -CH(OH)Ra인 화합물. - 청구항 1 내지 3 또는 8 중 어느 한 항에 있어서,
a. Ra는 C1-2 플루오로알킬인 화합물. - 청구항 9에 있어서,
a. Ra는 -CF3인 화합물. - 청구항 9에 있어서,
a. Ra은 -CH2F인 화합물. - 청구항 8에 있어서,
a. Ra는 C1-3 알킬인 화합물. - 청구항 12에 있어서,
a. Ra은 -CH3인 화합물. - 청구항 1 내지 13 중 어느 한 항에 있어서,
a. R2는 H인 화합물. - 청구항 1 내지 13에 있어서,
a. R2은 -CH2(CH2)mC(O)Rj인 화합물. - 청구항 15에 있어서,
a. Rj는 ORd인 화합물. - 청구항 16에 있어서,
a. Rd는 CH3인 화합물. - 청구항 15에 있어서,
a. Rj는 NH2인 화합물. - 청구항 1 내지 18 중 어느 한 항에 있어서,
a. R3는 H인 화합물. - 청구항 1 내지 18 중 어느 한 항에 있어서,
a. R3는 치환되거나 그렇지 않은 C1-6 알킬인 화합물. - 청구항 20에 있어서,
a. R3는 비치환된 C1-6 알킬인 화합물. - 청구항 21에 있어서,
a. R3는 CH3인 화합물. - 청구항 1 내지 22에 있어서,
a. R4는 H인 화합물. - 청구항 1 내지 22에 있어서,
a. R4는 치환되거나 그렇지 않은 C1-6 알킬인 화합물. - 청구항 24에 있어서,
a. R4는 비치환된 C1-6 알킬인 화합물. - 청구항 25에 있어서,
a. R4는 -CH3인 화합물. - 청구항 25에 있어서,
a. R4는 CH3CH2- 인 화합물. - 청구항 25에 있어서,
a. R4는 -CH2CH(CH3)2 인 화합물. - 청구항 24에 있어서,
a. R4는 치환된 C1-6 알킬 인 화합물. - 청구항 29에 있어서,
a. R4는 아릴 치환된 C1-6 알킬 인 화합물. - 청구항 30에 있어서,
a. R4는 페닐-CH2- 인 화합물. - 청구항 29에 있어서,
a. R4는 -(CH2)2C(O)NH2 인 화합물. - 청구항 1 내지 22 중 어느 한 항에 있어서,
a. R4는 치환되거나 그렇지 않은 C1-6 티오알킬 인 화합물. - 청구항 33에 있어서,
a. R4는 CH3S(CH2)2- 인 화합물. - 청구항 1 내지 22 중 어느 한 항에 있어서,
a. R4는 치환되거나 그렇지 않은 아릴인 화합물. - 청구항 35에 있어서,
a. R4는 페닐인 화합물. - 청구항 1 내지 22 중 어느 한 항에 있어서,
a. R4는 사이클로알킬인 화합물. - 청구항 1 내지 37 중 어느 한 항에 있어서,
a. R6는 H인 화합물. - 청구항 1 내지 37 중 어느 한 항에 있어서,
a. R6는 치환되거나 그렇지 않은 C1-6 알킬인 화합물. - 청구항 39에 있어서,
a. R6는 치환된 C1-6 알킬인 화합물. - 청구항 40에 있어서,
a. R6는 아릴 치환된 C1-6 알킬인 화합물. - 청구항 41에 있어서,
a. R6은 -알킬-페닐인 화합물. - 청구항 42에 있어서,
a. R6은 -CH2-페닐인 화합물. - 청구항 42 또는 43에 있어서,
a. R6은 -CH2-하이드록시페닐인 화합물. - 청구항 42에 있어서,
a. R6은 -(CH2)2-페닐인 화합물. - 청구항 41에 있어서,
a. R6은 -CH2-인돌인 화합물. - 청구항 39에 있어서,
a. R6는 비치환된 C1-6 알킬인 화합물. - 청구항 47에 있어서,
a. R6는 비치환된 C1-6 알킬인 화합물. - 청구항 48에 있어서,
a. R6는 CH3인 화합물. - 청구항 48에 있어서,
a. R6는 -CH(CH3)2인 화합물. - 청구항 1 내지 37 중 어느 한 항에 있어서,
a. R6는 치환되거나 그렇지 않은 C1-6 티오알킬인 화합물. - 청구항 51에 있어서,
a. R6는 CH3S(CH2)2-인 화합물. - 청구항 1 내지 37 중 어느 한 항에 있어서,
a. R6는 치환되거나 그렇지 않은 아릴인 화합물. - 청구항 53에 있어서,
a. R6는 페닐인 화합물. - 청구항 1 내지 37 중 어느 한 항에 있어서,
a. R6는 치환되거나 그렇지 않은 사이클로알킬인 화합물. - 청구항 55에 있어서,
a. R6는 벤조사이클로펜틸인 화합물. - 청구항 1 내지 56에 있어서,
a. R8는 H인 화합물. - 청구항 1 내지 56에 있어서,
a. R8는 치환되거나 그렇지 않은 C1-6 알킬인 화합물. - 청구항 58에 있어서,
a. R8는 비치환된 C1-6 알킬인 화합물. - 청구항 59에 있어서,
a. R8는 -CH(CH3)2인 화합물. - 청구항 59에 있어서,
a. R8는 -CH3인 화합물. - 청구항 58에 있어서,
a. R8는 치환된 C1-6 알킬인 화합물. - 청구항 62에 있어서,
a. R8는 아릴 치환된 C1-6 알킬인 화합물. - 청구항 63에 있어서,
a. R8은 -CH2-페닐인 화합물. - 청구항 1 내지 56 중 어느 한 항에 있어서,
a. R8는 치환되거나 그렇지 않은 C1-6 티오알킬인 화합물. - 청구항 65에 있어서,
a. R8는 CH3S(CH2)2-인 화합물. - 청구항 1 내지 56 중 어느 한 항에 있어서,
a. R8는 치환되거나 그렇지 않은 아릴인 화합물. - 청구항 67에 있어서,
a. R8는 비치환된 아릴인 화합물. - 청구항 68에 있어서,
a. R8는 페닐인 화합물. - 청구항 1 내지 56중 어느 한 항에 있어서,
a. R8는 치환되거나 그렇지 않은 사이클로알킬인 화합물. - 청구항 70에 있어서,
a. R8는 비치환된 사이클로알킬인 화합물. - 청구항 71에 있어서,
a. R8는 사이클로펜틸인 화합물. - 청구항 71에 있어서,
a. R8는 사이클로프로필인 화합물. - 청구항 1 내지 73 중 어느 한 항에 있어서,
a. R9는 RiOC(O)-인 화합물. - 청구항 74에 있어서,
a. Ri는 치환되거나 그렇지 않은 C1-10 알킬인 화합물. - 청구항 75에 있어서,
a. Ri는 비치환된 C1-10 알킬-인 화합물. - 청구항 76에 있어서,
a. Ri는 CH3-인 화합물. - 청구항 75에 있어서,
a. Ri는 치환된 C1-10 알킬-인 화합물. - 청구항 78에 있어서,
a. Ri는 페닐-CH2-인 화합물. - 청구항 1 내지 73 중 어느 한 항에 있어서,
a. R9는 RiC(O)-인 화합물. - 청구항 80에 있어서,
a. Ri는 치환되거나 그렇지 않은 아릴 또는 치환되거나 그렇지 않은 헤테로아릴인 화합물. - 청구항 81에 있어서,
a. Ri는 치환되거나 그렇지 않은 아릴인 화합물. - 청구항 82에 있어서,
a. Ri는 치환된 아릴인 화합물. - 청구항 83에 있어서,
a. Ri는 아릴-페닐-인 화합물. - 청구항 84에 있어서,
a. Ri는 페닐-페닐-인 화합물. - 청구항 84에 있어서,
a. Ri는 헤테로아릴-페닐-인 화합물. - 청구항 86에 있어서,
a. Ri는 디아지린-페닐-인 화합물. - 청구항 87에 있어서,
a. Ri는 트리플루오로메틸-디아지린-페닐-인 화합물. - 청구항 86에 있어서,
a. Ri는 피리딘-페닐-인 화합물. - 청구항 86에 있어서,
a. Ri는 옥사디아졸-페닐-인 화합물. - 청구항 83에 있어서,
a. Ri는 헤테로사이클릴-페닐-인 화합물. - 청구항 91에 있어서,
a. Ri는 모폴린-페닐-인 화합물. - 청구항 83에 있어서,
a. Ri는 알킬-페닐-인 화합물. - 청구항 93에 있어서,
a. Ri는 (CH3)2CH-페닐-인 화합물. - 청구항 93에 있어서,
a. Ri는 OHCH2-페닐-인 화합물. - 청구항 83에 있어서,
a. Ri는 플루오로페닐인 화합물. - 청구항 82에 있어서,
a. Ri는 비치환된 아릴인 화합물. - 청구항 97에 있어서,
a. Ri는 페닐인 화합물. - 청구항 81에 있어서,
a. Ri는 치환되거나 그렇지 않은 헤테로아릴인 화합물. - 청구항 99에 있어서,
a. Ri는 치환된 헤테로아릴인 화합물. - 청구항 100에 있어서,
a. Ri는 아릴-헤테로아릴-인 화합물. - 청구항 101에 있어서,
a. Ri는 페닐-헤테로아릴-인 화합물. - 청구항 102에 있어서,
a. Ri는 페닐-피라졸-인 화합물. - 청구항 102에 있어서,
a. Ri는 페닐-메틸피라졸-인 화합물. - 청구항 102에 있어서,
a. Ri는 페닐-티아졸-인 화합물. - 청구항 102에 있어서,
a. Ri는 페닐-피리딘-인 화합물. - 청구항 102에 있어서,
a. Ri는 페닐-푸라잔-인 화합물. - 청구항 100에 있어서,
a. Ri는 헤테로아릴-헤테로아릴-인 화합물. - 청구항 108에 있어서,
a. Ri는 피리딘-이소티아졸-인 화합물. - 청구항 99에 있어서,
a. Ri는 비치환된 헤테로아릴인 화합물. - 청구항 110에 있어서,
a. Ri는 피리딘인 화합물. - 청구항 111에 있어서,
a. Ri는 피라진인 화합물. - 청구항 112에 있어서,
a. Ri는 인돌인 화합물. - 청구항 80에 있어서,
a. Ri는 치환되거나 그렇지 않은 C1-10 알킬-인 화합물. - 청구항 114에 있어서,
a. Ri는 치환된 C1-10 알킬-인 화합물. - 청구항 115에 있어서,
a. Ri는 아릴-C1-10 알킬-인 화합물. - 청구항 116에 있어서,
a. Ri는 페닐-C1-10 알킬-인 화합물. - 청구항 117에 있어서,
a. Ri는 페닐-알킨-인 화합물. - 청구항 117에 있어서,
a. Ri는 페닐-CH2-인 화합물. - 청구항 119에 있어서,
a. Ri는 플루오로메톡시-페닐-CH2-인 화합물. - 청구항 120에 있어서,
a. Ri는 트리플루오로메톡시-페닐-CH2-인 화합물. - 청구항 121에 있어서,
a. Ri는 4-(트리플루오로메톡시)페닐-CH2-인 화합물. - 청구항 117에 있어서,
a. Ri는 플루오로알킬-디아지린-페닐-(C1-10 알킬)-인 화합물. - 청구항 123에 있어서,
a. Ri는 트리플루오로메틸-디아지린-페닐-CH2-인 화합물. - 청구항 124에 있어서,
a. Ri는 4-[3-트리플루오로메틸)-3H-디아지린-3-일]페닐-인 화합물. - 청구항 125에 있어서,
a. Ri는 3-[3-트리플루오로메틸)-3H-디아지린-3-일]페닐-인 화합물. - 청구항 114에 있어서,
a. Ri는 비치환된 C1-10 알킬 -인 화합물. - 청구항 127에 있어서,
a. Ri는 CH3(CH2)8-인 화합물. - 청구항 1 내지 73 중 어느 한 항에 있어서,
a. R9는 RmORiC(O)-인 화합물. - 청구항 129에 있어서,
a. Ri는 치환 또는 비치환된 C1-10 알킬인 화합물. - 청구항 130에 있어서,
a. Ri는 -CH2-인 화합물. - 청구항 129 내지 131 중 어느 한 항에 있어서,
a. Rm는 치환 또는 비치환된 C1-10 알킬인 화합물. - 청구항 132에 있어서,
a. Rm는 -CH2-인 화합물. - 청구항 133에 있어서,
a. Rm는 아릴-CH2-인 화합물. - 청구항 134에 있어서,
a. Rm는 페닐-CH2-인 화합물. - 청구항 129 내지 131 중 어느 한 항에 있어서,
a. Rm는 치환 또는 비치환된 아릴인 화합물. - 청구항 136에 있어서,
a. Rm는 페닐인 화합물. - 청구항 1 내지 73중 어느 한 항에 있어서,
a. R9는 RmC(O)RiC(O)-인 화합물. - 청구항 138에 있어서,
a. Rm는 헤테로아릴인 화합물. - 청구항 139에 있어서,
a. Rm는 모폴린인 화합물. - 청구항 138 내지 140중 어느 한 항에 있어서,
a. Ri는 아릴인 화합물. - 청구항 141에 있어서,
a. Ri는 페닐인 화합물. - 청구항 1 내지 73중 어느 한 항에 있어서,
a. R9는 RiS(O)n-인 화합물. - 청구항 143에 있어서,
a. Ri는 치환 또는 비치환된 아릴인 화합물. - 청구항 144에 있어서,
a. Ri는 치환된 아릴인 화합물. - 청구항 145에 있어서,
a. Ri는 치환된 페닐인 화합물. - 청구항 146에 있어서,
a. Ri는 페닐-페닐인 화합물. - 청구항 1 내지 148 중 어느 한 항에서 정의된 화합물 중 적어도 하나를 포함하는 약제학적 조성물.
- 청구항 61에 있어서, 청구항 1 내지 148 중 어느 한 항에서 정의된 화합물 중 적어도 하나를 추가로 포함하는 약제학적 조성물.
- 청구항 149 또는 150에 있어서, 환자의 지질 프로파일을 개선하는 적어도 하나의 다른 활성 성분을 추가로 포함하는 약제학적 조성물.
- 청구항 150 내지 151 중 어느 한 항에 있어서, 약제학적 담체 또는 부형제를 추가로 포함하는 약제학적 조성물.
- 약제로서 사용하기 위한 청구항 1 내지 148 중 어느 한 항의 화합물 또는 청구항 149 내지 152 중 어느 한 항의 조성물.
- 약제의 제조를 위한 청구항 1 내지 148 중 어느 한 항의 화합물 또는 청구항 149 내지 152 중 어느 한 항의 조성물.
- 청구항 155에 있어서, 상기 저밀도 지질-콜레스테롤-관련된 질환 또는 장애는 고콜레스테롤혈증인 화합물.
- 청구항 157에 있어서, 상기 저밀도 지질-콜레스테롤-관련된 질환 또는 장애는 고콜레스테롤혈증인 화합물
- 약제로서의, 청구항 1 내지 148 중 어느 한 항에서 정의된 식 I의 화합물, 또는 청구항 149 내지 152 중 어느 한 항에서 정의된 조성물의 용도.
- 청구항 159 내지 161 중 어느 한 항에 있어서, 상기 저밀도 지질-콜레스테롤-관련된 질환 또는 장애는 고콜레스테롤혈증인 용도.
- 하기를 포함하는, 대상체에서 저밀도 지질-콜레스테롤-관련된 질환 또는 장애를 예방 또는 치료하기 위한 키트로서:
(i) 청구항 1 내지 148 중 어느 한 항에서 정의된 화합물 또는 청구항 149 내지 152 중 어느 한 항에서 정의된 조성물 중 적어도 하나, 및
(i) (a) 환자의 지질 프로파일을 개선하는 적어도 하나의 다른 활성 성분;
(b) 적어도 하나의 다른 청구항 1 내지 148 중 어느 한 항에서 정의된 화합물 또는 청구항 149 내지 152 중 어느 한 항에서 정의된 조성물;
(c) 상기 화합물 및/또는 활성 성분용 용기; 및/또는
(d) 상기 대상체에서 저밀도 지질-콜레스테롤-관련된 질환 또는 장애를 예방 또는 치료하기 위한 상기 화합물을 사용하기 위한 설명서, 단, 본 화합물은 아래의 것이 아닌 키트:
- 청구항 163에 있어서, 상기 저밀도 지질-콜레스테롤-관련된 질환 또는 장애는 고콜레스테롤혈증인 키트.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361792249P | 2013-03-15 | 2013-03-15 | |
| US61/792,249 | 2013-03-15 | ||
| PCT/CA2014/050255 WO2014139008A1 (en) | 2013-03-15 | 2014-03-14 | Small molecule modulators of pcsk9 and methods of use thereof |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20150132362A true KR20150132362A (ko) | 2015-11-25 |
Family
ID=51535727
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020157029032A KR20150132362A (ko) | 2013-03-15 | 2014-03-14 | Pcsk9의 소분자 조절물질 및 그것의 사용 방법 |
Country Status (10)
| Country | Link |
|---|---|
| US (1) | US20160031935A1 (ko) |
| EP (1) | EP2961765A4 (ko) |
| JP (1) | JP2016511274A (ko) |
| KR (1) | KR20150132362A (ko) |
| CN (1) | CN105431447A (ko) |
| AU (1) | AU2014231330A1 (ko) |
| BR (1) | BR112015023761A2 (ko) |
| CA (1) | CA2905237A1 (ko) |
| HK (1) | HK1222864A1 (ko) |
| WO (1) | WO2014139008A1 (ko) |
Families Citing this family (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ES2785551T3 (es) | 2014-06-30 | 2020-10-07 | Glykos Finland Oy | Derivado de sacárido de una carga útil tóxica y sus conjugados con anticuerpos |
| EP3182971A4 (en) | 2014-08-21 | 2018-04-25 | SRX Cardio, LLC | Composition and methods of use of small molecules as binding ligands for the modulation of proprotein convertase subtilisin/kexin type 9(pcsk9) protein activity |
| US20170290806A1 (en) * | 2014-09-08 | 2017-10-12 | Temple University-Of The Commonwealth System Of Higher Education | PCSK9 Inhibitors and Methods of Use Thereof |
| AU2016235662B2 (en) * | 2015-03-20 | 2020-07-30 | Aarhus Universitet | Inhibitors of PCSK9 for treatment of lipoprotein metabolism disorders |
| JP2019525947A (ja) | 2016-06-01 | 2019-09-12 | エムスリー・バイオテクノロジー・インコーポレイテッドM3 Biotechnology, Inc. | 化合物 |
| EP3474875A1 (en) | 2016-06-24 | 2019-05-01 | H. Hoffnabb-La Roche Ag | Compositions and methods for treating cardiovascular disease |
| GB2567210B (en) | 2017-10-06 | 2020-01-15 | Rolls Royce Plc | A bladed disk |
| CN109096247A (zh) * | 2018-08-15 | 2018-12-28 | 上海罕道医药科技有限公司 | 一种3h双吖丙啶基双取代吡啶衍生物的制备方法 |
| CR20210441A (es) | 2019-01-18 | 2022-03-11 | Astrazeneca Ab | Inhibidores de la pcsk9 y métodos de uso de los mismos |
| LV15544A (lv) * | 2019-07-01 | 2021-01-20 | Latvijas Organiskās Sintēzes Institūts | Jauni borskābi saturoši peptidomimētiķi kā malārijas serīna proteāzes inhibitori |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2266525A1 (en) * | 1996-09-24 | 1998-04-02 | Charles Winston Saunders | Liquid laundry detergent compositions containing proteolytic enzyme and protease inhibitors |
| GB9623908D0 (en) * | 1996-11-18 | 1997-01-08 | Hoffmann La Roche | Amino acid derivatives |
| US6358491B1 (en) * | 1999-08-27 | 2002-03-19 | Berlex Laboratories, Inc. | Somatostatin analogs |
| EP2319523A1 (en) * | 2002-04-30 | 2011-05-11 | Trustees Of Tufts College | Serine protease inhibitors |
| MX2009010957A (es) * | 2007-04-13 | 2009-10-29 | Novartis Ag | Moleculas y metodos para modular la pro-proteina convertasa-subtilisina/quexina tipo 9 (pcsk9). |
| AR079344A1 (es) * | 2009-12-22 | 2012-01-18 | Lilly Co Eli | Analogo peptidico de oxintomodulina, composicion farmaceutica que lo comprende y uso para preparar un medicamento util para tratar diabetes no insulinodependiente y/u obesidad |
| BR112012022060A2 (pt) * | 2010-03-01 | 2018-05-08 | Onyx Therapeutics Inc | composto para a inibição de imunoproteassoma |
| KR20140132367A (ko) * | 2012-02-16 | 2014-11-17 | 알큐엑스 파마슈티컬스, 인크. | 선형 펩티드 항생제 |
-
2014
- 2014-03-14 KR KR1020157029032A patent/KR20150132362A/ko not_active Application Discontinuation
- 2014-03-14 CN CN201480026888.4A patent/CN105431447A/zh active Pending
- 2014-03-14 BR BR112015023761A patent/BR112015023761A2/pt active Search and Examination
- 2014-03-14 CA CA2905237A patent/CA2905237A1/en not_active Abandoned
- 2014-03-14 AU AU2014231330A patent/AU2014231330A1/en not_active Abandoned
- 2014-03-14 EP EP14765405.7A patent/EP2961765A4/en not_active Withdrawn
- 2014-03-14 US US14/776,701 patent/US20160031935A1/en not_active Abandoned
- 2014-03-14 JP JP2015561865A patent/JP2016511274A/ja active Pending
- 2014-03-14 WO PCT/CA2014/050255 patent/WO2014139008A1/en active Application Filing
-
2016
- 2016-09-19 HK HK16110987.6A patent/HK1222864A1/zh unknown
Also Published As
| Publication number | Publication date |
|---|---|
| HK1222864A1 (zh) | 2017-07-14 |
| EP2961765A4 (en) | 2016-11-09 |
| EP2961765A1 (en) | 2016-01-06 |
| CN105431447A (zh) | 2016-03-23 |
| JP2016511274A (ja) | 2016-04-14 |
| AU2014231330A1 (en) | 2015-10-01 |
| US20160031935A1 (en) | 2016-02-04 |
| BR112015023761A2 (pt) | 2017-07-18 |
| CA2905237A1 (en) | 2014-09-18 |
| WO2014139008A1 (en) | 2014-09-18 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20150132362A (ko) | Pcsk9의 소분자 조절물질 및 그것의 사용 방법 | |
| KR102481876B1 (ko) | 니트릴-함유 항바이러스 화합물 | |
| CN110809467B (zh) | Sestrin-gator2相互作用的调节剂及其用途 | |
| JP6063567B2 (ja) | Pad4阻害剤としての2−(アザインドール−2−イル)ベンズイミダゾール | |
| CN110312719A (zh) | 作为jak家族激酶抑制剂的咪唑并吡咯并吡啶 | |
| US11692008B2 (en) | Preparation and uses of reactive oxygen species scavenger derivatives | |
| WO2022021841A1 (zh) | 一种新型冠状病毒主蛋白酶的抑制剂及其制备方法和用途 | |
| JP2002502815A (ja) | 抗菌剤 | |
| EA005740B1 (ru) | Карбаматные ингибиторы каспазы и их использование | |
| KR19980703151A (ko) | 락탐-함유 히드록삼산 유도체, 그의 제조 그리고 매트릭스 메탈로프로테아제의 억제제로서의 그의 용도 | |
| US20200199108A1 (en) | Preparation and use of reactive oxygen species scavenger | |
| KR20210097154A (ko) | Hiv 요법에 유용한 화합물 | |
| KR20210024630A (ko) | 칼페인 억제제를 이용한 간 섬유증 치료 방법 | |
| JP6916171B2 (ja) | ヒト血漿カリクレイン阻害剤 | |
| Bhattarai et al. | LMP2 inhibitors as a potential treatment for Alzheimer’s Disease | |
| KR20100126762A (ko) | 세포내 효소 및 수용체 조절 | |
| EA021237B1 (ru) | Производные бензамида и их применение в качестве ингибиторов hsp90 | |
| JP2019507176A (ja) | Htra1阻害剤としての新規ジフルオロケタミド誘導体 | |
| US20150232420A1 (en) | Transglutaminase tg2 inhibitors, pharmaceutical compositions, and methods of use thereof | |
| WO2021094436A1 (en) | Substituted hydantoinamides as adamts7 antagonists | |
| JP2022512687A (ja) | Cgrpアンタゴニストのプロドラッグ | |
| WO1998046582A1 (en) | Protease inhibitors | |
| Bhattarai et al. | CNS-penetrant LMP2 Inhibitors as Potential Therapies for Age-related Macular Degeneration | |
| WO2019184744A1 (zh) | 四氢异喹啉类衍生物及其制备方法和用途 | |
| EA046321B1 (ru) | Нитрилсодержащие противовирусные соединения |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |