KR20140072019A - 체액 샘플에서의 아밀로이드 베타 올리고머의 검출 방법 및 그의 용도 - Google Patents
체액 샘플에서의 아밀로이드 베타 올리고머의 검출 방법 및 그의 용도 Download PDFInfo
- Publication number
- KR20140072019A KR20140072019A KR1020147003386A KR20147003386A KR20140072019A KR 20140072019 A KR20140072019 A KR 20140072019A KR 1020147003386 A KR1020147003386 A KR 1020147003386A KR 20147003386 A KR20147003386 A KR 20147003386A KR 20140072019 A KR20140072019 A KR 20140072019A
- Authority
- KR
- South Korea
- Prior art keywords
- antibody
- beta
- oligomer
- ndpoi
- oligomers
- Prior art date
Links
- 0 *1C2C1CCC2 Chemical compound *1C2C1CCC2 0.000 description 1
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
- G01N33/6893—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids related to diseases not provided for elsewhere
- G01N33/6896—Neurological disorders, e.g. Alzheimer's disease
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/28—Neurological disorders
- G01N2800/2814—Dementia; Cognitive disorders
- G01N2800/2821—Alzheimer
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/52—Predicting or monitoring the response to treatment, e.g. for selection of therapy based on assay results in personalised medicine; Prognosis
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Biomedical Technology (AREA)
- Molecular Biology (AREA)
- Immunology (AREA)
- Urology & Nephrology (AREA)
- Hematology (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biochemistry (AREA)
- Organic Chemistry (AREA)
- Food Science & Technology (AREA)
- General Physics & Mathematics (AREA)
- Biotechnology (AREA)
- Cell Biology (AREA)
- Neurology (AREA)
- Microbiology (AREA)
- Pathology (AREA)
- Neurosurgery (AREA)
- Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Peptides Or Proteins (AREA)
- Investigating Or Analysing Biological Materials (AREA)
- Investigating Or Analysing Materials By The Use Of Chemical Reactions (AREA)
- Investigating, Analyzing Materials By Fluorescence Or Luminescence (AREA)
Abstract
본원 발명은 환자의 생물학적 샘플에서 Aβ 올리고머를 신뢰성 있고 민감하게 검출할 수 있는 선택적 Aβ 올리고머 면역검정법에 관한 것이다. 한 실시양태에서, 본 발명의 검정법은 뇌척수액 (CSF) 샘플에서 Aβ 올리고머를 검출 및 정량하는 데에 항-Aβ 올리고머 항체인 19.3과 82E1의 쌍을 사용한다. 본 발명의 검정법은 알츠하이머병 (AD) 환자를 비-AD 환자로부터 구별하는 데에, 및/또는 AD 환자를 그의 질환 중증도에 따라 계층화하는 데에 사용될 수 있다. 본 발명의 검정법은 또한 치료 효능 및/또는 표적 관여의 평가를 위한 대용 종말점으로서 결합된 Aβ 올리고머를 측정할 수 있는 표적 관여 검정법으로 사용될 수 있다.
Description
본 발명은 생물학적 샘플에서 알츠하이머병 (AD)과 관련된 아밀로이드 베타 (Aβ) 올리고머를 검출하는 방법에 관한 것이다. 본 발명은 또한 AD를 진단하고 그의 치료를 평가하기 위한 방법을 제공한다.
알츠하이머병 (AD)은 학습 및 기억에 연관된 뇌 영역에서의 아밀로이드 β (Aβ) 플라크 축적을 특징으로 하는 파괴적인 신경변성 질환이다. 이러한 대형 불용성 플라크가 한때는 AD를 야기하는 것으로 여겨졌었지만, 현재 증거들은 Aβ의 소형 확산성 올리고머들이 원인이 될 수 있음을 나타내고 있다. 아밀로이드-유래 확산성 리간드 (ADDL)는 내인성 Aβ 올리고머와 유사한 특성을 갖는, 시험관 내에서 생성될 수 있는 Aβ 올리고머의 종이다 (U.S. 특허 제6,218,506호; 문헌 [Klein, et al., 2004, Neurobiol. Aging 25:569-580]; [Lambert, et al., 1998; Proc. Natl. Acad. Sci. U.S.A., 95:6448-6453]). Aβ 올리고머는 AD 환자의 뇌에 존재하는데, 그것은 뉴런에 결합하여 뉴런 형태구조 및 기억의 결손을 유도한다. Aβ 올리고머에 결합하는 항체를 사용한 연구는 뉴런 형태구조 및 기억 모두의 개선을 나타내었다.
아밀로이드 전구체 단백질 (APP)에 대한 β- 및 γ-세크레타제 효소의 활성을 사용하는 Aβ 단량체 측정 검정법들이 알려져 있기는 하지만, 정상 대조군 및 AD 양자에 있어서 뇌척수액 (CSF)과 같은 인간 체액 샘플에서 Aβ 올리고머를 특이적으로 신뢰성 있게 검출하는 것으로 보고된 검정법은 거의 없다 (문헌 [Georganopoulou, et al., 2005, Proc. Natl. Acad. Sci. U.S.A., 102:2273-2276]; [Fukumoto, et al., 2010, FASEB J., 24:2716-2726]; [Gao, et al., 2010, PLoS One. 2010 Dec. 30; 5(12):e15725]). 보고되어 있는 Aβ 올리고머 검정법들은 바이오-바코드(bio-barcode) PCR 증폭 플랫폼 (문헌 [Georganopoulou, et al., 2005])과 연계된 ADDL-특이적 항체, 역시 먼저 크기 배제 크로마토그래피 (문헌 [Fukomoto, et al., 2010])와 쌍을 이루는 중복 에피토프 ELISA (문헌 [Gandy, et al, 2010., Ann. Neurol., 68:220-230]; [Xia, et al.,2009, Arch. Neurol., 66:190-199]), 및 올리고머 해리 및 Aβ 단량체에 대한 항체를 사용한 측정이 이어지는 아밀로이드-친화성 매트릭스법 (문헌 [Gao, et al., 2010]; [Tanghe, et al., 2010, Int. J. Alz. Dis., Sep. 2, pii: 417314])을 포함한 수많은 접근법들을 사용하였다.
CSF 또는 뇌 중 어느 하나로부터의 웨스턴 블롯 (문헌 [Klyubin et al., 2008, J. Neurosci., 28:4231-4237]; [Hillen, et al., 2010, J. Neurosci., 30:10369-10379])이 이어지거나, 전기영동 절차 후 유지되는 올리고머의 분자량에 의존하는 크기 배제 크로마토그래피에 후속하는 (문헌 [Shankar, et al., 2011, Methods Mol. Biol,. 670:33-44]) 겔 전기영동을 사용하여서도 Aβ 올리고머가 검출된 바 있다. 그러나, 전기영동 및 블롯팅 기술은 정상 대조군 CSF에서 해당 종을 탐색하는 데에 요구되는 감도를 제공하지 못한다 (문헌 [Klyubin, et al., 2008]). 또한, 게오르가노풀루(Georganopoulou)의 발견은 1000-배의 Aβ 올리고머 농도 범위를 입증하고 있으며, fM로서 농도를 나타내고 있다. Aβ 올리고머 종은 넓은 분자량 범위를 나타내며, 그에 따라 정확한 몰농도의 할당이 문제가 된다. 게오르가노풀루 검정법은 준-정량적이어서, 3개 차수 크기의 분석 목표 농도 범위를 나타내며, 100 aM에서 하위 검출 한계를 가진다. 대부분의 보고되어 있는 방법들 (문헌 [Georganopoulou, et al. 2005]; [Gao, et al., 2010]; [Fukumoto, et al., 2010]; [Gandy, et al., 2010])은 Aβ 단량체와 비교하였을 때의 Aβ 올리고머로부터의 신호들 사이의 선택성을 판단하지 못하므로, 나타내는 농도를 주의 깊게 살펴볼 필요가 있다. 이뮤노바이올로지칼 래보래토리즈 인코포레이티드(Immunobiological Laboratories, Inc.) 사 (미네소타 미네아폴리스 소재)에 의해 시판되는 검정법으로서의 시아(Xia) 검정법 (문헌 [Xia, et al., 2009, Arch. Neurol., 66:190-199])은 Aβ40 단량체와 비교하였을 때 그의 Aβ1-16 이량체에 대하여 320배의 선택성을 주장하고 있지만, CSF에서의 Aβ 단량체와의 교차-반응성을 회피하는 데에 필요한 선택성이 결핍되어 있다. CSF 중 Aβ 올리고머는 가설상 fM 수준으로 존재하고 CSF Aβ 단량체는 1.5-2 nM 사이로 존재하기 때문에, CSF 샘플에서 Aβ 올리고머를 선택적으로 측정하는 검정법은 단량체 대비 Aβ 올리고머에 대하여 예외적인 선택성을 가져야 한다.
잠재적인 질환 바이오마커로서 인간 CSF 내에서 Aβ 올리고머 수준을 측정하는 것 이외에, Aβ 올리고머는 AD를 치료하기 위한 치료용 모노클로날 항체의 표적으로도 사용되고 있다 (예를 들면 U.S. 특허 제7,811,563호, 7,780,963호 및 7,731,962호 참조). 이러한 항체는 CNS에 접근한 후, 1) 소교세포의 Fc-매개 활성화에 의한 촉매 전환, 2) 뇌-혈관구조로의 항체/ADDL 복합체의 제거, 또는 3) 항체 결합, 및 분해 효소 예컨대 네프릴리신, 인슐린-분해 효소, 플라스민; 엔도텔린-전환 효소 (ECE-1 및 -2), 매트릭스 메탈로프로테이나제 (MMP-2, -3 및 -9), 및 안지오텐신-전환 효소 (ACE)의 접근성 향상에 따른 ADDL의 효소 분해를 통하여 뇌로부터 독성인 ADDL 종을 제거하는 것으로 여겨지고 있다. 따라서, 선택적 Aβ 올리고머 검정법의 목표는 항-올리고머 항체를 사용한 치료, 또는 Aβ 단량체/올리고머 형성 또는 제거를 변화시키는 다른 치료 후 중추신경계 Aβ 올리고머의 약역학 (PD) 변화를 측정하는 것이다. 또한, 항-Aβ 올리고머 항체에 결합된 Aβ 올리고머의 검출을 특이적으로 가능케 하는 검정법, 즉 표적 관여(target engagement) (TE) 검정법이라면, 치료 후 치료용 항체의 평가에 매우 유용할 것이다.
본 발명은 인간 체액 샘플에서 신뢰성 있고 민감하게 Aβ 올리고머를 검출할 수 있는 그와 같은 검정법을 제공한다.
본 발명은 환자의 생물학적 샘플, 즉 체액 샘플에서 신뢰성 있고 민감하게 Aβ 올리고머를 검출할 수 있는 선택적 Aβ 올리고머 검정법에 관한 것이다. 본 발명의 검정법은 뇌척수액 (CSF) 샘플에서 Aβ 올리고머를 검출 및 정량하는 데에 고도 선택적 항-Aβ 올리고머 항체인 19.3과 82E1의 쌍을 사용한다. 한 실시양태에서, 본 발명은 알츠하이머병 (AD) 환자를 비-AD 환자로부터 구별하고/거나 AD 환자를 그의 질환 중증도에 따라 계층화할 수 있는 선택적 Aβ 올리고머 약역학 (PD) 검정법이다. 또 다른 실시양태에서, 본 발명은 치료 효능의 평가를 위한 대용 종말점으로서 결합된 Aβ 올리고머를 측정할 수 있는 선택적 Aβ 올리고머 표적 관여 (TE) 검정법이다.
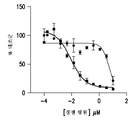
도 1a-1c는 Aβ 단량체 또는 Aβ 피브릴(fibril)과 비교하였을 때의 Aβ 올리고머 (각 조의 중간 막대)의 ADDL 종에 결합하는 항-ADDL 항체인 19.3의 선택성을 보여주는 도시이다. 도 1a는 단량체성 Aβ, ADDL 및 피브릴성 Aβ에 대한 인간화 항체 (h3B3) 및 친화도 성숙 항-ADDL 항체 (14.2, 7.2, 11.4, 9.2, 13.1, 17.1 및 19.3), 그리고 3종의 비교자 항체 (Comp 1, 2 및 3) 패널의 ELISA 결합을 나타낸다. 비교용 항체 2는 ADDL에 대하여 비-선택적인 항체인 것으로 알려졌다. 이와 같은 검정의 배경은 ELISA로부터 포획 항체를 제거함으로써 측정되었다 (no mAb). 오차 막대는 평균의 표준 오차를 나타낸다. 도 1b는 Aβ 올리고머 (▲) 또는 Aβ 단량체 (■) 중 어느 하나로 코팅된 플레이트를 사용하는 일-측 ELISA에서의 인간화된 항체 19.3의 상대적 친화성 및 최대 결합 특성을 나타낸다. 도 1c는 용액 중 경쟁 종 존재하에서의 ELISA 플레이트에 코팅된 Aβ 올리고머 (▲) 및 Aβ 단량체 (■)에 대한 19.3의 경쟁 ELISA 및 상대적 친화성을 나타낸다.
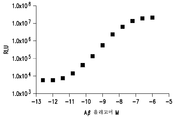
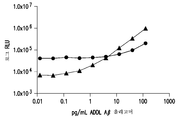
도 2a-2c는 검출 방법으로서 화학발광 (엔비젼(EnVision)® 멀티레이블 판독기(Multilable Reader), 퍼킨엘머(Perkin Elmer) 사, 매사추세츠 왈탐 소재)을 사용하는 샌드위치 ELISA 포맷에서의 3개 항체 쌍의 감도, 및 Aβ 올리고머에 대한 그들의 상대적 친화성을 보여주는 도시이다. 도 2a는 일련의 Aβ 올리고머 농도에 걸친 포획 항체로서의 항-Aβ 올리고머 항체 19.3 및 검출 항체로서의 82E1를 도시한다. 도 2b 및 2c는 포획 및 검출 항체 모두로서의 각각 6E10 및 19.3을 도시한다. 19.3×82E1 샌드위치 ELISA 쌍 (도 2a)이 다른 쌍들 (도 2b 및 2c)에 비해 Aβ 올리고머를 검출함에 있어서 상당히 더 민감하였다.
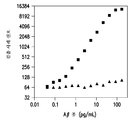
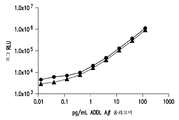
도 3은 에레나(Erenna)® 디지털 검출기 (싱귤렉스(Singulex)®, 알메다(Almeda) 사, 캘리포니아 소재)와 같은 상자성 마이크로-입자 검출기를 사용하여 측정하였을 때, 항-Aβ 올리고머 항체 19.3 및 82E1을 사용하여 Aβ 단량체 (▲)에 비교한 Aβ 올리고머 (■) 검출에 대한 감도 및 선택성의 도시이다. 상자성 마이크로-입자 검출기의 사용은 19.3/82E1 항체 쌍을 사용한 Aβ 올리고머의 검출 감도를 상당히 향상시켰다.
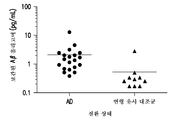
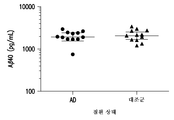
도 4a 및 4b는 인간 뇌척수액 (CSF) 샘플에서 검출되는 Aβ 올리고머 수준의 도시이다. 도 4a는 본원 발명의 방법을 사용한 맹검 평가에서, 연령이 유사한 대조군 즉 비-AD 환자와 비교하였을 때, AD 환자에서 Aβ 올리고머 수준이 4배 더 높았음을 보여준다. 군집이 비-가우스형인 것으로 가정한 쌍방향 t-검정 및 만 휘트니(Mann Whitney) 순위 분석을 사용하여 측정하였을 때, 차이는 p≤0.0004까지 통계적으로 유의성이 있었다. 도 4b는 본원 발명의 방법을 사용한 맹검 평가에서, 젊은 대조군 즉 비-AD 환자와 비교하였을 때, AD 환자에서 Aβ 올리고머 수준이 8배 더 높았음을 보여준다. p-값 ≤0.0021까지의 도 4a에서와 동일한 통계적 방법을 사용할 경우, 역시 해당 군들 사이의 차이는 통계적으로 유의성이 있었다.
도 5a 및 5b는 AD 샘플에서의 Aβ42 단량체 수준의 상응하는 감소, 및 Aβ40 단량체 수준의 변함없음을 수반하는, 임상적으로 확인된 AD 또는 젊은 대조군 즉 비-AD 환자 중 어느 하나의 CSF에서의 Aβ 단량체 수준의 도시이다. 이는 AD 환자에 대하여 관찰되는 대표적인 일반 패턴으로써, 도 4b에서 평가된 샘플의 질환 상태를 확인해 준다. 도 5a는 AD CSF 샘플에서의 Aβ42 단량체 수준의 감소를 나타낸다. 군집이 비-가우스형인 것으로 가정한 쌍방향 t-검정 및 만 휘트니 순위 분석을 사용하여 측정하였을 때, 차이는 p≤0.002까지 통계적으로 유의성이 있었다. 도 5b는 Aβ40 단량체 2개 군들 사이의 변함없는 수준을 보여준다.
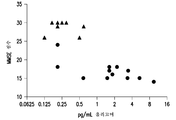
도 6은 인지 수행능력의 척도로서의 미니-멘탈 스테이트 이그잼(Mini-Mental State Exam) (MMSE) 점수와 본원에서 기술되는 본 발명 검정법을 사용하여 측정되는 Aβ 올리고머 수준 사이의 상관관계의 도시이다. 이와 같은 상관관계에는, 도 4b에 도시되어 있는 모든 환자들을 포함시켰다. Aβ 올리고머 -0.7445 pg/mL에서의 상관관계가 p≤0.0001로써 유의성이 있었다.
도 7a 및 7b는 표적 관여 검정법의 도시이다. 도 7a는 인간 CSF (●) 또는 카세인 완충제 (▲)에 첨가 투입함으로써 생체외에서 형성된 항-Aβ 올리고머 항체 19.3/Aβ 올리고머 복합체의 도시이다. 도 7b는 인간 CSF (●) 또는 카세인 완충제 (▲)에 첨가 투입함으로써 생체외에서 형성된 항-Aβ 올리고머 항체 19.3/Aβ 올리고머 복합체의 도시이다. 항-인간 카파 사슬 (포획) × 82E1 (검출) 표적 관여 ELISA (실시예 9)에서는, 19.3/Aβ 올리고머 복합체의 검출에 있어서 구별되는 감도가 관찰되었다. 항-카파 포획 항체는 인간 CSF에서 내인성 항체 종들로부터 항-Aβ 올리고머 항체 19.3을 저조하게 구별하였다.
도 8은 20 mg/kg의 볼루스 IV 투여량 투여 후, 대수조 포팅된 레서스 모델을 사용하여 영장류 (3마리의 수컷 레서스 원숭이) 뇌척수액 (CSF)에서 평가된 항-ADDL 항체 19.3의 PK의 도시이다. 투여 약 24시간 후, 항체 19.3은 100 ng/mL로 CSF 중에 존재하였다.
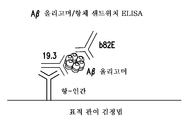
도 9a 및 9b는 각각 Aβ 올리고머 샌드위치 ELISA, 즉 약역학 (PD) 검정법, 및 Aβ 올리고머/항체 샌드위치 ELISA, 즉 표적 관여 검정법의 도시이다.
도 2a-2c는 검출 방법으로서 화학발광 (엔비젼(EnVision)® 멀티레이블 판독기(Multilable Reader), 퍼킨엘머(Perkin Elmer) 사, 매사추세츠 왈탐 소재)을 사용하는 샌드위치 ELISA 포맷에서의 3개 항체 쌍의 감도, 및 Aβ 올리고머에 대한 그들의 상대적 친화성을 보여주는 도시이다. 도 2a는 일련의 Aβ 올리고머 농도에 걸친 포획 항체로서의 항-Aβ 올리고머 항체 19.3 및 검출 항체로서의 82E1를 도시한다. 도 2b 및 2c는 포획 및 검출 항체 모두로서의 각각 6E10 및 19.3을 도시한다. 19.3×82E1 샌드위치 ELISA 쌍 (도 2a)이 다른 쌍들 (도 2b 및 2c)에 비해 Aβ 올리고머를 검출함에 있어서 상당히 더 민감하였다.
도 3은 에레나(Erenna)® 디지털 검출기 (싱귤렉스(Singulex)®, 알메다(Almeda) 사, 캘리포니아 소재)와 같은 상자성 마이크로-입자 검출기를 사용하여 측정하였을 때, 항-Aβ 올리고머 항체 19.3 및 82E1을 사용하여 Aβ 단량체 (▲)에 비교한 Aβ 올리고머 (■) 검출에 대한 감도 및 선택성의 도시이다. 상자성 마이크로-입자 검출기의 사용은 19.3/82E1 항체 쌍을 사용한 Aβ 올리고머의 검출 감도를 상당히 향상시켰다.
도 4a 및 4b는 인간 뇌척수액 (CSF) 샘플에서 검출되는 Aβ 올리고머 수준의 도시이다. 도 4a는 본원 발명의 방법을 사용한 맹검 평가에서, 연령이 유사한 대조군 즉 비-AD 환자와 비교하였을 때, AD 환자에서 Aβ 올리고머 수준이 4배 더 높았음을 보여준다. 군집이 비-가우스형인 것으로 가정한 쌍방향 t-검정 및 만 휘트니(Mann Whitney) 순위 분석을 사용하여 측정하였을 때, 차이는 p≤0.0004까지 통계적으로 유의성이 있었다. 도 4b는 본원 발명의 방법을 사용한 맹검 평가에서, 젊은 대조군 즉 비-AD 환자와 비교하였을 때, AD 환자에서 Aβ 올리고머 수준이 8배 더 높았음을 보여준다. p-값 ≤0.0021까지의 도 4a에서와 동일한 통계적 방법을 사용할 경우, 역시 해당 군들 사이의 차이는 통계적으로 유의성이 있었다.
도 5a 및 5b는 AD 샘플에서의 Aβ42 단량체 수준의 상응하는 감소, 및 Aβ40 단량체 수준의 변함없음을 수반하는, 임상적으로 확인된 AD 또는 젊은 대조군 즉 비-AD 환자 중 어느 하나의 CSF에서의 Aβ 단량체 수준의 도시이다. 이는 AD 환자에 대하여 관찰되는 대표적인 일반 패턴으로써, 도 4b에서 평가된 샘플의 질환 상태를 확인해 준다. 도 5a는 AD CSF 샘플에서의 Aβ42 단량체 수준의 감소를 나타낸다. 군집이 비-가우스형인 것으로 가정한 쌍방향 t-검정 및 만 휘트니 순위 분석을 사용하여 측정하였을 때, 차이는 p≤0.002까지 통계적으로 유의성이 있었다. 도 5b는 Aβ40 단량체 2개 군들 사이의 변함없는 수준을 보여준다.
도 6은 인지 수행능력의 척도로서의 미니-멘탈 스테이트 이그잼(Mini-Mental State Exam) (MMSE) 점수와 본원에서 기술되는 본 발명 검정법을 사용하여 측정되는 Aβ 올리고머 수준 사이의 상관관계의 도시이다. 이와 같은 상관관계에는, 도 4b에 도시되어 있는 모든 환자들을 포함시켰다. Aβ 올리고머 -0.7445 pg/mL에서의 상관관계가 p≤0.0001로써 유의성이 있었다.
도 7a 및 7b는 표적 관여 검정법의 도시이다. 도 7a는 인간 CSF (●) 또는 카세인 완충제 (▲)에 첨가 투입함으로써 생체외에서 형성된 항-Aβ 올리고머 항체 19.3/Aβ 올리고머 복합체의 도시이다. 도 7b는 인간 CSF (●) 또는 카세인 완충제 (▲)에 첨가 투입함으로써 생체외에서 형성된 항-Aβ 올리고머 항체 19.3/Aβ 올리고머 복합체의 도시이다. 항-인간 카파 사슬 (포획) × 82E1 (검출) 표적 관여 ELISA (실시예 9)에서는, 19.3/Aβ 올리고머 복합체의 검출에 있어서 구별되는 감도가 관찰되었다. 항-카파 포획 항체는 인간 CSF에서 내인성 항체 종들로부터 항-Aβ 올리고머 항체 19.3을 저조하게 구별하였다.
도 8은 20 mg/kg의 볼루스 IV 투여량 투여 후, 대수조 포팅된 레서스 모델을 사용하여 영장류 (3마리의 수컷 레서스 원숭이) 뇌척수액 (CSF)에서 평가된 항-ADDL 항체 19.3의 PK의 도시이다. 투여 약 24시간 후, 항체 19.3은 100 ng/mL로 CSF 중에 존재하였다.
도 9a 및 9b는 각각 Aβ 올리고머 샌드위치 ELISA, 즉 약역학 (PD) 검정법, 및 Aβ 올리고머/항체 샌드위치 ELISA, 즉 표적 관여 검정법의 도시이다.
본원 출원인은 Aβ 올리고머의 약역학 및 표적 관여 척도 양자로서 사용하기 위하여 환자의 CSF에서 Aβ 올리고머를 신뢰성 있고 민감하게 검출할 수 있는 방법을 제공한다. 본 발명의 방법은 이전에 tau/Abeta42 CSF 비 (문헌 [De Meyer, et al., 2010, Arch. Neurol., 67:949-56])에서 보고되었던 용도와 유사하게 AD 환자에서의 CNS Aβ 올리고머의 상승된 수준을 바탕으로 비-AD 환자로부터 AD를 구별하고 AD 질환 상태를 계층화할 수 있다. 또한, 가장 신경독성인 종을 검출하는 Aβ 올리고머 검정법은 Aβ 단량체 수준에서 관찰되던 저조한 상관관계와 비교할 때, 인지 수행능력의 변화를 더 우수하게 상관시키고, 그 변화의 더욱 역학적인 척도가 될 수 있다. 본원 출원인은 말초 투여된 항-Aβ 올리고머 항체가 혈액-뇌-장벽을 통과하여 Aβ 올리고머에 결합할 수 있으며, 본원의 본 발명 방법에 사용될 경우 AD 치료제의 평가를 위한 대용 종말점 검정법을 제공할 수 있다는 것을 처음으로 입증하는 바이다.
본원 출원인은 생물학적 샘플, 즉 체액 샘플 중 뉴런 유래 단백질의 수준을 검출하여 측정하는 고도로 민감한 검정법 및 그의 용도를 개발하였다. 본 발명의 한 실시양태에서, 상기 뉴런 유래 단백질은 Aβ 올리고머이며, 상기 체액 샘플은 뇌척수액 (CSF) 샘플이다. 본 발명의 방법은 상자성 마이크로-입자 검출을 사용하는 샌드위치 ELISA에 2종의 선택적 항-Aβ 올리고머 항체를 사용한다. Aβ 올리고머가 생물학적 샘플, 특히 CSF에서 발견되고 있기는 하지만 (문헌 [Georganopoulou, et al., 2005]; [Klyubin, et al., 2008]), 공지의 검출 방법들과 관련된 한계 (감도 및 선택성 모두 포함)는 환자의 질환 상태를 분류하는 데에 사용하거나 AD 치료제의 개발을 위한 Aβ 올리고머의 정량은 말할 것도 없이, 신뢰성 있는 검출도 가능케 하지 않았다. 상자성 마이크로-입자 검출과 함께 2종의 항-Aβ 올리고머 항체 19.3 및 82E1을 사용함으로써, 본원 출원인은 40 fg/mL의 검출 한계까지 생물학적 샘플에서 Aβ 올리고머를 검출하는 샌드위치 ELISA 검정법을 개발할 수 있었다. 이와 같은 검정법을 사용하여, 본원 출원인은 젊거나 연령이 유사한 대조군 중 어느 하나와 비교하였을 때의 임상적으로 확인된 AD 샘플에서의 Aβ 올리고머의 매우 중대한 상승을 입증한다. 이와 동일한 샘플을 Aβ42 및 Aβ40 단량체의 수준을 측정하는 데에 사용하여, AD 샘플에서는 Aβ42 단량체가 대조군에 비해 상당히 감소되는 반면 Aβ40 단량체 수준은 변화가 없음을 확인하였다. 본 발명의 Aβ 올리고머 샌드위치 ELISA 검정법은 Aβ 올리고머의 농도와 AD 중증도를 측정하는 데에 널리 사용되고 있으며 미니-멘탈 스테이트 이그잼 (MMSE)으로 알려져 있는 인지 시험에서의 수행능력 사이의 유의성 있는 상관관계를 입증하였는데; 인지 점수 (인지상 정상인 30점까지)가 더 높을수록, CSF 중 Aβ 올리고머의 수준은 더 낮았다. 본 발명의 Aβ 올리고머 샌드위치 ELISA 검정법은 추가적인 환자 샘플을 사용하여 공지의 체액, 영상화 및 인지 바이오마커와의 추가적인 상관관계를 생성시키는 데에 활용될 수 있다.
상기한 약역학 검정법 이외에도, 본 출원인은 인간 CSF 샘플에서 사용될 수 있도록 인간 IgG2/항-Aβ 올리고머 복합체에 대하여 선택성을 갖는 표적 관여법 (TE)을 개발하였다. 하기하는 실시예에 기술되어 있는 바와 같이, 본원에서 기술되는 TE 검정법은 인간 CSF에 존재하는 대량의 내인성 IgG 항체들로부터 비-자연 인간 IgG2 항체 (항-Aβ 올리고머, IgG2 항체)를 선택적으로 구별하는 문제를 극복한다. TE 검정법의 선택성은 인간 CSF에 존재하는 내인성 IgG2 종 중에서도 Aβ 올리고머 IgG2 항체/Aβ 올리고머 복합체를 포획할 수 있는 항체인 고도로 선택적인 항-IgG2-이소형 포획자 (서던 바이오테크(Southern Biotech) 사, 앨라배마 버밍햄 #9060-05 소재)를 사용하는 것에 의해 달성되었다. 19.3/IgG2 이소형 항체에 결합된 Aβ 올리고머의 검출은 시중의 항체인 82E1 (이뮤노바이올로지칼 래보래토리즈 인코포레이티드 사, 미네소타 미네아폴리스 소재)을 사용하여 수행되었다. 이와 같은 접근법은 완충제 내인지, Aβ 올리고머 항체로 처리된 동물로부터의 트랜스제닉 Tg2576 뇌의 추출물 내인지, 또는 외인성 항체 및 Aβ 올리고머를 사용하여 첨가된 인간 CSF 샘플 내에서인지에 관계없이, 19.3-IgG2 항체/Aβ 올리고머 복합체의 신뢰성 있고 일관된 검출을 가능케 하였다.
Aβ 올리고머에 결합된 치료용 항-Aβ 올리고머 IgG2 항체의 복합체를 검출하는 특별한 감도의 검정법을 가능케 하기 위하여, 항-인간 IgG2 항체는 하기 약역학 (PD) 검정법에 기술되어 있는 바와 같이 자성 마이크로입자 (MP)에 결합된다. MP/항-인간 IgG2 복합체는 IgG2 이소형의 치료용 항-Aβ 올리고머 항체 (치료용 IgG2 항체)가 투여된 개체로부터 채취된 CSF 샘플과 혼합된다. 이와 같은 치료용 항-Aβ 올리고머 항체는 개체의 CSF 샘플에 존재하는 소정의 Aβ 올리고머 종에 결합되게 된다. 이와 같은 MP/항-IgG2/항-Aβ 올리고머/Aβ 올리고머 복합체는 형광 염료 (플루오르(fluor))가 결합되어 있는 제2의 항-Aβ 올리고머 항체인 82E1과 혼합된다. MP/항-IgG2/항-Aβ 올리고머/Aβ 올리고머/82E1-플루오르 복합체는 마이크로입자의 자성 특성으로 인하여 잘 세척되며, 82E1-플루오르 복합체가 비드로부터 분리되어 배경을 감소시킨다. 하나의 82E1-플루오르 분자는 투여된 개체의 CSF에 존재하던 항-Aβ 올리고머/Aβ 올리고머 복합체의 원래 수준을 나타낸다. 이와 같은 검정법은 치료용 IgG2 항체가 Aβ 올리고머 표적에 관여하였다는 (도 9b) 확인을 가능케 하게 된다. 치료 동안의 Aβ 올리고머의 제거에 따라, 치료용 IgG2 항체는 더 적은 Aβ 올리고머에 관여함으로써 감소된 신호를 나타내게 된다. 따라서, 표적 관여 검정법은 평가되는 치료용 항체의 효능 측정을 가능케 하게 된다. 약역학 검정법 (도 9a) 역시 예컨대 치료 후의 Aβ 올리고머의 존재 감소에 기인할 신호 감소를 나타내게 된다. 따라서, 약역학 검정법은 AD의 치료에 사용되는 소정 치료제의 효능 평가를 위한 종말점 대용으로서 사용될 수 있다.
본원 발명은 AD 및 인간 대조군 개체 양자로부터의 CSF 샘플 중 내인성 Aβ 올리고머를 검출하여 정량하는 민감하며 선택성인 샌드위치 ELISA 검정법이다. 본 발명 검정법의 개발은 Aβ 단량체 및 피브릴 양자에 비해 Aβ 올리고머에 대하여 선택적인 항체를 생성하는 마우스 하이브리도마의 확인으로 시작되었다. 본 출원인에 의해 개발되어 본원에서 19.3으로 지칭되는 선택성 항-Aβ 올리고머 항체 (USSN 61/364,210호의 우선권을 주장하는 공동-계류 출원 PCT/US2011/XXXXXX호)가 IgG2 이소형으로 인간화되었으며, 일-측 ELISA에 의해 대략 1.6 nM의 EC50을 갖는 것으로 Aβ 올리고머에의 친화성에 대하여 추가 특성화되었다. Aβ 단량체에 대비한 용액 및 고체 상에서의 ADDL에 대한 19.3 항체의 추가적인 친화성 평가는 19.3이 경쟁 ELISA 포맷으로 평가하였을 때에 비해 Aβ 올리고머에 대하여 대략 600배 더 큰 선택성을 가진다는 것을 입증하였다. Aβ 올리고머에 대한 19.3의 감도 및 선택성은 Aβ 올리고머 검출을 위한 샌드위치 ELISA에서의 잠재적인 효용을 암시하였다.
19.3 항체는 샌드위치 ELISA 포맷에서 해당 비오티닐화에 이어지는 검출 항체 19.3, 7305 (그 전체가 본원에 참조로써 개재되는 US 특허 제7,780,963호) 및 82E1와 같은 3종의 상이한 항체들의 조합으로써의 Aβ 올리고머에 대한 잠재적 포획 반응물로서 평가되었다. 비오티닐화된 19.3은 검출 항체로서 조사되었으며, 중복 에피토프의 시험에서는 포획 항체로서 19.3과 쌍을 이루었다. 중복 에피토프의 존재는 다수의 에피토프를 갖는 Aβ 구축물을 표시하게 되는데, 이는 이량체 또는 더 고급 Aβ 올리고머의 존재를 암시한다. 19.3×19.3 중복 에피토프 ELISA는 98 pg/mL의 Aβ 올리고머에 대한 검출 한계 (LoD)를 가졌다 (도 2c). 항체 쌍 19.3 및 82E1에 대한 샌드위치 ELISA ("19.3×82E1 샌드위치 ELISA") (도 2a)는 물론, 19.3×7305 샌드위치 ELISA (데이터 미도시)는 1.3 pg/mL의 (LoD)를 가졌으며, Aβ 올리고머에 대하여 4.2 pg/mL의 신뢰성 있는 정량 한계 (LoRQ)를 가졌고, Aβ 올리고머/Aβ 단량체로부터의 신호 비가 대략 1,000:1로써; 검정법이 Aβ40 단량체에 비해 Aβ 올리고머에 대하여 1,000배 더 선택적이라는 것을 나타내었다. 본 출원인은 비-중복 에피토프 검정법, 즉 19.3×82E1 샌드위치 ELISA가 98 pg/mL의 Aβ 올리고머에 대한 검출 한계로 이어졌던 시중의 Aβ 항체 6E10을 사용한 유사한 검정법에 대하여 최근 공개된 결과에 비해 더 민감하며 (도 2b) (코밴스(Covance) 사, 뉴저지 프린스턴 소재) (문헌 [Gandy, et al., 2010, Ann. Neurol., 68:220-230]), 시중의 항체 82E1을 사용한 중복 에피토프 검정법과 비교하였을 때 동일한 감도로 이어진다는 (문헌 [Xia, et al. 2009, Arch. Neurol., 66:190-199]) (이뮤노바이올로지칼 래보래토리즈 인코포레이티드 사, 미네소타 미네아폴리스 소재) 것을 발견하였다. 화학발광 검출을 사용하여 수행되는 샌드위치 ELISA (도 2a, 2b 및 2c)가 Aβ 올리고머 표준을 검출하는 데에는 충분하였지만, fM (fg/mL) 범위인 이전의 CSF Aβ 올리고머 수준 기록들은 선택성 ELISA-기반 Aβ 올리고머 검정법이 CSF 샘플에서 Aβ 올리고머를 신뢰성 있게 검출하고 정량하기 위해서는 10 내지 100배 더 큰 감도 수준을 필요로 하게 됨을 암시하였다.
샌드위치 ELISA 검정법의 감도를 증가시키기 위하여, 본 출원인은 샌드위치 ELISA 복합체로부터 결합해제되는 형광 태그화 검출 항체의 검출을 사용하는 상자성 마이크로-입자 검출 시스템, 구체적으로 에레나® 시스템 (싱귤렉스®, 알메다 사, 캘리포니아 소재)에서 2종 항체 쌍의 수행능력을 평가하였다. 19.3×82E1 샌드위치 ELISA의 수행능력이 향상되었는데, 19.3×82E1 항체 쌍은 연령이 유사하거나 더 젊은 대조군 샘플 중 어느 것에 비해 더 높은 수준에서 AD CSF 샘플 중 Aβ 올리고머 신호의 검출을 가능케 하였다. 더 구체적으로, 검정법 LoD는 0.04 pg/mL로 대략 30배 향상된 반면, LoRQ는 0.42 pg/mL로 10배 향상되었다. 마찬가지로, Aβ 올리고머/Aβ 단량체 비 역시 5,000:1로 향상되었다. 이와 같은 검정법을 사용하여 측정하였을 때, AD CSF 샘플은 AD 환자의 특징인 감소된 Aβ42 수준 및 변함없는 Aβ40 수준을 가졌다. 합쳐보면, 상자성 마이크로-입자 검출 시스템을 사용하는 19.3×82E1 샌드위치 ELISA는 인간 CSF에서 Aβ 올리고머 종을 신뢰성 있게 특이적으로 측정할 수 있었다.
본원에서 사용될 때의 "Aβ 올리고머"라는 용어는 단량체 종의 자가-결합에서 기인하는 Aβ 단량체들의 다량체 종을 지칭한다. Aβ 올리고머는 주로 Aβ42의 다량체이지만, Aβ40의 Aβ 올리고머도 보고되어 있다. 시험관 내에서의 합성 Aβ 단량체의 응집 후, 또는 인간 뇌 또는 체액으로부터의 Aβ 종의 단리/추출 후, Aβ 올리고머는 이량체, 삼량체, 사량체 및 더 고급 종의 역동적인 범위를 포함할 수 있다. ADDL은 일종의 Aβ 올리고머이다.
본원에서 사용될 때의 "뉴런 유래 단백질" 또는 "뉴런 유래 관심 단백질"이라는 용어는 본원 발명의 검정법에 의해 평가되어야 할 뇌의 뉴런에서, 및/또는 그에 의해 생성되는 단백질을 지칭한다. 본원 발명의 한 실시양태에서, 뉴런 유래 단백질은 인간의 뇌척수액 (CSF) 샘플에 존재하는 Aβ 올리고머이다. 이와 같은 단백질은 뉴런이 아닌 다른 세포 또는 조직에서 Aβ로부터 형성될 수 있는 다른 Aβ 올리고머로부터 구별된다.
본원에서 사용될 때의 "ADDL" 또는 "아밀로이드-β 유래 확산성 리간드" 또는 "아밀로이드-β 유래 치매성(dementing) 리간드"라는 용어는 2개 이상의 Aβ 단백질 단량체를 포함하는 신경독성이며, 가용성이고, 구형이며, 비-피브릴성인 올리고머 구조를 지칭한다. 더 고급 올리고머 구조는 Aβ42로부터 뿐만 아니라, Aβ43 또는 Aβ40과 같이 가용성 비-피브릴성 Aβ 올리고머 구조를 안정하게 형성할 수 있는 소정의 Aβ 단백질로부터도 수득될 수 있다 (US 특허 제6,218,506호 및 WO 01/10900호).
본원에서 사용될 때의 "Aβ 피브릴" 또는 "피브릴" 또는 "피브릴성 아밀로이드"라는 용어는 티오플라빈 S와 같은 염료에 의한 그의 복굴절로 인하여 인간 및 트랜스제닉 마우스 뇌 조직에서 검출되는 불용성인 Aβ 종을 지칭한다. Aβ 단량체로 구성되는 섬유-형 구조를 형성하는 Aβ 종에는 β-주름 시트(pleated sheet)가 포함된다. 이들 종은 AD 뇌에서 발견되는 세포외 아밀로이드 플라크 구조의 직전 전구체인 것으로 여겨진다.
본원에서 사용될 때의 "Aβ40 단량체" 또는 "Aβ42 단량체"라는 용어는 무-세포 또는 세포 환경에서의 아밀로이드 단백질 전구체 (APP)에 대한 β-세크레타제 및 γ-세크레타제에 의한 효소 절단, 즉 아스파르트산 프로테아제 활성의 직접적인 생성물을 지칭한다. β-세크레타제에 의한 APP의 절단은 Asp1에서 시작하는 (절단 후의 Aβ 펩티드 서열에 따라 번호지정) Aβ 종을 생성시키는 반면, γ-세크레타제는 주로 잔기 40 또는 42 중 어느 하나에서 Aβ의 C-말단을 방출한다.
본원에서 사용될 때의 "포획 항체" 또는 "Aβ 올리고머 포획 항체" 또는 "항-인간 IgG2 포획 항체"라는 용어는 본원의 검정법에서 포획 항체로 사용되는 항체를 지칭한다. 본원에서 사용될 때의 포획 항체는 체액 샘플에서 측정 및/또는 검출되는 Aβ 올리고머 또는 Aβ 올리고머/항체 복합체에 결합한다. 본 발명의 한 실시양태에서, 포획 항체는 항-Aβ 올리고머 항체 19.3이며, 검출되는 복합체는 19.3/Aβ 올리고머이다. 또 다른 실시양태에서, 포획 항체는 항-인간 IgG2 포획 항체이며, 검출되는 복합체는 IgG2/19.3/Aβ 올리고머이다.
본원에서 사용될 때의 "IgG" 또는 "IgG2"라는 용어는 항체 분자로서 기능하는 소정의 단백질을 지칭한다. 각 IgG는 4개의 펩티드 사슬 - 2개의 중쇄 γ 및 2개의 경쇄 -로 구성된다. 각 IgG는 2개의 항원 결합 부위를 가진다. 인간에는 4종의 IgG 하위부류 (IgG1, 2, 3 및 4)가 존재하는데, 혈청에서의 그의 풍부도 순서로 명명되어 있다 (IgG1이 가장 풍부함). 힌지 영역의 구조는 4종의 IgG 부류 각각에 그의 독특한 생물학적 프로파일을 제공한다.
본원에서 사용될 때의 "카파 경쇄"라는 용어는 항원 결합 도메인 및 불변 영역 양자를 함유하는 이뮤노글로불린 G (IgG)의 부분을 지칭한다. 항체 분자 당 2개의 경쇄가 존재하는데, 각각 염색체 2 또는 22에 코딩되어 있는 카파 또는 람다 유형 중 어느 하나일 수 있다. B-세포 내에서 2개의 카파 경쇄가 생성되면, 2개의 중쇄와 함께 디술피드 결합을 통하여 조립됨으로써 완전한 IgG 항체 분자를 형성한 후, 체액 면역 방어 시스템의 일부로 기능하기 위하여 분비된다.
본원에서 사용될 때의 "생물학적 샘플" 또는 "체액 샘플"이라는 용어는 조직 또는 척추에 대비한 소정 유형의 체액을 지칭한다. 본원 검정법에서 사용될 수 있는 전형적인 예는 혈액, 소변, 눈물, 타액 및 뇌척수액으로써, 본 발명의 한 실시양태에서 사용된다. Aβ 올리고머가 존재할 경우, 모든 다른 종류의 체액 역시 사용될 수 있다.
본원에서 사용될 때의 "알츠하이머병" 또는 "AD" 또는 "아밀로이드생성 장애"라는 용어는 비제한적으로 다운 증후군, 루이 소체 치매, 파킨슨병, 전임상 알츠하이머병, 알츠하이머병으로 인한 경증 인지 손상, 조기 발병 알츠하이머병 (EOD), 가족성 알츠하이머병 (FAD) 내지는 알츠하이머병으로 인한 치매의 진행성 인지 손상 (문헌 [Jack, et al., 2011, Alzheimer's Dement., May 7(3):257-262]), 및 ApoE4 대립유전자의 존재와 관련된 질환을 포함한 질환 영역에 속하는 뇌에서의 Aβ 플라크 또는 신경원섬유 매듭(neurofibrillar tangle)의 형성 또는 침착과 관련된 뉴런 분해에 기인하는 일련의 치매 또는 인지 손상을 지칭한다.
본원에서 사용될 때의 "검출 한계" 또는 "LoD"라는 용어는 Aβ 올리고머의 부재를 제외하고 동일한 샘플상에서 검출될 수 있는 최저 농도에서의 검정법의 감도를 지칭한다. Aβ 올리고머 부재하에서의 신호는 "배경"으로 정의된다. 본원에서 사용될 때, Aβ 올리고머의 LoD는 배경의 평균을 ≥3 표준 편차 상회하는 것으로 정의된다.
본원에서 사용될 때의 "신뢰성 있는 정량의 하위 한계" 또는 "LLoRQ"는 배경으로부터 신뢰성 있고 재현가능하게 구별될 수 있는 최저 농도를 표시하기 위하여 가변성 계수와 조합된 검정법의 감도를 지칭한다. 이와 같은 한계는 통상적으로 감도의 하위 말단에서의 검정법의 실제 작용 범위를 한정하는데, ≥3개 측정값에 걸쳐 ≤20%의 가변성 계수를 나타내는 농도가다.
선택적 항-Aβ
올리고머
포획 항체의 확인 및 특성화
Aβ 올리고머에 대하여 선택적이고 특이적인 검정법을 개발하기 위하여, 본 출원인은 먼저 Aβ 올리고머의 비-피브릴성 종인 ADDL에 대하여 선택이면서도 특이적이었던 항체를 확인 탐색하였다. 프로인트(Freund's) (제1 및 제2 백신, 피하) 또는 불완전 프로인트 아주반트 (이하 모든 백신, 복강내) 중 어느 하나와 1:1 혼합된 ADDL Aβ 올리고머 종을 사용하여 마우스를 면역화함으로써, 항-ADDL 마우스 모노클로날 항체 3B3을 생성시켰다 (U.S. 특허 제7,811,563호 및 7,780,963호). 각 주사는 194±25 ㎍의 총 단백질과 등가인 정제 ADDL로 구성되었다. 최고 역가 혈청을 갖는 마우스로부터의 지라를 폴리에틸렌 글리콜의 존재하에 SP2/0 골수종 세포와 융합시키고, 96-웰 플레이트에 이식하였다. 200 μL의 히포크산틴-아미노프테린-티미딘 (HAT) 선택 배지 중에서 5% CO2를 사용하여 10일 동안 37℃로 세포를 배양하였다. 10일차에, 10% 소 태아 혈청 (FBS)이 보충된 이스코브 변형 둘베코 배지(Iscove's Modified Dulbecco's Medium) (IMDM) (시그마-알드리치(Sigma-Aldrich) 사, 미주리 세인트 루이스 소재)를 배양물에 1회 공급하고, 14일차에 배양 상청액을 제거한 후, 일-측 ELISA (실시예 ?)를 사용하여 양성의 Aβ 올리고머 항체-함유 웰을 스크리닝하였다. Aβ 단량체 또는 Aβ 피브릴에 비해 ADDL에 우선적으로 결합하는 그의 능력을 기준으로, 항체 3B3을 추가 개발용으로 선택하였다 (도 1a).
마우스 클론 11/3B3을 인간 IgG2 항체로 전환시키고, 19.3으로 명명하였다. Aβ 올리고머 결합 도메인을 코딩하는 3B3의 가변 중쇄 및 경쇄 도메인 영역을 서열분석하고, 이 CDR을 코딩하도록 생성된 cDNA를 인간 IgG2 구조(context)에 도입하였다. pFab3D 파지 디스플레이 벡터 내에 도입된 3B3의 가변 중쇄 및 경쇄 도메인을 사용하여 친화도 성숙 라이브러리를 생성시켰다. 결찰 생성물을 이. 콜라이(E. coli) TG1 세포에 형질감염시키고, 생성되는 파지 배양 상청액을 적정하고, 농축한 후, 파지 라이브러리 패닝(panning)용으로 분취량을 제조하였다. 다음에, 비오티닐화된 Aβ 올리고머를 사용하여 파지 라이브러리 패닝을 수행하였다. 비오티닐화 Aβ 올리고머에 결합된 파지를 용리하여, 다시 이. 콜라이 TG1 세포에 첨가하였다. Aβ 올리고머와 동일하지만 N-말단 비오티닐화 Aβ42 펩티드 (아메리칸 펩티드(American Peptide) 사, 캘리포니아 서니베일 소재)를 사용하여 개시되는 방법을 사용하여 비오티닐화된 Aβ 올리고머를 제조하였다 (실시예 1). 상기한 Aβ 단량체, Aβ 올리고머 및 Aβ 피브릴 구별 결합 ELISA에서, 파지 상청액 (약 100 μl)을 바로 분석에 사용하였다.
3B3의 경쇄 친화도 성숙 라이브러리로부터 생성된 항-Aβ 올리고머 항체 19.3에 대해서는, 2010년 7월 14일자 61/364,210호의 우선권을 주장하는 공동-계류 출원 PCT US2011/XXXXXXX호에 기술 및 특성화되어 있는 바, 본원에서 사용될 때에는 하기를 포함하는 단리된 항체이다:
하기의 서열 (서열 1)을 갖는 경쇄 가변 영역
하기의 서열 (서열 2)을 갖는 중쇄 가변 영역
하기의 서열 (서열 3)을 갖는 중쇄 불변 영역
항-Aβ
올리고머
항체 19.3의 Aβ
올리고머
선택성
Aβ40 단량체와 비교하였을 때의 Aβ 올리고머에 대한 19.3의 결합 효능을 확인하기 위하여, 별도의 Aβ 올리고머 또는 Aβ40 단량체-코팅 플레이트를 사용하고 일반적인 적정 곡선의 항체를 사용하여, 일-측 ELISA를 완료하였다 (도 1b). 총 Aβ 올리고머 결합 최대-절반의 척도인 19.3의 EC50은 Aβ 올리고머 및 Aβ40에 대하여 각각 1.6 nM 및 4.3 nM이었다. 이와 같은 포맷에서, 19.3 항체는 Aβ40 단량체에 비해 Aβ 올리고머에 대하여 대략 3배 더 큰 최대 결합을 나타낸 반면, 효능은 대략 3.7배 더 컸다. 도 1b에 나타낸 바와 같이, 양자가 독립적으로 검정 플레이트 표면에 고정되는 경우, 19.3은 Aβ40 단량체에 비해 Aβ 올리고머에 대하여 더 큰 친화성을 가졌다. 따라서, 본원에서 확인된 항-Aβ 올리고머 항체 19.3이, 각각이 검정 플레이트에 독립적으로 결합되어 있는 경우 Aβ40 단량체에 비해 Aβ 올리고머에 선택적으로 결합하기는 하지만, 본 출원인은 용액이거나 검정 플레이트에 고정된 것 중 어느 하나로써의 체액 또는 조직 샘플에서 이루어지게 되는 것과 같이 Aβ 올리고머 및 Aβ 단량체 종 양자가 동시에 존재하는 경우의 19.3의 상대적 결합 특성을 추가 비교 탐색하였다.
Aβ 올리고머 및 Aβ 단량체 양자가 존재하게 되는 시험관내 CSF 샘플을 더 정확하게 나타내기 위하여, 경쟁 ELISA 포맷으로 Aβ40 단량체 존재하에서의 Aβ 올리고머에 대한 19.3의 친화성을 시험하였다 (도 1c). 웰 당 50 pmol의 Aβ 올리고머 조제물로 먼저 코팅한 다음, 각 웰에 2 nM의 최종 농도로 19.3 항체를 첨가하는 것에 의해, ELISA 플레이트를 제조하였다. 이와 같은 19.3의 농도, 즉 2 nM은 일-측 ELISA에서 측정된 Aβ 올리고머 결합을 위한 EC50 농도를 나타낸다 (도 1b). Aβ 올리고머-코팅된 표면으로부터 19.3을 경쟁적으로 제거하기 위하여 적정 곡선으로 Aβ40 단량체를 첨가하는 것은 5.5 μM의 EC50으로 이어졌다. 웰 당 100 pmol의 Aβ40 단량체를 사용하여 ELISA 플레이트를 코팅하고, Aβ 올리고머를 항체 결합에 대하여 경쟁하도록 사용한 경우, EC50은 8.7 nM이었다. 이는 19.3이 용액 및 고체 상 모두에서 Aβ40 단량체에 비해 Aβ 올리고머에 대하여 더 고도의 친화성을 가졌음을 나타낸다. 따라서, Aβ 올리고머로부터 19.3의 50%를 대체하는 데에 요구되는 Aβ40의 농도는 Aβ40에 대한 19.3 결합을 대체하는 데에 요구되는 Aβ 올리고머의 농도보다 대략 600배 더 높았다. 1500 pM의 Aβ 단량체와 비교할 때, Aβ 올리고머 0.200 pM까지의 농도가 AD 환자로부터의 CSF에서 보고된 바 있다 (문헌 [Georganopoulou, et al., 2005, Proc. Natl. Acad. Sci. U.S.A., 102:2273-2276]). 따라서, 항체 19.3은 Aβ 단량체의 배경 수준상에서 Aβ 올리고머를 검출하는 데에 요구되게 되는 선택성 정도를 갖는 것으로 보였다. 추가적인 검정 개발을 위하여, AD 뇌에서 Aβ 올리고머를 검출하는 것으로 ELISA 포맷에서 이전에 보고되었던 (문헌 [Xia, et al., 2009, Arch. Neurol., 66:190-199]) 82E1 검출 항체와 19.3 항체를 연계하였다. 포획 및 검출 항체 모두로서 82E1 (이뮤노바이올로지칼 래보래토리즈 (IBL) 인코포레이티드 사, 미네소타 미네아폴리스 소재)을 사용한 경우 (82E1/82E1 ELISA), 이와 같은 항체는 인간 CSF와 함께 사용하는 데에 요구되는 수준 미만의 선택성을 가졌다 (데이터 미도시).
Aβ
올리고머
샌드위치
ELISA
에서의 Aβ
올리고머
선호 항체
샌드위치 ELISA 포맷에서의 포획 및 검출 항체 쌍의 스크리닝에서 (표 1), Aβ 올리고머 표준 곡선으로 카세인 차단 완충제 중에서 동등하게 수행된 항-Aβ 올리고머 항체 7305 (20C2, 그 전체가 본원에 참조로써 개재되는 U.S. 특허 제7,780,963호) 또는 82E1 (이뮤노바이올로지칼 래보래토리즈 (IBL) 인코포레이티드 사, 미네소타 미네아폴리스 소재) 중 어느 하나와의 포획 항체로서의 19.3의 조합이 각각 4 pg/mL 미만의 검출 한계 (LoD)를 생성하였다 (도 2a). 포획 및 검출 항체 모두로서의 항-Aβ 단량체 항체의 사용이 Aβ 올리고머 검정법으로 보고된 바 있으나, 절대적인 수준의 감도 또는 선택성 중 어느 것도 보고되지 않았거나 (6E10/6E10; 문헌 [Gandy, et al., 2010, Ann. Neurol., 68:220-230]), 선택성이 인간 CSF에서 Aβ 올리고머를 측정하는 검정법에서 원하는 것 미만이었다 (82E1/82E1; 문헌 [Xia, et al., 2009, Arch. Neurol., 66:190-199]).
간디(Gandy) 또는 시아 누구도 인간 CSF에서의 Aβ 올리고머의 검출에 대해 보고하지는 않았지만, 6E10을 사용한 본 출원인의 내부 연구 및 82E1을 사용한 IBL에 의해 공개된 보고는 이들의 감도가 인간 CSF에서의 Aβ 올리고머 검출에 요구되는 범위 이내일 수 있음을 암시하였다. 본원 출원인은 6E10/6E10 (도 2b) 및 19.3/19.3 (도 2c)와 같은 포획 및 검출 항체 모두에 있어서의 동일 항체의 사용은 물론, 포획 항체만으로서의 19.3을 사용한 샌드위치 ELISA 검정 쌍 (도 2a, 82E1 검출 사용)을 비교하였다. 표 1에 나타낸 바와 같이, 6E10/6E10 및 19.3/19.3은 모두 19.3/7305 또는 19.3/82E1 중 어느 하나에 비해 대략 100배 감소된 감도를 나타내었다. 발광 검출 기술 (엔비젼® 멀티라벨(Multilabel) 플레이트 판독기, 퍼킨엘머 사, 매사추세츠 왈탐 소재)을 이용하는 19.3/82E1 ELISA (도 2a)는 대략 1.3 pg/mL의 LoD를 생성하였다. 이와 같은 검정 포맷에서, Aβ 올리고머의 LLoRQ는 4.2 pg/mL이었으며 (이와 같은 최저 측정에서는 20% 미만의 분산 계수를 가짐), 검정은 Aβ40 단량체와 비교하였을 때 Aβ 올리고머 신호에 대하여 대략 1000 배-선택적이었다. 이와 같은 검정법을 사용하여 Aβ 올리고머 조제물을 평가하였지만, 그것은 인간 CSF에서 이전의 추정치 (문헌 [Georganopoulou, et al., 2005, Proc. Natl. Acad. Sci. U.S.A., 102:2273-2276])와 일치하는 수준으로 Aβ 올리고머 수준을 신뢰성 있게 검출하기에 충분하게 민감하지 않았다. 19.3×82E1 샌드위치 ELISA를 인간 체액에서 분석물을 검출하는 데에 더 큰 감도를 가지를 것으로 보고된 바 있는 상자성 마이크로-입자 검출 면역검정 플랫폼 (에레나®, 싱귤렉스®, 알메다 사, 캘리포니아 소재)으로 발전시켰다.
향상된 감도를 갖는 Aβ
올리고머
-선택적 샌드위치
ELISA
검정 감도가 인간 및 비-인간 영장류 체액 샘플에서의 Aβ 올리고머의 측정을 위해 더 향상될 수 있는지를 확인하기 위하여, 상자성 마이크로-입자 검출 면역검정 시스템인 에레나® 면역검정 시스템 (싱귤렉스®, 알메다 사, 캘리포니아 소재)을 사용하는 샌드위치 ELISA에서, 19.3과 7305 (19.3×7305) 및 19.3과 82E1 (19.3×82E1) 항체 쌍들 (표 1) 모두를 평가하였다. 본 발명의 한 실시양태에서, 면역검정법은 인간 CSF 샘플을 사용하여 수행되었다.
에레나® 면역검정 시스템과 같은 상자성 마이크로-입자 면역검정법이 Aβ40 및 Aβ42와 같이 나노몰 (nM) 범위로 생물학적 샘플에 존재하는 바이오마커에 사용된 바 있기는 하지만, 그와 같은 면역 시스템이 본원에서의 Aβ 올리고머와 같이 펨토몰 (fM) 범위로 CSF 샘플에 존재하는 바이오마커를 특이적으로 신뢰성 있게 검출할 수 있다는 것은 본원 출원인의 연구 이전에는 입증된 적이 없었다. 어떠한 이론에도 얽매이고자 하는 것은 아니나, 본 출원인은 청구되는 검정법의 특이성 및 감도가 샌드위치 ELISA에 선택되어 사용되는 항-ADDL 항체 쌍의 특이성 및 감도에 기인하는 것으로 믿고, 그것을 입증하였다. 마찬가지로, 본 출원인이 에레나® 면역검정 시스템을 사용하여 청구되는 검정법을 설명하기는 하였지만, 유사한 감도를 갖는 다른 검출 시스템이 본 발명의 방법에 사용되는 것이 가능하다.
19.3 항체를 에레나® 마이크로-입자 (MP) 비드에 공유-결합시키는 (이하 "19.3/MP 비드") 에레나® 면역검정 시스템 (싱귤렉스®, 알메다 사, 캘리포니아 소재)을 사용하여 19.3×7305 샌드위치 ELISA를 수행하였다. 다음에, 19.3/MP 비드를 표준 곡선의 Aβ 올리고머 또는 단량체성 Aβ40 중 어느 하나를 함유하는 완충제와 혼합하였다. 생성되는 19.3/MP 비드/Aβ 올리고머 또는 Aβ40 복합체 (이하 "Aβ 올리고머 복합체")를 세척하고, 형광-태그화된 7305 또는 82E1 검출 항체 중 어느 하나를 Aβ 올리고머 복합체에 결합시켰다. 단일-분자 계수를 할 수 있는 특허받은 검출 기술 (U.S. 특허 제7,572,640호 참조)을 사용하는 에레나® 기기가 샌드위치 ELISA로부터의 그의 방출 후 형광-표지된 검출 항체를 측정하였다. 표 2에 나타낸 바와 같이, 완충제 중 Aβ 올리고머 표준의 2-배 희석을 사용하는 19.3×7305 검정법으로부터의 데이터는 형광 신호 (검출 사례 평균)의 선형 2-배 희석으로 정렬되었다. 순 레서스(rhesus) CSF, 또는 표준 곡선의 Aβ 올리고머가 도입된 CSF에 의해 생성된 신호는 태그화된 7305 항체의 결합에 기인하는 형광 신호가 양 경우에서 동등하였던 반면, 19.3×82E1 샌드위치 검정법은 전체 표준 곡선에 걸쳐 첨가된 Aβ 올리고머를 검출할 수 있는 것으로 나타났다. 검출 항체로서 7305를 사용하는 검정 포맷에서, 이는 Aβ 올리고머의 일련의 희석 범위에 걸쳐 포화시키며 완충제 단독에서 Aβ 올리고머를 검출하기에 충분한 비-특이적 배경 (레서스 CSF에 존재하는 무언가로부터 유래)이 존재하였음을 나타낸다. 이어서, 형광 신호가 19.3 항체 결합의 부재하에서도 (데이터 미도시) 빈 마이크로-입자에서의 것과 동일하다는 것이 발견되었는데, 이것 역시 7305 항체 교차-반응성으로 인한 비-특이적 신호와 일치하였다.
7305 검출 항체를 82E1으로 대체한 에레나® 면역검정 시스템을 사용하여 개발된 Aβ 올리고머 선택적 샌드위치 ELISA의 제2 실시양태 역시 형광 태그와 연계되어 있다. 표 3에 나타낸 바와 같이, 검정법의 이와 같은 실시양태는 순 및 Aβ 올리고머 고갈 레서스 CSF 양자에서 비-특이적 신호를 제거함으로써, 7305 항체가 비-특이적 신호의 공급원이었다는 믿음을 다시 확인해 주었다. 어떠한 이론에도 얽매이고자 하는 것은 아니나, 19.3/7305 항체 쌍에서 관찰되었던 높은 배경 신호는 MP 비드에 결합하는 CSF 피브리노겐에 기인한 것으로 여겨졌는데, 19.3/82E1 항체 쌍에서는 이것이 관찰되지 않았다. Aβ 올리고머 선택적 샌드위치 ELISA의 이와 같은 실시양태는 0.04 pg/mL인 Aβ 올리고머 표준의 LoD, 0.42 pg/mL의 LLoRQ, 및 Aβ40 단량체 대비 5,000배인 Aβ 올리고머에 대한 검정법의 선택성을 생성하였다 (도 3). 이러한 발견을 바탕으로, 본 출원인은 이와 같은 검정법 포맷을 추가 최적화용으로 선택하였다.
약역학
(
PD
) 검정법
상기 발견을 사용하여, 본 출원인은 CSF 샘플 중 Aβ 올리고머의 수준을 검출하고 측정하는 데에 19.3 및 82E1 항체 쌍을 사용하는 선택적 Aβ 올리고머 샌드위치 ELISA를 개발하였다. 따라서, 이와 같은 검정법은 생성을 억제하거나, 제거를 증가시키거나, 아니면 Aβ 올리고머 수준을 변형시키는 치료 후 분석물, 즉 Aβ 올리고머 수준의 변화를 평가하기 위한 그의 용도에 대한 약역학 (PD) 검정법 (도 9a)으로 지칭될 것이다. 상기 PD 검정법은 비-AD 환자로부터 AD를 구별하는 데에, 즉 진단용으로, 질환의 진행을 모니터링 하는 데에, 즉 예후용으로, 또는 Aβ 올리고머 농도를 변화시키는 질환-변형 치료의 치료 가능성을 모니터링하는 데에 사용될 수도 있다.
실시예 7에 기술되어 있는 바와 같은 PD 검정법은 상자성 마이크로-입자 (MP) 비드에 결합된 19.3 항체 (MP 비드/19.3)를 ELISA 플레이트상의 웰에 위치시켰다. 인간 CSF 또는 Aβ 올리고머 표준 (트리스(Tris) 완충제 및 소 혈청 알부민에 첨가된 일련의 희석물들) 중 어느 하나를 상기 웰에 첨가하였다. 웰에 존재하는 소정의 Aβ 올리고머가 19.3/MP 비드에 의해 결합된 후, 과량의 용액을 세척 제거하였다. 검정 완충제 (1% 트리톤(triton) X-100, d-데스티오비오틴, BSA를 포함하는 트리스 완충제) 내의 검출 항체로서의 형광-표지된 82E1를 세척된 MP 비드/19.3/Aβ 올리고머 복합체에 첨가하고 인큐베이팅함으로써, Aβ 올리고머 복합체에 결합시켰다. 생성되는 MP 비드/19.3/Aβ 올리고머/82E1 복합체를 용리 완충제로 세척한 후, 소정의 비결합 항체를 사용하여 형광-표지된 82E1 항체를 용리하였다. 용액이 흘러 지나가면서 레이저에 의해 여기되는 에레나® 기기와 같은 상자성 마이크로-입자 검출기를 사용한 검출은 검출되는 분자, 즉 Aβ 올리고머와 등가인 형광 신호를 생성시켜 측정하는 단일 분자의 검출 (형광 태그는 고유 광 파장의 광자를 방출함)을 가능케 한다. Aβ 단량체와 비교한 에레나® 기기를 사용하여 측정하였을 때의 Aβ 올리고머의 표준 곡선을 도 3에 나타내었다.
인간
CSF
중 Aβ
올리고머
실시예 6의 19.3×82E1 Aβ 올리고머 선택적 샌드위치 ELISA를 사용하여 인간 CSF 샘플에서 Aβ 올리고머의 내인성 수준을 측정하였다 (도 4a 및 4b). 2개의 별도 샘플 군에서, Aβ 올리고머의 존재에 의해 생성되는 형광 신호는 젊거나 건강한 연령이 유사한 대조군 중 어느 하나에 비해 AD (25 미만의 MMSE 점수를 사용하여 AD일 가능성이 있는 것으로 임상 진단) CSF에서 상당히 상승되었다. p<0.0004의 t-검정, 쌍방향 만-휘트니 점수로 프레시젼 메디신(Precision Medicine) 사 (캘리포니아 솔라나 비치 소재)로부터의 CSF 샘플에서 관찰된 Aβ 올리고머의 절대 수준은 AD (N=20)에서 2.1 +/- 0.61 pg/mL이었으며, 연령이 유사한 대조군 (N=10)에서 0.53 +/- 0.26 pg/mL이었다 (도 4a). p<0.0021의 t-검정, 쌍방향 만-휘트니 점수로 바이오레클라메이션(Bioreclamation) 사 (뉴욕 힉스빌 소재)로부터의 CSF 샘플에서 관찰된 Aβ 올리고머의 절대 수준은 AD (N=10)에서 1.66 +/- 0.5 pg/mL이었으며, 대조군 (N=10)에서 0.24 +/- 0.05 pg/mL이었다 (도 4b). 2개 군을 합치면, 진단된 AD CSF 샘플 중 90%가 0.42 pg/mL의 LLoRQ를 상회한 반면, 연령이 유사한 대조군 중 20% 또는 젊은 대조군 중 10%만이 이와 같은 한계를 상회하였다. 모든 값들이 0.04 pg/mL의 LoD는 상회하였다. 바이오레클라메이션 사로부터 입수된 CSF 샘플에서 Aβ40 및 Aβ42 단량체 수준을 측정하였는데 (각각 도 5a 및 5b), Aβ40에 있어서는 AD와 대조군 CSF 사이에 유사하였던 반면 (도 5a), Aβ42에 있어서는 AD 샘플에서 상당히 감소되었다 (도 5b). 이는 이전에 AD CSF의 특징으로서 보고된 바 있는데 (문헌 [De Meyer, et al., 2010, Arch. Neurol. 67:949-956]; [Jack, et al., 2010, Lancet Neurol. 9:119-128]), 해당 샘플의 올바른 진단을 확인해 주었다. 어떠한 이론에도 얽매이고자 하는 것은 아니나, 본 출원인은 AD CSF 샘플에서의 더 낮은 Aβ42 수준이 AD 뇌의 아밀로이드 침착물에서의 Aβ42의 체류에 기인하는 것으로 믿고 있다. 이러한 관찰된 차이를 특이적으로 검출하여 정량하는 능력은 이와 같은 바이오마커가 AD의 진단 및 예후 척도로 사용될 수 있다는 것을 암시한다.
진단용 검정의 경우, 본원 발명의 검정법으로부터 검출되는 신호, 즉 Aβ 올리고머의 수준은 비-AD 환자에서 관찰되는 신호에 비해 AD 환자에서 통상적으로 (>0.5 pg/mL의 수준까지) 3배 이상 더 커지게 된다. 이는 연령이 유사한 대조군에 비해 AD CSF에서 Aβ 올리고머의 수준이 4-배 더 높았던 도 4a, 및 AD CSF에서 Aβ 올리고머의 수준이 8-배 더 높았던 도 4b 모두에 나타나 있는 데이터와 일치한다. 이와 같은 데이터는 또한 질환의 조기 단계에 환자를 확인하기 위한 본 발명 Aβ 올리고머 검정법의 용도 (즉 예후 검정)를 뒷받침한다. 연령이 AD 발병의 가장 큰 위험 인자이므로, AD와 연령이 유사한 대조군 사이에 관찰되는 차이는 AD와 젊은 대조군 사이에서에 비해 더 작다. 마찬가지로, 예후용 Aβ 올리고머 검정의 경우, 25 미만의 MMSE를 갖는 환자는 대조군에 비해 AD CSF에서 대략 2-배 더 낮은 Aβ42 단량체에 대하여 검출되는 신호와 비교하였을 때, ≥0.5 pg/mL (25를 상회하는 MMSE를 갖는 환자/정상에 비해 4 내지 8배 더 높음)의 검출되는 Aβ 올리고머 신호를 가지게 된다. 도 6은 ≤25의 MMSE 점수가 컷오프로 사용됨으로써 (문헌 [Mungas, D., 1991, Geriatrics 46(7): 54-58]) 그것을 상회하는 환자는 '정상 건강인'으로 간주되고 그것을 하회하는 환자는 약간 인지가 손상되거나 AD를 가지고 있는 것 중 어느 하나로 간주되는 경우, 0.5 pg/mL의 Aβ 올리고머 수준을 상회하는 환자는 25 미만의 MMSE 점수를 가질 가능성이 있는 것으로 예상될 것임을 암시한다.
표적 관여 (
TE
) 검정법
마찬가지로, 상기 발견을 사용하여, 본 출원인은 항-Aβ 올리고머 19.3 IgG2 항체, 즉 치료용 항체를 사용하여 치료된 환자로부터의 CSF 샘플에서 결합된 Aβ 올리고머의 수준을 검출하고 정량하는 데에 항 인간 IgG2 항체 × 82E1 항체 쌍을 사용하는 선택적 샌드위치 ELISA를 개발하였다. 이와 같은 검정법은 지금부터 생체 내에서 치료용 (포획) 항체에 결합된 Aβ 올리고머를 측정하기 위한 그의 용도로 인하여 표적 관여 검정법 (TE 검정법)으로 지칭될 것이다. 따라서, TE 검정법은 치료제에 의한 Aβ 올리고머의 관여를 확인하기 위하여 치료용 항체에 결합된 Aβ 올리고머의 수준을 측정하는 데에 사용될 수 있다. 이론에 얽매이고자 하는 것은 아니나, 본 출원인은 치료용 항-Aβ 올리고머 항체에 결합되는 Aβ 올리고머의 수준이 해당 치료제를 사용하여 장기간 동안 치료된 대상체로부터의 CSF 샘플에서는 더 낮을 것으로 믿고 있다. 투여-후 증가되거나 변함없는 결합 Aβ 올리고머의 수준은 치료제가 AD의 치료에 적합하지 않음을 암시하게 된다. 다르게는, 단순히 Aβ 올리고머를 격리하여 그것을 치료용 항체에 결합시킴으로써, 뇌에서의 뉴런과의 상호작용 감소로 인하여 급성 수행능력에 있어서 이익이 수득될 수 있는 경우가 있을 수 있다. 그러나, 이와 같은 이익은 Aβ 올리고머 자체의 변화와는 관련되지 않을 수 있다. 표적 관여 검정법은 최소한 CSF 내에서 Aβ 올리고머에 관여하는 치료용 항체의 능력을 평가하게 된다.
인간 CSF 매트릭스에서 Aβ 올리고머에 관여하는 Aβ 올리고머-특이적 항체의 능력을 입증하기 위하여, 본 출원인은 20 m/k (100 ng/mL, 도 8)로 IV 투여된 레서스 원숭이에서 24시간에 존재할 것으로 여겨지는 수준으로 항-Aβ 올리고머 항체 19.3을 첨가 투입함으로써, 인간 CSF 내에 19.3/Aβ 올리고머 복합체를 생성시켰다. 이와 같은 19.3-첨가 인간 CSF 샘플에, 내인성 Aβ 올리고머 농도 (0.1-5.0 pg/mL) (도 4a 및 4b)에 부합하는 동시에 또한 그것을 상승시켜 정상 범위를 상당히 상회하도록, 점증량의 Aβ 올리고머 표준을 첨가하였다. 인간 CSF에서 형성되는 19.3×Aβ 올리고머 복합체를 인간 카파 경쇄에 대한 항체 또는 인간 IgG2에 대한 항체 중 어느 하나로 코팅된 96-웰 ELISA 플레이트상에 포획시킨 다음, PD 검정법 (도 3a)에서 수행하였던 바와 같이 비오티닐화된 82E1 (b82E1)을 사용하여 검출하였다. 항-Aβ 올리고머 항체 19.3은 완충제 중에서 (▲, 도 7a 및 7b) 항-인간 카파 및 항-인간 IgG2 모두에 의해 충분하게 인식되었는데, 항체가 이들 특징 모두를 가지고 있기 때문이다. 도 7a에 나타낸 바와 같이 (●, CSF), 19.3/Aβ 올리고머 복합체를 검출 및 측정하기 위하여 포획 항체로서 항-인간 IgG2를 사용하고 검출 항체로서 82E1을 사용하는 검정법이 포획 항체로서 항-인간 카파를 사용하는 검정법에 비해 (●, CSF, 도 7b) 인간 CSF에서의 상당히 더 우수한 감도로 이어졌다. 양 검정법은 카세인 완충제 중에서는 등가의 감도를 가졌다. 19.3/Aβ 올리고머 복합체를 포획하기 위한 항-인간 카파의 사용은 100 ng/mL의 19.3에 결합된 Aβ 올리고머 42 pg/mL의 LoD까지인 저조한 감도로 이어졌는데, IgG2 종에 비해 더 높은 인간 CSF에서의 카파 경쇄를 갖는 IgG 종의 배경 수준으로 인한 것으로 보이며, 이는 항 IgG2를 사용한 검정 포맷에서의 더 큰 감도로 이어졌다. 치료용 항체로서 19.3 또는 관련 IgG2 항-Aβ 올리고머 항체를 사용한 인간 또는 실험 동물 중 어느 하나의 투여 후에는, 치료용 항체가 투여 수준의 0.1-0.2%로 CSF 중에 존재할 것으로 예상하게 된다 (문헌 [Thompson, 2005, Proteins of the Cerebrospinal Fluid, Elsevier Academic Press, NewYork, NY]). CSF에 존재하는 치료용 항체는 가용한 Aβ 올리고머에 결합되게 되며, 19.3 (IgG2)/Aβ 올리고머 복합체는 항-인간 19.3 IgG2 항체를 통하여 항-IgG2 포획 항체에 의해 포획되게 되고, 이후 82E1에 의해 Aβ 올리고머 복합체가 검출되게 된다. 이와 같은 플랫폼의 감도 역시 상기 PD 검정법에서 이용하였던 에레나® 면역검정 시스템 (싱귤렉스®, 알메다 사, 캘리포니아 소재)과 같은 상자성 마이크로-입자 검출 시스템을 사용하여 향상되게 된다.
항-Aβ 올리고머 항체를 사용한 치료제 치료 후 시간이 지나면, 19.3/Aβ 올리고머 복합체에 대하여 검출되는 신호는 (치료-전 수준에 비해) 감소될 것으로 예상된다. 결합된 Aβ 올리고머의 양은, 급성으로, 또는 일정 기간의 치료제 치료 후에 이들 복합체를 측정하였는지에 관계없이 표적 즉 Aβ 올리고머에 관여된 치료용 항체의 비율을 나타내므로, 치료용 항체의 효능에 대한 대용으로 사용될 수 있다.
실시예
본원에서는 하기의 약어들이 사용된다: Ab: 항체; Aβ: 아밀로이드 베타 단백질; AD: 알츠하이머병; ADDL: 아밀로이드-β 유래 확산성 리간드; aM: 아토몰; CSF: 뇌척수액; DE 평균: 검출 사례 평균; DMSO: 디메틸술폭시드; HFIP: 1,1,1,3,3,3 헥사플루오로-2-프로판올; HMW: 고분자량; LMW: 저분자량; LoD: 검출 한계; LLoRQ: 신뢰성 있는 정량의 하위 한계.
실시예 1
ADDL 제조 및 Aβ
캘리포니아 서니베일 소재 아메리칸 펩티드 캄파니 사로부터 Aβ40 및 Aβ42 (아밀로이드 β 펩티드 1-40, 아밀로이드 β 펩티드 1-42)를 입수하였다. Aβ42를 1,1,1,3,3,3 헥사플루오로-2-프로판올 (HFIP) (시그마-알드리치 사, 미주리 세인트 루이스 소재)에 용해시켜 응집에 "핵(seed)"으로 작용할 수 있는 소정의 기존 이차 구조를 제거하였다. 증발에 의해 HFIP를 제거함으로써 Aβ42 필름을 형성시켰다. 상기 Aβ42 펩티드 필름 (100% HFIP 용매로부터 건조된 1 mg의 Aβ42)을 44 μL의 DMSO에 용해시키고, 거기에 약하게 혼합하면서 1,956 μl의 저온 F12 배지 (기브코(GIBCO)®, 인비트로겐(Invitrogen) 사, 캘리포니아 칼스배드 소재, Cat # ME100014L1)를 첨가하고, 실온에서 18 내지 24시간 동안 인큐베이팅하였다. 샘플을 실온에서 14,200 g로 10분 동안 원심분리하였다. 상청액을 새 튜브로 옮기고, 4℃에서 15분 동안의 4,000 rpm의 회전을 통하여 0.5 ml 칼럼 YM-50 필터 튜브 (밀리포어(Millipore) 사, 매사추세츠 베드포드 소재; Cat# UFC505096, 0.5 ml)로 여과시켰다. 필터 삽입물을 뒤집어 잔류물을 수집하고, 새 수집 튜브로 바꾸어, 4℃에서 5분 동안 4,000 rpm으로 원심분리하였다. 브래드포드 어세이(Bradford Assay) (바이오래드(BioRad) 사, 캘리포니아 허큘리스 소재, Cat#_23236)에 의해 여과-전에 단백질 농도를 측정하고, μM로 기록하였다 (Aβ 단량체 분자량 (MW 4513)을 바탕으로 계산). 모든 샘플은 사용시까지 -80℃로 저장하였다.
실시예 2
항-ADDL 항체의 선택
A. 인간화된 항체 라이브러리의 패닝
경쇄 CDR3 아미노산 서열 중 일부가 무작위 돌연변이생성에 적용된 인간화 항-ADDL 항체 h3B3의 친화도 성숙 라이브러리 (U.S. 특허 제7,811,563호 및 7,780,963호 참조)를 구성하였다. 전체 CDR3 영역을 포괄하기 위하여, 2종의 하위-라이브러리를 구성하였다. 하나의 라이브러리는 모체 중쇄 가변 영역, 및 경쇄 CDR3 좌측 절반 (다른 것은 경쇄 CDR3 우측 절반)의 돌연변이된 아미노산으로 구성되었다. 유사한 전략이 3종의 하위 라이브러리를 갖는 중쇄 CDR 무작위 돌연변이생성에 사용되었다.
인간화된 3B3 (h3B3)을 업계에 알려져 있는 방법을 사용하는 친화도 성숙에 적용하였다. h3B3 가변 영역을 Fab 디스플레이 벡터 (pFab3D)에 클로닝하였다. 이와 같은 벡터에, 각각 불변 영역의 CH1 도메인 및 카파 불변 영역에 맞도록, 중쇄 및 경쇄의 가변 영역을 인-프레임(in-frame) 삽입하였다. Fab3D에서는, CH1 서열 뒤에 myc 에피토프 및 6개의 연속 히스티딘 아미노산이 이어져, 이후 디스플레이를 위한 파지 pIII 단백질에 연결된다. PCR 프라이머 내에 구성되는 축퇴성 올리고뉴클레오티드 서열을 사용하여, 중쇄 및 경쇄 CDR3의 모든 위치를 무작위로 돌연변이생성시켰다. 물리적 크기를 조정하기 위하여, 각각 5-6개 아미노산에 초점을 맞추어 하위-라이브러리를 구성하였다. 인간 3B3 (H3B3)의 벡터 DNA를 주형 DNA로 사용하여, 돌연변이된 PCR 프라이머 (표 4)로 중쇄 및 경쇄 모두를 증폭하였다. PCR 증폭 후, 합성된 DNA 단편을 1.3% 아가로스 겔상에서 전개하여 프라이머를 제거하고, 제한 효소를 사용하여 가변 단편을 분해하였다: 경쇄 가변 클로닝의 경우 BsiWI 및 XbaI 클로닝 부위, 중쇄 가변 클로닝의 경우, XhoI 및 ApaI.
pFab3D 파지 디스플레이 벡터에 친화도 성숙 라이브러리를 구성하기 위하여, pFab3D-3B3 DNA를 동일한 제한 효소 쌍으로 분해하고, 정제한 후, 중쇄 및 경쇄 가변부의 PCR 단편들을 T4 리가제 (인비트로겐 사, 캘리포니아 칼스배드 소재)로 16℃에서 밤새 결찰시켰다. 다음에, 결찰 생성물을 이. 콜라이 TG1 전기천공-적격(electroporation-competent) 세포 (스트라타진(Stratagene), 아길렌트 테크놀로지스(Agilent Technologies) 사, 캘리포니아 산타 클라라 소재)에 형질감염시키고, 라리브러리 크기를 적정하기 위하여 세균 배양물의 분취량을 LB 아가-카르베니실린 (50 ㎍/mL) 플레이트상에 플레이팅하였다. 나머지 배양물은 카르베니실린과 함께 대형 플레이트상에 플레이팅하고 이. 콜라이 라이브러리 모액용으로 30℃에서 밤새 인큐베이팅하거나, 또는 헬퍼 파지 M13K07 (인비트로겐 사, 캘리포니아 칼스배드 소재, 1011 pfu/mL)를 사용하여 실온에서 37℃로 10분 동안 인큐베이팅함으로써 감염시켰다. 다음에, 카르베니실린 (50 ㎍/mL)을 포함하는 2TY 배지를 첨가하고, 진탕하면서 37℃로 1시간 동안 인큐베이팅하였다. 다음에, 카나마이신 (70 ㎍/mL)을 첨가하고, 배양물을 진탕하면서 30℃로 밤새 성장시켰다. 파지 배양 상청액을 적정하고, 20% (v/v) PEG (폴리에틸렌글리콜)/NaCl을 사용한 침전에 의해 농축한 후, PBS 중에 재현탁하고, 0.22 ㎛ 필터로 멸균한 후, 파지 라이브러리 패닝용으로 분취량을 제조하였다.
다음에, 표 5에 요약되어 있는 바와 같이 파지 라이브러리 패닝을 수행하였다.
Fab 디스플레이 파지 라이브러리로부터의 투입 파지 (100 μl, 약 1011-12 pfu)를 900 μL의 차단 용액 (PBS 중 3% 무-지방 건조 우유)으로 차단함으로써, 파지 표면에 대한 비특이적 결합을 감소시켰다. 자성 분리기에서 200 μL의 비드 현탁액을 수집하고 상청액을 제거함으로써, 스트렙타비딘-코팅된 비드를 제조하였다. 다음에, 비드를 1 mL의 차단 용액에 현탁시킨 후, 30분 동안 회전 믹서상에 놓아두었다. 비-특이적 스트렙타비딘 결합 파지를 제거하기 위하여, 차단된 파지 라이브러리를 차단된 스트렙타비딘-코팅 비드와 혼합한 후, 30분 동안 회전 믹서상에 놓아두었다. 탈-선택(de-selection) 과정으로부터의 파지 현탁액을 새로운 튜브로 옮기고, 200 μL의 항원, 10% bADDL을 첨가한 후, 항체 및 항원 결합을 위하여 2시간 동안 인큐베이팅하였다. 인큐베이션 후, 혼합물을 차단된 스트렙타비딘-코팅 비드에 첨가하고, 회전 믹서상에서 1시간 동안 인큐베이팅함으로써 스트렙타비딘 비드에 Ab/Ag 복합체를 포획시켰다. 포획된 10% bADDL/파지 복합체를 갖는 비드를 PBS/0.05%의 트윈 20으로 5회, 이후 PBS 단독으로 2회 세척하였다. 200 μL의 100 mM TEA를 사용하여 결합된 파지를 bADDL로부터 용리하고, 20분 동안 인큐베이팅하였다. 다음에, 용리된 파지를 50 mL 튜브로 옮기고, 100 μL의 1 M 트리스-HCl pH7.5를 사용하여 중화한 후, 0.6-0.8 사이의 OD 600 nm를 갖는 10 mL의 이. 콜라이 TG1 세포에 첨가하였다. 1시간 동안의 진탕을 동반한 37℃에서의 인큐베이션 후, 산출 파지 수를 적정하기 위하여, 배양물 분취량을 LB 아가-카르베니실린 (50 ㎍/mL) 플레이트 상에 플레이팅하고, 나머지 세균은 원심분리한 후, 500 μl의 2×YT 배지 (테크노바(Teknova) 사, 캘리포니아 홀리스터 소재)를 사용하여 현탁하고, 100 ㎍/ml의 암피실린 및 1% 글루코스를 함유하는 생물검정 YT 아가 플레이트 (테크노바 사, 캘리포니아 홀리스터 소재)상에 플레이팅하였다. 상기 생물검정 플레이트를 30℃에서 밤새 성장시켰다.
각 패닝 라운드 후, 무작위로 단일 콜로니를 선출하여, 96-웰 플레이트에서 파지를 제조하였다. 96-웰 플레이트에서의 파지 제조 절차는 파지 침전 단계가 사용되지 않았다는 것 이외에는 상기한 것과 유사하였다. 100 ㎍/ml의 암피실린 및 0.1% 글루코스를 포함하는 120 μL의 2×YT 배지 (16 g의 박토(Bacto)-트립톤, 10 g의 박토-효모 추출물, 5 g의 NaCl (모두 BD 바이오사이언시즈(Biosciences) 사, 뉴저지 프랭클린 레이크스 소재), 1 L까지의 ddH2O (오토클레이브))에서 성장하는 콜로니를 함유하는 배양 플레이트를 히그로(HiGro)® 진탕기 (게노믹 솔루션즈(Genomic Solutions) 사, 미시시피 앤 아버 소재)에서 450 rpm으로 진탕하면서 30℃로 밤새 인큐베이팅하였다. 파지 상청액 (약 100 μL)을 상기한 AβDDL 결합 ELISA에서 바로 분석에 사용하였다. 양고추냉이 퍼옥시다제 (HRP)에 접합된 항-M13-항체 (아머샴 바이오사이언스(Amersham Bioscience) 사, GE 헬스케어(Healthcare) 사, 위스콘신 와우케샤 소재)를 사용하여 ADDL에 대한 파지의 결합을 검출하였다.
실시예 3
Aβ 올리고머 및 Aβ40에 대한 19.3의 EC50 측정
고도 단백질 결합 플레이트에 PBS 중 100 pmol/웰의 Aβ40 또는 50 pmol/웰의 Aβ 올리고머 중 어느 하나를 4℃에서 밤새 코팅하였다. 다음날, 플레이트를 PBS + 0.05% 트윈-20으로 5회 세척하고, 카세인 차단 완충제 (써모 사이언티픽(Thermo Scientific) 사, 매사추세츠 왈탐 소재) 및 0.05%의 트윈-20을 사용하여 밤새 차단시켰다. 실시예 2에서 확인된 19.3 항체를 0 내지 15 ㎍/ml의 12-단계 3배 일련의 희석으로 시험하였다. 실온 인큐베이션 2시간 후, 플레이트를 세척하고, 알칼리 포스파타제 접합 항-인간 IgG (써모사이언티픽 사, 매사추세츠 왈탐 소재)를 0.08 ㎍/ml로 첨가하였다. 실온에서 45분 동안의 인큐베이션 후, 플레이트를 세척하고, 트로픽스(Tropix) CDP 스타(star) (어플라이드 바이오시스템즈(Applied Biosystems) 사, 캘리포니아 포스터 시티 소재)를 첨가하였다. 30분 후 엔비젼® 플레이트 판독기 (퍼킨엘머 사, 매사추세츠 왈탐 소재)에서 발광을 검출하였다. 그래프패드 프리즘(GraphPad Prism) (그래프패드 소프트웨어 인코포레이티드(GraphPad Software, Inc.) 사, 캘리포니아 샌디에고 소재) 소프트웨어를 사용하여 곡선 피팅을 완료하였다.
실시예 4
Aβ 올리고머 및 Aβ 단량체를 사용한 경쟁 결합 검정
Aβ 올리고머 및 Aβ 단량체를 사용한 경쟁 결합 검정으로써 19.3 항체를 사용한 Aβ 올리고머 결합에 대한 선호를 입증하였다. 카세인 완충제 차단 단계를 통하여, 상기 실시예 3에서와 같이 Aβ 올리고머 플레이트를 제조하였다. 동일한 방식으로 100 pmol/웰을 사용하여, Aβ40 단량체-코팅된 플레이트를 제조하였다. 카세인 차단 완충제 매트릭스 중에서, 각 웰에 4 nM (상기 실시예 3에서 측정하였을 때의 Aβ 올리고머에 대한 EC50)로 실시예 2로부터의 19.3 항체를 적용하고, 진탕하면서 실온에서 30분 동안 Aβ 올리고머 또는 Aβ40과 상호작용시켰다. Aβ 올리고머 또는 Aβ40 중 어느 하나에 대하여, 10 μM에서 시작하는 12-단계 3-배 농도 곡선을 항체 함유 웰에 적용하였다. Aβ 올리고머로 코팅된 플레이트의 경우, Aβ40을 웰에 첨가하였으며; Aβ40 플레이트의 경우, Aβ 올리고머를 웰에 첨가하였다. 플레이트를 실온에서 1시간 30분 동안 인큐베이팅하였다. 잔류 항체 결합의 검출 및 EC50 계산 양자는 상기 실시예 3에서 확인하였다.
실시예 5
엔비젼 플랫폼에서의 샌드위치 ELISA
A. Aβ 올리고머 검정: 완전 Aβ 올리고머 조제물 또는 인간 CSF에 샌드위치 ELISA를 적용하였다. 19.3 Aβ 올리고머-선호 항체를 나트륨 비카르보네이트 완충제 (써모피셔(ThermoFisher) 사 #28382, 매사추세츠 왈탐 소재) 중 웰 당 0.5 ㎍으로 4℃에서 밤새 코팅하였다. 다음날, 0.05% 트윈 20을 포함하는 포스페이트-완충 식염수 (PBS-T)를 사용하여 웰을 세척하고, 0.1% 트윈이 첨가된 200 μL/웰의 PBS 중 카세인 완충제 (써모피셔 사, #37528, 매사추세츠 왈탐 소재)를 사용하여 4℃에서 밤새 차단시켰다. Aβ 올리고머 표준 또는 SEC 분획을 카세인 완충제에 희석하여, 100 μL/웰로 첨가하였다. 표준 곡선의 선형 범위에서 신호를 제공하는 희석물들을 계산에 사용하였다. 다음날, PBS-T를 사용하여 플레이트를 5회 세척하고, 비오틴-82E1 (IBL 사, No.10326, 캐나다 온타리오 토론토 소재)을 카세인 완충제 중에서 100 μl/웰로 실온에서 1시간 동안 첨가하였다. 플레이트를 다시 PBS-T로 세척하고, 뉴트라비딘(Neutravidin)-AP (써모피셔 사 #31002, 매사추세츠 왈탐 소재)를 실온에서 30분 동안 첨가하였다. 최종적으로, 추가적인 PBS-T 세척 후, 트로픽스® CDP®-스타 화학발광 기질 (라이프 테크놀로지스(Life Technologies)™ 사, 캘리포니아 칼스배드 소재)을 30분 동안 첨가하였다. 엔비젼® (퍼킨엘머 사, 매사추세츠 왈탐 소재) 플레이트 판독기에서 발광을 정량하였다.
B. Aβ 단량체 검정: Aβ40 (아메리칸 펩티드 캄파니 사, 캘리포니아 서니베일 소재)을 1,1,1,3,3,3 헥사플루오로-2-프로판올 (HFIP, 시그마-알드리치 사, 미주리 세인트 루이스 소재)에 용해시켰다. 증발에 의해 HFIP을 제거한 다음, 건조된 펩티드 필름을 디메틸 술폭시드 (DMSO, 시그마 알드리치 사, 미주리 세인트 루이스 소재)에 재-용해시켰다. ELISA 및/또는 반응물들의 비오티닐화를 수행하는 표준 방법은 문헌 [Antibodies: a Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, Harlow E, Lane D (1988)]에서 찾아볼 수 있다. 샌드위치 ELISA 프로토콜을 사용한 Aβ 단량체의 검출 방법에 대해서는 6E10, 12F4 및 G210 (코밴스 사, 뉴저지 프린스턴 소재)과 같은 시중에서 구입가능한 항체들을 사용하여 이전에 기록된 바 있다 (문헌 [Sankaranayaranan et al., J. Pharmacol. Exp. Ther., 328:131-140]).
실시예 6
인간 CSF 샘플
임상적으로-확인된 AD, 젊은 대조군 또는 연령이 유사한 대조군 환자로부터의 CSF 샘플들은 바이오레클라메이션 사 (뉴욕 힉스빌 소재) 또는 프레시젼 메드 사 (캘리포니아 솔라나 비치 소재)로부터 구매하였다. 인지 진단은 통상적으로 승인되어 있는 미니-멘탈 스테이트 이그잼 (MMSE)을 사용하여 이루어졌다. ELISA에 의한 Aβ40 및 Aβ42 단량체의 각 측정에 의해 샘플의 특성을 확인하였으며 (실시예 5B), 그것을 AD CSF에서 변함없는 것 또는 상당히 감소된 것 중 어느 하나로 기록하였다.
실시예 7
비-인간 영장류에서의 19.3의 약동학 분석
영장류 CSF에서의 19.3의 존재를 확인하기 위하여, 일군의 대수조 포팅된 레서스 원숭이에서 항-Aβ 올리고머 항체 19.3에 대하여 연구를 수행하였다. 6마리의 동물 (3마리 수컷/3마리 암컷)에 항체 19.3의 단일 정맥내 볼루스 (20 mg/kg)를 투여하였다. 다양한 시점에 대수조 포트로부터 CSF 샘플을 수집하고, 항-인간 IgG ELISA 검정법을 사용하여 CSF 중 항체 19.3의 농도를 측정하였다. 본 출원인은 항체 19.3이 영장류 CSF로 침투할 수 있으며, 거기에서 처음 24시간 동안 농도가 증가되어 약 100 ng/mL로 최대화된다는 것을 발견하였다. 이와 같은 농도는 인간 CSF에 첨가된 항 Aβ 올리고머 항체 19.3의 수준을 표적 관여 검정법의 개발로 이끈다.
실시예 8
Aβ 올리고머 샌드위치 ELISA 상자성 마이크로-입자 기반 면역검정법
인간 샘플 또는 Aβ 올리고머 표준에서 올리고머 수준을 측정하기 위하여, 상자성 마이크로입자-기반 면역검정 플랫폼 (에레나® 면역검정 시스템, 싱귤렉스®, 알메다 사, 캘리포니아 소재)을 사용하여 Aβ 올리고머 샌드위치 ELISA를 수행하였다. MP mg 당 포획 반응물인 Aβ 올리고머 항체 19.3 12.5 ㎍을 결합시킴으로써 포획용 마이크로-입자 (MP)를 제조하였다 (하기 방법 참조). 19.3 결합 MP를 검정 완충제 (1% 트리톤 X-100, d-데스티오비오틴, 0.1% 소 혈청 알부민을 포함하는 트리스 완충제)에 100 ㎍/mL로 희석하고, 100 μL 대 CSF 샘플 또는 표준 (트리스 완충제 및 3% 소 혈청 알부민에 희석) 100 μL로 첨가한 후, 25℃에서 2시간 동안 인큐베이팅하였다. 자성 베드를 통하여 MP를 유지하면서, 타이드로플렉스(THydroflex) 플레이트 세척액 (테칸(Tecan) 사, 스위스 만네도르프 소재)을 사용하는 검정 희석제를 사용하여, 비결합 물질을 단일 세척 단계로 제거하였다. 알렉사-형광-표지 검출 항체 82E1 (하기 실시예와 같이 제조)을 500 pg/mL의 최종 농도로 희석하고, 0.2 ㎛ 필터 (폴(Pall) 4187 사, 뉴욕 포트 워싱턴 소재)를 통하여 여과하였다. 항체를 20 μL/웰의 개별 샘플 입자에 첨가하였다. ELISA 플레이트를 지터버그(Jitterbug) (뵈켈(Boekel) 사, 펜실베이니아 피스터빌 소재)에서 진탕하면서 25℃로 1시간 동안 인큐베이팅하였다. 검정 완충제를 사용하여 4회 웰을 세척함으로써, 소정의 비결합 검출 반응물을 제거하였다. MP/19.3/Aβ 올리고머/82E1 복합체를 새로운 플레이트로 옮겨, 완충제를 흡인 제거하고, 10 μL/웰의 용리 완충제를 첨가한 후, 이어서 속도 5로 지터버그에서 진탕하면서 25℃로 5분 인큐베이팅하였다. 용리된 플루오르-표지 검출 항체 82E1을 10 μL/웰의 중화 완충제를 함유하는 384 플레이트로 옮기고, 상자성 마이크로-입자 검출기 (에레나®, 싱귤렉스®, 알메다 사, 캘리포니아 소재)에서 웰 당 60초의 판독 시간으로 판독하였다.
A. 포획 항체 표지
1. 디나비드(Dynabead) (MP 비드)에의 Aβ 올리고머 항체 (19.3)의 결합: 자석을 사용하여 50 μl의 디나비드로부터 상청액을 제거한다. 5 ㎍의 19.3을 함유하는 리파(RIPA) 완충제 [#9806, 셀 시그널링 테크놀로지스(Cell Signaling Technologies) 사, 매사추세츠 비버리 소재)]와 같은 항체 결합 및 세척 완충제 200 μl에 디나비드를 재현탁한다. 실온에서 회전시키면서 10분 동안 인큐베이팅한다. 자석을 사용하여 19.3/MP 비드 복합체로부터 상청액을 제거한다. 200 μl의 결합 및 세척 완충제를 사용하여 복합체를 세척한다.
2. 디나비드 (MP 비드)에의 Aβ 올리고머 항체 (19.3)의 커플링: 사용 직전에, 접합 완충제 (20 mM의 나트륨 포스페이트, 0.15 M의 NaCl (pH 7-9)) 중에서 5 mM의 BS3 용액 (비스(술포숙신이미딜)수베레이트, Cat. #21580 써모 피셔 사이언티픽 인코포레이티드(Thermo Fisher Scientific Inc.) 사, 매사추세츠 왈탐 소재)을 제조한다; 샘플 (5 ㎍ 19.3/50 μl MP의 비드 복합체) 당 이 용액 250 μl가 필요함. 19.3 커플링된 MP 비드 (19.3/MP 비드)를 200 μL의 접합 완충제 중에서 2회 세척한다. 자석상에 위치시키고, 상청액을 버린다. 250 μl의 5 mM BS3에 19.3/MP 비드를 재현탁한다. 기울임/회전을 수반하여 30분 동안 실온에서 인큐베이팅한다. 12.5 μl의 급랭 완충제 (1 M 트리스 HCl (pH 7.5))를 첨가함으로써 가교-결합 반응을 급랭하고, 기울임/회전을 수반하여 15분 동안 실온에서 인큐베이팅한다. 200 μl의 PBST를 사용하여 가교-결합된 MP 비드를 3회 세척한다. 상기 검정 프로토콜에서와 같이 사용하기 위하여, MP 비드를 검정 완충제 중에 100 ㎍/mL로 희석한다.
B. 검출 항체 표지
82E1에의 알렉사 플루오르 546의 커플링: 82E1을 제조자의 프로토콜에 따라 알렉사 플루오르 546 (인비트로겐 사, 캘리포니아 칼스배드 소재)와 유사한 형광 태그에 커플링시켰다. 간단하게 말하자면, 82E1을 1 mg/mL로 희석하고, 10분의 1 부피의 1 M 나트륨 비카르보네이트 완충제를 첨가하였다. 이 82E1 용액 (100 μL)을 알렉사 플루오르 546 염료의 바이알에 첨가하고, 바이알 뚜껑을 닫은 후, 약하게 뒤집어 염료를 용해시키고, 실온에서 1시간 동안 교반하였다. 칼럼을 회전시켜 검출 항체로부터 소정의 표지되지 않은 형광 태그를 분리하면서, 성분 C (바이오겔(BioGel)® P-30, 바이오래드 사, 캘리포니아 허큘리스 소재) 미세 크기 배제 정제 수지를 칼럼에 적재하였다. 겔 완충제 배수 제거 후, 100 μL의 19.3/MP 비드 및 염료 반응 부피를 회전하는 칼럼 상부에서 수지의 중앙으로 첨가함으로써, 겔 베드로 흡수시켰다. 칼럼에 실온에서 100 μL의 용리 완충제 (0.2 mM의 나트륨 아지드를 포함하는 0.01 M의 칼륨 포스페이트, 0.15 M의 NaCl, pH 7.2)를 천천히 첨가하였다. 추가 용리 완충제를 첨가하고, 칼럼이 전개될 때, 칼럼에 조명을 비추어 염색/태그화된 항체의 전면을 가시화하였다. 제1 칼럼 염료 선은 표지된 항체이다. 유리 염료는 칼럼 베드에 남게 되며, 회전 칼럼은 폐기한다.
바이오레클라메이션 사 (뉴욕 힉스빌 소재)로부터 인간 CSF 샘플을 입수하여, 해동 후 얼음상에 유지하였다. 상기 CSF 샘플을 샘플링 전에 0.05% 트윈-20으로 처리하였다 (2.5% 트윈-20 모액을 CSF에 1:50으로 희석하였음). 샘플 또는 Aβ 올리고머 표준을 3% 소 혈청 알부민 (BSA)를 포함하는 트리스 완충 식염수 (TBS)에 희석하였다. 19.3과 커플링된 MP를 TBS/0.1% BSA/1.0% 트리톤 X-100을 함유하는 검정 완충제에 100 ㎍/mL의 최종 농도로 희석하였다. 96-웰 플레이트의 각 웰에, 100 μL의 샘플/표준 및 100 μL의 19.3-코팅 MP를 첨가하였다. 샘플을 MP와 함께 실온 (RT)에서 60분 동안 인큐베이팅하고, TBS/0.1% BSA/1.0% 트리톤 X-100 MP 재-현탁 완충제의 첨가 후, 자성 분리를 사용하여 1회 세척하였다. 형광-표지된 검출 항체 82E1을 웰 당 20 μL로 첨가하고, 실온에서 30분 동안 인큐베이팅한 후, 이어서 자성 분리를 사용하여 MP 재-현탁 완충제로 4회 세척하였다. 검출 항체 82E1으로부터 형광태그를 용리 제거하고, 실온에서 5분 동안 인큐베이팅하였다. 용출액을 중화 완충제를 함유하는 미세플레이트로 옮긴 후, 웰 당 60초의 판독 시간으로 에레나® 기기 (싱귤렉스®, 알메다 사, 캘리포니아 소재)와 같은 자성 마이크로-입자 (MP)를 판독할 수 있는 검출 장치로 전달하였다.
실시예 9
Aβ 올리고머 복합체 샌드위치 ELISA 표적 관여 (TE) 검정법
Aβ 올리고머 복합체 샌드위치 ELISA는 시험관내 또는 생체내에서 형성된 항체/Aβ 올리고머 복합체를 검출하는 표적 관여 검정법으로 사용하기 위하여, 표적 관여를 나타내는 치료용 항체와 함께 사용하기 위하여, 또는 19.3/Aβ 올리고머 복합체를 감소시키는 치료용 항체의 효능을 입증하기 위하여 수행될 수 있다. 항-인간 IgG2 또는 항-인간 카파 (모두 서던 바이오테크 사의 것, 앨라배마 버밍햄 소재) 중 어느 하나를 나트륨 비카르보네이트 완충제 (BupH 카르보네이트-비카르보네이트 완충제 팩, #28382, 써모 피셔 사이언티픽 인코포레이티드 사, 매사추세츠 왈탐 소재) 중에서 4℃로 밤새 웰 당 0.5 ㎍으로 코팅하였다. 다음날, 0.05%의 트윈 20을 포함하는 포스페이트-완충 식염수 (PBS-T; 시그마-알드리치 사, 미주리 세인트 루이스 소재)로 웰을 세척하고, 0.1%의 트윈이 첨가된 PBS 중 200 μL/웰의 카세인 완충제를 사용하여 4℃에서 밤새 차단시켰다. 19.3 항체를 미세원심분리 튜브 (악시젠 인코포레이티드(Axygen Inc.) 사, 캘리포니아 유니온 시티 소재, MCT-175-L-C)에서 0.100 ㎍/mL로 카세인 완충제 (써모 피셔 사이언티픽 인코포레이티드 사, 매사추세츠 왈탐 소재) 또는 인간 CSF에 첨가하였다. 19.3 수준을 일정하게 유지하면서 Aβ 올리고머를 가변 농도로 첨가함으로써, 표준 곡선을 생성하였다. 샘플을 4℃에서 1시간 동안 교반함으로써 항체 (19.3)/Aβ 올리고머 복합체의 형성을 가능케 하였다. 항-인간 IgG2 또는 항-인간 카파-코팅된 플레이트 중 어느 하나에 100 μl의 샘플/웰을 적용하고 (n=3), 플레이트 진탕기상에서 4℃로 밤새 인큐베이팅하였다. 다음날, 플레이트를 PBS-T로 5회 세척하고, 비오틴-82E1 (IBL 사, 미네소타 미네아폴리스 소재, No.10326)을 100 μl/웰로 첨가하여, 실온에서 1시간 동안 카세인 차단 완충제 (시그마-알드리치 코포레이션 사, 미주리 세인트 루이스 소재), 0.1% 트윈 20에 1:5000으로 희석하였다. 플레이트를 다시 PBS-T로 세척하고, 뉴트라비딘-AP (써모피셔 사, 매사추세츠 왈탐 소재, #31002)를 카세인 완충제 중에 1:20,000으로 희석한 다음, 실온에서 30분 동안 첨가하였다. 추가적인 PBS-T 세척이 이어졌으며, 트로픽스 CDP 스타 발광 기질 (어플라이드 바이오시스템즈 사, 캘리포니아 포스터 시티 소재, T2214)을 30분 동안 적용하였다. 엔비젼 플레이트 판독기 (퍼킨엘머 사, 매사추세츠 왈탐 소재)에서 발광을 정량하였다.
SEQUENCE LISTING
<110> Savage, Mary J.
Shughrue, Paul J.
McCampbell, Alexander
Wolfe, Abigail L.
<120> METHOD FOR DETECTION OF AMYLOIDS BETA
OLIGOMERS IN A FLUID SAMPLE AND USES THEREOF
<130> 23090-US-PSP
<160> 9
<170> FastSEQ for Windows Version 4.0
<210> 1
<211> 115
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 1
Ala Ser Arg Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val
1 5 10 15
Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile
20 25 30
Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro
35 40 45
Gly Gln Ser Pro Gln Leu Leu Ile Tyr Lys Ala Ser Asn Arg Phe Ser
50 55 60
Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
65 70 75 80
Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys
85 90 95
Phe Gln Gly Ser Arg Leu Gly Pro Ser Phe Gly Gln Gly Thr Lys Leu
100 105 110
Glu Ile Lys
115
<210> 2
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 2
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Arg Gly Ser Ser Thr Ile Tyr Tyr Ala Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ile Thr Thr Ala Leu Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 3
<211> 326
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 3
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn Phe Gly Thr Gln Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Thr Val Glu Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro Ala Pro
100 105 110
Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
115 120 125
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
130 135 140
Val Ser His Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly
145 150 155 160
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn
165 170 175
Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Val His Gln Asp Trp
180 185 190
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro
195 200 205
Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu
210 215 220
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
225 230 235 240
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
245 250 255
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
260 265 270
Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
275 280 285
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
290 295 300
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
305 310 315 320
Ser Leu Ser Pro Gly Lys
325
<210> 4
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 4
tatggcttct agagatgtgg tgatg 25
<210> 5
<211> 82
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic
<221> misc_feature
<222> (0)...(0)
<223> M = A or C
<221> misc_feature
<222> (0)...(0)
<223> N = A, C, G or T
<400> 5
tgcagccacc gtacgcttga tctccagctt ggtgccctgg ccaaaggtgg ggggcacmnn 60
mnnmnnmnnm nngcagtagt ag 82
<210> 6
<211> 70
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic
<221> misc_feature
<222> (0)...(0)
<223> M = A or C
<221> misc_feature
<222> (0)...(0)
<223> N = A, C, G or T
<400> 6
tgcagccacc gtacgcttga tctccagctt ggtgccctgg ccaaamnnmn nmnnmnnmnn 60
gctgccctgg 70
<210> 7
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 7
aggcggccct cgaggaggtg cagc 24
<210> 8
<211> 83
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic
<221> misc_feature
<222> (0)...(0)
<223> M = A or C
<221> misc_feature
<222> (0)...(0)
<223> N = A, C, G or T
<400> 8
agaccgatgg gcccttggtg gaggcgctgg acacggtcac cagggtgccc tggccccamn 60
nmnnmnnmnn mnnggtgatg ccc 83
<210> 9
<211> 92
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic
<221> misc_feature
<222> (0)...(0)
<223> M = A or C
<221> misc_feature
<222> (0)...(0)
<223> N = A, C, G or T
<400> 9
agaccgatgg gcccttggtg gaggcgctgg acacggtcac cagggtgccc tggccccagt 60
agtccagmnn mnnmnnmnnm nnccgggcac ag 92
Claims (13)
- (a) 포유동물로부터 뉴런 유래 관심 단백질 (NDPOI)을 갖는 생물학적 샘플을 수득하는 단계;
(b) 상기 생물학적 샘플을 포획 항체/상자성 마이크로-입자 비드 (항체/MP 비드)와, NDPOI/포획 항체/MP 비드 복합체를 형성하기에 충분한 조건하에서 접촉시키는 단계;
(c) 단계 (b)의 NDPOI/포획 항체/MP 비드 복합체를 형광 표지된 검출 항체와, POI/포획 항체/MP 비드/검출 항체 복합체를 형성하기에 충분한 조건하에서 접촉시키는 단계; 및
(d) 단계 (c)의 상기 복합체로부터 생성된 형광 신호를 검출하는 단계
를 포함하며, 단계 (d)의 형광 신호는 NDPOI의 양을 나타내는 것인, 환자로부터 수득된 생물학적 샘플에서 NDPOI의 수준을 측정하는 방법. - 제1항에 있어서, NDPOI가 Aβ 올리고머인 방법.
- 제1항에 있어서, 포유동물이 인간인 방법.
- 제1항에 있어서, 포획 항체가 19.3, 7305, 82E1 및 W02로 이루어진 군에서 선택된 항-Aβ 올리고머 항체인 방법.
- 제1항에 있어서, 검출 항체가 82E1, 7305 및 6E10으로 이루어진 군에서 선택된 항-Aβ 올리고머 항체인 방법.
- 제1항에 있어서, 포획 항체가 19.3이고, 검출 항체가 82E1인 방법.
- 뉴런 유래 관심 단백질 (NDPOI)이 Aβ 올리고머이고, 0.5 pg/mL 내지 11 pg/mL 범위의 Aβ 올리고머 수준을 갖는 환자가 알츠하이머병을 갖는 것으로 결정되는, 환자로부터 수득된 생물학적 샘플에서 NDPOI의 수준을 측정하는 것에 의해 알츠하이머병을 갖는 환자를 확인하는 방법.
- (a) 환자로부터 뉴런 유래 관심 단백질 (NDPOI)을 갖는 생물학적 샘플을 수득하는 단계;
(b) 상기 생물학적 샘플을 포획 항체/상자성 마이크로-입자 비드 (항체/MP 비드)와, NDPOI/포획 항체/MP 비드 복합체를 형성하기에 충분한 조건하에서 접촉시키는 단계;
(c) 단계 (b)의 NDPOI/포획 항체/MP 비드 복합체를 형광 표지된 검출 항체와, NDPOI/포획 항체/MP 비드/검출 항체 복합체를 형성하는 조건하에서 접촉시키는 단계;
(d) 단계 (c)의 상기 복합체로부터 생성된 형광 신호를 검출하며, 여기서 형광 신호는 NDPOI의 양을 나타내는 것인 단계;
(e) 시험 치료제를 그를 필요로 하는 상기 환자에게 투여하는 단계;
(f) 상기 환자로부터 NDPOI를 갖는 제2 생물학적 샘플을 수득하는 단계;
(g) 상기 환자로부터의 제2 생물학적 샘플을 사용하여 단계 (b) 내지 (d)를 반복하는 단계; 및
(h) 제2 생물학적 샘플로부터 검출된 형광 신호를 제1 생물학적 샘플로부터의 상기 신호와 비교하는 단계
를 포함하며, 검출된 형광 신호의 감소는 효과적인 치료제를 나타내는 것인, 알츠하이머병을 치료하기 위한 치료제의 치료 효능을 측정하는 방법. - 제8항에 있어서, NDPOI가 Aβ 올리고머인 방법.
- 제8항에 있어서, 포획 항체가 19.3이고, 검출 항체가 82E1인 방법.
- (a) 치료용 항체를 포유동물에게 투여하는 단계;
(b) 상기 포유동물로부터 뉴런 유래 관심 단백질 (NDPOI)을 갖는 생물학적 샘플을 수득하는 단계;
(c) 상기 생물학적 샘플을 포획 항체/상자성 마이크로-입자 비드 (항체/MP 비드)와, NDPOI/포획 항체/MP 비드 복합체를 형성하기에 충분한 조건하에서 접촉시키는 단계;
(d) 단계 (b)의 NDPOI/포획 항체/MP 비드 복합체를 형광 표지된 검출 항체와, NDPOI/포획 항체/MP 비드/검출 항체 복합체를 형성하는 조건하에서 접촉시키는 단계; 및
(e) 단계 (c)의 상기 복합체로부터 생성된 형광 신호를 검출하며, 여기서 형광 신호는 NDPOI/치료용 항체의 표적 관여(target engagement)를 나타내는 것인 단계
를 포함하는, NDPOI에 결합된 치료용 항체의 표적 관여를 측정하는 방법. - 제11항에 있어서, NDPOI가 Aβ 올리고머인 방법.
- 제11항에 있어서, 포획 항체가 19.3이고, 검출 항체가 82E1인 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161507332P | 2011-07-13 | 2011-07-13 | |
| US61/507,332 | 2011-07-13 | ||
| PCT/US2012/045886 WO2013009667A1 (en) | 2011-07-13 | 2012-07-09 | Method for detection of amyloid beta oligomers in a fluid sample and uses thereof |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20140072019A true KR20140072019A (ko) | 2014-06-12 |
Family
ID=47506433
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020147003386A KR20140072019A (ko) | 2011-07-13 | 2012-07-09 | 체액 샘플에서의 아밀로이드 베타 올리고머의 검출 방법 및 그의 용도 |
Country Status (13)
| Country | Link |
|---|---|
| US (2) | US20130052670A1 (ko) |
| EP (2) | EP2732286A4 (ko) |
| JP (1) | JP2014521089A (ko) |
| KR (1) | KR20140072019A (ko) |
| CN (1) | CN103782171B (ko) |
| AU (1) | AU2012282825B2 (ko) |
| BR (1) | BR112014000671A2 (ko) |
| CA (1) | CA2840976A1 (ko) |
| DK (1) | DK2732289T3 (ko) |
| ES (1) | ES2666840T3 (ko) |
| MX (1) | MX2014000480A (ko) |
| RU (1) | RU2014105172A (ko) |
| WO (2) | WO2013009667A1 (ko) |
Families Citing this family (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN115227710A (zh) | 2009-06-17 | 2022-10-25 | 冷泉港实验室 | 用于在对象中调节smn2剪接的组合物和方法 |
| US9320793B2 (en) * | 2010-07-14 | 2016-04-26 | Acumen Pharmaceuticals, Inc. | Method for treating a disease associated with soluble, oligomeric species of amyloid beta 1-42 |
| EP2943225A4 (en) | 2013-01-09 | 2016-07-13 | Ionis Pharmaceuticals Inc | COMPOSITIONS AND METHODS FOR MODULATING SMN2 DISTRIBUTION IN THE BODY OF A PATIENT |
| EP3071240B1 (en) * | 2013-11-20 | 2021-01-06 | University of Iowa Research Foundation | Method for monitoring efficacy of treatment of alzheimer's disease with an apoe isoform |
| WO2015161170A2 (en) | 2014-04-17 | 2015-10-22 | Isis Pharmaceuticals, Inc. | Compositions and methods for modulation of smn2 splicing in a subject |
| WO2015175769A1 (en) | 2014-05-15 | 2015-11-19 | Biogen Ma Inc. | Methods for the detection of amyloid beta oligomers in biological samples |
| US10436802B2 (en) | 2014-09-12 | 2019-10-08 | Biogen Ma Inc. | Methods for treating spinal muscular atrophy |
| MA41480A (fr) * | 2014-10-17 | 2017-12-19 | Glenmark Pharmaceuticals Sa | Anticorps qui se lient au ccr6 et leurs utilisations |
| WO2017033152A1 (en) * | 2015-08-25 | 2017-03-02 | Prothena Biosciences Limited | Methods for detecting phosphorylated alpha-synuclein |
| EP3415912B1 (en) | 2016-02-08 | 2023-03-29 | Sysmex Corporation | Analyte detection method and reagent kit for detecting analyte |
| EP3471779A4 (en) | 2016-06-16 | 2020-07-08 | Ionis Pharmaceuticals, Inc. | COMBINATIONS FOR MODULATING THE SMN EXPRESSION |
| CN114026109A (zh) * | 2019-07-05 | 2022-02-08 | 株式会社岛津制作所 | β淀粉样蛋白的单克隆抗体、和使用该抗体的β淀粉样蛋白相关肽的测定方法 |
| CR20220485A (es) | 2020-02-28 | 2022-11-10 | Ionis Pharmaceuticals Inc | Compuestos y métodos para modular smn2 |
| WO2024026413A2 (en) * | 2022-07-27 | 2024-02-01 | Durin Technologies, Inc. | Early detection and monitoring of neurodegenerative diseases using a multi-disease diagnostic platform |
| CN117589996A (zh) * | 2022-08-09 | 2024-02-23 | 深圳智源生物医药有限公司 | 强毒性淀粉样蛋白寡聚体的诊断用途 |
Family Cites Families (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4665024A (en) | 1984-10-01 | 1987-05-12 | Becton, Dickinson And Company | Fluorescent gram stain |
| US6218506B1 (en) | 1997-02-05 | 2001-04-17 | Northwestern University | Amyloid β protein (globular assembly and uses thereof) |
| US6082205A (en) | 1998-02-06 | 2000-07-04 | Ohio State University | System and device for determining particle characteristics |
| DE60043165D1 (de) | 1999-08-04 | 2009-11-26 | Univ Southern California | Globularer Aufbau vom Amyloid-beta- protein und deren Verwendungen |
| CN1871517A (zh) * | 2002-02-19 | 2006-11-29 | 免疫公司 | 快速有效分离循环癌细胞的方法和试剂 |
| US7807157B2 (en) | 2004-02-20 | 2010-10-05 | Intellect Neurosciences Inc. | Monoclonal antibodies and use thereof |
| AU2005231364A1 (en) * | 2004-04-02 | 2005-10-20 | Merck & Co., Inc. | Methods for detecting substances which bind to the amyloid precursor protein or beta amyloid fragments, and binding compounds |
| US7572640B2 (en) | 2004-09-28 | 2009-08-11 | Singulex, Inc. | Method for highly sensitive detection of single protein molecules labeled with fluorescent moieties |
| EP1812062B1 (en) | 2004-10-25 | 2022-03-09 | Merck Sharp & Dohme Corp. | Anti-addl antibodies and uses thereof |
| US7731962B2 (en) | 2005-02-14 | 2010-06-08 | Merck & Co., Inc. | Anti-ADDL monoclonal antibody and use thereof |
| EP1940466B1 (en) * | 2005-10-21 | 2012-11-28 | Merck Sharp & Dohme Corp. | Anti-addl monoclonal antibodies and use thereof |
| US20090181359A1 (en) * | 2007-10-25 | 2009-07-16 | Lou Sheng C | Method of performing ultra-sensitive immunoassays |
| US20110166035A1 (en) * | 2009-11-24 | 2011-07-07 | Probiodrug Ag | Novel diagnostic method |
| EP2576617B1 (en) * | 2010-06-04 | 2016-04-27 | Georg-August-Universität Göttingen Stiftung Öffentlichen Rechts Universitätsmedizin | MONOCLONAL ANTIBODIES TARGETING Aß OLIGOMERS |
| MX338640B (es) * | 2010-07-14 | 2016-04-25 | Merck Sharp & Dohme | Anticuerpo monoclonal anti-ligando difundible derivado de amiloide beta y usos de los mismos. |
| US9320793B2 (en) * | 2010-07-14 | 2016-04-26 | Acumen Pharmaceuticals, Inc. | Method for treating a disease associated with soluble, oligomeric species of amyloid beta 1-42 |
-
2012
- 2012-07-09 MX MX2014000480A patent/MX2014000480A/es not_active Application Discontinuation
- 2012-07-09 KR KR1020147003386A patent/KR20140072019A/ko not_active Application Discontinuation
- 2012-07-09 US US13/544,554 patent/US20130052670A1/en not_active Abandoned
- 2012-07-09 EP EP12811245.5A patent/EP2732286A4/en not_active Withdrawn
- 2012-07-09 CN CN201280044598.3A patent/CN103782171B/zh active Active
- 2012-07-09 WO PCT/US2012/045886 patent/WO2013009667A1/en active Application Filing
- 2012-07-09 BR BR112014000671A patent/BR112014000671A2/pt not_active IP Right Cessation
- 2012-07-09 CA CA2840976A patent/CA2840976A1/en not_active Abandoned
- 2012-07-09 JP JP2014520229A patent/JP2014521089A/ja active Pending
- 2012-07-09 DK DK12737445.2T patent/DK2732289T3/en active
- 2012-07-09 WO PCT/US2012/045956 patent/WO2013009703A2/en active Application Filing
- 2012-07-09 EP EP12737445.2A patent/EP2732289B1/en active Active
- 2012-07-09 ES ES12737445.2T patent/ES2666840T3/es active Active
- 2012-07-09 RU RU2014105172/15A patent/RU2014105172A/ru not_active Application Discontinuation
- 2012-07-09 AU AU2012282825A patent/AU2012282825B2/en active Active
-
2013
- 2013-12-20 US US14/137,351 patent/US20140120037A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| EP2732289A2 (en) | 2014-05-21 |
| WO2013009667A1 (en) | 2013-01-17 |
| AU2012282825A1 (en) | 2014-01-16 |
| WO2013009703A3 (en) | 2013-03-21 |
| WO2013009703A8 (en) | 2014-01-23 |
| CA2840976A1 (en) | 2013-01-17 |
| CN103782171A (zh) | 2014-05-07 |
| AU2012282825B2 (en) | 2016-05-26 |
| EP2732286A4 (en) | 2015-02-25 |
| US20130052670A1 (en) | 2013-02-28 |
| JP2014521089A (ja) | 2014-08-25 |
| RU2014105172A (ru) | 2015-08-20 |
| EP2732289B1 (en) | 2018-04-11 |
| CN103782171B (zh) | 2016-12-14 |
| DK2732289T3 (en) | 2018-05-22 |
| ES2666840T3 (es) | 2018-05-08 |
| BR112014000671A2 (pt) | 2017-02-14 |
| MX2014000480A (es) | 2014-06-23 |
| WO2013009703A2 (en) | 2013-01-17 |
| EP2732286A1 (en) | 2014-05-21 |
| US20140120037A1 (en) | 2014-05-01 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20140072019A (ko) | 체액 샘플에서의 아밀로이드 베타 올리고머의 검출 방법 및 그의 용도 | |
| KR101706789B1 (ko) | 진단용 항체 검사법 | |
| AU2005306997B2 (en) | Anti-ADDL antibodies and uses thereof | |
| KR101461538B1 (ko) | 생물학적 관심대상의 펩티드 및 단백질의 측정을 위한 고감도 면역검정법 및 키트 | |
| JP2015511014A (ja) | アルツハイマー病の診断、予後および監視におけるオリゴマー型Aβ | |
| US9310383B2 (en) | Antibodies, kit and method for detecting amyloid beta oligomers | |
| WO2011045945A1 (ja) | アミロイドβのターン構造を認識する抗体 | |
| WO2023034324A2 (en) | Methods and materials to treat neurodegenerative disease | |
| JP2024507755A (ja) | 血漿および脳脊髄液中のニューロフィラメント軽鎖を検出するための方法 | |
| EP2981824B1 (en) | Method for detecting asyn-specific antibodies in a biological sample | |
| US20240034778A1 (en) | Amyloid-specific antibodies and uses thereof | |
| JP2022527087A (ja) | タウオパチーを診断するためのpS396アッセイの使用 | |
| AU2011204912B2 (en) | Anti-ADDL antibodies and uses thereof | |
| MX2007004909A (en) | Anti-addl antibodies and uses thereof |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |