KR20130115393A - 경구 투여용 고형 제제 - Google Patents
경구 투여용 고형 제제 Download PDFInfo
- Publication number
- KR20130115393A KR20130115393A KR1020137025458A KR20137025458A KR20130115393A KR 20130115393 A KR20130115393 A KR 20130115393A KR 1020137025458 A KR1020137025458 A KR 1020137025458A KR 20137025458 A KR20137025458 A KR 20137025458A KR 20130115393 A KR20130115393 A KR 20130115393A
- Authority
- KR
- South Korea
- Prior art keywords
- tablets
- tablet
- weight
- starch
- solid preparation
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/32—Macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. carbomers, poly(meth)acrylates, or polyvinyl pyrrolidone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2013—Organic compounds, e.g. phospholipids, fats
- A61K9/2018—Sugars, or sugar alcohols, e.g. lactose, mannitol; Derivatives thereof, e.g. polysorbates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2072—Pills, tablets, discs, rods characterised by shape, structure or size; Tablets with holes, special break lines or identification marks; Partially coated tablets; Disintegrating flat shaped forms
- A61K9/2086—Layered tablets, e.g. bilayer tablets; Tablets of the type inert core-active coat
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
Abstract
시클로덱스트린을 첨가할 필요없이 카리프라진 히드로클로라이드를 안정적으로 보존할 수 있는, 주 부형제로서 락토오스를 사용하고, 카리프라진 히드로클로라이드를 포함하는 경구 투여용 고형 제제에 관한 것이다.
Description
본 발명은 정신분열증과 같은 질환의 치료약으로서 유용한 카리프라진 히드로클로라이드의 경구 투여용 고형 제제에 관한 것이다.
하기 특허 문헌 1 에는, 하기 식의 카리프라진 히드로클로라이드가 D3/D2 수용체 길항제이며, 정신분열증과 같은 질환의 치료약으로서 유용하다고 기재되어 있다.
상기 공보의 제 27 페이지에는, 유효 성분으로서 카리프라진 히드로클로라이드를 포함한 식 (I) 의 화합물뿐만 아니라 시클로덱스트린도 함유하는 정제의 하기 처방예가 개시되어 있다.
"식 (I) 의 화합물 1-40 ㎎
희석제/충전제 (시클로덱스트린일 수도 있다) 50-250 ㎎
결합제 5-25 ㎎
붕괴제 (시클로덱스트린일 수도 있다) 5-50 ㎎
윤활제 1-5 ㎎
시클로덱스트린 1-100 ㎎
희석제: 미정질 셀룰로오스, 락토오스, 전분 등.
결합제: 폴리비닐피롤리돈, 히드록시프로필 메틸셀룰로오스 등.
붕괴제: 나트륨 전분 글리콜레이트, 크로스포피돈 등.
윤활제: 마그네슘 스테아레이트, 나트륨 스테아릴 푸마레이트 등."
일반적으로 제제에 시클로덱스트린을 첨가함으로써, 화학적으로 불안정한 화합물을 안정화시킬 수 있는 것이 알려져 있다. 또한, 시클로덱스트린은 의약 화합물의 수 용해도 개선, 생체이용율 개선 및 쓴맛 저감 (마스킹) 과 같은 효과를 가져, 의약품에 응용되고 있다.
[특허 문헌 1] WO2005/012266
시클로덱스트린은 안정화 효과를 갖는 것으로 기대되지만, 시클로덱스트린을 의약품 첨가제로서 사용했을 경우, 약물의 포접에 의한 체내 동태 및 약효에 대한 영향, 그리고 다른 병용 약제에 대한 영향이 불명확하다. 이러한 점에서, 시클로덱스트린을 함유하지 않으며 카리프라진 히드로클로라이드를 안정적으로 보존할 수 있는 경구 투여용 고형 제제가 요망되고 있다. 본 발명의 목적은 상기 경구 투여용 고형 제제를 제공하는 것이다.
본 발명자들은 카리프라진 히드로클로라이드를 함유하는 여러가지 고형 제제에 대해 예의 검토하였다. 그 결과, 본 발명자들은 다음과 같은 사실을 발견하고 본 발명을 완성하였다. 만니톨 또는 무수 인산수소칼슘을 부형제의 일부로서 제제에 함유시킨 경우, 및 결정질 셀룰로오스 만을 부형제로서 사용한 경우에는, 다량의 관련 물질이 생성되었다. 그러나, 락토오스를 주 부형제로서 사용한 경우에는, 시클로덱스트린을 첨가하지 않고도 카리프라진 히드로클로라이드가 안정적으로 보존되었다.
즉, 본 발명은 다음과 같다.
(1) 주 부형제로서 락토오스를 사용하고 카리프라진 히드로클로라이드를 포함하는 경구 투여용 고형 제제.
(2) 상기 (1) 에 있어서, 락토오스 이외의 부형제가 결정질 셀룰로오스 및/또는 전분인 고형 제제.
(3) 상기 (2) 에 있어서, 부형제의 총량에 대해서, 50-100 중량% 가 락토오스이고, 0-50 중량% 가 결정질 셀룰로오스이며, 0-35 중량% 가 전분인 고형 제제.
(4) 상기 (2) 에 있어서, 부형제의 총량에 대해서, 60-100 중량% 가 락토오스이고, 0-29 중량% 가 결정질 셀룰로오스이며, 0-11 중량% 가 전분인 고형 제제.
(5) 상기 (2) 에 있어서, 부형제의 총량에 대해서, 70-100 중량% 가 락토오스이고, 0-25 중량% 가 결정질 셀룰로오스이며, 0-5 중량% 가 전분인 고형 제제.
(6) 상기 (2) 에 있어서, 부형제의 총량에 대해서, 80-95 중량% 가 락토오스이고, 5-20 중량% 가 결정질 셀룰로오스이며, 전분을 함유하지 않는 고형 제제.
(7) 상기 (1) 내지 (6) 중 어느 하나에 있어서, 히드록시프로필 셀룰로오스, 히드록시프로필 메틸셀룰로오스, 에틸셀룰로오스, 메틸셀룰로오스, 포비돈 및 폴리비닐 알코올에서 선택되는 하나 이상의 결합제를 사용하는 고형 제제.
(8) 상기 (1) 내지 (7) 중 어느 하나에 있어서, 나트륨 전분 글리콜레이트, 크로스카르멜로오스 나트륨, 저 치환도 히드록시프로필 셀룰로오스, 분말 한천 및 크로스포피돈에서 선택되는 하나 이상의 붕괴제를 사용하는 고형 제제.
(9) 상기 (1) 내지 (8) 중 어느 하나에 있어서, 카리프라진 히드로클로라이드, 부형제, 결합제, 및 필요에 따라 붕괴제를 혼합하고; 혼합물을 과립화시키고; 과립에 붕괴제 및 윤활제를 혼합한 후; 과립을 압축성형함으로써 제조되는 고형 제제.
본 발명의 경구 투여용 고형 제제는 시클로덱스트린을 첨가하지 않고도 카리프라진 히드로클로라이드를 안정적으로 보존할 수 있다.
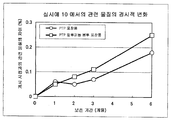
[도 1] 실시예 4 에서 제조한 정제에 있어서의 관련 물질의 경시적 변화를 나타낸다.
[도 2] 실시예 8 에서 제조한 정제에 있어서의 관련 물질의 경시적 변화를 나타낸다.
[도 3] 실시예 9 에서 제조한 정제에 있어서의 관련 물질의 경시적 변화를 나타낸다.
[도 4] 실시예 10 에서 제조한 정제에 있어서의 관련 물질의 경시적 변화를 나타낸다.
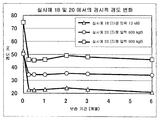
[도 5] 실시예 18 및 20 에서 제조한 정제의 경시적 경도 변화를 나타낸다.
[도 2] 실시예 8 에서 제조한 정제에 있어서의 관련 물질의 경시적 변화를 나타낸다.
[도 3] 실시예 9 에서 제조한 정제에 있어서의 관련 물질의 경시적 변화를 나타낸다.
[도 4] 실시예 10 에서 제조한 정제에 있어서의 관련 물질의 경시적 변화를 나타낸다.
[도 5] 실시예 18 및 20 에서 제조한 정제의 경시적 경도 변화를 나타낸다.
본 명세서에 있어서, 각 정제에서의 카리프라진 히드로클로라이드의 양은 통상적으로 0.01-70 중량%, 바람직하게는 0.1-50 중량%, 더욱 바람직하게는 0.4-10 중량% 이다.
주 부형제는 부형제의 총량의 50 중량% 이상의 양으로 함유되는 부형제이고, 본 발명의 고형 제제에는 락토오스가 주 부형제로서 사용된다. 다른 부형제는 결정질 셀룰로오스 및 전분 (예를 들어, 옥수수 전분, 감자 전분, 밀 전분, 쌀 전분, 부분 젤라틴화 전분 및 다공성 전분) 등을 포함한다. 결정질 셀룰로오스 및 전분은 보수성을 가지므로, 이것을 부형제의 일부로서 첨가함으로써, 습식 과립화시에 고형 제제의 제조 로트간의 편차를 억제할 수 있으며, 타정기의 모르타르에의 충전성이 향상된다. 바람직한 부형제는 (a) 부형제의 총량에 대해서, 50-100 중량% 가 락토오스이고, 0-50 중량% 가 결정질 셀룰로오스이며, 0-35 중량% 가 전분인 부형제; (b) 부형제의 총량에 대해서, 60-100 중량% 가 락토오스이고, 0-29 중량% 가 결정질 셀룰로오스이며, 0-11 중량% 가 전분인 부형제; (c) 부형제의 총량에 대해서, 70-100 중량% 가 락토오스이고, 0-25 중량% 가 결정질 셀룰로오스이며, 0-5 중량% 가 전분인 부형제; 및 (d) 부형제의 총량에 대해서, 80-95 중량% 가 락토오스이고, 5-20 중량% 가 결정질 셀룰로오스이며, 전분을 함유하지 않는 부형제를 포함한다. 또한, 전분을 사용하지 않거나 소량의 전분을 사용함으로써, 고형 제제의 경도 저하를 억제할 수 있으며, 습도가 낮거나 높든지 카리프라진 히드로클로라이드를 안정적으로 보존할 수 있다. 이들 효과는 바람직한 효과이다. 각 정제는 5-99.9 중량%, 바람직하게는 80-95 중량% 의 부형제를 함유할 수 있다.
결합제는 히드록시프로필 셀룰로오스, 히드록시프로필 메틸셀룰로오스, 에틸셀룰로오스, 메틸셀룰로오스, 폴리비닐피롤리돈, 포비돈, 폴리비닐 알코올, 아라비아 고무 분말, 젤라틴, 풀루란 등을 포함한다. 히드록시프로필 셀룰로오스와 같은 결합제가 바람직하다. 각 정제는 0.5-10 중량%, 바람직하게는 1-5 중량% 의 결합제를 함유할 수 있다.
붕괴제로서는, 카르멜로오스 칼슘, 크로스카르멜로오스 나트륨, 나트륨 전분 글리콜레이트, 크로스포피돈, 저 치환도 히드록시프로필 셀룰로오스, 분말 한천 등이 사용된다. 나트륨 전분 글리콜레이트, 크로스카르멜로오스 나트륨 및 저 치환도 히드록시프로필 셀룰로오스와 같은 붕괴제가 바람직하다. 각 정제는 0.1-15 중량%, 바람직하게는 1-5 중량% 의 붕괴제를 함유할 수 있다.
또한, 본 발명의 고형 제제는, 발명의 효과에 지장이 없는 한, 향료, 윤활제, 착색제 등, 또는 제제의 제조에 통상적으로 사용되는 여러가지 첨가제를 적당량 함유할 수 있다. 윤활제는 마그네슘 스테아레이트, 칼슘 스테아레이트, 수크로오스 지방산 에스테르, 폴리에틸렌 글리콜, 탈크, 스테아르산, 나트륨 스테아릴 푸마레이트 등을 포함한다. 착색제는 식용 황색 5 호, 식용 적색 2 호, 식용 청색 2 호와 같은 식용 색소, 식용 레이크 색소, 삼이산화철 등을 포함한다. 또한, 본 발명의 고형 제제를 제조할 때에, 입상 핵에 활성 성분, 첨가제 등을 피복한 후, 예를 들어 맛 및 악취의 추가의 마스킹, 및 장용 제제 또는 서방성 제제의 제조를 목적으로, 충분히 공지된 방법에 의해 코팅 혼합물을 사용할 수 있다.
본 발명의 고형 제제는, 예를 들어 정제, 캡슐제, 과립제 및 환약을 포함한다. 정제가 바람직하다. 정제의 형상은 특별히 한정되지 않고, 원형, 타원형, 직사각형과 같은 형상을 갖는 피복되지 않은 정제 및 상기 형상의 피복 정제일 수 있다. 또한, 본 발명의 고형 제제는 2 종류 이상의 과립을 혼합한 후에 정제화한 그룹 정제, 이층 정제 및 삼층 정제와 같은 다층 정제, 유핵정, 뿐만 아니라 프레스코팅 정제일 수 있다.
본 발명의 고형 제제는, 예를 들어 카리프라진 히드로클로라이드, 부형제, 결합제 및/또는 붕괴제를 고속 혼합 과립화기, 유동층 과립화 건조기, 원심 전동 유동층 과립화 코팅기 또는 혼련기와 같은 기기를 이용하여 물 또는 결합제 용액으로 습식 과립화시키고; 이 과립에 윤활제를 혼합 또는 분무한 후; 압축 성형함으로써 제조할 수 있다. 대안적으로는, 본 발명의 고형 제제는 카리프라진 히드로클로라이드, 부형제 및/또는 결합제 (붕괴제를 추가로 포함할 수도 있다) 를 롤러 콤팩터와 같은 기기를 이용하여 건식 과립화시키고; 이 과립에 붕괴제 (윤활제를 추가로 포함할 수도 있다) 를 혼합 또는 분무한 후; 압축 성형함으로써 제조할 수 있다.
실시예
이하에 실시예를 들어 본 발명을 한층 더 상세하게 설명한다. 그러나, 본 발명은 이들 실시예로 한정되지 않는다.
실시예에서는 하기의 기기를 사용하였다.
고속 혼합 과립화기: Powrex Corporation 제 FM-VG-10 또는 FM-VG-25;
전동 유동층 과립화 건조기: Powrex Corporation 제 MP-01;
유동층 과립화 건조기: Freund Corporation 제 FLO-5/2SJ 또는 Powrex Corporation 제 MP-01;
입자 크기 조절기: Powrex Corporation 제 QC-197S (0.991 ㎜ 원형 구멍 스크린);
V-혼합기: Fuji Paudal Co., Ltd. 제 VM-10 또는 Tokuju Corporation 제 TCV-20; 및
타정기: Kikusui Seisakusho Ltd. 제 AQUA0518SS2AII 또는 VIRG0518SS2AZ.
타정 압력의 단위는 기기 표시 단위 (AQUA: kgf 및 VIRG: kN) 로서 표에 기재하였다.
실시예
1
표 1 의 "건조 분말" 란에 기재된 각 성분을 고속 혼합 과립화기에 주입하고, 혼합한 후, 물로 과립화시켰다. 이 과립을 전동 유동층 과립화 건조기에서 건조시켜 건조 분말을 산출하였다. 수득된 건조 분말을 표 1 의 "정제 벌크 분말 혼합" 란에 기재된 각 성분과 V-혼합기로 혼합하여 정제 벌크 분말을 산출하였다. 이 정제 벌크 분말을 압축성형 (정제 직경: 7 ㎜; 곡률 반경: 10 ㎜) 하여, 1 정당 카리프라진 히드로클로라이드 0.5 ㎎ 을 함유하는 정제 (각각 120 ㎎) 를 제조하였다.
실시예
2
표 1 에 기재된 각 성분을 혼합하고, 실시예 1 에 기재한 방법 (고속 혼합 과립화법) 에 따라서, 1 정당 카리프라진 히드로클로라이드 2.5 ㎎ 을 함유하는 정제 (각각 120 ㎎) 를 제조하였다.
실시예
3
표 1 의 "건조 분말" 란에 기재된 각 성분 (결합제는 제외한다) 을 고속 혼합 과립화기에 주입하고, 혼합하였다. 이 혼합물을 유동층 과립화 건조기에 주입하여 유동화시키고, 표 1 에 기재된 양으로 준비한 결합제로 유동층 내에서 과립화시킨 후, 상기 층 내에서 건조시켜 건조 분말을 산출하였다. 건조 분말의 크기를 입자 크기 조절기에서 조절하고, 수득된 조절 분말을 표 1 의 "정제 벌크 분말 혼합" 란에 기재된 각 성분과 V-혼합기로 혼합하여 정제 벌크 분말을 산출하였다. 이 정제 벌크 분말을 압축성형 (정제 직경: 7 ㎜; 곡률 반경: 10 ㎜) 하여, 1 정당 카리프라진 히드로클로라이드 0.5 ㎎ 을 함유하는 정제 (각각 120 ㎎) 를 제조하였다.
실시예
4
표 1 에 기재된 성분을 혼합하고, 실시예 3 에 기재한 방법 (유동층 과립화법) 에 따라서, 1 정당 카리프라진 히드로클로라이드 0.5 ㎎ 을 함유하는 정제 (각각 120 ㎎) 를 제조하였다.
실시예
5
표 2 의 "건조 분말" 란에 기재된 각 성분 (결합제는 제외한다) 을 고속 혼합 과립화기에 주입하고, 혼합하였다. 이 혼합물을 유동층 과립화 건조기에 주입하여 유동화시키고, 표 2 에 기재된 양으로 준비한 결합제로 유동층 내에서 과립화시킨 후, 상기 층 내에서 건조시켜 건조 분말을 산출하였다. 건조 분말의 크기를 입자 크기 조절기에서 조절하고, 수득된 조절 분말을 표 2 의 "정제 벌크 분말 혼합" 란에 기재된 각 성분과 V-혼합기에서 혼합하여 정제 벌크 분말을 산출하였다. 이 정제 벌크 분말을 압축성형 (정제 직경: 7 ㎜; 평면 우각) 하여, 1 정당 카리프라진 히드로클로라이드 0.5 ㎎ 을 함유하는 정제 (각각 120 ㎎) 를 제조하였다.
실시예
6 -
실시예
19
표 2 에 기재된 성분을 혼합하고, 실시예 5 에 기재한 방법 (유동층 과립화법) 에 따라서 정제를 제조하였다. 각 정제의 중량은 120 ㎎ 이었고, 각 성분의 양은 표 2 에 기재하였다.
실시예
20 -
실시예
33
표 3 에 기재된 성분을 혼합하고, 실시예 5 에 기재한 방법 (유동층 과립화법) 에 따라서 정제를 제조하였다. 각 정제의 중량은 120 ㎎ 이었고, 각 성분의 양은 표 3 에 기재하였다.
비교예
1
표 4 의 "건조 분말" 란에 기재된 각 성분 (결합제는 제외한다) 을 실험실용 만능 분말 및 과립 물질 처리 장치 (Okada Seiko Co., Ltd. 제 Mechanomill) 에 주입하고, 혼합하였다. 이 혼합물을 유동층 과립화 건조기에 주입하여 유동화시키고, 표 4 에 기재된 양으로 준비한 결합제로 유동층 내에서 과립화시킨 후, 상기 층 내에서 건조시켜 건조 분말을 산출하였다. 건조 분말의 크기를 입자 크기 조절기에서 조절하고, 수득된 조절 분말을 표 4 의 "정제 벌크 분말 혼합" 란에 기재된 각 성분과 V-혼합기에서 혼합하여 정제 벌크 분말을 산출하였다. 이 정제 벌크 분말을 압축성형 (정제 직경: 7 ㎜; 평면 우각) 하여, 1 정당 카리프라진 히드로클로라이드 0.5 ㎎ 을 함유하는 정제 (각각 120 ㎎) 를 제조하였다. 락토오스 수화물을 D-만니톨로 변경한 것 외에는, 각 성분의 양 및 제조 방법은 실시예 5 와 동일하였다.
비교예
2
표 4 에 기재된 성분을 실험실용 만능 분말 및 과립 물질 처리 장치에 주입하고, 혼합하여 정제 벌크 분말을 산출하였다. 이 정제 벌크 분말을 압축성형 (정제 직경: 7 ㎜; 평면 우각) 하여, 1 정당 카리프라진 히드로클로라이드 0.5 ㎎ 을 함유하는 정제 (각각 120 ㎎) 를 제조하였다.
비교예
3
표 4 에 기재된 성분을 실험실용 만능 분말 및 과립 물질 처리 장치에 주입하고, 혼합하여 정제 벌크 분말을 산출하였다. 이 정제 벌크 분말을 압축성형 (정제 직경: 7 ㎜; 평면 우각) 하여, 1 정당 카리프라진 히드로클로라이드 0.5 ㎎ 을 함유하는 정제 (각각 120 ㎎) 를 제조하였다.
상기 실시예에서 수득한 정제의 여러가지 포장 형태에서의 안정성을 평가하였다.
실험예
1: 안정성 시험
실시예 4 에서 수득한 정제를 PTP (PVC) 블리스터 포장재 (PVC 성형 시이트: Daiwakasei Industry Co., Ltd., PVC 용 알루미늄 호일: Daiwakasei Industry Co., Ltd., 10 정/시이트) 로 포장하여 PTP 포장품을 산출하였다. 또한, 고 방습성 포장 형태의 비교예로서, 이 PTP 포장품 10 시이트를 알루미늄 가젯트 봉투 (Okada Shigyo Co., Ltd.) 에 넣고, 히트 실러 (Fujiimpulse Co., Ltd.) 로 히트 시일하여 PTP 알루미늄 봉투 포장품을 산출하였다. PTP 포장품 10 시이트와 실리카 겔 (Shin-etsu kasei Industry Co., Ltd.; 실리카 겔 Sanpo 1 g) 을 알루미늄 가젯트 봉투 (Okada Shigyo Co., Ltd.) 에 넣고, 히트 실러 (Fujiimpulse Co., Ltd.) 로 히트 시일하여 PTP 실리카 겔 알루미늄 봉투 포장품을 산출하였다. PTP 포장품, PTP 알루미늄 봉투 포장품 및 PTP 실리카 겔 알루미늄 봉투 포장품을 항온항습실 (온도는 40 ℃ 였고; 상대 습도는 75 % 였음) 에서 보존함으로써 안정성 시험을 실시하였다. 보존 기간은 모든 포장 형태에서 1, 2, 3 및 6 개월이었다. 각 기간 후, 포장으로부터 각각의 내용물을 꺼내고, 관련 물질을 고속 액체 크로마토그래피로 확인하여, 보존 개시 시점과 보존후 각 시점 사이의 정제내 관련 물질의 차이를 경시적으로 관찰하였다 (도 1).
실험예
2: 안정성 시험
실시예 8, 실시예 9 및 실시예 10 에서 수득한 정제를 실험예 1 에서와 같이 포장하여 PTP 포장품 및 PTP 알루미늄 봉투 포장품을 산출하였다. PTP 포장품 및 PTP 알루미늄 봉투 포장품을 항온항습실 (온도는 40 ℃ 였고; 상대 습도는 75 % 였다) 에서 보존함으로써 안정성 시험을 실시하였다. 보존 기간은 모든 포장 형태에서 1, 2, 3 및 6 개월이었다. 각 기간 후, 포장으로부터 각각의 내용물을 꺼내고, 관련 물질을 고속 액체 크로마토그래피로 확인하여, 보존 개시 시점과 보존후 각 시점 사이의 정제내 관련 물질의 차이를 경시적으로 관찰하였다 (도 2, 도 3 및 도 4).
실험예 1 및 2 에서 유래한 도 1, 도 2, 도 3 및 도 4 에서 보는 바와 같이, 실시예 4, 8, 9 및 10 에서 수득한 정제는 모두 관련 물질을 거의 생성하지 않았으며, 따라서 이들 정제는 우수한 보존 안정성을 가진다. 또한, 고 방습성을 갖는 포장 형태는 관련 물질을 많이 생성하는 경향이 있었다.
실험예
3: 안정성 시험
비교예 1, 2 및 3, 및 실시예 12, 14 및 15 에서 수득한 정제의 안정성 시험을, 이의 PTP 포장품을 항온실 (온도는 60 ℃ 였다) 에서 보존함으로써 실시하였다. 보존 기간은 2 개월이었고, 관련 물질을 고속 액체 크로마토그래피로 확인하였다. 60 ℃ 에서 2 개월간의 보존 조건에서의 관련 물질의 생성량을 표 5 에 나타냈다.
| 비교예 1 | 비교예 2 | 비교예 3 | 실시예 12 | 실시예 14 | 실시예 15 | |
| 관련 물질 1 | 0.20 % | 7.34 % | 0.15 % | 0.55 % | 0.28 % | 0.89 % |
| 관련 물질 2 | 5.75 % | 4.48 % | 5.17 % | 1.01 % | 1.00 % | 1.88 % |
| 관련 물질 3 | 0.41 % | - | 0.13 % | 0.09 % | 0.05 % | 0.07 % |
| 관련 물질 4 | 2.12 % | - | - | - | - | - |
실시예 12, 14 및 15 와 비교해서, 비교예 1, 2 및 3 에서는 관련 물질의 생성의 현저한 증가가 인정되었다. 즉, 비교예 1 에서는 관련 물질 2 의 현저한 증가와 함께, 다른 처방에서는 관찰되지 않은 특유한 관련 물질 (관련 물질 4) 이 생성되었다. 비교예 2 에서는 관련 물질 1 및 2 가 두드러지게 생성되었다. 또한, 비교예 3 에서는 관련 물질 2 가 두드러지게 증가하였다. 상기 관찰한 바와 같이, 부형제로서 만니톨 및 무수 인산수소칼슘을 사용하는 경우, 및 부형제로서 결정질 셀룰로오스만을 사용하는 경우에는, 다량의 관련 물질이 생성되므로, 이들을 부형제로서 사용하는 것은 바람직하지 않은 것으로 확인되었다. 한편, 주 부형제로서 락토오스를 사용하면, 카리프라진 히드로클로라이드를 화학적으로 안정적으로 보존할 수 있다는 것을 확인하였다.
실험예
4: 안정성 시험
실시예 18 및 실시예 20 에서 수득한 정제를 실험예 1 에 기재된 방법과 같이 포장하여 PTP 포장품, PTP 알루미늄 봉투 포장품 및 PTP 실리카 겔 알루미늄 봉투 포장품을 산출하였다. 수득된 각각의 포장품을 항온항습실 (실온은 40 ℃ 였고; 상대 습도는 75 % 였다) 에서 보존함으로써 안정성 시험을 실시하였다. 보존 기간은 6 개월이었다. 포장으로부터 꺼낸 후, 정제의 수분 활성값을 측정하였다. 그 후, 관련 물질을 고속 액체 크로마토그래피로 확인하였다. 실시예 18 에서 수득한 정제의 수분 활성값 및 관련 물질의 생성량을 표 6 에 나타냈다. 실시예 20 에서 수득한 정제의 수분 활성값 및 관련 물질의 생성량을 표 7 에 나타냈다. 수분 활성값 측정 장치로는, AQUALAB (series3TE, DECAGON) 을 사용하였다. 수분 활성값의 측정은 항온항습실에서 정제를 꺼낸지 12 시간 이내에 실시하였다. 또한, 실시예 18 에서 사용한 처방 및 제조 방법은, 결합제의 양을 총량의 2 % 에서 3 % 로 증가시키고, 결합제의 증가분을 상쇄하기 위해 옥수수 전분의 양을 감소시킨 것 외에는, 실시예 14 에서 사용한 것과 동일하였다.
| 수분 활성값 | 70.0 % (PTP 포장품) |
21.8 % (PTP 알루미늄 봉투 포장품) |
7.6 % (PTP 실리카 겔 알루미늄 포장품) |
| 관련 물질 1 | 0.40 % | 0.75 % | 0.44 % |
| 관련 물질 2 | 0.04 % | 0.47 % | 0.83 % |
| 관련 물질 3 | 0.13 % | 0.18 % | 0.14 % |
| 총량 | 0.57 % | 1.40 % | 1.41 % |
| 수분 활성값 | 70.0 % (PTP 포장품) |
33.9 % (PTP 알루미늄 봉투 포장품) |
7.8 % (PTP 실리카 겔 알루미늄 포장품) |
| 관련 물질 1 | 0.30 % | 0.67 % | 0.36 % |
| 관련 물질 2 | 0.05 % | 0.08 % | 0.35 % |
| 관련 물질 3 | 0.05 % | 0.17 % | 0.17 % |
| 총량 | 0.40 % | 0.92 % | 0.88 % |
표 6 및 7 에서 보는 바와 같이, 실시예 20 에서 수득한 정제는 실시예 18 에서 수득한 정제보다 우수한 안정성을 가지는 것으로 확인되었다. 특히, 실시예 20 의 정제는 저습도 조건하에서 특별히 안정하였고, 낮은 습도 의존성을 가졌다. 즉, 부형제로서 전분을 함유하지 않는 정제가 보다 우수한 것으로 밝혀졌다.
실험예
5: 안정성 시험
실험예 4 에서 사용한 PTP 포장품 (실시예 18 및 실시예 20) 을 항온항습실 (온도는 40 ℃ 였고; 상대 습도는 75 % 였다) 에서 보존함으로써 안정성 시험을 실시하였다. 보존 기간은 0.25, 0.5, 1, 2, 3 및 6 개월이었다. 포장으로부터 꺼낸 후, 경도를 측정하고, 경도의 경시적 변화를 관찰하였다 (도 5).
도 5 에서 보는 바와 같이, 실시예 18 의 정제는 경도가 현저하게 저하되었다. 통상적으로, 취급에 문제가 없는 경도는 20 N 이상이 요망되기 때문에, 상기 정제는 고습도 환경하에서 보존 문제를 가질 수 있다. 한편, 실시예 20 의 정제는 경도가 여전히 허용 가능한 범위내에 있었다. 상기 관찰한 바와 같이, 부형제로서 전분을 함유하지 않는 정제가 보다 우수한 것으로 밝혀졌다. 또한, 적절한 경도를 갖는 실시예 20 의 정제는 낮은 타정 압력을 사용하여 압축성형함으로써 제조할 수 있으므로, 우수한 제조성을 갖는 것으로 밝혀졌다.
산업상 이용가능성
본 발명은 시클로덱스트린을 첨가하지 않고도 카리프라진 히드로클로라이드를 안정적으로 보존할 수 있는 경구 투여용 고형 제제를 제공한다.
Claims (1)
- 주 부형제로서 락토오스를 사용하고 카리프라진 히드로클로라이드를 포함하는 경구 투여용 고형 제제.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JPJP-P-2008-040696 | 2008-02-21 | ||
| JP2008040696 | 2008-02-21 | ||
| JPJP-P-2008-284685 | 2008-11-05 | ||
| JP2008284685 | 2008-11-05 | ||
| PCT/JP2009/053039 WO2009104739A1 (ja) | 2008-02-21 | 2009-02-20 | 経口投与用固形製剤 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020107020649A Division KR101563383B1 (ko) | 2008-02-21 | 2009-02-20 | 경구 투여용 고형 제제 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20130115393A true KR20130115393A (ko) | 2013-10-21 |
Family
ID=40985616
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020107020649A KR101563383B1 (ko) | 2008-02-21 | 2009-02-20 | 경구 투여용 고형 제제 |
| KR1020137025458A KR20130115393A (ko) | 2008-02-21 | 2009-02-20 | 경구 투여용 고형 제제 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020107020649A KR101563383B1 (ko) | 2008-02-21 | 2009-02-20 | 경구 투여용 고형 제제 |
Country Status (9)
| Country | Link |
|---|---|
| US (1) | US20110059980A1 (ko) |
| EP (1) | EP2251011B1 (ko) |
| JP (2) | JP4409630B2 (ko) |
| KR (2) | KR101563383B1 (ko) |
| CN (1) | CN102014909B (ko) |
| AT (1) | ATE552002T1 (ko) |
| CA (1) | CA2715760C (ko) |
| EA (1) | EA023972B1 (ko) |
| WO (1) | WO2009104739A1 (ko) |
Families Citing this family (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| HUP0700353A2 (en) * | 2007-05-18 | 2008-12-29 | Richter Gedeon Nyrt | Metabolites of (thio)carbamoyl-cyclohexane derivatives |
| US7875610B2 (en) * | 2007-12-03 | 2011-01-25 | Richter Gedeon Nyrt. | Pyrimidinyl-piperazines useful as D3/D2 receptor ligands |
| ATE552002T1 (de) * | 2008-02-21 | 2012-04-15 | Richter Gedeon Nyrt | Feste zubereitung zur oralen verabreichung |
| AP2975A (en) | 2008-07-16 | 2014-09-30 | Richter Gedeon Nyrt | Pharmaceutical formulations containing dopamine receptor ligands |
| HU230067B1 (hu) | 2008-12-17 | 2015-06-29 | Richter Gedeon Nyrt | Új piperazin só és eljárás előállítására |
| HUP0800765A2 (en) | 2008-12-18 | 2010-11-29 | Richter Gedeon Nyrt | A new process for the preparation of piperazine derivatives and their hydrochloric salts |
| HUP0800766A2 (en) | 2008-12-18 | 2010-11-29 | Richter Gedeon Vegyeszet | Process for the preparation of piperazine derivatives |
| CN106560179B (zh) * | 2015-09-30 | 2020-02-21 | 石药集团中奇制药技术(石家庄)有限公司 | 盐酸卡利拉嗪药物组合物及其制备方法 |
| EP3231418A1 (en) * | 2016-04-14 | 2017-10-18 | Richter Gedeon Nyrt. | Granule formulation for oral administration |
| JP7020688B2 (ja) * | 2016-06-28 | 2022-02-16 | 株式会社日本抗菌総合研究所 | 賦形剤及び錠剤 |
| US11274087B2 (en) | 2016-07-08 | 2022-03-15 | Richter Gedeon Nyrt. | Industrial process for the preparation of cariprazine |
| CN107970217A (zh) * | 2016-10-25 | 2018-05-01 | 浙江京新药业股份有限公司 | 卡利拉嗪口腔崩解片及其制备方法 |
| CN108261394B (zh) * | 2017-01-04 | 2022-03-04 | 广东东阳光药业有限公司 | 一种盐酸卡利拉嗪注射制剂及其制备方法和用途 |
| HUP1700253A1 (hu) | 2017-06-13 | 2019-01-28 | Richter Gedeon Nyrt | Szilárd orális gyógyszerkészítmények |
| US11273156B2 (en) * | 2018-11-20 | 2022-03-15 | Aurobindo Pharma Ltd | Stable cariprazine formulations for oral use |
| US11547707B2 (en) | 2019-04-10 | 2023-01-10 | Richter Gedeon Nyrt. | Carbamoyl cyclohexane derivatives for treating autism spectrum disorder |
| US11344503B2 (en) * | 2019-12-13 | 2022-05-31 | Halo Science LLC | Cariprazine release formulations |
| EP4193987A1 (en) * | 2020-08-06 | 2023-06-14 | SK Biopharmaceuticals Co., Ltd. | Solid oral composition comprising carbamate compound, and preparation method therefor |
Family Cites Families (26)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4666911A (en) * | 1981-07-14 | 1987-05-19 | Taiho Pharmaceutical Company Limited | Allophanoylpiperazine compound and analgesic composition containing same as active ingredient |
| GB8802622D0 (en) * | 1988-02-05 | 1988-03-02 | Glaxo Group Ltd | Chemical compound |
| US4957921A (en) * | 1989-12-06 | 1990-09-18 | Warner-Lambert Company | Substituted cyclohexanols as central nervous system agents |
| US6334997B1 (en) * | 1994-03-25 | 2002-01-01 | Isotechnika, Inc. | Method of using deuterated calcium channel blockers |
| DE69535592T2 (de) * | 1994-03-25 | 2008-06-12 | Isotechnika, Inc., Edmonton | Verbesserung der effektivität von arzneimitteln duren deuterierung |
| US6528529B1 (en) * | 1998-03-31 | 2003-03-04 | Acadia Pharmaceuticals Inc. | Compounds with activity on muscarinic receptors |
| HUP0102609A3 (en) * | 1998-06-30 | 2002-12-28 | Zeria Pharm Co Ltd | N-phenyl-n'-phenylpropylpiperazine derivatives and process for the preparation thereof, and pharmaceutical compositions containing them |
| US6489341B1 (en) * | 1999-06-02 | 2002-12-03 | Sepracor Inc. | Methods for the treatment of neuroleptic and related disorders using sertindole derivatives |
| RS50680B (sr) * | 2001-02-27 | 2010-06-30 | Ortho-Mcneil Pharmaceutical Inc. | Karbamatna jedinjenja za upotrebu u sprečavanju i lečenju bipolarnih poremećaja |
| US6566550B2 (en) * | 2001-06-21 | 2003-05-20 | Pfizer Inc | Substituted aromatic ethers as inhibitors of glycine transport |
| HU227543B1 (en) * | 2001-09-28 | 2011-08-29 | Richter Gedeon Nyrt | N-[4-(2-piperazin- and 2-piperidin-1-yl-ethyl)-cyclohexyl]-sulfon- and sulfamides, process for their preparation, their use and pharmaceutical compositions containing them |
| US6919342B2 (en) * | 2003-06-05 | 2005-07-19 | Abbott Gmbh & Co. Kg | Triazole compounds suitable for treating disorders that respond to modulation of the dopamine D3 receptor |
| HU227534B1 (en) * | 2003-08-04 | 2011-08-29 | Richter Gedeon Nyrt | (thio)carbamoyl-cyclohexane derivatives, process for producing them and pharmaceutical compositions containing them |
| DE102004047517A1 (de) * | 2004-09-28 | 2006-03-30 | Merck Patent Gmbh | Neuartige Kristallform von (3-Cyan-1H-indol-7-yl)-[4-(4-fluorphenethyl)-piperazin-1-yl]-methanon, Hydrochlorid |
| PT2155200T (pt) * | 2007-05-11 | 2017-02-21 | Richter Gedeon Nyrt | Forma cristalina de um derivado de carbamoil-ciclohexano |
| HU230748B1 (hu) * | 2007-05-11 | 2018-02-28 | Richter Gedeon Nyrt | Új piperazin só és előállítási eljárása |
| HUP0700353A2 (en) * | 2007-05-18 | 2008-12-29 | Richter Gedeon Nyrt | Metabolites of (thio)carbamoyl-cyclohexane derivatives |
| HUP0700370A2 (en) * | 2007-05-24 | 2009-04-28 | Richter Gedeon Nyrt | Use of (thio)-carbamoyl-cyclohexane derivatives in the manufacture of a medicament for the treatment of acute mania |
| HUP0700369A2 (en) * | 2007-05-24 | 2009-04-28 | Richter Gedeon Nyrt | Use of (thio)-carbamoyl-cyclohexane derivatives in the manufacture of a medicament for the treatment in the manufacture of a medicament for the treatment of schizophrenia |
| US20100256145A1 (en) * | 2007-08-01 | 2010-10-07 | H. Lundbeck A/S | Use of kcnq potassium channel openers for reducing symptoms of or treating disorders or conditions wherein the dopaminergic system is disrupted |
| US7875610B2 (en) * | 2007-12-03 | 2011-01-25 | Richter Gedeon Nyrt. | Pyrimidinyl-piperazines useful as D3/D2 receptor ligands |
| ATE552002T1 (de) * | 2008-02-21 | 2012-04-15 | Richter Gedeon Nyrt | Feste zubereitung zur oralen verabreichung |
| AP2975A (en) * | 2008-07-16 | 2014-09-30 | Richter Gedeon Nyrt | Pharmaceutical formulations containing dopamine receptor ligands |
| HU230067B1 (hu) * | 2008-12-17 | 2015-06-29 | Richter Gedeon Nyrt | Új piperazin só és eljárás előállítására |
| HUP0800766A2 (en) * | 2008-12-18 | 2010-11-29 | Richter Gedeon Vegyeszet | Process for the preparation of piperazine derivatives |
| HUP0800765A2 (en) * | 2008-12-18 | 2010-11-29 | Richter Gedeon Nyrt | A new process for the preparation of piperazine derivatives and their hydrochloric salts |
-
2009
- 2009-02-20 AT AT09712557T patent/ATE552002T1/de active
- 2009-02-20 KR KR1020107020649A patent/KR101563383B1/ko active IP Right Grant
- 2009-02-20 KR KR1020137025458A patent/KR20130115393A/ko not_active Application Discontinuation
- 2009-02-20 EP EP09712557A patent/EP2251011B1/en active Active
- 2009-02-20 US US12/918,580 patent/US20110059980A1/en not_active Abandoned
- 2009-02-20 JP JP2009520724A patent/JP4409630B2/ja active Active
- 2009-02-20 CA CA2715760A patent/CA2715760C/en not_active Expired - Fee Related
- 2009-02-20 EA EA201001334A patent/EA023972B1/ru unknown
- 2009-02-20 WO PCT/JP2009/053039 patent/WO2009104739A1/ja active Application Filing
- 2009-02-20 CN CN2009801148592A patent/CN102014909B/zh active Active
- 2009-11-11 JP JP2009258219A patent/JP2010132654A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| JPWO2009104739A1 (ja) | 2011-06-23 |
| WO2009104739A1 (ja) | 2009-08-27 |
| CA2715760C (en) | 2017-06-13 |
| EA201001334A1 (ru) | 2011-06-30 |
| JP4409630B2 (ja) | 2010-02-03 |
| CA2715760A1 (en) | 2009-08-27 |
| CN102014909B (zh) | 2013-03-13 |
| JP2010132654A (ja) | 2010-06-17 |
| CN102014909A (zh) | 2011-04-13 |
| EA023972B1 (ru) | 2016-08-31 |
| EP2251011A1 (en) | 2010-11-17 |
| ATE552002T1 (de) | 2012-04-15 |
| US20110059980A1 (en) | 2011-03-10 |
| EP2251011B1 (en) | 2012-04-04 |
| EP2251011A4 (en) | 2011-03-02 |
| KR101563383B1 (ko) | 2015-10-26 |
| KR20100117676A (ko) | 2010-11-03 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101563383B1 (ko) | 경구 투여용 고형 제제 | |
| EP1810676B1 (en) | Levetiracetam formulations and methods for their manufacture | |
| US20090281136A1 (en) | Prasugrel pharmaceutical formulations | |
| JP4446177B2 (ja) | 耐湿性口腔内崩壊錠の製造方法 | |
| WO2011074660A1 (ja) | 溶出安定性製剤 | |
| EP2934488B1 (en) | A pharmaceutical composition containing candesartan cilexetil and amlodipine | |
| US20160008328A1 (en) | Stable Pharmaceutical Package Comprising Azilsartan Medoxomil | |
| KR20160002177A (ko) | 오셀타미비어 유리염기를 포함하는 약학 조성물 | |
| JP5844574B2 (ja) | ピタバスタチンを含有する安定化された薬物組成物 | |
| WO2010027101A1 (ja) | 医療用固形製剤 | |
| JPH1067657A (ja) | マルチプルユニット型持続性製剤 | |
| KR102044734B1 (ko) | 캡슐 제형 | |
| JP6106359B2 (ja) | ロキソプロフェンナトリウムとビタミンb1を含有する固形製剤 | |
| KR102102462B1 (ko) | 오셀타미비어 유리염기를 포함하는 약학 조성물 | |
| JP5774308B2 (ja) | 水溶性ビノレルビン塩の安定な医薬組成物 | |
| JP2020083887A (ja) | アジルサルタンを含有する錠剤 | |
| CA3048968A1 (en) | Oral pharmaceutical composition of lurasidone and preparation thereof | |
| CA2927437C (en) | Pharmaceutical dosage forms containing sodium-1-[6-(morpholin-4-yl)pyrimidin-4-yl]-4-(1h-1,2,3-triazol-1-yl)-1h-pyrazol-5-olate | |
| RU2266106C1 (ru) | Способ получения антимикробного средства | |
| WO2007049304A2 (en) | Stable coated pharmaceutical formulation of olanzapine and process for preparing the same | |
| JP2012140411A (ja) | ロキソプロフェンナトリウム及びdl−メチルエフェドリン塩酸塩を含有する固形製剤 | |
| CN108236609A (zh) | 一种gpr40激动剂药物组合物及其制备方法 | |
| JP2013119540A (ja) | 固形医薬組成物およびその製造法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A107 | Divisional application of patent | ||
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |