KR20120139699A - C형 간염 바이러스 감염의 치료 요법 - Google Patents
C형 간염 바이러스 감염의 치료 요법 Download PDFInfo
- Publication number
- KR20120139699A KR20120139699A KR1020127021714A KR20127021714A KR20120139699A KR 20120139699 A KR20120139699 A KR 20120139699A KR 1020127021714 A KR1020127021714 A KR 1020127021714A KR 20127021714 A KR20127021714 A KR 20127021714A KR 20120139699 A KR20120139699 A KR 20120139699A
- Authority
- KR
- South Korea
- Prior art keywords
- administered
- amount
- weeks
- administration
- hcv
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
- A61K31/4535—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems containing a heterocyclic ring having sulfur as a ring hetero atom, e.g. pizotifen
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
- A61K31/454—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems containing a five-membered ring with nitrogen as a ring hetero atom, e.g. pimozide, domperidone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7042—Compounds having saccharide radicals and heterocyclic rings
- A61K31/7052—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides
- A61K31/7056—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing five-membered rings with nitrogen as a ring hetero atom
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Molecular Biology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Virology (AREA)
- Communicable Diseases (AREA)
- Gastroenterology & Hepatology (AREA)
- Oncology (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Peptides Or Proteins (AREA)
Abstract
VX-222 및 VX-950을 HCV에 감염된 환자에게 동시투여하는 단계를 포함하는, HCV에 감염된 환자에서 VX-222의 약동학을 개선하는 방법이 제공된다. VX-222 및 VX-950을 HCV에 감염된 환자에게 투여하는 단계를 포함하는, HCV에 감염된 환자를 치료하는 방법으로서, 이때 VX-222를 약 20 mg 내지 약 400 mg의 양으로 투여하고, VX-950을 약 100 mg 내지 약 1,500 mg의 양으로 투여하는 것인 방법도 제공된다. 치료 유효량의 VX-222를 투여하는 단계를 포함하는, HCV에 감염된 환자를 치료하는 방법으로서, 이때 VX-222를 약 20 mg 내지 약 2,000 mg의 양으로 1일 1회 투여하는 것인 방법도 제공된다.
Description
관련 출원
본원은 2010년 1월 29일자로 출원된 미국 가출원 제61/299,643호, 2010년 2월 26일자로 출원된 미국 가출원 제61/308,506호, 2010년 3월 1일자로 출원된 미국 가출원 제61/309,117호 및 2010년 4월 15일자로 출원된 미국 가출원 제61/324,395호에 대한 우선권을 주장한다. 이들 출원들의 전체 교시내용은 본원에 참고로 도입된다.
기술분야
본 발명은 C형 간염 바이러스 감염의 치료 방법에 관한 것이다.
C형 간염 바이러스("HCV")에 의한 감염은 흥미로운 인간 의학 문제이다. HCV는 전세계적으로 3%의 추정된 인간 혈청양성률(sero-prevalence)을 나타내면서 비-A형 간염 및 비-B형 간염의 대다수 경우에 대한 병인물질로서 인식되어 있다(예를 들면, 문헌[A. Alberti et al., "Natural History of Hepatitis C." J. Hepatology. 31 (Suppl. 1), 17-24 (1999)] 참조). 미국에서만 거의 4백만명의 개체들이 감염되어 있을 수 있다(예를 들면, 문헌[M.J. Alter et al., "The Epidemiology of Viral Hepatitis in the United States, Gastroenterol. Clin. North Am., 23, 437-455 (1994)]; 및 문헌[M. J. Alter, "Hepatitis C Virus Infection in the United States," J. Hepatology, 31 (Suppl. 1), 88-91 (1999)] 참조).
HCV에 감염된 사람들 중에서 20% 내지 25%가 급성 감염 후 상기 바이러스를 제거할 수 있으나, 75% 내지 80%는 만성 C형 간염 감염을 발달시킬 것이다[예를 들면, 문헌[preface, Frontiers in Viral Hepatitis, Ed. RF Schinazi, J-P Sommadossi, and CM Rice, p. xi., Elsevier (2003)] 참조). 이것은 통상적으로 재발되고 점진적으로 악화되는 간 염증을 초래하고, 상기 간 염증은 보다 심각한 질환 상태, 예컨대, 경화증 및 간세포암종을 유발한다(예를 들면, 문헌[M.C. Kew, "Hepatitis C and Hepatocellular Carcinoma", FEMS Microbiology Reviews. 14, 211-220 (1994)]; 및 문헌[I. Saito et al., "Hepatitis C Virus Infection is Associated with the Development of Hepatocellular Carcinoma," Proc. Natl. Acad. Sci. USA. 87, 6547-6549 (1990)] 참조). 불운하게도, 만성 HCV의 진행을 약화시키기 위한 광범위하게 효과적인 치료가 존재하지 않는다.
HCV 게놈은 3010개 내지 3033개의 아미노산으로 구성된 폴리단백질을 코딩한다[예를 들면, 문헌[Q.L. Choo, et al., "Genetic Organization and Diversity of the Hepatitis C Virus," Proc. Natl. Acad. Sci. USA. 88, 2451-2455 (1991)]; 문헌[N. Kato et al., "Molecular Cloning of the Human Hepatitis C Virus Genome From Japanese Patients with Non-A, Non-B Hepatitis," Proc. Natl. Acad. Sci. USA, 87, 9524-9528 (1990)]; 및 문헌[A. Takamizawa et al., "Structure and Organization of the Hepatitis C Virus Genome Isolated From Human Carriers," J. Virol, 65, 1105-1113 (1991)] 참조). HCV 비구조(NS) 단백질은 바이러스 복제에 필수적인 촉매 기구를 제공하는 것으로 추정된다. NS 단백질은 상기 폴리단백질의 단백질분해적 절단에 의해 유도된다(예를 들면, 문헌[R. Bartenschlager et al., "Nonstructural Protein 3 of the Hepatitis C Virus Encodes a Serine-Type Proteinase Required for Cleavage at the NS3/4 and NS4/5 Junctions." J. Virol., 67, 3835-3844 (1993)]; 문헌[A. Grakoui et al., "Characterization of the Hepatitis C Virus-Encoded Serine Proteinase: Determination of Proteinase-Dependent Polyprotein Cleavage Sites." J. Virol., 67, 2832-2843 (1993)]; 문헌[A. Grakoui et al., "Expression and Identification of Hepatitis C Virus Polyprotein Cleavage Products," J. Virol., 67, 1385-1395 (1993)]; 및 문헌[L. Tomei et al., "NS3 is a serine protease required for processing of hepatitis C virus polyprotein", J. Virol., 67, 4017-4026 (1993)] 참조).
HCV NS 단백질 3(NS3)은 상기 바이러스 효소들의 대다수의 프로세싱에 기여하는 세린 단백질분해효소(protease) 활성을 보유하므로 바이러스 복제 및 감염성을 위해 필수적인 것으로 간주된다. 황열병(yellow fever) 바이러스 NS3 단백질분해효소에서의 돌연변이가 바이러스 감염성을 감소시킨다는 것은 공지되어 있다(예를 들면, 문헌[Chambers, T.J. et al., "Evidence that the N-terminal Domain of Nonstructural Protein NS3 From Yellow Fever Virus is a Serine Protease Responsible for Site-Specific Cleavages in the Viral Polyprotein", Proc. Natl. Acad. Sci. USA. 87, 8898-8902 (1990)] 참조). NS3의 처음 181개 아미노산(상기 바이러스 폴리단백질의 잔기 1027 내지 1207)은 HCV 폴리단백질의 모든 4개 하류(downstream) 부위를 프로세싱하는 NS3의 세린 단백질분해효소 도메인을 함유하는 것으로 밝혀졌다(예를 들면, 문헌[C. Lin et al., "Hepatitis C Virus NS3 Serine Proteinase: Trans-Cleavage Requirements and Processing Kinetics", J. Virol. 68, 8147-8157 (1994)] 참조).
HCV HS3 세린 단백질분해효소 및 이의 관련 보조인자인 NS4A는 모든 상기 바이러스 효소들의 프로세싱에 기여하므로 바이러스 복제를 위해 필수적인 것으로 간주된다. 이 프로세싱은 바이러스 효소 프로세싱에 관여하는 인간 면역결핍 바이러스 아스파르틸(aspartyl) 단백질분해효소에 의해 수행되는 프로세싱과 유사한 듯하다. 바이러스 단백질 프로세싱을 억제하는 HIV 단백질분해효소 억제제는 인간에서 강력한 항-바이러스제인데, 이것은 상기 바이러스 생존 주기의 이 단계의 차단이 치료 활성제를 발생시킨다는 것을 암시한다. 결과적으로, 상기 단백질분해효소는 약물 개발을 위한 흥미로운 표적이다.
현재 만족스러운 항-HCV 물질 또는 치료가 전혀 존재하지 않는다. 최근까지, HCV 질환에 대한 유일한 확립된 요법은 인터페론 치료이었다. HCV 감염에 대한 처음 승인된 요법은 표준(비페길화된(non-pegylated)) 인터페론 알파를 사용한 치료이었다. 그러나, 인터페론은 상당한 부작용을 나타내고(예를 들면, 문헌[M. A. Wlaker et al., "Hepatitis C Virus: An Overview of Current Approaches and Progress," DDT, 4, 518-29 (1999)]; 문헌[D. Moradpour et al., "Current and Evolving Therapies for Hepatitis C," Eur. J. Gastroenterol. Hepatol., 11, 1199-1202 (1999)]; 문헌[H. L. A. Janssen et al., "Suicide Associated with Alfa-Interferon Therapy for Chronic Viral Hepatitis." J. Hepatol., 21, 241-243 (1994)]; 및 문헌[P.F. Renault et al., "Side Effects of Alpha Interferon," Seminars in Liver Disease, 9, 273-277, (1989)] 참조), 인터페론 알파 단일요법은 단지 일부(약 25%)의 경우에만 장기간 경감을 유도한다(예를 들면, 문헌[O. Weiland, "Interferon Therapy in Chronic Hepatitis C Virus Infection", FEMS Microbiol. Rev., 14, 279-288 (1994)] 참조). 치료 섭생법에의 리바비린(ribavirin)의 첨가는 반응률을 약간 증가시킨다. 또한, 리바비린과 조합된 인터페론의 페길화된 형태(PEG-인트론(INTRON)(등록상표) 및 페가시스(PEGASYS)(등록상표))의 최근 도입은 경감률을 단지 약간 개선시켰고 부작용을 단지 부분적으로 감소시켰다. 관리의 현재 표준은 예후 인자, 예컨대, HCV 유전형 및 치료에 대한 초기 반응의 표시에 따라 24주 내지 48주 동안 지속되는 치료 섭생법이다. 더욱이, 효과적인 항-HCV 백신에 대한 전망은 불확실한 상태로 남아있다.
따라서, 항-HCV 요법 및 항-HCV 화합물에 대한 적절한 투여 섭생법이 필요한다.
HCV, 및 다른 질환 및 장애는 간 손상과 관련되어 있다. 간 손상을 치료하기 위한 요법 및 적절한 투여 섭생법도 필요하다.
발명의 개요
본 발명은 일반적으로 C형 간염 바이러스(HCV) 감염에 대한 치료를 제공한다. 또한, 본 발명은 일반적으로 C형 간염 바이러스 감염의 임상적 후유증의 예방을 제공한다.
한 양태에서, 본 발명은 HCV에 감염된 환자에서 VX-222의 약동학(pharmacokinetics)을 개선하는 방법에 관한 것이다. 상기 방법은 VX-222 및 VX-950을 상기 환자에게 동시투여하는(co-administering) 단계를 포함한다.
또 다른 양태에서, 본 발명은 HCV에 감염된 환자의 혈장에서 VX-222의 노출을 증가시키는 방법에 관한 것이다. 상기 방법은 VX-222 및 VX-950을 상기 환자에게 투여하는 단계를 포함한다.
또 다른 양태에서, 본 발명은 HCV에 감염된 환자의 치료 방법에 관한 것이다. 상기 방법은 VX-222 및 VX-950을 상기 환자에게 투여하는 단계를 포함하고, 여기서 VX-222를 약 20 mg 내지 약 400 mg의 양으로 투여하고, VX-950을 약 100 mg 내지 약 1,500 mg의 양으로 투여한다.
또 다른 양태에서, 본 발명은 치료적 유효량의 VX-222를 투여하는 단계를 포함하는, HCV에 감염된 환자의 치료 방법에 관한 것으로서, 여기서 VX-222를 약 20 mg 내지 약 2,000 mg의 양으로 1일 1회 투여한다.
또 다른 양태에서, 본 발명은 a) 약 20 mg 내지 약 400 mg의 양의 VX-222; 및 b) 약 100 mg 내지 약 1,500 mg의 양의 VX-950을 포함하는 약학적으로 허용가능한 조성물에 관한 것이다.
또한, 본 발명은 HCV에 감염된 환자에서 VX-222의 생체이용률을 증가시키기 위한 약제의 제조에 있어서 VX-222 및 VX-950의 용도를 제공한다.
또한, 본 발명은 HCV에 감염된 환자의 혈장에서 VX-222의 생체이용률 또는 노출을 증가시키기 위한 약제의 제조에 있어서 VX-222 및 VX-950의 용도를 제공한다.
또한, 본 발명은 HCV에 감염된 환자의 치료를 위한 약제의 제조에 있어서 VX-222 및 VX-950의 용도를 제공하고, 여기서 VX-222는 약 20 mg 내지 약 400 mg의 양이고, VX-950은 약 100 mg 내지 약 1,500 mg의 양이다.
또한, 본 발명은 HCV에 감염된 환자의 치료를 위한 약제의 제조에 있어서 VX-222의 용도를 제공하고, 여기서 VX-222는 약 20 mg 내지 약 2,000 mg 또는 약 50 mg 내지 약 2,000 mg의 양으로 1일 1회 투여된다.
도 1 및 2는 본 발명의 일부 실시양태의 연구 디자인을 보여주는 도표이다.
도 3 내지 8은 본 발명의 한 실시양태의 연구 결과를 보여주는 도표이다.
도 9는 화합물 1의 전구약물의 혈장 수준, 및 상기 전구약물의 투여 후 활성 대사물질로의 상기 전구약물의 전환을 보여주는 그래프이다.
도 3 내지 8은 본 발명의 한 실시양태의 연구 결과를 보여주는 도표이다.
도 9는 화합물 1의 전구약물의 혈장 수준, 및 상기 전구약물의 투여 후 활성 대사물질로의 상기 전구약물의 전환을 보여주는 그래프이다.
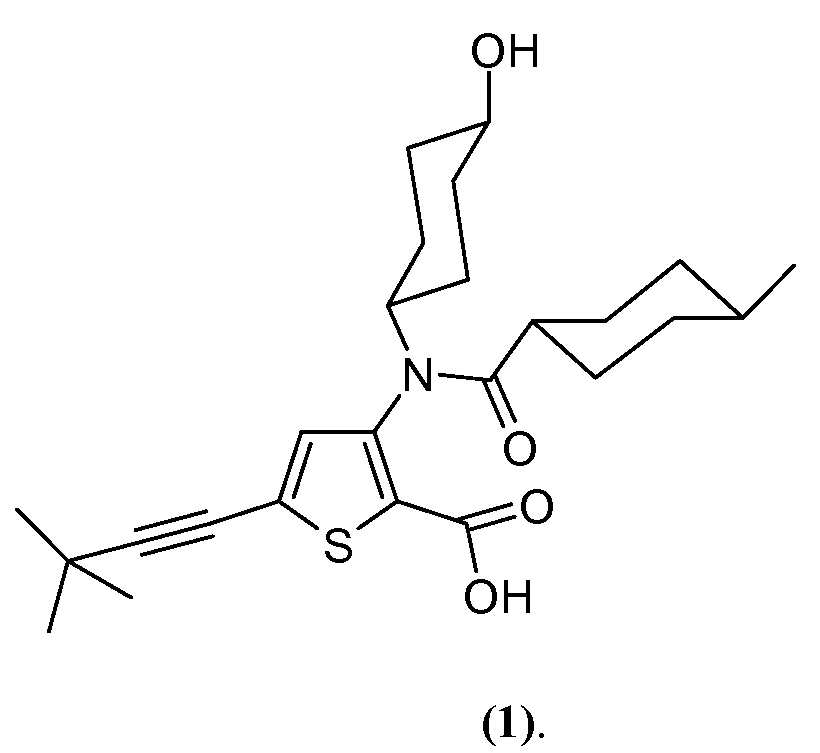
본 발명은 VX-222의 투여를 위한 특정 투여량 및 투여 섭생법에 관한 것이다. 본 발명의 목적을 위해, VX-222는 화합물 1 및 이의 약학적으로 허용가능한 염, 용매화물 및 전구약물, 및 화합물 1의 전구약물의 약학적으로 허용가능한 용매화물을 포함하고, 이때 화합물 1은 하기 화학식 (1)로 표시된다:
[화학식 (1)]
VX-222는 NS5B 중합효소 억제제이고 국제 특허출원 공보 제WO 2008/058393호에 기재되어 있다.
또한, 본 발명은 VX-950을 투여하기 위한 특정 투여량 및 투여 섭생법에 관한 것이다. VX-950은 정지 상태 결합 상수(ki*)가 7 nM인 경쟁적 가역성 펩티드모사체(peptidomimetic) NS3/4A 단백질분해효소 억제제이다. 예를 들면, 국제 특허출원 공보 제WO 02/018369호를 참조한다. 본 발명의 목적을 위해, VX-950은 화합물 2, 및 화합물 2의 약학적으로 허용가능한 염 및 전구약물을 포함하고, 이때 화합물 2는 하기 화학식 (2)로 표시된다:
[화학식 (2)]
VX-950은 국제 특허출원 공보 제WO 02/018369호, 제WO 2006/050250호 및 제WO 2008/144072호에 기재되어 있다. VX-950의 다른 설명은 국제 특허출원 공보 제WO 07/098270호 및 제WO 08/106151호에서 발견될 수 있다.
본원에서 사용된 바와 같이, 어구 "약학적으로 허용가능한 염(들)"은 안전하고 HCV 감염의 치료에 효과적인 염을 지칭한다. 약학적으로 허용가능한 산부가염은 염화수소산염, 브롬화수소산염, 요오드화수소산염, 질산염, 황산염, 중황산염, 인산염, 산 인산염, 이소니코틴산염, 아세트산염 및 젖산염을 포함하나 이들로 한정되지 않는다. 다양한 아미노산에 의해 형성된 약학적으로 허용가능한 염도 사용될 수 있고, 이들 아미노산염들의 사용도 본 발명의 범위 내에 있다. 적합한 염기염은 알루미늄염, 칼슘염, 리튬염, 마그네슘염, 칼륨염, 나트륨염, 아연염 및 디에탄올아민염을 포함하나 이들로 한정되지 않는다. 약학적으로 허용가능한 염에 대한 검토를 위해서는 문헌[Berge et al., J. Pharm. Sci., 66, 1-19 (1977)](이의 내용은 본원에 참고로 도입됨)을 참조한다.
화합물 1의 약학적으로 허용가능한 염의 특정 예, 예컨대, 아미노산(예를 들면, L-아르기닌, L-라이신)으로부터 유도된 염 및 적절한 염기로부터 유도된 염은 국제 특허출원 공보 제WO 2008/058393호에 기재되어 있고, 적절한 염기로부터 유도된 염은 알칼리금속(예를 들면, 나트륨, 리튬, 칼륨)염, 알칼리토금속(예를 들면, 칼슘, 마그네슘)염, 암모늄염, NR4 + 염(이때, R은 C1 - 4알킬임), 콜린염 및 트로메타민염을 포함한다. 한 실시양태에서, 약학적으로 허용가능한 염은 나트륨염이다. 또 다른 실시양태에서, 약학적으로 허용가능한 염은 리튬염이다. 또 다른 실시양태에서, 약학적으로 허용가능한 염은 칼륨염이다. 또 다른 실시양태에서, 약학적으로 허용가능한 염은 트로메타민염이다. 또 다른 실시양태에서, 약학적으로 허용가능한 염은 L-아르기닌염이다.
본원에서 사용된 바와 같이, 어구 화합물 1의 "약학적으로 허용가능한 전구약물"은 HCV 감염의 치료에서 그의 약리 효과를 나타내기 전에 생리학적 조건 하에 또는 가용매분해(solvolysis)에 의해 화합물 1 또는 화합물 1의 약학적으로 허용가능한 염으로 전환될 수 있는 화합물을 지칭한다. 본원에서 사용된 바와 같이, 어구 화합물 2의 "약학적으로 허용가능한 전구약물"은 HCV 감염의 치료에서 그의 약리 효과를 나타내기 전에 생리학적 조건 하에 또는 가용매분해에 의해 화합물 2 또는 화합물 2의 약학적으로 허용가능한 염으로 전환될 수 있는 화합물을 지칭한다. 전형적으로, 전구약물은 개선된 화학적 안정성, 개선된 환자 허용도 및 순응도, 개선된 생체이용률, 작용의 연장된 지속, 개선된 기관 선택성, 개선된 제제화(예를 들면, 증가된 수용성) 또는 감소된 부작용(예를 들면, 독성)을 위한 목적으로 제제화된다.
약학적으로 허용가능한 전구약물은 당업계에서 공지되어 있는 방법, 예를 들면, 문헌[Burger's Medicinal Chemistry and Drug Chemistry, Vol. 1, 172-178 and 949-982, John Wiley & Sons (1995)]에 기재된 방법을 이용하여 용이하게 제조할 수 있다. 문헌[Bertolini et al., J. Med. Chem., 40, 2011-2016 (1997)]; 문헌[Shan et al., J. Pharm. Sci., 86(7), 765-767 (1997)]; 문헌[Bagshawe, Drug Dev. Res., 34, 220-230 (1995)]; 문헌[Bodor, Advances in Drug Res., 13, 224-331 (1984)]; 문헌[Bundgaard, Design of Prodrugs, Elsevier Press (1985)]; 및 문헌[Larsen, Design and Application of Prodrugs, Drug Design and Development (Krogsgaard-Larsen et al., eds.), Harwood Academic Publishers (1991)] 또한 참조한다.
화합물 1의 전구약물의 특정 예로는 2010년 6월 28일자로 출원된 미국 가출원 제61/359,164호에 기재된 전구약물이 있다:
당업자는 본원에 기재된 화합물들이 상이한 용매화물 형태들, 예를 들면, 수화물로 존재할 수 있으나 여전히 생물학적 효능을 보유할 수 있다는 것도 인식할 것이다. 이러한 용매화물은 용매 분자가 결정화 공정 동안 화합물 분자의 결정성 격자 구조 내로 도입될 때 형성될 수도 있다. 본원에서 사용된 바와 같이, 어구 화합물 1의 "약학적으로 허용가능한 용매화물"은 용매 분자(들)를 함유하고 화합물 1의 생물학적 효능을 보유하는 화합물 1의 약학적으로 허용가능한 용매화물 형태를 지칭한다. 본원에서 사용된 바와 같이, 어구 화합물 1의 전구약물의 "약학적으로 허용가능한 용매화물"은 용매 분자(들)를 함유하고 화합물 1의 생물학적 효능을 보유하는 화합물 1의 전구약물의 약학적으로 허용가능한 용매화물 형태를 지칭한다.
하나 이상의 동위원소 농축 원자의 존재 면에서만 화합물 1 및 화합물 2와 상이한 화합물은 본 발명에 포함된다. 예를 들면, 중수소 또는 삼중수소에 의한 수소의 치환 또는 13C 또는 14C 풍부 탄소에 의한 탄소의 치환을 제외하고 본 구조를 갖는 화합물은 본 발명의 범위 내에 있다. 동위원소 풍부 화합물 2의 일부 예는 국제 특허출원 공개 제WO 2007/109080호 및 문헌[Maltais et al., J. of Medicinal Chemistry, "In Vitro and In Vivo Isotope Effects with Hepatitis C Protease Inhibitors: Enhanced Plasma Exposure of Deuterated Telaprevir versus Telaprevir in Rats" 2009; 52(24): 7993-8001]에서 발견될 수 있다.
화합물 1 및 화합물 2는 각각 독립적으로 하나 이상의 비대칭 탄소 원자를 함유할 수 있으므로 라세미체 및 라세미체 혼합물, 단일 거울상이성질체, 부분입체이성질체 혼합물 및 개별 부분입체이성질체로서 발생할 수 있다. 이들 화합물들의 모든 이러한 이성질체 형태들이 본 발명에 명확히 포함된다. 각각의 입체형성 탄소는 R 또는 S 배열을 가질 수 있다. 화합물 2의 N-프로필 측쇄에서의 D-이성질체 및 L-이성질체는 본 발명의 범위 내에 명확히 포함된다.
당업자는 본원에 기재된 화합물들이 상이한 다형성 형태들로 존재할 수 있다는 것을 인식할 것이다. 당업계에서 공지되어 있는 바와 같이, 다형성은 하나 초과의 상이한 결정성 또는 "다형성(polymorphic)" 종들로서 결정화하는 화합물의 능력이다. 다형체는 2개 이상의 상이한 정렬을 갖는 화합물의 고체 결정성 상(phase) 또는 고체 상태의 상기 화합물 분자의 다형성 형태이다. 임의의 주어진 화합물의 다형성 형태들은 동일한 화학식 또는 화학조성에 의해 정의되고 화학구조 면에서 2개의 상이한 화합물의 결정성 구조체들만큼 상이하다.
한 양태에서, 이하에 기재된 본 발명의 실시양태들 중 어느 하나에 있어서, VX-222는 화합물 1, 또는 이의 약학적으로 허용가능한 염, 용매화물 또는 전구약물, 또는 화합물 1의 전구약물의 용매화물이고; VX-950은 화합물 2, 또는 이의 약학적으로 허용가능한 염 또는 전구약물이다.
또 다른 양태에서, 이하에 기재된 본 발명의 실시양태들 중 어느 하나에 있어서, VX-222는 화합물 1, 또는 이의 약학적으로 허용가능한 염, 용매화물 또는 전구약물, 또는 화합물 1의 전구약물의 용매화물이고; VX-950은 화합물 2 또는 이의 약학적으로 허용가능한 염이다.
또 다른 양태에서, 이하에 기재된 본 발명의 실시양태들 중 어느 하나에 있어서, VX-222는 화합물 1, 또는 이의 약학적으로 허용가능한 염, 용매화물 또는 전구약물, 또는 화합물 1의 전구약물의 용매화물이고; VX-950은 화합물 2이다.
또 다른 양태에서, 이하에 기재된 본 발명의 실시양태들 중 어느 하나에 있어서, VX-222는 화합물 1, 또는 이의 약학적으로 허용가능한 염, 용매화물 또는 전구약물이고; VX-950은 화합물 2, 또는 이의 약학적으로 허용가능한 염 또는 전구약물이다.
또 다른 양태에서, 이하에 기재된 본 발명의 실시양태들 중 어느 하나에 있어서, VX-222는 화합물 1, 또는 이의 약학적으로 허용가능한 염, 용매화물 또는 전구약물이고; VX-950은 화합물 2 또는 이의 약학적으로 허용가능한 염이다.
또 다른 양태에서, 이하에 기재된 본 발명의 실시양태들 중 어느 하나에 있어서, VX-222는 화합물 1, 또는 이의 약학적으로 허용가능한 염, 용매화물 또는 전구약물이고; VX-950은 화합물 2이다.
또 다른 양태에서, 이하에 기재된 본 발명의 실시양태들 중 어느 하나에 있어서, VX-222는 화합물 1, 또는 이의 약학적으로 허용가능한 염 또는 용매화물이고; VX-950은 화합물 2, 또는 이의 약학적으로 허용가능한 염 또는 전구약물이다.
또 다른 양태에서, 이하에 기재된 본 발명의 실시양태들 중 어느 하나에 있어서, VX-222는 화합물 1, 또는 이의 약학적으로 허용가능한 염 또는 용매화물이고; VX-950은 화합물 2 또는 이의 약학적으로 허용가능한 염이다.
또 다른 양태에서, 이하에 기재된 본 발명의 실시양태들 중 어느 하나에 있어서, VX-222는 화합물 1, 또는 이의 약학적으로 허용가능한 염 또는 용매화물이고; VX-950은 화합물 2이다.
또 다른 양태에서, 이하에 기재된 본 발명의 실시양태들 중 어느 하나에 있어서, VX-222는 화합물 1 또는 이의 약학적으로 허용가능한 염이고; VX-950은 화합물 2, 또는 이의 약학적으로 허용가능한 염 또는 전구약물이다.
또 다른 양태에서, 이하에 기재된 본 발명의 실시양태들 중 어느 하나에 있어서, VX-222는 화합물 1 또는 이의 약학적으로 허용가능한 염이고; VX-950은 화합물 2 또는 이의 약학적으로 허용가능한 염이다.
또 다른 양태에서, 이하에 기재된 본 발명의 실시양태들 중 어느 하나에 있어서, VX-222는 화합물 1 또는 이의 약학적으로 허용가능한 염이고; VX-950은 화합물 2이다.
또 다른 양태에서, 이하에 기재된 본 발명의 실시양태들 중 어느 하나에 있어서, VX-222는 화합물 1이고; VX-950은 화합물 2, 또는 이의 약학적으로 허용가능한 염 또는 전구약물이다.
또 다른 양태에서, 이하에 기재된 본 발명의 실시양태들 중 어느 하나에 있어서, VX-222는 화합물 1이고; VX-950은 화합물 2 또는 이의 약학적으로 허용가능한 염이다.
또 다른 양태에서, 이하에 기재된 본 발명의 실시양태들 중 어느 하나에 있어서, VX-222는 화합물 1이고; VX-950은 화합물 2이다.
한 실시양태에서, 본 발명은 HCV에 감염된 환자에서 VX-222의 약동학을 개선하는 방법에 관한 것이다. 이 방법은 VX-222 및 VX-950을 상기 환자에게 동시투여하는 단계를 포함한다. VX-222의 개선된 약동학은 상기 환자의 혈장, 혈액 또는 간에서의 VX-222의 노출의 증가를 포함한다. 또 다른 실시양태에서, 본 발명은 HCV에 감염된 환자의 혈장에서 VX-222의 노출을 증가시키는 방법에 관한 것이다. 예를 들면, 혈장에서의 VX-222의 노출은 VX-222의 최저(trough) 수준(C최저), 평균 혈장 농도(C평균), 최대 혈장 농도(C최대) 또는 AUC(곡선 하의 면적) 값에 의해 측정될 수 있다. 본원에서 사용된 바와 같이, 용어 "최저 수준"(C최저)은 다음 투여 직전 혈장 중의 약물의 농도, 또는 2회 투여 사이의 최소 약물 농도를 지칭한다. 본원에서 사용된 바와 같이, 용어 "AUC"는 혈장(혈청 또는 혈액) 농도 대 시간 곡선 하의 면적을 지칭한다. 특정 실시양태에서, VX-222의 노출은 AUC0 -12(0시간 내지 12시간)의 값으로 표시된다. 또 다른 특정 실시양태에서, VX-222의 노출은 AUC0 -24(0시간 내지 24시간)의 값으로 표시된다.
VX-950의 동시투여에 의한 VX-222의 노출 증가는 VX-950 없이 투여된 VX-222의 노출을 VX-950과 함께 동시투여된 VX-222의 노출과 비교함으로써 측정할 수 있다. 한 특정 실시양태에서, VX-222의 노출은 VX-950 없이 투여된 VX-222의 노출에 비해 약 2배 내지 6배 증가한다. 한 특정 실시양태에서, VX-222의 노출은 VX-950 없이 투여된 VX-222의 노출에 비해 약 2배 내지 5배 증가한다. 한 특정 실시양태에서, VX-222의 노출은 VX-950 없이 투여된 VX-222의 노출에 비해 약 2배 또는 3배 증가한다. 몇몇 특정 실시양태들에서, 상기 증가는 VX-222의 혈장 노출에서의 증가이다.
본 발명에서, 각각의 투여에서 VX-950의 양은 약 100 mg 내지 약 1,500 mg, 약 300 mg 내지 약 1,500 mg, 약 500 mg 내지 약 1,500 mg, 약 300 mg 내지 약 1,250 mg, 약 450 mg, 약 750 mg, 또는 약 1,250 mg일 수 있다. 몇몇 특정 실시양태들에서, VX-950은 각각의 투여에서 약 750 mg의 양으로 투여된다. 몇몇 특정 실시양태들에서, VX-950은 각각의 투여에서 약 1,125 mg의 양으로 투여된다. VX-950의 양의 적합한 예는 국제 특허출원 공보 제WO 2008/144072호 및 제WO 06/050250호(이들의 전체 교시는 본원에 참고로 도입됨)에 기재되어 있다.
본 발명에서, 각각의 투여에서 VX-222의 양은 약 20 mg 내지 약 2,000 mg, 약 50 mg 내지 약 2,000 mg, 약 100 mg 내지 약 1,500 mg, 약 100 mg 내지 약 1,250 mg, 약 100 mg 내지 약 1,000 mg, 약 100 mg, 약 250 mg, 약 400 mg, 또는 약 750 mg일 수 있다. 몇몇 특정 실시양태에서, VX-222는 각각의 투여에서 약 100 mg의 양으로 투여된다. 몇몇 특정 실시양태에서, VX-222는 각각의 투여에서 약 250 mg의 양으로 투여된다. 몇몇 특정 실시양태에서, VX-222는 각각의 투여에서 약 400 mg의 양으로 투여된다. 몇몇 특정 실시양태에서, VX-222는 각각의 투여에서 약 750 mg의 양으로 투여된다. 몇몇 특정 실시양태에서, VX-222는 각각의 투여에서 약 1,000 mg의 양으로 투여된다. 몇몇 특정 실시양태에서, VX-222는 각각의 투여에서 약 1,500 mg의 양으로 투여된다. 몇몇 특정 실시양태에서, VX-222는 각각의 투여에서 약 500 mg의 양으로 투여된다. 몇몇 특정 실시양태에서, VX-222는 각각의 투여에서 약 1,125 mg의 양으로 투여된다. 몇몇 특정 실시양태에서, VX-222는 각각의 투여에서 약 1,250 mg의 양으로 투여된다.
또 다른 실시양태에서, 본 발명은 VX-222 및 VX-950을 HCV에 감염된 환자에게 투여하는 단계를 포함하는, HCV에 감염된 환자를 치료하는 방법에 관한 것이다. 특정 실시양태에서, VX-222는 각각의 투여에서 약 20 mg 내지 약 2,000 mg, 예컨대, 약 50 mg 내지 약 1,500 mg의 양으로 투여되고, VX-950은 각각의 투여에서 약 100 mg 내지 약 1,500 mg, 예컨대, 약 300 mg 내지 약 1,500 mg의 양으로 투여된다. 또 다른 특정 실시양태에서, VX-222는 각각의 투여에서 약 20 mg 내지 약 400 mg, 예컨대, 약 50 mg 내지 약 400 mg의 양으로 투여되고, VX-950은 각각의 투여에서 약 100 mg 내지 약 1,500 mg의 양으로 투여된다. 또 다른 특정 실시양태에서, VX-222는 각각의 투여에서 20 mg 이상 내지 400 mg 미만의 양으로 투여된다. 또 다른 특정 실시양태에서, VX-222는 각각의 투여에서 약 20 mg 내지 약 300 mg의 양으로 투여된다. 또 다른 특정 실시양태에서, VX-222는 각각의 투여에서 약 50 mg 내지 약 300 mg의 양으로 투여된다. 또 다른 특정 실시양태에서, VX-222는 각각의 투여에서 약 100 mg의 양으로 투여된다. 또 다른 특정 실시양태에서, VX-222는 각각의 투여에서 약 400 mg의 양으로 투여된다. 또 다른 특정 실시양태에서, VX-950은 각각의 투여에서 약 300 mg 내지 약 1,500 mg의 양으로 투여된다. 또 다른 특정 실시양태에서, VX-950은 각각의 투여에서 약 500 mg 내지 약 1,500 mg의 양으로 투여된다. 또 다른 특정 실시양태에서, VX-950은 각각의 투여에서 약 750 mg의 양으로 투여된다. 또 다른 특정 실시양태에서, VX-950은 각각의 투여에서 약 1,125 mg의 양으로 투여된다.
또 다른 실시양태에서, 본 발명은 VX-222를 투여하는 단계를 포함하는, HCV에 감염된 환자를 치료하는 방법에 관한 것으로서, 이때 VX-222를 약 20 mg 내지 약 2,000 mg의 양으로 투여한다. 구체적으로, VX-222의 양은 각각의 투여에서 약 100 mg 내지 약 1,500 mg, 약 100 mg 내지 약 1,250 mg, 약 100 mg 내지 약 1,000 mg, 약 100 mg, 약 250 mg, 약 400 mg, 약 500 mg, 약 750 mg, 약 1000 mg, 약 1,125 mg, 또는 약 1250 mg일 수 있다. 몇몇 실시양태에서, VX-222는 1일 1회 투여된다. 특정 실시양태에서, 상기 방법은 약 50 mg 내지 약 2,000 mg의 양으로 VX-222를 1일 1회 투여하는 단계를 포함한다. 몇몇 특정 실시양태에서, 투여되는 VX-222의 양은 1일 1회 약 100 mg이다. 몇몇 특정 실시양태에서, 투여되는 VX-222의 양은 1일 1회 약 250 mg이다. 몇몇 특정 실시양태에서, 투여되는 VX-222의 양은 1일 1회 약 400 mg이다. 몇몇 특정 실시양태에서, 투여되는 VX-222의 양은 1일 1회 약 500 mg이다. 몇몇 특정 실시양태에서, 투여되는 VX-222의 양은 1일 1회 약 750 mg이다. 몇몇 특정 실시양태에서, 투여되는 VX-222의 양은 1일 1회 약 1,000 mg이다. 몇몇 특정 실시양태에서, 투여되는 VX-222의 양은 1일 1회 약 1,250 mg이다. 일부 특정 실시양태들에서, 투여되는 VX-222의 양은 1일 1회 약 1,125 mg이다. 몇몇 특정 실시양태에서, 투여되는 VX-222의 양은 1일 1회 약 1,500 mg이다.
특정 실시양태에서, 본 발명은 VX-222를 약 20 mg 내지 약 2,000 mg(또는 약 50 mg 내지 약 2,000 mg, 또는 상기 논의된 임의의 특정 투여 섭생법)으로 1일 1회 투여하고 VX-222 이외의 하나 이상의 추가 HCV 약물을 추가로 투여하는 것을 이용하여 HCV에 감염된 환자를 치료하는 방법을 제공한다. VX-950, 인터페론 및 리바비린을 포함하는 상기 추가 HCV 약물의 적합한 예는 이하에 상세히 기재되어 있다. 추가 특정 실시양태에서, VX-950이 동시투여된다. VX-950의 양의 전형적인 예는 전술된 바와 같다. 또 다른 추가 특정 실시양태에서, 리바비린과 함께 또는 리바비린 없이 인터페론(예를 들면, 페길화된 인터페론, 예컨대, 페길화된 인터페론 알파-2a 또는 페길화된 인터페론 알파-2b)이 동시투여된다. 또 다른 추가 특정 실시양태에서, VX-950; 인터페론(예를 들면, 페길화된 인터페론, 예컨대, 페길화된 인터페론 알파-2a 또는 페길화된 인터페론 알파-2b); 및 리바비린이 동시투여된다.
또 다른 실시양태에서, 본 발명은 약 20 mg 내지 약 2,000 mg의 양으로 VX-222; 및 약 100 mg 내지 약 1,500 mg의 양으로 VX-950을 포함하는 약학적으로 허용가능한 조성물을 제공한다. 임의적으로, 약학적으로 허용가능한 담체도 포함될 수 있다. 특정 실시양태에서, 본 발명은 약 20 mg 내지 약 1,500 mg 또는 약 50 mg 내지 약 1,500 mg의 양으로 VX-222를 포함하는 약학적으로 허용가능한 조성물을 제공한다. 또 다른 특정 실시양태에서, 이들 약학 조성물들 중의 VX-950의 양은 약 300 mg 내지 약 1,500 mg, 약 300 mg 내지 약 1,250 mg, 약 300 mg 내지 약 1,000 mg, 약 300 mg 내지 약 750 mg 또는 약 375 mg이다. 또 다른 특정 실시양태에서, 이들 약학 조성물들 중의 VX-222의 양은 50 mg 이상 내지 400 mg 이하, 약 50 mg 내지 약 300 mg, 약 50 mg, 약 100 mg 또는 약 200 mg이다. 이들 약학 조성물들 각각은 예를 들면, 1일 1회, 2회 또는 3회 투여될 수 있다. 이들 조성물들 각각은 하나 이상의 투여 제형(예를 들면, 앰플, 캡슐, 크림, 유화액(emulsion), 유체, 입자, 적제(drop), 주사제, 현탁액, 정제, 산제)으로 존재할 수 있다. 이들 약학 조성물들 각각은 당업자에 의해 적절하다고 간주될 때 투여 제형에 따라 하나 이상의 경로(예를 들면, 경구, 관주, 주사, 국소 또는 비경구)에 의해 투여될 수 있다.
일반적으로, 전술된 본 발명의 방법에서, VX-222 및 VX-950 각각은 1일 1회(QD), 1일 2회(예를 들면, BID; q12h), 1일 3회(예를 들면, TID; q8h) 또는 1일 4회 독립적으로 투여될 수 있다. VX-222 및 VX-950 각각은 식품과 함께 또는 식품 없이 독립적으로 투여될 수 있다.
몇몇 실시양태에서, 본 발명의 방법은 VX-950을 환자에게 (a) 매회 약 450 mg의 양으로 8시간마다 1회씩 1일 3회 투여하거나; (b) 각각의 투여에서 약 750 mg의 양으로 8시간마다 1회씩 1일 3회 투여하거나; (c) 각각의 투여에서 약 1,125 mg의 양으로 12시간마다 1회씩 1일 2회 투여하거나; 또는 (d) 매회 약 1,250 mg의 양으로 12시간마다 1회씩 1일 2회 투여하는 단계를 포함한다.
몇몇 실시양태에서, 본 발명의 방법은 VX-950을 포함하는 조성물의 경구 투여량을 환자에게 투여하는 단계를 포함하고, 이때 상기 투여량은 투여 후 약 750 ng/㎖ 이상의 VX-950의 평균 혈장 농도(C평균)를 상기 환자에게 제공한다. 몇몇 실시양태에서, VX-950의 C평균은 약 1,000 ng/㎖ 또는 약 1,250 ng/㎖이다. 몇몇 실시양태에서, 상기 투여량은 본질적으로 약 750 mg의 VX-950을 함유한다. 몇몇 실시양태에서, C평균은 VX-950의 투여 후 3시간(예를 들면, 2시간 또는 1시간) 이내에 수득되거나 달성된다. 몇몇 실시양태에서, VX-950의 C평균은 약 24시간 이상(예를 들면, 5주 또는 12주)에 걸쳐 유지된다.
몇몇 실시양태에서, 본 발명의 방법은 VX-950을 환자에게 투여하는 단계를 포함하고, 이때 최저 VX-950 혈장 수준은 24시간에 걸쳐 최소한 약 750 ng/㎖, 800 ng/㎖, 900 ng/㎖ 또는 1,000 ng/㎖로 유지된다. 이론에 구속받고자 하는 것은 아니지만, 약 1,500 ng/㎖ 초과의 최저 수준은 본 발명에 의해 요구되지 않을 것으로 생각된다. 따라서, 약 750 ng/㎖, 800 ng/㎖, 900 ng/㎖, 1,000 ng/㎖ 내지 약 1,500 ng/㎖(특히, 1,000 ng/㎖ 내지 약 1,500 ng/㎖)의 최저 수준이 본 발명의 범위 내에 있다.
이상적으로, 본 발명의 방법이 HCV에 감염된 환자를 치료하는 단계를 포함할 때, 상기 방법은 VX-950의 치료 유효 혈장 농도를 상대적으로 신속하게 달성한 후, 유효 치료 반응이 달성되도록 상기 최저 수준을 유지하는 단계를 포함한다. 유효 치료 반응은 바람직하게는 a) 지속된 바이러스 반응을 달성하는 것; 및 b) 12주 이상(12주 또는 그 이상)까지 혈장 중의 검출불가능한 HCV RNA를 달성하는 것 중 하나 또는 둘다이다. 본원에서 사용된 바와 같이, "검출불가능한" HCV RNA는 HCV RNA가 현재 상업적으로 입수될 수 있는 분석에 의해 측정될 때, 바람직하게는 로슈 코바스 택만(Roche COBAS TaqMan)(상표명) HCV/HPS 분석에 의해 측정될 때 10 IU/㎖ 미만으로 존재한다는 것을 의미한다.
혈장 농도에서의 상대적으로 빠른 강하는 부하(loading) 투여량을 환자에게 투여함으로써 수득할 수 있다. 한 실시양태에서, 부하 투여량은 약 1,250 mg의 VX-950이다.
몇몇 실시양태에서, 본 발명의 방법은 VX-950을 동시투여하는 단계를 포함하고, VX-950은 약 750 mg의 VX-950을 함유하는 투여 제형(예를 들면, 약 375 mg의 VX-950을 함유하는 정제 2개)으로 투여되고, 상기 투여 제형은 1일 3회, 예를 들면, 8시간마다 1회(즉, q8h) 투여된다. 몇몇 실시양태에서, 본 발명의 방법은 VX-950을 투여하는 단계를 포함하고, VX-950은 약 1,125 mg의 VX-950을 함유하는 투여 제형(예를 들면, 약 375 mg의 VX-950을 함유하는 정제 3개)으로 투여되고, 상기 투여 제형은 1일 2회, 예를 들면, 12시간마다 1회(즉, q12h) 투여된다.
본 발명에서, VX-222 및 임의의 추가 HCV 약물(예컨대, VX-950; 리바비린과 함께 또는 리바비린 없이 인터페론(예를 들면, 페길화된 인터페론, 예컨대, 페길화된 인터페론 알파-2a 또는 페길화된 인터페론 알파-2b); 또는 VX-950, 인터페론(예를 들면, 페길화된 인터페론, 예컨대, 페길화된 인터페론 알파-2a 또는 페길화된 인터페론 알파-2b), 및 리바비린)은 전체 치료 기간에 걸쳐 독립적으로 투여될 수 있다. 이들 실시양태에서, VX-222 치료 기간과 추가 HCV 약물(들)의 치료 기간은 동일하다.
대안적으로, 몇몇 실시양태에서, VX-222 및 임의의 추가 HCV 약물(예컨대, VX-950; 리바비린과 함께 또는 리바비린 없이 인터페론(예를 들면, 페길화된 인터페론, 예컨대, 페길화된 인터페론 알파-2a 또는 페길화된 인터페론 알파-2b); 또는 VX-950, 인터페론(예를 들면, 페길화된 인터페론, 예컨대, 페길화된 인터페론 알파-2a 또는 페길화된 인터페론 알파-2b), 및 리바비린)은 두 시기, 즉 제1기 및 제2기에 걸쳐 독립적으로 투여될 수 있다. VX-222 및 임의의 추가 HCV 약물 각각은 제1기 또는 제2기에서 또는 이들 시기 둘다에서 투여될 수 있다. 몇몇 실시양태에서, VX-222는 제1기에서만 투여되고, 인터페론은 제1기 및 제2기 둘다에서 투여된다. 대안적으로, 몇몇 다른 실시양태에서, VX-222는 제2기에서만 투여되고, 인터페론은 제1기 및 제2기 둘다에서 투여된다. 몇몇 실시양태에서, VX-222 및 VX-950이 동시투여되고, VX-222 및 VX-950은 제1기에서만 또는 제2기에서만 투여된다. 몇몇 실시양태에서, VX-222, VX-950, 인터페론(예를 들면, 페길화된 인터페론, 예컨대, 페길화된 인터페론 알파-2a 또는 페길화된 인터페론 알파-2b), 및 리바비린이 동시투여되고, VX-222 및 VX-950은 제1기에서만 투여되고, 인터페론 및 리바비린은 제1기 및 제2기 둘다에서 투여된다.
제1기 및 제2기의 지속기간의 적합한 특정 예는 국제 특허출원 공보 제WO 2008/144072호에서 발견될 수 있다. 예를 들면, 제1기는 약 4주 이상, 또는 약 4주 내지 약 24주(예를 들면, 약 4주, 약 6주, 약 8주, 약 10주, 약 12주, 약 16주, 약 20주, 약 24주 등)의 기간일 수 있고, 제2기는 약 12주 이상일 수 있고, 예를 들면, 제2기는 약 12주 내지 약 36주일 수 있다. 일부 실시양태에서, 제2기는 약 12주이다. 다른 실시양태에서, 제2기는 약 24주이다. 다른 실시양태에서, 제2기는 약 36주이다. 일부 실시양태에서, 제1기와 제2기의 합계는 약 24주 내지 약 48주(예컨대, 약 24주, 36주 또는 48주)이다. 몇몇 실시양태에서, 제1기 및 제2기는 지속기간 면에서 동일할 수 있다.
몇몇 실시양태에서, 본 발명의 방법은 약 4주 내지 약 12주(예를 들면, 약 4주, 6주, 8주 또는 12주)의 기간 동안, 약 20주 내지 약 28주(예를 들면, 약 20주, 24주 또는 28주)의 기간 동안, 또는 약 8주 내지 약 24주(예를 들면, 약 8주, 12주, 16주 또는 24주)의 기간 동안 VX-222 및 인터페론을 독립적으로 동시투여하는 단계를 포함한다. 이들 실시양태 각각의 한 양태에서, VX-222 및 인터페론을 독립적으로 투여한 후(제1기), 약 4주 내지 약 36주(예를 들면, 약 8주 내지 약 36주, 약 8주 내지 약 24주, 또는 약 4주 내지 약 24주)의 기간 동안 (VX-222 없이) 인터페론을 투여한다(제2기). 특정 예시적인 섭생법은 총 약 24주의 치료 섭생법인 경우 약 8주 동안 VX-222 및 인터페론을 독립적으로 투여한 후, 약 16주 동안 (VX-222 없이) 인터페론을 투여하는 섭생법; 및 총 약 24주의 치료 섭생법인 경우 약 12주 동안 VX-222 및 인터페론을 독립적으로 투여한 후, 약 12주 동안 (VX-222 없이) 인터페론을 투여하는 섭생법을 포함한다. 이러한 섭생법들에서, 임의적으로 모든 시기 동안(제1기 및 제2기 둘다 동안) 또는 각각의 섭생법의 일부 시기 동안(예를 들면, 제1기 동안에만 또는 제2기 동안에만) 리바비린의 투여가 제공된다.
몇몇 실시양태에서, 본 발명의 방법은 약 4주 내지 약 12주(예를 들면, 약 4주, 6주, 8주 또는 12주)의 기간 동안, 약 20주 내지 약 28주(예를 들면, 약 20주, 24주 또는 28주)의 기간 동안, 또는 약 8주 내지 약 24주(예를 들면, 약 8주, 12주, 16주 또는 24주)의 기간 동안 VX-222 및 VX-950을 독립적으로 동시투여하는 단계를 포함한다. 이들 실시양태 각각의 한 양태에서, VX-222 및 VX-950을 독립적으로 투여한 후(제1기), 약 4주 내지 약 36주(예를 들면, 약 8주 내지 약 36주, 약 8주 내지 약 24주, 또는 약 4주 내지 약 24주)의 기간 동안 (VX-222 및 VX-950 없이) 인터페론 및 리바비린을 투여한다(제2기). 특정 예시적인 섭생법은 총 약 24주의 치료 섭생법인 경우 약 8주 동안 VX-222 및 VX-950을 독립적으로 투여한 후, 약 16주 동안 (VX-222 및 VX-950 없이) 인터페론 및 리바비린을 투여하는 섭생법; 및 총 약 24주의 치료 섭생법인 경우 약 12주 동안 VX-222 및 VX-950을 독립적으로 투여한 후, 약 12주 동안 (VX-222 및 VX-950 없이) 인터페론 및 리바비린을 투여하는 섭생법을 포함한다. 이러한 섭생법들에서, 임의적으로 VX-222 및 VX-950의 투여 시기 동안 인터페론 및 리바비린의 투여가 제공된다.
일부 실시양태에서, VX-222 및 임의적으로 VX-950 또는 인터페론이 약 12주 미만 동안 독립적으로 투여된다.
일부 실시양태에서, VX-222 및 임의적으로 VX-950 또는 인터페론이 약 8주 내지 12주 동안 독립적으로 투여된다.
일부 실시양태에서, VX-222 및 임의적으로 VX-950 또는 인터페론이 약 10주 동안 독립적으로 투여된다.
일부 실시양태에서, VX-222 및 임의적으로 VX-950 또는 인터페론이 약 10주 미만 동안 독립적으로 투여된다.
일부 실시양태에서, VX-222 및 임의적으로 VX-950 또는 인터페론이 약 2주 동안 독립적으로 투여된다.
다른 실시양태에서, VX-222 및 임의적으로 VX-950 또는 인터페론이 약 8주 미만 동안(또는 약 8주 동안), 약 6주 미만 동안(또는 약 6주 동안), 또는 약 4주 미만 동안(또는 약 4주 동안) 독립적으로 투여된다.
일부 실시양태에서, VX-222 및 VX-950이 약 12주(제1기) 동안 동시투여된 후, 임의적으로 인터페론 및 리바비린이 약 12주(제2기) 동안 독립적으로 동시투여된다.
일부 실시양태에서, VX-222, VX-950 및 인터페론이 약 12주 동안 동시투여된 후, 임의적으로 인터페론 및 리바비린이 약 12주(제2기) 동안 독립적으로 동시투여된다.
일부 실시양태에서, VX-222, VX-950, 인터페론 및 리바비린이 약 12주 동안 동시투여된 후, 임의적으로 인터페론 및 리바비린이 약 12주(제2기) 동안 독립적으로 동시투여된다.
일부 실시양태에서, VX-222, 인터페론 및 리바비린이 약 12주(제1기) 동안 동시투여된 후, 임의적으로 인터페론 및 리바비린이 약 12주(제2기) 동안 독립적으로 동시투여된다.
일부 실시양태에서, VX-222 및 VX-950이 약 12주(제1기) 동안 동시투여된 후, 임의적으로 인터페론 및 리바비린이 약 12주(제2기) 동안 동시투여된다.
일부 실시양태에서, VX-222, VX-950, 인터페론 및 리바비린이 약 12주(제1기) 동안 동시투여된 후, 임의적으로 인터페론 및 리바비린이 약 12주(제2기) 동안 동시투여된다.
일부 실시양태에서, VX-222, VX-950, 인터페론 및 리바비린이 약 12주(제1기) 동안 동시투여된 후, 임의적으로 인터페론 및 리바비린이 약 36주(제2기) 동안 동시투여된다.
몇몇 실시양태에서, 전술된 제1기 중 임의의 제1기는 12주 미만 동안 수행될 수 있고, 제2기는 약 12주 동안 수행될 수 있다. 대안적으로, 제1기는 약 12주 동안 수행될 수 있고, 제2기는 약 24주 동안 수행될 수 있다. 다른 양태에서, 제1기는 약 8주 동안 수행될 수 있고, 제2기는 약 36주 동안 수행될 수 있다. 다른 양태에서, 제1기는 약 4주 동안 수행될 수 있고, 제2기는 약 36주 동안 수행될 수 있다.
몇몇 실시양태에서, 전술된 제1기 중 임의의 제1기는 약 8주 동안 수행될 수 있고, 제2기는 약 16주 동안 수행될 수 있다. 대안적으로, 제1기는 약 8주 동안 수행될 수 있고, 제2기는 약 40주 동안 수행될 수 있다. 다른 양태에서, 제1기는 약 8주 동안 수행될 수 있고, 제2기는 약 40주 동안 수행될 수 있다.
몇몇 실시양태에서, 전술된 제1기 및 제2기 중 임의의 제1기 및 제2는 예를 들면, 제1기에서 (임의적으로 리바비린과 함께) 인터페론을 투여하고 제2기에서 (임의적으로 VX-950과 함께, 또는 VX-950, 인터페론 및 리바비린과 함께) VX-222를 투여하도록 서로 전환될 수 있다.
몇몇 실시양태에서, 전술된 본 발명의 방법은 총 약 12주 또는 약 24주 치료의 단기 치료 섭생법을 평가하는 데 있어서 반응에 따른 기준(response-guided criteria)을 이용한다. 이들 실시양태에서, 치료의 2주 및 8주에서 검출불가능한 (10 IC/㎖ 미만의) HCV RNA를 달성하는 환자들은 무작위로 선택되어 총 약 24주 치료의 경우 12주에서 모든 치료를 중단하거나 추가 12주의 Peg-IFN(페길화된 인터페론) 및 RBV(리바비린) 요법을 제공받고; 2주 및 8주에서 검출불가능한 HCV RNA를 달성하지 못한 환자들은 총 24주 치료의 경우 (VX-222 없이 또는 VX-222 및 VX-950 없이) 추가 12주의 Peg-IFN 및 RBV 요법을 제공받는다.
몇몇 실시양태에서, 전술된 본 발명의 방법은 총 약 12주, 약 24주 또는 약 36주 치료의 단기 치료 섭생법을 평가하는 데 있어서 반응에 따른 기준을 이용한다. 이들 실시양태에서, 치료의 2주 및 8주에서 검출불가능한 (10 IC/㎖ 미만의) HCV RNA를 달성하는 환자들은 12주에서 그들의 배정된 치료를 중단할 것이다. 2주 및 8주에서 검출불가능한 HCV RNA를 달성하지 못한 환자들은 총 약 24주 치료의 경우 (VX-222 없이 또는 VX-222 및 VX-950 없이) 추가 12주의 Peg-IFN 및 RBV 요법, 또는 총 36주 치료의 경우 (VX-222 없이 또는 VX-222 및 VX-950 없이) 추가 24주의 Peg-IFN 및 RBV 요법을 제공받는다. 몇몇 구체적인 실시양태에서, 본 방법은 (Peg-IFN 및 RBV 없이) VX-950 및 VX-222를 사용하고(예컨대, 1,125 mg의 VX-950을 1일 2회 사용하고 100 mg 또는 400 mg의 VX-222를 1일 2회 사용함), 치료의 2주 및 8주에서 검출불가능한 (10 IC/㎖ 미만의) HCV RNA를 달성하는 환자들은 12주에서 그들의 배정된 치료를 중단할 것이고; 2주 및 8주에서 검출불가능한 HCV RNA를 달성하지 못한 환자들은 총 36주 치료의 경우 (VX-222 없이 또는 VX-222 및 VX-950 없이) 추가 24주의 Peg-IFN 및 RBV 요법을 제공받는다. 몇몇 구체적인 실시양태에서, 본 방법은 VX-950, VX-222, Peg-IFN 및 RBV를 사용하고(예컨대, 1,125 mg의 VX-950을 1일 2회 사용하고, 100 mg 또는 400 mg의 VX-222를 1일 2회 사용하고, 180 mg의 Peg-IFN을 1주 당 1회 사용하고, 800 mg 내지 1,200 mg(예를 들면, 75 kg 미만의 체중을 갖는 환자의 경우 1,000 mg, 또는 75 kg 이상의 체중을 갖는 환자의 경우 1,200 mg)의 RBV를 1일 2회 사용함), 치료의 2주 및 8주에서 검출불가능한 (10 IC/㎖ 미만의) HCV RNA를 달성하는 환자들은 12주에서 그들의 배정된 치료를 중단할 것이고; 2주 및 8주에서 검출불가능한 HCV RNA를 달성하지 못한 환자들은 총 24주 치료의 경우 (VX-222 없이 또는 VX-222 및 VX-950 없이) 추가 12주의 Peg-IFN 및 RBV 요법을 제공받는다.
숙련된 실시자에 의해 인식될 바와 같이, 본 발명의 방법이 환자를 예방적으로 치료하기 위해 사용되고 있고 상기 환자가 C형 간염 바이러스에 감염되는 경우, 상기 방법은 상기 감염을 치료할 수 있다. 따라서, 본 발명의 한 실시양태는 환자에서 C형 간염 감염을 치료하거나 예방하는 방법을 제공한다.
C형 간염에 감염된 환자를 치료하는 것 이외에, 본 발명의 방법을 이용하여 환자가 C형 간염에 감염되는 것을 예방할 수 있다. 따라서, 본 발명의 한 실시양태는 전술된 바와 같이 임의적으로 임의의 추가 HCV 약물, 예컨대, VX-950; 인터페론; 인터페론 및 리바비린; 또는 VX-950, 인터페론 및 리바비린과 함께 VX-222를 환자에게 투여하는 단계를 포함하는, 상기 환자에서 C형 간염 바이러스 감염을 예방하는 방법을 제공한다.
본 발명의 방법은 면역조절제; 항-바이러스제; (VX-222 또는 VX-950 이외의) HCV 단백질분해효소 억제제; HCV 생존 주기에서 (NS3/4A 단백질분해효소 이외의) 또 다른 표적의 억제제; 내부 리보솜(ribosome) 도입 억제제; 광범위 스펙트럼 바이러스 억제제; 시토크롬 P-450 억제제; 및 이들의 조합물로부터 선택된 추가 약제를 포함하는 또 다른 성분의 투여도 포함할 수 있다. 또한, 상기 추가 약제는 바이러스 세포 도입 억제제로부터 선택된다.
따라서, 몇몇 실시양태에서, 상기 추가 약제는 또 다른 항-바이러스제, 바람직하게는, (VX-222 또는 VX-950 이외의) 항-HCV 약제이다. 이러한 항-바이러스제는 면역조절제, 예컨대, α-인터페론, β-인터페론 및 γ-인터페론 또는 티모신(thymosin), 페길화되고 유도체화된 인터페론-α 화합물, 및 티모신; 다른 항-바이러스제, 예컨대, 리바비린, 아만타딘(amantadine) 및 텔비부딘(telbivudine); C형 간염 단백질분해효소의 다른 억제제(NS2-NS3 억제제 및 NS3-NS4A 억제제); HCV 생존 주기에서 다른 표적의 억제제(헬리카제(helicase), 중합효소 및 금속단백질분해효소 억제제를 포함함); 내부 리보솜 도입 억제제; 광범위 스펙트럼 바이러스 억제제, 예컨대, IMPDH 억제제(예를 들면, 미국 특허 제5,807,876호, 제6,498,178호, 제6,344,465호 및 제6,054,472호, 및 국제 특허출원 공보 제WO 97/40028호, 제WO 98/40381호 및 제WO 00/56331호에 기재된 화합물; 및 이들의 마이코페놀산 및 유도체(VX-497, VX-148 및 VX-944를 포함하나 이들로 한정되지 않음)); 또는 이들의 임의의 조합물을 포함하나 이들로 한정되지 않는다.
다른 약제들(예를 들면, 비면역조절 또는 면역조절 화합물)이 본 발명의 화합물과 조합 사용될 수 있고 본원에 참고로 도입되는 국제 특허출원 공보 제WO 02/18369호(예를 들면, 제273면 제9행 내지 제22행 및 제274면 제4행 내지 제276면 제11행 참조(이의 개시내용은 본원에 참고로 구체적으로 도입됨))에 특정되어 있는 약제들을 포함하나 이들로 한정되지 않는다.
다른 약제들은 다양한 공개된 미국 특허출원들에 기재되어 있는 약제들을 포함한다. 이들 공보들은 특히, 간염의 치료를 위해 본 발명의 방법에서 VX-950과 조합 사용될 수 있는 화합물 및 방법의 추가 교시를 제공한다. 임의의 이러한 방법 및 조성물이 본 발명의 방법 및 조성물과 조합 사용될 수 있다고 생각된다. 간결함을 위해, 이들 공보들의 개시내용은 공개번호의 언급에 의해 언급되지만, 특히 화합물의 개시내용은 참고로 본원에 구체적으로 도입된다는 것을 주목해야 한다. 이러한 공보들의 예로는 미국 특허출원 공보 제20040058982호, 제20050192212호, 제20050080005호, 제20050062522호, 제20050020503호, 제20040229818호, 제20040229817호, 제20040224900호, 제20040186125호, 제20040171626호, 제200401 10747호, 제20040072788호, 제20040067901호, 제20030191067호, 제20030187018호, 제20030186895호, 제20030181363호, 제20020147160호, 제20040082574호, 제20050192212호, 제20050187192호, 제20050187165호, 제20050049220호 및 제20050222236호가 있다.
다른 약제들은 휴먼 게놈 사이언시스(Human Genome Sciences)로부터 입수가능한 알부페론(Albuferon)(상표명)(알부민-인터페론 알파); PEG-인트론(등록상표)(쉐링 코포레이션(Schering Corporation)(미국 뉴저지주 케닐워쓰 소재)으로부터 입수가능한 페그인터페론 알파-2b); 인트론-A(등록상표)(비라페론(VIRAFERON)(등록상표), 쉐링 코포레이션(미국 뉴저지주 케닐워쓰 소재)으로부터 입수가능한 인터페론 알파-2b); 리바비린(아이씨엔 파마슈티칼스 인코포레이티드(ICN Pharmaceuticals, Inc.)(미국 캘리포니아주 코스타 메사 소재)로부터 입수가능한 1-베타-D-리보푸라노실-1H-1,2,4-트리아졸-3-카르복스아미드; 머크 인덱스, 도입 8365, 제12판에 기재되어 있음); 레베트롤(REBETROL)(등록상표)(쉐링 코포레이션, 미국 뉴저지주 케닐워쓰 소재); 코페거스(COPEGUS)(등록상표)(호프만-라 로슈(Hoffmann-La Roche), 미국 뉴저지주 뉴틀리 소재); 페가시스(등록상표)(호프만-라 로슈(미국 뉴저지주 뉴틀리 소재)로부터 입수가능한 페그인터페론 알파-2a); 로페론(ROFERON)(등록상표)(호프만-라 로슈(미국 뉴저지주 뉴틀리 소재)로부터 입수가능한 재조합 인터페론 알파-2a); 베레포어(BEREFOR)(등록상표)(베링거 인겔하임 파마슈티칼 인코포레이티드(Boehringer Ingelheim Pharmaceutical, Inc.)(미국 코넥티컷주 리지필드 소재)로부터 입수가능한 인터페론 알파 2); 수미페론(SUMIFERON)(등록상표)(스미토모(Sumitomo)(일본 소재)로부터 입수가능한 중성 알파 인터페론, 예컨대, 수미페론의 정제된 블렌드); 웰페론(WELLFERON)(등록상표)(글락소 웰컴 리미티드(Glaxo Wellcome Ltd.)(영국 소재)로부터 입수가능한 인터페론 알파 n1); 알페론(ALFERON)(등록상표)(인터페론 사이언시스(Interferon Sciences)에 의해 제조되고 퍼듀 프레데릭 컴파니(Purdue Frederick Co.)(미국 코넥티컷주 소재)로부터 입수가능한 중성 알파 인터페론의 혼합물); α-인터페론; 중성 알파 인터페론 2a; 중성 알파 인터페론 2b; 페길화된 알파 인터페론 2a 또는 2b; 컨센서스(consensus) 알파 인터페론(암젠 인코포레이티드(Amgen Inc.), 미국 캘리포니아주 뉴버리 파크 소재); 레베트론(REBETRON)(등록상표)(쉐링 플로우(Schering Plough), 인터페론-알파 2B + 리바비린); 페길화된 인터페론 알파(Reddy, K.R. et al., "Efficacy and Safety of Pegylated (40-kd) Interferon alpha-2a Compared with Interferon alpha-2a in Noncirrhotic Patients with Chronic Hepatitis C," Hepatology. 33, 433-438 (2001)); 켄센서스 인터페론(인퍼겐(INFERGEN)(등록상표))(Kao, J.H., et al., "Efficacy of Consensus Interferon in the Treatment of Chronic Hepatitis," J. Gastroenterol. Hepatol. 15, 1418-1423 (2000)); 림프모구성(lymphoblastoid) 또는 "천연" 인터페론; 인터페론 타우(tau)(Clayette, P. et al., "IFN-tau, A New Interferon Type I with Antiretroviral activity" Pathol. Biol. (Paris) 47, 553-559 (1999)); 인터루킨-2(Davis, G.L. et al., "Future Options for the Management of Hepatitis C." Seminars in Liver Disease, 19. 103-112 (1999)); 인터루킨-6(Davis et al., "Future Options for the Management of Hepatitis C," Seminars in Liver Disease, 19, 103-112 (1999)); 인터루킨-12(Davis, G.L. et al., "Future Options for the Management of Hepatitis C." Seminars in Liver Disease, 19, 103-112 (1999)); 및 1형 헬퍼 T 세포 반응의 발달을 증강시키는 화합물(Davis et al., "Future Options for the Management of Hepatitis C." Seminars in Liver Disease, 19, 103-112 (1999))을 포함하나 이들로 한정되지 않는다. 단독으로 또는 토브라마이신(tobramycin) 및 이미퀴모드(Imiquimod)(3M Pharmaceuticals; Sauder, D.N. "Immunomodulatory and Pharmacologic Properties of Imiquimod," J. Am. Acad. Dermatol., 43 S6-11 (2000))와 함께 세포에서 인터페론의 합성을 자극하는 화합물(이중가닥 RNA를 포함하나 이로 한정되지 않음)도 포함된다(Tazulakhova, E.B. et al., "Russian Experience in Screening, analysis, and Clinical Application of Novel Interferon Inducers" J. Interferon Cytokine Res., 21, 65-73). 국제 특허출원 공보 제WO 02/18369호, 특히 제272면 제15행 내지 제273면 제8행(이 개시내용은 본원에 참고로 구체적으로 도입됨)도 참조한다.
시토크롬 P450 모노옥시게나제(monooxygenase)("CYP") 억제제의 적합한 예로는 리토나비르(ritonavir)(국제 특허출원 공보 제WO 94/14436호), 케토코나졸(ketoconazole), 트롤레안도마이신(troleandomycin), 4-메틸 피라졸, 시클로스포린(cyclosporin), 클로메티아졸(clomethiazole), 시메티딘(cimetidine), 이트라코나졸(itraconazole), 플루코나졸(fluconazole), 미코나졸(miconazole), 플루복스아민(fluvoxamine), 플루옥세틴(fluoxetine), 네파조돈(nefazodone), 세르트랄린(sertraline), 인디나비르(indinavir), 넬피나비르(nelfinavir), 암프레나비르(amprenavir), 포삼프레나비르(fosamprenavir), 사퀴나비르(saquinavir), 로피나비르(lopinavir), 델라비르딘(delavirdine), 에리쓰로마이신(erythromycin), VX-944, 및 VX-497이 있으나 이들로 한정되지 않는다. 바람직한 CYP 억제제는 리토나비르, 케토코나졸, 트롤레안도마이신, 4-메틸 피라졸, 시클로스포린 및 클로메티아졸을 포함한다.
본 발명의 한 실시양태는 CYP3A4 억제제를 동시투여하는 방법을 제공한다.
본 발명에서 사용될 수 있는 인터페론의 적합한 예로는 휴먼 게놈 사이언시스로부터 입수가능한 알부페론(상표명)(알부민-인터페론 알파); PEG-인트론(등록상표)(쉐링 코포레이션(미국 뉴저지주 케닐워쓰 소재)으로부터 입수가능한 페그인터페론 알파-2b); 인트론-A(등록상표)(비라페론(등록상표), 쉐링 코포레이션(미국 뉴저지주 케닐워쓰 소재)으로부터 입수가능한 인터페론 알파-2b); 페가시스(등록상표)(호프만-라 로슈(미국 뉴저지주 뉴틀리 소재)로부터 입수가능한 페그인터페론 알파-2a); 로페론(등록상표)(호프만-라 로슈(미국 뉴저지주 뉴틀리 소재)로부터 입수가능한 재조합 인터페론 알파-2a); 베레포어(등록상표)(베링거 인겔하임 파마슈티칼 인코포레이티드(미국 코넥티컷주 리지필드 소재)로부터 입수가능한 인터페론 알파 2); 수미페론(등록상표)(스미토모(일본 소재)로부터 입수가능한 중성 알파 인터페론, 예컨대, 수미페론의 정제된 블렌드); 웰페론(등록상표)(글락소 웰컴 리미티드(영국 소재)로부터 입수가능한 인터페론 알파 n1); 알페론(등록상표)(인터페론 사이언시스에 의해 제조되고 퍼듀 프레데릭 컴파니(미국 코넥티컷주 소재)로부터 입수가능한 중성 알파 인터페론의 혼합물); 알파-인터페론; 중성 알파 인터페론 2a; 중성 알파 인터페론 2b; 페길화된 알파 인터페론 2a 또는 2b; 컨센서스 알파 인터페론(암젠 인코포레이티드, 미국 캘리포니아주 뉴버리 파크 소재); 레베트론(등록상표)(쉐링 플로우, 인터페론-알파 2B + 리바비린); 페길화된 인터페론 알파(Reddy, K.R. et al., "Efficacy and Safety of Pegylated (40-kd) Interferon alpha-2a Compared with Interferon alpha-2a in Noncirrhotic Patients with Chronic Hepatitis C," Hepatology, 33, 433-438 (2001)); 켄센서스 인터페론(인퍼겐(등록상표)(Kao, J.H., et al., "Efficacy of Consensus Interferon in the Treatment of Chronic Hepatitis," J. Gastroenterol. Hepatol., 15, pp. 1418-1423 (2000)); 림프모구성 또는 "천연" 인터페론; 인터페론 타우(Clayette, P. et al., "IFN-tau, A New Interferon Type I with Antiretroviral activity," Pathol. Biol. (Paris) 47, pp. 553-559 (1999)); 및 이식가능한 듀로스(Duros)(등록상표)를 통해 오메가 인터페론을 전달하는 오메가 듀로스(Omega Duros)(등록상표)(인타르시아 쎄라퓨틱스 인코포레이티드(Intarcia Therapeutics, Inc.), 미국 캘리포니아주 마운틴 뷰 소재)가 있다.
몇몇 실시양태에서, 본 발명의 방법은 리바비린과 함께 또는 리바비린 없이 인터페론을 동시투여하는 단계를 이용한다. 구체적으로, 인터페론은 페길화된 인터페론(Peg-IFN)이다. 보다 구체적으로, 페길화된 인터페론은 페길화된 인터페론 알파, 예컨대, 페길화된 인터페론 알파-2a 또는 페길화된 인터페론 알파-2b이다.
일반적으로, VX-222 및 임의의 추가 HCV 약물(예컨대, VX-950, 인터페론 및 리바비린)은 별도로 또는 함께 독립적으로 투여될 수 있다. 일반적으로, VX-222 및 VX-950은 독립적으로 경구 투여될 수 있거나, 비경구 투여될 수 있거나, 설하 투여될 수 있거나, 흡입 분무에 의해 투여될 수 있거나, 국소 투여될 수 있거나, 직장 투여될 수 있거나, 비강 투여될 수 있거나, 협측 투여될 수 있거나, 질내 투여될 수 있거나, 또는 이식된 저장소(reservoir)를 통해 투여될 수 있다. 인터페론은 경구 투여되는 형태가 개발되고 있다 하더라도 전형적으로 경구 투여되지 않는다. 그럼에도 불구하고, 본원에서 어떠한 것도 본 발명의 방법 또는 조합물을 임의의 특정 투여 제형 또는 섭생법으로 한정하지 않는다. 숙련된 실시자에 의해 인식되는 바와 같이, 인터페론의 투여량은 전형적으로 IU(예를 들면, 약 400만 IU 내지 약 1,200만 IU) 단위로 측정된다. 인터페론은 ㎍ 단위로도 투여될 수 있다. 예를 들면, Peg-인트론(등록상표)의 표준 투여량은 약 1.0 ㎍/kg/주 내지 1.5 ㎍/kg/주이고, 페가시스(등록상표)의 표준 투여량은 약 180 ㎍/주이다. 리바비린은 전형적으로 경구 투여되고, 리바비린의 정제 제형은 현재 상업적으로 입수가능하다. 리바비린 정제(예를 들면, 약 200 mg 정제)의 일반적인 표준 1일 투여량은 약 800 mg 내지 약 1,200 mg이다. 예를 들면, 리바비린 정제는 75 kg 미만의 체중을 갖는 대상체의 경우 약 1,000 mg, 또는 75 kg 이상의 체중을 갖는 대상체의 경우 약 1,200 mg으로 투여된다. 그럼에도 불구하고, 본원에서 어떠한 것도 본 발명의 방법 또는 조합물을 임의의 특정 투여 제형 또는 섭생법으로 한정하지 않는다. 전형적으로, 리바비린은 그의 상업적 제품 표지에 기재된 투여 섭생법에 따라 투여될 수 있다.
일부 실시양태에서, VX-222 및 VX-950(이것이 사용되는 경우)은 각각 독립적으로 경구 또는 정맥내 투여된다. 또 다른 일부 실시양태에서, VX-222 및 VX-950(이것이 사용되는 경우)은 각각 독립적으로 경구 투여된다.
몇몇 실시양태에서, 추가 치료제는 시토크롬 P-450 억제제이다. CYP 억제제의 경우, 1일 약 0.001 mg/kg(체중) 내지 약 200 mg/kg(체중)의 투여량 수준이 전형적일 것이다. 1일 약 0.1 mg/kg 내지 약 50 mg/kg 또는 약 1.1 mg/kg 내지 약 25 mg/kg의 투여량 수준이 보다 전형적일 것이다.
몇몇 실시양태에서, 추가 치료제는 리토나비르이다. 리토나비르의 특정 투여 제형에 대해서는 미국 특허 제6,037,157호 및 여기서 인용된 문헌들(미국 특허 제5,484,801호, 미국 특허출원 제08/402,690호, 및 국제 특허출원 공보 제WO 95/07696호 및 제WO 95/09614호)을 참조한다.
일반적으로, 본 발명에서 하나 이상의 치료제(VX-950, 인터페론 및 리바비린, 및 이들의 임의의 조합물을 포함함)의 "투여" 또는 "동시투여"는 각각의 활성 치료제를 동일한 투여 제형 또는 상이한 투여 제형으로 투여하는 것을 포함한다. 상이한 투여 제형으로 투여되는 경우, 활성 치료제는 상이한 시간에서 투여될 수 있거나, 동시에 투여될 수 있거나, 또는 다른 투여 제형의 투여를 중심으로 임의의 시간 내에서 투여될 수 있다. 별도의 투여 제형은 임의의 순서로 투여될 수 있다. 즉, 임의의 투여 제형이 다른 투여 제형 전에, 다른 투여 제형과 함께 또는 다른 투여 제형 후에 투여될 수 있다.
일반적으로, 다양한 투여 제형, 제제 유형 및 투여 빈도, 및 이들의 조합이 본 발명에서 이용될 수 있다. 임의의 적합한 투여 제형 및 제제 유형이 본 발명에서 이용될 수 있다.
몇몇 실시양태에서, 본 발명의 방법은 약 100 mg의 VX-222를 함유하는 투여 제형(예를 들면, 2개의 50 mg의 VX-222 캡슐)으로 VX-222를 투여하는 단계를 포함하고, 상기 투여 제형은 1일 1회, 1일 2회, 예를 들면, 12시간마다 1회(즉, q12h), 또는 1일 3회, 예를 들면, 8시간마다 1회(즉, q8h) 투여된다. 몇몇 실시양태에서, 본 발명의 방법은 약 400 mg의 VX-222를 함유하는 투여 제형(예를 들면, 2개의 200 mg의 VX-222 캡슐)으로 VX-222를 투여하는 단계를 포함하고, 상기 투여 제형은 1일 1회, 1일 2회, 예를 들면, 12시간마다 1회(즉, q12h), 또는 1일 3회, 예를 들면, 8시간마다 1회(즉, q8h) 투여된다. 몇몇 실시양태에서, 본 발명의 방법은 약 750 mg의 VX-222를 함유하는 투여 제형(예를 들면, 3개의 200 mg의 VX-222 캡슐 및 3개의 50 mg의 VX-222 캡슐)으로 VX-222를 투여하는 단계를 포함하고, 상기 투여 제형은 1일 1회, 1일 2회, 예를 들면, 12시간마다 1회(즉, q12h), 또는 1일 3회, 예를 들면, 8시간마다 1회(즉, q8h) 투여된다. 몇몇 실시양태에서, 본 발명의 방법은 약 1,500 mg의 VX-222를 함유하는 투여 제형(예를 들면, 7개의 200 mg의 VX-222 캡슐 및 1개의 50 mg의 VX-222 캡슐)으로 VX-222를 투여하는 단계를 포함하고, 상기 투여 제형은 1일 1회 투여된다.
본 발명의 전술된 방법들 중 어느 한 방법의 한 양태에서, VX-950을 포함하는 조성물의 경구 투여량이 이를 필요로 하는 환자에게 투여되고, 이때 상기 투여량은 투여 후 약 750 ng/㎖ 이상의 VX-950의 평균 혈장 농도(C평균)를 상기 환자에게 제공한다. 몇몇 특정 실시양태에서, VX-950의 C평균은 약 1,000 ng/㎖ 또는 약 1,250 ng/㎖이다. 몇몇 특정 실시양태에서, 상기 투여량은 본질적으로 약 750 mg의 VX-950을 함유한다. 몇몇 특정 실시양태에서, 상기 C평균은 VX-950의 투여 후 3시간 이내(예를 들면, 2시간 또는 1시간)에 수득되거나 달성된다. 몇몇 특정 실시양태에서, VX-950의 C평균은 약 24시간 이상(예를 들면, 5주 또는 12주)에 걸쳐 유지된다. 또 다른 양태에서, 상기 경구 투여량은 24시간에 걸쳐 약 750 ng/㎖의 최저 혈장 VX-950 수준 최소치를 상기 환자에게 제공한다. 몇몇 특정 실시양태에서, 상기 투여 제형은 24시간에 걸쳐 약 800 ng/㎖(예를 들면, 약 900 ng/㎖ 또는 약 1,000 ng/㎖)의 최저 혈장 VX-950 수준 최소치를 유지하도록 투여된다. 또 다른 양태에서, 상기 경구 투여량에 의해 치료 유효 혈장 농도가 수득되고, 일정 최저 수준이 유지되고, 이때 최저 VX-950 혈장 수준은 24시간에 걸쳐 약 750 ng/㎖, 800 ng/㎖, 900 ng/㎖ 또는 1000 ng/㎖의 최소치로 유지된다. 일부 특정 실시양태에서, VX-950의 최저 수준은 약 750 ng/㎖, 800 ng/㎖, 900 ng/㎖, 1000 ng/㎖ 내지 약 1,500 ng/㎖(예를 들면, 1,000 ng/㎖ 내지 약 1,500 ng/㎖)이다. 일부 특정 실시양태에서, VX-950의 최저 수준은 약 750 ng/㎖, 800 ng/㎖, 900 ng/㎖, 1000 ng/㎖ 내지 약 2,500 ng/㎖(특히, 1,000 ng/㎖ 내지 약 2,500 ng/㎖)이다. VX-950을 인간에게 전달하기 위한 투여 제형도 제공되고, 이때 상기 투여 제형은 VX-950을 포함하고, 상기 투여 제형은 24시간 동안 1회 이상 투여된 경우 24시간에 걸쳐 약 750 ng/㎖, 800 ng/㎖, 900 ng/㎖ 또는 1000 ng/㎖ 이상 내지 24시간에 걸쳐 약 2,500 ng/㎖(예를 들면, 1,000 ng/㎖ 내지 약 2,500 ng/㎖, 또는 1,000 ng/㎖ 내지 약 1,500 ng/㎖)인 최저 혈장 VX-950 수준을 유지한다. 또 다른 양태에서, 상기 경구 투여량은 24시간에 걸쳐 약 30,000 hr*ng/㎖ 내지 약 120,000 hr*ng/㎖의 VX-950의 평균 AUC(0-24시간)를 상기 환자에게 제공한다. 일부 특정 실시양태에서, VX-950의 AUC(0-24시간)는 약 50,000 hr*ng/㎖ 내지 약 120,000 hr*ng/㎖이다. 일부 특정 실시양태에서, VX-950의 AUC(0-24시간)는 약 60,000 hr*ng/㎖ 내지 약 100,000 hr*ng/㎖이다. 일부 특정 실시양태에서, VX-950의 AUC(0-24시간)는 약 60,000 hr*ng/㎖ 내지 약 90,000 hr*ng/㎖이다. 국제 특허출원 공보 제WO 2008/144072호 및 제WO 2005/25517호에 개시된 VX-950의 다른 특정 투여 섭생법도 본 발명에서 이용될 수 있다.
본 발명의 전술된 방법 중 어느 한 방법의 한 양태에서, VX-222를 포함하는 조성물의 경구 투여량이 이를 필요로 하는 환자에게 투여되고, 이때 상기 투여량은 투여 후 약 750 ng/㎖ 이상의 VX-222의 평균 최대 혈장 농도(C최대)를 상기 환자에게 제공한다. 몇몇 특정 실시양태에서, VX-222의 C최대는 약 1,000 ng/㎖ 이상이다. 몇몇 특정 실시양태에서, VX-222의 C최대는 약 750 ng/㎖ 내지 약 15,000 ng/㎖이다. 몇몇 특정 실시양태에서, VX-222의 C최대는 약 1,000 ng/㎖ 내지 약 15,000 ng/㎖이다. 몇몇 특정 실시양태에서, VX-222의 C최대는 약 3,000 ng/㎖ 내지 약 15,000 ng/㎖이다. 몇몇 특정 실시양태에서, VX-222의 C최대는 약 3,000 ng/㎖ 내지 약 12,000 ng/㎖이다. 또 다른 양태에서, VX-222를 포함하는 조성물의 경구 투여량이 이를 필요로 하는 환자에게 제공되고, 이때 상기 투여량은 24시간에 걸쳐 약 5,000 hr*ng/㎖ 내지 약 150,000 hr*ng/㎖의 VX-222의 평균 AUC(0-24시간)를 상기 환자에게 제공한다. 몇몇 특정 실시양태에서, VX-222의 AUC(0-24시간)는 약 5,000 hr*ng/㎖ 내지 약 125,000 hr*ng/㎖이다. 몇몇 특정 실시양태에서, VX-222의 AUC(0-24시간)는 약 20,000 hr*ng/㎖ 내지 약 100,000 hr*ng/㎖이다. 몇몇 특정 실시양태에서, VX-222의 AUC(0-24시간)는 약 20,000 hr*ng/㎖ 내지 약 80,000 hr*ng/㎖이다.
VX-222 및 임의의 추가 약제는 별도의 투여 제형으로 제제화될 수 있다. 대안적으로, 환자에게 투여되는 투여 제형의 수를 감소시키기 위해, VX-222 및 임의의 추가 약제를 임의의 조합물로 함께 제제화할 수 있다. 임의의 별도의 투여 제형들을 동일한 시간 또는 상이한 시간에서 투여될 수 있다. 투여 제형들은 생물학적 효과가 유리하도록 일정 시간 이내에 투여되어야 한다는 것을 이해해야 한다.
예를 들면, 본 발명에 따른 VX-222 및 VX-950 각각의 양은 단일 투여 제형 또는 하나 초과의 투여 제형으로 투여될 수 있다. 별도의 투여 제형으로 투여되는 경우, 각각의 투여 제형은 거의 동시에 투여된다.
약학적으로 허용가능한 염이 본 발명에서 활성 치료제로서 사용되는 경우, 이들 염은 전형적으로 무기산 또는 유기산으로부터 유도된다. 이러한 산염에는 하기 염들이 포함된다: 아세트산염, 아디프산염, 알긴산염, 아스파르트산염, 벤조산염, 벤젠 설폰산염, 중황산염, 부티르산염, 시트르산염, 캄포르산염, 캄포르 설폰산염, 시클로펜탄-프로피온산염, 디글루콘산염, 도데실황산염, 에탄설폰산염, 푸마르산염, 글루코헵탄산염, 글리세로인산염, 반황산염, 헵탄산염, 헥산산염, 염화수소산염, 브롬화수소산염, 요오드화수소산염, 2-하이드록시에탄설폰산염, 젖산염, 말레산염, 메탄설폰산염, 2-나프탈렌설폰산염, 니코틴산염, 옥살산염, 파모산염, 펙틴산염, 과황산염, 3-페닐-프로피온산염, 피크르산염, 피발산염, 프로피온산염, 석신산염, 주석산염, 티오시안산염, 토실산염 및 운데칸산염. 염기 염은 암모늄염, 알칼리금속염, 예컨대, 나트륨염 및 칼륨염, 알칼리토금속염, 예컨대, 칼슘염 및 마그네슘염, 유기 염기에 의해 형성된 염, 예컨대, 디시클로헥실아민염, N-메틸-D-글루카민, 및 아미노산, 예컨대, 아르기닌, 라이신 등에 의해 형성된 염을 포함한다.
또한, 염기성 질소 함유 기는 저급 알킬 할라이드, 예컨대, 메틸, 에틸, 프로필 및 부틸 클로라이드, 브로마이드 및 요오다이드; 디알킬 설페이트, 예컨대, 디메틸, 디에틸, 디부틸 및 디아밀 설페이트, 장쇄 할라이드, 예컨대, 데실, 라우릴, 미리스틸 및 스테아릴 클로라이드, 브로마이드 및 요오다이드, 아르알킬 할라이드, 예컨대, 벤질 및 펜에틸 브로마이드 등과 같은 물질에 의해 사급화될 수 있다. 이로써, 물 또는 오일 가용성 또는 분산성 생성물이 수득된다.
원하는 경우, 본 발명에서 치료제(들)의 변형을 이용함으로써, 예를 들면, 적절한 작용기를 부착시킴으로써 선택적 생물학적 성질을 증강시킬 수도 있다. 이러한 변형은 당업계에서 공지되어 있고 주어진 생물학적 시스템(혈액, 림프 시스템, 중추신경계) 내로의 생물학적 침투를 증가시키는 변형, 경구 이용률을 증가시키는 변형, 가용성을 증가시켜 주사에 의한 투여를 가능하게 하는 변형, 대사를 변화시키는 변형 및 배출 속도를 변화시키는 변형을 포함한다.
전형적으로, 치료제(들)가 단독으로 투여될 수 있다 하더라도 본 발명에서 사용되는 VX-222 및 VX-950을 포함하는 하나 이상의 치료제는 약학 조성물에 포함된다. "약학 조성물"은 투여 방식 및 투여 제형의 성질에 따라 본원에 개시된 치료제; 및 약학적으로 허용가능한 담체, 희석제, 코팅제, 보조제, 부형제 또는 비히클, 예컨대, 보존제, 충전제, 붕해제, 습윤제, 유화제, 유화액 안정화제, 현탁제, 등장제, 감미제, 풍미제, 방향제, 착색제, 항균제, 항진균제, 다른 치료제, 윤활제, 흡수 지연제 또는 촉진제, 및 분배제를 포함하는 군으로부터 선택된 하나 이상의 성분을 포함하는 조성물을 의미한다. 상기 조성물은 정제, 환제, 과립제, 산제, 수성 용액 또는 현탁액, 주사가능한 용액, 엘릭시르 또는 시럽의 형태로 제공될 수 있다.
예시적인 현탁제는 에톡실화된 이소스테아릴 알코올, 폴리옥시에틸렌 소르비톨 및 소르비탄 에스테르, 미세결정성 셀룰로스, 메타수산화알루미늄, 벤토나이트, 한천(agar)-한천 및 트라가칸쓰, 또는 이들 물질들의 혼합물을 포함한다. 미생물의 작용의 방지를 위한 예시적인 항균제 및 항진균제는 파라벤, 클로로부탄올, 페놀, 소르브산 등을 포함한다. 예시적인 등장제는 당, 염화나트륨 등을 포함한다. 흡수를 연장하기 위한 예시적인 흡수 지연제는 모노스테아르산알루미늄 및 젤라틴을 포함한다. 흡수를 증강시키기 위한 예시적인 흡수 촉진제는 디메틸 설폭시드 및 관련 유사체를 포함한다. 예시적인 담체, 희석제, 용매, 비히클, 가용화제, 유화제 및 유화액 안정화제는 물, 클로로포름, 수크로스, 에탄올, 이소프로필 알코올, 에틸 카르보네이트, 에틸 아세테이트, 벤질 알코올, 테트라하이드로푸르푸릴 알코올, 벤질 벤조에이트, 폴리올, 프로필렌 글리콜, 1,3-부틸렌 글리콜, 글리세롤, 폴리에틸렌 글리콜, 디메틸포름아미드, 트윈 60, 스판&콤매트(Span&commat) 80, 세토스테아릴 알코올, 미리스틸 알코올, 글리세릴 모노스테아레이트 및 나트륨 라우릴 설페이트, 소르비탄의 지방산 에스테르, 식물성 오일(예컨대, 면실유, 땅콩유, 옥수수 배아유, 올리브유, 피마자유 및 참깨유) 및 주사가능한 유기 에스테르, 예컨대, 에틸 올레에이트 등, 또는 이들 물질들의 적합한 혼합물을 포함한다. 예시적인 부형제는 락토스, 유당, 시트르산나트륨, 탄산칼슘 및 인산이칼슘을 포함한다. 예시적인 붕해제는 전분, 알긴산 및 일부 착물 규산염을 포함한다. 예시적인 윤활제는 스테아르산마그네슘, 나트륨 라우릴 설페이트, 탈크 및 고분자량 폴리에틸렌 글리콜을 포함한다.
상기 약학 조성물에서 치료제 이외의 물질의 선택은 일반적으로 치료제의 화학적 성질, 예컨대, 가용성, 구체적인 투여 방식 및 약학적 관행에서 준수되어야 할 규정에 따라 결정된다. 예를 들면, 윤활제, 예컨대, 스테아르산마그네슘, 나트륨 라우릴 설페이트 및 탈크와 조합된 부형제, 예컨대, 락토스, 시트르산나트륨, 탄산칼슘, 인산이칼슘 및 붕해제, 예컨대, 전분, 알긴산 및 일부 착물 규산염이 정제의 제조를 위해 사용될 수 있다.
상기 약학 조성물은 다채로운 형태, 예컨대, 정제, 환제, 과립제, 산제, 수성 용액 또는 현탁액, 주사가능한 용액, 엘릭시르 또는 시럽으로 제공될 수 있다.
"액체 투여 제형"은 환자에게 투여될 치료제의 투여량이 액체 형태, 예를 들면, 약학적으로 허용가능한 유화액, 용액, 현탁액, 시럽 및 엘릭시르로 존재한다는 것을 의미한다. 상기 액체 투여 제형은 활성 화합물 이외에 당업계에서 통상적으로 사용되는 불활성 희석제, 예컨대, 용매, 가용화제 및 유화제를 함유할 수 있다.
고체 조성물은 락토스 또는 유당과 같은 부형제 및 고분자량 폴리에틸렌 글리콜 등을 사용하는 연질 충전된 젤라틴 캡슐 및 경질 충전된 젤라틴 캡슐에서 충전제로서도 사용될 수 있다.
수성 현탁액이 사용되는 경우, 상기 현탁액은 유화제 또는 현탁을 촉진하는 물질을 함유할 수 있다.
유화액 약학 조성물의 오일상은 공지된 방식에 의해 공지된 성분들로부터 구성될 수 있다. 상기 상은 단순히 유화제(에멀전트(emulgent)로도 공지되어 있음)를 포함할 수 있지만, 바람직하게는 하나 이상의 유화제와 지방 또는 오일의 혼합물 또는 하나 이상의 유화제와 지방 및 오일 둘다의 혼합물을 포함한다. 바람직하게는, 친수성 유화제가 안정화제로서 작용하는 친유성 유화제와 함께 포함된다. 오일 및 지방 둘다를 포함하는 것도 바람직하다. 더불어, 안정화제(들)와 함께 또는 안정화제(들) 없이 유화제(들)가 유화 왁스를 구성하고, 오일 및 지방과 함께 상기 왁스가 크림 제제의 오일 분산된 상을 형성하는 유화 연고 베이스(base)를 구성한다.
원하는 경우, 크림 베이스의 수성상은 예를 들면, 30%(중량/중량) 이상의 다가 알코올, 즉 2개 이상의 하이드록실 기를 갖는 알코올, 예컨대, 프로필렌 글리콜, 부탄 1,3-디올, 만니톨, 소르비톨, 글리세롤 및 폴리에틸렌 글리콜(PEG 400을 포함함) 및 이들의 혼합물을 포함할 수 있다. 국소 제제는 바람직하게는 피부 또는 다른 영향받은 영역을 통한 활성 성분의 흡수 또는 침투를 증강시키는 화합물을 포함할 수 있다.
제제에 적합한 오일 또는 지방의 선택은 원하는 미용 성질의 달성에 기초한다. 따라서, 상기 크림은 바람직하게는 튜브 또는 다른 용기로부터의 누출을 피하기에 적합한 경도를 갖는 비유지성, 비얼룩성 및 세척가능성 제품이어야 한다.
직쇄 또는 분지쇄 일염기성 또는 이염기성 알킬 에스테르, 예컨대, 디이소프로필 미리스테이트, 데실 올레에이트, 이소프로필 팔미테이트, 부틸 스테아레이트, 2-에틸헥실 팔미테이트 또는 크로다몰(Crodamol) CAP로서 공지된 분지쇄 에스테르의 블렌드가 사용될 수 있다. 이들은 요구되는 성질에 따라 단독 또는 조합 사용될 수 있다. 대안적으로, 고융점 지질, 예컨대, 백색 연질 파라핀 및/또는 액체 파라핀 또는 다른 광물유가 사용될 수 있다.
일반적으로, 본원에 개시된 치료제/약학 조성물은 경구, 흡입, 직장, 비강, 협측, 설하, 질내, 결장내, 비경구(피하, 근육내, 정맥내, 피내, 척수강내 및 경막외를 포함함), 낭내(intracisternal) 및 복강내 투여를 포함하는 국소 또는 전신 투여에 의해 인간 및 동물에게 적합한 제제로 투여될 수 있다. 바람직한 경로는 예를 들면, 수용자의 상태에 따라 변경될 수 있다는 것을 인식할 것이다.
"약학적으로 허용가능한 투여 제형"은 본원에 개시된 치료제(VX-950을 포함함)의 투여 제형을 지칭하고 예를 들면, 정제, 산제, 엘릭시르, 시럽, 현탁액을 포함하는 액체 제제, 분무제, 흡입 정제, 로젠지, 유화액, 용액, 과립, 캡슐 및 좌제뿐만 아니라 주사용 액체 제제(리포좀 제제를 포함함)도 포함한다. 기법 및 제제는 일반적으로 문헌[Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, PA, latest edition]에서 발견될 수 있다.
"경구 투여에 적합한 제제"는 예정된 양의 활성 성분을 각각 함유하는 분리된 유닛, 예컨대, 캡슐, 카세제 또는 정제; 산제 또는 과립제; 수성 액체 또는 비수성 액체 중의 용액 또는 현탁액; 또는 수중유 액체 유화액 또는 유중수 액체 유화액으로서 제공될 수 있다. 활성 성분은 볼루스(bolus), 연약(electuary) 또는 페이스트로서 제공될 수도 있다.
정제는 임의적으로 하나 이상의 보조 성분을 사용하여 압착 또는 성형하여 제조할 수 있다. 압착된 정제는 임의적으로 결합제, 윤활제, 불활성 희석제, 보존제, 표면 활성제 또는 분산제와 혼합된 활성 성분을 적합한 기계에서 자유 유동 형태, 예컨대, 산제 또는 과립제로 압착함으로써 제조할 수 있다. 성형된 정제는 적합한 기계에서 불활성 액체 희석제에 의해 습윤화된 분말 화합물의 혼합물을 성형함으로써 제조할 수 있다. 상기 정제를 임의적으로 코팅할 수 있거나 선을 새겨넣을 수 있고 내부에 존재하는 활성 성분의 서방출 또는 조절 방출을 제공하도록 제제화할 수 있다.
직장 투여를 위한 고체 조성물은 공지된 방법에 따라 제제화되고 하나 이상의 본 발명의 화합물을 함유하는 좌제를 포함한다.
원하는 경우 및 보다 효과적인 분포를 위해, 본원에 개시된 치료제를 서방출 또는 표적화된 전달 시스템, 예컨대, 생체상용성 및 생체분해성 중합체 매트릭스(예를 들면, 폴리(d, 1-락티드 코-글리콜라이드), 리포솜(liposome) 및 미세구 내에 미세캡슐화하거나 부착하고 피하 또는 근육내 데포(depot)로 지칭되는 기법으로 피하 또는 근육내 주사하여 2주 이상의 기간 동안 화합물(들)의 연속적인 서방출을 제공할 수 있다. 상기 치료제는 예를 들면, 박테리아 보유 필터를 통해 여과하거나, 또는 사용 직전에 멸균수 또는 일부 다른 멸균 주사가능한 매질에 용해될 수 있는 멸균 고체 조성물 형태의 멸균제를 도입함으로써 멸균할 수 있다.
"비강 또는 흡입 투여에 적합한 제제"는 환자에게 비강 투여되기에 적합하거나 흡입에 의해 투여되기에 적합한 형태로 존재하는 제제를 의미한다. 상기 제제는 입자 크기가 예를 들면, 1 마이크론 내지 500 마이크론(5 마이크론씩 증가하는 20 마이크론 내지 500 마이크론의 입자 크기, 예컨대, 30 마이크론, 35 마이크론 등을 포함함)인 분말 형태의 담체를 함유할 수 있다. 예를 들면, 비강 분무제 또는 비강 적제로서 투여하기에 적합한 제제(이때, 담체는 액체임)는 활성 성분의 수성 또는 유성 용액을 포함한다. 에어로졸 투여에 적합한 제제는 통상적인 방법에 따라 제조될 수 있고 다른 치료제와 함께 전달될 수 있다. 흡입 요법은 계량된 투여량 흡입기에 의해 용이하게 투여된다.
"경구 투여에 적합한 제제"는 환자에게 경구 투여되기에 적합한 형태로 존재하는 제제를 의미한다. 상기 제제는 예정된 양의 활성 성분을 각각 함유하는 분리된 유닛, 예컨대, 캡슐, 카세제 또는 정제; 산제 또는 과립제; 수성 액체 또는 비수성 액체 중의 용액 또는 현탁액; 또는 수중유 액체 유화액 또는 유중수 액체 유화액으로서 제공될 수 있다. 치료제는 볼루스, 연약 또는 페이스트로서 제공될 수도 있다.
"비경구 투여에 적합한 제제"는 환자에게 비경구 투여되기에 적합한 형태로 존재하는 제제를 의미한다. 상기 제제는 멸균되어 있고, 현탁제, 비후제, 항산화제, 완충제, 세균성장저해제(bacteriostats), 및 상기 제제를 등장성 상태로 만드는 용질을 함유할 수 있고 대상 수용자의 혈액에 적합하게 조절된 pH를 갖는 유화액, 현탁액, 수성 주사 용액 및 비수성 주사 용액을 포함한다.
"직장 또는 질내 투여에 적합한 제제"는 환자에게 직장 또는 질내 투여되기에 적합한 형태로 존재하는 제제를 의미한다. 상기 제제는 바람직하게는 본 발명의 화합물을 적합한 비자극성 부형제 또는 담체, 예컨대, 코코아 버터, 폴리에틸렌 글리콜 또는 좌제 왁스와 혼합하여 제조할 수 있는 좌제로서, 통상의 온도에서 고체이지만 체온에서 액체이므로 직장 또는 질강 내에서 용융되어 활성 성분을 방출하는 좌제의 형태로 존재한다.
"전신 투여에 적합한 제제"는 환자에게 전신 투여되기에 적합한 형태로 존재하는 제제를 의미한다. 상기 제제는 바람직하게는 경근육(transmuscular), 정맥내, 복강내 및 피하를 포함하는 주사에 의해 투여된다. 주사를 위해, 본 발명의 화합물은 액체 용액, 바람직하게는 생리학적으로 상용가능한 완충제, 예컨대, 행크 용액 또는 링거 용액에 의해 제제화된다. 또한, 상기 화합물은 고체 형태로 제제화될 수 있고 사용 직전에 재용해될 수 있거나 현탁될 수 있다. 동결건조된 형태도 포함된다. 또한, 전신 투여는 경점막 또는 경피 수단에 의해 수행될 수 있거나, 또는 상기 화합물은 경구 투여될 수 있다. 경점막 또는 경피 투여를 위해, 투과될 장벽에 적합한 침투제가 제제에서 사용된다. 이러한 침투제는 당업계에서 일반적으로 공지되어 있고 예를 들면, 경점막 투여를 위한 담즙산염 및 푸시드산 유도체를 포함한다. 또한, 세제를 사용하여 투과를 촉진할 수 있다. 경점막 투여는 예를 들면, 비강 분무제 또는 좌제의 사용을 통해 수행될 수 있다. 경구 투여를 위해, 상기 화합물은 통상적인 경구 투여 제형, 예컨대, 캡슐, 정제 및 강장제(tonics)로 제제화된다.
"국소 투여에 적합한 제제"는 환자에게 국소 투여되기에 적합한 형태로 존재하는 제제를 의미한다. 상기 제제는 당업계에서 일반적으로 공지되어 있는 바와 같이 국소 연고, 고약(salve), 산제, 분무제 및 흡입제, 겔(물 또는 알코올 기재) 또는 크림으로서 제공될 수 있거나, 또는 경피 장벽을 통한 화합물의 조절 방출을 가능하게 하는 패치 형태로의 도포를 위해 매트릭스 베이스 내로 도입될 수 있다. 연고로 제제화되는 경우, 활성 성분은 파라핀성 또는 수혼화성 연고 베이스와 함께 사용될 수 있다. 대안적으로, 활성 성분은 수중유 크림 베이스와 함께 크림으로 제제화될 수 있다. 눈에의 국소 투여에 적합한 제제는 활성 성분이 적합한 담체, 특히 활성 성분을 위한 수성 용매에 용해되어 있거나 현탁되어 있는 안적제를 포함한다. 구강 내로의 국소 투여에 적합한 제제는 풍미 성분, 통상적으로 수크로스 및 아카시아 또는 트라가칸쓰 중의 활성 성분을 포함하는 로젠지; 불활성 성분, 예컨대, 젤라틴 및 글리세린 또는 수크로스 및 아카시아 중의 활성 성분을 포함하는 향정(pastilles); 및 적합한 액체 담체 중의 활성 성분을 포함하는 구강세척제를 포함한다.
"고체 투여 제형"은 본원에 개시된 치료제의 투여 제형이 고체 제형, 예를 들면, 캡슐, 정제, 환제, 산제, 당의정 또는 과립제라는 것을 의미한다. 이러한 고체 투여 제형에서, 본 발명의 화합물은 하나 이상의 불활성 통상적 부형제(또는 담체), 예컨대, 시트르산나트륨 또는 인산이칼슘 또는 (a) 충전제 또는 증량제, 예를 들면, 전분, 락토스, 수크로스, 글루코스, 만니톨 및 규산, (b) 결합제, 예를 들면, 카르복시메틸셀룰로스, 알리그네이트(alignate), 젤라틴, 폴리비닐피롤리돈, 수크로스 및 아카시아, (c) 보습제, 예를 들면, 글리세롤, (d) 붕해제, 예를 들면, 한천-한천, 탄산칼슘, 감자 또는 타피오카 전분, 알긴산, 일부 착물 규산염 및 탄산나트륨, (e) 용해 지연제, 예를 들면, 파라핀, (f) 흡수 가속화제, 예를 들면, 사급 암모늄 화합물, (g) 습윤화제, 예를 들면, 세틸 알코올 및 글리세롤 모노스테아레이트, (h), 흡착제, 예를 들면, 고령토 및 벤토나이트, (i) 윤활제, 예를 들면, 탈크, 스테아르산칼슘, 스테아르산마그네슘, 고체 폴리에틸렌 글리콜, 나트륨 라우릴, (j) 불투명화제, 또는 (k) 완충제, 및 장관의 일정 부분에서 본 발명의 화합물(들)을 지연된 방식으로 방출시키는 물질과 혼합된다.
단일 투여 제형을 생성하기 위해 담체 및/또는 부형제 물질과 조합될 수 있는 활성 치료제(들)의 양은 치료될 숙주 및 구체적인 투여 방식에 따라 변경될 것이다. 전형적인 제제는 약 5%(중량/중량) 내지 약 95%(중량/중량)의 활성 치료제를 함유할 것이다. 바람직하게는, 이러한 제제는 약 20% 내지 약 80%의 치료제를 함유한다.
제제는 제약 분야에서 잘 공지되어 있는 방법들 중 임의의 방법에 의해 단일 투여 제형으로 제조될 수 있다. 이러한 방법은 활성 성분을, 하나 이상의 보조 성분을 구성하는 담체와 혼합하는 단계를 포함한다. 일반적으로, 제제는 활성 성분을 액체 담체 또는 미분된 고체 담체, 또는 이들 둘다와 균일하고 철저하게 혼합한 후 필요에 따라 생성물을 성형함으로써 제조한다.
제제는 유닛 투여량 또는 다중 투여량 용기, 예를 들면, 밀봉된 앰플 및 탄성체 마개를 가진 바이알 내에 제공되어 있을 수 있고 사용 직전에 멸균 액체 담체, 예를 들면, 주사용수의 첨가만을 요구하는 냉동건조된(동결건조된) 상태로 저장될 수 있다. 전술된 종류의 멸균 산제, 과립제 및 정제로부터 즉석 주사 용액 및 현탁액이 제조될 수 있다.
본원에 개시된 약학 조성물 및 투여 제제는 바람직하게는 생체내 사용을 위한 것이다. 그럼에도 불구하고, 이것은 임의의 목적을 위한 상기 약학 조성물 및 투여 제제의 사용을 한정하기 위한 것이 아니다. 예를 들면, 본원에 개시된 약학 조성물로 전처리된 생물학적 물질도 본 발명에서 사용될 수 있다. 이러한 생물학적 물질은 혈액 및 이의 성분, 예컨대, 혈장, 혈소판, 혈액 세포의 하위집단 등; 기관, 예컨대, 신장, 간, 심장, 폐 등; 정자 및 난자; 골수 및 이의 성분; 및 환자 내로 관주될 다른 유체, 예컨대, 식염수, 덱스트로스 등을 포함하나 이들로 한정되지 않는다.
임의의 구체적인 환자에 대한 특정 투여량 및 치료 섭생법은 사용되는 구체적인 화합물의 활성, 연령, 체중, 일반적인 건강, 성별, 식이, 투여 시간, 배출 속도, 약물 조합, 치료하는 의사의 판단 및 치료될 구체적인 질환의 심각도, 이전 치료 이력, 동반이환 또는 동반된 약물치료, 기준 바이러스 부하, 인종, 질환의 지속기간, 간 기능의 상태 및 간 섬유증/경화증의 정도, 및 치료의 목적(이식전 순환하는 바이러스의 제거 또는 바이러스 박멸)을 포함하는 다양한 인자에 의해 좌우될 것이라는 것도 이해할 것이다. 또한, 활성 성분의 양은 구체적인 기재된 화합물, 및 조성물 중의 추가 항-바이러스제의 존재 또는 부재 및 성질에 좌우될 것이다.
본 발명의 치료 섭생법 및 투여 제형에 따라, VX-950 및 인터페론의 공요법(co-therapy)은 샘플 또는 환자 내의 바이러스 부하를 감소시키기에 효과적이고, 이때 상기 바이러스는 바이러스 생존 주기에 필요한 (또는 본 발명의 방법을 수행하기에 효과적인 양으로) NS3/4A 세린 단백질분해효소를 코딩한다. 따라서, 본 발명은 바이러스의 생존 주기에 필요한, 바이러스에 의해 코딩된 NS3/4A 세린 단백질분해효소를 특징으로 하는 바이러스에 감염된 환자에게 전술된 바와 같이 VX-950 및 인터페론을 (임의적으로 하나 이상의 추가 치료제과 함께) 투여하여 상기 환자를 치료하는 방법도 제공한다.
본 발명에서, 본 발명에서 사용되는 각각의 활성 치료제는 식품과 함께 또는 식품 없이 환자에게 독립적으로 투여될 수 있다. 몇몇 실시양태에서, VX-222 및/또는 임의의 추가 HCV 약물은 식품과 함께 독립적으로 투여된다. 본원에서 사용된 바와 같이, 어구 "식품과 함께"는 활성 치료제(들)가 식품 소비의 약 90분 이내에, 예를 들면, 식품을 섭취한 후 약 90분 이내에 및 섭취 기간 전 약 90분 이내에 투여된다는 것을 의미한다. 몇몇 실시양태에서, 활성 치료제(들)는 식품 소비 전 약 30분 이내 또는 식품 소비 후 30분 이내에 투여된다. 식품 소비가 요구되지 않고 임의의 유형의 식품(고지방 또는 저지방)이 소비될 수 있지만, 고지방 식사는 저지방 식사에 비해 개선된 흡수를 제공할 수 있다. 본원에서 사용된 바와 같이, "고지방"은 칼로리의 약 30% 이상이 지방에 의해 제공되는 식품을 의미한다. 일부 실시양태에서, 식품은 약 50 이상의 칼로리를 갖는다. 또 다른 일부 실시양태에서, 식품은 약 100 이상의 칼로리를 갖는다. 또 다른 일부 실시양태에서, 식품은 약 50 내지 100 이상의 칼로리 내지 약 3,000 이하의 칼로리, 약 2,000 이하의 칼로리 또는 약 1,000 이하의 칼로리를 갖는다. 또 다른 일부 실시양태에서, 식품은 지방으로부터 제공된 칼로리를 그의 총 칼로리의 약 30% 이상으로 포함한다.
일반적으로 본 발명에서, 치료는 효과적인 치료 반응이 달성되도록 HCV 바이러스 감염을 완전히 박멸하거나 그의 심각도를 감소시킬 수 있다. 효과적인 치료 반응은 예를 들면, a) 지속된 바이러스 반응을 달성하는 것; 및 b) 약 12주 이상(약 12주 또는 그 이상)까지 혈장 중의 검출불가능한 HCV RNA를 달성하는 것 중 하나 또는 둘다일 수 있다. 용어 "검출불가능한"은 상기 정의된 바와 같다.
다른 실시양태에서, 본 발명의 방법은 투여 후 환자 내의 HCV RNA의 수준이 치료 전 수준보다 약 2 log10 이상(예를 들면, 약 4 log10 이상) 더 낮도록 HCV에 감염된 환자를 치료한다.
몇몇 실시양태에서, 부하 투여량을 환자에게 투여함으로써 바이러스 혈장 농도의 상대적으로 빠른 강하를 수득할 수 있다. 한 실시양태에서, 상기 부하 투여량은 약 1,250 mg의 VX-950이다.
몇몇 실시양태에서, 본 발명의 방법은 4주 RVR 및 12주 검출불가능한 상태를 달성할 수 있다.
일반적으로, 본 발명에서 "환자"는 포유동물, 특히 인간을 포함한다.
일부 실시양태에서, 본 발명의 방법은 유전형 1 C형 간염 바이러스에 감염된 환자의 치료를 제공한다. 일반적으로, 유전형 1 HCV 감염은 치료하기에 가장 어려운 HCV 균주이고 미국에서 가장 우세한 균주인 것으로 생각된다.
유리하게는, HCV 치료 무경험 환자 및 이전에 치료받은 환자 둘다 본 발명의 방법으로부터 이익을 얻는다. 의심의 여지를 없애기 위해, 본 발명의 방법에 따라 치료될 수 있는 환자는 비반응 환자, 반발 환자, 재발 환자 및 돌발(breakthrough) 환자를 포함하는, HCV 치료가 시도된 적 없거나 실패한 환자를 포함한다. 일부 실시양태에서, 본 발명의 방법은 HCV 치료 무경험 환자를 치료한다. 본원에서 사용된 바와 같이, "HCV 치료 무경험" 환자는 상기 환자가 미국 식품의약청(FDA) 또는 미국 FDA와 동등한 임의의 다른 미국 또는 국제 관청에 의해 승인된 또는 승인받고자 하는 약물(들)을 사용한 이전의 HCV 치료를 받지 않았다는 것을 의미한다.
본 발명의 방법은 만성 또는 급성 요법으로서 이용될 수 있다. 숙련된 실시자에 의해 인식될 바와 같이, 본 발명의 방법이 환자를 예방적으로 치료하는 데에 이용되고 있고 상기 환자가 C형 간염 바이러스에 감염되는 경우, 상기 방법은 상기 감염을 치료할 수 있다. 따라서, 본 발명의 한 실시양태는 환자에서 C형 간염 감염을 치료하거나 예방하는 방법을 제공한다.
환자의 혈장 중의 VX-222 및 VX-950 농도를 측정하기 위한 분석은 당업계에서 잘 공지되어 있는 방법에 의해 수행될 수 있다. 예를 들면, 문헌[Wasley, A. et al., Semin. Liver Dis., 20: 1-16, 2000]; 문헌[Alter, H.J. et al., Semin. Liver Dis., 20: 17-35, 2000]; 문헌[Brown, R.S. Jr. et al., Liver Transpl., 9: S10-S13, 2003]; 문헌[DeFrancesco, R. et al., Nature, 436(7053): 953-960, 2005]; 문헌[Bowen, D.G. et al., J. Hepatol., 42: 408-417, 2005]; 문헌[Hoofnagle, J.H., Hepatology, 36: S21-S29, 2002]; 문헌[Brown, R.S. Jr. et al., Nature, 436 (7053): 973-978, 2005]; 및 문헌[Chisari, F.V., Nature, 436(7053): 930-932, 2005]을 참조한다.
본 발명의 방법과 관련된 투여는 만성 또는 급성 요법으로서 이용될 수 있다. 담체 물질과 조합되어 단일 투여 제형을 생성할 수 있는 활성 성분의 양은 치료될 숙주 및 구체적인 투여 방식에 따라 변경될 것이다. 전형적인 제제는 약 5%(중량/중량) 내지 약 95%(중량/중량)의 활성 화합물을 함유할 것이다. 바람직하게는, 이러한 제제는 약 20% 내지 약 80%의 활성 화합물을 함유한다.
환자의 상태가 개선되었을 때, 필요에 따라 유지 투여량의 본 발명의 화합물, 조성물 또는 조합물이 투여될 수 있다. 그 후, 증상의 함수로서 투여량 또는 투여 빈도, 또는 이들 둘다를 개선된 상태가 유지되는 수준까지 감소시킬 수 있고, 증상이 원하는 수준까지 완화되었을 때 치료를 중단할 것이다. 그러나, 환자는 질환 증상의 임의의 재발시 장기간의 간헐적 치료를 요구할 수 있다.
임의의 구체적인 환자에 대한 특정 투여량 및 치료 섭생법은 사용되는 구체적인 화합물의 활성, 연령, 체중, 일반적인 건강, 성별, 식이, 투여 시간, 배출 속도, 약물 조합, 치료하는 의사의 판단 및 치료될 구체적인 질환의 심각도, 이전 치료 이력, 동반이환 또는 동반된 약물치료, 기준 바이러스 부하, 인종, 질환의 지속기간, 간 기능의 상태 및 간 섬유증/경화증의 정도, 및 치료의 목적(이식전 순환하는 바이러스의 제거 또는 바이러스 박멸)을 포함하는 다양한 인자에 의해 좌우될 것이라는 것도 이해할 것이다. 또한, 활성 성분의 양은 구체적인 기재된 화합물, 및 조성물 중의 추가 항-바이러스제의 존재 또는 부재 및 성질에 좌우될 것이다.
또 다른 실시양태에 따라, 본 발명은 바이러스의 생존 주기에 필요한, 바이러스에 의해 코딩된 NS3/4A 세린 단백질분해효소를 특징으로 하는 바이러스에 감염된 환자에게 본 발명의 약학적으로 허용가능한 조성물을 투여하여 상기 환자를 치료하는 방법을 제공한다. 바람직하게는, 본 발명의 방법은 HCV 감염으로부터 고통을 받는 환자를 치료하는 데에 이용된다. 이러한 치료는 상기 바이러스 감염을 완전히 박멸할 수 있거나 이의 심각도를 감소시킬 수 있다. 바람직하게는, 상기 환자는 포유동물이다. 보다 바람직하게는, 상기 환자는 인간이다.
본원의 투여량은 바람직하게는 생체내 사용을 위한 것이다. 그럼에도 불구하고, 이것은 임의의 목적을 위한 예를 들면, VX-222 또는 VX-950의 이들 양의 사용을 한정하기 위한 것이 아니다. 또 다른 실시양태에서, 본 발명은 환자에게 투여될 생물학적 물질을, 본 발명의 화합물을 포함하는 약학적으로 허용가능한 조성물과 접촉시키는 단계를 포함하는, 상기 생물학적 물질을 전처리하는 방법을 제공한다. 이러한 생물학적 물질은 혈액 및 이의 성분, 예컨대, 혈장, 혈소판, 혈액 세포의 하위집단 등; 기관, 예컨대, 신장, 간, 심장, 폐 등; 정자 및 난자; 골수 및 이의 성분; 및 환자 내로 관주될 다른 유체, 예컨대, 식염수, 덱스트로스 등을 포함하나 이들로 한정되지 않는다.
또한, 본 발명은 VX-222, VX-950 및 약학적으로 허용가능한 담체, 보조제 또는 비히클을 조합하는 단계를 포함하는, VX-222, VX-950 및 약학적으로 허용가능한 담체, 보조제 또는 비히클을 포함하는 조성물의 제조 방법을 제공하고, 이때 상기 조성물 중의 VX-222 및 VX-950 각각의 투여량은 본 발명의 임의의 실시양태에 따라 독립적이다. 본 발명의 대안적 실시양태는 상기 조성물이 본원에 기재된 하나 이상의 추가 약제를 포함하는 것인 상기 방법을 제공한다.
약학 조성물은 단일 포장 내에 치료의 전과정을 함유하는 "환자 팩", 통상적으로 블리스터 팩으로 환자에게 처방될 수도 있다. 환자 팩은 환자가 전통적인 처방전에서 통상적으로 결여되어 있는, 환자 팩 내에 함유된 포장 삽입물에 항상 접근할 수 있다는 점에서 약사가 대용량 공급물로부터 환자의 약물 공급물을 나누어 주는 전통적인 처방전에 비해 이점을 갖는다. 포장 삽입물의 포함은 의사의 지시에 대한 환자의 순응도를 개선하는 것으로 밝혀졌다.
본 발명의 정확한 이용을 환자에게 설명하는 포장 삽입물을 내부에 함유하는 단일 환자 팩 또는 제제 각각의 환자 팩에 의한 본 발명의 조합물의 투여가 본 발명의 원하는 추가 특징이라는 것을 이해할 것이다.
본 발명의 추가 양태에 따라, (본 발명에 따른 투여량의) VX-222, 및 본 발명의 조합물의 사용에 대한 설명서를 함유하는 정보 삽입물을 포함하는 팩이 제공된다. 본 발명의 임의의 조성물, 투여 제형, 치료 섭생법 또는 다른 실시양태가 약학 팩으로 제공될 수 있다. 본 발명의 대안적 실시양태에서, 상기 약학 팩은 본원에 기재된 바와 같은 하나 이상의 추가 약제를 추가로 포함한다. 상기 추가 약제 또는 약제들은 동일한 팩 또는 별도의 팩 내에 제공될 수 있다.
본 발명의 또 다른 양태는 약학 성분 각각의 단일 또는 복수의 약학 제제; 저장 동안 및 투여 전에 상기 약학 제제(들)를 수용하는 용기; 및 HCV 감염의 치료 또는 예방에 효과적인 방식으로 약물 투여를 수행하기 위한 설명서를 포함하는, HCV 감염의 치료 또는 HCV 감염의 예방에서 사용될 (또는 본 발명의 또 다른 방법에서 사용될) 환자용 포장 키트를 포함한다.
따라서, 본 발명은 일정한 투여량의 VX-222(및 임의적으로 추가 약제)의 동시적 또는 순차적 투여를 위한 키트를 제공한다. 전형적으로, 이러한 키트는 예를 들면, 약학적으로 허용가능한 담체(및 하나 또는 복수의 약학 제제) 중의 화합물 각각 및 임의적 추가 약제(들)로 구성된 조성물 및 상기 동시적 또는 순차적 투여에 대한 서면 설명서를 포함할 것이다.
또 다른 실시양태에서, 자가 투여를 위한 하나 이상의 투여 제형; 저장 동안 및 사용 전에 상기 투여 제형을 수용하기 위한 용기 수단, 바람직하게는 밀봉된 용기 수단; 및 환자가 약물 투여를 수행하기 위한 설명서를 함유하는 포장된 키트가 제공된다. 상기 설명서는 전형적으로 포장 삽입물, 표지, 및/또는 상기 키트의 다른 구성요소 상의 서면 설명서일 것이고, 상기 투여 제형 또는 제형들은 본원에 기재된 바와 같다. 각각의 투여 제형은 개별 칸 또는 기포 내에서 다른 것들로부터 단리되어 있는 각각의 투여 제형을 갖는 금속 포일-플라스틱 적층체의 쉬트에서와 같이 개별적으로 수용될 수 있거나, 또는 투여 제형은 플라스틱 병과 같은 단일 용기 내에 수용될 수 있다. 본 발명의 키트는 전형적으로 개별 키트 성분, 즉 투여 제형, 용기 수단 및 사용을 위한 서면 설명서를 포장하기 위한 수단도 포함할 것이다. 이러한 포장 수단은 판지 또는 종이 상자, 플라스틱 또는 포일 주머니 등의 형태를 취할 수 있다.
본 발명에 따른 키트는 본 발명의 임의의 양태, 예컨대, 임의의 조성물, 투여 제형, 치료 섭생법 또는 약학 팩을 구현할 수 있다.
본 발명에 따른 팩 및 키트는 임의적으로 복수의 조성물 또는 투여 제형을 포함한다. 따라서, 하나의 조성물 또는 하나 초과의 조성물을 함유하는 팩 및 키트는 본 발명의 범위 내에 포함될 것이다.
일부 예시적인 실시양태가 이하에 도시되고 기재되어 있다 하더라도, 당업계에서 통상의 기술을 가진 자에 의해 일반적으로 입수될 수 있는 적절한 출발 물질들을 사용하여 일반적으로 전술된 방법에 따라 본 발명의 화합물을 제조할 수 있다는 것도 인식할 것이다.
VX-222는 일반적으로 당업자에게 공지되어 있는 방법에 의해 제조될 수 있다(예를 들면, 국제 특허출원 공보 제WO 2002/100851호 및 제WO 2008/058393호 참조). 당업계에서 공지되어 있는 임의의 적합한 제제가 본 발명에서 사용될 수 있다. 예를 들면, 국제 특허출원 공보 제WO 2002/100851호 및 제WO 2008/058393호에 기재된 제제가 본 발명에서 사용될 수 있다. 본 발명에서 사용될 수 있는 한 특정 예는 VX-222의 자유산 형태; 아비셀(Avicel) PH 101; 락토스 일수화물; 폴록사머(Poloxamer) 188; 나트륨 라우릴 설페이트; 프로비돈(Providone) K29/32; 아비셀 PH 102; 락토스 일수화물; 크로스카멜로스(Crosscarmellose) 나트륨; 및 스테아르산마그네슘을 포함한다. 본 발명에서 사용될 수 있는 특정 제제는 실시예 5에 예시되어 있다.
본 발명의 한 실시양태는 VX-222(화학식 (1)로 표시된 화합물)의 자유산 형태; 아비셀 PH 101; 락토스 일수화물; 폴록사머(예를 들면, 폴록사머 188); 나트륨 라우릴 설페이트; 프로비돈 K29/32; 아비셀 PH 102; 락토스 일수화물; 크로스카멜로스 나트륨; 및 스테아르산마그네슘을 포함하는 VX-222의 제제이다. 특정 실시양태에서, 상기 제제는 45 중량% 내지 60 중량%의 VX-222의 자유산 형태; 약 5 중량% 내지 20 중량%의 아비셀 PH 101; 약 10 중량% 내지 20 중량%의 락토스 일수화물; 약 1 중량% 내지 10 중량%의 폴록사머(예를 들면, 폴록사머 188); 약 1 중량% 내지 5 중량%의 나트륨 라우릴 설페이트; 약 1 중량% 내지 10 중량%의 프로비돈(예를 들면, 프로비돈 K29/32); 약 1 중량% 내지 10 중량%의 아비셀 PH 102; 약 1 중량% 내지 10 중량%의 락토스 일수화물; 약 1 중량% 내지 10 중량%의 크로스카멜로스 나트륨; 및 약 0.1 중량% 내지 5 중량%의 스테아르산마그네슘을 포함한다. 실시예 5에 기재된 제제도 본 발명에 포함된다.
VX-950은 일반적으로 당업자에게 공지되어 있는 방법에 의해 제조될 수 있다(예를 들면, 국제 특허출원 공보 제WO 02/18369호 참조). 당업계에서 공지되어 있는 임의의 적합한 제제가 본 발명에서 사용될 수 있다. 예를 들면, 국제 특허출원 공보 제WO 2005/123075호, 제WO 2007/109604호, 제WO 2007/109605호 및 제WO 2008/080167호에 기재된 제제가 본 발명에서 사용될 수 있다. 본 발명에서 사용될 수 있는 특정 제제는 실시예 4에 예시되어 있다. 다른 특정 예로는 하기 제제가 있다:
여기서, HPMC[하이드록시프로필 메틸셀룰로스 60SH 50cP(비들 소이어(Biddle Sawyer) 또는 신-에츠 메톨로스(Shin-Etsu Metolose), HPMC60SH50)(하이프로멜로스 아세테이트 석시네이트, HG 등급, 신-에츠 케미칼 컴파니(Shin-Etsu Chemical Co.))], HPC(하이드록시프로필 셀룰로스), PVP(폴리비닐피롤리돈) 및 SLS(나트륨 라우릴 설페이트)는 국제 특허출원 공보 제WO 2005/123075호에 기재된 바와 같다. 일부 실시양태에서, 상기 기재된 고체 분산물은 1% HPMC 및 0.002% 시메티콘(simethicone) 함유 용액(1 중량% HPMC, 0.002 중량% 시메티콘 및 99 중량% 물)에 현탁될 수 있다. 추가 예로는 1:1 VX-950:PVPK30/1 중량% SLS(리프레쉬드 톡스(Refreshed Tox.)); 니로(Niro)-49 중량% HPMCAS/1 중량% SLS/1 중량% SDBS/49% VX-950; 40.5 중량% PVP-VA/10 중량% ETPGS/49.5 중량% VX-950; 40.5 중량% HPMC/10 중량% ETPGS/49.5 중량% VX-950; 49 중량% VX-950/49 중량% HPMCAS/1 중량% SLS/1 중량% SDBS; 및 49 중량% VX-950/16 중량% HPPh/33 중량% HPC/1 중량% SLS/1중량% SDBS가 있고, 이때 PVPK30(폴리비닐피롤리돈 K30), SDBS(나트륨 도데실 벤젠 설포네이트), HPMCAS(하이드록시프로필 메틸셀룰로스 아세테이트 석시네이트), 비타민 ETPGS, PVP(폴리비닐피롤리돈) 및 SLS(나트륨 라우릴 설페이트), 및 이들 제제들의 제조에 대한 세부내용은 국제 특허출원 공보 제WO 2005/123075호에서 발견될 수 있다. 추가 예로는 국제 특허출원 공보 제WO 2007/109604호에 기재된 고체 분산물들이 있다:
55 중량% VX-950, 24.4 중량% HPMCAS-HG(하이드록시프로필 메틸셀룰로스 아세테이트 석시네이트, JPE(비들 소이어 또는 신-에츠 HPMCAS-HG 등급)), 19.6 중량% HPMC-60SH(하이드록시프로필 메틸셀룰로스 60SH 50cP(비들 소이어 또는 신-에츠 메톨로스, HPMC60SH50)), 및 1 중량% 나트륨 라우릴 설페이트(SLS)를 포함하는 고체 분산물;
55 중량% VX-950, 14.7 중량% HPMCAS-HG(하이드록시프로필 메틸셀룰로스 아세테이트 석시네이트, JPE(비들 소이어 또는 신-에츠 HPMCAS-HG 등급)), 29.3 중량% HPMC-60SH(하이드록시프로필 메틸셀룰로스 60SH 50cP(비들 소이어 또는 신-에츠 메톨로스, HPMC60SH50)), 및 1 중량% 나트륨 라우릴 설페이트(SLS)를 포함하는 고체 분산물;
60 중량% VX-950, 24.4 중량% HPMCAS-HG(하이드록시프로필 메틸셀룰로스 아세테이트 석시네이트, JPE(비들 소이어 또는 신-에츠 HPMCAS-HG 등급)), 14.6 중량% HPMC-60SH(하이드록시프로필 메틸셀룰로스 60SH 50cP(비들 소이어 또는 신-에츠 메톨로스, HPMC60SH50)), 및 1 중량% 나트륨 라우릴 설페이트(SLS)를 포함하는 고체 분산물;
65 중량% VX-950, 17 중량% HPMCAS-HG(하이드록시프로필 메틸셀룰로스 아세테이트 석시네이트, JPE(비들 소이어 또는 신-에츠 HPMCAS-HG 등급)), 17 중량% HPMC-60SH(하이드록시프로필 메틸셀룰로스 60SH 50cP(비들 소이어 또는 신-에츠 메톨로스, HPMC60SH50)), 및 1 중량% 나트륨 라우릴 설페이트(SLS)를 포함하는 고체 분산물;
70 중량% VX-950, 9.7 중량% HPMCAS-HG(하이드록시프로필 메틸셀룰로스 아세테이트 석시네이트, JPE(비들 소이어 또는 신-에츠 HPMCAS-HG 등급)), 19.3 중량% HPMC-60SH(하이드록시프로필 메틸셀룰로스 60SH 50cP(비들 소이어 또는 신-에츠 메톨로스, HPMC60SH50)), 및 1 중량% 나트륨 라우릴 설페이트(SLS)를 포함하는 고체 분산물;
60 중량% VX-950, 39 중량% HPMCAS-HG(하이드록시프로필 메틸셀룰로스 아세테이트 석시네이트, JPE(비들 소이어 또는 신-에츠 HPMCAS-HG 등급)), 및 1 중량% 나트륨 라우릴 설페이트(SLS)를 포함하는 고체 분산물;
49.5 중량% VX-950, 24.5 중량% HPMCAS-HG(하이드록시프로필 메틸셀룰로스 아세테이트 석시네이트, JPE(비들 소이어 또는 신-에츠 HPMCAS-HG 등급)), 24.5 중량% HPMC-60SH(하이드록시프로필 메틸셀룰로스 60SH 50cP(비들 소이어 또는 신-에츠 메톨로스, HPMC60SH50)), 및 1 중량% 나트륨 라우릴 설페이트(SLS)를 포함하는 고체 분산물;
83 중량% VX-950, 8 중량% HPMCAS-HG(하이드록시프로필 메틸셀룰로스 아세테이트 석시네이트, JPE(비들 소이어 또는 신-에츠 HPMCAS-HG 등급)), 8 중량% HPMC-60SH(하이드록시프로필 메틸셀룰로스 60SH 50cP(비들 소이어 또는 신-에츠 메톨로스, HPMC60SH50)), 및 1 중량% 나트륨 라우릴 설페이트(SLS)를 포함하는 고체 분산물;
49.5 중량% VX-950, 24.5 중량% HPMCAS-HG(하이드록시프로필 메틸셀룰로스 아세테이트 석시네이트, JPE(비들 소이어 또는 신-에츠 HPMCAS-HG 등급)), 24.5 중량% HPMC-60SH(하이드록시프로필 메틸셀룰로스 60SH 50cP(비들 소이어 또는 신-에츠 메톨로스, HPMC60SH50)), 및 1 중량% 나트륨 라우릴 설페이트(SLS)를 포함하는 고체 분산물;
70 중량% VX-950, 14.5 중량% HPMCAS-HG(하이드록시프로필 메틸셀룰로스 아세테이트 석시네이트, JPE(비들 소이어 또는 신-에츠 HPMCAS-HG 등급)), 14.5 중량% HPMC-60SH(하이드록시프로필 메틸셀룰로스 60SH 50cP(비들 소이어 또는 신-에츠 메톨로스, HPMC60SH50)), 및 1 중량% 나트륨 라우릴 설페이트(SLS)를 포함하는 고체 분산물;
65 중량% VX-950, 14.6 중량% HPMCAS-HG(하이드록시프로필 메틸셀룰로스 아세테이트 석시네이트, JPE(비들 소이어 또는 신-에츠 HPMCAS-HG 등급)), 19.4 중량% HPMC-60SH(하이드록시프로필 메틸셀룰로스 60SH 50cP(비들 소이어 또는 신-에츠 메톨로스, HPMC60SH50)), 및 1 중량% 나트륨 라우릴 설페이트(SLS)를 포함하는 고체 분산물;
65 중량% VX-950, 9.7 중량% HPMCAS-HG(하이드록시프로필 메틸셀룰로스 아세테이트 석시네이트, JPE(비들 소이어 또는 신-에츠 HPMCAS-HG 등급)), 24.3 중량% HPMC-60SH(하이드록시프로필 메틸셀룰로스 60SH 50cP(비들 소이어 또는 신-에츠 메톨로스, HPMC60SH50)), 및 1 중량% 나트륨 라우릴 설페이트(SLS)를 포함하는 고체 분산물;
60 중량% VX-950, 19.5 중량% HPMCAS-HG(하이드록시프로필 메틸셀룰로스 아세테이트 석시네이트, JPE(비들 소이어 또는 신-에츠 HPMCAS-HG 등급)), 19.5 중량% HPMC-60SH(하이드록시프로필 메틸셀룰로스 60SH 50cP(비들 소이어 또는 신-에츠 메톨로스, HPMC60SH50)), 및 1 중량% 나트륨 라우릴 설페이트(SLS)를 포함하는 고체 분산물;
60 중량% VX-950, 14.6 중량% HPMCAS-HG(하이드록시프로필 메틸셀룰로스 아세테이트 석시네이트, JPE(비들 소이어 또는 신-에츠 HPMCAS-HG 등급)), 24.4 중량% HPMC-60SH(하이드록시프로필 메틸셀룰로스 60SH 50cP(비들 소이어 또는 신-에츠 메톨로스, HPMC60SH50)), 및 1 중량% 나트륨 라우릴 설페이트(SLS)를 포함하는 고체 분산물;
70 중량% VX-950, 9.7 중량% HPMCAS-HG(하이드록시프로필 메틸셀룰로스 아세테이트 석시네이트, JPE(비들 소이어 또는 신-에츠 HPMCAS-HG 등급)), 19.3 중량% HPMC-60SH(하이드록시프로필 메틸셀룰로스 60SH 50cP(비들 소이어 또는 신-에츠 메톨로스, HPMC60SH50)), 및 1 중량% 나트륨 라우릴 설페이트(SLS)를 포함하는 고체 분산물;
49.5 중량% VX-950, 24.5 중량% HPMCAS-HG(하이드록시프로필 메틸셀룰로스 아세테이트 석시네이트, JPE(비들 소이어 또는 신-에츠 HPMCAS-HG 등급)), 24.5 중량% HPMC-60SH(하이드록시프로필 메틸셀룰로스 60SH 50cP(비들 소이어 또는 신-에츠 메톨로스, HPMC60SH50)), 및 1 중량% 나트륨 라우릴 설페이트(SLS)를 포함하는 고체 분산물;
83 중량% VX-950, 8 중량% HPMCAS-HG(하이드록시프로필 메틸셀룰로스 아세테이트 석시네이트, JPE(비들 소이어 또는 신-에츠 HPMCAS-HG 등급)), 8 중량% HPMC-60SH(하이드록시프로필 메틸셀룰로스 60SH 50cP(비들 소이어 또는 신-에츠 메톨로스, HPMC60SH50)), 및 1 중량% 나트륨 라우릴 설페이트(SLS)를 포함하는 고체 분산물;
49.5 중량% VX-950, 49.5 중량% HPMCAS-HG(하이드록시프로필 메틸셀룰로스 아세테이트 석시네이트, JPE(비들 소이어 또는 신-에츠 HPMCAS-HG 등급)), 및 1 중량% 나트륨 라우릴 설페이트(SLS)를 포함하는 고체 분산물;
83 중량% VX-950, 16 중량% HPMCAS-HG(하이드록시프로필 메틸셀룰로스 아세테이트 석시네이트, JPE(비들 소이어 또는 신-에츠 HPMCAS-HG 등급)), 및 1 중량% 나트륨 라우릴 설페이트(SLS)를 포함하는 고체 분산물;
82.44 중량% VX-950, 15.89 중량% HPMCAS-HG(하이드록시프로필 메틸셀룰로스 아세테이트 석시네이트, JPE(비들 소이어 또는 신-에츠 HPMCAS-HG 등급)), 및 1.67 중량% 나트륨 라우릴 설페이트(SLS)를 포함하는 고체 분산물;
49.5 중량% VX-950, 24.75 중량% HPMCAS-HG(하이드록시프로필 메틸셀룰로스 아세테이트 석시네이트, JPE(비들 소이어 또는 신-에츠 HPMCAS-HG 등급)), 24.75 중량% HPMC-60SH(하이드록시프로필 메틸셀룰로스 60SH 50cP(비들 소이어 또는 신-에츠 메톨로스, HPMC60SH50)), 및 1 중량% 나트륨 라우릴 설페이트(SLS)를 포함하는 고체 분산물;
60 중량% VX-950, 24.6 중량% HPMCAS-HG(하이드록시프로필 메틸셀룰로스 아세테이트 석시네이트, JPE(비들 소이어 또는 신-에츠 HPMCAS-HG 등급)), 14.4 중량% HPMC-60SH(하이드록시프로필 메틸셀룰로스 60SH 50cP(비들 소이어 또는 신-에츠 메톨로스, HPMC60SH50)), 및 1 중량% 나트륨 라우릴 설페이트(SLS)를 포함하는 고체 분산물;
60 중량% VX-950, 39 중량% HPMCAS-HG(하이드록시프로필 메틸셀룰로스 아세테이트 석시네이트, JPE(비들 소이어 또는 신-에츠 HPMCAS-HG 등급)), 및 1 중량% 나트륨 라우릴 설페이트(SLS)를 포함하는 고체 분산물; 및
49.5 중량% VX-950, 49.5 중량% HPMCAS-HG(하이드록시프로필 메틸셀룰로스 아세테이트 석시네이트, JPE(비들 소이어 또는 신-에츠 HPMCAS-HG 등급)), 및 1 중량% 나트륨 라우릴 설페이트(SLS)를 포함하는 고체 분산물.
이들 고체 분산물의 제조에 대한 세부내용은 국제 특허출원 공보 제WO 2007/109604호에 기재되어 있다. 추가 특정 예로는 국제 특허출원 공보 제WO 2007/109604호에 기재에 VX-950의 분무 건조된 분산물을 함유하는 정제 제제가 있다:
추가 특정 예로는 국제 특허출원 공보 제WO 2008/080167호에 기재된 정제 제제가 있다:
VX
-950
SD
타정
실험 디자인(효능: 250
mg
VX
-950)
실험# A 제제
실험# C 제제
실험# E 제제
실험# F 제제
모든 인용된 문헌들은 본원에 참고로 도입된다.
본 발명이 보다 완전히 이해되도록 하기 위해, 하기 제조예 및 시험예가 기재된다. 이들 예들은 설명을 위한 목적으로만 제시되어 있고 본 발명의 범위를 어떠한 방식으로든 한정하는 것으로서 해석되어서는 안 된다.
실시예
하기 실시예에서, VX-222는 화합물 1을 지칭하고, VX-950은 화합물 2를 지칭한다.
실시예
1
:
HCV
레플리콘
(
Replicon
) 세포 분석 프로토콜
C형 간염 바이러스(HCV) 레플리콘을 함유하는 세포를, 10% 태아소 혈청(FBS), ㎖ 당 0.25 mg의 G418 및 적절한 보충제를 함유하는 DMEM(배지 A)에서 유지하였다.
1일째 날, 레플리콘 세포 단일층을 트립신:EDTA 혼합물로 처리하고 제거한 후 배지 A를 ㎖ 당 100,000개 세포의 최종 농도로 희석하였다. 100 ㎕ 중의 10,000개 세포를 96 웰 조직 배양 플레이트의 각각의 웰에 플레이팅하고, 37℃에서 조직 배양 항온처리기 내에서 밤새 배양하였다.
2일째 날, (100% DMSO 중의) 화합물을, 2% FBS, 0.5% DMSO 및 적절한 보충제를 함유하는 DMEM(배지 B)으로 연속적으로 희석하였다. DMSO의 최종 농도를 일련의 희석 전체에 걸쳐 0.5%로 유지하였다.
상기 레플리콘 세포 단일층 상의 배지를 제거한 후, 다양한 농도의 화합물을 함유하는 배지 B를 첨가하였다. 임의의 화합물을 함유하지 않은 배지 B를 화합물 부재 대조군으로서 다른 웰에 첨가하였다.
세포를 37℃에서 조직 배양 항온처리기 내에서 배지 B 중의 화합물 또는 0.5% DMSO와 함께 48시간 동안 항온처리하였다. 48시간 항온처리의 말기에서 상기 배지를 제거하고, 상기 레플리콘 세포 단일층을 PBS로 1회 세척하고 RNA 추출 전에 -80℃에서 저장하였다.
처리된 레플리콘 세포 단일층을 갖는 배양 플레이트를 해동시키고, 고정된 양의 또 다른 RNA 바이러스, 예컨대, 소 바이러스성 설사 바이러스(BVDV)를 각각의 웰 내의 세포에 첨가하였다. RNA의 분해를 피하기 위해, RNA 추출 시약(예컨대, 알엔이지(RNeasy) 키트로부터의 시약)을 세포에 즉시 첨가하였다. 추출 효율 및 일관성을 개선하도록 변형된 제조자의 설명서에 따라 총 RNA를 추출하였다. 최종적으로, HCV 레플리콘 RNA를 포함하는 총 세포 RNA를 용출하고 추가 프로세싱을 수행할 때까지 -80℃에서 저장하였다.
2 세트의 특이적 프라이머 및 프로브를 사용하여 택만(Taqman) 실시간 RT-PCR 정량화 분석을 셋업하였다. 한 세트는 HCV에 대한 것이고, 다른 세트는 BVDV에 대한 것이었다. 동일한 PCR 웰에서 HCV 및 BVDV RNA 둘다를 정량하기 위해, 처리된 HCV 레플리콘 세포로부터의 총 RNA 추출물을 PCR 반응액에 첨가하였다. 실험 실패를 각각의 웰 내의 BVDV RNA의 수준에 기초하여 표시하고 제외시켰다. 각각의 웰 내의 HCV RNA의 수준을 동일한 PCR 플레이트에서 표준 곡선 작도에 따라 계산하였다. DMSO 또는 화합물 부재 대조군을 0%의 억제율로서 이용하여 화합물 처리로 인한 HCV RNA 수준의 억제 또는 감소 백분율을 계산하였다. IC50(HCV RNA 수준의 50% 억제가 관찰되는 농도)을 임의의 주어진 화합물의 적정 곡선으로부터 계산하였다.
VX-950은 레플리콘 분석에서 상당한 활성을 나타내었다. VX-950은 240 ng/㎖의 IC50 및 476 ng/㎖의 IC90을 나타내는 것으로 밝혀졌다.
실시예 2
: HCV Ki 분석 프로토콜
5AB 기질 및 생성물의 분리를 위한 HPLC 마이크로보어(Microbore) 방법
기질: NH2-Glu-Asp-Val-Val-(알파)Abu-Cys-Ser-Met-Ser-Tyr-COOH(서열번호 1).
20 mM(또는 선택되는 농도의) 5AB의 저장 용액을 0.2 M DTT를 함유하는 DMSO로 제조하였다. 이것을 -20℃에서 분취액 형태로 저장하였다.
완충제: 50 mM HEPES, pH 7.8; 20% 글리세롤; 100 mM NaCl
총 분석 부피는 100 ㎕이었다.
완충제, KK4A, DTT 및 tNS3을 조합하고, 각각 78 ㎕를 96 웰 플레이트의 웰에 분배하였다. 이것을 30℃에서 약 5분 내지 10분 동안 항온처리하였다. 25 ㎕의 적절한 농도의 시험 화합물을 DMSO(대조군의 경우 DMSO만)에 용해시키고 각각의 웰에 첨가하였다. 이것을 실온에서 15분 동안 항온처리하였다. 20 ㎕의 250 μM 5AB 기질(25 μM 농도는 5AB의 경우 Km과 동등하거나 Km보다 약간 더 낮음)을 첨가하여 반응을 개시하였다. 반응 혼합물을 30℃에서 20분 동안 항온처리한 후, 25 ㎕의 10% TFA를 첨가하여 반응을 종결시키고, 120 ㎕의 혼합물 분취액을 분석을 위해 HPLC 바이알로 옮겼다. SMSY 생성물을 하기 방법으로 기질 및 KK4A로부터 분리하였다:
마이크로보어 분리 방법:
장치: 아질런트(Agilent) 1100
탈기기(degasser) G1322A
이원 펌프 G1312A
자동샘플러 G1313A
컬럼 온도조절된 챔버 G1316A
다이오드 어레이 검출기 G1315A
컬럼:
페노메넥스 주피터; 5 마이크론 C18; 300 옹스트롬; 150x2 mm; P/O 00F-4053-B0
컬럼 온도조절: 40℃
주입 부피: 100 ㎕
용매 A = HPLC 등급 물 + 0.1% TFA
용매 B = HPLC 등급 아세토니트릴 + 0.1% TFA
실시예 3
VX-950을 무작위화 이중 맹검 플라세포 대조 단일 투여량 상승 연구(randomized, double-blind, placebo-controlled single-dose escalatoin study)에서 조사하였다. 25명의 건강한 남성 지원자들을 등록하였다. 각각의 대상체는 7일 이상의 기간을 두고 다중 단일 투여량의 VX-950, 증가하는 투여량 수준에서 3회 투여량의 VX-950, 및 1회 투여량의 플라세포를 제공받았다.
25 mg 내지 1,250 mg의 투여량을 평가하였다. 보다 낮은 투여량 범위에서 적극적이고 보다 높은 투여량 범위에서 소극적이도록 투여량 배가(doubling)와 변형된 피보나시(Fibonacci)를 조합한 투여량 상승 방식을 이용하였다.
VX-950은 모든 투여량 수준에서 잘 허용되었고, 연구 동안 어떠한 심각한 부작용도 보고되지 않았다. 투여량 수준의 증가에 따른 부작용의 증가가 없는 것으로 보였다.
통계학적 모멘트(moment) 방법을 이용하여 약동학적 분석을 수행하였다. 약동학적 분석은 VX-950이 3시간의 중간값 T최대를 나타내면서 흡수되었다는 것을 보여주었다. 2% 미만의 VX-950이 소변에서 변하지 않은 상태로 제거되었는데, 이것은 상기 약물이 주로 대사 경로를 통해 제거된다는 것을 암시한다.
실시예 4
경구 투여 제형을 하기와 같이 제조하였다. VX-950 및 포비돈 K29/32를 염화메틸렌에 용해시킨 후, 나트륨 라우릴 설페이트를 첨가하고 용액에 분산시켜 균질한 현탁액을 형성하였다. 이 현탁액을 90℃의 입구 온도 및 56℃의 출구 온도를 이용하여 분무 건조하고, 생성물을 시클론(cyclone)으로부터 수집하였다. 분무 건조된 분산물을 75℃에서 8시간 동안 유동층 건조하였다. 생성된 분말을 유리 바이알 내로 예비측정하고, 투여 직전에 대상체에게 투여될한 물(30 ㎖)에 현탁시켰다. 투여와 관련하여, 각각의 바이알을 총 부피가 90 ㎖인 물의 3개 분리된 부분으로 세척하였다.
실시예
5
2개의 상이한 VX-222(여기서 화합물 1) 경구 투여 제제를 하기와 같이 제조하였다:
VX-222(여기서 화합물 1)의 형태 A의 일부 특징은 이하에 기재되어 있다:
밀봉된 튜브 공급원 및 하이-스타(Hi-Star) 면적 검출기가 장착된 브룩커(Bruker) D8 디스커버(Discover) 회절계(아셋 택(Asset Tag) V012842)(브룩커 에이엑스에스(Bruker AXS), 미국 위스콘신주 매디슨 소재)를 이용하여 실온에서 반사 모드로 XRPD 패턴을 획득하였다. X-선 발생기는 40 kV의 전압 및 35 mA의 전류에서 작동되고 있었다. 분말 샘플을 알루미늄 홀더 내에 배치하였다. 각각 120초의 노출 시간을 이용하여 2개의 프레임을 등록하였다. 그 다음, 데이터를 0.02°의 단계 크기로 4° 내지 40° 2θ의 범위에 걸쳐 통합하고 하나의 연속적인 패턴으로 합하였다.
VX-222의 형태 A를 이하에 기재된 하기 단계로 제조할 수 있다:
- 10 g의 VX-222(국제 특허출원 공보 제WO 2008/058393호에 기재된 바와 같이 제조된 화합물 1)를 반응기에 충전시키는 단계;
- 20 g의 메탄올을 충전시키고 60℃까지 가열하여 용해시키는 단계;
- 10℃까지 냉각시키고 고체가 형성되도록 기다리는 단계;
- 상기 고체를 여과하는 단계;
- 25℃에서 20 g의 아세톤을 첨가하는 단계;
- 1시간 동안 교반하는 단계;
- 상기 고체를 여과하는 단계; 및
- 75℃에서 12시간 동안 건조하는 단계.
실시예
6
: 연구
VX
-222-002로부터의 약동학적 데이터:
VX
-222와
VX
-950을 사용한 조합 치료
실시예 5의 제제를 VX-222 대신에 사용하였다. 본 연구에서, 20명의 건강한 대상체들을 집단 1 또는 집단 2(집단 당 10명의 대상체)에 등록하였다. 집단 1 및 집단 2의 대상체들은 본 연구의 3개 기간, 즉 치료 기간 1, 치료 기간 2 및 치료 기간 3 모두를 완료하였다. 치료 기간 1에서, 음식물이 공급된 상태에서 VX-222 또는 VX-222 플라시보를 대상체들에게 10일 동안 투여하였다. 치료 기간 2에서, 음식물이 공급된 상태에서 VX-950 또는 VX-950 플라시보를 대상체들에게 10일 동안 투여하였다. 치료 기간 3에서, 음식물이 공급된 상태에서 VX-222 및 VX-950 둘다 또는 VX-222 플라시보 및 VX-950 플라시보 둘다를 대상체들에게 10일 동안 동시에 투여하였다. VX-222가 치료 기간 1에서 투여되고 VX-950이 치료 기간 2에서 투여되기 때문에 치료 기간 1과 치료 기간 2는 7일의 세척 기간에 의해 분리되었다. 치료 기간 1 및 치료 기간 3에서 400 mg의 VX-222 또는 VX-222 플라시보를 집단 1의 대상체들에게 12시간마다(q12h) 투여하였다. 치료 기간 1 및 치료 기간 3에서 1,000 mg의 VX-222 또는 VX-222 플라시보를 집단 2의 대상체들에게 12시간마다(q12h) 투여하였다. 치료 기간 2 및 치료 기간 3에서 1,125 mg의 VX-950 또는 VX-950 플라시보를 집단 1 및 집단 2의 대상체들에게 12시간마다(q12h) 투여하였다. 본 연구의 연구 디자인은 도 1에 나타나 있다.
이중
맹검
플라시보
대조 병렬 군 순차적 투여량 하강
ㆍ N=20(집단 당 10명(8:2))
ㆍ 디자인:
- 10일 동안 VCH-222(이어서 세척 기간)
- 10일 동안 VX-950
- 10일 동안 VCH-222 및 VX-950
- 추적조사 - 7+/-3일
ㆍ 투여량:
- VX-950:
ㆍ 1,125 mg BID의 고정된 투여량
- VCH-222:
ㆍ 400 mg BID(집단 1)
ㆍ 1,000 mg BID(집단 2)
ㆍ 식사와 함께 동시에 투여된 VX-950 및 VCH-222
예비 안전성 분석은 치료 기간 3에서 보고된 심각한 부작용 또는 SAE가 없다는 것을 보여주었다. 보고된 부작용 중 대다수가 심각도 면에서 경미하였고, 뜻밖의 부작용 발생 또는 성향은 없었다. 설사, 감소된 식욕, 소양증, 코피 및 비충혈을 포함하는 몇몇 부작용은 치료 기간 1 및 치료 기간 3에 비해 치료 기간 3에서 더 빈번하였다.
약동학적 평가를 하기와 같이 수행하였다:
ㆍ VCH -222 혈장:
- 기간 1
ㆍ 1일: 0(투여 전), 및 투여 후 0.5시간, 1시간, 1.5시간, 2시간, 4시간, 6시간, 8시간 및 12시간
ㆍ 3일, 5일, 7일, 8일 및 9일: 0(투여 전)
ㆍ 10일: 0(투여 전), 및 투여 후 0.5시간, 1시간, 1.5시간, 2시간, 4시간, 6시간, 8시간, 12시간, 24시간, 48시간 및 72시간
- 기간 3
ㆍ 31일 및 33일: 0(투여 전)
ㆍ 37일: 0(투여 전), 및 투여 후 0.5시간, 1시간, 1.5시간, 2시간, 4시간, 6시간, 8시간, 12시간 및 24시간
ㆍ VX -950(및 대사물질) 혈장:
- 기간 2
ㆍ 22일, 24일 및 26일: 0(투여 전)
ㆍ 27일: 0(투여 전), 및 투여 후 0.5시간, 1시간, 1.5시간, 2시간, 4시간, 6시간, 8시간 및 12시간
-기간 3
ㆍ 31일 및 33일: 0(투여 전)
ㆍ 37일: 0(투여 전), 및 투여 후 0.5시간, 1시간, 1.5시간, 2시간, 4시간, 6시간, 8시간 및 12시간
ㆍ VCH -222 소변:
- 10일 및 37일: 투여 후 0시간 내지 4시간, 4시간 내지 8시간, 8시간 내지 12시간 및 12시간 내지 24시간(10일만)
하기 표 1은 본 연구의 예비 약동학적(PK) 결과를 제공한다. 하기 표에 나타낸 바와 같이, VX-222 혈장 노출이 증가하였다.
| 투여량 |
aC최대 (ng/㎖) |
aAUC0 -12 (ng*hr/㎖) |
aC12 (ng/㎖) |
bT최대 (시간) |
cT1 /2 (시간) |
|
| 400 mg BID(N=7/8) |
10일 | 1773(39%) | 8559(47%) | 212(71%) | 4[0;4] | 2.7(11%) |
| 37일 | 3954(43%) | 29534(46%) | 830(54%) | 4[4;6] | 5.4(39%) | |
| 1,000 mg BID(N=8) |
10일 | 4116(33%) | 25842(22%) | 589(37%) | 4[2;6] | 4(29%) |
| 37일 | 8151(51%) | 59892(47%) | 1580(79%) | 4[2;6] | 3.5(15%) | |
| a기하평균(CV%); b산술평균(CV%); c평균[최소;최대] | ||||||
실시예
7
:
파트
A에서 연구
VX
-222-102로부터의 약동학적 데이터:
VX
-222를 사용한 치료
실시예 5의 제제를 VX-222 대신에 사용하였다. 연구의 파트 A에서, 102명의 대상체들을 6:2(VX-222:플라시보)의 할당비로 VX-222 또는 플라시보 집단인 집단 1, 집단 2, 집단 3 또는 집단 4로 무작위로 배분하였다. 250 mg, 500 mg 또는 750 mg의 VX-222 또는 플라시보를 집단 1, 집단 2 및 집단 3에 등록된 대상체들에게 각각 3일 동안 매일 2회(b.i.d.) 투여하였다. 1,500 mg의 VX-222 또는 플라시보를 집단 4에 등록된 대상체들에게 3일 동안 매일 1회(qd) 투여하였다. 의사에 의해 적절하다고 판단되는 경우, 관리 치료의 표준인 Peg-IFN-알파-2a 및 RBV를 48주 이하 동안 파트 A에서 투여의 말기에 대상체에게 제공하였다.
A. 예비 결과
예비 안전성 분석: 유전형 1 만성 C형 간염 감염을 갖는 대상체들을 250 mg(집단 1), 500 mg(집단 2) 또는 750 mg(집단 3) b.i.d.로 VX-222 또는 플라시보의 다중 투여량에 3일 동안 노출시켰다. 예비 안전성 결과는 보고된 심각한 또는 중대한 부작용이 없다는 것을 보여주었다. 보고된 부작용의 대다수는 심각도 면에서 경미하였고, 뜻밖의 부작용 발생 또는 성향은 없었다.
예비 약동학적( PK ) 분석: 집단 1, 집단 2 및 집단 3으로부터의 예비 PK 파라미터의 요약은 하기 표 2에 제시되어 있다.
| 투여량 |
t최대(시) 중간값 범위 |
C최대(ng/㎖) 기하평균 (CV%) |
AUC0 -12시간 (hr*ng/㎖) |
C12(ng/㎖) | cT1 /2(시) | |||||
| 기하평균(CV%) | 기하평균(CV%) | 산술평균(CV%) | ||||||||
| 투여량 | 1일 | 3일 | 1일 | 3일 | 1일 | 3일 | 1일 | 3일 | 1일 | 3일 |
| 250 mg N=6 |
6 [4-8] |
4 [2-8] |
1812 (66) |
2959 (29) |
11690 (60) |
19490 (41) |
858 (78) |
728 (65) |
ND | 4.1 (22) |
| 500 mg N=6 |
3 [1.5-6] |
2.5 [1-6] |
4363 (52) |
5044 (36) |
22875 (54) |
29848 (54) |
767 (95) |
858 (120) |
ND | 4 (32) |
| 750 mg N=6 |
3 [3,4] |
2 [1-6] |
6522 (91) |
10288 (112) |
43552 (87) |
62952 (112) |
1691 (103) |
1677 (153) |
ND | 3.5 (26) |
| a기하평균(CV%); b산술평균(CV%); c평균[최소;최대] | ||||||||||
예비 HCV RNA 분석: 집단 1, 집단 2 및 집단 3으로부터의 예비 HCV RNA 분석의 요약은 표 3에 제공되어 있다. 집단 1, 집단 2 및 집단 3에서 유전형 1 HCV에 감염된 대상체들에 대한 4일째 날 평균 log HCV RNA 감소는 각각 3.1, 3.4 및 3.2이었다. 집단 4(이때, 대상체들은 1,500 mg의 VX-222를 1일 1회 투여받음)에서 유전형 1 HCV에 감염된 대상체들에 대한 4일째 날 평균 log HCV RNA 감소는 3.6이었다.
| 250 mg b.i.d.(N=6) |
500 mg b.i.d.(N=6) |
750 mg b.i.d.(N=6) |
1,500 mg QD(N=6) |
플라시보 (N=8) |
|
| 평균 (범위) |
-3.1 (-4.2;-2.0) |
-3.4 (-3.6;-3.2) |
-3.2 (-3.8;-2.3) |
-3.4 (-3.9;-3.1) |
-0.1 (-0.5;0.3) |
B. 추가 결과
연구 VX-222-102의 추가 결과는 도 2 내지 8에 기재되어 있다. 각각의 투여군에서 250 mg의 VX-222 BID, 500 mg의 VX-222 BID, 750 mg의 VX-222 BID 및 1,500 mg의 VX-222 QD를 제공받은 6명의 환자들을 포함하는, 만성 유전형 1 HCV 감염을 갖는 32명의 치료 무경험 환자들을 실험에 등록하였다. 총 8명의 환자들이 플라시보를 제공받도록 4개의 투여군 각각에서 2명의 환자들이 플라시보를 제공받았다. 실험의 파트 A는 미국, 캐나다 및 아르헨티나 내의 10개 센터에서 수행되었다. 실험에 등록된 환자들 중에서 24명의 환자들이 유전형 1a HCV 감염을 가졌고, 8명의 환자들이 유전형 1b HCV 감염을 가졌다. 실험에 등록된 환자들 중에서 6명의 환자들이 아프리카계 미국인이었고, 25명의 환자들이 백인이었고, 1명의 환자가 아메리카 인디언/알래스카인이었다.
연구 디자인 & 집단
ㆍ 다중심 무작위화 이중 맹검 플라시보 대조 투여량 범위 연구
- HCV 유전형 1에 감염된 환자
o 경화증의 증거가 없음
o 5 x ULM 미만의 ALT 값
o 스크리닝에서 5 log10 IU/㎖ 이상의 혈장 HCV RNA
- 4-암(arm) 비교 연구(6:2 무작위화 VX-222:플라시보)
- 이 투여량 범위 연구에의 등록은 순차적이었다.
o 3일 동안 250 mg BID
o 3일 동안 500 mg BID
o 3일 동안 750 mg BID
o 3일 동안 1,500 mg BID
기준 특징들은 도 3에 요약되어 있다. HCV RNA 변화는 도 4 내지 6에 나타나 있다. 도 7은 VX-222 약동학을 보여준다. 도 7에 나타낸 바와 같이, T최대는 투여 후 2시간 내지 6시간에서 도달되었고, VX-222 노출은 거의 비례적인 방식으로 투여량에 따라 증가하였다. 도 8은 3일째 날 VX-222 약동학의 요약을 보여준다.
바이러스 동역학 결과
VX-222를 사용한 치료는 4개의 VX-222 투여군에 걸쳐 3 log10 초과의 혈장 HCV RNA의 평균 감소를 발생시켰다. 또한, 4개의 투여군에 걸쳐 증가하는 투여량 반응이 관찰되었고, 이때 500 mg 투여군, 750 mg 투여군 및 1,500 mg 투여군에서 결과는 매우 유사하였다. 250 mg BID, 500 mg BID 및 750 mg BID의 VX-222를 투여한 지 3일 후 달성된 평균 HCV RNA 감소는 각각 3.1 log10(범위: 2.0 내지 4.2), 3.4 log10(범위: 3.2 내지 3.6) 및 3.2 log10(범위: 2.3 내지 3.8)이었다. 1,500 mg QD의 VX-222를 투여한 지 3일 후 달성된 평균 HCV RNA 감소는 3.4 log10(범위: 3.1 내지 3.9)이었다. 플라시보를 제공받은 환자에서 HCV RNA의 현저한 감소는 관찰되지 않았다. 유전형 1a 및 1b에 감염된 환자들의 경우 유사한 바이러스 감소가 관찰되었다.
이 실험의 파트 A의 이들 결과는 이전에 수행된, 750 mg BID로서 투여된 VX-222의 3일 5명 환자 바이러스 동역학 연구로부터의 발견과 일치한다.
안전성 및
내약성
(
tolerability
) 결과
이 실험의 파트 A에 대해 수집된 안전성 및 내약성 정보는 알려지지 않은 상태로 남아있으므로, 오늘날 제공된 안전성 정보는 플라시보 또는 VX-222의 투여 후 환자에 대해 수집된 데이터를 포함한다. 플라시보 또는 VX-222는 모두 4개의 투여군에 걸쳐 잘 허용되었고, 심각한 또는 중대한 부작용은 보고되지 않았고, 치료 불연속은 발생하지 않았다. 플라시보 또는 VX-222의 투여 후 보고된 모든 부작용들은 심각도 면에서 경미하거나 중간 정도이었다. 투여군 당 2명 이상의 환자들에서 발생한 가장 빈번하게 보고된 부작용은 설사, 두통, 구토, 무기력 및 발열이었다.
실시예
8
:
파트
C에서 연구
VX
-222-102로부터의 약동학적 데이터:
VX
-222를 사용한 치료
연구 101의 파트 C에서, VX-222를 C형 만성 간염을 갖는 치료 무경험 대상체들에게 750 mg b.i.d.의 다중 투여량으로서 3일 동안 투여하였다. 또한, 연구 102의 파트 A에서, VX-222를 250 mg 내지 750 mg BID(1일 2회) 및 1500 mg QD(1일 1회)의 다중 투여량으로서 만성 C형 간염을 갖는 치료 무경험 대상체들에게 3일 동안 투여하였다.
연구 101(최종 데이터) 및 연구 102(예비 데이터)에서 평가된 VX-222의 PK 파라미터는 이하에 요약되어 있다:
ㆍ AUC에 대한 누적 지수는 1.90이었고, C최대에 대한 누적 지수는 1.75배이었다.
ㆍ 반복된 측정 분석은 정지 상태가 치료 3일 이내에 달성되었다는 것을 암시하였다.
ㆍ 평균 C최대, AUCτ 및 Cτ에서의 증가에 의해 표시되는 바와 같이 VX-222 노출은 투여량의 증가에 따라 증가하였다. VX-222 노출은 250 mg 내지 750 mg b.i.d.의 투여량에서 대략적으로 투여량 비례 방식으로 증가하였다.
ㆍ VX-222 흡수는 정지 상태에서 2시간 내지 6시간의 중간값 T최대를 나타내면서 느렸다.
ㆍ 누적 지수는 b.i.d. 섭생법의 경우 약 2배이었다. qd 섭생법의 경우, 3일째 날 1,500 mg VX-222 노출은 1일째 날 관찰된 노출과 유사하였다.
ㆍ 평균 t1 /2는 모든 투여량에 걸쳐 변하지 않은 상태로 남아있었다.
ㆍ VX-222 t1 /2는 약 5시간이었다.
ㆍ 투여 간격의 말기에서 VX-222 농도는 모든 대상체들에 대해 시험관내 IC90(319 ng/㎖)보다 높았다.
ㆍ 일반적으로, 대상체에서 VCH-222 노출은 건강한 대상체에 비해 치료 무경험 HCV 대상체에서 약 2배 더 높았다.
파트 C에서 VX-222 임상 연구 효능
연구 101의 파트 C의 일차 목적은 유전형 1 만성 C형 간염을 갖는 치료 무경험 대상체들에서 VX-222의 약물역학을 평가하는 것이었다. 연속 3일 동안 750 mg b.i.d.로 투여된 VX-222의 최종 약물역학적 파라미터는 이하에 요약되어 있다:
ㆍ 평균 비변환된 기준(1일) HCV 혈장 RNA 수준은 4962600 IU/㎖(log10 = 6.4927)이었다.
ㆍ 2일째 날 내지 4일째 날 log10 투여 전 HCV 혈장 RNA를 이용하여 계산한 기준으로부터의 평균 최대 감소는 -3.6784이었다. 투여 전 RNA 수준과 log10 HCV RNA의 감소 크기 사이의 상관관계는 비교적 약하였다.
이들 결과는 건강한 대상체와 일치하고, VX-950과 함께 투여된 VX-222는 VX-222 단독보다 2배 더 높았다.
실시예 9
: 약물 조합 분석: VX-950 및 VX-222
재료 및 방법
세포
Huh-7 간암종 세포주로부터 유래된 레플리콘 세포주 Huh-7, ET 세포를 랄프 바르텐슐라거(Ralf Bartenschlager) 박사로부터 수득한다(Bartenschlager, R. Innovation: Hepatitis C virus replicons: potential role for drug development. Nat. Rev. Drug Discov., 2002, 1, 911-916; Krieger, N., Lohmann, V., Bartenschlager, R. Enhancement of hepatitis C virus RNA replication by cell culture-adaptive mutations. J. Virol., 2001, 75, 4614-4624; Lohmann, V., Korner, F., Koch, J.-O., Herian, U., Theilmann, L., Bartenschlager, R. Replication of subgenomic hepatitis C virus RNAs in a hepatoma cell line. Science. 1999, 285, 110-113)(레플리콘 게엠베하(Reblikon GmbH), 독일 가우-오데른하임 소재). 상기 Huh-7, ET 세포주는 네오마이신 유전자 이외에 초파리 루시퍼라제(luciferase) 유전자에 대한 통합된 카피를 보유하는, 세포 배양에 고도로 적응된 레플리콘 I389luc-ubi-neo/NS3-3'/5.1 구축물(HCV NS3 및 NS5 유전자 내의 3개의 적응 돌연변이의 존재를 특징으로 함)을 함유한다(Vrolijk, J.M., Kaul, A., Hansen, B.E., Lohmann, V., Haagmans, B.L., Schalm, S.W., Bartenschlager, R. A replicon-based bioassay for the measurement of interferons in patients with chronic hepatitis C. Journal of Virol. Methods, 2003, 110, 201-209). 이 세포주는 루시퍼라제 활성의 측정에 의한 HCV RNA 복제 및 번역의 측정을 가능하게 한다. 이들 세포에서 루시퍼라제 활성이 레플리콘 RNA 수준에 정확히 일치한다는 것은 이전에 밝혀졌다(J. Virol. 2001, 75, 4614-4624, Journal of Virol. Methods., 2003, 110, 201-209). 세포 배양을 위해 사용된 배양 배지는 최종 농도 1% 페니실린/스트렙토마이신, 1% 글루타민, 1% 피루브산나트륨, 1% 비필수 아미노산 및 180 ㎍/㎖의 제네티신(Geneticin)(G418)(인비트로겐(Invitrogen), 캐나다 온타리오주 버링톤 소재)과 함께 10% 태아소 혈청으로 보충된 DMEM(위센트 인코포레이티드(Wisent Inc.), 캐나다 퀘백주 세인트-브루노 소재)으로 구성된다. 세포를 5% CO2의 대기 하에 37℃에서 항온처리하고 주 당 2회 계대배양하여 서브컨플루언스(subconfluence)를 유지한다.
Huh-7 간암종 세포주로부터 유래된 레플리콘 세포주 Huh-7, 9-13 세포를 랄프 바르텐슐라거 박사로부터 수득한다(레플리콘 게엠베하, 독일 가우-오데른하임 소재). 상기 Huh-7, 9-13 세포는 HCV 하위게놈 레플리콘 pFK I377/NS3-3'/wt를 함유하고(Koutsoudakis, G., Kaul, A., Steinmann, E., Kallis, S., Lohmann, V., Pietschmann, T., Bartenschlager, R. Characterization of the Early Steps of Hepatitis C Virus Infection by Using Luciferase Reporter Viruses. J. Virol., 2006, 80, 5308-5320), 실시간 PCR 분석에서 사용된다. 정량적 실시간 PCR 분석(택만)은 레포터(reporter) 염료 및 소광제(quencher) 염료가 부착된 형광발생 올리고뉴클레오티드 프로브의 사용과 함께 본질적으로 표준 PCR이다. PCR 동안 상기 프로브는 정방향 프라이머 부위와 역방향 프라이머 부위 사이에서 관심 있는 표적에 어닐링한다. 각각의 연장 동안 상기 프로브는 Taq DNA 중합효소의 5' 핵산분해효소(nuclease) 활성에 의해 절단된다. 이것은 소광제 염료로부터 레포터 염료를 분리시켜 상기 레포터 염료의 형광 강도를 증가시킨다. 상기 형광 강도는 존재하는 표적 DNA의 양에 비례한다.
약물 조합 분석
루시퍼라제 분석(맥시너지(MacSynergy) 분석을 이용한 4일 실험). 100 ㎕ 부피의 배지 중의 Huh-7, ET 레플리콘 세포를 서브컨플루언스 밀도(웰 당 3 x 103개 세포)로 불투명 96 웰 세포 배양 마이크로타이터 플레이트에 시딩한다. 이 분석을 위해 사용된 세포 배양 배지는 이 배지가 G418 및 페놀 레드 둘다를 함유하지 않는다는 점을 제외하고 전술된 배지와 동일하다. 티오펜과 상이한 항-HCV 약물의 조합물을 다양한 농도로 함유하는 저장 용액의 매트릭스를 깊은 96 웰 플레이트에서 제조한다.
37℃에서 3시간 내지 4시간의 항온처리 기간 후, 200 ㎕의 최종 부피를 위해 상기 매트릭스 저장 용액 플레이트로부터의 화합물(100 ㎕)을 상기 세포에 첨가함으로써 하나의 화합물을 수평으로 적정하고 하나의 화합물을 수직으로 적정한다. 4개 이상의 세포 플레이트를 각각의 약물-약물 상호작용 실험을 위해 사용하고, 각각의 조합을 2회 이상 수행한다. 그 다음, 세포를 5% CO2 대기 하에 37℃에서 4일 동안 추가로 항온처리한다. 그 후, 배양 배지를 제거하고, 95 ㎕의 루시퍼라제 완충제(완충된 세제 중의 루시페린 기질)를 첨가하여 세포를 용해시킨다. 세포 용해물을 실온에서 항온처리하고 10분 이상 동안 직사광으로부터 보호한다. 발광측정기(왈락 마이크로베타 트릴룩스(Wallac MicroBeta Trilux), 퍼킨 엘머(상표명), 미국 매사추세츠주 소재)를 이용하여 루시퍼라제 카운트에 대해 플레이트를 판독한다.
화합물들의 조합이 부가적, 상승작용적 또는 길항적 효과를 나타내는지를 확인하기 위해, 티오펜과 각각의 다른 약물 사이의 4일 치료의 약물 조합 효과를 맥시너지 II(상표명) 프로그램으로 계산한다(Prichard, M.N., Prichard, L.E., Shipman, C. Strategic design and three-dimensional analysis of antiviral drug combinations. Antimicrob. Agents Chemother., 1993, 37:540-545; Prichard, M.N. and Shipman, C. A three-dimensional model to analyze drug-drug interactions. Antiviral Res., 1990, 14:181-205). 이 방법은 통계학적 확률에 기초하고 2종의 약물이 독립적으로 작용하여 복제를 억제한다고 추정하는 블리스(Bliss) 독립 귀무(null) 모델을 이용하여 약물 조합을 조사한다. 이 방법을 이용하여, 단독으로 작용하는 개별 약물들의 투여량 반응 곡선으로부터 이론적인 부가적 상호작용을 계산한다. 그 다음, 실험적으로 측정된 효과로부터 예측된 부가적 효과를 차감하여 투여량 반응 표면의 차이를 나타낸다. 생성된 표면은 상호작용이 부가적인 경우 0% 차이에서 수평면으로서 나타난다. 평면보다 높은 임의의 피크는 예측된 효과보다 더 높은 효과(상승작용)를 표시한다. 대조적으로, 평면 아래에 나타나는 피크는 예측된 효과보다 더 낮은 효과(길항작용)를 표시한다. 실험 투여량 반응 표면 주위의 신뢰구간을 이용하여 데이터를 통계학적으로 평가하고, 피크의 부피를 계산하여 생성된 상승작용 또는 길항작용을 정량한다.
또한, 단독으로 시험된 경우 모든 약물들의 억제 효과에 대한 50% 억제 농도(IC50)를 화합물 당 7개 내지 9개 농도를 이용하여 투여량 반응 곡선으로부터 측정한다. 비선형 회귀 분석을 이용하여 곡선을 데이터 점에 맞추고, 그래프패드 프리즘(GraphPad Prism) 소프트웨어 버전 2.0(그래프패드 소프트웨어 인코포레이티드(GraphPad Software Inc.), 미국 캘리포니아주 샌 디에고 소재)을 이용하여 상기 생성된 곡선으로부터 IC50을 내삽한다:
≤ 25 μM2%: 무의미한 양의 상승작용
25 μM2% - 50 μM2%: 미량의 상승작용
50 μM2% - 100 μM2%: 중간 정도의 상승작용
≥ 100 μM2%: 강한 상승작용
실시간 PCR 분석(HCV 레플리콘 바이러스 RNA 제거 및 재결합 실험)
레플리콘 세포주 Huh-7, 9-13 세포를 12 웰 배양 접시에서 1 ㎖의 부피로 웰 당 3 x 104개 세포의 밀도로 시딩한다. 이 분석을 위해 사용된 세포 배양 배지는 10% 태아소 혈청, 1% 페니실린/스트렙토마이신, 1% 글루타민, 1% 피루브산나트륨 및 1% 비필수 아미노산으로 보충된 DMEM이다. 3시간 내지 4시간의 항온처리 기간 후, 2 ㎖의 최종 부피를 위해 다양한 농도의 화합물을 첨가한다. 그 후, 세포를 5% CO2 대기 하에 37℃에서 14일 동안 추가로 항온처리한다. 상기 세포를 3일 내지 4일마다 분할하고, 배지 및 억제제를 재보충하고, 실시간 PCR에 의한 RNA 정량을 위해 세포 샘플을 회수한다. 14일의 항온처리 후, 상기 세포를 분할하고 항-바이러스 화합물의 부재 하에 새로운 배지 내로 플레이팅한다. 18일째 날, 세포를 분할하고 0.25 mg/㎖의 G418 항생제를 함유하는 새로운 선택 배지 내로 플레이팅한다. G418의 존재 하에 42일째 날까지 배양을 수행하고, 세포를 3일 내지 4일마다 분할하고, 이때 실시간 PCR에 의한 RNA 정량을 위해 세포 샘플을 회수한다. 퀴아젠 알엔이지 시약(퀴아젠 인코포레이티드(Qiagen Inc.), 캐나다 온타리오주 미시사우가 소재, 키트: 74106)을 사용하여 제조자의 프로토콜에 따라 총 RNA(세포 유래 및 바이러스 유래)를 추출하고, MMLV RT 효소를 사용한 cDNA 합성을 수행한다. 이 단계 후, PCR의 실시간 검출을 위해 에이비아이 프리즘(ABI PRISM)(등록상표) 7700 서열 검출 시스템(어플라이드 바이오시스템스(Applied Biosystems), 미국 캘리포니아주 포스터 시티 소재) 상에서 적절한 올리고뉴클레오티드, 택만 프로브 및 DNA Taq 중합효소를 사용하여 PCR 반응을 수행한다. 18S RNA 수준을 이용하여 각각의 웰에서 총 RNA의 양에 대해 표준화한다.
또한, 단독으로 시험된 경우 모든 약물들의 억제 효과에 대한 50% 억제 농도(IC50) 및 90% 억제 농도(IC90)를 화합물 당 6개의 농도를 중복적으로 이용하여 투여량 반응 곡선으로부터 측정한다. 비선형 회귀 분석을 이용하여 곡선을 데이터 점에 맞추고, 그래프패드 프리즘 소프트웨어 버전 2.0(그래프패드 소프트웨어 인코포레이티드, 미국 캘리포니아주 샌 디에고 소재)을 이용하여 상기 생성된 곡선으로부터 IC50 및 IC90을 내삽한다.
티오펜 화합물과 바이러스 단백질분해효소 억제제의 조합 연구
선택된 티오펜 화합물의 조합 연구는 전술된 단락의 재료 및 방법을 이용하였다. 상기 연구를 위해 선택된 HCV HS3 단백질분해효소 억제제는 VX-950이다. 맥시너지(상표명) 소프트웨어를 이용하여 수득한, 이들 화합물들 사이의 상승작용의 크기의 결과는 표 4에 기재되어 있다.
| 화합물# |
티오펜 구조 |
결과 |
| VX-950 (버텍스(Vertex)) |
||
| 1 |
|
중간 정도의 상승작용 (90 μM2%) (86 μM2%) |
실시예 10
: 화합물 1의 일부 전구약물의 합성
본원에서 사용된 바와 같이, 용어 RT(분)는 화합물과 관련된 LCMS 체류시간(분)을 지칭한다. 일부 특정 화합물들의 NMR 및 질량 분광 데이터는 하기 표 5에 요약되어 있다.
화합물 A의 제조
5-(3,3-디메틸부트-1-이닐)-3-[(트랜스-4-하이드록시시클로헥실)-(4-트랜스 메틸시클로헥산카르보닐)아미노]티오펜-2-카르복실산(화합물 (1), 300 mg, 0.67 mmol)을 디클로로메탄(DCM, 15 ㎖)에 용해시켰다. 이것에 (2S)-2-(tert-부톡시카르보닐아미노)-3-메틸-부탄산 Boc-L-발린(176 mg, 0.81 mmol), N,N-디메틸피리딘-4-아민(DMAP, 8.22 mg, 0.067 mmol), 트리에틸아민(Et3N, 136 mg, 187 ㎕, 1.35 mmol) 및 3-(에틸이미노메틸렌아미노)-N,N-디메틸-프로판-1-아민 하이드로클로라이드(EDC, 129 mg, 0.67 mmol)를 첨가하였다. 반응액을 밤새 교반하였다. 그 다음, 반응 혼합물을 농축하고 에틸 아세테이트(EtOAc)로 희석하고 물로 세척하고, 모아진 유기층을 염수로 세척하고 황산나트륨 상에서 건조하였다. 여과 및 농축을 수행하여 황색 오일을 수득하였고, 이 오일을 컬럼 크로마토그래피로 정제하였다. 그 다음, 수득된 생성물을 디옥산(15 ㎖) 중의 4 N HCl로 처리하여 HCl 염으로서 원하는 화합물 A(100 mg, 26%)를 수득하였다: MS: m/z (관측치): 545.4 [M+H]+; 체류시간: 3.45분; 1H NMR (300 MHz, MeOH) δ 7.04 (s, 1H), 4.75 - 4.58 (m, 1H), 4.39 (dt, J = 14.5, 9.4 Hz, 1H), 3.85 (d, J = 4.4 Hz, 1H), 3.80 - 3.68 (m, 1H), 3.61 - 3.51 (m, 1H), 2.24 (dt, J = 14.0, 6.9 Hz, 1H), 2.01 (dd, J = 15.2, 7.3 Hz, 6H), 1.60 (dd, J = 28.5, 14.8 Hz, 9H), 1.34 (s, 9H), 1.18 - 0.99 (m, 3H), 0.81 (d, J = 6.5 Hz, 3H), 0.66 (dd, J = 25.3, 12.9 Hz, 1H).
화합물 B의 제조
5-(3,3-디메틸부트-1-이닐)-3-[(트랜스-4-하이드록시시클로헥실)-(트랜스-4-메틸시클로헥산카르보닐)아미노]티오펜-2-카르복실산(화합물 (1), 100 mg, 0.12 mmol)을 디클로로메탄(DCM, 10.0 ㎖)에 용해시키고 0℃까지 냉각시켰다. 테트라졸(4.0 mg, 0.058 mmol)을 첨가한 후, N-(디-tert-부톡시포스파닐)-N-에틸-에탄아민(288 mg, 322 ㎕, 1.16 mmol)을 첨가하였다. 반응액을 실온에서 밤새 교반한 후 -78℃까지 냉각시켰다. 3-클로로벤젠카르보퍼옥소산(MCPBA)(99.7 mg, 0.58 mmol)을 첨가하고, 반응액을 2시간 동안 교반한 후 수성 Na2SO3으로 급랭시켰다. 혼합물을 에틸 아세테이트로 추출하고, 추출물을 물로 세척하였다. 유기층을 농축하여 무색 오일을 수득하였고, 이 오일을 ISCO 실리카 겔 크로마토그래피로 정제하고 다음 단계에서 직접적으로 사용하였다. CH2Cl2(5 ㎖) 및 2,2,2-트리플루오로아세트산(TFA)(5 ㎖)을 상기 생성물에 첨가하였다. 반응액을 2시간 동안 교반한 후 농축하고, 화합물 B를 HPLC로 정제하였다: MS: m/z (관측치): 526.39 [M+H]+; 체류시간: 6.51분; 1H NMR (3OO MHz, d6-DMSO) δ 7.18 (s, 1H), 4.29 (t, J = 11.8 Hz, 1H), 3.83 (s, 1H), 2.53 (d, J = 8.2 Hz, 3H), 1.84 (s, 2H), 1.75 - 1.33 (m, 7H), 1.30 (s, 9H), 1.27 - 1.09 (m, 3H), 0.90 (d, J = 12.9 Hz, 2H), 0.76 (d, J = 6.5 Hz, 2H), 0.70 - 0.47 (m, 2H); 31P NMR (121.5 MHz, d6-DMSO) δ -2.01 (s).
화합물 C의 제조
3-(에틸이미노메틸렌아미노)-N,N-디메틸-프로판-1-아민 하이드로클로라이(EDC)(32.2 mg, 0.17 mmol), N,N-디메틸피리딘-4-아민(DMAP)(10.3 mg, 0.084 mmol) 및 Et3N(34 mg, 0.33 mmol)을 CH2Cl2(15 ㎖) 중의 5-(3,3-디메틸부트-1-이닐)-3-[(4-트랜스-하이드록시시클로헥실)-(4-트랜스-메틸시클로헥산카르보닐)아미노]티오펜-2-카르복실산(화합물 (1), 75 mg, 0.17 mmol) 및 N-Boc-글리신(44.2 mg, 0.25 mmol)의 용액에 첨가하였다. 반응 혼합물을 주위 온도에서 밤새 교반한 후, 반응 혼합물을 증발시키고 ISCO 실리카 겔 크로마토그래피로 정제하여 화합물 (b4), 즉 [O-(N-tert-부톡시카르보닐)-글리실]-5-(3,3-디메틸부트-1-이닐)-3-[(4-트랜스-하이드록시시클로헥실)-(4-트랜스-메틸시클로헥산카르보닐)아미노]티오펜-2-카르복실산을 수득하였다: MS: m/z (관측치): 603.17 [M+H]+; 체류시간: 2.31분.
[O-(N-tert-부톡시카르보닐)-글리실]-5-(3,3-디메틸부트-1-이닐)-3-[(4-트랜스-하이드록시시클로헥실)-(4-트랜스-메틸시클로헥산카르보닐)아미노]티오펜-2-카르복실산(화합물 (b4), 40 mg, 0.066 mmol)을 디옥산(1 ㎖) 중의 4 N HCl로 처리하고 실온에서 밤새 교반하였다. 그 다음, 반응 혼합물을 농축하고 HPLC로 정제하여 화합물 C(11 mg)를 수득하였다: MS: m/z (관측치): 503.35 [M+H]+; 체류시간: 2.24분.
화합물 D의 제조
화합물 (a5), 즉 [O-(N-tert-부톡시카르보닐)-D-이소류실]-5-(3,3-디메틸부트-1-이닐)-3-[(4-트랜스-하이드록시시클로헥실)-(4-트랜스-메틸시클로헥산카르보닐)아미노]티오펜-2-카르복실산(상기 화합물 1 및 4에 대해 기재된 바와 같이 Boc-D-이소류신으로부터 제조됨)을 디옥산(10 ㎖) 중의 4 N HCl로 처리하고 실온에서 밤새 교반하였다. 그 다음, 반응 혼합물을 농축하고 HPLC로 정제하여 화합물 D를 수득하였다: MS: m/z (관측치): 559.4 [M+H]+; 체류시간: 2.39분.
화합물 E의 제조
화합물 (a6), 즉 [O-(N-tert-부톡시카르보닐)-D-발리닐]-5-(3,3-디메틸부트-1-이닐)-3-[(4-트랜스-하이드록시시클로헥실)-(4-트랜스-메틸시클로헥산카르보닐)아미노]티오펜-2-카르복실산(30 mg)(상기 화합물 1 및 4에 대해 기재된 바와 같이 Boc-D-발린으로부터 제조됨)을 디옥산(10 ㎖) 중의 4 N HCl로 처리하고 실온에서 밤새 교반하였다. 그 다음, 반응 혼합물을 농축하고 HPLC로 정제하여 화합물 E를 수득하였다: MS: m/z (관측치): 545.39 [M+H]+; 체류시간: 2.35분.
화합물 F의 제조
화합물 (a8), 즉 (O-(N-tert-부톡시카르보닐)-L-이소류실)-5-(3,3-디메틸부트-1-이닐)-3-[(4-트랜스-하이드록시시클로헥실)-(4-트랜스-메틸시클로헥산카르보닐)아미노]티오펜-2-카르복실산(상기 화합물 A 및 C에 대해 기재된 바와 같이 Boc-L-이소류신으로부터 제조됨)을 디옥산(10 ㎖) 중의 4 N HCl로 처리하고 실온에서 밤새 교반하였다. 그 다음, 반응 혼합물을 농축하고 HPLC로 정제하여 화합물 F를 수득하였다: MS: m/z (관측치): 559.47 [M+H]+; 체류시간: 3.2분.
화합물 G의 제조
화합물 (a9), 즉 (O-(N-tert-부톡시카르보닐)-L-알라닐)-5-(3,3-디메틸부트-1-이닐)-3-[(4-트랜스-하이드록시시클로헥실)-(4-트랜스-메틸시클로헥산카르보닐)아미노]티오펜-2-카르복실산(상기 화합물 A 및 C에 대해 기재된 바와 같이 Boc-L-알라닌으로부터 제조됨)(25 mg)을 디옥산 중의 4 N HCl에 용해시키고 실온에서 밤새 교반하였다. 그 다음, 반응 혼합물을 농축하고 HPLC로 정제하여 화합물 G를 수득하였다: MS: m/z (관측치): 517.43 [M+H]+; 체류시간: 2.99분.
화합물 H의 제조
화합물 (a10), 즉, (O-(N-tert-부톡시카르보닐)-D-알라닐)-5-(3,3-디메틸부트-1-이닐)-3-[(4-트랜스-하이드록시시클로헥실)-(4-트랜스-메틸시클로헥산카르보닐)아미노]티오펜-2-카르복실산(상기 화합물 1 및 4에 대해 기재된 바와 같이 Boc-D-알라닌으로부터 제조됨)(35 mg, 0.058 mmol)을 디옥산(10 ㎖) 중의 4 N HCl로 처리하고 실온에서 밤새 교반하였다. 그 다음, 반응 혼합물을 농축하고 HPLC로 정제하여 화합물 H를 수득하였다: MS: m/z (관측치): 517.43 [M+H]+; 체류시간: 3.0분.
| 화합물 |
LCMS [M+H]+ |
LCMS RT |
NMR |
| A |
545.45 |
3.45 |
1H NMR (300 MHz, MeOH) δ 7.04 (s, 1H), 4.75 - 4.58 (m, 1H), 4.39 (dt, J = 14.5, 9.4 Hz, 1H), 3.85 (d, J = 4.4 Hz, 1H), 3.80 - 3.68 (m, 1H), 3.61 - 3.51 (m, 1H), 2.24 (dt, J = 14.0, 6.9 Hz, 1H), 2.01 (dd, J = 15.2, 7.3 Hz, 6H), 1.60 (dd, J = 28.5, 14.8 Hz, 9H), 1.34 (s, 9H), 1.18 - 0.99 (m, 3H), 0.81 (d, J = 6.5 Hz, 3H), 0.66 (dd, J = 25.3, 12.9 Hz, 1H) |
| B |
526.39 |
6.51 |
1H NMR (300 MHz, d6-DMSO) δ 7.18 (s, 1H), 4.29 (t, J = 11.8 Hz, 1H), 3.83 (s, 1H), 2.53 (d, J = 8.2 Hz, 3H), 1.84 (s, 2H), 1.75 - 1.33 (m, 7H), 1.30 (s, 9H), 1.27 - 1.09 (m, 3H), 0.90 (d, J = 12.9 Hz, 2H), 0.76 (d, J = 6.5 Hz, 2H), 0.70 - 0.47 (m, 2H); 31P NMR (121.5 MHz, d6-DMSO) δ -2.01 (s). |
| C | 503.35 | 2.24 | |
| D | 559.4 | 2.39 | |
| E | 545.39 | 2.35 | |
| F | 559.47 | 3.2 | |
| G | 517.43 | 2.99 | |
| H | 517.43 | 3 |
실시예
10
: 화합물 1의
전구약물의
PK
파라미터
PK 파라미터가 측정될 전구약물을 0.5% MC/0.5% 트윈 80/99% 물 중의 용액으로서 제제화할 수 있고 3 mg/kg의 투여량으로 래트에게 위관영양법으로 경구 투여할 수 있다. 연구 전날, 래트의 중량을 측정한다. 인스텍(Instech) 자동 혈액 샘플링 장치를 이용하여 투여 전 및 투여 후 15분, 30분, 1시간, 2시간, 3시간, 4시간, 6시간, 8시간, 12시간 및 24시간에서 래트 혈장을 샘플링한다. 혈액을 K2-EDTA를 함유하는 튜브 내에 수집하고, 분석을 위해 110 ㎕의 혈장을 추출한다. 래트에게 무제한적으로 먹이를 공급하고, 표준 IACUC 및 SOP 프로토콜을 수행하였다. LC/MS/MS를 이용하여 전구약물 화합물 및 활성 대사물질 둘다에 대해 혈장 샘플 및 투여 샘플을 분석한다. 측정된 투여량의 전구약물을 사용하여 각각의 대상체에 대한 상기 두 분석대상물의 PK 파라미터를 계산한다.
화합물 H(도 9에서 "화합물 10"으로서 표시되어 있음, 화합물 1의 전구약물)의 PK 파라미터는 이전 단락에 기재된 바와 같이 측정되었고 도 9에 도시되어 있다. 도 9에 나타낸 바와 같이, 화합물 H의 -O-알라닐 기는 생체내에서 -OH 활성 대사물질로 전환된다.
Claims (93)
- HCV에 감염된 환자에게 VX-222 및 VX-950을 동시투여하는 단계를 포함하는, HCV에 감염된 환자에서 VX-222의 약동학(pharmacokinetics)을 개선하는 방법.
- 제1항에 있어서, 상기 환자의 혈장, 혈액 또는 간에서 VX-222의 노출이 개선되는 것인 방법.
- HCV에 감염된 환자에게 VX-222 및 VX-950을 투여하는 단계를 포함하는, HCV에 감염된 환자의 혈장에서 VX-222의 노출을 증가시키는 방법.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 상기 환자의 혈장에서 VX-222의 노출이 VX-950 없이 투여된 경우 VX-222의 혈장 노출에 비해 2배 내지 6배 증가하는 것인 방법.
- 제4항에 있어서, 상기 환자의 혈장에서 VX-222의 노출이 VX-950 없이 투여된 경우 VX-222의 혈장 노출에 비해 2배 내지 4배 증가하는 것인 방법.
- 제1항 내지 제5항 중 어느 한 항에 있어서, VX-222의 C(최저) 수준이 증가하는 것인 방법.
- 제1항 내지 제5항 중 어느 한 항에 있어서, VX-222의 C(최대) 값이 증가하는 것인 방법.
- 제1항 내지 제5항 중 어느 한 항에 있어서, VX-222의 AUC 값이 증가하는 것인 방법.
- 제1항 내지 제8항 중 어느 한 항에 있어서, VX-222를 각각의 투여에서 약 20 mg 내지 약 2,000 mg의 양으로 투여하는 것인 방법.
- 제9항에 있어서, VX-222를 각각의 투여에서 약 50 mg 내지 약 2,000 mg의 양으로 투여하는 것인 방법.
- 제10항에 있어서, VX-222를 각각의 투여에서 약 100 mg 내지 약 1,500 mg의 양으로 투여하는 것인 방법.
- 제11항에 있어서, VX-222를 각각의 투여에서 약 100 mg의 양으로 투여하는 것인 방법.
- 제11항에 있어서, VX-222를 각각의 투여에서 약 400 mg의 양으로 투여하는 것인 방법.
- 제11항에 있어서, VX-222를 각각의 투여에서 약 250 mg의 양으로 투여하는 것인 방법.
- 제11항에 있어서, VX-222를 각각의 투여에서 약 500 mg의 양으로 투여하는 것인 방법.
- 제11항에 있어서, VX-222를 각각의 투여에서 약 750 mg의 양으로 투여하는 것인 방법.
- 제1항 내지 제16항 중 어느 한 항에 있어서, VX-222를 1일 1회 투여하는 것인 방법.
- 제1항 내지 제16항 중 어느 한 항에 있어서, VX-222를 1일 2회 투여하는 것인 방법.
- 제11항에 있어서, VX-222를 각각의 투여에서 약 1,500 mg의 양으로 투여하는 것인 방법.
- 제19항에 있어서, VX-222를 1일 1회 투여하는 것인 방법.
- 제1항 내지 제20항 중 어느 한 항에 있어서, VX-950을 각각의 투여에서 약 100 mg 내지 약 1,500 mg의 양으로 투여하는 것인 방법.
- 제21항에 있어서, VX-950을 각각의 투여에서 약 500 mg 내지 약 1,500 mg의 양으로 투여하는 것인 방법.
- 제21항에 있어서, VX-950을 각각의 투여에서 약 750 mg의 양으로 투여하는 것인 방법.
- 제23항에 있어서, VX-950을 약 750 mg의 양으로 1일 3회 투여하는 것인 방법.
- 제22항에 있어서, VX-950을 각각의 투여에서 약 1,125 mg의 양으로 투여하는 것인 방법.
- 제25항에 있어서, VX-950을 약 1,125 mg의 양으로 1일 2회 투여하는 것인 방법.
- 제1항 내지 제26항 중 어느 한 항에 있어서, VX-950 및 VX-222 이외의 하나 이상의 추가 HCV 약물을 환자에게 투여하는 단계를 추가로 포함하는 방법.
- 제27항에 있어서, 인터페론을 동시투여하는 것인 방법.
- 제28항에 있어서, 인터페론이 페길화된(pegylated) 인터페론인 방법.
- 제28항에 있어서, 인터페론이 페길화된 인터페론 알파인 방법.
- 제30항에 있어서, 페길화된 인터페론 알파가 페길화된 인터페론 알파-2a 또는 페길화된 인터페론 알파-2b인 방법.
- 제27항 또는 제28항에 있어서, 리바비린(ribavirin)을 동시투여하는 것인 방법.
- 제1항 내지 제32항 중 어느 한 항에 있어서, VX-950 및 VX-222를 약 8주 내지 약 24주의 기간 동안 동시투여하는 것인 방법.
- 제33항에 있어서, VX-950 및 VX-222를 약 12주 동안 동시투여하는 것인 방법.
- 제27항에 있어서, 페길화된 인터페론 알파 및 리바비린을 투여하는 것인 방법.
- 제35항에 있어서, 페길화된 인터페론 알파가 페길화된 인터페론 알파-2a 또는 페길화된 인터페론 알파-2b인 방법.
- 제35항 또는 제36항에 있어서, VX-950 및 VX-222를 약 12주 동안 동시투여하는 것인 방법.
- 제37항에 있어서, 페길화된 인터페론 및 리바비린을 약 12주 동안 동시투여하는 것인 방법.
- 제37항에 있어서, 페길화된 인터페론 및 리바비린을 약 24주 동안 동시투여하는 것인 방법.
- VX-222 및 VX-950을 HCV에 감염된 환자에게 투여하는 단계를 포함하는, HCV에 감염된 환자를 치료하는 방법으로서, 여기서 VX-222는 각각의 투여에서 약 20 mg 내지 약 400 mg의 양이고, VX-950은 각각의 투여에서 약 100 mg 내지 약 1,500 mg의 양인 방법.
- 제40항에 있어서, VX-222는 각각의 투여에서 20 mg 이상 내지 400 mg 미만인 양인 방법.
- 제40항에 있어서, VX-222는 각각의 투여에서 약 20 mg 내지 약 300 mg의 양인 방법.
- 제40항에 있어서, VX-950은 각각의 투여에서 약 300 mg 내지 약 1,500 mg의 양인 방법.
- 제40항에 있어서, VX-950을 약 750 mg의 양으로 1일 3회 투여하는 것인 방법.
- 제40항에 있어서, VX-950을 약 1,125 mg의 양으로 1일 2회 투여하는 것인 방법.
- 제40항 내지 제45항 중 어느 한 항에 있어서, VX-222는 각각의 투여에서 약 100 mg의 양인 방법.
- 제40항 내지 제45항 중 어느 한 항에 있어서, VX-222는 각각의 투여에서 약 400 mg의 양인 방법.
- 제40항 내지 제47항 중 어느 한 항에 있어서, VX-222를 1일 1회 투여하는 것인 방법.
- 제40항 내지 제47항 중 어느 한 항에 있어서, VX-222를 1일 2회 투여하는 것인 방법.
- 제40항 내지 제49항 중 어느 한 항에 있어서, VX-950 및 VX-222 이외의 하나 이상의 추가 HCV 약물을 환자에게 투여하는 단계를 추가로 포함하는 방법.
- 제50항에 있어서, 인터페론을 동시투여하는 것인 방법.
- 제51항에 있어서, 인터페론이 페길화된 인터페론인 방법.
- 제52항에 있어서, 인터페론이 페길화된 인터페론 알파인 방법.
- 제52항에 있어서, 페길화된 인터페론 알파가 페길화된 인터페론 알파-2a 또는 페길화된 인터페론 알파-2b인 방법.
- 제50항 또는 제51항에 있어서, 리바비린을 동시투여하는 것인 방법.
- 제40항 내지 제55항 중 어느 한 항에 있어서, VX-950 및 VX-222를 약 8주 내지 약 24주의 기간 동안 투여하는 것인 방법.
- 제56항에 있어서, VX-950 및 VX-222를 약 12주 동안 투여하는 것인 방법.
- 제50항에 있어서, 페길화된 인터페론 알파 및 리바비린을 동시투여하는 것인 방법.
- 제58항에 있어서, 페길화된 인터페론 알파가 페길화된 인터페론 알파-2a 또는 페길화된 인터페론 알파-2b인 방법.
- 제58항 또는 제59항에 있어서, VX-950 및 VX-222를 12주 동안 투여하는 것인 방법.
- 제60항에 있어서, 페길화된 인터페론 및 리바비린을 12주 동안 투여하는 것인 방법.
- 제61항에 있어서, 페길화된 인터페론 및 리바비린을 24주 동안 투여하는 것인 방법.
- 치료적 유효량의 VX-222를 투여하는 단계를 포함하는, HCV에 감염된 환자를 치료하는 방법으로서, 여기서 VX-222를 약 20 mg 내지 약 2,000 mg의 양으로 1일 1회 투여하는 것인 방법.
- 제63항에 있어서, VX-222를 약 100 mg 내지 약 1,500 mg의 양으로 1일 1회 투여하는 것인 방법.
- 제64항에 있어서, VX-222를 약 1,500 mg의 양으로 1일 1회 투여하는 것인 방법.
- 제64항에 있어서, VX-222를 약 750 mg의 양으로 1일 1회 투여하는 것인 방법.
- 제64항에 있어서, VX-222를 약 500 mg의 양으로 1일 1회 투여하는 것인 방법.
- 제64항에 있어서, VX-222를 약 400 mg의 양으로 1일 1회 투여하는 것인 방법.
- 제64항에 있어서, VX-222를 약 250 mg의 양으로 1일 1회 투여하는 것인 방법.
- 제64항에 있어서, VX-222를 약 100 mg의 양으로 1일 1회 투여하는 것인 방법.
- 제63항 내지 제70항 중 어느 한 항에 있어서, VX-222 이외의 하나 이상의 추가 HCV 약물을 환자에게 투여하는 단계를 추가로 포함하는 방법.
- 제71항에 있어서, VX-950을 동시투여하는 것인 방법.
- 제72항에 있어서, VX-950을 각각의 투여에서 약 500 mg 내지 약 1,500 mg의 양으로 투여하는 것인 방법.
- 제72항에 있어서, VX-950을 750 mg의 양으로 1일 3회 투여하는 것인 방법.
- 제73항에 있어서, VX-950을 1,125 mg의 양으로 1일 2회 투여하는 것인 방법.
- 제72항 내지 제75항 중 어느 한 항에 있어서, VX-950 및 VX-222를 약 8주 내지 약 24주의 기간 동안 투여하는 것인 방법.
- 제76항에 있어서, 인터페론을 동시투여하는 것인 방법.
- 제77항에 있어서, 인터페론이 페길화된 인터페론인 방법.
- 제78항에 있어서, 인터페론이 페길화된 인터페론 알파인 방법.
- 제79항에 있어서, 페길화된 인터페론 알파가 페길화된 인터페론 알파-2a 또는 페길화된 인터페론 알파-2b인 방법.
- 제71항 내지 제77항 중 어느 한 항에 있어서, 리바비린을 동시투여하는 것인 방법.
- 제71항 내지 제76항 중 어느 한 항에 있어서, 페길화된 인터페론 알파 및 리바비린을 동시투여하는 것인 방법.
- 제82항에 있어서, 페길화된 인터페론 알파가 페길화된 인터페론 알파-2a 또는 페길화된 인터페론 알파-2b인 방법.
- 제82항에 있어서, VX-950; 페길화된 인터페론 알파-2a 또는 페길화된 인터페론 알파-2b; 및 리바비린을 동시투여하는 것인 방법.
- 제84항에 있어서, VX-950 및 VX-222를 약 12주 동안 투여하는 것인 방법.
- 제84항에 있어서, 페길화된 인터페론 및 리바비린을 약 12주 동안 투여하는 것인 방법.
- 제84항에 있어서, 페길화된 인터페론 및 리바비린을 약 24주 동안 투여하는 것인 방법.
- a) 약 20 mg 내지 약 400 mg의 양인 VX-222; 및
b) 약 100 mg 내지 약 1,500 mg의 양인 VX-950
을 포함하는, 약학적으로 허용가능한 조성물. - 제88항에 있어서, VX-222는 50 mg 이상 내지 400 mg 미만의 양인 조성물.
- 제88항에 있어서, VX-222는 약 100 mg 내지 약 400 mg의 양이고; VX-950은 약 300 mg 내지 약 750 mg의 양인 조성물.
- 제88항 내지 제90항 중 어느 한 항에 있어서, VX-950은 약 375 mg의 양인 조성물.
- 제88항 내지 제90항 중 어느 한 항에 있어서, VX-222는 약 50 mg의 양인 조성물.
- 제88항 내지 제90항 중 어느 한 항에 있어서, VX-222는 약 200 mg의 양인 조성물.
Applications Claiming Priority (9)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US29964310P | 2010-01-29 | 2010-01-29 | |
| US61/299,643 | 2010-01-29 | ||
| US30850610P | 2010-02-26 | 2010-02-26 | |
| US61/308,506 | 2010-02-26 | ||
| US30911710P | 2010-03-01 | 2010-03-01 | |
| US61/309,117 | 2010-03-01 | ||
| US32439510P | 2010-04-15 | 2010-04-15 | |
| US61/324,395 | 2010-04-15 | ||
| PCT/US2011/022854 WO2011094489A1 (en) | 2010-01-29 | 2011-01-28 | Therapies for treating hepatitis c virus infection |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20120139699A true KR20120139699A (ko) | 2012-12-27 |
Family
ID=43901208
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020127021714A KR20120139699A (ko) | 2010-01-29 | 2011-01-28 | C형 간염 바이러스 감염의 치료 요법 |
Country Status (14)
| Country | Link |
|---|---|
| US (1) | US20130034522A1 (ko) |
| EP (1) | EP2528605A1 (ko) |
| JP (1) | JP2013518124A (ko) |
| KR (1) | KR20120139699A (ko) |
| CN (1) | CN102844030A (ko) |
| AU (1) | AU2011210795A1 (ko) |
| CA (1) | CA2788348A1 (ko) |
| IL (1) | IL220937A0 (ko) |
| MX (1) | MX2012008652A (ko) |
| RU (1) | RU2012136824A (ko) |
| SG (1) | SG182589A1 (ko) |
| TW (1) | TW201130502A (ko) |
| WO (1) | WO2011094489A1 (ko) |
| ZA (1) | ZA201205547B (ko) |
Families Citing this family (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8399615B2 (en) | 2005-08-19 | 2013-03-19 | Vertex Pharmaceuticals Incorporated | Processes and intermediates |
| EP2585448A1 (en) * | 2010-06-28 | 2013-05-01 | Vertex Pharmaceuticals Incorporated | Compounds and methods for the treatment or prevention of flavivirus infections |
| PE20140608A1 (es) | 2010-09-22 | 2014-06-12 | Alios Biopharma Inc | Analogos de nucleotidos sustituidos |
| US8492386B2 (en) | 2011-10-21 | 2013-07-23 | Abbvie Inc. | Methods for treating HCV |
| CN104383541A (zh) | 2011-10-21 | 2015-03-04 | 艾伯维公司 | 用于治疗hcv的包含至少两种直接抗病毒剂和利巴韦林但无干扰素的方法 |
| DK2583680T1 (da) | 2011-10-21 | 2015-01-19 | Abbvie Inc | Mono (PSI-7977) eller kombinationsbehandling af DAA til anvendelse ved behandling af HCV |
| US8466159B2 (en) | 2011-10-21 | 2013-06-18 | Abbvie Inc. | Methods for treating HCV |
| EP2794630A4 (en) | 2011-12-22 | 2015-04-01 | Alios Biopharma Inc | SUBSTITUTED PHOSPHORTHIOAT NUCLEOTIDE ANALOGUE |
| WO2013142159A1 (en) * | 2012-03-21 | 2013-09-26 | Alios Biopharma, Inc. | Pharmaceutical combinations comprising a thionucleotide analog |
| NZ631601A (en) | 2012-03-21 | 2016-06-24 | Alios Biopharma Inc | Solid forms of a thiophosphoramidate nucleotide prodrug |
| WO2013142157A1 (en) | 2012-03-22 | 2013-09-26 | Alios Biopharma, Inc. | Pharmaceutical combinations comprising a thionucleotide analog |
| CA3022119A1 (en) | 2016-04-28 | 2017-11-02 | Emory University | Alkyne containing nucleotide and nucleoside therapeutic compositions and uses related thereto |
Family Cites Families (47)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ATE417836T1 (de) | 1992-12-29 | 2009-01-15 | Abbott Lab | Verfahren und intermediate zur herstellung von retroviralen proteasehemmern |
| IL110752A (en) | 1993-09-13 | 2000-07-26 | Abbott Lab | Liquid semi-solid or solid pharmaceutical composition for an HIV protease inhibitor |
| US5559158A (en) | 1993-10-01 | 1996-09-24 | Abbott Laboratories | Pharmaceutical composition |
| IL111991A (en) | 1994-01-28 | 2000-07-26 | Abbott Lab | Liquid pharmaceutical composition of HIV protease inhibitors in organic solvent |
| US6037157A (en) | 1995-06-29 | 2000-03-14 | Abbott Laboratories | Method for improving pharmacokinetics |
| US5807876A (en) | 1996-04-23 | 1998-09-15 | Vertex Pharmaceuticals Incorporated | Inhibitors of IMPDH enzyme |
| US6054472A (en) | 1996-04-23 | 2000-04-25 | Vertex Pharmaceuticals, Incorporated | Inhibitors of IMPDH enzyme |
| SK286662B6 (sk) | 1996-04-23 | 2009-03-05 | Vertex Pharmaceuticals Incorporated | Deriváty močoviny, farmaceutické prostriedky, ktoré ich obsahujú, a ich použitie ako inhibítorov aktivity IMPDH enzýmu |
| CA2282398A1 (en) | 1997-03-14 | 1998-09-17 | Steven M. Ronkin | Inhibitors of impdh enzyme |
| US20040058982A1 (en) | 1999-02-17 | 2004-03-25 | Bioavailability System, Llc | Pharmaceutical compositions |
| EE200100492A (et) | 1999-03-19 | 2002-12-16 | Vertex Pharmaceuticals Incorporated | Ensüümi IMPDH inhibiitorid |
| AU2001268885A1 (en) | 2000-06-28 | 2002-01-08 | National Research Council Of Canada | Helicobacter dd-heptosyltransferase |
| SV2003000617A (es) | 2000-08-31 | 2003-01-13 | Lilly Co Eli | Inhibidores de la proteasa peptidomimetica ref. x-14912m |
| MXPA03006514A (es) | 2001-01-22 | 2004-12-02 | Merck & Co Inc | Derivados de nucleosidos como inhibidores de polimerasa de acido ribonucleico viral dependiente de acido ribonucleico. |
| ATE438637T1 (de) | 2001-06-11 | 2009-08-15 | Virochem Pharma Inc | Thiophenderivate als antivirale mittel gegen flavivirus-infektion |
| CA2369711A1 (en) | 2002-01-30 | 2003-07-30 | Boehringer Ingelheim (Canada) Ltd. | Macrocyclic peptides active against the hepatitis c virus |
| US7091184B2 (en) | 2002-02-01 | 2006-08-15 | Boehringer Ingelheim International Gmbh | Hepatitis C inhibitor tri-peptides |
| US6642204B2 (en) | 2002-02-01 | 2003-11-04 | Boehringer Ingelheim International Gmbh | Hepatitis C inhibitor tri-peptides |
| CA2369970A1 (en) | 2002-02-01 | 2003-08-01 | Boehringer Ingelheim (Canada) Ltd. | Hepatitis c inhibitor tri-peptides |
| CA2494340C (en) | 2002-08-01 | 2012-01-24 | Pharmasset Inc. | Compounds with the bicyclo[4.2.1]nonane system for the treatment of flaviviridae infections |
| CA2413705A1 (en) | 2002-12-06 | 2004-06-06 | Raul Altman | Use of meloxicam in combination with an antiplatelet agent for treatment of acute coronary syndrome and related conditions |
| US7098231B2 (en) | 2003-01-22 | 2006-08-29 | Boehringer Ingelheim International Gmbh | Viral polymerase inhibitors |
| US7223785B2 (en) | 2003-01-22 | 2007-05-29 | Boehringer Ingelheim International Gmbh | Viral polymerase inhibitors |
| JP2006517960A (ja) | 2003-02-18 | 2006-08-03 | ファイザー インコーポレイテッド | C型肝炎ウイルスの阻害剤、それを使用する組成物および治療法 |
| DE602004029866D1 (de) | 2003-03-05 | 2010-12-16 | Boehringer Ingelheim Pharma | Peptidanaloga mit inhibitorischer wirkung auf hepatitis c |
| EP1601685A1 (en) | 2003-03-05 | 2005-12-07 | Boehringer Ingelheim International GmbH | Hepatitis c inhibiting compounds |
| CN1791599A (zh) | 2003-05-21 | 2006-06-21 | 贝林格尔.英格海姆国际有限公司 | 丙型肝炎抑制剂化合物 |
| WO2005018330A1 (en) | 2003-08-18 | 2005-03-03 | Pharmasset, Inc. | Dosing regimen for flaviviridae therapy |
| US20050120398A1 (en) | 2003-09-12 | 2005-06-02 | Vertex Pharmaceuticals Incorporated | Animal model for HCV infection |
| US6933760B2 (en) | 2003-09-19 | 2005-08-23 | Intel Corporation | Reference voltage generator for hysteresis circuit |
| US7642235B2 (en) | 2003-09-22 | 2010-01-05 | Boehringer Ingelheim International Gmbh | Macrocyclic peptides active against the hepatitis C virus |
| US7132504B2 (en) | 2003-11-12 | 2006-11-07 | Bristol-Myers Squibb Company | Hepatitis C virus inhibitors |
| EP1730167B1 (en) | 2004-01-21 | 2011-01-12 | Boehringer Ingelheim International GmbH | Macrocyclic peptides active against the hepatitis c virus |
| US20050187192A1 (en) | 2004-02-20 | 2005-08-25 | Kucera Pharmaceutical Company | Phospholipids for the treatment of infection by togaviruses, herpes viruses and coronaviruses |
| ES2431314T3 (es) | 2004-02-20 | 2013-11-26 | Boehringer Ingelheim International Gmbh | Inhibidores de polimerasa vírica |
| US20050288333A1 (en) | 2004-06-08 | 2005-12-29 | Kem William R | Controlling angiogenesis with anabaseine analogs |
| TWI437990B (zh) * | 2004-10-29 | 2014-05-21 | Vertex Pharma | Vx-950之醫藥用途 |
| AU2007217355B2 (en) | 2006-02-27 | 2012-06-21 | Vertex Pharmaceuticals Incorporated | Co-crystals comprising VX-950 and pharmaceutical compositions comprising the same |
| CA2646229A1 (en) | 2006-03-16 | 2007-09-27 | Vertex Pharmaceuticals Incorporated | Deuterated hepatitis c protease inhibitors |
| CN103272234A (zh) | 2006-03-20 | 2013-09-04 | 沃泰克斯药物股份有限公司 | 药物组合物 |
| US20070218138A1 (en) | 2006-03-20 | 2007-09-20 | Bittorf Kevin J | Pharmaceutical Compositions |
| CA2670260A1 (en) * | 2006-11-15 | 2008-05-22 | Virochem Pharma Inc. | Thiophene analogues for the treatment or prevention of flavivirus infections |
| MX2009006806A (es) | 2006-12-22 | 2009-08-27 | Vertex Pharma | Secado por rocio fluidizado. |
| TW200846343A (en) | 2007-02-27 | 2008-12-01 | Vertex Pharma | Co-crystals and pharmaceutical compositions comprising the same |
| CN101854936A (zh) | 2007-05-21 | 2010-10-06 | 弗特克斯药品有限公司 | 包含vx-950的剂型及其给药方案 |
| EA024359B1 (ru) * | 2007-06-29 | 2016-09-30 | Джилид Сайэнс, Инк. | Пуриновые производные и их применение в качестве модуляторов толл-подобного рецептора 7 |
| US8536187B2 (en) * | 2008-07-03 | 2013-09-17 | Gilead Sciences, Inc. | 2,4,6-trisubstituted pyrido(3,2-d)pyrimidines useful for treating viral infections |
-
2011
- 2011-01-28 RU RU2012136824/15A patent/RU2012136824A/ru not_active Application Discontinuation
- 2011-01-28 MX MX2012008652A patent/MX2012008652A/es active IP Right Grant
- 2011-01-28 KR KR1020127021714A patent/KR20120139699A/ko not_active Application Discontinuation
- 2011-01-28 EP EP11703776A patent/EP2528605A1/en not_active Withdrawn
- 2011-01-28 TW TW100103512A patent/TW201130502A/zh unknown
- 2011-01-28 CA CA2788348A patent/CA2788348A1/en not_active Abandoned
- 2011-01-28 CN CN2011800168308A patent/CN102844030A/zh active Pending
- 2011-01-28 SG SG2012053120A patent/SG182589A1/en unknown
- 2011-01-28 JP JP2012551302A patent/JP2013518124A/ja active Pending
- 2011-01-28 AU AU2011210795A patent/AU2011210795A1/en not_active Abandoned
- 2011-01-28 WO PCT/US2011/022854 patent/WO2011094489A1/en active Application Filing
-
2012
- 2012-07-12 IL IL220937A patent/IL220937A0/en unknown
- 2012-07-23 ZA ZA2012/05547A patent/ZA201205547B/en unknown
- 2012-07-27 US US13/559,995 patent/US20130034522A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| TW201130502A (en) | 2011-09-16 |
| JP2013518124A (ja) | 2013-05-20 |
| CN102844030A (zh) | 2012-12-26 |
| WO2011094489A1 (en) | 2011-08-04 |
| CA2788348A1 (en) | 2011-08-04 |
| RU2012136824A (ru) | 2014-03-10 |
| IL220937A0 (en) | 2012-09-24 |
| AU2011210795A1 (en) | 2012-08-02 |
| US20130034522A1 (en) | 2013-02-07 |
| EP2528605A1 (en) | 2012-12-05 |
| MX2012008652A (es) | 2012-08-23 |
| ZA201205547B (en) | 2013-04-24 |
| SG182589A1 (en) | 2012-08-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP1677827B1 (en) | Combinations for hcv treatment | |
| US8431615B2 (en) | Dose forms | |
| KR20120139699A (ko) | C형 간염 바이러스 감염의 치료 요법 | |
| US20100189688A1 (en) | Dose forms comprising VX-950 and their dosage regimen | |
| US20110274652A1 (en) | Methods for Treating Hepatitis C Virus Infection | |
| US20130273003A1 (en) | Therapies for Treating Hepatitis C Virus Infection | |
| AU2012200942A1 (en) | Dose forms comprising VX-950 and their dosage regimen | |
| EP1944042A1 (en) | Combinations for HCV treatment |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |