KR20120088660A - 경구투여가능한 인슐린 함유 약제학적 조성물 - Google Patents
경구투여가능한 인슐린 함유 약제학적 조성물 Download PDFInfo
- Publication number
- KR20120088660A KR20120088660A KR1020127005524A KR20127005524A KR20120088660A KR 20120088660 A KR20120088660 A KR 20120088660A KR 1020127005524 A KR1020127005524 A KR 1020127005524A KR 20127005524 A KR20127005524 A KR 20127005524A KR 20120088660 A KR20120088660 A KR 20120088660A
- Authority
- KR
- South Korea
- Prior art keywords
- insulin
- amino
- caproic acid
- casein
- human recombinant
- Prior art date
Links
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 title claims abstract description 140
- 102000004877 Insulin Human genes 0.000 title claims abstract description 70
- 108090001061 Insulin Proteins 0.000 title claims abstract description 70
- 229940125396 insulin Drugs 0.000 title claims abstract description 67
- 239000000825 pharmaceutical preparation Substances 0.000 title claims abstract description 22
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 17
- 206010012601 diabetes mellitus Diseases 0.000 claims abstract description 16
- 238000000034 method Methods 0.000 claims abstract description 14
- 239000000137 peptide hydrolase inhibitor Substances 0.000 claims abstract description 10
- 241000124008 Mammalia Species 0.000 claims abstract description 9
- 229940042399 direct acting antivirals protease inhibitors Drugs 0.000 claims abstract description 8
- 102000004169 proteins and genes Human genes 0.000 claims abstract description 8
- 108090000623 proteins and genes Proteins 0.000 claims abstract description 8
- 238000002360 preparation method Methods 0.000 claims abstract description 7
- SLXKOJJOQWFEFD-UHFFFAOYSA-N 6-aminohexanoic acid Chemical group NCCCCCC(O)=O SLXKOJJOQWFEFD-UHFFFAOYSA-N 0.000 claims description 23
- 229960002684 aminocaproic acid Drugs 0.000 claims description 20
- 239000005018 casein Substances 0.000 claims description 14
- BECPQYXYKAMYBN-UHFFFAOYSA-N casein, tech. Chemical compound NCCCCC(C(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(CC(C)C)N=C(O)C(CCC(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(C(C)O)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(COP(O)(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(N)CC1=CC=CC=C1 BECPQYXYKAMYBN-UHFFFAOYSA-N 0.000 claims description 14
- 235000021240 caseins Nutrition 0.000 claims description 14
- 239000000203 mixture Substances 0.000 claims description 14
- 238000009472 formulation Methods 0.000 claims description 12
- 235000018102 proteins Nutrition 0.000 claims description 7
- 101000976075 Homo sapiens Insulin Proteins 0.000 claims description 4
- 239000000654 additive Substances 0.000 claims description 4
- PBGKTOXHQIOBKM-FHFVDXKLSA-N insulin (human) Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@H]1CSSC[C@H]2C(=O)N[C@H](C(=O)N[C@@H](CO)C(=O)N[C@H](C(=O)N[C@H](C(N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=3C=CC(O)=CC=3)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC=3C=CC(O)=CC=3)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=3C=CC(O)=CC=3)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=3NC=NC=3)NC(=O)[C@H](CO)NC(=O)CNC1=O)C(=O)NCC(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)NCC(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)O)C(O)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O)=O)CSSC[C@@H](C(N2)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@@H](NC(=O)CN)[C@@H](C)CC)[C@@H](C)CC)[C@@H](C)O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@@H](NC(=O)[C@@H](N)CC=1C=CC=CC=1)C(C)C)C1=CN=CN1 PBGKTOXHQIOBKM-FHFVDXKLSA-N 0.000 claims description 4
- 239000003937 drug carrier Substances 0.000 claims description 3
- 239000004026 insulin derivative Substances 0.000 claims description 3
- 229940124158 Protease/peptidase inhibitor Drugs 0.000 claims description 2
- 230000000996 additive effect Effects 0.000 claims description 2
- 206010067584 Type 1 diabetes mellitus Diseases 0.000 claims 1
- 239000008280 blood Substances 0.000 description 9
- 210000004369 blood Anatomy 0.000 description 9
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 7
- 239000008103 glucose Substances 0.000 description 7
- 238000002474 experimental method Methods 0.000 description 5
- 229940125395 oral insulin Drugs 0.000 description 5
- 238000007920 subcutaneous administration Methods 0.000 description 5
- 241001465754 Metazoa Species 0.000 description 4
- 238000010521 absorption reaction Methods 0.000 description 4
- 230000000694 effects Effects 0.000 description 4
- 108091005804 Peptidases Proteins 0.000 description 3
- ZSJLQEPLLKMAKR-UHFFFAOYSA-N Streptozotocin Natural products O=NN(C)C(=O)NC1C(O)OC(CO)C(O)C1O ZSJLQEPLLKMAKR-UHFFFAOYSA-N 0.000 description 3
- 210000000813 small intestine Anatomy 0.000 description 3
- ZSJLQEPLLKMAKR-GKHCUFPYSA-N streptozocin Chemical compound O=NN(C)C(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O ZSJLQEPLLKMAKR-GKHCUFPYSA-N 0.000 description 3
- 229960001052 streptozocin Drugs 0.000 description 3
- 239000000126 substance Substances 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- -1 Na-salicylate Chemical class 0.000 description 2
- 102000035195 Peptidases Human genes 0.000 description 2
- 239000004365 Protease Substances 0.000 description 2
- 241000700157 Rattus norvegicus Species 0.000 description 2
- 239000004480 active ingredient Substances 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 239000007900 aqueous suspension Substances 0.000 description 2
- 239000003613 bile acid Substances 0.000 description 2
- 239000012876 carrier material Substances 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 210000001035 gastrointestinal tract Anatomy 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 238000000338 in vitro Methods 0.000 description 2
- 239000011159 matrix material Substances 0.000 description 2
- 229920001515 polyalkylene glycol Polymers 0.000 description 2
- 230000017854 proteolysis Effects 0.000 description 2
- 230000001603 reducing effect Effects 0.000 description 2
- 239000000243 solution Substances 0.000 description 2
- 239000002904 solvent Substances 0.000 description 2
- 238000012360 testing method Methods 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- OYHQOLUKZRVURQ-NTGFUMLPSA-N (9Z,12Z)-9,10,12,13-tetratritiooctadeca-9,12-dienoic acid Chemical compound C(CCCCCCC\C(=C(/C\C(=C(/CCCCC)\[3H])\[3H])\[3H])\[3H])(=O)O OYHQOLUKZRVURQ-NTGFUMLPSA-N 0.000 description 1
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 1
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 1
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 1
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 1
- 108010039627 Aprotinin Proteins 0.000 description 1
- 108010001478 Bacitracin Proteins 0.000 description 1
- 101001012217 Conus geographus Con-Ins G3 Proteins 0.000 description 1
- 101001012221 Conus tulipa Con-Ins T3 Proteins 0.000 description 1
- 239000004375 Dextrin Substances 0.000 description 1
- 229920001353 Dextrin Polymers 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 239000004366 Glucose oxidase Substances 0.000 description 1
- 108010015776 Glucose oxidase Proteins 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 239000005642 Oleic acid Substances 0.000 description 1
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 1
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 1
- 238000000692 Student's t-test Methods 0.000 description 1
- 108090000631 Trypsin Proteins 0.000 description 1
- 102000004142 Trypsin Human genes 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 108010027597 alpha-chymotrypsin Proteins 0.000 description 1
- 238000000540 analysis of variance Methods 0.000 description 1
- OUCPJZWNFRYRBI-UHFFFAOYSA-N aniline;formaldehyde Chemical compound O=C.NC1=CC=CC=C1 OUCPJZWNFRYRBI-UHFFFAOYSA-N 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 229960004405 aprotinin Drugs 0.000 description 1
- 229960003071 bacitracin Drugs 0.000 description 1
- 229930184125 bacitracin Natural products 0.000 description 1
- CLKOFPXJLQSYAH-ABRJDSQDSA-N bacitracin A Chemical compound C1SC([C@@H](N)[C@@H](C)CC)=N[C@@H]1C(=O)N[C@@H](CC(C)C)C(=O)N[C@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]1C(=O)N[C@H](CCCN)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@H](CC=2C=CC=CC=2)C(=O)N[C@@H](CC=2N=CNC=2)C(=O)N[C@H](CC(O)=O)C(=O)N[C@@H](CC(N)=O)C(=O)NCCCC1 CLKOFPXJLQSYAH-ABRJDSQDSA-N 0.000 description 1
- 238000006065 biodegradation reaction Methods 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 230000002950 deficient Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 230000000593 degrading effect Effects 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 235000019425 dextrin Nutrition 0.000 description 1
- 210000002249 digestive system Anatomy 0.000 description 1
- 229940043264 dodecyl sulfate Drugs 0.000 description 1
- 230000000667 effect on insulin Effects 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 229940088598 enzyme Drugs 0.000 description 1
- 239000007941 film coated tablet Substances 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 239000007903 gelatin capsule Substances 0.000 description 1
- 229940116332 glucose oxidase Drugs 0.000 description 1
- 235000019420 glucose oxidase Nutrition 0.000 description 1
- 150000002334 glycols Chemical class 0.000 description 1
- 239000000017 hydrogel Substances 0.000 description 1
- 230000003345 hyperglycaemic effect Effects 0.000 description 1
- 230000002779 inactivation Effects 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- ZPNFWUPYTFPOJU-LPYSRVMUSA-N iniprol Chemical compound C([C@H]1C(=O)NCC(=O)NCC(=O)N[C@H]2CSSC[C@H]3C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@H](C(N[C@H](C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=4C=CC(O)=CC=4)C(=O)N[C@@H](CC=4C=CC=CC=4)C(=O)N[C@@H](CC=4C=CC(O)=CC=4)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CC=4C=CC=CC=4)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCCN)NC(=O)[C@H](C)NC(=O)[C@H](CCCNC(N)=N)NC2=O)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](CC=2C=CC=CC=2)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H]2N(CCC2)C(=O)[C@@H](N)CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N2[C@@H](CCC2)C(=O)N2[C@@H](CCC2)C(=O)N[C@@H](CC=2C=CC(O)=CC=2)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N2[C@@H](CCC2)C(=O)N3)C(=O)NCC(=O)NCC(=O)N[C@@H](C)C(O)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@H](C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@H](C(=O)N1)C(C)C)[C@@H](C)O)[C@@H](C)CC)=O)[C@@H](C)CC)C1=CC=C(O)C=C1 ZPNFWUPYTFPOJU-LPYSRVMUSA-N 0.000 description 1
- 230000003914 insulin secretion Effects 0.000 description 1
- 210000005027 intestinal barrier Anatomy 0.000 description 1
- 230000007358 intestinal barrier function Effects 0.000 description 1
- 230000000968 intestinal effect Effects 0.000 description 1
- 210000000936 intestine Anatomy 0.000 description 1
- 238000010253 intravenous injection Methods 0.000 description 1
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 1
- 210000002429 large intestine Anatomy 0.000 description 1
- 239000000787 lecithin Substances 0.000 description 1
- 235000010445 lecithin Nutrition 0.000 description 1
- 229940067606 lecithin Drugs 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 229920003145 methacrylic acid copolymer Polymers 0.000 description 1
- 239000011859 microparticle Substances 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 1
- 229960002969 oleic acid Drugs 0.000 description 1
- 235000021313 oleic acid Nutrition 0.000 description 1
- 239000008177 pharmaceutical agent Substances 0.000 description 1
- 150000002989 phenols Chemical class 0.000 description 1
- 230000036470 plasma concentration Effects 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 235000019833 protease Nutrition 0.000 description 1
- 235000019419 proteases Nutrition 0.000 description 1
- 238000003127 radioimmunoassay Methods 0.000 description 1
- 238000004007 reversed phase HPLC Methods 0.000 description 1
- 229960001860 salicylate Drugs 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- UQFYDAAKCZKDHS-UHFFFAOYSA-M sodium;4-[(4-chloro-2-hydroxybenzoyl)amino]butanoate Chemical compound [Na+].OC1=CC(Cl)=CC=C1C(=O)NCCCC([O-])=O UQFYDAAKCZKDHS-UHFFFAOYSA-M 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 238000013222 sprague-dawley male rat Methods 0.000 description 1
- 210000002784 stomach Anatomy 0.000 description 1
- 230000007666 subchronic toxicity Effects 0.000 description 1
- 231100000195 subchronic toxicity Toxicity 0.000 description 1
- 150000003467 sulfuric acid derivatives Chemical class 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 238000012353 t test Methods 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 239000012588 trypsin Substances 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2013—Organic compounds, e.g. phospholipids, fats
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/195—Carboxylic acids, e.g. valproic acid having an amino group
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/22—Hormones
- A61K38/28—Insulins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/16—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing nitrogen, e.g. nitro-, nitroso-, azo-compounds, nitriles, cyanates
- A61K47/18—Amines; Amides; Ureas; Quaternary ammonium compounds; Amino acids; Oligopeptides having up to five amino acids
- A61K47/183—Amino acids, e.g. glycine, EDTA or aspartame
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/42—Proteins; Polypeptides; Degradation products thereof; Derivatives thereof, e.g. albumin, gelatin or zein
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/28—Dragees; Coated pills or tablets, e.g. with film or compression coating
- A61K9/2806—Coating materials
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/4841—Filling excipients; Inactive ingredients
- A61K9/4858—Organic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/48—Drugs for disorders of the endocrine system of the pancreatic hormones
- A61P5/50—Drugs for disorders of the endocrine system of the pancreatic hormones for increasing or potentiating the activity of insulin
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Diabetes (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Endocrinology (AREA)
- Zoology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Gastroenterology & Hepatology (AREA)
- Immunology (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Biophysics (AREA)
- Molecular Biology (AREA)
- Organic Chemistry (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Inorganic Chemistry (AREA)
- Emergency Medicine (AREA)
- Hematology (AREA)
- Obesity (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicinal Preparation (AREA)
Abstract
본 발명은 생명공학적으로 제조된 인간 재조합 인슐린 및/또는 변형 인슐린 또는 그것의 유사체 및/또는 유도체, 프로테아제 억제제 및 고분자량 (천연) 단백질의 조합물을 함유하는 경구투여가능한 약제학적 제제에 관한 것이다. 본 발명은 또한 약제학적 제제의 제조방법에 관한 것이다. 본 발명은 또한 약제학적 제제의 용도 및 포유동물의 당뇨병의 치료 방법에 관한 것이다.
Description
본 발명은 생물공학적으로 생산된 인간 재조합 인슐린 및/또는 변형 인슐린 또는 그들의 유사체 및/또는 유도체, 프로테아제 억제제 및 고분자량 (천연) 단백질의 조합물을 함유하는 경구투여가능한 약제학적 제제에 관한 것이다. 본 발명은 또한 약제학적 제제의 생산방법에 관한 것이다. 본 발명은 또한 약제학적 제제의 사용 및 포유동물에서 당뇨병의 치료방법에 관한 것이다.
경구투여가능한 인슐린 제제의 개발에서, 두 가지 기본적인 문제가 해결되어야만 한다: 펩티드 성질의 인슐린의 분해 억제 및 장내 장벽 통과.
문헌에 따르면, 인슐린을 함유하는 경구투여가능 약제학적 제제를 개발하기 위한 수많은 시도가 있어왔다. 본질적으로 이들 제제는 그들이 효소적 불활성화를 억제하고, 인슐린의 흡수 및 재흡수를 촉진하기 위해 인슐린에 더하여 다른 물질들을 함유한다는 점에서 서로 다르다.
문헌 EP 1454631는 수성 현탁물에 약제학적으로 유효한 양의 인슐린과 결정성 덱스트린 미립자를 함유하는 약제학적 제제를 기재한다. 제제는 단일상 또는 다중상일 수 있는 제어된 인슐린 방출을 제공한다.
문헌 US 1993005970는 올리고머에 공유결합적으로 결합된 인슐린을 함유하는 약제학적 제제를 기재한다.
국제공보 제WO0033866에 기재된 약제학적 제제는 현탁물 형태로, 긴사슬 PEG 종들과 혼합된, 비-수성 친수성 매질 중의 인슐린을 함유한다.
국제공보 제WO9636352는 적어도 두 가지의 흡수 촉진 화합물, 예를 들면, Na-살리실산염, Na-라우릴설페이트, 올레산, 리놀레산, 레시틴 등을 함유하는 경구 또는 비강 투여에 적합한 인슐린 제제를 기재한다.
미국 특허 제5438040호의 주제는 컨쥬게이트된 인슐린 복합체를 함유하는 경구투여가능한 약제학적 제제이고, 여기서 인슐린은 생리적으로 양립가능한 폴리알킬렌 글리콜 유도체에 공유적으로 결합하고, 이것은 안정하고, 수용성이고, 그리고 동시에 소화계에서 분해되지 않는다.
일본 특허출원 제54028807에 기재된 제제는 첨가제로서 뮤신과, 인슐린 억제제를 함유한다.
국제공보문헌 WOO 166085에 기재된 약제학적 제제는 인슐린, 알칼리성 금속 (C8 내지 C22 알칼리) 황산염, 용매로서의 물 또는 에탄올, 페놀성 화합물, 항산화제 및 프로테아제 억제제 - 예를 들면 바시트라신 또는 그것의 유도체, 소이 트립신 또는 아프로티닌을 함유한다
국제공보문헌 WO9310767는 위장관에서 효소적으로 불활성화되는 어느 펩티드-유형 활성 성분들의 경구 투여 문제에 대한 해결책을 제공한다. 인슐린의 경우, 이 목적은 인슐린을 젤라틴 매트릭스에 병합시킴으로써 달성된다. 젤라틴은 활성성분이 장시간 동안 펩티다아제의 열화 효과에 노출되지 않는 방식으로 대장과 소장에서 흡수되도록 한다.
문헌 EPO 127535에 기재된 약제학적 제제는 인슐린, 담즙산 및 프로테아제 억제제를 함유한다. 담즙산은 흡수를 촉진하고, 프로테아제 억제제는 인슐린은 단백질분해로부터 보호한다. 경구 투여된 제제는 위를 신속히 통과하고, 그리고 장에서 방출되고 그리고 신속히 흡수된다.
유럽 특허출원 EP0351651는 인슐린에 더하여, 흡수-촉진 물질로서 폴리옥시에틸렌 글리콜-카르복실산-글리세리드 에스테르, 및 담체 물질을 함유하는 경구 및 구강 투여에 적합한 제제를 기재한다.
미국 특허 제US3172814에 기재된 제제는 인슐린의 효과가 감소하는 것을 막기 위해, 인슐린과 무수-포름알테히드 아닐린을 함유한다.
국제공보 WO2007121318에 따른 제제는 인슐린과 담체 물질로서 소듐 4-CNAB를 함유하고, 이것은 함께 냉동건조되고, 그리고 나서 얻어진 분말은 타정되거나 또는 젤라틴 캡슐에 채워진다.
국제공보 WO9843615에 따르면, 삼킬 수 있는 하이드로겔 매트릭스가 사용되고, 이것은 메타크릴산과 폴리알킬렌 글리콜의 공중합체이고, 인슐린이 소장에 도달했을 때에만 방출되도록 한다. 중합체는 또한 소장에 있는 단백질분해효소의 작용을 억제하고, 인슐린이 흡수되기 전 장시간 활성을 유지하도록 돕는다.
지금까지 알려진 제제들은 일반적으로 인슐린의 생물학적 이용가능성이 낮고, 오직 소량만이 위장관에서 흡수되고, 신속히 분해되고 혈당 수준에 영향을 미치지 못한다는 사실로 특징된다.
본 발명의 목적은 지금까지 알려진 것보다 더 나은 생물학적 이용가능성을 갖는 인슐린을 함유하는 경구 투여가능한 약제학적 제제를 개발하는 것이다.
설정된 목적은 인슐린, 프로테아제-억제 물질 및 고분자량 천연 단백질의 조합물로 달성되었다. 프로테아제 억제 물질과 단백질은 둘 다 장내 담체를 가져서, 둘 다 장 내벽을 통과할 수 있고 적절한 담체 분자와 함께 펩티드 특성의 인슐린이 통과될 수 있게 한다.
본 발명은 생명공학적으로 생산된 인간 재조합 인슐린 및/또는 변형 인슐린 또는 그들의 유사체 및/또는 유도체, 프로테아제 억제제 및 고분자량 (천연) 단백질의 조합물을 함유하는 경구투여가능한 약제학적 제제에 관한 것이다.
인간 인슐린은 위치 B28에 Asp. Lys, Leu, VaI 또는 Ala 및 위치 B29에 Lys 또는 Pro을 갖는 유사체; 또는 des(B28-B30), des(B27) 또는 des(B30) 인간 인슐린이다.
본 발명의 바람직한 구현예에 따르면, 프로테아제 억제제는 ε-아미노-카프로산이고 및 고분자량 천연 단백질은 카제인이다.
본 발명에 따른 약제학적 제제는 인간 재조합 인슐린 40 - 100 IU, ε-아미노-카프로산 100 - 1000 mg 및 카제인 1 - 100 mg, 그리고 약제학적으로 허용가능한 담체 및 첨가물질을 함유한다.
본 발명에 따른 약제학적 제제는 포유동물의 (제1형 및 제2형) 당뇨병의 치료에 사용될 수 있다.
본 발명에 따른 약제학적 제제는 유리하기는 또한 임신부의 당뇨병의 치료에도 사용될 수 있다.
본 발명은 또한 포유동물의 (제1형 및 제2형) 당뇨병의 치료에 적합한 경구투여용 약제학적 조성물의 생산을 위한, 치료적으로 효과적인 양의 생물공학적으로 생산된 인간 재조합 인슐린 및/또는 변형 인슐린 또는 그들의 유사체 및/또는 유도체, ε-아미노-카프로산 및 카제인의 조합물의 용도에 관한 것이다.
본 발명의 주제는 또한 경구투여가능한 약제학적 제제의 생산방법으로 전환되고, 그것에 따라, 약제학적으로 허용가능한 담체 및 첨가물질과 혼합된, 생명공학적으로 생산된 인간 재조합 인슐린 및/또는 변형 인슐린 또는 그들의 유사체 및/또는 유도체 40-100 IU, ε-아미노-카프로산 100 -1000 mg 및 카제인 1 - 100 mg이 경구투여가능한 제형으로 제제화된다.
경구투여가능한 약제학적 제제는 캡슐제, 정제 또는 필름-코팅된 정제일 수 있다.
본 발명은 또한 포유동물의 (제1형 및 제2형) 당뇨병의 치료방법에 관한 것이고, 그 방법에 따라 환자에게 치료적으로 유효량의 생명공학적으로 생산된 인간 재조합 인슐린 및/또는 변형 인슐린 또는 그것의 유사체 및/또는 유도체, ε-아미노-카프로산 및 카제인을 함유하는 경구 투여가능한 약제학적 제제가 제공된다.
더욱 상세히는, 환자는 인간 재조합 인슐린 40-100 IU, ε-아미노-카프로산 10 -1000 mg 및 카제인 1-100 mg을 함유하는 약제학적 제제를 제공받는다.
본 발명에 따른 약제학적 제제는 30%를 넘는 생물학적 이용가능성에 의해 특징된다.
본 발명은 도 1-3 및 실시예에 나타낸 시험 결과들에 의해 더욱 상세히 설명된다.
도 1: α-키모트립신을 함유하는 용액 (1.5 μg/10 μl) 중에 등량의 인슐린/ε-아미노-카프로산 (아세프라민, Sigma, MO)의 존재에서의 인슐린 (100 μM; 천연) 안정성.
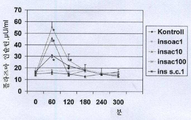
도 2: 피하 인슐린(10 IU/kg)과 비교한, 스트렙토조토신 (50 mg/kg i.v.) 유도 당뇨병에서 혈당 수준에 대한 인슐린 단일 경구 제형(10 IU/kg)의 효과.
* 대조군과 비교한 유의차 (p<0.05). 그룹당 n=8.
약어: insac 1 :ε-아미노-카프로산 1 mg/kg을 갖는 경구 인슐린;
insac 10: ε-아미노-카프로산 10 mg/kg을 갖는 경구 인슐린;
insac 100: ε-아미노-카프로산 100 mg/kg을 갖는 경구 인슐린;
ins s.c: 피하 인슐린
도 3: 피하 인슐린 (10 IU/kg)과 비교한, 스트렙토조토신 (50 mg/kg/ i.v.) 유도 당뇨병에서 플라즈마 인슐린 면역반응성에 대한 인슐린 단일 경구 제형 (10 IU/kg)의 효과.
* 대조군과 비교한 유의차 (p<0.05). 그룹당 n=8.
도 1의 데이타는 60분 후, 천연 인슐린의 80% 이상이 분해된 반면, 제제화된 인슐린의 60%가 분해되었음을 나타낸다.
도 2 및 도 3은 제제화된 경구 인슐린이 플라즈마 인슐린 수준을 증가시키고, 인슐린 결핍 당뇨병에서 혈당 수준을 효과적으로 감소시킨다는 것을 증명한다.
실험을 근거로, 동일한 표준 인슐린(10 IU/kg)과 함께, ε-아미노-카프로산 함량 100 mg/kg 은 10 mg/kg과 비교하여 이점을 제공하지 않았다. 피하 인슐린의 경우, "60 분" 값은 아마도 이미 감소하는 플라즈마 농도 값일 것이다.
도 2: 피하 인슐린(10 IU/kg)과 비교한, 스트렙토조토신 (50 mg/kg i.v.) 유도 당뇨병에서 혈당 수준에 대한 인슐린 단일 경구 제형(10 IU/kg)의 효과.
* 대조군과 비교한 유의차 (p<0.05). 그룹당 n=8.
약어: insac 1 :ε-아미노-카프로산 1 mg/kg을 갖는 경구 인슐린;
insac 10: ε-아미노-카프로산 10 mg/kg을 갖는 경구 인슐린;
insac 100: ε-아미노-카프로산 100 mg/kg을 갖는 경구 인슐린;
ins s.c: 피하 인슐린
도 3: 피하 인슐린 (10 IU/kg)과 비교한, 스트렙토조토신 (50 mg/kg/ i.v.) 유도 당뇨병에서 플라즈마 인슐린 면역반응성에 대한 인슐린 단일 경구 제형 (10 IU/kg)의 효과.
* 대조군과 비교한 유의차 (p<0.05). 그룹당 n=8.
도 1의 데이타는 60분 후, 천연 인슐린의 80% 이상이 분해된 반면, 제제화된 인슐린의 60%가 분해되었음을 나타낸다.
도 2 및 도 3은 제제화된 경구 인슐린이 플라즈마 인슐린 수준을 증가시키고, 인슐린 결핍 당뇨병에서 혈당 수준을 효과적으로 감소시킨다는 것을 증명한다.
실험을 근거로, 동일한 표준 인슐린(10 IU/kg)과 함께, ε-아미노-카프로산 함량 100 mg/kg 은 10 mg/kg과 비교하여 이점을 제공하지 않았다. 피하 인슐린의 경우, "60 분" 값은 아마도 이미 감소하는 플라즈마 농도 값일 것이다.
실시예 :
실시예 1: ε-아미노-카프로산 담체 분자에 의한 경구 인슐린 사용 가능성
수컷 위스타 래트 (Charles - River Laboratories, Budapest, Hungary)를 실험에 사용하였다. 실험 전에, 동물들은 16시간 동안 금식시켰다. 오전 8시 내지 9시 사이에 실험을 시작하였다. 그룹당 4마리씩 2 x 6 그룹을 무작위로 형성하였다. 동물들에게 다음과 같은 급식 탐색을 통해 예비 처리하였다: 그룹 1: ε-아미노-카프로산 1 g/kg; 그룹 2: 인슐린 0.1 U/kg; 그룹 3: 인슐린 0.1 U/kg 및 ε-아미노-카프로산 1 g/kg; 그룹 4: 인슐린 1.0 U/kg; 그룹 5: 인슐린 1.0 U/kg 및 ε-아미노-카프로산 1 g/kg; 그리고 그룹 6: 용매. 혈당과 플라즈마 인슐린 수준을 처음 6 그룹을 처치하고 15분 후 그리고 두번째 6 그룹의 경우 60분 후에 채취한 동맥 혈에서 측정하였다. 얻어진 결과를 표 1에 요약하였다:
실시예 2: 표준 카제인과 함께 인슐린의 흡수에 대한 아세프라민의 효과
건강한 수컷 위스타 래트(230-250 g)에 ε-아미노-카프로산-인간 재조합 인슐린 혼합물과 표준 카제인을 십이지장 내 투여하였다. 측정 종말점은 글루코스 옥시다제법으로 측정된 혈당이었고, 인슐린-아세프라민 제제(수성 현탁물)의 투여 후 15 및 60분에 방사선면역법으로 측정된 플라즈마 인슐린 면역활성이었다.
실험 결과를 표 2에 나타내었다:
데이타: 평균 ±S.D. 그룹 당 n=8. 통계: 분석 해석(ANOVA) 후, Bonferroni 정정된 t-테스트.
실시예 3: "인 비트로" 안정성
인 비트로 안정성은 천연 인슐린과 비교하여, 단백질 열화 효소의 존재하에 인슐린-아세프라민 혼합물의 초기 제제의 생분해를 의미한다(역상 HPLC 시험 결과).
실시예 4: 실험적 당뇨병에서 생물학적 이용가능성 및 효능
Sprague-Dawley 수컷 래트(230-250 g)에 스트렙토조토신을 단일 정맥 주사하여 실험적 당뇨병을 유도하였다. 10일 후, 금식 (금식 12시간 후) 혈당 수준이 15 mmol/l 보다 높은 동물에서 실험을 계속하였다. 동물에 경구적으로 또는 비경구적으로 (s.c.) 인슐린 (10 IU/kg)을 제공하고, 혈당 수준 (표 2의 데이타) 및 플라즈마 인슐린 면역반응성 (표 3의 데이타)을 측정하였다.
본 발명에 따른 약제학적 제제는 혈당 감소 효과의 면에서 피하로 투여된 인슐린과 거의 동등하였고, 이것은 당뇨병 포유동물의 치료에 비이상적 고혈당 수준을 감소시키기에 적합하다
약제학적 제제는 피하 투여된 인슐린에 대한 인슐린 민감 효과를 갖는다.
약제학적 제제의 제거 반감기는 래트에서 약 40분이다.
약제학적 제제는 아만성 독성을 나타내지 않는다.
Claims (12)
- 경구투여가능한 약제학적 제제로, 제제는 생명공학적으로 생산된 인간 재조합 인슐린 및/또는 변형 인슐린 또는 그것의 유사체 및/또는 유도체, 프로테아제 억제제 및 고분자량 천연 단백질의 조합물을 함유하는 것인 약제학적 제제.
- 제1항에 있어서, 인간 인슐린은 B28 위치에 Asp, Lys, Leu, VaI 또는 Ala 및 위치 B29에 Lys 또는 Pro를 갖는 유사체; 또는 des(B28-B30), des(B27) 또는 des(B30) 인간 인슐린인 약제학적 제제.
- 제1항에 있어서, 프로테아제 억제제가 ε-아미노-카프로산인 약제학적 제제.
- 제1항 또는 제2항에 있어서, 고분자량 천연 단백질이 카제인인 약제학적 제제.
- 제1항 내지 제4항 중 어느 한 항에 있어서, 제제는 인간 재조합 인슐린 40 - 100 IU, ε-아미노-카프로산 100 - 1000 mg 및 카제인 1 - 100 mg을 함유하는 것인 약제학적 제제.
- 포유동물의 (제1형 및 제2형) 당뇨병의 치료에 적합한 경구투여가능한 약제학적 제제를 제조하기 위한, 치료적으로 유효한 양의 생명공학적으로 생산된 인간 재조합 인슐린 및/또는 변형 인슐린 또는 그것의 유사체 및/또는 유도체, ε-아미노-카프로산 및 카제인의 조합물의 용도.
- 경구 투여가능한 약제학적 제제의 제조방법으로, 약제학적으로 허용가능한 담체 및 첨가 물질과 혼합된, 생명공학적으로 제조된 인간 재조합 인슐린 및/또는 변형 인슐린 또는 그것의 유사체 및/또는 유도체 40 - 100 IU, ε-아미노-카프로산 100 - 1000 mg 및 카제인 1 - 100 mg이 경구투여가능한 제형으로 제제화되는 것인 제조방법.
- 포유동물의 (제1형 및 제2형) 당뇨병의 치료를 위한, 제1항 내지 제5항 중 어느 한 항에 따른 약제학적 제제의 용도.
- 임신부의 당뇨병의 치료를 위한, 제1항 내지 제5항 중 어느 한 항에 따른 약제학적 제제의 용도.
- 포유동물의 (제1형 및 제2형) 당뇨병의 치료방법으로, 여기서 환자는 치료적으로 효과적인 양의 생명공학적으로 제조된 인간 재조합 인슐린 및/또는 변형 인슐린 또는 그것의 유사체 및/또는 유도체, ε-아미노-카프로산 및 카제인을 함유하는 경구투여가능한 약제학적 제제를 제공받는 것인 치료방법.
- 포유동물의 제1형 당뇨병의 치료방법으로, 여기서 환자는 인간 재조합 인슐린 40 - 100 IU, ε-아미노-카프로산 100 - 1000 mg 및 카제인 1 - 100 mg을 함유하는 약제학적 제제를 제공받는 것인 치료방법.
- 제1항 내지 제5항 중 어느 한 항에 있어서, 제제의 생물학적 이용가능성이 30%를 넘는 것인 약제학적 제제.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| HU0900482A HUP0900482A2 (en) | 2009-08-03 | 2009-08-03 | Pharmaceutical formulation for oral administration |
| HUP0900482 | 2009-08-03 | ||
| PCT/IB2010/053499 WO2011015984A1 (en) | 2009-08-03 | 2010-08-02 | Orally administerable pharmaceutical preparation containing insulin |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20120088660A true KR20120088660A (ko) | 2012-08-08 |
Family
ID=89989155
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020127005524A KR20120088660A (ko) | 2009-08-03 | 2010-08-02 | 경구투여가능한 인슐린 함유 약제학적 조성물 |
Country Status (15)
| Country | Link |
|---|---|
| US (1) | US20120129769A1 (ko) |
| EP (1) | EP2461820A1 (ko) |
| JP (1) | JP2013501043A (ko) |
| KR (1) | KR20120088660A (ko) |
| CN (1) | CN102791282A (ko) |
| AU (1) | AU2010280418B2 (ko) |
| BR (1) | BR112012002413A2 (ko) |
| CA (1) | CA2769620A1 (ko) |
| HU (1) | HUP0900482A2 (ko) |
| IL (1) | IL217856A0 (ko) |
| MX (1) | MX2012001461A (ko) |
| RU (1) | RU2012109006A (ko) |
| UA (1) | UA106506C2 (ko) |
| WO (1) | WO2011015984A1 (ko) |
| ZA (1) | ZA201201519B (ko) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| PL2726091T3 (pl) * | 2011-06-29 | 2020-08-10 | Rani Therapeutics, Llc | Preparaty lecznicze dostarczane do kanału przewodu jelitowego za pomocą połykalnego urządzenia dostarczającego lek |
| US20200126671A1 (en) * | 2017-06-28 | 2020-04-23 | Helmholtz Zentrum München - Deutsches Forschungszentrum für Gesundheit und Umwelt (GmbH) | Method for determining the risk to develop type 1 diabetes |
Family Cites Families (22)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3172814A (en) | 1962-04-06 | 1965-03-09 | Jr Edgar A Ferguson | Oral blood sugar lowering compositions |
| JPS5428807A (en) | 1977-08-09 | 1979-03-03 | Hiroyuki Sumi | Oral insulin |
| IL68769A (en) * | 1983-05-23 | 1986-02-28 | Hadassah Med Org | Pharmaceutical compositions containing insulin for oral administration |
| ES2045276T3 (es) | 1988-07-21 | 1994-01-16 | Hoffmann La Roche | Preparacion de insulina |
| CA2125284C (en) | 1991-12-05 | 2000-06-20 | Jens-Christian Wunderlich | Peroral administration form for peptidic medicaments, in particular insulin |
| JP3047948B2 (ja) * | 1992-12-07 | 2000-06-05 | 株式会社ツムラ | ペプチド類経鼻投与用組成物 |
| US5359030A (en) | 1993-05-10 | 1994-10-25 | Protein Delivery, Inc. | Conjugation-stabilized polypeptide compositions, therapeutic delivery and diagnostic formulations comprising same, and method of making and using the same |
| US5968899A (en) * | 1994-06-03 | 1999-10-19 | Tsumura & Co. | Medicinal compositions of peptides with EACA or tranexamic acid for enhanced mucosal absorption |
| US5461031A (en) * | 1994-06-16 | 1995-10-24 | Eli Lilly And Company | Monomeric insulin analog formulations |
| US5653987A (en) | 1995-05-16 | 1997-08-05 | Modi; Pankaj | Liquid formulations for proteinic pharmaceuticals |
| US5970193A (en) | 1996-10-24 | 1999-10-19 | Nortel Networks Corporation | Data communications structures relating to data shelf configurations |
| NZ500075A (en) | 1997-04-02 | 2001-03-30 | Purdue Research Foundation | Method for the oral delivery of a protein encapsulated within a hydrogel matrix |
| CN1329502A (zh) | 1998-12-04 | 2002-01-02 | 普罗瓦利斯英国有限公司 | 含有胰岛素的药物组合物 |
| US6375975B1 (en) | 1998-12-21 | 2002-04-23 | Generex Pharmaceuticals Incorporated | Pharmaceutical compositions for buccal and pulmonary application |
| PT1454630E (pt) | 2003-03-04 | 2010-12-15 | Technology Dev Company Ltd | Composição de insulina injectável de acção prolongada e métodos para o seu fabrico e utilização |
| JP5103748B2 (ja) * | 2005-02-16 | 2012-12-19 | 東レ株式会社 | 医薬組成物 |
| EP2722054B1 (en) * | 2005-09-06 | 2018-03-21 | Oramed Pharmaceuticals Inc. | Methods and compositions for oral administration of proteins |
| US8927015B2 (en) | 2006-04-12 | 2015-01-06 | Emisphere Technologies, Inc. | Formulations for delivering insulin |
| CN101062408B (zh) * | 2006-04-27 | 2010-12-08 | 深圳市隆阳生物科技有限公司 | 口服胰岛素复合制剂及其制备方法 |
| JP2008266179A (ja) * | 2007-04-19 | 2008-11-06 | Fujifilm Corp | 経肺用組成物 |
| EP2164466A1 (en) * | 2007-06-01 | 2010-03-24 | Novo Nordisk A/S | Spontaneously dispersible preconcentrates including a peptide drug in a solid or semisolid carrier |
| NZ591497A (en) * | 2008-08-18 | 2012-11-30 | Entera Bio Ltd | A compositions comprising a protein, a protease inhibitor and N-(8-[2-hydroxybenzoyl]amino)caprylate (SNAC) or N-(10[2-hydroxybenzoyl]amino)decanoate (SNAD) for diabetes mellitus treatment |
-
2009
- 2009-08-03 HU HU0900482A patent/HUP0900482A2/hu unknown
-
2010
- 2010-08-02 EP EP10757272A patent/EP2461820A1/en not_active Withdrawn
- 2010-08-02 BR BR112012002413A patent/BR112012002413A2/pt not_active IP Right Cessation
- 2010-08-02 WO PCT/IB2010/053499 patent/WO2011015984A1/en active Application Filing
- 2010-08-02 RU RU2012109006/15A patent/RU2012109006A/ru unknown
- 2010-08-02 MX MX2012001461A patent/MX2012001461A/es not_active Application Discontinuation
- 2010-08-02 KR KR1020127005524A patent/KR20120088660A/ko not_active Application Discontinuation
- 2010-08-02 AU AU2010280418A patent/AU2010280418B2/en not_active Expired - Fee Related
- 2010-08-02 CA CA2769620A patent/CA2769620A1/en not_active Abandoned
- 2010-08-02 US US13/387,212 patent/US20120129769A1/en not_active Abandoned
- 2010-08-02 CN CN201080038764XA patent/CN102791282A/zh active Pending
- 2010-08-02 UA UAA201202346A patent/UA106506C2/uk unknown
- 2010-08-02 JP JP2012523416A patent/JP2013501043A/ja active Pending
-
2012
- 2012-01-31 IL IL217856A patent/IL217856A0/en unknown
- 2012-02-29 ZA ZA2012/01519A patent/ZA201201519B/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| AU2010280418A1 (en) | 2012-03-22 |
| RU2012109006A (ru) | 2013-09-10 |
| UA106506C2 (uk) | 2014-09-10 |
| AU2010280418B2 (en) | 2015-04-09 |
| EP2461820A1 (en) | 2012-06-13 |
| JP2013501043A (ja) | 2013-01-10 |
| ZA201201519B (en) | 2013-05-29 |
| MX2012001461A (es) | 2012-05-22 |
| HUP0900482A2 (en) | 2011-03-28 |
| IL217856A0 (en) | 2012-03-29 |
| US20120129769A1 (en) | 2012-05-24 |
| WO2011015984A1 (en) | 2011-02-10 |
| CA2769620A1 (en) | 2011-02-10 |
| BR112012002413A2 (pt) | 2016-03-01 |
| CN102791282A (zh) | 2012-11-21 |
| HU0900482D0 (en) | 2009-10-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11246827B2 (en) | Methods and compositions for oral administration | |
| RU2566063C2 (ru) | Композиции и способы перорального введения эксенатида | |
| EP2814461B1 (fr) | Solution injectable a ph 7 comprenant au moins une insuline basale dont le pi est compris entre 5,8 et 8,5 et un co-polyaminoacide substitue | |
| EP2722054B1 (en) | Methods and compositions for oral administration of proteins | |
| JP2010525033A (ja) | 高濃縮のインスリン溶液及び組成物 | |
| KR101152470B1 (ko) | 치료제용 마이크로-입자 지방산 염 고형 투약 제형 | |
| KR20120088660A (ko) | 경구투여가능한 인슐린 함유 약제학적 조성물 | |
| US10143754B2 (en) | Method for peroral delivery of insulin and its analogues for therapeutic usage | |
| CN118019522A (zh) | 包含大的生理活性物质和赋形剂的药物组合物 | |
| JP2013501043A5 (ko) | ||
| KR20170093332A (ko) | 경구투여가능한 인슐린 함유 약제학적 조성물 | |
| WO2023095944A1 (en) | Ultra long acting pharmaceutical composition comprising insulin | |
| WO2024003400A1 (en) | Compositions comprising a peptide or a protein and an acylated amino acid | |
| EP4299057A1 (en) | Solid compositions comprising a peptide or a protein and an acylated amino acid | |
| Jindal et al. | Formulation and evaluation of insulin enteric microspheres for oral drug delivery | |
| EP4299052A1 (en) | Solid compositions comprising a peptide or a protein and a permeation enhancer | |
| AU2014218446B2 (en) | Methods and compositions for oral administration of proteins | |
| US20230053812A1 (en) | Stable peptide formulations for oral use | |
| AU2015243030A1 (en) | Methods and compositions for oral administration of proteins |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |