KR20120006991A - 급속 섭취를 위한 인슐린 제형 - Google Patents
급속 섭취를 위한 인슐린 제형 Download PDFInfo
- Publication number
- KR20120006991A KR20120006991A KR1020117023159A KR20117023159A KR20120006991A KR 20120006991 A KR20120006991 A KR 20120006991A KR 1020117023159 A KR1020117023159 A KR 1020117023159A KR 20117023159 A KR20117023159 A KR 20117023159A KR 20120006991 A KR20120006991 A KR 20120006991A
- Authority
- KR
- South Korea
- Prior art keywords
- insulin
- acid
- formulation
- formulations
- edta
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/195—Carboxylic acids, e.g. valproic acid having an amino group
- A61K31/197—Carboxylic acids, e.g. valproic acid having an amino group the amino and the carboxyl groups being attached to the same acyclic carbon chain, e.g. gamma-aminobutyric acid [GABA], beta-alanine, epsilon-aminocaproic acid, pantothenic acid
- A61K31/198—Alpha-aminoacids, e.g. alanine, edetic acids [EDTA]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/03—Peptides having up to 20 amino acids in an undefined or only partially defined sequence; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/12—Carboxylic acids; Salts or anhydrides thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/16—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing nitrogen, e.g. nitro-, nitroso-, azo-compounds, nitriles, cyanates
- A61K47/18—Amines; Amides; Ureas; Quaternary ammonium compounds; Amino acids; Oligopeptides having up to five amino acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/16—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing nitrogen, e.g. nitro-, nitroso-, azo-compounds, nitriles, cyanates
- A61K47/18—Amines; Amides; Ureas; Quaternary ammonium compounds; Amino acids; Oligopeptides having up to five amino acids
- A61K47/183—Amino acids, e.g. glycine, EDTA or aspartame
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/08—Solutions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/48—Drugs for disorders of the endocrine system of the pancreatic hormones
- A61P5/50—Drugs for disorders of the endocrine system of the pancreatic hormones for increasing or potentiating the activity of insulin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2121/00—Preparations for use in therapy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/22—Hormones
- A61K38/28—Insulins
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/575—Hormones
- C07K14/62—Insulins
Abstract
본 발명은 안정성과 작용의 급속개시가 개선된 주사가능한 인슐린 제형에 관한 것이고, 상기 제형은 피하, 진피내 또는 근육내투여를 위한 것이다. 바람직한 실시예에서, 상기 제형은 피하주사를 통하여 투여된다. 상기 제형은 킬레이트제 및 용해제와, 선택적으로 추가적인 부형제와 조합된 인슐린을 함유한다. 바람직한 실시예에서, 상기 제형은 인간 인슐린, EDTA와 같은 아연 킬레이트제, 및 시트르산 또는 시트르산 나트륨과 같은 용해제를 함유한다. 이들 제형은 피하주사에 의해 투여될 때 혈류안으로 급속하게 흡수된다.
Description
본 발명은 주사가능한 급속 작용 약물전달 인슐린 제형의 분야에 관한 것이다.
당뇨병 개관
포도당은 인간이 에너지를 생산하고 생명을 유지하기 위하여 신체의 모든 세포들이 사용하는 단순한 당이다.
인간은 생명을 유지하기 위하여 항상 혈액내에 최소한의 포도당 농도를 필요로 한다. 신체가 혈당을 생산하는 일차적인 방식은 음식물 소화에 의하는 것이다. 사람이 음식물 소화에서 이러한 포도당을 얻지 않을 때에는, 포도당은 세포조직안에 저장된 것으로부터 생산된다. 신체의 포도당 농도는 인슐린에 의해 조절된다. 인슐린은 췌장에서 자연적으로 분비되는 펩티드 호르몬이다. 인슐린은 포도당의 신체 세포에의 유입을 도와서 생체 에너지원을 제공한다.
건강한 인간이 식사를 시작하면, 췌장은 제1기 인슐린 분비라고 하는 인슐린의 자연 스파이크(spike)를 분비한다. 음식물 소화로부터 포도당의 혈액내 유입을 진행시키기 위하여 충분한 인슐린을 제공하는 것 외에, 제1기 인슐린 분비는 음식물 소화가 일어나는 동안에 포도당 생산을 중지하기 위한 신호로서 간에 작용한다. 간은 포도당을 생산하지않고 소화로부터 포도당 유입을 진행하는데 충분한 추가적인 인슐린이 있기 때문에 건강한 사람들의 혈당치는 상대적으로 일정하게 유지되고 그 사람들의 혈당치는 높지 않게 된다.
당뇨병은 비정상적으로 높은 혈당치와 부적합한 인슐린 수치에 의해 특징되는 질병이다. 당뇨병에는 2가지 타입, 제1형 및 제2형이 있다. 제1형 당뇨병에 있어서는, 신체는 인슐린을 생산하지 않는다. 제2형 당뇨병의 초기 단계에서는, 췌장이 인슐린을 샌산하지 않지만, 신체도 적시에 인슐린을 생산하지도 않고 신체의 세포는 인슐린을 무시한다(인슐린 저항으로 알려진 조건이다).
다른 징후가 있기전에도, 상기 제2형 당뇨병의 첫번째 효과중 하나는 음식물에서 유발된 제1기 인슐린 분비의 손실이다. 제1기 인슐린 분비가 없으면, 간은 포도당 생산 중지 신호를 수신하지 않는다. 그 결과, 간은 신체가 음식물 소화를 통하여 새로운 포도당을 생산하기 시작할 때 포도당을 계속 생산하게 된다. 그 결과, 당뇨병 환자의 포도당 수치는 식사후 너무 높아져 고혈당으로 알려진 조건으로 된다. 고혈당은 포도당이 비자연적으로 혈중내 어떤 단백질에 부착되는 것을 야기하여 단백질이 작은 혈액 용기들의 집합체를 유지하는 정상적인 기능을 수행하는 단백질의 능력을 방해하게 된다. 고혈당이 매 식사후 마다 발생함에 따라 상기 작은 혈액 용기는 결국에는 파괴되고 누설된다. 고혈당의 장기간 역효과는 실명, 콩팥기능 소실, 신경 손상 및 감각 손실, 잠재적으로 사지 절단이 요구되는 말초 순환불량을 포함한다.
식사 후 2 내지 3시간 사이에 조치되지 않은 당요병성 혈당은 상승하여 췌장은 과도하게 많은 량의 인슐린을 분비하는 신호를 수신한다. 제2형 당뇨병의 초기 환자에서는, 췌장은 여전히 반응하고 많은 량의 인슐린을 분비할 수 있다. 그러나, 이러한 현상은 소화가 거의 끝나고 혈당치가 떨어지기 시작할 때 일어난다. 이와 같은 과도하게 많은 량의 인슐린은 해로운 2가지 효과를 가진다. 하나는 이미 절충된 췌장에 부적절하게 과도한 요구를 가하고, 이는 췌장의 급속한 악화를 유발하고 궁극적으로는 췌장이 인슐린을 생산할 수 없도록 한다. 둘째, 식사후 너무 많은 인슐린이 체중 증가를 유발하고, 이는 질병 조건을 추가로 악화시킨다.
당뇨병에 대한 현재의 치료 및 그 한계
제1형 당뇨병 환자들은 인슐린을 전혀 생산하지 않으므로, 제1형 당뇨병의 일차적 치료는 매일 집중 인슐린 요법이다. 제2형 당뇨병의 치료는 전형적으로 다이어트 및 운동의 관리로 시작한다. 짧은 시간동안의 다이어트와 운동을 통한 치료는 도움이 되지만, 다이어트와 운동만으로는 제2형 당뇨병 환자의 대부분에게는 유효한 장기간 해결책은 아니다. 다이어트와 운동이 더 이상 충분하지 않을 때, 치료는 다양한 비-인슐린 경구 투약으로 시작된다. 이러한 경구 투약은 췌장에 의해 생산되는 인슐린 량을 증가시키고, 인슐린-민감 세포의 감도를 증가시키고, 간에서의 포도당 생산량을 감소시키는 작용을 하거나 이들 메카니즘의 몇몇 조합에 의해 작용한다. 이러한 치료들에는 질병을 효과적으로 관리하는 능력에 있어서 한계가 있고, 일반적으로 체중증가 및 고혈당과 같은 심각한 부작용을 가지고 있다. 비-인슐린 치료의 한계 때문에, 많은 제2형 당뇨병 환자들은 시간이 경과함에 따라 악화되고 결국에는 그들의 대사를 지원하기 위하여 인슐린 요법을 필요로 한다.
인슐린 요법은 당뇨병을 치료하기 위하여 80년 이상동안 사용되어 오고 있다. 이 인슐린 요법은 통상 매일 수회의 인슐린 주사를 투여하는 것을 포함한다. 이러한 주사는 매일 1 내지 2회의 지속형 기초 주사와, 매 식사 때마다 속효형 인슐린의 주사를 투여하는 것을 포함한다. 이러한 치료 요법은 효과적인 것으로 인정되지만, 한계를 가지고 있다. 첫째, 환자들은 불편함과 주사바늘의 고통때문에 인슐린을 주사하는 것을 싫어한다. 그 결과 환자들은 처방된 치료요법에 적절하게 따르지 않는 경향이 있고, 종종 부적절하게 투약한다.
더 중요한 것은, 적적하게 투여되는 경우에도 인슐린 주사는 자연적인 시간-작용 프로파일(profile)을 모사(replicate)하지 않는다. 특히, 당뇨병이 없는 사람에서 제1기 인슐린 분비의 자연적인 스파이크(spike)는 식사에 의한 혈당안으로 진입되는 혈중 인슐린 수치 증가를 초래한다. 대조적으로, 주사된 인슐린은 혈액안으로 서서히 진입하여 정상인의 인슐린의 주사후 80 내지 100분 이내에 최대 인슐린 수치가 발생한다.
잠재적 해결책은 식사 직후에 당뇨병 환자의 정맥에 인슐린을 직접 주사하는 것이다. 정맥내 주사에 관한 연구에서, 환자들은 식사 후 3 내지 6시간 동안 그들의 혈당을 더 잘 조절할 수 있음을 보여주었다. 그러나 여러가지 의학적 이유로 인하여, 식사전 정맥내 인슐린 주사는 실용적인 요법이 아니다.
인슐린치료에 있어서 중요한 개선 사항 중 하나는 인슐린 리스프로(IL), 인슐린 아스파르트(IA), 및 인슐린 글루리신(IG)과 같은, 1990년대의 급속 작용 인슐린 유사체의 도입이었다. 그러나 상기 급속 작용 인슐린 유사체로써도, 최고 인슐린 수치는 전형적으로 주사후 50 내지 90분 이내에 일어난다. 상기 급속 작용 인슐린 유사체가 제1기 인슐린 분비를 적절히 모방하지 않기 때문에, 인슐린 요법을 사용한 당뇨병은 식사 초기에 부적절한 인슐린 수치가 존재하게 하고, 식사 사이에는 너무 많은 인슐린이 존재하게 된다. 이러한 인슐린 전달의 지연은 식사 개시후 초기에 저혈당을 유발할 수 있다. 더욱이, 식사 사이에 과도한 인슐린은 저혈당증으로 알려진 비정상적으로 낮은 혈당 수치를 초래할 수 있다. 저혈당은 정신적 명료도의 손실, 착란, 증가된 심박수, 허기, 실신을 초래할 수 있다. 아주 낮은 혈당 수치에서, 저혈당은 의식의 손실, 혼수 및 사망에 이르게 할 수 있다. 미국 당뇨병 협회(American Diabets Association, ADA)에 따르면, 인슐린-사용 당뇨병 환자는 매년 평균 1.2건의 심각한 저혈당 사례를 가지고, 그 사례중 많은 경우 환자들이 응급실을 찾게 된다.
혈액으로의 인슐린 전달의 시간-경과가 전체 포도당 제어에 중요한 역할을 하기 때문에, 급속 작용 인슐린 유사체보다 더 급속히 열액에 도달하는 주사가능한 인슐린에 대한 중대한 필요가 있다.
따라서, 본 발명의 목적은 급속 작용 주사가능한 인슐린에 주사가능한 인슐린 조성물에 재선된 안정성 및 작용의 급속한 개시를 제공하는 것이다.
개선된 안정성과 작용의 급속 개시를 가진 주사가능한 인슐린 제형이 여기서 설명된다. 인슐린 제형은 피하 투여, 진피내의 투여, 근육내의 투여를 위한 것일 수 있다. 바람직한 실시예에서, 상기 제형은 피하 주사를 통하여 투여된다. 상기 제형은 킬레이트와 용해제 및 선택적으로 추가적인 부형제와의 조합으로 인슐린을 포함한다. 바람직한 실시예에서, 상기 제형은 인간의 인슐린, EDTA와 같은 아연 킬레이트, 시트르산 또는 시트르산 나트륨과 같은 그 염을 포함한다. 이들 제형은 피하주사에 의해 투여될 때 혈류속으로 급속하게 흡수된다. 실시예들은 사람은 pH를 생리학적 pH로 증가시킬 수 있고 더욱이 인슐린의 용해와 급속 섭취를 얻을 수 있음을 입증한다.
하나의 실시예에서, 인슐린은 무균의 바이알내의 건조 분말로서 제공된다. 이것은 물과 같은, 약학적으로 수용가능한 캐리어를 포함한 희석제와, EDTA 및/또는 시트르산과 같은 용해제와 투여시 또는 투여 직전에 혼합된다. 다른 실시예에서, 상기 인슐린은, 통상 약 4.0 pH에서, 냉동 혼합물로서 저장되어 해동시켜 사용 준비된다.
본 발명에 따른 제형은 피하주사 또는 근육내 주사에 의해 투여될 수 있다. 본 제형은 체계적인 전달을 위하여 혈장으로 급속히 흡수되고 수송되도록 고안되어 있다.
활성 물질로서 인슐린을 포함한 제형은 제1형 또는 제2형 당뇨병 환자에게 식사 전 또는 식사 중에 투여될 수 있다. 급속한 흡수로 인하여, 조성물은 글리코겐이 간에서 포도당으로 변환되는 것을 차단할 수 있고, 그로써 당뇨병과 제2형 당뇨병의 제1기 증후군으로 인한 합병증의 주요 원인인, 고혈당을 방지한다.
도 1은 노출된 표면전하를 보여주고 전하를 차폐하기에 적합한 크기를 가진 분자("용해 및 킬레이트제")로써 중첩된 인슐린의 3차원 구조이다.
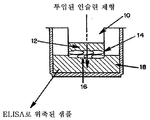
도 2는 0.1미크론 필터 16 위의 무한증식 경구 상피 세포 14의 4-5 층을 통하여 공여 챔버 12에서 리시버 챔버 18로 인슐린 흡수를 측정하기 위하여 사용되는 트랜스웰 장치 10의 개략적인 도면이다.
도 3a 및 3b는 도 2의 트랜스웰 시스템에서, 용해제로서 선택된 0.45 mg EDTA/ml과 함께 또는 없이, 경구 상피 세포를 통한 생체내 인슐린 수송(마이크로 단위의 누적 인슐린)을 비교하는 그래프이다. EDTA는 산농도가 다음과 같이 변화하는 동안 0.45mg/mL에서 일정하다:
도 3a, 숙신산( 0.41mg/mL), 아디프산(0.73mg/mL) 및 시트르산(0.29mg/mL), pH 3.2-3.8.
도 3b, 말레산(0.32mg/mL), 푸마르산(1.28mg/mL), pH 2-3. 2개의 기간(10, 30분)이 비교분석을 위해 선택되었다. 결과는 측정된 평균 플러그 마이너스 표준오차, n=4이다.
도 4a 및 4b는 도 2의 트랜스웰 시스템에서, 다음 등분자(1.50x10-3Mol) 농도에서 다른 용해제와, 0.56 mg EDTA/ml과 함께 또는 없이 경구 상피 세포를 통한 생체내 인슐린 수송(마이크로 단위의 누적 인슐린)을 비교하는 그래프: 1.80mg/mL(도 4b)에서, 아디프산(0.20mg/mL), 시트르산(0.22mg/mL), 및 시트르산(0.29mg/mL)(도4b). 2개의 기간(10분 및 30분)이 비교분석을 위해 선택되었다.
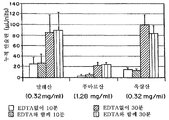
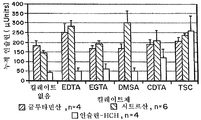
도 5는 다른 킬레이트제들의 효과를 비교하기 위하여 도 2의 트랜스웰 시스템을 사용하여, 경구 상피 세포를 통한 생체내 인슐린 수송의 그래프이다. 도 5는 동일한 분자 농도(4.84x10-3Mol)에서 다른 킬레이트제들이 첨가되는, 글루타민산, 시트르산 또는 염산을 포함하는 용액에서 경구 상피세포를 통하여 측정된 인슐린(1mg/mL)의 수송 그래프이다. 상기 킬레이트제들은 무 킬레이트(제어), EDTA, EGTA, DMSA, CDTA 및 TSC이다.
도 6은 시트르산 및 EDTA(12U)로써 제조된, KG당 평균 포도당 주입율(GIR)로서 측정된, 인슐린의 사람의 생체내에서의 약역학 효과의 그래프이다.
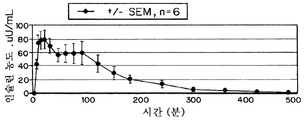
도 7은 RHI와 비교하여, 인체내에서 시트르산 및 EDTA로써 제조된 인슐린, t시간(qns)에 대한 인슐린 농도(마이크로 유니트/ml)의 생체내 약물동태의 그래프이다. 평균값(±SEM, n=10). 인슐린 투여량은 12U/환자이다.
도 8은 제2형 당뇨병 환자에서 시트르산 및 EDTA로써 제조된 인슐린의 생체내 약역학 그래프이고; RHI 및 IL과 비교하여, 시간(분)에 대한 혈당(mg/dl)을 그린 도면이다. 환자 시험에서 사용된 투여량은 환자별로, 환자의 최근 인슐린 요법에 근거한 각 환자별로 조정되었다.
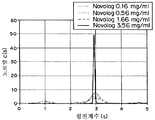
도 9a는 0.17, 0.51, 1.68, 및 3.62 mg/ml의 농도에서 RHI의 침전 계수의 그래프이다.
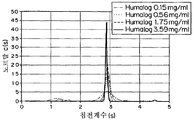
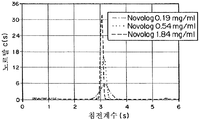
도 9b는 0.15, 0.56, 1.75, 및 3.59 mg/ml의 농도에서 IL의 침전 계수의 그래프이다.
도 9c는 0.16, 0.56, 1.66, 및 3.56 mg/ml의 농도에서 IA의 침전 계수의 그래프이다.
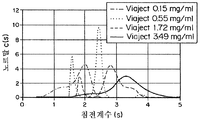
도 9d는 0.15, 0.55, 1.72, 및 3.48 mg/ml의 농도에서 CE100-4의 침전 계수의 그래프이다.
도 10a는 0.18, 0.55, 및 1.72 mg/ml의 농도에서 RHI의 침전 계수를 위한 부하농도로 표준화된 c(s) 분포 그래프이다.
도 10b는 0.17, 0.57, 1.82 mg/ml의 농도에서 IL의 침전 계수를 위한 부하농도로 표준화된 c(s) 분포 그래프이다.
도 10c는 0.19, 0.54, 1.84 mg/ml의 농도에서 IA의 침전 계수를 위한 부하농도로 표준화된 c(s) 분포 그래프이다.
도 10d는 0.18, 0.40, 0.84 mg/ml의 농도에서 CE100-4의 침전 계수를 위한 부하농도로 표준화된 c(s) 분포 그래프이다.
도 11은 0.18, 0.57, 1.74 및 3.52 mg/ml의 농도에서 제어 인슐린 pH 7의 침전 계수를 위한 부하농도로 표준화된 c(s) 분포 그래프이다.
도 12는 CE 100-4, CE 100-7, 및 CES 100-7에 대한 희석 함수로서 인슐린 평균 입자크기(nm)의 그래프이다.
도 13은 당뇨병의 miniature swine에서 시간(분)에 대한 ELISA로써 인슐린 농도(마이크로 유니트/ml)의 그래프이다.
도 2는 0.1미크론 필터 16 위의 무한증식 경구 상피 세포 14의 4-5 층을 통하여 공여 챔버 12에서 리시버 챔버 18로 인슐린 흡수를 측정하기 위하여 사용되는 트랜스웰 장치 10의 개략적인 도면이다.
도 3a 및 3b는 도 2의 트랜스웰 시스템에서, 용해제로서 선택된 0.45 mg EDTA/ml과 함께 또는 없이, 경구 상피 세포를 통한 생체내 인슐린 수송(마이크로 단위의 누적 인슐린)을 비교하는 그래프이다. EDTA는 산농도가 다음과 같이 변화하는 동안 0.45mg/mL에서 일정하다:
도 3a, 숙신산( 0.41mg/mL), 아디프산(0.73mg/mL) 및 시트르산(0.29mg/mL), pH 3.2-3.8.
도 3b, 말레산(0.32mg/mL), 푸마르산(1.28mg/mL), pH 2-3. 2개의 기간(10, 30분)이 비교분석을 위해 선택되었다. 결과는 측정된 평균 플러그 마이너스 표준오차, n=4이다.
도 4a 및 4b는 도 2의 트랜스웰 시스템에서, 다음 등분자(1.50x10-3Mol) 농도에서 다른 용해제와, 0.56 mg EDTA/ml과 함께 또는 없이 경구 상피 세포를 통한 생체내 인슐린 수송(마이크로 단위의 누적 인슐린)을 비교하는 그래프: 1.80mg/mL(도 4b)에서, 아디프산(0.20mg/mL), 시트르산(0.22mg/mL), 및 시트르산(0.29mg/mL)(도4b). 2개의 기간(10분 및 30분)이 비교분석을 위해 선택되었다.
도 5는 다른 킬레이트제들의 효과를 비교하기 위하여 도 2의 트랜스웰 시스템을 사용하여, 경구 상피 세포를 통한 생체내 인슐린 수송의 그래프이다. 도 5는 동일한 분자 농도(4.84x10-3Mol)에서 다른 킬레이트제들이 첨가되는, 글루타민산, 시트르산 또는 염산을 포함하는 용액에서 경구 상피세포를 통하여 측정된 인슐린(1mg/mL)의 수송 그래프이다. 상기 킬레이트제들은 무 킬레이트(제어), EDTA, EGTA, DMSA, CDTA 및 TSC이다.
도 6은 시트르산 및 EDTA(12U)로써 제조된, KG당 평균 포도당 주입율(GIR)로서 측정된, 인슐린의 사람의 생체내에서의 약역학 효과의 그래프이다.
도 7은 RHI와 비교하여, 인체내에서 시트르산 및 EDTA로써 제조된 인슐린, t시간(qns)에 대한 인슐린 농도(마이크로 유니트/ml)의 생체내 약물동태의 그래프이다. 평균값(±SEM, n=10). 인슐린 투여량은 12U/환자이다.
도 8은 제2형 당뇨병 환자에서 시트르산 및 EDTA로써 제조된 인슐린의 생체내 약역학 그래프이고; RHI 및 IL과 비교하여, 시간(분)에 대한 혈당(mg/dl)을 그린 도면이다. 환자 시험에서 사용된 투여량은 환자별로, 환자의 최근 인슐린 요법에 근거한 각 환자별로 조정되었다.
도 9a는 0.17, 0.51, 1.68, 및 3.62 mg/ml의 농도에서 RHI의 침전 계수의 그래프이다.
도 9b는 0.15, 0.56, 1.75, 및 3.59 mg/ml의 농도에서 IL의 침전 계수의 그래프이다.
도 9c는 0.16, 0.56, 1.66, 및 3.56 mg/ml의 농도에서 IA의 침전 계수의 그래프이다.
도 9d는 0.15, 0.55, 1.72, 및 3.48 mg/ml의 농도에서 CE100-4의 침전 계수의 그래프이다.
도 10a는 0.18, 0.55, 및 1.72 mg/ml의 농도에서 RHI의 침전 계수를 위한 부하농도로 표준화된 c(s) 분포 그래프이다.
도 10b는 0.17, 0.57, 1.82 mg/ml의 농도에서 IL의 침전 계수를 위한 부하농도로 표준화된 c(s) 분포 그래프이다.
도 10c는 0.19, 0.54, 1.84 mg/ml의 농도에서 IA의 침전 계수를 위한 부하농도로 표준화된 c(s) 분포 그래프이다.
도 10d는 0.18, 0.40, 0.84 mg/ml의 농도에서 CE100-4의 침전 계수를 위한 부하농도로 표준화된 c(s) 분포 그래프이다.
도 11은 0.18, 0.57, 1.74 및 3.52 mg/ml의 농도에서 제어 인슐린 pH 7의 침전 계수를 위한 부하농도로 표준화된 c(s) 분포 그래프이다.
도 12는 CE 100-4, CE 100-7, 및 CES 100-7에 대한 희석 함수로서 인슐린 평균 입자크기(nm)의 그래프이다.
도 13은 당뇨병의 miniature swine에서 시간(분)에 대한 ELISA로써 인슐린 농도(마이크로 유니트/ml)의 그래프이다.
이하, 설명되는 주사가능한 인간의 인슐린의 인슈린 제형은 식사 전 즉시 또는 식사 끝에 투여된다. 바람직한 실시예에서, 인슐린 제형은 재조합 인간 인슐린과 FDA에서 안전한 것으로 승인된 특정 성분을 결합한다. 인슐린 제형은 최근 시중에서 판매되는 급속-작용 인슐린 유사체보다 더 빨리 혈액속에 흡수되게 고안된다. 상기 인슐린 제형의 중요한 특징중의 하나는인슐린이 6개의 분자 또는 육량체의 인슐린 형태에서 단량체의 이량체의 인슐린 형태로 용해 또는 분해되게 하고 육량체의 형태로 재결합을 지연시키는 것이다.
단량체 또는 이량체의 형태를 선호함으로써 이 인슐린 제형은, 인슐린이 요구되는 생물학적 효과를 생성하기 위하여 체내로 흡수될 수 있기 전에 인간의 신체가 인슐린을 단일의 분자 형태로 요구함에 따라, 혈액속으로 더 따른 인슐린 수송을 허용한다. 주사용으로 판매되는 대부분의 인간 인슐린은 육량체 형태로 되어 있다. 이 것은, 인슐린 육량체가 이량체를 형성하고나서 단량체를 형성하기 위하여 먼저 용해되어야 하므로, 신체가 흡수하는 것을 더 어렵게 한다.
I. 정의
여기서, "인슐린"은, 자연적 소스에서 고립되거나 유전적으로 변경된 미생물에 의해 만들어지는 것이든, 인간의 췌장에서 분비되는 펩티드 호르몬이다. 여기서 ," 비인간 인슐린"은 인간의 인슐린과 같지만 돼지나 소와 같은 동물에서 비롯된다.
여기서, "인슐린 유사체"는 췌장에서 분비되는 인슐린과는 다른, 변경된 인슐린이지만, 천연 인슐린로서 동일한 작용을 수행하기 위하여 인간에 유용하다. 근간을 이루는 DNA의 유전공학을 통하여, 인슐린의 아미노산 서열은 그의 ADME(흡수, 분배, 대사, 및 배설)의 특성을 변경하기 위하여 변경될 수 있다. 실시예들은 인슐린 리스프로(insulin lispro), 인슐린 글라진(insulin glargine), 인슐린 아스파르트(insulin aspart), 인슐린 디터머(insulin detemir)를 포함한다. 인슐린은 예컨대 아세틸화에 의해 화학적으로 변경될 수 있다. 여기서 사용되는 바와 같이, 인간 인슐린 유사체는 인간 인슐린으로서 동일한 생물학적 작용을 수행할 수 있는 변경된 인간 인슐린이다.
"킬레이터(chelator)" 또는 "킬레이트제(chelating agent)"란 아연 이온과 하나 또는 하나 이상의 결합을 이루는 능력을 가진 화학적 화합물을 의미한다. 상기 아연 이온과의 결합은 전형적으로 이온 또는 배위결합이다. 상기 킬레이터는 무기 또는 유기 화합물일 수 있다. 킬레이트 합성물(chelate complex)은 금속이온이 킬레이트제의 둘 또는 그 이상의 원자와 결합된 합성물이다.
"가용화제(solubilizing agent)"는 용매에의 물질의 가용성, 예컨대 수용액내에 인슐린의 가용성을 증가시키는 화합물이다. 가용화제의 예들은, 표면활성제(TWEENS®); 에탄올과 같은 용매; 옥시에틸렌 모노스테레이트와 같은 미셀(micelle) 형성 화합물; 및 pH-조절제를 포함한다.
"용해제(dissolution agent)"는, 인슐린 및 EDTA에 첨가될 때, 아래의 실시예에서 설명하는 바와 같이 상피세포 트랜스웰 분석을 사용하여 측정한바, 동일한 pH에서 HCl 및 EDTA에 대한 인슐린의 수송 및 흡수를 강화하는, 산 또는 염이다. HCl은 용해제는 아니지만 가용화제일 수 있다. 시트르산 및 시트르산 나트륨은 이 분석에서 측정될 때 용해제이다. 이 것은 인슐린의 전하를 마스킹(masking)함으로써 적어도 부분적으로 얻어지고, 그 중 몇몇은 육량체에서 분리되는 동안에 노출된다는 것이라 믿는다.
"부형제(excipient)"는 킬레이터 또는 용해제 이외의 비활성 물질로서, 인슐린의 캐리어로서 사용되거나 물질이 제조되는 공정을 보조하기 위하여 사용되는 물질이다. 그러한 경우에, 상기 비활성 물질은 용해되거나 부형제와 혼합된다.
"생리적 pH(physiological pH)"는 6.8와 7.6 사이, 바람직하게는 7과 7.5, 가장 바람직하게는 약 7.4이다.
여기서, 'VIAJECT™'는 시트르산과 같은 용해제와 EDTA와 같은 킬레이터로써 제형화된 재조합 인간 인슐린에 대한 상표명이다. Viaject 25 U/ mL ( CE 25-4)는 25 U/mL의 정규의 재조합 인간 인슐린, 1.8 U/mL의 시트르산, 1.8 U/mL의 EDTA이나트륨, 0.82 U/mL의 염화나트륨(등장성), 및 3mg/mL의 m-크레졸을 함유한다. 그 것은 수용액으로 제공되고, 냉동저장되거나 건조 분말 인슐린 및 희석제로 이루어진 2 파트 키트안에, 그 중 적어도 하나는 시트르산과 EDTA를 포함한다. 재구성된 혼합물 및 냉동 용액의 pH는 약 pH4이다. Viaject 100 U/ mL ( CE 100-4)는 100 U/mL의 정규의 재조합 인간 인슐린, 1.8 U/mL의 시트르산, 1.8 U/mL의 EDTA이나트륨, 22 mg/mL의 글리세린, 및 3mg/mL의 m-크레졸을 함유한다. 이 것 역시 냉동 수용액 또는 냉동건조된 인슐린 및 희석제로 이루어진 2파트 키트로 제공된다. 재구성된 혼합물 및 냉동 용액 양자의 pH는 약 pH4이다. Viaject 100 U/ mL ( CE 100-7)는 100 U/mL의 정규의 재조합 인간 인슐린, 1.8 U/mL의 시트르산, 1.8 U/mL의 EDTA이나트륨, 22 mg/mL의 글리세린, 및 3mg/mL의 m-크레졸을 함유한다. 이 것은 약 7.4의 pH를 가진 수용액으로 제공되고, 4℃로 저장될 수 있다. 산염을 가진 Viaject(CE 100-7)는 물에, 1.8 U/mL의 EDTA이나트륨, 삼나트륨 시트르산 ㅇ삼나트염을 첨가하고 그리고나서 100 mg/mL의 100 U/mL의 인슐린을 첨가하여 pH 6으로 감소시킨후 그리고나서 pH를 7.4로 증가시켜 만든다.
제형(
Formulations
)
제형은 인슐린, 킬레이터 및 용해제 및 선택적으로 하나 또는 하나 이상의 다른 부형제를 포함한다.
바람직한 실시예에서, 상기 제형은 피하투여에 적합하고, 지방 피하 조직에 빠르게 흡수된다. 용해제 및 킬레이트제(chelator)의 선택, 상기 용해제와 킬레이트제의 농도 및 제형이 조정될 pH는 모두 시스템의 효과에 중대한 영향을 미친다. 많은 조합들이 효과를 가지지만, 바람직한 실시예는 안전성, 안정성, 조절 프로파일(profile) 및 성능을 포함하는 여러 가지 이유를 고려하여 선택된다.
바람직한 실시예에서, 제형 성분들중 적어도 하나는 활성제상의 전하를 마스크하기 위해 선택된다. 이것은 인슐린의 막이동을 촉진하여 작용 개시와 인슐린의 생체이용율을 증가시킨다. 상기 성분들은 또한 수성 매체안에서 급속히 용해되는 조성물을 형성하기 위하여 선택된다. 바람직하게는, 인슐린은 신속하게 혈장안으로 흡수되고 수송되어 급속 작용개시(바람직하게는 투여후 약 5분이내에 시작하고 투여후 약 15 내지 30분에서 피크로 된다)를 이루어 낸다.
EDTA와 같은 킬레이트제는 인슐린내의 아연을 킬레이트화하여 인슐린에서 아연을 제거한다. 이 것은 인슐린이 그 이량체 및 단량체 형태를 취하게 하고 육량체로 변환을 지연시킨다. 실시예에 설명된 실험들은 해리 육량체의 전체 크기가 아연 복합 인슐린 육량체보다 더 크다는 것을 보여주고, 상기 해리 육량체는 더 작은 단위를 형성한다. 상기 육량체, 이량체 및 단량체는 농도-유도 평형상태로 존재하므로, 단량체가 흡수될 때 더 많은 단량체가 생성된다. 그리하고 인슐린 단량체들가 피하 조직을 통하여 흡수될 때, 추가적인 이량체들은 더 많은 단량체를 형성하기 위하여 숨겨진다. 완전히 해리된 단량체 형태는 육량체 형태의 분자량의 1/6이하의 분자량을 가지고, 그 결과 인슐린 흡수량 및 속도를 현저히 증가시킨다. 킬레이트제(예컨대,EDTA) 및/또는 용해제(시트르산) 수소가 인슐린과 결합할 정도로, 인슐린 상의 전하를 마스크하여 인슐린의 막수송을 촉진하여 그 결과 작용 개시 및 인슐린의 생체이용률을 증가시킨다.
인슐린
인슐린은 재조합되거나 천연소스에서 정제될 수 있다. 인슐린은 인간 인슐린 또는 비인간 인슐린일 수 있다. 인간 인슐린이 바람직하다. 가장 바람직한 실시예에서는, 인슐린은 인간 재조합 인슐린이다. 재조합 인간 인슐린은 많은 소스(source)에서 이용할 수 있다. 인슐린은 인간 인슐린의 아미노산 서열에 기초를 두고 있으나 하나 또는 하나 이상의 아미노산 차이들을 가지고 있거나, 화학적으로 변경된 인슐린 또는 인슐린 유사체인 인슐린 유사체일 수 있다.
상기 인슐린의 투여량은 그의 생체이용률과 치료될 환자에게 달려 있다. 인슐린은 대개 1.5-100 IU의 범위내, 바람직하게는 인간 단위 투여량당 3-50 IU의 범위내로 포함된다. 전형적으로 인슐린은 100 IU 바이알로 제공된다.
용해제(
Dissolution
agents
)
어떤 산들, 또는 그 염들은 인슐린상의 전하를 마스크(mask)하는 것으로 보이고, 도 1에 도시된 바와 같이, 섭취와 수송을 촉진하는 것으로 보인다. 용해제로서 유효한 산들은, 아래 실시예에서 설명되는 트랜스웰 분석에서 측정되는 바와 같이, 염산에 비하여, 아세트산, 아스코르빈산, 시트르산, 글르타민 산, 아스파르트산, 숙신산, 푸마르산, 말레산 및 지방산을 포함한다. 예를 들면, 만약 활성제제가 인슐린이라면, 바람직한 용해제는 시트르산이다. 염산과 수산화나트륨은 pH 조정을 위한 바람직한 물질이다. HCl은 상기 제형중 어느 것과도 결합되어 사용될 수 있지만 용해제는 아니다.
상기 산들의 염은 아세트산 나트륨, 아스코르빈산염, 시트르산염, 글루타민산염, 아스파르트산염, 숙신산염, 푸마르산염, 말레산염, 및 지방산염을 포함한다. 유기산의 염들은 다양한 염기, 금속 수화물, 금속산화물, 금속탄산염, 금속중탄산염, 금속아민을 포함하지만, 그러나 이들에 한정되지 않는다, 뿐만아니라 염화암모늄, 탄산암모늄 등과 같은 암모늄 염기를 포함한다. 적합한 금속은 일가 및 다가 금속이온을 포함한다. 전형적인 금속 이온에는, 리튬, 나트륨, 칼륨과 같은 1가 금속; 바륨, 마그네슘, 칼슘 및 스트론티움과 같은 2가 금속; 및 알루미늄과 같은 반금속이 포함된다. 다가 금속이온은 하나 이상의 카르복실산기를 포함하는 유기산에 바람직할 수 있다. 이 것은 이들 이온들이 하나의 이상의 카르복실 산 기와 동시에 결합할 수 있기 때문이다.
용해제의 범위는 9.37x 10-4M 내지 9.37x10-2M 사이의 인슐린 및 EDTA와 결합하는 시트르산의 유효량에 대응한다.
킬레이트제(Chelators)
바람직한 실시예에서, 아연 킬레이트제는 인슐린과 혼합된다. 그 킬레이트제는 이온성 는 비이온성일 수 있다. 적합한 킬레이트제에는 에틸렌디아민테트라아세트산(EDTA), EGTA, 알긴산, 알파리포산, 디메르캡토숙신산(DMSA), CDTA(1,2-디아미노사이클로헥산테트라아세트산), 시트르산 삼나트륨(TSC)이 포함된다. 염산은 pH를 조정하기 위하여 TSC와 결합하여 사용되고, 그 과정에서 용해제인 시트르산 제형을 생성한다.
바람직한 실시예에서, 킬레이트제는 EDTA이다. 킬레이트제는 인슐린에서 아연을 포획하고, 그에 따라 육량체의 형태보다 이량체의 형태를 선호하고 투여 부위(예를 들면, 점막, 지방조직)를 둘러싸는 조직에 의해 인슐린 흡수를 촉진한다. 또, 수소 킬레이트제는 활성물질에 결합할 수 있고, 그로써 전하가 인슐린 단량체를 덮어주는 것을 도와주고 인슐린 단량체의 막수송을 촉진한다.
킬레이트제의 범위는 2.42x 10-4M 내지 9.68x10-2M 사이의 인슐린 및 시트르산과 결합하여 EDTA의 유효량에 대응한다.
부형제(
excipients
)
약학적 조성물은, 하나 또는 그 이상의 생리학적으로 수용가능한 캐리어를 사용하는 전통적인 방식으로 제형화될 수 있고, 그 캐리어는 활성의 화합물을 약학적으로 사용될 수 있는 약제로의 처리를 촉진하는 부형제 및 보조제를 포함한다. 약물의 제형은 예를 들면, Hoover, John E., Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, Pennsylvania (1975), 및 Liberman, H. A. and Lachman, L., Eds.,Liberman, H. A. and Lachman, L., Eds., Pharmaceutical Dosage Forms, Marcel Decker, New York, N.Y. (1980)에 논의된다.
바람직한 실시예에서, 하나 또는 그 이상의 가용화제들이 수용성 매개체에 급속한 용해를 촉진하기 위하여 인슐린제와 함께 포함된다. 적합한 가용화제에는, 폴리소르베이트, 글리세린 및 폴로사머(poloxamers), 비-이온성 및 이온성 표면활성제, 산성 및 염기성 식품(예, 중탄산나트륨)과 같은 습윤제와, 알코올 및 pH 조정을 위한 완충염이 포함된다.
안정화제는 예를 들면 산화반응을 포함하는 약물 분해반응을 방해하거나 억제하기 위하여 사용된다. 많은 안정화제가 사용될 수 있다. 적합한 안정화제는, 셀룰로스, 셀룰로스 유도체와 같은 다당류, 및 글리세롤과 같은 단순 알코올; 페놀과 같은 정균제, m-크레졸 및 메틸파라벤; 염화나트륨, 글리세롤 및 글루코스와 같은 등장제; 천연 레시틴(예를 들면, 달결 노른자 레시틴 또는 간장콩 레시틴)과 합성 및 반합성 레시틴(예를 들면, 디미리스토일 포스파티딜클로라인,디팔미토일포스파티딜클로라인, 또는 디스테아로일-포스파티딜 클로라인); 인지질산(phosphatide acids); 포스파티딜 에탄올아민(phosphatidylethanolamines); 디스테아로일-포스파티딜 세린, 디팔미토일포스파티딜 세린, 및 디아라치도일 포스파티딜세린과 같은 인지질세린(phosphatidylserines); 포스파티딜 글리세롤; 포스파티딜리노시톨; 카디오리핀; 스핑고미엘린을 포함한다. 하나의 실시예에서, 상기 안정화제는 글리세롤, 정균제, 및 등장제의 조합일 수 있다.
II
. 제형을 제조하는 방법
주사가능한 제형은 인슐린, 킬레이트제, 및 용해제를 포함한다. 바람직한 실시예에서, 주사가능한 제형은 인슐린, EDTA, 시트르산, 식염수 및/또는 글리세린을 함유한다.
일 실시예에서, 피하주사가능한 제형은 용액(“희석제”라 한다)을 형성하고 그 용액을 멸균하기 위하여 식염수와 글리세린, 시트르산과 EDTA를 혼합함으로써 제조된다. 상기 인슐린은 무균수에 첨가되어 용액을 형성하고, 여과되고, 소정량이 별도의 무균 주사병에 각각 들어간다. 상기 인슐린 용액은 분말을 형성하기 위하여 동결건조되고 희석제에서 분리되어 저장됨으로써 안정성을 유지한다. 투여하기 전에, 희석제가 인슐린 주사병에 첨가된다. 소정량의 인슐린이 환자의 피하에 주사된 후, 잔여 인슐린 용액은 저장될 수 있고, 바람직하게는 냉동 저장된다.
다른 실시예에서, 상기 인슐린은 pH 4의 희석제와 결합되어 다용도 주사병 또는 카트리지 안으로 무균 여과되고 사용하기 전에 냉동된다.
바람직한 실시예에서, 상기 인슐린은 수용액, pH 7.0에서 수용액으로서 바이알 또는 카트리지 안에 준비되고 4℃로 유지된다.
III
. 제형을 사용하는 방법
본 발명에 따른 제형은 피하주사 또는 근육내 주사에 의해 투여될 수 있다. 본 제형은 체계적인 전달을 위하여 혈장으로 급속히 흡수되고 수송되도록 고안되어 있다.
활성 물질로서 인슐린을 포함한 제형은 제1형 또는 제2형 당뇨병 환자에게 식사 전 또는 식사 중에 투여될 수 있다. 급속한 흡수로 인하여, 조성물은 글리코겐이 간에서 포도당으로 변환되는 것을 차단할 수 있고, 그로써 당뇨병과 제2형 당뇨병의 제1기 증후군으로 인한 합병증의 주요 원인인, 고혈당을 방지한다. 인슐린이 간에서의 포도당 생산을 차단하기 위하여 너무 늦게 흡수되므로, 근래 이용가능한, 표준의 인간 인슐린의 피하 주사는, 원하는 효과 이하를 제공하기 위하여 식사 전 약 1시간 반 안에 반드시 투여되어야 한다. 추가적으로, 그 질병(당뇨병)의 진행 초기에 투여된다면, 피하 인슐린 조성물은 제2형 당뇨병의 진행을 지연시키거나 중지시킬 수 있다.
저 pH 제형의 장점은, 불혼화성과 침전 때문에 상업적으로 이용가능한 이슐린의 다른 형의 인슐린과 혼합될 수 없는, BYETTA™(exenatide), SYMLIN®(pramlintide acetate), 및 LANTUS®지속작용 인슐린 유사체)과도 혼합될 수 있다는 것이다.
고 pH 인슐린의 장점은, 저 pH의 인슐린보다 저장되는 동안에 더 안정적이라는 것이다.
본 발명은 비 한정적인 다음 실시예를 참조하여 설명된다. 다음의 인슐린은 실시예에서 사용되었다.
HUMULIN®(RHI)는 재조합 인간 인슐린이다. 밀리리터당 정규 재조합 인간 인슐린 100unit, 0.22 % m-크레졸, pH 7의 1.4-1.8% 글리세린을 함유한다. 이 것은 몇몇 소스로부터 상업적으로 이용가능하다.
HUMALOG®from Eli Lilly (IL)는, 인슐린 리스프로 주사이고, Lsy(B28), Pro(B29) 인간 인슐린 유사체인 재조합 인간 인슐린 유사체이고, 인슐린 B-고리의 28 및 29 위치의 아미노산이 역전될 때 생성되는 것이다. IL 주사의 단위 mL당 인슐린 리스프로 100 units, 16mg의 글리세린, 1.88mg의 이염기성 인산나트륨(dibasic sodium phosphate), 3.15mg의 메타크레졸, 0.0197 mg의 아연 이온을 제공하기 위하여 조정된 산화 아연 함량, 미량의 페놀, 및 주사용 물을 함유한다. 인슐린 리스프로는 7.0 내지 7.8의 pH를 가진다. 10%의 염산 및/또는 10%의 수산화나트륨이 pH 조정을 위하여 첨가된다. IL 1 unit는 정규 인간 인슐린의 1 unit와 동일한 포도당-저하 효과를 가지지만, 그 효과는 기간이 더 짧고 더 빠르다.
NOVOLOG®(IA)는 Novo Nordisk A/S로부터 이용가능한 재조합 인슐린 유사체이다. 이 유사체는 아미노산 프롤린을 B28 위치의 아스파르트산으로 단일 교체한 것이고, 재조합 이스트에 의해 제조된다. 상기 유사체는, 100 units의 인슐린 아스파르/ml, 16mg/ml의 글리세린, 1.50mg의 페놀/ml, 1.72 mg의 메타크레졸/ml, 19.6 mg 아연/ml, 1.25mg의 제이인산수소나트륨/ml, 10% HCl 또는 NaOH로 조정된 pH 7.2 내지 7.6을 가진, 0.58mg의 염화나트륨/ml을 포함하는, 무균의 수용액안에 제공된다.
VIAJECT™은 시트르산과 EDTA로써 제형된 재조합 인간 인슐린이다. Viaject 25 U/mL( CE 25-4)는 25 U/mL의 정규의 재조합 인간 인슐린, 1.8 U/mL의 시트르산, 1.8 U/mL의 EDTA이나트륨, 0.82 U/mL의 염화나트륨(등장성), 및 3mg/mL의 m-크레졸을 함유한다. 그 것은 수용액으로 제공되고, 냉동저장되거나 건조 분말 인슐린 및 희석제로 이루어진 2 파트 키트안에, 그 중 적어도 하나는 시트르산과 EDTA를 포함한다. 재구성된 혼합물 및 냉동 용액의 pH는 약 pH4이다. 상기 재구성된 분말은 실시예에서 사용된 것이다. Viaject 100 U/ mL ( CE 100-4)는 100 U/mL의 정규의 재조합 인간 인슐린, 1.8 U/mL의 시트르산, 1.8 U/mL의 EDTA이나트륨, 22 mg/mL의 글리세린, 및 3mg/mL의 m-크레졸을 함유한다. 이 것 역시 냉동 수용액 또는 냉동건조된 인슐린 및 희석제로 이루어진 2파트 키트로 제공된다. 재구성된 혼합물 및 냉동 용액 양자의 pH는 약 pH4이다. 냉동된 수용액만 분석 원심분리기 데이터 및 말번에서 사용되었다. Viaject 100 U/ mL ( CE 100-7)는 100 U/mL의 정규의 재조합 인간 인슐린, 1.8 U/mL의 시트르산, 1.8 U/mL의 EDTA이나트륨, 22 mg/mL의 글리세린, 및 3mg/mL의 m-크레졸을 함유한다. 이 것은 약 7.4의 pH를 가진 수용액으로 제공되고, 4℃로 저장될 수 있다. 이것은 스와인 연구에 사용되었다. 산염을 가진 Viaject(CE 100-7)는,100U/mL의 인슐린 및 글리세린(22mg/mL)과 함께 물과 1.8 U/mL의 EDTA이나트륨, 시트르산 삼나트염로써 만들어진다. 최종 pH는 수산화나트륨으로써 7.4로 조정된다. 이는 말번 정보를 위한 최종 실시예에서 사용되었다.
상피세포
트랜스웰
분석을 사용하여 용해제의 작용으로서 인슐린의 섭취 및 수송의
시험관내
비교.
재료 및 방법
도 2에 도시된 바와 같이, 구강 상피세포들은 트랜스웰 삽입물상에서 복수의 세포층(4-5층)이 형성될 때까지 2주일동안 성장하였다. 수송 연구는 공여 웰(well)에 적당한 용액을 첨가하고, 10분후 시료를 수용 웰에서 제거함으로써 수행되었다. 용액은 물, +/-EDTA(0.45 mg/ml), NaCl(0.85% w/v), 1mg/ml 인슐린 및 pH를 3.8로 유지하기 위한 충분한 량의 산으로 구성되었다. 수용 웰에서의 인슐린 량은 ELISA를 사용하여 분석되었다.
결과
도 3a 내지 3b에 도시된 결과는 일부 산들은 상피세포를 통한 인슐린의 섭취 및 수송을 촉진하는 데 더 효과적임을 보여준다. 이러한 것들은 쉽게 시험될 수 있고, HCl을 사용하여 얻어진 실험결과와 비교될 수 있다. 그렇게 함으로써 어느 산들이 시험될 수 있고 용해제(예를 들면, HCl에 대한 섭취 및 수송을 강화)인지가 결정될 수 있는 표준을 제공한다.
pH 3.2 내지 3.8의 산으로써 얻어진 결과는 도 3a에 그룹화된다. 강산(pH<3)은 도 3b에 그룹되어 있다.
그 결과는 동일한 킬레이트제의 농도를 가진 산의 선택이 세포배양을 통하여 인슐린 섭취에 실질적인 효과를 가진다는 것을 입증한다. 바람직한 산은 시트르산이다.
상피세포
트랜스웰
분석을 사용하여 용해제의 농도의 작용으로서 인슐린의 섭취 및 수송의
시험관내
비교.
재료 및 방법
실시예1의 재료 및 방법은 시약의 다른 농도로써 사용되었다. 이 연구에서는, 등분자 농도의 산과 킬레이트제가 첨가되었다. 용액은 물, +/-EDTA(0.56 mg/ml), NaCl(0.85% w/v), 1mg/ml 인슐린 및 산: 아스파르트산(0.2 mg/ml), 글루타민산(0.22 mg/ml) 또는 시트르산(0.20 mg/ml)으로 구성된다. 시트르산은 1.8mg/mL의 더 높은 농도에서 킬레이트제와 함께 그리고 킬레이트제 없이 시험되었다. 이 데이터는 2개의 시간 기간, 세포공여 챔버의 투여후 10분 및 30분으로 보여진다.
결과
아스파르트산(0.2 mg/ml), 글루타민산(0.22 mg/ml) 또는 시트르산(0.29 mg/ml)으로써 얻어진 결과는 도 4a에 도시되어 있다. 이 경우, 킬레이트제의 추가에 의해 보여지는 차이는 없었다.
대조적으로, 1.80 mg/mL의 고 농도의 시트르산을 사용한 연구는 용액에 킬레이트제를 추가하였을 때 중대한 증가(t-시험 비교, 한쪽 측)를 보여준다. 도 4b에 나타난다. 이러한 결과로부터, 양 성분들의 농도가 섭취와 수송을 최적화하는 데 중요함이 입증된다.
상피세포
트랜스웰
분석을 사용하여
킬레이트제의
작용으로서 인슐린의 섭취 및 수송의
시험관내
비교.
재료 및 방법
구강 상피세포들은 트랜스웰 삽입물상에서 복수의 세포층(4-5층)이 형성될 때까지 2주일 동안 성장하였다. 수송 연구는 공여 웰(well)에 적당한 용액을 첨가하고, 10분, 20분 및 30분 후 시료를 수용 웰에서 제거함으로써 수행되었다.
용액은 다음의 방법으로 트랜스웰 실험하기 전에 즉시 준비되었다: 1.8mg/ml의 시트르산은 0.85% w/v의 식염수에서 용해되었고 그리고나서 다음의 킬레이트제 중 하나가 다음 농도의 용액에 첨가되었다: 1.80mg/ml의 EDTA, 1.84mg/ml의 EGTA, 0.88mg/ml의 DMSA 및 1.42mg/ml의 TSC. CDTA는 액체 형태로 사용되었기 때문에, 시트르산은 CDTA에 직접 첨가되었다. 이들 각 경우에서, 킬레이트제의 농도는 4.84 x 10-3 몰로 일정하였다.
그리고나서, 1mg/ml의 인슐린이 추가되었고, pH는 필요하다면 3.8로 재조정되었다. pH 조정을 위하여 단지 HCl만 사용하여 일련의 시료들을 조정하는 것이 비교를 위하여 포함된다. 트랜스웰 실험은 각 용액의 0.2ml를 공여 웰에 추가함으로써 행해졌다.
수용 웰의 인슐린 양은 ELSA를 사용하여 분석되었다.
결과
30분의 인슐린 데이터에 대한 그래프는 도 5에 도시되어 있다. 시트르산 또는 글루타민산이 사용되었을 때 TSC(시트르산 삼나트륨염)으로써 얻어진 결과와 비교되는 것을 제외하고는, 그 상피세포를 통하여 더 많은 인슐린이 전달되었다. TSC의 경우에, HCl은 pH 조정을 위하여 사용되었다. pH의 조정은 시트르산을 생성하였고, 이러한 것이 이들 결과를 설명한다.
이들 결과에 의해 입증된 바와 같이, 섭취와 수송의 촉진은 킬레이트제의 선택에 의존한다.
돼지의 시트르산 기초의 인슐린 제형에서
킬레이트제의
임상전
평가.
재료 및 방법
공개된 연구, 즉, “A. Plum, H. Agerso and L. Andersen., 속효형 인슐린 유사체, 인슐린 아스파르트의 생쥐, 개 및 돼지에서의 약물동태, 및 돼지에서의 인슐린 아스파르트의 약역학”, Drug Metab. Dispos., 28(2): 155-60 (2000)와 협력하여, 반감기 소실의 지연은 주사부위에서 더딘 흡수를 의미하므로 소실반감기가 인슐린의 흡수의 좋은 결정인자이었음이 결정되었다. 그러므로, 작은 돼지 연구의 비-구획화 분석이 PK 및 PD 파라메터, 특히 소실 반감기를 검사하기 위하여, 수행되었다.
당뇨병 돼지는 4개의 인슐린 제형중 하나로 피하주사되었다. 3개의 제형은 킬레이트제(EDTA, EGTA 또는 TSC)를 포함하였고, 네 번째 조정은 정규 인간 인슐린 RHI만을 함유하고 킬레이트제는 전혀 포함되지 않았다. 시트르산(1.8mg/ml)이 모든 킬레이트제의 제형에서 산으로서 사용되었고, NaCl 및 m-크레졸은 모든 경우에서 등방성과 제형 무균성을 위하여 첨가되었다. 킬레이트제는 모두 4.84 x 10- 3몰의 동일한 분자농도이었다.
돼지는 야간공복후, EDTA (n=3)을 함유한 0.12U/kg의 인간인슐린 또는 EGTA 또는 TSC(n=2)를 함유한 0.08 U/kg의 인간 인슐린의 투여량이 피하에 투여되었다. 투여량을 증가함에 따라 극심한 혈당 저하로 인하여 투여량은 감소되었다. 혈당과 인슐린 수치는 모든 시점에서 투여후 8시간으로 결정되었다.
약물동태학적 모델링이 균일한 무게화로써 비구획화 모델을 이용하여 Win Nonlin으로써 수행되었다. 소실 반감기들은 표1에서 비교되었다.
| 인슐린 | 반감기“람다 Z"(분 +/- sd) 최종 반감기 |
| RHI/킬레이트제 없음 | 120 |
| 인슐린/EDTA | 39.1+/- 15.8 |
| 인슐린/EGTA | 37.5 +/- 8.0 |
| 인슐린/TSC | 30.1 +/- 9.0 |
돼지에 대한 이 파이롯 연구에서 정규 인간 인슐린의 소실 반감기(120분)는 상기 문헌에 보여진 바와 일치하였고, 그 데이터를 확인하기 위하여 실험 포인트로서 사용되었다. 이러한 소실반감기가 다음의 근육내 투여보다 상당히 더 길므로, 주사후 주사 부위에서 늦은 흡수가 계속되고 있다는 것이 확인된다. 시트르산 제형에서 킬레이트제는 이 파라메터에서 감소를 분명하게 보여주고, 이들 3개의 킬레이트제는, 정도는 다르지만, 정규의 인간 인슐린의 흡수를 촉진하는 데 효과적임을 입증한다.
인간 임상시험에서 정규의 인간 인슐린에 대한 EDTA-시트르산 인슐린 제형의 비교.
재료 및 방법
이 연구의 목적은 시트르산과 EDTA, “CE 25-4"와 조합하여 인슐린을 함유한 시험 제형의 약물동태학적(PD) 특성을 평가하는 것이다. 5개의 유글리세미아 글루코스-클램프(euglycemic glucose-clamp)(Biostator; 목표 혈당 90mg/dl)가 10명의 공복상태의 건강한 자원자(평균 연령 40세(20-62세 범위); BMI 22.5(19.2-24.9)kg/m2)에 대하여 수행되었다. 고정된 치료 순서로써 교차 방안을 사용하여, 12 IU 정규 인슐린, CE인슐린 제형의 12 IU가 복부에 피하 주사되었다.
결과
결과는 도 6 및 7에 도시되어 있다. CE 25-4의 SC 주사는 포도당 소모 정규 인간 인슐린의 포도당 소모에 있어서 상당히 더 빠른 상승을 유발하는 시간-작용 프로파일을 얻었다(도 6). 평균 약역학 데이터는 그 PD결과를 확인시켜준다(도 7).
이 연구는 정규의 인간 인슐린에 시트르산과 EDTA를 첨가하면, 최대 농도에 대한 더 빠른 시간과 정규 인간 인슐린 단독에 비하여 더 빠른 작용 개시(도 6)에 의해 입증되는 바와 같이, 인슐린의 흡수율을 개선할 수 있음을 보여준다.
제1형 당뇨병 환자에 식전 즉시 피하주사하였을 때
CE
인슐린, 인슐린 리스프로, 및 정규 인간 인슐린의 약물동태 및
약역학
.
배경 및 목적
본 연구의 목적은 제1형 당뇨병 환자에게 표준 식사후 식후 혈당(BG) 운동에 CE 25-4, RHI 및 IL의 작용을 측정하기 위한 것이다.
재료 및 방법
9명의 환자(5명의 남자, 4명의 여자; 연령 40±10세, BMI 24.0±2.0 kg/㎡)가 식사 섭취 이전에 포도당 클램프(목표 BG 120mg/이)에 의해 안정화되었다. 포도당 주입은 표준 식사 및 인슐린 투여 이전에 중단되었다. 고정된 치료 순서와 교차 연구를 사용하여 VIAject™(CE25-4) IL 또는 RHI의 동일한 환자에 대한 특이 투여량이 식사 전에 즉시 피하 주사되었다. 그 결과, 식후 포도당 움직임은 8시간 동안 계속 관찰되었고, 포도당 주입은 BG(혈당)가 60mg/dl 이면 재개되었다. 혈장 인슐린 수치는 이 연구 동안 내내 측정되었다.
결과
표 2에 표준편차로서 나타낸 결과는, 식후 제2형 당뇨병 환자에게, 피하 주사후 인슐린 Tmax, 정규 인간 인슐린, 인슐린 플러스 시트르산 및 EDTA(CE) 및 리스프로를 비교한다. 표 3의 결과는 동일한 시험 대상들의 혈당을 비교한다.
| 약물 동태 | RHI | IL | (CE25-4) |
| 인슐린 Tmax(분) | 143±29* | 62±37 | 43±36* |
* p<.001, 대립 t-시험
| 약역학(0-180 분) | RHI | IL | (CE25-4) |
| BG TMax(분) | 93±56* | 47±28 | 41±26* |
| BG Max(mg/dl) | 185±44 | 158±33 | 87±24 |
| BG Min(mg/dl) | 103±21 | 73±31 | 87±24 |
| BG Max-BG Min(mg/dl) | 82±30 | 84±11* | 70±18* |
* p<0.05, 대립 t-시험
주사 후 3 내지 8시간의 고혈당 사례(포도당 주입이 필요한 시간)의 총수는 RHI에서는 13, IL에서는 11 그리고 CE25-4 제형에서는 4 이었다. 이 시간 동안 고혈당 현상을 방지하기 위하여 주입된 포도당 총 량은 RHI에서는 CE25-4에 비하여 6배 더 높았고 IL에서는 2배정도 높았다. 그룹의 모든 환자들을 총합한 규정 당뇨성 목표 영역(BG AVC 140 이상 및 80mg/dL이하)의 위 및 아래 영역은 RHI의 경우 81,859이고, IL의 경우 57,423이고, CE 25-4의 경우 38,740 mg/dl*분이었다. 평균 혈당 수치는 도 8에 도시되어 있다.
CE 25-4는 표준 식사후 혈당의 상승을 역전시키는 데 가장 빨랐다. CE 25-4로 조치된 환자는 감소된 식후 포도당 거동을 경험하였다. 대조적으로, RHI는 가장 높은 포도당 거동을 가졌고, 그의 가장 늦은 흡수율과 일치한다. 포도당 수치의 변동( 최대값과 최소값 사이의 평균 편차)는 CE 25-4의 경우 IL보다 상당히 적었고, 이는 제1형 당뇨병 환자에서 CE 25-4의 더 나은 포도당 조정을 입증하는 것이다.
광분산에
의한 인슐린 크기의 특성화.
CE 100-4는 환자에게 가장 빠른 작용 개시를 가진다. 급속 흡수 형태를 위한 기초를 이해하기 위하여, 시험관 내 실험은 상업적으로 이용가능한 다른 재조합 인간 인슐린과 속효성 인슐린 유사체와 비교하여 CE 100-4로 수행되었다. 광분산 기술이 합성 생체외 완충 유체내에 희석 계열 뿐만아니라 원 제품에 적용되었다. 그 결과는 다른 정규의 재조합 인슐린과 속효성 유사체, CE 100-4가 1:3 희석후 이량체의 것으로 크기가 감소하고, 이는 급속 흡수 형태와 일치한다.
재료 및 방법
이러한 작용의 급속 개시의 메커니즘을 밝히기 위하여, 천연적으로 후속 피하 주사를 유발하는 것을 자극하는 수단으로서, 생체밖 합성 완충액내 종래의 제형의 희석 효과를 연구하기 위하여, 시험관 내 실험이 고안되었다. 광분산 기술은 평균 크기 분포(nm)를 평가하기 위하여 사용되었다. 이들 시험관내 실험과 비교하기 위하여 사용된, 상업적 급속 작용 또는 식사 인슐린 제형은: IL, IA, RHI 및 CE 100-4이었다. 크기 비교를 위하여, 단량체의 인슐린(pH 2.0)와 육량체의 아연 인슐린(pH 7)의 표준 제조가 표준으로 사용되었다.
상업적 인슐린은 Zetasizer nano (Malvern Inst, UK)로써 크기에서 특성화되었다. 1mL의 샘플을 유리 큐벳안에 넣고 용액내 인슐린의 평균 체적 크기 분포(nm)를 측정하기 위하여 분석하였다. 3개의 시료(각 시료마다 수회의 실행을 거쳤다)들이 비교를 위한 기초로서 사용되었다. 초기의 완전 강도 분석후에 일련의 희석이 유사한 pH와 생체밖 유체의 완충 능력을 가진 완충액에서 1:2에서 1:16까지 수행되었다(ECF, 0.7 mN MgCl2, 1.2 mM CaCl2, 0.2 mM KCI, 0.5 mM Na2SO4, 104 mM NaCl, 28.3mM NaHCO3). 각 제형에 대한 단량체/이량체/육량체 크기 분포를 이해하기 위하여, 평균 크기는 상업적으로 이용가능한 인슐린 및 CE100-4로써 모든 희석에 대하여 측정되었다.
인슐린
RHI, IL, IA 및 CE 100-4
희석제
ECF, 0.7mM MgCl2, 1.2mM CaCl2, 2mM KH2PO4, 2mM KCl, 0.5mM Na2SO4, 104 mM NaCl, 무균수 내의 28.3 mM NaHCO3.
결과
크기 측정 연구에서, 희석되지 않은 CE100-4는 IL, IA 및 RHI보다 더 크다. 그러나, 다른 인슐린은 약 5nm의 육량체로 유지되는 동안에 1:3의 희석으로, CE100-4의 평균 크기는 단량체/이량체 크기에 대하여 2nm 만큼 감소하였다.
IL, IA 및 RHI가 아닌, CE 100-4는 증가된 희석으로 더욱 감소하였다. 희석되지 않은 RHI는 더 작게 보이지만 1:1 희석되면 5nm보다 더 크게 크기가 성장하고 1:16의 희석 외의 크기로 유지된다.
희석되지 않은 CE 100-4는 초기에는 표면에 약하게 부착된 시트르산과 EDTA로 인하여 다른 인슐린보다 더 큰 것으로 보인다. 상기 시트르산과 EDTA는 표면 전하를 마스킹함으로써 피하측에서 흡수율을 더욱 증가시키는 역할을 한다. 전하는 흡수에 대한 장애물일 수 있다. 피하 투여 직후에, 주사된 물질이 ECF에 의해 희석됨에 따라 CE 100-4는 동일한 희석에서 급속 작용 인슐린 유사체와 RHI보다 더 작은 평균 크기를 가진다.
인슐린의 분석적
초원심
분리
재료 및 방법
일 세트의 실험이 분석적 초원심분리 방법을 이용하여 실행되었고, 무게 평균화된 침전 계수(Svedbergs 20℃, 물 S(20,w))의 추정값을 측정하였다. 상기 추정값은 부유 유효 몰중량에 비례한다. 이러한 분석의 과정은 광분산 크기 측정과는 다소 다르다. 첫째, 각 샘플들은 조성에 있어서 상업적 제품과 동일한 희석제로 희석된다. 이를 얻기 위하여, CentriprepUltracel-3 멤브레인 필터 유닛(Millipore Inc, MA, USA)이 3kDa MW의 컷오프와 함께 희석제에서 인슐린을 분리하기 위하여 사용되었다. 원래의 희석제는 회복되었고, 어떠한 인슐린 내용물의 존재를 위하여 분석되었다. 확인된 인슐린없는 희석제가 상업적 제품을 희석시키기 위하여 사용되었다.
이들 첫 번째 데이터 세트는 인슐린을 안정된 단일 종 또는 자신의 희석제 안의 육량체, 이량체 단량체에서변화된 어느 하나의 것으로서 특성화하기 위하여 사용되었다. 두 세트의 데이터는 분석적 초원심분리를 사용하여 얻었다. 첫 번째 세트의 데이터는 정확하게 제형의 희석제로써 희석함으로써 얻어졌다. 상기 상업적 제제의 경우에, 이 것은 인슐린 또는 유사체를 희석제로부터 분리하는 센티프레프 튜브에 의해 얻어 졌다. 여과재는 단백질 함량이 조사되었고, 확인후가 실험의 일차 라운드에서 희석제로 사용되었다.
두 번째 샘플 세트는 ECF 완충액을 희석제 대신에 교체하여 제조되었다. 이 것이 작용하기 위하여, 최고 농축된 시료가 ECF 1:2로써 일차로 희석되었다. 추가적인 희석이 ECF로 행해졌다. CE100-4의 경우에, ECF로써 초기 희석은 등전압점이 어떠한 침전물을 제거하기 위하여 교차되었다는 것을 보증하기 위한 1:4이었다. 이러한 실험은 후 피하 주사 환경을 모방하기 위하여 의도되었다.
각 부하농도의 중량 평균 침전계수로 얻어지고 표준 조건으로 수정된 값들은 아래 표에서 주어진다. 속도 분석은 Beckman-Coulter XL- 분석적 초원심분리로써 간섭광학을 이용하여 20℃에서, 55,000RPM으로 행해졌다. 사파이어 창이 구비된 이중 섹터 합성 경계 세포가 샘플과 기준 메니시(menisci)를 일치시키기 위하여 사용되었다. 로터는 20℃ 진공하에서 평형이 되었고 20℃에서 약 1시간 후 상기 로터는 55,000RPM으로 가속되었다. 간섭 스캔은 5시간 동안 60초 간격으로 획득되었다.
다수의 분석 프로그램(DcDt+ 버전 2.1.02,과 Sedfit, 버전 11.3b3)은 각 샘플에 특이적 정보를 추출하기 위하여 상기 데이터로 구동되었다. DcDt는 모델 독립, 농도 프로파일의 시간 유도체를 사용하는 침전계수 분포 g(s*)이다. 농도의 증가로써 S의 값이 더 큰 값으로 전혀 이동하지 않으면, 가역 반응 발생(즉, 단량체, 이량체, 육량체)이 전혀 없다는 것이 강력한 증거이다. 만약, 크기와 형태가 희석 중 변한다면(육량체에서 이량체 또는 단량체로), 분자량의 추정값을 측정하는 것이 가능하지 않지만 유용한 정보가 침전계수 S(w)에 대한 Sedfit 프로그램에서 얻어질 수 있다. 또한, 이 프로그램은 Lamm 식에 대한 모델 기초 수치 해법을 사용하여 각 데이터 세트에 대한 직접 경계모델을 생성한다3. 그 것은 침전물의 상대적인 크기를 설명하는 곡선을 생성하기 위하여 연속적인 침전 계수 c(s) 대 침전계수를 그린다.
인슐린-특이적 희석제로써 각 인슐린의 희석
A.
RHI
RHI는 침전속도 초원심분리에 의해 분석을 위하여 제출되었다. 추정된 보존 농도는 3.745mg/ml이었다. 희석제는 위에서 설명한 바와 같다.
다음 물리적 상수는 프로그램 Sedterp5을 사용하여 단백질의 아미노산 조성물로부터 계산되었다.
RHI: MW seq=5792 Da, N20˚=0.726 ml/g
희석 밀도 및 점도는 20℃에서 Sedterp를 사용하여 각각 1.00231 g/ml와 0.01041로 계산되었다.
결과
도 9a는 RHI™의 부하 농도로 노르말화된 c(s) 분포 그래프를 보여준다. 노르말화된 c(s) 그래프를 위하여 보여진 데이터는 DcDt+에서의 g(s*) 데이터와 일치한다. 농도 증가에 따라 침전에서의 S의 더 낮은 값으로 뚜렷한 변화가 있었다.
| 세포 # | S(20,w)(Svedbergs) | 농도(mg/ml) |
| 1 | 3.05 | 0.168 |
| 2 | 3.00 | 0.561 |
| 3 | 3.00 | 1.678 |
| 4 | 2.84 | 3.624 |
결론
이러한 분석은 상기 실험조건에서 RHI가 주로 육량체로 존재하고 있음을 보여준다. 낮은 농도 샘플에 육량체의 이합체인 것으로 보여지는 것 뿐만아니라 더 느린 소량의 침전물이 있다.
B.
IL
재료와 방법은 위에서 설명된 바와 같다.
결과
도 9b는 각 농도에 대한 무게 평균 침전계수의 그래프이다. 단백질은 희석제에 의해 분리된다. 또, 바람직하게는 육량체의 이합체인 더 빠른 침전물의 적은 량(<5%)이 존재하는 것으로 보인다.
각 부하농도에 대한 무게평균 침전계수로 얻어지고 표준조건으로 수정된 값들이 아래 표 5에 도시되어 있다.
| 세포 # | S(20,w)(Svedbergs) | 농도(mg/ml) |
| 1 | 2.78 | 0.151 |
| 2 | 3.02 | 0.558 |
| 3 | 3.09 | 1.755 |
| 4 | 3.10 | 3.595 |
결론
이러한 분석은 상기 실험조건에서 IL이 주로 육량체로 존재하고 있음을 보여준다. 희석시 IL의 분해의 증거가 있고, 육량체의 이합체로 보이는 것들의 적은 량이 존재한다. 연구된 농도는 약 30, 100, 300, 및 600(단량 유니트)이다.
C.
IA
재료와 방법은 위에서 설명된 바와 같다.
결과
도 9c는 부하농도로 노르말화된 C(S) 분포의 그래프이다. 노르말화된 c(S) 그래프에서 보여지는 데이터는 DcDt+로부터 얻은 g(s*) 데이터와 일치한다. 저농도의 c(s) 곡선은 농도가 증가함에 따라 감소하는 더 작은 종(species)의 분포를 보여준다. 또한 농도 증가에 의해 침전물의 S의 더 낮은 값들로 약간의 이동이 있다. 바람직하게는 육량체의 이합체인 더 빠른 침전 종의 작은 량(<5%)이 있는 것으로 보인다.
각 부하농도에 대한 무게평균 침전계수로 얻어지고 표준조건으로 수정된 값들이 아래 표 6에 도시되어 있다.
| 세포 # | S(20,w)(Svedbergs) | 농도(mg/ml) |
| 1 | 2.72 | 0.158 |
| 2 | 3.05 | 0.561 |
| 3 | 3.19 | 1.655 |
| 4 | 3.14 | 3.563 |
결론
이러한 분석은 상기 실험조건에서 IA가 주로 육량체로 존재하고 있음을 보여준다. 희석시 IA의 분해의 증거가 있고, 육량체의 이합체로 보이는 것들의 적은 량이 존재한다. 연구된 농도는 약 30, 100, 300, 및 600(단량체 유니트)이었다.
D.
CE100
-4
재료와 방법은 위에서 설명된 바와 같다.
결과
CE 100-4용 데이터베이스는 Sedfit와 c(s)모델을 사용하여 분석되었다.
엄밀히 말하면, 이 모델은 비-상호작용 혼합물에 대하여 적용할 수 있을 뿐이고, 상호작용하는 종의 경우에는 어떤 종들이 용액에 존재하는 지에 대한 생각을 생기게 한다. 도 10d는 부하농도로 노르말화한 c(s)의 분포곡선 그래프를 보여준다. 상기 c(s) 그래프는 낮은 S값을 향하여 현저한 이동이 있다는 점에서 DcDt+로부터 얻은 g(s*)데이터와 일치한다. 가장 높은 농도에서 얻은 c(s) 그래프는 CE100-4가 육량체보다 더 클 수 있다는 것을 보여준다.
각 부하농도에 대한 무게평균 침전계수로 얻어지고 표준조건으로 수정된 값들이 아래 표 7에 도시되어 있다.
| 세포 # | S(20,w)(Svedbergs) | 농도(mg/ml) |
| 1 | 1.85 | 0.153 |
| 2 | 2.41 | 0.548 |
| 3 | 3.05 | 1.722 |
| 4 | 3.56 | 3.484 |
결론
이러한 분석은 단백질 샘플, CE100-4은 이 실험조건에서 단량체, 이량체, 육량체 및 가능한 가장 높은 농도의 더 큰 올리고머 사이에서 평형상태로 존재하는 것을 보여준다. 연구된 농도는 약 30μM, 300μM, 및 600μM(단량체 유니트)이었다.
ECF
완충액으로써
희석
상업적 제제는 먼저 ECF로써 1:2로 희석되고 CE100-4없이 1:4로 희석되었다. 이는 pH 4에서 시작하므로, 등전위점을 통한 침전을 피하기 위하여 다르게 처리되어야 한다. 다른 상업적 인슐린은 거의 pH 7에 있고 그리하여 초기 희석은 1:2로 하였다.
A. RHI
RHI는 침전속도 초원심분리에 의해 분석하기 위하여 제출되었다. 추정 농도는 공급된 ECF의 동일한 체적으로 희석한 후 1.87 mg/ml이었다.
RHI: MW seq=5792 Da, N20˚=0.726 ml/g
희석 밀도 및 점도는 20℃에서 Sedterp를 사용하여 각각 1.00231 g/ml와 0.01043으로 계산되었다.
원액을 사용하여 본 분석에서 사용된 세개의 세포들에 대한 희석 방법은 아래 표 8에 나타나 있다.
| 세포 # | 원액 체적(㎕) | 완충액 체적(㎕) | 추정 농도(mg/ml) |
| 1 | 45 | 405 | 0.19 |
| 2 | 150 | 300 | 0.62 |
| 3 | 450 | -- | 1.87 |
Sedfit, 버전 11.71이, Lamm 방정식3에 대한 모델 기초 수치해법을 사용하여 각 데이터 세트에 대하여 직접 경계 모델링 프로그램으로써 사용되었다.
다른 분석 방법에 대하여 연속적인 침전 계수 분포, c(s), 모델은 계산되었다. c(s) 분포 그래프는, 확산의 광역화효과가 마찰계수에 대한 평균값의 사용에 의해 제거되기 때문에, 다른 분석방법에 비하여 첨예하였다.
결과
도 10a는 부하농도로 노르말화한 c(s)의 분포곡선 그래프를 보여준다. 상기 노르말화한 s(s) 그래프에서 보여지는 데이터는 DcDt+로부터 얻은 g(s*)데이터와 일치한다. c(s) 그래프들은 거의 일치하지만, 농도가 증가함에 따라 침전의 낮은 낮은 S값을 향하여 작은 이동이 있다.
2개의 가장 낮은 농도 샘플에서 더 더딘 침전 물질의 작은 량(<1%)이 있고, 아마 육량체의 이합체인 더 빠른 침전 종의 적은 량(<3%)이 있는 것으로 보인다. 농도의 증가에 따라 더 더딘 종들의 감소와 더 빠른 종들의 증가는 시험 농도 범위에 걸쳐 RHI의 자기 연합(self-association)에서 아주 작은 이동만이 있다는 것을 의미한다.
각 부하농도에 대한 중량 평균 침전계수로 얻어져 표준조건으로 수정된 값들은 아래 표 9에 주어진다.
| 세포 # | S(20,w)(Svedbergs) | 농도(mg/ml) |
| 1 | 3.25 | 0.176 |
| 2 | 3.24 | 0.552 |
| 3 | 3.35 | 1.721 |
결론
이러한 분석은 상기 실험조건에서 RHI가 주로 육량체로 존재하고 있음을 보여준다. 더 낮은 농도 샘플에는 육량체의 이합체인 것으로 보이는 것 뿐만아니라 더 더딘 침전 물질이 아주 적은 량이 존재하고 있다. 연구된 농도는 약 30μM, 100μM, 300μM(단량체 유니트)이었다.
IL
방법은 위에서 설명되었다.
결과
도 10b는 부하농도로 노르말화한 c(s)의 분포곡선 그래프를 보여준다. 상기 노르말화한 s(s) 그래프에서 보여지는 데이터는 DcDt+로부터 얻은 g(s*)데이터와 일치한다. 저 농도의 c(s) 그래프들은, 농도가 증가함에 따라 감소하는 더 작은 종들(아마 이량체)의 상당한 분포를 보여준다. 또한 농도의 증가에 따라 더 더딘 침전의 S값들로 약간 이동한다.
더 빠른 침전 종의 적은 량(<2%)이 있는 것으로 보이고, 이는 2개의 가장 높은 농도 샘플에서 더욱 분명하다.
각 부하농도에 대한 중량 평균 침전계수로 얻어져 표준조건으로 수정된 값들은 아래 표 10에 주어진다.
| 세포 # | S(20,w)(Svedbergs) | 농도(mg/ml) |
| 1 | 3.17 | 0.167 |
| 2 | 3.12 | 0.568 |
| 3 | 3.17 | 1.820 |
결론
이러한 분석은 상기 실험조건에서 IL이 주로 육량체로 존재하고 있음을 보여준다. 이는 희석시 IL의 분리의 증거가 있고, 존재하는 육량체의 이합체인 것으로 보이는 것들의 적은 량이 있다. 연구된 농도는 약 30μM, 100μM, 300μM(단량체 유니트)이었다.
인슐린 아스파르트(
IA
)
방법은 위에서 설명되었다.
결과
도 10c는 부하농도로 노르말화한 c(s)의 분포곡선 그래프를 보여준다. 상기 노르말화한 s(s) 그래프에서 보여지는 데이터는 DcDt+로부터 얻은 g(s*)데이터와 일치한다. 저 농도의 c(s) 그래프들은, 농도가 증가함에 따라 감소하는 더 작은 종들(단량체/이량체)의 적은 량을 보여준다. 또한 농도의 증가에 따라 더 더딘 침전의 S값들로 약간 이동한다. 상기 그래프는 단백질이 희석시 약간 분리됨을 분명하게 보여준다. 또한 육량체의 이합체인 더 빠른 침전 종들의 적은 량(최고 농도샘플에서 약 3%)이 있는 것으로 보인다.
각 부하농도에 대한 중량 평균 침전계수로 얻어져 표준조건으로 수정된 값들은 아래 표 11에 주어진다.
| 세포 # | S(20,w)(Svedbergs) | 농도(mg/ml) |
| 1 | 3.10 | 0.186 |
| 2 | 3.23 | 0.544 |
| 3 | 3.24 | 1.848 |
결론
이러한 분석은 상기 실험조건에서 IA가 주로 육량체로 존재하고 있음을 보여준다. 이는 희석시 IA의 분리의 증거가 있고, 존재하는 육량체의 이합체인 것으로 보이는 것들의 적은 량이 있다. 연구된 농도는 약 30μM, 100μM, 300μM(단량체 유니트)이었다.
D.
CE
100-4
재료
추정된 스톡 농도(stock concentration)는 일 체적의 용액을 3체적의 공급 ECF로 희석한 후 0.936mg/ml이었다.
방법
원액을 사용하여, 분석에 사용된 4개의 세포들에 대한 희석방법은 아래 표 12에 나타나 있다.
| 세포 # | 원액 체적(㎕) | 완충액 체적(㎕) | 추정 농도(mg/ml) |
| 1 | 90 | 360 | 0.19 |
| 2 | 200 | 250 | 0.42 |
| 3 | 450 | -- | 0.94 |
결과
CE 100-4의 데이터 세트는 Sedfit와 그 c(s) 모델을 사용하여 분석되었다. 엄밀히 말하면, 이 모델은 비-상호작용 혼합물에 대하여 적용할 수 있을 뿐이고, 상호작용하는 종의 경우에는 어떤 종들이 용액에 존재하는 지에 대한 생각을 생기게 한다. 도 10d는 부하농도로 노르말화한 c(s)의 분포곡선 그래프를 보여준다. 상기 c(s) 그래프는 낮은 S값을 향하여 현저한 이동이 있다는 점에서 DcDt+로부터 얻은 g(s*)데이터와 일치한다. 가장 높은 농도에서 얻은 c(s) 그래프는 CE100-4가 육량체보다 더 클 수 있다는 것을 보여준다.
각 부하농도에 대한 무게평균 침전계수로 얻어지고 표준조건으로 수정된 값들이 아래 표 13에 도시되어 있다.
| 세포 # | S(20,w)(Svedbergs) | 농도(mg/ml) |
| 1 | 1.60 | 0.178 |
| 2 | 1.95 | 0.40 |
| 3 | 3.14 | 0.84 |
이러한 분석은 상기 실험조건에서 CE100-4가 단량체, 이량체, 육량체 및 가능한 가장 높은 농도의 더 큰 올리고머 사이에서 평형상태로 존재하는 것을 보여준다. 연구된 농도는 약 30μM, 70μM, 및 145μM(단량체 유니트)이었다.
HCl
로써
pH
2로 또는
NaOH
로써
pH
7로 조정된 물에서의 제어
다음 물리적 상수는 프로그램 Sedterp5을 사용하여 단백질의 아미노산 조성물로부터 계산되었다.
IC-pH7: MW seq=5792 Da, N20˚=0.726 ml/g
희석 밀도 및 점도는 20℃에서 Sedterp를 사용하여 각각 0.99823 g/ml와 0.01002 포아즈(poise)로 계산되었다.
내부 제어
IC
pH7
방법
pH 7의 NaOH와 함께 물을 분석에 사용된 4개의 세포의 희석제로 사용하는, 희석 방법은 아래 표 14에 나타나 있다.
| 세포 # | 원액 체적(㎕) | 완충액 체적(㎕) | 추정 농도(mg/ml) |
| 1 | 25 | 475 | 0.19 |
| 2 | 75 | 375 | 0.62 |
| 3 | 250 | 250 | 1.87 |
| 4 | 450 | -- | 3.745 |
연속적인 침전 계수 분포, c(s).
c(s) 분포 그래프는, 확산의 광역화효과가 마찰계수에 대한 평균값의 사용에 의해 제거되기 때문에, 다른 분석방법에 비하여 첨예하였다.
결과
IC-pH7의 데이터 세트는 Sedfit와 그 c(s) 모델을 사용하여 분석되었다. 엄밀히 말하면, 이 모델은 비-상호작용 혼합물에 대하여 적용할 수 있을 뿐이고, 상호작용하는 종의 경우에는 어떤 종들이 용액에 존재하는 지에 대한 생각을 생기게 한다. 도 11은 부하농도로 노르말화한 c(s)의 분포곡선 그래프를 보여준다. 상기 c(s) 그래프는 낮은 S값을 향하여 현저한 이동이 있다는 점에서 DcDt+로부터 얻은 g(s*)데이터와 일치한다. 가장 높은 농도에서 얻은 c(s) 그래프는 IC-pH7가 육량체보다 더 클 수 있다는 것을 보여준다.
각 부하농도에 대한 무게평균 침전계수로 얻어지고 표준조건으로 수정된 값들이 아래 표 15에 도시되어 있다.
| 세포 # | S(20,w)(Svedbergs) | 농도(mg/ml) |
| 1 | 2.43 | 0.18 |
| 2 | 2.90 | 0.57 |
| 3 | 3.04 | 1.74 |
| 4 | 3.10 | 3.52 |
상기 분석은 상기 실험조건에서 가장 낮은 희석에서 IC-pH7가 단량체-이량체의 평형상태로 존재하고, 여기에서 사용된 3개의 가장 높은 농도에서 육량체 상태를 선호하는 것을 보여준다. 연구된 농도는 약 30μM, 100μM, 305μM 및 620μM (단량체 유니트)이었다.
내부 제어
IC
pH
2
방법
인슐린은 위에서 설명한 바와 같이 0.01N HCl로 희석되었다.
결과
IC-pH2의 데이터 세트는 Sedfit와 그 c(s) 모델을 사용하여 주로 부하농도의 양호한 추정을 얻기 위하여 분석되었다. 각 부하농도에 대한 중량 평균 침전계수로서 얻어진 값들은 DcDt+로부터 얻은 값들가 상당히 일치한다. Sedfit를 사용하여 측정된 S20 W 값의 표 16는 아래에 도시된다.
| 세포 # | S(20,w)(Svedbergs) | 농도(mg/ml) |
| 1 | 1.26 | 0.17 |
| 2 | 1.28 | 0.56 |
| 3 | 1.28 | 1.77 |
| 4 | 1.28 | 3.61 |
상기 분석은 이러한 실험조건에서 가장 낮은 희석에서 IC-pH 2가 주로 단일의 종(추측컨대 인슐린 단량체)으로서 존재하고 있음을 보여주고, 상기 단일의 종은 자기-연합의 경향을 전혀 보여주지 않는다. 여기에서 사용된 3개의 가장 높은 농도에서 육량체 상태를 선호하는 것을 보여준다. 연구된 농도는 약 30μM, 97μM, 305μM 및 620μM (단량체 유니트)이었다.
전체 결론, 침전 분석
DcDt 소프트웨어를 이용한 RHI 분자량의 추정은 그 분자량이 전 희석범위에 걸쳐 육량체(35.6±1.6 kDa)와 일치함을 확인시켜 주었다. 단량체 인슐린(2.29nm)로서 표준인 pH 2의 인슐린은 희석 시리즈에 걸쳐 본질적으로 변하지 않는 1.28 S(20, w)의 침전 계수 값을 가지고, 이는 단량체 상태를 확인시켜준다. 관리 불안정의 pH 7의 인슐린은 전 농도에서 육량체이지만, pH 7의 희석제에서 희석시 크기 감소에 의해 입증된 바와 같이, 더 작은 이량체 형태로써 동적 평형상태에 있다. IA 및IL은 육량체 크기 범위에서 시작하여 ECF로 1:16으로 희석한 후 단량체/이량체 형태의 작은 집단을 가진다. CE 100-4를 가진 단량체/이량체 입자의 높은 비율은 더욱 급속 흡수 형태와 일치한다.
pH
7.4의 인슐린에 시트르산 나트륨 및
EDTA
을 첨가함으로써 인슐린 크기에 미치는 영향의 측정.
CES 100-4의 pH를 7로 상승시키는 것은 돼지 모델에서 급속한 흡수와 말번에 의한 크기 감소를 보여주므로, 시트르산 삼나트륨을 위한 시트르산의 대체가 pH 7.4로 작용하는지를 알기 위하여 다른 방법이 고안되었다.
재료 및 방법
EDTA 이나트륨(1.8 mg/ml)와 시트르산 나트륨(1.8 mg/ml)은 글리세린(22mg/ml)과 함께 물에 용해되었다. 농도 3.8 mg/ml의 용액에 인슐린이 첨가되었다. 수산화나트륨이 적하 첨가되어 pH를 7.4로 상승시켰다. 그리고나서 희석되지 않은 물질은 평균 입자크기를 위한 Malvern으로 분석되었고, 그리고나서 세포외 완충액(ECF)으로 희석되어 희석 시리즈에 따라 각 점에서 크기를 측정하였다.
결과
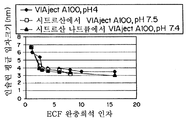
CSE 100-7, 스트르산 나트륨 인슐린 pH 7.4,는 ECF 완충액으로 희석되어 산성 및 중성 환경의 시트르산 제형과 비교하였다. 그 결과는 도 12에 나타나 있다. 도 12는 CE 100-7 pH 7.5 및 pH 7.4의 시트르산 대신 시트르산 나트륨을 함유한 CSE 100-7의 희석 함수로서, 인슐린 평균 입자크기(nm)에 대한 그래프이다.
그 결과는 급속히 분리되는 인슐린이 시트르산 나트륨, EDTA, 및 중성 pH의 용액의 인슐린을 혼합함으로써 생성될 수 있음을 입증한다. 평균 입자크기는 초기에는 전형적인 육량체보다 더 크고, 추정하건대 그 육량체가 분리되고 인슐린 분자의 연관된 다합체의 형태로 존재하는 것을 나타낸다. 주사 후 환경에서 1:2 희석시, 상기 인슐린은 급속히 작은 유닛, 가장 유사하게 인슐린 이량체로 된다. 새로운 제형은 정확하게 스트르산/EDTA 인슐린 제형으로 작용하고, 이 제형은 pH 4로 만들어져 pH 7로 된다.
당뇨병 소형 돼지의 시트르산
EDTA
인슐린
pH
7
재료와 방법
인슐린(3.8mg/ml), EDTA 이나트륨(1.8 mg/ml), 시트르산(1.8 mg/ml), 글리세린 및 m-크레졸(3mg/ml)을 혼합하여 인슐린이 제조되었고, HCl로써 pH를 4로 조정하였다. 그리고나서 상기 용액의 pH는 NaOH의 첨가에 의해 pH 7로 상승되었다. 이는, 최종 pH가 7.4에 도달하였을 때 정화되는 탁한 혼합물을 생성하는,인슐린의 등전위점을 통한 제형을 가져다 주었다. CE 100-7은 식사전 돼지에게 식이 인슐린으로 주어졌다.
6마리의 수컷 당뇨병 작은 돼지(30-50kg)에게 먼저 시험 인슐린 0.25IU가 투여되었고, 그리고나서 즉시 500kg의 표준 돼지 사료를 먹였다. 혈액 샘플은 식사전 -30, -20, -10, 0분, 그리고나서 투여후 5, 10, 15, 20, 30, 45, 60, 75, 90, 120, 150, 180, 240, 300, 360, 420, 480분에서 채취되었다. 2mL의 혈액이 경정맥 도관(jugular vein catheter)을 통하여 채취되었고, 그 경정맥 도관의 한 방울 적하가 표준 포도당 스트립방법을 사용한 포도당 측정조사를 위항 사용되었고, 나머지 샘플은 K2EDTA 로써 처리되었고 혈장 샘플은 다음 분석을 위하여 냉동되었다.
결과
pH 7 제형의 약물동태 형태는 도 13에 도시되어 있다. 이 급속 형태는 실시예 6에서의 당뇨병환자에게 보여지는 데이터와 일치한다. 시트르산과 EDTA를 함유한 산성 제형을 pH 7로 상승하는 것은 작은 당뇨병 돼지에게 잘 수행되었다. 이러한 pH 변경에 의해, 시트르산이 시트르산나트륨이 되었다. 그러므로, 산의 염 형태는 산과 마찬가지로 작용하여야 한다.
본 발명의 수정과 변형은 상기 상세한 설명으로부터 이 기술분야의 전문가에는 자명할 것이고, 첨부된 청구범위내에 속하게 될 것이다.
Claims (26)
- 인슐린, 용해제, 및 아연 킬레이트제를 포함한 인슐린 제형이고, 상기 제형은 생리적 pH를 가지며 투명한 수용액인 것을 특징으로 하는 인슐린 제형.
- 제1항에 있어서,
상기 킬레이트제는 에틸렌디아민테트라아세트산(EDTA), EGTA, 시트르산 삼나트륨(TSC), 알긴산, 알파 리포산, 디메르캡토숙신산(DMSA), CDTA(1,2-디아미노사이클로헥산테트라아세트산)으로 이루어진 그룹에서 선택되는 것을 특징으로 하는 인슐린 제형. - 제2항에 있어서,
상기 킬레이트제는 에틸렌디아민테트라아세트산(EDTA)인 것을 특징으로 하는 인슐린 제형. - 제1항에 있어서,
상기 용해제는 아세트산, 아스코르빈산, 시트르산, 글르타민산, 아스파르트산, 숙신산, 푸마르산, 말레산 및 지방산으로 이루어진 그룹에서 선택되는 산이거나, 그 염인 것을 특징으로 하는 인슐린 제형. - 제4항에 있어서,
상기 용해제는 시트르산 또는 시트르산 나트륨인 것을 특징으로 하는 인슈린 제형. - 제1항에 있어서,
상기 pH는 7 내지 7.5 사이에 있는 것을 특징으로 하는 인슐린 제형. - 제1항에 있어서,
상기 제형은 인슐린의 용액의 pH를 약 pH 4에서 생리적 pH로 상승시키는 것에 의해 제조되는 것을 특징으로 하는 인슐린 제형. - 제1항에 있어서,
상기 인슐린은, 인간 인슐린, 인슐린 유사체 및 그 조합으로 이루어진 그룹에서 선택되는 것을 특징으로 하는 인슐린 제형. - 제8항에 있어서,
상기 인슐린은 재조합 인간 인슐린인 것을 특징으로 하는 인슐린 제형. - 인슐린, 용해제, 및 아연 킬레이트제를 포함한 인슐린 제형이고, 상기 용해제는 염인 것을 특징으로 하는 인슐린 제형.
- 제10항에 있어서,
상기 킬레이트제는 에틸렌디아민테트라아세트산(EDTA), EGTA, 시트르산 삼나트륨(TSC), 알긴산, 알파 리포산, 디메르캡토숙신산(DMSA), CDTA(1,2-디아미노사이클로헥산테트라아세트산)으로 이루어진 그룹에서 선택되는 것을 특징으로 하는 인슐린 제형. - 제10항에 있어서,
상기 킬레이트제는 에틸렌디아민테트라아세트산(EDTA)인 것을 특징으로 하는 인슐린 제형. - 제10항에 있어서,
상기 용해제는, 아세트산, 아스코르빈산, 시트르산, 글르타민산, 아스파르트산, 숙신산, 푸마르산, 말레산 및 지방산, 및 1가 금속 또는 2가 금속으로 이루어진 그룹에서 선택되는 염인 것을 특징으로 하는 인슐린 제형. - 제13항에 있어서,
상기 용해제는 아스코르빈산 나트륨 또는 칼슘, 시트르산, 글루타민산, 아스파르트산, 숙신산, 푸마르산, 말레산 및 지방산으로 이루어진 그룹에서 선택되는 것을 특징으로 하는 인슐린 제형. - 제13항에 있어서,
상기 용해제는 시트르산 나트륨인 것을 특징으로 하는 인슐린 제형. - 제10항에 있어서,
상기 pH는 7 내지 7.5 사이에 있는 것을 특징으로 하는 인슐린 제형. - 제10항에 있어서,
상기 pH는 약 4인 것을 특징으로 하는 인슐린 제형. - 제10항에 있어서,
상기 인슐린은, 인간 인슐린, 인슐린 유사체 및 그 조합으로 이루어진 그룹에서 선택되는 것을 특징으로 하는 인슐린 제형. - 제10항에 있어서,
상기 인슐린은 상기 인슐린은 재조합 인간 인슐린인 것을 특징으로 하는 인슐린 제형. - 제1항에 있어서,
상기 인슐린은 제1용기안에 건조 분말로 제공되고, 킬레이트제 및 용해제중 적어도 하나는 희석제를 포함한 제2용기에 제공되는 것을 특징으로 하는 인슐린 제형. - 제10항에 있어서,
상기 인슐린은 제1용기안에 건조 분말로 제공되고, 상기 킬레이트제 및 용해제중 적어도 하나는 희석제를 포함하는 제2용기 안에 제공되는 것을 특징으로 하는 인슐린 제형. - 당뇨병 치료를 위하여 냉동 약학적으로 수용가능한 제형으로서 제공되는 제1항의 인슐린 제형.
- 당뇨병 치료를 위하여 냉동 약학적으로 수용가능한 제형으로서 제공되는 제10항의 인슐린 제형.
- 4℃의 투명한 수용액으로 제공되는 제1항의 인슐린 제형.
- 4℃의 투명한 수용액으로 제공되는 제10항의 인슐린 제형.
- 당뇨병 환자를 치료하는 방법이고, 주사가능한 인슐린 제형의 유효량을 주사하는 단계를 포함하고, 상기 주사가능한 인슐린 제형은, 인슐린과 용해제의 유효량 및 청구항 제1항에 한정된 아연 킬레이트제 및 HCl과 조합한 인슐린에 비하여 상피세포를 통한 인슐린 섭취 및 수송을 촉진하기 위한 아연 킬레이트제를 포함하는 것을 특징으로 하는 당뇨병 환자 치료방법.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US12/397,219 US9060927B2 (en) | 2009-03-03 | 2009-03-03 | Insulin formulations for rapid uptake |
| US12/397,219 | 2009-03-03 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20120006991A true KR20120006991A (ko) | 2012-01-19 |
Family
ID=42238758
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020117023159A KR20120006991A (ko) | 2009-03-03 | 2010-03-03 | 급속 섭취를 위한 인슐린 제형 |
Country Status (24)
| Country | Link |
|---|---|
| US (1) | US9060927B2 (ko) |
| EP (3) | EP3372238B1 (ko) |
| JP (1) | JP5794736B2 (ko) |
| KR (1) | KR20120006991A (ko) |
| CN (1) | CN102341119A (ko) |
| AU (1) | AU2010221397B2 (ko) |
| BR (1) | BRPI1012642A2 (ko) |
| CA (1) | CA2754251C (ko) |
| CY (2) | CY1120583T1 (ko) |
| DK (2) | DK3372238T3 (ko) |
| ES (2) | ES2845177T3 (ko) |
| HR (2) | HRP20181035T1 (ko) |
| HU (1) | HUE039333T2 (ko) |
| IL (1) | IL214699A (ko) |
| LT (2) | LT3372238T (ko) |
| MX (1) | MX2011009174A (ko) |
| NZ (1) | NZ595445A (ko) |
| PL (1) | PL2403520T3 (ko) |
| PT (1) | PT2403520T (ko) |
| RU (1) | RU2506945C2 (ko) |
| SG (1) | SG173858A1 (ko) |
| SI (2) | SI2403520T1 (ko) |
| TR (1) | TR201809817T4 (ko) |
| WO (1) | WO2010102020A1 (ko) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20140146209A (ko) * | 2012-04-16 | 2014-12-24 | 바이오델 아이엔씨 | 인슐린 및 인슐린 유사체의 약동학 및 약역학과 주사 통증을 조절하기 위한 마그네슘 조성물 |
| KR20160122145A (ko) * | 2014-01-13 | 2016-10-21 | 써멀린 다이어비티즈, 엘엘씨 | 초속효성 인슐린 제형 및 약제학적 전달 시스템 |
Families Citing this family (31)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9060927B2 (en) | 2009-03-03 | 2015-06-23 | Biodel Inc. | Insulin formulations for rapid uptake |
| FR2943538B1 (fr) * | 2009-03-27 | 2011-05-20 | Adocia | Formulation a action rapide d'insuline recombinante humaine |
| US9018190B2 (en) | 2009-03-27 | 2015-04-28 | Adocia | Functionalized oligosaccharides |
| US20120241356A1 (en) * | 2009-07-06 | 2012-09-27 | Sanofi-Aventis Deutschland Gmbh | Heat- and vibration-stable insulin preparations |
| CA2805031A1 (en) * | 2010-07-07 | 2012-01-12 | Biodel, Inc. | Compositions and methods for modulating the pharmacokinetics and pharmacodynamics of insulin |
| KR101810055B1 (ko) * | 2011-08-10 | 2017-12-18 | 아도시아 | 하나 이상의 유형의 기저 인슐린의 주사액 |
| US20130231281A1 (en) | 2011-11-02 | 2013-09-05 | Adocia | Rapid acting insulin formulation comprising an oligosaccharide |
| EA034393B1 (ru) | 2012-11-13 | 2020-02-03 | Адосиа | Состав инсулина быстрого действия, содержащий замещенное анионное соединение |
| WO2014169081A2 (en) | 2013-04-09 | 2014-10-16 | Biodel, Inc. | Methods and devices for point of use mixing of pharmaceutical formulations |
| FR3020947B1 (fr) | 2014-05-14 | 2018-08-31 | Adocia | Composition aqueuse comprenant au moins une proteine et un agent solubilisant, sa preparation et ses utilisations |
| US9795678B2 (en) | 2014-05-14 | 2017-10-24 | Adocia | Fast-acting insulin composition comprising a substituted anionic compound and a polyanionic compound |
| BR112017004544A2 (pt) * | 2014-10-06 | 2018-01-23 | Univ Case Western Reserve | insulina de cadeia simples, composição farmacêutica e método para tratar diabetes mellitus |
| AR102869A1 (es) * | 2014-12-16 | 2017-03-29 | Lilly Co Eli | Composiciones de insulina de rápida acción |
| JO3749B1 (ar) | 2015-08-27 | 2021-01-31 | Lilly Co Eli | تركيبات إنسولين سريعة المفعول |
| FR3043557B1 (fr) | 2015-11-16 | 2019-05-31 | Adocia | Composition a action rapide d'insuline comprenant un citrate substitue |
| GB201607918D0 (en) | 2016-05-06 | 2016-06-22 | Arecor Ltd | Novel formulations |
| CN107436311B (zh) * | 2016-05-25 | 2021-11-19 | 正大天晴药业集团股份有限公司 | 一种鉴别胰岛素单体或胰岛素多聚体的方法 |
| EP3518892B1 (en) | 2016-09-29 | 2023-06-21 | Arecor Limited | Pharmaceutical formulation comprising an insulin compound |
| US20180318426A1 (en) * | 2017-05-05 | 2018-11-08 | Merck Sharp & Dohme Corp. | Pharmaceutical formulations comprising insulin or insulin analogs conjugated to fucose for providing a basal pharmacodynamic profile |
| GB201707188D0 (en) | 2017-05-05 | 2017-06-21 | Arecor Ltd | Novel formulations |
| GB201707189D0 (en) * | 2017-05-05 | 2017-06-21 | Arecor Ltd | Novel formulations |
| GB201707187D0 (en) | 2017-05-05 | 2017-06-21 | Arecor Ltd | Novel formulations |
| EA201992351A1 (ru) | 2017-06-01 | 2020-03-26 | Эли Лилли Энд Компани | Быстродействующие композиции инсулина |
| US20200306444A1 (en) * | 2017-09-27 | 2020-10-01 | Becton, Dickinson And Company | Fluid delivery device with leak detection |
| US20210113763A1 (en) | 2018-04-04 | 2021-04-22 | Arecor Limited | Medical infusion pump system for the delivery of an insulin compound |
| WO2019193349A1 (en) | 2018-04-04 | 2019-10-10 | Arecor Limited | Medical infusion pump system for the delivery of an insulin compound |
| US20210038506A1 (en) | 2018-04-04 | 2021-02-11 | Arecor Limited | Medical infusion pump system for the delivery of an insulin compound |
| WO2019243627A1 (fr) | 2018-06-23 | 2019-12-26 | Adocia | Dispositif pour injecter une solution d'insuline(s) |
| FR3083985A1 (fr) | 2018-07-23 | 2020-01-24 | Adocia | Dispositif pour injecter une solution d'insuline(s) |
| FR3083984A1 (fr) | 2018-07-23 | 2020-01-24 | Adocia | Dispositif pour injecter une solution d'insuline(s) |
| GB202004814D0 (en) | 2020-04-01 | 2020-05-13 | Arecor Ltd | Novel formulations |
Family Cites Families (182)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2143590A (en) | 1936-09-26 | 1939-01-10 | Univ Alberta | Insulin preparation and process of producing crystals of insulin |
| US2626228A (en) | 1945-05-17 | 1953-01-20 | Novo Terapeutisk Labor As | Method of producing crystalline insulin |
| US2819999A (en) | 1953-11-13 | 1958-01-14 | Novo Terapeutisk Labor As | Process for crystallization of insulin using freeze dried insulin as seeding material |
| US3649456A (en) | 1969-09-08 | 1972-03-14 | Rohm & Haas | Separation of polypeptide substances with macroreticular resins |
| US3683635A (en) | 1970-12-07 | 1972-08-15 | Mario Campanelli | Freeze stabilized insulin |
| FR2224175B1 (ko) | 1973-04-04 | 1978-04-14 | Isf Spa | |
| GB1479283A (en) | 1973-07-23 | 1977-07-13 | Bespak Industries Ltd | Inhaler for powdered medicament |
| US4153689A (en) | 1975-06-13 | 1979-05-08 | Takeda Chemical Industries, Ltd. | Stable insulin preparation for nasal administration |
| DE2629568C3 (de) | 1976-07-01 | 1981-09-10 | Hoechst Ag, 6000 Frankfurt | Verfahren zur Reinigung von Insulin, seinen Analogen und Derivaten |
| US4211769A (en) | 1977-08-24 | 1980-07-08 | Takeda Chemical Industries, Ltd. | Preparations for vaginal administration |
| US4377482A (en) | 1978-04-28 | 1983-03-22 | Salk Institute For Biological Studies | Mobile phase for liquid chromatography |
| US4196196A (en) | 1978-06-19 | 1980-04-01 | Tiholiz Ivan C | Divalen/monovalent bipolar cation therapy for enhancement of tissue perfusion and reperfusion in disease states |
| US4272398A (en) | 1978-08-17 | 1981-06-09 | The United States Of America As Represented By The Secretary Of Agriculture | Microencapsulation process |
| JPS55138393A (en) | 1979-04-13 | 1980-10-29 | Shionogi & Co Ltd | Semisynthesis of insulin |
| JPS6034925B2 (ja) | 1979-07-31 | 1985-08-12 | 帝人株式会社 | 持続性鼻腔用製剤およびその製造法 |
| US4343898A (en) | 1980-02-11 | 1982-08-10 | Novo Industri A/S | Process for preparing esters of human insulin |
| DK147437A (en) | 1980-02-11 | 1900-01-01 | Process for preparing human insulin or threonine B30 esters of human insulin, or a salt or complex thereof | |
| US4364385A (en) | 1981-03-13 | 1982-12-21 | Lossef Steven V | Insulin delivery device |
| ATE23272T1 (de) | 1981-07-08 | 1986-11-15 | Draco Ab | Pulverinhalator. |
| JPS58501125A (ja) | 1981-07-17 | 1983-07-14 | ノルデイスク・インスリンラボラトリウム | 安定な水性治療性インシユリン製剤及びその製造方法 |
| US5260306A (en) | 1981-07-24 | 1993-11-09 | Fisons Plc | Inhalation pharmaceuticals |
| DK353781A (da) | 1981-08-10 | 1983-02-11 | Novo Industri As | Fremgangsmaade til fremstilling af insulinderivater |
| KR890000664B1 (ko) | 1981-10-19 | 1989-03-22 | 바리 안소니 뉴우샘 | 미분된 베클로메타손 디프로피오네이트 일수화물의 제조방법 |
| FI78616C (fi) | 1982-02-05 | 1989-09-11 | Novo Industri As | Foerfarande foer framstaellning av en foer infusionsaendamaol avsedd stabiliserad insulinloesning, som har en foerhoejd zinkhalt. |
| US4459226A (en) | 1982-02-26 | 1984-07-10 | Eli Lilly And Company | Process for recovering insulin |
| US4659696A (en) | 1982-04-30 | 1987-04-21 | Takeda Chemical Industries, Ltd. | Pharmaceutical composition and its nasal or vaginal use |
| JPS59163313A (ja) | 1983-03-09 | 1984-09-14 | Teijin Ltd | 経鼻投与用ペプチドホルモン類組成物 |
| WO1995013796A1 (en) | 1993-11-16 | 1995-05-26 | Depotech Corporation | Vesicles with controlled release of actives |
| US4946828A (en) | 1985-03-12 | 1990-08-07 | Novo Nordisk A/S | Novel insulin peptides |
| US5785989A (en) | 1985-05-01 | 1998-07-28 | University Utah Research Foundation | Compositions and methods of manufacturing of oral dissolvable medicaments |
| PT83613B (en) | 1985-10-28 | 1988-11-21 | Lilly Co Eli | Process for the selective chemical removal of a protein amino-terminal residue |
| SE453566B (sv) | 1986-03-07 | 1988-02-15 | Draco Ab | Anordning vid pulverinhalatorer |
| JPS6320301A (ja) | 1986-07-11 | 1988-01-28 | Dainichi Color & Chem Mfg Co Ltd | キトサン微小粒体 |
| US5042975A (en) | 1986-07-25 | 1991-08-27 | Rutgers, The State University Of New Jersey | Iontotherapeutic device and process and iontotherapeutic unit dose |
| AU612591B2 (en) | 1986-08-11 | 1991-07-18 | Innovata Biomed Limited | Pharmaceutical formulations comprising microcapsules |
| US4925673A (en) * | 1986-08-18 | 1990-05-15 | Clinical Technologies Associates, Inc. | Delivery systems for pharmacological agents encapsulated with proteinoids |
| USRE35862E (en) | 1986-08-18 | 1998-07-28 | Emisphere Technologies, Inc. | Delivery systems for pharmacological agents encapsulated with proteinoids |
| DE3779221D1 (de) | 1986-08-19 | 1992-06-25 | Genentech Inc | Einrichtung und dispersion zum intrapulmonalen eingeben von polypeptidwuchsstoffen und -zytokinen. |
| NO162160C (no) | 1987-01-09 | 1989-11-15 | Medi Cult As | Serumfritt vekstmedium, samt anvendelse derav. |
| US4861627A (en) | 1987-05-01 | 1989-08-29 | Massachusetts Institute Of Technology | Preparation of multiwall polymeric microcapsules |
| GB8723846D0 (en) | 1987-10-10 | 1987-11-11 | Danbiosyst Ltd | Bioadhesive microsphere drug delivery system |
| EP0360340A1 (en) | 1988-09-19 | 1990-03-28 | Akzo N.V. | Composition for nasal administration containing a peptide |
| JPH02104531A (ja) | 1988-10-14 | 1990-04-17 | Toyo Jozo Co Ltd | 経鼻投与用生理活性ペプチド組成物 |
| US5006343A (en) | 1988-12-29 | 1991-04-09 | Benson Bradley J | Pulmonary administration of pharmaceutically active substances |
| US5514646A (en) | 1989-02-09 | 1996-05-07 | Chance; Ronald E. | Insulin analogs modified at position 29 of the B chain |
| ES2062530T3 (es) | 1989-05-01 | 1994-12-16 | Alkermes Inc | Procedimiento para producir particulas pequeñas de moleculas biologicamente activas. |
| GB8921222D0 (en) | 1989-09-20 | 1989-11-08 | Riker Laboratories Inc | Medicinal aerosol formulations |
| US5188837A (en) | 1989-11-13 | 1993-02-23 | Nova Pharmaceutical Corporation | Lipsopheres for controlled delivery of substances |
| DE3942145A1 (de) | 1989-12-20 | 1991-06-27 | Boehringer Mannheim Gmbh | T-pa-solubilisierung |
| GB9001635D0 (en) | 1990-01-24 | 1990-03-21 | Ganderton David | Aerosol carriers |
| AU7908791A (en) | 1990-05-08 | 1991-11-27 | Liposome Technology, Inc. | Direct spray-dried drug/lipid powder composition |
| US5693338A (en) | 1994-09-29 | 1997-12-02 | Emisphere Technologies, Inc. | Diketopiperazine-based delivery systems |
| US6331318B1 (en) | 1994-09-30 | 2001-12-18 | Emisphere Technologies Inc. | Carbon-substituted diketopiperazine delivery systems |
| SE9002895D0 (sv) | 1990-09-12 | 1990-09-12 | Astra Ab | Inhalation devices for dispensing powders i |
| IL99699A (en) | 1990-10-10 | 2002-04-21 | Autoimmune Inc | Drug with the option of oral, intra-intestinal, or inhaled dosing for suppression of autoimmune response associated with type I diabetes |
| GB9024760D0 (en) | 1990-11-14 | 1991-01-02 | Riker Laboratories Inc | Inhalation device and medicament carrier |
| US5145684A (en) | 1991-01-25 | 1992-09-08 | Sterling Drug Inc. | Surface modified drug nanoparticles |
| WO1992014449A1 (en) | 1991-02-20 | 1992-09-03 | Nova Pharmaceutical Corporation | Controlled release microparticulate delivery system for proteins |
| US5492112A (en) | 1991-05-20 | 1996-02-20 | Dura Pharmaceuticals, Inc. | Dry powder inhaler |
| CA2070061C (en) | 1991-06-07 | 2004-02-10 | Shigeyuki Takama | Physiologically active polypeptide-containing pharmaceutical composition |
| ATE189124T1 (de) | 1991-07-02 | 2000-02-15 | Inhale Inc | Verfahren und vorrichtung zum abgeben von medikamenten in aerosolform |
| GB9116610D0 (en) | 1991-08-01 | 1991-09-18 | Danbiosyst Uk | Preparation of microparticles |
| US6063910A (en) | 1991-11-14 | 2000-05-16 | The Trustees Of Princeton University | Preparation of protein microparticles by supercritical fluid precipitation |
| US5329976A (en) | 1991-12-09 | 1994-07-19 | Habley Medical Technology Corporation | Syringe-filling and medication mixing dispenser |
| JP3121080B2 (ja) | 1991-12-19 | 2000-12-25 | アール・ピー・シーラー コーポレイション | カプセル封入用溶液 |
| EP0621774B1 (en) | 1992-01-21 | 1996-12-18 | Sri International | Improved process for preparing micronized polypeptide drugs |
| EP0558879B1 (en) | 1992-03-04 | 1997-05-14 | Astra Aktiebolag | Disposable inhaler |
| US5352461A (en) | 1992-03-11 | 1994-10-04 | Pharmaceutical Discovery Corporation | Self assembling diketopiperazine drug delivery system |
| EP0606486B1 (en) | 1992-06-12 | 2001-08-29 | Teijin Limited | Pharmaceutical preparation for intra-airway administration |
| GB9213874D0 (en) | 1992-06-30 | 1992-08-12 | Fisons Plc | Process to novel medicament form |
| US6582728B1 (en) | 1992-07-08 | 2003-06-24 | Inhale Therapeutic Systems, Inc. | Spray drying of macromolecules to produce inhaleable dry powders |
| US5785049A (en) | 1994-09-21 | 1998-07-28 | Inhale Therapeutic Systems | Method and apparatus for dispersion of dry powder medicaments |
| SK51695A3 (en) | 1992-10-19 | 1995-11-08 | Dura Pharma Inc | Dry powder medicament inhaler |
| US5364838A (en) | 1993-01-29 | 1994-11-15 | Miris Medical Corporation | Method of administration of insulin |
| US5888477A (en) | 1993-01-29 | 1999-03-30 | Aradigm Corporation | Use of monomeric insulin as a means for improving the bioavailability of inhaled insulin |
| TW402506B (en) | 1993-06-24 | 2000-08-21 | Astra Ab | Therapeutic preparation for inhalation |
| IS1796B (is) | 1993-06-24 | 2001-12-31 | Ab Astra | Fjölpeptíð lyfjablanda til innöndunar sem einnig inniheldur eykjaefnasamband |
| US5747445A (en) | 1993-06-24 | 1998-05-05 | Astra Aktiebolag | Therapeutic preparation for inhalation |
| US5562909A (en) | 1993-07-12 | 1996-10-08 | Massachusetts Institute Of Technology | Phosphazene polyelectrolytes as immunoadjuvants |
| AU7966694A (en) | 1993-07-21 | 1996-05-02 | University Of Kentucky Research Foundation, The | A multicompartment hard capsule with control release properties |
| US5534488A (en) | 1993-08-13 | 1996-07-09 | Eli Lilly And Company | Insulin formulation |
| AU682061B2 (en) | 1993-09-17 | 1997-09-18 | Novo Nordisk A/S | Acylated insulin |
| GB9322014D0 (en) | 1993-10-26 | 1993-12-15 | Co Ordinated Drug Dev | Improvements in and relating to carrier particles for use in dry powder inhalers |
| EP0655237A1 (de) | 1993-11-27 | 1995-05-31 | Hoechst Aktiengesellschaft | Medizinische Aerosolformulierung |
| US5484606A (en) | 1994-01-24 | 1996-01-16 | The Procter & Gamble Company | Process for reducing the precipitation of difficulty soluble pharmaceutical actives |
| HUT75676A (en) | 1994-03-07 | 1997-05-28 | Inhale Therapeutic Syst | Methods and compositions for pulmonary delivery of insulin |
| US6051256A (en) | 1994-03-07 | 2000-04-18 | Inhale Therapeutic Systems | Dispersible macromolecule compositions and methods for their preparation and use |
| US6395744B1 (en) | 1994-04-22 | 2002-05-28 | Queen's University At Kingston | Method and compositions for the treatment or amelioration of female sexual dysfunction |
| AU2517095A (en) | 1994-05-19 | 1995-12-18 | R.P. Scherer International Corporation | Solutions of aryl or heteroaryl substituted alkanoic acids in lipophilic solvents and soft gelatin capsules containing such solutions |
| IL110024A (en) | 1994-06-15 | 1998-04-05 | Yissum Res Dev Co | Controlled release oral drug delivery system containing hydrogel- forming polymer |
| US5461031A (en) | 1994-06-16 | 1995-10-24 | Eli Lilly And Company | Monomeric insulin analog formulations |
| US5474978A (en) | 1994-06-16 | 1995-12-12 | Eli Lilly And Company | Insulin analog formulations |
| US5547929A (en) | 1994-09-12 | 1996-08-20 | Eli Lilly And Company | Insulin analog formulations |
| AU691361B2 (en) | 1994-12-01 | 1998-05-14 | Toyama Chemical Co. Ltd. | Novel 2,3-diketopiperazine derivative or salt thereof |
| US5901703A (en) | 1995-02-06 | 1999-05-11 | Unisia Jecs Corporation | Medicine administering device for nasal cavities |
| US5653961A (en) | 1995-03-31 | 1997-08-05 | Minnesota Mining And Manufacturing Company | Butixocort aerosol formulations in hydrofluorocarbon propellant |
| US6258341B1 (en) | 1995-04-14 | 2001-07-10 | Inhale Therapeutic Systems, Inc. | Stable glassy state powder formulations |
| US6428771B1 (en) | 1995-05-15 | 2002-08-06 | Pharmaceutical Discovery Corporation | Method for drug delivery to the pulmonary system |
| US5653987A (en) | 1995-05-16 | 1997-08-05 | Modi; Pankaj | Liquid formulations for proteinic pharmaceuticals |
| US5766620A (en) | 1995-10-23 | 1998-06-16 | Theratech, Inc. | Buccal delivery of glucagon-like insulinotropic peptides |
| US5849322A (en) | 1995-10-23 | 1998-12-15 | Theratech, Inc. | Compositions and methods for buccal delivery of pharmaceutical agents |
| JP4307550B2 (ja) * | 1995-11-13 | 2009-08-05 | メドトロニック ミニメッド、 インコーポレイティド | 単量体状タンパク質の送達のための方法及び組成物 |
| DE19545257A1 (de) | 1995-11-24 | 1997-06-19 | Schering Ag | Verfahren zur Herstellung von morphologisch einheitlichen Mikrokapseln sowie nach diesem Verfahren hergestellte Mikrokapseln |
| FR2746035B1 (fr) * | 1996-03-15 | 1998-06-12 | Microparticules de gel composite susceptibles d'etre utilisees comme vecteur(s) de principe(s) actif(s), l'un de leurs procedes de preparation et leurs applications | |
| US5912014A (en) | 1996-03-15 | 1999-06-15 | Unigene Laboratories, Inc. | Oral salmon calcitonin pharmaceutical products |
| US5985309A (en) | 1996-05-24 | 1999-11-16 | Massachusetts Institute Of Technology | Preparation of particles for inhalation |
| US5874064A (en) | 1996-05-24 | 1999-02-23 | Massachusetts Institute Of Technology | Aerodynamically light particles for pulmonary drug delivery |
| USRE37053E1 (en) | 1996-05-24 | 2001-02-13 | Massachusetts Institute Of Technology | Particles incorporating surfactants for pulmonary drug delivery |
| US6503480B1 (en) | 1997-05-23 | 2003-01-07 | Massachusetts Institute Of Technology | Aerodynamically light particles for pulmonary drug delivery |
| US6254854B1 (en) | 1996-05-24 | 2001-07-03 | The Penn Research Foundation | Porous particles for deep lung delivery |
| AUPO066096A0 (en) | 1996-06-26 | 1996-07-18 | Peptide Delivery Systems Pty Ltd | Oral delivery of peptides |
| US5783556A (en) * | 1996-08-13 | 1998-07-21 | Genentech, Inc. | Formulated insulin-containing composition |
| US7312196B2 (en) | 1997-01-08 | 2007-12-25 | Amylin Pharmaceuticals, Inc. | Formulations for amylin agonist peptides |
| US6410511B2 (en) | 1997-01-08 | 2002-06-25 | Amylin Pharmaceuticals, Inc. | Formulations for amylin agonist peptides |
| EP0969860B1 (en) | 1997-03-20 | 2002-07-17 | Novo Nordisk A/S | Method for preparation of a therapeutic powder through coprecipitation of insulin and absorption enhancer |
| US5898028A (en) | 1997-03-20 | 1999-04-27 | Novo Nordisk A/S | Method for producing powder formulation comprising an insulin |
| US6310038B1 (en) | 1997-03-20 | 2001-10-30 | Novo Nordisk A/S | Pulmonary insulin crystals |
| EP0971729B1 (en) | 1997-03-20 | 2002-07-03 | Novo Nordisk A/S | Therapeutic powder formulation for pulmonary administration, containing crystalline insulin |
| JP3764174B2 (ja) | 1997-03-20 | 2006-04-05 | ノボ ノルディスク アクティーゼルスカブ | 肺用組成物において使用するための亜鉛非含有のインスリン結晶 |
| WO1999009997A1 (en) | 1997-08-26 | 1999-03-04 | Board Of Regents, The University Of Texas System | Edta and other chelators with or without antifungal antimicrobial agents for the prevention and treatment of fungal infections |
| JP2001517689A (ja) | 1997-10-01 | 2001-10-09 | フレミントン ファーマシューティカル コーポレイション | 極性または非極性の、バッカルスプレーまたはカプセル |
| DE69924232D1 (de) | 1998-01-09 | 2005-04-21 | Novo Nordisk As | Stabilisierte insulin-zubereitungen |
| AU3421099A (en) | 1998-04-09 | 1999-11-01 | Axiva Gmbh | Particulate active agent support for pulmonary application |
| US6552024B1 (en) | 1999-01-21 | 2003-04-22 | Lavipharm Laboratories Inc. | Compositions and methods for mucosal delivery |
| US6248363B1 (en) | 1999-11-23 | 2001-06-19 | Lipocine, Inc. | Solid carriers for improved delivery of active ingredients in pharmaceutical compositions |
| AU773556B2 (en) | 1999-04-05 | 2004-05-27 | Mannkind Corporation | Methods for fine powder formation |
| US7169889B1 (en) | 1999-06-19 | 2007-01-30 | Biocon Limited | Insulin prodrugs hydrolyzable in vivo to yield peglylated insulin |
| EP2280021B1 (en) | 1999-06-29 | 2016-02-17 | MannKind Corporation | Pharmaceutical formulations comprising insulin complexed with a diketopiperazine |
| AU779693B2 (en) | 1999-07-23 | 2005-02-03 | Mannkind Corporation | Unit dose capsules and dry powder inhaler |
| US7464706B2 (en) | 1999-07-23 | 2008-12-16 | Mannkind Corporation | Unit dose cartridge and dry powder inhaler |
| US6264981B1 (en) | 1999-10-27 | 2001-07-24 | Anesta Corporation | Oral transmucosal drug dosage using solid solution |
| IL149085A0 (en) | 1999-10-29 | 2002-11-10 | Inhale Therapeutic Syst | A dry powder composition containing a di or tripeptide |
| US6465425B1 (en) | 2000-02-10 | 2002-10-15 | Alkermes Controlled Therapeutics, Inc. | Microencapsulation and sustained release of biologically active acid-stable or free sulfhydryl-containing proteins |
| EP1941868A3 (en) | 2000-02-28 | 2011-06-29 | PharmaKodex Limited | Improvements in or relating to the delivery of oral drugs |
| US6432383B1 (en) | 2000-03-30 | 2002-08-13 | Generex Pharmaceuticals Incorporated | Method for administering insulin |
| US7316999B2 (en) | 2000-06-02 | 2008-01-08 | Novo Nordisk A/S | Glucose dependent release of insulin from glucose sensing insulin derivatives |
| CN1141974C (zh) | 2000-06-07 | 2004-03-17 | 张昊 | 结肠定位释放的口服生物制剂 |
| JP5048201B2 (ja) | 2000-08-04 | 2012-10-17 | ディーエムアイ バイオサイエンシズ インコーポレイテッド | ジケトピペラジン類の使用方法とジケトピペラジン類を含む組成物 |
| JP4147234B2 (ja) | 2004-09-27 | 2008-09-10 | キヤノン株式会社 | 吐出用液体、吐出方法、カートリッジ及び吐出装置 |
| DE10114178A1 (de) * | 2001-03-23 | 2002-10-10 | Aventis Pharma Gmbh | Zinkfreie und zinkarme Insulinzubereitungen mit verbesserter Stabilität |
| JP2005508220A (ja) | 2001-10-24 | 2005-03-31 | パーリ・ゲーエムベーハー | 薬用組成物調製用具 |
| US20030198666A1 (en) | 2002-01-07 | 2003-10-23 | Richat Abbas | Oral insulin therapy |
| US20030143195A1 (en) | 2002-01-30 | 2003-07-31 | Pinsker Judy Senior | Use of histamine as a drug delivery enhancing compound for use in transmucosal or transdermal delivery |
| US7255102B2 (en) | 2002-02-01 | 2007-08-14 | Generex Pharmaceuticals Inc. | Metered dose spray device for use with macromolecular pharmaceutical agents such as insulin |
| EP1490031A1 (en) | 2002-03-07 | 2004-12-29 | Vectura Limited | Fast melt multiparticulate formulations for oral delivery |
| US20030194420A1 (en) | 2002-04-11 | 2003-10-16 | Richard Holl | Process for loading a drug delivery device |
| WO2003094951A1 (en) | 2002-05-07 | 2003-11-20 | Novo Nordisk A/S | Soluble formulations comprising insulin aspart and insulin detemir |
| DE10227232A1 (de) | 2002-06-18 | 2004-01-15 | Aventis Pharma Deutschland Gmbh | Saure Insulinzubereitungen mit verbesserter Stabilität |
| DE10235168A1 (de) | 2002-08-01 | 2004-02-12 | Aventis Pharma Deutschland Gmbh | Verfahren zur Reinigung von Preproinsulin |
| JP2006512409A (ja) | 2002-10-31 | 2006-04-13 | ユーエムディー, インコーポレイテッド | 薬物送達用治療組成物で被覆上皮に対するもの及びそれを介するもの |
| WO2004056314A2 (en) | 2002-12-17 | 2004-07-08 | Nastech Pharmaceutical Company Inc. | Compositions and methods for enhanced mucosal delivery of y2 receptor-binding peptides and methods for treating and preventing obesity |
| JP2006514119A (ja) | 2003-02-12 | 2006-04-27 | アール アンド ピー コリア カンパニー リミテッド | 溶解率が向上した難溶性薬剤の溶媒系 |
| US20040171518A1 (en) | 2003-02-27 | 2004-09-02 | Medtronic Minimed, Inc. | Compounds for protein stabilization and methods for their use |
| CA2518216C (en) | 2003-03-06 | 2017-05-09 | Emisphere Technologies, Inc. | Oral insulin therapies and protocol |
| US20050203001A1 (en) | 2004-03-05 | 2005-09-15 | Emisphere Technologies, Inc. | Oral insulin therapies and protocol |
| KR101241862B1 (ko) * | 2003-09-19 | 2013-03-13 | 노보 노르디스크 에이/에스 | 신규 glp-1 유도체 |
| WO2005067898A2 (en) | 2004-01-07 | 2005-07-28 | Nektar Therapeutics | Improved sustained release compositions for pulmonary administration of insulin |
| CA2552707C (en) | 2004-01-12 | 2018-03-27 | Mannkind Corporation | A method of reducing serum proinsulin levels in type 2 diabetics |
| WO2005086814A2 (en) | 2004-03-09 | 2005-09-22 | The Uab Research Foundation | Methods and compositions related to regulation of cytokine production by glycogen synthase kinase 3 (gsk-3) |
| PT2319500E (pt) | 2004-03-12 | 2013-01-23 | Biodel Inc | Composições de distribuição de fármacos de actuação rápida |
| US20080090753A1 (en) | 2004-03-12 | 2008-04-17 | Biodel, Inc. | Rapid Acting Injectable Insulin Compositions |
| US20080096800A1 (en) | 2004-03-12 | 2008-04-24 | Biodel, Inc. | Rapid mucosal gel or film insulin compositions |
| US20080085298A1 (en) | 2004-03-12 | 2008-04-10 | Biodel, Inc. | Rapid Mucosal Gel or Film Insulin Compositions |
| WO2006088473A2 (en) | 2004-04-23 | 2006-08-24 | Panduranga Rao Koritala | Microcapsules and nanocapsules for the transmucosal delivery of therapeutic and diagnostic agents |
| US7964012B2 (en) * | 2005-08-03 | 2011-06-21 | Hollingsworth & Vose Company | Filter media with improved conductivity |
| US7713929B2 (en) * | 2006-04-12 | 2010-05-11 | Biodel Inc. | Rapid acting and long acting insulin combination formulations |
| US8084420B2 (en) | 2005-09-29 | 2011-12-27 | Biodel Inc. | Rapid acting and long acting insulin combination formulations |
| US20070086952A1 (en) | 2005-09-29 | 2007-04-19 | Biodel, Inc. | Rapid Acting and Prolonged Acting Inhalable Insulin Preparations |
| WO2007047948A2 (en) | 2005-10-20 | 2007-04-26 | Nastech Pharmaceutical Company Inc. | Intranasal administration of rapid acting insulin |
| WO2007059569A1 (en) * | 2005-11-22 | 2007-05-31 | Dia-B Tech Limited | Compositions and methods for treatment of diabetes |
| US8093207B2 (en) | 2005-12-09 | 2012-01-10 | Unigene Laboratories, Inc. | Fast-acting oral peptide pharmaceutical products |
| FR2896164B1 (fr) * | 2006-01-18 | 2008-07-04 | Flamel Technologies Sa | Formulation colloidale d'insuline longue action et sa preparation |
| AU2007238114B2 (en) | 2006-04-12 | 2010-10-14 | Biodel, Inc. | Rapid acting and long acting insulin combination formulations |
| US8084022B2 (en) | 2006-06-23 | 2011-12-27 | Aegis Therapeutics, Llc | Stabilizing alkylglycoside compositions and methods thereof |
| WO2008013955A2 (en) | 2006-07-27 | 2008-01-31 | Nektar Therapeutics | Sustained release formulations for pulmonary delivery |
| CA2660029A1 (en) | 2006-08-04 | 2008-02-07 | Nastech Pharmaceutical Company Inc. | Compositions for intranasal delivery of human insulin and uses thereof |
| GB0700523D0 (en) | 2007-01-11 | 2007-02-21 | Insense Ltd | The Stabilisation Of Proteins |
| ES2744384T3 (es) | 2007-06-13 | 2020-02-24 | Novo Nordisk As | Formulación farmacéutica que comprende un derivado de insulina |
| US20090175840A1 (en) | 2008-01-04 | 2009-07-09 | Biodel, Inc. | Insulin formulations for insulin release as a function of tissue glucose levels |
| TWI394580B (zh) | 2008-04-28 | 2013-05-01 | Halozyme Inc | 超快起作用胰島素組成物 |
| US9060927B2 (en) | 2009-03-03 | 2015-06-23 | Biodel Inc. | Insulin formulations for rapid uptake |
| RU2533217C3 (ru) | 2009-06-26 | 2020-12-21 | Ново Нордиск А/С | Препарат, содержащий инсулин, никотинамид и аминокислоту |
-
2009
- 2009-03-03 US US12/397,219 patent/US9060927B2/en active Active
-
2010
- 2010-03-03 TR TR2018/09817T patent/TR201809817T4/tr unknown
- 2010-03-03 SI SI201031716T patent/SI2403520T1/sl unknown
- 2010-03-03 ES ES18155633T patent/ES2845177T3/es active Active
- 2010-03-03 LT LTEP18155633.3T patent/LT3372238T/lt unknown
- 2010-03-03 HU HUE10713742A patent/HUE039333T2/hu unknown
- 2010-03-03 AU AU2010221397A patent/AU2010221397B2/en not_active Ceased
- 2010-03-03 SI SI201032043T patent/SI3372238T1/sl unknown
- 2010-03-03 CA CA2754251A patent/CA2754251C/en active Active
- 2010-03-03 DK DK18155633.3T patent/DK3372238T3/da active
- 2010-03-03 EP EP18155633.3A patent/EP3372238B1/en active Active
- 2010-03-03 WO PCT/US2010/026073 patent/WO2010102020A1/en active Application Filing
- 2010-03-03 RU RU2011139984/15A patent/RU2506945C2/ru not_active IP Right Cessation
- 2010-03-03 EP EP10713742.4A patent/EP2403520B1/en not_active Revoked
- 2010-03-03 CN CN2010800104301A patent/CN102341119A/zh active Pending
- 2010-03-03 BR BRPI1012642A patent/BRPI1012642A2/pt not_active IP Right Cessation
- 2010-03-03 ES ES10713742.4T patent/ES2680903T3/es active Active
- 2010-03-03 JP JP2011553081A patent/JP5794736B2/ja active Active
- 2010-03-03 PT PT107137424T patent/PT2403520T/pt unknown
- 2010-03-03 PL PL10713742T patent/PL2403520T3/pl unknown
- 2010-03-03 MX MX2011009174A patent/MX2011009174A/es active IP Right Grant
- 2010-03-03 EP EP20208197.2A patent/EP3811968A1/en not_active Withdrawn
- 2010-03-03 SG SG2011061561A patent/SG173858A1/en unknown
- 2010-03-03 LT LTEP10713742.4T patent/LT2403520T/lt unknown
- 2010-03-03 KR KR1020117023159A patent/KR20120006991A/ko not_active Application Discontinuation
- 2010-03-03 DK DK10713742.4T patent/DK2403520T3/en active
- 2010-03-03 NZ NZ595445A patent/NZ595445A/xx not_active IP Right Cessation
-
2011
- 2011-08-16 IL IL214699A patent/IL214699A/en not_active IP Right Cessation
-
2018
- 2018-07-05 HR HRP20181035TT patent/HRP20181035T1/hr unknown
- 2018-07-24 CY CY20181100771T patent/CY1120583T1/el unknown
-
2020
- 2020-12-02 CY CY20201101141T patent/CY1123597T1/el unknown
- 2020-12-08 HR HRP20201969TT patent/HRP20201969T1/hr unknown
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20140146209A (ko) * | 2012-04-16 | 2014-12-24 | 바이오델 아이엔씨 | 인슐린 및 인슐린 유사체의 약동학 및 약역학과 주사 통증을 조절하기 위한 마그네슘 조성물 |
| KR20160122145A (ko) * | 2014-01-13 | 2016-10-21 | 써멀린 다이어비티즈, 엘엘씨 | 초속효성 인슐린 제형 및 약제학적 전달 시스템 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20120006991A (ko) | 급속 섭취를 위한 인슐린 제형 | |
| JP6422855B2 (ja) | インスリンおよびインスリン類似体の薬物動態及び薬力学、ならびに注射部位の疼痛を調節するためのマグネシウム組成物 | |
| US8933023B2 (en) | Rapid acting injectable insulin compositions | |
| US20150273022A1 (en) | Stabilized ultra-rapid-acting insulin formulations | |
| AU2013249495A1 (en) | Magnesium compositions for modulating the pharmacokinetics and pharmacodynamics of insulin and insulin analogs, and injection site pain | |
| EP2590667A1 (en) | Compositions and methods for modulating the pharmacokinetics and pharmacodynamics of insulin | |
| JP2016531847A (ja) | 医薬組成物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |