KR101396095B1 - 피롤로벤조디아제핀 - Google Patents
피롤로벤조디아제핀 Download PDFInfo
- Publication number
- KR101396095B1 KR101396095B1 KR1020077027047A KR20077027047A KR101396095B1 KR 101396095 B1 KR101396095 B1 KR 101396095B1 KR 1020077027047 A KR1020077027047 A KR 1020077027047A KR 20077027047 A KR20077027047 A KR 20077027047A KR 101396095 B1 KR101396095 B1 KR 101396095B1
- Authority
- KR
- South Korea
- Prior art keywords
- group
- mmol
- etoac
- alkyl
- bis
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D519/00—Heterocyclic compounds containing more than one system of two or more relevant hetero rings condensed among themselves or condensed with a common carbocyclic ring system not provided for in groups C07D453/00 or C07D455/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/55—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole
- A61K31/551—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole having two nitrogen atoms, e.g. dilazep
- A61K31/5513—1,4-Benzodiazepines, e.g. diazepam or clozapine
- A61K31/5517—1,4-Benzodiazepines, e.g. diazepam or clozapine condensed with five-membered rings having nitrogen as a ring hetero atom, e.g. imidazobenzodiazepines, triazolam
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/04—Drugs for skeletal disorders for non-specific disorders of the connective tissue
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Physical Education & Sports Medicine (AREA)
- Epidemiology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Dermatology (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Oncology (AREA)
- Hematology (AREA)
- Rheumatology (AREA)
- Vascular Medicine (AREA)
- Biomedical Technology (AREA)
- Urology & Nephrology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
- Hydrogenated Pyridines (AREA)
Abstract
본 발명은 하기 화학식(I)을 갖는 화합물, 또는 그의 용매화물에 관한 것이다:
상기 식에서,
R2는 임의로 치환된 C5-20 아릴기이고;
R6 및 R9는 독립적으로 H, R, OH, OR, SH, SR, NH2, NHR, NRR', 니트로, Me3Sn 및 할로로부터 선택되고; 여기에서, R 및 R'는 독립적으로 임의로 치환된 C1-12 알킬, C3-2O 헤테로사이클릴 및 C5-2O 아릴 기로부터 선택되고;
R7은 H, R, OH, OR, SH, SR, NH2, NHR, NHRR', 니트로, Me3Sn 및 할로로부터 선택되고;
R"는 C3-12 알킬렌기로서 그 쇄에 하나 이상의 헤테로원자 및/또는 방향족 환이 개재할 수 있고,
X는 독립적으로 0, S 또는 NH로부터 선택되고;
z는 2 또는 3이고;
M은 1가의 약제학적으로 허용가능한 양이온이고;
R2', R6', R7', R9', X' 및 M'은 각각 R2, R6, R7, R9, X 및 M과 동일한 기로부터 선택되거나, M 및 M'은 함께 2가의 약제학적으로 허용가능한 양이온을 나타낼 수 있다.
Description
본 발명은 피롤로벤조디아제핀(PBD: pyrrolobenzodiazepine), 특히 C2 아릴 치환체를 갖는 피롤로벤조디아제핀 이량체에 관한 것이다.
몇몇 피롤로벤조디아제핀(PBD)은 DNA의 특이 서열을 인식하고 이에 결합하는 능력을 갖는데; 이때 바람직한 서열은 PuGPu이다. 제1 PBD 항종양 항생제인 안트라마이신은 1965년에 발견되었다([Leimgruber, et al., J. Am . Chem . Soc., 87, 5793-5795(1965)]; [Leimgruber, et al., J. Am . Chem . Soc., 87, 5791-5793(1965)]). 그 이후로, 다수의 자연 발생된 PBD가 보고되었으며, 다양한 유사체에 대해 10개 이상의 합성 경로가 개발되었다[Thurston, et al., Chem . Rev . 1994, 433-465(1994]. 계열의 일원으로는 아베시마이신[Hochlowski, et al., J. Antibiotics, 40, 145-148(1987)], 키카마이신[Konishi, et al., J. Antibiotics, 37, 200-206(1984)], DC-81(일본 특허 제58-180 487호; [Thurston, et al., Chem . Brit., 26, 767-772(1990)]; [Bose, et al., Tetrahedron, 48, 751-758(1992)]), 마제트라마이신[Kuminoto, et al., J. Antibiotics, 33, 665-667(1980)], 네오트라마이신 A 및 B[Takeuchi, et al., J. Antibiotics, 29, 93-96(1976)], 포로트라마이신[Tsunakawa, et al., J. Antibiotics, 41,1366-1373(1988)], 프로트라카 신([Shimizu, et al, J. Antibiotics, 29, 2492-2503(1982)]; [Langley and Thurston, J. Org . Chem ., 52, 91-97(1987)]), 시바노마이신(DC-102)([Hara, et al., J. Antibiotics , 41, 702-704(1988)]; [Itoh, et al., J. Antibiotics, 41,1281-1284(1988)]), 시비로마이신[Leber, et al., J. Am . Chem . Soc., 110, 2992-2993(1988)] 및 토마마이신[Arima, et al., J. Antibiotics , 25, 437-444(1972)]을 포함한다. PBD는 하기 일반 구조식을 갖는다:
이들은 그의 방향족 A 환 및 피롤로 C 환, 양자 모두에 있어서 치환체의 수, 유형 및 위치와 C 환의 포화도가 상이하다. B-환에는 DNA의 알킬화에 관여하는 친전자성 중심인 N10-C11 위치에 이민(N=C), 카비놀아민(NH-CH(OH)) 또는 카비놀아민 메틸 에테르(NH-CH(OMe))가 있다. 공지된 천연 생성물은 모두 키랄 C11a 위치에서 (S)-배열을 가져 C 환에서 A 환 쪽을 향해 볼 때 오른쪽으로 비틀려 있다. 이는 상기 생성물에 대해 B-형 DNA의 작은 홈을 가지면서 이소헬리시티(isohelicity)에 적절한 삼차원 형태를 제공하여 결합 위치에 딱 들어맞게 한다([Kohn, In Antibiotics III. Springer-Verlag, New York, pp. 3-11(1975)]; [Hurley and Needham-VanDevanter, Acc. Chem. Res., 19, 230-237(1986)]). 이들은 작은 홈에서 부가물을 형성하여 DNA 프로세싱(processing)을 방해할 수 있기 때문에 항종양제로 사용될 수 있다.
본 발명자들은 C2 위치에 아릴기를 갖는 세포독성 화합물, 예를 들면, 하기의 화합물에 대하여 WO 2004/043963에 앞서 개시한 바 있다:
본 발명자들은 또한 C2 아릴 치환체를 갖는 이량체 PBD 화합물, 예로서, 하기의 화합물에 대하여 동시계속 PCT 출원 PCT/GB2005/000768(공개번호 WO 2005/085251)에 앞서 개시한 바 있다:
발명의 개시
본 발명자들은 예로서, ZC-207과 같은 화합물의 용해도와 관련된 몇몇 문제에 부딪히게 되었고, 이는 상기 화합물의 상이한 형태를 사용함으로써 해소되었다.
본 발명은 하기 화학식(I)을 갖는 화합물, 또는 그의 용매화물을 포함한다:
상기 식에서,
R2는 임의로 치환된 C5 -20 아릴기이고;
R6 및 R9는 독립적으로 H, R, OH, OR, SH, SR, NH2, NHR, NRR', 니트로, Me3Sn 및 할로로부터 선택되고;
여기에서, R 및 R'는 독립적으로 임의로 치환된 C1 -12 알킬, C3 -2O 헤테로사이클릴 및 C5 -2O 아릴 기로부터 선택되고;
R7은 H, R, OH, OR, SH, SR, NH2, NHR, NHRR', 니트로, Me3Sn 및 할로로부터 선택되고;
R"는 C3-12 알킬렌기로서 그 쇄에 하나 이상의 헤테로원자, 예로서, O, S, NH 및/또는 방향족 환, 예로서, 벤젠 또는 피리딘이 개재할 수 있고,
X는 독립적으로 0, S 또는 NH로부터 선택되고;
z는 2 또는 3이고;
M은 1가의 약제학적으로 허용가능한 양이온이고;
R2', R6', R7', R9', X' 및 M'은 각각 R2, R6, R7, R9, X 및 M과 동일한 기로부터 선택되거나, M 및 M'은 함께 2가의 약제학적으로 허용가능한 양이온을 나타낼 수 있다.
이민 결합을 갖는 피롤로벤조디아제핀은 물중 디-카비놀아민 형태로 전환되는 것으로 알려져 있고, 분리된 피롤로벤조디아제핀은 대개 이민, 모노-카비놀아민 및 디-카비놀아민 형태의 혼합물로서 존재한다. 추가로, 화합물이 이들 3개 형태의 혼합물과 함꼐 분리될 경우, 그들 사이의 균형은 시간이 경과함에 따라 변할 수 있다. 이러한 것은 화합물을 투여하는데 문제시되지 않지만, 이는 소정량의 분말중 활성 물질의 양을 정확하게 평가하는데는 어려움이 있을 수 있다. 본 발명의 화합물은 활성이면서도 어느 정도까지는 난점을 극복할 수 있고, 이로써 약제로서의 제형에 적합하다.
이량체 피롤로벤조디아제핀은 마이너 그루브(minor groove)에서 DNA를 교차시키는 능력을 보유한다는 점에서 단량체 피롤로벤조디아제핀 비하여 이점을 제공하지만, 세포독성의 증가를 유발할 수 있다.
본 발명의 추가의 측면은 요법적 방법에서(특히, 증식성 질환 치료에서)의 화합물의 용도, 상기 화합물을 포함하는 약제학적 조성물, 및 증식성 질환 치료용 의약 제조에서의 상기 화합물의 용도에 관한 것이다.
정의
치환체
본 원에 사용된 어구 "임의로 치환된"은 치환될 수 없거나 치환될 수 있는 모기(parent group)에 관한 것이다.
다른 특별한 언급이 없으면, 본 원에 사용된 용어 "치환된"은 하나 이상의 치환체를 갖는 모기에 관한 것이다. 본 원에서 용어 "치환체"는 통상적인 의미로 사용되며, 모기에 공유적으로 결합되거나, 적절한 경우, 모기에 융합된 화학 부위를 언급한다. 매우 다양한 치환체가 잘 알려져 있으며, 이들의 형성 방법 및 각종 모기로의 도입 또한 당업계에 알려져 있다.
치환체의 예에 대해 하기에 보다 상세히 설명한다.
C1-12 알킬: 본 원에 사용된 용어 "C1-12 알킬"은 탄소 원자수 1 내지 7의 탄화수소 화합물의 탄소 원자로부터 하나의 수소를 제거하여 얻은 1가 부위에 관한 것이며, 지방족 또는 지환식일 수 있고, 포화 또는 불포화(예로서, 부분 불포화, 완전 불포화)될 수 있다. 따라서, 용어 "알킬"은 하기 기술되는 하위 부류의 알케닐, 알키닐, 사이클로알킬 등을 포함한다.
포화된 알킬기의 일례로는 메틸(C1), 에틸(C2), 프로필(C3), 부틸(C4), 펜틸(C5), 헥실(C6) 및 헵틸(C7)을 포함하나, 이들에만 한정되지 않는다.
포화된 선형 알킬기의 일례로는 메틸(C1), 에틸(C2), n-프로필(C3), n-부틸(C4), n-펜틸(아밀)(C5), n-헥실(C6) 및 n-헵틸(C7)을 포함하나, 이들에만 한정되지 않는다.
포화된 분지쇄 알킬기의 일례로는 이소-프로필(C3), 이소-부틸(C4), sec-부틸(C4), t-부틸(C4), 이소-펜틸(C5) 및 네오-펜틸(C5)을 포함하나, 이들에만 한정되지 않는다.
C2-12 알케닐: 본 원에 사용된 용어 "C2-12 알케닐"은 하나 이상의 탄소-탄소 이중 결합을 갖는 알킬기를 의미한다.
불포화된 알케닐기의 일례로는 에테닐(비닐, -CH=CH2), 1-프로페닐(-CH=CH-CH3), 2-프로페닐(알릴, -CH-CH=CH2), 이소프로페닐(1-메틸비닐, -C(CH3)=CH2), 부테닐(C4), 펜테닐(C5) 및 헥세닐(C6)을 포함하나, 이들에만 한정되지 않는다.
C2-12 알키닐: 본 원에 사용된 용어 "C2-12 알키닐"은 하나 이상의 탄소-탄소 삼중 결합을 갖는 알킬기를 의미한다.
불포화된 알키닐기의 일례로는 에티닐(에티닐, -C≡CH) 및 2-프로피닐(프로파길, -CH2-C≡CH)을 포함하나, 이들에만 한정되지 않는다.
C3 -12 사이클로알킬: 본 원에 사용된 용어 "C3 -12 사이클로알킬"은 또한 사이클릴기인 알킬기; 즉, 사이클릭 탄화수소(카보사이클릭) 화합물의 지환식 환 원자로부터 하나의 수소를 제거하여 얻은 1가 부위를 의미하며, 3 내지 7개의 환 원자를 포함하여 3 내지 7개의 탄소 원자를 가진다.
사이클로알킬기의 일례로는
포화 모노사이클릭 탄화수소 화합물:
사이클로프로판(C3), 사이클로부탄(C4), 사이클로펜탄(C5), 사이클로헥산(C6), 사이클로헵탄(C7), 메틸사이클로프로핀(C4), 디메틸사이클로프로판(C5), 메틸사이클로부탄(C5), 디메틸사이클로부탄(C6), 메틸사이클로펜탄(C6), 디메틸사이클로펜탄(C7) 및 메틸사이클로헥산(C7);
불포화 모노사이클릭 탄화수소 화합물:
사이클로프로펜(C3), 사이클로부텐(C4), 사이클로펜텐(C5), 사이클로헥센(C6), 메틸사이클로프로펜(C4), 디메틸사이클로프로펜(C5), 메틸사이클로부텐(C5), 디메틸사이클로부텐(C6), 메틸사이클로펜텐(C6), 디메틸사이클로펜텐(C7) 및 메틸사이클로헥센(C7); 및
포화 폴리사이클릭 탄화수소 화합물:
노르카란(C7), 노르피난(C7), 노르보난(C7)
으로부터 유도된 것들을 포함하나, 이들에만 한정되지 않는다.
C3 -20 헤테로사이클릴: 본 원에 사용된 용어 "C3 -20 헤테로사이클릴"은 헤테로사이클릭 화합물의 환 원자로부터 하나의 수소를 제거하여 얻은 1가 부위를 의미하며, 3 내지 20개의 환 원자를 포함하며 그중 1 내지 10개는 환 헤테로원자이다. 바람직하게, 각 환은 3 내지 7개의 환 원자를 가지며, 이중 1 내지 4개는 환 헤테로원자이다.
여기에서, 접두사(예로서, C3 -20, C3 -7, C5 -6 등)는 탄소 원자 또는 헤테로원자에 상관없이 환 원자수, 또는 환 원자수의 범위를 나타낸다. 예로서, 본 원에 사용된 용어 "C5 -6 헤테로사이클릴"은 5 또는 6개의 환원자를 갖는 헤테로사이클릴기에 관한 것이다.
모노사이클릭 헤테로사이클릴기의 일례로는
N1: 아지리딘(C3), 아제티딘(C4), 피롤리딘(테트라하이드로피롤)(C5), 피롤린(예로서, 3-피롤린, 2,5-디하이드로피롤)(C5), 2H-피롤 또는 3H-피롤(이소피롤, 이소아졸)(C5), 피페리딘(C6), 디하이드로피리딘(C6), 테트라하이드로피리딘(C6), 아제핀(C7);
O1: 옥시란(C3), 옥세탄(C4), 옥솔란(테트라하이드로푸란)(C5), 옥솔(디하이드로푸란)(C5), 옥산(테트라하이드로피란)(C6), 디하이드로피란(C6), 피란(C6), 옥세핀(C7);
S1: 티이란(C3), 티에탄(C4), 티올란(테트라하이드로티오펜)(C5), 티안(테트라하이드로티오피란)(C6), 티에판(C7);
O2: 디옥솔란(C5), 디옥산(C6), 디옥세판(C7);
03: 트리옥산(C6);
N2: 이미다졸리딘(C5), 피라졸리딘(디아졸리딘)(C5), 이미다졸린(C5), 피라졸린(디하이드로피라졸)(C5), 피페라진(C6);
N101: 테트라하이드로옥사졸(C5), 디하이드로옥사졸(C5), 테트라하이드로이속사졸(C5), 디하이드로이속사졸(C5), 모르폴린(C6), 테트라하이드로옥사진(C6), 디하이드로옥사진(C6), 옥사진(C6);
N1S1: 티아졸린(C5), 티아졸리딘(C5), 티오모르폴린(C6);
N201: 옥사디아진(C6);
O1S1: 옥사티올(C5) 및 옥사티안(티옥산)(C6); 및
N101S1: 옥사티아진(C6)
으로부터 유도된 것을 포함하나, 이들에만 한정되지 않는다.
치환된 모노사이클릭 헤테로사이클릴기의 일례로는 사이클릭 형태의 사카라이드로부터 유도된 것, 예로서, 아라비노푸라노스, 릭소푸라노스, 리보푸라노스 및 크실로푸라노스와 같은 푸라노스(C5) 및 알로피라노스, 알트로피라노스, 글루코피라노스, 만노피라노스, 굴로피라노스, 이도피라노스, 갈락토피라노스 및 탈로피라노스와 같은 피라노스(C6)를 포함하나, 이들에만 한정되지 않는다.
C5 -20 아릴: 본 원에 사용된 용어 "C5 -20 아릴"은 방향족 화합물의 방향족 환 원자로부터 하나의 수소를 제거하여 얻은 1가 부위를 의미하며, 3 내지 20개의 환 원자를 가진다. 바람직하게, 각 환은 5 내지 7개의 환 원자를 가진다.
여기에서, 접두사(예로서, C3 -20, C3 -7, C5 -6 등)는 탄소 원자 또는 헤테로원자에 상관없이 환 원자수, 또는 환 원자수의 범위를 나타낸다. 예로서, 본 원에 사용된 용어 "C5 -6 아릴"은 5 또는 6개의 환 원자를 갖는 아릴기에 관한 것이다.
환 원자는 "카보아릴기"에서와 같이 전부가 탄소 원자일 수 있다. 카보아릴기의 일례로는 벤젠(즉, 페닐)(C6), 나프탈렌(C10), 아줄렌(C10), 안트라센(C14), 페난트렌(C14), 나프타센(C18) 및 피렌(C16)으로부터 유도된 것들을 포함하나, 이들에만 한정되지 않는다.
적어도 하나가 방향족 환인 융합 환을 포함하는 아릴기의 일례로는 인단(예로서, 2,3-디하이드로-lH-인덴)(C9), 인덴(C9), 이소인덴(C9), 테트랄린(1,2,3,4-테트라하이드로나프탈렌(C10), 아세나프텐(C12), 플루오렌(C13), 페날렌(C13), 아세페난트렌(C15) 및 아세안트렌(C16)으로부터 유도된 기를 포함하나, 이들에만 한정되지 않는다.
별법으로, 환 원자는 "헤테로아릴기"에서와 같이 하나 이상의 헤테로원자를 포함할 수 있다. 모노사이클릭 헤테로아릴기의 예에는
N1: 피롤(아졸)(C5), 피리딘(아진)(C6);
O1: 푸란(옥솔)(C5);
S1: 티오펜(티올)(C5);
N1O1: 옥사졸(C5), 이속사졸(C5), 이속사진(C6);
N201: 옥사디아졸(푸라잔)(C5);
N301: 옥사트리아졸(C5);
N1S1: 티아졸(C5), 이소티아졸(C5);
N2: 이미다졸(1,3-디아졸)(C5), 피라졸(1,2-디아졸)(C5), 피리다진(1,2-이다진)(C6), 피리미딘(1,3-디아진)(C6)(예를 들어, 시토신, 티민, 우라실), 피라진(1,4-디아진)(C6));
N3: 트리아졸(C5), 트리아진(C6); 및
N4: 테트라졸(C5)
로부터 유도된 것을 포함하나, 이들에만 한정되지 않는다.
융합 환을 포함하는 헤테로아릴의 일례로는 다음의 것들을 포함하나, 이들에만 한정되지 않는다:
벤조푸란(O1), 이소벤조푸란(O1), 인돌(N1), 이소인돌(N1), 인돌리진(N1), 인돌린(N1), 이소인돌린(N1), 퓨린(N4)(예를 들어, 아데닌, 구아닌), 벤즈이미다졸(N2), 인다졸(N2), 벤족사졸(N1O1), 벤즈이속사졸(N1O1), 벤조디옥솔(02), 벤조푸라잔(N201), 벤조트리아졸(N3), 벤조티오푸란(S1), 벤조티아졸(N1S1), 벤조티아디아졸(N2S)로부터 유도된 C9(융합 환이 2개);
크로멘(O1), 이소크로멘(O1), 크로만(O1), 이소크로만(O1), 벤조디옥산(O2), 퀴놀린(N1), 이소퀴놀린(N1), 퀴놀리진(N1), 벤족사진(N1O1), 벤조디아진(N2), 피리도피리딘(N2), 퀴녹살린(N2), 퀴나졸린(N2), 신놀린(N2), 프탈라진(N2), 나프티리딘(N2), 프테리딘(N4)으로부터 유도된 C10(융합 환이 2개);
벤조디아제핀(N2)으로부터 유도된 C11(융합 환이 2개);
카바졸(N1), 디벤조푸란(O1), 디벤조티오펜(S1), 카볼린(N2), 페리미딘(N2), 피리도인돌(N2)로부터 유도된 C13(융합 환이 3개); 및
아크리딘(N1), 크산텐(O1), 티오크산텐(S1), 옥산트렌(O2), 페녹사티인(O1S1), 페나진(N2), 페녹사진(N1O1), 페노티아진(N1S1), 티안트렌(S2), 페난트리딘(N1), 페난트롤린(N2), 페나진(N2)으로부터 유도된 C14(융합 환이 3개).
상기의 기들은 단독으로 또는 다른 치환체의 일부로 존재하는 것에 상관없이, 그 자체로 이들 및 하기 추가의 치환체 중에서 선택된 하나 이상의 기에 의해 임의로 치환될 수 있다:
할로: -F, -Cl, -Br 및 -I.
하이드록시: -OH.
에테르: -OR, 여기에서 R은 에테르 치환체, 예로서, C1 -7 알킬기(또한 후술하는 C1 -7 알콕시기로도 언급), C3 -20 헤테로사이클릴기(또한 C3 -20 헤테로사이클릴옥시기로도 언급) 또는 C5 -20 아릴기(또한 C3 -20 아릴옥시기로도 언급), 바람직하게는 C1 -7 알킬기이다.
알콕시: -OR, 여기에서 R은 알킬기, 예로서, C1 -7 알킬기이다. C1 -7 알콕시기의 일례로는 -OMe(메톡시), -OEt(에톡시), -O(nPr)(n-프로폭시), -O(iPr)(이소프로폭시), -O(nBu)(n-부톡시), -O(sBu)(sec-부톡시), -O(iBu)(이소부톡시) 및 -O(tBu)(t-부톡시)이다.
아세탈: -CH(OR1)(OR2), 여기에서 R1 및 R2는 독립적으로 아세탈 치환체, 예로서, C1 -7 알킬기, C3 -20 헤테로사이클릴기 또는 C5 -20 아릴기, 바람직하게는 C1 -7 알킬기이거나, "사이클릭" 아세탈기의 경우, R1 및 R2는 이들이 결합된 2개의 산소 원자 및 이들이 결합된 탄소 원자와 함께 4 내지 8 환 원자의 헤테로사이클릭 환을 형성한다. 아세탈기의 일례로는 -CH(OMe)2, -CH(OEt)2 및 -CH(OMe)(OEt)을 포함하나, 이들에만 한정되지 않는다.
헤미아세탈: -CH(OH)(OR1), 여기에서 R1은 헤미아세탈 치환체, 예로서, C1 -7 알킬기, C3 -20 헤테로사이클릴기 또는 C5 -20 아릴기, 바람직하게는 C1 -7 알킬기이다. 헤미아세탈기의 일례로는 -CH(OH)(OMe) 및 -CH(OH)(OEt)를 포함하나, 이들에만 한정되지 않는다.
케탈: -CR(OR1)(OR2), 여기에서 R1 및 R2는 아세탈에 대해 정의된 바와 같고, R은 수소 이외의 케탈 치환체, 예로서, C1 -7 알킬기, C3 -20 헤테로사이클릴기 또는 C5 -20 아릴기, 바람직하게는 C1 -7 알킬기이다. 케탈기의 일례로는 -C(Me)(OMe)2, -C(Me)(OEt)2, -C(Me)(OMe)(OEt), -C(Et)(OMe)2, -C(Et)(OEt)2 및 -C(Et)(OMe)(OEt를 포함하나, 이들에만 한정되지 않는다.
헤미케탈: -CR(OH)(OR1), 여기에서 R1은 헤미아세탈에 대해 정의된 바와 같고, R은 수소 이외의 헤미케탈 치환체, 예를 들어, C1 -7 알킬기, C3 -20 헤테로사이클릴기 또는 C5 -20 아릴기, 바람직하게는 C1 -7 알킬기이다. 헤미아세탈기의 일례로는 -C(Me)(OH)(OMe), -C(Et)(OH)(OMe), -C(Me)(OH)(OEt) 및 -C(Et)(OH)(OEt)를 포함하나, 이들에만 한정되지 않는다.
옥소(케토, -온): =0.
티온(티오케톤): =S.
이미노(이민): =NR, 여기에서 R은 이미노 치환체, 예로서, 수소, C1 -7 알킬기, C3 -20 헤테로사이클릴기 또는 C5 -20 아릴기, 바람직하게는 수소 또는 C1 -7 알킬기이다. 에스테르기의 일례로는 =NH, =NMe, =NEt 및 =NPh를 포함하나, 이들에만 한정되지 않는다.
포르밀(카브알데히드, 카복스알데히드): -C(=O)H.
아실(케토): -C(=O)R, 여기에서 R은 아실 치환체, 예로서, C1 -7 알킬기(또한 C1-7 알킬아실 또는 C1 -7 알카노일기로 언급), C3 -20 헤테로사이클릴기(또한 C3 -20 헤테로사이클릴아실기로 언급), 또는 C5 -20 아릴기(또한 C5 -20 아릴아실기로 언급), 바람직하게는 C1 -7 알킬기이다. 아실기의 일례로는 -C(=O)CH3(아세틸), -C(=O)CH2CH3(프로피오닐), -C(=O)C(CH3)3(t-부티릴) 및 -C(=O)Ph(벤조일, 페논)를 포함하나, 이들에만 한정되지 않는다.
카복시(카복실산): -C(=O)OH.
티오카복시(티오카복실산): -C(=S)SH.
티올로카복시(티올로카복실산): -C(=O)SH.
티오노카복시(티오노카복실산): -C(=S)OH.
이미드산: -C(=NH)OH.
하이드록산삼산: -C(=NOH)OH.
에스테르(카복실레이트, 카복실산 에스테르, 옥시카보닐): -C(=O)OR, 여기에서 R은 에스테르 치환체, 예로서, C1 -7 알킬기, C3 -20 헤테로사이클릴기 또는 C5 -20 아릴기, 바람직하게는 C1 -7 알킬기이다. 에스테르기의 일례로는 -C(=O)OCH3, -C(=O)OCH2CH3, -C(=O)OC(CH3)3 및 -C(=O)OPh를 포함하나, 이들에만 한정되지 않는다.
아실옥시(역 에스테르): -OC(=O)R, 여기에서 R은 아실옥시 치환체, 예로서, C1-7 알킬기, C3 -20 헤테로사이클릴기 또는 C5 -20 아릴기, 바람직하게는 C1 -7 알킬기이다. 아실옥시기의 일례로는 -OC(=O)CH3(아세톡시), -OC(=O)CH2CH3, -OC(=O)C(CH3)3, -OC(=O)Ph 및 -OC(=O)CH2Ph를 포함하나, 이들에만 한정되지 않는다.
옥시카보닐옥시: -OC(=O)OR, 여기에서 R은 에스테르 치환체, 예로서, C1 -7 알킬기, C3 -20 헤테로사이클릴기 또는 C5 -20 아릴기, 바람직하게는 C1 -7 알킬기이다. 에스테르기의 일례로는 -OC(=O)OCH3, -OC(=O)OCH2CH3, -OC(=O)OC(CH3)3 및 -OC(=O)OPh를 포함하나, 이들에만 한정되지 않는다.
아미노: -NR1R2, 여기에서 R1 및 R2는 독립적으로 아미노 치환체, 예로서, 수소, C1 -7 알킬기(또한 C1 -7 알킬아미노 또는 디-C1 -7 알킬아미노기로 언급), C3 -20 헤테로사이클릴기 또는 C5 -20 아릴기, 바람직하게는 H 또는 C1 -7 알킬기이거나, "사이클릭" 아미노기의 경우, R1 및 R2는 이들이 결합된 질소 원자와 함께 4 내지 8 환 원자의 헤테로사이클릭 환을 형성한다. 아미노기는 일차(-NH2), 이차(-NHR1) 또는 삼차(-NHR1R2) 및 양이온 형태로 사차 (-+NR1R2R3)일 수 있다. 아미노기의 일례로는 -NH2, -NHCH3, -NHC(CH3)2, -N(CH3)2, -N(CH2CH3)2 및 -NHPh를 포함하나, 이들에만 한정되지 않는다. 사이클릭 아미노기의 일례로는 아지리디노, 아제티디노, 피롤리디노, 피페리디노, 피페라지노, 모르폴리노 및 티오모르폴리노를 포함하나, 이들에만 한정되지 않는다.
아미도(카바모일, 카바일, 아미노카보닐, 카복사미드): -C(=O)NR1R2, 여기에서 R1 및 R2는 독립적으로 아미노기에 대해 정의된 바와 같은 아미노 치환체이다. 아미도기의 일례로는 -C(=O)NH2, -C(=O)NHCH3, -C(=O)N(CH3)2, -C(=O)NHCH2CH3 및 -C(=O)N(CH2CH3)2, 및 예로서, 피페리디노카보닐, 모르폴리노카보닐, 티오모르폴리노카보닐 및 피페라지노카보닐에서와 같이, R1 및 R2가 함께 이들이 결합된 질소 원자와 함께 헤테로사이클릭 구조를 형성하는 아미도기를 포함하나, 이들에만 한정되지 않는다.
티오아미도(티오카바밀): -C(=S)NR1R2, 여기에서 R1 및 R2는 독립적으로 아미노기에 대해 정의된 바와 같은 아미노 치환체이다. 티오아미도기의 일례로는 -C(=S)NH2, -C(=S)NHCH3, -C(=S)N(CH3)2, -C(=S)NHCH2CH3을 포함하나, 이들에만 한정되지 않는다.
아실아미도(아실아미노): -NR1C(=O)R2, 여기에서 R1은 아미드 치환체, 예로서, 수소, C1 -7 알킬기, C3 -20 헤테로사이클릴기 또는 C5 -20 아릴기, 바람직하게는 수소 또는 C1 -7 알킬기이고, R2는 아실 치환체, 예로서, C1 -7 알킬기, C3 -20 헤테로사이클릴기 또는 C5 -20 아릴기, 바람직하게는 수소 또는 C1 -7 알킬기이다. 아실아미드기의 일례로는 -NHC(=O)CH3, -NHC(=O)CH2CH3 및 -NHC(=O)Ph를 포함하나, 이들에만 한정되지 않는다. 예로서, 숙신이미딜, 말레이미딜 및 프탈이미딜에서와 같이, R1 및 R2는 함께 사이클릭 구조를 형성할 수 있다:
아미노카보닐옥시: -OC(=O)NR1R2, 여기에서 R1 및 R2는 독립적으로 아미노기에 대해 정의된 바와 같은 아미노 치환체이다. 아미노카보닐옥시기의 일례로는 OC(=O)NH2, -OC(=O)NHMe, -OC(=O)NMe2 및 -OC(=O)NEt2를 포함하나, 이들에만 한정되지 않는다.
우레이도: -N(R1)CONR2R3, 여기에서 R2 및 R3는 독립적으로 아미노기에 대해 정의된 바와 같은 아미노 치환체이고, R1은 우레이도 치환체, 예로서, 수소, C1 -7 알킬기, C3 -20 헤테로사이클릴기 또는 C5 -20 아릴기, 바람직하게는 수소 또는 C1 -7 알킬기이다. 우레이도기의 일례로는 -NHCONH2, -NHCONHMe, -NHCONHEt, -NHCONMe2, -NHCONEt2, -NMeCONH2, -NMeCONHMe, -NMeCONHEt, -NMeCONMe2 및 -NMeCONEt2를 포함하나, 이들에만 한정되지 않는다.
구아니디노: -NH-C(=NH)NH2.
테트라졸릴: 하기와 같이 4개의 질소 원자 및 하나의 탄소 원자를 갖는 5원 방향족 환:
이미노: =NR, 여기에서 R은 이미노 치환체, 예로서, 수소, C1 -7 알킬기, C3 -20 헤테로사이클릴기 또는 C5 -20 아릴기, 바람직하게는 H 또는 C1 -7 알킬기이다. 이미노기의 일례로는 =NH, =NMe 및 =NEt를 포함하나, 이들에만 한정되지 않는다.
아미딘(아미디노): -C(=NR)NR2, 여기에서각 R2는 아미딘 치환체, 예로서, 수소, C1 -7 알킬기, C3 -20 헤테로사이클릴기 또는 C5 -20 아릴기, 바람직하게는 H 또는 C1 -7 알킬기이다. 이미딘기의 일례로는 -C(=NH)NH2, -C(=NH)NMe2 및 -C(=NMe)NMe2를 포함하나, 이들에만 한정되지 않는다.
니트로: -NO2.
니트로소: -NO.
아지도: -N3.
시아노(니트릴, 카보니트릴): -CN.
이소시아노: -NC.
시아네이토: -OCN.
이소시아네이토: -NCO.
티오시아노(티오시아네이토): -SCN.
이소티오시아노(이소티오시아네이토): -NCS.
설프하이드릴(티올, 머캅토): -SH.
티오에테르(설파이드): -SR, 여기에서 R은 티오에테르 치환체, 예로서, C1 -7 알킬기(또한 C1 -7 알킬티오기로 언급), C3 -20 헤테로사이클릴기 또는 C5 -20 아릴기, 바람직하게는 C1 -7 알킬기이다. C1 -7 알킬티오기의 일례로는 -SCH3 및 -SCH2CH3을 포함하나, 이들에만 한정되지 않는다.
디설파이드: -SS-R, 여기에서 R은 디설파이드 치환체, 예로서, C1 -7 알킬기, C3-20 헤테로사이클릴기 또는 C5 -20 아릴기, 바람직하게는 C1 -7 알킬기(또한 본 원에서 C1-7 알킬 디설파이드기로 언급)이다. C1 -7 알킬 디설파이드기의 일례로는 -SSCH3 및 -SSCH2CH3을 포함하나, 이들에만 한정되지 않는다.
설핀(설피닐, 설폭사이드): -S(=O)R, 여기에서 R은 설핀 치환체, 예로서, C1-7 알킬기, C3 -20 헤테로사이클릴기 또는 C5 -20 아릴기, 바람직하게는 C1 -7 알킬기이다. 설핀기의 일례로는 -S(=O)CH3 및 -S(=O)CH2CH3을 포함하나, 이들에만 한정되지 않는다.
설폰(설포닐): -S(=O)2R, 여기에서 R은 설폰 치환체, 예로서, C1 -7 알킬기, C3-20 헤테로사이클릴기 또는 C5 -20 아릴기, 바람직하게는 불소화 또는 과불소화 C1 -7 알킬기를 포함하는 C1 -7 알킬기이다. 설폰기의 일례로는 -S(=O)2CH3(메탄설포닐, 메실), -S(=0)2CF3(트리플릴), -S(=O)2CH2CH3(에실), -S(=O)2C4F9(노나플릴), -S(=O)2CH2CF3(트레실), -S(=O)2CH2CH2NH2(타우릴), -S(=O)2Ph(페닐설포닐, 베실), 4-메틸페닐설포닐(토실), 4-클로로페닐설포닐(클로실), 4-브로모페닐설포닐(브로실), 4-니트로페닐(노실), 2-나프탈렌설포네이트(납실) 및 5-디메틸아미노나프탈렌-1-일설포네이트(단실)를 포함하나, 이들에만 한정되지 않는다.
설핀산(설피노): -S(=O)OH, -SO2H.
설폰산(설포): -S(=0)2OH, -S03H.
설피네이트(설핀산 에스테르): -S(=O)OR; 여기에서 R은 설피네이트 치환체, 예로서, C1 -7 알킬기, C3 -20 헤테로사이클릴기 또는 C5 -20 아릴기, 바람직하게는 C1 -7 알킬기이다. 설피네이트기의 일례로는 -S(=O)OCH3(메톡시설피닐; 메틸 설피네이트) 및 -S(=O)OCH2CH3(에톡시설피닐; 에틸 설피네이트)를 포함하나, 이들에만 한정되지 않는다.
설포네이트(설폰산 에스테르): -S(=O)2OR, 여기에서 R은 설포네이트 치환체, 예로서, C1 -7 알킬기, C3 -20 헤테로사이클릴기 또는 C5 -20 아릴기, 바람직하게는 C1 -7 알킬기이다. 설포네이트기의 일례로는 -S(=O)2OCH3(메톡시설포닐; 메틸 설포네이트) 및 -S(=O)2OCH2CH3(에톡시설포닐; 에틸 설포네이트)를 포함하나, 이들에만 한정되지 않는다.
설피닐옥시: -OS(=O)R, 여기에서 R은 설피닐옥시 치환체, 예로서, C1 -7 알킬기, C3 -20 헤테로사이클릴기 또는 C5 -20 아릴기, 바람직하게는 C1 -7 알킬기이다. 설피닐옥시기의 일례로는 -OS(=O)CH3 및 -OS(=O)CH2CH3를 포함하나, 이들에만 한정되지 않는다.
설포닐옥시: -OS(=O)2R, 여기에서 R은 설포닐옥시 치환체, 예로서, C1 -7 알킬기, C3 -20 헤테로사이클릴기 또는 C5 -20 아릴기, 바람직하게는 C1 -7 알킬기이다. 설포닐옥시기의 일례로는 -OS(=O)2CH3(메실레이트) 및 -OS(=O)2CH2CH3(에실레이트)을 포함하나, 이들에만 한정되지 않는다.
설페이트: -OS(=0)2OR; 여기에서 R은 설페이트 치환체, 예로서, C1 -7 알킬기, C3-20 헤테로사이클릴기 또는 C5 -20 아릴기, 바람직하게는 C1 -7 알킬기이다. 설페이트기의 일례로는 -OS(=O)2OCH3 및 -SO(=O)2OCH2CH3을 포함하나, 이들에만 한정되지 않는다.
설파밀(설파모일; 설핀산 아미드; 설핀아미드): -S(=O)NR1R2, 여기에서 R1 및 R2는 독립적으로 아미노기에 대해 정의된 바와 같은 아미노 치환체이다. 설파밀기의 일례로는 -S(=O)NH2, -S(=O)NH(CH3), -S(=0)N(CH3)2, -S(=O)NH(CH2CH3), -S(=O)N(CH2CH3)2 및 -S(=O)NHPh를 포함하나, 이들에만 한정되지 않는다.
설폰아미도(설피나모일; 설폰산 아미드; 설폰아미드): -S(=O)2NR1R2, 여기에서 R1 및 R2는 독립적으로 아미노기에 대해 정의된 바와 같은 아미노 치환체이다. 설폰아미도기의 일례로는 -S(=O)2NH2, -S(=O)2NH(CH3), -S(=O)2N(CH3)2, -S(=O)2NH(CH2CH3), -S(=O)2N(CH2CH3)2 및 -S(=O)2NHPh를 포함하나, 이들에만 한정되지 않는다.
설파미노: -NR1S(=O)2OH, 여기에서 R1은 아미노기에 대해 정의된 바와 같은 아미노 치환체이다. 설파미노기의 일례로는 -NHS(=O)2OH 및 -N(CH3)S(=O)2OH를 포함하나, 이들에만 한정되지 않는다.
설폰아미노: -NR1S(=O)2R, 여기에서 R1은 아미노기에 대해 정의된 바와 같은 아미노 치환체이고, R은 설폰아미노 치환체, 예로서, C1 -7 알킬기, C3 -20 헤테로사이클릴기 또는 C5 -20 아릴기, 바람직하게는 C1 -7 알킬기이다. 설폰아미노기의 예에는 -NHS(=O)2CH3 및 -N(CH3)S(=O)2C6H5를 포함하나, 이들에만 한정되지 않는다.
설핀아미노: -NR1S(=O)R, 여기에서 R1은 아미노기에 대해 정의된 바와 같은 아미노 치환체이고, R은 설핀아미노 치환체, 예로서, C1 -7 알킬기, C3 -20 헤테로사이클릴기 또는 C5 -20 아릴기, 바람직하게는 C1 -7 알킬기이다. 설핀아미노기의 예에는 -NHS(=O)CH3 및 -N(CH3)S(=O)C6H5를 포함하나, 이들에만 한정되지 않는다.
포스피노(포스핀): -PR2, 여기에서 R은 포스피노 치환체, 예로서, -H, C1 -7 알킬기, C3 -20 헤테로사이클릴기 또는 C5 -20 아릴기, 바람직하게는 -H, C1 -7 알킬기 또는 C5 -20 아릴기이다. 포스피노기의 일례로는 -PH2, -P(CH3)2, -P(CH2CH3)2, -P(t-Bu)2 및 -P(Ph)2를 포함하나, 이들에만 한정되지 않는다.
포스포: -P(=O)2.
포스피닐(포스핀 옥시드): -P(=O)R2, 여기에서 R은 포스피닐 치환체, 예로서, C1 -7 알킬기, C3 -20 헤테로사이클릴기 또는 C5 -20 아릴기, 바람직하게는 C1 -7 알킬기 또는 C5 -20 아릴기이다. 포스피닐기의 일례로는 -P(=O)(CH3)2, -P(=O)(CH2CH3)2, -P(=O)(t-Bu)2 및 -P(=0)(Ph)2를 포함하나, 이들에만 한정되지 않는다.
포스폰산(포스포노): -P(=O)(OH)2.
포스포네이트(포스포노 에스테르): -P(=O)(OR)2, 여기에서 R은 포스포네이트 치환체, 예로서, -H, C1 -7 알킬기, C3 -20 헤테로사이클릴기 또는 C5 -20 아릴기, 바람직하게는 -H, C1 -7 알킬기 또는 C5 -20 아릴기이다. 포스포네이트기의 예에는 -P(=O)(OCH3)2, -P(=O)(0CH2CH3)2, -P(=O)(0-t-Bu)2 및 -P(=0)(OPh)2를 포함하나, 이들에만 한정되지 않는다.
인산(포스포노옥시): -OP(=O)(OH)2.
포스페이트(포스포노옥시 에스테르): -OP(=O)(OR)2, 여기에서 R은 포스페이트 치환체, 예로서, -H, C1 -7 알킬기, C3 -20 헤테로사이클릴기 또는 C5 -20 아릴기, 바람직하게는 -H, C1 -7 알킬기 또는 C5 -20 아릴기이다. 포스페이트기의 예에는 -OP(=O)(OCH3)2, -OP(=O)(0CH2CH3)2, -OP(=O)(0-t-Bu)2 및 -0P(=0)(OPh)2를 포함하나, 이들에만 한정되지 않는다.
아인산: -OP(OH)2.
포스파이트: -OP(OR)2, 여기에서 R은 포스파이트 치환체, 예로서, -H, C1 -7 알킬기, C3 -20 헤테로사이클릴기 또는 C5 -20 아릴기, 바람직하게는 -H, C1 -7 알킬기 또는 C5 -20 아릴기이다. 포스파이트기의 일례로는 -OP(OCH3)2, -OP(0CH2CH3)2, -OP(0-t-Bu)2 및 -0P(OPh)2를 포함하나, 이들에만 한정되지 않는다.
포스포르아미다이트: -OP(OR1)-NR2 2, 여기에서 R1 및 R2는 독립적으로 포스포르아미다이트 치환체, 예로서, -H, (임의로 치환된) C1 -7 알킬기, C3 -20 헤테로사이클릴기 또는 C5 -20 아릴기, 바람직하게는 -H, C1 -7 알킬기 또는 C5 -20 아릴기이다. 포스포르아미다이트기의 일례로는 -OP(OCH2CH3)-N(CH3)2, -OP(OCH2CH3)-N(i-Pr)2 및 -OP(OCH2CH2CN)-N(i-Pr)2를 포함하나, 이들에만 한정되지 않는다.
포스포르아미데이트: -OP(=O)(OR1)-NR2 2, 여기에서 R1 및 R2는 독립적으로 포스포르아미데이트 치환체, 예로서, -H, (임의로 치환된) C1 -7 알킬기, C3 -20 헤테로사이클릴기 또는 C5 -20 아릴기, 바람직하게는 -H, C1 -7 알킬기 또는 C5 -20 아릴기이다. 포스포르아미데이트기의 일례로는 -OP(=O)(OCH2CH3)-N(CH3)2, -OP(=O)(OCH2CH3)-N(i-Pr)2 및 -OP(=O)(OCH2CH2CN)-N(i-Pr)2를 포함하나, 이들에만 한정되지 않는다.
비스옥시알킬렌: -O-(CH2)n-O-로서(여기에서 n=1-3이다), 인접한 원자들에 결합하고 있다. 비스옥시알킬렌기의 일례로는 -0-CH2-O-를 포함하나, 이들에만 한정되지 않는다.
알킬렌
C3 -12 알킬렌: 본 원에 사용된 용어 "C3 -12 알킬렌"은 탄소 원자수 3 내지 12(달리 명시되지 않으면)의 탄화수소 화합물의 동일한 탄소 원자, 양자 모두로부터 또는 2개의 상이한 각 탄소 원자 하나로부터 2개의 수소를 제거하여 얻은 2가 부위를 의미하며, 지방족 또는 지환식일 수 있고, 포화, 부분 불포화 또는 완전 불포화될 수 있다. 따라서, 용어 "알킬렌"은 이후 기술되는 하위 부류의 알케닐렌, 알키닐렌, 사이클로알킬렌 등을 포함한다.
선형 포화 C3 -12 알킬렌기의 일례로는 -(CH2)n-(여기에서, n은 3 내지 12의 정수이다), 예로서, -CH2CH2CH2-(프로필렌), -CH2CH2CH2CH2-(부틸렌), -CH2CH2CH2CH2CH2-(펜틸렌) 및 -CH2CH2CH2CH2CH2CH2-(헵틸렌)을 포함하나, 이들에만 한정되지 않는다.
포화된 분지쇄 C3 -12 알킬렌기의 일례로는 -CH(CH3)CH2-, -CH(CH3)CH2CH2-, -CH(CH3)CH2CH2CH2-, -CH2CH(CH3)CH2-, -CH2CH(CH3)CH2CH2-, -CH(CH2CH3)-, -CH(CH2CH3)CH2-및 -CHC2H(CH2CH3)CH2-를 포함하나, 이들에만 한정되지 않는다.
부분 불포화된 선형 C3 -12 알킬렌기(C3-12 알케닐렌 및 알키닐렌기)의 일례로는 -CH=CH-CH2-, -CH2-CH=CH2-, -CH=CH-CH2-CH2-, -CH=CH-CH2-CH2-CH2-, -CH=CH-CH=CH-, -CH=CH-CH=CH-CH2-, -CH=CH-CH=CHCH2-CH2-, -CH=CH-CH2-CH=CH-, -CH=CH-CH2-CH2-CH=CH-및 -CH2-C≡C-CH2-를 포함하나, 이들에만 한정되지 않는다.
부분 불포화된 분지쇄 C3 -12 알킬렌기(C3-12 알케닐렌 및 알키닐렌기)의 일례로는 -C(CH3)=CH-, -C(CH3)=CH-CH2-, -CH=CH-CH(CH3)-및 -C≡C-CH(CH3)-을 포함하나, 이들에만 한정되지 않는다.
포화된 알리사이클릭 C3 -12 알킬렌기(C3-12 사이클로알킬렌)의 일례로는 사이클로펜틸렌(예로서, 사이클로펜트-1,3-일렌) 및 사이클로헥실렌(예로서, 사이클로헥스-1,4-일렌)을 포함하나, 이들에만 한정되지 않는다.
부분 불포화된 알리사이클릭 C3 -12 알킬렌기(C3-12 사이클로알킬렌)의 일례로는 사이클로펜테닐렌(예로서, 4-사이클로펜텐-1,3-일렌), 사이클로헥세닐렌(예로서, 2-사이클로헥센-1,4-일렌; 3-사이클로헥센-1,2-일렌; 2,5-사이클로헥사디엔-1,4-일렌)을 포함하나, 이들에만 한정되지 않는다.
약제학적으로 허용가능한 양이온
약제학적으로 허용가능한 1가 및 2가 양이온의 일례는 본원에서 참고로 인용되는 문헌[Berge, et al., J. Pharm . Sci., 66, 1-19(1977)]에 논의되어 있다.
약제학적으로 허용가능한 양이온은 무기 또는 유기일 수 있다.
약제학적으로 허용가능한 1가 무기 양이온의 일례로는 Na+ 및 K+와 같은 알칼리 금속 이온을 포함하나, 이들에만 한정되지 않는다. 약제학적으로 허용가능한 2가 무기 양이온의 일례로는 Ca2+ 및 Mg2+와 같은 알칼리 토금속 이온을 포함하나, 이들에만 한정되지 않는다. 약제학적으로 허용가능한 유기 양이온의 일례로는 암모늄 이온(즉, NH4 +) 및 치환된 암모늄 이온(예로서, NH3R+, NH2R2 +, NHR3 +, NR4 +)을 포함하나, 이들에만 한정되지 않는다. 일부 적합한 치환된 암모늄 이온의 일례로는 에틸아민, 디에틸아민, 디사이클로헥실아민, 트리에틸아민, 부틸아민, 에틸렌디아민, 에탄올아민, 디에탄올아민, 피페라진, 벤질아민, 페닐벤질아민, 콜린, 메글루민 및 트로메타민, 및 리신 및 아르기닌과 같은 아미노산으로부터 유도된 것이 있다. 통상의 4급 암모늄 이온의 일례는 N(CH3)4 +이다.
증식성 질환
당업자들이라면 후보 화합물이 임의 특정 세포 유형의 증식성 용태를 치료할 수 있을지의 여부를 용이하게 결정할 수 있을 것이다. 예로서, 특정 화합물에 의해 제공되는 활성을 평가하기 위하여 통상 사용될 수 있는 분석법을 하기 실시예에 기술한다.
용어 "증식성 질환"이란 시험관내 또는 생체내에서 원치않거나 조절되지 않는 세포의 과다 증식 또는 바람직하지 않은 비정상 세포, 예로서, 신생물 또는 과다형성 성장을 의미한다.
증식성 용태의 일례로는 신생물종양 및 종양(예로서, 조직구종, 신경아교종, 별아교세포종, 골종), 암(예로서, 폐암, 소세포폐암, 위장암, 장암, 결장암, 유방암종, 난소암종, 전립선암, 고환암, 간암, 신장암, 방광암, 췌장암, 뇌암, 육종, 골육종, 카포시육종, 흑색종), 백혈병, 건선, 골질환, 섬유증식성 질환(예로서, 결합 조직) 및 죽상경화증이 예시되나, 이들에만 한정되지 않는 양성, 악성전 및 악성 세포 증식을 포함하나, 이들에만 한정되지 않는다.
폐, 위장(예로서, 장, 결장 포함), 유방(젖), 난소, 전립선, 간(간장), 신장(콩팥), 방광, 췌장, 뇌 및 피부를 포함하나, 이들에만 한정되지 않는 모든 유형의 세포가 치료될 수 있다.
치료 방법
상술한 바와 같이, 본 발명은 요법적 방법에서의 화학식(I)의 화합물의 용도를 제공한다. 또한, 치료를 필요로 하는 대상에게 치료학적 유효량의 화학식(I)의 화합물, 바람직하게는 약제학적 조성물의 형태로 투여하는 것을 포함하는, 치료 방법을 제공한다. 용어 "치료적 유효량"은 환자에 이로운 상태를 제공하기에 충분한 양을 의미한다. 이러한 이점은 적어도 하나의 증상을 적어도 호전시키는 것일 수 있다. 실제 투여량, 투여 속도 및 시간대는 치료되는 대상의 상태 및 중증도에 따라 달라질 것이다. 처방, 예로서, 투여량 결정은 일반의 및 다른 의사들이 결정할 것이다.
화합물은 단독으로 또는 다른 치료제와 병용하여 치료하고자 하는 증상에 따라 동시적으로 또는 순차적으로 투여될 수 있다. 치료법 및 요법의 일례로는 화학요법(예로서, 약물을 포함한 활성제 투여); 수술; 및 방사선 치료를 포함하나, 이들에만 한정되지 않는다.
본 발명에 따른 약제학적 조성물, 및 본 발명에 따른 용도는 활성 성분, 즉, 화학식(I)의 화합물 이외에, 약제학적으로 허용가능한 부형제, 담체, 완충액, 안정제 또는 당업자에 널리 알려진 다른 물질을 포함할 수 있다. 이러한 물질은 비독성이어야 하고, 활성 성분의 약효를 방해하지 않아야 한다. 담체 또는 다른 물질의 정확한 성질은 투여 경로에 따라 달라질 것이며, 이들 투여 경로는 경구, 주사, 예로서, 피내, 경피 또는 정맥내 주사일 수 있다.
경구 투여용 약제학적 조성물은 정제, 캅셀제, 산제 또는 액제 형태일 수 있다. 정제는 고체 담체 또는 애주번트를 포함할 수 있다. 액체 약제학적 조성물은 일반적으로 물, 석유, 동물성 또는 식물성 오일, 광유 또는 합성 오일과 같은 액체 담체를 포함한다. 생리 식염수, 덱스트로스 또는 다른 사카라이드 용액, 또는 에틸렌 글리콜, 프로필렌 글리콜 또는 폴리에틸렌 글리콜과 같은 글리콜이 포함될 수 있다. 캅셀제는 젤라틴과 같은 고체 담체를 포함할 수 있다.
정맥내, 경피 또는 피하 주사, 또는 병변 부위에 주입하는 경우, 활성 성분은 발열물질이 없고 적당한 pH, 등장성 및 안정성을 보유한 비경구적으로 허용가능한 수용액 형태일 것이다. 당업자들은 예로서, 염화나트륨 주사액, 링거 주사액, 락테이트화 링거 주사액과 같은 등장성 비히클을 사용하여 적합한 용액을 제조할 수 있다. 방부제, 안정제, 완충액, 항산화제 및/또는 다른 첨가제들이 필요에 따라 포함될 수 있다.
포함된 다른 형태
달리 언급되지 않는 한, 상기 치환체들의 널리 알려진 이온 형태, 염, 용매화물 및 보호된 형태가 상기에 포함된다. 예를 들어, 카복실산(-COOH)은 또한 이들의 음이온(카복실레이트) 형태(-COO-), 염 또는 용매화물뿐 아니라 통상적인 보호 형태를 포함한다. 유사하게, 아미노기는 아미노기의 양성자화 형태(-N+HR1R2), 염 또는 용매화물, 예로서, 하이드로클로라이드염 및 통상적인 보호 형태를 포함한다. 유사하게, 하이드록실기는 또한 그의 음이온 형태(-0-), 염 또는 용매화물 및 통상적인 보호 형태를 포함한다.
특히, 기(-SOZM)에 대항 언급은 음이온 형태(-SOZ -), 또는 용매화물 및 통상적인 보호 형태를 포함한다.
이성체 및 용매화물
특정의 화합물은 시스-및 트랜스-형태; E-및 Z-형태; c-, t-, 및 r-형태; 엔도-및 엑소-형태; R-, S-및 메소-형태; D-및 L-형태; d-및 l-형태; (+) 및 (-) 형태; 케토-, 에놀-, 에놀레이트-형태; syn- 및 anti-형태; 향사(synclinal)-및 배사(anticlinal)-형태; a-및 β-형태; 축방향 및 수평방향 형태; 배-, 의자-, 트위스트-, 펼쳐진-및 반의자-형태; 및 이들의 조합 형태를 포함하나, 이들에만 한정되지 않는 하나 이상의 특정한 기하이성체, 광학이성체, 에난티오머 형태, 디아스테레오머 형태, 에피머 형태, 아트로픽 형태, 입체이성체, 호변체 형태, 구조 이성체 또는 아노머 형태로 존재할 수 있으며, 이들은 이후 종합적으로 "이성체"(또는 "이성체 형태")로 언급된다.
몇몇 실시태양에서, 본 발명의 화합물은 C11 위치에 하기 입체화학를 갖는다:
호변체 형태에 대해 이후 언급되는 것을 제외하고, 본 원에 사용된 용어 "이성체"로부터 구조(또는 구성) 이성체(즉, 공간에서 원자의 위치보다는 원자간의 결합에 차이가 있는 이성체)는 특별히 제외된다. 예를 들어, 메톡시기, -OCH3인 경우, 그의 구조 이성체, 하이드록시메틸기, -CH2OH를 의미하는 것으로 해석되어서는 안된다. 유사하게, 오르토-클로로페닐은 그의 구조 이성체, 메타-클로로페닐을 의미하지 않는다. 그러나, 구조 부류를 언급할 경우 그 부류 내에 속하는 구조 이성체를 포함할 수 있다(예를 들어, C1-7 알킬은 n-프로필 및 이소-프로필을 포함하며; 부틸은 n-, 이소-, sec-및 t-부틸을 포함하고; 메톡시페닐은 오르토-, 메타-및 파라-메톡시페닐을 포함한다).
상기 언급된 예외 규칙은 호변체 형태, 예로서, 하기 호변체 쌍: 케토/에놀(하기에 나타내었다), 이민/엔아민, 아미드/이미노 알콜, 아미딘/아미딘, 니트로소/옥심, 티오케톤/엔티올, N-니트로소/하이드록시아조 및 니트로/aci-니트로에서와 같이 케토-, 에놀-및 에놀레이트-형태에는 적용되지 않는다:
구체적으로, 용어 "이성체"는 하나 이상의 동위 치환체를 갖는 화합물을 포함함에 주의하기 바란다. 예를 들어, H는 1H, 2H(D) 및 3H(T)를 포함한 임의의 동위 형태일 수 있으며; C는 12C, 13C 및 14C를 포함한 임의의 동위 형태일 수 있고; 0는 160 및 180를 포함한 임의의 동위 형태 등일 수 있다.
달리 명시되지 않으면, 특정 화합물은 (전체 또는 부분) 라세미를 포함한 상기 모든 이성체 형태 및 이들의 다른 혼합물을 포함한다. 이들 이성체 형태의 제조(예로서, 비대칭 합성) 및 분리(예로서, 분별 결정 및 크로마토그래피 수단) 방법은 당업계에 공지되었거나, 본 원에 교시된 방법 또는 공지된 방법을 응용하거나 공지된 방법으로 용이하게 수득된다.
활성 화합물의 상응하는 용매화물을 제조, 정제 및/또는 취급하는 것이 편리하거나 바람직할 수 있다. 용어 "용매화물"은 본 원에서 용질(예로서, 활성 화합물 또는 활성 화합물의 염) 및 용매 복합물을 언급하기 위하여 통상적인 의미로 사용된다. 용매가 물인 경우, 용매화물은 편의상, 수화물, 예로서, 일수화물, 이수화물, 삼수화물 등을 의미할 수 있다.
일반적인 합성 경로
PBD 화합물의 합성은 본 원에서 참고로 인용되는 WO 00/12508호에 상세히 기재되어 있다.
상기 특허 출원에서 논의된 바와 같이, PBD에 대한 바람직한 경로에서 중요한 공정 단계는 B-환을 형성하는 폐환화로서, 이는 알데히드(또는 그의 작용성 등가물)의 생성을 포함하는데, 이는 11-번 위치가 될 것이며, 그 위에서 Pro-N10-질소에 의해 공격을 받게 될 것이다:
상기 식에서, 치환체는 상기 정의된 바와 같고, R8은 다른 PBD 부위에 대한 연결기(-X-R"-X-)이고, R10은 질소 보호기이고, R12는 R2이거나 그의 전구체이다. "차폐된 알데히드" -CPQ는 아세탈 또는 티오아세탈일 수 있으며, 이러한 경우, 폐환화는 노출을 포함한다. 별법으로, 알코올 -CHOH일 수 있으며, 이러한 경우, 반응은 산화, 예로서, TPAP, TEMPO 또는 DMSO(스원(Swern) 산화)에 의한 산화를 포함한다.
차폐된 알데히드 화합물은 상응하는 2,4-치환된 피롤리딘을 2-니트로벤조산으로 축합시킴으로써 생산될 수 있다:
이어서, 니트로기는 -NH2로 환원되고, 적합한 물질, 예로서, 클로로포름에이트와의 반응에 의해 보호됨으로써 이는 화학식(IV)의 화합물에서 제거가능한 질소 보호기를 제공할 수 있다.
산화-폐환화 과정을 포함하는 공정을 반응식 1(폐환화에 대한 대체 유형은 이후 반응식 2에 도시할 것이다)에 도시한다.
반응식 1
A4 체상에서 테트라프로필암모늄 과루테늄산염(TPAP)/N-메틸모르폴린 N-옥시드(NMO)에 알코올(B)(여기에서, Pro-N10-질소는 일반적으로 카바메이트로서 보호된다)을 노출시켜 산화시키고, 이에 수반하여 자발적으로 B-환을 폐환화하여 원하는 생성물 (IV)를 수득하였다. TPAP/NMO 산화 과정은 소규모 반응에 대하여 특히 편리한 반면, DMSO-기반 산화 방법은 사용, 특히, 스원 산화를 사용하는 것은 대규모 작업(예로서, > 1g)에 우수하다는 것이 밝혀졌다. 특히 바람직한 산화제는 CH2Cl2에 용해되어 있는 (디아세톡시요오도)벤젠(1.1 당량) 및 TEMPO(0.1 당량)이다.
폐환화되지 알코올(B)은 식(D)의 질소 보호 시약, 바람직하게, 클로로포름에이트 또는 산 클로라이드를 아미노 알코올 C의 용액에, 일반적으로 용액으로 일반적으로 피리딘과 같은 염기의 존재하에서(바람직하게 2당량) 적당한 온도하에서(예로서, 0℃)에서 반응시켜 제공될 수 있다. 이러한 조건하에서는 O-아실화가 통상 거의 없거나 전혀 없는 것으로 관찰된다.
중요한 아미노 알코올 C는 나머지 분자들을 그대로 남겨두는 방법을 선택하여 상응하는 니트로 화합물 E를 환원시킴으로써 제조할 수 있다. 적절한 용매, 예로서, 환류 메탄올중 염화주석(II)로 E를 처리함으로써 주석 염을 제거한 후, 원하는 생성물을 고수율로 수득한다.
물론 이러한 방법이 가능한 C 및 A-환 치환체의 범위와는 덜 상용성이기는 하나, E를 히드라진/레이니 니켈에 노출시킴으로써 주석 염의 생산을 막고, C를 고수율로 수득할 수 있다. 예를 들면, C-환이 불포화인 경우(환 그 자체에서 또는 R2또는 R3에서), 이러한 기법은 부적합할 수 있다. 또다른 적한합 환원 방법은 촉매로서 탄소상의 팔라듐을 사용하는 촉매적 수소화일 것이다.
화학식(E)의 니트로 화합물은 예로서, K2CO3의 존재하에서 -25℃의 N2 대기하에 적절한 o-니트로벤조일 클로라이드를 화학식(F)의 화합물에 커플링시켜 제조할 수 있다.화학식(F)의 화합물는 예를 들면, L-트랜스-하이드록시 프롤린으로부터 유도된 케톤의 올레핀화에 의해 용이하게 제조될 수 있다. 케톤 중간체는 또한 팔라듐 매개된 커플링 반응에서 사용하기 위한 에놀 트리플레이트로 전환시킴으로써 사용될 수 있다.
o-니트로벤조일 클로라이드는 화학식(G)의 o-니트로벤조산(또는 가수분해 후의 알킬 에스테르)으로부터 합성되는데, 그 자체는 바닐릭산 (또는 알킬 에스테르) 유도체 H로부터 제조된다. 이들 다수는 상업적으로 구입가능하고, 문헌[Althuis, T.H. and Hess, H.J., J. Medicinal Chem., 20(1), 146-266 (1977)]에 개시되어 있다.
대안적
폐환화
(반응식 2)
반응식 2
반응식 1에서의 최종 또는 두번째 단계는 산화적 폐환화였다. 티오아세탈 커플링을 사용하여 대안을 반응식 2에 제시한다. 수은-매개된 노출은 보호된 PBD 화합물 IV를 폐환화시킨다.
티오아세탈 화합물은 반응식 2에 제시된 바와 같이 제조될 수 있고: 티오아세탈 보호된 C-환(문헌 [Langley, D.R. & Thurston, D.E., J. Organic Chemistry , 52, 91-97 (1987)]상의 방법에 의해 제조됨)은 문헌상의 방법을 사용하여 o-니트로벤조산(또는 가수분해 후의 알킬 에스테르)(G)에 커플링된다. 생성된 니트로 화합물은 티오아세탈기 때문에 수소화에 의해 환원될 수 없는 바, 염화주석(II) 방법을 사용하여 아민을 수득한다. 이어서, 예로서, 클로로포름에이트 또는 산 클로라이드, 예로서, 2,2,2-트리클로로에틸클로로포름에이트와의 반응에 의해 N-보호된다. 아세탈-포함 C-환은, 산성 조건의 사용을 비롯한 다른 방법들을 포함하는 탈보호를 포함하는 이러한 유형의 경로에서 대안으로 사용될 수 있다.
이량체
합성(반응식 3)
반응식 3
본 발명에서의 것과 같은 PBD 이량체는 보호된 PBD 단량체를 합성하기 위해 개발된 전략법을 사용하여 합성될 수 있다. 반응식 3에 도시한 합성 경로는 이량체가 식 -O-(CH2)n-O-으로 연결되었을 때의 화합물을 제시하고 있고, 다른 이량체 연결에 대하여 용이하게 변형될 수 있다. 이량체 형성 단계는 보통 비스(니트로산) G'를 형성하기 위해 수행된다. 이어서, 이러한 화합물은 상기 반응식 1 또는 반응식 2에서와 같이 화합물 G로서 처리될 수 있다.
비스(니트로산) G'는 비스(카복실산)을 니트로화(예로서, 70% 니트르산)하여 수득될 수 있다. 이는 염기 조건하에 적절한 디요오도알칸을 사용하여 2당량의 관련 벤조산을 알킬화시킴으로써 합성될 수 있다. 다수의 벤조산은 상업적으로 구입가능하고, 다른 것들은 종래의 방법에 의해 합성될 수 있다. 별법으로, 관련 벤조산 에스테르는 적절한 알칸디올로 미츠노부(Mitsunobu) 에테르화한 후, 니트로화하고, 이어서 가수분해(도시하지 않음)함으로써 함께 연결될 수 있다.
비스(니트로산)의 대안적 합성은 예로서, 과망간산염을 사용하는 비스(니트로 알데히드)의 산화를포함한다. 이는 결국 예로서, 70% HNO3을 사용하는 비스(알데히드)의 직접적인 니트로화에 의해 수득될 수 있다. 최종적으로 비스(알데히드)는 적절한 알칸디올로 2당량의 벤조산 알데히드를 미츠노부 에테르화하여 수득될 수 있다.
PBD
에 대한 대안적 경로
N10 보호된 PBD를 합성하는 대안 방법은 본원에서 인용되고 있으며, 이소시아네이트 중간체의 사용에 대하여 기재되어 있는 WO 2005/023814에 개시되어 있다.
C2
아릴 치환체 도입:
C2
에
이탈기를
도입한다
C2 아릴 치환체는 적절한 물질을 사용하여 출발함으로써 화학식(IV)의 화합물중 적소에 존재할 수 있는데, 이러한 경우, N10은 탈보호화되어 원하는 화합물을 수득할 수 있다(하기 참조). 별법으로, R12가 보호된 하이드록시기인 경우 하기 방법을 사용할 수 있다. 폐환화하여 B-환을 형성한 후, 이어서, C11-알코올 IV는 종래의 방법에 의해 바람직하게 재-보호화되어 IIIb를 수득한다. 예를 들면, R11이 TBS인 경우, IV를 TBSOTf 및 2,6-루티딘과 반응시킴으로서 보호화될 수 있다. 이어서, IIIb를 C2-보호기로부터 절단함으로써 C2 알코올을 수득한다. 예를 들면, C2 보호기(R14)가 아실인 경우, K2CO3 수용액을 첨가함으로써 탈보호화를 실시할 수 있다.
C11 위치에서의 재보호화 및 C2 알코올에서의 탈보호화를 통해 C11 위치에 변함없이 남아있는 C2 알코올 위치를 선택적으로 순차적으로 반응시킬 수 있다. 이어서, C2-알코올을 케톤 IIIb로 산화시킬 수 있다. 바람직하게, 이러한 산화는 스웸(Swem) 조건하에서 우수한 수율로 실시된다. 그러한 TPAP 또는 데스 마르틴(Dess Martin) 시약을 포함하는 다른 산화 방법은 우수한 수율을 제공한다.
화학식(II)의 화합물중 R"12는 -OSO2CH3, -OSO2(CnF2n +i)(여기에서, n=0, 1 또는 4) 또는 -OSO2RS일 수 있는데, 이러한 경우, 적절한 무수물로 처리함으로써 IIIb로부터의 전환을 수행할 수 있다. R"12가 프리플레이트인 경우, 피리딘의 존재하에 DCM중 트리플루오로 메탄설폰산 무수물과 반응한다.
화학식(II)의 화합물중 R"12는 또한 -I 또는 -Br일 수 있고, 이러한 경우, 히드라진 및 요오드 또는 브롬과 각각 반응함으로써 IIIb로부터의 전환을 수행할 수 있다.
화학식(II)의 화합물중 R"12는 또한 -Cl일 수 있고, 이 경우, 옥시염화인(예로서, POCl3)과의 반응에 의해 IIIb로부터의 전환을 수행할 수 있다.
C2
아릴 치환체의 도입:
이탈기
대체
다양한 조건하에서 이러한 화학식(II)의 화합물을 반응시켜 C2 위치에 커플링된 부속기를 갖는 PBD 전구체 분자 Ic를 수득할 수 있다.
특히, 예로서, 스즈키(Suzuki), 스틸레(Stille) 및 헤크(Heck) 커플링과 같은 팔라듐 촉매화된 커플링을 사용하는 것이 바람직하다. 팔라듐 촉매는 임의의 적합한 촉매, 예를 들면, Pd(PPh3)4, Pd(OCOCH3)2, PdCl2, Pd(dba)3일 수 있다. 커플링되는 화합물은 임의의 적합한 시약으로서, 예로서, 헤크인 경우, sp 2 H를 갖는 알켄; 스틸레인 경우, 오가노스태난; 및 스즈키인 경우, 유기붕소일 수 있다.
본 발명의 바람직한 측면에서, 커플링은 마이크로파 조건하에서 실시될 수 있다. 전형적으로 팔라듐 촉매, 예로서, Pd(PPh3)4는 후처리를 촉진시키고 촉매의 가능한 재순환을 허용하기 위하여 예를 들면, 폴리스티렌상에 지지된 고체이다. PS-DEAM을 사용하여 트리플레이트를 완전히 소비시킨 후, 커플링 생성물을 단리시키기 위하여 사용되는 상 분리기 카트리지로 미반응 보론산을 격리시킬 수 있다. 그러한 방법을 통해 동시에 하나 이상(예로서, 10, 20 또는 30개 이하)의 화합물을 평형 합성시킬 수 있다.
화학식(Ic)의 화합물중 이민 결합을 표준 방법에 의해 탈보호화시켜 탈보호화된 화합물 Ib를 수득할 수 있다(사용되는 용매에 따라 그의 카비놀아민 또는 카보닐아민 에테르 형태일 수 있다). 예를 들면, R10이 Alloc인 경우, 팔라듐을 사용하여 N10 보호기를 제거한 후, 물을 제거하여 탈보호화를 수행한다. R10이 Troc인 경우, Cd/Pb 커플를 사용하여 탈보호화를 수행함으로써 화학식(Ib)의 화합물을 수득한다.
본원에서 참고로 인용되는 WO 2004/043963 및 WO 2005/085251에서의 합성 논의 및 실시예를 참고한다.
황 함유 형태로의 전환
적절한 중아황산염 또는 설피네이트 염을 첨가한 후, 적절한 정제 단계에 의해 화학식(Ib)의 화합물을 본 발명의 것으로 전환시킬 수 있다. 추가의 방법은, 본원에서 참고로 인용되는 GB 2 053 894에 기술되어 있다.
추가의 바람직한 것
X는 O인 것이 바람직하다.
R"는 포화된 선형 C3 -12 알킬렌기를 나타내는 것이 바람직하고, 3, 5, 7, 8, 9, 10, 11 또는 12개의 탄소 원자를 갖는 알킬렌기를 나타내는 것이 더욱 바람직하다. 이들중 C3 및 C5 포화된 선형 알킬렌기가 바람직하다.
R9는 바람직하게 H이다.
R6은 바람직하게 H, OH, OR, SH, NH2, 니트로 및 할로로부터 선택되고, 더욱 바람직하게는 H 또는 할로이며, 가장 바람직하게는 H이다.
R7은 바람직하게 H, OH, OR, SH, SR, NH2, NHR, NRR', 및 할로로부터 선택되고, 더욱 바람직하게는 독립적으로 H, OH 및 OR로부터 선택되며, 여기에서, R은 임의로 치환된 C1 -7 알킬, C3 -10 헤테로사이클릴 및 C5 -10 아릴 기로부터 선택된다. 7-번 위치의 특히 바람직한 치환체는 OMe 및 OCH2Ph이다.
R2는 바람직하게 임의로 치환된 C5 -7 아릴기, 및 가장 바람직하게 임의로 치환된 페닐기이다.
몇몇 실시태양에서, R2는 C9 -12 아릴기, 예를 들면, 나프틸-1-일 또는 나프-2-일이다. C9 -12 아릴기의 추가의 일례로는 퀴놀리닐, 예를 들면, 퀴놀린-2-일, 퀴놀린-3-일 및 퀴놀린-6-일을 포함한다.
다른 실시태양에서, R2는 C5 -7 헤테로아릴기, 예를 들면, 푸라닐, 티오페닐 및 피리딜이다. 이들 중 티오페닐, 예를 들면, 티오펜-2-일 및 티오펜-3-일이 바람직하다.
C5 -20 아릴기는 임의의 치환기를 가질 수 있다. 바람직하게는 1 내지 3개의 치환기를 갖고, 1 및 2개의 더욱 바람직하며, 1개의 치환기를 갖는 것이 가장 바람직하다.
바람직한 C5 -20 아릴 치환체, 특히, 페닐에 대하여 바람직한 C5 -20 아릴 치환체, 할로(예로서, F, Cl, Br); C1 -7 알콕시(예로서, 메톡시, 에톡시); C1 -7 알킬(예로서, 메틸, 트리플루오로메틸, 에틸, 프로필, t-부틸); 비스-옥시-알킬렌(예로서, 비스-옥시-메틸렌, -0-CH2-O-)을 포함한다.
특히 바람직한 치환된 C5 -20 아릴기는 4-메틸-페닐, 4-메톡시-페닐, 3-메톡시페닐, 4-플루오로-페닐, 3,4-비스옥시메틸렌-페닐, 4-트리플루오로메틸페닐, 4-메틸티오페닐, 4-시아노페닐 및 4-페녹시페닐을 포함하나, 이들에만 한정되지 않는다.
특히 바람직한 비치환된 C5 -20 아릴기는 티오펜-2-일, 나프-2-일, 퀴놀린-3-일 및 퀴놀린-6-일을 포함하나, 이들에만 한정되지 않는다.
R이 임의로 치환된 C1 -12 알킬인 경우, 이는 임의로 치환된 C1 -7 알킬인 것이 바람직하다.
PBD 단량체 양자 모두는 동일하게 치환되는 것이 바람직하다.
M 및 M'은 1가 약제학적으로 허용가능한 양이온인 것이 바람직하고, Na+인 것이 더욱 바람직하다.
z는 바람직하게 3이다.
바람직한 화합물은 하기의 것들을 포함한다:
더욱 바람직한 화합물은 하기의 것들을 포함한다:
가장 바람직한 화합물은 하기의 것을 포함한다:
상기 바람직한 화합물은 또한 C5 알킬렌 연결 쇄를 가질 수 있다.
실시예
1
(a) (2S,4R)-N-( 벤질옥시카보닐 )-2-t- 부틸디메틸실릴옥시메틸 -4-하이드록시피롤리딘( 1 )
화합물 1은 트랜스-4-하이드록시-L-프롤린으로부터 출발하여 당업계에 공지된 4개의 공정 과정을 거쳐 고수율로 형성된다[S.J. Gregson et al., J. Med . Chem., 2004, 1161-1174].
(b) (2S,4R)-N-( 벤질옥시카보닐 -2-t- 부틸디메틸실릴옥시메틸 -4- 옥시아세틸 피롤리딘( 2 )
피리딘(18.3g, 18.7mL, 232mmol, 1.1당량), 아세트산 무수물(23.6g, 21.8mL, 232mmol, 1.1당량) 및 DMAP (5.14g, 42.1mmol, 0.2당량)을 무수 THF(1L)중 1(76.9g, 211mmol)의 교반된 용액에 가하였다. 반응 혼합물을 16시간 동안 교반한 후, TLC(95:5v/v CHCl3/MeOH)를 통해 출발 물질이 완전히 소비되었음을 나타내었다. 회전식 증발에 의해 과량의 용매를 제거하고, 잔류물을 EtOAc(1L)에 용해시키고, HCl(2 x 1L), H2O(1L), 염수(1L)로 세척하고, 건조시켰다(MgSO4). 용매를 여과하고 증발시켜 무색 오일로서 아세테이트 2(80.7g, 94%)를 수득하였다:
(c) (2S,4R)-2-t- 부틸디메틸실릴옥시메틸 -4- 옥시아세틸피롤리딘( 3 )
무수 에탄올(10mL)중 실릴 에테르 2(1.95g, 4.80mmol) 및 10% Pd/C(0.17g) 슬러리를 16시간 동안 45 Psi에서 Parr 수소화시킨 후,TLC(95:5v/v CHCl3/MeOH)를 통해 출발 물질이 완전히 소비되었음을 나타내었다. 반응 혼합물을 셀라이트를 통해 여과하여 Pd/c를 제거하고, 필터 패드를 에탄올로 반복하여 세척하였다. 감압하에 회전식 증발에 의해 과량의 용매를 제거하여 옅은 오렌지색의 왁스성 오일로서 아민 3(1.28g, 98%)을 수득하였다: IR (CHCl3) 3315, 2930, 2858, 1739, 1652,1472,1435, 1375, 1251,1088, 838, 779, 667cm-1.
(d) 1,1'-[[(프로판-1,3- 디일 ) 디옥시 ] 비스 [(2S,4R)-(5- 메톡시 -2-니트로-1,4-페닐렌) 카보닐 ]] 비스 [2-(t- 부틸디메틸실릴옥시메틸 )-4- 옥시아세틸피롤리딘 ]( 5 )
촉매량의 DMF(2방울)를 무수 THF(250mL)중 니트로산 4(8.12g, 17.4mmol)1 및 옥살릴 클로라이드(3.80mL, 5.52g, 43.5mmol, 2.5당량)의 교반된 용액에 가하였다. 초기 침전물을 점차적으로 용해시키고, 반응 혼합물을 16시간 동안 실온에서 교반하였다. 생성된 산 클로라이드 용액을 질소 대기하에 0℃에서(얼음/아세톤) THF(100mL)중 아민 3(11.9g, 43.5mmol, 2.5당량), TEA(9.71mL, 7.05g, 69.7mmol, 4.0당량) 및 H2O(2.26mL)의 교반된 혼합물에 적가하였다. 반응 혼합물을 실온으로 가온시키고, 추가의 2.5시간 동안 교반하였다. 과량의 THF는 회전식 증발에 의해 제거하고, 생성된 잔류물을 H2O(400mL)과 EtOAc(400mL) 사이에 분배하였다. 층을 분리시키고, 수층을 EtOAc(3 x 200mL)로 추출하였다. 이어서, 혼합된 유기층을 포화된 NH4Cl(200mL), 포화된 NaHCO3(200mL), 염수(200mL)로 세척하고, 건조시켰다(MgSO4). 용매를 여과하고 증발시켜 다크 오일로서 미정제 생성물을 수득하였다. 플래쉬 크로마토그래피(99.7:0.3v/v CHCl3/MeOH)에 의해 정제하여 옅은 황색 유리상으로서 순수한 아미드 5(13.3g, 78%)를 분리하였다:
(e) 1,1'-[[(프로판-1,3- 디일 ) 디옥시 ] 비스 [(2S,4R)-(5- 메톡시 -2-아미노-1,4-페닐렌) 카보닐 ]] 비스 [2-(t- 부틸디메틸실릴옥시메틸 )-4- 옥시아세틸피롤리딘 ]( 6 )
티오황산나트륨(16.59g, 95.27mmol, 5당량)을 H2O(200mL) 및 THF(400mL)중 아미드 5(18.6g, 19.1mmol) 교반된 용액에 첨가하였다. 반응 혼합물을 36시간 동안 교반한 후, 과량의 THF 회전식 증발에 의해 제거하고, 생성된 잔류물을 EtOAc(3 x 250mL)로 추출하였다. 이어서, 혼합된 유기층을 H2O(300mL), 염수(300mL)로 세척하고, 건조시켰다(MgSO4). 용매를 여과하고 증발시켜 미정제 생성물을 수득하고, 이를 플래쉬 크로마토그래피(80:20v/v 헥산/EtOAc 이후의 구배는 순 EtOAc로)에 의해 정제하여 황색 포움으로서 생성물 6(9.53g, 55%)을 수득하였다:
(f) 1,1'-[[(프로판-1,3- 디일 ) 디옥시 ] 비스 [(2S,4R)-[5- 메톡시 -1,4- 페닐렌 -2-(2,2,2-트 리클로로에톡시카보 닐아미노)] 카보닐 ]] 비스 [2-(t- 부틸디메틸실릴옥시메 틸)-4- 옥시아세틸피롤리딘]( 7 )
무수 DCM(60mL)중 2,2,2-트리클로로에틸 클로로포름에이드(3.58mL, 5.50g, 26.0mmol, 2.2당량) 용액을 -10℃에서(액상 N2/에탄디올) 무수 DCM(15OmL)중 무수 피리딘(3.82mL, 3.80g, 47.2mmol, 4.0당량) 및 비스-아닐린 6(10.8g, 11.8mmol) 용액에 적가하였다. 실온에서 16시간 후에, 반응 혼합물을 포화된 NH4Cl(2 x 150mL), 포화된 CuSO4(150mL), H2O(150mL), 염수(150mL)로 세척하고, 건조시켰다(MgSO4). 용매를 여과하고 증발시켜 황색 점성 오일을 수득하고, 이를 플래쉬 크로마토그래피(70:30v/v 헥산/EtOAc)에 의해 정제하여 백색 유리상으로서 생성물 7(13.8g, 92%)을 수득하였다.
(g) 1,1'-[[(프로판-1,3- 디일 ) 디옥시 ] 비스 [(2S,4R)-[5- 메톡시 -1,4- 페닐렌 -2-(2,2,2-트 리클로로에톡시카보닐 아미노)] 카보닐 ]] 비스 (2- 하이드록시메틸 -4- 옥시아세틸피롤리딘 )( 8 )
빙초산(310mL) 및 H2O(100mL) 혼합물을 THF(250mL)중 7(13.8g, 10.9mmol)의 용액에 가하고, 16시간 동안 실온에서 교반하였다. 반응 혼합물을 DCM(750mL)으로 희석시키고, 포화된 NaHCO3(5L)로 중화시켰다. 수층을 DCM(3 x 500mL)으로 추출하고, 유기층을 혼합하고, 염수(1L)로 세척하고, 건조시켰다(MgSO4). TLC(60:40v/v 헥산/EtOAc)를 통해 출발 물질이 완전히 소실되었음을 확인하였다. 용매를 여과하고 증발시켜 미정제 생성물을 수득하고, 이를 플래쉬 칼럼 크로마토그래피(99.7:0.3v/v CHCl3/MeOH 이후의 구배는 96:4v/v CHCl3/MeOH로)에 의해 정제하여 백색 유리상으로서 생성물 8(11.6g, > 100%)을 수득하였다:
(h) 1,1'-[[(프로판-1,3- 디일 ) 디옥시 ] 비스 [(11S,11 aS , 2R)-10-(2,2,2- 트리 클로로에톡시카보닐)-11- 하이드록시 -7- 메톡시 -2- 옥시아세틸 -1,2,3,10,11,11a- 헥사하이드로 -5H- 피롤로[2,1-c][1,4]벤조디아제핀 -5-온]]( 9 )
TEMPO(0.69g, 4.42mmol, 0.4당량) 및 BAIB(15.7g, 48.7mmol, 4.4당량)를 DCM(150mL)중 디올 8(11.5g, 11.1mmol)의 교반된 용액에 가하였다. 반응 혼합물을 2시간 동안 교반하고, 포화된 NaHSO3(500mL), 포화된 NaHCO3(500mL), 염수(200mL)로 세척하고, 건조시켰다(MgSO4). 용매를 여과하고 증발시켜 미정제 생성물을 수득하고, 이를 플래쉬 칼럼 크로마토그래피(99.9:0.1v/v CHCl3/MeOH 이후의 구배는 99.7:0.3v/v CHCl3/MeOH로)에 의해 정제하여 황색 유리상으로서 생성물 9(4.43g, 39%)를 수득하였다:
(i) 1,1'-[[(프로판-1,3- 디일 ) 디옥시 ] 비스 [(11S,11 aS ,2R)-10-(2,2,2- 트리클 로로에톡시카보닐)-11-(t- 부틸디메틸실릴옥시 )-7- 메톡시 -2- 옥시아세틸 -1,2,3,10,11,11a-헥사하이드로-5H- 피롤로[2,1-c][1,4]벤조디아제핀 -5-온]]( 10 )
TBSOTf(2.70mL, 3.10g, 11.7mmol, 3.0당량)를 DCM(50mL)중 비스-알코올 9(4.05g, 3.91mmol) 및 2,6-루티딘(1.82mL, 1.68g, 15.6mmol, 4.0당량)의 교반된 용액에 가하였다. 반응 혼합물을 2.5시간 동안 교반하고, DCM(150mL)로 희석시키고, 포화된 CuSO4(2 X 100mL), 포화된 NaHCO3(100mL), 염수(200mL)로 세척하고, 건조시켰다(MgSO4). 용매를 여과하고 증발시켜 미정제 생성물을 수득하고, 이를 플래쉬 칼럼 크로마토그래피(99.9:0.1v/v CHCl3/MeOH)에 의해 정제하여 백색 유리상으로서 생성물 10(5.05g, >100%)을 수득하였다.
j) 1,1'-[[(프로판-1,3- 디일 ) 디옥시 ] 비스 [(11S,11 aS ,2R)-10-(2,2,2- 트리클 로로에톡시카보닐)-11-(t- 부틸디메틸실릴옥시 )-7- 메톡시 -2- 하이드록시 -1,2,3,10, 11,11a-헥 사하 이드로-5H- 피롤로[2,1-c][1,4]벤조디아제핀 -5-온]]( 11 )
H2O(2mL)중 K2CO3(93mg, 0.67mmol, 5.0당량) 용액을 MeOH(3mL)중 아세테이트 10(170mg, 0.13mmol)의 교반된 용액에 적가하였다. 초기의 무색 용액은 최종적으로는 황색으로 변색되고, 백색 침전물이 형성되는 것이 관찰되었다. TLC(95:5v/v CHCl3/MeOH)를 통해 출발 물질이 완전히 소비된 것으로 나타났을 때 반응 혼합물을 16시간 동안 교반하였다. 회전식 증발에 의해 과량의 용매를 제거하고, 1N HCl을 사용함으로써 주의하여 혼합물을 pH 7로 중화시켰다. 생성된 혼합물을 EtOAc(3 x 25mL)로 추출하고, 이어서 혼합된 유기층을 염수(40mL)로 세척하고, 건조시켰다(MgSO4). 용매를 여과하고 제거하여 백색 유리상으로서 생성물 11(151mg, 95%)을 수득하였다:
(k) 1,1'-[[(프로판-1,3- 디일 ) 디옥시 ] 비스 [(11S,11 aS )-10-(2,2,2- 트리클로로에톡시카보닐 )-11-(t- 부틸디메틸실릴옥시 )-7- 메톡시 -2-옥소-1,2,3,10,11,11a- 헥사하이드로 -5H- 피롤로[2,1-c][1,4]벤조디아제핀 -5-온]]( 12 )
무수 DCM(20mL)중 무수 DMSO(0.82mL, 0.90g, 11.5mmol, 6.0당량) 용액을 질소 대기하에 -6O℃에서(Hq N2/CHCl3) 옥살릴 클로라이드(DCM중 2M 용액 2.88mL, 5.76mmol, 3.0당량)의 교반된 용액에 적가하였다. 1.5시간 동안 -55℃에서 교반한 후, 무수 DCM(30mL)중 기질 11(2.26g, 1.92mmol)의 용액을 반응 혼합물에 적가한 후, -45℃에서 추가의 2시간 동안 교반하였다. 무수 DCM(90mL)중 TEA(10.8mL, 7.82g; 71.7mmol, 4.2당량) 용액을 혼합물에 적가하고, 추가의 30분 동안 교반하였다. 반응 혼합물을 방치하여 0℃로 가온시키고, 냉 1N HCl(2 x 50mL), H2O(50mL), 염수(50mL)로 세척하고, 건조시켰다(MgSO4). 용매를 진공하에 여과하고 증발시켜 미정제 생성물을 수득하고, 이를 플래쉬 칼럼 크로마토그래피(70:30v/v 헥산/EtOAc 이후의 구배는 40:60v/v 헥산/EtOAc로)로 정제하여 백색 유리상으로서 카비놀아민 12(1.62g, 72%)를 수득하였다:
(l) 1,1'-[[(프로판-1,3- 디일 ) 디옥시 ] 비스 [(11S,11 aS )-10-(2,2,2- 트리클로로에톡시카보닐 )-11-(t- 부틸디메틸실릴옥시 )-7- 메톡시 -2-[[( 트리플루오로메틸 ) 설포닐 ] 옥시 ]-1,10,11,11a- 테트라하이드로 -5H- 피롤로[2,1-c][1,4]벤조디아제핀 -5-온]]( 13 )
새로 개봉한 앰플로부터의 취한 트리플산 무수물(3.09mL, 5.19g, 18.4mmol, 22당량)을 1분량으로 질소 대기하에 실온에서 무수 DCM(50mL) 실온에서 케톤 12(0.98g, 0.84mmol) 및 무수 피리딘(1.49mL, 1.46g, 18.4mmol, 22당량)의 왕성하게 교반된 용액에 신속하게 가하였다. 초기 침전물을 점차적으로 용해시키고, 용해는 최종적으로는 암적색으로 변색되었다. TLC(80:20v/v EtOAc/헥산)를 통해 출발 물질이 완전히 소비된 것으로 나타났을 때 반응 혼합물을 4.5시간 동안 교반하였다. 혼합물을 포화된 냉 NaHCO3(60mL)에 붓고, DCM(3 x 80mL)으로 추출하였다. 이어서, 혼합된 유기층을 포화된 CuSO4(2 x 125mL), 염수(125mL)로 세척하고, 건조시켰다(MgSO4). 용매를 여과하고 증발시켜 미정제 생성물을 수득하고, 이를 플래쉬 칼럼 크로마토그래피(80:20v/v 헥산/EtOAc)에 의해 정제하여 옅은 황색 유리상으로서 트리플레이트 13(0.74mg, 61%)을 수득하였다:
(m) 1,1'-[[(프로판-1,3- 디일 ) 디옥시 ] 비스 [(11S,11 aS )-10-(2,2,2- 트리클로 로에톡시카보닐)-11-(t- 부틸디메틸실릴옥시 )-7- 메톡시 -2-(p- 메톡시벤젠 )-1,10,11,11a-테 트라하이 드로-5H- 피롤로[2,1-c][1,4]벤조디아제핀 -5-온]]( 14 )
H2O(1.5mL) 및 EtOH(10mL)중 TEA(0.20mL, 148mg, 1.46mmol, 6.0당량) 용액을 실온에서 톨루엔(10mL)중 트리플레이트 13(350mg, 0.24mmol)의 용액에 가하였다. 상기 혼합물에 4-메톡시벤젠보론산(96mg, 0.63mmol, 2.6당량) 및 Pd(PPh3)4(11mg, 9μmol, 0.04당량)을 가하였다. TLC(80:20v/v EtOAc/헥산)를 통해 출발 물질이 완전히 소비되었음이 나타났을 때, 반응 혼합물을 15분 동안 교반하였다. 과량의 용매 를 제거하고, 잔류물을 EtOAc(25mL)에 용해시키고, H2O(15mL), 염수(15mL)로 세척하고, 건조시켰다(MgSO4). 용매를 여과하고 증발시켜 미정제 생성물을 수득하고, 이를 플래쉬 칼럼 크로마토그래피(80:20v/v 헥산/EtOAc 이후의 구배는 50:50v/v 헥산/EtOAc)에 의해 정제하여 황색 유리상으로서 14(286mg, 87%)를 수득하였다:
(n) 1,1'-[[(프로판-1,3- 디일 ) 디옥시 ] 비스 [(11 aS )-7- 메톡시 -2-(p- 메톡시벤젠 )-1,11a- 디하이드로 -5H- 피롤로[2,1-c][1,4]벤조디아제핀 -5-온]]( ZC -207 )
10% Cd/Pd 커플(461mg, 3.73mmol, 20당량)을 신속하게 교반되는 14(253mg, 0.19mmol), THF(5mL) 및 1N NH4OAc(5mL)의 혼합물에 가하였다. TLC를 통해 출발 물질이 완전히 소비되었음이 나타났을 때, 반응 혼합물을 15시간 동안 교반하였다. 고체를 여과하고, H2O 및 DCM으로 세정하였다. 수층을 DCM(3 x 30mL)으로 추출하고, 유기 추출물을 혼합하고, 염수(50mL)로 세척하고, 건조시켰다(MgSO4). 용매를 여과하고 증발시켜 미정제 생성물을 수득하고, 이를 플래쉬 칼럼 크로마토그래피(99.9:0.1v/v CHCl3/MeOH 이후의 구배는 95:5v/v CHCl3/MeOH)에 의해 정제하여 황색 유리상으로서 ZC -207(132mg, 96%)을 수득하였다:
(o) 1,1'[[(프로판-1,5- 디일 ) 디옥시 ] 비스 [(11 aS )-11- 설포 -7- 메톡시 -2-(4- 메톡시페닐 )-1,10,11,11a- 테트라하이드로 -5H- 피롤로[2,1-c][1,4]벤조디아제핀 -5-온]] 나트륨 염( ZC -423 )
물(1.5mL)중 중아황산나트륨(6.74mg, 65μmol) 용액을 디클로로메탄(1.5mL)중 ZC -207(24.01mg, 32μmol)의 교반된 용액에 가하였다. 반응 혼합물을 2시간 동 안 왕성하게 교반한 후, 유기층 및 수층을 분리하였다. 수성 상의 TLC 분석(용리제-EtOAc)을 통해 ZC-207은 존재하지 않고, uv 흡수성이 강한 기준 물질이 존재한다는 것이 밝혀졌다. 수층을 동결건조시켜 백체 고체로서 중아황산염 부가물 ZC -423(17mg, 55%)을 수득하였다:
실시예
2
(a) 1,1'-[[(프로판-1,3- 디일 ) 디옥시 ] 비스 [(11S,11 aS )-10-(2,2,2- 트리클로 로에톡시카보닐)-11-(t- 부틸디메틸실릴옥시 )-7- 메톡시 -2-(나프탈렌-2-일)-1,10,11,11a-테트라하이드로-5H- 피롤로[2,1-c][1,4]벤조디아제핀 -5-온]]( 17 )
H2O(1mL) 및 EtOH(10mL)중 TEA(0.15mL, 1.05mmol, 6.0당량) 용액을 실온에서 톨루엔(6mL)중 13(251mg, 0.17mmol)의 용액에 가하였다. 상기 혼합물에 2-나프탈렌보론산(77.9mg, 0.45mmol, 2.6당량) 및 Pd(PPh3)4(8.0mg, 7μmol, 0.04당량)을 가하였다. TLC(80:20v/v EtOAc/헥산)를 통해 출발 물질이 완전히 소비되었음이 나타났 을 때, 20분 동안 마이크로파 조사하에 100℃에서 반응 혼합물을 가열하였다. 과량의 용매를 제거하고, 잔류물을 EtOAc(20mL)에 용해시키고, H2O(15mL), 염수(15mL)로 세척하고, 건조시켰다(MgSO4). 용매를 여과하고 증발시켜 미정제 생성물을 수득하고, 이를플래쉬 칼럼 크로마토그래피(80:20v/v 헥산/EtOAc 이후의 구배는 50:50v/v 헥산/EtOAc)에 의해 정제하여 황색 유리상으로서 17(191mg, 81%)을 수득하였다:
(b) 1,1'-[[(프로판-1,3- 디일 ) 디옥시 ] 비스 [(11 aS )-7- 메톡시 -2-(나프탈렌-2-일)-1,11a- 디하이드로 -5H- 피롤로[2,1-c][1,4]벤조디아제핀 -5-온]]( 18 )
10% Cd/Pd 커플(455mg, 3.71mmol, 26당량)을 신속하게 교반되는 17(190mg, 0.14mmol), THF(3.2mL) 및 1N NH4OAc(3.2mL)의 혼합물에 가하였다. TLC를 통해 출발 물질이 완전히 소비되었음이 나타났을 때, 반응 혼합물을 6.5시간 동안 교반하였다. 고체를 여과하고, H2O 및 MeOH로 세정하였다. 과량의 용매를 제거하고, 잔류물 을 H2O(25mL) 및 DCM(25mL)로 희석시켰다. 수층을 DCM(3 x 25mL)으로 추출하고, 유기 추출물을 혼합하고, 염수(50mL)로 세척하고, 건조시켰다(MgSO4). 용매를 여과하고 증발시켜 미정제 생성물을 수득하고, 이를 플래쉬 칼럼 크로마토그래피(99:1v/v CHCl3/MeOH 이후의 구배는 98:2v/v CHCl3/MeOH)에 의해 정제하여 황색 유리상으로서 38(38mg, 36%)을 수득하였다:
(c) 1,1'-[[(프로판-1,3- 디일 ) 디옥시 ] 비스 [(11 aS )-11- 설포 -7- 메톡시 -2-(나프탈렌-2-일)-1,10,11,11a- 테트라하이드로 -5H- 피롤로[2,1-c][1,4]벤조디아제핀 -5-온]] 나트륨 염( 19 )
H2O(1.5mL)중 중아황산나트륨(6.67mg, 0.064mmol, 2.0당량) 용액을 무수 DCM(1.5mL)중 화합물 18(25mg, 0.032mmol)의 용액에 가하였다. 반응 혼합물을 5시간 동안 교반하였다. 반응 혼합물을 DCM(5mL) 및 H2O(5mL)로 희석시켰다. 수층을 분리하고(분리식 깔때끼를 진탕시키지 않고), 세척하고, 냉동 건조기하에서 건조시켜 백색 고체로서 경량의 19(7mg, 22%)를 수득하였다:
실시예
3
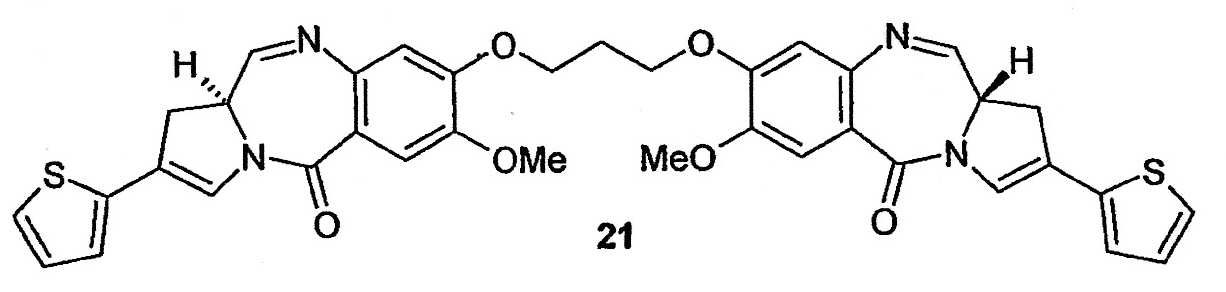
(a) 1,1'-[[(프로판-1,3- 디일 ) 디옥시 ] 비스 [(11S,11 aS )-10-(2,2,2- 트리클로 로에톡시카보닐)-11-(t- 부틸디메틸실릴옥시 )-7- 메톡시 -2-(티오펜-2-일)-1,10,11,11a-테트라하이드로-5H- 피롤로[2,1-c][1,4]벤조디아제핀 -5-온]]( 20 )
H2O(0.8mL) 및 EtOH(5mL)중 TEA(0.11mL, 0.82mmol, 6.0당량) 용액을 톨루엔(5mL)중 13(197mg, 0.14mmol)의 용액에 가하였다. 상기 혼합물에 티오펜-2-보론산(45.5mg, 0.36mmol, 2.6당량) 및 Pd(PPh3)4(6.3mg, 5μmol, 0.04당량)를 가하였다. TLC(80:20v/v EtOAc/헥산)를 통해 출발 물질이 완전히 소비되었음이 나타났을 때, 반응 혼합물을 실온에서 3시간 동안 교반하였다. 과량의 용매를 제거하고, 잔류물을 EtOAc(20mL)에 용해시키고, H2O(15mL), 염수(15mL)로 세척하고, 건조시켰다(MgSO4). 용매를 여과하고 증발시켜 미정제 생성물을 수득하고, 이를 플래쉬 칼럼 크로마토그래피(80:20v/v 헥산/EtOAc)에 의해 정제하여 황색 유리상으로서 20(168mg, 94%)를 수득하였다:
(b) 1,1'-[[(프로판-1,3- 디일 ) 디옥시 ] 비스 [(11 aS )-7- 메톡시 -2-(티오펜-2-일)-1,11a- 디하이드로 -5H- 피롤로[2,1-c][1,4]벤조디아제핀 -5-온]]( 21 )
10% Cd/Pd 커플(288mg, 2.35mmol, 20당량)을 신속하게 교반되는 20(154mg, 0.12mmol), THF(3mL) 및 1N NH4OAc(3mL)의 혼합물에 가하였다. TLC를 통해 출발 물질이 완전히 소비되었음이 나타났을 때, 반응 혼합물을 3시간 동안 교반하였다. 고체를 여과하고, H2O 및 DCM으로 세정하였다. 수층을 DCM(3 x 15mL)으로 추출하고, 유기 추출물을 혼합하고, 염수(40mL)로 세척하고, 건조시켰다(MgSO4). 용매를 여과하고 증발시켜 미정제 생성물을 수득하고, 이를 플래쉬 칼럼 크로마토그래피(99:1v/v CHCl3/MeOH 이후의 구배는 98:2v/v CHCl3/MeOH)에 의해 정제하여 황색 유리상으로서 21(59mg, 72%)을 수득하였다:
(c) 1,1'-[[(프로판-1,3- 디일 ) 디옥시 ] 비스 [(11 aS )-11- 설포 -7- 메톡시 -2-(티오펜-2-일)-1,10,11,11a- 테트라하이드로 -5H- 피롤로[2,1-c][1,4]벤조디아제핀 -5-온]] 나트륨 염( 22 )
H2O(3.5mL)중 중아황산나트륨(16.5mg, 0.159mmol, 2.0당량) 용액을 DCM(3.5mL)중 화합물 21(55.0mg, 0.079mmol) 용액에 가하였다. 반응 혼합물을 4시간 동안 교반하였다. TLC(EtOAc)가 출발 물질이 완전히 소비되었음을 나타내고, 기준선에서의 생성물 스팟을 나타내었다. 반응 혼합물을 DCM 및 H2O로 희석시켰다. 수층을 분리하고(분리식 깔때끼를 진탕시키지 않고), 세척하고, 냉동 건조기에서 건조시켜 황색 고체로서 경량의 22(53.9mg, 75%)를 수득하였다:
실시예
4
(a) 1,1'-[[(프로판-1,3- 디일 ) 디옥시 ] 비스 [(11S,11 aS )-10-(2,2,2- 트리클로로 에톡시카보닐)-11-(t- 부틸디메틸실릴옥시 )-7- 메톡시 -2-(퀴놀린-6-일)-1,10,11,11a-테트라하이드로-5H- 피롤로[2,1-c][1,4]벤조디아제핀 -5-온]]( 23 )
H2O(0.8mL) 및 EtOH(5mL)중 TEA(0.12mL, 0.84mmol, 6.0당량) 용액을 실온에서 톨루엔(5mL)중 트리플레이트 13(202mg, 0.14mmol) 용액에 가하였다. 상기 혼합물에 6-(4,4,5,5-테트라메틸-1,3,2-디옥사보로란-2-일) 퀴놀린(93.0mg, 0.36mmol, 2.6당량) 및 Pd(PPh3)4(6.5mg, 6μmol, 0.04당량)을 가하였다. TLC(80:20v/v EtOAc/헥산)를 통해 출발 물질이 완전히 소비되었음이 나타났을 때, 15분 동안 마이크로파 조사하에 100℃에서 반응 혼합물을 가열하였다. 과량의 용매를 제거하고, 잔류물을 EtOAc(20mL)에 용해시키고, H2O(15mL), 염수(15mL)로 세척하고, 건조시켰다(MgSO4). 용매를 여과하고 증발시켜 미정제 생성물을 수득하고, 이를 플래쉬 칼럼 크로마토그래피(80:20v/v 헥산/EtOAc 이후의 구배는 50:50v/v 헥산/EtOAc)에 의해 정제하여 황색 유리상으로서 23(126mg, 64%)을 수득하였다:
(b) 1,1'-[[(프로판-1,3- 디일 ) 디옥시 ] 비스 [(11 aS )-7- 메톡시 -2-(퀴놀린-6-일)-1,11a- 디하이드로 -5H- 피롤로[2,1-c][1,4]벤조디아제핀 -5-온]]( 24 )
10% Cd/Pd 커플(516mg, 4.21mmol, 25당량)을 신속하게 교반되는 23(234mg, 0.17mmol), THF(5mL) 및 1N NH4OAc(5mL)에 가하였다. TLC를 통해 출발 물질이 완전히 소비되었고, 소량의 부생성물이 형성되었다고 나타났을 때 반응 혼합물을 5시간 동안 교반하였다. 고체를 여과하고, H2O 및 대량의 MeOH로 세정하였다. 과량의 용매를 제거하고, 잔류물을 H2O(35mL) 및 CHCl3(35mL)로 희석시켰다. 수층을 CHCl3(3 x 30mL)으로 추출하고, 유기 추출물을 혼합하고, 염수(100mL)로 세척하고, 건조시켰다(MgSO4). 용매를 여과하고 증발시켜 미정제 생성물을 수득하고, 이를 플래쉬 칼럼 크로마토그래피(99.5:0.5v/v CHCl3/MeOH 이후의 구배는 96:4v/v CHCl3/MeOH)에 의해 정제하여 황색 유리상으로서 24(44mg, 33%)를 수득하였다:
실시예
5
(a) 1,1'-[[(프로판-1,3- 디일 ) 디옥시 ] 비스 [(11S,11 aS )-10-(2,2,2- 트리클로로 에톡시카보닐)-11-(t- 부틸디메틸실릴옥시 )-7- 메톡시 -2-(3- 메톡시벤젠 )-1,10,11,11a-테트라하이드로-5H- 피롤로[2,1-c][1,4]벤조디아제핀 -5-온]]( 25 )
H2O(0.6mL) 및 EtOH(3.5mL)중 TEA(0.071mL, 0.51mmol, 6.0당량) 용액을 실온에서 톨루엔(3.5mL)중 트리플레이트 13(122mg, 0.085mmol) 용액에 가하였다. 상기 혼합물에 3-메톡시페놀보론산(33.5mg, 0.22mmol, 2.6당량) 및 Pd(PPh3)4(3.9mg, 3.4μmol, 0.04당량)를 가하였다. TLC(80:20v/v EtOAc/헥산)를 통해 출발 물질이 완전히 소비되었음이 나타났을 때, 5분 동안 마이크로파 조사하에 100℃에서 반응 혼합물을 가열하였다. 과량의 용매를 제거하고, 잔류물을 EtOAc(10mL)에 용해시키고, H2O(10mL), 염수(10mL)로 세척하고, 건조시켰다(MgSO4). 용매를 여과하고 증발시켜 미정제 생성물을 수득하고, 이를 플래쉬 칼럼 크로마토그래피(80:20v/v 헥산/EtOAc 이후의 구배는 60:40v/v 헥산/EtOAc)에 의해 정제하여 황색 유리상으로서 25(66mg, 57%)를 수득하였다:
(b) 1,1'-[[(프로판-1,3- 디일 ) 디옥시 ] 비스 [(11 aS )-7- 메톡시 -2-(3- 메톡시벤젠 )-1,11a- 디하이드로 -5H- 피롤로[2,1-c][1,4]벤조디아제핀 -5-온]]( 26 )
10% Cd/Pd 커플(269mg, 2.20mmol, 25당량)을 신속하게 교반되는 25(119mg, 0.088mmol), THF(3mL) 및 1N NH4OAc(3mL)의 혼합물에 가하였다. TLC를 통해 출발 물질이 완전히 소비되었음이 나타났을 때, 반응 혼합물을 3.5시간 동안 교반하였다. 고체를 여과하고 H2O 및 MeOH으로 세정하였다. 과량의 용매를 제거하고, 잔류물을 H2O(20mL) 및 DCM(20mL)로 희석시켰다. 수층을 DCM(3 x 20mL)으로 추출하고, 유기 추출물을 혼합하고, H2O(50mL) 및 염수(50mL)로 세척하고, 건조시켰다(MgSO4). 용매를 여과하고 증발시켜 미정제 생성물을 수득하고, 이를 플래쉬 칼럼 크로마토그래 피(99.9:0.1v/v CHCl3/MeOH 이후의 구배는 98:2v/v CHCl3/MeOH)에 의해 정제하여 황색 유리상으로서 26(35mg, 54%)을 수득하였다:
(c) 1,1'-[[(프로판-1,3- 디일 ) 디옥시 ] 비스 [(11 aS )-11- 설포 -7- 메톡시 -2-(3- 메톡시벤젠 )-1,10,11,11a- 테트라하이드로 -5H- 피롤로[2,1-c][1,4]벤조디아제핀 -5-온]] 나트륨 염( 27 )
H2O(1.7mL)중 중아황산나트륨(7.6mg, 0.073mmol, 2.0당량) 용액을 DCM(1.7mL)중 화합물 26(27.0mg, 0.036mmol) 용액에 가하였다. 반응 혼합물을 2시간 동안 왕성하게 교반하였다. TLC(EtOAc)가 출발 물질이 완전히 소비되었음을 나타내고, 기준선에서의 생성물 스팟을 나타내었다. 반응 혼합물을 DCM(5mL) 및 H2O(5mL)로 희석시켰다. 수층을 분리하고, 동결건조시켜 백색 고체로서 경량의 27(12.1mg, 35%)을 수득하였다:
실시예
6
(a) 1,1'-[[(프로판-1,3- 디일 ) 디옥시 ] 비스 [(11S,11 aS )-10-(2,2,2- 트리클로로에톡시카보닐 )-11-(t- 부틸디메틸실릴옥시 )-7- 메톡시 -2-(3,4- 메틸렌디옥시페닐 )-1,10,11,11a-테트라하이드로-5H- 피롤로[2,1-c][1,4]벤조디아제핀 -5-온]]( 28 )
H2O(0.6mL) 및 EtOH(3.5mL)중 TEA(0.066mL, 0.47mmol, 6.0당량) 용액에 실온에서 톨루엔(3.5mL)중 트리플레이트 13(122mg, 0.085mmol)의 용액을 가하였다. 상기 혼합물에 3,4-메틸렌디옥시페닐보론산(34.2mg, 0.21mmol, 2.6당량) 및 Pd(PPh3)4(3.6mg, 3.2μmol, 0.04당량)을 가하였다. TLC(80:20v/v EtOAc/헥산)를 통해 출발 물질이 완전히 소비되었음이 나타났을 때, 5분 동안 마이크로파 조사하에 100℃에서 반응 혼합물을 가열하였다. 과량의 용매를 제거하고, 잔류물을 EtOAc(10mL)에 용해시키고, H2O(10mL), 염수(10mL)로 세척하고, 건조시켰다(MgSO4). 용매를 여과하고 증발시켜 미정제 생성물을 수득하고, 이를 플래쉬 칼럼 크로마토 그래피(80:20v/v 헥산/EtOAc 이후의 구배는 65:35v/v 헥산/EtOAc)에 의해 정제하여 황색 유리상으로서 28(84mg, 77%)을 수득하였다:
(b) 1,1'-[[(프로판-1,3- 디일 ) 디옥시 ] 비스 [(11 aS )-7- 메톡시 -2-(3,4- 메틸렌디옥시페닐 )-1,11a- 디하이드로 -5H- 피롤로[2,1-c][1,4]벤조디아제핀 -5-온]]( 29 )
10% Cd/Pd 커플(307mg, 2.51mmol, 25당량)을 신속하게 교반되는 28(139mg, 0.101mmol), THF(3.5mL) 및 1N NH4OAc(3.5mL)의 혼합물에 가하였다. TLC를 통해 출발 물질이 완전히 소비되었고, 소량의 부생성물이 형성되었다고 나타났을 때 반응 혼합물을 5시간 동안 교반하였다. 고체를 여과하고, H2O 및 MeOH로 세정하였다. 과량의 용매를 제거하고, 잔류물을 H2O(25mL) 및 DCM(25mL)로 희석시켰다. 수층을 DCM(3 x 40mL)으로 추출하고, 유기 추출물을 혼합하고, H2O(80mL) 및 염수(80mL)로 세척하고, 건조시켰다(MgSO4). 용매를 여과하고 증발시켜 미정제 생성물을 수득하 고, 이를 플래쉬 칼럼 크로마토그래피(99.9:0.1v/v CHCl3/MeOH 이후의 구배는 98:2v/v CHCl3/MeOH)에 의해 정제하여 황색 유리상으로서 26(30mg, 39%)을 수득하였다:
(c) 1,1'-[[(프로판-1,3- 디일 ) 디옥시 ] 비스 [(11 aS )-11- 설포 -7- 메톡시 -2-(3,4-메틸렌디옥시페닐)-1,10, 11,11a- 테트라하이드로 -5H- 피롤로[2,1-c][1,4]벤조디아제핀 -5-온]] 나트륨 염( 30 )
H2O(0.5mL)중 중아황산나트륨(2.2mg, 0.021mmol, 2.0당량) 용액을 DCM(0.5mL)중 화합물 29(8.1mg, 0.0105mmol) 용액에 가하였다. 반응 혼합물을 5시간 동안 교반하였다. TLC(EtOAc)가 출발 물질이 완전히 소비되었음을 나타내고, 기준선에서의 생성물 스팟을 나타내었다. 반응 혼합물을 DCM(1.5mL) 및 H2O(1.5mL)로 희석시켰다. 수층을 분리하고, 동결건조시켜 백색 고체로서 경량의 30(3.5mg, 34%)을 수득하였다:
실시예
7
(a) 1,1'-[[프로판-1,3- 디일 ) 디옥시 ] 비스 [(11S,11 aS )-10-(2,2,2- 트리클로로에톡시카보닐 -11-(t- 부틸디메틸실릴옥시 )-7- 메톡시 -2-(4- 플루오로벤젠 )-1,10,11,11a-테트라하이드로-5H- 피롤로[2,1-c][1,4]벤조디아제핀 -5-온]]( 31 )
H2O(0.6mL) 및 EtOH(3.5mL)중 TEA(0.072mL, 0.52mmol, 6.0당량) 용액을 실온에서 톨루엔(3.5mL)중 트리플레이트 13(125mg, 0.086mmol) 용액에 가하였다. 상기 혼합물에 4-플루오로벤젠보론산(31.6 0.22mmol, 2.6당량) 및 Pd(PPh3)4(4.0, 3.4μmol, 0.04당량)을 가하였다. TLC(80:20v/v EtOAc/헥산)를 통해 출발 물질이 완전히 소비되었음이 나타났을 때, 5분 동안 마이크로파 조사하에 100℃에서 반응 혼합물을 가열하였다. 과량의 용매를 제거하고, 잔류물을 EtOAc(10mL)에 용해시키고, H2O(10mL), 염수(10mL)로 세척하고, 건조시켰다(MgSO4). 용매를 여과하고 증발시켜 미정제 생성물을 수득하고, 이를 플래쉬 칼럼 크로마토그래피(80:20v/v 헥산/EtOAc 이후의 구배는 65:35v/v 헥산/EtOAc)에 의해 정제하여 황색 유리상으로서 31(82mg, 71%)을 수득하였다:
(b) 1,1'-[[(프로판-1,3- 디일 ) 디옥시 ] 비스 [(11 aS )-7- 메톡시 -2-(4- 플루오로벤젠 )-1,11a- 디하이드로 -5H- 피롤로[2,1-c][1,4]벤조디아제핀 -5-온]]( 32 )
10% Cd/Pd 커플(342mg, 2.80mmol, 25당량)을 신속하게 교반되는 31(149mg, 0.112mmol), THF(4.5mL) 및 1N NH4OAc(4.5mL)의 혼합물에 가하였다. TLC를 통해 출발 물질이 완전히 소비되었음이 나타났을 때, 반응 혼합물을 5시간 동안 교반하였다. 고체를 여과하고, H2O 및 MeOH로 세정하였다. 과량의 용매를 제거하고, 잔류물을 H2O(30mL) 및 DCM(30mL)로 희석시켰다. 수층을 DCM(3 x 30mL)으로 추출하고, 유기 추출물을 혼합하고, H2O(80mL) 및 염수(80mL)로 세척하고, 건조시켰다(MgSO4). 용매를 여과하고 증발시켜 미정제 생성물을 수득하고, 이를 플래쉬 칼럼 크로마토 그래피(99.9:0.1v/v CHCl3/MeOH 이후의 구배는 98:2v/v CHCl3/MeOH)에 의해 정제하여 황색 유리상으로서 32(60mg, 75%)를 수득하였다:
(c) 1,1'-[[(프로판-1,3- 디일 ) 디옥시 ] 비스 [(11 aS )-11- 설포 -7- 메톡시 -2-(4- 플루오로벤젠 )-1,10,11,11a- 테트라하이드로 -5H- 피롤로[2,1-c][1,4]벤조디아제핀 -5-온]] 나트륨 염( 33 )
H2O(3mL)중 중아황산나트륨(13.9mg, 0.134mmol, 2.0당량) 용액을 DCM(3mL)중 화합물 32(48.0mg, 0.067mmol) 용액에 가하였다. 반응 혼합물을 2시간 동안 교반하였다. TLC(EtOAc)가 출발 물질이 완전히 소비되었음을 나타내고, 기준선에서의 생성물 스팟을 나타내었다. 반응 혼합물을 DCM(8mL) 및 H2O(8mL)로 희석시켰다. 수층을 분리하고 동결건조시켜 백색 고체로서 경량의 33(35.5mg, 58%)을 수득하였다:
실시예
8
(a) 1,1'-[[(펜탄-1,5- 디일 ) 디옥시 ] 비스 [(2S,4R)-(5- 메톡시 -2-니트로-1,4-페닐렌) 카보닐 ]] 비스 [2-(t- 부틸디메틸실릴옥시메틸 )-4- 하이드록시아세틸피롤리딘 ]( 36 )
촉매량의 DMF(2방울)를 무수 THF(300mL)중 니트로산 34(15.0g, 30.4mmol) 및 옥살릴 클로라이드(13.5mL, 19.3g, 152mmol)의 교반된 용액에 가하였다. 반응 혼합물을 16시간 동안 실온에서 교반하고, 용매를 진공하에 증발시켜 제거하였다. 생성된 잔류물을 무수 THF(225mL)에 재용해시키고, 산 클로라이드 용액을 질소 대기하에 0℃에서(얼음/아세톤) THF(150mL)중 아민 35(20.7g, 76.0mmol) 및 TEA(84mL, 61.52g, 608mmol)의 교반된 혼합물에 적가하였다. 반응 혼합물을 실온으로 가온시키고, 추가로 16시간 동안 교반하였다. 과량의 THF를 회전식 증발에 의해 제거하 고, 생성된 잔류물을 H2O(400mL) 및 EtOAc(400mL)에 분배하였다. 층을 분리시키고, 수층을 EtOAc(3 x 130mL)으로 추출하였다. 이어서, 혼합된 유기층을 포화된 NH4Cl(200mL), 포화된 NaHCO3(200mL), 염수(200mL)로 세척하고, 건조시켰다(MgSO4). 용매를 여과하고 증발시켜 검은 색상의 오일로서 미정제 생성물을 수득하였다. 플래쉬 크로마토그래피에 의해 정제하여(구배 용출: 60:40v/v 헥산/EtOAc 내지 40:60v/v 헥산/EtOAc) 옅은 황색의 유리상으로서 순수한 아미드 36(23.56g, 77%)을 분리하였다:
(b) 1,1'-[[(펜탄-1,5- 디일 ) 디옥시 ] 비스 [(2S,4R)-(5- 메톡시 -2-아미노-1,4- 페닐렌 ) 카보닐 ]] 비스 [2-(t- 부틸디메틸실릴옥시메틸 )-4- 하이드록시아세틸피롤리딘 ]( 37 )
EtOAc(20mL)중 10% Pd-C((550mg) 슬러리를 EtOAc(73mL)중 니트로 화합물 36(5.5g, 5.47mmol) 용액에 가하였다. 혼합물을 총 24시간 동안 30 Psi에서 Parr 기기를 사용하여 수소화시켰다. 혼합물을 탈기시키고, 출발 물질이 완전히 소비되었음이 관찰된 경우 TLC(EtOAc)를 통해 분석하였다. 와트맨(Whatman) GF/F 여과지를 통해 진공 여과시켜 촉매를 제거하고 여액을 증발시켜 회색 포움으로서 아닐린 37(5.17g, 100%)을 수득하였다:
(c) 1,1'-[[(펜탄-1,5- 디일 ) 디옥시 ] 비스 [(2S,4R)-[5- 메톡시 -1,4- 페닐렌 -2-(2,2,2-트 리클로로에톡시카보닐 아미노)] 카보닐 ]] 비스 [2-(t- 부틸디메틸실릴옥시메틸 )-4- 하이드록시아세틸피롤리딘]( 38 )
무수 DCM(45mL)중 2,2,2-트리클로로에틸 클로로포름에이트(2.63mL, 4.05g, 19.1mmol) 용액을 -10℃에서(액상 N2/에탄디올) 무수 DCM(120mL)중 아민 37(8.21g, 8.70mmol) 및 무수 피리딘(2.81mL, 2.75g, 34.8mmol)의 교반된 용액에 적가하였다. 16시간 동안 실온에서 교반한 후, TLC(50:50v/v 헥산/EtOAc)를 통해 출발 물질이 완전히 소비되었음을 나타내었다. 반응 혼합물을 포화된 NH4Cl(2 x 70mL), 포화된 CuSO4(70mL), H2O(70mL), 염수(70mL)로 세척하고, 건조시켰다(MgSO4). 용매를 여과하고 증발시켜 황색 포움으로서 Troc-카바메이트 38(11.25g, 99%)를 수득하였다:
(d) 1,1'-[[(펜탄-1,5- 디일 ) 디옥시 ] 비스 [(2S,4R)-[5- 메톡시 -1,4- 페닐렌 -2-(2,2,2-트 리클로로에톡시카보닐 아미노)] 카보닐 ]] 비스 (2- 하이드록시메틸 -4- 하이드록시아세틸피롤리딘 )( 39 )
빙초산(90mL)을 H2O(30mL) 및 THF(30mL)중 38(5.06g, 3.91mmol)의 교반된 용액에 가하였다. 반응 혼합물을 16시간 동안 실온에서 교반하고, 이 시점에 TLC(95:5v/v CHCl3/MeOH)를 통해 출발 물질이 완전히 소비되었음을 나타내었다. 산성 용액을 0℃에서(얼음/아세톤) H2O(1.3L)중 NaHCO3(132g)의 교반된 용액에 적가하 였다. 수층을 EtOAc(3 x 200mL)으로 추출하고, 유기층을 혼합하고, H2O(200mL), 염수(200mL)로 세척하고, 건조시켰다(MgSO4). 용매를 진공하에 여과하고 증발시켜 미정제 생성물을 수득하고, 이를 플래쉬 칼럼 크로마토그래피(98:2v/v CHCl3/MeOH)에 의해 정제하여 백색 유리상으로서 비스-알코올 39(4.04g, 97%)를 수득하였다:
(e) 1,1'-[[(펜탄-1,5- 디일 ) 디옥시 ] 비스 [(11S,11 aS ,2R)-10-(2,2,2- 트리클로로에톡시카보닐 )-11- 하이드록시 -7- 메톡시 -2- 하이드록시 아세틸-1,2,3,10,11,11a-헥 사하이드로 -5H- 피롤로[2,1-c][1,4]벤조디아제핀 -5-온]]( 40 )
TEMPO(234mg, 1.50mmol) 및 BAIB(5.31g, 16.5mmol)를 DCM(140mL)중 비스-알코올 39(4.0g, 3.75mmol)의 교반된 용액에 가하였다. 반응 혼합물을 질소 대기하에 24시간 동안 교반하고, 이 시점에 TLC(95:5v/v CHCl3/MeOH)를 통해 출발 물질이 생성물로 전환되었음을 나타내었다. 혼합물을 DCM(30mL)로 희석시키고, 포화된 수성 NaHSO3(2 x 30mL), 포화된 수성 NaHCO3(2 x 30mL), 염수(30mL)로 세척하고, 건조시켰다(MgSO4). 용매를 여과하고 증발시켜 미정제 생성물을 수득하고, 이를 플래쉬 칼럼 크로마토그래피(구배 용출: CHCl3 내지 99.5:0.5v/v CHCl3/MeOH)에 의해 정제하여 옅은 황색의 유리상으로서 폐환화된 생성물 40(1.99g, 50%)을 수득하였다:
(f) 1,1'-[[(펜탄-1,5- 디일 ) 디옥시 ] 비스 [(11S,11 aS , 2R)-10-(2,2,2- 트리클로로에톡시카보닐 )-11-(t- 부틸디메틸실릴옥시 )-7- 메톡시 -2- 하이드록시아세틸 -1,2,3, 10, 11,11a- 헥사하이드로 -5H- 피롤로[2,1-c][1,4]벤조디아제핀 -5-온]]( 41 )
TBSOTF(1.27mL, 1.47g, 5.54mmol)를 무수 DCM(40mL)중 비스-알코올 40(1.96g, 1.85mmol) 및 2,6-루티딘(0.86mL, 0.79g, 7.39mmol)의 교반된 용액에 가하였다. 반응 혼합물을 N2 대기하에 5시간 동안 교반한 후, TLC(EtOAc)를 통해 출발 물질이 완전히 소비되었음을 나타내었다. DCM(50mL)에 용해시킨 후, 유기 혼합물을 포화된 CuSO4(30mL), 포화된 NaHCO3(30mL), 염수(50mL)로 세척하고, 건조시켰다(MgSO4). 용매를 진공하에 여과하고 증발시켜 미정제 생성물을 수득하고, 이를 플래쉬 칼럼 크로마토그래피(40:60v/v 헥산/EtOAc)에 의해 정제하여 백색 유리상으로서 생성물 41(1.31g, 55%)을 수득하였다:
(g) 1,1'-[[(펜탄-1,5- 디일 ) 디옥시 ] 비스 [(11S,11 aS ,2R)-10-(2,2,2- 트리클로 로에톡시카보닐)-11-(t- 부틸디메틸실릴옥시 )-7- 메톡시 -2- 하이드록시 -1,2,3,10,11,11a-헥사하이드로-5H- 피롤로[2,1-c][1,4]벤조디아제핀 -5-온]]( 42 )
H2O(15mL)중 K2CO3(685mg, 4.96mmol) 용액을 MeOH(15mL)중 아세테이트 화합물 41(1.28g, 0.99mmol)의 교반된 용액에 가하였다. 초기에는 무색이었던 용액이 결국에는 황색으로 변색되었고, 백색의 침전물이 형성된 것이 관찰되었다. 반응 혼합물을 5시간 동안 환류 가열시키고, 이 시점에 TLC(EtOAc)를 통해 출발 물질이 생성물로 전환되었음을 나타내었다. 회전식 증발에 의해 과량의 용매를 제거하고, 혼합물 은 1N HCl을 사용하여 pH 7로 조심스럽게 중화시켰다. 생성된 혼합물을 DCM(5 x 20mL)으로 추출한 후, 혼합된 유기층을 염수(50mL)로 세척하고, 건조시켰다(MgSO4). 여과시킨 후, 진공하에 증발시켜 용매를 제거하여 백색 고체로서 생성물 42(982mg, 82%)를 수득하였다:
(h) 1,1'-[[(펜탄-1,5- 디일 ) 디옥시 ] 비스 [(11S,11 aS )-1O-(2,2,2- 트리클로로에 톡시카보닐)-11-(t- 부틸디메틸실릴옥시 )-7- 메톡시 -2-옥소-1,2,3,10,11,11a- 헥사하이드로 -5H- 피롤로[2,1-c][1,4]벤조디아제핀 -5-온]]( 43 )
무수 DCM(4mL)중 무수 DMSO(0.34mL, 0.37g, 4.78mmol) 용액을 질소 대기하에 -60℃에서(액상 N2/CHCl3) 5분간에 걸쳐 옥살릴 클로라이드(DCM중 2M 용액 1.20mL, 2.39mmol)의 교반된 용액에 적가였다. -55℃에서 15분 동안 교반한 후, 무수 DCM(8mL)중 기질 42(962mg, 0.80mmol)의 슬러리를 10분간에 걸쳐 반응 혼합물에 적 가하였다. 추가의 1시간 동안 -55℃에서 교반한 후, 무수 DCM(4mL)중 TEA(1.56mL, 1.13g; 11.2mmol) 용액을 5분간에 걸쳐 반응 혼합물에 적가하였다. 반응 혼합물을 0℃로 가온시킨 후, DCM(50mL)으로 희석시켰다. 유기 용액을 냉 1N HCl(20mL), H2O(20mL), 염수(30mL)로 세척하고, 건조시켰다(MgSO4). 용매를 진공하에 여과하고 증발시켜 미정제 생성물을 수득하고, 이를 플래쉬 칼럼 크로마토그래피(50:50v/v 헥산/EtOAc)에 의해 정제하여 포움으로서 비스-케톤 43(550mg, 57%)을 수득하였다:
(i) 1,1'-[[(펜탄-1,5- 디일 ) 디옥시 ] 비스 [(11S,11 aS )-10-(2,2,2- 트리클로로에 톡시카보닐)-11-(t- 부틸디메틸실릴옥시 )-7- 메톡시 -2-[[( 트리플루오로메틸 ) 설포닐 ]옥시]-1,10,11,11a- 테트라하이드로 -5H- 피롤로[2,1-c][1,4]벤조디아제핀 -5-온]]( 44 )
새로 개봉한 앰플로부터 취한 무수 트리플산 무수물(1.61mL, 2.71g, 9.60mmol) 1분량을 0-5℃에서(얼음) 질소 대기하에 무수 DCM(25mL)중 케톤 43(525mg, 0.44mmol) 및 무수 피리딘(0.78mL, 759mg, 9.60mmol)의 왕성하게 교반된 용액에 신속하게 가하였다. 반응 혼합물을 질소 대기하에 총 28시간 동안 교반하고, 이 시점에 TLC(80:20v/v EtOAc/헥산)를 통해 출발 물질이 완전히 소비되었음을 나타내었다. 혼합물을 냉 포화된 NaHCO3(50mL)에 붓고, DCM(3 x 20mL)으로 추출하였다. 이어서, 혼합된 유기층을 포화된 CuSO4(30mL), 염수(30mL)로 세척하고, 건조시켰다(MgSO4). 용매를 진공하에 여과하고 증발시켜 미정제 생성물을 수득하고, 이를 플래쉬 칼럼 크로마토그래피(80:20v/v 헥산/EtOAc)에 의해 정제하여 황색 포움으로서 트리플레이트 44(249mg, 39%)를 수득하였다:
(j) 1,1'-[[(펜탄-1,5- 디일 ) 디옥시 ] 비스 [(11S,11 aS )-10-(2,2,2- 트리클로로에톡시카보닐 )-11-(t- 부틸디메틸실릴옥시 )-7- 메톡시 -2-(p- 메톡시페닐 )-1,10,11,11a-테트라하이드로-5H- 피롤로[2,1-c][1,4]벤조디아제핀 -5-온]]( 45 )
Pd(PPh3)4(7.43mg, 6.43μmol)를 실온에서 H2O(0.8mL), EtOH(5mL) 및 톨루 엔(5mL)중 트리플레이트 44 (236mg, 0.16mmol), 4-메톡시페닐보론산(63mg, 0.42mmol), TEA(0.13mL, 98mg, 0.97mmol) 용액에 가하였다. 반응 혼합물을 100℃에서 30분 동안 가열한 후, TLC(80:20v/v EtOAc/헥산)을 통해 출발 물질이 완전히 소비되었음을 나타내었다. 진공하에 증발시켜 과량의 용매를 제거하고, 생성된 잔류물을 EtOAc(50mL)에 용해시키고, H2O(20mL), 염수(20mL)로 세척하고, 건조시켰다(MgSO4). 용매를 여과하고 증발시켜 미정제 생성물을 수득하고, 이를 플래쉬 칼럼 크로마토그래피(구배 용출: 80:20v/v 헥산/EtOAc 내지 50:50v/v 헥산/EtOAc)에 의해 정제하여 황색 유리상으로서 C2-아릴 생성물 45(117mg, 52%)를 수득하였다:
(k) 1,1'-[[(펜탄-1,5- 디일 ) 디옥시 ] 비스 [(11 aS )-7- 메톡시 -2-(p- 메톡시페닐 )-1,11a-디 하 이드로-5H- 피롤로[2,1-c][1,4]벤조디아제핀 -5-온]]( 46 )
10% Cd/Pb 커플(192mg, 1.55mmol)을 신속하게 교반되는 45(107mg, 77.3μ mol), THF(2.5mL) 및 1N NH4OAc(2.5mL)의 혼합물에 가하였다. 반응 혼합물을 3시간 동안 교반하고, 이 시점에 TLC(95:5v/v CHCl3/MeOH)를 통해 부생성물을 수반하면서 원하는 PBD가 형성되었음을 나타내었다. 고체는 여과하여 수거하고, H2O 및 DCM으로 세정하였다. 수층을 DCM(3 x 10mL)으로 추출하고, 유기 추출물을 혼합하고, 염수(50mL)로 세척하고, 건조시켰다(MgSO4). 용매를 여과하고 증발시켜 미정제 생성물을 수득하고, 이를 플래쉬 칼럼 크로마토그래피(구배 용출: CHCl3 내지 99:1v/v CHCl3/MeOH)에 의해 정제하여 황색 유리상으로서 이민 46(32.5mg, 55%)을 수득하였다:
(l) 1,1'-[[(펜탄-1,5- 디일 ) 디옥시 ] 비스 [(11 aS )-11- 설포 -7- 메톡시 -2-(p- 메톡시페닐 )-1,10,11,11a- 테트라하이드로 -5H- 피롤로[2,1-c][1,4]벤조디아제핀 -5-온]] 나트륨 염( 47 )
물(3mL)중 중아황산나트륨(4.90mg, 47.2μmol) 용액을 디클로로메탄(1.5mL)중 46(18.11mg, 23.6μmol)의 교반된 용액에 가하였다. 반응 혼합물을 24시간 동안 왕성하게 교반하고, 유기층 및 수층을 분리하였다. 수성 상을 TLC 분석(95:5v/v CHCl3/MeOH)함으로써 46(Rf~O.3)은 존재하기 않고, UV 흡수성이 강한 기준 물질이 존재한다는 것이 밝혀졌다. 수층을 동결건조시켜 고체로서 경량의 중아황산염 부가물 47(10mg, 43%)을 수득하였다:
실시예
9:
시험관내
세포독성 측정
K562
세포주(
MTT
분석법)
1시간 노출
37℃에서 5% CO2를 함유하는 습윤 대기하에 10% 우태아 혈청 및 2mM 글루타민으로 보충된 RPM1 1640 배지에서 K562 인간 만성 골수성 백혈병 세포를 유지시키고, 1시간 동안 37℃의 암실에서 지정된 용량의 약물과 함께 항온 처리하였다. 원심분리(5분, 300g)함으로써 항온 처리를 마치고, 약물을 함유하지 않는 배지를 사용하여 세포를 1회 세척하였다. 적절한 약물로 처리한 후, 세포를 96-웰 마이크로티터 플레이트로 옮겼다(웰당 104개의 세포, 샘플당 8개의 웰). 이어서, 37℃에서 5% CO2를 함유하는 습윤 대기하에 37℃의 암실에 플레이트를 유지시켰다. 분석법은 황색의 가용성 테트라졸륨 염인, 3-(4,5-디메틸티아졸-2-일)-2,5-디페닐-2H-테트라졸륨 브로마이드(MTT, Aldrich-Sigma)를 보라색의 불용성 포마즌 침전물로 환원시키는 생육성 세포의 능력에 기초하였다. 플레이트를 4일동안 항온 처리한 후(대조군 세포의 갯수를 대략 10배까지 증가시키기 위하여), 20㎕의 MTT 용액(인산염-완충처리된 염수중 5mg/mL)을 각 웰에 가하고, 플레이트를 추가로 5시간 동안 항온 처리하였다. 이어서, 플레이트를 5분 동안 300g에서 원심분리하고, 웰당 10-20㎕이 남아있는 세포 펠릿으로부터 대량의 배지를 피펫팅하였다. DMSO(200㎕)를 각 웰에 가하고, 샘플을 교반하여 확실히 완전하게 혼합시켰다. 이어서, 타이터테크 멀티스캔(Titertek Multiscan) ELISA 플레이트 판독기상에서 550nm의 파장하에 광학 밀도를 판독하고, 용량-반응 곡선을 작성하였다. 각 곡선의 경우, IC50 값은 최종의 광학 밀도를 대조군 값의 50%까지로 감소시키는데 필요한 것으로서 판독하였다.
96시간 노출
상기 방법에 대한 변형으로, 10% 우태아 혈청(Sigma) 및 2OmM L-글루타민(Sigma)로 보충된 RPMI 1640 배지(Sigma)에서 5x104개의 K562 세포(상기와 동일)를 유지시키고, 이 용액 190㎕를 96시간 동안 37℃에서 5% CO2하에 지정된 용량의 약물(10㎕)과 함께 항온 처리하였다. 250μg/ml(최종) MTT를 각 웰에 가하고, 플레이트를 추가의 4시간 동안 항온 처리하였다. 인비젼(Envision) 플레이트 판독기 (Applied Biosystems)를 사용하여 450nm에서 흡광도를 판독하였다. 이어서, 그래프패드 PRISM(Graphpad PRISM)에 의해 데이타를 분석하고, IC50(세포 군집을 ½로 감 소시키기 위해서 필요한 화합물의 농도로서 정의된다)을 수득하였다.
결과
| 화합물 | IC 50 (μM) |
| ZC-207 | 0.0053a |
| ZC-423 | 0.0015b |
| a 1시간 항온 처리 b 96시간 항온 처리 |
|
K562
세포주(
알라마
블루
분석법)
시험하고자 하는 화합물을 100% 바이오테크(Biotech) 등급의 DMSO(Sigma)에 용해시킨 후, 2% DMSO중 2μM 또는 200nM의 원농축액에 희석시켰다. 중간 폴리스티렌 96 웰 세포 배양액 플레이트(Nunc)중 2% DMSO에서 100㎕의 원농축액을 3개당 하나씩 일렬로 희석시켰다. 블랭크로서 사용되는 외부 칼럼, 대조군으로서 사용되는 2번째 또는 11번째 칼럼(분석 플레이트의 상단 또는 하단 사용 여부에 따라 달라진다)에 2% DMSO를 놓았다. 이어서, 형광 상용성 폴리스티렌 96 웰 세포 배양액 플레이트(Greiner BioOne)중 B열 내지 D열 또는 E열 내지 G열에 중간 플레이트의 열 전체를 각 웰당 10㎕로 옮겼다. 5 x 104개의 세포/ml를 함유하는 세포 용액은 10% 우태아 혈청(Sigma) 및 2OmM L-글루타민(Sigma)으로 보충된, 페놀 레드가 없는 RPMI 1640(Sigma)로 구성되었다. 분석 플레이트의 각 웰에 칼럼 2부터 칼럼 11까지 190㎕ 세포 용액을 가하였다. 190㎕ 배양 배지를 칼럼 1 및 12에 가하였다. 플레이트를 96시간 동안 37℃에서 5% CO2하에 항온 처리하였다. (생육성 세포에 의해 형광성 레조푸린으로 전환되는) 1μM(최종) 레자주린을 각 웰에 가하고, 플레이트를 추가로 4시간 동안 항온 처리하였다. 인비전 플레이트 판독기(Applied Biosystems)를 사용하여 530-570nm 여기, 580-620nm 방출에서 형광을 판독하였다. 이어서, 그래프패드 PRISM에 의해 데이타를 분석하고, IC50(세포 군집을 ½로 감소시키기 위해서 필요한 화합물의 농도로서 정의된다)을 수득하였다.
결과
| 화합물 | IC 50 (nM) |
| 19 | <1 |
| 22 | <1 |
| 26 | <1 |
| 27 | <1 |
| 29 | <1 |
| 30 | <1 |
| 32 | <1 |
| 33 | <1 |
LOXIMVI
및
OVCAR
-5 세포주
5 x 104개의 세포/ml의 LOXIMVI 인간 흑색종 세포 또는 OVCAR-5 인간 난소 종양 세포를 함유하는 세포 용액은 10% 우태아 혈청(Sigma) 및 2OmM L-글루타민(Sigma)으로 보충된, 페놀 레드가 없는 RPMI 1640(Sigma)로 구성되었다. 형광 상용성 폴리스티렌 96 웰 세포 배양액 플레이트(Greiner BioOne)의 각 웰에 칼럼 2부터 칼럼 11까지 190㎕ 세포 용액을 가하였다. 190㎕ 배양 배지를 칼럼 1 및 12에 가하였다. 플레이트를 밤새도록 37℃에서 5% CO2하에 항온 처리하였다. 화합물을 100% 바이오테크 등급의 DMSO(Sigma)에 용해시킨 후, 2% DMSO중 원농축액에 희석시 켰다. 중간 폴리스티렌 96 웰 세포 배양액 플레이트(Nunc)중 2% DMSO에서 100㎕의 원농축액을 3개당 하나씩 일렬로 희석시켰다. 블랭크로서 사용되는 외부 칼럼, 대조군으로써 사용되는 2번째 또는 11번째 칼럼(분석 플레이트의 상단 또는 하단 사용 여부에 따라 달라진다)에 2% DMSO를 놓았다. 이어서, 세포 플레이트중 B열 내지 D열 또는 E열 내지 G열에 중간 플레이트의 열 전체를 각 웰당 10㎕로 옮겼다. 플레이트를 96시간 동안 37℃에서 5% CO2하에 항온 처리하였다. (생육성 세포에 의해 형광성 레조푸린으로 전환되는) 1μM(최종) 레자주린을 각 웰에 가하고, 플레이트를 추가로 4시간 동안 항온 처리하였다. 인비전 플레이트 판독기(Applied Biosystems)를 사용하여 530-570nm 여기, 580-620nm 방출에서 형광을 판독하였다. 이어서, 그래프패드 PRISM에 의해 데이타를 분석하고, IC50(세포 군집을 ½로 감소시키기 위해서 필요한 화합물의 농도로서 정의된다)을 수득하였다
결과
| 화합물 | ZC -423 IC 50 ( nM ) |
| LOXIMVI | 4.83 |
| OVCAR-5 | 5.2 |
실시예
10: 항종양 활성
하기 실험은 영국 런던에 소재하는 본사로부터 허가받은 프로젝트 라이선스하에 수행하였고, 이는 전반적으로 UK CCCR 가이드라인[Workman, P., et at., British Journal of Cancer, 77, 1-10 (1998)]을 따랐다.
LOX IMVI(인간 흑색종)를 누드 마우스(영국 헐에 소재하는 B&K Universal) 피하에서 배양하였다. 종양은 단일 종양 단편으로서 투관침에 의해 옆구리에 이식시켰다. 비히클로서 5% DMA/염수를 사용하여 3mgkg-1의, 앞서 확립된 단일 정맥(iv) 최대 내성 용량(MTD: maximum tolerated dose)으로 ZC423을 사용하여 8마리의 종양을 포함하는 마우스의 군들을 처리하였다. 대조군 마우스는 단지 비히클로만 처리하였다.
종양을 캘리퍼에 의해 확실하게 측정할 수 있을 때(평균 크기 4 x 4mm) 처리하기 시작하고, 매일 종양을 캘리퍼로 측정하고 마우스의 중량을 측정함으로써 치료학적 효과를 평가하였다. 종양의 부피는 식 a2 x b/2(여기에서, a는 종양의 더 작은 직경이고, b는 종양의 더 큰 직경이다)에 의해 측정하였다. 시간에 대하여 상대적인 종양 부피의 그래프로서 결과를 도 1로서 나타낸다(■ZC423; ◆대조군-용매만). 만-휘트니(Mann-Whitney) 분석법(예를 들면, 문헌[Essential Statistics 2nd Edition (1989), D.G.Rees, ISBN 0 412 32030 4, Chapman and Hall, London]에 기술된 바와 같다)에 의해 평가하였을 때 ZC423의 활성은 통계학적으로 유의적이었다.
도 2는 동일한 시험의 결과를 나타내지만(●ZC423; ◆대조군-용매만), 기간이 연장되었고, 평균 RTV에 대한 규모가 보다 컸다. 대조군은 16일째 사망하였고, 이 시점에서, 68일째 모든 동물에 종양이 없었던 처리군과 비교할 때 종양이 없는 마우스는 없었다.
본 연구는 상술한 바와 동일한 조건하에서 OVCAR-5(인간 난소 종양)을 사용 하여 수행하였다. 결과는 도 3(●ZC423; ◆대조군-용매만)에 나타낸다. 본 연구에서 대조군은 32일째 사망하였다.
실시예
11: 교차 및 용해도
DNA
교차
HindIII를 사용하여 폐쇄 환상 puc18 DNA를 선형으로 만든 후, 탈인산화시키고, 마지막으로 폴리뉴클레오티드 키나제를 사용하여 5'말단에 [γ32P]-ATP로 표지하였다. 37℃에서 50㎕의 최종 용적으로 수성 1 x TEOA (25mM 트리에탄올아민, 1mM EDTA, pH 7.2) 완충액에서 10ng의 DNA 및 약물을 포함하는 반응을 수행하였다. 동량의 종결 용액(0.6 M NaOAc, 20mM EDTA, 100μg/mL tRNA)을 가한 후, 에탄올로 침전시켜 반응을 종결시켰다. 샘플을 원심분리한 후, 상등액은 버리고, 펠릿을 동결건조시켰다. 샘플을 10㎕의 알칼리성 변성 완충액(4mg 브로모페놀 블루, 600mg 수크로스 및 40mg NaOH)에 재현탁시키고, 3분 동안 실온에서 와동시켰다. 변성되지 않은 대조군은 10㎕의 표준 수크로스 적재 염료(2.5mg 브로모페놀 블루, 2.5mg 크실렌 시아놀 블루 및 4g 수크로스)에 재현탁시켰다. 샘플 및 대조군 양자 모두 아가로스 겔상에 직접 적재하였다.
1 x TAE 분리 완충액(2.42g 트리스 염기, 0.372g EDTA, 0.571ml 빙초산)중에서 38-40V로 16시간 동안 20cm 길이의 0.8% 침하 수평 아가로스 겔상에서 전기영동을 실시하였다. 밑면에 DE81 여과지 층을 포함하는 한층의 와트맨 3MM상의 소반트 SG21 OD 스피드겔(Savant SG21 OD SpeedGel) 겔 건조기상에서 겔을 진공하에 80분 동안 80℃에서 건조시켰다. FujiRX x-선 필름상에서 밤새도록 노출시킨 후 방사능 사진을 얻었다. BioRad GS-670 영상 레이저 농도계를 사용하여 필름 밴드를 측량하였다. 오직 더블-스트랜드 밴드만의 밀도의 양에 대한 각 레인상의 전체 DNA(더블-스트랜드 및 싱글-스트랜드 밴드에 대한 밀도의 합)를 측정함으로써 교차율을 산출하였다. 용량-반응 곡선은 측정된 교차된 DNA 수준의 분율에 대하여 약물의 농도를 플롯팅하여 유도하였고, 이로부터는 DNA(XL50)중 50%를 교차시키는데 필요한 양이었다.
용해도
용해도는 최소량의 물에 시험 화합물을 용해시켜 포화 용액을 생성함으로써 측정하였다.
결과
DNA
교차
| 화합물 | IC 50 (μM) |
| 18 | 0.2 |
| 19 | 2 |
| 21 | 0.5 |
| 22 | 0.3 |
용해도
| 화합물 | 물 1L당 화합물의 양(g) |
| ZC-207 | 불용성 |
| ZC-423 | 11 |
| 27 | 9 |
| 30 | 4 |
| 33 | 3 |
Claims (17)
- 하기 화학식 (I)을 갖는 화합물, 또는 그의 용매화물:상기 식에서,R2는 할로, C1-7 포화된 알콕시 또는 메틸렌디옥시 기로 치환된 나프틸 또는 티오페닐 또는 페닐이고;R6 및 R9는 H이며;R7은 C1-7 알콕시 기이고;R"는 C3 또는 C5 포화된 알킬렌 기이며;X는 0, S 또는 NH로부터 선택되고;z는 2 또는 3이고;M은 1가의 약제학적으로 허용가능한 양이온이고;R2', R6', R7', R9', X' 및 M'는 각각 R2, R6, R7, R9, X 및 M과 동일한 기로부터 선택되거나, M 및 M'는 함께 2가의 약제학적으로 허용가능한 양이온을 나타낼 수 있음.
- 제1항에 있어서, X가 O인 화합물.
- 삭제
- 삭제
- 삭제
- 삭제
- 제1항에 있어서, R7이 OMe인 화합물.
- 제1항에 있어서, R2는 할로, C1-7 포화된 알콕시 또는 메틸렌디옥시 기로 치환된 페닐인 화합물.
- 삭제
- 제1항에 있어서, R2는 R2'와 동일하며, R7은 R7'와 동일하고, X는 X'와 동일한 것인 화합물.
- 제1항에 있어서, M 및 M'이 1가의 약제학적으로 허용가능한 양이온인 화합물.
- 제11항에 있어서, M 및 M'가 Na+인 화합물.
- 제1항에 있어서, z가 3인 화합물.
- 신생물종양, 종양, 암, 백혈병, 건선, 골질환, 섬유증식성 질환 및 죽상경화증으로부터 선택된 증식성 질환을 치료하기 위한 제1항에 따른 화합물을 포함하는 약제학적 조성물.
- 삭제
- 삭제
- 삭제
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GB0508084.1 | 2005-04-21 | ||
| GB0508084A GB0508084D0 (en) | 2005-04-21 | 2005-04-21 | Pyrrolobenzodiazepines |
| GB0522746.7 | 2005-11-07 | ||
| GB0522746A GB0522746D0 (en) | 2005-11-07 | 2005-11-07 | Pyrrolobenzodiazepines |
| PCT/GB2006/001456 WO2006111759A1 (en) | 2005-04-21 | 2006-04-21 | Pyrrolobenzodiazepines |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20080004618A KR20080004618A (ko) | 2008-01-09 |
| KR101396095B1 true KR101396095B1 (ko) | 2014-05-15 |
Family
ID=36589321
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020077027047A KR101396095B1 (ko) | 2005-04-21 | 2006-04-21 | 피롤로벤조디아제핀 |
Country Status (19)
| Country | Link |
|---|---|
| US (2) | US7612062B2 (ko) |
| EP (1) | EP1879901B1 (ko) |
| JP (1) | JP5061096B2 (ko) |
| KR (1) | KR101396095B1 (ko) |
| AT (1) | ATE452898T1 (ko) |
| AU (1) | AU2006238686B2 (ko) |
| BR (1) | BRPI0610284A8 (ko) |
| CA (1) | CA2604805C (ko) |
| CY (1) | CY1109911T1 (ko) |
| DE (1) | DE602006011300D1 (ko) |
| DK (1) | DK1879901T3 (ko) |
| ES (1) | ES2338696T3 (ko) |
| GB (1) | GB2439881C (ko) |
| MX (1) | MX2007013039A (ko) |
| NZ (1) | NZ563136A (ko) |
| PL (1) | PL1879901T3 (ko) |
| PT (1) | PT1879901E (ko) |
| SI (1) | SI1879901T1 (ko) |
| WO (1) | WO2006111759A1 (ko) |
Families Citing this family (107)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS5079103U (ko) * | 1973-11-24 | 1975-07-09 | ||
| GB9818730D0 (en) * | 1998-08-27 | 1998-10-21 | Univ Portsmouth | Collections of compounds |
| GB0404574D0 (en) * | 2004-03-01 | 2004-04-07 | Spirogen Ltd | Amino acids |
| GB0404577D0 (en) * | 2004-03-01 | 2004-04-07 | Spirogen Ltd | Pyrrolobenzodiazepines |
| WO2005085251A1 (en) * | 2004-03-01 | 2005-09-15 | Spirogen Limited | 11-hydroxy-5h-pyrrolo[2,1-c][1,4]benzodiazepin-5-one derivatives as key intermediates for the preparation of c2 substituted pyrrolobenzodiazepines |
| US7528126B2 (en) * | 2004-03-09 | 2009-05-05 | Spirogen Limited | Pyrrolobenzodiazepines |
| GB0410725D0 (en) * | 2004-05-13 | 2004-06-16 | Spirogen Ltd | Pyrrolobenzodiazepine therapeutic agents |
| DK1879901T3 (da) * | 2005-04-21 | 2010-05-03 | Spirogen Ltd | Pyrrolobenzodiazepiner |
| ATE427949T1 (de) | 2005-10-05 | 2009-04-15 | Spirogen Ltd | 4-a4-(5-oxo-2,3,5,11a-tetrahydro-5h-pyrrolo a2, 1-cua1,4ubenzodiazepin-8-yloxy)-butyrylaminou-1 - pyrrol-2-carbonsaurealkylesterderivate und verwandte verbindung zur behandlung einer proliferativen erkrankung |
| KR100952137B1 (ko) * | 2008-04-18 | 2010-04-09 | 실리콘 디스플레이 (주) | 입체 영상 디스플레이 장치 및 그 제조방법 |
| US8633477B2 (en) | 2008-07-17 | 2014-01-21 | Pavoninekorea Inc. | Organic light-emitting diode three-dimensional image display device |
| GB0813432D0 (en) | 2008-07-22 | 2008-08-27 | Spirogen Ltd | Pyrrolobenzodiazepines |
| GB0819097D0 (en) * | 2008-10-17 | 2008-11-26 | Spirogen Ltd | Pyrrolobenzodiazepines |
| GB0819095D0 (en) * | 2008-10-17 | 2008-11-26 | Spirogen Ltd | Pyrrolobenzodiazepines |
| EP2558475A1 (en) * | 2010-04-15 | 2013-02-20 | Spirogen Sàrl | Pyrrolobenzodiazepines used to treat proliferative diseases |
| GB201006340D0 (en) | 2010-04-15 | 2010-06-02 | Spirogen Ltd | Synthesis method and intermediates |
| JP5870400B2 (ja) * | 2010-04-15 | 2016-03-01 | シアトル ジェネティクス,インコーポレーテッド | 標的化ピロロベンゾジアゼピンコンジュゲート |
| US20130028917A1 (en) | 2010-04-15 | 2013-01-31 | Spirogen Developments Sàrl | Pyrrolobenzodiazepines and conjugates thereof |
| AR085091A1 (es) | 2011-01-26 | 2013-09-11 | Kolltan Pharmaceuticals Inc | Anticuerpos anti-kit y sus usos |
| EP3610889A1 (en) | 2011-05-08 | 2020-02-19 | LegoChem Biosciences, Inc. | Protein-active agent conjugates and method for preparing the same |
| AU2012311505B2 (en) | 2011-09-20 | 2016-09-29 | Medimmune Limited | Pyrrolobenzodiazepines as unsymmetrical dimeric PBD compounds for inclusion in targeted conjugates |
| AU2012322607B2 (en) | 2011-10-14 | 2017-02-16 | Genentech, Inc. | Pyrrolobenzodiazepines and conjugates thereof |
| WO2013053872A1 (en) | 2011-10-14 | 2013-04-18 | Spirogen Sàrl | Synthesis method and intermediates useful in the preparation of pyrrolobenzodiazepines |
| CN103997893B (zh) | 2011-10-14 | 2019-04-12 | 西雅图基因公司 | 吡咯并苯并二氮杂卓和靶向结合物 |
| CN110183470A (zh) | 2011-10-14 | 2019-08-30 | 麦迪穆有限责任公司 | 吡咯并苯并二氮杂卓 |
| WO2013055990A1 (en) * | 2011-10-14 | 2013-04-18 | Seattle Genetics, Inc. | Pyrrolobenzodiazepines and targeted conjugates |
| KR101891859B1 (ko) | 2011-10-14 | 2018-08-24 | 메디뮨 리미티드 | 피롤로벤조디아제핀 |
| CA2871172C (en) | 2012-04-30 | 2020-08-25 | Spirogen Sarl | Pyrrolobenzodiazepines |
| MX2014013144A (es) | 2012-04-30 | 2015-05-11 | Ucl Business Plc | Pirrolobenzodiacepinas. |
| EP4063391A1 (en) | 2012-07-25 | 2022-09-28 | Celldex Therapeutics, Inc. | Anti-kit antibodies and uses thereof |
| EP2906298B1 (en) | 2012-10-12 | 2018-10-03 | ADC Therapeutics SA | Pyrrolobenzodiazepine-antibody conjugates |
| CA2887899C (en) | 2012-10-12 | 2020-03-31 | Adc Therapeutics Sarl | Pyrrolobenzodiazepine-anti-cd22 antibody conjugates |
| ME03486B (me) | 2012-10-12 | 2020-01-20 | Medimmune Ltd | Pirolobenzodiazepini i njihovi konjugati |
| PT2906296T (pt) | 2012-10-12 | 2018-06-01 | Medimmune Ltd | Conjugados de pirrolobenzodiazepina-anticorpo |
| EP2906249B1 (en) | 2012-10-12 | 2018-06-27 | MedImmune Limited | Synthesis and intermediates of pyrrolobenzodiazepine derivatives for conjugation |
| LT2906253T (lt) | 2012-10-12 | 2018-10-10 | Adc Therapeutics Sa | Pirolobenzodiazepino-anti-psma antikūno konjugatas |
| CA3060520C (en) | 2012-10-12 | 2022-05-17 | Medimmune Limited | Pyrrolobenzodiazepines and conjugates thereof |
| EP2906297B1 (en) | 2012-10-12 | 2017-12-06 | ADC Therapeutics SA | Pyrrolobenzodiazepine-antibody conjugates |
| ES2680153T3 (es) | 2012-10-12 | 2018-09-04 | Adc Therapeutics Sa | Conjugados de anticuerpos anti-PSMA-pirrolobenzodiazepinas |
| ES2701076T3 (es) | 2012-11-24 | 2019-02-20 | Hangzhou Dac Biotech Co Ltd | Enlazadores hidrofílicos y sus usos para la conjugación de fármacos a las moléculas que se unen a las células |
| US9567340B2 (en) | 2012-12-21 | 2017-02-14 | Medimmune Limited | Unsymmetrical pyrrolobenzodiazepines-dimers for use in the treatment of proliferative and autoimmune diseases |
| EA031585B1 (ru) | 2012-12-21 | 2019-01-31 | Медимьюн Лимитед | Пирролобензодиазепины и их конъюгаты |
| CN105209077B (zh) | 2013-03-13 | 2019-06-11 | 麦迪穆有限责任公司 | 吡咯并苯并二氮杂卓以及其结合物 |
| CA2904044C (en) | 2013-03-13 | 2020-03-31 | Medimmune Limited | Pyrrolobenzodiazepines and conjugates thereof |
| AR096287A1 (es) | 2013-03-13 | 2015-12-23 | Spirogen Sàrl | Pirrolobenzodiacepinas y conjugados |
| GB201317981D0 (en) | 2013-10-11 | 2013-11-27 | Spirogen Sarl | Pyrrolobenzodiazepines and conjugates thereof |
| GB201317982D0 (en) | 2013-10-11 | 2013-11-27 | Spirogen Sarl | Pyrrolobenzodiazepines and conjugates thereof |
| WO2015052534A1 (en) | 2013-10-11 | 2015-04-16 | Spirogen Sàrl | Pyrrolobenzodiazepine-antibody conjugates |
| WO2015052532A1 (en) | 2013-10-11 | 2015-04-16 | Spirogen Sàrl | Pyrrolobenzodiazepine-antibody conjugates |
| EP3054986B1 (en) | 2013-10-11 | 2019-03-20 | Medimmune Limited | Pyrrolobenzodiazepine-antibody conjugates |
| US10464955B2 (en) | 2014-02-28 | 2019-11-05 | Hangzhou Dac Biotech Co., Ltd. | Charged linkers and their uses for conjugation |
| CN110841074B (zh) | 2014-03-21 | 2023-07-18 | 艾伯维公司 | 抗-egfr抗体及抗体药物偶联物 |
| US10160812B2 (en) | 2014-04-11 | 2018-12-25 | Medimmune, Llc | Bispecific HER2 antibodies |
| US10188746B2 (en) | 2014-09-10 | 2019-01-29 | Medimmune Limited | Pyrrolobenzodiazepines and conjugates thereof |
| GB201416112D0 (en) | 2014-09-12 | 2014-10-29 | Medimmune Ltd | Pyrrolobenzodiazepines and conjugates thereof |
| SG11201702079UA (en) | 2014-09-17 | 2017-04-27 | Genentech Inc | Pyrrolobenzodiazepines and antibody disulfide conjugates thereof |
| AU2015324924B2 (en) | 2014-10-01 | 2021-07-01 | Medimmune, Llc | Method of conjugating a polypeptide |
| CA2968447A1 (en) | 2014-11-25 | 2016-06-02 | Adc Therapeutics Sa | Pyrrolobenzodiazepine-antibody conjugates and their use to treat neoplasms |
| EA201791550A1 (ru) | 2015-01-14 | 2017-11-30 | Бристол-Маерс Сквибб Компани | Димеры бензодиазепинов, их конъюгаты и способы их получения и применения |
| WO2016115201A1 (en) | 2015-01-14 | 2016-07-21 | Bristol-Myers Squibb Company | Heteroarylene-bridged benzodiazepine dimers, conjugates thereof, and methods of making and using |
| GB201506402D0 (en) | 2015-04-15 | 2015-05-27 | Berkel Patricius H C Van And Howard Philip W | Site-specific antibody-drug conjugates |
| GB201506411D0 (en) | 2015-04-15 | 2015-05-27 | Bergenbio As | Humanized anti-axl antibodies |
| BR112017027258A2 (pt) | 2015-06-23 | 2018-08-28 | Bristol-Myers Squibb Company | dímeros de benzodiazepina macrocíclicos, conjugados dos mesmos, preparação e usos |
| CA2991973C (en) | 2015-07-12 | 2021-12-07 | Suzhou M-Conj Biotech Co., Ltd. | Bridge linkers for conjugation of a cell-binding molecule |
| US9839687B2 (en) | 2015-07-15 | 2017-12-12 | Suzhou M-Conj Biotech Co., Ltd. | Acetylenedicarboxyl linkers and their uses in specific conjugation of a cell-binding molecule |
| CA2992082A1 (en) | 2015-07-21 | 2017-01-26 | Immunogen, Inc. | Methods of preparing cytotoxic benzodiazepine derivatives |
| GB201601431D0 (en) | 2016-01-26 | 2016-03-09 | Medimmune Ltd | Pyrrolobenzodiazepines |
| RU2018128784A (ru) | 2016-01-27 | 2020-02-27 | МЕДИММЬЮН, ЭлЭлСи | Способы получения антител с заданным профилем гликозилирования |
| GB201602359D0 (en) | 2016-02-10 | 2016-03-23 | Medimmune Ltd | Pyrrolobenzodiazepine Conjugates |
| GB201602356D0 (en) | 2016-02-10 | 2016-03-23 | Medimmune Ltd | Pyrrolobenzodiazepine Conjugates |
| GB201607478D0 (en) | 2016-04-29 | 2016-06-15 | Medimmune Ltd | Pyrrolobenzodiazepine Conjugates |
| JP2019522643A (ja) | 2016-06-08 | 2019-08-15 | アッヴィ・インコーポレイテッド | 抗cd98抗体及び抗体薬物コンジュゲート |
| SG10201914119TA (en) | 2016-06-08 | 2020-02-27 | Abbvie Inc | Anti-b7-h3 antibodies and antibody drug conjugates |
| CA3027103A1 (en) | 2016-06-08 | 2017-12-14 | Abbvie Inc. | Anti-b7-h3 antibodies and antibody drug conjugates |
| CA3027033A1 (en) | 2016-06-08 | 2017-12-14 | Abbvie Inc. | Anti-cd98 antibodies and antibody drug conjugates |
| US20200002421A1 (en) | 2016-06-08 | 2020-01-02 | Abbvie Inc. | Anti-b7-h3 antibodies and antibody drug conjugates |
| WO2018071455A1 (en) | 2016-10-10 | 2018-04-19 | Cellerant Therapeutics, Inc. | Isoquinolidinobenzodiazepine (iqb)-1(chloromethyl)-2,3-dihydro-1h-benzo[e]indole (cbi) dimers |
| GB201617466D0 (en) | 2016-10-14 | 2016-11-30 | Medimmune Ltd | Pyrrolobenzodiazepine conjugates |
| KR20220150408A (ko) | 2016-11-14 | 2022-11-10 | 항저우 디에이씨 바이오테크 씨오, 엘티디 | 결합 링커, 그러한 결합 링커를 함유하는 세포 결합 분자-약물 결합체, 링커를 갖는 그러한 결합체의 제조 및 사용 |
| GB201619490D0 (en) * | 2016-11-17 | 2017-01-04 | Medimmune Ltd | Pyrrolobenzodiazepine conjugates |
| CN110392685B (zh) | 2016-11-23 | 2023-07-04 | 伊缪诺金公司 | 苯并二氮卓衍生物的选择性磺化 |
| GB201702031D0 (en) | 2017-02-08 | 2017-03-22 | Medlmmune Ltd | Pyrrolobenzodiazepine-antibody conjugates |
| KR20200032243A (ko) | 2017-02-08 | 2020-03-25 | 에이디씨 테라퓨틱스 에스에이 | 피롤로벤조디아제핀-항체 컨주게이트 |
| TW201836647A (zh) | 2017-04-06 | 2018-10-16 | 美商艾伯維有限公司 | 抗-prlr抗體藥物軛合物(adc)及其用途 |
| PT3612537T (pt) | 2017-04-18 | 2022-08-29 | Medimmune Ltd | Conjugados de pirrolobenzodiazepina |
| EP3612234B1 (en) | 2017-04-20 | 2024-03-13 | ADC Therapeutics SA | Combination therapy with an anti-axl antibody-drug conjugate |
| AR111963A1 (es) | 2017-05-26 | 2019-09-04 | Univ California | Método y moléculas |
| UA127900C2 (uk) | 2017-06-14 | 2024-02-07 | Ейдісі Терапьютікс Са | Схема дозування для введення adc до cd19 |
| DK3668874T3 (da) | 2017-08-18 | 2022-02-14 | Medimmune Ltd | Pyrrolobenzodiazepin-konjugater |
| CN117003875A (zh) | 2017-09-29 | 2023-11-07 | 第一三共株式会社 | 抗体或其功能性片段、多核苷酸、表达载体、宿主细胞、糖链重构抗体、药物组合物、应用 |
| ES2920123T3 (es) | 2017-11-14 | 2022-08-01 | Medimmune Ltd | Conjugados de pirrolobenzodiazepina |
| GB201803342D0 (en) | 2018-03-01 | 2018-04-18 | Medimmune Ltd | Methods |
| GB201806022D0 (en) | 2018-04-12 | 2018-05-30 | Medimmune Ltd | Pyrrolobenzodiazepines and conjugates thereof |
| US20210283141A1 (en) | 2018-05-25 | 2021-09-16 | Medimmune Limited | Pyrrolobenzodiazepine conjugates |
| WO2020079239A1 (en) | 2018-10-19 | 2020-04-23 | Medimmune Limited | Pyrrolobenzodiazepine conjugates |
| JP2022512716A (ja) | 2018-10-19 | 2022-02-07 | メドイミューン・リミテッド | ピロロベンゾジアゼピン複合体 |
| AU2019406199A1 (en) | 2018-12-21 | 2021-07-29 | Avidity Biosciences, Inc. | Anti-transferrin receptor antibodies and uses thereof |
| EP3918323A4 (en) | 2019-01-30 | 2022-12-28 | TrueBinding, Inc. | ANTI-GAL3 ANTIBODIES AND THEIR USES |
| BR112021018260A2 (pt) | 2019-03-15 | 2021-11-23 | Medimmune Ltd | Dímeros de azetidobenzodiazepina e conjugados compreendendo-os para uso no tratamento de câncer |
| CN115666589A (zh) | 2020-03-19 | 2023-01-31 | 艾维迪提生物科学公司 | 治疗面肩肱型肌营养不良的组合物和方法 |
| TW202202173A (zh) | 2020-03-27 | 2022-01-16 | 美商亞維代堤生物科學公司 | 治療肌肉萎縮症之組合物及方法 |
| UY39610A (es) | 2021-01-20 | 2022-08-31 | Abbvie Inc | Conjugados anticuerpo-fármaco anti-egfr |
| GB202105186D0 (en) | 2021-04-12 | 2021-05-26 | Medimmune Ltd | Pyrrolobenzodiazepine conjugates |
| GB202105187D0 (en) | 2021-04-12 | 2021-05-26 | Medimmune Ltd | Pyrrolobenzodiazepine conjugates |
| EP4370555A1 (en) | 2021-07-13 | 2024-05-22 | TrueBinding, Inc. | Methods of preventing protein aggregation |
| US11807685B2 (en) | 2021-08-05 | 2023-11-07 | The Uab Research Foundation | Anti-CD47 antibody and uses thereof |
| IL311452A (en) | 2021-09-16 | 2024-05-01 | Avidity Biosciences Inc | Compositions and methods for the treatment of FSHD muscular dystrophy |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS5569587A (en) * | 1978-11-17 | 1980-05-26 | Meiji Seika Kaisha Ltd | Novel antibiotic neothramycin derivative and its preparation |
| US4309437A (en) | 1979-07-17 | 1982-01-05 | The Green Cross Corporation | Pyrrolo-benzodiazepine compounds and anti-tumor composition thereof |
| EP1193270A2 (en) * | 1998-08-27 | 2002-04-03 | Spirogen Limited | Pyrrolobenzodiazepines |
Family Cites Families (22)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS58180487A (ja) | 1982-04-16 | 1983-10-21 | Kyowa Hakko Kogyo Co Ltd | 抗生物質dc−81およびその製造法 |
| GB9205051D0 (en) | 1992-03-09 | 1992-04-22 | Cancer Res Campaign Tech | Pyrrolobenzodiazepine derivatives,their preparation,and compositions containing them |
| FR2696176B1 (fr) * | 1992-09-28 | 1994-11-10 | Synthelabo | Dérivés de pipéridine, leur préparation et leur application en thérapeutique. |
| US6187797B1 (en) | 1996-12-23 | 2001-02-13 | Dupont Pharmaceuticals Company | Phenyl-isoxazoles as factor XA Inhibitors |
| GB9818732D0 (en) * | 1998-08-27 | 1998-10-21 | Univ Portsmouth | Collection of compounds |
| GB9818731D0 (en) * | 1998-08-27 | 1998-10-21 | Univ Portsmouth | Compounds |
| GB9818730D0 (en) * | 1998-08-27 | 1998-10-21 | Univ Portsmouth | Collections of compounds |
| US6909006B1 (en) * | 1999-08-27 | 2005-06-21 | Spirogen Limited | Cyclopropylindole derivatives |
| US6660856B2 (en) | 2002-03-08 | 2003-12-09 | Kaohsiung Medical University | Synthesis of pyrrolo[2,1-c][1,4]benzodiazepine analogues |
| US20040138269A1 (en) | 2002-10-11 | 2004-07-15 | Sugen, Inc. | Substituted pyrroles as kinase inhibitors |
| GB0226593D0 (en) * | 2002-11-14 | 2002-12-24 | Consultants Ltd | Compounds |
| GB0321295D0 (en) * | 2003-09-11 | 2003-10-15 | Spirogen Ltd | Synthesis of protected pyrrolobenzodiazepines |
| GB0416511D0 (en) | 2003-10-22 | 2004-08-25 | Spirogen Ltd | Pyrrolobenzodiazepines |
| US7511032B2 (en) * | 2003-10-22 | 2009-03-31 | The United States Of America As Represented By The Secretary, Department Of Health And Human Services | Pyrrolobenzodiazepine derivatives, compositions comprising the same and methods related thereto |
| GB0404577D0 (en) | 2004-03-01 | 2004-04-07 | Spirogen Ltd | Pyrrolobenzodiazepines |
| GB0404574D0 (en) * | 2004-03-01 | 2004-04-07 | Spirogen Ltd | Amino acids |
| GB0404578D0 (en) | 2004-03-01 | 2004-04-07 | Spirogen Ltd | Pyrrolobenzodiazepines |
| WO2005085251A1 (en) * | 2004-03-01 | 2005-09-15 | Spirogen Limited | 11-hydroxy-5h-pyrrolo[2,1-c][1,4]benzodiazepin-5-one derivatives as key intermediates for the preparation of c2 substituted pyrrolobenzodiazepines |
| US7528126B2 (en) * | 2004-03-09 | 2009-05-05 | Spirogen Limited | Pyrrolobenzodiazepines |
| GB0410725D0 (en) * | 2004-05-13 | 2004-06-16 | Spirogen Ltd | Pyrrolobenzodiazepine therapeutic agents |
| DK1879901T3 (da) | 2005-04-21 | 2010-05-03 | Spirogen Ltd | Pyrrolobenzodiazepiner |
| ATE427949T1 (de) * | 2005-10-05 | 2009-04-15 | Spirogen Ltd | 4-a4-(5-oxo-2,3,5,11a-tetrahydro-5h-pyrrolo a2, 1-cua1,4ubenzodiazepin-8-yloxy)-butyrylaminou-1 - pyrrol-2-carbonsaurealkylesterderivate und verwandte verbindung zur behandlung einer proliferativen erkrankung |
-
2006
- 2006-04-21 DK DK06726846.6T patent/DK1879901T3/da active
- 2006-04-21 CA CA2604805A patent/CA2604805C/en not_active Expired - Fee Related
- 2006-04-21 GB GB0720721A patent/GB2439881C/en not_active Expired - Fee Related
- 2006-04-21 JP JP2008507165A patent/JP5061096B2/ja not_active Expired - Fee Related
- 2006-04-21 EP EP06726846A patent/EP1879901B1/en active Active
- 2006-04-21 KR KR1020077027047A patent/KR101396095B1/ko active IP Right Grant
- 2006-04-21 MX MX2007013039A patent/MX2007013039A/es active IP Right Grant
- 2006-04-21 PL PL06726846T patent/PL1879901T3/pl unknown
- 2006-04-21 DE DE602006011300T patent/DE602006011300D1/de active Active
- 2006-04-21 AU AU2006238686A patent/AU2006238686B2/en not_active Ceased
- 2006-04-21 US US11/911,890 patent/US7612062B2/en not_active Expired - Fee Related
- 2006-04-21 ES ES06726846T patent/ES2338696T3/es active Active
- 2006-04-21 PT PT06726846T patent/PT1879901E/pt unknown
- 2006-04-21 BR BRPI0610284A patent/BRPI0610284A8/pt not_active Application Discontinuation
- 2006-04-21 SI SI200630604T patent/SI1879901T1/sl unknown
- 2006-04-21 NZ NZ563136A patent/NZ563136A/en not_active IP Right Cessation
- 2006-04-21 WO PCT/GB2006/001456 patent/WO2006111759A1/en not_active Application Discontinuation
- 2006-04-21 AT AT06726846T patent/ATE452898T1/de active
-
2009
- 2009-11-02 US US12/610,478 patent/US8633185B2/en not_active Expired - Fee Related
-
2010
- 2010-03-18 CY CY20101100248T patent/CY1109911T1/el unknown
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS5569587A (en) * | 1978-11-17 | 1980-05-26 | Meiji Seika Kaisha Ltd | Novel antibiotic neothramycin derivative and its preparation |
| US4309437A (en) | 1979-07-17 | 1982-01-05 | The Green Cross Corporation | Pyrrolo-benzodiazepine compounds and anti-tumor composition thereof |
| EP1193270A2 (en) * | 1998-08-27 | 2002-04-03 | Spirogen Limited | Pyrrolobenzodiazepines |
Also Published As
| Publication number | Publication date |
|---|---|
| GB2439881C (en) | 2011-08-10 |
| US20100113425A1 (en) | 2010-05-06 |
| DE602006011300D1 (de) | 2010-02-04 |
| AU2006238686A1 (en) | 2006-10-26 |
| ATE452898T1 (de) | 2010-01-15 |
| NZ563136A (en) | 2009-11-27 |
| PL1879901T3 (pl) | 2010-06-30 |
| BRPI0610284A8 (pt) | 2017-05-09 |
| GB2439881B (en) | 2009-04-08 |
| US8633185B2 (en) | 2014-01-21 |
| DK1879901T3 (da) | 2010-05-03 |
| EP1879901A1 (en) | 2008-01-23 |
| US7612062B2 (en) | 2009-11-03 |
| MX2007013039A (es) | 2008-03-13 |
| JP5061096B2 (ja) | 2012-10-31 |
| JP2008536905A (ja) | 2008-09-11 |
| GB0720721D0 (en) | 2007-12-05 |
| PT1879901E (pt) | 2010-03-29 |
| GB2439881A (en) | 2008-01-09 |
| EP1879901B1 (en) | 2009-12-23 |
| BRPI0610284A2 (pt) | 2010-06-08 |
| WO2006111759A1 (en) | 2006-10-26 |
| CA2604805C (en) | 2014-05-27 |
| SI1879901T1 (sl) | 2010-04-30 |
| KR20080004618A (ko) | 2008-01-09 |
| US20080167293A1 (en) | 2008-07-10 |
| CA2604805A1 (en) | 2006-10-26 |
| CY1109911T1 (el) | 2014-09-10 |
| ES2338696T3 (es) | 2010-05-11 |
| AU2006238686B2 (en) | 2011-10-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101396095B1 (ko) | 피롤로벤조디아제핀 | |
| KR101755722B1 (ko) | 증식 질환의 치료를 위한 비대칭 피롤로벤조디아제핀 이량체 | |
| KR101059183B1 (ko) | 피롤로벤조디아제핀 | |
| JP4909258B2 (ja) | C2置換ピロロベンゾジアゼピン類を調製するための主要な中間体としての11−ヒドロキシ−5H−ピロロ[2,1−c][1,4]ベンゾジアゼピン−5−オン誘導体 | |
| CN101171257B (zh) | 吡咯并苯并二氮杂类化合物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| N231 | Notification of change of applicant | ||
| E902 | Notification of reason for refusal | ||
| E90F | Notification of reason for final refusal | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant | ||
| FPAY | Annual fee payment |
Payment date: 20180427 Year of fee payment: 5 |
|
| FPAY | Annual fee payment |
Payment date: 20190430 Year of fee payment: 6 |