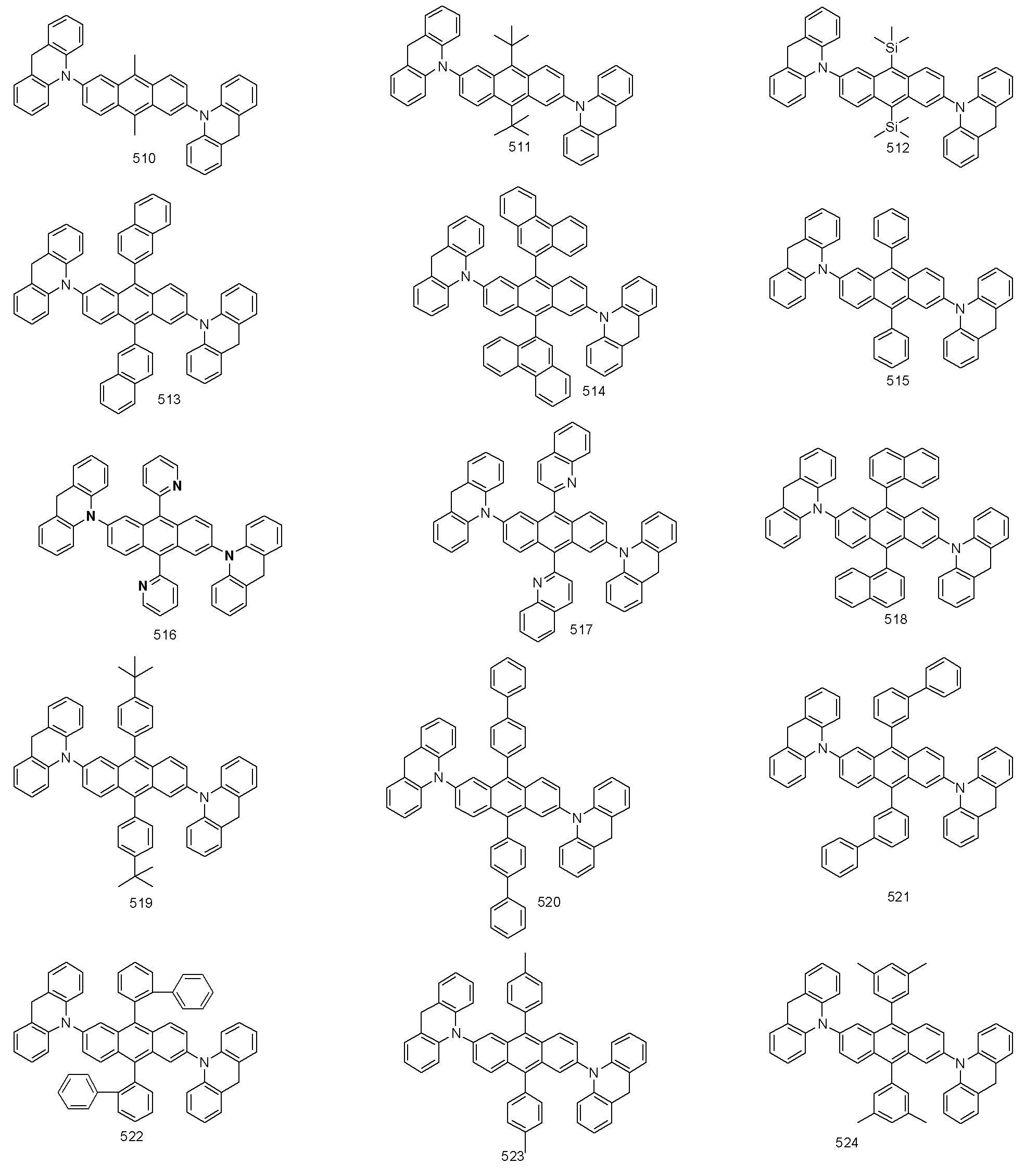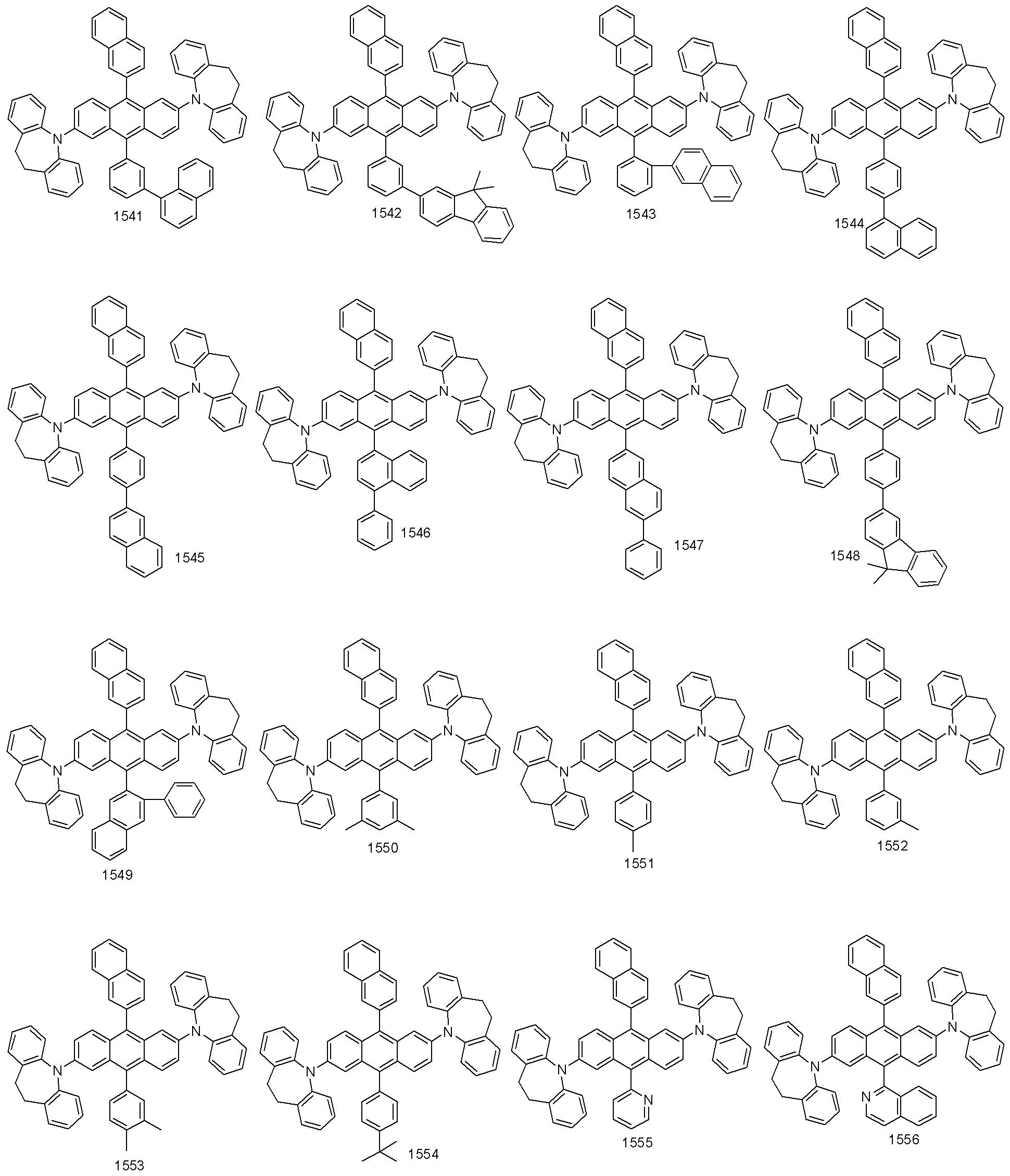KR101376530B1 - 신규한 유기 발광 화합물 및 이를 발광재료로서 채용하고 있는 유기 발광 소자 - Google Patents
신규한 유기 발광 화합물 및 이를 발광재료로서 채용하고 있는 유기 발광 소자 Download PDFInfo
- Publication number
- KR101376530B1 KR101376530B1 KR1020090056126A KR20090056126A KR101376530B1 KR 101376530 B1 KR101376530 B1 KR 101376530B1 KR 1020090056126 A KR1020090056126 A KR 1020090056126A KR 20090056126 A KR20090056126 A KR 20090056126A KR 101376530 B1 KR101376530 B1 KR 101376530B1
- Authority
- KR
- South Korea
- Prior art keywords
- alkyl
- light emitting
- tri
- aryl
- arylsilyl
- Prior art date
Links
- 0 *c1c(cccc2)c2c(*)c2cc(CN3CCCCCCCCC3)ccc12 Chemical compound *c1c(cccc2)c2c(*)c2cc(CN3CCCCCCCCC3)ccc12 0.000 description 3
- YWFBNQZODZUIRD-UHFFFAOYSA-N C(C1)c(cccc2)c2N(c2cc3c(-c(cc4)cc5c4[s]c4c5cccc4)c(ccc(N4c5ccccc5CCc5c4cccc5)c4)c4c(-c4c(cccc5)c5ccc4)c3cc2)c2c1cccc2 Chemical compound C(C1)c(cccc2)c2N(c2cc3c(-c(cc4)cc5c4[s]c4c5cccc4)c(ccc(N4c5ccccc5CCc5c4cccc5)c4)c4c(-c4c(cccc5)c5ccc4)c3cc2)c2c1cccc2 YWFBNQZODZUIRD-UHFFFAOYSA-N 0.000 description 1
- QWTGHVPYIMKUJR-UHFFFAOYSA-N C1c2ccccc2CC11c(cc(cc2)-c3c(ccc(N4c(cccc5)c5Oc5ccccc45)c4)c4c(-c4ccc5-c6ccccc6C(C6)(Cc7c6cccc7)c5c4)c(cc4)c3cc4N3c4ccccc4Oc4c3cccc4)c2-c2ccccc12 Chemical compound C1c2ccccc2CC11c(cc(cc2)-c3c(ccc(N4c(cccc5)c5Oc5ccccc45)c4)c4c(-c4ccc5-c6ccccc6C(C6)(Cc7c6cccc7)c5c4)c(cc4)c3cc4N3c4ccccc4Oc4c3cccc4)c2-c2ccccc12 QWTGHVPYIMKUJR-UHFFFAOYSA-N 0.000 description 1
- UROQRVYMVNOQMW-UHFFFAOYSA-N CC(C)(c1c2)c3cc(-c4c(cc(cc5)N6c(cccc7)c7[Si+](C)(C)c7ccccc67)c5c(-c5cc(cccc6)c6cc5)c5c4ccc(N4c6ccccc6[Si+](C)(C)c6c4cccc6)c5)ccc3-c1ccc2-c1ccccc1 Chemical compound CC(C)(c1c2)c3cc(-c4c(cc(cc5)N6c(cccc7)c7[Si+](C)(C)c7ccccc67)c5c(-c5cc(cccc6)c6cc5)c5c4ccc(N4c6ccccc6[Si+](C)(C)c6c4cccc6)c5)ccc3-c1ccc2-c1ccccc1 UROQRVYMVNOQMW-UHFFFAOYSA-N 0.000 description 1
- JBXZRHASRDLPHM-UHFFFAOYSA-N CC1(C)c(cc(cc2)-c3c(cc(cc4)N5c(cccc6)c6[Si+](C)(C)c6ccccc56)c4c(-c4c(cccc5)c5ccc4)c4c3ccc(N3c5ccccc5[Si+](C)(C)c5c3cccc5)c4)c2-c2ccccc12 Chemical compound CC1(C)c(cc(cc2)-c3c(cc(cc4)N5c(cccc6)c6[Si+](C)(C)c6ccccc56)c4c(-c4c(cccc5)c5ccc4)c4c3ccc(N3c5ccccc5[Si+](C)(C)c5c3cccc5)c4)c2-c2ccccc12 JBXZRHASRDLPHM-UHFFFAOYSA-N 0.000 description 1
- LERDJTBITNDPNW-UHFFFAOYSA-N CC1(C)c(cc(cc2)-c3c(ccc(N4c(cccc5)c5[Si+](C)(C)c5ccccc45)c4)c4c(-c4cc(-c5cc6ccccc6cc5)ccc4)c(cc4)c3cc4N3c4ccccc4[Si+](C)(C)c4c3cccc4)c2-c2ccccc12 Chemical compound CC1(C)c(cc(cc2)-c3c(ccc(N4c(cccc5)c5[Si+](C)(C)c5ccccc45)c4)c4c(-c4cc(-c5cc6ccccc6cc5)ccc4)c(cc4)c3cc4N3c4ccccc4[Si+](C)(C)c4c3cccc4)c2-c2ccccc12 LERDJTBITNDPNW-UHFFFAOYSA-N 0.000 description 1
- IQDHIUZRJHMYSE-UHFFFAOYSA-N CC1(C)c(cc(cc2)-c3c(ccc(N4c(cccc5)c5[Si+](C)(C)c5ccccc45)c4)c4c(-c4ccccc4-c4cccc5ccccc45)c(cc4)c3cc4N3c4ccccc4[Si+](C)(C)c4c3cccc4)c2-c2ccccc12 Chemical compound CC1(C)c(cc(cc2)-c3c(ccc(N4c(cccc5)c5[Si+](C)(C)c5ccccc45)c4)c4c(-c4ccccc4-c4cccc5ccccc45)c(cc4)c3cc4N3c4ccccc4[Si+](C)(C)c4c3cccc4)c2-c2ccccc12 IQDHIUZRJHMYSE-UHFFFAOYSA-N 0.000 description 1
- SQPPNNMBSJSDCJ-UHFFFAOYSA-N CC1(C)c(cccc2)c2N(c(cc2)cc3c2c(-c2cccc4c2[s]c2c4cccc2)c(cc(cc2)N(c4c(C5(C)C)cccc4)c4c5cccc4)c2c3-c2c3[s]c(cccc4)c4c3ccc2)c2c1cccc2 Chemical compound CC1(C)c(cccc2)c2N(c(cc2)cc3c2c(-c2cccc4c2[s]c2c4cccc2)c(cc(cc2)N(c4c(C5(C)C)cccc4)c4c5cccc4)c2c3-c2c3[s]c(cccc4)c4c3ccc2)c2c1cccc2 SQPPNNMBSJSDCJ-UHFFFAOYSA-N 0.000 description 1
- QXLLTPQETBITIE-UHFFFAOYSA-N CC1(C)c(cccc2)c2N(c(cc2)cc3c2c(-c2nc(c(nccc4)c4cc4)c4cc2)c(cc(cc2)N(c4c(C5(C)C)cccc4)c4c5cccc4)c2c3-c2nc(c3ncccc3cc3)c3cc2)c2c1cccc2 Chemical compound CC1(C)c(cccc2)c2N(c(cc2)cc3c2c(-c2nc(c(nccc4)c4cc4)c4cc2)c(cc(cc2)N(c4c(C5(C)C)cccc4)c4c5cccc4)c2c3-c2nc(c3ncccc3cc3)c3cc2)c2c1cccc2 QXLLTPQETBITIE-UHFFFAOYSA-N 0.000 description 1
- LCGHNHMYAFHGDX-UHFFFAOYSA-N CC1(C)c2cccc(-c3c(cc(cc4)N5c(cccc6)c6[Si+](C)(C)c6ccccc56)c4c(-c4c(cccc5)c5ccc4)c4c3ccc(N3c5ccccc5[Si+](C)(C)c5c3cccc5)c4)c2-c2c1cccc2 Chemical compound CC1(C)c2cccc(-c3c(cc(cc4)N5c(cccc6)c6[Si+](C)(C)c6ccccc56)c4c(-c4c(cccc5)c5ccc4)c4c3ccc(N3c5ccccc5[Si+](C)(C)c5c3cccc5)c4)c2-c2c1cccc2 LCGHNHMYAFHGDX-UHFFFAOYSA-N 0.000 description 1
- LRCLFDNMCGFDOH-UHFFFAOYSA-N CC1(C)c2ccccc2N(c(cc2)cc3c2c(-c2ccc-4c5c2cccc5-c2ccccc-42)c(cc(cc2)N(c4c(C5(C)C)cccc4)c4c5cccc4)c2c3-c2ccc-3c4c2cccc4-c2c-3cccc2)c2c1cccc2 Chemical compound CC1(C)c2ccccc2N(c(cc2)cc3c2c(-c2ccc-4c5c2cccc5-c2ccccc-42)c(cc(cc2)N(c4c(C5(C)C)cccc4)c4c5cccc4)c2c3-c2ccc-3c4c2cccc4-c2c-3cccc2)c2c1cccc2 LRCLFDNMCGFDOH-UHFFFAOYSA-N 0.000 description 1
- XXLLLQDEXXTGQN-UHFFFAOYSA-N CC1(C)c2ccccc2N(c(cc2)cc3c2c(-c2ccc4-c5ccccc5C5(c(cccc6)c6-c6c5cccc6)c4c2)c(cc(cc2)N(c4c(C5(C)C)cccc4)c4c5cccc4)c2c3-c(cc2)cc3c2-c2ccccc2C32c3ccccc3-c3ccccc23)c2c1cccc2 Chemical compound CC1(C)c2ccccc2N(c(cc2)cc3c2c(-c2ccc4-c5ccccc5C5(c(cccc6)c6-c6c5cccc6)c4c2)c(cc(cc2)N(c4c(C5(C)C)cccc4)c4c5cccc4)c2c3-c(cc2)cc3c2-c2ccccc2C32c3ccccc3-c3ccccc23)c2c1cccc2 XXLLLQDEXXTGQN-UHFFFAOYSA-N 0.000 description 1
- YHMAKTJVRUJQPR-UHFFFAOYSA-N CC1(C)c2ccccc2N(c(cc2)cc3c2c(-c2ccc4[s]c5ccccc5c4c2)c(cc(cc2)N4c5ccccc5C(C)(C)c5ccccc45)c2c3-c(cc2)cc3c2[s]c2c3cccc2)c2c1cccc2 Chemical compound CC1(C)c2ccccc2N(c(cc2)cc3c2c(-c2ccc4[s]c5ccccc5c4c2)c(cc(cc2)N4c5ccccc5C(C)(C)c5ccccc45)c2c3-c(cc2)cc3c2[s]c2c3cccc2)c2c1cccc2 YHMAKTJVRUJQPR-UHFFFAOYSA-N 0.000 description 1
- FCXZWWKFVBJPQS-UHFFFAOYSA-N CC1(C)c2ccccc2N(c(cc2)cc3c2c(-c2cccc4c2[o]c2ccccc42)c(cc(cc2)N(c4c(C5(C)C)cccc4)c4c5cccc4)c2c3-c2cccc3c2[o]c2c3cccc2)c2c1cccc2 Chemical compound CC1(C)c2ccccc2N(c(cc2)cc3c2c(-c2cccc4c2[o]c2ccccc42)c(cc(cc2)N(c4c(C5(C)C)cccc4)c4c5cccc4)c2c3-c2cccc3c2[o]c2c3cccc2)c2c1cccc2 FCXZWWKFVBJPQS-UHFFFAOYSA-N 0.000 description 1
- DJFNCUOOLLSGOS-UHFFFAOYSA-N CC1(C)c2ccccc2N(c(cc2)cc3c2c(-c2cccc4c2c(cccc2)c2[s]4)c(cc(cc2)N(c4c(C5(C)C)cccc4)c4c5cccc4)c2c3-c2cccc3c2c(cccc2)c2[s]3)c2c1cccc2 Chemical compound CC1(C)c2ccccc2N(c(cc2)cc3c2c(-c2cccc4c2c(cccc2)c2[s]4)c(cc(cc2)N(c4c(C5(C)C)cccc4)c4c5cccc4)c2c3-c2cccc3c2c(cccc2)c2[s]3)c2c1cccc2 DJFNCUOOLLSGOS-UHFFFAOYSA-N 0.000 description 1
- KPDXBNFZYAQPNI-UHFFFAOYSA-N C[Si+](C)(C)c(c1c2ccc(N3c(cccc4)c4[Si+](C)(C)c4c3cccc4)c1)c(ccc(N1c(cccc3)c3[Si+](C)(C)c3c1cccc3)c1)c1c2[Si+](C)(C)C Chemical compound C[Si+](C)(C)c(c1c2ccc(N3c(cccc4)c4[Si+](C)(C)c4c3cccc4)c1)c(ccc(N1c(cccc3)c3[Si+](C)(C)c3c1cccc3)c1)c1c2[Si+](C)(C)C KPDXBNFZYAQPNI-UHFFFAOYSA-N 0.000 description 1
- UEWFZOCGUXWNQZ-UHFFFAOYSA-N C[Si+]1(C)c(cccc2)c2N(c(cc2)cc3c2c(-c2ccc(cccc4)c4n2)c(cc(cc2)N4c5ccccc5[Si+](C)(C)c5c4cccc5)c2c3-c2nc(cccc3)c3cc2)c2c1cccc2 Chemical compound C[Si+]1(C)c(cccc2)c2N(c(cc2)cc3c2c(-c2ccc(cccc4)c4n2)c(cc(cc2)N4c5ccccc5[Si+](C)(C)c5c4cccc5)c2c3-c2nc(cccc3)c3cc2)c2c1cccc2 UEWFZOCGUXWNQZ-UHFFFAOYSA-N 0.000 description 1
- VUXUCZHAEUDCIS-UHFFFAOYSA-N C[Si+]1(C)c(cccc2)c2N(c(cc2)cc3c2c(-c2ccccn2)c(cc(cc2)N4c(cccc5)c5[Si+](C)(C)c5c4cccc5)c2c3-c2ccccn2)c2c1cccc2 Chemical compound C[Si+]1(C)c(cccc2)c2N(c(cc2)cc3c2c(-c2ccccn2)c(cc(cc2)N4c(cccc5)c5[Si+](C)(C)c5c4cccc5)c2c3-c2ccccn2)c2c1cccc2 VUXUCZHAEUDCIS-UHFFFAOYSA-N 0.000 description 1
- MQDSXDCXWLBNFC-UHFFFAOYSA-N C[Si+]1(C)c(cccc2)c2N(c2cc3c(-c(cc4)cc5c4[s]c4c5cccc4)c(ccc(N4c5ccccc5[Si+](C)(C)c5c4cccc5)c4)c4c(-c4c(cccc5)c5ccc4)c3cc2)c2ccccc12 Chemical compound C[Si+]1(C)c(cccc2)c2N(c2cc3c(-c(cc4)cc5c4[s]c4c5cccc4)c(ccc(N4c5ccccc5[Si+](C)(C)c5c4cccc5)c4)c4c(-c4c(cccc5)c5ccc4)c3cc2)c2ccccc12 MQDSXDCXWLBNFC-UHFFFAOYSA-N 0.000 description 1
- UXNOIOOPTBXWEI-UHFFFAOYSA-N C[Si+]1(C)c(cccc2)c2N(c2cc3c(-c(cc4)ccc4-c4cc5ccccc5c5c4cccc5)c(ccc(N4c5ccccc5[Si+](C)(C)c5ccccc45)c4)c4c(-c4cc(cccc5)c5cc4)c3cc2)c2ccccc12 Chemical compound C[Si+]1(C)c(cccc2)c2N(c2cc3c(-c(cc4)ccc4-c4cc5ccccc5c5c4cccc5)c(ccc(N4c5ccccc5[Si+](C)(C)c5ccccc45)c4)c4c(-c4cc(cccc5)c5cc4)c3cc2)c2ccccc12 UXNOIOOPTBXWEI-UHFFFAOYSA-N 0.000 description 1
- QRKCUDVNAQTUMG-UHFFFAOYSA-N C[Si+]1(C)c(cccc2)c2N(c2cc3c(-c(cc4)ccc4-c4ccccc4)c(ccc(N4c5ccccc5[Si+](C)(C)c5c4cccc5)c4)c4c(-c4c(cccc5)c5ccc4)c3cc2)c2ccccc12 Chemical compound C[Si+]1(C)c(cccc2)c2N(c2cc3c(-c(cc4)ccc4-c4ccccc4)c(ccc(N4c5ccccc5[Si+](C)(C)c5c4cccc5)c4)c4c(-c4c(cccc5)c5ccc4)c3cc2)c2ccccc12 QRKCUDVNAQTUMG-UHFFFAOYSA-N 0.000 description 1
- FSDHPGCCCSCTOR-UHFFFAOYSA-N C[Si+]1(C)c(cccc2)c2N(c2cc3c(-c(cc4)ccc4-c4nc5ccccc5[s]4)c(ccc(N4c5ccccc5[Si+](C)(C)c5c4cccc5)c4)c4c(-c4cc(cccc5)c5cc4)c3cc2)c2ccccc12 Chemical compound C[Si+]1(C)c(cccc2)c2N(c2cc3c(-c(cc4)ccc4-c4nc5ccccc5[s]4)c(ccc(N4c5ccccc5[Si+](C)(C)c5c4cccc5)c4)c4c(-c4cc(cccc5)c5cc4)c3cc2)c2ccccc12 FSDHPGCCCSCTOR-UHFFFAOYSA-N 0.000 description 1
- SHZBWNRQHGAOHT-UHFFFAOYSA-N C[Si+]1(C)c2ccccc2N(c(cc2)cc3c2c(-c2cc(cccc4)c4c4c2cccc4)c(cc(cc2)N4c(cccc5)c5[Si+](C)(C)c5c4cccc5)c2c3-c2cc3ccccc3c3c2cccc3)c2c1cccc2 Chemical compound C[Si+]1(C)c2ccccc2N(c(cc2)cc3c2c(-c2cc(cccc4)c4c4c2cccc4)c(cc(cc2)N4c(cccc5)c5[Si+](C)(C)c5c4cccc5)c2c3-c2cc3ccccc3c3c2cccc3)c2c1cccc2 SHZBWNRQHGAOHT-UHFFFAOYSA-N 0.000 description 1
- FQKWBVUYBMWVDK-UHFFFAOYSA-N C[Si+]1(C)c2ccccc2N(c(cc2)cc3c2c(-c2cc(cccc4)c4c4ccccc24)c(cc(cc2)N4c(cccc5)c5[Si+](C)(C)c5ccccc45)c2c3-c2c(cccc3)c3ccc2)c2c1cccc2 Chemical compound C[Si+]1(C)c2ccccc2N(c(cc2)cc3c2c(-c2cc(cccc4)c4c4ccccc24)c(cc(cc2)N4c(cccc5)c5[Si+](C)(C)c5ccccc45)c2c3-c2c(cccc3)c3ccc2)c2c1cccc2 FQKWBVUYBMWVDK-UHFFFAOYSA-N 0.000 description 1
- ZHRYTCUHNZSCJR-UHFFFAOYSA-N C[Si+]1(C)c2ccccc2N(c(cc2)cc3c2c(-c2cc4ccccc4cc2)c(cc(cc2)N4c(cccc5)c5[Si+](C)(C)c5c4cccc5)c2c3-c2cc(cccc3)c3cc2)c2c1cccc2 Chemical compound C[Si+]1(C)c2ccccc2N(c(cc2)cc3c2c(-c2cc4ccccc4cc2)c(cc(cc2)N4c(cccc5)c5[Si+](C)(C)c5c4cccc5)c2c3-c2cc(cccc3)c3cc2)c2c1cccc2 ZHRYTCUHNZSCJR-UHFFFAOYSA-N 0.000 description 1
- GZDVUKNNLUQHIW-UHFFFAOYSA-N C[Si+]1(C)c2ccccc2N(c(cc2)cc3c2c(-c2ccc-4c5c2cccc5-c2cccc5cccc-4c25)c(cc(cc2)N4c(cccc5)c5[Si+](C)(C)c5ccccc45)c2c3-c2cc(cccc3)c3cc2)c2ccccc12 Chemical compound C[Si+]1(C)c2ccccc2N(c(cc2)cc3c2c(-c2ccc-4c5c2cccc5-c2cccc5cccc-4c25)c(cc(cc2)N4c(cccc5)c5[Si+](C)(C)c5ccccc45)c2c3-c2cc(cccc3)c3cc2)c2ccccc12 GZDVUKNNLUQHIW-UHFFFAOYSA-N 0.000 description 1
- LYRGCVJVXAAMAC-UHFFFAOYSA-N C[Si+]1(C)c2ccccc2N(c(cc2)cc3c2c(-c2cccc4c2cccc4)c(cc(cc2)N4c5ccccc5[Si+](C)(C)c5c4cccc5)c2c3-c2cccc3c2cccc3)c2c1cccc2 Chemical compound C[Si+]1(C)c2ccccc2N(c(cc2)cc3c2c(-c2cccc4c2cccc4)c(cc(cc2)N4c5ccccc5[Si+](C)(C)c5c4cccc5)c2c3-c2cccc3c2cccc3)c2c1cccc2 LYRGCVJVXAAMAC-UHFFFAOYSA-N 0.000 description 1
- CFEGBWDUOICOEQ-UHFFFAOYSA-N C[Si+]1(C)c2ccccc2N(c(cc2)cc3c2c(-c2ccccc2)c(cc(cc2)N4c(cccc5)c5[Si+](C)(C)c5c4cccc5)c2c3-c2ccccc2)c2c1cccc2 Chemical compound C[Si+]1(C)c2ccccc2N(c(cc2)cc3c2c(-c2ccccc2)c(cc(cc2)N4c(cccc5)c5[Si+](C)(C)c5c4cccc5)c2c3-c2ccccc2)c2c1cccc2 CFEGBWDUOICOEQ-UHFFFAOYSA-N 0.000 description 1
- FKUGEXNDFYPXGV-UHFFFAOYSA-N C[Si+]1(C)c2ccccc2N(c(cc2)cc3c2c(-c2nc4c5ncccc5ccc4cc2)c(cc(cc2)N4c(cccc5)c5[Si+](C)(C)c5ccccc45)c2c3-c2cc(cccc3)c3cc2)c2c1cccc2 Chemical compound C[Si+]1(C)c2ccccc2N(c(cc2)cc3c2c(-c2nc4c5ncccc5ccc4cc2)c(cc(cc2)N4c(cccc5)c5[Si+](C)(C)c5ccccc45)c2c3-c2cc(cccc3)c3cc2)c2c1cccc2 FKUGEXNDFYPXGV-UHFFFAOYSA-N 0.000 description 1
- PUDZHSBDZWQDSE-UHFFFAOYSA-N Cc(cccc1)c1-c1c(ccc(N2c3ccccc3[Si+](C)(C)c3c2cccc3)c2)c2c(-c2c(cccc3)c3ccc2)c(cc2)c1cc2N1c2ccccc2[Si+](C)(C)c2ccccc12 Chemical compound Cc(cccc1)c1-c1c(ccc(N2c3ccccc3[Si+](C)(C)c3c2cccc3)c2)c2c(-c2c(cccc3)c3ccc2)c(cc2)c1cc2N1c2ccccc2[Si+](C)(C)c2ccccc12 PUDZHSBDZWQDSE-UHFFFAOYSA-N 0.000 description 1
- POACZVJHKHGYPI-UHFFFAOYSA-N Cc1c(ccc(N2c(cccc3)c3[Si+](C)(C)c3c2cccc3)c2)c2c(C)c(cc2)c1cc2N1c(cccc2)c2[Si+](C)(C)c2c1cccc2 Chemical compound Cc1c(ccc(N2c(cccc3)c3[Si+](C)(C)c3c2cccc3)c2)c2c(C)c(cc2)c1cc2N1c(cccc2)c2[Si+](C)(C)c2c1cccc2 POACZVJHKHGYPI-UHFFFAOYSA-N 0.000 description 1
- LXWRHQIMGYPQIQ-UHFFFAOYSA-N c(cc1)cc(cc2)c1cc2-c(cc1)ccc1-c1c(cc(cc2)N3c(cccc4)c4Oc4ccccc34)c2c(-c(cc2)ccc2-c2cc3ccccc3cc2)c2c1ccc(N1c3ccccc3Oc3c1cccc3)c2 Chemical compound c(cc1)cc(cc2)c1cc2-c(cc1)ccc1-c1c(cc(cc2)N3c(cccc4)c4Oc4ccccc34)c2c(-c(cc2)ccc2-c2cc3ccccc3cc2)c2c1ccc(N1c3ccccc3Oc3c1cccc3)c2 LXWRHQIMGYPQIQ-UHFFFAOYSA-N 0.000 description 1
- HRGYTXBHNWGDAC-UHFFFAOYSA-N c(cc1-c2cccc3c22)ccc1-c2ccc3-c1c(cc(cc2)N3c(cccc4)c4Oc4ccccc34)c2c(-c2ccc-3c4c2cccc4-c2c-3cccc2)c2c1ccc(N1c3ccccc3Oc3c1cccc3)c2 Chemical compound c(cc1-c2cccc3c22)ccc1-c2ccc3-c1c(cc(cc2)N3c(cccc4)c4Oc4ccccc34)c2c(-c2ccc-3c4c2cccc4-c2c-3cccc2)c2c1ccc(N1c3ccccc3Oc3c1cccc3)c2 HRGYTXBHNWGDAC-UHFFFAOYSA-N 0.000 description 1
- IQGHDGKBKCXYLT-UHFFFAOYSA-N c1cc(C2c3cccc(-c4c(ccc(N5c(cccc6)c6Oc6ccccc56)c5)c5c(-c5cccc(C6c7ccccc77)c5C7c5c6cccc5)c(cc5)c4cc5N4c5ccccc5Oc5c4cccc5)c3C3c4ccccc24)c3cc1 Chemical compound c1cc(C2c3cccc(-c4c(ccc(N5c(cccc6)c6Oc6ccccc56)c5)c5c(-c5cccc(C6c7ccccc77)c5C7c5c6cccc5)c(cc5)c4cc5N4c5ccccc5Oc5c4cccc5)c3C3c4ccccc24)c3cc1 IQGHDGKBKCXYLT-UHFFFAOYSA-N 0.000 description 1
- MWUNZENAHKEDDT-UHFFFAOYSA-N c1ccc(C2(c3cc(-c4c(cc(cc5)N6c(cccc7)c7Oc7ccccc67)c5c(-c(cc56)ccc5-c5ccccc5C6(c5ccccc5)c5ccccc5)c5c4ccc(N4c6ccccc6Oc6c4cccc6)c5)ccc3-c3ccccc23)c2ccccc2)cc1 Chemical compound c1ccc(C2(c3cc(-c4c(cc(cc5)N6c(cccc7)c7Oc7ccccc67)c5c(-c(cc56)ccc5-c5ccccc5C6(c5ccccc5)c5ccccc5)c5c4ccc(N4c6ccccc6Oc6c4cccc6)c5)ccc3-c3ccccc23)c2ccccc2)cc1 MWUNZENAHKEDDT-UHFFFAOYSA-N 0.000 description 1
- KFPMZGYSPZFPJT-UHFFFAOYSA-N c1ccc2c(-c(cc3)ccc3-c3c(cc(cc4)N5c(cccc6)c6Oc6ccccc56)c4c(-c(cc4)ccc4-c4c(cccc5)c5ccc4)c4c3ccc(N3c5ccccc5Oc5c3cccc5)c4)cccc2c1 Chemical compound c1ccc2c(-c(cc3)ccc3-c3c(cc(cc4)N5c(cccc6)c6Oc6ccccc56)c4c(-c(cc4)ccc4-c4c(cccc5)c5ccc4)c4c3ccc(N3c5ccccc5Oc5c3cccc5)c4)cccc2c1 KFPMZGYSPZFPJT-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- H—ELECTRICITY
- H05—ELECTRIC TECHNIQUES NOT OTHERWISE PROVIDED FOR
- H05B—ELECTRIC HEATING; ELECTRIC LIGHT SOURCES NOT OTHERWISE PROVIDED FOR; CIRCUIT ARRANGEMENTS FOR ELECTRIC LIGHT SOURCES, IN GENERAL
- H05B33/00—Electroluminescent light sources
- H05B33/10—Apparatus or processes specially adapted to the manufacture of electroluminescent light sources
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D219/00—Heterocyclic compounds containing acridine or hydrogenated acridine ring systems
- C07D219/14—Heterocyclic compounds containing acridine or hydrogenated acridine ring systems with hydrocarbon radicals, substituted by nitrogen atoms, attached to the ring nitrogen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D223/00—Heterocyclic compounds containing seven-membered rings having one nitrogen atom as the only ring hetero atom
- C07D223/14—Heterocyclic compounds containing seven-membered rings having one nitrogen atom as the only ring hetero atom condensed with carbocyclic rings or ring systems
- C07D223/18—Dibenzazepines; Hydrogenated dibenzazepines
- C07D223/22—Dibenz [b, f] azepines; Hydrogenated dibenz [b, f] azepines
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D223/00—Heterocyclic compounds containing seven-membered rings having one nitrogen atom as the only ring hetero atom
- C07D223/14—Heterocyclic compounds containing seven-membered rings having one nitrogen atom as the only ring hetero atom condensed with carbocyclic rings or ring systems
- C07D223/18—Dibenzazepines; Hydrogenated dibenzazepines
- C07D223/22—Dibenz [b, f] azepines; Hydrogenated dibenz [b, f] azepines
- C07D223/24—Dibenz [b, f] azepines; Hydrogenated dibenz [b, f] azepines with hydrocarbon radicals, substituted by nitrogen atoms, attached to the ring nitrogen atom
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/06—Luminescent, e.g. electroluminescent, chemiluminescent materials containing organic luminescent materials
-
- H—ELECTRICITY
- H05—ELECTRIC TECHNIQUES NOT OTHERWISE PROVIDED FOR
- H05B—ELECTRIC HEATING; ELECTRIC LIGHT SOURCES NOT OTHERWISE PROVIDED FOR; CIRCUIT ARRANGEMENTS FOR ELECTRIC LIGHT SOURCES, IN GENERAL
- H05B33/00—Electroluminescent light sources
- H05B33/12—Light sources with substantially two-dimensional radiating surfaces
- H05B33/14—Light sources with substantially two-dimensional radiating surfaces characterised by the chemical or physical composition or the arrangement of the electroluminescent material, or by the simultaneous addition of the electroluminescent material in or onto the light source
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/615—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene
- H10K85/626—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene containing more than one polycyclic condensed aromatic rings, e.g. bis-anthracene
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1011—Condensed systems
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/11—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E10/00—Energy generation through renewable energy sources
- Y02E10/50—Photovoltaic [PV] energy
- Y02E10/549—Organic PV cells
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P70/00—Climate change mitigation technologies in the production process for final industrial or consumer products
- Y02P70/50—Manufacturing or production processes characterised by the final manufactured product
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Physics & Mathematics (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Manufacturing & Machinery (AREA)
- Electroluminescent Light Sources (AREA)
- Plural Heterocyclic Compounds (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Nitrogen And Oxygen As The Only Ring Hetero Atoms (AREA)
- Indole Compounds (AREA)
- Hydrogenated Pyridines (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Quinoline Compounds (AREA)
- Other In-Based Heterocyclic Compounds (AREA)
- Nitrogen- Or Sulfur-Containing Heterocyclic Ring Compounds With Rings Of Six Or More Members (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Pyridine Compounds (AREA)
Abstract
본 발명은 신규한 유기 발광 화합물 및 이를 발광재료로서 채용하고 있는 유기 발광 소자에 관한 것으로, 상세하게는 본 발명에 따른 유기 발광 화합물은 하기 화학식 1의 화합물인 것을 특징으로 한다.
[화학식 1]
[상기 화학식 1에서, A고리 및 B고리는 서로 독립적으로 포화 5원 내지 6원의 헤테로고리아미노기이거나, 하기 구조에서 선택된 치환기이고,
상기 포화 5원 내지 6원의 헤테로고리아미노기는 NR36, O 및 S로부터 선택된 하나 이상의 헤테로 원자를 더 포함할 수 있고;
a 및 b는 서로 독립적으로 0 내지 4의 정수이고, 단 a+b=1~4의 정수이다.]
본 발명에 따른 유기 발광 화합물은 발광효율이 좋고 재료의 색순도 및 수명특성이 뛰어나 구동수명이 매우 우수한 OLED 소자를 제조할 수 있는 장점이 있다.
호스트, 유기 발광 화합물, 유기 발광 소자, 도판트, 청색, 녹색
Description
본 발명은 신규한 유기 발광 화합물 및 이를 발광층에 채용하는 유기 발광 소자에 관한 것으로, 보다 구체적으로는 녹색 발광 재료로서 사용되는 신규한 유기 발광 화합물 및 이를 도판트로서 채용하고 있는 유기 발광 소자에 관한 것이다.
고효율, 장수명 유기 EL 소자의 개발에 있어서 가장 중요한 요소는 고성능의 발광 재료의 개발이라고 하겠다. 현재 발광 재료 개발 측면에서 볼 때, 녹색 발광 재료는 적색, 청색 발광 재료에 비해, 월등한 발광 특성을 나타내고 있다. 그러나, 종래의 녹색 발광 재료로는, 패널의 대형화 및 저소비전력을 달성하는 데에는 아직도 많은 문제점을 안고 있다. 실제, 효율 및 수명 측면에서 녹색의 경우, 현재까지 다양한 종류의 재료들이 보고되고 있는데, 이들은 적색이나, 청색 발광 재료에 비하여 2 내지 5 배 이상의 특성을 나타내기는 하지만, 적색이나 청색 발광 재료의 특성 개선에 따른 녹색 발광 재료의 부담이 증대되고 있는 한편, 수명의 개선이 여전히 크게 이루어지지 않고 있어 보다 장수명 녹색 발광 재료에 대한 요구는 심각 한 상황에 이르고 있다.
녹색 형광 재료로는 쿠마린 유도체(화합물 D), 퀴나크리돈 유도체(화합물 E), DPT(화합물식 F) 등이 알려져 있다. 화합물 D는 쿠마린 유도체 중 현재 가장 널리 쓰이는 C545T의 구조이다. 대체로 이들 재료는 Alq를 호스트로서 수 내지 수십 % 정도의 농도로 도핑을 하여 발광 소자를 구성한다.
한편 일본공개특허공보 2001-131541호에는 하기의 화합물 G로 대표되는 안트라센의 2번과 6번 위치 각각에 디아릴아미노기가 직접 치환된 비스(2,6-디아릴아미노)-9,10-디페닐안트라센 유도체가 공지되어 있다.
정공수송층을 위한 화합물들을 공지하고 있는 일본공개특허공보 2003-146951호에서는 안트라센의 9번과 10번 위치에 페닐기가 치환된 경우 이외에는 2번과 6번 위치에 디아릴아미노 기가 직접 치환된 것을 개시하고 있지 아니할 뿐만 아니라, 일본공개특허공보 2003-146951호에서 안트라센 고리의 2번과 6번 위치에 각각 디아릴아미노기가 직접 치환되어 있는 화합물인 화합물 H의 경우 발광효율이 저하되는 문제점을 지적한 점을 본다면 상기 일본공개특허공보 2003-146951호 발명이 안트라센의 9번과 10번 위치에 페닐기가 치환된 범위 이외의 화합물을 인식하고 있지 아니하다는 것을 알 수 있다.
한편 일본공개특허공보 제2004-91334호에서는 안트라센에 디아릴아미노기가 직접 치환되어 있음에도 상기 디아릴아미노기의 아릴기가 디아릴아미노기로 더 치환되도록 함으로서 종래의 발광효율의 저하를 극복하고 이온화 포텐셜이 낮고 정공 수송성이 우수한 특성을 갖는 하기의 화합물 J로 대표되는 유기발광화합물을 제안한바 있다.
그러나 상기 일본공개특허공보 제2004-91334호에서 제안된 화합물들은 정공수송층으로서 적용한 것으로서 아민 작용기가 많아 이온화 포텐셜을 낮추고 정공수송성을 증대시키는 점을 극복하기는 하였으나, 아민 작용기의 과다로 인하여 정공 수송층으로서의 구동수명이 단축되는 문제를 갖고 있다.
따라서, 본 발명자들은 상기의 종래의 문제점을 해결하기 위하여 노력한 결과, 발광 효율이 뛰어나고 수명이 획기적으로 개선된 유기 발광 소자를 실현하기 위한 새로운 발광 화합물을 발명하게 되었다.
본 발명의 목적은 상기한 문제점들을 해결하기 위하여 기존의 도판트 재료보다 발광 효율 및 소자 수명이 좋으며, 적절한 색좌표를 갖는 우수한 골격의 유기 발광 화합물을 제공하는 것이며, 또 다른 목적으로서 상기 유기 발광 화합물을 발광 재료로서 채용하는 고효율 및 장수명의 유기 발광 소자를 제공하는 것이다.
본 발명은 하기 화학식 1로 표시되는 유기 발광 화합물 및 이를 포함하는 유기 발광 소자에 관한 것으로서, 본 발명에 따른 유기 발광 화합물은 발광효율이 좋고 재료의 색순도 및 수명특성이 뛰어나 구동수명이 매우 우수한 OLED 소자를 제조할 수 있는 장점이 있다.
[화학식 1]
[상기 화학식 1에서,
R1 및 R2는 서로 독립적으로 수소, 할로겐, (C1-C60)알킬, (C6-C60)아릴, (C3-C60)헤테로아릴, N, O, S 및 Si로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, (C1-C60)알콕시, (C1-C60)알킬티오, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, 카복실, 나이트로 또는 하이드록시이거나, 하기 구조에서 선택된 치환기이고,
R3 내지 R15는 서로 독립적으로 수소, 할로겐, (C1-C60)알킬, (C6-C60)아릴, (C3-C60)헤테로아릴, N, O, S 및 Si로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, (C1-C60)알콕시, (C1-C60)알킬티오, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, 카복실, 나이트로 또는 하이드 록시이거나, R3 내지 R15는 인접한 치환체와 융합고리를 포함하거나 포함하지 않는 (C3-C60)알킬렌 또는 (C3-C60)알케닐렌으로 연결되어 지환족 고리 및 단일환 또는 다환의 방향족 고리를 형성할 수 있으며;
X 및 Y는 서로 독립적으로 화학결합이거나, -(CR21R22)n-, -N(R23)-, -S-, -O-, -Si(R24)(R25)-, -P(R26)-, -C(=O)-, -B(R27)-, -In(R28)-, -Se-, -Ge(R29)(R30)-, -Sn(R31)(R32)-, -Ga(R33)- 또는 -(R34)C=C(R35)-이며;
R21 내지 R35는 서로 독립적으로 수소, 할로겐, (C1-C60)알킬, (C6-C60)아릴, (C3-C60)헤테로아릴, N, O, S 및 Si로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, (C1-C60)알콕시, (C1-C60)알킬티오, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, 카복실, 나이트로 또는 하이드록시이거나, R21과 R22, R24와 R25, R29와 R30, R31와 R32 및 R34와 R35는 융합고리를 포함하거나 포함하지 않는 (C3-C60)알킬렌 또는 (C3-C60)알케닐렌으로 연결되어 지환족 고리 및 단일환 또는 다환의 방향족 고리를 형성할 수 있으며;
A고리 및 B고리는 서로 독립적으로 포화 5원 내지 6원의 헤테로고리아미노기이거나, 하기 구조에서 선택된 치환기이고, 상기 포화 5원 내지 6원의 헤테로 고리아미노기는 NR36, O 및 S로부터 선택된 하나 이상의 헤테로 원자를 더 포함할 수 있으며,
R36은 수소, 할로겐, (C1-C60)알킬, (C6-C60)아릴, (C3-C60)헤테로아릴, (C3-C60)시클로알킬, 아다만틸, (C7-C60)바이시클로알킬 또는 (C6-C60)아르(C1-C60)알킬이고;
R41 내지 R48는 서로 독립적으로 수소, 할로겐, (C1-C60)알킬, (C6-C60)아릴, (C3-C60)헤테로아릴, N, O, S 및 Si로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, (C1-C60)알콕시, (C1-C60)알킬티오, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, 카복실, 나이트로 또는 하이드록시이거나, R41 내지 R48는 인접한 치환체와 융합고리를 포함하거나 포함하지 않는 (C3-C60)알킬렌 또는 (C3-C60)알케닐렌으로 연결되어 지환족 고리 및 단일환 또는 다환의 방향족 고리를 형성할 수 있으며;
R49 및 R50은 수소 또는 (C1-C6)알킬이며;
R49 및 R50은 수소 또는 (C1-C6)알킬이며;
Z는 화학결합이거나, -(CR51R52)m-, -N(R53)-, -S-, -O-, -Si(R54)(R55)-, -P(R56)-, -C(=O)-, -B(R57)-, -In(R58)-, -Se-, -Ge(R59)(R60)-, -Sn(R61)(R62)-, -Ga(R63)- 또는 -(R64)C=C(R65)-이며;
R51 내지 R65는 서로 독립적으로 수소, 할로겐, (C1-C60)알킬, (C6-C60)아릴, (C3-C60)헤테로아릴, N, O, S 및 Si로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, (C1-C60)알콕시, (C1-C60)알킬티오, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, 카복실, 나이트로 또는 하이드록시이거나, R51과 R52, R54와 R55, R59와 R60, R61와 R62 및 R64와 R65는 융합고리를 포함하거나 포함하지 않는 (C3-C60)알킬렌 또는 (C3-C60)알케닐렌으로 연결되어 지환족 고리 및 단일환 또는 다환의 방향족 고리를 형성할 수 있으며;
R1, R2, R3 내지 R15, R21 내지 R35, R36, R41 내지 R48 및 R51 내지 R65의 알킬, 아릴, 헤테로아릴, 헤테로시클로알킬, 시클로알킬, 트리알킬실릴, 디알킬아릴실릴, 트리아릴실릴, 아다만틸, 바이시클로알킬, 알케닐, 알키닐, 알킬아미노 및 아릴아미노는 할로겐, 할로겐으로 치환 또는 비치환된 (C1-C60)알킬, (C6-C60)아릴, (C6-C60)아릴로 치환 또는 비치환된 (C3-C60)헤테로아릴, N, O, S 및 Si로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, (C1-C60)알콕시, (C1-C60)알킬티오, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, 카복실, 나이트로 및 하이드록시로부터 선택된 하나 이상이 더 치환될 수 있으며;
m 및 n은 서로 독립적으로 1 내지 4의 정수이고;
a 및 b는 서로 독립적으로 0 내지 4의 정수이고, 단 a+b=1~4의 정수이다.]
본 발명에 기재된 “알킬”, “알콕시” 및 그 외 “알킬”부분을 포함하는 치환체는 직쇄 또는 분쇄 형태를 모두 포함한다.
본 발명에 기재된 「아릴」은 하나의 수소 제거에 의해서 방향족 탄화수소로부터 유도된 유기 라디칼로, 각 고리에 적절하게는 4 내지 7개, 바람직하게는 5 또는 6개의 고리원자를 포함하는 단일 또는 융합고리계를 포함한다. 구체적인 예로 페닐, 나프틸, 비페닐, 안트릴, 테트라히드로나프틸, 인다닐(indanyl), 플루오레닐, 페난트릴, 트라이페닐레닐, 피렌일, 페릴렌일, 크라이세닐, 나프타세닐, 플루오란텐일 등을 포함하지만, 이에 한정되지 않는다.
본 발명에 기재된 「헤테로아릴」은 방향족 고리 골격 원자로서 N, O 및 S로부터 선택된 1 내지 4개의 헤테로원자를 포함하고, 나머지 방향족 고리 골격 원자가 탄소인 아릴 그룹을 의미하는 것으로, 5 내지 6원 단환 헤테로아릴, 및 하나 이상의 벤젠 환과 축합된 다환식 헤테로아릴이며, 부분적으로 포화될 수도 있다. 상기 헤테로아릴기는 고리내 헤테로원자가 산화되거나 사원화되어, 예를 들어 N-옥사이드 또는 4차 염을 형성하는 2가 아릴 그룹을 포함한다. 구체적인 예로 퓨릴, 티오펜일, 피롤릴, 피란일, 이미다졸릴, 피라졸릴, 티아졸릴, 티아디아졸릴, 이소티아졸릴, 이속사졸릴, 옥사졸릴, 옥사디아졸릴, 트리아진일, 테트라진일, 트리아졸릴, 테트라졸릴, 퓨라잔일, 피리딜, 피라진일, 피리미딘일, 피리다진일 등의 단환 헤테로아릴, 벤조퓨란일, 벤조티오펜일, 이소벤조퓨란일, 벤조이미다졸릴, 벤조티아졸릴, 벤조이소티아졸릴, 벤조이속사졸릴, 벤조옥사졸릴, 이소인돌릴, 인돌릴, 인다졸릴, 벤조티아디아졸릴, 퀴놀릴, 이소퀴놀릴, 신놀리닐, 퀴나졸리닐, 퀴놀리진일, 퀴녹살리닐, 카바졸릴, 페난트리딘일, 벤조디옥솔릴 등의 다환식 헤테로아릴 및 이들의 상응하는 N-옥사이드(예를 들어, 피리딜 N-옥사이드, 퀴놀릴 N-옥사이드), 이들의 4차 염 등을 포함하지만, 이에 한정되지 않는다.
본 발명에 기재된 「포화 5원 내지 6원의 헤테로고리아미노」는 포화결합으로 이루어진 5원 내지 6원의 고리에 질소를 포함한 화합물로, N, O 및 S로부터 선택된 하나 이상의 헤테로 원자를 더 포함할 수 있다.
또한, 본 발명에 기재되어 있는 “(C1-C60)알킬”부분이 포함되어 있는 치환체들은 1 내지 60개의 탄소수를 가질 수도 있고, 1 내지 20개의 탄소수를 가질 수도 있고, 1 내지 10개의 탄소수를 가질 수도 있다. “(C6-C60)아릴”부분이 포함되어 있는 치환체들은 6 내지 60개의 탄소수를 가질 수도 있고, 6 내지 20개의 탄소수를 가질 수도 있고, 6 내지 12개의 탄소수를 가질 수도 있다. “(C3-C60)헤테로 아릴”부분이 포함되어 있는 치환체들은 3 내지 60개의 탄소수를 가질 수도 있고, 4 내지 20개의 탄소수를 가질 수도 있고, 4 내지 12개의 탄소수를 가질 수도 있다. “(C3-C60)시클로알킬”부분이 포함되어 있는 치환체들은 3 내지 60개의 탄소수를 가질 수도 있고, 3 내지 20개의 탄소수를 가질 수도 있고, 3 내지 7개의 탄소수를 가질 수도 있다. “(C2-C60)알케닐 또는 알키닐”부분이 포함되어 있는 치환체들은 2 내지 60개의 탄소수를 가질 수도 있고, 2 내지 20개의 탄소수를 가질 수도 있고, 2 내지 10개의 탄소수를 가질 수도 있다.
본 발명에 따른 유기발광화합물은 하기 화학식 2 내지 화학식 5로부터 선택될 수 있다.
[화학식 2]
[화학식 3]
[화학식 4]
[화학식 5]
[상기 화학식 2 내지 화학식 5에서, R1 및 R2는 상기 화학식 1에서의 정의와 동일하고,
A고리, A'고리, B고리 및 B'고리는 서로 독립적으로 포화 5원 내지 6원의 헤테로고리아미노기이거나, 하기 구조에서 선택된 치환기이고, 상기 포화 5원 내지 6원의 헤테로 고리아미노기는 NR36, O 및 S로부터 선택된 하나 이상의 헤테로 원자를 더 포함할 수 있으며,
R36은 수소, 할로겐, (C1-C60)알킬, (C6-C60)아릴, (C3-C60)헤테로아릴, (C3-C60)시클로알킬, 아다만틸, (C7-C60)바이시클로알킬 또는 (C6-C60)아르(C1-C60)알킬이고;
R41 내지 R48는 서로 독립적으로 수소, 할로겐, (C1-C60)알킬, (C6-C60)아릴, (C3-C60)헤테로아릴, N, O, S 및 Si로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, (C1-C60)알콕시, (C1-C60)알킬티오, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, 카복실, 나이트로 또는 하이드록시이거나, R41 내지 R48는 인접한 치환체와 융합고리를 포함하거나 포함하지 않는 (C3-C60)알킬렌 또는 (C3-C60)알케닐렌으로 연결되어 지환족 고리 및 단일환 또는 다환의 방향족 고리를 형성할 수 있으며;
R49 및 R50은 수소 또는 (C1-C6)알킬이며;
R49 및 R50은 수소 또는 (C1-C6)알킬이며;
Z는 화학결합이거나, -(CR51R52)m-, -N(R53)-, -S-, -O-, -Si(R54)(R55)-, -P(R56)-, -C(=O)-, -B(R57)-, -In(R58)-, -Se-, -Ge(R59)(R60)-, -Sn(R61)(R62)-, -Ga(R63)- 또는 -(R64)C=C(R65)-이며;
R51 내지 R65는 서로 독립적으로 수소, 할로겐, (C1-C60)알킬, (C6-C60)아릴, (C3-C60)헤테로아릴, N, O, S 및 Si로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, (C1-C60)알콕시, (C1-C60)알킬티오, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, 카복실, 나이트로 또는 하이드록시이거나, R51과 R52, R54와 R55, R59와 R60, R61와 R62 및 R64와 R65는 융합고리를 포함하거나 포함하지 않는 (C3-C60)알킬렌 또는 (C3-C60)알케닐렌으로 연결되어 지환족 고리 및 단일환 또는 다환의 방향족 고리를 형성할 수 있으며;
R36, R41 내지 R48 및 R51 내지 R65의 알킬, 아릴, 헤테로아릴, 헤테로시클로알킬, 시클로알킬, 트리알킬실릴, 디알킬아릴실릴, 트리아릴실릴, 아다만틸, 바이시클로알킬, 알케닐, 알키닐, 알킬아미노 및 아릴아미노는 할로겐, 할로겐으로 치환 또는 비치환된 (C1-C60)알킬, (C6-C60)아릴, (C6-C60)아릴로 치환 또는 비치환된 (C3-C60)헤테로아릴, N, O, S 및 Si로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, (C1-C60)알콕시, (C1-C60)알킬티오, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, 카복실, 나이트로 및 하이드록시로부터 선택된 하나 이상이 더 치환될 수 있으며;
m은 1 내지 4 의 정수이다.]
상기 A고리, A'고리, B고리 및 B'고리는 서로 독립적으로 하기 구조에서 선택되어지나, 이에 한정되는 것은 아니다.
또한, 상기 R1 및 R2는 서로 독립적으로 메틸, 에틸, n-프로필, i-프로필, n-부틸, i-부틸, t-부틸, n-펜틸, i-펜틸, n-헥실, n-헵틸, n-옥틸, 2-에틸헥실, n-노닐, 데실, 도데실, 헥사데실, 벤질, 트리플루오르메틸, 퍼플루오르에틸, 트리플루오르에틸, 퍼플루오르프로필, 퍼플루오르부틸, 메톡시, 에톡시, n-프로폭시, i-프로폭시, n-부톡시, i-부톡시, t-부톡시, n-펜톡시, i-펜톡시, n-헥실옥시, n-헵톡시, 트리메틸실릴, 트리에틸실릴, 트리프로필실릴, 트리(t-부틸)실릴, t-부틸디메틸실릴, 디메틸페닐실릴, 트리페닐실릴, 시클로프로필, 시클로부틸, 시클로펜 틸, 시클로헥실, 시클로헵틸, 시클로옥틸, 시클로노닐, 시클로데실, 모폴리노, 티오모폴리노, 아다만틸, 바이시클로[2.2.1]헵틸, 바이시클로[2.2.2]옥틸, 바이시클로[3.2.1]옥틸, 바이시클로[5.2.0]노닐, 바이시클로[4.2.2]데실, 바이시클로[2.2.2]옥틸, 4-펜틸바이시클로[2.2.2]옥틸, 에테닐, 페닐에테닐, 에티닐, 페닐에티닐, 시아노, 디메틸아미노, 디페닐아미노, 모노메틸아미노, 모노페닐아미노, 페닐옥시, 페닐티오, 메톡시카보닐, 에톡시카보닐, t-부톡시카보닐, 카복실, 나이트로, 클로로, 플루오르 또는 하이드록시이거나, 하기 구조에서 선택되나, 이에 한정되지는 않는다.
[R71 내지 R86은 서로 독립적으로 수소, 할로겐, (C1-C60)알킬, (C6-C60)아릴, (C3-C60)헤테로아릴, N, O, S 및 Si로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1- C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, (C1-C60)알콕시, (C1-C60)알킬티오, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, 카복실, 나이트로 또는 하이드록시이며, 상기 R71 내지 R86의 알킬, 아릴, 헤테로아릴, 헤테로시클로알킬, 시클로알킬, 트리알킬실릴, 디알킬아릴실릴, 트리아릴실릴, 아다만틸, 바이시클로알킬, 알케닐, 알키닐, 알킬아미노 또는 아릴아미노는 할로겐, (C1-C60)알킬, (C6-C60)아릴, (C3-C60)헤테로아릴, N, O, S 및 Si로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, (C1-C60)알콕시, (C1-C60)알킬티오, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, 카복실, 나이트로 또는 하이드록시로 더 치환될 수 있으며;
R87 내지 R89은 서로 독립적으로 수소, 할로겐, 할로겐으로 치환 또는 비치환된 (C1-C60)알킬, (C6-C60)아릴, (C6-C60)아릴로 치환 또는 비치환된 (C3-C60)헤테로아릴, N, O, S 및 Si로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, (C1-C60)알콕시, (C1-C60)알킬티오, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, 카복실, 나이트로 또는 하이드록시이며;
L1 및 L2는 서로 독립적으로 화학결합이거나, (C6-C60)아릴렌 또는 (C3-C60)헤테로아릴렌이고, 상기 L1 및 L2의 아릴렌 또는 헤테로아릴렌은 (C1-C60)알킬, 할로겐, 시아노, (C1-C60)알콕시, (C1-C60)알킬티오, (C3-C60)시클로알킬, (C6-C60)아릴, (C3-C60)헤테로아릴, 아다만틸, (C7-C60)바이시클로알킬, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, 카복실, 나이트로, 하이드록시, 트리(C1-C30)알킬실릴, 디(C1-C30)알킬(C6-C30)아릴실릴 및 트리(C6-C30)아릴실릴로부터 선택된 하나 이상이 더 치환될 수 있으며;
E 및 F는 서로 독립적으로 -C(R91)(R92)-, -N(R93)-, -S-, -O-, -Si(R94)(R95)-, -P(R96)-, -C(=O)-, -B(R97)-, -In(R98)-, -Se-, -Ge(R99)(R100)-, -Sn(R101)(R102)- 또는 -Ga(R103)-이며;
R91 내지 R103는 서로 독립적으로 수소, 할로겐, (C1-C60)알킬, (C6-C60)아릴, (C3-C60)헤테로아릴, N, O, S 및 Si로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, (C1-C60)알콕시, (C1-C60)알킬티오, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, 카복실, 나이트로 또는 하이드록시이거나, R91와 R92, R94와 R95, R99와 R100 및 R101와 R102는 융합고리를 포함하거나 포함하지 않는 (C3-C60)알킬렌 또는 (C3-C60)알케닐렌으로 연결되어 지환족 고리 및 단일환 또는 다환의 방향족 고리를 형성할 수 있으며;
x는 1 내지 5의 정수이고;
y는 1 내지 4의 정수이다.]
보다 구체적으로, 상기 R1 및 R2는 서로 독립적으로 하기 구조에서 선택되나, 이에 한정되지는 않는다.
본 발명에 따른 유기 발광 화합물은 보다 구체적으로 하기의 화합물로서 예시될 수 있으나, 하기 화합물이 본 발명을 한정하는 것은 아니다.
본 발명에 따른 유기 발광 화합물은 하기 반응식 1에 나타난 바와 같이, 제조될 수 있다.
[반응식 1]
[상기 반응식 1에서 A고리, B고리, R1, R2, a 및 b는 상기 화학식 1에서의 정의와 동일하다.]
또한 본 발명은 유기 태양 전지를 제공하며, 본 발명에 따른 유기 태양 전지는 상기 화학식 1의 유기 발광 화합물을 하나 이상 포함하는 것을 특징으로 한다.
또한 본 발명은 유기 발광 소자를 제공하며, 본 발명에 따른 유기 발광 소자는 제1 전극; 제2 전극; 및 상기 제1 전극 및 제2 전극 사이에 개재되는 1층 이상의 유기물층으로 이루어진 유기 발광 소자에 있어서, 상기 유기물층은 상기 화학식 1의 유기 발광 화합물을 하나 이상 포함하는 것을 특징으로 한다.
본 발명에 따른 유기 발광 소자는 상기 유기물층이 발광층을 포함하며, 상기 발광층은 상기 화학식 1의 하나 이상의 유기 발광 화합물을 발광 도판트로 하여 하나 이상의 호스트를 포함하는 것을 특징으로 하며, 본 발명의 유기 발광 소자에 적용되는 호스트는 특별히 제한되지 않으나, 하기 화학식 6 또는 화학식 7로 표시되는 화합물에서 선택되는 것이 바람직하다.
[화학식 6]
(Ar1)c-L11-(Ar2)d
[화학식 7]
(Ar3)e-L12-(Ar4)f
[상기 화학식 6 및 화학식 7에서,
L11는 (C6-C60)아릴렌 또는 (C4-C60)헤테로아릴렌이고;
L12는 안트라세닐렌이며;
Ar1 내지 Ar4은 서로 독립적으로 수소, (C1-C60)알킬, (C1-C60)알콕시, 할로겐, (C4-C60)헤테로아릴, (C5-C60)시클로알킬 또는 (C6-C60)아릴로부터 선택되고, 상기 Ar1 내지 Ar4의 시클로알킬, 아릴 또는 헤테로아릴은 할로겐으로 치환되거나 치환되지 않은 (C1-C60)알킬, (C1-C60)알콕시, (C3-C60)시클로알킬, 할로겐, 시아노, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴 및 트리(C6-C60)아릴실릴로 이루어진 군으로부터 선택된 하나 이상의 치환기로 치환되거나 치환되지 않은 (C6-C60)아릴 또는 (C4-C60)헤테로아릴, 할로겐으로 치환되거나 치환되지 않은 (C1-C60)알킬, (C1-C60)알콕시, (C3-C60)시클로알킬, 할로겐, 시아노, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴 및 트리(C6-C60)아릴실릴로 이루어지는 군으로부터 선택된 하나 이상의 치환기가 더 치환될 수 있고;
c, d, e 및 f는 서로 독립적으로 0 내지 4의 정수이다.]
상기 화학식 6 및 화학식 7의 호스트는 화학식 8 내지 화학식 10로 표시되는 안트라센 유도체 또는 벤즈[a]안트라센 유도체로 예시될 수 있다.
[화학식 8]
[화학식 9]
[화학식 10]
[상기 화학식 8 내지 화학식 10에서,
R201 및 R202는 서로 독립적으로 (C6-C60)아릴, (C4-C60)헤테로아릴, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬 또는 (C3-C60)시클로알킬이며, 상기 R201 및 R202의 아릴 또는 헤테로아릴은 (C1-C60)알킬, 할로(C1-C60)알킬, (C1-C60)알콕시, (C3-C60)시클로알킬, (C6-C60)아릴, (C4-C60)헤테로아릴, 할로겐, 시아노, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴 및 트리(C6-C60)아릴실릴로 이루어지는 군으로부터 선택된 하나 이상의 치환기가 더 치환될 수 있으며;
R203 내지 R206는 수소, (C1-C60)알킬, (C1-C60)알콕시, 할로겐, (C4-C60)헤테로아릴, (C5-C60)시클로알킬 또는 (C6-C60)아릴이며, 상기 R203 내지 R206의 헤테로아릴, 시클로알킬 또는 아릴은 할로겐으로 치환되거나 치환되지 않은 (C1-C60)알킬, (C1-C60)알콕시, (C3-C60)시클로알킬, 할로겐, 시아노, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴 및 트리(C6-C60)아릴실릴로 이루어지는 군으로부터 선택된 하나 이상의 치환기가 더 치환될 수 있고;
L21 및 L22는 서로 독립적으로 화합결합이거나 (C1-C60)알킬, (C1-C60)알콕시, (C6-C60)아릴, (C4-C60)헤테로아릴 또는 할로겐으로부터 선택된 하나 이상으로 치환되거나 치환되지 않은 (C6-C60)아릴렌이며, ;
Ar11 및 Ar13는 서로 독립적으로 하기 구조에서 선택된 아릴 또는 (C4-C60)헤테로아릴이며,
상기 Ar11 및 Ar13의 아릴 또는 헤테로아릴은 (C1-C60)알킬, (C1-C60)알콕시, (C6-C60)아릴 또는 (C4-C60)헤테로아릴로부터 선택된 치환기가 하나이상 치환될 수 있고;
Ar12는 (C6-C60)아릴렌, (C4-C60)헤테로아릴렌 또는 하기 구조의 화합물이며,
상기 Ar12의 아릴렌 또는 헤테로아릴렌은 (C1-C60)알킬, (C1-C60)알콕시, (C6-C60)아릴, (C4-C60)헤테로아릴 또는 할로겐으로부터 선택된 하나 이상의 치환기로 치환될 수 있으며;
R211, R212, R213 및 R214는 서로 독립적으로 수소, (C1-C60)알킬 또는 (C6-C60) 아릴이거나, 인접한 치환체와 융합고리를 포함하거나 포함하지 않는 (C3-C60)알킬렌 또는 (C3-C60)알케닐렌으로 연결되어 지환족 고리 및 단일환 또는 다환의 방향족 고리를 형성할 수 있으며,
R221, R222, R223 및 R224는 서로 독립적으로 수소, (C1-C60)알킬, (C1-C60)알콕시, (C6-C60)아릴, (C4-C60)헤테로아릴 또는 할로겐이거나, 인접한 치환체와 융합고리를 포함하거나 포함하지 않는 (C3-C60)알킬렌 또는 (C3-C60)알케닐렌으로 연결되어 지환족 고리 및 단일환 또는 다환의 방향족 고리를 형성할 수 있다.]
상기 발광층의 의미는 발광이 이루어지는 층으로서 단일 층일 수 있으며, 또한 2개 이상의 층이 적층된 복수의 층일 수 있다. 본 발명의 구성에서의 호스트-도판트를 혼합하여 사용하는 경우, 본 발명의 발광 호스트에 의한 발광 효율의 현저한 개선을 확인할 수 있었다. 이는 0.5 내지 10중량%의 도핑 농도로 구성할 수 있는데, 기존의 다른 호스트 재료에 비하여 정공, 전자에 대한 전도성이 매우 뛰어나며, 물질 안정성을 매우 우수하여 발광효율 뿐만 아니라, 수명도 현저히 개선시키는 특성을 보여 주고 있다.
따라서, 상기 화학식 8 내지 화학식 10로부터 선택된 화합물을 발광 호스트로 채택하는 경우, 본 발명의 화학식 1의 유기 발광 화합물의 전기적 단점을 상당히 보완해 주는 역할을 하고 있다고 설명할 수 있다.
상기 화학식 8 내지 화학식 10의 호스트 화합물은 하기 구조의 화합물로 예시될 수 있으나, 이에 한정되는 것은 아니다.
본 발명의 유기 발광 소자에 있어서, 화학식 1의 유기 발광 화합물을 포함하고, 동시에 아릴아민계 화합물 또는 스티릴아릴아민계 화합물로 이루어진 군으로부터 선택된 하나 이상의 화합물을 포함할 수 있으며, 아릴아민계 화합물 또는 스티릴아릴아민계 화합물의 예로 하기의 화학식 11의 화합물이 있으나, 이에 한정되는 것을 아니다.
[화학식 11]
[상기 화학식 11에서, Ar21 및 Ar22은 서로 독립적으로 (C1-C60)알킬, (C6-C60)아릴, (C4-C60)헤테로아릴, (C6-C60)아릴아미노, (C1-C60)알킬아미노, 모폴리노 또는 티오모폴리노, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬 또는 (C3-C60)시클로알킬이거나, Ar21 및 Ar22은 융합고리를 포함하거나 포함하지 않는 (C3-C60)알킬렌 또는 (C3-C60)알케닐렌으로 연결되어 지 환족 고리 및 단일환 또는 다환의 방향족 고리를 형성할 수 있고, 상기 Ar21 및 Ar22의 아릴, 헤테로아릴, 아릴아미노 또는 헤테로시클로알킬은 할로겐, (C1-C60)알킬, (C2-C60)알케닐, (C2-C60)알키닐, (C6-C60)아릴, (C4-C60)헤테로아릴, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C1-C60)알콕시, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, 카복실, 나이트로 및 하이드록시로부터 선택된 하나 이상이 더 치환될 수 있고;
Ar23은 (C6-C60)아릴, (C5-C60)헤테로아릴 또는 (C6-C60)아릴아미노이고, 상기 Ar23의 아릴, 헤테로아릴 또는 아릴아미노는 할로겐, (C1-C60)알킬, (C6-C60)아릴, (C4-C60)헤테로아릴, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, (C1-C60)알콕시, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, 카복실, 나이트로 및 하이드록시로부터 선택된 하나 이상이 더 치환될 수 있고;
g는 1 내지 4의 정수이다.]
상기 아릴아민계 화합물 또는 스티릴아릴아민계 화합물은 보다 구체적으로 하기의 화합물로서 예시될 수 있으나, 하기 화합물로 한정되는 것은 아니다.
또한, 본 발명의 유기 발광 소자에 있어서, 유기물층에 상기 화학식 1의 유기 발광 화합물 이외에 1족, 2족, 4주기, 5주기 전이금속, 란탄계열금속 및 d-전이원소의 유기금속으로 이루어진 군으로부터 선택된 하나 이상의 금속을 더 포함할 수도 있고, 상기 유기물층은 발광층 이외에 전하생성층을 동시에 포함할 수 있다.
본 발명의 화학식 1의 유기 발광 화합물을 포함하는 유기 발광 소자를 서브픽셀로 하고, Ir, Pt, Pd, Rh, Re, Os, Tl, Pb, Bi, In, Sn, Sb, Te, Au 및 Ag로 이루어진 군으로부터 선택된 하나 이상의 금속화합물을 포함하는 서브픽셀 하나 이상을 동시에 병렬로 패터닝한 독립발광방식의 픽셀구조를 가진 유기 전기 발광 소자를 구현할 수도 있다.
또한, 상기 유기물층에 상기 유기 발광 화합물 이외에 청색, 적색 또는 녹색 발광 화합물을 포함하는 유기발광층 하나 이상을 동시에 포함하여 백색 발광을 하는 유기 전계 발광 소자를 형성할 수 있으며, 상기 청색, 적색 또는 녹색 발광 화 합물은 하기 화학식 12 내지 화학식 18로 예시될 수 있으나 이에 한정되는 것은 아니다.
[화학식 12]
여기서 M1은 7족, 8족, 9족, 10족, 11족, 13족, 14족, 15족 및 16족의 금속으로 이루어진 군으로부터 선택되고, 리간드 L31, L32 및 L33 는 서로 독립적으로 하기 구조로부터 선택되어진다.
[R301 내지 R303은 서로 독립적으로 수소, 할로겐으로 치환되거나 치환되지 않은 (C1-C60)알킬, (C1-C60)알킬로 치환되거나 치환되지 않은 (C6-C60)아릴 또는 할로겐이고;
R304 내지 R319는 서로 독립적으로 수소, (C1-C60)알킬, (C1-C30)알콕시, (C3-C60)시클로알킬, (C2-C30)알케닐, (C6-C60)아릴, 모노 또는 디(C1-C30)알킬아미노, 모노 또는 디(C6-C30)아릴아미노, SF5, 트리(C1-C30)알킬실릴, 디(C1-C30)알킬(C6-C30)아릴실릴, 트리(C6-C30)아릴실릴, 시아노 또는 할로겐이고, 상기 R304 내지 R319의 알킬, 시클로알킬, 알케닐 또는 아릴은 (C1-C60)알킬, (C6-C60)아릴 또는 할로겐으로부터 선택된 하나 이상의 치환기로 더 치환될 수 있으며;
R320 내지 R323는 서로 독립적으로 수소, 할로겐으로 치환되거나 치환되지 않은 (C1-C60)알킬 또는 (C1-C60)알킬로 치환되거나 치환되지 않은 (C6-C60)아릴이고;
R324 및 R325는 서로 독립적으로 수소, 직쇄 또는 분쇄의 (C1-C60)알킬, (C6-C60)아릴 또는 할로겐이거나, R324와 R325는 융합고리를 포함하거나 포함하지 않는 (C3-C12)알킬렌 또는 (C3-C12)알케닐렌으로 연결되어 지환족 고리 및 단일환 또는 다환의 방향족 고리를 형성하며, 상기 R324 및 R325의 알킬, 아릴 또는 융합고리를 포함하거나 포함하지 않는 (C3-C12)알킬렌 또는 (C3-C12)알케닐렌으로 연결되어 형성된 지환족 고리 및 단일환 또는 다환의 방향족 고리는 할로겐으로 치환되거나 치환되지 않은 직쇄 또는 분쇄의 (C1-C60)알킬, (C1-C30)알콕시, 할로겐, 트리(C1-C30)알킬실릴, 트리(C6-C30)아릴실릴 및 (C6-C60)아릴로부터 선택된 하나 이상의 치환기로 더 치환될 수 있으며;
R326은 (C1-C60)알킬, (C6-C60)아릴, (C5-C60)헤테로아릴 또는 할로겐이고;
R327 내지 R329은 서로 독립적으로 수소, (C1-C60)알킬, (C6-C60)아릴 또는 할로겐이고, 상기 R326 내지 R329의 알킬 및 아릴은 할로겐 또는 (C1-C60)알킬로 더 치환될 수 있으며;
Q는 , 또는 이며, R331 내지 R342는 서로 독립적으로 수소, 할로겐으로 치환되거나 치환되지 않은 (C1-C60)알킬, (C1-C30)알콕시, 할로겐, (C6-C60)아릴, 시아노, (C5-C60)시클로알킬이거나, R331 내지 R342는 서로 인접한 치환체와 알킬렌 또는 알케닐렌으로 연결되어 (C5-C7)스피로고리 또는 (C5-C9)융합고리를 형성하거나 R307 또는 R308과 알킬렌 또는 알케닐렌으로 연결되어 (C5-C7)융합고리를 형성할 수 있다.]
[화학식 13]
[상기 화학식 13에서, R401 내지 R404은 서로 독립적으로 (C1-C60)알킬 또는 (C6-C60)아릴이거나, 서로 인접한 치환체와 융합고리를 포함하거나 포함하지 않는 (C3-C60)알킬렌 또는 (C3-C60)알케닐렌으로 연결되어 지환족 고리 및 단일환 또는 다환의 방향족 고리를 형성하며; 상기 R401 내지 R404의 알킬, 아릴 또는 융합고리를 포함하거나 포함하지 않는 (C3-C60)알킬렌 또는 (C3-C60)알케닐렌으로 연결되어 형성된 지환족 고리 및 단일환 또는 다환의 방향족 고리는 할로겐으로 치환되거나 치환되지 않은 (C1-C60)알킬, (C1-C60)알콕시, 할로겐, 트리(C1-C60)알킬실릴, 트리(C6-C60)아릴실릴 및 (C6-C60)아릴로부터 선택된 하나 이상의 치환기로 더 치환될 수 있다.]
[화학식 14]
[화학식 15]
[화학식 16]
[상기 화학식 16에서, 리간드 L34 및 L35 는 서로 독립적으로 하기 구조로부터 선택되고;
M2은 2가 또는 3가 금속이며;
M2이 2가 금속인 경우 h는 0이고, M2이 3가 금속인 경우 h는 1이고;
T는 (C6-C60)아릴옥시 또는 트리(C6-C60)아릴실릴이고, 상기 T의 아릴옥시 및 트리아릴실릴은 (C1-C60)알킬 또는 (C6-C60)아릴이 더 치환될 수 있으며;
G는 O, S 또는 Se 이고;
C 고리는 옥사졸, 싸이아졸, 이미다졸, 옥사디아졸, 싸이아디아졸, 벤조옥사졸, 벤조싸이아졸, 벤조이미다졸, 피리딘 또는 퀴놀린이고;
D 고리는 피리딘 또는 퀴놀린이며, 상기 D 고리는 (C1-C60)알킬, (C1-C60)알킬로 치환되거나 치환되지 않은 페닐 또는 나프틸이 더 치환될 수 있고;
R501 내지 R504은 서로 독립적으로 수소, (C1-C60)알킬, 할로겐, 트리(C1-C60)알킬실릴, 트리(C6-C60)아릴실릴 또는 (C6-C60)아릴이거나, 인접한 치환체와 (C3-C60)알킬렌, 또는 (C3-C60)알케닐렌으로 결합되어 융합고리를 형성할 수 있으며, 상기 피리딘 및 퀴놀린은 R501과 화학결합을 이루어 융합고리를 형성할 수 있으며;
상기 C 고리와 R501 내지 R504의 아릴기는 (C1-C60)알킬, 할로겐, 할로겐으로 치환된 (C1-C60)알킬, 페닐, 나프틸, 트리(C1-C60)알킬실릴, 트리(C6-C60)아릴실릴 또는 아미노기로 더 치환될 수 있다.]
[화학식 17]
[상기 화학식 17에서, Ar41 및 Ar42는 서로 독립적으로 (C1-C60)알킬, (C6-C60)아릴, (C4-C60)헤테로아릴, (C6-C60)아릴아미노, (C1-C60)알킬아미노, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬이거나, Ar41 및 Ar42은 융합고리를 포함하거나 포함하지 않는 (C3-C60)알킬렌 또는 (C3-C60)알케닐렌으로 연결되어 지환족 고리 및 단일환 또는 다환의 방향족 고리를 형성할 수 있고, 상기 Ar41 및 Ar42의 알킬, 아릴, 헤테로아릴, 아릴아미노, 알킬아미노, 시클로알킬 또는 헤테로시클로알킬은 할로겐, (C1-C60)알킬, (C6-C60)아릴, (C4-C60)헤테로아릴, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, (C1-C60)알콕시, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, 카복실, 나이트로 및 하이드록시로부터 선택된 하나 이상이 더 치환될 수 있고;
Ar43는 (C6-C60)아릴렌, (C4-C60)헤테로아릴렌 또는 하기 구조의 아릴렌이고,
Ar51은 (C6-C60)아릴렌 또는 (C4-C60)헤테로아릴렌이고,
상기 Ar43 및 Ar51의 아릴렌 및 헤테로아릴렌은 할로겐, (C1-C60)알킬, (C6-C60)아릴, (C4-C60)헤테로아릴, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, (C1-C60)알콕시, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, 카복실, 나이트로, 하이드록시로 이루어진 군으로부터 선택된 하나 이상의 치환기가 더 치환될 수 있고;
i는 1 내지 4의 정수이고,
j는 1 내지 4의 정수이고,
k는 0 또는 1의 정수이다.]
[화학식 18]
[상기 화학식 18에서, R601 내지 R604는 서로 독립적으로 수소, 할로겐, (C1-C60)알킬, (C6-C60)아릴, (C4-C60)헤테로아릴, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, (C1-C60)알콕시, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, 카복실, 나이트로 또는 하이드록시이거나 R601 내지 R604은 인접한 치환체와 융합고리를 포함하거나 포함하지 않는 (C3-C60)알킬렌 또는 (C3-C60)알케닐렌으로 연결되어 지환족 고리 및 단일환 또는 다환의 방향족 고리를 형성할 수 있고,
상기 R601 내지 R604의 알킬, 알케닐, 알키닐, 시클로알킬, 헤테로시클로알킬, 아릴, 헤테로아릴, 아릴실릴, 알킬실릴, 알킬아미노, 아릴아미노 및 인접한 치환체와 융합고리를 포함하거나 포함하지 않는 (C3-C60)알킬렌 또는 (C3-C60)알케닐렌으로 연결되어 지환족 고리 및 단일환 또는 다환의 방향족 고리는 할로겐, (C1-C60)알킬, (C6-C60)아릴, (C4-C60)헤테로아릴, N, O 및 S로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, (C1-C60)알콕시, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, 카복실, 나이트로 및 하이드록시로부터 선택된 하나 이상이 더 치환될 수 있다.]
상기 청색, 녹색 또는 적색 발광을 하는 화합물은 하기 화합물로 예시될 수 있으나, 이에 한정되는 것은 아니다.
본 발명의 유기 전기 발광 소자에 있어서, 한 쌍의 전극의 적어도 한쪽의 내측표면에, 칼코제나이드(chalcogenide)층, 할로겐화 금속층 및 금속 산화물층으로부터 선택된 일층(이하, 이들을 "표면층"이라고 지칭함) 이상을 배치하는 것이 바람직하다. 구체적으로는, 발광 매체층 측의 양극 표면에 규소 및 알루미늄의 금속의 칼코제나이드(산화물을 포함한다)층을, 또한 발광매체층 측의 음극 표면에 할로겐화 금속층 또는 금속 산화물층을 배치하는 것이 바람직하다. 이것에 의해, 구동의 안정화를 얻을 수 있다.
상기 칼코제나이드로서는 예컨대 SiOx(1≤X≤2), AlOX(1≤X≤1.5), SiON, SiAlON 등을 바람직하게 들 수 있으며, 할로겐화 금속으로서는 예컨대 LiF, MgF2, CaF2, 불화 희토류 금속 등을 바람직하게 들 수 있으며, 금속 산화물로서는 예컨대 Cs2O, Li2O, MgO, SrO, BaO, CaO 등을 바람직하게 들 수 있다.
또한, 본 발명의 유기 전기 발광 소자에 있어서, 이렇게 제작된 한 쌍의 전극의 적어도 한쪽의 표면에 전자 전달 화합물과 환원성 도판트의 혼합 영역 또는 정공 전달 화합물과 산화성 도판트의 혼합 영역을 배치하는 것도 바람직하다. 이러한 방식으로, 전자 전달 화합물이 음이온으로 환원되므로 혼합 영역으로부터 발광 매체에 전자를 주입 및 전달하기 용이해진다. 또한, 정공 전달 화합물은 산화되어 양이온으로 되므로 혼합 영역으로부터 발광 매체에 정공을 주입 및 전달하기 용이해진다. 바람직한 산화성 도판트로서는 각종 루이스산 및 억셉터(acceptor) 화합물을 들 수 있다. 바람직한 환원성 도판트로서는 알칼리 금속, 알칼리 금속 화합물, 알칼리 토류 금속, 희토류 금속 및 이들의 혼합물을 들 수 있다.
본 발명에 따른 유기 발광화합물은 발광효율이 좋고 재료의 수명특성이 뛰어나 소자의 구동수명이 매우 양호한 OLED 소자를 제조할 수 있는 장점이 있다.
이하에서, 본 발명의 상세한 이해를 위하여 본 발명의 대표 화합물을 들어 본 발명에 따른 유기 발광 화합물, 이의 제조방법 및 소자의 발광특성을 설명하나, 이는 단지 그 실시 양태를 예시하기 위한 것일 뿐, 본 발명의 범위를 한정하는 것은 아니다.
[
제조예
]
[제조예 1]화합물 1의 제조
화합물
A
의제조
2-브로모나프탈렌 44.1 g(270.7 mmol)을 건조된 테트라하이드로퓨란 용매 (tetrahydrofuran) 500 ml에 녹인 후에, -78℃에서 2.5M n-부틸리튬(n-butyllithium, 2.5M solution in n-Hexane) 130.0 mL(324.9 mmol)를 천천히 적가 하였다. 1시간동안 교반한 후에 2,6-디브로모안트라센-9,10-디온(2,7-dichloroanthracene-9,10-dione) 30.0 g(108.3 mmol)를 첨가하고 천천히 실온으로 올리면서 교반하였다. 17시간 뒤 물을 넣고 30분 동안 교반하고 에틸아세테이트 500 mL로 추출하고 물 500 mL로 세척한 후 얻은 유기층에 황산마그네슘를 넣어 수분을 제거한 후 감압 증류하고 건조하여 화합물 A 21.3 g(47.8 mmol)를 얻었다.
화합물
B
의 제조
화합물 A 7.0 g(14.51 mmol), 포타슘아이오다이드(KI) 9.64 g(58.06 mmol), 소듐포스페이트모노하이드레이트(NaH2PO2·H2O) 9.24 g(87.12 mmol)을 아세트산 150 mL에 녹이고 환류 교반하였다. 14시간 후 25℃로 냉각한 후 수산화나트륨 200 mL을 넣어 중화 한 후에 , 물을 400 mL로 씻어준 후 다이클로로메탄 용매 300 mL로 추출, 마그네슘설페이트로 건조, 필터 여과 하여 용매를 감압 제거한 후에 얻어진 화합물을 메틸렌클로라이드/헥산 = 1 / 100 조건 하에서 컬럼 분리하여 화합물 B 4.49 g(10.0 mmol)을 얻었다.
화합물
1477
의 제조
화합물 B 4.0g(6.79mmol), Iminodibenzyl 3.3g(16.99mmol), Pd(OAc)2 0.07g(0.33mmol), P(t-Bu)3(50% in toluene) 0.3ml(0.67mmol), Cs2CO3 6.6g(20.38mmol), toluene 50ml 를 넣고 110℃에서 5시간 교반한다. 메탄올을 50ml 넣고 생성된 고체를 감압 여과 한다. 고체를 증류수, 메탄올, 헥산으로 씻어 준다. 고체를 EA 100mL와 섞고 환류 교반 2시간 한다. 감압 여과 후 고체를 컬럼 분리한다. 얻어진 고체를 THF에 녹이고 메탄올을 넣어서 생성된 고체를 감압 여과하여 화합물 1477 1.6g(1.95mmol)를 얻었다.
상기 제조예 1의 방법을 이용하여 유기 발광 화합물 1 내지 화합물 1764을 제조하였으며, 표 1에 제조된 유기 발광 화합물들의 1H NMR 및 MS/FAB를 나타내었다.
[표 1]
[실시예 1] 본 발명에 따른 유기 발광 화합물을 이용한 OLED 소자 제작
본 발명의 발광 재료를 이용한 구조의 OLED 소자를 제작하였다.
우선, OLED용 글래스(삼성-코닝사 제조)(1)로부터 얻어진 투명전극 ITO 박막(15 Ω/□) (2)을, 트리클로로에틸렌, 아세톤, 에탄올, 증류수를 순차적으로 사용하여 초음파 세척을 실시한 후, 이소프로판올에 넣어 보관한 후 사용하였다.
다음으로, 진공 증착 장비의 기판 폴더에 ITO 기판을 설치하고, 진공 증착 장비 내의 셀에 하기 구조의 4,4',4"-tris(N,N-(2-naphthyl)-phenylamino) triphenylamine (2-TNATA)을 넣고, 챔버 내의 진공도가 10-6 torr에 도달할 때까지 배기시킨 후, 셀에 전류를 인가하여 2-TNATA를 증발시켜 ITO 기판 상에 60 nm 두께의 정공주입층(3)을 증착하였다.
이어서, 진공 증착 장비 내의 다른 셀에 하기구조 N,N'-bis(α-naphthyl)-N,N'-diphenyl-4,4'-diamine (NPB)을 넣고, 셀에 전류를 인가하여 NPB를 증발시켜 정공주입층 위에 20 nm 두께의 정공전달층(4)을 증착하였다.
정공주입층, 정공전달층을 형성시킨 후, 그 위에 발광층을 다음과 같이 증착시켰다. 진공 증착 장비 내의 한쪽 셀에 호스트로서 하기 구조의 H- 78를 넣고, 또 다른 셀에는 도판트로서 본 발명에 따른 화합물 513을 각각 넣은 후, 두 물질을 다른 속도로 증발시켜 호스트를 기준으로 2 내지 5 mol%로 도핑함으로써 상기 정공 전달층 위에 30 nm 두께의 발광층(5)을 증착하였다.
이어서 전자전달층(6)으로써 하기 구조의 tris(8-hydroxyquinoline)-aluminum(III) (Alq)를 20 nm 두께로 증착한 다음, 전자주입층(7)으로 하기 구조의 화합물 lithium quinolate (Liq)를 1 내지 2 nm 두께로 증착한 후, 다른 진공 증착 장비를 이용하여 Al 음극(8)을 150 nm의 두께로 증착하여 OLED를 제작하였다.
재료 별로 각 화합물은 10-6 torr 하에서 진공 승화 정제하여 OLED 발광재료로 사용하였다.
[비교예 1] 종래의 발광 재료를 이용한 OLED 소자 제작
상기 실시예 1과 동일한 방법으로 정공주입층, 정공전달층을 형성시킨 후, 상기 진공 증착 장비 내의 다른 셀에 발광 호스트 재료인 tris(8-hydroxyquinoline)-aluminum(III) (Alq)를 넣고, 또 다른 셀에는 하기 구조의 Coumarin 545T(C545T)를 각각 넣은 후, 두 물질을 다른 속도로 증발시켜 도핑함으로써 상기 정공 전달층 위에 30 nm 두께의 발광층을 증착하였다. 이 때의 도핑 농도는 Alq 기준으로 1 내지 3 mol%가 바람직하다.
이어서 실시예 1과 동일한 방법으로 전자전달층과 전자주입층을 증착한 후, 다른 진공 증착 장비를 이용하여 Al 음극을 150 nm의 두께로 증착하여 OLED를 제작하였다.
[실시예 2] 제조된 OLED 소자의 발광 특성
상기 실시예 1과 비교예 1에서 제조된 본 발명에 따른 유기 발광 화합물과 종래의 발광 화합물을 함유하는 OLED 소자의 발광 효율을 각각 5,000 cd/m2에서 측정하여 하기 표 2에 나타내었다.
[표 2]
상기 표 2에 나타난 바와 같이, 본 발명의 재료를 녹색 발광 소자에 적용한 결과, 종래의 Alq:C545T(비교예 1) 대비 2배가 넘는 발광 효율이 증가하였다.
이상에서와 같이 본 발명의 유기 발광 화합물은 고효율의 녹색 발광 재료로 사용될 수 있고, 더구나 색순도 측면에서는 본 발명의 도판트 재료를 적용하는 경우, 확연한 개선을 관찰하였으며, 이와 같이 색순도 및 발광 효율이 동시에 개선되는 결과는 본 발명의 재료가 우수한 특성을 가지고 있다는 것을 입증해 주고 있는 것이다.
도 1 - OLED 소자의 단면도
<도면 주요 부분에 대한 부호의 설명>
1 - 글래스 2 - 투명전극
3 - 정공주입층 4 - 정공전달층
5 - 발광층 6 - 전자전달층
7 - 전자주입층 8 - Al 음극
Claims (10)
- 하기 화학식 1로 표시되는 유기 발광 화합물.[화학식 1]상기 화학식 1에서,R1 및 R2는 플루오레닐이며;A고리 및 B고리는 하기 구조의 치환기이고;R41 내지 R44는 서로 독립적으로 수소, 할로겐, (C1-C60)알킬, (C6-C60)아릴, (C3-C60)헤테로아릴, N, O, S 및 Si로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, (C1-C60)알콕시, (C1-C60)알킬티오, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, 카복실, 나이트로 또는 하이드록시이거나, R41 내지 R44는 인접한 치환체와 융합고리를 포함하거나 포함하지 않는 (C3-C60)알킬렌 또는 (C3-C60)알케닐렌으로 연결되어 지환족 고리 및 단일환 또는 다환의 방향족 고리를 형성할 수 있으며;R49 및 R50은 수소 또는 (C1-C6)알킬이며;Z는 화학결합이거나 -(CR51R52)m-이며;R51 및 R52는 서로 독립적으로 수소, 할로겐, (C1-C60)알킬, (C6-C60)아릴, (C3-C60)헤테로아릴, N, O, S 및 Si로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, (C1-C60)알콕시, (C1-C60)알킬티오, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, 카복실, 나이트로 또는 하이드록시이거나, R51과 R52는 융합고리를 포함하거나 포함하지 않는 (C3-C60)알킬렌 또는 (C3-C60)알케닐렌으로 연결되어 지환족 고리 및 단일환 또는 다환의 방향족 고리를 형성할 수 있으며;R1 및 R2와, R41 내지 R44, R51 및 R52의 알킬, 아릴, 헤테로아릴, 헤테로시클로알킬, 시클로알킬, 트리알킬실릴, 디알킬아릴실릴, 트리아릴실릴, 아다만틸, 바이시클로알킬, 알케닐, 알키닐, 알킬아미노 및 아릴아미노는 할로겐, 할로겐으로 치환 또는 비치환된 (C1-C60)알킬, (C6-C60)아릴, (C6-C60)아릴로 치환 또는 비치환된 (C3-C60)헤테로아릴, N, O, S 및 Si로부터 선택된 하나 이상을 포함하는 5원 내지 6원의 헤테로시클로알킬, (C3-C60)시클로알킬, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴, 트리(C6-C60)아릴실릴, 아다만틸, (C7-C60)바이시클로알킬, (C2-C60)알케닐, (C2-C60)알키닐, (C1-C60)알콕시, (C1-C60)알킬티오, 시아노, (C1-C60)알킬아미노, (C6-C60)아릴아미노, (C6-C60)아르(C1-C60)알킬, (C6-C60)아릴옥시, (C6-C60)아릴티오, (C1-C60)알콕시카보닐, 카복실, 나이트로 및 하이드록시로부터 선택된 하나 이상의 치환기로 더 치환될 수 있으며;m은 1 내지 4의 정수이고;a 및 b는 서로 독립적으로 0 또는 1의 정수이고, 단 a+b=1 또는 2의 정수이다.
- 제1항 내지 제3항에서 선택되는 어느 한 항에 따른 유기 발광 화합물을 포함하는 것을 특징으로 하는 유기 전계 발광 소자.
- 제4항에 있어서, 상기 유기 전계 발광 소자는 제1 전극; 제2 전극; 및 상기 제1 전극과 제2 전극 사이에 개재되는 1층 이상의 유기물층으로 이루어져 있으며, 상기 유기물층은 상기 유기 발광 화합물 중의 하나 이상과 하기 화학식 6 및 화학식 7로 표시되는 호스트 중의 하나 이상을 포함하는 것을 특징으로 하는, 유기 전계 발광 소자.[화학식 6](Ar1)c-L11-(Ar2)d[화학식 7](Ar3)e-L12-(Ar4)f상기 화학식 6 및 화학식 7에서,L11는 (C6-C60)아릴렌 또는 (C4-C60)헤테로아릴렌이고;L12는 안트라세닐렌이며;Ar1 내지 Ar4은 서로 독립적으로 수소, (C1-C60)알킬, (C1-C60)알콕시, 할로겐, (C4-C60)헤테로아릴, (C5-C60)시클로알킬 및 (C6-C60)아릴로부터 선택되고, 상기 Ar1 내지 Ar4의 시클로알킬, 아릴 및 헤테로아릴은 할로겐으로 치환되거나 치환되지 않은 (C1-C60)알킬, (C1-C60)알콕시, (C3-C60)시클로알킬, 할로겐, 시아노, 트리(C1-C60)알킬실릴, 디(C1-C60)알킬(C6-C60)아릴실릴 및 트리(C6-C60)아릴실릴로 이루어진 군으로부터 선택된 하나 이상의 치환기로 치환되거나 치환되지 않은 (C6-C60)아릴 또는 (C4-C60)헤테로아릴; 할로겐으로 치환되거나 치환되지 않은 (C1-C60)알킬; (C1-C60)알콕시; (C3-C60)시클로알킬; 할로겐; 시아노; 트리(C1-C60)알킬실릴; 디(C1-C60)알킬(C6-C60)아릴실릴; 및 트리(C6-C60)아릴실릴로 이루어지는 군으로부터 선택된 하나 이상의 치환기로 더 치환될 수 있고;c, d, e 및 f는 서로 독립적으로 0 내지 4의 정수이다.
- 제5항에 있어서, 상기 유기물층은 아릴아민계 화합물 및 스티릴아릴아민계 화합물로 이루어진 군으로부터 선택된 하나 이상의 아민계 화합물을 포함하는 것을 특징으로 하는, 유기 전계 발광 소자.
- 제5항에 있어서, 상기 유기물층은 1족, 2족, 4주기, 5주기 전이금속, 란탄계열금속 및 d-전이원소의 유기금속으로 이루어진 군으로부터 선택된 하나 이상의 금속 또는 착체화합물을 더 포함하는 것을 특징으로 하는, 유기 전계 발광 소자.
- 제5항에 있어서, 상기 유기물층은 적색, 녹색 또는 청색 발광을 하는 유기화합물층을 하나 이상 더 포함하여 백색 발광을 하는, 유기 전계 발광 소자.
- 제5항에 있어서, 상기 유기물층은 발광층 및 전하생성층을 포함하는 것을 특징으로 하는, 유기 전계 발광 소자.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020080060376 | 2008-06-25 | ||
| KR20080060376 | 2008-06-25 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20100002153A KR20100002153A (ko) | 2010-01-06 |
| KR101376530B1 true KR101376530B1 (ko) | 2014-03-19 |
Family
ID=41139285
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020090056126A KR101376530B1 (ko) | 2008-06-25 | 2009-06-23 | 신규한 유기 발광 화합물 및 이를 발광재료로서 채용하고 있는 유기 발광 소자 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US20100051106A1 (ko) |
| EP (2) | EP2256176A1 (ko) |
| JP (2) | JP2010059144A (ko) |
| KR (1) | KR101376530B1 (ko) |
| CN (1) | CN101792422B (ko) |
| TW (1) | TW201008914A (ko) |
Families Citing this family (39)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101507166B1 (ko) * | 2008-12-08 | 2015-04-30 | 엘지디스플레이 주식회사 | 청색 발광 화합물 및 이를 포함하는 유기전계발광소자 |
| TWI458694B (zh) | 2009-01-19 | 2014-11-01 | Nippon Steel & Sumikin Chem Co | Organic light field components |
| WO2010085087A2 (ko) | 2009-01-20 | 2010-07-29 | 주식회사 엘지화학 | 신규한 시클로알켄 유도체 및 이를 이용한 유기전자소자 |
| CN102448945B (zh) | 2009-05-29 | 2016-01-20 | 出光兴产株式会社 | 蒽衍生物及使用该蒽衍生物的有机电致发光元件 |
| EP2440015B1 (en) | 2009-06-05 | 2017-11-15 | Beijing Visionox Technology Co., Ltd. | Organic electroluminescence device and testing method thereof |
| KR101120892B1 (ko) * | 2009-06-19 | 2012-02-27 | 주식회사 두산 | 아크리딘 유도체 및 이를 포함하는 유기 전계 발광 소자 |
| JPWO2011046182A1 (ja) | 2009-10-16 | 2013-03-07 | 出光興産株式会社 | 含フルオレン芳香族化合物、有機エレクトロルミネッセンス素子用材料及びそれを用いた有機エレクトロルミネッセンス素子 |
| EP2500343B1 (en) * | 2009-11-13 | 2018-01-31 | Beijing Visionox Technology Co., Ltd. | Organic materials and organic electroluminescent apparatuses using the same |
| EP3192789A1 (en) | 2010-01-15 | 2017-07-19 | Idemitsu Kosan Co., Ltd. | Nitrogenated heterocyclic ring derivative and organic electroluminescent element comprising same |
| KR101888659B1 (ko) * | 2010-04-28 | 2018-08-16 | 에스에프씨 주식회사 | 아민 유도체 화합물 및 이를 포함하는 유기전계발광소자 |
| WO2012017680A1 (ja) | 2010-08-05 | 2012-02-09 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子 |
| JP5653122B2 (ja) * | 2010-08-10 | 2015-01-14 | 住友化学株式会社 | 有機エレクトロルミネッセンス素子およびその製造方法 |
| JP5745549B2 (ja) | 2011-02-07 | 2015-07-08 | 出光興産株式会社 | ビスカルバゾール誘導体及びそれを用いた有機エレクトロルミネッセンス素子 |
| KR101874657B1 (ko) | 2011-02-07 | 2018-07-04 | 이데미쓰 고산 가부시키가이샤 | 비스카바졸 유도체 및 그것을 이용한 유기 전기발광 소자 |
| KR20130025087A (ko) * | 2011-09-01 | 2013-03-11 | 롬엔드하스전자재료코리아유한회사 | 신규한 유기 발광 화합물 및 이를 채용하고 있는 유기 발광 화합물 |
| JP6031302B2 (ja) * | 2011-09-14 | 2016-11-24 | 出光興産株式会社 | ヘテロ芳香族化合物及びそれを用いた有機エレクトロルミネッセンス素子 |
| KR101507004B1 (ko) | 2011-12-29 | 2015-03-30 | 제일모직 주식회사 | 유기광전자소자용 화합물, 이를 포함하는 유기발광소자 및 상기 유기발광소자를 포함하는 표시장치 |
| KR102126877B1 (ko) | 2012-02-03 | 2020-06-25 | 이데미쓰 고산 가부시키가이샤 | 카르바졸 화합물, 유기 일렉트로루미네선스 소자용 재료 및 유기 일렉트로루미네선스 소자 |
| CN104396042B (zh) * | 2012-06-28 | 2016-10-12 | 新日铁住金化学株式会社 | 有机电致发光元件用材料及有机电致发光元件 |
| KR102160946B1 (ko) * | 2012-08-07 | 2020-09-29 | 주식회사 동진쎄미켐 | 아크리딘 유도체를 포함하는 유기발광 화합물 및 이를 포함하는 유기발광소자 |
| US9312500B2 (en) | 2012-08-31 | 2016-04-12 | Idemitsu Kosan Co., Ltd. | Organic electroluminescence device |
| KR102240991B1 (ko) | 2012-09-12 | 2021-04-16 | 이데미쓰 고산 가부시키가이샤 | 신규 화합물, 유기 일렉트로 루미네선스 소자용 재료, 유기 일렉트로 루미네선스 소자 및 전자 기기 |
| KR20140049186A (ko) * | 2012-10-16 | 2014-04-25 | 롬엔드하스전자재료코리아유한회사 | 유기 전계 발광 화합물 및 이를 포함하는 유기 전계 발광 소자 |
| KR102121583B1 (ko) * | 2012-11-28 | 2020-06-10 | 에스에프씨 주식회사 | 안트라센 유도체 화합물 및 이를 포함하는 유기전계발광소자 |
| JP2014177442A (ja) * | 2013-03-15 | 2014-09-25 | Idemitsu Kosan Co Ltd | ジアミノアントラセン誘導体及び有機エレクトロルミネッセンス素子 |
| JP5847354B2 (ja) | 2013-03-15 | 2016-01-20 | 出光興産株式会社 | アントラセン誘導体及びそれを用いた有機エレクトロルミネッセンス素子 |
| TW201504230A (zh) * | 2013-06-05 | 2015-02-01 | Univ Kyushu Nat Univ Corp | 發光材料、有機發光元件及化合物 |
| EP3031805B1 (en) * | 2013-08-09 | 2021-08-25 | Kyushu University, National University Corporation | Organic metal complex, luminescent material, delayed phosphor and organic light emitting element |
| KR102086555B1 (ko) * | 2013-08-14 | 2020-03-10 | 삼성디스플레이 주식회사 | 안트라센계 화합물 및 이를 포함한 유기 발광 소자 |
| KR20150093440A (ko) * | 2014-02-07 | 2015-08-18 | 롬엔드하스전자재료코리아유한회사 | 유기 전계 발광 소자 |
| CN106336414B (zh) * | 2016-07-28 | 2018-08-17 | 长春海谱润斯科技有限公司 | 一种含氮杂环衍生物及其在有机电致发光器件中的应用 |
| CN108203416A (zh) * | 2016-12-20 | 2018-06-26 | 江苏三月光电科技有限公司 | 以芴为核心的化合物及有机电致发光器件 |
| CN108203417A (zh) * | 2016-12-20 | 2018-06-26 | 江苏三月光电科技有限公司 | 以芴为主体的有机化合物及有机电致发光器件 |
| CN106831743B (zh) * | 2016-12-30 | 2020-03-17 | 上海天马有机发光显示技术有限公司 | 一种有机电致发光材料以及有机光电装置 |
| CN110015994A (zh) * | 2019-04-29 | 2019-07-16 | 武汉华星光电半导体显示技术有限公司 | 热活化延迟荧光材料及其制备方法、显示装置 |
| KR20220065453A (ko) | 2020-11-13 | 2022-05-20 | 주식회사 엘지화학 | 화합물 및 이를 포함하는 유기 발광 소자 |
| KR20220065449A (ko) | 2020-11-13 | 2022-05-20 | 주식회사 엘지화학 | 화합물 및 이를 포함하는 유기 발광 소자 |
| KR20220065451A (ko) | 2020-11-13 | 2022-05-20 | 주식회사 엘지화학 | 화합물 및 이를 포함하는 유기 발광 소자 |
| KR20220065950A (ko) | 2020-11-13 | 2022-05-23 | 주식회사 엘지화학 | 화합물 및 이를 포함하는 유기 발광 소자 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20080122344A1 (en) * | 2006-11-24 | 2008-05-29 | Samsung Electronics Co., Ltd. | Organic light emitting compound and organic light emitting device comprising the same, and method of manufacturing the organic light emitting device |
| KR20090093897A (ko) * | 2008-02-29 | 2009-09-02 | 에스에프씨 주식회사 | 아민 유도체 및 이를 채용한 유기전계발광소자 |
Family Cites Families (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4117093B2 (ja) | 1998-12-28 | 2008-07-09 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子用材料およびそれを使用した有機エレクトロルミネッセンス素子 |
| JP2001335516A (ja) * | 1999-11-08 | 2001-12-04 | Idemitsu Kosan Co Ltd | 有機エレクトロルミネッセンス素子 |
| JP3855675B2 (ja) * | 2000-11-30 | 2006-12-13 | 三菱化学株式会社 | 有機電界発光素子 |
| JP4407102B2 (ja) | 2001-08-06 | 2010-02-03 | 三菱化学株式会社 | アントラセン系化合物、その製造方法および有機電界発光素子 |
| JP2004075750A (ja) * | 2002-08-12 | 2004-03-11 | Dainippon Printing Co Ltd | フェノキサジン系化合物、着色組成物および有機エレクトロルミネッセンス素子 |
| JP2004091334A (ja) | 2002-08-29 | 2004-03-25 | Mitsubishi Chemicals Corp | 2,6−アリールアミノアントラセン系化合物、電荷輸送材料及び有機電界発光素子 |
| JP2006248900A (ja) * | 2005-03-08 | 2006-09-21 | Sony Corp | アントラセン誘導体、アントラセン誘導体の合成方法、有機電界発光素子、および表示装置 |
| JP2007015933A (ja) * | 2005-07-05 | 2007-01-25 | Sony Corp | アントラセン誘導体の合成方法、有機電界発光素子、および表示装置 |
| US8298683B2 (en) * | 2005-09-15 | 2012-10-30 | Lg Chem, Ltd. | Organic compound and organic light emitting device using the same |
| US20070134512A1 (en) * | 2005-12-13 | 2007-06-14 | Eastman Kodak Company | Electroluminescent device containing an anthracene derivative |
| US20070141393A1 (en) * | 2005-12-21 | 2007-06-21 | Eastman Kodak Company | Amino anthracene compounds in OLED devices |
| TWI348463B (en) * | 2006-03-06 | 2011-09-11 | Lg Chemical Ltd | Novel anthracene derivative and organic electronic device using the same |
| KR100989815B1 (ko) * | 2008-03-20 | 2010-10-29 | 다우어드밴스드디스플레이머티리얼 유한회사 | 신규한 유기 발광 화합물 및 이를 발광재료로서 채용하고있는 유기 발광 소자 |
| JP5352304B2 (ja) * | 2008-04-02 | 2013-11-27 | 株式会社半導体エネルギー研究所 | アントラセン誘導体、発光材料、発光素子用材料、塗布用組成物、発光素子、及び発光装置 |
| JP5501656B2 (ja) * | 2008-05-16 | 2014-05-28 | 株式会社半導体エネルギー研究所 | 組成物、薄膜の作製方法、及び発光素子の作製方法 |
-
2009
- 2009-03-24 EP EP10172185A patent/EP2256176A1/en not_active Withdrawn
- 2009-03-24 EP EP09155969A patent/EP2141214A3/en not_active Withdrawn
- 2009-06-23 US US12/456,787 patent/US20100051106A1/en not_active Abandoned
- 2009-06-23 KR KR1020090056126A patent/KR101376530B1/ko active IP Right Grant
- 2009-06-24 JP JP2009149869A patent/JP2010059144A/ja active Pending
- 2009-06-25 CN CN2009101669017A patent/CN101792422B/zh active Active
- 2009-06-25 TW TW098121331A patent/TW201008914A/zh unknown
-
2014
- 2014-12-03 JP JP2014244858A patent/JP6027080B2/ja not_active Expired - Fee Related
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20080122344A1 (en) * | 2006-11-24 | 2008-05-29 | Samsung Electronics Co., Ltd. | Organic light emitting compound and organic light emitting device comprising the same, and method of manufacturing the organic light emitting device |
| KR20090093897A (ko) * | 2008-02-29 | 2009-09-02 | 에스에프씨 주식회사 | 아민 유도체 및 이를 채용한 유기전계발광소자 |
Also Published As
| Publication number | Publication date |
|---|---|
| CN101792422B (zh) | 2013-07-24 |
| EP2141214A2 (en) | 2010-01-06 |
| CN101792422A (zh) | 2010-08-04 |
| US20100051106A1 (en) | 2010-03-04 |
| JP2015083578A (ja) | 2015-04-30 |
| JP6027080B2 (ja) | 2016-11-16 |
| EP2141214A3 (en) | 2010-02-24 |
| JP2010059144A (ja) | 2010-03-18 |
| EP2256176A1 (en) | 2010-12-01 |
| TW201008914A (en) | 2010-03-01 |
| KR20100002153A (ko) | 2010-01-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101376530B1 (ko) | 신규한 유기 발광 화합물 및 이를 발광재료로서 채용하고 있는 유기 발광 소자 | |
| KR100910150B1 (ko) | 신규한 유기 발광 화합물 및 이를 발광재료로서 채용하고있는 유기 발광 소자 | |
| KR101178219B1 (ko) | 전기발광화합물을 발광재료로서 채용하고 있는 전기발광소자 | |
| KR101551207B1 (ko) | 신규한 유기 발광 화합물 및 이를 발광재료로서 채용하고 있는 유기 발광 소자 | |
| KR101495547B1 (ko) | 신규한 전자 재료용 화합물 및 이를 포함하는 유기 전자소자 | |
| JP5690276B2 (ja) | 新規な電界発光用有機金属化合物及びこれを発光材料として用いた電界発光素子 | |
| KR100989815B1 (ko) | 신규한 유기 발광 화합물 및 이를 발광재료로서 채용하고있는 유기 발광 소자 | |
| KR100850886B1 (ko) | 전기발광용 유기금속 화합물 및 이를 발광재료로 채용하고있는 표시소자 | |
| EP2281863A2 (en) | Fluorene-derivatives and organic electroluminescent device using the same | |
| KR100946411B1 (ko) | 신규한 유기 발광 화합물 및 이를 발광재료로서 채용하고있는 유기 발광 소자 | |
| EP2147962A1 (en) | Azaanthracene-derivatives and organic electroluminescent device using the same | |
| KR20100048203A (ko) | 신규한 유기 발광 화합물 및 이를 발광재료로서 채용하고 있는 유기 발광 소자 | |
| KR20100048447A (ko) | 신규한 유기 전자재료용 화합물 및 이를 포함하는 유기 전자 소자 | |
| KR20090098585A (ko) | 유기발광화합물을 발광재료로서 채용하고 있는유기전기발광소자 | |
| KR20090111915A (ko) | 신규한 유기 발광 화합물 및 이를 발광재료로서 채용하고있는 유기 발광 소자 | |
| KR20090105495A (ko) | 신규한 유기 발광 화합물 및 이를 발광재료로서 채용하고있는 유기 전기 발광 소자 | |
| KR20100041043A (ko) | 신규한 유기 발광 화합물 및 이를 발광재료로서 채용하고 있는 유기 발광 소자 | |
| JP2009185024A (ja) | 新規な有機電界発光化合物及びこれを使用する有機電界発光素子 | |
| KR20100028168A (ko) | 신규한 유기 발광 화합물 및 이를 발광재료로서 채용하고 있는 유기 발광 소자 | |
| KR20090100013A (ko) | 신규한 유기 발광 화합물 및 이를 발광재료로서 채용하고있는 유기 전계 발광 소자 | |
| KR20130058027A (ko) | 신규한 유기 전자재료용 화합물 및 이를 포함하는 유기 전자 소자 | |
| KR20100086972A (ko) | 유기발광화합물을 발광재료로서 채용하고 있는 유기전기발광소자 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| N231 | Notification of change of applicant | ||
| E902 | Notification of reason for refusal | ||
| AMND | Amendment | ||
| E902 | Notification of reason for refusal | ||
| AMND | Amendment | ||
| E601 | Decision to refuse application | ||
| J201 | Request for trial against refusal decision | ||
| AMND | Amendment | ||
| B701 | Decision to grant | ||
| GRNT | Written decision to grant | ||
| FPAY | Annual fee payment |
Payment date: 20170220 Year of fee payment: 4 |
|
| FPAY | Annual fee payment |
Payment date: 20180219 Year of fee payment: 5 |
|
| FPAY | Annual fee payment |
Payment date: 20200218 Year of fee payment: 7 |