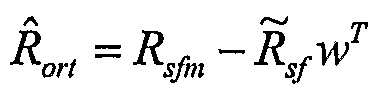KR101361697B1 - 광학적 반사율 측정을 교정하는 시스템 및 방법 - Google Patents
광학적 반사율 측정을 교정하는 시스템 및 방법 Download PDFInfo
- Publication number
- KR101361697B1 KR101361697B1 KR1020077026849A KR20077026849A KR101361697B1 KR 101361697 B1 KR101361697 B1 KR 101361697B1 KR 1020077026849 A KR1020077026849 A KR 1020077026849A KR 20077026849 A KR20077026849 A KR 20077026849A KR 101361697 B1 KR101361697 B1 KR 101361697B1
- Authority
- KR
- South Korea
- Prior art keywords
- spectral
- light
- spectrum
- spectra
- sample
- Prior art date
Links
- 230000003287 optical effect Effects 0.000 title claims abstract description 120
- 238000005259 measurement Methods 0.000 title claims abstract description 72
- 238000000034 method Methods 0.000 title claims description 136
- 238000001514 detection method Methods 0.000 claims abstract description 88
- 238000001228 spectrum Methods 0.000 claims description 221
- 230000003595 spectral effect Effects 0.000 claims description 198
- 239000000523 sample Substances 0.000 claims description 183
- 238000011068 loading method Methods 0.000 claims description 75
- 238000000513 principal component analysis Methods 0.000 claims description 69
- 239000012491 analyte Substances 0.000 claims description 64
- 238000012937 correction Methods 0.000 claims description 60
- 239000011159 matrix material Substances 0.000 claims description 27
- 239000013598 vector Substances 0.000 claims description 21
- 241001465754 Metazoa Species 0.000 claims description 16
- 230000005540 biological transmission Effects 0.000 claims description 9
- 238000012545 processing Methods 0.000 claims description 6
- 239000004020 conductor Substances 0.000 claims description 4
- 238000000691 measurement method Methods 0.000 abstract description 3
- 210000003205 muscle Anatomy 0.000 description 84
- 238000005286 illumination Methods 0.000 description 67
- 210000001519 tissue Anatomy 0.000 description 65
- 239000000835 fiber Substances 0.000 description 55
- 239000003925 fat Substances 0.000 description 54
- 238000000985 reflectance spectrum Methods 0.000 description 54
- 239000000975 dye Substances 0.000 description 38
- 238000002835 absorbance Methods 0.000 description 22
- 210000004369 blood Anatomy 0.000 description 22
- 239000008280 blood Substances 0.000 description 22
- 238000010521 absorption reaction Methods 0.000 description 20
- 238000000862 absorption spectrum Methods 0.000 description 17
- 230000000875 corresponding effect Effects 0.000 description 17
- 210000003743 erythrocyte Anatomy 0.000 description 16
- 239000013307 optical fiber Substances 0.000 description 16
- 239000000126 substance Substances 0.000 description 16
- 238000012360 testing method Methods 0.000 description 15
- 239000000463 material Substances 0.000 description 13
- 238000001320 near-infrared absorption spectroscopy Methods 0.000 description 13
- 230000008859 change Effects 0.000 description 11
- 230000002829 reductive effect Effects 0.000 description 11
- 238000004458 analytical method Methods 0.000 description 9
- 210000000689 upper leg Anatomy 0.000 description 9
- XUMBMVFBXHLACL-UHFFFAOYSA-N Melanin Chemical compound O=C1C(=O)C(C2=CNC3=C(C(C(=O)C4=C32)=O)C)=C2C4=CNC2=C1C XUMBMVFBXHLACL-UHFFFAOYSA-N 0.000 description 8
- 238000011481 absorbance measurement Methods 0.000 description 8
- 238000007405 data analysis Methods 0.000 description 8
- 210000000056 organ Anatomy 0.000 description 8
- 230000009471 action Effects 0.000 description 7
- 108010054147 Hemoglobins Proteins 0.000 description 6
- 102000001554 Hemoglobins Human genes 0.000 description 6
- 230000008569 process Effects 0.000 description 6
- 230000008901 benefit Effects 0.000 description 5
- 244000309466 calf Species 0.000 description 5
- 230000000694 effects Effects 0.000 description 5
- 150000003278 haem Chemical class 0.000 description 5
- 238000012986 modification Methods 0.000 description 5
- 230000004048 modification Effects 0.000 description 5
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 4
- 229910052782 aluminium Inorganic materials 0.000 description 4
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 4
- 239000013626 chemical specie Substances 0.000 description 4
- 239000003365 glass fiber Substances 0.000 description 4
- 229910052760 oxygen Inorganic materials 0.000 description 4
- 239000001301 oxygen Substances 0.000 description 4
- 239000004033 plastic Substances 0.000 description 4
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N silicon dioxide Inorganic materials O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 4
- 230000008326 skin blood flow Effects 0.000 description 4
- 238000004611 spectroscopical analysis Methods 0.000 description 4
- 238000003860 storage Methods 0.000 description 4
- 238000004590 computer program Methods 0.000 description 3
- 230000001276 controlling effect Effects 0.000 description 3
- 230000002596 correlated effect Effects 0.000 description 3
- 238000013461 design Methods 0.000 description 3
- 238000010586 diagram Methods 0.000 description 3
- 239000003814 drug Substances 0.000 description 3
- 210000000245 forearm Anatomy 0.000 description 3
- 239000007789 gas Substances 0.000 description 3
- 230000010354 integration Effects 0.000 description 3
- 210000002414 leg Anatomy 0.000 description 3
- 238000007726 management method Methods 0.000 description 3
- 238000012544 monitoring process Methods 0.000 description 3
- 238000010238 partial least squares regression Methods 0.000 description 3
- 238000001055 reflectance spectroscopy Methods 0.000 description 3
- 230000035939 shock Effects 0.000 description 3
- 230000037384 skin absorption Effects 0.000 description 3
- 231100000274 skin absorption Toxicity 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 239000000243 solution Substances 0.000 description 3
- INGWEZCOABYORO-UHFFFAOYSA-N 2-(furan-2-yl)-7-methyl-1h-1,8-naphthyridin-4-one Chemical compound N=1C2=NC(C)=CC=C2C(O)=CC=1C1=CC=CO1 INGWEZCOABYORO-UHFFFAOYSA-N 0.000 description 2
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 2
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 2
- 102000036675 Myoglobin Human genes 0.000 description 2
- 108010062374 Myoglobin Proteins 0.000 description 2
- 230000002745 absorbent Effects 0.000 description 2
- 239000002250 absorbent Substances 0.000 description 2
- 239000006096 absorbing agent Substances 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- 238000009125 cardiac resynchronization therapy Methods 0.000 description 2
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 2
- 230000008602 contraction Effects 0.000 description 2
- 229910052802 copper Inorganic materials 0.000 description 2
- 239000010949 copper Substances 0.000 description 2
- 230000008878 coupling Effects 0.000 description 2
- 238000010168 coupling process Methods 0.000 description 2
- 238000005859 coupling reaction Methods 0.000 description 2
- 238000002790 cross-validation Methods 0.000 description 2
- 108010002255 deoxyhemoglobin Proteins 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 230000006870 function Effects 0.000 description 2
- 239000008103 glucose Substances 0.000 description 2
- 239000000976 ink Substances 0.000 description 2
- 230000002452 interceptive effect Effects 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 238000013507 mapping Methods 0.000 description 2
- 239000000203 mixture Substances 0.000 description 2
- 238000001139 pH measurement Methods 0.000 description 2
- 230000036961 partial effect Effects 0.000 description 2
- 230000007310 pathophysiology Effects 0.000 description 2
- 230000005855 radiation Effects 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 230000000287 tissue oxygenation Effects 0.000 description 2
- WFKWXMTUELFFGS-UHFFFAOYSA-N tungsten Chemical compound [W] WFKWXMTUELFFGS-UHFFFAOYSA-N 0.000 description 2
- 229910052721 tungsten Inorganic materials 0.000 description 2
- 239000010937 tungsten Substances 0.000 description 2
- 210000001835 viscera Anatomy 0.000 description 2
- 230000029663 wound healing Effects 0.000 description 2
- 229920001817 Agar Polymers 0.000 description 1
- 235000004391 Chenopodium capitatum Nutrition 0.000 description 1
- 244000038022 Chenopodium capitatum Species 0.000 description 1
- 208000028399 Critical Illness Diseases 0.000 description 1
- 239000004593 Epoxy Substances 0.000 description 1
- JVTAAEKCZFNVCJ-UHFFFAOYSA-M Lactate Chemical compound CC(O)C([O-])=O JVTAAEKCZFNVCJ-UHFFFAOYSA-M 0.000 description 1
- 238000004497 NIR spectroscopy Methods 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 206010052428 Wound Diseases 0.000 description 1
- 208000027418 Wounds and injury Diseases 0.000 description 1
- 210000001015 abdomen Anatomy 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- 239000008272 agar Substances 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 235000013405 beer Nutrition 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 238000004061 bleaching Methods 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 238000004159 blood analysis Methods 0.000 description 1
- 230000017531 blood circulation Effects 0.000 description 1
- 238000009534 blood test Methods 0.000 description 1
- 210000004204 blood vessel Anatomy 0.000 description 1
- 210000000988 bone and bone Anatomy 0.000 description 1
- 210000004027 cell Anatomy 0.000 description 1
- 239000013043 chemical agent Substances 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 210000000038 chest Anatomy 0.000 description 1
- 235000012000 cholesterol Nutrition 0.000 description 1
- 238000004891 communication Methods 0.000 description 1
- 239000011365 complex material Substances 0.000 description 1
- 239000002131 composite material Substances 0.000 description 1
- 238000013500 data storage Methods 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 239000003792 electrolyte Substances 0.000 description 1
- 238000000295 emission spectrum Methods 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 239000011888 foil Substances 0.000 description 1
- 239000005350 fused silica glass Substances 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 238000009499 grossing Methods 0.000 description 1
- 229910052736 halogen Inorganic materials 0.000 description 1
- 150000002367 halogens Chemical class 0.000 description 1
- 230000017525 heat dissipation Effects 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 239000011261 inert gas Substances 0.000 description 1
- 238000002329 infrared spectrum Methods 0.000 description 1
- 229940028435 intralipid Drugs 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- WABPQHHGFIMREM-UHFFFAOYSA-N lead(0) Chemical compound [Pb] WABPQHHGFIMREM-UHFFFAOYSA-N 0.000 description 1
- 230000031700 light absorption Effects 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 238000012417 linear regression Methods 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 238000002483 medication Methods 0.000 description 1
- 238000012806 monitoring device Methods 0.000 description 1
- 210000001087 myotubule Anatomy 0.000 description 1
- 239000012811 non-conductive material Substances 0.000 description 1
- 238000010606 normalization Methods 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 230000001991 pathophysiological effect Effects 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 238000003672 processing method Methods 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 238000002106 pulse oximetry Methods 0.000 description 1
- 239000010453 quartz Substances 0.000 description 1
- 238000002310 reflectometry Methods 0.000 description 1
- 230000011514 reflex Effects 0.000 description 1
- 230000003252 repetitive effect Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- 229910052709 silver Inorganic materials 0.000 description 1
- 239000004332 silver Substances 0.000 description 1
- 210000003491 skin Anatomy 0.000 description 1
- 239000002689 soil Substances 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 238000010183 spectrum analysis Methods 0.000 description 1
- 229910052717 sulfur Inorganic materials 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 239000002470 thermal conductor Substances 0.000 description 1
- 230000008646 thermal stress Effects 0.000 description 1
- 238000013519 translation Methods 0.000 description 1
- 238000002834 transmittance Methods 0.000 description 1
- 238000002604 ultrasonography Methods 0.000 description 1
- 210000003462 vein Anatomy 0.000 description 1
- 230000002747 voluntary effect Effects 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/17—Systems in which incident light is modified in accordance with the properties of the material investigated
- G01N21/25—Colour; Spectral properties, i.e. comparison of effect of material on the light at two or more different wavelengths or wavelength bands
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/145—Measuring characteristics of blood in vivo, e.g. gas concentration, pH value; Measuring characteristics of body fluids or tissues, e.g. interstitial fluid, cerebral tissue
- A61B5/14535—Measuring characteristics of blood in vivo, e.g. gas concentration, pH value; Measuring characteristics of body fluids or tissues, e.g. interstitial fluid, cerebral tissue for measuring haematocrit
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/0059—Measuring for diagnostic purposes; Identification of persons using light, e.g. diagnosis by transillumination, diascopy, fluorescence
- A61B5/0075—Measuring for diagnostic purposes; Identification of persons using light, e.g. diagnosis by transillumination, diascopy, fluorescence by spectroscopy, i.e. measuring spectra, e.g. Raman spectroscopy, infrared absorption spectroscopy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/145—Measuring characteristics of blood in vivo, e.g. gas concentration, pH value; Measuring characteristics of body fluids or tissues, e.g. interstitial fluid, cerebral tissue
- A61B5/14539—Measuring characteristics of blood in vivo, e.g. gas concentration, pH value; Measuring characteristics of body fluids or tissues, e.g. interstitial fluid, cerebral tissue for measuring pH
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/145—Measuring characteristics of blood in vivo, e.g. gas concentration, pH value; Measuring characteristics of body fluids or tissues, e.g. interstitial fluid, cerebral tissue
- A61B5/1455—Measuring characteristics of blood in vivo, e.g. gas concentration, pH value; Measuring characteristics of body fluids or tissues, e.g. interstitial fluid, cerebral tissue using optical sensors, e.g. spectral photometrical oximeters
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/145—Measuring characteristics of blood in vivo, e.g. gas concentration, pH value; Measuring characteristics of body fluids or tissues, e.g. interstitial fluid, cerebral tissue
- A61B5/1455—Measuring characteristics of blood in vivo, e.g. gas concentration, pH value; Measuring characteristics of body fluids or tissues, e.g. interstitial fluid, cerebral tissue using optical sensors, e.g. spectral photometrical oximeters
- A61B5/14551—Measuring characteristics of blood in vivo, e.g. gas concentration, pH value; Measuring characteristics of body fluids or tissues, e.g. interstitial fluid, cerebral tissue using optical sensors, e.g. spectral photometrical oximeters for measuring blood gases
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01J—MEASUREMENT OF INTENSITY, VELOCITY, SPECTRAL CONTENT, POLARISATION, PHASE OR PULSE CHARACTERISTICS OF INFRARED, VISIBLE OR ULTRAVIOLET LIGHT; COLORIMETRY; RADIATION PYROMETRY
- G01J3/00—Spectrometry; Spectrophotometry; Monochromators; Measuring colours
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/17—Systems in which incident light is modified in accordance with the properties of the material investigated
- G01N21/25—Colour; Spectral properties, i.e. comparison of effect of material on the light at two or more different wavelengths or wavelength bands
- G01N21/27—Colour; Spectral properties, i.e. comparison of effect of material on the light at two or more different wavelengths or wavelength bands using photo-electric detection ; circuits for computing concentration
- G01N21/274—Calibration, base line adjustment, drift correction
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/17—Systems in which incident light is modified in accordance with the properties of the material investigated
- G01N21/25—Colour; Spectral properties, i.e. comparison of effect of material on the light at two or more different wavelengths or wavelength bands
- G01N21/31—Investigating relative effect of material at wavelengths characteristic of specific elements or molecules, e.g. atomic absorption spectrometry
- G01N21/35—Investigating relative effect of material at wavelengths characteristic of specific elements or molecules, e.g. atomic absorption spectrometry using infrared light
- G01N21/359—Investigating relative effect of material at wavelengths characteristic of specific elements or molecules, e.g. atomic absorption spectrometry using infrared light using near infrared light
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/17—Systems in which incident light is modified in accordance with the properties of the material investigated
- G01N21/47—Scattering, i.e. diffuse reflection
- G01N21/49—Scattering, i.e. diffuse reflection within a body or fluid
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/17—Systems in which incident light is modified in accordance with the properties of the material investigated
- G01N21/55—Specular reflectivity
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/17—Systems in which incident light is modified in accordance with the properties of the material investigated
- G01N21/59—Transmissivity
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/145—Measuring characteristics of blood in vivo, e.g. gas concentration, pH value; Measuring characteristics of body fluids or tissues, e.g. interstitial fluid, cerebral tissue
- A61B5/14546—Measuring characteristics of blood in vivo, e.g. gas concentration, pH value; Measuring characteristics of body fluids or tissues, e.g. interstitial fluid, cerebral tissue for measuring analytes not otherwise provided for, e.g. ions, cytochromes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/68—Arrangements of detecting, measuring or recording means, e.g. sensors, in relation to patient
- A61B5/6801—Arrangements of detecting, measuring or recording means, e.g. sensors, in relation to patient specially adapted to be attached to or worn on the body surface
- A61B5/6813—Specially adapted to be attached to a specific body part
- A61B5/6824—Arm or wrist
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/17—Systems in which incident light is modified in accordance with the properties of the material investigated
- G01N21/25—Colour; Spectral properties, i.e. comparison of effect of material on the light at two or more different wavelengths or wavelength bands
- G01N21/31—Investigating relative effect of material at wavelengths characteristic of specific elements or molecules, e.g. atomic absorption spectrometry
- G01N21/314—Investigating relative effect of material at wavelengths characteristic of specific elements or molecules, e.g. atomic absorption spectrometry with comparison of measurements at specific and non-specific wavelengths
- G01N2021/3155—Measuring in two spectral ranges, e.g. UV and visible
Landscapes
- Physics & Mathematics (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Pathology (AREA)
- Spectroscopy & Molecular Physics (AREA)
- General Physics & Mathematics (AREA)
- Engineering & Computer Science (AREA)
- Chemical & Material Sciences (AREA)
- Analytical Chemistry (AREA)
- Biochemistry (AREA)
- Immunology (AREA)
- Medical Informatics (AREA)
- Biophysics (AREA)
- Biomedical Technology (AREA)
- Heart & Thoracic Surgery (AREA)
- Molecular Biology (AREA)
- Surgery (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Optics & Photonics (AREA)
- Theoretical Computer Science (AREA)
- Mathematical Physics (AREA)
- Investigating Or Analysing Materials By Optical Means (AREA)
Abstract
본 발명은 타겟 영역들 상부에 놓인 피쳐들을 포함하는 샘플들의 타겟 영역내의 분석물들을 측정하는 측정 방법 및 시스템을 개시한다. 상기 시스템은 측정 시스템으로서, (a) 광원 ; (b) 검출 시스템 ; (c) 상기 광원으로부터의 광이 샘플로 전송되고 상기 샘플로부터 반사된 광이 상기 검출 시스템으로 지향되게 하는 적어도 제1, 제2 및 제3 광 포트들의 세트 - 상기 검출 시스템은 상기 샘플 내의 내부 타겟과 상기 내부 타겟 상부에 놓인 피쳐들에 해당하는 정보를 포함하는 제1 데이터 세트, 및 상기 제2 검출 간격에 해당하며 상기 내부 타겟 상부에 놓인 피쳐들에 해당하는 정보를 포함하는 제2 데이터 세트를 생성함 - ; 및 (d) 상기 내부 타겟을 나타내는 교정된 정보를 생성하기 위해 상기 제1 데이터 세트 및 상기 제2 데이터 세트를 이용하여 상기 제1 데이터 세트로부터 상기 상부에 놓인 피쳐들의 정보 특성을 제거하도록 구성된 프로세서를 포함한다.
Description
본 출원은 2005년 4월 25일자로 "SYSTEM AND METHODS FOR CORRECTING OPTICAL REFLECTANCE MEASUREMENT"란 명칭으로 출원된 미국 가출원 No. 60/674,379호의 우선권을 청구하며, 상기 문헌 내용은 본 명세서에서 참조된다.
본 발명은 분광계 시스템 및 방법, 특히 반사율 측정을 위한 분광계 시스템에 관한 것이다.
광학 분광법은 기체, 액체 및 고체 샘플들의 화학 종의 농도를 결정하는데 이용될 수 있다. 특정 화학 종에 의해 흡수되는 광의 양은 비어의 법칙(A=εlC)에 의해 농도와 선형적으로 관련되며, 여기서 A는 화학 종의 흡수도이며, ε는 화학제에 대한 특정 상수이며, l은 광의 경로 길이이며, c는 화학제 농도이다. 세기(I0)를 갖는 입사광이 샘플 상에 입사되고, 측정될 화학제를 포함하는 용액을 통과한 이후 I가 광의 세기가 될 때, 흡수도는 A=log(I0/I)로 주어진다.
파우더, 타블렛(tablet), 천연 물질(예를 들어, 토양, 농산물), 혈액, 피부 및 근육과 같이 복합(complex) 물질을 포함하는 불투명한 물질에 대해, 광학 정보 는 확산 반사 분광법을 통해 수집될 수 있다. 이러한 설정에 있어, A = I100/IR이며, 여기서 I100은 100% 확산 반사 기준으로부터 반사된 광이며, 입사 광과 등가(equivalent)이며, IR은 샘플 언더 스터디(sample under study)로부터 반사된 광이다. 이러한 복합 물질중 하나의 화학 성분의 농도는 선형적인 것은 아니지만, A와 관련된다. 예를 들어, 부분 최소 제곱 회귀(partial least squares regression) 및 다른 다변량 교정(multivariate calibration) 방법들과 같이, 보다 복잡한 산술(mathematical) 기술이 농도와 흡수도 사이의 관계를 결정하는데 이용된다. 일단 이러한 교정 모델이 유추되면, 투과율 또는 반사율 모드에서 흡수도를 측정함으로써 화학적 조성물을 결정하는데 이용될 수 있다.
근적외 분광법("NIRS")을 이용하는 확산 반사 분광 기술은 인체 및 동물 대상자의 혈액 및 조직의 비침범성(noninvasive) 측정을 위해 이용된다. NIRS(예를 들어, 약 650-1000nm 범위의 파장 이용)은 조직 산소화, 조직 pH, 혈액 적혈구용적("HcT"), 및 글루코스와 같은 다수의 중요한 의학적 파라미터를 측정하는데 이용될 수 있으나, 광범위한 의학 분야는 측정될 내부 구조물 뿐만 아니라 피개 조직(tissue overlying)에서 피검자간(inter-subject) 및 개인간(intra-subject) 분석물-무관 변이에 의해 방해된다. 예를 들어, 확산 반사 NIRS가 근육 또는 기관에서 혈액 적혈구용적을 측정하는데 이용될 때, 측정 정확도는 (예를 들어, 대상 환자군(patient population)에 있는 서로 다른 환자들 간의 또는 개별 환자에 대한 다른 위치들 간의 피부(skin) 층들 및 지방 두께의 변이로 인한) 근육 또는 기관 위에 놓인 층들에서의 흡수도 변화 및/또는 측정과 무관한 근육 및/또는 기관에서의 구조적 변이로 인한 스펙트럼 간섭에 의해 영향을 받게 될 수 있다.
근적외선광은 혈액 및 하부 조직에 존재하는 화학 종들에 대한 정보를 제공하도록 대상자의 스킨 및 뼈를 통과할 수 있다. 예를 들어, 동맥 헤모글로빈 산소 포화도를 측정하는 맥박 산소 측정기(pulse oximetry), 유비쿼터스 병원 모니터링 시스템은 2개-파장 NIRS를 기초로 한다. 화학적 데이터 분석(chemometrics)(즉, 복합 스펙트럼을 분석하는 통계-기반 방법들)과 조합하여, 다중-파장 NIRS는 혈액 및 조직에 존재하는 몇 가지 부가적인 분석물(analytes)의 비침범성 측정에 대한 플랫폼 기술을 제공할 수 있다. NIRS는 환자로부터 혈액 또는 조직 샘플을 제거할 필요 없이, 의학 분석물의 정확하고 연속적인 측정을 제공할 수 있다. 이런 기술 분야는 광섬유 다발을 통해 또는 직접적으로 피부 상에 근적외선광을 비추고 혈액 함유 근육으로부터 다시 반사되는 광의 스펙트럼을 측정하는 단계를 수반한다. 헤모글로빈 및 디옥시헤모글로빈에 의한 근적외선광 흡수는 다양한 조직 베드(beds)에서 산소 포화도를 측정하는데 이용되며, 종종 추가적인 산술 기술과 조합되는 다중-파장 분광법이 추가적 중요한 혈액 및 조직 분석물을 측정하기 위해 요구된다. 화학적 데이터 분석은 생물학적 조직과 같은 복합 배지(complex media)로부터 기록된 스펙트럼 반사율로부터 분석물 농도가 계산될 수 있도록 다중-파장 스펙트럼을 처리하는 통계-기반 기술을 제공하는 화학 분야이다.
화학적 데이터 분석은 샘플로부터 수집된 스펙트럼들의 관련 부분들과 해당 샘플의 분석물의 양 또는 농도 간의 산술 관계를 유추하는데 이용된다. 스펙트럼 과 화학적 농도 간의 관계는 환자 모니터로 프로그램될 수 있고 측정된 반사율 스펙트럼을 기초로 분석물 농도를 결정하는데 이용될 수 있는 "보정식(calibration equation)"으로 표현될 수 있다. 환자들로부터 수집된 스펙트럼들은 환자 모니터에 저장된 보정식(들)을 통해 처리될 수 있고, 이들 환자의 분석물 농도는 수집된 스펙트럼들 및 보정식들을 기초로 기록될 수 있다. 광학 반사율 기술들은 비침범성이기 때문에, 의학적 측정은 통상적으로 몇 초 정도로, 스펙트럼이 수집될 때마다 업데이트되어야 한다. 이러한 방법 사용의 타당성이 혈액 적혈구용적, 글루코스, 콜레스테롤, 전해질, 젖산염, 미오글로빈 포화, 근육 pH, 및 산소 분압(oxygen tension)("PO2")의 추정을 위해 동물들, 및 인체 대상자의 벤치(bench)에 대해 논증되었다.
보정식들이 화학적 데이터 분석을 사용하여 전개될 때, 적어도 2개의 데이터 세트가 수집된다. NIRS 스펙트럼들의 세트는 전체 생리학적 및 병리 생리학적 범위에 대한 분석물의 독립적인 신뢰성 있는 측정과 거의 동시적으로 기록된다. 예를 들어, 측정된 반사율 스펙트럼들로부터 혈액 적혈구용적을 결정하기 위해 보정식을 전개하는 것이 요구될 경우, 대상자로부터의 몇 개의 스펙트럼들이 이들 대상자로부터 취해진 혈액 샘플들과 비교되어 임상 실험실에서 적혈구용적에 대해 분석된다. 예를 들어 부분 최소 제곱("PLS") 회귀와 같은 화학적 데이터 분석은 스펙트럼 부분들 식별하고 측정된 적혈구용적과 상관시키는데 이용될 수 있다. 회귀 계수는 보정식을 발생시키는데 이용된다.
다음, 다른 환자들로부터 순차적인 반사율 스펙트럼이 수집될 때, 회귀 계수는 다른 환자들에 대한 NIRS-결정 적혈구용적 값을 생성하기 위해 다른 환자들의 스펙트럼과 조합될 수 있다. 간단한 선형 회귀를 보다는, 보정식을 유도하는데 PLS와 같은 화학적 데이터 분석 기술 사용에 따른 장점은 분석물 스펙트럼이 다른 흡수 종 및 산란 요소들(세포들 및 근섬유들 등)에 의해 악화될 때 스펙트럼들과 분석물들 간의 상호관계 설정시 PLS이 어뎁트(adept)된다는 것이다.
광범위한 기계 및 환경 조건 및 다양한 환자 특성에 따라 환자들에 대한 보정식을 정확하게 수행하기 위해, 보정 데이터 세트의 데이터는 가능한 광범위한 값을 포함해야 하며 전체 임상적으로 중요한 범위를 포함해야 한다. 또한 NIRS 스펙트럼들에 영향을 미칠 수 있는 다양한 환자 조건의 형태하에 데이터가 수집되는 것이 중요하다. 스펙트럼들에 영향을 줄 수 있는 조건들로는 온도 변화, 물 함량, 및 환자를 치료하는데 이용되는 간섭 화학제의 존재들이 포함된다. 이는 추후 대상자에 사용될 때 보정식이 정확해지게 보조하며, 이는 간섭제(interfering agent)의 작용이 보정식의 일부로서 모델링되기 때문이다.
의학적 치료를 위한 NIRS의 광범위한 분야는 근육 또는 표적 기관과 같은 표적 조직 위에 놓인 조직에서의 피검자간(inter-subject) 및 개인간(intra-subject) 변이 모두에 의해 방해된다. 부가적으로, NIRS 측정 기술은 피부 혈류량(skin blood flow)의 단기간 변화 또는 창상 치유(wound healing) 동안 피부 표면 및 텍스쳐(texture)의 장기간 변화로 인한 상기 측정 기술의 부정확한 성능에 의해 제한된다.
본 발명은 적어도 부분적으로, 분광계가 샘플로부터의 반사율 스펙트럼을 기록하기 위해 사용될 때, 샘플을 조명하는데 이용되는 광원과 반사된 광을 측정하는데 이용되는 검출기 간의 짧은 간격은 샘플의 표면과 비교적 근접해 있는 피쳐(features)에 민감한 스펙트럼들을 유도하는 반면 긴 광원-검출기 간의 간격은 표면 피쳐 및 샘플의 깊은곳에 놓인(예를 들어, 내부) 피쳐 모두에 민감한 스펙트럼들을 유도한다는 발견을 기초로 한다. 짧은 광원-검출기 간격으로 기록된 스펙트럼들에 대한 긴 광원-검출기 간격으로 기록된 스펙트럼들의 교정은 내부 깊은곳에 놓인 피쳐들의 스펙트럼들로부터 상부에 놓인 피쳐들의 스펙트럼 피쳐들을 제거할 수 있다. 또한 스펙트럼들은 해당 하부에 놓인 층들의 분석물의 측정과 관련되지 않는 내부 피쳐들의 광학적 산란 특성에서의 변화로 인해 야기되는 피쳐들을 제거하도록 교정될 수 있다.
스펙트럼들은 상이한 파장들의 광을 사용하여 기록될 수 있다. 예를 들어, 광원은 하나 이상의 근적외선, 적외선, 가시선, 자외선, 및 전자기 스펙트럼의 다른 영역들에 광을 제공할 수 있다.
제1 면에서, 본 발명의 피쳐 측정 시스템은, (a)광원; (b) 검출 시스템; (c) 광원으로부터의 광을 샘플로 전송하고 샘플로부터 반사된 광을 수신하여 검출 시스템으로 지향시키는 적어도 제1, 제2 및 제3 광 포트들의 세트; 및 (d)프로세서를 포함하며, 제1 포트와 제3 포트의 간격은 제1 검출 간격에 해당하며, 제2 포트와 제3 포트의 간격은 제2 검출 간격에 해당하며, 제1 검출 간격은 제2 검출 간격보다 크다. (i) 제1 및 제2 포트들은 전송 포트들이며 제3 포트는 수신 포트이거나, 또는 (ii) 제1 및 제2 포트들은 수신 포트들이고 제3 포트는 전송 포트이다. 검출 시스템은 제1 검출 간격에 해당하며 샘플 내의 내부 타겟과 내부 타겟 위에 놓인 피쳐 모두에 해당하는 정보를 포함하는 제1 데이터 세트, 및 제2 검출 간격에 해당하며 내부 타겟 위에 놓은 피쳐에 해당하는 정보를 포함하는 제2 데이터 세트를 생성한다. 프로세서는 내부 타겟을 나타내는 교정된 정보를 생성하기 위해 제1 및 제2 데이터 세트들을 이용하여 제1 데이터 세트로부터 상부에 놓인 피쳐의 정보 특성을 제거하도록 구성된다.
실시예들은 임의의 하기 피쳐를 포함할 수 있다.
적어도 제1, 제2 및 제3 포트들의 세트는 단일 프로브 상에 장착될 수 있다. 제2 검출 간격은 약 1mm 내지 약 5mm 사이, 예를 들면 약 1.5mm 내지 약 3.5mm 사이일 수 있다. 제1 검출 간격은 약 10mm 이상(예를 들어, 약 15mm 이상, 약 20mm 이상, 약 30mm 이상, 약 50mm 이상)일 수 있다. 시스템은 제1 또는 제2 전송 포트로부터의 광이 샘플을 조명하는지 여부를 제어하는 셔터 시스템을 포함할 수 있다.
프로브 헤드는 샘플로부터 열을 방산시키기 위한 열전도성 물질을 포함할 수 있다. 또한 시스템은 광 전송 포트들과 광 수신 포트들 사이에 열-전도성 브리지(bridge)를 더 포함할 수 있다.
광원은 전자기 스펙트럼의 근적외선 영역에 광을 제공할 수 있다. 광원은 백열 광원, 발광 다이오드, 레이저 다이오드 및 레이저 중 적어도 하나를 포함할 수 있다. 예를 들어, 광원은 발광 다이오드들의 어레이를 포함할 수 있다.
검출 시스템은 스펙트럼 검출 시스템일 수 있으며, 제1 및 제2 데이터 세트들은 제1 및 제2 스펙트럼 세트들을 포함할 수 있고, 프로세서는 내부 타겟을 나타내는 교정된 스펙트럼 정보를 생성하기 위해 제1 및 제2 스펙트럼 세트들을 이용하여 제1 스펙트럼 세트로부터 상부에 놓인 피쳐의 특정한 정보 특성을 제거할 수 있다. 스펙트럼 검출 시스템은 광을 수신하고 수신된 광으로부터의 스펙트럼 세트들을 발생시키도록 구성된 분광계를 포함할 수 있다. 선택적으로, 스펙트럼 검출 시스템은 제1 수신 포트로부터 광을 수신하고 제1 스펙트럼 세트를 생성하도록 구성된 제1 분광계, 및 제2 수신 포트로부터 광을 수신하고 제2 스펙트럼 세트를 생성하도록 구성된 제2 분광계를 포함할 수 있다.
프로세서는 그 내부의 해당 분석물과 관련되지 않은 내부 타겟의 광학적 산란 특성에서의 변화를 특징으로 하는 제1 스펙트럼 세트로부터 스펙트럼 정보를 제거하도록 구성될 수 있다. 프로세서는 그 내부의 해당 분석물과 관련되지 않은 내부 타겟의 광학적 산란 특성에서의 변화를 특징으로 하며 내부 타겟을 나타내는 교정된 스펙트럼 정보로부터 스펙트럼 정보를 제거하도록 구성될 수 있다. 프로세서는 식에 따라 제1 및 제2 스펙트럼 세트들을 이용하여 제1 스펙트럼 세트로부터 상부에 놓인 피쳐들의 스펙트럼 정보 특성을 제거하도록 구성되며, 여기서, 는 제1 스펙트럼 세트로부터의 스펙트럼이며, 는 제2 스펙트럼 세트로부터의 스펙트럼이며, w는 가중치(weight)이며, "T"는 매트릭스 전치 연산(matrix transpose operation)이며, 는 내부 타겟을 나타내는 교정된 스펙트럼 정보를 포함한다. 프로세서는 교정된 스펙트럼 정보를 생성하기 이전에 서로에 대해 제1 및 제2 스펙트럼 세트들이 정규화되도록 구성된다.
프로세서는 스펙트럼 정보를 제거하도록 구성될 수 있으며, 상기 스펙트럼 정보는 다수의 샘플로부터의 스펙트럼 세트로부터 결정된 주성분의 로딩 벡터들의 세트와 관련하여 제1 스펙트럼 세트를 직교화(orthogonalizing)함으로써 제1 스펙트럼 세트로부터 내부 타겟의 광학적 산란 특성의 변화를 특징으로 한다. 다수의 샘플은 선택된 범위 내에서 내부 타겟의 특성을 가질 수 있다. 예를 들어, 내부 타겟의 특성은 pH, 적혈구용적, 조직 산소화, 또는 다른 특성과 같은 분석물의 값일 수 있다. 상기 범위는 스펙트럼 분석 및/또는 교정이 용이하도록 선택될 수 있다. 예를 들어, pH에 대해 선택된 범위는 7.37±0.001 pH 유닛일 수 있다.
프로세서는 (a) 교정 스펙트럼의 주성분에 해당하는 로딩 벡터들의 세트를 결정하기 위해 교정 스펙트럼 세트에 대한 주성분 분석을 수행하는 단계; (b) 주성분 분석으로부터 하나 이상의 직교(orthogonalization) 팩터를 결정하는 단계; (c) 직교 팩터의 수와 같은 적어도 일차원을 갖는 로딩(loadings) 매트릭스를 형성하는 단계; 및 로딩 매트릭스를 기준으로 제1 스펙트럼 세트를 직교화하는 단계를 포함하는 단계들의 세트를 수행함으로써 제1 스펙트럼 세트를 직교화하도록 구성될 수 있다.
또 다른 면에서, 본 발명은 시스템에 의해 측정된 샘플 내에서 내부 타겟에 해당하는 정보를 교정하는 방법을 특징으로 하며, 상기 시스템은 광원, 검출 시스템, 및 광원으로부터의 광을 샘플로 전송하고 샘플로부터 반사된 광을 수신하여 검출 시스템으로 지향시키는 적어도 제1, 제2, 및 제3 광 포트들의 세트를 포함하며, 제1 포트와 제3 포트와의 간격은 제1 검출 간격에 해당하며 제2 포트와 제3 포트와의 간격은 제2 검출 간격에 해당하며, 제1 검출 간격은 제2 검출 간격보다 크며, (i) 제1 및 제2 포트들은 전송 포트들이고 제3 포트는 수신 포트이거나, 또는 (ii) 제1 및 제3 포트들은 수신 포트들이고 제3 포트는 전송 포트이다. 상기 방법은, (a) 하나 이상의 광 포트들의 세트로 샘플을 조명하는 단계; (b) 검출 시스템으로 반사된 광을 검출하는 단계; (c) 제1 검출 간격에 해당하며 샘플 내의 내부 타겟 및 내부 타겟 위에 놓인 피쳐 모두에 해당하는 정보를 포함하는 제1 데이터 세트, 및 제2 검출 간격에 해당하며 내부 타겟 위에 놓인 피쳐에 해당하는 정보를 포함하는 제2 데이터 세트를 생성하는 단계; 및 (d) 내부 타겟을 나타내는 교정된 정보를 생성하기 위해 제1 및 제2 데이터 세트들을 사용하여 제1 데이터 세트로부터 상부에 놓인 피쳐의 정보 특성을 제거하는 단계를 포함한다.
방법들의 실시예들은 하기 임의의 피쳐들을 포함할 수 있다.
검출 시스템은 스펙트럼 검출 시스템일 수 있으며, 제1 및 제2 데이터 세트들은 제2 및 제2 스펙트럼 세트들일 수 있고, 제1 데이터 세트로부터 상부에 놓인 피쳐의 스펙트럼 정보 특성을 제거하는 단계를 포함한다. 제1 스펙트럼 세트로부터의 샘플의 상부에 놓인 특성의 스펙트럼 정보 특성을 제거하는 단계는 식에 따라 제1 및 제2 스펙트럼 세트들을 조합하는 단계를 포함할 수 있으며, 여기서, 는 제1 스펙트럼 세트로부터의 스펙트럼이며, 는 제2 스펙트럼 세트로부터의 스펙트럼이며, w는 가중치이며, "T"는 매트릭스 전치 연산(matrix transpose operation)이며, 는 내부 타겟을 나타내는 교정된 스펙트럼 정보를 포함한다.
상기 방법은 교정된 스펙트럼 정보를 생성하기 이전에 서로에 대해 제1 및 제2 스펙트럼 세트들을 정규화하는 단계를 더 포함할 수 있다. 스펙트럼 세트들을 정규화하는 단계는 제1 및 제2 스펙트럼 세트들 사이에 다항식 적합도(polynomial fit)를 적용하는 단계를 포함할 수 있다. 다항식 적합도에 사용되는 계수는 하나 이상의 반사율 표준으로부터 기록된 제1 및 제2 스펙트럼 세트들로부터 유추될 수 있다.
상기 방법은 그 내부에 해당 분석물과 관계없는 내부 타겟의 광학 특성 변화의 스펙트럼 정보 특성을 제거하기 위해 제1 스펙트럼 세트를 처리하는 단계를 포함할 수 있다. 상기 방법은 그 내부에 해당 분석물과 관계없는 내부 타겟의 광학적 산란 특성 변화의 스펙트럼 정보를 제거하기 위해 내부 타겟을 나타내는 교정된 스펙트럼 정보를 처리하는 단계를 포함할 수 있다. 그 내부에 해당 분석물과 관계없는 내부 타겟의 광학 특성 변화의 스펙트럼 정보 특성을 제거하는 단계는 교정 스펙트럼 세트로부터 결정된 주성분의 로딩 팩터들의 세트를 기준으로 제1 스펙트럼 세트를 직교화하는 단계를 포함할 수 있다.
로딩 벡터들의 세트를 기준으로 제1 스펙트럼 세트를 직교화하는 단계는 (a) 교정 스펙트럼들의 세트의 주성분에 해당하는 로딩 벡터들의 세트를 결정하기 위해 교정 스펙트럼들의 세트에 대한 주성분 분석을 수행하는 단계; (b) 주성분 분석으로부터 하나 이상의 직교화 팩터를 결정하는 단계; (c) 직교화 팩터의 수와 같은 적어도 일차원을 가지는 로딩 매트릭스를 형성하는 단계; 및 (d) 로딩 매트릭스를 기준으로 제1 스펙트럼 세트를 직교화하는 단계를 포함한다.
또 다른 면에서, 본 발명은 (a) 본 발명에서 개시되는 방법에 따라 동물로부터 반사율 측정을 기초로 교정된 스펙트럼 세트를 생성하는 단계; (b) 동물의 분석 물질 측정과 동물로부터 교정된 스펙트럼 세트 간의 관계를 기초로 하나 이상의 보정식을 전개하는 단계; (c) 본 발명에서 개시되는 방법에 따라 대상자로부터 반사율 측정을 기초로 교정된 스펙트럼 세트를 생성하는 단계; 및 (d) 하나 이상의 보정식 및 대상자로부터 교정된 스펙트럼 세트를 기초로 대상자의 분석물의 값을 결정하는 단계에 의해, 대상자의 분석물을 측정하는 방법을 특징으로 한다. 대상자는 예를 들어 사람일 수 있다. 교정된 스펙트럼 세트는 동물로부터 반사율 측정을 기초로 생성될 수 있으며 대상자는 분석물을 포함하는 내부 타겟의 광학 특성 변화의 스펙트럼 정보 특성을 제거하도록 처리된다.
본 발명은 (a) 본 발명에 개시되는 방법에 따라 대상자의 제1 바디 지점으로부터 반사율 측정을 기초로 교정된 스펙트럼 세트를 생성하는 단계; (b) 제1 바디 지점에서 분석물의 측정과 제1 바디 지점으로부터 교정된 스펙트럼 세트 간의 관계를 기초로 하나 이상의 보정식을 전개하는 단계; (c) 본 발명에 개시된 방법에 따라 대상자의 제2 바디 지점으로부터 반사율 측정을 기초로 교정된 스펙트럼 세트를 생성하는 단계; 및 (d) 하나 이상의 보정식 및 제2 바디 지점으로부터 교정된 스펙트럼 세트를 기초로 제2 바디 지점에서 분석물의 값을 결정하는 단계에 의해 대상자의 분석물을 측정하는 방법을 특징으로 한다. 대상자는 사람일 수 있으며, 제1 바디 지점은 팔일 수 있으며, 제2 바디 지점은 다리일 수 있다. 제1 및 제2 바디 지점들로부터 반사율 측정을 기초로 생성된 교정된 스펙트럼 세트들은 분석물을 포함하는 내부 타겟의 광학 특성 변화의 스펙트럼 정보 특성을 제거하도록 처리될 수 있다.
별다른 정의가 없다면, 본 발명에 사용되는 모든 기술적 용어 및 과학적 용어는 본 발명이 속하는 기술분야의 사람들에게 통상적으로 인식되는 것과 동일한 의미를 갖는다. 본 발명에 개시된 것과 유사한 또는 등가의 방법 및 물질들이 본 발명을 실행 또는 테스트하는데 이용될 수 있지만, 적합한 방법 및 물질이 하기에 개시된다. 본 명세서에서 언급되는 모든 공보, 특허 출원, 특허 및 다른 참조문들은 본 명세서에서 참조된다. 모순되는 경우, 정의를 포함하여 본 명세서가 제어될 수 있다. 또한, 물질들, 방법들 및 예들은 도시를 위한 것으로 본 발명을 제한하고자 하는 것은 아니다.
본 발명의 다른 특징 및 장점들은 하기 첨부되는 상세한 설명 및 특허청구항들을 통해 명확해질 것이다.
도 1은 본 명세서에 개시된 분광계 시스템의 개략도,
도 2는 도 1의 분광계 시스템의 광학대 및 선택된 부품들의 상부 개략도,
도 3은 백열 램프의 개략도,
도 4A는 샘플로 광을 전달하는 2개의 광섬유 케이블 및 샘플로부터 분광기로 반사된 광을 전달하는 광섬유 케이블의 개략적 배치도,
도 4B는 샘플로 광을 반사하는 광섬유 케이블 및 샘플로부터 분광기로 반사된 광을 전달하는 광섬유 케이블 내의 섬유들의 개략적 배치 단부도,
도 5A는 샘플로 광을 전달하고 샘플로부터 반사된 광을 수신하는 프로브 헤드의 실시예의 개략적 단면도,
도 5B는 통합된 광원들을 갖춘 프로브 헤드의 실시예의 개략적 하부도,
도 6A는 도 5에 도시된 프로브 헤드를 유지하고 차단하는 광 차폐물의 개략적 상부도,
도 6B는 도 6A의 과 차폐물의 선택적 실시예의 개략적 상부도,
도 7은 도 1의 분광계 시스템에 사용되는 셔터의 개략도,
도 8은 도 7에 도시된 셔터를 제어하는 전기 회로의 회로도,
도 9A-9E는 인체 대상자로부터 측정된 반사율 스펙트럼으로부터 상부에 놓인 층들로 인한 스펙트럼 간섭을 제거하기 위한 교정 결과를 나타내는 그래프,
도 10A-10E는 또 다른 인체 대상자로부터 측정된 반사율 스펙트럼으로부터 상부에 놓인 층들로 인한 스펙트럼 간섭을 제거하기 위한 교정 결과를 나타내는 그래프,
도 11은 교정되지 않은 스펙트럼 데이터에 대해 측정된 혈액 적혈구용적 대 최대 헴(heme) 흡수도의 값들을 나타내는 그래프,
도 12는 상부 피부 및 지방층들로 인한 작용에 대해 교정된 스펙트럼 데이터에 대해 측정된 혈액 적혈구용적 대 최대 헴 흡수도의 값들을 나타내는 그래프,
도 13은 근적외선 반사율 분광계 시스템의 실시예의 이미지,
도 14는 상이한 인체 대상자들로부터 교정되지 않은 스펙트럼 흡수도 측정치들의 세트를 나타내는 그래프,
도 15는 PCA 로딩 교정 알고리즘을 적용한 이후, 상이한 인체 대상자들로부터의 스펙트럼 흡수도 측정치 세트를 나타내는 그래프,
도 16은 교정되지 않은 스펙트럼 흡수도 데이터를 기초한 pH의 PLS 모델에 대해 측정된 pH 대 예상 pH를 나타내는 그래프,
도 17은 PCA 로딩 교정 방법을 사용하여 교정된 스펙트럼 흡수도 데이터에 기초한 pH의 PLS 모델 대해 측정된 pH 대 예상 pH를 나타내는 그래프,
도 18은 다이 ADS780WS에 대한 수성 흡수 스펙트럼을 나타내는 그래프,
도 19는 조직-형 가상 샘플들의 세트에 대한 짧은 간격 흡수 스펙트럼을 나타내는 그래프,
도 20은 조직-형 가상 샘플들의 세트에 대한 짧은 간격 흡수 스펙트럼을 나타내는 그래프,
도 21은 짧은-간격 교정이 적용된 이후, 조직-형 가상 샘플들의 세트에 대한 긴 간격 흡수 스펙트럼을 나타내는 그래프,
도 22는 조직-형 가상 샘플들의 세트로부터 교정되지 않은 스펙트럼 흡수도 측정치를 나타내는 그래프,
도 23은 짧은-간격 교정이 적용된 이후, 조직-형 가상 샘플들의 세트로부터의 스펙트럼 흡수도 측정치를 나타내는 그래프,
도 24는 SNV 스케일링 교정이 적용된 이후, 조직-형 가상 샘플들의 세트로부터의 스펙트럼 흡수도 측정치를 나타내는 그래프,
도 25는 PCA 로딩 교정이 적용된 이후, 조직-형 가상 샘플들의 세트로부터 스펙트럼 흡수도 측정치를 나타내는 그래프,
도 26은 짧은-간격 교정 및 SNV 스케일링 교정이 적용된 이후 조직-형 가상 샘플들의 세트로부터 스펙트럼 흡수도 측정치를 나타내는 그래프,
도 27은 짧은-간격 교정, SNV 스케일링 교정, 및 PCA 로딩 교정이 적용된 이후 조직-형 가상 샘플들로부터의 스펙트럼 흡수도 측정치를 나타내는 그래프,
도 28은 교정되지 않은 스펙트럼 흡수도 데이터를 기초로 다이 농도의 PLS 모델에 대한 예상 결과를 나타내는 그래프,
도 29는 3개의 상이한 교정 방법들을 사용하여 교정된 스펙트럼 흡수도 데이터를 기초로 다이 농도의 PLS 모델에 대한 예상 결과를 나타내는 그래프,
도 30은 유사한 pH 레벨에서 상이한 대상자들로부터 기록되고 짧은-간격 및 SNV 스케일링 교정 방법을 사용하여 교정된 스펙트럼 흡수도 데이터를 나타내는 그래프,
도 31은 PCA 로딩 교정 방법을 사용하여 교정된, 도 30의 스펙트럼 흡수도 데이터를 나타내는 그래프,
도 32는 상이한 pH 값들에서 상이한 대상자들로부터 기록되고 짧은-간격 및 SNV 스케일링 교정 방법을 사용하여 교정되는 스펙트럼 흡수도 데이터를 나타내는 그래프,
도 33은 PCA 로딩 교정 방법을 이용하여 교정된, 도 32의 스펙트럼 흡수도 데이터를 나타내는 그래프.
다양한 도면에 있어 유사한 참조 부호는 동일한 부재를 나타낸다.
일반적 방법론
본 명세서에서 개시되는 바와 같이, 소정의 산술 알고리즘을 수행하도록 구성 및 프로그램된 관련 프로세서 및 새로운 광섬유 센서는 혈액 및 조직 화학작용(chemistry)의 비침범성 측정을 위한 NIRS의 응용성을 확장시키기 위해 사용된다. 센서는 근육 조직 및/또는 환자의 기관 조직으로부터의 산란과 같이, 해당 조직 상부에 놓이고 이들 조직들로부터의 측정된 신호들을 복잡하게 하는 피부 및 지방과 같이 해당되지 않는 하나 이상의 조직의 간섭 스펙트럼 영향을 제거하도록 설계되고 이용되어, 화학적 분석 데이터-기반 보정식의 보다 큰 보편화를 허용한다. 특히, 센서는 환자로부터 산란 및 반사된 광을 검출하는 검출부 및 검출부로부터 상이한 거리에 위치되는 적어도 2개의 조명부를 포함한다. 검출부와 근접한 조명부로부터의 광은 주로 상부 지방 및 피부 층들로 인한 반사율 스펙트럼의 원인이 되는 반면, 검출부와 보다 거리를 두고 있는 조명부로부터의 광은 상부 피부 및 지방층들 및 보다 깊은 근육 및/또는 기관층들로부터의 반사 조합으로 인한 반사율 스펙트럼의 원인이 된다. 2개의 스펙트럼 및 보편화된 화학적 데이터 분석-기반 보정식의 정보는 이를 테면, 하부 근육 및/또는 기관층과 같이 해당 조직에 대한 화학적 정보를 추출하는데 이용될 수 있다.
또한 센서는 해당 조직에서 샘플-대-샘플 구조 변형으로 인해 야기되는 간섭 스펙트럼 영향력을 감소 및/또는 제거하는데 이용될 수 있다. 예를 들어, 센서는 피부 및 지방층들 아래에 놓인 하나 이상의 근육 조직층들에서 특정 분석물을 측정하는데 이용될 수 있다. 측정된 반사율 스펙트럼으로부터 피부 및 지방층들의 스펙트럼 영향력을 제거한 이후, 근육 조직의 광학 특성의 변화로 인해 야기되는 스펙트럼 영향력을 제거하기 위해 추가의 단계들이 센서에 의해 수행될 수 있다. 예를 들어, 근육 조직의 광학 성질은 표면 텍스쳐, 및/또는 모세관 밀도, 및/또는 섬유 구조물, 및/또는 근육 조직의 다른 구조적 성질에 따라 변할 수 있다. 통상적으로 해당 조직의 광학 성질 변화는 조직의 광학적 산란 계수에 영향을 미친다.
교정된 반사율 스펙트럼에 기초한 보정식을 보편화시킴으로써, 센서가 교정 전개를 위해 사용되는 것과 상이한 근육 또는 다른 조직 위치에 위치될 때, 센서는 정확한 측정을 수행하는데 이용될 수 있고, 병리생리학의 동물 모델들로부터 전개된 보정식들이 임상적으로 허용가능한 결과에 따라 인체 대상자들에 적용될 수 있다. 또한 상기 방법은 피부 혈류 및 창상 치유 동안 발생하는 표면 변화와 같이, 스펙트럼을 변화시키는 환자 조건의 변화를 위한 지속적인 교정을 위해 임상 측정 동안 적용될 수 있다.
본 명세서에 개시되는 새로운 장치 및 기술들은 하부에 놓인 근육 및/또는 기관들로부터 측정된 스펙트럼에 대해 피부 및 지방과 같은 하부 조직으로부터의 스펙트럼 간섭을 감소시키는 것을 목표로 한다. 성공적으로 구현될 때, 이들 장치 및 기술을 이용하여 전개된 보정식은 상부에 놓인 층(들)의 광학 성질과 상관없이, 거의 임의의 해부 위치로부터 습득된 스펙트럼에 적용될 수 있다. 또한 새로운 장치 및 기술들은 해당 조직 내에서 특정 분석 물질의 측정에 대해 교정되지 않은 해당 조직의 구조적 변형으로부터 스펙트럼 간섭을 감소시키는 것을 목표로 한다. 예를 들어, 해당 조직의 광학 성질에 영향을 미치는 변형과 같이, 해당 조직에서의 구조적 변형에 대해 교정되는 스펙트럼을 기초로 전개된 보정식은 단일 측정 대상자 상의 상이한 측정 영역, 및/또는 상이한 측정 대상자들에 적용될 수 있다. 예를 들어, 얇은 지방 및 피부층을 가지는 환자의 팔에서 수행되는 측정을 기초로 전개된 보정식은 두꺼운 지방 및 피부층을 가지는 환자의 다리에서 교정된 스펙트럼에 적용될 수 있다.
강력한 광원 및 감응(sensitive) 검출기를 이용함으로써, 본 명세서에 개시된 장치 및 기술들은 상부 피부, 지방 및 근육 층들로부터 스펙트럼 간섭을 감소시킴으로써 내부 기관들로부터 그리고 내부 기관 조직들의 구조적 변형으로부터 정확한 스펙트럼들이 수집되게 할 수 있다. 새로운 방안의 또 다른 장점은 피부 혈류 및 표면 텍스쳐에서의 변형과 같은 환자 상태 변화를 지속적으로 보상하는 능력에 있다. 하부 층들의 스펙트럼으로부터 상부 층들로부터의 스펙트럼 간섭을 제거함으로써, 상부층 스펙트럼의 변형은 반사율 스펙트럼으로부터 얻어진 하부층에 대한 측정된 정보에서의 약간의 변형을 야기시킬 수 있다. 해당 조직(예를 들어, 하부 층들)에서의 구조적 변형으로부터 스펙트럼 간섭을 제거함으로써, 해당 조직의 구조 변형은 해당 조직의 선택된 분석물에 대해 측정된 정보에 대해 비교적 작은 변형만을 제공한다. 이러한 스펙트럼 간섭 교정은 환자들로부터 중요한 혈액 및 조직 화학작용 파라미터의 보다 정확한 검출을 허용한다.
생체내에서의 교정은 측정된 분석물의 변형을 가지며 장치 및 기술들의 추가적인 적용시 예상되는 동일한 또는 유사한 병리생리학을 제공하는 환자들에 대한 액세스를 요구한다. 때로, 충분한 수의 대상자들에 대한 액세스를 얻기는 어려우며 심지어 이를 이용가능하더라도, 변형은 모델링되고 측정되는 파라미터에 대한 전체 병리생리학적 범위를 포함하도록 충분히 크지 않을 수 있다. 또 다른 문제는 새로운 처리 방법들로부터 잠재적인 스펙트럼 간섭을 어떻게 통합시키는지에 대한 방법에 있다. 이를 테면, 충격(shock)으로부터 환자의 유도 심폐소생술(resuscitation)을 돕기 위해 근육 pH를 측정하는 방법을 전개할 때, 환자가 쇼크 상태에 있을 때 사용되는 새로운 치료제에 대한 근육 pH를 검출하는데 이용되는 보정식을 업데이트할 필요가 있다. 그러나, 업데이트된 보정식을 전개하기 위해 인체 테스트 대상자를 의도적으로 쇼크상태로 설정하는 것은 불가능하다. 의학적 파라미터를 광범위하게 확대시키고 새로운 조건 및 약품들에 대해 변경될 수 있는 강건한(robust) 보정식들에 대한 우수한 방법은 동물들에 대한 보정식을 전개하고 이를 인체에 직접 전가할 수 있다. 동물들을 사용함으로써 이를 테면 심각한 충격에 의해 야기되는 분석물 값들에서의 변형을 관찰하는 것이 가능하다. 이는 위급하게 아픈 사람들에게 사용되기 이전에 이를 적용하기 위한 센서 확인을 위해 다수 의 동물들에 대해 수행될 수 있다. 또한, 일부 분석물은 임상 셋팅시 신뢰성있게 변경되는 것이 어렵다. 그러나, 본 명세서에서 개시된 방법들은 동물들에 대해 전개된 보정식이 인체 대상자들에 대한 사용을 위해 성공적으로 전가되도록 허용한다. 일단 상부에 놓인 조직층들의 스펙트럼 영향력이 제거되면, 돼지와 같은 동물들의 근육 스펙트럼은 인체 대상자들과 유사하다. 인체와 동물 근육 구조에서의 스펙트럼 차는 이들 변형을 제거하는 방법을 사용하여 교정될 수 있다. 돼지 근육에서 유도된 보정식은 인체 대상자에 사용될 수 있다.
전체 시스템
도 1에 도시된 것처럼, 시스템으로부터 원격적으로 위치된 샘플(102)로부터 반사율 스펙트럼의 측정을 위한 휴대용, 광섬유-기반 분광 시스템(100)은 램프(104), 램프용 전원장치(106), 광학대(optical bench)(108), 셔터 시스템(110), 셔터 시스템용 구동기(112), 분광기(114), 광섬유 케이블(116) 및 컴퓨터(118)를 포함한다. 램프로부터의 광은 광학대(106) 내의 광학기에 의해 조작되며 셔터 구동기(112)에 의해 구동되는 셔터 시스템(110)에 의해 제어될 수 있다. 광은 셔터 시스템(110)에 의해 선택적으로 샘플을 조명하기 위해 샘플(102)로 광을 유도하는 제1 광섬유 케이블(116a) 또는 제2 광섬유 케이블(116d) 속으로 통과될 수 있다.
광이 광섬유 케이블(116a 또는 116d)에서 샘플로 유도될 때, 광은 샘플(102)로부터 반사되고 샘플(102)로부터 분광기(114)로 반사된 광을 유도하는 광섬유 케이블(116c)의 제3 부분에 의해 수집된다. 반사된 광은 샘플(102)에 대한 정보를 수집하기 위해 분광기(114)에 의해 분석된다.
분광기(114)는 컴퓨터 제어에 의해 동작될 수 있는 상업적으로 휴대가능한 분광기일 수 있다. 예를 들어, 500-1000nm의 파장 범위에서의 동작을 위해 최적화된 격자(grating)를 가지는 오션 옵틱스(Ocean Optics) USB2000 분광기가 사용될 수 있다. 분광 검출기는 2048 엘리먼트 쉘로우-웰 리니어 CCD-어레이일 수 있다. 분광기에는 해상도를 증가시키기 위한 200 미크론 와이드 슬릿, 검출기에서 광 수집 효율을 증가시키기 위한 수집 렌즈, 및 475nm 미만의 파장을 갖는 광이 검출기에 도달하는 것을 차단하는 장대역 필터(long pass filter)가 장착될 수 있다. USB2000 분광기는 예를 들어 USB 또는 RS232포트를 통해 컴퓨터(118)과 접속된다.
시스템(100)은 셔터 구동기, 분광기(114)를 제어하고 분광기로부터의 데이터를 처리, 저장 및 디스플레이하기 위한 온-보드 컴퓨터(118)를 더 포함할 수 있다.
도 2에 도시된 것처럼, 광학대(108)는 시스템의 몇 가지 주요한 광학 부품을 포함한다. 조명 램프(104)는 샘플을 조명하기 위해 광을 제공한다. 제1 광학적 접속기(212)는 샘플(102)을 조명하기 위해 광을 운반하는 제1 광섬유 케이블(116a)과 광을 접속시킨다. 제2 광학적 접속기(214)는 샘플(102)을 조명하기 위해 광을 운반하는 제2 광섬유 케이블(116d)과 광을 접속시킨다. 셔터(250)는 램프 광에 의해 제1 광섬유 케이블(116a)이 조명되는지 또는 제2 광섬유 케이블(116d)이 조명되는지 여부를 선택할 수 있다. 광학대(108)는 반사율 분광 측정 시스템으로서 시스템(100)의 정확도 및 재현성을 강화시키기 위해 상기 언급된 광학 부품들의 적절한 배치를 설정하고 유지하는데 이용된다. 광학대(108)는 알루미늄으로 제조될 수 있으며, 이는 알루미늄이 열 방사(heat dissipation)를 조장하는 높은 열전도성을 가지며 톨러런스(tolerance)에 근접하게 쉽게 기계가공되며 시스템(100)의 부품들에 대한 열적 스트레스 및 변형(distortion)을 최소화시키기 때문이다.
램프(104)는 램프의 신속한 램프-업 및 안정한 동작을 허용하도록 특정하게 설계된 전원장치(106)에 의해 구동되는 백색 광원(이를 테면, 웰치 알린(Welch Allyn) 8106-001 벌브(bulb)일 수 있다. 램프(104)는 연속파("cw") 광원 또는 펄스형 광원일 수 있다. 램프(104)는 자체 기계가공된 반사기 내에 고정되어, 필요시 비교적 쉽게 교체될 수 있고, 광학대의 설계를 통해 광학적 배열이 확보된다. 램프는 광섬유 케이블(116a, 116d)을 중심으로 정확하게 위치되는 것을 보증하는 기계적 정지부(mechanical stop)에 위치된다. 램프(104)로부터의 광은 후면 반사기(220)(예를 들어, 타원 반사기)에 의해 광학대(108)의 중심축 아래로 집중될 수 있다.
일반적인 램프 구성이 도 3에 도시되며, 투명 벌브(304) 내에 전기적 저항성 필라멘트(302)를 포함하는 백열 광원(300)이 도시된다. 일반적으로 필라멘트(302)는 텅스텐으로 구성된다. 벌브(304)는 유리, 석영 또는 다른 물질로 구성될 수 있으며 할로겐 가스, 불활성 가스 또는 가스들의 혼합물로 충진될 수 있다. 전류는 광원의 베이스(310)에 전기적으로 접속되는 전기적으로 전도성인 리드 와이어(308)를 통해 전원장치(306)로부터 필라멘트(302)로 공급된다. 전류는 필라멘트가 흑체로서 방사되게 한다. 전원장치(306)는 직류(DC) 또는 교류(AC)를 공급할 수 있다. 벌브로부터 방출되는 일정한 스펙트럼 및 램프(104)의 안정한 동작을 보증하기 위해, 필라멘트는 필라멘트의 온도를 실질적으로 일정하게 유지하도록 필라멘트에 전류를 공급하는 전기 회로에 의해 구동되어, 안정한 흑체 방사 스펙트럼이 벌브로부터 방출된다.
광섬유 케이블 시스템
다시 도 1을 참조로, 광원(104)으로부터의 광은 샘플(102)의 전자기 반사율 스펙트럼을 여기시키는데 이용될 수 있다. 샘플을 조명하고 샘플을 광학적으로 여기시키기 위해 광은 광섬유 케이블(116a 및/또는 116d)에서 광원(104)으로부터 샘플(102)로 향한다. 샘플(102)로부터 반사된 광은 광섬유 케이블(116c)에서 샘플로부터 샘플(102)의 반사율 스펙트럼을 측정하는 분광기(114)로 수집 및 전달될 수 있다. 케이블(116a)의 조명 광은 케이블을 벗어나 샘플로부터 반사된 광을 수집하고 분석을 위해 분광기(11)로 반사된 광을 유도하는 케이블(116c)에 대한 입구로부터 제1 간격(예를 들어, 약 32mm)으로 샘플(102)로 입사된다. 케이블(116d)의 조명 광은 케이블을 벗어나 제1 간격 보다 작은 제2 간격(예를 들어, 약 2.5mm)으로 입구로부터 케이블(116c)로 샘플(102) 상에 입사된다. 샘플이 케이블(116a) 및 케이블(116d)로부터 광에 의해 조명될 때 수집되는 샘플로부터의 스펙트럼들은 하기 설명되는 바와 같이, 샘플에 대한 상세한 정보를 추출하는데 이용될 수 있다.
도 2를 참조로, 샘플(102)을 조명하는 광섬유 조명 케이블(116a)은 램프(104)로부터 방출되는 광의 초점(focal point)에 있는 광섬유 케이블(116a) 단부 와 함께 램프(104)의 정면에서 직접 위치설정될 수 있다. 케이블(116a)은 시스템 사용 이전에 설정위치로 삽입되며, 기계적 클릭 정지부(click stop)는 케이블(116a)이 램프(104)와 반사기(220)를 기준으로 적절히 위치설정되고 고정되게 한다.
샘플(102)을 조명하는데 이용되는 제2 광섬유 케이블(116d)은 예를 들어, 집중된 빔 축을 기준으로 약 5도 내지 약 90도 사이(예를 들어, 약 10도 내지 약 60도 사이, 약 15도 내지 약 35도 사이)의 반사기(220)의 광학축에 대한 각도로 광학대에 있는 포트(214) 속으로 나사삽입된다(threaded). 집중된 빔 축에 대한 각도로 포트(214) 속으로의 케이블(116d) 배치는 케이블(116d)의 온-축 위치와 비교할 때, 케이블(116d)로 진입하는 광 세기를 감소시킨다. 그러나, 케이블(116d)은케이블(116d) 보다 검출 케이블(116c)로 보다 근접한 간격을 두고 샘플로 광을 전달하기 때문에, 샘플에 의해 반사되고 검출 케이블(116c)에 수집된 광의 양은 샘플이 케이블(116a)로부터 보다 높은 세기의 광 또는 케이블(116d)에서 보다 낮은 세기의 광으로 조명되는지 여부에 따라 유사할 수 있다.
도 4A에 도시된 것처럼, 광섬유 케이블은 상이한 섬유 다발(116a, 116c, 116d)을 포함할 수 있다. 샘플 다발(116a 또는 116d)을 보유하는 케이블은 분광기(114) 및 광원(104)을 보유하는 유닛(100) 외부에 리턴 다발(116c)을 보유하는 케이블을 갖춘 공통 보호 시쓰(sheath)에 포함될 수 있다. 샘플 다발(116a, 116c, 116d)은 시스템(100)의 하우징 외부에서 서로 수집될 수 있고, 상기 시스템(100)은 하우징으로부터 하향 약 8-12인치의 분광기(114) 및 램프(104)를 포함한다. 다 발(116a, 116c, 116d)을 포함하는 케이블은 샘플(102) 상에서의 반사율 측정을 수행하기 위해 샘플(102)에 위치될 수 있는 프로브 헤드(400)와 분광기(114) 및 램프(104)를 접속시킨다.
도 4B에 도시된 것처럼, 케이블 시스템의 샘플 단부에서, 프로브 헤드(400)는 샘플(102)의 표면과 직교하며 하우징(400)의 정면과 직교하도록 배향된 조명 다발(116a, 116d)을 포함한다. 하우징(400)은 조명 섬유 다발(116a), 조명 섬유 다발(116d), 및 검출 섬유 다발(116c)의 단부들을 보유할 수 있다. 섬유 다발(116a)은 약 0.66의 개구수(numerical aperture, NA)를 갖는 약 2666, 50㎛ 유리 섬유들을 포함할 수 있다. 리턴 케이블(116c)에서 섬유들의 검출 다발은 샘플로부터 분광기(114)로 반사된 광을 복귀시키며 일 실시예에서는 약 0.66의 NA를 갖는 109, 50㎛ 유리 섬유를 포함할 수 있다. 섬유들의 샘플 단부에서, 섬유들은 샘플(102)과 직교하게 배향된다. 광섬유 케이블의 길이를 따라, 광원(104)과 한쪽 단부에 있는 분광기(114) 및 다른쪽 단부에 있는 샘플(102) 사이에서, 샘플로 광을 전달하는 샘플 조명 다발(116a)은 리턴 다발(116c)로부터 불투명 테이프 또는 플라스틱 시쓰 또는 튜브와 같이, 불투명한 물질로 광학적으로 차폐되어, 조명 다발(116a 및/또는 116d)로부터 누설되는 임의의 광은 리턴 다발(116c)과 결합되지 않는다. 램프(104) 및 샘플 섬유 다발(116a, 116d) 사이의 광학적 결합을 개선시키기 위해, 광원의 0.42 NA를 섬유의 0.66 NA로 변환시키기 위해 테이퍼링된 NA 컨버터가 샘플 케이블 다발(116a, 116d)의 단부에 위치될 수 있다. 이는 섬유들로의 수집 효율을 약 15% 만큼 증가시킨다.
분광기(114)와 적절히 접속되는 것을 보증할 필요가 있기 때문에 리턴 섬유 다발의 NA를 0.22로 감소시키기 위해, 600㎛ 직경 용융 실리카 로드(rod)는 섬유 다발(116c)의 단부에 위치될 수 있다. 분광기(114)로 미광(stray light)이 진입하는 것을 방지하기 위해, 블랙의 광-흡수 에폭시 또는 다른 물질이 실리카 로드를 둘러싸는데 이용될 수 있다.
도 5에 도시된 것처럼, 광은 램프(104) 및 분광기(114)를 광 다발(116a 및/또는 116d)에서 광을 샘플(102)로 전달하는 프로브 헤드(400)에 수용하는 유닛(502)으로부터 전달될 수 있고, 샘플로부터 산란된 광은 수집되어 섬유 다발(116c)에서 분광기(114)로 다시 라우팅될 수 있다. 다발(116a, 116c, 116d)은 하우징 유닛(502)과 프로브 헤드(400) 사이로 연장되는 단일 케이블에 포함될 수 있으며, 케이블은 샘플 또는 환자로부터 데이터를 수집하도록 액세스가 편리하도록 수 미터로 길 수 있다. 광 조명 다발(116a, 116d)과 광 검출 다발(116c) 간의 혼선을 최소화시키기 위해, 램프(104)로부터 샘플(102)로 조명 광을 전달하는 다발(116a, 116d)은 임의의 누설된 광이 광 리턴 다발(116c)과 결합되지 않도록 블랙 테이프 또는 다른 불투명 물질로 감길 수 있다.
도 5에 도시된 것처럼, 프로브 헤드(400)는 샘플로부터 광을 수신하는 검출 광 포트(508)로부터 (SD)2 간격 만큼 공간적으로 이격된 샘플로 광을 전달하는 조명 광 포트(506)를 가질 수 있다. 섬유 다발(116a)은 프로브 헤드(400)로 수평으로 결합되며, 다발(116a)로부터의 광은 프로브 헤드 내에서 45도 미러(510)로부터 반 사되며 광 포트(506)로부터 샘플(102)을 향해 수직으로 지향될 수 있다. 유사하게, 샘플(102)로부터 산란된 광은 광 포트(508)에 의해 수집되어 미러(510)에 의해 검출기 섬유 다발(116c)로 반사될 수 있다. 선택적으로, 섬유 다발(116a, 116c)은 수평으로 프로브 헤드(400)로 진입되어 각각 광 포트(506, 508)와 직접적으로 결합될 수 있도록 수직 방향으로 90도 구부러진다.
조명 광 포트(506)는 하우징 유닛(502)으로부터 샘플(102)로 광을 지향시키기 위해 전체 0.66 NA를 가지는 50㎛ 유리 섬유의 3.5mm 다발을 포함할 수 있다. 샘플(102)은 상부층(예를 들어, 피부층)(102s), 상부에 놓인 층(예를 들어, 지방층)(102f), 및 하부에 놓인층(예를 들어, 근육층)(102m)을 포함할 수 있으며, 광은 임의의 또는 모든 층들로부터 검출기 섬유 다발(116c)로 반사될 수 있다. 다발(116c)에 결합되는 검출 광 포트(508)는 조명 광 포트(506)로부터 약 10mm 내지 약 1000mm 사이(예를 들면, 약 20mm 내지 약 50mm 사이, 약 30mm 내지 약 40mm 사이, 약 30mm 내지 약 32mm 사이)의 간격을 두고 이격되며, 샘플로부터 분광기(114)를 보유하는 유닛(502)으로 반사된 광을 확산되게 지향시키며, 반사된 광이 분석될 수 있다. 광 포트(508)는 0.66의 총체적 NA를 갖는 50㎛ 유리 섬유들의 1mm 직경 검출 다발을 가질 수 있다.
프로브 헤드(400)는 제1 조명 광 포트(506)와 유사하게 구성되나, (SD)1 간격을 두고, 제1 조명 광 포트(506) 보다 검출 광 포트(508)에 가깝게 위치된 추가의 조명 광 포트(514)를 포함할 수 있다. (SD)1 간격은 약 1mm 내지 약 5mm 사이(예를 들어, 약 1.5mm, 약 2.5mm, 약 3mm, 약 4mm)일 수 있다. 예를 들어, 제2 조명 광 포트(514)의 1mm 섬유 다발의 중심부는 검출 광 포트(508)의 1mm 직경 섬유 다발의 중심부로부터 약 2.5mm에 위치될 수 있는 반면, 제1 조명 광 포트(506)의 3.5mm 직경 섬유 다발은 검출 광 포트(508)의 중심부로부터 약 30mm에 위치될 수 있다. 광 포트(514)의 직경은 광 포트(506)의 직경보다 작을 수 있어, 광 포트(514) 보다는 광 포트(506)로부터 샘플(102)로 보다 많은 광이 입사되더라도, 대략 동일한 반사 세기가 샘플이 조명 포트(506 또는 514)로부터 광으로 조명되는지 여부와 상관없이 검출 광 포트(508)에 의해 수집된다. 샘플이 조명 포트(506 또는 514)로부터의 광으로 조명되든 조명되지 않든 유사한 세기의 반사 스펙트럼을 가짐으로써 2개의 조명 포트중 하나의 포트로부터 광이 사용될 때 보다 오랜 시간 동안 검출기 상에 통합되지 않고도 양호한 신호-대-잡음 비율이 허용될 수 있다.
2개의 조명 광 포트(506, 514)와 검출 광 포트(508)((SD)1 및 (SD)2) 간의 각각의 간격들은 샘플(102)에 대한 특정 정보를 얻기 위해 조명 광 포트(506, 514)로부터 방출된 광의 세기 및 스펙트럼과 샘플(102)의 반사율 스펙트럼과 관련하여 선택된다. 예를 들어, 분광계 시스템(100)은 환자로부터 혈액 또는 조직 샘플을 제거하지 않고 피부 아래의 조직에서 혈액 화학작용 또는 화학작용의 직접적인 비침범성 측정이 허용되도록 사람 환자의 피부를 통해 근적외선 방사선(예를 들어, 700-1000nm의 파장을 가지는 방사선)을 지향시키는데 이용된다. 특히, 시스템(100)은 근육 pH, 근육 산소 분압(PO2), 및 시스템을 이용하여 얻어지는 연속파 근적외선 스펙트럼으로부터 혈액 적혈구용적을 측정하는데 이용될 수 있다. 짧은 (SD)1 간격은 근육 또는 기관 조직과 같은 해당 조직 상부에 놓인 피부 및 지방과 같이, 단지 해당하지 않는 조직으로부터의 반사만을 적절히 유도하도록 선택되어야 한다. 하기에 개시되는 바와 같이, 이러한 간격은 상부에 놓인 피부 및 지방에 대해 계산되며, 여기서 근육은 해당 조직이다.
사람 환자로부터의 스펙트럼 정보를 기록하기 위해, 프로브 헤드(400)의 열전도성 피트(feet)(520)는 환자의 신체 중 일부와 접촉하게 위치되며, 광은 조명 포트(506 및/또는 514)로부터 환자로 지향되며, 반사된 광은 검출 포트(508)에 수집된다. 예를 들어, 프로브 헤드(400)의 피트(520)는 환자의 팔뚝(forearm) 표면 상의 피부와 접촉하게 위치될 수 있어, 광이 조명 광 포트(506 및/또는 514)로부터 방출되고, 환자의 신체중 일부(예를 들어, 환자의 손, 팔뚝, 종아리, 넓적다리, 복부, 또는 가슴) 내의 조직으로부터 반사되고 검출 광 포트(508)를 통해 수집될 수 있다. 환자의 근육으로부터 정보를 기록하기 위해, 조명 광 포트(506 및/또는 514)로부터의 광은 일반적으로 약 3mm 내지 약 10mm 사이의(예를 들어 약 4mm 내지 약 5mm 사이의) 두께인 피부층(102s)과 지방층(102f)을 관통하여 근육층(102m)에 도달한 다음, 광은 근육층으로부터 산란되어 검출 광 포트(508)에 수집된다. 일부 실시예에서, 제2 조명 광 포트(514) 및 검출 광 포트(508)는 예를 들어 인체 근육의 분석물의 검출을 수반하는 실시예에서,하나의 열 전도성 피트(520)에 함께 위치될 수 있다.
예를 들어, 8와트의 램프(104)를 사용함으로써, 약 7 루멘 광이 3.5mm 직경 조명 광 포트(506 또는 514)로부터 방출되거나, 또는 약 25 루멘 광이 6mm 직경 조명 광 포트로부터 방출될 수 있다. 조명 광 포트(506)와 검출 광 포트(508) 간에 약 30mm의 간격은 검출 광 포트(508)에 수집된 광이 피부 및 지방층들(102s, 102f) 아래에 놓인 근육 조직(102m)으로부터 산란된 광으로 인해 상당한 신호를 포함하도록 허용한다는 것이 실험적으로 밝혀졌다. 광이 제1 조명 광 포트(506) 보다 검출 광 포트(508)에 가깝게 위치된 제2 조명 광 포트(514)로부터 방출될 때, 검출 광 포트(508)에 수집된 광은 상부에 놓인 피부 및 지방층들(102s, 102f)로부터 산란된 광으로부터 상당한 신호를 포함한다. 이러한 제2 신호는 환자의 팔이 제1 조명 광 포트(506)로부터의 광으로 조명될 때 기록된 전체 신호에서 상부에 놓인 피부/지방층들(102s, 102f)로부터의 산란 및/또는 흡수로 인해 야기되는 신호 성분들을 제거하는데 이용될 수 있다. 2개의 조명 광 포트(506, 514)로부터 방출된 광은 동일한 램프(104)로부터 유래될 수 있으며, 셔터(250)는 하기 보다 상세히 설명되는 바와 같이 제1 조명 광 포트(506)와 제2 조명 광 포트(514) 각각으로부터의 광 방출을 제어하는데 이용될 수 있다.
얕은 피부/지방층들(102s, 102f) 및 깊은 근육층(102m)으로부터 산란되는 광에 해당하는 2개 신호는 하나의 조명 광 포트와 2개의 광 검출 포트를 사용함으로써 얻어질 수 있고, 2개의 광 검출 포트중 하나는 다른 광 검출 포트보다 조명 광 포트와 가깝게 위치된다.
프로브 헤드(400) 및 프로브 헤드의 피트(520)는 환자의 피부로부터 열을 전도시키기 위해 열적으로 전도성이 물질(예를 들어, 알루미늄 또는 구리)로 형성될 수 있다. 프로브 헤드가 비전도성 물질(예를 들어, 플라스틱)으로 형성될 경우, 조명 광 포트(506 및/또는 514)를 통해 전달된 열은 피부에서 혈관(blood vessel)을 팽창시키고 환자의 피부 혈액양(blood volume)을 변경시키기에 충분할 수 있다. 이러한 피부 혈류에 대한 열의 작용은 환자로부터 기록된 반사율 스펙트럼을 변경시킬 수 있다. 프로브 헤드(400)에서 열 전도체는 프로브 헤드(400)의 대향 단부에서 피트(520) 간에 열적 브리지를 제공하여, 환자 조직의 온도가 2개의 조명 포트(506, 514)와 검출 포트(508) 부근에서 실질적으로 동일해질 수 있다.
도 5B를 참조로, 일부 실시예에서, 광원은 하나 이상의 발광 다이오드를 포함할 수 있다. 프로브 헤드(400)는 검출 포트(584)로부터 (SD)2 간격을 두고 조명 포트를 형성하도록 프로브 헤드(400) 내에 위치된 제1 광원(580)을 포함한다. 또한 프로브 헤드(400)는 검출 포트(584)로부터 (SD)1 간격을 두고 조명 포트를 형성하도록 프로브 헤드(400) 내에 위치된 제2 광원(582)을 포함한다. 광원(580, 582)은 광섬유 케이블 또는 다른 결합 부재들을 포함하지 않으며, 각각의 광원으로부터의 광이 샘플을 직접적으로 조명하도록 위치설정된다. 샘플에 의해 반사된 광은 검출 포트(584)를 통해 시스템에 의해 수신된다.
광원(580, 582)은 각각 발광 다이오드(LED) 어레이를 포함할 수 있다. LED의 개수 및 공간적 분포는 각각의 광원으로부터 검출 포트(584)에 특정한 반사 광 세기를 제공하도록 선택될 수 있다. 예를 들어, 광원(580)은 비교적 조밀하게 패 키징된 LED 어레이를 포함할 수 있고, 광원(582)은 덜 조밀하게 패키징된 LED 어레이를 포함할 수 있어, 2개의 광원 각각으로부터 검출 포트(584)에 수신된 반사 광은 대략 세기가 동일해 질 수 있다.
광원(580 및/또는 582)에 사용되는 LED들은 전자기 스펙트럼들의 가변 영역들에서 광을 제공할 수 있다. 예를 들어, LED들은 스펙트럼의 가시광 및/또는 자외선 및/또는 근적외선 또는 적외선 영역들에서 파장을 가지는 광을 제공할 수 있다. LED 들은 스펙트럼의 다른 영역들, 및 동시에 스펙트럼의 다중 영역들에 광을 제공할 수 있다. 일부 실시예에서, 상이한 광 방출 특성(예를 들어, 파장, 세기 및 다른 특성들)을 가지는 다수의 상이한 형태의 LED들이 광원(580 및/또는 582)과 같은 단일 광원에 제공될 수 있다.
일부 실시예에서, 광원(580 및/또는 582)은 프로브 헤드(400)에 통합된 또는 프로브 헤드(400)와 결합된 다른 형태의 광원(예를 들어, 백열광원, 레이저 기반 광원)을 포함할 수 있다. 분광계와 같은 검출기는 프로브 헤드(400)에 통합되거나 또는 예를 들어 광섬유 케이블을 사용하여, 프로브 헤드(400)와 광학적으로 결합될 수 있다.
도 6A 및 도 6B를 참조로, 프로브 헤드(400)는 광 차폐물(600)에 의해 적절한 위치에 위치될 수 있다. 광 차폐물(600)은 프로브(400)의 피트(520)가 장착되는 개구부(602), 조명 광 포트(506)가 장착되는 개구부(604), 및 제2 피트(520)가 장착되는 개구부(606)를 포함한다. 제2 피트는 조명 광 포트(514) 설비(fit)와 검출 광 포트(508)를 수용할 수 있다. 따라서, 광 차폐물은 프로브 헤드(400)의 피트(520) 및 조명 및 검출 광 포트(506, 514)를 고정된 위치에 위치시킨다. 광 차폐물(600)은 미광으로부터 환자의 신체를 차단하는 불투명한 물질을 포함하여, 단지 조명 광 포트(506 및/또는 514)로부터의 광만이 환자에게 도달하고, 검출 광 포트(508)에 수집된 광이 조명 광 포트(506)로부터 방출되는 공지된 스펙트럼을 가지는 광에 의해 제공되게 한다. 광 차폐물(600)은 미광으로부터 검출 포트를 차단하기 위해 검출 광 포트(508)로부터 모든 방향으로 약 3.5cm로 연장될 수 있다. 광 차폐물(600)에 위치된 프로브 헤드(400)를 이용함으로, 프로브 헤드(400)는 환자의 신체에 대해, 예를 들어 환자의 신체에 대해 광 차폐물을 테이핑, 스트랩핑, 또는 스틱킹함으로써 위치설정될 수 있다. 예를 들어, 프로브 헤드(400)는 양면 접착제를 이용하여 광 차폐물(600)에 대해 보유될 수 있어, 프로브 헤드 아래에서 혈류량을 변경시킬 수 있는 과도한 압력 없이 환자 피부와 프로브 헤드(400)가 접촉될 수 있다.
도 6A에 도시된 것처럼, 일부 실시예에서, 광 차폐물은 다양한 개구부들 또는 구멍들을 가지는 주요부(601), 좁은 접속 영역(605)에 의해 주요부(601)에 접속된 케이블 관리부(603)를 포함하는 단일 부품으로 형성될 수 있다. 도 6B에 도시된 또 다른 실시예에서, 광 차폐물은 상부 주요부(601)와 케이블 관리부(603)가 이격된 2-부품 설계를 가질 수 있다. 이러한 배열은 접속 영역(605)의 길이 보다 큰 간격에 의해 2개 부품이 이격되게 한다. 이러한 다수의 실시예에서, 통상적으로 광 차폐 케이블 관리부(603)는 분광계 유닛(502)과 프로브 헤드(400) 사이에 광을 전송하는 섬유 다발(116a, 116c, 116d)을 포함하는 케이블을 고정할 수 있는 클 립(608) 또는 다른 메커니즘을 포함한다. 클립(608)은 케이블을 고정하여, 케이블의 중량이 환자의 위치에서 프로브 헤드를 변위시키지 않게 한다. 차폐물(600)은 예를 들어, 플라스틱, 또는 경량의 다른 불투명 물질로 형성될 수 있다. 또한 광 차폐물(600)은 과도한 열의 방산을 보조하도록 얇은 시트의 구리 또는 알루미늄과 같이, 열적으로 전도성인 물질로 형성될 수 있어, 열이 환자의 피부로 전달되지 않는다.
광학대
및 셔터 시스템
광학대는 광섬유 케이블 시스템의 상이한 레그들로 광을 지향시키는 셔터 시스템(110)을 포함할 수 있다. 케이블 시스템에서 광의 경로를 제어함으로써, 셔터 시스템은 상이한 조명 섬유(116a, 116d)로 샘플을 선택적으로 조명하는데 이용될 수 있다.
다시 도 2를 참조로, 광학대(108)는 셔터 시스템(110)의 광학 셔터(250)를 작동시키는 스텝퍼-모터(240)에 대한 마운트(mount)를 제공한다. 셔터(250)는 램프(104)와 2개의 광섬유 케이블(116a, 116d) 사이에 위치되며, 2개의 광섬유 케이블 각각에 대해 광을 차단 또는 통과시킬 수 있도록 형상화된다. 도 2에서, 단지 셔터(250)의 상부 에지만이 도시되어 있다. 불투명한 셔터(250)의 프로파일이 도 7에 도시된다. 셔터(250)는 셔터에 있는 홀(710)을 통과하는 샤프트에 의해 스텝퍼 모터(240)와 결합된다. 샤프트가 회전할 때, 셔터는 홀(710)의 중심부를 통과하는 축 부근에서 회전한다. 광학대(108)에 고정된 제2 샤프트(미도시)는 셔터(250)에 있는 제2 홀(720)을 통과하여 셔터(250)의 회전 운동을 제한한다.
셔터(250)가 시계방향으로 최대로 회전할 때, 도 7에 도시된 것처럼, 셔터에 있는 홀(730)은 샘플(102)로 유도되는 광섬유 케이블(116a)과 램프(104) 사이에 위치되어, 광이 홀(730)을 통해 전파되고 샘플(102)이 섬유 다발(116a)로부터 방출되는 광에 의해 조명된다. 이러한 위치에 있는 셔터(250)를 이용하여, 샘플(102)로부터 반사된 광은 케이블(116c)에 의해 수집되고 분광기(114)로 유도된다. 이러한 위치에서, 셔터(250)의 단부(740)는 광이 케이블(116d)로 진입하는 것을 차단한다.
홀(720)을 통과하는 샤프트가 홀(720)의 중심부에 위치되도록, 셔터(250)가 중심 위치로 반시계방향으로 회전할 때, 홀(730)은 램프(104)로부터 방출되는 광의 빔 경로 밖으로 회전한다. 따라서, 광은 홀(730)을 통과하지 않고, 불투명한 셔터(250)에 의해 샘플 케이블(116a)로의 진입이 차단된다. 또한 광은 셔터(250)의 단부(740)에 의해 섬유 다발(116d)로의 진입이 차단된다.
셔터(250)가 반시계방향으로 최대로 회전할 때, 광은 홀(720)을 통과하지 않으며 불투명한 셔터(250)에 의해 샘플 케이블(116a)의 진입이 차단된다. 광은 셔터(250)의 각진 엣지(750) 위를 통과하며 섬유 다발(116d)로 진입되어 분광기(114)에 도달한다. 이러한 위치에서, 분광기(114)는 샘플이 섬유 다발(116d)에 의해 조명될 때 샘플(102)의 반사율 스펙트럼을 측정한다.
컴퓨터(118)는 제1 채널에서의 데이터 수집(즉, 샘플(102)이 섬유 다발(116a)로부터의 광으로 조명될 때)과 제2 채널에서의 데이터 수집(즉, 샘플(102)이 섬유 다발(116d)로부터의 광으로 조명될 때) 사이에서 분광기(114)의 데이터 습득이 전환되도록 셔터(250)를 제어한다. 컴퓨터(118)는 셔터 구동기 회로를 통해 셔터(250)를 제어할 수 있다. 적절한 셔터 구동기 회로의 일 실시예가 도 8에 도시된다. 이러한 회로의 동작은 2005년 4월 25일 "SPECTROMETER SYSTEM FOR OPTICAL REFLECTANCE MEASUREMENTS"란 명칭으로 출원되고 현재 미국 공개 번호 2005/02592545호로 공개된 미국 출원 번호 11/113,347호에 개시되어 있으며, 이는 본 명세서에서 참조된다.
또한 컴퓨터(118)는 분광기(114)가 데이터를 수집하는 방법을 제어한다. 예를 들어, 컴퓨터(118)는 분광기 검출기의 통합시간(integration time), 평균화된 스펙트럼들의 개수, 및 컴퓨터에 스펙트럼이 저장되기 이전의 평활화(smoothing) 정도를 제어한다. 컴퓨터가 데이터 습득의 각각의 채널 대해 이를 독립적으로 수행하는 것이 가능하다. 파라미터들은 검출기 포화 없이 기준 채널 및 샘플 채널 각각에서의 응답을 최대화시키도록 선택될 수 있다.
다른 분광계 시스템
분광계 시스템(100)을 위한 적절한 광원들로는 백열광원, 이를 테면, 램프, 발광 다이오드(LED), 레이저 기반 광원, 및 다른 광원이 포함된다. 예를 들어, 하나 이상의 LED가 샘플로부터 반사율 측정치를 만드는데 이용되는 광을 제공하도록 조합될 수 있다. 다양한 광원에 의해 제공되는 광은 예를 들어, 적외선 및/또는 근적외선 영역, 가시광 영역, 자외선 영역과 같은 전자기 스펙트럼 영역 및/또는 전자기 스펙트럼의 다른 영역들에서 선택된 파장을 포함할 수 있다.
소정 실시예에서, 분광계 시스템(100)은 광섬유 케이블을 통해 광원으로부터의 조명 광과 결합되지 않고, 직접 샘플을 조명하도록 구성될 수 있다. 예를 들어, 광원은 구멍과 같은 조명 포트를 통과하는 샘플을 직접 조명하도록 위치된 백열 램프일 수 있다. 샘플로부터 반사된 광은 하나 이상의 검출기에 의해 수신되고 분석된다.
소정 실시예에서, 하나 이상의 검출기가 사용될 수 있다. 예를 들어, 광은 조명 포트로부터 샘플을 조명하는데 이용될 수 있고, 샘플로부터 반사된 조명 광은 2개 방향 포트에서 수신될 수 있다. 2개 방향 포트 각각은 반사된 광의 스펙트럼을 측정하도록 구성된 분광계와 결합될 수 있어, 검출 시스템은 평행하게 동작하는 2개의 분광계를 포함한다. 스펙트럼 데이터는 각각의 검출 포트에서 동시적으로 습득될 수 있어, 단지 하나의 분광계만을 가지는 시스템에 비해 속도면에서 장점을 제공할 수 있다. 시스템은 조명 포트를 차단 및 비차단하는데 셔터 시스템을 이용하지 않고 동작할 수 있어, 시스템 비용이 감소되고 시스템의 기계적 신뢰성이 증가될 수 있다.
스펙트럼 교정 알고리즘
구현될 수 있는 3개의 상이한 교정 알고리즘이 제공된다. 각각의 교정 알고리즘은 개별적으로 바람직하게(well) 작동하지만, 측정된 스펙트럼 데이터를 교정하기 위해 임의의 2개 알고리즘, 또는 3개 모두의 알고리즘이 함께 사용될 수 있다.
1. 짧은-간격 교정(Short-Distance Corrections)
해당 조직층들(예를 들어, 하부에 놓인 조직들) 상부에 놓인 조직층들로 인해 발생되는 스펙트럼 기여도(contribution)는 상부에 놓인 층들 및 하부에 놓인 층들 모두로부터의 기여도를 포함하는 반사율 스펙트럼으로부터 상부에 놓인 층들로 인한 기여도를 차감시킴으로써 교정될 수 있다. 2개 모든 형태의 층들로부터의 기여도를 포함하는 반사율 스펙트럼, 및 실질적으로 단지 상부에 놓인 층들로부터의 기여도를 포함하는 반사율 스펙트럼은 분광계 시스템(100)을 사용하여 개별적으로 측정될 수 있다. 예를 들어, 도 5에 도시된 것처럼, 조명 포트(506)와 검출 광 포트(508) 간의 (SD)2 간격은 조명 포트(514)와 검출 광 포트(508) 간의 간격(SD)1 보다 크다. (SD)2 간격은 샘플(102)이 조명 포트(506)로부터의 광으로 조명될 때 기록된 반사율 스펙트럼(Rsfm)이 피부층(102s), 지방층(102f), 및 근육층(102m)에 대한 스펙트럼 정보를 포함하도록 선택될 수 있다. (SD)1 간격은 샘플(102)이 조명 포트(514)로부터의 광으로 조명될 때 기록된 반사율 스펙트럼(Rsf)이 피부층(102s)과 지방층(102f)에 대한 스펙트럼 정보만을 포함하도록 선택될 수 있다. 기구(instrument) 파라미터들, 섬유 크기 및 시스템(100)의 분광계 통합 시간은 각각의 조명 포트 및 검출 포트에 대한 시스템의 동적 범위에 대해 반사율 스펙트럼에서 높은 신호-대-잡음 비율을 얻도록 선택될 수 있다.
상부에 놓인 조직층 및 하부에 놓인 조직층들 모두에 대한 정보를 포함하는 스펙트럼(Rsfm)으로부터 상부에 놓인 층들로 인한 Rsf 스펙트럼에 포함된 스펙트럼 정보를 차감시키기 이전에, Rsf 스펙트럼은 Rsfm 스펙트럼으로 정규화될 수 있고, 스펙트럼은 공통 측정 공간을 공유할 수 있다. Rsf를 Rsfm의 측정 공간으로 전송하기 위해, Rsf 스펙트럼을 Rsfm 스펙트럼으로의 광도적(photometric) 맵핑이 수행된다. 먼저 반사율 스펙트럼은 조명 포트(506) 및 조명 포트(514)로부터 샘플(102) 상에 광이 입사할 때 2% 내지 99% 범위의 반사율 값들을 가지는 광학적으로 균질한 3개 이상의 반사율 참조 표준(reference standard)으로 기록된다. 다음각각의 참조 표준에 대한 반사율 스펙트럼은 각각의 측정된 세기 스펙트럼을 99% 참조 표준에 대해 기록된 스펙트럼으로 나눔으로써 추정된다. 예를 들어, 50% 표준의 추정된 반사율(R)은 50/99(즉, 50.5%)이다. 마찬가지로, 99% 표준의 추정된 반사율은 99/99(즉, 100%)이다. 마지막으로, 파장-특정 다항식 모델은 표준이 제1 광 포트(506)로부터의 광으로 조명될 때 기록된 스펙트럼(Rsfm)과 제2 광 포트(514)로부터의 광으로 표준이 조명될 때 기록된 스펙트럼(Rsf)을 상관시킨다. 각각의 파장-특정 모델은 Rsf에서 Rsfm으로 반사율 추정 스케일을 조정하는데 이용된다. 이러한 과정은 상이한 조명 포트(506, 514)가 이용될 때 광 처리량 및 수집 효율의 차에 대해 교정된다. 다항식 모델은 다음과 같이 구현될 수 있다:
여기서, n과 λ는 각각 타겟 반사율 값(2-99%) 및 광 파장을 나타내는 지수들이며, a, b 및 c는 파장-특정 다항식 계수들이다. 다항식 계수들은 Rsfm 스펙트 럼으로 정규화되는 스펙트럼()으로 조직 스펙트럼(Rsf)의 추가 측정치들의 맵핑을 허용한다. 식 1은 2차 다항식 모델을 나타낸다. 그러나 일반적으로, 보다 높은 차수의(예를 들어, 3차, 4차, 및 보다 더 높은 차수) 다항식 모델이 구현될 수 있다.
상이한 조명 광 포트(506, 514)로부터의 광으로 기록된 스펙트럼의 정규화 이후, 상이한 조명 광 위치로 기록된 스펙트럼들이 직교화된다(즉, 상부에 놓인 층들로 인한 스펙트럼 성분들이 상부 및 하부에 놓인 층들 모두로 인한 성분들을 포함하는 스펙트럼으로부터 제거된다). 직교화는 매트릭스 곱(multiplication)을 수반한다. 먼저, 스펙트럼 Rsf와 Rsfm 간의 교정을 나타내는 파장 관련 가중치(w)가 하기 식에서 결정된다:
여기서, 첨자 T는 매트릭스의 전치를 나타내며, 는 광이 조명 포트(514)로부터 샘플(102)에 입사되고 Rsfm의 측정 공간으로 광도적으로 맵핑될 기록된 반사 광의 스펙트럼에 해당하는 벡터이다. 가중치가 결정된 이후, 상부에 놓인 층들의 스펙트럼 피쳐(feature)가 하기 식을 사용하여 제거될 수 있다 :
여기서, 는 피부 및 지방으로 인한 반사율 성분이 제거된 이후 야기되며, 실질적으로 하부에 놓인(근육)층(102m)으로부터의 정보만을 포함하는 직교화 스펙 트럼이다. 는 직교화 반사율 스펙트럼()으로부터 하부에 놓인 층(102m)의 화학적 특성을 결정하기 위한 보정식을 전개하기 위해 PLS 또는 다른 다변량 교정 기술들과 이용될 수 있고, 보정식은 상부에 놓인 층들의 광학 작용과 무관하다.
보정식이 의학적 모니터링 장치에 사용될 때, 환자 스펙트럼은 보정식을 생성하는데 이용되는 것과 동일한 설계의 광섬유 프로브로 수집될 수 있고, 직교화 스펙트럼은 보정식에 사용되기 이전에 계산되어야 한다.
2. 표준 정규 변수 스케일링에 의한 교정
표준 정규 변수(SNV, standard normal variate) 스케일링 기술은 측정된 반사율 스펙트럼에 대한 다른 원치 않는 기여도 및 산란을 감소시키기 위해 이용될 수 있다. 적절한 SNV 구현예는 예를 들어, R.J. Barnes 등에 의한 Applied Spectroscopy 43, 772(1989)에 개시되어 있으며, 이의 전체 내용은 본 명세서에서 참조된다. 예를 들어, SNV 방법은 근육 조직과 같은 해당 조직의 광학적 특성에서의 변화로 인해 야기되는 측정된 반사율 스펙트럼에 대한 기여도를 감소시키는데 이용된다.
3. 주성분 분석 로딩에 의한 교정
일부 실시예에서, 스펙트럼 반사율 측정치는 대상자 신체 상의 다중 위치로부터 기록된다. 예를 들어, 하나의 대상자에서 또 다른 대상자로 해당 조직의 광학적 특성 변이는 해당 분석물 측정과 관련되지 않는 반사율 데이터로 변이를 도입 할 수 있다. 예를 들어, 대상자 세트로부터 기록된 근육 조직 반사율 스펙트럼에서, 해당 측정 분석물은 근육 조직 pH일 수 있다. 그러나, 근육 조직 pH 변화로 인해 야기되는 변이 이외에, 상이한 대상자들의 근육 조직으로부터 기록되는 반사율 스펙트럼은 근육 조직 텍스쳐, 및/또는 모세관 밀도, 및/또는 섬유 구조, 및/또는 상이한 대상자들의 근육 조직의 다른 구조적 특징의 변이로 인해 야기되는 스펙트럼 기여도를 포함할 수 있다. 통상적으로 구조적 특성에서의 이러한 변이는 상이한 대상자들의 근육 조직에 대한 파장-관련 산란 계수에서의 변이를 산출한다.
큰 세트의 대상자들은 해당 조직에서의 광학적 특성 변이를 모델링하는데 이용될 수 있다. 그러나, 큰 세트의 테스트 대상자들로부터 반사율 스펙트럼을 측정하고 분석하는 것과 관련된 시간 및 비용은 이러한 방안을 임상 분야에 대해 비실용적으로 만들 수 있다. 선택적으로, 수치적 알고리즘(numerical algorithms)은 해당 분석물을 측정하기 위해 PLS 모델링 분야에서 반사율 스펙트럼 데이터를 사용하기 이전에, 해당 조직에서의 광학적 특성 변이로 인해 야기되는 반사율 스펙트럼에서의 스펙트럼 기여도를 감소 및/또는 제거시키는데 이용될 수 있다.
주성분 분석(PCA) 로딩 교정은 해당 조직의 광학적 특성의 분석물-무관 변이로부터 야기되는 반사율 스펙트럼에 대한 기여도를 감소 및/또는 제거시키는데 이용된다(예를 들어, 조직내 해당 분석물이 측정된다). 이러한 변이를 나타내는 광학적 특성으로는 산란 특성, 흡수 특성, 조직 굴절률, 및 다른 특성들이 포함될 수있다. 일반적으로, 해당 조직에 의한 적외선 흡수에서의 변이는 해당 하나 이상의 분석물의 교정과 관련된다. 따라서 해당 분석물의 정확한 측정은 반사율 스펙트럼 에 대한 분석물-무관 기여도에 대한 결정 및 교정을 포함한다.
PCA 분석은 분석물-무관 변이의 스펙트럼 "서명(signature)"을 얻는데 이용될 수 있으며, 이는 직교화 단계를 통해 스펙트럼 반사율 데이터로부터 제거될 수 있다. PCA 로딩 교정은 교정된 스펙트럼 반사율 데이터로부터 구성된 PLS 모델을 보다 개선시키기 위해 교정 및 이전 단계들 동안 적용될 수 있다.
해당 조직의 광학적 특성에서의 변이로부터 야기되는 스펙트럼 반사율 측정치에서의 변이는 일련의 단계에서 감소 및/또는 제거될 수 있다. 예를 들어, 일부 실시예에서, 제1 분석 단계는 실질적으로 유사한 값들을 가지는 분석물들의 동일한 교정 세트에서 상이한 대상자(및/또는 동일한 대상자 상의 상이한 위치들)로부터 수집된 스펙트럼 세트에 대해 PCA에 의해 타겟 분석물과 관련되지 않은 스펙트럼 반사율 데이터에서 변이 검출을 포함한다. 변이는 PCA로부터 얻어진 스펙트럼 주성분의 로딩 벡터 세트로서 표현될 수 있다. 제1 분석 단계는 식 4로 표시된다:
식 4에서, X0는 m0×n 치수를 갖는 매트릭스이다. X0의 m0 로우 각각은 PCA를 위해 사용되는 상이한 샘플들에 대해 기록된 반사율 스펙트럼에 해당하며, n은 각각의 반사율 스펙트럼에서의 파장 포인트들의 개수이다. X0에서 스펙트럼들은 분석물-무관 스펙트럼 편차를 포함한다. 매트릭스 X0 ,mean는 m0×n 치수를 가지며, m0 로 우를 포함하며, 각각의 로우는 1×n 벡터이며 이들 엘리먼트들은 X0의 컬럼 평균값(column mean values)에 해당하며, X0에서 X0 ,mean 차감은 m0×f0 치수를 갖는 매트릭스 X0 ,mc를 산출하며, f0는 X0에서의 편차를 모델링하는데 이용되는 다수의 주성분들이다. S는 m0×f0 치수를 갖는 PCA 매트릭스 스코어이며, 여기서 f0는 X0에서 변이를 모델링하기 위해 사용되는 주성분의 수이다. 매트릭스 P는 PCA 로딩 매트릭스이며 n×f0 치수를 갖는다. m0×n 치수를 갖는 매트릭스 E는 PCA에 의해 모델링되지 않은 X0의 잔류 스펙트럼의 매트릭스이다.
제2 분석 단계에서, PLS 교정에 사용되는 스펙트럼 및 PLS-기반 예상을 위해 사용되는 스펙트럼들은 제1 단계에서 얻어진 주성분들의 로딩 벡터들을 중심으로 직교화된다. 해당 조직의 광학 특성 변이로 인한 스펙트럼 기여도는 제2 분석 단계로부터 야기되는 교정된 스펙트럼에서 제거 및/또는 감소된다. 제2 분석 단계는 식 5에 개시된다:
식 5에서, 는 치수를 갖는 직교화된(예를 들어, 교정된) 스펙트럼 매트릭스이며, 여기서 m은 샘플들의 개수로, 예를 들어, 의 m 로우는 m 상이한 샘플들로부터 기록된 교정된 반사율 스펙트럼에 대응한다. 치수를 갖는 매 트릭스 X는 교정되지 않은 오리지널 m에 해당한다. 치수를 갖는 매트릭스 는 m 로우들을 포함하며, 각각의 로우는 엘리먼트들이 의 컬럼 평균값에 해당하는 벡터이다. 치수를 갖는 은 끝이 잘린(truncated) 로딩 매트릭스이며, 컬럼의 수 은 직교화 과정에서 사용되는 직교 팩터들의 수와 동일하다. 일반적으로, 은 보다 작거나 같으며, 에 대한 값은 식 4에서 계산된 S와 P 매트릭스에서 엘리먼트 값들을 기초로 선택된다. 직교화에 이어, 매트릭스 에서 교정된 반사율 스펙트럼은 해당 분석물의 값들을 예상하기 위한 PLS 교정 및/또는 모델링에 이용될 수 있다.
4. 조합된 교정 방법들
소정 실시예에서, 임의의 2개 또는 3개 모두의 짧은-간격 방법, SNV 방법, 및 PCA 로딩 방법들은 해당 측정 분석물로부터 야기되지 않는 스펙트럼 피쳐를 제거함으로써 반사율 스펙트럼을 교정하도록 조합될 수 있다. 예를 들어, 일부 실시예에서, 짧은-간격 교정 방법은 해당 조직층들 상부에 놓인 조직층들로 인해 스펙트럼 피쳐에 대해 교정되도록 저항률 측정치 세트들에 먼저 적용된다. 다음 SNV 및 PCA 로딩 교정이 해당 조직층들에서의 광학적 특성 변이를 교정하도록 연속하여 짧은-간격-교정 스펙트럼에 적용될 수 있다. 이를 테면, 반사율 측정치 세트는 대상자 신체 상의 상이한 위치들에서 측정된 반사율 데이터 및/또는 상이한 대상자들로부터의 반사율 데이터를 포함한다.
일반적으로, 본 명세서에 개시되는 알고리즘은 스펙트럼 반사율 데이터를 교정하기 위해 필요시 적용될 수 있다. 반사율 데이터에 선택된 순서로 인가되는 하나 이상의 알고리즘의 적합성은 일반적으로 (예에서 보다 상세히 설명되는) 교정된 스펙트럼 반사율 데이터를 기초로 전개되는 해당 분석물에 대한 PLS 모델의 정확성을 검출함으로써 제공된다.
구현예
앞서 개시된 식들 및 알고리즘들은 하드웨어 또는 소프트웨어, 또는 하드웨어와 소프트웨어의 조합물에서 쉽게 구현될 수 있다. 본 발명은 본 명세서에 개시된 방법 단계들 및 도면들에 이어 표준 프로그래밍 기술을 사용하여 컴퓨터 프로그램으로 구현될 수 있다. 프로그램들은 프로그램가능 프로세서 또는 컴퓨터들, 예를 들어 각각 적어도 하나의 프로세서, 적어도 하나의 데이터 저장 시스템(휘발성 및 비휘발성 메모리 및/또는 저장 엘리먼트를 포함), 키보다 또는 푸시 버튼 어레이와 같은 적어도 하나의 입력 장치, 및 CRT, LCD 또는 프린터와 같은 적어도 하나의 출력 장치를 포함하는 마이크로컴퓨터들에서 실행되도록 설계될 수 있다. 프로그램 코드는 본 명세서에 개시된 기능들을 수행하기 위해 입력 데이터에 인가된다. 출력 정보는 프린터 또는 CRT 또는 다른 모니터와 같은 하나 이상의 출력 장치에, 또는 예를 들어 원격 모니터링을 위해 웹사이트의 액세스를 이용하는 컴퓨터 모니터 상의 웹 페이지에 적용될 수 있다.
새로운 시스템에 사용되는 각각의 프로그램은 컴퓨터 시스템과 통신하도록 하이 레벨 절차(procedural) 또는 오브젝트 지향 프로그래밍 언어에서 바람직하게 구현된다. 그러나, 프로그램들은 원할 경우, 어셈블리 또는 기계 언어로 구현될 수 있다. 임의의 경우, 언어들은 컴파일 또는 번역 언어일 수 있다.
이러한 각각의 컴퓨터 프로그램은 저장 매체 또는 장치가 본 명세서에 개시된 절차를 수행하기 위해 컴퓨터에 의해 판독될 때 컴퓨터를 구성하고 동작시키기 위해 범용성 또는 특정용 프로그램가능 컴퓨터에 의해 판독가능한 저장 매체 또는 장치(예를 들어, ROM 또는 자기 디스켓)에 저장될 수 있다. 또한 시스템은 컴퓨터 프로그램으로 구성된, 컴퓨터-판독가능 저장 매체로서 구현되는 것으로 간주될 수 있으며, 이렇게 구성된 저장 매체는 컴퓨터내의 프로세서가 본 명세서에 개시된 기능들을 수행하도록 특정하게 예정된 방식으로 동작하게 한다.
임의의 통신 네트워크가 원격 모니터링으로부터의 결과를 얻도록 사용될 수 있지만, 인터넷 또는 무선 시스템들이 데이터 전송을 위한 유용한 선택을 제공한다.
예들
짧은-간격 교정의 스펙트럼 효과
예 1
시스템(100)의 실시예에서 인체 근육 위로 피부 및 지방의 존재를 교정하기 위해 조명 프로브(514)와 검출 프로브(508) 간의 최적의 (SD)1 간격을 결정하는 실험들이 수행된다. 2mm-6mm의 조정가능한 짧은 소스 검출기 (SD)1 간격 및 32.5mm의 고정된 긴 소스-검출기 (SD)2 간격을 갖는 프로브(400)가 인체의 상이한 위치에서 수행되는 측정을 위해 분석물의 측정치에서의 최저 변이가 야기되는 (SD)1 간격을 결정하도록, 4개의 상이한 대상자들 상에서 상이한 지방층 두께를 가지는 4개의 상이한 해부학 위치(팔, 종아리, 어깨, 및 넓적 다리)로부터 스펙트럼을 사용하기 위해 이용된다. 이상적으로, 인체의 상이한 위치로부터 상이한 지방 두께에 의해 야기되는 스펙트럼 차는 직교화 이후에 교정된다, 즉, 인체의 상이한 신체 부분들로부터 측정된 4개의 모든 스펙트럼들은 중첩되며, 이는 어떤 신체 부분이 측정되는지와 상관없이 신체 근육으로부터 동일한 정보가 회복되기 때문이다. 또한, 다양한 사람들의 피부색 및 상이한 지방 두께에 의해 야기되는 스펙트럼 차는 감소된다, 즉, 환자의 스펙트럼과 적혈구용적("Hct") 간에 보다 나은 교정은 스펙트럼이 상부에 놓인 피부 및 지방층들로부터 스펙트럼 기여도를 제거하기 위해 직교될 때 얻어진다.
반사율 스펙트럼은 32.5mm의 고정된 (SD)2 간격 및 1.83mm, 2.5mm, 3.0mm, 4.0mm, 및 5.4mm의 5개의 상이한 (SD)1 간격을 사용하여 인체의 4개 대상자인 팔, 종아리, 어깨 및 넓적다리로부터 측정된다. 대상자들에 대한 실제 지방 두께는 초음파를 사용하여 상이한 위치들에서 측정되며 하기 표 1에 나열된다. 이러한 연구를 위해 선택된 넓적다리 위치는 대퇴직근(전대퇴부)의 상부에 있으며, 두꺼운 지방은 외측광근(측대퇴부)의 상부보다 높은 위치에서 발견되었다. 각각의 사람의 Hct 레벨은 비침범성 혈액 테스트를 통해 측정되었으며, 상기 레벨은 하기 표 2에 나열된다.
표 1
| 팔(mm) | 종아리(mm) | 어깨(mm) | 넓적다리(mm) | |
| 대상자 A | 4.4 | 3.5 | 9.8 | 9.5 |
| 대상자 B | 1.8 | 5.8 | 9.0 | 10.7 |
| 대상자 C | 3.2 | 1.4 | 2.6 | 2.0 |
| 대상자 D | 6.3 | 9.5 | 11.6 | 18.6 |
표 2
| 대상자 A | 41.5% |
| 대상자 B | 44.8% |
| 대상자 C | 43.4% |
| 대상자 D | 40.8% |
도 9A-9E는 상이한 (SD)1 간격에 대해 대상자 A로부터 기록된 스펙트럼에 대해 상부에 놓인 조직층들에 대한 짧은-간격 교정의 효과를 나타낸다. 도 9A, 9B, 9C, 9D 및 9E에서의 결과는 각각 1.83mm, 2.5mm, 3.0mm, 4.0mm, 및 5.4mm의 (SD)1 간격에 대해 얻어진다. 각각의 도면에서, 스펙트럼(810)은 대상자들의 신체의 상이한 부분들이 조명 포트(506)로부터의 광으로 조명될 때 얻어진 스펙트럼이고, 스펙트럼(820)은 대상자의 신체의 상이한 부분들이 조명 포트(514)로부터의 광으로 조명될 때 얻어진 스펙트럼이고, 스펙트럼(830)은 직교화된 스펙트럼이다.
대상자의 신체상의 상이한 위치들에서 기록된 스펙트럼들 간의 차는 일반적으로 상이한 지방 두께로 야기되는 베이스라인 이동으로 나타나며, 직교화 프로세스에 의해 감소된다. 교정된 스펙트럼(830)은 원시(raw) 스펙트럼(810) 보다 서로 근접해 있다. 1.83mm, 2.5mm, 및 3.0mm의 (SD)1 간격을 가지는 프로브에 대해, 스펙트럼들은 교정 이후 서로 더 근접해있으며, 스펙트럼의 소정의 피쳐는 변한다. 4.0mm 및 5.4mm의 (SD)1 간격을 가지는 프로브에 대해, 스펙트럼은 교정 이후 서로 더 가깝고, 스펙트럼의 일부 피쳐들은 변한다. 예를 들어, 760nm에서 헤모글로빈으로 인한 흡수 피크는 4.0mm 및 5.4mm의 (SD)1 간격에서 직교화 이후 덜 표시된다. 이는 근육층(여기서 상당한 Hb 흡수가 발생)으로부터의 소정의 유용한 정보가 교정 프로세스에 의해 감소된다는 것을 의미할 수 있다. 이는 지방 및 피부 층들의 영향에 대해 교정되나, 근육 정보는 유지하는 목적과는 상반된다. 이러한 작용은 큰 (SD)1 간격에서 보다 깊은 광 관통에 의한 것일 수 있다. 광이 조직 내부로 보다 깊숙히 침투됨에 따라, 근육층에 대한 보다 많은 정보가 포착되며, 짧은 (SD)1 간격과 긴 (SD)2 간격 사이의 교정은 일분 근육 정보를 희생시킬 수 있다.
유사하게, 도 10A-10E는 상이한 (SD)1 간격에 대한 대상자 C의 4개의 신체 부분들로부터의 스펙트럼에 대한 교정 결과를 나타낸다. 대상자 A는 백인 피부를 가지며 대상자 C는 흑인 피부를 가지며, 직교화 프로세스의 결과는 양자 대상자들에 대해 유사한다. 대상자 A와 대상자 C의 피부의 절대 흡수도 값은 도 10A-10E의 스펙트럼(820)과 도 9A-9E의 스펙트럼(820)을 비교함으로써 제시되는 바와 같이, 상당히 상이하다. 그러나, 피부로 인한 스펙트럼 성분이 차감된 2 대상자에 대해 교정된 스펙트럼은 상당히 유사하다.
교정된 스펙트럼 반사율과 Hct 값들 간의 교정을 실험하기 위해, 대상자의 팔, 종아리, 어깨 및 넓적 다리의 평균 흡수도 값은 각각의 대상자에 대해 계산되며, 대상자의 평균 흡수고 값과 해당 대상자 Hct 값 간의 관계식은 짧은-간격 교정이 반사율 스펙트럼에 적용되기 이전 및 이후에 각각의 (SD)1 간격에 대해 설정된다. 조직 흡수도 스펙트럼에서 주도적인 헤모글로빈 피쳐는 760nm에서 탈산소헤모글로빈(deoxyhemoglobin) 피크이며, 각각의 대상자에 대한 스펙트럼에서 이러한 피크 높이는 대상자의 적혈구용적 레벨과 선형적으로 관련되어야 한다.
표 3은 4개의 분석물 위치에 대해 760nm에서의 평균 흡수도와 4개의 상이한 (SD)1 간격(즉, 1.83nm, 2.5nm, 3.0nm, 및 4.0nm)에 대한 Hct 값들 간의 관계식의 R2 교정 값을 나타낸다. 표 3의 값들로부터, 교정 이후 R2 가 개선된다는 것을 볼 수 있다. 이는 스펙트럼과 Hct 값들 간의 강한 교정은 (SD)1 간격 스펙트럼(Rsf)에 대해 (SD)2 간격 스펙트럼(Rsfm)을 교정함으로써 설정된다는 것을 나타낸다.
표 3
| (SD)1 간격 | 이전 | 이후 |
| 1.83mm | 0.577 | 0.967 |
| 2.5mm | 0.480 | 0.996 |
| 3.0mm | 0.471 | 0.975 |
| 4.0mm | 0.476 | 0.925 |
상기 결과로부터, 약 2.5mm의 (SD)1 간격은 본 실시예에 대한 최적의 결과를 제공할 수 있다. 일반적으로, 모든 샘플층들의 흡수 및 산란 계수들이 공지된 경 우, 짧은-소스-검출기 간격은 앞서 개시된 것처럼, 실험들을 통해, 또는 몬테 카를로(Monte Carlo) 모델링을 통해 결정될 수 있다.
예 2
측정된 스펙트럼 세기와 해당 분석물 간의 상관관계를 개선시키기 위한 반사율 스펙트럼의 짧은-간격 교정의 또 다른 예는 도 11 및 도 12에 도시된다. 도 11은 17의 상이한 인체 대상자들의 최대 헴 흡수도(헤모글로빈 및 미오글로빈 모두로부터의 기여도 포함)의 일련의 측정치를 나타낸다. 각각의 대상자로부터의 스펙트럼 데이터는 심지굴근(flexor digitorum profundus)으로부터 수집된다. 도 11에서 스펙트럼 데이터는 교정되지 않으며, 각각의 대상자에 대해 측정된 최대 헴 흡수도와 혈액 적혈구용적 레벨들 간에 큰 상호관계는 없다.
도 12는 17의 대상자들의 상부에 놓인 피부 및 지방 층들을 교정하기 위해 반사율 스펙트럼에 짧은-간격 교정이 적용된 이후 반사율 스펙트럼으로부터 계산된 혈액 적혈구용적 대 최대 헴 흡수도를 나타낸다. 교정된 데이터에서 보다 강한 선형 관계가 발견되며, 교정된 스펙트럼 데이터를 기초로 PLS 모델과 같은 예상 모델들이 환자들 및 다른 대상자들의 적혈구용적 레벨을 보다 정확하게 추정할 수 있게 제시된다.
PCA
로딩 교정의 스펙트럼 효과
예 3
측정된 스펙트럼 반사율 데이터에 대한 PCA 로딩 교정의 효과를 평가하기 우해, 반사율 스펙트럼 세트는 손잡이 운동(handgrip exercise)을 수행하는 인체 대상자로부터 수집되며, 다수-대상자 정맥혈 pH 모델이 반사율 측정치를 기초로 전개 및 평가된다. 손잡이 운동 프로토콜은 15% 최대의 수의적 수축(MVC, maximum voluntary contraction), 30% MVC, 45% MVC, 및 60% MVC의 4개의 상이한 작업 레벨(effort level)에서 대상자 손의 2초 수축, 이어서 1초 완화를 포함한다. 운동 강도가 증가함에 따라, 각각의 운동 기간 마지막에서 pH가 낮은 레벨로 떨어진다. 각각의 기간은 길이가 5분이며, 기간들은 40분 파트로 수행된다. 혈액은 측정 근육에 근접한 정맥에 위치된 정맥 카테터(venous catheter)로부터 흡수된다. 샘플들은 각각의 주기 직전에(베이스 라인 pH 측정치를 제공하도록), 운동 주기 동안 분 마다, 그리고 운동 후 5,10 및 20분 마다 얻어진다. 혈액 샘플은 정맥 pH를 결정하도록 I-Stat CG4++ 카트리지(뉴저지, 이스트 윈소르, i-STAT로부터 입수가능)를 사용하여 측정된다. 스펙트럼 반사율 측정은 도 13에 도시된 실시예와 유사한 분광계 시스템(100)의 실시예를 사용하여 이루어진다.
스펙트럼 반사율 데이터는 6개의 상이한 대상자로부터 측정된다. PLS-기반 pH 예측 모델의 정확도는 "리브-원-서브젝트-아웃(leave-one-subject-out)" 교차 타당성 검사(cross validation procedure)를 사용하여 스펙트럼 반사율 데이터의 PCA 로딩 교정 이전 및 이후에 추정된다. 이 과정에서, 각각의 대상자에 대한 pH 검출은 다른 5 대상자에 대해 측정된 데이터로부터 전개되는 보정식을 기초로 이루어진다. pH정확도는 NIRS 반사율 측정 및 정맥혈 분석으로부터 얻어진 pH 값들 간 의 예측 오차의 평균 제곱근(RMSEP, root mean square error of prediction)을 계산함으로써 추정된다.
도 14는 PCA 로딩 교정이 적용되기 이전에 단일 pH 값(약 7.35)에서 상이한 대상자들로부터의 교정 스펙트럼 세트를 나타낸다. 도 15는 PCA 로딩 교정이 적용된 이후 동일한 교정 스펙트럼 세트를 나타낸다. 교정 과정의 적용에 이어, 동일한 pH에서의 스펙트럼은 거의 일치한다. 이는 예를 들어, 근육 pH와 같이, 해당 분석물과 관련되지 않는 측정된 반사율 데이터에서의 대상자들간(subject-to-subject) 변이 감소와 일치한다.
손잡이 운동 기간 동안 수집된 혈액 샘플 및 반사율 스펙트럼으로부터의 PLS를 사용하여 보정식이 전개된다. 혈액 pH 값들은 적절한 경우, 측정된 스펙트럼 데이터에 해당하는 시간 간격에서 보간된다(interpolated). 도 16은 리브-원-서브젝트-아웃 교차-타당성에 따른 교정으로, 교정되지 않은 반사율 스펙트럼에 대해 (NIRS 측정치로부터) 예측된 pH 대 (정맥혈에 대해) 측정된 pH의 결과를 나타낸다. 도면에서의 대각선 라인은 측정된 pH 값과 예측된 pH 값 간의 완전한 매칭을 나타낸다. 교정되지 않은 스펙트럼에 기초한 pH 예측은 측정된 pH 값과 예측된 pH 값 간의 일치가 강하지 않다는 것을 나타내는, 약 0.44의 검출 계수(R2)에 의해 측정된 평균 상관성을 갖는다.
도 17은 PCA 로딩 교정 방법을 이용하여 교정되는 반사율 스펙트럼을 기초로 측정된 pH 값 대 예측된 pH 값의 결과를 나타낸다. 교정된 스펙트럼을 기초로한 측정된 pH 값과 예측된 pH 값 간의 일치에 대한 R2는 약 0.64로, 예측된 pH 값들은 대각선 라인을 따라 보다 밀접하게 밀집되어 교정된 스펙트럼에 기초한 pH가 도 16의 모델 보다 상당히 정확하다는 것을 나타낸다. RMSEP는 0.025 pH 유닛으로, 이는 대각선 부근에서 관찰된 산란을 나타낸다.
조합된 교정 알고리즘의 스펙트럼 효과
예 4
다중 스펙트럼 교정 알고리즘 조합 효과를 평가하기 위해, 3-층(예를 들어, 피부, 지방 및 근육) 조직형 솔리드 팬텀(solid phantom)이 마련된다. 아가(Agar)(MO, 루이스 스트리트 Sigma-Aldrich Inc.로부터 입수가능한 Agar A 7049)가 팬텀에 대한 솔리드 베이스 물질로 사용된다. (IL, 디어필드, Baxter Healthcare Corp.에서 입수가능한) 인트라리피드(intralipid)가 산란층으로 사용된다. 제조는 예를 들어 R. Cubeddu 등에 의해 Physics in Medicine and Biology 42 , 1971(1977)에 개시된 과정과 유사한 과정을 따르며, 상이한 흡수재(absorber)가 사용된다는 것을 제외하고 상기 문헌의 전체 내용은 본 명세서에서 참조된다. 각각의 층은 개별적으로 제조되며, 피부 및 지방 층들은 근육층 상부에 위치된다.
각각의 팬텀은 흡수재로서 0.15mg/mL 멜라닌(MO, 루이스 스트리트 Sigma-Aldrich Inc.로부터 입수가능한 Melanin M 8631)을 갖는 1.0mm 두께의 피부층을 포함한다. 근육층에서의 흡수재는 6×10-4 mL/mL 인디아 잉크(IL, 데스 플레인, Scientific Device Lab Inc.로부터 입수가능) 2.2% 용액 및 가변 농도의 NIR 염료 ADS780WS(캐나다, 퀘벡, American Dye Source, Inc.로부터 입수가능)이다.
인디아 잉크의 농도는 약 2.2%인 조직내 혈액의 농도를 기초로 선택된다. NIR 염료는 탈산소 헤모글로빈과 유사하게 약 780nm의 파장에서 최대 흡수도를 갖는 반면, 인디아 잉크는 비교적 파장과 무관한 흡수 특성을 갖는다. 통상적으로 사람의 지방은 매우 낮은 흡수율을 갖기 때문에 지방층으로 흡수재가 주입되지 않는다. 피부 및 지방에 대한 감소된 산란 계수(μs')는 각각 1.5mm-1 및 1.2mm-1이다. 조직 팬텀은 각각의 팬텀이 0.5mm-1, 0.65mm-1, 또는 0.8mm-1의 근육-감소 산란 계수(μs'), 2.0mm, 4.0mm, 또는 6.0mm의 지방 두께, 및 6.67μg/mL, 9.08μg/mL, 13.31μg/mL, 15.76μg/mL, 17.92μg/mL, 20.22μg/mL, 22.58μg/mL, 24.82μg/mL, 또는 26.68μg/mL의 근육 염료(dye) 농도를 갖도록 마련된다. 상기 근육 염료 농도중 하나의 농도를 갖는 조직 팬텀 세트들은 세트 각각의 멤버가 3개의 상이한 지방 두께 레벨중 하나와 3개의 상이한 근육 산란 계수중 하나를 갖도록 제조된다. 이를 테면, 9개의 상이한 팬텀이 동일한 근육 염료 농도로 마련된다. 팬텀들은 3일의 기간에 걸쳐, 저, 중 또는 고 근육 염료 농도를 갖는 27개 팬텀들의 3개 그룹으로 제조된다. 샘플들은 수분 손실을 방지하도록 플라스틱으로 밀봉되고, 광 표백(photo bleaching)을 방지하도록 알루미늄 호일로 커버되고 제조 이후 하루 정도 랜덤하게 측정되는 냉장고에 저장된다.
2.5mm 및 30mm 소스-검출기(SD) 간격에서 팬텀들 각각의 반사율 스펙트럼은 시스템(100)을 사용하여 측정된다. 8.5W 텅스텐 램프(NY, 스캐니아텔레스, Welch-Allyn Corp.로부터 입수가능한 모델 7106-003)는 팬텀 조명을 위해 사용되며 분광계(FL, 두네딘, Ocean Optics Inc.로부터 입수가능한 USB2000)는 스펙트럼 반사율 데이터를 수집하는데 이용된다. 시스템(100)의 2-간격 프로브는 하나의 검출기 섬유 다발과 검출기로부터 30mm(긴 간격) 및 2.5mm(짧은 간격) 떨어진 2개의 소스 섬유 다발을 포함한다. 검출기 섬유 다발의 직경은 1.0mm이고, 긴 간격 및 짧은 간격에서 소스 섬유 다발의 직경은 각각 3.5mm 및 1.0mm이다. 반사율 스펙트럼을 교정하는 동안, 검출기 다발은 분광계에 접속되는 반면, 2개의 소스 섬유 다발은 온-축 또는 오프-축 배향을 통해 램프에 접속된다. 컴퓨터 제어 셔터 시스템(110)은 단지 하나의 소스 섬유 다발이 램프에 의해 조명되도록 2개의 소스 섬유 위치들 사이에서 스위치되도록 램프 정면에 위치된다.
반사율 스펙트럼은 단지 실질적으로 팬텀의 피부 및 지방 층들로부터 짧은 간격(2.5mm SD)에서 포착된 정보를 수집한다. 긴 간격(30mm SD)에서 수집된 스펙트럼은 피부, 지방 및 근육 층들로부터의 스펙트럼 정보를 포함한다.
팬텀은 교정 및 테스트 샘플 세트로 분리된다. 교정 세트의 샘플들은 교정 동안 열악하게 및/또는 불완전하게 모델링되는 샘플들에 대한 PLS 모델 예측을 테스트하기 위해 교정 세트에 있는 것과 상이한 특성을 갖게 선택된다. 특히, 2.0mm의 지방 두께 및 다양한 염료 농도 및 근육 산란 계수(27개 팬텀 전체)를 가지는 팬텀들이 테스트 샘플로서 사용된다. 각각의 다양한 염료 농도 및 근육 산란 계수에 대한 4.0mm 또는 6.0mm 지방 두께를 갖는 나머지 샘플들(54개 팬텀 전체)이 교 정을 위해 사용된다. 2.0mm 두께의 지방층을 가지는 교정 샘플도 없고, 4.0mm 또는 6.0mm 두께의 지방층을 가지는 테스트 샘플도 없다.
팬텀 근육의 염료 농도에 대한 PLS 모델은 교정 샘플 데이터를 이용하여 생성되며, 모델은 테스트 샘플 스펙트럼으로부터 근육 염료 농도를 예측함으로써 유효화된다. 리브-원-아웃(leave-one-out) 교차-타당성은 다수의 PLS 모델 팩터를 결정하기 위해 이용된다. 다양한 스펙트럼 교정 방법을 평가하기 위해, PLS 회귀분석법(regression)은 PCA 로딩 교정 및/또는 짧은-간격 교정 및/또는 SNV 스케일링 교정을 이용 및 이용하지 않고 수행된다. 700nm 내지 900nm 범위의 스펙트럼 파장에서의 데이터가 분석에 이용된다. PLS 모델의 예측 정확도는 추정된 염료 농도와 실제 염료 농도 간의 R2(검출 계수), 및 추정된 측정치 에러에 의해 개시되며, 상기 추정된 측정치 에러는 하기 식에 따른 RMSEP(root mean squared error of prediction)로 계산된다:
여기서 N은 테스트 샘플의 개수이고, 및 yi는 추정된 염료 농도 및 실제 염료 농도이다. 큰 R2 값 및 낮은 RMSEP는 PLS 모델이 팬텀 샘플에서의 염료 농도를 정확하게 예측한다는 것을 나타낸다.
다양한 스펙트럼 교정 및 데이터 분석 알고리즘은 프로그래밍 언어(MA, 나틱, The Mathworks Inc.로부터 입수가능) 7.0 버전 및 (WA, 만 손, Eigenvector Research Inc.로부터 입수가능) 3.5 버전으로 기록된 프로그램에서 구현된다.
하기 예에서, 짧은-간격 교정이 다른 스펙트럼 교정 방법과 조합되어 반사율 스펙트럼에 적용될 때, 짧은-간격 교정이 먼저 적용된다. PCA 로딩 교정이 다른 스펙트럼 교정 방법과 조합되어 반사율 스펙트럼에 적용될 때, PCA 로딩 교정은 마지막에 적용된다. 예를 들어, 짧은-간격, SNV, 및 PCA 로딩 교정이 스펙트럼 데이터에 적용될 때, 짧은-간격 교정이 먼저 적용되고, 이어서 SNV 교정, 및 최종으로 PCA 로딩 교정이 적용된다.
동일한 염료 농도(예를 들어, n=6)를 갖는 6개의 교정 샘플들이 스펙트럼 데이터의 PCA 로딩 교정을 위한 PCA 로딩을 얻기 위해 이용된다. PCA 로딩이 얻어지는 염료 농도는 차후 "교정(calibration)" 염료 농도로 간주된다. 로딩들은 6개의 교정 샘플 세트에 대한 PCA로부터 얻어지며, 6개 샘플 각각의 세트는 9개의 상이하게 선택된 염료 농도 중 하나를 갖는다. 6개 샘플 각각의 세트에 대한 반사율 스펙트럼은 계산된 로딩 벡터에 대한 파라미터 및 방법들의 효과를 시험하기 위한 스펙트럼 교정 방법들의 상이한 조합을 이용하여 교정된다. PCA 로딩 교정에 사용되는 다수의 로딩 벡터들을 결정하기 위해, 리브-원-아웃 교차-타당성 교정 과정이 팬텀 샘플에서의 염료 농도에 대해 PLS 모델에 이용된다. 교정은 선택된 염료 농도 각각에서 1, 2, 3, 4 및 5 PCA 로딩 벡터를 이용하여 수행된다. 로딩 벡터의 수 및 교차-타당성의 최소 예측 오차의 평균 제곱근(RMSEP)을 산출하는 선택된 염료 농도는 스펙트럼 교정 방법의 평가를 위해 선택된다. 제1 4개의 로딩 벡터들이 20.22㎍/mL의 염료 농도를 갖는 교정 스펙트럼 상에서 PCA로부터 얻어진다는 것이 결정된 팬텀 분석은 테스트 샘플들에 대한 최상의 예측 결과를 제공한다. 3개의 스펙트럼 교정 방법들 - 짧은-간격 상부층 교정, SNV 교정, 및 PCA 로딩 교정 -은 상기 조건들 하에서 개별적으로 그리고 조합되어 비교된다.
도 18은 수용액에서 ADS780WS 염료의 흡수 스펙트럼을 나타낸다. 도 19 및 도 20은 각각 팬텀들의 짧은 간격(예를 들어, 2.5mm) 및 긴 간격(예를 들어, 30mm) 조명에 대한 팬텀 흡수도 스펙트럼을 나타낸다. 도 21은 앞서 개시된 바와 같이, 짧은-간격 교정 방법을 적용함으로써 교정된 긴 간격 흡수도 스펙트럼을 나타낸다. 도 19의 짧은 간격 흡수도 스펙트럼은 팬텀에서 근육층 위에 놓인 단지 피부 및 지방 층들로부터의 반사된 광을 나타낸다. 흡수도 곡선의 하향-기울어진 형상은 피부층에서 흡수재 멜라닌의 특성이다. 또한, 다양한 곡선들 중에서 베이스라인 이동은 다양한 팬텀들 중에서 상이한 지방층 두께로 인한 것이다.
도 20에서 긴 간격 스펙트럼은 도 18에 도시된 염료 용액 스펙트럼과 유사한 스펙트럼 형상을 갖는다. 긴-간격 스펙트럼은 염료가 위치되는 팬텀 근육층들로부터 반사된 광으로부터의 기여도를 포함한다. 예를 들어, 700nm 내지 750nm 사이의 흡수 변이는 염료 흡수에 따른 피부 흡수 중첩 및 지방 및 근육 산란 작용으로 인한 것이다. 짧은-간격 교정은 스펙트럼 흡수도 데이터로부터 피부 흡수 및 지방 산란 작용을 감소 및/또는 제거한다. 도 21에 도시된 것처럼, 형성되는 교정된 스펙트럼은 도 20의 교정되지 않은 스펙트럼 보다 도 18에 도시된 스펙트럼과 거의 일치하고 보다 더 유사하다. 그러나, 베이스라인 변이는 샘플들 사이에서 근육층 의 광학적 특성에서의 변이(예를 들어 근육층 산란 변이)로 인한 것이다. PCA 로딩 교정 알고리즘은 팬텀들 중에서 근육층의 광학적 특성의 비균일성으로부터 야기되는 변이를 감소 또는 제거하는데 이용될 수 있다.
도 22-27은 6개의 교정 샘플들의 흡수도 스펙트럼을 나타내며, 이들 각각은 20.22㎍/mL의 염료 농도, 및 지방층 두께(4.0mm 또는 6.0mm) 및 근육 산란 계수(0.5mm-1, 0.65mm-1, 또는 0.8mm-1)의 상이한 조합을 갖는다. 도 22는 교정되지 않은 흡수 스펙트럼을 나타낸다. 지방 및 근육 산란 및 피부 흡수로 인한 스펙트럼 작용이 다양한 팬텀들에서 완벽하게 교정될 경우, 동일한 염료 농도에 해당하는 스펙트럼들은 중첩된다. 도 22에 도시된 스펙트럼에서, 일부 베이스라인 이동 및 평탄화(flattening)는 700mm 내지 800mm 사이에서 관찰되며, 이들의 산란 및 흡수 작용에 기여한다.
도 23은 상부에 놓인 피부 및 지방 층들에 대한 짧은-간격 교정이 스펙트럼에 적용된 이후, 도 22의 스펙트럼을 나타낸다. 교정된 스펙트럼은 적용된 교정 결과로서 서로 근접하며, 도 18의 흡수대와 보다 유사한 형상을 갖는다. 그러나, 교정된 스펙트럼, 예를 들어 약 780nm의 흡수 피크 부근의 스펙트럼 영역에서는 여전히 약간의 차가 있다. 이러한 변이는 근육층 산란으로 발생되며, 이는 짧은-간격 알고리즘 및 방법에 의해 교정되지 않는다.
도 24는 SNV 스케일링 교정이 적용된 이후 도 22로부터의 스펙트럼을 나타낸다. 스펙트럼은 SNV 방법의 적용에 따라 서로 근접하나, 스펙트럼의 비교적 평탄 한 형상은 피부 및 지방 흡수 및 산란이 SNV 방법 단독으로는 교정되지 않는다는 것을 나타낸다. 일반적으로, SNV 방법은 샘플 스펙트럼에서의 변이가 분석물 변이 보다는, 주로 산란에 의해 야기될 때 다중 샘플들에서의 산란 차를 감소 및/또는 제거하는데 이용될 수 있다.
도 25는 PCA 로딩 교정이 스펙트럼에 적용된 이후 도 22로부터의 스펙트럼을 나타낸다. 20.22㎍/mL의 염료 농도를 가지는 교정 샘플의 PCA로부터 얻어진 4개의 로딩은 도 22에 도시된 흡수 스펙트럼을 교정하는데 이용된다. 도 25에 도시된 교정된 스펙트럼은 원래의 교정되지 않은 스펙트럼 보다 서로 더 가깝다. 그러나, 교정된 스펙트럼은 샘플의 피부층의 멜라린 흡수에 기여하는 스펙트럼 피쳐를 나타낸다.
다양한 교정 방법의 조합이 흡수도 스펙트럼에 적용될 수 있다. 도 26은 짧은-간격 교정 및 SNV 스케일링 교정이 연속적으로 적용된 이후 도 22의 스펙트럼을 나타낸다. 도 23의 짧은-간격 교정 스펙트럼과 비교할 때, 도 26의 스펙트럼이 서로 더 가깝고 베이스라인 변이는 여전히 존재하긴 하나 감소된다.
도 27은 짧은-간격 교정 이후 도 22로부터의 스펙트럼을 나타내며, SNV 스케일링 교정, 및 PCA 로딩 교정이 연속적으로 적용된다. 도 27에서 스펙트럼은 고도로 중첩되며, 이들의 형상은 700nm 내지 780nm의 단파장 영역에서 도 18에 도시된 염료 스펙트럼과 비교적 가깝게 유사하다. 스펙트럼 흡수 데이터에 3개의 모든 교정 방법의 적용은 피부 및 지방층 흡수 및 산란으로 인한 스펙트럼 기여도 및 근육층의 광학적 특성에서의 분석물-무관 변이로부터 야기되는 상이한 근육 산란 계수 를 상당시 감소시킨다.
PLS 예측 모델은 교정 데이터를 기초로 구성되며 테스트 샘플에서의 염료 농도 값을 예측하는데 이용된다. 교정 및 테스트 샘플들에 대한 스펙트럼 흡수 데이터는 교정되지 않거나, 또는 짧은-간격 교정만을 적용함으로써, SNV 스케일링 교정만을 적용함으로써, PCA 로딩 교정만을 적용함으로써, 짧은-간격 및 SNV 스케일링 교정의 조합, 짧은-간격 및 PCA 로딩 교정의 조합, SNV 스케일링 및 PCA 로딩 교정의 조합, 또는 짧은-간격, SNV 스케일링 및 PCA 로딩 교정의 조합에 의해 교정된다. 모델 예측 결과의 요약이 표 4에 도시된다. 각각의 PLS 모델은 큰 R2 값(0.95 이상)을 가지며, 이는 예측된 염료 농도와 측정된 염료 농도 간에 존재하는 강한 상관관계를 나타낸다. 임의의 스펙트럼 처리 없이, 예측된 염료 농도와 측정된 염료 농도가 상당히 상관되더라도, 큰 예측 에러가 발생된다: RMSEP는 4.31㎍/mL이며 이는 전체 농도 범위(26.68㎍/mL 내지 6.67㎍/mL)의 21.54% 에러에 해당한다.
짧은-간격 교정만을 이용하여, SNV 스케일링 교정만을 이용하여, 또는 PCA 로딩 교정만을 이용하여, PLS 모델의 RMSEP가 감소된다. 2개의 상이한 교정 방법의 조합은 PLS 모델의 RMSEP를 보다 감소시키며, 3개 모든 교정 방법의 조합은 어떠한 교정 방법도 사용되지 않은 PLS 모델에 비해 RMSEP에서 가장낮은 RMSEP, 1.08㎍/mL, 5.3% 퍼센테이지 에러 및 3-폴드(fold)는 감소를 갖는 PLS 모델을 산출한다.
표 4
| 스펙트럼 교정 방법 | R2 | RMSEP(㎍/mL) | 퍼센테이지 에러 | 팩터 수 |
| 없음 | 0.96 | 4.31 | 21.5 | 7 |
| 짧은-간격 만 | 0.97 | 3.86 | 19.3 | 7 |
| SNV 스케일링 만 | 0.97 | 3.16 | 15.8 | 2 |
| PCA 로딩 만 | 0.95 | 3.66 | 18.3 | 6 |
| 짧은-간격+SNV | 0.96 | 2.55 | 12.7 | 2 |
| 짧은-간격+PCA | 0.96 | 2.69 | 13.4 | 3 |
| SNV+PCA | 0.97 | 1.88 | 9.4 | 6 |
| 짧은-간격+SNV+PCA | 0.97 | 1.08 | 5.3 | 4 |
일부 실시예에서, 스펙트럼 교정 방법들의 사용은 PLS 모델에 사용되는 팩터의 수를 감소시킬 수 있다. 예를 들어, PCA 로딩 교정이 단독으로 또는 다른 교정 방법들과 조합되어 사용될 때, 팩터 모델의 수는 교정되지 않은 스펙트럼 흡수 데이터를 기초로 모델에서 사용되는 7개 미만의 팩터이다. 예로써, 3개의 교정 모델이 조합되어 사용될 때, 샘플의 근육층에서 염료 농도에 대한 PLS 모델은 4 모델 팩터를 사용한다. 농도 모델에 대한 이러한 팩터 개수 감소는 피부 색, 지방층 두께, 및 PLS 회귀분석법으로 모델링되는 근육층 광학 특성으로 인한 변이가 스펙트럼 데이터의 교정으로 제거되기 때문에 달성된다.
모델 예측 결과는 스펙트럼 흡수 데이터의 교정이 이용되지 않은 도 28, 및 짧은-간격, SNV 스케일링 및 PCA 로딩 교정의 조합을 사용하는 스펙트럼 데이터의 교정을 이용하는 도 29에 도시된다. 각각의 도면에서 대각선은 정확한 예측을 나타낸다. 도 28 및 도 29를 비교하면, 3개의 상이한 교정 방법을 사용한 스펙트럼 데이터 교정 이후, 예측 결과는 대각선 통합선을 따라 보다 밀집되게 집중되며, PLS 모델의 예측 값은 더 크다.
예 5
본 명세서에 개시된 스펙트럼 교정 방법들은 신체 조직 스펙트럼에 적용된다. 예를 들어, 해당 특정 분석물이 각각 동일한 값을 가지는 상이한 대상자들과 대응하는 스펙트럼이 이용될 때, PCA 로딩 교정은 스펙트럼에 기초한 PLS 모델을 개선시키는데 이용될 수 있다. 예로써, pH 값의 범위는 운동 기간 동안 대상자에 대해 얻어질 수 있다. 일반적으로, 젖산이 생성됨에 따라 운동하는 동안 근육 및 혈액 pH가 감소되어 운동이 중단될 때 pH는 베이스라인 값으로 빠르게 복귀된다. 흡수도 스펙트럼이 운동 주기 동안 지속적으로 기록되고 근육 및/또는 혈액 pH가 동시적으로 모니터링될 때, 상이한 시간에서 유사한 운동 프로토콜을 수행하는 상이한 대상자들로부터의 동일한 pH 값들에 해당하는 스펙트럼 데이터를 얻을 수 있다.
인체 대상자로부터의 스펙트럼 데이터에 대한 PCA 로딩 교정 방법을 평가하기 위해, 스펙트럼 세트 및 혈액 pH 측정치는 반복적인 손잡이 운동 프로토콜을 수행하는 3명의 신체 대상자의 팔뚝으로부터 수집된다. 각각의 대상자는 4초 동안 테스트 장치를 압착한 다음, 2초 동안 완화되고, 이러한 패턴을 전체 5분의 기간 동안 반복한다. 각각의 대상자는 4개의 상이한 운동 프로토콜을 상이하고, 연속적으로 증가하는 힘 레벨로 각각의 프로토콜 사이에 30분의 휴식 기간을 두고 수행한다.
도 30은 운동 프로토콜 동안 시간 포인트들에서 3명의 신체 대상자로부터 수집된 흡수도 스펙트럼 세트를 나타내며, 각각의 대상자의 혈액 pH는 7.37±0.001이다. 짧은-간격 및 SNV 스케일링 교정이 스펙트럼 데이터 세트에 적용된다. 도 31은 PCA 로딩 교정이 추가로 적용된 이후, 도 30에 도시된 흡수도 스펙트럼과 동일한 세트이다. 도 31에서의 흡수도 스펙트럼은 도 30에서의 스펙트럼의 PCA로부터 얻어진 제1 4개의 로딩 벡터들로 직교화된다. 스펙트럼 데이터의 PCA 로딩 이후, 상이한 대상자들로부터의 스펙트럼이 상당히 많이 중첩되며, 이는 pH와 상관되지 않는 한 대상자에서 다른 대상자로 근육 조직에서의 광학적 특성 변이로 인한 스펙트럼 기여도가 상당시 감소되었다는 것을 나타낸다.
도 32는 측정된 모든 pH 값들에서 운동 주기 동안 3명의 신체 대상자 각각으로부터의 모든 스펙트럼을 나타낸다. 짧은-간격 및 SNV 스케일링 교정이 스펙트럼 데이터에 적용된다. 도 33은 PCA 로딩 교정이 추가로 적용된 이후 도 32로부터의 데이터를 나타낸다. 데이터는 7.37±0.001 pH에 해당하는 도 30의 교정 스펙트럼의 PCA로부터 얻어진 제1 4개의 로딩 벡터와 직교화된다. PCA 로딩 교정의 적용은 근육 조직 광학 특성에서의 대상자-대-대상자 변이로 인한 스펙트럼의 변이를 상당히 감소시킨다. 도 33에 도시된 스펙트럼들 간의 변이는 통상적으로 근육 pH 레벨에서의 운동-유도 변화로부터 야기되는 흡수도 변이에 해당한다.
다른 실시예들
본 발명은 본 명세서의 상세한 설명과 관련하여 개시되었지만, 상기 설명들은 본 발명의 범주를 제한하고자 하는 것이 아니며 설명을 위한 것으로, 본 발명의 범주는 첨부된 특허청구범위의 범주에 의해 정의된다. 다른 특징, 장점 및 변형이 하기 특허청구범위의 범주내에서 이루어질 수 있다.
Claims (37)
- 측정 시스템으로서,(a) 광원 ;(b) 검출 시스템 ;(c) 상기 광원으로부터의 광이 샘플로 전송되게 하고 상기 샘플로부터 반사된 광을 수신하여 상기 검출 시스템으로 지향하게 하는 적어도 제1 광 포트, 제2 광 포트 및 제3 광 포트의 세트 ― 상기 제1 광 포트와 상기 제3 광 포트 간의 간격은 제1 간격이고, 상기 제2 광 포트와 상기 제3 광 포트 간의 간격은 제2 간격이며, 상기 제1 간격은 상기 제2 간격보다 더 크며, (i) 상기 제1 광 포트 및 상기 제2 광 포트는 전송 광 포트들이고 상기 제3 광 포트는 수신 광 포트이거나, 또는 (ii) 상기 제1 광 포트 및 상기 제2 광 포트는 수신 광 포트들이고 상기 제3 광 포트는 전송 광 포트이며,상기 검출 시스템은, 상기 제1 간격에 대응하고 상기 샘플 내의 내부 타겟 및 상기 내부 타겟 상부에 놓인 피쳐(feature)들에 대응하는 정보를 포함하는 제1 데이터 세트, 및 상기 제2 간격에 대응하고 상기 내부 타겟 상부에 놓인 피쳐들에 대응하는 정보를 포함하는 제2 데이터 세트를 생성함 ― ; 및(d) 상기 내부 타겟을 나타내는 교정된 정보를 생성하기 위해서 상기 제1 데이터 세트 및 상기 제2 데이터 세트를 이용하여 상기 제1 데이터 세트로부터 상기 상부에 놓인 피쳐들의 정보 특징을 제거하도록 구성되는 프로세서를 포함하는,측정 시스템.
- 제1항에 있어서,상기 적어도 제1 광 포트, 제2 광 포트 및 제3 광 포트의 세트는 단일 프로브 상에 위치되는,측정 시스템.
- 제1항에 있어서,상기 검출 시스템은 스펙트럼 검출 시스템이고,상기 제1 데이터 세트 및 상기 제2 데이터 세트는 제1 스펙트럼 세트 및 제2 스펙트럼 세트를 포함하며,상기 프로세서는 상기 내부 타겟을 나타내는 교정된 스펙트럼 정보를 생성하기 위해서 상기 제1 스펙트럼 세트 및 상기 제2 스펙트럼 세트를 이용하여 상기 제1 스펙트럼 세트로부터 상기 상부에 놓인 피쳐들의 스펙트럼 정보 특징을 제거하는,측정 시스템.
- 제1항에 있어서,상기 제2 간격은 1mm 내지 5mm인,측정 시스템.
- 제1항에 있어서,상기 제2 간격은 1.5mm 내지 3.5mm인,측정 시스템.
- 제1항에 있어서,상기 제1 간격은 10mm 보다 더 큰,측정 시스템.
- 제1항에 있어서,상기 제1 전송 광 포트 또는 제2 전송 광 포트로부터의 광이 상기 샘플을 조명하는지 여부를 제어하기 위한 셔터 시스템을 더 포함하는,측정 시스템.
- 제3항에 있어서,상기 스펙트럼 검출 시스템은 광을 수신하고 그리고 상기 수신된 광으로부터 스펙트럼 세트들을 생성하도록 구성되는 분광계를 포함하는,측정 시스템.
- 제3항에 있어서,상기 스펙트럼 검출 시스템은,상기 제1 수신 광 포트로부터 광을 수신하고, 그리고 상기 제1 스펙트럼 세트를 생성하도록 구성되는 제1 분광계, 및상기 제2 수신 광 포트로부터 광을 수신하고, 그리고 상기 제2 스펙트럼 세트를 생성하도록 구성되는 제2 분광계를 포함하는,측정 시스템.
- 제2항에 있어서,프로브 헤드는 상기 샘플로부터의 열을 방산시키기 위한 열 전도성 물질을 포함하는,측정 시스템.
- 제1항에 있어서,전송 광 포트들 및 수신 광 포트들 사이에 열-전도성 브리지(bridge)를 더 포함하는,측정 시스템.
- 제3항에 있어서,상기 프로세서는, 상기 내부 타겟 내의 관심있는 분석물(analyte)과 관련되지 않은 상기 내부 타겟의 광학적 산란 특성들의 변이들을 특징으로 하는 스펙트럼 정보를 상기 제1 스펙트럼 세트로부터 제거하도록 추가로 구성되는,측정 시스템.
- 제3항에 있어서,상기 프로세서는, 상기 내부 타겟 내의 관심있는 분석물과 관련되지 않은 상기 내부 타겟의 광학적 산란 특성들의 변이들을 특징으로 하는 스펙트럼 정보를 상기 내부 타겟을 나타내는 상기 교정된 스펙트럼 정보로부터 제거하도록 추가로 구성되는,측정 시스템.
- 제1항에 있어서,상기 광원은 전자기 스펙트럼의 근적외선 영역에서의 광을 제공하는,측정 시스템.
- 제1항에 있어서,상기 광원은 백열 광원 부재, 발광 다이오드, 레이저 다이오드, 및 레이저 중 적어도 하나를 포함하는,측정 시스템.
- 제1항에 있어서,상기 광원은 발광 다이오드들의 어레이를 포함하는,측정 시스템.
- 제3항에 있어서,상기 프로세서는, 상기 교정된 스펙트럼 정보를 생성하기 이전에 상기 제1 스펙트럼 세트 및 상기 제2 스펙트럼 세트를 서로에 대해 정규화(normalize)하도록 구성되는,측정 시스템.
- 제12항에 있어서,상기 프로세서는, 다수의 샘플들로부터의 스펙트럼 세트로부터 결정된 주성분들의 로딩 벡터들의 세트에 대해 상기 제1 스펙트럼 세트를 직교화함으로써 상기 제1 스펙트럼 세트로부터 상기 내부 타겟의 광학적 산란 특성들에서의 변이들을 특징으로 하는 스펙트럼 정보를 제거하도록 구성되는,측정 시스템.
- 제19항에 있어서,상기 다수의 샘플들은 선택된 범위 내에서 상기 내부 타겟의 특성을 갖는,측정 시스템.
- 제19항에 있어서,상기 프로세서는보정 스펙트럼의 주성분들에 대응하는 로딩 벡터들의 세트를 결정하기 위해 보정 스펙트럼 세트에 대한 주성분 분석을 수행하는 단계;상기 주성분 분석으로부터 하나 이상의 직교화 팩터들을 결정하는 단계;상기 직교화 팩터들의 개수와 동일한 적어도 하나의 차원(dimension)을 갖는 로딩 매트릭스를 형성하는 단계; 및상기 로딩 매트릭스에 대하여 상기 제1 스펙트럼 세트를 직교화하는 단계를 포함하는 단계들의 세트를 수행함으로써, 상기 제1 스펙트럼 세트를 직교화시키도록 구성되는,측정 시스템.
- 측정 시스템에 의해 측정된 샘플 내에서의 내부 타겟에 대응하는 정보를 교정하는 방법으로서,상기 측정 시스템은 광원, 검출 시스템, 및 상기 광원으로부터의 광이 샘플로 전송되게 하고 상기 샘플로부터 반사된 광을 수신하여 상기 검출 시스템으로 지향하게 하는 적어도 제1 광 포트, 제2 광 포트 및 제3 광 포트의 세트를 포함하고, 상기 제1 광 포트와 상기 제3 광 포트 간의 간격은 제1 간격이고, 상기 제2 광 포트와 상기 제3 광 포트 간의 간격은 제2 간격이며, 상기 제1 간격은 상기 제2 간격보다 더 크며, (i) 상기 제1 광 포트 및 상기 제2 광 포트는 전송 광 포트들이고 상기 제3 광 포트는 수신 광 포트이거나, 또는 (ii) 상기 제1 광 포트 및 상기 제2 광 포트는 수신 광 포트들이고 상기 제3 광 포트는 전송 광 포트이며,상기 측정 시스템에 의해 측정된 샘플 내에서의 내부 타겟에 대응하는 정보를 교정하는 방법은,상기 하나 이상의 광 포트들의 세트를 이용하여 상기 샘플을 조명하는 단계;상기 검출 시스템을 이용하여 상기 반사된 광을 검출하는 단계;상기 제1 간격에 대응하고 상기 샘플 내의 내부 타겟과 상기 내부 타겟 상부에 놓인 피쳐들에 대응하는 정보를 포함하는 제1 데이터 세트, 및 상기 제2 간격에 대응하고 상기 내부 타겟 상부에 놓인 피쳐들에 대응하는 정보를 포함하는 제2 데이터 세트를 생성하는 단계; 및상기 내부 타겟을 나타내는 교정된 정보를 생성하기 위해 상기 제1 데이터 세트 및 상기 제2 데이터 세트를 이용하여 상기 제1 데이터 세트로부터 상기 상부에 놓인 피쳐들의 정보 특성을 제거하는 단계를 포함하는,측정 시스템에 의해 측정된 샘플 내에서의 내부 타겟에 대응하는 정보를 교정하는 방법.
- 제22항에 있어서,상기 검출 시스템은 스펙트럼 검출 시스템이고,상기 제1 데이터 세트 및 상기 제2 데이터 세트는 제1 스펙트럼 세트 및 제2 스펙트럼 세트를 포함하며,상기 제1 데이터 세트로부터 상기 상부에 놓인 피쳐들의 정보 특성을 제거하는 단계는, 상기 내부 타겟을 나타내는 교정된 스펙트럼 정보를 생성하기 위해 상기 제1 스펙트럼 세트와 상기 제2 스펙트럼 세트를 이용하여 상기 제1 스펙트럼 세트로부터 상기 상부에 놓인 피쳐들의 스펙트럼 정보 특성을 제거하는 단계를 포함하는,측정 시스템에 의해 측정된 샘플 내에서의 내부 타겟에 대응하는 정보를 교정하는 방법.
- 제23항에 있어서,상기 제1 스펙트럼 세트로부터 상기 샘플의 상기 상부에 놓인 피쳐들의 스펙트럼 정보 특성을 제거하는 단계는, 등식 에 따라 상기 제1 스펙트럼 세트와 상기 제2 스펙트럼 세트를 조합하는 단계를 포함하고,여기서, 은 상기 제1 스펙트럼 세트로부터의 스펙트럼이고, 는 상기 제2 스펙트럼 세트로부터의 스펙트럼이며, w는 가중치이고, "T"는 매트릭스 전치 연산을 나타내며, 는 상기 내부 타겟을 나타내는 교정된 스펙트럼 정보를 포함하는,측정 시스템에 의해 측정된 샘플 내에서의 내부 타겟에 대응하는 정보를 교정하는 방법.
- 제23항에 있어서,상기 교정된 스펙트럼 정보를 생성하기 이전에 상기 제1 스펙트럼 세트 및 상기 제2 스펙트럼 세트를 서로에 대해 정규화하는 단계를 더 포함하는,측정 시스템에 의해 측정된 샘플 내에서의 내부 타겟에 대응하는 정보를 교정하는 방법.
- 제25항에 있어서,상기 정규화하는 단계는 상기 제1 스펙트럼 세트 및 상기 제2 스펙트럼 세트 사이에 다항식 적합도(polynomial fit)를 적용하는 단계를 포함하는,측정 시스템에 의해 측정된 샘플 내에서의 내부 타겟에 대응하는 정보를 교정하는 방법.
- 제26항에 있어서,상기 다항식 적합도에서 이용되는 계수들은 하나 이상의 반사율 표준(reflectance standard)들로부터 기록된 상기 제1 스펙트럼 세트 및 상기 제2 스펙트럼 세트로부터 유도되는,측정 시스템에 의해 측정된 샘플 내에서의 내부 타겟에 대응하는 정보를 교정하는 방법.
- 제23항에 있어서,상기 내부 타겟 내의 관심있는 분석물과 관련되지 않는 상기 내부 타겟의 광학 특성들의 변이들을 특징으로 하는 스펙트럼 정보를 제거하기 위해 상기 제1 스펙트럼 세트를 처리하는 단계를 더 포함하는,측정 시스템에 의해 측정된 샘플 내에서의 내부 타겟에 대응하는 정보를 교정하는 방법.
- 제23항에 있어서,상기 내부 타겟 내의 관심있는 분석물과 관련되지 않는 상기 내부 타겟의 광학적 산란 특성들의 변이들을 특징으로 하는 스펙트럼 정보를 제거하기 위해 상기 내부 타겟을 나타내는 상기 교정된 스펙트럼 정보를 처리하는 단계를 더 포함하는,측정 시스템에 의해 측정된 샘플 내에서의 내부 타겟에 대응하는 정보를 교정하는 방법.
- 제28항에 있어서,상기 내부 타겟 내의 관심있는 분석물과 관련되지 않는 상기 내부 타겟의 광학적 특성들의 변이들을 특징으로 하는 스펙트럼 정보를 제거하는 것은, 보정 스펙트럼 세트로부터 결정된 주성분들의 로딩 벡터들의 세트에 대하여 상기 제1 스펙트럼 세트를 직교화하는 단계를 포함하는,측정 시스템에 의해 측정된 샘플 내에서의 내부 타겟에 대응하는 정보를 교정하는 방법.
- 제30항에 있어서,상기 로딩 벡터들의 세트에 대하여 상기 제1 스펙트럼 세트를 직교화하는 단계는,상기 보정 스펙트럼 세트의 주성분들에 대응하는 로딩 벡터들의 세트를 결정하기 위해서 상기 보정 스펙트럼 세트에 대한 주성분 분석을 수행하는 단계;상기 주성분 분석으로부터 하나 이상의 직교화 팩터들을 결정하는 단계;직교화 팩터들의 개수와 동일한 적어도 하나의 차원을 갖는 로딩 매트릭스를 형성하는 단계; 및상기 로딩 매트릭스에 대하여 상기 제1 스펙트럼 세트를 직교화하는 단계를 포함하는,측정 시스템에 의해 측정된 샘플 내에서의 내부 타겟에 대응하는 정보를 교정하는 방법.
- 대상자(subject)에서의 분석물을 측정하는 방법으로서,제22항의 방법에 따라 동물로부터의 반사율 측정치들에 기초하여 교정된 스펙트럼 세트를 생성하는 단계;상기 동물에서의 분석물의 측정치와 상기 동물로부터의 교정된 스펙트럼 세트 사이의 관계에 기초하여 하나 이상의 보정 등식들을 전개하는 단계;제22항의 방법에 따라 상기 대상자로부터의 반사율 측정치들에 기초하여 교정된 스펙트럼 세트를 생성하는 단계; 및상기 하나 이상의 보정 등식들과 상기 대상자로부터의 상기 교정된 스펙트럼 세트에 기초하여 상기 대상자에서의 상기 분석물의 값을 결정하는 단계를 포함하는,대상자에서의 분석물을 측정하는 방법.
- 제32항에 있어서,상기 대상자는 사람인,대상자에서의 분석물을 측정하는 방법.
- 제32항에 있어서,상기 동물 및 상기 대상자로부터의 반사율 측정치들에 기초하여 생성된 상기 교정된 스펙트럼 세트들은 상기 분석물을 포함하는 내부 타겟들의 광학적 특성들의 변이들의 스펙트럼 정보 특징을 제거하도록 추가로 처리되는,대상자에서의 분석물을 측정하는 방법.
- 대상자에서의 분석물을 측정하는 방법으로서,제22항의 방법에 따라 상기 대상자의 제1 바디 지점으로부터의 반사율 측정치들에 기초하여 교정된 스펙트럼 세트를 생성하는 단계;상기 제1 바디 지점에서의 상기 분석물의 측정치와 상기 제1 바디 지점으로부터의 상기 교정된 스펙트럼 세트 사이의 관계에 기초하여 하나 이상의 보정 등식들을 전개하는 단계;제22항의 방법에 따라 상기 대상자의 제2 바디 지점으로부터의 반사율 측정치들에 기초하여 교정된 스펙트럼 세트를 생성하는 단계; 및상기 하나 이상의 보정 등식들과 상기 제2 바디 지점으로부터의 상기 교정된 스펙트럼 세트에 기초하여 상기 제2 바디 지점에서의 상기 분석물의 값을 결정하는 단계를 포함하는,대상자에서의 분석물을 측정하는 방법.
- 제35항에 있어서,상기 대상자는 사람이고, 상기 제1 바디 지점은 팔이며, 상기 제2 바디 지점은 다리인,대상자에서의 분석물을 측정하는 방법.
- 제35항에 있어서,상기 제1 바디 지점 및 상기 제2 바디 지점으로부터의 반사율 측정치들에 기초하여 생성된 상기 교정된 스펙트럼 세트들은 상기 분석물을 포함하는 내부 타겟들의 광학적 특성들의 변이들의 스펙트럼 정보 특징을 제거하도록 추가로 처리되는,대상자에서의 분석물을 측정하는 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US67437905P | 2005-04-25 | 2005-04-25 | |
| US60/674,379 | 2005-04-25 | ||
| PCT/US2006/015955 WO2006116569A2 (en) | 2005-04-25 | 2006-04-25 | Systems and methods for correcting optical reflectance measurements |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20070122565A KR20070122565A (ko) | 2007-12-31 |
| KR101361697B1 true KR101361697B1 (ko) | 2014-02-10 |
Family
ID=37215486
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020077026849A KR101361697B1 (ko) | 2005-04-25 | 2006-04-25 | 광학적 반사율 측정을 교정하는 시스템 및 방법 |
Country Status (8)
| Country | Link |
|---|---|
| US (4) | US7616303B2 (ko) |
| EP (2) | EP3505052A1 (ko) |
| JP (1) | JP5271700B2 (ko) |
| KR (1) | KR101361697B1 (ko) |
| CN (1) | CN101511261B (ko) |
| AU (1) | AU2006241076B2 (ko) |
| CA (1) | CA2605467C (ko) |
| WO (1) | WO2006116569A2 (ko) |
Families Citing this family (87)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6850788B2 (en) | 2002-03-25 | 2005-02-01 | Masimo Corporation | Physiological measurement communications adapter |
| US7459713B2 (en) * | 2003-08-14 | 2008-12-02 | Microptix Technologies, Llc | Integrated sensing system approach for handheld spectral measurements having a disposable sample handling apparatus |
| US20070103678A1 (en) * | 2005-02-14 | 2007-05-10 | Sterling Bernhard B | Analyte detection system with interferent identification and correction |
| EP3505052A1 (en) * | 2005-04-25 | 2019-07-03 | University of Massachusetts | Systems and methods for correcting optical reflectance measurements |
| EP2034893B1 (en) * | 2006-05-30 | 2014-09-17 | University of Massachusetts | Measuring tissue oxygenation |
| US8840549B2 (en) | 2006-09-22 | 2014-09-23 | Masimo Corporation | Modular patient monitor |
| US7468519B2 (en) * | 2006-12-05 | 2008-12-23 | The Boeing Company | Near infrared light diffuser |
| US8072616B2 (en) * | 2006-12-05 | 2011-12-06 | The Boeing Company | Application of crossed teflon diffuser to coatings on oriented surfaces |
| JP5565998B2 (ja) * | 2007-01-24 | 2014-08-06 | 株式会社日立メディコ | 光ファイバ素線計数装置 |
| WO2008117286A2 (en) * | 2007-03-27 | 2008-10-02 | Ariel Navon | Device and method for monitoring blood parameters |
| US7610157B2 (en) * | 2007-05-02 | 2009-10-27 | General Electric Company | Apparatus and method for fully automated closed system pH measurement |
| US8597190B2 (en) | 2007-05-18 | 2013-12-03 | Optiscan Biomedical Corporation | Monitoring systems and methods with fast initialization |
| US7783458B2 (en) * | 2007-06-22 | 2010-08-24 | Ricardo Claps | Discrete principal component analysis (DPCA) |
| US8554518B1 (en) | 2007-06-22 | 2013-10-08 | Ricardo Claps | Discrete principal component analysis (DPCA) for pattern recognition and diagnostics of tissue pathologies such as cancer |
| AU2008311221B2 (en) * | 2007-07-13 | 2014-08-21 | University Of Massachusetts | Physical performance monitoring and monitors |
| GB0721564D0 (en) * | 2007-11-02 | 2007-12-12 | Ge Healthcare Uk Ltd | Microscopy imaging phantoms |
| CN102176864B (zh) * | 2008-08-07 | 2014-12-31 | 马萨诸塞大学 | 分光镜传感器 |
| US20110208015A1 (en) | 2009-07-20 | 2011-08-25 | Masimo Corporation | Wireless patient monitoring system |
| US9091676B2 (en) | 2010-06-09 | 2015-07-28 | Optiscan Biomedical Corp. | Systems and methods for measuring multiple analytes in a sample |
| US8521244B2 (en) * | 2009-09-16 | 2013-08-27 | Analogic Corporation | Physiological parameter monitoring apparatus |
| WO2011068998A2 (en) * | 2009-12-02 | 2011-06-09 | Duke University | Systems and methods for determining hemoglobin concentration utilizing diffuse reflectance at isosbestic wavelengths |
| US9153112B1 (en) | 2009-12-21 | 2015-10-06 | Masimo Corporation | Modular patient monitor |
| US9057689B2 (en) * | 2010-01-22 | 2015-06-16 | University Of Massachusetts | Methods and systems for analyte measurement |
| US20130079607A1 (en) * | 2010-01-25 | 2013-03-28 | Oregon Health & Science University | Fiberoptic probe for measuring tissue oxygenation and method for using same |
| EP2635185A4 (en) | 2010-11-03 | 2014-12-24 | Univ Washington Through Its Ct For Com Ization | DETERMINATION OF THE IN VIVO OXYGEN ENRICHMENT OF A TISSUE |
| WO2012128614A1 (en) * | 2011-03-24 | 2012-09-27 | Erasmus University Medical Center Rotterdam | Method to determine the absorption coefficient in turbid media |
| US9943269B2 (en) | 2011-10-13 | 2018-04-17 | Masimo Corporation | System for displaying medical monitoring data |
| EP2766834B1 (en) | 2011-10-13 | 2022-04-20 | Masimo Corporation | Medical monitoring hub |
| JP2013103094A (ja) * | 2011-11-16 | 2013-05-30 | Sony Corp | 測定装置、測定方法、プログラム及び記録媒体 |
| US10149616B2 (en) | 2012-02-09 | 2018-12-11 | Masimo Corporation | Wireless patient monitoring device |
| US20130237845A1 (en) * | 2012-03-12 | 2013-09-12 | Ivwatch, Llc | Geometry of a Transcutaneous Sensor |
| TWI670738B (zh) * | 2012-03-13 | 2019-09-01 | 美商盧米泰克斯公司 | 光導和鍵盤背光 |
| US9907494B2 (en) | 2012-04-18 | 2018-03-06 | Hutchinson Technology Incorporated | NIRS device with optical wavelength and path length correction |
| EP2849634B1 (en) * | 2012-05-14 | 2019-05-01 | Gauss Surgical, Inc. | Method for managing blood loss of a patient |
| JP5961482B2 (ja) * | 2012-08-20 | 2016-08-02 | 株式会社日立ハイテクノロジーズ | 分光光度計 |
| AU2013316021B2 (en) * | 2012-09-02 | 2017-10-19 | Ivwatch, Llc | Systems and methods for mitigating the effects of tissue blood volume changes to aid in diagnosing infiltration or extravasation in animalia tissue |
| US9749232B2 (en) | 2012-09-20 | 2017-08-29 | Masimo Corporation | Intelligent medical network edge router |
| WO2014116277A1 (en) * | 2013-01-22 | 2014-07-31 | Ivwatch, Llc | Geometry of a transcutaneous sensor |
| US20140213909A1 (en) * | 2013-01-31 | 2014-07-31 | Xerox Corporation | Control-based inversion for estimating a biological parameter vector for a biophysics model from diffused reflectance data |
| US9804083B2 (en) * | 2013-02-14 | 2017-10-31 | Verisante Technology, Inc. | Optical standard for calibration of spectral measuring systems |
| JP6527086B2 (ja) * | 2013-03-15 | 2019-06-05 | シナプティヴ メディカル (バルバドス) インコーポレイテッドSynaptive Medical (Barbados) Inc. | ハイパースペクトル手術用撮像システム |
| JP2014232005A (ja) * | 2013-05-28 | 2014-12-11 | 富士ゼロックス株式会社 | 計測装置 |
| US20150022802A1 (en) * | 2013-07-22 | 2015-01-22 | Frederick Harold LONG | Spectroscopy detection system and method for material identification |
| US10832818B2 (en) | 2013-10-11 | 2020-11-10 | Masimo Corporation | Alarm notification system |
| USD763939S1 (en) | 2014-04-02 | 2016-08-16 | Cephalogics, LLC | Optical sensor array liner with optical sensor array pad |
| USD763938S1 (en) | 2014-04-02 | 2016-08-16 | Cephalogics, LLC | Optical sensor array |
| WO2015166340A2 (en) * | 2014-04-27 | 2015-11-05 | Coloright Ltd. | Apparatus and method for analyzing hair and/or predicting an outcome of a hair-coloring treatment |
| WO2016069862A1 (en) * | 2014-10-29 | 2016-05-06 | Zoll Medical Corporation | Measuring myocardial physiologic parameters |
| CN105866066B (zh) * | 2015-05-29 | 2020-04-28 | 深圳市琨伦创业投资有限公司 | 一种农作物营养安全检测装置 |
| WO2017024145A1 (en) | 2015-08-05 | 2017-02-09 | Canon U.S.A., Inc. | Forward and angle view endoscope |
| US10194065B2 (en) | 2015-08-05 | 2019-01-29 | Canon U.S.A., Inc. | Endoscope probes and systems, and methods for use therewith |
| KR102612874B1 (ko) | 2015-08-31 | 2023-12-12 | 마시모 코오퍼레이션 | 무선 환자 모니터링 시스템들 및 방법들 |
| CN109073456A (zh) * | 2015-10-20 | 2018-12-21 | 科里吉+柯扎卡电子有限责任公司 | 对防晒霜或其它防辐射霜的防护系数的光学确定 |
| US10444146B2 (en) | 2015-12-28 | 2019-10-15 | Canon U.S.A., Inc. | Optical probe, light intensity detection, imaging method and system |
| JP6688104B2 (ja) * | 2016-02-29 | 2020-04-28 | 日本光電工業株式会社 | パルスフォトメトリ用プローブ |
| US10321810B2 (en) | 2016-06-13 | 2019-06-18 | Canon U.S.A., Inc. | Spectrally encoded endoscopic probe having a fixed fiber |
| US10617302B2 (en) | 2016-07-07 | 2020-04-14 | Masimo Corporation | Wearable pulse oximeter and respiration monitor |
| US10401610B2 (en) | 2016-07-15 | 2019-09-03 | Canon Usa, Inc. | Spectrally encoded probe with multiple diffraction orders |
| JP2019527576A (ja) | 2016-07-15 | 2019-10-03 | キヤノン ユーエスエイ, インコーポレイテッドCanon U.S.A., Inc | スペクトル符号化プローブ |
| JP2019534069A (ja) | 2016-09-23 | 2019-11-28 | キヤノン ユーエスエイ, インコーポレイテッドCanon U.S.A., Inc | スペクトル符号化内視鏡検査装置および方法 |
| US11076777B2 (en) | 2016-10-13 | 2021-08-03 | Masimo Corporation | Systems and methods for monitoring orientation to reduce pressure ulcer formation |
| US10898068B2 (en) | 2016-11-01 | 2021-01-26 | Canon U.S.A., Inc. | Multi-bandwidth spectrally encoded endoscope |
| JP2018094395A (ja) | 2016-11-03 | 2018-06-21 | キヤノン ユーエスエイ, インコーポレイテッドCanon U.S.A., Inc | 診断用スペクトル符号化内視鏡検査装置およびシステム、ならびにこれらと共に使用するための方法 |
| US10825152B2 (en) | 2017-09-14 | 2020-11-03 | Canon U.S.A., Inc. | Distortion measurement and correction for spectrally encoded endoscopy |
| CN107631860B (zh) * | 2017-09-26 | 2019-10-25 | 成都国翼电子技术有限公司 | 一种计算vr相机所需最少led灯数量的方法 |
| CN111491561A (zh) * | 2017-12-20 | 2020-08-04 | 医疗光电设备有限公司 | 脂质测量装置及其方法 |
| GB2572626B (en) * | 2018-04-05 | 2021-04-07 | Life Meter Srl | Pulse oximetry device, system and method |
| EP3782165A1 (en) | 2018-04-19 | 2021-02-24 | Masimo Corporation | Mobile patient alarm display |
| KR102693439B1 (ko) | 2018-11-20 | 2024-08-07 | 삼성전자주식회사 | 스펙트럼 측정 장치, 스펙트럼의 광원 온도 변화 보정 방법, 농도 추정 장치 및 방법 |
| KR20200097144A (ko) * | 2019-02-07 | 2020-08-18 | 삼성전자주식회사 | 생체정보 추정 장치 및 방법 |
| JP2020148659A (ja) * | 2019-03-14 | 2020-09-17 | キオクシア株式会社 | 計測装置 |
| CN113474636A (zh) * | 2019-03-31 | 2021-10-01 | 安捷伦科技有限公司 | 用于分析微观颗粒的中红外扫描系统 |
| KR20210050967A (ko) | 2019-10-29 | 2021-05-10 | 삼성전자주식회사 | 분석 물질의 농도 추정 장치 및 방법과, 캘리브레이션 방법 |
| US11730379B2 (en) | 2020-03-20 | 2023-08-22 | Masimo Corporation | Remote patient management and monitoring systems and methods |
| WO2021231396A1 (en) * | 2020-05-11 | 2021-11-18 | Woods Hole Oceanographic Institution | Optical system and method to identify plastic |
| WO2021240922A1 (ja) * | 2020-05-28 | 2021-12-02 | 株式会社島津製作所 | ピークトラッキング装置、ピークトラッキング方法およびピークトラッキングプログラム |
| CN111999258B (zh) * | 2020-07-03 | 2022-06-17 | 桂林理工大学 | 一种面向光谱基线校正的加权建模局部优化方法 |
| BE1028508B1 (fr) | 2020-07-20 | 2022-02-15 | Pharma Flex S A | Sonde pour analyse spectroscopique d'objets individuels en défilement |
| USD974193S1 (en) | 2020-07-27 | 2023-01-03 | Masimo Corporation | Wearable temperature measurement device |
| USD980091S1 (en) | 2020-07-27 | 2023-03-07 | Masimo Corporation | Wearable temperature measurement device |
| WO2022039952A1 (en) * | 2020-08-17 | 2022-02-24 | Corning Research & Development Corporation | Intermittently bonded fiber optic ribbon |
| DE102020127424B4 (de) * | 2020-10-19 | 2023-01-19 | Erbe Elektromedizin Gmbh | Testeinrichtung |
| JP2024525489A (ja) * | 2021-07-01 | 2024-07-12 | ベーリンガー インゲルハイム フェトメディカ ゲーエムベーハー | 光学系及び使用方法 |
| USD1000975S1 (en) | 2021-09-22 | 2023-10-10 | Masimo Corporation | Wearable temperature measurement device |
| JP7379442B2 (ja) * | 2021-11-01 | 2023-11-14 | キヤノントッキ株式会社 | 反射率測定装置、成膜装置 |
| CN114136888B (zh) * | 2021-12-09 | 2023-07-11 | 四川启睿克科技有限公司 | 多光源便携式近红外光谱仪的光谱数据校准方法 |
| KR102681431B1 (ko) * | 2023-10-05 | 2024-07-04 | (주)메디띵스 | 방광 모니터링 기기의 이상 탐지 방법 및 시스템 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR960704216A (ko) * | 1994-05-24 | 1996-08-31 | 제이 웨이트 | 분광 장치(spectroscopic apparatus) |
| KR960042049A (ko) * | 1995-05-11 | 1996-12-19 | 신도 고조 | 광학적 측정방법 및 광학적 측정장치 |
| US5770454A (en) | 1994-05-19 | 1998-06-23 | Boehringer Mannheim Gmbh | Method and aparatus for determining an analyte in a biological sample |
Family Cites Families (45)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH0762650B2 (ja) * | 1988-12-09 | 1995-07-05 | 鶴見曹達株式会社 | 果実等の糖度測定方法 |
| JPH06103257B2 (ja) * | 1988-12-19 | 1994-12-14 | 大塚電子株式会社 | 光散乱を用いた物質の吸光係数測定方法および装置 |
| EP0700267A4 (en) * | 1993-05-28 | 1998-06-24 | Somanetics Corp | METHOD AND DEVICE FOR SPECTROPHOTOMETRIC CEREBRAL OXYMETRY |
| DE4337570A1 (de) * | 1993-11-04 | 1995-05-11 | Boehringer Mannheim Gmbh | Verfahren zur Analyse von Glucose in einer biologischen Matrix |
| WO1995032416A1 (de) * | 1994-05-19 | 1995-11-30 | Boehringer Mannheim Gmbh | Verfahren und vorrichtung zur bestimmung eines analyten in einer biologischen probe |
| US5486834A (en) * | 1994-08-08 | 1996-01-23 | Trimble Navigation Limited | Global orbiting navigation satellite system receiver |
| US5582170A (en) | 1994-12-01 | 1996-12-10 | University Of Massachusetts Medical Center | Fiber optic sensor for in vivo measurement of nitric oxide |
| US5537121A (en) * | 1995-04-28 | 1996-07-16 | Trimble Navigation Limited | Carrier phase multipath reduction technique |
| US6633255B2 (en) * | 1995-10-09 | 2003-10-14 | Qualcomm Inc. | Method for open loop tracking GPS signals |
| US5813403A (en) | 1995-11-08 | 1998-09-29 | Soller; Babs R. | Optical measurement of tissue pH |
| US5880826A (en) * | 1997-07-01 | 1999-03-09 | L J Laboratories, L.L.C. | Apparatus and method for measuring optical characteristics of teeth |
| US6052194A (en) | 1996-06-04 | 2000-04-18 | Valmet Automation (Canada) Ltd. | Method and apparatus for controlling the spectral reflectance of a material |
| US5808582A (en) * | 1996-09-13 | 1998-09-15 | Litton Consulting Group, Inc. | Global positioning system receiver with improved multipath signal rejection |
| US5901183A (en) * | 1996-09-25 | 1999-05-04 | Magellan Corporation | Signal correlation technique for a receiver of a spread spectrum signal including a pseudo-random noise code that reduces errors when a multipath signal is present |
| US6006119A (en) | 1998-02-04 | 1999-12-21 | Polestar Technologies, Inc. | Non-invasive optical measurement of blood hematocrit |
| US6353226B1 (en) * | 1998-11-23 | 2002-03-05 | Abbott Laboratories | Non-invasive sensor capable of determining optical parameters in a sample having multiple layers |
| US6615061B1 (en) * | 1998-11-23 | 2003-09-02 | Abbott Laboratories | Optical sensor having a selectable sampling distance for determination of analytes |
| US6587702B1 (en) | 1999-01-22 | 2003-07-01 | Instrumentation Metrics, Inc | Classification and characterization of tissue through features related to adipose tissue |
| US6608589B1 (en) * | 1999-04-21 | 2003-08-19 | The Johns Hopkins University | Autonomous satellite navigation system |
| US6704348B2 (en) * | 2001-05-18 | 2004-03-09 | Global Locate, Inc. | Method and apparatus for computing signal correlation at multiple resolutions |
| US6564088B1 (en) | 2000-01-21 | 2003-05-13 | University Of Massachusetts | Probe for localized tissue spectroscopy |
| IL138683A0 (en) * | 2000-09-25 | 2001-10-31 | Vital Medical Ltd | Apparatus and method for monitoring tissue vitality parameters |
| US6640117B2 (en) * | 2000-09-26 | 2003-10-28 | Sensys Medical, Inc. | Method and apparatus for minimizing spectral effects attributable to tissue state variations during NIR-based non-invasive blood analyte determination |
| WO2002069796A2 (en) | 2001-03-01 | 2002-09-12 | University Of Massachusetts | Correction of spectra for subject diversity |
| US7217266B2 (en) * | 2001-05-30 | 2007-05-15 | Anderson R Rox | Apparatus and method for laser treatment with spectroscopic feedback |
| AU2002359257A1 (en) | 2001-10-15 | 2003-04-28 | University Of Massachusetts | Tissue oxygen measurement system |
| DE10163972B4 (de) * | 2001-12-22 | 2005-10-27 | Roche Diagnostics Gmbh | Verfahren und Vorrichtung zur Bestimmung eines Lichttransportparameters und eines Analyten in einer biologischen Matrix |
| US7130326B2 (en) * | 2002-03-13 | 2006-10-31 | The Aerospace Corporation | Gated time division multiplexed spread spectrum correlator |
| US20040005717A1 (en) | 2002-06-11 | 2004-01-08 | Umass/Worcester | Methods for non-invasive measurement of blood electrolyte concentration |
| US7001413B2 (en) * | 2002-07-03 | 2006-02-21 | Life Support Technologies, Inc. | Methods and apparatus for light therapy |
| US7133440B1 (en) * | 2002-10-25 | 2006-11-07 | L-3 Communications Corporation | Acquisition of a synchronous CDMA TDD QPSK waveform using variable thresholds for PN and burst synchronization |
| JP2004150984A (ja) * | 2002-10-31 | 2004-05-27 | National Institute Of Advanced Industrial & Technology | 近赤外分光による溶質濃度測定方法とその装置 |
| CN100406872C (zh) * | 2002-11-04 | 2008-07-30 | 天津市先石光学技术有限公司 | 复合光谱测量方法及其光谱检测仪器 |
| US7186249B1 (en) * | 2003-01-16 | 2007-03-06 | Alfiero Balzano | Thermally conductive surgical probe |
| US7317752B2 (en) * | 2003-07-11 | 2008-01-08 | Samsung Electronics Co., Ltd. | Method and system for locating a GPS correlated peak signal |
| US7245373B2 (en) | 2004-04-26 | 2007-07-17 | University Of Massachusetts | Spectrometer system for optical reflectance measurements |
| US7916771B2 (en) * | 2004-05-17 | 2011-03-29 | Uti Limited Partnership | BOC signal acquisition and tracking method and apparatus |
| WO2006003673A1 (en) * | 2004-07-05 | 2006-01-12 | Accord Software & Systems Pvt. Ltd. | Low gate count sequential multitap correlator |
| US7881892B2 (en) | 2005-01-21 | 2011-02-01 | University Of Massachusetts | Standardization methods for correcting spectral differences across multiple spectroscopic instruments |
| EP3505052A1 (en) | 2005-04-25 | 2019-07-03 | University of Massachusetts | Systems and methods for correcting optical reflectance measurements |
| EP2034893B1 (en) | 2006-05-30 | 2014-09-17 | University of Massachusetts | Measuring tissue oxygenation |
| AU2008311221B2 (en) | 2007-07-13 | 2014-08-21 | University Of Massachusetts | Physical performance monitoring and monitors |
| CN102176864B (zh) | 2008-08-07 | 2014-12-31 | 马萨诸塞大学 | 分光镜传感器 |
| US9057689B2 (en) | 2010-01-22 | 2015-06-16 | University Of Massachusetts | Methods and systems for analyte measurement |
| CN114730353A (zh) | 2019-12-09 | 2022-07-08 | 美商新思科技有限公司 | 使用具有金属线的单元进行电路设计 |
-
2006
- 2006-04-25 EP EP18215142.3A patent/EP3505052A1/en not_active Withdrawn
- 2006-04-25 US US11/411,538 patent/US7616303B2/en active Active
- 2006-04-25 AU AU2006241076A patent/AU2006241076B2/en not_active Ceased
- 2006-04-25 JP JP2008509106A patent/JP5271700B2/ja not_active Expired - Fee Related
- 2006-04-25 CN CN2006800228717A patent/CN101511261B/zh not_active Expired - Fee Related
- 2006-04-25 EP EP06758654.5A patent/EP1875128B1/en active Active
- 2006-04-25 WO PCT/US2006/015955 patent/WO2006116569A2/en active Application Filing
- 2006-04-25 CA CA2605467A patent/CA2605467C/en not_active Expired - Fee Related
- 2006-04-25 KR KR1020077026849A patent/KR101361697B1/ko not_active IP Right Cessation
-
2009
- 2009-09-28 US US12/568,363 patent/US20100123897A1/en not_active Abandoned
-
2011
- 2011-02-04 US US13/021,065 patent/US8873035B2/en active Active
-
2014
- 2014-05-27 US US14/288,294 patent/US20150131098A1/en not_active Abandoned
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5770454A (en) | 1994-05-19 | 1998-06-23 | Boehringer Mannheim Gmbh | Method and aparatus for determining an analyte in a biological sample |
| KR960704216A (ko) * | 1994-05-24 | 1996-08-31 | 제이 웨이트 | 분광 장치(spectroscopic apparatus) |
| KR960042049A (ko) * | 1995-05-11 | 1996-12-19 | 신도 고조 | 광학적 측정방법 및 광학적 측정장치 |
Also Published As
| Publication number | Publication date |
|---|---|
| AU2006241076B2 (en) | 2011-11-24 |
| EP3505052A1 (en) | 2019-07-03 |
| WO2006116569A2 (en) | 2006-11-02 |
| KR20070122565A (ko) | 2007-12-31 |
| US20150131098A1 (en) | 2015-05-14 |
| US20100123897A1 (en) | 2010-05-20 |
| US8873035B2 (en) | 2014-10-28 |
| EP1875128A2 (en) | 2008-01-09 |
| JP2008539441A (ja) | 2008-11-13 |
| US20070038041A1 (en) | 2007-02-15 |
| CN101511261A (zh) | 2009-08-19 |
| WO2006116569A3 (en) | 2009-04-30 |
| JP5271700B2 (ja) | 2013-08-21 |
| CA2605467A1 (en) | 2006-11-02 |
| EP1875128B1 (en) | 2018-12-26 |
| US20110264411A1 (en) | 2011-10-27 |
| CA2605467C (en) | 2013-12-24 |
| US7616303B2 (en) | 2009-11-10 |
| EP1875128A4 (en) | 2012-08-22 |
| CN101511261B (zh) | 2011-09-28 |
| AU2006241076A1 (en) | 2006-11-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101361697B1 (ko) | 광학적 반사율 측정을 교정하는 시스템 및 방법 | |
| JP5982364B2 (ja) | 測定媒体の成分または特性、特に生理的血液値を特定およびモニタするための装置ならびに方法 | |
| US5360004A (en) | Non-invasive determination of analyte concentration using non-continuous radiation | |
| DK2034893T3 (en) | Measurement of tissue oxygenation | |
| US8483789B2 (en) | Continuous spectroscopic measurement of total hemoglobin | |
| JP3566277B1 (ja) | 血糖値測定装置 | |
| US6741875B1 (en) | Method for determination of analytes using near infrared, adjacent visible spectrum and an array of longer near infrared wavelengths | |
| WO2001016578A1 (en) | Method for determination of analytes using near infrared, adjacent visible spectrum and an array of longer near infrared wavelengths | |
| WO2007014173A9 (en) | Intrinsic raman spectroscopy | |
| EP2074407A1 (en) | Tissue hydration estimation by spectral absorption bandwidth measurement | |
| JP2008203234A (ja) | 血液成分濃度の分析方法及びその分析装置 | |
| CN103249362A (zh) | 用于血液参数的光学测量的系统、方法和计算机程序产品 | |
| EP0623307A1 (en) | Non-invasive determination of constituent concentration using non-continuous radiation | |
| JP4052461B2 (ja) | 血糖値の非侵襲測定装置 | |
| WO2019208561A1 (ja) | 血液成分の血中濃度測定方法、血中濃度測定装置およびプログラム | |
| Soller et al. | i, United States Patent (10) Patent No.: US 8873035 B2 | |
| JP2004135798A (ja) | 物質計測装置 | |
| Prince et al. | Functional optical imaging of a tissue based on diffuse reflectance with fibre spectrometer | |
| WO1996013204A1 (en) | Determination of analyte concentration using non-continuous radiation |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| G170 | Publication of correction | ||
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant | ||
| FPAY | Annual fee payment |
Payment date: 20170120 Year of fee payment: 4 |
|
| FPAY | Annual fee payment |
Payment date: 20180110 Year of fee payment: 5 |
|
| LAPS | Lapse due to unpaid annual fee |