JP7656941B2 - 光硬化性樹脂組成物 - Google Patents
光硬化性樹脂組成物 Download PDFInfo
- Publication number
- JP7656941B2 JP7656941B2 JP2022508349A JP2022508349A JP7656941B2 JP 7656941 B2 JP7656941 B2 JP 7656941B2 JP 2022508349 A JP2022508349 A JP 2022508349A JP 2022508349 A JP2022508349 A JP 2022508349A JP 7656941 B2 JP7656941 B2 JP 7656941B2
- Authority
- JP
- Japan
- Prior art keywords
- resin composition
- photocurable resin
- component
- group
- methylene
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F2/00—Processes of polymerisation
- C08F2/46—Polymerisation initiated by wave energy or particle radiation
- C08F2/48—Polymerisation initiated by wave energy or particle radiation by ultraviolet or visible light
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F22/00—Homopolymers and copolymers of compounds having one or more unsaturated aliphatic radicals each having only one carbon-to-carbon double bond, and at least one being terminated by a carboxyl radical and containing at least one other carboxyl radical in the molecule; Salts, anhydrides, esters, amides, imides or nitriles thereof
- C08F22/10—Esters
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F122/00—Homopolymers of compounds having one or more unsaturated aliphatic radicals each having only one carbon-to-carbon double bond, and at least one being terminated by a carboxyl radical and containing at least one other carboxyl radical in the molecule; Salts, anhydrides, esters, amides, imides or nitriles thereof
- C08F122/10—Esters
- C08F122/12—Esters of phenols or saturated alcohols
- C08F122/14—Esters having no free carboxylic acid groups
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F2/00—Processes of polymerisation
- C08F2/44—Polymerisation in the presence of compounding ingredients, e.g. plasticisers, dyestuffs, fillers
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F2/00—Processes of polymerisation
- C08F2/46—Polymerisation initiated by wave energy or particle radiation
- C08F2/48—Polymerisation initiated by wave energy or particle radiation by ultraviolet or visible light
- C08F2/50—Polymerisation initiated by wave energy or particle radiation by ultraviolet or visible light with sensitising agents
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08K—Use of inorganic or non-macromolecular organic substances as compounding ingredients
- C08K5/00—Use of organic ingredients
- C08K5/02—Halogenated hydrocarbons
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Medicinal Chemistry (AREA)
- Polymers & Plastics (AREA)
- Organic Chemistry (AREA)
- Polymerisation Methods In General (AREA)
- Epoxy Resins (AREA)
Description
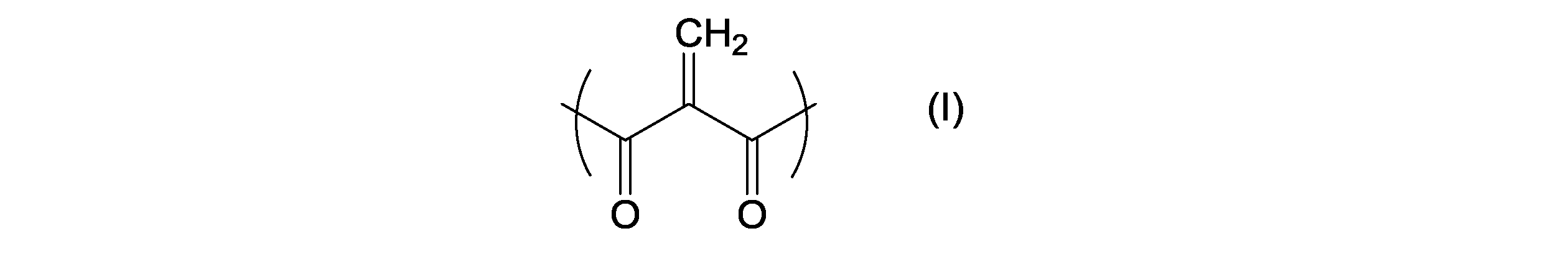
(a)2-メチレン-1,3-ジカルボニル化合物
(b)イオン型光塩基発生剤
(c)光増感剤
を含み、
前記2-メチレン-1,3-ジカルボニル化合物が、下記式(I):
で表される構造単位を少なくとも一つ含む化合物であり、
前記イオン型光塩基発生剤が、下記アニオン(i)及びカチオン(ii):
(i)式(BAr4-nXn)-(式中、Arは、各々独立に、非置換又は置換のC6-C10芳香族炭化水素基であり、Xは、各々独立に、非置換又は置換の直鎖状、分岐鎖状又は環状C1-C6脂肪族炭化水素基であり、nは0~2の整数であり、n=0のとき、少なくとも1つのArは置換C6-C10芳香族炭化水素基である)で表されるアニオン
(ii)アミジン構造、グアニジン構造又はビグアニド構造を有するカチオン
を含む塩である、光硬化性樹脂組成物。
(a)2-メチレン-1,3-ジカルボニル化合物
(b)イオン型光塩基発生剤
(c)光増感剤
ここで、成分(a)の前記2-メチレン-1,3-ジカルボニル化合物は、下記式(I):
で表される構造単位を少なくとも1つ含む化合物である。
また、成分(b)の前記イオン型光塩基発生剤は、下記アニオン(i)及びカチオン(ii):
(i)式(BAr4-nXn)-(式中、Arは、各々独立に、非置換又は置換のC6-C10芳香族炭化水素基であり、Xは、各々独立に、非置換又は置換の直鎖状、分岐鎖状又は環状C1-C6脂肪族炭化水素基であり、nは0~2の整数であり、n=0のとき、少なくとも1つのArは置換C6-C10芳香族炭化水素基である)で表されるアニオン
(ii)アミジン構造、グアニジン構造又はビグアニド構造を有するカチオン
を含む塩である。
以下、前記成分(a)~(c)について説明する。
本発明で用いる2-メチレン-1,3-ジカルボニル化合物(成分(a))は、下記式(I):
で表される構造単位を少なくとも1つ有する化合物である。成分(a)は、前記式(I)の構造単位を1つ又は2つ以上含む。ある態様においては、成分(a)は、前記式(I)の構造単位を2つから6つ、好ましくは2つ含む。
(式中、
X1及びX2は、各々独立に、単結合、O又はNR3(式中、R3は、水素又は1価の炭化水素基を表す)を表し、
R1及びR2は、各々独立に、水素、1価の炭化水素基又は下記式(III):
(式中、
X3及びX4は、各々独立に、単結合、O又はNR5(式中、R5は、水素又は1価の炭化水素基を表す)を表し、
Wは、スペーサーを表し、
R4は、水素又は1価の炭化水素基を表す)を表す)
で表される。
(式中、
R1及びR2は、各々独立に、水素、1価の炭化水素基又は下記式(V):
(式中、
Wは、スペーサーを表し、
R4は、水素又は1価の炭化水素基を表す)を表す)
で表される。
(式中、
R11は、下記式(VII):
で表される1,1-ジカルボニルエチレン単位を表し、
それぞれのR12は、各々独立に、スペーサーを表し、
R13及びR14は、各々独立に、水素又は1価の炭化水素基を表し、
X11並びにそれぞれのX12及びX13は、各々独立に、単結合、O又はNR15(式中、R15は、水素又は1価の炭化水素基を表す)を表し、
それぞれのmは、各々独立に、0又は1を表し、
nは、1以上20以下の整数を表す)
で表されるジカルボニルエチレン誘導体である。
前記1価の炭化水素基は、好ましくは、アルキル基、シクロアルキル基、アリール基又はシクロアルキル基で置換されているアルキル基であり、さらに好ましくは、アルキル基、シクロアルキル基、又はシクロアルキル基で置換されているアルキル基である。
上記スペーサーとしての2価の炭化水素基の具体的な例としては、1,4-n-ブチレン基及び1,4-シクロヘキシレンジメチレン基が挙げられるが、これらに限定されない。
本発明の光硬化性樹脂組成物は、イオン型光塩基発生剤(成分(b))を含む。光塩基発生剤は、光エネルギーが直接的又は間接的に関与する化学反応によって、塩基性物質を発生させることができる化合物である。本発明における成分(b)は、UV-A又はUV-B領域の紫外線を吸収したことによって励起された光増感剤(後述する成分(c))から伝達されたエネルギーによって化学反応を起こし、塩基性物質を発生させる。光塩基発生剤はイオン型のものと非イオン型のものに大別されるが、本発明においてはイオン型の光塩基発生剤を用いる。
成分(b)は、潜在化された開始剤の一種である。すなわち、成分(b)から発生する塩基性物質は、開始剤として、光硬化性樹脂組成物中の前記成分(a)がマイケル付加反応によって硬化する際の重合開始反応に寄与することが期待される。本発明において成分(b)として用いる化合物は、単独で使用しても、2種以上を併用してもよい。
(i)式(BAr4-nXn)-(式中、Arは、各々独立に、非置換又は置換のC6-C10芳香族炭化水素基であり、Xは、各々独立に、非置換又は置換の直鎖状、分岐鎖状又は環状C1-C6脂肪族炭化水素基であり、nは0~2の整数であり、n=0のとき、少なくとも1つのArは置換C6-C10芳香族炭化水素基である)で表されるアニオン
(ii)アミジン構造、グアニジン構造又はビグアニド構造を有するカチオン
を含む塩である。
アニオン(i)におけるXの例としては、非置換又は置換C1-C6アルキル基、非置換又は置換C3-C6シクロアルキル基、非置換又は置換C2-C6アルケニル基、非置換又は置換C2-C6アルキニル基等を挙げることができる。
アニオン(i)におけるnは、好ましくは0又は1であり、より好ましくは0である。なお前記のとおり、n=0のときには、アニオン(i)中の4つのArのうち少なくとも1つが置換基を有していなければならない。
一実施態様において、アニオン(i)は、テトラキス(モノハロフェニル)ボレートアニオン、例えばテトラキス(3-フルオロフェニル)ボレートアニオンである。
他の一実施態様において、アニオン(i)は、モノアルキルトリフェニルボレートアニオン、例えばn-ブチルトリフェニルボレートアニオンである。
前記アミジン化合物は、好ましくは、下記式:
(式中、
Ra、Rb、Rc及びRdは、各々独立に、水素原子、非置換又は置換の直鎖状、分岐鎖状又は環状C1-C6脂肪族炭化水素基、或いは非置換又は置換のC6-C10芳香族炭化水素基であり、
Raは、Rb、Rc又はRdと一緒になって、それらが結合している炭素原子及び窒素原子と共に、環を形成していてもよく、
Rbは、Rc又はRdと一緒になって、それらが結合している窒素原子及び前記窒素原子が結合している炭素原子と共に、環を形成していてもよく、
Rcは、Rdと一緒になって、それらが結合している窒素原子と共に、環を形成していてもよい)
で表される化合物である。Ra、Rb、Rc及びRdは各々、好ましくは非置換の直鎖状C1-C6脂肪族炭化水素基であり、より好ましくは非置換の直鎖状C1-C4脂肪族炭化水素基であり、特に好ましくは非置換の直鎖状C1-C3脂肪族炭化水素基である。RaとRc、及び、RbとRdとがそれぞれ一緒になって環を形成していることが、耐加水分解性の観点からより好ましい。即硬化性の観点から、アミジン化合物の分子量は、好ましくは100~600であり、より好ましくは100~200である。
(式中、
Rb、Rc、Rd、Re及びRfは、各々独立に、水素原子、非置換又は置換の直鎖状、分岐鎖状又は環状C1-C6脂肪族炭化水素基、或いは非置換又は置換の直鎖状、分岐鎖状又は環状C6-C10芳香族炭化水素基であり、
Rbは、Rc、Rd、Re又はRfと一緒になって、それらが結合している窒素原子及び前記窒素原子が結合している炭素原子と共に、環を形成していてもよく、
Re及びRfは、各々独立に、Rc又はRdと一緒になって、それらが結合している窒素原子及び前記窒素原子が結合している炭素原子と共に、環を形成していてもよく、
Rcは、Rdと一緒になって、それらが結合している窒素原子と共に、環を形成していてもよく、
Reは、Rfと一緒になって、それらが結合している窒素原子と共に、環を形成していてもよい)
で表される化合物である。Rb、Rc、Rd、Re及びRfは各々、好ましくは非置換の直鎖状C1-C6脂肪族炭化水素基であり、より好ましくは非置換の直鎖状C1-C4脂肪族炭化水素基であり、特に好ましくは非置換の直鎖状C1-C3脂肪族炭化水素基である。Rb、Rc、Rd、Re及びRfのうち2つ以上が環を形成する場合は、RcとRe、及び、RbとRdとがそれぞれ一緒になって環を形成していることが好ましい。即硬化性の観点から、グアニジン化合物の分子量は、好ましくは100~600であり、より好ましくは100~300である。
(式中、
Rb、Rc、Rd、Rg、Rh、Ri及びRjは、各々独立に、水素原子、非置換又は置換の直鎖状、分岐鎖状又は環状C1-C6脂肪族炭化水素基、或いは非置換又は置換の直鎖状、分岐鎖状又は環状C6-C10芳香族炭化水素基である)
で表される化合物である。Rb、Rc、Rd、Rg、Rh、Ri及びRjは各々、好ましくは非置換の直鎖状又は環状C1-C6脂肪族炭化水素基である。即硬化性の観点から、ビグアニド化合物の分子量は、好ましくは100~500であり、より好ましくは110~400であり、特に好ましくは150~350である。同じ理由で、ビグアニド化合物におけるRb、Rc、Rd、Rg、Rh、Ri及びRjのうち炭素数6以上であるものの数は、好ましくは4個以下であり、より好ましくは3個以下であり、特に好ましくは2個以下である。
別の一実施態様において、カチオン(ii)は、グアニジン構造を有するカチオン、例えば1,1,3,3-テトラメチルグアニジン(TMG)、あるいは、1,5,7-トリアザビシクロ[4.4.0]デカ-5-エン(TBD)に由来するカチオンである。 他の一実施態様において、カチオン(ii)は、ビグアニド構造(特に、Rcが水素原子であり、Rb、Rd、Rg、Rh、Ri及びRjがいずれもアルキル基であるもの)を有するカチオン、例えば1,2-ジシクロヘキシル-4,4,5,5-テトラメチルビグアニド、あるいは(Z)-{[ビス(ジメチルアミノ)メチリデン]アミノ}-N-シクロヘキシル(シクロヘキシルアミノ)メタンイミンに由来するカチオンである。
ある態様においては、このようなカチオン(ii)は、pKaが12以上である強塩基を発生させるので、即硬化性の観点から有利である。
本発明の光硬化性樹脂組成物は、光増感剤(成分(c))を含む。一般に、光増感剤とは、光の吸収によって励起され、その後自身が化学反応を起こさずに、励起エネルギーを他の物質に伝達し、その物質に化学反応を起こさせることができる化合物を指す。本発明においては、UV-A又はUV-B領域の紫外線の吸収によって励起されて上記反応を起こさせることができる光増感剤を用いる。本明細書において、用語「UV-A」及び「UV-B」は、国際照明委員会の定義に従って使用される。すなわち、「UV-A」とは、波長が315~400nmである紫外線を指す。「UV-B」とは、波長が280~315nmである紫外線を指す。また、本明細書においては、「UV-A」及び「UV-B」を、慣習に従い、それぞれ、UV-A領域の紫外線及びUV-B領域の紫外線と称することもある。
ある態様において、光増感剤は波長365nmの紫外線で励起される。
本発明において、成分(c)は、成分(b)とは異なる。また、成分(c)の光増感剤は、成分(b)のイオン型光塩基発生剤とは共有結合していない。このため、配合設計の自由度が高まり、成分(c)の量を適宜選択できる。光増感剤は、単独で使用しても、2種以上を併用してもよい。
また好ましくは、成分(b)のモル数に対する成分(c)のモル数の比は0.1~6である。成分(c)が少なすぎると、硬化が十分に起こらないおそれがある。一方、成分(c)が多すぎると、照射された紫外線が光硬化性樹脂組成物の表面でほとんど吸収されてしまい、光硬化性樹脂組成物の内部で硬化が十分に起こらないおそれがある。成分(b)のモル数に対する成分(c)のモル数の比は、より好ましくは0.1~4であり、さらに好ましくは0.1~2であり、特に好ましくは0.1~1、最も好ましくは0.1~0.99である。
なお、本発明においては、例えば特許文献4に開示されている光塩基発生剤とは異なり、光硬化性樹脂組成物中の成分(b)及び(c)の配合比率を適宜調節することで、所望の硬化速度や硬化物の物性を得ることができる。特に、本発明のある態様においては、光硬化性樹脂組成物は、成分(b)のモル数に対する成分(c)のモル数の比が1より大きくても十分な即時硬化性を示す。
本発明の光硬化性樹脂組成物を含むフィルムは、本発明の光硬化性樹脂組成物から公知の方法により得ることができる。例えば、本発明の光硬化性樹脂組成物を支持体の少なくとも片面に塗布し、支持体付のフィルム、または、支持体から剥離したフィルムとして提供することができる。
以下の実施例及び比較例において使用した光硬化性樹脂組成物の原料は、以下のとおりである。
2-メチレン-1,3-ジカルボニル化合物(成分(a)):
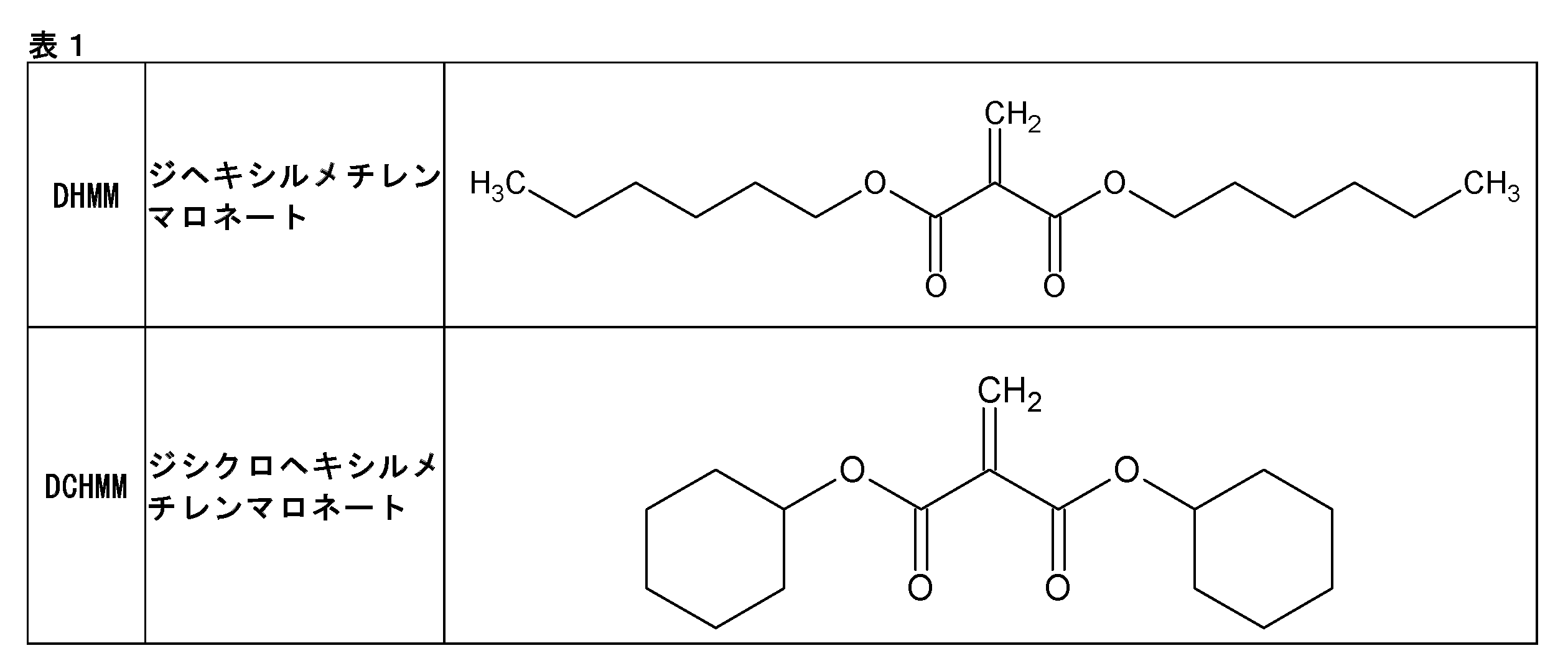
(a-1)DHMM (SIRRUS社製、ChemilianTM L3000 XP)
(a-2)DCHMM (SIRRUS社製、ChemilianTM H4000 XP)
上記2-メチレン-1,3-ジカルボニル化合物の具体的な構造は、下記表1中の化学式のとおりである。
(b-1)(Z)-{[ビス(ジメチルアミノ)メチリデン]アミノ}-N-シクロヘキシル(シクロヘキシルアミノ)メタンイミニウム テトラキス(3-フルオロフェニル)ボラート (WPBG-345、富士フィルム和光純薬株式会社製)
(b-2)1,2-ジシクロヘキシル-4,4,5,5-テトラメチルビグアニジウム n-ブチルトリフェニルボラート(WPBG-300、富士フィルム和光純薬株式会社製)
下記前駆体-1(282mg、0.681mmol)を純水に溶解し、得られた水溶液に、撹拌しながら、下記前駆体-2(200mg、0.619mmol)のクロロホルム溶液を室温で滴加し、2時間撹拌した。得られた反応混合物をクロロホルム層と水層に分離し、水層をクロロホルムで抽出し、得られた抽出物を前記クロロホルム層と合わせた。得られたクロロホルム溶液を飽和食塩水で3回洗浄し、硫酸ナトリウムで乾燥した後、濾過し、減圧下で濃縮することにより、360mgの目的物を淡褐色油状物質として得た。
1H-NMR (CDCl3): δ7.40-7.33 (m, 3H), 7.16-7.09 (m, 4H), δ7.07-6.92 (m, 10H), 6.65-6.56 (m, 4H), 4.30 (s, 2H), 3.19-3.13 (m, 2H), 3.07-3.00 (m, 4H), 2.60-2.52 (m, 2H), 1.79-1.33 (m, 8H)
DBU(サンアプロ社製、83.6mg、0.549mmol)をアセトン(2mL)に溶解し、得られた溶液を、0.5N塩酸(1.10mL、0.549mmol)にて中和した。得られた混合物に、撹拌しながら、下記前駆体-1(250mg、0.604mmol)の水溶液を室温にて滴加した。得られた混合物中に生じた油状物質を分離してクロロホルムに溶解し、得られた溶液を室温にて2時間撹拌した。得られた反応混合物をクロロホルムで希釈した。得られたクロロホルム溶液を水で洗浄し、次いで飽和食塩水で3回洗浄し、硫酸ナトリウムで乾燥した後、濾過し、減圧下で濃縮することにより、221mgの目的物を白色固体として得た。
1H-NMR (CDCl3): δ7.20-7.14 (m, 4H), 7.10-6.98 (m, 8H), 6.67-6.58 (m, 4H), 4.95 (s, 1H), 3.19-3.13 (m, 2H), 3.07-3.00 (m, 2H), 2.60-2.52 (m, 2H), 1.89-1.83 (m, 2H), 1.64-1.37 (m, 8H)
テトラメチルグアニジン(75.8mg、0.658mmol)をアセトンに溶解し、得られた溶液を、0.5N塩酸(1.32mL、0.658mmol)で中和した。得られた混合物に、下記前駆体-1(300mg、0.724mmol)の水溶液を滴加した。得られた混合物中に生じた油状物質を分離してクロロホルムに溶解し、得られた溶液を室温にて4時間撹拌した。得られた反応混合物をクロロホルムで希釈した。得られたクロロホルム溶液を水で洗浄し、次いで飽和食塩水で3回洗浄し、硫酸ナトリウムで乾燥した後、濾過し、減圧下で濃縮することにより、274.8mgの目的物を白色固体として得た。
1H-NMR (DMSO-d6): δ7.76 (s, 2H), 7.10-6.88 (m, 8H), 6.86-6.58 (m, 8H), 2.87 (s, 12H)
テトラメチルグアニジン(79.5mg、0.690mmol)をアセトンに溶解し、得られた溶液を、0.5N塩酸(1.38mL、0.690mmol)で中和した。得られた混合物に、テトラキス(4-フルオロフェニル)ホウ酸ナトリウム塩二水和物(富士フィルム和光純薬製)(300mg、0.724mmol)の水溶液を滴加した。得られた混合物中に生じた油状物質を分離してクロロホルムに溶解し、得られた溶液を室温にて4時間撹拌した。得られた反応混合物をクロロホルムで希釈した。得られたクロロホルム溶液を水で洗浄し、次いで飽和食塩水で3回洗浄し、硫酸ナトリウムで乾燥した後、濾過し、減圧下で濃縮することにより、283.7mgの目的物を白色固体として得た。
1H-NMR (DMSO-d6): δ7.75 (s, 2H), 7.11-7.00 (m, 8H), 6.80-6.68 (m, 8H), 2.87 (s, 12H)
(b-1’)1,2-ジイソプロピル-3-[ビス(ジメチルアミノ)メチレン]グアニジウム 2-(3-ベンゾイルフェニル)プロピオナート(WPBG-266、富士フィルム和光純薬株式会社製)
(b-2’)8-(9-オキソ-9H-チオキサンテン-2-イル)メチル-1,8-ジアザビシクロ[5.4.0]-7-ウンデセニウム テトラフェニルボレート
特開2017-36361記載の方法に従い合成した。
下記前駆体-1(190mg、0.459mmol)を純水に溶解し、得られた水溶液に、撹拌しながら、下記前駆体-3(200mg、0.437mmol)のクロロホルム溶液を室温にて滴加し、2終夜撹拌した。得られた反応混合物をクロロホルム層と水層に分離し、水層をクロロホルムで抽出し、得られた抽出物を前記クロロホルム層と合わせた。得られたクロロホルム溶液を飽和食塩水で3回洗浄し、硫酸ナトリウムで乾燥した後、濾過し、減圧下で濃縮することにより、270mgの目的物を薄黄色固体として得た。
1H-NMR(CDCl3): δ8.58 (d, 8.4 Hz, 1H), 8.15 (s, 1H), 7.70-7.48 (m, 4H), 7.20-6.94 (m, 13H), 6.66-6.56 (m, 4H), 4.30 (s, 2H), 3.36-3.26 (m, 2H), 3.21-3.03 (m, 4H), 2.48-2.37 (m, 2H), 1.91-1.79 (m, 2H), 1.72-1.39 (m, 6H)
(b-6’)トリブチルアンモニウム テトラフェニルボレート
トリブチルアミン(487mg、2.63mmol)をアセトン(6mL)に溶解し、得られた溶液を、0.5N塩酸(5.26mL、2.63mmol)にて中和した。得られた混合物に、テトラフェニルホウ酸ナトリウム(1.00g、2.92mmol)の水溶液を滴加した。得られた混合物を室温にて1時間撹拌し、得られた反応混合物中に生じた結晶を濾取して、純水で洗浄し、乾燥させることにより、1.18gの目的物を白色結晶として得た。
1H-NMR (DMSO-d6): δ8.85 (s, 1H), 7.23-7.13 (m, 8H), 6.98-6.88 (m, 8H), 6.83-6.74 (m, 4H), 3.09-2.95 (m, 6H), 1.63-1.50 (m, 6H), 1.38-1.24 (m, 6H), 0.91 (t 7.2 Hz, 9H)
なお、2-(ピペリジン-1-カルボニル)ベンズアルデヒドは、特許文献1の製造例1のPBG1、すなわち「2-(1-ピペリジニルカルボニル)ベンズアルデヒド」と同一の化合物である。
テトラメチルグアニジン(160mg、1.39mmol)をアセトンに溶解し、得られた溶液を、0.5N塩酸(2.78mL、1.39mmol)で中和した。得られた混合物に、テトラフェニルホウ酸ナトリウム(500mg、1.46mmol)の水溶液を滴加した。得られた混合物を室温にて4時間撹拌し、得られた反応混合物中に生じた結晶を濾取して、純水で洗浄し、乾燥させることにより、544mgの目的物を白色結晶として得た。
1H-NMR (DMSO-d6): δ7.75 (s, 2H), 7.22-7.13 (m, 8H), 6.96-6.87 (m, 8H), 6.83-6.74 (m, 4H), 2.87 (s, 12H)
(b-1”)2-メチル-4’-(メチルチオ)-2-モルホリノプロピオフェノン(Omnirad 907、富士フィルム和光純薬株式会社製)
(b-2”)2,4,6-トリメチルベンゾイルジフェニルホスフィンオキシド(Omnirad TPO、IGM Resins B.V.製)
前駆体-1(テトラキス(3-フルオロフェニル)ホウ酸ナトリウム)
下記文献に記載の方法にて合成した。
Journal of the American Chemical Society, (2010), 132(38), 13168-13169
特開2014-97930に記載の方法にて合成した。
特開2017-36361記載の方法にて合成した。
(c-1)2-エチルアントラキノン(富士フィルム和光純薬株式会社製)
(c-2)2-イソプロピルチオキサントン(東京化成工業株式会社製)
(c-3)4-ベンゾイル-4’-メチルジフェニルスルフィド(東京化成工業株式会社製)
光硬化性樹脂組成物の調製は、温度22℃、湿度50%±10%の、500nm以下の波長の光(紫外線を含む)をカットした室内にて行った。
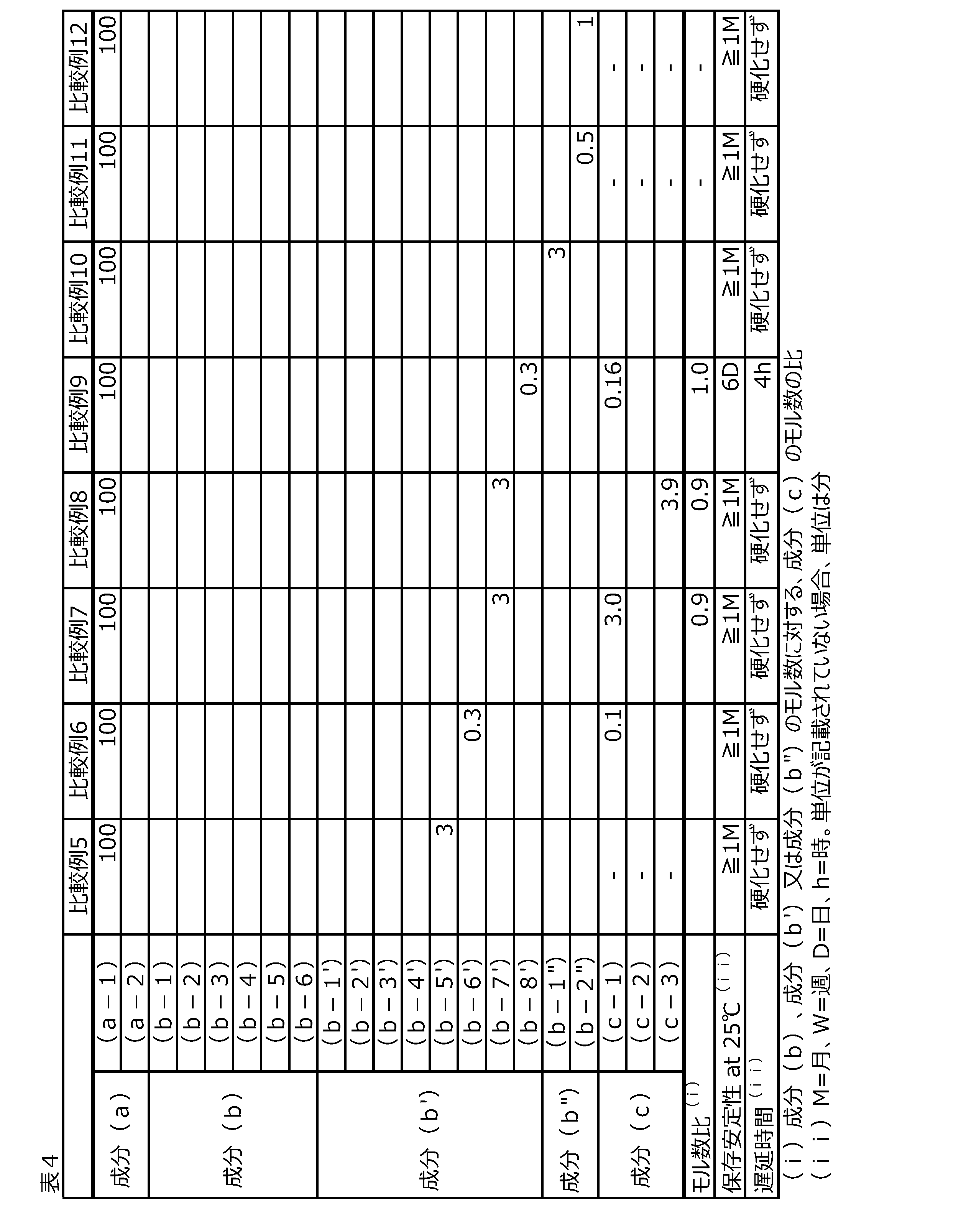
ホウ珪酸ガラス製のスクリュー管瓶(遮光用茶瓶)中、成分(a)2gに、成分(a)に対する重量比が表2~4に示す値となるように、成分(b)、(b’)または(b”)及び成分(c)を添加し、最大で3時間、超音波による分散を行いながら、混合物を得た。
以上の操作により、目視にて均一な溶液が得られたと判断された場合、得られた溶液を光硬化性樹脂組成物として用いた。
以上の操作で、目視にて均一な溶液が得られなかったと判断された場合、遠心分離操作を行い、上清部分を光硬化性樹脂組成物として用いた。
ホウ珪酸ガラス製のスクリュー管瓶(遮光用茶瓶)中の、製造された光硬化性樹脂組成物が、温度22℃±5℃、湿度50%±10%の、500nm以下の波長の光(紫外線を含む)をカットした室内にて、事実上流動性を失うまでの時間(保存安定性(時))を測定した。結果を表2~4に示す。保存安定性は、24時間以上であることが好ましく、1週間以上であることがより好ましく、1箇月以上であることがさらに好ましい。
本明細書において、「事実上流動性を失う」とは、前記ホウ珪酸ガラス製のスクリュー管瓶(遮光用茶瓶)にその容積の半分程度充填された前記光硬化性樹脂組成物が、前記ホウ珪酸ガラス製のスクリュー管瓶(遮光用茶瓶)を直立させた状態から瞬時に水平に傾けた場合に、重力下10秒間にわたり、その形状に明らかな変化が観察されない状態となることを指す。
温度22℃±5℃、湿度50%±10%の、500nm以下の波長の光(紫外線を含む)をカットした室内にて、光硬化性樹脂組成物を、スライドガラス上に1滴(0.02g程度)滴下し、単波長型UV LED光源(OmniCure(登録商標) AC475、エクセリタス・テクノロジーズ製)を用いて、波長365nmの紫外線で、積算光量が4000mJ/cm2(紫外線積算光量計UIT-250、受光器UVD-S365(ウシオ電機株式会社製)にて測定)となるまで、スライドガラス上面から光源までの高さ4cm、光源移動速度9mm/sで継続的に照射し、照射完了から、光硬化性樹脂組成物が硬化するまでの時間(遅延時間)を測定した。結果(遅延時間)を表2~4に示す。
この試験においては、スライドガラスを垂直に立てた状態で、重力下10秒間にわたり、スライドガラス上の光硬化性樹脂組成物の形状に明らかな変化が観察されなくなったときに、光硬化性樹脂組成物が硬化したとみなした。
光硬化性樹脂組成物が照射完了の直後の上記観察で硬化していると判断された場合には、遅延時間を「なし」とした。
光硬化性樹脂組成物が照射完了から2時間以内に硬化した場合には、照射完了から硬化までに要した時間を記載した。
光硬化性樹脂組成物が照射完了から2時間以内に硬化しなかった場合には、その後断続的に最長48時間後まで適宜観察を行い、照射完了から、光硬化性樹脂組成物が硬化したことが確認されるまでに要した時間を記載した。
光硬化性樹脂組成物が照射完了から48時間以内に硬化しなかった場合には、遅延時間を「硬化せず」とした。
上記遅延時間は、1時間以内であることが好ましく、30分以内であることがより好ましく、10分以内であることがさらに好ましく、数秒以内であることが最も好ましい。
実施例1~12より、上記成分(b)及び(c)を含む光硬化性樹脂組成物は、上記成分(a)が、DHMM等のような相対的に硬化させにくい2-メチレン-1,3-ジカルボニル化合物(2種以上の組み合わせであってもよい)であっても、波長365nmの低エネルギーの紫外線で、即時硬化を達成しうることがわかる。これは部分的には、上記成分(b)から発生する塩基性物質が、pKaが12以上である強塩基であることに起因している。加えて、上記成分(b)及び(c)を含む光硬化性樹脂組成物は、優れた安定性を示す。このことは、本発明の光硬化性樹脂組成物の硬化は、遮光下では実質的に進行しないことを示している。
実施例2より、成分(b)のアニオン(i)に関し、式(BAr4-nXn)-中のnが0でなくとも、光硬化性樹脂組成物の十分な即時硬化性及び安定性が得られることがわかる。
12 レンズ
14 ボイスコイルモータ
16 レンズユニット
18 支持体
20 カットフィルタ
22 撮像素子
24 プリント配線基板
30、32、34 接着剤
本明細書に記載された全ての文献、特許出願、および技術規格は、個々の文献、特許出願、および技術規格が参照により取り込まれることが具体的かつ個々に記された場合と同程度に、本明細書に参照により取り込まれる。
Claims (9)
- UV-A又はUV-B領域の紫外線の照射によって硬化させることができる光硬化性樹脂組成物であって、下記成分(a)~(c):
(a)2-メチレン-1,3-ジカルボニル化合物
(b)イオン型光塩基発生剤
(c)光増感剤
を含み、
前記2-メチレン-1,3-ジカルボニル化合物が、下記式(I):
で表される構造単位を少なくとも一つ含む化合物であり、
前記イオン型光塩基発生剤が、下記アニオン(i)及びカチオン(ii):
(i)式(BAr4-nXn)-(式中、Arは、各々独立に、非置換又は置換のC6-C10芳香族炭化水素基であり、Xは、各々独立に、非置換又は置換の直鎖状、分岐鎖状又は環状C1-C6脂肪族炭化水素基であり、nは0~2の整数であり、n=0のとき、少なくとも1つのArは置換C6-C10芳香族炭化水素基である)で表されるアニオン
(ii)アミジン構造、グアニジン構造又はビグアニド構造を有するカチオン
を含む塩であり、
前記光増感剤が、前記イオン型光塩基発生剤とは異なる、光硬化性樹脂組成物。 - アニオン(i)における少なくとも1つのArが置換フェニル基である、請求項1記載の光硬化性樹脂組成物。
- 置換フェニル基がフッ素を含む置換基を有する、請求項2記載の光硬化性樹脂組成物。
- フッ素を含む置換基が、置換フェニル基のホウ素原子に直接結合した炭素原子に対してメタ位にある炭素原子に結合している、請求項3記載の光硬化性樹脂組成物。
- フッ素を含む置換基がフッ素原子である、請求項3または4記載の光硬化性樹脂組成物。
- アニオン(i)におけるArがいずれも3-フルオロフェニル基である、請求項5記載の光硬化性樹脂組成物。
- アニオン(i)におけるnが0又は1である、請求項1記載の光硬化性樹脂組成物。
- nが0である、請求項7記載の光硬化性樹脂組成物。
- 成分(b)のモル数に対する成分(c)のモル数の比が0.1~6である、請求項1~8のいずれか1項記載の光硬化性樹脂組成物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2020048080 | 2020-03-18 | ||
| JP2020048080 | 2020-03-18 | ||
| PCT/JP2021/010401 WO2021187424A1 (ja) | 2020-03-18 | 2021-03-15 | 光硬化性樹脂組成物 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPWO2021187424A1 JPWO2021187424A1 (ja) | 2021-09-23 |
| JP7656941B2 true JP7656941B2 (ja) | 2025-04-04 |
Family
ID=77770971
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022508349A Active JP7656941B2 (ja) | 2020-03-18 | 2021-03-15 | 光硬化性樹脂組成物 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US20230143754A1 (ja) |
| EP (1) | EP4122963A4 (ja) |
| JP (1) | JP7656941B2 (ja) |
| KR (1) | KR20220155573A (ja) |
| CN (1) | CN115298230A (ja) |
| TW (1) | TWI864249B (ja) |
| WO (1) | WO2021187424A1 (ja) |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2014532625A (ja) | 2011-10-19 | 2014-12-08 | シラス・インコーポレイテッド | メチレンβ−ジケトンモノマー、メチレンβ−ジケトンモノマーを製造するための方法、これらから作られる重合可能な組成物および製品 |
| JP2015512460A (ja) | 2012-03-30 | 2015-04-27 | シラス・インコーポレイテッド | 重合性組成物の活性化方法、重合系およびこれにより形成される製品 |
| JP2017036361A (ja) | 2015-08-07 | 2017-02-16 | 三洋化成工業株式会社 | 光硬化性組成物 |
| US20180169642A1 (en) | 2016-12-15 | 2018-06-21 | Hanwha Total Petrochemical Co., Ltd. | Catalyst system for ethylene oligomerization and method for producing ethylene oligomerization using the same |
| WO2019014528A1 (en) | 2017-07-14 | 2019-01-17 | Sirrus, Inc. | METHOD FOR UV CURING METHYLENE MALONATES |
| WO2020071526A1 (ja) | 2018-10-05 | 2020-04-09 | ナミックス株式会社 | 樹脂組成物 |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9279022B1 (en) | 2014-09-08 | 2016-03-08 | Sirrus, Inc. | Solution polymers including one or more 1,1-disubstituted alkene compounds, solution polymerization methods, and polymer compositions |
| CN105949358A (zh) | 2010-10-20 | 2016-09-21 | 瑟拉斯公司 | 基本不含杂质的亚甲基丙二酸酯的合成 |
| JP2014097930A (ja) | 2012-11-13 | 2014-05-29 | San Apro Kk | 熱塩基発生剤 |
| JP6547143B2 (ja) * | 2014-11-07 | 2019-07-24 | 協立化学産業株式会社 | 光硬化性樹脂組成物 |
| JP7287628B2 (ja) | 2017-12-12 | 2023-06-06 | 学校法人東京理科大学 | 活性エネルギー線硬化型組成物 |
| JP6903039B2 (ja) | 2018-09-19 | 2021-07-14 | Kddi株式会社 | 伝搬品質判定装置、伝搬品質判定方法及び伝搬品質判定プログラム |
-
2021
- 2021-03-15 EP EP21772394.9A patent/EP4122963A4/en active Pending
- 2021-03-15 JP JP2022508349A patent/JP7656941B2/ja active Active
- 2021-03-15 US US17/912,204 patent/US20230143754A1/en active Pending
- 2021-03-15 KR KR1020227031428A patent/KR20220155573A/ko active Pending
- 2021-03-15 WO PCT/JP2021/010401 patent/WO2021187424A1/ja not_active Ceased
- 2021-03-15 CN CN202180022021.1A patent/CN115298230A/zh active Pending
- 2021-03-17 TW TW110109571A patent/TWI864249B/zh active
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2014532625A (ja) | 2011-10-19 | 2014-12-08 | シラス・インコーポレイテッド | メチレンβ−ジケトンモノマー、メチレンβ−ジケトンモノマーを製造するための方法、これらから作られる重合可能な組成物および製品 |
| JP2015512460A (ja) | 2012-03-30 | 2015-04-27 | シラス・インコーポレイテッド | 重合性組成物の活性化方法、重合系およびこれにより形成される製品 |
| JP2017036361A (ja) | 2015-08-07 | 2017-02-16 | 三洋化成工業株式会社 | 光硬化性組成物 |
| US20180169642A1 (en) | 2016-12-15 | 2018-06-21 | Hanwha Total Petrochemical Co., Ltd. | Catalyst system for ethylene oligomerization and method for producing ethylene oligomerization using the same |
| WO2019014528A1 (en) | 2017-07-14 | 2019-01-17 | Sirrus, Inc. | METHOD FOR UV CURING METHYLENE MALONATES |
| WO2020071526A1 (ja) | 2018-10-05 | 2020-04-09 | ナミックス株式会社 | 樹脂組成物 |
Also Published As
| Publication number | Publication date |
|---|---|
| US20230143754A1 (en) | 2023-05-11 |
| TW202146468A (zh) | 2021-12-16 |
| EP4122963A4 (en) | 2024-04-24 |
| JPWO2021187424A1 (ja) | 2021-09-23 |
| CN115298230A (zh) | 2022-11-04 |
| KR20220155573A (ko) | 2022-11-23 |
| EP4122963A1 (en) | 2023-01-25 |
| WO2021187424A1 (ja) | 2021-09-23 |
| TWI864249B (zh) | 2024-12-01 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6428646B2 (ja) | ボレート系塩基発生剤および該塩基発生剤を含有する塩基反応性組成物 | |
| KR101222214B1 (ko) | 신규한 술포늄 보레이트 착체 | |
| BR112012024198B1 (pt) | Composto e processo para a preparação de um aminoacrilato | |
| TWI722027B (zh) | 環氧系反應性稀釋劑及含有其之環氧樹脂組合物 | |
| WO1993013139A1 (fr) | Composition durcissable par irradiation | |
| WO2015053397A1 (ja) | 光カチオン硬化性塗料組成物及び塗膜形成方法、その塗装物品 | |
| WO2016031831A1 (ja) | 重合性単量体、硬化性組成物および樹脂部材 | |
| JP2019512567A (ja) | 光硬化性電子不足オレフィン含有組成物 | |
| EP3865519B1 (en) | Resin composition | |
| JP7656941B2 (ja) | 光硬化性樹脂組成物 | |
| JP5555532B2 (ja) | 有機el素子用封止剤及び有機el素子 | |
| EP1698646B1 (en) | Photocurable composition and photocurable compound | |
| JP7492754B2 (ja) | 重合性組成物及びそれを用いる硬化性樹脂組成物 | |
| KR102696789B1 (ko) | 감방사선성 조성물 및 그의 용도 | |
| JP2005187636A (ja) | 光硬化性樹脂組成物、表示素子用接着剤、接着方法および表示素子 | |
| JP6583049B2 (ja) | オルガノポリシロキサン、硬化性組成物及び硬化物の製造方法 | |
| KR20220052138A (ko) | 신규 화합물, 이를 포함하는 경화성 조성물 및 이의 경화물 | |
| CN118291046A (zh) | 低温固化型环氧粘合剂组合物 | |
| JP2025173135A (ja) | 組成物、硬化物及び硬化物の製造方法 | |
| CN102358758A (zh) | 含环缩醛的二苯甲酮光引发剂及其制备方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20240115 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20241022 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20241218 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20250311 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20250317 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7656941 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |