JP7653759B2 - 養子免疫療法における免疫細胞調節のための組成物および方法 - Google Patents
養子免疫療法における免疫細胞調節のための組成物および方法 Download PDFInfo
- Publication number
- JP7653759B2 JP7653759B2 JP2018537803A JP2018537803A JP7653759B2 JP 7653759 B2 JP7653759 B2 JP 7653759B2 JP 2018537803 A JP2018537803 A JP 2018537803A JP 2018537803 A JP2018537803 A JP 2018537803A JP 7653759 B2 JP7653759 B2 JP 7653759B2
- Authority
- JP
- Japan
- Prior art keywords
- cells
- cell
- pge
- population
- composition
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/4353—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems
- A61K31/436—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems the heterocyclic ring system containing a six-membered ring having oxygen as a ring hetero atom, e.g. rapamycin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/28—Bone marrow; Haematopoietic stem cells; Mesenchymal stem cells of any origin, e.g. adipose-derived stem cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/48—Reproductive organs
- A61K35/54—Ovaries; Ova; Ovules; Embryos; Foetal cells; Germ cells
- A61K35/545—Embryonic stem cells; Pluripotent stem cells; Induced pluripotent stem cells; Uncharacterised stem cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/08—Peptides having 5 to 11 amino acids
- A61K38/09—Luteinising hormone-releasing hormone [LHRH], i.e. Gonadotropin-releasing hormone [GnRH]; Related peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/14—Peptides containing saccharide radicals; Derivatives thereof, e.g. bleomycin, phleomycin, muramylpeptides or vancomycin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
- A61K38/21—Interferons [IFN]
- A61K38/212—IFN-alpha
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/43—Enzymes; Proenzymes; Derivatives thereof
- A61K38/46—Hydrolases (3)
- A61K38/50—Hydrolases (3) acting on carbon-nitrogen bonds, other than peptide bonds (3.5), e.g. asparaginase
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K40/00—Cellular immunotherapy
- A61K40/10—Cellular immunotherapy characterised by the cell type used
- A61K40/11—T-cells, e.g. tumour infiltrating lymphocytes [TIL] or regulatory T [Treg] cells; Lymphokine-activated killer [LAK] cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K40/00—Cellular immunotherapy
- A61K40/30—Cellular immunotherapy characterised by the recombinant expression of specific molecules in the cells of the immune system
- A61K40/31—Chimeric antigen receptors [CAR]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K40/00—Cellular immunotherapy
- A61K40/40—Cellular immunotherapy characterised by antigens that are targeted or presented by cells of the immune system
- A61K40/41—Vertebrate antigens
- A61K40/42—Cancer antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/7051—T-cell receptor (TcR)-CD3 complex
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0634—Cells from the blood or the immune system
- C12N5/0636—T lymphocytes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2239/00—Indexing codes associated with cellular immunotherapy of group A61K40/00
- A61K2239/31—Indexing codes associated with cellular immunotherapy of group A61K40/00 characterized by the route of administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2239/00—Indexing codes associated with cellular immunotherapy of group A61K40/00
- A61K2239/38—Indexing codes associated with cellular immunotherapy of group A61K40/00 characterised by the dose, timing or administration schedule
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/01—Fusion polypeptide containing a localisation/targetting motif
- C07K2319/03—Fusion polypeptide containing a localisation/targetting motif containing a transmembrane segment
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2510/00—Genetically modified cells
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Immunology (AREA)
- Engineering & Computer Science (AREA)
- Epidemiology (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Cell Biology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Zoology (AREA)
- Biomedical Technology (AREA)
- Developmental Biology & Embryology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Gastroenterology & Hepatology (AREA)
- Organic Chemistry (AREA)
- Biotechnology (AREA)
- Reproductive Health (AREA)
- Genetics & Genomics (AREA)
- Hematology (AREA)
- Virology (AREA)
- Wood Science & Technology (AREA)
- Biochemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Endocrinology (AREA)
- General Engineering & Computer Science (AREA)
- Microbiology (AREA)
- Gynecology & Obstetrics (AREA)
- Toxicology (AREA)
- Molecular Biology (AREA)
- Biophysics (AREA)
- Communicable Diseases (AREA)
- Oncology (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
Description
本出願は、2016年1月20日に出願された米国仮出願第62/281,064号、および2016年9月30日に出願された米国仮出願第62/402,883号の優先権を主張し、その開示は、参照により全体が本明細書に組み込まれる。
本発明は、養子細胞ベースの療法に適した免疫細胞の治療可能性を改善するための1つまたは複数の薬剤を十分量で含む組成物を提供する。改善された治療可能性を有する免疫細胞は、改善された増殖、持続性、細胞毒性、および/または細胞リコール/メモリーを提示する。免疫細胞は、特異的に改善された生体内増殖、生体内持続性、生体内細胞毒性、および/または生体内細胞リコール/メモリーを有してもよい。免疫細胞を改善するために、治療可能性は、T細胞集団におけるより良好な性質の免疫細胞を一般的に必要とし、例えば、ナイーブT細胞、幹細胞メモリーT細胞、ならびに/またはセントラルメモリーT細胞の、その維持、拡大、分化、および/もしくは脱分化を介した数あるいは割合の増大は、改善された生体内養子治療可能性についての、T細胞のより良好な性質の指標である。NK細胞集団において、例えば、その維持、サブタイプ偏向、拡大、分化、および/もしくは脱分化を介した養子NK細胞の数または割合の増大は、改善された生体内養子治療可能性についての、NK細胞のより良好な性質の指標である。NKT細胞集団に関して、例えば、その維持、サブタイプスイッチング、拡大、分化、および/もしくは脱分化を介したタイプI NKT細胞の数または割合の増大は、改善された生体内養子治療可能性についての、NKT細胞のより良好な性質の指標である。
本発明は、表1から選択される1つもしくは複数の薬剤と接触させた免疫細胞の単離された集団または亜集団を含む組成物を提供する。1つの実施形態において、免疫細胞の単離された集団または亜集団は、表1から選択される1つまたは複数の薬剤と免疫細胞の治療可能性を改善するのに十分な量で接触された。幾つかの実施形態において、処理された免疫細胞は、細胞ベースの養子療法において使用される。本発明は、免疫細胞の集団または亜集団、および表1において挙げられる薬剤から選択される1つまたは複数の薬剤をさらに提供し、ここで、表1において挙げられる薬剤から選択される1つもしくは複数の薬剤を使用した免疫細胞の集団または亜集団の処理が、養子療法の免疫細胞の治療可能性を改善する。処理は、細胞増殖、細胞毒性、および持続性を改善する、ならびに/または細胞療法の再発率を低減する免疫細胞の生物学的な特性を修飾することができる。
本発明は、養子細胞ベースの療法に適した免疫細胞の集団または亜集団を調節する方法を提供し、方法は、免疫細胞を表1から選択される少なくとも1つの薬剤を含む組成物と接触させることを含む。
試験管内細胞培養。フレッシュleukopak(AllCells、アラメダ、カリフォルニア州)を健常ドナーから得て、それから、EasySep Human T cell Enrichment Kit(ステムセルテクノロジーズ、バンクーバー、カナダ)を使用して、T細胞をネガティブセレクションした。新たに単離したT細胞を等分し、凍結保存した。スクリーニングを開始した日に、T細胞を解凍し、5%ヒトAB血清、IL-2、ペニシリン/ストレプトマイシン、およびさらに上清を含むX-Vivo 15に注いだ。細胞を、平底384ウェルプレートに、5×105細胞/mlにて、ビーズ対細胞比3:1の抗CD3/抗CD28dynabead(サーモフィッシャー、ウォルサム、マサチューセッツ州)と共に分注した。各プレートのカラム3からカラム22までの各ウェルに、終濃度10μMにて、個々の化合物を加えた。陽性および陰性対照をさらなるウェルに加えた。細胞を、約6日間、37℃にて、5%CO2でインキュベーションした。
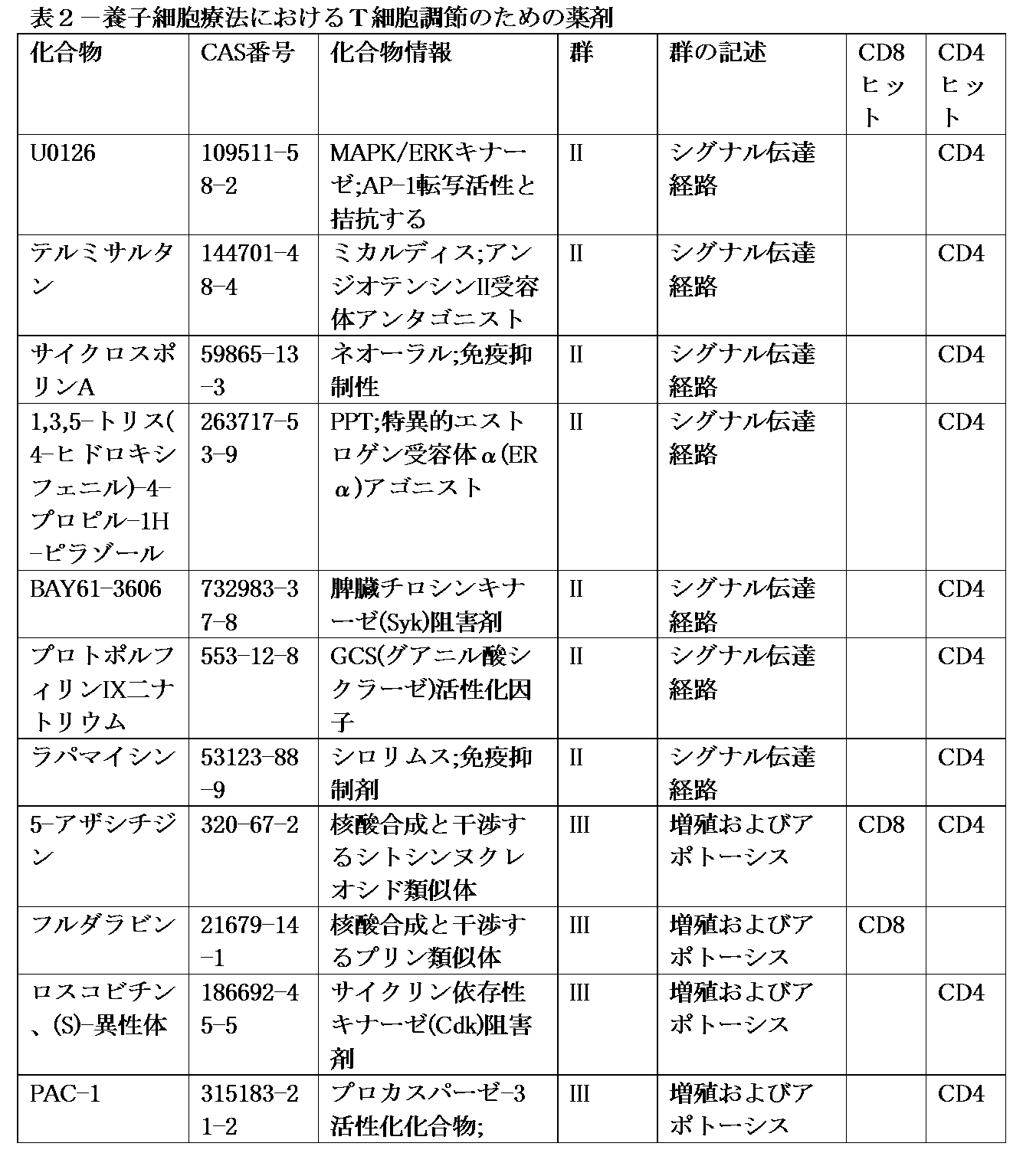
データを解析して、より高い割合もしくはより大きい絶対数のいずれかの、表現型の上で同定したナイーブ、幹細胞メモリー、またはセントラルメモリーT細胞を生じた化合物を同定した。これらの細胞を、CCR7およびCD62Lの発現により特徴付ける。それ故、これらの同定マーカーの両方を共発現する細胞を評価した。生CD4+集団および生CD8+集団内で、CCR7およびCD62Lを共発現する細胞のパーセントを決定した。所望されるT細胞サブセットの指標として、T細胞上でのCD62LまたはCCR7のいずれかの発現を、CAR-T細胞療法、および可能性のある他の養子T細胞療法の好ましい機能的特徴を有すると記載した。ドルソモルフィン、ヘプテリジン酸、GSK3阻害剤、6-メルカプトプリン、AC-93253ヨウ化物、チラトリコール、PI-103、5-アザシチジン、5,7-ジクロロ-8-キノリノール、ニトロフラントイン、5-クロロ-7-ヨード-8-キノリノール、またはジエチレントリアミンペンタ酢酸の処理の下で、CCR7およびCD62Lを共発現する細胞の数または割合は、生存CD4+集団と生存CD8+集団の両方において増大した(表2)。フルベストラント、タプシガルジン、SU4312、フルダラビン、2-ナフタセンカルボキサミド、7-クロロ-4-(ジメチルアミノ)-1,4,4a,5,5a,6,11,12a-オクタヒ、ニフロキサジド、塩化エドロホニウムの処理の下で、CCR7およびCD62Lを共発現する細胞の数または割合は、少なくとも生存CD8+集団において増大した(表2)。1-ピロリジンカルボジチオ酸、アンモニウム塩、U0126、テルミサルタン、サイクロスポリンA、1,3,5-トリス(4-ヒドロキシフェニル)-4-プロピル-1H-ピラゾール、BAY61-3606、プロトポルフィリンIX二ナトリウム、ラパマイシン、ロスコビチン、PAC-1、トスフロキサシン塩酸塩、BIX01294、およびテルフェナジンの処理の下で、CCR7およびCD62Lを共発現する細胞の数または割合は、少なくとも生存CD8+集団において増大した(表2)。
試験管内実験を行い、T細胞機能に対して決定的な影響を有する化合物曝露およびトリアージ化合物の方法を最適化する。第一の試験が、既に観察したナイーブ、幹細胞メモリー、およびセントラルメモリーT細胞に対する影響が、さらなるドナーにおいて繰り返されるかどうかを評価しながら、個々の化合物の最適な用量を決定する。T細胞に対する可能性のある決定的な機能的影響を有する化合物をトリアージするために、増殖能力、Th1およびTh17に二極化させる能力、凍結保存/解凍サイクルを通じた生存、伝達効率、ならびにCARにより伝達されたT細胞の殺腫瘍活性についての試験管内評価を行う。T細胞機能に対して有意な負の影響を伴わないで、拡大中にナイーブ、幹細胞メモリー、もしくはセントラルメモリーT細胞の割合または数を再生可能な方法で改善する化合物を、組み合わせで試験し、相加または相乗効果について評価する。これらの評価を通じて、有力候補または組み合わせを、生体内での追加試験に優先させる。
生体内スクリーニングおよび追跡試験管内トリアージ実験の結果を説明するために、選択した化合物の有力候補を、養子細胞療法の生体内モデルに適用する。具体的には、生着、殺腫瘍活性、2次的な殺腫瘍応答、遊走、細胞持続性、および移植片対宿主疾患に関して、養子細胞療法に対する小分子調節の影響を調べる。臨床において有効な応答と相関することが見い出された永続的養子細胞療法の特徴である他の読み取り情報もまた、調べる。
CD27は、4-1BBおよびOX-40も誘導するTRA結合TNF(腫瘍壊死因子)受容体ファミリーのメンバーである。これらの膜貫通型タンパク質は、リンパ球機能の制御に関与する。ヒトにおいて、大部分のナイーブ末梢T細胞(Tn)は、CD27を発現する。ナイーブ末梢T細胞が活性化されると、CD27の発現は有意に増大する。しかしながら、T細胞の最終エフェクター分化は、CD27の不可逆的な喪失と関連する(Hintzen et al. 1994)。CD27の役割のさらなる解明は、それが、T細胞免疫の発生および長期維持に必要であったことを示した(Hendriks et al. 2000)。
非ヒト霊長類モデルとNOD/Scid IL-2RγCnull(NSG)マウスモデルの両方における研究は、セントラルメモリー(Tcm)表現型を有するT細胞が、養子移植後、改善された持続性を有することを示した(Berger et al. 2008; Wang et al. 2011)。加えて、CARを発現するCD4かつCD8セントラルメモリーT細胞(Tcm)サブセットを、造血幹細胞移植後の非ホジキンリンパ腫患者に投与し、Tcm由来のCAR-T細胞が、改善された拡大を示し、これは、Tcmが、ヒトの癌の処置において治療上の利点を有し得ることを示している。Tcm表現型に集団を偏向させる際のラパマイシンとdmPGE2の組み合わせの能力を評価した。CD8 Tcmサブセットを、細胞表面マーカーCD45RAおよびCCR7の発現に基づき定義した。図4Aは、活性化されていないT細胞におけるCD45RAおよびCCR7発現の散布図を示し、次に、それを、Tcm、ナイーブ(Tn)、エフェクターメモリー(Tem)およびCD45RA+エフェクターメモリー(Temra)細胞を含むT細胞サブセットのゲーティングのため使用した。TnおよびTcm細胞は最低限分化し、最大の増殖可能性を有し、一方、Temra細胞は、最も十分に分化し、乏しい増殖可能性を有するが、強力なエフェクター機能を有する(D’Asaro et al. 2006)。
「枯渇」に起因したT細胞不全は、癌または感染症の十分な制御を起きないようにすることができる状態である。T細胞枯渇は、乏しいエフェクター細胞機能、ならびにPD-1およびTim-3を含む枯渇マーカーとして集合的に公知の、複数の細胞表面タンパク質の増大した発現により特徴付けられる(Wherry and Kurachi 2015)。枯渇マーカー発現に対するCAR-T細胞の化合物処理の効果を決定するために、実施例5において記載した通り、2人の異なるドナー由来の細胞を調製し、処理し、次に、PD-1およびTim-3について染色し、発現を、フローサイトメトリーを使用して決定した。図5において示した通り、ラパマイシンまたはdmPGE2のいずれかでの処理は、PD-1発現を低下させ、一方、ラパマイシンとdmPGE2の組み合わせでの処理は、ビヒクル、またはそれぞれの個々の化合物処理と比べ、PD-1発現においてわずかに大きな低減に至った。様々な処理下でのTim-3発現に関して、ビヒクルと比較したとき、ラパマイシン単独はTim-3発現を低下させ、一方、dmPGE2単独は効果を示さなかった。しかしながら、ラパマイシンとdmPGE2の組み合わせは、任意の単一の化合物処理または処理なしと比較して、Tim-3発現をより顕著に低減した。単独で使用したとき、dmPGE2は、Tim-3発現に対する効果を有しないという事実にも関らず、ビヒクル、ラパマイシン、およびdmPGE2と比べ、ラパ+dmPGE2の組み合わせによりTim-3発現において増強された低減を観察した。このデータは、ラパマイシンとdmPGE2の組み合わせでのT細胞の処理が、免疫不全に関与するT細胞枯渇を低減することにより、細胞の抗腫瘍能を増強することを示した。
細胞は、一般的に、2つの主要なエネルギー経路、解糖およびミトコンドリア呼吸を利用する。増大したストレスまたは労働に応答してエネルギーを生じるための細胞において利用可能な特別な能力である、ミトコンドリア予備呼吸容量(SRC)は、Tメモリー細胞において増大するが、TemraのようなTエフェクター細胞において増大しないことが示された(van der Windt et al. 2012)。
試験管内T細胞拡大プロセス中の、個々または組み合わせでのラパマイシンおよびdmPGE2処理のゲノム全体での影響を特徴付けるために、実施例5において記載した通り、形質導入し、処理した細胞からRNAを抽出し、Human Transcriptome Array gene(マイクロアレイ)チップ(アフィメトリクス、サンタクララ、カリフォルニア州)において解析し、結果を、ビヒクルで処理した試料と比較した。図7Aは、個々および組み合わせでの小分子により誘導された遺伝子プローブの転写変化を示すために、マイクロアレイチップを使用したゲノム全体での転写変化を描写する。図7Bにおいて模式的に示す通り、ラパ+dmPGE2処理下で、ビヒクル対照と比較して2倍より多く上方制御される遺伝子の総数は377であり、一方、それぞれ、ラパマイシン単独およびdmPGE2単独の処理下で215ならびに71であることは注目に値する。377種の上方制御された遺伝子のうち、264種の遺伝子は、組み合わせ処理で固有に上方制御されるが、いずれかの個々の化合物処理によってはされない。下方制御された遺伝子に関して、計581種の遺伝子が、ラパ+dmPGE2処理の下で、ビヒクル対照と比較して2倍より大きく下方制御され、一方、284種および38種のみの遺伝子が、それぞれ、ラパマイシン単独、およびdmPGE2単独処理下で下方制御される。581種の下方制御された遺伝子のうち、351種の遺伝子は、組み合わせ処理で固有に下方制御されるが、いずれかの個々の化合物処理によってはされない。単一または組み合わせの化合物処理下の差次的遺伝子発現特性は、両方の小分子を使用した組み合わせ処理が、それぞれの個々の処理の合計より有意に大きい、予め見い出された転写効果を有することを示し、これは、両方の経路の調節薬の存在下での相乗的応答を示している。
T細胞成熟に重要な遺伝子のパネルについての発現変化に対する、組み合わせでの両方の小分子の影響をさらに特徴付けるために、実施例5において形質導入し、調製した細胞から、トータルRNAを抽出した。RNAを、アフィメトリクスヒトトランスクリプトームアレイにおいて解析し、パネル中の遺伝子の(ビヒクル処理と比べた)変化の倍数を決定した。両方の小分子を含めることは、そのうち幾つかがメモリー表現型を促進することが公知である多くの鍵となるT細胞遺伝子に対する予め見いだされた転写の影響、同じく代謝への影響を有した(図8A)。ラパマイシンとdmPGE2の両方での処理は、転写因子遺伝子(図8B)と解糖に関与する遺伝子(図8B)の両方に対して相乗的効果をもたらした。転写因子TCF7およびLEF1は、機能的メモリー細胞の発生に重要であり(Zhou et al., J Immunol. 2012; 189(6): 2722-2726)、ラパマイシンとdmPGE2の両方での処理は、いずれかの化合物単独よりこれらの遺伝子の発現を増大した(図8B)。BLIMP-1は、最後まで分化したT細胞およびエフェクターメモリーT細胞において発現した転写抑制性遺伝子であり、BLIMP-1欠損は、セントラルメモリーT細胞特性の獲得を促進する(Rutishauser et al., Immunity. 2009; 31(2): 296-308)。ラパマイシンとdmPGE2の組み合わせでの処理は、いずれかの化合物単独と比較して、BLIMP-1発現のよりおおきな低下をもたらした(図8B)。興味深いことに、BLIMP-1は、dmPGE2単独で処理したとき、わずかに上方制御され、それは、dmPGE2がエフェクターT細胞分化を促進するという観察と一致する(Sreeramkumar et al., 2015)。故に、ラパマイシンとdmPGE2の両方を使用した組み合わせ処理は、T細胞分化をもたらす際のdmPGE2の傾向を「正す」だけでなく、下方制御されているBLIMP-1発現において、ラパマイシンと組み合わされたとき相乗的効果を達成することは驚くべきことである。
メモリー細胞偏向におけるラパ+dmPGE2の影響をさらに特徴付けるために、メモリーT細胞において高度に発現することが公知の、2つの鍵となる遺伝子CCR7およびCD62Lについての発現変化を調べた。トータルRNAを、実施例5において記載した通り、化合物で処理した細胞から抽出した。RNAを、各遺伝子に特異的なRT-qPCRおよびTaqMan遺伝子発現アッセイを使用して解析した。各遺伝子転写物の相対量を、各試験管内処理について決定した。図9Aおよび9Bは、ラパ+dmPGE2処理での両方の鍵となるメモリーT細胞遺伝子の発現における劇的な増大を示し、一方、個々の化合物は、これらの遺伝子の両方について比較的最小限の転写の増大を誘導した。図9Cは、実施例5および図3におけるCD27の細胞表面発現を裏付ける、CD27遺伝子発現に対するラパ+dmPGE2処理の同様の効果を示した。ラパマイシンとdmPGE2の両方について観察した要件は、発現の変化をメモリーT細胞に向けて促進する経路間の相乗的応答を暗示する。
臨床試験におけるCAR-T細胞療法の臨床上の診断マーカーは、処置後の患者においてCAR-T細胞の拡大である(Porter et al. 2015)。CAR-T細胞が、複数回のラウンド後に試験管内で腫瘍細胞を「排除する」ことを可能にする、試験管内連続殺傷アッセイは、CARにより認識される抗原を発現する腫瘍細胞の存在下でのCAR-T拡大を評価することができるモデルである。この終わりに、CD8 T細胞を形質導入して、CAR-T細胞を得て、実施例5において記載する通り処理し、次に、凍結保存した。解凍後、CAR-T細胞を、内在性CD19および遺伝子導入mKate2遠赤色蛍光タンパク質を発現するNalm6腫瘍細胞と共培養した。CAR-T細胞におけるeGFP、およびNalm6標的細胞におけるmKate2の発現は、連続殺傷アッセイにおいて両方の細胞タイプの容易かつ信頼性のある同定およびカウントを可能にする。殺傷の各ラウンドを開始する前に、Nalm6標的細胞に対するCAR-T細胞の同じ比が、異なる化合物処理から生じたCAR-T細胞培養に渡り維持されるように、細胞数を調整した。
拡大における観察した相違に関らず、試験管内で腫瘍細胞を殺傷するCAR-T細胞の能力は、3ラウンドの試験管内殺傷について影響しなかった。ラパ、dmPGE2、またはラパ+dmPGE2で予め処理したCAR-T細胞は、時間と共に標的細胞を首尾よく排除した(図11A)。3ラウンドの終わりに、共培養物における生存細胞のフローサイトメトリー解析は、ビヒクルおよび全ての、化合物で処理した細胞について非常にわずかのmKate2陽性細胞を示した(図11B)。
CD4 T細胞に対するラパ+dmPGE2の効果を決定するために、およびラパ+dmPGE2の増大した拡大が、より大きな拡大フォーマットまで増えるであろうことを示すために、CD4かつCD8 T細胞を、別々に活性化し、試験管内で拡大させた。活性化の1日後、細胞をCAR-2コンストラクト(図2)で形質導入し、次に、化合物を含むかまたは含まない24ウェルGREXプレートに再度蒔いた。半分の培地を、活性化の1週間後の回収までその後2日毎に置き換えた。図12は、ラパ+dmPGE2の添加が、DMSOと比べ、活性化の1週間後に増大したCD4かつCD8 T細胞拡大(図12A)およびばバイアビリティー(図12B)をもたらすことを示す。
ラパ+dmPGE2処理が、CAR-T細胞の生体内腫瘍クリアランスおよび持続性を増大したかどうかを決定するために、NSGマウスに、ホタルルシフェラーゼを発現するように操作したNalm-6-luc、CD19+ヒト腫瘍株を注射した。CAR-T細胞を、別々に活性化させ、試験管内で拡大させたCD4+かつCD8+T細胞から生じさせた。活性化の1日後、細胞をCAR-2コンストラクト(図2)で形質導入し、次に、化合物を含むかまたは含まない24ウェルGREXプレートに再度蒔いた。半分の培地を、活性化の1週間後の回収までその後2日毎に置き換えた。腫瘍注入の1週間後、NSGマウスを、後眼窩注射を介して、比1:1で混合した0.2×106CD4かつCD8 CAR-T細胞で処置した。マウスを、定期的に画像処理し、腫瘍負荷量を決定した。図13Aは、ラパ+dmPGE2またはPI3K阻害剤PI-103で処理したCAR-T細胞が、マウスの大部分から腫瘍を排除することができたが、一方、形質導入していないT細胞、またはDMSO、U0126もしくはTWS119で処理したCAR-T細胞で処置したものは、最小の腫瘍制御を示した。
最初の腫瘍クリアランスを仲介したCAR-T細胞が、持続することができ、長期の保護をもたらすかどうかを決定するために、原発腫瘍注入の60日後に、原発腫瘍負荷を生存したマウス(実施例14)に、CD19を発現するよう操作したヒト骨髄性白血病株K562-CD19を再負荷した。この再負荷研究の開始まで生存したマウスを有した唯一の2群は、ラパ+dmPGE2およびPI-103で処理したコホートであった。図13Bは、二次性腫瘍での負荷の21日後に、ラパ+dmPGE2で処理したCAR-Tのマウスの75%(3/4)、およびPI103 CAR-Tで処置したマウスの60%(3/5)が、検出可能な腫瘍を有しなかったことを示す。
ラパ+dmPGE2処理が、凍結保存後のCAR-T細胞の生体内腫瘍クリアランスおよび持続性を増大したかどうかを決定するために、本発明者らは、NSGマウスに、ホタルルシフェラーゼを発現するように操作した、0.5×106Nalm-6-luc、CD19発現ヒト腫瘍株を注入した。4日後、マウスを、比1:1で混合した1.0×106、0.5×106または0.2×106CD4かつCD8 CAR-T細胞で処置した。CAR-T細胞を、実施例14において記載した通り、別々に活性化し、試験管内で拡大したCD4+かつCD8+T細胞から生じさせた。活性化の1日後、細胞をCAR-2コンストラクト(図2)で形質導入し、次に、化合物を含むかまたは含まない24ウェルGREXプレートに再度蒔いた。半分の培地を、活性化の1週間後の回収までその後2日毎に置き換えた。細胞を凍結保存し、次に使用のため解凍した。NSGマウスに腫瘍細胞を注入し、続いて1週間後、後眼窩注射を介してCAR-Tを移植した。
Claims (18)
- T細胞の集団と、2種以上の薬剤を含む組成物であって、該2種以上の薬剤が、
(i) ラパマイシン;並びに
(ii) dmPGE2又はその類似体もしくは誘導体であって、PGE2、16,16-ジメチルPGE2p-(p-アセタミドベンズアミド)フェニルエステル、11-デオキシ-16,16-ジメチルPGE2、9-デオキシ-9-メチレン-16,16-ジメチルPGE2、9-デオキシ-9-メチレンPGE2、9-ケトフルプロステノール、5-トランスPGE2、17-フェニル-オメガ-トリノルPGE2、PGE2セリノールアミド、PGE2メチルエステル、16-フェニルテトラノルPGE2、15(S)-15-メチルPGE2、15(R)-15-メチルPGE2、8-イソ-15-ケトPGE2、8-イソPGE2イソプロピルエステル、8-イソ-16-シクロヘキシル-テトラノルPGE2、20-ヒドロキシPGE2、20-エチルPGE2、11-デオキシPGEi、ノクロプロスト、スルプロストン、ブタプロスト、15-ケトPGE2、及び19(R)ヒドロキシPGE2からなる群から選択されるもの
を含み、
前記2種以上の薬剤は、T細胞と接触すると、改善された治療可能性を有する調節されたT細胞を生じ、
前記T細胞の集団は、(a)キメラ抗原受容体(CAR)をコードする外来核酸を含み、(b)CD4又はCD8を発現するT細胞を含む、
組成物。 - 請求項1に記載の組成物であって、
(a) 前記2種以上の薬剤が、
(i) T細胞拡大、維持、分化、脱分化、及び/又は生存率を改善し;
(ii) T細胞増殖、細胞毒性、持続性、サイトカイン応答及び分泌、ならびに/又は細胞リコールを改善し;ならびに/又は
(iii) T細胞に接触すると1つもしくは複数の所望される免疫細胞亜集団の数又は割合を増大する、
ことができる薬剤であり、又は、
(b) 前記組成物が1つ又は複数の添加剤をさらに含む、
組成物。 - 請求項2に記載の組成物であって、以下の特徴のうち少なくとも一つを有する組成物。
(a) 1つ又は複数の所望される亜集団の数又は割合の増大が:
(i) ナイーブT細胞、幹細胞メモリーT細胞、及び/もしくはセントラルメモリーT細胞;
(ii) 少なくとも1つの遺伝子的に修飾されたモダリティ;及び/又は
(iii) 前記CARをコードする外来核酸を含むT細胞;
の数又は割合の増大を含む。 - 請求項2に記載の組成物であって、以下の特徴のうち少なくとも一つを有する組成物。
(b) 前記T細胞集団のT細胞は、
(A) ゲノム的に操作され、挿入、欠失、もしくは核酸置換を含む;
(B) 少なくとも1つの遺伝子的に修飾されたモダリティを含む;又は
(C) T細胞受容体(TCR)をコードする外来核酸を含む。 - 請求項2に記載の組成物であって、以下の特徴のうち少なくとも一つを有する組成物。
(c) 前記T細胞集団のT細胞は、遺伝子的に修飾されたモダリティを含み、該遺伝子的に修飾されたモダリティが、セーフティスイッチタンパク質、ターゲティングモダリティ、受容体、シグナル伝達分子、転写因子、医薬的に有効なタンパク質及びペプチド、薬物標的候補;又は前記免疫細胞の生着、輸送、ホーミング、バイアビリティー、自己再生、持続性、免疫応答制御及び調節、ならびに/もしくは生存を促進するタンパク質の少なくとも1つを含む。 - 請求項2に記載の組成物であって、以下の特徴のうち少なくとも一つを有する組成物。
(d) 前記T細胞集団のT細胞は、遺伝子的に修飾されたモダリティを含み、該少なくとも一つの遺伝子的に修飾されたモダリティが、
(i)欠失もしくは低減した発現のB2M、TAP1、TAP2、タパシン、NLRC5、PD1、LAG3、TIM3、RFXANK、CIITA、RFX5、又はRFXAP、及び染色体6p21領域中の任意の遺伝子;ならびに
(ii)誘導されたもしくは増大した発現のHLA-E、HLA-G、HACD16、hnCD16、41BBL、CD3、CD4、CD8、CD47、CD113、CD131、CD137、CD80、PDL1、A2AR、Fc受容体、又は二重もしくは多特異性又は普遍的エンゲイジャーとのカップリングのための表面トリガー受容体の1つ又は複数を含む。 - 請求項2に記載の組成物であって、以下の特徴のうち少なくとも一つを有する組成物。
(e) 前記組成物が、ラパマイシン及びdmPGE2を含む。 - 請求項2に記載の組成物であって、以下の特徴のうち少なくとも一つを有する組成物。
(f)前記一つ又は複数の添加剤が:
(i) ジメチルスルホキシド(DMSO)、N,N-ジメチルホルムアミド(DMF)、ジメトキシエタン(DME)、ジメチルアセトアミド、エタノール及びその組み合わせからなる群から選択される少なくとも1つの有機溶媒;
(ii) ペプチド、抗体、抗体フラグメント、サイトカイン、マイトジェン、成長因子、スモールRNA、dsRNA、単核血液細胞、フィーダー細胞、フィーダー細胞成分もしくは置換因子、対象となる1つもしくは複数のポリ核酸を含むベクター、化学療法剤もしくは放射性部分、及び免疫調節薬(IMiD)の少なくとも一つ;及び/又は
(iii) IL2、IL15、IL12、IL18及びIL21を含む刺激性サイトカインの少なくとも一つ、を含む。 - ドルソモルフィン、ヘプテリジン酸、1-ピロリジンカルボジチオ酸、2-デオキシグルコース(2-DG)、BIO、TWS119、CHIR99021、チアゾビビン、PD0325901、U0126、PS48、SB431542、6-メルカプトプリン、AC-93253ヨウ化物、チラトリコール、PI-103、フルベストラント、タプシガルジン、SU4312、テルミサルタン、サイクロスポリンA、1,3,5-トリス(4-ヒドロキシフェニル)-4-プロピル-1H-ピラゾール、BAY61-3606、プロトポルフィリンIX二ナトリウム、HS173、LY294002、ピクチリシブ、5-アザシチジン、フルダラビン、ロスコビチン(S)-異性体、PAC-1、5,7-ジクロロ-8-ヒドロキシキノリン、ニトロフラントイン、5-クロロ-7-ヨード-8-キノリノール、Cas No. 64-73-3、ニフロキサジド、トスフロキサシン塩酸塩、セルトラリン、ジエチレントリアミンペンタ酢酸、塩化エドロホニウム、BIX01294及びテルフェナジンから成る群より選ばれる1つ又は複数の薬剤をさらに含む、請求項1記載の組成物。
- T細胞の集団と、2種以上の薬剤を含む十分な量の組成物とを生体外で接触させることを含む、T細胞集団の調節方法であって、前記2種以上の薬剤が、
(i) ラパマイシン;及び
(ii) dmPGE2又はその類似体もしくは誘導体であって、PGE2、16,16-ジメチルPGE2p-(p-アセタミドベンズアミド)フェニルエステル、11-デオキシ-16,16-ジメチルPGE2、9-デオキシ-9-メチレン-16,16-ジメチルPGE2、9-デオキシ-9-メチレンPGE2、9-ケトフルプロステノール、5-トランスPGE2、17-フェニル-オメガ-トリノルPGE2、PGE2セリノールアミド、PGE2メチルエステル、16-フェニルテトラノルPGE2、15(S)-15-メチルPGE2、15(R)-15-メチルPGE2、8-イソ-15-ケトPGE2、8-イソPGE2イソプロピルエステル、8-イソ-16-シクロヘキシル-テトラノルPGE2、20-ヒドロキシPGE2、20-エチルPGE2、11-デオキシPGEi、ノクロプロスト、スルプロストン、ブタプロスト、15-ケトPGE2、及び19(R)ヒドロキシPGE2からなる群から選択されるもの
を含み、
前記T細胞の集団は、(a)キメラ抗原受容体(CAR)をコードする外来核酸を含み、(b)CD4又はCD8を発現するT細胞を含む、
改善された治療可能性を有する調節されたT細胞集団を得る、方法。 - 1つ又は複数の所望される亜集団を、前記調節されたT細胞集団から単離することを更に含む、請求項10記載の方法。
- 前記1つ又は複数の所望される亜集団が、ナイーブT細胞、幹細胞メモリーT細胞、及び/もしくはセントラルメモリーT細胞を含む、請求項11記載の方法。
- 請求項10記載の方法であって、前記接触の前の前記T細胞集団のT細胞が、
(a) 末梢血、骨髄、リンパ節組織、臍帯血、胸腺組織、感染の部位由来の組織、腹水、胸水、脾臓組織、もしくは腫瘍から単離されるか、又はそれに含まれる;
(b)
(i)健常対象;
(ii) 自己免疫疾患、造血器悪性腫瘍、ウイルス感染症もしくは固形腫瘍を有する対象;
(iii) 遺伝子的に修飾された免疫細胞を既に投与された対象;又は
(iv) CMV血清陽性である対象;
から単離される;
(c) ゲノム的に操作され、挿入、欠失、もしくは核酸置換を含むか、又は、少なくとも1つの遺伝子的に修飾されたモダリティを含む;
(d) 少なくとも1つの遺伝子的に修飾されたモダリティを含む;
(e) T細胞受容体(TCR)、及び/又はキメラ抗原受容体(CAR)をコードする外来核酸を含む;
(f) 幹細胞、造血幹細胞もしくは造血前駆細胞、又は前駆細胞から試験管内で分化する;及び/又は、
(g) 造血系又は非造血系の非多能性細胞から試験管内で分化転換する、
方法。 - 請求項13記載の方法であって、
(a) 前記幹細胞が、誘導された多能性幹細胞(iPSC)又は胚性幹細胞(ESC)を含む、
(b) 前記前駆細胞が、CD34+造血性内皮細胞、多能性前駆細胞、T細胞前駆細胞である;
(c) 前記幹細胞、造血幹細胞もしくは造血前駆細胞、又は前駆細胞が、
(i) ゲノム的に操作され、挿入、欠失、もしくは核酸置換を含む、
(ii) 少なくとも1つの遺伝子的に修飾されたモダリティを含む、又は
(iii) T細胞受容体(TCR)、及び/又はキメラ抗原受容体(CAR)をコードする外来核酸を含む;
(d) 前記遺伝子的に修飾されたモダリティが、セーフティスイッチタンパク質、ターゲティングモダリティ、受容体、シグナル伝達分子、転写因子、医薬的に有効なタンパク質及びペプチド、薬物標的候補;又は前記免疫細胞の生着、輸送、ホーミング、バイアビリティー、自己再生、持続性、免疫応答制御及び調節、ならびに/もしくは生存を促進するタンパク質の少なくとも1つを含む;又は
(e) 前記遺伝子的に修飾されたモダリティが、
(i)欠失もしくは低減した発現のB2M、TAP1、TAP2、タパシン、NLRC5、PD1、LAG3、TIM3、RFXANK、CIITA、RFX5、又はRFXAP、及び染色体6p21領域中の任意の遺伝子;ならびに
(ii)誘導されたもしくは増大した発現のHLA-E、HLA-G、HACD16、hnCD16、41BBL、CD3、CD4、CD8、CD47、CD113、CD131、CD137、CD80、PDL1、A2AR、Fc受容体、又は二重もしくは多特異性又は普遍的エンゲイジャーとのカップリングのための表面トリガー受容体の1つ又は複数を含む、
方法。 - 請求項10記載の方法であって、調節されたT細胞の集団が、組成物と接触させられていない、調節されていないT細胞の集団と比較して、
(a)CD27、CCR7、CD62L、TCF7及びLEF1の少なくとも1つにおける増大した遺伝子発現;
(b)増大した予備呼吸容量(SRC);
(c)増大したセントラルメモリーT細胞亜集団;
(d)低減したエフェクターT細胞亜集団;
(e)改善された拡大及びバイアビリティー;ならびに
(f)腫瘍クリアランス及び持続性における改善された能力、
の少なくとも1つを有する、方法。 - 前記組成物が、ドルソモルフィン、ヘプテリジン酸、1-ピロリジンカルボジチオ酸、2-デオキシグルコース(2-DG)、BIO、TWS119、CHIR99021、チアゾビビン、PD0325901、U0126、PS48、SB431542、6-メルカプトプリン、AC-93253ヨウ化物、チラトリコール、PI-103、フルベストラント、タプシガルジン、SU4312、テルミサルタン、サイクロスポリンA、1,3,5-トリス(4-ヒドロキシフェニル)-4-プロピル-1H-ピラゾール、BAY61-3606、プロトポルフィリンIX二ナトリウム、HS173、LY294002、ピクチリシブ、5-アザシチジン、フルダラビン、ロスコビチン(S)-異性体、PAC-1、5,7-ジクロロ-8-ヒドロキシキノリン、ニトロフラントイン、5-クロロ-7-ヨード-8-キノリノール、Cas No. 64-73-3、ニフロキサジド、トスフロキサシン塩酸塩、セルトラリン、ジエチレントリアミンペンタ酢酸、塩化エドロホニウム、BIX01294及びテルフェナジンから成る群より選ばれる1つ又は複数の薬剤をさらに含む、請求項10記載の方法。
- 請求項10~16のいずれか1項に記載の方法により、調節されたT細胞の集団を作製することを含む、治療組成物の製造方法。
- (a) 前記組成物が、ラパマイシン及びdmPGE2の組み合わせを含み;並びに/又は
(b) 調節されたT細胞集団のT細胞が、調節されていないT細胞と比較して、以下の少なくとも1つを有する、請求項10~16のいずれか1項に記載の方法。
(i) CD27、CCR7、CD62L、TCF7及びLEF1の少なくとも1つにおける増大した遺伝子発現;
(ii) 増大した予備呼吸容量(SRC);
(iii) 増大したセントラルメモリーT細胞亜集団;
(iv) 低減したエフェクターT細胞亜集団;及び
(v) 腫瘍クリアランス及び持続性における改善された能力。
Priority Applications (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2023000071A JP2023036919A (ja) | 2016-01-20 | 2023-01-04 | 養子免疫療法における免疫細胞調節のための組成物および方法 |
| JP2024219599A JP2025038093A (ja) | 2016-01-20 | 2024-12-16 | 養子免疫療法における免疫細胞調節のための組成物および方法 |
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662281064P | 2016-01-20 | 2016-01-20 | |
| US62/281,064 | 2016-01-20 | ||
| US201662402883P | 2016-09-30 | 2016-09-30 | |
| US62/402,883 | 2016-09-30 | ||
| PCT/US2017/014449 WO2017127755A1 (en) | 2016-01-20 | 2017-01-20 | Compositions and methods for immune cell modulation in adoptive immunotherapies |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2023000071A Division JP2023036919A (ja) | 2016-01-20 | 2023-01-04 | 養子免疫療法における免疫細胞調節のための組成物および方法 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2019502725A JP2019502725A (ja) | 2019-01-31 |
| JP2019502725A5 JP2019502725A5 (ja) | 2020-02-27 |
| JP7653759B2 true JP7653759B2 (ja) | 2025-03-31 |
Family
ID=59362155
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018537803A Active JP7653759B2 (ja) | 2016-01-20 | 2017-01-20 | 養子免疫療法における免疫細胞調節のための組成物および方法 |
| JP2023000071A Pending JP2023036919A (ja) | 2016-01-20 | 2023-01-04 | 養子免疫療法における免疫細胞調節のための組成物および方法 |
| JP2024219599A Pending JP2025038093A (ja) | 2016-01-20 | 2024-12-16 | 養子免疫療法における免疫細胞調節のための組成物および方法 |
Family Applications After (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2023000071A Pending JP2023036919A (ja) | 2016-01-20 | 2023-01-04 | 養子免疫療法における免疫細胞調節のための組成物および方法 |
| JP2024219599A Pending JP2025038093A (ja) | 2016-01-20 | 2024-12-16 | 養子免疫療法における免疫細胞調節のための組成物および方法 |
Country Status (4)
| Country | Link |
|---|---|
| US (2) | US11413309B2 (ja) |
| EP (1) | EP3405568A4 (ja) |
| JP (3) | JP7653759B2 (ja) |
| WO (1) | WO2017127755A1 (ja) |
Families Citing this family (42)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN116376826A (zh) | 2016-01-20 | 2023-07-04 | 菲特治疗公司 | 用来在过继性免疫疗法中进行免疫细胞调节的组合物和方法 |
| US11413309B2 (en) | 2016-01-20 | 2022-08-16 | Fate Therapeutics, Inc. | Compositions and methods for immune cell modulation in adoptive immunotherapies |
| WO2017143052A1 (en) * | 2016-02-16 | 2017-08-24 | Duke University | Methods for expanding and differentiating b cells for producing antibody |
| WO2018085419A1 (en) | 2016-11-01 | 2018-05-11 | Jian Feng | Method of producing naive pluripotent stem cells |
| EP3548049A4 (en) | 2016-12-05 | 2020-07-22 | Fate Therapeutics, Inc. | COMPOSITIONS AND METHODS FOR MODULATION OF IMMUNE CELLS IN ADOPTIVE IMMUNOTHERAPIES |
| CN110546265A (zh) | 2017-02-09 | 2019-12-06 | 因达普塔治疗公司 | 工程化自然杀伤(nk)细胞及其组合物和方法 |
| CN110621321B (zh) | 2017-03-15 | 2024-06-21 | 浩康生物系统公司 | 用于造血干细胞移植的组合物和方法 |
| CN118161496A (zh) | 2017-03-31 | 2024-06-11 | 小利兰·斯坦福大学托管委员会 | 通过抑制或调节t细胞受体信号传导来治疗t细胞耗竭的方法 |
| WO2019100911A1 (zh) * | 2017-11-23 | 2019-05-31 | 北京鼎材科技有限公司 | 化合物及使用了该化合物的有机电致发光器件 |
| BR112020010597A2 (pt) * | 2017-12-08 | 2020-10-27 | Fate Therapeutics, Inc. | imunoterapias com o uso de células efetoras derivadas de ipsc intensificadas |
| KR20250048610A (ko) | 2017-12-22 | 2025-04-09 | 페이트 세러퓨틱스, 인코포레이티드 | 향상된 면역 효과기 세포 및 이의 용도 |
| SG11202106249QA (en) | 2018-01-25 | 2021-07-29 | Mia Levite | Methods for improved immunotherapy |
| JP7575271B2 (ja) * | 2018-03-29 | 2024-10-29 | フェイト セラピューティクス,インコーポレイテッド | 操作された免疫エフェクター細胞およびその使用 |
| EP3884041A2 (en) | 2018-11-21 | 2021-09-29 | Indapta Therapeutics, Inc. | Methods for expansion of natural killer (nk) cell subset and related compositions and methods |
| JP2022512161A (ja) * | 2018-12-11 | 2022-02-02 | ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニア | 免疫療法のための組成物及び方法 |
| WO2020180882A1 (en) | 2019-03-05 | 2020-09-10 | Nkarta, Inc. | Cd19-directed chimeric antigen receptors and uses thereof in immunotherapy |
| US11697799B2 (en) | 2019-04-15 | 2023-07-11 | Ossium Health, Inc. | System and method for extraction and cryopreservation of bone marrow |
| WO2020219812A1 (en) | 2019-04-26 | 2020-10-29 | Allogene Therapeutics, Inc. | Methods of manufacturing allogeneic car t cells |
| EP3966316A4 (en) | 2019-05-10 | 2023-01-25 | The Regents of The University of California | MODIFIED PLURIPOTENT CELLS |
| US11162079B2 (en) | 2019-05-10 | 2021-11-02 | The Regents Of The University Of California | Blood type O Rh-hypo-immunogenic pluripotent cells |
| CA3154076A1 (en) * | 2019-10-15 | 2021-04-22 | Tobias Deuse | Transplanted cell protection via fc sequestration |
| CN110592016B (zh) * | 2019-10-28 | 2020-10-02 | 上海科医联创生物科技有限公司 | 一种特异性t细胞的培养方法 |
| CN110628717B (zh) * | 2019-10-28 | 2020-10-30 | 上海科医联创生物科技有限公司 | 一种浸润性t细胞的培养方法 |
| WO2021087466A1 (en) * | 2019-10-31 | 2021-05-06 | Research Institute At Nationwide Children's Hospital | Generation of cd38 knock-out primary and expanded human nk cells |
| AU2020394441B2 (en) | 2019-11-26 | 2025-11-13 | Novartis Ag | CD19 and CD22 chimeric antigen receptors and uses thereof |
| MX2022006725A (es) * | 2019-12-06 | 2022-08-22 | Fate Therapeutics Inc | Mejora de célula inmunitaria efectora derivada de ipsc mediante el uso de compuestos pequeños. |
| WO2021142081A1 (en) * | 2020-01-07 | 2021-07-15 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Methods of producing t cell populations using induced pluripotent stem cells |
| IL299106A (en) | 2020-06-19 | 2023-02-01 | Fate Therapeutics Inc | Combination of effector immune cells, derived from induced pluripotent stem cells for use in immunotherapy |
| WO2022020210A1 (en) | 2020-07-18 | 2022-01-27 | Ossium Health, Inc. | Permeation of whole vertebral bodies with a cryoprotectant using vacuum assisted diffusion |
| WO2022040504A2 (en) * | 2020-08-21 | 2022-02-24 | Georgetown University | Stem cell-like memory t cells and uses thereof |
| CN116583594B (zh) | 2020-10-14 | 2025-05-23 | 奥瑟姆健康公司 | 用于骨髓的提取和低温保藏的系统和方法 |
| CN117279650A (zh) | 2020-12-18 | 2023-12-22 | 奥瑟姆健康公司 | 细胞治疗方法 |
| CN114763563B (zh) * | 2021-01-12 | 2024-04-30 | 深圳华大临床检验中心 | 一种提高慢病毒感染效率的方法 |
| CA3207454A1 (en) * | 2021-02-07 | 2022-08-11 | Leonid S. Metelitsa | Engineered nkt cells for expansion and in vivo preservation and methods of use for the control of tumor cells |
| WO2022254337A1 (en) | 2021-06-01 | 2022-12-08 | Novartis Ag | Cd19 and cd22 chimeric antigen receptors and uses thereof |
| KR20250004622A (ko) | 2022-04-08 | 2025-01-08 | 페이트 세러퓨틱스, 인코포레이티드 | 종양 표적화를 위한 키메라 항원 수용체 |
| IL316101A (en) | 2022-04-08 | 2024-12-01 | Fate Therapeutics Inc | Skeletal cells refer to solid tumors and their use |
| WO2024211852A1 (en) * | 2023-04-07 | 2024-10-10 | Fate Therapeutics, Inc. | Ipsc-derived nk cell for lymphoma treatment |
| WO2024243325A2 (en) * | 2023-05-22 | 2024-11-28 | The Board Of Trustees Of The University Of Illinois | Combination of pac-1 and car t-cell treatments |
| CN116904400B (zh) * | 2023-09-12 | 2023-12-01 | 成都以邦医药科技有限公司 | 可利霉素在体外car/tcr-t细胞产品制备过程优化中的应用 |
| WO2025217183A1 (en) * | 2024-04-09 | 2025-10-16 | Board Of Regents, The University Of Texas System | Prepared natural killer cells and uses thereof |
| CN119161336B (zh) * | 2024-07-24 | 2025-09-05 | 四川大学 | 一种作为Blimp1抑制剂的小分子化合物及其用途 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2012515213A (ja) | 2009-01-14 | 2012-07-05 | ヘルス リサーチ インコーポレイテッド | 免疫応答を増強するための、mTOR阻害剤を含有する方法及び組成物 |
Family Cites Families (39)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| IL92382A (en) * | 1988-11-23 | 1994-12-29 | Univ Michigan | Use of a ligand specific for CD28 in the manufacture of medicament |
| BR9810366A (pt) | 1997-07-01 | 2000-08-29 | Warner Lambert Co | Derivados de ácido 4-bromo ou 4-iodo fenilamino benzidroxîmico e seu uso como inibidores de mek |
| WO2001012596A1 (fr) | 1999-08-13 | 2001-02-22 | Taisho Pharmaceutical Co., Ltd. | Derives de prostaglandine |
| US20020013294A1 (en) | 2000-03-31 | 2002-01-31 | Delong Mitchell Anthony | Cosmetic and pharmaceutical compositions and methods using 2-decarboxy-2-phosphinico derivatives |
| HU230251B1 (hu) | 2000-07-19 | 2015-11-30 | Warner-Lambert Co. | 4-Jód-fenil-amino-benzhidroxámsav-észter-származékok és ezeket tartalmazó gyógyászati készítmények |
| PL230179B1 (pl) | 2002-03-13 | 2018-09-28 | Array Biopharma Inc | N3 Alkilowane pochodne benzoimidazolu, kompozycja je zawierająca oraz ich zastosowanie do wytwarzania leku do leczenia zaburzeń hiperproliferacyjnych |
| US20040175373A1 (en) * | 2002-06-28 | 2004-09-09 | Xcyte Therapies, Inc. | Compositions and methods for eliminating undesired subpopulations of T cells in patients with immunological defects related to autoimmunity and organ or hematopoietic stem cell transplantation |
| US20050075276A1 (en) | 2003-03-14 | 2005-04-07 | Christopher Rudd | Use of inhibitors of glycogen synthase-3 to augment CD28 dependent -T-cell responses |
| CN1905873A (zh) | 2003-11-19 | 2007-01-31 | 阵列生物制药公司 | Mek的杂环抑制剂及其使用方法 |
| TW201238952A (en) | 2005-05-18 | 2012-10-01 | Array Biopharma Inc | Heterocyclic inhibitors of MEK and methods of use thereof |
| EP1991663A2 (en) | 2006-03-06 | 2008-11-19 | Government of the United States of America, Represented by the Secretary, Department of Health and Human Services | Autologous natural killer cells and lymphodepleting chemotherapy for the treatment of cancer |
| JP4960450B2 (ja) | 2006-07-14 | 2012-06-27 | ノバルティス アーゲー | Alk−5阻害剤としてのピリミジン誘導体 |
| GB2444853B (en) | 2006-12-14 | 2010-02-24 | Medical Res Council | Methods & uses |
| SG10202103401QA (en) | 2008-03-17 | 2021-05-28 | Scripps Research Inst | Combined chemical and genetic approaches for generation of induced pluripotent stem cells |
| WO2009155535A2 (en) | 2008-06-20 | 2009-12-23 | Duke University | Compositions, methods and kits for eliciting an immune response |
| CA3128456A1 (en) | 2008-12-03 | 2010-06-10 | The Scripps Research Institute | Compounds and methods for stabilizing cell cultures |
| ES2685171T3 (es) | 2010-06-14 | 2018-10-05 | The Scripps Research Institute | Reprogramación de células a un nuevo destino |
| EP3693017A1 (en) | 2010-12-14 | 2020-08-12 | University of Maryland, Baltimore | Universal anti-tag chimeric antigen receptor-expressing t cells and methods of treating cancer |
| EP2638896A1 (en) | 2012-03-14 | 2013-09-18 | Bioneer A/S | Cationic liposomal drug delivery system for specific targeting of human cd14+ monocytes in whole blood |
| EP3789487A1 (en) | 2013-04-03 | 2021-03-10 | Memorial Sloan Kettering Cancer Center | Effective generation of tumor-targeted t-cells derived from pluripotent stem cells |
| US9828399B2 (en) | 2014-02-28 | 2017-11-28 | The Royal Institution For The Advancement Of Learning/Mcgill University | TC-PTP inhibitors as APC activators for immunotherapy |
| WO2015155738A2 (en) | 2014-04-09 | 2015-10-15 | Christopher Rudd | Use of gsk-3 inhibitors or activators which modulate pd-1 or t-bet expression to modulate t cell immunity |
| US20150320754A1 (en) | 2014-04-16 | 2015-11-12 | Infinity Pharmaceuticals, Inc. | Combination therapies |
| SI3151672T1 (sl) | 2014-06-06 | 2021-03-31 | Bluebird Bio, Inc. | Izboljšani T-celični sestavki |
| US20170281624A1 (en) | 2014-09-13 | 2017-10-05 | Novartis Ag | Combination therapies of alk inhibitors |
| JP6800859B2 (ja) | 2015-01-26 | 2020-12-16 | フェイト セラピューティクス,インコーポレイテッド | 造血細胞分化を誘導するための方法および組成物 |
| EP3250682A4 (en) | 2015-01-26 | 2018-08-01 | Fate Therapeutics, Inc. | Cells with increased immuno-regulatory properties and methods for their use and manufacture |
| JP2018509459A (ja) | 2015-03-27 | 2018-04-05 | ナントクエスト インコーポレイテッド | がん治療薬との併用療法におけるnk−92細胞 |
| US20190119635A1 (en) | 2015-05-05 | 2019-04-25 | Fate Therapeutics, Inc. | Modulation of t lymphocytes |
| EP3294764B1 (en) | 2015-05-15 | 2020-12-30 | City of Hope | Chimeric antigen receptor compositions |
| WO2017040324A1 (en) | 2015-08-28 | 2017-03-09 | The Trustees Of The University Of Pennsylvania | Methods and compositions for cells expressing a chimeric intracellular signaling molecule |
| JP7534070B2 (ja) | 2015-11-04 | 2024-08-14 | フェイト セラピューティクス,インコーポレイテッド | 造血細胞分化を誘導するための方法および組成物 |
| CN116376826A (zh) | 2016-01-20 | 2023-07-04 | 菲特治疗公司 | 用来在过继性免疫疗法中进行免疫细胞调节的组合物和方法 |
| US11413309B2 (en) | 2016-01-20 | 2022-08-16 | Fate Therapeutics, Inc. | Compositions and methods for immune cell modulation in adoptive immunotherapies |
| EP3494208A1 (en) * | 2016-08-05 | 2019-06-12 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Ex vivo generation of gamma delta foxp3+ regulatory t cells and therapeutic uses thereof |
| US11365392B2 (en) * | 2016-08-05 | 2022-06-21 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Ex vivo generation of MHCII restricted CD4+ FOXP3+ regulatory T cells and therapeutic uses thereof |
| EP3548049A4 (en) | 2016-12-05 | 2020-07-22 | Fate Therapeutics, Inc. | COMPOSITIONS AND METHODS FOR MODULATION OF IMMUNE CELLS IN ADOPTIVE IMMUNOTHERAPIES |
| EP3638775A1 (en) | 2017-06-13 | 2020-04-22 | Fate Therapeutics, Inc. | Compositions and methods for inducing myeloid suppressive cells and use thereof |
| WO2019036855A1 (en) | 2017-08-21 | 2019-02-28 | Adagene Inc. | Anti-cd137 molecules and use thereof |
-
2017
- 2017-01-20 US US16/071,460 patent/US11413309B2/en active Active
- 2017-01-20 JP JP2018537803A patent/JP7653759B2/ja active Active
- 2017-01-20 WO PCT/US2017/014449 patent/WO2017127755A1/en not_active Ceased
- 2017-01-20 EP EP17742065.0A patent/EP3405568A4/en active Pending
-
2022
- 2022-07-08 US US17/861,042 patent/US12419870B2/en active Active
-
2023
- 2023-01-04 JP JP2023000071A patent/JP2023036919A/ja active Pending
-
2024
- 2024-12-16 JP JP2024219599A patent/JP2025038093A/ja active Pending
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2012515213A (ja) | 2009-01-14 | 2012-07-05 | ヘルス リサーチ インコーポレイテッド | 免疫応答を増強するための、mTOR阻害剤を含有する方法及び組成物 |
Non-Patent Citations (3)
| Title |
|---|
| Cellular Immunology, 1981, 61, pp.52-61 |
| J Immunol., 2012年01月01日, 188(1), pp.21-28 |
| J Pharmacol Sci, 2010, 112, pp.1-5 |
Also Published As
| Publication number | Publication date |
|---|---|
| US11413309B2 (en) | 2022-08-16 |
| JP2025038093A (ja) | 2025-03-18 |
| US20190282618A1 (en) | 2019-09-19 |
| US20220401487A1 (en) | 2022-12-22 |
| JP2023036919A (ja) | 2023-03-14 |
| US12419870B2 (en) | 2025-09-23 |
| WO2017127755A1 (en) | 2017-07-27 |
| EP3405568A1 (en) | 2018-11-28 |
| EP3405568A4 (en) | 2019-12-04 |
| JP2019502725A (ja) | 2019-01-31 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US12419870B2 (en) | Compositions and methods for immune cell modulation in adoptive immunotherapies | |
| US12281329B2 (en) | Compositions and methods for immune cell modulation in adoptive immunotherapies | |
| US20240263135A1 (en) | Compositions and methods for immune cell modulation in adoptive immunotherapies | |
| US12036241B2 (en) | Compositions and methods for immune cell modulation in adoptive immunotherapies | |
| HK40092133A (zh) | 用来在过继性免疫疗法中进行免疫细胞调节的组合物和方法 | |
| HK1253869A1 (en) | Compositions and methods for immune cell modulation in adoptive immunotherapies | |
| HK1253869B (en) | Compositions and methods for immune cell modulation in adoptive immunotherapies | |
| HK40018398B (zh) | 用於诱导骨髓抑制细胞的组合物和方法以及其用途 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200117 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20200117 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210203 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20210430 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210803 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20211206 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20220307 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220606 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20220902 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230104 |
|
| C60 | Trial request (containing other claim documents, opposition documents) |
Free format text: JAPANESE INTERMEDIATE CODE: C60 Effective date: 20230104 |
|
| C11 | Written invitation by the commissioner to file amendments |
Free format text: JAPANESE INTERMEDIATE CODE: C11 Effective date: 20230116 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230113 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230208 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20230228 |
|
| C092 | Termination of reconsideration by examiners before appeal proceedings |
Free format text: JAPANESE INTERMEDIATE CODE: C092 Effective date: 20230301 |
|
| C21 | Notice of transfer of a case for reconsideration by examiners before appeal proceedings |
Free format text: JAPANESE INTERMEDIATE CODE: C21 Effective date: 20230301 |
|
| A912 | Re-examination (zenchi) completed and case transferred to appeal board |
Free format text: JAPANESE INTERMEDIATE CODE: A912 Effective date: 20230414 |
|
| C211 | Notice of termination of reconsideration by examiners before appeal proceedings |
Free format text: JAPANESE INTERMEDIATE CODE: C211 Effective date: 20230418 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20241204 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20250318 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7653759 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |