JP7464397B2 - ペリレン誘導体化合物、該化合物を用いた有機半導体用組成物、該有機半導体用組成物を用いた有機薄膜トランジスタ - Google Patents
ペリレン誘導体化合物、該化合物を用いた有機半導体用組成物、該有機半導体用組成物を用いた有機薄膜トランジスタ Download PDFInfo
- Publication number
- JP7464397B2 JP7464397B2 JP2020015420A JP2020015420A JP7464397B2 JP 7464397 B2 JP7464397 B2 JP 7464397B2 JP 2020015420 A JP2020015420 A JP 2020015420A JP 2020015420 A JP2020015420 A JP 2020015420A JP 7464397 B2 JP7464397 B2 JP 7464397B2
- Authority
- JP
- Japan
- Prior art keywords
- group
- substituent
- carbon atoms
- linear
- general formula
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Landscapes
- Electroluminescent Light Sources (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Thin Film Transistor (AREA)
Description
水素原子、ハロゲン原子、
置換基を有していてもよい炭素原子数1~20の直鎖状もしくは分岐状のアルキル基、
置換基を有していてもよい炭素原子数2~20の直鎖状もしくは分岐状のアルケニル基、
置換基を有していてもよい炭素原子数5~10のシクロアルキル基、
置換基を有していてもよい炭素原子数6~36の芳香族炭化水素基、
または置換基を有していてもよい環形成原子数5~36の複素環基を表す。
R2およびR3は、同一でも異なっていてもよく、
水素原子、水酸基、
置換基を有していてもよい炭素原子数1~20の直鎖状もしくは分岐状のアルキル基、
置換基を有していてもよい炭素原子数2~20の直鎖状もしくは分岐状のアルケニル基、
置換基を有していてもよい炭素原子数5~10のシクロアルキル基、
置換基を有していてもよい炭素原子数1~20の直鎖状もしくは分岐状のアルコキシ基、
置換基を有していてもよい炭素原子数5~10のシクロアルコキシ基、
置換基を有していてもよい炭素原子数0~18のチオ基、
置換基を有していてもよい炭素原子数0~20のアミノ基、
置換基を有していてもよい炭素原子数6~36の芳香族炭化水素基、
または置換基を有していてもよい環形成原子数5~36の複素環基を表す。
R5およびR6は、同一でも異なっていてもよく、
水素原子、ハロゲン原子、シアノ基、ニトロ基、ニトロソ基、
置換基を有していてもよい炭素原子数1~20の直鎖状もしくは分岐状のフッ化アルキル基、
置換基を有していてもよい炭素原子数6~36のフッ化アリール基、
置換基を有していてもよい炭素原子数1~20のアシル基、
または置換基を有していてもよい炭素原子数0~20のスルホニル基を表し、
R2とR3、R5とR6は互いに結合して環を形成していてもよい。]
水素原子、ハロゲン原子、
置換基を有していてもよい炭素原子数1~20の直鎖状もしくは分岐状のアルキル基、
置換基を有していてもよい炭素原子数1~20の直鎖状もしくは分岐状のアルケニル基、
置換基を有していてもよい炭素原子数5~10のシクロアルキル基、
置換基を有していてもよい炭素原子数6~36の芳香族炭化水素基、
または置換基を有していてもよい環形成原子数5~36の複素環基を表す。
R2は、水酸基、
置換基を有していてもよい炭素原子数1~20の直鎖状もしくは分岐状のアルキル基、
置換基を有していてもよい炭素原子数2~20の直鎖状もしくは分岐状のアルケニル基、
置換基を有していてもよい炭素原子数5~10のシクロアルキル基、
置換基を有していてもよい炭素原子数1~20の直鎖状もしくは分岐状のアルコキシ基、
置換基を有していてもよい炭素原子数5~10のシクロアルコキシ基、
置換基を有していてもよい炭素原子数0~18のチオ基、
置換基を有していてもよい炭素原子数0~20のアミノ基、
置換基を有していてもよい炭素原子数6~36の芳香族炭化水素基、
または置換基を有していてもよい環形成原子数5~36の複素環基を表す。
R5は、ハロゲン原子、シアノ基、ニトロ基、ニトロソ基、
置換基を有していてもよい炭素原子数1~20の直鎖状もしくは分岐状のフッ化アルキル基、
置換基を有していてもよい炭素原子数6~36のフッ化アリール基、
置換基を有していてもよい炭素原子数1~20のアシル基、
または置換基を有していてもよい炭素原子数0~20のスルホニル基を表す。]
メチルエステル基、エチルエステル基などのカルボン酸エステル基;
メチル基、エチル基、n-プロピル基、イソプロピル基、n-ブチル基、イソブチル基、s-ブチル基、t-ブチル基、n-ペンチル基、イソペンチル基、n-ヘキシル基、2-エチルヘキシル基、ヘプチル基、オクチル基、イソオクチル基、ノニル基、デシル基などの炭素原子数1~18の直鎖状もしくは分岐状のアルキル基;
ビニル基、1-プロペニル基、アリル基、1-ブテニル基、2-ブテニル基、1-ペンテニル基、1-ヘキセニル基、イソプロペニル基、イソブテニル基など炭素原子数2~20の直鎖状もしくは分岐状のアルケニル基;
メトキシ基、エトキシ基、プロポキシ基、t-ブトキシ基、ペンチルオキシ基、ヘキシルオキシ基などの炭素原子数1~18の直鎖状もしくは分岐状のアルコキシ基;
フェニル基、ナフチル基、アントリル基、フェナントリル基、ピレニル基などの炭素原子数6~30の芳香族炭化水素基;
ピリジル基、ピリミジリニル基、トリアジニル基、チエニル基、フリル基(フラニル基)、ピロリル基、イミダゾリル基、ピラゾリル基、トリアゾリル基、キノリル基、イソキノリル基、ナフチルジニル基、アクリジニル基、フェナントロリニル基、ベンゾフラニル基、ベンゾチエニル基、オキサゾリル基、インドリル基、カルバゾリル基、ベンゾオキサゾリル基、チアゾリル基、ベンゾチアゾリル基、キノキサリニル基、ベンゾイミダゾリル基、ピラゾリル基、ジベンゾフラニル基、ジベンゾチエニル基、カルボニリル基などの環形成原子数2~30の複素環基;
無置換アミノ基(―NH2)、エチルアミノ基、アセチルアミノ基、フェニルアミノ基などの一置換アミノ基、またはジエチルアミノ基、ジフェニルアミノ基、アセチルフェニルアミノ基などの二置換アミノ基である、炭素原子数0~18のアミノ基;
無置換チオ基(チオール基:―SH)、メチルチオ基、エタンチオ基、プロピルチオ基、ジ-t-ブチルチオ基、ヘキサ-5-エン-3-チオ基、フェニルチオ基、ビフェニルチオ基などの炭素原子数0~18のチオ基;
などをあげることができる。これらの「置換基」は、1つのみ含まれてもよく、複数含まれてもよく、複数含まれる場合は互いに同一でも異なっていてもよい。また、これら「置換基」はさらに前記例示した置換基を有していてもよい。
水素原子、水酸基、
置換基を有していてもよい炭素原子数1~20の直鎖状もしくは分岐状のアルキル基、
置換基を有していてもよい炭素原子数2~20の直鎖状もしくは分岐状のアルケニル基、
置換基を有していてもよい炭素原子数5~10のシクロアルキル基、
置換基を有していてもよい炭素原子数1~20の直鎖状もしくは分岐状のアルコキシ基、
置換基を有していてもよい炭素原子数5~10のシクロアルコキシ基、
置換基を有していてもよい炭素原子数0~18のチオ基、
置換基を有していてもよい炭素原子数0~20のアミノ基、
置換基を有していてもよい炭素原子数6~36の芳香族炭化水素基、
または置換基を有していてもよい環形成原子数5~36の複素環基などをあげることができる。
水素原子、ハロゲン原子、シアノ基、ニトロ基、ニトロソ基、
置換基を有していてもよい炭素原子数1~20の直鎖状もしくは分岐状のフッ化アルキル基、
置換基を有していてもよい炭素原子数6~36のフッ化アリール基、
置換基を有していてもよい炭素原子数1~20のアシル基、
または置換基を有していてもよい炭素原子数0~20のスルホニル基などをあげることができる。
水酸基、
置換基を有していてもよい炭素原子数1~20の直鎖状もしくは分岐状のアルキル基、
置換基を有していてもよい炭素原子数2~20の直鎖状もしくは分岐状のアルケニル基、
置換基を有していてもよい炭素原子数5~10のシクロアルキル基、
置換基を有していてもよい炭素原子数1~20の直鎖状もしくは分岐状のアルコキシ基、
置換基を有していてもよい炭素原子数5~10のシクロアルコキシ基、
置換基を有していてもよい炭素原子数0~18のチオ基、
置換基を有していてもよい炭素原子数0~20のアミノ基、
置換基を有していてもよい炭素原子数6~36の芳香族炭化水素基、
または置換基を有していてもよい環形成原子数5~36の複素環基などをあげることができる。
ハロゲン原子、シアノ基、ニトロ基、ニトロソ基、
置換基を有していてもよい炭素原子数1~20の直鎖状もしくは分岐状のフッ化アルキル基、
置換基を有していてもよい炭素原子数6~36のフッ化アリール基、
置換基を有していてもよい炭素原子数1~20のアシル基、
または置換基を有していてもよい炭素原子数0~20のスルホニル基、
などがあげられる。
また、これらの化合物の同定は、核磁気共鳴分析(NMR)により行うことができる。
有機薄膜トランジスタは、一般的に、基板と、有機半導体層と、この有機半導体層にゲート絶縁層を介して積層されたゲート電極と、有機半導体層を介して対向配置されたソース電極及びドレイン電極とを備えて構成されている。本発明においては、前記有機半導体層として、前記一般式(1)で表されるペリレン誘導体化合物を含む有機半導体薄膜を用いる。有機薄膜トランジスタの形態は特に限定されるものではなく、ボトムゲート・ボトムコンタクト型、ボトムゲート・トップコンタクト型、トップゲート・ボトムコンタクト型、トップゲート・トップコンタクト型のいずれの形態を用いてもよく、それぞれの形態に応じて上記ゲート電極、ゲート絶縁層、ソース電極、ドレイン電極及び有機半導体層を適宜配置すればよい。
図1は有機薄膜トランジスタの一形態を示す模式的断面図であり、ボトムゲート・ボトムコンタクト構造をとる。この有機薄膜トランジスタの形態においては、基板1上にゲート電極2が設けられ、そのゲート電極上にゲート絶縁膜3が積層されており、その上に所定の間隔で形成されたソース電極6およびドレイン電極4が形成されており、さらにその上に有機半導体層5が積層されている。
v=μE (a-1)
比例係数μが移動度(cm2/V・s)である。半導体において移動度は抵抗率に反比例するため、移動度は物質の電気的特性を決める重要なパラメータである。
本発明の有機薄膜トランジスタなどの有機半導体素子に使用する基板としては、特に限定するものではないが、一般にはガラス、石英、シリコン、ポリイミド、ポリエステル、ポリエチレン、ポリスチレン、ポリプロピレンおよびポリカーボネートなどのプラスチック基板などを用いることができる。
有機薄膜トランジスタの電極に用いる材料としては、導電性の材料であれば用いることができる。好ましくは有機半導体材料への電子注入障壁が小さい材料が望ましい。
ゲート電極を構成する材料としては、例えば、pドープシリコン、nドープシリコン、インジウム・錫酸化物(ITO)、ドーピングしたポリチオフェンやポリアニリン系等の導電性高分子、金,銀,白金,アルミニウム、クロム等の金属等があげられ、本発明においては、アルミニウムを用いるのが好ましい。
ゲート絶縁層を構成する材料としては、例えば、酸化シリコン,窒化シリコン,酸化アルミニウム,窒化アルミニウム,酸化タンタル等の無機化合物、ポリビニルアルコール、ポリビニルフェノール、ポリメチルメタクリレート、シアノエチルプルラン、パリレン(日本パリレン合同会社 登録商標)など有機高分子化合物を用いることができる。
ソース電極及びおよびドレイン電極を構成する材料としては、例えば、金、銀、白金、クロム、アルミニウム、インジウム、アルカリ金属(Li,Na,K,Rb,Cs)、アルカリ土類金属(Mg,Ca,Sr,Ba)等があげられる。本発明においては金を用いるのが好ましい。
本発明の有機薄膜トランジスタは、有機半導体層に前記一般式(1)で表される化合物を含有してなるものである。
有機半導体層には、本発明のペリレン誘導体化合物に加え、例えば、フラーレンおよびその誘導体や、フッ素やニトリル等の電子吸引基で置換された、ナフタレン、ナフタレンジイミド、アントラセン、テトラセン、ペリレン、ペンタセン、ピレン、コロネン、クリセン、デカシクレン、ビオランスレン等の多環芳香族分子およびこれらの誘導体、トリフェニレン、チオフェンオリゴマー、ポリチオフェン等の芳香環オリゴマー、ポリマーおよびこれらの誘導体、フタロシアニン、テトラチアフルバレン、テトラチオテトラセンおよびこれらの誘導体等の、電子欠乏性の有機半導体材料を適切な量で併用してもよい。また、ポリスチレン、ポリビニルフェノールなどのポリマー材料を適切な量添加しても良い。
本発明の有機薄膜トランジスタは、大気中の酸素や水分などの影響を軽減する目的で、有機薄膜トランジスタの外周面の全面または一部にガスバリア層を設けることができる。ガスバリア層を形成する材料としては、ポリビニルアルコール、エチレン-ビニルアルコール、共重合体、ポリ塩化ビニル、ポリテトラフルオロエチレンなどがあげられる。
1,7-ジブロモペリレン-3,4,9,10-テトラカルボン酸ジ無水物の合成をJ.Org.Chem.,2004,69,P.7933-7939に記載の方法にて行い、下記式(3)で表される1,7-ジブロモペリレン-3,4,9,10-テトラカルボン酸ジ無水物を20g得た。(工程1)
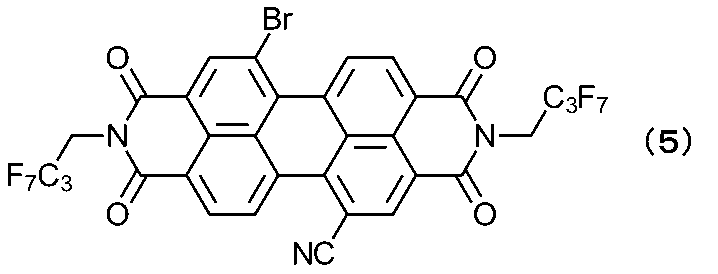
アルゴン置換した反応容器に、上記式(5)で表される1-シアノ-7-ブロモペリレン-3,4,9,10-テトラカルボン酸ジイミド(300mL)、フェノール(50mg)、18-Crown-6-Ether(555mg)、炭酸カリウム(145mg)のトルエン溶液(60mL)をアルゴン気流下、室温にて2時間攪拌した。反応液を濃縮し、粗生成物を得た。粗生成物を水(20mL)で洗浄し、その後メタノール(20mL)で洗浄した。洗浄後の粗生成物をクロロホルム溶解し、カラムクロマトグラフィー(担体:シリカゲル、展開溶液:クロロホルム)で精製後、減圧乾燥を行った。得られた精製物にトルエン(20mL)を加え、加熱還流攪拌を1時間実施した。溶解後、室温へ冷却し、1時間攪拌後、析出固体を濾過して得た。濾取物を減圧乾燥し、目的の化合物である1-シアノ-7-フェノキシ-3,4,9,10-テトラカルボン酸ジイミド(収量:67mg、収率:21%)を赤紫色固体として得た。
アルゴン置換した反応容器に、上記式(5)で表される1,7-ジブロモペリレン-3,4,9,10-テトラカルボン酸ジイミド(912mg)、ヨウ化銅(38mg)、1,10-フェナントロリン水和物(39mg)、カリウムトリメトキシ(トリフルオロメチル)ボラート(222mg)のジメチルスルホキシド溶液(10mL)をアルゴン気流下60℃にて7時間攪拌した。反応液を室温まで冷却後、酢酸エチル(200mL)に注加し30分攪拌後、濾過して不溶解分を除去した。得られた濾液を水(150mL)で2回洗浄し、飽和食塩水(150mL)で1回洗浄し、有機層を濃縮して粗生成物を得た。粗生成物のカラムクロマトグラフィー(担体:シリカゲル、展開溶液:ヘキサン/酢酸エチル)で精製後、減圧乾燥を行い、下記式(6)で表される1-ブロモ-7-トリフルオロメチル-3,4,9,10-テトラカルボン酸ジイミド(収量:450mg、収率:50%)を得た。
アルゴン置換した反応容器に、上記式(6)で表される1-トリフルオロメチル-7-ブロモペリレン-3,4,9,10-テトラカルボン酸ジイミド(450mg)のメタノール溶液(100mL)に、28%NaOMe/MeOH溶液(2000mg)を滴下後、室温にて6時間攪拌を行った。反応液に1N塩酸(50mL)加え、30分攪拌後、濾過して粗生成物を得た。粗生成物をクロロホルム溶解し、カラムクロマトグラフィー(担体:シリカゲル、展開溶液:トルエン)で精製後、減圧乾燥を行い、目的の化合物である1-シアノ-7-メトキシ-3,4,9,10-テトラカルボン酸ジイミド(収量:170mg、収率:40%)を赤紫色固体として得た。
Angew.Chem.Int.Ed.2004,43,6363-6366に記載の方法にて行い、下記式(B-1)で表される1,7-ジシアノペリレン-3,4,9,10-テトラカルボン酸ジイミドを得た。
[比較化合物]化合物(B-2)の合成
アルゴン置換した反応容器に、上記式(4)表される1,7-ジブロモペリレン-3,4,9,10-テトラカルボン酸ジイミド(912mg)、ヨウ化銅(76mg)、1,10-フェナントロリン水和物(79mg)、カリウムトリメトキシ(トリフルオロメチル)ボラート(1270mg)のジメチルスルホキシド溶液(10mL)をアルゴン気流下60℃にて7時間攪拌した。反応液を室温まで冷却後、酢酸エチル(200mL)に注加し30分攪拌後、濾過して不溶解分を除去した。得られた濾液を水(150mL)で2回洗浄し、飽和食塩水(150mL)で1回洗浄し、有機層を濃縮して粗生成物を得た。粗生成物のカラムクロマトグラフィー(担体:シリカゲル、展開溶液:ヘキサン/酢酸エチル)で精製後、再度カラムクロマトグラフィー(担体:シリカゲル、展開溶液:トルエン)を行い精製後、減圧乾燥を行い、下記式(5)で表される1,7-ジトリフロメチルペリレン-3,4,9,10-テトラカルボン酸ジイミド(収量:180mg、収率:20%)を得た。
化合物(A-2)を透明サンプルチューブに秤量し、濃度が0.2質量%となるようにトルエンに添加し、50℃に加熱下にて振盪後、室温(25±2℃)まで冷却し、数時間後に溶解性を目視にて評価した。同様に、クロロホルム0.5質量%、モノクロロベンゼン0.3質量%、1,2-ジクロロベンゼン0.3質量%にて評価した。結果を表1に示す。判定条件は完全溶解(25±2℃)を○、濁る程度に析出(25±2℃)を△、不溶解または室温まで冷却後全て析出(25±2℃)を×と表記した。
化合物(A-2)の代わりに(A-3)を用いて実施例1と同様に溶解度測定を行った。結果を表1に示す。
化合物(A-2)の代わりに比較化合物(B-1)を用いて実施例1と同様に溶解度測定を行った。結果を表1に示す。
ガラス基板を中性洗剤で10分間、水で10分間、アセトンで10分間、イソプロピルアルコールで10分間、超音波洗浄を行った後、100℃のオーブンにて1時間乾燥を行った。基板表面に、ゲート電極となるアルミを、メタルマスクを用いて50nmの厚さに蒸着した。その後、ポリビニルフェノールとメラミンの混合溶液をスピンコート法により塗布し、ホットプレートにて100℃で10分間、150℃で1時間加熱し、400nmの厚さに絶縁層を形成した。続いて、絶縁層の上に、ソースおよびドレイン電極となる金を50nmの厚さに蒸着し、フォトリソグラフィー法により、チャネル幅500μm、チャネル長5μmのソースおよびドレイン電極を形成した。
化合物(A-2)の代わりに化合物(A-3)を用い、濃度が0.1質量%となるようにクロロホルムに溶解した以外は実施例3と同様に作製した有機薄膜トランジスタの伝達特性の測定行った。この測定より求めた移動度の結果を表2に示す。
化合物として、(A-2)の代わりに本発明に属さない(B-2)を用い、濃度が0.1質量%となるようにトルエンに溶解した以外は実施例10と同様に作製した有機薄膜トランジスタの伝達特性の測定行った。この測定より求めた移動度の結果を表2に示す。
2:ゲート電極
3:ゲート絶縁層
4:ドレイン電極
5:有機半導体層
6:ソース電極
Claims (9)
- 下記一般式(1)で表されるペリレン誘導体化合物。
水素原子、ハロゲン原子、
置換基を有していてもよい炭素原子数1~20の直鎖状もしくは分岐状のアルキル基、
置換基を有していてもよい炭素原子数2~20の直鎖状もしくは分岐状のアルケニル基、
置換基を有していてもよい炭素原子数5~10のシクロアルキル基、
置換基を有していてもよい炭素原子数6~36の芳香族炭化水素基、
または置換基を有していてもよい環形成原子数5~36の複素環基を表す。
R2およびR3は、同一でも異なっていてもよく、
水素原子、水酸基、
置換基(フッ素を除く)を有していてもよい炭素原子数1~20の直鎖状もしくは分岐状のアルキル基、
置換基を有していてもよい炭素原子数2~20の直鎖状もしくは分岐状のアルケニル基、
置換基を有していてもよい炭素原子数5~10のシクロアルキル基、
置換基を有していてもよい炭素原子数1~20の直鎖状もしくは分岐状のアルコキシ基、
置換基を有していてもよい炭素原子数1~20のアリールオキシ基、
置換基を有していてもよい炭素原子数5~10のシクロアルコキシ基、
置換基を有していてもよい炭素原子数0~18のチオ基、
置換基を有していてもよい炭素原子数0~20のアミノ基、
置換基(フッ素を除く)を有していてもよい炭素原子数6~36の芳香族炭化水素基、
または置換基を有していてもよい環形成原子数5~36の複素環基を表し、
R 2 およびR 3 の少なくとも一方は水素原子以外の上記基を表す。
R5およびR6は、同一でも異なっていてもよく、
水素原子、ハロゲン原子、シアノ基、ニトロ基、ニトロソ基、
置換基を有していてもよい炭素原子数1~20の直鎖状もしくは分岐状のフッ化アルキル基、
置換基を有していてもよい炭素原子数6~36のフッ化アリール基、
置換基を有していてもよい炭素原子数1~20のアシル基、
または置換基を有していてもよい炭素原子数0~20のスルホニル基を表し、
R 5 およびR 6 の少なくとも一方は水素原子以外の上記基を表し、
R2とR3、R5とR6は互いに結合して環を形成していてもよい。] - 下記一般式(2)で表される、請求項1に記載のペリレン誘導体化合物。
水素原子、ハロゲン原子、
置換基を有していてもよい炭素原子数1~20の直鎖状もしくは分岐状のアルキル基、
置換基を有していてもよい炭素原子数1~20の直鎖状もしくは分岐状のアルケニル基、
置換基を有していてもよい炭素原子数5~10のシクロアルキル基、
置換基を有していてもよい炭素原子数6~36の芳香族炭化水素基、
または置換基を有していてもよい環形成原子数5~36の複素環基を表す。
R2は、水酸基、
置換基(フッ素を除く)を有していてもよい炭素原子数1~20の直鎖状もしくは分岐状のアルキル基、
置換基を有していてもよい炭素原子数2~20の直鎖状もしくは分岐状のアルケニル基、
置換基を有していてもよい炭素原子数5~10のシクロアルキル基、
置換基を有していてもよい炭素原子数1~20の直鎖状もしくは分岐状のアルコキシ基、
置換基を有していてもよい炭素原子数1~20のアリールオキシ基、
置換基を有していてもよい炭素原子数5~10のシクロアルコキシ基、
置換基を有していてもよい炭素原子数0~18のチオ基、
置換基を有していてもよい炭素原子数0~20のアミノ基、
置換基(フッ素を除く)を有していてもよい炭素原子数6~36の芳香族炭化水素基、
または置換基を有していてもよい環形成原子数5~36の複素環基を表す。
R5は、ハロゲン原子、シアノ基、ニトロ基、ニトロソ基、
置換基を有していてもよい炭素原子数1~20の直鎖状もしくは分岐状のフッ化アルキル基、
置換基を有していてもよい炭素原子数6~36のフッ化アリール基、
置換基を有していてもよい炭素原子数1~20のアシル基、
または置換基を有していてもよい炭素原子数0~20のスルホニル基を表す。]
- 前記一般式(1)において、R1およびR4の置換基の少なくとも1個がフッ素原子である、請求項1又は請求項2に記載のペリレン誘導体化合物。
- 前記一般式(1)において、R2、R3のうち少なくとも1個が水酸基、置換基を有していてもよい炭素原子数1~20の直鎖状もしくは分岐状のアルコキシ基、または置換基を有していてもよい炭素原子数0~18のチオ基である、請求項1~請求項3に記載のペリレン誘導体化合物。
- 前記一般式(1)において、R5、R6のうち少なくとも1つがシアノ基、または置換基を有していてもよい炭素原子数1~20の直鎖状もしくは分岐状のフッ化アルキル基である、請求項1~請求項4のいずれか一項に記載のペリレン誘導体化合物。
- 25±2℃における芳香族系有機溶媒またはハロゲン系有機溶媒への溶解度が0.02~5質量%濃度である、請求項1~請求項5のいずれか一項に記載のペリレン誘導体化合物。
- 請求項1~請求項6のいずれか一項に記載のペリレン誘導体化合物を含有する有機半導体用組成物。
- 請求項7に記載の有機半導体用組成物を用いた有機半導体素子。
- 請求8に記載の有機半導体素子を用いた有機薄膜トランジスタ。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2020015420A JP7464397B2 (ja) | 2020-01-31 | 2020-01-31 | ペリレン誘導体化合物、該化合物を用いた有機半導体用組成物、該有機半導体用組成物を用いた有機薄膜トランジスタ |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2020015420A JP7464397B2 (ja) | 2020-01-31 | 2020-01-31 | ペリレン誘導体化合物、該化合物を用いた有機半導体用組成物、該有機半導体用組成物を用いた有機薄膜トランジスタ |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2021125476A JP2021125476A (ja) | 2021-08-30 |
| JP7464397B2 true JP7464397B2 (ja) | 2024-04-09 |
Family
ID=77459435
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2020015420A Active JP7464397B2 (ja) | 2020-01-31 | 2020-01-31 | ペリレン誘導体化合物、該化合物を用いた有機半導体用組成物、該有機半導体用組成物を用いた有機薄膜トランジスタ |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP7464397B2 (ja) |
Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2006065548A2 (en) | 2004-12-17 | 2006-06-22 | Eastman Kodak Company | N-type semiconductor materials for thin film transistors |
| WO2006068833A2 (en) | 2004-12-21 | 2006-06-29 | Eastman Kodak Company | N-type semiconductor materials for thin film transistors |
| JP2007527114A (ja) | 2004-01-26 | 2007-09-20 | ノースウエスタン ユニバーシティ | ペリレンn型半導体及び関連装置 |
| WO2011052721A1 (ja) | 2009-10-29 | 2011-05-05 | 大日精化工業株式会社 | 有機半導体材料、有機半導体薄膜および有機薄膜トランジスタ |
| WO2011105152A1 (ja) | 2010-02-25 | 2011-09-01 | 株式会社Adeka | ペリレンテトラカルボン酸ジイミド化合物を含有してなる有機半導体材料、及び有機半導体素子 |
| JP2014529593A (ja) | 2011-08-12 | 2014-11-13 | ビーエーエスエフ ソシエタス・ヨーロピアBasf Se | フッ素化ペリレンベースの半導体材料 |
| JP2017532768A (ja) | 2014-08-18 | 2017-11-02 | ビーエーエスエフ ソシエタス・ヨーロピアBasf Se | 液状媒体を含有する有機半導体組成物 |
| JP2020120031A (ja) | 2019-01-25 | 2020-08-06 | 保土谷化学工業株式会社 | ペリレン誘導体化合物、該化合物を用いた有機半導体用組成物、該有機半導体用組成物を用いた有機薄膜トランジスタ |
-
2020
- 2020-01-31 JP JP2020015420A patent/JP7464397B2/ja active Active
Patent Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2007527114A (ja) | 2004-01-26 | 2007-09-20 | ノースウエスタン ユニバーシティ | ペリレンn型半導体及び関連装置 |
| WO2006065548A2 (en) | 2004-12-17 | 2006-06-22 | Eastman Kodak Company | N-type semiconductor materials for thin film transistors |
| WO2006068833A2 (en) | 2004-12-21 | 2006-06-29 | Eastman Kodak Company | N-type semiconductor materials for thin film transistors |
| WO2011052721A1 (ja) | 2009-10-29 | 2011-05-05 | 大日精化工業株式会社 | 有機半導体材料、有機半導体薄膜および有機薄膜トランジスタ |
| WO2011105152A1 (ja) | 2010-02-25 | 2011-09-01 | 株式会社Adeka | ペリレンテトラカルボン酸ジイミド化合物を含有してなる有機半導体材料、及び有機半導体素子 |
| JP2014529593A (ja) | 2011-08-12 | 2014-11-13 | ビーエーエスエフ ソシエタス・ヨーロピアBasf Se | フッ素化ペリレンベースの半導体材料 |
| JP2017532768A (ja) | 2014-08-18 | 2017-11-02 | ビーエーエスエフ ソシエタス・ヨーロピアBasf Se | 液状媒体を含有する有機半導体組成物 |
| JP2020120031A (ja) | 2019-01-25 | 2020-08-06 | 保土谷化学工業株式会社 | ペリレン誘導体化合物、該化合物を用いた有機半導体用組成物、該有機半導体用組成物を用いた有機薄膜トランジスタ |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2021125476A (ja) | 2021-08-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101410150B1 (ko) | 전계 효과 트랜지스터 | |
| JP5562652B2 (ja) | シリルエチニル化されたヘテロアセン類およびそれで作製された電子装置 | |
| CN105102462B (zh) | 含有氧族元素的有机化合物、其制造方法以及用途 | |
| EP2818464A1 (en) | Novel chalcogen-containing organic compound and use thereof | |
| EP2109162A1 (en) | Organic semiconductor composite, organic transistor material and organic field effect transistor | |
| KR20120043009A (ko) | 신규한 유기 반도체 재료 및 이것을 이용한 전자 디바이스 | |
| KR20080100982A (ko) | 헤테로아센 화합물, 이를 포함하는 유기 박막 및 상기박막을 포함하는 전자 소자 | |
| JP5569774B2 (ja) | テトラチアフルバレン誘導体 | |
| KR20120083498A (ko) | 유기 반도체 재료, 유기 반도체 박막 및 유기 박막 트랜지스터 | |
| JP2006206503A (ja) | π電子系化合物、及びそれを用いたn−型有機電界効果トランジスタ | |
| JP5478189B2 (ja) | 大気安定性に優れた有機トランジスタ | |
| JP2015199716A (ja) | 多環縮環化合物、有機半導体材料、有機半導体デバイス及び有機トランジスタ | |
| JP7464397B2 (ja) | ペリレン誘導体化合物、該化合物を用いた有機半導体用組成物、該有機半導体用組成物を用いた有機薄膜トランジスタ | |
| CN100585902C (zh) | 有机半导体材料和有机场效应晶体管 | |
| JP7290948B2 (ja) | ペリレン誘導体化合物、該化合物を用いた有機半導体用組成物、該有機半導体用組成物を用いた有機薄膜トランジスタ | |
| US8901543B2 (en) | Organic semiconductor device and its production method, and compound | |
| CN116057058B (zh) | 有机半导体材料 | |
| KR100868863B1 (ko) | 신규한 축합고리 화합물 및 이를 이용한 유기전자소자 | |
| JP5637985B2 (ja) | ジアザボロール化合物、およびそれを含有した電界効果トランジスタ | |
| WO2020241582A1 (ja) | 有機トランジスタ材料及び有機トランジスタ | |
| KR100865703B1 (ko) | 아릴아세틸렌 구조의 유기반도체 화합물 및 이를 이용한유기박막트랜지스터 | |
| WO2021054161A1 (ja) | 縮合多環芳香族化合物 | |
| KR101280592B1 (ko) | 비닐그룹을 갖는 안트라센 뼈대에 기초한 고성능 유기반도체 화합물 및 이를 이용한 유기 반도체 박막 및 유기박막 전자 소자 | |
| JP2019052111A (ja) | ヘテロアセン誘導体、有機半導体層、及び有機薄膜トランジスタ | |
| Liu | Study on structure-property relationship of 1, 5-naphthyridine-2, 6-dione (NTD) derivatives for organic field-effect transistors |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20221220 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20231017 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20231219 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240215 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20240326 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20240328 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7464397 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |