JP7128399B2 - 癌治療のための治療決定におけるpd-l1発現の使用方法 - Google Patents
癌治療のための治療決定におけるpd-l1発現の使用方法 Download PDFInfo
- Publication number
- JP7128399B2 JP7128399B2 JP2019505328A JP2019505328A JP7128399B2 JP 7128399 B2 JP7128399 B2 JP 7128399B2 JP 2019505328 A JP2019505328 A JP 2019505328A JP 2019505328 A JP2019505328 A JP 2019505328A JP 7128399 B2 JP7128399 B2 JP 7128399B2
- Authority
- JP
- Japan
- Prior art keywords
- cancer
- expression
- immune checkpoint
- subject
- cells
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- G01N33/5759—
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/39558—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against tumor tissues, cells, antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2827—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against B7 molecules, e.g. CD80, CD86
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
- G01N33/5008—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics
- G01N33/5011—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics for testing antineoplastic activity
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/705—Assays involving receptors, cell surface antigens or cell surface determinants
- G01N2333/70503—Immunoglobulin superfamily, e.g. VCAMs, PECAM, LFA-3
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/705—Assays involving receptors, cell surface antigens or cell surface determinants
- G01N2333/70503—Immunoglobulin superfamily, e.g. VCAMs, PECAM, LFA-3
- G01N2333/70532—B7 molecules, e.g. CD80, CD86
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Immunology (AREA)
- Engineering & Computer Science (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Biomedical Technology (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Organic Chemistry (AREA)
- Molecular Biology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Urology & Nephrology (AREA)
- Hematology (AREA)
- Microbiology (AREA)
- Biochemistry (AREA)
- Epidemiology (AREA)
- Cell Biology (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Oncology (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Analytical Chemistry (AREA)
- Food Science & Technology (AREA)
- Physics & Mathematics (AREA)
- Biotechnology (AREA)
- Mycology (AREA)
- Genetics & Genomics (AREA)
- Tropical Medicine & Parasitology (AREA)
- Biophysics (AREA)
- Toxicology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Hospice & Palliative Care (AREA)
Description
上述のように定められる、所定の関連関連する実施形態及び側面において、方法は、1つ以上の治療有効量の追加の抗癌剤を対象に投与することを更に含む。追加の抗癌剤は、以下に限定されるものではないが、免疫療法剤、化学療法剤、放射線治療薬、既存の癌剤、CCR5及びCXCR4等を含む。
本明細書で使用する不定冠詞「a」又は「an」は、一以上を意味することがある。本明細書において、用語「comprising(含む、有する、備える)」等と関連して使用される場合、不定冠詞「a」又は「an」は、一又は複数を意味することがある。本明細書で使用する「他の(another)」は、少なくとも第2の又はこれ以上を意味することがある。更に、文脈による要求がない限り、単数形の用語は複数を含み、複数形の用語は単数を含む。
液体生検は、末梢血中に見出される循環腫瘍細胞(CTC)のリアルタイムで連続的な追跡を提供し、このようなアッセイは組織生検の代替物として使用できる[1-4]。末梢血中の循環腫瘍細胞(CTC)を評価することによって、特定の治療を受ける特定の対象における癌診断、並びに腫瘍のスクリーニング、モニタリング治療、及び感受性判定のための手段として、上皮間葉転換が進行しているCTC亜型(EMTCTC)[2,3,5-9]及び予後に関連する病理学的に定義可能なCTC(PDCTC)[6-10]を含むCTCの異種集団を検査できる。
上述のように、本発明は、免疫チェックポイント阻害剤に対する感受性について癌を有する対象をスクリーニングする方法に関する。この方法は、PD-L1発現について、癌を有する対象から単離された、循環腫瘍細胞(CTC)、上皮間葉転換CTC(EMTCTC)、癌関連マクロファージ様細胞(CAML)、及び癌関連血管内皮細胞(CAVE)のうちの1つ以上をアッセイすることを含み、PD-L1発現が検出された場合、対象は免疫チェックポイント阻害剤の感受性を有するとみなす。
また、本発明は、免疫チェックポイント阻害剤による治療に対する癌を有する対象の応答性を予測する方法に関する。この方法は、PD-L1発現について、癌を有する対象から単離された、CTC、EMTCTC、CAML、及びCAVEのうちの1つ以上をアッセイすることを含み、PD-L1発現が検出された場合、対象は、免疫チェックポイント阻害剤による処置に応答性を有すると予測する。
更に、本発明は、癌を有する対象の治療法を選択するための方法に関する。この方法は、PD-L1発現について、癌を有する対象から単離された、CTC、EMTCTC、CAML、及びCAVEのうちの1つ以上をアッセイすることを含み、PD-L1発現が検出された場合、対象の治療として、治療有効量の免疫チェックポイント阻害剤の対象への投与を選択する。
更に、本発明は、免疫チェックポイント阻害剤治療を受ける癌を有する対象を特定するためのアッセイに関する。この方法は、PD-L1発現について、癌を有する対象から単離された、CTC、EMTCTC、CAML、及びCAVEのうちの1つ以上をアッセイすることを含み、PD-L1発現が検出された場合、対象は、免疫チェックポイント阻害剤処置を受ける対象として特定される。
また、本発明は、癌を有する対象を治療する方法に関する。この方法は、(a)PD-L1発現について、癌を有する対象から単離されたCTC、EMTCTC、CAML、及びCAVEのうちの1つ以上をアッセイすることと、(b)PD-L1の発現が検出された場合、治療有効量の免疫チェックポイント阻害剤を対象に投与することとを含む。免疫チェックポイント阻害剤は、免疫チェックポイント阻害剤及び薬学的に許容される担体を含む医薬製剤として投与できる。
また、本発明は、癌を有する対象におけるPD-L1発現をモニタリングする方法も包含する。この方法は、(a)PD-L1発現について、第1の時点で癌を有する対象から単離されたCTC、EMTCTC、CAML、及びCAVEのうちの1つ以上をアッセイすることと、(b)PD-L1発現について、第2の時点で癌を有する対象から単離されたCTC、EMTCTC、CAML、及びCAVEのうちの1つ以上をアッセイすることと、(c)第1の時点及び第2の時点で単離された細胞においてアッセイされたPD-L1発現を比較することとを含む。この実施形態の特定の側面では、対象は、癌の治療を受けている。
また、本発明は、癌を有する対象における治療をモニタリングする方法を更に包含する。本発明は、(a)PD-L1発現について、第1の時点で癌治療中対象から単離されたCTC、EMTCTC、CAML、及びCAVEのうちの1つ以上をアッセイすることと、(b)PD-L1発現について、第2の時点で癌治療中対象から単離されたCTC、EMTCTC、CAML、及びCAVEのうちの1つ以上をアッセイすることと、(c)第1の時点及び第2の時点で単離された細胞においてアッセイされたPD-L1発現を比較することにより、癌を有する対象における治療をモニタリングすることを含む。この実施形態の特定の側面では、対象は、免疫チェックポイント阻害剤を用いて治療されている。
本明細書で使用する「免疫チェックポイント阻害剤」という用語は、例えば、T細胞等の免疫系の細胞及び幾つかのタイプの癌細胞によって発現されるタンパク質を阻害又は遮断する薬物(抗体を含む)を指す。これらのタンパク質は、免疫応答を阻害し、T細胞が癌細胞を死滅させることを阻止することがある。これらのタンパク質がブロックされると、免疫系の阻害が克服され、T細胞が癌細胞を死滅させることができる。T細胞又は癌細胞について見出されるチェックポイントタンパク質の例としては、PD-1/PD-L1及びCTLA-4/B7-1/B7-2が挙げられる。このように、免疫チェックポイント阻害剤は、免疫系攻撃に対する癌の主な防御(すなわち、T細胞)の1つを克服しようとするものである。
癌の治療に関する本発明の実施形態及び側面において、方法には、免疫チェックポイント阻害剤に加えて治療有効量の1つ以上の抗癌剤を対象に投与することが含まれうる。
本説明から明らかなように、本発明の方法は、細胞におけるPD-L1発現のアッセイ、すなわち、検出及び/又は測定に基づいている。本発明の一側面では、単に、選択された細胞がPD-L1を発現しているか否かを判定することで、本明細書で定義する方法のそれぞれを使用できる。したがって、これらの方法は、細胞内のPD-L1発現の量を定量化する必要なく実施できる。なお、本発明の別の側面では、本明細書で定義する方法のそれぞれは、細胞によるPD-L1発現の相対量又は特定量を判定することによって使用できる。相対量は、例えば、細胞が他の細胞又は標準よりも多くのPD-L1を発現しているか否かを判定することによって判定してもよい。特定量は、例えば、細胞中のPD-L1発現のレベルを定量化することによって判定してもよい。
本発明の方法で使用される細胞は、CTC、EMTCTC、CAML、及びCAVEのうちの1つ以上を含む。したがって、これらの方法は、これらのタイプの循環細胞の1つ、2つ、3つ、又は4つ全てを使用して実施しうる。
本発明の方法において言及される対象は、ヒト、非ヒト霊長類、トリ、ウマ、ウシ、ヤギ、ヒツジ、並びにイヌ、ネコ、齧歯類等のペット動物、又は他の哺乳類が挙げられる。
上で定義した特定の関連する実施形態及び側面において、少なくとも1つのCTC、EMTCTC、CAML、又はCAVEは、少なくとも1つのRAD50巣を示す。
実施例1
血液サンプル採取
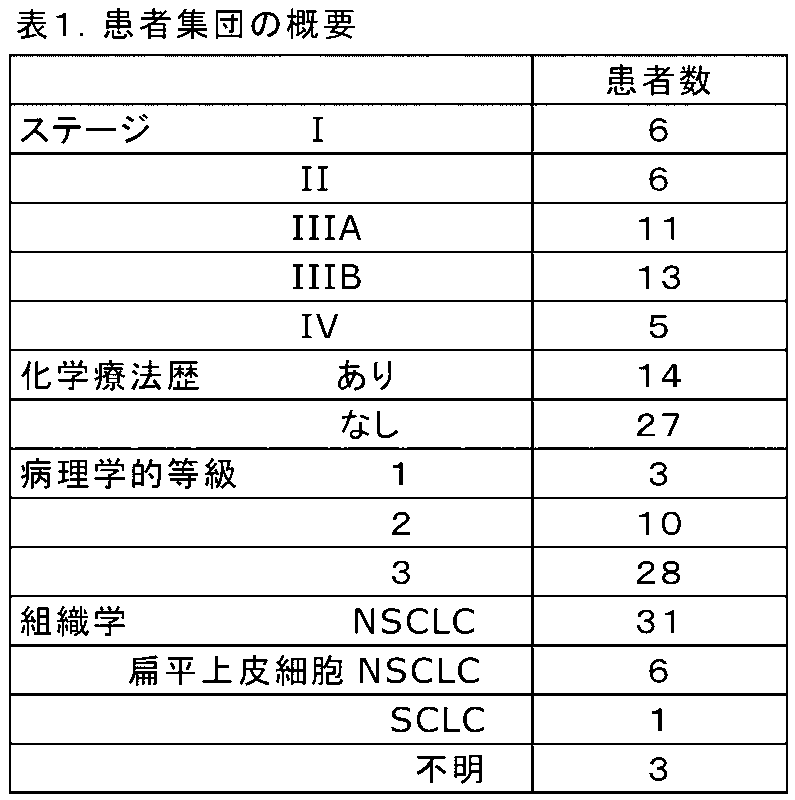
ステージI~IV肺癌を有する41人の患者について、前向きパイロット研究を行った(表1)。書面によるインフォームドコンセント及び現地IRBの承認に従って、匿名化された末梢血サンプルを採取した。2013年7月から2014年5月の期間、原発性肺癌の放射線療法を開始する前の患者を募集した。4例の患者はステージI疾患のための体幹部定位放射線治療(Stereotactic Body Radiation Therapy:SBRT)を受け、37例の患者は、ステージII-IV疾患のための、プロトン療法(n=16)又は強度変調放射線療法(Intensity-modulated radiation therapy:IMRT)(n=21)を用いた化学放射線療法を受けた。匿名の血液サンプル(7.5mL)を採取し、MDアンダーソン癌センター(MD Anderson Cancer Center:MDA)においてオンサイトで処理した。スライドを匿名化し、クリーティービーマイクロテック社(CreatvMicroTech, Inc.)の臨床試験室に搬送し、ここで分析を行った。製造業者のプロトコール(ダコ(DAKO))に従って、原発腫瘍由来の匿名化生検サンプルをMDAにおいて処理した。この施設からの結果は、研究の完了までは、共有されず、伝達されなかった。
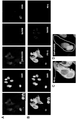
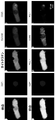
低圧真空システムを用いたセルシーブ(商標)マイクロフィルトレーションアッセイ(CellSieve Microfiltration Assay)によって、セルセーブ保存チューブ(CellSave preservative tubes:商標)に採取した血液サンプル(7.5mL)を処理した[1,12]。セルシーブ(商標)マイクロフィルトレーションアッセイは、>7ミクロンのサイズ排除に基づいて循環細胞を分離する。形態学的特徴及びCD45、EpCAM、サイトケラチン8,18,19及びDAPIの表現型発現に基づいて、事前に知られている細胞学的特徴[6,11,14]を用いて、熟練した細胞学者が予後に病理学的に定義可能なCTC(PDCTC)、EMTCTC、及びCAMLを同定した(図1及び図2)[1,6,12]。イメージングの全てにおいて、オリンパスBX54WI蛍光顕微鏡と共にカールツァイス(CarlZeiss)AxioCam及びZen2011Blue(カールツァイス)を使用した。
癌患者に見出される2つの最も一般的なCTC亜型(PDCTCS及びEMTCTC)の定義的な特徴及びCAML同定のための特徴は、既に開示されている[1,6,10~14]。本研究では、無傷のPDCTC、EMTCTC、及びCAMLのみを特徴付けた(図2及び図3)[1,6,10~14]。PDCTCは、CD45陰性であり、線維性サイトケラチン陽性であり、悪性病理学的基準を有するDAPI陽性核を有し、CTCのセルサーチ(CellSearch:登録商標)亜型として分類される[1,6,10~14]。EMTCTCは、これまでに定義されているように、CD45陰性であり、拡散性サイトケラチンシグナル及び異常な基準を有するDAPI陽性核を有する[1,6,9,12,13]。CAMLは、拡大された(>30μm)、拡散した細胞質サイトケラチン染色を伴う多核細胞、及び/又はCD45+/CD14+として記述される[6,11,14,17,22,43]。3つの細胞型については、全て、熟練したCTC細胞学者が同定し、画像化し、病理学者が確認した。上述のような細胞学的分類ができなかったアポトーシス性CTC及びCTCは、含まれなかった。同定の後、細胞を画像化し、将来の分析のために各セルのx-y軸をマークした。サンプルは、4℃で1~3年間保存した。
PDCTC、EMTCTC、及びCAMLの最初の同定及び定量化の後、蛍光をクエンチし、RAD50-DyLight550(Pierce Thermo)、PD-L1-AlexaFluor488(R&D systems社)、及びDAPI核染色(図1)によってサンプルを再染色した。既に開示された、QUAS-R(クエンチ、非誘導体化、アミンストリップ及び再染色(Quench, Underivatize, Amine-Strip and Restain)技術を使用した[13]。簡単に説明すると、サンプルを撮像し、マークした後のフィルターに、クエンチング溶液、トリス、及び洗浄ステップの順次的化学処理を施した。化学的クエンチングの後、フィルターをPBSで洗浄し、1XPBS/20%FBSでインキュベートし、次に、RAD50-AlexaFluor550及びPD-L1-AlexaFluor488に対する抗体と共に、室温で1時間インキュベートした。抗体インキュベーションの後、フィルターを1xPBSTで洗浄し、Fluoromount-G/DAPI(Southern Biotech社)によってスライドマウントした。サンプルをx/y軸に沿って配向させ、Zen2011Blue(カールツァイス)マーク及び発見ソフトウェアを用いて先に画像化した細胞を再配置した。Zen2011Blue(Carl Zeiss社)を用いて画像を処理した。
ダコpharmDxクローン22c3及びダコpharmDxクローン28-8の両方を用いて、製造業者のガイドラインに従い、利用可能な全ての原発腫瘍生検からのPD-L1発現を分析した(図4)。この研究の8人の患者については、両方のクローンをスクリーニングするために十分な腫瘍サンプルが保存されており、1つのサンプルは、クローン22c3に対する単一のIHC試験のために十分な腫瘍を保存していた。両方のクローンを、既に開示されている標準操作手順[29-31,38]に従って染色した。
各細胞の核局在化RAD50遺伝子座を列挙することによってRAD50遺伝子座の形成を判定した(図1及び図5)[23]。細胞全体の面積を用いて、ZenBlueソフトウェアにより各細胞のPD-L1ピクセル強度を測定した。各画像の局所的バックグラウンドの平均ピクセル強度から各セルの平均ピクセル強度を減算した(図1C)。細胞の平均ピクセル強度を0-負(ピクセル平均0~150)、1-低(ピクセル平均151-300)、2-中(ピクセル平均301-750)、及び3-高(ピクセル平均751+)の4つのIHC群に四分化した(図5)。IHCスコアリングのためのPD-L1強度のIHC範囲閾値は、150ピクセル強度を、局所化されたバックグラウンドシグナルの標準偏差とし、300ピクセル強度を、局所化されたバックグラウンドの標準偏差の2倍とし、750を、局所化されたバックグラウンドの強度の2倍とすることによって定義した(図5)。
MATLAB R2013Aにおいて、全ての亜型及び既知の患者集団からのカウントを用いて解析を行った。無増悪生存期間(progression free survival)分析のために、増悪までの時間を、T0血液サンプルを取得したときから、増悪の日までと定義し、24ヶ月のエンドポイントまで全ての患者について研究を行い、すなわち、研究を打ち切った患者はなかった。RAD50巣形成及びPD-L1発現の平均変化の有意性は、スチューデントのT検定によって判定した。個々の測定値について、ピアソン係数を使用して、RAD50巣とPD-L1発現との間の相関を判定した。カプランマイヤープロットの有意性は、ログランク分析によって判定した。
LC患者におけるPDCTC、EMTCTC、及びCAML
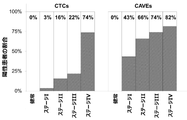
セルサーチ(CellSearch:登録商標)プラットフォームを使用するNSCLC患者におけるCTC亜集団は、通常、非転移性症例のうち、0~5%にしか見出されないことが報告されている。これに対し、EMTCTC集団は、通常、非転移性患者集団の約80%に見出され、CAMLについては、NSCLCにおける広範に亘る評価は行われていない[3-6,8,15,17,43-45]。放射線療法の開始前に採取された最初のベースライン血液サンプル(T0)では、41サンプル中35サンプル(85%)において、少なくとも1つのサイトケラチン陽性細胞(すなわち、PDCTC、EMTCTC、又はCAML)を同定できた(図1及び図3)。その後、放射線療法開始から2~3週間後、又はSBRT患者については最後の分画の後に、患者の第2のフォローアップサンプル(T1)を採取した。T1については、41サンプル全て(100%)に少なくとも1つのサイトケラチン陽性細胞(すなわち、PDCTC、EMTCTC、又はCAML)が見出された。具体的には、EMTCTCは、T0サンプルの49%及びT1サンプルの66%に見出された。CAMLは、T0サンプルの81%及びT1サンプルの100%に見出された(図3)。PDCTCは、T0において1サンプル(2%)のみ、T1において3サンプルのみ(7%)に見出された(図3)。PDCTCは、セルサーチ(CellSearch:登録商標)CTCシステムによって単離された同じCTC集団であることが示されており、これらの数値は、これまでの報告[7-9,15]に合致する。セルサーチシステムは、ステージIIIのNSCLCでは0~5%の陽性、ステージIVでは21~32%の範囲で、NSCLC患者のCTCを単離した[7-9,15]。患者のうちの35人がステージI-IIIとして病期分類されたので、2~7%は、通例的なCTC集団の範囲内である(表1)[7-9,15]。通例的なPDCTC集団の発生率が低いことは、サンプルの85%(T0)及び100%(T1)に存在するEMTCTC及びCAMLとは対照的である(図3)。EMTCTC単独では、NSCLCにおける液体生検に対する感度が幾らか向上する可能性があると推論されてきたが[7-9,16]、これらの結果は、EMTCTC及びCAMLの両方の組み合わせによって、腫瘍由来細胞を分析する血液ベースの診断の感度が向上することを示唆している。
これまで、原発腫瘍の部位からの末梢血への播種としてCTC及びCAMLが記述されてきたが、これらの細胞が循環に入る前に存在する正確な位置を確認した研究は未だなされていない。このように起原が不明であることの主な理由は、患者の腫瘍/間質細胞を標識し、これらの播種を追跡することが困難であり、このような実験が患者に危険をもたらす可能性があるためである。哺乳類細胞におけるIRIF形成物内のRAD50巣が、細胞への直接放射線曝露の生物学的トラッカーとして示されることはあったが、これは、放射線治療を受けている患者の循環腫瘍又は間質細胞においては、未だ評価されていない。T0ベースラインにおける非照射LC患者において、EMTCTC細胞内のRAD50巣の核当たりの巣数は、0~4の範囲であり、平均は0.59±0.97であり、CAMLでは、巣数は、0~5の範囲であり、平均0.38±1.07であった(図6及び図7)。RAD50巣は、通常、少数の未治療細胞で同定される正常な生物学的修復メカニズムであるため、細胞内に幾つかのRAD50巣が存在することは、驚くべきことではない[21,23,24]。T1において患者を腫瘍指向性放射線療法に曝露した後、RAD50巣数は、EMTCTCにおいて、核当たり0~9、平均4.27±2.63及びCAMLにおいて、核当たり0~20、平均3.9±3.93に有意に増加した(図6)。この増加は、T0及びT1の両方の時点(n=35)で検出可能な細胞を有する全ての患者において観察され、正常なCD45+白血球のバックグラウンドでは殆ど見いだされなかった(図1B)。このように、EMTCTC及びCAMLの両方において、RAD50は、T0における平均0.48からT1における平均4.05(p<0.0001)に増加した(図6)。これらの結果は、RAD50を使用して、腫瘍部位に由来する照射された細胞を標識及び追跡でき、したがって、腫瘍動態を追跡できることを示唆している。
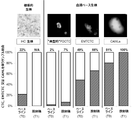
放射線を含む様々な細胞傷害性療法によって、腫瘍にPD-L1が誘発され得ることが示唆されている[29-34,36-40,42]。BBBを使用してこれを視認できるかを判定するために、T0及びT1の時点でPD-L1染色を評価した。従来の0-3IHC組織生検スコアリングと同様の方法で、標準化された比較スコアリングシステムを開発した(図5)。染色及び画像化の後、LC患者において見出された全ての373細胞のPD-L1発現及び局所バックグラウンドを測定した。各画像の局所的バックグラウンドのピクセル強度を375±150に平均化した(図5)。局所化されたバックグラウンド効果を考慮するために、測定された各細胞から各画像のバックグラウンドを減算し、PD-L1ピクセル強度範囲を17-3090に補正した(図5)。次に、0~150ピクセルのバックグラウンドの標準偏差をスコア0(細胞の26%)とし、標準偏差の2倍(151-300ピクセル)をスコア1(低発現、細胞の42%)として、補正したピクセル強度で細胞を分類した。中程度の発現、すなわちスコア2(細胞の22%)は、平均バックグラウンドシグナル(301-750ピクセル)の2倍として判定し、高発現、すなわちスコア3(細胞の10%)を平均バックグラウンドシグナルの>2倍(>750ピクセル)に設定した(図5)。
クローン22c3及び28-8(ダコ(DAKO))を使用する市販の2つのCLIA認定試験を使用して、IHCによる元の診断生検から利用可能な組織を染色した。病理学的アーカイブから有用な組織又は細胞ブロックを回収できたのは、41人の患者のうち9人のみであり、1回のIHC検査に十分な組織を有していたのは、これらの9人の患者のうち1人のみであった(図4)。これは、腫瘍壊死又は小結節の結果、PD-L1 IHC試験を行うために十分な集団が得られなかったためである。9個のアーカイブサンプルのうち、2個のみがPD-L1染色陽性であり、2個の試験間で発現スコア及びパーセンテージの変動があった(図4C)。これに対し、PD-L1発現は、BBBを使用して、T0患者サンプルの85%(n=35/41)及びT1患者サンプルの100%(n=41/41)で定量可能であった。具体的には、T0において、EMTCTC及びCAMLは、21人の患者(60%)において低/負(スコア0/1)のPD-L1発現を示し、9人の患者(26%)において中等度(スコア2)の発現を示し、5人の患者(14%)において高(スコア3)の発現を示した(図4C)。
組織生検では、バイオマーカーPD-L1の発現のみでは、肺癌における生存の予後指標にならず、一方、RAD50の巣形成は、生存と正の相関を有することが示されている[14,18,20,24,29,30,32,35,39,40,42]。T0とT1の両方の時点でのPD-L1の発現又はRAD50の平均数に基づいて患者の臨床転帰を分析した(図8)。PD-L1の発現を用いてPFSを比較するために、カットオフ基準として中程度の発現、すなわち、2つのコホートについて、<2対≧2を使用した。T0においてPD-L1が低い患者は、1.8の僅かに悪いハザード比(hazard ratio:HR)を有し、これは、有意ではなかった(p=0.305)。T1では、PD-L1が低い患者は、全体的PFSがやや良好(HR=0.7)であったが、これも有意ではなかった(p=0.581)。このデータは、T0又はT1におけるPD-L1レベルの発現に基づく全体的PFSとの相関が限定的又は相関が認められないことを示唆している。PFS中央値を使用することにより、T0においてより高いPD-L1を有する細胞において、PFS中央値へのより良好な傾向(16ヶ月対>24ヶ月間)を見出したが、これを確認するには、遥かに大きなサンプルサイズが必要である。
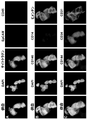
腫瘍血管内皮細胞(tumor endothelial cell:TEC)[60-62]は、血管新生及び新生血管形成のための重要な構造を形成することによって、腫瘍の開始、生存及び成長に必要とされる間質細胞の集団である。TECは、全ての腫瘍部位において必須成分であり、腫瘍脈管構造に必要とされ、転移性ニッチのプライミングを補助し、腫瘍の分子不安定性に寄与する。循環において、共通のTEC集団が同定されており、これらは、これらの大きなサイズ、多細胞クラスター化、及び周知のECマーカーCD31及びビメンチン(Vimentin)[60]に基づいて、癌関連血管内皮細胞(CAVE)として定義されている。
図13は、細胞のクラスター中に出現するCAVEを検証するための染色を示している。癌腫患者から捕捉された全ての細胞の最初の染色において、DAPI、サイトケラチン8、18及び19、EpCAM及びCD45についてサンプルを染色した。図13の一番上の列は、サイトケラチン発現、及びEpCAM、CD45発現なしのクラスターを示している。図13の二番目の列は、DAPI、PD-L1、CD14及びCD31について細胞が再染色されたことを示している。CD31+膜染色及び陰性CD45及びCD14染色は、これがCAVEクラスターであることを示している。このCAVEのクラスターは、PD-L1の高発現を有する。図13の三番目の列は、CD144、CXCR4及びビメンチンについて細胞が再染色されたことを示している。CXCR4は、他の薬剤標的である。再染色のためにQUAS-Rを使用し[13]、この再染色は、蛍光色素をクエンチングし、続いて再染色することからなる。この再染色は、併用免疫療法を分析する方法を示している。この例では、PD-L1とCXCR4の両方の発現が高く、この併用療法は、この患者にとって有効である可能性があることを示している。
現在の免疫療法コンパニオン診断は、組織生検におけるPD-L1タンパク質発現に基づいている。しかしながら、IHC組織生検法は、生検を繰り返すことの臨床的実現可能性及びコスト、固有の腫瘍異質性、及びPD-L1 IHC陰性患者が依然として免疫療法に応答する可能性があるとの知識のために制限されている。
<付記事項>
[付記事項1]
免疫チェックポイント阻害剤に対する感受性について、癌を有する対象をスクリーニングする方法であって、
PD-L1発現について、癌を有する対象から単離された、循環腫瘍細胞(CTC)、上皮間葉転換CTC(EMTCTC)、癌関連マクロファージ様細胞(CAML)、及び癌関連血管内皮細胞(CAVE)のうちの1つ以上をアッセイすることを含み、
PD-L1発現が検出された場合、前記対象は、免疫チェックポイント阻害剤が有効であるとみなす、前記方法。
[付記事項2]
免疫チェックポイント阻害剤による治療に対する、癌を有する対象の応答性を予測する方法であって、
PD-L1発現について、癌を有する対象から単離された、CTC、EMTCTC、CAML、及びCAVEのうちの1つ以上をアッセイすることを含み、
PD-L1発現が検出された場合、前記対象は、免疫チェックポイント阻害剤による処置に応答性があると予測する、前記方法。
[付記事項3]
癌を有する対象の治療を選択する方法であって、
PD-L1発現について、癌を有する対象から単離された、CTC、EMTCTC、CAML、及びCAVEの1つ以上をアッセイすることを含み、
PD-L1発現が検出された場合、前記対象の治療として前記対象への治療有効量の免疫チェックポイント阻害剤の投与を選択する、前記方法。
[付記事項4]
免疫チェックポイント阻害剤治療を受ける癌を有する対象を同定するためのアッセイの方法であって、
PD-L1発現について、癌を有する対象から単離された、CTC、EMTCTC、CAML、及びCAVEのうちの1つ以上をアッセイすることを含み、
PD-L1発現が検出された場合、前記対象は、免疫チェックポイント阻害剤治療を受ける対象として同定される、前記方法。
[付記事項5]
癌を有する対象を治療する方法であって、
(a)PD-L1発現について、癌を有する対象から単離された、CTC、EMTCTC、CAML、及びCAVEのうちの1つ以上をアッセイすることと、
(b)PD-L1発現が検出された場合、前記対象に治療有効量の免疫チェックポイント阻害剤を投与することと、
を含む方法。
[付記事項6]
癌を有する対象を治療する方法であって、
癌を有する対象に治療有効量の免疫チェックポイント阻害剤を投与することを含み、前記免疫チェックポイント阻害剤は、前記癌を有する対象から単離されたCTC、EMTCTC、CAML、及びCAVEのうちの1つ以上において、PD-L1発現が検出された後に投与される、前記方法。
[付記事項7]
癌を有する対象におけるPD-L1発現をモニタリングする方法であって、
(a)PD-L1発現について、癌を有する対象から第1の時点で単離された、CTC、EMTCTC、CAML、及びCAVEのうちの1つ以上をアッセイすることと、
(b)PD-L1発現について、前記癌を有する対象から第2の時点で単離されたCTC、EMTCTC、CAML、及びCAVEのうちの1つ以上をアッセイすることと、
(c)前記第1及び第2の時点で単離された細胞においてアッセイされたPD-L1発現を比較することと、
を含む方法。
[付記事項8]
前記対象は、癌の治療を受けている、付記事項7に記載の方法。
[付記事項9]
癌を有する対象における治療をモニタリングする方法であって、
(a)PD-L1発現について、癌の治療を受けている対象から第1の時点で単離されたCTC、EMTCTC、CAML、及びCAVEのうちの1つ以上をアッセイすることと、
(b)PD-L1発現について、前記癌の治療を受けている対象から第2の時点で単離されたCTC、EMTCTC、CAML、及びCAVEのうちの1つ以上をアッセイすることと、
(c)前記第1及び第2の時点で単離された細胞においてアッセイされたPD-L1発現を比較することにより、前記癌を有する対象における治療をモニタリングすることと、
を含む、前記方法。
[付記事項10]
前記対象は免疫チェックポイント阻害剤を用いて治療されている、付記事項9に記載の方法。
[付記事項11]
前記免疫チェックポイント阻害剤は、PD-L1アンタゴニスト、PD-1アンタゴニスト、及びCTLA-4アンタゴニストのうちの1つ以上である、付記事項1~6及び10のいずれか一項に記載の方法。
[付記事項12]
前記免疫チェックポイント阻害剤は、PD-L1とPD-1との間の結合を阻害する、付記事項1~6及び10のいずれか一項に記載の方法。
[付記事項13]
前記免疫チェックポイント阻害剤は、PD-L1のその結合パートナーへの結合を阻害する、付記事項1~6及び10のいずれか一項に記載の方法。
[付記事項14]
前記免疫チェックポイント阻害剤は、PD-1のその結合パートナーへの結合を阻害する、付記事項1~6及び10のいずれか一項に記載の方法。
[付記事項15]
前記免疫チェックポイント阻害剤は、CTLA-4のその結合パートナーへの結合を阻害する、付記事項1~6及び10のいずれか一項に記載の方法。
[付記事項16]
前記免疫チェックポイント阻害剤は、抗体である、付記事項1~6及び10のいずれか一項に記載の方法。
[付記事項17]
前記免疫チェックポイント阻害剤は、モノクローナル抗体である、付記事項1~6及び10のいずれか一項に記載の方法。
[付記事項18]
前記免疫チェックポイント阻害剤は、ヒト抗体、ヒト化抗体、又はキメラ抗体である、付記事項1~6及び10のいずれか一項に記載の方法。
[付記事項19]
前記免疫チェックポイント阻害剤は、ニボルマブ(オプジーボ)、イピリムマブ(ヤーボイ)、ペムブロリズマブ(キイトルーダ)、アテゾリズマブ(テセントリク)、トレメリムマブ、及びデュルバルマブ(MED14736)のうちの1つ以上である、付記事項1~6及び10のいずれか一項に記載の方法。
[付記事項20]
1つ以上の追加の抗癌剤の治療有効量を対象に投与することを更に含む、付記事項5、6、8、及び10のいずれか一項に記載の方法。
[付記事項21]
前記1つ以上の追加の抗癌剤は、免疫療法剤、化学療法剤、放射線療法剤、既存の癌剤、CCR5及びCXCR4からなる群から選択される、付記事項20に記載の方法。
[付記事項22]
前記1つ以上の追加の抗癌剤は、T-VEC、AM-0010、CXCR4アンタゴニスト、TGF-βキナーゼ阻害剤ガルニセルチブ、抗CSF-1Rモノクローナル抗体、アベマシクリブ、ファスロデックス、ネシツムマブ、AZD9291、サイラムザ(ラムシルマブ)、TPIV200、ガルニセルチブ、癌ワクチン、サイトカイン、細胞ベースの療法、二重及び多重特異性抗体、腫瘍ターゲティングmAbs、リツキシマブ、腫瘍溶解性ウイルス、レオウイルス、ブリナツモマブ、シプリューセル-T、T-Vec、IL-2、IFN-α、トラスツズマブ、セルキシマブ、ベバシズマブ、Tim-3、BTLA、抗IL-10、GM-CSF、抗血管新生治療、VEGF遮断薬、HMGB1、Nrp1、TAM受容体チロシンキナーゼ、Axl、MerTK、ALT-803、IL-15、免疫抑制リガンドホスファチジルセリン(PS)、バビツキシマブ、ベバシズマブ(抗VEGF)、コブルメチニブ(MEK阻害剤)、ベムラフェニブ(BRAF阻害剤)、エルロチニブ(EGFR)、アレクチニブ(ALK阻害剤)、ベバシズマブ(抗VEGF)、パゾパニブ(チロシンキナーゼ阻害剤)、ダブラフェニブ(BRAF阻害剤)、トラメチニブ(MEK阻害剤)、デュルバルマブ(抗PD-L1)、スニチニブ(RTK阻害剤)、パゾパニブ(RTK阻害剤)、サルグラモスチム、VISTA、TIM-3、LAG-3、PRS-343、CD137(4-1BB)/HER2二重特異性抗体、USP7、抗HER2、SEMA4D、CTLA-4、PD-1、PD-L1、及びPD-L2からなる群から選択される、付記事項20に記載の方法。
[付記事項23]
前記PD-L1発現のアッセイは、PD-L1タンパク質発現を検出すること及びPD-L1mRNA産生を検出することのうちの1つ以上によって行われる、付記事項1~10のいずれか一項に記載の方法。
[付記事項24]
前記PD-L1タンパク質発現は、免疫組織化学(IHC)によって検出される、付記事項23に記載の方法。
[付記事項25]
前記IHCは、膜染色、細胞質染色、又はこれらの組み合わせによって行われる、付記事項24に記載の方法。
[付記事項26]
前記IHCは、抗PD-L1抗体を用いて行われる、付記事項24又は25に記載の方法。
[付記事項27]
PD-L1タンパク質発現は、IHCによって低染色強度として検出される、付記事項24~26のいずれか一項に記載の方法。
[付記事項28]
PD-L1タンパク質発現は、IHCによって高染色強度として検出される、付記事項24~26のいずれか一項に記載の方法。
[付記事項29]
PD-L1タンパク質発現は、IHCによって誘導可能であるとして検出される、付記事項24~26のいずれか一項に記載の方法。
[付記事項30]
PD-L1タンパク質発現は、単離された細胞の染色として検出される、付記事項24~26のいずれか一項に記載の方法。
[付記事項31]
IHCは、PD-L1に対する結合特異性を有する1つ以上の抗体を利用する免疫蛍光(IF)染色を用いて行われる、付記事項24に記載の方法。
[付記事項32]
PD-L1への抗PD-L1抗体の結合は、前記抗PD-L1抗体にコンジュゲートされた蛍光化合物を介して検出される、付記事項31に記載の方法。
[付記事項33]
PD-L1への抗PD-L1抗体の結合は、抗PD-L1抗体に対する結合特異性を有するフルオロフォアコンジュゲート二次抗体を介して検出される、付記事項31に記載の方法。
[付記事項34]
PD-L1発現レベルが、癌に罹患していない同じ種の対象由来の間質細胞の集団のPD-L1発現よりも大きい場合、PD-L1発現が検出される、付記事項1~6のいずれか一項に記載の方法。
[付記事項35]
CTC、EMTCTC、CAML、及びCAVEは、前記癌を有する対象から得た血液から単離される、付記事項1~6のいずれか一項に記載の方法。
[付記事項36]
前記血液は末梢血である、付記事項35に記載の方法。
[付記事項37]
前記癌を有する対象は、標的薬剤、化学療法、又は放射線療法のうちの1つ以上を用いて治療を受けている、付記事項1~10のいずれか一項に記載の方法。
[付記事項38]
前記癌は、固形腫瘍である、付記事項1~10のいずれか一項に記載の方法。
[付記事項39]
前記固形腫瘍は、ステージI、ステージII、ステージIII、又はステージIVの癌である、付記事項38に記載の方法。
[付記事項40]
前記固形腫瘍は、癌腫、肉腫、神経芽細胞腫、又はメラノーマである、付記事項40に記載の方法。
[付記事項41]
前記癌は、肺癌、乳癌、前立腺癌、膵臓癌、メラノーマ、膀胱癌、腎臓癌、頭頸部癌、大腸癌、肝臓癌、卵巣癌、神経芽細胞腫、肉腫、骨肉腫、食道癌、脳及びその他神経系癌、喉頭癌、気管支癌、口腔及び咽頭癌、胃癌、精巣癌、甲状腺癌、子宮頸癌、又は子宮体癌の1つ以上である、付記事項1~10のいずれか一項に記載の方法。
[付記事項42]
前記肺癌は、非小細胞肺癌(NSCLC)である、付記事項41に記載の方法。
[付記事項43]
少なくとも1つのCTC、EMTセル、CAML、又はCAVEは、少なくとも1つのRAD50巣を示す、付記事項1~10のいずれか一項に記載の方法。
本明細書で言及した全ての特許文献及び刊行物は、本発明が関係する当業者の技術水準を示すものである。引用された特許文献及び刊行物のそれぞれは、引用によってその全体が本明細書に援用される。以下の参考文献の全てが本出願に引用されている。
1. Adams DL, Zhu P, Makarova OV, Martin SS, Charpentier M, Chumsri S, et al. The systematic study of circulating tumor cell isolation using lithographic microfilters. RSC Advances. 2014;4:4334-42.
2. Lianidou ES, Markou A. Circulating tumor cells in breast cancer: detection systems, molecular characterization, and future challenges. Clinical chemistry. 2011;57:1242-55.
3. Pantel K, Brakenhoff RH, Brandt B. Detection, clinical relevance and specific biological properties of disseminating tumour cells. Nature reviews Cancer. 2008;8:329-40.
4. Paterlini-Brechot P, Benali NL. Circulating tumor cells (CTC) detection: clinical impact and future directions. Cancer letters. 2007;253:180-204.
5. Adams D, Tsai S, Makarova OV, Zhu P, Li S, Amstutz PT, et al. Low cytokeratin-and low EpCAM-expressing circulating tumor cells in pancreatic cancer. ASCO Annual Meeting Proceedings; 2013. p. 11046.
6. Adams DL, Stefansson S, Haudenschild C, Martin SS, Charpentier M, Chumsri S, et al. Cytometric characterization of circulating tumor cells captured by microfiltration and their correlation to the cellsearch((R)) CTC test. Cytometry Part A : the journal of the International Society for Analytical Cytology. 2015;87:137-144.
7. Krebs MG, Hou JM, Sloane R, Lancashire L, Priest L, Nonaka D, et al. Analysis of circulating tumor cells in patients with non-small cell lung cancer using epithelial marker-dependent and -independent approaches. J Thorac Oncol. 2012;7:306-15.
8. Farace F, Massard C, Vimond N, Drusch F, Jacques N, Billiot F, et al. A direct comparison of CellSearch and ISET for circulating tumour-cell detection in patients with metastatic carcinomas. British journal of cancer. 2011;105:847-53.
9. Lecharpentier A, Vielh P, Perez-Moreno P, Planchard D, Soria JC, Farace F. Detection of circulating tumour cells with a hybrid (epithelial/mesenchymal) phenotype in patients with metastatic non-small cell lung cancer. British journal of cancer. 2011;105:1338-41.
10. Adams DL, Adams DK, Stefansson S, Haudenschild C, Martin SS, Charpentier M, et al. Mitosis in circulating tumor cells stratifies highly aggressive breast carcinomas. Breast cancer research : BCR. 2016;18:44.
11. Adams DL, Adams DK, Alpaugh RK, Cristofanilli M, Martin SS, Chumsri S, et al. Circulating Cancer-Associated Macrophage-Like Cells Differentiate Malignant Breast Cancer and Benign Breast Conditions. Cancer Epidemiol Biomarkers Prev. 2016;25:1037-42.
12. Adams DL, Alpaugh RK, Martin SS, Charpentier M, Chumsri S, Cristofanilli M, et al. Precision microfilters as an all in one system for multiplex analysis of circulating tumor cells. RSC Advances. 2016;6:6405-14.
13. Adams DL, Alpaugh RK, Tsai S, Tang CM, Stefansson S. Multi-Phenotypic subtyping of circulating tumor cells using sequential fluorescent quenching and restaining. Sci Rep. 2016;6:33488.
14. Adams DL, Martin SS, Alpaugh RK, Charpentier M, Tsai S, Bergan RC, et al. Circulating giant macrophages as a potential biomarker of solid tumors. Proceedings of the National Academy of Sciences of the United States of America. 2014;111:3514-9.
15. Allard WJ, Matera J, Miller MC, Repollet M, Connelly MC, Rao C, et al. Tumor cells circulate in the peripheral blood of all major carcinomas but not in healthy subjects or patients with nonmalignant diseases. Clin Cancer Res. 2004;10:6897-904.
16. Anantharaman A, Friedlander T, Lu D, Krupa R, Premasekharan G, Hough J, et al. Programmed death-ligand 1 (PD-L1) characterization of circulating tumor cells (CTCs) in muscle invasive and metastatic bladder cancer patients. BMC Cancer. 2016;16:744.
17. Mu Z, Benali-Furet N, Uzan G, Znaty A, Ye Z, Paolillo C, et al. Detection and Characterization of Circulating Tumor Associated Cells in Metastatic Breast Cancer. Int J Mol Sci. 2016;17.
18. Abuzeid WM, Jiang X, Shi G, Wang H, Paulson D, Araki K, et al. Molecular disruption of RAD50 sensitizes human tumor cells to cisplatin-based chemotherapy. J Clin Invest. 2009;119:1974-85.
19. Adams DL, Edelman MJ, Fang P, Jiang W, He J, Xu T, et al. Sequential tracking of PD-L1 expression and RAD50 induction in CTCs and circulating stromal cells of lung cancer patients during treatment with radiotherapy. Cancer Research. 2016;76:4990-.
20. Flores-Perez A, Rafaelli LE, Ramirez-Torres N, Arechaga-Ocampo E, Frias S, Sanchez S, et al. RAD50 targeting impairs DNA damage response and sensitizes human breast cancer cells to cisplatin therapy. Cancer Biol Ther. 2014;15:777-88.
21. Garcia-Villa A, Balasubramanian P, Miller BL, Lustberg MB, Ramaswamy B, Chalmers JJ. Assessment of gamma-H2AX levels in circulating tumor cells from patients receiving chemotherapy. Front Oncol. 2012;2:128.
22. Lin SH, He J, Edelman M, Xu T, Gao H, Reuben J, et al. Sequential Assessment of DNA Damage Response and PD-L1 Expression in Circulating Tumor Cells of Lung Cancer Patients during Radiotherapy. JOURNAL OF THORACIC ONCOLOGY; 2015: ELSEVIER SCIENCE INC 360 PARK AVE SOUTH, NEW YORK, NY 10010-1710 USA. p. S266-S7.
23. Maser RS, Monsen KJ, Nelms BE, Petrini JH. hMre11 and hRad50 nuclear foci are induced during the normal cellular response to DNA double-strand breaks. Mol Cell Biol. 1997;17:6087-96.
24. Wang LH, Pfister TD, Parchment RE, Kummar S, Rubinstein L, Evrard YA, et al. Monitoring drug-induced gammaH2AX as a pharmacodynamic biomarker in individual circulating tumor cells. Clin Cancer Res. 2010;16:1073-84.
25. Gatei M, Jakob B, Chen P, Kijas AW, Becherel OJ, Gueven N, et al. ATM protein-dependent phosphorylation of Rad50 protein regulates DNA repair and cell cycle control. J Biol Chem. 2011;286:31542-56.
26. Teng SC, Wu KJ, Tseng SF, Wong CW, Kao L. Importin KPNA2, NBS1, DNA repair and tumorigenesis. J Mol Histol. 2006;37:293-9.
27. Demaria S, Golden EB, Formenti SC. Role of Local Radiation Therapy in Cancer Immunotherapy. JAMA Oncol. 2015;1:1325-32.
28. Derer A, Deloch L, Rubner Y, Fietkau R, Frey B, Gaipl US. Radio-Immunotherapy-Induced Immunogenic Cancer Cells as Basis for Induction of Systemic Anti-Tumor Immune Responses - Pre-Clinical Evidence and Ongoing Clinical Applications. Front Immunol. 2015;6:505.
29. Brahmer J, Reckamp KL, Baas P, Crino L, Eberhardt WE, Poddubskaya E, et al. Nivolumab versus Docetaxel in Advanced Squamous-Cell Non-Small-Cell Lung Cancer. N Engl J Med. 2015;373:123-35.
30. Brahmer JR, Tykodi SS, Chow LQ, Hwu WJ, Topalian SL, Hwu P, et al. Safety and activity of anti-PD-L1 antibody in patients with advanced cancer. N Engl J Med. 2012;366:2455-65.
31. Garon EB, Rizvi NA, Hui R, Leighl N, Balmanoukian AS, Eder JP, et al. Pembrolizumab for the treatment of non-small-cell lung cancer. N Engl J Med. 2015;372:2018-28.
32. Gettinger SN, Horn L, Gandhi L, Spigel DR, Antonia SJ, Rizvi NA, et al. Overall Survival and Long-Term Safety of Nivolumab (Anti-Programmed Death 1 Antibody, BMS-936558, ONO-4538) in Patients With Previously Treated Advanced Non-Small-Cell Lung Cancer. J Clin Oncol. 2015;33:2004-12.
33. Ilie M, Long-Mira E, Bence C, Butori C, Lassalle S, Bouhlel L, et al. Comparative study of the PD-L1 status between surgically resected specimens and matched biopsies of NSCLC patients reveal major discordances: a potential issue for anti-PD-L1 therapeutic strategies. Annals of oncology : official journal of the European Society for Medical Oncology / ESMO. 2016;27:147-53.
34. Reck M, Rodriguez-Abreu D, Robinson AG, Hui R, Csoszi T, Fulop A, et al. Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer. N Engl J Med. 2016.
35. Sundar R, Cho BC, Brahmer JR, Soo RA. Nivolumab in NSCLC: latest evidence and clinical potential. Therapeutic advances in medical oncology. 2015;7:85-96.
36. Topalian SL, Hodi FS, Brahmer JR, Gettinger SN, Smith DC, McDermott DF, et al. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer. N Engl J Med. 2012;366:2443-54.
37. Antonia S, Goldberg SB, Balmanoukian A, Chaft JE, Sanborn RE, Gupta A, et al. Safety and antitumour activity of durvalumab plus tremelimumab in non-small cell lung cancer: a multicentre, phase 1b study. The lancet oncology. 2016;17:299-308.
38. Borghaei H, Paz-Ares L, Horn L, Spigel DR, Steins M, Ready NE, et al. Nivolumab versus Docetaxel in Advanced Nonsquamous Non-Small-Cell Lung Cancer. N Engl J Med. 2015;373:1627-39.
39. Ma W, Gilligan BM, Yuan J, Li T. Current status and perspectives in translational biomarker research for PD-1/PD-L1 immune checkpoint blockade therapy. J Hematol Oncol. 2016;9:47.
40. Taube JM, Klein A, Brahmer JR, Xu H, Pan X, Kim JH, et al. Association of PD-1, PD-1 ligands, and other features of the tumor immune microenvironment with response to anti-PD-1 therapy. Clin Cancer Res. 2014;20:5064-74.
41. Herbst RS, Soria JC, Kowanetz M, Fine GD, Hamid O, Gordon MS, et al. Predictive correlates of response to the anti-PD-L1 antibody MPDL3280A in cancer patients. Nature. 2014;515:563-7.
42. Ung C, Kockx MM. Challenges & Perspectives of Immunotherapy Biomarkers & The HistoOncoImmuneTM Methodology. Expert Review of Precision Medicine and Drug Development. 2016;1:9-24.
43. Zhu P, Stanton ML, Castle EP, Joseph RW, Adams DL, Li S, et al. Detection of tumor-associated cells in cryopreserved peripheral blood mononuclear cell samples for retrospective analysis. J Transl Med. 2016;14:198.
44. Alix-Panabieres C, Pantel K. Challenges in circulating tumour cell research. Nature reviews Cancer. 2014;14:623-31.
45. Marrinucci D, Bethel K, Kolatkar A, Luttgen MS, Malchiodi M, Baehring F, et al. Fluid biopsy in patients with metastatic prostate, pancreatic and breast cancers. Phys Biol. 2012;9:016003.
46. Callahan MK, Ott PA, Odunsi K, Bertolini SV, Pan LS, Venhaus RR, et al. A phase 1 study to evaluate the safety and tolerability of MEDI4736, an anti-PD-L1 antibody, in combination with tremelimumab in patients with advanced solid tumors. ASCO Annual Meeting Proceedings; 2014. p. TPS3120.
47. Mazel M, Jacot W, Pantel K, Bartkowiak K, Topart D, Cayrefourcq L, et al. Frequent expression of PD-L1 on circulating breast cancer cells. Mol Oncol. 2015;9:1773-82.
48. Satelli A, Batth IS, Brownlee Z, Rojas C, Meng QH, Kopetz S, et al. Potential role of nuclear PD-L1 expression in cell-surface vimentin positive circulating tumor cells as a prognostic marker in cancer patients. Sci Rep. 2016;6:28910.
49. Nicolazzo C, Raimondi C, Mancini M, Caponnetto S, Gradilone A, Gandini O, et al. Monitoring PD-L1 positive circulating tumor cells in non-small cell lung cancer patients treated with the PD-1 inhibitor Nivolumab. Sci Rep. 2016;6:31726.
50. Daniel L. Adams, R. Katherine Alpaugh, Steven H. Lin, Jeffrey R. Marks, Raymond Bergan, Stuart S. Martin, Saranya Chumsri, Massimo Cristofanilli, Cha-Mei Tang, Steingrimur Stefansson, "Multiplex phenotyping of circulating cancer associated macrophage-like cells in patients with solid tumors", Proceedings of AACR, Vol. 58, April 2017. Abstract #778.
51. American Cancer Society. http://www.cancer.org/cancer/cancerbasics/lifetime-probability-of-developing-or-dying-from-cancer
52. SEER. https://seer.cancer.gov/
53. CDC. https://www.cdc.gov/nchs/fastats/leading-causes-of-death.htm
54. Burstein HJ, Krilov L, Aragon-Ching JB, Baxter† NN, Chiorean EG, Chow WN, De Groot JF, Devine SM, and more, Clinical Cancer Advances 2017: Annual Report on Progress Against Cancer From the American Society of Clinical Oncology. J. of Clinical Oncology, 2017, February 1, 35. DOI: 10.1200/JCO.2016.71.5292. http://ascopubs.org/doi/abs/10.1200/JCO.2016.71.5292
55. Yervoy (ipilimumab) FDA approval history. https://www.drugs.com/history/yervoy.html
56. Opdivo (nivolumab) FDA approval history. https://www.drugs.com/history/opdivo.html
57. Keytruda (pembrolizumab) FDA approval history. https://www.drugs.com/history/keytruda.html
58. Tecentriq (atezolizumab) FDA approval history. https://www.drugs.com/history/tecentriq.html
59. Yervoy and Opdivo combination FDA approval history. http://www.fda.gov/Drugs/InformationOnDrugs/ApprovedDrugs/ucm465274.htm
60. Adams DL "Detection and monitoring of circulating immune cells in solid tumors: shifting priorities In liquid biopsies in solid tumors" (Chapter 5), Springer, 2017.
61. El-Heliebi A, et al "Are morphological criteria sufficient for the identification of circulating tumor cells in renal cancer?" J. Trans Med. 11:214, 201362. Cima I, et al "Tumor-derived circulating endothelial cell clusters in colorectal cancer." Sci Trans Med 8(345):345ra389 2016.
Claims (34)
- 免疫チェックポイント阻害剤に対する感受性を判定する方法であって、
PD-L1発現について、癌を有する対象から単離された、癌関連マクロファージ様細胞(CAML)及び上皮間葉転換CTC(EMTCTC)をアッセイすることを含み、
CAML及びEMTCTCにPD-L1発現が検出された場合、免疫チェックポイント阻害剤に対する感受性を有すると判定する、前記方法。 - 免疫チェックポイント阻害剤に対する応答性を予測する方法であって、
PD-L1発現について、癌を有する対象から単離された、CAML及びEMTCTCをアッセイすることを含み、
CAML及びEMTCTCにPD-L1発現が検出された場合、免疫チェックポイント阻害剤に対する応答性があると予測する、前記方法。 - 癌を有する対象の治療を選択する方法であって、
PD-L1発現について、癌を有する対象から単離された、CAML及びEMTCTCをアッセイすること含み、
CAML及びEMTCTCにPD-L1発現が検出された場合、前記対象の治療として前記対象への治療有効量の免疫チェックポイント阻害剤の投与を選択する、前記方法。 - 免疫チェックポイント阻害剤治療を受ける癌を有する対象を同定するためのアッセイの方法であって、
PD-L1発現について、癌を有する対象から単離された、CAML及びEMTCTCをアッセイすること含み、
CAML及びEMTCTCにPD-L1発現が検出された場合、前記対象は、免疫チェックポイント阻害剤治療を受ける対象として同定される、前記方法。 - 前記免疫チェックポイント阻害剤は、PD-L1アンタゴニスト、PD-1アンタゴニスト、及びCTLA-4アンタゴニストのうちの1つ以上である、請求項1~4のいずれか一項に記載の方法。
- 前記免疫チェックポイント阻害剤は、PD-L1とPD-1との間の結合を阻害する、請求項1~4のいずれか一項に記載の方法。
- 前記免疫チェックポイント阻害剤は、PD-L1のその結合パートナーへの結合を阻害する、請求項1~4のいずれか一項に記載の方法。
- 前記免疫チェックポイント阻害剤は、PD-1のその結合パートナーへの結合を阻害する、請求項1~4のいずれか一項に記載の方法。
- 前記免疫チェックポイント阻害剤は、CTLA-4のその結合パートナーへの結合を阻害する、請求項1~4のいずれか一項に記載の方法。
- 前記免疫チェックポイント阻害剤は、抗体である、請求項1~4のいずれか一項に記載の方法。
- 前記免疫チェックポイント阻害剤は、モノクローナル抗体である、請求項1~4のいずれか一項に記載の方法。
- 前記免疫チェックポイント阻害剤は、ヒト抗体、ヒト化抗体、又はキメラ抗体である、請求項1~4のいずれか一項に記載の方法。
- 前記免疫チェックポイント阻害剤は、ニボルマブ(オプジーボ)、イピリムマブ(ヤーボイ)、ペムブロリズマブ(キイトルーダ)、アテゾリズマブ(テセントリク)、トレメリムマブ、及びデュルバルマブ(MED14736)のうちの1つ以上である、請求項1~4のいずれか一項に記載の方法。
- 前記PD-L1発現のアッセイは、PD-L1タンパク質発現を検出すること及びPD-L1mRNA産生を検出することのうちの1つ以上によって行われる、請求項1~4のいずれか一項に記載の方法。
- 前記PD-L1タンパク質発現は、免疫組織化学(IHC)によって検出される、請求項14に記載の方法。
- 前記IHCは、膜染色、細胞質染色、又はこれらの組み合わせによって行われる、請求項15に記載の方法。
- 前記IHCは、抗PD-L1抗体を用いて行われる、請求項15又は16に記載の方法。
- PD-L1タンパク質発現は、IHCによって低染色強度として検出される、請求項15~17のいずれか一項に記載の方法。
- PD-L1タンパク質発現は、IHCによって高染色強度として検出される、請求項15~17のいずれか一項に記載の方法。
- PD-L1タンパク質発現は、IHCによって誘導可能であるとして検出される、請求項15~17のいずれか一項に記載の方法。
- PD-L1タンパク質発現は、単離された細胞の染色として検出される、請求項15~17のいずれか一項に記載の方法。
- IHCは、PD-L1に対する結合特異性を有する1つ以上の抗体を利用する免疫蛍光(IF)染色を用いて行われる、請求項15に記載の方法。
- PD-L1への抗PD-L1抗体の結合は、前記抗PD-L1抗体にコンジュゲートされた蛍光化合物を介して検出される、請求項22に記載の方法。
- PD-L1への抗PD-L1抗体の結合は、抗PD-L1抗体に対する結合特異性を有するフルオロフォアコンジュゲート二次抗体を介して検出される、請求項22に記載の方法。
- PD-L1発現レベルが、癌に罹患していない同じ種の対象由来の間質細胞の集団内のPD-L1発現よりも大きい場合、PD-L1発現が検出される、請求項1~4のいずれか一項に記載の方法。
- EMTCTC及びCAMLは、前記癌を有する対象から得た血液から単離される、請求項1~4のいずれか一項に記載の方法。
- 前記血液は末梢血である、請求項26に記載の方法。
- 前記癌を有する対象は、標的薬剤、化学療法、又は放射線療法のうちの1つ以上を用いて治療を受けている、請求項1~4のいずれか一項に記載の方法。
- 前記癌は、固形腫瘍である、請求項1~4のいずれか一項に記載の方法。
- 前記固形腫瘍は、ステージI、ステージII、ステージIII、又はステージIVの癌である、請求項29に記載の方法。
- 前記固形腫瘍は、癌腫、肉腫、神経芽細胞腫、又はメラノーマである、請求項29に記載の方法。
- 前記癌は、肺癌、乳癌、前立腺癌、膵臓癌、メラノーマ、膀胱癌、腎臓癌、頭頸部癌、大腸癌、肝臓癌、卵巣癌、神経芽細胞腫、肉腫、骨肉腫、食道癌、脳及びその他神経系癌、喉頭癌、気管支癌、口腔及び咽頭癌、胃癌、精巣癌、甲状腺癌、子宮頸癌、又は子宮体癌の1つ以上である、請求項1~4のいずれか一項に記載の方法。
- 前記肺癌は、非小細胞肺癌(NSCLC)である、請求項32に記載の方法。
- EMTCTC又はCAMLの少なくとも1つは、少なくとも1つのRAD50巣を示す、請求項1~4のいずれか一項に記載の方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662322570P | 2016-04-14 | 2016-04-14 | |
| US62/322,570 | 2016-04-14 | ||
| PCT/US2017/027714 WO2017181073A1 (en) | 2016-04-14 | 2017-04-14 | Methods of using pd-l1 expression in treatment decisions for cancer therapy |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2019514028A JP2019514028A (ja) | 2019-05-30 |
| JP2019514028A5 JP2019514028A5 (ja) | 2020-05-21 |
| JP7128399B2 true JP7128399B2 (ja) | 2022-08-31 |
Family
ID=60042267
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019505328A Active JP7128399B2 (ja) | 2016-04-14 | 2017-04-14 | 癌治療のための治療決定におけるpd-l1発現の使用方法 |
Country Status (9)
| Country | Link |
|---|---|
| US (2) | US11353459B2 (ja) |
| EP (1) | EP3443013B1 (ja) |
| JP (1) | JP7128399B2 (ja) |
| KR (2) | KR102436984B1 (ja) |
| CN (1) | CN109311989A (ja) |
| AU (1) | AU2017250284C1 (ja) |
| CA (1) | CA3020854A1 (ja) |
| ES (1) | ES3014978T3 (ja) |
| WO (1) | WO2017181073A1 (ja) |
Families Citing this family (31)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2015306692B2 (en) * | 2014-08-25 | 2021-07-22 | Creatv Microtech, Inc. | Use of circulating cell biomarkers in the blood for detection and diagnosis of diseases and methods of isolating them |
| WO2017106332A1 (en) | 2015-12-14 | 2017-06-22 | X4 Pharmaceuticals, Inc. | Methods for treating cancer |
| US10953003B2 (en) | 2015-12-14 | 2021-03-23 | X4 Pharmaceuticals, Inc. | Methods for treating cancer |
| WO2017112894A1 (en) | 2015-12-22 | 2017-06-29 | X4 Pharmaceuticals, Inc. | Methods for treating immunodeficiency disease |
| US11337969B2 (en) | 2016-04-08 | 2022-05-24 | X4 Pharmaceuticals, Inc. | Methods for treating cancer |
| JP7128399B2 (ja) * | 2016-04-14 | 2022-08-31 | クリエイティブ マイクロテック インコーポレーテッド | 癌治療のための治療決定におけるpd-l1発現の使用方法 |
| CA3027498A1 (en) | 2016-06-21 | 2017-12-28 | X4 Pharmaceuticals, Inc. | Cxcr4 inhibitors and uses thereof |
| CA3027495A1 (en) | 2016-06-21 | 2017-12-28 | X4 Pharmaceuticals, Inc. | Cxcr4 inhibitors and uses thereof |
| WO2017223243A1 (en) | 2016-06-21 | 2017-12-28 | X4 Pharmaceuticals, Inc. | Cxcr4 inhibitors and uses thereof |
| WO2018089518A1 (en) * | 2016-11-08 | 2018-05-17 | Dana-Farber Cancer Institute, Inc. | Compositions and methods of modulating anti-tumor immunity |
| JP7300394B2 (ja) | 2017-01-17 | 2023-06-29 | ヘパリジェニックス ゲーエムベーハー | 肝再生の促進又は肝細胞死の低減もしくは予防のためのプロテインキナーゼ阻害 |
| CA3080821A1 (en) * | 2017-11-07 | 2019-05-16 | X4 Pharmaceuticals, Inc. | Cancer biomarkers and methods of use thereof |
| WO2019178226A1 (en) * | 2018-03-13 | 2019-09-19 | Creatv Microtech, Inc. | Methods for monitoring treatment response and disease progression in subjects using circulating cells |
| WO2019213509A1 (en) * | 2018-05-03 | 2019-11-07 | Rutgers, The State University Of New Jersey | Compositions and methods for treating cancer |
| US10548889B1 (en) | 2018-08-31 | 2020-02-04 | X4 Pharmaceuticals, Inc. | Compositions of CXCR4 inhibitors and methods of preparation and use |
| CN112789684B (zh) * | 2018-10-01 | 2025-05-09 | 文塔纳医疗系统公司 | 用于预测对pd-1轴导向疗法的应答的方法和系统 |
| WO2020246846A1 (ko) * | 2019-06-05 | 2020-12-10 | 연세대학교 산학협력단 | Tox에 기초한 면역 항암 요법에 대한 치료 반응 예측 방법 |
| CN110687281B (zh) * | 2019-08-26 | 2023-05-23 | 中国医学科学院肿瘤医院 | Pd-l1自身抗体在肿瘤预后评估中的应用 |
| KR102325962B1 (ko) * | 2019-10-28 | 2021-11-12 | 경북대학교 산학협력단 | 칼슘 채널 차단제에 의한 엑소좀 분비 억제 또는 pd-l1 발현 억제 용도 |
| JP2023517956A (ja) | 2020-03-10 | 2023-04-27 | エックス4 ファーマシューティカルズ, インコーポレイテッド | 好中球減少症を処置する方法 |
| JP7593584B2 (ja) * | 2020-03-10 | 2024-12-03 | 学校法人杏林学園 | 腫瘍細胞マーカー、および腫瘍細胞を検出または回収する方法 |
| CN111521792A (zh) * | 2020-04-21 | 2020-08-11 | 山东第一医科大学(山东省医学科学院) | 检测非小细胞肺癌患者外周血循环肿瘤细胞pd-l1基因突变的免疫荧光试剂盒及方法 |
| CN111686111B (zh) * | 2020-06-09 | 2023-06-13 | 南方医科大学 | Malt1蛋白酶抑制剂在制备非小细胞肺癌治疗药物中的应用 |
| CN112014564B (zh) * | 2020-09-07 | 2023-03-21 | 中南大学湘雅医院 | p62/SQSTM1在制备PD-L1/PD-1单抗肿瘤免疫治疗药物中的应用 |
| CN112194723B (zh) * | 2020-09-25 | 2021-09-21 | 广州百吉生物制药有限公司 | 一种免疫细胞在治疗癌症中应用 |
| KR102745783B1 (ko) * | 2021-04-09 | 2024-12-24 | 주식회사 싸이토젠 | 면역관문억제제를 이용한 암 치료방법 |
| KR20240033068A (ko) * | 2021-07-21 | 2024-03-12 | 크리에티브이 마이크로테크, 인크. | 순환성 암 관련 대식세포 유사 세포(caml)의 변화를 이용한 암 치료 반응의 예측 및/또는 모니터링 방법 |
| KR20230125672A (ko) * | 2022-02-21 | 2023-08-29 | 사회복지법인 삼성생명공익재단 | 암 환자에 대한 면역관문억제제의 반응성 예측용 조성물 |
| JP2025513724A (ja) * | 2022-03-31 | 2025-04-30 | ヴェンタナ メディカル システムズ, インク. | ミスマッチ修復が欠損した結腸直腸腫瘍におけるpd-1軸指向治療薬に対する応答を予測するための方法およびシステム |
| KR20230151916A (ko) * | 2022-04-25 | 2023-11-02 | 웰마커바이오 주식회사 | 항-igsf1 항체에 대한 암 환자의 감수성 예측용 바이오마커 조성물 및 이를 이용하는 방법 |
| WO2024250002A1 (en) * | 2023-06-02 | 2024-12-05 | Creatv Microtech, Inc. | Methods for predicting progression free survival and overall survival in subjects having cancer using tumor macrophage hybrid cells |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2016033103A1 (en) | 2014-08-25 | 2016-03-03 | Creatv Microtech, Inc. | Use of circulating cell biomarkers in the blood for detection and diagnosis of diseases and methods of isolating them |
| WO2016061064A1 (en) | 2014-10-15 | 2016-04-21 | Epic Sciences, Inc. | Circulating tumor cell diagnostics for therapy targeting pd-l1 |
| WO2016121574A1 (ja) | 2015-01-29 | 2016-08-04 | コニカミノルタ株式会社 | 相互作用する分子を有する血中細胞の同時検出方法 |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2589418A1 (en) | 1999-08-24 | 2001-03-01 | Medarex, Inc. | Human ctla-4 antibodies and their uses |
| CN102264762B (zh) * | 2008-09-26 | 2018-03-27 | 达纳-法伯癌症研究公司 | 人抗pd‑1、pd‑l1和pd‑l2的抗体及其应用 |
| EP2785375B1 (en) * | 2011-11-28 | 2020-07-22 | Merck Patent GmbH | Anti-pd-l1 antibodies and uses thereof |
| CA3213528A1 (en) * | 2012-05-15 | 2013-11-21 | Bristol-Myers Squibb Company | Cancer immunotherapy by disrupting pd-1/pd-l1 signaling |
| WO2013181532A1 (en) * | 2012-06-01 | 2013-12-05 | Creatv Microtech, Inc. | Capture, identification and use of a new biomarker of solid tumors in body fluids |
| AR095363A1 (es) * | 2013-03-15 | 2015-10-14 | Genentech Inc | Biomarcadores y métodos para el tratamiento de condiciones relacionadas con pd-1 y pd-l1 |
| WO2014165422A1 (en) * | 2013-04-02 | 2014-10-09 | Merck Sharp & Dohme Corp. | Immunohistochemical assay for detecting expression of programmed death ligand 1 (pd-l1) in tumor tissue |
| JOP20200094A1 (ar) * | 2014-01-24 | 2017-06-16 | Dana Farber Cancer Inst Inc | جزيئات جسم مضاد لـ pd-1 واستخداماتها |
| WO2016172624A1 (en) * | 2015-04-22 | 2016-10-27 | Agenus Inc. | Methods for treating cancer |
| JP7128399B2 (ja) * | 2016-04-14 | 2022-08-31 | クリエイティブ マイクロテック インコーポレーテッド | 癌治療のための治療決定におけるpd-l1発現の使用方法 |
-
2017
- 2017-04-14 JP JP2019505328A patent/JP7128399B2/ja active Active
- 2017-04-14 KR KR1020187032222A patent/KR102436984B1/ko active Active
- 2017-04-14 CN CN201780034556.4A patent/CN109311989A/zh active Pending
- 2017-04-14 WO PCT/US2017/027714 patent/WO2017181073A1/en not_active Ceased
- 2017-04-14 AU AU2017250284A patent/AU2017250284C1/en active Active
- 2017-04-14 ES ES17783284T patent/ES3014978T3/es active Active
- 2017-04-14 EP EP17783284.7A patent/EP3443013B1/en active Active
- 2017-04-14 US US16/092,998 patent/US11353459B2/en active Active
- 2017-04-14 CA CA3020854A patent/CA3020854A1/en active Pending
- 2017-04-14 KR KR1020227029136A patent/KR102548385B1/ko active Active
-
2022
- 2022-04-26 US US17/729,208 patent/US12480952B2/en active Active
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2016033103A1 (en) | 2014-08-25 | 2016-03-03 | Creatv Microtech, Inc. | Use of circulating cell biomarkers in the blood for detection and diagnosis of diseases and methods of isolating them |
| WO2016061064A1 (en) | 2014-10-15 | 2016-04-21 | Epic Sciences, Inc. | Circulating tumor cell diagnostics for therapy targeting pd-l1 |
| WO2016121574A1 (ja) | 2015-01-29 | 2016-08-04 | コニカミノルタ株式会社 | 相互作用する分子を有する血中細胞の同時検出方法 |
Non-Patent Citations (3)
| Title |
|---|
| Chiara Nicolazzo et al.,Scientific Rreports,Vol.6:31726,2016年08月,pp.1-7,doi: 10.1038/srep31726 |
| Martine Mazela et al.,Molecular Oncology,2015年,Vol.9,pp.1773-1782 |
| Rachel Krupa et al.,Journal of Thoracic Oncology,2016年02月,Vol.11, No.2 Supplement,S52 |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2017181073A1 (en) | 2017-10-19 |
| CN109311989A (zh) | 2019-02-05 |
| AU2017250284A1 (en) | 2018-11-08 |
| AU2017250284C1 (en) | 2024-06-20 |
| KR102436984B1 (ko) | 2022-08-26 |
| CA3020854A1 (en) | 2017-10-19 |
| KR20180133465A (ko) | 2018-12-14 |
| KR102548385B1 (ko) | 2023-06-28 |
| US11353459B2 (en) | 2022-06-07 |
| US20220252605A1 (en) | 2022-08-11 |
| JP2019514028A (ja) | 2019-05-30 |
| AU2017250284B2 (en) | 2023-12-21 |
| EP3443013A1 (en) | 2019-02-20 |
| EP3443013A4 (en) | 2019-11-20 |
| ES3014978T3 (en) | 2025-04-28 |
| EP3443013B1 (en) | 2025-01-22 |
| US12480952B2 (en) | 2025-11-25 |
| EP3443013C0 (en) | 2025-01-22 |
| US20190128892A1 (en) | 2019-05-02 |
| KR20220123475A (ko) | 2022-09-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US12480952B2 (en) | Methods of using PD-L1 expression in treatment decisions for cancer therapy | |
| JP2019514028A5 (ja) | ||
| US12049503B2 (en) | Treatment of LAG-3 positive tumors | |
| JP7495886B2 (ja) | 多発性骨髄腫を治療すること及び4-(4-(4-(((2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-4-イル)オキシ)メチル)ベンジル)ピペラジン-1-イル)-3-フルオロベンゾニトリルのバイオマーカーの使用 | |
| WO2015088930A1 (en) | Immunohistochemical proximity assay for pd-1 positive cells and pd-ligand positive cells in tumor tissue | |
| US20170261507A1 (en) | Methods for Predicting and Monitoring Cancer Patients' Response to Teatment by Measuring Myeloid Derived Suppressor Cells (MDSCs) | |
| ES2837155T3 (es) | Uso de PD-1 y Tim-3 como medida de células CD8+ para predecir y tratar el carcinoma de células renales | |
| Patel et al. | Progress in personalized immunotherapy for patients with brain metastasis | |
| CN119291200A (zh) | 一种用于检测cxcr4+cd8+t细胞用于预测肿瘤免疫治疗的检测试剂盒 | |
| KR20250053141A (ko) | 순환 기질세포의 세포외 소포 및 미세핵의 임상 결과 예측을 위한 범암적 바이오마커로서의 용도 | |
| JP2024529385A (ja) | 循環癌関連マクロファージ様細胞(caml)の変化を用いて癌治療反応を予測及び/又はモニタリングする方法 | |
| JP2021038270A (ja) | グリオーマの予後、遠隔部再発リスク及び浸潤を判定する方法及びキット並びにグリオーマを処置するための医薬組成物 | |
| JP6195716B2 (ja) | 抗癌剤耐性診断マーカー | |
| WO2024249993A1 (en) | Methods of using beta-2 adrenergic receptor expression in treatment decisions for cancer therapy | |
| WO2024211413A2 (en) | Trogocytosis in cancer cells and methods for treating cancer related thereto |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200410 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20200410 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20210322 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210330 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20210630 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210716 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20211130 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220228 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20220628 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20220726 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7128399 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |