JP6979968B2 - 環縮合チアゾリノ2−ピリドン類、その製造方法並びに結核の処置及び/又は予防におけるそれらの使用 - Google Patents
環縮合チアゾリノ2−ピリドン類、その製造方法並びに結核の処置及び/又は予防におけるそれらの使用 Download PDFInfo
- Publication number
- JP6979968B2 JP6979968B2 JP2018552820A JP2018552820A JP6979968B2 JP 6979968 B2 JP6979968 B2 JP 6979968B2 JP 2018552820 A JP2018552820 A JP 2018552820A JP 2018552820 A JP2018552820 A JP 2018552820A JP 6979968 B2 JP6979968 B2 JP 6979968B2
- Authority
- JP
- Japan
- Prior art keywords
- methyl
- aza
- oxo
- cyclopropyl
- thia
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 0 *CC(C(*)=C1N2C(*)C(*)*1)=C(*)C2=O Chemical compound *CC(C(*)=C1N2C(*)C(*)*1)=C(*)C2=O 0.000 description 13
- WUBBRNOQWQTFEX-UHFFFAOYSA-N Nc1ccc(C(O)=O)c(O)c1 Chemical compound Nc1ccc(C(O)=O)c(O)c1 WUBBRNOQWQTFEX-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/4353—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems
- A61K31/4365—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems the heterocyclic ring system having sulfur as a ring hetero atom, e.g. ticlopidine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/4353—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems
- A61K31/437—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems the heterocyclic ring system containing a five-membered ring having nitrogen as a ring hetero atom, e.g. indolizine, beta-carboline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4409—Non condensed pyridines; Hydrogenated derivatives thereof only substituted in position 4, e.g. isoniazid, iproniazid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4427—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems
- A61K31/444—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems containing a six-membered ring with nitrogen as a ring heteroatom, e.g. amrinone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/69—Boron compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
- A61P31/06—Antibacterial agents for tuberculosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Pulmonology (AREA)
- Communicable Diseases (AREA)
- Oncology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Description
本開示は、環縮合チアゾリノ2−ピリドン類、このような化合物を製造するための方法、結核感染を処置及び/又は予防する際のそれらの使用、それらの治療上の使用のための方法、並びにいずれかのこのような化合物を含有する医薬組成物に関する。詳細には、本開示は、結核に対する薬物と組み合わせた上記環縮合チアゾリノ2−ピリドン類、結核感染を処置及び/又は予防する際のこのような組み合わせの使用、その治療上の使用のための方法並びにいずれかの上記組み合わせを含有する医薬組成物に関する。
本開示は:
(i) 結核に対する薬物、
又はその薬学的に許容しうる塩;及び
(ii) 式II
を含む組み合わせを提供し、
式中、
R1は:
a) C(O)OH、
b) テトラゾリル、
c) CH2OH、
d) C(O)NR6aR6b、
e) C(O)NHSO2R7、
f) C(O)OR8、
g) NH2、
h) H、
i)
k)
a) H、
b) Cl、F、Br又はI、
c) CH2OH、
d) C1−C4アルキル、及び
e) NY1Y2
からなる群より選択され、
R3は:
a) メチル、フルオロ、クロロ、ブロモ、シアノ及びメトキシからなる群より選択される0、1、2又は3つの置換基でそれぞれ独立して置換された、1−ナフチル、2−ナフチル又は1−ナフチルオキシ、
b) メチル、フルオロ、クロロ、シアノ及びトリフルオロメチルからなる群より独立して選択される0、1、2又は3つの置換基で置換されたフェニル、
c) メチル、フルオロ、クロロ及びトリフルオロメチルからなる群より独立して選択される0、1、2又は3つの置換基で置換されたアミノフェニル
d) 2−(3−メチル)フェニルメチレン、
e) ベンゾチオフェン−2−イル、
f) H又はC1−C4−アルキル、
g) 2−メチル−1−アザ−2−ボラ−1H−ナフタ−5−イルオキシ、
h) 2−メチル−1−アザ−2−ボラ−1H−ナフタ−5−イル、
i) 2−メチル−1−アザ−2−ボラ−1H−ナフタ−8−イルオキシ、及び
j) 2−メチル−1−アザ−2−ボラ−1H−ナフタ−8−イル
からなる群より選択され、
R4は:
a) 0、1、2、3又は4つのフルオロで置換されたC1−C4アルキル;
b) C3−C6シクロアルキル、
c) 0、1、2、3又は4つのフルオロで置換されたC1−C4アルコキシ、
d) C3−C6シクロアルコキシ、
e) 3員、4員、5員又は6員複素環、
f) N−メチル3−インドリル、及び
h) NR9R10、
からなる群より選択され、
R5は:
a) H、
b) 0、1、2又は3つのメチル基で置換されたフェニル、
c) ベンジル、
d) チエニル、
e) C1−C4アルコキシ、及び
f) 3員、4員、5員又は6員複素環
からなる群より選択される。
COO−、
C(O)N−SO2R7から選択され、そして
ここで
R2、R3、R4、R5及びR7は式IIについて記載されたとおりであり得る]
の化合物又はその薬学的に許容しうる塩が提供される。
本開示は:
(i) 結核に対する薬物、
又はその薬学的に許容しうる塩;及び
(ii) 式II
を含む組み合わせを提供し、
式中、
R1は:
a) C(O)OH、
b) テトラゾリル、
c) CH2OH、
d) C(O)NR6aR6b、
e) C(O)NHSO2R7、
f) C(O)OR8、
g) NH2、
h) H、
i)
k)
a) H、
b) Cl、F、Br又はI、
c) CH2OH、
d) C1−C4アルキル、及び
e) NY1Y2
からなる群より選択され、
R3は:
a) メチル、フルオロ、クロロ、ブロモ、シアノ及びメトキシからなる群より選択される0、1、2又は3つの置換基でそれぞれ独立して置換された、1−ナフチル、2−ナフチル又は1−ナフチルオキシ、
b) メチル、フルオロ、クロロ、シアノ及びトリフルオロメチルからなる群より独立して選択される0、1、2又は3つの置換基で置換されたフェニル、
c) メチル、フルオロ、クロロ及びトリフルオロメチルからなる群より独立して選択される0、1、2又は3つの置換基で置換されたアミノフェニル、
d) 2−(3−メチル)フェニルメチレン、
e) ベンゾチオフェン−2−イル、
f) H又はC1−C4−アルキル、
i) 2−メチル−1−アザ−2−ボラ−1H−ナフタ−5−イルオキシ、及び
j) 2−メチル−1−アザ−2−ボラ−1H−ナフタ−5−イル
からなる群より選択され、
R4は:
a) 0、1、2、3又は4つのフルオロで置換されたC1−C4アルキル、
b) C3−C6シクロアルキル、
c) 0、1、2、3又は4つのフルオロで置換されたC1−C4アルコキシ、
d) C3−C6シクロアルコキシ、
e) 3員、4員、5員又は6員複素環、
f) N−メチル3−インドリル、及び
h) NR9R10
からなる群より選択され、
R5は:
a) H、
b) 0、1、2又は3つのメチル基で置換されたフェニル、
c) ベンジル、
d) チエニル、
e) C1−C4アルコキシ、及び
f) 3員、4員、5員又は6員複素環
からなる群より選択される。
R9bはC1−C4アルキルを表し、
R10はC1−C4アルキルを表し、又は
R9及びR10は一緒にCH2(CH2)mCH2を形成する。
アミノグリコシド類、例えばアミカシン又はカナマイシン、
ポリペプチド類、例えばカプレオマイシン、バイオマイシン、エンビオマイシン、
フルオロキノロン類、例えばシプロフロキサシン(CIP)、レボフロキサシン、モキシフロキサシン(MXF);
チオアミド類、例えばエチオナミド、プロチオナミド、
サイクロセリン、
テリジドン。
リファブチン、
マクロライド類、例えばクラリトロマイシン(chlaritromycin)(CLLR)、
リネゾリド (LZD)、
チオリダジン;
アルギニン、
ビタミンD、
ベダキリン、
プレトマニド、
デラマニド。
(i) 式I
又はその薬学的に許容しうる塩、及び
(ii) 式II
を含む組み合わせが提供され、
式中、
R1は:
a) C(O)OH、
b) テトラゾリル、
c) CH2OH、
d) C(O)NR6aR6b、
e) C(O)NHSO2R7、
f) C(O)OR8、
g) NH2、
h) H、
i)
k)
a) H、
b) Cl、F、Br又はI、及び
c) CH2OH、
からなる群より選択され、
R3は:
a) メチル、フルオロ、クロロ、ブロモ、シアノ及びメトキシからなる群より選択される0、1、2又は3つの置換基でそれぞれ独立して置換された、1−ナフチル、2−ナフチル又は1−ナフチルオキシ、
b) メチル、フルオロ、クロロ、シアノ及びトリフルオロメチルからなる群より独立して選択される0、1、2又は3つの置換基で置換されたフェニル、
c) メチル、フルオロ、クロロ及びトリフルオロメチルからなる群より独立して選択される0、1、2又は3つの置換基で置換されたアミノフェニル、
d) 2−(3−メチル)フェニルメチレン、
e) ベンゾチオフェン−2−イル、
f) H又はC1−C4−アルキル、
i) 2−メチル−1−アザ−2−ボラ−1H−ナフタ−5−イルオキシ、及び
j) 2−メチル−1−アザ−2−ボラ−1H−ナフタ−5−イル
からなる群より選択され
R4は:
a) 0、1、2、3又は4つのフルオロで置換されたC1−C4アルキル;
b) C3−C6シクロアルキル、
c) 0、1、2、3又は4つのフルオロで置換されたC1−C4アルコキシ、
d) C3−C6シクロアルコキシ、
e) 2−チエニル、
f) N−メチル3−インドリル、及び
h) NR9R10
からなる群より選択され、
R5は:
a) H、
b) 0、1、2又は3つのメチル基で置換されたフェニル、
c) ベンジル、
d) チエニル、
e) C1−C4アルコキシ、及び
f) 1−トリアゾリル
からなる群より選択され
R1、R2、R3、R4、R5、m及びXのさらなる値は以下に続く。当然のことながら、これらの値は本開示の式IIのいずれの化合物にも適用され得る。
a) メチル、フルオロ、クロロ、シアノ及びメトキシからなる群より選択される0、1、2又は3つの置換基でそれぞれ独立して置換された、1−ナフチル、2−ナフチル又は1−ナフチルオキシ、並びに
b) メチル、フルオロ、クロロ、シアノ及びトリフルオロメチルからなる群より独立して選択される0、1、2又は3つの置換基で独立して置換されたフェニル
からなる群より選択され得る。
1−ナフチル、2−ナフチル、4−メチル−1−ナフチル、4−フルオロ−1−ナフチル、4−ブロモ−1−ナフチル、4−メトキシ−1−ナフチル、2−メトキシ−1−ナフチル、2−メトキシ−1−ナフチル、1−ナフチルオキシ、3−メチルフェニル、2,3−ジメチルフェニル、2−フルオロ−5−メチルフェニル、2,3−ジクロロフェニル、2−(3−メチル)フェニルメチレン;2,3−キシリルアミン、3−トリフルオロメチルフェニル及びベンゾチオフェン−2−イル
からなる群より選択され得る。
a) メチル、フルオロ、クロロ、シアノ及びメトキシからなる群より選択される0、1、2又は3つの置換基でそれぞれ置換された、1−ナフチル、2−ナフチル又は1−ナフチルオキシ
からなる群より選択され得る。例えば、R3は1−ナフチルであり得る。
(i) イソニコチニルヒドラジドもしくはベダキリンのような結核に対する薬物、又はその薬学的に許容しうる塩を含むか又はそれからなる組成物、及び
(ii) 本明細書に記載される式IIの化合物、その薬学的に許容しうる塩を含むか又はそれからなる組成物
を含む組み合わせをさらに提供する。
(i) イソニコチニルヒドラジドもしくはベダキリンのような結核に対する薬物、又はその薬学的に許容しうる塩を含むか又はそれからなる組成物、及び
(ii) 本明細書に記載される式IIの化合物、又はその薬学的に許容しうる塩を含むか又はそれからなる組成物
を含むキットオブパーツが提供され得る。
(i) イソニコチニルヒドラジド又はベダキリンのような結核に対する薬物、又はその薬学的に許容しうる塩、及び
(ii) 本明細書に記載される式IIの化合物、又はその薬学的に許容しうる塩
を含む単一の組成物として提供され得る。
(3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−4−オキソ−6−{(7−チアビシクロ[4.3.0]ノナ−1,3,5,8−テトラエン−8−イル)メチル}−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−[(4−フルオロ−1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−[(4−メチル−1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3S)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
5−シクロプロピル−4−[(1−ナフチル)メチル]−2−オキソ−8−(3−チエニル)−7−チア−1−アザビシクロ[4.3.0]ノナ−3,5,8−トリエン−9−カルボン酸
(3R)−7−シクロプロピル−6−[(1−ナフチルオキシ)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−[(2−フルオロ−5−メチル−フェニル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−4−オキソ−6−[(2,3−キシリル)メチル]−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−メチル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(N−メチルメトキシアミノ){(3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダニル}ホルムアルデヒド
(3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−3−(1H−1,2,3,4−テトラゾール−5−イル)−1−チア−3a−アザ−4−インダノン
5−シクロプロピル−4−[(1−ナフチル)メチル]−2−オキソ−8−フェニル−7−チア−1−アザビシクロ[4.3.0]ノナ−3,5,8−トリエン−9−カルボン酸5−シクロプロピル−4−[(1−ナフチル)メチル]−2−オキソ−8−(m−トリル)−7−チア−1−アザビシクロ[4.3.0]ノナ−3,5,8−トリエン−9−カルボン酸
(3R)−7−シクロプロピル−6−[(2−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−3−(ヒドロキシメチル)−6−[(1−ナフチル)メチル]−1−チア−3a−アザ−4−インダノン
(3R)−6−[(1−ナフチル)メチル]−4−オキソ−7−(2−チエニル)−1−チア−3a−アザ−3−インダンカルボン酸
5−シクロプロピル−4−[(1−ナフチル)メチル]−2−オキソ−8−(1H−1,2,3−トリアゾール−4−イル)−7−チア−1−アザビシクロ[4.3.0]ノナ−3,5,8−トリエン−9−カルボン酸
8−ベンジル−5−シクロプロピル−4−[(1−ナフチル)メチル]−2−オキソ−7−チア−1−アザビシクロ[4.3.0]ノナ−3,5,8−トリエン−9−カルボン酸(3R)−7−シクロプロピル−6−[(2,3−ジクロロフェニル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボキサミド
{(3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダニル}(フェニルスルホニルアミノ)ホルムアルデヒド
(3R)−7−イソプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−メチル−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−6−[(p−クロロフェニル)メチル]−7−シクロプロピル−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
{(3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダニル}(メチルスルホニルアミノ)ホルムアルデヒド
(3R)−7−シクロプロピル−4−オキソ−6−[(m−トリル)メチル]−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−イソプロピル−4−オキソ−6−[2−(m−トリル)エチル]−1−チア−3a−アザ−3−インダンカルボン酸
7−(1−メチル−1H−インドール−3−イル)−6−[(1−ナフチルオキシ)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−6−[(4−ブロモ−1−ナフチル)メチル]−7−シクロプロピル−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(1−ナフチル)メチル]−1−チア−3a−アザ−4−インダノン
(3R)−7−シクロプロピル−5−(ヒドロキシメチル)−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3S)−3−アミノ−7−シクロプロピル−6−[(1−ナフチル)メチル]−1−チア−3a−アザ−4−インダノン
(2R,3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−2−フェニル−1−チア−3a−アザ−3−インダンカルボン酸
(2S,3R)−7−シクロプロピル−2−メトキシ−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−4−オキソ−6−{[m−(トリフルオロメチル)フェニル]メチル}−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸2−{2−[1−(ヒドロキシメチル)プロピルアミノ]エチルアミノ}ブチル
{7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダニル}(2−イソニコチノイルヒドラジノ)ホルムアルデヒド
7−シクロプロピル−6−[(4−メトキシ−1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−(ジメチルアミノ)−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−5−ブロモ−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(1−ナフチル)メチル]−1,1−ジオキソ−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−4−オキソ−6−[(2,3−キシリジノ)メチル]−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(1−ナフチル)メチル]−1−オキソ−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−エトキシ−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−6−[(1−ナフチル)メチル]−4−オキソ−7−(トリフルオロメチル)−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−イソブトキシ−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−[(2−メトキシ−1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−(シクロプロピルメトキシ)−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(2−メチル−1−アザ−2−ボラ−1H−ナフタ−5−イル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(2−メチル−1−アザ−2−ボラ−1H−ナフタ−5−イルオキシ)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(2−メチル−1−アザ−2−ボラ−1H−ナフタ−8−イル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(2−メチル−1−アザ−2−ボラ−1H−ナフタ−8−イルオキシ)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
又は上記化合物のいずれかの薬学的に許容しうる塩。
(3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−4−オキソ−6−{(7−チアビシクロ[4.3.0]ノナ−1,3,5,8−テトラエン−8−イル)メチル}−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−[(4−フルオロ−1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−[(4−メチル−1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3S)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−[(1−ナフチルオキシ)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−[(2−フルオロ−5−メチル−フェニル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−4−オキソ−6−[(2,3−キシリル)メチル]−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−メチル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(N−メチルメトキシアミノ){(3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダニル}ホルムアルデヒド
(3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−3−(1H−1,2,3,4−テトラゾール−5−イル)−1−チア−3a−アザ−4−インダノン
(3R)−7−シクロプロピル−6−[(2−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−3−(ヒドロキシメチル)−6−[(1−ナフチル)メチル]−1−チア−3a−アザ−4−インダノン
(3R)−6−[(1−ナフチル)メチル]−4−オキソ−7−(2−チエニル)−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−[(2,3−ジクロロフェニル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボキサミド
{(3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダニル}(フェニルスルホニルアミノ)ホルムアルデヒド
(3R)−7−イソプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−メチル−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−6−[(p−クロロフェニル)メチル]−7−シクロプロピル−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
{(3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダニル}(メチルスルホニルアミノ)ホルムアルデヒド
(3R)−7−シクロプロピル−4−オキソ−6−[(m−トリル)メチル]−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−イソプロピル−4−オキソ−6−[2−(m−トリル)エチル]−1−チア−3a−アザ−3−インダンカルボン酸
7−(1−メチル−1H−インドール−3−イル)−6−[(1−ナフチルオキシ)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−6−[(4−ブロモ−1−ナフチル)メチル]−7−シクロプロピル−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(1−ナフチル)メチル]−1−チア−3a−アザ−4−インダノン
(3R)−7−シクロプロピル−5−(ヒドロキシメチル)−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3S)−3−アミノ−7−シクロプロピル−6−[(1−ナフチル)メチル]−1−チア−3a−アザ−4−インダノン
(2R,3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−2−フェニル−1−チア−3a−アザ−3−インダンカルボン酸
(2S,3R)−7−シクロプロピル−2−メトキシ−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−4−オキソ−6−{[m−(トリフルオロメチル)フェニル]メチル}−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸2−{2−[1−(ヒドロキシメチル)プロピルアミノ]エチルアミノ}ブチル
{7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダニル}(2−イソニコチノイルヒドラジノ)ホルムアルデヒド
7−シクロプロピル−6−[(4−メトキシ−1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−(ジメチルアミノ)−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−5−ブロモ−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(1−ナフチル)メチル]−1,1−ジオキソ−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−4−オキソ−6−[(2,3−キシリジノ)メチル]−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(1−ナフチル)メチル]−1−オキソ−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−エトキシ−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−6−[(1−ナフチル)メチル]−4−オキソ−7−(トリフルオロメチル)−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−イソブトキシ−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−[(2−メトキシ−1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−(シクロプロピルメトキシ)−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(2−メチル−1−アザ−2−ボラ−1H−ナフタ−5−イル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(2−メチル−1−アザ−2−ボラ−1H−ナフタ−5−イルオキシ)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(2−メチル−1−アザ−2−ボラ−1H−ナフタ−8−イル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(2−メチル−1−アザ−2−ボラ−1H−ナフタ−8−イルオキシ)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
又は上記化合物のいずれかの薬学的に許容しうる塩。
5−シクロプロピル−4−[(1−ナフチル)メチル]−2−オキソ−8−(3−チエニル)−7−チア−1−アザビシクロ[4.3.0]ノナ−3,5,8−トリエン−9−カルボン酸
5−シクロプロピル−4−[(1−ナフチル)メチル]−2−オキソ−8−フェニル−7−チア−1−アザビシクロ[4.3.0]ノナ−3,5,8−トリエン−9−カルボン酸5−シクロプロピル−4−[(1−ナフチル)メチル]−2−オキソ−8−(m−トリル)−7−チア−1−アザビシクロ[4.3.0]ノナ−3,5,8−トリエン−9−カルボン酸
5−シクロプロピル−4−[(1−ナフチル)メチル]−2−オキソ−8−(1H−1,2,3−トリアゾール−4−イル)−7−チア−1−アザビシクロ[4.3.0]ノナ−3,5,8−トリエン−9−カルボン酸
8−ベンジル−5−シクロプロピル−4−[(1−ナフチル)メチル]−2−オキソ−7−チア−1−アザビシクロ[4.3.0]ノナ−3,5,8−トリエン−9−カルボン酸又は上記化合物のいずれかの薬学的に許容しうる塩
の少なくとも1つから選択される式IIの化合物を含み得る。
(3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−4−オキソ−6−{(7−チアビシクロ[4.3.0]ノナ−1,3,5,8−テトラエン−8−イル)メチル}−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−[(4−フルオロ−1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−[(4−メチル−1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3S)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
5−シクロプロピル−4−[(1−ナフチル)メチル]−2−オキソ−8−(3−チエニル)−7−チア−1−アザビシクロ[4.3.0]ノナ−3,5,8−トリエン−9−カルボン酸
(3R)−7−シクロプロピル−6−[(1−ナフチルオキシ)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−[(2−フルオロ−5−メチル−フェニル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−4−オキソ−6−[(2,3−キシリル)メチル]−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−メチル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(N−メチルメトキシアミノ){(3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダニル}ホルムアルデヒド
(3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−3−(1H−1,2,3,4−テトラゾール−5−イル)−1−チア−3a−アザ−4−インダノン
5−シクロプロピル−4−[(1−ナフチル)メチル]−2−オキソ−8−フェニル−7−チア−1−アザビシクロ[4.3.0]ノナ−3,5,8−トリエン−9−カルボン酸5−シクロプロピル−4−[(1−ナフチル)メチル]−2−オキソ−8−(m−トリル)−7−チア−1−アザビシクロ[4.3.0]ノナ−3,5,8−トリエン−9−カルボン酸
(3R)−7−シクロプロピル−6−[(2−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−3−(ヒドロキシメチル)−6−[(1−ナフチル)メチル]−1−チア−3a−アザ−4−インダノン
(3R)−6−[(1−ナフチル)メチル]−4−オキソ−7−(2−チエニル)−1−チア−3a−アザ−3−インダンカルボン酸
5−シクロプロピル−4−[(1−ナフチル)メチル]−2−オキソ−8−(1H−1,2,3−トリアゾール−4−イル)−7−チア−1−アザビシクロ[4.3.0]ノナ−3,5,8−トリエン−9−カルボン酸
8−ベンジル−5−シクロプロピル−4−[(1−ナフチル)メチル]−2−オキソ−7−チア−1−アザビシクロ[4.3.0]ノナ−3,5,8−トリエン−9−カルボン酸(3R)−7−シクロプロピル−6−[(2,3−ジクロロフェニル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボキサミド
{(3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダニル}(フェニルスルホニルアミノ)ホルムアルデヒド
(3R)−7−イソプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−メチル−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−6−[(p−クロロフェニル)メチル]−7−シクロプロピル−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
{(3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダニル}(メチルスルホニルアミノ)ホルムアルデヒド
(3R)−7−シクロプロピル−4−オキソ−6−[(m−トリル)メチル]−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−イソプロピル−4−オキソ−6−[2−(m−トリル)エチル]−1−チア−3a−アザ−3−インダンカルボン酸
7−(1−メチル−1H−インドール−3−イル)−6−[(1−ナフチルオキシ)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−6−[(4−ブロモ−1−ナフチル)メチル]−7−シクロプロピル−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(1−ナフチル)メチル]−1−チア−3a−アザ−4−インダノン
(3R)−7−シクロプロピル−5−(ヒドロキシメチル)−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3S)−3−アミノ−7−シクロプロピル−6−[(1−ナフチル)メチル]−1−チア−3a−アザ−4−インダノン
(2R,3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−2−フェニル−1−チア−3a−アザ−3−インダンカルボン酸
(2S,3R)−7−シクロプロピル−2−メトキシ−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
又は上記化合物のいずれかの薬学的に許容しうる塩
の少なくとも1つから選択される式IIの化合物を含み得る。
(3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−4−オキソ−6−{(7−チアビシクロ[4.3.0]ノナ−1,3,5,8−テトラエン−8−イル)メチル}−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−[(4−フルオロ−1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−[(4−メチル−1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3S)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
5−シクロプロピル−4−[(1−ナフチル)メチル]−2−オキソ−8−(3−チエニル)−7−チア−1−アザビシクロ[4.3.0]ノナ−3,5,8−トリエン−9−カルボン酸
(3R)−7−シクロプロピル−6−[(1−ナフチルオキシ)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−[(2−フルオロ−5−メチル−フェニル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−4−オキソ−6−[(2,3−キシリル)メチル]−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−メチル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(N−メチルメトキシアミノ){(3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダニル}ホルムアルデヒド
(3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−3−(1H−1,2,3,4−テトラゾール−5−イル)−1−チア−3a−アザ−4−インダノン
5−シクロプロピル−4−[(1−ナフチル)メチル]−2−オキソ−8−フェニル−7−チア−1−アザビシクロ[4.3.0]ノナ−3,5,8−トリエン−9−カルボン酸5−シクロプロピル−4−[(1−ナフチル)メチル]−2−オキソ−8−(m−トリル)−7−チア−1−アザビシクロ[4.3.0]ノナ−3,5,8−トリエン−9−カルボン酸
(3R)−7−シクロプロピル−6−[(2−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−3−(ヒドロキシメチル)−6−[(1−ナフチル)メチル]−1−チア−3a−アザ−4−インダノン
(3R)−6−[(1−ナフチル)メチル]−4−オキソ−7−(2−チエニル)−1−チア−3a−アザ−3−インダンカルボン酸
5−シクロプロピル−4−[(1−ナフチル)メチル]−2−オキソ−8−(1H−1,2,3−トリアゾール−4−イル)−7−チア−1−アザビシクロ[4.3.0]ノナ−3,5,8−トリエン−9−カルボン酸
8−ベンジル−5−シクロプロピル−4−[(1−ナフチル)メチル]−2−オキソ−7−チア−1−アザビシクロ[4.3.0]ノナ−3,5,8−トリエン−9−カルボン酸(3R)−7−シクロプロピル−6−[(2,3−ジクロロフェニル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボキサミド
{(3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダニル}(フェニルスルホニルアミノ)ホルムアルデヒド
(3R)−7−イソプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−メチル−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−6−[(p−クロロフェニル)メチル]−7−シクロプロピル−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
{(3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダニル}(メチルスルホニルアミノ)ホルムアルデヒド
(3R)−7−シクロプロピル−4−オキソ−6−[(m−トリル)メチル]−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−イソプロピル−4−オキソ−6−[2−(m−トリル)エチル]−1−チア−3a−アザ−3−インダンカルボン酸
7−(1−メチル−1H−インドール−3−イル)−6−[(1−ナフチルオキシ)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−6−[(4−ブロモ−1−ナフチル)メチル]−7−シクロプロピル−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(1−ナフチル)メチル]−1−チア−3a−アザ−4−インダノン
(3R)−7−シクロプロピル−5−(ヒドロキシメチル)−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3S)−3−アミノ−7−シクロプロピル−6−[(1−ナフチル)メチル]−1−チア−3a−アザ−4−インダノン
(2R,3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−2−フェニル−1−チア−3a−アザ−3−インダンカルボン酸
(2S,3R)−7−シクロプロピル−2−メトキシ−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
又は上記化合物のいずれかの薬学的に許容しうる塩
の少なくとも1つから選択される式IIの化合物を含み得る。
7−シクロプロピル−4−オキソ−6−{[m−(トリフルオロメチル)フェニル]メチル}−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸2−{2−[1−(ヒドロキシメチル)プロピルアミノ]エチルアミノ}ブチル
{7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダニル}(2−イソニコチノイルヒドラジノ)ホルムアルデヒド
7−シクロプロピル−6−[(4−メトキシ−1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−(ジメチルアミノ)−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−5−ブロモ−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(1−ナフチル)メチル]−1,1−ジオキソ−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−4−オキソ−6−[(2,3−キシリジノ)メチル]−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(1−ナフチル)メチル]−1−オキソ−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−エトキシ−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−6−[(1−ナフチル)メチル]−4−オキソ−7−(トリフルオロメチル)−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−イソブトキシ−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−[(2−メトキシ−1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−(シクロプロピルメトキシ)−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(2−メチル−1−アザ−2−ボラ−1H−ナフタ−5−イル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(2−メチル−1−アザ−2−ボラ−1H−ナフタ−5−イルオキシ)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(2−メチル−1−アザ−2−ボラ−1H−ナフタ−8−イル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(2−メチル−1−アザ−2−ボラ−1H−ナフタ−8−イルオキシ)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
又は上記化合物のいずれかの薬学的に許容しうる塩
の少なくとも1つから選択される。本段落に記載される式IIの化合物それ自体もまた提供される。
(3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−4−オキソ−6−{[m−(トリフルオロメチル)フェニル]メチル}−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−4−オキソ−6−{(7−チアビシクロ[4.3.0]ノナ−1,3,5,8−テトラエン−8−イル)メチル}−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−[(4−フルオロ−1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−[(4−メチル−1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3S)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−4−オキソ−6−[(m−トリル)メチル]−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸2−{2−[1−(ヒドロキシメチル)プロピルアミノ]エチルアミノ}ブチル
{7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダニル}(2−イソニコチノイルヒドラジノ)ホルムアルデヒド
(3R)−7−シクロプロピル−6−[(2−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−[(2−フルオロ−5−メチル−フェニル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−メチル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−[(2,3−ジクロロフェニル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
又は上記化合物のいずれかの薬学的に許容しうる塩
の少なくとも1つから選択される式IIの化合物を含み得る。
(3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−4−オキソ−6−{[m−(トリフルオロメチル)フェニル]メチル}−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−4−オキソ−6−{(7−チアビシクロ[4.3.0]ノナ−1,3,5,8−テトラエン−8−イル)メチル}−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−[(4−フルオロ−1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−[(4−メチル−1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3S)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−4−オキソ−6−[(m−トリル)メチル]−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸2−{2−[1−(ヒドロキシメチル)プロピルアミノ]エチルアミノ}ブチル
{7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダニル}(2−イソニコチノイルヒドラジノ)ホルムアルデヒド
(3R)−7−シクロプロピル−6−[(2−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(4−メトキシ−1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
5−シクロプロピル−4−[(1−ナフチル)メチル]−2−オキソ−8−(3−チエニル)−7−チア−1−アザビシクロ[4.3.0]ノナ−3,5,8−トリエン−9−カルボン酸
(3R)−7−シクロプロピル−6−[(1−ナフチルオキシ)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−[(2−フルオロ−5−メチル−フェニル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−4−オキソ−6−[(2,3−キシリル)メチル]−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−メチル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−(ジメチルアミノ)−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
5−シクロプロピル−4−[(1−ナフチル)メチル]−2−オキソ−8−フェニル−7−チア−1−アザビシクロ[4.3.0]ノナ−3,5,8−トリエン−9−カルボン酸5−シクロプロピル−4−[(1−ナフチル)メチル]−2−オキソ−8−(m−トリル)−7−チア−1−アザビシクロ[4.3.0]ノナ−3,5,8−トリエン−9−カルボン酸
(3R)−7−シクロプロピル−6−[(2,3−ジクロロフェニル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボキサミド
7−シクロプロピル−6−[(1−ナフチル)メチル]−1−オキソ−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
又は上記化合物のいずれかの薬学的に許容しうる塩
の少なくとも1つから選択される式IIの化合物を含み得る。
(3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−4−オキソ−6−{[m−(トリフルオロメチル)フェニル]メチル}−1−チア−3a−アザ−3−インダンカルボン酸、
(3R)−7−シクロプロピル−4−オキソ−6−{(7−チアビシクロ[4.3.0]ノナ−1,3,5,8−テトラエン−8−イル)メチル}−1−チア−3a−アザ−3−インダンカルボン酸(indancarboxylic)
又は上記化合物のいずれかの薬学的に許容しうる塩
の少なくとも1つから選択される式IIの化合物を含み得る。
本開示の化合物は、薬学的に許容しうる塩として提供され得る。本開示の化合物の適切な薬学的に許容しうる塩は、例えば、十分酸性である本開示の化合物の塩基付加塩、例えば、金属塩、例えば、リチウム、ナトリウム、カリウム、カルシウム、マグネシウム、亜鉛又はアルミニウム、アンモニウム塩、生理的に許容しうるカチオンを提供する有機塩基との塩であり得、これらとしては、水酸化第四級アンモニウム、例えばメチルアミン、エチルアミン、ジエチルアミン、トリメチルアミン、tert−ブチルアミン、トリエチルアミン、ジベンジルアミン、N,N−ジベンジルエチルアミン、シクロヘキシルエチルアミン、tris−(2−ヒドロキシエチル)アミン、ヒドロキシエチル ジエチルアミン、(IR、2S)−2−ヒドロキシインデン−l−アミン、モルホリン、N−メチルピペリジン、N−エチルピペリジン、イミダゾール、ピペラジン、メチルピペラジン、アダマンチルアミン、水酸化コリン、水酸化テトラブチルアンモニウム、水酸化tris−(ヒドロキシメチル)メチルアミン、L−アルギニン、N−メチル D−グルカミン、リジン又はアルギニンが挙げられる。例において、本開示の化合物のイミダゾール塩が提供される。
本開示の特定の化合物は、溶媒和物又は水和物として存在し得る。当然のことながら、本開示は全てのこのような溶媒和物又は水和物を包含する。
本開示の化合物はまた、このような化合物を構成する原子の1つ又はそれ以上において非天然の比率の原子異性体を含有し得る。例えば、化合物は、例えばトリチウム(3H)、ヨウ素−125(125I)又は炭素−14(14C)のような放射性同位体で放射標識され得る。本開示の化合物の全ての同位体変異体は、放射活性でも放射活性でなくても、本開示の範囲内に包含されることを意図される。
塩において、プロトン移動は、活性医薬成分と塩の対イオンとの間で起こり得る。しかし、いくつかの場合において、プロトン移動はないかまたは部分的なプロトン移動しかなく、従って固体は真の塩ではない。プロトン移動は実際には連続体であり、そして温度によって変化し得、従って塩が「共結晶」とよりよく記載される点は主観的であるかもしれないということが受け入れられている。本明細書で使用される用語「共結晶」は、ホスト分子(活性医薬成分)及びゲスト(又は共結晶形成剤(co−former))分子が存在する多成分系を指す。ゲスト又は共結晶形成剤分子は、溶媒和物と共結晶を区別するために室温で固体として存在すると定義される。しかし、共結晶自体は溶媒和物を形成し得る。共結晶において、一般に水素結合のような非イオン性力による相互作用について優位性が存在する。
本開示の化合物は、完全な非晶質から完全な結晶までの範囲に及ぶ固体状態の連続体で存在し得る。従って、当然のことながら、全ての多形、例えば異なる多形の混合物が、特許請求される化合物の範囲内に含まれる。
さらに、本開示の化合物は、プロドラッグの形態で投与され得る。プロドラッグは、それ自体でほとんど又は全く薬理活性を有していなくてもよいが、そのような化合物が患者の体内又は身体上に投与された場合、式IIの化合物に変換される化合物である。
本開示の化合物はWO 2014/185833に記載されるように製造され得る。化合物はまた、構造的に関連する化合物について記載されるように製造され得る。反応は標準的手順で、又は本書面の実験項に記載されるように行われ得る。式IIの化合物のスルフィドは、メタ−クロロ過安息香酸(mCPBA)を用いてそれぞれスルホキシド及びスルホンに酸化され得る。さらに又はあるいは、化合物は以下に示されるスキーム1〜10に示されるように製造され得る。
本開示は、本明細書に記載される式IIの化合物の合成における中間体として使用され得る化合物を提供する。例えば、中間体は以下の化合物の少なくとも1つであり得る:
(4R)−2−(シクロプロピルメチル)Δ2−1,3−チアゾリン−4−カルボン酸ベンジル、
5−{1−ヒドロキシ−2−[m−(トリフルオロメチル)フェニル]エチリデン}−2,2−ジメチル−1,3−ジオキサン−4,6−ジオン、
(3R)−7−シクロプロピル−4−オキソ−6−{[m−(トリフルオロメチル)フェニル]メチル}−1−チア−3a−アザ−3−インダンカルボン酸ベンジル、
(3R)−7−シクロプロピル−4−オキソ−6−{[m−(トリフルオロメチル)フェニル]メチル}−1−チア−3a−アザ−3−インダンカルボン酸メチル。これらの中間体は、R3がメタ−トリフルオロメチルである式IIの化合物、すなわち、以下の化学構造を有する化合物の合成において使用され得る:
一般的にPASとして知られる4−アミノサリチル酸は、結核を処置するために使用される抗生物質である。本開示は:
(i) 4−アミノサリチル酸、すなわち
(ii) 本明細書に記載される式II[式中、R1、R2、R3、R4、R5及びXは本書面に記載される値を有し得る]の化合物、又はその薬学的に許容しうる塩
を含む組み合わせを提供する。
R11は:
a)
R2、R3、R4、R5及びXは、本書面において記載される値を有し得る]
の化合物又はその薬学的に許容しうる塩を生じ得る。
1. Org. Biomol. Chem.、2005、3、3886-3892、Aeberg、Veronica et al.
2. Bioorganic & Medicinal Chemistry Letters(2008)、18(12)、3536-3540、Aberg、Veronica et al.
3. Journal of Medicinal Chemistry (2010)、53(15)、5690-5695、Chorell、Erik et al4. Tetrahedron Letters (2007)、48(26)、4543-4546、Pemberton、Nils et al
5. Bioorganic & Medicinal Chemistry(2012)、20(9)、3128-3142、Chorell、Erik et al.
6. Organic & Biomolecular Chemistry(2005)、3(15)、2817-2823、Aaberg、Veronica et
al
7. WO2014/185853 A1.
8. Journal of Organic Chemistry (2007)、72(13)、4917-4924、Chorell、Erik et al.
9. Comb. Chem. 2002、4、630-639、Emtenaes、Hans et al.
10. J. Med. Chem. 2016、59、2094-2108、James A. D. Good et al.
11. Cell Chemical Biology 23、404-414、James A.D. Good et al.
12. PCT/EP2015/076578
ANOVA 分散分析
aq 水性
BOC tert-ブチルオキシカルボニル
BSA ウシ血清アルブミン
CFU コロニー形成単位
CPME シクロペンチルメチルエーテル
DCC ジシクロヘキシルカルボジイミド
DMAP ジメチルアミノピリジン
DMF ジメチルホルムアミド
DCM ジクロロメタン
EMB エタンブトール
FAB 高速原子衝撃法
HRMS 高分解能質量分析
INH イソニアジド又はイソニコチニルヒドラジド
IUPAC 国際純正・応用化学連合
OADC Middlebrookオレイン酸-アルブミン-デキストロース-カタラーゼ増殖サプリメント(Oleic Albumin Dextrose Catalase Growth Supplement)
KatG カタラーゼ-ペルオキシダーゼ
MeCN アセトニトリル
MIC 最小阻害濃度
MicroM マイクロモル濃度
μM マイクロモル濃度
Mtb マイコバクテリウム・ツベルクローシス
MW マイクロ波加熱
MS 質量分析
NMR 核磁気共鳴
ND 不検出
nm ナノメートル
OD 光学密度
λ 波長
ODλ600 600nmでの光学密度
PBS リン酸緩衝化食塩水緩衝液
PZA ピラジナミド
RIF リファンピシン又はリファンピン
RT 室温
rt 室温
sat 飽和
TB 結核
TEA トリエチルアミン
TFA トリフルオロ酢酸
THF テトラヒドロフラン
TWEEN 80 ポリオキシエチレンソルビタンモノオレアート
WT 野生型
全般
1H NMRスペクトルを400又は600 MHz分光計で298Kにて記録し、そして内部標準として溶媒の残留ピークを使用することにより較正した(CDCl3:δH=7.26 ppm;δC=77.16 ppm;DMSO-d6:δH=2.50 ppm;δC=39.52 ppm)。全ての最終化合物の純度はLC-MSにより≧95%であった。
実施例1〜54の化合物を、本明細書に記載される参考文献1〜11に従って、もしくは同様に、又は本書面に記載されるように製造した。1H NMRデータは新規化合物36〜50について提供される。さらに、NMRデータを実施例1、15及び27について示す。表1は実施例1〜54についてのデータを示す。
(3R)-7-シクロプロピル-6-[(1-ナフチル)メチル]-4-オキソ-1-チア-3a-アザ-3-インダンカルボン酸
シクロプロピルアセトニトリルをエタノール及び塩化アセチルと反応させて、2-シクロプロピル-1-エトキシ-1-エタンイミンを生成し、これを(R)-システイン メチルエステル塩酸塩及びEt3NとCH2Cl2中で反応させて、後処理無しに2-(シクロプロピルメチル)Δ2-1,3-チアゾリン-4-カルボン酸メチルを形成した。DCC及びDMAPで活性化された(1-ナフチル)酢酸を、2,2-ジメチル-1,3-ジオキサン-4,6-ジオンとDCM中で反応させて5-[1-ヒドロキシ-2-(1-ナフチル)エチリデン]-2,2-ジメチル-1,3-ジオキサン-4,6-ジオンを得た。
これらの2つのビルディングブロックを高温でTFAと反応させて(3R)-7-シクロプロピル-4-オキソ-6-{[m-(トリフルオロメチル)フェニル]メチル}-1-チア-3a-アザ-3-インダンカルボン酸ベンジルを得た。THF中LiOH又は含水(2%)アセトニトリル中のLiBr及びEt3Nを用いた加水分解により(3R)-7-シクロプロピル-6-[(1-ナフチル)メチル]-4-オキソ-1-チア-3a-アザ-3-インダンカルボン酸 (スキーム1)を得た。NMR及びMSデータを表1に示す。
(4R)-2-(シクロプロピルメチル)Δ 2 -1,3-チアゾリン-4-カルボン酸ベンジル
aq、10mL)を加え、そして相を分離した。水相をCH2Cl2で抽出し、そして合わせた有機相を乾燥し(Na2SO4)、ろ過し、そして真空濃縮して587mg淡黄色油状物を得た。カラムクロマトグラフィー(Biotage 50g、ヘプタン中10-30% EtOAc)により精製して生成物324mg (58%)を淡黄色油状物として得た。 1H NMR (600 MHz、CHCl3):δ 7.35 (m、5H)、5.24 (dd、J=12.6、22.8 Hz、2H)、5.10 (m、1H)、3.53 (m、2H)、2.46 (m、2H)、0.98 (m、1H)、0.57 (m、2H)、0.22 (m、2H)。
1H NMR (400 MHz、CHCl3):δ 15.37 (br s、1H)、7.67-7.62 (m、1H)、7.61-7.53 (m、2H)、7.48-7.42 (m、1H)、4.48 (s、2H)、1.73 (s、6H)
マイコバクテリウム・ツベルクローシスのバイオフィルム阻害
実施例1〜50の化合物をDMSOに溶解し、そしてマイコバクテリウム・ツベルクローシスのバイオフィルム阻害について、以下に記載されるように10 microM、25 microM、50 microM及び/又は100 microMで試験した。バイオフィルム阻害の測定は、試験された結核菌の視診により行われた。各濃度について、3回又はそれ以上の測定を行い、次いで平均値を計算した。各測定について、バイオフィルム阻害は、完全、部分的又は起こっていないとみなされた。完全又は十分な日青フィルム阻害は、試験された結核菌がどれもバイオフィルムを示さない、すなわち阻害が100%であることを意味する。部分的バイオフィルム阻害は、結核菌が破壊されたかつ/又は限定されたバイオフィルムを示すことを意味する。計算の簡潔さのために、部分的バイオフィルム阻害が観察された場合に50%の阻害値を設定した。バイオフィルム阻害は、全ての試験された結核菌がバイオフィルムを示した場合、すなわちバイオフィルム阻害が0%であった場合に起こっていないとみなされた。
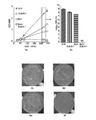
図5aは、0.05% DMSOを含有し、そして1.959 x 108 CFUのマイコバクテリウム・ツベルクローシスを播種された寒天プレート、及び播種の時点でプレート上に置いた水5μlをスポットしたディスクを示す。写真は37℃、5%CO2で4週間インキュベートした後に撮影された。
エルトマン野生型マイコバクテリウム・ツベルクローシス菌の処置
(3R)-7-シクロプロピル-6-[(1-ナフチル)メチル]-4-オキソ-1-チア-3a-アザ-3-インダンカルボン酸(実施例1)のINH感受性に対する効果は、25μM 実施例1及び/又は0.25μg/ml INH、(これはINH (0.02-0.06μg/ml)のMICの約10倍)を含有するクランクトン通気Mtb培養をインキュベートし、そしてODλ600の変化として増殖を経時的にモニタリングすることにより実証された。実施例1の化合物もINHも含まない対照と比較を行った。
この実験を、カタラーゼkatGにおける変異を有するMtbをWT Mtbの代わりに使用した事以外は、WT Mtbを使用した上の実験と同様にして行った。INH耐性株は、イソニアジドを含有するプレート上にエルトマンWT株を行い、そして細菌の耐性コロニーを選択することにより誘導された。使用前に、katG遺伝子を配列決定して変異を決定した。
それぞれ0.25μg/ml INH、25μM実施例1又は組み合わせの存在下でのプランクトン条件での増殖された、図8a〜8bはWT Mtb、そして図9a〜9bはkatGFSAA6 Mtbについての結果を示す。培養物吸光度を経時的に測定しそしてCFUを播種の10日後にプレーティングした。誤差バーは2つのサンプルの範囲を表す。差異の有意性を、ANOVAによりP値を計算することにより決定した。* P < 0.05。** P < 0.01。*** P < 0.001。**** P < 0.0001。(B、E) ND=不検出;検出限界=1 CFU/ml。(c) WT又は(f) katGFSAA6 Mtb株を、INH、実施例1、又はINH+実施例1の組み合わせを含有するソートン寒天プレート上にプレーティングした。INHと実施例1の化合物との組み合わせはWT Mtbを根絶し、そしてまたkatGFSAA6に変異を有するMtbも根絶したと結論付けられた。
Claims (15)
- 結核の処置及び/又は予防のための組み合わせ医薬であって、
前記組み合わせ医薬は、
(i) 以下:イソニコチニルヒドラジド、ベダキリン、エチオナミド、プレトマニド、4−アミノサリチル酸、リファンピシン、ピラジナミド、エタンブトールの1つ又はそれ以上から選択される結核に対する薬物、
又はその薬学的に許容しうる塩;及び
(ii) 式II
を含み、式中
R1は:
a) C(O)OH、
b) テトラゾリル、
c) CH2OH、
d) C(O)NR6aR6b、
e) C(O)NHSO2R7、
f) C(O)OR8、
g) NH2、
h) H、
i)
k)
R2は:
a) H、
b) Cl、F、Br又はI、
c) CH2OH、
d) C1−C4アルキル、及び
e) NY1Y2
からなる群より選択され、
R3は:
a) メチル、フルオロ、クロロ、ブロモ、シアノ及びメトキシからなる群より選択される、0、1、2又は3つの置換基でそれぞれ独立して置換された、1−ナフチル、2−ナフチル又は1−ナフチルオキシ、
b) メチル、フルオロ、クロロ、シアノ及びトリフルオロメチルからなる群より独立して選択される、0、1、2又は3つの置換基で置換されたフェニル
c) メチル、フルオロ、クロロ及びトリフルオロメチルからなる群より独立して選択される0、1、2又は3つの置換基で置換されたアミノフェニル
d) 2−(3−メチル)フェニルメチレン、
e) ベンゾチオフェン−2−イル
f) H又はC1−C4−アルキル、
i) 2−メチル−1−アザ−2−ボラ−1H−ナフタ−5−イルオキシ、及び
j) 2−メチル−1−アザ−2−ボラ−1H−ナフタ−5−イル、
からなる群より選択され、
R4は:
a) 0、1、2、3又は4つのフルオロで置換されたC1−C4アルキル;
b) C3−C6シクロアルキル、
c) 0、1、2、3又は4つのフルオロで置換されたC1−C4アルコキシ、
d) C3−C6シクロアルコキシ、
e) 3員、4員、5員又は6員複素環、
f) N−メチル 3−インドリル、及び
h) NR9R10、
からなる群より選択され、
R5は:
a) H、
b) 0、1、2又は3つのメチル基で置換されたフェニル、
c) ベンジル、
d) チエニル、
e) C1−C4アルコキシ、及び
f) 3員、4員、5員又は6員複素環、
からなる群より選択され、
そして上記定義において:
R6aはH及びC1−C4アルキルからなる群より選択され、
R6bは、H、C1−C4アルキル、C1−C4アルコキシ及びイソニコチノイルアミノからなる群より選択され;
R7はC1−C4アルキル又はフェニルであり、
R8は2−{2−[1−(ヒドロキシメチル)プロピルアミノ]エチルアミノ}ブチル)を表し、
R 9 はC1−C4アルキルを表し、
R 10 はC1−C4アルキルを表し、又は
R9及びR10は一緒にCH2(CH2)mCH2を形成し、
Y1及びY2はそれぞれ独立して、水素、メチル、CH3S(O)2もしくはC(O)CH3を表し、又はY1及びY2は一緒にCH2CH2CH2CH2もしくはCH2CH2CH2CH2CH2を形成し、
mは1、2又は3であり、そして
XはS、SO又はSO2である、
上記組み合わせ医薬。 - XはS又はSOである、請求項1〜3のいずれか1項に記載の組み合わせ医薬。
- R1はC(O)OH、テトラゾリル又はC(O)NHSO2R7である、請求項1〜4のいずれか1項に記載の組み合わせ医薬。
- R2はHである、請求項1〜5のいずれか1項に記載の組み合わせ医薬。
- R3は:
a) メチル、フルオロ、クロロ、シアノ及びメトキシからなる群より選択される0、1、2又は3つの置換基でそれぞれ独立して置換された、1−ナフチル、2−ナフチル及び1−ナフチルオキシ、ならびに
b) メチル、フルオロ、クロロ、シアノ及びトリフルオロメチルからなる群より独立して選択される0、1、2又は3つの置換基で置換されたフェニル
からなる群より選択される、請求項1〜6のいずれか1項に記載の組み合わせ医薬。 - R4がシクロプロピルである、請求項1〜7のいずれか1項に記載の組み合わせ医薬。
- R5がH、又は0、1、2又は3つのメチル基で置換されたフェニルである、請求項1〜8のいずれか1項に記載の組み合わせ医薬。
- (i) 以下:イソニコチニルヒドラジド、ベダキリン、エチオナミド、プレトマニド、4−アミノサリチル酸、リファンピシン、ピラジナミド、エタンブトールの1つ又はそれ以上から選択される結核に対する薬物、
又はその薬学的に許容しうる塩;及び
(ii) 以下:
(3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−4−オキソ−6−{(7−チアビシクロ[4.3.0]ノナ−1,3,5,8−テトラエン−8−イル)メチル}−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−[(4−フルオロ−1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−[(4−メチル−1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3S)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−
チア−3a−アザ−3−インダンカルボン酸
5−シクロプロピル−4−[(1−ナフチル)メチル]−2−オキソ−8−(3−チエニル)−7−チア−1−アザビシクロ[4.3.0]ノナ−3,5,8−トリエン−9−カルボン酸
(3R)−7−シクロプロピル−6−[(1−ナフチルオキシ)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−[(2−フルオロ−5−メチル−フェニル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−4−オキソ−6−[(2,3−キシリル)メチル]−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−メチル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(N−メチルメトキシアミノ){(3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダニル}ホルムアルデヒド
(3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−3−(1H−1,2,3,4−テトラゾール−5−イル)−1−チア−3a−アザ−4−インダノン
5−シクロプロピル−4−[(1−ナフチル)メチル]−2−オキソ−8−フェニル−7−チア−1−アザビシクロ[4.3.0]ノナ−3,5,8−トリエン−9−カルボン酸
5−シクロプロピル−4−[(1−ナフチル)メチル]−2−オキソ−8−(m−トリル)−7−チア−1−アザビシクロ[4.3.0]ノナ−3,5,8−トリエン−9−カルボン酸
(3R)−7−シクロプロピル−6−[(2−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−3−(ヒドロキシメチル)−6−[(1−ナフチル)メチル]−1−チア−3a−アザ−4−インダノン
(3R)−6−[(1−ナフチル)メチル]−4−オキソ−7−(2−チエニル)−1−チア−3a−アザ−3−インダンカルボン酸
5−シクロプロピル−4−[(1−ナフチル)メチル]−2−オキソ−8−(1H−1,2,3−トリアゾール−4−イル)−7−チア−1−アザビシクロ[4.3.0]ノナ−3,5,8−トリエン−9−カルボン酸
8−ベンジル−5−シクロプロピル−4−[(1−ナフチル)メチル]−2−オキソ−7−チア−1−アザビシクロ[4.3.0]ノナ−3,5,8−トリエン−9−カルボン酸
(3R)−7−シクロプロピル−6−[(2,3−ジクロロフェニル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボキサミド
{(3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダニル}(フェニルスルホニルアミノ)ホルムアルデヒド
(3R)−7−イソプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−メチル−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−6−[(p−クロロフェニル)メチル]−7−シクロプロピル−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
{(3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダニル}(メチルスルホニルアミノ)ホルムアルデヒド
(3R)−7−シクロプロピル−4−オキソ−6−[(m−トリル)メチル]−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−イソプロピル−4−オキソ−6−[2−(m−トリル)エチル]−1−チア−3a−アザ−3−インダンカルボン酸
7−(1−メチル−1H−インドール−3−イル)−6−[(1−ナフチルオキシ)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−6−[(4−ブロモ−1−ナフチル)メチル]−7−シクロプロピル−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(1−ナフチル)メチル]−1−チア−3a−アザ−4−インダノン
(3R)−7−シクロプロピル−5−(ヒドロキシメチル)−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3S)−3−アミノ−7−シクロプロピル−6−[(1−ナフチル)メチル]−1−チア−3a−アザ−4−インダノン
(2R,3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−2−フェニル−1−チア−3a−アザ−3−インダンカルボン酸
(2S,3R)−7−シクロプロピル−2−メトキシ−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−4−オキソ−6−{[m−(トリフルオロメチル)フェニル]メチル}−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸2−{2−[1−(ヒドロキシメチル)プロピルアミノ]エチルアミノ}ブチル
{7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダニル}(2−イソニコチノイルヒドラジノ)ホルムアルデヒド
7−シクロプロピル−6−[(4−メトキシ−1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−5−ブロモ−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(1−ナフチル)メチル]−1,1−ジオキソ−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−4−オキソ−6−[(2,3−キシリジノ)メチル]−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(1−ナフチル)メチル]−1−オキソ−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−エトキシ−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−[(2−メトキシ−1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−(シクロプロピルメトキシ)−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(2−メチル−1−アザ−2−ボラ−1H−ナフタ−5−イル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(2−メチル−1−アザ−2−ボラ−1H−ナフタ−5−イルオキシ)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(2−メチル−1−アザ−2−ボラ−1H−ナフタ−8−イル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸、及び
7−シクロプロピル−6−[(2−メチル−1−アザ−2−ボラ−1H−ナフタ−8−イルオキシ)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸からなる群より選択される化合物
又は上記化合物のいずれかの薬学的に許容しうる塩を含む、組み合わせ医薬。 - (i) 以下:イソニコチニルヒドラジド、ベダキリン、エチオナミド、プレトマニド、4−アミノサリチル酸、リファンピシン、ピラジナミド、エタンブトールの1つ又はそれ以上から選択される結核に対する薬物、
又はその薬学的に許容しうる塩;及び
(ii) 以下:
(3R)−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−4−オキソ−6−{[m−(トリフルオロメチル)フェニル]メチル}−1−チア−3a−アザ−3−インダンカルボン酸、及び
(3R)−7−シクロプロピル−4−オキソ−6−{(7−チアビシクロ[4.3.0]ノナ−1,3,5,8−テトラエン−8−イル)メチル}−1−チア−3a−アザ−3−インダンカルボン酸からなる群より選択される化合物
又は上記化合物のいずれかの薬学的に許容しうる塩を含む、組み合わせ医薬。 - 結核に対する薬物は、イソニコチニルヒドラジドである、請求項1〜11のいずれか1項に記載の組み合わせ医薬。
- 以下:
7−シクロプロピル−4−オキソ−6−{[m−(トリフルオロメチル)フェニル]メチル}−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸2−{2−[1−(ヒドロキシメチル)プロピルアミノ]エチルアミノ}ブチル
{7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダニル}(2−イソニコチノイルヒドラジノ)ホルムアルデヒド
7−シクロプロピル−6−[(4−メトキシ−1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−5−ブロモ−7−シクロプロピル−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(1−ナフチル)メチル]−1,1−ジオキソ−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−4−オキソ−6−[(2,3−キシリジノ)メチル]−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(1−ナフチル)メチル]−1−オキソ−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−エトキシ−6−[(1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
(3R)−7−シクロプロピル−6−[(2−メトキシ−1−ナフチル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(2−メチル−1−アザ−2−ボラ−1H−ナフタ−5−イル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(2−メチル−1−アザ−2−ボラ−1H−ナフタ−5−イルオキシ)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(2−メチル−1−アザ−2−ボラ−1H−ナフタ−8−イル)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
7−シクロプロピル−6−[(2−メチル−1−アザ−2−ボラ−1H−ナフタ−8−イルオキシ)メチル]−4−オキソ−1−チア−3a−アザ−3−インダンカルボン酸
から選択される、化合物、又は上記化合物のいずれかの薬学的に許容しうる塩。 - 結核の処置及び/又は予防のための医薬組成物であって、有効量の請求項1〜12のい
ずれか1項に記載の組み合わせ医薬又は請求項13に定義される化合物を含む、医薬組成物。 - 結核の処置及び/又は予防のための薬剤の製造のための、請求項1〜12のいずれか1項に記載の組み合わせ医薬又は請求項1〜13のいずれか1項に定義される化合物の使用。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662319838P | 2016-04-08 | 2016-04-08 | |
| US62/319,838 | 2016-04-08 | ||
| PCT/IB2017/051999 WO2017175182A1 (en) | 2016-04-08 | 2017-04-07 | Ring-fused thiazolino 2-pyridones, methods for preparation thereof and their use in the treatment and/or prevention of tuberculosis |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2019519471A JP2019519471A (ja) | 2019-07-11 |
| JP6979968B2 true JP6979968B2 (ja) | 2021-12-15 |
Family
ID=58578964
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018552820A Active JP6979968B2 (ja) | 2016-04-08 | 2017-04-07 | 環縮合チアゾリノ2−ピリドン類、その製造方法並びに結核の処置及び/又は予防におけるそれらの使用 |
Country Status (14)
| Country | Link |
|---|---|
| US (3) | US10945999B2 (ja) |
| EP (1) | EP3439655B1 (ja) |
| JP (1) | JP6979968B2 (ja) |
| KR (2) | KR20180126511A (ja) |
| CN (2) | CN113975274B (ja) |
| AU (1) | AU2017245653B2 (ja) |
| CA (1) | CA3019741A1 (ja) |
| DK (1) | DK3439655T3 (ja) |
| ES (1) | ES2870230T3 (ja) |
| LT (1) | LT3439655T (ja) |
| PH (1) | PH12018502111A1 (ja) |
| PL (1) | PL3439655T3 (ja) |
| WO (1) | WO2017175182A1 (ja) |
| ZA (2) | ZA201806768B (ja) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10945999B2 (en) * | 2016-04-08 | 2021-03-16 | Quretech Bio Ab | Ring-fused thiazolino 2-pyridones, methods for preparation thereof and their use in the treatment and/or prevention of tuberculosis |
| US11129816B2 (en) | 2017-10-05 | 2021-09-28 | Quretech Bio Ab | Ring-fused thiazolino 2-pyridones in combination with a drug against tuberculosis |
| EP4146659A1 (en) * | 2020-05-08 | 2023-03-15 | Quretech Bio AB | Ring-fused 2-pyridone compounds, methods for preparation thereof and their use in the treatment and/or prevention of a disease involving gram-positive bacteria |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU1923501A (en) * | 1999-11-19 | 2001-05-30 | Washington University | Pyridinones to treat and prevent bacterial infections |
| WO2005102330A2 (en) | 2004-04-16 | 2005-11-03 | Washingtion University | Amino methylated 2-pyridinones |
| KR101767849B1 (ko) | 2007-06-20 | 2017-08-11 | 오스펙스 파마슈티칼스, 인코포레이티드 | 섬유증 저해제로서의 치환된 n-아릴 피리디논 |
| GB0724342D0 (en) | 2007-12-13 | 2008-01-30 | Prolysis Ltd | Anitbacterial compositions |
| WO2014185853A1 (en) | 2013-05-14 | 2014-11-20 | Quretech Bio Ab | Compounds and methods for treatment of chlamydia infections |
| EP3024445B1 (en) * | 2013-07-26 | 2019-01-09 | Sanofi | Antitubercular composition comprising rifampicin, isoniazid, ethambutol and pyrazinamide and its process of preparation |
| WO2016075296A1 (en) * | 2014-11-13 | 2016-05-19 | Quretech Bio Ab | 2,3-dihydro-thiazolo[3,2-a]pyridin-5-one derivatives, intermediates thereof, and their use as antibacerial agents |
| US10945999B2 (en) * | 2016-04-08 | 2021-03-16 | Quretech Bio Ab | Ring-fused thiazolino 2-pyridones, methods for preparation thereof and their use in the treatment and/or prevention of tuberculosis |
-
2017
- 2017-04-07 US US16/091,774 patent/US10945999B2/en active Active
- 2017-04-07 JP JP2018552820A patent/JP6979968B2/ja active Active
- 2017-04-07 EP EP17718418.1A patent/EP3439655B1/en active Active
- 2017-04-07 LT LTEP17718418.1T patent/LT3439655T/lt unknown
- 2017-04-07 ES ES17718418T patent/ES2870230T3/es active Active
- 2017-04-07 AU AU2017245653A patent/AU2017245653B2/en active Active
- 2017-04-07 PL PL17718418T patent/PL3439655T3/pl unknown
- 2017-04-07 DK DK17718418.1T patent/DK3439655T3/da active
- 2017-04-07 CN CN202111394454.8A patent/CN113975274B/zh active Active
- 2017-04-07 CN CN201780024302.4A patent/CN109069492B/zh active Active
- 2017-04-07 WO PCT/IB2017/051999 patent/WO2017175182A1/en active Application Filing
- 2017-04-07 KR KR1020187029354A patent/KR20180126511A/ko active Application Filing
- 2017-04-07 KR KR1020227006865A patent/KR102442586B1/ko active IP Right Grant
- 2017-04-07 CA CA3019741A patent/CA3019741A1/en active Pending
-
2018
- 2018-10-01 PH PH12018502111A patent/PH12018502111A1/en unknown
- 2018-10-11 ZA ZA2018/06768A patent/ZA201806768B/en unknown
-
2020
- 2020-07-24 US US16/937,851 patent/US20200352919A1/en not_active Abandoned
-
2022
- 2022-01-11 ZA ZA2022/00511A patent/ZA202200511B/en unknown
- 2022-09-14 US US17/944,228 patent/US20230115208A1/en active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| KR102442586B1 (ko) | 2022-09-08 |
| PH12018502111A1 (en) | 2019-09-23 |
| AU2017245653A1 (en) | 2018-11-01 |
| US20200352919A1 (en) | 2020-11-12 |
| US10945999B2 (en) | 2021-03-16 |
| ZA202200511B (en) | 2024-02-28 |
| CN113975274A (zh) | 2022-01-28 |
| US20190091210A1 (en) | 2019-03-28 |
| EP3439655A1 (en) | 2019-02-13 |
| ES2870230T3 (es) | 2021-10-26 |
| CN109069492A (zh) | 2018-12-21 |
| AU2017245653B2 (en) | 2022-04-14 |
| CN109069492B (zh) | 2021-12-10 |
| LT3439655T (lt) | 2021-07-12 |
| JP2019519471A (ja) | 2019-07-11 |
| US20230115208A1 (en) | 2023-04-13 |
| DK3439655T3 (da) | 2021-05-10 |
| WO2017175182A1 (en) | 2017-10-12 |
| RU2018135698A3 (ja) | 2020-07-09 |
| KR20220029788A (ko) | 2022-03-08 |
| ZA201806768B (en) | 2022-04-28 |
| CA3019741A1 (en) | 2017-10-12 |
| PL3439655T3 (pl) | 2021-09-27 |
| RU2018135698A (ru) | 2020-05-12 |
| EP3439655B1 (en) | 2021-03-03 |
| CN113975274B (zh) | 2024-04-09 |
| KR20180126511A (ko) | 2018-11-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7233059B2 (ja) | 結核に対する薬剤と組み合わせた環融合型チアゾリノ2-ピリドン | |
| TWI404535B (zh) | 潛伏期結核病之治療 | |
| US20230115208A1 (en) | Ring-fused thiazolino 2-pyridones, methods for preparation thereof and their use in the treatment and/or prevention of tuberculosis | |
| JP5661037B2 (ja) | 結核についての併用療法 | |
| WO2014190199A1 (en) | Compounds for treatment of drug resistant and persistent tuberculosis | |
| JP2017141262A (ja) | 潜伏性結核の処置 | |
| US10752621B2 (en) | Oxazolidinone compounds and methods of use thereof as antibacterial agents | |
| RU2786572C2 (ru) | Тиазолино 2-пиридоны с конденсированными кольцами, способы их получения и их применение в лечении и/или профилактике туберкулеза | |
| RU2791467C2 (ru) | Тиазолино-2-пиридоны с конденсированными циклами в комбинации с лекарственным средством против туберкулеза | |
| WO2020128981A1 (en) | Discovery of bd oxidase inhibitors for the treatment of mycobacterial diseases | |
| RU2629369C1 (ru) | Четвертичные аммонийные производные 2-аминотиофен-3-карбоксилатов, обладающие противотуберкулезной активностью | |
| BR112018072255B1 (pt) | Azasteroides para tratamento de tuberculose | |
| Mohite et al. | Synthesis and biological activities of some 3-chloro-4-(substituted phenyl)-1-{[2-oxo-2-(5-phenyl-1H-tetrazol-1-yl) ethyl] amino} azetidin-2-one as potential antibacterial agents | |
| Berg et al. | SAR study of piperidine derivatives as inhibitors of 1, 4-dihydroxy-2-naphthoate isoprenyltransferase (MenA) from Mycobacterium tuberculosis | |
| WO2022119899A1 (en) | A medicament for treating mycobacterial infection characterized by combining a cytochrome bc1 inhibitor with clarithromycin or azithromycin | |
| MXPA05013413A (en) | Treatment of latent tuberculosis |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20200326 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20210118 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210209 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210422 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210713 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20211001 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20211102 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20211116 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6979968 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |