JP6906520B2 - チェックポイント阻害剤と組みわせて2−デオキシ−2−フルオロ−l−フコースを用いる癌治療 - Google Patents
チェックポイント阻害剤と組みわせて2−デオキシ−2−フルオロ−l−フコースを用いる癌治療 Download PDFInfo
- Publication number
- JP6906520B2 JP6906520B2 JP2018528650A JP2018528650A JP6906520B2 JP 6906520 B2 JP6906520 B2 JP 6906520B2 JP 2018528650 A JP2018528650 A JP 2018528650A JP 2018528650 A JP2018528650 A JP 2018528650A JP 6906520 B2 JP6906520 B2 JP 6906520B2
- Authority
- JP
- Japan
- Prior art keywords
- cancer
- pharmaceutical composition
- fucose
- deoxy
- fluoro
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/39541—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against normal tissues, cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/39558—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against tumor tissues, cells, antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2818—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against CD28 or CD152
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
Description
本出願は、2015年12月4日に出願された米国特許仮出願第62/263,228号、2016年3月15日に出願された米国特許仮出願第62/308,583号、2016年4月13日に出願された米国特許仮出願第62/321,857号の利益を主張するものであり、その内容は、その全体においておよび全ての目的のために、本明細書に組み込まれる。
用語「阻害する」または「阻害」は、測定可能な量だけ減少させるか、または完全に防止することを意味する。本明細書で使用される阻害という用語は、少なくとも約10%、少なくとも約15%、少なくとも約20%、少なくとも約25%、少なくとも約30%、少なくとも約35%、少なくとも約40%、少なくとも約50%、少なくとも約60%、少なくとも約70%、少なくとも約80%、少なくとも約90%、少なくとも約95%、または少なくとも約99%の阻害または減少を意味することができる。
固相での2−デオキシ−2−フルオロ−L−フコースは、以下の化学構造(I):
スクロースまたはサッカリンなどの甘味剤;ペパーミント、サリチル酸メチルまたはオレンジ香味などの香味剤;および着色料。
KLH−A20 Id Fabは、OkeleyらPNAS 2012に記載されているように作製した。A20細胞(ATCC)を、10%FBS、10mM HEPES、1mMピルビン酸ナトリウム、50μM2−メルカプトエタノールおよびペニシリン(100U/ml)/ストレプトマイシン(100μg/ml)(PS)を含むRPMI 1640中で培養した。免疫化群(BALB/c、Harlan)に、KLH−Fab結合体(50μg)をTiterMaxアジュバント(1:1)と共に、21日目に皮下注射し、−7日目に追加免疫した。2−デオキシ−2−フルオロ−L−フコース処置群は、−14日目に開始する20mM 2−デオキシ−2−フルオロ−L−フコースを含有する飲料水を受けた。2回目のワクチン接種の1週間後(0日目)、全てのマウスに2.5×106個のA20腫瘍細胞(i.v.)を投与した。2−デオキシ−2−フルオロ−L−フコース処置を21日目まで続け、続いて通常の飲料水を続けた。免疫細胞の枯渇は、−6、−5、−4、0および+7日目(200μg/マウス腹腔内)に投与された枯渇抗体で達成された。抗CD4(GK1.5)または−CD8(53−6.72)抗体によるCD4またはCD8 T細胞枯渇が、−1、7、14、21、29日目の血液中で確認された(FACS分析)。同様の結果が、BALB/cマウスからの0日目および29日目の脾臓においても見られた。図1Aおよび1Bは、CD4またはCD8 T細胞の枯渇が、A20イディオタイプワクチン+2−デオキシ−2−フルオロ−L−フコースの組み合わせの活性を低下させることを示す。したがって、CD4およびCD8T細胞は、組合せ活性において役割を果たす。
T細胞を10mLの全血から単離し、1200rpm(300×g)で10分間遠心分離した(ブレーキなし)。血小板を含む最上層を、白血球層を破壊することなく注意深く除去した。その後、残りの血液(500μL/10mL血液)にRosetteSep(商標)ヒトT細胞濃縮カクテル(StemCell technologies、Vancouver、BCのPanT細胞)を加えた。これを20分間インキュベートし、次いで、10mLのPBSと共に1mLのFBSを添加した。調製した血液/PBS溶液を50mLのファルコンに入れたヒストパーク(20〜25mL)を非常にゆっくりと重ねた。これをブレーキなしで遠心分離した(25℃、1500rpm、25分間)。上層を除去し、軟膜層中のT細胞を新しい50mLチューブに移した。T細胞をPBSで洗浄し、1mLのACK溶解緩衝液に再懸濁し、25mLまで補充し、5分間インキュベートし、PBSで50mLにし、ペレット化した。この赤血球溶解工程を2回繰り返した。次いで、T細胞をT細胞培地(10%ウシ胎仔血清(FCS)、1%PSを補充したRPMI培地)に再懸濁し、2つのT25フラスコに入れた(100〜200μMの2−デオキシ−2−フルオロ−L−フコースありまたはなし)。CD3/CD28抗体被覆ビーズ(20μL/フラスコ、Miltenyi Biotec)を添加してT細胞を活性化した。24時間後、IL2を添加した(100ng/μL、R&D Systems)。細胞を継代するたびに、新たなIL2および2−デオキシ−2−フルオロ−L−フコースを添加した。
共培養実験を、48ウェルプレート中、10:1(T細胞:DC)の比でDC培地中で行った。DC培地(20000〜30000/ウェル)および10倍のT細胞を、各ウェルに合計200μL/ウェルのDC培地で播種した。共培養物を24時間インキュベートした後、後述するように細胞がDC成熟マーカーについて評価した。
トランスウェルアッセイを、24ウェルプレートで行った。共培養は、ウェルあたり500μLの最終容量で上記のようにして培養した。トランスウェルサンプルについては、DCをウェルに播種し、T細胞をインサートに入れた。次いで、細胞を24時間インキュベートし、トランスウェルを含まない共培養と同じ方法で調べた。
DCは、2つのフラスコに分けられた1つは正常培地で、もう1つは無血清培地で分割された8日目まで説明したように増殖させた。血清は存在しないが、X−VIVO(商標)15培地は、培養物の健康を維持するのに役立つ成長因子を含む。48ウェルプレート中で上記のように共培養実験を行った。
共培養物をFACS分析を用いて試験した。インキュベーション後、細胞をヒトFcブロック(EMD Millipore)を有するBD染色緩衝液(BSA)中で洗浄し、氷上で30分間インキュベートした。次いで、細胞を、蛍光標識した抗MHCII、抗CD86、抗CD83、および抗CD40一次抗体(BD、BD染色緩衝液(BSA)中の1:100または1:50)または適切なアイソタイプ対照(氷、暗所、40分)。次いで、細胞をBD染色緩衝液(BSA)で2回洗浄し、LSRIIフローサイトメーターで分析した。DCを前方散乱および側方散乱によって同定し、各マーカーのMFIを2−デオキシ−2−フルオロ−L−フコース処置培養物で対照培養物のものと比較した。図2Aおよび2Bは、血清含有および無血清アッセイ条件の両方について、これらのマーカー間の倍数差異を示す。
抗原特異的四量体および陰性対照四量体は、MBL(Woburn、MA)から購入した。2−デオキシ−2−フルオロ−L−フコース(100μM)の有無にかかわらず上記のように増殖させたT細胞を丸底96ウェルプレートに播種し、遠心分離し、ヒトFcブロック(EMD Millipore)とともにBD染色緩衝液(BSA)に再懸濁し、室温で10分間インキュベートした。次いで、細胞を所望の四量体10μL/ウェルまたは陰性対照で染色し、暗所で30分間室温でインキュベートした。細胞を遠心分離し、BD染色緩衝液(BSA)中で洗浄し、次いで、冷やしたBD BSA染色緩衝液中で再懸濁して、LSRIIフローサイトメーターで分析した。図3は、3つの異なる四量体(EBV、M1、およびCMV;MBL Bio)の対照T細胞と比較した、2−デオキシ−2−フルオロ−L−フコース処置T細胞への結合のMFI倍数変化(fold change)を示す。
精製したT細胞を6ウェルプレート(2.5×106細胞/ウェル、2.5mLのT細胞培地)に播種し、0〜4時間、37℃でCD3/CD28ビーズ(20μLビーズ/ウェル、Miltenyi Biotec、San Diego、CA)で活性化した。示された時間に試料を採取し、PBSで洗浄し、RIPA緩衝液(Thermo Scientific、DNAseおよびプロテアーゼ/ホスファターゼ阻害剤を含む)で溶解し、ドライアイス上で急速凍結した後、−80℃で保存した。細胞溶解物(BCAアッセイによって決定された約3μg/サンプル)をSDS−PAGE上で流し、抗pZAP70抗体(Cell Signaling Technologies)を用いたニトロセルロース膜のウエスタンブロットによって調べた。簡単に述べると、ブロットを5%ミルク入りTBST(Cell Signaling TechnologiesからのTBST)中で室温で1時間ブロックし、TBSTでリンスし、次いで、一次抗体(TBST中の5%BSA中の抗pZAP70 1:1000)とともに4℃で一晩インキュベートした。ブロットをTBSTで3回洗浄し、HRP結合二次抗体でRTで1時間(TBST中5%脱脂乳で1:2000)、続いて洗浄(3×TBST)し、メーカーの指示にしたがって、Cell Signaling Elite ECLを用いて検出した。ブロットをAmersham(商標)600イメージャ(GE Healthcare)を用いてスキャンした。画像化されると、ブロットを除去し、他の一次抗体を用いてさらなるマーカーについて再プローブすることができた。この方法のために、膜を、最初にPBSで洗浄した後、Thermo ScientificのRestore(商標)PLUSウエスタンブロットストリッピングバッファーを使用して室温で30分間ストリッピングした。これに続いて、膜をTBST中で洗浄し、5%ミルク入りTBST中で室温で1時間ブロッキングした。次いで、全ZAP70を染色するために、上記のブロットプロトコルを続けた。図4は、2−デオキシ−2−フルオロ−L−フコース処置T細胞を有する対照T細胞と比較して、ZAP70強度に対して正規化されたpZAP70タンパク質レベルを示す。
精製したT細胞を12ウェルプレート(106細胞/ウェル、1〜2mLのT細胞培地)に播種し、CD3/CD28ビーズ(4μLビーズ/2mL培地、Miltenyi Biotec)で活性化した。細胞を37℃で一晩インキュベートし、次いで、固定および透過処理後のFACS分析後のガレクチン−3発現について分析した。要するに、細胞をペレット化し(2×105個)、BD染色緩衝液(FBS)で2回洗浄した後、冷やしたBD Cytofix(商標)固定バッファー(30分、RT)で再懸濁した。細胞をペレット化し、BD染色緩衝液(FBS)で2回洗浄し、BD Perm/Wash(商標)バッファー(30分、室温)に再懸濁した。細胞を新鮮なBD Perm/Wash(商標)バッファーで洗浄し、抗ガレクチン−3抗体(Life Technologies、または適切なアイソタイプ対照)でRT(40分、暗所)で染色した。細胞を室温でBD Perm/Wash(商標)で2回洗浄し、LSRIIフローサイトメーターで分析するためにBD染色緩衝液(FBS)に再懸濁した。図5は、対照T細胞の細胞と比較した、2−デオキシ−2−フルオロ−L−フコース処置T細胞におけるガレクチン−3MFIの倍数変化を示す。
血清を含まないRPMI培地(1%PS、2.5mL)を含む6ウェル皿(2.5x106細胞/ウェル)に細胞を播種し、血清飢餓の6時間後に、細胞をTGFβ(5ng/mL)で10分間刺激した。細胞を採取し、PBSで2回洗浄し、ドライアイス上で急速凍結し、続いて−80℃で保存した。細胞をRIPA緩衝液(DNAseおよびプロテアーゼ/ホスファターゼ阻害剤を含む)で溶解した。以前に記載したように、細胞溶解物をSDS−PAGE上で流し、抗pSMAD2抗体および抗アクチン抗体を用いたニトロセルロース膜のウエスタンブロットによって調べた。図6は、2−デオキシ−2−フルオロ−L−フコース処置T細胞についての同じ比率と比較した対照T細胞についてのアクチン強度に対するpSMAD2の比を示す。
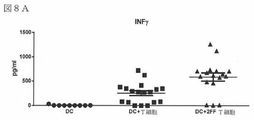
先に記載したT細胞/DC共培養由来の組織培養上清を回収し、Luminexアッセイによってサイトカイン変化について評価した。同様に、A20ワクチンモデル研究からの血液サンプルを凝固させ、サイトカイン(MCYTOMAG01L1X-13マウスサイトカイン磁気ビーズパネル、Millipore)の分析のために血清を回収した。図8A、8Bおよび8Cは、DCおよび2−デオキシ−2−フルオロ−L−フコース処置T細胞の共培養において、抗原特異的T細胞活性化に重要なサイトカイン、例えばINFy、IL12p40およびCD40Lが、対照T細胞を含有する培養物と比較した場合、組織培養上清中で増加したことを示す。図9は、組織培養共培養系で観察されたサイトカインの変化に加えて、免疫応答に重要なサイトカインの特異的増加が、A20腫瘍ワクチンモデルで観察されたことを示している(上記、枯渇なし、−21日目、−14日目、0日目、および1日目で採取したサンプル;IL15)。これらのデータは、2−デオキシ−2−フルオロ−L−フコース処置が、インビトロおよびインビボで最適な免疫応答の鍵となるサイトカインのアップレギュレーションをもたらし得ることを示している。
CMV陽性ドナー(Astarte(商標)Biologics)からのCMV反応性ヒトPMBCを解凍し、6ウェルプレートに播種し、DC培地(30%DMEM 70%X−ビボ+2mMグルタマックス+10%ATB血清+1%PS)中で一晩培養した。翌日、上清を回収してT細胞を単離し、接着細胞を培地で洗浄し、次いで1ウェルあたりIL4(100ng/μL)およびGMCSF(200ng/μL)を補充した培地2mLを補充、付着している単球をDCへと分化および増殖させた。プレートを4〜5日間インキュベートし、次いで細胞をT25フラスコに移した。細胞が継代されるたびに(2〜3日ごと)、新しいサイトカインが与えられた。上清中のT細胞を、StemSepヒトT細胞濃縮キット(Stemcell technologies)を用いて単離した。次いで、T細胞をT細胞培地(RPMI+10%ウシ胎児血清、1%PS)に再懸濁し、2つのT25フラスコに入れた(100〜200μM 2FFありまたはなし)。T細胞を活性化するために、CD3CD28抗体被覆ビーズ(Miltenyi Biotec)(20μL/フラスコ)を添加した。24時間後にIL2を添加した(100ng/μL)。細胞を継代するたびに、新しいIL2および2FFを添加した。細胞を10〜12日間培養し、5μg/mLのCMV抗原刺激(Astarte Biologics)を伴うまたは伴わない、および、1μg/mLの抗PD1(ペンブロリズマブ、Keytruda)を伴うまたは伴わない48ウェルプレート中の10:1(T細胞:DC)比のDC培地中で共培養実験を行った。共培養物を24時間インキュベートした後、ヒトT細胞高感度ルミネックスアッセイ(Millipore)を用いて製造業者の指示に従って上清をIFNγおよびIL12p70についてアッセイした。
A20細胞(ATCC)を、10%FBS、10mM HEPES、1mMピルビン酸ナトリウム、50μM2−メルカプトエタノールおよびペニシリン(100U/ml)/ストレプトマイシン(100μg/ml)(PS)を含むRPMI1640中で培養した。すべてのマウス(BALB/c、n=6/群)に1×105個のA20腫瘍細胞(i.v.)を移植し、4つの群:未処置;2FFのみで処置;抗PD1抗体のみで処置;抗PD1抗体との2FFの組み合わせで処置、に分けた。2FF処置群は、腫瘍移植の日から開始して20mM 2FFを含む飲料水を受け、研究の全体を通して継続した。2FFを受けていないマウスには通常の飲料水が与えられた。抗PD1抗体(Ebiosciences、クローンJ43)処置群は、腫瘍移植後5日目から開始して3日ごとに5mg/kgの3回の投与を受けた。図11に示されるように、2FF単独処置群は、未処置群と比較して生存率が増加させたが、抗PD1抗体単独処置群は、未処置群と比較して生存率を改善しなかった。2FFと抗PD1抗体との組み合わせで処置したマウスの群は、腫瘍移植後約54日の50%の耐性生存率を示し、腫瘍移植後約90日で実験終了まで持続した。このことは、実験の最後まで続く約40日間の処置後の抗PD1単独処置群および未処置群におけるわずか17%の生存率であることと比較され、また、約90日での実験の終了まで続く処置の70日後の2FF単独処置群におけるわずか17%の生存率と比較される。これらのデータは、2FFおよび抗PD1の組み合わせが、未処置および2FFまたは抗PD1単剤処置と比較して、腫瘍移植マウスの生存期間を延長させることを示す。
実施例に示すように、2FFは、抗CTLA4抗体で観察されるものと同様に、調節性T細胞集団を減少させる能力を実証している。調節性T細胞集団の減少は、調節性T細胞発生に重要なTGF−βシグナル伝達およびFOXp3誘導の減弱と関連する。したがって、抗PD1遮断抗体の存在下での2FFのコンビナトリアル活性をインビトロおよびインビボの両方で評価した。実施例は、インビトロで2FFが抗PD1抗体と協力して抗原特異的T細胞活性化を増加させることを実証した;インビボでは、2FFは、未処置または単剤処置群と比較して、リンパ腫の同系マウスモデルにおいて、抗PD1抗体に対する抗腫瘍応答および全生存期間を延長させることを示した。
腫瘍浸潤免疫細胞に対する2FF処置の効果を評価するために、balb/cマウスに4T1細胞(2×104皮下注射)を移植し、同日に20mM 2FFの飲料水で開始した。19日目(腫瘍が約250〜300mm3のとき)または28日目(腫瘍が約800〜1000mm3のとき)に腫瘍を除去し、カミソリの刃で細かく刻んだ後、5mLの冷却した解離緩衝液(DMEM(高グルコース)培地、5%FBS、1M HEPES、2mg/mLコラゲナーゼD(Roche)、0.1mg/mL DNAse I(50mg/mL 20mMトリス−HCL(ph7.5)、1mM MgCl2、50%グリセロールでストック)に溶解し、Miltenyi C−チューブに移した。GentleMACSを各チューブ上で泳動し、チューブを37℃で40分間連続回転させてインキュベートした。次いで、GentleMACSを2回泳動させ、チューブを急速に回転させて、チューブの底に腫瘍を集めた。次いで、管の内容物を、シリンジのゴム栓を用いて70μmのメッシュフィルターに通して50mLのファルコンチューブに通し、組織を穏やかに解離させた。フィルターを5mLの冷却した酵素阻害剤緩衝液(DMEM(高グルコース)、0.25M EDTA)で洗浄し、チューブを遠心分離し、上清を捨て、サンプルをPBSに再懸濁させた。次いで、細胞を、製造者の指示に従ってeFluor(登録商標)506バイアビリティ色素(eBioscience)で染色した。細胞をFACS染色緩衝液(0.5%FBS、0.05%NaN3)中で2回洗浄し、免疫細胞を同定するためにCD45に対する抗体をそれぞれ含む3つの異なるパネルの抗体で免疫表現型を調べた。樹状細胞抗原について表現型を調べた細胞を、暗所で氷上で30分間所望の抗体で染色し、染色緩衝液で2回洗浄し、1:4のPBS:固定緩衝液(Biolgend)に再懸濁し、4℃で一晩保存した。翌日、細胞をFACS染色緩衝液で洗浄し、LSRIIフローサイトメーターで分析した。T調節性細胞について表現型を調べた細胞を、氷上で暗所で30分間、細胞表面抗原に対する所望の抗体で最初に染色した。次いで、細胞を洗浄し、固定し、透過処理し、製造指示(カタログ番号77-5775)に従ってeBioscience染色セットを用いてFOXp3で染色した。
以下は、本発明の実施形態の一つである。
(1)有効量の2−デオキシ−2−フルオロ−L−フコースもしくはそのプロドラッグ、または薬学的に許容可能なその塩と、チェックポイント阻害剤とを組み合わせて、それを必要とする対象に投与することを含む、前記対象における癌を治療する方法。
(2)有効量の2−デオキシ−2−フルオロ−L−フコースもしくはそのプロドラッグ、または薬学的に許容可能なその塩と、チェックポイント阻害剤とを組み合わせて、それを必要とする対象に投与することを含む、前記対象における腫瘍の増殖を阻害する方法。
(3)投与される2−デオキシ−2−フルオロ−L−フコースもしくはそのプロドラッグ、または薬学的に許容可能なその塩と、前記チェックポイント阻害剤との前記組み合わせは、癌の治療においてまたは腫瘍細胞の増殖の阻害において、相加効果または相乗効果を提供する、(1)または(2)に記載の方法。
(4)投与される2−デオキシ−2−フルオロ−L−フコースもしくはそのプロドラッグ、または薬学的に許容可能なその塩と、前記チェックポイント阻害剤との前記組み合わせは、癌の治療においてまたは腫瘍細胞の増殖の阻害において相乗効果を提供する、(3)に記載の方法。
(5)2−デオキシ−2−フルオロ−L−フコースまたは薬学的に許容可能なその塩が、チェックポイント阻害剤と組み合わせて投与される、(1)〜(4)のいずれかに記載の方法。
(6)前記2−デオキシ−2−フルオロ−L−フコースのプロドラッグまたは薬学的に許容可能なその塩が、チェックポイント阻害剤と組み合わせて投与される、(1)〜(4)のいずれかに記載の方法。
(7)2−デオキシ−2−フルオロ−L−フコースのカルボン酸エステルのプロドラッグまたは薬学的に許容可能なその塩が、チェックポイント阻害剤と組み合わせて投与される、(6)に記載の方法。
(8)2−デオキシ−2−フルオロ−L−フコースの酢酸エステルまたは薬学的に許容可能なその塩が、チェックポイント阻害剤と組み合わせて投与される、(7)に記載の方法。
(9)前記チェックポイント阻害剤は、生物学的治療薬または小分子である、(1)〜(8)のいずれかに記載の方法。
(10)前記チェックポイント阻害剤は、モノクローナル抗体、ヒト化抗体、完全ヒト抗体および融合タンパク質またはそれらの組み合わせからなる群から選択される、(1)〜(8)のいずれかに記載の方法。
(11)前記チェックポイント阻害剤は、CTLA−4、PD−1、PD−L1、PD−L2、B7−H3、B7−H4、BMA、HVEM、TIM3、GAL9、LAG3、VISTA、KIR、2B4、CD160、CGEN−15049、CHK1、CHK2、A2aR、およびB−7ファミリーリガンドまたはこれらの組み合わせからなる群から選択されるチェックポイントタンパク質のリガンドを阻害するまたは該リガンドと相互作用する、(9)または(10)に記載の方法。
(12)前記チェックポイント阻害剤は、PD−L1、PD−L2、またはPD−1阻害剤である、(11)に記載の方法。
(13)前記チェックポイント阻害剤は、PD−1阻害剤である、(12)に記載の方法。
(14)PD−1阻害剤である前記チェックポイント阻害剤は、ニボルマブまたはペンブロリズマブである、(13)に記載の方法。
(15)PD−1阻害剤である前記チェックポイント阻害剤は、ニボルマブである、(14)に記載の方法。
(16)前記癌は、泌尿生殖器、婦人科、肺、胃腸、頭頚部癌、悪性神経膠腫および脳転移を含む脳腫瘍、悪性中皮腫、非転移性または転移性乳癌、悪性黒色腫、メルケル細胞癌腫または骨および軟部組織肉腫、血液学的腫瘍、多発性髄腫、ホジキン病、非ホジキンリンパ腫、急性骨髄性白血病、慢性骨髄性白血病、骨髄異形成症候群および急性リンパ芽球性白血病などのリンパ腫、非小細胞肺癌(NSCLC)、乳癌、転移性結腸直腸癌、ホルモン感受性またはホルモン不応性前立腺癌、結腸直腸癌、卵巣癌、肝細胞癌、腎細胞癌、膵臓癌、胃癌、食道癌、肝細胞癌、胆管細胞癌、頭頸部扁平上皮癌軟部組織肉腫、および小細胞肺癌からなる群から選択される、(1)〜(15)のいずれかに記載の方法。
(17)前記癌は、非小細胞肺癌(NSCLC)、乳癌、または結腸直腸癌である、(16)に記載の方法。
(18)前記癌は、非小細胞肺癌(NSCLC)である、(17)に記載の方法。
(19)2−デオキシ−2−フルオロ−L−フコースもしくはそのプロドラッグ、または薬学的に許容可能なその塩を含む組成物が、前記対象に投与される、(1)〜(18)のいずれかに記載の方法。
(20)前記組成物は、固体または液体製剤である、(19)に記載の方法。
(21)前記対象は哺乳類である、(1)〜(20)のいずれかに記載の方法。
(22)前記哺乳類はヒトである、(21)に記載の方法。
(23)有効量の2−デオキシ−2−フルオロ−L−フコースもしくはそのプロドラッグ、または薬学的に許容可能なその塩と、チェックポイント阻害剤とを組み合わせて、それを必要とする対象に投与することを含む、チェックポイント阻害剤の効果を開始、増強、または延長する、または、前記対象において、チェックポイント阻害剤に前記対象が応答することを可能にする方法。
(24)投与される2−デオキシ−2−フルオロ−L−フコースもしくはそのプロドラッグ、または薬学的に許容可能なその塩と、前記チェックポイント阻害剤との前記組み合わせは、癌の治療においてまたは腫瘍細胞の増殖の阻害において、相加効果または相乗効果を提供する、(23)に記載の方法。
(25)投与される2−デオキシ−2−フルオロ−L−フコースもしくはそのプロドラッグ、または薬学的に許容可能なその塩と、前記チェックポイント阻害剤との前記組み合わせは、癌の治療においてまたは腫瘍細胞の増殖の阻害において相乗効果を提供する、(24)に記載の方法。
(26)抗腫瘍の反応は、腫瘍成長の阻害、腫瘍細胞死の誘発、腫瘍退行、腫瘍再発、腫瘍成長、腫瘍拡大の予防または遅延、および腫瘍排除から選択される、(23)〜(25)のいずれかに記載の方法。
(27)2−デオキシ−2−フルオロ−L−フコースまたは薬学的に許容可能なその塩が、チェックポイント阻害剤と組み合わせて投与される、(23)〜(26)のいずれかに記載の方法。
(28)前記2−デオキシ−2−フルオロ−L−フコースのプロドラッグまたは薬学的に許容可能なその塩が、チェックポイント阻害剤と組み合わせて投与される、(23)〜(27)のいずれかに記載の方法。
(29)2−デオキシ−2−フルオロ−L−フコースのカルボン酸エステルのプロドラッグまたは薬学的に許容可能なその塩が、チェックポイント阻害剤と組み合わせて投与される、(28)に記載の方法。
(30)2−デオキシ−2−フルオロ−L−フコースの酢酸エステルまたは薬学的に許容可能なその塩が、チェックポイント阻害剤と組み合わせて投与される、(29)に記載の方法。
(31)前記チェックポイント阻害剤は、生物学的治療薬または小分子である、(23)〜(30)のいずれかに記載の方法。
(32)前記チェックポイント阻害剤は、モノクローナル抗体、ヒト化抗体、完全ヒト抗体および融合タンパク質またはそれらの組み合わせからなる群から選択される、(23)〜(31)のいずれかに記載の方法。
(33)前記チェックポイント阻害剤は、CTLA−4、PD−1、PD−L1、PD−L2、B7−H3、B7−H4、BMA、HVEM、TIM3、GAL9、LAG3、VISTA、KIR、2B4、CD160、CGEN−15049、CHK1、CHK2、A2aR、およびB−7ファミリーリガンドまたはそれらの組み合わせからなる群から選択される、チェックポイントタンパク質のリガンドを阻害するまたは該リガンドと相互作用する、(31)または(32)に記載の方法。
(34)前記チェックポイント阻害剤は、PD−L1、PD−L2、またはPD−1阻害剤である、(33)に記載の方法。
(35)前記チェックポイント阻害剤は、PD−1阻害剤である、(34)に記載の方法。
(36)PD−1阻害剤である前記チェックポイント阻害剤は、ニボルマブまたはペンブロリズマブである、(35)に記載の方法。
(37)PD−1阻害剤である前記チェックポイント阻害剤は、ニボルマブである、(35)に記載の方法。
(38)前記癌は、泌尿生殖器、婦人科、肺、胃腸、頭頚部癌、悪性神経膠腫および脳転移を含む脳腫瘍、悪性中皮腫、非転移性または転移性乳癌、悪性黒色腫、メルケル細胞癌腫または骨および軟部組織肉腫、血液学的腫瘍、多発性髄腫、ホジキン病、非ホジキンリンパ腫、急性骨髄性白血病、慢性骨髄性白血病、骨髄異形成症候群および急性リンパ芽球性白血病などのリンパ腫、非小細胞肺癌(NSCLC)、乳癌、転移性結腸直腸癌、ホルモン感受性またはホルモン不応性前立腺癌、結腸直腸癌、卵巣癌、肝細胞癌、腎細胞癌、膵臓癌、胃癌、食道癌、肝細胞癌、胆管細胞癌、頭頸部扁平上皮癌軟部組織肉腫、および小細胞肺癌からなる群から選択される、(23)〜(37)のいずれかに記載の方法。
(39)前記癌は、非小細胞肺癌(NSCLC)、乳癌、または結腸直腸癌である、(38)に記載の方法。
(40)前記癌は、非小細胞肺癌(NSCLC)である、(39)に記載の方法。
(41)2−デオキシ−2−フルオロ−L−フコースもしくはそのプロドラッグ、または薬学的に許容可能なその塩を含む組成物が、前記対象に投与される、(23)〜(40)のいずれかに記載の方法。
(42)前記組成物は、固体または液体製剤である、(41)に記載の方法。
(43)前記対象は哺乳類である、(23)〜(42)のいずれかに記載の方法。
(44)前記哺乳類はヒトである、(43)に記載の方法。
Claims (39)
- 有効量の2−デオキシ−2−フルオロ−L−フコースもしくはその酢酸エステル、カルボン酸エステル、もしくはリン酸エステルプロドラッグ、または薬学的に許容可能なその塩を含み、チェックポイント阻害剤と組み合わせて使用される、それを必要とする対象における癌を治療するための医薬組成物であって、チェックポイント阻害剤が、PD−L1、PD−L2、またはPD−1を阻害するモノクローナル抗体である、医薬組成物。
- 有効量の2−デオキシ−2−フルオロ−L−フコースもしくはその酢酸エステル、カルボン酸エステル、もしくはリン酸エステルプロドラッグ、または薬学的に許容可能なその塩と、チェックポイント阻害剤を含む、それを必要とする対象における癌を治療するための医薬組成物であって、チェックポイント阻害剤が、PD−L1、PD−L2、またはPD−1を阻害するモノクローナル抗体である、医薬組成物。
- 有効量の2−デオキシ−2−フルオロ−L−フコースもしくはその酢酸エステル、カルボン酸エステル、もしくはリン酸エステルプロドラッグ、または薬学的に許容可能なその塩を含み、チェックポイント阻害剤と組み合わせて使用される、それを必要とする対象における腫瘍の増殖を阻害するための医薬組成物であって、チェックポイント阻害剤が、PD−L1、PD−L2、またはPD−1を阻害するモノクローナル抗体である、医薬組成物。
- 有効量の2−デオキシ−2−フルオロ−L−フコースもしくはその酢酸エステル、カルボン酸エステル、もしくはリン酸エステルプロドラッグ、または薬学的に許容可能なその塩と、チェックポイント阻害剤を含む、それを必要とする対象における腫瘍の増殖を阻害するための医薬組成物であって、チェックポイント阻害剤が、PD−L1、PD−L2、またはPD−1を阻害するモノクローナル抗体である、医薬組成物。
- 2−デオキシ−2−フルオロ−L−フコースもしくはその酢酸エステル、カルボン酸エステル、もしくはリン酸エステルプロドラッグ、または薬学的に許容可能なその塩と、前記チェックポイント阻害剤との前記組み合わせは、癌の治療においてまたは腫瘍細胞の増殖の阻害において、相加効果または相乗効果を提供する、請求項1〜4のいずれか一項に記載の医薬組成物。
- 2−デオキシ−2−フルオロ−L−フコースもしくはその酢酸エステル、カルボン酸エステル、もしくはリン酸エステルプロドラッグ、または薬学的に許容可能なその塩と、前記チェックポイント阻害剤との前記組み合わせは、癌の治療においてまたは腫瘍細胞の増殖の阻害において相乗効果を提供する、請求項5に記載の医薬組成物。
- 2−デオキシ−2−フルオロ−L−フコースまたは薬学的に許容可能なその塩を含む、請求項1〜6のいずれか一項に記載の医薬組成物。
- 2−デオキシ−2−フルオロ−L−フコースの酢酸エステル、カルボン酸エステル、もしくはリン酸エステルプロドラッグまたは薬学的に許容可能なその塩を含む、請求項1〜6のいずれか一項に記載の医薬組成物。
- 2−デオキシ−2−フルオロ−L−フコースのカルボン酸エステルプロドラッグまたは薬学的に許容可能なその塩を含む、請求項8に記載の医薬組成物。
- 2−デオキシ−2−フルオロ−L−フコースの酢酸エステルまたは薬学的に許容可能なその塩を含む、請求項8に記載の医薬組成物。
- 前記チェックポイント阻害剤は、ヒト化抗体および完全ヒト抗体からなる群から選択される、請求項1〜10のいずれか一項に記載の医薬組成物。
- 前記チェックポイント阻害剤は、PD−1阻害剤である、請求項1〜11のいずれか一項に記載の医薬組成物。
- PD−1阻害剤は、ニボルマブまたはペンブロリズマブである、請求項12に記載の医薬組成物。
- PD−1阻害剤は、ニボルマブである、請求項12に記載の医薬組成物。
- 前記癌は、泌尿生殖器、婦人科、肺、胃腸、頭頚部癌、悪性神経膠腫および脳転移を含む脳腫瘍、悪性中皮腫、非転移性または転移性乳癌、悪性黒色腫、メルケル細胞癌腫または骨および軟部組織肉腫、血液学的腫瘍、多発性髄腫、ホジキン病、非ホジキンリンパ腫、急性骨髄性白血病、慢性骨髄性白血病、骨髄異形成症候群および急性リンパ芽球性白血病などのリンパ腫、非小細胞肺癌(NSCLC)、乳癌、転移性結腸直腸癌、ホルモン感受性またはホルモン不応性前立腺癌、結腸直腸癌、卵巣癌、肝細胞癌、腎細胞癌、膵臓癌、胃癌、食道癌、肝細胞癌、胆管細胞癌、頭頸部扁平上皮癌軟部組織肉腫、および小細胞肺癌からなる群から選択される、請求項1〜14のいずれか一項に記載の医薬組成物。
- 前記癌は、非小細胞肺癌(NSCLC)、乳癌、または結腸直腸癌である、請求項15に記載の医薬組成物。
- 前記癌は、非小細胞肺癌(NSCLC)である、請求項16に記載の医薬組成物。
- 固体または液体製剤である、請求項1〜17のいずれか一項に記載の医薬組成物。
- 前記対象は哺乳類である、請求項1〜18のいずれか一項に記載の医薬組成物。
- 前記哺乳類はヒトである、請求項19に記載の医薬組成物。
- 有効量の2−デオキシ−2−フルオロ−L−フコースもしくはその酢酸エステル、カルボン酸エステル、もしくはリン酸エステルプロドラッグ、または薬学的に許容可能なその塩を含み、チェックポイント阻害剤と組み合わせて使用される、チェックポイント阻害剤の効果を開始、増強、または延長するための、または、それを必要とする対象において、チェックポイント阻害剤に前記対象が応答することを可能にするための医薬組成物であって、チェックポイント阻害剤が、PD−L1、PD−L2、またはPD−1を阻害するモノクローナル抗体である、医薬組成物。
- 有効量の2−デオキシ−2−フルオロ−L−フコースもしくはその酢酸エステル、カルボン酸エステル、もしくはリン酸エステルプロドラッグ、または薬学的に許容可能なその塩と、チェックポイント阻害剤を含む、チェックポイント阻害剤の効果を開始、増強、または延長するための、または、それを必要とする対象において、チェックポイント阻害剤に前記対象が応答することを可能にするための医薬組成物であって、チェックポイント阻害剤が、PD−L1、PD−L2、またはPD−1を阻害するモノクローナル抗体である、医薬組成物。
- 2−デオキシ−2−フルオロ−L−フコースもしくはその酢酸エステル、カルボン酸エステル、もしくはリン酸エステルプロドラッグ、または薬学的に許容可能なその塩と、前記チェックポイント阻害剤との前記組み合わせは、癌の治療においてまたは腫瘍細胞の増殖の阻害において、相加効果または相乗効果を提供する、請求項21または22に記載の医薬組成物。
- 2−デオキシ−2−フルオロ−L−フコースもしくはその酢酸エステル、カルボン酸エステル、もしくはリン酸エステルプロドラッグ、または薬学的に許容可能なその塩と、前記チェックポイント阻害剤との前記組み合わせは、癌の治療においてまたは腫瘍細胞の増殖の阻害において相乗効果を提供する、請求項23に記載の医薬組成物。
- 腫瘍成長の阻害、腫瘍細胞死の誘発、腫瘍退行、腫瘍再発、腫瘍成長、腫瘍拡大の予防または遅延、および腫瘍排除から選択される抗腫瘍応答のための、請求項21〜24のいずれか一項に記載の医薬組成物。
- 2−デオキシ−2−フルオロ−L−フコースまたは薬学的に許容可能なその塩を含む、請求項21〜25のいずれか一項に記載の医薬組成物。
- 2−デオキシ−2−フルオロ−L−フコースの酢酸エステル、カルボン酸エステル、もしくはリン酸エステルプロドラッグまたは薬学的に許容可能なその塩を含む、請求項21〜25のいずれか一項に記載の医薬組成物。
- 2−デオキシ−2−フルオロ−L−フコースのカルボン酸エステルプロドラッグまたは薬学的に許容可能なその塩を含む、請求項27に記載の医薬組成物。
- 2−デオキシ−2−フルオロ−L−フコースの酢酸エステルまたは薬学的に許容可能なその塩を含む、請求項27に記載の医薬組成物。
- 前記チェックポイント阻害剤は、ヒト化抗体および完全ヒト抗体からなる群から選択される、請求項21〜29のいずれか一項に記載の医薬組成物。
- 前記チェックポイント阻害剤は、PD−1阻害剤である、請求項21〜30のいずれか一項に記載の医薬組成物。
- PD−1阻害剤は、ニボルマブまたはペンブロリズマブである、請求項31に記載の医薬組成物。
- PD−1阻害剤は、ニボルマブである、請求項31に記載の医薬組成物。
- 前記癌は、泌尿生殖器、婦人科、肺、胃腸、頭頚部癌、悪性神経膠腫および脳転移を含む脳腫瘍、悪性中皮腫、非転移性または転移性乳癌、悪性黒色腫、メルケル細胞癌腫または骨および軟部組織肉腫、血液学的腫瘍、多発性髄腫、ホジキン病、非ホジキンリンパ腫、急性骨髄性白血病、慢性骨髄性白血病、骨髄異形成症候群および急性リンパ芽球性白血病などのリンパ腫、非小細胞肺癌(NSCLC)、乳癌、転移性結腸直腸癌、ホルモン感受性またはホルモン不応性前立腺癌、結腸直腸癌、卵巣癌、肝細胞癌、腎細胞癌、膵臓癌、胃癌、食道癌、肝細胞癌、胆管細胞癌、頭頸部扁平上皮癌軟部組織肉腫、および小細胞肺癌からなる群から選択される、請求項21〜33のいずれか一項に記載の医薬組成物。
- 前記癌は、非小細胞肺癌(NSCLC)、乳癌、または結腸直腸癌である、請求項34に記載の医薬組成物。
- 前記癌は、非小細胞肺癌(NSCLC)である、請求項35に記載の医薬組成物。
- 固体または液体製剤である、請求項21〜36のいずれか一項に記載の医薬組成物。
- 前記対象は哺乳類である、請求項21〜37のいずれか一項に記載の医薬組成物。
- 前記哺乳類はヒトである、請求項38に記載の医薬組成物。
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562263228P | 2015-12-04 | 2015-12-04 | |
| US62/263,228 | 2015-12-04 | ||
| US201662308583P | 2016-03-15 | 2016-03-15 | |
| US62/308,583 | 2016-03-15 | ||
| US201662321857P | 2016-04-13 | 2016-04-13 | |
| US62/321,857 | 2016-04-13 | ||
| PCT/US2016/064783 WO2017096274A1 (en) | 2015-12-04 | 2016-12-02 | Cancer treatment using 2-deoxy-2-fluoro-l-fucose in combination with a checkpoint inhibitor |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2019501145A JP2019501145A (ja) | 2019-01-17 |
| JP2019501145A5 JP2019501145A5 (ja) | 2020-01-16 |
| JP6906520B2 true JP6906520B2 (ja) | 2021-07-21 |
Family
ID=58797961
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018528650A Active JP6906520B2 (ja) | 2015-12-04 | 2016-12-02 | チェックポイント阻害剤と組みわせて2−デオキシ−2−フルオロ−l−フコースを用いる癌治療 |
Country Status (13)
| Country | Link |
|---|---|
| US (1) | US20180353524A1 (ja) |
| EP (1) | EP3383404A4 (ja) |
| JP (1) | JP6906520B2 (ja) |
| KR (1) | KR20180086233A (ja) |
| CN (1) | CN108289903B (ja) |
| AU (1) | AU2016362993A1 (ja) |
| BR (1) | BR112018011261A2 (ja) |
| CA (1) | CA3005997A1 (ja) |
| EA (1) | EA201891340A1 (ja) |
| IL (1) | IL259479B (ja) |
| MX (1) | MX2018006674A (ja) |
| SG (2) | SG11201804263PA (ja) |
| WO (1) | WO2017096274A1 (ja) |
Families Citing this family (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DK2608796T3 (en) | 2010-08-05 | 2019-03-18 | Seattle Genetics Inc | Inhibition of protein fucosylation in vivo using fucose analogues |
| CN117586403A (zh) | 2016-10-11 | 2024-02-23 | 艾吉纳斯公司 | 抗lag-3抗体及其使用方法 |
| KR20200015580A (ko) | 2017-06-07 | 2020-02-12 | 시애틀 지네틱스, 인크. | 감소된 표면 푸코실화를 갖는 t 세포 및 이를 생산하고 사용하는 방법 |
| US11911404B2 (en) * | 2017-10-13 | 2024-02-27 | H. Lee Moffitt Cancer Center And Research Institute, Inc. | Fucosylation and immune surveillance in melanoma |
| CA3107596A1 (en) | 2018-08-23 | 2020-02-27 | Seagen Inc. | Anti-tigit antibodies |
| KR20210104837A (ko) * | 2018-12-19 | 2021-08-25 | 씨젠 인크. | 항체의 제어된 푸코실화 |
| WO2021034774A1 (en) * | 2019-08-16 | 2021-02-25 | H. Lee Moffitt Cancer Center And Research Institute, Inc. | Fucosylation and immune modulation in cancer |
| CN111973749B (zh) * | 2020-09-07 | 2023-03-21 | 威海人生药业集团股份有限公司 | 一种抗肿瘤免疫治疗的药物组合物 |
| WO2022221766A1 (en) * | 2021-04-16 | 2022-10-20 | H. Lee Moffitt Cancer Center And Research Institute, Inc. | Fucosylation and immune modulation in cancer |
| CN113274502B (zh) * | 2021-05-05 | 2023-01-03 | 中山大学肿瘤防治中心(中山大学附属肿瘤医院、中山大学肿瘤研究所) | 用于特定型三阴乳腺癌免疫治疗的组合物 |
| WO2022236017A1 (en) * | 2021-05-06 | 2022-11-10 | H. Lee Moffitt Cancer Center And Research Institute, Inc. | L-fucose and anti-androgen receptor therapy for treatment of cancer |
| CN113413465B (zh) * | 2021-06-15 | 2022-06-03 | 北京大学 | 岩藻糖基化抑制剂在抗癌导致炎症中的应用 |
| CN115466297B (zh) * | 2022-08-25 | 2023-07-07 | 青岛农业大学 | L-岩藻糖的应用以及动物饲料 |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DK2608796T3 (en) * | 2010-08-05 | 2019-03-18 | Seattle Genetics Inc | Inhibition of protein fucosylation in vivo using fucose analogues |
| KR20160093012A (ko) | 2013-11-05 | 2016-08-05 | 코그네이트 바이오서비시즈, 인코포레이티드 | 암 치료를 위한 체크포인트 억제제 및 치료제의 배합물 |
-
2016
- 2016-12-02 EP EP16871645.4A patent/EP3383404A4/en not_active Withdrawn
- 2016-12-02 WO PCT/US2016/064783 patent/WO2017096274A1/en active Application Filing
- 2016-12-02 CN CN201680071076.0A patent/CN108289903B/zh not_active Expired - Fee Related
- 2016-12-02 SG SG11201804263PA patent/SG11201804263PA/en unknown
- 2016-12-02 CA CA3005997A patent/CA3005997A1/en not_active Abandoned
- 2016-12-02 BR BR112018011261A patent/BR112018011261A2/pt not_active Application Discontinuation
- 2016-12-02 EA EA201891340A patent/EA201891340A1/ru unknown
- 2016-12-02 AU AU2016362993A patent/AU2016362993A1/en not_active Abandoned
- 2016-12-02 US US15/781,256 patent/US20180353524A1/en not_active Abandoned
- 2016-12-02 KR KR1020187017824A patent/KR20180086233A/ko unknown
- 2016-12-02 JP JP2018528650A patent/JP6906520B2/ja active Active
- 2016-12-02 MX MX2018006674A patent/MX2018006674A/es unknown
- 2016-12-02 SG SG10202005298RA patent/SG10202005298RA/en unknown
-
2018
- 2018-05-21 IL IL259479A patent/IL259479B/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| SG11201804263PA (en) | 2018-06-28 |
| EP3383404A1 (en) | 2018-10-10 |
| KR20180086233A (ko) | 2018-07-30 |
| EP3383404A4 (en) | 2019-07-31 |
| CA3005997A1 (en) | 2017-06-08 |
| IL259479A (en) | 2018-07-31 |
| WO2017096274A1 (en) | 2017-06-08 |
| BR112018011261A2 (pt) | 2018-11-21 |
| AU2016362993A1 (en) | 2018-07-12 |
| CN108289903A (zh) | 2018-07-17 |
| MX2018006674A (es) | 2018-11-09 |
| JP2019501145A (ja) | 2019-01-17 |
| US20180353524A1 (en) | 2018-12-13 |
| EA201891340A1 (ru) | 2018-11-30 |
| SG10202005298RA (en) | 2020-07-29 |
| IL259479B (en) | 2022-03-01 |
| CN108289903B (zh) | 2021-08-03 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6906520B2 (ja) | チェックポイント阻害剤と組みわせて2−デオキシ−2−フルオロ−l−フコースを用いる癌治療 | |
| US11779555B2 (en) | Combination of immunotherapy with local chemotherapy for the treatment of malignancies | |
| EP2893003B1 (en) | Selective and controlled expansion of educated nk cells | |
| KR20200133370A (ko) | 입양 주입된 t 세포의 지속성 강화 방법 | |
| US7951374B2 (en) | Methods for inhibiting STAT3 signaling in immune cells | |
| CA2937499A1 (en) | Methods and compositions for antibody and antibody-loaded dendritic cell mediated therapy | |
| US20210060158A1 (en) | Agonist of aryl hydrocarbon receptor for use in cancer combination therapy | |
| EP3806848A2 (en) | Increasing immune activity through modulation of postcellular signaling factors | |
| JP2022512161A (ja) | 免疫療法のための組成物及び方法 | |
| TW202241468A (zh) | 用腫瘤浸潤性淋巴球療法與braf抑制劑及/或mek抑制劑組合治療癌症患者 | |
| US11559504B2 (en) | Ceramide nanoliposomes, compositions and methods of using for immunotherapy | |
| EP4321533A1 (en) | Cellular immunotherapy use | |
| JP2021523098A (ja) | T細胞による認識を強化するよう抗原性を調節する方法 | |
| JP6712262B2 (ja) | 免疫療法に使用するための細胞集団 | |
| EP3750988A1 (en) | Improved alpha beta t processed cell production method | |
| US9101558B2 (en) | Use of anti-cancer cell composition for treatment of head and neck cancer, which is intended to be administered to nutrient artery of tumor | |
| JP2017526702A (ja) | PPAR−γアゴニストを投与する段階を含む、癌を治療する方法 | |
| Wang | Sialoglycan–Siglec axis in the modulation of dendritic cells functions | |
| CA3222925A1 (en) | Cancer therapies comprising peptide loaded cxcr3- and ccr5-inducing dendritic cells and chemokine modulatory agents | |
| WO2024092227A1 (en) | Factors for optimizing immunotherapy | |
| WO2023004461A1 (en) | Universal receptor immune cell therapy | |
| WO2022265864A2 (en) | Tim-3 modulates anti-tumor immunity by regulating inflammasome activation |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| RD01 | Notification of change of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7426 Effective date: 20190705 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20190705 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20191129 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20191129 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20200918 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20200929 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20201224 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20210601 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20210629 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6906520 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |