KR20180086233A - 체크포인트 저해제와 병용되는 2-데옥시-2-플루오로-l-푸코스를 사용하는 암 치료 - Google Patents
체크포인트 저해제와 병용되는 2-데옥시-2-플루오로-l-푸코스를 사용하는 암 치료 Download PDFInfo
- Publication number
- KR20180086233A KR20180086233A KR1020187017824A KR20187017824A KR20180086233A KR 20180086233 A KR20180086233 A KR 20180086233A KR 1020187017824 A KR1020187017824 A KR 1020187017824A KR 20187017824 A KR20187017824 A KR 20187017824A KR 20180086233 A KR20180086233 A KR 20180086233A
- Authority
- KR
- South Korea
- Prior art keywords
- cancer
- deoxy
- fucose
- fluoro
- checkpoint inhibitor
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/39541—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against normal tissues, cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/39558—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against tumor tissues, cells, antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2818—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against CD28 or CD152
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Immunology (AREA)
- Epidemiology (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- Mycology (AREA)
- Biomedical Technology (AREA)
- Microbiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Biochemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Oncology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicinal Preparation (AREA)
Abstract
본 발명은 체크포인트 저해제와 병용되는 유효량의 2-데옥시-2-플루오로-L-푸코스 또는 이의 전구약물, 또는 이의 약제학적으로 허용 가능한 염을 이를 필요로 하는 대상체에 투여하는 단계를 포함하는, 암 치료 방법에 대한 것이다.
Description
관련 출원에 대한 교차 참고
본 출원은 2015년 12월 4일에 출원된 미국 특허 가출원 제62/263,228호; 2016년 3월 15일에 출원된 제62/308,583호; 및 2016년 4월 13일에 출원된 제62/321,857호의 이익을 청구하며, 각각은 그 전문이 모든 목적에 대해 본원에 포함된다.
6-데옥시-L-갈락토스로도 지칭되는 L-푸코스는 동물에서 일부 N- 및 O-결합 글리칸 및 당지질의 성분인 단당류이다(문헌[Becker and Lowe, Glycobiology 13:41R-51R (2003)] 참조). 푸코스는 전형적으로 혈액형 항원, 셀렉틴 및 항체에 부착된 글리칸을 포함하는, 글리칸에 대한 말단 변형으로서 부가된다. 푸코스는 특이적 푸코실전달효소에 의해 α(1,2)-, α(1,3)-, α(1,4)- 및 α(1,6)-결합을 통해 글리칸에 부착될 수 있다. α(1,2)-푸코스 결합은 전형적으로 H-혈액형 항원과 연관된다. α(1,3)- 및 α(1,4)-푸코스 결합은 루이스(LewisX) 항원의 변형과 연관된다. α(1,6)-푸코스 결합은 항체 상에 있는 것들과 같은, N-결합 GlcNAc 분자와 연관된다.
단백질의 푸코실화는 포유류 발생에서 역할을 담당하는 것으로 여겨진다. FX 유전자의 표적화된 돌연변이에 대해 동종접합성인 마우스는 치사 표현형을 포함하는 다표현형발현 비정상성을 나타낸다. 이종접합성 교배로부터의 마우스의 회복 감소도 보고되었다(Becker et al., Mammalian Genome 14:130-139 (2003)). 이상 단백질 푸코실화는 암에서의 시알릴 루이스X의 상향-조절을 포함하여, 인간 질환과 연관되는 것으로 제안되었다. 이들 글리칸은 E- 및 P-셀렉틴 분자에 대한 리간드이다. 암 세포에서 시알릴 루이스X 글리칸의 증가는 내피 상에서 E- 및 P-셀렉틴과의 상호작용을 통해 전이를 증가시키는 것으로 추정된다. 2-데옥시-2-플루오로-L-푸코스를 포함하는 푸코스 유사체의 생체내 투여, 단백질 탈푸코실화에 대한 이의 효과, 및 암 치료를 위한 이의 잠재적 용도가 국제 출원 WO 2012019165에 기재되었으며, 이는 본원에 참고로 포함된다.
표적화된 제제로 면역 반응을 복귀시키고, 이에 따라 신체의 면역계를 활성화함으로써 암을 간접적으로 치료하기 위해 면역계의 T-세포 상에서 오프-스위치로 작용하는 면역 체크포인트가 조사되었다.
국제 출원 W02002086083, W02004004771, W02004056875, W02006121168, W02008156712, W02010077634, W02011066389, W02014055897 및 W02014100079는 PD-1, PD-L1 저해 항체 및/또는 이러한 항체의 확인 방법을 보고한다. 또한 US8735553 및 US8168757과 같은 미국 특허는 PD-1 또는 PD-L1 저해 항체 및/또는 융합 단백질을 보고한다. W02002086083, W02004004771, W02004056875, W02006121168, W02008156712, W02010077634, W02011066389, W02014055897 및 W02014100079뿐만 아니라 US8735553 및 US8168757의 개시는 본원에 이의 전문이 참고로 포함된다.
또한, 국제 출원 W02011161699, W02012168944, W02013144704, W02013132317 및 WO 2016044900은 프로그래밍된 세포사(PD-1) 신호전달 경로를 억제하고/하거나 저해할 수 있는 펩티드 또는 펩티도모사 화합물을 보고한다. W02011161699, W02012168944, W02013144704, W02013132317 및 WO 2016044900의 개시는 본원에 이의 전문이 참고로 포함된다.
또한, 국제 출원 WO 2016142852, WO 2016142894, WO 2016142886, WO 2016142835 및 WO 2016142833은 프로그래밍된 세포사 1(PD-1) 신호전달 경로를 억제하고/하거나 저해할 수 있고/있거나 PD-1, PD-L1 또는 PD-L2에 의해 유도되는 면역억제 신호를 저해함으로써 장애를 치료할 수 있는 소분자 화합물을 보고한다. WO 2016142852, WO 2016142894, WO 2016142886, WO 2016142835 및 WO 2016142833의 개시는 이의 전문이 본원에 참고로 포함된다.
최근에, 세포독성 T-림프구-연관 항원 4(CTLA-4)를 표적화하는 모노클로날 항체인 이필리무맵(Yervoy®) 및 T-세포 표면 상의 프로그래밍된 세포사 단백질 1 경로(PD-1)를 표적화하는 모노클로날 항체인 니볼루맵(nivolumab, Opdivo®)이 진행 흑색종, 진행 신장 세포 암종, 및 비-소세포 폐암의 치료에 대해 미국 식약처의 승인을 받았다. 그러나 최근의 체크포인트 저해제 치료법은 부분적으로 기존 면역 활성화 및 저해 수용체의 존재로 인해, 암 대상체 모집단의 비교적 작은 모집단에서의 암 치료에 유효하다. 따라서, 비반응 대상체 모집단 및 반응 대상체 모집단 모두에서 체크포인트 저해제의 효과를 개시하거나 증강시키기 위한 방법 및 조합 치료법을 개발할 필요성이 존재한다.
본 발명의 요약
본 발명은 대상체에서 암의 치료 또는 종양 세포의 증식을 저해하는 데 유효하고/하거나 종양 세포에 대한 면역 반응을 개시하거나, 증강시키거나, 연장시킬 수 있는, 2-데옥시-2-플루오로-L-푸코스(본원에서 "2FF"로도 지칭됨) 및 체크포인트 저해제를 사용하는 조합 치료를 개시한다.
도 1a는 KLH-접합 A20 Id Fab(음용수 중 20 mM 2-데옥시-2-플루오로-L-푸코스)를 이용한 백신접종을 포함하거나 포함하지 않는 BALB/c 마우스에서 IV 이식된 A20 마우스 림프종 세포의 성장에 대한 2-데옥시-2-플루오로-L-푸코스의 생체내 효과를 나타낸다.
도 1b는 KLH-접합 A20 Id Fab(음용수 중 20 mM 2-데옥시-2-플루오로-L-푸코스)를 이용한 백신접종과 조합으로 BALB/c 마우스에서 IV 이식된 A20 마우스 림프종 세포의 성장에 대한 2-데옥시-2-플루오로-L-푸코스의 생체내 효과에 대한 면역 세포 하위세트 고갈의 효과를 나타낸다.
도 2a는 혈청-함유 배지 중 T-세포와 공동-배양된 DC 상의 수지상 세포("DC"로도 지칭됨) 마커의 측정(대조군 공동-배양 대비 2-데옥시-2-플루오로-L-푸코스-처리 공동-배양의 MFI)을 나타낸다.
도 2b는 혈청-비함유 배지 중 T-세포와 공동-배양된 DC 상의 DC 마커의 측정(대조군 혈청-비함유 공동-배양 대비 2-데옥시-2-플루오로-L-푸코스-처리 혈청-비함유 공동-배양의 MFI)을 나타낸다.
도 3은 3가지 상이한 테트라머(EBV, M1, 및 CMV)에 대한 T-세포의 테트라머 결합의 비교(대조군 T-세포 대비 2-데옥시-2-플루오로-L-푸코스-처리 T-세포에 대한 결합의 MFI)를 나타낸다.
도 4는 CD3/CD28 활성화 T-세포(2-데옥시-2-플루오로-L-푸코스 처리를 포함하거나 포함하지 않는)에서 ZAP의 TCR-매개 인산화를 나타낸다.
도 5는 FACS에 의해 평가되는 2-데옥시-2-플루오로-L-푸코스 처리를 포함하거나 포함하지 않는 T-세포에서의 갈렉틴-3의 발현을 나타낸다.
도 6은 TGFβ로 자극받은 대조군 T-세포 대비 2-데옥시-2-플루오로-L-푸코스 처리된 T-세포에서의 SMAD2의 인산화의 비교를 나타낸다.
도 7a 및 7b는 대조군 T-세포 대비 2-데옥시-2-플루오로-L-푸코스 처리된 T-세포에서의 FOXp3 발현 및 조절 T-세포%의 비교를 나타낸다.
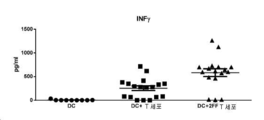
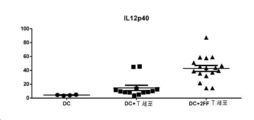
도 8a, 8b 및 8c는 각각 (a) INFγ, (b) IL12p40, 및 (c) CD40L에서의 T-세포/DC 공동-배양 사이토카인을 나타낸다.
도 9는 2-데옥시-2-플루오로-L-푸코스 + KLH-개별특이형(2-데옥시-2-플루오로-L-푸코스)(BALB/c 마우스) 대비 KLH-개별특이형(대조군)의 A20 백신 모델 사이토카인 평가를 나타낸다.
도 10a 및 10b는 인간 공동-배양에서, 각각 IFNγ 및 IL-12p70의 시험관내 생산을 나타낸다.
도 11은 BALB/c 마우스에서 IV 이식된 A20 마우스 림프종 세포의 성장에 대한 2-데옥시-2-플루오로-L-푸코스, 항-PD1 항체 및 2FF와 항-PD1 항체의 조합의 생체내 효과를 나타낸다(음용수 중 20 mM 2FF, 5 ㎎/㎏ 항-PD1 q3×3).
도 12a~c는 종양 미세환경에서의 활성 면역 반응을 나타낸다.
도 1b는 KLH-접합 A20 Id Fab(음용수 중 20 mM 2-데옥시-2-플루오로-L-푸코스)를 이용한 백신접종과 조합으로 BALB/c 마우스에서 IV 이식된 A20 마우스 림프종 세포의 성장에 대한 2-데옥시-2-플루오로-L-푸코스의 생체내 효과에 대한 면역 세포 하위세트 고갈의 효과를 나타낸다.
도 2a는 혈청-함유 배지 중 T-세포와 공동-배양된 DC 상의 수지상 세포("DC"로도 지칭됨) 마커의 측정(대조군 공동-배양 대비 2-데옥시-2-플루오로-L-푸코스-처리 공동-배양의 MFI)을 나타낸다.
도 2b는 혈청-비함유 배지 중 T-세포와 공동-배양된 DC 상의 DC 마커의 측정(대조군 혈청-비함유 공동-배양 대비 2-데옥시-2-플루오로-L-푸코스-처리 혈청-비함유 공동-배양의 MFI)을 나타낸다.
도 3은 3가지 상이한 테트라머(EBV, M1, 및 CMV)에 대한 T-세포의 테트라머 결합의 비교(대조군 T-세포 대비 2-데옥시-2-플루오로-L-푸코스-처리 T-세포에 대한 결합의 MFI)를 나타낸다.
도 4는 CD3/CD28 활성화 T-세포(2-데옥시-2-플루오로-L-푸코스 처리를 포함하거나 포함하지 않는)에서 ZAP의 TCR-매개 인산화를 나타낸다.
도 5는 FACS에 의해 평가되는 2-데옥시-2-플루오로-L-푸코스 처리를 포함하거나 포함하지 않는 T-세포에서의 갈렉틴-3의 발현을 나타낸다.
도 6은 TGFβ로 자극받은 대조군 T-세포 대비 2-데옥시-2-플루오로-L-푸코스 처리된 T-세포에서의 SMAD2의 인산화의 비교를 나타낸다.
도 7a 및 7b는 대조군 T-세포 대비 2-데옥시-2-플루오로-L-푸코스 처리된 T-세포에서의 FOXp3 발현 및 조절 T-세포%의 비교를 나타낸다.
도 8a, 8b 및 8c는 각각 (a) INFγ, (b) IL12p40, 및 (c) CD40L에서의 T-세포/DC 공동-배양 사이토카인을 나타낸다.
도 9는 2-데옥시-2-플루오로-L-푸코스 + KLH-개별특이형(2-데옥시-2-플루오로-L-푸코스)(BALB/c 마우스) 대비 KLH-개별특이형(대조군)의 A20 백신 모델 사이토카인 평가를 나타낸다.
도 10a 및 10b는 인간 공동-배양에서, 각각 IFNγ 및 IL-12p70의 시험관내 생산을 나타낸다.
도 11은 BALB/c 마우스에서 IV 이식된 A20 마우스 림프종 세포의 성장에 대한 2-데옥시-2-플루오로-L-푸코스, 항-PD1 항체 및 2FF와 항-PD1 항체의 조합의 생체내 효과를 나타낸다(음용수 중 20 mM 2FF, 5 ㎎/㎏ 항-PD1 q3×3).
도 12a~c는 종양 미세환경에서의 활성 면역 반응을 나타낸다.
본 발명은 적응 면역 반응의 활성화 또는 증강에 기반하는 신규한 조합 치료를 기재한다. 적응 면역 반응 메커니즘은 기존 항-종양 면역 반응(즉, 활성화 T-세포)이 존재하는 경우에만 체크포인트 저해제가 작용하거나 더 효과적으로 작용할 것임을 암시한다. 예를 들어, 기존 항-종양 반응을 갖지 않는 환자에서, 체크포인트 저해제만으로는 유효하지 않을 수 있을 것이다. 따라서, 항-종양 활성(예컨대, 항-종양 면역 반응)을 활성화하고 체크포인트 차단을 저해할 수 있는 조합 치료는 체크포인트 저해제만에 의한 치료에 반응하지 않는 대상체가 이러한 조합된 치료로부터 이익을 얻도록 할 것이므로 바람직할 수 있다.
본 발명은 특히, 체크포인트 저해제와 병용되는 유효량의 2-데옥시-2-플루오로-L-푸코스 또는 이의 전구약물, 또는 이의 약제학적으로 허용 가능한 염을 이를 필요로 하는 대상체에 투여하는 단계를 포함하는 암 치료 방법을 제공한다. 본 발명은 특히, 체크포인트 저해제와 병용되는 유효량의 2-데옥시-2-플루오로-L-푸코스 또는 이의 전구약물, 또는 이의 약제학적으로 허용 가능한 염을 대상체에 투여하는 단계를 포함하는, 이를 필요로 하는 대상체에서 종양의 증식 저해 방법을 또한 제공한다. 본 발명은 특히, 체크포인트 저해제와 병용되는 유효량의 2-데옥시-2-플루오로-L-푸코스 또는 이의 전구약물, 또는 이의 약제학적으로 허용 가능한 염을 대상체에 투여하는 단계를 포함하는, 이를 필요로 하는 대상체에서 체크포인트 저해제의 효과 증강 또는 연장 방법을, 또는 대상체가 체크포인트 저해제에 반응할 수 있도록 하는 방법을 추가로 제공한다.
일부 양태에서, 투여되는 2-데옥시-2-플루오로-L-푸코스 또는 이의 전구약물, 또는 이의 약제학적으로 허용 가능한 염, 및 체크포인트 저해제의 조합은 암 치료에서 또는 종양 세포의 증식 저해에서 상가효과 또는 상승효과를 제공한다. 다른 양태에서, 투여되는 2-데옥시-2-플루오로-L-푸코스 또는 이의 전구약물, 또는 이의 약제학적으로 허용 가능한 염, 및 체크포인트 저해제의 조합은 암 치료에서 또는 종양 세포의 증식 저해에서 상승적 효과를 제공한다. 다른 양태에서, 2-데옥시-2-플루오로-L-푸코스 또는 이의 약제학적으로 허용 가능한 염은 체크포인트 저해제와 병용 투여된다. 다른 양태에서, 2-데옥시-2-플루오로-L-푸코스의 전구약물 또는 이의 약제학적으로 허용 가능한 염은 체크포인트 저해제와 병용 투여된다. 일부 구현예에서, 2-데옥시-2-플루오로-L-푸코스의 카복실릭 에스테르 전구약물 또는 이의 약제학적으로 허용 가능한 염은 체크포인트 저해제와 병용 투여된다. 일부 구현예에서, 2-데옥시-2-플루오로-L-푸코스의 아세테이트 에스테르 또는 이의 약제학적으로 허용 가능한 염은 체크포인트 저해제와 병용 투여된다.
일부 구현예에서, 체크포인트 저해제는 생물학적 치료제 또는 소분자이다. 일부 구현예에서, 체크포인트 저해제는 모노클로날 항체, 인간화 항체, 완전 인간 항체 및 융합 단백질 또는 이의 조합으로 이루어진 군으로부터 선택된다. 일부 구현예에서, 체크포인트 저해제는 CTLA-4, PD-1, PD-L1, PD-L2, B7-H3, B7-H4, BMA, HVEM, TIM3, GAL9, LAG3, VISTA, KIR, 2B4, CD160, CGEN-15049, CHK1, CHK2, A2aR, 및 B-7 패밀리 리간드 또는 이의 조합으로 이루어진 군으로부터 선택되는 체크포인트 단백질의 리간드를 저해하거나 이와 상호작용한다. 일부 구현예에서, 체크포인트 저해제는 PD-L1, PD-L2, 또는 PD-1 저해제이다. 일부 구현예에서, 체크포인트 저해제는 PD-1 저해제이다. 일부 구현예에서, 체크포인트 저해제는 PD-1 저해제는 니볼루맵 또는 펨브롤리주맵(pembrolizumab)이다. 다른 구현예에서, 체크포인트 저해제는 PD-1 저해제는 니볼루맵이다.
일부 구현예에서, 암은 고형 종양이다. 일부 구현예에서, 암은 액체 종양이다. 일부 구현예에서, 암은 비뇨생식기 암, 부인과 암, 폐암, 위장관 암, 두부경부암, 악성 교종 및 뇌 전이를 포함하는 뇌암, 악성 중피종, 비-전이성 또는 전이성 유방암, 악성 흑색종, 메르켈 세포 암종 또는 뼈 및 연조직 육종, 혈액 종양, 다발 골수종, 림프종, 예컨대 호지킨병, 비-호지킨 림프종, 급성 골수성 백혈병, 만성 골수성 백혈병, 골수형성이상 증후군 및 급성 림프모구 백혈병, 비-소세포 폐암(NSCLC), 유방암, 전이성 결장직장암, 호르몬 민감성 또는 호르몬 불응성 전립선암, 결장직장암, 난소암, 간세포암, 신장 세포암, 췌장암, 위암, 식도암, 간세포암, 쓸개관세포암, 두부경부 편평상피세포암 연조직 육종, 및 소세포 폐암으로 이루어진 군으로부터 선택된다. 일부 구현예에서, 암은 비-소세포 폐암(NSCLC), 유방암, 또는 결장직장암이다. 일부 구현예에서, 암은 비-소세포 폐암(NSCLC)이다. 일부 구현예에서, 2-데옥시-2-플루오로-L-푸코스 또는 이의 전구약물, 또는 이의 약제학적으로 허용 가능한 염을 포함하는 조성물은 대상체에 투여된다. 일부 구현예에서, 조성물은 고체 또는 액체 제형이다. 일부 구현예에서, 체크포인트 저해제 및 2-데옥시-2-플루오로-L-푸코스는 동시에 또는 어느 순서로든 순차적으로 투여된다. 일부 구현예에서, 대상체는 포유류이다. 일부 구현예에서, 포유류는 인간이다.
정의
용어 "저해하다" 또는 "의 저해"는 측정 가능한 양만큼 감소시키거나 전적으로 예방하는 것을 의미한다. 본원에서 사용되는 바와 같은 용어 저해는 적어도 약 10%, 적어도 약 15%, 적어도 약 20%, 적어도 약 25%, 적어도 약 30%, 적어도 약 35%, 적어도 약 40%, 적어도 약 50%, 적어도 약 60%, 적어도 약 70%, 적어도 약 80%, 적어도 약 90%, 적어도 약 95%, 또는 적어도 약 99% 저해 또는 감소를 지칭할 수 있다.
용어 "치료" 또는 "치료하다"는 질환 또는 병태의 임상 또는 진단 증상의 감소 또는 제거에 의해 입증되는 바와 같이, 환자에서의 질환 또는 병태의 진행 지연, 중지, 또는 역전을 지칭한다. 치료는, 예를 들어, 증상의 중증도, 증상의 수, 또는 재발의 빈도 감소를 포함할 수 있다.
용어 "약제학적으로 허용 가능한"은 연방 또는 주 정부의 규제 당국에 의해 승인되었거나 동물, 및 보다 구체적으로 인간에서의 사용을 위해 미국 약전 또는 다른 일반적으로 인식되는 약전에 기재되었음을 의미한다. 용어 "약제학적으로 상용성인 성분"은 2-데옥시-2-플루오로-L-푸코스와 함께 투여되는 약제학적으로 허용 가능한 희석제, 아주반트, 부형제, 또는 비히클을 지칭한다.
본원에서 사용되는 바와 같은 용어 "전구약물"은 생체내 투여 시 화합물의 활성 형태로 전환되는 화합물을 지칭한다. 예를 들어, 활성 화합물의 전구약물 형태는 비제한적으로 활성 화합물의 아실화(아세틸화 또는 기타) 및 에테르 유도체, 카복실릭 에스테르 또는 포스페이트 에스테르 및 다양한 염 형태일 수 있다. 당업자는 숙주 유기체 또는 환자 내의 표적화된 부위로 활성 화합물의 전달을 촉진하기 위해 주제 발명의 화합물을 어떻게 쉽게 전구약물 형태로 변형하는지를 인지할 것이다. 당업자는 또한 적용 가능한 경우, 암의 치료에서 화합물의 의도되는 효과를 최대화하기 위해 숙주 유기체 또는 환자 내의 표적화된 부위로의 요망되는 화합물의 전달에서 전구약물 형태의 바람직한 약동학 파라미터를 이용할 것이다.
2-데옥시-2-플루오로-L-푸코스 또는 이의 전구약물, 또는 이의 약제학적으로 허용 가능한 염은 전형적으로 요망되지 않는 오염물질로부터 실질적으로 순수하다. 이는 2-데옥시-2-플루오로-L-푸코스 또는 이의 전구약물, 또는 이의 약제학적으로 허용 가능한 염이 전형적으로 적어도 약 50% w/w(중량/중량) 또는 약 80% w/w 순도, 보다 바람직하게는 적어도 약 90% 또는 약 95% w/w 순도일 뿐만 아니라 불순물 및 다른 오염물질이 실질적으로 없음을 의미한다. 통상적인 정제 기법을 사용하여, 적어도 99% w/w의 균질한 산물이 수득될 수 있다.
치료 목적을 위한 용어 "대상체" 또는 "환자"는 임의의 동물, 특히 인간, 가축 및 농장 동물, 및 동물원, 스포츠, 또는 애완 동물, 예컨대 개, 말, 고양이, 소 등을 포함하는 포유류로 분류되는 동물을 지칭한다. 바람직하게는, 대상체는 인간이다.
용어 "치료 유효량" 또는 "유효량"은 대상체에서 암의 진행을 지연하거나, 중지시키거나, 역전시키기에 또는 환자의 생존을 증가시키기에 충분한 본원에 기재되는 바와 같은 하나 이상의 제제 또는 조성물의 양을 지칭한다. 치료 유효량은, 예를 들어, 질환 진행의 지연에서 유효한 것으로 나타난 표적 혈청 농도를 지칭할 수 있다. 용어 "치료 유효량"이 조합 치료법을 지칭하기 위해 사용되는 경우, 이는 조합된 효과가 요망되는 생물학적 또는 의학적 반응을 유발하도록 함께 취해지는 제제의 조합량을 지칭한다. 유효성은 치료받을 병태에 따라, 통상적 방식으로 측정될 수 있다. 예를 들어, 종양 질환에서, 유효성은 질환 진행까지의 시간(TTP)을 평가하거나 반응률(RR)을 결정함으로써 측정될 수 있다.
본원에서 사용되는 바와 같은 용어 "상승작용" 또는 "상승적 효과"는 제제 조합의 유효성의 설명에 관해 사용되는 경우, 개별 제제의 효과의 합으로부터 예측되는 효과보다 큰 조합의 임의의 측정된 효과를 의미한다.
본원에서 사용되는 바와 같은 용어 "상가" 또는 "상가효과"는 제제 조합의 유효성의 설명에 관해 사용되는 경우, 개별 제제의 효과의 합으로부터 예측되는 효과와 유사한 조합의 임의의 측정된 효과를 의미한다.
치료 방법
고상 2-데옥시-2-플루오로-L-푸코스는 다음과 같은 화학 구조(I)를 가지며, 알파 또는 베타 아노머일 수 있다:
[화학식 I]
용액 중, 2-데옥시-2-플루오로-L-푸코스는 상응하는 알도스 형태를 통해 다음과 같은 화학 구조(II)를 갖는 화합물로 상호전환될 수 있다:
[화학식 II]
따라서, 본원에서 사용되는 바와 같은 용어 "2-데옥시-2-플루오로-L-푸코스"는 화학식 I, II의 화합물, 또는 상응하는 알도스 형태, 또는 이의 혼합물을 지칭하며, 각각의 화학식 I 또는 II는 독립적으로 알파 또는 베타 아노머일 수 있다.
시험관내 숙주 세포에 의해 생산되는 항체 또는 항체 유도체의 복잡한 N-글리코시드-결합 당쇄 내로의 푸코스 혼입을 감소시키는 2-데옥시-2-플루오로-L-푸코스가 WO 2009/135181에 기재되어 있다. 생체내 투여되는 경우 단백질 푸코실화를 저해하는 2-데옥시-2-플루오로-L-푸코스뿐만 아니라 그 잠재적인 항-종양 효과가 WO 2012/019165에 기재되어 있다. WO 2009/135181 및 WO 2012/019165 둘 다의 개시는 본 출원의 개시에 이의 전문이 참고로 포함된다.
놀랍게도 2-데옥시-2-플루오로-L-푸코스는 조절 T-세포를 감소시키는 것으로 확인되었다. 본원에 제공되는 방법에서, 2-데옥시-2-플루오로-L-푸코스는 T-세포가 2-데옥시-2-플루오로-L-푸코스로의 처리에 의해 비푸코실화되는 경우 유도되는 T-세포 활성 변화로 인해 암을 치료하기 위한 면역조정제로서 사용될 수 있다. 일어나는 변화는 조절 T-세포 모집단의 감소, 항원 제시 세포의 T-세포 활성화 증가뿐만 아니라 다시 APC의 증가된 활성화를 일으킬 수 있는 증가된 T-세포 수용체 신호전달을 포함한다. T-세포 활성의 이러한 변형의 결과는 면역억제성 종양 미세환경을 감소시킬뿐만 아니라 T-세포 및 APC 활성화를 증가시킬 것이다. 따라서, 2-데옥시-2-플루오로-L-푸코스로의 처리는 증가된 숙주-매개 항-종양 면역 반응으로 이어져서 종양 진행의 지연 또는 종양 개시까지의 지연을 일으킬 것이다. 항-종양 활성은 또한 2-데옥시-2-플루오로-L-푸코스 처리 세포의 직접적인, 적응 전달과 함께 일어날 수 있다. 본원에 제공되는 방법을 위한 2-데옥시-2-플루오로-L-푸코스는 대상체, 예컨대 이를 필요로 하는 인간에서 암을 치료하기 위한 유효량으로 대상체에 체크포인트 저해제와 병용으로 안전하게 투여될 수 있다. 본원에 제공되는 방법에서, 체크포인트 저해제와 조합되는 2-데옥시-2-플루오로-L-푸코스는 또한 기존 PD-1 조합 치료, 예컨대 PD-1 저해제 및 CTLA-4 저해제의 조합에 비해 더 우수한 안전성 프로필을 제공한다.
일부 구현예에서, 2-데옥시-2-플루오로-L-푸코스(또는 2-데옥시-2-플루오로-L-푸코스의 세포내 대사물질 또는 산물)는 암 백신과 함께 투여되는 경우 체액성 및 세포성 면역 반응을 증가시킨다. 일부 구현예에서, 2-데옥시-2-플루오로-L-푸코스(또는 2-데옥시-2-플루오로-L-푸코스의 세포내 대사물질 또는 산물)는 CD45RO1+ T-세포 모집단(기억 T-세포 표현형)을 증가시킨다. 일부 구현예에서, 2-데옥시-2-플루오로-L-푸코스(또는 2-데옥시-2-플루오로-L-푸코스의 세포내 대사물질 또는 산물) 처리 T-세포는 비-처리(대조군) T-세포에 비해 수지상 세포를 더 활성화한다. 일부 구현예에서, 2-데옥시-2-플루오로-L-푸코스(또는 2-데옥시-2-플루오로-L-푸코스의 세포내 대사물질 또는 산물)는 항원-특이적(예를 들어, EBV-특이적) 테트라머 결합을 증가시킨다. 일부 구현예에서, 2-데옥시-2-플루오로-L-푸코스(또는 2-데옥시-2-플루오로-L-푸코스의 세포내 대사물질 또는 산물)는 조절 T-세포 모집단뿐만 아니라 FOXp3+ 세포의 수를 감소시킨다. 항-CTLA4 체크포인트 저해제는 조절 T-세포 모집단을 감소시키는 것으로 나타났으며 상이한 기계적 표적을 갖는 다른 체크포인트 저해제, 예컨대 항-PD1 및 항-PD-L1 항체와 성공적으로 조합되었다. 따라서, 일부 구현예에서, 2-데옥시-2-플루오로-L-푸코스(또는 2-데옥시-2-플루오로-L-푸코스의 세포내 대사물질 또는 산물)는 다른 체크포인트 저해제, 예컨대 항-PD1 또는 항-PD-L1 항체와 병용 투여된다.
본원에 제공되는 2-데옥시-2-플루오로-L-푸코스는 대상체에서 암을 치료하는 데 유용하다. 이를 필요로 하는 동물(예컨대, 포유류, 예컨대 인간)에 대한 2-데옥시-2-플루오로-L-푸코스의 투여는 종양 세포(들) 또는 암 세포(들)의 증식 저해, 또는 동물(예컨대, 인간 환자)에서의 암 치료를 일으킬 수 있다. 따라서 2-데옥시-2-플루오로-L-푸코스는 동물 암 치료를 위한 다양한 설정에서 사용될 수 있다.
2-데옥시-2-플루오로-L-푸코스로 치료될 수 있는 특정 유형의 암은 고형 종양 및 혈액 종양을 포함한다. 이러한 암은 비제한적으로 (1) 비제한적으로 섬유육종, 점액육종, 지방육종, 연골육종, 뼈 육종, 척삭종, 혈관육종, 내피육종, 림프관육종, 림프관내피육종, 윤활막종, 중피종, 유잉 종양, 평활근육종, 횡문근육종, 결장암, 결장직장암, 신장암, 췌장암, 뼈암, 유방암, 난소암, 전립선암, 식도암, 위암, 구강암, 비강암, 인후암, 편평상피세포 암종, 기저 세포 암종, 샘암종, 땀샘 암종, 피지샘 암종, 유두모양 암종, 유두모양 샘암종, 낭샘암종, 수질 암종, 기관지유래 암종, 신장 세포 암종, 간암 쓸개관 암종, 융모막암종, 고환종, 배아 암종, 윌름 종양, 자궁경부암, 자궁암, 고환암, 소세포 폐암종, 방광 암종, 폐암, 상피 암종, 교종, 교모세포종, 다형 별아교세포종, 수모세포종, 머리인두종, 뇌실막종, 솔방울샘종, 혈관모세포종, 청신경집종, 희소돌기아교세포종, 수막종, 피부암, 흑색종, 신경모세포종, 및 망막모세포종을 포함하는 고형 종양; (2) 비제한적으로 급성 림프모구 백혈병 "ALL", 급성 림프모구 B-세포 백혈병, 급성 림프모구 T-세포 백혈병, 급성 골수모구 백혈병 "AML", 급성 전골수구 백혈병 "APL", 급성 단일모구 백혈병, 급성 적백혈병성 백혈병, 급성 거대모구 백혈병, 급성 골수단핵구 백혈병, 급성 비림프구 백혈병, 급성 미분화 백혈병, 만성 골수구 백혈병 "CML", 만성 림프구 백혈병 "CLL", 털세포 백혈병, 다발 골수종, 급성 및 만성 백혈병, 예컨대, 림프모구 골수구 및 림프구 골수구 백혈병을 포함하는 혈액-매개 암, 및 (3) 림프종, 예컨대 호지킨병, 비-호지킨 림프종, 다발 골수종, 발덴스트롬 마크로글로불린혈증, 중쇄 질환, 및 진성적혈구증가증을 포함한다.
일부 양태에서, 2-데옥시-2-플루오로-L-푸코스는 적어도 10 mM의 농도에서 제형 완충액(예컨대 수성 제형 완충액) 중 가용성이다. 일부 구현예에서, 2-데옥시-2-플루오로-L-푸코스는 적어도 100 mM의 농도에서 제형 완충액 중 가용성이다. 일부 양태에서, 2-데옥시-2-플루오로-L-푸코스는 적어도 100 ㎍/㎖, 적어도 1 ㎎/㎖, 적어도 50 ㎎/㎖, 적어도 약 100 ㎎/㎖, 적어도 약 200 ㎎/㎖, 또는 적어도 약 300 ㎎/㎖의 농도에서 제형 완충액(예컨대 수성 제형 완충액) 중 가용성이다.
2-데옥시-2-플루오로-L-푸코스 또는 그 전구약물, 또는 이의 약제학적으로 허용 가능한 염은 치료 또는 예방 유효량의 2-데옥시-2-플루오로-L-푸코스 또는 그 전구약물, 또는 이의 약제학적으로 허용 가능한 염 및 하나 이상의 약제학적으로 상용성인(허용 가능한) 성분을 포함하는 약학 조성물로서 제형화될 수 있다. 일부 양태에서, 유효량의 2-데옥시-2-플루오로-L-푸코스(들)가 포유류에 대한 투여에 적합한 부형제와 혼합된, 2-데옥시-2-플루오로-L-푸코스 및 약제학적 부형제의 약학 조성물이 제공된다. 바람직한 양태에서, 2-데옥시-2-플루오로-L-푸코스는 인간에 대한 투여를 위해 제형화된다. 따라서, 본 발명은 인간에 대한 투여를 위해 제형화된 2-데옥시-2-플루오로-L-푸코스를 포함하는 약학 조성물을 제공한다. 제형화된 2-데옥시-2-플루오로-L-푸코스는 일반적으로 하나 이상의 약제학적으로 상용성인(허용 가능한) 성분을 포함할 것이다.
예시적인 약학 또는 비-약학 조성물은 전형적으로 하나 이상의 담체(예컨대, 멸균 액체, 예컨대 물 및 석유, 동물, 식물 또는 합성 기원의 것들을 포함하는 오일, 예컨대 땅콩유, 대두유, 미네랄 오일, 참기름 등)를 포함한다. 약학 조성물이 정맥내 투여되는 경우, 물이 보다 전형적인 담체이다. 식염수 용액 및 수성 덱스트로스 및 글리세롤 용액도 액체 담체로서, 특히 주사용 용액을 위해 이용될 수 있다. 적합한 부형제는, 예를 들어, 아미노산, 전분, 글루코스, 락토스, 수크로스, 젤라틴, 맥아, 쌀, 밀가루, 석회분말, 실리카 겔, 스테아르산나트륨, 모노스테아르산글리세롤, 활석, 염화나트륨, 건조 탈지유, 글리세롤, 프로필렌, 글리콜, 물, 에탄올 등을 포함한다. 조성물은, 요망되는 경우, 소량의 수화제 또는 유화제, 또는 pH 완충제를 또한 함유할 수 있다. 이들 조성물은 용액, 현탁액, 에멀젼, 정제, 알약, 캡슐, 분말, 지속-방출 제형 등의 형태를 취할 수 있다. 적합한 약제학적 담체의 예는 문헌["Remington's Pharmaceutical Sciences" by E.W. Martin]에 기재되어 있다. 이러한 조성물은 전형적으로 대상체에 대한 적절한 투여를 위한 형태를 제공하기 위해 적합한 양의 담체와 함께, 전형적으로 정제된 형태로 치료 유효량의 2-데옥시-2-플루오로-L-푸코스를 함유할 것이다. 제형은 투여 방식에 상응한다.
본원에 기재되는 약학 조성물은 조성물이 동물(예컨대, 포유류)에 투여될 수 있도록 하는 임의의 형태일 수 있다. 조성물은 고체 또는 액체의 형태일 수 있다. 전형적인 투여 경로는 비제한적으로 경구, 비경구, 및 설하를 포함한다. 비경구 투여는 피하 주사, 복강내 주사, 정맥내, 근육내, 흉골내 주사 또는 주입 기법을 포함한다. 바람직하게는, 조성물은 경구 투여된다. 이들 약학 조성물은 2-데옥시-2-플루오로-L-푸코스가 동물에 대한 조성물의 투여 시 생체 적합성이 되도록 제형화될 수 있다. 조성물은 또한, 예를 들어, 정제가 단일 투여량 단위일 수 있는, 하나 이상의 투여량 단위의 형태를 취할 수 있고, 고체 형태의 2-데옥시-2-플루오로-L-푸코스의 용기는 복수의 투여량 단위를 보유할 수 있다.
약학 조성물의 제조에서 사용되는 물질은 사용되는 양으로 비독성일 수 있다. 당업자에게는 약학 조성물 중 활성 성분(들)의 최적 투여량이 다양한 요인에 의존할 것임이 명백할 것이다. 관련 인자는 비제한적으로 동물(예컨대, 인간)의 유형, 2-데옥시-2-플루오로-L-푸코스의 특정 형태, 투여 방식, 이용되는 조성물, 및 치료받는 질환 또는 병태의 중증도를 포함한다.
약제학적으로 허용 가능한 담체 또는 비히클은 조성물이, 예를 들어 정제 또는 분말 형태이도록 하는 미립자일 수 있다. 담체(들)는 액체일 수 있고, 조성물은, 예를 들어, 경구 시럽, 풍미 첨가수, 또는 주사액이다.
경구 투여를 위해 의도되는 경우, 조성물은 바람직하게는 고체 또는 액체 형태이며, 여기서 반-고체, 반-액체, 현탁액 및 겔 형태는 고체 또는 액체로서 본원에서 간주되는 형태 내에 포함된다.
경구 투여를 위한 고체 조성물로서, 조성물은 분말, 과립, 압축 정제, 알약, 캡슐, 츄잉 검, 웨이퍼 등의 형태로 제형화될 수 있다. 이러한 고체 조성물은 전형적으로 하나 이상의 불활성 희석제를 함유한다. 또한, 다음 중 하나 이상이 존재할 수 있다: 결합제, 예컨대 카복시메틸셀룰로스, 에틸 셀룰로스, 미세결정질 셀룰로스, 또는 젤라틴; 부형제, 예컨대 전분, 락토스 또는 덱스트린, 붕해제, 예컨대 알긴산, 알긴산나트륨, 프리모겔(Primogel), 옥수수 전분 등; 윤활제, 예컨대 스테아르산마그네슘 또는 스테로텍스(Sterotex); 활택제, 예컨대 콜로이드성 이산화규소; 감미제, 예컨대 수크로스 또는 사카린, 풍미제, 예컨대 페퍼민트, 살리실산메틸 또는 오렌지 풍미제, 및 착색제.
조성물이 캡슐, 예컨대, 젤라틴 캡슐의 형태인 경우, 이는 상기 유형의 물질에 부가하여, 액체 담체, 예컨대 폴리에틸렌 글리콜, 사이클로덱스트린 또는 지방 오일을 함유할 수 있다.
조성물은 액체, 예컨대, 엘릭서, 시럽, 용액, 에멀젼 또는 현탁액의 형태일 수 있다. 액체는 경구 투여 또는 주사에 의한 전달에 유용할 수 있다. 경구 투여를 위해 의도되는 경우, 조성물은 하나 이상의 감미제, 보존제, 염료/착색제, 및 풍미 증강제를 포함할 수 있다. 일부 양태에서, 조성물은 분말로 제형화되며, 최종 사용자가 경구 투여를 위한 수용액에 분말을 혼합한다. 주사에 의한 투여를 위한 조성물(상술된 바와 같음)에서, 하나 이상의 계면활성제, 보존제, 수화제, 분산제, 현탁화제, 완충액, 안정화제 및 등장화제가 또한 포함될 수 있다.
상기 주지된 바와 같이, 본원에 기재되는 방법에서 유효한 2-데옥시-2-플루오로-L-푸코스의 양은 장애 또는 병태의 성질에 의존할 것이며, 표준 임상 기법에 의해 결정될 수 있다. 또한, 시험관내 또는 생체내 검정이 선택적으로 이용되어 최적 투여량 범위의 확인을 도울 수 있다. 조성물에서 이용될 정확한 용량도 투여 경로, 및 질환 또는 장애의 심각성에 의존할 것이며, 실시자의 판단 및 각 환자의 상황에 따라 결정되어야 한다.
조성물은 적합한 투여량이 수득되도록 할 유효량의 2-데옥시-2-플루오로-L-푸코스를 포함한다. 전형적으로, 이 양은 조성물 중량을 기준으로 적어도 약 0.01%의 2-데옥시-2-플루오로-L-푸코스이다. 일부 양태에서, 경구 투여를 위해 의도되는 경우, 이 양은 조성물 중량을 기준으로 약 0.1% 내지 약 100% 범위까지 변할 수 있다. 바람직한 경구 조성물은, 예를 들어, 조성물 중량을 기준으로 약 4% 내지 100%, 4% 내지 75% 또는 4% 내지 약 50%의 2-데옥시-2-플루오로-L-푸코스를 포함할 수 있다.
일부 양태에서, 정맥내 투여를 위해, 투여되는 양은 2-데옥시-2-플루오로-L-푸코스 약 1 내지 약 500 ㎎/체중㎏의 범위일 것이다.
일반적으로, 동물에 투여되는 2-데옥시-2-플루오로-L-푸코스의 경구 투여량은 약 1 ㎎/동물 체중㎏ 내지 약 1 g/동물 체중㎏, 더욱 전형적으로 약 5 ㎎/동물 체중㎏, 10 ㎎/동물 체중㎏, 25 ㎎/동물 체중㎏, 50 ㎎/동물 체중㎏, 100 ㎎/동물 체중㎏, 150 ㎎/동물 체중㎏, 200 ㎎/동물 체중㎏, 250 ㎎/동물 체중㎏, 또는 300 ㎎/동물 체중㎏ 내지 약 500 ㎎/동물 체중㎏이다. 일부 양태에서, 동물에 투여되는 투여량은 1일 당 약 1 g, 약 5 g, 또는 약 10 g 내지 약 150 g, 또는 1일 당 약 1 g, 약 5 g, 약 10 g, 약 15 g 또는 약 20 g 내지 약 60 g이다.
일반적으로, 2-데옥시-2-플루오로-L-푸코스 또는 이의 약학 조성물은 요망되는 효과에 따라, 매일, 매주, 2주마다 또는 매달 일정으로 투여될 수 있다. 일부 양태에서, 2-데옥시-2-플루오로-L-푸코스 또는 이의 약학 조성물은 약 1 내지 5, 약 1 내지 약 10, 약 1 내지 약 15 이상의 사이클로 투여될 수 있으며, 각각의 사이클은 1개월 기간이다. 각 사이클 내의 용량은 매일(1일 1회, 1일 2회, 또는 1일 2회 초과 포함), 2일마다, 1주 2회, 매주, 2주 1회, 3주 1회 또는 매월 기준으로 제공될 수 있다. 사이클은 선택적으로 휴약 기간을 포함할 수 있다. 대안적으로, 휴약 기간은 사이클 사이에 포함될 수 있다. 일부 양태에서, 투여는 질환의 기간 동안일 것이다.
2-데옥시-2-플루오로-L-푸코스, 또는 이의 약학 조성물의 바람직한 투여 방식은 실시자의 판단에 달려 있으며, 부분적으로는 의학적 병태 부위에 의존할 것이다. 하나의 구현예에서, 2-데옥시-2-플루오로-L-푸코스 또는 조성물은 비경구로 투여된다. 다른 구현예에서, 2-데옥시-2-플루오로-L-푸코스 또는 조성물은 경구로 투여된다.
다른 구현예에서, 2-데옥시-2-플루오로-L-푸코스는 소포, 특히 리포좀(문헌[Langer, Science 249:1527-1533 (1990); Treat et al., in LIPOSOMES IN THE THERAPY OF INFECTIOUS DISEASE AND CANCER, Lopez-Berestein and Fidler (eds.), Liss, New York, pp. 353-365 (1989); Lopez-Berestein, 동일 문헌, pp. 317-327] 참조; 일반적으로 동일 문헌 참조)에서 전달될 수 있다.
다른 구현예에서, 2-데옥시-2-플루오로-L-푸코스 또는 조성물은 제어 방출 시스템에서 전달될 수 있다. 하나의 구현예에서, 펌프가 사용될 수 있다(문헌[Langer, 상기 문헌; Sefton, CRC Crit. Ref. Biomed. Eng. 14:201 (1987); Buchwald et al., Surgery 88:507 (1980); Saudek et al., N. Engl. J. Med. 321:574 (1989)] 참조). 다른 구현예에서, 중합체성 물질이 사용될 수 있다(문헌[MEDICAL APPLICATIONS OF CONTROLLED RELEASE, Langer and Wise (eds.), CRC Pres., Boca Raton, Fla. (1974); CONTROLLED DRUG BIOAVAILABILITY, DRUG PRODUCT DESIGN AND PERFORMANCE, Smolen and Ball (eds.) Wiley, New York (1984); Ranger and Peppas, J. Macromol. Sci. Rev. Macromol. Chem. 23:61 (1983)] 참조; 또한 문헌[Levy et al., Science 228:190(1985); During et al., Ann. Neurol. 25:351(1989); Howard et al., J. Neurosurg. 71:105 (1989)] 참조). Langer의 리뷰(Science 249:1527-1533 (1990))에서 논의된 다른 제어-방출 시스템이 사용될 수 있다.
용어 "담체"는 2-데옥시-2-플루오로-L-푸코스와 함께 투여되는 희석제, 아주반트 또는 부형제를 지칭한다. 이러한 약제학적 담체는 액체, 예컨대 물 및 석유, 동물, 식물 또는 합성 기원의 것들을 포함하는 오일, 예컨대 땅콩유, 대두유, 미네랄 오일, 참기름 등일 수 있다. 담체는 식염수, 아카시아 고무, 젤라틴, 전분 페이스트, 활석, 케라틴, 콜로이드성 실리카, 우레아 등일 수 있다. 또한, 보조제, 안정화제, 증점제, 윤활제 및 착색제가 사용될 수 있다. 하나의 구현예에서, 동물에 투여되는 경우, 2-데옥시-2-플루오로-L-푸코스 또는 조성물 및 약제학적으로 허용 가능한 담체는 멸균성이다. 2-데옥시-2-플루오로-L-푸코스가 정맥내 투여되는 경우 물이 바람직한 담체이다. 식염수 용액 및 수성 덱스트로스 및 글리세롤 용액도 액체 담체로서, 특히 주사 용액을 위해 이용될 수 있다. 적합한 약제학적 담체는 또한 부형제, 예컨대 전분, 글루코스, 락토스, 수크로스, 젤라틴, 맥아, 쌀, 밀가루, 석회분말, 실리카 겔, 스테아르산나트륨, 모노스테아르산글리세롤, 활석, 염화나트륨, 건조 탈지유, 글리세롤, 프로필렌, 글리콜, 물, 에탄올 등을 포함한다. 본 발명의 조성물은, 요망되는 경우, 소량의 수화제 또는 유화제, 또는 pH 완충제를 또한 함유할 수 있다.
면역 체크포인트는 자가-관용성을 유지하고 말초 조직 손상을 최소화하기 위해 면역계 반응 정도를 조정하는 데 관여하는 면역계에서의 저해 경로를 지칭한다. 그러나, 종양 세포는 또한 종양 조직에 대해 면역 반응의 효과를 감소시키기 위해(면역 반응을 '차단하기 위해') 면역계 체크포인트를 활성화할 수 있다. 대부분의 항암제와는 대조적으로, 체크포인트 저해제는 종양 세포를 직접 표적화하지 않으며, 오히려 면역계의 내인성 항종양 활성을 증강시키기 위해 림프구 수용체 또는 이의 리간드를 표적화한다(Pardoll, 2012, Nature Reviews Cancer 12:252-264) 면역계 체크포인트, 예컨대 CTLA4, PD1 및 PD-L1에 대한 길항성 체크포인트 차단 항체를 이용한 치료법은 암 및 다른 질환에 대한 면역치료법의 가장 유망한 새로운 방법 중 하나이다. 추가적인 체크포인트 표적, 예컨대 TIM-3, LAG-3, 다양한 B-7 리간드, CHK 1 및 CHK2 키나제, BTLA, A2aR 등도 조사 중이다. 현재, CTLA-4 저해제인 이필리무맵(Yervoy®), 및 둘 다 PD-1 저해제인 펨브롤리주맵(Keytruda®) 및 니볼루맵(Opdivo®)을 포함하는 3개의 체크포인트 저해제가 암 치료를 위해 미국 식약처로부터 신속 승인을 받았다. 또한, 몇몇 체크포인트 저해제가 임상 시험 중이다.
최근 데이터는 종양 자체 내에서 일어날 수 있는 항-CTLA-4 항체의 이차적 메커니즘을 제시한다. CTLA-4는 종양내 효과기 T-세포(본원에서 "Teff 세포"로도 지칭됨)에 비해, 조절 T-세포(본원에서 "Treg 세포"로도 지칭됨) 상에서 더 높은 수준으로 종양 내 발현되는 것으로 나타나서, 항-CTLA-4가 Treg 세포에 우선적으로 영향을 미친다는 가설을 유도하였다["Therapeutic use of anti-CTLA-4 antibodies", Christian U. Blank and Alexander Enk, International Immunology, Vol. 27, No. 1, pp. 3-10]. PD-1 및 CTLA-4 조합의 최근 연구는 CTLA-4 및 PD-1 경로의 조합 차단이 또한 협력하여 조절 T-세포 및 MDSC 둘 다에 대한 Teff 세포의 비를 증가시킴으로써 종양 미세환경에서 억제를 감소시키고 염증을 촉진함을 나타낸다["Combination of CTLA-4 and PD-1 blockade expands infiltrating T-cells and reduces regulatory T and myeloid cells within B16 melanoma tumors" Curran et al., PNAS | March 2, 2010 | vol. 107 | no. 9 | 4275-4280]. 체크포인트 저해제 및 다른 치료제(들)의 조합은 체크포인트 저해제의 항-종양 반응 및/또는 치료제의 효과를 증강시키거나 연장시킬 수 있다. 이에 관해, WO 2015/069770은 암의 치료를 위한, 적응 면역 반응의 활성화에 기반한 조합 치료, 특히 CTLA-4 및 PD-1 저해제의 조합을 개시한다. WO 2015/069770의 개시는 본 출원의 개시에서 그 전문이 참고로 포함된다.
체크포인트 차단 항-CTLA-4 항체가 항-종양 효과를 매개하는 하나의 메커니즘은 조절 T-세포의 감소에 의한다. 항-CTLA-4 항체 작용의 구별되는 메커니즘으로 인해, 이들은 효과기 T-세포에 부여되는 억제 신호전달을 방출하기 위해 작용하는 항-PD1 체크포인트 차단 항체와 성공적으로 조합될 수 있다. 이들 항체를 이용한 이중 차단은 조합되어 전임상(Proc Natl Acad Sci USA 2010, 107, 4275-4280) 및 임상(N Engl J Med 2013, 369, 122-133; N Engl J Med 2015, 372, 2006-2017)에서 항-종양 반응을 개선한다.
일반적으로, 암의 치료에 유효한 2-데옥시-2-플루오로-L-푸코스 및 체크포인트 저해제의 최적량은 표준 임상 기법에 의해 결정될 수 있다. 또한, 시험관내 검정이 선택적으로 이용되어 최적 투여량 범위의 확인을 도울 수 있다. 제형에서 이용될 정확한 용량은 또한 투여 경로, 및 종양 단계에 의존할 것이며, 실시자의 판단 및 각 환자의 상황에 따라 결정되어야 한다. 유효 용량은 시험관내 또는 동물 모델 평가 시스템으로부터 유도되는 용량-반응 곡선으로부터 외삽될 수 있다.
추가 양태에서, 체크포인트 저해제 및 2-데옥시-2-플루오로-L-푸코스는 동시에 또는 어느 순서로든 순차적으로 투여된다. 특정 양태에서, 체크포인트 저해제는 PD-1 저해제 또는 CTLA-4 저해제이다. 다른 특정 양태에서, 체크포인트 저해제는 PD-1 저해제이다.
일부 구현예에서, 2-데옥시-2-플루오로-L-푸코스 및 체크포인트 저해제는 최대 관용 용량(MTD) 또는 최적 생물학적 용량(OBD)으로 대상체에 투여될 것이다. MTD 또는 OBD를 결정하는 것은 당분야의 범위 내이다. 일부 양태에서, 2-데옥시-2-플루오로-L-푸코스는 그 MTD 또는 OBD로 제공될 것이며, 체크포인트 저해제는 MTD 또는 OBD의 50%~100%, 바람직하게는 50% 내지 90%로 투여될 것이다. 대안적으로, 체크포인트 저해제는 그 MTD 또는 OBD로 투여될 것이며 2-데옥시-2-플루오로-L-푸코스는 MTD 또는 OBD의 50%~100%, 바람직하게는 50% 내지 90%로 투여될 것이다. 일부 양태에서, 2-데옥시-2-플루오로-L-푸코스 및 체크포인트 저해제는 둘 다 MTD 또는 OBD의 60% 내지 90%로 투여될 것이다.
본 발명에서 사용되는 바와 같이, 조합 요법은 동시에 제공될 수 있거나 엇갈리는 요법으로, 체크포인트 저해제가 치료 과정 동안 2-데옥시-2-플루오로-L-푸코스와 상이한 시점에 주어지며 제공될 수 있다. 상기 시차는 두 제제의 투여 간에 수 분, 수 시간, 수 일, 수 주 이상의 범위일 수 있다. 따라서, 용어 조합은 반드시 동시에 또는 단일 용량으로 투여됨을 의미하지는 않으며, 각각의 성분은 요망되는 치료 기간 동안 투여된다. 제제는 또한 상이한 경로로 투여될 수 있다.
2-데옥시-2-플루오로-L-푸코스의 전구약물 또는 2-데옥시-2-플루오로-L-푸코스 또는 그 전구약물의 약제학적으로 허용 가능한 염이 또한 본원에 제공된다. 따라서, 본원에 제공되는 임의의 다양한 구현예에서, 2-데옥시-2-플루오로-L-푸코스의 전구약물 또는 2-데옥시-2-플루오로-L-푸코스 또는 그 전구약물의 약제학적으로 허용 가능한 염이 사용될 수 있다.
본 발명의 이러한 및 다른 양태는 하기 상세한 설명, 특정 구현예의 비제한적인 실시예, 및 첨부 도면을 참고로 보다 자세히 이해될 수 있다.
실시예
실시예는 본 발명의 추가 이해를 보조하기 위해 제공된다. 이용되는 특정 물질, 프로토콜 및 조건은 본 발명의 추가 예시인 것으로 의도되며 이의 합리적인 범위를 제한하기 위한 것으로 간주되어서는 안 된다.
실시예 1. 면역 하위세트가 고갈된 A20 마우스 림프종 연구
KLH-A20 Id Fab를 문헌[Okeley et al PNAS 2012]에 기재된 바와 같이 생성하였다. A20 세포(ATCC)를 10% FBS, 10 mM HEPES, 1 mM 피루브산나트륨, 50 μM 2-메르캅토에탄올 및 페니실린(100 U/㎖)/스트렙토마이신(100 ㎍/㎖)(PS) 함유 RPMI 1640 중에 배양하였다. 면역접종 군(BALB/c, Harlan)에 TiterMax 아주반트 함유 KLH-Fab 콘주게이트(50 ㎍)(1:1)를 -21일에 피하 주사하고 -7일에 추가접종하였다. 2-데옥시-2-플루오로-L-푸코스 처리군은 -14일에 시작하여 20 mM 2-데옥시-2-플루오로-L-푸코스 함유 음용수를 수여하였다. 두 번째 백신접종(0일) 1주 후, 모든 마우스는 2.5×106 A20 종양 세포(i.v.)를 수여하였다. 2-데옥시-2-플루오로-L-푸코스 처리는 21일까지 계속한 후 일반 음용수를 제공하였다. 면역 세포의 고갈은 -6, -5, -4, 0 및 +7일에 투여된 고갈 항체를 이용하여 수행하였다(200 ㎍/마우스 i.p.). 항-CD4(GK1.5) 또는 항-CD8(53-6.72) 항체에 의한 CD4 또는 CD8 T-세포 고갈을 -1, 7, 14, 21, 29일에 혈중 확인하였다(FACS 분석). BALB/c 마우스로부터 0 및 29일에 비장에서 유사한 결과를 확인하였다. 도 1a 및 1b는 CD4 또는 CD8 T-세포의 고갈이 A20 개별특이형 백신 + 2-데옥시-2-플루오로-L-푸코스 조합의 활성을 감소시킴을 실증한다. 따라서 CD4 및 CD8 T-세포는 조합 활성에서 역할을 담당한다.
실시예 2. 전혈로부터의 T-세포 및 수지상 세포 단리
T-세포를 10 ㎖의 전혈로부터 단리하고 이를 처음에 10분 동안(중단 없이) 1200 rpm(300 × g)에서 원심분리하였다. 백혈구층을 손상시키지 않으면서 혈소판 함유 상부층을 조심스럽게 제거하였다. 이어서 RosetteSep™ 인간 T-세포 농축 칵테일(StemCell technologies(Vancouver, BC)로부터의 전체(Pan) T-세포)을 나머지 혈액(500 ㎕/혈액 10 ㎖)에 첨가하였다. 이를 20분 동안 인큐베이션한 후 1 ㎖ FBS를 10 ㎖ PBS와 함께 첨가하였다. 50 ㎖ Falcon 제조 혈액/PBS 용액에 둔 Histopaque(20~25 ㎖)를 매우 느리게 오버레이하였다. 이를 중단 없이 원심분리하였다(25℃, 1500 rpm, 25분). 상부층을 제거한 후 백혈구 연층 내 T-세포를 새로운 50 ㎖ 튜브로 옮겼다. T-세포를 PBS로 세척하고, 1 ㎖ ACK 용해 완충액 중에 재현탁하고, 25 ㎖까지 채우고, 5분 동안 인큐베이션하고, PBS로 50 ㎖로 만든 후 펠렛화하였다. 이 적혈구 용해 단계를 두 번째로 반복하였다. 이어서 T-세포를 T-세포 배지(10% 우태 혈청(FCS), 1% PS가 보충된 RPMI 배지 중에 재현탁하고, 2개의 T25 플라스크(100~200 μM 2-데옥시-2-플루오로-L-푸코스 함유 또는 비함유) 내로 분할하였다. CD3/CD28 항체 코팅 비드(20 ㎕/플라스크, Miltenyi Biotec)를 첨가하여 T-세포를 활성화하였다. 24 hr 후, IL2를 첨가하였다(100 ng/㎕, R&D Systems). 매 시기마다 세포를 계대하고, 새로운 IL2 및 2-데옥시-2-플루오로-L-푸코스를 첨가하였다.
90 ㎖의 혈액을 사용하고 혈소판 제거 후 RosetteSep™ 인간 T-세포 농축 칵테일을 첨가하지 않은 대신 동일 부피의 PBS(90 ㎖)를 첨가한 후 Histopaque 상에 오버레이한 것을 제외하고, PBMC를 T-세포와 유사하게 단리하였다. 상기와 같은 Histopaque 상의 원심분리는 PBMC-함유 백혈구 연층을 생성한다. 적혈구 용해 후, PBMC를 수지상 세포(DC) 배지(30% DMEM 70% X-VIVO™ 15 + 2 mM 글루타맥스 + 10% ATB 혈청 + 1% PS) 중에 재현탁하고, 6-웰 플레이트 내에 접종하고, 하룻밤 동안 인큐베이션하였다. 다음 날 상청액을 흡입하여 폐기하면서 부착 세포를 배지 중에 세척한 후 웰 당 IL4(100 ng/㎕, R&D Systems) 및 GM-CSF(200 ng/㎕, R&D Systems)가 보충된 2 ㎖ 배지로 보충하여 부착 단핵구를 DC로 분화 및 증식시켰다. 플레이트를 4~5일 동안 인큐베이션한 후, 세포를 T25 플라스크 내로 이동시켰다. 매 시기마다 세포를 계대하고(2~3일마다) 새로운 사이토카인을 제공하였다.
T-세포 및 DC의 공동-배양
48웰 플레이트에서 10:1(T-세포:DC)의 비로 DC 배지 중에서 공동-배양 실험을 수행하였다. DC(20000~30000/웰) 및 10배 더 많은 T-세포를 DC 배지 중 총 200 ㎕/웰로 각 웰에 접종하였다. 공동-배양을 24 h 인큐베이션한 후 세포를 후술된 바와 같이 DC 성숙 마커에 대해 평가하였다.
트랜스웰 공동-배양
트랜스웰 검정을 24-웰 플레이트에서 수행하였다. 공동-배양을 500 ㎕의 웰 당 최종 부피로 상술된 바와 같이 접종하였다. 트랜스웰 샘플에 있어서 DC를 웰 내 접종하고 T-세포를 삽입부 내에 넣었다. 그 뒤 세포를 24 h 인큐베이션하고 트랜스웰 없이 공동-배양과 동일한 방식으로 검사하였다.
혈청-비함유 공동-배양
DC를 8일까지 기재된 바와 같이 성장시켜, 일반 배지를 함유하는 하나의 플라스크 및 혈청 비함유 배지를 갖는 다른 플라스크의 2개 플라스크 내로 분할하였다. 혈청이 존재하지 않지만, X-VIVO™ 15 배지는 배양의 건강상태 유지를 돕는 성장 인자를 함유한다. 공동-배양 실험을 48-웰 플레이트에서 상술된 바와 같이 수행하였다.
공동-배양에서 DC 마커의 분석
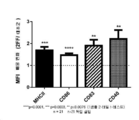
공동-배양을 FACS 분석을 사용하여 검사하였다. 인큐베이션 후, 세포를 인간 Fc 차단물(EMD Millipore)을 함유하는 BD 염색 완충액(BSA) 중에 세척하고 30분 동안 얼음 상에서 인큐베이션하였다. 이어서 세포를 형광 표지된 항-MHCII, 항-CD86, 항-CD83, 및 항-CD40 일차 항체(BD, 1:100 또는 1:50, BD 염색 완충액(BSA) 중) 또는 적절한 이소형 대조군으로 염색하였다(얼음, 암소, 40분). 그 뒤 세포를 BD 염색 완충액(BSA) 중에 2회 세척하고 LSRII 유세포 측정기 상에서 분석하였다. DC를 전방 및 측방 산란장치에 의해 확인하고 2-데옥시-2-플루오로-L-푸코스-처리 배양에서의 각각의 관심 마커의 MFI를 대조군 배양에서의 MFI와 비교하였다. 도 2a 및 2b는 혈청-함유 및 혈청-비함유 검정 조건 둘 다에 대한 이들 마커 간 배율 차이를 실증한다.
도 2b는 T-세포와 자가 DC의 공동-배양 실험으로 2-데옥시-2-플루오로-L-푸코스-처리 T-세포가 대조군 T-세포에 비해 DC를 더 활성화한다는 것을 드러내었음을 실증한다. 이는 DC 활성화 및 성숙 마커 MHCII, CD86, CD83 및 CD40의 증가에 의해 나타난다. 트랜스웰 삽입부가 T-세포 및 DC를 분리하기 위해 사용되는 경우 이러한 증가가 일어나지 않으므로, 이는 접종 의존적이며, 가용성 인자가 단독 관여하지 않을 수 있음을 제시한다. DC 단독으로는 2-데옥시-2-플루오로-L-푸코스 처리를 포함하건 포함하지 않건 이들 마커의 변화를 나타내지 않는다. 혈청-비함유 배지는 동일한 증가를 제공하지 않으므로, 이러한 상호작용은 이들 세포 표면 활성화 마커의 증가를 위해 항원이 존재할 것을 또한 필요로 한다.
실시예 3. T-세포의 테트라머 염색
항원 특이적 테트라머 및 음성 대조군 테트라머를 MBL(Woburn, MA)로부터 구매하였다. 2-데옥시-2-플루오로-L-푸코스(100 μM)를 포함하거나 포함하지 않고 상술된 바와 같이 증식된 T-세포를 둥근 바닥 96-웰 플레이트에 접종하고, 원심분리하고, 인간 Fc 차단물(EMD Millipore) 함유 BD 염색 완충액(BSA) 중에 재현탁하고 10분 동안 RT에서 인큐베이션하였다. 이어서 세포를 요망되는 테트라머 10 ㎕/웰 또는 음성 대조군으로 염색하고 암소에서 RT로 30분 동안 인큐베이션하였다. 세포를 원심분리하고 BD 염색 완충액(BSA) 중에 세척한 후 LSRII 유세포 측정기를 사용한 분석을 위해 저온 BD BSA 염색 완충액 중에 재현탁하였다. 도 3은 3가지 상이한 테트라머(EBV, M1, 및 CMV; MBL Bio)에 있어서 대조군 T-세포 대비 2-데옥시-2-플루오로-L-푸코스-처리 T-세포에 대한 결합의 MFI 배율 변화를 실증한다.
실시예 4. TCR 신호전달
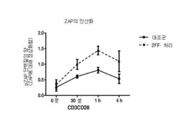
정제된 T-세포를 6-웰 플레이트(2.5×106 세포/웰, 2.5 ㎖ T-세포 배지)에 접종하고 0~4 h 동안 37℃에서 CD3/CD28 비드(20 ㎕/웰, Miltenyi Biotec, San Diego, CA)로 활성화하였다. 이어서 나타낸 시점에, 샘플을 수확하고, PBS 중에 세척하고, RIPA 완충액(Thermo Scientific, DNAse 및 프로테아제/포스파타제 저해제 함유)으로 용해시키고, 드라이 아이스 상에서 급속 냉동한 후 -80℃에 보관하였다. 세포 용해물(BCA 검정에 의해 결정된 약 3 ㎍/샘플)을 SDS-PAGE 상에 걸고 항-pZAP70 항체(Cell Signaling Technologies)를 이용하여 니트로셀룰로스 막 상에서 웨스턴 블롯에 의해 검사하였다. 간략하게, 블롯을 TBST(Cell Signling Technologies의 TBST) 중 5% 우유로 실온에서 1 h 동안 차단하고, TBST로 헹군 후 하룻밤 동안 4℃에서 일차 항체(항-pZAP70, 1:1000, TBST 중 5% BSA 중)와 인큐베이션하였다. 블롯을 TBST로 3× 세척하고 RT에서 1 hr 동안 HRP-접합 이차 항체(1:2000, TBST 중 5% 무지방 우유 중) 및 제조업체의 지침에 따라 Cell Signaling Elite ECL을 사용한 검출로 탐침분석하였다. 블롯을 Amersham™ 600 이미지화 장치(GE Healthcare)를 사용하여 스캐닝하였다. 이미지화되면, 블롯을 스트리핑하고, 다른 일차 항체를 사용하여 추가 마커에 대해 재탐침분석하였다. 이 방법을 위해, 막을 Thermo Scientific의 Restore™ PLUS 웨스턴 블롯 스트리핑 완충액을 사용하여 RT에서 30분 동안 스트리핑한 후, PBS 중에 첫 번째 세척하였다. 그 이후, 막을 TBST 중에 세척하고 RT에서 1 hr 동안 TBST 중 5% 우유로 차단하였다. 이어서 전체 ZAP70의 염색을 위해 상기 블로팅 프로토콜을 따랐다. 도 4는 2-데옥시-2-플루오로-L-푸코스-처리 T-세포로 대조군 T-세포 대비 ZAP70 세기에 대해 정상화된 pZAP70 단백질 수준을 실증한다.
실시예 5. 갈렉틴-3의 활성화된 T-세포 발현
정제된 T-세포를 12-웰 플레이트(106 세포/웰, 1~2 ㎖ T-세포 배지)에 접종하고 CD3/CD28 비드(4 ㎕ 비드/2 ㎖ 배지, Miltenyi Biotec)로 활성화하였다. 세포를 하룻밤 동안 37℃에서 인큐베이션한 후, 고정 및 투과화에 이어 FACS 분석 후에 갈렉틴-3 발현에 대해 분석하였다. 간략하게, 세포를 펠렛화하고(2×105 BD 염색 완충액(FBS)으로 2회 세척한 후 저온 BD Cytofix™ 고정 완충액(30분, RT) 중 재현탁하였다. 세포를 펠렛화하고, BD 염색 완충액(FBS) 중에 2회 세척하고, BD Perm/Wash™ 완충액(30분, RT) 중 재현탁하였다. 세포를 신선 BD Perm/Wash™ 완충액 내로 세척하고 RT(40분, 암소)에서 항-갈렉틴-3 항체로(Life Technologies, 또는 적절한 이소형 대조군으로) 염색하였다. 세포를 RT에서 BD Perm/Wash™ 중에 2회 세척하고 LSRII 유세포 측정기를 사용한 분석을 위해 BD 염색 완충액(FBS) 중에 재현탁하였다. 도 5는 대조군 T-세포 세포 대비 2-데옥시-2-플루오로-L-푸코스-처리 T-세포에서 갈렉틴-3 MFI의 배율 변화를 실증한다.
T-세포 수용체(TCR)는 항원 제시 세포 상에서 펩티드-MHC와 직접 상호작용하며 푸코실화 분자인 것으로 제시된다(Garcia et al. 1996, Science, 274). 본 발명자들은 대조군 세포 대비 2-데옥시-2-플루오로-L-푸코스-처리 T-세포에서 유세포 측정에 의한 EBV-특이적 테트라머 결합의 증가를 관찰하였다(다른 항원; flu, CMV로도 약간의 증가를 관찰하였음). 이는 p-MHC에 대한 TCR의 친화도 증가를 시사한다. 또한, T-세포와 DC의 공동-배양으로부터의 항원(혈청 단백질 형태의 펩티드 항원) 제거는 DC 상에서 증가된 활성화 마커를 거의 또는 전혀 생성하지 않았다. 함께 종합된 이들 결과는 TCR/pMHC 상호작용이 2-데옥시-2-플루오로-L-푸코스 처리에 의해 조정되고 있음을 제시한다. TCR이 관여되고 T-세포 신호전달이 일어나기 위해, TCR/펩티드-MHC 상호작용은 TCR의 기저 신호전달 및 활성화를 조절하는 갈렉틴-당단백질 격자 상호작용을 극복하기 위해 충분히 커야 한다. 본 발명자들은 2-데옥시-2-플루오로-L-푸코스 처리로, 갈렉틴-3-당단백질 상호작용을 감소시키고 더 용이한 TCR/pMHC-매개 신호전달을 허용할 T-세포에서의 갈렉틴-3-수준 감소가 존재함을 관찰하였다. 본 발명자들이 TCR 신호전달을 검사했을 때, TCR 신호전달 캐스케이드의 중심에 있는 것으로 알려져 있는 단백질인 Zap70이 상당히 더 인산화되어 있고, 나이브(naive) 세포 대비 2-데옥시-2-플루오로-L-푸코스-처리 T-세포에서 더 장기간 동안 인산화된 채 유지된다는 것을 관찰하였다(다른 신호전달 단백질로 유사한 결과를 관찰하였음).
실시예 6. TGFβ 신호전달 및 조절 T-세포 분석
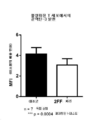
세포를 혈청-비함유 RPMI 배지(1% PS, 2.5 ㎖)와 함께 6-웰 디쉬에 접종하고(2.5×106 세포/웰) 혈청 결핍 6 h 후, 세포를 10분 동안 TGFβ(5 ng/㎖)로 자극하였다. 세포를 수확하고, PBS 중 2회 세척하고, 드라이 아이스 상에서 급속 냉동한 후 -80℃에 보관하였다. 세포를 RIPA 완충액(DNAse 및 프로테아제/포스파타제 저해제 함유)으로 용해시켰다. 전술된 바와 같이, 세포 용해액을 SDS-PAGE 상에 걸고 항-pSMAD2 및 항-액틴 항체로 니트로셀룰로스 막 상의 웨스턴 블롯에 의해 검사하였다. 도 6은 2-데옥시-2-플루오로-L-푸코스-처리 T-세포에 대한 동일한 비에 대비하여 대조군 T-세포에 대한 pSMAD2 대 액틴 세기의 비를 실증한다.
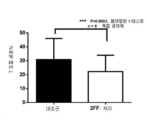
인간 조절 T-세포 칵테일(BD Pharmingen™)을 사용하여 배양 중 조절 T-세포를 확인하고 FACS를 사용하여 분석하였다. 간략하게, 세포를 인간 Fc 차단물(EMD Millipore)을 함유하는 BD 염색 완충액(BSA) 내로 세척하고 30분 동안 얼음 상에서 인큐베이션하였다. 이어서 세포를 형광 표지된 인간 조절 T-세포 칵테일(BD Pharmingen™, 1:100, BD 염색 완충액(BSA) 중)로 또는 적절한 이소형 대조군(얼음, 암소, 40분)으로 염색하였다. 그 뒤, 세포를 BD 염색 완충액(BSA) 중에 2회 세척하고 LSRII 유세포 측정기 상에서 분석하였다. 조절 T-세포는 CD4+, CD25+ 및 CD127 LOW로서 확인되었다. 도 7a 및 7b는 이러한 삼중 관문화된 모집단에서의 세포%를 실증한다.
T-세포를 상기에서의 세포내 염색에 대한 것과 동일한 방식으로 제조하였고, 이들을 고정하고 투과화하고 항-FOXp3 항체(BD Biosciences)로 염색하고 FACS에 의해 분석하였다. 간략하게, 전술된 바와 같이 30분 동안 얼음 상에서 인간 Fc 차단물(Miltenyi Biotec)을 함유하는 BD 염색 완충액(FBS) 중 인큐베이션 후, 세포를 암소에서 20분 동안(RT) 항-CD4 항체로 염색하였다. 동일 부피의 BD 염색 완충액(FBS)을 첨가하고 샘플을 회전시키고 BD 염색 완충액(FBS) 중 1회 세척한 뒤 RT에서 30분 동안 저온 BD Cytofix™ 고정 완충액 중 재현탁하였다. 세포를 펠렛화하고 BD 염색 완충액(FBS) 중에 2회 세척하고, 재현탁하고, 30분 동안 RT에서 BD Perm/Wash™ 완충액 중 인큐베이션하였다. 세포를 신선 BD Perm/Wash™ 완충액 내로 세척하고 RT(45분, 암소)에서 항-FOXp3 항체로(또는 적절한 이소형 대조군으로) 염색하였다. 세포를 RT에서 BD Perm/Wash™ 중 2회 세척하고 LSRII 유세포 측정기를 사용한 분석을 위해 BD 염색 완충액(FBS) 중에 재현탁하였다. 세포를 CD4+ 상에서 관문화하고 이 관문으로부터 FOXp3+ 세포를 확인하였다. 도 7a 및 7b는 대조군 T-세포 배양 대비 2-데옥시-2-플루오로-L-푸코스-처리 배양 중 FOXp3+ T-세포 총 수의 배율 변화를 실증한다.
스프라그-다울리(Sprague-Dawley) 래트(CD®[Crl:CD®(SD)]에 0, 125, 500 또는 2000 ㎎/㎏/일의 용량으로 연속 42일 동안 매일 경구 급식에 의해 2-데옥시-2-플루오로-L-푸코스를 투여하였다. 혈액 샘플(0.4 ㎖/시점)을 사전 평가에서 그리고 연구 2, 7, 22, 43, 49, 56, 및 71일에 나트륨 헤파린 중에 수집하였다. 샘플을 수집 24시간 내에 가공하였다. 분취량의 시료를 각각의 마커에 대해 특이적인, 소정 부피의 이전에 평가되고 역가 분석된 모노클로날 항체로 염색하였다. 각각의 튜브에서 적색 세포를 용해시키고 염색 후 세포를 Versalyse 용해 완충 용액(Beckman Coulter)으로 고정하였다. 제조된 시료를 Beckman-Coulter FC 500 MPL 유세포 측정기 상에서 분석하였다.
TGFβR이 푸코실화되며, 문헌에서는 이 푸코실화가 종양 세포에서 TGFβ 결합에 영향을 미칠 수 있음을 제시한다(British Journal of Cancer (2014) 110, 156-163). SMAD-매개 전사는 TGFβI 수용체에 대한 TGFβ 결합 후 인산화를 필요로 한다. 도 6은 T-세포의 2-데옥시-2-플루오로-L-푸코스 처리가 TGFβ 자극 후 대조군 T-세포 대비 감소된 SMAD2 인산화를 일으킴을 실증하여, 비푸코실화 T-세포에 대한 TGFβ 결합 및 신호전달에서의 변경을 뒷받침한다. FOXp3 발현은 TGFβ 신호전달로부터 하류에 있는 SMAD 전사 인자에 의해 유도된다. 2-데옥시-2-플루오로-L-푸코스-처리 T-세포는 조절 T-세포 모집단(총 세포%, 도 7b)의 감소와 연관된 FOXp3+의 감소된 발현을 나타낸다(도 7a). 표 1은 래트를 2-데옥시-2-플루오로-L-푸코스로 처리했을 때 이 결과가 생체내 반영되었음을 나타낸다. 2일차에 수집을 시작하여, 조절 T-세포(CD3+, CD4+, CD25+, FOXp3+)의 상대 비율은 평가 전 값 대비, 2-데옥시-2-플루오로-L-푸코스가 투여된 모든 군에서 감소하는 경향을 나타내었다(표 1). SMAD2 전사 인자의 인산화를 통한 TGFβ 신호전달은 2-데옥시-2-플루오로-L-푸코스 처리에 의해 감소되며, 이는 다시 T-세포 배양에서 감소된 FOXp3 발현 및 감소된 T-조절 세포수를 일으킨다. 조절 T-세포의 감소는 면역억제성이 덜한 종양 미세환경을 야기하는 것으로 알려져 있다. 항-CTLA4 항체에 의해 부여되는 활성의 일부는 조절 T-세포의 고갈로 유도된다(Simpson et al. (2013) JEM, 210). 항-CTLA4 항체는 전임상, 그리고 최근 임상에서, 항-PD1 또는 항-PDL1 체크포인트 항체와 성공적으로 조합되었다(Larkin et al. (2015) NEJM 373). 조절 T-세포 감소에 대한 2-데옥시-2-플루오로-L-푸코스의 효과는 2-데옥시-2-플루오로-L-푸코스의 영향을 받는 T-세포와 PD1 또는 PDL1 표적화 제제의 조합이 추가 증강된 항-종양 면역성을 부여할 것임을 제시할 것이다.
| 조절 T-세포에 대한 효과의 요약 a | |||||||
| 125 ㎎/㎏/일 | 500 ㎎/㎏/일 | 2000 ㎎/㎏/일 | |||||
| 종결점 | 간격 | M | F | M | F | M | F |
| 관문화된 Treg% | 2일 | -44% | -54% | -61% | -56% | -42% | -41% |
| 7일 | -64% | -67% | -63% | -60% | -43% | -39% | |
| 22일 | -65% | -61% | -64% | -60% | -51% | -43% | |
| 43일 | -59% | -64% | -58% | -50% | -29% | -28% | |
| 49일 b | -46% | -40% | -48% | -43% | -6% | -19% | |
| 56일 b | -47% | -51% | -47% | -38% | -12% | -16% | |
| 71일 b | -42% | -45% | -48% | -40% | -13% | -26% | |
| M - 수컷; F - 암컷 a - 사전 평가 평균 대비 변화% b - 회복 기간 |
|||||||
실시예 7. T-세포/DC 공동-배양에서 분비된 사이토카인 및 생체내 관찰된 사이토카인의 분석
이전에 기재된 T-세포/DC 공동-배양으로부터의 조직 배양 상청액을 수집하고 Luminex 검정에 의해 사이토카인 변화에 대해 평가하였다. 유사하게, A20 백신 모델 연구로부터의 혈액 샘플이 응고하게 두고, 혈청을 사이토카인 분석을 위해 수집하였다(MCYTOMAG01L1X-13 마우스 사이토카인 자기 비드 패널, Millipore). 도 8a, 8b 및 8c는 DC 및 2-데옥시-2-플루오로-L-푸코스-처리 T-세포의 공동-배양에서, 항원 특이적 T-세포 활성화를 위해 중요한 사이토카인, 예컨대 INFy, IL12p40, 및 CD40L이 대조군 T-세포를 함유하는 배양과 대비되는 경우 조직 배양 상청액에서 증가되었음을 실증한다. 도 9는 조직 배양 공동-배양 시스템에서 관찰되는 사이토카인 변화에 부가하여, 면역 반응을 위해 중요한 사이토카인에서의 특이적 증가가 A20 종양 백신 모델(상술됨, 고갈 없음, 샘플은 -21, -14, 0, 및 1일에 채취함; IL15)에서 관찰되었음을 실증한다. 이들 데이터는 2-데옥시-2-플루오로-L-푸코스 처리가 시험관내 및 생체내 최적 면역 반응을 위한 핵심 사이토카인의 상향조절을 일으킬 수 있음을 시사한다.
실시예 8. 인간 PBMC에서 시험관내 2FF 및 항-PD1 항체 조합
CMV 양성 공여자(Astarte™ Biologics)로부터의 CMV 반응성 인간 PMBC를 해동하고, 6-웰 플레이트 내에 접종하고, DC 배지(30% DMEM 70% X-vivo + 2 mM 글루타맥스 + 10% ATB 혈청 + 1% PS) 중에서 하룻밤 동안 배양하였다. 다음 날 상청액을 수집하여 T-세포를 단리하고, 부착 세포를 배지 중에 세척한 후 웰 당 IL4(100 ng/㎕) 및 GMCSF(200 ng/㎕)가 보충된 2 ㎖ 배지를 보충하여 부착 단핵구를 DC로 분화 및 증식시켰다. 플레이트를 4~5일 동안 인큐베이션한 후 세포를 T25 플라스크 내로 옮겼다. 매 시기마다 세포를 계대하고(2~3일마다) 새로운 사이토카인을 제공하였다. 상청액 중 T-세포를 StemSep 인간 T-세포 농축 키트(Stemcell technologies)를 사용하여 단리하였다. 이어서 T-세포를 T-세포 배지(RPMI + 10% 우태 혈청, 1% PS) 중에 재현탁하고 2개의 T25 플라스크(100~200 μM 2FF 함유 또는 비함유) 내로 분할하였다. CD3CD28 항체 코팅 비드(Miltenyi Biotec)(20 ㎕/플라스크)를 첨가하여 T-세포를 활성화하였다. 24 h 후 IL2를 첨가하였다(100 ng/㎕). 매 시기마다 세포를 계대하고 새로운 IL2 및 2FF를 첨가하였다. 세포를 10~12일 동안 배양하고 5 ㎍/㎖ CMV 항원 자극(Astarte Biologics)을 포함하거나 포함하지 않고, 및 1 ㎍/㎖ 항-PD1(펨브롤리주맵, Keytruda)을 포함하거나 포함하지 않고, 48 웰 플레이트에서 10:1(T-세포:DC)의 비로 DC 배지 중에서 공동-배양 실험을 수행하였다. 공동-배양을 24 h 동안 인큐베이션한 후, 상청액을 제조업체의 지침에 따라 인간 T-세포 고민감성 Lumenix 검정(Millipore)을 사용하여 IFNγ 및 IL12p70에 대해 검정하였다.
5일 공동-배양으로부터의 상청액 중 IFNγ 및 IL12p70을 Lumenix 검정을 사용하여 측정하고 각각의 사이토카인의 농도를 내부 표준 곡선을 사용해서 계산하였다. 도 10a 및 10b에 나타낸 바와 같이, CMV 항원에 노출된 2FF 성숙 T-세포는 대조군 세포 대비 상승된 항원 특이적 T 세포 반응을 가지며, 조합에 대한 항-PD1의 첨가는 2FF 성숙 T-세포의 항원 특이적 반응을 추가 증강시킨다.
실시예 9. A20 마우스 림프종 연구
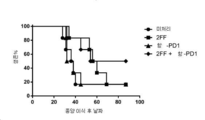
A20 세포(ATCC)를 10% FBS, 10 mM HEPES, 1 mM 피루브산나트륨, 50 μM 2-메르캅토에탄올 및 페니실린(100 U/㎖)/스트렙토마이신(PS) 함유 RPMI1640 중에 배양하였다. 모든 마우스(BALB/c, n = 6/군)에 1×105 A20 종양 세포를 이식하고(i.v.) 4개 군: 미처리; 2FF 단독 처리; 항-PD1 항체 단독 처리; 및 2FF와 항-PD1 항체의 조합 처리군으로 나누었다. 2FF 처리군에는 종양 이식일에 시작하여 20 mM 2FF를 함유하는 음용수를 수여하였고 연구 전반에 걸쳐 계속하였다. 2FF를 수여받지 않은 마우스에는 일반 음용수를 수여하였다. 항-PD1 항체(Ebiosciences, 클론 J43) 처리군에는 종양 이식 후 5일에 시작하여 3일마다 5 ㎎/㎏의 3개 용량을 수여하였다. 도 11에 나타낸 바와 같이, 2FF 단독 처리군은 미처리군 대비 증가된 생존을 가졌던 반면, 항-PD1 항체 단독 처리군은 미처리군 대비 생존을 증가시키지 않았다. 2FF와 항-PD1 항체의 조합으로 처리된 군은 종양 이식 후 54일경에 마우스 50%의 오래 가는 생존을 나타내어 종양 이식 후 약 90일차에 실험 종료까지 전반적으로 지속되었다. 이는 처리 약 40일 후부터 실험 종료까지 지속되는 미처리군 및 항-PD1 단독 처리군에서의 단지 17% 생존과 비교되며, 처리 70일 후부터 또한 약 90일차에 실험 종료까지 지속되는 2FF 단독 처리군에서의 단지 17% 생존과도 비교된다. 이들 데이터는 미처리 및 2FF 또는 항-PD1 단일 제제 처리 대비 2FF 및 항-PD1의 조합이 종양 이식된 마우스의 생존을 연장시켰음을 나타낸다.
논의
실시예에 나타낸 바와 같이, 2FF는 항-CTLA4 항체로 관찰되는 것과 유사한, 조절 T-세포 모집단을 감소시키는 능력을 실증하였다. 조절 T-세포 모집단의 감소는 조절 T-세포 발달에 중추적인 TGF-베타 신호전달 및 FOXp3 유도의 약화와 연관된다. 따라서, 항-PD1 차단 항체의 존재 하에 2FF의 조합 활성을 시험관내 및 생체내에서 모두 평가하였다. 이 실시예는 시험관내에서, 2FF가 항-PD1 항체와 협력하여 항원 특이적 T-세포 활성화를 증가시킴을; 그리고 생체내에서, 2FF가 항-PD1 항체에 대한 항-종양 반응을 증강시키고 미처리 또는 단일 제제 처리군 대비 림프종의 동계 마우스 모델에서 전반적인 생존을 연장시킴을 실증하였다.
실시예 10. 4T1 마우스 종양 연구
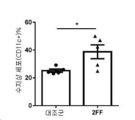
종양 침윤 면역 세포에 대한 2FF 처리의 효과를 평가하기 위해, balb/c 마우스에 4T1 세포를 이식하고(2×104 sc. 주사) 같은 날 20 mM 2FF 음용수 처리를 시작하였다. 19일차에(종양이 대략 250~300 ㎣일 때) 또는 28일차에(종양이 약 800~1000 ㎣일 때) 종양을 제거하고, 레이저 블레이드로 미세하게 다지고 5 ㎖ 저온 해리 완충액(DMEM(고 글루코스) 배지, 5% FBS, 1 M HEPES, 2 ㎎/㎖ 콜라게나제 D(Roche), 0.1 ㎎/㎖ DNAse I(50 ㎎/㎖ 스톡, 20 mM Tris-HCL(ph 7.5), 1 mM MgCl2, 50% 글리세롤) 중에 현탁하고 Miltenyi C-튜브로 옮겼다. GentleMACS를 각각의 튜브 상에서 수행하고 튜브를 연속 회전시키면서 40분 동안 37℃에서 인큐베이션하였다. 이어서 GentleMACS를 2회 수행하고 튜브를 빠르게 회전침강시켜 종양을 튜브 하부에 수집하였다. 그 뒤 주사기의 고무 마개를 사용하여 튜브 내용물을 70 ㎛ 메쉬 필터를 통해 50 ㎖ falcon 튜브 내로 통과시켜 조직을 온화하게 해리하였다. 필터를 5 ㎖의 저온 효소 저해제 완충액(DMEM(고 글루코스), 0.25 M EDTA)으로 세척하고 튜브를 회전침강시키고, 상청액을 폐기하고, 샘플을 PBS 중에 재현탁하였다. 이어서 세포를 제조업체의 지침에 따라 eFluor® 506 생활성 염료(eBioscience)로 염색하였다. 세포를 FACS 염색 완충액(0.5% FBS, 0.05% NaN3) 중에 2회 세척하고 각각 CD45에 대한 항체를 함유하는 3가지 상이한 항체 패널로 면역 표현형을 분석하여 면역 세포를 확인하였다. 수지상 세포 항원에 대한 표현형으로 분석된 세포를 얼음 상 암소에서 30분 동안 요망되는 항체로 염색하고, 염색 완충액 중 2회 세척하고, 1:4 PBS:고정 완충액(Biolgend) 중 재현탁하고 하룻밤 동안 4℃에 보관하였다. 다음 날 세포를 FACS 염색 완충액 중에 세척하고 LSRII 유세포 측정기 상에서 분석하였다. T 조절 세포로 표현형 분석된 세포를 먼저 얼음 상 암소에서 30분 동안 세포 표면 항원에 대해 요망되는 항체로 염색하였다. 이어서 세포를 세척하고 고정하고 투과화하고, 제조업체의 지침에 따라 eBioscience 염색 세트(카탈로그#77-5775)를 사용하여 FOXp3으로 염색하였다.
도 12a~c에 나타낸 바와 같이, 2FF-처리 동물은 상당히 감소된 T 조절 세포 및 증가된 수지상 세포를 가졌으며, 이는 이식 후 19일차에 더 활성화된다. 이 결과는 또한 이식 후 28일차에, 2FF-처리 동물로부터의 종양이 증가된 기억 및 효과기 T 세포를 가졌음을 나타낸다.
Claims (44)
- 체크포인트 (checkpoint) 저해제와 병용되는 유효량의 2-데옥시-2-플루오로-L-푸코스 또는 이의 전구약물, 또는 이의 약제학적으로 허용 가능한 염을 대상체에 투여하는 단계를 포함하는, 이를 필요로 하는 대상체에서의 암 치료 방법.
- 체크포인트 저해제와 병용되는 유효량의 2-데옥시-2-플루오로-L-푸코스 또는 이의 전구약물, 또는 이의 약제학적으로 허용 가능한 염을 대상체에 투여하는 단계를 포함하는, 이를 필요로 하는 대상체에서의 종양의 증식 저해 방법.
- 제1항 또는 제2항에 있어서, 투여되는 2-데옥시-2-플루오로-L-푸코스 또는 이의 전구약물, 또는 이의 약제학적으로 허용 가능한 염, 및 체크포인트 저해제의 조합이 암 치료 또는 종양 세포의 증식 저해에서 상가효과 또는 상승효과를 제공하는 방법.
- 제3항에 있어서, 투여되는 2-데옥시-2-플루오로-L-푸코스 또는 이의 전구약물, 또는 이의 약제학적으로 허용 가능한 염, 및 체크포인트 저해제의 조합이 암 치료 또는 종양 세포의 증식 저해에서 상승효과를 제공하는 방법.
- 제1항 내지 제4항 중 어느 한 항에 있어서, 2-데옥시-2-플루오로-L-푸코스 또는 이의 약제학적으로 허용 가능한 염이 체크포인트 저해제와 병용 투여되는 방법.
- 제1항 내지 제4항 중 어느 한 항에 있어서, 2-데옥시-2-플루오로-L-푸코스의 전구약물, 또는 이의 약제학적으로 허용 가능한 염이 체크포인트 저해제와 병용 투여되는 방법.
- 제6항에 있어서, 2-데옥시-2-플루오로-L-푸코스의 카복실릭 에스테르 전구약물 또는 이의 약제학적으로 허용 가능한 염이 체크포인트 저해제와 병용 투여되는 방법.
- 제7항에 있어서, 2-데옥시-2-플루오로-L-푸코스의 아세테이트 에스테르 또는 이의 약제학적으로 허용 가능한 염이 체크포인트 저해제와 병용 투여되는 방법.
- 제1항 내지 제8항 중 어느 한 항에 있어서, 체크포인트 저해제가 생물학적 치료제 또는 소분자인 방법.
- 제1항 내지 제8항 중 어느 한 항에 있어서, 체크포인트 저해제가 모노클로날 항체, 인간화 항체, 완전 인간 항체 및 융합 단백질 또는 이의 조합으로 이루어진 군으로부터 선택되는 방법.
- 제9항 또는 제10항에 있어서, 체크포인트 저해제가 CTLA-4, PD-1, PD-L1, PD-L2, B7-H3, B7-H4, BMA, HVEM, TIM3, GAL9, LAG3, VISTA, KIR, 2B4, CD160, CGEN-15049, CHK1, CHK2, A2aR, 및 B-7 패밀리 리간드 또는 이의 조합으로 이루어진 군으로부터 선택되는 체크포인트 단백질의 리간드를 저해하거나 이와 상호작용하는 방법.
- 제11항에 있어서, 체크포인트 저해제가 PD-L1, PD-L2, 또는 PD-1 저해제인 방법.
- 제12항에 있어서, 체크포인트 저해제가 PD-1 저해제인 방법.
- 제13항에 있어서, 체크포인트 저해제가 PD-1 저해제가 니볼루맵 또는 펨브롤리주맵인 방법.
- 제14항에 있어서, 체크포인트 저해제가 PD-1 저해제가 니볼루맵인 방법.
- 제1항 내지 제15항 중 어느 한 항에 있어서, 암이 비뇨생식기 암, 부인과 암, 폐암, 위장관 암, 두부경부암, 악성 교종 및 뇌 전이를 포함하는 뇌암, 악성 중피종, 비-전이성 또는 전이성 유방암, 악성 흑색종, 메르켈 세포 암종 또는 뼈 및 연조직 육종, 혈액 종양, 다발 골수종, 림프종, 예컨대 호지킨병, 비-호지킨 림프종, 급성 골수성 백혈병, 만성 골수성 백혈병, 골수형성이상 증후군 및 급성 림프모구 백혈병, 비-소세포 폐암(NSCLC), 유방암, 전이성 결장직장암, 호르몬 민감성 또는 호르몬 불응성 전립선암, 결장직장암, 난소암, 간세포암, 신장 세포암, 췌장암, 위암, 식도암, 간세포암, 쓸개관세포암, 두부경부 편평상피세포암 연조직 육종, 및 소세포 폐암으로 이루어진 군으로부터 선택되는 방법.
- 제16항에 있어서, 암이 비-소세포 폐암(NSCLC), 유방암, 또는 결장직장암인 방법.
- 제17항에 있어서, 암이 비-소세포 폐암(NSCLC)인 방법.
- 제1항 내지 제18항 중 어느 한 항에 있어서, 2-데옥시-2-플루오로-L-푸코스 또는 이의 전구약물, 또는 이의 약제학적으로 허용 가능한 염을 포함하는 조성물이 대상체에 투여되는 방법.
- 제19항에 있어서, 조성물이 고체 또는 액체 제형인 방법.
- 제1항 내지 제20항 중 어느 한 항에 있어서, 대상체가 포유류인 방법.
- 제21항에 있어서, 포유류가 인간인 방법.
- 체크포인트 저해제와 병용되는 유효량의 2-데옥시-2-플루오로-L-푸코스 또는 이의 전구약물, 또는 이의 약제학적으로 허용 가능한 염을 대상체에 투여하는 단계를 포함하는, 이를 필요로 하는 대상체에서 체크포인트 저해제의 효과를 개시, 증강 또는 연장하거나, 또는 대상체가 체크포인트 저해제에 반응할 수 있도록 하는 방법.
- 제23항에 있어서, 투여되는 2-데옥시-2-플루오로-L-푸코스 또는 이의 전구약물, 또는 이의 약제학적으로 허용 가능한 염, 및 체크포인트 저해제의 조합이 암 치료에서 또는 종양 세포의 증식 저해에서 상가효과 또는 상승효과를 제공하는 방법.
- 제24항에 있어서, 투여되는 2-데옥시-2-플루오로-L-푸코스 또는 이의 전구약물, 또는 이의 약제학적으로 허용 가능한 염, 및 체크포인트 저해제의 조합이 암 치료에서 또는 종양 세포의 증식 저해에서 상승효과를 제공하는 방법.
- 제23항 내지 제25항 중 어느 한 항에 있어서, 항-종양 반응이 종양 성장의 저해, 종양 세포사의 유도, 종양 퇴행, 종양 재발, 종양 성장, 종양 확산의 예방 또는 지연 및 종양 제거로부터 선택되는 방법.
- 제23항 내지 제26항 중 어느 한 항에 있어서, 2-데옥시-2-플루오로-L-푸코스 또는 이의 약제학적으로 허용 가능한 염이 체크포인트 저해제와 병용 투여되는 방법.
- 제23항 내지 제27항 중 어느 한 항에 있어서, 2-데옥시-2-플루오로-L-푸코스의 전구약물 또는 이의 약제학적으로 허용 가능한 염이 체크포인트 저해제와 병용 투여되는 방법.
- 제28항에 있어서, 2-데옥시-2-플루오로-L-푸코스의 카복실릭 에스테르 전구약물 또는 이의 약제학적으로 허용 가능한 염이 체크포인트 저해제와 병용 투여되는 방법.
- 제29항에 있어서, 2-데옥시-2-플루오로-L-푸코스의 아세테이트 에스테르 또는 이의 약제학적으로 허용 가능한 염이 체크포인트 저해제와 병용 투여되는 방법.
- 제23항 내지 제30항 중 어느 한 항에 있어서, 체크포인트 저해제가 생물학적 치료제 또는 소분자인 방법.
- 제23항 내지 제31항 중 어느 한 항에 있어서, 체크포인트 저해제가 모노클로날 항체, 인간화 항체, 완전 인간 항체 및 융합 단백질 또는 이의 조합으로 이루어진 군으로부터 선택되는 방법.
- 제31항 또는 제32항에 있어서, 체크포인트 저해제가 CTLA-4, PD-1, PD-L1, PD-L2, B7-H3, B7-H4, BMA, HVEM, TIM3, GAL9, LAG3, VISTA, KIR, 2B4, CD160, CGEN-15049, CHK1, CHK2, A2aR, 및 B-7 패밀리 리간드 또는 이의 조합으로 이루어진 군으로부터 선택되는 체크포인트 단백질의 리간드를 저해하거나 이와 상호작용하는 방법.
- 제33항에 있어서, 체크포인트 저해제가 PD-L1, PD-L2, 또는 PD-1 저해제인 방법.
- 제34항에 있어서, 체크포인트 저해제가 PD-1 저해제인 방법.
- 제35항에 있어서, 체크포인트 저해제가 PD-1 저해제가 니볼루맵 또는 펨브롤리주맵인 방법.
- 제35항에 있어서, 체크포인트 저해제가 PD-1 저해제가 니볼루맵인 방법.
- 제23항 내지 제37항 중 어느 한 항에 있어서, 암이 비뇨생식기 암, 부인과 암, 폐암, 위장관 암, 두부경부암, 악성 교종 및 뇌 전이를 포함하는 뇌암, 악성 중피종, 비-전이성 또는 전이성 유방암, 악성 흑색종, 메르켈 세포 암종 또는 뼈 및 연조직 육종, 혈액 종양, 다발 골수종, 림프종, 예컨대 호지킨병, 비-호지킨 림프종, 급성 골수성 백혈병, 만성 골수성 백혈병, 골수형성이상 증후군 및 급성 림프모구 백혈병, 비-소세포 폐암(NSCLC), 유방암, 전이성 결장직장암, 호르몬 민감성 또는 호르몬 불응성 전립선암, 결장직장암, 난소암, 간세포암, 신장 세포암, 췌장암, 위암, 식도암, 간세포암, 쓸개관세포암, 두부경부 편평상피세포암 연조직 육종, 및 소세포 폐암으로 이루어진 군으로부터 선택되는 방법.
- 제38항에 있어서, 암이 비-소세포 폐암(NSCLC), 유방암, 또는 결장직장암인 방법.
- 제39항에 있어서, 암이 비-소세포 폐암(NSCLC)인 방법.
- 제23항 내지 제40항 중 어느 한 항에 있어서, 2-데옥시-2-플루오로-L-푸코스 또는 이의 전구약물, 또는 이의 약제학적으로 허용 가능한 염을 포함하는 조성물이 대상체에 투여되는 방법.
- 제41항에 있어서, 조성물이 고체 또는 액체 제형인 방법.
- 제23항 내지 제42항 중 어느 한 항에 있어서, 대상체가 포유류인 방법.
- 제43항에 있어서, 포유류가 인간인 방법.
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562263228P | 2015-12-04 | 2015-12-04 | |
| US62/263,228 | 2015-12-04 | ||
| US201662308583P | 2016-03-15 | 2016-03-15 | |
| US62/308,583 | 2016-03-15 | ||
| US201662321857P | 2016-04-13 | 2016-04-13 | |
| US62/321,857 | 2016-04-13 | ||
| PCT/US2016/064783 WO2017096274A1 (en) | 2015-12-04 | 2016-12-02 | Cancer treatment using 2-deoxy-2-fluoro-l-fucose in combination with a checkpoint inhibitor |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20180086233A true KR20180086233A (ko) | 2018-07-30 |
Family
ID=58797961
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020187017824A KR20180086233A (ko) | 2015-12-04 | 2016-12-02 | 체크포인트 저해제와 병용되는 2-데옥시-2-플루오로-l-푸코스를 사용하는 암 치료 |
Country Status (13)
| Country | Link |
|---|---|
| US (1) | US20180353524A1 (ko) |
| EP (1) | EP3383404A4 (ko) |
| JP (1) | JP6906520B2 (ko) |
| KR (1) | KR20180086233A (ko) |
| CN (1) | CN108289903B (ko) |
| AU (1) | AU2016362993A1 (ko) |
| BR (1) | BR112018011261A2 (ko) |
| CA (1) | CA3005997A1 (ko) |
| EA (1) | EA201891340A1 (ko) |
| IL (1) | IL259479B (ko) |
| MX (1) | MX2018006674A (ko) |
| SG (2) | SG10202005298RA (ko) |
| WO (1) | WO2017096274A1 (ko) |
Families Citing this family (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20190022884A (ko) | 2010-08-05 | 2019-03-06 | 시애틀 지네틱스, 인크. | 푸코스 유사체를 사용한 생체 내에서의 단백질 푸코실화 억제 방법 |
| SG10201912663YA (en) | 2016-10-11 | 2020-03-30 | Agenus Inc | Anti-lag-3 antibodies and methods of use thereof |
| EP3634427A1 (en) * | 2017-06-07 | 2020-04-15 | Seattle Genetics, Inc. | T cells with reduced surface fucosylation and methods of making and using the same |
| WO2019075449A1 (en) * | 2017-10-13 | 2019-04-18 | H. Lee Moffitt Cancer Center And Research Institute, Inc. | FUCOSYLATION AND IMMUNOSURVEILLANCE OF MELANOMA |
| WO2020041541A2 (en) | 2018-08-23 | 2020-02-27 | Seattle Genetics, Inc. | Anti-tigit antibodies |
| CN113438951A (zh) * | 2018-12-19 | 2021-09-24 | 西根股份有限公司 | 抗体的受控岩藻糖基化 |
| WO2021034774A1 (en) * | 2019-08-16 | 2021-02-25 | H. Lee Moffitt Cancer Center And Research Institute, Inc. | Fucosylation and immune modulation in cancer |
| CN111973749B (zh) * | 2020-09-07 | 2023-03-21 | 威海人生药业集团股份有限公司 | 一种抗肿瘤免疫治疗的药物组合物 |
| WO2022221766A1 (en) * | 2021-04-16 | 2022-10-20 | H. Lee Moffitt Cancer Center And Research Institute, Inc. | Fucosylation and immune modulation in cancer |
| CN113274502B (zh) * | 2021-05-05 | 2023-01-03 | 中山大学肿瘤防治中心(中山大学附属肿瘤医院、中山大学肿瘤研究所) | 用于特定型三阴乳腺癌免疫治疗的组合物 |
| WO2022236017A1 (en) * | 2021-05-06 | 2022-11-10 | H. Lee Moffitt Cancer Center And Research Institute, Inc. | L-fucose and anti-androgen receptor therapy for treatment of cancer |
| CN113413465B (zh) * | 2021-06-15 | 2022-06-03 | 北京大学 | 岩藻糖基化抑制剂在抗癌导致炎症中的应用 |
| CN115466297B (zh) * | 2022-08-25 | 2023-07-07 | 青岛农业大学 | L-岩藻糖的应用以及动物饲料 |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20190022884A (ko) * | 2010-08-05 | 2019-03-06 | 시애틀 지네틱스, 인크. | 푸코스 유사체를 사용한 생체 내에서의 단백질 푸코실화 억제 방법 |
| EA201690912A1 (ru) * | 2013-11-05 | 2016-10-31 | Когнейт Биосервисис, Инк. | Комбинации ингибиторов контрольных точек и терапевтических средств для лечения рака |
-
2016
- 2016-12-02 US US15/781,256 patent/US20180353524A1/en not_active Abandoned
- 2016-12-02 WO PCT/US2016/064783 patent/WO2017096274A1/en active Application Filing
- 2016-12-02 CA CA3005997A patent/CA3005997A1/en not_active Abandoned
- 2016-12-02 MX MX2018006674A patent/MX2018006674A/es unknown
- 2016-12-02 CN CN201680071076.0A patent/CN108289903B/zh not_active Expired - Fee Related
- 2016-12-02 KR KR1020187017824A patent/KR20180086233A/ko unknown
- 2016-12-02 SG SG10202005298RA patent/SG10202005298RA/en unknown
- 2016-12-02 AU AU2016362993A patent/AU2016362993A1/en not_active Abandoned
- 2016-12-02 EA EA201891340A patent/EA201891340A1/ru unknown
- 2016-12-02 BR BR112018011261A patent/BR112018011261A2/pt not_active Application Discontinuation
- 2016-12-02 JP JP2018528650A patent/JP6906520B2/ja active Active
- 2016-12-02 SG SG11201804263PA patent/SG11201804263PA/en unknown
- 2016-12-02 EP EP16871645.4A patent/EP3383404A4/en not_active Withdrawn
-
2018
- 2018-05-21 IL IL259479A patent/IL259479B/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| AU2016362993A1 (en) | 2018-07-12 |
| MX2018006674A (es) | 2018-11-09 |
| CN108289903A (zh) | 2018-07-17 |
| IL259479B (en) | 2022-03-01 |
| EA201891340A1 (ru) | 2018-11-30 |
| BR112018011261A2 (pt) | 2018-11-21 |
| JP2019501145A (ja) | 2019-01-17 |
| US20180353524A1 (en) | 2018-12-13 |
| EP3383404A4 (en) | 2019-07-31 |
| CN108289903B (zh) | 2021-08-03 |
| SG11201804263PA (en) | 2018-06-28 |
| IL259479A (en) | 2018-07-31 |
| SG10202005298RA (en) | 2020-07-29 |
| WO2017096274A1 (en) | 2017-06-08 |
| JP6906520B2 (ja) | 2021-07-21 |
| CA3005997A1 (en) | 2017-06-08 |
| EP3383404A1 (en) | 2018-10-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6906520B2 (ja) | チェックポイント阻害剤と組みわせて2−デオキシ−2−フルオロ−l−フコースを用いる癌治療 | |
| EP2893003B1 (en) | Selective and controlled expansion of educated nk cells | |
| US20210024649A1 (en) | Methods and Compositions for Antibody and Antibody-loaded Dendritic Cell Mediated Therapy | |
| BR112021002826A2 (pt) | construtos de receptor de célula t e usos dos mesmos | |
| US8506954B2 (en) | Tumor vaccination in combination with hematopoietic cell transplantation for cancer therapy | |
| US7951374B2 (en) | Methods for inhibiting STAT3 signaling in immune cells | |
| KR20200133370A (ko) | 입양 주입된 t 세포의 지속성 강화 방법 | |
| US20210060158A1 (en) | Agonist of aryl hydrocarbon receptor for use in cancer combination therapy | |
| EP3132802B1 (en) | Therapeutic agent for solid cancer | |
| Provinciali et al. | Immunoprevention and immunotherapy of cancer in ageing | |
| EP3806848A2 (en) | Increasing immune activity through modulation of postcellular signaling factors | |
| Barber et al. | NK cells negatively regulate antigen presentation and tumor-specific CTLs in a syngeneic lymphoma model | |
| Lo et al. | Harnessing the tumour-derived cytokine, CSF-1, to co-stimulate T-cell growth and activation | |
| JP2022512161A (ja) | 免疫療法のための組成物及び方法 | |
| Simhadri et al. | A novel role for reciprocal CD30-CD30L signaling in the cross-talk between natural killer and dendritic cells | |
| WO2018222989A1 (en) | Ceramide nanoliposomes, compositions and methods of using for immunotherapy | |
| JP2023524435A (ja) | T細胞療法 | |
| CN113316449A (zh) | 胍那苄作为免疫疗法的佐剂 | |
| JP2021523098A (ja) | T細胞による認識を強化するよう抗原性を調節する方法 | |
| Cycon et al. | The immunogenicity of L1210 lymphoma clones correlates with their ability to function as antigen‐presenting cells | |
| EP3750988A1 (en) | Improved alpha beta t processed cell production method | |
| JP2017526702A (ja) | PPAR−γアゴニストを投与する段階を含む、癌を治療する方法 | |
| Bailey | Role of the Akt signalling pathway in CD8 T cell immune response | |
| WO2023083439A1 (en) | Tlr7 agonist and combinations for cancer treatment | |
| 三輪 et al. | Current status of immunotherapy for sarcomas |