JP6901807B1 - セレン酸イオンを含む水の処理方法 - Google Patents
セレン酸イオンを含む水の処理方法 Download PDFInfo
- Publication number
- JP6901807B1 JP6901807B1 JP2020140765A JP2020140765A JP6901807B1 JP 6901807 B1 JP6901807 B1 JP 6901807B1 JP 2020140765 A JP2020140765 A JP 2020140765A JP 2020140765 A JP2020140765 A JP 2020140765A JP 6901807 B1 JP6901807 B1 JP 6901807B1
- Authority
- JP
- Japan
- Prior art keywords
- ion
- water
- selenate
- sulfate
- added
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Landscapes
- Removal Of Specific Substances (AREA)
Abstract
Description
しかし、堆積物における平均含有量は0.4mg/kg程度と、かなり高いことが知られている。
地殻や堆積物中では、各種セレン化物鉱物や亜セレン酸塩鉱物として、そして硫化物鉱物のイオウを置換して存在する。
このため、水質汚濁に関する環境基準のうち、人の健康の保護に関する環境基準においては、セレン濃度は0.01mg/L以下と定められている。
また一律排水基準においては、セレン及びその化合物の濃度はセレン換算で0.1mg/L以下とされている。
特許文献1と特許文献2には、鉄(II)塩を用いた還元法が記載され、特許文献3には、金属鉄を用いた還元法が記載され、特許文献4には金属チタンを用いた還元法が記載されている。
例えば特許文献5には、イットリウム、ランタン、セリウム又はイッテルビウムの酸化物あるいは水酸化物、メチルグルカミン基を有する素材などが記載されている。特許文献6には酸化水酸化鉄鉱物の1種であるシュベルトマナイトを用いる方法が記載されている。
例えば特許文献7には沈殿材として水溶性バリウム塩を用いる方法が記載され、特許文献8には、アルミン酸カルシウム、硫酸アルミニウム、石灰およびアルカリ金属リン酸塩を併用する方法が記載されている。
(請求項1)
セレン酸イオンを含む処理対象水に共存する硫酸イオンの濃度範囲が、0.5〜15mmol/Lとなるように調整した上で、前記処理対象水にカルシウム化合物及びアルミニウム化合物を添加し、
前記処理対象水に含まれる硫酸イオンとセレン酸イオンの合計量1物質量部に対して、4物質量部以上の前記カルシウム化合物と、4/3物質量部以上の前記アルミニウム化合物を添加し、
前記硫酸イオンと前記セレン酸イオンよりエトリンガイトの固溶体を形成する際に、前記セレン酸イオンを含む処理対象水に、該セレン酸イオンの物質量よりも多量の物質量の硫酸イオンを共存させ、
前記セレン酸イオンを、硫酸イオンと共にエトリンガイトの固溶体として、少なくとも0.1mg/L以下の濃度まで除去することを特徴とするセレン酸イオンを含む水の処理方法。
(請求項2)
前記カルシウム化合物が、酸化カルシウム、水酸化カルシウム又は塩化カルシウムから選ばれる少なくとも1種であり、前記アルミニウム化合物が、塩化アルミニウム、アルミン酸ナトリウムから選ばれる少なくとも1種であることを特徴とする請求項1記載のセレン酸イオンを含む水の処理方法。
(請求項3)
前記硫酸イオンと前記セレン酸イオンよりエトリンガイトの固溶体を形成する際に、前記カルシウム化合物及び前記アルミニウム化合物の添加後、10分以上撹拌して反応させることを特徴とする請求項1又は2記載のセレン酸イオンを含む水の処理方法。
また、本発明によれば、単純かつ容易に入手できるカルシウム化合物およびアルミニウム化合物を用いるので、それらの投入量を独立に調節することにより多様な水質の水に対して適用可能である。
本発明の処理方法は、セレン酸イオンを含む処理対象水(以下、原水ともいう)に、カルシウム化合物及びアルミニウム化合物を添加し、前記処理対象水に初めから共存する硫酸イオン又は後から添加する硫酸イオンと共に、前記セレン酸イオンを、エトリンガイトの固溶体として除去する。
硫酸イオンの共存という場合は、処理対象水に初めから共存する硫酸イオンが存在していてもよいし、あるいは後から硫酸イオンを添加して共存する硫酸イオンを存在させるようにしてもよい。
共存硫酸イオンの濃度は、エトリンガイトの固溶体を作成する上で必要になるカルシウム化合物及びアルミニウム化合物の添加量が過大にならないようにし、セレン酸イオン除去に適した組成となるように適宜調節されることが好ましい。
トリンガイト構造の中に硫酸イオンとセレン酸イオンのどちらが取り込まれやすいのかについて、本発明者の実験によると、セレン酸イオンは硫酸イオンよりも取り込まれにくいというデータを得ている。セレン酸イオンを含む水に、セレン酸イオンよりもはるかに多量の硫酸イオンが共存するような条件を作れば、硫酸イオンとセレン酸イオンを全部エトリンガイトとして沈殿させることが可能となる。
処理対象水に、共存する硫酸イオンに存在していない場合や、0.5mmol/L未満である場合には、上記範囲に入るように、水溶性硫酸塩を添加することが好ましい。セレン酸イオンの除去率を上げるためである。
処理対象水の硫酸イオンの濃度が、15mmol/Lを超える場合には、硫酸イオンの除去を行う。例えば、硫酸イオンと難溶性化合物を形成する物質を添加し、硫酸イオンの一部を難溶性塩として沈殿させ除去することができる。具体的には、水溶性カルシウム塩、ケギン型構造を持つ多核ヒドロキソアルミニウムイオンの塩化物塩、キトサンなどが好ましい。このとき沈殿の沈降を促進するため、高分子凝集剤を添加することができる。かかる硫酸イオンの除去は、後段で添加すべきカルシウム化合物とアルミニウム化合物の量を減らすことができるので好ましい。
カルシウム化合物及びアルミニウム化合、並びにアルカリは、それぞれ別個に、あるいは同時に、更には事前に混合して、添加して反応させ、上記式で表されるエトリンガイトの固溶体を得る。
更に言及すれば、原水に相当濃度の硫酸イオンが含まれる場合、アルミニウムを硫酸アルミニウムとして加えると、添加量にかかわらず(硫酸イオン+セレン酸イオン)/アルミニウムイオンのモル比が2/3よりも大きくなり、水酸化カルシウムを加えても、硫酸イオンの全量をエトリンガイトにすることはできない。ここで2/3というのはエトリンガイトの硫酸イオン/アルミニウムイオンのモル比である。
セレン酸イオンは硫酸イオンよりも固溶体に取り込まれにくいので、水中の残留硫酸イオン濃度が高い場合、セレン酸イオンも残留しがちとなる。
本発明では、硫酸イオンを含まないアルミニウム化合物を用いることで、(硫酸イオン+セレン酸イオン)/アルミニウムイオンのモル比を2/3以下にすることができ,硫酸イオン濃度を十分下げることができる。
好ましい態様としては、合計量1物質量部に対して4物質量部以上のカルシウム化合物と、4/3物質量部以上のアルミニウム化合物を添加する。
なお、カルシウム化合物およびアルミニウム化合物の添加量を、上記で記載した量よりも多くすることにより、処理時間を短縮することができる。
凝集剤を用いなくても沈降が十分早い場合には、凝集剤の添加は省略できる。
沈降部は容器から抜き出して脱水し、スラッジとして処理する。上澄み部は別容器に移送し、処理液として放流する。
そのような物質としては、鉄またはアルミニウムの酸化物および水酸化物、鉄及びアルミニウムの水溶性塩がある。
pH調節のために用いる酸の種類には、一般的には制限はないが、pH調節後の水質が排水基準を満たすような種類の酸を用いる。
1.処理対象水
セレン酸イオン濃度が、セレンとして0.91mg/L、共存硫酸イオン濃度が58mg/Lの井水を用いた。
この処理対象水に対して、カルシウム化合物として水酸化カルシウムを添加し、またアルミニウム化合物としてアルミン酸ナトリウムを添加して、セレン酸イオンの除去を行った。
この処理対象水の硫酸イオン濃度は、約0.5mmol/L〜約15mmol/Lの範囲にあったので、濃度調整はおこなわなかった。
原水100mLをプラスチック容器にとり、マグネチックスタラーで撹拌しながら、水酸化カルシウム粉末と、5.87mol/Lのアルミン酸ナトリウム溶液を添加して、さらに15分間撹拌し、非イオン性高分子凝集剤を添加して凝集沈降させ、上澄みの一部を0.45μmのメンブランフィルタでろ過した後、ろ液の硫酸イオン濃度及びセレン濃度を測定した。
原水100mLに対して、水酸化カルシウム75mgの添加は、硫酸イオンとセレン酸イオンの合計1物質量部に対して、約17物質量部、アルミン酸ナトリウム溶液0.06mLの添加は、硫酸イオンとセレン酸イオンの合計1物質量部に対して、約5.8物質量部に相当する(以上は、参考例)。
また、水酸化カルシウム150mgの添加は、硫酸イオンとセレン酸イオンの合計1物質量部に対して、約34物質量部、アルミン酸ナトリウム溶液0.12mLの添加は、硫酸イオンとセレン酸イオンの合計1物質量部に対して、約12物質量部に相当する(以上は、実施例)。
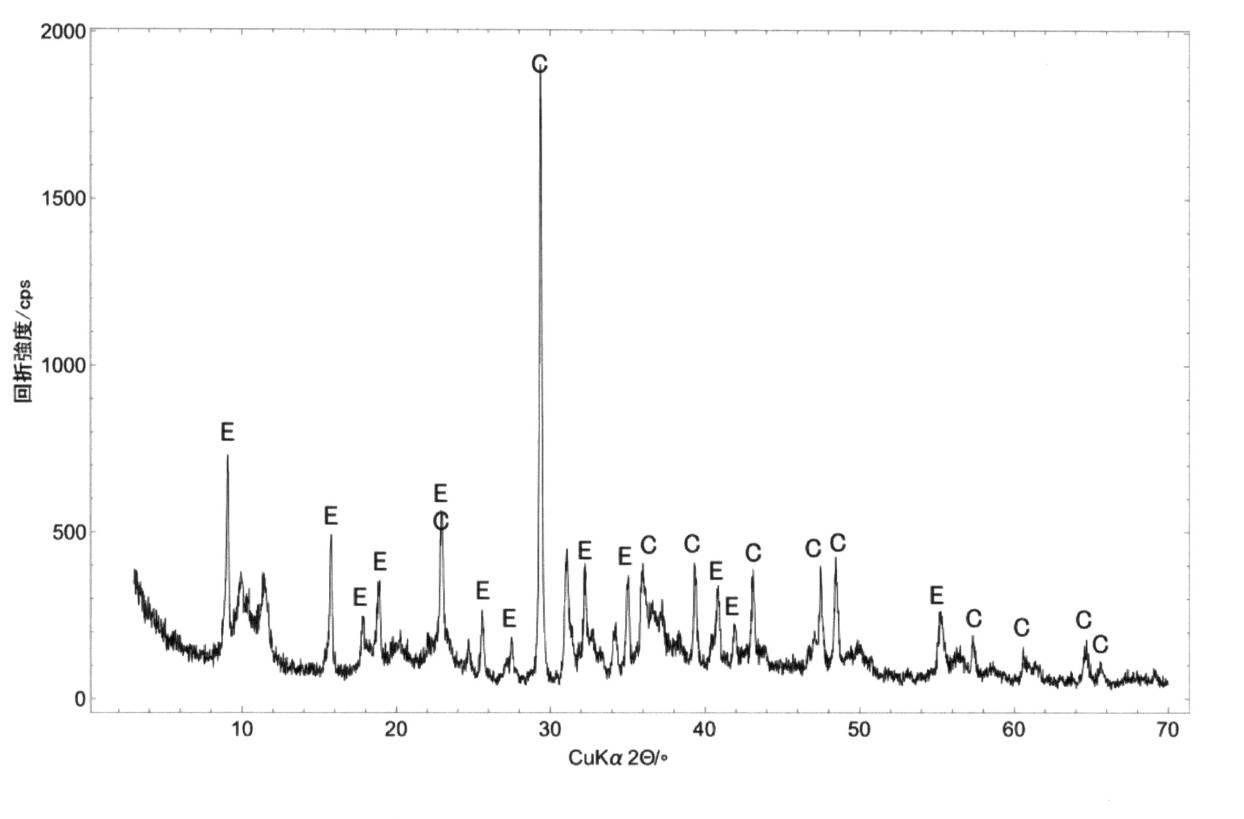
Eを付した回折ピークはエトリンガイト由来のものであり、Cを付したピークは炭酸カルシウム由来のものである。
沈殿物は、ほぼエトリンガイトと炭酸カルシウムからなることが示された。
エトリンガイトは、処理対象水に含まれる硫酸イオンとセレン酸イオン、添加した水酸化カルシウムとアルミン酸ナトリウムの反応によって生成したものである。
Claims (3)
- セレン酸イオンを含む処理対象水に共存する硫酸イオンの濃度範囲が、0.5〜15mmol/Lとなるように調整した上で、前記処理対象水にカルシウム化合物及びアルミニウム化合物を添加し、
前記処理対象水に含まれる硫酸イオンとセレン酸イオンの合計量1物質量部に対して、4物質量部以上の前記カルシウム化合物と、4/3物質量部以上の前記アルミニウム化合物を添加し、
前記硫酸イオンと前記セレン酸イオンよりエトリンガイトの固溶体を形成する際に、前記セレン酸イオンを含む処理対象水に、該セレン酸イオンの物質量よりも多量の物質量の硫酸イオンを共存させ、
前記セレン酸イオンを、硫酸イオンと共にエトリンガイトの固溶体として、少なくとも0.1mg/L以下の濃度まで除去することを特徴とするセレン酸イオンを含む水の処理方法。 - 前記カルシウム化合物が、酸化カルシウム、水酸化カルシウム又は塩化カルシウムから選ばれる少なくとも1種であり、前記アルミニウム化合物が、塩化アルミニウム、アルミン酸ナトリウムから選ばれる少なくとも1種であることを特徴とする請求項1記載のセレン酸イオンを含む水の処理方法。
- 前記硫酸イオンと前記セレン酸イオンよりエトリンガイトの固溶体を形成する際に、前記カルシウム化合物及び前記アルミニウム化合物の添加後、10分以上撹拌して反応させることを特徴とする請求項1又は2記載のセレン酸イオンを含む水の処理方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2020140765A JP6901807B1 (ja) | 2020-08-24 | 2020-08-24 | セレン酸イオンを含む水の処理方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2020140765A JP6901807B1 (ja) | 2020-08-24 | 2020-08-24 | セレン酸イオンを含む水の処理方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP6901807B1 true JP6901807B1 (ja) | 2021-07-14 |
| JP2022036515A JP2022036515A (ja) | 2022-03-08 |
Family
ID=76753116
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2020140765A Active JP6901807B1 (ja) | 2020-08-24 | 2020-08-24 | セレン酸イオンを含む水の処理方法 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP6901807B1 (ja) |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2005052723A (ja) * | 2003-08-01 | 2005-03-03 | Ataka Construction & Engineering Co Ltd | 重金属除去方法およびその装置 |
| JP2008273994A (ja) * | 2006-10-18 | 2008-11-13 | Murakashi Sekkai Kogyo Kk | 有害物質不溶化処理用組成物 |
| JP2010253440A (ja) * | 2009-04-28 | 2010-11-11 | Panasonic Corp | 環境浄化用組成物の製造方法、環境浄化用組成物、及び環境浄化方法 |
-
2020
- 2020-08-24 JP JP2020140765A patent/JP6901807B1/ja active Active
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2005052723A (ja) * | 2003-08-01 | 2005-03-03 | Ataka Construction & Engineering Co Ltd | 重金属除去方法およびその装置 |
| JP2008273994A (ja) * | 2006-10-18 | 2008-11-13 | Murakashi Sekkai Kogyo Kk | 有害物質不溶化処理用組成物 |
| JP2010253440A (ja) * | 2009-04-28 | 2010-11-11 | Panasonic Corp | 環境浄化用組成物の製造方法、環境浄化用組成物、及び環境浄化方法 |
Non-Patent Citations (1)
| Title |
|---|
| GUO BINGLIN,(外2名): "Characterization of the intermediate in formation of selenate-substituted ettringite", CEMENT AND CONCRETE RESEARCH, vol. 99, JPN6020037867, 2017, pages 30 - 37, XP085050549, ISSN: 0004439708, DOI: 10.1016/j.cemconres.2017.05.002 * |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2022036515A (ja) | 2022-03-08 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101093557B1 (ko) | 철광석 폐수를 이용한 하수 또는 폐수에 포함된 인과 질소의 처리방법 | |
| JP5878278B2 (ja) | ホウ素除去用水処理剤及び水処理方法 | |
| JP5451323B2 (ja) | 水処理方法 | |
| JP5831914B2 (ja) | 水処理方法 | |
| JP4306394B2 (ja) | セメントキルン抽気ダストの処理方法 | |
| JP5206453B2 (ja) | セメントキルン抽気ダストの処理方法 | |
| JP6901807B1 (ja) | セレン酸イオンを含む水の処理方法 | |
| JP2005152741A (ja) | セメントキルン抽気ダストの処理方法 | |
| CN113797893A (zh) | 除磷剂及其制备方法和含磷污水的处理方法 | |
| JP4306413B2 (ja) | セメントキルン抽気ダストの処理方法 | |
| JP2007209886A (ja) | フッ素除去剤、それを用いたフッ素含有排水の処理方法及びその処理装置 | |
| TWI694057B (zh) | 石膏的製造方法及水泥組成物的製造方法 | |
| JP4039820B2 (ja) | 排水の処理方法 | |
| JPS61192386A (ja) | 重金属錯体を含む廃水の処理方法 | |
| JP4468568B2 (ja) | 水処理凝集剤及びその製造方法並びに水処理方法 | |
| JP5306977B2 (ja) | ホウ素含有水の処理方法及びホウ素除去剤 | |
| JP2015108606A (ja) | 放射性Cs汚染水の処理方法 | |
| JP7496577B2 (ja) | 水処理方法および水処理装置 | |
| JP2009262109A (ja) | クロム及び砒素の処理剤およびそれを用いた処理方法 | |
| JP5206454B2 (ja) | セメントキルン抽気ダストの処理方法 | |
| JP2011147867A (ja) | 水銀除去方法 | |
| JP2021020148A (ja) | 尿または下水添加によるリンおよび金属の同時除去または回収方法 | |
| JP4043547B2 (ja) | 凝集剤 | |
| JP2013184144A (ja) | カドミウム含有排水の処理方法 | |
| JP5988226B2 (ja) | リン除去材 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20200902 |
|
| A871 | Explanation of circumstances concerning accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A871 Effective date: 20200902 |
|
| A975 | Report on accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A971005 Effective date: 20200925 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20201013 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20201207 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210209 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210316 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20210518 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20210611 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6901807 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |