JP6560200B2 - 自己免疫疾患の治療に応答性の対象を同定する方法およびそれを治療するための組成物 - Google Patents
自己免疫疾患の治療に応答性の対象を同定する方法およびそれを治療するための組成物 Download PDFInfo
- Publication number
- JP6560200B2 JP6560200B2 JP2016523296A JP2016523296A JP6560200B2 JP 6560200 B2 JP6560200 B2 JP 6560200B2 JP 2016523296 A JP2016523296 A JP 2016523296A JP 2016523296 A JP2016523296 A JP 2016523296A JP 6560200 B2 JP6560200 B2 JP 6560200B2
- Authority
- JP
- Japan
- Prior art keywords
- subject
- pharmaceutical composition
- cells
- composition according
- bcg
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
- G01N33/5008—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics
- G01N33/5044—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics involving specific cell types
- G01N33/5047—Cells of the immune system
- G01N33/505—Cells of the immune system involving T-cells
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/566—Immunoassay; Biospecific binding assay; Materials therefor using specific carrier or receptor proteins as ligand binding reagents where possible specific carrier or receptor proteins are classified with their target compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/02—Bacterial antigens
- A61K39/025—Enterobacteriales, e.g. Enterobacter
- A61K39/0266—Klebsiella
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/02—Bacterial antigens
- A61K39/04—Mycobacterium, e.g. Mycobacterium tuberculosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/14—Prodigestives, e.g. acids, enzymes, appetite stimulants, antidyspeptics, tonics, antiflatulents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/02—Drugs for disorders of the urinary system of urine or of the urinary tract, e.g. urine acidifiers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/14—Drugs for dermatological disorders for baldness or alopecia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
- A61P21/02—Muscle relaxants, e.g. for tetanus or cramps
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
- A61P21/04—Drugs for disorders of the muscular or neuromuscular system for myasthenia gravis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/16—Otologicals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/06—Antihyperlipidemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/14—Drugs for disorders of the endocrine system of the thyroid hormones, e.g. T3, T4
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/38—Drugs for disorders of the endocrine system of the suprarenal hormones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/04—Antihaemorrhagics; Procoagulants; Haemostatic agents; Antifibrinolytic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/06—Antianaemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/08—Vasodilators for multiple indications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/26—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving oxidoreductase
- C12Q1/28—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving oxidoreductase involving peroxidase
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/564—Immunoassay; Biospecific binding assay; Materials therefor for pre-existing immune complex or autoimmune disease, i.e. systemic lupus erythematosus, rheumatoid arthritis, multiple sclerosis, rheumatoid factors or complement components C1-C9
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/57—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2
- A61K2039/572—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2 cytotoxic response
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/46—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans from vertebrates
- G01N2333/47—Assays involving proteins of known structure or function as defined in the subgroups
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/575—Hormones
- G01N2333/62—Insulins
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/705—Assays involving receptors, cell surface antigens or cell surface determinants
- G01N2333/70503—Immunoglobulin superfamily, e.g. VCAMs, PECAM, LFA-3
- G01N2333/70517—CD8
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/04—Endocrine or metabolic disorders
- G01N2800/042—Disorders of carbohydrate metabolism, e.g. diabetes, glucose metabolism
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/24—Immunology or allergic disorders
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/52—Predicting or monitoring the response to treatment, e.g. for selection of therapy based on assay results in personalised medicine; Prognosis
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Chemical & Material Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Chemistry (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Immunology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Biomedical Technology (AREA)
- Hematology (AREA)
- Urology & Nephrology (AREA)
- Molecular Biology (AREA)
- Cell Biology (AREA)
- Microbiology (AREA)
- Diabetes (AREA)
- Neurology (AREA)
- Biochemistry (AREA)
- Biotechnology (AREA)
- Analytical Chemistry (AREA)
- Physics & Mathematics (AREA)
- Pathology (AREA)
- General Physics & Mathematics (AREA)
- Food Science & Technology (AREA)
- Physical Education & Sports Medicine (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Neurosurgery (AREA)
- Rheumatology (AREA)
- Dermatology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Epidemiology (AREA)
- Tropical Medicine & Parasitology (AREA)
- Toxicology (AREA)
Description
第1の態様において、本発明は、自己免疫疾患を有する対象が腫瘍壊死因子-α(TNF-α)受容体II(TNFR2)活性化因子による治療に応答する可能性を判定する方法を提供する。この方法は、以下のステップ:
(i) 上記対象由来のCD8+ T細胞集団を含むin vitro生物学的サンプルを、TNFR2活性化因子を含む組成物と接触させるステップ;および
(ii) 上記集団中の自己反応性CD8+ T細胞の表面上のCD8タンパク質密度を測定するステップ;
を含み、ここで基準CD8+ T細胞と比較した、上記自己反応性CD8+T細胞の表面上のCD8タンパク質密度の低下は、対象が治療に応答しやすいことを示す。一部の実施形態において、基準CD8+ T細胞は、自己免疫疾患を有し、且つTNFR2活性化因子により治療または前治療されていない対象由来の基準サンプルに由来する。他の実施形態において、基準CD8+ T細胞は、健康な対象由来の基準サンプルに由来する。ある実施形態において、測定は、蛍光色素にコンジュゲートされていてよい抗CD8抗体を用いて行われる。特定の実施形態において、生物学的サンプルは、接触の前にダサチニブと共にインキュベートされる(例えば、生物学的サンプルは少なくとも4時間ダサチニブと共にインキュベートされ、および/または生物学的サンプルは最大48時間ダサチニブと共にインキュベートされる)。
(i) サンプルを、表面に固定化捕捉剤を有するデバイスと接触させることにより、サンプル中のCペプチドを固定化捕捉剤に結合させるステップ;
(ii) 上記表面を結合検出剤に接触させることにより、Cペプチドを上記結合検出剤に結合させるステップ;および
(iii) 上記結合検出剤を用いてサンプル中のCペプチドの濃度を測定するステップ
を含む。
(i) 治療後に対象から採取された血液サンプル中のHbA1cレベルを測定するステップ、
(ii) 上記HbA1cレベルを基準HbA1cレベルと比較するステップ、および
(iii) 上記HbA1cレベルが基準HbA1cレベル以上である場合、上記対象を、1つ以上のTNFR2活性化因子による反復治療を必要としていると同定するステップ
を含む。
本明細書において使用される「約」は、挙げられた値の±10%の値を意味する。
本発明者は、自己免疫疾患を有する対象が、TNF-α受容体II(TNFR2)活性化因子による治療に応答しやすいかまたはTNF-α受容体II(TNFR2)活性化因子による治療に応答しにくいかを判定する方法を見出した。本発明の方法によれば、自己免疫疾患を有する対象由来のサンプル中の、表面上のCD8タンパク質密度の低下を示す、in vivoまたはin vitroで1つ以上のTNF-α受容体II(TNFR2)活性化因子に曝露された自己反応性CD8+ T細胞集団の存在は、対象が1つ以上のTNFR2活性化因子による治療に応答しやすいことを示し得る。1つ以上のTNFR2活性化因子に曝露された自己反応性CD8+ T細胞の表面上のCD8タンパク質密度の低下は、基準CD8+ T細胞の表面上のCD8タンパク質密度に対する低下であり得る。基準CD8+ T細胞は、自己免疫疾患を有し、且つTNFR2活性化因子によりin vivoまたはin vitroで治療または前治療されていない対象由来のサンプルに由来し得る。あるいは、基準CD8+ T細胞は、健康な対象由来のサンプルに由来し得る。本発明の方法によれば、CD8+ T細胞の表面上のCD8タンパク質密度は、抗CD8抗体を用いて決定することができる。
CD8表面タンパク質アッセイ
本発明は、自己免疫疾患を有する対象(例えばヒト)を1つ以上のTNFR2活性化因子による治療に応答しやすいと同定する方法を特徴とする。一部の実施形態において、上記方法は以下のステップ:(i) 上記対象由来の1つ以上のCD8+T細胞を含むin vitro生物学的サンプル(例えば血液)を、TNFR2活性化因子を含む組成物と接触させるステップ、および(ii) 抗CD8抗体を用いて自己反応性CD8+T細胞を検出するステップを含む。基準CD8+ T細胞と比較した、1つ以上の自己反応性CD8+ T細胞の表面上のCD8タンパク質密度の低下は、対象が治療に応答しやすいことを示す。基準CD8+T細胞(例えば自己反応性CD8+ T細胞)は、自己免疫疾患を有し、且つTNFR2活性化因子によりin vivoまたはin vitroで治療または前治療されていない対象由来のサンプルに由来するものであってよい。あるいは、基準CD8+ T細胞(例えば、非自己反応性CD8+ T細胞)は、健康な対象由来のサンプルに由来するものであってよい。
本発明はまた、1型糖尿病を有する対象(例えばヒト)を1つ以上のTNFR2活性化因子による治療に応答しやすいと同定する方法も特徴とする。この方法は、対象(例えばヒト)由来のin vitro生物学的サンプル(例えば、血液、血液成分(例えば血清もしくは血漿)、または尿)を、サンプル中のCペプチドを検出することができるデバイスと接触させるステップを含む。約1.5pmol/L超(例えば約2.5pmol/L超)のサンプル中のCペプチドレベルの検出は、対象(例えばヒト)が治療に応答しやすいことを示す。約1.5pmol/L未満のサンプル中のCペプチドレベルの検出は、対象が治療に応答しにくいことを示す(例えば、対象をこのような治療法から除外してもよいし、TNFR2療法を細胞療法(例えば多能性細胞(例えばHox11+脾細胞))と組み合わせて投与してもよい)。約1.5pmol/L〜約900pmol/Lの範囲(例えば、約500pmol/L、約200pmol/L、約100pmol/L、約50pmol/L、または約4.0pmol/L)の、サンプル中のCペプチドレベルの検出は、対象が治療に応答しやすいことを示す。本発明の方法によれば、対象は長期糖尿病患者であり得る。1.5pmol/L超のCペプチドレベルは、対象がTNFR2活性化因子による治療に応答しやすいことを示す。Cペプチドレベルは、空腹時対象由来のサンプル(空腹時Cペプチドレベル)、または混合食物耐性試験もしくはグルカゴン試験による刺激における対象由来のサンプル中で測定することができる。治療が自己反応性CD8+ T細胞の細胞死および/または内因性β膵島細胞の増殖もしくは再生を引き起こし、これにより治療前のレベルと比較して、インスリンレベルの増加および平均血漿グルコースレベルの低下をもたらす(例えば、正常血糖を確立する)場合、対象はTNFR2活性化因子による治療に応答するであろう。
本発明はまた、対象の治療前、治療中、または治療後に対象由来の血液サンプル中のHbA1cレベルを測定することにより、対象がTNFR2活性化因子による治療(単独で、または1つ以上の多能性細胞(例えばHox11+脾細胞)を含む組成物と組み合わせて)に応答しやすい状態にあるかまたは将来応答しやすいであろうかを判定する方法も特徴とする。対象の治療の前に測定されたHbA1cレベルを、基準HbA1cレベルとして使用することができる。対象から採取された血液サンプル中のHbA1cレベルのさらなる測定は、対象の治療の少なくとも1ヶ月(例えば少なくとも3ヶ月、少なくとも6ヶ月、少なくとも1年、少なくとも2年、少なくとも3年、少なくとも4年、少なくとも5年または少なくとも6年)後に行うことができる。本発明の方法は、治療後に測定されたHbA1cレベルを基準HbA1cレベルに対して比較するステップ、およびHbA1cレベルが基準HbA1cレベル以上である場合、対象を、本発明の医薬組成物による反復治療を必要としていると同定するステップをさらに含み得る。1つ以上のTNFR2活性化因子の投与後、HbA1cレベルを対象由来のサンプル中で測定してエンドポイントを決定し、治療の長期成功を評価することができる。基準HbA1cレベルと比較した、HbA1cレベルの少なくとも約0.1%(例えば0.15%、0.2%、0.25%、0.3%、0.4%または0.5%)の低下は、治療の長期成功の可能性が高いことを示す。基準HbA1cレベルを超える、HbA1cレベルの少なくとも約0.1%(例えば0.2%、0.3%、0.4%または0.5%)の増加は、本発明の医薬組成物による1回以上の反復治療を対象に与えるべきであることを示し得る。
本発明はまた、自己免疫疾患(例えば1型糖尿病)を有する対象(例えばヒト)の治療において、また特に、本発明の1つ以上の診断方法により治療に応答しやすい(例えば、CD8+ T細胞死を経験しやすいおよび/または自己免疫疾患により損傷した組織(例えば、1型糖尿病を有する対象におけるβ膵島細胞)の修復および/または再生を経験しやすい)と同定された対象の治療において使用するための1つ以上のTNFR2活性化因子を含む医薬組成物も特徴とする。
本発明の方法による、1型糖尿病を有し、実質的に検出不能なCペプチドレベル(例えば、約1.5pmol/L未満のCペプチドレベル)を有する対象の同定は、対象が、β膵島細胞またはβ膵島細胞を再生することができる細胞(例えば、多能性細胞(例えばHox11+脾細胞))による治療から利益を得る可能性があるか、またはそれを必要とすることを示し得る。Hox11+脾細胞は、国際公開番号第WO 2005/042727号(この文献は参照により本明細書に組み込まれる)に記載されるとおり、対象においてin vivoでβ膵島細胞を再生することができる細胞の内因性源である。従って、1型糖尿病を有する対象は、1つ以上のTNFR2活性化因子による治療が、自己反応性T細胞を死滅させ、さらに対象が内因性β膵島細胞を(例えば、内因性β膵島細胞の増殖を通じて、または多能性細胞(例えばHox11+脾細胞)のβ膵島細胞への分化により)再生することを可能とする場合、細胞治療から(例えば、4年以内(例えば3年以内))の長期利益を有し得る。対象においてβ膵島細胞に分化し得る他の種類の多能性細胞(例えば、米国特許第7,432,104号および第8,008,075号(これらの文献は参照により本明細書に組み込まれる)に記載されている多能性細胞など)を、対象に投与することができる。1型糖尿病を有する対象由来のサンプル中の実質的に検出不能なCペプチドレベル(例えば約1.5pmol/L未満)は、対象が、例えば、Hox11+脾細胞コンパートメントから、β膵島細胞を再生する能力を喪失したことを示し得る。このようにして、対象は、β膵島細胞の外因性源の投与から利益を得ることができる。
1つ以上のTNFR2活性化因子を含む本発明の医薬組成物は、任意の経路による投与、例えば皮内、筋肉内、非経口、静脈内、動脈内、頭蓋内、皮下、眼窩内、脳室内、脊髄内、腹腔内、または鼻腔内投与用に製剤化することができる。本発明の組成物は、皮内投与用に製剤化することができる。
CD8表面タンパク質アッセイ用キット
本発明は、対象由来のサンプル用の容器、保存剤(例えば、ダサチニブ(例えばサンプル中少なくとも約10nM(例えば少なくとも約50nM、少なくとも約100nM、少なくとも約200nM、少なくとも約500nM、または少なくとも約1μM)のダサチニブの最終溶液;例えば少なくとも約10mMのダサチニブを有する1mL溶液を生成するのに十分な量のダサチニブ)、または少なくとも約1.0μg〜約25mgの固体形態のダサチニブを有する容器)、サンプルを採取しおよび/またはサンプルを容器に入れるための機器、ならびにサンプルを採取および保存するための使用説明書を含むキットを提供する。本キットは、蛍光色素にコンジュゲートしたCD8抗体および/またはTNFR2活性化因子(例えば、バチルス・カルメット-ゲラン(BCG)、完全フロイントアジュバント、TNF-α、TNF-α受容体IIアゴニスト、TNF-αムテイン、インターロイキン-1、インターロイキン-2、組織プラスミノーゲン因子、リポ多糖(LPS)、リンホトキシン、またはカケクチン)をさらに含み得る。上記のキット中の使用説明書は、実務者(例えば、医師、看護師、または実験助手)が、対象がTNFR2活性化因子による治療に応答しやすいか否かを判定するために対象由来のサンプルを使用し得る方法についても説明し得る。本キットは、サンプルの採取および上記の容器への移動のための器具(例えば、注射針またはカテーテル)、細胞を規定の温度(例えば、約4℃〜約27℃)に保つための成分、例えば冷却剤(例えば、アイスパック、ドライアイス、冷却ポーチ、または冷却板)をさらに含み得る。本キットは、必要であれば、細胞サンプルを輸送するためのクーラーボックスまたは絶縁担体も含み得る。
本発明はまた、捕捉剤(例えば、Cペプチドに結合する抗体)が表面に固定されたデバイス、ペルオキシダーゼ酵素にコンジュゲートした結合検出剤(例えば、Cペプチドに選択的に結合する抗体)、ペルオキシダーゼ基質、実務者(例えば、医師、看護師、または実験助手)が、対象がTNFR2活性化因子による治療に応答しやすいか否かを判定するための対象由来のサンプルの分析のためにキットの内容物を使用し得る方法を説明する使用説明書を含むキットも提供する。
本発明はまた、対象由来のサンプルを保存するための容器、およびサンプル中のHbA1cレベルを決定し、このHbA1cレベルを用いて対象がTNFR2活性化因子含有組成物の投与を必要とするか否かを判定するための使用説明書を含むキットも提供する。
[1] 自己免疫疾患を有する対象が腫瘍壊死因子-α(TNF-α)受容体II(TNFR2)活性化因子による治療に応答する可能性を判定する方法であって、以下のステップ:
(i) 該対象由来のCD8+ T細胞集団を含むin vitro生物学的サンプルを、TNFR2活性化因子を含む組成物と接触させるステップ;および
(ii) 該集団中の自己反応性CD8+ T細胞の表面上のCD8タンパク質密度を測定するステップ;
を含み、ここで基準CD8+ T細胞と比較した、該自己反応性CD8+T細胞の表面上のCD8タンパク質密度の低下は、該対象が該治療に応答しやすいことを示す、前記方法。
[2] 前記基準CD8+ T細胞が、自己免疫疾患を有し、且つTNFR2活性化因子により治療または前治療されていない対象に由来する基準サンプルに由来する、上記[1]に記載の方法。
[3] 前記基準CD8+ T細胞が、健康な対象に由来する基準サンプルに由来する、上記[1]に記載の方法。
[4] 前記測定が、抗CD8抗体を用いて行われる、上記[1]〜[3]のいずれかに記載の方法。
[5] 前記抗体が蛍光色素にコンジュゲートされている、上記[4]に記載の方法。
[6] 前記生物学的サンプルが、前記接触の前にダサチニブと共にインキュベートされる、上記[1]〜[5]のいずれかに記載の方法。
[7] 前記接触の前に、前記生物学的サンプルが少なくとも4時間ダサチニブと共にインキュベートされる、上記[6]に記載の方法。
[8] 前記接触の前に、前記生物学的サンプルが最大48時間ダサチニブと共にインキュベートされる、上記[7]に記載の方法。
[9] 前記自己免疫疾患が、1型糖尿病、円形脱毛症、強直性脊椎炎、抗リン脂質症候群、自己免疫性アディソン病、自己免疫性溶血性貧血、自己免疫性肝炎、ベーチェット病、水疱性類天疱瘡、心筋症、セリアックスプルー皮膚炎、慢性疲労免疫不全症候群(CFIDS)、慢性炎症性脱髄性多発性神経障害、チャーグ・ストラウス症候群、瘢痕性類天疱瘡、CREST症候群、寒冷凝集素症、クローン病、円板状ループス、全身性エリテマトーデス、潰瘍性大腸炎、乾癬性関節炎、本態性混合型クリオグロブリン血症、線維筋痛-線維筋炎、グレーブス病、ギラン・バレー症候群、橋本甲状腺炎、甲状腺機能低下、特発性肺線維症、特発性血症板減少性紫斑病(ITP)、IgA腎症、若年性関節炎、扁平苔癬、ループス、メニエール病、混合結合組織疾患、多発性硬化症、重症筋無力症、尋常性天疱瘡、悪性貧血、結節性多発動脈炎、多発性軟骨炎、多腺性症候群、リウマチ性多発筋痛、多発性筋炎および皮膚筋炎、原発性原発性無ガンマグロブリン血症、原発性胆汁性肝硬変、乾癬、レイノー現象、ライター症候群、リウマチ熱、関節リウマチ、サルコイドーシス、強皮症、シェーグレン症候群、スティッフマン症候群、デビック病、高安動脈炎、側頭動脈炎/巨細胞性動脈炎、潰瘍性大腸炎、ブドウ膜炎、血管炎、白斑、ウェゲナー肉芽腫症ならびに自己免疫神経障害からなる群から選択される、上記[1]〜[8]のいずれかに記載の方法。
[10] 前記自己免疫疾患が、1型糖尿病、セリアックスプルー皮膚炎、クローン病、グレーブス病、甲状腺機能低下、ループス、多発性硬化症、乾癬、関節リウマチ、サルコイドーシス、シェーグレン症候群、および潰瘍性大腸炎からなる群から選択される、上記[9]に記載の方法。
[11] 前記自己免疫神経障害が、ニューロンに対する自己免疫媒介性損傷、自己免疫性アルツハイマー病、自己免疫性パーキンソン病、または自己免疫媒介性筋萎縮性側索硬化症である、上記[9]に記載の方法。
[12] 1型糖尿病を有する対象が腫瘍壊死因子-α(TNF-α)受容体II(TNFR2)活性化因子による治療に応答する可能性を判定する方法であって、該方法が、該対象由来のin vitro生物学的サンプルを該サンプル中のCペプチドを検出することができるデバイスと接触させるステップを含み、ここで該サンプル中の検出可能なCペプチドレベルは該対象が該治療に応答しやすいことを示し、また実質的に検出不能なCペプチドレベルは該対象が該治療に応答しにくいことを示す、前記方法。
[13] 前記Cペプチドの実質的に検出不能なレベルは、前記対象が前記治療から除外されるべきであることを示す、上記[12]に記載の方法。
[14] 前記実質的に検出不能なレベルが、約1.5pmol/L未満のCペプチドレベルである、上記[12]または[13]に記載の方法。
[15]
前記実質的に検出不能なレベルが、約1.0pmol/L未満のCペプチドレベルである、上記[12]〜[14]のいずれかに記載の方法。
[16] 前記検出可能なレベルが、約1.5pmol/L超のCペプチドレベルである、上記[12]に記載の方法。
[17] 前記Cペプチドの濃度が約1.5pmol/L〜約4.0pmol/Lの範囲である場合、前記対象が前記治療に応答しやすいと同定される、上記[12]〜[16]のいずれかに記載の方法。
[18] 前記接触が、前記対象の前記治療の前に行われる、上記[12]〜[17]のいずれかに記載の方法。
[19] 前記治療を開始する前に、前記対象由来の血液サンプル中の基準HbA1cレベルを測定するステップをさらに含む、上記[12]〜[18]のいずれかに記載の方法。
[20] さらに以下のステップ:
(i) 前記治療後に前記対象から採取された血液サンプル中のHbA1cレベルを測定するステップ、
(ii) 該HbA1cレベルを前記基準HbA1cレベルと比較するステップ、および
(iii) 該HbA1cレベルが該基準HbA1cレベル以上である場合、該対象を、前記1つ以上のTNFR2活性化因子による反復治療を必要としていると同定するステップ
を含む、上記[18]に記載の方法。
[21] 前記血液サンプルが、前記治療の少なくとも6ヶ月後に前記対象から採取される、上記[20]に記載の方法。
[22] 前記血液サンプルが、前記治療の少なくとも1年後に前記対象から採取される、上記[21]に記載の方法。
[23] 前記血液サンプルが、前記治療の少なくとも2年後に前記対象から採取される、上記[22]に記載の方法。
[24] 前記血液サンプルが、前記治療の少なくとも3年後に前記対象から採取される、上記[23]に記載の方法。
[25] 前記血液サンプルが、前記治療の少なくとも5年後に前記対象から採取される、上記[24]に記載の方法。
[26] 前記接触が、以下のステップ:
(i) 前記サンプルを、表面に固定化捕捉剤を有する前記デバイスと接触させることにより、該サンプル中の前記Cペプチドを該固定化捕捉剤に結合させるステップ;
(ii) 該表面を結合検出剤と接触させることにより、該Cペプチドを該結合検出剤に結合させるステップ;および
(iii) 該結合検出剤を用いて該サンプル中の該Cペプチドのレベルを測定するステップを含む、上記[12]〜[25]のいずれかに記載の方法。
[27] 前記結合検出剤がペルオキシダーゼ酵素を含む、上記[26]に記載の方法。
[28] 前記測定が、前記表面を、過酸化水素およびペルオキシダーゼ基質を含む溶液と接触させるステップを含む、上記[26]に記載の方法。
[29] 前記サンプルが、血液、血液成分、または尿サンプルを含む、上記[1]〜[28]のいずれかに記載の方法。
[30] 前記血液成分が、血清または血漿である、上記[29]に記載の方法。
[31] 前記サンプルが尿を含む、上記[29]に記載の方法。
[32] 前記TNFR2活性化因子が、バチルス・カルメット-ゲラン(BCG)、完全フロイントアジュバント、TNF-α、TNF-α受容体IIアゴニスト、TNF-αムテイン、インターロイキン-1、インターロイキン-2、組織プラスミノーゲン因子、リポ多糖(LPS)、リンホトキシンおよびカケクチンからなる群から選択される、上記[1]〜[31]のいずれかに記載の方法。
[33] 前記TNFR2活性化因子がBCGである、上記[32]に記載の方法。
[34] 上記[10]に記載の方法であって、前記自己免疫疾患が1型糖尿病であり、また前記方法が上記[12]〜[33]のいずれかに記載の1つ以上の方法と組み合わせて使用される、前記方法。
[35] 前記治療に応答しやすいと診断された対象における自己免疫疾患の治療において使用するための、1つ以上のTNFR2活性化因子を含む医薬組成物。
[36] 前記対象由来のサンプルが、基準対象由来のサンプル中の基準T細胞の表面上のCD8タンパク質密度と比較して、TNFR2活性化因子への曝露後に表面上のCD8タンパク質密度の低下を示すT細胞集団を含む、上記[35]に記載の医薬組成物。
[37] 前記基準対象が健康な対象である、上記[36]に記載の医薬組成物。
[38] 前記基準対象が自己免疫疾患を有し、1つ以上のTNFR2活性化因子により治療または前治療されていない、上記[36]に記載の医薬組成物。
[39] 前記自己免疫疾患が、I型糖尿病、円形脱毛症、強直性脊椎炎、抗リン脂質症候群、自己免疫性アディソン病、自己免疫性溶血性貧血、自己免疫性肝炎、ベーチェット病、水疱性類天疱瘡、心筋症、セリアックスプルー皮膚炎、慢性疲労免疫不全症候群(CFIDS)、慢性炎症性脱髄性多発性神経障害、チャーグ・ストラウス症候群、瘢痕性類天疱瘡、CREST症候群、寒冷凝集素症、クローン病、円板状ループス、全身性エリテマトーデス、潰瘍性大腸炎、乾癬性関節炎、本態性混合型クリオグロブリン血症、線維筋痛-線維筋炎、グレーブス病、ギラン・バレー症候群、橋本甲状腺炎、甲状腺機能低下、特発性肺線維症、特発性血症板減少性紫斑病(ITP)、IgA腎症、若年性関節炎、扁平苔癬、ループス、メニエール病、混合結合組織疾患、多発性硬化症、重症筋無力症、尋常性天疱瘡、悪性貧血、結節性多発動脈炎、多発性軟骨炎、多腺性症候群、リウマチ性多発筋痛、多発性筋炎および皮膚筋炎、原発性無ガンマグロブリン血症、原発性胆汁性肝硬変、乾癬、レイノー現象、ライター症候群、リウマチ熱、関節リウマチ、サルコイドーシス、強皮症、シェーグレン症候群、スティッフマン症候群、デビック病、高安動脈炎、側頭動脈炎/巨細胞性動脈炎、潰瘍性大腸炎、ブドウ膜炎、血管炎、白斑、ウェゲナー肉芽腫症ならびに自己免疫神経障害からなる群から選択される、上記[35]〜[38]のいずれかに記載の医薬組成物。
[40] 前記自己免疫疾患が、1型糖尿病、セリアックスプルー皮膚炎、クローン病、グレーブス病、甲状腺機能低下、ループス、多発性硬化症、乾癬、関節リウマチ、サルコイドーシス、シェーグレン症候群、および潰瘍性大腸炎からなる群から選択される、上記[39]に記載の医薬組成物。
[41] 前記自己免疫神経障害が、ニューロンに対する自己免疫媒介性損傷、自己免疫性アルツハイマー病、自己免疫性パーキンソン病、または自己免疫媒介性筋萎縮性側索硬化症である、上記[39]に記載の医薬組成物。
[42] 前記対象が、上記[1]〜[11]のいずれかに記載の方法により前記治療に応答しやすいと同定される、上記[35]〜[41]のいずれかに記載の医薬組成物。
[43] 前記治療前に、前記対象由来のin vitroサンプル中のCペプチドのレベルを決定することによって該治療に応答しやすいと同定された対象における1型糖尿病の治療において使用するための、1つ以上のTNFR2活性化因子を含む医薬組成物であって、実質的に検出不能なCペプチドレベルは該対象が該治療に応答しにくいことを示し、また検出可能なCペプチドレベルは該対象が該治療に応答しやすいことを示す、前記医薬組成物。
[44] 前記実質的に検出不能なCペプチドレベルが、前記対象が前記治療から除外されるべきであることを示す、上記[43]に記載の医薬組成物。
[45] 前記実質的に検出不能なレベルが、1.5pmol/L未満のCペプチドレベルである、上記[43]または[44]に記載の医薬組成物。
[46] 前記検出可能なレベルが、1.5pmol/Lを超えることはないCペプチドである、上記[43]または[44]に記載の医薬組成物。
[47] 前記対象由来の尿サンプルが約4.0pmol/mmol未満の、クレアチニンに対するCペプチドの比率を示す場合、該対象が前記治療から除外される、上記[43]〜[46]のいずれかに記載の医薬組成物。
[48] 前記対象由来の尿サンプルが約4.0pmol/mmol以上の、クレアチニンに対するCペプチドの比率を示す場合、該対象が前記治療に応答しやすいと同定される、上記[43]〜[46]のいずれかに記載の医薬組成物。
[49] 前記対象が、上記[11]〜[33]のいずれかに記載の方法により前記治療に応答しやすいと同定される、上記[43]〜[46]のいずれかに記載の医薬組成物。
[50] 前記対象のHbA1cレベルが、前記組成物の投与後約4年以内に少なくとも0.1%低下することを特徴とする、上記[43]〜[46]のいずれかに記載の医薬組成物。
[51] 前記対象のHbA1cレベルが、前記組成物の投与後約3年以内に少なくとも0.1%低下することを特徴とする、上記[50]に記載の医薬組成物。
[52] 前記組成物が、前記対象における1型糖尿病の2回目またはそれ以降の治療において使用するためのものであり、ここで前記対象におけるHbA1cレベルは、以前の治療の前の前記対象におけるHbA1cレベルと比較して増加するかまたは変化しない、上記[43]〜[49]のいずれかに記載の医薬組成物。
[53] 前記対象が、上記[20]〜[25]のいずれかに記載の方法により1つ以上のTNFR2活性化因子による反復治療を必要としていると同定されている、上記[52]に記載の医薬組成物。
[54] 前記対象がヒトである、上記[35]〜[53]のいずれかに記載の医薬組成物。
[55] 前記対象が長期糖尿病患者である、上記[35]〜[54]のいずれかに記載の医薬組成物。
[56] 前記1つ以上のTNFR2活性化因子が、バチルス・カルメット-ゲラン(BCG)、完全フロイントアジュバント、TNF-α、TNF-α受容体IIアゴニスト、TNF-αムテイン、インターロイキン-1、インターロイキン-2、組織プラスミノーゲン因子、リポ多糖(LPS)、リンホトキシンおよびカケクチンからなる群から選択される、上記[35]〜[55]のいずれかに記載の医薬組成物。
[57] 前記1つ以上のTNFR2活性化因子がBCGである、上記[56]に記載の医薬組成物。
[58] 前記組成物が、2x106 CFU超/BCG用量を含む、上記[57]に記載の医薬組成物。
[59] 前記組成物が、2.3x106 CFU超/BCG用量を含む、上記[57]または[58]に記載の医薬組成物。
[60] 前記組成物が、4x106 CFU未満/BCG用量を含む、上記[57]〜[59]のいずれかに記載の医薬組成物。
[61] 前記組成物が凍結乾燥BCGを含む、上記[57]〜[60]のいずれかに記載の医薬組成物。
[62] 前記組成物が、BCGの生理食塩水溶液を含む、上記[57]〜[61]のいずれかに記載の医薬組成物。
[63] 前記組成物が、前記対象に1回以上投与される、上記[56]〜[62]のいずれかに記載の医薬組成物。
[64] 前記組成物が、前記対象に2回以上投与される、上記[63]に記載の医薬組成物。
[65] 前記組成物が、前記対象に2回投与される、上記[63]または[64]に記載の医薬組成物。
[66] 前記組成物の前記投与の少なくとも2回は、少なくとも2週間の間隔があけられる、上記[64]または[65]に記載の医薬組成物。
[67] 前記組成物の前記投与の少なくとも2回は、少なくとも4週間の間隔があけられる、上記[64]〜[66]のいずれかに記載の医薬組成物。
[68] 前記組成物が、皮内、筋肉内、非経口、静脈内、動脈内、頭蓋内、皮下、眼窩内、脳室内、脊髄内、腹腔内および鼻腔内からなる群から選択される経路による投与のために製剤化される、上記[35]〜[67]のいずれかに記載の医薬組成物。
[69] 前記組成物が皮内投与用に製剤化される、上記[68]に記載の医薬組成物。
[70] 前記組成物が、生理食塩水溶液としての投与用に製剤化される、上記[35]〜[69]のいずれかに記載の医薬組成物。
[71] 前記溶液が、1用量当たり約0.2cc未満の体積を有する、上記[70]に記載の医薬組成物。
[72] 前記溶液が、1用量当たり0.1ccの体積を有する、上記[71]に記載の医薬組成物。
[73] 2つ以上のTNFR2活性化因子の個別投与用に製剤化される、上記[35]〜[72]のいずれかに記載の医薬組成物。
[74] 2つ以上のTNFR2活性化因子の組み合わせ投与用に製剤化される、上記[35]〜[73]のいずれかに記載の医薬組成物。
[75] 前記組成物が、前記対象においてTNF-αの発現を誘導することができることを特徴とする、上記[35]〜[74]のいずれかに記載の医薬組成物。
[76] 前記組成物が、前記対象の自己反応性免疫細胞におけるNF-κB経路の活性化を誘導することができることを特徴とする、上記[35]〜[75]のいずれかに記載の医薬組成物。
[77] 前記自己反応性免疫細胞が、自己反応性CD8+ T細胞である、上記[76]に記載の医薬組成物。
[78] 前記組成物が、前記対象において自己反応性免疫細胞の死滅を引き起こすことを特徴とする、上記[35]〜[75]のいずれかに記載の医薬組成物。
[79] 前記組成物が、前記対象において調節T細胞の増殖を引き起こすことを特徴とする、上記[35]〜[78]のいずれかに記載の医薬組成物。
[80] 前記調節T細胞が、調節CD4+ T細胞である、上記[79]に記載の医薬組成物。
[81] 前記組成物が、前記対象において高血糖症に由来する合併症を予防することを特徴とする、上記[35]〜[80]のいずれかに記載の医薬組成物。
[82] 前記高血糖症に由来する合併症が、腎障害、神経障害、心血管損傷、網膜への損傷、足への損傷、脚への損傷、心臓への損傷、およびケトアシドーシスからなる群から選択される、上記[81]に記載の医薬組成物。
[83] 前記組成物が、1つ以上の製薬上許容される担体または賦形剤を含む、上記[35]〜[82]のいずれかに記載の医薬組成物。
以下の実施例は、本発明を説明することを意図するものである。これらの実施例は、決して本発明を限定することを意図するものではない。
本発明の医薬組成物(例えばTNFR2活性化因子)による治療の前に、対象(例えばヒト)を試験して対象が治療に応答しやすいかどうかを判定してもよい。試験は、対象から採取されたサンプル(例えば、血液、血液成分、または尿)を用いて行ってもよい。例えば、血清サンプルを調製するため、血液を静脈穿刺によって採取して凝固させてもよく、さらに遠心分離により血清を分離してもよい。血漿サンプルを調製するため、血液を、静脈穿刺によって抗凝血剤としてのヘパリンまたはEDTAを含むチューブに採取してもよく;その後血漿画分をサンプルから分離してもよい。尿サンプルを調製するため、24時間尿サンプル(保存剤なし)を採取してもよい。細胞デブリを、試験の前に、濾過または遠心分離のいずれかによってサンプルから除去してもよい。
TNFR2活性化因子(例えばBCG)による治療の前に、サンプル(例えば血液)を、実施例1で治療に応答しやすいと同定された対象から採取することができる。HbA1cレベルについてサンプルを分析し、研究のためのベースラインHbA1cレベルを決定することができる。
1. T細胞アッセイ
CD4+およびCD8+ T細胞は、新鮮なヒト血液から、静脈穿刺の1.5時間以内に、Dynal社製CD4陽性単離キットおよびDynal社製CD8陽性単離キット(Invitrogen社、カールスバッド、カリフォルニア州)を用いて単離することができる。この方法は、磁性粒子も抗体による陽性選択も用いずに細胞が得られる点において独特である。
以前に記載されたとおり(Verginisら, Proc. Natl. Acad. Sci. U.S.A. 105:3479-3484, 2008年)、高度に精製された、高収率の生存CD8+ T細胞を、テトラマー染色に利用することができる。テトラマーは、外部結合溝中にロードされたペプチドを有する特異的HLAクラス1タンパク質の結合領域から構成される診断試薬である。次いで、当該テトラマーは蛍光発光性にされ、提示されたペプチドフラグメントに対して特異的反応性を有するT細胞に結合し得る診断試薬として機能する。インスリンに対する自己反応性T細胞の検出については、HLVEALYLVのフラグメントを有する、HLA*0210インスリンβ10-18に対するテトラマー(Beckman Coulter社、#T02001)を使用することができる。陰性対照テトラマーについては、以下のテトラマー試薬を使用することができる:KIFGSLAFLに対する配列を有するHLA *0201 Her-2/neu(Beckman Coulter社、#T02001)、乳癌ペプチド、非特異的ペプチドフラグメントを有さないHLA *0201 null(Beckman Coulter社、#T01010)および/またはNLVPMVATVの配列を有する、CMVウイルスHLA-A *0201 CMGPP65に対するテトラマー(Beckman Coulter社、#T01009)。
TREG細胞の検出のため、2つの異なる方法を使用することができる。TREG細胞は、CD4、CD25bright、およびFoxp3染色を用いて、またはCD4、CD25bright、およびCD127low抗体染色により検出することができる。手短に言えば、単離したCD4陽性細胞を、CD4-PE-Cy5(クローンRPA-T4)抗体およびCD25-PE(クローンBC96)抗体と共に室温で20分間インキュベートすることができる。洗浄後、細胞を、Foxp3 Fix/Perm溶液(Biolegend社)を用いて室温で20分間かけて固定することができる。細胞を洗浄し、Biolegend社のFoxp3 Permバッファーを用いて室温で15分間かけて透過処理することができる。次いで、細胞を、Foxp3 Alexa Fluor477抗体(クローン259D)で30分間かけて染色することができる。フローサイトメトリー分析の前に、各サンプルについてアイソタイプコントロールを行うことができる。あるいは、T調節細胞の検出のため、CD4抗体(クローンRPA-T4、BD Biosciences社、サンノゼ、カリフォルニア州)および抗ヒトCD127抗体(クローンhIL-7R-M21、BD Biosciences社)による染色も行うことができる。TREG細胞を検出するための他の方法は、米国特許出願第61/763,217号(この文献は参照によりその全体が本明細書に組み込まれる)に記載されている。
材料及び方法
対象
マサチューセッツ総合病院(Massachusetts General Hospital)にて、1型糖尿病を有する患者を集めた。糖尿病患者を日常的にスクリーニングして疾患の経過を特徴付け、干渉の可能性がある医学的状態を有する対象を除外した。スクリーニングの間、3人の患者が、長期1型糖尿病を有し、且つEBVを最近発症したと同定された。この研究においては、EBV感染を伴わない糖尿病患者(N=66)を基準集団として用いた。全ての患者および対照の血液は、EDTAを含むBD Vacutainer(商標)チューブ(BD社、フランクリン・レイク、ニュージャージー州)中に採血された。
本研究は、マサチューセッツ総合病院(Massachusetts General Hospital)の施設内治験審査委員会(Institutional Review Board)によって承認された(IRBプロトコルNo. 2001P-001379)。全ての血液ドナーから書面による同意を得た。
拘束された抗原特異性を有するT細胞の特定亜集団の検出のため、小ペプチドフラグメントがロードされた市販のHLAクラスI試薬を使用した。これらの市販の試薬は、一般的にはテトラマー(MBL International社、デスプレーンズ、イリノイ州、以前はBeckman Coulter社、フラートン、カリフォルニア州)またはデキストラマー(Immudex社、フェアファックス、バージニア州)と呼ばれる。2つのT細胞検出法は、検出試薬の骨格構造において異なるが、自己反応性T細胞に対する結合特異性は異ならない。テトラマーまたはデキストラマー試薬は、購入されて、フローサイトメーターによる、抗原特異的T細胞に結合した試薬の検出のために蛍光標識される。
新鮮な血液からCD8+T細胞を直接単離するため、抗CD8抗体でコーティングした常磁性ビーズをベースとした「Detach-a-bead」CD8陽性単離キットを使用した(Life Technologies社、カールスバッド、カリフォルニア州)(Burgerら, PLoS One, 6:e22430, 2011年(この文献は参照により本明細書に組み込まれる)参照)。ビーズを、タンブラー上の連続撹拌下、室温で1時間付着させた。次いで、ビーズ/細胞複合体を磁石を用いて固定化し、任意の非結合(非CD8)細胞を、2%FBS(ウシ胎仔血清)を含むHBSS(カルシウムおよびマグネシウムを含まないハンクス液(Hank's Balanced Salt Solution)、Invitrogen社、グランドアイランド、ニューヨーク州)による反復洗浄によって除去した。その後、ビーズを、単離キット中に供給されるDetach-A-Bead試薬を用いて残りのCD8+細胞から分離した。この試薬は、ビーズ上にコーティングされたCD8抗体の抗原認識部位に対するポリクローナル抗体である。この試薬は、CD8抗体結合部位に対する競合によって抗体/ビーズ複合体を細胞から分離し、本質的に処女細胞としておく。
血液サンプルを、最初に2%FBSを含む50倍体積のHBSSで洗浄した。次いで、これらをテトラマーまたはデキストラマーで標識し(暗所で室温(RT)にて20分間)、その後APC-抗CD8抗体で標識して(暗所で室温(RT)にて10分間)、CD8+ T細胞上でゲーティングすることを可能とした。次いで、フローサイトメトリーのため、サンプルを同時に溶解してNH4Cl/ホルムアルデヒドバッファーで固定し、HBSSで洗浄し、HBSS/ホルムアルデヒドに再懸濁した。
FACSCaliburフローサイトメーター(BD Biosciences社、サンノゼ、カリフォルニア州)を用いて細胞を分析し、リストモードでデータを収集した。データ分析は、Cell Questソフトウェア(BD Biosciences社)を用いて行った。全ての細胞を取り込むため、フローゲートを「オープン」に設定した。オープンゲートはあらゆるサイズの細胞を取り込んだが、細胞デブリ、赤血球、断片化した細胞、およびアポトーシス小体は排除した。PE蛍光およびAPC蛍光を、FL2およびFL7中でそれぞれ検出した。パーセントCD8+ T細胞は、CD8陽性事象の数と、リンパ球ゲート中の事象の総数との比率として定義された。
Cペプチドを、EBV感染患者の血液血清中のElisaによって決定した。超高感度CペプチドElisaは、Mercodia社(ウプサラ、スウェーデン)から購入した。このキットを、製造者の使用説明書に従って使用した。VCA IgM、早期抗原D、およびEBNAの血清レベルは、マサチューセッツ総合病院臨床検査サービス(Massachusetts General Hospital Clinical Laboratory Services)によって決定された。
統計的有意性は、0.05の信頼レベルの独立片側スチューデントt検定(図3Aおよび2B)または片側コルモゴロフ-スミルノフ検定(図2)を用いて決定した。
臨床プロファイル
1型糖尿病患者の日常的な受診の過程で、臨床的には単核球症または「モノ」としても知られるEBV感染を最近発症した3人の患者を同定した(表1参照)。これらの患者を、感染の提示後少なくとも15週間注意深く経過観察した。EBV感染の最近の発症は、EBV感染の臨床症状中および臨床症状後の両方の、自己免疫T細胞およびEBV-特異的T細胞の罹患率および特性を研究する機会を提供する。EBV感染の最近の発症はまた、EBV感染が膵臓によるインスリン産生の一過性増加を引き起こした(共分泌されたCペプチドとして測定された)という、BCG治療の臨床試験における過去の観察の再現性を実証する機会も提供する(Faustmanら, PLoS One, 7:e41756, 2012年(この文献は参照により本明細書に組み込まれる)参照)。
EBV感染の症状の提示および臨床的診断の後、感染の経時変化の詳細を決定し、感染開始時点を推定するため、ここで実施された連続血液研究と比較して、さらに詳細なEBV抗体血清学を行った(表2)。
EBV感染の診断の典型的な臨床的方法は抗体検査を伴うが、研究の設定において、新たに創出されたEBV-特異的T細胞の直接モニタリングによって感染を確認することが可能である。EBV-特異的テトラマー(すなわち合成ペプチド配列GLCTLVAMLをロードしたHLAクラスIタンパク質)を使用した。このようにして、フローサイトメトリーを用いてEBV-特異的CD8+ T細胞を検出した(図1Aおよび1B)。対象1においては、これらのEBV-特異的T細胞の検出のために対象2および3に対してわずかに異なる方法を用いたが(溶解した血液中のCD8+ T細胞の直接観察に対し、単離CD8+ T細胞)、全ての対象は、EBV特異的T細胞が蛍光のバックグラウンドレベルを超えて早期に上昇していた(図1B)。
最近15年間にわたる研究は、BCGまたはEBVのいずれかによるTNFの全身性増加またはTNFの誘導が、Cペプチドの回復と共に膵臓の再生をもたらすことを示した(Kodamaら, Science, 302:1223-1227, 2003年;Faustmanら, PLoS One, 7:e41756, 2012年;およびFaustman, J. Clin. Immunol. 13:1-7, 1993年(参照により本明細書に組み込まれる)を参照)。Cペプチドはインスリンと共分泌されるタンパク質であり、体外から投与されたインスリンの存在下における膵臓からのインスリン分泌を測定するための高感度な方法である。
前のデータは、BCG(または非cGMP対応完全フロイントアジュバント(CFA))によるNODマウスまたは糖尿病ヒトの治療が、死滅した自己反応性T細胞の一過性増加をもたらすことを示す。NODマウスにおいて、膵臓に存在する自己反応性T細胞は、膵臓中のインスリン分泌膵島の上部で、TNF、BCGまたはCFAにより直接アポトーシスを受けることが観察される(Kuhtreiberら, J. Mol. Endocrinol. 31:373-399, 2003年、この文献は参照により本明細書に組み込まれる)。ヒトにおいて、死滅した自己反応性T細胞を循環に迅速に放出させることにより、TNFが自己反応性T細胞に与える影響をモニターすることができる(Faustmanら, PLoS One, 7:e41756, 2012年(この文献は参照により本明細書に組み込まれる)を参照)。増加したTNFまたはTNFR2アゴニスト抗体は、培地中でマウスおよびヒトの糖尿病自己反応性T細胞のアポトーシスを引き起こすことが知られている(Banら, Proc. Nat. Acad. Sci. USA, 105:13644-13649, 2008年(この文献は参照により本明細書に組み込まれる)を参照)。
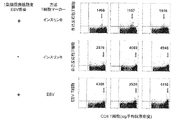
EBVウイルスに感染した長期糖尿病患者におけるインスリンB自己反応性T細胞のさらなる分析は、抗原特異的CD8+ T細胞の幾つかのさらなる顕著な特徴を明らかにした(図3B)。EBV感染後、循環中にさらに多くのインスリンB自己反応性CD8+ T細胞が存在していただけでなく、細胞上のCD8マーカーの密度も劇的に低かった。図3Bの3つの特徴的ヒストグラムに示されるとおり、EBV感染した対象におけるインスリンB自己反応性T細胞について、CD8の平均log蛍光密度は、1408、1157および1516であった。対照的に、感染していない長期糖尿病対象に由来するインスリンB自己反応性T細胞について、CD8マーカーの平均log抗原密度は、2976、4003、および4948であった。EBV感染した対象におけるより低いCD8タンパク質の密度は、全ての抗原特異的T細胞に一般化された傾向ではなく、自己反応性T細胞にのみ特異的であった。これらの同じ感染した対象について、EBV特異的T細胞のlog CD8+T細胞密度は正常であった。細胞表面上のCD8タンパク質密度は、4308、3530および4416(感染していない糖尿病患者のインスリンB自己反応性T細胞上のCD8タンパク質の密度と同様の値)であった(図3B)。CD8+マーカーの喪失は、T細胞の細胞損傷またはアポトーシスを示す(Diazら, J. Leukoc. Biol., 76:609-615, 2004年(この文献は参照により本明細書に組み込まれる)参照)。このように、TNFR2活性化因子(例えばTNF-αまたはBCG)に反応した自己反応性T細胞の表面上のCD8タンパク質の喪失は、自己免疫疾患を有する対象を、TNFR2活性化因子を用いて治療し得る可能性を診断するための代用指標(proxy)として使用することができる。
上記の明細書中で言及される全ての刊行物、特許、および特許出願は、参照により本明細書に組み込まれる。本発明の記載される装置および使用方法の様々な改変および変形は、本発明の範囲および精神を逸脱することなく当業者に明らかであろう。本発明は具体的実施形態に関連して記載されているが、請求される発明は、このような具体的実施形態に過度に限定されるべきではないと理解されるべきである。実際、当業者には明らかである本発明を実施するための記載される様式の様々な改変は、本発明の範囲内にあることが意図される。
Claims (32)
- 対象における1型糖尿病の治療方法に使用するための、BCGを含む医薬組成物であって、前記対象は、約1.5pmol/L〜約4.0pmol/Lの血中Cペプチドレベルを有し、前記方法は、BCGの投与前の前記対象から採取された血液サンプル中の糖化ヘモグロビン(HbA1c)レベルと比較した、BCGの投与の少なくとも6ヶ月後の前記対象から採取された血液サンプル中のHbA1cレベルの低下を検出することを含む、前記医薬組成物。
- 前記対象がヒトである、請求項1に記載の医薬組成物。
- 前記対象が長期糖尿病患者である、請求項1または2に記載の医薬組成物。
- 前記組成物が、2x106 CFU超/BCG用量を含む、請求項1〜3のいずれか1項に記載の医薬組成物。
- 前記組成物が、2.3x106 CFU超/BCG用量を含む、請求項4に記載の医薬組成物。
- 前記組成物が、4x106 CFU未満/BCG用量を含む、請求項4または5に記載の医薬組成物。
- 前記組成物が凍結乾燥BCGを含む、請求項4〜6のいずれか1項に記載の医薬組成物。
- 前記組成物が、BCGの生理食塩水溶液を含む、請求項4〜6のいずれか1項に記載の医薬組成物。
- 前記組成物が、前記対象への1回以上の投与用に製剤化されている、請求項4〜8のいずれか1項に記載の医薬組成物。
- 前記組成物が、前記対象への2回以上の投与用に製剤化されている、請求項9に記載の医薬組成物。
- 前記組成物が、前記対象への2回の投与用に製剤化されている、請求項9または10に記載の医薬組成物。
- 前記組成物は、少なくとも2週間の間隔での投与用に製剤化されている、請求項10または11に記載の医薬組成物。
- 前記組成物は、少なくとも4週間の間隔での投与用に製剤化されている、請求項10〜12のいずれか1項に記載の医薬組成物。
- 前記組成物が、皮内、筋肉内、非経口、静脈内、動脈内、頭蓋内、皮下、眼窩内、脳室内、脊髄内、腹腔内および鼻腔内からなる群から選択される経路による投与のために製剤化される、請求項1〜13のいずれか1項に記載の医薬組成物。
- 前記組成物が皮内投与用に製剤化される、請求項14に記載の医薬組成物。
- 前記溶液が、1用量当たり約0.2cc未満の体積を有する、請求項8に記載の医薬組成物。
- 前記溶液が、1用量当たり0.1ccの体積を有する、請求項16に記載の医薬組成物。
- 前記組成物が、前記対象においてTNF-αの発現を誘導することができることを特徴とする、請求項1〜17のいずれか1項に記載の医薬組成物。
- 前記組成物が、前記対象の自己反応性免疫細胞におけるNF-κB経路の活性化を誘導することができることを特徴とする、請求項1〜18のいずれか1項に記載の医薬組成物。
- 前記自己反応性免疫細胞が、自己反応性CD8+ T細胞である、請求項19に記載の医薬組成物。
- 前記組成物が、前記対象において自己反応性免疫細胞の死滅を引き起こすことを特徴とする、請求項1〜18のいずれか1項に記載の医薬組成物。
- 前記組成物が、前記対象において調節T細胞の増殖を引き起こすことを特徴とする、請求項1〜21のいずれか1項に記載の医薬組成物。
- 前記調節T細胞が、調節CD4+ T細胞である、請求項22に記載の医薬組成物。
- 前記組成物が、前記対象において高血糖症に由来する合併症を予防することを特徴とする、請求項1〜23のいずれか1項に記載の医薬組成物。
- 前記高血糖症に由来する合併症が、腎障害、神経障害、心血管損傷、網膜への損傷、足への損傷、脚への損傷、心臓への損傷、およびケトアシドーシスからなる群から選択される、請求項24に記載の医薬組成物。
- 前記組成物が、1つ以上の製薬上許容される担体または賦形剤を含む、請求項1〜25のいずれか1項に記載の医薬組成物。
- 前記血液サンプルが、BCGの投与の少なくとも1年後の前記対象から採取されたものである、請求項1〜26のいずれか1項に記載の医薬組成物。
- 前記血液サンプルが、BCGの投与の少なくとも2年後の前記対象から採取されたものである、請求項27に記載の医薬組成物。
- 前記血液サンプルが、BCGの投与の少なくとも3年後の前記対象から採取されたものである、請求項28に記載の医薬組成物。
- 前記血液サンプルが、BCGの投与の少なくとも5年後の前記対象から採取されたものである、請求項29に記載の医薬組成物。
- 前記対象は、BCGの前記対象への投与の前に定期的なインスリン注射療法を受けている、請求項1〜30のいずれか1項に記載の医薬組成物。
- 前記血液サンプル中のHbA1cレベルの低下の検出後に、前記対象において前記インスリン注射療法が低減又は中止される、請求項31に記載の医薬組成物。
Priority Applications (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2019132484A JP6964632B2 (ja) | 2013-10-17 | 2019-07-18 | 自己免疫疾患の治療に応答性の対象を同定する方法およびそれを治療するための組成物 |
| JP2021170871A JP2022023882A (ja) | 2013-10-17 | 2021-10-19 | 自己免疫疾患の治療に応答性の対象を同定する方法およびそれを治療するための組成物 |
| JP2023171996A JP2024001123A (ja) | 2013-10-17 | 2023-10-03 | 自己免疫疾患の治療に応答性の対象を同定する方法およびそれを治療するための組成物 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361892140P | 2013-10-17 | 2013-10-17 | |
| US61/892,140 | 2013-10-17 | ||
| PCT/US2014/060908 WO2015057968A2 (en) | 2013-10-17 | 2014-10-16 | Methods of identifying subjects responsive to treatment for an autoimmune disease and compositions for treating the same |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019132484A Division JP6964632B2 (ja) | 2013-10-17 | 2019-07-18 | 自己免疫疾患の治療に応答性の対象を同定する方法およびそれを治療するための組成物 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2016540195A JP2016540195A (ja) | 2016-12-22 |
| JP2016540195A5 JP2016540195A5 (ja) | 2017-11-24 |
| JP6560200B2 true JP6560200B2 (ja) | 2019-08-14 |
Family
ID=52828855
Family Applications (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016523296A Active JP6560200B2 (ja) | 2013-10-17 | 2014-10-16 | 自己免疫疾患の治療に応答性の対象を同定する方法およびそれを治療するための組成物 |
| JP2019132484A Active JP6964632B2 (ja) | 2013-10-17 | 2019-07-18 | 自己免疫疾患の治療に応答性の対象を同定する方法およびそれを治療するための組成物 |
| JP2021170871A Pending JP2022023882A (ja) | 2013-10-17 | 2021-10-19 | 自己免疫疾患の治療に応答性の対象を同定する方法およびそれを治療するための組成物 |
| JP2023171996A Pending JP2024001123A (ja) | 2013-10-17 | 2023-10-03 | 自己免疫疾患の治療に応答性の対象を同定する方法およびそれを治療するための組成物 |
Family Applications After (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019132484A Active JP6964632B2 (ja) | 2013-10-17 | 2019-07-18 | 自己免疫疾患の治療に応答性の対象を同定する方法およびそれを治療するための組成物 |
| JP2021170871A Pending JP2022023882A (ja) | 2013-10-17 | 2021-10-19 | 自己免疫疾患の治療に応答性の対象を同定する方法およびそれを治療するための組成物 |
| JP2023171996A Pending JP2024001123A (ja) | 2013-10-17 | 2023-10-03 | 自己免疫疾患の治療に応答性の対象を同定する方法およびそれを治療するための組成物 |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US20160245808A1 (ja) |
| JP (4) | JP6560200B2 (ja) |
| KR (1) | KR102393711B1 (ja) |
| CN (3) | CN105829885B (ja) |
| WO (1) | WO2015057968A2 (ja) |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR102393711B1 (ko) * | 2013-10-17 | 2022-05-04 | 더 제너럴 하스피탈 코포레이션 | 자가면역 질환의 치료에 반응하는 대상체의 식별 방법 및 그의 치료를 위한 조성물 |
| WO2017059132A1 (en) * | 2015-09-29 | 2017-04-06 | The General Hospital Corporation | Methods of treating and diagnosing disease using biomarkers for bcg therapy |
| US11408900B2 (en) * | 2016-01-15 | 2022-08-09 | Massachusetts Eye And Ear Infirmary | Secreted P-glycoprotein is a non-invasive biomarker of chronic rhinosinusitis |
| TWI644682B (zh) * | 2016-12-15 | 2018-12-21 | 深圳瑞健生命科學硏究院有限公司 | 一種纖溶酶原在製備促進胰島細胞損傷修復的藥物上的用途 |
| US11077179B2 (en) * | 2017-08-10 | 2021-08-03 | Epicgenetics, Inc. | Method for treating fibromyalgia and chronic fatigue syndrome |
| CN109055523A (zh) * | 2018-07-16 | 2018-12-21 | 中山大学附属第三医院(中山大学肝脏病医院) | Tnfr2基因及其编码蛋白的应用 |
| KR102282342B1 (ko) * | 2018-11-20 | 2021-07-27 | 아주대학교산학협력단 | 베체트병 진단 또는 예후 예측용 바이오마커 조성물 |
| CN110804643B (zh) * | 2019-10-29 | 2022-06-21 | 同济大学 | 一种体外评价卡介苗对中性粒细胞活性影响的方法 |
| CN112806322B (zh) * | 2021-03-22 | 2022-08-16 | 石河子大学 | 一种构建色素脱失模型的方法 |
Family Cites Families (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ATE178074T1 (de) * | 1994-07-08 | 1999-04-15 | Dartmouth College | Proinsulin-peptid-verbindungen für den nachweis und die behandlung von typ-i-diabetes |
| US5837467A (en) * | 1997-01-21 | 1998-11-17 | Yissum Research Development Company Of The Hebrew University Of Jerusalem | Method for predicting the response to treatment with BCG of superficial bladder carcinoma |
| AU2002952834A0 (en) * | 2002-09-16 | 2002-12-05 | The Walter And Eliza Hall Institute Of Medical Research | A method of treating an autoimmune disease |
| WO2004045376A2 (en) * | 2002-11-15 | 2004-06-03 | The General Hospital Corporation | Screening methods to identify treatments for autoimmune disease |
| CN1448724A (zh) * | 2003-05-13 | 2003-10-15 | 上海晶泰生物技术有限公司 | 1型糖尿病相关抗原抗体同时检测蛋白芯片 |
| EP1777523A1 (en) * | 2005-10-19 | 2007-04-25 | INSERM (Institut National de la Santé et de la Recherche Médicale) | An in vitro method for the prognosis of progression of a cancer and of the outcome in a patient and means for performing said method |
| RU2009143345A (ru) * | 2007-04-24 | 2011-05-27 | Диамид Терапьютикс Аб (Se) | Лекарственные средства и способы для лечения аутоиммунного заболевания и рака |
| JP2009014626A (ja) * | 2007-07-06 | 2009-01-22 | Medibic:Kk | Bcgによる治療効果の予測方法 |
| MX2011003347A (es) * | 2008-09-30 | 2011-05-25 | Baylor Res Inst | Metodos para reducir celulas t, b-auxiliares para tratar enfermedades autoinmunes. |
| EP2192197A1 (en) * | 2008-11-27 | 2010-06-02 | Vereniging voor christelijk hoger onderwijs, wetenschappelijk onderzoek en patiëntenzorg | Predicting clinical response to treatment with a soluble tnf-antagonist or tnf, or a tnf receptor agonist |
| WO2011005779A2 (en) * | 2009-07-07 | 2011-01-13 | University Of Southern California | Biomarkers for the early detection of autoimmune diseases |
| WO2011028257A1 (en) * | 2009-08-24 | 2011-03-10 | The Trustees Of Columbia University In The City Of New York | Assay for determining health of cd8+ t cells |
| JO3183B1 (ar) * | 2010-01-29 | 2018-03-08 | Regeneron Pharma | طرق لمعالجة أمراض المناعة الذاتية مضادات dll4 |
| JP6034283B2 (ja) * | 2010-03-26 | 2016-11-30 | トラスティーズ・オブ・ダートマス・カレッジ | Vista制御性t細胞メディエータタンパク質、vista結合剤、およびその使用 |
| WO2011127299A1 (en) * | 2010-04-09 | 2011-10-13 | The General Hospital Corporation | Methods for the treatment of autoimmune diseases |
| JP2013534925A (ja) * | 2010-06-25 | 2013-09-09 | グラクソ グループ リミテッド | 免疫関連疾患患者の治療方法 |
| JP2012108112A (ja) * | 2010-10-27 | 2012-06-07 | Arkray Inc | HbA1c測定結果の表示方法、表示装置、及び表示プログラム |
| JP5900044B2 (ja) * | 2012-03-12 | 2016-04-06 | オムロンヘルスケア株式会社 | 糖尿病治療支援装置、糖尿病治療支援方法、糖尿病治療支援プログラム |
| KR102393711B1 (ko) * | 2013-10-17 | 2022-05-04 | 더 제너럴 하스피탈 코포레이션 | 자가면역 질환의 치료에 반응하는 대상체의 식별 방법 및 그의 치료를 위한 조성물 |
-
2014
- 2014-10-16 KR KR1020167011472A patent/KR102393711B1/ko active IP Right Grant
- 2014-10-16 CN CN201480068827.4A patent/CN105829885B/zh active Active
- 2014-10-16 JP JP2016523296A patent/JP6560200B2/ja active Active
- 2014-10-16 CN CN202010079354.5A patent/CN111239415B/zh active Active
- 2014-10-16 WO PCT/US2014/060908 patent/WO2015057968A2/en active Application Filing
- 2014-10-16 US US15/027,757 patent/US20160245808A1/en active Pending
- 2014-10-16 CN CN202010769898.4A patent/CN111879948A/zh active Pending
-
2019
- 2019-07-18 JP JP2019132484A patent/JP6964632B2/ja active Active
-
2021
- 2021-10-19 JP JP2021170871A patent/JP2022023882A/ja active Pending
-
2023
- 2023-10-03 JP JP2023171996A patent/JP2024001123A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| CN105829885B (zh) | 2020-08-18 |
| CN111879948A (zh) | 2020-11-03 |
| CN111239415A (zh) | 2020-06-05 |
| JP2022023882A (ja) | 2022-02-08 |
| KR102393711B1 (ko) | 2022-05-04 |
| JP2016540195A (ja) | 2016-12-22 |
| KR20160065934A (ko) | 2016-06-09 |
| WO2015057968A3 (en) | 2015-06-11 |
| US20160245808A1 (en) | 2016-08-25 |
| JP6964632B2 (ja) | 2021-11-10 |
| CN105829885A (zh) | 2016-08-03 |
| WO2015057968A2 (en) | 2015-04-23 |
| CN111239415B (zh) | 2024-03-26 |
| JP2019215354A (ja) | 2019-12-19 |
| JP2024001123A (ja) | 2024-01-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6964632B2 (ja) | 自己免疫疾患の治療に応答性の対象を同定する方法およびそれを治療するための組成物 | |
| Balkwill et al. | Evidence for tumour necrosis factor/cachectin production in cancer | |
| Van Schouwenburg et al. | A novel method for the detection of antibodies to adalimumab in the presence of drug reveals “hidden” immunogenicity in rheumatoid arthritis patients | |
| JP2019014743A (ja) | 自己免疫関連障害または炎症性障害の治療のための低用量il−2の使用 | |
| Mondino et al. | Autoimmune phenomena of the external eye | |
| US9783600B2 (en) | Apolipoprotein C3 (ApoCIII) antagonists and methods of their use to remove ApoCIII inhibition of lipoprotein lipase (LPL) | |
| US20190290698A1 (en) | Methods of Using Human Mesenchymal Stem Cells to Effect Cellular and Humoral Immunity | |
| CN1867827A (zh) | 用于诊断骨髓前体细胞(BMPs)和/或血液来源的循环前体细胞(BDPs)的心血管功能性的体外方法 | |
| Li et al. | Plasma levels of acylated ghrelin in children with pulmonary hypertension associated with congenital heart disease | |
| Zhang et al. | Distinct expression of Tim-3 during different stages of rat experimental autoimmune neuritis | |
| Bleesing et al. | Human T cell activation induces the expression of a novel CD45 isoform that is analogous to murine B220 and is associated with altered O-glycan synthesis and onset of apoptosis | |
| Zhao et al. | Pharmacokinetics, pharmacodynamics and preliminary observations for clinical activity and safety of multiple doses of human mouse chimeric anti-CD22 monoclonal antibody (SM03) in Chinese patients with systemic lupus erythematosus | |
| Grattan | Histamine-releasing autoantibodies in chronic urticaria | |
| Tanimine et al. | Kinetics of cellular and humoral immunity in a successful case of positive crossmatch kidney transplantation: a case report | |
| JPWO2006118085A1 (ja) | 肝細胞複製促進剤およびインスリン抵抗性改善剤 | |
| Homburger et al. | Diagnosis of allergy: in vitro testing | |
| Washburn et al. | A novel three‐dose regimen of daclizumab in liver transplant recipients with hepatitis C: A pharmacokinetic and pharmacodynamic study | |
| Vukojević et al. | Lisinopril-induced pemphigus foliaceus in a patient with diabetes mellitus and Kaposi-Juliusberg varicelliform eruption | |
| KR20240060627A (ko) | 골수 유래 중간엽 줄기 세포의 투여를 포함하는 노화 노쇠의 치료 | |
| Borrione et al. | Impact of different concentrations of human recombinant growth hormone on T lymphocytes | |
| Moskalets | THE FREQUENCY OF DETECTING ANTI-DRUG ANTIBODIES IN NON-HODGKIN’S LYMPHOMA | |
| RU2605621C1 (ru) | СПОСОБ ПОЛУЧЕНИЯ ДИАГНОСТИКУМА ДЛЯ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ЛЕЧЕБНОГО РЕКОМБИНАНТНОГО α-ИНТЕРФЕРОНА В СЫВОРОТКЕ КРОВИ БОЛЬНЫХ ВИРУСНЫМИ ИНФЕКЦИЯМИ | |
| AU2005282218B2 (en) | Therapeutic strategy for treating autoimmune and degenerative diseases | |
| JP2009178052A (ja) | 膵臓の膵島病変を予防、緩和または治療する化合物のスクリーニング方法 | |
| Lau | Modelling aspects of preeclampsia in vitro and in vivo |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20171016 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20171016 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20180828 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20181115 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190228 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20190618 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20190718 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6560200 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |