JP6541581B2 - 低濃度抗体製剤 - Google Patents
低濃度抗体製剤 Download PDFInfo
- Publication number
- JP6541581B2 JP6541581B2 JP2015562515A JP2015562515A JP6541581B2 JP 6541581 B2 JP6541581 B2 JP 6541581B2 JP 2015562515 A JP2015562515 A JP 2015562515A JP 2015562515 A JP2015562515 A JP 2015562515A JP 6541581 B2 JP6541581 B2 JP 6541581B2
- Authority
- JP
- Japan
- Prior art keywords
- formulation
- polysorbate
- therapeutic protein
- surfactant
- protein
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39591—Stabilisation, fragmentation
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/16—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing nitrogen, e.g. nitro-, nitroso-, azo-compounds, nitriles, cyanates
- A61K47/18—Amines; Amides; Ureas; Quaternary ammonium compounds; Amino acids; Oligopeptides having up to five amino acids
- A61K47/183—Amino acids, e.g. glycine, EDTA or aspartame
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/20—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing sulfur, e.g. dimethyl sulfoxide [DMSO], docusate, sodium lauryl sulfate or aminosulfonic acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/26—Carbohydrates, e.g. sugar alcohols, amino sugars, nucleic acids, mono-, di- or oligo-saccharides; Derivatives thereof, e.g. polysorbates, sorbitan fatty acid esters or glycyrrhizin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2809—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against the T-cell receptor (TcR)-CD3 complex
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/40—Immunoglobulins specific features characterized by post-translational modification
- C07K2317/41—Glycosylation, sialylation, or fucosylation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Immunology (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Organic Chemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Dermatology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Medicinal Preparation (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Inorganic Chemistry (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
Description
ある態様においては、本発明は、以下a)およびb):a)治療用タンパク質;およびb)界面活性剤;ここで該治療用タンパク質に対する該界面活性剤のモル比は少なくとも100である、を含む該治療用タンパク質のための製剤を対象とする。
(実施例)
オテリキシズマブは、そのFcドメイン内にグリコシル化部位を持たない、ヒトCD3に対するヒト化mAb(IgG1)である。臨床用量(1日当たり0.1〜0.5 mg)の正確な調製および投与を容易にするため、この薬品を、様々な1日量に対応する種々のバイアル単位表示を用いて0.2 mg/mLの濃度で作成した。該用量の投与には、等張0.9%食塩水(生理食塩水)を含有するi.v.バッグ中での前記mAbの希釈と、標準的な注入ポンプによる全バッグ内容物の送達が必要であった。この投薬方法により、i.v.バッグ中のタンパク質濃度は2μg/mLという低さになった。直接的な結果としては、有意なタンパク質損失のリスクが非常に高かった。こうした理由から、商業的に関連のあるi.v.投与セットを用いた短期間の安定性および適合性試験を実施することにより、既存製品の投与の実行可能性を評価するだけでなく、提案した希釈および投与設計の意図を支持するであろう代替製剤を開発した。
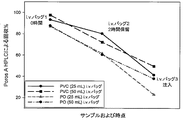
ヒスチジン緩衝液のみからなる前記の0.2 mg/mL製剤の投与の実行可能性を評価するために、市販のi.v.投与セットを使用して安定性試験を実行した。目標用量(0.1 mg)と同等の薬品量をi.v.生理食塩水バッグに添加してから、この希釈した製品の安定性を評価した。吸着による潜在的なタンパク質損失を最小限に抑えるために25または50 mLという比較的少ない生理食塩水量を選択したところ、i.v.バッグにおける活性濃度はそれぞれ4および2μg/mLとなった。さらに、2つの異なる種類の材料(ポリオレフィンPO、およびポリ塩化ビニルPVC)で構成されているi.v.バッグについて評価した。該バッグを研究室の作業台に設置し、周囲温度および照明条件に曝露した。各試験構成に対して3セットのバッグを調製した:バッグ1は初期条件の試験としての役割を果たし、バッグ2は保留(hold)を表し、またバッグ3は、インラインフィルターを備えたi.v.ライン(B. Braun Horizon Pump Filtered i.v.セット)を通じてのタンパク質溶液の臨床的調製および注入をシミュレートするために使用した。該バッグは二重に調製しかつ試験した。i.v.バッグ調製直後(i.v.バッグ中0時間保留)、およびi.v.バッグ中での2時間保留の後にサンプルを採集して試験を行った。追加のサンプルは、前記i.v.ラインを通じての2時間注入の後に採集した。ポリソルベート80(PS80)を全ての保持サンプルに0.001%の最終濃度で添加することにより、採集用チューブ内での吸着による損失を予防した。平均回収率(%)結果はPoros A-HPLC分析により測定した。回収は前記バッグ中の目的物濃度に基づいて算出し、また報告値は2つの異なる調製物の平均値とした。
ヒスチジン緩衝液のみで製剤化されたmAbの投与時の許容できないタンパク質回収を理由に、界面活性剤ポリソルベート80(PS80)の前記製剤への組み入れがその用量の90%以上の送達を可能にしうるか否かを判定するために第2試験を実施した。従って、0.1 mgのタンパク質の調製および注入について、50 mLの生理食塩水を含有するPOバッグを、インラインフィルターを備えたi.v.ラインと組み合わせて使用して試験した(2μg/mL mAb)。初期の結果は、PVCバッグでの回収と比較した場合のPOバッグでのより低い回収を示しており、このことはPOバッグが許容しうるタンパク質回収を実証するためのより困難な障害でありうることを示しているので、このPOバッグのみを調べた。
加速条件下のタンパク質安定性は従来、有効期間の予測を与えるためだけでなく、長期保存用の最適な製剤を選択するためにも、バイオ医薬品の開発時に利用されている。ここで、PS80-含有製剤の安定性を評価するため、具体的にはPS80が長期保存中に酸化的分解によりmAbの安定性に悪影響を及ぼしうるリスクを評価するために、40℃で短期(2週間)加速安定性試験を行った。
提案した0.1%PS80含有製剤中のmAbの化学的安定性を改善するであろう賦形剤をスクリーニングするために、追加の研究をさらに行った。5つの異なる抗酸化剤(複数種のフリーラジカル捕捉剤および1種の金属キレート剤を含む)について試験した。
表2
0.1%PS80および様々な抗酸化剤を用いて製剤化した0.2 mg/mL mAbの安定性:バイアル中40℃で2週間保存した後のMSおよびcIEF分析の結果
PS80、Met、およびEDTAを含有する0.2 mg/mL mAb製剤の長期および加速安定性を評価するために、開発的安定性試験(development stability study)を実施した。0〜40 mMに及ぶ一連の6つのMet濃度を含めた幅広い条件について試験した。EDTAレベルは、mAbに関する以前の経験に基づいて0.05 mMに固定した。全部で8種の製剤を安定した状態で設置した。試験した製剤の概要を表3に示す。製剤A〜Fには、固定レベルのEDTA(0.05 mM)およびPS80(0.1%)と共に0、5、10、15、20、および40 mMのMetを組み入れた。製剤GおよびHは、それぞれ、PS80(単独)および緩衝液のみ(賦形剤無し)の対照としての役割を果たした。各製剤を複数のガラスバイアルに等分して入れ、さらに該バイアルを冷蔵(2〜8℃、一次)および25℃(加速)条件で倒立させて保存した。各バイアル中のmAb濃度は0.2 mg/mLであった。分析的データ取得(analytical pulls)を1、2、3、および6ヶ月間計画し、その結果を初期と比較した。
表3
製剤開発的安定性試験の実験構成。各処方コードに関係する製剤組成を詳述する
異なるレベルの界面活性剤、抗酸化剤、および金属キレート剤を含有する、様々な保存温度での6ヶ月間の保存後のオテリキシズマブ安定性サンプルA〜H中の様々なメチオニン残基について報告された、MS分析によるペプチドマッピングの結果。各処方コードに関係する製剤組成は表3に詳細に記載されている。
下記表5は、低濃度オテリキシズマブ製剤(0.2 mg/mL)の組成と賦形剤機能の概要である。賦形剤のレベルおよび機能性は本製剤独自のものである。
他の市販のmAbと比較した場合、前記のオテリキシズマブの組成は高い賦形剤/mAb比(複数あり)を呈する。下記表6を参照されたい。
[1] 以下a)およびb):a)治療用タンパク質;およびb)界面活性剤;ここで該治療用タンパク質に対する該界面活性剤のモル比が少なくとも100である、を含む該治療用タンパク質のための製剤。
[2] 前記の治療用タンパク質に対する界面活性剤のモル比が、少なくとも150、少なくとも200、少なくとも250、少なくとも300、少なくとも400、および少なくとも500からなる群より選択される、1記載の製剤。
[3] 前記の治療用タンパク質に対する界面活性剤のモル比が約545である、1または2記載の製剤。
[4] 前記界面活性剤が、ポリソルベート-20、ポリソルベート-40、ポリソルベート-60、ポリソルベート-65、ポリソルベート-80、ポリソルベート-85、ポロキサマー88、およびそれらの混合物からなる群より選択される、1〜3のいずれか1項記載の製剤。
[5] 前記製剤がc)抗酸化剤をさらに含み、ここで前記治療用タンパク質に対する該抗酸化剤のモル比が少なくとも750である、1〜4のいずれか1項記載の製剤。
[6] 前記の治療用タンパク質に対する抗酸化剤のモル比が、少なくとも5500、少なくとも6000、少なくとも6500、および少なくとも7000からなる群より選択される、5記載の製剤。
[7] 前記の治療用タンパク質に対する抗酸化剤のモル比が約7143である、5または6記載の製剤。
[8] 前記抗酸化剤が、メチオニン、システイン、グルタチオン、およびモノチオグリセロールからなる群より選択される、5〜7のいずれか1項記載の製剤。
[9] 前記製剤がd)緩衝液をさらに含み、ここで前記製剤のpHが約4.0〜約8.0である、1〜8のいずれか1項記載の製剤。
[10] 前記緩衝液が、ヒスチジン、酢酸塩、クエン酸塩、およびコハク酸塩からなる群より選択される、9記載の製剤。
[11] 前記治療用タンパク質が抗原結合性タンパク質である、1〜10のいずれか1項記載の製剤。
[12] 前記抗原結合性タンパク質が抗体またはその断片である、11記載の製剤。
[13] 前記抗原結合性タンパク質が免疫グロブリン単一可変ドメインである、11記載の製剤。
[14] 前記抗原結合性タンパク質がヒトCD3に結合する、11記載の製剤。
[15] 前記の抗原結合性ポリペプチドが抗-CD3抗体である、14記載の製剤。
[16] 前記抗-CD3抗体が、配列番号1を含む重鎖および配列番号2を含む軽鎖を含む、15記載の製剤。
[17] 前記治療用タンパク質が約0.01 mg/mL〜約1 mg/mLの濃度で存在する、1〜16のいずれか1項記載の製剤。
[18] 前記治療用タンパク質が約0.1 mg/mL〜約0.5 mg/mLの濃度で存在する、1〜17のいずれか1項記載の製剤。
[19] 前記治療用タンパク質が約0.2 mg/mLの濃度で存在する、1〜18のいずれか1項記載の製剤。
[20] 前記製剤が再構成された製剤である、1〜19のいずれか1項記載の製剤。
[21] 前記製剤が液体医薬製剤である、1〜20のいずれか1項記載の製剤。
[22] 前記製剤が非経口投与に適したものである、1〜21のいずれか1項記載の製剤。
[23] 治療用タンパク質のための製剤であって、以下a)〜d):a)治療用タンパク質;およびb)約0.01%w/v〜約0.5%w/vの界面活性剤、ここで該治療用タンパク質に対する該界面活性剤のモル比が少なくとも100である;c)約1 mM〜約50 mMの抗酸化剤、ここで治療用タンパク質に対する該抗酸化剤のモル比が少なくとも750である;およびd)約1 mM〜約100 mMの緩衝液を含み、ここで上記製剤のpHが約4.0〜約8.0である、上記製剤。
[24] 前記治療用タンパク質が抗体であり、前記界面活性剤がポリソルベート80であり、前記抗酸化剤がメチオニンであり、かつ前記緩衝液がヒスチジンである、23記載の製剤。
[25] 前記抗体が約0.2 mg/mLの濃度で存在する、24記載の製剤。
[26] 前記製剤が約0.01 mM〜約1.0 mMのEDTAをさらに含む、1〜25のいずれか1項記載の製剤。
[27] 前記製剤が約0.01 mM〜約0.1 mMのEDTAを含む、26記載の製剤。
[28] 前記製剤が約0.05 mMのEDTAを含む、27記載の製剤。
Claims (12)
- 以下のa)およびb)およびc):a)0.01 mg/mL〜1 mg/mLの濃度の、抗原結合性タンパク質である治療用タンパク質;b)界面活性剤;ここで該治療用タンパク質に対する該界面活性剤のモル比が少なくとも100である、及びc)抗酸化剤、ここで前記治療用タンパク質に対する該抗酸化剤のモル比が少なくとも750であり、前記界面活性剤が、ポリソルベート-20、ポリソルベート-40、ポリソルベート-60、ポリソルベート-65、ポリソルベート-80、ポリソルベート-85、ポロキサマー188、およびそれらの混合物からなる群より選択される、を含む該治療用タンパク質のための製剤。
- 前記の治療用タンパク質に対する界面活性剤のモル比が、少なくとも150、少なくとも200、少なくとも250、少なくとも300、少なくとも400、少なくとも500および545からなる群より選択される、請求項1に記載の製剤。
- 前記の治療用タンパク質に対する抗酸化剤のモル比が、少なくとも5500、少なくとも6000、少なくとも6500、少なくとも7000および7143からなる群より選択される、請求項1または2に記載の製剤。
- 前記抗酸化剤が、メチオニン、システイン、グルタチオン、およびモノチオグリセロールからなる群より選択される、請求項1〜3のいずれか1項に記載の製剤。
- 前記製剤がd)緩衝液をさらに含み、ここで前記製剤のpHが4.0〜8.0である、請求項1〜4のいずれか1項に記載の製剤。
- 前記緩衝液が、ヒスチジン、酢酸塩、クエン酸塩、およびコハク酸塩からなる群より選択される、請求項5に記載の製剤。
- 前記抗原結合性タンパク質が抗体またはその断片、免疫グロブリン単一可変ドメイン、および抗-CD3抗体からなる群より選択され、前記抗-CD3抗体は配列番号1の配列を有する重鎖および配列番号2の配列を有する軽鎖を含む、請求項1〜6のいずれか1項に記載の製剤。
- 前記治療用タンパク質が0.1 mg/mL〜0.5 mg/mLまたは0.2 mg/mLの濃度で存在する、請求項1〜7のいずれか1項に記載の製剤。
- 前記製剤が再構成された製剤である、および/または液体医薬製剤である、および/または非経口投与に適したものである、請求項1〜8のいずれか1項に記載の製剤。
- 治療用タンパク質のための製剤であって、以下a)〜d):a) 0.01 mg/mL〜1 mg/mLの濃度の、抗原結合性タンパク質である治療用タンパク質;およびb)0.01%w/v〜0.5%w/vの界面活性剤、ここで該治療用タンパク質に対する該界面活性剤のモル比が少なくとも100である;c)1 mM〜50 mMの抗酸化剤、ここで治療用タンパク質に対する該抗酸化剤のモル比が少なくとも750である;およびd)1 mM〜100 mMの緩衝液を含み、ここで上記製剤のpHが4.0〜8.0であり、前記界面活性剤が、ポリソルベート-20、ポリソルベート-40、ポリソルベート-60、ポリソルベート-65、ポリソルベート-80、ポリソルベート-85、ポロキサマー188、およびそれらの混合物からなる群より選択される、上記製剤。
- 前記治療用タンパク質が抗体であり、前記界面活性剤がポリソルベート80であり、前記抗酸化剤がメチオニンであり、かつ前記緩衝液がヒスチジンである、請求項10に記載の製剤。
- 前記製剤がさらに0.01 mM〜1.0 mMのEDTA、0.01 mM〜0.1 mMのEDTA、または0.05 mMのEDTAを含む、請求項1〜11のいずれか1項に記載の製剤。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361787709P | 2013-03-15 | 2013-03-15 | |
| US61/787,709 | 2013-03-15 | ||
| PCT/IB2014/059757 WO2014141152A2 (en) | 2013-03-15 | 2014-03-13 | Low concentration antibody formulations |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2016513635A JP2016513635A (ja) | 2016-05-16 |
| JP6541581B2 true JP6541581B2 (ja) | 2019-07-10 |
Family
ID=50397215
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015562515A Active JP6541581B2 (ja) | 2013-03-15 | 2014-03-13 | 低濃度抗体製剤 |
Country Status (13)
| Country | Link |
|---|---|
| US (1) | US10537638B2 (ja) |
| EP (2) | EP3686217A1 (ja) |
| JP (1) | JP6541581B2 (ja) |
| KR (1) | KR20150132332A (ja) |
| CN (1) | CN105073136A (ja) |
| AU (1) | AU2014229282B2 (ja) |
| BR (1) | BR112015023498A2 (ja) |
| CA (1) | CA2902289A1 (ja) |
| IL (1) | IL240754A0 (ja) |
| RU (1) | RU2015137685A (ja) |
| SG (1) | SG11201506499YA (ja) |
| TW (1) | TW201501724A (ja) |
| WO (1) | WO2014141152A2 (ja) |
Families Citing this family (51)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101681818B1 (ko) | 2011-08-23 | 2016-12-01 | 로슈 글리카트 아게 | T 세포 활성화 항원 및 종양 항원에 대해 특이적인 이중특이적 항체 및 이의 사용 방법 |
| EP2904016B1 (en) | 2012-10-08 | 2018-11-14 | Roche Glycart AG | Fc-free antibodies comprising two fab-fragments and methods of use |
| EP3444278A1 (en) | 2013-02-26 | 2019-02-20 | Roche Glycart AG | Bispecific t cell activating antigen binding molecules |
| KR20180023035A (ko) | 2013-02-26 | 2018-03-06 | 로슈 글리카트 아게 | 이중특이적 t 세포 활성화 항원 결합 분자 |
| RU2015137685A (ru) | 2013-03-15 | 2017-04-20 | ГлаксоСмитКлайн Интеллекчуал Проперти (N2) Лимитед | Композиции антитела в низкой концентрации |
| PE20210107A1 (es) | 2013-12-17 | 2021-01-19 | Genentech Inc | Anticuerpos anti-cd3 y metodos de uso |
| DK3177643T3 (da) | 2014-08-04 | 2019-07-15 | Hoffmann La Roche | Bispecifikke T-celle-aktiverende antigenbindende molekyler |
| US9751946B2 (en) | 2014-09-12 | 2017-09-05 | Genentech, Inc. | Anti-CLL-1 antibodies and immunoconjugates |
| DK3221356T3 (da) | 2014-11-20 | 2020-11-02 | Hoffmann La Roche | T-celleaktiverende, bispecifikke, antigenbindende molekyler mod folr1 og cd3 |
| DK4141032T3 (da) | 2014-11-20 | 2024-08-05 | Hoffmann La Roche | Kombinationsbehandling med T-celleaktiverende bispecifikke antigenbindende molekyler og PD-1-aksebindende antagonister |
| DK3221357T3 (da) | 2014-11-20 | 2020-08-10 | Hoffmann La Roche | Fælles letkæder og fremgangsmåder til anvendelse |
| AR103173A1 (es) | 2014-12-22 | 2017-04-19 | Novarits Ag | Productos farmacéuticos y composiciones líquidas estables de anticuerpos il-17 |
| CA2981103A1 (en) | 2015-03-31 | 2016-10-06 | Vhsquared Limited | Polypeptides |
| KR102789821B1 (ko) | 2015-03-31 | 2025-04-02 | 소리소 파마슈티컬스 인크. | 프로테아제-절단가능 링커를 갖는 펩티드 구조물 |
| CN107849132B (zh) | 2015-06-16 | 2022-03-08 | 豪夫迈·罗氏有限公司 | 人源化的和亲和力成熟的针对FcRH5的抗体和使用方法 |
| EP3310378B1 (en) | 2015-06-16 | 2024-01-24 | F. Hoffmann-La Roche AG | Anti-cll-1 antibodies and methods of use |
| EP3916018A1 (en) | 2015-06-16 | 2021-12-01 | Genentech, Inc. | Anti-cd3 antibodies and methods of use |
| AR106188A1 (es) | 2015-10-01 | 2017-12-20 | Hoffmann La Roche | Anticuerpos anti-cd19 humano humanizados y métodos de utilización |
| KR20180073561A (ko) | 2015-10-02 | 2018-07-02 | 에프. 호프만-라 로슈 아게 | 이중특이적 항-ceaxcd3 t 세포 활성화 항원 결합 분자 |
| WO2017077382A1 (en) | 2015-11-06 | 2017-05-11 | Orionis Biosciences Nv | Bi-functional chimeric proteins and uses thereof |
| KR102850929B1 (ko) | 2015-12-09 | 2025-08-27 | 에프. 호프만-라 로슈 아게 | 항-약물 항체의 형성을 감소시키기 위한 ii형 항-cd20 항체 |
| AU2016380988B2 (en) * | 2015-12-30 | 2022-07-21 | Genentech, Inc. | Formulations with reduced degradation of polysorbate |
| ES2837428T3 (es) | 2016-01-08 | 2021-06-30 | Hoffmann La Roche | Procedimientos de tratamiento de cánceres positivos para CEA usando antagonistas de unión al eje PD-1 y anticuerpos biespecíficos anti-CEA/anti-CD3 |
| EP3998281A1 (en) | 2016-02-05 | 2022-05-18 | Orionis Biosciences BV | Cd8 binding agents |
| JP7015244B2 (ja) | 2016-03-22 | 2022-02-02 | エフ・ホフマン-ラ・ロシュ・アクチェンゲゼルシャフト | プロテアーゼ活性化t細胞二重特異性分子 |
| AU2017240190A1 (en) | 2016-03-31 | 2018-09-20 | Sorriso Pharmaceuticals, Inc. | Compositions |
| SE540001C2 (en) * | 2016-04-05 | 2018-02-20 | Kyttinge Invest Ab | Self-propelling trolley assembly |
| ES2897217T3 (es) | 2016-09-30 | 2022-02-28 | Hoffmann La Roche | Anticuerpos biespecíficos frente a p95HER2 |
| AR109621A1 (es) * | 2016-10-24 | 2018-12-26 | Janssen Pharmaceuticals Inc | Formulaciones de vacunas contra glucoconjugados de expec |
| CN109923128A (zh) | 2016-11-15 | 2019-06-21 | 基因泰克公司 | 用于用抗cd20/抗cd3双特异性抗体进行治疗的给药 |
| EP3576765B1 (en) | 2017-02-06 | 2025-07-16 | Orionis Biosciences, Inc. | Targeted engineered interferon and uses thereof |
| JP7407699B2 (ja) | 2017-07-28 | 2024-01-04 | エフ・ホフマン-ラ・ロシュ・アクチェンゲゼルシャフト | 二重特異性抗体製剤 |
| SMT202300129T1 (it) * | 2017-08-22 | 2023-05-12 | Biogen Ma Inc | Composizioni farmaceutiche contenenti anticorpi anti-beta amiloide |
| CA3075896A1 (en) * | 2017-09-22 | 2019-03-28 | Immunogen, Inc. | Methods of preventing methionine oxidation in immunoconjugates |
| WO2019064263A1 (en) * | 2017-09-29 | 2019-04-04 | Janssen Biotech, Inc. | NOVEL FORMULATIONS FOR STABILIZING LOW DOSE ANTIBODY COMPOSITIONS |
| CN118772288A (zh) | 2018-02-08 | 2024-10-15 | 豪夫迈·罗氏有限公司 | 双特异性抗原结合分子和使用方法 |
| KR102735988B1 (ko) | 2019-02-18 | 2024-12-03 | 일라이 릴리 앤드 캄파니 | 치료 항체 제제 |
| EP3986571A1 (en) | 2019-06-21 | 2022-04-27 | Sorriso Pharmaceuticals, Inc. | Polypeptides |
| AU2020296979A1 (en) | 2019-06-21 | 2022-02-24 | Sorriso Pharmaceuticals, Inc. | Polypeptides |
| CA3155125A1 (en) * | 2019-10-25 | 2021-04-29 | Chen Zhu | Compositions and methods for minimizing protein loss at low protein concentrations |
| KR20220113790A (ko) | 2019-12-13 | 2022-08-16 | 제넨테크, 인크. | 항-ly6g6d 항체 및 사용 방법 |
| IL294461A (en) * | 2020-01-13 | 2022-09-01 | Aptevo Res & Development Llc | Methods and compositions for preventing adsorption of therapeutic proteins to drug delivery system components |
| BR112022025856A2 (pt) | 2020-06-19 | 2023-01-10 | Hoffmann La Roche | Anticorpo que se liga a cd3 e cd19, polinucleotídeo isolado, célula hospedeira, método de produção de um anticorpo que se liga a cd3 e cd19, composição farmacêutica, uso do anticorpo, método para tratar uma doença em um indivíduo e invenção |
| MX2023005130A (es) | 2020-11-04 | 2023-05-25 | Genentech Inc | Dosis subcutanea de anticuerpos biespecificos anti-cd20/anti-cd3. |
| WO2022098638A2 (en) | 2020-11-04 | 2022-05-12 | Genentech, Inc. | Dosing for treatment with anti-cd20/anti-cd3 bispecific antibodies |
| EP4330282A1 (en) | 2021-04-30 | 2024-03-06 | F. Hoffmann-La Roche AG | Dosing for combination treatment with anti-cd20/anti-cd3 bispecific antibody and anti-cd79b antibody drug conjugate |
| KR20240007171A (ko) | 2021-05-14 | 2024-01-16 | 제넨테크, 인크. | 모수네투주맙 및 폴라투주맙 베도틴을 이용한 cd20 양성 증식성 장애의 치료 방법 |
| EP4508087A1 (en) * | 2022-04-13 | 2025-02-19 | Genentech, Inc. | Pharmaceutical compositions of therapeutic proteins and methods of use |
| TW202519266A (zh) * | 2022-04-13 | 2025-05-16 | 美商建南德克公司 | 莫蘇妥珠單抗之醫藥組成物及其使用方法 |
| CN118515783B (zh) * | 2024-06-06 | 2024-11-08 | 威瑞生物科技(昆明)有限责任公司 | 新冠病毒N蛋白和编码S1抗原mRNA分子结合的仿生病毒结构疫苗及其制备方法 |
| CN118818070A (zh) * | 2024-06-21 | 2024-10-22 | 北京市华信行生物科技有限公司 | 一种稳定保存氧化型脂蛋白的合成基质溶液 |
Family Cites Families (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS57106673A (en) | 1980-12-24 | 1982-07-02 | Chugai Pharmaceut Co Ltd | Dibenzo(b,f)(1,4)oxazepin derivative |
| GB8607679D0 (en) | 1986-03-27 | 1986-04-30 | Winter G P | Recombinant dna product |
| CA2156255C (en) * | 1993-12-17 | 2008-02-05 | Yasuyuki Kunihiro | Soluble thrombomodulin-containing composition |
| JP4454571B2 (ja) * | 1998-03-06 | 2010-04-21 | 中外製薬株式会社 | 蛋白非添加製剤 |
| IL127127A0 (en) | 1998-11-18 | 1999-09-22 | Peptor Ltd | Small functional units of antibody heavy chain variable regions |
| EP2281837B1 (en) | 2001-08-10 | 2016-10-05 | Aberdeen University | Antigen binding domains from fish |
| US20030104996A1 (en) | 2001-08-30 | 2003-06-05 | Tiansheng Li | L-methionine as a stabilizer for NESP/EPO in HSA-free formulations |
| CA2463473A1 (en) | 2001-10-16 | 2003-04-24 | Symbiontics Inc. | Targeted therapeutic proteins |
| ATE556591T1 (de) * | 2001-11-08 | 2012-05-15 | Abbott Biotherapeutics Corp | Stabile pharmazeutische flüssigformulierung von igg-antikörpern |
| WO2006096490A2 (en) * | 2005-03-08 | 2006-09-14 | Pharmacia & Upjohn Company Llc | ANTI-MAdCAM ANTIBODY COMPOSITIONS |
| US7989665B2 (en) | 2005-04-05 | 2011-08-02 | Firmenich Sa | Hydrogenation of esters with Ru/tetradentate ligands complexes |
| WO2007033230A2 (en) * | 2005-09-12 | 2007-03-22 | Novimmune S.A. | Anti-cd3 antibody formulations |
| WO2012052996A2 (en) | 2010-10-19 | 2012-04-26 | Yeda Research And Development Co. Ltd. | Novel ruthenium complexes and their uses in processes for formation and/or hydrogenation of esters, amides and derivatives thereof |
| EP2225275A4 (en) | 2007-11-28 | 2013-04-03 | Medimmune Llc | PROTEIN FORMULATION |
| JP2010241718A (ja) * | 2009-04-03 | 2010-10-28 | Kyowa Hakko Kirin Co Ltd | 安定な抗体の水溶液製剤 |
| WO2011008770A2 (en) | 2009-07-14 | 2011-01-20 | Biogen Idec Ma Inc. | Methods for inhibiting yellow color and peroxide formation in a composition |
| US20120294866A1 (en) | 2010-01-19 | 2012-11-22 | F. Hoffmann-La Roche Ag | Pharmaceutical formulation for proteins |
| EP2585828A4 (en) | 2010-06-25 | 2014-03-12 | Glaxo Group Ltd | METHOD FOR THE TREATMENT OF PATIENTS WITH IMMUNE SYSTEM DISEASES |
| AR086823A1 (es) | 2011-06-30 | 2014-01-22 | Genentech Inc | Formulaciones de anticuerpo anti-c-met, metodos |
| RU2015137685A (ru) | 2013-03-15 | 2017-04-20 | ГлаксоСмитКлайн Интеллекчуал Проперти (N2) Лимитед | Композиции антитела в низкой концентрации |
-
2014
- 2014-03-13 RU RU2015137685A patent/RU2015137685A/ru not_active Application Discontinuation
- 2014-03-13 CN CN201480016095.4A patent/CN105073136A/zh active Pending
- 2014-03-13 JP JP2015562515A patent/JP6541581B2/ja active Active
- 2014-03-13 KR KR1020157028852A patent/KR20150132332A/ko not_active Withdrawn
- 2014-03-13 BR BR112015023498A patent/BR112015023498A2/pt not_active Application Discontinuation
- 2014-03-13 WO PCT/IB2014/059757 patent/WO2014141152A2/en not_active Ceased
- 2014-03-13 EP EP19198476.4A patent/EP3686217A1/en not_active Withdrawn
- 2014-03-13 CA CA2902289A patent/CA2902289A1/en not_active Abandoned
- 2014-03-13 AU AU2014229282A patent/AU2014229282B2/en not_active Ceased
- 2014-03-13 TW TW103108897A patent/TW201501724A/zh unknown
- 2014-03-13 EP EP14714396.0A patent/EP2968535A2/en not_active Ceased
- 2014-03-13 SG SG11201506499YA patent/SG11201506499YA/en unknown
- 2014-03-13 US US14/775,900 patent/US10537638B2/en active Active
-
2015
- 2015-08-23 IL IL240754A patent/IL240754A0/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| JP2016513635A (ja) | 2016-05-16 |
| CN105073136A (zh) | 2015-11-18 |
| US10537638B2 (en) | 2020-01-21 |
| KR20150132332A (ko) | 2015-11-25 |
| WO2014141152A2 (en) | 2014-09-18 |
| WO2014141152A3 (en) | 2014-12-04 |
| SG11201506499YA (en) | 2015-09-29 |
| CA2902289A1 (en) | 2014-09-18 |
| EP3686217A1 (en) | 2020-07-29 |
| TW201501724A (zh) | 2015-01-16 |
| US20160000916A1 (en) | 2016-01-07 |
| RU2015137685A (ru) | 2017-04-20 |
| RU2015137685A3 (ja) | 2018-03-05 |
| BR112015023498A2 (pt) | 2017-10-10 |
| AU2014229282B2 (en) | 2017-02-02 |
| EP2968535A2 (en) | 2016-01-20 |
| IL240754A0 (en) | 2015-10-29 |
| AU2014229282A1 (en) | 2015-10-08 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6541581B2 (ja) | 低濃度抗体製剤 | |
| AU2015260758B2 (en) | Antibody formulation | |
| AU2012240050B2 (en) | Formulations with reduced viscosity | |
| US20140044727A1 (en) | Formulations with reduced viscosity | |
| KR20140044305A (ko) | 동결건조된 제제 | |
| US10525137B2 (en) | Formulations with reduced degradation of polysorbate | |
| KR20230009897A (ko) | 항-IL-23p19 항체를 포함하는 제제, 이의 제조방법 및 용도 | |
| JP2024528724A (ja) | 抗pd-1抗体医薬組成物及びその使用 | |
| WO2014141149A1 (en) | Formulations with reduced viscosity | |
| JP2024539265A (ja) | 製剤 | |
| CN119095618A (zh) | 用于治疗巨噬细胞活化综合征的组合物和方法 | |
| JP2024539502A (ja) | 製剤 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20151117 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20170217 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20171003 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20171219 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20180522 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180821 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20181204 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190404 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20190418 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20190521 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20190611 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6541581 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |