JP6418878B2 - 経口投与用錠剤 - Google Patents
経口投与用錠剤 Download PDFInfo
- Publication number
- JP6418878B2 JP6418878B2 JP2014204278A JP2014204278A JP6418878B2 JP 6418878 B2 JP6418878 B2 JP 6418878B2 JP 2014204278 A JP2014204278 A JP 2014204278A JP 2014204278 A JP2014204278 A JP 2014204278A JP 6418878 B2 JP6418878 B2 JP 6418878B2
- Authority
- JP
- Japan
- Prior art keywords
- tablet
- component
- diameter
- spherical
- oral administration
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Landscapes
- Medicinal Preparation (AREA)
Description
イブプロフェンやアスピリン等は、水に溶解しにくい水難溶性の薬物である。このため、イブプロフェンやアスピリン等を含有する経口投与用錠剤(イブプロフェン等含有錠剤)は、薬物が水溶性高分子化合物等と共に湿式造粒されて造粒粒子群とされ、この造粒粒子群が打錠されて錠剤とされるのが一般的である。
これに対し、錠剤が崩壊するまでの時間を短くすることを目的として、例えば、有効薬剤と、薬学的に許容される水崩壊性又は水溶性賦形剤と、を含有し、二重凸形状を形成する主面表面が向かい合った投与剤型が提案されている(特許文献1参照)。この特許文献1の技術においては、投与剤型が水性媒質と接触して約3分以内に実質的に崩壊又は溶解するように崩壊性の向上が図られている。
特に、イブプロフェンやアスピリン等の水難溶性薬物は、体内に吸収されるのが遅い薬物である。このため、造粒粒子群に含まれる薬物が水難溶性薬物である従来の錠剤においては、体内での崩壊性を高めるだけで即効性を良くすることは困難であった。
本発明者らは、検討により、体内での錠剤の崩壊性を高めるだけではなく、体内で崩壊した錠剤から溶け出す薬物の体内での分散性を高めること、が錠剤の即効性をより高めるのに非常に効果的である、という知見を得た。
例えば、平たい円柱における両方の端面のそれぞれの周縁がテーパー状に面取り加工された形態の円形スミ角錠;平面視円形であり、円柱の両端面のそれぞれに球欠部(ドーム形状の部分)を有する形態の二段R錠がある。
前記二段R錠は、円柱の端面周縁(錠剤の角部分)が丸みのある形状であることから飲みやすく、服用性が良好である。しかし、二段R錠の製造においては、打錠時に、原料に打錠圧が均一に加わりにくいことから、錠剤における粉体の密度に偏りが生じやすい。この錠剤中の過密な部分は、薬物の体内での分散性が低いため、二段R錠には即効性の点で問題がある。
前記円形スミ角錠の製造においては、打錠時に、原料に打錠圧が均一に加わりやすいことから、錠剤中に粉体の過密な部分が形成されにくく、錠剤全体が一様な状態をとりやすい。このため、円形スミ角錠は、薬物の体内での分散性が高まり、即効性が良好である。しかし、円形スミ角錠は、錠剤の角部分が鋭角形状であることから飲みにくく、服用性の点で問題がある。
特許文献1に記載された投与剤型は、二段R錠であり、服用性は良いものの、即効性が不充分であった。
本発明の経口投与用錠剤においては、前記曲率半径(β2)は、前記第2の球欠部の周縁部よりも天頂部の方が大きいことが好ましい。
本発明の経口投与用錠剤においては、前記円柱部の一方の端面と他方の端面との距離(h)が1〜7mmであることが好ましい。
本発明の経口投与用錠剤の製造方法によれば、即効性及び服用性がいずれも優れた経口投与用錠剤を製造できる。
本発明の経口投与用錠剤(以下単に「錠剤」ともいう。)は、水難溶性薬物(a)を含む粒子群(A)(以下「(A)成分」ともいう。)と、炭酸塩及び炭酸水素塩からなる群より選ばれる少なくとも一種(B)(以下「(B)成分」ともいう。)と、を含有する。
加えて、本発明の錠剤は、円柱部と、該円柱部の一方の端面の周縁近傍から、該一方の端面の中心に向かうに従って膨出する第1の球欠部と、該円柱部の他方の端面の周縁近傍から、該他方の端面の中心に向かうに従って膨出する第2の球欠部と、を有する。
本発明の錠剤は、(A)成分と、(B)成分と、必要に応じて他の成分と、を含有する。
本発明における(A)成分は、水難溶性薬物(a)(以下「(a)成分」ともいう。)を含む粒子群である。
本発明において、水難溶性薬物とは、20℃の水に対する溶解度が0〜1.3g/100mLである薬物をいう。
錠剤中の(a)成分の含有割合は、錠剤の服用量及び製造性等を勘案して決定され、錠剤1錠当たり、例えば0.25〜81質量%が好ましく、2〜72質量%がより好ましく、4〜56質量%がより好ましい。
錠剤中の(a)成分の含有割合が、好ましい下限値以上であると、充分な薬効が得られる。また、薬物以外の配合成分の含有量が相対的に少なくなるため、錠剤の1回当たりの服用量の低減化が図れ、服用性がより良好になる。一方、好ましい上限値以下であれば、打錠時における粉体の打錠成型機等への付着が抑制され、製造性が良好になる。
(a)成分とこれ以外の成分との粒子群は、(a)成分の粒子群と、(a)成分以外の成分の粒子群と、の混合物でもよいし、(a)成分とこれ以外の成分との造粒粒子群でもよいし、該造粒粒子群と(a)成分の粒子群と(a)成分以外の成分の粒子群とからなる群より選ばれる2以上の混合物でもよい。中でも、(a)成分の体内での分散性がより高まることから、(a)成分とこれ以外の成分との造粒粒子群が好ましい。
(a)成分とこれ以外の成分との造粒粒子群としては、(a)成分と後述の結合剤との造粒粒子群がより好ましく、(a)成分と水溶性高分子化合物との造粒粒子群がさらに好ましい。
(a)成分以外の成分としては、結合剤以外に、後述の界面活性剤、崩壊剤、賦形剤などが挙げられる。
(a)成分とこれ以外の成分との粒子群、に占める(a)成分の割合は、(A)成分の総質量に対して20質量%以上が好ましく、30〜70質量%がより好ましい。
(A)成分としては、(a)成分の粒子群、(a)成分とこれ以外の成分との造粒粒子群が好ましい。
錠剤中の(A)成分の含有割合は、錠剤1錠当たり、例えば20〜80質量%が好ましく、25〜70質量%がより好ましい。
本発明における(B)成分は、炭酸塩及び炭酸水素塩からなる群より選ばれる少なくとも一種である。経口投与用錠剤において、(B)成分は、主に、体内での(a)成分の分散性向上に寄与する。
(B)成分における炭酸水素塩としては、炭酸水素ナトリウム、炭酸水素カリウム、炭酸水素アンモニウム等が挙げられる。
上記の中でも、(B)成分としては、粉体の流動性もしくは吸湿性、又は錠剤の体内での分散性の面から、炭酸水素塩が好ましく、炭酸水素ナトリウムがより好ましい。
錠剤中の(B)成分の含有割合は、錠剤1錠当たり、下限値としては1.5質量%以上が好ましく、2質量%以上がより好ましく、2.5質量%以上がさらに好ましい。一方、上限値としては95質量%以下が好ましく、50質量%以下がより好ましく、20質量%以下がさらに好ましい。
錠剤中の(B)成分の含有割合が、前記の好ましい下限値以上であると、(a)成分の体内での分散性がより向上する。また、(B)成分が多量に含まれると、錠剤を服用した際に苦味や塩味といった不快な味を感じるようになる。前記の好ましい上限値以下であれば、錠剤を服用した際に前記不快な味が感じられにくくなる。
本発明の錠剤は、(A)成分及び(B)成分以外に、必要に応じて他の成分を含有してもよい。
(A)成分及び(B)成分以外に含有してもよい他の成分としては、本発明の効果を阻害しない範囲で、通常、経口投与用錠剤に配合されている成分を用いることができる。
かかる他の成分としては、例えば、界面活性剤、結合剤、崩壊剤、賦形剤、滑沢剤、香料、矯味剤(甘味料、酸味料など)、(a)成分以外の薬物等が挙げられる。
(C)成分としては、特に限定されず、通常、経口製剤等で用いられているアニオン界面活性剤、カチオン界面活性剤、ノニオン界面活性剤、両性界面活性剤などが挙げられる。
尚、上記例示のノニオン界面活性剤の表記における括弧内の数値は、エチレンオキシド(EO)の平均付加モル数を表す。
上記の中でも、(C)成分としては、体内での(a)成分の分散性がより高まることから、アニオン界面活性剤、ノニオン界面活性剤が好ましく、アニオン界面活性剤がより好ましい。この中でも、より良好な濡れ性を(a)成分に付与できることから、アルキル硫酸エステル塩が特に好ましく、ラウリル硫酸ナトリウムがもっとも好ましい。
錠剤中の(C)成分の含有割合は、錠剤1錠当たり、例えば0.005〜45質量%が好ましく、0.025〜22.5質量%がより好ましい。
錠剤中の(C)成分の含有割合が、前記の好ましい範囲内であれば、より良好な濡れ性を(a)成分に付与でき、体内での(a)成分の分散性がさらに向上する。
結合剤として具体的には、ポリビニルピロリドン、ポリエチレングリコール、ポリビニルアルコール、メチルセルロース、ヒプロメロース、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース、メチルセルロース等が挙げられる。中でも、結合剤としては、より良好な濡れ性を(a)成分に付与でき、体内での(a)成分の分散性向上の効果が高いことから、水溶性高分子化合物が好ましく、ヒドロキシプロピルセルロース、メチルセルロースが特に好ましい。
結合剤は、1種を単独で用いてもよく、2種以上を併用してもよい。
錠剤中の結合剤の含有割合は、錠剤1錠当たり、例えば0.01〜27質量%が好ましい。錠剤中の結合剤の含有割合が、前記の好ましい下限値以上であると、錠剤に充分な濡れ性及び硬度が付与され、体内での(a)成分の分散性がより向上する。一方、前記の好ましい上限値以下であれば、造粒時又は打錠時における粉体の装置への付着がより軽減する。
賦形剤としては、前記崩壊剤で例示した成分に加えて、乳糖、コーンスターチ、タルク、結晶セルロース(アビセルなど)、粉糖、マンニトール、軽質無水ケイ酸、炭酸カルシウム、L−システイン等が挙げられる。
滑沢剤としては、ステアリン酸マグネシウム、ステアリン酸カルシウム、ポリエチレングリコール、タルク、ステアリン酸、ショ糖脂肪酸エステル等が挙げられる。
香料としては、メントール、リモネン、植物精油(ハッカ油、ミント油、ライチ油、オレンジ油、レモン油など)等が挙げられる。
甘味料としては、サッカリンナトリウム、アスパルテーム、ステビア、グリチルリチン酸二カリウム、アセスルファムカリウム、ソーマチン、スクラロース等が挙げられる。
酸味料としては、クエン酸、酒石酸、リンゴ酸、コハク酸、フマル酸、乳酸、又はこれらの塩等が挙げられる。
本発明の経口投与用錠剤は、円柱部と、該円柱部の一方の端面の周縁近傍から、該一方の端面の中心に向かうに従って膨出する第1の球欠部と、該円柱部の他方の端面の周縁近傍から、該他方の端面の中心に向かうに従って膨出する第2の球欠部と、を有する。
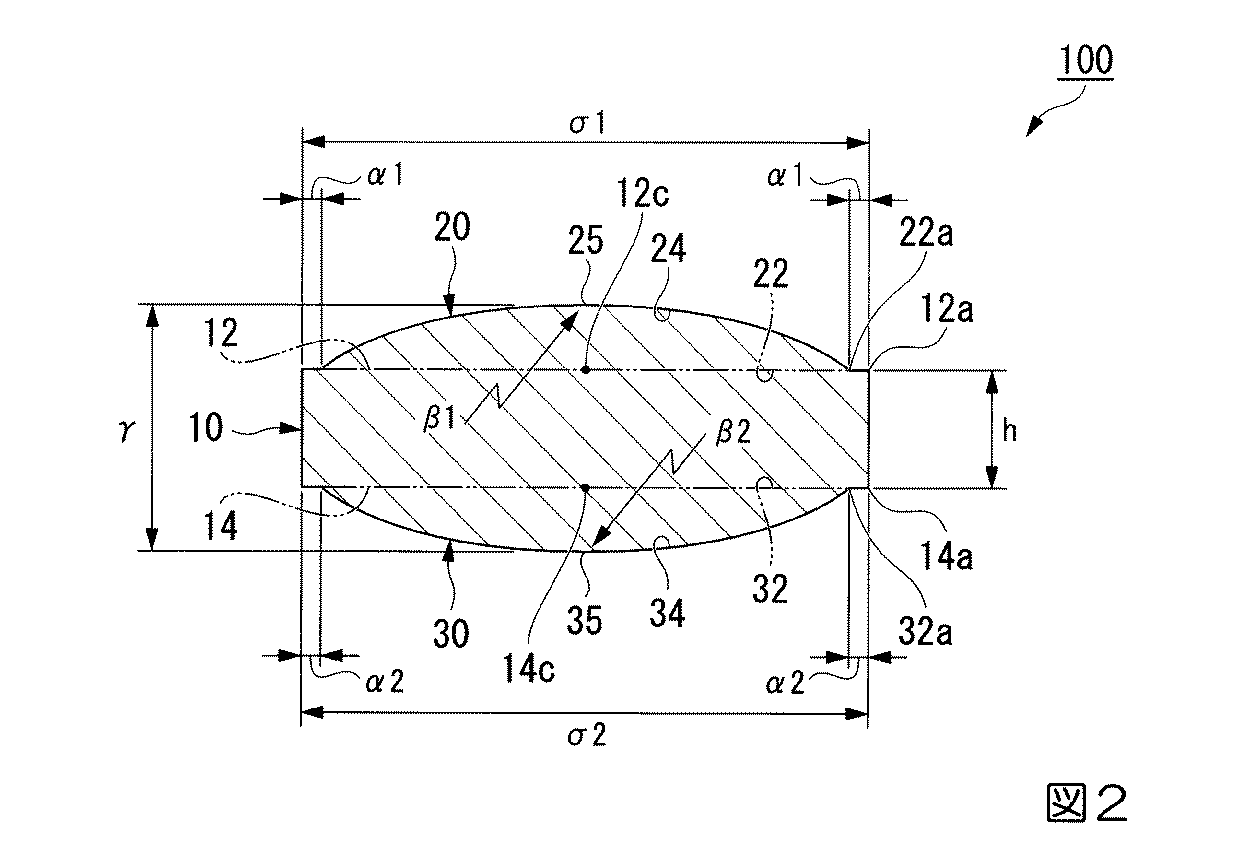
図1及び図2は、本発明の経口投与用錠剤の一実施形態を示す。図1は、錠剤を第1の球欠部側から見た平面図である。図2は、図1のX−X断面図、すなわち、前記一方の端面に対して直径(σ1)の位置で垂直方向に切断した際の断面を示す図である。
第1の球欠部20は、円柱部10の一方の端面(第1の端面)12の周縁12a近傍から、第1の端面12の中心12cに向かうに従って円弧状に膨出する。第1の球欠部20の表面24は球冠状であって、第1の球欠部20と円柱部10との境界は、平面視円形の仮想平面22とされる。
第2の球欠部30は、円柱部10の他方の端面(第2の端面)14の周縁14a近傍から、第2の端面14の中心14cに向かうに従って円弧状に膨出する。第2の球欠部30の表面34は球冠状であって、第2の球欠部30と円柱部10との境界は、平面視円形の仮想平面32とされる。
第2の端面14の周縁14aと、第2の球欠部30の周縁32a(仮想平面32の外周)と、の距離(α2)は、前記距離(α1)と同様である。距離(α1)と距離(α2)とは同じでもよいし、異なってもよい。
円柱部10の直径(σ)は、5〜13mmである。中でも、服用性がより良好となることから、直径(σ)の上限値としては12.5mm以下が好ましく、12mm以下がより好ましく、下限値としては5mm以上であればよく、(a)成分の配合量又は賦形剤の配合量等を考慮し、適宜決定すればよい。
図2に示す錠剤100における曲率半径(β1)及び曲率半径(β2)は、球欠部表面の位置によらず一律である。
曲率半径(β1)を、前記の好ましい下限値以上とすることで、第1の端面12と天頂25との距離が短くなり、錠剤の厚さが厚くなりにくい。これにより、服用性が良好となり、また、体内での(a)成分の分散性が高まる。一方、前記の好ましい上限値以下とすることで、錠剤表面に適度な湾曲が形成され、服用性がより良好になる。
第2の球欠部30の表面34の曲線の曲率半径(β2)は、前記曲率半径(β1)と同様である。曲率半径(β1)と曲率半径(β2)とは同じでもよいし、異なってもよい。
かかる比(β1)/(σ1)が、前記下限値以上であれば、体内での(a)成分の分散性が高まり、一方、前記上限値以下であれば、服用性が良好となる。
第2の端面14に対して直径(σ2)の位置で垂直方向に切断した際の断面における、前記曲率半径(β2)と前記直径(σ2)との比(β2)/(σ2)は、前記の比(β1)/(σ1)と同様である。比(β1)/(σ1)と比(β2)/(σ2)とは同じでもよいし、異なってもよい。
かかる距離(γ)を、前記の好ましい下限値以上とすることで、錠剤の強度や硬度が維持しやすくなり、輸送中に錠剤の摩損等が生じにくくなる。一方、前記の好ましい上限値以下とすることで、服用性がより良好になる。
かかる比(γ)/(σ)が、前記上限値以下であれば、服用性が良好になる。一方、前記下限値以上であれば、錠剤の強度や硬度が維持しやすくなり、輸送中に錠剤の摩損等が生じにくくなる。
かかる距離(h)が、前記の好ましい下限値以上であれば、錠剤の強度や硬度が維持しやすくなり、輸送中に錠剤の摩損等が生じにくくなる。一方、前記の好ましい上限値以下であれば、服用性が良好になる。
曲率半径(β1)及び曲率半径(β2)は、柔軟性のある定規を用いて第1及び第2の球欠部表面の曲線(円弧)の長さを測定し、別に測定した距離(α1)、距離(α2)、直径(σ1)、直径(σ2)の値を利用して算出できる。
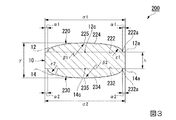
錠剤100では、球欠部表面の位置によらず、曲率半径(β1)及び曲率半径(β2)がそれぞれ一律であったが、例えば図3に示す実施形態の錠剤200のように、球欠部表面の位置によって異なる実施形態(いわゆる二段R錠)であってもよい。
図3に示す実施形態の錠剤200は、平面視真円形であり、円柱部10と、第1の球欠部220と、第2の球欠部230と、を有する一体成形物であり、全体として円板状である。
第1の球欠部220は、第1の端面12の周縁12a近傍から、第1の端面12の中心12cに向かうに従って円弧状に膨出する。第1の球欠部220の表面224は球冠状であって、第1の球欠部220と円柱部10との境界は、平面視円形の仮想平面222とされる。第2の球欠部230は、第2の端面14の周縁14a近傍から、第2の端面14の中心14cに向かうに従って円弧状に膨出する。第2の球欠部230の表面234は球冠状であって、第2の球欠部230と円柱部10との境界は、平面視円形の仮想平面232とされる。
錠剤200においては、第1の球欠部220の天頂部の曲線についての曲率半径(β1)が、第1の球欠部220の周縁部の曲線についての曲率半径(ε1)よりも大きいとされる。同様に、第2の球欠部230の天頂部の曲線の曲率半径(β2)が、第2の球欠部230の周縁部の曲線についての曲率半径(ε2)よりも大きいとされる。このように曲率半径が異なる錠剤200では、第1の球欠部220の周縁222a、及び第2の球欠部230の周縁232a近傍の丸みが大きくなる。これにより、飲みやすさが高まり、服用性がより良好となる。
前記曲率半径(ε1)は、2〜5mmが好ましく、2〜4mmがより好ましい。前記曲率半径(ε2)は、前記曲率半径(ε1)と同様である。曲率半径(ε1)と曲率半径(ε2)とは同じでもよいし、異なってもよい。
上記本発明の経口投与用錠剤は、前記(A)成分と前記(B)成分とを打錠する方法により製造できる。
かかる錠剤の製造方法の一実施形態としては、前記(A)成分と前記(B)成分とを混合して混合物を得る工程(混合工程)と、前記混合物を打錠して錠剤を成形する工程(成形工程)と、を備える方法が挙げられる。
混合工程では、(A)成分と、(B)成分と、必要に応じて他の成分と、を混合して混合物を得る。
前記(A)成分は、(a)成分の原末をそのまま用いてもよく、造粒したもの(造粒粒子群)を用いてもよい。この造粒粒子群には、例えば、(a)成分の原末を造粒したもの、(a)成分とこれ以外の成分とを造粒したものが用いられる。
(a)成分には、平均粒子径が30μm未満の粒子群を用いることが好ましい。(a)成分の平均粒子径の上限値としては、30μm未満が好ましく、より好ましくは15μm以下であり、さらに好ましくは2μm以下である。一方、その下限値としては、特に限定されないが、0.01μm以上が好ましく、より好ましくは0.1μm以上である。(a)成分の粒子群の平均粒子径が、好ましい上限値以下であれば、(a)成分の体内での分散性がより向上する。一方、好ましい下限値以上であれば、粉砕効率が良好となり、製造効率の向上が図れる。
前記(B)成分は、原末をそのまま用いることができる。(B)成分の粒子群の平均粒子径は、10〜800μmが好ましい。
本明細書において、粒子群の平均粒子径とは、体積平均粒子径を意味し、レーザー回折・散乱法により測定される値を示す。例えば、レーザー回折・散乱式粒度分布測定装置「LA−920」(株式会社堀場製作所製)を用いてマニュアルフローセル測定法により測定される。
乾式造粒法としては、例えば乾式圧縮法が挙げられ、具体的には、(a)成分とこれ以外の成分とを混合して得られた混合物を圧縮して造粒する方法が挙げられる。
湿式造粒法としては、例えば流動層造粒法、撹拌造粒法、押出し造粒法、転動造粒法、捏和・破砕造粒等が挙げられる。これらの中でも、湿式造粒法が好ましく、流動層造粒法、撹拌造粒法が特に好ましい。
流動層造粒法による造粒粒子群の製造は、例えば、撹拌型流動造粒装置(例えば株式会社パウレック製のマルチプレックス、フロンイント産業株式会社製のスパイラフロー等)を用いて、前記水性液を噴霧しながら造粒することにより実施できる。
撹拌造粒法による造粒粒子群の製造は、例えば、撹拌造粒機(例えば深江パウテック株式会社製のハイスピードミキサー、株式会社ダルトン製の高速攪拌造粒機)を用いて、前記水性液を噴霧又は滴下しながら撹拌錬合した後に、押出し造粒機(たとえば株式会社ダルトン製のドームグラン)を用いて造粒することにより実施できる。
造粒条件は、特に限定されないが、(a)成分の融点よりも低い温度で行うことが好ましい。例えば(a)成分がイブプロフェンの場合、65℃よりも低い温度で造粒することが好ましい。
(a)成分と崩壊剤等との混合物の平均粒子径は、好ましくは1〜600μmである。
結合剤としては、錠剤の崩壊性、及び体内での(a)成分の分散性がより高まることから、水溶性高分子化合物を配合することが好ましい。
該水性液における結合剤の濃度は、好ましくは0.2〜20質量%である。
結合剤を含有する水性液の噴霧は、造粒粒子群中の(a)成分の含有量が5〜60質量%となるまで行うのが好ましく、10〜55質量%となるまで行うのがより好ましい。(a)成分の含有量が、前記の好ましい下限値以上であれば、(a)成分以外の成分の配合量を減らせるため、1回当りの服用量を減らすことができ、服用性がより良好になる。一方、前記の好ましい上限値以下であれば、打錠時における流動性がより良好になり、粉体の打錠成型機等への付着が抑制される。
かかる平均粒子径が前記の好ましい下限値以上であれば、錠剤の服用性がより向上する。また、粉体の流動性が良好になり、製造時のハンドリング性が向上する。一方、前記の好ましい上限値以下であれば、体内での(a)成分の分散性がより良好になる。また、造粒粒子の粒子径の粗大化が起こりにくくなる。
その際、(B)成分を湿式造粒することなく、(A)成分((a)成分を含む造粒粒子群)と(B)成分の粒子群との混合物を得ることが好ましい。すなわち、加水せずに(B)成分を(A)成分と混合することが好ましい。これにより、(a)成分の安定化が図れる。また、製造時、粉体の打錠成型機等への付着が抑制される。
混合方法としては、粉体混合、乾式造粒法が好適であり、より簡便な方法であることから、粉体混合が特に好ましい。これによって、崩壊性及び体内での分散性のより高い錠剤が得られやすい。
本工程では、全成分を混合機に投入して混合することもできるし、一部の成分を混合した後、残りの成分を逐次投入して混合することもできる。
成形工程では、上記混合工程で得られた混合物を打錠して錠剤を成形する。
打錠方法は、打錠後の錠剤が上述した特定の形状となるように設計された杵、を備えた打錠成型機を用いて成形する方法が挙げられる。
打錠条件は、特に限定されず、錠剤に求める硬度等を勘案して適宜決定される。例えば、打錠圧は、錠剤の硬度が4〜10kgf(39〜99N)となるように設定することが好ましい。
加えて、本実施形態の錠剤100は、特定の形状、すなわち、円柱部10と第1の球欠部20と第2の球欠部30とを有し、距離(α1)及び距離(α2)がそれぞれ0〜0.3mm、直径(σ1)及び直径(σ2)がそれぞれ5〜13mm、曲率半径と直径との比(β1)/(σ1)及び比(β2)/(σ2)がそれぞれ0.8以上3.8未満、距離(γ)と直径との比(γ)/(σ1)及び比(γ)/(σ2)がそれぞれ0.8以下である。
かかる形状の錠剤100においては、打錠時に均一に圧力が加わりやすいことで、体内での(a)成分の分散性が向上し、即効性が高まる。さらに、服用した際、咽頭部との接触が少ないため、飲みやすく、服用性に優れる。
このように、本実施形態の錠剤100によれば、即効性と服用性との両立が図れる。
・(A)成分:水難溶性薬物(a)を含む粒子群
(A)成分として、以下に示す(a)成分の粒子群、(a)成分とこれ以外の成分との造粒粒子群を用いた。
イブプロフェン、商品名「イブプロフェンDC25」(BASF社製)、平均粒子径25μm。
アスピリン、商品名「RHODINE3220」(Novacyl社製)、平均粒子径130μm。
アリルイソプロピルアセチル尿素、商品名「アリプロナール粉砕品」(金剛化学株式会社製)、平均粒子径30μm。
造粒粒子群(1):以下に示す造粒方法により調製したもの。
イブプロフェンと低置換度ヒドロキシプロピルセルロースとが表1に示す混合比率となるように、リボンミキサー(5L、株式会社徳寿工作所製)を用い、イブプロフェンと低置換度ヒドロキシプロピルセルロースとの合計約3kgを混合した。その後、ピンミル粉砕機(株式会社パウレック製)を用い、約30分間共粉砕した。得られた共粉砕物の体積平均粒子径は13.7μmであった。該共粉砕物の体積平均粒子径は、ベックマン・コールター株式会社製の製品名LS13 320を用いて測定した(測定条件:ドライパウダーモジュール、所要時間20秒間)。粉砕機の温度は、GRAPHTEC社製の製品名midi LOGGER GL200A-UM-801を用いて測定した。この後、得られた共粉砕物とアセトアミノフェンとを混合した。
次に、ヒドロキシプロピルセルロースの6質量%水溶液にD−マンニトールを溶解して噴霧用水性液を調製した。
次に、スパイラフロー(フロイント産業株式会社製、5型)を用い、前記共粉砕物とアセトアミノフェンとの混合物約2.3kgに、前記噴霧用水性液を噴霧しながら造粒した。噴霧終了後、排気温度が43℃になるまで乾燥し、平均粒子径200μmの造粒粒子群(1)を得た。
撹拌機付きの容器内で、ヒドロキシプロピルセルロースの2質量%水溶液を調製した。次に、表1に示す混合比率となるように、この2質量%水溶液にイブプロフェンを投入して分散させ、合計約1kgの分散液を得た。この分散液を、ビーズミル(寿工業株式会社製、UAM015)で処理し、粒子径が約0.5μmのイブプロフェン粒子が分散した粉砕分散液を得た。
次に、表1に示す混合比率となるように、前記粉砕分散液1kgにラウリル硫酸ナトリウムを溶解させて噴霧用水性液を調製した。次いで、流動層造粒機(株式会社パウレック製、MP−01)を用い、50℃の空気を供給し、平均粒子径が30μmのアセトアミノフェンを投入して流動させつつ、前記噴霧用水性液を噴霧しながら造粒を行った。噴霧終了後、排気温度が43℃になるまで乾燥し、平均粒子径200μmの造粒粒子群(2)を得た。
炭酸水素ナトリウム、商品名「重炭酸ナトリウムKF」(旭硝子株式会社製)。
ラウリル硫酸ナトリウム、商品名「SLS」(日光ケミカルズ株式会社製)。
ヒドロキシプロピルセルロース、商品名「HPC−SSL」(日本曹達株式会社製)2質量%水溶液の20℃における粘度2.5mPa・s、結合剤。
低置換度ヒドロキシプロピルセルロース、商品名「LH−31」(信越化学株式会社製)、崩壊剤。
クロスポビドン、商品名「Kollidon CL−SF」(BASF社製)、崩壊剤。
マンニトール、商品名「ペアリトール200SD」(ロケットジャパン社製)、賦形剤。
D−マンニトール、商品名「ペアリトール50C」(ロケットジャパン社製)、賦形剤。
乾燥水酸化アルミニウムゲル、商品名「S−100」(協和化学工業株式会社製)、制酸剤。
アセトアミノフェン、商品名「アセトアミノフェンRKF−20」(岩城製薬株式会社製)、薬物。
無水カフェイン、商品名「0.2/0.5」(白鳥製薬株式会社製)、薬物。
ステアリン酸マグネシウム、商品名「ステアリン酸マグネシウム」(太平化学産業株式会社製)、滑沢剤。
表2〜6に示す組成(配合成分、含有割合(質量%/錠))に従い、各例の経口投与用錠剤を下記の製造方法によりそれぞれ製造した。
表に記載されている各成分の含有割合(質量%/錠)は、錠剤1錠当たりの各配合成分の含有割合である。表中、配合成分の含有割合は、純分換算量での値を示す。
1錠当たりの組成が表2及び表3に示す組成となるように、混合機(ボーレコンテナミキサー:コトブキ技研工業株式会社製、20型)に全配合成分の約3kgを投入し、30分間混合して混合粉体を得た。
次いで、ロータリー式打錠機(株式会社菊水製作所社製、リブラ)を用い、表2及び表3に示す仕様となるように、得られた混合粉体を前記打錠機に充填し、打錠圧600kgで打錠することにより、図1及び図2に示す錠剤100と同様の形状Pである経口投与用錠剤を得た。
ただし、実施例1、4、5は参考例である。
1錠当たりの組成が表4に示す組成となるように、実施例1〜14と同様にして、全配合成分の約3kgの混合粉体を得た。その際、(A)成分として、造粒粒子群(1)とアリルイソプロピルアセチル尿素の粒子群とを配合した。
次いで、ロータリー式打錠機(株式会社菊水製作所社製、リブラ)を用い、表4に示す仕様となるように、得られた混合粉体を前記打錠機に充填し、打錠圧600kgで打錠することにより、図3に示す錠剤200と同様の形状Qである経口投与用錠剤を得た。
1錠当たりの組成が表4に示す組成となるように、実施例1〜14と同様にして、全配合成分の約3kgの混合粉体を得た。その際、(A)成分として、造粒粒子群(2)とアリルイソプロピルアセチル尿素の粒子群とを配合した。
次いで、ロータリー式打錠機(株式会社菊水製作所社製、リブラ)、及び、所定の形状を有する杵を用い、打錠することにより経口投与用錠剤を得た。
次いで、ロータリー式打錠機(株式会社菊水製作所社製、リブラ)を用い、表4に示す仕様となるように、得られた混合粉体を前記打錠機に充填し、打錠圧600kgで打錠することにより、図3に示す錠剤200と同様の形状Qである経口投与用錠剤を得た。
表5に示す組成となるように、実施例1〜14と同様にして、全配合成分の約3kgの混合粉体を得た。
次いで、ロータリー式打錠機(株式会社菊水製作所社製、リブラ)を用い、表5に示す仕様となるように、得られた混合粉体を前記打錠機に充填し、打錠圧600kgで打錠することにより、図1及び図2に示す錠剤100と同様の形状Pである経口投与用錠剤を得た。
表6に示す組成となるように、実施例1〜14と同様にして、全配合成分の約3kgの混合粉体を得た。
次いで、ロータリー式打錠機(株式会社菊水製作所社製、リブラ)を用い、表6に示す仕様となるように、得られた混合粉体を前記打錠機に充填し、打錠圧600kgで打錠することにより、図4に示す錠剤300と同様の形状Rである経口投与用錠剤を得た。
図4に示す実施形態の錠剤300は、平面視真円形であり、円柱部310における両方の端面312、314のそれぞれの周縁に、平面状の隅切り312a、314aが設けられた、いわゆる円形スミ角錠である。
尚、実施例15及び実施例16についての曲率半径は、球欠部表面(天頂部)の曲線の曲率半径(β1)及び曲率半径(β2)と、球欠部表面(周縁部)の曲線の曲率半径(ε1)及び曲率半径(ε2)と、を示した。その他の例の経口投与用錠剤は、球欠部表面の位置によらず、曲率半径が一律なものである。
各例の経口投与用錠剤において、距離(α1)と距離(α2)とは同じ値であり、直径(σ1)と直径(σ2)とは同じ値であり、曲率半径(β1)と曲率半径(β2)とは同じ値であり、比(β1)/(σ1)と比(β2)/(σ2)とは同じ値であり、比(γ)/(σ1)と比(γ)/(σ2)とは同じ値である。
各例の経口投与用錠剤について、即効性及び服用性をそれぞれ評価した。その結果を表2〜6に示した。
パドル溶出試験器(富山産業株式会社)を用い、以下のようにして分散性評価試験を行った。
パドルの撹拌翼が充分に隠れる程度の胃モデル液(塩化ナトリウムと塩酸とを水に溶かし、pHを1.8に調整した液)に、経口投与用錠剤2錠を添加し、崩壊した錠剤が強制的に液中で分散しない程度に撹拌した。
前記錠剤2錠を、胃モデル液に添加してから10分間経過後に、その液を採取してバイアル瓶に移し、アセトニトリルと酢酸とを添加して(a)成分を溶解した。
(a)成分を溶解した後、0.45μmのフィルターでろ過し、高速液体クロマトグラフィで(a)成分の量を測定した。この高速液体クロマトグラフィの測定結果から、錠剤から胃モデル液に分散した(a)成分の量を逆算した。
錠剤を添加してから10分間経過後の分散率は、添加した錠剤中の(a)成分の質量に対する、該錠剤から分散した(a)成分の質量の割合(%)、を求めることにより算出した。
本評価において、かかる分散率が60%以上であれば、体内での(a)成分の分散性が充分に高く、その錠剤は即効性が良い、と言える。また、かかる分散率が65%以上であることがより好ましく、70%以上であることがさらに好ましい、と言える。
20〜50歳代の女性パネラー10名に対し、経口投与用錠剤2錠を1回、各自のタイミングで、水と一緒に服用する服用性評価試験を行った。服用時の水の量は100mL以下とした。
錠剤2錠を服用する際、錠剤の喉の通りやすさについて、下記の評価基準に基づいて評価した。
評価基準
7点:非常に良い。
6点:かなり良い。
5点:やや良い。
4点:どちらともいえない。
3点:やや悪い。
2点:かなり悪い。
1点:非常に悪い。
そして、女性パネラー10名のうちの最高点と最低点とを除く8名の評価点の平均値を算出し、下記の判定基準に基づいて服用性を評価した。
判定基準
◎:6〜7点。
○:5〜6点未満。
△:4〜5点未満。
×:4点未満。
Claims (5)
- 水難溶性薬物(a)を含む粒子群(A)と、炭酸塩及び炭酸水素塩からなる群より選ばれる少なくとも一種(B)との混合物、を含有し、
円柱部と、該円柱部の一方の端面の周縁近傍から、該一方の端面の中心に向かうに従って膨出する第1の球欠部と、該円柱部の他方の端面の周縁近傍から、該他方の端面の中心に向かうに従って膨出する第2の球欠部と、を有し、
前記一方の端面周縁と前記第1の球欠部の周縁との距離(α1)が0.02〜0.3mmであり、
前記他方の端面周縁と前記第2の球欠部の周縁との距離(α2)が0.02〜0.3mmであり、
前記円柱部の直径(σ)が5〜13mmであり、
前記第1の球欠部の天頂と前記第2の球欠部の天頂との距離(γ)は、3.7〜10.4mmであり、
前記一方の端面に対して直径(σ1)の位置で垂直方向に切断した際の断面は、前記第1の球欠部表面の曲線における天頂部の曲率半径(β1)と前記直径(σ1)との比(β1)/(σ1)が0.8以上1.44以下であり、
前記他方の端面に対して直径(σ2)の位置で垂直方向に切断した際の断面は、前記第2の球欠部表面の曲線における天頂部の曲率半径(β2)と前記直径(σ2)との比(β2)/(σ2)が0.8以上1.44以下であり、
前記距離(γ)と、前記直径(σ)との比(γ)/(σ)が0.8以下であることを特徴とする、経口投与用錠剤。 - 前記曲率半径(β1)は、前記第1の球欠部の周縁部よりも天頂部の方が大きいことを特徴とする、請求項1に記載の経口投与用錠剤。
- 前記曲率半径(β2)は、前記第2の球欠部の周縁部よりも天頂部の方が大きいことを特徴とする、請求項1又は2に記載の経口投与用錠剤。
- 前記円柱部の一方の端面と他方の端面との距離(h)が1〜7mmであることを特徴とする、請求項1〜3のいずれか一項に記載の経口投与用錠剤。
- 前記(B)成分は、炭酸水素塩であることを特徴とする請求項1〜4のいずれか一項に記載の経口投与用錠剤。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2014204278A JP6418878B2 (ja) | 2014-10-02 | 2014-10-02 | 経口投与用錠剤 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2014204278A JP6418878B2 (ja) | 2014-10-02 | 2014-10-02 | 経口投与用錠剤 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2016074611A JP2016074611A (ja) | 2016-05-12 |
| JP6418878B2 true JP6418878B2 (ja) | 2018-11-07 |
Family
ID=55950730
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014204278A Active JP6418878B2 (ja) | 2014-10-02 | 2014-10-02 | 経口投与用錠剤 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP6418878B2 (ja) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP7050484B2 (ja) * | 2017-12-26 | 2022-04-08 | ライオン株式会社 | 積層錠、医薬製剤及び積層錠の製造方法 |
| JP7040418B2 (ja) * | 2018-11-21 | 2022-03-23 | 株式会社村田製作所 | 錠剤 |
Family Cites Families (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2003080023A2 (en) * | 2002-03-20 | 2003-10-02 | Elan Pharma International Limited | Fast dissolving dosage forms having reduced friability |
-
2014
- 2014-10-02 JP JP2014204278A patent/JP6418878B2/ja active Active
Also Published As
| Publication number | Publication date |
|---|---|
| JP2016074611A (ja) | 2016-05-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6014044B2 (ja) | 迅速分散顆粒、口腔内崩壊錠、および方法 | |
| EP2209501B1 (en) | Zibotentan composition containing mannitol and microcrystalline cellulose | |
| JP6433066B2 (ja) | 錠剤及びその製造方法 | |
| JP2007314529A (ja) | 造粒粒子、錠剤、及び造粒粒子の製造方法 | |
| JP5974469B2 (ja) | 錠剤の製造方法 | |
| JP6090610B2 (ja) | 錠剤の製造方法 | |
| ES2694644T3 (es) | Nueva composición de alfentanilo para el tratamiento del dolor agudo | |
| JP6418878B2 (ja) | 経口投与用錠剤 | |
| JP5663238B2 (ja) | 内服固形製剤及びその製造方法 | |
| JP6304896B2 (ja) | 錠剤 | |
| JP7391639B2 (ja) | 医薬製剤 | |
| JP6440317B2 (ja) | 内服固形錠剤 | |
| JP7607621B2 (ja) | 錠剤の製造方法及び造粒粒子群 | |
| JP2000063269A (ja) | 固形製剤 | |
| JP6292788B2 (ja) | 錠剤及び錠剤の製造方法 | |
| JP2012046454A (ja) | 内服用錠剤およびその製造方法 | |
| JP6532153B2 (ja) | 内服用錠剤 | |
| JP7109255B2 (ja) | 粉砕物の製造方法及び錠剤の製造方法 | |
| JP6180382B2 (ja) | 錠剤及びその製造方法 | |
| JP2017066133A (ja) | 安定性及び速効性の高いイブプロフェン含有固形製剤 | |
| JP6037824B2 (ja) | エトドラク含有固形製剤 | |
| JP7515253B2 (ja) | 固形医薬製剤 | |
| KR102620329B1 (ko) | 정제 및 정제의 제조 방법 | |
| JP2025081930A (ja) | 錠剤、造粒粒子、造粒粒子の製造方法及び錠剤の製造方法 | |
| JP2025091085A (ja) | 錠剤及び錠剤の製造方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20170616 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20180220 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180420 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20180515 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180711 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20180911 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20181009 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6418878 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| S531 | Written request for registration of change of domicile |
Free format text: JAPANESE INTERMEDIATE CODE: R313531 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |