JP6387008B2 - インスリンアナローグダイマー - Google Patents
インスリンアナローグダイマー Download PDFInfo
- Publication number
- JP6387008B2 JP6387008B2 JP2015534623A JP2015534623A JP6387008B2 JP 6387008 B2 JP6387008 B2 JP 6387008B2 JP 2015534623 A JP2015534623 A JP 2015534623A JP 2015534623 A JP2015534623 A JP 2015534623A JP 6387008 B2 JP6387008 B2 JP 6387008B2
- Authority
- JP
- Japan
- Prior art keywords
- chain
- insulin
- seq
- alkyl
- amino acid
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 0 CNC(C(CS)**)=O Chemical compound CNC(C(CS)**)=O 0.000 description 11
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/575—Hormones
- C07K14/62—Insulins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/54—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/54—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound
- A61K47/55—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound the modifying agent being also a pharmacologically or therapeutically active agent, i.e. the entire conjugate being a codrug, i.e. a dimer, oligomer or polymer of pharmacologically or therapeutically active compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/56—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic macromolecular compound, e.g. an oligomeric, polymeric or dendrimeric molecule
- A61K47/59—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic macromolecular compound, e.g. an oligomeric, polymeric or dendrimeric molecule obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyureas or polyurethanes
- A61K47/60—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic macromolecular compound, e.g. an oligomeric, polymeric or dendrimeric molecule obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyureas or polyurethanes the organic macromolecular compound being a polyoxyalkylene oligomer, polymer or dendrimer, e.g. PEG, PPG, PEO or polyglycerol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/62—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being a protein, peptide or polyamino acid
- A61K47/65—Peptidic linkers, binders or spacers, e.g. peptidic enzyme-labile linkers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
Description
本出願は、米国仮特許出願No.61/705,834(2012年9月26日出願)(前記の内容は参照によりその全体が本明細書に組み入れられる)の優先権を主張する。
電子提出資料の参照による組み入れ
本明細書と同時に提出され、以下のとおりのコンピューター読み出し可能ヌクレオチド/アミノ酸配列リストは、参照によりその全体が本明細書に組み入れられる:2013年9月25日作成の名称“216463SEQLIST_ST25.txt”の45キロバイトACII(テキスト)ファイル。
インスリンは二鎖ヘテロダイマーを含むペプチドホルモンであり、効力の低い単鎖プロインスリン前駆体から酵素的プロセッシングを介して生合成により誘導される。ヒトインスリンは、ジスルフィド結合によって一緒に結合した2つのペプチド鎖(“A鎖”(配列番号:1)及び“B鎖”(配列番号:2))を含み、合計51アミノ酸を有する。B鎖のC-末端領域及びA鎖の2つの末端領域は三次元構造において共同して、インスリン受容体との高親和性結合のための部位を組み立てる。
インスリンは、実質的に全ての形態の糖尿病でグルコースを低下させる比類のない能力を示す。不幸なことに、その薬理学的反応はグルコース感受性ではなく、したがって生命にかかわる低血糖に至る過剰作用を示し得る。相反する薬理学的反応は、低血糖を生じることなく血中グルコースを正常化することが極めて困難であるというインスリン療法の特徴である。さらにまた、自然のままのインスリンは作用の持続時間が短く、基礎グルコース制御での使用に適切であるように改変を必要とする。インスリン作用の開始を遅らせる確立されたアプローチには可溶性の低下及びアルブミン結合が含まれる。
インスリン様成長因子1及び2は単鎖線形(liner)ペプチドホルモンであり、前記は、それらのA鎖及びB鎖配列において高度に相同性であって、自然のままのインスリンとほぼ50%の相同性を共有する。IGFのA鎖及びB鎖は“C-ペプチド”によって連結され、ここで2つのIGFのC-ペプチドはサイズ及びアミノ酸配列が異なり、第一のC-ペプチドは長さが12アミノ酸、第二のものは8アミノ酸である。ヒトIGF-1は、配列番号:3に示すタンパク質配列を有する70aaの塩基性ペプチドであり、プロインスリンと43%の相同性を有する(Rinderknecht et al.(1978) J.Biol.Chem.253:2769-2776)。ヒトIGF-2は、配列番号:4に示すタンパク質配列を有する67アミノ酸の塩基性ペプチドである。IGFは、インスリンB受容体アイソフォームでA-受容体アイソフォームよりも顕著に低い活性を示す。
インスリン及びインスリンアナローグのマルチマーを形成し、自然のままのヒトインスリンと同様な態様で糖尿病を治療するために用いることができる。本明細書に開示するように、出願人らは、インスリンアナローグダイマーの活性は、サイズ及びダイマー化リンカーが2つのインスリンポリペプチドを継ぎ合わせる位置に大きく左右されることを発見した。本明細書に開示するように、出願人らは、サブタイプBインスリン受容体に対し選択性を有するダイマーと同様、完全な固有の効力を保有するが部分的最大応答性しか示さないインスリンダイマーを発見した。そのようなダイマーは、投与部位から除去され血漿中で平衡化された後で、より厳密に制御されたインスリン作用の開始及び持続時間を提供できる。
第一及び第二のインスリンポリペプチドは、当業者に公知の標準的技術を用い、2つの官能基間での共有結合の形成によって互いに共有結合され得る。例えば、2つのインスリンポリペプチドは必要な官能基を含むか又は必要な官能基を含むように改変でき、該官能基は、ジスルフィド結合、アミド結合、チオエーテル結合又はエステル結合を含むダイマー化結合の形成を可能にする。ある種の実施態様では、二官能性リンカーが提供されて第一及び第二のインスリンポリペプチドを連結し、ここで、該二官能性リンカーは、ヒドロキシル基及びカルボキシレート、又はアミン基及びカルボキシレート、又はチオール基及びカルボキシレート、又はチオール基及びチオール基を含む。ある実施態様では、第一及び第二のインスリンポリペプチドはジスルフィド結合を介して連結され、また別の実施態様では第一及び第二のインスリンポリペプチドはチオエーテル結合を介して連結される。
アシル化又はアルキル化は循環中のインスリンポリペプチドの半減期を延長することができる。アシル化又はアルキル化は有利には作用の開始を遅らせ、及び/又はインスリン受容体における作用の持続時間を延長する。インスリンアナローグは同じアミノ酸の位置でアシル化又はアルキル化させることができ、ここに親水性部分が連結される。前記には例えば連結部分の8位又は自己切断ジペプチド成分を含むアミノ酸の側鎖が含まれる。
a)第一及び第二のインスリンポリペプチドは、それぞれ第一及び第二のインスリンポリペプチドのB29位のアミノ酸の側鎖を介して互いに連結されるか、
b)前記第一及び第二のインスリンポリペプチドの少なくとも一方が単鎖インスリンポリペプチドであり、さらに第一及び第二のインスリンポリペプチドは、前記第一及び第二のインスリンポリペプチドの一方のB1位のアミノ酸の側鎖及び前記連結部分のアミノ酸の側鎖を介して互いに連結されるか、又は
c)第一及び第二のインスリンポリペプチドがともに単鎖インスリンポリペプチドであり、さらに第一及び第二のインスリンポリペプチドは、それぞれ第一及び第二のインスリンポリペプチドの連結部分のアミノ酸の側鎖を介して互いに連結される。有利には、該部分的アゴニストダイマーは最大用量応答の低下を示し、したがって出願人らは患者への投与に際して低血糖のリスクが減少するであろうと予想する。
式中X68はアルギニン、オルニチン、リジン又は下記構造Iの側鎖を含むアミノ酸であり:
ここで、第一及び第二のインスリンポリペプチドは、(i)前記第一又は第二のインスリンポリペプチドの一方のN-末端アミン又はN-末端アミノ酸の側鎖及び他方のインスリンポリペプチド連結部分の側鎖を介して、又は(ii)第一及び第二のインスリンポリペプチドのそれぞれの連結部分の各々のアミノ酸の側鎖を介して互いに連結される。
本発明の開示及び特許請求の範囲の記載に際して、以下の用語体系が下記に示す定義にしたがって用いられるであろう。
本明細書で用いられる“約”という用語は、記述されている値又は値の範囲より10パーセント高いか又は低いことを意味するが、ただし一切の値又は値の範囲をこのより広範囲の定義にのみ指定しようとするものではない。“約”という用語が先行する値又は値の範囲の各々がまた、記述されている絶対的値又は値の範囲の統合体を包含することが意図される。
本明細書で用いられるように、“プロドラッグ”という用語は、その薬理学的作用を示す前に化学的改変を受ける任意の化合物と定義される。
本明細書で用いられるように“アミノ酸”という用語は、アミノ及びカルボキシル官能基の両方を含む任意の分子を包含し、ここでアミノ及びカルボキシル基は同じ炭素(アルファ炭素)に添付される。アルファ炭素は場合によって1つ又は2つのさらに別の有機置換基を有し得る。本開示の目的のためには、その立体化学構造を指定せずにあるアミノ酸を指示する場合は、当該アミノ酸のL若しくはD型のどちらか又はラセミ混合物を包含することが意図される。しかしながら、アミノ酸がその3文字コードで指示されかつ上付き数字を含む場合には、該アミノ酸のD型は3文字コード及び上付き数字の前に小文字dを含むことによって指定され(例えばdLys-1)、ここで小文字dを欠く指示(例えばLys-1)は該アミノ酸の自然のままのL型を指定することが意図される。この命名体系では、上付き数字の組み入れは当該インスリンアナローグ配列中の当該アミノ酸の位置を示し、ここで該インスリンアナローグ内に配置されるアミノ酸は、N-末端から連続的に付与される正の上付き数字によって指示される。N-末端に又は側鎖を介してインスリンアナローグペプチドに連結される追加のアミノ酸は、0から始まり該インスリンアナローグ配列からさらに離れるにつれ増大する負の整数値が付与される。例えば、インスリンアナローグのN-末端に連結されるジペプチドプロドラッグ内のアミノ酸の位置はaa-1-aa0-インスリンアナローグと表示され、ここでaa0はジペプチドのカルボキシ末端アミノ酸を表し、aa-1はジペプチドのアミノ末端アミノ酸を示す。
本明細書で用いられる“ヒドロキシ酸”という用語は、改変されてアルファ炭素のアミノ基がヒドロキシル基に取り替えられてあるアミノ酸を包含する。
本明細書で用いられる“非コードアミノ酸”という用語は、以下の20のアミノ酸のいずれかのL-異性体ではない任意のアミノ酸を包含する:Ala、Cys、Asp、Glu、Phe、Gly、His、Ile、Lys、Leu、Met、Asn、Pro、Gln、Arg、Ser、Thr、Val、Trp、Tyr。
本明細書で用いられるように、さらに別の指示を含まない“化学的切断”という用語は、化学的共有結合の破壊をもたらす非酵素性反応を包含する。
“生物活性ポリペプチド”は、生物学的作用をin vitro及び/又はin vivoで示すことができるポリペプチドを指す。
本明細書で用いられるように、一般的にペプチド/ポリペプチドというとき、改変されたアミノ及びカルボキシ末端を有するペプチド/ポリペプチドを包含することが意図される。例えば、標準的なアミノ酸を指定するアミノ酸配列は、N-及びC-末端に標準的なアミノ酸とともに、N-末端に対応するヒドロキシ酸、及び/又は末端カルボン酸の代わりにアミド基を含むように改変された対応するC-末端アミノ酸を含むことが意図される。
本明細書で用いられる“アシル化”アミノ酸は、天然に存在するアミノ酸にとって自然のものではないアシル基を含むアミノ酸であり、それが生成される手段には無関係である。アシル化アミノ酸及びアシル化ペプチドを生成する例示的方法は当業界で公知であり、ペプチドに組み入れる前にアミノ酸をアシル化するか、又はペプチド合成の後で該ペプチドを化学的にアシル化することを含む。いくつかの実施態様では、アシル基はペプチドに以下の1つ以上の現象を引き起こす:(i)循環中の半減期の延長、(ii)作用開始の遅延、(iii)作用持続時間の延長、(iv)プロテアーゼ(例えばDPP-IV)に対する耐性の改善、及び(v)IGF及び/又はインスリンペプチド受容体での効力の増加。
本明細書で用いられるように“医薬的に許容できる担体”という用語は、任意の標準的な医薬担体、例えば、リン酸緩衝食塩水溶液、水、エマルジョン(例えば油/水又は水/油エマルジョン)及び多様なタイプの湿潤剤を含む。前記用語はまた、米連邦政府の規制庁に承認された又は動物(ヒトを含む)で使用される米薬局方に列挙された任意の薬剤を包含する。
本明細書で用いられるように“親水性部分”という用語は、容易に水に溶解又は容易に水を吸収でき、かつ有害作用がなく哺乳動物種がin vivoで耐性を示す(すなわち生物適合性である)任意の化合物を包含する。親水性部分の例には、ポリエチレングリコール(PEG)、ポリ乳酸、ポリグリコール酸、ポリ乳酸−ポリグリコール酸コポリマー、ポリビニルアルコール、ポリビニルピロリドン、ポリメトキサゾリン、ポリエチルオキサゾリン、ポリヒドロキシエチルメタクリレート、ポリヒドロキシプロピルメタクリルアミド、ポリメタクリルアミド、ポリジメチルアクリルアミド、及び誘導セルロース(例えばヒドロキシメチルセルロース又はヒドロキシエチルセルロース及びそれらのコポリマー)とともに天然のポリマー(例えばアルブミン、ヘパリン及びデキストラン)が含まれる。
本明細書で用いられるように、インスリンアナローグの“有効な”量又は“治療的に有効な量”は、所望の作用を提供するために有害ではないが十分な量のインスリンアナローグを指す。例えば、所望されるある作用は高血糖の予防又は治療であろう。“有効”である量は、個体の年齢及び一般的状態、投与態様などに応じて対象動物ごとに変動するであろう。したがって、厳密な“有効量”を指定することが常に可能であるとは限らない。しかしながら、任意の個々の事例において適切な“有効”量を日常的な試験を用いて当業者は決定し得る。
“非経口的”という用語は、栄養管を通過しないが何らかの他のルート(例えば鼻内、吸入、皮下、筋肉内、脊髄内又は静脈内)によることを意味する。
本明細書で用いられる“IGF1アナローグ”は、A鎖及びB鎖を含み、当該A鎖及びB鎖配列の各々が自然のままのIGF1 A及びB鎖配列とそれぞれ90%以上の配列同一性を共有するポリペプチドを包含する包括的用語である。前記用語はまたIGF YLアナローグを包含する。
本明細書で用いられる“IGF2アナローグ”は、A鎖及びB鎖を含み、当該A鎖及びB鎖配列の各々が自然のままのIGF2 A及びB鎖配列とそれぞれ90%以上の配列同一性を共有するポリペプチドを包含する包括的用語である。
“IGF YLアナローグ”は、配列番号:19のIGF A鎖及び配列番号:51のIGF B鎖を含むペプチドである。
本明細書で用いられるように“単鎖インスリンアナローグ”という用語は構造的に関連する一群のタンパク質を包含し、ここで、インスリン又はIGF A及びB鎖、又は前記のアナローグ若しくは誘導体は、共有結合により互いに連結されて線状ポリペプチド鎖を形成する。本明細書で開示するように、単鎖インスリンアナローグは、B鎖のカルボキシ末端とA鎖のアミノ末端との連結部分を介した共有結合を含む。
本明細書で用いられる“インスリンB鎖”という用語(更なる説明的言葉を含まない)は、配列番号:2の30アミノ酸配列とともに自然のままのB鎖の改変された機能的アナローグを包含することが意図され、前記アナローグは、B16又はB25位のアミノ酸から4-アミノフェニルアラニンまでの改変、又はB1、B2、B3、B4、B5、B9、B10、B13、B14、B17、B20、B21、B22、B23、B25、B26、B27、B28、B29及びB30から選択される位置に1つ以上のアミノ酸の挿入、欠失若しくは置換、又はB1−4及びB26−30位のいずれか若しくは全ての欠失を含む。
本明細書で用いられる“誘導体”という用語は、化合物(例えばアミノ酸)に対する化学的改変を包含することが意図され、前記改変には、例えばポリペプチドの1つ以上の位置の側鎖に基(例えばチロシン残基にニトロ基を又はチロシン残基にヨウ素)を導入することによって、又は遊離カルボキシル基のエステル基若しくはアミド基への変換によって、又はアミノ基のアシル化によるアミドへの変換によって、又はヒドロキシ基をアシル化してエステルにすることによって、又は一級アミンをアルキル化して二級アミンにすることによって、又はアミノ酸側鎖への親水性部分の結合によってin vitroで化学的に改変することが含まれる。他の誘導体は、ポリペプチド内のアミノ酸残基の側鎖の酸化又は還元によって入手される。
本明細書で用いられる“IGF YL B鎖”という用語(更なる説明的言葉を含まない)は、配列番号:21を含むアミノ酸配列(例えば配列番号:6の配列を含む)とともにIGF YL B鎖のアナローグ及びその誘導体を包含することが意図され、前記誘導体は、B16又はB25位のアミノ酸から4-アミノフェニルアラニンまでの改変、又はB1、B2、B3、B4、B5、B9、B10、B13、B14、B17、B20、B21、B22、B23、B26、B27、B28、B29及びB30から選択される位置における1つ以上のアミノ酸の置換、又はB1−4及びB26−30位のいずれか若しくは全ての欠失を含む。
本明細書で用いられるように、第二の受容体と比較した第一の受容体に対する分子の“選択性”という用語は以下の比率を指す:第一の受容体における分子のEC50で割った第二の受容体における分子のEC50。例えば、第一の受容体で1nMのEC50及び第二の受容体で100nMのEC50を有する分子は、第二の受容体と比較して第一の受容体に対して100倍の選択性を有する。
本明細書で用いられる、アミノ酸の“置換”は、あるアミノ酸残基の異なるアミノ酸残基による取替えを指す。
本明細書で用いられる、“保存的アミノ酸置換”という用語は、以下の5つのグループの1つの中での変更と定義される:
I. 小さな脂肪族で、非極性又はわずかに極性の残基:Ala、Ser、Thr、Pro、Gly;
II. 極性で負に荷電した残基及びそれらのアミド:Asp、Asn、Glu、Gln、システイン酸及びホモシステイン酸;
III. 極性で正に荷電した残基;His、Arg、Lys、オルニチン(Orn);
IV. 大きな脂肪族の非極性残基:Met、Leu、Ile、Val、Cys、ノルロイシン(Nle)、ホモシステイン;
V. 大きな芳香族残基:Phe、Tyr、Trp、アセチルフェニルアラニン。
本明細書で用いられる“PEG化”などの用語は、ポリエチレングリコール鎖を任意の化合物に連結することによってその自然の状態から改変されてある化合物を含む。“PEG化ポリペプチド”は、当該ポリペプチドと共有結合されたPEG鎖を有するポリペプチドである。
本明細書で用いられる“リンカー”は、2つの別々の実体を互いに結合させる結合、分子又は分子の基である。リンカーは2つの実体の最適な間隙を提供するか、さらにまた2つの物体が互いに分離状態にあることを可能にする不安定な結合を提供できる。不安定な結合には、光切断可能基、易酸性部分、易塩基性部分及び酵素切断可能基が含まれる。
本明細書で用いられる“インスリンダイマー”は、リンカーにより互いに共有結合された2つのインスリンポリペプチドを含む複合体である。インスリンダイマーという用語は、何らの修飾の言葉を含まずに用いられるときインスリンホモダイマー及びインスリンヘテロダイマーの両方を包含する。インスリンホモダイマーは2つの同一のインスリンポリペプチドを含み、一方、インスリンヘテロダイマーは異なる2つのインスリンポリペプチドを含む。
“C2−Cnアルケニル”(式中nは2から6であり得る)という用語は、2から指定の数の炭素原子及び少なくとも1つの二重結合有する、オレフィン系不飽和分枝又は直鎖基を表す。そのような基の例には、1-プロペニル、2-プロペニル(-CH2-CH=CH2)、1,3-ブタジエニル(-CH=CHCH=CH2)、1-ブテニル(-CH=CHCH2CH3)、ヘキセニル、ペンテニルなどが含まれるが、ただしこれらに限定されない。
“C2−Cnアルキニル”(式中nは2から6であり得る)という用語は、2からn個の炭素原子及び少なくとも1つの三重結合有する不飽和分枝又は直鎖基を表す。そのような基の例には、1-プロピニル、2-プロピニル、1-ブチニル、2-ブチニル、1-ペンチニルなどが含まれるが、ただしこれらに限定されない。
本明細書で用いられる“ヘテロアリール”という用語は、1つ又は2つの芳香環を含み、かつ1つの芳香環内に少なくとも1つの窒素、酸素又は硫黄原子を含む、単環式又は二環式環系を指す。ヘテロアリール環のサイズ及び置換基又は連結基の存在は、存在する炭素数を指示することによって示される。例えば、“(C1-Cnアルキル)(C5-C6ヘテロアリール)”という用語は、1から“n”員のアルキル鎖を介して親部分に添付される5から6員のヘテロアリールを指す。
本明細書で用いられるように、“ハロ”という用語は、フッ素、塩素、臭素及びヨウ素から成る、当該基の1つ以上のメンバーを指す。
本明細書で用いられる“単離された”という用語は、その天然の環境から移動されてあることを意味する。いくつかの実施態様では、アナローグは組換え方法を介して作製され、該アナローグは宿主細胞から単離される。
本明細書で用いられる“精製される”という用語は、自然のままの又は天然の環境においてある分子又は化合物に通常付随する夾雑物を実質的に含まない形態で該分子又は化合物を単離することを包含し、本来の組成物の他の成分から分離された結果として純度が高められてあることを意味する。 “精製されたポリペプチド”という用語は、他の化合物(核酸分子、脂質及び炭水化物を含むが、ただしこれらに限定されない)から分離されてあるポリペプチドを指すために本明細書では用いられる。
本明細書で用いられる“荷電アミノ酸”又は“荷電残基”という用語は、生理学的pHの水溶液中で陰性に荷電する(すなわち脱プロトン化)又は陽性に荷電する(すなわちプロトン化)側鎖を含むアミノ酸を指す。例えば、陰性荷電アミノ酸には、アスパラギン酸、グルタミン酸、システイン酸、ホモシステイン酸、及びホモグルタミン酸が含まれ、一方、陽性荷電アミノ酸には、アルギニン、リジン、及びヒスチジンが含まれる。荷電アミノ酸には、ヒトタンパク質で一般的に見出される20アミノ酸中の荷電アミノ酸とともに、非定型的又は天然に存在しないアミノ酸が含まれる。
本明細書で用いられる“酸性アミノ酸”は、第二の酸性部分(アミノ酸のアルファカルボン酸以外、例えば側鎖のカルボン酸又はスルホン酸)を含むアミノ酸を指す。
本明細書で用いられる“ミニPEGリンカー”(更なる説明的言葉を含まない)という用語は、エチレングリコール(4−16エチレングリコールユニットを含む)の直鎖ポリマーであり、前記はポリペプチドを第二のポリマー(典型的には第二のポリペプチド)に連結する。場合によって、ミニPEGはアミノ酸を含むことができる。
インスリンアナローグは以下のように略称される:
インスリンA及びB鎖は、A鎖については大文字AでB鎖については大文字Bで示され、ここで、上付き数字0(例えばA0又はB0)は基本配列がインスリン配列であること(A鎖は配列番号:1、B鎖は配列番号:2)、上付き数字1(例えばA1又はB1)は基本配列がIGF-1配列であること(A鎖は配列番号:5、B鎖は配列番号:87)を示す。自然のままのインスリン配列及びIGF配列から外れる改変は、A又はB鎖の指定に続くカッコ内に示され(例えば[B1(H5,H10,Y16,L17):A1(H8,N18,N21)])、置換を示す一文字アミノ酸略称及びそれぞれA又はB鎖内の置換位置(自然のままのインスリン番号付けを用いる)が付随する。A鎖とB鎖の間のコロンは二鎖インスリンを示し、一方、ダッシュは共有結合(したがって単鎖アナローグ)を示す。単鎖アナローグでは、連結部分はA鎖とB鎖の間に含まれ、C1の表示は自然のままのIGF1 Cペプチド(配列番号:17)を指す。連結部分に関して“C8位”の表示は、配列番号:17の8番目のアミノ酸に対応する位置に存在するアミノ酸を指す。
実施態様
本明細書に開示されるものは、インスリン受容体アゴニスト活性を有するインスリンアナローグダイマーである。該ダイマーのインスリン活性のレベルは、ダイマー構造、並びに特にインスリンアナローグの配列、ダイマーリンカーの長さ、及び2つのインスリンポリペプチドをつなぐダイマー化の位置の関数である。本明細書に開示するインスリンダイマーは第一及び第二のインスリンポリペプチド間で形成され、各インスリンポリペプチドはA鎖及びB鎖を含む。第一及び第二のインスリンポリペプチドは、二鎖インスリンアナローグ(すなわち、前記ではA及びB鎖は内部システイン残基間の鎖間ジスルフィド結合だけで連結される)、及び単鎖インスリンアナローグ(すなわち、前記ではA及びB鎖は直線鎖として共有結合により互いに連結され、鎖間ジスルフィド結合もまた含まれる)から別個に選択することができ、第一及び第二のインスリンポリペプチドは互いに連結されて共有結合又は二官能性リンカーによりダイマーを形成する。ある実施態様にしたがえば、第一及び第二のインスリンポリペプチドは、
A)第一のインスリンポリペプチドのB鎖のN-末端アルファアミン又はN-末端アミノ酸側鎖を、
i)第二のインスリンポリペプチドのN-末端アルファアミン又はN-末端アミノ酸側鎖に、若しくは
ii)第二のインスリンポリペプチドが単鎖インスリンアナローグであるときは、前記B鎖を第二のインスリンポリペプチドのA鎖に継ぎ合わせる連結部分のアミノ酸の側鎖に、
B)第一のインスリンポリペプチドのB鎖のB29アミノ酸の側鎖を
i)第二のインスリンポリペプチドのB鎖のB29アミノ酸の側鎖に、若しくは
ii)前記B鎖を第二のインスリンポリペプチドのA鎖に継ぎ合わせる連結部分のアミノ酸の側鎖に、又は
C)第一のインスリンポリペプチドが単鎖インスリンアナローグであるときは、前記B鎖を第一のインスリンポリペプチドのA鎖に継ぎ合わせる第一の連結部分のアミノ酸の側鎖を、前記B鎖を第二のインスリンポリペプチドのA鎖に継ぎ合わせる第二の連結部分のアミノ酸の側鎖に継ぎ合わせて、ジスルフィド結合又は二官能性リンカーによって互いに連結される。ある実施態様では、ダイマー化リンカーが連結部分のアミノ酸の側鎖を介して第一及び第二のインスリンポリペプチドを継ぎ合わせるときは、連結は該連結部分のC8位のアミノ酸を介して生じる。
式中、X68は下記構造の側鎖を含むアミノ酸であり、
ある実施態様では、2つのインスリンポリペプチドを含む部分的アゴニスト/アンタゴニストインスリンアナローグが提供され、ここで、インスリンポリペプチドの少なくとも一方は単鎖インスリンであり、第一及び第二のインスリンポリペプチドは、該単鎖インスリンポリペプチドの連結ペプチド内に含まれるアミノ酸のアミノ酸側鎖、及び第二のインスリンポリペプチドのN-末端アルファアミン又はN-末端アミノ酸の側鎖を介して互いに連結される。ある実施態様にしたがえば、第一及び第二のインスリンポリペプチドは、ヒトインスリンのB鎖及びA鎖、又はそのアナローグ若しくは誘導体を含む。
さらに別の実施態様では、サブタイプBインスリン受容体(IR-B)に対して選択性を示すインスリンダイマーが提供される。出願人らは、インスリン系ポリペプチドとより高いIR-A/IR-B比を示す(すなわちIR-Bと対比してIR-Aにより高い親和性を示す)ペプチドとの間で形成されるヘテロダイマーは、IR-Aと比べてIR-Bでのより高レベルの最大受容体応答によって示されるようにIR-B活性化に優先性を示すことを発見した。ある実施態様では、サブタイプAインスリン受容体と比べてIR-B活性化に優先性を示すインスリンヘテロダイマーが提供される。
ある実施態様では、第一のインスリンポリペプチドは、GIVX4X5CCX8X9X10CX12LX14X15LEX18X19CX21-R13(配列番号:70)のA鎖アミノ酸配列及びX25LCGX29X30LVX33X34LYLVCGX41X42GFX45(配列番号:44)のB鎖アミノ酸配列を含み、さらに第二のポリペプチドは、GIVEECCFRSCDLALLETYCA(配列番号:7)、TPAX75SEGIVEECCFRSCDLALLETYCA(配列番号:88)又はGIVDECCFRSCDLRRLEMYCA(配列番号:5)のA鎖酸配列、AYRPSETLCGGELVDTLQFVCGDRGFYFSRPA(配列番号:87)又はGPETLCGAELVDALQFVCGDRGFYFNKPT(配列番号:10)のB鎖配列並びにPEG8-X68-PEG4及びGYGSSSRX68APQT(配列番号:9)から成る群から選択される配列を含む連結部分を含み、式中、X4はグルタミン酸又はアスパラギン酸であり、X5はグルタミン酸又はグルタミンであり、X8はスレオニン、ヒスチジン又はフェニルアラニンであり、X9はセリン、アルギニン、オルニチン又はアラニンあり、X10はセリン又はイソロイシンであり、X12はセリン又はアスパラギン酸であり、X14はアルギニン、チロシン、オルニチン又はアラニンであり、X15はグルタミン、アルギニン、アラニン、オルニチン又はロイシンであり、X18はメチオニン、アスパラギン又はスレオニンであり、X19はチロシン、4-メトキシ-フェニルアラニン又は4-アミノフェニルアラニンであり、X21はアラニン、グリシン又はアスパラギンであり、X25はヒスチジン又はスレオニンであり、X29アラニン、グリシン又はセリンであり、X30はヒスチジン、アスパラギン酸、グルタミン酸、ホモシステイン酸又はシステイン酸であり、X33はアスパラギン酸又はグルタミン酸であり、X34はアラニン又はスレオニンであり、X41はアスパラギン酸又はグルタミン酸であり、X42はアラニン、オルニチン又はアルギニンであり、X45はチロシン又はフェニルアラニンであり、R13はCOOH又はCONH2であり、X68はアルギニン、リジン又は下記構造Iの側鎖を含むアミノ酸であり:
ある実施態様にしたがえば、本明細書に開示する単鎖インスリンアナローグの連結部分は、IGF1 C鎖配列(GYGSSSRRAPQT;配列番号:24)又はその誘導体である。ある実施態様では、該誘導体は、リジン、システイン、オルニチン、ホモシステイン又はアセチル-フェニルアラニン残基による一アミノ酸置換だけ配列番号:24と相違するペプチドであり、さらに別の実施態様では、リジン、システイン、オルニチン、ホモシステイン又はアセチル-フェニルアラニンアミノ酸はPEG化されるか又は脂肪アシル化される。さらに別のある実施態様では、連結部分は一リジン置換だけ配列番号:24と相違するペプチドである。ある具体的な実施態様では、置換は配列番号:24の8位で実施される。
出願人らは、IGF1 C鎖配列及びそのアナローグの連結部分としての使用は、野生型に近いインスリン活性を有する単鎖インスリンアナローグを生じることを見出した。さらにまた、IGF1 C鎖配列の2位が改変されているか、又はカルボキシ末端の4アミノ酸がIGF1 C鎖配列から欠失しているIGF1 C鎖配列アナローグの連結部分としての使用は、インスリンに対して選択性を有する(すなわちIGF-1受容体と比較してインスリン受容体でより強い結合及び/又は活性を有する)単鎖インスリンポリペプチドを生成する。ある実施態様では、該単鎖インスリンポリペプチドは、IGF-1受容体と対比してインスリン受容体で5x、10x、20x、30x、40x又は50x高い親和性又は活性を有する。
ある実施態様では、連結部分は8から17アミノ酸配列であり、前記は、配列X51X52GSSSRR(配列番号:27)、配列番号:27のペプチド模倣体、又は配列番号:27の3−8位の1つにおける1、2又は3アミノ酸置換だけ配列番号:27と相違するアミノ酸配列から成り、式中、X51は、グリシン、アラニン、バリン、ロイシン、イソロイシン、プロリン及びメチオニンから成る群から選択され、X52は任意のアミノ酸である。ある実施態様では、連結部分は長さが8アミノ酸のペプチドであり、配列GYGSSSRR(配列番号:25)、又は一アミノ酸置換だけ配列番号:18と相違するアミノ酸配列、又は前記の誘導体を含む。
別の実施態様では、連結部分は8から17アミノ酸配列であり、前記は、配列GX52GSSSRR(配列番号:31)(式中X52は任意のアミノ酸)、配列番号:31のペプチド模倣体、又はそのアナローグを含み、前記アナローグは、配列番号:31の1、3、4、5、6、7又は8位のいずれかにおける一アミノ酸置換だけ配列番号:31と相違するが、ただし、連結ペプチドが8アミノ酸より長いときX52はチロシン以外であることを条件とする。ある実施態様にしたがえば、連結部分は8−17アミノ酸配列を含み、前記配列は、GYGSSSRR(配列番号:25)、GAGSSSRR(配列番号:27)、GAGSSSRRA(配列番号:28)、GAGSSSRRAP(配列番号:29)、GAGSSSRRAPQ(配列番号:30)、GAGSSSRRAPQT(配列番号:26)、PYGSSSRR(配列番号:31)、PAGSSSRR(配列番号:32)、PAGSSSRRA(配列番号:33)、PAGSSSRRAP(配列番号:34)、PAGSSSRRAPQ(配列番号:35)、PAGSSSRRAPQT(配列番号:36)から成る群から選択される。
ある実施態様では、本明細書に開示する単鎖インスリンポリペプチドの連結部分は相対的に短い二官能性非ペプチドポリマーリンカーであり、長さがほぼ8−16アミノ酸の配列である。ある実施態様にしたがえば、非ペプチド連結部分は、4から20、8から18、8から16、8から14、10から14、10から12又は11から13のモノマーである。ある実施態様では、自然のままのB鎖の最後の5カルボキシアミノ酸が欠失してB25アミノ酸が共有結合によって連結部分に直接連結される、単鎖インスリンアゴニストが提供される。連結部分の第二の末端はA鎖のA1アミノ酸と共有結合し、したがって連結部分を介してB及びA鎖を連結する。ある実施態様では、連結部分は、16を超えないが少なくとも10のモノマーユニットを含む直鎖ポリエチレングリコールの連結部分であり、別の実施態様では、ポリエチレングリコール連結部分は16を超えないが少なくとも12のモノマーユニットを含み、さらに別の実施態様では、ポリエチレングリコール連結部分は14を超えないが少なくとも10のモノマーユニットを含む。
ある実施態様にしたがえば、ポリエチレングリコール連結部分は下記構造を含み:
ある実施態様では、単鎖インスリンアゴニストが提供されここでは、自然のままのB鎖の最後の5カルボキシアミノ酸が欠失し、B25アミノ酸がA鎖のA1アミノ酸に連結部分を介して連結され、該連結部分は、16を超えないが少なくとも8モノマーユニットのポリエチレングリコール及び1から4アミノ酸のアミノ酸配列を含む。ある実施態様にしたがえば、連結部分は、1−4アミノ酸の配列及び前記1−4アミノ酸の配列に共有結合した長さが14未満少なくとも8モノマーユニットの直鎖ポリエチレングリコールを含むが、ただし該アミノ酸配列はYTPK(配列番号:37)又はFNKP(配列番号:38)ではないことを条件とする。別の実施態様では、単鎖インスリンアナローグが提供され、ここでは、自然のままのB鎖の最後の5カルボキシアミノ酸が欠失し、B25アミノ酸がA鎖のA1アミノ酸に連結部分を介して連結され、該連結部分は、長さが少なくとも8(ただし16未満)モノマーユニットのポリエチレングリコール及び2−5アミノ酸のアミノ酸配列を含む。該2−5アミノ酸の配列は、B鎖とポリエチレングリコール鎖との間、又はA鎖とポリエチレングリコール鎖との間に位置し得る。しかしながら、2−5アミノ酸配列がB鎖とポリエチレングリコール鎖との間に位置するときは、該アミノ酸配列はYTPKT(配列番号:39)でもFNKPT(配列番号:40)でもない。
式中、W2及びY2は、別個に下記一般構造のポリエチレングリコールであり:
本発明のインスリンポリペプチドは、ヒトインスリンの自然のままのB及びA鎖(それぞれ配列番号:1及び2)、又はその公知のアナローグ若しくは誘導体のいずれかを含み、それらは、ヘテロ二重体として互いに連結されたときインスリンアゴニスト活性を示す。そのようなアナローグは、当該インスリンアナローグのインスリン活性を破壊しない1つ以上のアミノ酸欠失、1つ以上のアミノ酸置換、1つ以上のアミノ酸の挿入を有することによって、ヒトインスリンのA鎖及びB鎖と相違するA鎖及びB鎖を有するタンパク質を含む。
インスリンアナローグの一タイプ、“モノマーインスリンアナローグ”は当業界では周知である。これらはヒトインスリンの急速作用性アナローグであり、例えば以下のようなインスリンアナローグが含まれる:
(a)B28位のアミノアシル残基はAsp、Lys、Leu、Val又はAlaにより置換され、さらにB29位のアミノアシル基はLys又はProである;
(b)B27、B28、B29及びB30位のいずれかのアミノアシル残基は欠失するか、又は自然のままのものではないアミノ酸により置換される。
ある実施態様では、B28位のAsp置換又はB28位のLys置換及びB29位のプロリン置換を含むインスリンアナローグが提供される。また別のモノマーインスリンアナローグが以下に開示されている:Chance, et al., U.S.Pat.No.5,514,646;Chance, et al., 米国特許出願Ser.No.08/255,297;Brems, et al., Protein Engineering, 5:527-533, 1992;Brange, et al.,欧州特許公開公報No.214,826(1987年3月18日公開);及び Brange, et al., Current Opinion in Structural Biology, 1:934-940, 1991。前記文献は、モノマーインスリンアナローグを説明するために、参照によりその全体が本明細書に組み入れられる。
本明細書で開示するように、B鎖のカルボキシ末端が連結部分を介してA鎖のアミノ末端に連結される、ヒトインスリンのB鎖及びA鎖又はそのアナローグ若しくは誘導体を含むインスリン単鎖アナローグが提供される。ある実施態様では、該A鎖は、GIVEQCCTSICSLYQLENYCN(配列番号:1)、GIVDECCFRSCDLRRLEMYCA(配列番号:5)又はGIVEECCFRSCDLALLETYCA(配列番号:7)から成る群から選択されるアミノ酸配列であり、B鎖は、FVNQHLCGSHLVEALYLVCGERGFFYTPKT(配列番号:2)、GPEHLCGAELVDALYLVCGDRGFY(配列番号:14)及びGPETLCGX26ELVDX27LYLVCGDX42GFYFNKPT-R14(配列番号:41)(式中X26及びX27は各々アラニンでありX42はアルギニンである)、又は前記のカルボキシ短縮配列(B26、B27、B28、B29及びB30に対応する1から5つのアミノ酸が欠失されている)、及び前記の配列のアナローグ(各配列は、A5、A8、A9、A10、 A14、A15、A17、A18、A21、B1、B2、B3、B4、B5、B9、B10、B13、B14、B20、B22、B23、B26、B27、B28、B29及びB30から選択される自然のままのインスリンの位置(図4の示すペプチドアラインメント参照)と対応する位置における1から5つのアミノ酸置換を含むように改変されている)から選択される配列を含む。ある実施態様では、該アミノ酸置換は保存的アミノ酸置換である。インスリンの所望の活性に有害な影響を与えないそれらの位置における適切なアミノ酸置換は当業者に公知であり、例えば以下の文献に示されている:Mayer, et al., Insulin Structure and Function, Biopolymers.2007;88(5):687-713(前記文献は参照によりその全体が本明細書に組み入れられる)。
追加のアミノ酸配列が、本発明のインスリンポリペプチドのB鎖のアミノ末端又はA鎖のカルボキシ末端に付加され得る。例えば、一連の陰性荷電アミノ酸をB鎖のアミノ末端に付加でき、前記には、長さが例えば1から12、1から10、1から8又は1から6アミノ酸が含まれ、1つ以上の陰性荷電アミノ酸(例えばグルタミン酸及びアスパラギン酸を含む)を含む。ある実施態様では、B鎖アミノ末端伸長部は1から6の荷電アミノ酸を含む。ある実施態様では、B鎖は、配列GEEEEEWFVNQHLCGSHLVEALYLVCGERGFFYTPR(配列番号:42)又はGEEEEEKGPEHLCGAHLVDALYLVCGDX42GFY(配列番号:43)(式中、X42はアラニン、リジン、オルニチン及びアルギニンから成る群から選択される)を含む。ある実施態様にしたがえば、開示のインスリンポリペプチドは、A鎖のC-末端カルボキシレートの代わりにC-末端アミド又はエステルを含む。
単鎖IGF又はインスリンA鎖及びB鎖へのさらに別の改変には、例えばA19、B16又はB25位の1つ以上におけるアミノ酸の4-アミノフェニルアラニンへの改変、又はA5、A8、A9、A10、 A14、A15、A17、A18、A21、B1、B2、B3、B4、B5、B9、B10、B13、B14、B20、B21、B22、B23、B26、B27、B28、B29及びB30(自然のままのインスリンのA及びB鎖と対比して)から選択される位置の1つ以上のアミノ酸の置換、又はB1−4及びB26−30位のいずれか又は全部の欠失が含まれる。ある実施態様では、A5、A8、A9、A10、 A14、A15、A17、A18、A21、B1、B2、B3、B4、B5、B9、B10、B13、B14、B20、B21、B22、B23、B26、B27、B28、B29及びB30から選択される位置における置換は、自然のままのインスリン配列と対比して保存的アミノ酸置換である。
X4はグルタミン酸又はアスパラギン酸であり、
X5はグルタミン又はグルタミン酸であり、
X8はヒスチジン、スレオニン又はフェニルアラニンであり、
X9はセリン、アルギニン、リジン、オルニチン又はアラニンあり、
X10はイソロイシン又はセリンであり、
X12はセリン又はアスパラギン酸であり、
X14はチロシン、アルギニン、リジン、オルニチン又はアラニンであり、
X15はグルタミン、グルタミン酸、アルギニン、アラニン、リジン、オルニチン又はロイシンであり、
X17はグルタミン酸、アスパラギン酸、アスパラギン、リジン、オルニチン又はグルタミンであり、
X18はメチオニン、アスパラギン、グルタミン、アスパラギン酸、グルタミン酸又はスレオニンであり、
X19はチロシン、4-メトキシ-フェニルアラニン又は4-アミノフェニルアラニンであり、
X21は、アラニン、グリシン、セリン、バリン、スレオニン、イソロイシン、ロイシン、グルタミン、グルタミン酸、アスパラギン、アスパラギン酸、ヒスチジン、トリプトファン、チロシン及びメチオニンから成る群から選択され、
X25はヒスチジン又はスレオニンであり、
X29アラニン、グリシン及びセリンから成る群から選択され、
X30はヒスチジン、アスパラギン酸、グルタミン酸、ホモシステイン酸又はシステイン酸から成る群から選択され、
X33はアスパラギン酸、グルタミン及びグルタミン酸から成る群から選択され、
X34はアラニン及びスレオニンから成る群から選択され、
X41はグルタミン酸、アスパラギン酸又はアスパラギンから成る群から選択され、
X42はアラニン、リジン、オルニチン及びアルギニンから成る群から選択され、
X45はチロシン又はフェニルアラニンであり、
R22は、AYRPSE(配列番号:46)、FVNQ(配列番号:47)、PGPE(配列番号:48)、トリペプチドのグリシン-プロリン-グルタミン酸、トリペプチドのバリン-アスパラギン-グルタミン、ジペプチドのプロリン-グルタミン酸、ジペプチドのアスパラギン-グルタミン、グルタミン、グルタミン酸、及びN-末端アルファアミンから成る群から選択され、さらに
R13はCOOH又はCONH2である。ある実施態様では、X8、X25及びX30は各々ヒスチジンである。さらに別の実施態様では、インスリンポリペプチドは、配列番号:68のA鎖ペプチド配列のアナローグ及び/又は配列番号:69のB鎖ペプチド配列のアナローグを含み、該A鎖及びB鎖のアナローグは各々1−3のさらに別のアミノ酸置換を含む。
X8はスレオニン及びヒスチジンから成る群から選択され、
X17はグルタミン酸又はグルタミンであり、
X19はチロシン、4-メトキシ-フェニルアラニン又は4-アミノフェニルアラニンであり、
X23はアスパラギン又はグリシンであり、
X25はヒスチジン又はスレオニンから成る群から選択され、
X29アラニン、グリシン及びセリンから成る群から選択され、
X30はヒスチジン、アスパラギン酸、グルタミン酸、ホモシステイン酸及びシステイン酸から成る群から選択される。
さらに別の実施態様では、B鎖は配列X22VNQX25LCGX29X30LVEALYLVCGERGFFYT-Z1-B1(配列番号:66)を含み、式中、
X22はフェニルアラニン及びデスアミノ-フェニルアラニンから成る群から選択され、
X25はヒスチジン及びスレオニンから成る群から選択され、
X29アラニン、グリシン及びセリンから成る群から選択され、
X30はヒスチジン、アスパラギン酸、グルタミン酸、ホモシステイン酸又はシステイン酸から成る群から選択され、
Z1は、アスパルテート-リジン、リジン-プロリン、及びプロリン-リジンから成る群から選択されるジペプチドであり、さらに
B1は、スレオニン、アラニン又はスレオニン-アルギニン-アルギニントリペプチドから成る群から選択される。
X4はグルタミン酸又はアスパラギン酸であり、
X8はヒスチジン、スレオニン又はフェニルアラニンであり、
X9はアルギニン、リジン、オルニチン又はアラニンあり、
X14はアルギニン、リジン、オルニチン又はアラニンであり、
X15はグルタミン、グルタミン酸、アルギニン、アラニン、リジン、オルニチン又はロイシンであり、
X17はグルタミン又はグルタミン酸であり、
X18はメチオニン、アスパラギン、グルタミン、アスパラギン酸、グルタミン酸又はスレオニンであり、
X19はチロシン、4-メトキシ-フェニルアラニン又は4-アミノフェニルアラニンであり、
X21は、アラニン、グリシン、セリン、バリン、スレオニン、イソロイシン、ロイシン、グルタミン、グルタミン酸、アスパラギン、アスパラギン酸、ヒスチジン、トリプトファン、チロシン及びメチオニンから成る群から選択され、
X22はフェニルアラニン及びデスアミノ-フェニルアラニンから成る群から選択され、
X25はヒスチジン又はスレオニンであり、
X29アラニン及びグリシンから成る群から選択され、
X30はヒスチジン、アスパラギン酸、グルタミン酸、ホモシステイン酸及びシステイン酸から成る群から選択され、
X33はアスパラギン酸、グルタミン及びグルタミン酸から成る群から選択され、
X34はアラニン及びスレオニンから成る群から選択され、
X41はグルタミン酸、アスパラギン酸又はアスパラギンから成る群から選択され、
X42はアラニン、リジン、オルニチン及びアルギニンから成る群から選択され、
X45はチロシン又はフェニルアラニンであり、
R22は、X22VNQ(配列番号:101)、トリペプチドのバリン-アスパラギン-グルタミン、ジペプチドのアスパラギン-グルタミン、グルタミン及び結合から成る群から選択され、
R23は、N-末端アルファアミン又はX60(X61X62)dX63K(配列番号:102)であり、式中、X60は、グリシン、グルタミン酸及びアスパラギン酸から成る群から選択され、X61及びX62は別個に、グルタミン酸及びアスパラギン酸から成る群から選択され、X63はアルギニン、アスパラギン酸及びグルタミン酸から成る群から選択され、dは1−3から選択される整数であり、R24は、AYRPSE(配列番号:46)、PGPE(配列番号:48)、トリペプチドのグリシン-プロリン-グルタミン酸、ジペプチドのプロリン-グルタミン酸、グルタミン、グルタミン酸及び結合から成る群から選択され、さらにR13はCOOH又はCONH2である。
X8はヒスチジン又はフェニルアラニンであり、
X9及びX14は別個に、アルギニン、リジン、オルニチン又はアラニンから選択され、
X15はアルギニン、リジン、オルニチン又はロイシンであり、
X17はグルタミン酸又はグルタミンであり、
X18はメチオニン、アスパラギン又はスレオニンであり、
X19はチロシン、4-メトキシ-フェニルアラニン又は4-アミノフェニルアラニンであり、
X21は、アラニン、グリシン又はアスパラギンであり、
X23はアスパラギン又はグリシンであり、
X25はヒスチジン及びスレオニンから成る群から選択され、
X29アラニン、グリシン及びセリンから成る群から選択され、
X30はヒスチジン、アスパラギン酸、グルタミン酸、ホモシステイン酸又はシステイン酸から成る群から選択され、
X33はアスパラギン酸及びグルタミン酸から成る群から選択され、
X34はアラニン及びスレオニンから成る群から選択され、
X42はアラニン、リジン、オルニチン及びアルギニンから成る群から選択され、
X45はチロシンであり、さらに
R13はCOOH又はCONH2である。ある実施態様では、n及びkの少なくとも一方は1である。
X9及びX14は別個に、アルギニン、リジン、オルニチン又はアラニンから選択され、
X15はアルギニン、リジン、オルニチン又はロイシンであり、
X17はグルタミン酸、アスパラギン酸、アスパラギン、リジン、オルニチン又はグルタミンであり、
X18はメチオニン、アスパラギン又はスレオニンであり、
X19はチロシン、4-メトキシ-フェニルアラニン又は4-アミノフェニルアラニンであり、
X21は、アラニン、グリシン又はアスパラギンであり、
X23はアスパラギン又はグリシンであり、
X25はヒスチジン及びスレオニンから成る群から選択され、
X29アラニン、グリシン及びセリンから成る群から選択され、
X30はヒスチジン、アスパラギン酸、グルタミン酸、ホモシステイン酸又はシステイン酸から成る群から選択され、
X33はアスパラギン酸及びグルタミン酸から成る群から選択され、
X34はアラニン及びスレオニンから成る群から選択され、
X42はアラニン、リジン、オルニチン及びアルギニンから成る群から選択され、
X45はチロシン又はフェニルアラニンであり、さらに
R13はCOOH又はCONH2である。
さらに別の実施態様では、A鎖は配列GIVDECCHX9SCDLX14X15LX17MX19CX21-R13(配列番号:52)を含み、B鎖は配列X25LCGAX30LVDALYLVCGDX42GFX45(配列番号:53)を含み、式中、
X9、X14及びX15は別個にオルニチン、リジン又はアルギニンであり、
X17はグルタミン酸又はグルタミンであり、
X19はチロシン、4-メトキシ-フェニルアラニン又は4-アミノフェニルアラニンであり、
X21は、アラニン、グリシン又はアスパラギンであり、
X25はヒスチジン及びスレオニンから成る群から選択され、
X30はヒスチジン、アスパラギン酸及びグルタミン酸から成る群から選択され、
X42はアラニン、リジン、オルニチン及びアルギニンから成る群から選択され、
X45はチロシン又はフェニルアラニンであり、さらに
R13はCOOH又はCONH2である。
ある実施態様では、B鎖は、HLCGAELVDALYLVCGDX42GFY(配列番号:54)、GPEHLCGAELVDALYLVCGDX42GFY(配列番号:55)、GPEHLCGAELVDALYLVCGDX42GFYFNPKT(配列番号:57)及びGPEHLCGAELVDALYLVCGDX42GFYFNKPT(配列番号:57)から成る群から選択され、式中、X42はオルニチン、リジン及びアルギニンから成る群から選択される。
さらに別の実施態様では、A鎖は配列GIVDECCHX9SCDLX14X15LQMYCN-R13(配列番号:18)を含み、式中X9、X14及びX15は別個にオルニチン、リジン又はアルギニンである。
ある実施態様では、B鎖は、HLCGAELVDALYLVCGDOGFY(配列番号:60)、GPEHLCGAELVDALYLVCGDOGFY(配列番号:61)、GPEHLCGAELVDALYLVCGDOGFYFNPKT(配列番号:62)及びGPEHLCGAELVDALYLVCGDOGFYFNKPT(配列番号:63)から成る群から選択され、A鎖はGIVDECCHOSCDLOOLQMX19CN-R13(配列番号:64)であり、式中、X19はチロシン、4-メトキシ-フェニルアラニン又は4-アミノフェニルアラニンである。
驚くべきことに、出願人らは、親水性部分を本明細書に開示するインスリン単鎖アナローグに共有結合により連結することによって、活性のより遅い開始、持続時間の延長を有しさらに基本的活性プロフィールを示すアナローグが提供されることを見出した。ある実施態様では、本明細書に開示するインスリンポリペプチドはさらに改変されて共有結合により連結された親水性部分を含み、前記親水性部分は、A鎖のA9、A14及びA15から成る群から選択される位置のアミノ酸の側鎖、又はB鎖のN-末端アルファアミン(例えばインスリン系B鎖のためのB1位又はIGF-1系B鎖のためのB2位)、又はB鎖のB1、B2、B10、B22、B28若しくはB29位のアミノ酸の側鎖、又は単鎖アナローグのA鎖及びB鎖を連結する連結部分の任意の位置に連結される。例示的実施態様では、この親水性部分は、これらの位置のいずれかのLys、Cys、Orn、ホモシステイン又はアセチル-フェニルアラニン残基に共有結合により連結される。ある実施態様では、親水性部分は連結部分のアミノ酸の側鎖に共有結合により連結される。
ある実施態様では、親水性部分としてデキストランが用いられる。デキストランは、もっぱらα1-6結合によって連結されたグルコースサブユニットの多糖類ポリマーである。デキストランは、多くの分子量範囲(例えば約1kDから約100kD、又は約5、10、15若しくは20kDから約20、30、40、50、60、70、80若しくは90kD)で入手できる。
直鎖又は分枝ポリマーが意図される。複合物の生成調製物は本質的に単分散又は多分散が可能で、ペプチド当たり約0.5、0.7、1、1,2、1.5又は2ポリマーを有し得る。
本発明の具体的な特徴では、チオールを有するインスリンポリペプチドのアミノ酸残基が親水性部分(例えばPEG)により改変される。いくつかの実施態様では、チオールはミカエル添加反応でマレイミド活性化PEGにより改変されて、下記に示すチオエーテル結合を含むPEG化ペプチドを生じる:
いくつかの実施態様では、インスリンポリペプチドは改変されてアシル基を含む。アシル基は、インスリンポリペプチドのアミノ酸に直接的に、又はインスリンポリペプチドのアミノ酸にスペーサーを介して間接的に共有結合により連結でき、該スペーサーはインスリンポリペプチドのアミノ酸とアシル基との間に存在する。インスリンポリペプチドは、親水性部分が連結される同じアミノ酸の位置で、又は異なるアミノ酸の位置でアシル化できる。例えば、アシル化は、A又はB鎖の任意のアミノ酸を含む任意の位置とともに連結部分内の位置でも生じ得るが、ただし非アシル化インスリンポリペプチドによって示される活性がアシル化時に維持されることを条件とする。非限定例には、A鎖のA14及びA15位、インスリン系B鎖のB1位、又はIGF-1系B鎖のB2位、B鎖のB10、B22、B28若しくはB29位、又は単鎖インスリンアナローグの連結部分の任意の位置におけるアシル化が含まれる。
[式I]
いくつかの例示的な実施態様では、式Iのアミノ酸は、nが4(Lys)又はnが3(Orn)のアミノ酸である。
別の実施態様では、インスリンポリペプチドは下記式IIのアミノ酸を含み:
[式II]
いくつかの例示的な実施態様では、式IIのアミノ酸は、nが1(Ser)のアミノ酸である。
さらに別の実施態様では、インスリンポリペプチドは下記式IIIのアミノ酸の側鎖チオールを含み:
[式III]
いくつかの例示的な実施態様では、式IIIのアミノ酸は、nが1(Cys)のアミノ酸である。
ある実施態様にしたがえば、アシル化インスリンポリペプチドは当該ペプチドとアシル基との間にスペーサーを含む。いくつかの実施態様では、インスリンポリペプチドはスペーサーと共有結合し、スペーサーはアシル基と共有結合する。いくつかの例示的実施態様では、インスリンポリペプチドは改変され、スペーサーのアミン、ヒドロキシル又はチオールのアシル化によってアシル基を含み、前記スペーサーは、B28又はB29位(自然のままのインスリンA及びB鎖配列のアミノ酸番号付けにしたがう)又はスペーサー部分の任意の位置のアミノ酸の側鎖に添付される。スペーサーが添付されるインスリンポリペプチドのアミノ酸は、スペーサーとの結合を許容する部分を含む任意のアミノ酸であり得る。例えば、側鎖-NH2、-OH又は-COOHを含むアミノ酸(例えばLys、Orn、Ser、Asp又はGlu)が適切である。
ある種の実施態様では、インスリンポリペプチドに添付されるスペーサーによる長鎖アルカンのアシル化によってアシル基を含むように、インスリンポリペプチドは改変される。具体的な特徴では、長鎖アルカンは、スペーサーのカルボキシル基又はその活性化型と反応するアミン、ヒドロキシル又はチオール基を含む。カルボキシル基又はその活性化型を含む適切なスペーサーは本明細書に記載され、前記には、例えば二官能性スペーサー、例えばアミノ酸、ジペプチド、トリペプチド、親水性二官能性スペーサー及び疎水性二官能性スペーサーが含まれる。本明細書で用いられるように、“カルボキシル基の活性化型”という用語は、一般式R(C=O)Xを有するカルボキシル基を指す(式中、Xは脱離基であり、Rはインスリンポリペプチド又はスペーサーである)。例えば、カルボキシル基の活性化型には、アシルクロリド、無水物及びエステルが含まれるが、ただしこれらに限定されない。いくつかの実施態様では、活性化カルボキシル基はN-ヒドロキシスクシンイミド(NHS)脱離基を有するエステルである。
いくつかの実施態様では、インスリンポリペプチドのアミン、ヒドロキシル又はチオール基はコレステロール酸でアシル化される。具体的な実施態様では、ペプチドは、アルキル化デスアミノCysスペーサー(すなわちアルキル化3-メルカプトプロピオン酸スペーサー)を介してコレステロール酸に連結される。アミン、ヒドロキシル及びチオールを介するペプチドアシル化の適切な方法は当業界で公知である。例えば以下を参照されたい:Miller, Biochem Biophys Res Commun 218: 377-382, 1996;Shimohigashi and Stammer, Int J Pept Protein Res 19: 54-62, 1982;及びPreviero et al., Biochim Biophys Acta 263: 7-13, 1972(ヒドロキシル介するアシル化の方法);並びにSan and Silvius, J Pept Res 66: 169-180, 2005(チオールを介するアシル化の方法);Bioconjugate Chem.“Chemical Modifications of Proteins: History and Applications”pp.2-12, 1990;Hashimoto et al., Pharmacuetical Res.“Synthesis of Palmitoyl Derivatives of Insulin and their Biological Activity”Vol.6, No:2 pp.171-176, 1989。
また別の実施態様では、アシル基は胆汁酸である。該胆汁酸は任意の適切な胆汁酸でよい。前記にはコール酸、ケノデオキシコール酸、デオキシコール酸、リトコール酸、タウロコール酸、グリココール酸及びコレステロール酸が含まれるが、ただしこれらに限定されない。
本明細書に記載するアシル化インスリンポリペプチドはさらに改変され親水性部分を含むことができる。いくつかの具体的な実施態様では、親水性部分は、ポリエチレングリコール(PEG)鎖を含むことができる。親水性部分の取り込みは、任意の適切な手段(例えば本明細書に記載する方法のいずれか)によって達成できる。いくつかの実施態様では、アシル化単鎖アナローグはCys、Lys、Orn、ホモ-Cys又はAc-Pheから成る群から選択されるアミノ酸を含み、前記アミノ酸の側鎖が親水性部分(例えばPEG)と共有結合される。ある実施態様では、アシル基は、A14、A15、B1位(インスリン系B鎖のため)、B2位(IGF-1系B鎖のため)、B10、B22、B28又はB29(自然のままのインスリンのA及びB鎖の番号付けにしたがう)に、場合によってCys、Lys、Orn、ホモ-Cys又はAc-Pheを含むスペーサーを介して添付される。
また別には、アシル化インスリンポリペプチドは、アシル化されかつ親水性部分を含むように改変されたスペーサーを含む。適切なスペーサーの非限定的な例には、Cys、Lys、Orn、ホモ-Cys及びAc-Pheから成る群から選択される1つ以上のアミノ酸を含むスペーサーが含まれる。
いくつかの実施態様では、インスリンポリペプチドは改変されてアルキル基を含む。アルキル基は、インスリンポリペプチドのアミノ酸に直接的に、又はインスリンポリペプチドのアミノ酸にスペーサーを介して間接的に共有結合により連結でき、該スペーサーはインスリンポリペプチドのアミノ酸とアルキル基との間に存在する。アルキル基は、エーテル、チオエーテル又はアミノ結合を介してインスリンポリペプチドに添付できる。例えば、インスリンポリペプチドは、親水性部分が連結される同じアミノ酸の位置で、又は異なるアミノ酸の位置でアルキル化できる。アルキル化はインスリンポリペプチド内の任意の位置で実施でき、前記には例えばB鎖のC-末端領域又は連結部分内の位置が含まれるが、ただしインスリン活性が維持されることを条件とする。本発明の具体的な特徴では、インスリンポリペプチドは、当該ポリペプチドのアミノ酸の側鎖のアミン、ヒドロキシル又はチオールの直接アルキル化によりアルキル基を含むように改変される。いくつかの実施態様では、インスリンポリペプチドは、アミノ酸の側鎖アミン、ヒドロキシル又はチオールを介して直接的にアルキル化される。本発明のいくつかの具体的な実施態様では、インスリンポリペプチドの直接アルキル化は、A14、A15、B1位(インスリン系B鎖のため)、B2位(IGF-1系B鎖のため)、B10、B22、B28又はB29位(自然のままのインスリンのA及びB鎖の番号付けにしたがう)のアミノ酸の側鎖アミン、ヒドロキシル又はチオールを介して生じる。
いくつかの例示的実施態様では、インスリンポリペプチドは改変され、スペーサーのアミン、ヒドロキシル又はチオールのアルキル化によってアルキル基を含み、前記スペーサーは、A14、A15、B1位(インスリン系B鎖のため)、B2位(IGF-1系B鎖のため)、B10、B22、B28又はB29位(自然のままのインスリンのA及びB鎖の番号付けにしたがう)のアミノ酸の側鎖に添付される。スペーサーが添付されるインスリンポリペプチドのアミノ酸は、スペーサーとの結合を許容する部分を含む任意のアミノ酸(例えば一α-置換アミノ酸又はα,α-二置換アミノ酸)であり得る。側鎖-NH2、-OH又は-COOHを含むインスリンポリペプチドのアミノ酸(例えばLys、Orn、Ser、Asp又はGlu)が適切である。いくつかの実施態様では、インスリンポリペプチドのペプチドとアルキル基との間のスペーサーは、側鎖アミン、ヒドロキシル若しくはチオールを含むアミノ酸、又は側鎖アミン、ヒドロキシル若しくはチオールを含むアミノ酸を含むジペプチド又はトリペプチドである。
アルキル化がスペーサーのアミノ酸のヒドロキシル基を介して生じるとき、スペーサーのアミノ酸又はスペーサーの複数のアミノ酸の1つは式IIのアミノ酸であり得る。具体的な例示的実施態様では、アミノ酸はSerである。アルキル化がスペーサーのアミノ酸のチオール基を介して生じるとき、スペーサーのアミノ酸又はスペーサーの複数のアミノ酸の1つは式IIIのアミノ酸であり得る。具体的な例示的実施態様では、アミノ酸はCysである。
いくつかの実施態様では、インスリンポリペプチドとアシル基との間のスペーサーは疎水性二官能性スペーサーである。ある種の実施態様では、疎水性二官能性スペーサーは、2つ以上の反応基(例えばアミン、ヒドロキシル、チオール及びカルボキシル基又は前記の任意の組み合わせ)を含む。ある種の実施態様では、疎水性二官能性スペーサーはヒドロキシル基及びカルボキシレートを含む。他の実施態様では、疎水性二官能性スペーサーはアミン基及びカルボキシレートを含む。他の実施態様では、疎水性二官能性スペーサーはチオール基及びカルボキシレートを含む。カルボキシレート及びヒドロキシル基又はチオール基を含む適切な疎水性二官能性スペーサーは当業界で公知であり、例えば8-ヒドロキシオクタン酸及び8-メルカプトオクタン酸が含まれる。
ある実施態様にしたがえば、二官能性スペーサーは合成又は天然に存在するアミノ酸であり、長さが3から10原子のアミノ酸骨格を含む(例えば6-アミノヘキサン酸、5-アミノ吉草酸、7-アミノヘプタン酸及び8-アミノオクタン酸)。また別には、スペーサーは、長さが3から10原子(例えば6から10原子)のペプチド骨格を有するジペプチド又はトリペプチドであり得る。インスリンポリペプチドに添付されるジペプチド又はトリペプチドは、天然に存在するアミノ酸及び/又は天然に存在しないアミノ酸を含むことができ、前記には例えば本明細書に教示するアミノ酸のいずれかが含まれる。いくつかの実施態様では、スペーサーは全体的に陰性荷電を含み、例えば1つ以上の陰性荷電アミノ酸を含む。いくつかの実施態様では、ジペプチドスペーサーは、Ala-Ala、β-Ala- β-Ala、Leu-Leu、Pro-Pro、γアミノ酪酸-γ-アミノ酪酸、及びγ-Glu-γ-Gluから成る群から選択される。ある実施態様では、ジペプチドスペーサーはγ-Glu-γ-Gluである。
いくつかの具体的な実施態様では、アルキル基は、胆汁酸のステロイド部分、例えばコール酸、ケノデオキシコール酸、デオキシコール酸、リトコール酸、タウロコール酸、グリココール酸及びコレステロール酸を含む。
ある種の実施態様では、インスリンポリペプチドは、求核性長鎖アルカンをインスリンポリペプチドに添付されたスペーサーと反応させることによってアルキル基を含むように改変され、ここでスペーサーは脱離基を含む。具体的な特徴では、長鎖アルカンはアミン、ヒドロキシル又はチオール基を含む。ある種の実施態様では、脱離基を含むスペーサーは本明細書で考察される任意のスペーサー、例えばアミノ酸、ジペプチド、トリペプチド、親水性二官能性スペーサー及び疎水性二官能性スペーサーであってさらに適切な脱離基を含む。
長鎖アルカンがインスリンポリペプチド又はスペーサーによってアルキル化されるとき、該長鎖アルカンは任意のサイズであり、任意の長さの炭素鎖を含むことができる。長鎖アルカンは直鎖又は分枝鎖であり得る。ある種の特徴では、長鎖アルカンはC4からC30アルカンである。例えば長鎖アルカンは、C4アルカン、C6アルカン、C8アルカン、C10アルカン、C12アルカン、C14アルカン、C16アルカン、C18アルカン、C20アルカン、C22アルカン、C24アルカン、C26アルカン、C28アルカン又はC30アルカンのいずれかであり得る。いくつかの実施態様では、長鎖アルカンはC8からC20アルカン、例えばC14アルカン、C16アルカン又はC18アルカンを含む。
いくつかの実施態様では、本明細書に記載するインスリンポリペプチドはグリコシル化され、アミド化され、カルボキシル化され、リン酸化され、エステル化され、N-アセチル化され、環化され(例えばジスルフィド架橋による)、又は塩(例えば酸付加塩、塩基付加塩)に変換され、及び/又は場合によって複合物化される。本開示はまた、インスリンポリペプチドが異種部分と連結されている複合物を包含する。インスリンポリペプチドと異種部分との複合物化は、共有結合、非共有結合(例えば静電気的相互作用、水素結合、ファンデルワールス相互作用、塩架橋、疎水性相互作用など)、又は両結合タイプにより生じ得る。多様な非共有結合的結合系を用いることができ、前記には以下が含まれる:ビオチン-アビジン、リガンド/受容体、酵素/基質、核酸/核酸結合タンパク質、脂質/脂質結合タンパク質、細胞接着分子パートナー、又は互いに親和性を有する任意の結合パートナー若しくはそのフラグメント。いくつかの特徴では、共有結合はペプチド結合である。インスリンポリペプチドと異種部分との複合物化は間接的又は直接的複合物化が可能であり、前者はリンカー又はスペーサーを伴うことができる。適切なリンカー及びスペーサーは当業界では公知であり、記載されている任意のリンカー又はスペーサーが含まれる(ただしこれらに限定されない)。
いくつかの実施態様では、インスリンポリペプチドと複合物化される異種部分はポリマーである。いくつかの実施態様では、ポリマーは以下から成る群から選択される:ポリアミド、ポリカルボネート、ポリアルキレン及びその誘導体(ポリアルキレングリコール、ポリアルキレンオキシド、ポリアルキレンテレフタレートを含む)、アクリル及びメタクリルエステルのポリマー(ポリ(メチルメタクリレート)、ポリ(エチルメタクリレート)、ポリ(ブチルメタクリレート)、ポリ(イソブチルメタクリレート)、ポリ(ヘキシルメタクリレート)、ポリ(イソデシルメタクリレート)、ポリ(ラウリルメタクリレート)、ポリ(フェニルメタクリレート)、ポリ(メチルアクリレート)、ポリ(イソプロピルアクリレート)、ポリ(イソブチルアクリレート)及びポリ(オクタデシルアクリレート)を含む)、ポリビニルポリマー(ポリビニルアルコール、ポリビニルエーテル、ポリビニルエステル、ポリビニルハライド、ポリ(ビニルアセテート)及びポリビニルピロリドンを含む)、ポリグリコリド、ポリシロキサン、ポリウレタン及びそのコポリマー、セルロース(アルキルセルロース、ヒドロキシアルキルセルロース、セルロースエーテル、セルロースエステル、ニトロセルロース、メチルセルロース、エチルセルロース、ヒドロキシプロピルセルロース、ヒドロキシ-プロピルメチルセルロース、ヒドロキシブチルメチルセルロース、セルロースアセテート、セルロースプロピオネート、セルロースアセテートブチレート、セルロースアセテートフタレート、カルボキシエチルセルロース、セルローストリアセテート、セルローススルフェートナトリウム塩を含む)ポリプロピレン、ポリエチレン(ポリ(エチレングリコール)、ポリ(エチレンオキシド)、及びポリ(エチレンテレフタレート)を含む)並びにポリスチレン。
いくつかの特徴では、ポリマーは、生物接着性ポリマー、例えば生物腐食性ヒドロゲル(下記文献に記載されている:H.S.Sawhney, C.P.Pathak and J.A.Hubbell in Macromolecules, 1993, 26, 581-587(前記文献の教示は本明細書に含まれる))、ポリヒアルロン酸、カゼイン、ゼラチン、グルチン、ポリ酸無水物、ポリアクリル酸、アルギネート、キトサン、ポリ(メチルメタクリレート)、ポリ(エチルメタクリレート)、ポリ(ブチルメタクリレート)、ポリ(イソブチルメタクリレート)、ポリ(ヘキシルメタクリレート)、ポリ(イソデシルメタクリレート)、ポリ(ラウリルメタクリレート)、ポリ(フェニルメタクリレート)、ポリ(メチルアクリレート)、ポリ(イソプロピルアクリレート)、ポリ(イソブチルアクリレート)及びポリ(オクタデシルアクリレート)である。
いくつかの実施態様では、異種部分は脂質である。脂質は、いくつかの実施態様では、脂肪酸、エイコサノイド、プロスタグランジン、ロイコトリエン、トロンボキサン、N-アシルエタノールアミン、グリセロリピド(例えば、一、二、三置換グリセロール)、グリセロホスホリピド(例えば、ホスファチジルコリン、ホスファチジルイノシトール、ホスファチジルエタノールアミン、ホスファチジルセリン)、スフィンゴリピド(例えばスフィンゴシン、セラミド)、ステロールリピド(例えば、ステロイド、コレステロール)、プレノールリピド、サッカロリピド、又はポリケチド、油、ロウ、コレステロール、ステロール、脂溶性ビタミン、モノグリセリド、ジグリセリド、トリグリセリド、リン脂質である。
また別には、インスリンポリペプチドはデポー型に改変でき、したがって本開示の複合物が投与された体内に前記複合物が放出される態様を時間及び体内の位置について制御することができる(例えば米国特許4,450,150号を参照されたい)。本開示の複合物のデポー型は、例えば本開示の複合物及び多孔性又は無孔性物質(例えばポリマー)を含む移植可能な組成物であり、ここで、本開示の複合物は、該物質によって被包化されるか若しくは当該物質全体に拡散されるか、及び/又は該無孔物質の分解によって拡散される。該デポーは体内の所望の位置に移植され、本開示の複合物は該移植物から予め定められた速度で放出される。
また別には、大きなデポーポリマーを、本明細書に記載のインスリンポリペプチドに共有結合させた自己切断ジペプチド成分に連結することができる。この実施態様では、該デポーポリマーは、その後で当該インスリンポリペプチドが非酵素反応を介して予め定めた速度で該単鎖アナローグから切断されるまで該インスリンポリペプチドをその投与部位に効果的に隔離する。自己切断ジペプチドを用いるインスリンアナローグのデポー処方物はPCT/US2009/068713に記載されている(前記文献の開示は参照により本明細書に含まれる)。ある実施態様では、ジペプチドプロドラッグ成分を含むインスリンアナローグが提供され、ここで、該ジペプチドプロドラッグ成分は大きなポリマー(例えばPEG又はデキストラン)に連結されるか、又はC18-C25炭化水素でアシル化される。ある実施態様では、大きなデポーポリマー(例えばPEGを含む)を含む自己切断ジペプチド成分は、インスリン単鎖アナローグの連結部分のアミノ酸(例えば連結部分のC8位のアミノ酸を含む)の側鎖に連結される。
本開示はまた、本明細書に開示するインスリンポリペプチドのプロドラッグアナローグを包含する。有利には、プロドラッグ処方物は、基礎ペプチドの治療インデックスを改善し、作用の開始を遅らせ、当該インスリンポリペプチドの半減期を高める。本開示のプロドラッグの化学反応は活性部位アミンとの化学的複合物化を生じてアミドを形成し、前記アミドは、ジケトピペラジン形成及びプロドラッグ成分の放出に際して親アミンに復帰することができる(国際特許出願PCT/US2009/068713を参照されたい(前記文献の開示は参照により本明細書に含まれる))。この新規な生物学的に好ましいプロドラッグ化学反応は、生理学的条件(例えば水性環境のpH約7、37℃)下で偶発的分解をもたらし、酵素分解に依存しない。プロドラッグアナローグの持続時間はジペプチドプロドラッグ配列の選択によって決定され、したがってプロドラッグ処方の融通性を高める。
ある実施態様では、非酵素性活性化の半減期(t1/2)が生理学的条件下で1から100時間であるプロドラッグが提供される。本明細書に開示の生理学的条件は、水性環境で約35から40℃の温度及び約7.0から約7.4のpHを含み、より典型的にはpH7.2から7.4及び36から38℃の温度を含むことが意図される。ある実施態様では、ジペプチド(生理学的条件下でジケトピペラジン形成を経ることができる)は、アミド又はエステル結合を介してインスリンポリペプチドと共有結合により連結される(国際出願WO2009/099763及びPCT/US2009/068713を参照されたい(前記文献の開示は参照により本明細書に含まれる))。
有利には、切断(したがってプロドラッグの活性化)の速度は、ジペプチド前駆部分の構造及び立体化学とともに求核強度に左右される。本明細書に開示するプロドラッグは、最終的にはインスリン/IGF受容体によって認識され得る構造に化学的に変換され、この化学的変換速度は、in vivoの生物学的作用の開始時間及び持続時間を決定するであろう。本出願に開示するプロドラッグの化学反応は、付け加えられる化学的添加剤又は酵素に左右されない分子内化学反応を必要とするであろう。変換速度は、ジペプチド置換基の化学的性質及び生理学的条件下での前記の切断によって制御される。生理学的なpH及び温度は高度に規定された範囲内で厳密に調節されるので、プロドラッグから薬剤への変換速度は高い患者内及び患者間再現性を示すであろう。
R3は、C1-C18アルキル、(C1-C18アルキル)OH、(C1-C18アルキル)NH2、(C1-C18アルキル)SH、(C0-C4アルキル)(C3-C6)シクロアルキル、(C0-C4アルキル)(C2-C5複素環)、(C0-C4 アルキル)(C6-C10アリール)R7、及び(C1-C4アルキル)(C3-C9ヘテロアリール)から成る群から選択されるか、又はR4及びR3は、それらが結合する原子と一緒になって4、5又は6員複素環式環を形成し;
R5はNHR6又はOHであり;
R6はH、C1-C8アルキルであるか、又はR6及びR2は、それらが添付される原子と一緒になって4、5又は6員複素環式環を形成し;さらに
R7はH及びOHから成る群から選択される。ある実施態様では、プロドラッグ成分がインスリンポリペプチドのN-末端アルファアミンに連結され、さらにR4及びR3が、それらが添付される原子と一緒になって4、5又は6員複素環式環を形成するとき、R1及びR2の少なくとも1つはH以外である。
X8は、スレオニン及びヒスチジンから成る群から選択され;
X17は、グルタミン酸又はグルタミンであり;
X19は、下記一般構造のアミノ酸であり(式中、XはOH又はNHR10(R10は、H又は一般構造U-B(Uはアミノ酸又はヒドロキシル酸で、BはN-アルキル化アミノ酸である)を含むジペプチド成分である)から成る群から選択される);
X25は、ヒスチジン及びスレオニンから成る群から選択され;
X29は、アラニン、グリシン及びセリンから成る群から選択され;
X30は、ヒスチジン、アスパラギン酸、グルタミン酸、ホモシステイン酸及びシステイン酸から成る群から選択され;
R22は、FVNQ(配列番号:47)、トリペプチドのバリン-アスパラギン-グルタミン、ジペプチドのアスパラギン-グルタミン、グルタミン、グルタミン酸及びN-末端アルファアミンから成る群から選択され;さらに
R23は、結合又は1から6つの荷電アミノ酸を含むアミノ配列である。
X22は、フェニルアラニン及びデスアミノ-フェニルアラニンから成る群から選択され;
X25は、ヒスチジン及びスレオニンから成る群から選択され;
X29は、アラニン、グリシン及びセリンから成る群から選択され;
X30は、ヒスチジン、アスパラギン酸、グルタミン酸、ホモシステイン酸及びシステイン酸から成る群から選択され;
Z1は、アスパルテート-リジン、リジン-プロリン及びプロリン-リジンから成る群から選択されるジペプチドであり;さらに
B1は、スレオニン、アラニン又はスレオニン-アルギニン-アルギニントリペプチドから成る群から選択される。
ある実施態様にしたがえば、構造:IB-LM-IAを含むインスリンポリペプチドが提供され、式中、IBは配列X25LCGX29X30LVEALYLVCG ERGFF(配列番号:65)を含み、LMはIBをIAに共有結合により連結する本明細書に開示の連結部分であり、IAは配列GIVEQCCX8SICSLYQLENX19CX21(配列番号:55)を含み、ここで、配列番号:65のC-末端フェニルアラニン残基は、介在アミノ酸を全く存在させることなく連結部分LMに直接共有結合される。
Jは、H又はU-Bの一般構造(Uはアミノ酸又はヒドロキシル酸であり、Bはアミド結合により連結されるN-アルキル化アミノ酸である)を含むジペプチド成分であり;
X4は、アスパラギン酸又はグルタミン酸であり;
X8は、ヒスチジン又はフェニルアラニンであり;
X9及びX14は、別個にアルギニン、オルニチン、リジン又はアラニンから選択され;
X15は、アルギニン、リジン、オルニチン又はロイシンであり;
X17は、グルタミン酸又はグルタミンであり;
X18は、メチオニン、アスパラギン又はスレオニンであり;
X19はチロシンであり;
X21は、アラニン、グリシン又はアスパラギンであり;
R22は、共有結合、AYRPSE(配列番号:46)、グリシン-プロリン-グルタミン酸トリペプチド、プロリン-グルタミン酸ジペプチド及びグルタミン酸から成る群から選択され;
R23は、結合又は1から6つの荷電アミノ酸を含むアミノ酸配列であり;
X25は、ヒスチジン及びスレオニンから成る群から選択され;
X29は、アラニン、グリシン及びセリンから成る群から選択され;
X30は、ヒスチジン、アスパラギン酸、グルタミン酸、ホモシステイン酸及びシステイン酸から成る群から選択され;
X33は、アスパラギン酸及びグルタミン酸から成る群から選択され;
X34は、アラニン及びスレオニンから成る群から選択され;
X42は、アラニン、リジン、オルニチン及びアルギニンから成る群から選択され;
X45はチロシンであり;さらに
R13は、COOH又はCONH2である。
ジペプチドプロドラッグ成分の置換基及びインスリンポリペプチドへのその添付部位を選択して、本明細書に開示するインスリンポリペプチドのプロドラッグアナローグについて所望の半減期を提供できる。例えば、下記構造を含むジペプチドプロドラッグ成分がインスリンポリペプチドB鎖のN-末端アミノ酸のアルファアミノ基に連結されるとき、
R1及びR2は別個にC1-C18アルキル又はアリールであるか、又はR1及びR2は-(CH2)p(式中pは2−9である) により連結され;
R3はC1-C18アルキルであり;
R4及びR8は各々水素であり;さらに
R5はアミンである。
他の実施態様では、N-末端で連結され、さらに約1時間のt1/2を有するプロドラッグは、下記構造を有するジペプチドプロドラッグ成分を含む:
R3はC1-C18アルキルであり;
R4及びR8は各々水素であり;
R5はNH2であり;
R7は、水素、C1-C18アルキル、C2-C18 アルケニル、(C0-C4アルキル)CONH2、(C0-C4アルキル)COOH、(C0-C4アルキル)NH2、(C0-C4アルキル)OH及びハロから成る群から選択され;さらに
R8はHである。
また別にある実施態様では、インスリンポリペプチドプロドラッグ誘導体が提供され、ここで該ジペプチドプロドラッグは、インスリンポリペプチドB鎖のN-末端アミノ酸のアルファアミノ基に連結され、さらに該プロドラッグは生理学的条件下のPBS中で約6から約24時間のt1/2を有する。ある実施態様では、生理学的条件下のPBS中で約6から約24時間のt1/2を有するインスリンポリペプチドプロドラッグ誘導体が提供され、ここで該プロドラッグ成分は式Xの構造を有し、さらに
R1及びR2は、別個に水素、C1-C18アルキル及びアリールから成る群から選択されるか、又はR1及びR2は-(CH2)p-(式中pは2−9である) により連結され;
R3はC1-C18アルキルであるか、又はR3及びR4はそれらが添付される原子と一緒になって4−12複素環式環を形成し;
R4及びR8は、別個に水素、C1-C8アルキル及びアリールから選択され;さらに
R5はアミンであるが、ただし、R1及びR2がともに水素ではないということはなく、R4又はR8の1つは水素であることを条件とする。
R1は、水素、C1-C8アルキル及びアリールから成る群から選択され;
R2はHであり;
R3はC1-C18アルキルであり;
R4及びR8は各々水素であり;さらに
R5は、アミン又はN-置換アミン又はヒドロキシルであるが、ただし、R1がアルキル又はアリールである場合、R1及びR5はそれらが添付される原子と一緒になって4−11複素環式環を形成することを条件とする。
R1及びR2は、別個に水素、C1-C18アルキル、(C1-C18アルキル)OH、(C1-C4アルキル)NH2及び(C0-C4アルキル)(C6-C10アリール)R7から成る群から選択されるか、又はR1及びR2は(CH2)p(式中pは2−9である) により連結され;
R3はC1-C18アルキルであるか、又はR3及びR4はそれらが添付される原子と一緒になって4−12複素環式環を形成し;
R4及びR8は、別個に水素、C1-C8アルキル及び(C0-C4アルキル)(C6-C10アリール)R7から成る群から選択され;
R5はNH2であり;さらに
R7は、H、C1-C18アルキル、C2-C18 アルケニル、(C0-C4アルキル)CONH2、(C0-C4アルキル)COOH、(C0-C4アルキル)NH2、(C0-C4アルキル)OH及びハロから成る群から選択されるが;
ただし、R1及びR2がともに水素ではないということはなく、R4又はR8の1つは水素であることを条件とする。
いくつかの実施態様では、インスリンポリペプチドB鎖ペプチドのN-末端アミノ酸に連結されるジペプチドプロドラッグ成分を有し、さらに例えば約12から約72時間、又はいくつかの実施態様では約12から約48時間のt1/2を有するプロドラッグは、下記構造のジペプチドプロドラッグ成分を含み:
R3はC1-C8アルキルであるか、又はR3及びR4はそれらが添付される原子と一緒になって4−6複素環式環を形成し;
R4は、水素及びC1-C8アルキルから成る群から選択され;さらに
R5はNH2であるが;
ただし、R1及びR2がともに水素ではないということはないことを条件とする。
他の実施態様では、インスリンポリペプチドB鎖ペプチドのN-末端アミノ酸に連結されるジペプチドプロドラッグ成分を有し、さらに例えば約12から約72時間、又はいくつかの実施態様では約12から約48時間のt1/2を有するプロドラッグは、下記構造のジペプチドプロドラッグ成分を含み:
R3はC1-C6アルキルであり;
R4は水素であり;さらに
R5はNH2であるが;
ただし、R1及びR2がともに水素ではないということはないことを条件とする。
いくつかの実施態様では、インスリンポリペプチドB鎖ペプチドのN-末端アミノ酸に連結されるジペプチドプロドラッグ成分を有し、さらに例えば約12から約72時間、又はいくつかの実施態様では約12から約48時間のt1/2を有するプロドラッグは、下記構造のジペプチドプロドラッグ成分を含み:
R3はC1-C8アルキルであり;
R4は(C0-C4アルキル)(C6-C10アリール)R7であり;
R5はNH2であり;さらに
R7は、水素、C1-C8アルキル及び(C0-C4アルキル)OHから成る群から選択されるが;
ただし、R1及びR2がともに水素ではないということはないことを条件とする。
R3はC1-C18アルキルであり;
R4及びR8は各々水素であり;
R5はNHR6又はOHであり;
R6はH、C1-C8アルキルであるか、又はR6及びR1はそれらが添付される原子と一緒になって4、5又は6員の複素環式環を形成し;さらに
R7は、水素、C1-C18アルキル、C2-C18アルケニル、(C0-C4アルキル)CONH2、(C0-C4アルキル)COOH、(C0-C4アルキル)NH2、(C0-C4アルキル)OH及びハロから成る群から選択されるが、ただしR1がアルキル又は(C0-C4アルキル)(C6-C10アリール)R7である場合、R1及びR5は、それらが添付される原子と一緒になって4−11複素環式環を形成することを条件とする。
R3はC1-C18アルキルであり;
R4及びR8は各々水素であり;
R5はNH2であり;さらに
R7は、水素、C1-C18アルキル、C2-C18アルケニル、(C0-C4アルキル)CONH2、(C0-C4アルキル)COOH、(C0-C4アルキル)NH2、(C0-C4アルキル)OH及びハロから成る群から選択される。
さらにまた、例えば約6から約24時間のt1/2を有し、さらに内部アミノ酸側鎖に連結されるジペプチドプロドラッグ成分を有するプロドラッグが提供され、ここで、該プロドラッグは下記構造を有するジペプチドプロドラッグ成分を含む:
R3はC1-C18アルキルであるか、又はR3及びR4は、それらが添付される原子と一緒になって4−12複素環式環を形成し;
R4及びR8は、別個に水素、C1-C18アルキル又は(C0-C4アルキル)(C6-C10アリール)R7であり;
R5はNHR6であり;
R6はH又はC1-C8アルキルであるか、又はR6及びR2は、それらが添付される原子と一緒になって4、5又は6員複素環式環を形成し;さらに
R7は、水素、C1-C18アルキル、C2-C18アルケニル、(C0-C4アルキル)CONH2、(C0-C4アルキル)COOH、(C0-C4アルキル)NH2、(C0-C4アルキル)OH及びハロから成る群から選択されるが;
ただしR1及びR2がともに水素ではないということはなく、R4又はR8の少なくとも1つは水素であるということを条件とする。
R3はC1-C18アルキルであり;
R4及びR8は各々水素であり;
R5はNHR6又はOHであり;
R6はH又はC1-C8アルキルであるか、又はR6及びR1は、それらが添付される原子と一緒になって4、5又は6員複素環式環を形成し;さらに
R7は、水素、C1-C18アルキル、C2-C18アルケニル、(C0-C4アルキル)CONH2、(C0-C4 アルキル)COOH、(C0-C4アルキル)NH2、(C0-C4アルキル)OH及びハロから成る群から選択されるが;
ただしR1及びR2がともにそれぞれ別個にアルキル又は(C0-C4アルキル)(C6-C10アリール)R7である場合、R1又はR2のどちらかが(CH2)p(式中pは2−9である) によりR5に連結されることを条件とする。
R3はC1-C18アルキルであるか、又はR3及びR4は、それらが添付される原子と一緒になって4−12複素環式環を形成し;
R4及びR8は、別個に水素、C1-C18アルキル及び(C0-C4アルキル)(C6-C10アリール)R7から成る群から選択され;
R5はNH2又はOHであり;さらに
R7は、水素、C1-C18アルキル、C2-C18 アルケニル、(C0-C4アルキル)CONH2、(C0-C4アルキル)COOH、(C0-C4アルキル)NH2、(C0-C4アルキル)OH及びハロから成る群から選択される。
別の実施態様では、式IVの構造(m1は0から3の整数である)を含み、生理学的条件下のPBSで約6から約24時間のt1/2を有するインスリンポリペプチドプロドラッグ誘導体が提供される。ある実施態様では、生理学的条件下のPBSで約6から約24時間のt1/2を有するインスリンポリペプチドプロドラッグは式IVの構造を含み、ここで、
R1は水素、C1-C18アルキル及びアリールから成る群から選択されるか、又はR1及びR2は-(CH2)p-(式中pは2−9である) により連結され;
R3はC1-C18アルキルであるか、又はR3及びR4は、それらが添付される原子と一緒になって4−6複素環式環を形成し;
R4及びR8は、別個に水素、C1-C18アルキル及びアリールから成る群から選択され;さらに
R5はアミン又はN-置換アミンである。ある実施態様では、m1は1である。
R3はC1-C18アルキルであるか、又はR3及びR4はそれらが添付される原子と一緒になって4−6複素環式環を形成し;
R4及びR8は、別個に水素、C1-C18アルキル及び(C0-C4アルキル)(C6-C10アリール)R7から成る群から選択され;
R5はNHR6であり;
R6はH、C1-C8アルキルであるか、又はR6及びR1は、それらが添付される原子と一緒になって4、5又は6員複素環式環を形成し;さらに
R7は、水素、C1-C18アルキル、C2-C18アルケニル、(C0-C4アルキル)CONH2、(C0-C4アルキル)COOH、(C0-C4アルキル)NH2、(C0-C4アルキル)OH及びハロから成る群から選択される。
別の実施態様では、式IVの構造(m1は0から3の整数である)を含み、生理学的条件下のPBSで約72から約168時間のt1/2を有するインスリンポリペプチドプロドラッグ誘導体が提供される。ある実施態様では、生理学的条件下のPBSで約72から約168時間のt1/2を有するインスリンポリペプチドプロドラッグは式IVの構造を含み、ここで、
R1及びR2は、別個に水素、C1-C8アルキル及びアリールから成る群から選択され;
R3はC1-C18アルキルであるか、又はR3及びR4は、それらが添付される原子と一緒になって4−6複素環式環を形成し;
R4及びR8は各々水素であり;さらに
R5は、アミン、N-置換アミン及びヒドロキシルから選択される。ある実施態様では、m1は1である。
R3は、C1-C18アルキルであるか、又はR3及びR4はそれらが添付される原子と一緒になって4−6複素環式環を形成し;
R4は水素であるか、又はR3とともに4−6複素環式環を形成し;
R8は水素であり;
R5はNHR6又はOHであり;
R6はH又はC1-C8アルキルであるか、又はR6及びR1は、それらが添付される原子と一緒になって4、5又は6員複素環式環を形成し;さらに
R7は、水素、C1-C18アルキル、C2-C18アルケニル、(C0-C4アルキル)CONH2、(C0-C4アルキル)COOH、(C0-C4アルキル)NH2、(C0-C4アルキル)OH及びハロから成る群から選択される。
ある実施態様では、構造IB-LM-IAを含むインスリンポリペプチドが提供され、ここでIBは配列J-R23-R22-X25LCGX29X30LVX33X34LX36LVCGX41X42GFX45(配列番号:69)を含み、LMは本明細書に開示する連結部分を含み、
さらにIAは配列GIVX4X5CCX8X9X10CX12LX14X15LEX18X19CX21-R13(配列番号:70)を含み、式中、
JはH又は式Xのジペプチド成分であり;
X4は、グルタミン酸又はアスパラギン酸であり;
X5は、グルタミン又はグルタミン酸であり;
X8は、ヒスチジン、スレオニン又はフェニルアラニンであり;
X9は、セリン、アルギニン、リジン、オルニチン又はアラニンであり;
X10は、イソロイシン又はセリンであり;
X12は、セリン又はアスパラギン酸であり;
X14は、チロシン、アルギニン、リジン、オルニチン又はアラニンであり;
X15は、グルタミン、グルタミン酸、アルギニン、アラニン、リジン、オルニチン又はロイシンであり;
X18は、メチオニン、アスパラギン、グルタミン、アスパラギン酸、グルタミン酸又はスレオニンであり;
X19は、下記一般構造のアミノ酸であり(式中、XはOH又はNHR10(R10は、H又は式Xの一般構造を含むジペプチド成分である)から成る群から選択される);
X25は、ヒスチジン又はスレオニンであり;
X29は、アラニン、グリシン及びセリンから成る群から選択され;
X30は、ヒスチジン、アスパラギン酸、グルタミン酸、ホモシステイン酸及びシステイン酸から成る群から選択され;
X33は、アスパラギン酸、グルタミン及びグルタミン酸から成る群から選択され;
X34は、アラニン及びスレオニンから成る群から選択され;
X41は、グルタミン酸、アスパラギン酸又はアスパラギンから成る群から選択され;
X42は、アラニン、リジン、オルニチン及びアルギニンから成る群から選択され;
X45は、下記一般構造のアミノ酸であり(式中、X13はH、OH及びNHR12(R12は、H又は式Xの一般構造を含むジペプチド成分である)から成る群から選択される);
R23は、結合又はG(X60)d(X61)gK(配列番号:71)(式中、X60、X61は別個にグルタミン酸又はアスパラギン酸で、d及びgは別個に1−6の範囲の整数である)であり;さらに
R13はCOOH又はCONHであり;
さらに式Xのジペプチドはアシル化又はPEG化される。ある実施態様では、Jは、式Xのアシル化又はPEG化ジペプチドを含む。
ある実施態様では、親水性部分は、血漿タンパク質、ポリエチレングリコール鎖又は免疫グロブリンのFc部分である。したがって、ある実施態様では、本開示のインスリンアナローグはさらに改変され、アミノ酸の側鎖に共有結合により連結される1つ以上の親水性基を含む。
ある実施態様にしたがえば、本明細書に開示するインスリンプロドラッグは、B鎖のN-末端アミノ酸又はB鎖のカルボキシ末端(例えば配列番号:2の29位を含む)に位置するアミノ酸リジン(又は他の適切なアミノ酸)の側鎖のどちらかに、親水性部分を連結することによってさらに改変される。ある実施態様では、連結部分のアミノ酸の1つがペプチドリンカーの側鎖に親水性部分を連結することによって改変される、単鎖インスリンプロドラッグ誘導体が提供される。ある実施態様では、改変されるアミノ酸はシステイン、リジン又はアセチルフェニルアラニンである。
別の実施態様では、本明細書に開示するインスリンポリペプチド及びそのプロドラッグアナローグは、インスリンポリペプチドのA鎖のカルボキシ若しくはアミノ末端に、又はB鎖のアミノ末端に改変アミノ酸を付加することによってさらに改変され、ここで該付加アミノ酸は改変され、該アミノ酸に連結された親水性部分を含む。ある実施態様では、C-末端に付加されるアミノ酸は改変システイン、リジン又はアセチルフェニルアラニンである。ある実施態様では、親水性部分は、血漿タンパク質、ポリエチレングリコール鎖及び免疫グロブリンのFc部分から成る群から選択される。
本開示にしたがって高血糖症を治療する1つの方法は、本開示のインスリンダイマー又はそのデポー若しくはプロドラッグ誘導体を標準的な投与ルート(非経口的(例えば静脈内、腹腔内、皮下又は筋肉内、髄腔内、皮内、直腸内)、経口的、鼻内又は吸入によるルートを含む)を用いて患者に投与する工程を含む。ある実施態様では、組成物は皮下又は筋肉内に投与される。ある実施態様では、組成物は非経口的に投与され、インスリンポリペプチド又はそのプロドラッグ誘導体は注射筒内に前もって充填される。
本明細書に記載する全ての治療方法、医薬組成物、キット及び他の類似の実施態様は、インスリンダイマー又はそのプロドラッグ誘導体は、医薬的に許容できる前記の全ての塩を含むことを意図する。
ある実施態様では、キットは、患者にインスリンダイマー組成物を投与するための装置とともに提供される。キットはさらに多様な容器を、例えばバイアル、チューブ、ビンなどを含むことができる。好ましくは、キットはまた使用のための指示を含むであろう。ある実施態様にしたがえば、キットの装置は、組成物がエーロゾル装置に前もって充填されたエーロゾル調剤装置である。別の実施態様では、キットは注射筒及び注射針を含み、さらにある実施態様では、インスリンダイマー組成物は注射筒に前もって充填される。
本発明の化合物は、標準的な合成方法、組換えDNA技術、又はペプチド及び融合タンパク質を調製する他の任意の方法によって調製される。ある種の非天然アミノ酸は標準的な組換えDNA技術で発現させることはできないが、それらの調製技術は当業界で公知である。非ペプチド部分を包含する本発明の化合物は、標準的なペプチド化学反応に加えて、利用可能なときは標準的な有機化学反応によって合成できる。
A鎖:
A鎖1 GIVEQCCTSICSLYQLENYCN(配列番号:1)、
A鎖2 GIVDECCFRSCDLRRLENYCN(配列番号:11)、
A鎖3 GIVDECCFRSCDLRRLEMYCA(配列番号:5)、
A鎖4 TPAX75SEGIVEECCFRSCDLALLETYCA(配列番号:88)、
A鎖5 TPAKSEGIVEECCFRSCDLALLETYCA(配列番号:103)、
A鎖6 GIVEECCFRSCDLALLETYCA(配列番号:7)、
B鎖:
B鎖1 FVNQHLCGSHLVEALYLVCGERGFFYTPKT(配列番号:2)、
B鎖2 FVNQHLCGSHLVEALYLVCGERGFF(配列番号:77)、
B鎖3 GPETLCGAELVDALYLVCGDRGFY(配列番号:77)、
B鎖4 CGPEHLCGAELVDALYLVCGDRGFYFNPK(配列番号:79)、
B鎖5 GPETLCGAELVDALYLVCGDRGFYFNKPT(配列番号:79)、
B鎖6 AYRPSETLCGGELVDTLQFVCGDRGFYFSRPA(配列番号:87)、
B鎖7 GPETLCGAELVDALQFVCGDRGFYFNKPT(配列番号:10)、
B鎖8 TPAKSEGIVEECCFRSCDLALLETYCA(配列番号:103)、
B鎖9 AYRPSETLCGGELVDTLQFVCGDRGFY(配列番号:90)、
B鎖10 AYRPSETLCGGELVDTLYLVCGDRGFYFSRPA(配列番号:80)、
B鎖11 CFVNQHLCGSHLVEALYLVCGERGFFYTPKT(配列番号:94)、
B鎖12 CGPETLCGAELVDALYLVCGDRGFYFNKPT(配列番号:95)、
B鎖13 CGPETLCGAELVDALQFVCGDRGFYFNKPT(配列番号:96)、
B鎖14 CGPEHLCGAELVDALYLVCGDRGFYNKPT(配列番号:97)、
B鎖15 CAYRPSETLCGGELVDTLQFVCGDRGFY(配列番号:91)、及び
B鎖16 CAYRPSETLCGGELVDTLYLVCGDRGFY(配列番号:93)。
Boc化学反応を用いて、インスリンA及びB鎖を4-メチルベンゾヒドリルアミン(MBHA)樹脂又は4-ヒドロキシメチル-フェニルアセトアミドメチル(PAM)樹脂上で合成した。HF/p-クレゾール(95:5)を0℃で1時間用いて、樹脂からペプチドを切断した。HF除去及びエーテル沈殿に続いて、ペプチドを50%酢酸水溶液に溶解し凍結乾燥させた。また別には、ペププチドはFmoc化学反応を用いて合成した。前記ペプチドは、トリフルオロ酢酸(TFA)/トリイソプロピルシラン(TIS)/H2O(95:2.5:2.5)を室温で2時間用いて樹脂から切断した。ペプチドを過剰量のジエチルエーテルの添加により沈殿させ、ペレットを酸性緩衝水に溶解した。ペプチドの品質はRP-HPLCによってモニターし、質量分析(ESI又はMALDI)によって確認した。
インスリンA鎖は、アミノ酸7位のただ1つの遊離システインを用いて合成し、他の全てのシステインはアセトアミドメチルA-(SH)7(Acm)6,11,20として保護した。インスリンB鎖は、7位のただ1つの遊離システインを用いて合成し、他のシステインはアセトアミドメチルB-(SH)7(Acm)19として保護した。粗ペプチドは通常のRP-HPLCによって精製した。
合成したA及びB鎖は、図1に概略した一般的な方法にしたがって、それらの自然のままのジスルフィド結合により互いに連結させた。それぞれのB鎖を、DMF又はDMSOへの溶解によりCys7-Npysに活性化させ、2,2’-ジチオビス(5-ニトロピリジン)(Npys)と1:1のモル比及び室温で反応させた。前記活性化をRP-HPLCでモニターし、生成物はESI-MSで確認した。
第一のB7-A7ジスルフィド結合は、それぞれA-(SH)7(Acm)6,11,20及びB-(Npys)7(Acm)19を1:1のモル比で総ペプチド濃度10mg/mLに溶解することによって形成された。鎖の結合反応が完了したとき、混合物を50%酢酸水濃度に稀釈した。最後の2つのジスルフィド結合はヨウ素の添加により同時に形成された。40倍モル過剰のヨウ素を前記溶液に添加し、この混合物を室温でさらに1時間攪拌した。アスコルビン酸水溶液を添加して反応を終了させた。混合物をRP-HPLCで精製し、最終化合物をMALDI-MSによって確認した。図2及び表1のデータが示すように、この方法にしたがって調製した合成インスリンは、インスリン受容体結合について精製インスリンと良好な類似を示す。
改変アミノ酸(例えばA19位の4-アミノフェニルアラニン)を含むインスリンペプチドもまた、非コードアミノ酸のタンパク質への取り込みを可能にする系を用いてin vivoで合成できる。前記系には、例えば米国特許第7,045,337号及び7,083,970号に教示された系が含まれる。
a.合成
インスリン(又はインスリンアナローグ)、mPEG20k-アルデヒド及びNaBH3CN(モル比1:2:30)を酢酸緩衝液(pH4.1−4.4)に溶解した。反応溶液は、0.1NのNaCl、0.2N酢酸及び0.1NのNa2CO3を含んでいた。インスリンペプチド濃度は約0.5mg/mLであった。反応は室温で6時間にわたって生じた。反応の程度はRP-HPLCでモニターし、反応収量は約50%であった。
b.精製
反応混合物を0.1%のTFAで2−5倍に稀釈し、調製用RP-HPLCカラムに適用した。HPLC条件:C4カラム、流速は10mL/分、A緩衝液は水に10%ACN及び0.1%TFA、B緩衝液はACNに0.1%TFA、直線状グラジエントB%は0−40%(0−80分)。PEG-インスリン又はアナローグは約35%緩衝液Bで溶出した。所望の化合物はMALDI-TOEとその後のスルフトリシス又はトリプシン分解による化学的改変によって立証した。
N-ヒドロキシスクシンイミドアシル化によるアミン基(N-末端及びリジン)のPEG化
a.合成
インスリン(又はインスリンアナローグ)をmPEG20k-NHSとともに0.1Nのビシン緩衝液(pH8.0)に1:1のモル比で溶解した。インスリンペプチド濃度は約0.5mg/mLであった。反応の進行はHPLCでモニターした。反応収量は室温で2時間後に約90%であった。
b.精製
反応混合物を2−5倍に稀釈し、RP-HPLCにロードした。HPLC条件:C4カラム、流速は10mL/分、A緩衝液は水に10%ACN及び0.1%TFA、B緩衝液はACNに0.1%TFA、直線状グラジエントB%は0−40%(0−80分)。PEG-インスリン又はアナローグは約35%Bで収集された。所望の化合物はMALDI-TOEとその後のスルフトリシス又はトリプシン分解による化学的改変によって立証した。
フェニルアラニンの芳香環のアセチル基の還元的アミノ化PEG化
a.合成
インスリン(又はインスリンアナローグ)、mPEG20k-ヒドラジド及びNaBH3CN(モル比1:2:20)を酢酸緩衝液(pH4.1−4.4)に溶解した。反応溶液は、0.1NのNaCl、0.2N酢酸及び0.1NのNa2CO3を含んでいた。室温、24時間のインスリン又はインスリンアナローグの濃度は約0.5mg/mLであった。反応の進行はHPLCでモニターした。反応の変換は約50%であった(HPLCによって計算)。
b.精製
反応混合物を2−5倍に稀釈し、RP-HPLCにロードした。HPLC条件:C4カラム、流速は10mL/分、A緩衝液は水に10%ACN及び0.1%TFA、B緩衝液はACNに0.1%TFA、直線状グラジエントB%は0−40%(0−80分)。PEG-インスリン又はPEG-インスリンアナローグは約35%Bで収集された。所望の化合物はMALDI-TOEとその後のスルフトリシス又はトリプシン分解による化学的改変によって立証した。
各ペプチドのインスリン又はIGF-1受容体に対する親和性を、シンチレーションプロクシミティ技術を利用する競合結合アッセイで測定した。ペプチドの連続3倍希釈をトリス-Cl緩衝液(0.05Mトリス-HCl(pH7.5)、0.15M NaCl、0.1%w/vウシ血清アルブミン)で作成し、96ウェルプレート(Corning Inc., Acton, MA)にて0.05nMの(3-[125I]-ヨードチロシル)A TyrA14インスリン又は(3-[125I]-iodotyrosyl)IGF-1(Amersham Biosciences, Piscataway, NJ)と混合した。ヒトインスリン又はIGF-1受容体を過剰発現する細胞から調製した形質膜フラグメントの1−6マイクログラムのアリコットが各ウェルに存在し、ポリエチレンイミン処置コムギ胚芽アグルチニンA型シンチレーションプロクシミティアッセイビーズ(Amersham Biosciences, Piscataway, NJ)を0.25mg/ウェルで添加した。800rpmで5分振盪させた後で、プレートを室温で12時間インキュベートし、放射能をMicroBeta 1450液体シンチレーションカウンター(Perkin-Elmer, Wellesley, MA)で測定した。非特異的結合(NSB)の放射能を、テストサンプルの最高濃度の4倍濃度過剰の“コールド”の自然のままのリガンドを有するウェルで測定した。全結合放射能は競合物を含まないウェルで検出した。特異的結合パーセントを以下のように計算した:特異的結合パーセント=(結合NSB/全結合NSB)x100。IC50値はオリジンソフトウェア(Origin software, OriginLab, Northampton, MA )を用いて決定した。
インスリン又はインスリンアナローグの受容体のリン酸化を測定するために、受容体をトランスフェクトしたHEK293細胞を96ウェルの組織培養プレート(Costar #3596, Cambridge, MA)にプレートし、ダルベッコー改変イーグル培養液(DMEM(Dulbecco’s modified Eagle medium ))で5%CO2及び90%湿度下にて16−20時間37℃で培養した。前記培養液は100IU/mLペニシリン、100μg/mLストレプトマイシン、10mM HEPES及び0.25%のウシ増殖血清(HyClone SH30541, Logan, UT)が補充されてあった。インスリン又はインスリンアナローグの連続希釈を、0.5%ウシ血清アルブミン(Roche Applied Science #100350, Indianapolis, IN)補充DMEMで調製し、接着細胞を含むウェルに添加した。5%CO2を含む湿潤雰囲気にて37℃で15分インキュベートした後、細胞を5%パラホルムアルデヒドで20分間室温にて固定し、リン酸緩衝食塩水(pH7.4)で2回洗浄し、さらにPBS中の2%ウシ血清アルブミンで1時間ブロックした。続いて前記プレートを3回洗浄し、製造業者の推奨にしたがって2%ウシ血清アルブミン含有PBSで再構成したセイヨウワサビペルオキシダーゼ結合抗ホスホチロシン抗体(Upstate biotechnology #16-105, Temecula, CA)を充填した。室温で3時間インキュベートした後、前記プレートを4回洗浄し、0.1mLのTMBシングルソリューション基質(single solution substrate, Invitrogen, #00-2023, Carlbad, CA)を各ウェルに添加した。発色は5分後に1NのHCl(0.05mL)を添加して停止させた。450nmでの吸収をタイターテックマルチスキャンMCC340(Titertek Multiscan, ThermoFisher, Pittsburgh, PA)で測定した。吸収対ペプチド濃度用量応答曲線を作図し、EC50値をオリジンソフトウェア(OriginLab, Northampton, MA)を用いて決定した。
ジペプチドN-末端伸長部の切断速度を試験することができるモデルペプチドとして、特定のヘキサペプチド(HSRGTF-NH2;配列番号:72)を用いた。ジペプチド伸長モデルペプチドを調製し、該モデルペプチド結合樹脂にBoc保護サルコシン及びリジンを連続的に付加してペプチドA(Lys-Sar-HSRGTF-NH2;配列番号:74)を作製した。ペプチドAをHFによって切断し、調製用HPLCによって精製した。
HPLCを用いる調製的精製:
精製は、シリカ系1x25cmのVydac C18(粒子サイズ5μ、孔サイズ300Å)カラムでHPLC分析を用いて実施した。以下の装置を用いた:ウォーターアソシエーツ(Waters Associates)モデル600ポンプ、インジェクターモデル717、及びUV検出装置モデル486。全サンプルについて230nmの波長を用いた。溶媒Aは蒸留水中に10%CH3CN/0.1%TFAを含み、溶媒BはCH3CN中に0.1%TFAを含んでいた。直線状グラジエントを用いた(2時間で0−100%B)。流速は10mL/分で、分画サイズは4mLであった。約150mgの粗ペプチド、30mgの精製ペプチドが得られた。
ペプチドAをPBS緩衝液に1mg/mLの濃度で溶解した。この溶液を37℃でインキュベートした。サンプルを5h、8h、24h、31h及び47hで分析のために収集した。ジペプチド切断は等体積の0.1%TFAを用いてpHを低下させることによって停止させた。切断速度をLC-MSによって定性的にモニターし、HPLCによって定量的に調べた。ピークシンプルクロマトグラフィーソフトウェアを用いて、保持時間及び相対的ピーク面積をプロドラッグ及び親モデルペプチドについて定量した。
質量分析を用いる分析:
標準的なESIイオン源付きSciex API-IIIエレクトロスプレー四極質量分析計を用いて、質量スペクトルを入手した。用いたイオン化条件は下記のとおりである:陽イオンモードのESI;イオンスプレー電圧は3.9kV;オリフィス電位は60V。使用した霧状化及びカーテンガスは流速0.9L/分の窒素であった。質量スペクトルは、0.5Th/ステップ及び2msec持続時間で600から1800トンプソンまで記録した。サンプル(約1mg/mL)を1%の酢酸を含む50%アセトニトリル水に溶解し、外部注射筒ポンプによって5μL/分の速度で導入した。製造業者(Millipore Corporation, Billerica, MA)によって提供された指示にしたがい、0.6μLのC4樹脂を含むZipTip固相抽出チップを用いて、PBSに溶解したペプチドを分析前に脱塩した。
HPLCを用いる分析:
214nmでのUV検出装置及び150mmx4.6mmのC8 Vydacカラムが搭載されている、ベックマンシステムゴールドクロマトグラフィー(Beckman System Gold Chromatography)系を用いて、HPLC分析を実施した。流速は1mL/分であった。溶媒Aは蒸留水中に0.1%TFAを含み、溶媒Bは90%のCH3CN中に0.1%TFAを含んでいた。直線状グラジエントを用いた(10分で0から30%B)。ピークシンプルクロマトグラフィーソフトウェアを用いて、データを収集し分析した。
それぞれのプチドについて、切断速度を決定した。プロペプチド及びモデル親ペプチドの濃度をそれらの対応するピーク面積によって決定した。プロドラッグの一次解離速度定数は、多様な時間間隔におけるプロドラッグの濃度の対数を作図することによって決定された。このプロットの勾配は速度定数‘k’を提供する。種々のプロドラッグの切断半減期は、式t1/2=0.693/kを用いて計算した。このモデルペプチドHSRGTF-NH2(配列番号:72)のLys-Sar伸長部の半減期は14.0hであると決定された。
追加のモデルヘキサペプチド(dHdTdRGdTdF-NH2、配列番号:75)を用いて、血漿中でのジペプチド切断速度を決定した。各アミノ酸のD異性体(ただしプロドラッグ伸長部は除く)を用いて、該モデルペプチドの酵素的切断を防止した。このモデルD異性体ヘキサペプチドはL-異性体と類似の態様で合成された。ペプチドAについて以前に報告したようにN-末端にサルコシン及びリジンを連続的に付加して、ペプチドB(dLys-dSar-dHdTdRGdTdF-NH2、配列番号:75)を調製した。
それぞれのプロペプチドについて切断速度を決定した。プロペプチド及びモデル親ペプチドの濃度をそれらの対応するピーク面積によって決定した。プロドラッグの一次解離速度定数は、多様な時間間隔におけるプロドラッグの濃度の対数を作図することによって決定された。このプロットの勾配は速度定数‘k’を提供する。このモデルペプチドdHdTdRGdTdF-NH2(配列番号:74)のLys-Sar伸長部の半減期は18.6hであると決定された。
A鎖の19位はインスリン活性のために重要な部位であることは知られている。したがって、プロドラッグ成分の添付を可能にするこの部位の改変が所望される。A19指定インスリンアナローグを合成し、インスリン受容体におけるそれらの活性について特徴を調べた。高い活性を有する2つの構造アナローグをA19で同定したが、第二の活性部位である芳香族残基(B24)と比肩し得る構造変化では、同じように完全な活性をもつインスリンアナローグを同定できなかった。
表4及び5は、インスリン受容体における完全な活性のためのA19位における高度な構造的保存を示す(受容体結合は実施例3に記載したアッセイを用いて決定した)。表4は、A19に改変を有する2つのインスリンだけが自然のままのインスリンに類似する受容体結合活性を有することを示す。4-アミノインスリンアナローグについては、3つの別々の実験のデータが提供される。“活性(検定)”と表示した欄は、同時に実施した2つの別々の実験で自然のままのインスリンと対比して当該インスリンアナローグのパーセント結合を比較する。“活性(0.60nM)”と表示した欄は、このアッセイを用いてインスリン結合について得られた文献上の(historical)平均値と対比した当該インスリンアナローグの相対的パーセント結合である。どちらのアッセイでも、2つのA19インスリンアナローグ(4-アミノフェニルアラニン及び4-メトキシフェニルアラニン)は、自然のままのインスリンとほぼ等価の受容体結合を示す。表5は、自然のままのインスリンと等価の結合活性を示す2つのA19インスリンアナローグ(4-アミノ及び4-メトキシ)はまた、該インスリン受容体で等価の活性を示すことを表している(受容体活性は実施例4に記載したアッセイを用いて決定した)。
出願人らは、インスリン受容体で自然のままのインスリンと類似の活性を示すIGFアナローグを見出した。より具体的には、IGFアナローグ、IGF1(YB16LB17)は、自然のままのIGF A鎖(配列番号:5)及び改変B鎖(配列番号:6)を含み、自然のままのIGF B鎖(配列番号:3)の15及び16位の本来のグルタミン及びフェニルアラニンが、それぞれチロシン及びロイシン残基で入れ替えられている。図3及び下記の表6に示すように、IGF1(YB16LB17)及び自然のままのインスリンの結合活性は、各々がインスリン受容体の極めて強力なアゴニストであることを示している。
A19インスリンアナローグの活性を基にして(実施例8参照)、IGF1 A:B(YB16LB17)アナローグに対して類似の改変を実施し、インスリン受容体に結合し前記を刺激するその能力を調べた。表7に示すように、IGFアナローグ、IGF1(YB16LB17)A(p-NH2-F)19は、インスリン受容体に特異的に結合する(当該アナローグのジペプチド伸長アナローグは該インスリン受容体に特異的に結合できない)。当該ジペプチド伸長部分は、ジペプチドの偶発的切断を可能にする適切な構造を欠き(当該ジペプチドの第二の位置にN-アルキル化アミノ酸を欠く)、したがってインスリン受容体結合の回復がないことに留意されたい。
改変アミノ酸(例えばA19位の4-アミノフェニルアラニン)を含むIGF1 A:B(YB16LB17)もまた、非コードアミノ酸のタンパク質への取り込みを可能にする系(例えば米国特許第7,045,337号及び7,083,970号に教示された系が含まれる)を用いてin vivoで合成することができる
IGFYB16B17アナローグペプチドのさらに別のプロドラッグアナローグを調製した(前記アナローグペプチドでは、ジペプチドプロドラッグ成分(アラニン-プロリン)は、A鎖 (IGF1(Y B16LB17)(AlaPro)A-1,0)のアミノ末端にアミド結合を介して連結された)。表8に示すように、IGF1(Y B16LB17)(AlaPro)A-1,0はインスリン受容体に対する親和性が低下した。表3のデータを基準にすれば、該ジペプチドプロドラッグ成分は、当該ジペプチドプロドラッグ成分の偶発的な切断を可能にする適切な構造を欠き、したがってこのインスリン受容体結合の検出は、該プロドラッグ成分の切断の結果ではないことに留意されたい。
IGF1(YB16LB17)ペプチド配列の更なる改変によって、インスリン及びIGF1受容体でそれらの効力が変化するさらに別のIGFインスリンアナローグが明らかになった。これらのアナローグの各々について表9に結合データ(実施例3のアッセイを用いる)を提示する。これらのアナローグでは、改変の位置は、自然のままのインスリンペプチドの対応する位置を基準に示される(DPI=des B26−30)。例えば、本明細書で、更なる説明が一切なく“B28位”と言えば、配列番号:2の最初のアミノ酸が欠失したインスリンアナローグのB鎖の対応する27位を意味する。したがって、 “B(Y16)”という一般的呼称は、自然のままのIGF-1配列(配列番号:3)のB鎖の15位のチロシン残基の置換を指す。インスリン及びIGFアナローグの相対的受容体結合に関するデータは表9に提供され、IGFアナローグ刺激リン酸化に関するデータ(実施例4のアッセイを用いる)は表10に提供される。
IGF-I C鎖を介して連結される自然のままのB及びA鎖を含むインスリン-IGF-I(B0-C1-A0)ミニ遺伝子を、酵母ピキア・パストリス(Pichia pastoris)での構成的発現及び組換えタンパク質の精製のためにGAPプロモーター(グリセルアルデヒド-3-ホスフェートデヒドロゲナーゼ(GAPDH))下に発現ベクターpGAPZα(Invitrogenより購入)でクローニングした。組換えタンパク質の培地中への分泌のために、サッカロミセス・セレビシアエ(Saccharomyces cerevisiae)のアルファ-接合因子リーダーシグナルをコードするN-末端ペプチドに前記ミニ遺伝子を融合させた。該ミニ遺伝子と先導α-接合因子配列との間のKex2切断部位を用いて、自然のままのアミノ末端を有するミニ遺伝子の分泌のためのリーダー配列を切断した。一部位アラニン変異を、B0C1A0ミニ遺伝子のCペプチドの1位(G1A)、2位(Y2A)、3位(G3A)、4位(S4A)、5位(S5A)、6位(S6A)、7位(R7A)、8位(R8A)、10位(P10A)、11位(Q11A)及び12位(T12A) に導入した。
B0C1A0、11のアラニン変異体及び他の選別誘導体を含むミニ遺伝子で、エレクトロポレーションによって酵母ピキア・パストリスを形質転換した。陽性の形質転換体を最少メタノールプレートで選別し、各ピキア単離株のゲノム調製を実施し、該構築物の酵母ゲノムへの組み込みをPCRにより確認した。アガロースDNAゲル上で833塩基対PCR生成物を可視化した。対応する酵母株を発酵させてインスリンアナローグを製造した。酵母細胞は500mLのベックマン(Beckman)遠心管にて5Kで20分遠心分離してペレットにし、培地はその後のタンパク質精製のために維持した。
増殖培地上清を0.2μmのミリポア(Millipore)フィルターでろ過した。該上清にアセトニトリル(ACN)を最終体積20%で添加した。20%のACN水溶液で前平衡化したアンバーライト(Amberlite)XAD7HP樹脂(Sigma)で前記上清を精製した。続いて前記樹脂を30mLの20%ACN水溶液で2回洗浄し、さらに0.1%のTFAを含む30%ACN水溶液で夾雑物を除去した。部分精製インスリンアナローグを0.1%TFA含有54%ACN水溶液で前記カラムから溶出し凍結乾燥した。凍結乾燥サンプルを0.025MのNH3HCO3(pH8)に再懸濁し、ルナ(Luna)C18カラム(粒子サイズ10μm、ポアサイズ300Å)で精製した。ACN水溶液の20−60%直線状グラジエントを用いてタンパク質をカラムから溶出した。MALDI-MS陽性分画をプールし、その後の凍結乾燥のために使い捨てシンチレーションバイアルに移した。続いて凍結乾燥サンプルを0.1%TFA含有20%ACN水溶液に再懸濁し、ルナ(Luna)C18カラム(粒子サイズ10μm、ポアサイズ300Å)で精製した。ACN水溶液の18−54%直線状グラジエントを用いてタンパク質をカラムから溶出した。タンパク質の溶出は280nmの吸収でモニターした。MALDI-TOF MS陽性分画をC8分析用カラムで分析して純度を確認した。
B0-C1-A0アナローグは、インスリン受容体アイソフォーム及びIGF-1受容体の双方で等しく有効な効力を示した。2位のチロシンのアラニンへの変異又はC9-12の欠失による8アミノ酸へのC-ペプチド短縮は、IGF-1受容体活性の有意な低下によってインスリン作用の特異性の選択的強化を提供した。表11A及び11Bに提供するデータを参照されたい。
二工程ネイティブチェーンリゲーション法を用いて、一連の単鎖インスリンアナローグを固相合成によって調製した。初期ペプチドは線状構築物であった。前記構築物では、N末端はCysB19で始まりAsnA21まで続き、最後のB鎖アミノ酸のC-末端からA鎖の最初のアミノ酸(典型的にはグリシン)のN-末端までの接続として機能するエチレングリコールの短い線状ポリマーを有する。B鎖(典型的には最終的インスリンアナローグの最初のN-末端アミノ酸で開始し、B鎖のアミノ酸18(典型的にはバリン)で終わる)のN-末端終部を、単個線状ペプチドにフラグメント結合させた(fragment-coupled)。チオール補助ネイティブチェーンリゲーションによりいったん結合が完了したら、前記ペプチドをクロマトグラフィーにより精製し、正確なジスルフィド異性体に変換し、さらにもう一度高速クロマトグラフィーによって精製した。全てのインスリンアナローグをHPLC及びMS分析によって純度を分析した。
図8Aは、リンカーとしてPEG8を用いる一事例を示す合成設計の模式図を提供する。同じアプローチを用いて、長さがもっと短い及びもっと長いアナローグとともに、アミドのような直鎖状態様で共有結合により連結される1つ以上のミニPEGを使用することによって得られる多様な長さをもつアナローグも合成した。
図8B及び8Cは、特定の位置で指定の長さのミニPEGによって連結される単鎖インスリンアナローグの試験から得られたin vitro実験結果を提供する。図8b及び8Cは、4、8又は16エチレングリコールユニットのミニPEGの使用は効力の貧弱なインスリンアナローグ(結合又は生化学シグナリングによって測定したとき自然のままのホルモンと比較して5%未満の活性を有する)を生じることを示す。
表11Cに提示するデータは、同じサイズのミニPEGリンカーを用いて短縮B鎖のC-末端をA鎖のN-末端に結合させたとき、劇的に効力が増加することを示す。デス-V(アミノ酸B26-30を亡失)インスリンアナローグはいったんミニPEGと結合すると、自然のままのホルモンに負けない、完全長B鎖アナローグと対比して10倍を超える効力を示した。
リン酸化による受容体シグナリングで測定したとき、種々のサイズのPEG連結部分がどのようにインスリン及びIGF-1受容体におけるin vitro活性に影響を与えるかを測定するために、PEG鎖リンカーを用いて比較分析を単鎖アナローグで実施した。データは、PEG12デスV構築物(B鎖の5カルボキシ末端アミノ酸が欠失している)はもっとも強力な化合物を提供することを示した。
PEG12及び単個アミノ酸(グリシン又はリジン)を連結部分として含み、自然のままのインスリンA鎖にデスV B鎖を連結する、単鎖アナローグを構築した。単鎖PEG/アミノ酸連結アナローグのインスリン及びIGF-1受容体におけるin vitro活性の比較分析は、受容体結合及びリン酸化による受容体シグナリングによって測定したとき、PEG/アミノ酸連結アナローグは強力なインスリン受容体アゴニストであることを示した。同様に、連結部分への2つのリジン残基の付加(単鎖PEG/(リジン)2連結アナローグ)は、受容体結合及びリン酸化による受容体シグナリングによって測定したとき、強力な単鎖PEG/アミノ酸連結インスリン受容体アゴニストを生じた。
比較インスリン耐性試験をマウスで実施し、血中グルコース濃度を低下させ低血中グルコース濃度を維持するヒトインスリンの能力を3つの異なるアシル化インスリンアナローグと比較した。化合物を2つの異なる濃度で試験した(27nmol/kg及び90nmol/kg)。アシル化インスリンにはMIU-41(A14位に位置するリジン残基に添付されるガンマグルタミン酸リンカーを介してC16アシル化を有する二鎖インスリンアナローグ)、MIU-36(B鎖のN-末端に連結されるC16アシル化を有する二鎖インスリンアナローグ)、及びMIU-37(B22位に位置するリジン残基に添付されるガンマグルタミン酸リンカーを介してC16アシル化を有する二鎖インスリンアナローグ)が含まれていた。3つのアシル化インスリンアナローグはいずれも、自然のままのインスリンと比較して、より基礎的なグルコースレベルを提供し低下グルコースレベルを8時間後でさえも維持した(図9A−9Dを参照されたい)。
多様なPEG化インスリンアナローグを調製しin vitroで試験した。表12は自然のままのインスリンと比較した各アナローグのパーセント活性を示す。
表12:PEG化IGF-1及びインスリンアナローグ
比較インスリン耐性試験をマウスで実施し、アシル化インスリンアナローグ、デテミア(Detemir)の能力をPEG化単鎖インスリンアナローグMIU-56(B1(H5,Y16,L17)25-PEG8-K-PEG4-A1(N18,21))と対比して比較した。この単鎖アナローグは、A鎖及びB鎖を継ぎ合わせる連結部分(PEG8-K-PEG4)中のただ1つのリジン残基の側鎖に連結される20kDaのPEGを含む。このPEG化アナローグは24時間の作用持続の維持を示し、作用の開始は、24時間を通して作用を持続させるために必要とされる投薬時における動物の鎮静薬を回避するために十分にゆるやかである。
20kDaのPEG鎖を介して頭対頭で連結される2つのインスリン単鎖アナローグ(B1(H5,Y16,L17)25-C1-A1(N18,21))を含むダイマー(MIU58)を調製した。このダイマーは、親化合物よりも効力は低いが、なお活性を有することが判明した。
要約すれば、インスリンアナローグのPEG化は、インスリン系又はIGF系ペプチド骨格のいずれを用いても、in vivoで低血糖をもたらさずにより延長された作用持続及び基礎プロフィールを提供する。
正常マウスにインスリンヘテロダイマーアナローグ[B1(Y16,L17,Y25)29a:A1(aF19-NH2)]又はそのプロドラッグを投与した。プロドラッグ誘導体[B1(Y16,L17,Y25)29a:A1(aF19-dLys(Ac),NLeu)]はA19位に4-アミノ-フェニルアラニン置換を有し、このA19位でジペプチドdLys(Ac),NLeuが、当該A19残基の4-アミノの位置に共有結合により連結される。このジペプチドは、生理学的条件下で約5時間の半減期で自己切断されるであろう。プロドラッグ誘導体[B1(Y16,L17,Y25)29a:A1(aF19-dLys(Ac),NLeu)]をex vivoで24時間インキュベートした後、生じた化合物をマウスに投与し、血中グルコースを低下させるその能力を親化合物と比較した。2つの化合物はほぼ同一の性能を示すことが判明した。
本明細書に開示する多様なインスリンアナローグの作用持続時間は、インスリン受容体におけるそれらの活性を低下させることによって増加させることができる。したがって、ある実施態様では、本明細書に開示のインスリンアナローグは、改変してインスリン受容体におけるそれらの効力を減少させることができる。前記には、1から8、1から5、1から3、1から2又は1アミノ酸置換による改変が含まれる。ある実施態様では、アミノ酸置換は、B5、B10、B24、A1又はA8から成る群から選択される位置のアラニン置換である。これらの位置の1つ以上におけるアラニン置換は実質的に効力を低下させ、したがってインスリン受容体における作用持続時間を延長する。ある実施態様では、本明細書に開示のインスリンアナローグは、B5、B24、A1又はA8位における一アラニンアミノ酸置換によってさらに改変される。これらの化合物を、表13に示すようにPEG化によってさらに改変することができる(GE5W=GEEEEEW、可溶性を高めるためにインスリンアナローグのN-末端に付加されるペプチド)。
表14に示すように、単鎖及び二鎖インスリンアナローグを調製し、インスリン及びIGF-1受容体における活性についてin vitroで試験し、さらにそれらのPEG化誘導体と比較した。非PEG化型はPEG化誘導体と比較して高い活性を有する。さらにまた、2つの10kDa PEG鎖を用いる二PEG化二鎖インスリンアナローグは、ただ1つの20kDa PEG鎖を含む同じアナローグと比較してほぼ同様な活性を有する化合物を生じる(B1,A14-10K B1(H5,10Y16L17R29)29:A1(H8K14N18,21)及びB1(H5,10Y16L17K29)29:A1(H8N18,21)と対比したB1(H5,10Y16L17K29)29:A1(H8,N18,21)の相対的活性を参照されたい)。単鎖アナローグB1(H5,10Y16L17K29)29-A1(H8,N18,21)については、20kDaの付加は、インスリンタイプA受容体でほぼ100倍の活性を有する化合物B1(H5,10Y16L17K29)29-A1(H8N18,21)を生じる。したがって、二鎖又は単鎖アナローグを調製し、PEG鎖のサイズ、数及び添付部位を選択することによって、インスリンアナローグのin vivo効力を、及びおそらくはin vivo作用持続時間を改変できる。
ダイマー誘導体を合成するために用いられるモノマーペプチドの配列は表16に列挙される。
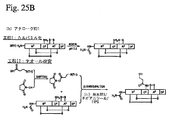
ダイマー#48は、インスリンアナローグ#2*の2つの分子をそれらのN末端システインでジスルフィド結合により架橋して調製した。アナローグ#2*は、2つのペプチドセグメントのネイティブケミカルリゲーションにより調製した。非天然アミノ酸、チアゾリジン-4-カルボン酸(Thz)(前記はシステインの保護型である)をB鎖のN末端に導入した。インスリンアナローグを形成された3つのジスルフィド結合により正確な構造に折り畳んだ後、pH4.0の水溶液中でメトキシルアミンによりで処理してThzをシステインに変換した。Thzの導入はB鎖のN末端に追加のシステインを提供し、本来のインスリン配列中の他の6つのシステインのジスルフィドペアリングを破壊しない。B鎖N末端における架橋ジスルフィドの形成を促進するために、DTNP(2,2’-ジチオビス(5-ニトロピリジン))をCysB1ペプチドの半分に添加してN-末端システインを活性化させた。続いて前記活性化ペプチドを他方の半分のCysB1ペプチドと反応させて、ジスルフィド連結ホモダイマーを形成した。合成完了後に、このダイマーアナローグをトリプシン処理して、両ペプチドサブユニットを二鎖構造に変換した(図22A:#48(CysB1-CysB1#2ダイマー)の合成模式図を参照されたい)。
アナローグ#49及び#50を2つのインスリンアナローグ(#28又は#30)のダイマー化によって調製した。ペプチド#28はインスリンB鎖(デスB30)及びA鎖とともに、酵素切断を可能にするためにただ1つのKB29R変異を含んでいた。ペプチド#28は別のアルギニンをB22位に含んでいた(前記のプロテアーゼ消化のアクセス性はより低い)。反応時間、反応温度及び酵素/ペプチド比を制御することによって、ArgB29のC末端で選択的に切断して二鎖インスリンを生成することができた。二鎖構造への変換は、質量分析で測定したとき18Daの分子量付加によって確認できた。ペプチド#30は、RB22H変異及びN末端における前配列GEEEEEWの存在を除いて#28と構造的に類似していた。ArgB22はHisB22によって取り換えられてより厳密で有効なトリプシン切断を可能にした。
#49及び#50はともに、類似する方法で2つのインスリンペプチドをN末端のアミノ基で架橋することにより合成された。ダイマー#49の合成は図22Bに示されている。s-トリチル-メルカプトプロピオン酸をDIC及びDIEAの存在下でヒドロキシルスクシンイミドにより活性化し、アミン反応性スクシンイミジルエステル(NHSエステル)を生成した。前記NHSエステルをN末端アミノ基と反応させ、各ペプチドのN末端のs-トリチル-メルカプトプロピオン酸とともにアミド結合を形成させた。続いて無水TFAで処理してトリチル保護基を除去した。この方法によって、さらに別のチオール基を各生合成インスリンペプチドのN末端に導入した。N-末端チオール改変ペプチドの半分をDTNP(2,2’-ジチオビス(5-ニトロピリジン))で活性化し、続いて他方の半分と混合してN末端架橋インスリンダイマーを生成した(#49及び#50)。合成完了後に、ダイマーをトリプシンで処理して両ペプチドサブユニットを二鎖構造に変換した。
ダイマー#51は、2つの自然のままのヒトインスリンペプチドをそれらのLysB29残基でダイマー化して合成した。B鎖及びA鎖のN末端のアミノ基をpH7.0でカルバミル化によって選択的に保護した。続いて、リジンB29の側鎖のε-アミンを活性化s-トリチル-メルカプトプロピオン酸と反応させてLysB29チオール-改変インスリンを生成した。前記トリチル保護基をTFA処理により除去し、続いてDTNP(2,2’-ジチオビス(5-ニトロピリジン))を触媒に用い2つのチオール基間でジスルフィド結合を形成した(図22C参照)。
ダイマー#52及び#54はともに生合成単鎖インスリンアナローグ(前記は意図的に配列中にただ1つのリジンを含んでいる)のダイマーである。ダイマー#52は、LysB29残基で対称的に架橋されたMIU-3*の2つの分子を含んでいた。MIU-3は以前に単鎖インスリンアナローグと確認され、3つの受容体(タイプA及びタイプBインスリン受容体並びにIGF-1受容体を含む)でアゴニスト作用を示した。MIU-3*はMIU-3と同じペプチド配列を共有するが、ただしN末端に前配列GEEEEEWを有していた。ダイマー#54は単鎖インスリンアナローグ#11*を用いて構築された。アナローグ#11*はアナローグ#11のC8位にただ1つのリジン取替えを含んでいた。#52及び#54はともに、#51の合成と類似する方法を用いリジン残基の架橋によって構築された。N-末端α-アミンをカルバミル化によって選択的にブロックし、続いて#51の合成で記載したように(スキーム4)、チオール改変をリジン側鎖のε-アミンに導入した。
ダイマー#53はインスリンアナローグ#3(Cドメインとして非ペプチドリンカーを含んでいる)から調製した。ペプチド#3は、デスV B鎖、PEGリンカー及びA鎖を含んでいた。リジン残基を8ユニットPEG及び4ユニットPEGの間に挿入し、ダイマー化部位として供した。ペプチド#3は、2つのペプチドセグメント間におけるネイティブケミカルリゲーションにより調製された。簡単に記せば、セグメント1はB鎖の最初の17アミノ酸及びそのC末端に活性化チオエステルを含んでいた。セグメント1のN末端をアシル化し、一方、ペプチドアッセンブリー完了後にもなお樹脂上で維持した。セグメント1を、B鎖のC末端であるセグメント2、PEGリンカー及びA鎖に連結し、完全長の単鎖インスリンペプチドを生成した。この完全長生成物を折畳み緩衝液で脱塩し、ペプチドの折り畳み及びジスルフィド形成を可能にした。正確に折り畳まれたペプチドを逆相クロマトグラフィーで精製し、続いてチオール改変に用いた。ペプチド#3は、Cドメインの中央のリジン側鎖上にただ1つのアミノ基を含み、前記は位置特異的チオール導入を可能にした。DTNPの触媒作用下で2つのチオール基間にジスルフィド結合を形成することによって、チオール改変インスリンペプチド(#3)をダイマー化した(図22E)。
ダイマー#55は、それらのリジンB1側鎖アミンで短い9ユニットPEGスペーサーにより架橋された2つの単鎖インスリンペプチド#20*を含んでいた。ペプチド#20*は、B1位のTrpからLysへの変異を除き#20と同じ配列を共有していた。ペプチド#20*はインスリンペプチドのN末端に前配列GEEEEEを含み、前記前配列の除去のためのLysC切断部位としてB1位にリジンを有していた。N末端アミンをカルバミル化によって選択的にブロックし、LysB1のε-アミンをアミン反応性試薬による架橋反応のために残した。続いてLysB1のε-アミンを、両末端上にスクシンイミジルエステルを有するホモ-二官能性9-ユニットPEGと反応させて、PEG9-連結インスリンダイマーを生成した(図22F参照)。PEGペプチドダイマーは、逆相クロマトグラフィーによってモノPEG化ペプチド及び未反応試薬から分離された。
ダイマー#56及び#57は、2つの単鎖インスリンペプチドのN末端アミノ基を異なる長さの二官能性PEGリンカーにより架橋して調製された。PEGリンカーは両端をスクシンイミジルエステル(NHSエステル)で官能化され、前記エステルはN末端アミンと反応して、PEGリンカーの両端と2つのインスリン分子を結合させた(図22G参照)。PEGペプチドダイマーは、逆相クロマトグラフィーによってモノPEG化ペプチド及び未反応試薬から分離された。
ダイマー#58は、2つの単鎖インスリンアナローグ#3のリジンε-アミンを両端にNHSエステルを有する二官能性20K PEGリンカーで架橋して調製された。ε-アミンとNHSエステルとの間の反応により、2つのペプチドはPEGリンカーンの両端に結合された(図21H参照)。PEGペプチドダイマーは、逆相クロマトグラフィーによってモノPEG化ペプチド及び未反応試薬から分離された。
B1-B1インスリンダイマー
#48:Cys B1 -Cys B1 #2 * ダイマー(完全アゴニスト):
インスリンアナローグB1[H5Y16L17O22R29]29:A1[O9,14,15N18,21]は、ArgB29以外の全てのアルギニンをオルニチンに取り替えたIGF-1から誘導した。オルニチンの側鎖はリジンの側鎖より1メチレン基だけ短い。オルニチンペプチドはトリプシンにより認識されない。なぜならば、短縮側鎖は該酵素の活性部位に嵌合しないからである。したがって、トリプシン切断はB鎖C末端のArgB29に向かい、切断後に二鎖インスリンを生じた。このアナローグは、以前の結合アッセイの結果によればタイプAインスリン受容体で55%の活性を示した。アナローグ#2*は、B鎖N末端に追加の本来のものではないアミノ酸Thzを含んでいた(前記はメトキシルアミンによる処理でシステインに変換できる)。折り畳みプロセスの完了後に、遊離Cysの存在下に折り畳み緩衝液中でThzB1をCysB1に変換した。CysB1と溶液中に存在する添加した遊離アミノ酸システインとの間でジスルフィド結合を形成することによって、アナローグ2*をモノマー状態で維持した。タイプAインスリン受容体では、Cys-CysB1ペプチドは、リン酸化アッセイで23.1%の活性及び結合アッセイで55.4%の活性を示した。このことは、ただ1つのシステインをB鎖N末端に添加することはin vitro結合又はシグナリングに影響しないことを示した。
アナローグ#48(アナローグ#2*のダイマー型)は、リン酸活性では101.7%の受容体活性及び結合アッセイでは146.7%の活性を示した。ダイマー化は受容体活性で3−4倍の増加をもたらし、前記は関数的であるかもしれない。
B1-B1ジスルフィド連結ダイマー(#48)の合成:
ペプチドセグメント、B1[Thz1H5Y16L17](1-18)-α-チオエステル-RRRR-NH2、B1(19-29)[O22]-A1[O9,14,15N18,21]-NH2、及びN-アセチル-B1[H5Y16L17](1-18)-α-チオエステル-RRRR-NH2を段階的固相ペプチド合成によって合成した。ネイティブケミカルリゲーションにより2つのペプチドセグメントを一緒に連結して、完全長のインスリンペプチドを生成した。N末端のThzアミノ酸を2mMのメトキシルアミンでpH4.0にて処理してシステインに変換した。反応物を室温で3時間攪拌し、変換の完了はMALDI-TOFで確認した。続いてペプチド溶液をpH8.0に調節し、10%DMSOを添加してジスルフィド結合を誘発した。ダイマーの生成は分析用HPLCでモニターした。ダイマー化生成物は逆相カラムで未反応モノマーから分離し、その実体はMALDIで確認した。
s-トリチル-メルカプトプロピオン酸(Trt-SCH2CH2COOH)(National Biochemical Corp., Ohio)、N-ヒドロキシスクシンイミド(NHS)(Sigma)及びジイソプロピルカルボジイミド(DIC)の各々1mmolを2mLのDMF中で室温にて30分攪拌しながら混合し、Trt-SCH2CH2CO-NHSエステルを調製した。5%TFAを含む無水DMFにインスリンペプチドを10mMの濃度で溶解した。活性化Trt-SCH2CH2CO-NHSエステルの2当量を前記溶液に添加した。2%エタノールアミンで終了させる前に、反応物を室温で2時間攪拌した。続いて4%チオアニソール(Sigma)及び8%トリイソプロピルシラン(TIPS)(Sigma)を含む無水TFAで、前記反応物を5倍に稀釈してトリチル保護基を除去した。脱保護反応物を室温で30分攪拌し、続いてエーテルで20倍に稀釈しペプチドを沈殿物として抽出した。前記希釈反応物を遠心分離し、沈殿ペプチドを1%酢酸/20%アセトニトリル水溶液に溶解して凍結乾燥させた。凍結乾燥生成物をDMSOに再溶解した。前記ペプチド溶液の半分と1等量の2,2’-ジチオビス(5-ニトロピリジン)(DTNP)(Sigma)を混合してチオール基を活性化した。前記活性化反応は分析用HPLCでモニターでき、反応の過程もまた黄色の出現で提示された。続いて活性化ペプチドと他方の半分の未反応ペプチドを混合しジスルフィド結合ダイマーを生成した。ダイマー化生成物を逆相HPLCで未反応モノマーから分離し、所望の分画をプールし凍結乾燥させた。前記の実体はMALDI又はLC-MSで確認した。
インスリンアナローグを生物学的合成によって大腸菌(E. coli)細胞から調製した。N末端アミンをカルバミル化するために、50mMシアン酸カリウム(Sigma)を含むPBS緩衝液(pH7.0)にインスリンペプチドを0.5mg/mLの濃度で溶解した。反応物を室温で一晩攪拌し、カルバミル化反応の完了をMALDIで確認した。前記カルバミル化ペプチドを逆相カラムで脱塩し、ペプチド含有分画をプールし凍結乾燥させた。N末端のα-アミン又はリジン側鎖のε-アミンでHS-CH2CH2COをペプチドに結合させて、ダイマー#53の合成で述べたように2つの分子間でジスルフィド結合を形成することによってインスリンダイマーを生成した。
化学合成又は生合成によって調製したインスリンペプチドを5%DIEA含有無水DMFに10mg/mLの濃度で溶解した。二官能性NHS-PEGn-NHS(n=9、10K、20K)(Creative PEGWorks)の0.5当量をペプチド溶液に添加した。反応物を室温で1時間攪拌した。反応過程は分析用HPLCでモニターした。完了後、反応物を少なくとも20倍の反応物体積に0.1%TFA/10%アセトニトリル水溶液で稀釈した。稀釈反応物を続いて逆相カラムにロードし、ダイマー化誘導体を精製し凍結乾燥させた。
競合結合アッセイ:
インスリンアナローグの受容体結合親和性を、シンチレーションプロキシミティ技術を用いて競合結合アッセイで試験した。組換えヒトインスリン(Eli Lilly & Co., Indianapolis, IN)を標準物質として(“コールド”の自然のままのインスリン)この試験に加えた。96ウェルプレート(Corning Inc., Acton, MA)で、インスリンアナローグ及びインスリン標準物についてシンチレーションプロキシミティ緩衝液で連続5倍稀釈を実施した。前記緩衝液は以下を含む:50mMトリス-HCl、150mM NaCl、0.1%w/vウシ血清アルブミン(Sigma Aldrich, St Louis, MO)(pH7.5)。稀釈ペプチドを0.05nMの組換えヒト[125I]-インスリン(3-[125I]ヨードチロシルTyrA14インスリン)(Perkin Elmer, Waltham, MA)と混合した。ヒトインスリン受容体を過剰発現する細胞の1−6mgの形質膜フラグメントのアリコットを、プロテアーゼ阻害剤及び0.25mgのポリエチレンイミン処理(PVT)コムギ胚芽アグルチニン(WGA)シンチレーションプロキシミティビーズ(Aersham Biosciences, Piscataway, NJ)とともに各ウェルに添加した。プレートを800rpmで5分間震盪し、続いて12時間室温でインキュベートした。放射能をマイクロベータ(MicroBeta1)450液体シンチレーション計測装置(Perkin Elmer, Waltham, MA)で測定した。非特異的結合(NSB)の放射能は、最高濃度の試験サンプルの4倍濃度の“コールド”の自然のままのインスリンを含むウェルで測定した。全結合放射能(TB)は、競合物として“コールド”の自然のままのインスリンを含まないウェルで検出した。特異的結合パーセンテージは[(結合-NSB)/TB]x100%として計算した。試験サンプル濃度に対する%特異的結合のプロットはIC50値を提供する(前記はオリジンソフト(Origin software(Origin Lab, Northampton, MA))によって決定された)。アナローグの親和性は自然のままのヒトインスリンの親和性と比較した値として示された:[IC50(インスリン)/IC50(アナローグ)x100%。
タイプAインスリン受容体、タイプBインスリン受容体又はIGF-1受容体を過剰発現するトランスフェクトHEK293細胞を、抗生物質、10mM HEPES及び125μg/mLゼオシン(Zeocine)を含む10%ウシ増殖血清補充ダルベッコー(Dulbecco)改変イーグル培地(DMEM, Hycone, Logan, UT)で維持した。ポリリジン被覆96ウェルプレート(Corning)で、細胞を80μLの血清枯渇培地に4.0x104細胞/ウェルの密度でプレートした。細胞を16時間、無血清DMEM(0.25%ウシ増殖血清、抗生物質及び10mM HEPESを含む)で培養した。0.5%BSA含有DMEMでインスリンアナローグ及びインスリン標準物質について連続5倍稀釈を実施した。トランスフェクト細胞を含む各ウェルに20μLのアナローグ溶液を添加し、37℃で15分間インキュベートした。インキュベーション後に細胞をホルマリンで20分間固定し、続いて0.1%トリトンX-100含有PBS緩衝液で2回洗浄した。続いて封鎖溶液(PBS、0.1%トリトンX-100及び2%BSAを含む)を添加して、非特異的な抗体結合部位を封鎖した。3回洗浄後、50μLの抗体(4G10抗ホスホチロシン-HPR結合物(Millipore))を10,000倍稀釈してプレートに添加した。細胞を抗体とともに3時間室温でインキュベートし、続いて0.1%トリトンX-100含有PBSで4回洗浄した。100μLの蛍光発生基質3,3’,5,5’-テトラメチルベンジジン(TMB)(Invitrogen, Carlsbad, CA)を添加し、蛍光発生のために5−10分間インキュベートした。蛍光発生反応は1NのHClを添加して停止させた。蛍光シグナルは、タイターテック(Titerteck)マルチスキャンMCC340リーダーにより450nmでプレートをスキャンして記録した。EC50値は、オリジンソフト(Origin Lab, Northampton, MA)を用いて、試験サンプル濃度に対してOD450nmをプロットすることによって計算した。
全てのアッセイでヒトインスリン標準物質又はヒトIGF標準物質と比較した活性が各実験内で決定され、続いて実験数に対して平均が決定される。したがって、あるアナローグのEC50又はIC50は受容体結合活性を示すであろう。
0.5%BSA含有DMEMでインスリンアナローグ及びインスリン標準物質について連続5倍稀釈を実施した。10μLのアナローグ溶液を10μLのインスリン溶液(12nM)と混合して、6nMのインスリン及び所望の濃度のインスリンアナローグを含む混合物を調製した。20μLの混合溶液を、トランスフェクト細胞を含む各ウェルに添加し、37℃で15分間インキュベートした。この後に続く手順は上記に記載した受容体キナーゼ活性アッセイと同じであった。
急性インスリン耐性試験を試験期間中ずっと絶食させたC57BL/6マウス又はdb/dbマウスで実施した。試験化合物は皮下に投与した。血中グルコースレベルを注射直前、並びに8時間試験では1、2、3、6及び8時間で、又は24時間試験では1、2、3、6、8、12及び24時間で測定した。
一連のPEG連結B1-B1ダイマーを調製し、受容体活性におけるリンカーの長さの影響を同定した。PEGリンカーの分子サイズは500Daから20KDaまで変化させた。全てのPEG連結B1-B1ダイマーはインスリン受容体で完全なアゴニストであった。それらの受容体活性は表17に要約されている。ダイマー#55は2つのインスリンアナローグ間にリンカーとして9ユニットの短いPEGを含み、#55の活性はそのモノマーペプチド骨格#20*と類似していた。ダイマー#56及び#57は相対的に大きなPEGリンカーを含んでいた。これは、おそらく立体的妨害のために受容体活性を高度に低下させた。PEGリンカーの分子サイズの増加は、明らかに受容体活性に対してより強い負の影響を誘発した。しかしながら、タイプA及びタイプB受容体の双方で、PEG20K架橋ダイマー(#57)は、20K PEG化モノマー(#39)よりもほぼ4倍強力であり、ダイマー構造はインスリン受容体に対して相乗的結合を誘発し受容体活性の増加をもたらすように思われることを示している。
#51:Lys B29 -Lys B29 インスリンダイマー(部分的アゴニスト):
ダイマー#51は、自然のままのインスリン配列で組み立てられたB29-B29架橋ダイマーである。ダイマー#51は、以前に報告したB29-B29’PEG連結ダイマーと構造的に類似するが、#51がジスルフィド結合によって架橋されているという点が異なる。同一ではないが、#51のリンカーの長さは、LysB29のε-アミンが8原子リンカーによって離されているので29-B29’ダイマーとほぼ同じである。さらにまた、#51は、B鎖及びA鎖のN末端にカルバミル化を含み、それは受容体効力を〜30%減少させるがインスリン受容体における完全なアゴニスト作用は維持した。
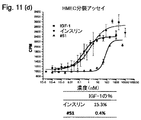
以前に報告したB29-B29’ダイマーと同じように、#51はまたインスリン受容体で部分的アゴニスト作用を示した。ダイマー#51はS字状用量応答曲線を誘発することができ、インスリン受容体でダイマー#51によって誘発される最大応答は、自然のままのインスリンによって誘発される最大応答のちょうど半分であった(図11A及び図11B)。インスリン受容体における他の弱い完全なアゴニストとは異なり、最大応答はリガンドの濃度を単純に上昇させることでは達成できなかった。部分的アゴニストのEC50は図11に列挙されなかった。なぜならば、当該値は、最大応答のレベルの相違のために完全アゴニストの値と対比させることができなかったからである。
部分的アゴニスト#51はまた、インスリン受容体でインスリン作用に対してアンタゴニスト作用を示した。アンタゴニスト作用を試験するために、インスリン受容体を過剰発現する操作HEK293細胞を表示の濃度の#51及び6nMのインスリンの組み合わせで処理した。受容体キナーゼ活性アッセイの以前の結果を基にして、6nMのインスリンが95%の最大応答を誘発できた。コントロール実験では、インスリンと入れ替えて当該手順をダイマー#51で繰り返した。この拮抗アッセイは、#51はインスリン作用と拮抗し、自然のままのインスリンによって誘発される最大応答の半分に受容体応答を減少させ得ることを示した。
ダイマー#51はまた、自然のままのインスリンと比較したときIGF-1受容体で効力の低下を示した(図11C)。応答曲線は低い効力のために不完全であったので、IGF-1受容体で#51は部分的アゴニストであったのか又は弱い完全アゴニストであったのかは明瞭ではない。ダイマー#51はまた、HMEC分裂アッセイでHMEC細胞増殖の刺激に弱い効力を示した(図11D)。
#53:Lys C8 -Lys C8 #3ダイマー(部分的アゴニスト):
ダイマー#53はアナローグ#3の2つの分子をダイマー化して調製された。ペプチド#3はIGF-1誘導単鎖アナローグであり、8-ユニットミニPEG、リジン及び4-ユニットミニPEGで連結されたIGF-1 B鎖及びA鎖を含む。インスリン受容体活性を回復させさらにIGF-1受容体活性を減少させるために、精選変異をB鎖及びA鎖に導入した。ペプチド#3はインスリン受容体で完全な効力を示した。追加のチオール基をメルカプトプロピオン酸との反応によりLysC8側鎖に導入した。それぞれのC8位の2つのチオール基の間にジスルフィド基を形成し、2つのペプチドを架橋してダイマー#53を生成した。
ダイマー#53はまたタイプA及びタイプB両インスリン受容体で部分的なアゴニストであった。#53によって誘発される最大応答はまた、両受容体でインスリンによって誘発される最大応答のちょうど半分であった。濃度の増加につれて、受容体応答は減少した。高濃度で、#53は当該受容体を完全に不活化することができた。拮抗アッセイは#53が競合的にインスリンの作用を阻害することを示し、高濃度ではインスリン受容体は完全にサイレントであった。IGF-1受容体では、#53はまた部分的アゴニスト作用を示した。#53は受容体応答刺激で不完全性を示したが、前記はインスリン受容体との結合では完全に強力であった。結合アッセイでは、#53は、濃度が増加するにつれインスリン受容体から放射能標識インスリンを完全に追い出すことができた。#53の結合親和性は自然のままのインスリンより〜1.5倍も高かった(図17)。結合親和性と生物学的応答誘発能力との間の矛盾は、インスリン作用に対するアンタゴニスト作用が理由であるはずである。この現象は、B29-B29’ダイマーの研究で報告され、B29-B29’ダイマー及びC8-C8’ダイマーの本データでもまた観察され、当該矛盾は部分的アゴニストダイマーの固有の構造的な特徴であることが示唆される。この部分的アゴニスト作用は、in vivoにおける新規な治療特性と不可分であり得る。なぜならば、インスリン作用と拮抗する能力は過剰投与の傾向を制限し得るからである。
アナローグ#3のC8位に結合される20kPEGを有するアナローグ#38は完全アゴニストである。したがって、C8位の改変により誘発される構造的変化で部分的アゴニスト作用は引き起こされなかった。ダイマー内の2つのインスリン分子間の距離の影響を調べるために、20K PEGリンカーを導入して、アナローグ#3の2つの分子をそれらのC8位で架橋した(前記はダイマー#58を生じた)。#58では、2つのインスリン分子は大きなPEGスペーサーで離され、より独立的に作用すると期待された。ダイマー#58はインスリン受容体で完全なアゴニスト作用を示し、おそらくは立体的PEGリンカーのために効力が低下した。PEGリンカーによるインスリン分子の分離はインスリン受容体における部分的アゴニスト作用を停止し、2つの活性部位間の距離は部分的アゴニスト作用にとって決定的であることを示唆した。PEG連結ダイマー#58はPEG化モノマー#38と類似する効力を示した。B1-B1 PEG連結ダイマーについて観察された効力の増加はC8-C8 PEG連結ダイマーでは出現せず、C8-C8’結合は、インスリン受容体との相乗的結合のためにB1-B1’結合ほど適切ではない可能性を示唆した。
ダイマー#54もまたIGF-1誘導単鎖アナローグ(#11*)から作製された。ミニPEGリンカーの代わりに、#11*のCドメインはIGF-1 Cペプチドに由来する12アミノ酸を含んでいた。IGF-1 CペプチドのArgC8をLysC8と取り替え、前記をダイマー化部位として用いた。ダイマー#54もまたインスリン受容体でほぼ完全なアゴニストであった(図18A及び18B)。#54によって誘発される最大受容体応答のレベルは、他の2つの部分的アゴニスト(#51及び#53)によって誘発されるものよりはるかに高かった。ダイマー#53及びダイマー#54は受容体における作用態様で大きな相違を示したが、ただしそれらはともにC8-C8'結合を有していた。前記相違はペプチド骨格の構造から発した。#3と#11*との間のもっとも顕著な相違はCドメインの内容であった。ペプチド#3はCドメインとして非ペプチジルPEGを利用し、一方、#11は12アミノ酸配列を含んでいた。両Cドメインの長さはほぼ同じであったが、PEGリンカーはアミノ酸配列よりも可撓性がより大きいと考えられ、構造的剛直性による拘束はおそらくより少なかった。構造的可撓性の重要性はまたB29-B29ダイマーの研究でも観察された。二鎖インスリンのダイマー(#51)は部分的アゴニストであり、一方、12アミノ酸CペプチドによるB鎖及びA鎖の結合(#52)は部分的アゴニスト作用を喪失させた。ペプチド#11*はまたB10及びA8位に追加された2つのHis変異を含み、前記は受容体選択性を高めるために設計された。これら2つの変異は、部分的アゴニスト作用の決定に必要とされる蓋然性はより少ないと考えられる。
B1-B1’ダイマー#50(完全アゴニスト)及びB29-B29’ダイマー#51(部分的アゴニスト):
完全アゴニスト#50及び部分的アゴニスト#51を実験期間中ずっと絶食させた正常マウスで試験した。試験化合物は皮下注射により投与し、血中グルコースレベルを注射後24時間にわたって測定した。
インスリンを正常マウスに陽性コントロールとして投与した。インスリンは注射後2時間以内に血中グルコースレベルの迅速な減少を誘発した。血中グルコースレベルは注射後2時間で上昇し始め、4時間後に基準線に復帰した(図14A)。完全アゴニスト#50はin vivoで効力の有意な強化を示した。#50の12nmol/kgの投薬は、自然のままのインスリンの60nmol/kg投薬と同様な血糖効果を示した。60nmol/kg用量で#50を投与された8匹のマウスのグループで2匹のマウスのみが生存し、300nmol/kg投与では当該グループのマウスはいずれも生存しなかった(図14B)。ダイマー#50はin vitroアッセイでは自然のままのインスリンよりも〜2倍強力であったが、in vivoではインスリンよりも約5倍強力であった。in vivoアッセイにおけるこの顕著な増加はアビジチーの結果の可能性がある(in vitro細胞系アッセイではそれを捕捉できなかった)。
部分的アゴニスト#51はin vivoで効力の低下を示した。#51の60nmol/kgの投薬によって誘発される血糖効果はインスリンの20nmol/kg投薬によって誘発される血糖効果と同様であった。#51の300nmol/kg投薬によって誘発される血中グルコースプロフィールはインスリンの60nmol/kg投薬によって誘発されるものと同様であった。最高の投薬の300nmol/kgでも、#51は低血糖を誘発しなかった(図14C)。この効力の低下は、in vitroで観察されたように、おそらく受容体における部分的活性化によって引き起こされる。
PEG化モノマー及びPEG連結ダイマーはともに血中グルコースの減少を誘発でき、前記作用は非PEG化ペプチドと比較して長く続いた。PEG化モノマーの血糖効果は24時間にわたって延長されたが、PEG連結ダイマーの投与後に血中グルコースレベルは6時間後に上昇を開始した。このことは、PEG連結ダイマーは、PEG化モノマーよりも循環からより迅速に除去される可能性があることを示した。
PEG連結ダイマーはインスリン受容体で完全なアゴニストであった。GlyB2-PEG20K-GlyB2ダイマー#57は、GlyB2-PEG20Kモノマー#39よりもin vitroで約5倍強力であった。しかしながら、ダイマー#57のin vivo血糖効果はモノマー#39の血糖効果よりも延長が短く、ダイマー#57の両投薬のAUCはモノマー#39のAUCよりも低かった。当該ダイマーによってもたらされる受容体における効力の増加は受容体媒介除去を加速する可能性があり、前記は薬理動態プロフィールの短縮をもたらすであろう(図15A及び15B参照)。
本実験では、我々は、B29及びA1をつなぐペプチド結合を介して1つの活性な単鎖インスリン及び1つの不活性なモノマーミニプロインスリンを含む共有結合連結インスリンヘテロダイマーを調製した。不活性なモノマーユニットは酵素により活性な状態に変換でき、前記は各モノマーユニットの個々の機能の解明を可能にした。さらにまた、我々は、IR-A優先IGF-2結合を介してIR-A活性に選択的に拮抗するように、2つのインスリン-IGF-2ヘテロダイマーを設計した。インスリン-インスリンヘテロダイマー及びインスリン-IGF-2ヘテロダイマーに関するこの構造情報は表18に要約され、これらのヘテロダイマーの構築に用いられたモノマーペプチドは表19に列挙されている。
ダイマー#59は2つの異なるインスリンアナローグ#2(sc)及び#3を含んでいた。前記ダイマーは、#2(sc)のB1位と#3のC8位との間で架橋された。#2及び#3はともに、インスリン受容体活性を回復しさらにIGF-1受容体活性を低下させる精選変異を有するIGF-1系配列から誘導された。ペプチド#2(sc)は、直鎖α-アミド結合によってつながれたLysB29及びGlyA1を有するB鎖及びA鎖を含んでいた。単鎖#2(sc)は、LysC酵素による処理で二鎖アナローグ#2(tc)に変換できた。ペプチド#2(tc)は、インスリン受容体との結合及び受容体活性化刺激において完全な効力を示した。アナローグ#2は、非天然アミノ酸ThzをB鎖のN-末端に含み、前記は水溶液中においてpH4.0でメトキシルアミンによる処理でシステインに変換できた。N-末端システインを他のペプチドの活性化チオール基と反応させてジスルフィドを形成した(前記は2つのインスリンモノマーを架橋してダイマーを形成する)。
#2の全合成は図23Aに示されている。2つのペプチドセグメントを段階的固相ペプチド合成によって個々に調製した。第一のセグメントはB鎖のN-末端18アミノ酸とともにネイティブケミカルリゲーションのために意図されるチオエステル活性化を含んでいた。4つのアルギニンを前記チオエステルのC末端に付加し、このセグメントの可溶性を強化した。第二のセグメントは残りのB鎖及び完全長のA鎖を含んでいた。この2つのペプチドセグメントを逆相クロマトグラフィーで精製してから、一緒に連結して完全長の単鎖インスリンを生成した。第二のセグメントのN-末端システインを第一のセグメントのC-末端チオエステルとチオール-チオエステル交換により反応させて、チオエステル連結中間体を生成した。再編成は5員環内で生じ、2つのペプチドセグメント間で本来のペプチド結合を形成した。連結反応の完了は分析用HPLC及び質量分析によって確認された。完了したら、脱塩及び緩衝液交換のために前記連結反応物をサイズ排除クロマトグラフィーにロードした。ペプチドを小分子試薬から分離し、折畳み緩衝液(20mMグリシン、0.5M GnHCl(pH0.5))と交換した。所望のペプチド生成物を含む分画をプールし、ペプチド濃度を0.5mg/mLに調整した。前記折畳み反応物にシステインを8mMの濃度で添加してジスルフィドシャッフリング及びペプチド再折畳みプロセスを促進した。窒素をペプチド溶液に送り込み空気媒介酸化を減少させた(前記によって過誤折り畳み異性体の生成が減少する)。折畳み反応は攪拌せずに室温でまた別には4℃で維持した。ペプチドの折り畳みプロセスを完了させるために、一般的には室温で24時間、4℃で48時間を要した。正確な構造に折り畳まれた後は疎水性が減少するので、折り畳みの進行は分析用HPLCで観察できた。ペプチドの折り畳みはまた質量分析によっても確認でき、3つのジスルフィド結合の形成により6ダルトンの分子量の減少が提示された。正確に折り畳まれたペプチドは、逆相クロマトグラフィーによって過誤折り畳み異性体及び他の試薬から分離された。続いて精製インスリンアナローグ#2をメトキシルアミン(pH4.0)で処理し、N末端Thzをシステインに変換した。チオール活性化試薬2,2’-ジチオビス(5-ニトロピリジン)(DTNP)もまた当該ペプチド溶液に添加して、N-末端システインのチオール基をin situで活性化した。チオール活性化インスリンアナローグ#2を逆相クロマトグラフィーで精製し、ヘテロダイマーの構築に用いた。
チオール活性化インスリンアナローグ#2及びチオール改変アナローグ#3を1:1の比でDMSOに溶解した。2つのチオール基との間のジスルフィド結合の形成は2つのインスリン分子間でB1-C8結合を生じて#59(CysB1-LysC8#2(sc)-#3インスリンヘテロダイマー)を生成した(図24A)。ダイマー#59はLysCプロテアーゼによって#60に変換できた。LysCは選択的にLysB29のC末端で切断され、二鎖構造を生成した(図24B)。
アナローグ#61は、1つの単鎖インスリンモノマー及び1つのIGF-2モノマーを含むヘテロダイマーであった。インスリンアナローグ#27のN-末端アミンはジスルフィド結合を介してIGF-2アナローグ#31のLysC8側鎖アミンと架橋された。ペプチド#27は、インスリンデスV B鎖、12アミノ酸IGF-1 C鎖及びインスリンA鎖を含む単鎖インスリンアナローグであった。ペプチド#31はArgC8Lys及びLysD4Argの2つの変異を有するIGF-2アナローグで、前記はC8位への位置特異的結合を可能にした。#27及び#31をともに大腸菌細胞での生合成で調製した。精製インスリンアナローグ#27を、s-トリチル-メルカプトプロピオン酸の活性化NHSエステルと反応させてN-末端アミンを改変した。トリチル保護基はTFAで切断して遊離チオール基を生じ、このチオール基を続いてDTNP(2,2’-ジチオビス(5-ニトロピリジン))を用いて活性化した(図25A)。チオール活性化インスリン#27は、IGF-2アナローグ#31と架橋させる前に精製した。意図的に、#31は配列のC8位にただ1つのリジンアミノ酸を含んでいた。アナローグ#31のN-末端アミンは、シアン酸カリウムとの反応によるpH7.0でのカルバミル化によって選択的に封鎖され、この活性化NHSエステルとのカップリングのためのただ1つの反応部位としてLysC8が残された。続いて、上記に記載した同じ手法を用いてメルカプトプロピオニル基でLysC8を改変した(図25B)。続いてDMSO中でチオール改変#31を#27と1:1の比で混合して、ダイマー#61(#27-#31ヘテロダイマー)を生成した(図25C)。ジスルフィド形成反応で遊離された5-ニトロピリジン-2-チオールはDMSO中で黄色を示した(前記は反応の進行を示した)。
#59の一方のモノマーを直鎖α-アミド結合でB29からA1に繋ぐことによって不活化した。以前の実験によって、インスリンのLysB29とA鎖のN末端との間のペプチド結合は当該分子を完全に不活化するが、B29-A1インスリンの結晶構造は自然のままのインスリンと本質的には同じであることが示された。一方のモノマーを不活化することによって、他方の活性なモノマーの機能を#59で解明しようとした。ダイマー#59は、タイプAインスリン受容体でほとんどアゴニスト作用を示さなかった。#59によって誘発される最大受容体応答は、基準線レベルから顕著には相違しなかった。インスリン受容体を過剰発現するHEK293細胞を6nMのインスリン及び指定濃度の#59で処理した。6nMのインスリン濃度は、インスリン受容体で最大応答の95%の誘発に有効であることが立証された。受容体応答は、6nMのインスリンの存在下で#59の濃度を増加させることによって低下し、ダイマー#59は、インスリン受容体のアンタゴニストとして作用して受容体応答を阻害できることが示された(図20A)。ポリエチレングリコール(PEG)のアナローグ#3のLysC8への結合はこの最大応答のレベルを変化させなかった(なぜならば、アナローグ#38は効力が低下した(EC50がより高い)完全なアゴニストであるからである)。インスリン配列の精選残基に結合させた部分(例えばPEG又は脂肪酸)が最大受容体活性化に影響を及ぼすことはこれまで報告されたことはない。不活性なインスリン分子を活性なインスリンペプチドに結合させることの生物学的な結果は、不活性なポリマー(例えばPEG)をインスリンに結合させることによる結果とは甚だしく相違した。アナローグ#2(sc)はインスリン受容体でPEGとほぼ同じ程度に不活性であったが、ダイマー構造で存在するとき前記は顕著な阻害効果を提示した。
不活性なモノマーユニット#2(sc)を、LysCプロテアーゼで処理して活性な二鎖構造#2(tc)に変換した(ダイマー#60が生成された)。B1-C8結合によって架橋された、#60の両ユニットは活性なものであった。酵素処理は部分的アゴニスト作用を回復させ、最大受容体応答は50%まで増加した。ダイマー#60もまたインスリン作用に対してアンタゴニスト効果を示した。6nMインスリンと一緒にインキュベートしたとき、#60の濃度の増加は受容体応答を100%近くから0%(基準線レベル)に低下させることができた(図20B)。#60は、#59よりも高い最大応答をインスリン受容体で誘発したが、インスリンの作用と拮抗する能力は#59とほぼ同じであった。拮抗試験で測定したとき、#60の50%最大阻害濃度(IC50)は1.89±0.29nMであったが、#59のIC50は2.08±0.54nMであった。タイプBインスリン受容体では、#59によって誘発される最大応答は、自然のままのインスリンによって誘発されるもののわずか10%であった。酵素処理によって生成されたダイマー#60はなお部分的アゴニストであったが、#60によって誘発される最大応答は50%に増加した(図20C)。ダイマー#59はIGF-1受容体で部分的アゴニスト作用を示した。#59によって誘発される最大応答レベルは、自然のままのIGF-1によって誘発される最大応答の50%であった。ダイマー#60は完全なアゴニストでありIGF-1受容体で顕著に効力が増加した(図20D)。#60のダイマー構造はIGF-1受容体との相乗的結合を可能にしたのかもしれない(前記は2つの弱い一価IGF-1受容体アゴニストを強力な二価ダイマーに変換した)。
#60の受容体応答曲線は本質的には#53のものと同じであった(#53はC8-C8結合を有するインスリンアナローグ#3のホモダイマーである)。このことは、1つのインスリンアナローグの別の単鎖インスリンのC8位への架橋は、B1-C8結合であろうと又はC8-C8結合であろうと部分的アゴニスト作用のための1つの要件であることを示唆した。C8位に結合されるモノマーインスリンユニットの受容体活性は、ダイマー化誘導体によって誘発されるインスリン受容体における最大応答のレベルに影響を及ぼした。このユニットが不活性であるとき、受容体活性はほぼ完全に阻害された。このユニットの受容体活性の回復はまた最大受容体応答のレベルを増加させた。
1つの不活性なモノマーユニットを含むヘテロダイマーについて観察された阻害効果は、受容体アイソフォーム選択性が強化されたヘテロダイマーを設計するという概念を提供した。インスリン受容体は2つのアイソフォームとして存在する(タイプAインスリン受容体(IR-A)及びタイプBインスリン受容体(IR-B))。IR-Bはもっぱらインスリン応答組織で発現され、代謝作用と不可分であると一般的に考えられている。IR-Bに対する優先性はインスリン薬剤設計で重要な意味を有する。なぜならば前記優先性は薬理学的利益の改善を提供し得るからである。インスリンは両アイソフォームに等しく結合しこれを活性化する。構造的に類似するペプチドIGF-2は、インスリンの親和性に近い親和性でIR-Aと結合できるが、IR-Bに対しては10倍低い結合親和性を有する。2つのインスリン分子のダイマー構造としての連結はインスリン受容体でアンタゴニスト作用を生じるので、IR-A優先IGF-2ペプチドとインスリンとの結合はまた、IR-BよりもIR-Aでより強いアンタゴニスト作用を提供するかもしれない。受容体活性化を刺激する固有の効力(前記はEC50で測定される)を改変する代わりに、受容体選択性を有するヘテロダイマーを設計して最大受容体応答のレベルを調整した。
化学合成によるインスリンヘテロダイマーの調製
インスリンアナローグ#2(sc) B1[Thz1H5Y16L17K29]29-A1[N18,21]を、固相ペプチド合成及びネイティブケミカルリゲーションによって合成した。ネイティブケミカルリゲーションの完了後、連結ペプチド#2(sc)をサイズ排除クロマトグラフィーにより折畳み緩衝液(0.5M GnHCl、20mMグリシン(pH10.5))に置き換えた。ペプチド濃度を0.5mg/mLに調整し、8mMシステインをペプチド溶液に添加した。折り畳み反応物を攪拌せずに24時間室温に静置した。折り畳み反応の完了は分析用逆相HPLC及び質量分析によってモニターできた。折り畳み完了後、pHを4.0に調整し、2mMのメトキシルアミンをペプチド溶液に添加した。チオール活性化試薬2,2’-ジチオビス(5-ニトロピリジン)(DTNP)もまたインスリンペプチド1当量につき2当量で添加した。一般的にThzからCysへの変換は完了に4時間を要し、CysB1はin situでDTNPにより活性化された。CysB1(Npys)-ペプチド#2(sc)は逆相HPLCで精製した。
単鎖インスリンアナローグ#3を活性化NHSエステルと反応させてチオール改変ペプチドを生成した。Trt-SCH2CH2CO-NHSエステルを調製するために、s-トリチル-メルカプトプロピオン酸(Trt-SCH2CH2COOH)(National Biochemical Corp., Ohio)、N-ヒドロキシスクシンイミド(NHS)(Sigma)及びジイソプロピルカルボジイミド(DIC)のそれぞれ1mmolを2mLのDMFに室温で30分間攪拌しながら混合した。インスリンペプチドを5%TFA含有無水DMFに10mMの濃度で溶解した。活性化Trt-SCH2CH2CO-NHSエステルの2当量を前記溶液に添加した。反応物を室温で2時間攪拌してから2%のエタノールアミンで終了させた。4%のチオアニソール(Sigma)及び8%のトリイソプロピルシラン(TIPS)(Sigma)を含む無水TFAの5倍体積を続いて添加し、トリチル保護基を除去した。脱保護反応物を室温で30分間攪拌し、続いてエーテルで20倍に稀釈してペプチドを沈殿物として抽出した。前記希釈反応物を遠心分離し、沈殿ペプチドを1%酢酸/20%アセトニトリル水溶液に溶解して凍結乾燥した。Cys活性化#2(sc)及びチオール改変#3をDMSOに1:1の比で溶解して、#2のCysB1と#3のLysC8(SCH2CH2COOH)との間でジスルフィド結合を形成させた(前記によってB1-C8連結ヘテロダイマー#59が生成された)。Npysはジスルフィド形成後に遊離されるので、ダイマー形成は黄色の発色によって示された。反応の過程は分析用HPLCによってモニターし、ダイマーの形成は質量分析によって確認した。ダイマー#59を逆相HPLCによって精製して凍結乾燥した。
ダイマー#61は、ダイマー#59のモノマー#2ユニットをLysCプロテアーゼによって二鎖構造に切断することによって生成した。ダイマー#59をPBSに0.5mg/mLの濃度で溶解した。1mgペプチドにつき0.5ユニットのLysCをペプチド溶液に添加した。切断反応物を37℃の水浴中で12時間インキュベートした。切断は、質量分析で分子量の18ダルトン増加により確認した。
インスリン及びIGF-2アナローグを大腸菌細胞から生物学的合成によって調製した。インスリンアナローグ#27*及びIGF-2アナローグ#31をN末端アミンでカルバミル化した。ペプチドを0.5mg/mLの濃度で、50mMシアン酸カリウム(Sigma)含有PBS緩衝液(pH7.0)に溶解した。前記反応物を一晩室温で攪拌し、カルバミル化反応の完了をMALDIで確認した。カルバミル化ペプチドを逆相カラムで脱塩し、ペプチドを含む分画をプールし凍結乾燥した。IGF-2のLysD4のε-アミンを封鎖するためにIGF-2ペプチドを50mMのNaHCO3水溶液(pH10.5)に溶解した。メチルアセトイミデート(Sigma)を50倍モル過剰でペプチド溶液に添加した。アセトイミド化反応物を室温で30分間攪拌した。1NのHClでpHを3.0に低下させて反応を終了した。
アナローグ#27*若しくはIGF-2ペプチドのN末端α-アミン又はカルバミル化#27*若しくは#31のリジン側鎖ε-アミンにHS-CH2CH2COを結合させた。インスリンアナローグ#27又は#27*に導入したチオール基をDTNPで活性化した。改変ペプチドを逆相HPLCで精製し、凍結乾燥した。#27及び#31を1:1の比でDMSOに溶解し、ダイマー#61を生成した。#27*及びIGF-2を1:1の比でDMSOに溶解し、ダイマー#62を生成した。
B1-C8結合を有する2つのインスリン-IGF-2ヘテロダイマーを設計して、2つのインスリン受容体アイソフォームにおけるそれらの活性を精査した。ダイマー#61は1つの単鎖インスリン#27及び1つのIGF-2アナローグ#31を含んでいた。#27のN末端はジスルフィド結合によって#31のLysC8に架橋された。ペプチド#31は、LysD4Arg及びArgC8Lysの2つの変異を有するIGF-2配列から誘導された。この設計はLysC8位との架橋反応をもたらした。これら2つの位置は受容体活性のために必須ではなく、これら2つの位置の変異は、IR-A及びIR-Bの双方でわずかに2倍効力を低下させた。ダイマー#62はまた1つの単鎖インスリンアナローグ#27*を含み、そのLysC8は自然のままのIGF-2のN-末端アミンにジスルフィド結合を介して架橋されていた。インスリン及びIGF-2モノマーの向きは、2つのモノマーユニットの向きの影響を調べるために#62で逆になっていた。
ダイマー#61は両受容体で部分的アゴニストであったが、最大応答はIR-Bで高かった。IR-Aでは、#61によって誘発される最大応答は、自然のままのインスリンによって誘発される最大応答の〜50%であったが、IR-Bでは最大応答は〜80%であった(図22A及び22B)。逆向きのインスリン及びIGF-1ユニットを含むダイマー#62もまたIR-Bでより高い最大応答を示した。ダイマー#62は、最大応答がIR-Bでインスリンのそれとほぼ同じであったのでIR-Bではほぼ完全なアゴニストであった。対照的に、#62はIR-Aではなお部分的アゴニストであった。前記はインスリンがタイプA受容体で誘発する最大応答の約80%を誘発した。
#61及び#62はともに、より高い最大応答で示されるようにタイプBインスリン受容体に対して優先性を示した。ダイマー#61は、受容体活性化において#62よりも強い阻害性作用を示した。なぜならば、両受容体アイソフォームで#61によって誘発される最大応答は、#62によって誘発されるものよりも低いからである。インスリン及びIGF-2モノマーユニットの向きは受容体選択性を変化させなかったが、受容体活性化の阻害にはなお影響を示した。#61及び#62の応答曲線はベル形であった(前記ベル形はインスリンホモダイマー#53及びインスリンヘテロダイマー#60についても観察された)。最大レベルに達した後、受容体応答は#61又は#62の濃度を増加させることによって低下した。しかしながら、#61又は#62では受容体応答は〜50%までしか低下しなかったが、一方、#53及び#60は高濃度で受容体活性化を完全に阻害することができた。#61及び#62はIGF-1受容体でともに部分的アゴニストであり、さらに#61は、最大受容体活性化で#62よりも強い阻害性作用を示した(図22E)。
本発明の好ましい態様は、下記の通りである。
〔1〕インスリンアナローグダイマーであって、以下のi)、ii)、iii)又はiv)の第一のインスリンポリペプチド及び第二のインスリンポリペプチド、
i)第一のインスリンポリペプチド及び第二のインスリンポリペプチドであって、
前記第一のインスリン及び第二のインスリンポリペプチドはともに単鎖インスリンアナローグであり、各々はA鎖、B鎖及び連結部分の第一並びに第二のセットを含み、A鎖、B鎖及び連結部分の各セットについて前記連結部分の第一の末端はB鎖のカルボキシ末端と共有結合しており、前記連結部分の第二の末端はA鎖のアミノ末端と共有結合しており、さらに第一及び第二のインスリンポリペプチドはPEGを介して互いに連結されているか、又は第一及び第二のインスリンポリペプチドそれぞれの連結部分のリジンの側鎖に共有結合するジスルフィド保有ダイマー化リンカーを介して互いに連結されており、
前記第一及び第二のインスリンポリペプチドのA鎖は、GIVEQCCTSICSLYQLENYCN(配列番号:1)、GIVDECCFRSCDLRRLENYCN(配列番号:11)、GIVDECCFRSCDLRRLEMYCA(配列番号:5)及びGIVEECCFRSCDLALLETYCA(配列番号:7)から独立して選択される配列を含み、
前記第一及び第二のインスリンポリペプチドのB鎖は、FVNQHLCGSHLVEALYLVCGERGFF(配列番号:23)、GPETLCGAELVDALYLVCGDRGFY(配列番号:77)、GPETLCGAELVDALQFVCGDRGFY(配列番号:89)、GPEHLCGAELVDALYLVCGDRGFY(配列番号:14)、AYRPSETLCGGELVDTLQFVCGDRGFY(配列番号:90)及びAYRPSETLCGGELVDTLYLVCGDRGFY(配列番号:92)から独立して選択される配列を含み、
前記第一及び第二のインスリンポリペプチドの連結部分は、GYGSSSRX 68 APQT(配列番号:9)、X 51 X 52 GSSSX 57 X 58 APQT(配列番号:16)及びPEG8-X 68 -PEG4から独立して選択される配列を含み、
X 51 はグリシン、アラニン、バリン、ロイシン、イソロイシン及びプロリンから成る群から選択され、
X 52 はアラニン、チロシン、バリン、ロイシン、イソロイシン又はプロリンであり、
X 57 及びX 58 の一方はアルギニンであり、他方は下記構造Iの側鎖を含むアミノ酸であり、
且つ、
X 68 は下記構造Iの側鎖を含むアミノ酸である、
ii)第一のインスリンポリペプチド及び第二のインスリンポリペプチドであって、
前記第一のインスリンポリペプチドは第一のA鎖及び第一のB鎖を含む二鎖インスリンアナローグであり、前記第一のA鎖及び第一のB鎖は鎖間ジスルフィド結合を介して互いに連結されており、
前記第二のインスリンポリペプチドは第二のA鎖、第二のB鎖及び連結部分を含む単鎖インスリンアナローグであり、前記連結部分の第一の末端は第二のB鎖のカルボキシ末端と共有結合しており、前記連結部分の第二の末端は第二のA鎖のアミノ末端と共有結合しており、
第一及び第二のインスリンポリペプチドはジスルフィド保有ダイマー化リンカーを介して互いに連結されており、該ダイマー化リンカーの第一の末端は前記第一のインスリンポリペプチドのB鎖のN-末端アミノ酸の側鎖と共有結合しており、該ダイマー化リンカーの第二の末端は第二のインスリンポリペプチドの連結部分のリジンの側鎖と共有結合しており、
前記第一及び第二のインスリンポリペプチドのA鎖は、GIVEQCCTSICSLYQLENYCN(配列番号:1)、GIVDECCFRSCDLRRLENYCN(配列番号:11)、GIVDECCFRSCDLRRLEMYCA(配列番号:5)及びGIVEECCFRSCDLALLETYCA(配列番号:7)から独立して選択される配列を含み、
前記第一のインスリンポリペプチドのB鎖は、CFVNQHLCGSHLVEALYLVCGERGFFYTPKT(配列番号:94)、CGPETLCGAELVDALYLVCGDRGFYFNKPT(配列番号:95)、CGPETLCGAELVDALQFVCGDRGFYFNKPT(配列番号:96)、CGPEHLCGAELVDALYLVCGDRGFYNKPT(配列番号:97)、CAYRPSETLCGGELVDTLQFVCGDRGFY(配列番号:91)及びCAYRPSETLCGGELVDTLYLVCGDRGFY(配列番号:93)から独立して選択される配列を含み、
前記第二のインスリンポリペプチドのB鎖は、FVNQHLCGSHLVEALYLVCGERGFF(配列番号:23)、GPETLCGAELVDALYLVCGDRGFY(配列番号:77)、GPETLCGAELVDALQFVCGDRGFY(配列番号:89)、GPEHLCGAELVDALYLVCGDRGFY(配列番号:14)、AYRPSETLCGGELVDTLQFVCGDRGFY(配列番号:90)及びAYRPSETLCGGELVDTLYLVCGDRGFY(配列番号:92)から独立して選択される配列を含み、
前記第二のインスリンポリペプチドの連結部分は、GYGSSSRX 68 APQT(配列番号:9)、X 51 X 52 GSSSX 57 X 58 APQT(配列番号:16)及びPEG8-X 68 -PEG4から独立して選択される配列を含み、
X 51 はグリシン、アラニン、バリン、ロイシン、イソロイシン及びプロリンから成る群から選択され、
X 52 はアラニン、チロシン、バリン、ロイシン、イソロイシン又はプロリンであり、
X 57 及びX 58 の一方はアルギニンであり、他方は下記構造Iの側鎖を含むアミノ酸であり、
X 68 は下記構造Iの側鎖を含むアミノ酸である、
iii)第一のインスリンポリペプチド及び第二のインスリンポリペプチドあって、
前記第一のインスリン及び第二のインスリンポリペプチドはともに、それぞれA鎖及びB鎖の第一並びに第二のセットを含む二鎖インスリンアナローグであり、各セットのA鎖及びB鎖は鎖間ジスルフィド結合を介して互いに連結されており、さらに該第一及び第二のインスリンポリペプチドは、2つのB鎖それぞれのカルボキシ末端アミノ酸の側鎖を継ぎ合わせるダイマー化リンカーを介して互いに連結されており、
前記第一及び第二のインスリンポリペプチドのA鎖は、GIVEQCCTSICSLYQLENYCN(配列番号:1)、GIVDECCFRSCDLRRLENYCN(配列番号:11)、GIVDECCFRSCDLRRLEMYCA(配列番号:5)及びGIVEECCFRSCDLALLETYCA(配列番号:7)から成る群から独立して選択される配列を含み、
前記第一及び第二のインスリンのB鎖は、FVNQHLCGSHLVEALYLVCGERGFFYTPX 68 T(配列番号:2)及びGPETLCGAELVDALYLVCGDRGFYFNX 68 PT(配列番号:99)から成る群から独立して選択される配列を含み、
X 68 は下記構造Iの側鎖を含むアミノ酸である、
iv)第一のインスリンポリペプチド及び第二のインスリンポリペプチドであって、
前記第一のインスリン及び第二のインスリンポリペプチドはともに、各々がA鎖、B鎖及び連結部分の第一並びに第二のセットを含む単鎖インスリンアナローグであり、A鎖、B鎖及び連結部分の各セットについて前記連結部分の第一の末端はB鎖のカルボキシ末端と共有結合しており、前記連結部分の第二の末端はA鎖のアミノ末端と共有結合しており、さらに第一及び第二のインスリンポリペプチドはPEG又はジスルフィド保有ダイマー化リンカーを介して互いに連結されており、ここで該ダイマー化リンカーの第一の末端は第一又は第二のインスリンポリペプチドの一方の連結部分のリジンの側鎖と共有結合しており、該ダイマー化リンカーの第二の末端は他方の第一又は第二のインスリンポリペプチドのB鎖のN-末端アミンと共有結合しており、
前記第一のインスリンポリペプチドのA鎖は、配列TPAKSEGIVEECCFRSCDLALLETYCA(配列番号:103)を含み、
前記第一のインスリンポリペプチドのB鎖は、配列AYRPSETLCGGELVDTLQFVCGDRGFY(配列番号:90)又はAYRPSETLCGGELVDTLYLVCGDRGFY(配列番号:92)を含み、
前記第二のインスリンポリペプチドのA鎖は、配列GIVEQCCTSICSLYQLENYCN(配列番号:1)を含み、
前記第二のインスリンポリペプチドのB鎖は、FVNQHLCGSHLVEALYLVCGERGFF(配列番号:23)及びGPEHLCGAELVDALYLVCGDRGFY(配列番号:14)から独立して選択される配列を含み、
前記第一及び第二のインスリンポリペプチドの連結部分はGYGSSSRX68APQT(配列番号:9)、SRVSRX68SR(配列番号:87)及びPEG8-X 68 -PEG4から独立して選択される配列を含み、
X 68 はアルギニン又は下記構造Iの側鎖を含むアミノ酸である、
を含む、インスリンアナローグダイマー。
〔2〕前記ダイマーが第一のインスリンポリペプチド及び第二のインスリンポリペプチドを含み、
前記第一のインスリン及び第二のインスリンポリペプチドがともに単鎖インスリンアナローグであり、
前記第一及び第二のインスリンのA鎖がGIVEQCCTSICSLYQLENYCN(配列番号:1)及びGIVDECCFRSCDLRRLENYCN(配列番号:11)から独立して選択される配列を含み、
前記第一及び第二のインスリンのB鎖がFVNQHLCGSHLVEALYLVCGERGFF(配列番号:23)及びGPEHLCGAELVDALYLVCGDRGFY(配列番号:14)から独立して選択される配列を含み、
前記ダイマー化リンカーがGYGSSSRX 68 APQT(配列番号:9)及びPEG8-X 68 -PEG4から独立して選択される配列を含み、
X 68 が下記構造Iの側鎖を含むアミノ酸である、
前記〔1〕に記載のインスリンアナローグダイマー。
〔3〕前記ダイマーが第一のインスリンポリペプチド及び第二のインスリンポリペプチドを含み、
前記第一のインスリンポリペプチドが第一のA鎖及び第一のB鎖を含む二鎖インスリンアナローグであり、前記第一のA鎖及び第一のB鎖が鎖間ジスルフィド結合を介して互いに連結されており、
前記第二のインスリンポリペプチドが第二のA鎖、第二のB鎖及び連結部分を含む単鎖インスリンアナローグであり、前記連結部分の第一の末端が第二のB鎖のカルボキシ末端と共有結合しており、前記連結部分の第二の末端が第二のA鎖のアミノ末端と共有結合しており、
第一及び第二のインスリンポリペプチドが、第一のインスリンポリペプチドのB鎖のN-末端システイン側鎖と第二のインスリンポリペプチドの連結部分の改変リジンの側鎖との間でジスルフィド結合を介して互いに連結されており、
前記第一及び第二のインスリンポリペプチドのA鎖が、GIVEQCCTSICSLYQLENYCN(配列番号:1)、GIVDECCFRSCDLRRLENYCN(配列番号:11)、GIVDECCFRSCDLRRLEMYCA(配列番号:5)及びGIVEECCFRSCDLALLETYCA(配列番号:7)から独立して選択される配列を含み、
前記第一のインスリンポリペプチドのB鎖がCFVNQHLCGSHLVEALYLVCGERGFFYTPKT(配列番号:94)及びCGPEHLCGAELVDALYLVCGDRGFYNKPT(配列番号:97)から独立して選択される配列を含み、
前記第二のインスリンポリペプチドのB鎖がFVNQHLCGSHLVEALYLVCGERGFF(配列番号:23)及びGPEHLCGAELVDALYLVCGDRGFY(配列番号:14)から独立して選択される配列を含み、
前記第二のインスリンポリペプチドの連結部分が配列GYGSSSRX 68 APQT(配列番号:9)を含み、X 68 が下記の側鎖を含むアミノ酸である、
前記〔1〕に記載のインスリンアナローグダイマー。
〔4〕前記ダイマーが第一のインスリンポリペプチド及び第二のインスリンポリペプチドを含み、
前記第一のインスリン及び第二のインスリンポリペプチドがともに単鎖インスリンアナローグであり、
前記第一のインスリンポリペプチドのA鎖が配列TPAKSEGIVEECCFRSCDLALLETYCA(配列番号:103)を含み、
前記第一のインスリンポリペプチドのB鎖が配列AYRPSETLCGGELVDTLQFVCGDRGFY(配列番号:90)を含み、前記第一のインスリンポリペプチドのための連結部分が配列SRVSRX 68 SR(配列番号:98)を含み、
前記第二のインスリンポリペプチドのA鎖が配列GIVEQCCTSICSLYQLENYCN(配列番号:1)を含み、
前記第二のインスリンポリペプチドのB鎖が配列FVNQHLCGSHLVEALYLVCGERGFF(配列番号:23)を含み、前記第二のインスリンポリペプチドのための連結部分が配列GYGSSSRX 68 APQT(配列番号:9)を含み、
X 68 がアルギニン又は下記構造Iの側鎖を含むアミノ酸である、
前記〔1〕に記載のインスリンアナローグダイマー。
〔5〕糖尿病治療に付随する低血糖のリスクを軽減する方法であって、前記方法が、前記〔1〕〜〔4〕のいずれか1項に記載のインスリンアナローグダイマーを含む医薬組成物の有効量を投与する工程を含む、前記方法。
〔6〕部分的アゴニストインスリンダイマーを含む医薬組成物の有効量を投与する工程を含む、糖尿病治療に付随する低血糖のリスクを軽減する方法であって、
前記部分的アゴニストインスリンダイマーが、ダイマー化リンカーを介して互いに連結されている第一及び第二のインスリンポリペプチドを含み、前記第一及び第二のインスリンポリペプチドは各々独立して、下記i)及びii)から成る群から選択されるインスリンポリペプチドを含み、
i)鎖間ジスルフィド結合を介して連結されているA鎖及びB鎖を含む二鎖ヘテロ二重体、ii)A鎖、B鎖及び連結部分を含む単鎖インスリンポリペプチドであって、前記連結部分の第一の末端がB鎖のカルボキシ末端と共有結合しており、前記連結部分の第二の末端がA鎖のアミノ末端と共有結合している前記ポリペプチド、
前記A鎖はGIVX4X 5 CCX 8 X 9 X 10 CX 12 LX 14 X 15 LEX 18 X 19 CX 21 -R 13 (配列番号:70)の配列を含み、
前記B鎖はX 25 LCGX 29 X 30 LVX 33 X 34 LYLVCGX 41 X 42 GFX 45 (配列番号:44)の配列を含み、
X 4 はグルタミン酸又はアスパラギン酸であり、
X 5 はグルタミン酸又はグルタミンであり、
X 8 はスレオニン、ヒスチジン又はフェニルアラニンであり、
X 9 はセリン、アルギニン、オルニチン又はアラニンあり、
X 10 はセリン又はイソロイシンであり、
X 12 はセリン又はアスパラギン酸であり、
X 14 はアルギニン、チロシン、オルニチン又はアラニンであり、
X 15 はグルタミン、アルギニン、アラニン、オルニチン又はロイシンであり、
X 18 はメチオニン、アスパラギン又はスレオニンであり、
X 19 はチロシン、4-メトキシ-フェニルアラニン又は4-アミノフェニルアラニンであり、
X 21 はアラニン、グリシン又はアスパラギンであり、
X 25 はヒスチジン又はスレオニンであり、
X 29 アラニン、グリシン又はセリンであり、
X 30 はヒスチジン、アスパラギン酸、グルタミン酸、ホモシステイン酸又はシステイン酸であり、
X 33 はアスパラギン酸又はグルタミン酸であり、
X 34 はアラニン又はスレオニンであり、
X 41 はアスパラギン酸又はグルタミン酸であり、
X 42 はアラニン、オルニチン又はアルギニンであり、
X 45 はチロシン又はフェニルアラニンであり、及び、
R 13 はCOOH又はCONH 2 であり、且つ、
a)第一及び第二のインスリンポリペプチドは、第一及び第二のインスリンポリペプチドそれぞれのB29位アミノ酸の側鎖を介して互いに連結されているか、
b)前記第一及び第二のインスリンポリペプチドの少なくとも一方は単鎖インスリンポリペプチドであり、該第一及び第二のインスリンポリペプチドは、前記第一及び第二のインスリンポリペプチドの一方のB1位アミノ酸の側鎖と前記連結部分のアミノ酸の側鎖とを介して互いに連結されているか、又は
c)第一及び第二のインスリンポリペプチドがともに単鎖インスリンポリペプチドであり、該第一及び第二のインスリンポリペプチドは、第一及び第二のインスリンポリペプチドそれぞれの連結部分のアミノ酸の側鎖を介して互いに連結されている、前記方法。
〔7〕該単鎖インスリンアナローグの連結部分が、GYGSSSRX 68 APQT(配列番号:9)、SRVSRX 68 SR(配列番号:98)、X 51 X 52 GSSSX 57 X 58 APQT(配列番号:16)、(SSSSX 59 APPPSLPSPSRLPGPSDTPILPQX 60 ) n (配列番号:18)、MGSSSSX 59 APPPSLPSPSRLPGPSDTPILPQEEEEEX 60 (配列番号:19)及びW 2 -Z 2 -Y 2 から成る群から選択され、
W 2 はPEG6、PEG7又はPEG8であり、
Y 2 はPEG4、PEG5又はPEG6であり、且つ
Z 2 はリジン、システイン、又は下記構造Iの側鎖を含むアミノ酸であり、
nは1、2又は3から成る群から選択される整数であり、
X 51 はグリシン、アラニン、バリン、ロイシン、イソロイシン及びプロリンから成る群から選択され、
X 52 はアラニン、チロシン、バリン、ロイシン、イソロイシン又はプロリンであり、
X 57 及びX 58 は独立して、アルギニン、リジン、システイン、ホモシステイン、アセチルフェニルアラニン又はオルニチンであり、
X 59 及びX 60 は独立してアルギニン又はリジンであり、且つ
X 68 は、アルギニン、システイン、又は下記構造Iの側鎖を含むアミノ酸であり、
mは1−4〜選択される整数である、
前記〔6〕に記載の方法。
〔8〕該第一及び第二のインスリンポリペプチドの連結部分が独立して、SRVSRX 68 SR(配列番号:98)、GYGSSSRKAPQT(配列番号:21)、GYGSSSRX 68 APQT(配列番号:9)及びPEG8-X 68 -PEG4から成る群から選択され、
X 68 が下記構造Iの側鎖を含むアミノ酸であり、
mが4である、
前記〔6〕又は〔7〕に記載の方法。
〔9〕該第一のインスリンポリペプチドが第一の連結部分を含む単鎖インスリンポリペプチドであり、第一及び第二のインスリンポリペプチドが、第二のインスリンポリペプチドのN-末端アミン又はB1位アミノ酸の側鎖と前記第一の連結部分のアミノ酸の側鎖とを介して互いに連結されている、前記〔6〕〜〔8〕のいずれか1項に記載の方法。
〔10〕該第二のインスリンポリペプチドが、鎖間ジスルフィド結合を介して連結されているA鎖及びB鎖を含む二鎖ヘテロ二重体であり、該第一のインスリンポリペプチドが、A鎖、B鎖及び連結部分を含む単鎖インスリンポリペプチドであり、該連結部分がPEG8-X 68 -PEG4又はGYGSSSRX 68 APQT(配列番号:9)であり、X 68 が下記構造IIの側鎖を含むアミノ酸であり、
且つ、
前記第一及び第二のインスリンポリペプチドが、第二のインスリンポリペプチドのN-末端アミン又はB1位アミノ酸の側鎖と第一のインスリンポリペプチドの連結部分に存在する構造IIの側鎖を含むアミノ酸とを介して互いに連結されている、前記〔6〕〜〔8〕のいずれか1項に記載の方法。
〔11〕該第一及び第二のインスリンポリペプチドが、GIVEQCCTSICSLYQLENYCN(配列番号:1)、GIVDECCFRSCDLRRLENYCN(配列番号:11)、GIVDECCFRSCDLRRLEMYCA(配列番号:5)及びGIVEECCFRSCDLALLETYCA(配列番号:7)から成る群から独立して選択されるA鎖、並びにFVNQHLCGSHLVEALYLVCGERGFFYTPKT(配列番号:2)、FVNQHLCGSHLVEALYLVCGERGFF(配列番号:23)、GPETLCGAELVDALYLVCGDRGFY(配列番号:77)、CGPEHLCGAELVDALYLVCGDRGFYFNPK(配列番号:78)、GPETLCGAELVDALYLVCGDRGFYFNKPT(配列番号:79)及びAYRPSETLCGGELVDTLYLVCGDRGFYFSRPA(配列番号:80)から成る群から独立して選択されるB鎖を含む、前記〔6〕〜〔10〕のいずれか1項に記載の方法。
〔12〕該第一及び第二のインスリンポリペプチドが各々単鎖インスリンポリペプチドであり、
該第一のインスリンポリペプチドが、GIVEQCCTSICSLYQLENYCN(配列番号:1)のA鎖配列、FVNQHLCGSHLVEALYLVCGERGFF(配列番号:23)のB鎖配列、並びにPEG8-X 68 -PEG4及びGYGSSSRX 68 APQT(配列番号:9)から成る群から選択される配列を含む第一の連結部分を含み、
該第二のインスリンポリペプチドが、GIVEECCFRSCDLALLETYCA(配列番号:7)、TPAX 75 SEGIVEECCFRSCDLALLETYCA(配列番号:88)又はGIVDECCFRSCDLRRLEMYCA(配列番号:5)のA鎖配列、AYRPSETLCGGELVDTLQFVCGDRGFYFSRPA(配列番号:87)又はGPETLCGAELVDALQFVCGDRGFYFNKPT(配列番号:10)のB鎖配列、並びにPEG8-X 68 -PEG4及びGYGSSSRX 68 APQT(配列番号:9)から成る群から選択される配列を含む第二の連結部分を含み、
X 68 はアルギニン又は下記構造Iの側鎖を含むアミノ酸であり、
X 75 はリジン又はアルギニンであり、さらに、
該第一及び第二のインスリンポリペプチドは、前記第一又は第二のインスリンポリペプチドの一方のN末端アミン又はB1位アミノ酸の側鎖と他方のインスリンポリペプチドの連結部分のリジン側鎖とを介して互いに連結されている、前記〔6〕に記載の方法。
〔13〕第一のインスリンポリペプチド及び第二のインスリンポリペプチドを含むインスリンアナローグダイマーであって、
前記第一のインスリンポリペプチドは単鎖インスリンポリペプチドであり、GIVX 4 X 5 CCX 8 X 9 X 10 CX 12 LX 14 X 15 LEX 18 X 19 CX 21 -R 13 (配列番号:70)の第一のA鎖配列、X 25 LCGX 29 X 30 LVX 33 X 34 LYLVCGX 41 X 42 GFX 45 (配列番号:44)の第一のB鎖配列及び第一の連結部分を含み、前記第一の連結ペプチドの第一の末端は第一のB鎖のカルボキシ末端と共有結合しており、前記第一の連結部分の第二の末端は第一のA鎖のアミノ末端と共有結合しており、
前記第二のインスリンポリペプチドは単鎖インスリン又は二鎖インスリンであって、GIVX 4 X 5 CCX 8 X 9 X 10 CX 12 LX 14 X 15 LEX 18 X 19 CX 21 -R 13 (配列番号:70)の第二のA鎖配列及びX 25 LCGX 29 X 30 LVX 33 X 34 LYLVCGX 41 X 42 GFX 45 (配列番号:44)の第二のB鎖配列を含むが、ただし前記第二のインスリンポリペプチドが単鎖インスリンであるときは、前記第二のインスリンポリペプチドはさらに第二の連結部分を含むことを条件とし、ここで前記第二の連結部分の第一の末端は該B鎖のカルボキシ末端と共有結合しており、前記第二の連結部分の第二の末端は該A鎖のアミノ末端と共有結合しており、
前記第一及び第二のインスリンポリペプチドは、前記第一の連結部分の8位アミノ酸の側鎖を、a)第二のインスリンポリペプチドのアミノ末端、又はb)第二の連結部分の8位アミノ酸の側鎖と共有結合により連結する結合又は二官能性連結部分を介して互いに連結されており、
X 4 はグルタミン酸又はアスパラギン酸であり、
X 5 はグルタミン酸又はグルタミンであり、
X 8 はスレオニン、ヒスチジン又はフェニルアラニンであり、
X 9 はセリン、アルギニン、オルニチン又はアラニンあり、
X 10 はセリン又はイソロイシンであり、
X 12 はセリン又はアスパラギン酸であり、
X 14 はアルギニン、チロシン、オルニチン又はアラニンであり、
X 15 はグルタミン、アルギニン、アラニン、オルニチン又はロイシンであり、
X 18 はメチオニン、アスパラギン又はスレオニンであり、
X 19 はチロシン、4-メトキシ-フェニルアラニン又は4-アミノフェニルアラニンであり、
X 21 はアラニン、グリシン又はアスパラギンであり、
X 25 はヒスチジン又はスレオニンであり、
X 29 アラニン、グリシン又はセリンであり、
X 30 はヒスチジン、アスパラギン酸、グルタミン酸、ホモシステイン酸又はシステイン酸であり、
X 33 はアスパラギン酸又はグルタミン酸であり、
X 34 はアラニン又はスレオニンであり、
X 41 はアスパラギン酸又はグルタミン酸であり、
X 42 はアラニン、オルニチン又はアルギニンであり、
X 45 はチロシン又はフェニルアラニンであり、且つ
R 13 はCOOH又はCONH 2 であり、さらに、
前記ダイマーが、自然のままのインスリンと比較して60%以下の最大用量応答を示す、前記インスリンアナローグダイマー。
〔14〕前記第一及び場合によって第二の連結部分が独立して、GYGSSSRX 68 APQT(配列番号:9)、SRVSRX 68 SR(配列番号:98)、X 51 X 52 GSSSX 57 X 58 APQT(配列番号:16)、(SSSSX 59 APPPSLPSPSRLPGPSDTPILPQX 60 ) n (配列番号:18)、MGSSSSX 59 APPPSLPSPSRLPGPSDTPILPQEEEEEX 60 (配列番号:19)及びW 2 -Z 2 -Y 2 から成る群から選択され、
W 2 はPEG6、PEG7又はPEG8であり、
Y 2 はPEG4、PEG5又はPEG6であり、且つ
Z 2 はリジン、システイン、又は下記構造Iの側鎖を含むアミノ酸であり
nは1、2又は3から成る群から選択される整数であり、
X 51 はグリシン、アラニン、バリン、ロイシン、イソロイシン及びプロリンから成る群から選択され、
X 52 はアラニン、チロシン、バリン、ロイシン、イソロイシン又はプロリンであり、
X 57 及びX 58 は独立して、アルギニン、リジン、システイン、ホモシステイン、アセチルフェニルアラニン又はオルニチンであり、
X 59 及びX 60 は独立してアルギニン又はリジンであり、且つ
X 68 はシステイン又は下記構造Iの側鎖を含むアミノ酸であり、
mは1〜4から選択される整数である、
前記〔13〕に記載のインスリンアナローグダイマー。
〔15〕前記第一及び場合によって第二の連結部分が独立して、配列GYGSSSRKAPQT(配列番号:21)、GYGSSSRX 68 APQT(配列番号:9)、SRVSRX 68 SR(配列番号:98)又はPEG8-X 68 -PEG4から成り、mが4である、前記〔13〕に記載のインスリンアナローグダイマー。
〔16〕該第二のインスリンポリペプチドが二鎖インスリンであり、前記第一及び第二のインスリンポリペプチドが、第一の連結ペプチドの8位アミノ酸のアミノ酸側鎖を、第二のインスリンポリペプチドのB鎖のN-末端アルファアミンに共有結合により連結する結合又は二官能性連結部分を介して互いに共有結合されている、前記〔13〕〜〔15〕のいずれか1項に記載のインスリンアナローグダイマー。
〔17〕該第二のインスリンポリペプチドが単鎖インスリンであり、前記第一及び第二のインスリンポリペプチドが、前記第一の連結ペプチドの8位アミノ酸のアミノ酸側鎖を、前記第二の連結ペプチドの8位アミノ酸の側鎖に共有結合により連結する結合又は二官能性連結部分を介して互いに共有結合されている、前記〔15〕に記載のインスリンアナローグダイマー。
〔18〕該第一の連結部分がPEG8-X 68 -PEG4又は配列GYGSSSRX 68 APQT(配列番号:9)から成り、
X 68 は下記構造Iの側鎖を有するアミノ酸であり、
mは1〜4から選択される整数であり、且つ、第一及び第二のインスリンポリペプチドが、下記構造Iの側鎖を有する第一の連結部分のアミノ酸の側鎖と、
第二のインスリンポリペプチドのN-末端に付加されるシステインの側鎖との間でジスルフィド結合を介して互いに共有結合されている、前記〔15〕に記載のインスリンアナローグダイマー。
〔19〕該第一及び第二のインスリンポリペプチドが同じ配列を有する、前記〔13〕〜〔18〕のいずれか1項に記載のインスリンアナローグダイマー。
〔20〕該第一のインスリンポリペプチドが自然のままのヒトインスリンA及びB鎖を含み、該第二のインスリンポリペプチドがIGF-2 A及びB鎖を含む、前記〔13〕〜〔18〕のいずれか1項に記載のインスリンアナローグダイマー。
〔21〕該第一及び第二のインスリンポリペプチドが各々単鎖インスリンポリペプチドであり、
該第一のインスリンポリペプチドが、GIVEQCCTSICSLYQLENYCN(配列番号:1)のA鎖配列、FVNQHLCGSHLVEALYLVCGERGFF(配列番号:23)のB鎖配列、並びにPEG8-X 68 -PEG4及びGYGSSSRX 68 APQT(配列番号:9)から成る群から選択される配列を含む第一の連結部分を含み、且つ
該第二のポリペプチドが、TPAX75SEGIVEECCFRSCDLALLETYCA(配列番号:88)のA鎖配列、AYRPSETLCGGELVDTLQFVCGDRGFYFSRPA(配列番号:87)のB鎖配列、並びにPEG8-X 68 -PEG4及びGYGSSSRX 68 APQT(配列番号:9)から成る群から選択される配列を含む第二の連結部分を含み、
X 68 はアルギニン又は下記構造Iの側鎖を含むアミノ酸であり、
X 75 はリジン又はアルギニンであり、さらに、
第一及び第二のインスリンポリペプチドは、前記第一又は第二のインスリンポリペプチドの一方のB鎖のN末端アミン又はB1位アミノ酸の側鎖と他方のインスリンポリペプチドの連結部分のリジン側鎖とを介して互いに連結されている、
前記〔20〕に記載のインスリンアナローグダイマー。
〔22〕該第一及び第二のインスリンポリペプチドが、GIVDECCX 8 X 9 SCDLRRLEX 18 YCX 21 -R 13 (配列番号:81)のA鎖配列及びX 25 LCGAELVDALYLVCGDX 42 GFY(配列番号:82)のB鎖配列を含み、
X 8 はヒスチジン又はフェニルアラニンであり、
X 9 はアルギニン、オルニチン又はアラニンであり、
X 18 はメチオニン、アスパラギンであり、
X 21 はアラニン又はアスパラギンであり、
X 25 はヒスチジン又はスレオニンであり、
X 42 はアラニン、オルニチン及びアルギニンから成る群から選択され、且つ
R 13 はCOOHである、
前記〔13〕〜〔20〕のいずれか1項に記載のインスリンアナローグダイマー。
〔23〕該第一及び第二のインスリンポリペプチドが、GIVEQCCTSICSLYQLENYCN(配列番号:1)、GIVDECCFRSCDLRRLEMYCA(配列番号:5)及びGIVEECCFRSCDLALLETYCA(配列番号:7)から成る群から独立して選択されるA鎖、並びにFVNQHLCGSHLVEALYLVCGERGFFYTPKT(配列番号:2)、GPETLCGAELVDALYLVCGDRGFY(配列番号:77)、GPETLCGAELVDALYLVCGDRGFYFNKPT(配列番号:)及びAYRPSETLCGGELVDTLYLVCGDRGFYFSRPA(配列番号:80)から成る群から独立して選択されるB鎖を含む、前記〔22〕に記載のインスリンアナローグダイマー。
〔24〕X 8 がフェニルアラニンであり、X 9 がアルギニンあり、X 18 及びX 21 がともにアスパラギンであり、X 25 がヒスチジンであり、且つ、X 42 がアルギニンである、前記〔22〕に記載のインスリンアナローグダイマー。
〔25〕前記第一及び第二のインスリンポリペプチドのA鎖がGIVDECCX8RSCDLRRLENYCN(配列番号:83)及びGIVEQCCTSICSLYQLENYCN(配列番号:1)から独立して選択される配列を含み、前記第一及び第二のインスリンポリペプチドのB鎖がGPETLCGAELVDALYLVCGDRGFY(配列番号:77)、HLCGAELVDALYLVCGDRGFY(配列番号:84)及びHLCGSHLVEALYLVCGERGFF(配列番号:85)から独立して選択される配列を含み、X 8 がヒスチジン又はフェニルアラニンである、前記〔13〕〜〔20〕のいずれか1項に記載のインスリンアナローグダイマー。
〔26〕親水性部分が、該連結部分のアミノ酸と、又はA鎖のA9、A14及びA15から成る群から選択される位置又はB鎖のB1、B2、B10、B22、B28若しくはB29位のアミノ酸で共有結合により連結されている、前記〔1〕〜〔4〕及び〔13〕〜〔25〕のいずれか1項に記載のインスリンアナローグダイマー。
〔27〕該親水性部分がポリエチレングリコール鎖である、前記〔26〕に記載のインスリンアナローグダイマー。
〔28〕下記式Xの構造のジペプチド成分をさらに含む、前記〔1〕〜〔4〕及び〔13〕〜〔27〕のいずれか1項に記載のインスリンアナローグダイマーであって、
前記ジペプチド成分は、該ジペプチド成分と第一又は第二のインスリンポリペプチドのアミンとの間で形成されるアミド結合を介して前記インスリンアナローグダイマーに連結されており、
R 1 、R 2 、R 4 及びR 8 は、H、C 1 -C 18 アルキル、C 2 -C 18 アルケニル、(C 1 -C 18 アルキル)OH、(C 1 -C 18 アルキル)SH、(C 2 -C 3 アルキル)SCH 3 、(C 1 -C 4 アルキル)CONH 2 、(C 1 -C 4 アルキル)COOH、(C 1 -C 4 アルキル)NH 2 、(C 1 -C 4 アルキル)NHC(NH 2 + )NH 2 、(C 0 -C 4 アルキル)(C 3 -C 6 シクロアルキル)、(C 0 -C 4 アルキル)(C 2 -C 5 複素環)、(C 0 -C 4 アルキル)(C 6 -C 10 アリール)R 7 、(C 1 -C 4 アルキル)(C 3 -C 9 ヘテロアリール)、及びC 1 -C 12 アルキル(W 1 )C 1 -C 12 アルキルから成る群から独立して選択され、W 1 はN、S及びOから成る群から選択されるヘテロ原子であり、又は
R 1 及びR 2 は、それらが結合する原子と一緒にC 3 -C 12 シクロアルキル又はアリールを形成しているか、若しくは
R 4 及びR 8 はそれらが結合する原子と一緒にC 3 -C 6 シクロアルキルを形成しており、
R 3 は、C 1 -C 18 アルキル、(C 1 -C 18 アルキル)OH、(C 1 -C 18 アルキル)NH 2 、(C 1 -C 18 アルキル)SH、(C 0 -C 4 アルキル)(C 3 -C 6 )シクロアルキル、(C 0 -C 4 アルキル)(C 2 -C 5 複素環)、(C 0 -C 4 アルキル)(C 6 -C 10 アリール)R 7 、及び(C 1 -C 4 アルキル)(C 3 -C 9 ヘテロアリール) から成る群から選択されるか、又はR 4 及びR 3 はそれらが結合する原子と一緒に4、5又は6員複素環式環を形成しており、
R 5 はNHR 6 又はOHであり、
R 6 はH、C 1 -C 8 アルキルであるか、又はR 6 及びR 1 はそれらが結合する原子と一緒に4、5又は6員複素環式環を形成しており、且つ
R 7 は、H、OH、C 1 -C 18 アルキル、C 2 -C 18 アルケニル、(C 0 -C 4 アルキル)CONH 2 、(C 0 -C 4 アルキル)COOH、(C 0 -C 4 アルキル)NH 2 、(C 0 -C 4 アルキル)OH、及びハロから成る群から選択される、
前記インスリンアナローグダイマー。
〔29〕R 1 及びR 2 が独立してC 1 -C 18 アルキル又はアリールであり、
R 3 はC 1 -C 18 アルキルであるか、又はR 3 及びR 4 はそれらが結合する原子と一緒に4〜12複素環式環を形成しており、
R 4 及びR 8 は水素、C 1 -C 18 アルキル及びアリールから成る群から独立して選択され、且つ
R 5 はアミン又はヒドロキシルである、
前記〔28〕に記載のインスリンアナローグダイマー。
〔30〕R 1 及びR 2 が水素、C 1 -C 8 アルキル及びアリールから成る群から独立して選択され、
R 3 はC 1 -C 18 アルキルであるか、又はR 3 及びR 4 はそれらが結合する原子と一緒に4〜6複素環式環を形成しており、
R 4 及びR 8 は各々水素であり、且つ
R 5 は、アミン、N-置換アミン及びヒドロキシルから成る群から選択される、
前記〔28〕に記載のインスリンアナローグダイマー。
〔31〕該ジペプチド成分のアミノ酸に連結されたデポーポリマーをさらに含む、前記〔28〕に記載のインスリンアナローグダイマー。
〔32〕第一又は第二のインスリンポリペプチドのアミノ酸側鎖が、アルキルアミン、アミド、エーテル、エステル、チオエーテル、又はチオエステル結合によりアシル基又はアルキル基に共有結合により付着しており、前記アシル基又はアルキル基は天然に存在するアミノ酸にとって本来のものではない、前記〔1〕〜〔4〕及び〔8〕〜〔26〕のいずれか1項に記載のインスリンアナローグダイマー。
〔33〕ジペプチド成分を構成するアミノ酸の一つのアミノ酸側鎖が、アルキルアミン、アミド、エーテル、エステル、チオエーエル、又はチオエステル結合によりアシル基又はアルキル基に共有結合により付着しており、前記アシル基又はアルキル基は天然に存在するアミノ酸にとって本来のものではない、前記〔28〕〜〔30〕のいずれか1項に記載のインスリンアナローグダイマー。
〔34〕前記ダイマーが、B鎖のN-末端アルファアミン、A14、A15、B1、B2、B10、B22、B28、B29位アミノ酸の側鎖、アミノ酸の側鎖、又は連結部分のアミノ酸の側鎖から選択される1つ以上の位置でアシル化されている、前記〔32〕に記載のインスリンアナローグダイマー。
〔35〕前記〔1〕〜〔4〕又は〔13〕〜〔34〕のいずれか1項に記載のインスリンアナローグダイマー及び医薬的に許容できる担体を含む、医薬組成物。
〔36〕糖尿病を治療する方法であって、前記方法が前記〔35〕に記載の医薬組成物の有効量を投与する工程を含む、前記方法。
〔37〕高血糖治療用医薬の製造における、前記〔1〕〜〔4〕又は〔13〕〜〔34〕のいずれか1項に記載の化合物の使用。
〔38〕糖尿病を治療するための、前記〔1〕〜〔4〕又は〔13〕〜〔34〕のいずれか1項に記載の化合物の使用。
Claims (10)
- 第一のインスリンポリペプチド及び第二のインスリンポリペプチドを含むインスリンアナローグダイマーであって、
i)前記第一及び第二のインスリンポリペプチドはともに単鎖インスリンアナローグであり、各々はA鎖、B鎖及び連結部分を含み、
前記第一及び第二のインスリンポリペプチドの各々について、前記連結部分の第一の末端はB鎖のカルボキシ末端と共有結合しており、前記連結部分の第二の末端はA鎖のアミノ末端と共有結合しており、
前記第一のインスリンポリペプチドは第一の連結部分、第一のA鎖及び第一のB鎖を含み、かつ、前記第二のインスリンポリペプチドは第二の連結部分、第二のA鎖及び第二のB鎖を含み、
前記第一及び第二のA鎖の配列はそれぞれ、GIVEQCCTSICSLYQLENYCN(配列番号:1)及びGIVDECCFRSCDLRRLENYCN(配列番号:11)からなる群より独立して選択される配列を含み、
前記第一及び第二のB鎖の配列はそれぞれ、FVNQHLCGSHLVEALYLVCGERGFF(配列番号:23)及びGPEHLCGAELVDALYLVCGDRGFY(配列番号:14)からなる群より独立して選択される配列を含み、
前記第一及び第二のインスリンポリペプチドは、前記第一及び第二の連結部分のアミノ酸側鎖間のジスルフィド結合を介して互いに連結されており、前記第一及び第二の連結部分はそれぞれ、配列GYGSSSRX 68 APQT(配列番号:9)を含み、X 68 は下記構造の側鎖を含むアミノ酸である
、又は、
ii)前記第一のインスリンポリペプチドは第一のA鎖及び第一のB鎖を含む二鎖インスリンアナローグであり、前記第一のA鎖及び第一のB鎖は鎖間ジスルフィド結合を介して互いに連結されており、
前記第二のインスリンポリペプチドは第二のA鎖、第二のB鎖及び第二の連結部分を含む単鎖インスリンアナローグであり、前記第二の連結部分の第一の末端は第二のB鎖のカルボキシ末端と共有結合しており、前記第二の連結部分の第二の末端は第二のA鎖のアミノ末端と共有結合しており、
前記第一及び第二のインスリンポリペプチドが、第一のインスリンポリペプチドのB鎖のN-末端システイン側鎖と第二の連結部分の改変リジンの側鎖との間でジスルフィド結合を介して互いに連結されており、
前記第一及び第二のインスリンポリペプチドのA鎖が、GIVEQCCTSICSLYQLENYCN(配列番号:1)、GIVDECCFRSCDLRRLENYCN(配列番号:11)、GIVDECCFRSCDLRRLEMYCA(配列番号:5)及びGIVEECCFRSCDLALLETYCA(配列番号:7)から独立して選択される配列を含み、 前記第一のインスリンポリペプチドのB鎖がCFVNQHLCGSHLVEALYLVCGERGFFYTPKT(配列番号:94)及びCGPEHLCGAELVDALYLVCGDRGFYNKPT(配列番号:97)から独立して選択される配列を含み、
前記第二のインスリンポリペプチドのB鎖がFVNQHLCGSHLVEALYLVCGERGFF(配列番号:23)及びGPEHLCGAELVDALYLVCGDRGFY(配列番号:14)から独立して選択される配列を含み、 前記第二のインスリンポリペプチドの第二の連結部分が配列GYGSSSRX 68 APQT(配列番号:9)を含み、X 68 が下記の側鎖を含むアミノ酸である、
、前記インスリンアナローグダイマー。 - 前記第一及び第二のインスリンポリペプチドがともに、配列が同一の単鎖インスリンアナローグである、請求項1に記載のインスリンアナローグダイマー。
- 前記第一及び第二のインスリンポリペプチドがともに単鎖インスリンアナローグであり、
前記第一及び第二のインスリンポリペプチドのA鎖がそれぞれGIVEQCCTSICSLYQLENYCN(配列番号:1)の配列を含み、
前記第一及び第二のインスリンポリペプチドのB鎖がそれぞれGPEHLCGAELVDALYLVCGDRGFY(配列番号:14)の配列を含み、
前記第一及び第二のインスリンポリペプチドは、前記第一及び第二の連結部分のアミノ酸側鎖間のジスルフィド結合を介して互いに連結されている、請求項1に記載のインスリンアナローグダイマー。 - 前記第一のインスリンポリペプチドが第一のA鎖及び第一のB鎖を含む二鎖インスリンアナローグであり、前記第一のA鎖及び第一のB鎖が鎖間ジスルフィド結合を介して互いに連結されており、
前記第二のインスリンポリペプチドが第二のA鎖、第二のB鎖及び第二の連結部分を含む単鎖インスリンアナローグであり、前記第二の連結部分の第一の末端が第二のB鎖のカルボキシ末端と共有結合しており、前記第二の連結部分の第二の末端が第二のA鎖のアミノ末端と共有結合しており、
前記第一及び第二のインスリンポリペプチドの第一及び第二のA鎖がそれぞれ、GIVDECCFRSCDLRRLENYCN(配列番号:11)の配列を含み、
前記第一のインスリンポリペプチドの第一のB鎖がCGPEHLCGAELVDALYLVCGDRGFYNKPT(配列番号:97)の配列を含み、
前記第二のインスリンポリペプチドの第二のB鎖がGPEHLCGAELVDALYLVCGDRGFY(配列番号:14)の配列を含み、
前記第二のインスリンポリペプチドの第二の連結部分が配列GYGSSSRX68APQT(配列番号:9)を含み、X68が下記の側鎖を含むアミノ酸であり、
前記第一及び第二のインスリンポリペプチドが、第一のインスリンポリペプチドのB鎖のN-末端システイン側鎖と第二の連結部分の8位のアミノ酸の側鎖との間でジスルフィド結合を介して互いに連結されている、請求項1に記載のインスリンアナローグダイマー。 - 親水性部分が、第一又は第二の連結部分のアミノ酸と、又はA鎖のA9、A14及びA15から成る群から選択される位置又はB鎖のB1、B2、B10、B22、B28若しくはB29位のアミノ酸で共有結合により連結されている、請求項1〜4のいずれか1項に記載のインスリンアナローグダイマー。
- 前記親水性部分がポリエチレングリコール鎖である、請求項5に記載のインスリンアナローグダイマー。
- 下記式Xの構造のジペプチド成分をさらに含む、請求項1〜4のいずれか1項に記載のインスリンアナローグダイマーであって、
前記ジペプチド成分は、該ジペプチド成分と第一又は第二のインスリンポリペプチドのアミンとの間で形成されるアミド結合を介して前記インスリンアナローグダイマーに連結されており、
R1、R2、R4及びR8は、H、C1-C18アルキル、C2-C18アルケニル、(C1-C18アルキル)OH、(C1-C18アルキル)SH、(C2-C3アルキル)SCH3、(C1-C4アルキル)CONH2、(C1-C4アルキル)COOH、(C1-C4アルキル)NH2、(C1-C4アルキル)NHC(NH2 +)NH2、(C0-C4アルキル)(C3-C6シクロアルキル)、(C0-C4アルキル)(C2-C5複素環)、(C0-C4アルキル)(C6-C10アリール)R7、(C1-C4アルキル)(C3-C9ヘテロアリール)、及びC1-C12アルキル(W1)C1-C12アルキルから成る群から独立して選択され、W1はN、S及びOから成る群から選択されるヘテロ原子であり、又は
R1及びR2は、それらが結合する原子と一緒にC3-C12シクロアルキル又はアリールを形成しているか、若しくは
R4及びR8はそれらが結合する原子と一緒にC3-C6シクロアルキルを形成しており、
R3は、C1-C18アルキル、(C1-C18アルキル)OH、(C1-C18アルキル)NH2、(C1-C18アルキル)SH、(C0-C4アルキル)(C3-C6)シクロアルキル、(C0-C4アルキル)(C2-C5複素環)、(C0-C4アルキル)(C6-C10アリール)R7、及び(C1-C4アルキル)(C3-C9ヘテロアリール) から成る群から選択されるか、又はR4及びR3はそれらが結合する原子と一緒に4、5又は6員複素環式環を形成しており、
R5はNHR6又はOHであり、
R6はH、C1-C8アルキルであるか、又はR6及びR1はそれらが結合する原子と一緒に4、5又は6員複素環式環を形成しており、且つ
R7は、H、OH、C1-C18アルキル、C2-C18アルケニル、(C0-C4アルキル)CONH2、(C0-C4アルキル)COOH、(C0-C4アルキル)NH2、(C0-C4アルキル)OH、及びハロから成る群から選択される、
前記インスリンアナローグダイマー。 - 第一又は第二のインスリンポリペプチドのアミノ酸側鎖が、アルキルアミン、アミド、エーテル、エステル、チオエーテル、又はチオエステル結合によりアシル基又はアルキル基に共有結合により付着しており、前記アシル基又はアルキル基は天然に存在するアミノ酸にとって本来のものではない、請求項1〜4のいずれか1項に記載のインスリンアナローグダイマー。
- 請求項1〜8のいずれか1項に記載のインスリンアナローグダイマー及び医薬的に許容できる担体を含む、医薬組成物。
- 糖尿病の治療に用いるための、請求項9に記載の医薬組成物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261705834P | 2012-09-26 | 2012-09-26 | |
| US61/705,834 | 2012-09-26 | ||
| PCT/US2013/061676 WO2014052451A2 (en) | 2012-09-26 | 2013-09-25 | Insulin analog dimers |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2015532283A JP2015532283A (ja) | 2015-11-09 |
| JP2015532283A5 JP2015532283A5 (ja) | 2016-11-10 |
| JP6387008B2 true JP6387008B2 (ja) | 2018-09-05 |
Family
ID=50389126
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015534623A Expired - Fee Related JP6387008B2 (ja) | 2012-09-26 | 2013-09-25 | インスリンアナローグダイマー |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US9593156B2 (ja) |
| EP (2) | EP2900255B1 (ja) |
| JP (1) | JP6387008B2 (ja) |
| CN (2) | CN104981251B (ja) |
| AU (1) | AU2013323669B2 (ja) |
| CA (1) | CA2886228A1 (ja) |
| WO (1) | WO2014052451A2 (ja) |
Families Citing this family (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2011146902A1 (en) | 2010-05-21 | 2011-11-24 | Merrimack Pharmaceuticals, Inc. | Bi-specific fusion proteins |
| MX2015005662A (es) * | 2012-11-05 | 2015-08-20 | Univ Case Western Reserve | Analogos de insulina de una sola cadena de larga accion. |
| KR102101136B1 (ko) | 2014-11-21 | 2020-04-14 | 머크 샤프 앤드 돔 코포레이션 | 인슐린 수용체 부분 효능제 |
| KR101669140B1 (ko) | 2015-04-28 | 2016-10-26 | (주)케어젠 | 항비만 및 항당뇨 효능을 갖는 펩타이드 및 이의 용도 |
| AR105616A1 (es) | 2015-05-07 | 2017-10-25 | Lilly Co Eli | Proteínas de fusión |
| CA3000742A1 (en) | 2015-10-02 | 2017-04-06 | Silver Creek Pharmaceuticals, Inc. | Bi-specific therapeutic proteins for tissue repair |
| US11058775B2 (en) * | 2016-04-26 | 2021-07-13 | Merck Sharp & Dohme Corp. | Insulin dimer-incretin conjugates |
| US10953076B2 (en) | 2016-05-24 | 2021-03-23 | Merck Sharp & Dohme Corp. | Insulin receptor partial agonists and GLP-1 analogues |
| WO2017205309A1 (en) * | 2016-05-25 | 2017-11-30 | Merck Sharp & Dohme Corp. | Insulin receptor partial agonists |
| WO2017210077A1 (en) * | 2016-06-02 | 2017-12-07 | Indiana University Research And Technology Corporation | Single chain insulin prodrugs |
| KR101887577B1 (ko) * | 2016-10-19 | 2018-09-10 | (주)케어젠 | 항비만 및 항당뇨 효능을 갖는 펩타이드 및 이의 용도 |
| EP3645713A4 (en) * | 2017-06-27 | 2021-06-30 | Codexis, Inc. | PENICILLIN G ACYLASES |
| MA49896A (fr) | 2017-08-17 | 2020-06-24 | Novo Nordisk As | Nouveaux analogues d'insuline acylés et leurs utilisations |
| EP3956355A4 (en) * | 2019-04-19 | 2023-01-18 | The Trustees of Indiana University | STABILIZATION OF PRANDIAL OR BASAL INSULIN ANALOGS BY AN INTERNAL DISELENIDE BRIDGE |
| CN113801236A (zh) * | 2020-06-11 | 2021-12-17 | 宁波鲲鹏生物科技有限公司 | 一种赖脯胰岛素的制备方法 |
| CN113801235A (zh) * | 2020-06-11 | 2021-12-17 | 宁波鲲鹏生物科技有限公司 | 一种赖脯胰岛素衍生物及其应用 |
| WO2022081794A1 (en) * | 2020-10-15 | 2022-04-21 | Tavotek Biotherapeutics (Hong Kong) Limited | Shielded biologics with masking domains to shield antigen binding capability of biologics and uses thereof |
| US20230120635A1 (en) * | 2021-10-12 | 2023-04-20 | Betavive Ltd. | Peptides and Fragments for Treating Diabetes and Associated Metabolic Diseases |
Family Cites Families (82)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3740385A (en) | 1970-05-07 | 1973-06-19 | M Ondetti | N-terminal derivatives of secretin |
| US4450150A (en) | 1973-05-17 | 1984-05-22 | Arthur D. Little, Inc. | Biodegradable, implantable drug delivery depots, and method for preparing and using the same |
| US4275152A (en) | 1977-02-03 | 1981-06-23 | Eastman Kodak Company | Hydrolysis of protein-bound cholesterol esters |
| DK119785D0 (da) | 1985-03-15 | 1985-03-15 | Nordisk Gentofte | Insulinpraeparat |
| PH25772A (en) | 1985-08-30 | 1991-10-18 | Novo Industri As | Insulin analogues, process for their preparation |
| PT83613B (en) | 1985-10-28 | 1988-11-21 | Lilly Co Eli | Process for the selective chemical removal of a protein amino-terminal residue |
| US4741897A (en) | 1986-07-08 | 1988-05-03 | Baxter Travenol | Thyroxine analogs and reagents for thyroid hormone assays |
| US4876242A (en) | 1987-09-21 | 1989-10-24 | Merck & Co., Inc. | Human insulin-like growth factor analoges with reduced binding to serum carrier proteins and their production in yeast |
| GB8728561D0 (en) | 1987-12-07 | 1988-01-13 | Glaxo Group Ltd | Chemical compounds |
| US5514646A (en) | 1989-02-09 | 1996-05-07 | Chance; Ronald E. | Insulin analogs modified at position 29 of the B chain |
| US6225449B1 (en) | 1991-10-04 | 2001-05-01 | Washington University | Hormone analogs with multiple CTP extensions |
| HU210142B (en) | 1989-04-20 | 1995-02-28 | Sinai School Medicine | Process for producing hepatospecific insulin-analogues and pharmaceutical compositions containing them |
| US5268453A (en) | 1991-08-08 | 1993-12-07 | Scios Inc. | Tissue-selective insulin analogs |
| AU680462B2 (en) * | 1992-12-18 | 1997-07-31 | Eli Lilly And Company | Insulin analogs |
| EP0688364A4 (en) | 1993-03-09 | 1997-10-15 | Abbott Lab | ENZYMES PRODUCED BY GENETIC ENGINEERING AND CONJUGATES OF SAID ENZYMES FOR DIAGNOSTIC ANALYSIS |
| US5359030A (en) | 1993-05-10 | 1994-10-25 | Protein Delivery, Inc. | Conjugation-stabilized polypeptide compositions, therapeutic delivery and diagnostic formulations comprising same, and method of making and using the same |
| US6476290B1 (en) | 1995-04-19 | 2002-11-05 | Dalhousie University | Transgenic tilapia comprising a humanized insulin gene |
| AU5724996A (en) | 1995-05-05 | 1996-11-21 | Eli Lilly And Company | Single chain insulin with high bioactivity |
| US6180767B1 (en) | 1996-01-11 | 2001-01-30 | Thomas Jefferson University | Peptide nucleic acid conjugates |
| JP2001505872A (ja) | 1996-09-09 | 2001-05-08 | ジーランド ファーマシューティカルズ アクティーゼルスカブ | α―ヒドロキシ酸リンカーを含むペプチドプロドラッグ |
| UA65549C2 (uk) | 1996-11-05 | 2004-04-15 | Елі Ліллі Енд Компані | Спосіб регулювання ожиріння шляхом периферійного введення аналогів та похідних glp-1 (варіанти) та фармацевтична композиція |
| AU2546399A (en) | 1998-02-10 | 1999-08-30 | Yoshitomi Pharmaceutical Industries, Ltd. | Preparations with controlled release |
| HUP0100928A3 (en) | 1998-02-23 | 2001-11-28 | Neurocrine Biosciences Inc San | Methods for treatment of diabetes using peptide analogues of insulin |
| EP1950223A3 (en) | 1998-03-09 | 2009-05-13 | Zealand Pharma A/S | Pharmacologically active peptide conjugates having a reduced tendency towards enzymatic hydrolysis |
| US20030236190A1 (en) | 1998-09-02 | 2003-12-25 | Renuka Pillutla | Isulin and IGF-1 receptor agonists and antagonists |
| US6875741B2 (en) | 1998-09-02 | 2005-04-05 | Renuka Pillutla | Insulin and IGF-1 receptor agonists and antagonists |
| GB2344287A (en) | 1998-12-03 | 2000-06-07 | Ferring Bv | Controlled release pharmaceutical formulation |
| DE19908041A1 (de) | 1999-02-24 | 2000-08-31 | Hoecker Hartwig | Kovalent verbrückte Insulindimere |
| MXPA01009805A (es) | 1999-03-29 | 2004-07-30 | Univ Ulster | Peptido. |
| US6746853B1 (en) | 1999-05-19 | 2004-06-08 | Xencor, Inc. | Proteins with insulin-like activity useful in the treatment of diabetes |
| AUPQ661800A0 (en) | 2000-03-31 | 2000-05-04 | Metabolic Pharmaceuticals Limited | Insulin-potentiating compounds |
| CN1454214A (zh) | 2000-08-02 | 2003-11-05 | 赛莱技术公司 | 具有增高功效的修饰生物肽 |
| WO2002012201A1 (en) | 2000-08-04 | 2002-02-14 | Dmi Biosciences, Inc. | Method of synthesizing diketopiperazines |
| ATE516820T1 (de) | 2000-09-29 | 2011-08-15 | Schering Corp | Pegyliertes interleukin 10 |
| KR100449454B1 (ko) | 2000-10-02 | 2004-09-21 | 이현철 | 단일사슬 인슐린 유도체의 유전자를 포함하는 당뇨병치료용 벡터 |
| KR101229995B1 (ko) | 2000-12-11 | 2013-02-06 | 씨제이 주식회사 | 생체내 에리스로포이에틴 활성이 증진된 융합단백질 |
| EP1243276A1 (en) | 2001-03-23 | 2002-09-25 | Franciscus Marinus Hendrikus De Groot | Elongated and multiple spacers containing activatible prodrugs |
| EP2322631B1 (en) | 2001-04-19 | 2014-11-12 | The Scripps Research Institute | Methods and compositions for the prodcution of orthogonal tRNA-aminoacyl-tRNA synthetase pairs |
| MXPA04006084A (es) | 2001-12-20 | 2005-03-31 | Lilly Co Eli | Molecula de insulina que tiene una accion en el tiempo prolongada. |
| FR2842209B1 (fr) | 2002-07-09 | 2007-11-23 | Nouvelle protease aspartique dite saspase et son utilisation dans le domaine cosmetique et therapeutique | |
| ATE458534T1 (de) | 2002-10-04 | 2010-03-15 | Microchips Inc | Medizinische vorrichtung zur gesteuerten arzneimittelverabreichung sowie herzüberwachung und/oder herzstimulation |
| WO2004067548A2 (en) | 2003-01-31 | 2004-08-12 | Theratechnologies Inc. | Chemically modified metabolites of regulatory peptides and methods of producing and using same |
| EP1626981A4 (en) | 2003-03-04 | 2006-11-22 | Biorexis Pharmaceutical Corp | PROTEINS PROTECTED AGAINST DIPEPTIDYLPEPTIDASE |
| EP1605897B1 (en) | 2003-03-19 | 2012-07-25 | Eli Lilly And Company | Polyethelene glycol link glp-1 compounds |
| CA2843439A1 (en) | 2003-04-08 | 2004-10-21 | Yeda Research And Development Co. Ltd | Reversible pegylated drugs |
| BRPI0414539B8 (pt) | 2003-09-19 | 2021-05-25 | Novo Nordisk As | composto, composição farmacêutica, e, uso de um composto |
| WO2005035003A2 (en) | 2003-09-22 | 2005-04-21 | Dihedron Corporation | Compositions and methods for increasing drug efficiency |
| PT1680443E (pt) | 2003-11-05 | 2013-12-11 | Harvard College | Péptidos alfa-helicoidais estabilizados e suas utilizações |
| CN102816228A (zh) | 2003-12-03 | 2012-12-12 | 诺和诺德公司 | 单链胰岛素 |
| WO2006047214A2 (en) | 2004-10-21 | 2006-05-04 | Igf Oncology, Llc | Toxins and radionuclides coupled to igf-1 receptor ligands for treatment of cancer |
| WO2006097521A1 (en) | 2005-03-18 | 2006-09-21 | Novo Nordisk A/S | Pegylated single-chain insulin |
| US7521211B2 (en) * | 2005-04-05 | 2009-04-21 | Regeneron Pharmaceuticals, Inc | IGF-1 and IGF-2 chimeric polypeptides and therapeutic uses thereof |
| US20090209453A1 (en) | 2005-04-13 | 2009-08-20 | University Of Medicine And Dentistry Of New Jersey | Glycoprotein Hormone Analogs |
| GB2427360A (en) * | 2005-06-22 | 2006-12-27 | Complex Biosystems Gmbh | Aliphatic prodrug linker |
| US8304386B2 (en) | 2006-02-03 | 2012-11-06 | Prolor Biotech, Inc. | Long-acting growth hormone and methods of producing same |
| US20090069216A1 (en) | 2006-02-21 | 2009-03-12 | Novo Nordisk A/S | Single-Chain Insulin Analogues and Pharmaceutical Formulations Thereof |
| WO2007104786A1 (en) | 2006-03-15 | 2007-09-20 | Novo Nordisk A/S | Mixtures of amylin and insulin |
| US9505823B2 (en) | 2006-08-07 | 2016-11-29 | TEV A Biopharmaceuticals USA, Inc. | Albumin-insulin fusion proteins |
| JP5399244B2 (ja) | 2006-08-17 | 2014-01-29 | アミリン・ファーマシューティカルズ,リミテッド・ライアビリティ・カンパニー | 選択可能な特性を持つdpp−iv耐性gipハイブリッドポリペプチド |
| CL2007002502A1 (es) | 2006-08-31 | 2008-05-30 | Hoffmann La Roche | Variantes del factor de crecimiento similar a insulina-1 humano (igf-1) pegilados en lisina; metodo de produccion; proteina de fusion que la comprende; y su uso para tratar la enfermedad de alzheimer. |
| AU2007292903B2 (en) | 2006-09-08 | 2012-03-29 | Ambrx, Inc. | Modified human plasma polypeptide or Fc scaffolds and their uses |
| US20090098130A1 (en) * | 2007-01-05 | 2009-04-16 | Bradshaw Curt W | Glucagon-like protein-1 receptor (glp-1r) agonist compounds |
| RU2422134C1 (ru) | 2007-04-19 | 2011-06-27 | Донг-А Фармасьютикал. Ко., Лтд | Композиция биоразлагающихся микросфер, пригодная для контролируемого высвобождения контролирующего уровень глюкозы пептида, и ее состав |
| EP2036539A1 (en) | 2007-09-11 | 2009-03-18 | Novo Nordisk A/S | Stable formulations of amylin and its analogues |
| EP2036923A1 (en) | 2007-09-11 | 2009-03-18 | Novo Nordisk A/S | Improved derivates of amylin |
| CN101157725B (zh) | 2007-10-24 | 2012-07-25 | 中国药科大学 | 人胰岛素类似物的制备方法及用途 |
| US8946148B2 (en) | 2007-11-20 | 2015-02-03 | Ambrx, Inc. | Modified insulin polypeptides and their uses |
| AR063987A1 (es) | 2007-11-27 | 2009-03-04 | Segundo Mariano | Aposito utilizable como cobertura temporal para el tratamiento de heridas y procesos para su fabricacion |
| CN101983066B (zh) | 2008-01-30 | 2016-06-29 | 印第安那大学科技研究公司 | 基于酯的胰岛素前药 |
| AU2009209565B2 (en) | 2008-02-01 | 2013-09-19 | Ascendis Pharma As | Prodrug comprising a self-cleavable linker |
| EP2356139A4 (en) | 2008-07-23 | 2013-01-09 | Harvard College | LIGATURE OF STAPLED POLYPEPTIDES |
| US8969288B2 (en) | 2008-12-19 | 2015-03-03 | Indiana University Research And Technology Corporation | Amide based glucagon and superfamily peptide prodrugs |
| MX2011006527A (es) | 2008-12-19 | 2011-08-17 | Univ Indiana Res & Tech Corp | Agentes medicinales unidos a dipeptido. |
| EP2376521B1 (en) * | 2008-12-19 | 2016-04-13 | Indiana University Research and Technology Corporation | Amide-based insulin prodrugs |
| EP2376520B1 (en) * | 2008-12-19 | 2014-02-12 | Indiana University Research&Technology Corporation | Insulin analogs |
| US8569231B2 (en) | 2009-03-20 | 2013-10-29 | Smartcells, Inc. | Soluble non-depot insulin conjugates and uses thereof |
| SG178193A1 (en) | 2009-07-31 | 2012-03-29 | Sanofi Aventis Deutschland | Prodrugs comprising an insulin linker conjugate |
| CN101993485B (zh) * | 2009-08-20 | 2013-04-17 | 重庆富进生物医药有限公司 | 促胰岛素分泌肽类似物同源二聚体及其用途 |
| WO2011159895A2 (en) | 2010-06-16 | 2011-12-22 | Indiana University Research And Technology Corporation | Single chain insulin agonists exhibiting high activity at the insulin receptor |
| MX2012014576A (es) | 2010-06-24 | 2013-02-21 | Univ Indiana Res & Tech Corp | Profarmacos de peptido de la superfamilia de glucagon basado en amida. |
| WO2011163460A1 (en) | 2010-06-24 | 2011-12-29 | Indiana University Research And Technology Corporation | Yl-based insulin-like growth factors exhibiting high activity at the insulin receptor |
| AU2011270832B2 (en) | 2010-06-24 | 2016-05-12 | Indiana University Research And Technology Corporation | Amide-based insulin prodrugs |
-
2013
- 2013-09-25 CN CN201380061231.7A patent/CN104981251B/zh not_active Expired - Fee Related
- 2013-09-25 AU AU2013323669A patent/AU2013323669B2/en not_active Ceased
- 2013-09-25 US US14/431,040 patent/US9593156B2/en active Active
- 2013-09-25 CN CN201810145984.0A patent/CN108383902A/zh active Pending
- 2013-09-25 JP JP2015534623A patent/JP6387008B2/ja not_active Expired - Fee Related
- 2013-09-25 EP EP13841334.9A patent/EP2900255B1/en not_active Not-in-force
- 2013-09-25 CA CA2886228A patent/CA2886228A1/en not_active Abandoned
- 2013-09-25 WO PCT/US2013/061676 patent/WO2014052451A2/en active Application Filing
- 2013-09-25 EP EP18174352.7A patent/EP3395358B1/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| CN108383902A (zh) | 2018-08-10 |
| EP2900255B1 (en) | 2019-01-30 |
| US20150274802A1 (en) | 2015-10-01 |
| EP2900255A2 (en) | 2015-08-05 |
| AU2013323669A1 (en) | 2015-03-26 |
| JP2015532283A (ja) | 2015-11-09 |
| CN104981251A (zh) | 2015-10-14 |
| AU2013323669B2 (en) | 2018-03-01 |
| US9593156B2 (en) | 2017-03-14 |
| EP2900255A4 (en) | 2016-06-22 |
| EP3395358B1 (en) | 2019-11-06 |
| CN104981251B (zh) | 2018-03-20 |
| EP3395358A1 (en) | 2018-10-31 |
| WO2014052451A2 (en) | 2014-04-03 |
| CA2886228A1 (en) | 2014-04-03 |
| WO2014052451A3 (en) | 2014-06-19 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6387008B2 (ja) | インスリンアナローグダイマー | |
| US10233225B2 (en) | Single chain insulin agonists exhibiting high activity at the insulin receptor | |
| JP6538645B2 (ja) | インスリン‐インクレチン複合物 | |
| JP6657230B2 (ja) | インクレチン−インスリンコンジュゲート | |
| JP6392123B2 (ja) | 糖尿病治療のためのctp系インスリンアナローグ | |
| TWI489992B (zh) | 醯胺系胰高血糖素超級家族之胜肽前驅藥物 | |
| WO2011159882A2 (en) | Novel stabilized insulin agonists | |
| JP2017534675A (ja) | 脂質化アミド系インスリンプロドラッグ |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160923 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20160923 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20170809 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20171102 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20180105 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180209 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20180711 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20180810 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6387008 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| LAPS | Cancellation because of no payment of annual fees |