JP5743905B2 - ジエチレントリアミン五酢酸(dtpa)−デキストランを放射標識するための組成物 - Google Patents
ジエチレントリアミン五酢酸(dtpa)−デキストランを放射標識するための組成物 Download PDFInfo
- Publication number
- JP5743905B2 JP5743905B2 JP2011547973A JP2011547973A JP5743905B2 JP 5743905 B2 JP5743905 B2 JP 5743905B2 JP 2011547973 A JP2011547973 A JP 2011547973A JP 2011547973 A JP2011547973 A JP 2011547973A JP 5743905 B2 JP5743905 B2 JP 5743905B2
- Authority
- JP
- Japan
- Prior art keywords
- dtpa
- dextran
- sodium
- formulation
- mannosyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 239000000203 mixture Substances 0.000 title claims description 86
- 229920002307 Dextran Polymers 0.000 title claims description 84
- QPCDCPDFJACHGM-UHFFFAOYSA-N N,N-bis{2-[bis(carboxymethyl)amino]ethyl}glycine Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(=O)O)CCN(CC(O)=O)CC(O)=O QPCDCPDFJACHGM-UHFFFAOYSA-N 0.000 title claims description 26
- 238000000163 radioactive labelling Methods 0.000 title description 18
- 229960003330 pentetic acid Drugs 0.000 title description 17
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Natural products NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 claims description 78
- 238000009472 formulation Methods 0.000 claims description 54
- 239000004471 Glycine Substances 0.000 claims description 35
- 238000000034 method Methods 0.000 claims description 35
- 239000006174 pH buffer Substances 0.000 claims description 26
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Natural products OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 claims description 23
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 claims description 13
- 239000000243 solution Substances 0.000 claims description 12
- FWPIDFUJEMBDLS-UHFFFAOYSA-L tin(II) chloride dihydrate Chemical group O.O.Cl[Sn]Cl FWPIDFUJEMBDLS-UHFFFAOYSA-L 0.000 claims description 10
- 239000011261 inert gas Substances 0.000 claims description 9
- 239000003963 antioxidant agent Substances 0.000 claims description 8
- 230000003078 antioxidant effect Effects 0.000 claims description 8
- 235000006708 antioxidants Nutrition 0.000 claims description 8
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 8
- 150000002840 non-reducing disaccharides Chemical class 0.000 claims description 6
- 150000003839 salts Chemical class 0.000 claims description 6
- 125000003396 thiol group Chemical group [H]S* 0.000 claims description 6
- 239000002211 L-ascorbic acid Substances 0.000 claims description 5
- 235000000069 L-ascorbic acid Nutrition 0.000 claims description 5
- 238000004108 freeze drying Methods 0.000 claims description 5
- 125000000311 mannosyl group Chemical group C1([C@@H](O)[C@@H](O)[C@H](O)[C@H](O1)CO)* 0.000 claims description 5
- 230000007774 longterm Effects 0.000 claims description 4
- 238000003860 storage Methods 0.000 claims description 4
- 239000008215 water for injection Substances 0.000 claims description 4
- DPVHGFAJLZWDOC-PVXXTIHASA-N (2r,3s,4s,5r,6r)-2-(hydroxymethyl)-6-[(2r,3r,4s,5s,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxyoxane-3,4,5-triol;dihydrate Chemical group O.O.O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 DPVHGFAJLZWDOC-PVXXTIHASA-N 0.000 claims description 3
- CIWBSHSKHKDKBQ-SZSCBOSDSA-N 2-[(1s)-1,2-dihydroxyethyl]-3,4-dihydroxy-2h-furan-5-one Chemical compound OC[C@H](O)C1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-SZSCBOSDSA-N 0.000 claims description 3
- 229910052782 aluminium Inorganic materials 0.000 claims description 3
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 claims description 3
- 150000001720 carbohydrates Chemical class 0.000 claims description 3
- 239000011521 glass Substances 0.000 claims description 3
- 159000000000 sodium salts Chemical group 0.000 claims description 3
- 125000003630 glycyl group Chemical group [H]N([H])C([H])([H])C(*)=O 0.000 claims description 2
- -1 salt dihydrate Chemical class 0.000 claims description 2
- 239000007921 spray Substances 0.000 claims description 2
- 230000000087 stabilizing effect Effects 0.000 claims description 2
- 238000010828 elution Methods 0.000 description 46
- 229940088679 drug related substance Drugs 0.000 description 41
- 239000008186 active pharmaceutical agent Substances 0.000 description 40
- 229960002449 glycine Drugs 0.000 description 34
- PPASLZSBLFJQEF-RKJRWTFHSA-M sodium ascorbate Substances [Na+].OC[C@@H](O)[C@H]1OC(=O)C(O)=C1[O-] PPASLZSBLFJQEF-RKJRWTFHSA-M 0.000 description 25
- 229960005055 sodium ascorbate Drugs 0.000 description 25
- PPASLZSBLFJQEF-RXSVEWSESA-M sodium-L-ascorbate Chemical compound [Na+].OC[C@H](O)[C@H]1OC(=O)C(O)=C1[O-] PPASLZSBLFJQEF-RXSVEWSESA-M 0.000 description 25
- 229940079593 drug Drugs 0.000 description 24
- 239000003814 drug Substances 0.000 description 24
- 235000010378 sodium ascorbate Nutrition 0.000 description 24
- 238000001542 size-exclusion chromatography Methods 0.000 description 21
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 20
- QTBSBXVTEAMEQO-UHFFFAOYSA-N acetic acid Substances CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 20
- 239000000546 pharmaceutical excipient Substances 0.000 description 20
- 229910052708 sodium Inorganic materials 0.000 description 20
- 239000011734 sodium Substances 0.000 description 20
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 18
- 239000003446 ligand Substances 0.000 description 18
- 239000003085 diluting agent Substances 0.000 description 14
- 239000007788 liquid Substances 0.000 description 14
- 239000000902 placebo Substances 0.000 description 14
- 229940068196 placebo Drugs 0.000 description 14
- 210000005005 sentinel lymph node Anatomy 0.000 description 14
- GKLVYJBZJHMRIY-UHFFFAOYSA-N technetium atom Chemical compound [Tc] GKLVYJBZJHMRIY-UHFFFAOYSA-N 0.000 description 12
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 11
- 229920002594 Polyethylene Glycol 8000 Polymers 0.000 description 11
- 229960005070 ascorbic acid Drugs 0.000 description 11
- 239000007924 injection Substances 0.000 description 11
- 238000002347 injection Methods 0.000 description 11
- 229910052713 technetium Inorganic materials 0.000 description 11
- 230000002378 acidificating effect Effects 0.000 description 10
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 10
- 239000011780 sodium chloride Substances 0.000 description 10
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 9
- 239000011668 ascorbic acid Substances 0.000 description 9
- MSWZFWKMSRAUBD-UHFFFAOYSA-N beta-D-galactosamine Natural products NC1C(O)OC(CO)C(O)C1O MSWZFWKMSRAUBD-UHFFFAOYSA-N 0.000 description 9
- 239000007974 sodium acetate buffer Substances 0.000 description 9
- 239000001488 sodium phosphate Substances 0.000 description 9
- 229910000162 sodium phosphate Inorganic materials 0.000 description 9
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 9
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 8
- 235000010323 ascorbic acid Nutrition 0.000 description 8
- 238000002474 experimental method Methods 0.000 description 8
- 239000012669 liquid formulation Substances 0.000 description 8
- 238000012216 screening Methods 0.000 description 8
- 239000001632 sodium acetate Substances 0.000 description 8
- 235000017281 sodium acetate Nutrition 0.000 description 8
- MSWZFWKMSRAUBD-IVMDWMLBSA-N 2-amino-2-deoxy-D-glucopyranose Chemical compound N[C@H]1C(O)O[C@H](CO)[C@@H](O)[C@@H]1O MSWZFWKMSRAUBD-IVMDWMLBSA-N 0.000 description 7
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 7
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 7
- 229960002442 glucosamine Drugs 0.000 description 7
- 239000000084 colloidal system Substances 0.000 description 6
- 239000001509 sodium citrate Substances 0.000 description 6
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 6
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 5
- 239000008351 acetate buffer Substances 0.000 description 5
- 239000004067 bulking agent Substances 0.000 description 5
- 125000002843 carboxylic acid group Chemical group 0.000 description 5
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 5
- 239000013583 drug formulation Substances 0.000 description 5
- 239000012216 imaging agent Substances 0.000 description 5
- 230000002452 interceptive effect Effects 0.000 description 5
- 150000002500 ions Chemical class 0.000 description 5
- 230000014759 maintenance of location Effects 0.000 description 5
- 239000002953 phosphate buffered saline Substances 0.000 description 5
- 229940095064 tartrate Drugs 0.000 description 5
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 4
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 4
- 230000001588 bifunctional effect Effects 0.000 description 4
- 238000001574 biopsy Methods 0.000 description 4
- 239000007975 buffered saline Substances 0.000 description 4
- 239000002738 chelating agent Substances 0.000 description 4
- 239000003638 chemical reducing agent Substances 0.000 description 4
- 238000001514 detection method Methods 0.000 description 4
- 239000012153 distilled water Substances 0.000 description 4
- 210000001165 lymph node Anatomy 0.000 description 4
- 229910052757 nitrogen Inorganic materials 0.000 description 4
- 230000002829 reductive effect Effects 0.000 description 4
- 229910052717 sulfur Inorganic materials 0.000 description 4
- 239000011593 sulfur Substances 0.000 description 4
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 4
- TXUICONDJPYNPY-UHFFFAOYSA-N (1,10,13-trimethyl-3-oxo-4,5,6,7,8,9,11,12,14,15,16,17-dodecahydrocyclopenta[a]phenanthren-17-yl) heptanoate Chemical compound C1CC2CC(=O)C=C(C)C2(C)C2C1C1CCC(OC(=O)CCCCCC)C1(C)CC2 TXUICONDJPYNPY-UHFFFAOYSA-N 0.000 description 3
- 239000004201 L-cysteine Substances 0.000 description 3
- 235000013878 L-cysteine Nutrition 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- GKLVYJBZJHMRIY-OUBTZVSYSA-N Technetium-99 Chemical compound [99Tc] GKLVYJBZJHMRIY-OUBTZVSYSA-N 0.000 description 3
- 229910021626 Tin(II) chloride Inorganic materials 0.000 description 3
- 235000001014 amino acid Nutrition 0.000 description 3
- 150000001413 amino acids Chemical class 0.000 description 3
- 238000003556 assay Methods 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 229910001873 dinitrogen Inorganic materials 0.000 description 3
- 239000012931 lyophilized formulation Substances 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 238000005259 measurement Methods 0.000 description 3
- 238000012633 nuclear imaging Methods 0.000 description 3
- 239000008363 phosphate buffer Substances 0.000 description 3
- 229920000642 polymer Polymers 0.000 description 3
- 238000002360 preparation method Methods 0.000 description 3
- 150000003141 primary amines Chemical class 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 230000009467 reduction Effects 0.000 description 3
- 235000011150 stannous chloride Nutrition 0.000 description 3
- 239000001119 stannous chloride Substances 0.000 description 3
- 235000000346 sugar Nutrition 0.000 description 3
- 238000012546 transfer Methods 0.000 description 3
- IVLXQGJVBGMLRR-UHFFFAOYSA-N 2-aminoacetic acid;hydron;chloride Chemical compound Cl.NCC(O)=O IVLXQGJVBGMLRR-UHFFFAOYSA-N 0.000 description 2
- 102000003886 Glycoproteins Human genes 0.000 description 2
- 108090000288 Glycoproteins Proteins 0.000 description 2
- 206010028980 Neoplasm Diseases 0.000 description 2
- 229910019142 PO4 Inorganic materials 0.000 description 2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 2
- 238000009825 accumulation Methods 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 239000001045 blue dye Substances 0.000 description 2
- 201000011510 cancer Diseases 0.000 description 2
- 150000001875 compounds Chemical class 0.000 description 2
- 238000003745 diagnosis Methods 0.000 description 2
- 150000004683 dihydrates Chemical class 0.000 description 2
- 238000010494 dissociation reaction Methods 0.000 description 2
- 230000005593 dissociations Effects 0.000 description 2
- 229940126534 drug product Drugs 0.000 description 2
- 229960001269 glycine hydrochloride Drugs 0.000 description 2
- 238000003384 imaging method Methods 0.000 description 2
- 239000012535 impurity Substances 0.000 description 2
- 210000001365 lymphatic vessel Anatomy 0.000 description 2
- 235000010355 mannitol Nutrition 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 238000000691 measurement method Methods 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 230000007935 neutral effect Effects 0.000 description 2
- 239000000825 pharmaceutical preparation Substances 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 2
- 239000010452 phosphate Substances 0.000 description 2
- 229910000160 potassium phosphate Inorganic materials 0.000 description 2
- 235000011009 potassium phosphates Nutrition 0.000 description 2
- 102000004196 processed proteins & peptides Human genes 0.000 description 2
- 108090000765 processed proteins & peptides Proteins 0.000 description 2
- 235000018102 proteins Nutrition 0.000 description 2
- 102000004169 proteins and genes Human genes 0.000 description 2
- 108090000623 proteins and genes Proteins 0.000 description 2
- 230000002285 radioactive effect Effects 0.000 description 2
- 239000012217 radiopharmaceutical Substances 0.000 description 2
- 229940121896 radiopharmaceutical Drugs 0.000 description 2
- 230000002799 radiopharmaceutical effect Effects 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 238000001356 surgical procedure Methods 0.000 description 2
- 238000012360 testing method Methods 0.000 description 2
- 150000007944 thiolates Chemical class 0.000 description 2
- CEOQIIPQXIIEQT-PQYRJTSOSA-N (2r)-2-[(1s)-1,2-dihydroxyethyl]-3,4-dihydroxy-2h-furan-5-one;dihydrate Chemical compound O.O.OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CEOQIIPQXIIEQT-PQYRJTSOSA-N 0.000 description 1
- JALIROBOQHQXST-DKWTVANSSA-N (2r)-2-amino-3-sulfanylpropanoic acid;sodium Chemical compound [Na].SC[C@H](N)C(O)=O JALIROBOQHQXST-DKWTVANSSA-N 0.000 description 1
- PWKSKIMOESPYIA-UHFFFAOYSA-N 2-acetamido-3-sulfanylpropanoic acid Chemical compound CC(=O)NC(CS)C(O)=O PWKSKIMOESPYIA-UHFFFAOYSA-N 0.000 description 1
- 102000009027 Albumins Human genes 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 1
- 238000009007 Diagnostic Kit Methods 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- ZOKXTWBITQBERF-AKLPVKDBSA-N Molybdenum Mo-99 Chemical compound [99Mo] ZOKXTWBITQBERF-AKLPVKDBSA-N 0.000 description 1
- 101100208721 Mus musculus Usp5 gene Proteins 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 1
- 241001428384 Zamora Species 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 150000001408 amides Chemical class 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 150000008064 anhydrides Chemical class 0.000 description 1
- 229940007424 antimony trisulfide Drugs 0.000 description 1
- NVWBARWTDVQPJD-UHFFFAOYSA-N antimony(3+);trisulfide Chemical compound [S-2].[S-2].[S-2].[Sb+3].[Sb+3] NVWBARWTDVQPJD-UHFFFAOYSA-N 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 239000001055 blue pigment Substances 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- FATUQANACHZLRT-KMRXSBRUSA-L calcium glucoheptonate Chemical compound [Ca+2].OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C(O)C([O-])=O.OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C(O)C([O-])=O FATUQANACHZLRT-KMRXSBRUSA-L 0.000 description 1
- 150000007942 carboxylates Chemical class 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 230000000536 complexating effect Effects 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- 238000007872 degassing Methods 0.000 description 1
- 210000004443 dendritic cell Anatomy 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000002059 diagnostic imaging Methods 0.000 description 1
- 229940127043 diagnostic radiopharmaceutical Drugs 0.000 description 1
- MTHSVFCYNBDYFN-UHFFFAOYSA-N diethylene glycol Chemical compound OCCOCCO MTHSVFCYNBDYFN-UHFFFAOYSA-N 0.000 description 1
- 150000002016 disaccharides Chemical class 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 238000009510 drug design Methods 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 230000003511 endothelial effect Effects 0.000 description 1
- 229920005570 flexible polymer Polymers 0.000 description 1
- 229910001385 heavy metal Inorganic materials 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 229910052738 indium Inorganic materials 0.000 description 1
- APFVFJFRJDLVQX-UHFFFAOYSA-N indium atom Chemical compound [In] APFVFJFRJDLVQX-UHFFFAOYSA-N 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 201000001441 melanoma Diseases 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 229950009740 molybdenum mo-99 Drugs 0.000 description 1
- 229930014626 natural product Natural products 0.000 description 1
- 125000004433 nitrogen atom Chemical group N* 0.000 description 1
- 230000036963 noncompetitive effect Effects 0.000 description 1
- 230000000474 nursing effect Effects 0.000 description 1
- 238000005457 optimization Methods 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 238000010525 oxidative degradation reaction Methods 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 239000008194 pharmaceutical composition Substances 0.000 description 1
- UEZVMMHDMIWARA-UHFFFAOYSA-M phosphonate Chemical compound [O-]P(=O)=O UEZVMMHDMIWARA-UHFFFAOYSA-M 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- 230000035479 physiological effects, processes and functions Effects 0.000 description 1
- 239000002504 physiological saline solution Substances 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 239000000700 radioactive tracer Substances 0.000 description 1
- 238000003608 radiolysis reaction Methods 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- HELHAJAZNSDZJO-OLXYHTOASA-L sodium L-tartrate Chemical compound [Na+].[Na+].[O-]C(=O)[C@H](O)[C@@H](O)C([O-])=O HELHAJAZNSDZJO-OLXYHTOASA-L 0.000 description 1
- 239000012064 sodium phosphate buffer Substances 0.000 description 1
- 239000001433 sodium tartrate Substances 0.000 description 1
- 229960002167 sodium tartrate Drugs 0.000 description 1
- 235000011004 sodium tartrates Nutrition 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 229940056501 technetium 99m Drugs 0.000 description 1
- 150000003568 thioethers Chemical class 0.000 description 1
- 230000001052 transient effect Effects 0.000 description 1
- PTIBVSAWRDGWAE-UHFFFAOYSA-K trisodium;phosphate;heptahydrate Chemical compound O.O.O.O.O.O.O.[Na+].[Na+].[Na+].[O-]P([O-])([O-])=O PTIBVSAWRDGWAE-UHFFFAOYSA-K 0.000 description 1
- 238000011179 visual inspection Methods 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B59/00—Introduction of isotopes of elements into organic compounds ; Labelled organic compounds per se
- C07B59/005—Sugars; Derivatives thereof; Nucleosides; Nucleotides; Nucleic acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K51/00—Preparations containing radioactive substances for use in therapy or testing in vivo
- A61K51/02—Preparations containing radioactive substances for use in therapy or testing in vivo characterised by the carrier, i.e. characterised by the agent or material covalently linked or complexing the radioactive nucleus
- A61K51/04—Organic compounds
- A61K51/0491—Sugars, nucleosides, nucleotides, oligonucleotides, nucleic acids, e.g. DNA, RNA, nucleic acid aptamers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K51/00—Preparations containing radioactive substances for use in therapy or testing in vivo
- A61K51/02—Preparations containing radioactive substances for use in therapy or testing in vivo characterised by the carrier, i.e. characterised by the agent or material covalently linked or complexing the radioactive nucleus
- A61K51/04—Organic compounds
- A61K51/06—Macromolecular compounds, carriers being organic macromolecular compounds, i.e. organic oligomeric, polymeric, dendrimeric molecules
- A61K51/065—Macromolecular compounds, carriers being organic macromolecular compounds, i.e. organic oligomeric, polymeric, dendrimeric molecules conjugates with carriers being macromolecules
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B59/00—Introduction of isotopes of elements into organic compounds ; Labelled organic compounds per se
- C07B59/001—Acyclic or carbocyclic compounds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B59/00—Introduction of isotopes of elements into organic compounds ; Labelled organic compounds per se
- C07B59/004—Acyclic, carbocyclic or heterocyclic compounds containing elements other than carbon, hydrogen, halogen, oxygen, nitrogen, sulfur, selenium or tellurium
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B63/00—Purification; Separation; Stabilisation; Use of additives
- C07B63/04—Use of additives
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/531—Production of immunochemical test materials
- G01N33/532—Production of labelled immunochemicals
- G01N33/534—Production of labelled immunochemicals with radioactive label
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/58—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving labelled substances
- G01N33/60—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving labelled substances involving radioactive labelled substances
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/05—Isotopically modified compounds, e.g. labelled
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Immunology (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- General Health & Medical Sciences (AREA)
- Biomedical Technology (AREA)
- Hematology (AREA)
- Urology & Nephrology (AREA)
- Physics & Mathematics (AREA)
- Medicinal Chemistry (AREA)
- Biochemistry (AREA)
- Biotechnology (AREA)
- Analytical Chemistry (AREA)
- Microbiology (AREA)
- Cell Biology (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Food Science & Technology (AREA)
- Pharmacology & Pharmacy (AREA)
- Optics & Photonics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Epidemiology (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicinal Preparation (AREA)
- Polysaccharides And Polysaccharide Derivatives (AREA)
Description
99m Tc標識DTPA−マンノシル−デキストランおよびDTPAの溶出プロフィール
図1は、再構成した99mテクネチウム標識Lymphoseekリガンド薬品(99mTc−DTPA−マンノシル−デキストラン)、ロットNMK001の、サイズ排除クロマトグラフィー(SEC)を用いて放射活性(NaI、1000cps/ボルトに設定)検出器により測定した、典型的な溶出プロフィールを示す図である。このSEC放射化学的純度測定法の条件は以下の通りである:TSKゲルカラム(トーソー・バイオサイエンス社(Tosoh Bioscience)製、G3000PWXL(7.8×30cm、6μm、カラム温度25±5℃))を、均一濃度の移動相として50mMリン酸バッファー(pH7.2)および300mM塩化ナトリウムと共に用いる。凍結乾燥バイアルを、10ミリキュリーの99mTc過テクネチウム酸0.8ccで再構成し、混合し、周囲室温で少なくとも10分間放射標識し、その後、0.2ccのリン酸緩衝生理食塩水でサンプルを部分的に中和する。冷蔵した薬品サンプル15μLを注入し、0.6mL/分、実行時間40分でクロマトグラフィーにかけた。99mTc−DTPA−マンノシル−デキストラン(99mTc−DMD)ピークの保持時間は約12〜12.5分であり、9〜15分にまたがり、約15〜15.5分の放射活性ピークに溶出する99mTc標識された賦形剤によるテーリングの肩が見られる。
最初のパイロット製剤:干渉する賦形剤の研究
図3中、一番上の放射化学的溶出プロフィールは、10ミリキュリーの99mTc過テクネチウム酸で再構成してSEC放射化学的純度測定法にかけた最初の凍結乾燥製剤パイロット(5μM(0.1mg/mL)のDTPA−マンノシル−デキストラン、20mMのクエン酸ナトリウム(pH5.6)、5.7mMのL−システインナトリウム、2%(w/v)D−マンニト−ル、および75μg/mLの塩化第一スズ(二水和物))を示している(この最初の凍結乾燥薬品製剤パイロットはSEC放射化学的純度測定法を展開する直前に用意した)。この溶出プロフィールは、99mTc−DMDピークの放射化学的純度が約25%未満であることを明らかに示している。
DTPA−マンノシル−デキストランの放射標識向上のためのpHバッファー、トランスキレート剤、増量賦形剤のスクリーニング
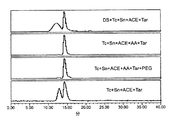
図5は、SEC放射化学的純度測定法により測定される、リン酸ナトリウムpHバッファーならびに種々の組合せのトランスキレート剤、還元剤、および増量剤を含むDTPA−マンノシル−デキストラン薬剤物質の液体プラセボ製剤パイロットの放射化学的溶出プロフィールを縦に並べて示した図である。一番上の放射化学的溶出プロフィールは、pH4の20mMリン酸ナトリウムバッファーおよび1.5mg/mLのアスコルビン酸ナトリウムを用いた場合の小さな99mTc標識干渉ピークを示している。2番目〜6番目の溶出プロフィールは、20mMリン酸ナトリウム(pH4)、75μg/mLのSnCL2・2H2O、および12.5mCiの99mTc過テクネチウム酸と以下の各潜在的賦形剤を示すものである:1mg/mLのクエン酸ナトリウム;1%のPEG8000;1mg/mLのクエン酸ナトリウムおよび1.5mg/mLのアスコルビン酸ナトリウム;1.5mg/mLのアスコルビン酸ナトリウムおよび1%のPEG8000;ならびに1.5mg/mLのアスコルビン酸ナトリウム、1mg/mLのクエン酸ナトリウム、および1%のPEG8000。これらは全て、顕著な99mTc標識干渉ピークを示しており、99mTc−PEG8000はRT約14分という早い時間に溶出し、99mTc−シトラートはより低分子量側の保持時間約15分に溶出している。
凍結乾燥DTPA−マンノシル−デキストラン薬品の放射標識向上のための製剤の最適化
低pHで99mTc−DMDの放射化学的純度が向上する酢酸バッファー製剤の明白なpH感受性を研究する必要があった。最初のpH実験ではpH2および3の10mMリン酸ナトリウムならびに対照としてpH4の20mM酢酸ナトリウムを用いた。図12は、12.5mCiの99mTc過テクネチウム酸を添加したDMD薬剤物質製剤(25μMのDTPA−マンノシル−デキストラン(0.5mg/mL)、pHバッファー、0.5mg/mLのグリシン、0.5mg/mLのアスコルビン酸ナトリウム、2%(w/v)のα,α−トレハロース、38.5mMの塩化ナトリウム、および75μg/mLのSnCL2・2H2Oを含む)の放射化学的溶出プロフィールを縦に並べて示した図である。一番上の溶出プロフィールはpH4の酢酸製剤を示しており、これはSEC放射化学的純度測定法による測定で99mTc−DMD純度が96.9%である。この製剤は、本発明者らの薬剤物質液体製剤の目標を満たす(すなわち、95%を超える99mTc−DMD純度)。残念ながら、pH3および2の10mMリン酸ナトリウム製剤はRT約14.0分に顕著な99mTc標識干渉ピークを有する(図12参照)。その後、グリシン/塩酸が潜在的な非干渉トランスキレート剤としてだけでなく好適な酸性pHバッファーとしても機能することを突き止めた。図13は、以下の賦形剤を含むpH3、2、および4のDMD薬剤物質製剤の放射化学的溶出プロフィールを縦に並べて示した図である:25μMのDTPA−マンノシル−デキストラン(0.5mg/mL)、0.5mg/mLのグリシン、0.5mg/mLのアスコルビン酸ナトリウム、2%(w/v)のα,α−トレハロース、および75μg/mLのSnCL2・2H2O(およびpH4では10mM酢酸ナトリウム)。幸運にも、酸性pHバッファーおよびトランスキレート剤として塩酸グリシンを用いたことで、pH3およびpH2の薬剤物質製剤がそれぞれ97.6%および97.1%の99mTc−DMD純度を示し、これは薬剤物質製剤の所望の目標を満たす(図13参照)。図13中ではpH4の酢酸製剤が薬剤物質製剤の目標を満たさなかったが(95%超に対して93.6%の99mTC−DMD純度)、これは、製剤の調製における日毎の変動、溶液の不完全な脱ガス、塩化第一スズ二水和物の不十分な混合等によるものであり得る。pH4の製剤中で酢酸バッファーに加えて塩酸グリシンバッファーを用いてもよい。
凍結乾燥DTPA−マンノシル−デキストラン薬品の放射標識における使いやすさ向上のための、リン酸緩衝生理食塩水希釈剤の使用を含む、再構成手順の構築
Lymphoseekリガンド薬品製剤は最終pHが約3であり、非経口薬に推奨されるpH(Stranz, M. and Kastango, E. S. (2002) Int. J. Pharm. Compound. 6(3), 216-220)よりも低いため、99mTc過テクネチウム酸を用いた再構成後に、より痛みが少なく害の少ないpH(例えばpH5〜9)へとpHを中和する希釈剤を使用することに決定した。0.9%塩化ナトリウムまたは等張生理食塩水を用いてモリブデン−99ジェネレータから99mTc過テクネチウム酸ナトリウムを溶出させる。輸液看護学会(Infusion Nursing Society)の推奨を満たして1mLの99mTc過テクネチウム酸ナトリウムで再構成した後に500mOsm\L未満になるようにLymphoseekリガンド薬品を処方する。ヒトの非経口薬との使用に適した希釈剤としてグリア・ラボラトリーズ社(Greer Laboratories)の注射用緩衝生理食塩水を同定した。この希釈剤の配合は、0.107%のリン酸ナトリウム(七水和物)、0.036%のリン酸カリウム(望ましくはUSP−NF、米国薬局方−国民医薬品集)、0.5%の塩化ナトリウム、および0.4%のフェノールである。凍結乾燥させたLymphoseekリガンド薬品のバイアルを10〜50mCiの99mTc過テクネチウム酸ナトリウム0.7ccを用いて周囲室温で少なくとも10分間再構成し、断続的に混合し、その後、0.3ccの注射用緩衝生理食塩水で希釈することが推奨される。Lymphoseek(登録商標)リガンド薬品は、再構成後少なくとも12時間安定性を有するが、再構成された薬品は6時間以内の投与が推奨される(データ示さず)。したがって、中和された99mTc標識Lymphoseekリガンド薬品は内皮注射で患者に十分に耐えられると考えられる。
本発明は、以下の発明を包含する。
(1)ジエチレントリアミン五酢酸(DTPA)−デキストランをテクネチウム−99で放射標識するための組成物であって、
(a)0.50mg/バイアル以下の濃度のDTPA−デキストラン、
(b)2%(w/v)以下の濃度の非還元性二糖の群から選択される糖、
(c)濃度が約0.5mg/バイアルである、非スルフヒドリル酸化防止剤、
(d)第一スズ塩の二水和物形態の濃度が75マイクログラム/バイアル以下である、第一スズ塩、
(e)約0.5mg/バイアル以下の濃度のpHバッファーの群から選択される、pHバッファー、および
(f)不活性ガスで脱ガスおよび脱気された注射用蒸留水(WFI)
を含んでなる、組成物。
(2)前記DTPA−デキストランが、複数のDTPA基を含み、該DTPA基が約2:1〜12:1のモル範囲でデキストランに接合されてなる、(1)に記載の組成物。
(3)前記DTPA−デキストランが、平均分子量が約5,000〜20,000ダルトンのデキストランを含んでなる、(1)に記載の組成物。
(4)前記DTPA−デキストランが、DTPA−マンノシル−デキストランであり、該DTPA−マンノシル−デキストランが、接合されたマンノース基をDTPA−デキストランに対して約2:1〜12:1のモル比の範囲で含んでなる、(1)に記載の組成物。
(5)前記非還元性二糖が、α,α−トレハロース二水和物である、(1)に記載の組成物。
(6)前記非スルフヒドリル酸化防止剤が、L(+)−アスコルビン酸のナトリウム塩である、(1)に記載の組成物。
(7)前記第一スズ塩が、塩化第一スズ二水和物である、(1)に記載の組成物。
(8)前記pHバッファーおよびトランスキレート剤が、グリシンである、(1)に記載の組成物。
(9)前記脱気されたWFIに用いられる前記不活性ガスが、窒素である、(1)に記載の組成物。
(10)長期保存のためにDTPA−デキストランのコールドキットを安定化する方法であって、
(a)目標体積の約90%の脱ガスおよび脱気された注射用蒸留水を含む容器に、
(i)2%(w/v)以下の濃度の非還元性二糖の群から選択される糖、
(ii)約0.5mg/バイアル以下の濃度のpHバッファーの群から選択されるpHバッファー
を含んでなる水性組成物を添加し、
(b)濃度が約0.5mg/バイアルの非スルフヒドリル酸化防止剤を添加し、
(c)不活性ガスの散布を維持しながら、6Nの塩酸を用いて溶液のpHを目標pHである3.2±0.2に調整し、
(d)第一スズ塩の二水和物の形態の濃度が75マイクログラム/バイアル以下の第一スズ塩を添加し、
(e)0.50mg/バイアル以下の濃度のDTPA−デキストランを添加し、
(f)不活性ガスの散布を維持しながら、6Nの塩酸を用いて溶液のpHを目標pHである3.2±0.2に調整し、
(g)脱ガスおよび脱気された注射用蒸留水を用いて製剤の体積を目標体積の100%に調整し、
(h)0.22ミクロンのフィルターを用いて前記水性組成物をろ過し、1.0mL±10%の前記水性組成物をガラス製バイアルに充填し、前記バイアルの首に栓を置き、
(i)工程aにおいて、凍結乾燥により、生成物の水分の大部分を除去し、残留水分を約1%未満の水分量にまで低下させ、
(j)工程bにおいて、前記バイアルに栓をする前に、前記凍結乾燥生成物に約11.5p.s.i.まで不活性ガスをバックフィルし、
(k)工程cにおいて、前記凍結乾燥生成物バイアルをアルミニウムシールで圧着し、
(l)工程dにおいて、前記圧着シールした凍結乾燥生成物バイアルを2〜8℃または25℃で保存すること
を含んでなる、方法。
(11)前記非還元性二糖が、α,α−トレハロース二水和物である、(10)に記載の方法。
(12)前記pHバッファー兼トランスキレート剤が、グリシンである、(10)に記載の方法。
(13)前記非スルフヒドリル酸化防止剤が、L(+)−アスコルビン酸のナトリウム塩である、(10)に記載の方法。
(14)前記第一スズ塩が、塩化第一スズ二水和物である、(10)に記載の方法。
(15)前記DTPA−デキストランが、複数のDTPA基を含み、該DTPA基が、約2:1〜12:1のモル比でデキストランに接合されてなる、(10)に記載の方法。
(16)前記DTPA−デキストランが、平均分子量が約5,000〜約20,000ダルトンのデキストランを含む、(10)に記載の方法。
(17)前記DTPA−マンノシル−デキストランが、接合されたマンノース基をDTPA−デキストランに対して約2:1〜12:1のモル比の範囲で含んでなる、(10)に記載の方法。
(18)診断用の放射性医薬品として使用するために 99m Tc過テクネチウム酸ナトリウム溶液および希釈剤を用いてDTPA−デキストランコールドキットを放射標識し、患者の快適さのために最終溶液pHを調整する方法であって、
(a)水性過テクネチウム酸ナトリウム(Tc 99m )組成物であって、
(i)体積0.7mL中、1mmolのDTPA−デキストラン当たり約100キュリーを超える過テクネチウム酸ナトリウム(Tc 99m )、
(ii)最終体積1.0mL中の用量0.2mL中、Tc 99m 線量範囲約0.3〜5.0ミリキュリーのTc 99m の許容
を含んでなる水性過テクネチウム酸ナトリウム(Tc 99m )組成物を添加し、
(b)水性の緩衝生理食塩水希釈剤組成物であって、
(i)0.5%(w/v)のUSPの塩化ナトリウム、
(ii)0.107%のリン酸ナトリウム七水和物、
(iii)0.036%のリン酸カリウム、
(iv)0.4%のフェノール、
(v)最終体積までの十分な量(q.s.)の注射用蒸留水(wfi)の添加、および
(vi)必要に応じてphを約7.0に調整するために濃水酸化ナトリウムまたは塩酸の添加
を含んでなる水性の緩衝生理食塩水希釈剤組成物を0.3mlの体積で添加すること
を含んでなる、方法。
Claims (9)
- 長期保存のためにDTPA−デキストランのコールドキットを安定化する方法であって、
(a)目標体積の90%の脱ガスおよび脱気された注射用水を含む容器に、
(i)2%(w/v)以下の濃度の非還元性二糖の群から選択される糖、
(ii)0.5mg/mL以下の濃度のpHバッファーの群から選択されるpHバッファー
を含んでなる水性組成物を添加し、
(b)濃度が0.5mg/mLの非スルフヒドリル酸化防止剤を添加し、
(c)不活性ガスの散布を維持しながら、6Nの塩酸を用いて溶液のpHを目標pHである3.2±0.2に調整し、
(d)第一スズ塩の二水和物の形態の濃度が75マイクログラム/mL以下の第一スズ塩を添加し、
(e)0.50mg/mL以下の濃度のDTPA−デキストランを添加し、
(f)不活性ガスの散布を維持しながら、6Nの塩酸を用いて溶液のpHを目標pHである3.2±0.2に調整し、
(g)脱ガスおよび脱気された注射用水を用いて製剤の体積を目標体積の100%に調整し、
(h)0.22ミクロンのフィルターを用いて前記水性組成物をろ過し、1.0mL±10%の前記水性組成物をガラス製バイアルに充填し、
(i)凍結乾燥により、生成物の水分の大部分を除去し、残留水分を1%未満の水分量にまで低下させ、
(j)前記バイアルに栓をする前に、前記凍結乾燥生成物に11.5p.s.i.まで不活性ガスをバックフィルし、
(k)前記凍結乾燥生成物バイアルをアルミニウムシールで圧着し、
(l)前記圧着シールした凍結乾燥生成物バイアルを2〜8℃または25℃で保存すること
を含んでなる、方法。 - 前記非還元性二糖が、α,α−トレハロース二水和物である、請求項1に記載の方法。
- 前記pHバッファーが、トランスキレート剤として作用する、請求項1に記載の方法。
- 前記pHバッファーが、グリシンである、請求項3に記載の方法。
- 前記非スルフヒドリル酸化防止剤が、L(+)−アスコルビン酸のナトリウム塩である、請求項1に記載の方法。
- 前記第一スズ塩が、塩化第一スズ二水和物である、請求項1に記載の方法。
- 前記DTPA−デキストランが、複数のDTPA基を含み、該DTPA基が、2:1〜12:1のモル比でデキストランに接合されてなる、請求項1に記載の方法。
- 前記DTPA−デキストランが、平均分子量が5,000〜20,000ダルトンのデキストランを含む、請求項1に記載の方法。
- 前記DTPA−マンノシル−デキストランが、接合されたマンノース基をDTPA−デキストランに対して2:1〜12:1のモル比の範囲で含んでなる、請求項1に記載の方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US12/362,778 US20100196272A1 (en) | 2009-01-30 | 2009-01-30 | Compositions for radiolabeling diethylenetriaminepentaacetic acid (dtpa)-dextran |
| US12/362,778 | 2009-01-30 | ||
| PCT/US2010/000222 WO2010087959A1 (en) | 2009-01-30 | 2010-01-28 | Compositions for radiolabeling diethylenetriaminepentaacetic acid (dtpa)-dextran |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015090380A Division JP6040276B2 (ja) | 2009-01-30 | 2015-04-27 | ジエチレントリアミン五酢酸(dtpa)−デキストランを放射標識するための組成物 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2012516328A JP2012516328A (ja) | 2012-07-19 |
| JP5743905B2 true JP5743905B2 (ja) | 2015-07-01 |
Family
ID=42395938
Family Applications (5)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011547973A Active JP5743905B2 (ja) | 2009-01-30 | 2010-01-28 | ジエチレントリアミン五酢酸(dtpa)−デキストランを放射標識するための組成物 |
| JP2015090380A Active JP6040276B2 (ja) | 2009-01-30 | 2015-04-27 | ジエチレントリアミン五酢酸(dtpa)−デキストランを放射標識するための組成物 |
| JP2016217326A Active JP6509796B2 (ja) | 2009-01-30 | 2016-11-07 | ジエチレントリアミン五酢酸(dtpa)−デキストランを放射標識するための組成物 |
| JP2019071387A Active JP6833892B2 (ja) | 2009-01-30 | 2019-04-03 | ジエチレントリアミン五酢酸(dtpa)−デキストランを放射標識するための組成物 |
| JP2021015866A Withdrawn JP2021088566A (ja) | 2009-01-30 | 2021-02-03 | ジエチレントリアミン五酢酸(dtpa)−デキストランを放射標識するための組成物 |
Family Applications After (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015090380A Active JP6040276B2 (ja) | 2009-01-30 | 2015-04-27 | ジエチレントリアミン五酢酸(dtpa)−デキストランを放射標識するための組成物 |
| JP2016217326A Active JP6509796B2 (ja) | 2009-01-30 | 2016-11-07 | ジエチレントリアミン五酢酸(dtpa)−デキストランを放射標識するための組成物 |
| JP2019071387A Active JP6833892B2 (ja) | 2009-01-30 | 2019-04-03 | ジエチレントリアミン五酢酸(dtpa)−デキストランを放射標識するための組成物 |
| JP2021015866A Withdrawn JP2021088566A (ja) | 2009-01-30 | 2021-02-03 | ジエチレントリアミン五酢酸(dtpa)−デキストランを放射標識するための組成物 |
Country Status (9)
| Country | Link |
|---|---|
| US (4) | US20100196272A1 (ja) |
| EP (2) | EP3884965A1 (ja) |
| JP (5) | JP5743905B2 (ja) |
| KR (2) | KR101765717B1 (ja) |
| CN (1) | CN102301429A (ja) |
| AU (1) | AU2010208624B2 (ja) |
| BR (1) | BRPI1007487A2 (ja) |
| CA (1) | CA2750230C (ja) |
| WO (1) | WO2010087959A1 (ja) |
Families Citing this family (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20100196272A1 (en) * | 2009-01-30 | 2010-08-05 | Neoprobe Corporation | Compositions for radiolabeling diethylenetriaminepentaacetic acid (dtpa)-dextran |
| JP6163698B2 (ja) * | 2013-03-21 | 2017-07-19 | 国立大学法人 千葉大学 | マクロファージマンノース受容体を認識する新規多糖金属錯体化合物、及び、その医薬組成物 |
| KR20210095972A (ko) | 2013-07-22 | 2021-08-03 | 나비디아 바이오파마슈티컬즈, 인크. | Cd206 발현 세포-관련 장애를 진단 및 치료하기 위한 조성물, 방법 및 키트 |
| CN106456768B (zh) | 2014-06-13 | 2019-12-03 | 腾博龙公司 | 含有抗egfr1抗体的缀合物 |
| US10806803B2 (en) | 2014-07-17 | 2020-10-20 | Ohio State Innovation Foundation | Compositions for targeting macrophages and other CD206 high expressing cells and methods of treating and diagnosis |
| WO2016011415A2 (en) * | 2014-07-17 | 2016-01-21 | Ohio State Innovation Foundation | Compounds and compositions for targeting macrophages and other mannose-binding c-type lectin receptor high expressing cells and methods of treating and diagnosis using same |
| CN111796039B (zh) * | 2014-11-13 | 2023-03-17 | 沃特世科技公司 | 快速标记的n-聚糖的液相色谱校准方法 |
| GB201504064D0 (en) | 2015-03-10 | 2015-04-22 | Accretion Biotechnology Ltd | Method and kits for preparing radionuclide complexes |
| CN106317237B (zh) * | 2015-07-03 | 2019-07-19 | 华中科技大学 | 一种用于spect成像的当归多糖衍生物及其合成方法 |
| CN106188226B (zh) * | 2016-07-04 | 2019-12-24 | 江苏省原子医学研究所 | 一种用于淋巴结检查的大分子显像剂及其制备方法 |
| US10695450B2 (en) | 2016-07-26 | 2020-06-30 | Laboratoires Cyclopharma | Synthesis of a radioactive agent composition |
| FR3054445B1 (fr) * | 2016-07-26 | 2019-07-05 | Laboratoires Cyclopharma | Synthese d'une composition d'agent radioactif |
| JP6329302B2 (ja) * | 2017-05-10 | 2018-05-23 | 国立大学法人千葉大学 | マクロファージマンノース受容体を認識する新規多糖金属錯体化合物、及び、その医薬組成物 |
| US20220175973A1 (en) * | 2019-03-29 | 2022-06-09 | National Institutes for Quantum Science and Technology | Method for producing radiopharmaceutical and radiopharmaceutical |
| US11859023B2 (en) | 2020-07-08 | 2024-01-02 | Navidea Biopharmaceuticals, Inc. | Synthesis of uniformly defined molecular weight mannosylated dextrans and derivatives thereof |
Family Cites Families (31)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| IT1053508B (it) * | 1970-07-06 | 1981-10-10 | Searle & Co | Procedimento per prepare composizioni marcate adatte a mettere in evidenza alterazioni della mucosa gastrointestinale prodotto ottenuto e relativo metodo di impiego |
| US4364920A (en) * | 1975-04-30 | 1982-12-21 | Medi-Physics, Inc. | Stable diagnostic reagents |
| US4048296A (en) * | 1975-05-27 | 1977-09-13 | Mallinckrodt, Inc. | Radiopharmaceutical scanning agents |
| JPS5569517A (en) * | 1978-11-20 | 1980-05-26 | Nippon Mejifuijitsukusu Kk | Labelling preparation for labelling of erythrocytes with radio-active technetium |
| SE465907B (sv) | 1984-11-01 | 1991-11-18 | Nyegaard & Co As | Diagnosticeringsmedel innehaallande en paramagnetisk metall |
| US5336762A (en) | 1985-11-18 | 1994-08-09 | Access Pharmaceuticals, Inc. | Polychelating agents for image and spectral enhancement (and spectral shift) |
| US4822594A (en) | 1987-01-27 | 1989-04-18 | Gibby Wendell A | Contrast enhancing agents for magnetic resonance images |
| CS263561B1 (en) | 1987-09-18 | 1989-04-14 | Kery Vladimir | Process for preparing water soluble allylderivatives of oligo and polysaccharides |
| GB8801646D0 (en) * | 1988-01-26 | 1988-02-24 | Nycomed As | Chemical compounds |
| US5328679A (en) * | 1988-04-01 | 1994-07-12 | Immunomedics, Inc. | Methods for technetium/rhenium labeling of proteins |
| DD286598A5 (de) | 1989-06-29 | 1991-01-31 | Adw Der Ddr,Zi F. Mulekularbiologie,De | Verfahren zur einfuehrung von primaeren aminogruppen in wasserloesliche polymere |
| EP0516873A1 (en) * | 1991-06-06 | 1992-12-09 | THE STATE of ISRAEL Atomic Energy Commission Soreq Nuclear Research Center | A method and kit for protein labelling with 99 mTC |
| US5789578A (en) | 1996-01-11 | 1998-08-04 | Massey University | Methods for the preparation of resins with ligands attached thereto through a linking group comprising sulfide, sulfoxide or sulfone functionality |
| US20010055563A1 (en) * | 1999-09-09 | 2001-12-27 | Rhomed Incorporated | Post-labeling stabilization of radiolabeled proteins and peptides |
| AU2526497A (en) * | 1996-02-02 | 1997-08-22 | Rhomed Incorporated | Post-labeling stabilization of radiolabeled proteins and peptides |
| US6066309A (en) * | 1996-02-02 | 2000-05-23 | Rhomed Incorporated | Post-labeling stabilization of radiolabeled proteins and peptides |
| AU5135698A (en) | 1996-11-28 | 1998-06-22 | Nihon Schering K.K. | Contrast compound, contrast medium for mri, and method for mri |
| US6409990B1 (en) * | 1999-05-14 | 2002-06-25 | The Regents Of The University Of California | Macromolecular carrier for drug and diagnostic agent delivery |
| US6887462B2 (en) * | 2001-04-09 | 2005-05-03 | Chiron Corporation | HSA-free formulations of interferon-beta |
| US7666979B2 (en) | 2002-03-01 | 2010-02-23 | Bracco International B.V. | Methods for preparing multivalent constructs for therapeutic and diagnostic applications and methods of preparing the same |
| NZ571508A (en) * | 2002-05-24 | 2010-05-28 | Schering Corp | Neutralizing human anti-IGFR antibody |
| WO2004078778A2 (en) | 2003-03-03 | 2004-09-16 | Dyax Corp. | PEPTIDES THAT SPECIFICALLY BIND HGF RECEPTOR (cMet) AND USES THEREOF |
| DK1658848T3 (da) * | 2004-10-29 | 2007-11-26 | Pharma Mar Sa | Formuleringer omfattende ecteinascidin og et disaccharid |
| TWI398272B (zh) * | 2005-03-08 | 2013-06-11 | Intervet Int Bv | 化學定義的安定劑 |
| CA2624503A1 (en) * | 2005-10-04 | 2007-04-12 | Alk-Abello A/S | Solid vaccine formulation |
| AU2007234612B2 (en) * | 2006-12-14 | 2013-06-27 | Johnson & Johnson Regenerative Therapeutics, Llc | Protein stabilization formulations |
| ES2365832T3 (es) * | 2007-03-05 | 2011-10-11 | Cadila Healthcare Limited | Composiciones que comprenden conjugados de peg-interferón alfa y rafinosa como crioprotector. |
| US20100196272A1 (en) | 2009-01-30 | 2010-08-05 | Neoprobe Corporation | Compositions for radiolabeling diethylenetriaminepentaacetic acid (dtpa)-dextran |
| KR20210095972A (ko) | 2013-07-22 | 2021-08-03 | 나비디아 바이오파마슈티컬즈, 인크. | Cd206 발현 세포-관련 장애를 진단 및 치료하기 위한 조성물, 방법 및 키트 |
| WO2016011415A2 (en) | 2014-07-17 | 2016-01-21 | Ohio State Innovation Foundation | Compounds and compositions for targeting macrophages and other mannose-binding c-type lectin receptor high expressing cells and methods of treating and diagnosis using same |
| EP3169336A4 (en) | 2014-07-17 | 2018-04-04 | Ohio State Innovation Foundation | Compositions for targeting macrophages and other cd206 high expressing cells and methods of treating and diagnosis |
-
2009
- 2009-01-30 US US12/362,778 patent/US20100196272A1/en not_active Abandoned
-
2010
- 2010-01-28 EP EP21152405.3A patent/EP3884965A1/en not_active Withdrawn
- 2010-01-28 KR KR1020177005797A patent/KR101765717B1/ko active IP Right Grant
- 2010-01-28 KR KR1020117020202A patent/KR101713559B1/ko active IP Right Grant
- 2010-01-28 CA CA2750230A patent/CA2750230C/en active Active
- 2010-01-28 BR BRPI1007487A patent/BRPI1007487A2/pt not_active IP Right Cessation
- 2010-01-28 EP EP10736135.4A patent/EP2392012B1/en active Active
- 2010-01-28 CN CN2010800062510A patent/CN102301429A/zh active Pending
- 2010-01-28 AU AU2010208624A patent/AU2010208624B2/en active Active
- 2010-01-28 JP JP2011547973A patent/JP5743905B2/ja active Active
- 2010-01-28 WO PCT/US2010/000222 patent/WO2010087959A1/en active Application Filing
-
2012
- 2012-05-01 US US13/461,306 patent/US8545808B2/en active Active
-
2013
- 2013-09-27 US US14/039,648 patent/US9439985B2/en active Active
-
2015
- 2015-04-27 JP JP2015090380A patent/JP6040276B2/ja active Active
-
2016
- 2016-08-10 US US15/233,144 patent/US20160347679A1/en not_active Abandoned
- 2016-11-07 JP JP2016217326A patent/JP6509796B2/ja active Active
-
2019
- 2019-04-03 JP JP2019071387A patent/JP6833892B2/ja active Active
-
2021
- 2021-02-03 JP JP2021015866A patent/JP2021088566A/ja not_active Withdrawn
Also Published As
| Publication number | Publication date |
|---|---|
| JP6509796B2 (ja) | 2019-05-08 |
| US20120213700A1 (en) | 2012-08-23 |
| JP6833892B2 (ja) | 2021-02-24 |
| JP2012516328A (ja) | 2012-07-19 |
| JP2019178133A (ja) | 2019-10-17 |
| CA2750230C (en) | 2018-06-05 |
| US9439985B2 (en) | 2016-09-13 |
| CN102301429A (zh) | 2011-12-28 |
| BRPI1007487A2 (pt) | 2018-02-20 |
| KR20170027874A (ko) | 2017-03-10 |
| AU2010208624A1 (en) | 2011-08-25 |
| KR20110115148A (ko) | 2011-10-20 |
| CA2750230A1 (en) | 2010-08-05 |
| US20160347679A1 (en) | 2016-12-01 |
| EP2392012A4 (en) | 2012-11-14 |
| JP2021088566A (ja) | 2021-06-10 |
| AU2010208624B2 (en) | 2016-02-04 |
| US20100196272A1 (en) | 2010-08-05 |
| EP2392012B1 (en) | 2021-01-20 |
| US20140023586A1 (en) | 2014-01-23 |
| WO2010087959A1 (en) | 2010-08-05 |
| EP3884965A1 (en) | 2021-09-29 |
| JP2017066148A (ja) | 2017-04-06 |
| JP6040276B2 (ja) | 2016-12-07 |
| US8545808B2 (en) | 2013-10-01 |
| JP2015164933A (ja) | 2015-09-17 |
| KR101713559B1 (ko) | 2017-03-08 |
| KR101765717B1 (ko) | 2017-08-07 |
| EP2392012A1 (en) | 2011-12-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6833892B2 (ja) | ジエチレントリアミン五酢酸(dtpa)−デキストランを放射標識するための組成物 | |
| JP3853354B2 (ja) | 放射性標識ペプチドおよびタンパク質の自己放射線分解を防止する安定剤 | |
| EP2271373B1 (en) | 99mtc-labeled 19 amino acid containing peptide for use as phosphatidylethanolamine binding molecular probe and radiopharmaceutical | |
| AU7045394A (en) | Technetium-99m labeled peptides for imaging inflammation | |
| Sano et al. | Radioimmunodetection of membrane type-1 matrix metalloproteinase relevant to tumor malignancy with a pre-targeting method | |
| EP0788377B1 (en) | Radiolabelled glucans | |
| EP1437145A1 (en) | Enhanced scintigraphic imaging agents for imaging of infection and inflammation | |
| Núñez et al. | Combining dose and injection volume for good performance of a specific radiopharmaceutical for sentinel node detection | |
| AU2018372768B2 (en) | Pharmaceutical composition comprising tetrofosmin and pharmaceutically acceptable salts thereof | |
| WO2023135538A1 (en) | Detection and localization of internal bleeding | |
| Cohen | Inertly labeled monoclonal antibodies for PET and optical imaging: unique tools to support antibody development and application in cancer therapy | |
| Peter Laverman et al. | 2 A novel method to label liposomes with Tc-99m by the hydrazino nicotinyl derivative |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20130116 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20140207 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20140502 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20140513 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20140606 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20140613 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20140704 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20140711 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140807 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20150227 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20150325 |
|
| R155 | Notification before disposition of declining of application |
Free format text: JAPANESE INTERMEDIATE CODE: R155 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20150428 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5743905 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |