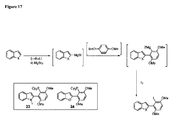
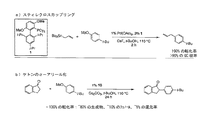
JP5591714B2 - 遷移金属触媒によるクロスカップリングのためのリガンド、およびその使用方法 - Google Patents
遷移金属触媒によるクロスカップリングのためのリガンド、およびその使用方法 Download PDFInfo
- Publication number
- JP5591714B2 JP5591714B2 JP2010538198A JP2010538198A JP5591714B2 JP 5591714 B2 JP5591714 B2 JP 5591714B2 JP 2010538198 A JP2010538198 A JP 2010538198A JP 2010538198 A JP2010538198 A JP 2010538198A JP 5591714 B2 JP5591714 B2 JP 5591714B2
- Authority
- JP
- Japan
- Prior art keywords
- certain embodiments
- present
- relates
- aryl
- group
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 239000003446 ligand Substances 0.000 title claims description 440
- 238000000034 method Methods 0.000 title claims description 431
- 229910052723 transition metal Inorganic materials 0.000 title claims description 70
- 150000003624 transition metals Chemical class 0.000 title claims description 70
- 238000006880 cross-coupling reaction Methods 0.000 title description 28
- 125000000217 alkyl group Chemical group 0.000 claims description 173
- 125000003118 aryl group Chemical group 0.000 claims description 152
- 125000001072 heteroaryl group Chemical group 0.000 claims description 95
- 239000001257 hydrogen Substances 0.000 claims description 95
- 229910052739 hydrogen Inorganic materials 0.000 claims description 95
- -1 1- adamantyl Chemical group 0.000 claims description 91
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 74
- 239000000203 mixture Substances 0.000 claims description 74
- 125000003710 aryl alkyl group Chemical group 0.000 claims description 60
- 150000001408 amides Chemical class 0.000 claims description 51
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 claims description 51
- 125000004475 heteroaralkyl group Chemical group 0.000 claims description 46
- 229910052751 metal Inorganic materials 0.000 claims description 38
- 125000000592 heterocycloalkyl group Chemical group 0.000 claims description 34
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 claims description 32
- 229910052736 halogen Inorganic materials 0.000 claims description 31
- 239000002184 metal Substances 0.000 claims description 31
- 150000002367 halogens Chemical class 0.000 claims description 30
- 229910052763 palladium Inorganic materials 0.000 claims description 30
- 125000000623 heterocyclic group Chemical group 0.000 claims description 26
- 125000003342 alkenyl group Chemical group 0.000 claims description 24
- 125000004429 atom Chemical group 0.000 claims description 24
- 229910052794 bromium Inorganic materials 0.000 claims description 22
- 229910052801 chlorine Inorganic materials 0.000 claims description 22
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 claims description 22
- 229910052757 nitrogen Inorganic materials 0.000 claims description 19
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 claims description 16
- 229910019142 PO4 Inorganic materials 0.000 claims description 16
- 150000004703 alkoxides Chemical class 0.000 claims description 16
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 claims description 16
- 239000010452 phosphate Substances 0.000 claims description 16
- 125000003107 substituted aryl group Chemical group 0.000 claims description 16
- 125000005842 heteroatom Chemical group 0.000 claims description 15
- 229910052759 nickel Inorganic materials 0.000 claims description 15
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 claims description 14
- 125000004103 aminoalkyl group Chemical group 0.000 claims description 12
- 125000000392 cycloalkenyl group Chemical group 0.000 claims description 12
- 229910052697 platinum Inorganic materials 0.000 claims description 12
- 229910052740 iodine Inorganic materials 0.000 claims description 11
- GJVFBWCTGUSGDD-UHFFFAOYSA-L pentamethonium bromide Chemical group [Br-].[Br-].C[N+](C)(C)CCCCC[N+](C)(C)C GJVFBWCTGUSGDD-UHFFFAOYSA-L 0.000 claims description 11
- 125000003545 alkoxy group Chemical group 0.000 claims description 10
- 125000004415 heterocyclylalkyl group Chemical group 0.000 claims description 10
- XLYOFNOQVPJJNP-UHFFFAOYSA-M hydroxide Chemical compound [OH-] XLYOFNOQVPJJNP-UHFFFAOYSA-M 0.000 claims description 10
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 10
- 125000005010 perfluoroalkyl group Chemical group 0.000 claims description 7
- KRHYYFGTRYWZRS-UHFFFAOYSA-M Fluoride anion Chemical compound [F-] KRHYYFGTRYWZRS-UHFFFAOYSA-M 0.000 claims description 6
- 125000004404 heteroalkyl group Chemical group 0.000 claims description 6
- 150000004678 hydrides Chemical class 0.000 claims description 6
- 125000004665 trialkylsilyl group Chemical group 0.000 claims description 6
- 125000004435 hydrogen atom Chemical class [H]* 0.000 claims description 5
- 125000005106 triarylsilyl group Chemical group 0.000 claims description 5
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 claims description 3
- 238000006243 chemical reaction Methods 0.000 description 205
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 127
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 120
- 239000000243 solution Substances 0.000 description 112
- 239000003054 catalyst Substances 0.000 description 103
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 102
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical group CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 93
- KDLHZDBZIXYQEI-UHFFFAOYSA-N palladium Substances [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 82
- 238000005481 NMR spectroscopy Methods 0.000 description 74
- 230000015572 biosynthetic process Effects 0.000 description 70
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 description 69
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 68
- 238000003786 synthesis reaction Methods 0.000 description 66
- 150000002431 hydrogen Chemical class 0.000 description 60
- 239000002904 solvent Substances 0.000 description 58
- 235000019439 ethyl acetate Nutrition 0.000 description 56
- 229910052786 argon Inorganic materials 0.000 description 51
- 239000007787 solid Substances 0.000 description 51
- 239000000047 product Substances 0.000 description 49
- 150000001875 compounds Chemical class 0.000 description 47
- 239000002585 base Substances 0.000 description 44
- 238000003756 stirring Methods 0.000 description 43
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 42
- 150000001412 amines Chemical class 0.000 description 42
- 150000001500 aryl chlorides Chemical class 0.000 description 42
- 239000012043 crude product Substances 0.000 description 41
- 230000008569 process Effects 0.000 description 41
- PAYRUJLWNCNPSJ-UHFFFAOYSA-N Aniline Chemical compound NC1=CC=CC=C1 PAYRUJLWNCNPSJ-UHFFFAOYSA-N 0.000 description 40
- 239000011541 reaction mixture Substances 0.000 description 40
- MFRIHAYPQRLWNB-UHFFFAOYSA-N sodium tert-butoxide Chemical compound [Na+].CC(C)(C)[O-] MFRIHAYPQRLWNB-UHFFFAOYSA-N 0.000 description 37
- 229910052573 porcelain Inorganic materials 0.000 description 36
- 238000005859 coupling reaction Methods 0.000 description 35
- 0 CCCc(cc1CCC)cc(CCC)c1-c(c(*)c(cc1)OC)c1OC Chemical compound CCCc(cc1CCC)cc(CCC)c1-c(c(*)c(cc1)OC)c1OC 0.000 description 31
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 31
- 239000000377 silicon dioxide Substances 0.000 description 31
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 30
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 29
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 29
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 29
- BAVYZALUXZFZLV-UHFFFAOYSA-N Methylamine Chemical compound NC BAVYZALUXZFZLV-UHFFFAOYSA-N 0.000 description 27
- 239000000758 substrate Substances 0.000 description 27
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 26
- 230000008878 coupling Effects 0.000 description 25
- 238000010168 coupling process Methods 0.000 description 25
- 238000010992 reflux Methods 0.000 description 25
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 24
- 125000001424 substituent group Chemical group 0.000 description 24
- 239000004809 Teflon Substances 0.000 description 23
- 229920006362 Teflon® Polymers 0.000 description 23
- XYFCBTPGUUZFHI-UHFFFAOYSA-N Phosphine Natural products P XYFCBTPGUUZFHI-UHFFFAOYSA-N 0.000 description 21
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical compound C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 21
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical group CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 20
- MZRVEZGGRBJDDB-UHFFFAOYSA-N n-Butyllithium Substances [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 20
- YRGAYAGBVIXNAQ-UHFFFAOYSA-N 1-chloro-4-methoxybenzene Chemical compound COC1=CC=C(Cl)C=C1 YRGAYAGBVIXNAQ-UHFFFAOYSA-N 0.000 description 18
- 238000012360 testing method Methods 0.000 description 18
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 17
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 17
- 229910052799 carbon Inorganic materials 0.000 description 17
- 239000013078 crystal Substances 0.000 description 17
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 16
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 16
- 230000009257 reactivity Effects 0.000 description 16
- GEHJYWRUCIMESM-UHFFFAOYSA-L sodium sulfite Chemical compound [Na+].[Na+].[O-]S([O-])=O GEHJYWRUCIMESM-UHFFFAOYSA-L 0.000 description 16
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 15
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 15
- DLEDOFVPSDKWEF-UHFFFAOYSA-N lithium butane Chemical compound [Li+].CCC[CH2-] DLEDOFVPSDKWEF-UHFFFAOYSA-N 0.000 description 15
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 15
- 239000007858 starting material Substances 0.000 description 15
- MVPPADPHJFYWMZ-UHFFFAOYSA-N chlorobenzene Chemical compound ClC1=CC=CC=C1 MVPPADPHJFYWMZ-UHFFFAOYSA-N 0.000 description 14
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 13
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 13
- 150000002576 ketones Chemical class 0.000 description 13
- 230000035484 reaction time Effects 0.000 description 13
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 12
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 12
- OFBQJSOFQDEBGM-UHFFFAOYSA-N Pentane Chemical compound CCCCC OFBQJSOFQDEBGM-UHFFFAOYSA-N 0.000 description 12
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 12
- 239000012044 organic layer Substances 0.000 description 12
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 12
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 12
- LPXPTNMVRIOKMN-UHFFFAOYSA-M sodium nitrite Chemical compound [Na+].[O-]N=O LPXPTNMVRIOKMN-UHFFFAOYSA-M 0.000 description 12
- 125000000304 alkynyl group Chemical group 0.000 description 11
- 235000010290 biphenyl Nutrition 0.000 description 11
- 239000004305 biphenyl Substances 0.000 description 11
- 230000003197 catalytic effect Effects 0.000 description 11
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 11
- 229910052760 oxygen Inorganic materials 0.000 description 11
- 239000012041 precatalyst Substances 0.000 description 11
- 230000002829 reductive effect Effects 0.000 description 11
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 10
- SNRUBQQJIBEYMU-UHFFFAOYSA-N dodecane Chemical compound CCCCCCCCCCCC SNRUBQQJIBEYMU-UHFFFAOYSA-N 0.000 description 10
- 229920001971 elastomer Polymers 0.000 description 10
- 239000010410 layer Substances 0.000 description 10
- 238000011068 loading method Methods 0.000 description 10
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 10
- 229910000073 phosphorus hydride Inorganic materials 0.000 description 10
- 150000003141 primary amines Chemical class 0.000 description 10
- 239000000376 reactant Substances 0.000 description 10
- 239000011734 sodium Substances 0.000 description 10
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 9
- YLQBMQCUIZJEEH-UHFFFAOYSA-N Furan Chemical compound C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 9
- 150000001448 anilines Chemical class 0.000 description 9
- 238000006254 arylation reaction Methods 0.000 description 9
- 239000012267 brine Substances 0.000 description 9
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 9
- 150000002148 esters Chemical class 0.000 description 9
- 239000011521 glass Substances 0.000 description 9
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 9
- 238000006464 oxidative addition reaction Methods 0.000 description 9
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 9
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 9
- 238000006467 substitution reaction Methods 0.000 description 9
- 229910052717 sulfur Inorganic materials 0.000 description 9
- UGOMMVLRQDMAQQ-UHFFFAOYSA-N xphos Chemical compound CC(C)C1=CC(C(C)C)=CC(C(C)C)=C1C1=CC=CC=C1P(C1CCCCC1)C1CCCCC1 UGOMMVLRQDMAQQ-UHFFFAOYSA-N 0.000 description 9
- PAAZPARNPHGIKF-UHFFFAOYSA-N 1,2-dibromoethane Chemical compound BrCCBr PAAZPARNPHGIKF-UHFFFAOYSA-N 0.000 description 8
- BMVXCPBXGZKUPN-UHFFFAOYSA-N 1-hexanamine Chemical compound CCCCCCN BMVXCPBXGZKUPN-UHFFFAOYSA-N 0.000 description 8
- WNCYZVMZKSOPMU-UHFFFAOYSA-N 2-fluoro-1,4-dimethoxybenzene Chemical compound COC1=CC=C(OC)C(F)=C1 WNCYZVMZKSOPMU-UHFFFAOYSA-N 0.000 description 8
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 8
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 8
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 8
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 description 8
- DSODRWWHAUGSGD-UHFFFAOYSA-N [5-(carbamimidoylsulfanylmethyl)thiophen-2-yl]methyl carbamimidothioate;dihydrochloride Chemical compound Cl.Cl.NC(=N)SCC1=CC=C(CSC(N)=N)S1 DSODRWWHAUGSGD-UHFFFAOYSA-N 0.000 description 8
- 150000001299 aldehydes Chemical class 0.000 description 8
- 238000005576 amination reaction Methods 0.000 description 8
- 150000001502 aryl halides Chemical class 0.000 description 8
- 125000001246 bromo group Chemical group Br* 0.000 description 8
- 239000003153 chemical reaction reagent Substances 0.000 description 8
- 230000000694 effects Effects 0.000 description 8
- 239000011630 iodine Substances 0.000 description 8
- 239000011777 magnesium Substances 0.000 description 8
- 229910052749 magnesium Inorganic materials 0.000 description 8
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 8
- 235000010265 sodium sulphite Nutrition 0.000 description 8
- FUMMYHVKFAHQST-UHFFFAOYSA-N 2-bromo-1,3,5-tri(propan-2-yl)benzene Chemical compound CC(C)C1=CC(C(C)C)=C(Br)C(C(C)C)=C1 FUMMYHVKFAHQST-UHFFFAOYSA-N 0.000 description 7
- LOUYGKSUFMSHGM-UHFFFAOYSA-N 2-iodo-1,4-dimethoxy-3-[2,4,6-tri(propan-2-yl)phenyl]benzene Chemical group COC1=CC=C(OC)C(C=2C(=CC(=CC=2C(C)C)C(C)C)C(C)C)=C1I LOUYGKSUFMSHGM-UHFFFAOYSA-N 0.000 description 7
- 239000007818 Grignard reagent Substances 0.000 description 7
- 150000001491 aromatic compounds Chemical group 0.000 description 7
- 125000004432 carbon atom Chemical group C* 0.000 description 7
- 238000006555 catalytic reaction Methods 0.000 description 7
- 125000001033 ether group Chemical group 0.000 description 7
- 238000002474 experimental method Methods 0.000 description 7
- 150000004795 grignard reagents Chemical class 0.000 description 7
- 150000004820 halides Chemical class 0.000 description 7
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 7
- COCAUCFPFHUGAA-MGNBDDOMSA-N n-[3-[(1s,7s)-5-amino-4-thia-6-azabicyclo[5.1.0]oct-5-en-7-yl]-4-fluorophenyl]-5-chloropyridine-2-carboxamide Chemical compound C=1C=C(F)C([C@@]23N=C(SCC[C@@H]2C3)N)=CC=1NC(=O)C1=CC=C(Cl)C=N1 COCAUCFPFHUGAA-MGNBDDOMSA-N 0.000 description 7
- 239000001301 oxygen Substances 0.000 description 7
- 239000000126 substance Substances 0.000 description 7
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 description 7
- 239000011593 sulfur Substances 0.000 description 7
- SOIIHESTBYNJRH-PMPSAXMXSA-N (3r,6r,8as)-6-(benzylsulfonylamino)-n-[3-(diaminomethylideneamino)propyl]-5-oxo-2,3,6,7,8,8a-hexahydro-[1,3]thiazolo[3,2-a]pyridine-3-carboxamide Chemical compound N([C@@H]1CC[C@@H]2SC[C@H](N2C1=O)C(=O)NCCCN=C(N)N)S(=O)(=O)CC1=CC=CC=C1 SOIIHESTBYNJRH-PMPSAXMXSA-N 0.000 description 6
- 229910021591 Copper(I) chloride Inorganic materials 0.000 description 6
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 6
- SIKJAQJRHWYJAI-UHFFFAOYSA-N Indole Chemical compound C1=CC=C2NC=CC2=C1 SIKJAQJRHWYJAI-UHFFFAOYSA-N 0.000 description 6
- UFWIBTONFRDIAS-UHFFFAOYSA-N Naphthalene Chemical compound C1=CC=CC2=CC=CC=C21 UFWIBTONFRDIAS-UHFFFAOYSA-N 0.000 description 6
- KYQCOXFCLRTKLS-UHFFFAOYSA-N Pyrazine Chemical compound C1=CN=CC=N1 KYQCOXFCLRTKLS-UHFFFAOYSA-N 0.000 description 6
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 6
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 6
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 description 6
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 6
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 6
- 125000004414 alkyl thio group Chemical group 0.000 description 6
- MWPLVEDNUUSJAV-UHFFFAOYSA-N anthracene Chemical compound C1=CC=CC2=CC3=CC=CC=C3C=C21 MWPLVEDNUUSJAV-UHFFFAOYSA-N 0.000 description 6
- 150000004982 aromatic amines Chemical class 0.000 description 6
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 6
- XSCHRSMBECNVNS-UHFFFAOYSA-N benzopyrazine Natural products N1=CC=NC2=CC=CC=C21 XSCHRSMBECNVNS-UHFFFAOYSA-N 0.000 description 6
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 6
- 238000004440 column chromatography Methods 0.000 description 6
- OXBLHERUFWYNTN-UHFFFAOYSA-M copper(I) chloride Chemical compound [Cu]Cl OXBLHERUFWYNTN-UHFFFAOYSA-M 0.000 description 6
- 125000004093 cyano group Chemical group *C#N 0.000 description 6
- 238000003818 flash chromatography Methods 0.000 description 6
- 238000005755 formation reaction Methods 0.000 description 6
- 125000000524 functional group Chemical group 0.000 description 6
- 125000003187 heptyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 6
- 125000002347 octyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 6
- 125000003367 polycyclic group Chemical group 0.000 description 6
- 150000003839 salts Chemical class 0.000 description 6
- 239000012047 saturated solution Substances 0.000 description 6
- 229910052708 sodium Inorganic materials 0.000 description 6
- 235000010288 sodium nitrite Nutrition 0.000 description 6
- 239000002879 Lewis base Substances 0.000 description 5
- PCNDJXKNXGMECE-UHFFFAOYSA-N Phenazine Natural products C1=CC=CC2=NC3=CC=CC=C3N=C21 PCNDJXKNXGMECE-UHFFFAOYSA-N 0.000 description 5
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 5
- 238000007112 amidation reaction Methods 0.000 description 5
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 5
- 239000007795 chemical reaction product Substances 0.000 description 5
- 125000004122 cyclic group Chemical group 0.000 description 5
- 125000005241 heteroarylamino group Chemical group 0.000 description 5
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 5
- 239000007788 liquid Substances 0.000 description 5
- 150000002894 organic compounds Chemical class 0.000 description 5
- 150000003139 primary aliphatic amines Chemical class 0.000 description 5
- 150000003335 secondary amines Chemical class 0.000 description 5
- AVIDGKOMVYPADX-UHFFFAOYSA-N (4-tert-butylphenyl) methanesulfonate Chemical compound CC(C)(C)C1=CC=C(OS(C)(=O)=O)C=C1 AVIDGKOMVYPADX-UHFFFAOYSA-N 0.000 description 4
- GQHTUMJGOHRCHB-UHFFFAOYSA-N 2,3,4,6,7,8,9,10-octahydropyrimido[1,2-a]azepine Chemical compound C1CCCCN2CCCN=C21 GQHTUMJGOHRCHB-UHFFFAOYSA-N 0.000 description 4
- BWRRWBIBNBVHQF-UHFFFAOYSA-N 4-(3-pyridin-2-yl-1,2,4-oxadiazol-5-yl)butanoic acid Chemical compound O1C(CCCC(=O)O)=NC(C=2N=CC=CC=2)=N1 BWRRWBIBNBVHQF-UHFFFAOYSA-N 0.000 description 4
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 4
- UJOBWOGCFQCDNV-UHFFFAOYSA-N 9H-carbazole Chemical compound C1=CC=C2C3=CC=CC=C3NC2=C1 UJOBWOGCFQCDNV-UHFFFAOYSA-N 0.000 description 4
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 4
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 4
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 4
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 4
- LCGLNKUTAGEVQW-UHFFFAOYSA-N Dimethyl ether Chemical compound COC LCGLNKUTAGEVQW-UHFFFAOYSA-N 0.000 description 4
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 4
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 4
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical compound C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 description 4
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 4
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 4
- DGEZNRSVGBDHLK-UHFFFAOYSA-N [1,10]phenanthroline Chemical compound C1=CN=C2C3=NC=CC=C3C=CC2=C1 DGEZNRSVGBDHLK-UHFFFAOYSA-N 0.000 description 4
- DZBUGLKDJFMEHC-UHFFFAOYSA-N acridine Chemical compound C1=CC=CC2=CC3=CC=CC=C3N=C21 DZBUGLKDJFMEHC-UHFFFAOYSA-N 0.000 description 4
- XQJHRCVXRAJIDY-UHFFFAOYSA-N aminophosphine Chemical compound PN XQJHRCVXRAJIDY-UHFFFAOYSA-N 0.000 description 4
- 125000006615 aromatic heterocyclic group Chemical group 0.000 description 4
- WGQKYBSKWIADBV-UHFFFAOYSA-N benzylamine Chemical compound NCC1=CC=CC=C1 WGQKYBSKWIADBV-UHFFFAOYSA-N 0.000 description 4
- MUALRAIOVNYAIW-UHFFFAOYSA-N binap Chemical compound C1=CC=CC=C1P(C=1C(=C2C=CC=CC2=CC=1)C=1C2=CC=CC=C2C=CC=1P(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 MUALRAIOVNYAIW-UHFFFAOYSA-N 0.000 description 4
- 238000006664 bond formation reaction Methods 0.000 description 4
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 4
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 4
- 239000007819 coupling partner Substances 0.000 description 4
- 238000001212 derivatisation Methods 0.000 description 4
- WDVGNXKCFBOKDF-UHFFFAOYSA-N dicyclohexyl-[3,6-dimethoxy-2-[2,4,6-tri(propan-2-yl)phenyl]phenyl]phosphane Chemical compound COC1=CC=C(OC)C(C=2C(=CC(=CC=2C(C)C)C(C)C)C(C)C)=C1P(C1CCCCC1)C1CCCCC1 WDVGNXKCFBOKDF-UHFFFAOYSA-N 0.000 description 4
- SBZXBUIDTXKZTM-UHFFFAOYSA-N diglyme Chemical compound COCCOCCOC SBZXBUIDTXKZTM-UHFFFAOYSA-N 0.000 description 4
- 238000011156 evaluation Methods 0.000 description 4
- OAKJQQAXSVQMHS-UHFFFAOYSA-N hydrazine group Chemical group NN OAKJQQAXSVQMHS-UHFFFAOYSA-N 0.000 description 4
- 238000011065 in-situ storage Methods 0.000 description 4
- 239000000543 intermediate Substances 0.000 description 4
- AWJUIBRHMBBTKR-UHFFFAOYSA-N isoquinoline Chemical compound C1=NC=CC2=CC=CC=C21 AWJUIBRHMBBTKR-UHFFFAOYSA-N 0.000 description 4
- ZCSHNCUQKCANBX-UHFFFAOYSA-N lithium diisopropylamide Chemical compound [Li+].CC(C)[N-]C(C)C ZCSHNCUQKCANBX-UHFFFAOYSA-N 0.000 description 4
- 239000000463 material Substances 0.000 description 4
- 230000000269 nucleophilic effect Effects 0.000 description 4
- 230000003287 optical effect Effects 0.000 description 4
- RDOWQLZANAYVLL-UHFFFAOYSA-N phenanthridine Chemical compound C1=CC=C2C3=CC=CC=C3C=NC2=C1 RDOWQLZANAYVLL-UHFFFAOYSA-N 0.000 description 4
- ACVYVLVWPXVTIT-UHFFFAOYSA-M phosphinate Chemical group [O-][PH2]=O ACVYVLVWPXVTIT-UHFFFAOYSA-M 0.000 description 4
- UEZVMMHDMIWARA-UHFFFAOYSA-M phosphonate Chemical group [O-]P(=O)=O UEZVMMHDMIWARA-UHFFFAOYSA-M 0.000 description 4
- LFGREXWGYUGZLY-UHFFFAOYSA-N phosphoryl Chemical group [P]=O LFGREXWGYUGZLY-UHFFFAOYSA-N 0.000 description 4
- 239000003880 polar aprotic solvent Substances 0.000 description 4
- 239000002798 polar solvent Substances 0.000 description 4
- 229910052700 potassium Inorganic materials 0.000 description 4
- 239000011591 potassium Substances 0.000 description 4
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 4
- 125000006239 protecting group Chemical group 0.000 description 4
- 238000006894 reductive elimination reaction Methods 0.000 description 4
- 229930192474 thiophene Natural products 0.000 description 4
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 4
- LIKMAJRDDDTEIG-UHFFFAOYSA-N 1-hexene Chemical compound CCCCC=C LIKMAJRDDDTEIG-UHFFFAOYSA-N 0.000 description 3
- YOFQTXJUKOHKLM-UHFFFAOYSA-N 2-(2-iodo-3-methoxyphenyl)-1,3,5-tri(propan-2-yl)benzene Chemical group COC1=CC=CC(C=2C(=CC(=CC=2C(C)C)C(C)C)C(C)C)=C1I YOFQTXJUKOHKLM-UHFFFAOYSA-N 0.000 description 3
- KZNRNQGTVRTDPN-UHFFFAOYSA-N 2-chloro-1,4-dimethylbenzene Chemical group CC1=CC=C(C)C(Cl)=C1 KZNRNQGTVRTDPN-UHFFFAOYSA-N 0.000 description 3
- RWOIGTWEPILDJJ-UHFFFAOYSA-N 2-iodo-1,5-dimethoxy-3-[2,4,6-tri(propan-2-yl)phenyl]benzene Chemical group COC1=CC(OC)=C(I)C(C=2C(=CC(=CC=2C(C)C)C(C)C)C(C)C)=C1 RWOIGTWEPILDJJ-UHFFFAOYSA-N 0.000 description 3
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 3
- IMPPGHMHELILKG-UHFFFAOYSA-N 4-ethoxyaniline Chemical compound CCOC1=CC=C(N)C=C1 IMPPGHMHELILKG-UHFFFAOYSA-N 0.000 description 3
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 3
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 3
- ZCQWOFVYLHDMMC-UHFFFAOYSA-N Oxazole Chemical compound C1=COC=N1 ZCQWOFVYLHDMMC-UHFFFAOYSA-N 0.000 description 3
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical compound C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 description 3
- 229910004298 SiO 2 Inorganic materials 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 238000005700 Stille cross coupling reaction Methods 0.000 description 3
- 239000002253 acid Substances 0.000 description 3
- 150000001298 alcohols Chemical class 0.000 description 3
- 125000001931 aliphatic group Chemical group 0.000 description 3
- 229910052783 alkali metal Inorganic materials 0.000 description 3
- 150000001345 alkine derivatives Chemical group 0.000 description 3
- 230000009435 amidation Effects 0.000 description 3
- 125000005228 aryl sulfonate group Chemical group 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- RAABOESOVLLHRU-UHFFFAOYSA-N diazene Chemical group N=N RAABOESOVLLHRU-UHFFFAOYSA-N 0.000 description 3
- IWMMXPNBCHCFCY-UHFFFAOYSA-M dicyclohexyl-[3,6-dimethoxy-2-[2,4,6-tri(propan-2-yl)phenyl]phenyl]phosphane;palladium(2+);2-phenylethanamine;chloride Chemical compound [Pd+]Cl.NCCC1=CC=CC=[C-]1.COC1=CC=C(OC)C(C=2C(=CC(=CC=2C(C)C)C(C)C)C(C)C)=C1P(C1CCCCC1)C1CCCCC1 IWMMXPNBCHCFCY-UHFFFAOYSA-M 0.000 description 3
- 125000006575 electron-withdrawing group Chemical group 0.000 description 3
- OAYLNYINCPYISS-UHFFFAOYSA-N ethyl acetate;hexane Chemical compound CCCCCC.CCOC(C)=O OAYLNYINCPYISS-UHFFFAOYSA-N 0.000 description 3
- 230000006872 improvement Effects 0.000 description 3
- PZOUSPYUWWUPPK-UHFFFAOYSA-N indole Natural products CC1=CC=CC2=C1C=CN2 PZOUSPYUWWUPPK-UHFFFAOYSA-N 0.000 description 3
- RKJUIXBNRJVNHR-UHFFFAOYSA-N indolenine Natural products C1=CC=C2CC=NC2=C1 RKJUIXBNRJVNHR-UHFFFAOYSA-N 0.000 description 3
- 239000012035 limiting reagent Substances 0.000 description 3
- 230000001404 mediated effect Effects 0.000 description 3
- 150000002739 metals Chemical class 0.000 description 3
- 125000004170 methylsulfonyl group Chemical group [H]C([H])([H])S(*)(=O)=O 0.000 description 3
- 125000002950 monocyclic group Chemical group 0.000 description 3
- 239000012452 mother liquor Substances 0.000 description 3
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 3
- 230000003647 oxidation Effects 0.000 description 3
- 238000007254 oxidation reaction Methods 0.000 description 3
- 230000037361 pathway Effects 0.000 description 3
- 229920000642 polymer Polymers 0.000 description 3
- 239000002243 precursor Substances 0.000 description 3
- PBMFSQRYOILNGV-UHFFFAOYSA-N pyridazine Chemical compound C1=CC=NN=C1 PBMFSQRYOILNGV-UHFFFAOYSA-N 0.000 description 3
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 3
- 238000007086 side reaction Methods 0.000 description 3
- 241000894007 species Species 0.000 description 3
- 229940124530 sulfonamide Drugs 0.000 description 3
- 150000003456 sulfonamides Chemical group 0.000 description 3
- BDHFUVZGWQCTTF-UHFFFAOYSA-M sulfonate Chemical compound [O-]S(=O)=O BDHFUVZGWQCTTF-UHFFFAOYSA-M 0.000 description 3
- 150000003871 sulfonates Chemical class 0.000 description 3
- CXWXQJXEFPUFDZ-UHFFFAOYSA-N tetralin Chemical compound C1=CC=C2CCCCC2=C1 CXWXQJXEFPUFDZ-UHFFFAOYSA-N 0.000 description 3
- 238000012546 transfer Methods 0.000 description 3
- 238000003828 vacuum filtration Methods 0.000 description 3
- KZPYGQFFRCFCPP-UHFFFAOYSA-N 1,1'-bis(diphenylphosphino)ferrocene Chemical compound [Fe+2].C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1 KZPYGQFFRCFCPP-UHFFFAOYSA-N 0.000 description 2
- DPZNOMCNRMUKPS-UHFFFAOYSA-N 1,3-Dimethoxybenzene Chemical compound COC1=CC=CC(OC)=C1 DPZNOMCNRMUKPS-UHFFFAOYSA-N 0.000 description 2
- VYXHVRARDIDEHS-UHFFFAOYSA-N 1,5-cyclooctadiene Chemical compound C1CC=CCCC=C1 VYXHVRARDIDEHS-UHFFFAOYSA-N 0.000 description 2
- 239000004912 1,5-cyclooctadiene Substances 0.000 description 2
- FLBAYUMRQUHISI-UHFFFAOYSA-N 1,8-naphthyridine Chemical compound N1=CC=CC2=CC=CN=C21 FLBAYUMRQUHISI-UHFFFAOYSA-N 0.000 description 2
- IANQTJSKSUMEQM-UHFFFAOYSA-N 1-benzofuran Chemical compound C1=CC=C2OC=CC2=C1 IANQTJSKSUMEQM-UHFFFAOYSA-N 0.000 description 2
- IBSQPLPBRSHTTG-UHFFFAOYSA-N 1-chloro-2-methylbenzene Chemical compound CC1=CC=CC=C1Cl IBSQPLPBRSHTTG-UHFFFAOYSA-N 0.000 description 2
- WJFKNYWRSNBZNX-UHFFFAOYSA-N 10H-phenothiazine Chemical compound C1=CC=C2NC3=CC=CC=C3SC2=C1 WJFKNYWRSNBZNX-UHFFFAOYSA-N 0.000 description 2
- TZMSYXZUNZXBOL-UHFFFAOYSA-N 10H-phenoxazine Chemical compound C1=CC=C2NC3=CC=CC=C3OC2=C1 TZMSYXZUNZXBOL-UHFFFAOYSA-N 0.000 description 2
- 238000004791 1D NOESY Methods 0.000 description 2
- BAXOFTOLAUCFNW-UHFFFAOYSA-N 1H-indazole Chemical compound C1=CC=C2C=NNC2=C1 BAXOFTOLAUCFNW-UHFFFAOYSA-N 0.000 description 2
- VEPOHXYIFQMVHW-XOZOLZJESA-N 2,3-dihydroxybutanedioic acid (2S,3S)-3,4-dimethyl-2-phenylmorpholine Chemical compound OC(C(O)C(O)=O)C(O)=O.C[C@H]1[C@@H](OCCN1C)c1ccccc1 VEPOHXYIFQMVHW-XOZOLZJESA-N 0.000 description 2
- VOWZNBNDMFLQGM-UHFFFAOYSA-N 2,5-dimethylaniline Chemical compound CC1=CC=C(C)C(N)=C1 VOWZNBNDMFLQGM-UHFFFAOYSA-N 0.000 description 2
- UXGVMFHEKMGWMA-UHFFFAOYSA-N 2-benzofuran Chemical compound C1=CC=CC2=COC=C21 UXGVMFHEKMGWMA-UHFFFAOYSA-N 0.000 description 2
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 2
- VHMICKWLTGFITH-UHFFFAOYSA-N 2H-isoindole Chemical compound C1=CC=CC2=CNC=C21 VHMICKWLTGFITH-UHFFFAOYSA-N 0.000 description 2
- MGADZUXDNSDTHW-UHFFFAOYSA-N 2H-pyran Chemical compound C1OC=CC=C1 MGADZUXDNSDTHW-UHFFFAOYSA-N 0.000 description 2
- KRZCOLNOCZKSDF-UHFFFAOYSA-N 4-fluoroaniline Chemical compound NC1=CC=C(F)C=C1 KRZCOLNOCZKSDF-UHFFFAOYSA-N 0.000 description 2
- GKJSZXGYFJBYRQ-UHFFFAOYSA-N 6-chloroquinoline Chemical compound N1=CC=CC2=CC(Cl)=CC=C21 GKJSZXGYFJBYRQ-UHFFFAOYSA-N 0.000 description 2
- GJCOSYZMQJWQCA-UHFFFAOYSA-N 9H-xanthene Chemical compound C1=CC=C2CC3=CC=CC=C3OC2=C1 GJCOSYZMQJWQCA-UHFFFAOYSA-N 0.000 description 2
- DLFVBJFMPXGRIB-UHFFFAOYSA-N Acetamide Chemical compound CC(N)=O DLFVBJFMPXGRIB-UHFFFAOYSA-N 0.000 description 2
- KXDAEFPNCMNJSK-UHFFFAOYSA-N Benzamide Chemical compound NC(=O)C1=CC=CC=C1 KXDAEFPNCMNJSK-UHFFFAOYSA-N 0.000 description 2
- MONCLUXREQDGAF-UHFFFAOYSA-N C(C)(C)C1=C(C(=CC(=C1)C(C)C)C(C)C)C1=CC(=CC(=C1)OC)OC.C(C)(C)(C)P Chemical group C(C)(C)C1=C(C(=CC(=C1)C(C)C)C(C)C)C1=CC(=CC(=C1)OC)OC.C(C)(C)(C)P MONCLUXREQDGAF-UHFFFAOYSA-N 0.000 description 2
- WRWPPGUCZBJXKX-UHFFFAOYSA-N Cc(cc1)ccc1F Chemical compound Cc(cc1)ccc1F WRWPPGUCZBJXKX-UHFFFAOYSA-N 0.000 description 2
- GWHJZXXIDMPWGX-UHFFFAOYSA-N Cc1cc(C)c(C)cc1 Chemical compound Cc1cc(C)c(C)cc1 GWHJZXXIDMPWGX-UHFFFAOYSA-N 0.000 description 2
- LUYISICIYVKBTA-UHFFFAOYSA-N Cc1cc2cccnc2cc1 Chemical compound Cc1cc2cccnc2cc1 LUYISICIYVKBTA-UHFFFAOYSA-N 0.000 description 2
- ITQTTZVARXURQS-UHFFFAOYSA-N Cc1cnccc1 Chemical compound Cc1cnccc1 ITQTTZVARXURQS-UHFFFAOYSA-N 0.000 description 2
- 238000010485 C−C bond formation reaction Methods 0.000 description 2
- GSNUFIFRDBKVIE-UHFFFAOYSA-N DMF Natural products CC1=CC=C(C)O1 GSNUFIFRDBKVIE-UHFFFAOYSA-N 0.000 description 2
- BDAGIHXWWSANSR-UHFFFAOYSA-M Formate Chemical compound [O-]C=O BDAGIHXWWSANSR-UHFFFAOYSA-M 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical group [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 2
- 101150003085 Pdcl gene Proteins 0.000 description 2
- ATUOYWHBWRKTHZ-UHFFFAOYSA-N Propane Chemical compound CCC ATUOYWHBWRKTHZ-UHFFFAOYSA-N 0.000 description 2
- 238000003477 Sonogashira cross-coupling reaction Methods 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 2
- FZWLAAWBMGSTSO-UHFFFAOYSA-N Thiazole Chemical compound C1=CSC=N1 FZWLAAWBMGSTSO-UHFFFAOYSA-N 0.000 description 2
- 150000001241 acetals Chemical class 0.000 description 2
- 230000004913 activation Effects 0.000 description 2
- 125000004442 acylamino group Chemical group 0.000 description 2
- 230000010933 acylation Effects 0.000 description 2
- 238000005917 acylation reaction Methods 0.000 description 2
- 150000003973 alkyl amines Chemical class 0.000 description 2
- 125000003277 amino group Chemical group 0.000 description 2
- 150000003927 aminopyridines Chemical class 0.000 description 2
- 150000005005 aminopyrimidines Chemical class 0.000 description 2
- 125000004397 aminosulfonyl group Chemical group NS(=O)(=O)* 0.000 description 2
- 229940121375 antifungal agent Drugs 0.000 description 2
- 239000003429 antifungal agent Substances 0.000 description 2
- 239000000010 aprotic solvent Substances 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 239000012300 argon atmosphere Substances 0.000 description 2
- 150000005347 biaryls Chemical class 0.000 description 2
- 238000009835 boiling Methods 0.000 description 2
- ZADPBFCGQRWHPN-UHFFFAOYSA-N boronic acid Chemical compound OBO ZADPBFCGQRWHPN-UHFFFAOYSA-N 0.000 description 2
- QARVLSVVCXYDNA-UHFFFAOYSA-N bromobenzene Chemical compound BrC1=CC=CC=C1 QARVLSVVCXYDNA-UHFFFAOYSA-N 0.000 description 2
- 238000010743 carbon-heteroatom bond forming reactions Methods 0.000 description 2
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 2
- AKJFBIZAEPTXIL-UHFFFAOYSA-N chloro(dicyclohexyl)phosphane Chemical compound C1CCCCC1P(Cl)C1CCCCC1 AKJFBIZAEPTXIL-UHFFFAOYSA-N 0.000 description 2
- USJRLGNYCQWLPF-UHFFFAOYSA-N chlorophosphane Chemical compound ClP USJRLGNYCQWLPF-UHFFFAOYSA-N 0.000 description 2
- QZHPTGXQGDFGEN-UHFFFAOYSA-N chromene Chemical compound C1=CC=C2C=C[CH]OC2=C1 QZHPTGXQGDFGEN-UHFFFAOYSA-N 0.000 description 2
- WCZVZNOTHYJIEI-UHFFFAOYSA-N cinnoline Chemical compound N1=NC=CC2=CC=CC=C21 WCZVZNOTHYJIEI-UHFFFAOYSA-N 0.000 description 2
- XLJMAIOERFSOGZ-UHFFFAOYSA-M cyanate Chemical compound [O-]C#N XLJMAIOERFSOGZ-UHFFFAOYSA-M 0.000 description 2
- 230000002950 deficient Effects 0.000 description 2
- JQVDAXLFBXTEQA-UHFFFAOYSA-N dibutylamine Chemical compound CCCCNCCCC JQVDAXLFBXTEQA-UHFFFAOYSA-N 0.000 description 2
- KPUWHANPEXNPJT-UHFFFAOYSA-N disiloxane Chemical class [SiH3]O[SiH3] KPUWHANPEXNPJT-UHFFFAOYSA-N 0.000 description 2
- CDMGRVSWUWPAEK-UHFFFAOYSA-N ethyl 3-methylsulfonyloxybenzoate Chemical compound CCOC(=O)C1=CC=CC(OS(C)(=O)=O)=C1 CDMGRVSWUWPAEK-UHFFFAOYSA-N 0.000 description 2
- 239000007789 gas Substances 0.000 description 2
- 238000004817 gas chromatography Methods 0.000 description 2
- 238000010438 heat treatment Methods 0.000 description 2
- HOBCFUWDNJPFHB-UHFFFAOYSA-N indolizine Chemical compound C1=CC=CN2C=CC=C21 HOBCFUWDNJPFHB-UHFFFAOYSA-N 0.000 description 2
- 239000002917 insecticide Substances 0.000 description 2
- ZLTPDFXIESTBQG-UHFFFAOYSA-N isothiazole Chemical compound C=1C=NSC=1 ZLTPDFXIESTBQG-UHFFFAOYSA-N 0.000 description 2
- CTAPFRYPJLPFDF-UHFFFAOYSA-N isoxazole Chemical compound C=1C=NOC=1 CTAPFRYPJLPFDF-UHFFFAOYSA-N 0.000 description 2
- 150000007527 lewis bases Chemical class 0.000 description 2
- QDLAGTHXVHQKRE-UHFFFAOYSA-N lichenxanthone Natural products COC1=CC(O)=C2C(=O)C3=C(C)C=C(OC)C=C3OC2=C1 QDLAGTHXVHQKRE-UHFFFAOYSA-N 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 229910052744 lithium Inorganic materials 0.000 description 2
- YNESATAKKCNGOF-UHFFFAOYSA-N lithium bis(trimethylsilyl)amide Chemical compound [Li+].C[Si](C)(C)[N-][Si](C)(C)C YNESATAKKCNGOF-UHFFFAOYSA-N 0.000 description 2
- UBJFKNSINUCEAL-UHFFFAOYSA-N lithium;2-methylpropane Chemical compound [Li+].C[C-](C)C UBJFKNSINUCEAL-UHFFFAOYSA-N 0.000 description 2
- OTCKOJUMXQWKQG-UHFFFAOYSA-L magnesium bromide Chemical compound [Mg+2].[Br-].[Br-] OTCKOJUMXQWKQG-UHFFFAOYSA-L 0.000 description 2
- 229910001623 magnesium bromide Inorganic materials 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 150000003956 methylamines Chemical class 0.000 description 2
- 239000000178 monomer Substances 0.000 description 2
- SQDFHQJTAWCFIB-UHFFFAOYSA-N n-methylidenehydroxylamine Chemical compound ON=C SQDFHQJTAWCFIB-UHFFFAOYSA-N 0.000 description 2
- 125000005151 nonafluorobutanesulfonyl group Chemical group FC(C(C(S(=O)(=O)*)(F)F)(F)F)(C(F)(F)F)F 0.000 description 2
- 239000012074 organic phase Substances 0.000 description 2
- 150000002923 oximes Chemical class 0.000 description 2
- 230000000737 periodic effect Effects 0.000 description 2
- 239000012071 phase Substances 0.000 description 2
- YNPNZTXNASCQKK-UHFFFAOYSA-N phenanthrene Chemical compound C1=CC=C2C3=CC=CC=C3C=CC2=C1 YNPNZTXNASCQKK-UHFFFAOYSA-N 0.000 description 2
- 229950000688 phenothiazine Drugs 0.000 description 2
- HXITXNWTGFUOAU-UHFFFAOYSA-N phenylboronic acid Chemical compound OB(O)C1=CC=CC=C1 HXITXNWTGFUOAU-UHFFFAOYSA-N 0.000 description 2
- 229910052698 phosphorus Inorganic materials 0.000 description 2
- LFSXCDWNBUNEEM-UHFFFAOYSA-N phthalazine Chemical compound C1=NN=CC2=CC=CC=C21 LFSXCDWNBUNEEM-UHFFFAOYSA-N 0.000 description 2
- 229910000027 potassium carbonate Inorganic materials 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 238000001556 precipitation Methods 0.000 description 2
- BDERNNFJNOPAEC-UHFFFAOYSA-N propan-1-ol Chemical compound CCCO BDERNNFJNOPAEC-UHFFFAOYSA-N 0.000 description 2
- 125000002577 pseudohalo group Chemical group 0.000 description 2
- CPNGPNLZQNNVQM-UHFFFAOYSA-N pteridine Chemical compound N1=CN=CC2=NC=CN=C21 CPNGPNLZQNNVQM-UHFFFAOYSA-N 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- XFTQRUTUGRCSGO-UHFFFAOYSA-N pyrazin-2-amine Chemical compound NC1=CN=CC=N1 XFTQRUTUGRCSGO-UHFFFAOYSA-N 0.000 description 2
- BBEAQIROQSPTKN-UHFFFAOYSA-N pyrene Chemical compound C1=CC=C2C=CC3=CC=CC4=CC=C1C2=C43 BBEAQIROQSPTKN-UHFFFAOYSA-N 0.000 description 2
- JWVCLYRUEFBMGU-UHFFFAOYSA-N quinazoline Chemical compound N1=CN=CC2=CC=CC=C21 JWVCLYRUEFBMGU-UHFFFAOYSA-N 0.000 description 2
- 238000001953 recrystallisation Methods 0.000 description 2
- 229920006395 saturated elastomer Polymers 0.000 description 2
- WRIKHQLVHPKCJU-UHFFFAOYSA-N sodium bis(trimethylsilyl)amide Chemical compound C[Si](C)(C)N([Na])[Si](C)(C)C WRIKHQLVHPKCJU-UHFFFAOYSA-N 0.000 description 2
- 150000003462 sulfoxides Chemical class 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- RAOIDOHSFRTOEL-UHFFFAOYSA-N tetrahydrothiophene Chemical compound C1CCSC1 RAOIDOHSFRTOEL-UHFFFAOYSA-N 0.000 description 2
- GVIJJXMXTUZIOD-UHFFFAOYSA-N thianthrene Chemical compound C1=CC=C2SC3=CC=CC=C3SC2=C1 GVIJJXMXTUZIOD-UHFFFAOYSA-N 0.000 description 2
- 150000007970 thio esters Chemical class 0.000 description 2
- 125000002813 thiocarbonyl group Chemical group *C(*)=S 0.000 description 2
- 230000009466 transformation Effects 0.000 description 2
- WLPUWLXVBWGYMZ-UHFFFAOYSA-N tricyclohexylphosphine Chemical compound C1CCCCC1P(C1CCCCC1)C1CCCCC1 WLPUWLXVBWGYMZ-UHFFFAOYSA-N 0.000 description 2
- ITMCEJHCFYSIIV-UHFFFAOYSA-M triflate Chemical compound [O-]S(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-M 0.000 description 2
- 125000001889 triflyl group Chemical group FC(F)(F)S(*)(=O)=O 0.000 description 2
- IGNTWNVBGLNYDV-UHFFFAOYSA-N triisopropylphosphine Chemical compound CC(C)P(C(C)C)C(C)C IGNTWNVBGLNYDV-UHFFFAOYSA-N 0.000 description 2
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical compound CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 2
- YWWDBCBWQNCYNR-UHFFFAOYSA-N trimethylphosphine Chemical group CP(C)C YWWDBCBWQNCYNR-UHFFFAOYSA-N 0.000 description 2
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 2
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 2
- COIOYMYWGDAQPM-UHFFFAOYSA-N tris(2-methylphenyl)phosphane Chemical compound CC1=CC=CC=C1P(C=1C(=CC=CC=1)C)C1=CC=CC=C1C COIOYMYWGDAQPM-UHFFFAOYSA-N 0.000 description 2
- CYPYTURSJDMMMP-WVCUSYJESA-N (1e,4e)-1,5-diphenylpenta-1,4-dien-3-one;palladium Chemical compound [Pd].[Pd].C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1 CYPYTURSJDMMMP-WVCUSYJESA-N 0.000 description 1
- UKSZBOKPHAQOMP-SVLSSHOZSA-N (1e,4e)-1,5-diphenylpenta-1,4-dien-3-one;palladium Chemical compound [Pd].C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1 UKSZBOKPHAQOMP-SVLSSHOZSA-N 0.000 description 1
- CSPLGDDGIJDAJS-UHFFFAOYSA-N (2-methoxyphenyl) methanesulfonate Chemical compound COC1=CC=CC=C1OS(C)(=O)=O CSPLGDDGIJDAJS-UHFFFAOYSA-N 0.000 description 1
- RWLMSXZGLKJNHR-UHFFFAOYSA-N (3,4,5-trimethoxyphenyl) methanesulfonate Chemical compound COC1=CC(OS(C)(=O)=O)=CC(OC)=C1OC RWLMSXZGLKJNHR-UHFFFAOYSA-N 0.000 description 1
- KERGNBBIBYFCRB-UHFFFAOYSA-N (4-fluorophenyl) methanesulfonate Chemical compound CS(=O)(=O)OC1=CC=C(F)C=C1 KERGNBBIBYFCRB-UHFFFAOYSA-N 0.000 description 1
- CJDLTSDLPAQTLG-UHFFFAOYSA-M (4-phenylphenyl)methanesulfonate Chemical compound C1=CC(CS(=O)(=O)[O-])=CC=C1C1=CC=CC=C1 CJDLTSDLPAQTLG-UHFFFAOYSA-M 0.000 description 1
- POILWHVDKZOXJZ-ARJAWSKDSA-M (z)-4-oxopent-2-en-2-olate Chemical compound C\C([O-])=C\C(C)=O POILWHVDKZOXJZ-ARJAWSKDSA-M 0.000 description 1
- SCYULBFZEHDVBN-UHFFFAOYSA-N 1,1-Dichloroethane Chemical compound CC(Cl)Cl SCYULBFZEHDVBN-UHFFFAOYSA-N 0.000 description 1
- RMFRFTSSEHRKKW-UHFFFAOYSA-N 1,2-bis(diisopropylphosphino)ethane Chemical compound CC(C)P(C(C)C)CCP(C(C)C)C(C)C RMFRFTSSEHRKKW-UHFFFAOYSA-N 0.000 description 1
- ZKWQSBFSGZJNFP-UHFFFAOYSA-N 1,2-bis(dimethylphosphino)ethane Chemical compound CP(C)CCP(C)C ZKWQSBFSGZJNFP-UHFFFAOYSA-N 0.000 description 1
- VEZJOZSIGSNYEB-UHFFFAOYSA-N 1,2-dibromo-3,4,5,6-tetramethylbenzene Chemical compound CC1=C(C)C(C)=C(Br)C(Br)=C1C VEZJOZSIGSNYEB-UHFFFAOYSA-N 0.000 description 1
- JXDHKPJDJGEGRN-UHFFFAOYSA-N 1,3-dimethoxy-5-phenyl-2,4,6-tri(propan-2-yl)benzene Chemical group COC1=C(C(C)C)C(OC)=C(C(C)C)C(C=2C=CC=CC=2)=C1C(C)C JXDHKPJDJGEGRN-UHFFFAOYSA-N 0.000 description 1
- SGUVLZREKBPKCE-UHFFFAOYSA-N 1,5-diazabicyclo[4.3.0]-non-5-ene Chemical compound C1CCN=C2CCCN21 SGUVLZREKBPKCE-UHFFFAOYSA-N 0.000 description 1
- GPRYKVSEZCQIHD-UHFFFAOYSA-N 1-(4-aminophenyl)ethanone Chemical compound CC(=O)C1=CC=C(N)C=C1 GPRYKVSEZCQIHD-UHFFFAOYSA-N 0.000 description 1
- SQMSONJPJNTOGW-UHFFFAOYSA-N 1-[4-(4-phenylanilino)phenyl]ethanone Chemical compound C1=CC(C(=O)C)=CC=C1NC1=CC=C(C=2C=CC=CC=2)C=C1 SQMSONJPJNTOGW-UHFFFAOYSA-N 0.000 description 1
- LMFRTSBQRLSJHC-UHFFFAOYSA-N 1-bromo-3,5-dimethylbenzene Chemical compound CC1=CC(C)=CC(Br)=C1 LMFRTSBQRLSJHC-UHFFFAOYSA-N 0.000 description 1
- DURPTKYDGMDSBL-UHFFFAOYSA-N 1-butoxybutane Chemical compound CCCCOCCCC DURPTKYDGMDSBL-UHFFFAOYSA-N 0.000 description 1
- WQHNWJBSROXROL-UHFFFAOYSA-N 1-chloro-3,5-dimethoxybenzene Chemical compound COC1=CC(Cl)=CC(OC)=C1 WQHNWJBSROXROL-UHFFFAOYSA-N 0.000 description 1
- IWFKMNAEFPEIOY-UHFFFAOYSA-N 1-fluoro-3,5-dimethoxybenzene Chemical compound COC1=CC(F)=CC(OC)=C1 IWFKMNAEFPEIOY-UHFFFAOYSA-N 0.000 description 1
- MFJNOXOAIFNSBX-UHFFFAOYSA-N 1-fluoro-3-methoxybenzene Chemical compound COC1=CC=CC(F)=C1 MFJNOXOAIFNSBX-UHFFFAOYSA-N 0.000 description 1
- BLRHMMGNCXNXJL-UHFFFAOYSA-N 1-methylindole Chemical compound C1=CC=C2N(C)C=CC2=C1 BLRHMMGNCXNXJL-UHFFFAOYSA-N 0.000 description 1
- 238000001644 13C nuclear magnetic resonance spectroscopy Methods 0.000 description 1
- 238000005160 1H NMR spectroscopy Methods 0.000 description 1
- WQVMTPGOXQLVHU-UHFFFAOYSA-N 2,5-dimethyl-n-(4-pyrrol-1-ylphenyl)aniline Chemical compound CC1=CC=C(C)C(NC=2C=CC(=CC=2)N2C=CC=C2)=C1 WQVMTPGOXQLVHU-UHFFFAOYSA-N 0.000 description 1
- SWUBPLNGYDBIAV-UHFFFAOYSA-N 2,5-dimethyl-n-[3-(trifluoromethyl)phenyl]aniline Chemical compound CC1=CC=C(C)C(NC=2C=C(C=CC=2)C(F)(F)F)=C1 SWUBPLNGYDBIAV-UHFFFAOYSA-N 0.000 description 1
- WKBALTUBRZPIPZ-UHFFFAOYSA-N 2,6-di(propan-2-yl)aniline Chemical compound CC(C)C1=CC=CC(C(C)C)=C1N WKBALTUBRZPIPZ-UHFFFAOYSA-N 0.000 description 1
- RZBOMSOHMOVUES-UHFFFAOYSA-N 2-(2-chlorophenyl)ethanamine Chemical compound NCCC1=CC=CC=C1Cl RZBOMSOHMOVUES-UHFFFAOYSA-N 0.000 description 1
- XGLVDUUYFKXKPL-UHFFFAOYSA-N 2-(2-methoxyethoxy)-n,n-bis[2-(2-methoxyethoxy)ethyl]ethanamine Chemical compound COCCOCCN(CCOCCOC)CCOCCOC XGLVDUUYFKXKPL-UHFFFAOYSA-N 0.000 description 1
- ZWEHNKRNPOVVGH-UHFFFAOYSA-N 2-Butanone Chemical compound CCC(C)=O ZWEHNKRNPOVVGH-UHFFFAOYSA-N 0.000 description 1
- NAMYKGVDVNBCFQ-UHFFFAOYSA-N 2-bromopropane Chemical compound CC(C)Br NAMYKGVDVNBCFQ-UHFFFAOYSA-N 0.000 description 1
- MIOCUERTSIJEDP-UHFFFAOYSA-N 2-diethylphosphanylethyl(diethyl)phosphane Chemical compound CCP(CC)CCP(CC)CC MIOCUERTSIJEDP-UHFFFAOYSA-N 0.000 description 1
- KWPQTFXULUUCGD-UHFFFAOYSA-N 3,4,5,7,8,9,10,10a-octahydropyrido[1,2-a][1,4]diazepine Chemical compound C1CCN=CC2CCCCN21 KWPQTFXULUUCGD-UHFFFAOYSA-N 0.000 description 1
- DZJRIEASIKLRQK-UHFFFAOYSA-N 3,5-dimethoxy-n-methylaniline Chemical compound CNC1=CC(OC)=CC(OC)=C1 DZJRIEASIKLRQK-UHFFFAOYSA-N 0.000 description 1
- VIUDTWATMPPKEL-UHFFFAOYSA-N 3-(trifluoromethyl)aniline Chemical compound NC1=CC=CC(C(F)(F)F)=C1 VIUDTWATMPPKEL-UHFFFAOYSA-N 0.000 description 1
- PWRBCZZQRRPXAB-UHFFFAOYSA-N 3-chloropyridine Chemical compound ClC1=CC=CN=C1 PWRBCZZQRRPXAB-UHFFFAOYSA-N 0.000 description 1
- QRPNDOFSVHOGCK-UHFFFAOYSA-N 3-di(propan-2-yl)phosphanylpropyl-di(propan-2-yl)phosphane Chemical compound CC(C)P(C(C)C)CCCP(C(C)C)C(C)C QRPNDOFSVHOGCK-UHFFFAOYSA-N 0.000 description 1
- CSDQQAQKBAQLLE-UHFFFAOYSA-N 4-(4-chlorophenyl)-4,5,6,7-tetrahydrothieno[3,2-c]pyridine Chemical compound C1=CC(Cl)=CC=C1C1C(C=CS2)=C2CCN1 CSDQQAQKBAQLLE-UHFFFAOYSA-N 0.000 description 1
- HRZSNESBRSONNG-UHFFFAOYSA-N 4-di(propan-2-yl)phosphanylbutyl-di(propan-2-yl)phosphane Chemical compound CC(C)P(C(C)C)CCCCP(C(C)C)C(C)C HRZSNESBRSONNG-UHFFFAOYSA-N 0.000 description 1
- 229960000549 4-dimethylaminophenol Drugs 0.000 description 1
- JFXDIXYFXDOZIT-UHFFFAOYSA-N 4-methoxy-n-methylaniline Chemical compound CNC1=CC=C(OC)C=C1 JFXDIXYFXDOZIT-UHFFFAOYSA-N 0.000 description 1
- ODGIMMLDVSWADK-UHFFFAOYSA-N 4-trifluoromethylaniline Chemical compound NC1=CC=C(C(F)(F)F)C=C1 ODGIMMLDVSWADK-UHFFFAOYSA-N 0.000 description 1
- 241001120493 Arene Species 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-M Bicarbonate Chemical class OC([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-M 0.000 description 1
- ZOXJGFHDIHLPTG-UHFFFAOYSA-N Boron Chemical compound [B] ZOXJGFHDIHLPTG-UHFFFAOYSA-N 0.000 description 1
- BVNRGLAAFYNAFL-UHFFFAOYSA-N C1CC[IH]C1 Chemical compound C1CC[IH]C1 BVNRGLAAFYNAFL-UHFFFAOYSA-N 0.000 description 1
- LUTGGXZRZPXEQO-UHFFFAOYSA-N CCOC(c1cccc(SI)c1)=O Chemical compound CCOC(c1cccc(SI)c1)=O LUTGGXZRZPXEQO-UHFFFAOYSA-N 0.000 description 1
- WSWPHHNIHLTAHB-UHFFFAOYSA-N CCOc1ccc(C)cc1 Chemical compound CCOc1ccc(C)cc1 WSWPHHNIHLTAHB-UHFFFAOYSA-N 0.000 description 1
- IWPMQXOVTMABLF-UHFFFAOYSA-N COc(cc(cc1OC)I)c1OC Chemical compound COc(cc(cc1OC)I)c1OC IWPMQXOVTMABLF-UHFFFAOYSA-N 0.000 description 1
- PBYXULCRFZLBRZ-UHFFFAOYSA-N COc(cc1)c(-c2ccccc2)c(I)c1OC Chemical compound COc(cc1)c(-c2ccccc2)c(I)c1OC PBYXULCRFZLBRZ-UHFFFAOYSA-N 0.000 description 1
- DQNSKXYRRRCKGH-UHFFFAOYSA-N COc(cc1)ccc1SC Chemical compound COc(cc1)ccc1SC DQNSKXYRRRCKGH-UHFFFAOYSA-N 0.000 description 1
- WNRGWPVJGDABME-UHFFFAOYSA-N COc1cc(N)cc(OC)c1 Chemical compound COc1cc(N)cc(OC)c1 WNRGWPVJGDABME-UHFFFAOYSA-N 0.000 description 1
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 1
- KXDHJXZQYSOELW-UHFFFAOYSA-N Carbamic acid Chemical compound NC(O)=O KXDHJXZQYSOELW-UHFFFAOYSA-N 0.000 description 1
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 1
- UUSRESKCAODAHR-UHFFFAOYSA-N Cc(c(-c(c1ccccc1cc1)c1[O](C)C)c(cc1)OC)c1OC Chemical compound Cc(c(-c(c1ccccc1cc1)c1[O](C)C)c(cc1)OC)c1OC UUSRESKCAODAHR-UHFFFAOYSA-N 0.000 description 1
- ZZLCFHIKESPLTH-UHFFFAOYSA-N Cc(cc1)ccc1-c1ccccc1 Chemical compound Cc(cc1)ccc1-c1ccccc1 ZZLCFHIKESPLTH-UHFFFAOYSA-N 0.000 description 1
- AGHYMXKKEXDUTA-UHFFFAOYSA-N Cc(cc1)ccc1Nc1ccccc1 Chemical compound Cc(cc1)ccc1Nc1ccccc1 AGHYMXKKEXDUTA-UHFFFAOYSA-N 0.000 description 1
- CHLICZRVGGXEOD-UHFFFAOYSA-N Cc(cc1)ccc1OC Chemical compound Cc(cc1)ccc1OC CHLICZRVGGXEOD-UHFFFAOYSA-N 0.000 description 1
- DTFKRVXLBCAIOZ-UHFFFAOYSA-N Cc(cccc1)c1OC Chemical compound Cc(cccc1)c1OC DTFKRVXLBCAIOZ-UHFFFAOYSA-N 0.000 description 1
- BHWJMPDCCDMCKC-UHFFFAOYSA-N Cc(cccc1)c1SC Chemical compound Cc(cccc1)c1SC BHWJMPDCCDMCKC-UHFFFAOYSA-N 0.000 description 1
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 1
- 229910021595 Copper(I) iodide Inorganic materials 0.000 description 1
- 229920000742 Cotton Polymers 0.000 description 1
- XFXPMWWXUTWYJX-UHFFFAOYSA-N Cyanide Chemical compound N#[C-] XFXPMWWXUTWYJX-UHFFFAOYSA-N 0.000 description 1
- OTMSDBZUPAUEDD-UHFFFAOYSA-N Ethane Chemical compound CC OTMSDBZUPAUEDD-UHFFFAOYSA-N 0.000 description 1
- TWLLPUMZVVGILS-UHFFFAOYSA-N Ethyl 2-aminobenzoate Chemical compound CCOC(=O)C1=CC=CC=C1N TWLLPUMZVVGILS-UHFFFAOYSA-N 0.000 description 1
- 238000005033 Fourier transform infrared spectroscopy Methods 0.000 description 1
- 238000004566 IR spectroscopy Methods 0.000 description 1
- 239000012359 Methanesulfonyl chloride Substances 0.000 description 1
- SOWBFZRMHSNYGE-UHFFFAOYSA-N Monoamide-Oxalic acid Natural products NC(=O)C(O)=O SOWBFZRMHSNYGE-UHFFFAOYSA-N 0.000 description 1
- KWYHDKDOAIKMQN-UHFFFAOYSA-N N,N,N',N'-tetramethylethylenediamine Chemical compound CN(C)CCN(C)C KWYHDKDOAIKMQN-UHFFFAOYSA-N 0.000 description 1
- JLTDJTHDQAWBAV-UHFFFAOYSA-N N,N-dimethylaniline Chemical compound CN(C)C1=CC=CC=C1 JLTDJTHDQAWBAV-UHFFFAOYSA-N 0.000 description 1
- 238000007126 N-alkylation reaction Methods 0.000 description 1
- AHVYPIQETPWLSZ-UHFFFAOYSA-N N-methyl-pyrrolidine Natural products CN1CC=CC1 AHVYPIQETPWLSZ-UHFFFAOYSA-N 0.000 description 1
- 238000012565 NMR experiment Methods 0.000 description 1
- IOVCWXUNBOPUCH-UHFFFAOYSA-M Nitrite anion Chemical compound [O-]N=O IOVCWXUNBOPUCH-UHFFFAOYSA-M 0.000 description 1
- ZBYAHAFOQKZXKG-UHFFFAOYSA-N OCCc1cccc(S)c1 Chemical compound OCCc1cccc(S)c1 ZBYAHAFOQKZXKG-UHFFFAOYSA-N 0.000 description 1
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- 239000007868 Raney catalyst Substances 0.000 description 1
- 229910000564 Raney nickel Inorganic materials 0.000 description 1
- KJTLSVCANCCWHF-UHFFFAOYSA-N Ruthenium Chemical compound [Ru] KJTLSVCANCCWHF-UHFFFAOYSA-N 0.000 description 1
- BUGBHKTXTAQXES-UHFFFAOYSA-N Selenium Chemical compound [Se] BUGBHKTXTAQXES-UHFFFAOYSA-N 0.000 description 1
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 1
- 238000006069 Suzuki reaction reaction Methods 0.000 description 1
- 238000006161 Suzuki-Miyaura coupling reaction Methods 0.000 description 1
- 238000002441 X-ray diffraction Methods 0.000 description 1
- CUJRVFIICFDLGR-UHFFFAOYSA-N acetylacetonate Chemical compound CC(=O)[CH-]C(C)=O CUJRVFIICFDLGR-UHFFFAOYSA-N 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 150000001260 acyclic compounds Chemical class 0.000 description 1
- 125000002015 acyclic group Chemical group 0.000 description 1
- 125000002252 acyl group Chemical group 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 125000002723 alicyclic group Chemical group 0.000 description 1
- 150000001338 aliphatic hydrocarbons Chemical class 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 150000001340 alkali metals Chemical class 0.000 description 1
- 125000005021 aminoalkenyl group Chemical group 0.000 description 1
- 125000005014 aminoalkynyl group Chemical group 0.000 description 1
- 229940064734 aminobenzoate Drugs 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 125000002490 anilino group Chemical group [H]N(*)C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- 150000001450 anions Chemical class 0.000 description 1
- 239000003443 antiviral agent Substances 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 150000001499 aryl bromides Chemical class 0.000 description 1
- 150000008378 aryl ethers Chemical class 0.000 description 1
- 150000001503 aryl iodides Chemical class 0.000 description 1
- 238000011914 asymmetric synthesis Methods 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- MNFORVFSTILPAW-UHFFFAOYSA-N azetidin-2-one Chemical class O=C1CCN1 MNFORVFSTILPAW-UHFFFAOYSA-N 0.000 description 1
- 150000001540 azides Chemical group 0.000 description 1
- 229910052788 barium Inorganic materials 0.000 description 1
- DSAJWYNOEDNPEQ-UHFFFAOYSA-N barium atom Chemical compound [Ba] DSAJWYNOEDNPEQ-UHFFFAOYSA-N 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical class OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 229910052796 boron Inorganic materials 0.000 description 1
- 125000005620 boronic acid group Chemical class 0.000 description 1
- QDHFHIQKOVNCNC-UHFFFAOYSA-N butane-1-sulfonic acid Chemical group CCCCS(O)(=O)=O QDHFHIQKOVNCNC-UHFFFAOYSA-N 0.000 description 1
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 1
- 229910000024 caesium carbonate Inorganic materials 0.000 description 1
- ZFXVRMSLJDYJCH-UHFFFAOYSA-N calcium magnesium Chemical compound [Mg].[Ca] ZFXVRMSLJDYJCH-UHFFFAOYSA-N 0.000 description 1
- 125000003739 carbamimidoyl group Chemical group C(N)(=N)* 0.000 description 1
- 125000003917 carbamoyl group Chemical group [H]N([H])C(*)=O 0.000 description 1
- 125000002837 carbocyclic group Chemical group 0.000 description 1
- CREMABGTGYGIQB-UHFFFAOYSA-N carbon carbon Chemical compound C.C CREMABGTGYGIQB-UHFFFAOYSA-N 0.000 description 1
- 238000001460 carbon-13 nuclear magnetic resonance spectrum Methods 0.000 description 1
- 238000010758 carbon-nitrogen bond forming reactions Methods 0.000 description 1
- 150000004649 carbonic acid derivatives Chemical class 0.000 description 1
- 150000007942 carboxylates Chemical class 0.000 description 1
- 150000001735 carboxylic acids Chemical class 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 229910052729 chemical element Inorganic materials 0.000 description 1
- 238000001311 chemical methods and process Methods 0.000 description 1
- JZPDBTOWHLZQFC-UHFFFAOYSA-N chloro-di(propan-2-yl)phosphane Chemical compound CC(C)P(Cl)C(C)C JZPDBTOWHLZQFC-UHFFFAOYSA-N 0.000 description 1
- 239000000306 component Substances 0.000 description 1
- 239000000470 constituent Substances 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 150000004696 coordination complex Chemical class 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- 239000010949 copper Substances 0.000 description 1
- LSXDOTMGLUJQCM-UHFFFAOYSA-M copper(i) iodide Chemical compound I[Cu] LSXDOTMGLUJQCM-UHFFFAOYSA-M 0.000 description 1
- 150000001913 cyanates Chemical class 0.000 description 1
- 150000001923 cyclic compounds Chemical class 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000007812 deficiency Effects 0.000 description 1
- 238000003795 desorption Methods 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 125000005266 diarylamine group Chemical group 0.000 description 1
- KHQXDNILONPNNV-UHFFFAOYSA-N dibutyl(2-dibutylphosphanylethyl)phosphane Chemical compound CCCCP(CCCC)CCP(CCCC)CCCC KHQXDNILONPNNV-UHFFFAOYSA-N 0.000 description 1
- BOUYBUIVMHNXQB-UHFFFAOYSA-N dicyclohexyl(2-dicyclohexylphosphanylethyl)phosphane Chemical compound C1CCCCC1P(C1CCCCC1)CCP(C1CCCCC1)C1CCCCC1 BOUYBUIVMHNXQB-UHFFFAOYSA-N 0.000 description 1
- CGAQDESDFUINDU-UHFFFAOYSA-N dicyclohexyl(4-dicyclohexylphosphanylpentan-2-yl)phosphane Chemical compound C1CCCCC1P(C1CCCCC1)C(C)CC(C)P(C1CCCCC1)C1CCCCC1 CGAQDESDFUINDU-UHFFFAOYSA-N 0.000 description 1
- 125000001891 dimethoxy group Chemical group [H]C([H])([H])O* 0.000 description 1
- QDYBCIWLGJMJGO-UHFFFAOYSA-N dinitromethanone Chemical compound [O-][N+](=O)C(=O)[N+]([O-])=O QDYBCIWLGJMJGO-UHFFFAOYSA-N 0.000 description 1
- 239000012153 distilled water Substances 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 239000003814 drug Substances 0.000 description 1
- 238000000921 elemental analysis Methods 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 230000032050 esterification Effects 0.000 description 1
- 238000005886 esterification reaction Methods 0.000 description 1
- 150000002170 ethers Chemical class 0.000 description 1
- VONUJCUIZJOVGS-UHFFFAOYSA-N ethyl 2-(4-fluoroanilino)benzoate Chemical compound CCOC(=O)C1=CC=CC=C1NC1=CC=C(F)C=C1 VONUJCUIZJOVGS-UHFFFAOYSA-N 0.000 description 1
- DKNWWXNFCUIOFZ-UHFFFAOYSA-N ethyl 3-[4-(trifluoromethyl)anilino]benzoate Chemical compound CCOC(=O)C1=CC=CC(NC=2C=CC(=CC=2)C(F)(F)F)=C1 DKNWWXNFCUIOFZ-UHFFFAOYSA-N 0.000 description 1
- MWSMNBYIEBRXAL-UHFFFAOYSA-N ethyl 3-hydroxybenzoate Chemical compound CCOC(=O)C1=CC=CC(O)=C1 MWSMNBYIEBRXAL-UHFFFAOYSA-N 0.000 description 1
- GVEPBJHOBDJJJI-UHFFFAOYSA-N fluoranthrene Natural products C1=CC(C2=CC=CC=C22)=C3C2=CC=CC3=C1 GVEPBJHOBDJJJI-UHFFFAOYSA-N 0.000 description 1
- 238000001640 fractional crystallisation Methods 0.000 description 1
- 150000002244 furazanes Chemical class 0.000 description 1
- 238000007429 general method Methods 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 150000002390 heteroarenes Chemical class 0.000 description 1
- 150000002391 heterocyclic compounds Chemical class 0.000 description 1
- 229930195733 hydrocarbon Natural products 0.000 description 1
- 150000002430 hydrocarbons Chemical class 0.000 description 1
- 150000004679 hydroxides Chemical class 0.000 description 1
- 150000003949 imides Chemical class 0.000 description 1
- 239000012442 inert solvent Substances 0.000 description 1
- 238000002329 infrared spectrum Methods 0.000 description 1
- 230000002452 interceptive effect Effects 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- 230000001678 irradiating effect Effects 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 238000006317 isomerization reaction Methods 0.000 description 1
- 125000000468 ketone group Chemical group 0.000 description 1
- 229910052747 lanthanoid Inorganic materials 0.000 description 1
- 150000002602 lanthanoids Chemical class 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 229920002521 macromolecule Polymers 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-M methanesulfonate group Chemical group CS(=O)(=O)[O-] AFVFQIVMOAPDHO-UHFFFAOYSA-M 0.000 description 1
- QARBMVPHQWIHKH-UHFFFAOYSA-N methanesulfonyl chloride Chemical compound CS(Cl)(=O)=O QARBMVPHQWIHKH-UHFFFAOYSA-N 0.000 description 1
- 125000000250 methylamino group Chemical group [H]N(*)C([H])([H])[H] 0.000 description 1
- 239000002808 molecular sieve Substances 0.000 description 1
- JLEVIIXQWDFJLG-UHFFFAOYSA-N n'-phenylbutane-1,4-diamine Chemical compound NCCCCNC1=CC=CC=C1 JLEVIIXQWDFJLG-UHFFFAOYSA-N 0.000 description 1
- WFPADYCHZPODFR-UHFFFAOYSA-N n-(4-ethoxyphenyl)-2,5-dimethylaniline Chemical compound C1=CC(OCC)=CC=C1NC1=CC(C)=CC=C1C WFPADYCHZPODFR-UHFFFAOYSA-N 0.000 description 1
- ILSLURRFYAEXEG-UHFFFAOYSA-N n-(4-ethoxyphenyl)-4-methoxyaniline Chemical compound C1=CC(OCC)=CC=C1NC1=CC=C(OC)C=C1 ILSLURRFYAEXEG-UHFFFAOYSA-N 0.000 description 1
- RLBMOECAVLNERB-UHFFFAOYSA-N n-(4-fluorophenyl)-3,4,5-trimethoxyaniline Chemical compound COC1=C(OC)C(OC)=CC(NC=2C=CC(F)=CC=2)=C1 RLBMOECAVLNERB-UHFFFAOYSA-N 0.000 description 1
- ITBAWYAKHGPVMM-UHFFFAOYSA-N n-(4-fluorophenyl)-4-methoxyaniline Chemical compound C1=CC(OC)=CC=C1NC1=CC=C(F)C=C1 ITBAWYAKHGPVMM-UHFFFAOYSA-N 0.000 description 1
- XRXJZMDLIJKAOP-UHFFFAOYSA-N n-(4-methoxyphenyl)-2,5-dimethylaniline Chemical compound C1=CC(OC)=CC=C1NC1=CC(C)=CC=C1C XRXJZMDLIJKAOP-UHFFFAOYSA-N 0.000 description 1
- ZAQKQSWOMFKXGK-UHFFFAOYSA-N n-(piperidin-4-ylmethyl)aniline Chemical compound C1CNCCC1CNC1=CC=CC=C1 ZAQKQSWOMFKXGK-UHFFFAOYSA-N 0.000 description 1
- LIJJGMDKVVOEFT-UHFFFAOYSA-N n-benzyl-4-methoxyaniline Chemical compound C1=CC(OC)=CC=C1NCC1=CC=CC=C1 LIJJGMDKVVOEFT-UHFFFAOYSA-N 0.000 description 1
- GTWJETSWSUWSEJ-UHFFFAOYSA-N n-benzylaniline Chemical compound C=1C=CC=CC=1CNC1=CC=CC=C1 GTWJETSWSUWSEJ-UHFFFAOYSA-N 0.000 description 1
- DYMRYCZRMAHYKE-UHFFFAOYSA-N n-diazonitramide Chemical compound [O-][N+](=O)N=[N+]=[N-] DYMRYCZRMAHYKE-UHFFFAOYSA-N 0.000 description 1
- UYZLKJAXJYIOOM-UHFFFAOYSA-N n-hexyl-2-methylaniline Chemical compound CCCCCCNC1=CC=CC=C1C UYZLKJAXJYIOOM-UHFFFAOYSA-N 0.000 description 1
- SZMWGXHQUQJAGU-UHFFFAOYSA-N n-hexyl-4-methoxyaniline Chemical compound CCCCCCNC1=CC=C(OC)C=C1 SZMWGXHQUQJAGU-UHFFFAOYSA-N 0.000 description 1
- OXHJCNSXYDSOFN-UHFFFAOYSA-N n-hexylaniline Chemical compound CCCCCCNC1=CC=CC=C1 OXHJCNSXYDSOFN-UHFFFAOYSA-N 0.000 description 1
- DBGFNLVRAFYZBI-UHFFFAOYSA-N n-methylpyridin-3-amine Chemical compound CNC1=CC=CN=C1 DBGFNLVRAFYZBI-UHFFFAOYSA-N 0.000 description 1
- XXTCHBBZIBFUCN-UHFFFAOYSA-N n-methylquinolin-6-amine Chemical compound N1=CC=CC2=CC(NC)=CC=C21 XXTCHBBZIBFUCN-UHFFFAOYSA-N 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- BMGNSKKZFQMGDH-FDGPNNRMSA-L nickel(2+);(z)-4-oxopent-2-en-2-olate Chemical compound [Ni+2].C\C([O-])=C\C(C)=O.C\C([O-])=C\C(C)=O BMGNSKKZFQMGDH-FDGPNNRMSA-L 0.000 description 1
- 230000001546 nitrifying effect Effects 0.000 description 1
- 150000002825 nitriles Chemical class 0.000 description 1
- 125000004433 nitrogen atom Chemical group N* 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- ALJYEHUPOPFBCG-UHFFFAOYSA-N nitrophosphonic acid Chemical compound OP(O)(=O)[N+]([O-])=O ALJYEHUPOPFBCG-UHFFFAOYSA-N 0.000 description 1
- 125000006574 non-aromatic ring group Chemical group 0.000 description 1
- 239000012454 non-polar solvent Substances 0.000 description 1
- 238000000655 nuclear magnetic resonance spectrum Methods 0.000 description 1
- IOQPZZOEVPZRBK-UHFFFAOYSA-N octan-1-amine Chemical compound CCCCCCCCN IOQPZZOEVPZRBK-UHFFFAOYSA-N 0.000 description 1
- 238000006384 oligomerization reaction Methods 0.000 description 1
- 239000011368 organic material Substances 0.000 description 1
- 125000001181 organosilyl group Chemical group [SiH3]* 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- 125000004430 oxygen atom Chemical group O* 0.000 description 1
- ATGUVEKSASEFFO-UHFFFAOYSA-N p-aminodiphenylamine Chemical compound C1=CC(N)=CC=C1NC1=CC=CC=C1 ATGUVEKSASEFFO-UHFFFAOYSA-N 0.000 description 1
- 150000002940 palladium Chemical class 0.000 description 1
- YJVFFLUZDVXJQI-UHFFFAOYSA-L palladium(ii) acetate Chemical compound [Pd+2].CC([O-])=O.CC([O-])=O YJVFFLUZDVXJQI-UHFFFAOYSA-L 0.000 description 1
- NFHFRUOZVGFOOS-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 125000000951 phenoxy group Chemical group [H]C1=C([H])C([H])=C(O*)C([H])=C1[H] 0.000 description 1
- 150000003003 phosphines Chemical class 0.000 description 1
- 125000004437 phosphorous atom Chemical group 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- 238000001394 phosphorus-31 nuclear magnetic resonance spectrum Methods 0.000 description 1
- LTEKQAPRXFBRNN-UHFFFAOYSA-N piperidin-4-ylmethanamine Chemical compound NCC1CCNCC1 LTEKQAPRXFBRNN-UHFFFAOYSA-N 0.000 description 1
- GKKCIDNWFBPDBW-UHFFFAOYSA-M potassium cyanate Chemical compound [K]OC#N GKKCIDNWFBPDBW-UHFFFAOYSA-M 0.000 description 1
- 229910000160 potassium phosphate Inorganic materials 0.000 description 1
- 235000011009 potassium phosphates Nutrition 0.000 description 1
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 239000001294 propane Substances 0.000 description 1
- LJXQPZWIHJMPQQ-UHFFFAOYSA-N pyrimidin-2-amine Chemical compound NC1=NC=CC=N1 LJXQPZWIHJMPQQ-UHFFFAOYSA-N 0.000 description 1
- 150000004040 pyrrolidinones Chemical class 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 239000012429 reaction media Substances 0.000 description 1
- 238000004064 recycling Methods 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000027756 respiratory electron transport chain Effects 0.000 description 1
- 229910052703 rhodium Inorganic materials 0.000 description 1
- 239000010948 rhodium Substances 0.000 description 1
- MHOVAHRLVXNVSD-UHFFFAOYSA-N rhodium atom Chemical compound [Rh] MHOVAHRLVXNVSD-UHFFFAOYSA-N 0.000 description 1
- 238000007363 ring formation reaction Methods 0.000 description 1
- 229910052707 ruthenium Inorganic materials 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 229910052711 selenium Inorganic materials 0.000 description 1
- 239000011669 selenium Substances 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 238000010898 silica gel chromatography Methods 0.000 description 1
- URGAHOPLAPQHLN-UHFFFAOYSA-N sodium aluminosilicate Chemical compound [Na+].[Al+3].[O-][Si]([O-])=O.[O-][Si]([O-])=O URGAHOPLAPQHLN-UHFFFAOYSA-N 0.000 description 1
- ODZPKZBBUMBTMG-UHFFFAOYSA-N sodium amide Chemical compound [NH2-].[Na+] ODZPKZBBUMBTMG-UHFFFAOYSA-N 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 238000000527 sonication Methods 0.000 description 1
- 238000001228 spectrum Methods 0.000 description 1
- 229910001220 stainless steel Inorganic materials 0.000 description 1
- 239000010935 stainless steel Substances 0.000 description 1
- 125000000547 substituted alkyl group Chemical group 0.000 description 1
- 125000005346 substituted cycloalkyl group Chemical group 0.000 description 1
- 150000003460 sulfonic acids Chemical group 0.000 description 1
- 150000008053 sultones Chemical class 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 150000003512 tertiary amines Chemical class 0.000 description 1
- 125000003698 tetramethyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 150000003566 thiocarboxylic acids Chemical class 0.000 description 1
- 150000003568 thioethers Chemical class 0.000 description 1
- 125000003396 thiol group Chemical group [H]S* 0.000 description 1
- RYYWUUFWQRZTIU-UHFFFAOYSA-K thiophosphate Chemical compound [O-]P([O-])([O-])=S RYYWUUFWQRZTIU-UHFFFAOYSA-K 0.000 description 1
- 125000002088 tosyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1C([H])([H])[H])S(*)(=O)=O 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 150000003852 triazoles Chemical class 0.000 description 1
- XTTGYFREQJCEML-UHFFFAOYSA-N tributyl phosphite Chemical compound CCCCOP(OCCCC)OCCCC XTTGYFREQJCEML-UHFFFAOYSA-N 0.000 description 1
- TUQOTMZNTHZOKS-UHFFFAOYSA-N tributylphosphine Chemical compound CCCCP(CCCC)CCCC TUQOTMZNTHZOKS-UHFFFAOYSA-N 0.000 description 1
- FICPQAZLPKLOLH-UHFFFAOYSA-N tricyclohexyl phosphite Chemical compound C1CCCCC1OP(OC1CCCCC1)OC1CCCCC1 FICPQAZLPKLOLH-UHFFFAOYSA-N 0.000 description 1
- BDZBKCUKTQZUTL-UHFFFAOYSA-N triethyl phosphite Chemical compound CCOP(OCC)OCC BDZBKCUKTQZUTL-UHFFFAOYSA-N 0.000 description 1
- RXJKFRMDXUJTEX-UHFFFAOYSA-N triethylphosphine Chemical compound CCP(CC)CC RXJKFRMDXUJTEX-UHFFFAOYSA-N 0.000 description 1
- 125000002827 triflate group Chemical group FC(S(=O)(=O)O*)(F)F 0.000 description 1
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 1
- CYTQBVOFDCPGCX-UHFFFAOYSA-N trimethyl phosphite Chemical compound COP(OC)OC CYTQBVOFDCPGCX-UHFFFAOYSA-N 0.000 description 1
- SJHCUXCOGGKFAI-UHFFFAOYSA-N tripropan-2-yl phosphite Chemical compound CC(C)OP(OC(C)C)OC(C)C SJHCUXCOGGKFAI-UHFFFAOYSA-N 0.000 description 1
- QOPBTFMUVTXWFF-UHFFFAOYSA-N tripropyl phosphite Chemical compound CCCOP(OCCC)OCCC QOPBTFMUVTXWFF-UHFFFAOYSA-N 0.000 description 1
- KCTAHLRCZMOTKM-UHFFFAOYSA-N tripropylphosphane Chemical compound CCCP(CCC)CCC KCTAHLRCZMOTKM-UHFFFAOYSA-N 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 239000008096 xylene Substances 0.000 description 1
- 238000010507 β-hydride elimination reaction Methods 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic Table
- C07F9/02—Phosphorus compounds
- C07F9/28—Phosphorus compounds with one or more P—C bonds
- C07F9/50—Organo-phosphines
- C07F9/5022—Aromatic phosphines (P-C aromatic linkage)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C209/00—Preparation of compounds containing amino groups bound to a carbon skeleton
- C07C209/04—Preparation of compounds containing amino groups bound to a carbon skeleton by substitution of functional groups by amino groups
- C07C209/06—Preparation of compounds containing amino groups bound to a carbon skeleton by substitution of functional groups by amino groups by substitution of halogen atoms
- C07C209/10—Preparation of compounds containing amino groups bound to a carbon skeleton by substitution of functional groups by amino groups by substitution of halogen atoms with formation of amino groups bound to carbon atoms of six-membered aromatic rings or from amines having nitrogen atoms bound to carbon atoms of six-membered aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C213/00—Preparation of compounds containing amino and hydroxy, amino and etherified hydroxy or amino and esterified hydroxy groups bound to the same carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C231/00—Preparation of carboxylic acid amides
- C07C231/08—Preparation of carboxylic acid amides from amides by reaction at nitrogen atoms of carboxamide groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/72—Nitrogen atoms
- C07D213/74—Amino or imino radicals substituted by hydrocarbon or substituted hydrocarbon radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D241/00—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings
- C07D241/02—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings not condensed with other rings
- C07D241/10—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members
- C07D241/14—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D241/20—Nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F15/00—Compounds containing elements of Groups 8, 9, 10 or 18 of the Periodic Table
- C07F15/0006—Compounds containing elements of Groups 8, 9, 10 or 18 of the Periodic Table compounds of the platinum group
- C07F15/006—Palladium compounds
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Biochemistry (AREA)
- General Health & Medical Sciences (AREA)
- Molecular Biology (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Catalysts (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
- Quinoline Compounds (AREA)
- Pyridine Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Pyrrole Compounds (AREA)
- Hydrogenated Pyridines (AREA)
Description
便宜上、本発明をさらに説明する前に、明細書、実施例、および添付の特許請求の範囲において使用される特定の用語をここに集める。
本発明の反応のある実施の形態によれば、反応体、例えば、アミン、アミド、アリールハライド、ヘテロアリールハライドなどを過剰に使用する必要はない。意外なことに、実質的に化学量論的量の試薬を用いて、所望の生成物に、反応が迅速かつ高収率で進行する。例えば、本発明のアミノ化またはアミド化において、アミンまたはアミドは、芳香族化合物に対して、2倍の過剰、または20%以下の過剰な量でしか存在しないであろう。あるいは、芳香族化合物は、アミンまたはアミドに対して、2倍の過剰、または20%以下の過剰な量でしか存在しないであろう。
Rは、各存在毎に独立して、アルキル、ヘテロアルキル、シクロアルキル、ヘテロシクロアルキル、アリール、ヘテロアリール、アラルキル、ヘテロアラルキル、および−(CH2)m−R10からなる群より選択され;
R1、R2、R3、およびR4の内の少なくとも1つが−OR11であるという条件で、R1、R2、R3、およびR4が、各存在毎に独立して、水素、ハロゲン、アルキル、シクロアルキル、ヘテロシクロアルキル、アリール、ヘテロアリール、アラルキル、ヘテロアラルキル、−OR11、−N(R11)2、−Si(R11)3、および−(CH2)m−R10からなる群より選択されるか;またはR1、R2、R3、およびR4の任意の2つの隣接するものが、それらが結合している炭素と一緒になって、5員または6員の置換または未置換のアリールまたはヘテロアリール環を形成し;
R5、R7およびR9は、各存在毎に独立して、水素、アルキル、シクロアルキル、ヘテロシクロアルキル、アリール、ヘテロアリール、アラルキル、ヘテロアラルキル、−Si(R11)3、−(CH2)m−R10、−OH、−OR11、−NH2、−NHR11および−N(R11)2からなる群より選択され;
R6およびR8は、各存在毎に独立して、水素、低級アルキルおよびハロゲンからなる群より選択されるか;または、R5、R6、R7、R8、またはR9の任意の2つの隣接するものが、それらが結合する炭素と一緒になって、5員または6員の置換または未置換のアリールまたはヘテロアリール環を形成し;
R10は、未置換または置換アリール、シクロアルキル、シクロアルケニル、ヘテロ環、または多環を表し;
R11は、各存在毎に独立して、アルキル、シクロアルキル、ヘテロシクロアルキル、アリール、ヘテロアリール、アラルキル、およびヘテロアラルキルからなる群より選択され;
mは、各存在毎に独立して、0から8までの整数であり;
前記リガンドは、アキラルであるか、またはキラルである場合、1つの立体異性体または立体異性体の混合物である。
Rは、各存在毎に独立して、アルキル、シクロアルキル、アリール、ヘテロアリール、アラルキル、ヘテロアラルキル、および−(CH2)m−R10からなる群より選択され;
R1、R2、R3、およびR4の内の少なくとも2つが−OR11であるという条件で、R1、R2、R3、およびR4が、各存在毎に独立して、水素、ハロゲン、アルキル、シクロアルキル、ヘテロシクロアルキル、アリール、ヘテロアリール、アラルキル、ヘテロアラルキル、−OR11、−N(R11)2、−Si(R11)3、および−(CH2)m−R10からなる群より選択されるか;またはR1、R2、R3、およびR4の任意の2つの隣接するものが、それらが結合している炭素と一緒になって、5員または6員の置換または未置換のアリールまたはヘテロアリール環を形成し;
R5、R7およびR9は、各存在毎に独立して、アルキル、シクロアルキル、ヘテロシクロアルキル、アリール、ヘテロアリール、アラルキル、ヘテロアラルキル、−Si(R11)3、および−(CH2)m−R10からなる群より選択され;
R6およびR8は、各存在毎に独立して、水素、低級アルキルおよびハロゲンからなる群より選択され;
R10は、未置換または置換アリール、シクロアルキル、シクロアルケニル、ヘテロ環、または多環を表し;
R11は、各存在毎に独立して、アルキル、シクロアルキル、ヘテロシクロアルキル、アリール、ヘテロアリール、アラルキル、およびヘテロアラルキルからなる群より選択され;
mは、各存在毎に独立して、0から8までの整数であり;
前記リガンドは、アキラルであるか、またはキラルである場合、1つの立体異性体または立体異性体の混合物である。
Rは、各存在毎に独立して、アルキル、シクロアルキル、アリール、ヘテロアリール、アラルキル、ヘテロアラルキル、および−(CH2)m−R10からなる群より選択され;
R2およびR3が、各存在毎に独立して、水素、ハロゲン、アルキル、シクロアルキル、ヘテロシクロアルキル、アリール、ヘテロアリール、アラルキル、ヘテロアラルキル、−OR11、−N(R11)2、−Si(R11)3、および−(CH2)m−R10からなる群より選択されるか;またはR2およびR3の任意の2つの隣接するものが、それらが結合している炭素と一緒になって、5員または6員の置換または未置換のアリールまたはヘテロアリール環を形成し;
R5、R7およびR9は、各存在毎に独立して、アルキル、シクロアルキル、ヘテロシクロアルキル、アリール、ヘテロアリール、アラルキル、ヘテロアラルキル、−Si(R11)3、および−(CH2)m−R10からなる群より選択され;
R6およびR8は、各存在毎に独立して、水素、低級アルキルおよびハロゲンからなる群より選択され;
R10は、未置換または置換アリール、シクロアルキル、シクロアルケニル、ヘテロ環、または多環を表し;
R11は、各存在毎に独立して、アルキル、シクロアルキル、ヘテロシクロアルキル、アリール、ヘテロアリール、アラルキル、およびヘテロアラルキルからなる群より選択され;
mは、各存在毎に独立して、0から8までの整数であり;
前記リガンドは、アキラルであるか、またはキラルである場合、1つの立体異性体または立体異性体の混合物である。
Rは、各存在毎に独立して、アルキル、シクロアルキル、アリール、ヘテロアリール、アラルキル、ヘテロアラルキル、および−(CH2)m−R10からなる群より選択され;
R1およびR4は、各存在毎に独立して、水素、ハロゲン、アルキル、シクロアルキル、ヘテロシクロアルキル、アリール、ヘテロアリール、アラルキル、ヘテロアラルキル、−OR11、−N(R11)2、−Si(R11)3、および−(CH2)m−R10からなる群より選択され;
R5、R7およびR9は、各存在毎に独立して、アルキル、シクロアルキル、ヘテロシクロアルキル、アリール、ヘテロアリール、アラルキル、ヘテロアラルキル、−Si(R11)3、および−(CH2)m−R10からなる群より選択され;
R6およびR8は、各存在毎に独立して、水素、低級アルキルおよびハロゲンからなる群より選択され;
R10は、未置換または置換アリール、シクロアルキル、シクロアルケニル、ヘテロ環、または多環を表し;
R11は、各存在毎に独立して、アルキル、シクロアルキル、ヘテロシクロアルキル、アリール、ヘテロアリール、アラルキル、およびヘテロアラルキルからなる群より選択され;
mは、各存在毎に独立して、0から8までの整数であり;
前記リガンドは、キラルである場合、1つの立体異性体または立体異性体の混合物である。
Rは、各存在毎に独立して、アルキル、シクロアルキル、アリール、ヘテロアリール、アラルキル、ヘテロアラルキル、および−(CH2)m−R10からなる群より選択され;
R1およびR3は、各存在毎に独立して、水素、ハロゲン、アルキル、シクロアルキル、ヘテロシクロアルキル、アリール、ヘテロアリール、アラルキル、ヘテロアラルキル、−OR11、−N(R11)2、−Si(R11)3、および−(CH2)m−R10からなる群より選択され;
R5、R7およびR9は、各存在毎に独立して、アルキル、シクロアルキル、ヘテロシクロアルキル、アリール、ヘテロアリール、アラルキル、ヘテロアラルキル、−Si(R11)3、および−(CH2)m−R10からなる群より選択され;
R6およびR8は、各存在毎に独立して、水素、低級アルキルおよびハロゲンからなる群より選択され;
R10は、未置換または置換アリール、シクロアルキル、シクロアルケニル、ヘテロ環、または多環を表し;
R11は、各存在毎に独立して、アルキル、シクロアルキル、ヘテロシクロアルキル、アリール、ヘテロアリール、アラルキル、およびヘテロアラルキルからなる群より選択され;
mは、各存在毎に独立して、0から8までの整数であり;
前記リガンドは、キラルである場合、1つの立体異性体または立体異性体の混合物である。
Rは、各存在毎に独立して、アルキル、アリール、およびシクロアルキルからなる群より選択される。
Xは、O、NR8、およびSからなる群より選択され;
Rは、各存在毎に独立して、アルキル、シクロアルキル、アリール、ヘテロアリール、アラルキル、ヘテロアラルキル、および−(CH2)m−R10からなる群より選択され;
R1、R2、R3、およびR4の内の少なくとも2つが−OR11であるという条件で、R1、R2、R3、およびR4が、各存在毎に独立して、水素、ハロゲン、アルキル、シクロアルキル、ヘテロシクロアルキル、アリール、ヘテロアリール、アラルキル、ヘテロアラルキル、−OR11、−N(R11)2、−Si(R11)3、および−(CH2)m−R10からなる群より選択されるか;またはR1、R2、R3、およびR4の任意の2つの隣接するものが、それらが結合している炭素と一緒になって、5員または6員の置換または未置換のアリールまたはヘテロアリール環を形成し;
R5、R6およびR7は、各存在毎に独立して、アルキル、シクロアルキル、ヘテロシクロアルキル、アリール、ヘテロアリール、アラルキル、ヘテロアラルキル、−Si(R11)3、および−(CH2)m−R10からなる群より選択されるか;またはR5、R6、およびR7の任意の2つの隣接するものが、それらが結合している炭素と一緒になって、5員または6員の置換または未置換のアリールまたはヘテロアリール環を形成し;
R8は、水素、ハロゲン、アルキル、シクロアルキル、ヘテロシクロアルキル、アリール、ヘテロアリール、アラルキル、ヘテロアラルキル、−OR11、−N(R11)2、−Si(R11)3、または−(CH2)m−R10を表し;
R10は、未置換または置換アリール、シクロアルキル、シクロアルケニル、ヘテロ環、または多環を表し;
R11は、各存在毎に独立して、アルキル、シクロアルキル、ヘテロシクロアルキル、アリール、ヘテロアリール、アラルキル、およびヘテロアラルキルからなる群より選択され;
mは、各存在毎に独立して、0から8までの整数であり;
前記リガンドは、アキラルであるか、またはキラルである場合、1つの立体異性体または立体異性体の混合物である。
Xは、O、NR12、およびSからなる群より選択され;
Rは、各存在毎に独立して、アルキル、シクロアルキル、アリール、ヘテロアリール、アラルキル、ヘテロアラルキル、および−(CH2)m−R10からなる群より選択され;
R2およびR3は、各存在毎に独立して、水素、ハロゲン、アルキル、シクロアルキル、ヘテロシクロアルキル、アリール、ヘテロアリール、アラルキル、ヘテロアラルキル、−OR11、−N(R11)2、−Si(R11)3、および−(CH2)m−R10からなる群より選択されるか;またはR2およびR3の任意の2つの隣接するものが、それらが結合している炭素と一緒になって、5員または6員の置換または未置換のアリールまたはヘテロアリール環を形成し;
R5、R6、R7、R8、およびR9は、各存在毎に独立して、水素、ハロゲン、アルキル、シクロアルキル、ヘテロシクロアルキル、アリール、ヘテロアリール、アラルキル、ヘテロアラルキル、−OR11、−N(R11)2、−Si(R11)3、および−(CH2)m−R10からなる群より選択され;
R10は、未置換または置換アリール、シクロアルキル、シクロアルケニル、ヘテロ環、または多環を表し;
R11は、各存在毎に独立して、アルキル、シクロアルキル、ヘテロシクロアルキル、アリール、ヘテロアリール、アラルキル、およびヘテロアラルキルからなる群より選択され;
R12は、水素、ハロゲン、アルキル、シクロアルキル、ヘテロシクロアルキル、アリール、ヘテロアリール、アラルキル、ヘテロアラルキル、−OR11、−N(R11)2、−Si(R11)3、および−(CH2)m−R10を表し;
mは、各存在毎に独立して、0から8までの整数であり;
前記リガンドは、アキラルであるか、またはキラルである場合、1つの立体異性体または立体異性体の混合物である。
Rは、アルキル、シクロアルキル、およびアリールからなる群より選択され;
XはOまたはNR12である。
ここに記載するように、本発明の第1の態様は、遷移金属のための新規のリガンドに関する。本発明の第2の態様は、遷移金属触媒による炭素−ヘテロ原子および炭素−炭素結合形成反応(例えば、鈴木カップリング、薗頭カップリング、およびスティレクロスカップリング)における、これらのリガンドを含む触媒の使用に関する。主題の方法は、様々な適切な基質、触媒の回転数、反応条件、および効率を含む、遷移金属触媒による反応の多くの特徴を改善する。
低触媒添加量でのアニリンおよびアリールクロライドに関するクロスカップリング反応の文献に、2つの例がある。ノーラン(Nolan)と共同研究者は、大きい2,6−ジイソプロピルアニリンのみに、0.01%の触媒添加量を使用できることを示した。Marion, N.; Navarro, O.; Mei, J.; Stevens, E.D.; Scott, N.M.; Nolan, S.P. J. Am. Chem. Soc. 2006, 128, 4101-4111。ベラー(Bellar)と共同研究者は、0.01%の触媒添加量での一例を示したが、50:1のリガンド:Pd比および140℃の反応温度を使用しなければならなかった。Rataboul, F.; Zapf, A.; Jackstell, R.; Harkal, S.; Riermeier, T.; Monsees, A.; Dingerdissen, U.; Beller, M. Chem. Eur. J. 2004, 10, 2983-2990。
図5は、ヘテロアリールアミンのクロスカップリング反応におけるリガンド1の有用性を示している。アミノピリミジン、アミノピラジン、およびアミノピリジンをカップリングさせる触媒系が公知であるが、そのような反応は18から24時間かかり、収率は57%ほど低かった。Anderson, K. W.; Tundel, R. E.; Ikawa, T.; Altman, R. A.; Buchwald, S. L. Angew. Chem. Int. Ed. 2006, 45, 6523-6527。リガンド1を使用することによって、アミノピリミジン(図5、エントリー1)、アミノピラジン(図5、エントリー2)、およびアミノピリジン(図5、エントリー3)の全てが、短い反応時間で、優れた収率でうまくカップリングされた。
アミドのカップリングにおける本発明のリガンドの有効性も調査した(図6参照)。リガンド7(図3参照)を用いたアセトアミドの2−クロロトルエンとのカップリングは18時間かかり、71%の収率が得られた。Ikawa, T.; Barder, T. E.; Biscoe, M. R.; Buchwald, S. L. J. Am. Chem. Soc. 2007, 2183-2192。しかしながら、リガンド6を使用すると、同じカップリングが、85%の収率で1.5時間内で行われた(図6、エントリー2)。
ビフェニル系リガンド
本発明のリガンドの実施例により、初めて、低触媒添加量のモノホスフィン系触媒を使用して、高選択性のモノアリール化が促進された。本発明の触媒系は概してクロスカップリング反応において高レベルの反応性を示したので、これらの系を用いた第一級アミンのモノアリール化を調査した。10を使用した場合、ジアリール化よりもモノアリール化を>97:3の選択率で、メチルアミンを4−クロロアニソールとうまくカップリングさせた。11を使用した類似の反応は、室温でどのような生成物を生成しなかった。この温度を80℃に上昇させることによって、反応は進行したが、ジアリール化に有利に働き、選択率は20:80に逆になった(図10、表6、エントリー3)。より大きなリガンド12を用いると、選択率は82:18まで増加するが(図10、表6、エントリー4)、とても1ほど選択的にはならなかった。Anderson, K. W.; Tundel, R. E.; Ikawa, T.; Altman, R. A.; Buchwald, S. L. Angew. Chem. Int. Ed. 2006, 45, 6523。図10に概説し、室温で行った反応について(エントリー1、2および4)、最も安定な触媒系を作製するために、余計な当量の1は必要なかった。その上、リガンド1の使用により、二置換アミンを含む反応がうまく阻害され、室温でメタルアミンの高選択的なモノアリール化が可能である(図11、表7)。
上記の結果により、第二級アミンに優先した第一級アミンのアリール化について高レベルの化学選択性が観察されるはずであることが示唆された。1を使用すると、第二級アニリノ基の存在下で、14の第一級アミノ基を>40:1の選択率でカップリングした(図13、表9)。この結果は、アニリンが脂肪族アミンに優先して反応した以前のレポートに好意的である。Biscoe, M. R.; Barder, T. E.; Buchwald, S. L. Angew. Chem. Int. Ed. 2007, 46, 7232。さらに、15における第一級および環状の第二級アミンの間と、16における第一級および第二級アニリンの間の分子内競合において、第一級アミノ基はN−優先的にアリール化され、>20:1の選択率で優れた収率で進んだ(図13、表9)。Cabello-Sanchez, N.; Jean, L.; Maddaluno, J.; Lasne, M.; Rouden, J. J. Org. Chem. 2007, 72, 2030。
ビフェニル系リガンド(1)またはヘテロアリール系リガンド(23)により支援された、4−クロロアニソールおよびヘキシルアミンの反応時間およびモノアリール化のジアリール化の比の比較が図19に示されている。ヘテロアリール系リガンド(23)を利用した反応の時間は著しく長いが、このリガンドにより、モノアリール化生成物のジアリール化生成物に対する比がより高くなる。これらの反応に関する一般手法が実施例59に示されている。
面白いことに、これらのリガンドは、亜硝酸ナトリウムと適切な触媒の存在下でのアリールクロライドの硝化も触媒する(図20および21)。図1に示されるように、リガンド6は、たった2時間の反応時間後に、50%を超えた収率(GC)を生じた。しかしながら、リガンド6に関する24時間の反応時間で、ほとんど100%の所望の硝化生成物が生成された。リガンド25、26および27は、この反応の触媒ではそれほど成功しなかった。
本発明のリガンドは、アリールクロライドおよび金属シアン酸塩からのN−アリールカルバメートの合成にうまくいくことも実証された。t−BuOHの存在下で、リガンド6は、74%の収率で所望の生成物の合成を触媒した(図22)。この反応の一般手法が、実施例55に示されている。
ビフェニル系リガンド
本発明の改良リガンドにより、アリールメシラートの初めてのアミノ化が可能になる。この効果を探求するための引き続きの労力において、新たなリガンドを調製し(図7)、その内の1つが、ホスフィン含有アレーンのメトキシ置換を含み(BrettPhos、1、実施例9)、アリールメシラートのアミノ化において効果的であることが示された。
本発明のヘテロアリール系リガンド、例えば、リガンド23も、アリールメシラートとアニリンの反応を触媒するのにうまくいくことが実証された。図23は、この反応におけるこのリガンドの使用を示している。詳細な手法が実施例60に示されている。
アリールメシラートのうまくいったカップリングの他の例が図24に示されている。K2CO3、t−BuOH、および水活性化の存在下での、Pd(OAc)2およびリガンド6への曝露の際に、様々なアミドが様々なアリールメシラートにカップリングされて、24時間後に出発材料が100%転化された。これらの反応の一般手法が実施例56に示されている。
アリールクロライドの硝化に見られた成功に加え、アリールトリフラートおよびアリールノナフラートも、本発明のリガンドを用いてうまく硝化された。図21は、リガンド6を使用した反応においてカップリングされたアリールトリフラートおよびアリールノナフラートのいくつかの例を示している。アリールクロライドの場合と同様に、基質の立体電子的性質は、反応の収率にほとんどから全く役割を果たさない。これらの反応の一般手法が実施例54に概説されている。
スティレクロスカップリング
本発明のリガンドは、図25(a)に示されるように、スティレクロスカップリングの触媒作用における最高の汎用性が実証された。リガンド1は、たった2時間後にGCによる収率90%で所望の生成物を提供した。
本発明のリガンドにより触媒された様々な反応の別の例が図25(b)に示されている。ケトンが、ケトンのα位置でアリールメシラートによりうまくアリール化されて、所望の生成物が約80%の収率で得られた。
他のリガンドと比較した1の特有の反応性を理解しようとして、一連の1・Pd(II)ArX(X=ClまたはBr、図14)錯体を、(COD)Pd(CH2SiPhMe2)2、1およびArXを組み合わせることによって調製した。Pan, Y.; Young, G. B. J. Organomet. Chem. 1999, 577, 257。これらの錯体は、2種類の明確な立体配座異性体の混合物として溶液中に存在する。その場での31P NMRによる反応混合物の調査により、約2:1の比で2種類の生成物が示された。この溶液にペンタンを転化すると、Pd(II)錯体の沈殿が誘発され、この錯体は単一の配座異性体として結晶化する。単離された錯体の新たに調製した溶液は、主要な配座異性体からの信号しか示さない(1Hおよび31P NMR)。しかしながら、急激な異性化が観察され、少量の異性体が、室温で5分以内に検出可能になる。これらの実験における全ての濃度は、内部標準に対して測定した。
本発明の反応は幅広い条件下で行ってもよいが、ここに挙げられた溶媒および温度範囲は、制限的ではなく、本発明のプロセスの好ましい様式に対応するものでしかないことが理解されよう。
Zは、必要に応じて置換されたアリール、ヘテロアリールおよびアルケニルからなる群より選択され;
Xは、−Cl、−Br、−I、−OS(O)2アルキル、−OS(O)2ペルフルオロアルキル、および−OS(O)2アリールからなる群より選択され;
R’およびR”は、各存在毎に独立して、水素、アルキル、ヘテロアルキル、アリール、ヘテロアリール、アラルキル、ヘテロアラルキル、アルコキシル、アミノ、アミノアルキル、ヘテロシクリルアルキル、トリアルキルシリル、およびトリアリールシリルからなる群より選択される;またはR’および(C=O)pR”が、一緒になって、3〜10の主鎖原子からなる必要に応じて置換された環を形成し、この環が、必要に応じて、R’および(C=O)pR”が結合している窒素に加え、1、2または3つのヘテロ原子を備えており;
R’はZに共有結合していてよく;
R”はZに共有結合していてよく;
pは0または1であり;
遷移金属が、Ni、PdおよびPtからなる群より選択され;
塩基が、フッ化物、水素化物、水酸化物、カーボネート、ホスフェート、アルコキシド、金属アミド、およびカルバニオンからなる群より選択され;
リガンドが上述したビフェニル系リガンドの内の任意の1つである。
R”’は低級アルキルであり;
R’はZに共有結合していてよく;
R”はZに共有結合していてよく;
pは0または1であり;
遷移金属は、PdまたはPtであり;
塩基は、水酸化物、カーボネート、ホスフェート、およびアルコキシドからなる群より選択され;
リガンドが上述したビフェニル系リガンドの内の任意の1つである。
Zは、必要に応じて置換されたアリール、ヘテロアリールおよびアルケニルからなる群より選択され;
Xは、−Cl、−Br、−I、−OS(O)2アルキル、−OS(O)2ペルフルオロアルキル、および−OS(O)2アリールからなる群より選択され;
Rは、メチル、エチル、プロピル、ブチル、またはペンチルを表し;
R’は、アリル、アルケニル、またはアリールを表し;
遷移金属は、Ni、PdおよびPtからなる群より選択され;
塩基は、フッ化物、水素化物、水酸化物、カーボネート、ホスフェート、アルコキシド、金属アミド、およびカルバニオンからなる群より選択され;
リガンドが上述したビフェニル系リガンドの内の任意の1つである。
Zは、必要に応じて置換されたアリール、ヘテロアリールおよびアルケニルからなる群より選択され;
Xは、−Cl、−Br、−I、−OS(O)2アルキル、−OS(O)2ペルフルオロアルキル、および−OS(O)2アリールからなる群より選択され;
Rは、置換または未置換のアリール、ヘテロアリール、またはt−Buを表し:
R’は、アルキル、アリール、またはヘテロアリールを表し;
RおよびR’は、一緒に共有結合していてもよく;
遷移金属は、Ni、PdおよびPtからなる群より選択され;
塩基は、フッ化物、水素化物、水酸化物、カーボネート、ホスフェート、アルコキシド、金属アミド、およびカルバニオンからなる群より選択され;
リガンドは、上述したビフェニル系リガンドの内の任意の1つである。
Zは、必要に応じて置換されたアリール、ヘテロアリールおよびアルケニルからなる群より選択され;
Xは、−Cl、−Br、−I、−OS(O)2アルキル、−OS(O)2ペルフルオロアルキル、および−OS(O)2アリールからなる群より選択され;
Mは、リチウム、ナトリウム、またはカリウムを表し;
遷移金属は、Ni、PdおよびPtからなる群より選択され;
塩基は、フッ化物、水素化物、水酸化物、カーボネート、ホスフェート、アルコキシド、金属アミド、およびカルバニオンからなる群より選択され;
リガンドは、上述したビフェニル系リガンドの内の任意の1つである。
Zは、必要に応じて置換されたアリール、ヘテロアリールおよびアルケニルからなる群より選択され;
Xは、−Cl、−Br、−I、−OS(O)2アルキル、−OS(O)2ペルフルオロアルキル、および−OS(O)2アリールからなる群より選択され;
Mは、リチウム、ナトリウム、またはカリウムを表し;
遷移金属は、Ni、PdおよびPtからなる群より選択され;
Rはアルキルまたはアリールであり;
リガンドは、上述したビフェニル系リガンドの内の任意の1つである。
Zは、必要に応じて置換されたアリール、ヘテロアリールおよびアルケニルからなる群より選択され;
Xは、−Cl、−Br、−I、−OS(O)2アルキル、−OS(O)2ペルフルオロアルキル、および−OS(O)2アリールからなる群より選択され;
R’およびR”は、各存在毎に独立して、水素、アルキル、ヘテロアルキル、アリール、ヘテロアリール、アラルキル、ヘテロアラルキル、アルコキシル、アミノ、アミノアルキル、ヘテロシクリルアルキル、トリアルキルシリル、およびトリアリールシリルからなる群より選択される;またはR’および(C=O)pR”が、一緒になって、3〜10の主鎖原子からなる必要に応じて置換された環を形成し、この環が、必要に応じて、R’および(C=O)pR”が結合している窒素に加え、1、2または3つのヘテロ原子を備えており;
R’はZに共有結合していてよく;
R”はZに共有結合していてよく;
pは0または1であり;
遷移金属が、Ni、PdおよびPtからなる群より選択され;
塩基が、フッ化物、水素化物、水酸化物、カーボネート、ホスフェート、アルコキシド、金属アミド、およびカルバニオンからなる群より選択され;
リガンドが上述したヘテロアリール系リガンドの内の任意の1つである。
R”’は低級アルキルであり;
R’はZに共有結合していてよく;
R”はZに共有結合していてよく;
pは0または1であり;
遷移金属は、PdまたはPtであり;
塩基は、水酸化物、カーボネート、ホスフェート、およびアルコキシドからなる群より選択され;
リガンドが上述したヘテロアリール系リガンドの内の任意の1つである。
磁器撹拌子を備え、マグネシウム削りくず(360mg、15.36ミリモル)が入れられた、オーブン乾燥された三口の100mLの丸底フラスコに、還流冷却器、ガラス栓、およびゴム製セプタムを取り付けた。このフラスコを真空にし、アルゴンを充填し(この工程は合計で3回繰り返した)、次いで、注射器でTHF(40mL)および2,4,6−トリイソプロピルブロモベンゼン(3.62g、12.8ミリモル)を加えた。この反応系を加熱して、還流し、1,2−ジブロモメタン(40μL)を滴下した。この反応系を1時間に亘り還流しながら撹拌し、次いで、室温まで冷却した。磁器撹拌子を備え、セプタムが取り付けられた、別のオーブン乾燥された500mLの丸底フラスコを真空にし、アルゴンを充填し(この工程は合計で3回繰り返した)、次いで、このフラスコに注射器でTHF(160mL)および1,4−ジメトキシ−2−フルオロベンゼン(2g、12.8ミリモル)を加えた。この反応系を−78℃に冷却し、15分間でn−BuLi(ヘキセン中2.5M、5.12mL、12.8ミリモル)を滴下した。この溶液を30分間撹拌し、第1の反応槽内で調製したグリニャール試薬を20分間でカニュラ移送法により加え、1時間に亘り−78℃で撹拌した。この反応系を室温までゆっくりと暖めて、この温度で、さらに1.5時間に亘り撹拌した。次いで、反応系を0℃まで冷却し、THF中のヨウ素溶液(0.38M、40mL、15.36ミリモル)を15分間で滴下により加え、次いで、この暗赤色の溶液を室温まで暖め、1時間に亘り撹拌した。この反応系を回転式エバポレータで濃縮し、CH2Cl2中に取り込み、亜硫酸ナトリウムの飽和溶液で洗浄し、塩水で洗浄した。次いで、有機層をMgSO4で乾燥させ、濾過し、回転式エバポレータで濃縮して、黄色固体を得た。粗製品をEtOAcから再結晶化させて、白色固体として2.471g(41%)の生成物を得た。(この分子の代わりの合成については実施例8および46を参照のこと)。
磁器撹拌子を備えた、2−ヨード−2’,4’,6’−トリイソプロピル−3,6−ジメトキシビフェニル(1g、2.15ミリモル)が入れられた、オーブン乾燥された25mLの丸底フラスコを真空にし、アルゴンを充填した(この工程は合計で3回繰り返した)。注射器でTHF(10mL)を加え、この反応系を−78℃に冷却し、n−BuLi(ヘキサン中2.5M、940μL、2.36ミリモル)を10分間で滴下した。この溶液を30分間撹拌し、次いで、ClPR2(2.26ミリモル)を10分間で滴下した。この反応系を−78℃で1時間に亘り撹拌し、次いで、室温までゆっくりと暖め、さらに1.5時間に亘り撹拌した。この溶液を、シリカの栓に重ねたCelite(登録商標)の栓に通して濾過し(EtOAcで溶出)、次いで、回転式エバポレータで濃縮して、白色固体を得た。粗製品をアセトンから再結晶化させて(リガンドの2から5はMeOHから再結晶化された)、所望の生成物の白色結晶を得た。
磁器撹拌子を備え、マグネシウム削りくず(360mg、15.36ミリモル)が入れられた、オーブン乾燥された三口の100mLの丸底フラスコに、還流冷却器、ガラス栓、およびゴム製セプタムを取り付けた。このフラスコを真空にし、アルゴンを充填し(この工程は合計で3回繰り返した)、次いで、注射器でTHF(40mL)および2,4,6−トリイソプロピルブロモベンゼン(3.62g、12.8ミリモル)を加えた。この反応系を加熱して、還流し、1,2−ジブロモメタン(40μL)を滴下した。この反応系を1時間に亘り還流しながら撹拌し、次いで、室温まで冷却した。磁器撹拌子を備え、セプタムが取り付けられた、別のオーブン乾燥された500mLの丸底のシュレンクフラスコを真空にし、アルゴンを充填し(この工程は合計で3回繰り返した)、次いで、このフラスコに注射器でTHF(160mL)および1,4−ジメトキシ−2−フルオロベンゼン(2g、12.8ミリモル)を加えた。この反応系を−78℃に冷却し、15分間でn−BuLi(ヘキセン中2.5M、5.12mL、12.8ミリモル)を滴下した。この溶液を30分間撹拌し、第1の反応槽内で調製したグリニャール試薬を20分間でカニュラ移送法により加え、1時間に亘り−78℃で撹拌した。この反応系を室温までゆっくりと暖めて、この温度で、さらに3時間に亘り撹拌した。アルゴンを一定量で流しながら、セプタムを取り外し、無水CuCl(1.267g、12.8ミリモル)を迅速に加えた。次いで、ClP(t−Bu)2(2.44mL、12.8ミリモル)を注射器で加え、シュレンク管をテフロン(登録商標)ネジ蓋で密封した。この反応系を48時間で75℃に加熱し、次いで、室温まで冷却した。この反応系をNH4OHの30%水溶液(100mL)で急冷し、得られた懸濁液をEtOAc(200mL)で抽出した。その有機層をNH4OHの30%水溶液(100mLで3回)と塩水(100mL)で洗浄し、MgSO4で乾燥させ、濾過し、回転式エバポレータで濃縮して、どろっとした黄色油を得た。この粗製品を最小量の高温のMeOH中に取り込み、−25℃の冷凍庫内に一晩置いて、1.11g(18%)の白色結晶を得た。
グローブボックス内で、磁器撹拌子を備えた、オーブン乾燥した試験管にNaOt−Bu(1.2当量)、アリールクロライド(1.0当量)、アミン(1.2当量)、Bu2O(2mL/ミリモル)を入れた。前触媒とリガンド1のトルエン溶液(0.002M、0.01%)を加え、試験管に蓋をし、グローブボックスから取り出し、ここで、GCによりモニタして出発材料が完全に消費されるまで110℃に加熱した。次いで、この反応系を室温まで冷却し、EtOAcで希釈し、水で洗浄し、真空中で濃縮し、Biotage SP4(シリカ充填25+Mカートリッジ)により精製した。
磁器撹拌子を備え、「テフロン」ネジ蓋セプタムが取り付けられた、オーブン乾燥された試験管にPd(OAc)2(0.01ミリモル)および1(0.03ミリモル)を入れた。この反応槽を真空にし、アルゴンを充填し(この工程は合計で3回繰り返した)、次いで、t−BuOH(2mL)および脱気したH2O(0.04ミリモル)を注射器で加えた。水の添加後、この溶液を1分間80℃に加熱した。
磁器撹拌子を備え、「テフロン」ネジ蓋セプタムが取り付けられた、オーブン乾燥された試験管にPd(OAc)2(0.01ミリモル)および6(0.022ミリモル)を入れた。この反応槽を真空にし、アルゴンを充填し(この工程は合計で3回繰り返した)、次いで、t−BuOH(2mL)および脱気したH2O(0.04ミリモル)を注射器で加えた。水の添加後、この溶液を1.5分間110℃に加熱した。
一般の試薬情報
全ての反応はアルゴン雰囲気下で行った。メチルアミン溶液、1,4−ジオキサン、THF、およびtert−ブタノールは、Sure−Seal(商標)瓶でアルドリッチ・ケミカル社(Aldrich Chemical Co.)から購入し、入手した状態のまま使用した。ジブチルエーテルは、無水でアルドリッチ・ケミカル社から購入し、ナトリウム金属を用いて蒸留した。ペンタンは、「Sure−Seal」瓶でアルドリッチ・ケミカル社から購入し、N2スパージし、グローブボックス内で活性化3Åモレキュラーシーブ上に貯蔵した。Pd(OAc)2はBASF社からの寄贈品であり、アリールハライドおよびアミンは、アルドリッチ・ケミカル社、アルファ・エーサー社(Alfa Aesar)、パークウェイ・サイエンティフィック社(Parkway Scientific)、またはTCIアメリカ社(TCI America)から購入した。1,4−ジメトキシフルオロベンゼンは、シンケスト・ラブス社(Synquest Labs, Inc.)から購入し、入手した状態のまま使用した。液体であった全てのアミンおよび図12、表8に使用したアリールクロライドは、水素化カルシウムから蒸留し、アルゴン雰囲気下で貯蔵した。固体であったアミンおよび他の全てのアリールハライドは、さらに精製せずに、購入したままの状態で使用した。蒸留水を真空下で短い(30秒)超音波処理により脱気した。炭酸カリウムおよびナトリウムtert−ブトキシドの両方とも、アルドリッチ・ケミカル社から購入し、入手した状態のまま使用した。塩基全体はN2グローブボックス内で貯蔵した。少量をガラスバイアル内にこのボックスから取り出し、空気中で秤量した。リガンド13と8および前触媒10は、文献の手法を用いて合成した。Huang, X.; Anderson, K. W.; Zim, D.; Jiang, L.; Klapers, A.; Buchwald, S. L. J. Am. Chem. Soc. 2003, 125, 6653; Anderson, K. W.; Tundel, R. E.; Ikawa, T.; Altman, R. A.; Buchwald, S. L. Angew. Chem. Int. Ed. 2006, 45, 6523; Biscoe, M. R.; F
ors, B. P.; Bucwhald, S. L. J. Am. Chem. Soc. 2008, 130, 2754。
全ての化合物は、1H NMR、13C NMR、およびIR分光法によって特徴付けた。核磁気共鳴スペクトルは、Varian 300MHz装置およびBruker 400MHz装置で記録した。全ての1H NMR実験は、δ単位の100万分の一(ppm)で報告され、別記しない限り、重水素化溶媒中の残留クロロホルム(7.26ppm)に関する信号に対して測定した。全ての13C NMRスペクトルは、重水素クロロホルム(77.23ppm)に対するppmで報告され、全ては、1Hをデカップリングして得た。全てのIRスペクトルはPerkin−Elmer 2000 FTIRで得た。全てのGC分析は、J&W DB−1カラム(10m、0.1mm内径)を用いたFID検出器を備えたAgilent 6890ガスクロマトグラフで行った。元素分析は、ジョージア州ノークロス所在のアトランティック・マイクロラブス社(Atlantic Microlabs Inc.)により行った。
磁器撹拌子を備えた、2−ヨード−2’,4’,6’−トリイソプロピル−3,6−ジメトキシビフェニル(1g、2.15ミリモル)が入れられた、オーブン乾燥された25mLの丸底フラスコを真空にし、アルゴンを充填した(この工程は合計で3回繰り返した)。注射器でTHF(10mL)を加え、この反応系を−78℃に冷却し、n−BuLi(ヘキサン中2.5M、940μL、2.36ミリモル)を10分間で滴下した。この溶液を30分間撹拌し、次いで、ClPCy2(527mg、2.26ミリモル)を10分間で注射器により加えた。この反応混合物を−78℃で1時間に亘り撹拌し、次いで、室温までゆっくりと暖め、この温度で、さらに1.5時間に亘り撹拌した。この溶液を、シリカの栓に重ねた「Celite」の栓に通して濾過し(EtOAcで溶出)、次いで、回転式エバポレータを用いて溶媒を除去して、白色固体を得た。粗製品をアセトンから再結晶化させて、白色結晶として所望の生成物を得た。次いで、母液を濃縮し、残りの白色固体をアセトンから再結晶化させて、追加の白色結晶を得た(合計で1.012g、収率88%)、mp191〜193℃。1H NMR (300 MHz, CDCl3) δ: 6.96 (s, 2H), 6.85 (d, J = 9.0 Hz, 1H), 6.78 (d, J = 9.0 Hz, 1H), 3.82 (s, 3H), 3.56 (s, 3H), 2.93 (septet, J = 7.0 Hz, 1H), 2.42 (septet, J = 7.0 Hz, 2H), 2.19 (m, 2H), 1.82 - 1.60 (m, 8H), 1.41 - 0.90 (m, 12H), 1.31 (d, J = 7.0 Hz, 6H), 1.16 (d, J = 7.0 Hz, 6H), 0.92 (d, J = 7.0 Hz, 6H) ppm. 13C NMR (75 MHz, CDCl3) δ: 156.5, 156.5, 152.5, 152.4, 147.1, 146.2, 146.1, 139.5, 139.0, 132.9, 132.8, 127.0, 126.6, 120.4, 120.3, 110.9, 108.8, 55.3, 54.9, 54.8, 36.9, 36.7, 34.0, 33.3, 32.9, 31.2, 31.0, 30.7, 28.2, 28.1, 27.9, 27.7, 26.7, 25.3, 24.2, 23.8 ppm (観察された複雑さはP−C分裂によるものである). 31P NMR (121 MHz, CDCl3) δ: -1.62 ppm. IR (neat, cm-1): 3378, 2849, 1654, 1654, 1457, 1423, 1384, 1249, 1053. Anal. Calcd. for C35H53O2P: C, 78.32; H, 9.95. Found: C, 78.44; H, 10.09。
前触媒を用いた一般手法
磁器撹拌子を備え、「テフロン」製セプタムが取り付けられた、オーブン乾燥された試験管に、前触媒(1モル%)、リガンド(1モル%)、4−t−ブチルフェニルメタンスルホネート(0.5ミリモル、114mg)、およびK2CO3(97mg、0.7ミリモル)を入れた。この反応槽を真空にし、アルゴンを充填し(この工程は合計で3回繰り返した)、次いで、注射器でアニリン(55μL、0.6ミリモル)およびtert−ブタノール(6mL)を加えた。この溶液を4時間に亘り110℃に加熱し、室温まで冷却し、酢酸エチルで希釈し、水で洗浄した。次いで、内部基準としてドデカンを加え、反応をGCにより分析した。
磁器撹拌子を備え、「テフロン」製セプタムが取り付けられた、オーブン乾燥された試験管に、Pd(OAc)2(1モル%)およびリガンド(3モル%)を入れた。この反応槽を真空にし、アルゴンを充填し(この工程は合計で3回繰り返した)、tert−ブタノール(1mL)および脱気したH2O(8モル%)を注射器で加えた。水の添加後、この溶液を1分間に亘り110℃に加熱した。
一般手法A
磁器撹拌子を備え、「テフロン」製セプタムが取り付けられた、オーブン乾燥された試験管に、10(1モル%)、1(1モル%)およびK2CO3(97mg、0.7ミリモル)を入れた。この反応槽を真空にし、アルゴンを充填し(この工程は合計で3回繰り返した)、次いで、アリールメシラート(0.5ミリモル)、アミン(0.6ミリモル)、およびtert−ブタノール(6mL)を注射器で加えた(室温で固体であったアリールクロライドまたはアミンは、触媒および塩基と共に加えた)。この溶液を、GCによりモニタして出発材料が完全に消費されるまで、110℃に加熱した。次いで、反応混合物を室温まで冷却し、酢酸エチルで希釈し、水で洗浄し、真空中で濃縮し、Biotage SP4(シリカ充填25+Mカートリッジ)により精製した。
全て公知のアリールメシラートを、文献の手法を用いて合成した。Munday, R. H.; Martinelli, J. R.; Buchwald, S. L. J. Am. Chem. Soc. 2008, 130, 2754. Ritter, T.; Stanek, K.; Larrosa, I.; Carreira, E. M. Org. Lett. 2004, 6, 1513. Fujikawa, N.; Ohta, T.; Yamaguchi, T.; Fukuda, T.; Ishibashi, F.; Iwao, M. Tetrahedron 2006, 62, 594。
一般手法B
磁器撹拌子を備え、「テフロン」製セプタムが取り付けられた、オーブン乾燥された試験管に、前触媒(0.01当量)およびNaOt−Bu(120mg、1.2ミリモル)を入れた。この反応槽を真空にし、アルゴンを充填し(この工程は合計で3回繰り返した)、次いで、アリールクロライド(1.0ミリモル)、THFの2Mのメチルアミン溶液(1mL、2.0ミリモル)、およびt−BuOH(1mL)を続けて注射器で加えた(室温で固体であったアリールクロライドは、前触媒および塩基と共に加えた)。この溶液を、GCによりモニタして出発材料のアリールクロライドが完全に消費されるまで、室温で撹拌した。次いで、この反応混合物を酢酸エチルで希釈し、NH4Cl水溶液で洗浄し、Na2SO4で乾燥させ、真空中で濃縮し、シリカゲルのカラムクロマトグラフィーにより精製した。
以下の変更を行って、一般手法Aを使用した:THF中の2Mのメチルアミン溶液(1mL、2.0ミリモル)およびt−BuOH(4mL)を予混し、反応槽に加えた。
一般手法D
磁器撹拌子を備え、「テフロン」製セプタムが取り付けられた、オーブン乾燥された試験管に、10(0.05モル%)、1(0.05モル%)およびNaOt−Bu(1.15g、12ミリモル)を入れた。この反応槽を真空にし、アルゴンを充填し(この工程は合計で3回繰り返した)、次いで、アリールクロライド(10ミリモル)、アミン(14ミリモル)、およびBu2O(3mL)を注射器で加えた。この溶液を、GCによりモニタして、出発材料が完全に消費されるまで、85℃に加熱した。次いで、この反応混合物を室温まで冷却し、酢酸エチルで希釈し、水で洗浄し、真空中で濃縮し、Biotage SP4(シリカ充填100gスナップ・カートリッジ)により精製した。
磁器撹拌子を備えた、オーブン乾燥された試験管を、窒素充填したドライボックス内に入れ、この試験管に、NaOt−Bu(115mg、1.2ミリモル)、アミン(1.2ミリモル)、アリールクロライド(1.0ミリモル)、およびBu2O(1mL)を入れた。トルエン中1および10の溶液(50μL、0.02M、0.01モル%の1、0.01モル%の10)を加え、次いで、この反応槽を密閉し、ドライボックスから取り出し、GCによりモニタして、出発材料が完全に消費されるまで、110℃に加熱した。次いで、この反応混合物を室温まで冷却し、酢酸エチルで希釈し、水で洗浄し、真空中で濃縮し、Biotage SP4(シリカ充填25+Mカートリッジ)により精製した。
一般手法F
磁器撹拌子を備え、「テフロン」製セプタムが取り付けられた、オーブン乾燥された試験管に、10(1モル%)、1(1モル%)およびNaOt−Bu(2.0当量)を入れた。この反応槽を真空にし、アルゴンを充填し(この工程は合計で3回繰り返した)、次いで、アリールクロライド(1.0当量)、アミン(1.2当量)、およびジオキサン(1mL/ミリモル)を注射器で加えた。この溶液を、GCによりモニタして、出発材料が完全に消費されるまで、80℃に加熱した。次いで、この反応混合物を室温まで冷却し、酢酸エチルで希釈し、水で洗浄し、真空中で濃縮し、Biotage SP4(シリカ充填50gスナップ・カートリッジ)により精製した。
2−ジシクロヘキシルホスフィン−2’,4’,6’−トリイソプロピル−3,5−ジメトキシビフェニル(21) 磁器撹拌子を備え、2−ヨード−2’,4’,6’−トリイソプロピル−3,5−ジメトキシビフェニル(2g、4.29ミリモル)が入れられた、オーブン乾燥された25mLの丸底フラスコを真空にし、アルゴンを充填した(この工程は合計で3回繰り返した)。THF(10mL)を注射器で加え、この反応系を−78℃に冷却し、n−BuLi(ヘキサン中2.5M、1.8mL、4.5ミリモル)を10分間で滴下した。この溶液を30分間に亘り撹拌し、次いで、ClPCy2(1.038mL、4.7ミリモル)を10分間で注射器により加えた。この反応系を−78℃で1時間に亘り撹拌し、次いで、室温までゆっくりと暖め、この温度でさらに1.5時間に亘り撹拌した。この溶液を、シリカの栓に重ねた「Celite」の栓に通して濾過し(EtOAcで溶出)、次いで、溶媒を回転式エバポレータにより除去して、白色固体を得た。粗製品をアセトンから再結晶化させて、白色結晶として所望の生成物を得た。次いで、母液を濃縮し、残りの白色固体をアセトンから再結晶化させて、追加の白色結晶を得た。
磁器撹拌子を備え、「テフロン」製セプタムが取り付けられた、オーブン乾燥された試験管にPd(OAc)2(1モル%)およびリガンド(1、21、または22)(3モル%)を入れた。この反応槽を真空にし、アルゴンを充填し(この工程は合計で3回繰り返した)、t−BuOH(2mL)および脱気したH2O(4モル%)を注射器で加えた。水の添加後、この溶液を1.5分間に亘り110℃に加熱した。
磁器撹拌子を備え、「テフロン」製セプタムが取り付けられた、オーブン乾燥されたシュレンク管に、Pd2(dba)3(0.5モル%)、リガンド(6、25、26、または27)(1.2モル%)、およびNaNO2(138mg、2.0ミリモル)(室温で固体であったアリールハライド*は、触媒と共に加えた)を入れた。この反応槽を真空にし、アルゴンを充填し(この工程は合計で3回繰り返した)、次いで、アリールハライド*(1.0ミリモル)、トリス(3,6−ジオキサヘプチル)アミン(5モル%)、およびtert−ブタノール(2mL)を注射器で加えた。この反応槽を「テフロン」ネジ蓋で密閉し、24時間で110℃に加熱した。この溶液を室温まで冷却し、酢酸エチルで希釈し、水で洗浄し、フラッシュクロマトグラフィーによって精製した。
*アリールトリフラートおよびアリールノナフラートを含む。
磁器撹拌子を備え、「テフロン」製セプタムが取り付けられた、オーブン乾燥された試験管に、Pd2(dba)3(1モル%)、t−BuBrettPhos(6)(2モル%)、およびシアン酸ナトリウム(2.2ミリモル)を入れた。この反応槽を真空にし、アルゴンを充填し(この工程は合計で3回繰り返した)、次いで、アリールクロライド(1.0ミリモル)およびtert−ブタノール(2mL)を注射器で加えた。この溶液を、24時間に亘り110℃に加熱し、室温まで冷却し、酢酸エチルで希釈し、水で洗浄した。有機相を回転式エバポレータで濃縮し、粗製品をフラッシュクロマトグラフィーによって精製した。
磁器撹拌子を備え、「テフロン」製セプタムが取り付けられた、オーブン乾燥された試験管に、Pd(OAc)2(1モル%)、およびt−BuBrettPhos(6)(3モル%)を入れた。この反応槽を真空にし、アルゴンを充填し(この工程は合計で3回繰り返した)、t−BuOH(2mL)および脱気したH2O(8モル%)を注射器で加えた。水の添加後、この溶液を1.5分間に亘り110℃に加熱した。
当業者には、日常的に過ぎない実験を使用して、ここに記載された本発明の特定の実施の形態に対する同等物の多くを認識または確認できるであろう。したがって、先の実施の形態はほんの一例として提示されたものであり、添付の特許請求の範囲およびその同等物の範囲内で、本発明は、具体的に記載されクレームされたのとは別のやり方で実施してもよいことが理解されよう。
Claims (16)
- 下記式Iにより表されるリガンドであって、該リガンドは、アキラルであるか、またはキラルである場合1つの立体異性体または立体異性体の混合物であるリガンド:
R1、R2、R3、およびR4の内の少なくとも2つが−OR11であるという条件で、R1、R2、R3、およびR4が、各存在毎に独立して、水素、ハロゲン、アルキル、シクロアルキル、ヘテロシクロアルキル、アリール、ヘテロアリール、アラルキル、ヘテロアラルキル、−OR11、−N(R11)2、−Si(R11)3、および−(CH2)m−R10からなる群より選択され;
R 5 、R 7 およびR 9 は、各存在毎に独立して、アルキル、シクロアルキル、ヘテロシクロアルキル、アリール、ヘテロアリール、アラルキル、ヘテロアラルキル、−Si(R11)3、および−(CH2)m−R10からなる群より選択され;
R6およびR8は、各存在毎に独立して、水素、低級アルキルおよびハロゲンからなる群より選択され;
R10は、未置換または置換アリール、シクロアルキル、シクロアルケニル、ヘテロ環、または多環を表し;
R11は、各存在毎に独立して、アルキル、シクロアルキル、ヘテロシクロアルキル、アリール、ヘテロアリール、アラルキル、およびヘテロアラルキルからなる群より選択され;
mは、各存在毎に独立して、0から8までの整数である。 - R1およびR4が−OR11であることを特徴とする請求項1記載のリガンド。
- R2およびR3が−OR11であることを特徴とする請求項1記載のリガンド。
- R2およびR4が−OR11であることを特徴とする請求項1記載のリガンド。
- R2およびR3が−OR11であることを特徴とする請求項5記載のリガンド。
- Rが、アルキル、アリールまたはシクロアルキルであることを特徴とする請求項1、5、7および8いずれか1項記載のリガンド。
- R5、R7およびR9がi−Prであることを特徴とする請求項1、5、7および8いずれか1項記載のリガンド。
- スキーム1:
により表される方法であって、ここで、
Zは、必要に応じて置換されたアリール、ヘテロアリールおよびアルケニルからなる群より選択され;
Xは、−Cl、−Br、−I、−OS(O)2アルキル、−OS(O)2ペルフルオロアルキル、および−OS(O)2アリールからなる群より選択され;
R’およびR”は、各存在毎に独立して、水素、アルキル、ヘテロアルキル、アリール、ヘテロアリール、アラルキル、ヘテロアラルキル、アルコキシル、アミノ、アミノアルキル、ヘテロシクリルアルキル、トリアルキルシリル、およびトリアリールシリルからなる群より選択される;またはR’および(C=O)pR”が一緒になって、3〜10の主鎖原子からなる必要に応じて置換された環を形成し、該環が、必要に応じて、R’および(C=O)pR”が結合している窒素に加え、1、2または3つのヘテロ原子を備えており;
R’はZに共有結合していてよく;
R”はZに共有結合していてよく;
pは0または1であり;
遷移金属が、Ni、PdおよびPtからなる群より選択され;
塩基が、フッ化物、水素化物、水酸化物、カーボネート、ホスフェート、アルコキシド、金属アミド、およびカルバニオンからなる群より選択され;
リガンドが請求項1から14記載のリガンドからなる群より選択されるものである方法。 - スキーム1:
により表される方法であって、ここで、各存在毎に独立して、
Zは、
Xは、OS(O)2CH3、OS(O)2CF3、Cl、Br、およびIからなる群より選択され;
R’およびR”は、
R”’は低級アルキルであり;
R’はZに共有結合していてよく;
R”はZに共有結合していてよく;
pは0または1であり;
遷移金属は、PdまたはPtであり;
塩基は、水酸化物、カーボネート、ホスフェート、およびアルコキシドからなる群より選択され;
リガンドが請求項1から14記載のリガンドからなる群より選択されるものである方法。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US1317407P | 2007-12-12 | 2007-12-12 | |
| US61/013,174 | 2007-12-12 | ||
| US8736808P | 2008-08-08 | 2008-08-08 | |
| US61/087,368 | 2008-08-08 | ||
| PCT/US2008/086651 WO2009076622A2 (en) | 2007-12-12 | 2008-12-12 | Ligands for transition-metal-catalyzed cross-couplings, and methods of use thereof |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2011508726A JP2011508726A (ja) | 2011-03-17 |
| JP2011508726A5 JP2011508726A5 (ja) | 2012-02-02 |
| JP5591714B2 true JP5591714B2 (ja) | 2014-09-17 |
Family
ID=40756138
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010538198A Active JP5591714B2 (ja) | 2007-12-12 | 2008-12-12 | 遷移金属触媒によるクロスカップリングのためのリガンド、およびその使用方法 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US7858784B2 (ja) |
| EP (1) | EP2231680B1 (ja) |
| JP (1) | JP5591714B2 (ja) |
| CN (1) | CN101952298B (ja) |
| CA (1) | CA2708369C (ja) |
| WO (1) | WO2009076622A2 (ja) |
Families Citing this family (31)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP5803042B2 (ja) * | 2010-04-05 | 2015-11-04 | ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング | クロスカップリング反応におけるモノリン配位子及びそれらの使用 |
| US9255074B2 (en) | 2010-07-16 | 2016-02-09 | Abbvie Inc. | Process for preparing antiviral compounds |
| US8975443B2 (en) | 2010-07-16 | 2015-03-10 | Abbvie Inc. | Phosphine ligands for catalytic reactions |
| KR101774742B1 (ko) | 2010-07-16 | 2017-09-11 | 애브비 아일랜드 언리미티드 컴퍼니 | 촉매 반응용 포스핀 리간드 |
| NZ705225A (en) | 2010-07-16 | 2016-11-25 | Abbvie Bahamas Ltd | Process for preparing antiviral compounds |
| CN102241614B (zh) * | 2011-05-10 | 2015-09-02 | 浙江建业化工股份有限公司 | 一种n-烃基取代酰胺化合物的合成方法 |
| CN102516300A (zh) * | 2011-11-09 | 2012-06-27 | 中山大学 | 一类膦配体及其对映体或消旋体及其制备方法 |
| CN102557966A (zh) * | 2011-12-23 | 2012-07-11 | 中国石油化工股份有限公司 | 一种制备防老剂dtpd的方法 |
| WO2013159229A1 (en) * | 2012-04-24 | 2013-10-31 | Dalhousie University | Silanyloxyaryl phosphine ligand and uses thereof in c-n cross-coupling |
| WO2013184198A1 (en) | 2012-06-08 | 2013-12-12 | Massachusetts Institute Of Technology | Phosphine-ligated palladium sulfonate palladacycles |
| TWI593717B (zh) * | 2012-07-06 | 2017-08-01 | Sumitomo Chemical Co | 芳香族化合物之製造方法 |
| CN104540871B (zh) * | 2012-07-06 | 2016-08-24 | 住友化学株式会社 | 芳香族化合物的制备方法 |
| RS60202B1 (sr) | 2012-09-26 | 2020-06-30 | Hoffmann La Roche | Jedinjenja cikličnog etra pirazol-4-il-heterociklil-karboksamida i postupci primene |
| AR092960A1 (es) | 2012-10-10 | 2015-05-06 | Hoffmann La Roche | Procedimiento para preparar compuestos tienopirimidina |
| US9556112B2 (en) | 2012-11-15 | 2017-01-31 | Duquesne University Of The Holy Ghost | Carboxylic acid ester prodrug inhibitors of MEK |
| US10093692B2 (en) | 2013-09-18 | 2018-10-09 | The Hong Kong Polytechnic University | Phosphines, synthesis thereof and their use in catalysis |
| JP6275846B2 (ja) | 2013-12-05 | 2018-02-07 | エフ・ホフマン−ラ・ロシュ・アクチェンゲゼルシャフト | 求電子性官能基を有するヘテロアリールピリドン及びアザ−ピリドン化合物 |
| CN103819369B (zh) * | 2014-03-11 | 2016-06-01 | 杨雪飞 | 一种苯磺酰胺类化合物的合成方法 |
| EP3119775B1 (en) | 2014-03-18 | 2019-11-06 | F. Hoffmann-La Roche AG | Oxepan-2-yl-pyrazol-4-yl-heterocyclyl-carboxamide compounds and methods of use |
| US9394387B2 (en) | 2014-05-15 | 2016-07-19 | Chevron Phillips Chemical Company Lp | Synthesis of aryl coupled bis phenoxides and their use in olefin polymerization catalyst systems with activator-supports |
| WO2016094489A1 (en) | 2014-12-10 | 2016-06-16 | The Regents Of The University Of California | Phosphorus ligands and methods of use |
| CN106588983B (zh) * | 2015-10-14 | 2021-10-01 | 香港理工大学深圳研究院 | 咔唑基磷配体、及其制备方法和应用 |
| CN105273006B (zh) * | 2015-11-02 | 2017-09-19 | 盘锦格林凯默科技有限公司 | 2‑二环己基膦‑2,4,6‑三异丙基联苯的制备方法 |
| US20170173569A1 (en) | 2015-12-16 | 2017-06-22 | Bruce H. Lipshutz | Fe-ppm Pd, Cu and/or Ni Nanoparticle-Catalyzed Reactions in Water |
| WO2018081672A1 (en) | 2016-10-31 | 2018-05-03 | The Regents Of The University Of California | Biaryl ligands for transition metal-catalyzed reactions |
| CN109956970A (zh) * | 2017-12-26 | 2019-07-02 | 南开大学 | 联苯型三齿配体钌络合物及其制备方法和应用 |
| CN110240616B (zh) | 2018-03-07 | 2021-03-23 | 东莞市均成高新材料有限公司 | 三联芳单膦配体、它们的制备方法和在催化偶联反应中的用途 |
| JP7041092B2 (ja) * | 2019-04-05 | 2022-03-23 | 日本化学工業株式会社 | ビアリールホスフィンの製造方法 |
| CN113019463B (zh) * | 2021-05-25 | 2021-09-07 | 江苏欣诺科催化剂有限公司 | 钯复合催化剂及其制备方法和应用 |
| WO2024171068A1 (en) * | 2023-02-15 | 2024-08-22 | Indian Institute Of Technology Bombay | Development of ligands for metals and metal-catalyzed reactions |
| WO2024191833A2 (en) * | 2023-03-10 | 2024-09-19 | Flexsys America L.P. | Quinolineimine antidegradant compounds and uses thereof |
Family Cites Families (32)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS51132190A (en) | 1975-03-04 | 1976-11-17 | Agency Of Ind Science & Technol | Complex catalist for asymmetric reaction |
| SE449456B (sv) * | 1983-11-15 | 1987-05-04 | Uponor Ab | Forfarande och anordning for framstellning av ror varvid formbacksdelarna er delade i formstreckans lengsriktning |
| US4885376A (en) | 1987-10-13 | 1989-12-05 | Iowa State University Research Foundation, Inc. | New types of organometallic reagents and catalysts for asymmetric synthesis |
| JP2733880B2 (ja) | 1991-03-12 | 1998-03-30 | 高砂香料工業株式会社 | 光学活性三級ホスフィン化合物およびこれを配位子とする遷移金属錯体 |
| JP2939510B2 (ja) | 1991-10-04 | 1999-08-25 | 一雄 阿知波 | 新規な非対称軸不斉アミノホスフィン誘導体 |
| US5739396A (en) | 1991-12-09 | 1998-04-14 | Stanford University | Asymmetric ligands useful for transition metal catalyzed bond forming reactions |
| JP3369560B2 (ja) * | 1992-01-31 | 2003-01-20 | エフ・ホフマン−ラ ロシユ アーゲー | 燐化合物 |
| US5530150A (en) | 1993-03-12 | 1996-06-25 | Takasago International Corporation | Phosphine compound, complex containing the phosphine compound as ligand, process for producing optically active aldehyde using the phosphine compound or the complex, and 4-[(R)-1'-formylethyl]azetidin-2-one derivatives |
| DE4338826A1 (de) | 1993-11-13 | 1995-05-18 | Hoechst Ag | Verfahren zur Herstellung von 1,1`-Binaphthylen |
| JPH07330786A (ja) | 1994-06-09 | 1995-12-19 | Sumitomo Chem Co Ltd | 光学活性3級ホスフィン化合物、これを配位子とする遷移金属錯体およびこれを用いる製造法 |
| DE4435189A1 (de) | 1994-09-30 | 1996-04-04 | Hoechst Ag | Neue sulfonierte Phosphine, Verfahren zu ihrer Herstellung und ihre Verwendung als Bestandteil von Katalysatorsystemen |
| US5621129A (en) | 1995-03-09 | 1997-04-15 | Sumitomo Chemical Co., Ltd. | Optically active tertiary phosphine compound, transition metal complex comprising the same as ligand and process for preparing optically active organic silicon compound using said transition metal complex |
| US5508458A (en) | 1995-05-26 | 1996-04-16 | Hoechst Celanese Corporation | Chiral catalysts and processes for preparing the same |
| US5567856A (en) | 1995-05-30 | 1996-10-22 | Hoechst Celanese Corporation | Synthesis of and hydroformylation with fluoro-substituted bidentate phosphine ligands |
| AU7446196A (en) | 1995-10-13 | 1997-04-30 | Penn State Research Foundation, The | Asymmetric synthesis catalyzed by transition metal complexes with new chiral ligands |
| JP3430775B2 (ja) | 1996-03-01 | 2003-07-28 | 住友化学工業株式会社 | 3級ホスフィン化合物、これを配位子とする遷移金属錯体およびその用途 |
| JP3431749B2 (ja) | 1996-03-07 | 2003-07-28 | 高砂香料工業株式会社 | 新規な1−置換−2−ジフェニルホスフィノナフタレンおよびこれを配位子とする遷移金属錯体 |
| US5929281A (en) | 1996-04-19 | 1999-07-27 | Tosoh Corporation | Process for producing heterocyclic aromatic amine or arylamine |
| US5817877A (en) | 1996-09-23 | 1998-10-06 | Yale University | Metal-catalyzed amination of organic sulfonates to organic amines |
| US5847166A (en) | 1996-10-10 | 1998-12-08 | Massachusetts Institute Of Technology | Synthesis of aryl ethers |
| EP0849274A1 (en) | 1996-12-20 | 1998-06-24 | Schering Aktiengesellschaft | Bissteroidal compounds and their use for the preparation of chiral complexes |
| US6307087B1 (en) | 1998-07-10 | 2001-10-23 | Massachusetts Institute Of Technology | Ligands for metals and improved metal-catalyzed processes based thereon |
| US6395916B1 (en) * | 1998-07-10 | 2002-05-28 | Massachusetts Institute Of Technology | Ligands for metals and improved metal-catalyzed processes based thereon |
| US7223879B2 (en) | 1998-07-10 | 2007-05-29 | Massachusetts Institute Of Technology | Ligands for metals and improved metal-catalyzed processes based thereon |
| US6100398A (en) | 1998-10-14 | 2000-08-08 | Yale University | Transition metal-catalyzed process for preparing N-aryl amine compounds |
| WO2001000581A1 (en) * | 1999-06-30 | 2001-01-04 | The Penn State Research Foundation | Ligands based on chiral 2-amino-2'-hydroxy-1,1'-binaphthyl and related frameworks for asymmetric catalysis |
| US6525210B1 (en) * | 1999-08-23 | 2003-02-25 | The Penn State Research Foundation | Chiral ligands, transition-metal complexes thereof and uses thereof in asymmetric reactions |
| WO2003006420A1 (en) | 2001-07-12 | 2003-01-23 | Yale University | Catalytic method to convert aryl compounds to aryl amines |
| AU2003296326A1 (en) * | 2002-12-09 | 2004-06-30 | Massachusetts Institute Of Technology | Ligands for metals and improved metal-catalyzed processes based thereon |
| JP5244399B2 (ja) | 2005-01-10 | 2013-07-24 | マサチューセッツ インスティテュート オブ テクノロジー | 遷移金属を触媒とする炭素−窒素結合および炭素−炭素結合形成反応 |
| US7833927B2 (en) * | 2005-08-31 | 2010-11-16 | Rohm And Haas Company | Single site palladium catalyst complexes |
| DE102005046344A1 (de) * | 2005-09-28 | 2007-03-29 | Saltigo Gmbh | Verfahren zur Kupplung von Benzylaminen mit Halogenaromaten |
-
2008
- 2008-12-12 WO PCT/US2008/086651 patent/WO2009076622A2/en active Application Filing
- 2008-12-12 JP JP2010538198A patent/JP5591714B2/ja active Active
- 2008-12-12 CA CA2708369A patent/CA2708369C/en active Active
- 2008-12-12 CN CN200880126921.5A patent/CN101952298B/zh active Active
- 2008-12-12 EP EP08860439.2A patent/EP2231680B1/en active Active
- 2008-12-12 US US12/334,083 patent/US7858784B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| WO2009076622A2 (en) | 2009-06-18 |
| CN101952298A (zh) | 2011-01-19 |
| WO2009076622A3 (en) | 2010-08-12 |
| CN101952298B (zh) | 2015-06-17 |
| CA2708369C (en) | 2017-04-04 |
| JP2011508726A (ja) | 2011-03-17 |
| CA2708369A1 (en) | 2009-06-18 |
| US20090221820A1 (en) | 2009-09-03 |
| EP2231680A4 (en) | 2012-05-30 |
| US7858784B2 (en) | 2010-12-28 |
| EP2231680B1 (en) | 2018-03-28 |
| EP2231680A2 (en) | 2010-09-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5591714B2 (ja) | 遷移金属触媒によるクロスカップリングのためのリガンド、およびその使用方法 | |
| US6307087B1 (en) | Ligands for metals and improved metal-catalyzed processes based thereon | |
| US20040171833A1 (en) | Ligands for metals and improved metal-catalyzed processes based thereon | |
| DK2583958T3 (en) | LIGANDS OF METALS AND IMPROVED METAL catalyzed processes based thereon | |
| JP2018061956A (ja) | ホスフィン配位パラジウムスルホナートパラダサイクル | |
| Hao et al. | Air-stable and highly efficient indenyl-derived phosphine ligand: Application to Buchwald–Hartwig amination reactions | |
| WO2006128097A1 (en) | Nucleophilic heterocyclic carbene derivatives of pd(acac)2 for cross-coupling reactions | |
| CN101184711A (zh) | 用于交叉偶联反应的Pd(acac) 2的亲核杂环卡宾衍生物 | |
| CA2556850A1 (en) | Transition metal complexes of n-heterocyclic carbenes, method of preparation and use in transition metal catalyzed organic transformations | |
| WO2016057771A1 (en) | Method for coupling a first compound to a second compound | |
| JP4360096B2 (ja) | 光学活性四級アンモニウム塩、その製造方法、及びこれを相間移動触媒として用いた光学活性α−アミノ酸誘導体の製造方法 | |
| EP3204351A1 (en) | Method for coupling a fluorosulfonate compound with an amine compound | |
| CA2551412A1 (en) | Transition metal complexes of n-heterocyclic carbenes, method of preparation and use in transition metal catalyzed organic transformations | |
| JP7088690B2 (ja) | 芳香族化合物の製造方法 | |
| JP6869614B2 (ja) | ホスフィン化合物及びこれを配位子とするカップリング用触媒 | |
| Chen et al. | Efficient synthesis of triarylamines catalyzed by palladium/N-heterocyclic carbene | |
| Penn | Controlled α-Halogenation of Alkyl Sulfonamides and Development of Highly Active Bifunctional (Benz) Imidazolyl-Palladium Catalysts for Application in Sustainable Cross-Coupling Reactions | |
| CN111056986A (zh) | 1,3-二咔唑基苯的制备方法 | |
| Hoi | The Development of Sterically Demanding Pd-PEPPSI-Complexes: Structure-activity Relationships and Applications in Cross-couplings | |
| To | Exploration and development of carbazole-based phosphine ligands towards Suzuki-Miyaura cross-coupling and Buchwald-Hartwig amination | |
| Alsabeh | The Development of Catalysts for the Monoarylation of Ammonia and Related Challenging Cross-Coupling Reactions | |
| EP3429987A1 (en) | Method for coupling a first compound to a second compound |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20111207 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20111207 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20131003 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20131008 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140108 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20140318 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140612 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20140701 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20140730 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5591714 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |