JP5090697B2 - 金属回収方法 - Google Patents
金属回収方法 Download PDFInfo
- Publication number
- JP5090697B2 JP5090697B2 JP2006259938A JP2006259938A JP5090697B2 JP 5090697 B2 JP5090697 B2 JP 5090697B2 JP 2006259938 A JP2006259938 A JP 2006259938A JP 2006259938 A JP2006259938 A JP 2006259938A JP 5090697 B2 JP5090697 B2 JP 5090697B2
- Authority
- JP
- Japan
- Prior art keywords
- metal
- leaching
- iron
- metals
- platinum
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P10/00—Technologies related to metal processing
- Y02P10/20—Recycling
Landscapes
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Manufacture And Refinement Of Metals (AREA)
Description
本発明で用いる鉄還元細菌としては、例えば、ゲオバクター属(代表種:Geobacter metallireducens:ゲオバクター メタリレデューセンス、ATCC(American Type Culture Collection)53774株)、デスルフォモナス属(代表種:Desulfuromonas palmitatis:デスルフォモナス パルミタティス:ATCC51701株)、デスルフォムサ属(代表種:Desulfuromusa kysingii:デスルフォムサ キシンリDSM(Deutsche Sammlung von Mikroorganismen und Zellkulturen)7343株)、ペロバクター属(代表種:Pelobacter venetianus:ペロバクター ベネティアヌス:ATCC2394株)、シワネラ属(Shewanella algae:シワネラ アルゲ、(以下、「S. algae」という):ATCC51181株)、フェリモナス属(Ferrimonas balearica:フェリモナス バレアリカ:DSM9799株)、エアロモナス属(Aeromonas hydrophila:エアロモナス ヒドロフィラ:ATCC15467株)、スルフロスピリルム属(代表種:Sulfurospirillum barnesii:スルフロスピリルム バーネシイ:ATCC700032株)、ウォリネラ属(代表種:ウォリネラ スシノゲネス:Wolinella succinogenes:ATCC29543株)、デスルフォビブリオ属(代表種:Desulfovibrio desulfuricans:デスルフォビブリオ デスルフリカンス:ATCC29577株)、ゲオトリクス属(代表種:Geothrix fermentans:ゲオトリクス フェルメンタンス:ATCC700665株)、デフェリバクター属(代表種:Deferribacter thermophilus:デフェリバクター テルモフィルス:DSM14813株)、ゲオビブリオ属(代表種:Geovibrio ferrireducens:ゲオビブリオ フェリレデューセンス:ATCC51996株)、ピロバクルム 属(代表種:Pyrobaculum islandicum:テルモプロテウス アイランディカム:DSM4184株)、テルモトガ属(代表種:Thermotoga maritima:テルモトガ マリティマ:DSM3109株)、アルカエグロブス属(代表種:Archaeoglobus fulgidus:アルカエグロブス フルギダス:ATCC49558株)、ピロコックス属(代表種:Pyrococcus furiosus:ピロコックス フリオサス:ATCC43587株)、ピロディクティウム属(代表種:Pyrodictium abyssi:ピロディクティウム アビーシイ:DSM6158株)などが挙げられる。これらの鉄還元細菌は、嫌気性細菌である。
図2は、S. algaeを用いて、金属酸化物または金属水酸化物を還元して、浸出させる機構を説明する図である。図2に示すように、S. algaeにより、Fe(III)イオンが還元され、Fe(II)イオンを生成する。このFe(II)イオンの還元作用により、金属酸化物または金属水酸化物が還元されるに伴い、コバルトやニッケルなどが液中に浸出する。また、白金などは残渣に含まれる。このように金属酸化物または金属水酸化物を還元して、酸化されたFe(III)イオンは、S. algaeにより、還元され、Fe(II)イオンを生成(再生)し、金属酸化物または金属水酸化物に対して還元作用をする。
本発明の方法に用いられる金属酸化物または金属水酸化物としては、コバルト、ニッケル、マンガン、鉄、亜鉛、鉛などの酸化物または金属水酸化物が挙げられる。具体的には、コバルト・リッチ・クラスト(以下、クラストと記載)のような深海底鉱物資源、ラテライトなどの金属含有酸化鉱(陸上鉱物)や、金属含有焼却残渣などの廃棄物(人工鉱物)などである。これらの金属酸化物または金属水酸化物は、貴金属類や白金族金属類を含んでいてもよい。貴金属類や白金族金属類は、鉄還元細菌による浸出作用により、溶液中に浸出せず、残渣に含まれる。また、貴金属類や白金族金属類は、金属酸化物または金属水酸化物に少量しか含まれず、これらを比較的に高濃度レベルに、迅速に濃縮して、回収することは、産業上の価値が大きい。このような貴金属類としては、例えば、金、銀などが挙げられ、白金族金属類としては、例えば、白金、レニウム、オスニウム、イリジウム、テクネチウム、ルテニウム、ロジウム、パラジウムなどが挙げられる。
本発明の別な形態は、鉄還元細菌が、白金族金属類や白金族金属類のイオンを直接白金に還元・析出できることを見出したことにある。貴金属類や白金族金属類のイオンの還元・析出は、例えば以下のように行う。
実験の準備は、窒素ガス雰囲気(酸素濃度3%以下)のグローブボックス内で行った。
対数増殖末期(培養期間30時間)に収穫したS.algae細胞を、緩衝液(35mol/m3 炭酸水素ナトリウム、pH7.0)を用いて洗浄した。その際、遠心分離(2000rpm 5分)によって、代謝物や不純物を沈殿させた。ここで用いた緩衝液は、N2−CO2(80:20)混合ガスで1時間バブリングして嫌気状態にしたものである。S.algae細菌懸濁液10cm3を、所定濃度の塩化白金酸と乳酸ナトリウムを溶解させた緩衝溶液(35mol/m3 炭酸水素ナトリウム、pH7.0)10cm3に添加して還元実験を開始した。電子供与体である乳酸ナトリウム濃度は、33.3mol/m3である。電子受容体である白金(IV)イオンの初期濃度は、1.05mol/m3、初期菌体濃度は1.1×1015cells/m3である。細胞洗浄時の懸濁操作と実験開始時の混合操作は全て窒素ガス雰囲気(酸素濃度3%以下)のグローブボックス内で行った。実験は室温で行い、所定の時間ごとに試料採取した。白金測定用の試料は、試料採取後直ちにメンブレンフィルター(孔径0.2μm)を用いて細菌をろ過したものである。
細胞サイドでの白金粒子の生成を確認するため、還元実験後に採取したS.algae細胞を電界放出型透過型電子顕微鏡で観察し、その元素分析をエネルギー分散型X線分析計(EDX)によって行った。図9に電子顕微鏡での観察結果を示す。生成粒子は、直径5nm程度のナノサイズ粒子より構成される凝集体である。この生成粒子は、細胞外部には存在せずに、細胞表面または内部で生成し、その生成場に保持されていると推測される。また、生成粒子は、白金粒子であることをEDX元素分析によって確認した。
反応容器としては、図6に示す、バッチ式の攪拌型反応器で、容量が10Lのものを用いた以外は、実施例1と同様にして行った。結果は、図7に示すように、容量が1Lのバッチ式攪拌型反応器を用いた場合と同程度であった。
この結果、本発明の方法を用いると、スケールアップしても、同様の効果が得られることがわかった。
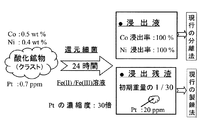
図5に示すように、実施例1で用いたものとは、組成の異なるクラスト(コバルトを0.4wt%、ニッケルを0.4wt%、白金を0.24ppm)を用いた。反応器内の白金量は、全体で、1.17μgになるようにした。pHを、1.2kmol/m3塩酸溶液を用いて所定のpH(7.0、6.0)に調整した以外は、実施例1と同様にした。結果を表3に示す。なお、浸出実験で時間が経過するに伴い、pHは増加する傾向にあった。このため、浸出実験中も1.2kmol/m3塩酸溶液を添加して、溶液pHの増加を抑制した。したがって、pH値の左側の値は、処理前の値(初期値)で、右側の値は、実験途中での最大pH値を意味する。また、処理前のpHが同じであっても、浸出実験の条件、浸出実験中の1.2kmol/m3塩酸溶液の添加の程度に応じて、実験途中での最大pH値が異なった。
4 密閉蓋
5 攪拌翼
6 バルブ
7 バッフル
Claims (5)
- 電子供与体と電子受容体として3価鉄を含む培地中で、
鉄還元細菌を作用させ、3価鉄を2価鉄に還元し、
前記2価鉄を用いて、金属酸化物および金属水酸化物からなる群に含まれる金属を浸出させ、浸出液と浸出されない金属を含む残渣を生成し、
前記浸出液と残渣とを分離し、前記浸出液および/または残渣から所望の金属を回収する金属回収方法。 - 前記所望の金属が、コバルト、ニッケル、マンガン、鉄、亜鉛および鉛からなる群から選ばれる1種以上の金属または白金族金属類からなる群から選ばれる1種以上の金属である請求項1に記載の方法。
- 電子供与体として炭素数1〜7のカルボン酸塩を含む培地中で、前記浸出液のpHを調整して、白金族金属類からなる群から選ばれる1種以上の金属を浸出させる割合と残渣に濃縮させる割合を調整する請求項1または2に記載の金属回収方法。
- 炭素数1〜7のカルボン酸塩を含む緩衝液中で、
鉄還元細菌を作用させ、
白金族金属類からなる群から選ばれる1種以上の金属イオンを含む液から、前記金属イオンを直接還元して、金属を回収する金属回収方法。 - 前記鉄還元細菌が、シワネラ アルゲである請求項1ないし4のいずれかに記載の方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2006259938A JP5090697B2 (ja) | 2005-09-26 | 2006-09-26 | 金属回収方法 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2005278021 | 2005-09-26 | ||
| JP2005278021 | 2005-09-26 | ||
| JP2006259938A JP5090697B2 (ja) | 2005-09-26 | 2006-09-26 | 金属回収方法 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2007113116A JP2007113116A (ja) | 2007-05-10 |
| JP2007113116A5 JP2007113116A5 (ja) | 2009-11-12 |
| JP5090697B2 true JP5090697B2 (ja) | 2012-12-05 |
Family
ID=38095571
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006259938A Active JP5090697B2 (ja) | 2005-09-26 | 2006-09-26 | 金属回収方法 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP5090697B2 (ja) |
Families Citing this family (21)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4273161B2 (ja) * | 2007-06-28 | 2009-06-03 | シャープ株式会社 | 銀の除去方法と洗濯機 |
| JP5235140B2 (ja) * | 2009-01-13 | 2013-07-10 | 独立行政法人日本原子力研究開発機構 | 白金族ナノ粒子担持材料とその製造方法、白金族ナノ粒子の析出方法、触媒材料 |
| JP5666835B2 (ja) * | 2009-06-23 | 2015-02-12 | 公立大学法人大阪府立大学 | 金属の回収方法 |
| JP2011127156A (ja) * | 2009-12-16 | 2011-06-30 | Jfe Engineering Corp | 金属回収方法 |
| JP5533076B2 (ja) * | 2010-03-16 | 2014-06-25 | Jfeスチール株式会社 | 金属回収方法 |
| KR101169523B1 (ko) | 2010-03-25 | 2012-07-27 | 전북대학교산학협력단 | 바이오매스를 이용한 금속 나노입자의 제조방법 |
| WO2012060417A1 (ja) * | 2010-11-02 | 2012-05-10 | 森下仁丹株式会社 | 非鉄金属収集用カプセルおよび非鉄金属を収集する方法 |
| JP2013005794A (ja) | 2011-05-26 | 2013-01-10 | Osaka Prefecture Univ | 複合体およびその用途 |
| JP5899048B2 (ja) * | 2011-06-10 | 2016-04-06 | 株式会社ジパング | 金ナノ粒子を形成する微生物及びこれを用いた金ナノ粒子の形成方法 |
| JP5229416B1 (ja) * | 2011-06-29 | 2013-07-03 | Jfeスチール株式会社 | マンガン回収方法 |
| CN104937119B (zh) | 2013-01-21 | 2016-12-07 | 三菱丽阳株式会社 | 金属浓缩方法和金属回收方法、以及金属浓缩装置和金属回收装置 |
| WO2015049959A1 (ja) * | 2013-10-02 | 2015-04-09 | 公立大学法人大阪府立大学 | 複合貴金属ナノ粒子の製造方法、それを用いて製造された複合貴金属ナノ粒子、および、それを含む触媒 |
| TWI580647B (zh) | 2013-12-28 | 2017-05-01 | 公立大學法人大阪府立大學 | Precious metal recovery method |
| JP6121359B2 (ja) * | 2014-03-31 | 2017-04-26 | Jx金属株式会社 | 金属酸化物の浸出方法 |
| JP2015227474A (ja) * | 2014-05-30 | 2015-12-17 | 公立大学法人大阪府立大学 | 白金族金属の分離回収方法 |
| CN107674975B (zh) * | 2015-11-27 | 2019-04-23 | 江苏理工学院 | 一种钴锰废料中钴和锰的分离回收方法 |
| CN107739827B (zh) * | 2015-11-27 | 2019-07-02 | 江苏理工学院 | 一种用氨-碳酸钠分离回收低钴高锰废料中钴和锰的方法 |
| CN107674976B (zh) * | 2015-11-27 | 2019-04-23 | 江苏理工学院 | 一种用氨-碳酸氢铵分离回收低钴高锰废料中钴和锰的方法 |
| KR20220049041A (ko) | 2019-10-18 | 2022-04-20 | 제이에프이 스틸 가부시키가이샤 | 폐건전지로부터의 망간 회수 방법 및 회수 설비 |
| WO2021075136A1 (ja) | 2019-10-18 | 2021-04-22 | Jfeスチール株式会社 | 廃乾電池からのマンガン回収方法および回収設備 |
| KR20230098861A (ko) | 2021-03-04 | 2023-07-04 | 제이에프이 스틸 가부시키가이샤 | 폐건전지로부터의 망간 회수 방법 및 회수 설비 |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AR245506A1 (es) * | 1990-11-07 | 1994-01-31 | Leaching S R L Y Shell Chile S | Un proceso de bio-metalurgica en el cual se produce la bio-oxidacion de compuestos minerales |
| JP4065226B2 (ja) * | 2003-11-13 | 2008-03-19 | 新日本製鐵株式会社 | 汚染土壌および汚染地下水の浄化方法 |
| JP4273161B2 (ja) * | 2007-06-28 | 2009-06-03 | シャープ株式会社 | 銀の除去方法と洗濯機 |
-
2006
- 2006-09-26 JP JP2006259938A patent/JP5090697B2/ja active Active
Also Published As
| Publication number | Publication date |
|---|---|
| JP2007113116A (ja) | 2007-05-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5090697B2 (ja) | 金属回収方法 | |
| Jadhav et al. | A review of recovery of metals from industrial waste | |
| Zeng et al. | Influence of silver ions on bioleaching of cobalt from spent lithium batteries | |
| Deveci et al. | Bioleaching of complex zinc sulphides using mesophilic and thermophilic bacteria: comparative importance of pH and iron | |
| Gomez et al. | Silver-catalysed bioleaching of a chalcopyrite concentrate with mixed cultures of moderately thermophilic microorganisms | |
| Adekola et al. | Bioleaching of Zn (II) and Pb (II) from Nigerian sphalerite and galena ores by mixed culture of acidophilic bacteria | |
| JP5229416B1 (ja) | マンガン回収方法 | |
| Haghshenas et al. | Adaptation of Acidithiobacillus ferrooxidans to high grade sphalerite concentrate | |
| Zhao et al. | Bioleaching of spent Ni–Cd batteries by continuous flow system: Effect of hydraulic retention time and process load | |
| CN106867921B (zh) | 嗜酸硫杆菌及该菌处理矿山酸性废水回收铁资源的方法 | |
| Choi et al. | Bioleaching of uranium from low grade black schists by Acidithiobacillus ferrooxidans | |
| Saitoh et al. | Microbial recovery of gold from neutral and acidic solutions by the baker's yeast Saccharomyces cerevisiae | |
| JP5666835B2 (ja) | 金属の回収方法 | |
| US5030426A (en) | Biomining of gallium and germanium containing ores | |
| JP2011127156A (ja) | 金属回収方法 | |
| Sadeghieh et al. | Effect of water salinity on the bioleaching of copper, nickel and cobalt from the sulphidic tailing of Golgohar Iron Mine, Iran | |
| Bosio et al. | Integrated bacterial process for the treatment of a spent nickel catalyst | |
| KD et al. | Bio-assisted leaching of copper, nickel and cobalt from copper converter slag | |
| Castro et al. | Improving zinc recovery by thermoacidophilic archaeon Acidianus copahuensis using tetrathionate | |
| JP5985926B2 (ja) | 金属回収方法、および、それに用いられる金属回収装置 | |
| Alafara et al. | Investigation of Chemical and Microbial Leaching of Iron ore in Sulphuric acid | |
| Molaei et al. | A study of Acidithiobacillus ferrooxidans DSMZ 583 adaptation to heavy metals | |
| Song et al. | Effect of Cu2+ ions on bioleaching of marmatite | |
| Gholami et al. | Heavy metals recovery from spent catalyst using Acidithiobacillus ferrooxidans and Acidithiobacillus thiooxidans | |
| Giese et al. | Bioleaching of primary nickel ore using Acidithiobacillus ferrooxidans LR cells immobilized in glass beads |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20090925 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20090925 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20091027 |
|
| RD03 | Notification of appointment of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7423 Effective date: 20111031 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20111031 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20120521 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120529 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120730 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20120821 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20120913 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20150921 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5090697 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313115 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| S533 | Written request for registration of change of name |
Free format text: JAPANESE INTERMEDIATE CODE: R313533 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |