JP4932112B2 - 診断及び治療用エピトープ並びにトランスジェニック植物 - Google Patents
診断及び治療用エピトープ並びにトランスジェニック植物 Download PDFInfo
- Publication number
- JP4932112B2 JP4932112B2 JP2001528704A JP2001528704A JP4932112B2 JP 4932112 B2 JP4932112 B2 JP 4932112B2 JP 2001528704 A JP2001528704 A JP 2001528704A JP 2001528704 A JP2001528704 A JP 2001528704A JP 4932112 B2 JP4932112 B2 JP 4932112B2
- Authority
- JP
- Japan
- Prior art keywords
- gliadin
- peptide
- cells
- celiac disease
- cell
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 230000001225 therapeutic effect Effects 0.000 title abstract description 5
- 230000009261 transgenic effect Effects 0.000 title description 31
- 108090000765 processed proteins & peptides Proteins 0.000 claims abstract description 182
- 210000001744 T-lymphocyte Anatomy 0.000 claims abstract description 157
- 108010061711 Gliadin Proteins 0.000 claims abstract description 147
- 208000015943 Coeliac disease Diseases 0.000 claims abstract description 128
- 238000000034 method Methods 0.000 claims abstract description 95
- 150000001413 amino acids Chemical class 0.000 claims abstract description 36
- 239000000203 mixture Substances 0.000 claims abstract description 22
- 108091008874 T cell receptors Proteins 0.000 claims abstract description 17
- 238000000338 in vitro Methods 0.000 claims abstract description 15
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 claims abstract description 13
- 210000004027 cell Anatomy 0.000 claims description 72
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 66
- 108091033319 polynucleotide Proteins 0.000 claims description 40
- 102000040430 polynucleotide Human genes 0.000 claims description 40
- 239000002157 polynucleotide Substances 0.000 claims description 40
- 230000027455 binding Effects 0.000 claims description 33
- 108060008539 Transglutaminase Proteins 0.000 claims description 29
- 102000003601 transglutaminase Human genes 0.000 claims description 29
- 239000000427 antigen Substances 0.000 claims description 26
- 108091007433 antigens Proteins 0.000 claims description 26
- 102000036639 antigens Human genes 0.000 claims description 26
- 102000004127 Cytokines Human genes 0.000 claims description 20
- 108090000695 Cytokines Proteins 0.000 claims description 20
- 108010074328 Interferon-gamma Proteins 0.000 claims description 20
- 238000001514 detection method Methods 0.000 claims description 20
- 241000209140 Triticum Species 0.000 claims description 18
- 235000021307 Triticum Nutrition 0.000 claims description 17
- 238000012360 testing method Methods 0.000 claims description 12
- 239000013598 vector Substances 0.000 claims description 12
- 108091026890 Coding region Proteins 0.000 claims description 10
- 238000004519 manufacturing process Methods 0.000 claims description 9
- 102100037850 Interferon gamma Human genes 0.000 claims description 8
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 8
- 210000004369 blood Anatomy 0.000 claims description 7
- 239000008280 blood Substances 0.000 claims description 7
- 235000007319 Avena orientalis Nutrition 0.000 claims description 6
- 244000075850 Avena orientalis Species 0.000 claims description 6
- 235000007340 Hordeum vulgare Nutrition 0.000 claims description 6
- 235000007238 Secale cereale Nutrition 0.000 claims description 6
- 235000019714 Triticale Nutrition 0.000 claims description 6
- 239000008194 pharmaceutical composition Substances 0.000 claims description 6
- 230000002265 prevention Effects 0.000 claims description 6
- 230000028327 secretion Effects 0.000 claims description 6
- 239000007787 solid Substances 0.000 claims description 6
- 241000228158 x Triticosecale Species 0.000 claims description 6
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims description 5
- 208000032309 susceptibility to 1 celiac disease Diseases 0.000 claims description 5
- 206010061218 Inflammation Diseases 0.000 claims description 4
- 108020001507 fusion proteins Proteins 0.000 claims description 4
- 102000037865 fusion proteins Human genes 0.000 claims description 4
- 230000004054 inflammatory process Effects 0.000 claims description 4
- 210000004962 mammalian cell Anatomy 0.000 claims description 4
- 230000001105 regulatory effect Effects 0.000 claims description 4
- 201000010099 disease Diseases 0.000 claims description 3
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 3
- 239000003937 drug carrier Substances 0.000 claims description 3
- 210000001236 prokaryotic cell Anatomy 0.000 claims description 3
- 241000894006 Bacteria Species 0.000 claims description 2
- 239000003085 diluting agent Substances 0.000 claims description 2
- 241000209219 Hordeum Species 0.000 claims 3
- 241000209056 Secale Species 0.000 claims 3
- 238000007689 inspection Methods 0.000 claims 1
- 238000010998 test method Methods 0.000 claims 1
- 239000003795 chemical substances by application Substances 0.000 abstract description 60
- 108010038807 Oligopeptides Proteins 0.000 abstract description 4
- 102000015636 Oligopeptides Human genes 0.000 abstract description 4
- 230000004044 response Effects 0.000 description 106
- 241000196324 Embryophyta Species 0.000 description 75
- 239000003814 drug Substances 0.000 description 73
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 69
- 229940079593 drug Drugs 0.000 description 66
- 108090000623 proteins and genes Proteins 0.000 description 53
- 239000000126 substance Substances 0.000 description 52
- 239000005557 antagonist Substances 0.000 description 42
- 102000004169 proteins and genes Human genes 0.000 description 42
- 238000003114 enzyme-linked immunosorbent spot assay Methods 0.000 description 40
- 235000018102 proteins Nutrition 0.000 description 40
- 235000001014 amino acid Nutrition 0.000 description 37
- 108010068370 Glutens Proteins 0.000 description 34
- 235000021312 gluten Nutrition 0.000 description 34
- 239000000047 product Substances 0.000 description 31
- 230000009258 tissue cross reactivity Effects 0.000 description 29
- 230000000694 effects Effects 0.000 description 28
- 238000011510 Elispot assay Methods 0.000 description 27
- 235000008429 bread Nutrition 0.000 description 27
- 235000006171 gluten free diet Nutrition 0.000 description 27
- 235000020884 gluten-free diet Nutrition 0.000 description 27
- 239000000556 agonist Substances 0.000 description 23
- 239000000523 sample Substances 0.000 description 22
- 238000003556 assay Methods 0.000 description 21
- 210000000612 antigen-presenting cell Anatomy 0.000 description 19
- 210000001519 tissue Anatomy 0.000 description 19
- 230000005867 T cell response Effects 0.000 description 18
- 230000004071 biological effect Effects 0.000 description 18
- 238000006467 substitution reaction Methods 0.000 description 18
- 230000008859 change Effects 0.000 description 16
- 239000012634 fragment Substances 0.000 description 15
- 238000001727 in vivo Methods 0.000 description 15
- 230000035772 mutation Effects 0.000 description 15
- 210000005259 peripheral blood Anatomy 0.000 description 15
- 239000011886 peripheral blood Substances 0.000 description 15
- HZWWPUTXBJEENE-UHFFFAOYSA-N 5-amino-2-[[1-[5-amino-2-[[1-[2-amino-3-(4-hydroxyphenyl)propanoyl]pyrrolidine-2-carbonyl]amino]-5-oxopentanoyl]pyrrolidine-2-carbonyl]amino]-5-oxopentanoic acid Chemical compound C1CCC(C(=O)NC(CCC(N)=O)C(=O)N2C(CCC2)C(=O)NC(CCC(N)=O)C(O)=O)N1C(=O)C(N)CC1=CC=C(O)C=C1 HZWWPUTXBJEENE-UHFFFAOYSA-N 0.000 description 14
- 241000282414 Homo sapiens Species 0.000 description 13
- 230000004048 modification Effects 0.000 description 13
- 238000012986 modification Methods 0.000 description 13
- 102000008070 Interferon-gamma Human genes 0.000 description 12
- 239000011324 bead Substances 0.000 description 12
- 229960003130 interferon gamma Drugs 0.000 description 12
- 235000013305 food Nutrition 0.000 description 11
- 230000028993 immune response Effects 0.000 description 11
- 210000005087 mononuclear cell Anatomy 0.000 description 10
- 238000000159 protein binding assay Methods 0.000 description 10
- 230000002829 reductive effect Effects 0.000 description 10
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 8
- 108090000317 Chymotrypsin Proteins 0.000 description 8
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 8
- 101150106931 IFNG gene Proteins 0.000 description 8
- 241000124008 Mammalia Species 0.000 description 8
- 229960002376 chymotrypsin Drugs 0.000 description 8
- 229930195712 glutamate Natural products 0.000 description 8
- 125000000291 glutamic acid group Chemical group N[C@@H](CCC(O)=O)C(=O)* 0.000 description 8
- 208000024891 symptom Diseases 0.000 description 8
- 239000011230 binding agent Substances 0.000 description 7
- 230000006240 deamidation Effects 0.000 description 7
- 238000002405 diagnostic procedure Methods 0.000 description 7
- 235000013922 glutamic acid Nutrition 0.000 description 7
- 239000004220 glutamic acid Substances 0.000 description 7
- 235000004554 glutamine Nutrition 0.000 description 7
- 230000000968 intestinal effect Effects 0.000 description 7
- 210000005105 peripheral blood lymphocyte Anatomy 0.000 description 7
- 102000003814 Interleukin-10 Human genes 0.000 description 6
- 108090000174 Interleukin-10 Proteins 0.000 description 6
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 6
- 210000000987 immune system Anatomy 0.000 description 6
- 230000001965 increasing effect Effects 0.000 description 6
- 239000000463 material Substances 0.000 description 6
- 229920001184 polypeptide Polymers 0.000 description 6
- 239000013641 positive control Substances 0.000 description 6
- 238000012545 processing Methods 0.000 description 6
- 210000002966 serum Anatomy 0.000 description 6
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical group OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 5
- 241001465754 Metazoa Species 0.000 description 5
- 238000010171 animal model Methods 0.000 description 5
- 230000008485 antagonism Effects 0.000 description 5
- 238000001574 biopsy Methods 0.000 description 5
- 238000003745 diagnosis Methods 0.000 description 5
- 230000005714 functional activity Effects 0.000 description 5
- 210000004698 lymphocyte Anatomy 0.000 description 5
- 238000013507 mapping Methods 0.000 description 5
- 230000004043 responsiveness Effects 0.000 description 5
- 241000894007 species Species 0.000 description 5
- 230000009870 specific binding Effects 0.000 description 5
- 108010027412 Histocompatibility Antigens Class II Proteins 0.000 description 4
- 102000018713 Histocompatibility Antigens Class II Human genes 0.000 description 4
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 4
- 108010027597 alpha-chymotrypsin Proteins 0.000 description 4
- 229960002685 biotin Drugs 0.000 description 4
- 235000020958 biotin Nutrition 0.000 description 4
- 239000011616 biotin Substances 0.000 description 4
- 239000000872 buffer Substances 0.000 description 4
- 238000012217 deletion Methods 0.000 description 4
- 230000037430 deletion Effects 0.000 description 4
- 238000002474 experimental method Methods 0.000 description 4
- WHUUTDBJXJRKMK-VKHMYHEASA-L glutamate group Chemical group N[C@@H](CCC(=O)[O-])C(=O)[O-] WHUUTDBJXJRKMK-VKHMYHEASA-L 0.000 description 4
- 238000003306 harvesting Methods 0.000 description 4
- 230000002163 immunogen Effects 0.000 description 4
- 230000003834 intracellular effect Effects 0.000 description 4
- 238000005259 measurement Methods 0.000 description 4
- 102000054765 polymorphisms of proteins Human genes 0.000 description 4
- 238000012163 sequencing technique Methods 0.000 description 4
- 230000002483 superagonistic effect Effects 0.000 description 4
- 240000005979 Hordeum vulgare Species 0.000 description 3
- 206010020649 Hyperkeratosis Diseases 0.000 description 3
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 3
- 239000004472 Lysine Substances 0.000 description 3
- 239000006146 Roswell Park Memorial Institute medium Substances 0.000 description 3
- 244000082988 Secale cereale Species 0.000 description 3
- 108010090804 Streptavidin Proteins 0.000 description 3
- 230000003042 antagnostic effect Effects 0.000 description 3
- 229910052799 carbon Inorganic materials 0.000 description 3
- 230000001186 cumulative effect Effects 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 230000018109 developmental process Effects 0.000 description 3
- 235000005911 diet Nutrition 0.000 description 3
- 230000029087 digestion Effects 0.000 description 3
- 231100000673 dose–response relationship Toxicity 0.000 description 3
- 230000007717 exclusion Effects 0.000 description 3
- 235000013312 flour Nutrition 0.000 description 3
- 125000000404 glutamine group Chemical class N[C@@H](CCC(N)=O)C(=O)* 0.000 description 3
- 230000001939 inductive effect Effects 0.000 description 3
- 230000000977 initiatory effect Effects 0.000 description 3
- 239000007924 injection Substances 0.000 description 3
- 238000002347 injection Methods 0.000 description 3
- 102000006495 integrins Human genes 0.000 description 3
- 108010044426 integrins Proteins 0.000 description 3
- 230000003278 mimic effect Effects 0.000 description 3
- 210000004400 mucous membrane Anatomy 0.000 description 3
- 231100000252 nontoxic Toxicity 0.000 description 3
- 230000003000 nontoxic effect Effects 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 230000009467 reduction Effects 0.000 description 3
- 238000011069 regeneration method Methods 0.000 description 3
- 238000011160 research Methods 0.000 description 3
- 230000035945 sensitivity Effects 0.000 description 3
- 238000000926 separation method Methods 0.000 description 3
- 210000000813 small intestine Anatomy 0.000 description 3
- 239000000243 solution Substances 0.000 description 3
- 238000010561 standard procedure Methods 0.000 description 3
- 239000000758 substrate Substances 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- 235000012794 white bread Nutrition 0.000 description 3
- LWTDZKXXJRRKDG-KXBFYZLASA-N (-)-phaseollin Chemical compound C1OC2=CC(O)=CC=C2[C@H]2[C@@H]1C1=CC=C3OC(C)(C)C=CC3=C1O2 LWTDZKXXJRRKDG-KXBFYZLASA-N 0.000 description 2
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 2
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 2
- 108700028369 Alleles Proteins 0.000 description 2
- 229940122450 Altered peptide ligand Drugs 0.000 description 2
- 239000004475 Arginine Substances 0.000 description 2
- 241000283707 Capra Species 0.000 description 2
- 108020004705 Codon Proteins 0.000 description 2
- 108020004414 DNA Proteins 0.000 description 2
- 206010011968 Decreased immune responsiveness Diseases 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- 108010062347 HLA-DQ Antigens Proteins 0.000 description 2
- 241000238631 Hexapoda Species 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- 108010036012 Iodide peroxidase Proteins 0.000 description 2
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 2
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 2
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 2
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 2
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 2
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 2
- 102000043131 MHC class II family Human genes 0.000 description 2
- 108091054438 MHC class II family Proteins 0.000 description 2
- 108091005804 Peptidases Proteins 0.000 description 2
- 239000004365 Protease Substances 0.000 description 2
- 241000700159 Rattus Species 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- IQFYYKKMVGJFEH-XLPZGREQSA-N Thymidine Chemical compound O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 IQFYYKKMVGJFEH-XLPZGREQSA-N 0.000 description 2
- 102000014267 Thyroid peroxidases Human genes 0.000 description 2
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 2
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 2
- 238000007792 addition Methods 0.000 description 2
- -1 amino, acetyl Chemical group 0.000 description 2
- 230000005875 antibody response Effects 0.000 description 2
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 238000005119 centrifugation Methods 0.000 description 2
- 150000001875 compounds Chemical class 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 235000018417 cysteine Nutrition 0.000 description 2
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 2
- 230000000593 degrading effect Effects 0.000 description 2
- 230000037213 diet Effects 0.000 description 2
- 238000009792 diffusion process Methods 0.000 description 2
- 238000001647 drug administration Methods 0.000 description 2
- 238000004520 electroporation Methods 0.000 description 2
- 229940088598 enzyme Drugs 0.000 description 2
- 230000006870 function Effects 0.000 description 2
- 238000012239 gene modification Methods 0.000 description 2
- 230000005017 genetic modification Effects 0.000 description 2
- 235000013617 genetically modified food Nutrition 0.000 description 2
- 230000012010 growth Effects 0.000 description 2
- 230000002363 herbicidal effect Effects 0.000 description 2
- 239000004009 herbicide Substances 0.000 description 2
- 238000004128 high performance liquid chromatography Methods 0.000 description 2
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 2
- 238000009396 hybridization Methods 0.000 description 2
- 210000004408 hybridoma Anatomy 0.000 description 2
- 230000003053 immunization Effects 0.000 description 2
- 230000006698 induction Effects 0.000 description 2
- 230000005764 inhibitory process Effects 0.000 description 2
- 238000003780 insertion Methods 0.000 description 2
- 230000037431 insertion Effects 0.000 description 2
- 238000007918 intramuscular administration Methods 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- 239000003550 marker Substances 0.000 description 2
- 239000013642 negative control Substances 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- 102000039446 nucleic acids Human genes 0.000 description 2
- 108020004707 nucleic acids Proteins 0.000 description 2
- 150000007523 nucleic acids Chemical class 0.000 description 2
- 239000004031 partial agonist Substances 0.000 description 2
- 239000011505 plaster Substances 0.000 description 2
- 230000003389 potentiating effect Effects 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 210000001938 protoplast Anatomy 0.000 description 2
- 238000004007 reversed phase HPLC Methods 0.000 description 2
- 230000003248 secreting effect Effects 0.000 description 2
- 230000007480 spreading Effects 0.000 description 2
- 238000003892 spreading Methods 0.000 description 2
- 235000020790 strict gluten-free diet Nutrition 0.000 description 2
- 229940124597 therapeutic agent Drugs 0.000 description 2
- 238000011426 transformation method Methods 0.000 description 2
- 230000001131 transforming effect Effects 0.000 description 2
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 2
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 description 1
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 1
- IAJOBQBIJHVGMQ-UHFFFAOYSA-N 2-amino-4-[hydroxy(methyl)phosphoryl]butanoic acid Chemical compound CP(O)(=O)CCC(N)C(O)=O IAJOBQBIJHVGMQ-UHFFFAOYSA-N 0.000 description 1
- 108010020183 3-phosphoshikimate 1-carboxyvinyltransferase Proteins 0.000 description 1
- 101150001232 ALS gene Proteins 0.000 description 1
- 208000004998 Abdominal Pain Diseases 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- 102000009027 Albumins Human genes 0.000 description 1
- 101100272041 Arabidopsis thaliana ATS3 gene Proteins 0.000 description 1
- 101100410782 Arabidopsis thaliana PXG1 gene Proteins 0.000 description 1
- 206010003445 Ascites Diseases 0.000 description 1
- 206010003694 Atrophy Diseases 0.000 description 1
- 208000023275 Autoimmune disease Diseases 0.000 description 1
- 229930192334 Auxin Natural products 0.000 description 1
- 241000193388 Bacillus thuringiensis Species 0.000 description 1
- DWRXFEITVBNRMK-UHFFFAOYSA-N Beta-D-1-Arabinofuranosylthymine Natural products O=C1NC(=O)C(C)=CN1C1C(O)C(O)C(CO)O1 DWRXFEITVBNRMK-UHFFFAOYSA-N 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- 208000035473 Communicable disease Diseases 0.000 description 1
- 150000008574 D-amino acids Chemical class 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- 206010012735 Diarrhoea Diseases 0.000 description 1
- 108700016256 Dihydropteroate synthases Proteins 0.000 description 1
- 208000035240 Disease Resistance Diseases 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 206010015150 Erythema Diseases 0.000 description 1
- 238000012413 Fluorescence activated cell sorting analysis Methods 0.000 description 1
- 101710087459 Gamma-gliadin Proteins 0.000 description 1
- 208000034826 Genetic Predisposition to Disease Diseases 0.000 description 1
- 108700039691 Genetic Promoter Regions Proteins 0.000 description 1
- 229930191978 Gibberellin Natural products 0.000 description 1
- 239000005561 Glufosinate Substances 0.000 description 1
- 239000005562 Glyphosate Substances 0.000 description 1
- 108030006517 Glyphosate oxidoreductases Proteins 0.000 description 1
- 102100036243 HLA class II histocompatibility antigen, DQ alpha 1 chain Human genes 0.000 description 1
- 108010086786 HLA-DQA1 antigen Proteins 0.000 description 1
- 108010058597 HLA-DR Antigens Proteins 0.000 description 1
- 102000006354 HLA-DR Antigens Human genes 0.000 description 1
- 108010033040 Histones Proteins 0.000 description 1
- 241000701044 Human gammaherpesvirus 4 Species 0.000 description 1
- 206010061598 Immunodeficiency Diseases 0.000 description 1
- 108060003951 Immunoglobulin Proteins 0.000 description 1
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 1
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 1
- 108010002350 Interleukin-2 Proteins 0.000 description 1
- 102000000588 Interleukin-2 Human genes 0.000 description 1
- 108090000978 Interleukin-4 Proteins 0.000 description 1
- 102000004388 Interleukin-4 Human genes 0.000 description 1
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- 241000699666 Mus <mouse, genus> Species 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- 241000187479 Mycobacterium tuberculosis Species 0.000 description 1
- 101710202365 Napin Proteins 0.000 description 1
- 206010028813 Nausea Diseases 0.000 description 1
- 206010030113 Oedema Diseases 0.000 description 1
- 101710089395 Oleosin Proteins 0.000 description 1
- 101710183587 Omega-gliadin Proteins 0.000 description 1
- 208000007117 Oral Ulcer Diseases 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 240000007594 Oryza sativa Species 0.000 description 1
- 235000007164 Oryza sativa Nutrition 0.000 description 1
- CHNUNORXWHYHNE-UHFFFAOYSA-N Oxadiazon Chemical compound C1=C(Cl)C(OC(C)C)=CC(N2C(OC(=N2)C(C)(C)C)=O)=C1Cl CHNUNORXWHYHNE-UHFFFAOYSA-N 0.000 description 1
- 108090000854 Oxidoreductases Proteins 0.000 description 1
- 239000005590 Oxyfluorfen Substances 0.000 description 1
- OQMBBFQZGJFLBU-UHFFFAOYSA-N Oxyfluorfen Chemical compound C1=C([N+]([O-])=O)C(OCC)=CC(OC=2C(=CC(=CC=2)C(F)(F)F)Cl)=C1 OQMBBFQZGJFLBU-UHFFFAOYSA-N 0.000 description 1
- 102000035195 Peptidases Human genes 0.000 description 1
- 102000003992 Peroxidases Human genes 0.000 description 1
- 101710163504 Phaseolin Proteins 0.000 description 1
- 241000209504 Poaceae Species 0.000 description 1
- 241000276498 Pollachius virens Species 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- 108700039882 Protein Glutamine gamma Glutamyltransferase 2 Proteins 0.000 description 1
- 102100038095 Protein-glutamine gamma-glutamyltransferase 2 Human genes 0.000 description 1
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 1
- 108010003581 Ribulose-bisphosphate carboxylase Proteins 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- 240000000111 Saccharum officinarum Species 0.000 description 1
- 235000007201 Saccharum officinarum Nutrition 0.000 description 1
- 235000012377 Salvia columbariae var. columbariae Nutrition 0.000 description 1
- 240000005481 Salvia hispanica Species 0.000 description 1
- 235000001498 Salvia hispanica Nutrition 0.000 description 1
- 208000034189 Sclerosis Diseases 0.000 description 1
- 240000006394 Sorghum bicolor Species 0.000 description 1
- 235000011684 Sorghum saccharatum Nutrition 0.000 description 1
- 229940100389 Sulfonylurea Drugs 0.000 description 1
- 230000017274 T cell anergy Effects 0.000 description 1
- 230000006052 T cell proliferation Effects 0.000 description 1
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 1
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 1
- 108700019146 Transgenes Proteins 0.000 description 1
- 240000003834 Triticum spelta Species 0.000 description 1
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 1
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 1
- 240000008042 Zea mays Species 0.000 description 1
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 description 1
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 1
- HPDFFWOTIYEPLZ-UHFFFAOYSA-N [[2-[methyl(methylsulfonyl)amino]-2-oxoethyl]amino]methylphosphonic acid Chemical compound CS(=O)(=O)N(C)C(=O)CNCP(O)(O)=O HPDFFWOTIYEPLZ-UHFFFAOYSA-N 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 108020002494 acetyltransferase Proteins 0.000 description 1
- 102000005421 acetyltransferase Human genes 0.000 description 1
- NUFNQYOELLVIPL-UHFFFAOYSA-N acifluorfen Chemical compound C1=C([N+]([O-])=O)C(C(=O)O)=CC(OC=2C(=CC(=CC=2)C(F)(F)F)Cl)=C1 NUFNQYOELLVIPL-UHFFFAOYSA-N 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 235000004279 alanine Nutrition 0.000 description 1
- 230000000735 allogeneic effect Effects 0.000 description 1
- 125000000539 amino acid group Chemical group 0.000 description 1
- AVKUERGKIZMTKX-NJBDSQKTSA-N ampicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1 AVKUERGKIZMTKX-NJBDSQKTSA-N 0.000 description 1
- 229960000723 ampicillin Drugs 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 230000037444 atrophy Effects 0.000 description 1
- 101150033568 ats1 gene Proteins 0.000 description 1
- 239000002363 auxin Substances 0.000 description 1
- 210000003719 b-lymphocyte Anatomy 0.000 description 1
- 229940097012 bacillus thuringiensis Drugs 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- IQFYYKKMVGJFEH-UHFFFAOYSA-N beta-L-thymidine Natural products O=C1NC(=O)C(C)=CN1C1OC(CO)C(O)C1 IQFYYKKMVGJFEH-UHFFFAOYSA-N 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 150000004657 carbamic acid derivatives Chemical class 0.000 description 1
- 239000004202 carbamide Substances 0.000 description 1
- 125000000837 carbohydrate group Chemical group 0.000 description 1
- 238000010370 cell cloning Methods 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 238000001516 cell proliferation assay Methods 0.000 description 1
- 230000005859 cell recognition Effects 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 230000007969 cellular immunity Effects 0.000 description 1
- 235000013339 cereals Nutrition 0.000 description 1
- 238000001311 chemical methods and process Methods 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 235000014167 chia Nutrition 0.000 description 1
- 230000009137 competitive binding Effects 0.000 description 1
- 238000012790 confirmation Methods 0.000 description 1
- 235000005822 corn Nutrition 0.000 description 1
- 244000038559 crop plants Species 0.000 description 1
- 210000004748 cultured cell Anatomy 0.000 description 1
- 238000012258 culturing Methods 0.000 description 1
- UQHKFADEQIVWID-UHFFFAOYSA-N cytokinin Natural products C1=NC=2C(NCC=C(CO)C)=NC=NC=2N1C1CC(O)C(CO)O1 UQHKFADEQIVWID-UHFFFAOYSA-N 0.000 description 1
- 239000004062 cytokinin Substances 0.000 description 1
- 230000002950 deficient Effects 0.000 description 1
- 210000004443 dendritic cell Anatomy 0.000 description 1
- 230000000378 dietary effect Effects 0.000 description 1
- 208000010643 digestive system disease Diseases 0.000 description 1
- 239000012470 diluted sample Substances 0.000 description 1
- 238000007865 diluting Methods 0.000 description 1
- USIUVYZYUHIAEV-UHFFFAOYSA-N diphenyl ether Chemical class C=1C=CC=CC=1OC1=CC=CC=C1 USIUVYZYUHIAEV-UHFFFAOYSA-N 0.000 description 1
- 230000008034 disappearance Effects 0.000 description 1
- 235000013601 eggs Nutrition 0.000 description 1
- 210000002257 embryonic structure Anatomy 0.000 description 1
- 230000003511 endothelial effect Effects 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 231100000321 erythema Toxicity 0.000 description 1
- 210000003238 esophagus Anatomy 0.000 description 1
- 210000003527 eukaryotic cell Anatomy 0.000 description 1
- 239000013604 expression vector Substances 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 238000000684 flow cytometry Methods 0.000 description 1
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 1
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- 230000037406 food intake Effects 0.000 description 1
- 208000018685 gastrointestinal system disease Diseases 0.000 description 1
- 238000001502 gel electrophoresis Methods 0.000 description 1
- IXORZMNAPKEEDV-UHFFFAOYSA-N gibberellic acid GA3 Natural products OC(=O)C1C2(C3)CC(=C)C3(O)CCC2C2(C=CC3O)C1C3(C)C(=O)O2 IXORZMNAPKEEDV-UHFFFAOYSA-N 0.000 description 1
- 239000003448 gibberellin Substances 0.000 description 1
- 108010050792 glutenin Proteins 0.000 description 1
- XDDAORKBJWWYJS-UHFFFAOYSA-N glyphosate Chemical compound OC(=O)CNCP(O)(O)=O XDDAORKBJWWYJS-UHFFFAOYSA-N 0.000 description 1
- 229940097068 glyphosate Drugs 0.000 description 1
- 239000003630 growth substance Substances 0.000 description 1
- 229910052736 halogen Inorganic materials 0.000 description 1
- 150000002367 halogens Chemical class 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 239000000833 heterodimer Substances 0.000 description 1
- 238000002744 homologous recombination Methods 0.000 description 1
- 230000006801 homologous recombination Effects 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 1
- 125000001165 hydrophobic group Chemical group 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 230000001969 hypertrophic effect Effects 0.000 description 1
- UGQQAJOWXNCOPY-VBCJEVMVSA-N i1osj03h46 Chemical compound C([C@H]12)C[C@H]3[C@@](C4(Cl)Cl)(Cl)C(Cl)=C(Cl)[C@@]4(Cl)[C@H]3CC[C@@H]1[C@]1(Cl)C(Cl)=C(Cl)[C@@]2(Cl)C1(Cl)Cl UGQQAJOWXNCOPY-VBCJEVMVSA-N 0.000 description 1
- 238000003018 immunoassay Methods 0.000 description 1
- 238000010166 immunofluorescence Methods 0.000 description 1
- 102000018358 immunoglobulin Human genes 0.000 description 1
- 229940072221 immunoglobulins Drugs 0.000 description 1
- 230000001976 improved effect Effects 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- SEOVTRFCIGRIMH-UHFFFAOYSA-N indole-3-acetic acid Chemical compound C1=CC=C2C(CC(=O)O)=CNC2=C1 SEOVTRFCIGRIMH-UHFFFAOYSA-N 0.000 description 1
- 230000002458 infectious effect Effects 0.000 description 1
- 230000004941 influx Effects 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 230000002452 interceptive effect Effects 0.000 description 1
- 210000004347 intestinal mucosa Anatomy 0.000 description 1
- 230000031146 intracellular signal transduction Effects 0.000 description 1
- 210000005024 intraepithelial lymphocyte Anatomy 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 239000000644 isotonic solution Substances 0.000 description 1
- 125000001909 leucine group Chemical group [H]N(*)C(C(*)=O)C([H])([H])C(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 230000001926 lymphatic effect Effects 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 210000001161 mammalian embryo Anatomy 0.000 description 1
- 238000004949 mass spectrometry Methods 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 239000002609 medium Substances 0.000 description 1
- 239000011859 microparticle Substances 0.000 description 1
- 108091005601 modified peptides Proteins 0.000 description 1
- 230000009149 molecular binding Effects 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 239000003471 mutagenic agent Substances 0.000 description 1
- 231100000707 mutagenic chemical Toxicity 0.000 description 1
- 230000008693 nausea Effects 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- 235000016709 nutrition Nutrition 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 238000005457 optimization Methods 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 230000008520 organization Effects 0.000 description 1
- 150000004866 oxadiazoles Chemical class 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 101800002712 p27 Proteins 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 108040007629 peroxidase activity proteins Proteins 0.000 description 1
- 238000002823 phage display Methods 0.000 description 1
- 239000008024 pharmaceutical diluent Substances 0.000 description 1
- LWTDZKXXJRRKDG-UHFFFAOYSA-N phaseollin Natural products C1OC2=CC(O)=CC=C2C2C1C1=CC=C3OC(C)(C)C=CC3=C1O2 LWTDZKXXJRRKDG-UHFFFAOYSA-N 0.000 description 1
- 150000008048 phenylpyrazoles Chemical class 0.000 description 1
- 239000002504 physiological saline solution Substances 0.000 description 1
- 230000008121 plant development Effects 0.000 description 1
- 230000008635 plant growth Effects 0.000 description 1
- 230000004481 post-translational protein modification Effects 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 230000002062 proliferating effect Effects 0.000 description 1
- 125000001500 prolyl group Chemical group [H]N1C([H])(C(=O)[*])C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- 230000001172 regenerating effect Effects 0.000 description 1
- 230000008929 regeneration Effects 0.000 description 1
- 230000003252 repetitive effect Effects 0.000 description 1
- 230000033458 reproduction Effects 0.000 description 1
- 235000009566 rice Nutrition 0.000 description 1
- 230000014639 sexual reproduction Effects 0.000 description 1
- 238000002741 site-directed mutagenesis Methods 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 1
- 230000030118 somatic embryogenesis Effects 0.000 description 1
- 238000001228 spectrum Methods 0.000 description 1
- 210000004989 spleen cell Anatomy 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 239000008174 sterile solution Substances 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 230000002123 temporal effect Effects 0.000 description 1
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 229940104230 thymidine Drugs 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 239000003053 toxin Substances 0.000 description 1
- 231100000765 toxin Toxicity 0.000 description 1
- 238000013518 transcription Methods 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- 238000001890 transfection Methods 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 230000001052 transient effect Effects 0.000 description 1
- 238000013519 translation Methods 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- 239000012588 trypsin Substances 0.000 description 1
- 210000004881 tumor cell Anatomy 0.000 description 1
- 125000001493 tyrosinyl group Chemical group [H]OC1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 238000011870 unpaired t-test Methods 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 238000011179 visual inspection Methods 0.000 description 1
- 239000011534 wash buffer Substances 0.000 description 1
- 239000008215 water for injection Substances 0.000 description 1
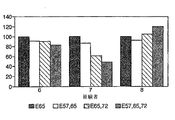
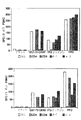
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/415—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from plants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K49/00—Preparations for testing in vivo
- A61K49/0004—Screening or testing of compounds for diagnosis of disorders, assessment of conditions, e.g. renal clearance, gastric emptying, testing for diabetes, allergy, rheuma, pancreas functions
- A61K49/0006—Skin tests, e.g. intradermal testing, test strips, delayed hypersensitivity
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/82—Vectors or expression systems specially adapted for eukaryotic hosts for plant cells, e.g. plant artificial chromosomes (PACs)
- C12N15/8241—Phenotypically and genetically modified plants via recombinant DNA technology
- C12N15/8242—Phenotypically and genetically modified plants via recombinant DNA technology with non-agronomic quality (output) traits, e.g. for industrial processing; Value added, non-agronomic traits
- C12N15/8257—Phenotypically and genetically modified plants via recombinant DNA technology with non-agronomic quality (output) traits, e.g. for industrial processing; Value added, non-agronomic traits for the production of primary gene products, e.g. pharmaceutical products, interferon
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/82—Vectors or expression systems specially adapted for eukaryotic hosts for plant cells, e.g. plant artificial chromosomes (PACs)
- C12N15/8241—Phenotypically and genetically modified plants via recombinant DNA technology
- C12N15/8242—Phenotypically and genetically modified plants via recombinant DNA technology with non-agronomic quality (output) traits, e.g. for industrial processing; Value added, non-agronomic traits
- C12N15/8257—Phenotypically and genetically modified plants via recombinant DNA technology with non-agronomic quality (output) traits, e.g. for industrial processing; Value added, non-agronomic traits for the production of primary gene products, e.g. pharmaceutical products, interferon
- C12N15/8258—Phenotypically and genetically modified plants via recombinant DNA technology with non-agronomic quality (output) traits, e.g. for industrial processing; Value added, non-agronomic traits for the production of primary gene products, e.g. pharmaceutical products, interferon for the production of oral vaccines (antigens) or immunoglobulins
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
- G01N33/5008—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics
- G01N33/5044—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics involving specific cell types
- G01N33/5047—Cells of the immune system
- G01N33/505—Cells of the immune system involving T-cells
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/564—Immunoassay; Biospecific binding assay; Materials therefor for pre-existing immune complex or autoimmune disease, i.e. systemic lupus erythematosus, rheumatoid arthritis, multiple sclerosis, rheumatoid factors or complement components C1-C9
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
- G01N33/6854—Immunoglobulins
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
- G01N33/6863—Cytokines, i.e. immune system proteins modifying a biological response such as cell growth proliferation or differentiation, e.g. TNF, CNF, GM-CSF, lymphotoxin, MIF or their receptors
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
- G01N33/6878—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids in eptitope analysis
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/90—Enzymes; Proenzymes
- G01N2333/91—Transferases (2.)
- G01N2333/91045—Acyltransferases (2.3)
- G01N2333/91074—Aminoacyltransferases (general) (2.3.2)
- G01N2333/9108—Aminoacyltransferases (general) (2.3.2) with definite EC number (2.3.2.-)
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10S—TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10S435/00—Chemistry: molecular biology and microbiology
- Y10S435/975—Kit
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Chemical & Material Sciences (AREA)
- Immunology (AREA)
- Molecular Biology (AREA)
- Biomedical Technology (AREA)
- Genetics & Genomics (AREA)
- Hematology (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Urology & Nephrology (AREA)
- Cell Biology (AREA)
- Biotechnology (AREA)
- Organic Chemistry (AREA)
- Biochemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Physics & Mathematics (AREA)
- Microbiology (AREA)
- Pathology (AREA)
- Food Science & Technology (AREA)
- Analytical Chemistry (AREA)
- General Physics & Mathematics (AREA)
- Pharmacology & Pharmacy (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Zoology (AREA)
- General Engineering & Computer Science (AREA)
- Wood Science & Technology (AREA)
- Biophysics (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Gastroenterology & Hepatology (AREA)
- Rheumatology (AREA)
- Plant Pathology (AREA)
- Toxicology (AREA)
- Botany (AREA)
Description
本発明はセリアック病の診断及び治療、並びにセリアック病を引き起こさないグリアジンタンパク質に関する。
【0002】
食物中のグリアジン(グルテンの一成分)に対する免疫反応はセリアック病を引き起こす。腸組織における免疫応答は腸のトランスグルタミナーゼによって修飾されているグリアジンに対して優先的に応答することが知られている。セリアック病は抗筋内膜抗体の検出によって診断するが、これは腸生検においてリンパ性炎症を発見することによる確認を必要とする。そのような生検の実施は患者にとって不都合である。
【0003】
本発明者らは、従来、腸のT細胞応答のみがグリアジンに対する免疫応答の正確な指標をもたらすものと仮定していた。したがって、彼らは腸組織におけるT細胞応答の研究に集中していた1。(免疫系によって認識される前に)トランスグルタミナーゼ修飾を必要とするグリアジンエピトープは公知である2。
【0004】
本発明者らは、セリアック病において免疫系によって認識される免疫優性T細胞を見出しており、これがセリアック病患者の末梢血中のT細胞によって認識されることを示している。このようなT細胞は、再刺激なしに検出可能であるのに十分高い頻度で存在することが見出された(すなわち、「新鮮な応答(fresh response)」検出システムを用いることができた)。エピトープは、認識されるエピトープをより正確に反映する非T細胞クローン化ベースの方法を用いて同定した。この免疫優性エピトープは、免疫系の認識の前に(特定のグルタミンからグルタメートへの置換を生じる)トランスグルタミナーゼ修飾を必要とする。
【0005】
この研究に基づいて、本発明者らは早期段階のセリアック病の診断に用いることができる試験を開発している。この試験は末梢血に由来するサンプルに対して行うことができ、したがって、生検は必要ない。この試験は、現在用いられている抗体試験よりも感度が良い。
【0006】
したがって、本発明は、個体におけるセリアック病、又はセリアック病への罹患のし易さの診断方法であって、
(a)宿主からのサンプルを、(i)配列番号1もしくは2である配列又は配列番号3によって表されるグリアジンの天然相同体に由来する等価配列を含むエピトープ、(ii)配列番号1、又は配列番号3によって表されるグリアジンの天然相同体に由来する等価配列を含む配列を有するエピトープであって、グリアジンタンパク質から誘導される単離オリゴペプチドであるエピトープ、(iii)(i)もしくは(ii)を認識するT細胞受容体によって認識され得る(i)もしくは(ii)の類似体であって、ペプチド類似体の場合には長さが50アミノ酸以下である類似体、あるいは(iv)(i)、(ii)もしくは(iii)において定義される薬剤を2つ以上含む生成物から選択される薬剤と接触させ、並びに(b)in vitroでサンプル中のT細胞がその薬剤を認識するかどうかを決定し、T細胞による認識が、その個体がセリアック病に罹患しているか、又はそれに罹患しやすいことを示す方法を提供する。
【0007】
また、本発明は、個体におけるセリアック病、又はセリアック病への罹患のし易さの診断方法において用いるための診断手段の調製への薬剤の使用であって、該方法が、個体のT細胞がその薬剤を認識するかどうかを決定することを含み、T細胞による認識が、その個体がセリアック病に罹患しているか、又はそれに罹患しやすいことを示す使用も提供する。
【0008】
トランスグルタミナーゼによって修飾される免疫優性エピトープの発見は、このエピトープに対する他のタイプの免疫応答が存在するかどうかを決定することに基づくセリアック病の診断をも可能にする。したがって、本発明は、個体におけるセリアック病、又はセリアック病への罹患のし易さの診断方法であって、その個体からのサンプルにおけるエピトープに結合する抗体の存在を決定することを含み、その抗体の存在が、その個体がセリアック病に罹患しているか、又はそれに罹患しやすいことを示す方法も提供する。
【0009】
加えて、本発明は、任意に担体を伴う薬剤であって、その薬剤を認識するT細胞を寛容化することによるセリアック病の治療又は予防方法において用いるための薬剤を提供する。任意に担体を伴う、(i)もしくは(ii)を認識するT細胞受容体を有するT細胞のアンタゴニストであって、そのようなT細胞に拮抗することによるセリアック病の治療又は予防方法において用いるためのアンタゴニストも提供される。加えて、抗体に結合する薬剤又は類似体であって(抗体は該薬剤に結合する)、そのような抗体の産生を防止するため個体を寛容化することによる個体におけるセリアック病の治療又は予防方法において用いるための薬剤又は類似体が提供される。
【0010】
本発明は、組成物がセリアック病を引き起こすことが可能であるかどうかを決定する方法であって、トランスグルタミナーゼによって上に定義されるオリゴペプチド配列に修飾することが可能であるタンパク質が該組成物中に存在するかどうかを決定することを含み、該タンパク質の存在が、該組成物がセリアック病を引き起こし得ることを示す方法を提供する。
【0011】
また、本発明は、突然変異グリアジンタンパク質であって、その野生型配列はトランスグルタミナーゼによって上に定義されるエピトープ含有配列を含む配列に修飾され得るが、該突然変異グリアジンタンパク質はトランスグルタミナーゼによってそのようなエピトープ含有配列を含む配列に修飾され得る配列を含まないような方法で修飾されている突然変異グリアジンタンパク質;又は少なくとも15アミノ酸の長さであり、かつ該方法で修飾されている配列を含む突然変異グリアジンタンパク質の断片も提供する。
【0012】
また、本発明は、T細胞受容体に結合することが可能である配列を含むタンパク質であって、該T細胞受容体は前記薬剤を認識し、かつ該配列はそのようなT細胞受容体を担持するT細胞の拮抗を生じ得るタンパク質も提供する。
【0013】
加えて、本発明は、上に定義されるタンパク質を含む食品を提供する。
【0014】
本発明は添付の図面によって説明されるが、図面の説明は後記する。
【0015】
発明の詳細な説明
「セリアック病」という用語は、平坦な小腸粘膜を特徴とする重篤形態(肥厚性絨毛萎縮)及びより穏やかな症状を特徴とする他の形態を含めて、様々な程度のグルテン感受性によって引き起こされる状態のスペクトルを包含する。
【0016】
(診断又は治療の脈絡における)上記個体はヒトである。彼らはセリアック病(症候性及び無症候性)を患うか、又はそれを患っていることが疑われる。彼らはグルテン非含有食品を摂取していてもよい。彼らは急性期応答の状態にあってもよい(例えば、彼らはセリアック病を患うが、最後の24時間にのみグルテンを摂取し、それ以前はグルテン非含有食品を14〜28日間摂取していてもよい)。
【0017】
個体はセリアック病に対して感受性、例えば、遺伝的感受性(例えば、セリアック病を患う身内がいるか、又はセリアック病の素因を生じる遺伝子を有する個体によって決定される)であってもよい。
【0018】
薬剤
薬剤は、典型的には、例えば長さ7〜50アミノ酸の、例えば長さが10〜40、又は15〜30アミノ酸の、ペプチドである。
【0019】
配列番号1はPQPELPYである。配列番号2はQLQPFPQPELPYPQPQSである。配列番号3は表1に示され、A−グリアジン全体の配列である。配列番号1の4位のグルタメート(配列番号2の9位と等価)はA−グリアジンのトランスグルタミナーゼ処理によって生成される。
【0020】
薬剤は、グリアジンタンパク質から誘導される単離オリゴペプチドである、配列番号1もしくは2又は配列番号1を含むエピトープ含有配列で表されるペプチド;又は配列番号3の相同体である、天然グリアジンタンパク質に由来するこれらの配列の等価物であり得る。このような誘導体は、典型的には、グリアジンの断片、又はタンパク質全体もしくは断片の突然変異誘導体である。したがって、本発明のエピトープはこの天然グリアジンタンパク質全体は含まず、かつ他の天然グリアジン全体は含まない。
【0021】
したがって、エピトープは、配列番号1の配列を含み、トランスグルタミナーゼで(完全に、もしくは部分的に)処理することによって得ることができ、すなわち、グルタメートに置換された1、2、3以上のグルタミンを有する(配列番号1内の置換を含む)、A−グリアジンの断片(例えば、配列番号3)であり得る。
【0022】
このような断片は、表1に示される配列番号3の55〜70、58〜73、61〜77位によって表される配列であってもよく、それを含んでいてもよい。典型的には、そのような断片はT細胞によって、配列番号1もしくは2によって表されるペプチドがセリアック病患者からのサンプルを用いて本明細書に記載されるアッセイのいずれかにおいて認識されるのと少なくとも同じ程度まで認識される。
【0023】
別のグリアジンタンパク質(例えば、本明細書において言及されるグリアジンタンパク質のいずれか、又はセリアック病を引き起こすあらゆるグリアジン)に由来する上記エピトープ(断片を含む)と等価である配列をエピトープが含む場合、そのような等価配列は、トランスグルタミナーゼで(部分的に、もしくは完全に)典型的に処理されたグリアジンタンパク質の断片に相当する。そのような等価ペプチドは、(例えば、本明細書において言及されるプログラムのいずれかを用いて)他のグリアジンタンパク質の配列を配列番号3と整列させることによって決定することができる。トランスグルタミナーゼは商業的に入手可能である(例えば、Sigma T-5398)。表4は適切な等価配列の例を示す。
【0024】
類似体である薬剤は(i)又は(ii)を認識するTCRによって認識され得る。したがって、一般には、(i)又は(ii)の存在下において、典型的には抗原提示細胞(APC)(例えば、本明細書において言及されるAPCのいずれか)の存在下であっても、類似体をT細胞に加えた場合、その類似体は(i)又は(ii)の認識を阻害し、すなわち、その類似体はそのような系において(i)又は(ii)と競合することができる。
【0025】
この類似体は(i)又は(ii)を認識するTCRに結合できるものであり得る。このような結合は標準技術によって試験することができる。このようなTCRは、(i)又は(ii)を認識することが示されているT細胞から(例えば、本発明の方法を用いて)単離することができる。類似体のTCRへの結合の実証は、その類似体がその類似体を結合する物質、例えば、その類似体に対する抗体に結合するのをそのTCRが阻害するかどうかを決定することによって示すことができる。典型的には、類似体はそのような結合アッセイの阻害においてクラスII MHC分子(例えば、HLA−DQ2)に結合する。
【0026】
典型的には、類似体は(i)又は(ii)のTCRへの結合を阻害する。この場合、その類似体の存在下においてTCRに結合することができる(i)又は(ii)の量は減少する。これは、その類似体がTCRに結合でき、したがって、TCRへの結合について(i)又は(ii)と競合するためである。
【0027】
上記結合実験において用いるためのT細胞はセリアック病患者から、例えば本発明の助けを借りて、単離することができる。類似体の他の結合特性も(i)又は(ii)と同じである可能性があり、したがって、典型的には、類似体はそのペプチドが結合するものと同じMHCクラスII分子(HLA−DQ2)に結合する。類似体は、典型的には、(i)又は(ii)に特異的である抗体に結合し、したがって、(i)又は(ii)のそのような抗体への結合を阻害する。
【0028】
類似体は典型的にはペプチドである。それは、例えば少なくとも15を超える(例えば、その類似体及び/又は(i)もしくは(ii)の全長又はTCRに接触するか、もしくはMHC分子に結合する領域にわたって)連続するアミノ酸の領域にわたって、(i)又は(ii)との相同性、典型的には(i)又は(ii)との少なくとも70%の相同性、好ましくは少なくとも80、90%、95%、97%又は99%の相同性を有し得る。タンパク質の相同性を測定する方法は当該技術分野において公知であり、本発明の脈絡においては相同性をアミノ酸同一性に基づいて算出することを当業者は理解するであろう(時折「ハード相同性(hard homology)」と呼ぶ)。
【0029】
例えば、UWGCG Packageは(例えばそのデフォルト設定で用いて)相同性の算出に用いることができるBESTFITプログラムを提供する(Devereux et al (1984) Nucleic Acids Research 12, p387-395)。例えばAltschul S. F. (1993) J Mol Evol 36:290-300;Altschul, S, F et al (1990) J Mol Biol 215:403-10に記載されるように、PILEUP及びBLASTアルゴリズムを(典型的にはそれらのデフォルト設定で)相同性の算出又は配列の整列に用いることができる。
【0030】
BLAST分析を実施するためのソフトウェアはNational Center for Biotechnology Information(http://www.ncbi.nlm.nih.gov/)を通して公的に利用可能である。このアルゴリズムは、まず、データベース配列内の同じ長さのワードと整列させたときにある正数閾値スコアTと一致するか、又はそれを満足する照会配列内に長さWの短ワードを同定することによって高スコアリング配列対(HSP)を同定することを含む。Tは隣接ワードスコア閾値(neighbourhood word score threshold)と呼ばれる(Altschulら、前出)。これらの初期隣接ワードのヒットはそれらを含むHSPを見出す検索を開始するための種として作用する。これらのワードのヒットを累積配列スコアが増加し得る限り各々の配列に沿って両方向に拡張する。累積整列スコアがその最大達成値から量Xだけ離れたときに各々の方向におけるワードヒットの拡張を停止し、累積スコアは1つ以上の負スコアの残基整列の集積のため、又はいずれかの配列の終わりに到達するため、ゼロ以下に向かう。これらのBLASTアルゴリズムパラメータW、T及びXはその整列の感度及び速度を決定する。BLASTプログラムは、デフォルトとして、11のワード長さ(W)、50のBLOSUM62スコアリング行列(Henikoff and Henikoff (1992) Proc. Natl. Acad. Sci. USA 89: 10915-10919を参照)整列(B)、10の見込み(E)、M=5、N=4、及び両鎖の比較を用いる。
【0031】
BLASTアルゴリズムは2つの配列間の類似性の統計分析を行う;例えば、Karlin and Altschul (1993) Proc. Natl. Acad. Sci. USA 90: 5873-5787を参照。BLASTアルゴリズムによってもたらされる類似性の測定の1つは最小合計確率(smallest sum probability)(P(N))であり、これは2つのヌクレオチド又はアミノ酸配列の間での一致が偶然生じる確率の指標を提供する。例えば、ある配列は別の配列と、第1配列の第2配列との比較における最小合計確率が約1未満、好ましくは約0.1未満、より好ましくは約0.01未満、最も好ましくは約0.001未満である場合に類似するとみなされる。
【0032】
相同ペプチド類似体は、典型的には、1、2、3、4、5、6、7、8もしくはそれ以上の突然変異(これは置換、欠失又は挿入であり得る)によって(i)又は(ii)とは異なる。これらの突然変異は、相同性の算出に関して上述される領域のいずれかにわたって測定することができる。置換は好ましくは「保存性」である。これらは下記表に従って定義される。第2欄内の同じブロックにおける、及び好ましくは、第3欄内の同じ行におけるアミノ酸は互いに置換することができる:
【0033】
【表】
典型的には、MHC分子の結合に寄与するか、又はTCRによる認識の原因である(i)又は(ii)中のアミノ酸と等価の位置の類似体中のアミノ酸は同じであるか、又は保存される。
【0034】
典型的には、類似体ペプチドは1つ以上の修飾を含み、それは天然の翻訳後修飾であっても人工的な修飾であってもよい。修飾は(典型的には、例えばC−H結合の、水素の置換によって)化学的部分、例えば、アミノ、アセチル、ヒドロキシもしくはハロゲン(例えば、フッ素)基又は炭水化物基をもたらすものであり得る。典型的には、修飾はN又はC末端上に存在する。
【0035】
類似体は1つ以上の非天然アミノ酸、例えば、天然アミノ酸とは異なる側鎖を有するアミノ酸を含み得る。一般には、非天然アミノ酸はN末端及び/又はC末端を有する。非天然アミノ酸はL−又はD−アミノ酸であり得る。
【0036】
類似体は、典型的には、(i)又は(ii)に実質的に類似する形状、サイズ、自由度又は電気的配置を有する。これは、典型的には、(i)又は(ii)の誘導体である。一態様においては、類似体は、配列番号1もしくは2の配列、又は本明細書において言及される他のペプチドのいずれか;及び非グリアジン配列を含む融合タンパク質である。
【0037】
一態様においては、類似体はMHCクラスII分子に結合する(i)もしくは(ii)であるか、又はそれを模倣する。2、3、4もしくはそれ以上のそのような複合体が、例えばビオチン/ストレプトアビジン・ベースの系(ここでは、典型的には、2、3もしくは4つのビオチン標識MHC分子がストレプトアビジン部分に結合する)を用いて、互いに会合又は結合していてもよい。この類似体は、典型的には、(i)もしくは(ii)/MHCクラスII複合体がTCR又はその複合体に特異的である抗体に結合するのを阻害する。
【0038】
類似体は、典型的には、抗体又は抗体の断片、例えば、Fab又は(Fab)2断片である。類似体、特には、MHC分子に結合するペプチドを模倣する抗体は固体支持体上に固定することができる。
【0039】
類似体は、典型的には、計算手段によって設計した後、当該技術分野において公知の方法を用いて合成する。その代わりに、化合物のライブラリから類似体を選択することもできる。このライブラリは組合せライブラリ又は表示(display)ライブラリ、例えば、ファージ表示ライブラリであり得る。化合物のライブラリは表示ライブラリにおいてMHCクラスII分子、例えば、HLA−DQ2に結合している形態で発現させることができる。類似体は、一般には、このライブラリから(i)又は(ii)の結合特性を模倣するそれらの能力に基づいて選択される。したがって、それらはTCR又は(i)もしくは(ii)を認識する抗体を結合する能力に基づいて選択することができる。
【0040】
典型的には、類似体はT細胞により、典型的にはセリアック病患者に由来するT細胞を用いる、本明細書に記載されるアッセイのいずれかにおいて少なくとも薬剤(i)もしくは(ii)のいずれかが認識されるのと同じ程度まで、例えば、少なくとも等価エピトープが認識されるのと同じ程度まで、好ましくは、配列番号2によって表されるペプチドが認識されるのと同じ程度まで認識される。類似体はin vivoでこれらの程度まで認識することができ、したがって、(例えば、ヒト患者又は動物モデルにおいて)少なくとも本明細書において言及される薬剤のいずれかと同じ程度までセリアック病の症状を誘発することができる。
【0041】
類似体は、候補物質が本発明のエピトープを認識するT細胞受容体によって認識されるかどうかを決定することを含み、物質の認識はその物質が類似体であることを示す方法において同定することができる。そのようなTCRは本明細書において言及されるTCRのいずれであってもよく、T細胞上の存在し得る。本明細書において言及されるあらゆる適切なアッセイを類似体の同定に用いることができる。一態様においては、この方法をin vivoで行う。上述のように、好ましい類似体は少なくともペプチド配列番号2と同じ程度まで認識されるため、その方法はこの程度まで認識される類似体の同定に用いることができる。
【0042】
一態様において、この方法は、候補物質が本発明のエピトープの認識を阻害することができるかどうかを決定することを含み、認識の阻害はその物質が類似体であることを示す。
【0043】
薬剤は、(i)、(ii)又は(iii)によって定義される少なくとも2、5、10又は20の薬剤を含む生成物であり得る。典型的には、この組成物は異なるグリアジン、例えば、本明細書において言及されるグリアジンの種もしくは変種もしくはタイプのいずれかに由来する本発明のエピトープ(又は等価類似体)を含む。好ましい組成物は、本明細書において言及される種もしくは変種のいずれかのうちに存在する全てのグリアジンに由来する、又は本明細書において言及される2、3、4もしくはそれ以上の種に由来する(例えば、コムギ、ライムギ、オオムギ、カラスムギ及びライコムギからなる種のパネルに由来する)、少なくとも1種類の本発明のエピトープ又は等価類似体を含む。
【0044】
診断
上述のように、本発明の診断方法は、薬剤を結合するT細胞の検出、又は薬剤を認識する抗体の検出に基づくものである。
【0045】
(上述の使用を含む)方法において薬剤を認識するT細胞は、一般には、in vivoでグリアジンに対して予備感作されているT細胞である。上述のように、そのような抗原経験T細胞は末梢血中に存在することが見出されている。
【0046】
この方法においては、これらのT細胞をin vitro又はin vivoで薬剤と接触させ、それらのT細胞が薬剤を認識するかどうかの決定をin vitro又はin vivoで行うことができる。したがって、本発明は、人体に対して実施される診断方法において用いるための薬剤を提供する。そのような方法において同時に、別々に、又は連続して用いるための異なる薬剤が提供される。
【0047】
in vitro法は典型的には水溶液中で行われ、そこに薬剤を添加する。この溶液はT細胞(及び、特定の態様においては、以下に論じられるAPC)をも含む。本明細書で用いられる「接触させる」という用語には、特定の物質を溶液に添加することが含まれる。
【0048】
T細胞が薬剤を認識するかどうかの決定は、一般には、薬剤の存在下におけるT細胞の状態の変化を検出するか、又はT細胞がその薬剤を結合するかどうかを決定することにより行われる。状態の変化は、一般には、TCRが薬剤を結合した後のT細胞の抗原特異的機能活性によって生じる。状態の変化はT細胞の内部(例えば、タンパク質の細胞内発現)又は外部(例えば、分泌物質の検出)で測定することができる。
【0049】
T細胞の状態の変化は、T細胞からの物質、例えばサイトカイン、特にはIFN−γ、IL−2もしくはTNF−α、の分泌の開始又はその増加であり得る。IFN−γ分泌の決定が特に好ましい。物質は、典型的には、それを特異的結合性薬剤に結合させた後、特異的結合性薬剤/物質複合体の存在を測定することによって検出することができる。特異的結合性薬剤は典型的には抗体、例えば、ポリクローナルもしくはモノクローナル抗体である。サイトカインに対する抗体は商業的に入手可能であるか、又は標準技術を用いて作製することができる。
【0050】
典型的には、特異的結合性薬剤は固体支持体上に固定する。物質を結合させた後、その固体支持体を場合により洗浄して薬剤に特異的に結合していない物質を除去することができる。薬剤/物質複合体は、その複合体に結合する第2結合性薬剤を用いることによって検出することができる。典型的には、この第2結合性薬剤は第1薬剤が結合する部位とは異なる部位で物質に結合する。第2薬剤は好ましくは抗体であり、検出可能な標識で直接又は間接的に標識されている。
【0051】
したがって、第2作用性物質は、典型的には検出可能な標識で直接又は間接的に標識されている第3薬剤によって検出することができる。例えば、第2薬剤はビオチン部分を含むことができ、これはストレプトアビジン部分及び、典型的には、検出可能な標識としてのアルカリホスファターゼを含む第3薬剤による検出を可能にする。
【0052】
一実施形態においては、用いられる検出システムはWO 98/23960に記載されるex-vivo ELISPOTアッセイである。このアッセイにおいては、T細胞から分泌されるIFN−γを固体支持体上に固定されている第1 INF−γ特異的抗体と結合させる。次に、その結合INF−γを、検出可能な標識で標識されている第2 INF−γ特異的抗体を用いて検出する。そのような標識抗体はMABTECH(ストックホルム、スウェーデン)から入手することができる。用いることができる他の検出可能な標識は以下に論じられる。
【0053】
測定することができるT細胞の状態の変化はT細胞による物質の取り込み、例えば、チミジンの取り込みの増加であり得る。状態の変化はT細胞のサイズもしくはT細胞の増殖の増加、又はT細胞上の細胞表面マーカーの変化であり得る。
【0054】
一実施形態においては、状態の変化を、タンパク質の細胞内発現の変化、例えば、上述のサイトカインのいずれかの細胞内発現の増加を測定することによって検出する。このような細胞内変化は、T細胞の内部を、発現したタンパク質を特異的に結合し、かつフローサイトメトリーによるT細胞の分類を可能にする部分と接触させることによって検出することができる。
【0055】
一実施形態においては、TCRを結合したとき、薬剤は典型的には抗原提示細胞(APC)の表面上に存在するMHCクラスII分子(典型的には、HLA−DQ2)に結合する。しかしながら、本明細書に記載されるように、他の薬剤はMHC分子にも結合する必要性なしにTCRを結合することができる。
【0056】
一般には、T細胞を含む他のタイプのサンプルを用いることもできるが、この方法において接触させるT細胞は個体から血液サンプルの形態で採取する。このサンプルはアッセイに直接加えることも、最初に処理することもできる。典型的には、この処理は、例えば水又はバッファで、サンプルを希釈することを含み得る。典型的には、サンプルを1.5〜100倍、例えば、2〜50又は5〜10倍に希釈する。
【0057】
この処理はサンプルの成分の分離を含み得る。典型的には、単核細胞(MC)をサンプルから分離する。MCはT細胞及びAPCを含む。したがって、この方法においては、分離したMC中に存在するAPCがT細胞にペプチドを提示することができる。別の態様においては、T細胞のみ、例えば、CD4 T細胞のみをサンプルから精製することができる。PBMC、MC及びT細胞は、当該技術分野において公知の技術、例えば、Lalvani et al (1997) J. Exp. Med. 186, p859-865 に記載されるものを用いてサンプルから分離することができる。
【0058】
一実施形態においては、アッセイにおいて用いられるT細胞は非処理もしくは希釈サンプルの形態であるか、又は新たに単離されたT細胞(例えば、新たに単離されたMC又はPBMCの形態)であり、ex vivoで直接用いられ、すなわち、この方法において用いられる前に培養されることはない。したがって、T細胞はin vitroで抗原特異的に再刺激されてはいない。しかしながら、使用前に、例えば1種類以上の薬剤の存在下において、及び一般には、さらに外来性成長促進性サイトカインの存在下において、T細胞を培養することができる。培養の間、薬剤(1種類もしくは複数種類)は、典型的には、APC、例えば、この方法において用いられるAPCの表面上に存在する。T細胞の予備培養はこの方法における感度の増加をもたらし得る。したがって、T細胞を細胞株、例えば、短期細胞株(例えば、Ota et al (1990) Nature 346, pl83-l87 に記載されるようなもの)に変換することができる。
【0059】
本方法において典型的に存在するAPCはT細胞と同じ個体に由来するものであっても、異なる宿主に由来するものであってもよい。APCは天然APCであっても人工APCであってもよい。APCはT細胞にペプチドを提示することができる細胞である。それは典型的にはB細胞、樹状細胞又はマクロファージである。それは、典型的には、T細胞と同じサンプルから分離し、典型的には、T細胞と同時精製する。したがって、APCはMC又はPBMC中に存在し得る。APCは、典型的には、新たに単離されたex vivo細胞又は培養細胞である。それは細胞株、例えば、短期もしくは不死化細胞株の形態であり得る。APCはその表面上に空のMHCクラスII分子を発現することができる。
【0060】
この方法においては、1種類以上の(異なる)薬剤を用いることができる。典型的には、サンプルから誘導されたT細胞を試験しようとする全ての薬剤と共にアッセイに投入することができ、又はそれらのT細胞を分割し、各々1種類以上の薬剤を含む別々のアッセイに投入することができる。
【0061】
本発明は、同時に、別々に又は連続的に使用するための(例えば、in vivo用途のための)本明細書に記載される薬剤の任意の2種類以上(例えば、上述の組成物剤中に存在する薬剤の組合せ)のような薬剤をも提供する。
【0062】
一実施形態においては、薬剤それ自体を、T細胞及びAPCを含むアッセイに直接加える。上述のように、そのようなアッセイにおけるT細胞及びAPCはMCの形態であり得る。APCによる提示の必要性なしにT細胞によって認識され得る薬剤が用いられる場合、APCは必要ない。MHC分子に結合する元の(i)又は(ii)を模倣する類似体がそのような薬剤の例である。
【0063】
一実施形態においては、T細胞の不在下において薬剤をAPCに与える。次に、そのAPCを、典型的にはその表面上に抗原が提示された後、T細胞に与える。ペプチドはAPCの内部に取り込まれて提示されるか、又はAPCの内部に侵入することなく単に表面上に取り込まれている。
【0064】
薬剤をT細胞と接触させる持続時間はペプチド認識の測定に用いられる方法に依存して変化する。典型的には105〜107、好ましくは5×105〜106 PBMCを各々のアッセイに加える。薬剤をアッセイに直接加える場合、その濃度は10− 1〜103μg/ml、好ましくは0.5〜50μg/ml又は1〜10μg/mlである。
【0065】
典型的には、T細胞を薬剤と共にインキュベートする時間の長さは4〜24時間、好ましくは6〜16時間である。ex vivo PBMCを用いる場合、0.3×106 PBMCを10μg/mlのペプチド中で12時間、37℃でインキュベートできることが見出されている。
【0066】
T細胞による薬剤の認識の測定は、その薬剤のT細胞への結合を測定することによって行うことができる(これは、本明細書において論じられるあらゆる適切な結合アッセイ形式を用いて行うことができる)。典型的には、薬剤を結合するT細胞を、例えばFACS機器を用いて、この結合に基づいて分類することができる。その薬剤を用いて分類される細胞の頻度が「対照」値を上回る場合に、薬剤を認識するT細胞が生じていると考えられる。薬剤経験T細胞の頻度は一般には1/106〜1/103であり、したがって、分類される細胞が抗原経験T細胞であるかどうかを決定することができる。
【0067】
T細胞による薬剤の認識の測定はin vivoで測定することができる。典型的には、薬剤を宿主に投与した後、薬剤の認識を示す応答を測定することができる。薬剤は、典型的には、皮内又は表皮投与する。薬剤は、典型的には、皮膚の外側と接触させることによって投与し、プラスター又は包帯の助けを借りてその部位に保持することができる。あるいは、薬剤を針によって、例えば注射によって投与することができるが、他の方法、例えば、バリスティスク(ballistics)(例えば、核酸の送達に用いられているバリスティクス技術)によって投与することもできる。EP−A−0693119は薬剤の投与に典型的に用いることができる技術を記載する。典型的には0.001〜1000μg、例えば、0.01〜100μg又は0.1〜10μgの薬剤を投与する。
【0068】
一実施形態においては、in vivoで薬剤を提供し得る製品を投与することができる。したがって、薬剤を発現し得るポリヌクレオチドを、典型的には薬剤の投与について上述される方法のいずれかで、投与することができる。このポリヌクレオチドは、典型的には、以下に論じられる、本発明によって提供されるポリヌクレオチドの特徴のいずれかを有する。薬剤はこのポリヌクレオチドからin vivoで発現される。典型的には、0.001〜1000μg、例えば、0.01〜100μg又は0.1〜10μgのポリヌクレオチドを投与する。
【0069】
皮膚に投与された薬剤の認識は、典型的には、投与部位での炎症(例えば、硬化、紅斑又は浮腫)の発生によって示される。これは、一般には、その部位の目視検査によって測定する。
【0070】
薬剤を結合する抗体の検出に基づく診断方法は、典型的には、個体からのサンプル(例えば、本明細書に記載されるあらゆる方法で任意に処理されている、本明細書に記載されるサンプルのいずれか)を薬剤と接触させ、かつサンプル中の抗体がその薬剤を結合するかどうかを決定することによって行われ、そのような結合はその個体がセリアック病に罹患し、又はセリアック秒に罹患し易いことを示す。任意の適切な形式の結合アッセイ、例えば、本明細書に記載される任意の形式の結合アッセイを用いることができる。
【0071】
治療
免疫優性エピトープの同定は、このエピトープを認識するT細胞(そのようなT細胞はグリアジンに対する免疫応答に関与するものである)を標的とする治療用製品の製造を可能にする。この知見は、そのエピトープに対する抗体又はT細胞応答を(寛容化によって)抑制することにより、セリアック病の予防又は治療をも可能にする。
【0072】
本発明の特定の薬剤は(上で論じられる結合アッセイのいずれかを用いて測定されるように)本発明のエピトープを認識するTCRを結合し、そのTCRを担持するT細胞の寛容化を引き起こす。したがって、場合によって担体を伴う、そのような薬剤をセリアック病の予防又は治療に用いることができる。
【0073】
一般に、寛容化は、(TCRによって認識された後に)T細胞の抗原特異的機能活性(例えば、本明細書に記載される任意のそのような活性、例えば、サイトカインの分泌)を生じることができるものと同じペプチドによって生じ得る。そのような薬剤は、「寛容化」の局面においてそれらが免疫系に提示されるときに寛容化を生じる。
【0074】
寛容化は免疫系によるT細胞又は抗体エピトープの認識の低下につながる。T細胞エピトープの場合、これはそのエピトープを認識するT細胞の欠失又はアネルギー化によって生じ得る。したがって、そのエピトープに応答する(例えば、本明細書に記載される適切なアッセイにおいて測定される)T細胞活性が低下する。抗体応答の寛容化は、エピトープが投与されたときに産生されるそのエピトープに対する特異的抗体の量が減少することを意味する。
【0075】
免疫系に抗原を提示する方法はそのような脈絡において公知であり、例えば、Yoshida et al. Clin. Immunol. Immunopathol. 82, 207-215 (1997)、Thurau et al. Clin. Exp. Immunol. 109, 370-6 (1997)、及びWeiner et al. Res. Immunol. 148, 528-33 (1997)に記載されている。特に、特定の投与経路、例えば、経口、鼻内又は腹腔内が寛容化を生じ得る。寛容化を生じる特定の生成物を(例えば、薬剤をも含む組成物中で)個体に投与することができる。そのような生成物にはサイトカイン、例えば、Th2応答を優先するサイトカイン(例えば、IL−4、TGF−β又はIL−10)が含まれる。寛容化を生じる用量で生成物又は薬剤を投与することができる。
【0076】
本発明は、T細胞(このT細胞は薬剤を認識する)のアンタゴニストとして作用し得る配列を含むタンパク質を提供する。このようなタンパク質及びこのようなアンタゴニストはセリアック病の予防又は治療に用いることもできる。このアンタゴニストはT細胞応答の低下を生じる。一実施形態においては、アンタゴニストはT細胞のTCR(一般にはHLA−DQ2との複合体の形態)と結合するが、正常な機能的活性化を生じる代わりにTCR細胞内シグナル伝達カスケードを通過する異常シグナルを生じ、これがT細胞の(例えば、典型的には本明細書に記載されるあらゆる適切なアッセイによって測定される、エピトープの認識に応答しての)機能的活性を低下させる。
【0077】
一実施形態においては、アンタゴニストはエピトープと競合してMHCプロセス及び提示経路の成分、例えば、MHC分子(典型的には、HLA−DQ2)に結合する。したがって、アンタゴニストはHLA−DQ2(したがって、このHMC分子によって提示されるペプチド)、例えば、ペプチドTP(表10)又はそれらの相同体に結合することができる。
【0078】
拮抗を生じる方法は当該技術分野において公知である。一実施形態においては、アンタゴニストは上述のエピトープの相同体であり、薬剤(特には類似体)の配列、結合もしくは他の特性の任意のものを有し得る。これらのアンタゴニストは、典型的には、1、2、3、4もしくはそれ以上の突然変異(それらの各々は置換、挿入又は欠失であり得る)によって(T細胞において正常抗原特異的機能を引き起こし得る)上記エピトープのいずれとも異なる。このようなアンタゴニストを当該技術分野においては「代替ペプチドリガンド」又は「APL」と呼ぶ。これらの突然変異は、典型的には、TCRと接触するアミノ酸位置に存在する。
【0079】
アンタゴニストはA−グリアジンのアミノ酸65〜67によって表される配列に等価である配列内での置換によってエピトープと異なっていてもよい(このようなアンタゴニストは表9に示される)。したがって、好ましくは、アンタゴニストは64、65又は67位に等価の位置に置換を有する。好ましくは、置換は64W、67W、67M又は65Tである。
【0080】
個体における本発明のエピトープに対するT細胞免疫応答はポリクローナルであるため、異なるTCRを有するT細胞の応答の拮抗を引き起こすには、2種類以上のアンタゴニストを投与することが必要となり得る。したがって、アンタゴニストは、各々異なるT細胞と拮抗する少なくとも2、4、6もしくはそれ以上の異なるアンタゴニストを含む組成物の形態で投与することができる。
【0081】
本発明は、T細胞(これは、薬剤を認識する)のアンタゴニストを同定する方法であって、候補物質をT細胞と接触させ、そしてその物質が、T細胞の抗原特異的応答能力を低下させるかどうかを(例えば、本明細書に記載されるあらゆる適切なアッセイを用いて)検出することを含み、該能力においてそのような低下が検出されることはその物質がアンタゴニストであることを示すこととなるような方法も提供する。
【0082】
一実施形態においては、アンタゴニスト(特定のエピトープに対するアンタゴニストの組合せを含む)又は寛容化(T細胞及び抗体寛容化)薬剤は、本発明の異なるエピトープ(例えば、2種類以上の物質を含む生成物である薬剤に関して上で論じられるエピトープの組合せ)と拮抗し、又はそれを寛容化する、少なくとも2、4、6もしくはそれ以上のアンタゴニスト又は薬剤を含む組成物の形態で存在する。
【0083】
組成物がセリアック病を引き起こすことができるかどうかの試験
上述のように、本発明は組成物がセリアック病を引き起こすことができるかどうかを決定する方法であって、トランスグルタミナーゼによって本発明の薬剤又はエピトープを含む配列に修飾されることができるタンパク質配列の存在を検出することを含む方法を提供する(そのようなトランスグルタミナーゼ活性はヒト腸トランスグルタミナーゼ活性であり得る)。典型的には、これは結合アッセイを用いることによって行い、そこでは、その配列に特異的な様式で結合する部分をその組成物と接触させ、配列/部分複合体の形成を検出して薬剤の存在を確認する。そのような部分は本明細書に記載されるあらゆる適切な物質(又は物質のタイプ)であり得、典型的には特異的抗体である。任意の好適な形式の結合アッセイを用いることができる(例えば、本明細書に記載されるもの)。
【0084】
一実施形態においては、組成物を、異なるグリアジンに由来する本発明のエピトープに特異的である少なくとも2、5、10もしくはそれ以上の抗体、例えば、2種類以上の物質を含む生成物である本発明の薬剤に関して上に論じられるエピトープの組合せを認識し得る抗体のパネルと接触させる。
【0085】
この組成物は、典型的には、セリアック病を引き起こし得るグリアジンを発現する植物(例えば、本明細書に記載されるグリアジン又は植物のいずれか)に由来する物質を含む。このような物質は植物の部分、例えば、収穫産物(例えば、種子)であり得る。この物質は植物材料の加工製品(例えば、本明細書に記載されるあらゆるそのような製品)、例えば、グリアジンを含む小麦粉又は食品であり得る。食品材料の加工及び適切な結合アッセイにおける試験は、例えばKricka LJ, J. Biolumin. Chemilumin. 13, 189-93 (1998)において言及されるもののような、慣用のものである。
【0086】
結合アッセイ
本明細書に記載されるあらゆる2つの物質間の結合の測定は、結合で変化するいずれかもしくは両者の物質の特徴、例えば、分光学的変化を測定することによって行うことができる。
【0087】
結合アッセイの形式は「バンド・シフト(band shift)」システムであり得る。これは、ゲル電気泳動の間、ある物質(例えば、候補物質)の存在が他の物質の前進を進めるのか、又は遅らせるのかを測定することを含む。
【0088】
この形式は、ある物質が、他の物質の、その物質を結合することが知られる薬剤(例えば特異的抗体)への結合を阻害できるかどうかを測定する、競合結合法であってもよい。
【0089】
突然変異グリアジンタンパク質
本発明は、本発明のエピトープ配列、またはそのような配列を提供するようにトランスグルタミナーゼにより修飾することができる配列が、突然変異を受けており、その結果エピトープを認識するT細胞応答を引き起こすことができないか、これにより認識されなくなっている、グリアジンタンパク質を提供する。この文脈において、認識という用語は、T細胞の正常な(アンタゴニスト的ではない)抗原特異的機能活性が起きるように、TCRがエピトープに結合することを意味する。
【0090】
他のグリアジン中の同等のエピトープを同定する方法は、上記した。突然変異グリアジンの野生型は、セリアック病を引き起こすものである。そのようなグリアジンは、配列番号3と相同性を有し、例えば配列番号3のすべてにわたってまたは配列番号の15、30、60、100または120の連続アミノ酸にわたって上記した程度に(類似体に関して)相同性を有する。
【0091】
突然変異グリアジンは、セリアック病を引き起こさないか、又はセリアック病の症状の軽減をもたらす。典型的には突然変異は、T細胞応答を誘導するエピトープの能力を低下させる。突然変異したエピトープは、HLA-DQ2への結合が低下しており、APCにより提示される能力が低下しており、または薬剤を認識するT細胞に結合するかまたはこれに認識される(すなわち、抗原特異的機能活性を引き起こす)能力が低下している。従って、突然変異グリアジンまたはエピトープは、本発明の診断態様に関して本明細書に記載のアッセイのいずれにおいても、認識が無いかまたは低下している。
【0092】
突然変異は、例えば配列番号2またはその同等物にわたる、エピトープ中の長さ1〜3、4〜6、6〜10、11〜15、またはそれ以上の1つ以上の欠失、付加または置換である。好ましくは突然変異グリアジンは、配列番号1中に少なくとも1つの突然変異を有する。好適な突然変異は、A-グリアジンの65位である(または、他のグリアジン中の同等の位置)。典型的には、この位置に天然に存在するグルタミンは、表3に記載のいずれかの他のアミノ酸(好ましくは、ヒスチジン、チロシン、トリプトファン、リジン、プロリン、またはアルギニン)に置換される。
【0093】
従って本発明はまた、セリアック病を引き起こすグリアジンタンパク質の能力を低下させるための、グリアジンタンパク質のエピトープ(このエピトープは本発明のエピトープである)中の突然変異(本明細書に記載の配列のいずれかにおける任意の突然変異)の使用を提供する。
【0094】
ある実施形態において突然変異配列は、アンタゴニストとして作用することができる。すなわち本発明は、T細胞受容体に結合することができる配列を含むタンパク質を提供し、このT細胞受容体は本発明の薬剤を認識し、この配列は、そのようなT細胞受容体を有するT細胞の拮抗作用を引き起こすことができる。
【0095】
本発明はまた、上記突然変異グリアジンタンパク質の断片であるタンパク質を提供し、これは、少なくとも15アミノ酸長(例えば、少なくとも30、60、100、150、200、または250アミノ酸の長さ)であり、これはグリアジンが認識される能力を低下させる上記の突然変異を含む。本明細書に記載の突然変異タンパク質(断片を含む)のいずれかはまた、例えば他のグリアジンまたは非グリアジンタンパク質との融合タンパク質の形で存在しうる。
【0096】
突然変異グリアジンタンパク質と同等の野生型タンパク質は、典型的にはイネ科の単子葉植物、例えばコムギ属植物(例えば、コムギ、ライ麦、オオムギ、オート麦、ライコムギ)由来である。このタンパク質は典型的には、α、αβ、β、γ、またはωグリアジンである。グリアジンは、A-グリアジンでもよい。
【0097】
キット
本発明はまた、1つ以上の薬剤、および場合によりT細胞による薬剤の認識を検出するための手段を含む方法を実施するためのキットを提供する。典型的には、同時の、別々の、または連続的使用のための、異なる薬剤が提供される。典型的には、認識を検出するための手段は、上記方法に基づく検出を可能にするかまたは助ける。
【0098】
すなわちこの手段は、認識後にT細胞により分泌される物質の検出を可能にする。従ってこのキットはさらに、抗体のような物質のための特異的結合部分を含んでいてもよい。この部分は典型的には、IFN-γに特異的である。この部分は典型的には、固体支持体上に固定化される。これは、この部分に結合後に、物質がこれを分泌したT細胞の近傍にとどまることを意味する。すなわち物質/部分複合体の「スポット」が支持体上に形成され、各スポットは、物質を分泌しているT細胞を示す。スポットを定量し、対照に対して比較すると、薬剤の認識を測定できる。
【0099】
このキットはまた、物質/部分複合体を検出するための手段を含みうる。物質に結合後に部分自身に検出可能な変化(例えば、色の変化)が起きる。あるいは、検出のために直接または間接に標識された第2の部分を、物質/部分複合体に結合させて、スポットを測定できる。上記したように第2の部分は、物質に特異的でもよいが、物質上の第1の部分とは異なる部位に結合する。
【0100】
固定化された支持体は、ウェルを有するプレート、例えばマイクロタイタープレートでもよい。従って各アッセイは、プレート中の別々のウェルで行われる。
【0101】
キットはさらに、検出工程で使用されるT細胞用の培地、検出成分、または洗浄緩衝液を含有してもよい。キットはさらに、サンプルからの分離、例えばサンプルからのPBMCまたはT細胞の分離に適した試薬を含有してもよい。キットは、サンプルの成分を分離する必要無く、サンプル中のT細胞を直接検出できるように設計してもよい。
【0102】
キットは、薬剤の投与、例えば皮内または表皮投与を可能にする装置を含有してもよい。典型的にはそのような装置は、プラスター、包帯、または1つ以上の針を含む。装置は、薬剤の衝撃送達(ballistic delvery)を可能にするものでもよい。キット中の薬剤は、医薬組成物の形でもよい。
【0103】
キットはまた、対照(例えば、陽性対照または陰性対照)を含有してもよい。陽性対照は、検出系を試験することを可能にする。すなわち陽性対照は典型的には、任意の上記方法において薬剤の認識を模倣する。典型的には、in vitroで認識を測定するように設計されるキットでは、陽性対照はサイトカインである。in vitroで薬剤の認識を測定するように設計されるキットでは、陽性対照は、多くの個体が応答する抗原でもよい。
【0104】
キットはまた、宿主からT細胞を含有するサンプル(例えば、血液サンプル)を取る手段を含有してもよい。キットは、宿主のサンプルから単核細胞またはT細胞を分離する手段を含有してもよい。
【0105】
ポリヌクレオチド、細胞、トランスジェニック哺乳動物、および抗体
本発明はまた、発現して薬剤または突然変異グリアジンタンパク質を与えることができるポリヌクレオチドを提供する。典型的にはポリヌクレオチドは、DNAまたはRNAであり、1本鎖または2本鎖である。ポリヌクレオチドは好ましくは、少なくとも50塩基対、例えば50〜100、100〜500、500〜1000、または1000〜2000、またはそれ以上の塩基または塩基対を含む。従ってポリヌクレオチドは、配列番号1もしくは2または本明細書に記載の任意の薬剤をコードする配列を含む。本発明のポリヌクレオチドは、このコード配列の5'または3'に、対応するグリアジン遺伝子中におけるこれらの配列の5'および3'の配列またはコドンとは異なる配列またはコドンを有する。
【0106】
ペプチドをコードする配列の5'および/または3'に、ポリヌクレオチドは、コード配列または非コード配列を有する。コード配列の5'および/または3'の配列は、薬剤をコードする配列の発現を助ける(例えば転写および/または翻訳)配列、を含有してもよい。ポリヌクレオチドは、原核細胞または真核細胞中で薬剤を発現することができる。ある実施形態においてポリヌクレオチドは、哺乳動物細胞(例えば、ヒト、霊長類または齧歯類(例えば、マウスまたはラット)細胞)中で、薬剤を発現することができる。
【0107】
本発明のポリヌクレオチドは、配列番号3をコードするポリヌクレオチドに、バックグランドよりかなり高いレベルで、選択的にハイブリダイズする。選択的ハイブリダイゼーションは、典型的には中程度から高度にストリンジェントな培地条件(例えば、0.03M 塩化ナトリウムと0.03M クエン酸ナトリウム、約50℃〜約60℃)を使用して行われる。しかしそのようなハイブリダイゼーションは、当該分野で公知の任意の適当な条件を使用して行うことができる(Sambrookら(1989), Molecular Cloning: A Laboratory Manualを参照)。例えば、高度のストリンジェンシーが必要なら、適当な条件は60℃、0.2×SSCを含む。より低度のストリンジェンシーが必要なら、適当な条件は60℃、2×SSCを含む。
【0108】
本発明の薬剤またはタンパク質は、本明細書に記載のポリヌクレオチドによりコードされてよい。
【0109】
ポリヌクレオチドは、複製可能なベクターを形成するかまたはこの中に取り込まれうる。そのようなベクターは、適当な細胞中で複製することができる。ベクターは、発現ベクターでもよい。そのようなベクターにおいて本発明のポリヌクレオチドは、ポリヌクレオチドの発現をもたらすことができる調節配列に機能できる形で結合している。ベクターは、選択マーカー(例えば、アンピシリン耐性遺伝子)を含有してもよい。
【0110】
ポリヌクレオチドまたはベクターは、細胞中に存在してもよい。そのような細胞は、ポリヌクレオチドまたはベクターで形質転換されていてもよい。細胞は、該薬剤を発現しうる。細胞は、該ベクターと適合できるように選択され、例えば原核生物(細菌)、酵母、昆虫または哺乳動物細胞でもよい。ポリヌクレオチドまたはベクターは、従来法(リン酸カルシウム沈降法、DEAE−デキストラントランスフェクション、または電気穿孔法を含む)を使用して、宿主細胞中に導入することができる。
【0111】
本発明は、組換え手段による本発明のタンパク質の産生法を提供する。これは、(a)上記で定義した形質転換細胞を、タンパク質の発現を可能にする条件下で培養し、好ましくは(b)発現されたポリペプチドを回収することを含む。場合により、ポリペプチドは、当該分野で公知の方法により単離および/または精製される。
【0112】
本発明はまた、薬剤を認識(または結合)するTCR、またはこのような認識(または結合)が可能なその断片を提供する。これらは、本発明のタンパク質に関連して、本明細書に記載の任意の形態(例えば、純度)で存在することができる。本発明はまた、本発明の細胞について本明細書に記載の任意の形態(例えば、純度)で存在することができる、そのようなTCRを発現するT細胞を提供する。
【0113】
本発明はまた、薬剤(例えば、本発明の任意のエピトープ)を特異的に認識し、本発明の突然変異グリアジンタンパク質を認識する(および典型的には、同等の野生型グリアジンを認識しない)モノクローナル抗体またはポリクローナル抗体と、そのような抗体の作成法を提供する。本発明の抗体は、本発明のこれらの物質に特異的に結合する。
【0114】
本発明の目的において「抗体」という用語は、Fv、F(ab)、F(ab)2断片のような抗体断片、ならびに1本鎖抗体を含む。
【0115】
ポリクローナル抗体の作成法は、適当な宿主動物(例えば、実験動物)を免疫原で免疫し、血清から免疫グロブリンを単離することを含む。従って動物は、免疫原を接種され、次に動物から血液が採取され、IgG画分が精製される。モノクローナル抗体の作成法は、所望の抗体を産生する細胞を不死化することを含む。ハイブリドーマ細胞は、接種した実験動物の脾臓細胞を腫瘍細胞と融合することにより産生できる(KohlerとMilsterin (1975) Nature 256, 495-497)。
【0116】
所望の抗体を産生する不死化した細胞は、従来法により分泌される。ハイブリドーマは、培養して増殖させるか、または腹水の生成のために腹腔内投与するか、または同種異型の宿主または免疫無防備状態の宿主の血流中に注入される。ヒト抗体は、ヒトリンパ球をin vitro免疫し、次にリンパ球をエプスタインバーウイルスで形質転換することにより調製できる。
【0117】
モノクローナル抗体およびポリクローナル抗体双方の産生のために、実験動物はヤギ、ウサギ、ラットまたはマウスが適している。所望であれば、免疫原が、例えばアミノ酸残基の1つの側鎖を介して、適当な担体に結合した結合体として、投与しうる。担体分子は、典型的には生理的に許容される担体である。得られる抗体は、単離され、所望であれば精製される。
【0118】
本発明のポリヌクレオチド、薬剤、タンパク質、または抗体は、検出可能な標識を有してよい。視覚的に、場合によっては光学的拡大手段の助けを借りて、分泌された物質の検出を可能にする検出可能な標識が、好ましい。そのようなシステムは典型的には、基質中の色の変化を引き起こす酵素標識、例えば基質における色の変化を引き起こすアルカリホスファターゼに基づく。そのような基質は、例えばBioRadから市販されている。他の適当な標識には、ペルオキシダーゼのような他の酵素、タンパク質標識(例えば、ビオチン)、または放射性同位元素(例えば、32Pまたは35S)がある。上記標識は、公知の技術を使用して検出できる。
【0119】
本発明のポリヌクレオチド、薬剤、タンパク質、または抗体は、実質的に精製された形態でありうる。これらは実質的に単離された形態でもよく、ここでこれらは一般に、その調製物中に少なくとも80%、例えば少なくとも90、95、97、または99%のポリヌクレオチド、ペプチド、抗体、細胞、または乾燥質量を含む。ポリヌクレオチド、薬剤、タンパク質、または抗体は、典型的には、他の細胞成分を実質的に含まない。ポリヌクレオチド、薬剤、タンパク質、または抗体は、方法中でそのような実質的に単離された形態、精製された形態、または遊離の形態で使用されるか、またはキット中にそのような形態で存在してもよい。
【0120】
本発明はまた、本発明のTCRを発現するトランスジェニック哺乳動物を提供する。これは、(例えば、抗体の産生に関して)本明細書に記載の任意の哺乳動物でよい。好ましくは、哺乳動物は、セリアック病を有するかまたはこれに罹りやすい。哺乳動物はまた、HLA-DQ2を発現してもよく、および/またはセリアック病を引き起こすグリアジンを含有する食餌(例えば、本明細書に記載の任意のグリアジンタンパク質)を与えてもよい。哺乳動物は、セリアック病の動物モデルとして機能しうる。
【0121】
本発明はまた、セリアック病を有するかまたはこれに罹りやすい本発明の哺乳動物に、候補物質を投与し、そしてこの物質が哺乳動物のセリアック病を予防または治療するか否かを決定することを含んでなる、セリアック病の治療薬となる生成物の同定法を提供し、このセリアック病の予防または治療は、この物質が治療用生成物であることを意味する。そのような生成物は、セリアック病を治療または予防するのに使用できる。
【0122】
本発明は、治療薬(予防薬を含む)または診断用物質(本発明の薬剤、タンパク質およびポリヌクレオチドを含む)を提供する。これらの薬剤は、薬学的に許容される担体または希釈剤と混合して、臨床投与用に製剤化される。例えばこれらは、局所的、非経口、静脈内、筋肉内、皮下、眼内、皮内、上皮、または経皮投与用に、製剤化できる。この物質は、薬学的に許容されかつ所望の投与経路に適した任意のビヒクルと混合される。注射用の薬剤用担体または希釈剤は、例えば注射用水としての無菌もしくは等張溶液、または生理食塩水、または衝撃投与のための担体粒子でもよい。
【0123】
物質の用量は、種々のパラメータ、特に使用される薬剤、試験される患者の年齢、体重、および状態;使用される投与方法;治療すべき病状の重篤度;および必要な臨床的処方に従って、調製できる。参考のため、注射により投与される物質の量は、0.01mg/kg〜30mg/kg、好ましくは0.1mg/kg〜10mg/kgである。
【0124】
当業者であれば、特定の患者および症状のための、最適な投与経路と投与量を容易に決定できるため、記載の投与経路と投与量は、参考にすぎない。
【0125】
従って本発明の物質は、ヒトまたは動物の体の治療法、またはヒトの体の診断法に使用し得る。特にこれらはまた、セリアック病の治療または予防法で使用できる。本発明はまた、セリアック病を治療または予防するための薬剤の製造法で使用される薬剤を提供する。すなわち本発明は、それを必要とするヒトに本発明の物質(典型的には、その非毒性有効量)を投与することを含む、セリアック病の予防法または治療法を提供する。
【0126】
本発明の薬剤は、例えば自動合成機のような標準的合成化学技術を使用して作成することができる。この薬剤は、例えば融合タンパク質のようなより長いポリペプチド(このポリペプチドは、典型的にはペプチドの配列を含む)から作成することができる。このペプチドは、例えばプロテアーゼを使用してポリペプチドを部分的に分解して、またはポリペプチドを物理的に分解することにより、ポリペプチドから得ることができる。本発明のポリヌクレオチドは、例えば合成機を使用するなどの標準的方法を使用して作成することができる。
【0127】
突然変異グリアジンタンパク質を発現するかまたはアンタゴニストとして作用することができる配列を含むタンパク質を発現する、植物細胞および植物
本発明の細胞は、植物細胞、例えばイネ科の単子葉植物の細胞でもよい。この種は、その野生型がグリアジン(例えば上記のグリアジンタンパク質(本明細書に記載の配列番号3と任意の程度の相同性を有するグリアジンが含まれる)のいずれか)を発現するものである。そのようなグリアジンは、ヒトでセリアック病を引き起こす。上記細胞は、コムギ、トウモロコシ、オート麦、ライ麦、イネ、オオムギ、ライコムギ、ソルガム、またはサトウキビの細胞でもよい。典型的には上記細胞は、コムギ属(例えば、アエスチブム(aestivum)、スペルタ(spelta)、ポロニクム(polonicum)またはモノコッカム(monococcum))の細胞である。
【0128】
本発明の植物細胞は典型的には、野生型グリアジン(例えば、セリアック病を引き起こし得る上記のグリアジンのいずれか)を発現しないものか、または該物質を認識するT細胞により認識され得る配列を含むグリアジンを発現しないものである。すなわち、野生型植物細胞がそのようなグリアジンを発現する場合には、そのようなグリアジンの発現を抑制または低下させるように、またはグリアジンのアミノ酸配列を変化させるように遺伝子操作して、(典型的には、本発明のエピトープを発現しないようにすることにより)もはやセリアック病を引き起こさないようにしてもよい。
【0129】
これは、例えば細胞中のそのようなグリアジン遺伝子の1、2、3つもしくはそれ以上またはそのすべてに、例えばコードまたは非コード領域(例えばプロモーター領域)に、突然変異を導入することにより行われる。そのような突然変異は、本明細書に記載(例えば、相同タンパク質に関して)の種類または長さのいずれのものでもよい。突然変異は、指向的方法で(例えば、部位特異的突然変異誘発または相同組換え法を使用して)、またはランダムな方法で(例えば、突然変異誘発物質を使用し、通常は次に、もはやグリアジン(または、セリアック病を引き起こすグリアジン配列)を発現しない突然変異誘発された細胞を選択することにより行われる。
【0130】
アンタゴニストとして作用することができる配列を含むタンパク質を発現する植物または植物細胞の場合、そのような植物または植物細胞は、野生型グリアジンタンパク質(例えば、セリアック病を引き起こすもの)を発現することがあり得る。しかし、好ましくは、アンタゴニスト配列が存在することにより、植物または植物細胞に由来するタンパク質を含む食物を摂取する個体において、セリアック病症状の低減(無症状を含む)が引き起こされるであろう。
【0131】
植物細胞中に存在する(または植物細胞に形質転換された)ポリヌクレオチドは一般に、植物細胞中で突然変異グリアジンタンパク質を発現することができるプロモーターを含む。所望の発現パターンに応じて、プロモーターは、構成的、組織特異的、もしくは段階特異的;および/または誘導性でもよい。例えば植物中での強い構成的発現は、CAMV35S、Rubisco ssu、またはヒストンプロモーターを用いて得ることができる。また組織特異的または段階特異的プロモーターを用いて、本発明のタンパク質の発現を、トランスジェニック植物の特定の組織またはその発生の特定の段階に標的化させることもできる。すなわち、例えば種子特異的、根特異的、葉特異的、花特異的プロモーターなどが使用できる。種子特異的プロモーターには、Daltaら(Biotechnology Ann. Rev. (1997), 3, pp. 269-296)に記載のものが挙げられる。種子特異的プロモーターの具体的な例は、ナピンプロモーター(EP-A-0,255,378)、ファセオリンプロモーター、グルテニンプロモーター、ヘリアンセニンプロモーター(WO92/17580)、アルブミンプロモーター(WO98/45460)、オレオシンプロモーター(WO98/45461)ならびにATS1およびATS3プロモーター(PCT/US98/06798)がある。
【0132】
上記細胞は、どのような形態のものでもよい。例えばこれは、単離された細胞、例えばプロトプラストでもよいし、または植物組織の一部(例えば、カルス)もしくは植物から切り出した組織でもよいし、あるいは植物全体の一部でもよい。細胞は、どのような種類のものでもよい(例えば、任意の種類の植物部分)。例えば、カルス細胞のような未分化細胞;または例えば、胚、花粉、根、シュートまたは葉中に見いだされる種類の細胞のような分化細胞である。植物部分は、根、シュート、葉、および生殖に関与する部分(例えば、花粉、卵、雄しべ、葯、花弁、がく片、および花の他の部分)を含む。
【0133】
本発明は、トランスジェニック植物細胞を得る方法であって、植物細胞を本発明のポリヌクレオチドまたはベクターで形質転換してトランスジェニック植物細胞を与えることを含んでなる方法を提供する。任意の適当な形質転換法が使用され得る(コムギの場合、Vasil Vら、Biotechnology 10, 667-674 (1992)に記載の技術が使用される)。好適な形質転換法には、植物プロトプラストの電気穿孔法および微粒子銃法がある。こうして形質転換により、一部の細胞がトランスジェニックであり、一部はトランスジェニックではないキメラ組織またはキメラ植物が作製される。
【0134】
本発明の細胞すなわちこうして得られる細胞は、公知の方法によりトランスジェニック植物に再生することができる。これらには、トランスジェニック細胞の増殖および/または分裂を促進するための植物生長物質、例えばオーキシン、ジベレリンおよび/またはサイトカイニンの使用を伴うものであってよい。同様に体細胞胚形成および分裂組織培養のような技術が使用される。再生法は、当技術分野で公知であり、例えば、米国特許第4,459,355号、米国特許第4,536,475号、米国特許第5,464,763号、米国特許第5,177,010号、米国特許第5,187,073号、EP 267,159号、EP 604,662号、EP 672,752号、米国特許第4,945,050号、米国特許第5,036,006号、米国特許第5,100,792号、米国特許第5,371,014号、米国特許第5,478,744号、米国特許第5,179,022号、米国特許第5,565,346号、米国特許第5,484,956号、米国特許第5,508,468号、米国特許第5,538,877号、米国特許第5,554,798号、米国特許第5,489,520号、米国特許第5,510,318号、米国特許第5,204,253号、米国特許第5,405,765号、EP 442,174号、EP 486,233号、EP 486,234号、EP 539,563号、EP 674,725号、WO 91/02071号、およびWO 95/06128号中に見いだされる。
【0135】
そのような方法の大部分においては、1つの工程は、カルス(すなわち、増殖細胞および/または分裂細胞を含む植物組織)の形成である。そのようなカルスは、他の種類の植物細胞培養物および植物部分と同様に、本発明のさらなる態様である。すなわち例えば、本発明はトランスジェニック植物組織および植物部分(胚、分裂組織、種子、シュート、根、茎、葉、および花の部分を含む)を提供する。これらは、その細胞の一部が本発明の細胞であり、一部はそうではないという意味でキメラであってもよい。本発明のトランスジェニック植物の部分および組織、植物および種子は、本明細書に記載の植物種のいずれのものでもよい。
【0136】
再生方法は典型的にはマーカー遺伝子を用いた形質転換細胞の選択を伴う。
【0137】
再生ステップは、第1世代トランスジェニック植物をもたらす。本発明はまた、この第1世代植物からさらなる世代のトランスジェニック植物を得る方法をも提供する。これらの植物は子孫トランスジェニック植物として知られている。第2、第3、第4、第5、第6およびそれ以降の世代の子孫植物は当技術分野で公知の任意の手段により第1世代トランスジェニック植物から得ることができる。
【0138】
したがって、本発明は、本発明の第1世代トランスジェニック植物から第2世代トランスジェニック子孫植物を得て、そして場合によりこうして得られた第2世代子孫植物から1代以上さらなる世代の世代のトランスジェニック植物を得ることを含む、トランスジェニック子孫植物を得る方法を提供する。
【0139】
子孫植物は、より早い世代に属するそれらの先祖から公知の任意の手法によって作製することができる。特に、子孫植物は以下の方法によって作製することができる。すなわち:
前の世代に属する本発明のトランスジェニック植物からトランスジェニック種子を得て、次に該トランスジェニック種子を育てることにより新しい世代に属する本発明のトランスジェニック子孫植物を得る;および/または
前の世代に属する本発明のトランスジェニック植物をクローン的に増殖させて新しい世代に属する本発明のトランスジェニック子孫植物を得る;および/または
前の世代に属する本発明の第1世代トランスジェニック植物を別の適合する植物と交配し、新しい世代に属する本発明のトランスジェニック子孫植物を得る;さらに場合により、
そのようにして得た子孫植物から1代以上さらなる世代のトランスジェニック子孫植物を得る。
【0140】
これらの技法は任意の組み合わせで用いることができる。例えば、栽培に適したトランスジェニック植物を作出する過程において、クローン的に増殖および有性生殖を異なる時点で用いることができる。特に、作物栽培学的に望ましい特性を有する植物分類群との反復的な戻し交配を行なうことができる。また植物から細胞を取り出し、それから新しい植物体を再生するステップをさらに実施することもできる。
【0141】
また、上記の過程における任意の適切な段階で、細胞、植物組織、植物または種子を形質転換して、本発明のポリヌクレオチド以外の所望のコーディング配列を導入することによって、さらに望ましい特性を導入することが可能である。この導入は、本発明のポリヌクレオチドを導入するために本明細書に記述した技法によって実施することができる。
【0142】
例えば、他の除草剤耐性形質、例えばグリホサートに対する耐性 [例:EPSPシンターゼ遺伝子(例:EP-A-0 293,358)またはグリホサートオキシドレダクターゼ(WO 92/000377)遺伝子を用いる];またはホサメチン(fosametin)、ジハロベンゾニトリル、グルホシネート(glufosinate)に対する耐性 [例:ホスフィノトリシン(phosphinothrycin)アセチルトランスフェラーゼ(PAT)またはグルタミンシンターゼ遺伝子(EP-A-0 242,236参照)を用いる] ;アスラム(asulam)に対する耐性[ジヒドロプテロエイト(dihydropteroate)シンターゼ遺伝子(EP-A-0 369,367)を用いる];またはスルホニル尿素に対する耐性(例:ALS遺伝子を用いる);アシフルオルフェンもしくはオキシフルオルフェン等のジフェニルエーテルに対する耐性[例:プロトポルフィロゲン(protoporphyrogen)オキシダーゼ遺伝子を用いる];オキサジアゾン等のオキサジアゾールに対する耐性;クロロフタリム(chlorophthalim)等の環状イミドに対する耐性;TNP等のフェニルピラゾールまたはそのフェノピラートもしくはカルバメート類似体に対する耐性、をコードする遺伝子から、さらなるトランスジーンを選択することができる。
【0143】
同様に、除草剤耐性以外の有益な特性をコードする遺伝子を導入することができる。例えば、昆虫耐性をコードする遺伝子、特にBacillus thuringiensis (Bt)毒素をコードする遺伝子を導入することができる。同様に、例えばWO91/02701またはWO95/06128に記述されているように、疾患耐性をコードする遺伝子を導入することもできる。
【0144】
典型的には、本発明のタンパク質は本発明の植物中で発現される。使用するプロモーターによって、この発現は構成的または誘導的発現となる。同様に、この発現は組織特異的または段階特異的、すなわち、特定の植物組織(本明細書に記述する組織の任意のもの、等)または植物発生の特定の段階に向けられてもよい。
【0145】
本発明はまた、本発明のトランスジェニック植物を収穫し、そして場合によりさらに加工して作物製品を得る方法を提供する。「作物製品(crop product)」とは、作物植物から得ることができる任意の有用製品を意味する。
【0146】
突然変異グリアジンタンパク質またはアンタゴニストとして作用することができる配列を含むタンパク質を含有する製品
本発明は、突然変異グリアジンタンパク質またはアンタゴニストとして作用することができる配列を含むタンパク質を含有する製品を提供する。この製品は、典型的には、上記タンパク質を発現する本明細書に記載の植物から得られるか、または該植物由来の植物部分を含む。そのような製品は、本発明の植物を収穫することにより直接的に、または本発明の植物を収穫し、さらに加工することによって間接的に得ることができる。直接得ることができる製品としては穀粒が挙げられる。または、そのような製品は、収穫し、さらに加工することにより間接的に得ることもできる。さらなる加工により得られる産物の例としては、穀粉または蒸留酒;直接得られたかまたはさらに加工された材料から作られた食品、例えば穀粉から作られた焼製品(例えばパン)が挙げられる。典型的には、そのような食品はヒトによって摂取可能であり、かつ消化可能なものである(すなわち、非毒性であり、かつ栄養的価値がある)。
【0147】
アンタゴニスト配列を含むタンパク質を含む食品の場合、該食品は野生型グリアジンをも含んでいてもよいが、好ましくは該アンタゴニストはそのような食品が摂取された後にセリアック病症状の低減(例えば、完全な消失)を引き起こすことが可能である。
【0148】
以下の実施例により本発明を説明する。
【0149】
実施例1
我々は、十分に特徴づけられたa-グリアジンである「A-グリアジン」の完全な配列(表1参照)全体に及ぶ51個の合成15merペプチドのセットを用いて、セリアック病におけるエピトープマッピングを実施した。また、A-グリアジンペプチドを各々tTGで処理し、in vivoで産生される産物によく似た産物を作製した3。本発明者らはまた、実験的感染性疾患および自己免疫疾患において記述されているように、エピトープ「拡散」または「枯渇」がすでに起こっている可能性を回避するため、セリアック病患者を疾患再発の開始時点で試験しようと努めた。
【0150】
3 および 10 日間のパンチャレンジを用いた臨床的および A- グリアジン特異的T細胞応答
予備試験において、無グルテン治療食を摂っている、血清抗筋内膜抗体(EMA)の不存在によって規定された、寛解期のセリアック病を患う被験者2人に、彼らの通常の無グルテン治療食に加えて標準的なグルテンを含有する白パンを毎日4枚与えた。被験者1は腹痛、口腔潰瘍および中程度の下痢のために3日後にパンを止めたが、被験者2は1週間目に軽い吐き気が見られたのみで10日間パン食を継続した。被験者2においてはパンチャレンジの1週間後にEMAが陽性となり、使用したパンがセリアック病の再発を引き起こしたことを示した。しかし被験者1においては、EMAはパンチャレンジの2ヵ月後まで陰性のままであった。どちらの被験者においても、パンチャレンジによって現われた症状は無グルテン治療食に戻って2日以内に消散した。
【0151】
パンチャレンジの前または期間中において、IFNγ ELISPOTアッセイにおけるA-グリアジンペプチドに対するPBMC応答は見いだされなかった。しかし、被験者1においてパンを止めた翌日(チャレンジの4日目)から、tTGで処理したA-グリアジン51-85に及ぶ5個の相互にオーバーラップするペプチドからなる1つのプール(プール3)が強いIFNg応答を示した(図1a参照)。被験者1においては、A-グリアジンペプチドに対するPBMC IFNg応答はプール3のみに向けられ続け、そして8日目に最大であった。プール3への応答の強さおよび大きさは、α-キモトリプシンで消化したグリアジンによって誘導されたものに類似していた。tTGで処理したプール3に対するPBMC IFNγ応答は、tTGで処理していないプール3に対する応答よりも一貫して5から12倍大きかった。そして、α-キモトリプシンで消化したグリアジンに対する応答は、tTGで処理されていた場合、3から10倍大きかった。被験者2においてもtTGで処理したプール3が8日目においてA-グリアジンペプチドの唯一の免疫原性セットであったが、この応答は被験者1よりも弱く、4日目には見られず、そして11日目までにプール3に対する応答は減少し、tTGで処理したA-グリアジンペプチドの他のプールがより強いIFNα応答を誘導した(図1b参照)。
【0152】
上記の予備試験は、これらのセリアック病患者における初期T細胞応答が5個のペプチドからなるtTG処理A-グリアジンプールの1つに対するものであり、これは末梢血中で容易に測定されることを示した。しかし抗原暴露が3日間ではなく10日間続くと、エピトープ拡散と一致して、他のA-グリアジンペプチドに対するT細胞応答が出現する。
【0153】
tTG 処理 A- グリアジンペプチドによるセリアック病特異的 IFN-g 誘導
無グルテン治療食を摂っている6人のさらなるセリアック病患者のうち5人において(表1参照)、3日間のパンチャレンジによりプール3のtTG処理ペプチド、特に56-70 (12)および60-75 (13)に対応するペプチドが、PBMCからIFNγを誘導するただ1つのA-グリアジン成分として同定された(図2参照)。IFNγ ELISPOTアッセイと並行して実施したIL-10 ELISPOTアッセイは、tTGで処理したペプチド12または13に対してIL-10応答を全く示さなかった。1人の被験者においては、パンチャレンジの前、該チャレンジの期間中または該チャレンジ後4日目まで、いずれのA-グリアジンペプチドまたはα-キモトリプシン消化グリアジンに対してもIFNγ応答が全く見られなかった。パンチャレンジ後2ヶ月間まで測定したところ、これらのセリアック病患者のいずれにおいてもEMA状態はベースラインから変化しなかった。
【0154】
1ヶ月間無グルテン治療食を摂った後パンによるチャレンジを3日間うけた、HLA-DQ対立遺伝子α1*0501、β1*0201を有する4人の健康でEMA陰性の被験者(年齢28-52、女性2人)由来のPBMCは、tTGで処理した又はしていないA-グリアジンペプチドのいずれに対しても陰性対照を上回るIFNγ応答を示さなかった。したがって、tTG処理プール3ならびにA-グリアジンペプチド56-70 (12)および60-75 (13)に対するPBMCにおけるIFNγの誘導は、セリアック病に特異的であった(7/8対0/4、カイ2乗検定により P<0.01)。
【0155】
最小 A- グリアジンT細胞エピトープの精密なマッピング
A-グリアジン56-75のトランケーション型に相当するtTG処理ペプチドは、試験した5人のセリアック病患者全員において、同一のコアペプチド配列(QPQLP)が抗原性にとって必須であることを明らかにした(図3参照)。このコア配列全体に及び、7mer PQPQLPYから始まり長さが徐々に増大していくtTG処理ペプチドに対するPBMC IFNγ応答は、tTGで処理した17mer であるQLQPFPQPQLPYPQPQS(A-グリアジン57-73)がIFNγ ELISPOTアッセイにおいて最適活性を有することを示した(図4参照)。
【0156】
tTG による Q65 の脱アミド化は A- グリアジン中に免疫優性T細胞エピトープを生じる
HPLC分析は、A-グリアジン56-75のtTG処理は親ペプチドよりも少し遅れて溶出する1つの産物を生成することを示した。アミノ酸配列決定は、A-グリアジン56-75に含まれる6個のグルタミン(Q)残基のうちQ65がtTGによって優先的に脱アミド化されることを示した(図5参照)。Q65がグルタミン酸(E)に置換されているコアA-グリアジン62-68配列からの連続的な拡がりに対応するペプチドの生物学的活性は、tTG処理後のQ65を有する同ペプチドの生物学的活性と等価であった(図4a参照)。EによるQ57およびQ72の置換は、E65と一緒であっても、またはそれら単独であっても、試験した3人のセリアック病患者における上記17merの抗原性を増強しなかった(図6参照)。グリアジンペプチド中でプロリンの前に位置するグルタミン残基はin vitroではtTGによって脱アミド化されないので[W. Vaderら、第8回国際セリアック病シンポジウム議事録(Proceedings 8th International Symposium Coeliac Disease)]、Q57およびQ72を調べた。したがって、免疫優性T細胞エピトープはQLQPFPQPELPYPQPQSと定められた。
【0157】
免疫優性T細胞エピトープ応答は DQ2 に拘束され、かつ CD4 に依存する
HLA-α1*0501、β1*0201についてホモ接合である2人のセリアック病患者において、抗DQモノクローナル抗体はtTG処理A-グリアジン56-75に対するELISPOT IFNγ応答をブロックしたが、抗DPおよび抗DR抗体はブロックしなかった(図7参照)。2人のセリアック病患者由来のPBMCの抗CD4および抗CD8磁性ビーズによる枯渇は、tTG処理A-グリアジン56-75に対するIFNγ応答がCD4 T細胞によって媒介されることを示した。
【0158】
考察
本研究において我々は、配列QLQPFPQPELPYPQPQS(残基57-73)を有する、tTG処理A-グリアジン17merに応答するセリアック病患者の末梢血中のCD4 T細胞の一過性集団を誘導するための、標準的白パンを用いた比較的簡易な食事性抗原チャレンジを記述する。A-グリアジン56-75 (Q-E65)に対する免疫応答は、セリアック病関連HLA対立遺伝子であるDQ α1*0501、β1*0201に拘束される。in vitroにおける組織トランスグルタミナーゼ作用はQ65を選択的に脱アミド化する。Q65からE65への置換(Q-E65)を有する合成A-グリアジンペプチドに対して誘導された末梢血IFNg応答は、tTGで処理したQ65 A-グリアジンペプチドに対する応答と等価である;両方とも、改変されていないQ65 A-グリアジンペプチドと比較してIFNg ELISPOTで最大で10倍を超えるT細胞を刺激する。
【0159】
我々は、T細胞クローンの使用によってエピトープマッピングにおいて発生しうる方法論的人為的生成物の可能性を回避するため、in vivo抗原チャレンジおよび短期間のex vivo免疫アッセイを用いて慎重にこのセリアック病特異的T細胞エピトープを規定した。我々の所見は、グルテンの摂取に対する末梢血T細胞応答は迅速であるが短期間しか続かず、エピトープマッピングに利用できることを示している。in vivo抗原チャレンジもまた、A-グリアジンペプチドに対する免疫応答の一時的な階層状態が存在することを示した;tTGによって改変されたA-グリアジン57-73はPBMC中に最も強いIFNg応答を誘導するのみでなく、これは出現する一番最初のIFNγ応答でもある。
【0160】
本発明者らはA-グリアジン全体に及ぶペプチドのみを評価したので、セリアック病の発生において等しく又はより重要な他のペプチド中の他のエピトープが存在するかもしれない。実際、本発明者らが同定した、A-グリアジンのエピトープのコアに存在するペプチド配列(PQPQLPY)は他のいくつかのグリアジン(SwissProt および Trembl 登録番号:P02863, Q41528, Q41531, Q41533, Q9ZP09, P04722, P04724, P18573)によって共有されている。しかし、生検チャレンジおよびin vivo試験において生物学的活性を有することが以前に示されたA-グリアジンペプチド(例:31-43、44-55、および206-217)4,5は、セリアック病患者において3日間のパンチャレンジ後PBMC中にIFNg応答を誘導しなかった。これらのペプチドは免疫応答の拡散にともなって生じる「二次的」T細胞エピトープであるのかもしれない。
【0161】
実施例 2
免疫優性エピトープ中における置換のT細胞認識に及ぼす効果
57-73 A-グリアジンエピトープの65位に存在するグルタミン酸を置換することの効果を、合成ペプチドを50 μg/mlの濃度で用いたIFNγ ELISPOTアッセイにおいて置換したエピトープに対する末梢血応答を測定することによって確かめた。グルテンチャレンジ(3日間にわたって毎日4枚のパン)を開始して6日後のセリアック病患者3人について上記の応答を測定した。結果を表3および図8に示す。これらから分かるように、グルタミン酸をヒスチジン、チロシン、トリプトファン、リシン、プロリンまたはアルギニンに置換することにより、免疫優性エピトープに対する応答の大きさの10%未満である大きさの応答が刺激された。したがって、この位置におけるA-グリアジンの突然変異は、免疫応答性の減少した、または欠如した突然変異グリアジンを作製するために用いることができた。
【0162】
実施例 3
他の天然に存在するグリアジンに由来する等価なペプチドの免疫反応性の試験
他の天然に存在するコムギグリアジンに由来する等価なペプチドの免疫反応性を、天然に存在する配列に対応する合成ペプチドであってトランスグルタミナーゼで処理したものを用いて評価した。これらのペプチドはELISPOTアッセイにおいて同じ方法で、そして実施例2に記述した被験者と同じ被験者に由来するPBMCを用いて試験した。上記ペプチドのうち少なくとも5個はA-グリアジン57-73 E65ペプチド(トランスグルタミナーゼ処理後の)に匹敵する免疫反応性を示し、コムギ中の他のグリアジンタンパク質もまたこのセリアック病特異的免疫応答を誘導する可能性があることを示した(表4および図9)。
【0163】
方法
被験者:この試験に用いた患者は、セリアック病診療所(Coeliac Clinic in Oxford, United Kingdom)にかかっていた患者であった。セリアック病は典型的な小腸組織学、ならびに無グルテン治療食を用いた症状および小腸組織学の標準化に基づいて診断された。
【0164】
組織タイピング:EDTAにより抗凝結化した末梢血から抽出したDNAを用いて組織タイピングを実施した。HLA-DQAおよびDQB遺伝子型のタイピングは、配列特異的プライマーミックスを用いたPCRによって実施した6-8。
【0165】
抗筋内膜抗体アッセイ:サル食道を用いて1:5に希釈した患者血清を用い、次にFITC結合ヤギ抗ヒトIgAを用いる間接免疫蛍光法によりEMAを検出した。EMAに先立ってIgAを定量した。被験者はいずれもIgA欠乏性ではなかった。
抗原チャレンジ:無グルテン治療食を摂っているセリアック病患者は、3または10日間、グルテンを含有するパンを4枚(50 g/枚、Sainsbury製 “standard white sandwich bread”)毎日消費した。このパンチャレンジ開始に先立つ週、および開始後2ヶ月までEMAを評価した。無グルテン治療食を4週間継続した健康な被験者は、4枚のグルテン含有パンを含む彼らの通常の食事を3日間摂り、次に無グルテン治療食に戻ってこれをさらに6日間摂った。
【0166】
IFN γおよび IL-10 ELISPOT アッセイ:Ficoll-Hypaque密度遠心分離法により50-100 mlの静脈血からPBMCを調製した。3回洗浄後、10%の熱不活化ヒトAB血清を含有する完全RPMIにPBMCを再懸濁した。96ウエルプレート(MAIP-S-45; Millipore, Bedford, MA)を使用し市販のキット(Mabtech; Stockholm, Sweden)を製造者の指示にしたがって用いて(別の文献に記述されているように9)、各ウエルに2-5x105個のPBMC (IFNγの場合)または0.4-1x105個のPBMC (IL-10の場合)を入れて、IFNγおよびIL-10の単一細胞分泌に関するELISPOTアッセイを実施した。ペプチドはそれぞれ2つのウエルを用いてアッセイした。また、全てのアッセイは陽性対照としてヒト結核菌(Mycobacterium tuberculosis)精製タンパク質誘導体(PPD RT49)(Serum Institute; Copenhagen, Denmark)(20μg/ml)を含んでいた。
【0167】
ペプチド:合成ペプチドはResearch Genetics (Huntsville, Alabama)から購入した。質量分析およびHPLCにより、ペプチドが真正であること、および純度が>70%であることを確かめた。α-キモトリプシン(Sigma; C-3142)を用いたグリアジン(Sigma; G-3375)(100 mg/ml)の消化(グリアジン:ケモトリプシン=200:1(w/w))は、室温で0.1 M NH4HCO3中で2 M尿素の存在下で実施し、24時間後に10分間98℃まで過熱することにより停止させた。遠心分離(13,000 g、10分間)後、グリアジン消化物の上清を濾過滅菌した(0.2 mm)。グリアジンの消化はSDS-PAGEおよびタンパク質濃度の評価によって確かめた。α-キモトリプシンで消化したグリアジン(640μg/ml)および合成グリアジンペプチド(15mer: 160μg/ml、他のペプチド:0.1 mM)を、tTG (Sigma; T-5398)(50μg/ml)を含むPBS + CaCl2 1 mM中溶液で2時間、37℃でそれぞれ処理した。ペプチドおよびペプチドプールを無菌の96ウエルプレートに分注し、使用するまで-20℃に凍結して保存した。
【0168】
ペプチドのアミノ酸配列決定:A-グリアジン56-75のtTG処理から生じたペプチドを精製するために逆相HPLCを用いた。単一生成物を同定し、アミノ酸配列決定にかけた(自動シークエンサーモデル494A, Applied Biosystems, Foster City, California)。改変されていないG56-75の配列は LQLQPFPQPQLPYPQPQSFPであることが確認され、またtTGで処理したG56-75は LQLQPFPQPELPYPQPQSFPであると同定された。グルタミル残基の脱アミド化は、アミノ酸配列決定のサイクル2、4、8、10、15および17において回収されたグルタミンおよびグルタミン酸の合計量の百分率として表現される、回収されたグルタミン酸の量(pmol)として規定された。tTGに起因する脱アミド化は(tTG処理ペプチドにおけるグルタミンの脱アミド化% - 未処理ペプチドにおける脱アミド化%)/(100 -未処理ペプチドにおける脱アミド化%)と規定される。
【0169】
CD4/CD8 および HLA クラス II 拘束:抗CD4または抗CD8被覆磁性ビーズ(Dynal,Oslo,Norway)をRPMIで4回洗浄し、次に10%熱不活化ヒトAB血清を含む完全RPMI中でPBMC (5x106細胞/ml)と共に30分間氷上でインキュベートした。磁石を用いてビーズを除去し、残った細胞をカウントした。ペプチドの添加に先立ってPBMC (5x106細胞/ml)を抗HLA-DR (L243)、-DQ (L2)および-DP (B7.21)モノクローナル抗体(10μg/ml)と共に室温で1時間インキュベートすることによって、免疫応答のtTG処理A-グリアジン56-75へのin vivo におけるHLA-クラスII拘束が確立された。
【0170】
実施例 4
グリアジン特異的末梢血リンパ球による粘膜インテグリン発現
内皮アドレシンとリンパ球アドレシンの間の相互作用は器官特異的リンパ球のホーミング(homing)を容易にする。多数のアドレシンが公知である。ヘテロ二量体α4β7は腸固有層および他の粘膜リンパ球に特異的であり、αEβ7は腸および皮膚の上皮内リンパ球に特異的である。末梢血CD4 T細胞の約30%がα4β7を発現し、これらの細胞は粘膜部位への移行中であることが推定される。他方、末梢血T細胞の5%はαEβ7を発現する。αEまたはβ7に特異的な抗体で被覆された免疫磁性ビーズは、αEβ7、またはαEβ7およびα4β7を発現する細胞からPBMCをそれぞれ枯渇させる。ELISPOTアッセイと組み合わせると、免疫磁性ビーズによる枯渇はグリアジン特異的T細胞のアドレシン発現の測定を可能にし、その測定は、粘膜表面にホーミングするものとしてこれらの細胞を同定することができる。興味深いことに、in vivoにおけるグルテンチャレンジは、90%以上のリンパ球がα4β7を発現する小腸固有層(上皮内部位ではない)へのCD4 T細胞の迅速な流入と関連していた。
【0171】
免疫磁性ビーズを調製し、そして3日間のグルテンチャレンジを開始して6日目または7日目のセリアック病患者由来のPBMCを枯渇させるのに用いた。FACS分析は、αEビーズが陽性CD4 T細胞の約50%を枯渇させることを示した。他方、β7ビーズはβ7陽性CD4 T細胞を全て枯渇させた。CD8-またはαE-ビーズではなく、CD4-またはβ7-ビーズを用いたPBMCの枯渇は、インターフェロンγ ELISPOTアッセイにおける応答を完全に消滅させた。tTGグリアジンおよびPPD応答はCD4枯渇によって消滅したが、インテグリン特異的ビーズ枯渇による影響を一貫して受けた。
【0172】
このように、グルテンチャレンジ後にセリアック病患者中に誘導されたA-グリアジン57-73 QE65特異的T細胞は、小腸の固有層CD4 T細胞上に存在するインテグリンであるα4β7を発現する。
【0173】
実施例 5
最適なT細胞エピトープの長さ
A-グリアジンにおける優性T細胞エピトープのコア全体に及ぶ、長さが7から17アミノ酸であるペプチドを試験した以前のデータは、17merのA-グリアジン57-73 QE65が、3日間のグルテンチャレンジを開始して6日目のセリアック病患者ボランティア由来の末梢血単核細胞(PBMC)を用いたインターフェロンγ ELISPOTアッセイにおいて最大応答を誘導することを示した。
【0174】
A-グリアジンにおける優性T細胞エピトープのコア配列を形成する拡がりを示すペプチドを、3日間のグルテンチャレンジを開始して6日目のセリアック病ボランティア(n=4)由来の末梢血単核細胞(PBMC)を用いたインターフェロンγ ELISPOTアッセイによって評価した。ペプチド13:A-グリアジン59-71 QE65 (13mer)、ペプチド15: 58-72 QE65 (15mer)、... 、ペプチド27: 52-78 QE65 (27mer)。
【0175】
図11に示すように、A-グリアジン57-73 QE65配列の拡張はIFNγ ELISPOTアッセイにおける応答を実質的に増強しない。以下の実施例において、17merペプチドを用いてA-グリアジン57-73 QE65のアゴニストおよびアンタゴニスト活性を特徴づける。
【0176】
実施例 6
A- グリアジン 57-73 QE65 と、セリアック病における他の DQ2 拘束性T細胞エピトープとの比較
セリアック病患者の腸生検に由来するグルテン特異的T細胞クローンおよび細胞系のT細胞エピトープに対応する、未改変ペプチドおよびトランスグルタミナーゼ処理ペプチドを用いて用量応答試験を実施した。各ペプチドに対する応答は、A-グリアジン57-73 QE65への応答の百分率として表現した。全ての被験者はHLA-DQ2+であった(DQ8+の被験者はいなかった)。
【0177】
この試験は、A-グリアジン57-73 QE65が、グルテンチャレンジ後のセリアック病患者由来のPBMCを用いたELISPOTアッセイにおいてインターフェロンγを誘導する上で最も強力なグリアジンペプチドであることを示している(図12a-hならびに表5および6参照)。第2および第3のエピトープはより大きいペプチド、すなわちA-グリアジン57-73 QE65およびGDA4 WHEAT PO4724-84-100 QE92の次善の断片である。このエピトープは小さい生物学的活性を有するにすぎない(ブランクを差し引いた後、A-グリアジン57-73 QE65の約1/20の活性である)。
【0178】
A-グリアジン57-73 QE65はセリアック病における他の公知のT細胞エピトープよりも強力である。配列決定したグリアジン遺伝子には、A-グリアジン57-73の16個の多型(配列PQLPYを含む)が存在する。それらの生物学的活性を以下に評価する。
【0179】
実施例 7
末梢血におけるグリアジン特異的応答と A- グリアジン 57-73 QE65 特異的応答との比較
セリアック病におけるグリアジンに対する全T細胞応答と比較した、優性エピトープであるA-グリアジン57-73 QE65の相対的寄与は重大な問題である。セリアック病においてT細胞系およびクローンを発生させるための抗原として、ペプシン-トリプシンおよびキモトリプシンで消化したグリアジンが伝統的に用いられてきた。しかし、これらのプロテアーゼは特定のペプチドエピトープを開裂してしまう可能性がある。実際、組換えα9-グリアジンのキモトリプシン消化はペプチドQLQPFPQPELPYを生じる。これは最適エピトープ配列QLQPFPQPELPYPQPQS(上記参照)のトランケーション型である。トランスグルタミナーゼ処理は、グリアジン特異的T細胞クローンおよび細胞系の増殖アッセイにおけるキモトリプシン消化グリアジンの力を実質的に増大させる。したがって、トランスグルタミナーゼで処理したキモトリプシン消化グリアジン(tTGグリアジン)は理想的な抗原ではないかもしれないが、この混合物に対する応答はグリアジンに特異的な末梢血リンパ球の「総」数に近似する可能性がある。ELISPOTアッセイにおけるA-グリアジン57-73 QE65とtTGグリアジンとに対する応答の比較は、この優性エピトープがセリアック病におけるグリアジンに対する全免疫応答に寄与しており、そしてまたエピトープ拡散の尺度(measure)となることを示している。
【0180】
4人のセリアック病患者からグルテンチャレンジ開始後6または7日目に採取したPBMCを、tTGで処理した又はしていないキモトリプシン消化グリアジンを用いた用量応答試験で評価し、そして最適濃度のA-グリアジン57-73 QE65 (25 mcg/ml)に対するELISPOT応答と比較した。グリアジンのtTG処理はELISPOTアッセイにおけるPBMC応答を約10倍増大させた(単独で評価した場合、tTGはブランクに匹敵した)(図13a-c参照)。試験した4人のセリアック病患者において、A-グリアジン57-73 QE65 (25 mcg/ml)はtTGグリアジン(500 mcg/ml)が誘導した応答の14から115%の応答を誘導した。そして、A-グリアジン57-73 QE65に対する応答が大きくなるほど、その応答はtTGグリアジン応答のより大きい割合に相当した。
【0181】
比較的限定されたデータは、数人の患者においてはA-グリアジン57-73 QE65応答はtTGグリアジン応答に匹敵すると示唆している。より進展した抗グリアジンT細胞応答と結びついたエピトープ拡散が、数人の末梢血における「全」グリアジン応答へのA-グリアジン57-73 QE65のより小さい寄与を説明するかもしれない。エピトープ拡散は、厳格さのより低い無グルテン治療食を摂っている個体中では維持される可能性がある。
【0182】
実施例 8
セリアック病において生物学的に活性なグリアジンペプチドの規定: A- グリアジン 57-73 の多型
セリアック病における免疫優性配列を同定するため、A-グリアジンの完全な配列にまたがる、相互にオーバーラップする15merペプチドを評価した。A-グリアジンは最初の完全に配列決定されたα-グリアジンタンパク質および遺伝子であるが、これはコムギ中の約30-50個の関連するα-グリアジンタンパク質の1つにすぎない。さらに8個のα-グリアジンを記載しているタンパク質データベース(Swiss-ProtおよびTREMBL)を検索することによって25個の別々なα-グリアジン遺伝子が同定された。これら25個のα-グリアジンには、A-グリアジン57-73 に対応する配列の16の異なる多型が含まれている(表7参照)。
【0183】
これら16の多型に対応する合成ペプチドであって、未改変形態のもの、トランスグルタミナーゼでin vitro処理したもの、および位置10に置換されたグルタミン酸(A-グリアジン57-73の QE65と等価)を有するものを、通常は無グルテン治療食を摂っている、グルテンチャレンジ開始後6または7日目のセリアック病患者由来のPBMCを用いたインターフェロンγ ELISPOTアッセイで評価した。グルタミン酸で置換されたペプチドは3種類の濃度(2.5、25および250 mcg/ml)で比較し、未改変ペプチドおよびトランスグルタミナーゼ処理ペプチドは25 mcg/mlの濃度のみで評価した。生物学的活性は、個々の患者(n=4)におけるA-グリアジン57-73 QE65 25 mcg/mlと関連する応答の%として表現した。(図14参照)。
【0184】
「野生型」ペプチドの生物学的活性はトランスグルタミナーゼを用いた処理により実質的に増大した(>5倍)。野生型ペプチドのトランスグルタミナーゼ処理は、位置10をグルタミン酸で置換した同一ペプチドの生物学的活性に類似した生物学的活性をもたらした。グルタミン酸で置換した5個のペプチド(B、C、K、L、M)の生物学的活性はA-グリアジン57-73 QE65 (A)の生物学的活性の70%以上であったが、A-グリアジン57-73 QE65よりも有意に生物学的活性が大きいものはなかった。グルタミン酸で置換したペプチド(濃度2.5および250 mcg/ml)に対するPBMC応答は、濃度25 mcg/mlの該ペプチドに対する応答に匹敵した。グルタミン酸で置換した6個のグリアジンペプチド(H、I、J、N、O、P)はA-グリアジン57-73 QE65の生物学的活性の15%未満であった。他のペプチドは生物学的活性が中程度であった。
【0185】
少なくとも6個のグリアジン由来ペプチドがトランスグルタミナーゼによる改変後、力価(potency)においてA-グリアジン57-73 QE65と等価である。相対的には生物学的に不活性な、A-グリアジン57-73 QE65の多型もまた存在する。これらのデータは、Tricetum aestivum、T. uartuおよびT. speltaのいくつかのグリアジンに由来するペプチドのトランスグルタミナーゼによる改変は、セリアック病における免疫優性なT細胞エピトープを生じうることを示している。
【0186】
非セリアック病毒性のコムギを作出するためのコムギの遺伝子改変は、多数のグリアジン遺伝子の除去または改変を必要とするようである。A-グリアジン57-73 の変更されたペプチドリガンドアンタゴニストをコードする配列を組み込んだグリアジン又は他のタンパク質又はペプチドを含有するコムギの作出は、セリアック病において「非毒性」というよりむしろ治療的な、遺伝子的に改変されたコムギを作出するための別の戦略である。
【0187】
実施例 9
コアエピトープ配列の規定
A-グリアジン56-75をNおよびC末端から切断していった切断形に対応するペプチドの比較は、T細胞エピトープのコア配列がPELPY (A-グリアジン64-68)であることを示した。非アゴニストおよびアンタゴニストを規定するための試みは、生物学的活性に実質的に寄与している残基が置換されている、A-グリアジンの変異体に焦点をあてることになろう。
【0188】
残基57から73を置換したアラニン(図15)またはリシン(図16)を有するA-グリアジン57-73 QE65に対応するペプチドを、3日間のグルテンチャレンジを開始して6日目のセリアック病患者ボランティア由来の末梢血単核細胞(PBMC)を用いたIFNγ ELISPOTアッセイで比較した(N=8)。[BLはブランクを表わし、EはA-グリアジン57-73 QE65:QLQPFPQPELPYPQPQSを表わす。]
【0189】
A-グリアジン60-70 QE65 (PFPQPELPYPQ)に対応する残基が、A-グリアジン57-73 QE65の生物学的活性に実質的に寄与していることが判明した。位置60-70で置換したA-グリアジン57-73 QE65の変異体を2段階法により評価する。最初に、対照的な特性を有する10個の異なるアミノ酸を用いて位置60-70の残基を置換したA-グリアジン57-73 QE65をアッセイする。A-グリアジン57-73 QE65変異体の第2グループ(改変に感受性の位置で、システインを除く他の全ての天然に存在するアミノ酸で置換されている)は2番目に評価される。
【0190】
実施例 10
A- グリアジン 57-73 QE65 の置換された変異体のアゴニスト活性
A-グリアジン60-70 QE65は、A-グリアジンにおける優性T細胞エピトープのコア配列である。このエピトープのアンタゴニストおよび非アゴニストペプチド変異体は、このコア配列の改変によって生成される可能性が最も高い。最初に、対照的な特性を有する10個の異なるアミノ酸を用いて位置60-70の残基を置換したA-グリアジン57-73 QE65が、3日間のグルテンチャレンジを開始して6日目のセリアック病患者由来のPBMCを用いたIFNγ ELISPOTアッセイで評価されるであろう。A-グリアジン57-73 QE65変異体の第2グループ(システインを除く他の全ての天然に存在するアミノ酸によって位置61-70で置換されている)もまた評価された。これらペプチド(すべて濃度50 mcg/ml、1ペプチドにつき2個のサンプルを使用)の両グループを8人の患者由来のPBMCを用いて評価し、そして未改変ペプチドと比較した(1アッセイにつき20回の実験)。以前の研究は、このアッセイにおけるA-グリアジン57-73 QE65の最適濃度は10から100 mcg/mlであると示している。
【0191】
結果を、各患者におけるA-G 57-73 QE65平均応答を100%とした時のスポット形成細胞における平均応答(95%信頼区間)として表わす。改変ペプチドのELISPOT応答をA-G 57-73 QE65と比較するために対応のないt検定が用いられるであろう。超アゴニストは、p<0.01の有意水準でA-G 57-73 QE65よりも大きい応答を有するものと定義された。部分的アゴニストは、p<0.01の有意水準でA-G 57-73 QE65よりも小さい応答を有するものと定義された。そして非アゴニストは、ブランク(ペプチドを含まないバッファー)と有意差がない(p>0.01)ものと定義された。A-グリアジン57-73 QE65のアゴニスト活性の30%以下のアゴニスト活性を有するペプチドは、アンタゴニスト活性を評価するのに「適した」部分的アゴニストまたは非アゴニストと見なされた(表8および図17-27参照)。
【0192】
PBMCのA-グリアジン57-73 QE65に対するIFNγ ELISPOT応答は分子レベルで高度に特異的である。位置64のプロリン(P64)、位置65のグルタミン酸(E65)および位置66のロイシン(L66)ならびに程度はより低いがQ63、P67、Y68およびP69は改変に対して特に感受性である。Y61およびY70という置換は両方とも、おそらくHLA-DQ2への結合を増強することによって(なぜなら、このHLA分子のモチーフは位置1および9における大きい疎水性残基への選択性を示すからである)、親ペプチドよりも30%大きい生物学的活性を有する超アゴニストをもたらす。18個の非アゴニストペプチドが同定された。変異体P65、K64、K65およびY65 (50 mcg/ml)の生物学的活性(7-8%)はブランク(7%)に匹敵した。A-グリアジン57-73 QE65の合計57個の突然変異させた変異体は、生物学的活性がA-グリアジン57-73 QE65と比較して30%以下であった。
【0193】
優性エピトープであるA-グリアジン57-73 QE65に対する末梢血リンパ球(PBL) T細胞応答の分子特異性は、HLA-DQ2+セリアック病患者において一貫して再現可能であり、そして7個のコアアミノ酸中の限定された数のアミノ酸に対して高度に特異的である。A-グリアジン57-73 QE65の特定の単一アミノ酸変異体は、全てのHLA-DQ2+セリアック病患者において一貫して非アゴニストである。
【0194】
実施例 11
置換された変異体のアンタゴニスト活性
HLA-DQ2+セリアック病患者におけるA-グリアジン57-73 QE65に対するPBL T細胞応答の等質性は、たとえ該PBL T細胞応答はポリクローナル性またはオリゴクローナル性のようであっても、ex vivoでPBMC中で拮抗作用が可能な変更されたペプチドリガンド(APL)が存在するかもしれないことを示唆している。APLアンタゴニストは一般に弱いアゴニストである。30%以下のアゴニスト活性を有する、A-グリアジン57-73 QE65の57個の単一アミノ酸置換変異体が同定されており、これらはAPLアンタゴニストの適切な候補である。さらに、A-グリアジン57-73 QE65の軽度に生物学的に活性で天然に存在する多型もまた同定されており(下記参照)、これらは「天然に存在する」APLアンタゴニストであるかもしれない。また、MHCに結合するための競合もまた抗原特異的T細胞免疫を打ち消す可能性があることが示唆された。したがって、グルテンチャレンジ後のセリアック病患者のPBMC中にIFNγ応答を誘導しないがHLA-DQ2に結合することが知られている非グリアジンペプチドは、A-グリアジン57-73 QE65によって誘導されたT細胞応答を減少させることが可能であるかもしれない。HLA-DQ2に旺盛に結合する2個のペプチドは、HLAクラス1α 46-60 (HLA 1a)(PRAPWIEQEGPEYW)および甲状腺ペルオキシダーゼ(tp) 632-645Y (IDVWLGGLLAENFLPY)である。
【0195】
3日間のグルテンチャレンジを開始して6日目のセリアック病患者ボランティア由来のPBMCを用いたIFNγ ELISPOTアッセイにおいて(n=5)、ペプチド(50μg/ml)またはバッファー、およびA-グリアジン57-73 QE65 (10μg/ml)を同時に添加した。結果を、バッファーおよびA-G 57-73 QE65を用いた場合の応答%(20回の実験の平均値)としての、ペプチドおよびA-G 57-73 QE65を用いた場合の応答(2回の実験の平均値)として表わした。(表9参照)。
【0196】
A-グリアジン57-73 QE65の4つの単一アミノ酸置換変異体は、A-グリアジン57-73 QE65に対するインターフェロンγ PBMC ELISPOT応答を25%から28%減少させる(p<0.01)。13個の他のペプチド変異体はELISPOT応答を18%から24%減少させる(p<0.06)。HLA-DQ2バインダーである甲状腺ペルオキシダーゼ(tp) 632-645Yは、A-グリアジン57-73 QE65に対するPBMCインターフェロンγ応答を31%減少させるが(p<0.0001)、もう1つのHLA-DQ2バインダーであるHLAクラス1α 46-60 は応答を変化させない(表9参照)。A-グリアジン57-73 のトランスグルタミナーゼ改変多型に対応するペプチドであるSwissProt受託番号P04725 82-98 QE90 (PQPQPFPPELPYPQPQS)はA-グリアジン57-73 QE65に対する応答を19%減少させる(p<0.009)(表11参照)。
【0197】
ELISPOTアッセイにおけるA-グリアジン57-73 QE65に対するPBMCのインターフェロンγ応答は、特定の単一アミノ酸置換A-グリアジン57-73 QE65変異体、A-グリアジン57-73 QE65の多型、およびHLA-DQ2と5倍過剰に結合することが公知の関連しないペプチドを同時に投与することによって減少する。これらの所見は、A-グリアジン57-73 QE65の変更されたペプチドリガンドアンタゴニストが存在することを示唆する。推定されるAPLアンタゴニストばかりでなく、HLA-DQ2に結合する特定のペプチドもまた、A-グリアジン57-73 QE65に対するPBL T細胞応答を効果的に減少させる。
【0198】
これらの所見は、HLA-DQ2+セリアック病において優性なA-グリアジンエピトープに対するT細胞応答を妨害するための2つの戦略を支持する。
1.「伝統的」ペプチド医薬品として使用するため、またはコムギ中のグリアジン遺伝子の特定の遺伝子改変のため、1つ以上の位置(64-67)でアミノ酸を置換することによるAPLアンタゴニストの最適化。
2.HLA-DQ2と共同したA-グリアジン57-73 QE65の提示を競合的に阻止するための高親和性HLA-DQ2結合ペプチドの使用。
【0199】
これらの2つのアプローチは互いに両立可能である。F61およびQ70をチロシン残基で置換することにより超アゴニストが生成された。これらの超アゴニストはT細胞受容体との接触が増大したためというより、むしろHLA-DQ2への結合が向上したために生じたようである。これらの改変を適度に効果的なAPLアンタゴニストをもたらす他の置換と組み合わせることは、置換されたA-グリアジン57-73 QE65変異体の阻止効果を実質的に増強するかもしれない。
【0200】
実施例 12
セリアック病の診断法としての、 PBMC および A- グリアジン 57-73 QE65 および P04724 84-100 QE92 を用いたインターフェロンγ ELISPOT アッセイの開発:新たに診断されたセリアック病における免疫応答性の定義
インターフェロンγ ELISPOTアッセイにおいて測定される、PBMC中の優性なA-グリアジンT細胞エピトープに対する応答性の誘導は、長期間厳格な無グルテン治療食(GFD)を摂っている殆ど全てのDQ2+セリアック病患者においてはグルテンチャレンジの結果として起こるが、厳格なGFDを4週間摂りつづけた健康なDQ2+被験者には起こらない。A-グリアジン57-73 QE65応答は、グルテンチャレンジ以前にはセリアック病患者のPBMC中で測定できない。また予備データは、未治療のセリアック病患者のPBMC中ではこれらの応答は測定できないであろうことを示唆していた。これらのデータは、セリアック病においては、A-グリアジン57-73 QE65に対する免疫応答性が抗原排除(GFD)の後で回復することを示唆している。ELISPOTアッセイおよびPBMCを用いた診断テストを開発するのであれば、グルテンチャレンジがA-グリアジン57-73 QE65および血中の他の免疫反応性グリアジンペプチドに対する応答を誘導しうる前に必要とされるGFDの摂取期間を規定することが望ましい。
【0201】
新たに診断されたDQ2+セリアック病患者を胃腸病外来から集めた。患者がGFD摂取を開始する前および開始後1または2週間目にPBMCを調製し、IFNγ ELISPOTアッセイにより試験した。さらに、GFD摂取の開始後1または2週間目にグルテンチャレンジ(3日間、標準的白パン4枚を毎日消費する:200 g/日)を実施した。グルテンチャレンジ開始後6日目にPBMCを調製し、アッセイした。A-グリアジン57-73 QE65 (A)、P04724 84-100 QE92 (B)(単独で、および組み合わせて) およびA-グリアジン57-73 QP65 (P65)(生物学的に不活性な変異体、上記参照)(全て25 mcg/ml)を評価した。
【0202】
1人を除いて新たに診断されたセリアック病患者は全員がDQ2+であった(1人はDQ8+)(n=11)。まだ治療を受けていない、または1もしくは2週間GFDを摂取した、新たに診断されたセリアック病患者由来のPBMCは、A-グリアジン57-73 QE65およびP04724 84-100 QE92(単独または組み合わせ)に対して応答を示さなかった。これはブランクまたはA-グリアジン57-73 QP65に対する応答と有意差がなかった(n=9)(図28参照)。1週間のみGFDを摂取したセリアック病患者におけるグルテンチャレンジは、A-グリアジン57-73 QE65またはP04724 84-100 QE92(単独または組み合わせ)に対する応答を実質的に増強しなかった。しかし、GFD摂取の開始後2週間目に行なったグルテンチャレンジは、A-グリアジン57-73 QE65およびP04724 84-100 QE92(単独または組み合わせ)に対する応答を誘導した。それらの応答は、生物学的に不活性な変異体であるA-グリアジン57-73 QP65およびブランクに対する応答よりも有意に大きかった。2週間目にグルテンチャレンジを行なった後のこれらの応答は実質的なものであったが、GFD摂取開始後2ヶ月以上経過した被験者における応答よりも少ないように思われた。A-グリアジン57-73 QE65単独に対する応答は、P04724 84-100 QE92単独又はこれとA-グリアジン57-73 QE65との組合わせに対する応答と等価であるか、またはそれより大きかった。グルテンチャレンジによって困った症状を体験した被験者はいなかった。
【0203】
A-グリアジンに対する免疫応答性(グルテンチャレン後にPBMC中で測定される)は、GFD摂取の開始後2週間目に部分的に回復する。これは、この優性T細胞エピトープに対する「免疫非応答性」は、未治療のセリアック病において、およびGFD摂取の開始後少なくとも1週間の間は、優勢であることを意味する。グルテンチャレンジおよびA-グリアジン57-73 QE65に対する応答のELISPOTアッセイによる測定を用いるセリアック病診断テストを実施する最適な時期は、GFD摂取の開始後少なくとも2週間たってからである。
【0204】
A-グリアジン57-73 QE65に特異的な、インターフェロンγを分泌するT細胞は、未治療のセリアック病患者の末梢血中では測定不可能であって、少なくとも2週間GFDを摂取(抗原排除)した後のグルテンチャレンジによって初めて誘導されうる。したがって、この方法を用いる診断テストの時期は非常に重要で、その最適化のためにはさらなる研究が必要である。これらの所見は、抗原排除(GFD)によって一変させられた、優性エピトープ(すなわちA-グリアジン57-73 QE65)に特異的なT細胞の機能性アネルギーと矛盾しない。この現象はヒト疾患においてはこれまで示されておらず、セリアック病においてペプチド療法によってT細胞アネルギーが誘導できるかもしれないという可能性を支持している。
【0205】
参照文献
1. Molberg O, et al. Nature Med. 4, 713-717 (1998).
2. Quarsten H, et al. Eur. J. Immunol. 29, 2506-2514 (1999).
3. Greenberg C S et al. FASEB 5, 3071-3077 (1991).
4. Mantzaris G. Jewell D. Scand. J. Gastroenterol. 26, 392-398 (1991).
5. Mauri L, et al. Scand. J. Gastroenterol. 31, 247-253 (1996).
6. Bunce M, et al. Tissue Antigens 46, 355-367 (1995).
7. Olerup O, et al. Tissue Antigens 41, 119-134 (1993).
8. Mullighan CG, et al. Tissue Antigens. 50, 688-92 (1997).
9. Plebanski M et al. Eur. J. Immunol. 28, 4345-4355 (1998).
【表1】
【0206】
【表2】
【0207】
【表3】
【0208】
【表4】
【0209】
【表5】
【0210】
【表6】
【0211】
【表7】
【0212】
【表8】
【0213】
【表9】
【0214】
【表10】
【0215】
【表11】
【図面の簡単な説明】
【図1】 図1は、最初にグルテン非含有食事に続く緩解状態にあり、次いで毎日パン200gを第1日から3日間チャレンジしたセリアック病被験者1における、A−グリアジン51−85(表1を参照)にわたる5つの重複15量体及びキモトリプシン消化グリアジン(40μg/ml)を含むトランスグルタミナーゼ(tTG)処理及び非処理ペプチドプール3(各々ペプチド10μg/ml)に対する新たに単離されたPBMC(抹消血単核細胞)IFNγELISPOTの応答(縦軸は106 PBMC当たりのスポット形成細胞を示す)を示す(a)。10日のパンチャレンジ期間の、完全A−グリアジンタンパク質全体にわたるtTG処理A−グリアジンペプチドプール1−10に対する被験者2によるPBMC IFNγ ELISPOT応答(b)。横軸はパン食開始後の日数を示す。
【図2】 図2は、最初にグルテン非含有食事による緩解状態で、3日間(第1日〜第3日)パンをチャレンジした7名の別々のセリアック病被験者における、(A−グリアジン51−85にわたる)tTG処理ペプチドプールに対するPBMC IFNγ ELISPOT応答を示す。横軸はパン食開始後の日数を示す(a)。プール3に含まれるtTG処理重複15量体ペプチドに対するPBMC IFNg Elispot応答;バーは第6日または第7日の6名のセリアック病被験者における個々のペプチド(10μg/ml)に対する平均(±SEM)応答を表す(b)。(個々の被験者において、縦軸によって示されるように、ペプチドに対するELISPOT応答をペプチド12によって誘発される応答の%として算出した。)
【図3】 第3図は、A−グリアジン56−75のtTG処理末端切断体(truncate)(0.1μM)に対するPBMC IFNγ ELISPOTを示す。バーは5名のセリアック病被験者における平均(±SEM)を表す。(個々の被験者において、応答を試験したペプチドのいずれかによって誘発される最大応答の%として算出した。)
【図4】 図4は、配列PQPQLPY(A−グリアジン62−68)を含むtTG処理7−17量体A−グリアジンペプチド(0.1μM)(a)、及びtTG処理はされていないがQ−E65置換されている同じペプチド(b)を用いて優性A−グリアジンエピトープの最小構造をマッピングする方法を示す。各々のラインは、第1−3日にパンを摂取した後第6または7日の3名のセリアック病被験者の各々におけるPBMC IFNg ELISPOT応答を表す。(個々の被験者において、ELISPOT応答を17量体、A−グリアジン57−73によって誘発される応答の%として算出した。)
【図5】 図5は、tTGによって脱アミド化されたアミノ酸を示す。A−グリアジン56−75(LQLQPFPQPQLPYPQPQSFP)(0.1μM)をtTG(50μg/ml)と共に37℃で2時間インキュベートした。単一の産生物を同定し、逆相HPLCによって精製した。アミノ酸分析により、tTGに寄与し得るA−グリアジン56−75中の各Gln残基の脱アミド化%(Q−E)を算出することが可能となった(縦軸)。
【図6】 図6は、17量体を用いて、Q65に加えてA−グリアジン57−73における他の位置でのQ→E置換の効果を示す:第1−3日にパンを摂取した後第6または7日の3名のセリアック病被験者におけるQLQPFPQPELPYPQPES(E57,65)、QLQPFPQPELPYPQPES(E65,72)、ELQPFPQPELPYPQPES(E57,65,72)、及びQLQPFPQPELPYPQPQS(E65)。縦軸はE65応答の%を示す。
【図7】 図7は、(a)CD4及びCD8磁性ビーズ除去PBMCにおいてtTG処理A−グリアジン56−75(0.1μM)がIFN−g ELISPOT応答を誘発したことを示す(バーはCD4除去PBMC応答をCD8除去PBMC応答の%として表す; CD8除去PBMC100万当たりのスポット形成細胞は:被験者4:29、被験者6:535であった)。(b)HLA-DQ a1*0501、b1*0201についてホモ接合である2名のセリアック病被験者における、tTG処理56−75(0.1μM)の1時間前にHLA−DR(L243)、−DQ(L2)及び−DP(B7.21)(10μg/ml)に対するモノクローナル抗体とインキュベートした後のPBMC INFγ ELISPOT応答(スポット形成細胞/100万PBMC)。
【図8】 図8は、免疫優性エピトープにおいて65位で他のアミノ酸の代わりにGluを用いる効果を示す。縦軸はその免疫優性エピトープに関する3名の被験者における応答%を示す。
【図9】 図9は、トランスグルタミナーゼ処理あり(影付き)及び処理なし(白抜き)の、配列PQLPYを含む天然グリアジンペプチドの免疫反応性を示す(3名の被験者から応答を測定)。
【図10】 図10は、グルテンチャレンジ、次いでインターフェロンガンマELISpotの開始後6日の2名のセリアック病被験者に由来する末梢血単核細胞のCD8、CD4、β7、及びαE−特異的免疫磁性ビーズ除去を示す。A−グリアジン57−73(25mcg/ml)、tTG処理キモトリプシン消化グリアジン(100mcg/ml)又はPPD(10mcg/ml)を抗原として用いた。
【図11】 図11は、最適T細胞エピトープ長を示す。
【図12】 図12は、用量応答研究におけるA−グリアジン57−73 QE65と他のペプチドとの比較を示す。
【図13】 図13は、グリアジン及びA−グリアジン57−73特異的応答の比較を示す。
【図14】 図14は、セリアック病被験者におけるグリアジン多形の生物活性を示す。
【図15】 図15は、コアエピトープ配列の定義を示す。
【図16】 図16は、コアエピトープ配列の定義を示す。
【図17】 図17は、A−グリアジン57−73 QE65変異体のアゴニスト活性を示す。
【図18】 図18は、A−グリアジン57−73 QE65変異体のアゴニスト活性を示す。
【図19】 図19は、A−グリアジン57−73 QE65変異体のアゴニスト活性を示す。
【図20】 図20は、A−グリアジン57−73 QE65変異体のアゴニスト活性を示す。
【図21】 図21は、A−グリアジン57−73 QE65変異体のアゴニスト活性を示す。
【図22】 図22は、A−グリアジン57−73 QE65変異体のアゴニスト活性を示す。
【図23】 図23は、A−グリアジン57−73 QE65変異体のアゴニスト活性を示す。
【図24】 図24は、A−グリアジン57−73 QE65変異体のアゴニスト活性を示す。
【図25】 図25は、A−グリアジン57−73 QE65変異体のアゴニスト活性を示す。
【図26】 図26は、A−グリアジン57−73 QE65変異体のアゴニスト活性を示す。
【図27】 図27は、A−グリアジン57−73 QE65変異体のアゴニスト活性を示す。
【図28】 図28は、異なる患者群における応答を示す。
Claims (41)
- 配列番号1のアミノ酸配列を含み、かつ長さが7〜50アミノ酸である、A-グリアジン由来のペプチド。
- 配列番号2のアミノ酸配列を含む、請求項1に記載のペプチド。
- (a)請求項1に記載のペプチド、及び
(b)他のグリアジン配列又は非グリアジン配列を含むペプチド。 - グリアジン配列がコムギ、ライムギ、オオムギ、カラスムギ、又はライコムギに由来する、請求項3に記載のペプチド。
- (b)が非グリアジン配列である、請求項3に記載のペプチド。
- 融合タンパク質である、請求項1〜5のいずれか1項に記載のペプチド。
- 請求項1に記載のペプチドを認識するT細胞受容体によって認識され得、ペプチド類似体である場合には長さが50アミノ酸以下である、請求項1に記載のペプチドの類似体。
- 請求項1〜7に定義されるペプチド又は類似体を2つ以上含む生成物。
- 請求項1〜6のいずれか1項に記載のペプチド、請求項7に記載の類似体、又は請求項8に記載の生成物と、薬学的に許容し得る担体又は希釈剤を含む医薬組成物。
- (a)少なくとも1つの請求項1に記載のペプチド、並びに
(b)コムギ、ライムギ、オオムギ、カラスムギ、及びライコムギのうちの少なくとも1種由来のグリアジンエピトープ
を含む、請求項9に記載の医薬組成物。 - コムギ、ライムギ、オオムギ、カラスムギ、及びライコムギのそれぞれ由来のグリアジンエピトープを含む、請求項10に記載の医薬組成物。
- セリアック病を治療又は予防する方法において用いるための、請求項1〜6のいずれか1項に定義されるペプチド、請求項7に記載の類似体、請求項8に定義される生成物、請求項9〜11のいずれか1項に定義される医薬組成物、又は請求項1に定義されるペプチドからなるエピトープと結合する類似体。
- セリアック病の治療又は予防が寛容化することによるものである、請求項12に定義されるペプチド、類似体、生成物、又は医薬組成物。
- 個体におけるセリアック病、又はセリアック病への罹患のし易さの検査方法であって:
(a)宿主からのサンプルを、請求項1〜6のいずれか1項に記載のペプチドと接触させ、さらに;
(b)in vitroでサンプル中のT細胞が該ペプチドを認識するかどうかを検出することを含み;
T細胞による認識が、その個体がセリアック病に罹患しているか、又はそれに罹患し易いことを示す、前記方法。 - 個体におけるセリアック病、又はセリアック病への罹患のし易さの検査方法における請求項1〜6のいずれか1項に記載のペプチドの使用であって、該方法が、個体由来のT細胞が該ペプチドを認識するかどうかを検出することを含み、T細胞による認識が、その個体がセリアック病に罹患しているか、又はそれに罹患し易いことを示す、前記使用。
- 方法が、ペプチドを個体の皮膚に塗布し、さらに塗布部位での炎症の存在を検出することを含み、炎症の検出が、個体のT細胞が該ペプチドを認識することを示す、請求項15に記載の使用。
- サンプルが血液サンプルである、請求項14に記載の方法。
- サンプルが血液サンプルである、請求項15に記載の使用。
- T細胞が前記検出の前にin vitroで抗原特異的な様式で再刺激されていない、請求項14又は17に記載の方法。
- T細胞が前記検出の前にin vitroで抗原特異的な様式で再刺激されていない、請求項15又は18に記載の使用。
- T細胞によるペプチドの認識を、T細胞からのサイトカインの分泌を検出することによって検出する、請求項14、17、及び19のいずれか1項に記載の方法。
- T細胞によるペプチドの認識を、T細胞からのサイトカインの分泌を検出することによって検出する、請求項15、16、18、及び20のいずれか1項に記載の使用。
- サイトカインがIFN−γである、請求項21に記載の方法。
- サイトカインがIFN−γである、請求項22に記載の使用。
- サイトカインを該サイトカインに特異的な固定化抗体に結合させ、次いで抗体/サイトカイン複合体の存在を検出することによりサイトカインを検出する、請求項21又は23に記載の方法。
- サイトカインを該サイトカインに特異的な固定化抗体に結合させ、次いで抗体/サイトカイン複合体の存在を検出することによりサイトカインを検出する、請求項22又は24に記載の使用。
- ペプチドがT細胞受容体に結合するかどうかを測定することによって前記検出を行う、請求項14、17、及び19のいずれか1項に記載の方法。
- ペプチドがT細胞受容体に結合するかどうかを測定することによって前記検出を行う、請求項15、16、18、及び20のいずれか1項に記載の使用。
- 個体におけるセリアック病、又はセリアック病への罹患のし易さの検査方法であって、該個体からのサンプルにおいて、請求項1に記載のペプチドに結合する抗体の存在を検査することを含み、抗体の存在が、個体がセリアック病に罹患しているか、又はそれに罹患し易いことを示す、前記検査方法。
- 組成物がセリアック病を引き起こし得るかどうかを決定する方法であって、トランスグルタミナーゼによって請求項1に定義されるペプチドへと修飾され得る配列が該組成物中に存在するかどうかを決定することを含み、該配列の存在が、該組成物がセリアック病を引き起こし得ることを示す、前記決定方法。
- 組成物を、請求項1に定義されるペプチドへと修飾され得る配列に特異的な抗体と接触させることにより前記決定を行い、組成物中の配列への抗体の結合が、該組成物がセリアック病を引き起こし得ることを示す、請求項30に記載の方法。
- 請求項1〜6のいずれか1項に記載のペプチド及びT細胞によるペプチドの認識を検出する手段を含む、請求項14〜28のいずれか1項に記載の方法又は使用を実施するためのキット。
- 認識を検出する手段がIFN−γに対する抗体を含む、請求項32に記載のキット。
- 抗体を固体支持体上に固定し、かつ、抗体/IFN−γ複合体を検出する手段をも含む、請求項33に記載のキット。
- ペプチドに特異的な抗体を産生させるための、請求項1〜6のいずれか1項に定義されるペプチドの使用。
- 請求項1〜6のいずれか1項に定義されるペプチドをコードするコーディング配列を含むポリヌクレオチド。
- コーディング配列に機能的に連結される1つ以上の調節配列をさらに含み、該調節配列が細胞中での該コーディング配列の発現を確実なものとすることができる、請求項36に記載のポリヌクレオチド。
- 1又は複数の調節配列が原核細胞又は哺乳動物細胞におけるコーディング配列の発現を可能にする、請求項37に記載のポリヌクレオチド。
- ベクターであるか、又はベクターの形態にある、請求項36〜38のいずれか1項に記載のポリヌクレオチド。
- 請求項36〜39のいずれか1項に定義されるポリヌクレオチドを含むか、又はそのようなポリヌクレオチドで形質転換されている細胞。
- 原核細胞又は哺乳動物細胞である、請求項40に記載の細胞。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GBGB9923306.6A GB9923306D0 (en) | 1999-10-01 | 1999-10-01 | Diagnostic and therapeutic epitope, and transgenic plant |
| GB9923306.6 | 1999-10-01 | ||
| PCT/GB2000/003760 WO2001025793A2 (en) | 1999-10-01 | 2000-10-02 | Diagnosis of coeliac disease using a gliadin epitope |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010135844A Division JP5371890B2 (ja) | 1999-10-01 | 2010-06-15 | 診断及び治療用エピトープ並びにトランスジェニック植物 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2003511670A JP2003511670A (ja) | 2003-03-25 |
| JP2003511670A5 JP2003511670A5 (ja) | 2007-11-22 |
| JP4932112B2 true JP4932112B2 (ja) | 2012-05-16 |
Family
ID=10861989
Family Applications (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2001528704A Expired - Lifetime JP4932112B2 (ja) | 1999-10-01 | 2000-10-02 | 診断及び治療用エピトープ並びにトランスジェニック植物 |
| JP2010135844A Expired - Lifetime JP5371890B2 (ja) | 1999-10-01 | 2010-06-15 | 診断及び治療用エピトープ並びにトランスジェニック植物 |
| JP2013018731A Expired - Lifetime JP6139154B2 (ja) | 1999-10-01 | 2013-02-01 | 診断及び治療用エピトープ並びにトランスジェニック植物 |
| JP2016053617A Pending JP2016164169A (ja) | 1999-10-01 | 2016-03-17 | 診断及び治療用エピトープ並びにトランスジェニック植物 |
Family Applications After (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010135844A Expired - Lifetime JP5371890B2 (ja) | 1999-10-01 | 2010-06-15 | 診断及び治療用エピトープ並びにトランスジェニック植物 |
| JP2013018731A Expired - Lifetime JP6139154B2 (ja) | 1999-10-01 | 2013-02-01 | 診断及び治療用エピトープ並びにトランスジェニック植物 |
| JP2016053617A Pending JP2016164169A (ja) | 1999-10-01 | 2016-03-17 | 診断及び治療用エピトープ並びにトランスジェニック植物 |
Country Status (15)
| Country | Link |
|---|---|
| US (5) | US7144569B1 (ja) |
| EP (2) | EP1218751B1 (ja) |
| JP (4) | JP4932112B2 (ja) |
| AT (2) | ATE449965T1 (ja) |
| AU (1) | AU782262B2 (ja) |
| CA (1) | CA2386089C (ja) |
| CY (2) | CY1105282T1 (ja) |
| DE (2) | DE60026332T2 (ja) |
| DK (2) | DK1218751T3 (ja) |
| ES (2) | ES2256042T3 (ja) |
| GB (1) | GB9923306D0 (ja) |
| HK (1) | HK1088068A1 (ja) |
| MX (1) | MXPA02003295A (ja) |
| PT (2) | PT1672368E (ja) |
| WO (1) | WO2001025793A2 (ja) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2013126991A (ja) * | 1999-10-01 | 2013-06-27 | Isis Innovation Ltd | 診断及び治療用エピトープ並びにトランスジェニック植物 |
| US9464120B2 (en) | 2008-11-30 | 2016-10-11 | Immusant, Inc. | Compositions for treatment of celiac disease |
| US10449228B2 (en) | 2013-09-10 | 2019-10-22 | Immusant, Inc. | Dosage of a gluten peptide composition |
Families Citing this family (46)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7320788B2 (en) | 2002-02-14 | 2008-01-22 | The Board Of Trustees Of The Leland Stanford Junior University | Enzyme treatment of foodstuffs for Celiac Sprue |
| US8143210B2 (en) | 2002-02-14 | 2012-03-27 | The Board Of Trustees Of The Leland Stanford Junior University | Enzyme treatment of foodstuffs for celiac sprue |
| DE60336754D1 (de) * | 2002-02-14 | 2011-05-26 | Univ R | Enzymbehandlung von nahrungsmitteln für zöliakie-sprue |
| US7265093B2 (en) | 2002-05-14 | 2007-09-04 | The Board Of Trustees Of The Leland Stanford Junior University | Drug therapy for Celiac Sprue |
| US7462688B2 (en) * | 2002-05-14 | 2008-12-09 | The Board Of Trustees Of The Leland Stanford Junior University | Peptides for diagnostic and therapeutic methods for celiac sprue |
| CA2487247A1 (en) | 2002-05-14 | 2003-11-27 | The Board Of Trustees Of The Leland Stanford Junior University | Drug therapy for celiac sprue |
| US7202216B2 (en) * | 2002-05-14 | 2007-04-10 | The Board Of Trustees Of The Leland Stanford Junior University | Drug therapy for celiac sprue |
| GB0212885D0 (en) * | 2002-06-05 | 2002-07-17 | Isis Innovation | Therapeutic epitopes and uses thereof |
| EP1563300B1 (en) | 2002-11-20 | 2012-04-18 | The Board Of Trustees Of The Leland Stanford Junior University | Diagnostic method for celiac sprue |
| US7579313B2 (en) | 2003-11-18 | 2009-08-25 | The Board Of Trustees Of The Leland Stanford Junior University | Transglutaminase inhibitors and methods of use thereof |
| US20070185021A1 (en) * | 2004-01-09 | 2007-08-09 | Scott Fraser W | Diabetogenic epitopes |
| US7563864B2 (en) * | 2004-04-26 | 2009-07-21 | Celiac Sprue Research Foundation | Prolyl endopeptidase mediated destruction of T cell epitopes in whole gluten |
| US7534426B2 (en) * | 2004-04-26 | 2009-05-19 | The Board Of Trustees Of The Leland Stanford Junior University | Glutenase enzyme assays |
| US7628985B2 (en) | 2004-04-26 | 2009-12-08 | The Board Of Regents Of The Leland Stanford Junior University | Therapeutic enzyme formulations and uses thereof in celiac sprue and/or dermatitis herpetoformis |
| NZ550600A (en) | 2004-04-28 | 2010-03-26 | Btg Int Ltd | Epitopes related to coeliac disease |
| US10105437B2 (en) | 2004-04-28 | 2018-10-23 | Btg International Limited | Epitopes related to coeliac disease |
| AU2011247868B2 (en) * | 2004-04-28 | 2014-05-22 | Btg International Limited | Epitopes related to coeliac disease |
| EP1612558A1 (en) | 2004-06-30 | 2006-01-04 | Academisch Ziekenhuis Leiden | Method for detecting gluten |
| WO2007105024A1 (en) * | 2006-03-15 | 2007-09-20 | Isocell Pharma S.A. | Pharmaceutical compositions comprising sods and prolamine based peptide fragments |
| US7576040B2 (en) * | 2007-01-11 | 2009-08-18 | Halliburton Energy Services, Inc. | Cement compositions comprising humic acid grafted fluid loss control additives |
| US8778338B2 (en) | 2007-03-16 | 2014-07-15 | The Board Of Trustees Of The Leland Stanford Junior University | Combination enzyme therapy for digestion of dietary gluten |
| BRPI0815474B1 (pt) | 2007-08-13 | 2021-04-13 | Commonwealth Scientific And Industrial Research Organisation | Método para produzir um alimento ou bebida à base de malte apropriado para consumo por um indivíduo com doença celíaca |
| JP6017422B2 (ja) | 2010-08-10 | 2016-11-02 | エコール・ポリテクニーク・フェデラル・ドゥ・ローザンヌ(ウペエフエル)Ecole Polytechnique Federale de Lausanne (EPFL) | 赤血球結合療法 |
| US9517257B2 (en) | 2010-08-10 | 2016-12-13 | Ecole Polytechnique Federale De Lausanne (Epfl) | Erythrocyte-binding therapeutics |
| US9850296B2 (en) | 2010-08-10 | 2017-12-26 | Ecole Polytechnique Federale De Lausanne (Epfl) | Erythrocyte-binding therapeutics |
| JP5937106B2 (ja) * | 2011-01-20 | 2016-06-22 | サイレックス ラボラトリーズ,エルエルシー | グルテン感受性の検出およびグルテン感受性とセリアック病を鑑別するための方法ならびに装置 |
| US20140037661A1 (en) * | 2011-02-08 | 2014-02-06 | Phadia Ab | Wheat Antigens and Peptides for Diagnosis of Wheat Induced Hypersensitivity |
| US9629848B2 (en) | 2011-05-26 | 2017-04-25 | The Regents Of The University Of Colorado, A Body Corporate | Compounds that modulate autoimmunity and methods of using the same |
| US20160091491A1 (en) * | 2013-05-02 | 2016-03-31 | The Board Of Trustees Of The Leland Stanford Junior University | Methods for diagnosis of celiac disease |
| US20160145636A1 (en) * | 2013-05-08 | 2016-05-26 | Jm Biologicals | Compositions and methods for the production of gluten free food products |
| EP2997368B1 (en) * | 2013-05-14 | 2019-01-02 | Oslo Universitetssykehus HF | Detection of gluten-specific t-cells |
| US10953101B2 (en) | 2014-02-21 | 2021-03-23 | École Polytechnique Fédérale De Lausanne (Epfl) | Glycotargeting therapeutics |
| ES2874884T3 (es) | 2014-02-21 | 2021-11-05 | Ecole Polytechnique Fed De Lausanne Epfl Epfl Tto | Compuestos terapéuticos dirigidos a la glucosa |
| US10046056B2 (en) | 2014-02-21 | 2018-08-14 | École Polytechnique Fédérale De Lausanne (Epfl) | Glycotargeting therapeutics |
| US10946079B2 (en) | 2014-02-21 | 2021-03-16 | Ecole Polytechnique Federale De Lausanne | Glycotargeting therapeutics |
| EP3134735A4 (en) * | 2014-04-24 | 2018-06-20 | Immusant Inc. | Methods of measuring antigen-specific t cells |
| AU2015323979A1 (en) | 2014-09-29 | 2017-05-18 | Immusant, Inc. | Use of HLA genetic status to assess or select treatment of celiac disease |
| CA2968422A1 (en) | 2014-11-21 | 2016-05-26 | Immusant, Inc. | Peptides for use in treatment and diagnosis of type 1 diabetes |
| WO2016115253A1 (en) | 2015-01-14 | 2016-07-21 | The Regents Of The University Ofcolordo, A Body Corporate | Insulin mimotopes and methods of using the same |
| DE102015204012A1 (de) | 2015-03-05 | 2016-09-08 | Clariant International Ltd. | SCR-Katalysator mit verbesserter Haftung |
| AU2017236977B2 (en) | 2016-03-24 | 2022-05-26 | Immunomolecular Therapeutics, Inc. | Methods of treating autoimmune disease |
| CA3035484A1 (en) * | 2016-09-01 | 2018-03-08 | Cellectis | Methods for altering amino acid content in plants |
| US11253579B2 (en) | 2017-06-16 | 2022-02-22 | The University Of Chicago | Compositions and methods for inducing immune tolerance |
| US11052060B2 (en) | 2018-02-12 | 2021-07-06 | The Regents Of The University Of Colorado, A Body Corporate | Compounds and methods for treating autoimmunity |
| US11013707B2 (en) | 2018-03-23 | 2021-05-25 | The Regents Of The University Of Colorado, A Body Corporate | Administration of oral methyldopa |
| CN110128549B (zh) * | 2019-05-27 | 2021-07-06 | 深圳市亚辉龙生物科技股份有限公司 | 脱酰胺基麦胶蛋白多肽重组抗原、重组抗原表达基因、重组表达载体及其制备方法和应用 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0905518A1 (en) * | 1997-09-23 | 1999-03-31 | Academisch Ziekenhuis Leiden | Peptides specific for gluten-sensitive T-cells and use thereof |
Family Cites Families (82)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4459355A (en) | 1982-07-12 | 1984-07-10 | International Paper Company | Method for transforming plant cells |
| US4536475A (en) | 1982-10-05 | 1985-08-20 | Phytogen | Plant vector |
| NL8300698A (nl) | 1983-02-24 | 1984-09-17 | Univ Leiden | Werkwijze voor het inbouwen van vreemd dna in het genoom van tweezaadlobbige planten; agrobacterium tumefaciens bacterien en werkwijze voor het produceren daarvan; planten en plantecellen met gewijzigde genetische eigenschappen; werkwijze voor het bereiden van chemische en/of farmaceutische produkten. |
| JPS6047683A (ja) * | 1983-08-24 | 1985-03-15 | Kirin Brewery Co Ltd | プロモ−タ− |
| US4945050A (en) | 1984-11-13 | 1990-07-31 | Cornell Research Foundation, Inc. | Method for transporting substances into living cells and tissues and apparatus therefor |
| US5036006A (en) | 1984-11-13 | 1991-07-30 | Cornell Research Foundation, Inc. | Method for transporting substances into living cells and tissues and apparatus therefor |
| US5100792A (en) | 1984-11-13 | 1992-03-31 | Cornell Research Foundation, Inc. | Method for transporting substances into living cells and tissues |
| US4943674A (en) | 1987-05-26 | 1990-07-24 | Calgene, Inc. | Fruit specific transcriptional factors |
| DK162399C (da) | 1986-01-28 | 1992-03-23 | Danisco | Fremgangsmaade til ekspression af gener i baelgplanteceller, dna-fragment, rekombineret dna-fragment samt plasmid til brug ved udoevelsen af fremgangsmaaden |
| DE3765449D1 (de) | 1986-03-11 | 1990-11-15 | Plant Genetic Systems Nv | Durch gentechnologie erhaltene und gegen glutaminsynthetase-inhibitoren resistente pflanzenzellen. |
| US5107065A (en) * | 1986-03-28 | 1992-04-21 | Calgene, Inc. | Anti-sense regulation of gene expression in plant cells |
| US5187073A (en) | 1986-06-30 | 1993-02-16 | The University Of Toledo | Process for transforming gramineae and the products thereof |
| US5177010A (en) | 1986-06-30 | 1993-01-05 | University Of Toledo | Process for transforming corn and the products thereof |
| NZ221259A (en) | 1986-07-31 | 1990-05-28 | Calgene Inc | Seed specific transcriptional regulation |
| EP0267159A3 (de) | 1986-11-07 | 1990-05-02 | Ciba-Geigy Ag | Verfahren zur genetischen Modifikation monokotyler Pflanzen |
| US4866247A (en) | 1986-12-11 | 1989-09-12 | The Lincoln Electric Company | Apparatus and method of short circuiting arc welding |
| US4971908A (en) | 1987-05-26 | 1990-11-20 | Monsanto Company | Glyphosate-tolerant 5-enolpyruvyl-3-phosphoshikimate synthase |
| US5356799A (en) * | 1988-02-03 | 1994-10-18 | Pioneer Hi-Bred International, Inc. | Antisense gene systems of pollination control for hybrid seed production |
| US5371014A (en) | 1988-02-12 | 1994-12-06 | Daicel Chemical Industries, Ltd. | Process for the production of optically active 2-hydroxy acid esters using microbes to reduce the 2-oxo precursor |
| US5179022A (en) | 1988-02-29 | 1993-01-12 | E. I. Du Pont De Nemours & Co. | Biolistic apparatus for delivering substances into cells and tissues in a non-lethal manner |
| US5614395A (en) * | 1988-03-08 | 1997-03-25 | Ciba-Geigy Corporation | Chemically regulatable and anti-pathogenic DNA sequences and uses thereof |
| US5250515A (en) | 1988-04-11 | 1993-10-05 | Monsanto Company | Method for improving the efficacy of insect toxins |
| US5565346A (en) | 1988-07-27 | 1996-10-15 | Calgene, Inc. | Transformation and regeneration system for legumes |
| US5428146A (en) * | 1988-11-07 | 1995-06-27 | Max-Planck-Gesellschaft Zur Forderung | Wound-stimulated DNA-sequence from solanum tuberosum and its use |
| US5110732A (en) | 1989-03-14 | 1992-05-05 | The Rockefeller University | Selective gene expression in plants |
| US5086169A (en) | 1989-04-20 | 1992-02-04 | The Research Foundation Of State University Of New York | Isolated pollen-specific promoter of corn |
| US5629183A (en) * | 1989-05-08 | 1997-05-13 | The United States Of America As Represented By The Secretary Of Agriculture | Plant transformation by gene transfer into pollen |
| US5097025A (en) | 1989-08-01 | 1992-03-17 | The Rockefeller University | Plant promoters |
| US5550318A (en) | 1990-04-17 | 1996-08-27 | Dekalb Genetics Corporation | Methods and compositions for the production of stably transformed, fertile monocot plants and cells thereof |
| EP0814166A3 (en) | 1989-08-09 | 1998-05-13 | DeKalb Genetics Corporation | Methods and compositions for the production of stably transformed fertile monocot plants and cells thereof |
| US7705215B1 (en) | 1990-04-17 | 2010-04-27 | Dekalb Genetics Corporation | Methods and compositions for the production of stably transformed, fertile monocot plants and cells thereof |
| AU652349B2 (en) | 1989-10-27 | 1994-08-25 | Salk Institute For Biological Studies, The | Glutamate receptor compositions and methods |
| US5589583A (en) | 1990-01-11 | 1996-12-31 | Monsanto Company | Plant promoter |
| CA2074355C (en) | 1990-01-22 | 2008-10-28 | Ronald C. Lundquist | Method of producing fertile transgenic corn plants |
| US5484956A (en) | 1990-01-22 | 1996-01-16 | Dekalb Genetics Corporation | Fertile transgenic Zea mays plant comprising heterologous DNA encoding Bacillus thuringiensis endotoxin |
| EP0442174A1 (en) | 1990-02-13 | 1991-08-21 | Pioneer Hi-Bred International, Inc. | Stable transformation of plant cells |
| US5618988A (en) | 1990-03-02 | 1997-04-08 | Amoco Corporation | Enhanced carotenoid accumulation in storage organs of genetically engineered plants |
| US5204253A (en) | 1990-05-29 | 1993-04-20 | E. I. Du Pont De Nemours And Company | Method and apparatus for introducing biological substances into living cells |
| US5187267A (en) | 1990-06-19 | 1993-02-16 | Calgene, Inc. | Plant proteins, promoters, coding sequences and use |
| CA2083948C (en) | 1990-06-25 | 2001-05-15 | Ganesh M. Kishore | Glyphosate tolerant plants |
| NZ239977A (en) | 1990-11-14 | 1993-08-26 | Pioneer Hi Bred Int | Transforming plants by the use of agrobacterium |
| US5932782A (en) | 1990-11-14 | 1999-08-03 | Pioneer Hi-Bred International, Inc. | Plant transformation method using agrobacterium species adhered to microprojectiles |
| EP0559742A1 (en) | 1990-11-26 | 1993-09-15 | E.I. Du Pont De Nemours And Company | Herbicidal oxazine ethers |
| US5459252A (en) | 1991-01-31 | 1995-10-17 | North Carolina State University | Root specific gene promoter |
| EP0570422B1 (en) | 1991-02-07 | 2007-12-19 | Bayer BioScience N.V. | Stamen-specific promoters from corn |
| IL101508A0 (en) | 1991-04-08 | 1992-12-30 | Rhone Poulenc Agrochimie | Chimeric plant genes based on upstream regulatory elements of helianthinin |
| EP0539563B2 (en) | 1991-05-15 | 2008-01-23 | Monsanto Technology LLC | Method of creating a transformed rice plant |
| US5405765A (en) | 1991-08-23 | 1995-04-11 | University Of Florida | Method for the production of transgenic wheat plants |
| US5591616A (en) | 1992-07-07 | 1997-01-07 | Japan Tobacco, Inc. | Method for transforming monocotyledons |
| EP0669976B1 (en) | 1992-10-29 | 1999-06-16 | Medical Research Council | Screening method using transcription factor DP-1 |
| US5389226A (en) | 1992-12-17 | 1995-02-14 | Amorphous Technologies International, Inc. | Electrodeposition of nickel-tungsten amorphous and microcrystalline coatings |
| TW360548B (en) | 1993-04-08 | 1999-06-11 | Powderject Res Ltd | Products for therapeutic use |
| WO1994025613A1 (en) | 1993-05-03 | 1994-11-10 | Cornell Research Foundation, Inc. | Isolated dna elements that direct pistil-specific and anther-specific gene expression and methods of using same |
| US5670349A (en) | 1993-08-02 | 1997-09-23 | Virginia Tech Intellectual Properties, Inc. | HMG2 promoter expression system and post-harvest production of gene products in plants and plant cell cultures |
| WO1995006722A1 (fr) | 1993-09-03 | 1995-03-09 | Japan Tobacco Inc. | Procede permettant de transformer une monocotyledone avec un scutellum d'embryon immature |
| WO1995019030A1 (en) * | 1994-01-05 | 1995-07-13 | Pois, Inc. | Apparatus and method for a personal onboard information system |
| US5495007A (en) | 1994-04-29 | 1996-02-27 | Thompson; Gary A. | Phloem-specific promoter |
| US5459007A (en) * | 1994-05-26 | 1995-10-17 | Xerox Corporation | Liquid developer compositions with block copolymers |
| US5633363A (en) * | 1994-06-03 | 1997-05-27 | Iowa State University, Research Foundation In | Root preferential promoter |
| US5646333A (en) | 1994-09-02 | 1997-07-08 | Drexel University | Plant promoter useful for directing the expression of foreign proteins to the plant epidermis |
| HUT76355A (en) | 1995-11-24 | 1997-08-28 | Bay Zoltan Alkalmazott Kutatas | Plant gene-expression vector family based on dna fragments regulating alfalfa h3 histon gene variant (ms h3g1) |
| US6036983A (en) | 1996-05-20 | 2000-03-14 | Novo Nordisk A/S | Method of obtaining protein hydrolysates |
| WO1997047647A1 (es) | 1996-06-13 | 1997-12-18 | Consejo Superior De Investigaciones Cientificas | Proteinas vegetales |
| GB9624456D0 (en) | 1996-11-25 | 1997-01-15 | Isis Innovation | Assay method |
| US5959175A (en) | 1997-04-09 | 1999-09-28 | Thomas; Terry L. | Sunflower albumin 5' regulatory region for the modification of plant seed lipid composition |
| US5977436A (en) | 1997-04-09 | 1999-11-02 | Rhone Poulenc Agrochimie | Oleosin 5' regulatory region for the modification of plant seed lipid composition |
| ES2132025B1 (es) | 1997-06-12 | 2000-12-01 | Consejo Superior Investigacion | Proteinas urag de las plantas. |
| US6100450A (en) | 1997-10-22 | 2000-08-08 | Rhone-Poulenc Agrochimie | Seed specific promoters based on arabidopsis genes |
| US6232445B1 (en) * | 1997-10-29 | 2001-05-15 | Sunol Molecular Corporation | Soluble MHC complexes and methods of use thereof |
| EP1068335A2 (en) | 1998-04-09 | 2001-01-17 | E.I. Dupont De Nemours And Company | Cell cycle regulatory proteins |
| JP2002514423A (ja) | 1998-05-08 | 2002-05-21 | コンセホ・スペリオル・デ・インヴェスティガシオンス・シエンティフィカス | 組換え植物e2fペプチドを発現するトランスジェニック植物細胞 |
| WO2000047614A1 (en) | 1999-02-12 | 2000-08-17 | Pioneer Hi-Bred International, Inc. | Transgenic plants with modified expression of the dp protein |
| GB9923306D0 (en) | 1999-10-01 | 1999-12-08 | Isis Innovation | Diagnostic and therapeutic epitope, and transgenic plant |
| EP1377604B1 (en) | 2001-04-12 | 2014-12-31 | Academisch Ziekenhuis Leiden | Methods and means for use of hla-dq restricted t-cell receptors and hla-dq-binding prolamine-derived peptides |
| EP1454291B1 (en) * | 2001-12-11 | 2007-08-08 | Tagsys SA | Secure data tagging systems |
| EP1332760A1 (en) | 2002-02-04 | 2003-08-06 | Academisch Ziekenhuis Leiden | Novel epitopes for celiac disease and autoimmune diseases, methods for detecting those and novel non-antigenic food compounds |
| DE60336754D1 (de) * | 2002-02-14 | 2011-05-26 | Univ R | Enzymbehandlung von nahrungsmitteln für zöliakie-sprue |
| US7202216B2 (en) | 2002-05-14 | 2007-04-10 | The Board Of Trustees Of The Leland Stanford Junior University | Drug therapy for celiac sprue |
| CA2487247A1 (en) | 2002-05-14 | 2003-11-27 | The Board Of Trustees Of The Leland Stanford Junior University | Drug therapy for celiac sprue |
| GB0212885D0 (en) | 2002-06-05 | 2002-07-17 | Isis Innovation | Therapeutic epitopes and uses thereof |
| EP1563300B1 (en) | 2002-11-20 | 2012-04-18 | The Board Of Trustees Of The Leland Stanford Junior University | Diagnostic method for celiac sprue |
| US7144567B2 (en) * | 2002-12-16 | 2006-12-05 | Erling Jim Andersen | Renewable energy carrier system and method |
-
1999
- 1999-10-01 GB GBGB9923306.6A patent/GB9923306D0/en not_active Ceased
-
2000
- 2000-10-02 DE DE60026332T patent/DE60026332T2/de not_active Expired - Lifetime
- 2000-10-02 US US10/089,700 patent/US7144569B1/en not_active Expired - Lifetime
- 2000-10-02 AT AT05027922T patent/ATE449965T1/de active
- 2000-10-02 AT AT00964460T patent/ATE319091T1/de active
- 2000-10-02 PT PT05027922T patent/PT1672368E/pt unknown
- 2000-10-02 AU AU75394/00A patent/AU782262B2/en not_active Expired
- 2000-10-02 WO PCT/GB2000/003760 patent/WO2001025793A2/en active IP Right Grant
- 2000-10-02 EP EP00964460A patent/EP1218751B1/en not_active Expired - Lifetime
- 2000-10-02 PT PT00964460T patent/PT1218751E/pt unknown
- 2000-10-02 JP JP2001528704A patent/JP4932112B2/ja not_active Expired - Lifetime
- 2000-10-02 ES ES00964460T patent/ES2256042T3/es not_active Expired - Lifetime
- 2000-10-02 DK DK00964460T patent/DK1218751T3/da active
- 2000-10-02 DK DK05027922T patent/DK1672368T3/da active
- 2000-10-02 ES ES05027922T patent/ES2335895T3/es not_active Expired - Lifetime
- 2000-10-02 CA CA2386089A patent/CA2386089C/en not_active Expired - Lifetime
- 2000-10-02 EP EP05027922A patent/EP1672368B1/en not_active Expired - Lifetime
- 2000-10-02 MX MXPA02003295A patent/MXPA02003295A/es active IP Right Grant
- 2000-10-02 DE DE60043402T patent/DE60043402D1/de not_active Expired - Lifetime
-
2006
- 2006-05-29 CY CY20061100681T patent/CY1105282T1/el unknown
- 2006-08-28 HK HK06109536.6A patent/HK1088068A1/xx not_active IP Right Cessation
- 2006-11-03 US US11/556,218 patent/US7888460B2/en not_active Expired - Lifetime
- 2006-11-03 US US11/556,208 patent/US8329144B2/en not_active Expired - Lifetime
-
2010
- 2010-02-24 CY CY20101100177T patent/CY1109837T1/el unknown
- 2010-06-15 JP JP2010135844A patent/JP5371890B2/ja not_active Expired - Lifetime
-
2012
- 2012-11-08 US US13/672,183 patent/US20130318648A1/en not_active Abandoned
-
2013
- 2013-02-01 JP JP2013018731A patent/JP6139154B2/ja not_active Expired - Lifetime
-
2016
- 2016-03-17 JP JP2016053617A patent/JP2016164169A/ja active Pending
-
2017
- 2017-04-06 US US15/481,007 patent/US20180057547A1/en not_active Abandoned
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0905518A1 (en) * | 1997-09-23 | 1999-03-31 | Academisch Ziekenhuis Leiden | Peptides specific for gluten-sensitive T-cells and use thereof |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2013126991A (ja) * | 1999-10-01 | 2013-06-27 | Isis Innovation Ltd | 診断及び治療用エピトープ並びにトランスジェニック植物 |
| US9464120B2 (en) | 2008-11-30 | 2016-10-11 | Immusant, Inc. | Compositions for treatment of celiac disease |
| US10449228B2 (en) | 2013-09-10 | 2019-10-22 | Immusant, Inc. | Dosage of a gluten peptide composition |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4932112B2 (ja) | 診断及び治療用エピトープ並びにトランスジェニック植物 | |
| JP6438423B2 (ja) | 治療用エピトープ及びそれらの使用 | |
| JP5946231B2 (ja) | セリアック病に関連するエピトープ | |
| AU2016273885C1 (en) | Epitopes related to coeliac disease | |
| ANDERSON et al. | Patent 2386089 Summary | |
| ANDERSON et al. | Patent 2960504 Summary |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070928 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20070928 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20091215 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20100217 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20100224 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100615 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20110104 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110404 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20120117 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20120215 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 4932112 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20150224 Year of fee payment: 3 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| S531 | Written request for registration of change of domicile |
Free format text: JAPANESE INTERMEDIATE CODE: R313531 |
|
| S533 | Written request for registration of change of name |
Free format text: JAPANESE INTERMEDIATE CODE: R313533 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |