JP4722480B2 - 糖タンパク質viドメインを含むイムノアドヘシン - Google Patents
糖タンパク質viドメインを含むイムノアドヘシン Download PDFInfo
- Publication number
- JP4722480B2 JP4722480B2 JP2004511349A JP2004511349A JP4722480B2 JP 4722480 B2 JP4722480 B2 JP 4722480B2 JP 2004511349 A JP2004511349 A JP 2004511349A JP 2004511349 A JP2004511349 A JP 2004511349A JP 4722480 B2 JP4722480 B2 JP 4722480B2
- Authority
- JP
- Japan
- Prior art keywords
- gpvi
- collagen
- fusion protein
- platelet
- protein
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 102000003886 Glycoproteins Human genes 0.000 title claims abstract description 36
- 108090000288 Glycoproteins Proteins 0.000 title claims abstract description 36
- 229920001436 collagen Polymers 0.000 claims abstract description 210
- 102000008186 Collagen Human genes 0.000 claims abstract description 190
- 108010035532 Collagen Proteins 0.000 claims abstract description 190
- 102000037865 fusion proteins Human genes 0.000 claims abstract description 125
- 108020001507 fusion proteins Proteins 0.000 claims abstract description 125
- 238000000034 method Methods 0.000 claims abstract description 68
- 108090000765 processed proteins & peptides Proteins 0.000 claims abstract description 16
- 229920001184 polypeptide Polymers 0.000 claims abstract description 15
- 102000004196 processed proteins & peptides Human genes 0.000 claims abstract description 15
- 108060003951 Immunoglobulin Proteins 0.000 claims abstract description 12
- 102000018358 immunoglobulin Human genes 0.000 claims abstract description 12
- 125000003275 alpha amino acid group Chemical group 0.000 claims abstract 9
- 102000004169 proteins and genes Human genes 0.000 claims description 46
- 108090000623 proteins and genes Proteins 0.000 claims description 46
- 208000010110 spontaneous platelet aggregation Diseases 0.000 claims description 45
- 150000001875 compounds Chemical class 0.000 claims description 36
- 230000000694 effects Effects 0.000 claims description 34
- 238000012360 testing method Methods 0.000 claims description 34
- 239000003112 inhibitor Substances 0.000 claims description 33
- 206010012601 diabetes mellitus Diseases 0.000 claims description 31
- 238000000338 in vitro Methods 0.000 claims description 30
- 230000003902 lesion Effects 0.000 claims description 29
- 201000001320 Atherosclerosis Diseases 0.000 claims description 25
- 206010003210 Arteriosclerosis Diseases 0.000 claims description 24
- 208000037260 Atherosclerotic Plaque Diseases 0.000 claims description 21
- 238000012216 screening Methods 0.000 claims description 21
- 238000011282 treatment Methods 0.000 claims description 21
- 150000007523 nucleic acids Chemical class 0.000 claims description 19
- 150000001413 amino acids Chemical class 0.000 claims description 18
- 239000008194 pharmaceutical composition Substances 0.000 claims description 18
- 102100038394 Platelet glycoprotein VI Human genes 0.000 claims description 14
- 230000003143 atherosclerotic effect Effects 0.000 claims description 14
- 108020004707 nucleic acids Proteins 0.000 claims description 13
- 102000039446 nucleic acids Human genes 0.000 claims description 13
- 238000002360 preparation method Methods 0.000 claims description 12
- 208000011580 syndromic disease Diseases 0.000 claims description 12
- 230000001404 mediated effect Effects 0.000 claims description 11
- 238000001361 intraarterial administration Methods 0.000 claims description 10
- 230000010118 platelet activation Effects 0.000 claims description 9
- 230000002265 prevention Effects 0.000 claims description 8
- 239000000178 monomer Substances 0.000 claims description 7
- 208000010125 myocardial infarction Diseases 0.000 claims description 7
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims description 6
- 238000001990 intravenous administration Methods 0.000 claims description 6
- 206010003178 Arterial thrombosis Diseases 0.000 claims description 5
- 238000012217 deletion Methods 0.000 claims description 5
- 230000037430 deletion Effects 0.000 claims description 5
- 239000013598 vector Substances 0.000 claims description 5
- 208000004476 Acute Coronary Syndrome Diseases 0.000 claims description 4
- 238000007792 addition Methods 0.000 claims description 4
- 239000002552 dosage form Substances 0.000 claims description 4
- 230000002163 immunogen Effects 0.000 claims description 3
- 208000034189 Sclerosis Diseases 0.000 claims description 2
- 125000000539 amino acid group Chemical group 0.000 claims description 2
- 210000001367 artery Anatomy 0.000 claims description 2
- 238000007912 intraperitoneal administration Methods 0.000 claims description 2
- 238000004519 manufacturing process Methods 0.000 claims description 2
- 101710194982 Platelet glycoprotein VI Proteins 0.000 claims 7
- 239000000710 homodimer Substances 0.000 claims 6
- 238000006467 substitution reaction Methods 0.000 claims 3
- 108010062266 glycyl-glycyl-argininal Proteins 0.000 claims 2
- HQRHFUYMGCHHJS-LURJTMIESA-N Gly-Gly-Arg Chemical compound NCC(=O)NCC(=O)N[C@H](C(O)=O)CCCN=C(N)N HQRHFUYMGCHHJS-LURJTMIESA-N 0.000 claims 1
- 230000000879 anti-atherosclerotic effect Effects 0.000 claims 1
- 238000007920 subcutaneous administration Methods 0.000 claims 1
- 230000008569 process Effects 0.000 abstract description 18
- 239000000539 dimer Substances 0.000 abstract description 15
- 238000001727 in vivo Methods 0.000 description 79
- 241000699670 Mus sp. Species 0.000 description 76
- 230000002776 aggregation Effects 0.000 description 59
- 238000004220 aggregation Methods 0.000 description 59
- 230000003993 interaction Effects 0.000 description 55
- 208000024248 Vascular System injury Diseases 0.000 description 48
- 208000012339 Vascular injury Diseases 0.000 description 48
- 102000005962 receptors Human genes 0.000 description 47
- 108020003175 receptors Proteins 0.000 description 47
- 208000007536 Thrombosis Diseases 0.000 description 39
- 210000004027 cell Anatomy 0.000 description 35
- 210000004369 blood Anatomy 0.000 description 32
- 239000008280 blood Substances 0.000 description 32
- 235000018102 proteins Nutrition 0.000 description 30
- 230000005764 inhibitory process Effects 0.000 description 29
- 230000015572 biosynthetic process Effects 0.000 description 28
- 210000001715 carotid artery Anatomy 0.000 description 27
- 208000032843 Hemorrhage Diseases 0.000 description 23
- 208000034158 bleeding Diseases 0.000 description 23
- 230000000740 bleeding effect Effects 0.000 description 23
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 22
- 230000001965 increasing effect Effects 0.000 description 22
- 239000002953 phosphate buffered saline Substances 0.000 description 22
- 241000699666 Mus <mouse, genus> Species 0.000 description 20
- 230000001154 acute effect Effects 0.000 description 20
- 210000003038 endothelium Anatomy 0.000 description 20
- 108010047303 von Willebrand Factor Proteins 0.000 description 20
- 230000037396 body weight Effects 0.000 description 19
- 230000002950 deficient Effects 0.000 description 19
- 230000006870 function Effects 0.000 description 18
- 102100036537 von Willebrand factor Human genes 0.000 description 18
- 241001465754 Metazoa Species 0.000 description 16
- 230000014509 gene expression Effects 0.000 description 16
- 108010064773 platelet membrane glycoprotein VI Proteins 0.000 description 16
- 238000002965 ELISA Methods 0.000 description 15
- 102000003992 Peroxidases Human genes 0.000 description 15
- 230000004913 activation Effects 0.000 description 15
- 239000003814 drug Substances 0.000 description 15
- 108040007629 peroxidase activity proteins Proteins 0.000 description 15
- 238000000799 fluorescence microscopy Methods 0.000 description 14
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 13
- 230000001464 adherent effect Effects 0.000 description 13
- 230000002401 inhibitory effect Effects 0.000 description 13
- 210000004623 platelet-rich plasma Anatomy 0.000 description 13
- 239000003446 ligand Substances 0.000 description 12
- 238000005259 measurement Methods 0.000 description 12
- 210000004204 blood vessel Anatomy 0.000 description 11
- 238000005119 centrifugation Methods 0.000 description 11
- 230000001419 dependent effect Effects 0.000 description 11
- 230000002829 reductive effect Effects 0.000 description 11
- 239000000243 solution Substances 0.000 description 11
- 230000002792 vascular Effects 0.000 description 11
- 238000010171 animal model Methods 0.000 description 10
- 210000001168 carotid artery common Anatomy 0.000 description 10
- 230000003511 endothelial effect Effects 0.000 description 10
- 238000002474 experimental method Methods 0.000 description 10
- 102000006495 integrins Human genes 0.000 description 10
- 108010044426 integrins Proteins 0.000 description 10
- 230000005012 migration Effects 0.000 description 10
- 238000013508 migration Methods 0.000 description 10
- 230000000638 stimulation Effects 0.000 description 10
- 238000005406 washing Methods 0.000 description 10
- 241000283707 Capra Species 0.000 description 9
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 9
- 208000011775 arteriosclerosis disease Diseases 0.000 description 9
- 238000012512 characterization method Methods 0.000 description 9
- 239000007928 intraperitoneal injection Substances 0.000 description 9
- 239000000463 material Substances 0.000 description 9
- 239000011159 matrix material Substances 0.000 description 9
- 230000007246 mechanism Effects 0.000 description 9
- 239000000203 mixture Substances 0.000 description 9
- 230000010412 perfusion Effects 0.000 description 9
- 241000701161 unidentified adenovirus Species 0.000 description 9
- 108010048623 Collagen Receptors Proteins 0.000 description 8
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 8
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 8
- 239000000872 buffer Substances 0.000 description 8
- 230000001684 chronic effect Effects 0.000 description 8
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 8
- 239000012634 fragment Substances 0.000 description 8
- 230000007774 longterm Effects 0.000 description 8
- 102000012422 Collagen Type I Human genes 0.000 description 7
- 108010022452 Collagen Type I Proteins 0.000 description 7
- 108010052285 Membrane Proteins Proteins 0.000 description 7
- 241000700159 Rattus Species 0.000 description 7
- 238000011156 evaluation Methods 0.000 description 7
- 230000000977 initiatory effect Effects 0.000 description 7
- 239000011780 sodium chloride Substances 0.000 description 7
- 238000003786 synthesis reaction Methods 0.000 description 7
- 229960001134 von willebrand factor Drugs 0.000 description 7
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 6
- 239000007995 HEPES buffer Substances 0.000 description 6
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 6
- 102000018697 Membrane Proteins Human genes 0.000 description 6
- 108091028043 Nucleic acid sequence Proteins 0.000 description 6
- 102100023472 P-selectin Human genes 0.000 description 6
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 6
- 230000002785 anti-thrombosis Effects 0.000 description 6
- 239000003146 anticoagulant agent Substances 0.000 description 6
- 238000006243 chemical reaction Methods 0.000 description 6
- 230000006378 damage Effects 0.000 description 6
- 231100000673 dose–response relationship Toxicity 0.000 description 6
- 239000008187 granular material Substances 0.000 description 6
- 238000011534 incubation Methods 0.000 description 6
- 239000013612 plasmid Substances 0.000 description 6
- 239000000523 sample Substances 0.000 description 6
- 230000001052 transient effect Effects 0.000 description 6
- -1 GPVI Proteins 0.000 description 5
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 5
- 101000917826 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor II-a Proteins 0.000 description 5
- 101000917824 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor II-b Proteins 0.000 description 5
- 101000621371 Homo sapiens WD and tetratricopeptide repeats protein 1 Proteins 0.000 description 5
- 101000892274 Human adenovirus C serotype 2 Adenovirus death protein Proteins 0.000 description 5
- 102100029204 Low affinity immunoglobulin gamma Fc region receptor II-a Human genes 0.000 description 5
- 101000820656 Rattus norvegicus Seminal vesicle secretory protein 4 Proteins 0.000 description 5
- 208000027418 Wounds and injury Diseases 0.000 description 5
- 235000001014 amino acid Nutrition 0.000 description 5
- 230000004087 circulation Effects 0.000 description 5
- 239000006059 cover glass Substances 0.000 description 5
- 239000012228 culture supernatant Substances 0.000 description 5
- 239000003937 drug carrier Substances 0.000 description 5
- 210000002889 endothelial cell Anatomy 0.000 description 5
- 230000009843 endothelial lesion Effects 0.000 description 5
- 238000003384 imaging method Methods 0.000 description 5
- 208000015181 infectious disease Diseases 0.000 description 5
- 208000014674 injury Diseases 0.000 description 5
- 230000007505 plaque formation Effects 0.000 description 5
- 230000036470 plasma concentration Effects 0.000 description 5
- 230000007115 recruitment Effects 0.000 description 5
- 238000004626 scanning electron microscopy Methods 0.000 description 5
- 239000000126 substance Substances 0.000 description 5
- 239000006228 supernatant Substances 0.000 description 5
- 238000002560 therapeutic procedure Methods 0.000 description 5
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 5
- 102000013918 Apolipoproteins E Human genes 0.000 description 4
- 108010025628 Apolipoproteins E Proteins 0.000 description 4
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 4
- 241000283690 Bos taurus Species 0.000 description 4
- 208000010867 Carotid Artery injury Diseases 0.000 description 4
- 102000009268 Collagen Receptors Human genes 0.000 description 4
- 108020004414 DNA Proteins 0.000 description 4
- 108010049003 Fibrinogen Proteins 0.000 description 4
- 102000008946 Fibrinogen Human genes 0.000 description 4
- SXRSQZLOMIGNAQ-UHFFFAOYSA-N Glutaraldehyde Chemical compound O=CCCCC=O SXRSQZLOMIGNAQ-UHFFFAOYSA-N 0.000 description 4
- 101000622137 Homo sapiens P-selectin Proteins 0.000 description 4
- 101000777658 Homo sapiens Platelet glycoprotein 4 Proteins 0.000 description 4
- 102100025305 Integrin alpha-2 Human genes 0.000 description 4
- 102100031574 Platelet glycoprotein 4 Human genes 0.000 description 4
- 239000004698 Polyethylene Substances 0.000 description 4
- 208000006011 Stroke Diseases 0.000 description 4
- 239000007983 Tris buffer Substances 0.000 description 4
- 238000004458 analytical method Methods 0.000 description 4
- 238000004873 anchoring Methods 0.000 description 4
- 238000003556 assay Methods 0.000 description 4
- 239000003795 chemical substances by application Substances 0.000 description 4
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 4
- 238000011161 development Methods 0.000 description 4
- 239000006185 dispersion Substances 0.000 description 4
- 229940012952 fibrinogen Drugs 0.000 description 4
- 238000000684 flow cytometry Methods 0.000 description 4
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 4
- 238000002073 fluorescence micrograph Methods 0.000 description 4
- 210000004408 hybridoma Anatomy 0.000 description 4
- 238000003119 immunoblot Methods 0.000 description 4
- 239000007924 injection Substances 0.000 description 4
- 238000002347 injection Methods 0.000 description 4
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 4
- 239000006166 lysate Substances 0.000 description 4
- 239000002609 medium Substances 0.000 description 4
- 239000012071 phase Substances 0.000 description 4
- 230000026731 phosphorylation Effects 0.000 description 4
- 238000006366 phosphorylation reaction Methods 0.000 description 4
- 210000002381 plasma Anatomy 0.000 description 4
- 239000004033 plastic Substances 0.000 description 4
- 229920003023 plastic Polymers 0.000 description 4
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 4
- 239000000758 substrate Substances 0.000 description 4
- 239000000725 suspension Substances 0.000 description 4
- 230000001225 therapeutic effect Effects 0.000 description 4
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 4
- 238000010865 video microscopy Methods 0.000 description 4
- 230000003442 weekly effect Effects 0.000 description 4
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 3
- UAIUNKRWKOVEES-UHFFFAOYSA-N 3,3',5,5'-tetramethylbenzidine Chemical compound CC1=C(N)C(C)=CC(C=2C=C(C)C(N)=C(C)C=2)=C1 UAIUNKRWKOVEES-UHFFFAOYSA-N 0.000 description 3
- 206010003162 Arterial injury Diseases 0.000 description 3
- WVDDGKGOMKODPV-UHFFFAOYSA-N Benzyl alcohol Chemical compound OCC1=CC=CC=C1 WVDDGKGOMKODPV-UHFFFAOYSA-N 0.000 description 3
- 208000024172 Cardiovascular disease Diseases 0.000 description 3
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 3
- 239000004471 Glycine Substances 0.000 description 3
- 101001015004 Homo sapiens Integrin beta-3 Proteins 0.000 description 3
- 102000004877 Insulin Human genes 0.000 description 3
- 108090001061 Insulin Proteins 0.000 description 3
- 108010017642 Integrin alpha2beta1 Proteins 0.000 description 3
- 102100032999 Integrin beta-3 Human genes 0.000 description 3
- 241000283973 Oryctolagus cuniculus Species 0.000 description 3
- 229910019142 PO4 Inorganic materials 0.000 description 3
- 102000015795 Platelet Membrane Glycoproteins Human genes 0.000 description 3
- 108010010336 Platelet Membrane Glycoproteins Proteins 0.000 description 3
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 3
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 238000002835 absorbance Methods 0.000 description 3
- BFNBIHQBYMNNAN-UHFFFAOYSA-N ammonium sulfate Chemical compound N.N.OS(O)(=O)=O BFNBIHQBYMNNAN-UHFFFAOYSA-N 0.000 description 3
- 229910052921 ammonium sulfate Inorganic materials 0.000 description 3
- 235000011130 ammonium sulphate Nutrition 0.000 description 3
- 230000000844 anti-bacterial effect Effects 0.000 description 3
- 239000000427 antigen Substances 0.000 description 3
- 102000036639 antigens Human genes 0.000 description 3
- 108091007433 antigens Proteins 0.000 description 3
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 3
- 239000012148 binding buffer Substances 0.000 description 3
- 230000000903 blocking effect Effects 0.000 description 3
- 230000036765 blood level Effects 0.000 description 3
- 230000008614 cellular interaction Effects 0.000 description 3
- 238000010367 cloning Methods 0.000 description 3
- 239000011248 coating agent Substances 0.000 description 3
- 238000000576 coating method Methods 0.000 description 3
- 230000003247 decreasing effect Effects 0.000 description 3
- 230000007812 deficiency Effects 0.000 description 3
- 235000005911 diet Nutrition 0.000 description 3
- 230000037213 diet Effects 0.000 description 3
- 238000010790 dilution Methods 0.000 description 3
- 239000012895 dilution Substances 0.000 description 3
- 239000002612 dispersion medium Substances 0.000 description 3
- 239000012149 elution buffer Substances 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 239000000835 fiber Substances 0.000 description 3
- GNBHRKFJIUUOQI-UHFFFAOYSA-N fluorescein Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 GNBHRKFJIUUOQI-UHFFFAOYSA-N 0.000 description 3
- 239000011521 glass Substances 0.000 description 3
- 238000013537 high throughput screening Methods 0.000 description 3
- 238000007654 immersion Methods 0.000 description 3
- 230000001976 improved effect Effects 0.000 description 3
- 238000011065 in-situ storage Methods 0.000 description 3
- 239000004615 ingredient Substances 0.000 description 3
- 230000002427 irreversible effect Effects 0.000 description 3
- 208000028867 ischemia Diseases 0.000 description 3
- 239000010410 layer Substances 0.000 description 3
- 238000001000 micrograph Methods 0.000 description 3
- 238000000386 microscopy Methods 0.000 description 3
- 238000006386 neutralization reaction Methods 0.000 description 3
- 239000000825 pharmaceutical preparation Substances 0.000 description 3
- 229940127557 pharmaceutical product Drugs 0.000 description 3
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 3
- 239000010452 phosphate Substances 0.000 description 3
- 239000000843 powder Substances 0.000 description 3
- 238000000159 protein binding assay Methods 0.000 description 3
- 239000012460 protein solution Substances 0.000 description 3
- 238000000746 purification Methods 0.000 description 3
- 229940107685 reopro Drugs 0.000 description 3
- 230000004043 responsiveness Effects 0.000 description 3
- 238000001878 scanning electron micrograph Methods 0.000 description 3
- 239000011734 sodium Substances 0.000 description 3
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 3
- 239000002904 solvent Substances 0.000 description 3
- 238000010186 staining Methods 0.000 description 3
- 238000003756 stirring Methods 0.000 description 3
- 230000007704 transition Effects 0.000 description 3
- 230000005945 translocation Effects 0.000 description 3
- 230000003966 vascular damage Effects 0.000 description 3
- UCTWMZQNUQWSLP-VIFPVBQESA-N (R)-adrenaline Chemical compound CNC[C@H](O)C1=CC=C(O)C(O)=C1 UCTWMZQNUQWSLP-VIFPVBQESA-N 0.000 description 2
- 229930182837 (R)-adrenaline Natural products 0.000 description 2
- 229920000936 Agarose Polymers 0.000 description 2
- 206010002388 Angina unstable Diseases 0.000 description 2
- 208000031104 Arterial Occlusive disease Diseases 0.000 description 2
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 2
- 101000583086 Bunodosoma granuliferum Delta-actitoxin-Bgr2b Proteins 0.000 description 2
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 2
- 208000017667 Chronic Disease Diseases 0.000 description 2
- 108010014754 Chrono-lume Proteins 0.000 description 2
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 2
- 238000011537 Coomassie blue staining Methods 0.000 description 2
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 2
- 108010087819 Fc receptors Proteins 0.000 description 2
- 102000009109 Fc receptors Human genes 0.000 description 2
- 102100022132 High affinity immunoglobulin epsilon receptor subunit gamma Human genes 0.000 description 2
- 108091010847 High affinity immunoglobulin epsilon receptor subunit gamma Proteins 0.000 description 2
- 101001078143 Homo sapiens Integrin alpha-IIb Proteins 0.000 description 2
- 102100025306 Integrin alpha-IIb Human genes 0.000 description 2
- 208000032382 Ischaemic stroke Diseases 0.000 description 2
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- 229930195725 Mannitol Natural products 0.000 description 2
- 241001529936 Murinae Species 0.000 description 2
- 101000782194 Mus musculus von Willebrand factor Proteins 0.000 description 2
- SNIOPGDIGTZGOP-UHFFFAOYSA-N Nitroglycerin Chemical compound [O-][N+](=O)OCC(O[N+]([O-])=O)CO[N+]([O-])=O SNIOPGDIGTZGOP-UHFFFAOYSA-N 0.000 description 2
- 108010035766 P-Selectin Proteins 0.000 description 2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- 108010035030 Platelet Membrane Glycoprotein IIb Proteins 0.000 description 2
- 102100038411 Platelet glycoprotein V Human genes 0.000 description 2
- 101710195077 Platelet glycoprotein V Proteins 0.000 description 2
- 239000002202 Polyethylene glycol Substances 0.000 description 2
- 229920001213 Polysorbate 20 Polymers 0.000 description 2
- PXIPVTKHYLBLMZ-UHFFFAOYSA-N Sodium azide Chemical compound [Na+].[N-]=[N+]=[N-] PXIPVTKHYLBLMZ-UHFFFAOYSA-N 0.000 description 2
- 108090000190 Thrombin Proteins 0.000 description 2
- 208000035896 Twin-reversed arterial perfusion sequence Diseases 0.000 description 2
- 208000007814 Unstable Angina Diseases 0.000 description 2
- 238000010521 absorption reaction Methods 0.000 description 2
- 239000012190 activator Substances 0.000 description 2
- 239000004480 active ingredient Substances 0.000 description 2
- 239000000556 agonist Substances 0.000 description 2
- 238000000137 annealing Methods 0.000 description 2
- 239000005557 antagonist Substances 0.000 description 2
- 239000003242 anti bacterial agent Substances 0.000 description 2
- 239000003429 antifungal agent Substances 0.000 description 2
- 229940121375 antifungal agent Drugs 0.000 description 2
- 229940127218 antiplatelet drug Drugs 0.000 description 2
- 208000021328 arterial occlusion Diseases 0.000 description 2
- 235000010323 ascorbic acid Nutrition 0.000 description 2
- 229960005070 ascorbic acid Drugs 0.000 description 2
- 239000011668 ascorbic acid Substances 0.000 description 2
- 230000000923 atherogenic effect Effects 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 230000033228 biological regulation Effects 0.000 description 2
- 229910052799 carbon Inorganic materials 0.000 description 2
- 239000007795 chemical reaction product Substances 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- OSASVXMJTNOKOY-UHFFFAOYSA-N chlorobutanol Chemical compound CC(C)(O)C(Cl)(Cl)Cl OSASVXMJTNOKOY-UHFFFAOYSA-N 0.000 description 2
- 235000012000 cholesterol Nutrition 0.000 description 2
- 208000035850 clinical syndrome Diseases 0.000 description 2
- 238000010276 construction Methods 0.000 description 2
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 2
- 230000034994 death Effects 0.000 description 2
- 230000007423 decrease Effects 0.000 description 2
- 230000008021 deposition Effects 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 201000010099 disease Diseases 0.000 description 2
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 229960005139 epinephrine Drugs 0.000 description 2
- 230000002349 favourable effect Effects 0.000 description 2
- PJMPHNIQZUBGLI-UHFFFAOYSA-N fentanyl Chemical compound C=1C=CC=CC=1N(C(=O)CC)C(CC1)CCN1CCC1=CC=CC=C1 PJMPHNIQZUBGLI-UHFFFAOYSA-N 0.000 description 2
- 229960002428 fentanyl Drugs 0.000 description 2
- 239000012091 fetal bovine serum Substances 0.000 description 2
- 108060002894 fibrillar collagen Proteins 0.000 description 2
- 102000013373 fibrillar collagen Human genes 0.000 description 2
- 238000001914 filtration Methods 0.000 description 2
- 239000007850 fluorescent dye Substances 0.000 description 2
- 238000001415 gene therapy Methods 0.000 description 2
- 235000011187 glycerol Nutrition 0.000 description 2
- 230000013595 glycosylation Effects 0.000 description 2
- 238000006206 glycosylation reaction Methods 0.000 description 2
- 230000023597 hemostasis Effects 0.000 description 2
- 238000005286 illumination Methods 0.000 description 2
- 238000003364 immunohistochemistry Methods 0.000 description 2
- 238000012750 in vivo screening Methods 0.000 description 2
- 230000001939 inductive effect Effects 0.000 description 2
- 238000001802 infusion Methods 0.000 description 2
- 229940125396 insulin Drugs 0.000 description 2
- 201000004332 intermediate coronary syndrome Diseases 0.000 description 2
- 238000002608 intravascular ultrasound Methods 0.000 description 2
- 238000010253 intravenous injection Methods 0.000 description 2
- 239000007951 isotonicity adjuster Substances 0.000 description 2
- 210000004731 jugular vein Anatomy 0.000 description 2
- 238000011813 knockout mouse model Methods 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 230000004807 localization Effects 0.000 description 2
- 238000004020 luminiscence type Methods 0.000 description 2
- 239000000594 mannitol Substances 0.000 description 2
- 235000010355 mannitol Nutrition 0.000 description 2
- HRLIOXLXPOHXTA-UHFFFAOYSA-N medetomidine Chemical compound C=1C=CC(C)=C(C)C=1C(C)C1=CN=C[N]1 HRLIOXLXPOHXTA-UHFFFAOYSA-N 0.000 description 2
- 229960002140 medetomidine Drugs 0.000 description 2
- QSHDDOUJBYECFT-UHFFFAOYSA-N mercury Chemical compound [Hg] QSHDDOUJBYECFT-UHFFFAOYSA-N 0.000 description 2
- 229910052753 mercury Inorganic materials 0.000 description 2
- 238000010197 meta-analysis Methods 0.000 description 2
- DDLIGBOFAVUZHB-UHFFFAOYSA-N midazolam Chemical compound C12=CC(Cl)=CC=C2N2C(C)=NC=C2CN=C1C1=CC=CC=C1F DDLIGBOFAVUZHB-UHFFFAOYSA-N 0.000 description 2
- 229960003793 midazolam Drugs 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 229910052697 platinum Inorganic materials 0.000 description 2
- 229920000573 polyethylene Polymers 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 2
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 238000004393 prognosis Methods 0.000 description 2
- 238000011002 quantification Methods 0.000 description 2
- 230000004044 response Effects 0.000 description 2
- 230000002441 reversible effect Effects 0.000 description 2
- 238000012552 review Methods 0.000 description 2
- 238000007423 screening assay Methods 0.000 description 2
- 230000028327 secretion Effects 0.000 description 2
- 230000019491 signal transduction Effects 0.000 description 2
- 150000003384 small molecules Chemical class 0.000 description 2
- 239000012064 sodium phosphate buffer Substances 0.000 description 2
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 2
- 238000000352 supercritical drying Methods 0.000 description 2
- 229960004072 thrombin Drugs 0.000 description 2
- 230000001732 thrombotic effect Effects 0.000 description 2
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 2
- 230000003827 upregulation Effects 0.000 description 2
- 210000005166 vasculature Anatomy 0.000 description 2
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 1
- WPUZGNPQMIWOHE-UHFFFAOYSA-N 3',6'-diacetyloxy-3-oxospiro[2-benzofuran-1,9'-xanthene]-5-carboxylic acid Chemical compound O1C(=O)C2=CC(C(O)=O)=CC=C2C21C1=CC=C(OC(C)=O)C=C1OC1=CC(OC(=O)C)=CC=C21 WPUZGNPQMIWOHE-UHFFFAOYSA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 1
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 1
- 102000049320 CD36 Human genes 0.000 description 1
- 108010045374 CD36 Antigens Proteins 0.000 description 1
- 206010008111 Cerebral haemorrhage Diseases 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- 241000702421 Dependoparvovirus Species 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 208000005189 Embolism Diseases 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 241000283073 Equus caballus Species 0.000 description 1
- 241000588724 Escherichia coli Species 0.000 description 1
- 241000620209 Escherichia coli DH5[alpha] Species 0.000 description 1
- 108010012088 Fibrinogen Receptors Proteins 0.000 description 1
- 108010067306 Fibronectins Proteins 0.000 description 1
- 102000016359 Fibronectins Human genes 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 108060003393 Granulin Proteins 0.000 description 1
- 101001047640 Homo sapiens Linker for activation of T-cells family member 1 Proteins 0.000 description 1
- 101001090688 Homo sapiens Lymphocyte cytosolic protein 2 Proteins 0.000 description 1
- 101000702132 Homo sapiens Protein spinster homolog 1 Proteins 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 208000028622 Immune thrombocytopenia Diseases 0.000 description 1
- 102000007547 Laminin Human genes 0.000 description 1
- 108010085895 Laminin Proteins 0.000 description 1
- 241000254158 Lampyridae Species 0.000 description 1
- 102100024032 Linker for activation of T-cells family member 1 Human genes 0.000 description 1
- 108060001084 Luciferase Proteins 0.000 description 1
- 239000005089 Luciferase Substances 0.000 description 1
- 102100034709 Lymphocyte cytosolic protein 2 Human genes 0.000 description 1
- 208000031481 Pathologic Constriction Diseases 0.000 description 1
- 229930182555 Penicillin Natural products 0.000 description 1
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 1
- 108010022425 Platelet Glycoprotein GPIIb-IIIa Complex Proteins 0.000 description 1
- 229940127392 Platelet Glycoprotein IIb/IIIA Inhibitors Drugs 0.000 description 1
- 206010037549 Purpura Diseases 0.000 description 1
- 241001672981 Purpura Species 0.000 description 1
- 238000011530 RNeasy Mini Kit Methods 0.000 description 1
- 229920002684 Sepharose Polymers 0.000 description 1
- 241000700584 Simplexvirus Species 0.000 description 1
- DWAQJAXMDSEUJJ-UHFFFAOYSA-M Sodium bisulfite Chemical compound [Na+].OS([O-])=O DWAQJAXMDSEUJJ-UHFFFAOYSA-M 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- FHNINJWBTRXEBC-UHFFFAOYSA-N Sudan III Chemical compound OC1=CC=C2C=CC=CC2=C1N=NC(C=C1)=CC=C1N=NC1=CC=CC=C1 FHNINJWBTRXEBC-UHFFFAOYSA-N 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 102000000551 Syk Kinase Human genes 0.000 description 1
- 108010016672 Syk Kinase Proteins 0.000 description 1
- 208000031981 Thrombocytopenic Idiopathic Purpura Diseases 0.000 description 1
- 108010000499 Thromboplastin Proteins 0.000 description 1
- 102000002262 Thromboplastin Human genes 0.000 description 1
- 101710120037 Toxin CcdB Proteins 0.000 description 1
- 102100023935 Transmembrane glycoprotein NMB Human genes 0.000 description 1
- 102000014384 Type C Phospholipases Human genes 0.000 description 1
- 108010079194 Type C Phospholipases Proteins 0.000 description 1
- 208000025865 Ulcer Diseases 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- 101001038499 Yarrowia lipolytica (strain CLIB 122 / E 150) Lysine acetyltransferase Proteins 0.000 description 1
- 229960000446 abciximab Drugs 0.000 description 1
- 230000035508 accumulation Effects 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 230000021736 acetylation Effects 0.000 description 1
- 238000006640 acetylation reaction Methods 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- 238000001261 affinity purification Methods 0.000 description 1
- 238000013019 agitation Methods 0.000 description 1
- GZCGUPFRVQAUEE-SLPGGIOYSA-N aldehydo-D-glucose Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C=O GZCGUPFRVQAUEE-SLPGGIOYSA-N 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 238000002399 angioplasty Methods 0.000 description 1
- 230000002965 anti-thrombogenic effect Effects 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 235000006708 antioxidants Nutrition 0.000 description 1
- 230000006502 antiplatelets effects Effects 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 230000036523 atherogenesis Effects 0.000 description 1
- 230000036778 atheroma formation Effects 0.000 description 1
- 230000007214 atherothrombosis Effects 0.000 description 1
- 201000003710 autoimmune thrombocytopenic purpura Diseases 0.000 description 1
- 230000003385 bacteriostatic effect Effects 0.000 description 1
- 235000019445 benzyl alcohol Nutrition 0.000 description 1
- 230000006287 biotinylation Effects 0.000 description 1
- 238000007413 biotinylation Methods 0.000 description 1
- 230000017531 blood circulation Effects 0.000 description 1
- 238000006664 bond formation reaction Methods 0.000 description 1
- 230000007211 cardiovascular event Effects 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 230000001364 causal effect Effects 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- JBTHDAVBDKKSRW-UHFFFAOYSA-N chembl1552233 Chemical compound CC1=CC(C)=CC=C1N=NC1=C(O)C=CC2=CC=CC=C12 JBTHDAVBDKKSRW-UHFFFAOYSA-N 0.000 description 1
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 1
- 229960004926 chlorobutanol Drugs 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 230000015271 coagulation Effects 0.000 description 1
- 238000005345 coagulation Methods 0.000 description 1
- 108010077026 collagen-related peptide Proteins 0.000 description 1
- 230000006957 competitive inhibition Effects 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 238000003271 compound fluorescence assay Methods 0.000 description 1
- 108010089485 convulxin Proteins 0.000 description 1
- 210000004351 coronary vessel Anatomy 0.000 description 1
- 238000012937 correction Methods 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- 230000001627 detrimental effect Effects 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 235000013681 dietary sucrose Nutrition 0.000 description 1
- UGMCXQCYOVCMTB-UHFFFAOYSA-K dihydroxy(stearato)aluminium Chemical compound CCCCCCCCCCCCCCCCCC(=O)O[Al](O)O UGMCXQCYOVCMTB-UHFFFAOYSA-K 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 238000006471 dimerization reaction Methods 0.000 description 1
- 230000007783 downstream signaling Effects 0.000 description 1
- 238000001647 drug administration Methods 0.000 description 1
- 238000003255 drug test Methods 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 238000010828 elution Methods 0.000 description 1
- 229940088598 enzyme Drugs 0.000 description 1
- 230000003628 erosive effect Effects 0.000 description 1
- 210000003743 erythrocyte Anatomy 0.000 description 1
- 238000010195 expression analysis Methods 0.000 description 1
- 210000002950 fibroblast Anatomy 0.000 description 1
- 238000005194 fractionation Methods 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 238000007710 freezing Methods 0.000 description 1
- 230000008014 freezing Effects 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 238000001502 gel electrophoresis Methods 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 208000031169 hemorrhagic disease Diseases 0.000 description 1
- 230000002008 hemorrhagic effect Effects 0.000 description 1
- 230000002439 hemostatic effect Effects 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 238000003018 immunoassay Methods 0.000 description 1
- 230000016784 immunoglobulin production Effects 0.000 description 1
- 229940072221 immunoglobulins Drugs 0.000 description 1
- 238000011532 immunohistochemical staining Methods 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000000099 in vitro assay Methods 0.000 description 1
- 238000010874 in vitro model Methods 0.000 description 1
- 239000007972 injectable composition Substances 0.000 description 1
- 239000004026 insulin derivative Substances 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 208000020658 intracerebral hemorrhage Diseases 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 239000000787 lecithin Substances 0.000 description 1
- 235000010445 lecithin Nutrition 0.000 description 1
- 229940067606 lecithin Drugs 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 230000031700 light absorption Effects 0.000 description 1
- 239000008176 lyophilized powder Substances 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 239000003550 marker Substances 0.000 description 1
- 238000000691 measurement method Methods 0.000 description 1
- 229940126601 medicinal product Drugs 0.000 description 1
- 210000003593 megakaryocyte Anatomy 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 235000010270 methyl p-hydroxybenzoate Nutrition 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 238000010172 mouse model Methods 0.000 description 1
- 210000004897 n-terminal region Anatomy 0.000 description 1
- 239000000346 nonvolatile oil Substances 0.000 description 1
- 238000013421 nuclear magnetic resonance imaging Methods 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 239000008188 pellet Substances 0.000 description 1
- 229940049954 penicillin Drugs 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 238000002823 phage display Methods 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 229960003742 phenol Drugs 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 230000035790 physiological processes and functions Effects 0.000 description 1
- 239000002504 physiological saline solution Substances 0.000 description 1
- 230000009805 platelet accumulation Effects 0.000 description 1
- 239000000106 platelet aggregation inhibitor Substances 0.000 description 1
- 229920000729 poly(L-lysine) polymer Polymers 0.000 description 1
- 229920005862 polyol Polymers 0.000 description 1
- 150000003077 polyols Chemical class 0.000 description 1
- 229920000136 polysorbate Polymers 0.000 description 1
- 239000013641 positive control Substances 0.000 description 1
- 238000011533 pre-incubation Methods 0.000 description 1
- 230000001376 precipitating effect Effects 0.000 description 1
- 230000000750 progressive effect Effects 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 238000001742 protein purification Methods 0.000 description 1
- 230000017854 proteolysis Effects 0.000 description 1
- 101150002764 purA gene Proteins 0.000 description 1
- 230000033300 receptor internalization Effects 0.000 description 1
- 230000006798 recombination Effects 0.000 description 1
- 238000005215 recombination Methods 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000010410 reperfusion Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- PYWVYCXTNDRMGF-UHFFFAOYSA-N rhodamine B Chemical compound [Cl-].C=12C=CC(=[N+](CC)CC)C=C2OC2=CC(N(CC)CC)=CC=C2C=1C1=CC=CC=C1C(O)=O PYWVYCXTNDRMGF-UHFFFAOYSA-N 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 230000009291 secondary effect Effects 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 230000011664 signaling Effects 0.000 description 1
- 239000002356 single layer Substances 0.000 description 1
- 239000003998 snake venom Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 235000010267 sodium hydrogen sulphite Nutrition 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 230000002269 spontaneous effect Effects 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 230000036262 stenosis Effects 0.000 description 1
- 208000037804 stenosis Diseases 0.000 description 1
- 229960005322 streptomycin Drugs 0.000 description 1
- 229960004793 sucrose Drugs 0.000 description 1
- 229940099373 sudan iii Drugs 0.000 description 1
- 229940073450 sudan red Drugs 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- 150000005846 sugar alcohols Polymers 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 230000008093 supporting effect Effects 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 238000010257 thawing Methods 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 229940124788 therapeutic inhibitor Drugs 0.000 description 1
- 238000001931 thermography Methods 0.000 description 1
- RTKIYNMVFMVABJ-UHFFFAOYSA-L thimerosal Chemical compound [Na+].CC[Hg]SC1=CC=CC=C1C([O-])=O RTKIYNMVFMVABJ-UHFFFAOYSA-L 0.000 description 1
- 229940033663 thimerosal Drugs 0.000 description 1
- 201000003067 thrombocytopenia due to platelet alloimmunization Diseases 0.000 description 1
- 230000002885 thrombogenetic effect Effects 0.000 description 1
- 238000007395 thrombosis prophylaxis Methods 0.000 description 1
- 238000001890 transfection Methods 0.000 description 1
- 239000012096 transfection reagent Substances 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 108091007466 transmembrane glycoproteins Proteins 0.000 description 1
- 238000002834 transmittance Methods 0.000 description 1
- 231100000397 ulcer Toxicity 0.000 description 1
- 241001430294 unidentified retrovirus Species 0.000 description 1
- 238000001291 vacuum drying Methods 0.000 description 1
- 230000006441 vascular event Effects 0.000 description 1
- 231100000216 vascular lesion Toxicity 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 239000013603 viral vector Substances 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 239000008215 water for injection Substances 0.000 description 1
- 238000001262 western blot Methods 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/745—Blood coagulation or fibrinolysis factors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
- A61K47/6811—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates the drug being a protein or peptide, e.g. transferrin or bleomycin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
- A61P25/36—Opioid-abuse
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/02—Antithrombotic agents; Anticoagulants; Platelet aggregation inhibitors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K19/00—Hybrid peptides, i.e. peptides covalently bound to nucleic acids, or non-covalently bound protein-protein complexes
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
- G01N33/5008—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics
- G01N33/5082—Supracellular entities, e.g. tissue, organisms
- G01N33/5088—Supracellular entities, e.g. tissue, organisms of vertebrates
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/86—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving blood coagulating time or factors, or their receptors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/30—Non-immunoglobulin-derived peptide or protein having an immunoglobulin constant or Fc region, or a fragment thereof, attached thereto
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2799/00—Uses of viruses
- C12N2799/02—Uses of viruses as vector
- C12N2799/021—Uses of viruses as vector for the expression of a heterologous nucleic acid
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Immunology (AREA)
- Organic Chemistry (AREA)
- Molecular Biology (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Biochemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biomedical Technology (AREA)
- Hematology (AREA)
- Urology & Nephrology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Cell Biology (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Toxicology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Analytical Chemistry (AREA)
- Biotechnology (AREA)
- General Physics & Mathematics (AREA)
- Gastroenterology & Hepatology (AREA)
- Physics & Mathematics (AREA)
- Microbiology (AREA)
- Food Science & Technology (AREA)
- Pathology (AREA)
- Zoology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Tropical Medicine & Parasitology (AREA)
- Addiction (AREA)
- Epidemiology (AREA)
- Vascular Medicine (AREA)
- Psychiatry (AREA)
Description
Boersma E、Harrington RA、Moliterno DJ、White H、Theroux P、Van de Werf F、de Torbal A、Armstrong PW、Wallentin LC、Wilcox RG、Simes J、Califf RM、Topol EJ、Simoons ML.Platelet glycoprotein IIb/IIIa inhibitors in acute coronary syndromes:a meta−analysis of all major randomised clinical trials.Lancet 2002;359:189〜98頁 Dickfeld T、Ruf A、Pogatsa−Murray G、Muller I、Engelmann B、Taubitz W、Fischer J、Meier O、Gawaz M.Differential antiplatelet effects of various glycoprotein IIb−IIIa antagonists.Thromb Res.2001;101:53〜64頁 Gawaz M、Neumann FJ、Schomig A.Evaluation of platelet membrane glycoproteins in cornary artery disease:consequences for diagnosis and therapy.Circulation.1999;99:E1〜E11頁 Biondo−Zoccai GGL;Abbate A;Liuzzo G、Biasucci L:Atherothrombosis,inflammation,and diabetes.J Am Coll Cardiol 41;1071〜1077頁;2003 Ruggeri、Z.M.:Mechanisms initiating platelet thrombus formation.Thromb.Haemost.1997;78、611〜616頁 van Zanten、G.H.ら.Increased platelet deposition on atherosclerotic coronary arteries.J Clin.Invest 1994;93、615〜632頁 Clemetson、K.J.&Clemetson、J.M.Platelet collagen receptors.Thromb.Haemost.2001、86、189〜197頁 Moroi M、Jung SM、Okuma M、Shinmyozu K.A patient with platelets deficient in glycoprotein VI that lack both collagen−induced aggregation and adhesion.J Clin Invest 1989;84:1440〜1445頁
(a)コラーゲンと結合する機能を有する、糖タンパク質VI(GP VI)の細胞外ドメインまたはその変異体、および
(b)免疫グロブリンのFcドメインまたはその機能保存的部分
を含む融合タンパク質(Fc−GPVI−nt)を提供する。
(a)図7に示すアミノ酸配列をコードしているFc−GPVI−nt用アデノウィルスをHela細胞に感染させ、感染から2日後に培養上清を集め;
(b)工程(a)の上清を遠心分離(3800g、30分、4℃)し;
(c)工程(b)の上清をろ過(0.45μm)し;
(d)同体積量の硫酸アンモニウム(761g/l)を加えて4℃で一晩撹拌することによってイムノアドヘシンを沈殿させ;
(e)遠心分離(3000g、30分、4℃)によってタンパク質をペレットにし;
(f)工程(e)のペレットにしたタンパク質を0.1倍体積量のPBS中に溶解し、4℃で終夜PBS中で透析し;
(g)遠心分離(3000g、30分、4℃)によってタンパク質溶液を清澄化し;
(h)工程(g)の溶液をプロテインAカラム(HiTrap(商標)プロテインA HP、Amersham Pharmacia Biotech AB、スウェーデン、Uppsala)に導入し;
(i)OD280<0.01になるまでカラムを結合バッファー(20mMリン酸ナトリウムバッファーpH7.0、0.02%NaN3)で洗浄し;
(k)溶出バッファー(100mMグリシンpH2.7)を用いて画分に分けて溶出させ;
(l)溶出した画分を中和バッファー(1Mトリス/HCl pH9.0、0.02%NaN3)を用いて中和し;
(m)画分をプールし;
(n)プールした画分を4℃で終夜PBS中で透析し、
(o)透析生成物を小分けして、−20℃で凍結させる。
(i)配列番号2の核酸配列または遺伝コードの縮重によって同じポリペプチドをコードするその変異体;
(ii)配列番号2によってコードされるポリペプチドに対する配列相同性が少なくとも70%であるポリペプチドをコードする核酸配列;
(iii)そのうちの少なくとも100アミノ酸のセグメントがコラーゲンと結合するのに機能的であり、少なくとも200アミノ酸のセグメントがFcドメインとして機能する、少なくとも300アミノ酸のポリペプチドをコードする核酸;ならびに
(iv)請求項1の融合タンパク質をコードする核酸配列
から選択される配列を含む。
(i)コラーゲンを提示する表面を準備し;
(ii)前記表面の一部分を前記融合タンパク質と前記表面の結合を可能にする所定の条件下で本発明の融合タンパク質と接触させ;
(iii)工程(ii)と同じ条件下で、前記表面の別の部分を試験化合物の存在下で前記融合タンパク質と接触させ;
(iv)前記試験化合物の不在下または存在下で前記表面に結合した前記融合タンパク質の量を測定し;
(v)前記融合タンパク質と前記表面の結合が、試験化合物の不在下と比較して前記試験化合物の存在下のほうが少ない場合、試験化合物を阻害剤として特定し;また
(vi)場合によって、血小板凝集および/または血小板活性化に対する前記阻害剤の機能的作用を決定する。
(i)コラーゲンを提示する表面を準備し;
(ii)コラーゲンへの血小板の接着を可能にする所定の条件下で表面を血小板と接触させ;
(iii)試験化合物の存在下で血小板の接着を測定し;また
(iv)コラーゲンへの血小板接着が、試験化合物の不在下と比較して試験化合物の存在下でより少ない場合、試験化合物をGPVIの阻害剤として特定し;また
(v)場合によって、血小板凝集および/または血小板活性化に対する前記阻害剤の機能的作用を決定する
工程を含む。
(i)活性血管内病変のin vivoモデルを用意し;
(ii)試験化合物の存在下で活性な血管内病変への血小板接着を測定し、
(iii)活性な血管内病変への血小板接着が、試験化合物の不在下と比較して試験化合物の存在のほうが少ない場合、試験化合物をGPVIの阻害剤として特定する
工程を含む。
(a)コラーゲンと結合するのに機能的な糖タンパク質VIの細胞外ドメインまたはその変異体、および
(b)免疫グロブリンのFcドメインまたはその機能保存的部分
を含む融合タンパク質を使用することを提供する。
(a)図7に示すアミノ酸配列をコードしている、Fc−GPVI−nt用アデノウィルスをHela細胞に感染させ、感染から2日後に培養上清を捕集し;
(b)工程(a)の上清を遠心分離(3800g、30分、4℃)し;
(c)工程(b)の上清をろ過(0.45μm)し;
(d)等体積量の硫酸アンモニウム(761g/l)を加えることによってイムノアドヘシンを沈殿させ、4℃で終夜撹拌し;
(e)遠心分離(3000g、30分、4℃)によってタンパク質をペレット化し、
(f)工程(e)のペレット化したタンパク質を0.1容のPBS中に溶解し、4℃で終夜PBS中で透析し;
(g)遠心分離(3000g、30分、4℃)によってタンパク質溶液を清澄化し;
(h)工程(g)の溶液をプロテインAカラム(HiTrap(商標)プロテインA HP、Amersham Pharmacia Biotech AB、スウェーデン、Uppsala)に導入し;
(i)OD280<0.01になるまでカラムを結合バッファー(20mMリン酸ナトリウムバッファーpH7.0、0.02%NaN3)で洗浄し;
(k)溶出バッファー(100mMグリシンpH2.7)を用いて画分に分けて溶出し;
(l)溶出した画分を中和バッファー(1Mトリス/HCl pH9.0、0.02%NaN3)を用いて中和し;
(m)画分をプールし;
(n)プールした画分を4℃で終夜PBS中で透析し、
(o)透析した生成物を小分けして、−20℃で凍結させる。
(a)患者に活性な血管内病変があるか否か判定し;
(b)血管内病変がある場合には、血小板糖タンパク質VI(GPVI)に対する抗体を用いて患者を治療する
工程を含む。
(a)患者にアテローム進行が起こっているか否かを判定し;
(b)血管内病変がある場合には、血小板糖タンパク質VI(GPVI)に対する抗体を用いて患者を治療する
工程を含む。
血小板凝集およびATP放出
マウスの血小板リッチな血漿を、ウシ型Iコラーゲンの濃度を0.2〜4μ/mlに増やしながら刺激すると、2〜95%の凝集が用量依存的に誘発され、また0〜1.66nMのATP放出が用量依存的に誘発される。ハーフ−マキシマム(最大値の半分を誘発する)コラーゲン濃度を選択してさらなる実験を行った。特異的な抗マウスGPVI抗体JAQ 1(50μg/mlおよび100μg/ml)と一緒にマウス血小板リッチな血漿をインキュベーションすると、2μgコラーゲン/mlで刺激した後の血小板凝集がほぼ完全に失われた(50μgJAQ 1の場合:2±0.7;100μgJAQ 1の場合:1.5±0.3%)。さらに、ATP放出は抗体の用量依存的に、10μg抗体/mlで1.09nM ATPに阻害され、50および100μg抗体/mlで完全になくなった。
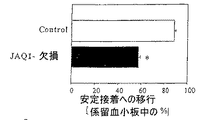
フローチャンバー中で生理学的剪断条件下における血小板の接着を試験した。血小板の初期接着および強固な接着は、Fc−GPVI−ntイムノアドヘシンを60%加えることによって著しく阻害された(図4を参照のこと)。
コラーゲンでコーティングされたプレートへのFc−GPVI−ntの接着は、ELISAに基づいた蛍光アッセイで測定した。イムノアドヘシンFc−GPVI−ntの結合は、0.2〜10μgFc−GPVI−ntで用量依存的に増大し飽和レベルにまで達した(図5を参照のこと)。その特異性は、Fc−GPVI−ntの結合を空のイムノアドヘシンFc−ntの結合またはコーティングしていないプラスチック表面への結合とを比較することによって実証した(図6を参照のこと)。
病変へのin vivo接着プロセスでの血小板−コラーゲン相互作用の生物学的重要性を評価するために、マウス頚動脈の血管損傷後の血小板−血管壁相互作用を評価する。この重要な血管床での血管損傷は、動脈硬化症の初期の内皮の病変、または内皮下層からのコラーゲン原線維の露出が起こる動脈硬化症の後期段階におけるプラーク破裂などの、動脈硬化症の第1のステップのモデルとなり得る。さらに、このモデルにより、その後の血管損傷の合併症の研究が可能になる。小さな内皮病変により、血小板の活性が最大になり、その後の血小板接着および凝集のステップへと続く。さらなるステップでは、血小板凝集体は、続発性虚血性脳卒中を伴う頚動脈からの塞栓症を招く可能性がある。したがって、この実験構成は、急性冠状動脈症候群および脳卒中をもたらすプラーク破裂および内皮病変を伴う不安定アテローム性動脈硬化症のある、患者のサブグループに関連したin vivoモデルとなる。
種々の異なる受容体およびシグナル伝達経路が関与する血小板−血管壁相互作用は非常に複雑なので、このプロセスのin vivoにおける阻害は非常に困難になる。フォンビルブランド因子(vWF)によってコラーゲンと間接的に相互作用するGPIb−V−I−XおよびαIIbβ3インテグリンの他に、多くのコラーゲン受容体が血小板上で同定されており、最も重要なものとしてはα2β1インテグリン(Santoro、S.A.「初期の2価カチオン依存性の血小板のコラーゲンへの接着を仲介する160000ダルトンの血小板膜タンパク質の同定」Identification of a 160,000 dalton platelet membrane protein that mediates the initial divalent cation−dependent adhesion of platelets to collagen.Cell 1986;46、913〜920頁)、GPV(Moog、S.ら.「血小板糖タンパク質Vはコラーゲンへの結合と凝集に関与する」Platelet glycoprotein V binds to collagen and participates in platelet adhesion and aggregation.Blood 2001;98、1038〜1046頁)、およびGPVI(Moroi、M.、Jung、S.M.、Okuma、M.&Shinmyozu、K.「コラーゲンに誘導される凝集と接着がない、糖タンパク質VIの欠損した血小板を有する患者」A patient with platelets deficient in glycoprotein VI that lack both collagen−induced aggregation and adhesion.J Clin.Invest 84、1440〜1445頁)が含まれている。in vitroで働く異なるシグナル伝達系についていくつかの報告があるが、そのなかでGPVIも議論されている(Gibbins、J.M.、Okuma、M.、Farndale、R.、Barnes、M.&Watson、S.P.「糖タンパク質VIは血小板中でのコラーゲン受容体であり、Fc受容体γ鎖のチロシンリン酸化の根底をなす」Glycoprotein VI is the collagen receptor in platelets which underlies tyrosine phosphorylation of the Fc receptor gamma−chain.FEBS Lett.1997;413、255〜259頁;Nieswandt、B.ら.「マウスにおける血小板グリコプロテインVIのインビボ涸渇による長期抗血栓性保護」Long−term antithrombotic protection by in vivo depletion of platelet glycoprotein VI in mice.J.Exp.Med.2001;193、459〜469頁、Nieswandt,B.ら.「α2β1インテグリンではなく糖タンパク質VIが血小板とpコラーゲンの相互作用に必須である」Glycoprotein VI but not α2β1 integrin is essential for platelet interaction with collagen.EMBO J 2001;20、2120〜2130頁)。
この作用が表面結合JAQ1によって他の受容体、例えばGPIb−V−IXの立体障害に基づいている可能性を排除するために、我々は、血管損傷の5日前にJAQ1を注射することによってGPVI欠損マウスを生成した。既に報告されているように、このような処理により、例えば循環血小板中のGPVIの内部移行およびたんぱく質分解によってGPVIの実質的に完全な損失が誘導され、「GPVIノックアウト」様表現型が少なくとも2週間もたらされる(Nieswandt、B.ら.「マウスにおける血小板グリコプロテインVIのインビボ涸渇による長期抗血栓性保護」Long−term antithrombotic protection by in vivo depletion of platelet glycoprotein VI in mice.J.Exp.Med.2001;193、459〜469頁)。図3aに示すように、GPVIは、対照IgGではなく100μg/マウスJAQ1を注射してから5日目のJAQ1処理マウス由来の血小板では検出されなかったが、GPIb−V−IX、αIIbβ3、およびα2β1を含む試験した他のすべての受容体の表面発現および機能は、両方のグループのマウスで変わらず、それまでの結果を裏付けた(図示していないデータおよびNieswandt、B.ら.「マウスにおける血小板グリコプロテインVIのインビボ涸渇による長期抗血栓性保護」Long−term antithrombotic protection by in vivo depletion of platelet glycoprotein VI in mice.J.Exp.Med.2001;193、459〜469頁)。
次に、以下の具体例を参照して本発明をさらに詳細に説明する。
実験動物。 特定病原体不在C57BL6/JマウスをCharles River社(スルツフェルト、ドイツ)から入手した。実験には12週齢の雄マウスを使用した。実験動物に行ったすべての実験手順はドイツの動物保護に関する法律で承認されるものである。
GPVI欠損マウスを作製するため、野生型C57BL6/JマウスにJAQ1を100μg投与した。血小板接着のin vivoでの評価のためにはモノクローナル抗体注射後5日目の動物を使用した。。血小板上でのGPVIの発現が欠損していることは、ウェスタンブロット解析とフローサイトメトリーにより確認した。
野生型C57BL6/JマウスまたはGPVI欠損マウスから得たヘパリン化全血を、タイロード−HEPESバッファー(134mM NaCl、0.34mM Na2HPO4、2.9mM KCl、12mM NaHCO3、20mM HEPES、5mMグルコース、1mM MgCl2、pH6.6)で30倍に希釈した。試料を蛍光標識した抗GPVI(JAQ1)および抗CD41モノクローナル抗体とともに室温で10分間培養し、直接FACScan(商標)(Becton Dickinson社)で解析した。
可溶型ヒトGPVIを作製するため、以下の実施例1から実施例3に従い、ヒトまたはマウスGPVI細胞外ドメインをクローン化し、ヒト免疫グロブリンFcドメインに融合した。GPVI−Fc融合タンパク質もしくは対照であるFcをコードするアデノウィルス構築体を調製し、組換えタンパク質を作製した。発現タンパク質のミスフォルディングとグリコシル化の欠損を防ぐため、ヒトHeLa細胞系を使用して、GPVI−Fcおよび対照Fcを可溶性分泌タンパク質として発現させた。
GPVI細胞外ドメインをコードするGPVIのN端末部と、IgGのFc部との組換え融合タンパク質を作製することにより、GPVI受容体のイムノアドヘシンを作製した。Fcは、正方向プライマー5’−cgcggggcggccgcgagtccaaatcttgtgacaaaac−3’および逆方向プライマー5’−gcgggaagctttcatttacccggagacagggag−3’を用い、ヒト心臓cDNAライブラリ(Clonetech社、パロ・アルト、カルフォルニア)からPCRにより増幅した。PCR反応はExpand High Fidelity PCR System(Roche Molecular Biochemicals社、マンハイム、ドイツ)を用い、アニール温度を58℃として20サイクル行った。PCR断片をNotI/HindIIIを用いてpADTrackCMVプラスミドでクローニングし、配列をシーケンサー(MediGenomix社、マルティンスリート、ドイツ)により確認した。
ヒトGPVI細胞外ドメインのクローニングのために、培養巨核球からRNA(RNeasy Mini Kit;Qiagen社、ヒルデン、ドイツ)を製造社のプロトコールに従って単離し、2μgのRNAを用いて37℃で一晩逆転写を行った(Omniscript RT Kit;Qiagen社)。100ngの上記反応生成物を鋳型として用い、プライマー5’−gcggggagatctaccaccatgtctccatccccgacc−3’および5’−cgcggggcggccgccgttgcccttggtgtagtac−3’を用いてhGPVIのPCRにより増幅を行った。PCR反応はExpand High Fidelity PCR System(Roche Molecular Biochemicals社、マンハイム、ドイツ)を用い、アニール温度を54℃として24サイクル行った。PCR断片をBgIII/NotIを用い上記pDATrackCMV・Fcプラスミドでクローニングし、配列を確認した。
Fc単量体断片を、プライマー対5’−cgcggggcggccgcccagcacctgaactcctg−3’および5’−cgcggggatatctcatttacccggagacagggag−3’を用い、鋳型としてpADTrackCMV gpVI−Fcを用いてPCR増幅した。PCR反応はExpand High Fidelity PCR System(Roche Molecular Biochemicals社、マンハイム、ドイツ)を用い、58℃でアニールを行い、20サイクル行った。Fc単量体のPCR断片(NotI/EcoRV)およびpADTrackCMV gpVI−Fc(BgIII/NotI)からのgpVI断片を、上述と同様にクローニングした。
プラスミドpADTrackCMV Fc−GPVI−ntをPmeI(New England Biolabs社、ビバリー、マサチューセッツ)で一晩直線化し、脱リン酸化し、精製した(GFX DNA and Gel Purification Kit;Amersham Pharmacia Biotech AB社、ウプサラ、スウェーデン)。組換えのため、1μgの直線化プラスミドと0.1μgのpAdeasy1を用いて、エレクトロコンピテント大腸菌BJ5183(Stratagene社、ラジョラ、カルフォルニア)を2500V、200Ω、25μFDで形質転換し(E.coli−pulser;Biorad社、ハイデルベルク、ドイツ)、培地に塗布し、37℃で一晩培養した。コロニーから小規模で調製したプラスミドDNAをPacIを用いて確認し、陽性クローンで大腸菌DH5αを再形質転換した。
単量体を発現する細胞を実施例2に従って作製した。
Ad−Fc−GPVI−ntを感染させたHeLa細胞の培養上清を感染2日後に収集、遠心分離し(3800g、30分、4℃)、濾過した(0.45μm)。イムノアドヘシンに1体積の硫酸アンモニウム(761g/l)を加えて、4℃で一晩攪拌した。タンパク質を遠心分離(3000g、30分、4℃)でペレット化し、0.1体積のPBSに溶解し、PBSを用いて4℃で透析した。タンパク質溶液を遠心分離(3000g、30分、4℃)で清澄化し、Protein Aカラム(HiTrap(商標)Protein A HP;Amersham Pharmacia Biotech AB社、ウプサラ、スウェーデン)で精製した。カラム洗浄はOD280が0.01未満になるまで結合バッファー(20mMリン酸ナトリウムバッファーpH7.0、0.02%NaH3)を用いて行い、溶出バッファー(100mMグリシン、pH2.7)で溶出した。溶出画分を中和バッファー(1M Tris/HCl pH9.0、0.02%NaH3)で中和し、回収したものを、PBSで4℃で一晩透析し、分注して−20℃で凍結した。
精製されたFc−GPVI−ntは還元条件下でSDSゲル電気泳動した後に、クマシーブルー染色もしくはヤギ抗ヒトFcペルオキシダーゼ結合抗体または抗GPVIモノクローナル抗体5C4を用いたイムノブロット法により、分子量約80kDaで検出された(図1a上段と中段)。一方、非還元条件下では約160kDaのタンパク質が同定され(図1下段)、これはGPVI−Fcは全て二量体として得られるという報告を裏付けるものであった(21)。
ELISAプレート(Immulon2 HB;Dynx Technologies社、チャンティリー、バージニア)を1μg/ウェルのコラーゲン(ウシ由来I型;BD Bioscience社、ベッドフォード、マサチューセッツ)を含む50mMのTris/HCl(pH8.0)100μLを用い4℃で一晩コーティングした。プレートを250μL/ウェルのPBS−0.05%Tween20(PBST)で2回洗浄し、250μL/ウェルのRoti−Block(Roth社、カールスルーエ、ドイツ)で一晩ブロッキングした。プレートを250μL/ウェルのPBSTで2回洗浄し、Fc−GPVI−ntを含むPBSTを100μL加え(最適値2μg/ウェル)、プレートを室温で1時間インキュベートした。250μLのPBSTで5回洗浄した後、1:10000に希釈したヤギ抗ヒトIgGペルオキシダーゼ結合抗体(Dianova社、ハンブルク、ドイツ)を100μL加え、室温で1時間インキュベートした。250μLのPBSTで繰り返し洗浄した後、100μLの検出試薬(BMブルーPOD基質;Roche社、マンハイム、ドイツ)を加え、15分間インキュベートした。1MのH2SO4を100μL加えて反応を停止させ、690nmを参照として450nmにおける吸光度を測定した。阻害剤のスクリーニングには、PBS−Tで様々な濃度に調製した試験物質100μLをインキュベートの際に加えた。
ex vivoおよびin vitroでの血小板凝集は、クエン酸処理した血試料を用いて、37℃で2チャンネルChronolog凝集測定装置(Nobis社、ドイツ)を用いて、光学式凝集測定法により評価した。多血小板血漿はクエン酸処理した全血から遠心分離(200gで20分間)により調製し、自家血漿を用いて最終血小板数を2x108血小板/mLに調節した。ベースライン補正した後、0.2ないし0.4μg/mLのコラーゲン(ウシ由来I型)を加え、凝集を5分間記録した。また、ATPの放出をホタル発光測定法で記録した。50μg/mLの抗GPVIモノクローナル抗体JAQ1と15分間インキュベートした。
ACD血液(最終濃度20%)から多血小板血漿を調製し、HEPES−タイロード液(pH6.5)により最終濃度を108血小板/mLに調節した。異なる濃度の種類の異なる血小板接着タンパク質(コラーゲン、vWF)でカバーグラスを単層コーティングした。灌流実験はこれらのカバーガラスを用いて作製した灌流チャンバーで行った。灌流は低〜中500/s、また高速流2000/sの剪断速度で行った。血小板接着を37℃で20分間測定し、自動シリンジポンプを使用して一定の壁剪断速度で5分間チャンバーに引き流した。灌流後、チャンバーから取りはずしたカバーガラスをHEPES−タイロード液で軽く洗浄した。カバーガラスをHEPES−タイロード液で繰り返し洗浄して、接着血小板を完全に取り除いた。懸濁液中の血小板をFACS測定により定量分析した。標準的なフローサイトメトリーの手順に従い、表面マーカー発現分析(CD41,CD61およびCD62P)の解析により血小板の機能状態をさらに評価した。
血小板(野生型もしくはGPVI欠損型)を既報(Massberg,S.et al.Platelet−endothelial cell interactions during ischemia/reperfusion:the role of P−selectin.Blood 1998;92,507〜515頁)のように全血から単離し、5−カルボキシフルオレセインジアセテートスクシンイミジルエステル(DCF)で標識した。DCF標識した血小板懸濁液を最終濃度200x106血小板/250μLに調製した。必要な場合には、蛍光野生型血小板を50μ/mLの抗GPVI(JAQ1)Fab断片もしくは抗GPIbα(p0p/B)Fab断片と10分間前培養した。その後、前処理した血小板をFab断片とともに野生型レピシエントマウスに注入し、下記のように、血小板接着を頚動脈損傷の前後でin vivoビデオ顕微鏡検査法により評価した。
野生型C57BL6/JマウスまたはGPVI欠損マウスに、ミダゾラム(5mg/体重kg、Ratiopharm社、ウルム、ドイツ)、メデトミジン(0.5mg/体重kg、Pfizer社、カールスルーエ、ドイツ)およびフェンタニル(0.05mg/体重kg、CuraMed Pharma社、ミュンヘン、ドイツ)の溶液を腹腔内注射して麻酔した。ポリエチレン製カテーテル(Portex社、ハイズ、イギリス)を右頚静脈に植え込み、蛍光血小板(200x106/250μL)を静脈注入した。右総頚動脈を切開して開放し、頚動脈分岐部付近を5分間きつく結紮して血管損傷を引き起こした。血管損傷の前後で、右総頚動脈のin vivoビデオ顕微鏡検査法により、蛍光血小板をin situで視覚化した。血小板と血管壁の相互作用は、落射照明用100W・HBO水銀ランプを付けたZeiss社製Axiotech顕微鏡(20x水浸対物レンズ、W20x/0.5、Zeiss社)を使いモニターした。ビデオに撮った画像はすべて、コンピュータ援用画像解析プログラム(Cap Image7.4;Zeintl博士、ハデルベルク、ドイツ)を使用して評価した。一過性接着血小板を、中心線速度より著しく低い速度で血管の仮想垂線を横切る細胞と定義した。その数は内皮表面1mm2あたりの細胞数で決定される。接着血小板の数は、10秒以内に動かないか内皮表面から離れない細胞数を数えて評価した。血管損傷部位での血小板凝集数も定量化し、1mm2あたりの数で表した。
生体ビデオ蛍光顕微鏡検査の後、上記頚動脈にPBS(37℃)を1分間還流させ、続いてリン酸緩衝グルタルアルデヒド(1%vol/vol)で灌流固定した。頚動脈を切除し、縦方向に開き、1%のPBS緩衝グルタルアルデヒドに12時間浸してさらに固定化し、エタノールで脱水し、CO2を用いた臨界点乾燥法により処理した。その後、頚動脈検体の管腔を露出させ、炭素ペーストを用いて試料台に載せ、プラチナをスパッタコーティングし、電界放出形走査電子顕微鏡(JSM−6300F;日本電子(株))を使用して測定した。
Fc−GPVI−ntの固定化コラーゲンへの結合は以下のとおり測定した。すなわち、ELISAプレート(Immulon2 HB;Dynx Technologies、チャンティリー、バージニア)を1μg/ウェルのコラーゲン(ウシ由来I型;BD Bioscience社、ベッドフォード、マサチューセッツ)を含むコーティングバッファー(1.59g/L Na2CO3、2.93g/l NaHCO3、0.2g/L NaN3、pH9.6)100μLを用い4℃で一晩コーティングした。プレートを250μ/ウェルのPBS−0.05%Tween20(PBST)で2回洗浄し、250μL/ウェルのRoti−Block(Roth社、カールスルーエ、ドイツ)で一晩ブロッキングし、さらに250μL/ウェルのPBSTで2回洗浄し、3.0、6.0、12.5、25.0、50.0もしくは100μg/mLのFc−GPVI−ntを含むPBSTを加え、室温で1時間培養した。必要に応じ、Fc−GPVI−nt(20μg/mL)を可溶性コラーゲンとともに10分間プレインキュベートした。インキュベート後、プレートを250μLのPBSTで5回洗浄し、1:10000に希釈したFcγ断片特異的ヤギ抗ヒトIgGペルオキシダーゼ結合抗体(109−035−098;Dianova社、ハンブルク、ドイツ)を加え、室温で1時間培養した。250μLのPBSTで5回洗浄した後、100μLの検出試薬(BMブルーPOD基質;Roche社、マンハイム、ドイツ)を加え、10分間培養した。1MのH2SO4を100μLを加えて反応を停止させ、プレートを690nmを対照として450nmにおける吸光度を測定した。
モノクローナル抗体を既報(17)のように作製した。Lou/Cラットを、アデノウィルスで発現したヒトFc−GPVI−nt融合タンパク質で免疫した。得られたハイブリドーマの培養上清をFc−GPVI−ntまたはGPVIドメインを欠くFcを用いて固相イムノアッセイでスクリーニングした。その結果ハイブリドーマ5C4の上清がFc−GPVI−ntに特異的に結合し、かつ対照Fcには結合しないことがわかった。免疫グロブリンの型を、ラットIgクラス(抗IgM)およびマウスIgGサブクラス特異的モノクローナル抗体を用いて決定した。5C4モノクローナル抗体はプロテインGセファロースカラムを使用して精製した。5C4の抗体特異性をFc−GPVI−ntと対照Fcに対するイムノブロット法により確認したところ、モノクローナル抗体5C4はアデノウィルスで発現させたFc−GPVI−ntと結合するたが、対照Fcとは結合しないことが示された。さらに、ヒト血小板から得た溶解物よりヒトGPVIを回収した。また、フローサイトメトリーを用いた結果より、5C4は血小板表面に特異的に結合するが、白血球や赤血球の表面には結合しないことが示された(データ略)。
クエン酸処理ヒト血液を志願者から調製した。多血小板血漿(PRP)を4℃で2000rpmの遠心分離し、洗浄(PBS1x、pH7.2)と再懸濁により作製した。染色バッファー(1xPBS(Ca2+およびMg2+不含)、0.1%アジ化ナトリウム、2%ウシ胎児血清(FBS)および2mM CaCl)で希釈したPRPを、ウマI型コラーゲン(0;2;5および10μg/mL;Nobis社)と、Fc−GPVI−nt(100μg/mL)もしくは等モル濃度の対照Fcの存在下で培養した。フルオロフォア・ペルオキシダーゼで標識した抗CD62P抗体(Immunotech社)を加えた。FACS測定はBecton Dickenson社製FACScalibur装置を用いて行った。
PRPは上述のとおり作製した。血小板凝集は全血凝集測定装置500VS(Chrono−Log社)で測定した。タイロード−HEPESバッファー(2.5mmol/L HEPES、150mmol/L NaCl、12mmol/L NaHCO3、2.5mmol/L KCl、1mmol/L MgCl2、2mmol/L CaCl2、5.5mmol D−グルコース、1mg/mL BSA、pH7.4)により、PRPの血小板細胞数を1.0x108細胞/mLに調製した。ATP測定のためにChrono−Lume#395(Chrono−Log社)を加えた。血小板凝集作用効果を持つ様々な物質を血小板に加え、ピペットで凝集測定装置に入れ、規定の攪拌条件下で凝集を誘導した。凝集は凝固する血小板が原因の光透過率の変化により測定し、内部標準に標準化した。ATPの放出はATPに対するChrono−Lumeの特性波長で測定し、製造会社のプロトコルに従い内部標準に基づいて標準化した。
志願者から採取した血液より、PRPを上記のように調製した。ヒト血小板からのPDGF放出は、キット(DHD00B;R&D Systems社)を用い製造会社のプロトコルに従い測定した。PDGF放出を対照条件下、またはFc−GPVI−nt(100μg/mL)もしくは等モル濃度の対照Fcの存在下で、1型コラーゲン(20μg/mL;Nobis社)を用い刺激した。PDGF放出は製造会社の標準プローブに基づいて標準化された。
in vitroでの出血時間をPFA−100装置(Dade−Behring社)を用いて測定した。800μLのヒト全血をPFA−100装置に注入した。出血時間は、製造会社のプロトコルに従い、ADP/コラーゲンおよびエピネフリン/コラーゲンでコーティングされた測定セルを用いて測定した。
ヒト全血は既報(18)と同様にADC抗凝固全血から単離した。洗浄血小板をタイロード−HEPESバッファー(2.5mmol/L HEPES、150mmol/L NaCl、12mmol/L NaHCO3、2.5mmol/L KCl、1mmol/L MgCl2、2mmol/L CaCl2、5.5mmol D−グルコースおよび1mg/mL BSA、pH7.4)に再懸濁し、血小板数を2x108細胞/mLに調製した。固定化コラーゲンでコーティングしたプレートへの血小板接着を、平行平板型フローチャンバーで、200μg/mLのFc−GPVI−ntもしくは対照Fcの存在下で測定した。
マウス血小板を既報(19)のように全血から単離し、5−carboxyfluorescein diacetate succinimidyl ester(DCF)で標識した。DCF標識した血小板懸濁液を最終濃度200x106血小板/250μLに調製した。後述のように、マウス血小板の接着を頚動脈損傷の前後でin vivoビデオ顕微鏡検査法により評価した。
内皮除去後の血小板動態を既報(3)のように行った。すなわち、野生型C57BL6/Jマウスに、ミダゾラム(5mg/体重kg、Ratiopharm社、ウルム、ドイツ)、メデトミジン(0.5mg/体重kg、Pfizer社、カールスルーエ、ドイツ)およびフェンタニル(0.05mg/体重kg、CuraMed Pharma社、ミュンヘン、ドイツ)の溶液を腹腔内注射して麻酔した。必要に応じ、Fc−GPVI−nt(1または2mg/体重kg)もしくは2mg/kgのFc−GPVI−ntと同モル濃度量の対照Fcを静脈投与した。その後、頚動脈分岐部付近を5分間きつく結紮して内皮除去を引き起こした。血管損傷を引き起こした後、蛍光血小板(200x106/250μL)を右頚静脈に埋め込んだポリエチレン製カテーテル(Portex社、ハイズ、イギリス)を通じて静脈注入した。落射照明用100W・HBO水銀ランプを付けたZeiss社製Axiotech顕微鏡(20x水浸対物レンズ、W20x/0.5、Zeiss社)を用い、右総頚動脈のin vivoビデオ顕微鏡検査法により、蛍光血小板をin situで視覚化した。ビデオ撮影した画像はすべて、コンピュータ援用画像解析プログラム(Cap Image7.4;Zeintl博士、ハイデルベルク、ドイツ(19;20))を使用して評価した。係留血小板はは、血管壁とはじめに接触し、その、非常にゆっくりと(中心における速度より著しく低い速度で)表面を転位する、もしくは強固に接着する「すべての」細胞数と定義される。その数は内皮表面1mm2あたりの細胞数で与えられる。本実施例においては10秒以内に内皮表面から離れなかった細胞を計数することで接着血小板の数を評価した。血管損傷部位での血小板凝集数も定量化し、1mm2あたりの数で表した。また、血栓の全部位をCap Image 7.4を使用して評価した。
生体ビデオ蛍光顕微鏡検査の後、1群あたり3匹の実験動物について上記頚動脈にPBS(37℃)を1分間還流させ、続いてリン酸緩衝グルタルアルデヒド(1%vol/vol)で灌流固定した。頚動脈を切除し、縦方向開き、1%のPBS緩衝グルタルアルデヒドに12時間浸してさらに固定化し、エタノールで脱水し、CO2を用いた臨界点乾燥法により処理した。その後、頚動脈検体の管腔を露出させ、炭素ペーストを用いて試料台に載せ、プラチナをスパッタコーティングし、電界放出形走査電子顕微鏡(JSM−6300F;日本電子(株))を使用して測定した。
Fc−GPVI−ntで処理したマウスから得た頚動脈を急速凍結し、クライオブロック(medite社、Medizintechnik社、ブルクドルフ、ドイツ)に固定した。Fc−GPVI−ntの内皮および内皮下層への結合を、Fcγ特異的ヤギ抗ヒトIgGペルオキシダーゼ結合抗体(109−035−098;Dianova社、ハンブルク、ドイツ)で染色した5μmのクライオスタット断面で測定した。Fcで処置したマウスから得た頚動脈を対照として使用した。
実験動物を2mg/kgまたは4mg/kgのFc−GPVI−nt、もしくは等モル濃度の外部GPVIドメインを欠く対照Fcで処置した。Fc−GPVI−ntもしくは対照Fcを注入した場合も、最大投与量である4mg/kgまでのいずれの濃度においても、末梢血小板数に有意な影響は与えなかった。さらに、Fc−GPVI−nt融合タンパク質は、対照実験動物と比較して尾部出血時間を有意に増大させなかった(図15a)。出血時間の絶対値は、PBS処置マウスでは1.9±0.9minであり、2mg/kgもしくは4mg/kgのFc−GPVI−ntで処置したマウスでは2.9±1.9minおよび4.6±0.6minであった。これに対して、Integrillin(0.2mg/kg、静脈注射)で処置した実験動物では出血時間が顕著に(42.6±21.6min)増大した。
生後4週目のApoE−/−マウス(The Jackson Laboratory)に0.25%コレステロール食(Harlan Research diets)を6週間消費させた。2週間経過後、コレステロール食を継続しながら、4匹のApoE−/−マウスに1匹あたり200μgのFc−GPVI−ntを週2回注射した。同様のプロトコールで4匹のApoE−/−マウスに対照Fcタンパク質(200μg)を週2回注射し、対照マウスとした。プラーク形成を評価するため、実験動物を屠殺し血管樹を実験動物から慎重に切開し、大動脈および頚動脈全部の標本を0.9%塩化ナトリウム液で洗い流し固定化した。血管全部の標本をSudanIII赤でプラーク形成を評価するため染色し、顕微鏡で観察した。アテローム性動脈硬化易発性ApoE−/−ノックアウトマウスをFc−GPVI−ntで4週間処置すると、アテローム進行は著しく減少した(図16)。
糖尿病患者111人または非糖尿病患者363人から血液を採取し、クエン酸処理を行った。多血小板血漿(PRP)を4℃において2000rpmで遠心分離して洗浄し(PBS1x、pH7.2)、再懸濁により作製した。フルオロフォア・ペルオキシダーゼで標識した抗CD61および抗CD32抗体(Immunotech社)、もしくはFITCで標識した抗・抗GPVIモノクローナル抗体4c9を加えた。FACS測定はBecton Dickenson社製FACScalibur装置を用いて行った。表面発現は蛍光により定量化した。CD32の蛍光と4C9の蛍光の相関は、相関係数r=0.516と計算された。
群中央値の比較を、マン・ホイットニー順位和検定を使用して行った。文中データは中央値±標準誤差を表す。P<0.05ならば有意であるとみなした。
Claims (29)
- 以下のa)およびb):
a) 以下の(i)または(ii)から選択されるGPVI タンパク質:
(i)そのアミノ酸配列が、配列番号1のアミノ酸 1〜267によって表されるGPVIの細胞外ドメイン;
(ii) (i)のアミノ酸配列における1または数個のアミノ酸の置換、欠失または付加により (i)のGPVI の細胞外ドメインと異なっており、かつ、コラーゲンに結合することができる(i)のGPVI の細胞外ドメインの変異体、
b)以下の(iii)または(vi) から選択されるFc 部分:
(iii)そのアミノ酸配列が、配列番号1のアミノ酸 273〜504によって表される免疫グロブリンのFc ドメイン;
(iv) (iii) のアミノ酸配列における1または数個のアミノ酸の置換、欠失または付加により(iii)の免疫グロブリンのFc ドメインと異なっており、かつ、融合タンパク質をコラーゲンとの結合が可能な形態で生産することを可能とすることが出来る(iii)の免疫グロブリンのFc ドメインの機能保存変異体、
を含み、該GPVIタンパク質とFcタンパク質とがアミノ酸配列 Gly-Gly-Argを特徴とするリンカーを介して融合している融合タンパク質。 - 1または数個のアミノ酸においてグリコシル化されている請求項1または2のいずれかの融合タンパク質。
- ホモ二量体融合タンパク質である請求項1〜3のいずれかの融合タンパク質。
- 2つの単量体が共有結合している請求項4の融合タンパク質。
- 蛍光標識されている請求項4または5の融合タンパク質。
- 配列番号2の配列からなる請求項7の核酸。
- 請求項7または8のいずれかの核酸にコードされるタンパク質。
- 請求項7または8のいずれかの核酸によってコードされる2本のポリペプチド鎖を含み、各鎖が鎖間ジスルフィド結合によって他方の鎖のヒンジ領域に連結しているヒンジ領域を有する、アテローム性動脈硬化症の治療または予防のための抗アテローム硬化性医薬組成物。
- 請求項7または8のいずれかの核酸を含むベクター。
- 請求項1〜3のいずれかの融合タンパク質または請求項4または5のホモ二量体融合タンパク質を発現する細胞。
- 請求項4または5のホモ二量体融合タンパク質を含む医薬組成物。
- 請求項 1の融合タンパク質のホモ二量体であるイムノアドヘシンを含む医薬組成物。
- イムノアドヘシンが配列番号1のポリペプチドのホモ二量体である請求項14の医薬組成物。
- 静脈内用調製物である請求項14または15の医薬組成物。
- 請求項4または5のホモ二量体融合タンパク質またはホモ二量体形態の場合の請求項9のタンパク質を含む、患者におけるアテローム性動脈硬化症の治療または予防のための医薬組成物。
- アテローム進行の予防のための請求項17の医薬組成物。
- 請求項4または5のホモ二量体融合タンパク質またはホモ二量体形態の場合の請求項9のタンパク質を含む、患者における動脈内血栓症の予防のための医薬組成物。
- 患者が急性冠症候群または頸動脈症候群に罹患しており、かつ、活動性動脈内病変を有する、請求項19の医薬組成物。
- 糖尿病のアテローム硬化性合併症の治療のための、請求項17〜20のいずれかの医薬組成物。
- 請求項4または5のホモ二量体融合タンパク質、またはホモ二量体形態の場合の請求項9のタンパク質を含む、心筋梗塞および/または脳卒中の治療または予防のための医薬組成物。
- 経口、皮下、腹腔内または静脈内投与用の請求項17〜22のいずれかの医薬組成物。
- 融合タンパク質0.5〜6.0 mg/kgを送達するための剤形である請求項17〜23のいずれかの医薬組成物。
- GPVIとコラーゲンとの結合の阻害剤をインビトロでスクリーニングするための請求項4または5のホモ二量体融合タンパク質またはホモ二量体形態の場合の請求項9のタンパク質の使用。
- ホモ二量体融合タンパク質が蛍光標識されている請求項25の使用。
- 以下の工程を含む糖タンパク質 VIのコラーゲンへの結合の阻害剤をインビトロでスクリーニングする方法:
(i)コラーゲンを露出する表面を提供する工程;
(ii)該表面の一部分と、請求項4または5の融合タンパク質またはホモ二量体形態の場合の請求項9のタンパク質とを、該融合タンパク質の該表面への結合を可能とするあらかじめ決められた条件下で接触させる工程;
(iii)該表面の別の部分と、該融合タンパク質とを、工程(ii)の条件下で被験化合物の存在下で接触させる工程;
(iv)該被験化合物の非存在下および存在下での該表面に結合した該融合タンパク質の量を測定する工程;
(v)被験化合物の非存在下と比較して該被験化合物の存在下において該表面への該融合タンパク質の結合が少なければ該被験化合物を阻害剤として同定する工程;および、
(vi)血小板凝集および/または血小板活性化に対する該阻害剤の機能的効果を測定する工程。 - 請求項4または5のホモ二量体融合タンパク質またはホモ二量体形態の場合の請求項9のタンパク質の、GPVIに媒介される血小板の活動性血管内病変への付着の阻害剤をインビトロでスクリーニングするための使用。
- 請求項4または5のホモ二量体融合タンパク質またはホモ二量体形態の場合の請求項9のタンパク質を免疫原として使用することを含む非ヒト哺乳類からのモノクローナル抗体の産生方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP02012742A EP1369128A1 (en) | 2002-06-07 | 2002-06-07 | Inhibitors of glycoprotein VI and their therapeutic use |
| EP02012742.9 | 2002-06-07 | ||
| PCT/EP2003/005929 WO2003104282A2 (en) | 2002-06-07 | 2003-06-05 | Immunoadhesin comprising a glycoprotein vi domain |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2006512894A JP2006512894A (ja) | 2006-04-20 |
| JP2006512894A5 JP2006512894A5 (ja) | 2006-07-06 |
| JP4722480B2 true JP4722480B2 (ja) | 2011-07-13 |
Family
ID=29433140
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2004511349A Expired - Lifetime JP4722480B2 (ja) | 2002-06-07 | 2003-06-05 | 糖タンパク質viドメインを含むイムノアドヘシン |
Country Status (13)
| Country | Link |
|---|---|
| US (1) | US7514543B2 (ja) |
| EP (4) | EP1369128A1 (ja) |
| JP (1) | JP4722480B2 (ja) |
| CN (1) | CN1668721B (ja) |
| AT (1) | ATE346095T1 (ja) |
| AU (2) | AU2003250825A1 (ja) |
| CA (1) | CA2488630C (ja) |
| DE (1) | DE60309865T2 (ja) |
| DK (1) | DK1860118T3 (ja) |
| ES (2) | ES2527717T3 (ja) |
| SI (1) | SI1511770T1 (ja) |
| WO (2) | WO2003104282A2 (ja) |
| ZA (1) | ZA200409776B (ja) |
Families Citing this family (25)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7531178B2 (en) | 2002-06-07 | 2009-05-12 | Trigen Gmbh | Immunoadhesin comprising a glycoprotein VI domain |
| US20070071744A1 (en) | 2002-06-07 | 2007-03-29 | Gotz Munch | Agents which bind to epitopes of glycoprotein VI |
| GB0511590D0 (en) * | 2005-06-07 | 2005-07-13 | Procorde Gmbh | Anti-thrombotic agents |
| EP1369128A1 (en) | 2002-06-07 | 2003-12-10 | Procorde GmbH | Inhibitors of glycoprotein VI and their therapeutic use |
| US7645592B2 (en) | 2004-04-29 | 2010-01-12 | Otsuka Pharmaceutical Co., Ltd. | Glycoprotein VI antibodies and methods of use thereof |
| WO2005111083A2 (en) * | 2004-04-29 | 2005-11-24 | Otsuka Pharmaceutical Co., Ltd. | Antibodies specific for glycoprotein vi and methods of producing these antibodies |
| ES2534288T3 (es) | 2004-08-03 | 2015-04-21 | Innate Pharma | Composiciones terapéuticas contra el cáncer que seleccionan como objetivo 4Ig-B7-H3 |
| EP1824979A2 (en) * | 2004-12-10 | 2007-08-29 | Trigen GmbH | Methods, products and uses involving platelets and/or the vasculature |
| FR2884831B1 (fr) * | 2005-04-22 | 2007-08-10 | Merck Sante Soc Par Actions Si | Methode de criblage de composes inhibiteurs de la mtp |
| JP5224707B2 (ja) * | 2005-04-28 | 2013-07-03 | 持田製薬株式会社 | 抗血小板膜糖蛋白質viモノクローナル抗体 |
| CA2606450A1 (en) * | 2005-04-28 | 2006-11-09 | Mochida Pharmaceutical Co., Ltd. | Anti-platelet membrane glycoprotein vi monoclonal antibody |
| US20090041783A1 (en) * | 2005-04-28 | 2009-02-12 | Mochida Pharmaceutical Co., Ltd. | Anti-platelet membrane glycoprotein vi monoclonal antibody |
| CA2639624A1 (en) * | 2005-12-22 | 2007-06-28 | Shionogi & Co., Ltd. | Prognostic prediction method for acute coronary syndrome |
| US20100297116A1 (en) * | 2007-10-31 | 2010-11-25 | Yongge Liu | Uses of a glycoprotein vi (gpvi) inhibitor |
| US9012221B2 (en) * | 2008-12-04 | 2015-04-21 | Inserm (Institut National De La Sante Et De La Recherche Medicale) | Method for producing platelets from megakaryocytes |
| AU2010246872B2 (en) * | 2009-05-15 | 2015-01-22 | The Hospital For Sick Children | Compositions and methods for treating hematologic cancers targeting the SIRPalpha - CD47 interaction |
| EP2397495A1 (en) * | 2010-06-21 | 2011-12-21 | Sanofi | Novel antagonist antibodies and their Fab fragments against GPVI and uses thereof |
| EP2336188A1 (en) * | 2009-12-18 | 2011-06-22 | Sanofi-Aventis | Novel antagonist antibodies and their Fab fragments against GPVI and uses thereof |
| EA201290525A1 (ru) * | 2009-12-18 | 2013-01-30 | Санофи | Новые антитела-антагонисты, их fab-фрагменты против gpvi и способы их применения |
| EP2377888A1 (en) | 2010-04-07 | 2011-10-19 | Corimmun GmbH | Fusion protein |
| HUE058790T2 (hu) | 2012-12-17 | 2022-09-28 | Pf Argentum Ip Holdings Llc | CD47+ beteg sejtek kezelése SIRP-alfa-Fc fúziókkal |
| CA2895693C (en) * | 2012-12-20 | 2017-02-28 | Fujimori Kogyo Co., Ltd. | Method for comprehensive assessment of platelet aggregation |
| EP3424957A1 (en) | 2017-07-03 | 2019-01-09 | advanceCOR GmbH | Fusion protein |
| CN110964119A (zh) * | 2019-12-05 | 2020-04-07 | 沣潮医药科技(上海)有限公司 | 抗疟二聚体免疫粘附素、药物组合物和用途 |
| WO2021158878A1 (en) * | 2020-02-06 | 2021-08-12 | Boehringer Ingelheim Animal Health USA Inc. | Polypeptides useful for detecting anti-rhabdovirus antibodies |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1999060135A1 (en) * | 1998-05-21 | 1999-11-25 | Cancer Research Ventures Limited | Generation of multiple gene products from chimeric fusion proteins by cleavage with ubiquitous endoproteases |
| WO2001000810A1 (en) * | 1999-06-30 | 2001-01-04 | Millennium Pharmaceuticals, Inc. | Glycoprotein vi and uses thereof |
Family Cites Families (21)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5156840A (en) * | 1982-03-09 | 1992-10-20 | Cytogen Corporation | Amine-containing porphyrin derivatives |
| ZA887365B (en) | 1987-10-02 | 1990-05-30 | Genentech Inc | Adheson variants |
| NZ226414A (en) | 1987-10-02 | 1992-07-28 | Genentech Inc | Cd4 peptide adhesion variants and their preparation and use |
| US5116964A (en) | 1989-02-23 | 1992-05-26 | Genentech, Inc. | Hybrid immunoglobulins |
| US6406697B1 (en) | 1989-02-23 | 2002-06-18 | Genentech, Inc. | Hybrid immunoglobulins |
| US5525491A (en) * | 1991-02-27 | 1996-06-11 | Creative Biomolecules, Inc. | Serine-rich peptide linkers |
| GB9806806D0 (en) | 1998-03-30 | 1998-05-27 | Univ Cambridge Tech | Peptides and uses thereof |
| GB9809951D0 (en) | 1998-05-08 | 1998-07-08 | Univ Cambridge Tech | Binding molecules |
| RU2287580C2 (ru) | 1999-05-07 | 2006-11-20 | Авентис Фарма Дойчланд Гмбх | Рекомбинантный рецептор коллагена на тромбоцитах гликопротеин vi и его применение в фармацевтике |
| US20040001826A1 (en) | 1999-06-30 | 2004-01-01 | Millennium Pharmaceuticals, Inc. | Glycoprotein VI and uses thereof |
| US6245527B1 (en) * | 1999-06-30 | 2001-06-12 | Millennium Pharmaceuticals, Inc. | Nucleic acid molecules encoding glycoprotein VI and recombinant uses thereof |
| WO2001016321A1 (en) | 1999-09-01 | 2001-03-08 | Otsuka Pharmaceutical Co., Ltd. | Platelet membrane glycoprotein vi (gpvi) dna and protein sequences, and uses thereof |
| EP1224942A1 (en) | 2001-01-23 | 2002-07-24 | Bernhard Dr. Nieswandt | Use of JAQ1 (monoclonal antibody anti GPVI) as a medicament for the protection against thrombotic diseases |
| SG157961A1 (en) | 2001-05-25 | 2010-01-29 | Univ Duke | Modulators of pharmacological agents |
| AU2002333241B2 (en) | 2001-07-18 | 2008-09-18 | Merck Patent Gmbh | Glycoprotein VI fusion proteins |
| GB0130543D0 (en) | 2001-12-20 | 2002-02-06 | Univ Cambridge Tech | Human antibodies and their use |
| GB0130832D0 (en) | 2001-12-22 | 2002-02-06 | Univ Reading | Modulation of the activity of the platelet endothelial cell adhesion molecule-1 (pecam-1) |
| GB0211750D0 (en) | 2002-05-22 | 2002-07-03 | Ouwehand Willem | Abnormal blood conditions |
| US7531178B2 (en) | 2002-06-07 | 2009-05-12 | Trigen Gmbh | Immunoadhesin comprising a glycoprotein VI domain |
| EP1369128A1 (en) | 2002-06-07 | 2003-12-10 | Procorde GmbH | Inhibitors of glycoprotein VI and their therapeutic use |
| EP1538165A1 (en) | 2003-12-03 | 2005-06-08 | Procorde GmbH | Inhibitors of glycoprotein VI based on monoclonal antibody hgp 5c4 |
-
2002
- 2002-06-07 EP EP02012742A patent/EP1369128A1/en not_active Withdrawn
-
2003
- 2003-06-05 CA CA2488630A patent/CA2488630C/en not_active Expired - Lifetime
- 2003-06-05 CN CN038172798A patent/CN1668721B/zh not_active Expired - Lifetime
- 2003-06-05 DK DK06023943.1T patent/DK1860118T3/en active
- 2003-06-05 ES ES06023943.1T patent/ES2527717T3/es not_active Expired - Lifetime
- 2003-06-05 WO PCT/EP2003/005929 patent/WO2003104282A2/en active IP Right Grant
- 2003-06-05 AT AT03735562T patent/ATE346095T1/de not_active IP Right Cessation
- 2003-06-05 SI SI200330640T patent/SI1511770T1/sl unknown
- 2003-06-05 ES ES03735562T patent/ES2276078T3/es not_active Expired - Lifetime
- 2003-06-05 AU AU2003250825A patent/AU2003250825A1/en not_active Abandoned
- 2003-06-05 EP EP03757030A patent/EP1511480A2/en not_active Withdrawn
- 2003-06-05 EP EP03735562A patent/EP1511770B1/en not_active Expired - Lifetime
- 2003-06-05 AU AU2003236704A patent/AU2003236704B2/en not_active Expired
- 2003-06-05 WO PCT/EP2003/005919 patent/WO2003103662A2/en not_active Application Discontinuation
- 2003-06-05 US US10/489,053 patent/US7514543B2/en not_active Expired - Lifetime
- 2003-06-05 DE DE60309865T patent/DE60309865T2/de not_active Expired - Lifetime
- 2003-06-05 EP EP06023943.1A patent/EP1860118B1/en not_active Expired - Lifetime
- 2003-06-05 JP JP2004511349A patent/JP4722480B2/ja not_active Expired - Lifetime
-
2004
- 2004-12-02 ZA ZA200409776A patent/ZA200409776B/xx unknown
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1999060135A1 (en) * | 1998-05-21 | 1999-11-25 | Cancer Research Ventures Limited | Generation of multiple gene products from chimeric fusion proteins by cleavage with ubiquitous endoproteases |
| WO2001000810A1 (en) * | 1999-06-30 | 2001-01-04 | Millennium Pharmaceuticals, Inc. | Glycoprotein vi and uses thereof |
Also Published As
| Publication number | Publication date |
|---|---|
| EP1511770A2 (en) | 2005-03-09 |
| ATE346095T1 (de) | 2006-12-15 |
| WO2003104282A2 (en) | 2003-12-18 |
| CA2488630C (en) | 2011-07-05 |
| EP1511480A2 (en) | 2005-03-09 |
| CN1668721B (zh) | 2012-11-14 |
| EP1860118A3 (en) | 2008-07-30 |
| CA2488630A1 (en) | 2003-12-18 |
| ZA200409776B (en) | 2007-02-28 |
| WO2003103662A3 (en) | 2004-11-04 |
| AU2003250825A1 (en) | 2003-12-22 |
| EP1860118A2 (en) | 2007-11-28 |
| WO2003104282A3 (en) | 2004-10-14 |
| ES2527717T3 (es) | 2015-01-28 |
| WO2003103662A2 (en) | 2003-12-18 |
| DK1860118T3 (en) | 2015-02-09 |
| US20050079541A1 (en) | 2005-04-14 |
| EP1511770B1 (en) | 2006-11-22 |
| DE60309865T2 (de) | 2007-10-18 |
| AU2003250825A8 (en) | 2003-12-22 |
| AU2003236704B2 (en) | 2010-07-08 |
| DE60309865D1 (de) | 2007-01-04 |
| EP1369128A1 (en) | 2003-12-10 |
| US7514543B2 (en) | 2009-04-07 |
| SI1511770T1 (sl) | 2007-04-30 |
| ES2276078T3 (es) | 2007-06-16 |
| AU2003236704A1 (en) | 2003-12-22 |
| WO2003104282A8 (en) | 2004-04-29 |
| JP2006512894A (ja) | 2006-04-20 |
| EP1860118B1 (en) | 2014-12-31 |
| CN1668721A (zh) | 2005-09-14 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4722480B2 (ja) | 糖タンパク質viドメインを含むイムノアドヘシン | |
| Massberg et al. | Soluble glycoprotein VI dimer inhibits platelet adhesion and aggregation to the injured vessel wall in vivo | |
| Lasser et al. | C1qTNF–related protein-1 (CTRP-1): a vascular wall protein that inhibits collagen-induced platelet aggregation by blocking VWF binding to collagen | |
| Massberg et al. | A crucial role of glycoprotein VI for platelet recruitment to the injured arterial wall in vivo | |
| US8119135B2 (en) | Antibodies which bind to epitopes of glycoprotein VI | |
| US7488478B2 (en) | Methods and compositions for treatment of inflammatory disease using cadherin-11 modulating agents | |
| BRPI0911385B1 (pt) | Polipeptídeo isolado, polipeptídeo de fusão, multímero e composição farmacêutica | |
| PT808367E (pt) | Adressinas vasculares da mucosa e suas utilizações | |
| US20090130021A1 (en) | Methods, products and uses involving platelets and/or the vasculature | |
| KR20020062698A (ko) | 혈전성 질환에 대한 보호용 약제 | |
| US20020147314A1 (en) | Mucosal vascular addressins and uses thereof | |
| JP2002524099A5 (ja) | ||
| US7531178B2 (en) | Immunoadhesin comprising a glycoprotein VI domain | |
| US8278271B2 (en) | Inhibiting collagen-induced platelet aggregation and activation with peptide variants | |
| Kuijpers et al. | Complementary roles of platelet glycoprotein VI and integrin α2β1 in collagen‐induced thrombus formation in flowing whole blood ex vivo | |
| WO2001052883A1 (en) | Inhibitors of protease-activated receptor-2 (par-2) as novel asthma therapeutics | |
| CA2384115C (en) | Methods and compositions for treatment of inflammatory disease using cadherin-11 modulating agents | |
| KR20160084177A (ko) | 뮤턴트 루테리알에 특이적으로 결합하는 항체 및 이의 제조방법 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20060512 Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20060512 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20060512 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20060512 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20060512 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20090421 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20090707 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20090714 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20091021 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20091117 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20100217 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20100224 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20100317 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20100325 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100419 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20100723 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20100723 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20110329 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20110406 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20140415 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 4722480 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| EXPY | Cancellation because of completion of term |