JP4635231B2 - 亜鉛原料の処理方法 - Google Patents
亜鉛原料の処理方法 Download PDFInfo
- Publication number
- JP4635231B2 JP4635231B2 JP2005164799A JP2005164799A JP4635231B2 JP 4635231 B2 JP4635231 B2 JP 4635231B2 JP 2005164799 A JP2005164799 A JP 2005164799A JP 2005164799 A JP2005164799 A JP 2005164799A JP 4635231 B2 JP4635231 B2 JP 4635231B2
- Authority
- JP
- Japan
- Prior art keywords
- raw material
- zinc
- oxide
- leaching
- zinc raw
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P10/00—Technologies related to metal processing
- Y02P10/20—Recycling
Landscapes
- Manufacture And Refinement Of Metals (AREA)
Description
例えば、前記亜鉛原料に不純物としてFe(鉄)やSi(ケイ素)が多く含有されていると、焙焼物の浸出後に生成する亜鉛浸出残渣の沈降性が悪化する。特に、不純物がSi化合物であるシリカであると、その含有量が多くなるに従い当該シリカがゲル化し、前記亜鉛浸出残渣と絡み合うため、前記固液分離工程の沈降性・ろ過性が著しく悪くなる。そこで、前記固液分離工程における沈降性・ろ過性を向上させるため、特許文献1を始めとする提案がされている。
亜鉛原料から亜鉛を抽出する湿式亜鉛製錬工程において、
焙焼した亜鉛原料を硫酸酸性溶液を用いて浸出する際、ビスマス酸化物、チタン酸化物、アンチモン酸化物、錫酸化物、ガリウム酸化物、カドミニウム酸化物、リン酸カルシウム塩、酸化リン、弗化カルシウム、鉛酸化物、硫酸鉛、硫化鉛、パラジウム、銀酸化物、銀、鉄酸化物、マンガン酸化物、から選択される1種以上の添加物質が添加された硫酸酸性溶液を用いて、浸出をおこなうことを特徴とする亜鉛原料の処理方法である。
前記鉄酸化物として、前記湿式亜鉛製錬工程から産出するヘマタイトを用いることを特徴とする第1の手段に記載の亜鉛原料の処理方法である。
前記マンガン酸化物として、前記湿式亜鉛製錬工程から産出するMn澱物を用いることを特徴とする第1の手段に記載の亜鉛原料の処理方法である。
前記酸化ビスマスおよび/または銀として、
鉛製錬工程から産出され、BiまたはAgを3wt%以上含有する、Bi密陀および/または鉛電解スライムを用いることを特徴とする第1または第2の手段に記載の亜鉛原料の処理方法である。
前記添加物質の1種以上が添加され、当該添加物質を0.02g/L以上含有する硫酸酸性溶液を用いることを特徴とする第1から第4の手段のいずれかに記載の亜鉛原料の処理方法である。
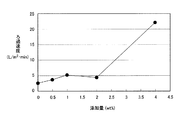
前記添加物質としてBi2O3を用い、前記硫酸酸性溶液中に4g/L以上添加することを特徴とする第1の手段に記載の亜鉛原料の処理方法である。
前記添加物質として鉛製錬工程から産出するBi密陀を用い、前記硫酸酸性溶液中に4g/L以上添加することを特徴とする第1の手段に記載の亜鉛原料の処理方法である。
前記添加物質として鉛製錬工程から産出する鉛電解スライムを用い、前記硫酸酸性溶液中に1g/L以上添加することを特徴とする第1の手段に記載の亜鉛原料の処理方法である。
前記浸出前の前記硫酸酸性溶液のpHを、1.5以下とすることを特徴とする第1から第8の手段のいずれかに記載の亜鉛原料の処理方法である。
前記亜鉛原料を浸出する時間を、10分間以上5時間以下とすることを特徴とする第1から第9の手段のいずれかに記載の亜鉛原料の処理方法である。
図1に示すように、亜鉛鉱石等の亜鉛原料は、まず、焙焼・粉砕されるが、粉砕は浸出の前後で実施され粉砕物となる。この粉砕物へ、後述する電解尾液の液体部分や脱鉄后液の混合液を含む硫酸酸性の浸出液を加え、1次の浸出操作の後、固液分離工程を行って液体の浸出液と固体の亜鉛浸出残査とを得る。次に、当該浸出液を浄液操作の後に電解処理し、電気亜鉛と電解尾液とを得る。当該電気亜鉛は亜鉛製錬の次工程へと送られるが、電解尾液は固液分離工程の後、液体部分は上述した浸出液として循環使用され、固体部分はMn澱物となる。
Pb・Ag残査とは、上述した1次の浸出操作で産出した固形分である亜鉛浸出残渣(ジンクフェライトというFeとZn(亜鉛)との化合物である。)を、さらにSO2等により2次浸出した残査のことである。主成分は、PbSO4とSiO2とであり、他に、少量のSn・Sb化合物、極少量のAgが含有されている。これらの各成分は、当初の亜鉛原料(亜鉛精鉱や、それを焙焼した焼鉱)の成分比率により変化する。即ち、当初の亜鉛原料において、Pbが少ないものはPbが少なくなるし、Agが極少量含まれれば、極少量のAgを含むこととなる。当社での操業におけるPbAg残渣の代表的な組成比率としては、SiO2が20%、Pbが20%その他、SO4などの塩類やSn・Sb化合物であり、Agは約2000ppmである。尤も、Ag濃度は鉱石ブレンドによって変動し、4000〜5000ppmになることもある。
また、Agは、非酸化性の酸には溶解しないので、当該Agが析出するシリカの種晶として効果をもたらしていると考えられる。
この種晶として存在しているBi2O3が、一旦、再溶解したSiO2が再析出する際の種晶として作用していると考えられる。さらに、BiはPbと同様に、非常に重い元素である為、化合物自身の比重が重いことによるアンカー効果によって、SiO2の沈降性、ろ過性を改善していると考えられる。ここでBi濃度範囲を調整して浸出液に添加したところ、浸出液中のBi濃度の増加に伴い、シリカの沈降性・ろ過性向上の効果が現れるが、4g/L以上になると、該効果が顕著になることが判明した。
原料として用いた亜鉛原料の焙焼物の組成を表1に示し、浸出液として用いた電解尾液の液体部分および脱鉄后液の組成を表2に示す。
ここで、AgO、Ag粉は、同和ハイテック(株)製のAgO(粒径約10ミクロン)、Ag粉(粒径約1ミクロン)、Pb・Ag残渣を準備した。
ヘマタイトは、上述した亜鉛製錬工程の脱鉄工程で発生するヘマタイト(純度90%以上)を乾燥し解砕したものを準備した。
Mn澱物は、上述した亜鉛錬工程の電解工程でアノードに付着する澱物を採集し、乾燥・解砕して準備した。
Pb・Ag残渣は、上述した亜鉛製錬工程における亜鉛残査を2次浸出して採取されたものを乾燥・解砕して調整し準備した。
Pd粉は、小坂製錬(株)製のPd粉体(粒径約100ミクロン)を準備した。
その他の添加物は、市販の試薬を準備した。
原料、浸出液は、実施例1と同様のものを用いるが、浸出液へ添加物質を加えることなく実施例1と同様の操作をおこなった。
まず、各添加物質を添加しない浸出液の液温を60℃とし、pH、ORPを測定し、さらに0.2ミクロンのフィルターでろ過し、金属元素の分析を行った。その結果も表3に示す。
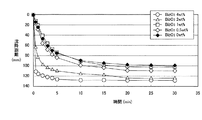
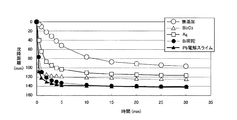
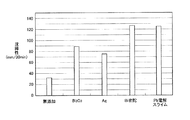
実施例1と同様に浸出液へ凝集剤を15ppm添加し、さらに10秒間手撹拌した後、30分間の沈降性を評価した。この沈降性評価結果の一覧も表5に示し、併せて、当該沈降性評価結果を、図4に縦軸を沈降距離、横軸を時間としたグラフで示し、1分間後の沈降性評価結果を棒グラフで図2に示し、同様に30分間後の沈降性評価結果を図3に示した。
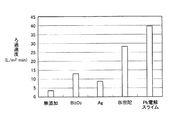
さらに実施例1と同様にスラリーのろ過性評価をおこなった。このろ過性評価結果の一覧も表5に示し、併せて、ろ過速度を図5に棒グラフで示した。この時、浸出液は若干冷めており液温は60℃となっていた。
表3〜5に示した試験結果より、種晶となる各物質を添加する実施例1と、添加しない比較例1とを比較した。すると表3より、いずれの物質を添加した場合であっても、無添加の場合より沈降性またはろ過性の少なくとも一方で向上が見られた。そして、PbO2、AgO、Ag粉、ヘマタイト、Mn澱物、Bi2O3、TiO2、Sb2O3、SnO2、Ga2O3、CdO、Pd、P2O5、CaF2を添加した場合は、無添加の場合より沈降性およびろ過性で向上が見られた。さらに、PbO2、Ag粉、Bi2O3、Ca3(PO4)2、CaF2を添加した場合は、PbAg残渣を添加した場合以上のろ過性改善の効果があることが判明した。
前記浸出液にPbO2を添加しても、それほどPb濃度は上がらないが、Mn濃度が下がる。この時、MnがMnO2となって析出しているのが観察される。つまり、PbO2の大半が種晶となっていると推測される。
AgO添加では、ほぼ全量が溶解し、浸出後も溶解したままであった。それにも拘わらず、比較例1と比較して沈降性が改善されているのは、液性の変化によると考えられる。
Ag粉添加では、約半分が溶解したが、pHの上昇と共に析出した為、液中には残っていない。つまりAgは、共沈による効果と種晶としての効果との両方の効果を発現した可能性が考えられる。
ヘマタイト添加では、若干Fe濃度が上昇していることから、一部溶解したと考えられるが、大部分は種晶として残ることで効果を発揮したと考えられる。
Bi2O3添加では、浸出前に、ほぼ全量溶解している。そして、浸出後はBiが液中に存在しないことから、共沈による効果と種晶としての効果との両方の効果を発現した可能性が考えられる。
Sb2O3添加では、一部が溶解し、一部が未溶解であることから共沈による効果と種晶としての効果との両方の効果を発現した可能性が考えられる。
SnO2およびGa2O3添加では、ほとんど未溶解であることから種晶として効果を発揮したと考えられる。
CdO添加では全量が溶解し、pHが上昇しても溶解したままであった。それにも拘わらず、比較例1と比較して沈降性が改善されているのは、液性の変化によると考えられる。
Ca3(PO4)2およびCaF2添加では、亜鉛原料の焙焼物添加前における浸出液のCa濃度が若干上昇していることから、ごく僅かは溶解していると考えられるが、ほとんど未溶解であることから種晶として効果を発揮したと考えられる。
P2O5添加では、P2O5+3H2O→2H3PO4の反応により、H3PO4となり浸出液に入れると同時に溶解している。
原料として、実施例1で説明したものと同様の亜鉛原料の焙焼物、浸出液として電解尾液の液体部分および脱鉄后液を準備した。実施例1と同様に、電解尾液の液体部分440g、脱鉄后液272gを混合したものを浸出液とした。
実施例1、2と同様に浸出液を準備した。実施例2で説明したBi2O3に加えて、市販のAg、鉛製錬工程から採取したBi密陀、およびPb電解スライムを準備した。これらを前記浸出液へ10g/L(5wt%)添加し、各試料を調製した。尚、撹拌速度は300rpmである。
尚、該Bi密陀、およびPb電解スライムの分析結果を表7に示す。表8より、該Bi密陀、およびPb電解スライムとも、3wt%以上のBiおよびAgを含有していることが判明した。
Claims (10)
- 亜鉛原料から亜鉛を抽出する湿式亜鉛製錬工程において、
焙焼した亜鉛原料を硫酸酸性溶液を用いて浸出する際、ビスマス酸化物、チタン酸化物、アンチモン酸化物、錫酸化物、ガリウム酸化物、カドミニウム酸化物、リン酸カルシウム塩、酸化リン、弗化カルシウム、鉛酸化物、硫酸鉛、硫化鉛、パラジウム、銀酸化物、銀、鉄酸化物、マンガン酸化物から選択される1種以上の添加物質が添加された硫酸酸性溶液を用いて、浸出をおこなうことを特徴とする亜鉛原料の処理方法。 - 前記鉄酸化物として、前記湿式亜鉛製錬工程から産出するヘマタイトを用いることを特徴とする請求項1に記載の亜鉛原料の処理方法。
- 前記マンガン酸化物として、前記湿式亜鉛製錬工程から産出するMn澱物を用いることを特徴とする請求項1に記載の亜鉛原料の処理方法。
- 前記ビスマス酸化物および/または銀として、
鉛製錬工程から産出され、BiまたはAgを3wt%以上含有する、Bi密陀および/または鉛電解スライムを用いることを特徴とする請求項1または2に記載の亜鉛原料の処理方法。 - 前記添加物質の1種以上が添加され、当該添加物質を0.02g/L以上含有する硫酸酸性溶液を用いることを特徴とする請求項1から4のいずれかに記載の亜鉛原料の処理方法。
- 前記添加物質としてBi2O3を用い、前記硫酸酸性溶液中に4g/L以上添加することを特徴とする請求項1に記載の亜鉛原料の処理方法。
- 前記添加物質として鉛製錬工程から産出するBi密陀を用い、前記硫酸酸性溶液中に4g/L以上添加することを特徴とする請求項1に記載の亜鉛原料の処理方法。
- 前記添加物質として鉛製錬工程から産出する鉛電解スライムを用い、前記硫酸酸性溶液中に1g/L以上添加することを特徴とする請求項1に記載の亜鉛原料の処理方法。
- 前記浸出前の前記硫酸酸性溶液のpHを、1.5以下とすることを特徴とする請求項1から8のいずれかに記載の亜鉛原料の処理方法。
- 前記亜鉛原料を浸出する時間を、10分間以上5時間以下とすることを特徴とする請求項1から9のいずれかに記載の亜鉛原料の処理方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2005164799A JP4635231B2 (ja) | 2005-02-16 | 2005-06-03 | 亜鉛原料の処理方法 |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2005039072 | 2005-02-16 | ||
| JP2005164799A JP4635231B2 (ja) | 2005-02-16 | 2005-06-03 | 亜鉛原料の処理方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2006257540A JP2006257540A (ja) | 2006-09-28 |
| JP4635231B2 true JP4635231B2 (ja) | 2011-02-23 |
Family
ID=37097116
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2005164799A Expired - Fee Related JP4635231B2 (ja) | 2005-02-16 | 2005-06-03 | 亜鉛原料の処理方法 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP4635231B2 (ja) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7691347B2 (en) | 2007-09-19 | 2010-04-06 | Freeport-Mcmoran Corporation | Silica removal from pregnant leach solutions |
| CN115612860B (zh) * | 2022-10-26 | 2023-09-19 | 云南驰宏资源综合利用有限公司 | 一种高硅锌焙烧矿的浸出方法 |
| KR102551098B1 (ko) * | 2022-11-03 | 2023-07-05 | 고려아연 주식회사 | 아연의 습식 제련 공법에서 염소를 제거하는 방법 |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP3411320B2 (ja) * | 1993-01-19 | 2003-05-26 | 秋田製錬株式会社 | 亜鉛製錬法 |
| JP3911536B2 (ja) * | 2000-01-31 | 2007-05-09 | Dowaメタルマイン株式会社 | 亜鉛精鉱の浸出法 |
| JP4129499B2 (ja) * | 2000-08-08 | 2008-08-06 | Dowaメタルマイン株式会社 | 鉱物からの硫黄の回収方法 |
-
2005
- 2005-06-03 JP JP2005164799A patent/JP4635231B2/ja not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| JP2006257540A (ja) | 2006-09-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP3999805B1 (ja) | 砒素含有溶液の処理方法 | |
| JP5439997B2 (ja) | 含銅鉄物からの銅回収方法 | |
| JPH10503552A (ja) | 工業廃棄物からの化学価回収法 | |
| JP4846677B2 (ja) | 砒素含有溶液の処理方法 | |
| JP2001316735A (ja) | 銅電解殿物の処理方法 | |
| CN103781923A (zh) | 用于纯化氧化锌的方法 | |
| KR20130077889A (ko) | 황산아연을 함유하는 용액 처리 방법 | |
| JP2013155432A (ja) | ビスマスの回収方法 | |
| JP2009179841A (ja) | 溶融飛灰等の処理方法 | |
| JP2010138490A (ja) | 亜鉛の回収方法等 | |
| JP4615561B2 (ja) | 砒素含有溶液の処理方法 | |
| JP4087433B2 (ja) | 砒素含有溶液の処理方法 | |
| CN102650000A (zh) | 一种从含砷铋的溶液中回收铋和砷的方法 | |
| US20210292927A1 (en) | Method for refining bismuth | |
| JP4635231B2 (ja) | 亜鉛原料の処理方法 | |
| JP3802046B1 (ja) | 重金属含有粉末の処理方法 | |
| JP2008169449A (ja) | 砒素液の浄化方法 | |
| JP2008260683A (ja) | 砒酸鉄粉末 | |
| JP4735943B2 (ja) | 亜鉛原料の処理方法 | |
| JP4149488B2 (ja) | 砒酸鉄粉末 | |
| JP2000169116A (ja) | セレンの選択的浸出回収方法 | |
| EP2042472A1 (en) | Iron arsenate powder | |
| JP5288778B2 (ja) | 重金属含有粉末の処理方法 | |
| JP4914976B2 (ja) | 硫酸亜鉛溶液からのタリウム除去方法 | |
| JP4735947B2 (ja) | 亜鉛原料の処理方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20080324 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20101019 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20101026 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A712 Effective date: 20101101 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20101101 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20101101 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20131203 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |