JP4004635B2 - 有機エレクトロルミネッセント素子 - Google Patents
有機エレクトロルミネッセント素子 Download PDFInfo
- Publication number
- JP4004635B2 JP4004635B2 JP11784198A JP11784198A JP4004635B2 JP 4004635 B2 JP4004635 B2 JP 4004635B2 JP 11784198 A JP11784198 A JP 11784198A JP 11784198 A JP11784198 A JP 11784198A JP 4004635 B2 JP4004635 B2 JP 4004635B2
- Authority
- JP
- Japan
- Prior art keywords
- group
- organic electroluminescent
- electroluminescent device
- polymer
- layer
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- OGGKVJMNFFSDEV-UHFFFAOYSA-N Cc1cc(N(c2ccccc2)c(cc2)ccc2-c(cc2)ccc2N(c2ccccc2)c2cccc(C)c2)ccc1 Chemical compound Cc1cc(N(c2ccccc2)c(cc2)ccc2-c(cc2)ccc2N(c2ccccc2)c2cccc(C)c2)ccc1 OGGKVJMNFFSDEV-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/631—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/10—Organic polymers or oligomers
- H10K85/111—Organic polymers or oligomers comprising aromatic, heteroaromatic, or aryl chains, e.g. polyaniline, polyphenylene or polyphenylene vinylene
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/30—Coordination compounds
- H10K85/321—Metal complexes comprising a group IIIA element, e.g. Tris (8-hydroxyquinoline) gallium [Gaq3]
- H10K85/324—Metal complexes comprising a group IIIA element, e.g. Tris (8-hydroxyquinoline) gallium [Gaq3] comprising aluminium, e.g. Alq3
Landscapes
- Physics & Mathematics (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Addition Polymer Or Copolymer, Post-Treatments, Or Chemical Modifications (AREA)
- Electroluminescent Light Sources (AREA)
Description
【発明の属する技術分野】
本発明は、新規なアリールアミン含有ビニルモノマーの重合物を用いた平面光源や表示素子に利用可能な有機エレクトロルミネッセント素子に関するものである。
【0002】
【従来の技術】
発光層が有機薄膜から構成される有機EL素子は低電圧駆動の大面積表示素子を実現するものとして注目されている。素子の高効率化にはキャリア輸送性の異なる有機層を積層する素子構造が有効であり、正孔輸送層に低分子芳香族アミン、電子輸送性発光層にアルミキレート錯体を用いた素子が報告されている〔C.W.Tang,Appl.Phys.Lett.,51,p.913(1987)〕。この素子では10V以下の印加電圧で1000cd/m2の実用化に十分な高輝度を得ている。
【0003】
しかし、従来検討されてきた低分子芳香族アミンの正孔輸送層では材料のガラス転移温度が60℃〜100℃程度と低く、再結晶化や凝集による素子構造の破壊や、高い環境温度での保存における素子劣化が問題になっている。そのため、初期特性がよい素子でも長時間の使用には向かず、駆動素子寿命が数千時間程度と既存の無機系の発光素子たとえば発光ダイオードに比べると短いという欠点を有している。
【0004】
【発明が解決しようとする課題】
そこで、本発明は、従来のこのような問題点を解決するため、発光効率、発光輝度ならびに安定性に優れた有機エレクトロルミネッセント素子を提供することを目的としている。
【0005】
【課題を解決するための手段】
前記課題を解決するため、本発明者は、結晶化や凝集を起こしにくく膜安定性の高い高分子材料に着目し、正孔輸送性のアリールアミン誘導体を高分子化することを検討した。そして、これらの高分子材料が低分子モデル化合物よりはるかに高いガラス転移温度(140℃以上)を示し、膜の安定性が優れているうえ、正孔輸送層として良好に機能し、高い発光効率、発光輝度を示すとともに素子の安定性の向上に大いに有効であることを見いだし本発明を完成するに至った。
【0006】
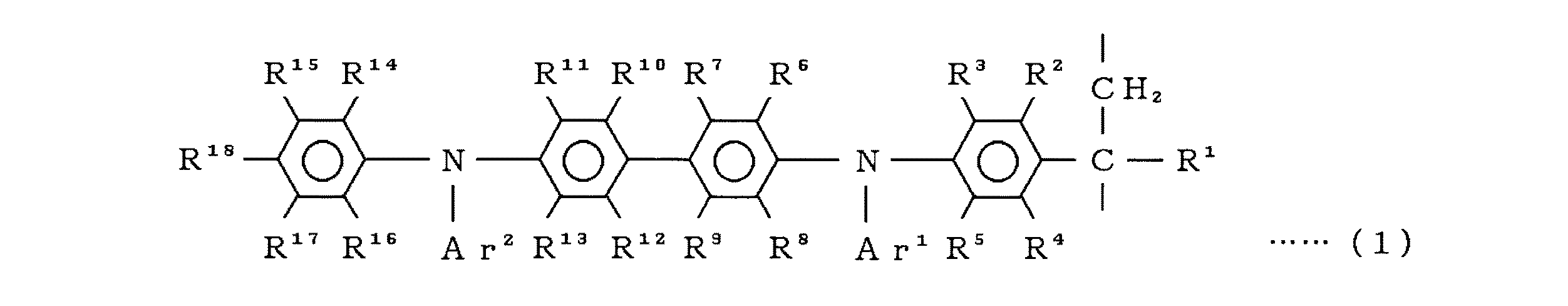
すなわち、本発明は、一般式(1)
【化2】
(式中、R1〜R18は、水素原子、アルキル基、アミノ基、アルコキシ基および置換基を有してもよいアリール基よりなる群からそれぞれ独立して選ばれた基を示し、Ar1とAr2は置換基を有してもよいアリール基よりなる群からそれぞれ独立して選ばれた基を示し、前記いずれの置換基も、フェニル基、ジメチルアミノフェニル基、ジフェニルアミノフェニル基よりなる群からそれぞれ独立して選ばれた基である。)
で示される繰り返し単位を含有する数平均分子量1,000〜1,000,000のアリールアミン含有ビニルポリマーを用いたことを特徴とする有機エレクトロルミネッセント素子に関する。
【0007】
前記R1〜R18における前記アルキル基またはアルコキシ基としては、炭素数1〜20の直鎖状または分岐状のものを挙げることができ、とくに炭素数1〜3のものが好ましい。また、アリール基としては、フェニル基、ナフタレン基、ビフェニール基などを挙げることができる。
【0008】
前記、アリール基の置換基としては正孔特性を阻害しない基であればよく、例えばフェニル基、ジメチルアミノフェニル基、ジフェニルアミノフェニル基などを挙げることができる。
【0009】
前記Ar1〜Ar2におけるアリール基としては、フェニル基、ナフタレン基、ビフェニール基などを挙げることができる。
【0010】
前記、アリール基の置換基としては正孔特性を阻害しない基であればよく、例えばフェニル基、ジメチルアミノフェニル基、ジフェニルアミノフェニル基などを挙げることができる。
【0011】
本発明のアリールアミン含有ビニルポリマーを形成するためのアリールアミン含有ビニルモノマーは例えばつぎのようにして合成することができる。
【0012】
【化3】
【0013】
本発明の高分子化合物を得るための重合または共重合はたとえばラジカル重合触媒の存在下、塊重合、溶液重合、懸濁重合、乳化重合など任意の重合方法を採用することができる。
【0014】
前記アリールアミン含有ビニルモノマーには、任意のビニルモノマーを共重合させることができるが、本発明の有機エレクトロルミネッセント素子に有用なアリールアミン含有ビニルポリマーを得るためには、一般式
【化4】
(式中、R19は水素またはメチル基であり、R20は水素、メチル基、フェニル基、カルボキシレート基、カルバゾール基よりなる群から選ばれた基である。)
で示されるモノマーを使用することができる。この代表的モノマーとしては、エチレン、プロピレン、スチレン、アクリル酸、メタクリル酸、メチルアリクレート、メチルメタクリレート、N−ビニルカルバゾールなどを挙げることができる。
【0015】
また、本発明の有機エレクトロルミネッセント素子を製造するのに適したポリマーを得るためには、アリールアミン含有ビニル単量体が主成分となることが好ましい。そのためには前記一般式(2)のモノマーは全モノマー中50重量%、とくに30重量%を下まわる量で使用することが好ましい。
【0016】
本発明の有機エレクトロルミネッセント素子は、前記高分子材料からなる有機層を備えていれば、素子構造は特に限定されず、有機層一層からなる単層型でも二層以上の多層型であってもよい。要するに前記高分子材料を備えた種々の素子構造に適用することができる。
【0017】
本発明で用いられる高分子は平均分子量が1,000〜1,000,000、とくに3,000〜100,000のものが好ましい。また、この高分子層を含む素子を構成する各層の膜厚については、本発明においては特に限定されない。高分子層は高分子を適当な溶媒に溶解した溶液からの塗布法のほかにもインクジェット法、ラングミュア−ブロジェット法によっても形成される。他の有機層に関しては真空蒸着法などの気相成長法や溶液塗布法によって形成することができる。
【0018】
〔作用〕
有機エレクトロルミネッセント素子では大きな仕事関数を有する陽極すなわち正孔注入電極から正孔が有機層へ注入され、小さな仕事関数を有する陰極電極から電子が有機層へ注入される。正孔輸送層と電子輸送性発光層からなる二層型素子の場合、注入された正孔は正孔輸送層を通り発光層との界面付近において、発光層に注入されてきた電子と再結合し発光層中で励起子を生ずる。この結果、発光層より発光が生じる。このとき、高い発光効率、輝度を得るには、各層の電荷の輸送特性の向上ばかりでなく電極からの電荷の注入効率を上げることが重要である。また、通電によるジュール熱による有機層の再結晶化、凝集の促進、すなわち素子劣化を防ぐためにもガラス転移点の高い材料を選択する必要がある。
【0019】
本発明においては、正孔輸送層に高い正孔輸送特性を有する高分子を用いることにより、電極との密着性を高め電荷の注入特性を上げる。また、アミノ結合を有し、高いガラス転移点を有する高分子を使用するため、結晶化や凝集による素子劣化が抑制され、良好な特性を有する有機エレクトロルミネッセント素子を得ることができる。
【0020】
【実施例】
以下に実施例を挙げて本発明を説明するが、本発明は、これにより何等限定されるものではない。
【0021】
実施例1(テトラフェニルジアミン含有ビニルポリマーの合成)
合成は下記の反応式によった。
【化5】
【0022】
[ジフェニルのテトラフェニルジアミンの合成(TPDD)]
ジフェニルベンジジン14.7g(43mmol)、ヨードベンゼン32.1g(160mmol)、活性銅8.82g(140mmol)、水酸化ナトリウム4.3g(11mmol)を加え、230℃で24時間反応させた。反応後テトラヒドロフラン(THF)で希釈し濾過することにより銅と水酸化ナトリウムを除去した。濾液を回収しエバポレーターで濃縮することにより赤黒い固体を回収した。これにアセトン300mlを加えて撹拌洗浄を行い沈殿物を吸引濾過により回収するとクリーム色の粗結晶が得られた。これは溶媒への溶解性が悪く、カラム精製が困難であるためにさらにアセトンで洗浄を行った。収率:76.94%(18.8g)
【0023】
構造確認のためにこれを少量昇華精製した。構造確認はIRスペクトル、1H−NMRスペクトルと元素分析により行い、それぞれのスペクトルを図1および図2に示した。元素分析値も下記のように理論値と分析値がよく一致した。
融点:235.6〜236.9℃
FT−IR(KBr):1260cm-1〔(Ar)3N〕
1H−NMR(270MHz,DMSO,TMS):δ(ppm)=7.0〜7.8(m,14H,Ar)
元素分析値(C36H28N2):理論値C88.49%、H5.73%、N5.78%、分析値C88.74%、H5.78%、N5.88%
【0024】
[ジフェニルのテトラフェニルジアミンのアルデヒド化(TPDA)]
前記反応により得られたジフェニルのテトラフェニルジアミン(TPDD)7.2g(0.014mol)を50℃のジクロロエタン300mlに溶かし、ジメチルホルムアミド(DMF)30ml中に塩化ホスホニル5.4g(0.035mol)を加えた溶液を滴下した。滴下後、反応は水浴中で1時間行い、そこから反応温度を40〜45℃に設定して一昼夜行った。反応終了後、分液した後、油層を抽出し粘体を得た。得たものは、黒色のタール物質であった。得られたタール物質をクロロホルム:ヘキサン=2:1の混合液を用いてカラム精製をしたところ黄色の粗結晶を得た。収率:38.0%
【0025】
少量を昇華精製し、構造確認を行った。構造確認はIRスペクトル、1H−NMRスペクトルと元素分析により行い、それぞれのスペクトルを図3、図4に示した。元素分析値も下記のように理論値と分析値がよく一致した。
融点:95.9〜97.2℃
元素分析値(C37H28N2O1):理論値C86.02%、H5.46%、N5.42%、分析値C86.00%、H5.54%、N5.41%
【0026】
[ジフェニルのテトラフェニルジアミンのビニル化(TPDV)]
前記反応により得られたジフェニルテトラフェニルジアミンのアルデヒド誘導体(TPDA)5.75g(21mmol)をベンゼン50mlに溶かし、TPDA溶液とする。トリフェニルホスフィンブロマイド7.33g(21mmol)をベンゼン50mlとTHF10mlの混合溶液に加え、懸濁溶液とし、これにブチルリウム−ヘキサン溶液(1.63mol/l)14mlを滴下して、ホスホランを作りその溶液をTPDA溶液に滴下した。反応温度を室温にして、3時間撹拌して反応を行った。反応終了後、ジエチルエーテルで希釈し、塩酸水溶液で洗浄後、有機層を回収した。エバポレーターで濃縮することにより黄色い粘体を得た。この粘体をトルエン:ヘキサン=1:3の混合液を用いてカラム精製をしたところ目的物の白い粗結晶をえた。収率:39.0%(2.23g)
【0027】
構造確認はIRスペクトル、1H−NMRスペクトルと元素分析により行い、それぞれのスペクトルを図5、図6に示した。元素分析値も下記のように理論値と分析値がよく一致した。
融点:86.9〜88.3℃
FT−IR(KBr,cm-1):1500,1600,3000(Ar)
1H−NMR(270MHz,DMSO,TMS):δ(ppm)=47.0〜7.8(m,14H,Ar)
元素分析値(C38H30N2):理論値C88.68%、H5.88%、N5.44%、分析値C88.34%、H6.19%、N5.15%
【0028】
[テトラフェニルジアミン含有ビニルポリマーの合成(PTPD)]
コック付き重合管中で前記工程で得られたテトラフェニルジアミン含有ビニルモノマー(TPAV)0.76g(mol)と開始剤であるアゾイソブチロニトリル(AIBN)0.007g(mol)を溶媒のベンゼン6.0mlに溶かし、凍結脱気後、60℃で24時間反応を行った。反応終了後、メタノール1000mlに注ぎポリマーを沈殿させた。精製は3回再沈精製(クロロホルム/メタノール)を行い、下記の繰り返し単位をもつテトラフェニルジアミン含有ビニルポリマーを得た。重量平均分子量は24000であった。収率:93.2%、ガラス転移点143℃、分解温度413℃であった。
【0029】
【化6】
【0030】
このポリマーは、示差走査熱量計(パーキンエルマー社製DSC7)で測定したガラス転移温度は143℃であり、熱重量計(パーキンエルマー社製TGA7)で測定した窒素ガス中での分解温度も416℃と高く、高い熱安定性を示した。理研計器社製表面分析装置(AC−1)で測定したイオン化ポテンシャルは5.6eVであり、ホール輸送性材料としては十分に小さいイオン化ポテンシャルを有することがわかった。
【0031】
(EL素子の作製)
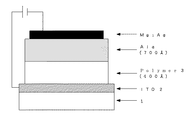
図7は本発明の一実施例の断面図である。1はガラス基板で、その上にシート抵抗15Ω/□のITO(インジウム−チン−オキサイド)2がコートされている。その上に正孔輸送性高分子層3として、前記方法で得られたテトラフェニルジアミン含有ビニルポリマーをクロロホルム溶液からディップコーティング法により400Åの膜厚に形成した。その上から、発光層4として下記式
【化7】
で示される電子輸送性のトリス(8−ヒドロキシキノリノラト)アルミニウム錯体を700Å、10−5Torrの真空下で蒸着して形成した。最後に陰極電極としてMgとAg(10:1)を同じ真空度で2000Å共蒸着した。発光領域の領域は縦0.5cm、横0.5cmの正方形状とした。
【0032】
前記の有機エレクトロルミネッセント素子においてITOを陽極、Mg:Agを陰極として、直流電圧を印加してガラス基板を通して発光を観察した。輝度はトプコン輝度計BM−8により測定した。この素子からは直流電圧の印加により緑色の発光が得られ、発光スペクトルから発光層のトリス(8−キノリノラト)アルミニウム錯体が発光していることを確認した(図8参照)。輝度は9Vで2000cd/m2と高い値を示した。また、作製後3カ月間、室温にて乾燥窒素雰囲気中で保存した素子においても初期特性とほとんど変わらず、素子の保存安定性は極めて良好であることを確認した。さらに、乾燥窒素雰囲気中で100℃の条件で100時間保存した素子においてもおおきな劣化は見られず、この素子が高い耐熱性を有することが確認された。また、一定電流値で連続駆動を行った場合においても、3カ月後に輝度の大幅な低下は見られなかった。
【0033】
比較例1
低分子モデル化合物である下記式
【化8】
で示されるアリールアミン蒸着膜を正孔輸送層に用いた同様の素子では輝度半減時間がわずかに25時間であった。
【0034】
実施例1と比較例1から明らかなように本発明の新規高分子は高いガラス転移温度をもつことにより有機層の安定性が大幅に改善されていることがわかる。
なお、本発明の素子は発光層がトリス(8−キノリノラト)アルミニウム錯体以外の有機材料を用いた時でも同様に安定性の向上が認められた。
【0035】
【発明の効果】
以上、説明したとおり、本発明によれば新規なポリマーを用いて発光特性および安定性に優れた有機エレクトロルミネッセント素子を提供することができた。そして、本発明の有機エレクトロルミネッセント素子は実用化に十分な信頼性を有し、表示、照明の分野で広く利用できる。
【図面の簡単な説明】
【図1】実施例1のジフェニルのテトラフェニルジアミン(TPDD)のIRスペクトル図である。
【図2】実施例1のジフェニルのテトラフェニルジアミン(TPDD)の1H−NMRスペクトル図である。
【図3】実施例1のジフェニルのテトラフェニルジアミンのアルデヒド誘導体のIRスペクトル図である。
【図4】実施例1のジフェニルのテトラフェニルジアミンのアルデヒド誘導体の1H−NMRスペクトル図である。
【図5】実施例1のジフェニルのテトラフェニルジアミンのビニル誘導体のIRスペクトル図である。
【図6】実施例1のジフェニルのテトラフェニルジアミンのビニル誘導体の1H−NMRスペクトル図である。
【図7】実施例1の有機エレクトロルミネッセント素子の断面図である。
【図8】実施例1の発光スペクトル図である。
Claims (1)
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP11784198A JP4004635B2 (ja) | 1998-04-13 | 1998-04-13 | 有機エレクトロルミネッセント素子 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP11784198A JP4004635B2 (ja) | 1998-04-13 | 1998-04-13 | 有機エレクトロルミネッセント素子 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPH11292829A JPH11292829A (ja) | 1999-10-26 |
| JP4004635B2 true JP4004635B2 (ja) | 2007-11-07 |
Family
ID=14721599
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP11784198A Expired - Lifetime JP4004635B2 (ja) | 1998-04-13 | 1998-04-13 | 有機エレクトロルミネッセント素子 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP4004635B2 (ja) |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS6360310A (ja) * | 1986-08-29 | 1988-03-16 | 芝浦メカトロニクス株式会社 | 軌条清掃車 |
| EP2327739B1 (en) | 2002-08-09 | 2014-05-07 | Tosoh Corporation | Novel triarylamine polymer, process for its production and its use |
| TW200613514A (en) * | 2004-05-21 | 2006-05-01 | Showa Denko Kk | Polymer light-emitting material and organic light emitting element |
| JP4866041B2 (ja) * | 2005-08-29 | 2012-02-01 | 株式会社リコー | アリールアミン重合体 |
| EP2413663A1 (en) | 2009-03-27 | 2012-02-01 | FUJIFILM Corporation | Coating solution for organic electroluminescent element |
| JP2012043912A (ja) * | 2010-08-17 | 2012-03-01 | Fujifilm Corp | 有機電界発光素子用材料、該有機電界発光素子用材料を含む組成物、並びに、該組成物により形成された膜、及び有機電界発光素子 |
| JP2015193632A (ja) * | 2015-06-02 | 2015-11-05 | ユー・ディー・シー アイルランド リミテッド | 有機電界発光素子用材料、該有機電界発光素子用材料を含む組成物、並びに、該組成物により形成された膜、及び有機電界発光素子 |
-
1998
- 1998-04-13 JP JP11784198A patent/JP4004635B2/ja not_active Expired - Lifetime
Also Published As
| Publication number | Publication date |
|---|---|
| JPH11292829A (ja) | 1999-10-26 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2717454B2 (ja) | 有機薄膜エレクトロルミネッセンス素子 | |
| JP3760491B2 (ja) | 高分子蛍光体、その製造方法及び有機エレクトロルミネッセンス素子 | |
| KR20000011462A (ko) | 붕소킬레이트를함유한전자발광어셈블리 | |
| JP3546645B2 (ja) | 高分子蛍光体および有機エレクトロルミネッセンス素子 | |
| JPH0945478A (ja) | 高分子蛍光体とその製造方法および有機エレクトロルミネッセンス素子 | |
| JPH10324870A (ja) | 高分子蛍光体および有機エレクトロルミネッセンス素子 | |
| US6368731B2 (en) | Electroluminescent assemblies using boron chelates of 8-aminoquinoline derivatives | |
| US6652995B2 (en) | Organic electroluminescence device | |
| US6503643B1 (en) | Electro-luminescent arrangements with thiophene carboxylate metal complexes | |
| JP4608044B2 (ja) | 新規なアリールアミン含有ビニルポリマーおよびそれを用いた有機エレクトロルミネッセント素子 | |
| JP4004635B2 (ja) | 有機エレクトロルミネッセント素子 | |
| JP4258583B2 (ja) | 電界発光素子 | |
| JP5613941B2 (ja) | 青色発光性高分子化合物、有機エレクトロルミネッセンス素子およびその用途 | |
| JP3817957B2 (ja) | 有機蛍光材料および有機エレクトロルミネッセンス素子 | |
| JP3550741B2 (ja) | カルバゾール誘導体とアントラセン誘導体との共重合体を用いた電界発光素子 | |
| JP3473916B2 (ja) | 有機エレクトロルミネッセント素子 | |
| US6885038B2 (en) | Light-emitting polymers and polymer light-emitting diodes | |
| KR102770440B1 (ko) | 유기 발광 소자 | |
| KR102770365B1 (ko) | 유기 발광 소자 | |
| JP3483979B2 (ja) | 新規モノマー、新規高分子化合物とそれを用いた有機薄膜素子 | |
| JP4643810B2 (ja) | 新規フルオレン含有アリールアミン共重合体、その製造方法およびそれを用いた有機el素子 | |
| JP3972565B2 (ja) | 有機エレクトロルミネッセンス素子、重合性環状構造を有する化合物又はその重合体ならびに蛍光性薄膜 | |
| KR100509122B1 (ko) | 스파이로 화합물 및 이를 포함하는 유기 발광 소자 | |
| JP3965893B2 (ja) | 有機電界発光素子 | |
| JPH04359989A (ja) | 有機エレクトロルミネッセンス素子 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20050401 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20070522 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070719 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20070807 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20070822 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20100831 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130831 Year of fee payment: 6 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| EXPY | Cancellation because of completion of term |