JP3879201B2 - スルホンアミド化合物及びアゾ化合物 - Google Patents
スルホンアミド化合物及びアゾ化合物 Download PDFInfo
- Publication number
- JP3879201B2 JP3879201B2 JP27086497A JP27086497A JP3879201B2 JP 3879201 B2 JP3879201 B2 JP 3879201B2 JP 27086497 A JP27086497 A JP 27086497A JP 27086497 A JP27086497 A JP 27086497A JP 3879201 B2 JP3879201 B2 JP 3879201B2
- Authority
- JP
- Japan
- Prior art keywords
- group
- sulfonamide
- alkyl group
- formula
- compound
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- -1 Sulfonamide compounds Chemical class 0.000 title claims description 22
- 229940124530 sulfonamide Drugs 0.000 title claims description 15
- 125000000217 alkyl group Chemical group 0.000 claims description 11
- 125000004432 carbon atom Chemical group C* 0.000 claims description 8
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 5
- 125000004206 2,2,2-trifluoroethyl group Chemical group [H]C([H])(*)C(F)(F)F 0.000 claims description 4
- 125000001153 fluoro group Chemical group F* 0.000 claims description 4
- 125000000547 substituted alkyl group Chemical group 0.000 claims description 4
- 125000003545 alkoxy group Chemical group 0.000 claims description 3
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 3
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 3
- 125000000565 sulfonamide group Chemical group 0.000 claims description 3
- 125000001301 ethoxy group Chemical group [H]C([H])([H])C([H])([H])O* 0.000 claims description 2
- 125000005843 halogen group Chemical group 0.000 claims description 2
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 claims description 2
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 claims description 2
- 150000003839 salts Chemical class 0.000 claims 1
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 39
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 24
- 229910052757 nitrogen Inorganic materials 0.000 description 19
- 150000001875 compounds Chemical class 0.000 description 16
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 15
- 239000000243 solution Substances 0.000 description 14
- 239000013078 crystal Substances 0.000 description 10
- 239000000126 substance Substances 0.000 description 9
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 8
- 238000000862 absorption spectrum Methods 0.000 description 8
- 238000002329 infrared spectrum Methods 0.000 description 8
- 239000000047 product Substances 0.000 description 8
- ITMCEJHCFYSIIV-UHFFFAOYSA-N triflic acid Chemical class OS(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-N 0.000 description 8
- 239000000975 dye Substances 0.000 description 7
- 239000000203 mixture Substances 0.000 description 7
- 230000003287 optical effect Effects 0.000 description 7
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 7
- 238000006243 chemical reaction Methods 0.000 description 6
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 6
- 238000003756 stirring Methods 0.000 description 6
- KKNZBEYKJLVQJJ-UHFFFAOYSA-N n',n'-diethyl-1,1,1-trifluoro-n-phenylmethanesulfonohydrazide Chemical compound CCN(CC)N(S(=O)(=O)C(F)(F)F)C1=CC=CC=C1 KKNZBEYKJLVQJJ-UHFFFAOYSA-N 0.000 description 5
- ITMCEJHCFYSIIV-UHFFFAOYSA-M triflate Chemical compound [O-]S(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-M 0.000 description 5
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 4
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 4
- 239000000987 azo dye Substances 0.000 description 4
- 238000001914 filtration Methods 0.000 description 4
- 238000001819 mass spectrum Methods 0.000 description 4
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 4
- 239000001632 sodium acetate Substances 0.000 description 4
- 235000017281 sodium acetate Nutrition 0.000 description 4
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- PAYRUJLWNCNPSJ-UHFFFAOYSA-N Aniline Chemical compound NC1=CC=CC=C1 PAYRUJLWNCNPSJ-UHFFFAOYSA-N 0.000 description 3
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- CZYVDGPUWFGIGL-UHFFFAOYSA-N N',N'-dibutyl-1,1,1-trifluoro-N-phenylmethanesulfonohydrazide Chemical compound C(CCC)N(N(C1=CC=CC=C1)S(=O)(=O)C(F)(F)F)CCCC CZYVDGPUWFGIGL-UHFFFAOYSA-N 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 3
- 229910000027 potassium carbonate Inorganic materials 0.000 description 3
- 239000002904 solvent Substances 0.000 description 3
- WJKHJLXJJJATHN-UHFFFAOYSA-N triflic anhydride Chemical compound FC(F)(F)S(=O)(=O)OS(=O)(=O)C(F)(F)F WJKHJLXJJJATHN-UHFFFAOYSA-N 0.000 description 3
- JDHRBIXYTWIMKK-UHFFFAOYSA-N 1,1-diethyl-2-phenylhydrazine Chemical compound CCN(CC)NC1=CC=CC=C1 JDHRBIXYTWIMKK-UHFFFAOYSA-N 0.000 description 2
- LBUJPTNKIBCYBY-UHFFFAOYSA-N 1,2,3,4-tetrahydroquinoline Chemical compound C1=CC=C2CCCNC2=C1 LBUJPTNKIBCYBY-UHFFFAOYSA-N 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 2
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 2
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 2
- 150000008065 acid anhydrides Chemical class 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 239000004202 carbamide Substances 0.000 description 2
- 230000008878 coupling Effects 0.000 description 2
- 238000010168 coupling process Methods 0.000 description 2
- 238000005859 coupling reaction Methods 0.000 description 2
- 125000000664 diazo group Chemical group [N-]=[N+]=[*] 0.000 description 2
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 2
- 238000000921 elemental analysis Methods 0.000 description 2
- 239000000835 fiber Substances 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 125000000623 heterocyclic group Chemical group 0.000 description 2
- 238000000034 method Methods 0.000 description 2
- WWECJGLXBSQKRF-UHFFFAOYSA-N n,n-dimethylformamide;methanol Chemical compound OC.CN(C)C=O WWECJGLXBSQKRF-UHFFFAOYSA-N 0.000 description 2
- PEMGGJDINLGTON-UHFFFAOYSA-N n-(3-aminophenyl)acetamide Chemical compound CC(=O)NC1=CC=CC(N)=C1 PEMGGJDINLGTON-UHFFFAOYSA-N 0.000 description 2
- 229920003023 plastic Polymers 0.000 description 2
- 239000004033 plastic Substances 0.000 description 2
- GEHJYWRUCIMESM-UHFFFAOYSA-L sodium sulfite Chemical compound [Na+].[Na+].[O-]S([O-])=O GEHJYWRUCIMESM-UHFFFAOYSA-L 0.000 description 2
- 125000001424 substituent group Chemical group 0.000 description 2
- NAWXUBYGYWOOIX-SFHVURJKSA-N (2s)-2-[[4-[2-(2,4-diaminoquinazolin-6-yl)ethyl]benzoyl]amino]-4-methylidenepentanedioic acid Chemical compound C1=CC2=NC(N)=NC(N)=C2C=C1CCC1=CC=C(C(=O)N[C@@H](CC(=C)C(O)=O)C(O)=O)C=C1 NAWXUBYGYWOOIX-SFHVURJKSA-N 0.000 description 1
- NSFXSOOBLDWYSG-UHFFFAOYSA-N 1,1-dibutyl-2-phenylhydrazine Chemical compound CCCCN(CCCC)NC1=CC=CC=C1 NSFXSOOBLDWYSG-UHFFFAOYSA-N 0.000 description 1
- WQJHRSQSAUIUHF-UHFFFAOYSA-N 1,1-diethyl-2-(4-methoxyphenyl)hydrazine Chemical compound CCN(CC)NC1=CC=C(OC)C=C1 WQJHRSQSAUIUHF-UHFFFAOYSA-N 0.000 description 1
- UGUHFDPGDQDVGX-UHFFFAOYSA-N 1,2,3-thiadiazole Chemical group C1=CSN=N1 UGUHFDPGDQDVGX-UHFFFAOYSA-N 0.000 description 1
- MPPPKRYCTPRNTB-UHFFFAOYSA-N 1-bromobutane Chemical compound CCCCBr MPPPKRYCTPRNTB-UHFFFAOYSA-N 0.000 description 1
- CXCHEKCRJQRVNG-UHFFFAOYSA-N 2,2,2-trifluoroethanesulfonyl chloride Chemical compound FC(F)(F)CS(Cl)(=O)=O CXCHEKCRJQRVNG-UHFFFAOYSA-N 0.000 description 1
- MLOXIXGLIZLPDP-UHFFFAOYSA-N 2-amino-1h-imidazole-4,5-dicarbonitrile Chemical compound NC1=NC(C#N)=C(C#N)N1 MLOXIXGLIZLPDP-UHFFFAOYSA-N 0.000 description 1
- RXQNKKRGJJRMKD-UHFFFAOYSA-N 5-bromo-2-methylaniline Chemical compound CC1=CC=C(Br)C=C1N RXQNKKRGJJRMKD-UHFFFAOYSA-N 0.000 description 1
- QUXBHHSFRNHYDV-UHFFFAOYSA-N 5-methyl-3h-1,2,4-thiadiazol-2-amine Chemical compound CC1=NCN(N)S1 QUXBHHSFRNHYDV-UHFFFAOYSA-N 0.000 description 1
- AORAGQDTUKSAOP-UHFFFAOYSA-N N',N'-dibutyl-N-phenylacetohydrazide Chemical compound C(CCC)N(N(C1=CC=CC=C1)C(C)=O)CCCC AORAGQDTUKSAOP-UHFFFAOYSA-N 0.000 description 1
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 1
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 1
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 1
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 239000002168 alkylating agent Substances 0.000 description 1
- 229940100198 alkylating agent Drugs 0.000 description 1
- 230000002152 alkylating effect Effects 0.000 description 1
- 125000000751 azo group Chemical group [*]N=N[*] 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 238000004040 coloring Methods 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 229940125904 compound 1 Drugs 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 238000010908 decantation Methods 0.000 description 1
- 238000006193 diazotization reaction Methods 0.000 description 1
- VAYGXNSJCAHWJZ-UHFFFAOYSA-N dimethyl sulfate Chemical compound COS(=O)(=O)OC VAYGXNSJCAHWJZ-UHFFFAOYSA-N 0.000 description 1
- 230000020169 heat generation Effects 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 239000005457 ice water Substances 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 239000000976 ink Substances 0.000 description 1
- HVTICUPFWKNHNG-UHFFFAOYSA-N iodoethane Chemical compound CCI HVTICUPFWKNHNG-UHFFFAOYSA-N 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 239000004973 liquid crystal related substance Substances 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 229910021645 metal ion Inorganic materials 0.000 description 1
- 239000011259 mixed solution Substances 0.000 description 1
- FUPMLXVNXBAYIE-UHFFFAOYSA-N n,n-bis(ethylamino)aniline Chemical compound CCNN(NCC)C1=CC=CC=C1 FUPMLXVNXBAYIE-UHFFFAOYSA-N 0.000 description 1
- 229910052759 nickel Inorganic materials 0.000 description 1
- 238000006396 nitration reaction Methods 0.000 description 1
- 125000004430 oxygen atom Chemical group O* 0.000 description 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- 239000000049 pigment Substances 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 235000019260 propionic acid Nutrition 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 1
- 238000010992 reflux Methods 0.000 description 1
- 239000004065 semiconductor Substances 0.000 description 1
- 239000000741 silica gel Substances 0.000 description 1
- 229910002027 silica gel Inorganic materials 0.000 description 1
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 1
- 235000017557 sodium bicarbonate Nutrition 0.000 description 1
- 229910052938 sodium sulfate Inorganic materials 0.000 description 1
- 235000011152 sodium sulphate Nutrition 0.000 description 1
- 235000010265 sodium sulphite Nutrition 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 239000008096 xylene Substances 0.000 description 1
Images
Landscapes
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Optical Record Carriers And Manufacture Thereof (AREA)
- Heterocyclic Compounds Containing Sulfur Atoms (AREA)
- Quinoline Compounds (AREA)
- Thiazole And Isothizaole Compounds (AREA)
- Nitrogen- Or Sulfur-Containing Heterocyclic Ring Compounds With Rings Of Six Or More Members (AREA)
- Pyridine Compounds (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Nitrogen And Oxygen As The Only Ring Hetero Atoms (AREA)
Description
【発明の属する技術分野】
本発明は、新規なスルホンアミド化合物及びスルホンアミド系アゾ化合物に関するものである。本発明に係るスルホンアミド化合物は、光ディスク用の色素の中間体として有用である。また、本発明のスルホンアミド系アゾ化合物は、プラスチック着色剤、繊維用染料、光学フィルター用色素、印刷インキ、感熱転写用色素等の色材分野、および金属イオン指示薬としても有用である。
【0002】
【従来の技術及び発明が解決しようとする課題】
光ディスクには各種のものが提案されているが、その一つに記録層に有機色素を含むものがある。有機色素としては種々のものが検討されているが、未だ満足すべきものは知られていない。本発明は光ディスク、特に金属反射層を有していて、短波長の半導体レーザーを使用する光ディスクに好適なアゾ系色素の合成に有用な中間体を提供せんとするものである。
【0003】
【課題を解決するための手段】
本発明に係る中間体は、一般式(7)で示されるスルホンアミド化合物である。また、本発明に係る中間体は、一般式(8)で示されるスルホンアミド基を有するアゾ化合物に関する。
【0004】
【化7】
【0005】
(7)式において、Xは水素原子、置換されていてもよいアルキル基若しくはアルコキシ基、又はハロゲン原子を示す。Yは少くとも2個のフッ素原子を有するアルキル基を示す。R1 及びR2 は、それぞれ独立して、置換されていてもよいアルキル基を示すか、又はR1 はXと結合して環を形成していてもよい。
【0006】
好ましくは、Xは水素原子、メチル基、エチル基、メトキシ基、エトキシ基又はメトキシエトキシ基であり、Yは少くとも2個のフッ素原子を有する炭素数1〜3のアルキル基、特にトリフルオロメチル基又は2,2,2−トリフルオロエチル基であり、R1 及びR2 は、それぞれ独立して、置換基を有していてもよい炭素数1〜6のアルキル基である。置換基としては炭素数1〜6のアルコキシ基、フェニル基、シクロヘキシル基、ビニル基などが挙げられる。また、R 1 がXと結合して環を形成している場合には、その環は酸素原子などを含んでいてもよい6員環であるのが好ましく、また環上にはメチル基やエチル基など炭素数1〜4のアルキル基が置換していてもよい。
【0007】
【化8】
【0008】
(8)式において、X、Y、R1 、R2 は式(7)に於けると同一である。Dとしては、イミダゾール環、チアジアゾール環などの複素環があげられる。複素環としては、Dyes and Digments 3(1982)p81〜121に記載のある各種の化合物が好ましく用いられる。本発明に係るスルホンアミド化合物のいくつかを下記の表−1に例示する。
【0009】
【表1】
【0010】
【表2】
【0011】
【表3】
【0012】
本発明に係るスルホンアミド化合物は、下記(9)式で示されるアニリン類に、アルキル基に少くとも2個のフッ素原子を有するアルキルスルホニルハライド又はアルキルスルホン酸無水物を反応させることにより、製造することができる。
【0013】
【化9】
【0014】
(式中、X、R1 及びR2 は(7)式と同じ意義を有する。)
この反応は、一般に−20〜80℃で行うが、好ましくは20℃以下、特に0℃以下で反応を開始し、20〜30℃で反応を終了させるようにする。この反応は溶媒中で行うのが好ましく、溶媒としてはベンゼン、トルエン、キシレン、n−ヘキサン、塩化メチレンなど各種のものを用いることができる。好ましくは塩化メチレン又はトルエンが用いられる。
【0015】
アルキルスルホン酸無水物として、トリフルオロメタンスルホン酸無水物を使用した場合には、スルホンアミド化合物のトリフルオロメタンスルホン酸塩が得られる。
トリフルオロメタンスルホン酸塩は、メタノール、エタノール、N,N−ジメチルホルムアミドなどの適当な溶媒中で酢酸ナトリウム、炭酸水素ナトリウムなどのアルカリを作用させることにより、目的とする遊離のスルホンアミド化合物が得られる。
次工程のジアゾ化カップリングには、トリフルオロメタンスルホン酸塩をそのまま使用してもさしつかえない。
【0016】
【化10】
【0017】
なお、(9)式の化合物は公知の種々の方法により製造することができる。例えばXが水素原子であり、R1 及びR2 がそれぞれ置換されていてもよいアルキル基である化合物は、市場で容易に入手し得る3−アミノアセトアニリドをアルキル化したのち加水分解することにより、容易に製造することができる。また、XとR1 とが環を形成している化合物、例えば表−1のNo.9に対応する化合物は、テトラヒドロキノリンを臭化n−ブチルなどのアルキル化剤を用いてアルキル化し、次いでニトロ化及び還元することにより製造できる。
【0018】
本発明に係るスルホンアミド化合物は、アゾ色素を製造する際のカップリング成分として用いられる。ここに得られるアゾ色素は、光学記録媒体用をはじめ液晶用、感熱転写用、繊維用、プラスチック着色用など種々の用途に用い得る。例えば下記の反応により、得られる含ニッケルアゾ色素は、光学記録媒体のレーザー光吸収用色素として有用である。なお、式中、Eは炭素数1〜3のアルキル基を示す。
【0019】
【化11】
【0020】
本発明に係るアゾ基を有するスルホンアミド化合物のいくつかを下記の表−2に例示する。
【0021】
【表4】
【0022】
【表5】
【0025】
【実施例】
以下に実施例により本発明をさらに具体的に説明するが、本発明は以下の実施例に限定されるものではない。
実施例1
純度93%の3−N,N−ジエチルアミノアニリン8.8g(0.05モル)を20mlのトルエンに溶解させた。窒素気流下でトリフルオロメタンスルホン酸無水物20gを撹拌しながら20℃以下に保ち、これに上記のトルエン溶液を約30分かけて滴下した。引続き0〜5℃で1時間撹拌したのち1夜放置した。氷水200ml中にこの反応液を注ぎ、水層をデカンテーションで除いた。白色沈殿の生成しているトルエン層にn−ヘキサン50mlを加え、淡褐色結晶を得た。このものを濾取し、水洗及び乾燥して、表−1のNo.1の化合物である3−N,N−ジエチルアミノ−トリフルオロメタンスルホンアニリドのトリフルオロメタンスルホン酸塩15.21gを得た。
元素分析結果は、表−3の通りであり、
【0026】
【表8】
【0027】
の計算値と合致した。また、このもののマススペクトルは、M+ 296でありトリフルオロメタンスルホン酸が外れた形で検出された。このもののIRスペクトルを図1に示す。
次に、上記の方法により得られた3−N,N−ジエチルアミノ−トリフルオロメタンスルホンアニリドのトリフルオロメタンスルホン酸塩5gを20〜25℃でメタノール10ml中に溶解させた。このものに、酢酸ナトリウム5gを加え20〜25℃で1時間かきまぜたのち水20mlを加え、トルエン50mlで抽出した。得られた抽出液を水100mlで3回洗浄したのち、硫酸ナトリウムを加え乾燥した。“ワコーゲルC−200”(和光純薬社製シリカゲル)を充填したカラムを用いてカラムクロマト精製を行い、主留分からトルエンを減圧留去することにより、表−1No.1の化合物である3−N,N−ジメチルアミノ−トリフルオロメチルスルホンアニリドの灰白色結晶1.82gを得た。
このものの元素分析結果は表−4の通りであり、
【0028】
【化12】
【0029】
の計算値と合致した。
【0030】
【表9】
【0031】
このもののIRスペクトルを図2に示す。
実施例2
N−メチルピロリドン中、炭酸カリウムの存在下に、3−アミノアセトアニリドとn−ブチルブロミドとを反応させて3−N,N−ジ−n−ブチルアミノ−アセトアニリドを合成した。これを10(容量)%の硫酸水溶液中に加えて溶解させ、還流下に4時間撹拌した。次いで水酸化ナトリウムで中和し、トルエンで抽出することにより、3−N,N−ジ−n−ブチルアミノアニリンを得た。
【0032】
このアニリン化合物を用いた以外は実施例1と同様にして、表−1のNo.2の化合物である3−N,N−ジ−n−ブチルアミノ−トリフルオロメタンスルホンアニリドのトリフルオロメタンスルホン酸塩を得た。このもののマススペクトルを測定するとトリフルオロメタンスルホン酸が外れた形のM+ 352が検出された。このもののIRスペクトルを図3に示す。
【0033】
実施例3
実施例1において、N,N−ジエチルアミノアニリンの代りに3−N,N−ジエチルアミノ−4−メトキシアニリンを用いた以外は実施例1と同様にして、表−1のNo.8の化合物である3−N,N−ジエチルアミノ−4−メトキシ−トリフルオロメタンスルホンアニリドのトリフルオロメタンスルホン酸塩を得た。このもののマススペクトルを測定するとトリフルオロメタンスルホン酸の外れた形のM+ 326が検出された。
IRスペクトルを図3に示す。
【0034】
実施例4
室温のジクロロメタン100mlに、3−N,N−ジエチルアミノアニリン4.08g(0.025モル)とトリエチルアミン6.29g(0.062モル)を溶解した。これに2,2,2−トリフルオロエチルスルホニルクロライド5.0g(0.027モル)をジクロロメタン30mlに溶解したものを滴下した。室温で30分間撹拌したのち50mlの水を添加し、更に30分間撹拌した。反応液をジクロロメタンで抽出し、抽出液から表−1のNo.5の化合物である3−N,N−ジエチルアミノ(2,2,2−トリフルオロエチル)スルホンアニリドを得た。このものの分子量は、マススペクトルにより、3−N,N−ジエチルアミノ−(2,2,2−トリフルオロエチル)スルホンアニリドであることを確認した。
参考例1
【0035】
【化13】
【0036】
上記構造式(10)で示される2−アミノ−4,5−ジシアノイミダゾール2.00gを水60ml、35%塩酸10mlに溶解し、0〜5℃で亜硫酸ナトリウム1.14gの水溶液4.5mlを滴下し、ジアゾ化した。得られたジアゾ液をメタノール65mlに3−N,N−ジエチルアミノトリフルオロメタンスルホンアニリド・トリフルオロメタンスルホン酸塩5.33g、尿素0.6g、酢酸ナトリウム6.0gを溶解させた溶液に0〜5℃で滴下し、3時間撹拌後、一晩放置した。析出した結晶を濾別し、乾燥して下記構造式(11)で示される赤色結晶5.23gを得た。
【0037】
【化14】
【0038】
この化合物のメタノール溶液中での吸収λmaxは、487nmであった。吸収スペクトルを図5に示す。
実施例5
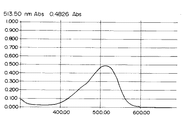
参考例1の処方で合成した構造式(11)で示される本発明の化合物6.6gをメタノール150mlに溶解させ、20℃でかきまぜながら硫酸ジメチル2.0gを2分間で滴下した。このとき発熱のため反応温度は24℃まで上昇した。24〜25℃で1hr撹拌した後、炭酸カリウム2.2gを加え、24〜25℃で5時間撹拌した。生成した結晶を濾別乾燥することにより下記構造式(12)で示される赤色結晶2.56gを得た。この化合物のメタノール溶液中でのλmaxは、513.5nmであった。吸収スペクトルを図6に示す。
【0039】
【化15】
【0040】
実施例6
参考例1の処方で合成した構造式(11)で示される本発明の化合物4.4gをN,N−ジメチルホルムアミド(以降DMFと略す)35mlに溶解させ、炭酸カリウム1.38gを加える。15〜25℃で撹拌しながらヨウ化エチル1.87gを10分間で滴下した。このものを60〜63℃に加熱し3時間反応させ、10〜15℃まで冷却後脱塩水25mlを約15分間で滴下した。一晩放置した後、結晶を濾別水洗した。得られた結晶をメタノール100ml中に分散させ15℃〜25℃で1時間かきまぜた後、結晶を濾別、メタノールで洗浄、乾燥することにより下記構造式(13)で示される赤色の化合物2.87gを得た。
【0041】
【化16】
【0042】
この化合物のDMF−メタノール(5:95)混合溶液中のλmaxは、517.5nmであった。吸収スペクトルを図7に示す。
【0044】
実施例7
【0045】
【化18】
【0046】
上記構造式(17)で示される2−アミノ−5−メチル−1,2,4−チアジアゾール1.15gを酢酸10ml、プロピオン酸5mlに溶解させ、撹拌しながら0〜5℃で硫酸1mlを滴下し、さらに0〜5℃で43%ニトロシル硫酸3.55gを滴下してジアゾ化した。
得られたジアゾ液をメタノール30mlに3−N,N−ジブチルアミノトリフルオロメタンスルホンアニリド、トリフルオロメタンスルホン酸塩5.0g、尿素0.4g、酢酸ナトリウム4.0gを溶解させた溶液中に0〜5℃で滴下し3時間撹拌後、一晩放置した。
析出した結晶を濾別、乾燥して下記構造式(18)で示される赤褐色の化合物1.6gを得た。
【0047】
【化19】
【0048】
メタノール溶液中のλmaxは523nmであった。吸収スペクトルを図8に示す。
【図面の簡単な説明】
【図1】実施例1で得られた3−N,N−ジエチルアミノ−トリフルオロメタンスルホンアニリドのトリフルオロメタンスルホン酸塩のIRスペクトルである。
【図2】実施例1で得られた3−N,N−ジエチルアミノトリフルオロメタンスルホンアニリドのIRスペクトルである。
【図3】実施例2で得られた3−N,N−ジ−n−ブチルアミノ−トリフルオロメタンスルホンアニリドのIRスペクトルである。
【図4】実施例3で得られた3−N,N−ジエチルアミノ−4−メトキシ−トリフルオロメタンスルホンアニリドのIRスペクトルである。
【図5】参考例1で得られた物質の、メタノール溶液中での吸収スペクトルである。
【図6】実施例5で得られた物質の、メタノール溶液中での吸収スペクトルである。
【図7】実施例6で得られた物質の、DMF−メタノール(5:95)で溶液中での吸収スペクトルである。
【図8】実施例7で得られた物質の、メタノール溶液中での吸収スペクトルである。
Claims (5)
- Yがトリフルオロメチル基又は2,2,2−トリフルオロエチル基であることを特徴とする請求項1記載のスルホンアミド化合物。
- Xが水素原子、メチル基、エチル基、メトキシ基、エトキシ基又はメトキシエトキシ基であり、R1 及びR2 が、それぞれ独立して、炭素数1ないし6のアルキル基であることを特徴とする請求項1又は2記載のスルホンアミド化合物。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP27086497A JP3879201B2 (ja) | 1996-11-20 | 1997-10-03 | スルホンアミド化合物及びアゾ化合物 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP30917896 | 1996-11-20 | ||
| JP8-309178 | 1996-11-20 | ||
| JP27086497A JP3879201B2 (ja) | 1996-11-20 | 1997-10-03 | スルホンアミド化合物及びアゾ化合物 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPH10204070A JPH10204070A (ja) | 1998-08-04 |
| JP3879201B2 true JP3879201B2 (ja) | 2007-02-07 |
Family
ID=26549416
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP27086497A Expired - Lifetime JP3879201B2 (ja) | 1996-11-20 | 1997-10-03 | スルホンアミド化合物及びアゾ化合物 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP3879201B2 (ja) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2005026263A1 (ja) * | 2003-09-11 | 2005-03-24 | Mitsubishi Chemical Corporation | アゾ金属キレート色素及び光学記録媒体 |
| JP4510500B2 (ja) * | 2004-04-15 | 2010-07-21 | 株式会社リコー | アゾ置換インドール化合物及びアゾ金属キレート化合物、並びに光記録媒体 |
| JP5471382B2 (ja) * | 2008-12-26 | 2014-04-16 | セントラル硝子株式会社 | 含フッ素アルキルスルホニルアミノエチルα−置換アクリレート類の製造方法 |
-
1997
- 1997-10-03 JP JP27086497A patent/JP3879201B2/ja not_active Expired - Lifetime
Also Published As
| Publication number | Publication date |
|---|---|
| JPH10204070A (ja) | 1998-08-04 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JPS5941363A (ja) | 新規ピリリウム系染料およびその製造方法 | |
| KR20110033454A (ko) | 친유성 나노 입자 표지를 위한 신규 시아닌 화합물 및 그 제조방법 | |
| JP3879201B2 (ja) | スルホンアミド化合物及びアゾ化合物 | |
| JPH0313265B2 (ja) | ||
| JPH0313266B2 (ja) | ||
| JP3009267B2 (ja) | 含フッ素モノアゾ染料 | |
| US4246414A (en) | 2-Alkoxyalkoxy-5-nitrobenzenesulfonic acid and salt thereof | |
| CN101735637B (zh) | 含薁类结构菁染料及其制备方法 | |
| US4394314A (en) | Process of preparing aromatic aldehydes by reacting selected aromatic compounds with formamidine acetate and an organic acid anhydride | |
| JPH0232301B2 (ja) | Jisuazosenryonoseizoho | |
| JP2002322151A (ja) | 新規化合物、及びそれを用いたアゾ化合物の製造方法 | |
| JPH02302471A (ja) | アゾ化合物およびその製法 | |
| JPS60140240A (ja) | シアン色素のための色素開放剤を含有するカラー写真記録材料、これらの色素を用いて生成されたカラー画像、および色素 | |
| JP2986467B2 (ja) | アゾ化合物の製造方法 | |
| EP0028464B1 (en) | Azo dyestuff preparation by phase transfer catalysed coupling in a two-phase medium | |
| US4233237A (en) | 2-Alkoxyalkoxy-5-aminobenzenesulfonic acid | |
| JP5008332B2 (ja) | アジン系化合物 | |
| JPS59102955A (ja) | ビスアゾ系黄色色素 | |
| JPH05255221A (ja) | パーフルオロアルキル置換アゾ化合物の製造方法 | |
| JP3780693B2 (ja) | アザチオキサンテン系化合物及びその製造方法 | |
| JP2568941B2 (ja) | オキソノール染料の製造方法 | |
| JPH11171870A (ja) | 新規オキソノール化合物 | |
| JPS58154560A (ja) | 新規なトリスアゾ化合物 | |
| GB2080287A (en) | 2-Alkoxy-5-aminobenzene Sulfonates and 5-Diazo Derivatives thereof | |
| JPS5821934B2 (ja) | アザメチン染料 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20060725 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20060920 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20061017 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20061030 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313113 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20091117 Year of fee payment: 3 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20101117 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20111117 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20121117 Year of fee payment: 6 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20131117 Year of fee payment: 7 |
|
| EXPY | Cancellation because of completion of term |