JP3658397B2 - 飛行時間型二次イオン質量分析法による素子の情報取得方法、および、情報取得装置 - Google Patents
飛行時間型二次イオン質量分析法による素子の情報取得方法、および、情報取得装置 Download PDFInfo
- Publication number
- JP3658397B2 JP3658397B2 JP2003161862A JP2003161862A JP3658397B2 JP 3658397 B2 JP3658397 B2 JP 3658397B2 JP 2003161862 A JP2003161862 A JP 2003161862A JP 2003161862 A JP2003161862 A JP 2003161862A JP 3658397 B2 JP3658397 B2 JP 3658397B2
- Authority
- JP
- Japan
- Prior art keywords
- biochip
- information acquisition
- ion beam
- primary
- primary ion
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N23/00—Investigating or analysing materials by the use of wave or particle radiation, e.g. X-rays or neutrons, not covered by groups G01N3/00 – G01N17/00, G01N21/00 or G01N22/00
- G01N23/22—Investigating or analysing materials by the use of wave or particle radiation, e.g. X-rays or neutrons, not covered by groups G01N3/00 – G01N17/00, G01N21/00 or G01N22/00 by measuring secondary emission from the material
- G01N23/225—Investigating or analysing materials by the use of wave or particle radiation, e.g. X-rays or neutrons, not covered by groups G01N3/00 – G01N17/00, G01N21/00 or G01N22/00 by measuring secondary emission from the material using electron or ion
- G01N23/2255—Investigating or analysing materials by the use of wave or particle radiation, e.g. X-rays or neutrons, not covered by groups G01N3/00 – G01N17/00, G01N21/00 or G01N22/00 by measuring secondary emission from the material using electron or ion using incident ion beams, e.g. proton beams
- G01N23/2258—Measuring secondary ion emission, e.g. secondary ion mass spectrometry [SIMS]
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01J—ELECTRIC DISCHARGE TUBES OR DISCHARGE LAMPS
- H01J49/00—Particle spectrometers or separator tubes
- H01J49/02—Details
- H01J49/10—Ion sources; Ion guns
- H01J49/16—Ion sources; Ion guns using surface ionisation, e.g. field-, thermionic- or photo-emission
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01J—ELECTRIC DISCHARGE TUBES OR DISCHARGE LAMPS
- H01J49/00—Particle spectrometers or separator tubes
- H01J49/26—Mass spectrometers or separator tubes
- H01J49/34—Dynamic spectrometers
- H01J49/40—Time-of-flight spectrometers
Landscapes
- Chemical & Material Sciences (AREA)
- Analytical Chemistry (AREA)
- Physics & Mathematics (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Molecular Biology (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Biochemistry (AREA)
- General Health & Medical Sciences (AREA)
- General Physics & Mathematics (AREA)
- Immunology (AREA)
- Pathology (AREA)
- Engineering & Computer Science (AREA)
- Plasma & Fusion (AREA)
- Other Investigation Or Analysis Of Materials By Electrical Means (AREA)
- Analysing Materials By The Use Of Radiation (AREA)
- Investigating Or Analysing Biological Materials (AREA)
Description
【発明の属する技術分野】
本発明は、複数の生体関連物質を基板上にマトリクス状に配置した、所謂、バイオチップ表面の各マトリクスのイメージング、および、各マトリクスの組成分析に関する。
【0002】
【背景技術】
DNAチップ、プロテインチップ等、各種のプローブ分子を基板上にマトリクス状に配置したもの、所謂、バイオチップは、ゲノム解析、あるいは、遺伝子の発現解析などの目的に利用されるようななってきた。また、それらバイオチップを利用した解析の結果は、癌、遺伝病、生活習慣病、感染症等の診断、予後予想、治療方針の決定等に、重要な指標を提供するものと期待されている。
【0003】
バイオチップの作製方法には、幾つかの手法が知られている。DNAチップを例にとって説明すると、フォトリソグラフィーを用いて、直接基板上にDNAプローブを逐次的に合成していく方法(米国特許第5405783号明細書等)、あるいは、予め合成したDNA、または、cDNA(コンプリメンタリーDNA)を、基板上に供給し結合する方法(米国特許第5601980号明細書、特開平11‐187900号公報、Science Vol.270, 467, 1995等)が代表的なDNAチップの作製法である。
【0004】
一般的には、前記二種の方法によってバイオチップは作製されるが、作製されたバイオチップを先に述べた用途に使用しようとする場合、解析の信頼性、すなわち、定量性、再現性を保証するためには、各マトリクスに存在するプローブ、すなわち、プローブに利用する生体関連物質の量、つまり、密度を知ることが重要である。また、実際に、どのようなマトリクス形状(形状、サイズ、状態)で存在するかを知ること(イメージング)も、やはり、定量性、再現性の確保といった見地から重要である。さらに、後述するように、チップ作製に利用される基板に、マトリクスの位置を明示するための物理的アドレスを設けていない場合、例えば、インクジェット法によってプローブ溶液を微小な液滴として供給するような手法でバイオチップを作製した際、物理的アドレスがないため、検出の手段によっては、バイオチップ上のどのプローブ部分を分析しているか、判断に迷うという問題をかかえることにもなる。その場合、採用している検出手段そのものが、マトリクス位置の顕影化を可能とするものであることが必要となる。
【0005】
しかし、バイオチップ上のプローブは、原理的には単分子膜レベルとされており、基本的に、マトリクス位置の顕影化を含めた生体関連物質の分析には、極めて高感度な表面解析技術が必要となる。
【0006】
前記の要件を満足する高感度な表面解析技術の一つとして、プローブ自体にアイソトープラベルを施す方法が知られてはいるが、ラベル化の手法が煩雑であり、利用されるアイソトープラベル自体、被爆源となる危険性を有し、そのため、特殊な施設、装置が必要等の理由で、汎用性の観点で難点を有している。
【0007】
別の方法として、プローブを蛍光標識する方法、または、プローブと特異的に結合する物質に蛍光標識を施し、これとプローブを結合させる方法、すなわち、DNAチップにおいては、蛍光ハイブリダイゼーション法が考えられる。しかしながら、標識に利用する蛍光色素の安定性、蛍光クエンチング、あるいは、蛍光色素の基板表面への非特異的吸着、さらには、特異的結合(ハイブリダイゼーション)の定量性(安定性、再現性)等、高い定量性を達成する上では、種々の問題が存在しており、プローブ自体の存在量を定量的に把握するには、なお課題が残る。
【0008】
その他、一般的な検出対象に利用可能な高感度表面分析手段として、FT−IR(フーリエ変換赤外分光)法を用いたATR法、XPS(X線光電子分光)法等があるが、いずれも、生体関連物質である、バイオチップのプローブの定量的分析、あるいは、イメージングには十分な感度を有しているとはいえない。特に、バイオチップの作製用基板として、一般的なガラスを用いる場合には、例えば、FT−IR(ATR)法では、基板のガラス自体に起因する吸収の影響、また、XPS法では、ガラス自体は絶縁性材料であるため、チャージアップの影響等があり、有効な分析手段とはいえない。
【0009】
また、生体関連物質に利用可能な、別の高感度表面分析手段として、レーザー共鳴イオン化法(RIS:Resonance Ionization Spectroscopy)によるDNAの検出方法が、米国特許第5821060号明細書に開示されている。この方法では、試料表面から放出される注目元素のイオン化エネルギーに相当する波長のレーザービームを照射して、当該元素をイオン化し検出するものである。その際、試料表面から元素を放出させる手段としては、レーザービームを用いる方式、イオンを用いる方式が開示されているが、特定元素の検出しかできないという技術的な制約を持つ。
【0010】
さらに、他の高感度表面分析手段としては、動的二次イオン質量分析法(dynamic−SIMS)があるが、この手法では、二次イオンを生成する過程で、有機化合物を小さいフラグメントイオン、または粒子にまで分解している。そのため、質量スペクトルから得られる化学構造情報は多くなく、例えば、構成する塩基は共通した四種しかない核酸関連物質のような有機物の分析には、得られる情報は不十分であり、汎用的に利用するには適していない。
【0011】
これに対して、同じく二次イオン質量分析法の一手法として知られている、飛行時間型二次イオン質量分析(TOF−SIMS)法は、固体試料の最表面にどのような原子または分子が存在するかを調べるための分析方法であり、下記する特長を持つ。すなわち、109atoms/cm2(最表面1原子層の1/105に相当する量)の極微量成分の検出能があること、有機物、無機物のどちらにも適用できること、表面に存在するすべての元素や化合物を測定できること、試料表面に存在する物質からの二次イオンのイメージングが可能なことである。
【0012】
以下に、この飛行時間型二次イオン質量分析法の原理を簡単に説明する。
【0013】
高真空中において、高速のイオンビーム(一次イオン)を固体試料表面に照射すると、スパッタリング現象によって表面の構成成分が真空中に放出される。この過程で発生する正または負の電荷を帯びたイオン(二次イオン)を、電場によって一方向に収束し、一定距離だけ離れた位置で検出する。スパッタの際には、試料表面の組成に応じて、様々な質量をもった二次イオンが発生するが、一定の電界中では、質量の軽いイオンほど速い速度で、反対に、重いイオンほど遅い速度で飛行する。そのため、二次イオンが発生してから、検出器に到達するまでの時間(飛行時間)を測定することで、発生した二次イオンの質量を分析することができる。
【0014】
一方、dynamic−SIMS法では、既に述べたように、イオン化の際、有機化合物は、小さいフラグメントイオンまたは粒子にまで分解してしまうため、質量スペクトルから得られる化学構造情報、例えば、質量範囲は限定されるのに対し、TOF−SIMS法では、一次イオン照射量が著しく少ないため、有機化合物は化学構造を保った状態でイオン化され、幅の広い質量範囲で測定される質量スペクトルから有機化合物の構造をより直接的に知ることができる。加えて、固体試料表面の最も外側で発生した二次イオンのみが、真空中へ放出されるので、試料の最表面(深さ数Å程度)の情報を、選択的に得ることができる。
【0015】
前記測定原理を採用するTOF−SIMS装置には、大きく分けて、セクター型とリフレクトロン型のふたつのタイプがある。この二方式間の違いの一つは、被分析試料を固定するホルダの電気的な接地方法である。セクター型では、装置の機構上、固定ホルダに数kVの正または負の電圧を印加することで、発生した二次イオンを質量分析計に導いているのに対し、リフレクトロン型では、固定ホルダは接地し、二次イオン引き出し電極に数kV〜数10kVの正または負の電圧を印加することで、二次イオンを質量分析計に導いている。
【0016】
TOF−SIMS法では、正の一次イオンが多用されるが、一次イオンの極性にかかわらず正の二次イオンと負の二次イオンが発生する。また、一次イオンの極性に依らず、一般的な測定条件では、一次イオンの照射により二次電子が発生し、二次電子の発生量は一次イオン量に比べて多量であるために、結果として、被分析試料の表面は正に帯電し易く、この帯電電荷が過剰(所謂、チャージアップ状態)になると、定量的な測定に支障をきたすことになる。このチャージアップに関して、装置構成を考えると、セクター型装置を用いて、絶縁物の負の二次イオンを測定する場合に、最も大きく正に帯電し得るといえる(発生した二次電子が全て、上記の正電圧を印加した二次イオン引き出し電極に向かってしまうため)。
【0017】
上記チャージアップの正帯電を中和するため、セクター型、リフレクトロン型の両タイプとも、帯電中和用のパルス型電子銃を装備することが多い。このパルス型電子銃による、具体的な帯電中和方法は、一次イオン(サブ〜数nsのパルス)照射、正または負の二次イオンの飛行時間計測を行った後、次の一次イオンパルスを照射するまでの間に、上記パルス型電子銃からの電子線を被分析試料に一定時間照射する工程を設けるものである。なお、パルス型電子線から電子線を被分析試料に照射する間は、セクター型においては、試料ホルダへの電圧印加、また、リフレクトロン型においては、二次イオン引き出し電極への電圧印加はともに停止され、それぞれ接地される。
【0018】
この帯電中和方法により、チャージアップした正帯電は緩和され(もしくは解消し)、絶縁物の分析が可能となることが多い。なお、セクター型装置を使った絶縁物の測定で、負の二次イオンを測定する場合に、最も大きく正に帯電し易いため、帯電中和のマージンは、この測定形態が最も狭い。いずれにしても、チャージアップを回避するには、常時、試料ホルダが電気的に接地されているリフレクトロン型装置を使う方が、セクター型装置を使うよりも(一般的には)有利である。特に、被分析試料の導電率が低い場合(抵抗率が高い、もしくは、誘電率が高いと言い換えることができる)、例えば、ガラス等の場合には、リフレクトロン型装置の方が、定量的な測定に適しているといえる。
【0019】
【特許文献1】
米国特許第5405783号明細書
【特許文献2】
米国特許第5601980号明細書
【特許文献3】
特開平11−187900号公報
【特許文献4】
米国特許第5821060号明細書
【非特許文献1】
Science Vol.270, 467, 1995
【0020】
【発明が解決しようとする課題】
さて、リフレクトロン型であれ、セクター型であれ、TOF−SIMS法は、極めて感度の高い分析方法であるため、チャージアップの影響が少ない被分析試料、例えば、導電性に優れた金属基板上に単分子膜レベルで形成されたオリゴヌクレオチドを分析することが可能である(Proceeding of the12th International Conference on Secondary Ion Mass Spectrometry 951, 1999)。また、本発明者らによる検討では、チャージアップ防止操作をすることにより、例えば、高抵抗率材料の基板である、ガラス基板のような誘電率の高い基板表面に結合された、例えば、オリゴヌクレオチドなどの生体関連物質であっても、個別的なスポット測定を行う際には、例えば、一次イオンを直径数μm程度で照射して、その場で分析することが可能である。
【0021】
しかしながら、本発明者らによる検討では、抵抗率が高い基板を用いる場合、ある程度広い領域、例えば、500μm×500μmの範囲を、一次イオンビーム直径5μmで、テレビ受像機の走査線のように、一定の方向に一次イオンビームを順次スキャン(ラスタースキャン)し、二次元的な二次イオン測定画像を得ようとすると、チャージアップの影響が大きく、良好な画像を得ることができなかった。
【0022】
本発明は前記の課題を解決するもので、本発明は、抵抗率が高い基板上に固定されている生体関連物質に関して、ある程度広い領域に関して、TOF−SIMS法を利用して、その二次元的な二次イオン測定画像を得る際、チャージアップの影響を抑制して、定量性の良好な二次元的な測定画像を得ることを可能とする測定方法を提供する。
【0023】
【課題を解決するための手段】
本発明者らは、上記の課題、すなわち、TOF−SIMS法を利用して、比較的抵抗率の高い基板上に生体関連物質が形成されているバイオチップの、比較的面積の大きな部分の二次元的なイメージングを行う際、チャージアップの影響を抑制する手段について、鋭意検討した結果、一次イオンビームをスポット照射する際、その照射スポットを、パルス的とし、さらに、非連続的なパターンで移行しつつ、二次イオン測定を進め、最終的に、前記非連続的なパターンに従って、二次イオン測定結果を二次元的なイメージ画像へと再構成することで、十分に高い位置分解能を有する二次元的なイメージ測定画像が得られることを見出した。本発明者らは、前記の離散的なパターンに従って、一次イオンビームをパルス照射すると、帯電中和が若干不足するスポット部分があっても、それに隣接するスポット点の測定がなされるまでの間に、チャージアップ状態の解消がなされ、結果として、二次イオン測定に実質的な影響を及ぼさないことを確認し、これらの知見に基づき、本発明を完成するに至った。
【0024】
すなわち、本発明にかかる素子の情報取得方法は、
複数の物質が基板表面上に配置された素子の表面から、飛行時間型二次イオン質量分析法を用いて、情報取得する方法であって、
前記素子の表面上の被測定領域の面積と比較して、より小さい面積の被照射部とする一次イオンビームを、非連続的パターンでパルスとして前記素子の表面に照射する工程、
前記照射される一次イオンビームによって被照射部から発生する二次イオンを飛行時間的に質量分析する工程、および
前記質量分析で得られる二次イオンの分析結果を、前記一次イオンビームのパルス的照射のパターンに基づいて、二次元的情報に再構成する工程を、有することを特徴とする素子の情報取得方法である。その際、前記非連続的パターンは、前記素子の表面において二次元的にランダムなパターンであることが好ましい。また、前記非連続的パターンは、前記素子の表面において特定のプログラムされたパターンであってもよい。
【0025】
本発明にかかる情報取得方法においては、前記一次イオンビームのイオン種として、金イオンまたは金の多原子イオンを好適に利用することができる。必要に応じて、該素子表面から情報取得が、一次イオンビームのスキャンと、前記基板自体の位置的スキャンとを複合して行う形式を選択することができる。
【0026】
なお、本発明にかかる情報取得方法は、前記物質が、核酸である際に好適に適用できる。特に、前記核酸として、DNA、RNAのいずれかが選択されている場合に好適である。その際、前記一次イオンビームによって発生する二次イオン種は、少なくとも、核酸由来のリン酸バックボーンのフラグメント化、および、イオン化に基づくものを含むことができる。具体的には、DNA、RNAを対象とする場合、前記一次イオンビームによって発生する二次イオン種は、少なくとも、P-、PO-、PO2 -、またはPO3 -のいずれかを含むことができる。
【0027】
さらには、核酸を対象とすることに付随して、前記一次イオンビームによって発生する二次イオン種は、少なくとも、核酸塩基のフラグメント化、および、イオン化に基づくものを含むことができる。具体的には、前記一次イオンビームによって発生する二次イオン種は、少なくとも、(アデニン−H)-、(チミン−H)-、(グアニン−H)-、(シトシン−H)-、(ウラシル−H)-のいずれかを含むことができる。
【0028】
なお、前記物質はPNAであってもよく、その際には、前記一次イオンビームによって発生する二次イオン種は、少なくとも、ペプチドバックボーンのフラグメント化、および、イオン化に基づくものを含むことができる。
【0029】
さらには、前記物質はタンパク質であってもよく、その際には、前記一次イオンビームによって発生する二次イオン種は、少なくとも、アミノ酸残基のフラグメント化、および、イオン化に基づくものを含むことができる。
【0030】
本発明にかかる情報取得方法においては、利用される飛行時間型二次イオン質量分析装置として、前記基板を電気的に接地した状態で保持しつつ、測定がなされるリフレクトロン型TOF−SIMS装置を選択することが好ましい。
【0031】
加えて、本発明は、素子表面の組成分析へも適用でき、
すなわち、本発明にかかる素子表面の組成分析方法は、
複数の物質が基板表面上に配置された素子の表面を、飛行時間型二次イオン質量分析法を用いて、該素子表面上に配置される物質の組成を分析する方法であって、
前記素子の表面上の被測定領域の面積と比較して、より小さい面積の被照射部とする一次イオンビームを、非連続的パターンのパルスとして前記素子の表面に照射する工程、
前記照射される一次イオンビームによって被照射部から発生する二次イオンを飛行時間的に質量分析する工程、
前記質量分析で得られる二次イオンの分析結果を、前記一次イオンビームのパルス的照射のパターンに基づいて、二次元的画像に再構成する工程、
得られた二次元的画像中に含まれる必要な部分のマススペクトル情報に基づき、前記表面に配置された物質の組成分析を行う工程とを
少なくとも有することを特徴とする素子表面の組成分析方法である。
【0032】
対応して、本発明は、上述する本発明にかかる情報取得方法の実施に適する測定装置の発明をも提供し、
すなわち、本発明にかかる素子表面の情報取得装置は、
複数の物質が基板表面上に配置された素子表面から、飛行時間型二次イオン質量分析法を用いて、情報取得するための装置であって、
前記素子の表面上の被測定領域の面積と比較して、より小さい面積の被照射部となる一次イオンビームを、非連続的パターンでパルスとして前記素子の表面に照射する手段、
前記パルス的に照射される一次イオンビームによって被照射部から発生する二次イオンを飛行時間的に質量分析する手段、および
前記質量分析で得られる二次イオンの分析結果を、一次イオンビームの照射のパターンに基づいて、二次元的情報に再構成する手段を、具えていることを特徴とする素子表面の情報取得装置である。
【0033】
なお、本発明は、分析対象である素子がバイオチップである際に、より好適な形態となり、
すなわち、本発明にかかるバイオチップの情報取得方法は、
複数の生体関連物質が基板表面上に配置されたバイオチップに関して、飛行時間型二次イオン質量分析法を用いて、該バイオチップ表面から情報取得する方法であって、
前記バイオチップの生体関連物質が配置される表面上の被測定領域の面積と比較して、より小さい面積のスポットサイズを有する一次イオンビームを、非連続的パターンでパルス的に前記バイオチップの表面に照射する工程、
前記パルス的に照射される一次イオンビームによって発生する二次イオンを飛行時間的に質量分析する工程、および
前記質量分析で得られる二次イオンの分析結果を、一次イオンビームのパルス的照射のパターンに基づいて、二次元的情報に再構成する工程を、少なくとも有することを特徴とするバイオチップの情報取得方法である。
【0034】
さらには、本発明にかかるバイオチップ表面の組成分析方法は、
複数の生体関連物質が基板表面上に配置されたバイオチップに関して、飛行時間型二次イオン質量分析法を用いて、該バイオチップ表面上に配置される生体関連物質の組成を分析する方法であって、
前記バイオチップの生体関連物質が配置される表面上の被測定領域の面積と比較して、よりも小さい面積のスポットサイズを有する一次イオンビームを、非連続的パターンでパルス的に前記バイオチップの表面に照射する工程、
前記パルス的に照射される一次イオンビームによって発生する二次イオンを飛行時間的に質量分析する工程、
前記質量分析で得られる二次イオンの分析結果を、一次イオンビームのパルス的照射のパターンに基づいて、二次元的画像に再構成する工程、
得られた二次元的画像中に含まれる必要な部分のマススペクト情報に基づき、該部分の生体関連物質の組成分析を行う工程とを少なくとも有することを特徴とするバイオチップ表面の組成分析方法である。
【0035】
加えて、本発明は、上述するバイオチップ表面から情報取得方法に利用可能な装置の発明をも提供し、すなわち、本発明にかかるバイオチップ表面の情報取得装置は、
複数の生体関連物質が基板表面上に配置されたバイオチップに関して、飛行時間型二次イオン質量分析法を用いて、該バイオチップ表面から情報取得するための装置であって、
前記バイオチップの生体関連物質が配置される表面上の被測定領域の面積と比較して、よりも小さい面積のスポットサイズを有する一次イオンビームを、非連続的パターンでパルス的に前記バイオチップの表面に照射する手段、
前記パルス的に照射される一次イオンビームによって発生する二次イオンを飛行時間的に質量分析する手段、および
前記質量分析で得られる二次イオンの分析結果を、一次イオンビームのパルス的照射のパターンに基づいて、二次元的情報に再構成する手段を、少なくとも具えていることを特徴とするバイオチップ表面の情報取得装置である。
【0036】
【発明の実施の形態】
以下に、本発明をより詳細に説明する。
【0037】
本発明の方法では、TOF−SIMSを用いて画像取得を行うにあたって、一次イオンのパルス照射を、上記のラスタースキャンではなく、非連続的パターンに基づいて行い、得られたそれぞれのパルス照射による質量分析の結果を、一次イオンのパルス照射のパターンに基づいて再構成して、画像化することを特徴としている。この非連続的パターンによるスキャンの手法により、比較的抵抗率の高い基板上に生体関連物質が形成されたバイオチップの、比較的面積の大きな部分のイメージングが可能となる。
【0038】
スキャンの非連続的パターンは、原則的には、チャージアップの影響を排除可能であれば、いかようなパターンでもかまわなく、好適な非連続的パターンの例として、ランダムなパターン、あるいは、特定のプログラムされたパターンを挙げることができる。非連続的パターンでスキャンする場合、一次イオン照射される(ビーム形状と同一形状を有する)単位部分(以下、ピクセルと呼ぶ)は、最終的に隣接するピクセルと重なり合っても差し支えないが、同一部分が同一回のスキャンで複数回照射されると、複数回照射における、二回目以降の照射において得られるデータは実際の数値を反映しないことになり、好ましくない。すなわち、仮に、ランダム・パターン発生にコンピューター上で乱数を用いる場合、使用する範囲で一様な発生確率を有する乱数を使用することが望ましい。また、場合により、上記のように適宜プログラムされ特定のパターンを使用することができる。なお、上記の「特定のプログラムされたパターン」に関しては、原理的には、そのスキャン軌跡が、十分に離散的であれば、ランダム・スキャンと同等の効果が期待できるが、その一方で、該スキャン軌跡が離散的ではあるが、その間隔が狭い場合、例えば、照射するピクセルが一つ置きのように近い場合、チャージアップの影響を排除できない可能性もある。したがって、上記の「特定のプログラムされたパターン」を使用する場合、スキャン軌跡が、十分に離散的であることが好ましい。
【0039】
上述するように、取得された各ピクセルのマススペクトルにより画像を形成しようとする場合、一次イオンのスキャンを非連続的、すなわち、ランダム、あるいは、特定のプログラムされたパターン等によって行うので、データを得られた順に再構成すると、実際を正しく反映する画像を得ることができない。このようなスキャン方法を採用する場合、本発明では、一次イオンの照射パターンを記憶し、得られたデータを、これら記憶されたパターンに基づいて再構成して、実際を正しく反映した画像を得る。
【0040】
本発明における、非連続的一次イオン照射と得られるデータの再構成は、チャージアップに大きく影響される、主として抵抗率の高い基板を用いる場合に、極めて有効である。逆に、通常のラスタースキャンでもイメージング可能な抵抗率の低い基板を用いる場合には、非連続スキャンでは、データの再構成に、ラスタースキャンに比べると長い時間を必要とするので、却って、現実的には、その利点が十分に発揮できないこともある。その利点を発揮する上では、使用する基板の抵抗率によって、適宜スキャン方法を選択すればよい。例えば、非連続的なスキャンが特に有効な基板材料としては、その抵抗率が、体積抵抗率で1010ohm・cm(300K)以上の範囲である絶縁性材料が例示できる。
【0041】
バイオチップの基板として、好適に使用されるガラス基板の体積抵抗率は、約1010ohm・cm(300K)以上であり、本発明にかかる二次元的画像化方法を応用するには最も適している基板といえる。
【0042】
また、一次イオン種としては、イオン化効率、質量分解能等の観点からガリウムイオン、セシウムイオン、また、場合によっては金(Au)イオン等が、好適に用いられる。なお、Auイオンを用いると、極めて高感度の分析が可能となる点で好ましい。その際、Auイオンのみならず、金の多原子イオンである、Au2イオン、Au3イオンを用いることができ、この順で感度の上昇が図られる場合も多く、金の多原子イオンの利用は、さらに好ましい形態となる。
【0043】
TOF−SIMSを用いてイメージングを行う場合には、質量分解能、分析面積、分析時間は、測定条件の一次イオンパルス周波数、一次イオンビームエネルギー、一次イオンパルス幅と、画像処理に利用されるコンピューターのデータハンドリング能力とは相互に密接に関係しており、一義的には簡単に決まらない。しかしながら、分析可能であるという観点から、前記測定条件の各設定値は、ある範囲であることが必要となる。
【0044】
それらの観点から、本発明では、一次イオンビームパルス周波数は、1kHz〜50kHzの範囲であることが望ましく、また、一次イオンビームエネルギーは、12keV〜25keVの範囲であること、さらには、一次イオンビームパルス幅は、0.5ns〜10nsの範囲であることが望ましい。
【0045】
また、本発明は、高い分解能を有する質量スペクトルによるイメージング、あるいは、後述のように、イメージングから高い質量分解能を有する組成分析を目標とする。その際、定量精度を向上させるために、高い質量分解能を保持し、比較的短時間で測定を完了させる必要があることから(一測定に要する時間を、数10秒〜数10分のオーダーとする)、二次元イメージングに必要とする位置分解能を満足する範囲で、一次イオンビーム径を多少犠牲にして、得られる二次イオン量を多くする条件で測定することが好ましい。具体的には、一次イオンビーム径をサブミクロンオーダーまで絞り込まず、寧ろ、分析対象バイオチップの各マトリクス(ドット、あるいは、スポットともいう)のサイズが、通常、直径10μm〜100μm、また、10μm×10μm〜100μm×100μmの範囲であることを勘案した上で、一次イオンビーム径(直径)を1μm〜10μmの範囲に設定することが好ましい。
【0046】
一次イオンビームによるスキャンのエリアは、上述のように他の要因と関係するので、やはり一義的には決まらないが、直径50μm〜500μmの範囲、あるいは、50μm×50μm〜500μm×500μmの範囲に選択することが望ましい。
【0047】
一回の特定のスキャンが何個の一次イオンビームの照射数、すなわち、ピクセル数から構成されるかは、スキャンエリアサイズ、一次イオンビーム径、ピクセルが、どの程度重なる(オーバーラップ)か、また、一次イオン照射周波数、もしくは、一回のスキャン時間によって決まり、それらは、また、二次イオン像を構成するピクセル数を自動的に既定する。その意味からいって、二次イオン像は、56個×56個〜1024個×1024個の範囲のピクセルで構成されていることが望ましい。
【0048】
一般的に用いられているバイオチップの外形サイズは、例えば、1cm×1cm、1インチ×1インチ(25.4mm×25.4mm)、あるいは、スライドグラスサイズ(例えば、26mm×76mm)であり、マトリクスは、その内部に配置されている。上述のスキャンエリアサイズでは、前記外形サイズのバイオチップ基板全面にわたり、一度に全てをイメージングすることはできない。このようにイメージングすべき領域サイズがスキャンエリアサイズを超えている場合には、必要に応じて、一次イオンビームスキャンに加えて、基板の位置的スキャン(一般的には基板を搭載したステージをスキャンするので、ステージスキャンという)を併用して、より広い範囲のスキャンすることが望ましい。このステージスキャンを併用する場合、より広い範囲をスキャンしようとすると長い分析時間を必要とすることになるが、基板内の全面にマトリクスが配置されているわけはなく、従って、必要に応じて分析エリアを選択することになるが、その際、基板の位置的スキャンのスキャンエリアとしては、直径1mm〜直径30mmの範囲、または、1mm×1mm〜30mm×30mmの範囲であることが望ましい。
【0049】
これまで述べてきたように、本発明は、TOF−SIMSを用いたバイオチップのイメージングをその主眼とする。しかしながら、これを逆からみると、イメージングは、TOF−SIMSで検出、測定、分析可能なフラグメントイオンの質量データに基づく。すなわち、さらに別の面からみると、イメージングされたバイオチップの質量データの検出されている部分(もしくはピクセル)からは、原理的にマススペクトルデータが抽出可能であることになる。本発明は、これらイメージングされ、位置が特定された部分の組成分析を包含する。これによって、実際に製作されたバイオチップの特定の部分がイメージングされることにより、位置や形状が特定され、かつ、その部分の組成分析が可能となる。
【0050】
本発明の方法によって、イメージングされ、または、組成分析されるバイオチップに搭載され生体関連物質は、本発明によるTOF−SIMS法によってイメージングされ、または、組成分析可能であるものであれば、特に限定されるものではなく、どのような物質であってもかまわない。本発明者らの検討では、バイオチップに搭載され生体関連物質が、核酸、蛋白質であれば好適に分析し得る。核酸の例としては、オリゴデオキシヌクレオチド、ポリデオキシヌクレオチド、cDNA(コンプリメンタリーDNA)等のDNA、または、mRNA、tRNA、rRNA等のRNA、さらには、骨格がペプチドで構成されるPNA(ペプチド核酸)で代表される核酸アナログがあげられる。蛋白質の例としては、オリゴペプチド、ポリペプチド、酵素、抗体等を例としてあげることができる。
【0051】
これらの生体関連物質は、基板上にどのような様態で存在してもかまわないが、バイオチップ自体のバイオチップとしての使用様態(例えば、DNAチップの場合は、ハイブリダイゼーション等)と、TOF−SIMS法を用いる分析時の、例えば、イオン化の安定性等を勘案すると、生体関連物質は、基板表面に共有結合によって結合しているものが望ましい。これら共有結合の方法には様々な方法が知られており、それらを適宜応用すればよい。利用可能な共有結合方法の一例は、特開平11−187900号公報に記載されている。
【0052】
また、共有結合の一形態として、固相上での核酸、蛋白質の逐次合成方法が知られており、本発明の方法が対象とする、バイオチップの作製方法として、前記固相合成方法を用いてもかまわない。
【0053】
さらに、生体関連物質の基板への共有結合方法として、予め共有結合をするための官能基を有する、例えば、核酸、蛋白質を、上記官能基と共有結合可能な官能基が形成された基板に供給し、共有結合させる方法がある。その際、基板上への生体関連物質の供給方法としては、既知の方法であるピエゾジェット法、サーマルジェット法を代表とするインクジェット法を好適に用いることができる。特開平11−187900号公報には、サーマルジェット法によるDNAプローブの基板への供給方法についても記載がなされている。
【0054】
TOF−SIMS法によって、バイオチップのイメージング、組成分析を行うためには、上記生体関連物質に特有のフラグメントイオンが二次イオンとして検出される必要がある。その際、検出するフラグメントイオンは、生体関連物質に特有であり、かつ、TOF−SIMS法で検出可能であれば、いかなるイオン種であってもかまわない。
【0055】
以下に、生体関連物質と、それに特異的なフラグメントイオンについて、限定的でない例を挙げる。
【0056】
生体関連物質が核酸であれば、リン酸ジエステルからなるバックボーンを有するので、フラグメントイオンとしては、上記リン酸バックボーンのフラグメントイオンであるP-、PO-、PO2 -、またはPO3 -のいずれをも好適に検出することができる。
【0057】
また、核酸は、それがDNAであれば、アデニン、チミン、グアニン、シトシン、RNAであれば、チミンの替わりにウラシルの、それぞれ4種の塩基を有する。また、代表的な核酸アナログであるPNAも、4種の塩基、アデニン、チミン、グアニン、シトシンを持つので、これらの塩基のフラグメントイオン、すなわち、(アデニン−H)-:C5H4N5 -、(チミン−H)-:C5H5N2O2 -、(グアニン−H)-:C5H4N5O-、(シトシン−H)-:C4H4N3O-、(ウラシル−H)-:C4H3N2O2 -を、二次イオンとして利用することができる。
【0058】
また、PNAはバックボーンがペプチド結合で構成されているので、このペプチド結合のフラグメントイオン、例えば、CNO-イオン(N=C=O-)やCN-イオンなどをTOF−SIMSの検出に好適に利用し得る。
【0059】
検出すべき生体関連物質が、蛋白質である場合も、PNAと同様にバックボーンはペプチド結合で構成されているので、ペプチド結合のフラグメントイオンを利用できる。また、ペプチド鎖を構成する、各アミノ酸残基由来のフラグメントイオンも利用可能である。なお、DNA、RNA、PNAを構成する核酸のヌクレオチド残基は、各4種であるのに対して、ペプチド鎖を構成するアミノ酸残基は、20種以上であり、その結果として、1種のアミノ酸残基由来のマススペクトル強度が小さくなるので、検出の効率は低下することになる。
【0060】
本発明の情報取得方法において、二次元的なイメージング、および、組成分析における手段として利用するTOF−SIMS装置に関しては、検出、二次元イメージング、組成分析が可能な装置であれば、どのような型式の装置であってもかまわない。なお、既述のように、絶縁性材料を用いる際における、基板のチャージアップの影響をより効果的に低減する目的からは、常時、基板を固定するホルダが電気的に接地されているリフレクトロン型装置を利用することがより望ましい。
【0061】
【実施例】
以下に、実施例を挙げて、本発明をより具体的に説明する。以下に示す具体例は、本発明にかかる最良の実施形態の一例ではあるが、本発明はかかる具体的形態に限定されるものではない。
【0062】
(実施例1)
dT40プローブによる核酸プローブチップの作製
特開平11−187900号公報に記載の方法に準じて、石英ガラス基板を利用して、核酸プローブチップを作製した。
【0063】
(1)基板洗浄
25.4mm×25.4mm×1mmの合成石英基板をラックに入れ、純水で10%に稀釈した超音波洗浄用洗剤(ブランソン:GPIII)に一晩浸した。その後、該洗剤中で20分間超音波洗浄を行い、その後、水洗により洗剤を除去した。純水ですすいだ後、純水の入った容器中でさらに超音波処理を20分間行った。次に、予め80℃に加温した1N水酸化ナトリウム水溶液に、この基板を10分間浸した。引き続き水洗、純水洗浄を行って、そのまま乾燥せず、洗浄済基板として、次工程に供した。
【0064】
(2)表面処理
アミノ基を結合したシランカップリング剤、N−β−(アミノエチル)−γ−アミノプロピルトリメトキシシラン KBM603(信越化学工業)の1wt%水溶液を室温下で2時間攪拌し、該シラン化合物の分子内のメトキシ基を加水分解した。この溶液に、上記(1)で得た洗浄済基板を室温で1時間浸漬した後、純水で洗浄し、窒素ガスを基板の両面に吹き付けて乾燥させた。次に、基板を120℃に加熱したオーブン中で1時間ベークして、最終的に基板表面にアミノ基を導入した。
【0065】
次いで、N−マレイミドカプロイロキシスクシンイミド(同仁化学研究所:以下、EMCS)2.7mgを、ジメチルスルホキシド(DMSO)/エタノールの1:1(容量比)溶液に濃度が0.3mg/mlとなる様に溶解した。前記シランカップリング処理を行った石英基板を、このEMCS溶液中に室温で2時間浸漬して、シランカップリング処理によって基板表面に導入されているアミノ基と、EMCSのスクシイミド基を反応させた。この反応に伴い、基板表面にはEMCS由来のマレイミド基が存在することになる。EMCS溶液から引き上げた基板は、前記DMSO/エタノール混合溶媒、及びエタノールで順次洗浄した後、窒素ガスを吹き付けて乾燥させた。
【0066】
(3)プローブDNAの合成
DNA合成業者(ベックス)に依頼して、配列番号:1の一本鎖核酸(dTの40量体)を合成した。なお、配列番号:1の一本鎖DNAの5’末端には、合成時にチオールモディファイア(グレンリサーチ)を用いて、スルファニル基(SH)を導入した。DNA合成後、脱保護、DNAの回収は、常法に従って行い、また、精製には、HPLCを用いた。合成から精製までの一連の工程は、すべて合成業者に依頼して行った。
配列番号:1
5’−HS−(CH2)6−O−PO2−O−TTTTTTTTTT TTTTTTTTTT TTTTTTTTTT TTTTTTTTTT 3’
(4)サーマルジェットプリンターによるDNA吐出、および基板への結合
(3)に記載する配列番号:1の一本鎖DNAを、最終濃度8μMで、グリセリン7.5wt%、尿素7.5wt%、チオジグリコール7.5wt%、アセチレンアルコール(商品名:アセチレノールEH;川研ファインケミカル(株)社製)1wt%を含む溶液に溶解した。
【0067】
一方、サーマルジェット法の一種であるバブルジェット法を用いたバブルジェットプリンターBJF−850(キヤノン)用のプリンターヘッドBC−50(キヤノン)を、数100μlの溶液を吐出可能とするべく改造した。この改造を施したヘッドを、平板である石英基板上へ、インク吐出が可能となるよう改造した吐出描画機に搭載した。このヘッドの改造タンク部に、前記DNA溶液を数100μl注入し、吐出描画機にEMCS処理基板を装着して、EMCS処理表面にスポッティングした。なお、スポッティング時の吐出量は、4pl/dropletで、スポッティングの範囲は、基板の中央部に10mm×10mmの範囲に、200dpi、すなわち、127μmのピッチで吐出した。この条件では、スポッティングされたドットの直径は約50μmであった。
【0068】
スポッティング終了後、基板を30分間加湿チャンバー内に静置し、基板表面のマレイミド基と、核酸プローブ5’末端のスルファニル基(−SH)とを反応させ、DNAプローブを固定させた。次いで、基板を純水で洗浄し、純水中で保存した。DNA結合基板(DNAチップ)は、TOF−SIMSによる分析直前に窒素ガスを吹き付けて乾燥し、真空デシケーター中でさらに乾燥した。
【0069】
(実施例2)
TOF−SIMSによるイメージング、組成分析
(1)実施例1で作製したDNAチップのイメージング、および、組成分析を、ION TOF社製TOF−SIMS IV装置を用いて行った。
【0070】
以下に、測定に用いた装置、条件をまとめて示す。
【0071】
<一次イオン>
一次イオン:25kV Ga+、0.6pA(パルス電流値)、ランダムスキャンモード
一次イオンのパルス周波数:2.5kHz(400μs/shot)
一次イオンパルス幅:1ns
一次イオンビーム直径:5μm
<二次イオン>一次イオンの照射パターンについて再構成しイメージング
二次イオン検出モード:negative
測定領域:300μm×300μm
二次イオンimageのpixel数:128×128
積算回数:256
(2)測定結果
図1に、実施例1で作製したDNAチップについて、TOF−SIMS IV型装置で上記の測定条件に基づき分析し、得られたデータから代表的なイオン種について二次元イメージングを行った結果を示す。図1−1、1−2はそれぞれ、DNAのリン酸バックボーンのフラグメントイオンであるPO2 -、PO3 -イオンによるイメージング結果である。これらの二次元イメージ像に示すように、DNAチップ上にDNAがバブルジェットでスポッティングした形状(直径約50μmのほぼ円形形状、ピッチ約125μm)で存在していることが確認される。1種のフラグメントイオンによるイメージングだけではなく、図1−3に示すように、PO2 -イオンとPO3 -イオンの加算による二次元イメージングも可能である。
【0072】
リン酸バックボーン由来のフラグメントイオンの他にも、例えば、図1−4に示すように、核酸塩基由来のフラグメントC5H5N2O2 -イオンによるイメージングも可能である。本実施例に使用したプローブDNAは、チミジル酸のホモオリゴマーであるので、検出される核酸塩基由来のフラグメントイオンは、C5H5N2O2 -イオン、すなわち、(チミン−H)-イオンのみであった。
【0073】
図2に、得られたイメージング画像のドットの内部と外部の代表的な二次イオンに関する質量スペクトルプロファイルを示す。例えば、SiH3イオンは、ドットの内部のDNAに特異的ではないので、ドットの内部、外部で同様に検出される。一方、DNAに特異的、すなわち、ドットの外部より存在確率の高い、O2 -、P-、PO-、PO2 -、PO3 -、CNO-(核酸塩基由来)、C5H5N2O2 -の各イオンは、ドットの外部と比較して、ドットの内部で有意にイオン強度が強く検出されている。図2に示す結果より、本発明の方法を用いることで、マススペクトルにより二次元的なイメージングがなされ、位置が特定された部位の組成分析が可能であることが判る。
【0074】
(実施例3)
4種塩基混在50量体プローブによる核酸プローブアレイの作製、ならびにそのイメージング、組成分析
(1)DNAチップの作製
実施例1に記載する手順と、全く同様な方法により、下記配列番号:2のDNAを用いて、DNAチップを作製した。
配列番号:2
5’ HS−(CH2)6−O−PO2−O−TGCAGGCATG CAAGCTTGGC ACTGGCCGTC GTTTTACAAC GTCGTGACTG 3’
(2)TOF−SIMSによるイメージング、組成分析
実施例2に記載する測定条件、方法と全く同様な方法で、前記配列番号:2のDNAからなるDNAチップに対して、イメージングと組成分析を行った。
【0075】
その結果、実施例2に示す、リン酸バックボーン由来のフラグメントイオン、(チミン−H)-イオンなどのフラグメントイオンに加えて、(アデニン−H)-、(グアニン−H)-、(シトシン−H)-の各フラグメントイオンによるイメージングと、組成分析が可能であった。
【0076】
(実施例4)
RNAチップの作製と、そのイメージングと組成分析
(1)RNAチップの作製
RNA分解酵素であるRNaseフリーな条件で、全ての作製工程を行うこと以外は、実施例1と全く同様な条件、手順で、配列番号:3のRNA(U20)を用いて、RNAチップを作製した。
配列番号:3
5’ HS−(CH2)6−O−PO2−O−UUUUUUUUUU UUUUUUUUUU 3’
(2)TOF−SIMSによるイメージング、組成分析
実施例2に記載する測定条件、方法と全く同様な方法で、前記配列番号:3のRNAからなるRNAチップに対して、イメージングと組成分析を行った。なお、TOF−SIMS分析の直前まで、RNAチップ基板をRNaseフリーな条件に保った。
【0077】
その結果、実施例2と同様に、リン酸バックボーン由来のフラグメントイオンが検出された他に、(ウラシル−H)-イオンが検出され、イメージング、および、組成分析が可能であった。
【0078】
(実施例5)
PNAチップの作製と、イメージングと組成分析
(1)PNAチップの作製
実施例3で用いたDNAプローブと塩基配列が同一(配列番号:2’とする)のPNAを、合成業者(ベックス)に依頼して合成した。なお、N末端(核酸分子における5’末端に対応)に、下記に示したリンカーを介して、アミノ酸の一種であるシステインを結合した。システインは、側鎖にSH基を有しているので、このSH基を用いて、石英基板の表面処理後のマレイミド基と結合することが可能である。
【0079】
配列番号:2’のPNAを用いて、実施例1と同様な方法により、PNAチップを作製した。
配列番号:2’
N−Cys−NH(CH2)2−O−(CH2)2−O−CH2CONH−TGCAGGCATG CAAGCTTGGC ACTGGCCGTC GTTTTACAAC GTCGTGACTG
(2)TOF−SIMSによるイメージング、組成分析
実施例2に記載する測定条件、方法と全く同様な方法で、前記配列番号:2’のPNAからなるPNAチップに対して、イメージングと組成分析を行った。
【0080】
その結果、実施例3と同様に、PNAを構成する4種の塩基に由来する、(アデニン−H)-、(チミン−H)-、(グアニン−H)-、(シトシン−H)-の各フラグメントイオンによるイメージングと、組成分析が可能であった。なお、PNAには、リン酸バックボーンが存在しないので、リン酸バックボーンに由来するフラグメントイオンに代えて、PNAのバックボーンであるペプチド結合に由来するフラグメントイオン、例えば、CNO-イオンやCN-イオンなどをも検出した。
【0081】
(実施例6)
蛋白質チップの作製と、イメージングと組成分析
(1)蛋白質チップの作製
実施例1〜5に示す、合成核酸プローブとは異なり、蛋白質を石英基板上に固定し、具体的には、市販(シグマ−アルドリッチジャパン)の牛胸腺アルブミン(BSA:蛋白質の一種)を用いて、蛋白質チップを作製した。なお、BSAには、システイン(Cysteine)残基が含まれており、実施例5と同様に、このシステイン側鎖のSH基と基板表面のマレイミド基の反応により、基板上への結合を図った。
【0082】
実施例1と同様の方法により、該蛋白質溶液のスポットを行い、蛋白質チップを作製した。なお、バブルジェットによるBSAの吐出に関しては、利用する溶媒条件、BSA濃度などを適宜調整した。
【0083】
(2)TOF−SIMSによるイメージング、組成分析
二次イオンの検出モードを、positiveに選択する以外は、実施例2と全く同様な方法、手順で、上記BSAを固定したチップのイメージングと組成分析を行った。
【0084】
その結果、幾つかのアミノ酸残基のフラグメントイオンによるイメージングと組成分析が可能であった。イメージングに利用される、代表的な二次イオン種は、Pro残基由来のフラグメントイオンと考えられるC4H6N+、C4H8N+、Arg残基由来のフラグメントイオンと考えられるCH3N+、C2H7N3 +、C4H10N3 +、C4H11N3 +、C5H8N3 +、および、Trp残基由来のフラグメントイオンと考えられるC9H8N+、C10H11N+、C11H8NO+、であった。加えて、Cys残基由来のフラグメントイオンと考えられるC2H6NS+、CHS+も観測されている。
【0085】
すなわち、上記のようなアミノ酸残基に起因すると考えられるフラグメントイオンを用いることで、絶縁物基板上の蛋白質についてイメージングすることが可能である。アミノ酸配列に特徴のある蛋白質の場合、当該蛋白質の二次元分布に相当するイメージ像を、上記アミノ酸残基由来のフラグメントイオンを用いることで得ることができる。また、各アミノ酸残基に起因すると考えられるそれぞれのフラグメントイオンによるイメージ像と数値解析(例えば、複数の蛋白質について、当該蛋白質に含まれるアミノ酸の存在量を数値化し、これと対応するアミノ酸残基由来のフラグメントイオンの強度(イメージ像の強度)を相関づけることなど)により、蛋白質毎のイメージ像(二次元分布像)を算出する(抽出する)ことも可能である。
【0086】
(実施例7)
一次イオン種をAu+とする以外は、実施例2と全く同様の方法で、実施例1で作製したDNAチップについて、イメージング、及び、組成分析を行った。その結果、実施例2で検出された各イオンに関して、約二桁感度の高い質量スペクトルと、それに基づいたイメージングが可能であった。なお、前記感度の対比は、同一の加速エネルギーで照射される一次イオンの単位イオン量当たりの、検出される二次イオン量を指標として行った。
【0087】
(実施例8)
4種塩基混在18量体プローブによる核酸プローブアレイの作製、ならびに一次イオン種としてGa+およびAu3 +を用いたTOF−SIMSによるイメージング、組成分析
(1)DNAチップの作製
実施例1に記載する手順と、全く同様な方法により、下記配列番号:4のDNAを用いて、DNAチップを作製した。
配列番号:4
5’ HS−(CH2)6−O−PO2−O−ACTGGCCGTC GTTTTACA 3’
(2)TOF−SIMSによるイメージング、組成分析
一次イオン種としてGa+およびAu3+を用い(装置は、ION TOF社製TOF−SIMS IV)、前記配列番号:4のDNAからなるDNAチップに対して、イメージングと組成分析を行った。以下に、各測定条件をまとめて示す。
一次イオン種としてGa+を用いる場合:
<一次イオン>
一次イオン:25kV Ga+、0.6pA(パルス電流値)、ランダムスキャンモード
一次イオンのパルス周波数:2.5kHz(400μs/shot)
一次イオンパルス幅:約1ns
一次イオンビーム直径:5μm
<二次イオン>一次イオンの照射パターンについて再構成しイメージング
二次イオン検出モード:negative
測定領域:300μm×300μm
二次イオンimageのpixel数:128×128
積算回数:256
一次イオン種としてAu3 +を用いる場合:
<一次イオン>
一次イオン:25kV Au3 +、0.07pA(パルス電流値)、ランダムスキャンモード
一次イオンのパルス周波数:5kHz(200μs/shot)
一次イオンパルス幅:約1ns
一次イオンビーム直径:5μm
<二次イオン>一次イオンの照射パターンについて再構成しイメージング
二次イオン検出モード:negative
測定領域:300μm×300μm
二次イオンimageのpixel数:128×128
積算回数:281
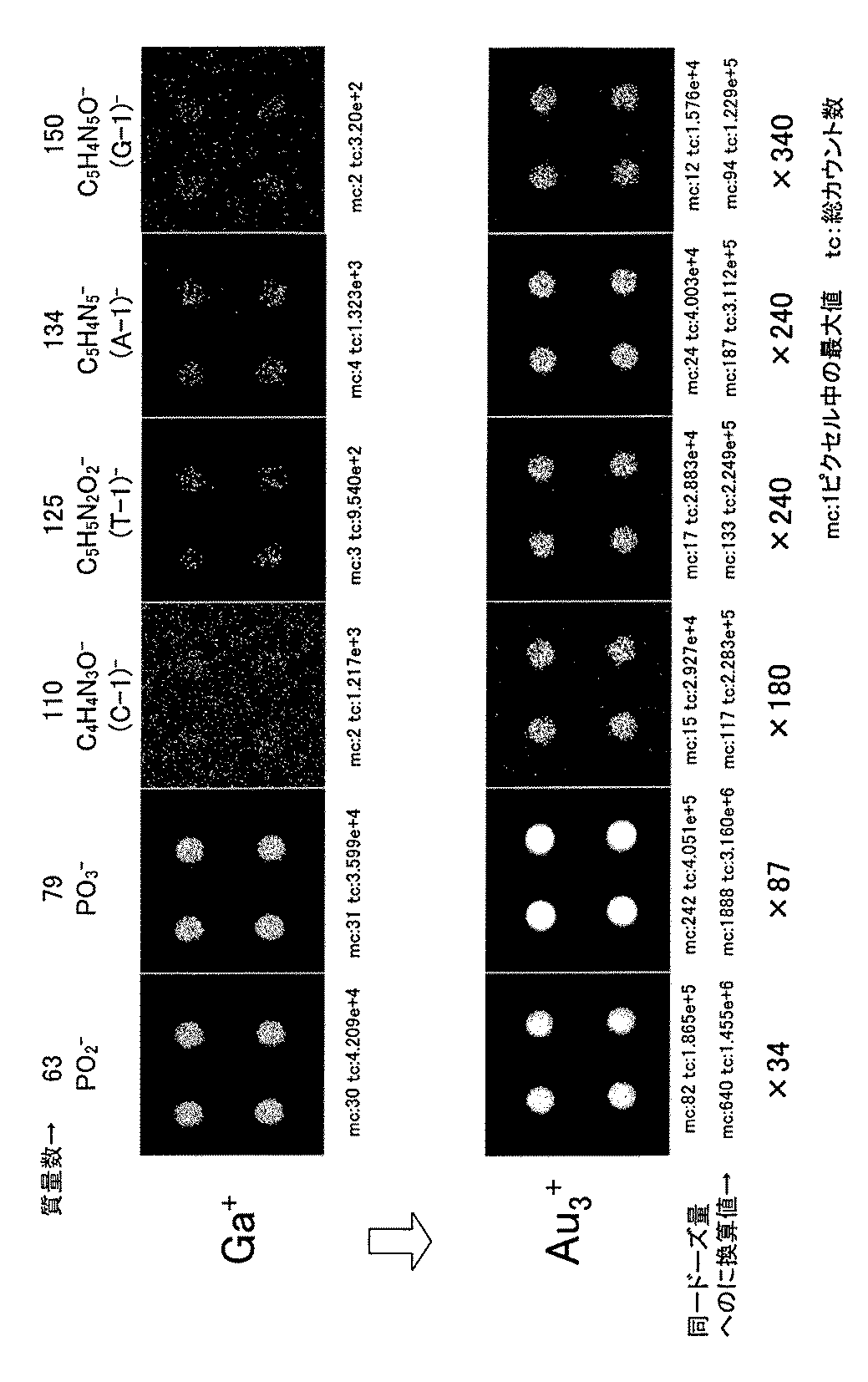
上記の測定条件により、一次イオン種として、Ga+ならびにAu3 +を用いて得られたTOF−SIMS分析結果を図3に示す。図3では、4種塩基混在DNAプローブアレイのTOF−SIMS分析で観測される代表的な二次イオンである、PO2 -,PO3 -,C4H4N3O-:(シトシン−H)-,C5H5N2O2 -:(チミン−H)-,C5H4N5 -:(アデニン−H)-,C5H4N5O-:(グアニン−H)-について、Ga+を一次イオン種に用いて得られたもの(上段)、Au3 +を一次イオン種に用いて得られたもの(下段)をそれぞれ示している。なお、図3中に示す、各二次イオンについて、mcは、1ピクセル中の最大値を、tcは、全128×128ピクセルの総カウント数をそれぞれ示している。この対比結果から、一次イオン種として、Ga+を用いる場合に比べて、Au3 +を用いることにより、リン酸バックボーンに由来するPO3 -に対しては、二桁近く感度が上昇し(一次イオンの同一ドーズ量換算では、約87倍の二次イオン量、また、同一測定時間当たり、約20倍の二次イオン量(パルス電流値が0.12倍、パルスサイクルが2倍であるので))、4種の塩基に起因するフラグメントイオンに対しては、二桁以上、感度が上昇することが判った。すなわち、DNAプローブを固定しているバイオチップのTOF−SIMS分析では、一次イオン源として、Au3 +銃の使用が極めて有効であることが判った。
【0088】
【発明の効果】
本発明の方法により、比較的誘電率の高い基板上に単分子膜レベルで形成された生体関連物質からなる、所謂、バイオチップに関して、チャージアップの影響を排除して、飛行時間型二次イオン質量分析による定量性に優れた二次元イメージング、さらには、組成分析が可能となる。
【0089】
【配列表】
【図面の簡単な説明】
【図1】実施例2のイメージング結果を示す図であり、図1−1にPO2 -イオン、図1−2にPO3 -イオン、図1−3にPO2 -イオン+PO3 -イオン、図1−4に(チミン−H)-イオンに基づき再構成した二次元イメージを示す。
【図2】実施例2の組成分析結果において、利用したマススペクトルの結果を示す。
【図3】実施例8のイメージング結果を示す図であり、上段にGa+を用いて得られた二次元イメージを、下段にAu3 +を用いて得られた二次元イメージを示す。
Claims (17)
- 複数の生体関連物質が基板表面上に配置されたバイオチップの表面から、飛行時間型二次イオン質量分析法を用いて、情報取得する方法であって、
前記バイオチップの表面上の被測定領域の面積と比較して、より小さい面積の照射部を有する一次イオンビームを、被照射部のチャージアップの影響を抑制できるようにスキャン軌跡が離散的な特定のプログラムされたパターンあるいはランダムなパターンであって、且つ一次イオン照射される単位部分が同一回のスキャンで、複数回照射されないパターンのパルスとして前記バイオチップの表面に照射する工程、
前記照射される一次イオンビームによって被照射部から発生する二次イオンを、飛行時間型二次イオン質量分析法により質量分析する工程、および
前記質量分析で得られる二次イオンの分析結果を、前記一次イオンビームのパルス照射のパターンに基づいて、二次元的情報に再構成する工程を、有する
ことを特徴とするバイオチップの情報取得方法。 - 前記基板の基板材料は、体積抵抗率が10 10 ohm・cm(300K)以上の絶縁性材料である
ことを特徴とする請求項1に記載のバイオチップの情報取得方法。 - 前記一次イオンビームのイオン種は、ガリウムイオンである
ことを特徴とする請求項1に記載のバイオチップの情報取得方法。 - 前記一次イオンビームのイオン種は、金イオンまたは金の多原子イオンである
ことを特徴とする請求項1に記載のバイオチップの情報取得方法。 - 該バイオチップ表面からの情報取得が、一次イオンビームのスキャンと、前記基板自体の位置的スキャンとを複合して行う
ことを特徴とする請求項1に記載のバイオチップの情報取得方法。 - 前記生体関連物質は、核酸である
ことを特徴とする請求項1に記載のバイオチップの情報取得方法。 - 前記核酸として、DNA、RNAのいずれかが選択されている
ことを特徴とする請求項6に記載のバイオチップの情報取得方法。 - 前記一次イオンビームによって発生する二次イオン種は、
少なくとも、核酸由来のリン酸バックボーンのフラグメント化、および、イオン化に基づくものを含む
ことを特徴とする請求項7に記載のバイオチップの情報取得方法。 - 前記一次イオンビームによって発生する二次イオン種は、
少なくとも、P-、PO-、PO2 -、またはPO3 -のいずれかを含む
ことを特徴とする請求項8に記載のバイオチップの情報取得方法。 - 前記一次イオンビームによって発生する二次イオン種は、
少なくとも、核酸塩基のフラグメント化、および、イオン化に基づくものを含む
ことを特徴とする請求項6に記載のバイオチップの情報取得方法。 - 前記一次イオンビームによって発生する二次イオン種は、
少なくとも、(アデニン−H)-、(チミン−H)-、(グアニン−H)-、(シトシン−H)-、(ウラシル−H)-のいずれかを含む
ことを特徴とする請求項10に記載のバイオチップの情報取得方法。 - 前記生体関連物質がPNAであり、前記一次イオンビームによって発生する二次イオン種は、
少なくとも、ペプチドバックボーンのフラグメント化、および、イオン化に基づくものを含む
ことを特徴とする請求項1に記載のバイオチップの情報取得方法。 - 前記生体関連物質がタンパク質であり、前記一次イオンビームによって発生する二次イオン種は、
少なくとも、アミノ酸残基のフラグメント化、および、イオン化に基づくものを含むことを特徴とする請求項1に記載のバイオチップの情報取得方法。 - 利用される飛行時間型二次イオン質量分析装置として、前記基板を電気的に接地した状態で保持しつつ、測定がなされるリフレクトロン型TOF−SIMS装置を選択する
ことを特徴とする請求項1に記載のバイオチップの情報取得方法。 - 前記基板表面上に配置される前記生体関連物質の配置部位サイズは、直径10μm〜100μmの範囲、あるいは10μm×10μm〜100μm×100μmの範囲である
ことを特徴とする請求項1に記載のバイオチップの情報取得方法。 - 複数の生体関連物質が基板表面上に配置されたバイオチップについて、飛行時間型二次イオン質量分析法を用いて、該バイオチップ表面上に配置される該生体関連物質の組成を分析する方法であって、
前記バイオチップ表面上の被測定領域の面積と比較して、より小さい面積の照射部を有する一次イオンビームを、被照射部のチャージアップの影響を抑制できるようにスキャン軌跡が離散的な特定のプログラムされたパターンあるいはランダムなパターンであって、且つ一次イオン照射される単位部分が同一回のスキャンで、複数回照射されないパターンのパルスとして前記バイオチップ表面に照射する工程、
前記照射される一次イオンビームによって被照射部から発生する二次イオンを飛行時間型二次イオン質量分析法により質量分析する工程、
前記質量分析で得られる二次イオンの分析結果を、前記一次イオンビームのパルス照射のパターンに基づいて、二次元的画像に再構成する工程、および
得られた二次元的画像中に含まれる必要な部分のマススペクトル情報に基づき、前記表面に配置された前記生体関連物質の組成分析を行う工程とを、少なくとも有する
ことを特徴とする組成分析方法。 - 複数の生体関連物質が基板表面上に配置されたバイオチップ表面から、飛行時間型二次イオン質量分析法を用いて、情報取得するための装置であって、
前記バイオチップの表面上の被測定領域の面積と比較して、より小さい面積の照射部を有する一次イオンビームを、被照射部のチャージアップの影響を抑制できるようにスキャン軌跡が離散的な特定のプログラムされたパターンあるいはランダムなパターンであって、且つ一次イオン照射される単位部分が同一回のスキャンで、複数回照射されないパターンのパルスとして前記バイオチップ表面に照射する手段、
前記パルス照射される一次イオンビームによって被照射部から発生する二次イオンを飛行時間型二次イオン質量分析法により質量分析する手段、および
前記質量分析で得られる二次イオンの分析結果を、前記一次イオンビームの照射のパターンに基づいて、二次元的情報に再構成する手段を、具えている
ことを特徴とするバイオチップ表面の情報取得装置。
Priority Applications (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2003161862A JP3658397B2 (ja) | 2002-06-28 | 2003-06-06 | 飛行時間型二次イオン質量分析法による素子の情報取得方法、および、情報取得装置 |
| US10/601,777 US7188031B1 (en) | 2002-06-28 | 2003-06-24 | Method for acquiring information of a biochip using time of flight secondary ion mass spectrometry and an apparatus for acquiring information for the application thereof |
| EP03014310A EP1376652A3 (en) | 2002-06-28 | 2003-06-25 | A method and apparatus for acquiring information of a biochip |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2002191208 | 2002-06-28 | ||
| JP2003161862A JP3658397B2 (ja) | 2002-06-28 | 2003-06-06 | 飛行時間型二次イオン質量分析法による素子の情報取得方法、および、情報取得装置 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2004085546A JP2004085546A (ja) | 2004-03-18 |
| JP3658397B2 true JP3658397B2 (ja) | 2005-06-08 |
Family
ID=29718464
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2003161862A Expired - Fee Related JP3658397B2 (ja) | 2002-06-28 | 2003-06-06 | 飛行時間型二次イオン質量分析法による素子の情報取得方法、および、情報取得装置 |
Country Status (3)
| Country | Link |
|---|---|
| US (1) | US7188031B1 (ja) |
| EP (1) | EP1376652A3 (ja) |
| JP (1) | JP3658397B2 (ja) |
Families Citing this family (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2004024203A (ja) * | 2002-06-28 | 2004-01-29 | Canon Inc | 飛行時間型二次イオン質量分析法によるrnaの分析方法 |
| JP2005292013A (ja) * | 2004-04-02 | 2005-10-20 | Jeol Ltd | 表面分析装置 |
| JP4636859B2 (ja) | 2004-11-25 | 2011-02-23 | キヤノン株式会社 | 情報取得方法 |
| JP4789518B2 (ja) * | 2005-06-30 | 2011-10-12 | キヤノン株式会社 | 製造条件付きプローブ固定担体を用いた標的物質の検出方法ならびにそのための装置、キット及びシステム |
| HU226837B1 (hu) * | 2006-05-31 | 2009-12-28 | Semmelweis Egyetem | Folyadéksugárral mûködõ deszorpciós ionizációs eljárás és eszköz |
| JP5120955B2 (ja) * | 2006-06-13 | 2013-01-16 | 国立大学法人京都大学 | 二次イオン質量分析方法及びイメージング方法 |
| JP5142580B2 (ja) * | 2006-06-29 | 2013-02-13 | キヤノン株式会社 | 表面解析方法および表面解析装置 |
| JP4861788B2 (ja) | 2006-10-11 | 2012-01-25 | キヤノン株式会社 | 生体標本の処理方法及び解析方法 |
| US8119982B2 (en) * | 2007-04-04 | 2012-02-21 | Shimadzu Corporation | Method and system for mass spectrometry data analysis |
| JP4426600B2 (ja) | 2007-04-27 | 2010-03-03 | キヤノン株式会社 | 処理溶液の使用方法 |
| US8618518B2 (en) * | 2011-03-15 | 2013-12-31 | Avago Technologies General Ip (Singapore) Pte. Ltd. | Apparatus and method for forming a solid immersion lens using a binary bitmap milling pattern |
| US8772712B2 (en) * | 2012-04-24 | 2014-07-08 | Semiconductor Energy Laboratory Co., Ltd. | Analysis apparatus and analysis method |
| WO2014146724A1 (en) | 2013-03-22 | 2014-09-25 | Eth Zurich | Laser ablation cell |
| JP6546177B2 (ja) * | 2013-09-13 | 2019-07-17 | ザ ボード オブ トラスティーズ オブ ザ レランド スタンフォード ジュニア ユニバーシティー | 質量タグ及び二次イオン質量分析計を用いた組織の多重化イメージング |
| EP3552005A4 (en) * | 2016-12-09 | 2020-08-12 | Northeastern University | SUSTAINABLE ENZYME BIOCAPTER AND DROP-DEPOSIT IMMOBILIZATION PROCESS |
| KR102101484B1 (ko) * | 2018-09-07 | 2020-04-16 | 한국과학기술연구원 | 이차이온 질량분석기 및 주성분 분석을 이용한 흔적증거물 감식방법 |
Family Cites Families (21)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE3144604A1 (de) | 1981-11-10 | 1983-05-19 | Leybold-Heraeus GmbH, 5000 Köln | Vorrichtung zur untersuchung einer probe |
| JPS6049252A (ja) | 1983-08-29 | 1985-03-18 | Nippon Telegr & Teleph Corp <Ntt> | 二次イオン質量分析計 |
| FR2624610B1 (fr) * | 1987-12-11 | 1990-03-30 | Cameca | Procede d'analyse en temps de vol, a balayage continu, et dispositif d'analyse pour la mise en oeuvre de ce procede |
| JPH071686B2 (ja) | 1988-09-22 | 1995-01-11 | 株式会社日立製作所 | イオンマイクロアナライザ |
| JPH02183150A (ja) | 1989-01-09 | 1990-07-17 | Hitachi Ltd | イオンの質量分析法および装置 |
| US5143854A (en) * | 1989-06-07 | 1992-09-01 | Affymax Technologies N.V. | Large scale photolithographic solid phase synthesis of polypeptides and receptor binding screening thereof |
| GB9304462D0 (en) | 1993-03-04 | 1993-04-21 | Kore Tech Ltd | Mass spectrometer |
| JP2901172B2 (ja) | 1993-12-01 | 1999-06-07 | 株式会社アドバンテスト | 荷電粒子線試験装置及び半導体集積回路試験装置 |
| US5491062A (en) * | 1993-11-23 | 1996-02-13 | Stratagene | Polynucleotide amplification mycoplasma assay, primers, and kits therefore |
| DE4416413C2 (de) * | 1994-05-10 | 1996-03-28 | Ion Tof Gmbh | Verfahren zum Betreiben eines Flugzeit-Sekundärionen-Massenspektrometers |
| US5601980A (en) * | 1994-09-23 | 1997-02-11 | Hewlett-Packard Company | Manufacturing method and apparatus for biological probe arrays using vision-assisted micropipetting |
| US5589685A (en) * | 1995-05-26 | 1996-12-31 | Jen Wu; Kuang | Matrix enhanced SIMS |
| GB9513586D0 (en) * | 1995-07-04 | 1995-09-06 | Ionoptika Limited | Sample analyzer |
| WO1997012897A1 (en) * | 1995-10-03 | 1997-04-10 | The Penn State Research Foundation | Method to identify a surface-bound molecule |
| US6027890A (en) * | 1996-01-23 | 2000-02-22 | Rapigene, Inc. | Methods and compositions for enhancing sensitivity in the analysis of biological-based assays |
| US5821060A (en) * | 1996-08-02 | 1998-10-13 | Atom Sciences, Inc. | DNA sequencing, mapping, and diagnostic processes using hybridization chips and unlabeled DNA |
| JP4313861B2 (ja) * | 1997-08-01 | 2009-08-12 | キヤノン株式会社 | プローブアレイの製造方法 |
| US6137110A (en) * | 1998-08-17 | 2000-10-24 | The United States Of America As Represented By The United States Department Of Energy | Focused ion beam source method and apparatus |
| DE60016323T2 (de) * | 1999-07-23 | 2005-11-24 | Canon K.K. | Neue Pyrylium Verbindung, Verfahren zu ihrer Herstellung, Nucleinsäure-Färbemittel und markierte Nucleinsäure |
| US20020074517A1 (en) * | 2000-12-15 | 2002-06-20 | Andrew Krutchinsky | High capacity and scanning speed system for sample handling and analysis |
| JP2004024203A (ja) | 2002-06-28 | 2004-01-29 | Canon Inc | 飛行時間型二次イオン質量分析法によるrnaの分析方法 |
-
2003
- 2003-06-06 JP JP2003161862A patent/JP3658397B2/ja not_active Expired - Fee Related
- 2003-06-24 US US10/601,777 patent/US7188031B1/en not_active Expired - Fee Related
- 2003-06-25 EP EP03014310A patent/EP1376652A3/en not_active Withdrawn
Also Published As
| Publication number | Publication date |
|---|---|
| JP2004085546A (ja) | 2004-03-18 |
| US20070042496A1 (en) | 2007-02-22 |
| US7188031B1 (en) | 2007-03-06 |
| EP1376652A3 (en) | 2006-02-15 |
| EP1376652A2 (en) | 2004-01-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP3658397B2 (ja) | 飛行時間型二次イオン質量分析法による素子の情報取得方法、および、情報取得装置 | |
| JP5094939B2 (ja) | 情報取得方法 | |
| US7701138B2 (en) | Information acquisition method, information acquisition apparatus and disease diagnosis method | |
| EP1522853A1 (en) | Dna microarray having standard probe and kit containing the array | |
| JP4636859B2 (ja) | 情報取得方法 | |
| JP2006153493A5 (ja) | ||
| JP4636822B2 (ja) | 情報取得方法 | |
| JP2004212206A (ja) | 高分子分析用基板、高分子分析用アレイおよび高分子分析方法 | |
| JP2004037120A (ja) | 飛行時間型二次イオン質量分析法による有機膜の組成分析方法 | |
| US20040137491A1 (en) | Method of analyzing probe carrier using time-of-flight secondary ion mass spectrometry | |
| EP1519189A1 (en) | Method of analyzing probe support by using flying time secondary ion mass spectrometry | |
| JP4040372B2 (ja) | 核酸チップおよび核酸チップの分析方法 | |
| JP4380535B2 (ja) | プローブ担体および該プローブ担体の分析方法 | |
| JP3990948B2 (ja) | ハロゲン標識による飛行時間型二次イオン質量分析法を用いた核酸ハイブリッド体の分析方法 | |
| JP3990946B2 (ja) | ハロゲン標識による飛行時間型二次イオン質量分析法を用いたプローブ担体の分析方法 | |
| JP3890265B2 (ja) | 飛行時間型二次イオン質量分析法による核酸チップの分析方法 | |
| JP2004085557A (ja) | プローブ結合基板、その製造方法、及びその分析方法 | |
| JP2004024203A (ja) | 飛行時間型二次イオン質量分析法によるrnaの分析方法 | |
| JP2004085556A (ja) | プローブ担体の製造方法、製造装置及び品質保証方法 | |
| US20050214769A1 (en) | Method for producing probe carrier, apparatus for producing the same and method for quality assurance therefor | |
| JP2004037128A (ja) | マトリクス援助レーザー脱着/イオン化飛行時間型質量分析法による基板上の物質の解析方法 | |
| US20040053308A1 (en) | Probe immobilized substrate and method for manufacturing the same, and analytical method | |
| JP2005172501A (ja) | 飛行時間型二次イオン質量分析を用いた核酸塩基配列の決定方法 | |
| JP2006184197A (ja) | 情報取得方法、分析方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20030606 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20040830 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20041110 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20050111 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20050111 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20050302 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20050311 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20080318 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20090318 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20100318 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20100318 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110318 Year of fee payment: 6 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120318 Year of fee payment: 7 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130318 Year of fee payment: 8 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20140318 Year of fee payment: 9 |
|
| LAPS | Cancellation because of no payment of annual fees |