JP2020037567A - S1p受容体調節因子の使用 - Google Patents
S1p受容体調節因子の使用 Download PDFInfo
- Publication number
- JP2020037567A JP2020037567A JP2019201411A JP2019201411A JP2020037567A JP 2020037567 A JP2020037567 A JP 2020037567A JP 2019201411 A JP2019201411 A JP 2019201411A JP 2019201411 A JP2019201411 A JP 2019201411A JP 2020037567 A JP2020037567 A JP 2020037567A
- Authority
- JP
- Japan
- Prior art keywords
- alkyl
- substituted
- halogen
- formula
- amino
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 229940075993 receptor modulator Drugs 0.000 title abstract description 33
- 150000003839 salts Chemical group 0.000 claims abstract description 29
- 208000006289 Rett Syndrome Diseases 0.000 claims abstract description 5
- 230000002401 inhibitory effect Effects 0.000 claims abstract description 5
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 5
- 239000000203 mixture Substances 0.000 claims abstract 8
- -1 4-octylphenyl Chemical group 0.000 claims description 33
- 239000003814 drug Substances 0.000 claims description 6
- YPFDHNVEDLHUCE-UHFFFAOYSA-N propane-1,3-diol Chemical compound OCCCO YPFDHNVEDLHUCE-UHFFFAOYSA-N 0.000 claims description 6
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 5
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical group Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 claims description 4
- 229940124597 therapeutic agent Drugs 0.000 claims description 3
- 150000000185 1,3-diols Chemical class 0.000 claims 1
- SUDROTOHDPFFQA-UHFFFAOYSA-N 2-methyl-4-(4-octylphenyl)butan-2-amine Chemical compound CCCCCCCCC1=CC=C(CCC(C)(C)N)C=C1 SUDROTOHDPFFQA-UHFFFAOYSA-N 0.000 claims 1
- 102000011011 Sphingosine 1-phosphate receptors Human genes 0.000 abstract description 50
- 108050001083 Sphingosine 1-phosphate receptors Proteins 0.000 abstract description 47
- 102000004219 Brain-derived neurotrophic factor Human genes 0.000 abstract description 36
- 108090000715 Brain-derived neurotrophic factor Proteins 0.000 abstract description 36
- 229940077737 brain-derived neurotrophic factor Drugs 0.000 abstract description 36
- KKGQTZUTZRNORY-UHFFFAOYSA-N fingolimod Chemical compound CCCCCCCCC1=CC=C(CCC(N)(CO)CO)C=C1 KKGQTZUTZRNORY-UHFFFAOYSA-N 0.000 abstract description 19
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 abstract description 14
- 201000010099 disease Diseases 0.000 abstract description 7
- 230000001419 dependent effect Effects 0.000 abstract description 5
- 230000002265 prevention Effects 0.000 abstract description 2
- 125000000217 alkyl group Chemical group 0.000 description 98
- 150000001875 compounds Chemical class 0.000 description 65
- 229910052739 hydrogen Inorganic materials 0.000 description 48
- 239000001257 hydrogen Substances 0.000 description 46
- 229910052736 halogen Inorganic materials 0.000 description 44
- 150000002367 halogens Chemical class 0.000 description 44
- 125000003545 alkoxy group Chemical group 0.000 description 40
- 150000002431 hydrogen Chemical class 0.000 description 31
- 238000000034 method Methods 0.000 description 28
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 26
- 229960000556 fingolimod Drugs 0.000 description 16
- 125000003118 aryl group Chemical group 0.000 description 15
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 13
- 125000001424 substituent group Chemical group 0.000 description 13
- 238000004519 manufacturing process Methods 0.000 description 12
- 125000002252 acyl group Chemical group 0.000 description 11
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 11
- 229910052760 oxygen Inorganic materials 0.000 description 11
- 229910052717 sulfur Inorganic materials 0.000 description 11
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 9
- 125000000623 heterocyclic group Chemical group 0.000 description 9
- 229910019142 PO4 Inorganic materials 0.000 description 8
- 208000010877 cognitive disease Diseases 0.000 description 8
- 239000010452 phosphate Substances 0.000 description 8
- 241000700159 Rattus Species 0.000 description 7
- 125000004423 acyloxy group Chemical group 0.000 description 7
- 125000004414 alkyl thio group Chemical group 0.000 description 7
- 125000002947 alkylene group Chemical group 0.000 description 7
- 208000035475 disorder Diseases 0.000 description 7
- 125000005843 halogen group Chemical group 0.000 description 7
- 125000001072 heteroaryl group Chemical group 0.000 description 7
- 239000000902 placebo Substances 0.000 description 7
- 229940068196 placebo Drugs 0.000 description 7
- DUYSYHSSBDVJSM-KRWOKUGFSA-N sphingosine 1-phosphate Chemical compound CCCCCCCCCCCCC\C=C\[C@@H](O)[C@@H](N)COP(O)(O)=O DUYSYHSSBDVJSM-KRWOKUGFSA-N 0.000 description 7
- 208000036864 Attention deficit/hyperactivity disease Diseases 0.000 description 6
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 6
- 125000004442 acylamino group Chemical group 0.000 description 6
- 125000003710 aryl alkyl group Chemical group 0.000 description 6
- 208000015802 attention deficit-hyperactivity disease Diseases 0.000 description 6
- 125000004356 hydroxy functional group Chemical group O* 0.000 description 6
- 208000015122 neurodegenerative disease Diseases 0.000 description 6
- 210000002569 neuron Anatomy 0.000 description 6
- 208000024891 symptom Diseases 0.000 description 6
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 5
- 208000028698 Cognitive impairment Diseases 0.000 description 5
- 208000008589 Obesity Diseases 0.000 description 5
- 238000003556 assay Methods 0.000 description 5
- 125000004432 carbon atom Chemical group C* 0.000 description 5
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 5
- 229910052801 chlorine Inorganic materials 0.000 description 5
- 239000000460 chlorine Substances 0.000 description 5
- 230000000694 effects Effects 0.000 description 5
- 230000004770 neurodegeneration Effects 0.000 description 5
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 5
- 235000020824 obesity Nutrition 0.000 description 5
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 5
- 208000019116 sleep disease Diseases 0.000 description 5
- 125000004953 trihalomethyl group Chemical group 0.000 description 5
- 125000005913 (C3-C6) cycloalkyl group Chemical group 0.000 description 4
- 125000006552 (C3-C8) cycloalkyl group Chemical group 0.000 description 4
- 206010010356 Congenital anomaly Diseases 0.000 description 4
- 239000000556 agonist Substances 0.000 description 4
- 125000003282 alkyl amino group Chemical group 0.000 description 4
- 206010012601 diabetes mellitus Diseases 0.000 description 4
- 150000002148 esters Chemical class 0.000 description 4
- 210000004698 lymphocyte Anatomy 0.000 description 4
- 230000036651 mood Effects 0.000 description 4
- 125000003386 piperidinyl group Chemical group 0.000 description 4
- 238000002821 scintillation proximity assay Methods 0.000 description 4
- 239000012453 solvate Substances 0.000 description 4
- 208000011580 syndromic disease Diseases 0.000 description 4
- 125000004768 (C1-C4) alkylsulfinyl group Chemical group 0.000 description 3
- 125000004769 (C1-C4) alkylsulfonyl group Chemical group 0.000 description 3
- 125000004890 (C1-C6) alkylamino group Chemical group 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- 208000024827 Alzheimer disease Diseases 0.000 description 3
- 208000006096 Attention Deficit Disorder with Hyperactivity Diseases 0.000 description 3
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 3
- 125000000882 C2-C6 alkenyl group Chemical group 0.000 description 3
- 125000003601 C2-C6 alkynyl group Chemical group 0.000 description 3
- 206010054089 Depressive symptom Diseases 0.000 description 3
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 3
- 101100236683 Homo sapiens MBTPS1 gene Proteins 0.000 description 3
- 208000018737 Parkinson disease Diseases 0.000 description 3
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 3
- 208000007014 Retinitis pigmentosa Diseases 0.000 description 3
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 3
- 125000003342 alkenyl group Chemical group 0.000 description 3
- 125000003302 alkenyloxy group Chemical group 0.000 description 3
- 125000002102 aryl alkyloxo group Chemical group 0.000 description 3
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 3
- 229910052794 bromium Inorganic materials 0.000 description 3
- 210000004027 cell Anatomy 0.000 description 3
- 230000008859 change Effects 0.000 description 3
- 230000004064 dysfunction Effects 0.000 description 3
- 229910052731 fluorine Inorganic materials 0.000 description 3
- 239000011737 fluorine Substances 0.000 description 3
- 125000005842 heteroatom Chemical group 0.000 description 3
- 125000000592 heterocycloalkyl group Chemical group 0.000 description 3
- 230000001939 inductive effect Effects 0.000 description 3
- 125000001624 naphthyl group Chemical group 0.000 description 3
- 125000003884 phenylalkyl group Chemical group 0.000 description 3
- 239000000651 prodrug Substances 0.000 description 3
- 229940002612 prodrug Drugs 0.000 description 3
- 102000005962 receptors Human genes 0.000 description 3
- 108020003175 receptors Proteins 0.000 description 3
- 230000001953 sensory effect Effects 0.000 description 3
- 208000020685 sleep-wake disease Diseases 0.000 description 3
- BKMMTJMQCTUHRP-UHFFFAOYSA-N 2-aminopropan-1-ol Chemical class CC(N)CO BKMMTJMQCTUHRP-UHFFFAOYSA-N 0.000 description 2
- KJJPLEZQSCZCKE-UHFFFAOYSA-N 2-aminopropane-1,3-diol Chemical class OCC(N)CO KJJPLEZQSCZCKE-UHFFFAOYSA-N 0.000 description 2
- 125000000094 2-phenylethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])([H])* 0.000 description 2
- 208000027205 Congenital disease Diseases 0.000 description 2
- 206010011878 Deafness Diseases 0.000 description 2
- 208000020401 Depressive disease Diseases 0.000 description 2
- 208000007590 Disorders of Excessive Somnolence Diseases 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- 208000023105 Huntington disease Diseases 0.000 description 2
- 208000001456 Jet Lag Syndrome Diseases 0.000 description 2
- TWRXJAOTZQYOKJ-UHFFFAOYSA-L Magnesium chloride Chemical compound [Mg+2].[Cl-].[Cl-] TWRXJAOTZQYOKJ-UHFFFAOYSA-L 0.000 description 2
- 108010052285 Membrane Proteins Proteins 0.000 description 2
- 208000001089 Multiple system atrophy Diseases 0.000 description 2
- 208000001738 Nervous System Trauma Diseases 0.000 description 2
- 208000012902 Nervous system disease Diseases 0.000 description 2
- 201000007737 Retinal degeneration Diseases 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- 206010052428 Wound Diseases 0.000 description 2
- 208000027418 Wounds and injury Diseases 0.000 description 2
- 230000004913 activation Effects 0.000 description 2
- 125000001931 aliphatic group Chemical group 0.000 description 2
- 125000004849 alkoxymethyl group Chemical group 0.000 description 2
- 125000005133 alkynyloxy group Chemical group 0.000 description 2
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 2
- 239000011324 bead Substances 0.000 description 2
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 2
- 125000000051 benzyloxy group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])O* 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 125000003917 carbamoyl group Chemical group [H]N([H])C(*)=O 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 239000013592 cell lysate Substances 0.000 description 2
- 210000003169 central nervous system Anatomy 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- 125000004093 cyano group Chemical group *C#N 0.000 description 2
- 239000003085 diluting agent Substances 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 230000010370 hearing loss Effects 0.000 description 2
- 231100000888 hearing loss Toxicity 0.000 description 2
- 208000016354 hearing loss disease Diseases 0.000 description 2
- 125000003187 heptyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 2
- 230000006872 improvement Effects 0.000 description 2
- 238000000338 in vitro Methods 0.000 description 2
- 238000001727 in vivo Methods 0.000 description 2
- 208000035231 inattentive type attention deficit hyperactivity disease Diseases 0.000 description 2
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- 210000001165 lymph node Anatomy 0.000 description 2
- 238000002595 magnetic resonance imaging Methods 0.000 description 2
- 230000015654 memory Effects 0.000 description 2
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 2
- 125000002757 morpholinyl group Chemical group 0.000 description 2
- 201000003631 narcolepsy Diseases 0.000 description 2
- 208000028412 nervous system injury Diseases 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- 210000001986 peyer's patch Anatomy 0.000 description 2
- 239000000546 pharmaceutical excipient Substances 0.000 description 2
- 125000000951 phenoxy group Chemical group [H]C1=C([H])C([H])=C(O*)C([H])=C1[H] 0.000 description 2
- 125000000843 phenylene group Chemical group C1(=C(C=CC=C1)*)* 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 125000006239 protecting group Chemical group 0.000 description 2
- 125000003072 pyrazolidinyl group Chemical group 0.000 description 2
- 125000000168 pyrrolyl group Chemical group 0.000 description 2
- 229940044601 receptor agonist Drugs 0.000 description 2
- 239000000018 receptor agonist Substances 0.000 description 2
- 230000000306 recurrent effect Effects 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 230000004258 retinal degeneration Effects 0.000 description 2
- 150000003410 sphingosines Chemical class 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- 125000004568 thiomorpholinyl group Chemical group 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 2
- AFINAILKDBCXMX-PBHICJAKSA-N (2s,3r)-2-amino-3-hydroxy-n-(4-octylphenyl)butanamide Chemical compound CCCCCCCCC1=CC=C(NC(=O)[C@@H](N)[C@@H](C)O)C=C1 AFINAILKDBCXMX-PBHICJAKSA-N 0.000 description 1
- 125000006273 (C1-C3) alkyl group Chemical group 0.000 description 1
- 125000006570 (C5-C6) heteroaryl group Chemical group 0.000 description 1
- 125000004502 1,2,3-oxadiazolyl group Chemical group 0.000 description 1
- FLBPTSOAFRMSPF-UHFFFAOYSA-N 1-[4-[3-amino-4-hydroxy-3-(hydroxymethyl)butyl]phenyl]-5-phenylpentan-1-one Chemical compound C1=CC(CCC(CO)(CO)N)=CC=C1C(=O)CCCCC1=CC=CC=C1 FLBPTSOAFRMSPF-UHFFFAOYSA-N 0.000 description 1
- KIHYPELVXPAIDH-UHFFFAOYSA-N 1-[[4-[n-[[4-cyclohexyl-3-(trifluoromethyl)phenyl]methoxy]-c-methylcarbonimidoyl]-2-ethylphenyl]methyl]azetidine-3-carboxylic acid Chemical compound CCC1=CC(C(C)=NOCC=2C=C(C(C3CCCCC3)=CC=2)C(F)(F)F)=CC=C1CN1CC(C(O)=O)C1 KIHYPELVXPAIDH-UHFFFAOYSA-N 0.000 description 1
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 1
- BXIWYZLGTUWLCD-UHFFFAOYSA-N 2-amino-2-tetradecylpropane-1,3-diol Chemical compound CCCCCCCCCCCCCCC(N)(CO)CO BXIWYZLGTUWLCD-UHFFFAOYSA-N 0.000 description 1
- ITJCKQTXCLGXHE-UHFFFAOYSA-N 2-amino-4-(4-heptoxyphenyl)-2-methylbutan-1-ol Chemical compound CCCCCCCOC1=CC=C(CCC(C)(N)CO)C=C1 ITJCKQTXCLGXHE-UHFFFAOYSA-N 0.000 description 1
- APNSMSZFHDYDHX-UHFFFAOYSA-N 2-amino-4-[2-chloro-4-(3-phenylmethoxyphenyl)sulfanylphenyl]-2-methylbutan-1-ol Chemical compound C1=C(Cl)C(CCC(N)(CO)C)=CC=C1SC1=CC=CC(OCC=2C=CC=CC=2)=C1 APNSMSZFHDYDHX-UHFFFAOYSA-N 0.000 description 1
- QPRQEDXDYOZYLA-UHFFFAOYSA-N 2-methyl-1-butanol Substances CCC(C)CO QPRQEDXDYOZYLA-UHFFFAOYSA-N 0.000 description 1
- QCQCHGYLTSGIGX-GHXANHINSA-N 4-[[(3ar,5ar,5br,7ar,9s,11ar,11br,13as)-5a,5b,8,8,11a-pentamethyl-3a-[(5-methylpyridine-3-carbonyl)amino]-2-oxo-1-propan-2-yl-4,5,6,7,7a,9,10,11,11b,12,13,13a-dodecahydro-3h-cyclopenta[a]chrysen-9-yl]oxy]-2,2-dimethyl-4-oxobutanoic acid Chemical compound N([C@@]12CC[C@@]3(C)[C@]4(C)CC[C@H]5C(C)(C)[C@@H](OC(=O)CC(C)(C)C(O)=O)CC[C@]5(C)[C@H]4CC[C@@H]3C1=C(C(C2)=O)C(C)C)C(=O)C1=CN=CC(C)=C1 QCQCHGYLTSGIGX-GHXANHINSA-N 0.000 description 1
- NESAWTWENPISNE-UHFFFAOYSA-N 5-amino-5-[2-chloro-4-(3-phenylmethoxyphenoxy)phenyl]hexane-1,3-diol Chemical compound C1=C(Cl)C(C(N)(CC(O)CCO)C)=CC=C1OC1=CC=CC(OCC=2C=CC=CC=2)=C1 NESAWTWENPISNE-UHFFFAOYSA-N 0.000 description 1
- HDZHTSPCWJHFLR-UHFFFAOYSA-N 5-amino-5-[2-chloro-4-(3-phenylmethoxyphenyl)sulfanylphenyl]hexane-1,3-diol Chemical compound C1=C(Cl)C(C(N)(CC(O)CCO)C)=CC=C1SC1=CC=CC(OCC=2C=CC=CC=2)=C1 HDZHTSPCWJHFLR-UHFFFAOYSA-N 0.000 description 1
- 125000003341 7 membered heterocyclic group Chemical group 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- 208000019901 Anxiety disease Diseases 0.000 description 1
- 208000031694 Autosomal recessive spastic paraplegia type 15 Diseases 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- WPYMKLBDIGXBTP-UHFFFAOYSA-N Benzoic acid Natural products OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 1
- 208000020925 Bipolar disease Diseases 0.000 description 1
- GDOPTJXRTPNYNR-UHFFFAOYSA-N CC1CCCC1 Chemical compound CC1CCCC1 GDOPTJXRTPNYNR-UHFFFAOYSA-N 0.000 description 1
- GAWIXWVDTYZWAW-UHFFFAOYSA-N C[CH]O Chemical group C[CH]O GAWIXWVDTYZWAW-UHFFFAOYSA-N 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 206010008027 Cerebellar atrophy Diseases 0.000 description 1
- 206010008874 Chronic Fatigue Syndrome Diseases 0.000 description 1
- 208000019888 Circadian rhythm sleep disease Diseases 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- 229940126062 Compound A Drugs 0.000 description 1
- 206010012289 Dementia Diseases 0.000 description 1
- 208000032131 Diabetic Neuropathies Diseases 0.000 description 1
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical compound C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 1
- 239000005977 Ethylene Substances 0.000 description 1
- 229910052688 Gadolinium Inorganic materials 0.000 description 1
- NLDMNSXOCDLTTB-UHFFFAOYSA-N Heterophylliin A Natural products O1C2COC(=O)C3=CC(O)=C(O)C(O)=C3C3=C(O)C(O)=C(O)C=C3C(=O)OC2C(OC(=O)C=2C=C(O)C(O)=C(O)C=2)C(O)C1OC(=O)C1=CC(O)=C(O)C(O)=C1 NLDMNSXOCDLTTB-UHFFFAOYSA-N 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical class Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 206010062016 Immunosuppression Diseases 0.000 description 1
- 208000009829 Lewy Body Disease Diseases 0.000 description 1
- 201000002832 Lewy body dementia Diseases 0.000 description 1
- 206010025327 Lymphopenia Diseases 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- 208000002720 Malnutrition Diseases 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-M Methanesulfonate Chemical compound CS([O-])(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-M 0.000 description 1
- 150000001204 N-oxides Chemical class 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 108010025020 Nerve Growth Factor Proteins 0.000 description 1
- 102000007072 Nerve Growth Factors Human genes 0.000 description 1
- 240000007817 Olea europaea Species 0.000 description 1
- 108091000080 Phosphotransferase Proteins 0.000 description 1
- 206010036105 Polyneuropathy Diseases 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 1
- 208000005587 Refsum Disease Diseases 0.000 description 1
- 206010039966 Senile dementia Diseases 0.000 description 1
- 208000009106 Shy-Drager Syndrome Diseases 0.000 description 1
- 208000010340 Sleep Deprivation Diseases 0.000 description 1
- 208000013738 Sleep Initiation and Maintenance disease Diseases 0.000 description 1
- 206010041349 Somnolence Diseases 0.000 description 1
- 208000027073 Stargardt disease Diseases 0.000 description 1
- 229910000831 Steel Inorganic materials 0.000 description 1
- 208000030886 Traumatic Brain injury Diseases 0.000 description 1
- 208000014769 Usher Syndromes Diseases 0.000 description 1
- 201000004810 Vascular dementia Diseases 0.000 description 1
- 230000005856 abnormality Effects 0.000 description 1
- 125000004450 alkenylene group Chemical group 0.000 description 1
- 125000004453 alkoxycarbonyl group Chemical group 0.000 description 1
- 125000000304 alkynyl group Chemical group 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- 230000036506 anxiety Effects 0.000 description 1
- 230000037007 arousal Effects 0.000 description 1
- 125000002785 azepinyl group Chemical group 0.000 description 1
- HONIICLYMWZJFZ-UHFFFAOYSA-N azetidine Chemical compound C1CNC1 HONIICLYMWZJFZ-UHFFFAOYSA-N 0.000 description 1
- 210000003719 b-lymphocyte Anatomy 0.000 description 1
- 230000003542 behavioural effect Effects 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-M benzenesulfonate Chemical compound [O-]S(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-M 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- 125000003236 benzoyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)=O 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 208000028683 bipolar I disease Diseases 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 1
- 238000011260 co-administration Methods 0.000 description 1
- 230000006999 cognitive decline Effects 0.000 description 1
- 230000001149 cognitive effect Effects 0.000 description 1
- 231100000870 cognitive problem Toxicity 0.000 description 1
- 229940125890 compound Ia Drugs 0.000 description 1
- 125000000000 cycloalkoxy group Chemical group 0.000 description 1
- 125000000753 cycloalkyl group Chemical group 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 230000006735 deficit Effects 0.000 description 1
- 230000007850 degeneration Effects 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 125000005982 diphenylmethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])(*)C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- 230000009266 disease activity Effects 0.000 description 1
- 230000006806 disease prevention Effects 0.000 description 1
- 238000010494 dissociation reaction Methods 0.000 description 1
- 230000005593 dissociations Effects 0.000 description 1
- 210000005064 dopaminergic neuron Anatomy 0.000 description 1
- 230000007783 downstream signaling Effects 0.000 description 1
- 230000001073 episodic memory Effects 0.000 description 1
- 235000013861 fat-free Nutrition 0.000 description 1
- 206010016256 fatigue Diseases 0.000 description 1
- LRFKWQGGENFBFO-UHFFFAOYSA-N fingolimod phosphate Chemical compound CCCCCCCCC1=CC=C(CCC(N)(CO)COP(O)(O)=O)C=C1 LRFKWQGGENFBFO-UHFFFAOYSA-N 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 230000006870 function Effects 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- UIWYJDYFSGRHKR-UHFFFAOYSA-N gadolinium atom Chemical compound [Gd] UIWYJDYFSGRHKR-UHFFFAOYSA-N 0.000 description 1
- 230000002518 glial effect Effects 0.000 description 1
- 125000001188 haloalkyl group Chemical group 0.000 description 1
- 230000002489 hematologic effect Effects 0.000 description 1
- 125000005446 heptyloxy group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])O* 0.000 description 1
- 208000008675 hereditary spastic paraplegia Diseases 0.000 description 1
- 201000007816 hereditary spastic paraplegia 15 Diseases 0.000 description 1
- 102000034345 heterotrimeric G proteins Human genes 0.000 description 1
- 108091006093 heterotrimeric G proteins Proteins 0.000 description 1
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 150000003840 hydrochlorides Chemical class 0.000 description 1
- 230000002209 hydrophobic effect Effects 0.000 description 1
- 125000002632 imidazolidinyl group Chemical group 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 230000001506 immunosuppresive effect Effects 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 230000010365 information processing Effects 0.000 description 1
- 206010022437 insomnia Diseases 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 208000028867 ischemia Diseases 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- 125000003965 isoxazolidinyl group Chemical group 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- 208000033915 jet lag type circadian rhythm sleep disease Diseases 0.000 description 1
- 230000003902 lesion Effects 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 210000003563 lymphoid tissue Anatomy 0.000 description 1
- 231100001023 lymphopenia Toxicity 0.000 description 1
- 229910001629 magnesium chloride Inorganic materials 0.000 description 1
- 229940049920 malate Drugs 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N malic acid Chemical compound OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 230000036210 malignancy Effects 0.000 description 1
- 230000001071 malnutrition Effects 0.000 description 1
- 235000000824 malnutrition Nutrition 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 230000008897 memory decline Effects 0.000 description 1
- 208000030159 metabolic disease Diseases 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- 208000027061 mild cognitive impairment Diseases 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 125000006372 monohalo methyl group Chemical group 0.000 description 1
- 208000029766 myalgic encephalomeyelitis/chronic fatigue syndrome Diseases 0.000 description 1
- 210000005036 nerve Anatomy 0.000 description 1
- 210000000653 nervous system Anatomy 0.000 description 1
- 210000004498 neuroglial cell Anatomy 0.000 description 1
- 239000003900 neurotrophic factor Substances 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 208000015380 nutritional deficiency disease Diseases 0.000 description 1
- 238000003305 oral gavage Methods 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 125000004043 oxo group Chemical group O=* 0.000 description 1
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 1
- 210000005105 peripheral blood lymphocyte Anatomy 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 125000004344 phenylpropyl group Chemical group 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 102000020233 phosphotransferase Human genes 0.000 description 1
- 239000002574 poison Substances 0.000 description 1
- 231100000614 poison Toxicity 0.000 description 1
- 230000007824 polyneuropathy Effects 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 230000003449 preventive effect Effects 0.000 description 1
- 201000002212 progressive supranuclear palsy Diseases 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- LVTJOONKWUXEFR-FZRMHRINSA-N protoneodioscin Natural products O(C[C@@H](CC[C@]1(O)[C@H](C)[C@@H]2[C@]3(C)[C@H]([C@H]4[C@@H]([C@]5(C)C(=CC4)C[C@@H](O[C@@H]4[C@H](O[C@H]6[C@@H](O)[C@@H](O)[C@@H](O)[C@H](C)O6)[C@@H](O)[C@H](O[C@H]6[C@@H](O)[C@@H](O)[C@@H](O)[C@H](C)O6)[C@H](CO)O4)CC5)CC3)C[C@@H]2O1)C)[C@H]1[C@H](O)[C@H](O)[C@H](O)[C@@H](CO)O1 LVTJOONKWUXEFR-FZRMHRINSA-N 0.000 description 1
- 125000004309 pyranyl group Chemical group O1C(C=CC=C1)* 0.000 description 1
- 125000003373 pyrazinyl group Chemical group 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- 125000002098 pyridazinyl group Chemical group 0.000 description 1
- 125000004076 pyridyl group Chemical group 0.000 description 1
- 125000000714 pyrimidinyl group Chemical group 0.000 description 1
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 1
- 150000003254 radicals Chemical class 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 230000029058 respiratory gaseous exchange Effects 0.000 description 1
- 210000003994 retinal ganglion cell Anatomy 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 201000000980 schizophrenia Diseases 0.000 description 1
- 210000004116 schwann cell Anatomy 0.000 description 1
- 210000001044 sensory neuron Anatomy 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 201000002859 sleep apnea Diseases 0.000 description 1
- 230000008454 sleep-wake cycle Effects 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 239000010959 steel Substances 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 125000000475 sulfinyl group Chemical group [*:2]S([*:1])=O 0.000 description 1
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- LMBFAGIMSUYTBN-MPZNNTNKSA-N teixobactin Chemical compound C([C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(=O)N[C@H](CCC(N)=O)C(=O)N[C@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(=O)N[C@H]1C(N[C@@H](C)C(=O)N[C@@H](C[C@@H]2NC(=N)NC2)C(=O)N[C@H](C(=O)O[C@H]1C)[C@@H](C)CC)=O)NC)C1=CC=CC=C1 LMBFAGIMSUYTBN-MPZNNTNKSA-N 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 125000001412 tetrahydropyranyl group Chemical group 0.000 description 1
- 125000003831 tetrazolyl group Chemical group 0.000 description 1
- 125000001113 thiadiazolyl group Chemical group 0.000 description 1
- 125000001984 thiazolidinyl group Chemical group 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- 125000001544 thienyl group Chemical group 0.000 description 1
- 230000009529 traumatic brain injury Effects 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
- 125000003866 trichloromethyl group Chemical group ClC(Cl)(Cl)* 0.000 description 1
- 230000001960 triggered effect Effects 0.000 description 1
- 230000003936 working memory Effects 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/397—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having four-membered rings, e.g. azetidine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/135—Amines having aromatic rings, e.g. ketamine, nortriptyline
- A61K31/137—Arylalkylamines, e.g. amphetamine, epinephrine, salbutamol, ephedrine or methadone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/135—Amines having aromatic rings, e.g. ketamine, nortriptyline
- A61K31/138—Aryloxyalkylamines, e.g. propranolol, tamoxifen, phenoxybenzamine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/145—Amines having sulfur, e.g. thiurams (>N—C(S)—S—C(S)—N< and >N—C(S)—S—S—C(S)—N<), Sulfinylamines (—N=SO), Sulfonylamines (—N=SO2)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/20—Hypnotics; Sedatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/22—Anxiolytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/24—Antidepressants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
Landscapes
- Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Chemical & Material Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Medicinal Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Epidemiology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Chemistry (AREA)
- Biomedical Technology (AREA)
- Neurosurgery (AREA)
- Neurology (AREA)
- Emergency Medicine (AREA)
- Diabetes (AREA)
- Psychiatry (AREA)
- Obesity (AREA)
- Hematology (AREA)
- Psychology (AREA)
- Hospice & Palliative Care (AREA)
- Anesthesiology (AREA)
- Endocrinology (AREA)
- Child & Adolescent Psychology (AREA)
- Pain & Pain Management (AREA)
- Immunology (AREA)
- Dermatology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
Description
は予防におけるS1P受容体調節因子の使用に関連する。
体中の標的細胞、つまりニューロンおよびグリア細胞やシュワン細胞に由来するタンパク
質で、ニューロンの生存および分化を維持するための活性を示す。
示された。
として知られてきた。BDNFはまた、糖尿病の処置のための治療薬としても有益であると説
明されてきた。
処置、遅延または予防が可能な症状を処置するために、BDNFの産生を誘導(またはBDNFの
発現を刺激)することで、S1P受容体調節因子を使用することができる。
ミノ-プロパノール誘導体、例えば式Yの基を含む化合物などのスフィンゴシン類似体であ
る。
既知のS1P受容体、つまりS1P1〜S1P8が存在する。S1P受容体調節因子は、典型的には、2
置換2-アミノ-プロパン-1,3-ジオールまたは2-アミノ-プロパノール誘導体、例えば式Y
り置換されたフェニル、ハロゲン、C3-8シクロアルキル、フェニルおよびOHにより置換さ
れたフェニルから構成される群から選定される、1〜3個の置換基により置換されたC1-6ア
ルキルまたはCH2-R4zであり、ここでR4ZはOH、アシルオキシまたは式(a)
R5zおよびR6zは各々、独立的に水素、または所望により1、2もしくは3個のハロゲン原子
により置換されていてもよいC1-4アルキルである}
の残基であり、
R1ZはOH、アシルオキシまたは式(a)の残基であり、R2zおよびR3zは各々、独立的に水素
、C1-4アルキルまたはアシルである〕
の基を含む化合物などのスフィンゴシン類似体である。
が式(a)の残基であるかまたはそれを含む得られた分子が1種以上のスフィンゴシン-1-
リン酸受容体においてアゴニストとして信号伝達する程度に、1個以上の脂肪族、脂環式
、芳香族および/または複素環残基を含む分子に、末端基として結合している官能基であ
る。
P1〜S1P8においてアゴニストとして信号伝達する化合物である。S1P受容体に結合するア
ゴニストは、例えば細胞内ヘテロ三量体G-タンパク質のGα-GTPおよびGβγ-GTPへの解離
、および/またはアゴニストが占める受容体のリン酸化増加および下流シグナル伝達経路
/キナーゼの活性化を結果的に生む場合がある。
って決定され得る:
化合物のS1P受容体調節因子活性は、ヒトS1P受容体、S1P1、S1P2、S1P3、S1P4およびS1
P5で試験する。機能的受容体の活性化は、適切なヒトS1P受容体を安定的に発現する形質
転換したCHO細胞またはRH7777細胞から調製される膜タンパク質に結合する化合物により
誘導されたGTP [γ-35S]を定量することで評価される。使用されるアッセイ技術は、SPA
(シンチレーション近接アッセイ)である。手短に言えば、DMSOに溶解した化合物を連続
希釈し、50 mM Hepes、100 mM NaCl、10 mM MgCl2、10 μM GDP、0.1%無脂肪BSAおよび0.
2 nM GTP [γ-35S](1200 Ci/mmol)の存在下で、膜タンパク質(10〜20μg/ウェル)を
発現するSPAビーズ(Amersham-Pharmacia)固定化S1P受容体に添加する。96ウェルマイク
ロタイタープレートで、室温で120分培養した後、未結合のGTP [γ-35S]は遠心分離手順
により分離される。膜に結合されたGTP [γ-35S]により誘発されたSPAビーズの発光は、T
OPcountプレート読み取り機(Packard)により定量化される。EC50は、標準の曲線適合ソ
フトウェアを用いて計算される。このアッセイにおいて、S1P受容体調節因子は、好まし
くはS1P受容体に対して<50 nMの結合親和性を有する。
好適なS1P受容体調節因子は、例えばS1Pの結合特性に加えて加速的なリンパ球ホーミン
グ特性も有する化合物や、全身的な免疫抑制を惹起することなく、二次リンパ組織への循
環からのリンパ球の好ましくは可逆的な再分配によるリンパ球減少症を引き出す化合物で
ある。ナイーブ細胞は隔離され、血液からのCD4およびCD8のT細胞およびB細胞を刺激して
リンパ節(LN)およびパイエル板(PP)に移動される。
S1P受容体調節因子または賦形剤が、ラットに強制経口投与される。血液学的監視のた
めの尾部分の血液を個体ベースライン値を得るために-1日目に、ならびに投与から2、6、
24、48および72時間後に得る。このアッセイにおいて、S1P受容体アゴニストまたは修飾
因子は、例えば<20 mg/kgの用量で投与される場合、末梢血リンパ球を例えば50%枯渇さ
せる。
式I
R1はハロゲン、トリハロメチル、OH、C1-7アルキル、C1-4アルコキシ、トリフルオロメト
キシ、フェノキシ、シクロヘキシルメチルオキシ、ピリジルメトキシ、シンナミルオキシ
、ナフチルメトキシ、フェノキシメチル、CH2-OH、CH2-CH2-OH、C1-4アルキルチオ、C1-4
アルキルスルフィニル、C1-4アルキルスルホニル、ベンジルチオ、アセチル、ニトロまた
はシアノ、またはフェニル、フェニルC1-4アルキルまたはフェニル-C1-4アルコキシであ
り、該フェニル基は各々、所望によりハロゲン、CF3、C1-4アルキルまたはC1-4アルコキ
シで置換されていてもよく、
R2は水素、ハロゲン、トリハロメチル、C1-4アルコキシ、C1-7アルキル、フェネチルまた
はベンジルオキシであり、
R3は水素、ハロゲン、CF3、OH、C1-7アルキル、C1-4アルコキシ、ベンジルオキシ、フェ
ニルまたはC1-4アルコキシメチルであり、
R4 およびR5は各々、独立的に水素または式(a)
よいC1-4アルキルである}
の残基であり、
nは1〜4の整数である〕
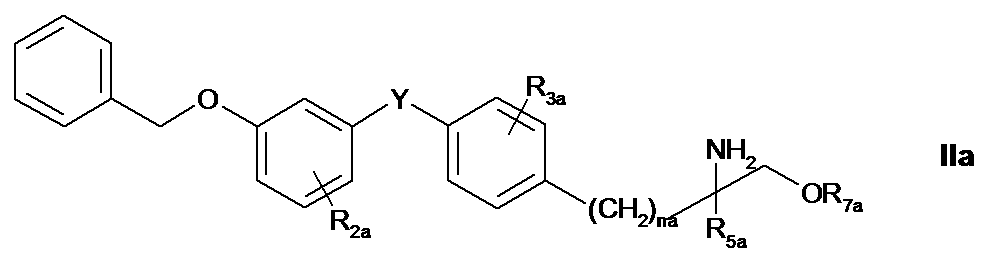
アミノアルコール化合物またはその医薬品として容認できる塩、
R1aはハロゲン、トリハロメチル、C1-4アルキル、C1-4アルコキシ、C1-4アルキルチオ、C
1-4アルキルスルフィニル、C1-4アルキル-スルホニル、アラルキル、所望により置換され
たフェノキシまたはアラルキルオキシであり、
R2aは水素、ハロゲン、トリハロメチル、C1-4アルキル、C1-4アルコキシ、アラルキルま
たはアラルキルオキシであり、
R3aは水素、ハロゲン、CF3、C1-4アルキル、C1-4アルコキシ、C1-4アルキルチオまたはベ
ンジルオキシであり、
R4aは水素、C1-4アルキル、フェニル、所望により置換されたベンジルまたはベンゾイル
、または低級脂肪族C1-5アシルであり、
R5aは水素、モノハロメチル、C1-4アルキル、C1-4アルコキシ-メチル、C1-4アルキル-チ
オメチル、ヒドロキシエチル、ヒドロキシプロピル、フェニル、アラルキル、C2-4アルケ
ニルまたは-アルキニルであり、
R6aは水素またはC1-4アルキルであり、
R7aは水素、C1-4アルキルまたは上記で定義されるとおりの式(a)の残基であり、
XaはO、S、SOまたはSO2であり、
naは1〜4の整数である〕
の化合物またはその医薬品として容認できる塩。
臭素およびヨウ素を含む。「トリハロメチル基」という用語は、トリフルオロメチルおよ
びトリクロロメチルを含む。「C1-7アルキル」は、直鎖または分岐アルキル、例えばメチ
ル、エチル、プロピル、イソプロピル、ブチル、t-ブチル、ペンチル、ヘキシルまたはヘ
プチルを含む。「置換または非置換フェノキシ基」という語句は、そのベンゼン環の任意
の位置において、フッ素、塩素、臭素およびヨウ素などのハロゲン原子、トリフルオロメ
チル、C1-4アルキルまたはC1-4アルコキシを有するものを含む。「アラルキル基」または
「アラルキルオキシ基」などに見られる「アラルキル基」という用語は、ベンジル、ジフ
ェニルメチル、フェネチルおよびフェニルプロピルを含む。「C1-4アルコキシ」、「C1-4
アルキルチオ」、「C1-4アルキルスルフィニル」または「C1-4アルキルスルホニル」に存
在する場合のアルキル部分は、直鎖または分岐C1-4アルキル、例えばメチル、エチル、プ
ロピル、イソプロピルまたはブチルを含む。「置換または非置換アラルキル基」という語
句は、そのベンゼン環の任意の位置において、フッ素、塩素、臭素およびヨウ素などのハ
ロゲン原子、トリフルオロメチル、1〜4個の炭素原子を有する低級アルキル、または1〜4
個の炭素原子を有する低級アルコキシを有するものを含む。
R2、R3、R4、R5およびnは上記で定義されるとおりであり、また、
R6は水素、ハロゲン、C1-7アルキル、C1-4アルコキシまたはトリフルオロメチルである〕
の化合物である。
フェニルチオ)-2-クロロフェニル]-2-エチル-プロパン-1,3-ジオール、2-アミノ-2-[4-
(3-ベンジルオキシフェノキシ)-2-クロロフェニル]プロピル-1,3-プロパン-ジオールま
たは2-アミノ-2-[4-(3-ベンジルオキシフェニルチオ)-2-クロロフェニル]プロピル-1,3
-プロパン-ジオール)または薬理学的な塩またはその水和物、およびその対応するリン酸
誘導体であるものである。さらに例示されるものとしては、リン酸モノ-2-アミノ-2-[4-
(3-ベンジルオキシフェニルチオ)-2-クロロフェニル]エチル-プロピル]エステルがある
。リン酸モノ-2-アミノ-2-[4-(3-ベンジルオキシフェニルチオ)-2-クロロフェニル]エ
チル-プロピル]エステルは、WO 2005/021503に記載されている手順により鏡像異性的に純
粋な形で調製することができる。
ニルチオ)-2-クロロフェニル]-2-メチルブタン-1-オール)、対応するリン酸モノ-2-ア
ミノ-4-[4-(3-ベンジルオキシフェニルチオ)-2-クロロフェニル]-2-メチルブチル]エス
テル、2-アミノ-4-[4-(3-ベンジルオキシフェニルチオ)-2-クロロフェニル]-2-エチル
ブタン-1-オール、および対応するリン酸モノ-2-アミノ-4-[4-(3-ベンジルオキシフェニ
ルチオ)-2-クロロフェニル]-2-エチルブチル]エステルであるものである。
びWO04/026817に開示されており、リン酸化誘導体は例えばWO 04/074297に開示されてお
り、その内容の全体を参照により本明細書に組み込む。式IおよびIIの化合物は、上記で
引用した参考文献で開示されているとおりに調製され得る。
シフェニルチオ)-2-クロロフェニル]エチル-プロピル]エステル)は、WO 2005/021503(
例えば11〜12ページを参照)に記載されているリン酸化化合物の合成手順を用いて調製す
ることができる。構造式(I)の光学活性な化合物およびそのリン酸化誘導体、特に式(I
a)のものは、例えば『Hinterding et al., Synthesis, Vol. 11, pp.1667-1670(2003)
』に記載される手順を用いて純度の高い形で調製することができる。例として、構造式(
Ia)の光学活性な化合物、リン酸モノ-2-アミノ-2-[4-(3-ベンジルオキシフェニルチオ
)-2-クロロフェニル]エチル-プロピル]エステルは、前記の『Hinterding et al. (2003
)』の手順を用いて、下記の図式に記載されているとおり調製することができる。
- これは鎖中に二重結合、三重結合、O、S、NR6から選定される結合またはヘテロ原子を
有してもよく、ここでR6は水素、C1-4アルキル、アリール-C1-4アルキル、アシルまたは
(C1-4アルコキシ)カルボニル、およびカルボニルであり、および/または
これは置換基としてC1-4アルコキシ、C2-4アルケニルオキシ、C2-4アルキニルオキシ、ア
リールC1-4アルキル-オキシ、アシル、C1-4アルキルアミノ、C1-4アルキルチオ、アシル
アミノ、(C1-4アルコキシ)カルボニル、(C1-4アルコキシ)-カルボニルアミノ、アシ
ルオキシ、(C1-4アルキル)カルバモイル、ニトロ、ハロゲン、アミノ、ヒドロキシイミ
ノ、ヒドロキシまたはカルボキシを有してもよく、または
R1は、
- アルキルが直線または分岐(C6-20)炭素鎖であるフェニルアルキルであり、または
- フェニルアルキルであり、ここでアルキルは直線または分岐(C1-30)炭素鎖であり、
上記フェニルアルキルは下記により置換される
- ハロゲンにより随意に置換される直線または分岐(C6-20)炭素鎖、
- ハロゲンにより随意に置換される直線または分岐(C6-20)アルコキシ鎖、
- 直線または分岐(C6-20)アルケニルオキシ、
- フェニル-C1-14アルコキシ、ハロフェニル-C1-4アルコキシ、フェニル-C1-14アルコキ
シ-C1-14アルキル、フェノキシ-C1-4アルコキシまたはフェノキシ-C1-4アルキル、
- C6-20アルキルにより置換されたシクロアルキルアルキル、
- C6-20アルキルにより置換されたヘテロアリールアルキル、
- 複素環C6-20アルキルまたは
- C2-20アルキルにより置換された複素環アルキル、
またここで、
アルキル部分は
- 炭素鎖中に、二重結合、三重結合、O、S、スルフィニル、スルホニル、またはNR6から
選定される結合またはヘテロ原子を有し、ここでR6は上記で定義されるとおりであり、ま
た、
- 置換基としてのC1-4アルコキシ、C2-4アルケニルオキシ、C2-4アルキニルオキシ、アリ
ールC1-4アルキル-オキシ、アシル、C1-4アルキルアミノ、C1-4アルキルチオ、アシルア
ミノ、(C1-4アルコキシ)カルボニル、(C1-4アルコキシ)-カルボニルアミノ、アシル
オキシ、(C1-4アルキル)カルバモイル、ニトロ、ハロゲン、アミノ、ヒドロキシまたは
カルボキシを有していてもよく、
R2、R3、R4およびR5の各々は、独立的に水素、C1-4アルキルまたはアシルである〕
の化合物またはその医薬品として容認できる塩あるいはその水和物、
ルキルまたはアシルである〕
の化合物またはその医薬品として容認できる塩あるいはその水和物、
- EP0778263 A1で開示されている化合物、例えば式V
Hで置換されたフェニル、R’’4O(CH2)nであるか、またはハロゲン、C3-8シクロアルキ
ル、フェニルおよびOHにより置換されたフェニルから構成される群より選定される1〜3の
置換基により置換されたC1-6アルキルであり、
Xは、水素またはp個の炭素原子を有する非置換または置換された直鎖アルキル、または(
p-1)個の炭素原子を有する非置換または置換された直鎖アルコキシ、例えばC1-6アルキ
ル、OH、C1-6アルコキシ、アシルオキシ、アミノ、C1-6アルキルアミノ、アシルアミノ、
オキソ、ハロC1-6アルキル、ハロゲンから構成される群より選定される1〜3の置換基によ
る置換、非置換フェニルおよびC1-6アルキル、OH、C1-6アルコキシ、アシル、アシルオキ
シ、アミノ、C1-6アルキルアミノ、アシルアミノ、ハロC1-6アルキルおよびハロゲンから
構成される群より選定される1〜3の置換基により置換されるフェニルであり、Yは水素、C
1-6アルキル、OH、C1-6アルコキシ、アシル、アシルオキシ、アミノ、C1-6アルキルアミ
ノ、アシルアミノ、ハロC1-6アルキルまたはハロゲンであり、Z2は一重結合またはq個の
炭素原子を有する直鎖アルキレンであり、
pおよびqは各々、独立的に1〜20の整数であり、6≦p+q≦23という条件で、m’は1、2また
は3、nは2または3であり、
R’’1、R’’2、R’’3 およびR’’4の各々は、独立的に水素、C1-4アルキルまたはア
シルである〕
の化合物またはその医薬品として容認できる塩あるいはその水和物、
ロゲンにより置換され、naは1または2、R1sは水素または(C1-4)アルキルで、このアル
キルは非置換またはハロゲンにより置換され、R1aは水素、OH、(C1-4)アルキルまたはO
(C1-4)アルキルで、ここでアルキルは非置換または1〜3個のハロゲンにより置換され、
R1bは水素、OHまたは(C1-4)アルキル、ここでアルキルは非置換またはハロゲンにより
置換され、各々のR2aは独立的に水素または(C1-4)アルキルから選定され、このアルキ
ルは非置換またはハロゲンにより置換され、R3aは水素、OH、ハロゲンまたはO(C1-4)ア
ルキルであり、ここでアルキルは非置換またはハロゲンにより置換され、およびR3bは水
素、OH、ハロゲン、(C1-4)アルキルであり、ここでアルキルは非置換またはヒドロキシ
、またはO(C1-4)アルキルにより置換され、ここでアルキルは非置換またはハロゲンに
より置換され、Yaは-CH2-、-C(O)-、-CH(OH)-、-C(=NOH)-、OまたはS、およびR4a
は(C4-14)アルキルまたは(C4-14)アルケニルである〕
の化合物またはその医薬品として容認できる塩あるいはその水和物、
R3dは水素、ヒドロキシ保護基または式、
の基であり、
ndは1〜6の整数であり、
Xdはエチレン、ビニレン、エチニレン、式- D-CH2-(ここでDはカルボニル、- CH(OH)-
、O、SまたはN)、アリールまたは以下で定義される群aから選定される最高3つの置換基
により置換されたアリールを有する基であり、
Ydは一重結合、C1-10アルキレン、aおよびbの群から選定される最高3つの置換基により置
換されるC1-10アルキレン、炭素鎖の中間または端部にOまたはSを有するC1-10アルキレン
、aおよびbの群から選定される最高3つの置換基により置換される炭素鎖の中間または端
部にOまたはSを有するC1-10アルキレンであり、
R5dは水素、C3-6シクロアルキル、アリール、複素環基、aおよびbの群から選定される最
高3つの置換基により置換されるC3-6シクロアルキル、aおよびbの群から選定される最高3
つの置換基により置換されるアリール、またはaおよびbの群から選定される最高3つの置
換基により置換される複素環基であり、
R6dおよびR7dの各々は、独立的に水素または群aから選定される置換基であり、
R8dおよびR9dは各々、独立的に水素または所望によりハロゲンによって置換されていても
よいC1-4アルキルであり、
<群a>はハロゲン、低級アルキル、ハロゲノ低級アルキル、低級アルコキシ、低級アルキ
ルチオ、カルボキシル、低級アルコキシカルボニル、ヒドロキシ、低級脂肪族アシル、ア
ミノ、モノ-低級アルキルアミノ、ジ-C1-4アルキルアミノ、アシルアミノ、シアノまたは
ニトロであり、また、
<群b>はC3-6シクロアルキル、アリールまたは複素環基であり、各々は群aから選定される
最高3つの置換基により随意に置換されている。
ただし、R5dが水素であるとき、Ydは一重結合または直鎖C1-10アルキレンである〕
の化合物、またはその薬理学的に容認できる塩、エステルまたは水和物
ているとおりのものである〕
の化合物、またはその薬理学的に容認できる塩、エステルまたは水和物、
Arはフェニルまたはナフチルであり、mgおよびngの各々は独立的には0または1であり、A
はCOOH、PO3H2、PO2H、SO3H、PO(C1-3アルキル)OHおよび1H-テトラゾール-5-イルから
選定され、R1gおよびR2gの各々は独立的に水素、ハロゲン、OH、COOHまたは所望によりハ
ロゲンによって置換されていてもよいC1-4アルキルであり、R3gは水素または所望により
ハロゲンまたはOHにより置換されていてもよいC1-4アルキルであり、各々のR4gは独立的
にハロゲン、または所望によりハロゲンで置換されていてもよいC1-4アルキルまたはC1-3
アルコキシであり、RgおよびMの各々はWO 03/062252A1においてそれぞれBおよびCで示さ
れる意味の1つを有し〕
の化合物またはその薬学的に容認される塩、溶媒和物または水和物、
ラゾール-5-イル、PO3H2、PO2H2、-SO3HまたはPO(R5h)OHであり、ここでR5hはC1-4アル
キル、ヒドロキシC1-4アルキル、フェニル、-CO-C1-3アルコキシおよび-CH(OH)-フェニ
ルから選定され、ここで上記フェニルまたはフェニル部分は随意に置換され、R1hおよびR
2hの各々は独立的に水素、ハロゲン、OH、COOH、または所望によりハロゲノ置換されたC1
-6アルキルまたはフェニルであり、R3hは水素または所望によりハロゲンおよび/またはO
Hにより置換されていてもよいC1-4アルキルであり、各々のR4hは独立的にハロゲン、OH、
COOH、C1-4アルキル、S(O)0,1 または2C1-3アルキル、C1-3アルコキシ、C3-6シクロア
ルコキシ、アリールまたはアラルコキシであり、ここでアルキルの部分は所望により1〜3
個のハロゲンにより置換されていてもよく、RhおよびMの各々はWO03/062248A2においてそ
れぞれBおよびCで示される意味の1つを有する〕
の化合物または薬理学的に容認できる塩、溶媒和物またはその水和物、
化合物、例えば式XIaまたはXIb
AkはCOOR5k、OPO(OR5k)2、PO(OR5k)2、SO2OR5k、POR5kOR5kまたは1H-テトラゾール-5
-イルであり、R5kは水素またはC1-6アルキルであり、
Wkは結合、C1-3アルキレンまたはC2-3アルケニレンであり、
Ykはハロゲン、OH、NO2、C1-6アルキル、C1-6アルコキシから選定される1〜3のラジカル
により随意に置換されるC6-10アリールまたはC3-9ヘテロアリール、あるいはハロ置換さ
れたC1-6アルキルおよびハロ置換されたC1-6アルコキシであり、
ZkはWO 04/103306Aで示される複素環基(例:アゼチジン)であり、
R1kはC1-6アルキル、C6-10アリール、C6-10アリールC1-4アルキル、C3-9ヘテロアリール
、C3-9ヘテロアリールC1-4アルキル、C3-8シクロアルキル、C3-8シクロアルキルC1-4アル
キルにより随意に置換されるC6-10アリールまたはC3-9ヘテロアリールであり、
C3-8ヘテロシクロアルキルまたはC3-8ヘテロシクロアルキルC1-4アルキルで、ここでR1k
のアリール、ヘテロアリール、シクロアルキルまたはヘテロシクロアルキルはハロゲン、
C1-6アルキル、C1-6アルコキシおよびハロ置換された-C1-6アルキルまたは-C1-6アルコキ
シから選定される1〜5個の基により置換でき、
R2kは水素、C1-6アルキル、ハロ置換されたC1-6アルキル、C2-6アルケニルまたはC2-6ア
ルキニルであり、また、
R3kまたはR4kの各々は、独立的に水素、ハロゲン、OH、C1-6アルキル、C1-6アルコキシま
たはハロ置換されたC1-6アルキルまたはC1-6アルコキシである〕
の化合物およびそのN-オキシド誘導体またはそのプロドラッグ、またはその薬理学的に容
認できる塩、溶媒和物あるいは水和物である。
品として容認できる塩の例には、塩酸塩、臭化水素酸塩および硫酸などの無機酸との塩、
酢酸、フマル酸、マレイン酸エステル、安息香酸エステル、クエン酸塩、リンゴ酸塩、メ
タンスルホン酸塩およびベンゼンスルホン酸塩などの有機酸との塩、または適切な場合に
は、ナトリウム、カリウム、カルシウムおよびアルミニウムなどの金属との塩、トリエチ
ルアミンなどのアミン類との塩および、リシンなどの二塩基性アミノ酸との塩が含まれる
。本発明の組み合わせの化合物および塩には、水和物および溶媒和物の形態も含まれる。
ェニル-C1-4アルキルである残基Ry-CO-でもよい。別途記載されていない限り、アルキル
、アルコキシ、アルケニルまたはアルキニルは直鎖直線でも分岐鎖でもよい。
ドロキシまたはカルボキシにより置換されることが好ましい。炭素鎖が随意に置換された
フェニレンにより中断される場合、炭素鎖は置換されないことが好ましい。フェニレン部
分が置換されている場合は、ハロゲン、ニトロ、アミノ、メトキシ、ヒドロキシまたはカ
ルボキシにより置換されることが好ましい。
シにより随意に置換されるC13-20アルキルであるもの、またより好ましくはR1がハロゲン
により随意に置換されるC6-14-アルキル鎖により置換されたフェニルアルキルであり、ア
ルキル部分がヒドロキシにより随意に置換されるC1-6アルキルであるものである。より好
ましくは、R1は直鎖または分岐鎖、好ましくは直鎖のC6-14アルキル鎖によりフェニル上
で置換されたフェニル-C1-6アルキルである。C6-14アルキル鎖は、オルト、メタまたはパ
ラでもよく、好ましくはパラである。
有する5〜7員の複素環基を示す。このような複素環基の例は、上記で示されたヘテロアリ
ール基、および部分的または完全に水素化されたヘテロアリール基(例:フリル、チエニ
ル、ピロリル、アゼピニル、ピラゾリル、イミダゾリル、オキサゾリル、イソキサゾリル
、チアゾリル、イソチアゾリル、1,2,3-オキサジアゾリル、トリアゾリル、テトラゾリル
、チアジアゾリル、ピラニル、ピリジル、ピリダジニル、ピリミジニル、ピラジニル、テ
トラヒドロピラニル、モルホリニル、チオモルホリニル、ピロリジニル、ピロリル、イミ
ダゾリジニル、ピラゾリジニル、ピペリジニル、ピペラジニル、オキサゾリジニル、イソ
オキサゾリジニル、チアゾリジニルまたはピラゾリジニル)に対応する複素環化合物を含
む。好適な複素環基は、5員または6員のヘテロアリール基であり、最も好適な複素環基は
モルホリニル基、チオモルホリニル基またはピペリジニル基である。
特に好適なS1P受容体アゴニストはFTY720、すなわち、以下に示されるような、遊離型ま
たは医薬品として容認できる塩型、例えば塩酸塩の2-アミノ-2-[2-(4-オクチルフェニル
)エチル]プロパン-1,3-ジオール(以下、化合物Aと記載)である。
離型または医薬品として容認できる塩型の2-アミノ-2-{2-[4-(1-オキソ-5-フェニルペン
チル)フェニル]エチル}プロパン-1,3-ジオール(例:塩酸塩)(以下、化合物Bと記載)
である。
チルオキシおよびYが水素であるもの、すなわち、遊離型または医薬品として容認できる
塩型の2-アミノ-4-(4-ヘプチルオキシフェニル)-2-メチル-ブタンオール(例:塩酸塩
)(以下、化合物Cと記載)である。R-エナンチオマーが特に好ましい。
はOH)である。式VIbの好適な化合物は、化合物C-リン酸(R2aは水素、R3bはOH、XaはO、
R1aおよびR1bはOH、YaはOおよびR4aはヘプチル)である。式Vの好適な化合物は化合物B-
リン酸である。
ベンゾ[b]チエン-6-イル]-2-メチルブタン-1-オールである。
ベンジルオキシイミノ)-エチル]-2-エチル-ベンジル}-アゼチジン-3-カルボン酸、また
はそのプロドラッグである。
解される。例えば化合物は、リン酸化型でもよい。
受ける症状に対して阻害効果、予防効果または遅延効果を有することが判明した。
激するなどして、S1P受容体調節因子の属を代表する本明細書に記載される化合物はBDNF
のレベルを高める。
、または糖尿病の処置に対する処置薬として使用することができる。
は毒薬などにとって有益である。特に、感覚ニューロンまたは網膜神経節細胞が損傷を受
けた症状の処置に使用することができる。
ン病(パーキンソン病の症状はドーパミン作動性ニューロンの退化によって引き起こされ
る場合がある)、パーキンソンプラス症候群(例:進行性核上性麻痺(スティール・リチ
ャードソン・オルゼウスキー症候群)、オリーブ橋小脳萎縮症(OPCA)、シャイ・ドレー
ガー症候群(多系統萎縮症)、およびグアム・パーキンソン痴呆複合)、ハンチントン病
(ハンチントン舞踏病)、およびレット症候群であるが、これらに限定されない疾患の処
置に使用することができる。
性疾患の処置に使用することもできる。
群およびバーナード・ショルツ症候群)、網膜色素変性症、スタルガルト病、アッシャー
症候群(先天的聴力損失が伴う網膜色素変性症)およびレフスム症候群(網膜色素変性症
、先天的聴力損失、および多発神経障害)の処置にも使用することができる。
および記憶(例えば作業記憶やエピソード記憶)の欠如および異常の処置にも使用してよ
い。さらに、認知障害に関連する他の障害には、睡眠時呼吸障害(SRBD)、行動障害、情
報処理能力欠如、加齢に伴う障害、注意欠陥多動障害(ADHD)、小児ADHD、成人ADHD、昼
間過剰傾眠、睡眠時無呼吸、外傷性脳損傷、記憶および認知の問題を伴う神経変性障害(
アルツハイマー病、レビー小体型認知症、老人性痴呆症、血管性痴呆、パーキンソン病な
ど)、慢性疲労症候群、断眠または長時間覚醒を伴う疲労、年齢関連性の記憶および認知
機能の低下(軽度の認知障害など)、気分障害を伴う認知障害(うつ病など)および不安
、精神分裂症、ナルコレプシーを伴う日中の眠気などがある。
務交代症候群、時間帯症候群(時差ぼけ))などの睡眠障害の処置に使用することもでき
る。
1.1 処置を必要とする対象におけるBDNFの産生によって影響を受ける症状を予防、阻害
または処置する方法であって、上記対象への治療に有効な量のS1P受容体調節因子、例え
ば式I〜XIbの化合物の投与を含む方法。
1.2 処置を必要とする対象における肥満、睡眠障害または抑鬱障害の症状の進行を緩和
または遅延させる方法で、該方法において上記疾患に関連するBDNF依存性因子は予防また
は阻害され、上記対象への治療に有効な量のS1P受容体調節因子、例えば式I〜XIbの化合
物の投与を含む方法。
1.3 処置を必要とする対象におけるBDNFの産生を誘発する方法であって、上記対象への
治療に有効な量のS1P受容体調節因子、例えば式I〜XIbの化合物の投与を含む方法。
1.4 対象における肥満、睡眠障害または抑鬱障害の進行を鈍化させる方法であって、該
方法において上記疾患に関連するBDNF依存性因子は予防または阻害されており、そして上
記対象への治療に有効な量のS1P受容体調節因子、例えば式I〜XIbの化合物の投与を含む
方法。
1.5 S1P受容体調節因子が断続的に投与される上述の方法。
例えばS1P受容体調節因子は、対象に2日ごと、または3日ごと、または週一回、投与し
てもよい。
2. S1P受容体調節因子、例えば、上記で定義される式I〜XIbの化合物と1つまたはそれ以
上の医薬品として容認できる希釈剤または担体を含む、方法1.1〜1.5の何れか1つにおい
て使用される医薬組成物。
3. 方法1.1〜1.5の何れか1つで使用するためのS1P受容体調節因子、例えば、上記の式I
〜XIbの化合物。
4. 方法1.1〜1.5の何れか1つで使用する薬剤の調製に使用するためのS1P受容体調節因子
、例えば、上記の式I〜XIbの化合物。
いて式Yの群を含むS1P受容体調節因子)の実用性は、例えば以下に記載される方法に従い
、動物実験方法のほか、臨床試験でも実証され得る。
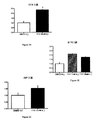
メスDAラットをFTY720の経口投与により9日間(5日間、2日間休止、4日間)処置した。
実験1:0.3 mg/kg/dと賦形剤の比較。
N=ラット3匹/群
最終処置から1日後、ラットに氷冷したPBSを灌流し、異なるCNS領域が単離された。
結果を図1に示す。
メスDAラットをFTY720の経口投与によりで9日間(5日間、2日間休止、4日間)処置した
。
0.1、0.3または1 mg/kg/dと賦形剤の比較。
N=ラット3匹/群
最終処置から1日後、ラットに氷冷したPBSを灌流し、異なるCNS領域が単離された。
結果を図2に示す。
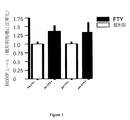
培養したCTX、STR、およびHIPニューロンにおけるBDNF発現に対するFTY720の効果が調
査された。
。
細胞溶解物を生体外で21日目に収集した。
Y軸は、対照に対して標準化されたBDNFレベルを示す。
* DMSOと比してP<0.05
結果を図3A、BおよびCに示す。
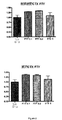
培養したCTXおよびHIPのニューロンにおけるBDNF発現に対するFTY720の効果が調査され
た。
処理した。
細胞溶解物を生体外で21日目に収集した。
Y軸は、対照に対して標準化されたBDNFレベルを示す。
結果を図4に示す。
再発性MSを患う患者281人が関与した6カ月間のプラシーボ対照第II相試験において、1
日1回の1.25 mgおよび5 mg用量において、プラシーボと比較した場合、FTY720はガドリニ
ウム増強磁気共鳴映像法(MRI)病変を最高で80%、年間再発率を50%以上も低下させた。3
MRIおよび再発の両方に対する結果的に生じる低い疾患活性は、FTY720で処置を受けた患
者では、用量盲検の延長相で最高24カ月間、維持された。プラシーボを受けた患者にもま
た、延長相でFTY720に切り替えた後には改善が見られた。
。結果をここに示す。
再発性MS(再発寛解型または二次性進行型)を患う患者は無作為割付され、6カ月間、
プラシーボまたはFTY720を1.25 mg/日または5 mg/日受け取った(中核研究)。この期間
の終了時に、プラシーボで処置を受けた患者は2つのFTY720用量のうちの1つに無作為割り
付けされ、その一方で本来FTY720に無作為割り付けされた患者は同一用量で引き続き処置
を受けた。約18〜24カ月間後、より高い用量はより低い用量に比べて一切の有効性をもた
らさないという証拠に鑑み、FTY720を5 mg受けた患者は1.25 mgに切り替えられた。
24カ月目(すなわち延長相の開始から6カ月後および18カ月後)で投与された。これは、
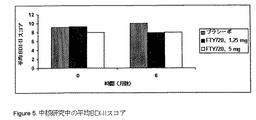
うつ病に関連するさまざまな症状や態度を測定する、21項目の自己報告尺度である。回答
者は、過去2週間において経験した抑鬱症状を、重症度が高い順に0〜3でコードされる4ポ
イント尺度で評価する。21項目全体にわたる合計スコアが集計され、合計スコアが低いこ
とから抑鬱症状の全体的な重症度が低いことが示された。BDI-IIの合計スコアが14以上の
場合は、臨床的うつ病を意味する。BDI-IIスコアにおけるNyの低下は、うつ病の改善を意
味する。
患者
処置のために本来無作為割付された患者281人のうち、255人が中核研究を終了した。ベ
ースラインおよび6カ月目でのBDI-IIスコアは、患者239人で得られた。
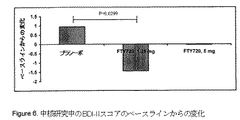
中核研究中の平均BDI-IIスコアを図5に示し、中核研究中のベースラインでの上記スコ
アからの変化を図6に示す。BDI-IIスコアは、FTY720を1.25 mg/日受けた患者ではベース
ラインから低下し、FTY720を5.0 mg/日受けた患者では引き続き一定のままであり、プラ
シーボを服用する患者では上昇した。6カ月目に、1.25 mg/日のFTY720で処置を受けた患
者における、ベースラインからのBDI-IIスコアの変化は、プラシーボで処置を受けた患者
よりも有意に大きかった。FTY720の2つの用量間でのBDI-IIスコアの変化の差異は、5%レ
ベルでは有意ではなかった。
本発明は以下の態様を含み得る。
[1]
BDNFの産生によって影響を受ける症状の予防、阻害または処置を必要とする患者におい
てそれらを行う方法であり、上記対象への治療に有効な量のS1P受容体調節因子、例えば
、本明細書で定義される式I〜XIbの化合物の投与を含む方法。
[2]
BDNF産生によって影響を受ける症状が1つまたはそれ以上の糖尿病、創傷による神経系
損傷、先天的症状、神経変性疾患、知覚神経機能不全、肥満、認知障害、注意欠陥障害、
睡眠障害または抑鬱障害から選択される、請求項1の方法。
[3]
それを必要とする対象におけるBDNFの産生を誘発する方法で、上記対象への治療に有効
な量のS1P受容体調節因子、例えば式I〜XIbの化合物の投与を含む方法。
[4]
患者の気分を、例えばうつ病の症状を解消することで向上させる方法であって、上記対
象への治療に有効な量のS1P受容体調節因子、例えば式I〜XIbの化合物の投与を含む方法
。
[5]
S1P受容体調節因子が断続的に投与される、請求項1または2に記載の方法。
[6]
S1P受容体調節因子、例えば、本明細書で定義される式I〜XIbの化合物を、1つまたは
それ以上の医薬品として容認できる希釈剤または担体と共に含む、請求項1〜5のいずれ
かに記載の方法において使用する医薬組成物。
[7]
請求項1〜5のいずれかに記載の方法での、S1P受容体調節因子、例えば、本明細書の
式I〜XIbの化合物の使用。
[8]
請求項1〜5のいずれかに記載の方法において使用する薬物の調製における、S1P受容
体調節因子、例えば、本明細書の式I〜XIbの化合物の使用。
[9]
毒性のない治療に有効な量のS1P受容体調節因子および第二の処置物質の、例えば同時
のまたは連続的な併用投与を含む、請求項1〜5のいずれかに記載の方法。
[10]
a)遊離型または医薬品として容認できる塩型のS1P受容体調節因子、例えば本明細書に
定義される式I〜XIbの化合物である第一の薬剤、およびb)本書で記載されたBDNF関連の
症状または疾患において使用する際の取扱説明書を含む、医薬上の組み合わせ、例えばキ
ット。
[11]
BDNF関連の症状または疾患が1つまたはそれ以上の糖尿病、創傷による神経系損傷、先
天的症状、神経変性疾患、知覚神経機能不全、肥満、認知障害、注意欠陥障害、睡眠障害
または抑鬱障害から選択される、請求項9の組み合わせ。
[12]
S1P受容体調節因子が遊離型または医薬品として容認できる塩型の2-アミノ-2-[2-(4-
オクチルフェニル)エチル]プロパン-1,3-ジオールである、請求項1〜11のいずれかに
記載の方法、使用、医薬組成物または医薬上の組み合わせ。
Claims (7)
- レット症候群を予防、抑制または治療するための医薬組成物であって、遊離形態または
薬学的に許容される塩の形態の2-アミノ-2-[2-(4-オクチルフェニル)エチル]プロパン-
1,3-ジオールを含有する組成物。 - さらなる処置剤をも含有する、請求項1に記載の組成物。
- 同時または逐次投与されるさらなる処置剤と併用される、請求項1に記載の組成物。
- 断続的に投与される、請求項1〜3のいずれかに記載の組成物。
- 薬学的に許容される塩が、塩酸塩である、請求項1〜4のいずれかに記載の組成物。
- 遊離形態または薬学的に許容される塩の形態の2-アミノ-2-[2-(4-オクチルフェニル)
エチル]プロパン-1,3-ジオール、およびレット症候群において使用する際の取扱説明書を
含む、レット症候群の治療に使用するためのキットである医薬上の組合せ。 - 薬学的に許容される塩が、塩酸塩である、請求項6に記載の組合せ。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US91598507P | 2007-05-04 | 2007-05-04 | |
| US60/915,985 | 2007-05-04 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017022557A Division JP2017105823A (ja) | 2007-05-04 | 2017-02-09 | S1p受容体調節因子の使用 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2020037567A true JP2020037567A (ja) | 2020-03-12 |
Family
ID=39588961
Family Applications (5)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010506902A Pending JP2010526116A (ja) | 2007-05-04 | 2008-05-01 | S1p受容体調節因子の使用 |
| JP2013254024A Active JP5764643B2 (ja) | 2007-05-04 | 2013-12-09 | S1p受容体調節因子の使用 |
| JP2015119902A Withdrawn JP2015199756A (ja) | 2007-05-04 | 2015-06-15 | S1p受容体調節因子の使用 |
| JP2017022557A Withdrawn JP2017105823A (ja) | 2007-05-04 | 2017-02-09 | S1p受容体調節因子の使用 |
| JP2019201411A Pending JP2020037567A (ja) | 2007-05-04 | 2019-11-06 | S1p受容体調節因子の使用 |
Family Applications Before (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010506902A Pending JP2010526116A (ja) | 2007-05-04 | 2008-05-01 | S1p受容体調節因子の使用 |
| JP2013254024A Active JP5764643B2 (ja) | 2007-05-04 | 2013-12-09 | S1p受容体調節因子の使用 |
| JP2015119902A Withdrawn JP2015199756A (ja) | 2007-05-04 | 2015-06-15 | S1p受容体調節因子の使用 |
| JP2017022557A Withdrawn JP2017105823A (ja) | 2007-05-04 | 2017-02-09 | S1p受容体調節因子の使用 |
Country Status (12)
| Country | Link |
|---|---|
| US (4) | US20100093672A1 (ja) |
| EP (1) | EP2142184B1 (ja) |
| JP (5) | JP2010526116A (ja) |
| KR (3) | KR101526835B1 (ja) |
| CN (2) | CN104337808A (ja) |
| AU (1) | AU2008248648B2 (ja) |
| BR (1) | BRPI0810733A2 (ja) |
| CA (1) | CA2684953C (ja) |
| ES (1) | ES2707576T3 (ja) |
| MX (1) | MX2009011943A (ja) |
| RU (1) | RU2498796C2 (ja) |
| WO (1) | WO2008135522A1 (ja) |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101526835B1 (ko) * | 2007-05-04 | 2015-06-05 | 노파르티스 아게 | S1p 수용체 조절제의 용도 |
| CN101973898B (zh) * | 2010-09-09 | 2013-06-19 | 南京明生医药技术有限公司 | 2-对辛基苯乙基-2-氨基丙二醇衍生物及其应用 |
| UA114283C2 (uk) | 2011-01-07 | 2017-05-25 | Новартіс Аг | Композиції імуносупресантів |
| EP2567959B1 (en) | 2011-09-12 | 2014-04-16 | Sanofi | 6-(4-hydroxy-phenyl)-3-styryl-1h-pyrazolo[3,4-b]pyridine-4-carboxylic acid amide derivatives as kinase inhibitors |
| AU2012307535A1 (en) * | 2011-09-13 | 2014-04-03 | Novartis Ag | Combinations comprising a S1P receptor modulator |
| WO2013082299A1 (en) * | 2011-11-29 | 2013-06-06 | Als Therapy Development Institute | Targeting of t-lymphocytes to treat amyotrophic lateral sclerosis |
| WO2016135644A1 (en) | 2015-02-26 | 2016-09-01 | Novartis Ag | Treatment of autoimmune disease in a patient receiving additionally a beta-blocker |
| CN106466479A (zh) * | 2015-08-18 | 2017-03-01 | 周意 | 脑源性神经营养因子前体蛋白用作治疗情感障碍的靶点 |
| US11434200B2 (en) | 2017-03-09 | 2022-09-06 | Novartis Ag | Solid forms comprising an oxime ether compound and a coformer, compositions and methods of use thereof |
| US11629124B2 (en) | 2017-03-09 | 2023-04-18 | Novartis Ag | Solid forms comprising an oxime ether compound, compositions and methods of use thereof |
| EP4483960A3 (en) * | 2020-02-06 | 2025-03-05 | Mitsubishi Tanabe Pharma Corporation | Therapeutic agent for myalgic encephalomyelitis/chronic fatigue syndrome |
Family Cites Families (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1383778B1 (en) * | 2001-01-30 | 2009-10-21 | University Of Virginia Patent Foundation | Agonists and antagonists of sphingosine-1-phosphate receptors |
| AU2002320470A1 (en) * | 2001-07-11 | 2003-01-29 | Musc Foundation For Research Development | Modulators of ceramidase and methods of use based thereon |
| CN1329372C (zh) | 2001-09-27 | 2007-08-01 | 杏林制药株式会社 | 二芳基硫醚衍生物及其加成盐和免疫抑制剂 |
| WO2003062252A1 (en) | 2002-01-18 | 2003-07-31 | Merck & Co., Inc. | Edg receptor agonists |
| MY150088A (en) * | 2003-05-19 | 2013-11-29 | Irm Llc | Immunosuppressant compounds and compositions |
| JP4861177B2 (ja) * | 2003-09-12 | 2012-01-25 | ニューロノバ エービー | 神経系の障害の処置 |
| WO2005041899A2 (en) | 2003-11-03 | 2005-05-12 | University Of Virginia Patent Foundation | Orally available sphingosine 1-phosphate receptor agonists and antagonists |
| KR20070006889A (ko) | 2004-05-03 | 2007-01-11 | 노파르티스 아게 | S1p 수용체 작용제 및 jak3 키나제 억제제를 포함하는조합물 |
| CN102600472A (zh) * | 2004-11-29 | 2012-07-25 | 诺瓦提斯公司 | S1p受体激动剂的剂量方案 |
| WO2006064616A1 (ja) | 2004-12-16 | 2006-06-22 | Matsushita Electric Industrial Co., Ltd. | 生ごみ処理装置 |
| GB0504544D0 (en) | 2005-03-04 | 2005-04-13 | Novartis Ag | Organic compounds |
| GB0612721D0 (en) * | 2006-06-27 | 2006-08-09 | Novartis Ag | Organic compounds |
| AU2007338771A1 (en) * | 2006-12-19 | 2008-07-03 | Merrimack Pharmaceuticals, Inc. | Coadministration of alpha-fetoprotein and an immunomodulatory agent to treat multiple sclerosis |
| KR101526835B1 (ko) * | 2007-05-04 | 2015-06-05 | 노파르티스 아게 | S1p 수용체 조절제의 용도 |
-
2008
- 2008-05-01 KR KR1020147031025A patent/KR101526835B1/ko not_active Expired - Fee Related
- 2008-05-01 WO PCT/EP2008/055405 patent/WO2008135522A1/en not_active Ceased
- 2008-05-01 ES ES08749978T patent/ES2707576T3/es active Active
- 2008-05-01 CN CN201410584780.9A patent/CN104337808A/zh active Pending
- 2008-05-01 JP JP2010506902A patent/JP2010526116A/ja active Pending
- 2008-05-01 AU AU2008248648A patent/AU2008248648B2/en not_active Ceased
- 2008-05-01 MX MX2009011943A patent/MX2009011943A/es not_active Application Discontinuation
- 2008-05-01 CN CN200880014840A patent/CN101674819A/zh active Pending
- 2008-05-01 RU RU2009144846/15A patent/RU2498796C2/ru not_active IP Right Cessation
- 2008-05-01 KR KR1020097025249A patent/KR20100021430A/ko not_active Ceased
- 2008-05-01 US US12/598,771 patent/US20100093672A1/en not_active Abandoned
- 2008-05-01 BR BRPI0810733-5A2A patent/BRPI0810733A2/pt not_active IP Right Cessation
- 2008-05-01 EP EP08749978.6A patent/EP2142184B1/en active Active
- 2008-05-01 KR KR1020157002829A patent/KR101528125B1/ko not_active Expired - Fee Related
- 2008-05-01 CA CA2684953A patent/CA2684953C/en not_active Expired - Fee Related
-
2011
- 2011-12-05 US US13/310,941 patent/US20120245129A1/en not_active Abandoned
-
2013
- 2013-05-13 US US13/893,295 patent/US20140011884A1/en not_active Abandoned
- 2013-12-05 US US14/097,623 patent/US9265754B2/en active Active
- 2013-12-09 JP JP2013254024A patent/JP5764643B2/ja active Active
-
2015
- 2015-06-15 JP JP2015119902A patent/JP2015199756A/ja not_active Withdrawn
-
2017
- 2017-02-09 JP JP2017022557A patent/JP2017105823A/ja not_active Withdrawn
-
2019
- 2019-11-06 JP JP2019201411A patent/JP2020037567A/ja active Pending
Non-Patent Citations (3)
| Title |
|---|
| JOURNAL OF NEUROIMMUNOLOGY, vol. 153, JPN6013028382, 2004, pages 108 - 121, ISSN: 0004505689 * |
| THE JOURNAL OF BIOLOGICAL CHEMISTRY, vol. 277, no. 24, JPN6013028385, 2002, pages 21453 - 21457, ISSN: 0004505691 * |
| THE JOURNAL OF PHARMACOLOGY AND EXPERIMENTAL THERAPEUTICS, vol. 305, no. 1, JPN6013028383, 2003, pages 70 - 77, ISSN: 0004505690 * |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2014088395A (ja) | 2014-05-15 |
| KR20100021430A (ko) | 2010-02-24 |
| ES2707576T3 (es) | 2019-04-04 |
| JP5764643B2 (ja) | 2015-08-19 |
| WO2008135522A1 (en) | 2008-11-13 |
| MX2009011943A (es) | 2009-11-13 |
| KR20150017391A (ko) | 2015-02-16 |
| CA2684953C (en) | 2016-08-09 |
| RU2498796C2 (ru) | 2013-11-20 |
| JP2017105823A (ja) | 2017-06-15 |
| KR101528125B1 (ko) | 2015-06-11 |
| EP2142184A1 (en) | 2010-01-13 |
| US9265754B2 (en) | 2016-02-23 |
| AU2008248648B2 (en) | 2012-02-23 |
| EP2142184B1 (en) | 2018-10-24 |
| CA2684953A1 (en) | 2008-11-13 |
| US20120245129A1 (en) | 2012-09-27 |
| CN101674819A (zh) | 2010-03-17 |
| KR20140141716A (ko) | 2014-12-10 |
| RU2009144846A (ru) | 2012-08-10 |
| US20140011884A1 (en) | 2014-01-09 |
| JP2015199756A (ja) | 2015-11-12 |
| AU2008248648A1 (en) | 2008-11-13 |
| BRPI0810733A2 (pt) | 2014-10-21 |
| JP2010526116A (ja) | 2010-07-29 |
| KR101526835B1 (ko) | 2015-06-05 |
| CN104337808A (zh) | 2015-02-11 |
| US20100093672A1 (en) | 2010-04-15 |
| US20140235610A1 (en) | 2014-08-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2020037567A (ja) | S1p受容体調節因子の使用 | |
| JP6931019B2 (ja) | 多発性硬化症を処置するためのs1p受容体モジュレーター | |
| JP2013129664A (ja) | S1p受容体アゴニストの投与レジメン | |
| JP2010526116A5 (ja) | ||
| AU2012200503B2 (en) | "Use of S1P receptor modulator" |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20191128 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20191128 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20200908 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20201126 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210305 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210518 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20210804 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20220208 |