JP2019532997A - T細胞療法とbtk阻害剤との併用療法 - Google Patents
T細胞療法とbtk阻害剤との併用療法 Download PDFInfo
- Publication number
- JP2019532997A JP2019532997A JP2019523665A JP2019523665A JP2019532997A JP 2019532997 A JP2019532997 A JP 2019532997A JP 2019523665 A JP2019523665 A JP 2019523665A JP 2019523665 A JP2019523665 A JP 2019523665A JP 2019532997 A JP2019532997 A JP 2019532997A
- Authority
- JP
- Japan
- Prior art keywords
- cells
- inhibitor
- cell
- cancer
- subject
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 210000001744 T-lymphocyte Anatomy 0.000 title claims abstract description 420
- 238000002659 cell therapy Methods 0.000 title claims abstract description 60
- 238000002648 combination therapy Methods 0.000 title claims abstract description 18
- 229940124291 BTK inhibitor Drugs 0.000 title claims description 67
- 239000003112 inhibitor Substances 0.000 claims abstract description 318
- 238000000034 method Methods 0.000 claims abstract description 272
- 239000000203 mixture Substances 0.000 claims abstract description 166
- 238000004519 manufacturing process Methods 0.000 claims abstract description 83
- 108010019670 Chimeric Antigen Receptors Proteins 0.000 claims abstract description 78
- 108091000080 Phosphotransferase Proteins 0.000 claims abstract description 54
- 102000020233 phosphotransferase Human genes 0.000 claims abstract description 54
- 102000039446 nucleic acids Human genes 0.000 claims abstract description 47
- 108020004707 nucleic acids Proteins 0.000 claims abstract description 47
- 150000007523 nucleic acids Chemical class 0.000 claims abstract description 47
- 230000027455 binding Effects 0.000 claims abstract description 29
- 230000000694 effects Effects 0.000 claims abstract description 23
- 239000003795 chemical substances by application Substances 0.000 claims abstract description 19
- 239000002955 immunomodulating agent Substances 0.000 claims abstract description 14
- 230000001965 increasing effect Effects 0.000 claims abstract description 8
- 230000002688 persistence Effects 0.000 claims abstract description 5
- 230000035755 proliferation Effects 0.000 claims abstract description 5
- 210000004027 cell Anatomy 0.000 claims description 527
- 239000000427 antigen Substances 0.000 claims description 324
- 108091007433 antigens Proteins 0.000 claims description 324
- 102000036639 antigens Human genes 0.000 claims description 324
- 206010028980 Neoplasm Diseases 0.000 claims description 312
- 201000011510 cancer Diseases 0.000 claims description 286
- 102000042834 TEC family Human genes 0.000 claims description 153
- 108091082333 TEC family Proteins 0.000 claims description 153
- 238000011282 treatment Methods 0.000 claims description 151
- 102000005962 receptors Human genes 0.000 claims description 133
- 108020003175 receptors Proteins 0.000 claims description 133
- 238000002560 therapeutic procedure Methods 0.000 claims description 95
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 claims description 92
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 claims description 92
- 210000003719 b-lymphocyte Anatomy 0.000 claims description 90
- 230000035772 mutation Effects 0.000 claims description 86
- -1 Lewis Y Proteins 0.000 claims description 84
- XYFPWWZEPKGCCK-GOSISDBHSA-N ibrutinib Chemical compound C1=2C(N)=NC=NC=2N([C@H]2CN(CCC2)C(=O)C=C)N=C1C(C=C1)=CC=C1OC1=CC=CC=C1 XYFPWWZEPKGCCK-GOSISDBHSA-N 0.000 claims description 77
- 239000002177 L01XE27 - Ibrutinib Substances 0.000 claims description 76
- 229960001507 ibrutinib Drugs 0.000 claims description 76
- 230000004044 response Effects 0.000 claims description 62
- 102100024964 Neural cell adhesion molecule L1 Human genes 0.000 claims description 56
- 210000004369 blood Anatomy 0.000 claims description 50
- 239000008280 blood Substances 0.000 claims description 50
- 102100039079 Tyrosine-protein kinase TXK Human genes 0.000 claims description 48
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 claims description 48
- 230000005764 inhibitory process Effects 0.000 claims description 44
- 102100024423 Carbonic anhydrase 9 Human genes 0.000 claims description 42
- 108010012255 Neural Cell Adhesion Molecule L1 Proteins 0.000 claims description 42
- 108010022366 Carcinoembryonic Antigen Proteins 0.000 claims description 41
- 102100025475 Carcinoembryonic antigen-related cell adhesion molecule 5 Human genes 0.000 claims description 41
- 239000003446 ligand Substances 0.000 claims description 39
- 102100024222 B-lymphocyte antigen CD19 Human genes 0.000 claims description 34
- 101000980825 Homo sapiens B-lymphocyte antigen CD19 Proteins 0.000 claims description 34
- 230000036210 malignancy Effects 0.000 claims description 33
- 108050008953 Melanoma-associated antigen Proteins 0.000 claims description 30
- 102100026497 Zinc finger protein 654 Human genes 0.000 claims description 30
- 239000003814 drug Substances 0.000 claims description 30
- 230000014509 gene expression Effects 0.000 claims description 30
- 229940124597 therapeutic agent Drugs 0.000 claims description 30
- 230000001605 fetal effect Effects 0.000 claims description 29
- 108010058905 CD44v6 antigen Proteins 0.000 claims description 28
- 102100031507 Fc receptor-like protein 5 Human genes 0.000 claims description 28
- 102100036735 Prostate stem cell antigen Human genes 0.000 claims description 28
- 208000008383 Wilms tumor Diseases 0.000 claims description 28
- 208000026448 Wilms tumor 1 Diseases 0.000 claims description 28
- 102100022748 Wilms tumor protein Human genes 0.000 claims description 28
- 101710127857 Wilms tumor protein Proteins 0.000 claims description 28
- 102000003735 Mesothelin Human genes 0.000 claims description 27
- 108090000015 Mesothelin Proteins 0.000 claims description 27
- 102000004422 Phospholipase C gamma Human genes 0.000 claims description 27
- 108010056751 Phospholipase C gamma Proteins 0.000 claims description 27
- 102100038080 B-cell receptor CD22 Human genes 0.000 claims description 26
- 102100022005 B-lymphocyte antigen CD20 Human genes 0.000 claims description 26
- 101000884305 Homo sapiens B-cell receptor CD22 Proteins 0.000 claims description 26
- 101000897405 Homo sapiens B-lymphocyte antigen CD20 Proteins 0.000 claims description 26
- 102100031940 Epithelial cell adhesion molecule Human genes 0.000 claims description 25
- 101000920667 Homo sapiens Epithelial cell adhesion molecule Proteins 0.000 claims description 25
- 210000004698 lymphocyte Anatomy 0.000 claims description 25
- 201000001441 melanoma Diseases 0.000 claims description 24
- 102100025570 Cancer/testis antigen 1 Human genes 0.000 claims description 23
- 101000856237 Homo sapiens Cancer/testis antigen 1 Proteins 0.000 claims description 23
- 230000011664 signaling Effects 0.000 claims description 23
- 108091008874 T cell receptors Proteins 0.000 claims description 22
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 claims description 22
- 102100036011 T-cell surface glycoprotein CD4 Human genes 0.000 claims description 20
- 102100034922 T-cell surface glycoprotein CD8 alpha chain Human genes 0.000 claims description 20
- 210000001185 bone marrow Anatomy 0.000 claims description 20
- 206010073071 hepatocellular carcinoma Diseases 0.000 claims description 20
- 231100000844 hepatocellular carcinoma Toxicity 0.000 claims description 20
- 244000052769 pathogen Species 0.000 claims description 20
- 230000001717 pathogenic effect Effects 0.000 claims description 20
- 108090000623 proteins and genes Proteins 0.000 claims description 19
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 claims description 18
- 230000000139 costimulatory effect Effects 0.000 claims description 18
- 102200162764 rs1057519825 Human genes 0.000 claims description 18
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 claims description 17
- 108700010039 chimeric receptor Proteins 0.000 claims description 17
- 102000016736 Cyclin Human genes 0.000 claims description 16
- 108050006400 Cyclin Proteins 0.000 claims description 16
- 102100027907 Cytoplasmic tyrosine-protein kinase BMX Human genes 0.000 claims description 16
- 101150029707 ERBB2 gene Proteins 0.000 claims description 16
- 101000935548 Homo sapiens Cytoplasmic tyrosine-protein kinase BMX Proteins 0.000 claims description 16
- 102000037982 Immune checkpoint proteins Human genes 0.000 claims description 16
- 108091008036 Immune checkpoint proteins Proteins 0.000 claims description 16
- 101710101516 Tyrosine-protein kinase TXK Proteins 0.000 claims description 16
- 210000001766 X chromosome Anatomy 0.000 claims description 16
- OIRDTQYFTABQOQ-KQYNXXCUSA-N adenosine Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O OIRDTQYFTABQOQ-KQYNXXCUSA-N 0.000 claims description 16
- 210000000349 chromosome Anatomy 0.000 claims description 16
- 229940126546 immune checkpoint molecule Drugs 0.000 claims description 16
- 230000002829 reductive effect Effects 0.000 claims description 16
- 102100031585 ADP-ribosyl cyclase/cyclic ADP-ribose hydrolase 1 Human genes 0.000 claims description 15
- 102100032912 CD44 antigen Human genes 0.000 claims description 15
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 claims description 15
- 101000777636 Homo sapiens ADP-ribosyl cyclase/cyclic ADP-ribose hydrolase 1 Proteins 0.000 claims description 15
- 101000868273 Homo sapiens CD44 antigen Proteins 0.000 claims description 15
- 208000031671 Large B-Cell Diffuse Lymphoma Diseases 0.000 claims description 15
- 229960004397 cyclophosphamide Drugs 0.000 claims description 15
- 206010012818 diffuse large B-cell lymphoma Diseases 0.000 claims description 15
- 229960000390 fludarabine Drugs 0.000 claims description 15
- GIUYCYHIANZCFB-FJFJXFQQSA-N fludarabine phosphate Chemical compound C1=NC=2C(N)=NC(F)=NC=2N1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@@H]1O GIUYCYHIANZCFB-FJFJXFQQSA-N 0.000 claims description 15
- 102100021663 Baculoviral IAP repeat-containing protein 5 Human genes 0.000 claims description 14
- 108700012439 CA9 Proteins 0.000 claims description 14
- 108010044090 Ephrin-B2 Proteins 0.000 claims description 14
- 102100023721 Ephrin-B2 Human genes 0.000 claims description 14
- 101150032879 Fcrl5 gene Proteins 0.000 claims description 14
- 102000003688 G-Protein-Coupled Receptors Human genes 0.000 claims description 14
- 108090000045 G-Protein-Coupled Receptors Proteins 0.000 claims description 14
- 102100041003 Glutamate carboxypeptidase 2 Human genes 0.000 claims description 14
- 101100165850 Homo sapiens CA9 gene Proteins 0.000 claims description 14
- 101000846908 Homo sapiens Fc receptor-like protein 5 Proteins 0.000 claims description 14
- 101000892862 Homo sapiens Glutamate carboxypeptidase 2 Proteins 0.000 claims description 14
- 101000998120 Homo sapiens Interleukin-3 receptor subunit alpha Proteins 0.000 claims description 14
- 101000878605 Homo sapiens Low affinity immunoglobulin epsilon Fc receptor Proteins 0.000 claims description 14
- 101000578784 Homo sapiens Melanoma antigen recognized by T-cells 1 Proteins 0.000 claims description 14
- 101001051490 Homo sapiens Neural cell adhesion molecule L1 Proteins 0.000 claims description 14
- 101000884271 Homo sapiens Signal transducer CD24 Proteins 0.000 claims description 14
- 108010017511 Interleukin-13 Receptors Proteins 0.000 claims description 14
- 102000004559 Interleukin-13 Receptors Human genes 0.000 claims description 14
- 102100020793 Interleukin-13 receptor subunit alpha-2 Human genes 0.000 claims description 14
- 101710112634 Interleukin-13 receptor subunit alpha-2 Proteins 0.000 claims description 14
- 102100033493 Interleukin-3 receptor subunit alpha Human genes 0.000 claims description 14
- 102100038007 Low affinity immunoglobulin epsilon Fc receptor Human genes 0.000 claims description 14
- 102100022430 Melanocyte protein PMEL Human genes 0.000 claims description 14
- 102100028389 Melanoma antigen recognized by T-cells 1 Human genes 0.000 claims description 14
- 102000001068 Neural Cell Adhesion Molecules Human genes 0.000 claims description 14
- 108010069196 Neural Cell Adhesion Molecules Proteins 0.000 claims description 14
- 108010072866 Prostate-Specific Antigen Proteins 0.000 claims description 14
- 102100038081 Signal transducer CD24 Human genes 0.000 claims description 14
- 101800001271 Surface protein Proteins 0.000 claims description 14
- 108010002687 Survivin Proteins 0.000 claims description 14
- OIPILFWXSMYKGL-UHFFFAOYSA-N acetylcholine Chemical compound CC(=O)OCC[N+](C)(C)C OIPILFWXSMYKGL-UHFFFAOYSA-N 0.000 claims description 14
- 229960004373 acetylcholine Drugs 0.000 claims description 14
- 230000003432 anti-folate effect Effects 0.000 claims description 14
- 229940127074 antifolate Drugs 0.000 claims description 14
- 239000000539 dimer Substances 0.000 claims description 14
- 230000009977 dual effect Effects 0.000 claims description 14
- 102000015694 estrogen receptors Human genes 0.000 claims description 14
- 108010038795 estrogen receptors Proteins 0.000 claims description 14
- 239000004052 folic acid antagonist Substances 0.000 claims description 14
- 208000002672 hepatitis B Diseases 0.000 claims description 14
- 230000000977 initiatory effect Effects 0.000 claims description 14
- 102000003998 progesterone receptors Human genes 0.000 claims description 14
- 108090000468 progesterone receptors Proteins 0.000 claims description 14
- 208000037821 progressive disease Diseases 0.000 claims description 14
- 230000000638 stimulation Effects 0.000 claims description 14
- 210000001550 testis Anatomy 0.000 claims description 14
- SSOORFWOBGFTHL-OTEJMHTDSA-N (4S)-5-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-6-amino-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[2-[(2S)-2-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-6-amino-1-[[(2S)-1-[[(2S)-1-[[(2S,3S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-6-amino-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-5-amino-1-[[(2S)-1-[[(2S)-1-[[(2S)-6-amino-1-[[(2S)-6-amino-1-[[(2S)-1-[[(2S)-1-[[(2S)-5-amino-1-[[(2S)-5-carbamimidamido-1-[[(2S)-5-carbamimidamido-1-[[(1S)-4-carbamimidamido-1-carboxybutyl]amino]-1-oxopentan-2-yl]amino]-1-oxopentan-2-yl]amino]-1,5-dioxopentan-2-yl]amino]-5-carbamimidamido-1-oxopentan-2-yl]amino]-5-carbamimidamido-1-oxopentan-2-yl]amino]-1-oxohexan-2-yl]amino]-1-oxohexan-2-yl]amino]-5-carbamimidamido-1-oxopentan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-1,5-dioxopentan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-3-hydroxy-1-oxopropan-2-yl]amino]-3-hydroxy-1-oxopropan-2-yl]amino]-3-hydroxy-1-oxopropan-2-yl]amino]-1-oxopropan-2-yl]amino]-1-oxohexan-2-yl]amino]-3-hydroxy-1-oxopropan-2-yl]amino]-1-oxo-3-phenylpropan-2-yl]amino]-3-methyl-1-oxopentan-2-yl]amino]-3-methyl-1-oxobutan-2-yl]amino]-5-carbamimidamido-1-oxopentan-2-yl]amino]-1-oxohexan-2-yl]amino]-3-methyl-1-oxobutan-2-yl]amino]-5-carbamimidamido-1-oxopentan-2-yl]amino]-3-methyl-1-oxobutan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-1-oxopropan-2-yl]amino]-5-carbamimidamido-1-oxopentan-2-yl]carbamoyl]pyrrolidin-1-yl]-2-oxoethyl]amino]-3-(1H-indol-3-yl)-1-oxopropan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-1-oxo-3-phenylpropan-2-yl]amino]-5-carbamimidamido-1-oxopentan-2-yl]amino]-1-oxohexan-2-yl]amino]-3-methyl-1-oxobutan-2-yl]amino]-5-carbamimidamido-1-oxopentan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-1-oxo-3-phenylpropan-2-yl]amino]-3-(1H-imidazol-4-yl)-1-oxopropan-2-yl]amino]-3-methyl-1-oxobutan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-4-[[(2S)-2-[[(2S)-2-[[(2S)-2,6-diaminohexanoyl]amino]-3-methylbutanoyl]amino]propanoyl]amino]-5-oxopentanoic acid Chemical compound CC[C@H](C)[C@H](NC(=O)[C@@H](NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@@H]1CCCN1C(=O)CNC(=O)[C@H](Cc1c[nH]c2ccccc12)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](Cc1ccccc1)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](Cc1ccccc1)NC(=O)[C@H](Cc1c[nH]cn1)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@@H](N)CCCCN)C(C)C)C(C)C)C(C)C)C(C)C)C(C)C)C(C)C)C(=O)N[C@@H](Cc1ccccc1)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O SSOORFWOBGFTHL-OTEJMHTDSA-N 0.000 claims description 13
- 101000623901 Homo sapiens Mucin-16 Proteins 0.000 claims description 13
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 claims description 13
- 101000801433 Homo sapiens Trophoblast glycoprotein Proteins 0.000 claims description 13
- 102100023123 Mucin-16 Human genes 0.000 claims description 13
- 101710201161 Natural cytotoxicity triggering receptor 3 ligand 1 Proteins 0.000 claims description 13
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 claims description 13
- 102100033579 Trophoblast glycoprotein Human genes 0.000 claims description 13
- 108091008605 VEGF receptors Proteins 0.000 claims description 13
- 102000009484 Vascular Endothelial Growth Factor Receptors Human genes 0.000 claims description 13
- 238000002512 chemotherapy Methods 0.000 claims description 13
- 229940014144 folate Drugs 0.000 claims description 13
- OVBPIULPVIDEAO-LBPRGKRZSA-N folic acid Chemical compound C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-LBPRGKRZSA-N 0.000 claims description 13
- 235000019152 folic acid Nutrition 0.000 claims description 13
- 239000011724 folic acid Substances 0.000 claims description 13
- 230000007781 signaling event Effects 0.000 claims description 13
- 208000031404 Chromosome Aberrations Diseases 0.000 claims description 12
- 108010060273 Cyclin A2 Proteins 0.000 claims description 12
- 102100025191 Cyclin-A2 Human genes 0.000 claims description 12
- 102100034256 Mucin-1 Human genes 0.000 claims description 12
- 102000006495 integrins Human genes 0.000 claims description 12
- 108010044426 integrins Proteins 0.000 claims description 12
- 230000004068 intracellular signaling Effects 0.000 claims description 12
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 11
- 208000004736 B-Cell Leukemia Diseases 0.000 claims description 10
- 108010002350 Interleukin-2 Proteins 0.000 claims description 10
- 102000000588 Interleukin-2 Human genes 0.000 claims description 10
- 230000004913 activation Effects 0.000 claims description 10
- 230000037396 body weight Effects 0.000 claims description 10
- 201000010099 disease Diseases 0.000 claims description 10
- 239000012634 fragment Substances 0.000 claims description 10
- 201000005787 hematologic cancer Diseases 0.000 claims description 10
- 230000002519 immonomodulatory effect Effects 0.000 claims description 10
- 238000000099 in vitro assay Methods 0.000 claims description 10
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 claims description 9
- 208000003950 B-cell lymphoma Diseases 0.000 claims description 9
- 206010025323 Lymphomas Diseases 0.000 claims description 9
- 208000032839 leukemia Diseases 0.000 claims description 9
- 150000003384 small molecules Chemical group 0.000 claims description 9
- 238000006467 substitution reaction Methods 0.000 claims description 9
- 208000031261 Acute myeloid leukaemia Diseases 0.000 claims description 8
- 108091023037 Aptamer Proteins 0.000 claims description 8
- 239000002126 C01EB10 - Adenosine Substances 0.000 claims description 8
- 101000998953 Homo sapiens Immunoglobulin heavy variable 1-2 Proteins 0.000 claims description 8
- 101000934338 Homo sapiens Myeloid cell surface antigen CD33 Proteins 0.000 claims description 8
- 101000851376 Homo sapiens Tumor necrosis factor receptor superfamily member 8 Proteins 0.000 claims description 8
- 101000851370 Homo sapiens Tumor necrosis factor receptor superfamily member 9 Proteins 0.000 claims description 8
- 102100036887 Immunoglobulin heavy variable 1-2 Human genes 0.000 claims description 8
- 102100025243 Myeloid cell surface antigen CD33 Human genes 0.000 claims description 8
- 206010061902 Pancreatic neoplasm Diseases 0.000 claims description 8
- 206010035226 Plasma cell myeloma Diseases 0.000 claims description 8
- 206010039491 Sarcoma Diseases 0.000 claims description 8
- 102100036857 Tumor necrosis factor receptor superfamily member 8 Human genes 0.000 claims description 8
- 102100036856 Tumor necrosis factor receptor superfamily member 9 Human genes 0.000 claims description 8
- 229960005305 adenosine Drugs 0.000 claims description 8
- 125000000539 amino acid group Chemical group 0.000 claims description 8
- 230000035578 autophosphorylation Effects 0.000 claims description 8
- 230000003915 cell function Effects 0.000 claims description 8
- 230000007423 decrease Effects 0.000 claims description 8
- 229940043355 kinase inhibitor Drugs 0.000 claims description 8
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 claims description 8
- 201000000050 myeloid neoplasm Diseases 0.000 claims description 8
- 201000002528 pancreatic cancer Diseases 0.000 claims description 8
- 208000008443 pancreatic carcinoma Diseases 0.000 claims description 8
- 239000003757 phosphotransferase inhibitor Substances 0.000 claims description 8
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 8
- 102000004169 proteins and genes Human genes 0.000 claims description 8
- 101710089372 Programmed cell death protein 1 Proteins 0.000 claims description 7
- 230000006870 function Effects 0.000 claims description 7
- 230000003834 intracellular effect Effects 0.000 claims description 7
- 230000019491 signal transduction Effects 0.000 claims description 7
- 230000004083 survival effect Effects 0.000 claims description 7
- 238000003556 assay Methods 0.000 claims description 6
- 230000001580 bacterial effect Effects 0.000 claims description 6
- 230000003071 parasitic effect Effects 0.000 claims description 6
- 230000037361 pathway Effects 0.000 claims description 6
- 230000009261 transgenic effect Effects 0.000 claims description 6
- 230000003612 virological effect Effects 0.000 claims description 6
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 claims description 5
- 230000036541 health Effects 0.000 claims description 5
- 210000002865 immune cell Anatomy 0.000 claims description 5
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 claims description 5
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 claims description 4
- 108010074708 B7-H1 Antigen Proteins 0.000 claims description 4
- 206010005003 Bladder cancer Diseases 0.000 claims description 4
- 206010005949 Bone cancer Diseases 0.000 claims description 4
- 208000018084 Bone neoplasm Diseases 0.000 claims description 4
- 208000003174 Brain Neoplasms Diseases 0.000 claims description 4
- 206010006187 Breast cancer Diseases 0.000 claims description 4
- 208000026310 Breast neoplasm Diseases 0.000 claims description 4
- 108010021064 CTLA-4 Antigen Proteins 0.000 claims description 4
- 201000009030 Carcinoma Diseases 0.000 claims description 4
- 102100025064 Cellular tumor antigen p53 Human genes 0.000 claims description 4
- 206010008342 Cervix carcinoma Diseases 0.000 claims description 4
- 206010009944 Colon cancer Diseases 0.000 claims description 4
- 208000001333 Colorectal Neoplasms Diseases 0.000 claims description 4
- 206010067477 Cytogenetic abnormality Diseases 0.000 claims description 4
- 208000000461 Esophageal Neoplasms Diseases 0.000 claims description 4
- 102100034458 Hepatitis A virus cellular receptor 2 Human genes 0.000 claims description 4
- 101100166600 Homo sapiens CD28 gene Proteins 0.000 claims description 4
- 101001068133 Homo sapiens Hepatitis A virus cellular receptor 2 Proteins 0.000 claims description 4
- 101000666896 Homo sapiens V-type immunoglobulin domain-containing suppressor of T-cell activation Proteins 0.000 claims description 4
- 108010021625 Immunoglobulin Fragments Proteins 0.000 claims description 4
- 102000008394 Immunoglobulin Fragments Human genes 0.000 claims description 4
- 208000008839 Kidney Neoplasms Diseases 0.000 claims description 4
- 206010058467 Lung neoplasm malignant Diseases 0.000 claims description 4
- 208000028018 Lymphocytic leukaemia Diseases 0.000 claims description 4
- 101100407308 Mus musculus Pdcd1lg2 gene Proteins 0.000 claims description 4
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 claims description 4
- 206010030155 Oesophageal carcinoma Diseases 0.000 claims description 4
- 206010033128 Ovarian cancer Diseases 0.000 claims description 4
- 206010061535 Ovarian neoplasm Diseases 0.000 claims description 4
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 claims description 4
- 108700030875 Programmed Cell Death 1 Ligand 2 Proteins 0.000 claims description 4
- 102100024216 Programmed cell death 1 ligand 1 Human genes 0.000 claims description 4
- 102100024213 Programmed cell death 1 ligand 2 Human genes 0.000 claims description 4
- 206010060862 Prostate cancer Diseases 0.000 claims description 4
- 208000000236 Prostatic Neoplasms Diseases 0.000 claims description 4
- 208000015634 Rectal Neoplasms Diseases 0.000 claims description 4
- 206010038389 Renal cancer Diseases 0.000 claims description 4
- 208000021712 Soft tissue sarcoma Diseases 0.000 claims description 4
- 208000005718 Stomach Neoplasms Diseases 0.000 claims description 4
- 208000024770 Thyroid neoplasm Diseases 0.000 claims description 4
- 108010078814 Tumor Suppressor Protein p53 Proteins 0.000 claims description 4
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 claims description 4
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 claims description 4
- 208000002495 Uterine Neoplasms Diseases 0.000 claims description 4
- 102100038282 V-type immunoglobulin domain-containing suppressor of T-cell activation Human genes 0.000 claims description 4
- 208000014619 adult acute lymphoblastic leukemia Diseases 0.000 claims description 4
- 201000011184 adult acute lymphocytic leukemia Diseases 0.000 claims description 4
- 230000000735 allogeneic effect Effects 0.000 claims description 4
- 201000007455 central nervous system cancer Diseases 0.000 claims description 4
- 201000010881 cervical cancer Diseases 0.000 claims description 4
- 238000012217 deletion Methods 0.000 claims description 4
- 230000037430 deletion Effects 0.000 claims description 4
- 201000004101 esophageal cancer Diseases 0.000 claims description 4
- IJJVMEJXYNJXOJ-UHFFFAOYSA-N fluquinconazole Chemical compound C=1C=C(Cl)C=C(Cl)C=1N1C(=O)C2=CC(F)=CC=C2N=C1N1C=NC=N1 IJJVMEJXYNJXOJ-UHFFFAOYSA-N 0.000 claims description 4
- 206010017758 gastric cancer Diseases 0.000 claims description 4
- 201000010536 head and neck cancer Diseases 0.000 claims description 4
- 208000014829 head and neck neoplasm Diseases 0.000 claims description 4
- 208000024200 hematopoietic and lymphoid system neoplasm Diseases 0.000 claims description 4
- 229940127121 immunoconjugate Drugs 0.000 claims description 4
- 230000003993 interaction Effects 0.000 claims description 4
- 201000010982 kidney cancer Diseases 0.000 claims description 4
- 201000005202 lung cancer Diseases 0.000 claims description 4
- 208000020816 lung neoplasm Diseases 0.000 claims description 4
- 208000003747 lymphoid leukemia Diseases 0.000 claims description 4
- 201000002120 neuroendocrine carcinoma Diseases 0.000 claims description 4
- 239000008194 pharmaceutical composition Substances 0.000 claims description 4
- 206010038038 rectal cancer Diseases 0.000 claims description 4
- 201000001275 rectum cancer Diseases 0.000 claims description 4
- 201000011549 stomach cancer Diseases 0.000 claims description 4
- 230000008685 targeting Effects 0.000 claims description 4
- 201000002510 thyroid cancer Diseases 0.000 claims description 4
- 210000003171 tumor-infiltrating lymphocyte Anatomy 0.000 claims description 4
- 201000005112 urinary bladder cancer Diseases 0.000 claims description 4
- 206010046766 uterine cancer Diseases 0.000 claims description 4
- 102000004127 Cytokines Human genes 0.000 claims description 3
- 108090000695 Cytokines Proteins 0.000 claims description 3
- 230000003259 immunoinhibitory effect Effects 0.000 claims description 3
- 230000009467 reduction Effects 0.000 claims description 3
- 230000028327 secretion Effects 0.000 claims description 3
- 230000004663 cell proliferation Effects 0.000 claims description 2
- 230000003013 cytotoxicity Effects 0.000 claims description 2
- 231100000135 cytotoxicity Toxicity 0.000 claims description 2
- 230000002401 inhibitory effect Effects 0.000 claims description 2
- 230000007774 longterm Effects 0.000 claims description 2
- 210000004986 primary T-cell Anatomy 0.000 claims description 2
- 101001103039 Homo sapiens Inactive tyrosine-protein kinase transmembrane receptor ROR1 Proteins 0.000 claims 14
- 101001109501 Homo sapiens NKG2-D type II integral membrane protein Proteins 0.000 claims 14
- 101001103036 Homo sapiens Nuclear receptor ROR-alpha Proteins 0.000 claims 14
- 101001136592 Homo sapiens Prostate stem cell antigen Proteins 0.000 claims 14
- 102100039615 Inactive tyrosine-protein kinase transmembrane receptor ROR1 Human genes 0.000 claims 14
- 102100022680 NKG2-D type II integral membrane protein Human genes 0.000 claims 14
- 102000052116 epidermal growth factor receptor activity proteins Human genes 0.000 claims 14
- 108700015053 epidermal growth factor receptor activity proteins Proteins 0.000 claims 14
- YOHYSYJDKVYCJI-UHFFFAOYSA-N n-[3-[[6-[3-(trifluoromethyl)anilino]pyrimidin-4-yl]amino]phenyl]cyclopropanecarboxamide Chemical compound FC(F)(F)C1=CC=CC(NC=2N=CN=C(NC=3C=C(NC(=O)C4CC4)C=CC=3)C=2)=C1 YOHYSYJDKVYCJI-UHFFFAOYSA-N 0.000 claims 14
- 101150047061 tag-72 gene Proteins 0.000 claims 14
- 102100028757 Chondroitin sulfate proteoglycan 4 Human genes 0.000 claims 13
- 101000916489 Homo sapiens Chondroitin sulfate proteoglycan 4 Proteins 0.000 claims 13
- 102000025850 HLA-A2 Antigen Human genes 0.000 claims 7
- 108010074032 HLA-A2 Antigen Proteins 0.000 claims 7
- 102000007066 Prostate-Specific Antigen Human genes 0.000 claims 7
- 229920001481 poly(stearyl methacrylate) Polymers 0.000 claims 7
- 101001133056 Homo sapiens Mucin-1 Proteins 0.000 claims 6
- 102100023990 60S ribosomal protein L17 Human genes 0.000 claims 2
- 229940045513 CTLA4 antagonist Drugs 0.000 claims 2
- 102100039498 Cytotoxic T-lymphocyte protein 4 Human genes 0.000 claims 2
- 102000017578 LAG3 Human genes 0.000 claims 2
- 101150030213 Lag3 gene Proteins 0.000 claims 2
- 230000002584 immunomodulator Effects 0.000 claims 2
- 229940121354 immunomodulator Drugs 0.000 claims 2
- 101100504181 Arabidopsis thaliana GCS1 gene Proteins 0.000 claims 1
- 101710098119 Chaperonin GroEL 2 Proteins 0.000 claims 1
- 206010066901 Treatment failure Diseases 0.000 claims 1
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 claims 1
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 claims 1
- 239000003183 carcinogenic agent Substances 0.000 claims 1
- 230000009870 specific binding Effects 0.000 claims 1
- 238000011467 adoptive cell therapy Methods 0.000 abstract description 10
- 238000009169 immunotherapy Methods 0.000 abstract description 10
- 230000001976 improved effect Effects 0.000 abstract description 5
- 230000001225 therapeutic effect Effects 0.000 abstract description 4
- 230000001413 cellular effect Effects 0.000 abstract description 2
- 230000036515 potency Effects 0.000 abstract description 2
- 108091007741 Chimeric antigen receptor T cells Proteins 0.000 description 17
- 101710120463 Prostate stem cell antigen Proteins 0.000 description 14
- 101000716102 Homo sapiens T-cell surface glycoprotein CD4 Proteins 0.000 description 12
- 101000946843 Homo sapiens T-cell surface glycoprotein CD8 alpha chain Proteins 0.000 description 12
- 241000699670 Mus sp. Species 0.000 description 9
- 108010009978 Tec protein-tyrosine kinase Proteins 0.000 description 8
- 102100038358 Prostate-specific antigen Human genes 0.000 description 7
- 101001039269 Rattus norvegicus Glycine N-methyltransferase Proteins 0.000 description 7
- 108010053099 Vascular Endothelial Growth Factor Receptor-2 Proteins 0.000 description 7
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 description 7
- 238000002474 experimental method Methods 0.000 description 7
- 102000006942 B-Cell Maturation Antigen Human genes 0.000 description 6
- 108010008014 B-Cell Maturation Antigen Proteins 0.000 description 6
- 108010008707 Mucin-1 Proteins 0.000 description 6
- 102100023345 Tyrosine-protein kinase ITK/TSK Human genes 0.000 description 6
- 108010075324 emt protein-tyrosine kinase Proteins 0.000 description 6
- 102100040678 Programmed cell death protein 1 Human genes 0.000 description 5
- 230000008859 change Effects 0.000 description 5
- 101001018097 Homo sapiens L-selectin Proteins 0.000 description 4
- 102100033467 L-selectin Human genes 0.000 description 4
- 235000018102 proteins Nutrition 0.000 description 4
- 239000003981 vehicle Substances 0.000 description 4
- 102100025137 Early activation antigen CD69 Human genes 0.000 description 3
- 101000934374 Homo sapiens Early activation antigen CD69 Proteins 0.000 description 3
- 101001023379 Homo sapiens Lysosome-associated membrane glycoprotein 1 Proteins 0.000 description 3
- 102100035133 Lysosome-associated membrane glycoprotein 1 Human genes 0.000 description 3
- 208000025205 Mantle-Cell Lymphoma Diseases 0.000 description 3
- 238000012258 culturing Methods 0.000 description 3
- 230000001461 cytolytic effect Effects 0.000 description 3
- 238000000684 flow cytometry Methods 0.000 description 3
- 230000002250 progressing effect Effects 0.000 description 3
- 102000006306 Antigen Receptors Human genes 0.000 description 2
- 108010083359 Antigen Receptors Proteins 0.000 description 2
- 108091008875 B cell receptors Proteins 0.000 description 2
- 102000008203 CTLA-4 Antigen Human genes 0.000 description 2
- 102100029722 Ectonucleoside triphosphate diphosphohydrolase 1 Human genes 0.000 description 2
- 101001012447 Homo sapiens Ectonucleoside triphosphate diphosphohydrolase 1 Proteins 0.000 description 2
- 101001057504 Homo sapiens Interferon-stimulated gene 20 kDa protein Proteins 0.000 description 2
- 101001055144 Homo sapiens Interleukin-2 receptor subunit alpha Proteins 0.000 description 2
- 102100027268 Interferon-stimulated gene 20 kDa protein Human genes 0.000 description 2
- 102100020862 Lymphocyte activation gene 3 protein Human genes 0.000 description 2
- 101710092458 Lymphocyte activation gene 3 protein Proteins 0.000 description 2
- 241001465754 Metazoa Species 0.000 description 2
- 230000029918 bioluminescence Effects 0.000 description 2
- 238000005415 bioluminescence Methods 0.000 description 2
- 230000010261 cell growth Effects 0.000 description 2
- 230000016396 cytokine production Effects 0.000 description 2
- 238000004141 dimensional analysis Methods 0.000 description 2
- 239000003651 drinking water Substances 0.000 description 2
- 235000020188 drinking water Nutrition 0.000 description 2
- 239000012636 effector Substances 0.000 description 2
- 238000002513 implantation Methods 0.000 description 2
- 210000005087 mononuclear cell Anatomy 0.000 description 2
- 239000011886 peripheral blood Substances 0.000 description 2
- 210000005259 peripheral blood Anatomy 0.000 description 2
- 210000000952 spleen Anatomy 0.000 description 2
- CCEKAJIANROZEO-UHFFFAOYSA-N sulfluramid Chemical group CCNS(=O)(=O)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)F CCEKAJIANROZEO-UHFFFAOYSA-N 0.000 description 2
- 238000012546 transfer Methods 0.000 description 2
- 230000004614 tumor growth Effects 0.000 description 2
- ZIIUUSVHCHPIQD-UHFFFAOYSA-N 2,4,6-trimethyl-N-[3-(trifluoromethyl)phenyl]benzenesulfonamide Chemical group CC1=CC(C)=CC(C)=C1S(=O)(=O)NC1=CC=CC(C(F)(F)F)=C1 ZIIUUSVHCHPIQD-UHFFFAOYSA-N 0.000 description 1
- 108010029445 Agammaglobulinaemia Tyrosine Kinase Proteins 0.000 description 1
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 description 1
- 102100036301 C-C chemokine receptor type 7 Human genes 0.000 description 1
- 102100028990 C-X-C chemokine receptor type 3 Human genes 0.000 description 1
- 238000011357 CAR T-cell therapy Methods 0.000 description 1
- 206010011968 Decreased immune responsiveness Diseases 0.000 description 1
- 101000716065 Homo sapiens C-C chemokine receptor type 7 Proteins 0.000 description 1
- 101000916050 Homo sapiens C-X-C chemokine receptor type 3 Proteins 0.000 description 1
- 101000611023 Homo sapiens Tumor necrosis factor receptor superfamily member 6 Proteins 0.000 description 1
- 102000043136 MAP kinase family Human genes 0.000 description 1
- 108091054455 MAP kinase family Proteins 0.000 description 1
- RRHONYZEMUNMJX-UHFFFAOYSA-N N-[5-[[5-[(4-acetyl-1-piperazinyl)-oxomethyl]-4-methoxy-2-methylphenyl]thio]-2-thiazolyl]-4-[(3-methylbutan-2-ylamino)methyl]benzamide Chemical compound C1=C(C(=O)N2CCN(CC2)C(C)=O)C(OC)=CC(C)=C1SC(S1)=CN=C1NC(=O)C1=CC=C(CNC(C)C(C)C)C=C1 RRHONYZEMUNMJX-UHFFFAOYSA-N 0.000 description 1
- 108010057466 NF-kappa B Proteins 0.000 description 1
- 102000003945 NF-kappa B Human genes 0.000 description 1
- 102000015439 Phospholipases Human genes 0.000 description 1
- 108010064785 Phospholipases Proteins 0.000 description 1
- 102100040403 Tumor necrosis factor receptor superfamily member 6 Human genes 0.000 description 1
- 102100029823 Tyrosine-protein kinase BTK Human genes 0.000 description 1
- 208000033559 Waldenström macroglobulinemia Diseases 0.000 description 1
- 230000001594 aberrant effect Effects 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 230000011712 cell development Effects 0.000 description 1
- 238000003501 co-culture Methods 0.000 description 1
- 230000001143 conditioned effect Effects 0.000 description 1
- 231100000433 cytotoxic Toxicity 0.000 description 1
- 230000001472 cytotoxic effect Effects 0.000 description 1
- 238000002784 cytotoxicity assay Methods 0.000 description 1
- 231100000263 cytotoxicity test Toxicity 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 208000037765 diseases and disorders Diseases 0.000 description 1
- 208000035475 disorder Diseases 0.000 description 1
- 230000003828 downregulation Effects 0.000 description 1
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 1
- 108020005243 folate receptor Proteins 0.000 description 1
- 102000006815 folate receptor Human genes 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 238000010353 genetic engineering Methods 0.000 description 1
- 230000008821 health effect Effects 0.000 description 1
- 230000003862 health status Effects 0.000 description 1
- 230000001506 immunosuppresive effect Effects 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 229910052738 indium Inorganic materials 0.000 description 1
- 230000002427 irreversible effect Effects 0.000 description 1
- 230000002147 killing effect Effects 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 230000005923 long-lasting effect Effects 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 230000002085 persistent effect Effects 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 230000006798 recombination Effects 0.000 description 1
- 238000005215 recombination Methods 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 210000004881 tumor cell Anatomy 0.000 description 1
- 238000013413 tumor xenograft mouse model Methods 0.000 description 1
- 238000007492 two-way ANOVA Methods 0.000 description 1
- 230000003827 upregulation Effects 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/66—Phosphorus compounds
- A61K31/675—Phosphorus compounds having nitrogen as a ring hetero atom, e.g. pyridoxal phosphate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7042—Compounds having saccharide radicals and heterocyclic rings
- A61K31/7052—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides
- A61K31/706—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom
- A61K31/7064—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines
- A61K31/7076—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines containing purines, e.g. adenosine, adenylic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/14—Blood; Artificial blood
- A61K35/17—Lymphocytes; B-cells; T-cells; Natural killer cells; Interferon-activated or cytokine-activated lymphocytes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001102—Receptors, cell surface antigens or cell surface determinants
- A61K39/001103—Receptors for growth factors
- A61K39/001104—Epidermal growth factor receptors [EGFR]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001102—Receptors, cell surface antigens or cell surface determinants
- A61K39/001103—Receptors for growth factors
- A61K39/001106—Her-2/neu/ErbB2, Her-3/ErbB3 or Her 4/ErbB4
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001102—Receptors, cell surface antigens or cell surface determinants
- A61K39/001103—Receptors for growth factors
- A61K39/001109—Vascular endothelial growth factor receptors [VEGFR]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001102—Receptors, cell surface antigens or cell surface determinants
- A61K39/001103—Receptors for growth factors
- A61K39/00111—Hepatocyte growth factor receptor [HGFR or c-met]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001102—Receptors, cell surface antigens or cell surface determinants
- A61K39/001111—Immunoglobulin superfamily
- A61K39/001112—CD19 or B4
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001102—Receptors, cell surface antigens or cell surface determinants
- A61K39/001111—Immunoglobulin superfamily
- A61K39/001113—CD22, BL-CAM, siglec-2 or sialic acid- binding Ig-related lectin 2
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001102—Receptors, cell surface antigens or cell surface determinants
- A61K39/001116—Receptors for cytokines
- A61K39/001119—Receptors for interleukins [IL]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001102—Receptors, cell surface antigens or cell surface determinants
- A61K39/001122—Ephrin Receptors [Eph]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001102—Receptors, cell surface antigens or cell surface determinants
- A61K39/001124—CD20
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001102—Receptors, cell surface antigens or cell surface determinants
- A61K39/001126—CD38 not IgG
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001102—Receptors, cell surface antigens or cell surface determinants
- A61K39/001128—CD44 not IgG
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001102—Receptors, cell surface antigens or cell surface determinants
- A61K39/001129—Molecules with a "CD" designation not provided for elsewhere
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001148—Regulators of development
- A61K39/001149—Cell cycle regulated proteins, e.g. cyclin, CDC, CDK or INK-CCR
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001148—Regulators of development
- A61K39/00115—Apoptosis related proteins, e.g. survivin or livin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001152—Transcription factors, e.g. SOX or c-MYC
- A61K39/001153—Wilms tumor 1 [WT1]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001166—Adhesion molecules, e.g. NRCAM, EpCAM or cadherins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001166—Adhesion molecules, e.g. NRCAM, EpCAM or cadherins
- A61K39/001168—Mesothelin [MSLN]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001169—Tumor associated carbohydrates
- A61K39/00117—Mucins, e.g. MUC-1
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001169—Tumor associated carbohydrates
- A61K39/001171—Gangliosides, e.g. GM2, GD2 or GD3
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/00118—Cancer antigens from embryonic or fetal origin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/00118—Cancer antigens from embryonic or fetal origin
- A61K39/001182—Carcinoembryonic antigen [CEA]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001184—Cancer testis antigens, e.g. SSX, BAGE, GAGE or SAGE
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001184—Cancer testis antigens, e.g. SSX, BAGE, GAGE or SAGE
- A61K39/001186—MAGE
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001184—Cancer testis antigens, e.g. SSX, BAGE, GAGE or SAGE
- A61K39/001188—NY-ESO
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001184—Cancer testis antigens, e.g. SSX, BAGE, GAGE or SAGE
- A61K39/001189—PRAME
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/00119—Melanoma antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/00119—Melanoma antigens
- A61K39/001191—Melan-A/MART
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/00119—Melanoma antigens
- A61K39/001192—Glycoprotein 100 [Gp100]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001193—Prostate associated antigens e.g. Prostate stem cell antigen [PSCA]; Prostate carcinoma tumor antigen [PCTA]; PAP or PSGR
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001193—Prostate associated antigens e.g. Prostate stem cell antigen [PSCA]; Prostate carcinoma tumor antigen [PCTA]; PAP or PSGR
- A61K39/001195—Prostate specific membrane antigen [PSMA]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/461—Cellular immunotherapy characterised by the cell type used
- A61K39/4611—T-cells, e.g. tumor infiltrating lymphocytes [TIL], lymphokine-activated killer cells [LAK] or regulatory T cells [Treg]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/463—Cellular immunotherapy characterised by recombinant expression
- A61K39/4631—Chimeric Antigen Receptors [CAR]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/464—Cellular immunotherapy characterised by the antigen targeted or presented
- A61K39/4643—Vertebrate antigens
- A61K39/4644—Cancer antigens
- A61K39/464402—Receptors, cell surface antigens or cell surface determinants
- A61K39/464411—Immunoglobulin superfamily
- A61K39/464412—CD19 or B4
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0634—Cells from the blood or the immune system
- C12N5/0636—T lymphocytes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/515—Animal cells
- A61K2039/5156—Animal cells expressing foreign proteins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/515—Animal cells
- A61K2039/5158—Antigen-pulsed cells, e.g. T-cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/57—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2
- A61K2039/572—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2 cytotoxic response
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2239/00—Indexing codes associated with cellular immunotherapy of group A61K39/46
- A61K2239/31—Indexing codes associated with cellular immunotherapy of group A61K39/46 characterized by the route of administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2239/00—Indexing codes associated with cellular immunotherapy of group A61K39/46
- A61K2239/38—Indexing codes associated with cellular immunotherapy of group A61K39/46 characterised by the dose, timing or administration schedule
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2239/00—Indexing codes associated with cellular immunotherapy of group A61K39/46
- A61K2239/46—Indexing codes associated with cellular immunotherapy of group A61K39/46 characterised by the cancer treated
- A61K2239/48—Blood cells, e.g. leukemia or lymphoma
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/50—Cell markers; Cell surface determinants
- C12N2501/599—Cell markers; Cell surface determinants with CD designations not provided for elsewhere
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/70—Enzymes
- C12N2501/72—Transferases (EC 2.)
- C12N2501/727—Kinases (EC 2.7.)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2510/00—Genetically modified cells
Abstract
Description
本出願は、米国仮特許出願第62/417,312号(2016年11月3日出願、発明の名称「T細胞療法とBTK阻害剤との併用療法」)、米国仮特許出願第62/429,735号(2016年12月3日出願、発明の名称「T細胞療法とBTK阻害剤との併用療法」)、および米国仮特許出願第62/574,706号(2017年10月19日出願、発明の名称「T細胞療法とBTK阻害剤との併用療法」)の優先権を主張する(これらのそれぞれの内容がその全体における参照により組み入れられる)。
本出願は電子的フォーマットでの配列表と一緒に提出されている。配列表は、735042005240SeqList.TXT(2017年10月24日作成、サイズ:25,608バイト)と題されるファイルとして提供される。配列表の電子的フォーマットでの情報はその全体が参照により組み入れられる。
本開示は、いくつかの局面において、免疫療法、例えば養子細胞療法(例えばT細胞療法)などと、BTKまたはITKなどのTEKファミリーキナーゼの阻害剤とを伴う方法、組成物および使用に関する。提供された方法、組成物、および使用には、1つまたは複数のそのような阻害剤を、別の作用物質との併用で、例えばT細胞を標的とする免疫療法剤など、例えば治療用抗体、例えば多重特異性の(例えば、T細胞結合)抗体などおよび/または遺伝子操作されたT細胞(例えば、キメラ抗原受容体(CAR)発現T細胞など)などとの併用で、投与または使用することを伴う併用療法のためのものが含まれる。操作された細胞を製造する方法、細胞、組成物、対象への投与の方法、これらの方法において使用するための核酸、製造品、およびキットもまた提供される。いくつかの局面において、これらの方法および細胞の特徴により、養子細胞療法のためのT細胞、または免疫療法剤によって動員される内因性T細胞の増大したまたは改善された活性、効力、持続性、拡大、および/または増殖がもたらされる。
様々な戦略が免疫療法のために利用可能であり、例えば、操作されたT細胞を養子療法のために投与するために利用可能である。例えば、様々な戦略が、CARなどの遺伝子操作された抗原受容体を発現するT細胞を操作し、そのような細胞を含む組成物を対象に投与するために利用可能である。そのような必要性を満たす方法、細胞、組成物、キットおよびシステムが提供される。
1つまたは複数のT細胞または他の免疫細胞を動員することができる免疫療法または免疫療法剤(例えば、養子細胞療法(例えば、T細胞療法など)のための細胞(例えば、CAR発現T細胞)またはT細胞結合療法剤(例えば、二重特異性または多重特異性の作用物質または抗体など)を含む組成物など)を投与することに伴うT細胞活性の増殖および/または活性を強化するまたは調節する様々な方法が本明細書において提供される。いくつかの態様において、これらの方法は一般に、免疫療法または免疫療法剤(例えば、養子細胞療法(例えば、T細胞療法など)のための細胞(例えば、CAR発現T細胞)またはT細胞結合療法剤を含む組成物など)と、TECファミリーのキナーゼの阻害剤(例えば、Btk阻害剤(例えば、イブルチニブ)など)との併用療法を投与することを伴う。
1つまたは複数のT細胞または他の免疫細胞を動員することができる免疫療法または免疫療法剤(例えば、養子細胞療法(例えば、T細胞療法など)のための細胞(例えば、CAR発現T細胞)またはT細胞結合療法剤(例えば、二重特異性または多重特異性の作用物質または抗体など)を含む組成物など)を投与することに伴うT細胞活性の増殖および/または活性を強化するまたは調節する様々な方法が本明細書において提供される。いくつかの態様において、併用療法は、TECファミリーのキナーゼの阻害剤(例えば、BtK阻害剤(イブルチニブ)など)の投与と、免疫療法または免疫療法剤(例えば、養子細胞療法(例えば、T細胞療法など)のための細胞(例えば、CAR発現T細胞)またはT細胞結合療法剤を含む組成物など)の投与とを伴う。
本明細書において、T細胞の機能または活性を伴う免疫療法(例えば、T細胞療法など)と、TECファミリーキナーゼの阻害剤(例えば、ブルトン型チロシンキナーゼ(Btk)またはIL2誘導性T細胞キナーゼ(ITK)の阻害剤など、例えば、イブルチニブ)とを投与することを伴う併用療法が提供される。
本明細書において、1)TECファミリーキナーゼの阻害剤と、2)免疫療法または免疫療法剤、例えば、養子免疫細胞療法(例えば、T細胞療法(例えば、CAR発現細胞、例えば、T細胞))、またはT細胞結合療法もしくは免疫調節療法(例えば、多重特異性T細胞動員抗体および/またはチェックポイント阻害剤)などとの併用療法を対象に投与することを含む、疾患または障害(例えば、癌または増殖性疾患)を処置するための併用療法のための方法が提供される。いくつかの態様において、免疫療法は、疾患または障害(例えば、癌または増殖性疾患)に関連する抗原を特異的に認識するかつ/または標的とするT細胞を含む養子免疫細胞療法である。T細胞療法を含む組成物、および/またはTECファミリーキナーゼの阻害剤を含む組成物を含有する組み合わせおよび製造品(例えば、キットなど)、ならびに、癌を含めて様々な疾患、状態および障害を処置するかまたは防止するためのそのような組成物および組み合わせの使用もまた提供される。
本明細書で提供される方法、組成物、組み合わせ、キットおよび使用のいくつかの態様では、併用療法は、T細胞療法(例えばCAR発現T細胞)またはT細胞結合療法などの免疫療法を対象に投与することを含む。そのような療法は、記載されているように、1つまたは複数のTEKファミリーキナーゼの阻害剤の投与の前に、投与後に、投与と同時に投与することができる。
いくつかの態様では、免疫療法は、T細胞上に発現される表面分子に結合することができる結合分子であるかまたはそれを含むT細胞結合療法であるかまたはそれを含む。いくつかの態様では、表面分子は、T細胞受容体複合体の成分などのT細胞の活性化成分である。いくつかの態様では、表面分子はCD3またはCD2である。いくつかの態様では、T細胞結合療法は、抗体または抗原結合断片であるかまたはそれを含む。いくつかの態様では、T細胞結合療法は、T細胞の活性化成分(例えばT細胞表面分子、例えばCD3またはCD2)に結合する少なくとも1つの抗原結合ドメイン、および腫瘍細胞または癌細胞上の表面抗原、例えば本明細書に記載の列挙された抗原のいずれか、例えばCD19などの標的細胞上の表面抗原に結合する少なくとも1つの抗原結合ドメインを含む二重特異性抗体である。いくつかの態様では、そのような抗体のその両方の標的への同時またはほぼ同時の結合は、標的細胞とT細胞との間に一時的な相互作用をもたらすことができ、それによってT細胞の活性化、例えば細胞傷害活性およびその後の標的細胞の溶解をもたらす。そのような例示的な二重特異性抗体T細胞エンゲージャーの中には、柔軟なリンカーによって融合されたタンデムscFv分子を含む二重特異性T細胞エンゲージャー(BiTE)分子があり、これは、柔軟なリンカーによって融合されたタンデムscFv分子(例えばNagorsen and Bauerle,Exp Cell Res 317,1255-1260(2011)参照);例えば柔軟なリンカーを介して互いに融合された、安定に会合することができる第一および第二のサブユニットからなるFcドメインをさらに含むタンデムscFv分子(国際公開公報第2013026837号);ダイアボディおよびタンデムダイアボディを含むその誘導体(Holliger et al,Prot Eng 9,299-305(1996);Kipriyanov et al,J Mol Biol 293,41-66(1999));C末端ジスルフィド架橋を有するダイアボディ形式を含み得る二重親和性再標的指向性(DART)分子;または全ハイブリッドマウス/ラットIgG分子を含むトリオマブ(Seimetz et al,Cancer Treat Rev 36,458-467(2010))を含む。いくつかの態様では、T細胞結合療法は、ブリナツモマブまたはAMG330である。そのようなT細胞エンゲージャーのいずれもが、提供される方法において使用することができる。
いくつかの局面では、T細胞療法は、腫瘍浸潤リンパ球(TIL)療法、トランスジェニックTCR療法、または組換え受容体発現細胞療法などの遺伝子操作された細胞を含むT細胞療法であるかまたはそれを含む。いくつかの態様では、組換え受容体は、疾患または状態に関連するもの、例えば腫瘍または癌の細胞に関連するかまたはその細胞上に発現されるものなどのリガンドに特異的に結合する。いくつかの態様では、T細胞療法は、キメラ抗原受容体(CAR)を発現するように操作されたT細胞を投与することを含む。
いくつかの態様では、組換え抗原受容体、例えばCARまたはTCRで操作された細胞を含むT細胞療法などのT細胞療法の細胞の用量は、薬学的組成物または製剤などの組成物または製剤として提供される。そのような組成物は、疾患、状態、および障害の予防または治療などにおいて、提供される方法に従って使用することができる。
いくつかの態様では、細胞の用量は提供される併用療法に従って対象に投与される。いくつかの態様では、用量のサイズまたはタイミングは、対象における特定の疾患または状態の関数として決定される。提供される説明を考慮して特定の疾患についての用量のサイズまたはタイミングを経験的に決定することは、当業者のレベル範囲内である。
提供された併用療法方法、組成物、組み合わせ、キットおよび使用では、免疫療法剤または免疫療法(例えば、T細胞療法)の投与、例えば、キメラ抗原受容体(CAR)を発現するT細胞の投与に先立って、そのような投与に引き続いて、そのような投与の期間中に、そのような投与と同時もしくはほぼ同時に、そのような投与と逐次的に、かつ/またはそのような投与と断続的に投与され得るTECファミリーキナーゼの阻害剤の投与が伴う。
本明細書で提供される併用療法、組成物、組み合わせ、キットおよび使用のいくつかの態様では、併用療法は、1つまたは複数の組成物、例えばTECファミリーキナーゼの阻害剤、例えばBtk阻害剤、および/または細胞療法、例えばT細胞療法を含む薬学的組成物で投与することができる。
いくつかの態様において、提供された併用療法方法は、TECファミリーキナーゼの阻害剤(例えば、BTK阻害剤)の治療有効量と、細胞療法(例えば、T細胞療法(例えば、CAR発現T細胞)またはT細胞結合療法など)とを対象に投与することを伴う。いくつかの態様において、TECファミリーキナーゼの阻害剤(例えば、BTK阻害剤)は、細胞療法(例えば、T細胞療法(例えば、CAR発現T細胞)またはT細胞結合療法など)の投与に先立って、投与に引き続いて、投与の期間中に、投与の経過期間中に、投与と同時に、投与とほぼ同時に、投与と逐次的に、かつ/または投与と断続的に投与される。いくつかの態様において、方法は、TECファミリーキナーゼの阻害剤(例えば、BTK阻害剤)をT細胞療法の投与に先立って投与する工程を伴う。他の態様において、方法は、TECファミリーキナーゼの阻害剤(例えば、BTK阻害剤)をT細胞療法の投与後に投与することを伴う。いくつかの態様において、TECファミリーキナーゼの阻害剤(例えば、BTK阻害剤)は、T細胞療法の開始後にはさらに投与されない。いくつかの態様において、投薬スケジュールは、TECファミリーキナーゼの阻害剤(例えば、BTK阻害剤)をT細胞療法の開始前および開始後に投与することを含む。いくつかの態様において、投薬スケジュールは、TECファミリーキナーゼの阻害剤(例えば、BTK阻害剤)をT細胞療法の投与と同時に投与することを含む。
いくつかの局面において、提供された方法は、1つまたは複数のリンパ球枯渇療法を、例えば、免疫療法(例えば、T細胞療法(例えば、CAR発現T細胞)またはT細胞結合療法など)の投与の開始前または開始と同時などにおいて投与することをさらに含むことができる。いくつかの態様において、リンパ球枯渇療法は、ホスファミド(例えば、シクロホスファミドなど)を投与することを含む。いくつかの態様において、リンパ球枯渇療法は、フルダラビンを投与することを含むことができる。
いくつかの態様では、提供される併用療法の方法に従って使用するためのT細胞療法は、疾患または状態に関連する分子を認識し、および/またはそれに特異的に結合して、そのような分子への結合時にそのような分子に対する免疫応答などの応答をもたらすように設計された組換え受容体を発現する操作された細胞を投与することを含む。受容体は、キメラ受容体、例えばキメラ抗原受容体(CAR)、およびトランスジェニックT細胞受容体(TCR)を含む他のトランスジェニック抗原受容体を含み得る。
細胞は一般に、機能的非TCR抗原受容体を含む抗原受容体、例えばキメラ抗原受容体(CAR)、および他の抗原結合受容体、例えばトランスジェニックT細胞受容体(TCR)などの組換え受容体を発現する。受容体の中には他のキメラ受容体もある。
CARを含む例示的な抗原受容体、およびそのような受容体を操作し、細胞に導入するための方法は、例えば国際公開公報第200014257号、同第2013126726号、同第2012/129514号、同第2014031687号、同第2013/166321号、同第2013/071154号、同第2013/123061号、米国特許出願公開第2002131960号、同第2013287748号、同第20130149337号、米国特許第6,451,995号、同第7,446,190号、同第8,252,592号、同第8,339,645号、同第8,398,282号、同第7,446,179号、同第6,410,319号、同第7,070,995号、同第7,265,209号、同第7,354,762号、同第7,446,191号、同第8,324,353号、および同第8,479,118号、および欧州特許出願公開第2537416号に記載されているもの、ならびに/またはSadelain et al.,Cancer Discov.,3(4):388-398(2013);Davila et al.,PLoS ONE 8(4):e61338(2013);Turtle et al.,Curr.Opin.Immunol.,24(5):633-39(2012);Wu et al.,Cancer,18(2):160-75(2012)によって記載されているものを含む。いくつかの局面では、抗原受容体は、米国特許第7,446,190号に記載されているようなCAR、および国際公開公報第2014055668A1号に記載されているものを含む。CARの例としては、国際公開公報第2014031687号、米国特許第8,339,645号、同第7,446,179号、米国特許出願公開第2013/0149337号、米国特許第7,446,190号、同第8,389,282号、Kochenderfer et al.,Nature Reviews Clinical Oncology,10,267-276(2013);Wang et al.,J.Immunother.35(9):689-701(2012);およびBrentjens et al.,Sci Transl Med.5(177)(2013)などの前述の刊行物のいずれかに開示されているCARが挙げられる。国際公開公報第2014031687号、米国特許第8,339,645号、同第7,446,179号、米国特許出願公開第2013/0149337号、米国特許第7,446,190号、および米国特許第8,389,282号も参照のこと。CARなどのキメラ受容体は、一般に、抗体分子の一部などの細胞外抗原結合ドメイン、一般に抗体の可変重(VH)鎖領域および/または可変軽(VL)鎖領域、例えばscFv抗体断片を含む。
いくつかの態様では、腫瘍の抗原、ウイルスまたは自己免疫タンパク質などの標的ポリペプチドのペプチドエピトープまたはT細胞エピトープを認識するT細胞受容体(TCR)またはその抗原結合部分を発現する、T細胞などの操作された細胞が提供される。
いくつかの態様では、細胞および方法は、それぞれが同じかまたは異なる抗原を認識し、典型的にはそれぞれが異なる細胞内シグナル伝達成分を含む、細胞上の2つまたはそれ以上の遺伝子操作された受容体の発現などのマルチターゲティング戦略を含む。そのようなマルチターゲティング戦略は、例えば国際公開公報第2014055668A1号(例えば、オフターゲット細胞、例えば正常細胞上では個別に存在するが、治療される疾患または状態の細胞上でのみ一緒に存在する2つの異なる抗原を標的とする、活性化CARと共刺激CARとの組み合わせを記載する)、ならびにFedorov et al.,Sci.Transl.Medicine,5(215)(2013)(活性化CARが正常細胞または非罹患細胞、および治療される疾患または状態の細胞の両方で発現される1つの抗原に結合し、阻害性CARが正常細胞または治療されることが望ましくない細胞でのみ発現される別の抗原に結合するものなどの、活性化CARと阻害性CARを発現する細胞を記載する)に記載されている。
受容体を発現し、提供される方法によって投与される細胞の中には、操作された細胞がある。遺伝子操作は通常、レトロウイルス形質導入、トランスフェクション、または形質転換などによる、細胞を含む組成物への組換えまたは操作された成分をコードする核酸の導入を含む。
組換え受容体をコードする核酸分子の導入は、多くの公知のベクターのいずれかを使用して行わてもよい。そのようなベクターには、レンチウイルスおよびガンマレトロウイルスのシステム、同様にまた、トランスポゾンに基づくシステム(例えば、PiggyBacまたはSleeping Beautyに基づく遺伝子移入システムなど)を含めて、ウイルスシステムおよび非ウイルスシステムが含まれる。例示的な方法には、ウイルス(例えば、レトロウイルスまたはレンチウイルス)による形質導入、トランスポゾンおよびエレクトロポレーションによる方法を含めて、受容体をコードする核酸を移入するための様々な方法が含まれる。
本明細書において提供される方法、組成物、組み合わせ、キットおよび使用のいくつかの態様において、提供された併用療法は、下記において記載されるような1つまたは複数の処置成績(例えば、治療または処置に伴うパラメーターのいずれか1つまたは複数に関連する特徴など)を提供する。いくつかの態様において、併用療法は、対象を併用療法による処置のために、および/または併用療法を継続するために特定するための1つまたは複数のスクリーニング工程、ならびに/あるいは処置成績の評価および/または処置成績のモニタリングのための工程をさらに含むことができる。いくつかの態様において、処置成績を評価するための工程は、処置を評価および/またはモニターするための工程、ならびに/あるいは対象を治療のさらなる工程もしくは残りの工程の投与のためにおよび/または反復治療のために特定するための工程を含むことができる。いくつかの態様において、スクリーニング工程および/または処置成績の評価は、本明細書において提供される併用療法の用量、頻度、継続期間、時期および/または順序を決定するために使用することができる。
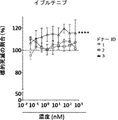
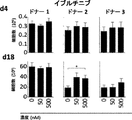
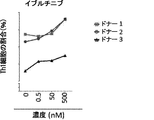
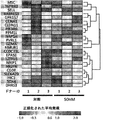
いくつかの態様において、スクリーニング工程ならびに/あるいは成績の処置の評価および/または処置成績のモニタリングのために評価され得るパラメーターを含む、治療または処置成績に関連するパラメーターには、T細胞、例えばT細胞に基づく治療のために投与されるT細胞の曝露、持続性および増殖があるかあるいは含まれる。いくつかの態様において、提供された方法、組成物、または製造品における細胞、例えば免疫療法、例えばT細胞療法のために投与される細胞の、増大した曝露、または長期にわたる拡大および/もしくは持続性、ならびに/あるいはそれらの細胞の細胞表現型または機能的活性における変化を、T細胞の特徴をインビトロまたはエクスビボで評価することによって測定することができる。いくつかの態様において、そのようなアッセイは、本明細書において提供される併用療法の1つまたは複数の工程を投与する前または投与した後において、免疫療法、例えばT細胞療法のために使用されるT細胞の機能を判定または確認するために使用することができる。
いくつかの態様では、スクリーニング工程および/または治療アウトカムの評価および/または治療アウトカムのモニタリングのために評価することができるパラメーターを含む、療法または治療アウトカムに関連するパラメーターは、T細胞の活性、表現型、増殖または機能の1つまたは複数を含む。いくつかの態様では、T細胞、例えばT細胞療法のために投与されるT細胞の活性、表現型、増殖および/または機能を評価するための当技術分野で公知のアッセイのいずれかを使用することができる。細胞ならびに/またはTECファミリーキナーゼの阻害剤の投与の前および/または後に、いくつかの態様では、操作された細胞集団の生物学的活性が、例えば多くの公知の方法のいずれかによって測定される。評価するパラメーターには、インビボで、例えばイメージングによって、またはエクスビボで、例えばELISAもしくはフローサイトメトリーによって、操作されたもしくは天然のT細胞または他の免疫細胞の抗原への特異的結合が含まれる。特定の態様では、操作された細胞が標的細胞を破壊する能力は、例えばKochenderfer et al.,J.Immunotherapy,32(7):689-702(2009)、およびHerman et al.,J.Immunological Methods,285(1):25-40(2004)に記載されている細胞毒性アッセイなどの、当技術分野で公知の任意の適切な方法を用いて測定することができる。特定の態様では、細胞の生物学的活性は、CD107a、IFNγ、IL-2、GM-CSFおよびTNFαなどの1つもしくは複数のサイトカインの発現および/もしくは分泌を検定することによって、ならびに/または細胞溶解活性を評価することによって測定される。
いくつかの態様において、スクリーニング工程ならびに/あるいは成績の処置の評価および/または処置成績のモニタリングのために評価され得るパラメーターを含む、治療または処置成績に関連するパラメーターには、腫瘍負荷または疾患負荷が含まれる。免疫療法(例えば、T細胞療法(例えば、CAR発現T細胞)またはT細胞結合療法など)および/またはTECファミリーキナーゼの阻害剤の投与は、対象における疾患または状態の拡大または負荷を軽減させるかまたは防止することができる。例えば、疾患または状態が腫瘍である場合、方法は一般には、腫瘍の大きさ、嵩、転移、骨髄における芽球の割合、または分子的に検出可能な癌を減少させるか、かつ/あるいは予後もしくは生存または腫瘍負荷量に関連する他の症状を改善する。
TECファミリーキナーゼの阻害剤、例えばBtk阻害剤、例えばイブルチニブと、免疫療法のための構成成分(例えば、抗体またはその抗原結合フラグメント)またはT細胞療法(例えば、操作された細胞)ならびに/あるいはその組成物とを含有する製造品もまた提供される。製造品は、容器と、容器表面の、または容器に付随するラベルまたは添付文書とを含む場合がある。好適な容器には、例えば、ボトル、バイアル、シリンジ、IV溶液バッグなどが含まれる。容器は様々な材料(例えば、ガラスまたはプラスチックなど)から形成されてもよい。容器はいくつかの態様において、単独での組成物、あるいは前記状態の治療、防止および/または診断のために効果的な別の組成物と組み合わされる組成物を保持する。いくつかの態様において、容器は無菌アクセスポートを有する。例示的な容器には、注射用ニードルによって突き刺すことができる栓を有するものを含めて、静脈内溶液バッグ、バイアル、あるいは、経口投与剤のためのボトルまたはバイアルが含まれる。ラベルまたは添付文書は、組成物を、疾患または状態を治療するために使用することを示す場合がある。
別途定義される場合を除き、本明細書において使用するすべての専門用語、表記法、ならびに他の技術用語および科学用語または用語法は、請求項に記載された主題が関係する技術分野の当業者によって一般に理解されるのと同じ意味を有することが意図される。いくつかの場合には、一般に理解されている意味を有する用語が、明快さのために、かつ/または即座の参照のために本明細書において定義されており、そして、そのような定義が本明細書に含まれることは、当技術分野において一般に理解されていることを超える実質的な違いを表すように必ずしも解釈されなければならないことはない。
以下の態様が提供される。
1.
(1)癌に関連する抗原、もしくは癌の細胞上に発現される抗原、もしくは癌の細胞上に存在する抗原、および/または、癌を特異的に標的としかつ対象に投与されたことがあるもしくは投与されることになる治療剤に含まれるタグを特異的に認識するかあるいは該抗原または該タグに特異的に結合するT細胞を、癌を有する対象に投与する工程、および
(2)該対象にTECファミリーキナーゼの阻害剤を投与する工程
を含む処置方法であって、
癌がB細胞悪性腫瘍でなく、B細胞白血病もしくはリンパ腫でなく、非血液癌であるか、または固形腫瘍であり、かつ/あるいは
抗原がB細胞抗原でなく、かつ/あるいは
抗原が、CD19、CD20、CD22およびROR1からなる群より選択されるB細胞抗原でない、
処置方法。
2.
癌に関連する抗原、もしくは癌の細胞上に発現される抗原、もしくは癌の細胞上に存在する抗原、および/または、癌を特異的に標的としかつ対象に投与されたことがあるもしくは投与されることになる治療剤に含まれるタグを特異的に認識するかあるいは該抗原または該タグに特異的に結合するT細胞を、癌を有する対象に投与する工程
を含む、処置方法であって、
該対象が、TECファミリーキナーゼの阻害剤を投与されたことがあり、
癌がB細胞悪性腫瘍でなく、B細胞白血病もしくはリンパ腫でなく、非血液癌であるか、または固形腫瘍であり、かつ/あるいは
抗原がB細胞抗原でなく、かつ/あるいは
抗原が、CD19、CD20、CD22およびROR1からなる群より選択されるB細胞抗原でない、
処置方法。
3.
癌を有する対象にTECファミリーキナーゼの阻害剤を投与する工程を含む処置方法であって、
該対象が、疾患もしくは状態に関連する抗原、または疾患もしくは状態の細胞上に発現される抗原、または疾患もしくは状態の細胞上に存在する抗原、および/または、癌を特異的に標的としかつ対象に投与されたことがあるもしくは投与されることになる治療剤に含まれるタグを特異的に認識するかあるいは該抗原または該タグに特異的に結合するT細胞を投与されたことがあり、
癌がB細胞悪性腫瘍でなく、B細胞白血病もしくはリンパ腫でなく、非血液癌であるか、または固形腫瘍であり、かつ/あるいは
抗原がB細胞抗原でなく、かつ/あるいは
抗原が、CD19、CD20、CD22およびROR1からなる群より選択されるB細胞抗原でない、
処置方法。
4.
抗原が、CD19、CD20、CD22およびROR1からなる群より選択されるB細胞抗原でなく、かつ/または
癌が、CD19、CD20、CD22およびROR1からなる群より選択されるB細胞抗原ならびに/あるいはカッパ軽鎖を発現しない、態様1〜3のいずれかの方法。
5.
癌がCD19を発現せず、細胞によって特異的に認識されるかまたは標的とされる抗原がCD19でなく、かつ/あるいは、T細胞が、CD19に特異的に結合する組換え受容体を含まず、かつ/または、T細胞が、抗CD19抗原結合ドメインを含まないキメラ抗原受容体(CAR)を含む、態様1〜4のいずれかの方法。
6.
細胞によって特異的に認識されるかまたは標的とされる抗原が、Her2、L1-CAM、メソテリン、CEA、B型肝炎表面抗原、抗葉酸受容体、CD23、CD24、CD38、CD44、EGFR、EGP-2、EGP-4、EPHa2、ErbB2、3もしくは4、erbB二量体、EGFR vIII、FBP、FCRL5、FCRH5、胎児アセチルコリンe受容体、GD2、GD3、HMW-MAA、IL-22R-アルファ、IL-13R-アルファ2、kdr、Lewis Y、L1-細胞接着分子(L1-CAM)、メラノーマ関連抗原(MAGEMAGE-A1、MAGE-A3、MAGE-A6、メラノーマの優先的発現抗原(PRAME)、サバイビン、EGP2、EGP40、TAG72、B7-H6、IL-13受容体a2(IL-13Ra2)、CA9、GD3、HMW-MAA、CD171、G250/CAIX、HLA-AI MAGE Al、HLA-A2 NY-ESO-1、PSCA、葉酸受容体-a、CD44v6、CD44v7/8、avb6インテグリン、8H9、NCAM、VEGF受容体、5T4、胎児AchR、NKG2Dリガンド、CD44v6、二重抗原、およびユニバーサルタグに関連する抗原、癌精巣抗原、メソテリン、MUC1、MUC16、PSCA、NKG2Dリガンド、NY-ESO-1、MART-1、gp100、Gタンパク質共役受容体5D(GPCR5D)、腫瘍胎児性抗原、TAG72、VEGF-R2、癌胎児性抗原(CEA)、前立腺特異的抗原、PSMA、エストロゲン受容体、プロゲステロン受容体、エフリンB2、CD123、c-Met、GD-2 O-アセチル化GD2(OGD2)、CE7、ウィルムス腫瘍1(WT-1)、サイクリン、サイクリンA2、CCL-1、CD138、ならびに病原体特異的抗原の中から選択される、態様1〜5のいずれかの方法。
7.
(1)癌に関連する抗原を特異的に認識するかまたは該抗原と特異的に結合するT細胞を、癌を有する対象に投与する工程であって、該抗原が、B細胞成熟抗原(BCMA)、Her2、L1-CAM、メソテリン、CEA、B型肝炎表面抗原、抗葉酸受容体、CD23、CD24、CD30、CD33、CD38、CD44、EGFR、EGP-2、EGP-4、EPHa2、ErbB2、3もしくは4、erbB二量体、EGFR vIII、FBP、FCRL5、FCRH5、胎児アセチルコリンe受容体、GD2、GD3、HMW-MAA、IL-22R-アルファ、IL-13R-アルファ2、kdr、カッパ軽鎖、Lewis Y、L1-細胞接着分子(L1-CAM)、メラノーマ関連抗原(MAGE)-A1、MAGE-A3、MAGE-A6、メラノーマの優先的発現抗原(PRAME)、サバイビン、EGP2、EGP40、TAG72、B7-H6、IL-13受容体a2(IL-13Ra2)、CA9、GD3、HMW-MAA、CD171、G250/CAIX、HLA-AI MAGE Al、HLA-A2 NY-ESO-1、PSCA、葉酸受容体-a、CD44v6、CD44v7/8、avb6インテグリン、8H9、NCAM、VEGF受容体、5T4、胎児AchR、NKG2Dリガンド、CD44v6、二重抗原、およびユニバーサルタグに関連する抗原、癌精巣抗原、メソテリン、MUC1、MUC16、PSCA、NKG2Dリガンド、NY-ESO-1、MART-1、gp100、Gタンパク質共役受容体5D(GPCR5D)、腫瘍胎児性抗原、TAG72、VEGF-R2、癌胎児性抗原(CEA)、前立腺特異的抗原、PSMA、エストロゲン受容体、プロゲステロン受容体、エフリンB2、CD123、c-Met、GD-2、O-アセチル化GD2(OGD2)、CE7、ウィルムス腫瘍1(WT-1)、サイクリン、サイクリンA2、CCL-1、CD138、ならびに病原体特異的抗原から選択される、工程、および
(2)該対象にTECファミリーキナーゼの阻害剤を投与する工程
を含む、処置方法。
8.
癌に関連する抗原を特異的に認識するかまたは該抗原と特異的に結合するT細胞を、癌を有する対象に投与する工程であって、該抗原が、B細胞成熟抗原(BCMA)、Her2、L1-CAM、メソテリン、CEA、B型肝炎表面抗原、抗葉酸受容体、CD23、CD24、CD30、CD33、CD38、CD44、EGFR、EGP-2、EGP-4、EPHa2、ErbB2、3もしくは4、erbB二量体、EGFR vIII、FBP、FCRL5、FCRH5、胎児アセチルコリンe受容体、GD2、GD3、HMW-MAA、IL-22R-アルファ、IL-13R-アルファ2、kdr、カッパ軽鎖、Lewis Y、L1-細胞接着分子(L1-CAM)、メラノーマ関連抗原(MAGE)-A1、MAGE-A3、MAGE-A6、メラノーマの優先的発現抗原(PRAME)、サバイビン、EGP2、EGP40、TAG72、B7-H6、IL-13受容体a2(IL-13Ra2)、CA9、GD3、HMW-MAA、CD171、G250/CAIX、HLA-AI MAGE Al、HLA-A2 NY-ESO-1、PSCA、葉酸受容体-a、CD44v6、CD44v7/8、avb6インテグリン、8H9、NCAM、VEGF受容体、5T4、胎児AchR、NKG2Dリガンド、CD44v6、二重抗原、およびユニバーサルタグに関連する抗原、癌精巣抗原、メソテリン、MUC1、MUC16、PSCA、NKG2Dリガンド、NY-ESO-1、MART-1、gp100、Gタンパク質共役受容体5D(GPCR5D)、腫瘍胎児性抗原、TAG72、VEGF-R2、癌胎児性抗原(CEA)、前立腺特異的抗原、PSMA、エストロゲン受容体、プロゲステロン受容体、エフリンB2、CD123、c-Met、GD-2、O-アセチル化GD2(OGD2)、CE7、ウィルムス腫瘍1(WT-1)、サイクリン、サイクリンA2、CCL-1、CD138、ならびに病原体特異的抗原から選択される、工程
を含み、該対象が、TECファミリーキナーゼの阻害剤を投与されたことがある、処置方法。
9.
癌を有する対象にTECファミリーキナーゼの阻害剤を投与する工程を含む処置方法であって、
該対象が、癌に関連する抗原を特異的に認識するかまたは該抗原と特異的に結合するT細胞を投与されたことがあり、
該抗原が、B細胞成熟抗原(BCMA)、Her2、L1-CAM、メソテリン、CEA、B型肝炎表面抗原、抗葉酸受容体、CD23、CD24、CD30、CD33、CD38、CD44、EGFR、EGP-2、EGP-4、EPHa2、ErbB2、3もしくは4、erbB二量体、EGFR vIII、FBP、FCRL5、FCRH5、胎児アセチルコリンe受容体、GD2、GD3、HMW-MAA、IL-22R-アルファ、IL-13R-アルファ2、kdr、カッパ軽鎖、Lewis Y、L1-細胞接着分子(L1-CAM)、メラノーマ関連抗原(MAGE)-A1、MAGE-A3、MAGE-A6、メラノーマの優先的発現抗原(PRAME)、サバイビン、EGP2、EGP40、TAG72、B7-H6、IL-13受容体a2(IL-13Ra2)、CA9、GD3、HMW-MAA、CD171、G250/CAIX、HLA-AI MAGE Al、HLA-A2 NY-ESO-1、PSCA、葉酸受容体-a、CD44v6、CD44v7/8、avb6インテグリン、8H9、NCAM、VEGF受容体、5T4、胎児AchR、NKG2Dリガンド、CD44v6、二重抗原、およびユニバーサルタグに関連する抗原、癌精巣抗原、メソテリン、MUC1、MUC16、PSCA、NKG2Dリガンド、NY-ESO-1、MART-1、gp100、Gタンパク質共役受容体5D(GPCR5D)、腫瘍胎児性抗原、TAG72、VEGF-R2、癌胎児性抗原(CEA)、前立腺特異的抗原、PSMA、エストロゲン受容体、プロゲステロン受容体、エフリンB2、CD123、c-Met、GD-2、O-アセチル化GD2(OGD2)、CE7、ウィルムス腫瘍1(WT-1)、サイクリン、サイクリンA2、CCL-1、CD138、ならびに病原体特異的抗原から選択される、処置方法。
10.
前記抗原が、ウイルス抗原、細菌抗原、または寄生虫抗原である病原体特異的抗原である、態様6〜9のいずれかの方法。
11.
(1)癌に関連する抗原、もしくは癌の細胞上に発現される抗原、もしくは癌の細胞上に存在する抗原、および/または、癌を特異的に標的としかつ対象に投与されたことがあるもしくは投与されることになる治療剤に含まれるタグを特異的に認識するかあるいは該抗原または該タグと特異的に結合するT細胞を含む組成物を、癌を有する対象に投与する工程、および
(2)該対象にTECファミリーキナーゼの阻害剤を投与する工程
を含む処置方法であって、
(i)該対象および/または癌は、(a)ブルトン型チロシンキナーゼ(BTK)の阻害に対して抵抗性であり、かつ/または(b)該阻害剤による阻害に対して抵抗性である細胞の集団を含む、
(ii)該対象および/または癌は、BTKをコードする核酸における変異を含み、任意で変異は、該阻害剤によるおよび/またはイブルチニブによるBTKの阻害を低減させるかまたは防止することができ、任意で変異はC481Sである、
(iii)該対象および/または癌は、ホスホリパーゼCガンマ2(PLCガンマ2)をコードする核酸における変異を含み、任意で変異は構成的なシグナル伝達活性を生じさせ、任意で変異はR665WまたはL845Fである、
(iv)(1)における投与開始時および(2)における投与開始時において、該対象は、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置の後での寛解の後で再発しており、または、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置に対して難治性であるとみなされている、
(v)(1)における投与開始時および(2)における投与開始時において、該対象は、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置の後で進行しており、任意で該対象は、以前の処置に対する最良の応答として進行性疾患を、または以前の処置に対する以前の応答の後で進行を示した、ならびに/あるいは
(vi)(1)における投与開始時および(2)における投与開始時において、該対象は、完全奏功(CR)に達しない応答を、該阻害剤によるおよび/もしくはBTK阻害剤療法による少なくとも6ヶ月にわたる以前の処置の後で示した、
処置方法。
12.
癌に関連する抗原、もしくは癌の細胞上に発現される抗原、もしくは癌の細胞上に存在する抗原、および/または、癌を特異的に標的としかつ対象に投与されたことがあるもしくは投与されることになる治療剤に含まれるタグを特異的に認識するかあるいは該抗原または該タグと特異的に結合するT細胞を含む組成物を、癌を有する対象に投与する工程を含む、処置方法であって、
該対象が、T細胞を含む組成物の投与との併用療法における使用のために、TECファミリーキナーゼの阻害剤を投与されたことがあり、
(i)該対象および/または癌は、(a)ブルトン型チロシンキナーゼ(BTK)の阻害に対して抵抗性であり、かつ/または(b)該阻害剤による阻害に対して抵抗性である細胞の集団を含む、
(ii)該対象および/または癌は、BTKをコードする核酸における変異を含み、任意で変異は、該阻害剤によるおよび/またはイブルチニブによるBTKの阻害を低減させるかまたは防止することができ、任意で変異はC481Sである、
(iii)該対象および/または癌は、ホスホリパーゼCガンマ2(PLCガンマ2)をコードする核酸における変異を含み、任意で変異は構成的なシグナル伝達活性を生じさせ、任意で変異はR665WまたはL845Fである、
(iv)TECファミリーキナーゼの阻害剤の投与開始時およびT細胞を含む組成物の投与開始時において、該対象は、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置の後での寛解の後で再発しており、または、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置に対して難治性であるとみなされている、
(v)TECファミリーキナーゼの阻害剤の投与開始時およびT細胞を含む組成物の投与開始時において、該対象は、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置の後で進行しており、任意で該対象は、以前の処置に対する最良の応答として進行性疾患を、または以前の処置に対する以前の応答の後で進行を示した、ならびに/あるいは
(vi)TECファミリーキナーゼの阻害剤の投与開始時およびT細胞を含む組成物の投与開始時において、該対象は、完全奏功(CR)に達しない応答を、該阻害剤によるおよび/もしくはBTK阻害剤療法による少なくとも6ヶ月にわたる以前の処置の後で示した、
処置方法。
13.
癌を有する対象にTECファミリーキナーゼの阻害剤を投与する工程を含む処置方法であって、
該対象が、癌に関連する抗原、もしくは癌の細胞上に発現される抗原、もしくは癌の細胞上に存在する抗原、および/または、癌を特異的に標的としかつ該対象に投与されたことがあるもしくは投与されることになる治療剤に含まれるタグを特異的に認識するかあるいは該抗原または該タグと特異的に結合するT細胞を含む組成物を投与されたことがあり、
(i)該対象および/または癌は、(a)ブルトン型チロシンキナーゼ(BTK)の阻害に対して抵抗性であり、かつ/または(b)該阻害剤による阻害に対して抵抗性である細胞の集団を含む、
(ii)該対象および/または癌は、BTKをコードする核酸における変異を含み、任意で変異は、該阻害剤によるおよび/またはイブルチニブによるBTKの阻害を低減させるかまたは防止することができ、任意で変異はC481Sである、
(iii)該対象および/または癌は、ホスホリパーゼCガンマ2(PLCガンマ2)をコードする核酸における変異を含み、任意で変異は構成的なシグナル伝達活性を生じさせ、任意で変異はR665WまたはL845Fである、
(iv)T細胞を含む組成物の投与開始時およびTECファミリーキナーゼの阻害剤の投与開始時において、該対象は、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置の後での寛解の後で再発しており、または、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置に対して難治性であるとみなされている、
(v)T細胞を含む組成物の投与開始時およびTECファミリーキナーゼの阻害剤の投与開始時において、該対象は、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置の後で進行しており、任意で該対象は、以前の処置に対する最良の応答として進行性疾患を、または以前の処置に対する以前の応答の後で進行を示した、ならびに/あるいは
(vi)T細胞を含む組成物の投与開始時およびTECファミリーキナーゼの阻害剤の投与開始時において、該対象は、完全奏功(CR)に達しない応答を、該阻害剤によるおよび/もしくはBTK阻害剤療法による少なくとも6ヶ月にわたる以前の処置の後で示した、
処置方法。
14.
細胞の集団が、B細胞の集団であるかもしくはB細胞の集団を含み、かつ/またはT細胞を含まない、態様11〜13のいずれかの方法。
15.
T細胞が、腫瘍浸潤リンパ球(TIL)を含むか、または抗原に特異的に結合する組換え受容体を発現する遺伝子操作されたT細胞を含む、態様1〜14のいずれかの方法。
16.
T細胞が、抗原に特異的に結合する組換え受容体を発現する遺伝子操作されたT細胞を含み、そのような受容体が任意でキメラ抗原受容体である、態様15の方法。
17.
(1)対象に対して自家であり、かつ
癌に関連する抗原に、および/または、癌を特異的に標的としかつ対象に投与されたことがあるもしくは投与されることになる治療剤に含まれるタグに、特異的に結合する組換え受容体を発現する
T細胞を含む組成物を、癌を有する対象に投与する工程、および
(2)該対象にTECファミリーキナーゼの阻害剤を投与する工程
を含む処置方法であって、
複数回の抗原特異的刺激の後でのインビトロアッセイにおいて、組換え受容体を発現するように操作されていない対象由来のT細胞および/または自家T細胞が、T細胞の参照集団または参照レベルもしくは閾値レベルと比較して、T細胞の機能、健康状態、もしくは活性を示す因子の低下したレベルを示すかまたは示すことが認められている、
処置方法。
18.
対象に対して自家であり、かつ
癌に関連する抗原に、および/または、癌を特異的に標的としかつ対象に投与されたことがあるもしくは投与されることになる治療剤に含まれるタグに、特異的に結合する組換え受容体を発現する
T細胞を含む組成物を、癌を有する対象に投与する工程を含む、処置方法であって、
該対象が、TECファミリーキナーゼの阻害剤を投与されたことがあり、
複数回の抗原特異的刺激の後でのインビトロアッセイにおいて、組換え受容体を発現するように操作されていない対象由来のT細胞および/または自家T細胞が、T細胞の参照集団または参照レベルもしくは閾値レベルと比較して、T細胞の機能、健康状態、もしくは活性を示す因子の低下したレベルを示すかまたは示すことが認められている、
処置方法。
19.
癌を有する対象にTECファミリーキナーゼの阻害剤を投与する工程を含む処置方法であって、
該対象が、
該対象に対して自家であり、かつ
癌に関連する抗原に、および/または、癌を特異的に標的としかつ該対象に投与されたことがあるもしくは投与されることになる治療剤に含まれるタグに、特異的に結合する組換え受容体を発現する
T細胞を、投与されたことがあり、
複数回の抗原特異的刺激の後でのインビトロアッセイにおいて、組換え受容体を発現するように操作されていない対象由来のT細胞および/または自家T細胞が、T細胞の参照集団または参照レベルもしくは閾値レベルと比較して、T細胞の機能、健康状態、もしくは活性を示す因子の低下したレベルを示すかまたは示すことが認められている、
処置方法。
20.
T細胞の参照集団が、癌を有しないまたは癌を有することが疑われない対象の血液由来のT細胞の集団であり、
参照値または閾値が、同じインビトロアッセイで測定されるような、癌を有しないまたは癌を有することが疑われない対象の血液由来のT細胞の集団について認められる平均値であるか、あるいは、
参照値または閾値は、同じインビトロアッセイで測定されるような、癌を有する他の対象の血液由来のT細胞の集団について認められる平均値である、
態様17〜19のいずれかの方法。
21.
前記因子が、細胞増殖、細胞生存、抗原特異的細胞傷害性、および/もしくはサイトカイン分泌の程度であるか、またはそれらを含む、態様17〜20のいずれかの方法。
22.
前記因子のレベルが、ただ1回の刺激および/または前記複数よりも少ない回数の刺激の後で評価されたとき、同じアッセイにおいて、参照集団または参照レベルと比較して低下していない、態様17〜21のいずれかの方法。
23.
複数回の刺激が、少なくとも3回、4回、もしくは5回を含み、かつ/または、少なくとも10日、11日、12日、13日、14日、15日、16日、17日、18日、19日、20日、21日、22日、23日、24日、もしくは25日の期間にわたって行われる、態様17〜22のいずれかの方法。
24.
組換え受容体が、トランスジェニックT細胞受容体(TCR)または機能的な非T細胞受容体である、態様16〜23のいずれかの方法。
25.
組換え受容体が、任意でキメラ抗原受容体(CAR)であるキメラ受容体である、態様16〜24のいずれかの方法。
26.
(1)癌を有する対象に、任意でキメラ抗原受容体(CAR)であるキメラ受容体を発現する細胞を含む組成物を投与する工程であって、該受容体が、CD19、CD20、CD22もしくはROR1でない癌に関連する抗原に特異的に結合し、および/または癌を特異的に標的としかつ対象に投与されたことがあるもしくは投与されることになる治療剤に含まれるタグに特異的に結合する、工程、および
(2)該対象にTECファミリーキナーゼの阻害剤を投与する工程
を含む処置方法。
27.
癌を有する対象に、任意でキメラ抗原受容体(CAR)であるキメラ受容体を発現する細胞を含む組成物を投与する工程を含む、処置方法であって、
該受容体が、CD19、CD20、CD22もしくはROR1でない癌に関連する抗原に特異的に結合し、および/または癌を特異的に標的としかつ対象に投与されたことがあるもしくは投与されることになる治療剤に含まれるタグに特異的に結合し、
該対象が、TECファミリーキナーゼの阻害剤を投与されたことがある、
処置方法。
28.
癌を有する対象にTECファミリーキナーゼの阻害剤を投与する工程を含む、処置方法であって、
該対象が、任意でキメラ抗原受容体(CAR)であるキメラ受容体を発現する細胞を含む組成物を投与されたことがあり、
該受容体が、CD19、CD20、CD22もしくはROR1でない癌に関連する抗原に特異的に結合し、および/または癌を特異的に標的としかつ対象に投与されたことがあるもしくは投与されることになる治療剤に含まれるタグに特異的に結合する、
処置方法。
29.
キメラ抗原受容体(CAR)が、前記抗原に特異的に結合する細胞外の抗原認識ドメインと、ITAMを含む細胞内のシグナル伝達ドメインとを含む、態様26〜29のいずれかの方法。
30.
細胞内のシグナル伝達ドメインがCD3ゼータ(CD3ζ)鎖の細胞内ドメインを含む、態様29の方法。
31.
キメラ抗原受容体(CAR)が共刺激性のシグナル伝達領域をさらに含む、態様29または態様30の方法。
32.
共刺激性のシグナル伝達領域がCD28または4-1BBのシグナル伝達ドメインを含む、態様31の方法。
33.
共刺激性ドメインがCD28のドメインである、態様31または態様32の方法。
34.
(1)癌を有する対象に、任意でキメラ抗原受容体であるキメラ受容体を発現する細胞を含む組成物を投与する工程であって、キメラ受容体が、抗体またはその抗原結合フラグメントを含む細胞外ドメイン;ヒトCD28の膜貫通部分であるかまたはそれを含有する膜貫通ドメイン;およびヒト4-1BBまたはヒトCD28のシグナル伝達ドメインとヒトCD3ゼータのシグナル伝達ドメインとを含む細胞内のシグナル伝達ドメインを含む、工程、および
(2)該対象にTECファミリーキナーゼの阻害剤を投与する工程
を含む、癌を処置する方法。
35.
癌がB細胞悪性腫瘍である、態様7〜34のいずれかの方法。
36.
B細胞悪性腫瘍が、白血病、リンパ腫または骨髄腫である、態様35の方法。
37.
B細胞悪性腫瘍が、急性リンパ芽球性白血病(ALL)、成人ALL、慢性リンパ芽球性白血病(CLL)、小リンパ球性白血病(SLL)、非ホジキンリンパ腫(NHL)、びまん性大細胞型B細胞リンパ腫(DLBCL)、または急性骨髄性白血病(AML)である、態様35または態様36の方法。
38.
B細胞悪性腫瘍がCLLまたはSLLである、態様35〜37のいずれかの方法。
39.
T細胞を含む組成物の投与の開始時または開始前、およびTECファミリーキナーゼの阻害剤の投与の開始時または開始前において、前記対象が、
(i)任意で少なくとも1つの細胞遺伝学的異常が17p欠失である、1つまたは複数の細胞遺伝学的異常、任意で少なくとも2つまたは3つの細胞遺伝学的異常、
(ii)TP53変異、および/または
(iii)変異していない免疫グロブリン重鎖可変領域(IGHV)
を有するB細胞悪性腫瘍を有するかあるいは有するとして特定される、態様35〜37のいずれかの方法。
40.
T細胞を含む組成物の投与の開始時または開始前、およびTECファミリーキナーゼの阻害剤の投与の開始時または開始前において、前記対象が、B細胞悪性腫瘍を処置するための1つまたは複数の先行療法、任意で組換え受容体を発現する細胞の別の用量とは異なる1つ、2つ、または3つの先行療法による処置に失敗しているか、あるいはそのような先行療法による処置後の寛解の後で再発しているか、あるいはそのような先行療法に対して難治性になっており、任意で少なくとも1つの先行療法が、該阻害剤またはBTK阻害剤療法による以前の処置であった、態様35〜39のいずれかの方法。
41.
以前の処置がイブルチニブによる以前の処置であった、態様11〜40のいずれかの方法。
42.
癌が、B細胞抗原を発現する癌でなく、非血液癌であり、B細胞悪性腫瘍でなく、B細胞白血病でなく、または固形腫瘍である、態様7〜34のいずれかの方法。
43.
癌が、肉腫、癌腫、リンパ腫、白血病、または骨髄腫であり、任意で癌が、非ホジキンリンパ腫(NHL)、びまん性大細胞型B細胞リンパ腫(DLBCL)、CLL、SLL、ALL、またはAMLである、態様1〜34および42のいずれかの方法。
44.
癌が、膵臓癌、膀胱癌、結腸直腸癌、乳癌、前立腺癌、腎臓癌、肝細胞癌、肺癌、卵巣癌、子宮頸癌、膵臓癌、直腸癌、甲状腺癌、子宮癌、胃癌、食道癌、頭頸部癌、メラノーマ、神経内分泌癌、CNS癌、脳腫瘍、骨癌、または軟部組織肉腫である、態様1〜34、42および43のいずれかの方法。
45.
(i)対象および/または癌が、(a)ブルトン型チロシンキナーゼ(BTK)の阻害に対して抵抗性であり、かつ/または(b)該阻害剤による阻害に対して抵抗性である細胞の集団を含む、
(ii)対象および/または癌が、BTKをコードする核酸における変異を含み、任意で変異は、該阻害剤によるおよび/またはイブルチニブによるBTKの阻害を低減させるかまたは防止することができ、任意で変異はC481Sである、
(iii)対象および/または癌が、ホスホリパーゼCガンマ2(PLCガンマ2)をコードする核酸における変異を含み、任意で変異は構成的なシグナル伝達活性を生じさせ、任意で変異はR665WまたはL845Fである、
(iv)TECファミリーキナーゼの阻害剤の投与開始時およびT細胞を含む組成物の投与開始時において、対象が、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置の後での寛解の後で再発しており、または、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置に対して難治性であるとみなされている、
(v)TECファミリーキナーゼの阻害剤の投与開始時およびT細胞を含む組成物の投与開始時において、対象が、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置の後で進行しており、任意で対象は、以前の処置に対する最良の応答として進行性疾患を、または以前の処置に対する以前の応答の後で進行を示した、ならびに/あるいは
(vi)TECファミリーキナーゼの阻害剤の投与開始時およびT細胞を含む組成物の投与開始時において、対象が、完全奏功(CR)に達しない応答を、該阻害剤によるおよび/もしくはBTK阻害剤療法による少なくとも6ヶ月にわたる以前の処置の後で示した、
態様1〜10および17〜44のいずれかの方法。
46.
細胞の集団が、B細胞の集団であるかもしくはB細胞の集団を含み、かつ/またはT細胞を含まない、態様45の方法。
47.
BTKをコードする核酸における変異が、位置C481における置換、任意でC481SまたはC481R、および/または位置T474における置換、任意でT474IまたはT474Mを含む、態様11〜14および態様45〜46のいずれかの方法。
48.
T細胞が、ROR1、B細胞成熟抗原(BCMA)、tEGFR、Her2、L1-CAM、CD19、CD20、CD22、メソテリン、CEA、およびB型肝炎表面抗原、抗葉酸受容体、CD23、CD24、CD30、CD33、CD38、CD44、EGFR、EGP-2、EGP-4、EPHa2、ErbB2、3もしくは4、erbB二量体、EGFR vIII、FBP、FCRL5、FCRH5、胎児アセチルコリンe受容体、GD2、GD3、HMW-MAA、IL-22R-アルファ、IL-13R-アルファ2、kdr、カッパ軽鎖、Lewis Y、L1-細胞接着分子(L1-CAM)、メラノーマ関連抗原(MAGE)-A1、MAGE-A3、MAGE-A6、メラノーマの優先的発現抗原(PRAME)、サバイビン、EGP2、EGP40、TAG72、B7-H6、IL-13受容体a2(IL-13Ra2)、CA9、GD3、HMW-MAA、CD171、G250/CAIX、HLA-AI MAGE Al、HLA-A2 NY-ESO-1、PSCA、葉酸受容体-a、CD44v6、CD44v7/8、avb6インテグリン、8H9、NCAM、VEGF受容体、5T4、胎児AchR、NKG2Dリガンド、CD44v6、二重抗原、およびユニバーサルタグに関連する抗原、癌精巣抗原、メソテリン、MUC1、MUC16、PSCA、NKG2Dリガンド、NY-ESO-1、MART-1、gp100、Gタンパク質共役受容体5D(GPCR5D)、腫瘍胎児性抗原、ROR1、TAG72、VEGF-R2、癌胎児性抗原(CEA)、前立腺特異的抗原、PSMA、Her2/neu、エストロゲン受容体、プロゲステロン受容体、エフリンB2、CD123、c-Met、GD-2、O-アセチル化GD2(OGD2)、CE7、ウィルムス腫瘍1(WT-1)、サイクリン、サイクリンA2、CCL-1、CD138、ならびに病原体特異的抗原から選択される抗原を認識するかまたは標的とする、態様11〜47のいずれかの方法。
49.
前記阻害剤が1つまたは複数のチロシンキナーゼを阻害し、該チロシンキナーゼのそれぞれが個々に、ブルトン型チロシンキナーゼ(Btk)、IL2誘導性T細胞キナーゼ(ITK)、肝細胞癌において発現されるチロシンキナーゼ(TEC)、染色体Xに対するチロシンキナーゼ骨髄キナーゼ(BMX)、およびT細胞X染色体キナーゼ(TXK;休止期リンパ球キナーゼ、RLK)からなる群より選択される、ならびに/あるいは
TECファミリーキナーゼが、ブルトン型チロシンキナーゼ(Btk)、IL2誘導性T細胞キナーゼ(ITK)、肝細胞癌において発現されるチロシンキナーゼ(TEC)、染色体Xに対するチロシンキナーゼ骨髄キナーゼ(BMX)、およびT細胞X染色体キナーゼ(TXK;休止期リンパ球キナーゼ、RLK)からなる群より選択される1つまたは複数のTECファミリーキナーゼを含む、ならびに/あるいは
TECファミリーキナーゼがBtkであるかまたはBtkを含む、
態様1〜48のいずれかの方法。
50.
前記阻害剤が、ITKを阻害するか、あるいは1000 nM未満もしくは約1000 nM未満、900 nM未満もしくは約900 nM未満、800 nM未満もしくは約800 nM未満、600 nM未満もしくは約600 nM未満、500 nM未満もしくは約500 nM未満、400 nM未満もしくは約400 nM未満、300 nM未満もしくは約300 nM未満、200 nM未満もしくは約200 nM未満、100 nM未満もしくは約100 nM未満、またはそれ以下の半数阻害濃度(IC50)でITKを阻害する、態様1〜49のいずれかの方法。
51.
TECファミリーキナーゼが癌の細胞によって発現されず、通常の場合、癌が由来する細胞において発現されないかまたは発現されることが疑われない、ならびに/あるいは
癌が前記阻害剤に対して感受性でない、ならびに/あるいは
少なくとも複数のT細胞がTECファミリーキナーゼを発現する、ならびに/あるいは
TECファミリーキナーゼがT細胞において発現される、ならびに/あるいは
TECファミリーキナーゼが通常の場合、T細胞において発現されない、
態様1〜50のいずれかの方法。
52.
前記阻害剤が、小分子、ペプチド、タンパク質、抗体もしくはその抗原結合フラグメント、抗体模倣物、アプタマー、または核酸分子である、態様1〜51のいずれかの方法。
53.
前記阻害剤が、チロシンキナーゼの活性化を不可逆的に低減させるかまたは排除し、SEQ ID NO:18に示される配列における残基C481に対応するアミノ酸残基を含むチロシンキナーゼの活性部位において結合部位に特異的に結合し、かつ/あるいはチロシンキナーゼの自己リン酸化活性を低減させるかまたは排除する、態様49〜52のいずれかの方法。
54.
前記阻害剤がイブルチニブである、態様1〜53のいずれかの方法。
55.
前記阻害剤が、T細胞を含む組成物の投与開始と同時にまたは投与開始に続いて投与される、態様1〜54のいずれかの方法。
56.
前記阻害剤がT細胞の投与開始に続いて投与される、態様1〜55のいずれかの方法。
57.
前記阻害剤が、T細胞の投与開始の1時間以内もしくは約1時間以内に、2時間以内もしくは約2時間以内に、6時間以内もしくは約6時間以内に、12時間以内もしくは約12時間以内に、24時間以内もしくは約24時間以内に、48時間以内もしくは約48時間以内に、72時間以内もしくは約72時間以内に、96時間以内もしくは約96時間以内に、または1週間以内もしくは約1週間以内に投与される、態様55または態様56の方法。
58.
前記阻害剤が、
対象由来の血液中の検出可能なT細胞療法の細胞数が、T細胞の投与を開始した後の先行する時点での対象における場合と比較して低下している時点、
血液中の検出可能なT細胞療法の細胞数が、T細胞の投与の投与開始の後で対象の血液中の検出可能なT細胞療法の細胞のピーク数または最大数の1.5倍未満もしくは約1.5倍未満、2倍未満もしくは約2倍未満、3倍未満もしくは約3倍未満、4倍未満もしくは約4倍未満、5倍未満もしくは約5倍未満、10倍未満もしくは約10倍未満、50倍未満もしくは約50倍未満、100倍未満もしくは約100倍未満、またはそれ以下である時点、ならびに/あるいは
T細胞療法の細胞のピークレベルまたは最大レベルが対象の血液中で検出可能となった後の時点で、対象由来の血液中の検出可能なT細胞の細胞数もしくは該T細胞に由来する細胞数が、対象の血液中の総末梢血単核細胞(PBMC)の10%未満、5%未満、1%未満または0.1%未満よりも少ない時点
で投与される、態様55〜57のいずれかの方法。
59.
増大または低下が、1.2倍超もしくは約1.2倍超、1.5倍超もしくは約1.5倍超、2倍超もしくは約2倍超、3倍超もしくは約3倍超、4倍超もしくは約4倍超、5倍超もしくは約5倍超、10倍超もしくは約10倍超、またはそれ以上である、態様58の方法。
60.
前記阻害剤が、T細胞の投与の投与開始の2日後までに、7日後までに、14日後までに、21日後までに、30日後もしくは1ヶ月後までに、60日後もしくは2ヶ月後までに、90日後もしくは3ヶ月後までに、6ヶ月後までに、または1年後までに、ある期間にわたって投与される、態様1〜59のいずれかの方法。
61.
前記阻害剤が、T細胞の投与開始の3ヶ月後までにまたは90日後までに投与される、態様1〜60のいずれかの方法。
62.
前記阻害剤の投与が、少なくともT細胞の投与の開始後から、
対象由来の血液中の検出可能な投与されたT細胞の細胞数もしくは該T細胞に由来する細胞数が、前記阻害剤の投与直前の先行する時点での対象における場合と比較してまたはT細胞療法を投与した後での先行する時点と比較して、増大するまで、
血液中の検出可能なT細胞の細胞数もしくは該T細胞に由来する細胞数が、T細胞の投与の開始後に対象の血液中で認められるピーク数もしくは最大数の2倍以内もしくは1/2倍以内であるまで、
対象由来の血液中の検出可能なT細胞の細胞数が、対象の血液中の総末梢血単核細胞(PBMC)の10%超もしくは約10%超、15%超もしくは約15%超、20%超もしくは約20%超、30%超もしくは約30%超、40%超もしくは約40%超、50%超もしくは約50%超、または60%超もしくは約60%超となるまで、ならびに/あるいは
T細胞を投与する直前の時点または阻害剤を投与する直前の時点での腫瘍負荷量と比較して、対象が腫瘍負荷量における低下を示すまで、ならびに/あるいは
対象が完全寛解または臨床的寛解を示すまで
継続される、態様1〜61のいずれかの方法。
63.
前記阻害剤が、経口投与、皮下投与、または静脈内投与される、態様1〜62のいずれかの方法。
64.
前記阻害剤が経口投与される、態様63の方法。
65.
前記阻害剤が1日に6回、1日に5回、1日に4回、1日に3回、1日に2回、1日に1回、1日おきに、週に3回、または少なくとも週に1回、投与される、態様1〜64のいずれかの方法。
66.
前記阻害剤が、1日に1回または1日に2回、投与される、態様65の方法。
67.
前記阻害剤が、少なくとも50 mg/日もしくは少なくとも約50 mg/日、少なくとも100 mg/日もしくは少なくとも約100 mg/日、少なくとも150 mg/日もしくは少なくとも約150 mg/日、少なくとも175 mg/日もしくは少なくとも約175 mg/日、少なくとも200 mg/日もしくは少なくとも約200 mg/日、少なくとも250 mg/日もしくは少なくとも約250 mg/日、少なくとも280 mg/日もしくは少なくとも約280 mg/日、少なくとも300 mg/日もしくは少なくとも約300 mg/日、少なくとも350 mg/日もしくは少なくとも約350 mg/日、少なくとも400 mg/日もしくは少なくとも約400 mg/日、少なくとも420 mg/日もしくは少なくとも約420 mg/日、少なくとも450 mg/日もしくは少なくとも約450 mg/日、少なくとも500 mg/日もしくは少なくとも約500 mg/日、少なくとも600 mg/日もしくは少なくとも約600 mg/日、少なくとも700 mg/日もしくは少なくとも約700 mg/日、少なくとも800 mg/日もしくは少なくとも約800 mg/日、またはそれ以上の一日総投薬量で投与される、態様1〜66のいずれかの方法。
68.
前記阻害剤が、少なくとも420 mg/日または少なくとも約420 mg/日または約420 mg/日または420 mg/日の一日総投薬量で投与される、態様67の方法。
69.
前記阻害剤が1日あたり420 mg未満または約420 mg未満または約420 mgまたは420 mgの量で、任意で1日あたり少なくとも280 mgまたは少なくとも約280 mgである量で投与される、態様1〜67のいずれかの方法。
70.
T細胞療法が、CD4+またはCD8+であるT細胞を含む、態様1〜69のいずれかの方法。
71.
T細胞療法が、対象に対して自家である細胞を含む、態様1〜70のいずれかの方法。
72.
T細胞療法が、対象に対して同種であるT細胞を含む、態様1〜71のいずれかの方法。
73.
T細胞療法が、それぞれが両端の値を含む5 x 105細胞/kg(対象体重)〜1 x 107細胞/kgの間もしくはおよそ5 x 105細胞/kg(対象体重)〜1 x 107細胞/kgの間、0.5 x 106細胞/kg〜5 x 106細胞/kgの間もしくはおよそ0.5 x 106細胞/kg〜5 x 106細胞/kgの間、0.5 x 106細胞/kg〜3 x 106細胞/kgの間もしくはおよそ0.5 x 106細胞/kg〜3 x 106細胞/kgの間、0.5 x 106細胞/kg〜2 x 106細胞/kgの間もしくはおよそ0.5 x 106細胞/kg〜2 x 106細胞/kgの間、0.5 x 106細胞/kg〜1 x 106細胞/kgの間もしくはおよそ0.5 x 106細胞/kg〜1 x 106細胞/kgの間、1.0 x 106細胞/kg(対象体重)〜5 x 106細胞/kgの間もしくはおよそ1.0 x 106細胞/kg(対象体重)〜5 x 106細胞/kgの間、1.0 x 106細胞/kg〜3 x 106細胞/kgの間もしくはおよそ1.0 x 106細胞/kg〜3 x 106細胞/kgの間、1.0 x 106細胞/kg〜2 x 106細胞/kgの間もしくはおよそ1.0 x 106細胞/kg〜2 x 106細胞/kgの間、2.0 x 106細胞/kg(対象体重)〜5 x 106細胞/kgの間もしくはおよそ2.0 x 106細胞/kg(対象体重)〜5 x 106細胞/kgの間、2.0 x 106細胞/kg〜3 x 106細胞/kgの間もしくはおよそ2.0 x 106細胞/kg〜3 x 106細胞/kgの間、または3.0 x 106細胞/kg(対象体重)〜5 x 106細胞/kgの間もしくはおよそ3.0 x 106細胞/kg(対象体重)〜5 x 106細胞/kgの間での細胞数を含む用量の投与を含む、態様1〜72のいずれかの方法。
74.
T細胞療法が、1 x 108個未満もしくは約1 x 108個未満もしくは約1 x 108個もしくは1 x 108個の総組換え受容体発現細胞、任意でCAR+細胞、総T細胞もしくは総末梢血単核細胞(PBMC)、例えば、5 x 107個未満もしくは約5 x 107個未満もしくは約5 x 107個もしくは5 x 107個、2.5 x 107個未満もしくは約2.5 x 107個未満もしくは約2.5 x 107個もしくは2.5 x 107個、1.0 x 107個未満もしくは約1.0 x 107個未満もしくは約1.0 x 107個もしくは1.0 x 107個、5.0 x 106個未満もしくは約5.0 x 106個未満もしくは約5.0 x 106個もしくは5.0 x 106個、1.0 x 106個未満もしくは約1.0 x 106個未満もしくは約1.0 x 106個もしくは1.0 x 106個、5.0 x 105個未満もしくは約5.0 x 105個未満もしくは約5.0 x 105個もしくは5.0 x 105個、または1 x 105個未満もしくは約1 x 105個未満もしくは約1 x 105個もしくは1 x 105個などの総組換え受容体発現細胞、任意でCAR+細胞、総T細胞もしくは総末梢血単核細胞(PBMC)を含む細胞の用量の投与を含む、態様1〜72のいずれかの方法。
75.
T細胞療法が、両端の値を含む1 x 105個〜1 x 108個の総組換え受容体発現細胞、任意でCAR+細胞、総T細胞もしくは総末梢血単核細胞(PBMC)、例えば、それぞれが両端の値を含む1 x 105個〜5 x 107個、1 x 105個〜2.5 x 107個、1 x 105個〜1.0 x 107個、1 x 105個〜5.0 x 106個、1 x 105個〜1.0 x 106個、1.0 x 105個〜5.0 x 105個、5.0 x 105個〜5 x 107個、5 x 105個〜2.5 x 107個、5 x 105個〜1.0 x 107個、5 x 105個〜5.0 x 106個、5 x 105個〜1.0 x 106個、1.0 x 106個〜5 x 107個、1 x 106個〜2.5 x 107個、1 x 106個〜1.0 x 107個、1 x 106個〜5.0 x 106個、5.0 x 106個〜5 x 107個、5 x 106個〜2.5 x 107個、5 x 106個〜1.0 x 107個、1.0 x 107個〜5 x 107個、1 x 107個〜2.5 x 107個、または2.5 x 107個〜5 x 107個などの総組換え受容体発現細胞、任意でCAR+細胞、総T細胞もしくは総末梢血単核細胞(PBMC)を含む細胞の用量の投与を含む、態様1〜72および74のいずれかの方法。
76.
細胞の用量は、組換え受容体を発現するCD4+細胞の、組換え受容体を発現するCD8+細胞に対する定義された比率、および/または、CD4+細胞の、CD8+細胞に対する定義された比率を含み、そのような比率は任意でおよそ1:1であるかまたはおよそ1:3〜およそ3:1の間である、態様1〜75のいずれかの方法。
77.
投与される細胞の用量が、T細胞療法が阻害剤の投与を伴うことなく投与される方法における用量よりも少ない、態様1〜76のいずれかの方法。
78.
前記用量が、少なくとも1.5倍、2倍、3倍、4倍、5倍または10倍少ない、態様77の方法。
79.
T細胞が、任意で細胞を含む単一の薬学的組成物である単一用量で投与される、態様1〜78のいずれかの方法。
80.
T細胞が分割用量として投与され、単一用量の細胞が、最大でも3日の期間にわたって、合計して前記用量の細胞を含む複数の組成物で投与され、かつ/または、
前記方法が、T細胞の1つまたは複数のさらなる用量を投与する工程をさらに含む、
態様1〜79のいずれかの方法。
81.
T細胞の投与に先立ってリンパ球枯渇化学療法を投与する工程をさらに含み、かつ/または
T細胞の投与に先立って対象がリンパ球枯渇化学療法を受けたことがある、
態様1〜80のいずれかの方法。
82.
リンパ球枯渇化学療法が、フルダラビンおよび/またはシクロホスファミドを対象に投与することを含む、態様81の方法。
83.
リンパ球枯渇療法が、両端の値を含む約200 mg/m2〜400 mg/m2、任意で300 mg/m2もしくは約300 mg/m2でシクロホスファミドを、および/または約20 mg/m2〜40 mg/m2、任意で30 mg/m2でフルダラビンを、それぞれが2日間〜4日間、任意で3日間にわたって毎日、投与することを含む、態様82の方法。
84.
リンパ球枯渇療法が、300 mg/m2もしくは約300 mg/m2でシクロホスファミドを、約30 mg/m2でフルダラビンを、3日間にわたってそれぞれ毎日、投与することを含む、態様82または態様83の方法。
85.
免疫調節剤を対象に投与する工程をさらに含み、
細胞の投与および免疫調節剤の投与が、同時に、別々に、もしくは単一の組成物において、または、どちらの順序であれ逐次的に行われる、
態様1〜84のいずれかの方法。
86.
免疫調節剤が、分子の機能または分子を伴うシグナル伝達経路を阻害またはブロックすることができ、該分子が免疫阻害性分子であり、かつ/または該分子が免疫チェックポイント分子である、態様85の方法。
87.
免疫チェックポイント分子または経路が、PD-1、PD-L1、PD-L2、CTLA-4、LAG-3、TIM3、VISTA、アデノシン2A受容体(A2AR)もしくはアデノシン、または前述のいずれかを伴う経路からなる群より選択される、態様86の方法。
88.
免疫調節剤が、任意で抗体フラグメント、単鎖抗体、多重特異性抗体、もしくは免疫コンジュゲートである抗体であるか、または該抗体を含む、態様85〜87のいずれかの方法。
89.
前記抗体が、免疫チェックポイント分子またはそのリガンドもしくは受容体に特異的に結合する、ならびに/あるいは
前記抗体が、免疫チェックポイント分子とそのリガンドまたは受容体との間の相互作用をブロックするかまたは損なうことができる、態様88の方法。
90.
阻害剤の非存在下でT細胞療法が対象に投与される方法と比較して、T細胞療法が、対象における増大したまたは長期にわたる増殖および/または持続性を示す、態様1〜89のいずれかの方法。
91.
阻害剤の非存在下でT細胞療法が対象に投与される同等の方法により認められるであろう低下と比較して、腫瘍負荷量をより大きい程度におよび/またはより長期間にわたって低下させる、態様1〜89のいずれかの方法。
92.
B細胞抗原以外の抗原、またはCD19、CD20、CD22およびROR1からなる群より選択されるB細胞抗原以外の抗原に結合する組換え受容体を発現する遺伝子操作されたT細胞と、
TECファミリーキナーゼの阻害剤と
を含む、組み合わせ。
93.
前記抗原が、Her2、L1-CAM、メソテリン、CEA、B型肝炎表面抗原、抗葉酸受容体、CD23、CD24、CD38、CD44、EGFR、EGP-2、EGP-4、EPHa2、ErbB2、3もしくは4、erbB二量体、EGFR vIII、FBP、FCRL5、FCRH5、胎児アセチルコリンe受容体、GD2、GD3、HMW-MAA、IL-22R-アルファ、IL-13R-アルファ2、kdr、Lewis Y、L1-細胞接着分子(L1-CAM)、メラノーマ関連抗原(MAGEMAGE-A1、MAGE-A3、MAGE-A6、メラノーマの優先的発現抗原(PRAME)、サバイビン、EGP2、EGP40、TAG72、B7-H6、IL-13受容体a2(IL-13Ra2)、CA9、GD3、HMW-MAA、CD171、G250/CAIX、HLA-AI MAGE Al、HLA-A2 NY-ESO-1、PSCA、葉酸受容体-a、CD44v6、CD44v7/8、avb6インテグリン、8H9、NCAM、VEGF受容体、5T4、胎児AchR、NKG2Dリガンド、CD44v6、二重抗原、およびユニバーサルタグに関連する抗原、癌精巣抗原、メソテリン、MUC1、MUC16、PSCA、NKG2Dリガンド、NY-ESO-1、MART-1、gp100、腫瘍胎児性抗原、TAG72、VEGF-R2、癌胎児性抗原(CEA)、前立腺特異的抗原、PSMA、エストロゲン受容体、プロゲステロン受容体、エフリンB2、CD123、c-Met、GD-2 O-アセチル化GD2(OGD2)、CE7、ウィルムス腫瘍1(WT-1)、サイクリン、サイクリンA2、CCL-1、CD138、ならびに病原体特異的抗原の中から選択される、態様92の組み合わせ。
94.
前記抗原が、ウイルス抗原、細菌抗原、または寄生虫抗原である病原体特異的抗原である、態様92または態様93の組み合わせ。
95.
組換え受容体が、トランスジェニックT細胞受容体(TCR)または機能的な非T細胞受容体である、態様92〜94のいずれかの組み合わせ。
96.
組換え受容体が、任意でキメラ抗原受容体(CAR)であるキメラ受容体である、態様92〜95のいずれかの組み合わせ。
97.
組換え受容体が、前記抗原に特異的に結合する細胞外の抗原認識ドメインと、ITAMを含む細胞内のシグナル伝達ドメインとを含む、態様92〜96のいずれかの組み合わせ。
98.
細胞内のシグナル伝達ドメインがCD3ゼータ(CD3ζ)鎖の細胞内ドメインを含む、態様97の組み合わせ。
99.
組換え受容体が共刺激性のシグナル伝達領域をさらに含む、態様97または態様98の組み合わせ。
100.
共刺激性のシグナル伝達領域がCD28または4-1BBのシグナル伝達ドメインを含む、態様99の組み合わせ。
101.
共刺激性ドメインがCD28のドメインである、態様99または態様100の組み合わせ。
102.
前記阻害剤が1つまたは複数のチロシンキナーゼを阻害し、該チロシンキナーゼのそれぞれが個々に、ブルトン型チロシンキナーゼ(Btk)、IL2誘導性T細胞キナーゼ(ITK)、肝細胞癌において発現されるチロシンキナーゼ(TEC)、染色体Xに対するチロシンキナーゼ骨髄キナーゼ(BMX)、およびT細胞X染色体キナーゼ(TXK;休止期リンパ球キナーゼ、RLK)からなる群より選択される、ならびに/あるいは
TECファミリーキナーゼが、ブルトン型チロシンキナーゼ(Btk)、IL2誘導性T細胞キナーゼ(ITK)、肝細胞癌において発現されるチロシンキナーゼ(TEC)、染色体Xに対するチロシンキナーゼ骨髄キナーゼ(BMX)、およびT細胞X染色体キナーゼ(TXK;休止期リンパ球キナーゼ、RLK)からなる群より選択される1つまたは複数のTECファミリーキナーゼを含む、ならびに/あるいは
TECファミリーキナーゼがBtkであるかまたはBtkを含む、
態様79〜88のいずれかの組み合わせ。
103.
TECファミリーキナーゼが癌の細胞によって発現されず、通常の場合、癌が由来する細胞において発現されないかまたは発現されることが疑われない、ならびに/あるいは
癌が前記阻害剤に対して感受性でない、ならびに/あるいは
少なくとも複数のT細胞がTECファミリーキナーゼを発現する、ならびに/あるいは
TECファミリーキナーゼがT細胞において発現される、ならびに/あるいは
TECファミリーキナーゼが通常の場合、T細胞において発現されない、
態様92〜102のいずれかの組み合わせ。
104.
前記阻害剤が、小分子、ペプチド、タンパク質、抗体もしくはその抗原結合フラグメント、抗体模倣物、アプタマー、または核酸分子である、態様92〜103のいずれかの組み合わせ。
105.
前記阻害剤が、チロシンキナーゼの活性化を不可逆的に低減させるかまたは排除し、SEQ ID NO:18に示される配列における残基C481に対応するアミノ酸残基を含むチロシンキナーゼの活性部位において結合部位に特異的に結合し、かつ/あるいはチロシンキナーゼの自己リン酸化活性を低減させるかまたは排除する、態様92〜104のいずれかの組み合わせ。
106.
前記阻害剤がイブルチニブである、態様92〜105のいずれかの組み合わせ。
107.
同じ組成物において製剤化される、態様92〜106のいずれかの組み合わせ。
108.
別々の組成物において製剤化される、態様92〜107のいずれかの組み合わせ。
109.
態様92〜108のいずれかの組み合わせと、
遺伝子操作細胞および阻害剤またはTECファミリーキナーゼを、癌を処置するための対象に投与するための説明書と
を含む、キット。
110.
B細胞抗原以外の抗原、またはCD19、CD20、CD22、およびROR1からなる群より選択されるB細胞抗原以外の抗原に結合する組換え受容体を発現する遺伝子操作T細胞の治療有効量を含む組成物と、
TECファミリーキナーゼの阻害剤を用いた併用治療において、遺伝子操作細胞を、癌を処置するための対象に投与するための説明書と
を含む、キット。
111.
TECファミリーキナーゼの阻害剤の治療有効量を含む組成物と、
B細胞抗原以外の抗原、またはCD19、CD20、CD22、およびROR1からなる群より選択されるB細胞抗原以外の抗原に結合する組換え受容体を発現する遺伝子操作T細胞を用いた併用治療において、TECファミリーキナーゼの阻害剤を、癌を処置するための対象に投与するための説明書と
を含む、キット。
112.
癌が、B細胞抗原を発現する癌でなく、非血液癌であり、B細胞悪性腫瘍でなく、B細胞白血病でなく、または固形腫瘍である、態様109〜111のいずれかのキット。
113.
癌が、肉腫、癌腫、リンパ腫、白血病、または骨髄腫であり、任意で癌が、非ホジキンリンパ腫(NHL)、びまん性大細胞型B細胞リンパ腫(DLBCL)、CLL、SLL、ALL、またはAMLである、態様109〜112のいずれかのキット。
114.
癌が、膵臓癌、膀胱癌、結腸直腸癌、乳癌、前立腺癌、腎臓癌、肝細胞癌、肺癌、卵巣癌、子宮頸癌、膵臓癌、直腸癌、甲状腺癌、子宮癌、胃癌、食道癌、頭頸部癌、メラノーマ、神経内分泌癌、CNS癌、脳腫瘍、骨癌、または軟部組織肉腫である、態様109〜113のいずれかのキット。
115.
説明書が、投与が対象に対するものであることを規定し、この場合、
(i)対象および/または癌は、(a)ブルトン型チロシンキナーゼ(BTK)の阻害に対して抵抗性であり、かつ/または(b)該阻害剤による阻害に対して抵抗性である細胞の集団を含む、
(ii)対象および/または癌は、BTKをコードする核酸における変異を含み、任意で変異は、該阻害剤によるおよび/またはイブルチニブによるBTKの阻害を低減させるかまたは防止することができ、任意で変異はC481Sである、
(iii)対象および/または癌は、ホスホリパーゼCガンマ2(PLCガンマ2)をコードする核酸における変異を含み、任意で変異は構成的なシグナル伝達活性を生じさせ、任意で変異はR665WまたはL845Fである、
(iv)T細胞を含む組成物の投与開始時およびTECファミリーキナーゼの阻害剤の投与開始時において、対象は、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置の後での寛解の後で再発しており、または、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置に対して難治性であるとみなされている、
(v)T細胞を含む組成物の投与開始時およびTECファミリーキナーゼの阻害剤の投与開始時において、対象は、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置の後で進行しており、任意で対象は、以前の処置に対する最良の応答として進行性疾患を、または以前の処置に対する以前の応答の後で進行を示した、ならびに/あるいは
(vi)TECファミリーキナーゼの阻害剤の投与開始時およびT細胞を含む組成物の投与開始時において、対象は、完全奏功(CR)に達しない応答を、該阻害剤によるおよび/もしくはBTK阻害剤療法による少なくとも6ヶ月にわたる以前の処置の後で示した、
態様109〜114のいずれかのキット。
116.
TECファミリーキナーゼの阻害剤の治療有効量を含む組成物と、
癌に関連する抗原、もしくは癌の細胞上に発現される抗原、もしくは癌の細胞上に存在する抗原、および/または、癌を特異的に標的としかつ対象に投与されたことがあるもしくは投与されることになる治療剤に含まれるタグを特異的に認識するかあるいは該抗原または該タグと特異的に結合する遺伝子操作T細胞を用いた併用治療において、TECファミリーキナーゼの阻害剤を、癌を処置するための対象に投与するための説明書と
を含むキットであって、説明書が、
(i)対象および/または癌は、(a)ブルトン型チロシンキナーゼ(BTK)の阻害に対して抵抗性であり、かつ/または(b)該阻害剤による阻害に対して抵抗性である細胞の集団を含むこと、
(ii)対象および/または癌は、BTKをコードする核酸における変異を含み、任意で変異は、該阻害剤によるおよび/またはイブルチニブによるBTKの阻害を低減させるかまたは防止することができ、任意で変異はC481Sであること、
(iii)対象および/または癌は、ホスホリパーゼCガンマ2(PLCガンマ2)をコードする核酸における変異を含み、任意で変異は構成的なシグナル伝達活性を生じさせ、任意で変異はR665WまたはL845Fであること、
(iv)T細胞を含む組成物の投与開始時およびTECファミリーキナーゼの阻害剤の投与開始時において、対象は、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置の後での寛解の後で再発しており、または、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置に対して難治性であるとみなされていること、
(v)T細胞を含む組成物の投与開始時およびTECファミリーキナーゼの阻害剤の投与開始時において、対象は、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置の後で進行しており、任意で対象は、以前の処置に対する最良の応答として進行性疾患を、または以前の処置に対する以前の応答の後で進行を示したこと、ならびに/あるいは
(vi)TECファミリーキナーゼの阻害剤の投与開始時およびT細胞を含む組成物の投与開始時において、対象は、完全奏功(CR)に達しない応答を、該阻害剤によるおよび/もしくはBTK阻害剤療法による少なくとも6ヶ月にわたる以前の処置の後で示したこと
を規定する、キット。
117.
癌に関連する抗原、もしくは癌の細胞上に発現される抗原、もしくは癌の細胞上に存在する抗原、および/または、癌を特異的に標的としかつ対象に投与されたことがあるもしくは投与されることになる治療剤に含まれるタグを特異的に認識するかあるいは該抗原または該タグと特異的に結合する遺伝子操作T細胞の治療有効量を含む組成物と、
TECファミリーキナーゼの阻害剤を用いた併用治療において、該遺伝子操作細胞を、癌を処置するための対象に投与するための説明書と
を含むキットであって、説明書が、
(i)対象および/または癌は、(a)ブルトン型チロシンキナーゼ(BTK)の阻害に対して抵抗性であり、かつ/または(b)該阻害剤による阻害に対して抵抗性である細胞の集団を含むこと、
(ii)対象および/または癌は、BTKをコードする核酸における変異を含み、任意で変異は、該阻害剤によるおよび/またはイブルチニブによるBTKの阻害を低減させるかまたは防止することができ、任意で変異はC481Sであること、
(iii)対象および/または癌は、ホスホリパーゼCガンマ2(PLCガンマ2)をコードする核酸における変異を含み、任意で変異は構成的なシグナル伝達活性を生じさせ、任意で変異はR665WまたはL845Fであること、
(iv)T細胞を含む組成物の投与開始時およびTECファミリーキナーゼの阻害剤の投与開始時において、対象は、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置の後での寛解の後で再発しており、または、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置に対して難治性であるとみなされていること、
(v)T細胞を含む組成物の投与開始時およびTECファミリーキナーゼの阻害剤の投与開始時において、対象は、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置の後で進行しており、任意で対象は、以前の処置に対する最良の応答として進行性疾患を、または以前の処置に対する以前の応答の後で進行を示したこと、ならびに/あるいは
(vi)TECファミリーキナーゼの阻害剤の投与開始時およびT細胞を含む組成物の投与開始時において、対象は、完全奏功(CR)に達しない応答を、該阻害剤によるおよび/もしくはBTK阻害剤療法による少なくとも6ヶ月にわたる以前の処置の後で示したこと
を規定する、キット。
118.
細胞の集団が、B細胞の集団であるかもしくはB細胞の集団を含み、かつ/またはT細胞を含まない、態様115〜117のいずれかのキット。
119.
癌がB細胞悪性腫瘍である、態様116〜118のいずれかのキット。
120.
B細胞悪性腫瘍が、白血病、リンパ腫、または骨髄腫である、態様119の方法。
121.
B細胞悪性腫瘍が、急性リンパ芽球性白血病(ALL)、成人ALL、慢性リンパ芽球性白血病(CLL)、小リンパ球性白血病(SLL)、非ホジキンリンパ腫(NHL)、びまん性大細胞型B細胞リンパ腫(DLBCL)、または急性骨髄性白血病(AML)である、態様119または態様120の方法。
122.
B細胞悪性腫瘍がCLLまたはSLLである、態様119〜121のいずれかの方法。
123.
T細胞が、B細胞成熟抗原(BCMA)、CD19、CD20、CD22、およびROR1から選択される抗原を認識するかまたは標的とする、態様116〜122のいずれかの方法。
124.
説明書が、投与することを、
(i)任意で少なくとも1つの細胞遺伝学的異常が17p欠失である、1つまたは複数の細胞遺伝学的異常、任意で少なくとも2つまたは3つの細胞遺伝学的異常、
(ii)TP53変異、および/または
(iii)変異していない免疫グロブリン重鎖可変領域(IGHV)
であるかあるいはこれらを有するとして特定されるB細胞悪性腫瘍を有する対象
のためのものであると規定する、態様116〜123のいずれかの方法。
125.
説明書が、投与することを、
B細胞悪性腫瘍を処置するための1つまたは複数の先行療法による処置、任意で組換え受容体を発現する細胞の別の用量とは異なる1つ、2つ、または3つの先行療法による処置に失敗しているか、あるいはそのような先行療法による処置の後での寛解の後で再発しているか、あるいはそのような先行療法に対して難治性になっている対象
のためのものであると規定し、
任意で少なくとも1つの先行療法が、前記阻害剤またはBTK阻害剤療法による以前の処置であった、
態様116〜124のいずれかの方法。
126.
以前の処置がイブルチニブによる以前の処置であった、態様116〜125のいずれかの方法。
127.
BTKをコードする核酸における変異が、位置C481における置換、任意でC481SまたはC481R、および/または位置T474における置換、任意でT474IまたはT474Mを含む、態様115または態様118のキット。
128.
前記抗原が、Her2、L1-CAM、メソテリン、CEA、B型肝炎表面抗原、抗葉酸受容体、CD23、CD24、CD38、CD44、EGFR、EGP-2、EGP-4、EPHa2、ErbB2、3もしくは4、erbB二量体、EGFR vIII、FBP、FCRL5、FCRH5、胎児アセチルコリンe受容体、GD2、GD3、HMW-MAA、IL-22R-アルファ、IL-13R-アルファ2、kdr、Lewis Y、L1-細胞接着分子(L1-CAM)、メラノーマ関連抗原(MAGEMAGE-A1、MAGE-A3、MAGE-A6、メラノーマの優先的発現抗原(PRAME)、サバイビン、EGP2、EGP40、TAG72、B7-H6、IL-13受容体a2(IL-13Ra2)、CA9、GD3、HMW-MAA、CD171、G250/CAIX、HLA-AI MAGE Al、HLA-A2 NY-ESO-1、PSCA、葉酸受容体-a、CD44v6、CD44v7/8、avb6インテグリン、8H9、NCAM、VEGF受容体、5T4、胎児AchR、NKG2Dリガンド、CD44v6、二重抗原、およびユニバーサルタグに関連する抗原、癌精巣抗原、メソテリン、MUC1、MUC16、PSCA、NKG2Dリガンド、NY-ESO-1、MART-1、gp100、Gタンパク質共役受容体5D(GPCR5D)、腫瘍胎児性抗原、TAG72、VEGF-R2、癌胎児性抗原(CEA)、前立腺特異的抗原、PSMA、エストロゲン受容体、プロゲステロン受容体、エフリンB2、CD123、c-Met、GD-2 O-アセチル化GD2(OGD2)、CE7、ウィルムス腫瘍1(WT-1)、サイクリン、サイクリンA2、CCL-1、CD138、ならびに病原体特異的抗原の中から選択される、態様110〜127のいずれかのキット。
129.
前記抗原が、ウイルス抗原、細菌抗原、または寄生虫抗原である病原体特異的抗原である、態様110〜128のいずれかのキット。
130.
組換え受容体が、トランスジェニックT細胞受容体(TCR)または機能的な非T細胞受容体である、態様110〜129のいずれかのキット。
131.
組換え受容体が、任意でキメラ抗原受容体(CAR)であるキメラ受容体である、態様110〜130のいずれかのキット。
132.
組換え受容体が、前記抗原に特異的に結合する細胞外の抗原認識ドメインと、ITAMを含む細胞内のシグナル伝達ドメインとを含む、態様110〜131のいずれかのキット。
133.
細胞内のシグナル伝達ドメインがCD3ゼータ(CD3ζ)鎖の細胞内ドメインを含む、態様132のキット。
134.
組換え受容体が共刺激性のシグナル伝達領域をさらに含む、態様132または態様133のキット。
135.
共刺激性のシグナル伝達領域がCD28または4-1BBのシグナル伝達ドメインを含む、態様134のキット。
136.
共刺激性ドメインがCD28のドメインである、態様134または態様135のキット。
137.
前記阻害剤が1つまたは複数のチロシンキナーゼを阻害し、該チロシンキナーゼのそれぞれが個々に、ブルトン型チロシンキナーゼ(Btk)、IL2誘導性T細胞キナーゼ(ITK)、肝細胞癌において発現されるチロシンキナーゼ(TEC)、染色体Xに対するチロシンキナーゼ骨髄キナーゼ(BMX)、およびT細胞X染色体キナーゼ(TXK;休止期リンパ球キナーゼ、RLK)からなる群より選択される、ならびに/あるいは
TECファミリーキナーゼが、ブルトン型チロシンキナーゼ(Btk)、IL2誘導性T細胞キナーゼ(ITK)、肝細胞癌において発現されるチロシンキナーゼ(TEC)、染色体Xに対するチロシンキナーゼ骨髄キナーゼ(BMX)、およびT細胞X染色体キナーゼ(TXK;休止期リンパ球キナーゼ、RLK)からなる群より選択される1つまたは複数のTECファミリーキナーゼを含む、ならびに/あるいは
TECファミリーキナーゼがBtkであるかまたはBtkを含む、
態様110〜136のいずれかのキット。
138.
TECファミリーキナーゼが癌の細胞によって発現されず、通常の場合、癌が由来する細胞において発現されないかまたは発現されることが疑われない、ならびに/あるいは
癌が前記阻害剤に対して感受性でない、ならびに/あるいは
少なくとも複数のT細胞がTECファミリーキナーゼを発現する、ならびに/あるいは
TECファミリーキナーゼがT細胞において発現される、ならびに/あるいは
TECファミリーキナーゼが通常の場合、T細胞において発現されない、
態様110〜137のいずれかのキット。
139.
前記阻害剤が、小分子、ペプチド、タンパク質、抗体もしくはその抗原結合フラグメント、抗体模倣物、アプタマー、または核酸分子である、態様110〜138のいずれかのキット。
140.
前記阻害剤が、チロシンキナーゼの活性化を不可逆的に低減させるかまたは排除し、SEQ ID NO:18に示される配列における残基C481に対応するアミノ酸残基を含むチロシンキナーゼの活性部位において結合部位に特異的に結合し、かつ/あるいはチロシンキナーゼの自己リン酸化活性を低減させるかまたは排除する、態様110〜139のいずれかのキット。
141.
前記阻害剤がイブルチニブである、態様110〜140のいずれかのキット。
142.
説明書が、T細胞を含む組成物の投与開始と同時にまたは投与開始に続いて、前記阻害剤を投与することを規定する、態様110〜141のいずれかのキット。
143.
説明書が、T細胞の投与開始に続いて前記阻害剤を投与することを規定する、態様110〜142のいずれかのキット。
144.
説明書が、
T細胞の投与開始の1時間以内もしくは約1時間以内に、2時間以内もしくは約2時間以内に、6時間以内もしくは約6時間以内に、12時間以内もしくは約12時間以内に、24時間以内もしくは約24時間以内に、48時間以内もしくは約48時間以内に、72時間以内もしくは約72時間以内に、96時間以内もしくは約96時間以内に、または1週間以内もしくは約1週間以内に、前記阻害剤を投与すること
を規定する、態様142または態様143のキット。
145.
説明書が、
対象由来の血液中の検出可能なT細胞療法の細胞数が、T細胞の投与を開始した後の先行する時点での対象における場合と比較して低下している時点、
血液中の検出可能なT細胞療法の細胞数が、T細胞の投与の投与開始の後で対象の血液中の検出可能なT細胞療法の細胞のピーク数または最大数の1.5倍未満もしくは約1.5倍未満、2倍未満もしくは約2倍未満、3倍未満もしくは約3倍未満、4倍未満もしくは約4倍未満、5倍未満もしくは約5倍未満、10倍未満もしくは約10倍未満、50倍未満もしくは約50倍未満、100倍未満もしくは約100倍未満、またはそれ以下である時点、ならびに/あるいは
T細胞療法の細胞のピークレベルまたは最大レベルが対象の血液中で検出可能となった後の時点で、対象由来の血液中の検出可能なT細胞の細胞数もしくは該T細胞に由来する細胞数が、対象の血液中の総末梢血単核細胞(PBMC)の10%未満、5%未満、1%未満または0.1%未満よりも少ない時点
で阻害剤を投与することを規定する、態様142〜144のいずれかのキット。
146.
増大または低下が、1.2倍超もしくは約1.2倍超、1.5倍超もしくは約1.5倍超、2倍超もしくは約2倍超、3倍超もしくは約3倍超、4倍超もしくは約4倍超、5倍超もしくは約5倍超、10倍超もしくは約10倍超、またはそれ以上である、態様145のキット。
147.
説明書が、
T細胞の投与の投与開始の2日後までに、7日後までに、14日後までに、21日後までに、1ヶ月後もしくは30日後までに、2ヶ月後もしくは60日後までに、3ヶ月後もしくは90日後までに、6ヶ月後までに、または1年後までに、ある期間にわたって前記阻害剤を投与する
ためのものである、態様109〜146のいずれかのキット。
148.
説明書が、T細胞の投与開始の少なくとも3ヶ月もしくは90日後までにまたは少なくとも3ヶ月間もしくは90日間にわたって、前記阻害剤を投与することを規定する、態様109〜147のいずれかのキット。
149.
説明書が、少なくともT細胞の投与の開始後から、
対象由来の血液中の検出可能な投与されたT細胞の細胞数もしくは該T細胞に由来する細胞数が、前記阻害剤の投与直前の先行する時点での対象における場合と比較してまたはT細胞療法を投与した後での先行する時点と比較して、増大するまで、
血液中の検出可能なT細胞の細胞数もしくは該T細胞に由来する細胞数が、T細胞の投与の開始後に対象の血液中で認められるピーク数もしくは最大数の2倍以内もしくは1/2倍以内であるまで、
対象由来の血液中の検出可能なT細胞の細胞数が、対象の血液中の総末梢血単核細胞(PBMC)の10%超もしくは約10%超、15%超もしくは約15%超、20%超もしくは約20%超、30%超もしくは約30%超、40%超もしくは約40%超、50%超もしくは約50%超、または60%超もしくは約60%超となるまで、ならびに/あるいは
T細胞を投与する直前の時点または阻害剤を投与する直前の時点での腫瘍負荷量と比較して、対象が腫瘍負荷量における低下を示すまで、ならびに/あるいは
対象が完全寛解または臨床的寛解を示すまで
前記阻害剤を投与することを規定する、態様109〜148のいずれかのキット。
150.
説明書が、前記阻害剤を経口投与、皮下投与、または静脈内投与することを規定する、態様109〜149のいずれかのキット。
151.
説明書が、前記阻害剤を経口投与することを規定する、態様150のキット。
152.
説明書が、1日に6回、1日に5回、1日に4回、1日に3回、1日に2回、1日に1回、1日おきに、週に3回、または少なくとも週に1回、前記阻害剤を投与することを規定する、態様109〜151のいずれかのキット。
153.
説明書が、1日に1回または1日に2回、前記阻害剤を投与することを規定する、態様152のキット。
154.
説明書が、少なくとも50 mg/日もしくは少なくとも約50 mg/日、少なくとも100 mg/日もしくは少なくとも約100 mg/日、少なくとも150 mg/日もしくは少なくとも約150 mg/日、少なくとも175 mg/日もしくは少なくとも約175 mg/日、少なくとも200 mg/日もしくは少なくとも約200 mg/日、少なくとも250 mg/日もしくは少なくとも約250 mg/日、少なくとも280 mg/日もしくは少なくとも約280 mg/日、少なくとも300 mg/日もしくは少なくとも約300 mg/日、少なくとも350 mg/日もしくは少なくとも約350 mg/日、少なくとも400 mg/日もしくは少なくとも約400 mg/日、少なくとも420 mg/日もしくは少なくとも約420 mg/日、少なくとも450 mg/日もしくは少なくとも約450 mg/日、少なくとも500 mg/日もしくは少なくとも約500 mg/日、少なくとも600 mg/日もしくは少なくとも約600 mg/日、少なくとも700 mg/日もしくは少なくとも約700 mg/日、少なくとも800 mg/日もしくは少なくとも約800 mg/日、またはそれ以上の一日総投薬量で阻害剤を投与することを規定する、態様109〜153のいずれかのキット。
155.
説明書が、少なくとも420 mg/日または約少なくとも420 mg/日または約420 mg/日または420 mg/日の一日投薬量で前記阻害剤を投与することを規定する、態様109〜153のいずれかのキット。
156.
説明書が、1日あたり420 mg未満または約420 mg未満または約420 mgまたは420 mgの量で、任意で1日あたり少なくとも280 mgまたは少なくとも約280 mgまたは約280 mgまたは280 mgである量で前記阻害剤を投与することを規定する、態様109〜154のいずれかのキット。
157.
遺伝子操作T細胞が、CD4+またはCD8+であるT細胞を含む、態様109〜156のいずれかのキット。
158.
遺伝子操作T細胞が、対象に対して自家である細胞を含む、態様109〜157のいずれかのキット。
159.
遺伝子操作T細胞が、対象に対して同種であるT細胞を含む、態様109〜158のいずれかのキット。
160.
説明書が、
それぞれが両端の値を含む5 x 105細胞/kg(対象体重)〜1 x 107細胞/kgの間もしくはおよそ5 x 105細胞/kg(対象体重)〜1 x 107細胞/kgの間、0.5 x 106細胞/kg〜5 x 106細胞/kgの間もしくはおよそ0.5 x 106細胞/kg〜5 x 106細胞/kgの間、0.5 x 106細胞/kg〜3 x 106細胞/kgの間もしくはおよそ0.5 x 106細胞/kg〜3 x 106細胞/kgの間、0.5 x 106細胞/kg〜2 x 106細胞/kgの間もしくはおよそ0.5 x 106細胞/kg〜2 x 106細胞/kgの間、0.5 x 106細胞/kg〜1 x 106細胞/kgの間もしくはおよそ0.5 x 106細胞/kg〜1 x 106細胞/kgの間、1.0 x 106細胞/kg(対象体重)〜5 x 106細胞/kgの間もしくはおよそ1.0 x 106細胞/kg(対象体重)〜5 x 106細胞/kgの間、1.0 x 106細胞/kg〜3 x 106細胞/kgの間もしくはおよそ1.0 x 106細胞/kg〜3 x 106細胞/kgの間、1.0 x 106細胞/kg〜2 x 106細胞/kgの間もしくはおよそ1.0 x 106細胞/kg〜2 x 106細胞/kgの間、2.0 x 106細胞/kg(対象体重)〜5 x 106細胞/kgの間もしくはおよそ2.0 x 106細胞/kg(対象体重)〜5 x 106細胞/kgの間、2.0 x 106細胞/kg〜3 x 106細胞/kgの間もしくはおよそ2.0 x 106細胞/kg〜3 x 106細胞/kgの間、または3.0 x 106細胞/kg(対象体重)〜5 x 106細胞/kgの間もしくはおよそ3.0 x 106細胞/kg(対象体重)〜5 x 106細胞/kgの間での細胞数を含む用量で、遺伝子操作T細胞を投与すること
を規定する、態様109〜159のいずれかのキット。
161.
説明書が、
1 x 108個未満もしくは約1 x 108個未満もしくは約1 x 108個もしくは1 x 108個の総組換え受容体発現細胞、任意でCAR+細胞、総T細胞もしくは総末梢血単核細胞(PBMC)、例えば、5 x 107個未満もしくは約5 x 107個未満もしくは約5 x 107個もしくは5 x 107個、2.5 x 107個未満もしくは約2.5 x 107個未満もしくは約2.5 x 107個もしくは2.5 x 107個、1.0 x 107個未満もしくは約1.0 x 107個未満もしくは約1.0 x 107個もしくは1.0 x 107個、5.0 x 106個未満もしくは約5.0 x 106個未満もしくは約5.0 x 106個もしくは5.0 x 106個、1.0 x 106個未満もしくは約1.0 x 106個未満もしくは約1.0 x 106個もしくは1.0 x 106個、5.0 x 105個未満もしくは約5.0 x 105個未満もしくは約5.0 x 105個もしくは5.0 x 105個、または1 x 105個未満もしくは約1 x 105個未満もしくは約1 x 105個もしくは1 x 105個などの総組換え受容体発現細胞、任意でCAR+細胞、総T細胞もしくは総末梢血単核細胞(PBMC)を含む用量で、遺伝子操作T細胞を投与すること
を規定する、態様109〜159のいずれかのキット。
162.
説明書が、
両端の値を含む1 x 105個〜1 x 108個の総組換え受容体発現細胞、任意でCAR+細胞、総T細胞もしくは総末梢血単核細胞(PBMC)、例えば、それぞれが両端の値を含む1 x 105個〜5 x 107個、1 x 105個〜2.5 x 107個、1 x 105個〜1.0 x 107個、1 x 105個〜5.0 x 106個、1 x 105個〜1.0 x 106個、1.0 x 105個〜5.0 x 105個、5.0 x 105個〜5 x 107個、5 x 105個〜2.5 x 107個、5 x 105個〜1.0 x 107個、5 x 105個〜5.0 x 106個、5 x 105個〜1.0 x 106個、1.0 x 106個〜5 x 107個、1 x 106個〜2.5 x 107個、1 x 106個〜1.0 x 107個、1 x 106個〜5.0 x 106個、5.0 x 106個〜5 x 107個、5 x 106個〜2.5 x 107個、5 x 106個〜1.0 x 107個、1.0 x 107個〜5 x 107個、1 x 107個〜2.5 x 107個、または2.5 x 107個〜5 x 107個などの総組換え受容体発現細胞、任意でCAR+細胞、総T細胞もしくは総末梢血単核細胞(PBMC)を含む用量で、遺伝子操作T細胞を投与すること
を規定する、態様109〜159および161のいずれかのキット。
163.
説明書が、
細胞の用量は、組換え受容体を発現するCD4+細胞の、組換え受容体を発現するCD8+細胞に対する定義された比率、および/または、CD4+細胞の、CD8+細胞に対する定義された比率を含み、そのような比率は任意でおよそ1:1であるかまたはおよそ1:3〜およそ3:1の間であること
を規定する、態様109〜162のいずれかのキット。
164.
説明書が、T細胞療法が阻害剤の投与を伴うことなく投与される場合の用量よりも少ない用量の細胞を投与することを規定する、態様109〜163のいずれかのキット。
165.
用量が、少なくとも1.5倍、2倍、3倍、4倍、5倍または10倍少ない、態様164のキット。
166.
説明書が、任意で細胞を含む単一の薬学的組成物である単一用量でT細胞を投与することを規定する、態様109〜165のいずれかのキット。
167.
説明書が、T細胞を分割用量として投与することを規定し、この場合、単一用量の細胞が、最大でも3日の期間にわたって、合計して前記用量の細胞を含む複数の組成物で投与され、かつ/または、
説明書が、T細胞の1つまたは複数のさらなる用量を投与することをさらに規定する、
態様109〜166のいずれかのキット。
168.
説明書が、
リンパ球枯渇化学療法をT細胞の投与に先立って投与することをさらに規定し、かつ/または
投与が、リンパ球枯渇化学療法をT細胞の投与に先立って受けたことがある対象への投与であることを規定する、
態様109〜167のいずれかのキット。
169.
リンパ球枯渇化学療法が、フルダラビンおよび/またはシクロホスファミドを対象に投与することを含む、態様168のキット。
170.
リンパ球枯渇療法が、両端の値を含む約200 mg/m2〜400 mg/m2、任意で300 mg/m2もしくは約300 mg/m2でシクロホスファミドを、および/または約20 mg/m2〜40 mg/m2、任意で30 mg/m2でフルダラビンを、それぞれが2日間〜4日間、任意で3日間にわたって毎日、投与することを含む、態様168または態様169のキット。
171.
リンパ球枯渇療法が、300 mg/m2もしくは約300 mg/m2でシクロホスファミドを、および約30 mg/m2でフルダラビンを、それぞれ3日間にわたって毎日、投与することを含む、態様168〜170のいずれかのキット。
172.
説明書が、免疫調節剤を対象に投与することをさらに規定し、細胞の投与および免疫調節剤の投与が、同時に、別々に、もしくは単一の組成物において、またはどちらの順序であれ逐次的に行われる、態様109〜171のいずれかのキット。
173.
免疫調節剤が、分子の機能または分子を伴うシグナル伝達経路を阻害またはブロックすることができ、該分子が免疫阻害性分子であり、かつ/または該分子が免疫チェックポイント分子である、態様172のキット。
174.
免疫チェックポイント分子または経路が、PD-1、PD-L1、PD-L2、CTLA-4、LAG-3、TIM3、VISTA、アデノシン2A受容体(A2AR)もしくはアデノシン、または前述のいずれかを伴う経路からなる群より選択される、態様173のキット。
175.
免疫調節剤が、任意で抗体フラグメント、単鎖抗体、多重特異性抗体、もしくは免疫コンジュゲートである抗体であるか、または該抗体を含む、態様172〜174のいずれかのキット。
176.
前記抗体が、免疫チェックポイント分子またはそのリガンドもしくは受容体に特異的に結合する、ならびに/あるいは
前記抗体が、免疫チェックポイント分子とそのリガンドまたは受容体との間の相互作用をブロックするかまたは損なうことができる、態様175のキット。
177.
組成物が単回投薬のために製剤化される、態様176のキット。
178.
組成物が多回投薬のために製剤化される、態様176のキット。
179.
T細胞を含む細胞の集団をTECファミリーキナーゼの阻害剤と接触させる工程、および
組換え受容体をコードする核酸を、組換え受容体が発現されるような条件のもとでT細胞の集団に導入する工程
を含む、組換え受容体を発現する免疫細胞を操作する方法。
180.
組換え受容体が、リガンドに、任意で抗原またはユニバーサルタグに結合する、態様179の方法。
181.
組換え受容体がT細胞受容体(TCR)またはキメラ抗原受容体(CAR)である、態様179または態様180の方法。
182.
細胞の集団が末梢血単核細胞であるかまたは末梢血単核細胞を含む、態様179〜181のいずれかの方法。
183.
細胞の集団がT細胞であるかまたはT細胞を含む、態様179〜182のいずれかの方法。
184.
T細胞がCD4+および/またはCD8+である、態様183の方法。
185.
細胞の集団が、対象、任意でヒト対象から単離される、態様179〜184のいずれかの方法。
186.
接触させる工程が、導入する工程の前におよび/または導入する工程の間に行われる、態様179〜185のいずれかの方法。
187.
組換え受容体をコードする核酸分子を初代T細胞に導入する工程を含み、
該T細胞が、TECファミリーキナーゼの阻害剤を投与されたことがある対象に由来する、
遺伝子操作されたT細胞を作製する方法。
188.
前記対象が、核酸分子を導入する最大でも30日前に、20日前に、10日前に、9日前に、8日前に、7日前に、6日前に、5日前に、4日前に、3日前に、2日前に、または1日前に、前記阻害剤を投与されている、態様187の方法。
189.
前記阻害剤が1つまたは複数のチロシンキナーゼを阻害し、該チロシンキナーゼのそれぞれが個々に、ブルトン型チロシンキナーゼ(Btk)、IL2誘導性T細胞キナーゼ(ITK)、肝細胞癌において発現されるチロシンキナーゼ(TEC)、染色体Xに対するチロシンキナーゼ骨髄キナーゼ(BMX)、およびT細胞X染色体キナーゼ(TXK;休止期リンパ球キナーゼ、RLK)からなる群より選択される、ならびに/あるいは
TECファミリーキナーゼが、ブルトン型チロシンキナーゼ(Btk)、IL2誘導性T細胞キナーゼ(ITK)、肝細胞癌において発現されるチロシンキナーゼ(TEC)、染色体Xに対するチロシンキナーゼ骨髄キナーゼ(BMX)、およびT細胞X染色体キナーゼ(TXK;休止期リンパ球キナーゼ、RLK)からなる群より選択される1つまたは複数のTECファミリーキナーゼを含む、ならびに/あるいは
TECファミリーキナーゼがBtkであるかまたはBtkを含む、
態様187または188の方法。
190.
TECファミリーキナーゼが癌の細胞によって発現されず、通常の場合、癌が由来する細胞において発現されないかまたは発現されることが疑われない、ならびに/あるいは
癌が前記阻害剤に対して感受性でない、ならびに/あるいは
少なくとも複数のT細胞がTECファミリーキナーゼを発現する、ならびに/あるいは
TECファミリーキナーゼがT細胞において発現される、ならびに/あるいは
TECファミリーキナーゼが通常の場合、T細胞において発現されない、
態様187〜189のいずれかの方法。
191.
前記阻害剤が、小分子、ペプチド、タンパク質、抗体もしくはその抗原結合フラグメント、抗体模倣物、アプタマー、または核酸分子である、態様187〜190のいずれかの方法。
192.
前記阻害剤が、チロシンキナーゼの活性化を不可逆的に低減させるかまたは排除し、SEQ ID NO:18に示される配列における残基C481に対応するアミノ酸残基を含むチロシンキナーゼの活性部位において結合部位に特異的に結合し、かつ/あるいはチロシンキナーゼの自己リン酸化活性を低減させるかまたは排除する、態様187〜191のいずれかの方法。
193.
前記阻害剤がイブルチニブである、態様187〜192のいずれかの方法。
194.
前記阻害剤が、経口投与、皮下投与、または静脈内投与される、態様187〜193のいずれかの方法。
195.
前記阻害剤が経口投与される、態様194の方法。
196.
前記阻害剤が1日に6回、1日に5回、1日に4回、1日に3回、1日に2回、1日に1回、1日おきに、週に3回、または少なくとも週に1回、投与される、態様187〜195のいずれかの方法。
197.
前記阻害剤が、1日に1回または1日に2回、投与される、態様196の方法。
198.
前記阻害剤が、少なくとも50 mg/日もしくは少なくとも約50 mg/日、少なくとも100 mg/日もしくは少なくとも約100 mg/日、少なくとも150 mg/日もしくは少なくとも約150 mg/日、少なくとも175 mg/日もしくは少なくとも約175 mg/日、少なくとも200 mg/日もしくは少なくとも約200 mg/日、少なくとも250 mg/日もしくは少なくとも約250 mg/日、少なくとも280 mg/日もしくは少なくとも約280 mg/日、少なくとも300 mg/日もしくは少なくとも約300 mg/日、少なくとも350 mg/日もしくは少なくとも約350 mg/日、少なくとも400 mg/日もしくは少なくとも約400 mg/日、少なくとも420 mg/日もしくは少なくとも約420 mg/日、少なくとも450 mg/日もしくは少なくとも約450 mg/日、少なくとも500 mg/日もしくは少なくとも約500 mg/日、少なくとも600 mg/日もしくは少なくとも約600 mg/日、少なくとも700 mg/日もしくは少なくとも約700 mg/日、少なくとも800 mg/日もしくは少なくとも約800 mg/日、またはそれ以上の一日総投薬量で投与される、態様187〜197のいずれかの方法。
199.
前記阻害剤が1日あたり420 mg未満または約420 mg未満または約420 mgまたは420 mgの量で投与される、態様187〜198のいずれかの方法。
200.
T細胞がCD4+またはCD8+細胞を含む、態様187〜199のいずれかの方法。
以下の実施例は例示目的のためだけに含まれ、本発明の範囲を限定するためには意図されない。
Btk阻害剤(イブルチニブ)の存在下におけるCAR発現T細胞の性質をインビトロ研究において評価した。
上記のように作製されるCAR T細胞をポリD-リジンプレートに三連でプレーティングし、その後、イブルチニブ抵抗性のCD19発現標的細胞(CD19を発現するように形質導入されたK562細胞、K562-CD19)と、2.5:1のエフェクター:標的(E:T)比で共培養した。標的細胞を、顕微鏡法による標的細胞の追跡を可能にするために、NucLight Red(NLR)により標識した。イブルチニブを、5000 nM、500 nM、50 nM、5 nMおよび0.5 nMの濃度で培養物に加えた(これらは、超生理学的であることが認められる用量(500 nM)、およびCmaxであることが認められる用量(227 nM)を含む投薬量範囲を反映する)。イブルチニブの非存在下において標的細胞の存在下でインキュベーションされるCAR-T細胞を「非処理」対照として使用した。細胞溶解活性を、(IncuCyte(登録商標)生細胞分析システム(Essen Bioscience)を使用して)赤色蛍光シグナルによって求められるように、生存標的細胞の喪失を4日の期間にわたって測定することによって評価した。標的殺傷の割合(%)を、正規化された標的細胞数についての曲線下面積(AUC)を経時的に測定し、逆数AUC(1/AUC)値を、0%値(標的細胞単独)および100%値(ビヒクル対照において標的細胞と共培養されるCAR+T細胞)を定義することにより正規化することによって評価した。
イブルチニブの存在下で培養される抗CD19 CAR T細胞の様々な表現型マーカーを評価するために、(3名のドナーからの)CAR+のCD4+細胞およびCD8+細胞での一連の活性化マーカーを、CD19を発現する放射線照射されたK562標的細胞による刺激の後で4日にわたって追跡した。上記のように作製されるCAR-T細胞を96ウエルのポリD-リジン被覆プレートに100,000細胞/ウエルでプレーティングした。放射線照射K562-CD19標的細胞を2.5:1のエフェクター対標的比で加えた。細胞を培養の継続期間にわたって、5000 nM、500 nM、50 nM、5 nMおよび0.5 nMの濃度で、イブルチニブの非存在下または存在下において4日までにわたって培養した。細胞を、1日、2日、3日および4日で採取し、T細胞の活性化および分化の表面マーカー(CD69、CD107a、PD-1、CD25、CD38、CD39、CD95、CD62L、CCR7、CD45RO)について、加えて切断型EGFR(CAR形質導入細胞のための代用マーカー)についてフローサイトメトリーによって分析した。
イブルチニブの存在下または非存在下で培養される抗CD19 CAR T細胞によるサイトカインの産生を、CAR-T細胞および放射線照射K562-CD19標的細胞の共培養物の上清におけるサイトカインレベルを評価することによって評価した。上記のように作製されるCAR-T細胞を、放射線照射された標的細胞(K562-CD19)が2.5:1のエフェクター対標的比で加えられる96ウエルのポリD-リジン被覆プレートに100,000細胞/ウエルでプレーティングした。細胞を、4日までの培養の継続期間にわたってイブルチニブの非存在下、または0.5 nM、5 nM、50 nMもしくは500 nMのイブルチニブの存在下において4日までにわたって培養した。培養上清を、1日目、2日目、3日目および4日目に24時間毎に採取し、IFNγ、IL-2、TNFα、IL-4およびIL-10を、Meso Scale Discovery(MSD)から得られるサイトカインキットを使用して培養上清から測定した。
いくつかの局面において細胞が反復刺激後にエクスビボで増殖する能力は、CAR-T細胞が(例えば、初期活性化後に)持続することができることを示す可能性があり、かつ/あるいは、インビボでの機能および/または適合性を示す(Zhao et al.(2015)Cancer Cell, 28:415-28)。上記のように作製される抗CD19 CAR+T細胞を、三連で96ウエルのポリD-リジン被覆プレートに100,000細胞/ウエルでプレーティングし、放射線照射された標的細胞(K562-CD19)を、2.5:1のエフェクター対標的比で加えた。細胞を500 nMおよび50 nMのイブルチニブの存在下で刺激し、3日毎〜4日毎に採取し、計数し、その後、細胞数を各回について初期播種密度に再設定した後で、同じ培養条件および添加された濃度のイブルチニブを使用して新しい標的細胞による再刺激のために培養した。25日の培養期間の期間中における合計で7回の刺激を行った。
イブルチニブの存在下で培養されるとき、抗CD19 CAR T細胞はTH1表現型に向けられることを実証するアッセイを行った。イブルチニブは、ITKの阻害を介してTh2 CD4 T細胞の活性化および増殖を制限することが認められている(Honda, F., et al.(2012)Nat Immunol, 13(4):369-78)。連続再刺激アッセイを上記のように行い、細胞を様々な時点で採取し、フローサイトメトリーによって分析して、TH1表現型のT細胞(これはCD4+CXCR3+CRTH2-として評価される)またはTH2表現型(これはCD4+CXCR3-CRTH2+として評価される)の割合を評価した。示された濃度のイブルチニブを伴っておよび伴うことなくそれぞれ培養された細胞についての代表的なプロットが図5Aに示され、連続再刺激の経過にわたる培養および様々な濃度のイブルチニブのもとでの培養の後のTH1細胞の割合が、それぞれ図5Bおよび図5Cに示される。
様々な遺伝子の発現を、上記のような18日間の連続刺激の期間中に、イブルチニブ(50 nMまたは500 nM)の存在下または非存在下で培養される抗CD19 CAR T細胞において評価した。連続刺激後18日目に、RNAを抗CD19 CAR T細胞から単離し、Nanostring Immune V2パネル試験を594個の遺伝子にわたって実施した。各遺伝子のlog2(変化倍数)を、データを処置対対照について計数するために正規化される非スケール化(unscaled)ハウスキーピング遺伝子のANOVA検定から導かれる-log10(未処理p値)に対してプロットした。結果は、連続再刺激の期間中におけるイブルチニブによる処理が遺伝子発現を有意に変化させないことを示した。
播種性腫瘍異種移植マウスモデルを、BTK阻害に対して抵抗性であることが確認されるCD19+Nalm-6播種性腫瘍株の細胞をNOD/Scid/gc-/-(NSG)マウスに注射することによって作製した。
実施例2に記載されるNSGマウスに、ホタルルシフェラーゼを発現する5 x 105個のNalm-6細胞を0日目に静脈内注射した。4日目から始めて、研究の継続期間にわたって毎日、マウスをビヒクル対照により処置したか、または飲料水(D.W.)において25 mg/kg/日でイブルチニブにより毎日処置した。橋渡し実験により、飲料水によるイブルチニブの投与が経口胃管法による投与と同等であることが確認された(データは示されず)。阻害剤との併用療法の影響の評価を可能にするために、抗CD19 CAR T細胞の最適以下の用量を、5日目に5 x 105個/マウスにi.v.注射した。対照として、CAR-T細胞または阻害剤の投与を伴わずに、マウスにビヒクル対照を投与した。
抗CD19 CAR-T細胞を、T細胞がびまん性大細胞型B細胞リンパ腫(DLBCL)を有する2名の異なるヒト対象から単離されたことを除いて、実質的には実施例1に記載されるように作製した。細胞を、CAR-T細胞を500 nMおよび50 nMのイブルチニブの存在下、2.5:1のエフェクター対標的比でK562-CD19標的細胞と共培養し、細胞を3日毎〜4日毎に採取し、再刺激を細胞数の再設定後、同じ条件のもとで行うことによって、実施例1.Dに記載するように連続再刺激に供した。細胞を21日の培養期間にわたって連続再刺激に供し、細胞拡大および細胞傷害活性についてモニターした。図9Aに示すように、細胞倍加数によって求められるような細胞拡大を、それぞれの個々の対象に由来する細胞について21日の培養期間の期間中に観察した。イブルチニブは、どちらの患者についても患者由来のCAR T細胞の増殖を阻害しなかった(図9A)。これは、健常者ドナー由来のCAR T細胞から得られた以前のデータと一致する観察結果である。図9Bに示すように、それぞれの個々の対象に由来する細胞から製造されるCAR-T細胞は、16日間の連続刺激の後で、500 nMのイブルチニブの存在下での細胞溶解機能における増大を示した(図9B)。1名の患者に由来する細胞では、16日間の連続刺激の後での細胞溶解活性における増大が、50 nMのイブルチニブに関して認められた(P<0.01)(図9B)。細胞溶解活性におけるこの増大は健常者ドナー細胞からの結果と一致している(図1C、図1D)。
イブルチニブ(50 nM、500 nM)または対照(0 nM)の存在下での連続刺激アッセイで18日間処置された、3名の異なるドナーに由来する個々のCAR発現細胞から、RNAを単離した。RNA単離は、RNEasy Micro Kit(Qiagen)を使用して行った。試料を配列決定し、RNASeqリードをヒトゲノム(GRCh38)に対してマッピングし、GENCODE(リリース24)遺伝子モデルにアラインメントした。RNAseq品質マトリックスを、試料間の一貫性を確認するために作製し、評価した。示差的に発現した遺伝子を、0.5のlog2変化倍数カットオフおよび0.05のBenjamini-Hochberg調整偽陽性発見率(FDR)カットオフを課すことによって特定した。
Claims (200)
- (1)癌に関連する抗原、もしくは癌の細胞上に発現される抗原、もしくは癌の細胞上に存在する抗原、および/または、癌を特異的に標的としかつ対象に投与されたことがあるもしくは投与されることになる治療剤に含まれるタグを特異的に認識するかあるいは該抗原または該タグに特異的に結合するT細胞を、癌を有する対象に投与する工程、および
(2)該対象にTECファミリーキナーゼの阻害剤を投与する工程
を含む処置方法であって、
癌がB細胞悪性腫瘍でなく、B細胞白血病もしくはリンパ腫でなく、非血液癌であるか、または固形腫瘍であり、かつ/あるいは
抗原がB細胞抗原でなく、かつ/あるいは
抗原が、CD19、CD20、CD22およびROR1からなる群より選択されるB細胞抗原でない、
処置方法。 - 癌に関連する抗原、もしくは癌の細胞上に発現される抗原、もしくは癌の細胞上に存在する抗原、および/または、癌を特異的に標的としかつ対象に投与されたことがあるもしくは投与されることになる治療剤に含まれるタグを特異的に認識するかあるいは該抗原または該タグに特異的に結合するT細胞を、癌を有する対象に投与する工程
を含む、処置方法であって、
該対象が、TECファミリーキナーゼの阻害剤を投与されたことがあり、
癌がB細胞悪性腫瘍でなく、B細胞白血病もしくはリンパ腫でなく、非血液癌であるか、または固形腫瘍であり、かつ/あるいは
抗原がB細胞抗原でなく、かつ/あるいは
抗原が、CD19、CD20、CD22およびROR1からなる群より選択されるB細胞抗原でない、
処置方法。 - 癌を有する対象にTECファミリーキナーゼの阻害剤を投与する工程を含む処置方法であって、
該対象が、疾患もしくは状態に関連する抗原、または疾患もしくは状態の細胞上に発現される抗原、または疾患もしくは状態の細胞上に存在する抗原、および/または、癌を特異的に標的としかつ対象に投与されたことがあるもしくは投与されることになる治療剤に含まれるタグを特異的に認識するかあるいは該抗原または該タグに特異的に結合するT細胞を投与されたことがあり、
癌がB細胞悪性腫瘍でなく、B細胞白血病もしくはリンパ腫でなく、非血液癌であるか、または固形腫瘍であり、かつ/あるいは
抗原がB細胞抗原でなく、かつ/あるいは
抗原が、CD19、CD20、CD22およびROR1からなる群より選択されるB細胞抗原でない、
処置方法。 - 抗原が、CD19、CD20、CD22およびROR1からなる群より選択されるB細胞抗原でなく、かつ/または
癌が、CD19、CD20、CD22およびROR1からなる群より選択されるB細胞抗原ならびに/あるいはカッパ軽鎖を発現しない、請求項1〜3のいずれか一項記載の方法。 - 癌がCD19を発現せず、細胞によって特異的に認識されるかまたは標的とされる抗原がCD19でなく、かつ/あるいは、T細胞が、CD19に特異的に結合する組換え受容体を含まず、かつ/または、T細胞が、抗CD19抗原結合ドメインを含まないキメラ抗原受容体(CAR)を含む、請求項1〜4のいずれか一項記載の方法。
- 細胞によって特異的に認識されるかまたは標的とされる抗原が、Her2、L1-CAM、メソテリン、CEA、B型肝炎表面抗原、抗葉酸受容体、CD23、CD24、CD38、CD44、EGFR、EGP-2、EGP-4、EPHa2、ErbB2、3もしくは4、erbB二量体、EGFR vIII、FBP、FCRL5、FCRH5、胎児アセチルコリンe受容体、GD2、GD3、HMW-MAA、IL-22R-アルファ、IL-13R-アルファ2、kdr、Lewis Y、L1-細胞接着分子(L1-CAM)、メラノーマ関連抗原(MAGEMAGE-A1、MAGE-A3、MAGE-A6、メラノーマの優先的発現抗原(PRAME)、サバイビン、EGP2、EGP40、TAG72、B7-H6、IL-13受容体a2(IL-13Ra2)、CA9、GD3、HMW-MAA、CD171、G250/CAIX、HLA-AI MAGE Al、HLA-A2 NY-ESO-1、PSCA、葉酸受容体-a、CD44v6、CD44v7/8、avb6インテグリン、8H9、NCAM、VEGF受容体、5T4、胎児AchR、NKG2Dリガンド、CD44v6、二重抗原、およびユニバーサルタグに関連する抗原、癌精巣抗原、メソテリン、MUC1、MUC16、PSCA、NKG2Dリガンド、NY-ESO-1、MART-1、gp100、Gタンパク質共役受容体5D(GPCR5D)、腫瘍胎児性抗原、TAG72、VEGF-R2、癌胎児性抗原(CEA)、前立腺特異的抗原、PSMA、エストロゲン受容体、プロゲステロン受容体、エフリンB2、CD123、c-Met、GD-2 O-アセチル化GD2(OGD2)、CE7、ウィルムス腫瘍1(WT-1)、サイクリン、サイクリンA2、CCL-1、CD138、ならびに病原体特異的抗原の中から選択される、請求項1〜5のいずれか一項記載の方法。
- (1)癌に関連する抗原を特異的に認識するかまたは該抗原と特異的に結合するT細胞を、癌を有する対象に投与する工程であって、該抗原が、B細胞成熟抗原(BCMA)、Her2、L1-CAM、メソテリン、CEA、B型肝炎表面抗原、抗葉酸受容体、CD23、CD24、CD30、CD33、CD38、CD44、EGFR、EGP-2、EGP-4、EPHa2、ErbB2、3もしくは4、erbB二量体、EGFR vIII、FBP、FCRL5、FCRH5、胎児アセチルコリンe受容体、GD2、GD3、HMW-MAA、IL-22R-アルファ、IL-13R-アルファ2、kdr、カッパ軽鎖、Lewis Y、L1-細胞接着分子(L1-CAM)、メラノーマ関連抗原(MAGE)-A1、MAGE-A3、MAGE-A6、メラノーマの優先的発現抗原(PRAME)、サバイビン、EGP2、EGP40、TAG72、B7-H6、IL-13受容体a2(IL-13Ra2)、CA9、GD3、HMW-MAA、CD171、G250/CAIX、HLA-AI MAGE Al、HLA-A2 NY-ESO-1、PSCA、葉酸受容体-a、CD44v6、CD44v7/8、avb6インテグリン、8H9、NCAM、VEGF受容体、5T4、胎児AchR、NKG2Dリガンド、CD44v6、二重抗原、およびユニバーサルタグに関連する抗原、癌精巣抗原、メソテリン、MUC1、MUC16、PSCA、NKG2Dリガンド、NY-ESO-1、MART-1、gp100、Gタンパク質共役受容体5D(GPCR5D)、腫瘍胎児性抗原、TAG72、VEGF-R2、癌胎児性抗原(CEA)、前立腺特異的抗原、PSMA、エストロゲン受容体、プロゲステロン受容体、エフリンB2、CD123、c-Met、GD-2、O-アセチル化GD2(OGD2)、CE7、ウィルムス腫瘍1(WT-1)、サイクリン、サイクリンA2、CCL-1、CD138、ならびに病原体特異的抗原から選択される、工程、および
(2)該対象にTECファミリーキナーゼの阻害剤を投与する工程
を含む、処置方法。 - 癌に関連する抗原を特異的に認識するかまたは該抗原と特異的に結合するT細胞を、癌を有する対象に投与する工程であって、該抗原が、B細胞成熟抗原(BCMA)、Her2、L1-CAM、メソテリン、CEA、B型肝炎表面抗原、抗葉酸受容体、CD23、CD24、CD30、CD33、CD38、CD44、EGFR、EGP-2、EGP-4、EPHa2、ErbB2、3もしくは4、erbB二量体、EGFR vIII、FBP、FCRL5、FCRH5、胎児アセチルコリンe受容体、GD2、GD3、HMW-MAA、IL-22R-アルファ、IL-13R-アルファ2、kdr、カッパ軽鎖、Lewis Y、L1-細胞接着分子(L1-CAM)、メラノーマ関連抗原(MAGE)-A1、MAGE-A3、MAGE-A6、メラノーマの優先的発現抗原(PRAME)、サバイビン、EGP2、EGP40、TAG72、B7-H6、IL-13受容体a2(IL-13Ra2)、CA9、GD3、HMW-MAA、CD171、G250/CAIX、HLA-AI MAGE Al、HLA-A2 NY-ESO-1、PSCA、葉酸受容体-a、CD44v6、CD44v7/8、avb6インテグリン、8H9、NCAM、VEGF受容体、5T4、胎児AchR、NKG2Dリガンド、CD44v6、二重抗原、およびユニバーサルタグに関連する抗原、癌精巣抗原、メソテリン、MUC1、MUC16、PSCA、NKG2Dリガンド、NY-ESO-1、MART-1、gp100、Gタンパク質共役受容体5D(GPCR5D)、腫瘍胎児性抗原、TAG72、VEGF-R2、癌胎児性抗原(CEA)、前立腺特異的抗原、PSMA、エストロゲン受容体、プロゲステロン受容体、エフリンB2、CD123、c-Met、GD-2、O-アセチル化GD2(OGD2)、CE7、ウィルムス腫瘍1(WT-1)、サイクリン、サイクリンA2、CCL-1、CD138、ならびに病原体特異的抗原から選択される、工程
を含み、該対象が、TECファミリーキナーゼの阻害剤を投与されたことがある、処置方法。 - 癌を有する対象にTECファミリーキナーゼの阻害剤を投与する工程を含む処置方法であって、
該対象が、癌に関連する抗原を特異的に認識するかまたは該抗原と特異的に結合するT細胞を投与されたことがあり、
該抗原が、B細胞成熟抗原(BCMA)、Her2、L1-CAM、メソテリン、CEA、B型肝炎表面抗原、抗葉酸受容体、CD23、CD24、CD30、CD33、CD38、CD44、EGFR、EGP-2、EGP-4、EPHa2、ErbB2、3もしくは4、erbB二量体、EGFR vIII、FBP、FCRL5、FCRH5、胎児アセチルコリンe受容体、GD2、GD3、HMW-MAA、IL-22R-アルファ、IL-13R-アルファ2、kdr、カッパ軽鎖、Lewis Y、L1-細胞接着分子(L1-CAM)、メラノーマ関連抗原(MAGE)-A1、MAGE-A3、MAGE-A6、メラノーマの優先的発現抗原(PRAME)、サバイビン、EGP2、EGP40、TAG72、B7-H6、IL-13受容体a2(IL-13Ra2)、CA9、GD3、HMW-MAA、CD171、G250/CAIX、HLA-AI MAGE Al、HLA-A2 NY-ESO-1、PSCA、葉酸受容体-a、CD44v6、CD44v7/8、avb6インテグリン、8H9、NCAM、VEGF受容体、5T4、胎児AchR、NKG2Dリガンド、CD44v6、二重抗原、およびユニバーサルタグに関連する抗原、癌精巣抗原、メソテリン、MUC1、MUC16、PSCA、NKG2Dリガンド、NY-ESO-1、MART-1、gp100、Gタンパク質共役受容体5D(GPCR5D)、腫瘍胎児性抗原、TAG72、VEGF-R2、癌胎児性抗原(CEA)、前立腺特異的抗原、PSMA、エストロゲン受容体、プロゲステロン受容体、エフリンB2、CD123、c-Met、GD-2、O-アセチル化GD2(OGD2)、CE7、ウィルムス腫瘍1(WT-1)、サイクリン、サイクリンA2、CCL-1、CD138、ならびに病原体特異的抗原から選択される、処置方法。 - 前記抗原が、ウイルス抗原、細菌抗原、または寄生虫抗原である病原体特異的抗原である、請求項6〜9のいずれか一項記載の方法。
- (1)癌に関連する抗原、もしくは癌の細胞上に発現される抗原、もしくは癌の細胞上に存在する抗原、および/または、癌を特異的に標的としかつ対象に投与されたことがあるもしくは投与されることになる治療剤に含まれるタグを特異的に認識するかあるいは該抗原または該タグと特異的に結合するT細胞を含む組成物を、癌を有する対象に投与する工程、および
(2)該対象にTECファミリーキナーゼの阻害剤を投与する工程
を含む処置方法であって、
(i)該対象および/または癌は、(a)ブルトン型チロシンキナーゼ(BTK)の阻害に対して抵抗性であり、かつ/または(b)該阻害剤による阻害に対して抵抗性である細胞の集団を含む、
(ii)該対象および/または癌は、BTKをコードする核酸における変異を含み、任意で変異は、該阻害剤によるおよび/またはイブルチニブによるBTKの阻害を低減させるかまたは防止することができ、任意で変異はC481Sである、
(iii)該対象および/または癌は、ホスホリパーゼCガンマ2(PLCガンマ2)をコードする核酸における変異を含み、任意で変異は構成的なシグナル伝達活性を生じさせ、任意で変異はR665WまたはL845Fである、
(iv)(1)における投与開始時および(2)における投与開始時において、該対象は、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置の後での寛解の後で再発しており、または、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置に対して難治性であるとみなされている、
(v)(1)における投与開始時および(2)における投与開始時において、該対象は、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置の後で進行しており、任意で該対象は、以前の処置に対する最良の応答として進行性疾患を、または以前の処置に対する以前の応答の後で進行を示した、ならびに/あるいは
(vi)(1)における投与開始時および(2)における投与開始時において、該対象は、完全奏功(CR)に達しない応答を、該阻害剤によるおよび/もしくはBTK阻害剤療法による少なくとも6ヶ月にわたる以前の処置の後で示した、
処置方法。 - 癌に関連する抗原、もしくは癌の細胞上に発現される抗原、もしくは癌の細胞上に存在する抗原、および/または、癌を特異的に標的としかつ対象に投与されたことがあるもしくは投与されることになる治療剤に含まれるタグを特異的に認識するかあるいは該抗原または該タグと特異的に結合するT細胞を含む組成物を、癌を有する対象に投与する工程を含む、処置方法であって、
該対象が、T細胞を含む組成物の投与との併用療法における使用のために、TECファミリーキナーゼの阻害剤を投与されたことがあり、
(i)該対象および/または癌は、(a)ブルトン型チロシンキナーゼ(BTK)の阻害に対して抵抗性であり、かつ/または(b)該阻害剤による阻害に対して抵抗性である細胞の集団を含む、
(ii)該対象および/または癌は、BTKをコードする核酸における変異を含み、任意で変異は、該阻害剤によるおよび/またはイブルチニブによるBTKの阻害を低減させるかまたは防止することができ、任意で変異はC481Sである、
(iii)該対象および/または癌は、ホスホリパーゼCガンマ2(PLCガンマ2)をコードする核酸における変異を含み、任意で変異は構成的なシグナル伝達活性を生じさせ、任意で変異はR665WまたはL845Fである、
(iv)TECファミリーキナーゼの阻害剤の投与開始時およびT細胞を含む組成物の投与開始時において、該対象は、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置の後での寛解の後で再発しており、または、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置に対して難治性であるとみなされている、
(v)TECファミリーキナーゼの阻害剤の投与開始時およびT細胞を含む組成物の投与開始時において、該対象は、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置の後で進行しており、任意で該対象は、以前の処置に対する最良の応答として進行性疾患を、または以前の処置に対する以前の応答の後で進行を示した、ならびに/あるいは
(vi)TECファミリーキナーゼの阻害剤の投与開始時およびT細胞を含む組成物の投与開始時において、該対象は、完全奏功(CR)に達しない応答を、該阻害剤によるおよび/もしくはBTK阻害剤療法による少なくとも6ヶ月にわたる以前の処置の後で示した、
処置方法。 - 癌を有する対象にTECファミリーキナーゼの阻害剤を投与する工程を含む処置方法であって、
該対象が、癌に関連する抗原、もしくは癌の細胞上に発現される抗原、もしくは癌の細胞上に存在する抗原、および/または、癌を特異的に標的としかつ該対象に投与されたことがあるもしくは投与されることになる治療剤に含まれるタグを特異的に認識するかあるいは該抗原または該タグと特異的に結合するT細胞を含む組成物を投与されたことがあり、
(i)該対象および/または癌は、(a)ブルトン型チロシンキナーゼ(BTK)の阻害に対して抵抗性であり、かつ/または(b)該阻害剤による阻害に対して抵抗性である細胞の集団を含む、
(ii)該対象および/または癌は、BTKをコードする核酸における変異を含み、任意で変異は、該阻害剤によるおよび/またはイブルチニブによるBTKの阻害を低減させるかまたは防止することができ、任意で変異はC481Sである、
(iii)該対象および/または癌は、ホスホリパーゼCガンマ2(PLCガンマ2)をコードする核酸における変異を含み、任意で変異は構成的なシグナル伝達活性を生じさせ、任意で変異はR665WまたはL845Fである、
(iv)T細胞を含む組成物の投与開始時およびTECファミリーキナーゼの阻害剤の投与開始時において、該対象は、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置の後での寛解の後で再発しており、または、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置に対して難治性であるとみなされている、
(v)T細胞を含む組成物の投与開始時およびTECファミリーキナーゼの阻害剤の投与開始時において、該対象は、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置の後で進行しており、任意で該対象は、以前の処置に対する最良の応答として進行性疾患を、または以前の処置に対する以前の応答の後で進行を示した、ならびに/あるいは
(vi)T細胞を含む組成物の投与開始時およびTECファミリーキナーゼの阻害剤の投与開始時において、該対象は、完全奏功(CR)に達しない応答を、該阻害剤によるおよび/もしくはBTK阻害剤療法による少なくとも6ヶ月にわたる以前の処置の後で示した、
処置方法。 - 細胞の集団が、B細胞の集団であるかもしくはB細胞の集団を含み、かつ/またはT細胞を含まない、請求項11〜13のいずれか一項記載の方法。
- T細胞が、腫瘍浸潤リンパ球(TIL)を含むか、または抗原に特異的に結合する組換え受容体を発現する遺伝子操作されたT細胞を含む、請求項1〜14のいずれか一項記載の方法。
- T細胞が、抗原に特異的に結合する組換え受容体を発現する遺伝子操作されたT細胞を含み、そのような受容体が任意でキメラ抗原受容体である、請求項15記載の方法。
- (1)対象に対して自家であり、かつ
癌に関連する抗原に、および/または、癌を特異的に標的としかつ対象に投与されたことがあるもしくは投与されることになる治療剤に含まれるタグに、特異的に結合する組換え受容体を発現する
T細胞を含む組成物を、癌を有する対象に投与する工程、および
(2)該対象にTECファミリーキナーゼの阻害剤を投与する工程
を含む処置方法であって、
複数回の抗原特異的刺激の後でのインビトロアッセイにおいて、組換え受容体を発現するように操作されていない対象由来のT細胞および/または自家T細胞が、T細胞の参照集団または参照レベルもしくは閾値レベルと比較して、T細胞の機能、健康状態、もしくは活性を示す因子の低下したレベルを示すかまたは示すことが認められている、
処置方法。 - 対象に対して自家であり、かつ
癌に関連する抗原に、および/または、癌を特異的に標的としかつ対象に投与されたことがあるもしくは投与されることになる治療剤に含まれるタグに、特異的に結合する組換え受容体を発現する
T細胞を含む組成物を、癌を有する対象に投与する工程を含む、処置方法であって、
該対象が、TECファミリーキナーゼの阻害剤を投与されたことがあり、
複数回の抗原特異的刺激の後でのインビトロアッセイにおいて、組換え受容体を発現するように操作されていない対象由来のT細胞および/または自家T細胞が、T細胞の参照集団または参照レベルもしくは閾値レベルと比較して、T細胞の機能、健康状態、もしくは活性を示す因子の低下したレベルを示すかまたは示すことが認められている、
処置方法。 - 癌を有する対象にTECファミリーキナーゼの阻害剤を投与する工程を含む処置方法であって、
該対象が、
該対象に対して自家であり、かつ
癌に関連する抗原に、および/または、癌を特異的に標的としかつ該対象に投与されたことがあるもしくは投与されることになる治療剤に含まれるタグに、特異的に結合する組換え受容体を発現する
T細胞を、投与されたことがあり、
複数回の抗原特異的刺激の後でのインビトロアッセイにおいて、組換え受容体を発現するように操作されていない対象由来のT細胞および/または自家T細胞が、T細胞の参照集団または参照レベルもしくは閾値レベルと比較して、T細胞の機能、健康状態、もしくは活性を示す因子の低下したレベルを示すかまたは示すことが認められている、
処置方法。 - T細胞の参照集団が、癌を有しないまたは癌を有することが疑われない対象の血液由来のT細胞の集団であり、
参照値または閾値が、同じインビトロアッセイで測定されるような、癌を有しないまたは癌を有することが疑われない対象の血液由来のT細胞の集団について認められる平均値であるか、あるいは、
参照値または閾値は、同じインビトロアッセイで測定されるような、癌を有する他の対象の血液由来のT細胞の集団について認められる平均値である、
請求項17〜19のいずれか一項記載の方法。 - 前記因子が、細胞増殖、細胞生存、抗原特異的細胞傷害性、および/もしくはサイトカイン分泌の程度であるか、またはそれらを含む、請求項17〜20のいずれか一項記載の方法。
- 前記因子のレベルが、ただ1回の刺激および/または前記複数よりも少ない回数の刺激の後で評価されたとき、同じアッセイにおいて、参照集団または参照レベルと比較して低下していない、請求項17〜21のいずれか一項記載の方法。
- 複数回の刺激が、少なくとも3回、4回、もしくは5回を含み、かつ/または、少なくとも10日、11日、12日、13日、14日、15日、16日、17日、18日、19日、20日、21日、22日、23日、24日、もしくは25日の期間にわたって行われる、請求項17〜22のいずれか一項記載の方法。
- 組換え受容体が、トランスジェニックT細胞受容体(TCR)または機能的な非T細胞受容体である、請求項16〜23のいずれか一項記載の方法。
- 組換え受容体が、任意でキメラ抗原受容体(CAR)であるキメラ受容体である、請求項16〜24のいずれか一項記載の方法。
- (1)癌を有する対象に、任意でキメラ抗原受容体(CAR)であるキメラ受容体を発現する細胞を含む組成物を投与する工程であって、該受容体が、CD19、CD20、CD22もしくはROR1でない癌に関連する抗原に特異的に結合し、および/または癌を特異的に標的としかつ対象に投与されたことがあるもしくは投与されることになる治療剤に含まれるタグに特異的に結合する、工程、および
(2)該対象にTECファミリーキナーゼの阻害剤を投与する工程
を含む処置方法。 - 癌を有する対象に、任意でキメラ抗原受容体(CAR)であるキメラ受容体を発現する細胞を含む組成物を投与する工程を含む、処置方法であって、
該受容体が、CD19、CD20、CD22もしくはROR1でない癌に関連する抗原に特異的に結合し、および/または癌を特異的に標的としかつ対象に投与されたことがあるもしくは投与されることになる治療剤に含まれるタグに特異的に結合し、
該対象が、TECファミリーキナーゼの阻害剤を投与されたことがある、
処置方法。 - 癌を有する対象にTECファミリーキナーゼの阻害剤を投与する工程を含む、処置方法であって、
該対象が、任意でキメラ抗原受容体(CAR)であるキメラ受容体を発現する細胞を含む組成物を投与されたことがあり、
該受容体が、CD19、CD20、CD22もしくはROR1でない癌に関連する抗原に特異的に結合し、および/または癌を特異的に標的としかつ対象に投与されたことがあるもしくは投与されることになる治療剤に含まれるタグに特異的に結合する、
処置方法。 - キメラ抗原受容体(CAR)が、前記抗原に特異的に結合する細胞外の抗原認識ドメインと、ITAMを含む細胞内のシグナル伝達ドメインとを含む、請求項26〜29のいずれか一項記載の方法。
- 細胞内のシグナル伝達ドメインがCD3ゼータ(CD3ζ)鎖の細胞内ドメインを含む、請求項29記載の方法。
- キメラ抗原受容体(CAR)が共刺激性のシグナル伝達領域をさらに含む、請求項29または請求項30記載の方法。
- 共刺激性のシグナル伝達領域がCD28または4-1BBのシグナル伝達ドメインを含む、請求項31記載の方法。
- 共刺激性ドメインがCD28のドメインである、請求項31または請求項32記載の方法。
- (1)癌を有する対象に、任意でキメラ抗原受容体であるキメラ受容体を発現する細胞を含む組成物を投与する工程であって、キメラ受容体が、抗体またはその抗原結合フラグメントを含む細胞外ドメイン;ヒトCD28の膜貫通部分であるかまたはそれを含有する膜貫通ドメイン;およびヒト4-1BBまたはヒトCD28のシグナル伝達ドメインとヒトCD3ゼータのシグナル伝達ドメインとを含む細胞内のシグナル伝達ドメインを含む、工程、および
(2)該対象にTECファミリーキナーゼの阻害剤を投与する工程
を含む、癌を処置する方法。 - 癌がB細胞悪性腫瘍である、請求項7〜34のいずれか一項記載の方法。
- B細胞悪性腫瘍が、白血病、リンパ腫または骨髄腫である、請求項35記載の方法。
- B細胞悪性腫瘍が、急性リンパ芽球性白血病(ALL)、成人ALL、慢性リンパ芽球性白血病(CLL)、小リンパ球性白血病(SLL)、非ホジキンリンパ腫(NHL)、びまん性大細胞型B細胞リンパ腫(DLBCL)、または急性骨髄性白血病(AML)である、請求項35または請求項36記載の方法。
- B細胞悪性腫瘍がCLLまたはSLLである、請求項35〜37のいずれか一項記載の方法。
- T細胞を含む組成物の投与の開始時または開始前、およびTECファミリーキナーゼの阻害剤の投与の開始時または開始前において、前記対象が、
(i)任意で少なくとも1つの細胞遺伝学的異常が17p欠失である、1つまたは複数の細胞遺伝学的異常、任意で少なくとも2つまたは3つの細胞遺伝学的異常、
(ii)TP53変異、および/または
(iii)変異していない免疫グロブリン重鎖可変領域(IGHV)
を有するB細胞悪性腫瘍を有するかあるいは有するとして特定される、請求項35〜37のいずれか一項記載の方法。 - T細胞を含む組成物の投与の開始時または開始前、およびTECファミリーキナーゼの阻害剤の投与の開始時または開始前において、前記対象が、B細胞悪性腫瘍を処置するための1つまたは複数の先行療法、任意で組換え受容体を発現する細胞の別の用量とは異なる1つ、2つ、または3つの先行療法による処置に失敗しているか、あるいはそのような先行療法による処置後の寛解の後で再発しているか、あるいはそのような先行療法に対して難治性になっており、任意で少なくとも1つの先行療法が、該阻害剤またはBTK阻害剤療法による以前の処置であった、請求項35〜39のいずれか一項記載の方法。
- 以前の処置がイブルチニブによる以前の処置であった、請求項11〜40のいずれか一項記載の方法。
- 癌が、B細胞抗原を発現する癌でなく、非血液癌であり、B細胞悪性腫瘍でなく、B細胞白血病でなく、または固形腫瘍である、請求項7〜34のいずれか一項記載の方法。
- 癌が、肉腫、癌腫、リンパ腫、白血病、または骨髄腫であり、任意で癌が、非ホジキンリンパ腫(NHL)、びまん性大細胞型B細胞リンパ腫(DLBCL)、CLL、SLL、ALL、またはAMLである、請求項1〜34および42のいずれか一項記載の方法。
- 癌が、膵臓癌、膀胱癌、結腸直腸癌、乳癌、前立腺癌、腎臓癌、肝細胞癌、肺癌、卵巣癌、子宮頸癌、膵臓癌、直腸癌、甲状腺癌、子宮癌、胃癌、食道癌、頭頸部癌、メラノーマ、神経内分泌癌、CNS癌、脳腫瘍、骨癌、または軟部組織肉腫である、請求項1〜34、42および43のいずれか一項記載の方法。
- (i)対象および/または癌が、(a)ブルトン型チロシンキナーゼ(BTK)の阻害に対して抵抗性であり、かつ/または(b)該阻害剤による阻害に対して抵抗性である細胞の集団を含む、
(ii)対象および/または癌が、BTKをコードする核酸における変異を含み、任意で変異は、該阻害剤によるおよび/またはイブルチニブによるBTKの阻害を低減させるかまたは防止することができ、任意で変異はC481Sである、
(iii)対象および/または癌が、ホスホリパーゼCガンマ2(PLCガンマ2)をコードする核酸における変異を含み、任意で変異は構成的なシグナル伝達活性を生じさせ、任意で変異はR665WまたはL845Fである、
(iv)TECファミリーキナーゼの阻害剤の投与開始時およびT細胞を含む組成物の投与開始時において、対象が、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置の後での寛解の後で再発しており、または、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置に対して難治性であるとみなされている、
(v)TECファミリーキナーゼの阻害剤の投与開始時およびT細胞を含む組成物の投与開始時において、対象が、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置の後で進行しており、任意で対象は、以前の処置に対する最良の応答として進行性疾患を、または以前の処置に対する以前の応答の後で進行を示した、ならびに/あるいは
(vi)TECファミリーキナーゼの阻害剤の投与開始時およびT細胞を含む組成物の投与開始時において、対象が、完全奏功(CR)に達しない応答を、該阻害剤によるおよび/もしくはBTK阻害剤療法による少なくとも6ヶ月にわたる以前の処置の後で示した、
請求項1〜10および17〜44のいずれか一項記載の方法。 - 細胞の集団が、B細胞の集団であるかもしくはB細胞の集団を含み、かつ/またはT細胞を含まない、請求項45記載の方法。
- BTKをコードする核酸における変異が、位置C481における置換、任意でC481SまたはC481R、および/または位置T474における置換、任意でT474IまたはT474Mを含む、請求項11〜14および請求項45〜46のいずれか一項記載の方法。
- T細胞が、ROR1、B細胞成熟抗原(BCMA)、tEGFR、Her2、L1-CAM、CD19、CD20、CD22、メソテリン、CEA、およびB型肝炎表面抗原、抗葉酸受容体、CD23、CD24、CD30、CD33、CD38、CD44、EGFR、EGP-2、EGP-4、EPHa2、ErbB2、3もしくは4、erbB二量体、EGFR vIII、FBP、FCRL5、FCRH5、胎児アセチルコリンe受容体、GD2、GD3、HMW-MAA、IL-22R-アルファ、IL-13R-アルファ2、kdr、カッパ軽鎖、Lewis Y、L1-細胞接着分子(L1-CAM)、メラノーマ関連抗原(MAGE)-A1、MAGE-A3、MAGE-A6、メラノーマの優先的発現抗原(PRAME)、サバイビン、EGP2、EGP40、TAG72、B7-H6、IL-13受容体a2(IL-13Ra2)、CA9、GD3、HMW-MAA、CD171、G250/CAIX、HLA-AI MAGE Al、HLA-A2 NY-ESO-1、PSCA、葉酸受容体-a、CD44v6、CD44v7/8、avb6インテグリン、8H9、NCAM、VEGF受容体、5T4、胎児AchR、NKG2Dリガンド、CD44v6、二重抗原、およびユニバーサルタグに関連する抗原、癌精巣抗原、メソテリン、MUC1、MUC16、PSCA、NKG2Dリガンド、NY-ESO-1、MART-1、gp100、Gタンパク質共役受容体5D(GPCR5D)、腫瘍胎児性抗原、ROR1、TAG72、VEGF-R2、癌胎児性抗原(CEA)、前立腺特異的抗原、PSMA、Her2/neu、エストロゲン受容体、プロゲステロン受容体、エフリンB2、CD123、c-Met、GD-2、O-アセチル化GD2(OGD2)、CE7、ウィルムス腫瘍1(WT-1)、サイクリン、サイクリンA2、CCL-1、CD138、ならびに病原体特異的抗原から選択される抗原を認識するかまたは標的とする、請求項11〜47のいずれか一項記載の方法。
- 前記阻害剤が1つまたは複数のチロシンキナーゼを阻害し、該チロシンキナーゼのそれぞれが個々に、ブルトン型チロシンキナーゼ(Btk)、IL2誘導性T細胞キナーゼ(ITK)、肝細胞癌において発現されるチロシンキナーゼ(TEC)、染色体Xに対するチロシンキナーゼ骨髄キナーゼ(BMX)、およびT細胞X染色体キナーゼ(TXK;休止期リンパ球キナーゼ、RLK)からなる群より選択される、ならびに/あるいは
TECファミリーキナーゼが、ブルトン型チロシンキナーゼ(Btk)、IL2誘導性T細胞キナーゼ(ITK)、肝細胞癌において発現されるチロシンキナーゼ(TEC)、染色体Xに対するチロシンキナーゼ骨髄キナーゼ(BMX)、およびT細胞X染色体キナーゼ(TXK;休止期リンパ球キナーゼ、RLK)からなる群より選択される1つまたは複数のTECファミリーキナーゼを含む、ならびに/あるいは
TECファミリーキナーゼがBtkであるかまたはBtkを含む、
請求項1〜48のいずれか一項記載の方法。 - 前記阻害剤が、ITKを阻害するか、あるいは1000 nM未満もしくは約1000 nM未満、900 nM未満もしくは約900 nM未満、800 nM未満もしくは約800 nM未満、600 nM未満もしくは約600 nM未満、500 nM未満もしくは約500 nM未満、400 nM未満もしくは約400 nM未満、300 nM未満もしくは約300 nM未満、200 nM未満もしくは約200 nM未満、100 nM未満もしくは約100 nM未満、またはそれ以下の半数阻害濃度(IC50)でITKを阻害する、請求項1〜49のいずれか一項記載の方法。
- TECファミリーキナーゼが癌の細胞によって発現されず、通常の場合、癌が由来する細胞において発現されないかまたは発現されることが疑われない、ならびに/あるいは
癌が前記阻害剤に対して感受性でない、ならびに/あるいは
少なくとも複数のT細胞がTECファミリーキナーゼを発現する、ならびに/あるいは
TECファミリーキナーゼがT細胞において発現される、ならびに/あるいは
TECファミリーキナーゼが通常の場合、T細胞において発現されない、
請求項1〜50のいずれか一項記載の方法。 - 前記阻害剤が、小分子、ペプチド、タンパク質、抗体もしくはその抗原結合フラグメント、抗体模倣物、アプタマー、または核酸分子である、請求項1〜51のいずれか一項記載の方法。
- 前記阻害剤が、チロシンキナーゼの活性化を不可逆的に低減させるかまたは排除し、SEQ ID NO:18に示される配列における残基C481に対応するアミノ酸残基を含むチロシンキナーゼの活性部位において結合部位に特異的に結合し、かつ/あるいはチロシンキナーゼの自己リン酸化活性を低減させるかまたは排除する、請求項49〜52のいずれか一項記載の方法。
- 前記阻害剤がイブルチニブである、請求項1〜53のいずれか一項記載の方法。
- 前記阻害剤が、T細胞を含む組成物の投与開始と同時にまたは投与開始に続いて投与される、請求項1〜54のいずれか一項記載の方法。
- 前記阻害剤がT細胞の投与開始に続いて投与される、請求項1〜55のいずれか一項記載の方法。
- 前記阻害剤が、T細胞の投与開始の1時間以内もしくは約1時間以内に、2時間以内もしくは約2時間以内に、6時間以内もしくは約6時間以内に、12時間以内もしくは約12時間以内に、24時間以内もしくは約24時間以内に、48時間以内もしくは約48時間以内に、72時間以内もしくは約72時間以内に、96時間以内もしくは約96時間以内に、または1週間以内もしくは約1週間以内に投与される、請求項55または請求項56記載の方法。
- 前記阻害剤が、
対象由来の血液中の検出可能なT細胞療法の細胞数が、T細胞の投与を開始した後の先行する時点での対象における場合と比較して低下している時点、
血液中の検出可能なT細胞療法の細胞数が、T細胞の投与の投与開始の後で対象の血液中の検出可能なT細胞療法の細胞のピーク数または最大数の1.5倍未満もしくは約1.5倍未満、2倍未満もしくは約2倍未満、3倍未満もしくは約3倍未満、4倍未満もしくは約4倍未満、5倍未満もしくは約5倍未満、10倍未満もしくは約10倍未満、50倍未満もしくは約50倍未満、100倍未満もしくは約100倍未満、またはそれ以下である時点、ならびに/あるいは
T細胞療法の細胞のピークレベルまたは最大レベルが対象の血液中で検出可能となった後の時点で、対象由来の血液中の検出可能なT細胞の細胞数もしくは該T細胞に由来する細胞数が、対象の血液中の総末梢血単核細胞(PBMC)の10%未満、5%未満、1%未満または0.1%未満よりも少ない時点
で投与される、請求項55〜57のいずれか一項記載の方法。 - 増大または低下が、1.2倍超もしくは約1.2倍超、1.5倍超もしくは約1.5倍超、2倍超もしくは約2倍超、3倍超もしくは約3倍超、4倍超もしくは約4倍超、5倍超もしくは約5倍超、10倍超もしくは約10倍超、またはそれ以上である、請求項58記載の方法。
- 前記阻害剤が、T細胞の投与の投与開始の2日後までに、7日後までに、14日後までに、21日後までに、30日後もしくは1ヶ月後までに、60日後もしくは2ヶ月後までに、90日後もしくは3ヶ月後までに、6ヶ月後までに、または1年後までに、ある期間にわたって投与される、請求項1〜59のいずれか一項記載の方法。
- 前記阻害剤が、T細胞の投与開始の3ヶ月後までにまたは90日後までに投与される、請求項1〜60のいずれか一項記載の方法。
- 前記阻害剤の投与が、少なくともT細胞の投与の開始後から、
対象由来の血液中の検出可能な投与されたT細胞の細胞数もしくは該T細胞に由来する細胞数が、前記阻害剤の投与直前の先行する時点での対象における場合と比較してまたはT細胞療法を投与した後での先行する時点と比較して、増大するまで、
血液中の検出可能なT細胞の細胞数もしくは該T細胞に由来する細胞数が、T細胞の投与の開始後に対象の血液中で認められるピーク数もしくは最大数の2倍以内もしくは1/2倍以内であるまで、
対象由来の血液中の検出可能なT細胞の細胞数が、対象の血液中の総末梢血単核細胞(PBMC)の10%超もしくは約10%超、15%超もしくは約15%超、20%超もしくは約20%超、30%超もしくは約30%超、40%超もしくは約40%超、50%超もしくは約50%超、または60%超もしくは約60%超となるまで、ならびに/あるいは
T細胞を投与する直前の時点または阻害剤を投与する直前の時点での腫瘍負荷量と比較して、対象が腫瘍負荷量における低下を示すまで、ならびに/あるいは
対象が完全寛解または臨床的寛解を示すまで
継続される、請求項1〜61のいずれか一項記載の方法。 - 前記阻害剤が、経口投与、皮下投与、または静脈内投与される、請求項1〜62のいずれか一項記載の方法。
- 前記阻害剤が経口投与される、請求項63記載の方法。
- 前記阻害剤が1日に6回、1日に5回、1日に4回、1日に3回、1日に2回、1日に1回、1日おきに、週に3回、または少なくとも週に1回、投与される、請求項1〜64のいずれか一項記載の方法。
- 前記阻害剤が、1日に1回または1日に2回、投与される、請求項65記載の方法。
- 前記阻害剤が、少なくとも50 mg/日もしくは少なくとも約50 mg/日、少なくとも100 mg/日もしくは少なくとも約100 mg/日、少なくとも150 mg/日もしくは少なくとも約150 mg/日、少なくとも175 mg/日もしくは少なくとも約175 mg/日、少なくとも200 mg/日もしくは少なくとも約200 mg/日、少なくとも250 mg/日もしくは少なくとも約250 mg/日、少なくとも280 mg/日もしくは少なくとも約280 mg/日、少なくとも300 mg/日もしくは少なくとも約300 mg/日、少なくとも350 mg/日もしくは少なくとも約350 mg/日、少なくとも400 mg/日もしくは少なくとも約400 mg/日、少なくとも420 mg/日もしくは少なくとも約420 mg/日、少なくとも450 mg/日もしくは少なくとも約450 mg/日、少なくとも500 mg/日もしくは少なくとも約500 mg/日、少なくとも600 mg/日もしくは少なくとも約600 mg/日、少なくとも700 mg/日もしくは少なくとも約700 mg/日、少なくとも800 mg/日もしくは少なくとも約800 mg/日、またはそれ以上の一日総投薬量で投与される、請求項1〜66のいずれか一項記載の方法。
- 前記阻害剤が、少なくとも420 mg/日または少なくとも約420 mg/日または約420 mg/日または420 mg/日の一日総投薬量で投与される、請求項67記載の方法。
- 前記阻害剤が1日あたり420 mg未満または約420 mg未満または約420 mgまたは420 mgの量で、任意で1日あたり少なくとも280 mgまたは少なくとも約280 mgである量で投与される、請求項1〜67のいずれか一項記載の方法。
- T細胞療法が、CD4+またはCD8+であるT細胞を含む、請求項1〜69のいずれか一項記載の方法。
- T細胞療法が、対象に対して自家である細胞を含む、請求項1〜70のいずれか一項記載の方法。
- T細胞療法が、対象に対して同種であるT細胞を含む、請求項1〜71のいずれか一項記載の方法。
- T細胞療法が、それぞれが両端の値を含む5 x 105細胞/kg(対象体重)〜1 x 107細胞/kgの間もしくはおよそ5 x 105細胞/kg(対象体重)〜1 x 107細胞/kgの間、0.5 x 106細胞/kg〜5 x 106細胞/kgの間もしくはおよそ0.5 x 106細胞/kg〜5 x 106細胞/kgの間、0.5 x 106細胞/kg〜3 x 106細胞/kgの間もしくはおよそ0.5 x 106細胞/kg〜3 x 106細胞/kgの間、0.5 x 106細胞/kg〜2 x 106細胞/kgの間もしくはおよそ0.5 x 106細胞/kg〜2 x 106細胞/kgの間、0.5 x 106細胞/kg〜1 x 106細胞/kgの間もしくはおよそ0.5 x 106細胞/kg〜1 x 106細胞/kgの間、1.0 x 106細胞/kg(対象体重)〜5 x 106細胞/kgの間もしくはおよそ1.0 x 106細胞/kg(対象体重)〜5 x 106細胞/kgの間、1.0 x 106細胞/kg〜3 x 106細胞/kgの間もしくはおよそ1.0 x 106細胞/kg〜3 x 106細胞/kgの間、1.0 x 106細胞/kg〜2 x 106細胞/kgの間もしくはおよそ1.0 x 106細胞/kg〜2 x 106細胞/kgの間、2.0 x 106細胞/kg(対象体重)〜5 x 106細胞/kgの間もしくはおよそ2.0 x 106細胞/kg(対象体重)〜5 x 106細胞/kgの間、2.0 x 106細胞/kg〜3 x 106細胞/kgの間もしくはおよそ2.0 x 106細胞/kg〜3 x 106細胞/kgの間、または3.0 x 106細胞/kg(対象体重)〜5 x 106細胞/kgの間もしくはおよそ3.0 x 106細胞/kg(対象体重)〜5 x 106細胞/kgの間での細胞数を含む用量の投与を含む、請求項1〜72のいずれか一項記載の方法。
- T細胞療法が、1 x 108個未満もしくは約1 x 108個未満もしくは約1 x 108個もしくは1 x 108個の総組換え受容体発現細胞、任意でCAR+細胞、総T細胞もしくは総末梢血単核細胞(PBMC)、例えば、5 x 107個未満もしくは約5 x 107個未満もしくは約5 x 107個もしくは5 x 107個、2.5 x 107個未満もしくは約2.5 x 107個未満もしくは約2.5 x 107個もしくは2.5 x 107個、1.0 x 107個未満もしくは約1.0 x 107個未満もしくは約1.0 x 107個もしくは1.0 x 107個、5.0 x 106個未満もしくは約5.0 x 106個未満もしくは約5.0 x 106個もしくは5.0 x 106個、1.0 x 106個未満もしくは約1.0 x 106個未満もしくは約1.0 x 106個もしくは1.0 x 106個、5.0 x 105個未満もしくは約5.0 x 105個未満もしくは約5.0 x 105個もしくは5.0 x 105個、または1 x 105個未満もしくは約1 x 105個未満もしくは約1 x 105個もしくは1 x 105個などの総組換え受容体発現細胞、任意でCAR+細胞、総T細胞もしくは総末梢血単核細胞(PBMC)を含む細胞の用量の投与を含む、請求項1〜72のいずれか一項記載の方法。
- T細胞療法が、両端の値を含む1 x 105個〜1 x 108個の総組換え受容体発現細胞、任意でCAR+細胞、総T細胞もしくは総末梢血単核細胞(PBMC)、例えば、それぞれが両端の値を含む1 x 105個〜5 x 107個、1 x 105個〜2.5 x 107個、1 x 105個〜1.0 x 107個、1 x 105個〜5.0 x 106個、1 x 105個〜1.0 x 106個、1.0 x 105個〜5.0 x 105個、5.0 x 105個〜5 x 107個、5 x 105個〜2.5 x 107個、5 x 105個〜1.0 x 107個、5 x 105個〜5.0 x 106個、5 x 105個〜1.0 x 106個、1.0 x 106個〜5 x 107個、1 x 106個〜2.5 x 107個、1 x 106個〜1.0 x 107個、1 x 106個〜5.0 x 106個、5.0 x 106個〜5 x 107個、5 x 106個〜2.5 x 107個、5 x 106個〜1.0 x 107個、1.0 x 107個〜5 x 107個、1 x 107個〜2.5 x 107個、または2.5 x 107個〜5 x 107個などの総組換え受容体発現細胞、任意でCAR+細胞、総T細胞もしくは総末梢血単核細胞(PBMC)を含む細胞の用量の投与を含む、請求項1〜72および74のいずれか一項記載の方法。
- 細胞の用量は、組換え受容体を発現するCD4+細胞の、組換え受容体を発現するCD8+細胞に対する定義された比率、および/または、CD4+細胞の、CD8+細胞に対する定義された比率を含み、そのような比率は任意でおよそ1:1であるかまたはおよそ1:3〜およそ3:1の間である、請求項1〜75のいずれか一項記載の方法。
- 投与される細胞の用量が、T細胞療法が阻害剤の投与を伴うことなく投与される方法における用量よりも少ない、請求項1〜76のいずれか一項記載の方法。
- 前記用量が、少なくとも1.5倍、2倍、3倍、4倍、5倍または10倍少ない、請求項77記載の方法。
- T細胞が、任意で細胞を含む単一の薬学的組成物である単一用量で投与される、請求項1〜78のいずれか一項記載の方法。
- T細胞が分割用量として投与され、単一用量の細胞が、最大でも3日の期間にわたって、合計して前記用量の細胞を含む複数の組成物で投与され、かつ/または、
前記方法が、T細胞の1つまたは複数のさらなる用量を投与する工程をさらに含む、
請求項1〜79のいずれか一項記載の方法。 - T細胞の投与に先立ってリンパ球枯渇化学療法を投与する工程をさらに含み、かつ/または
T細胞の投与に先立って対象がリンパ球枯渇化学療法を受けたことがある、
請求項1〜80のいずれか一項記載の方法。 - リンパ球枯渇化学療法が、フルダラビンおよび/またはシクロホスファミドを対象に投与することを含む、請求項81記載の方法。
- リンパ球枯渇療法が、両端の値を含む約200 mg/m2〜400 mg/m2、任意で300 mg/m2もしくは約300 mg/m2でシクロホスファミドを、および/または約20 mg/m2〜40 mg/m2、任意で30 mg/m2でフルダラビンを、それぞれが2日間〜4日間、任意で3日間にわたって毎日、投与することを含む、請求項82記載の方法。
- リンパ球枯渇療法が、300 mg/m2もしくは約300 mg/m2でシクロホスファミドを、約30 mg/m2でフルダラビンを、3日間にわたってそれぞれ毎日、投与することを含む、請求項82または請求項83記載の方法。
- 免疫調節剤を対象に投与する工程をさらに含み、
細胞の投与および免疫調節剤の投与が、同時に、別々に、もしくは単一の組成物において、または、どちらの順序であれ逐次的に行われる、
請求項1〜84のいずれか一項記載の方法。 - 免疫調節剤が、分子の機能または分子を伴うシグナル伝達経路を阻害またはブロックすることができ、該分子が免疫阻害性分子であり、かつ/または該分子が免疫チェックポイント分子である、請求項85記載の方法。
- 免疫チェックポイント分子または経路が、PD-1、PD-L1、PD-L2、CTLA-4、LAG-3、TIM3、VISTA、アデノシン2A受容体(A2AR)もしくはアデノシン、または前述のいずれかを伴う経路からなる群より選択される、請求項86記載の方法。
- 免疫調節剤が、任意で抗体フラグメント、単鎖抗体、多重特異性抗体、もしくは免疫コンジュゲートである抗体であるか、または該抗体を含む、請求項85〜87のいずれか一項記載の方法。
- 前記抗体が、免疫チェックポイント分子またはそのリガンドもしくは受容体に特異的に結合する、ならびに/あるいは
前記抗体が、免疫チェックポイント分子とそのリガンドまたは受容体との間の相互作用をブロックするかまたは損なうことができる、請求項88記載の方法。 - 阻害剤の非存在下でT細胞療法が対象に投与される方法と比較して、T細胞療法が、対象における増大したまたは長期にわたる増殖および/または持続性を示す、請求項1〜89のいずれか一項記載の方法。
- 阻害剤の非存在下でT細胞療法が対象に投与される同等の方法により認められるであろう低下と比較して、腫瘍負荷量をより大きい程度におよび/またはより長期間にわたって低下させる、請求項1〜89のいずれか一項記載の方法。
- B細胞抗原以外の抗原、またはCD19、CD20、CD22およびROR1からなる群より選択されるB細胞抗原以外の抗原に結合する組換え受容体を発現する遺伝子操作されたT細胞と、
TECファミリーキナーゼの阻害剤と
を含む、組み合わせ。 - 前記抗原が、Her2、L1-CAM、メソテリン、CEA、B型肝炎表面抗原、抗葉酸受容体、CD23、CD24、CD38、CD44、EGFR、EGP-2、EGP-4、EPHa2、ErbB2、3もしくは4、erbB二量体、EGFR vIII、FBP、FCRL5、FCRH5、胎児アセチルコリンe受容体、GD2、GD3、HMW-MAA、IL-22R-アルファ、IL-13R-アルファ2、kdr、Lewis Y、L1-細胞接着分子(L1-CAM)、メラノーマ関連抗原(MAGEMAGE-A1、MAGE-A3、MAGE-A6、メラノーマの優先的発現抗原(PRAME)、サバイビン、EGP2、EGP40、TAG72、B7-H6、IL-13受容体a2(IL-13Ra2)、CA9、GD3、HMW-MAA、CD171、G250/CAIX、HLA-AI MAGE Al、HLA-A2 NY-ESO-1、PSCA、葉酸受容体-a、CD44v6、CD44v7/8、avb6インテグリン、8H9、NCAM、VEGF受容体、5T4、胎児AchR、NKG2Dリガンド、CD44v6、二重抗原、およびユニバーサルタグに関連する抗原、癌精巣抗原、メソテリン、MUC1、MUC16、PSCA、NKG2Dリガンド、NY-ESO-1、MART-1、gp100、Gタンパク質共役受容体5D(GPCR5D)、腫瘍胎児性抗原、TAG72、VEGF-R2、癌胎児性抗原(CEA)、前立腺特異的抗原、PSMA、エストロゲン受容体、プロゲステロン受容体、エフリンB2、CD123、c-Met、GD-2 O-アセチル化GD2(OGD2)、CE7、ウィルムス腫瘍1(WT-1)、サイクリン、サイクリンA2、CCL-1、CD138、ならびに病原体特異的抗原の中から選択される、請求項92記載の組み合わせ。
- 前記抗原が、ウイルス抗原、細菌抗原、または寄生虫抗原である病原体特異的抗原である、請求項92または請求項93記載の組み合わせ。
- 組換え受容体が、トランスジェニックT細胞受容体(TCR)または機能的な非T細胞受容体である、請求項92〜94のいずれか一項記載の組み合わせ。
- 組換え受容体が、任意でキメラ抗原受容体(CAR)であるキメラ受容体である、請求項92〜95のいずれか一項記載の組み合わせ。
- 組換え受容体が、前記抗原に特異的に結合する細胞外の抗原認識ドメインと、ITAMを含む細胞内のシグナル伝達ドメインとを含む、請求項92〜96のいずれか一項記載の組み合わせ。
- 細胞内のシグナル伝達ドメインがCD3ゼータ(CD3ζ)鎖の細胞内ドメインを含む、請求項97記載の組み合わせ。
- 組換え受容体が共刺激性のシグナル伝達領域をさらに含む、請求項97または請求項98記載の組み合わせ。
- 共刺激性のシグナル伝達領域がCD28または4-1BBのシグナル伝達ドメインを含む、請求項99記載の組み合わせ。
- 共刺激性ドメインがCD28のドメインである、請求項99または請求項100記載の組み合わせ。
- 前記阻害剤が1つまたは複数のチロシンキナーゼを阻害し、該チロシンキナーゼのそれぞれが個々に、ブルトン型チロシンキナーゼ(Btk)、IL2誘導性T細胞キナーゼ(ITK)、肝細胞癌において発現されるチロシンキナーゼ(TEC)、染色体Xに対するチロシンキナーゼ骨髄キナーゼ(BMX)、およびT細胞X染色体キナーゼ(TXK;休止期リンパ球キナーゼ、RLK)からなる群より選択される、ならびに/あるいは
TECファミリーキナーゼが、ブルトン型チロシンキナーゼ(Btk)、IL2誘導性T細胞キナーゼ(ITK)、肝細胞癌において発現されるチロシンキナーゼ(TEC)、染色体Xに対するチロシンキナーゼ骨髄キナーゼ(BMX)、およびT細胞X染色体キナーゼ(TXK;休止期リンパ球キナーゼ、RLK)からなる群より選択される1つまたは複数のTECファミリーキナーゼを含む、ならびに/あるいは
TECファミリーキナーゼがBtkであるかまたはBtkを含む、
請求項79〜88のいずれか一項記載の組み合わせ。 - TECファミリーキナーゼが癌の細胞によって発現されず、通常の場合、癌が由来する細胞において発現されないかまたは発現されることが疑われない、ならびに/あるいは
癌が前記阻害剤に対して感受性でない、ならびに/あるいは
少なくとも複数のT細胞がTECファミリーキナーゼを発現する、ならびに/あるいは
TECファミリーキナーゼがT細胞において発現される、ならびに/あるいは
TECファミリーキナーゼが通常の場合、T細胞において発現されない、
請求項92〜102のいずれか一項記載の組み合わせ。 - 前記阻害剤が、小分子、ペプチド、タンパク質、抗体もしくはその抗原結合フラグメント、抗体模倣物、アプタマー、または核酸分子である、請求項92〜103のいずれか一項記載の組み合わせ。
- 前記阻害剤が、チロシンキナーゼの活性化を不可逆的に低減させるかまたは排除し、SEQ ID NO:18に示される配列における残基C481に対応するアミノ酸残基を含むチロシンキナーゼの活性部位において結合部位に特異的に結合し、かつ/あるいはチロシンキナーゼの自己リン酸化活性を低減させるかまたは排除する、請求項92〜104のいずれか一項記載の組み合わせ。
- 前記阻害剤がイブルチニブである、請求項92〜105のいずれか一項記載の組み合わせ。
- 同じ組成物において製剤化される、請求項92〜106のいずれか一項記載の組み合わせ。
- 別々の組成物において製剤化される、請求項92〜107のいずれか一項記載の組み合わせ。
- 請求項92〜108のいずれか一項記載の組み合わせと、
遺伝子操作細胞および阻害剤またはTECファミリーキナーゼを、癌を処置するための対象に投与するための説明書と
を含む、キット。 - B細胞抗原以外の抗原、またはCD19、CD20、CD22、およびROR1からなる群より選択されるB細胞抗原以外の抗原に結合する組換え受容体を発現する遺伝子操作T細胞の治療有効量を含む組成物と、
TECファミリーキナーゼの阻害剤を用いた併用治療において、遺伝子操作細胞を、癌を処置するための対象に投与するための説明書と
を含む、キット。 - TECファミリーキナーゼの阻害剤の治療有効量を含む組成物と、
B細胞抗原以外の抗原、またはCD19、CD20、CD22、およびROR1からなる群より選択されるB細胞抗原以外の抗原に結合する組換え受容体を発現する遺伝子操作T細胞を用いた併用治療において、TECファミリーキナーゼの阻害剤を、癌を処置するための対象に投与するための説明書と
を含む、キット。 - 癌が、B細胞抗原を発現する癌でなく、非血液癌であり、B細胞悪性腫瘍でなく、B細胞白血病でなく、または固形腫瘍である、請求項109〜111のいずれか一項記載のキット。
- 癌が、肉腫、癌腫、リンパ腫、白血病、または骨髄腫であり、任意で癌が、非ホジキンリンパ腫(NHL)、びまん性大細胞型B細胞リンパ腫(DLBCL)、CLL、SLL、ALL、またはAMLである、請求項109〜112のいずれか一項記載のキット。
- 癌が、膵臓癌、膀胱癌、結腸直腸癌、乳癌、前立腺癌、腎臓癌、肝細胞癌、肺癌、卵巣癌、子宮頸癌、膵臓癌、直腸癌、甲状腺癌、子宮癌、胃癌、食道癌、頭頸部癌、メラノーマ、神経内分泌癌、CNS癌、脳腫瘍、骨癌、または軟部組織肉腫である、請求項109〜113のいずれか一項記載のキット。
- 説明書が、投与が対象に対するものであることを規定し、この場合、
(i)対象および/または癌は、(a)ブルトン型チロシンキナーゼ(BTK)の阻害に対して抵抗性であり、かつ/または(b)該阻害剤による阻害に対して抵抗性である細胞の集団を含む、
(ii)対象および/または癌は、BTKをコードする核酸における変異を含み、任意で変異は、該阻害剤によるおよび/またはイブルチニブによるBTKの阻害を低減させるかまたは防止することができ、任意で変異はC481Sである、
(iii)対象および/または癌は、ホスホリパーゼCガンマ2(PLCガンマ2)をコードする核酸における変異を含み、任意で変異は構成的なシグナル伝達活性を生じさせ、任意で変異はR665WまたはL845Fである、
(iv)T細胞を含む組成物の投与開始時およびTECファミリーキナーゼの阻害剤の投与開始時において、対象は、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置の後での寛解の後で再発しており、または、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置に対して難治性であるとみなされている、
(v)T細胞を含む組成物の投与開始時およびTECファミリーキナーゼの阻害剤の投与開始時において、対象は、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置の後で進行しており、任意で対象は、以前の処置に対する最良の応答として進行性疾患を、または以前の処置に対する以前の応答の後で進行を示した、ならびに/あるいは
(vi)TECファミリーキナーゼの阻害剤の投与開始時およびT細胞を含む組成物の投与開始時において、対象は、完全奏功(CR)に達しない応答を、該阻害剤によるおよび/もしくはBTK阻害剤療法による少なくとも6ヶ月にわたる以前の処置の後で示した、
請求項109〜114のいずれか一項記載のキット。 - TECファミリーキナーゼの阻害剤の治療有効量を含む組成物と、
癌に関連する抗原、もしくは癌の細胞上に発現される抗原、もしくは癌の細胞上に存在する抗原、および/または、癌を特異的に標的としかつ対象に投与されたことがあるもしくは投与されることになる治療剤に含まれるタグを特異的に認識するかあるいは該抗原または該タグと特異的に結合する遺伝子操作T細胞を用いた併用治療において、TECファミリーキナーゼの阻害剤を、癌を処置するための対象に投与するための説明書と
を含むキットであって、説明書が、
(i)対象および/または癌は、(a)ブルトン型チロシンキナーゼ(BTK)の阻害に対して抵抗性であり、かつ/または(b)該阻害剤による阻害に対して抵抗性である細胞の集団を含むこと、
(ii)対象および/または癌は、BTKをコードする核酸における変異を含み、任意で変異は、該阻害剤によるおよび/またはイブルチニブによるBTKの阻害を低減させるかまたは防止することができ、任意で変異はC481Sであること、
(iii)対象および/または癌は、ホスホリパーゼCガンマ2(PLCガンマ2)をコードする核酸における変異を含み、任意で変異は構成的なシグナル伝達活性を生じさせ、任意で変異はR665WまたはL845Fであること、
(iv)T細胞を含む組成物の投与開始時およびTECファミリーキナーゼの阻害剤の投与開始時において、対象は、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置の後での寛解の後で再発しており、または、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置に対して難治性であるとみなされていること、
(v)T細胞を含む組成物の投与開始時およびTECファミリーキナーゼの阻害剤の投与開始時において、対象は、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置の後で進行しており、任意で対象は、以前の処置に対する最良の応答として進行性疾患を、または以前の処置に対する以前の応答の後で進行を示したこと、ならびに/あるいは
(vi)TECファミリーキナーゼの阻害剤の投与開始時およびT細胞を含む組成物の投与開始時において、対象は、完全奏功(CR)に達しない応答を、該阻害剤によるおよび/もしくはBTK阻害剤療法による少なくとも6ヶ月にわたる以前の処置の後で示したこと
を規定する、キット。 - 癌に関連する抗原、もしくは癌の細胞上に発現される抗原、もしくは癌の細胞上に存在する抗原、および/または、癌を特異的に標的としかつ対象に投与されたことがあるもしくは投与されることになる治療剤に含まれるタグを特異的に認識するかあるいは該抗原または該タグと特異的に結合する遺伝子操作T細胞の治療有効量を含む組成物と、
TECファミリーキナーゼの阻害剤を用いた併用治療において、該遺伝子操作細胞を、癌を処置するための対象に投与するための説明書と
を含むキットであって、説明書が、
(i)対象および/または癌は、(a)ブルトン型チロシンキナーゼ(BTK)の阻害に対して抵抗性であり、かつ/または(b)該阻害剤による阻害に対して抵抗性である細胞の集団を含むこと、
(ii)対象および/または癌は、BTKをコードする核酸における変異を含み、任意で変異は、該阻害剤によるおよび/またはイブルチニブによるBTKの阻害を低減させるかまたは防止することができ、任意で変異はC481Sであること、
(iii)対象および/または癌は、ホスホリパーゼCガンマ2(PLCガンマ2)をコードする核酸における変異を含み、任意で変異は構成的なシグナル伝達活性を生じさせ、任意で変異はR665WまたはL845Fであること、
(iv)T細胞を含む組成物の投与開始時およびTECファミリーキナーゼの阻害剤の投与開始時において、対象は、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置の後での寛解の後で再発しており、または、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置に対して難治性であるとみなされていること、
(v)T細胞を含む組成物の投与開始時およびTECファミリーキナーゼの阻害剤の投与開始時において、対象は、該阻害剤によるおよび/もしくはBTK阻害剤療法による以前の処置の後で進行しており、任意で対象は、以前の処置に対する最良の応答として進行性疾患を、または以前の処置に対する以前の応答の後で進行を示したこと、ならびに/あるいは
(vi)TECファミリーキナーゼの阻害剤の投与開始時およびT細胞を含む組成物の投与開始時において、対象は、完全奏功(CR)に達しない応答を、該阻害剤によるおよび/もしくはBTK阻害剤療法による少なくとも6ヶ月にわたる以前の処置の後で示したこと
を規定する、キット。 - 細胞の集団が、B細胞の集団であるかもしくはB細胞の集団を含み、かつ/またはT細胞を含まない、請求項115〜117のいずれか一項記載のキット。
- 癌がB細胞悪性腫瘍である、請求項116〜118のいずれか一項記載のキット。
- B細胞悪性腫瘍が、白血病、リンパ腫、または骨髄腫である、請求項119記載の方法。
- B細胞悪性腫瘍が、急性リンパ芽球性白血病(ALL)、成人ALL、慢性リンパ芽球性白血病(CLL)、小リンパ球性白血病(SLL)、非ホジキンリンパ腫(NHL)、びまん性大細胞型B細胞リンパ腫(DLBCL)、または急性骨髄性白血病(AML)である、請求項119または請求項120記載の方法。
- B細胞悪性腫瘍がCLLまたはSLLである、請求項119〜121のいずれか一項記載の方法。
- T細胞が、B細胞成熟抗原(BCMA)、CD19、CD20、CD22、およびROR1から選択される抗原を認識するかまたは標的とする、請求項116〜122のいずれか一項記載の方法。
- 説明書が、投与することを、
(i)任意で少なくとも1つの細胞遺伝学的異常が17p欠失である、1つまたは複数の細胞遺伝学的異常、任意で少なくとも2つまたは3つの細胞遺伝学的異常、
(ii)TP53変異、および/または
(iii)変異していない免疫グロブリン重鎖可変領域(IGHV)
であるかあるいはこれらを有するとして特定されるB細胞悪性腫瘍を有する対象
のためのものであると規定する、請求項116〜123のいずれか一項記載の方法。 - 説明書が、投与することを、
B細胞悪性腫瘍を処置するための1つまたは複数の先行療法による処置、任意で組換え受容体を発現する細胞の別の用量とは異なる1つ、2つ、または3つの先行療法による処置に失敗しているか、あるいはそのような先行療法による処置の後での寛解の後で再発しているか、あるいはそのような先行療法に対して難治性になっている対象
のためのものであると規定し、
任意で少なくとも1つの先行療法が、前記阻害剤またはBTK阻害剤療法による以前の処置であった、
請求項116〜124のいずれか一項記載の方法。 - 以前の処置がイブルチニブによる以前の処置であった、請求項116〜125のいずれか一項記載の方法。
- BTKをコードする核酸における変異が、位置C481における置換、任意でC481SまたはC481R、および/または位置T474における置換、任意でT474IまたはT474Mを含む、請求項115または請求項118記載のキット。
- 前記抗原が、Her2、L1-CAM、メソテリン、CEA、B型肝炎表面抗原、抗葉酸受容体、CD23、CD24、CD38、CD44、EGFR、EGP-2、EGP-4、EPHa2、ErbB2、3もしくは4、erbB二量体、EGFR vIII、FBP、FCRL5、FCRH5、胎児アセチルコリンe受容体、GD2、GD3、HMW-MAA、IL-22R-アルファ、IL-13R-アルファ2、kdr、Lewis Y、L1-細胞接着分子(L1-CAM)、メラノーマ関連抗原(MAGEMAGE-A1、MAGE-A3、MAGE-A6、メラノーマの優先的発現抗原(PRAME)、サバイビン、EGP2、EGP40、TAG72、B7-H6、IL-13受容体a2(IL-13Ra2)、CA9、GD3、HMW-MAA、CD171、G250/CAIX、HLA-AI MAGE Al、HLA-A2 NY-ESO-1、PSCA、葉酸受容体-a、CD44v6、CD44v7/8、avb6インテグリン、8H9、NCAM、VEGF受容体、5T4、胎児AchR、NKG2Dリガンド、CD44v6、二重抗原、およびユニバーサルタグに関連する抗原、癌精巣抗原、メソテリン、MUC1、MUC16、PSCA、NKG2Dリガンド、NY-ESO-1、MART-1、gp100、Gタンパク質共役受容体5D(GPCR5D)、腫瘍胎児性抗原、TAG72、VEGF-R2、癌胎児性抗原(CEA)、前立腺特異的抗原、PSMA、エストロゲン受容体、プロゲステロン受容体、エフリンB2、CD123、c-Met、GD-2 O-アセチル化GD2(OGD2)、CE7、ウィルムス腫瘍1(WT-1)、サイクリン、サイクリンA2、CCL-1、CD138、ならびに病原体特異的抗原の中から選択される、請求項110〜127のいずれか一項記載のキット。
- 前記抗原が、ウイルス抗原、細菌抗原、または寄生虫抗原である病原体特異的抗原である、請求項110〜128のいずれか一項記載のキット。
- 組換え受容体が、トランスジェニックT細胞受容体(TCR)または機能的な非T細胞受容体である、請求項110〜129のいずれか一項記載のキット。
- 組換え受容体が、任意でキメラ抗原受容体(CAR)であるキメラ受容体である、請求項110〜130のいずれか一項記載のキット。
- 組換え受容体が、前記抗原に特異的に結合する細胞外の抗原認識ドメインと、ITAMを含む細胞内のシグナル伝達ドメインとを含む、請求項110〜131のいずれか一項記載のキット。
- 細胞内のシグナル伝達ドメインがCD3ゼータ(CD3ζ)鎖の細胞内ドメインを含む、請求項132記載のキット。
- 組換え受容体が共刺激性のシグナル伝達領域をさらに含む、請求項132または請求項133記載のキット。
- 共刺激性のシグナル伝達領域がCD28または4-1BBのシグナル伝達ドメインを含む、請求項134記載のキット。
- 共刺激性ドメインがCD28のドメインである、請求項134または請求項135記載のキット。
- 前記阻害剤が1つまたは複数のチロシンキナーゼを阻害し、該チロシンキナーゼのそれぞれが個々に、ブルトン型チロシンキナーゼ(Btk)、IL2誘導性T細胞キナーゼ(ITK)、肝細胞癌において発現されるチロシンキナーゼ(TEC)、染色体Xに対するチロシンキナーゼ骨髄キナーゼ(BMX)、およびT細胞X染色体キナーゼ(TXK;休止期リンパ球キナーゼ、RLK)からなる群より選択される、ならびに/あるいは
TECファミリーキナーゼが、ブルトン型チロシンキナーゼ(Btk)、IL2誘導性T細胞キナーゼ(ITK)、肝細胞癌において発現されるチロシンキナーゼ(TEC)、染色体Xに対するチロシンキナーゼ骨髄キナーゼ(BMX)、およびT細胞X染色体キナーゼ(TXK;休止期リンパ球キナーゼ、RLK)からなる群より選択される1つまたは複数のTECファミリーキナーゼを含む、ならびに/あるいは
TECファミリーキナーゼがBtkであるかまたはBtkを含む、
請求項110〜136のいずれか一項記載のキット。 - TECファミリーキナーゼが癌の細胞によって発現されず、通常の場合、癌が由来する細胞において発現されないかまたは発現されることが疑われない、ならびに/あるいは
癌が前記阻害剤に対して感受性でない、ならびに/あるいは
少なくとも複数のT細胞がTECファミリーキナーゼを発現する、ならびに/あるいは
TECファミリーキナーゼがT細胞において発現される、ならびに/あるいは
TECファミリーキナーゼが通常の場合、T細胞において発現されない、
請求項110〜137のいずれか一項記載のキット。 - 前記阻害剤が、小分子、ペプチド、タンパク質、抗体もしくはその抗原結合フラグメント、抗体模倣物、アプタマー、または核酸分子である、請求項110〜138のいずれか一項記載のキット。
- 前記阻害剤が、チロシンキナーゼの活性化を不可逆的に低減させるかまたは排除し、SEQ ID NO:18に示される配列における残基C481に対応するアミノ酸残基を含むチロシンキナーゼの活性部位において結合部位に特異的に結合し、かつ/あるいはチロシンキナーゼの自己リン酸化活性を低減させるかまたは排除する、請求項110〜139のいずれか一項記載のキット。
- 前記阻害剤がイブルチニブである、請求項110〜140のいずれか一項記載のキット。
- 説明書が、T細胞を含む組成物の投与開始と同時にまたは投与開始に続いて、前記阻害剤を投与することを規定する、請求項110〜141のいずれか一項記載のキット。
- 説明書が、T細胞の投与開始に続いて前記阻害剤を投与することを規定する、請求項110〜142のいずれか一項記載のキット。
- 説明書が、
T細胞の投与開始の1時間以内もしくは約1時間以内に、2時間以内もしくは約2時間以内に、6時間以内もしくは約6時間以内に、12時間以内もしくは約12時間以内に、24時間以内もしくは約24時間以内に、48時間以内もしくは約48時間以内に、72時間以内もしくは約72時間以内に、96時間以内もしくは約96時間以内に、または1週間以内もしくは約1週間以内に、前記阻害剤を投与すること
を規定する、請求項142または請求項143記載のキット。 - 説明書が、
対象由来の血液中の検出可能なT細胞療法の細胞数が、T細胞の投与を開始した後の先行する時点での対象における場合と比較して低下している時点、
血液中の検出可能なT細胞療法の細胞数が、T細胞の投与の投与開始の後で対象の血液中の検出可能なT細胞療法の細胞のピーク数または最大数の1.5倍未満もしくは約1.5倍未満、2倍未満もしくは約2倍未満、3倍未満もしくは約3倍未満、4倍未満もしくは約4倍未満、5倍未満もしくは約5倍未満、10倍未満もしくは約10倍未満、50倍未満もしくは約50倍未満、100倍未満もしくは約100倍未満、またはそれ以下である時点、ならびに/あるいは
T細胞療法の細胞のピークレベルまたは最大レベルが対象の血液中で検出可能となった後の時点で、対象由来の血液中の検出可能なT細胞の細胞数もしくは該T細胞に由来する細胞数が、対象の血液中の総末梢血単核細胞(PBMC)の10%未満、5%未満、1%未満または0.1%未満よりも少ない時点
で阻害剤を投与することを規定する、請求項142〜144のいずれか一項記載のキット。 - 増大または低下が、1.2倍超もしくは約1.2倍超、1.5倍超もしくは約1.5倍超、2倍超もしくは約2倍超、3倍超もしくは約3倍超、4倍超もしくは約4倍超、5倍超もしくは約5倍超、10倍超もしくは約10倍超、またはそれ以上である、請求項145記載のキット。
- 説明書が、
T細胞の投与の投与開始の2日後までに、7日後までに、14日後までに、21日後までに、1ヶ月後もしくは30日後までに、2ヶ月後もしくは60日後までに、3ヶ月後もしくは90日後までに、6ヶ月後までに、または1年後までに、ある期間にわたって前記阻害剤を投与する
ためのものである、請求項109〜146のいずれか一項記載のキット。 - 説明書が、T細胞の投与開始の少なくとも3ヶ月もしくは90日後までにまたは少なくとも3ヶ月間もしくは90日間にわたって、前記阻害剤を投与することを規定する、請求項109〜147のいずれか一項記載のキット。
- 説明書が、少なくともT細胞の投与の開始後から、
対象由来の血液中の検出可能な投与されたT細胞の細胞数もしくは該T細胞に由来する細胞数が、前記阻害剤の投与直前の先行する時点での対象における場合と比較してまたはT細胞療法を投与した後での先行する時点と比較して、増大するまで、
血液中の検出可能なT細胞の細胞数もしくは該T細胞に由来する細胞数が、T細胞の投与の開始後に対象の血液中で認められるピーク数もしくは最大数の2倍以内もしくは1/2倍以内であるまで、
対象由来の血液中の検出可能なT細胞の細胞数が、対象の血液中の総末梢血単核細胞(PBMC)の10%超もしくは約10%超、15%超もしくは約15%超、20%超もしくは約20%超、30%超もしくは約30%超、40%超もしくは約40%超、50%超もしくは約50%超、または60%超もしくは約60%超となるまで、ならびに/あるいは
T細胞を投与する直前の時点または阻害剤を投与する直前の時点での腫瘍負荷量と比較して、対象が腫瘍負荷量における低下を示すまで、ならびに/あるいは
対象が完全寛解または臨床的寛解を示すまで
前記阻害剤を投与することを規定する、請求項109〜148のいずれか一項記載のキット。 - 説明書が、前記阻害剤を経口投与、皮下投与、または静脈内投与することを規定する、請求項109〜149のいずれか一項記載のキット。
- 説明書が、前記阻害剤を経口投与することを規定する、請求項150記載のキット。
- 説明書が、1日に6回、1日に5回、1日に4回、1日に3回、1日に2回、1日に1回、1日おきに、週に3回、または少なくとも週に1回、前記阻害剤を投与することを規定する、請求項109〜151のいずれか一項記載のキット。
- 説明書が、1日に1回または1日に2回、前記阻害剤を投与することを規定する、請求項152記載のキット。
- 説明書が、少なくとも50 mg/日もしくは少なくとも約50 mg/日、少なくとも100 mg/日もしくは少なくとも約100 mg/日、少なくとも150 mg/日もしくは少なくとも約150 mg/日、少なくとも175 mg/日もしくは少なくとも約175 mg/日、少なくとも200 mg/日もしくは少なくとも約200 mg/日、少なくとも250 mg/日もしくは少なくとも約250 mg/日、少なくとも280 mg/日もしくは少なくとも約280 mg/日、少なくとも300 mg/日もしくは少なくとも約300 mg/日、少なくとも350 mg/日もしくは少なくとも約350 mg/日、少なくとも400 mg/日もしくは少なくとも約400 mg/日、少なくとも420 mg/日もしくは少なくとも約420 mg/日、少なくとも450 mg/日もしくは少なくとも約450 mg/日、少なくとも500 mg/日もしくは少なくとも約500 mg/日、少なくとも600 mg/日もしくは少なくとも約600 mg/日、少なくとも700 mg/日もしくは少なくとも約700 mg/日、少なくとも800 mg/日もしくは少なくとも約800 mg/日、またはそれ以上の一日総投薬量で阻害剤を投与することを規定する、請求項109〜153のいずれか一項記載のキット。
- 説明書が、少なくとも420 mg/日または約少なくとも420 mg/日または約420 mg/日または420 mg/日の一日投薬量で前記阻害剤を投与することを規定する、請求項109〜153のいずれか一項記載のキット。
- 説明書が、1日あたり420 mg未満または約420 mg未満または約420 mgまたは420 mgの量で、任意で1日あたり少なくとも280 mgまたは少なくとも約280 mgまたは約280 mgまたは280 mgである量で前記阻害剤を投与することを規定する、請求項109〜154のいずれか一項記載のキット。
- 遺伝子操作T細胞が、CD4+またはCD8+であるT細胞を含む、請求項109〜156のいずれか一項記載のキット。
- 遺伝子操作T細胞が、対象に対して自家である細胞を含む、請求項109〜157のいずれか一項記載のキット。
- 遺伝子操作T細胞が、対象に対して同種であるT細胞を含む、請求項109〜158のいずれか一項記載のキット。
- 説明書が、
それぞれが両端の値を含む5 x 105細胞/kg(対象体重)〜1 x 107細胞/kgの間もしくはおよそ5 x 105細胞/kg(対象体重)〜1 x 107細胞/kgの間、0.5 x 106細胞/kg〜5 x 106細胞/kgの間もしくはおよそ0.5 x 106細胞/kg〜5 x 106細胞/kgの間、0.5 x 106細胞/kg〜3 x 106細胞/kgの間もしくはおよそ0.5 x 106細胞/kg〜3 x 106細胞/kgの間、0.5 x 106細胞/kg〜2 x 106細胞/kgの間もしくはおよそ0.5 x 106細胞/kg〜2 x 106細胞/kgの間、0.5 x 106細胞/kg〜1 x 106細胞/kgの間もしくはおよそ0.5 x 106細胞/kg〜1 x 106細胞/kgの間、1.0 x 106細胞/kg(対象体重)〜5 x 106細胞/kgの間もしくはおよそ1.0 x 106細胞/kg(対象体重)〜5 x 106細胞/kgの間、1.0 x 106細胞/kg〜3 x 106細胞/kgの間もしくはおよそ1.0 x 106細胞/kg〜3 x 106細胞/kgの間、1.0 x 106細胞/kg〜2 x 106細胞/kgの間もしくはおよそ1.0 x 106細胞/kg〜2 x 106細胞/kgの間、2.0 x 106細胞/kg(対象体重)〜5 x 106細胞/kgの間もしくはおよそ2.0 x 106細胞/kg(対象体重)〜5 x 106細胞/kgの間、2.0 x 106細胞/kg〜3 x 106細胞/kgの間もしくはおよそ2.0 x 106細胞/kg〜3 x 106細胞/kgの間、または3.0 x 106細胞/kg(対象体重)〜5 x 106細胞/kgの間もしくはおよそ3.0 x 106細胞/kg(対象体重)〜5 x 106細胞/kgの間での細胞数を含む用量で、遺伝子操作T細胞を投与すること
を規定する、請求項109〜159のいずれか一項記載のキット。 - 説明書が、
1 x 108個未満もしくは約1 x 108個未満もしくは約1 x 108個もしくは1 x 108個の総組換え受容体発現細胞、任意でCAR+細胞、総T細胞もしくは総末梢血単核細胞(PBMC)、例えば、5 x 107個未満もしくは約5 x 107個未満もしくは約5 x 107個もしくは5 x 107個、2.5 x 107個未満もしくは約2.5 x 107個未満もしくは約2.5 x 107個もしくは2.5 x 107個、1.0 x 107個未満もしくは約1.0 x 107個未満もしくは約1.0 x 107個もしくは1.0 x 107個、5.0 x 106個未満もしくは約5.0 x 106個未満もしくは約5.0 x 106個もしくは5.0 x 106個、1.0 x 106個未満もしくは約1.0 x 106個未満もしくは約1.0 x 106個もしくは1.0 x 106個、5.0 x 105個未満もしくは約5.0 x 105個未満もしくは約5.0 x 105個もしくは5.0 x 105個、または1 x 105個未満もしくは約1 x 105個未満もしくは約1 x 105個もしくは1 x 105個などの総組換え受容体発現細胞、任意でCAR+細胞、総T細胞もしくは総末梢血単核細胞(PBMC)を含む用量で、遺伝子操作T細胞を投与すること
を規定する、請求項109〜159のいずれか一項記載のキット。 - 説明書が、
両端の値を含む1 x 105個〜1 x 108個の総組換え受容体発現細胞、任意でCAR+細胞、総T細胞もしくは総末梢血単核細胞(PBMC)、例えば、それぞれが両端の値を含む1 x 105個〜5 x 107個、1 x 105個〜2.5 x 107個、1 x 105個〜1.0 x 107個、1 x 105個〜5.0 x 106個、1 x 105個〜1.0 x 106個、1.0 x 105個〜5.0 x 105個、5.0 x 105個〜5 x 107個、5 x 105個〜2.5 x 107個、5 x 105個〜1.0 x 107個、5 x 105個〜5.0 x 106個、5 x 105個〜1.0 x 106個、1.0 x 106個〜5 x 107個、1 x 106個〜2.5 x 107個、1 x 106個〜1.0 x 107個、1 x 106個〜5.0 x 106個、5.0 x 106個〜5 x 107個、5 x 106個〜2.5 x 107個、5 x 106個〜1.0 x 107個、1.0 x 107個〜5 x 107個、1 x 107個〜2.5 x 107個、または2.5 x 107個〜5 x 107個などの総組換え受容体発現細胞、任意でCAR+細胞、総T細胞もしくは総末梢血単核細胞(PBMC)を含む用量で、遺伝子操作T細胞を投与すること
を規定する、請求項109〜159および161のいずれか一項記載のキット。 - 説明書が、
細胞の用量は、組換え受容体を発現するCD4+細胞の、組換え受容体を発現するCD8+細胞に対する定義された比率、および/または、CD4+細胞の、CD8+細胞に対する定義された比率を含み、そのような比率は任意でおよそ1:1であるかまたはおよそ1:3〜およそ3:1の間であること
を規定する、請求項109〜162のいずれか一項記載のキット。 - 説明書が、T細胞療法が阻害剤の投与を伴うことなく投与される場合の用量よりも少ない用量の細胞を投与することを規定する、請求項109〜163のいずれか一項記載のキット。
- 用量が、少なくとも1.5倍、2倍、3倍、4倍、5倍または10倍少ない、請求項164記載のキット。
- 説明書が、任意で細胞を含む単一の薬学的組成物である単一用量でT細胞を投与することを規定する、請求項109〜165のいずれか一項記載のキット。
- 説明書が、T細胞を分割用量として投与することを規定し、この場合、単一用量の細胞が、最大でも3日の期間にわたって、合計して前記用量の細胞を含む複数の組成物で投与され、かつ/または、
説明書が、T細胞の1つまたは複数のさらなる用量を投与することをさらに規定する、
請求項109〜166のいずれか一項記載のキット。 - 説明書が、
リンパ球枯渇化学療法をT細胞の投与に先立って投与することをさらに規定し、かつ/または
投与が、リンパ球枯渇化学療法をT細胞の投与に先立って受けたことがある対象への投与であることを規定する、
請求項109〜167のいずれか一項記載のキット。 - リンパ球枯渇化学療法が、フルダラビンおよび/またはシクロホスファミドを対象に投与することを含む、請求項168記載のキット。
- リンパ球枯渇療法が、両端の値を含む約200 mg/m2〜400 mg/m2、任意で300 mg/m2もしくは約300 mg/m2でシクロホスファミドを、および/または約20 mg/m2〜40 mg/m2、任意で30 mg/m2でフルダラビンを、それぞれが2日間〜4日間、任意で3日間にわたって毎日、投与することを含む、請求項168または請求項169記載のキット。
- リンパ球枯渇療法が、300 mg/m2もしくは約300 mg/m2でシクロホスファミドを、および約30 mg/m2でフルダラビンを、それぞれ3日間にわたって毎日、投与することを含む、請求項168〜170のいずれか一項記載のキット。
- 説明書が、免疫調節剤を対象に投与することをさらに規定し、細胞の投与および免疫調節剤の投与が、同時に、別々に、もしくは単一の組成物において、またはどちらの順序であれ逐次的に行われる、請求項109〜171のいずれか一項記載のキット。
- 免疫調節剤が、分子の機能または分子を伴うシグナル伝達経路を阻害またはブロックすることができ、該分子が免疫阻害性分子であり、かつ/または該分子が免疫チェックポイント分子である、請求項172記載のキット。
- 免疫チェックポイント分子または経路が、PD-1、PD-L1、PD-L2、CTLA-4、LAG-3、TIM3、VISTA、アデノシン2A受容体(A2AR)もしくはアデノシン、または前述のいずれかを伴う経路からなる群より選択される、請求項173記載のキット。
- 免疫調節剤が、任意で抗体フラグメント、単鎖抗体、多重特異性抗体、もしくは免疫コンジュゲートである抗体であるか、または該抗体を含む、請求項172〜174のいずれか一項記載のキット。
- 前記抗体が、免疫チェックポイント分子またはそのリガンドもしくは受容体に特異的に結合する、ならびに/あるいは
前記抗体が、免疫チェックポイント分子とそのリガンドまたは受容体との間の相互作用をブロックするかまたは損なうことができる、請求項175記載のキット。 - 組成物が単回投薬のために製剤化される、請求項176記載のキット。
- 組成物が多回投薬のために製剤化される、請求項176記載のキット。
- T細胞を含む細胞の集団をTECファミリーキナーゼの阻害剤と接触させる工程、および
組換え受容体をコードする核酸を、組換え受容体が発現されるような条件のもとでT細胞の集団に導入する工程
を含む、組換え受容体を発現する免疫細胞を操作する方法。 - 組換え受容体が、リガンドに、任意で抗原またはユニバーサルタグに結合する、請求項179記載の方法。
- 組換え受容体がT細胞受容体(TCR)またはキメラ抗原受容体(CAR)である、請求項179または請求項180記載の方法。
- 細胞の集団が末梢血単核細胞であるかまたは末梢血単核細胞を含む、請求項179〜181のいずれか一項記載の方法。
- 細胞の集団がT細胞であるかまたはT細胞を含む、請求項179〜182のいずれか一項記載の方法。
- T細胞がCD4+および/またはCD8+である、請求項183記載の方法。
- 細胞の集団が、対象、任意でヒト対象から単離される、請求項179〜184のいずれか一項記載の方法。
- 接触させる工程が、導入する工程の前におよび/または導入する工程の間に行われる、請求項179〜185のいずれか一項記載の方法。
- 組換え受容体をコードする核酸分子を初代T細胞に導入する工程を含み、
該T細胞が、TECファミリーキナーゼの阻害剤を投与されたことがある対象に由来する、
遺伝子操作されたT細胞を作製する方法。 - 前記対象が、核酸分子を導入する最大でも30日前に、20日前に、10日前に、9日前に、8日前に、7日前に、6日前に、5日前に、4日前に、3日前に、2日前に、または1日前に、前記阻害剤を投与されている、請求項187記載の方法。
- 前記阻害剤が1つまたは複数のチロシンキナーゼを阻害し、該チロシンキナーゼのそれぞれが個々に、ブルトン型チロシンキナーゼ(Btk)、IL2誘導性T細胞キナーゼ(ITK)、肝細胞癌において発現されるチロシンキナーゼ(TEC)、染色体Xに対するチロシンキナーゼ骨髄キナーゼ(BMX)、およびT細胞X染色体キナーゼ(TXK;休止期リンパ球キナーゼ、RLK)からなる群より選択される、ならびに/あるいは
TECファミリーキナーゼが、ブルトン型チロシンキナーゼ(Btk)、IL2誘導性T細胞キナーゼ(ITK)、肝細胞癌において発現されるチロシンキナーゼ(TEC)、染色体Xに対するチロシンキナーゼ骨髄キナーゼ(BMX)、およびT細胞X染色体キナーゼ(TXK;休止期リンパ球キナーゼ、RLK)からなる群より選択される1つまたは複数のTECファミリーキナーゼを含む、ならびに/あるいは
TECファミリーキナーゼがBtkであるかまたはBtkを含む、
請求項187または188記載の方法。 - TECファミリーキナーゼが癌の細胞によって発現されず、通常の場合、癌が由来する細胞において発現されないかまたは発現されることが疑われない、ならびに/あるいは
癌が前記阻害剤に対して感受性でない、ならびに/あるいは
少なくとも複数のT細胞がTECファミリーキナーゼを発現する、ならびに/あるいは
TECファミリーキナーゼがT細胞において発現される、ならびに/あるいは
TECファミリーキナーゼが通常の場合、T細胞において発現されない、
請求項187〜189のいずれか一項記載の方法。 - 前記阻害剤が、小分子、ペプチド、タンパク質、抗体もしくはその抗原結合フラグメント、抗体模倣物、アプタマー、または核酸分子である、請求項187〜190のいずれか一項記載の方法。
- 前記阻害剤が、チロシンキナーゼの活性化を不可逆的に低減させるかまたは排除し、SEQ ID NO:18に示される配列における残基C481に対応するアミノ酸残基を含むチロシンキナーゼの活性部位において結合部位に特異的に結合し、かつ/あるいはチロシンキナーゼの自己リン酸化活性を低減させるかまたは排除する、請求項187〜191のいずれか一項記載の方法。
- 前記阻害剤がイブルチニブである、請求項187〜192のいずれか一項記載の方法。
- 前記阻害剤が、経口投与、皮下投与、または静脈内投与される、請求項187〜193のいずれか一項記載の方法。
- 前記阻害剤が経口投与される、請求項194記載の方法。
- 前記阻害剤が1日に6回、1日に5回、1日に4回、1日に3回、1日に2回、1日に1回、1日おきに、週に3回、または少なくとも週に1回、投与される、請求項187〜195のいずれか一項記載の方法。
- 前記阻害剤が、1日に1回または1日に2回、投与される、請求項196記載の方法。
- 前記阻害剤が、少なくとも50 mg/日もしくは少なくとも約50 mg/日、少なくとも100 mg/日もしくは少なくとも約100 mg/日、少なくとも150 mg/日もしくは少なくとも約150 mg/日、少なくとも175 mg/日もしくは少なくとも約175 mg/日、少なくとも200 mg/日もしくは少なくとも約200 mg/日、少なくとも250 mg/日もしくは少なくとも約250 mg/日、少なくとも300 mg/日もしくは少なくとも約300 mg/日、少なくとも350 mg/日もしくは少なくとも約350 mg/日、少なくとも400 mg/日もしくは少なくとも約400 mg/日、少なくとも450 mg/日もしくは少なくとも約450 mg/日、少なくとも500 mg/日もしくは少なくとも約500 mg/日、少なくとも600 mg/日もしくは少なくとも約600 mg/日、少なくとも700 mg/日もしくは少なくとも約700 mg/日、少なくとも800 mg/日もしくは少なくとも約800 mg/日、またはそれ以上の一日総投薬量で投与される、請求項187〜197のいずれか一項記載の方法。
- 前記阻害剤が1日あたり420 mg未満または約420 mg未満または約420 mgまたは420 mgの量で投与される、請求項187〜198のいずれか一項記載の方法。
- T細胞がCD4+またはCD8+細胞を含む、請求項187〜199のいずれか一項記載の方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2023103197A JP2023120386A (ja) | 2016-11-03 | 2023-06-23 | T細胞療法とbtk阻害剤との併用療法 |
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662417312P | 2016-11-03 | 2016-11-03 | |
| US62/417,312 | 2016-11-03 | ||
| US201662429735P | 2016-12-03 | 2016-12-03 | |
| US62/429,735 | 2016-12-03 | ||
| US201762574706P | 2017-10-19 | 2017-10-19 | |
| US62/574,706 | 2017-10-19 | ||
| PCT/US2017/060060 WO2018085731A2 (en) | 2016-11-03 | 2017-11-03 | Combination therapy of a t cell therapy and a btk inhibitor |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2023103197A Division JP2023120386A (ja) | 2016-11-03 | 2023-06-23 | T細胞療法とbtk阻害剤との併用療法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2019532997A true JP2019532997A (ja) | 2019-11-14 |
| JP2019532997A5 JP2019532997A5 (ja) | 2020-12-17 |
Family
ID=60515805
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019523665A Pending JP2019532997A (ja) | 2016-11-03 | 2017-11-03 | T細胞療法とbtk阻害剤との併用療法 |
| JP2023103197A Pending JP2023120386A (ja) | 2016-11-03 | 2023-06-23 | T細胞療法とbtk阻害剤との併用療法 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2023103197A Pending JP2023120386A (ja) | 2016-11-03 | 2023-06-23 | T細胞療法とbtk阻害剤との併用療法 |
Country Status (9)
| Country | Link |
|---|---|
| US (1) | US20190298772A1 (ja) |
| EP (1) | EP3534938A2 (ja) |
| JP (2) | JP2019532997A (ja) |
| CN (1) | CN110139669A (ja) |
| AU (1) | AU2017355544A1 (ja) |
| CA (1) | CA3042049A1 (ja) |
| MA (1) | MA46783A (ja) |
| MX (2) | MX2019005029A (ja) |
| WO (1) | WO2018085731A2 (ja) |
Families Citing this family (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11590167B2 (en) | 2016-12-03 | 2023-02-28 | Juno Therapeutic, Inc. | Methods and compositions for use of therapeutic T cells in combination with kinase inhibitors |
| WO2018204427A1 (en) * | 2017-05-01 | 2018-11-08 | Juno Therapeutics, Inc. | Combination of a cell therapy and an immunomodulatory compound |
| JP2020522489A (ja) | 2017-06-02 | 2020-07-30 | ジュノー セラピューティクス インコーポレイテッド | 養子細胞療法を用いる処置のための製造物品および方法 |
| KR20200116077A (ko) | 2017-11-01 | 2020-10-08 | 주노 쎄러퓨티크스 인코퍼레이티드 | B 세포 성숙 항원에 특이적인 키메라 항원 수용체 및 암호화 폴리뉴클레오타이드 |
| US11851679B2 (en) | 2017-11-01 | 2023-12-26 | Juno Therapeutics, Inc. | Method of assessing activity of recombinant antigen receptors |
| US20190284553A1 (en) | 2018-03-15 | 2019-09-19 | KSQ Therapeutics, Inc. | Gene-regulating compositions and methods for improved immunotherapy |
| US20230158071A1 (en) * | 2018-12-07 | 2023-05-25 | Crage Medical Co., Limited | Tumor combined immunotherapy |
| EP4004054A4 (en) * | 2019-07-26 | 2023-10-25 | Yuhan Corporation | BISPECIFIC ANTI-HER2/ANTI-4-1BB ANTIBODY AND ITS USE |
| JP2022554348A (ja) | 2019-11-05 | 2022-12-28 | ジュノー セラピューティクス インコーポレイテッド | 治療用t細胞組成物の属性を決定する方法 |
| CN115803824A (zh) | 2020-05-13 | 2023-03-14 | 朱诺治疗学股份有限公司 | 鉴定与临床反应相关的特征的方法及其用途 |
| WO2023278424A1 (en) * | 2021-06-28 | 2023-01-05 | The Regents Of The University Of California | Methods for treating and ameliorating t cell related diseases |
| WO2023230548A1 (en) | 2022-05-25 | 2023-11-30 | Celgene Corporation | Method for predicting response to a t cell therapy |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2015527070A (ja) * | 2012-08-20 | 2015-09-17 | フレッド ハッチンソン キャンサー リサーチ センター | 細胞免疫療法のための方法および組成物 |
| WO2015157252A1 (en) * | 2014-04-07 | 2015-10-15 | BROGDON, Jennifer | Treatment of cancer using anti-cd19 chimeric antigen receptor |
Family Cites Families (81)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4452773A (en) | 1982-04-05 | 1984-06-05 | Canadian Patents And Development Limited | Magnetic iron-dextran microspheres |
| US4690915A (en) | 1985-08-08 | 1987-09-01 | The United States Of America As Represented By The Department Of Health And Human Services | Adoptive immunotherapy as a treatment modality in humans |
| US4795698A (en) | 1985-10-04 | 1989-01-03 | Immunicon Corporation | Magnetic-polymer particles |
| US5219740A (en) | 1987-02-13 | 1993-06-15 | Fred Hutchinson Cancer Research Center | Retroviral gene transfer into diploid fibroblasts for gene therapy |
| AU4746590A (en) | 1988-12-28 | 1990-08-01 | Stefan Miltenyi | Methods and materials for high gradient magnetic separation of biological materials |
| US5200084A (en) | 1990-09-26 | 1993-04-06 | Immunicon Corporation | Apparatus and methods for magnetic separation |
| US5827642A (en) | 1994-08-31 | 1998-10-27 | Fred Hutchinson Cancer Research Center | Rapid expansion method ("REM") for in vitro propagation of T lymphocytes |
| WO1996013593A2 (en) | 1994-10-26 | 1996-05-09 | Procept, Inc. | Soluble single chain t cell receptors |
| WO1996018105A1 (en) | 1994-12-06 | 1996-06-13 | The President And Fellows Of Harvard College | Single chain t-cell receptor |
| DE19608753C1 (de) | 1996-03-06 | 1997-06-26 | Medigene Gmbh | Transduktionssystem und seine Verwendung |
| WO1997034634A1 (en) | 1996-03-20 | 1997-09-25 | Sloan-Kettering Institute For Cancer Research | Single chain fv constructs of anti-ganglioside gd2 antibodies |
| WO1999018129A1 (en) | 1997-10-02 | 1999-04-15 | Sunol Molecular Corporation | Soluble single-chain t-cell receptor proteins |
| PT1066380E (pt) | 1998-05-19 | 2002-05-31 | Avidex Ltd | Receptor de celula t soluvel |
| JP2002524081A (ja) | 1998-09-04 | 2002-08-06 | スローン − ケッタリング インスティチュート フォー キャンサー リサーチ | 前立腺−特異的膜抗原に特異的な融合受容体およびその使用 |
| US6410319B1 (en) | 1998-10-20 | 2002-06-25 | City Of Hope | CD20-specific redirected T cells and their use in cellular immunotherapy of CD20+ malignancies |
| US20020131960A1 (en) | 2000-06-02 | 2002-09-19 | Michel Sadelain | Artificial antigen presenting cells and methods of use thereof |
| EP1334188B1 (en) | 2000-11-07 | 2006-08-30 | City of Hope | Cd19-specific redirected immune cells |
| PT1347971E (pt) | 2000-12-21 | 2006-06-30 | Bristol Myers Squibb Co | Inibidores tiazolilicos de tirosina-cinases da familia tec |
| US7070995B2 (en) | 2001-04-11 | 2006-07-04 | City Of Hope | CE7-specific redirected immune cells |
| US20090257994A1 (en) | 2001-04-30 | 2009-10-15 | City Of Hope | Chimeric immunoreceptor useful in treating human cancers |
| ES2239246T3 (es) | 2001-08-31 | 2005-09-16 | Avidex Limited | Receptor soluble de celulas t. |
| US7939059B2 (en) | 2001-12-10 | 2011-05-10 | California Institute Of Technology | Method for the generation of antigen-specific lymphocytes |
| US20030170238A1 (en) | 2002-03-07 | 2003-09-11 | Gruenberg Micheal L. | Re-activated T-cells for adoptive immunotherapy |
| US7446190B2 (en) | 2002-05-28 | 2008-11-04 | Sloan-Kettering Institute For Cancer Research | Nucleic acids encoding chimeric T cell receptors |
| SE0202462D0 (sv) | 2002-08-14 | 2002-08-14 | Astrazeneca Ab | Novel use |
| SE0202463D0 (sv) | 2002-08-14 | 2002-08-14 | Astrazeneca Ab | Novel compounds |
| SE0202461D0 (sv) | 2002-08-14 | 2002-08-14 | Astrazeneca Ab | Novel compounds |
| SE0202429D0 (sv) | 2002-08-14 | 2002-08-14 | Astrazeneca Ab | Novel Compounds |
| EP1549748B1 (en) | 2002-10-09 | 2014-10-01 | Immunocore Ltd. | Single chain recombinant t cell receptors |
| US20050129671A1 (en) | 2003-03-11 | 2005-06-16 | City Of Hope | Mammalian antigen-presenting T cells and bi-specific T cells |
| RS20060162A (en) | 2003-09-08 | 2008-06-05 | Aventis Pharmaceuticals Inc., | Thienopyrazoles |
| US20050176792A1 (en) | 2004-01-14 | 2005-08-11 | Boehringer Ingelheim Pharmaceuticals, Inc. | Ketone substituted benzimidazole compounds |
| WO2005079791A1 (en) | 2004-02-12 | 2005-09-01 | Boehringer Ingelheim Pharmaceuticals, Inc. | Thiophene -2- carboxylic acid - (1h - benzimidazol - 2 yl) - amide derivatives and related compounds as inhibitors of the tec kinase itk (interleukin -2- inducible t cell kinase) for the treatment of inflammation, immunological and allergic disorders |
| EP1791865B1 (en) | 2004-06-29 | 2010-07-28 | Immunocore Ltd. | Cells expressing a modified t cell receptor |
| WO2006065946A1 (en) | 2004-12-16 | 2006-06-22 | Vertex Pharmaceuticals Incorporated | Pyrid-2-ones useful as inhibitors of tec family protein kinases for the treatment of inflammatory, proliferative and immunologically-mediated diseases |
| WO2007016977A1 (de) | 2005-08-05 | 2007-02-15 | Delica Ag | Vorrichtung zum extrahieren eines in einer kapsel enthaltenen extraktionsgutes mit einem flüssigen extraktionsmittel |
| AU2006285038A1 (en) | 2005-08-29 | 2007-03-08 | Vertex Pharmaceuticals Incorporated | 3,5-disubstituted pyrid-2-ones useful as inhibitors of Tec family of non-receptor tyrosine kinases |
| JP2009515879A (ja) | 2005-11-12 | 2009-04-16 | ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング | Tecキナーゼ阻害剤 |
| WO2007076228A2 (en) | 2005-12-20 | 2007-07-05 | Boehringer Ingelheim International Gmbh | 2-(ih-thieno [3,2-c] pyrazol-3yl)-ih-indole derivatives and related compounds as tec kinase inhibitors for the treatment of inflammations and immunological disorders |
| AU2007254179B2 (en) | 2006-05-18 | 2013-03-21 | Pharmacyclics Llc | Intracellular kinase inhibitors |
| EP2057158B8 (en) | 2006-08-30 | 2015-09-30 | Cellzome Limited | Triazole derivatives as kinase inhibitors |
| EP1900727A1 (en) | 2006-08-30 | 2008-03-19 | Cellzome Ag | Aminopyridine derivatives as kinase inhibitors |
| EP1900739A1 (en) | 2006-08-30 | 2008-03-19 | Cellzome Ag | Diazolodiazine derivatives as kinase inhibitors |
| NZ601278A (en) | 2006-09-22 | 2013-09-27 | Pharmacyclics Inc | Inhibitors of Bruton's tyrosine kinase |
| CA2967847C (en) | 2007-03-30 | 2023-08-01 | Memorial Sloan-Kettering Cancer Center | Constitutive expression of costimulatory ligands on adoptively transferred t lymphocytes |
| US7982036B2 (en) | 2007-10-19 | 2011-07-19 | Avila Therapeutics, Inc. | 4,6-disubstitued pyrimidines useful as kinase inhibitors |
| EP2227271B1 (en) | 2007-12-07 | 2018-01-24 | Miltenyi Biotec GmbH | Sample processing system and methods |
| US8479118B2 (en) | 2007-12-10 | 2013-07-02 | Microsoft Corporation | Switching search providers within a browser search box |
| US20120164718A1 (en) | 2008-05-06 | 2012-06-28 | Innovative Micro Technology | Removable/disposable apparatus for MEMS particle sorting device |
| JP5173594B2 (ja) | 2008-05-27 | 2013-04-03 | キヤノン株式会社 | 管理装置、画像形成装置及びそれらの処理方法 |
| US8338439B2 (en) | 2008-06-27 | 2012-12-25 | Celgene Avilomics Research, Inc. | 2,4-disubstituted pyrimidines useful as kinase inhibitors |
| KR20110025224A (ko) | 2008-06-27 | 2011-03-09 | 아빌라 테라퓨틱스, 인크. | 헤테로아릴 화합물 및 이의 용도 |
| PL3006459T3 (pl) | 2008-08-26 | 2022-01-17 | City Of Hope | Sposób i kompozycje dla wzmocnionego działania efektorowego komórek t przeciw guzowi nowotworowemu |
| WO2011017219A1 (en) | 2009-08-03 | 2011-02-10 | The Regents Of The University Of California | Imidazoquinoxalinones and anti-tumor treatment |
| EP2486049A1 (en) | 2009-10-06 | 2012-08-15 | The Board Of Trustees Of The UniversityOf Illinois | Human single-chain t cell receptors |
| TR201904484T4 (tr) | 2009-11-03 | 2019-05-21 | Hope City | Transdüse T hücre seçimine yönelik kesik epiderimal büyüme faktörü reseptörü (EGFRt). |
| CA3007787C (en) | 2010-06-03 | 2020-03-10 | Pharmacyclics Llc | The use of inhibitors of bruton's tyrosine kinase (btk) |
| PT3214091T (pt) | 2010-12-09 | 2019-01-11 | Univ Pennsylvania | Utilização de células t modificadas por recetor de antigénio quimérico para tratar o cancro |
| BR112013024395B1 (pt) | 2011-03-23 | 2021-10-26 | Fred Hutchinson Cancer Research Center | Composições adotivas de imunoterapia celular e método para fabricação da dita composição |
| US8398282B2 (en) | 2011-05-12 | 2013-03-19 | Delphi Technologies, Inc. | Vehicle front lighting assembly and systems having a variable tint electrowetting element |
| US20130078250A1 (en) | 2011-08-23 | 2013-03-28 | Oliver Ast | Bispecific t cell activating antigen binding molecules |
| CN104080797A (zh) | 2011-11-11 | 2014-10-01 | 弗雷德哈钦森癌症研究中心 | 针对癌症的靶向细胞周期蛋白a1的t细胞免疫疗法 |
| EP3594245A1 (en) | 2012-02-13 | 2020-01-15 | Seattle Children's Hospital d/b/a Seattle Children's Research Institute | Bispecific chimeric antigen receptors and therapeutic uses thereof |
| WO2013126726A1 (en) | 2012-02-22 | 2013-08-29 | The Trustees Of The University Of Pennsylvania | Double transgenic t cells comprising a car and a tcr and their methods of use |
| US9751928B2 (en) | 2012-05-03 | 2017-09-05 | Fred Hutchinson Cancer Research Center | Enhanced affinity T cell receptors and methods for making the same |
| MY187999A (en) | 2012-06-04 | 2021-11-08 | Pharmacyclics Llc | Crystalline forms of a bruton's tyrosine kinase inhibitor |
| CA2886859C (en) | 2012-10-02 | 2022-05-17 | Memorial Sloan-Kettering Cancer Center | Compositions and methods for immunotherapy |
| CA2890111A1 (en) | 2012-11-02 | 2014-05-08 | Pharmacyclics, Inc. | Tec family kinase inhibitor adjuvant therapy |
| US9649313B2 (en) | 2012-11-26 | 2017-05-16 | The University Of North Carolina At Chapel Hill | Use of ITK inhibitors for the treatment of cancer |
| US9260426B2 (en) | 2012-12-14 | 2016-02-16 | Arrien Pharmaceuticals Llc | Substituted 1H-pyrrolo [2, 3-b] pyridine and 1H-pyrazolo [3, 4-b] pyridine derivatives as salt inducible kinase 2 (SIK2) inhibitors |
| WO2014097442A1 (ja) | 2012-12-20 | 2014-06-26 | 三菱電機株式会社 | 車載装置及びプログラム |
| WO2014105958A2 (en) | 2012-12-26 | 2014-07-03 | Medivation Technologies, Inc. | Fused pyrimidine compounds and use thereof |
| WO2014145403A1 (en) | 2013-03-15 | 2014-09-18 | Nantbio, Inc. | Substituted indol-5-ol derivatives and their therapeutic applications |
| TWI654206B (zh) | 2013-03-16 | 2019-03-21 | 諾華公司 | 使用人類化抗-cd19嵌合抗原受體治療癌症 |
| US8957080B2 (en) | 2013-04-09 | 2015-02-17 | Principia Biopharma Inc. | Tyrosine kinase inhibitors |
| US9206188B2 (en) | 2013-04-18 | 2015-12-08 | Arrien Pharmaceuticals Llc | Substituted pyrrolo[2,3-b]pyridines as ITK and JAK inhibitors |
| EP3004168A4 (en) | 2013-05-24 | 2017-03-01 | Board of Regents, The University of Texas System | Chimeric antigen receptor-targeting monoclonal antibodies |
| US9108442B2 (en) | 2013-08-20 | 2015-08-18 | Ricoh Company, Ltd. | Image forming apparatus |
| KR20230007559A (ko) | 2013-12-20 | 2023-01-12 | 프레드 허친슨 캔서 센터 | 태그된 키메라 이펙터 분자 및 그의 리셉터 |
| MA45341A (fr) * | 2016-06-06 | 2019-04-10 | Hutchinson Fred Cancer Res | Procédés de traitement de malignités de lymphocytes b au moyen d'une thérapie cellulaire adoptive |
| US11590167B2 (en) * | 2016-12-03 | 2023-02-28 | Juno Therapeutic, Inc. | Methods and compositions for use of therapeutic T cells in combination with kinase inhibitors |
-
2017
- 2017-11-03 JP JP2019523665A patent/JP2019532997A/ja active Pending
- 2017-11-03 US US16/346,528 patent/US20190298772A1/en active Pending
- 2017-11-03 MA MA046783A patent/MA46783A/fr unknown
- 2017-11-03 MX MX2019005029A patent/MX2019005029A/es unknown
- 2017-11-03 WO PCT/US2017/060060 patent/WO2018085731A2/en unknown
- 2017-11-03 CN CN201780082035.6A patent/CN110139669A/zh active Pending
- 2017-11-03 CA CA3042049A patent/CA3042049A1/en active Pending
- 2017-11-03 AU AU2017355544A patent/AU2017355544A1/en active Pending
- 2017-11-03 EP EP17807967.9A patent/EP3534938A2/en active Pending
-
2019
- 2019-04-29 MX MX2023004707A patent/MX2023004707A/es unknown
-
2023
- 2023-06-23 JP JP2023103197A patent/JP2023120386A/ja active Pending
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2015527070A (ja) * | 2012-08-20 | 2015-09-17 | フレッド ハッチンソン キャンサー リサーチ センター | 細胞免疫療法のための方法および組成物 |
| WO2015157252A1 (en) * | 2014-04-07 | 2015-10-15 | BROGDON, Jennifer | Treatment of cancer using anti-cd19 chimeric antigen receptor |
Non-Patent Citations (3)
| Title |
|---|
| BLOOD (JAN 2016) VOL.127, ISSUE 9,P.1117-1127, JPN6021040860, ISSN: 0004998450 * |
| J. CLIN. ONCOL. (2015) VOL.33, NO.15,P.1688-1696, JPN6021040857, ISSN: 0004998452 * |
| NAT. REV. CLIN. ONCOL. (MAR 2016)VOL.13, ISSUE 6, P.370-383, JPN6021040858, ISSN: 0004998451 * |
Also Published As
| Publication number | Publication date |
|---|---|
| MX2023004707A (es) | 2023-05-09 |
| US20190298772A1 (en) | 2019-10-03 |
| EP3534938A2 (en) | 2019-09-11 |
| JP2023120386A (ja) | 2023-08-29 |
| CA3042049A1 (en) | 2018-05-11 |
| WO2018085731A3 (en) | 2018-07-12 |
| CN110139669A (zh) | 2019-08-16 |
| AU2017355544A1 (en) | 2019-05-16 |
| MX2019005029A (es) | 2019-10-24 |
| WO2018085731A2 (en) | 2018-05-11 |
| MA46783A (fr) | 2019-09-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7224318B2 (ja) | 養子細胞療法用の操作された細胞 | |
| KR102644950B1 (ko) | 입양 세포 치료법을 이용한 b 세포 악성종양의 치료 방법 | |
| US10786533B2 (en) | Engineered cells for adoptive cell therapy | |
| JP7299841B2 (ja) | 細胞療法と免疫調節化合物の併用 | |
| JP2019532997A (ja) | T細胞療法とbtk阻害剤との併用療法 | |
| US20240016840A1 (en) | Methods and compositions for use of therapeutic t cells in combination with kinase inhibitors | |
| JP2022101625A (ja) | 養子細胞療法のための方法および組成物 | |
| US20210128616A1 (en) | Phenotypic markers for cell therapy and related methods | |
| JP7275104B2 (ja) | 遺伝子操作された細胞の組成物および関連組成物を産生するための方法 | |
| KR20200046045A (ko) | 유전자 조작된 세포를 제조하기 위한 방법 및 조성물 | |
| RU2795454C2 (ru) | Способы и композиции для получения генно-инженерных клеток |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190814 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20201102 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20201102 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20210204 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20211018 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220114 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20220601 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20220830 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20221130 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20230224 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230623 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230731 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20230803 |
|
| A912 | Re-examination (zenchi) completed and case transferred to appeal board |
Free format text: JAPANESE INTERMEDIATE CODE: A912 Effective date: 20230901 |