JP2017193569A - 血液脳関門透過性の調節のためのセマフォリン−4d結合分子の使用 - Google Patents
血液脳関門透過性の調節のためのセマフォリン−4d結合分子の使用 Download PDFInfo
- Publication number
- JP2017193569A JP2017193569A JP2017129377A JP2017129377A JP2017193569A JP 2017193569 A JP2017193569 A JP 2017193569A JP 2017129377 A JP2017129377 A JP 2017129377A JP 2017129377 A JP2017129377 A JP 2017129377A JP 2017193569 A JP2017193569 A JP 2017193569A
- Authority
- JP
- Japan
- Prior art keywords
- sema4d
- antibody
- subject
- binding molecule
- binding
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 230000027455 binding Effects 0.000 title claims abstract description 288
- 230000008499 blood brain barrier function Effects 0.000 title claims abstract description 235
- 210000001218 blood-brain barrier Anatomy 0.000 title claims abstract description 234
- 108010056102 CD100 antigen Proteins 0.000 title claims abstract description 210
- 102100027744 Semaphorin-4D Human genes 0.000 title claims abstract description 202
- 230000035699 permeability Effects 0.000 title claims abstract description 87
- 238000000034 method Methods 0.000 claims abstract description 129
- 208000036110 Neuroinflammatory disease Diseases 0.000 claims abstract description 56
- 230000003993 interaction Effects 0.000 claims abstract description 32
- 102000004057 Claudin-5 Human genes 0.000 claims abstract description 29
- 108090000582 Claudin-5 Proteins 0.000 claims abstract description 29
- 101710100559 Plexin-B1 Proteins 0.000 claims abstract description 29
- 102100034384 Plexin-B1 Human genes 0.000 claims abstract description 29
- 230000001603 reducing effect Effects 0.000 claims abstract description 26
- 230000014509 gene expression Effects 0.000 claims abstract description 25
- 239000000427 antigen Substances 0.000 claims description 116
- 108091007433 antigens Proteins 0.000 claims description 116
- 102000036639 antigens Human genes 0.000 claims description 116
- 239000012634 fragment Substances 0.000 claims description 92
- 210000004556 brain Anatomy 0.000 claims description 46
- 208000024827 Alzheimer disease Diseases 0.000 claims description 17
- 239000003112 inhibitor Substances 0.000 claims description 16
- 210000004369 blood Anatomy 0.000 claims description 15
- 239000008280 blood Substances 0.000 claims description 15
- 208000018737 Parkinson disease Diseases 0.000 claims description 12
- 230000004888 barrier function Effects 0.000 claims description 10
- 201000006417 multiple sclerosis Diseases 0.000 claims description 8
- 206010002026 amyotrophic lateral sclerosis Diseases 0.000 claims description 7
- 206010015037 epilepsy Diseases 0.000 claims description 7
- 201000009906 Meningitis Diseases 0.000 claims description 6
- 206010048962 Brain oedema Diseases 0.000 claims description 5
- 208000030886 Traumatic Brain injury Diseases 0.000 claims description 5
- 208000006752 brain edema Diseases 0.000 claims description 5
- 150000003384 small molecules Chemical class 0.000 claims description 5
- 230000002401 inhibitory effect Effects 0.000 abstract description 5
- 108010047041 Complementarity Determining Regions Proteins 0.000 description 59
- 108090000765 processed proteins & peptides Proteins 0.000 description 56
- 102000004196 processed proteins & peptides Human genes 0.000 description 48
- 235000001014 amino acid Nutrition 0.000 description 45
- 229920001184 polypeptide Polymers 0.000 description 45
- 210000002889 endothelial cell Anatomy 0.000 description 43
- 238000011282 treatment Methods 0.000 description 41
- 210000004027 cell Anatomy 0.000 description 40
- 150000001413 amino acids Chemical class 0.000 description 35
- 229940024606 amino acid Drugs 0.000 description 34
- 125000003275 alpha amino acid group Chemical group 0.000 description 33
- 108060003951 Immunoglobulin Proteins 0.000 description 31
- 230000000694 effects Effects 0.000 description 31
- 102000018358 immunoglobulin Human genes 0.000 description 31
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 30
- 102000005962 receptors Human genes 0.000 description 29
- 108020003175 receptors Proteins 0.000 description 29
- 241000699670 Mus sp. Species 0.000 description 24
- 210000003169 central nervous system Anatomy 0.000 description 24
- 201000010099 disease Diseases 0.000 description 21
- 210000001130 astrocyte Anatomy 0.000 description 20
- 238000000338 in vitro Methods 0.000 description 20
- 108090000623 proteins and genes Proteins 0.000 description 20
- 230000007423 decrease Effects 0.000 description 17
- 239000000203 mixture Substances 0.000 description 17
- 235000018102 proteins Nutrition 0.000 description 17
- 102000004169 proteins and genes Human genes 0.000 description 17
- 241000699666 Mus <mouse, genus> Species 0.000 description 16
- 238000006467 substitution reaction Methods 0.000 description 16
- 230000006870 function Effects 0.000 description 15
- 238000001727 in vivo Methods 0.000 description 15
- 230000002829 reductive effect Effects 0.000 description 15
- 230000015572 biosynthetic process Effects 0.000 description 14
- 230000003511 endothelial effect Effects 0.000 description 14
- 238000005259 measurement Methods 0.000 description 14
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 14
- 241001465754 Metazoa Species 0.000 description 13
- 230000035772 mutation Effects 0.000 description 13
- 238000011084 recovery Methods 0.000 description 13
- 101100310048 Mus musculus Sema4d gene Proteins 0.000 description 12
- 210000003719 b-lymphocyte Anatomy 0.000 description 12
- 238000002474 experimental method Methods 0.000 description 12
- 229940012952 fibrinogen Drugs 0.000 description 12
- 102000008946 Fibrinogen Human genes 0.000 description 11
- 108010049003 Fibrinogen Proteins 0.000 description 11
- 210000001744 T-lymphocyte Anatomy 0.000 description 11
- 201000002491 encephalomyelitis Diseases 0.000 description 11
- 210000001519 tissue Anatomy 0.000 description 11
- 125000000539 amino acid group Chemical group 0.000 description 10
- 230000004048 modification Effects 0.000 description 10
- 238000012986 modification Methods 0.000 description 10
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 9
- 208000035475 disorder Diseases 0.000 description 9
- 239000008194 pharmaceutical composition Substances 0.000 description 9
- 239000000126 substance Substances 0.000 description 9
- 210000004443 dendritic cell Anatomy 0.000 description 8
- 239000003814 drug Substances 0.000 description 8
- 210000002569 neuron Anatomy 0.000 description 8
- 238000002560 therapeutic procedure Methods 0.000 description 8
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 7
- 230000000903 blocking effect Effects 0.000 description 7
- 230000036541 health Effects 0.000 description 7
- 230000000670 limiting effect Effects 0.000 description 7
- 230000001404 mediated effect Effects 0.000 description 7
- 208000015122 neurodegenerative disease Diseases 0.000 description 7
- 230000036961 partial effect Effects 0.000 description 7
- 230000009467 reduction Effects 0.000 description 7
- 210000002966 serum Anatomy 0.000 description 7
- 239000000243 solution Substances 0.000 description 7
- 241000894007 species Species 0.000 description 7
- 208000024891 symptom Diseases 0.000 description 7
- 230000032258 transport Effects 0.000 description 7
- 102000013455 Amyloid beta-Peptides Human genes 0.000 description 6
- 108010090849 Amyloid beta-Peptides Proteins 0.000 description 6
- 102000006496 Immunoglobulin Heavy Chains Human genes 0.000 description 6
- 108010019476 Immunoglobulin Heavy Chains Proteins 0.000 description 6
- 102000013463 Immunoglobulin Light Chains Human genes 0.000 description 6
- 108010065825 Immunoglobulin Light Chains Proteins 0.000 description 6
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 6
- 241000283984 Rodentia Species 0.000 description 6
- 102000000591 Tight Junction Proteins Human genes 0.000 description 6
- 108010002321 Tight Junction Proteins Proteins 0.000 description 6
- 210000001175 cerebrospinal fluid Anatomy 0.000 description 6
- 230000008859 change Effects 0.000 description 6
- 230000000295 complement effect Effects 0.000 description 6
- 229940072221 immunoglobulins Drugs 0.000 description 6
- 230000001976 improved effect Effects 0.000 description 6
- 230000006698 induction Effects 0.000 description 6
- 230000004054 inflammatory process Effects 0.000 description 6
- 210000005210 lymphoid organ Anatomy 0.000 description 6
- 238000004519 manufacturing process Methods 0.000 description 6
- 210000004379 membrane Anatomy 0.000 description 6
- 239000012528 membrane Substances 0.000 description 6
- 238000002360 preparation method Methods 0.000 description 6
- 230000035755 proliferation Effects 0.000 description 6
- 239000011780 sodium chloride Substances 0.000 description 6
- 230000004083 survival effect Effects 0.000 description 6
- 238000012360 testing method Methods 0.000 description 6
- 101150013553 CD40 gene Proteins 0.000 description 5
- 208000016192 Demyelinating disease Diseases 0.000 description 5
- -1 IgM Chemical compound 0.000 description 5
- 206010061218 Inflammation Diseases 0.000 description 5
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 5
- 108050003978 Semaphorin Proteins 0.000 description 5
- 102100040245 Tumor necrosis factor receptor superfamily member 5 Human genes 0.000 description 5
- 230000004913 activation Effects 0.000 description 5
- 230000006907 apoptotic process Effects 0.000 description 5
- 239000000872 buffer Substances 0.000 description 5
- 230000003727 cerebral blood flow Effects 0.000 description 5
- 239000003795 chemical substances by application Substances 0.000 description 5
- 230000003247 decreasing effect Effects 0.000 description 5
- 238000013401 experimental design Methods 0.000 description 5
- 238000010369 molecular cloning Methods 0.000 description 5
- 238000002703 mutagenesis Methods 0.000 description 5
- 231100000350 mutagenesis Toxicity 0.000 description 5
- 230000001537 neural effect Effects 0.000 description 5
- 210000003668 pericyte Anatomy 0.000 description 5
- 230000028327 secretion Effects 0.000 description 5
- 210000000278 spinal cord Anatomy 0.000 description 5
- 230000001225 therapeutic effect Effects 0.000 description 5
- 238000012546 transfer Methods 0.000 description 5
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 5
- 102100025218 B-cell differentiation antigen CD72 Human genes 0.000 description 4
- 108010078791 Carrier Proteins Proteins 0.000 description 4
- 102100025566 Chymotrypsin-like protease CTRL-1 Human genes 0.000 description 4
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 4
- 101000934359 Homo sapiens B-cell differentiation antigen CD72 Proteins 0.000 description 4
- 101000856199 Homo sapiens Chymotrypsin-like protease CTRL-1 Proteins 0.000 description 4
- 101000650817 Homo sapiens Semaphorin-4D Proteins 0.000 description 4
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 4
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 4
- 239000004472 Lysine Substances 0.000 description 4
- 102000006386 Myelin Proteins Human genes 0.000 description 4
- 108010083674 Myelin Proteins Proteins 0.000 description 4
- 239000002202 Polyethylene glycol Substances 0.000 description 4
- 102000014105 Semaphorin Human genes 0.000 description 4
- 108010073929 Vascular Endothelial Growth Factor A Proteins 0.000 description 4
- 102000009524 Vascular Endothelial Growth Factor A Human genes 0.000 description 4
- 238000010521 absorption reaction Methods 0.000 description 4
- 210000000612 antigen-presenting cell Anatomy 0.000 description 4
- 230000000890 antigenic effect Effects 0.000 description 4
- 239000007864 aqueous solution Substances 0.000 description 4
- 230000008901 benefit Effects 0.000 description 4
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 4
- 238000004113 cell culture Methods 0.000 description 4
- 230000000875 corresponding effect Effects 0.000 description 4
- 230000009260 cross reactivity Effects 0.000 description 4
- 239000006185 dispersion Substances 0.000 description 4
- 239000003937 drug carrier Substances 0.000 description 4
- 230000005284 excitation Effects 0.000 description 4
- 230000001900 immune effect Effects 0.000 description 4
- 230000016784 immunoglobulin production Effects 0.000 description 4
- 238000010874 in vitro model Methods 0.000 description 4
- 208000027866 inflammatory disease Diseases 0.000 description 4
- 238000001990 intravenous administration Methods 0.000 description 4
- 210000004925 microvascular endothelial cell Anatomy 0.000 description 4
- 210000005012 myelin Anatomy 0.000 description 4
- 235000015097 nutrients Nutrition 0.000 description 4
- 210000004248 oligodendroglia Anatomy 0.000 description 4
- 229920001223 polyethylene glycol Polymers 0.000 description 4
- 102000040430 polynucleotide Human genes 0.000 description 4
- 108091033319 polynucleotide Proteins 0.000 description 4
- 239000002157 polynucleotide Substances 0.000 description 4
- 230000001681 protective effect Effects 0.000 description 4
- 239000003642 reactive oxygen metabolite Substances 0.000 description 4
- 230000000284 resting effect Effects 0.000 description 4
- 230000011664 signaling Effects 0.000 description 4
- 238000010186 staining Methods 0.000 description 4
- 230000004797 therapeutic response Effects 0.000 description 4
- 210000001578 tight junction Anatomy 0.000 description 4
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 4
- 230000003313 weakening effect Effects 0.000 description 4
- NFGXHKASABOEEW-UHFFFAOYSA-N 1-methylethyl 11-methoxy-3,7,11-trimethyl-2,4-dodecadienoate Chemical compound COC(C)(C)CCCC(C)CC=CC(C)=CC(=O)OC(C)C NFGXHKASABOEEW-UHFFFAOYSA-N 0.000 description 3
- WVDDGKGOMKODPV-UHFFFAOYSA-N Benzyl alcohol Chemical compound OCC1=CC=CC=C1 WVDDGKGOMKODPV-UHFFFAOYSA-N 0.000 description 3
- 102000004506 Blood Proteins Human genes 0.000 description 3
- 108010017384 Blood Proteins Proteins 0.000 description 3
- 102000004127 Cytokines Human genes 0.000 description 3
- 108090000695 Cytokines Proteins 0.000 description 3
- 206010012305 Demyelination Diseases 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- 108010087819 Fc receptors Proteins 0.000 description 3
- 102000009109 Fc receptors Human genes 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 239000004471 Glycine Substances 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- 101001013022 Homo sapiens Migration and invasion enhancer 1 Proteins 0.000 description 3
- 101001043564 Homo sapiens Prolow-density lipoprotein receptor-related protein 1 Proteins 0.000 description 3
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 3
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 3
- 241000124008 Mammalia Species 0.000 description 3
- 102000002233 Myelin-Oligodendrocyte Glycoprotein Human genes 0.000 description 3
- 108010000123 Myelin-Oligodendrocyte Glycoprotein Proteins 0.000 description 3
- 206010028980 Neoplasm Diseases 0.000 description 3
- 102000003940 Occludin Human genes 0.000 description 3
- 108090000304 Occludin Proteins 0.000 description 3
- 102100021923 Prolow-density lipoprotein receptor-related protein 1 Human genes 0.000 description 3
- 208000006011 Stroke Diseases 0.000 description 3
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Chemical compound CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 3
- 230000009471 action Effects 0.000 description 3
- 230000001154 acute effect Effects 0.000 description 3
- 230000002776 aggregation Effects 0.000 description 3
- 238000004220 aggregation Methods 0.000 description 3
- 239000003242 anti bacterial agent Substances 0.000 description 3
- 230000005875 antibody response Effects 0.000 description 3
- 230000003376 axonal effect Effects 0.000 description 3
- 230000004071 biological effect Effects 0.000 description 3
- 210000004899 c-terminal region Anatomy 0.000 description 3
- 230000015556 catabolic process Effects 0.000 description 3
- 230000020411 cell activation Effects 0.000 description 3
- 230000001413 cellular effect Effects 0.000 description 3
- 230000001684 chronic effect Effects 0.000 description 3
- 150000001875 compounds Chemical class 0.000 description 3
- 210000005220 cytoplasmic tail Anatomy 0.000 description 3
- 230000006378 damage Effects 0.000 description 3
- 230000001419 dependent effect Effects 0.000 description 3
- 238000013461 design Methods 0.000 description 3
- 239000008121 dextrose Substances 0.000 description 3
- 238000009792 diffusion process Methods 0.000 description 3
- 238000010494 dissociation reaction Methods 0.000 description 3
- 230000005593 dissociations Effects 0.000 description 3
- 239000002552 dosage form Substances 0.000 description 3
- 229940079593 drug Drugs 0.000 description 3
- 238000009472 formulation Methods 0.000 description 3
- 210000004408 hybridoma Anatomy 0.000 description 3
- 230000002209 hydrophobic effect Effects 0.000 description 3
- 210000002865 immune cell Anatomy 0.000 description 3
- 230000036039 immunity Effects 0.000 description 3
- 238000003119 immunoblot Methods 0.000 description 3
- 238000012744 immunostaining Methods 0.000 description 3
- 230000001771 impaired effect Effects 0.000 description 3
- 238000001802 infusion Methods 0.000 description 3
- 238000002347 injection Methods 0.000 description 3
- 239000007924 injection Substances 0.000 description 3
- 150000002500 ions Chemical class 0.000 description 3
- 230000004807 localization Effects 0.000 description 3
- 238000012423 maintenance Methods 0.000 description 3
- 239000011159 matrix material Substances 0.000 description 3
- 210000002418 meninge Anatomy 0.000 description 3
- 230000004060 metabolic process Effects 0.000 description 3
- 239000002207 metabolite Substances 0.000 description 3
- 230000005012 migration Effects 0.000 description 3
- 238000013508 migration Methods 0.000 description 3
- 230000003959 neuroinflammation Effects 0.000 description 3
- 230000008506 pathogenesis Effects 0.000 description 3
- 230000001575 pathological effect Effects 0.000 description 3
- 239000013641 positive control Substances 0.000 description 3
- 239000000843 powder Substances 0.000 description 3
- 239000003755 preservative agent Substances 0.000 description 3
- 230000002265 prevention Effects 0.000 description 3
- 238000011002 quantification Methods 0.000 description 3
- 238000011160 research Methods 0.000 description 3
- 230000004044 response Effects 0.000 description 3
- 230000002441 reversible effect Effects 0.000 description 3
- 239000002904 solvent Substances 0.000 description 3
- 230000000638 stimulation Effects 0.000 description 3
- 230000002792 vascular Effects 0.000 description 3
- 239000013598 vector Substances 0.000 description 3
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 2
- 244000105975 Antidesma platyphyllum Species 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 208000032116 Autoimmune Experimental Encephalomyelitis Diseases 0.000 description 2
- 230000003844 B-cell-activation Effects 0.000 description 2
- 241000894006 Bacteria Species 0.000 description 2
- 241000283690 Bos taurus Species 0.000 description 2
- 108091026890 Coding region Proteins 0.000 description 2
- 206010010904 Convulsion Diseases 0.000 description 2
- 108020004414 DNA Proteins 0.000 description 2
- 238000012286 ELISA Assay Methods 0.000 description 2
- 206010015866 Extravasation Diseases 0.000 description 2
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 2
- 101000896414 Homo sapiens Nuclear nucleic acid-binding protein C1D Proteins 0.000 description 2
- 102000008100 Human Serum Albumin Human genes 0.000 description 2
- 108091006905 Human Serum Albumin Proteins 0.000 description 2
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 2
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 2
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 2
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 2
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 2
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 2
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 2
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 2
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 2
- 241000283973 Oryctolagus cuniculus Species 0.000 description 2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 2
- 108010029485 Protein Isoforms Proteins 0.000 description 2
- 102000001708 Protein Isoforms Human genes 0.000 description 2
- 108010076504 Protein Sorting Signals Proteins 0.000 description 2
- 241000700159 Rattus Species 0.000 description 2
- 230000006052 T cell proliferation Effects 0.000 description 2
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 2
- 239000004473 Threonine Substances 0.000 description 2
- 239000013504 Triton X-100 Substances 0.000 description 2
- 229920004890 Triton X-100 Polymers 0.000 description 2
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 2
- 102100021657 Tyrosine-protein phosphatase non-receptor type 6 Human genes 0.000 description 2
- 101710128901 Tyrosine-protein phosphatase non-receptor type 6 Proteins 0.000 description 2
- 239000004480 active ingredient Substances 0.000 description 2
- 239000013543 active substance Substances 0.000 description 2
- 230000003941 amyloidogenesis Effects 0.000 description 2
- 230000033115 angiogenesis Effects 0.000 description 2
- 230000003110 anti-inflammatory effect Effects 0.000 description 2
- 229940088710 antibiotic agent Drugs 0.000 description 2
- 239000004599 antimicrobial Substances 0.000 description 2
- 238000003556 assay Methods 0.000 description 2
- 230000005784 autoimmunity Effects 0.000 description 2
- 210000002469 basement membrane Anatomy 0.000 description 2
- 230000009286 beneficial effect Effects 0.000 description 2
- 210000004781 brain capillary Anatomy 0.000 description 2
- 210000000133 brain stem Anatomy 0.000 description 2
- 210000005013 brain tissue Anatomy 0.000 description 2
- 230000012292 cell migration Effects 0.000 description 2
- 230000036755 cellular response Effects 0.000 description 2
- OSASVXMJTNOKOY-UHFFFAOYSA-N chlorobutanol Chemical compound CC(C)(O)C(Cl)(Cl)Cl OSASVXMJTNOKOY-UHFFFAOYSA-N 0.000 description 2
- 238000003776 cleavage reaction Methods 0.000 description 2
- 230000000139 costimulatory effect Effects 0.000 description 2
- 230000002950 deficient Effects 0.000 description 2
- 230000007850 degeneration Effects 0.000 description 2
- 230000004041 dendritic cell maturation Effects 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 230000018109 developmental process Effects 0.000 description 2
- 239000003085 diluting agent Substances 0.000 description 2
- 239000002612 dispersion medium Substances 0.000 description 2
- 230000004064 dysfunction Effects 0.000 description 2
- 239000012636 effector Substances 0.000 description 2
- 239000003792 electrolyte Substances 0.000 description 2
- 239000000839 emulsion Substances 0.000 description 2
- 230000010595 endothelial cell migration Effects 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 208000012997 experimental autoimmune encephalomyelitis Diseases 0.000 description 2
- 230000036251 extravasation Effects 0.000 description 2
- 239000012530 fluid Substances 0.000 description 2
- 235000009424 haa Nutrition 0.000 description 2
- 210000002216 heart Anatomy 0.000 description 2
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 2
- 239000005556 hormone Substances 0.000 description 2
- 229940088597 hormone Drugs 0.000 description 2
- 230000003053 immunization Effects 0.000 description 2
- 238000002649 immunization Methods 0.000 description 2
- 230000006872 improvement Effects 0.000 description 2
- 230000002779 inactivation Effects 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- 238000001361 intraarterial administration Methods 0.000 description 2
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 2
- 229960000310 isoleucine Drugs 0.000 description 2
- 210000003734 kidney Anatomy 0.000 description 2
- 239000010410 layer Substances 0.000 description 2
- 239000000787 lecithin Substances 0.000 description 2
- 229940067606 lecithin Drugs 0.000 description 2
- 235000010445 lecithin Nutrition 0.000 description 2
- 210000000265 leukocyte Anatomy 0.000 description 2
- 210000003141 lower extremity Anatomy 0.000 description 2
- 210000001165 lymph node Anatomy 0.000 description 2
- 238000002595 magnetic resonance imaging Methods 0.000 description 2
- 244000005700 microbiome Species 0.000 description 2
- 210000000274 microglia Anatomy 0.000 description 2
- 239000003607 modifier Substances 0.000 description 2
- 210000001616 monocyte Anatomy 0.000 description 2
- 239000000178 monomer Substances 0.000 description 2
- 210000002161 motor neuron Anatomy 0.000 description 2
- 230000004770 neurodegeneration Effects 0.000 description 2
- 230000000926 neurological effect Effects 0.000 description 2
- 230000016273 neuron death Effects 0.000 description 2
- 230000007935 neutral effect Effects 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 230000003000 nontoxic effect Effects 0.000 description 2
- 230000035515 penetration Effects 0.000 description 2
- 210000001428 peripheral nervous system Anatomy 0.000 description 2
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 2
- 239000008363 phosphate buffer Substances 0.000 description 2
- 230000026731 phosphorylation Effects 0.000 description 2
- 238000006366 phosphorylation reaction Methods 0.000 description 2
- 229920000642 polymer Polymers 0.000 description 2
- 239000002243 precursor Substances 0.000 description 2
- 230000003405 preventing effect Effects 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 230000000770 proinflammatory effect Effects 0.000 description 2
- 230000006337 proteolytic cleavage Effects 0.000 description 2
- NGVDGCNFYWLIFO-UHFFFAOYSA-N pyridoxal 5'-phosphate Chemical compound CC1=NC=C(COP(O)(O)=O)C(C=O)=C1O NGVDGCNFYWLIFO-UHFFFAOYSA-N 0.000 description 2
- 230000000717 retained effect Effects 0.000 description 2
- 230000007017 scission Effects 0.000 description 2
- 238000010845 search algorithm Methods 0.000 description 2
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 2
- 210000000952 spleen Anatomy 0.000 description 2
- 230000002269 spontaneous effect Effects 0.000 description 2
- 238000010561 standard procedure Methods 0.000 description 2
- 239000004094 surface-active agent Substances 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 229940124597 therapeutic agent Drugs 0.000 description 2
- 210000001541 thymus gland Anatomy 0.000 description 2
- 231100000331 toxic Toxicity 0.000 description 2
- 230000002588 toxic effect Effects 0.000 description 2
- 239000003053 toxin Substances 0.000 description 2
- 231100000765 toxin Toxicity 0.000 description 2
- 108700012359 toxins Proteins 0.000 description 2
- 230000009466 transformation Effects 0.000 description 2
- 230000009261 transgenic effect Effects 0.000 description 2
- 238000011830 transgenic mouse model Methods 0.000 description 2
- 108091005703 transmembrane proteins Proteins 0.000 description 2
- 102000035160 transmembrane proteins Human genes 0.000 description 2
- 239000004474 valine Substances 0.000 description 2
- 239000003981 vehicle Substances 0.000 description 2
- 230000035899 viability Effects 0.000 description 2
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 1
- PXFBZOLANLWPMH-UHFFFAOYSA-N 16-Epiaffinine Natural products C1C(C2=CC=CC=C2N2)=C2C(=O)CC2C(=CC)CN(C)C1C2CO PXFBZOLANLWPMH-UHFFFAOYSA-N 0.000 description 1
- CHHHXKFHOYLYRE-UHFFFAOYSA-M 2,4-Hexadienoic acid, potassium salt (1:1), (2E,4E)- Chemical compound [K+].CC=CC=CC([O-])=O CHHHXKFHOYLYRE-UHFFFAOYSA-M 0.000 description 1
- GOJUJUVQIVIZAV-UHFFFAOYSA-N 2-amino-4,6-dichloropyrimidine-5-carbaldehyde Chemical group NC1=NC(Cl)=C(C=O)C(Cl)=N1 GOJUJUVQIVIZAV-UHFFFAOYSA-N 0.000 description 1
- BUOYTFVLNZIELF-UHFFFAOYSA-N 2-phenyl-1h-indole-4,6-dicarboximidamide Chemical compound N1C2=CC(C(=N)N)=CC(C(N)=N)=C2C=C1C1=CC=CC=C1 BUOYTFVLNZIELF-UHFFFAOYSA-N 0.000 description 1
- FWBHETKCLVMNFS-UHFFFAOYSA-N 4',6-Diamino-2-phenylindol Chemical compound C1=CC(C(=N)N)=CC=C1C1=CC2=CC=C(C(N)=N)C=C2N1 FWBHETKCLVMNFS-UHFFFAOYSA-N 0.000 description 1
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 1
- 102000007469 Actins Human genes 0.000 description 1
- 108010085238 Actins Proteins 0.000 description 1
- 102100034540 Adenomatous polyposis coli protein Human genes 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- 102000009027 Albumins Human genes 0.000 description 1
- 239000012103 Alexa Fluor 488 Substances 0.000 description 1
- 239000012110 Alexa Fluor 594 Substances 0.000 description 1
- 208000037259 Amyloid Plaque Diseases 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 1
- 208000023345 Autoimmune Diseases of the Nervous System Diseases 0.000 description 1
- 208000023275 Autoimmune disease Diseases 0.000 description 1
- 101100356682 Caenorhabditis elegans rho-1 gene Proteins 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- 102000014914 Carrier Proteins Human genes 0.000 description 1
- 241000700198 Cavia Species 0.000 description 1
- 108010001857 Cell Surface Receptors Proteins 0.000 description 1
- 102000000844 Cell Surface Receptors Human genes 0.000 description 1
- 108700010070 Codon Usage Proteins 0.000 description 1
- 108010035532 Collagen Proteins 0.000 description 1
- 102000008186 Collagen Human genes 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- 206010061818 Disease progression Diseases 0.000 description 1
- 208000012661 Dyskinesia Diseases 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 1
- 102400000686 Endothelin-1 Human genes 0.000 description 1
- 101800004490 Endothelin-1 Proteins 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 1
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 108010067306 Fibronectins Proteins 0.000 description 1
- 102000016359 Fibronectins Human genes 0.000 description 1
- 241000233866 Fungi Species 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 208000032843 Hemorrhage Diseases 0.000 description 1
- 101000878605 Homo sapiens Low affinity immunoglobulin epsilon Fc receptor Proteins 0.000 description 1
- 101001124991 Homo sapiens Nitric oxide synthase, inducible Proteins 0.000 description 1
- 101001067174 Homo sapiens Plexin-B1 Proteins 0.000 description 1
- 101000686246 Homo sapiens Ras-related protein R-Ras Proteins 0.000 description 1
- 102000009786 Immunoglobulin Constant Regions Human genes 0.000 description 1
- 108010009817 Immunoglobulin Constant Regions Proteins 0.000 description 1
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 1
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 1
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- 108010001831 LDL receptors Proteins 0.000 description 1
- 102000000853 LDL receptors Human genes 0.000 description 1
- 108010085895 Laminin Proteins 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- 102100038007 Low affinity immunoglobulin epsilon Fc receptor Human genes 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 241000699660 Mus musculus Species 0.000 description 1
- 101100480715 Mus musculus Mapt gene Proteins 0.000 description 1
- 101100042271 Mus musculus Sema3b gene Proteins 0.000 description 1
- 101000808007 Mus musculus Vascular endothelial growth factor A Proteins 0.000 description 1
- 108010057466 NF-kappa B Proteins 0.000 description 1
- 102000003945 NF-kappa B Human genes 0.000 description 1
- 206010056677 Nerve degeneration Diseases 0.000 description 1
- 208000012902 Nervous system disease Diseases 0.000 description 1
- 208000025966 Neurological disease Diseases 0.000 description 1
- 102100029438 Nitric oxide synthase, inducible Human genes 0.000 description 1
- 108091028043 Nucleic acid sequence Proteins 0.000 description 1
- 206010030113 Oedema Diseases 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 206010033892 Paraplegia Diseases 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 102000035195 Peptidases Human genes 0.000 description 1
- 206010057249 Phagocytosis Diseases 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- 102000007327 Protamines Human genes 0.000 description 1
- 108010007568 Protamines Proteins 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 description 1
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 description 1
- 108010067787 Proteoglycans Proteins 0.000 description 1
- 101150111584 RHOA gene Proteins 0.000 description 1
- 102100024683 Ras-related protein R-Ras Human genes 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 1
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 1
- BUGBHKTXTAQXES-UHFFFAOYSA-N Selenium Chemical compound [Se] BUGBHKTXTAQXES-UHFFFAOYSA-N 0.000 description 1
- 238000012300 Sequence Analysis Methods 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 1
- 108010021188 Superoxide Dismutase-1 Proteins 0.000 description 1
- 102100038836 Superoxide dismutase [Cu-Zn] Human genes 0.000 description 1
- 208000018359 Systemic autoimmune disease Diseases 0.000 description 1
- 230000024932 T cell mediated immunity Effects 0.000 description 1
- 241000282458 Ursus sp. Species 0.000 description 1
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 1
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 1
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 1
- 230000005856 abnormality Effects 0.000 description 1
- 239000008351 acetate buffer Substances 0.000 description 1
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 1
- 230000021736 acetylation Effects 0.000 description 1
- 238000006640 acetylation reaction Methods 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 238000011374 additional therapy Methods 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 235000004279 alanine Nutrition 0.000 description 1
- 230000001476 alcoholic effect Effects 0.000 description 1
- 230000000735 allogeneic effect Effects 0.000 description 1
- VREFGVBLTWBCJP-UHFFFAOYSA-N alprazolam Chemical compound C12=CC(Cl)=CC=C2N2C(C)=NN=C2CN=C1C1=CC=CC=C1 VREFGVBLTWBCJP-UHFFFAOYSA-N 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- PNEYBMLMFCGWSK-UHFFFAOYSA-N aluminium oxide Inorganic materials [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 description 1
- CEGOLXSVJUTHNZ-UHFFFAOYSA-K aluminium tristearate Chemical compound [Al+3].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O CEGOLXSVJUTHNZ-UHFFFAOYSA-K 0.000 description 1
- 229940063655 aluminum stearate Drugs 0.000 description 1
- 206010002022 amyloidosis Diseases 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 210000004102 animal cell Anatomy 0.000 description 1
- 230000002424 anti-apoptotic effect Effects 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 230000003302 anti-idiotype Effects 0.000 description 1
- 230000001028 anti-proliverative effect Effects 0.000 description 1
- 229940121375 antifungal agent Drugs 0.000 description 1
- 239000003429 antifungal agent Substances 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 238000003782 apoptosis assay Methods 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 239000008365 aqueous carrier Substances 0.000 description 1
- 239000003125 aqueous solvent Substances 0.000 description 1
- 239000007900 aqueous suspension Substances 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 125000003118 aryl group Chemical group 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 235000009582 asparagine Nutrition 0.000 description 1
- 229960001230 asparagine Drugs 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 208000035362 autoimmune disorder of the nervous system Diseases 0.000 description 1
- 210000002457 barrier cell Anatomy 0.000 description 1
- 210000004227 basal ganglia Anatomy 0.000 description 1
- 230000006736 behavioral deficit Effects 0.000 description 1
- 238000009227 behaviour therapy Methods 0.000 description 1
- 230000003542 behavioural effect Effects 0.000 description 1
- 235000019445 benzyl alcohol Nutrition 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 108091008324 binding proteins Proteins 0.000 description 1
- 238000012742 biochemical analysis Methods 0.000 description 1
- 239000000090 biomarker Substances 0.000 description 1
- 210000004204 blood vessel Anatomy 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 230000006931 brain damage Effects 0.000 description 1
- 231100000874 brain damage Toxicity 0.000 description 1
- 208000029028 brain injury Diseases 0.000 description 1
- BPKIGYQJPYCAOW-FFJTTWKXSA-I calcium;potassium;disodium;(2s)-2-hydroxypropanoate;dichloride;dihydroxide;hydrate Chemical compound O.[OH-].[OH-].[Na+].[Na+].[Cl-].[Cl-].[K+].[Ca+2].C[C@H](O)C([O-])=O BPKIGYQJPYCAOW-FFJTTWKXSA-I 0.000 description 1
- 210000001043 capillary endothelial cell Anatomy 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 150000001720 carbohydrates Chemical group 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 239000012876 carrier material Substances 0.000 description 1
- 239000006143 cell culture medium Substances 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 238000001516 cell proliferation assay Methods 0.000 description 1
- 230000004656 cell transport Effects 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 235000010980 cellulose Nutrition 0.000 description 1
- 230000008496 central nervous system homeostasis Effects 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- 238000007385 chemical modification Methods 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 229960004926 chlorobutanol Drugs 0.000 description 1
- 208000007118 chronic progressive multiple sclerosis Diseases 0.000 description 1
- 238000010367 cloning Methods 0.000 description 1
- 238000011260 co-administration Methods 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 230000007278 cognition impairment Effects 0.000 description 1
- 230000003930 cognitive ability Effects 0.000 description 1
- 229920001436 collagen Polymers 0.000 description 1
- 239000008119 colloidal silica Substances 0.000 description 1
- 238000002648 combination therapy Methods 0.000 description 1
- 238000012875 competitive assay Methods 0.000 description 1
- 230000002860 competitive effect Effects 0.000 description 1
- 230000006957 competitive inhibition Effects 0.000 description 1
- 230000024203 complement activation Effects 0.000 description 1
- 238000004590 computer program Methods 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 1
- 210000000805 cytoplasm Anatomy 0.000 description 1
- 210000004292 cytoskeleton Anatomy 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 230000001934 delay Effects 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- 230000008021 deposition Effects 0.000 description 1
- 238000009795 derivation Methods 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 238000002405 diagnostic procedure Methods 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- UGMCXQCYOVCMTB-UHFFFAOYSA-K dihydroxy(stearato)aluminium Chemical compound CCCCCCCCCCCCCCCCCC(=O)O[Al](O)O UGMCXQCYOVCMTB-UHFFFAOYSA-K 0.000 description 1
- GXGAKHNRMVGRPK-UHFFFAOYSA-N dimagnesium;dioxido-bis[[oxido(oxo)silyl]oxy]silane Chemical compound [Mg+2].[Mg+2].[O-][Si](=O)O[Si]([O-])([O-])O[Si]([O-])=O GXGAKHNRMVGRPK-UHFFFAOYSA-N 0.000 description 1
- ZPWVASYFFYYZEW-UHFFFAOYSA-L dipotassium hydrogen phosphate Chemical compound [K+].[K+].OP([O-])([O-])=O ZPWVASYFFYYZEW-UHFFFAOYSA-L 0.000 description 1
- 229910000396 dipotassium phosphate Inorganic materials 0.000 description 1
- 235000019797 dipotassium phosphate Nutrition 0.000 description 1
- 230000006806 disease prevention Effects 0.000 description 1
- 230000005750 disease progression Effects 0.000 description 1
- BNIILDVGGAEEIG-UHFFFAOYSA-L disodium hydrogen phosphate Chemical compound [Na+].[Na+].OP([O-])([O-])=O BNIILDVGGAEEIG-UHFFFAOYSA-L 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 230000003828 downregulation Effects 0.000 description 1
- 230000001490 effect on brain Effects 0.000 description 1
- 230000005611 electricity Effects 0.000 description 1
- 210000003038 endothelium Anatomy 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 238000011067 equilibration Methods 0.000 description 1
- BEFDCLMNVWHSGT-UHFFFAOYSA-N ethenylcyclopentane Chemical compound C=CC1CCCC1 BEFDCLMNVWHSGT-UHFFFAOYSA-N 0.000 description 1
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 1
- 229940093471 ethyl oleate Drugs 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 210000002744 extracellular matrix Anatomy 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 230000022244 formylation Effects 0.000 description 1
- 238000006170 formylation reaction Methods 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 230000005021 gait Effects 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 125000005456 glyceride group Chemical group 0.000 description 1
- 229960002449 glycine Drugs 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 210000000020 growth cone Anatomy 0.000 description 1
- 230000000004 hemodynamic effect Effects 0.000 description 1
- 238000007489 histopathology method Methods 0.000 description 1
- 239000000710 homodimer Substances 0.000 description 1
- 102000055762 human PLXNB1 Human genes 0.000 description 1
- 230000028996 humoral immune response Effects 0.000 description 1
- 150000002433 hydrophilic molecules Chemical class 0.000 description 1
- 230000006951 hyperphosphorylation Effects 0.000 description 1
- 210000001822 immobilized cell Anatomy 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 230000006058 immune tolerance Effects 0.000 description 1
- 230000000984 immunochemical effect Effects 0.000 description 1
- 238000002991 immunohistochemical analysis Methods 0.000 description 1
- 230000002055 immunohistochemical effect Effects 0.000 description 1
- 238000009169 immunotherapy Methods 0.000 description 1
- 239000011261 inert gas Substances 0.000 description 1
- 210000004969 inflammatory cell Anatomy 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 230000037456 inflammatory mechanism Effects 0.000 description 1
- 230000028709 inflammatory response Effects 0.000 description 1
- 230000004941 influx Effects 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 108091008042 inhibitory receptors Proteins 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 239000007972 injectable composition Substances 0.000 description 1
- 229940102223 injectable solution Drugs 0.000 description 1
- 208000014674 injury Diseases 0.000 description 1
- 102000006495 integrins Human genes 0.000 description 1
- 108010044426 integrins Proteins 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- PGHMRUGBZOYCAA-ADZNBVRBSA-N ionomycin Chemical compound O1[C@H](C[C@H](O)[C@H](C)[C@H](O)[C@H](C)/C=C/C[C@@H](C)C[C@@H](C)C(/O)=C/C(=O)[C@@H](C)C[C@@H](C)C[C@@H](CCC(O)=O)C)CC[C@@]1(C)[C@@H]1O[C@](C)([C@@H](C)O)CC1 PGHMRUGBZOYCAA-ADZNBVRBSA-N 0.000 description 1
- PGHMRUGBZOYCAA-UHFFFAOYSA-N ionomycin Natural products O1C(CC(O)C(C)C(O)C(C)C=CCC(C)CC(C)C(O)=CC(=O)C(C)CC(C)CC(CCC(O)=O)C)CCC1(C)C1OC(C)(C(C)O)CC1 PGHMRUGBZOYCAA-UHFFFAOYSA-N 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 239000007951 isotonicity adjuster Substances 0.000 description 1
- 230000002147 killing effect Effects 0.000 description 1
- 238000011813 knockout mouse model Methods 0.000 description 1
- 238000011005 laboratory method Methods 0.000 description 1
- 150000002605 large molecules Chemical class 0.000 description 1
- 239000003446 ligand Substances 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 230000033001 locomotion Effects 0.000 description 1
- 210000005230 lumbar spinal cord Anatomy 0.000 description 1
- 210000004924 lung microvascular endothelial cell Anatomy 0.000 description 1
- 210000003563 lymphoid tissue Anatomy 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 239000000391 magnesium silicate Substances 0.000 description 1
- 229940099273 magnesium trisilicate Drugs 0.000 description 1
- 229910000386 magnesium trisilicate Inorganic materials 0.000 description 1
- 235000019793 magnesium trisilicate Nutrition 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 210000001161 mammalian embryo Anatomy 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 239000003550 marker Substances 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 108010082117 matrigel Proteins 0.000 description 1
- 230000035800 maturation Effects 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 230000015654 memory Effects 0.000 description 1
- 210000001259 mesencephalon Anatomy 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- 230000000116 mitigating effect Effects 0.000 description 1
- 230000037230 mobility Effects 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 239000007922 nasal spray Substances 0.000 description 1
- 210000005036 nerve Anatomy 0.000 description 1
- 230000007372 neural signaling Effects 0.000 description 1
- 210000004498 neuroglial cell Anatomy 0.000 description 1
- 230000002314 neuroinflammatory effect Effects 0.000 description 1
- 230000007514 neuronal growth Effects 0.000 description 1
- 230000003472 neutralizing effect Effects 0.000 description 1
- 239000012457 nonaqueous media Substances 0.000 description 1
- 239000000346 nonvolatile oil Substances 0.000 description 1
- 238000007899 nucleic acid hybridization Methods 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- 238000002515 oligonucleotide synthesis Methods 0.000 description 1
- 150000002482 oligosaccharides Polymers 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 150000002895 organic esters Chemical class 0.000 description 1
- 230000002018 overexpression Effects 0.000 description 1
- 230000004792 oxidative damage Effects 0.000 description 1
- 230000000242 pagocytic effect Effects 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 239000008010 parenteral excipient Substances 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 230000010412 perfusion Effects 0.000 description 1
- 230000008782 phagocytosis Effects 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 229960003742 phenol Drugs 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 239000007981 phosphate-citrate buffer Substances 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 108050009312 plexin Proteins 0.000 description 1
- 102000002022 plexin Human genes 0.000 description 1
- 229920000058 polyacrylate Polymers 0.000 description 1
- 229920005862 polyol Polymers 0.000 description 1
- 150000003077 polyols Chemical class 0.000 description 1
- 229950008882 polysorbate Drugs 0.000 description 1
- 229920000136 polysorbate Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 235000010241 potassium sorbate Nutrition 0.000 description 1
- 239000004302 potassium sorbate Substances 0.000 description 1
- 229940069338 potassium sorbate Drugs 0.000 description 1
- 238000011045 prefiltration Methods 0.000 description 1
- 230000002335 preservative effect Effects 0.000 description 1
- 238000002203 pretreatment Methods 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- 238000004393 prognosis Methods 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- 229950008679 protamine sulfate Drugs 0.000 description 1
- 238000011552 rat model Methods 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 238000007634 remodeling Methods 0.000 description 1
- 230000008439 repair process Effects 0.000 description 1
- 230000003252 repetitive effect Effects 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 239000000523 sample Substances 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 230000037390 scarring Effects 0.000 description 1
- 201000008628 secondary progressive multiple sclerosis Diseases 0.000 description 1
- 229910052711 selenium Inorganic materials 0.000 description 1
- 239000011669 selenium Substances 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 230000037432 silent mutation Effects 0.000 description 1
- 239000002356 single layer Substances 0.000 description 1
- 238000002741 site-directed mutagenesis Methods 0.000 description 1
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 1
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 1
- 239000001488 sodium phosphate Substances 0.000 description 1
- 229910000162 sodium phosphate Inorganic materials 0.000 description 1
- 235000010199 sorbic acid Nutrition 0.000 description 1
- 229940075582 sorbic acid Drugs 0.000 description 1
- 239000004334 sorbic acid Substances 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 230000006886 spatial memory Effects 0.000 description 1
- 230000009870 specific binding Effects 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 230000001954 sterilising effect Effects 0.000 description 1
- 238000004659 sterilization and disinfection Methods 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- 150000005846 sugar alcohols Polymers 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- RTKIYNMVFMVABJ-UHFFFAOYSA-L thimerosal Chemical compound [Na+].CC[Hg]SC1=CC=CC=C1C([O-])=O RTKIYNMVFMVABJ-UHFFFAOYSA-L 0.000 description 1
- 229940033663 thimerosal Drugs 0.000 description 1
- 230000036964 tight binding Effects 0.000 description 1
- 238000013518 transcription Methods 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- 230000031998 transcytosis Effects 0.000 description 1
- 238000013519 translation Methods 0.000 description 1
- 230000001296 transplacental effect Effects 0.000 description 1
- 230000008736 traumatic injury Effects 0.000 description 1
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 1
- 210000001364 upper extremity Anatomy 0.000 description 1
- 230000003827 upregulation Effects 0.000 description 1
- 238000001291 vacuum drying Methods 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 235000013311 vegetables Nutrition 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 210000002268 wool Anatomy 0.000 description 1
- 150000003751 zinc Chemical class 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/10—Antioedematous agents; Diuretics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
- A61P21/02—Muscle relaxants, e.g. for tetanus or cramps
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/08—Antiepileptics; Anticonvulsants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Neurology (AREA)
- Immunology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Biomedical Technology (AREA)
- Neurosurgery (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Pain & Pain Management (AREA)
- Epidemiology (AREA)
- Mycology (AREA)
- Microbiology (AREA)
- Endocrinology (AREA)
- Hospice & Palliative Care (AREA)
- Psychology (AREA)
- Psychiatry (AREA)
- Physical Education & Sports Medicine (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Rheumatology (AREA)
- Diabetes (AREA)
- Hematology (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Peptides Or Proteins (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
Description
本出願とともに提出したASCIIテキストファイル(名称:"1843_068PC03_SequenceListing_ascii.txt";サイズ:33,807バイト;および作成日:2012年10月10日)における電子的に提示した配列表の内容は、全体として参照により本明細書に組み入れられる。
CD100としても公知であるセマフォリン4D(SEMA4D)は、セマフォリン遺伝子ファミリーに属する膜貫通タンパク質である(例えば、SEQ ID NO: 1(ヒト);SEQ ID NO: 2(マウス))。SEMA4Dは、ホモ二量体として細胞表面上に発現しているが、細胞活性化時に、SEMA4Dは、タンパク質分解性切断を介して細胞表面から放出されて、タンパク質の可溶型であるsSEMA4Dを生成することができ、これもまた生物学的に活性を有する。例えば、Suzuki et al., Nature Rev. Immunol. 3:159-167 (2003)(非特許文献1);Kikutani et al., Nature Immunol. 9:17-23 (2008)(非特許文献2)を参照されたい。
I.定義
「1つの」(「a」または「an」)実体という用語は、1つまたは複数のその実体を指し;例えば、「抗SEMA4D抗体(an anti-SEMA4D antibody)」は、1つまたは複数の抗SEMA4D抗体を表すように理解されることに、注意されたい。そのように、「1つの」、「1つまたは複数の」、および「少なくとも1つの」という用語は、本明細書において互換的に使用することができる。
血液脳関門(BBB)は、循環血液と中枢神経系(CNS)との間の活性界面である。BBBは、2種の区画間の様々な物質の自由な移動を制限し、CNSの恒常性の維持において重大な役割を果たす。BBBは、関門機能および担体機能の両方を有する。BBBは、関門として、細胞および潜在的に毒性または有害な物質の血液から脳への移動を制限する。他方で、BBBは、担体として、脳へ栄養分を輸送することおよび代謝物を除去することを担当する。
本明細書において使用される際、「セマフォリン-4D」、「SEMA4D」、および「SEMA4Dポリペプチド」という用語は、「SEMA4D」および「Sema4D」のように、互換的に使用される。ある特定の態様において、SEMA4Dは、細胞の表面上に発現しているか、または細胞により分泌される。別の態様において、SEMA4Dは膜結合性である。別の態様において、SEMA4Dは可溶性、例えばsSEMA4Dである。他の態様において、SEMA4Dは、完全なサイズのSEMA4D、またはその断片、またはSEMA4D変異体ポリペプチドを含んでもよく、該SEMA4Dの断片またはSEMA4D変異体ポリペプチドは、完全なサイズのSEMA4Dのいくつかまたはすべての機能特性を保持している。
SEMA4Dに結合する抗体は、当技術分野において記載されている。例えば、米国特許出願公開第2008/0219971 A1号、米国特許出願公開第2010/0285036 A1号、および米国特許出願公開第2006/0233793 A1号、国際特許出願である国際公開公報第93/14125号、国際公開公報第2008/100995号、および国際公開公報第2010/129917号、ならびにHerold et al., Int. Immunol. 7(1): 1-8 (1995)を参照されたく、これらの各々は、全体として参照により本明細書に組み入れられる。
本発明の方法は、神経炎症性障害を有する対象において血液脳関門透過性を低下させるための、SEMA4DのSEMA4D受容体との相互作用の阻害物質、例えば、抗SEMA4D結合分子、抗プレキシンB1結合分子、またはこれらの組み合わせ、例えば、その抗原結合断片、変異体、および誘導体を含む抗体の使用に向けられる。ある特定の態様において、神経炎症性障害は、例えば、多発性硬化症、筋萎縮性側索硬化症、てんかん、アルツハイマー病、パーキンソン病、髄膜炎、脳浮腫、脳外傷、または卒中である。ある特定の態様において、内皮細胞は、SEMA4D受容体を発現し;ある特定の態様において、該受容体はプレキシン-B1である。以下の議論は、抗SEMA4D抗体、抗プレキシンB1抗体、およびこれらの組み合わせの投与に言及するが、本明細書において記載される方法はまた、本発明の抗SEMA4D抗体または抗プレキシンB1抗体の望ましい特性を保持する、例えば、SEMA4D、例えば、ヒト、マウス、またはヒトおよびマウスのSEMA4Dに特異的に結合することができる、SEMA4D中和活性を有する、ならびに/またはSEMA-4Dのその受容体、例えばプレキシン-B1との相互作用を遮断する、これらの抗SEMA4D抗体または抗プレキシンB1抗体の抗原結合断片、変異体、および誘導体にも適用可能である。
抗SEMA4D結合分子、抗プレキシンB1結合分子、またはこれらの組み合わせ、例えば、抗体、またはその抗原結合断片、変異体、もしくは誘導体を調製する方法、およびこれらを必要とする対象に投与する方法は、当業者に周知であるか、または当業者により容易に決定される。抗SEMA4D結合分子、抗プレキシンB1結合分子、またはこれらの組み合わせ、例えば、抗体、またはその抗原結合断片、変異体、もしくは誘導体の投与の経路は、例えば、経口であるか、非経口であるか、吸入によるか、または局所であることができる。本明細書において使用される非経口という用語は、例えば、静脈内投与、動脈内投与、腹腔内投与、筋肉内投与、皮下投与、直腸投与、または膣投与を含む。投与のこれらの形態のすべてが、本発明の範囲内であると明らかに企図されるが、投与のための形態の例は、注射用、特に、静脈内または動脈内の注射または点滴用の溶液であろう。注射に適した薬学的組成物は、緩衝剤(例えば、酢酸緩衝剤、リン酸緩衝剤、またはクエン酸緩衝剤)、界面活性剤(例えばポリソルベート)、任意で安定剤(例えばヒトアルブミン)などを含むことができる。しかしながら、本明細書における教示と適合する他の方法において、抗SEMA4D結合分子、抗プレキシンB1結合分子、またはこれらの組み合わせ、例えば、抗体、またはその抗原結合断片、変異体、もしくは誘導体を、有害な細胞集団の部位に直接送達し、それにより患部組織の治療剤への曝露を増加させることができる。
実験設計
動的インビトロBBB(「DIV-BBB」)モデルを行って、BBBの完全性に対する組み換えヒトSEMA4D(huSEMA4D-his)およびVX15/2503(全体として参照により本明細書に組み入れられる米国特許出願公開第2010/0285036 A1号において詳細に記載されている)の作用を研究した。2個のDIV-BBBカートリッジを、モデルにおいて試験した。基本的な実験設計を、図1に示す。増大する濃度の組み換えSEMA4D(rSEMA4D)を、12時間間隔で管腔中に添加し、平衡化させた(およそ12時間/濃度)。rSEMA4Dを、時間0で0.05μg/mlの濃度で管腔中に最初に添加した。rSEMA4Dの濃度を、各間隔で10倍に、例えば、12時間で0.5μg/ml、24時間で5.0μg/ml、36時間で50.0μg/mlに増大させた。TEER測定値を、変動する濃度のrSEMA4DでのBBBの透過性の変化の反映として、各間隔の間に取得した。36時間で50.0μg/mlの最終用量のrSEMA4Dの添加後に、VX15/2503を、48時間で250μg/mlの濃度で管腔中に添加した。VX15/2503の添加の24時間後である72時間で、BBBの透過性を再び測定した。
BBBの形成後に、BBBの完全性に対するrSEMA4Dの作用を、増大する濃度の組み換えSEMA4D(rSEMA4D)を2個のカートリッジの管腔中に添加することにより測定した。rSEMA4Dを、時間0で0.05μg/mlの濃度で管腔中に最初に添加した。rSEMA4Dの濃度を、各12時間間隔で10倍に、例えば、12時間で0.5μg/ml、24時間で5μg/ml、および36時間で50.0μg/mlに増大させた。TEER測定値を、変動する濃度のrSEMA4DでのBBBの透過性の変化の反映として、各間隔の間および各間隔中に取得した。全体的に、BBBの透過性は、0.05μg/mlのrSEMA4Dで相対的に安定のままであった。0.5μg/mlから開始して、増大する濃度のrSEMA4D(すなわち、0.5μg/ml、5μg/ml、および50μg/ml)は、内皮細胞層の透過性の増大を反映するTEER測定値の低下を結果としてもたらした。これらの結果を、図2に示す。
段階的に増加する投薬量のrSEMA4Dへの曝露後のBBBに対する抗SEMA4D抗体の作用を測定するために、VX15/2503を、48時間で250μg/mlの濃度で添加した。TEER測定値を、72時間で取得した。VX15/2503での処置は、2個のカートリッジにおいて全体的なBBBの透過性の低下(または抵抗率の増大)を結果としてもたらした。この透過性の低下は、BBBの回復を反映する。結果を、図2に示す。
実験設計
インビトロDIV-BBBモデルを使用する第2の実験を行って、BBBの完全性に対するSEMA4DおよびVX15/2503の作用を研究した。基本的な実験設計は、上記の実施例1および図1において示されるものと同様であった。2週間、DIV-BBBカートリッジは、内皮細胞区画および星状細胞区画におけるBBB形成を受けた。TEER中に反映されるBBBの形成を、図3および図4に示す。
BBBの形成後に、BBBの完全性に対するrSEMA4Dの作用を、増大する濃度の組み換えSEMA4D(rSEMA4D)を12時間間隔で3個のカートリッジのセットのうちの第1のカートリッジの管腔中に添加し、平衡化させることにより(およそ12時間/濃度)測定した。rSEMA4Dを、時間0で0.5μg/mlの濃度で管腔中に最初に添加した。rSEMA4Dの濃度を、各間隔で10倍に、例えば、12時間で5μg/ml、および24時間で50.0μg/mlに増大させた。TEER測定値を、変動する濃度のrSEMA4DでのBBBの透過性の変化の反映として、各間隔の間に取得した。全体的に、増大する濃度のrSEMA4Dは、BBBの透過性の増大を反映するTEER測定値の低下を結果としてもたらした。これらの結果を、図3に示す。
24時間で50.0μg/mlの最終用量のrSEMA4Dの添加後に、TEERおよびBBBの透過性に対するVX15/2503の作用を測定した。図3において、VX15/2503抗体を、36時間で250μg/mlの濃度で、段階的に増加した用量のrSEMA4Dを受け取った3個のカートリッジのうちの2個に添加し、他方、同一濃度のアイソタイプ対照抗体を、段階的に増加した用量のrSEMA4Dを受け取った残りの1個のカートリッジに添加した。TEER測定値を、種々のその後の時点で取得した。VX15/2503での処置は、実験の開始時のピークレベルに戻るTEERの増大を結果としてもたらし、全体的なBBBの透過性の低下(すなわち、BBBの回復)を反映した。アイソタイプ対照抗体を受け取った1個のカートリッジにおいて、TEERレベルは、rSEMA4Dでの処置により誘導された相対的に低減したレベルのままであり、BBBの透過性の有意味な低下を示さなかった。同様の結果を、図4に示す。図4において、VX15/2503抗体を、48時間で250μg/mlの濃度で、最初に対照組み換えC35タンパク質を、その後50μg/mlのrSEMA4Dを12時間受け取った2個のカートリッジに添加した。VX15/2503での処置は、実験の開始時のピークレベルに戻るTEERの増大を結果としてもたらし、全体的なBBBの透過性の低下(すなわちBBBの回復)を反映した。
別の研究を実施して、BBBの完全性に対する抗プレキシン-B1抗体(MAB37491 Human Plexin-B1 MAb (Clone 559830), R&D Systems)の作用を測定した。この抗体は、SEMA4Dのプレキシン-B1受容体に対する結合を遮断する。この研究の結果を、図5に示す。図5に示すように、4個のDIV-BBBカートリッジ中のヒト内皮細胞および星状細胞は、上記の実験と同様のBBB形成を受けた。BBB形成後、rSEMA4Dを、BBB透過性の増大(すなわちBBBの破壊)を誘導する50.0μg/mlの濃度で添加した。rSEMA4Dの添加後、抗プレキシン-B1抗体を、6時間で、125μg/mlの濃度で4個のカートリッジのうちの2個に添加し、VX15/2503抗体を、250μg/mlの濃度で4個のカートリッジのうちの1個に添加し、アイソタイプ対照抗体を、250μg/mlの濃度で残りのカートリッジに添加した。TEER測定値を、種々のその後の時点で取得した。VX15/2503または抗プレキシン-B1抗体いずれかでの処置は、両方の作用物質でのTEERレベルの増大を結果としてもたらした。VX15/2503での処置は、最後の時点で、抗プレキシン-B1抗体での処置よりもいくらか大きいTEERの増大を結果としてもたらした。2種の抗体の作用は、すべての他の時点では区別不能である。TEERの増大は、VX15/2503または抗プレキシン-B1抗体いずれかの存在下で、全体的なBBBの透過性の低下(すなわちBBBの回復)を反映する。アイソタイプ対照抗体を受け取った1個のカートリッジにおいて、TEERレベルは、rSEMA4Dでの処置により誘導された相対的に低減したレベルのままであり、BBBの透過性の有意味な低下を示さなかった。処置がまた、VX15/2503および抗プレキシン-B1の組み合わせを用いて実施できることも、認識されるべきである。
実験設計
インビトロDIV-BBBモデルを使用する別の実験を行って、活性化末梢血単核細胞(PBMC)およびフロー停止により誘導されるBBBの崩壊後のBBBの完全性の回復に対するVX15/2503の作用を研究した。2週間、2個のDIV-BBBカートリッジは、内皮細胞区画および星状細胞区画におけるBBB形成を受けた。
BBBの形成後に、BBBの完全性に対する活性化PBMCの作用を測定した。PBMCを、PMA/イオノマイシンで2時間活性化させ、次に、106/mlの濃度で2個のカートリッジの管腔中に添加した。TEER測定値を、BBBの透過性の変化の反映として、活性化PBMCの添加前および添加後に取得した。全体的に、活性化PBMCを106/mlでカートリッジに添加することは、BBBの透過性の増大を反映するTEER測定値の低下を結果としてもたらした。これらの結果を、図6に示す。
活性化PBMCおよびフロー停止への曝露後に、TEERおよびBBBの透過性に対するVX15/2503の作用を測定した。VX15/2503抗体を、250μg/mlの濃度で、活性化PBMCを受け取った2個のカートリッジのうちの1個に添加し、他方、同一濃度のアイソタイプ対照抗体(Isotype Control Ig, 2269)を、残りのカートリッジに添加した。TEER測定値を、種々のその後の時点で取得した。図6に示すように、VX15/2503での処置は、実験の開始時のピークレベルに戻るTEERの増大を結果としてもたらし、全体的なBBBの透過性の低下(すなわちBBBの回復)を反映した。アイソタイプ対照抗体を受け取ったカートリッジにおいて、TEERレベルは、活性化PBMCおよびフロー停止での処置により誘導された相対的に低減したレベルのままであり、BBBの透過性の有意味な低下を示さなかった。
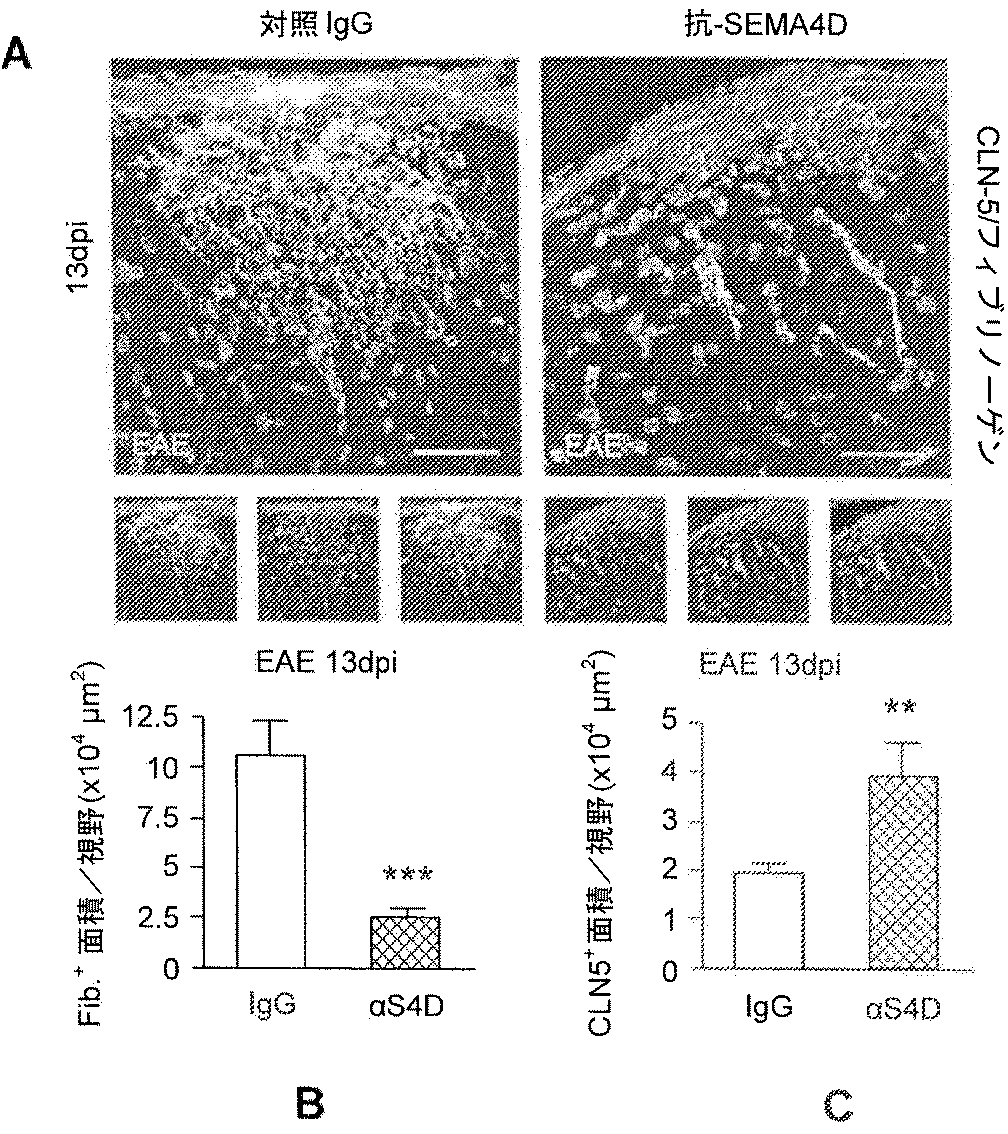
抗SEMA4D結合分子、例えば、抗体、またはその抗原結合断片、変異体、もしくは誘導体、例えばVX15/2503を、インビボ実験的自己免疫性脳脊髄炎(EAE)モデルにおいて試験した。
インビボEAEモデルにおいて、EAEを、CFA(完全フロイントアジュバント)中のPLPペプチド(139-151)での免疫処置により、12週齢のSJL/Jマウス(1群あたり10匹)中で誘導させた。マウスを、次に、誘導後7日目から1週間に1回、600μgの抗SEMA4D抗体(VX15/2503抗体)または対照IgGで処置した。神経学的兆候を、誘導後11日目に最初に観察した(dpi)。誘導後13日目、疾患の急性期中に、1群あたり4匹のマウスを屠殺し、組織病理学的解析のために腰髄試料を調製した。試料中のBBB破壊を検出するために、これらの試料をフィブリノーゲンおよびクローディン-5について免疫染色した。免疫染色の手順は以下である:切片をPBS中で2回すすぎ、次にPBS 0.1%グリシン中で10分間インキュベーションし、PBS 0.3%Triton X-100 10%ヤギ血清中で1時間ブロッキングし、ブロッキング緩衝液中の一次抗体と一晩4℃でインキュベーションした。クローディン-5(CLN-5)については、ブロッキングの前に、切片を100℃のEDTA、pH8中に浸した。使用した一次抗体は、抗CLN-5(1:50)および抗フィブリノーゲン(1:1,000)であった。PBS 0.3%Triton X-100中で3回洗浄した後、切片を次に、ブロッキング緩衝液中のAlexaFluor 488および/またはAlexaFluor 594と結合した関連する種特異的な二次抗体(1/100; Molecular Probes)において1時間25℃でインキュベーションし、再び3回洗浄し、4,6-ジアミジノ-2-フェニルインドール(DAPI)で対比染色した。すべての試料を、Axiovert 200倒立蛍光顕微鏡に付属したZeiss LSM 510 METAレーザー走査共焦点システムを用いて検討し、撮影した。
実験設計
CNSに由来する内皮細胞の可溶性組み換えSEMA4Dでの処置後の、鍵となる内皮密着結合タンパク質であるクローディン-5の発現を調査した。このモデルにおいては、初代マウス中枢神経系(CNS)内皮培養物を単離し、6ウェルのマトリゲルでコーティングしたプレート上にプレーティングした(10個の脳から単離したMBCECを、3 mlの初代内皮細胞培養培地中に再懸濁して、ウェルあたり250 ulでプレーティングした)。培養物を、単離後7日目に使用した。培養物を、1ng/ml、10ng/ml、または100ng/mlの組み換えマウスSEMA4Dまたは100ng/mlのマウスVEGF-A(陽性対照)で24時間処置した。動物の内皮培養物を次に、SDS-ポリアクリルアミドゲル電気泳動(SDS-PAGE)、ならびに、クローディン-5密着結合タンパク質およびアクチンをローディングした対照についての免疫ブロッティングに供した。データを走査し、ImageJソフトウェア(NIH)を用いた濃度測定に供した。
抗SEMA4D結合分子または抗プレキシンB1結合分子、例えば、抗体、またはその抗原結合断片、変異体、もしくは誘導体、例えばMAb 67(全体として参照により本明細書に組み入れられる米国特許出願公開第2010/0285036 A1号に詳細に記載されている)を、インビボ実験的アルツハイマー病(AD)遺伝子導入マウスモデルAPPSwDI/NOSC-/-を含むがこれに限定されない、神経炎症性障害の種々のモデルシステムにおいて試験する。これらのマウスは、APP-Swedish-Dutch-Iowa変異体マウスを酸化窒素合成酵素2ノックアウトマウスと交配することにより作製された(Colton et al., J Alzheimers Dis.15:571-587, 2008;Van Nostrand et al., Stroke 41:S135-S138, 2010)。APPSwDI/NOSC-/-マウスは、BBB機能の破壊、実質内アミロイド班、マウスtauの過剰なリン酸化、神経炎症、神経細胞死、および認知欠損を伴う、年齢に関連した神経血管アミロイド症を発症する。Wilcockらは、アミロイド-βに向けた能動免疫療法でのAPPSwDI/NOSC-/-マウスの処置が、アミロイド沈着の著しい低減をもたらすが、微出血の発生率の増大を伴うことを示している(Wilcock et al., J Neurosci. 29:7957-7965, 2009)。
[本発明1001]
神経炎症性障害を有する対象において血液脳関門透過性を低下させる方法であって、セマフォリン-4D(SEMA4D)に特異的に結合する単離された結合分子の有効量を該対象に投与する段階を含み、それにより該対象において血液脳関門透過性を低下させる、方法。
[本発明1002]
神経炎症性障害を有する対象においてクローディン-5の発現を維持するかまたは増加させる方法であって、セマフォリン-4D(SEMA4D)に特異的に結合する単離された結合分子の有効量を該対象に投与する段階を含み、該結合分子が該対象においてクローディン-5の発現を維持するかまたは増加させる、方法。
[本発明1003]
結合分子が、SEMA4Dのプレキシン-B1との相互作用を阻害する、本発明1001または1002の方法。
[本発明1004]
神経炎症性障害を有する対象において血液脳関門透過性を低下させる方法であって、セマフォリン4D(SEMA4D)のSEMA4D受容体との相互作用を特異的に阻害する単離された結合分子の有効量を該対象に投与する段階を含み、それにより該対象において血液脳関門透過性を低下させる、方法。
[本発明1005]
神経炎症性障害を有する対象を処置する方法であって、セマフォリン4D(SEMA4D)のSEMA4D受容体との相互作用を特異的に阻害する単離された結合分子の有効量を該対象に投与する段階を含み、該結合分子が血液脳関門の透過性を低下させ、それにより該対象を処置する、方法。
[本発明1006]
SEMA4D受容体がプレキシン-B1である、本発明1004または1005の方法。
[本発明1007]
結合分子が、SEMA4Dまたはプレキシン-B1に特異的に結合する、本発明1004〜1006のいずれかの方法。
[本発明1008]
VX15/2503または67からなる群より選択される参照モノクローナル抗体がSEMA4Dに特異的に結合することを、前記結合分子が競合的に阻害する、本発明1001〜1007のいずれかの方法。
[本発明1009]
神経炎症性障害を有する対象において血液脳関門透過性を低下させる方法であって、SEMA4Dに特異的に結合する単離された結合分子の有効量を該対象に投与する段階を含み、VX15/2503または67からなる群より選択される参照モノクローナル抗体がSEMA4Dに特異的に結合することを、該結合分子が競合的に阻害し、それにより該対象において血液脳関門透過性を低下させる、方法。
[本発明1010]
結合分子が、VX15/2503または67からなる群より選択される参照モノクローナル抗体と同一のSEMA4Dエピトープに特異的に結合する、本発明1001〜1009のいずれかの方法。
[本発明1011]
結合分子が、抗体またはその抗原結合断片を含む、本発明1001〜1010のいずれかの方法。
[本発明1012]
抗体またはその抗原結合断片が、SEQ ID NO 6、7、および8をそれぞれ含むVHCDR1〜3を含む可変重鎖(VH)、ならびに、SEQ ID NO 14、15、および16をそれぞれ含むVLCDR1〜3を含む可変軽鎖(VL)を含む、本発明1011の方法。
[本発明1013]
抗体またはその抗原結合断片が、モノクローナル抗体VX15/2503または67である、本発明1012の方法。
[本発明1014]
結合分子が、プレキシン-B1に特異的に結合する、本発明1007の方法。
[本発明1015]
SEMA4Dがプレキシン-B1に結合することを、前記結合分子が競合的に阻害する、本発明1014の方法。
[本発明1016]
結合分子が、抗プレキシン-B1抗体またはその抗原結合断片である、本発明1014または1015の方法。
[本発明1017]
神経炎症性障害を有する対象を処置する方法であって、セマフォリン-4D(SEMA4D)に特異的に結合する単離された結合分子およびプレキシン-B1に特異的に結合する単離された結合分子の有効量を該対象に投与する段階を含み、該SEMA4D結合分子およびプレキシン-B1結合分子が血液脳関門の透過性を低下させ、それにより該対象を処置する、方法。
[本発明1018]
神経炎症性障害を有する対象を処置する方法であって、セマフォリン4D(SEMA4D)のSEMA4D受容体との相互作用の阻害物質の有効量を該対象に投与する段階を含み、該阻害物質が血液脳関門の透過性を低下させ、それにより該対象を処置する、方法。
[本発明1019]
阻害物質が、抗SEMA4D結合分子、抗プレキシンB1結合分子、SEMA4Dの低分子阻害物質、またはSEMA4D受容体の低分子阻害物質からなる群より選択される、本発明1018の方法。
[本発明1020]
神経炎症性障害が、多発性硬化症、筋萎縮性側索硬化症、てんかん、アルツハイマー病、パーキンソン病、髄膜炎、脳浮腫、および脳外傷からなる群より選択される、本発明1001〜1019のいずれかの方法。
Claims (20)
- 神経炎症性障害を有する対象において血液脳関門透過性を低下させる方法であって、セマフォリン-4D(SEMA4D)に特異的に結合する単離された結合分子の有効量を該対象に投与する段階を含み、それにより該対象において血液脳関門透過性を低下させる、方法。
- 神経炎症性障害を有する対象においてクローディン-5の発現を維持するかまたは増加させる方法であって、セマフォリン-4D(SEMA4D)に特異的に結合する単離された結合分子の有効量を該対象に投与する段階を含み、該結合分子が該対象においてクローディン-5の発現を維持するかまたは増加させる、方法。
- 結合分子が、SEMA4Dのプレキシン-B1との相互作用を阻害する、請求項1または2記載の方法。
- 神経炎症性障害を有する対象において血液脳関門透過性を低下させる方法であって、セマフォリン4D(SEMA4D)のSEMA4D受容体との相互作用を特異的に阻害する単離された結合分子の有効量を該対象に投与する段階を含み、それにより該対象において血液脳関門透過性を低下させる、方法。
- 神経炎症性障害を有する対象を処置する方法であって、セマフォリン4D(SEMA4D)のSEMA4D受容体との相互作用を特異的に阻害する単離された結合分子の有効量を該対象に投与する段階を含み、該結合分子が血液脳関門の透過性を低下させ、それにより該対象を処置する、方法。
- SEMA4D受容体がプレキシン-B1である、請求項4または5記載の方法。
- 結合分子が、SEMA4Dまたはプレキシン-B1に特異的に結合する、請求項4〜6のいずれか一項記載の方法。
- VX15/2503または67からなる群より選択される参照モノクローナル抗体がSEMA4Dに特異的に結合することを、前記結合分子が競合的に阻害する、請求項1〜7のいずれか一項記載の方法。
- 神経炎症性障害を有する対象において血液脳関門透過性を低下させる方法であって、SEMA4Dに特異的に結合する単離された結合分子の有効量を該対象に投与する段階を含み、VX15/2503または67からなる群より選択される参照モノクローナル抗体がSEMA4Dに特異的に結合することを、該結合分子が競合的に阻害し、それにより該対象において血液脳関門透過性を低下させる、方法。
- 結合分子が、VX15/2503または67からなる群より選択される参照モノクローナル抗体と同一のSEMA4Dエピトープに特異的に結合する、請求項1〜9のいずれか一項記載の方法。
- 結合分子が、抗体またはその抗原結合断片を含む、請求項1〜10のいずれか一項記載の方法。
- 抗体またはその抗原結合断片が、SEQ ID NO 6、7、および8をそれぞれ含むVHCDR1〜3を含む可変重鎖(VH)、ならびに、SEQ ID NO 14、15、および16をそれぞれ含むVLCDR1〜3を含む可変軽鎖(VL)を含む、請求項11記載の方法。
- 抗体またはその抗原結合断片が、モノクローナル抗体VX15/2503または67である、請求項12記載の方法。
- 結合分子が、プレキシン-B1に特異的に結合する、請求項7記載の方法。
- SEMA4Dがプレキシン-B1に結合することを、前記結合分子が競合的に阻害する、請求項14記載の方法。
- 結合分子が、抗プレキシン-B1抗体またはその抗原結合断片である、請求項14または15記載の方法。
- 神経炎症性障害を有する対象を処置する方法であって、セマフォリン-4D(SEMA4D)に特異的に結合する単離された結合分子およびプレキシン-B1に特異的に結合する単離された結合分子の有効量を該対象に投与する段階を含み、該SEMA4D結合分子およびプレキシン-B1結合分子が血液脳関門の透過性を低下させ、それにより該対象を処置する、方法。
- 神経炎症性障害を有する対象を処置する方法であって、セマフォリン4D(SEMA4D)のSEMA4D受容体との相互作用の阻害物質の有効量を該対象に投与する段階を含み、該阻害物質が血液脳関門の透過性を低下させ、それにより該対象を処置する、方法。
- 阻害物質が、抗SEMA4D結合分子、抗プレキシンB1結合分子、SEMA4Dの低分子阻害物質、またはSEMA4D受容体の低分子阻害物質からなる群より選択される、請求項18記載の方法。
- 神経炎症性障害が、多発性硬化症、筋萎縮性側索硬化症、てんかん、アルツハイマー病、パーキンソン病、髄膜炎、脳浮腫、および脳外傷からなる群より選択される、請求項1〜19のいずれか一項記載の方法。
Applications Claiming Priority (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161545809P | 2011-10-11 | 2011-10-11 | |
| US61/545,809 | 2011-10-11 | ||
| US201161555726P | 2011-11-04 | 2011-11-04 | |
| US61/555,726 | 2011-11-04 | ||
| US201261593641P | 2012-02-01 | 2012-02-01 | |
| US61/593,641 | 2012-02-01 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014535877A Division JP6395606B2 (ja) | 2011-10-11 | 2012-10-11 | 血液脳関門透過性の調節のためのセマフォリン−4d結合分子の使用 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2017193569A true JP2017193569A (ja) | 2017-10-26 |
Family
ID=48082436
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014535877A Active JP6395606B2 (ja) | 2011-10-11 | 2012-10-11 | 血液脳関門透過性の調節のためのセマフォリン−4d結合分子の使用 |
| JP2017129377A Pending JP2017193569A (ja) | 2011-10-11 | 2017-06-30 | 血液脳関門透過性の調節のためのセマフォリン−4d結合分子の使用 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014535877A Active JP6395606B2 (ja) | 2011-10-11 | 2012-10-11 | 血液脳関門透過性の調節のためのセマフォリン−4d結合分子の使用 |
Country Status (16)
| Country | Link |
|---|---|
| US (2) | US20130095118A1 (ja) |
| EP (1) | EP2766093B1 (ja) |
| JP (2) | JP6395606B2 (ja) |
| KR (1) | KR101999872B1 (ja) |
| CN (2) | CN110105452A (ja) |
| AU (1) | AU2012322721B2 (ja) |
| BR (1) | BR112014008885B1 (ja) |
| CA (1) | CA2851805C (ja) |
| DK (1) | DK2766093T3 (ja) |
| EA (1) | EA029023B1 (ja) |
| ES (1) | ES2669209T3 (ja) |
| IL (1) | IL232072B (ja) |
| MX (1) | MX353550B (ja) |
| PT (1) | PT2766093T (ja) |
| SG (1) | SG11201401458UA (ja) |
| WO (1) | WO2013055922A1 (ja) |
Families Citing this family (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2010245668B2 (en) | 2009-05-08 | 2016-07-14 | Vaccinex, Inc. | Anti-CD100 antibodies and methods for using the same |
| US8790652B2 (en) | 2011-12-06 | 2014-07-29 | Vaccinex, Inc. | Use of the combination of semaphorin-4D inhibitory molecules and VEGF inhibitory molecules to inhibit angiogenesis |
| US9090709B2 (en) | 2012-03-28 | 2015-07-28 | Vaccinex, Inc. | Anti-SEMA4D antibodies and epitopes |
| US9708601B2 (en) | 2012-04-26 | 2017-07-18 | Vaccinex, Inc. | Fusion proteins to facilitate selection of cells infected with specific immunoglobulin gene recombinant vaccinia virus |
| US10494440B2 (en) | 2012-05-11 | 2019-12-03 | Vaccinex, Inc. | Use of semaphorin-4D binding molecules to promote neurogenesis following stroke |
| EA036591B1 (ru) | 2013-06-25 | 2020-11-26 | Вэксинекс, Инк. | Способ ингибирования, замедления или уменьшения роста раковой опухоли у субъекта |
| NZ630881A (en) * | 2013-10-10 | 2016-03-31 | Vaccinex Inc | Use of semaphorin-4d binding molecules for treatment of atherosclerosis |
| NZ630892A (en) * | 2013-10-21 | 2016-03-31 | Vaccinex Inc | Use of semaphorin-4d binding molecules for treating neurodegenerative disorders |
| EP3416663B1 (en) | 2016-02-18 | 2021-04-14 | The Penn State Research Foundation | Generating gabaergic neurons in brains |
| SG11201808554TA (en) | 2016-04-22 | 2018-11-29 | Vaccinex Inc | Integral membrane protein display on poxvirus extracellular enveloped virions |
| RU2747557C2 (ru) | 2016-08-02 | 2021-05-06 | Вэксинекс, Инк. | Улучшенные способы получения библиотек полинуклеотидов в вирусах осповакцины/эукариотических клетках |
| CA3036838A1 (en) * | 2016-09-13 | 2018-03-22 | Angiocrine Bioscience, Inc. | Blood-brain barrier comprising engineered endothelial cells |
| IL267940B2 (en) * | 2017-02-22 | 2025-04-01 | Vaccinex Inc | Early detection of glial cell activation in neurodegenerative or neuroinflammatory diseases |
| WO2018204895A1 (en) * | 2017-05-05 | 2018-11-08 | Vaccinex, Inc. | Human anti-semaphorin 4d antibody |
| US20190092818A1 (en) * | 2017-09-22 | 2019-03-28 | Kite Pharma, Inc. | Chimeric polypeptides and uses thereof |
| WO2019152857A1 (en) * | 2018-02-02 | 2019-08-08 | Gong Chen | Methods and materials for treating brain injuries |
| CA3127452A1 (en) * | 2019-01-22 | 2020-07-30 | Massachusetts Institute Of Technology | In vitro human blood brain barrier |
| CN113660951A (zh) * | 2019-03-29 | 2021-11-16 | 中外制药株式会社 | 含有抗il-6受体抗体的抑制bbb功能低下的抑制剂 |
| JP7610767B2 (ja) * | 2020-06-25 | 2025-01-09 | バクシネックス インコーポレーティッド | レット症候群の処置のためのセマフォリン4d結合分子の使用 |
| EP3973979A1 (en) * | 2020-09-25 | 2022-03-30 | The Provost, Fellows, Foundation Scholars, and The Other Members of Board, of The College of The Holy and Undivided Trinity of Queen Elizabeth | A tight junction (zonulae occludentes) protein for use in treating or preventing epilepsy |
| CN113456813A (zh) * | 2021-07-26 | 2021-10-01 | 苏州大学 | Semaphorin7A单克隆抗体在制备用于治疗血栓及脑血管疾病药物方面的应用 |
| WO2023012314A1 (en) * | 2021-08-05 | 2023-02-09 | Lifearc | Anti-plexin-b1 antibodies |
| CN114539204B (zh) * | 2022-03-23 | 2023-08-22 | 福建金兰厚普生物科技有限公司 | 己糖激酶抑制剂及其合成方法和应用 |
| WO2024204440A1 (ja) * | 2023-03-28 | 2024-10-03 | 株式会社エヌビィー健康研究所 | 抗体、核酸、細胞、及び医薬 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2010129917A2 (en) * | 2009-05-08 | 2010-11-11 | Vaccinex, Inc. | Anti-cd100 antibodies and methods for using the same |
Family Cites Families (65)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| NZ201918A (en) | 1981-09-18 | 1987-04-30 | Genentech Inc | N-terminal methionyl analogues of bovine growth hormone |
| US4873192A (en) | 1987-02-17 | 1989-10-10 | The United States Of America As Represented By The Department Of Health And Human Services | Process for site specific mutagenesis without phenotypic selection |
| US5070192A (en) | 1988-03-23 | 1991-12-03 | The Johns Hopkins University | Cloned human topoisomerase i: cdna expression, and use for autoantibody detection |
| EP1690935A3 (en) | 1990-01-12 | 2008-07-30 | Abgenix, Inc. | Generation of xenogeneic antibodies |
| US6497872B1 (en) | 1991-07-08 | 2002-12-24 | Neurospheres Holdings Ltd. | Neural transplantation using proliferated multipotent neural stem cells and their progeny |
| FR2686087A1 (fr) | 1992-01-13 | 1993-07-16 | Inst Nat Sante Rech Med | Nouvel antigene lymphocytaire, anticorps correspondant et leurs applications. |
| US5639856A (en) | 1993-09-13 | 1997-06-17 | The Regents Of The University Of California | Semaphorin gene family |
| US5595756A (en) | 1993-12-22 | 1997-01-21 | Inex Pharmaceuticals Corporation | Liposomal compositions for enhanced retention of bioactive agents |
| US6576754B2 (en) | 1995-11-09 | 2003-06-10 | Dana-Farber Cancer Institute | CD100 antigen and uses therefor |
| US20020032315A1 (en) | 1997-08-06 | 2002-03-14 | Manuel Baca | Anti-vegf antibodies |
| ES2273415T3 (es) | 1997-04-07 | 2007-05-01 | Genentech, Inc. | Anticuerpos anti-vegf. |
| US6884879B1 (en) | 1997-04-07 | 2005-04-26 | Genentech, Inc. | Anti-VEGF antibodies |
| JP2001516226A (ja) | 1997-04-11 | 2001-09-25 | デンドレオン コーポレイション | 腫瘍関連性の抗原に対する免疫応答を誘導するための組成物および方法 |
| EP0892047A3 (de) * | 1997-07-09 | 2000-03-08 | Hoechst Marion Roussel Deutschland GmbH | Humanes und murines Semaphorin L |
| US5968829A (en) | 1997-09-05 | 1999-10-19 | Cytotherapeutics, Inc. | Human CNS neural stem cells |
| US6638501B1 (en) | 1997-09-29 | 2003-10-28 | Neurospheres Holdings Ltd. | Use of multipotent neural stem cell progeny to augment non-neural tissues |
| US5958767A (en) | 1998-08-14 | 1999-09-28 | The Children's Medical Center Corp. | Engraftable human neural stem cells |
| ATE407206T1 (de) | 1998-11-10 | 2008-09-15 | Univ Rochester | Methoden zu herstellung von genbanken |
| US6737056B1 (en) | 1999-01-15 | 2004-05-18 | Genentech, Inc. | Polypeptide variants with altered effector function |
| JP3787473B2 (ja) | 1999-11-30 | 2006-06-21 | 独立行政法人科学技術振興機構 | セマフォリン受容体 |
| WO2001046384A2 (en) | 1999-12-23 | 2001-06-28 | Cornell Research Foundation, Inc. | A method for isolating and purifying multipotential neural progenitor cells and multipotential neural progenitor cells |
| US6635742B1 (en) | 2000-01-25 | 2003-10-21 | Nuvelo, Inc. | Antibodies specific for semaphorin-like polypeptides |
| CN1329060A (zh) | 2000-06-19 | 2002-01-02 | 上海博德基因开发有限公司 | 一种新的多肽——人semaphorin蛋白9和编码这种多肽的多核苷酸 |
| WO2002102973A2 (en) | 2001-06-20 | 2002-12-27 | Prochon Biotech Ltd. | Antibodies that block receptor protein tyrosine kinase activation, methods of screening for and uses thereof |
| US20080219974A1 (en) | 2002-03-01 | 2008-09-11 | Bernett Matthew J | Optimized antibodies that target hm1.24 |
| US20040132101A1 (en) | 2002-09-27 | 2004-07-08 | Xencor | Optimized Fc variants and methods for their generation |
| EP1365018A1 (en) | 2002-05-23 | 2003-11-26 | Institut National De La Sante Et De La Recherche Medicale (Inserm) | CD100 semaphorin in myelination |
| ATE483472T1 (de) | 2002-05-30 | 2010-10-15 | Macrogenics Inc | Cd16a bindungsproteine und verwendung zur behandlung von immunkrankheiten |
| US9809654B2 (en) | 2002-09-27 | 2017-11-07 | Vaccinex, Inc. | Targeted CD1d molecules |
| EP1442749A1 (en) * | 2003-01-31 | 2004-08-04 | Institut National De La Sante Et De La Recherche Medicale (Inserm) | Use of anti-CD100 antibodies for the treatment and the diagnosis of inflammatory disorder affecting the central nervous system |
| CN1788017B (zh) * | 2003-02-10 | 2013-04-24 | to-BBB控股股份有限公司 | 炎症状态下在血脑屏障中差异表达的核酸 |
| RS20150135A1 (sr) | 2003-05-30 | 2015-08-31 | Genentech Inc. | Tretman sa anti-vegf antitelima |
| WO2005026209A2 (en) | 2003-09-11 | 2005-03-24 | Critical Therapeutics, Inc. | Monoclonal antibodies against hmgb1 |
| AU2004296184B2 (en) | 2003-12-04 | 2010-12-16 | Vaccinex, Inc. | Methods of killing tumor cells by targeting internal antigens exposed on apoptotic tumor cells |
| CA2548282A1 (en) | 2003-12-11 | 2005-06-30 | Genentech, Inc. | Methods and compositions for inhibiting c-met dimerization and activation |
| US7476724B2 (en) | 2004-08-05 | 2009-01-13 | Genentech, Inc. | Humanized anti-cmet antibodies |
| US20060147449A1 (en) | 2004-11-15 | 2006-07-06 | Brass Lawrence F | Method of using CD100 (or Sema4D) to mediate platelet activation and inflammatory responses |
| JP2008535856A (ja) | 2005-04-07 | 2008-09-04 | ノバルティス ヴァクシンズ アンド ダイアグノスティクス インコーポレイテッド | 癌の診断、検出および治療におけるsema4d |
| EP1952147A2 (en) | 2005-11-16 | 2008-08-06 | Novartis AG | Biomarkers for anti-nogo-a antibody treatment in spinal cord injury |
| JP2007308465A (ja) | 2006-05-15 | 2007-11-29 | Boehringer Ingelheim Internatl Gmbh | 炎症性疾患、自己免疫疾患又は骨吸収異常の治療方法 |
| WO2008025020A2 (en) | 2006-08-25 | 2008-02-28 | Seattle Genetics, Inc. | Cd30 binding agents and uses thereof |
| US9382327B2 (en) | 2006-10-10 | 2016-07-05 | Vaccinex, Inc. | Anti-CD20 antibodies and methods of use |
| DK2099826T3 (da) * | 2007-01-05 | 2014-01-20 | Univ Zuerich | Anti-beta-amyloid-antistof og anvendelser deraf |
| DE602008004296D1 (de) | 2007-02-14 | 2011-02-17 | Vaccinex Inc | Humanisierte anti-cd100-antikörper |
| WO2008103392A2 (en) | 2007-02-21 | 2008-08-28 | Vaccinex, Inc. | Modulation of nkt cell activity with antigen-loaded cdid molecules |
| CA2710680C (en) | 2007-12-26 | 2018-10-16 | Vaccinex, Inc. | Anti-c35 antibody combination therapies and methods |
| WO2009089461A1 (en) | 2008-01-10 | 2009-07-16 | Genentech, Inc. | Plexind1 agonists and their use |
| ES2679043T3 (es) | 2009-05-15 | 2018-08-21 | Irx Therapeutics, Inc. | Inmunoterapia de vacuna |
| JP5500944B2 (ja) | 2009-10-29 | 2014-05-21 | 三菱電機株式会社 | 加熱調理器 |
| NZ605260A (en) | 2010-06-14 | 2013-12-20 | Joseph King Allan | Anti-vegf antibodies and uses thereof |
| US9963504B2 (en) | 2010-09-02 | 2018-05-08 | Vaccinex, Inc. | Anti-CXCL13 antibodies and methods of using the same |
| DK2711023T3 (en) | 2011-05-13 | 2017-10-16 | Nat Univ Corp Tokyo Medical & Dental Univ | osteogenesis |
| US8790652B2 (en) | 2011-12-06 | 2014-07-29 | Vaccinex, Inc. | Use of the combination of semaphorin-4D inhibitory molecules and VEGF inhibitory molecules to inhibit angiogenesis |
| AU2013225812B2 (en) | 2012-03-02 | 2017-11-30 | Vaccinex, Inc. | Methods for the treatment of B cell-mediated inflammatory diseases |
| US9090709B2 (en) | 2012-03-28 | 2015-07-28 | Vaccinex, Inc. | Anti-SEMA4D antibodies and epitopes |
| US9708601B2 (en) | 2012-04-26 | 2017-07-18 | Vaccinex, Inc. | Fusion proteins to facilitate selection of cells infected with specific immunoglobulin gene recombinant vaccinia virus |
| US10494440B2 (en) | 2012-05-11 | 2019-12-03 | Vaccinex, Inc. | Use of semaphorin-4D binding molecules to promote neurogenesis following stroke |
| KR102176962B1 (ko) | 2013-01-31 | 2020-11-10 | 백시넥스 인코포레이티드 | 면역글로불린 a 수준을 증가시키기 위한 방법 |
| US9371352B2 (en) | 2013-02-08 | 2016-06-21 | Vaccinex, Inc. | Modified glycolipids and methods of making and using the same |
| EA036591B1 (ru) | 2013-06-25 | 2020-11-26 | Вэксинекс, Инк. | Способ ингибирования, замедления или уменьшения роста раковой опухоли у субъекта |
| NZ630881A (en) | 2013-10-10 | 2016-03-31 | Vaccinex Inc | Use of semaphorin-4d binding molecules for treatment of atherosclerosis |
| NZ630892A (en) | 2013-10-21 | 2016-03-31 | Vaccinex Inc | Use of semaphorin-4d binding molecules for treating neurodegenerative disorders |
| SG11201808554TA (en) | 2016-04-22 | 2018-11-29 | Vaccinex Inc | Integral membrane protein display on poxvirus extracellular enveloped virions |
| RU2747557C2 (ru) | 2016-08-02 | 2021-05-06 | Вэксинекс, Инк. | Улучшенные способы получения библиотек полинуклеотидов в вирусах осповакцины/эукариотических клетках |
| IL267940B2 (en) | 2017-02-22 | 2025-04-01 | Vaccinex Inc | Early detection of glial cell activation in neurodegenerative or neuroinflammatory diseases |
-
2012
- 2012-10-11 BR BR112014008885-3A patent/BR112014008885B1/pt active IP Right Grant
- 2012-10-11 MX MX2014004457A patent/MX353550B/es active IP Right Grant
- 2012-10-11 CN CN201910351743.6A patent/CN110105452A/zh active Pending
- 2012-10-11 WO PCT/US2012/059757 patent/WO2013055922A1/en not_active Ceased
- 2012-10-11 AU AU2012322721A patent/AU2012322721B2/en active Active
- 2012-10-11 ES ES12839601.7T patent/ES2669209T3/es active Active
- 2012-10-11 JP JP2014535877A patent/JP6395606B2/ja active Active
- 2012-10-11 KR KR1020147012547A patent/KR101999872B1/ko active Active
- 2012-10-11 DK DK12839601.7T patent/DK2766093T3/en active
- 2012-10-11 CN CN201280059376.9A patent/CN104168956A/zh active Pending
- 2012-10-11 CA CA2851805A patent/CA2851805C/en active Active
- 2012-10-11 US US13/649,651 patent/US20130095118A1/en not_active Abandoned
- 2012-10-11 EA EA201490768A patent/EA029023B1/ru not_active IP Right Cessation
- 2012-10-11 PT PT128396017T patent/PT2766093T/pt unknown
- 2012-10-11 EP EP12839601.7A patent/EP2766093B1/en active Active
- 2012-10-11 SG SG11201401458UA patent/SG11201401458UA/en unknown
-
2014
- 2014-04-10 IL IL232072A patent/IL232072B/en active IP Right Grant
-
2017
- 2017-06-30 JP JP2017129377A patent/JP2017193569A/ja active Pending
-
2019
- 2019-06-06 US US16/433,496 patent/US11534488B2/en active Active
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2010129917A2 (en) * | 2009-05-08 | 2010-11-11 | Vaccinex, Inc. | Anti-cd100 antibodies and methods for using the same |
Non-Patent Citations (4)
| Title |
|---|
| FABIS MJ, ET AL.: "Loss of blood-brain barrier integrity in the spinal cord is common to experimental allergic encephal", PROCEEDINGS OF THE NATIONAL ACADEMY OF SCIENCES OF THE UNITED STATES OF AMERICA, vol. 104, no. 13, JPN6016029057, 27 March 2007 (2007-03-27), pages 5656 - 5661 * |
| OKUNO T,ET AL.: "Roles of Sema4D-plexin-B1 interactions in the central nervous system for pathogenesis of experimenta", THE JOURNAL OF IMMUNOLOGY, vol. 184, no. 3, JPN6016029055, 28 December 2009 (2009-12-28), pages 1499 - 1506, XP055149724, DOI: doi:10.4049/jimmunol.0903302 * |
| 中川 慎介,丹羽 正美: "キーワード解説 血液脳関門(BBB)", 日本薬理学雑誌, vol. 第133巻,第3号, JPN6017039401, 2009, pages p.170−172 * |
| 奥野 龍禎 ほか: "実験的自己免疫性脳脊髄炎(EAE)に対するSema4D阻害療法の効果とその作用メカニズムの検討", 臨床神経学, vol. 第50巻,第12号, JPN6016029054, December 2010 (2010-12-01), pages p.1094 * |
Also Published As
| Publication number | Publication date |
|---|---|
| JP6395606B2 (ja) | 2018-09-26 |
| MX353550B (es) | 2018-01-18 |
| WO2013055922A1 (en) | 2013-04-18 |
| AU2012322721B2 (en) | 2016-05-05 |
| US20190358321A1 (en) | 2019-11-28 |
| KR101999872B1 (ko) | 2019-07-12 |
| EP2766093B1 (en) | 2018-02-21 |
| BR112014008885B1 (pt) | 2021-02-17 |
| MX2014004457A (es) | 2014-06-05 |
| NZ623856A (en) | 2016-04-29 |
| CN110105452A (zh) | 2019-08-09 |
| BR112014008885A2 (pt) | 2017-04-18 |
| IL232072B (en) | 2021-01-31 |
| CA2851805A1 (en) | 2013-04-18 |
| ES2669209T3 (es) | 2018-05-24 |
| EA201490768A1 (ru) | 2014-09-30 |
| AU2012322721A1 (en) | 2013-05-16 |
| CA2851805C (en) | 2021-12-28 |
| EP2766093A4 (en) | 2015-03-25 |
| EA029023B1 (ru) | 2018-01-31 |
| SG11201401458UA (en) | 2014-07-30 |
| US11534488B2 (en) | 2022-12-27 |
| EP2766093A1 (en) | 2014-08-20 |
| JP2014530239A (ja) | 2014-11-17 |
| PT2766093T (pt) | 2018-05-18 |
| US20130095118A1 (en) | 2013-04-18 |
| CN104168956A (zh) | 2014-11-26 |
| DK2766093T3 (en) | 2018-06-06 |
| IL232072A0 (en) | 2014-05-28 |
| KR20140076616A (ko) | 2014-06-20 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6395606B2 (ja) | 血液脳関門透過性の調節のためのセマフォリン−4d結合分子の使用 | |
| AU2021202095B2 (en) | Use of semaphorin-4D binding molecules for treating neurodegenerative disorders | |
| US9512224B2 (en) | Use of semaphorin-4D binding molecules for treatment of atherosclerosis | |
| JP6218810B2 (ja) | 卒中後の神経形成を促進するためのセマフォリン−4d結合分子の使用 | |
| NZ623856B2 (en) | Use of semaphorin-4d binding molecules for modulation of blood brain barrier permeability |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170727 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20170727 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20180404 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20180703 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20181129 |