JP2016500447A - 電気化学分析用検査装置 - Google Patents
電気化学分析用検査装置 Download PDFInfo
- Publication number
- JP2016500447A JP2016500447A JP2015548655A JP2015548655A JP2016500447A JP 2016500447 A JP2016500447 A JP 2016500447A JP 2015548655 A JP2015548655 A JP 2015548655A JP 2015548655 A JP2015548655 A JP 2015548655A JP 2016500447 A JP2016500447 A JP 2016500447A
- Authority
- JP
- Japan
- Prior art keywords
- conductor
- conductive polymer
- electrode
- group
- conductive
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 0 C*/C(/[C@@](*)C*C/C(/C1*=CC1)=C1/NC2C([C@@](*)[C@](C)*)*=S)=C1\O*C2=C Chemical compound C*/C(/[C@@](*)C*C/C(/C1*=CC1)=C1/NC2C([C@@](*)[C@](C)*)*=S)=C1\O*C2=C 0.000 description 4
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N27/00—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means
- G01N27/26—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means by investigating electrochemical variables; by using electrolysis or electrophoresis
- G01N27/28—Electrolytic cell components
- G01N27/30—Electrodes, e.g. test electrodes; Half-cells
- G01N27/327—Biochemical electrodes, e.g. electrical or mechanical details for in vitro measurements
- G01N27/3271—Amperometric enzyme electrodes for analytes in body fluids, e.g. glucose in blood
- G01N27/3272—Test elements therefor, i.e. disposable laminated substrates with electrodes, reagent and channels
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N27/00—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means
- G01N27/26—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means by investigating electrochemical variables; by using electrolysis or electrophoresis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D265/00—Heterocyclic compounds containing six-membered rings having one nitrogen atom and one oxygen atom as the only ring hetero atoms
- C07D265/28—1,4-Oxazines; Hydrogenated 1,4-oxazines
- C07D265/34—1,4-Oxazines; Hydrogenated 1,4-oxazines condensed with carbocyclic rings
- C07D265/38—[b, e]-condensed with two six-membered rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D279/00—Heterocyclic compounds containing six-membered rings having one nitrogen atom and one sulfur atom as the only ring hetero atoms
- C07D279/10—1,4-Thiazines; Hydrogenated 1,4-thiazines
- C07D279/14—1,4-Thiazines; Hydrogenated 1,4-thiazines condensed with carbocyclic rings or ring systems
- C07D279/18—[b, e]-condensed with two six-membered rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D279/00—Heterocyclic compounds containing six-membered rings having one nitrogen atom and one sulfur atom as the only ring hetero atoms
- C07D279/10—1,4-Thiazines; Hydrogenated 1,4-thiazines
- C07D279/14—1,4-Thiazines; Hydrogenated 1,4-thiazines condensed with carbocyclic rings or ring systems
- C07D279/36—[b, e]-condensed, at least one with a further condensed benzene ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings
- C07D417/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/001—Enzyme electrodes
- C12Q1/004—Enzyme electrodes mediator-assisted
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/001—Enzyme electrodes
- C12Q1/005—Enzyme electrodes involving specific analytes or enzymes
- C12Q1/006—Enzyme electrodes involving specific analytes or enzymes for glucose
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N27/00—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means
- G01N27/26—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means by investigating electrochemical variables; by using electrolysis or electrophoresis
- G01N27/28—Electrolytic cell components
- G01N27/30—Electrodes, e.g. test electrodes; Half-cells
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N27/00—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means
- G01N27/26—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means by investigating electrochemical variables; by using electrolysis or electrophoresis
- G01N27/28—Electrolytic cell components
- G01N27/30—Electrodes, e.g. test electrodes; Half-cells
- G01N27/327—Biochemical electrodes, e.g. electrical or mechanical details for in vitro measurements
- G01N27/3271—Amperometric enzyme electrodes for analytes in body fluids, e.g. glucose in blood
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/558—Immunoassay; Biospecific binding assay; Materials therefor using diffusion or migration of antigen or antibody
- G01N33/561—Immunoelectrophoresis
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N27/00—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means
- G01N27/26—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means by investigating electrochemical variables; by using electrolysis or electrophoresis
- G01N27/28—Electrolytic cell components
- G01N27/30—Electrodes, e.g. test electrodes; Half-cells
- G01N27/327—Biochemical electrodes, e.g. electrical or mechanical details for in vitro measurements
- G01N27/3271—Amperometric enzyme electrodes for analytes in body fluids, e.g. glucose in blood
- G01N27/3273—Devices therefor, e.g. test element readers, circuitry
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E60/00—Enabling technologies; Technologies with a potential or indirect contribution to GHG emissions mitigation
- Y02E60/30—Hydrogen technology
- Y02E60/50—Fuel cells
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Immunology (AREA)
- Molecular Biology (AREA)
- Engineering & Computer Science (AREA)
- Analytical Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Physics & Mathematics (AREA)
- Biochemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Biophysics (AREA)
- Microbiology (AREA)
- Electrochemistry (AREA)
- Pathology (AREA)
- General Physics & Mathematics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Hematology (AREA)
- Biotechnology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Genetics & Genomics (AREA)
- General Engineering & Computer Science (AREA)
- Emergency Medicine (AREA)
- Biomedical Technology (AREA)
- Urology & Nephrology (AREA)
- Cell Biology (AREA)
- Food Science & Technology (AREA)
- Medicinal Chemistry (AREA)
- Investigating Or Analysing Biological Materials (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
Abstract
Description
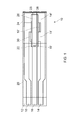
2つ以上の導電性トラックが上に配置された基板と;
少なくとも1つの導電性トラックの一部の上に配置された試薬組成物と;および
2つ以上の導電性トラックの一部を覆い、基板とともにサンプル収容室を形成する最上層とを含み;
少なくとも1つの導電性トラックが導電性ポリマーを含む、検査装置を提供する。
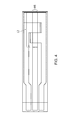
絶縁基板と;
絶縁基板の主面上で少なくとも約25mmの長さLtを有する導電性トラックであって、少なくとも1つの電極を含む導電性トラックとを含み;
導電性トラックの少なくとも約5mmの長さLcpは導電性ポリマーから形成され、導電性トラックの少なくとも約20mmの長さLcmは導電性材料から形成される、装置も提供する。
(a)体液を含むサンプル、および(b)体液中の形態の検出を促進するために構成される試薬をセンサに接触させるステップと;
(i)サンプルおよび試薬と電気的に導通するセンサの導電性ポリマー部分の色の変化を監視するステップであって、導電性ポリマーの少なくとも一部が、体液および試薬に接触するセンサから間隔を開けて配置されるステップ、
または(ii)センサの導電性ポリマー部分に沿ってセンサから電気信号が通され、サンプルと電気的に導通する導電性ポリマーの一部の色の変化を監視するステップであって、導電性ポリマーの少なくとも一部が、体液および試薬に接触するセンサから間隔を開けて配置されるステップのいずれかとを含む、方法を提供する。
(式中、R1は、OまたはSのいずれかであり、R2〜R15は、同じまたは異なっていてよく、独立して、水素;スルホニル;カルボキシル;ヒドロキシル;C1〜12非置換、置換、直鎖、または分岐のアルキル、アルケニル、またはアルキニル;アミノ;アミド;アリール、ハロ、アルコキシ、ニトロを含む群から選択することができ、さらに2つの隣接するR基が一緒になってアリール基、ヘテロアリール基、シクロアルキル基、またはシクロヘテロアリール基を形成してもよい)
から選択される式で表される化合物またはその塩を提供する。
(式中、R1は、OまたはSのいずれかであり、R2〜12は、同じまたは異なっていてよく、独立して、水素;スルホニル;カルボキシル;ヒドロキシル;C1〜12非置換、置換、直鎖、または分岐のアルキル、アルケニル、またはアルキニル;アミノ;アミド;アリール、ハロ、アルコキシ、ニトロを含む群から選択することができ、さらに2つの隣接するR基が一緒になってアリール基、ヘテロアリール基、シクロアルキル基、またはシクロヘテロアリール基を形成してもよい)
から選択される式で表される化合物またはその塩を提供する。
(式中、R1は、OまたはSのいずれかであり、R2〜R11は、同じまたは異なっていてよく、独立して、水素;スルホニル;カルボキシル;ヒドロキシル;C1〜12非置換、置換、直鎖、または分岐のアルキル、アルケニル、またはアルキニル;アミノ;アミド;アリール、ハロ、アルコキシ、ニトロを含む群から選択することができ、さらに2つの隣接するR基が一緒になってアリール基、ヘテロアリール基、シクロアルキル基、またはシクロヘテロアリール基を形成してもよい)
で表される化合物またはその塩を提供する。
(式中、R1は、OまたはSのいずれかであり、R2〜10は、同じまたは異なっていてよく、独立して、水素;スルホニル;カルボキシル;ヒドロキシル;C1〜12非置換、置換、直鎖、または分岐のアルキル、アルケニル、またはアルキニル;アミノ;アミド;アリール、ハロ、アルコキシ、ニトロを含む群から選択することができ、さらに2つの隣接するR基が一緒になってアリール基、ヘテロアリール基、シクロアルキル基、またはシクロヘテロアリール基を形成してもよい)
で表される化合物またはその塩を提供する。
(式中、R1は、OまたはSのいずれかであり、R2は、O、S、またはNHのいずれかであり、R3〜10は、同じまたは異なっていてよく、独立して、水素;スルホニル;カルボキシル;ヒドロキシル;C1〜12非置換、置換、直鎖、または分岐のアルキル、アルケニル、またはアルキニル;アミノ;アミド;アリール、ハロ、アルコキシ、ニトロを含む群から選択することができ、さらに2つの隣接するR基が一緒になってアリール基、ヘテロアリール基、シクロアルキル基、またはシクロヘテロアリール基を形成してもよい)
で表される化合物またはその塩を提供する。
(式中、R1は、OまたはSのいずれかであり、R2は、O、SまたはNHのいずれかであり、R3〜12は、同じまたは異なっていてよく、独立して、水素;スルホニル;カルボキシル;ヒドロキシル;C1〜12非置換、置換、直鎖、または分岐のアルキル、アルケニル、またはアルキニル;アミノ;アミド;アリール、ハロ、アルコキシ、ニトロを含む群から選択することができ、さらに2つの隣接するR基が一緒になってアリール基、ヘテロアリール基、シクロアルキル基、またはシクロヘテロアリール基を形成してもよい)
で表される化合物またはその塩を提供する。
(式中、R1は、SまたはOであり、R3は、H、CH2COOH、CH2SO3H、CH2NH2、またはCH2NO2のいずれかであり、R2およびR4〜R9は、同じまたは異なっていてよく、独立して、水素;スルホニル;カルボキシル;ヒドロキシル;C1〜12非置換、置換、直鎖、または分岐のアルキル、アルケニル、またはアルキニル;アミノ;アミド;アリール、ハロ、アルコキシ、ニトロを含む群から選択することができ、さらに2つの隣接するR基が一緒になってアリール基、ヘテロアリール基、シクロアルキル基、またはシクロヘテロアリール基を形成してもよい)
で表される化合物またはその塩を提供する。
Claims (52)
- 検査装置であって;
2つ以上の導電性トラックが上に配置された基板と;
少なくとも1つの導電性トラックの一部の上に配置された試薬組成物と;
前記2つ以上の導電性トラックの一部を覆い、前記基板とともにサンプル収容室を形成する最上層とを含み;
少なくとも1つの導電性トラックが導電性ポリマーを含む、検査装置。 - 前記装置が、2、3、4、5、または6個の導電性トラックを含み、各トラックが導電性ポリマーを含む、請求項1に記載の検査装置。
- 前記導電性ポリマーが、ポリチオフェン、ポリピロール、ポリアニリン、ポリフルオレン、ポリアセチレン、ポリ(p−フェニレンビニレン)、ポリ(3,4−エチレンジオキシチオフェン)、ポリ(3,4−プロピレンジオキシチオフェン)、ポリ(3,3−ジベンジル−3,4−プロピレンジオキシチオフェン)、ポリ(3−4−エチレンジオキシチオフェン)、ビス−ポリ(エチレングリコール)、ラウリル末端ポリ(3,4−エチレンジオキシチオフェン)−ブロックPEG、およびテトラメタクリレートでエンドキャップされたポリ(3,4−エチレンジオキシチオフェン)、またはそれらの組み合わせを含む、請求項1または請求項2に記載の装置。
- 前記導電性ポリマーが、ポリ(3,4−エチレンジオキシチオフェン)と対イオンとを含む複合体である、請求項1〜3のいずれか一項に記載の装置。
- 前記対イオンが、ポリスチレンスルホネート(PSS)、パークロレート、パークロレートp−トルエン(perchlorate p−toluene)、スルホネートp−トルエン(sulfonate p−toluene)、トシレートから選択される、請求項に記載の装置。
- 前記導電性ポリマーが、ポリ(3,4−エチレンジオキシチオフェン)およびポリスチレンスルホネート(PEDOT:PSS)を含む複合体である、請求項5に記載の装置。
- 導電性ポリマーを含む前記少なくとも1つの導電性トラックが、炭素、金、白金、銀、パラジウム、銅、インジウムスズ酸化物、およびそれらの組み合わせを含む群から選択される別の導電性材料をさらに含む、請求項1〜6のいずれか一項に記載の装置。
- 前記試薬組成物が、オキシドレダクターゼ酵素およびメディエーター化合物を含む、請求項1〜7のいずれか一項に記載の装置。
- 前記オキシドレダクターゼが、グルコースオキシダーゼ、グルコースデヒドロゲナーゼ、乳酸デヒドロゲナーゼ、アルコールデヒドロゲナーゼ、ヒドロキシ酪酸デヒドロゲナーゼ、コレステロールオキシダーゼ、アミノ酸オキシダーゼ、ピルビン酸オキシダーゼ、ペルオキシダーゼ、サルコシンオキシダーゼ、乳酸オキシダーゼ、アルコールオキシダーゼ、モノアミンオキシダーゼ、グリセロールオキシダーゼ、グリセロールリン酸オキシダーゼ、尿酸オキシダーゼ、キサンチンオキシダーゼ、アスコルビン酸オキシダーゼ、カタラーゼ、ジアホラーゼ、およびそれらの組み合わせからなる群から選択される、請求項8に記載の装置。
- 前記グルコースデヒドロゲナーゼが、キノプロテイングルコースデヒドロゲナーゼ、FAD依存性グルコースデヒドロゲナーゼ、およびNAD依存性グルコースデヒドロゲナーゼから選択される、請求項9に記載の装置。
- 前記FAD依存性グルコースデヒドロゲナーゼが、Sekisui DiagnosticsのFAD依存性グルコースデヒドロゲナーゼ(カタログ番号GLDE−70−1192(E.C.番号1.1.99.10)、アスペルギルス種(Aspergillus sp.)由来)、またはBBI enzymesのFAD依存性グルコースデヒドロゲナーゼ(カタログ番号GLD1)である、請求項10に記載の装置。
- 前記メディエーター化合物が、フェリシアン化カリウム、フェロセン誘導体、フェノキサジン誘導体、フェノチアジン誘導体、キノン誘導体、および可逆レドックス遷移金属錯体、特にルテニウムおよびオスミウムの錯体、ニコチンアミドアデニンジヌクレオチド(リン酸塩)、ジイミン類、フェナントロリン誘導体、ジクロロフェノールインドフェノール、テトラゾリウム染料、フェニルイミノ−ベンゾフェノキサジン、ならびにそれらの組み合わせを含む群から選択される、請求項8〜11のいずれか一項に記載の装置。
- 前記メディエーター化合物が3−(3’,5’−ジカルボキシ−フェニルイミノ)−3H−フェノチアジンである、請求項8〜12のいずれか一項に記載の装置。
- 前記オキシドレダクターゼ酵素および/または前記メディエーター化合物が、化学結合または物理的閉じ込めによって、前記導電性ポリマー中に混入される、または前記導電性ポリマーに結合する、請求項8〜13のいずれか一項に記載の装置。
- リンカー分子を使用して、前記メディエーターを前記導電性ポリマーに結合させることで、前記オキシドレダクターゼ酵素分子の活性部位と電極表面との間に前記メディエーターを移動させ、それによって前記酵素から前記電極への電子の移動を促進させる、請求項14に記載の装置。
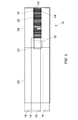
- テストストリップの製造方法であって;
導電性ポリマーの層を形成するステップと;
少なくとも2つの電気的に絶縁された導電性トラックを画定するステップであって、前記トラックの少なくとも1つが導電性ポリマーを含むステップと;
前記トラックの少なくとも1つの一部の一部の上に試薬組成物を塗布するステップと;
前記試薬組成物と、前記トラックの少なくとも1つの一部との上にサンプル収容室を形成するステップとを含む、方法。 - 導電性ポリマー以外の導電性材料の層を形成するステップをさらに含む、請求項16に記載の方法。
- 導電性ポリマーの層および/または存在する場合には導電性材料の層を形成する前記ステップが、前記材料を絶縁基板に塗布するステップを含む、請求項16または17に記載の方法。
- 前記電気的に絶縁された導電性トラックを画定する前記ステップが、導電性ポリマーの層および/または存在する場合には導電性材料の層を形成する前記ステップと同時に行われる、請求項16〜18のいずれか一項に記載の方法。
- 前記少なくとも2つの電気的に絶縁された導電性トラックを画定するために、スクリーン印刷、グラビア印刷、インクジェット印刷が使用される、請求項16〜19のいずれか一項に記載の方法。
- 前記導電性ポリマーおよび/または存在する場合の導電性材料が、前記絶縁基板上にコーティングされ、レーザーアブレーション法によってパターン化されて、前記少なくとも2つの電気的に絶縁された導電性トラックが画定される、請求項16または17に記載の方法。
- 前記導電性ポリマー、および存在する場合の導電性材料の少なくとも一部の上に絶縁層を取り付けることで、サンプルに曝露するための領域が画定される、請求項16〜21のいずれか一項に記載の方法。
- (a)体液を含むサンプルと、(b)前記体液中の検体の検出を促進するために構成された試薬とを第1の電極に接触させるステップと;
前記第1の電極からの第1の電気信号を、前記第1の電極と電気的に導通する第1の導体に沿って通すステップとを含み、前記第1の導体の少なくとも一部は、前記体液および試薬に接触する前記第1の電極から間隔を開けて配置され、前記第1の導体が導電性ポリマーを含む、方法。 - 接触させる前記ステップが、(a)前記体液を含む前記サンプルと、(b)前記体液中の検体の検出を促進するために構成された前記試薬とを、第2の電極に接触させるステップであって、前記第2の電極が、前記第1の電極から間隔を開けて配置されるステップと;第2の電気信号を第2の導体に沿って通すステップとをさらに含み、前記第2の導体は、前記第2の電極と電気的に導通しており、前記第1の導体および前記第1の電極から間隔を開けて配置される、請求項23に記載の方法。
- 前記第2の導体が、前記第2の電極と電気的に導通する導電性ポリマーを含む、またはからなる、請求項24に記載の方法。
- 接触させる前記ステップが、(a)前記体液を含む前記サンプルと、(b)前記体液中の検体の検出を促進するために構成された前記試薬とを、第3の電極に接触させるステップであって、前記第3の電極が、前記第1および第2の電極から間隔を開けて配置されるステップと;第3の電気信号を第3の導体に沿って通すステップとをさらに含み、前記第3の導体は、前記第3の電極と電気的に導通しており、前記第1および第2の導体ならびに前記第1および第2の電極から間隔を開けて配置される、請求項24または請求項25に記載の方法。
- 前記第3の導体が、前記第3の電極と電気的に導通する導電性ポリマーを含む、またはからなる、請求項26に記載の方法。
- 前記電気信号を前記第1の導体に沿って、前記電気信号の受信および/または供給を行うために構成された機器の接点まで通すステップをさらに含む、請求項23〜27のいずれか一項に記載の方法。
- 前記第1の導体を前記接点に機械的に係合させるステップをさらに含む、請求項28に記載の方法。
- (a)前記電気信号を前記第1の導体に沿って、前記電気信号の受信および/または供給を行うために構成された機器の第1の接点まで通すステップと、(b)前記電気信号を前記第2の導体に沿って、前記電気信号の受信および/または供給を行うために構成された前記機器の第2の接点まで通すステップとをさらに含む、請求項24〜29のいずれか一項に記載の方法。
- 前記第1の導体を前記第1の接点に機械的に係合させるステップと、前記第2の導体を前記第2の接点に係合させるステップとをさらに含む、請求項30に記載の方法。
- 前記第2の導体を前記第2の接点に係合させるステップが、前記第2の導体を前記第2の接点に機械的に係合させるステップを含む、請求項31に記載の方法。
- (a)前記電気信号を前記第1の導体に沿って、前記電気信号の受信および/または供給を行うために構成された機器の第1の接点まで通すステップと、(b)前記電気信号を前記第2の導体に沿って、前記電気信号の受信および/または供給を行うために構成された前記機器の第2の接点まで通すステップと、(c)前記電気信号を前記第3の導体に沿って、前記電気信号の受信および/または供給を行うために構成された前記機器の第3の接点まで通すステップとをさらに含む、請求項26〜32のいずれか一項に記載の方法。
- 前記第1の導体を前記第1の接点に機械的に係合させるステップと、前記第2の導体を前記第2の接点に係合させるステップと、前記第3の導体を前記第3の接点に係合させるステップとをさらに含む、請求項33に記載の方法。
- 前記第2の導体を前記第2の接点に係合させるステップが、前記第2の導体の前記導電性ポリマーを前記第2の接点に機械的に係合させるステップを含み、前記第3の導体の導電性ポリマーを前記第3の接点に係合させるステップが、前記第3の導体を前記第3の接点に機械的に係合させるステップを含む、請求項34に記載の方法。
- 前記係合させるステップが、(i)前記第1の導体を含むテストストリップ、(ii)前記第1および第2の導体を含むテストストリップ、あるいは(iii)前記第1、第2、および第3の導体を含むテストストリップを前記機器中に挿入するステップを含む、請求項29〜35のいずれか一項に記載の方法。
- 前記テストストリップが使い捨てのテストストリップであり、前記方法が前記テストストリップを前記機器から取り外すステップを含む、請求項36に記載の方法。
- 前記第1、第2、および第3の導体の少なくとも1つから前記機器に電気信号が通された後に、前記電気信号の受信および/または供給を行うために構成された前記機器によって、隣接する導体間に高電流が流され、それによって前記導体の少なくとも1つによって、さらなる電気信号が前記機器に通されるのが防止される、請求項28〜37のいずれか一項に記載の方法。
- 標的がグルコースであり、前記試薬が、グルコースの検出を促進するために構成された少なくとも1種類の酵素を含み、前記機器がグルコースメーターを含む、請求項23〜38のいずれか一項に記載の方法。
- 前記体液が血液である、請求項23〜39のいずれか一項に記載の方法。
- (a)体液を含むサンプル、および(b)体液中の形態の検出を促進するために構成される試薬とをセンサに接触させるステップと;
(i)前記サンプルおよび前記試薬と電気的に導通する前記センサの導電性ポリマー部分の色の変化を監視するステップであって、前記導電性ポリマーの少なくとも一部が、前記体液および試薬に接触する前記センサから間隔を開けて配置されるステップ、
または(ii)前記センサの導電性ポリマー部分に沿ってセンサから電気信号が通され、前記サンプルと電気的に導通する前記導電性ポリマーの一部の色の変化を監視するステップであって、前記導電性ポリマーの少なくとも一部が、前記体液および試薬に接触する前記センサから間隔を開けて配置されるステップのいずれかとを含む、方法。 - 請求項42〜49のいずれか一項に記載の化合物またはその塩の、オキシドレダクターゼ酵素および緩衝塩を含む電気化学分析における試薬組成物の成分としての使用。
- 前記電気化学分析が、前記オキシドレダクターゼ酵素と結合した抗体を含む任意の電気化学イムノアッセイであり、前記オキシドレダクターゼ酵素が前記化合物またはその塩を酸化型から還元型に変換し、前記還元された化合物またはその塩を酸化型に戻すために電極が使用され、その際、少なくとも1つの電子が前記電極に移動し、それが電流として記録される、請求項50に記載の使用。
- 請求項42〜49のいずれか一項に記載の化合物またはその塩と、生物学的流体サンプルとを含む混合物であって、前記流体が血液、血漿、血清、髄液、尿、唾液、痰、精液から選択される、混合物。
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261745211P | 2012-12-21 | 2012-12-21 | |
| GB1223166.8 | 2012-12-21 | ||
| GBGB1223166.8A GB201223166D0 (en) | 2012-12-21 | 2012-12-21 | Test strip |
| US61/745,211 | 2012-12-21 | ||
| US201361770233P | 2013-02-27 | 2013-02-27 | |
| US61/770,233 | 2013-02-27 | ||
| PCT/EP2013/077797 WO2014096407A1 (en) | 2012-12-21 | 2013-12-20 | Test device for electrochemical analysis |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2016500447A true JP2016500447A (ja) | 2016-01-12 |
| JP2016500447A5 JP2016500447A5 (ja) | 2017-01-19 |
Family
ID=47682396
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015548655A Pending JP2016500447A (ja) | 2012-12-21 | 2013-12-20 | 電気化学分析用検査装置 |
Country Status (9)
| Country | Link |
|---|---|
| US (1) | US20150330935A1 (ja) |
| EP (1) | EP2938602A1 (ja) |
| JP (1) | JP2016500447A (ja) |
| KR (1) | KR20150097692A (ja) |
| CN (2) | CN104918925B (ja) |
| AU (1) | AU2013366464B2 (ja) |
| GB (2) | GB201223166D0 (ja) |
| HK (2) | HK1213568A1 (ja) |
| WO (1) | WO2014096407A1 (ja) |
Families Citing this family (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101740034B1 (ko) | 2015-07-20 | 2017-06-08 | 주식회사 아이센스 | 베타-히드록시부틸레이트 검출을 위한 산화환원 시약 조성물, 및 상기시약 조성물을 포함하는 전기화학적 바이오센서 |
| JP2017036951A (ja) * | 2015-08-07 | 2017-02-16 | ソニー株式会社 | カートリッジ、検出装置及び検出方法 |
| BR112018013260A2 (pt) * | 2015-12-28 | 2018-12-11 | Lifescan Scotland Ltd | tira de teste analítico de base eletroquímica com conexões de detecção de tensão de eletrodo e medidor de teste portátil para uso com a mesma |
| CN106596693B (zh) * | 2016-11-30 | 2019-03-29 | 中国科学院上海应用物理研究所 | 一种用于肌氨酸的电化学检测方法 |
| CN107478707A (zh) * | 2017-07-13 | 2017-12-15 | 大连大学 | 一种用于血糖测定的新型电极及其测定方法 |
| EP3480595A1 (en) * | 2017-11-02 | 2019-05-08 | Elisha Systems Ltd. | Biosensor manufacture |
| CN109781989A (zh) * | 2017-11-10 | 2019-05-21 | 上海瀚联医疗技术股份有限公司 | 血糖测试的方法及生物传感器 |
| CN109781821B (zh) * | 2017-11-10 | 2023-10-24 | 上海瀚联医疗技术股份有限公司 | 一种血糖检测仪 |
| CN109781804A (zh) * | 2017-11-10 | 2019-05-21 | 上海瀚联医疗技术股份有限公司 | 一种血糖测试模块 |
| WO2019224628A1 (en) * | 2018-05-21 | 2019-11-28 | King Abdullah University Of Science And Technology | Inkjet-printed electrochemical metabolite sensors |
| CN109507250A (zh) * | 2019-01-16 | 2019-03-22 | 威海纽普生物技术有限公司 | 检测d二聚体的电化学试剂盒及其制备方法 |
| KR102248653B1 (ko) * | 2020-02-24 | 2021-05-04 | 성균관대학교산학협력단 | 가변저항소자, 이의 제조 방법 및 이를 포함하는 수위센서 |
| KR20210112137A (ko) * | 2020-03-04 | 2021-09-14 | 동우 화인켐 주식회사 | 전기화학센서 및 이의 제조방법 |
| KR20210116889A (ko) | 2020-03-18 | 2021-09-28 | 동우 화인켐 주식회사 | 바이오센서 |
| CN114632559B (zh) * | 2022-01-26 | 2023-03-31 | 浙江大学 | 基于电阻抗检测的片上微槽阵列数字pcr芯片及制作方法 |
Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS625171A (ja) * | 1985-06-28 | 1987-01-12 | マイルス・インコーポレーテッド | 電気化学的センサ−用電極 |
| JP2003238830A (ja) * | 2002-02-19 | 2003-08-27 | Hitachi Chem Co Ltd | 相分離型樹脂組成物、相分離型樹脂フィルム及び相分離型樹脂組成物付き回路基板の製造方法 |
| JP2006058289A (ja) * | 2004-07-23 | 2006-03-02 | Canon Inc | 酵素電極、センサ、燃料電池、電気化学反応装置 |
| JP2007509355A (ja) * | 2003-10-24 | 2007-04-12 | バイエル・ヘルスケア・エルエルシー | 酵素的電気化学的バイオセンサ |
| JP2007232378A (ja) * | 2006-02-27 | 2007-09-13 | Sumitomo Electric Ind Ltd | バイオセンサシステム及びその測定器 |
| JP2009159964A (ja) * | 2006-11-14 | 2009-07-23 | Toyobo Co Ltd | 改変型フラビンアデニンジヌクレオチド依存性グルコースデヒドロゲナーゼ |
| JP2010032501A (ja) * | 2008-06-24 | 2010-02-12 | Panasonic Corp | バイオセンサ、その製造方法、及びそれを備える検出システム |
| JP2011507809A (ja) * | 2007-12-10 | 2011-03-10 | バイエル・ヘルスケア・エルエルシー | 3−フェニルイミノ−3h−フェノチアジン又は3−フェニルイミノ−3h−フェノキサジンメディエーターを調製する方法 |
Family Cites Families (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR0171222B1 (ko) * | 1989-12-15 | 1999-02-18 | 스티브 올드함 | 산화 환원 조정시약 및 바이오센서 |
| US5631371A (en) * | 1995-11-22 | 1997-05-20 | Bayer Corporation | Method for the preparation of substituted 3-(phenylimino)-3H-phenothiazines and phenoxazines |
| US6033866A (en) * | 1997-12-08 | 2000-03-07 | Biomedix, Inc. | Highly sensitive amperometric bi-mediator-based glucose biosensor |
| CN100510732C (zh) * | 2000-11-30 | 2009-07-08 | 松下电器产业株式会社 | 生物传感器、生物传感器用测量装置 |
| RU2450263C2 (ru) * | 2006-09-22 | 2012-05-10 | БАЙЕР ХЕЛТКЭА ЭлЭлСи | Биосенсорная система, обладающая повышенной стабильностью и гематокритной эффективностью |
| US8696917B2 (en) * | 2009-02-09 | 2014-04-15 | Edwards Lifesciences Corporation | Analyte sensor and fabrication methods |
| WO2011012754A2 (es) * | 2009-07-30 | 2011-02-03 | Fundacion Cidetec | Sensor electroquímico para la detección de analitos en medios líquidos |
| US20130345534A1 (en) * | 2011-12-09 | 2013-12-26 | Abbott Diabetes Care Inc. | Electrodes with Conductive Polymer Underlayer |
| EP2840144A1 (en) * | 2013-08-20 | 2015-02-25 | Roche Diagniostics GmbH | A method for making a dry sensor element for an enzymatic determination of an analyte in a body fluid, a dry sensor element and article |
-
2012
- 2012-12-21 GB GBGB1223166.8A patent/GB201223166D0/en not_active Ceased
-
2013
- 2013-12-20 US US14/654,490 patent/US20150330935A1/en not_active Abandoned
- 2013-12-20 CN CN201380069068.9A patent/CN104918925B/zh not_active Expired - Fee Related
- 2013-12-20 JP JP2015548655A patent/JP2016500447A/ja active Pending
- 2013-12-20 AU AU2013366464A patent/AU2013366464B2/en not_active Ceased
- 2013-12-20 KR KR1020157019224A patent/KR20150097692A/ko not_active Application Discontinuation
- 2013-12-20 EP EP13815755.7A patent/EP2938602A1/en not_active Withdrawn
- 2013-12-20 WO PCT/EP2013/077797 patent/WO2014096407A1/en active Application Filing
- 2013-12-20 CN CN201710902932.9A patent/CN107941865A/zh active Pending
- 2013-12-20 GB GB1410773.4A patent/GB2523419A/en not_active Withdrawn
-
2016
- 2016-02-12 HK HK16101586.0A patent/HK1213568A1/zh unknown
- 2016-02-26 HK HK16102310.1A patent/HK1214360A1/zh unknown
Patent Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS625171A (ja) * | 1985-06-28 | 1987-01-12 | マイルス・インコーポレーテッド | 電気化学的センサ−用電極 |
| JP2003238830A (ja) * | 2002-02-19 | 2003-08-27 | Hitachi Chem Co Ltd | 相分離型樹脂組成物、相分離型樹脂フィルム及び相分離型樹脂組成物付き回路基板の製造方法 |
| JP2007509355A (ja) * | 2003-10-24 | 2007-04-12 | バイエル・ヘルスケア・エルエルシー | 酵素的電気化学的バイオセンサ |
| JP2006058289A (ja) * | 2004-07-23 | 2006-03-02 | Canon Inc | 酵素電極、センサ、燃料電池、電気化学反応装置 |
| JP2007232378A (ja) * | 2006-02-27 | 2007-09-13 | Sumitomo Electric Ind Ltd | バイオセンサシステム及びその測定器 |
| JP2009159964A (ja) * | 2006-11-14 | 2009-07-23 | Toyobo Co Ltd | 改変型フラビンアデニンジヌクレオチド依存性グルコースデヒドロゲナーゼ |
| JP2011507809A (ja) * | 2007-12-10 | 2011-03-10 | バイエル・ヘルスケア・エルエルシー | 3−フェニルイミノ−3h−フェノチアジン又は3−フェニルイミノ−3h−フェノキサジンメディエーターを調製する方法 |
| JP2010032501A (ja) * | 2008-06-24 | 2010-02-12 | Panasonic Corp | バイオセンサ、その製造方法、及びそれを備える検出システム |
Non-Patent Citations (2)
| Title |
|---|
| MACAYA DANIEL J., SENSORS AND ACTUATORS B: CHEMICAL, vol. V123 N1, JPN5016000733, 30 March 2007 (2007-03-30), CH, pages 374 - 378, ISSN: 0003640324 * |
| NA YOUNG SHIM, SENSORS, vol. V9 N12, JPN5016000734, 4 December 2009 (2009-12-04), CH, pages 9896 - 9902, ISSN: 0003640325 * |
Also Published As
| Publication number | Publication date |
|---|---|
| CN104918925B (zh) | 2017-11-14 |
| GB201410773D0 (en) | 2014-07-30 |
| WO2014096407A1 (en) | 2014-06-26 |
| HK1214360A1 (zh) | 2016-07-22 |
| US20150330935A1 (en) | 2015-11-19 |
| AU2013366464A1 (en) | 2015-08-06 |
| GB2523419A (en) | 2015-08-26 |
| EP2938602A1 (en) | 2015-11-04 |
| GB201223166D0 (en) | 2013-02-06 |
| KR20150097692A (ko) | 2015-08-26 |
| CN104918925A (zh) | 2015-09-16 |
| AU2013366464B2 (en) | 2017-05-25 |
| HK1213568A1 (zh) | 2016-07-08 |
| CN107941865A (zh) | 2018-04-20 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2016500447A (ja) | 電気化学分析用検査装置 | |
| US10982251B2 (en) | Method of making an electrochemical sensor strip | |
| US10761045B2 (en) | Sensor, sensor system, method of manufacturing sensor, and method of measuring concentration of target substance | |
| US9546974B2 (en) | Concentration determination in a diffusion barrier layer | |
| JP6338748B2 (ja) | センサ | |
| BRPI0717430A2 (pt) | Sistema de biossensor tendo estabilidade e desempenho de hematócritos maiores | |
| CN104280431A (zh) | 用于生物传感器的试剂组合物及包含所述试剂组合物的生物传感器 | |
| ES2555215T3 (es) | Composiciones de reactivo de bajo contenido salino total y sistemas para biosensores | |
| KR20060048711A (ko) | 산화환원 시약 시스템 효소를 특징으로 하는 방법 및조성물 | |
| JP2006275819A (ja) | バイオセンサ | |
| Zhang et al. | Disposable electrochemical capillary-fill device for glucose sensing incorporating a water-soluble enzyme/mediator layer |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20150707 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20161201 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20161201 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20170912 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20170913 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20171208 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20180209 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20180508 |