JP2015524849A - 神経変性疾患に対するエキソソームに基づく治療法 - Google Patents
神経変性疾患に対するエキソソームに基づく治療法 Download PDFInfo
- Publication number
- JP2015524849A JP2015524849A JP2015527641A JP2015527641A JP2015524849A JP 2015524849 A JP2015524849 A JP 2015524849A JP 2015527641 A JP2015527641 A JP 2015527641A JP 2015527641 A JP2015527641 A JP 2015527641A JP 2015524849 A JP2015524849 A JP 2015524849A
- Authority
- JP
- Japan
- Prior art keywords
- exosomes
- mir
- cell
- cells
- patient
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 210000001808 exosome Anatomy 0.000 title claims abstract description 382
- 238000002560 therapeutic procedure Methods 0.000 title description 11
- 208000015122 neurodegenerative disease Diseases 0.000 title description 7
- 230000004770 neurodegeneration Effects 0.000 title description 6
- 210000004027 cell Anatomy 0.000 claims abstract description 165
- 230000036542 oxidative stress Effects 0.000 claims abstract description 108
- 238000000034 method Methods 0.000 claims abstract description 92
- 208000016192 Demyelinating disease Diseases 0.000 claims abstract description 80
- 239000000203 mixture Substances 0.000 claims abstract description 65
- 150000002632 lipids Chemical class 0.000 claims abstract description 16
- 108090000623 proteins and genes Proteins 0.000 claims description 82
- 108010074328 Interferon-gamma Proteins 0.000 claims description 53
- 102000004169 proteins and genes Human genes 0.000 claims description 53
- 102100037850 Interferon gamma Human genes 0.000 claims description 48
- 201000006417 multiple sclerosis Diseases 0.000 claims description 37
- 108091063841 miR-219 stem-loop Proteins 0.000 claims description 35
- 108020004999 messenger RNA Proteins 0.000 claims description 31
- 239000008194 pharmaceutical composition Substances 0.000 claims description 25
- 102000004127 Cytokines Human genes 0.000 claims description 21
- 108090000695 Cytokines Proteins 0.000 claims description 21
- 239000003963 antioxidant agent Substances 0.000 claims description 21
- 239000003814 drug Substances 0.000 claims description 21
- 108091034054 MiR-138 Proteins 0.000 claims description 20
- 108091030496 miR-138 stem-loop Proteins 0.000 claims description 20
- 210000002569 neuron Anatomy 0.000 claims description 19
- 238000000338 in vitro Methods 0.000 claims description 16
- 206010027599 migraine Diseases 0.000 claims description 16
- 230000003078 antioxidant effect Effects 0.000 claims description 15
- 108091025686 miR-199a stem-loop Proteins 0.000 claims description 14
- 208000019695 Migraine disease Diseases 0.000 claims description 13
- 210000002865 immune cell Anatomy 0.000 claims description 13
- 229940124597 therapeutic agent Drugs 0.000 claims description 13
- 208000010877 cognitive disease Diseases 0.000 claims description 12
- 230000001590 oxidative effect Effects 0.000 claims description 12
- 230000006999 cognitive decline Effects 0.000 claims description 10
- 239000007800 oxidant agent Substances 0.000 claims description 10
- 208000033808 peripheral neuropathy Diseases 0.000 claims description 9
- 208000006011 Stroke Diseases 0.000 claims description 8
- 201000001119 neuropathy Diseases 0.000 claims description 8
- 230000007823 neuropathy Effects 0.000 claims description 8
- 208000024827 Alzheimer disease Diseases 0.000 claims description 7
- 208000018737 Parkinson disease Diseases 0.000 claims description 7
- 108020004459 Small interfering RNA Proteins 0.000 claims description 6
- 239000003937 drug carrier Substances 0.000 claims description 6
- 206010015037 epilepsy Diseases 0.000 claims description 4
- 238000012258 culturing Methods 0.000 claims description 3
- 210000005260 human cell Anatomy 0.000 claims description 3
- 210000001789 adipocyte Anatomy 0.000 claims description 2
- 239000002679 microRNA Substances 0.000 description 85
- 108091070501 miRNA Proteins 0.000 description 76
- 238000011282 treatment Methods 0.000 description 73
- 102000006386 Myelin Proteins Human genes 0.000 description 65
- 108010083674 Myelin Proteins Proteins 0.000 description 65
- 210000005012 myelin Anatomy 0.000 description 65
- 230000001965 increasing effect Effects 0.000 description 63
- 150000007523 nucleic acids Chemical class 0.000 description 56
- 241001465754 Metazoa Species 0.000 description 54
- KISWVXRQTGLFGD-UHFFFAOYSA-N 2-[[2-[[6-amino-2-[[2-[[2-[[5-amino-2-[[2-[[1-[2-[[6-amino-2-[(2,5-diamino-5-oxopentanoyl)amino]hexanoyl]amino]-5-(diaminomethylideneamino)pentanoyl]pyrrolidine-2-carbonyl]amino]-3-hydroxypropanoyl]amino]-5-oxopentanoyl]amino]-5-(diaminomethylideneamino)p Chemical compound C1CCN(C(=O)C(CCCN=C(N)N)NC(=O)C(CCCCN)NC(=O)C(N)CCC(N)=O)C1C(=O)NC(CO)C(=O)NC(CCC(N)=O)C(=O)NC(CCCN=C(N)N)C(=O)NC(CO)C(=O)NC(CCCCN)C(=O)NC(C(=O)NC(CC(C)C)C(O)=O)CC1=CC=C(O)C=C1 KISWVXRQTGLFGD-UHFFFAOYSA-N 0.000 description 51
- RWSXRVCMGQZWBV-WDSKDSINSA-N glutathione Chemical compound OC(=O)[C@@H](N)CCC(=O)N[C@@H](CS)C(=O)NCC(O)=O RWSXRVCMGQZWBV-WDSKDSINSA-N 0.000 description 50
- 230000000694 effects Effects 0.000 description 47
- 102000039446 nucleic acids Human genes 0.000 description 47
- 108020004707 nucleic acids Proteins 0.000 description 47
- 206010012305 Demyelination Diseases 0.000 description 45
- 102000047918 Myelin Basic Human genes 0.000 description 44
- 101710107068 Myelin basic protein Proteins 0.000 description 44
- 241000700159 Rattus Species 0.000 description 42
- 230000000971 hippocampal effect Effects 0.000 description 40
- 230000032683 aging Effects 0.000 description 38
- 210000004248 oligodendroglia Anatomy 0.000 description 37
- 210000001744 T-lymphocyte Anatomy 0.000 description 32
- 230000004069 differentiation Effects 0.000 description 30
- 238000010186 staining Methods 0.000 description 30
- ASWBNKHCZGQVJV-UHFFFAOYSA-N (3-hexadecanoyloxy-2-hydroxypropyl) 2-(trimethylazaniumyl)ethyl phosphate Chemical compound CCCCCCCCCCCCCCCC(=O)OCC(O)COP([O-])(=O)OCC[N+](C)(C)C ASWBNKHCZGQVJV-UHFFFAOYSA-N 0.000 description 29
- 230000001225 therapeutic effect Effects 0.000 description 29
- 108010024636 Glutathione Proteins 0.000 description 26
- 210000004556 brain Anatomy 0.000 description 26
- 230000007423 decrease Effects 0.000 description 26
- 201000010099 disease Diseases 0.000 description 26
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 26
- 238000004519 manufacturing process Methods 0.000 description 26
- 230000023105 myelination Effects 0.000 description 25
- 230000014509 gene expression Effects 0.000 description 24
- 229960003180 glutathione Drugs 0.000 description 24
- 241000894007 species Species 0.000 description 23
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 22
- MJVAVZPDRWSRRC-UHFFFAOYSA-N Menadione Chemical compound C1=CC=C2C(=O)C(C)=CC(=O)C2=C1 MJVAVZPDRWSRRC-UHFFFAOYSA-N 0.000 description 22
- 230000037396 body weight Effects 0.000 description 22
- 210000000274 microglia Anatomy 0.000 description 20
- 235000006708 antioxidants Nutrition 0.000 description 19
- 238000011002 quantification Methods 0.000 description 19
- -1 miR-451 Proteins 0.000 description 17
- 238000001262 western blot Methods 0.000 description 17
- 238000000540 analysis of variance Methods 0.000 description 16
- 108090000765 processed proteins & peptides Proteins 0.000 description 16
- 210000002966 serum Anatomy 0.000 description 15
- 108091093085 MiR-338 Proteins 0.000 description 14
- 230000006378 damage Effects 0.000 description 14
- 210000004443 dendritic cell Anatomy 0.000 description 14
- 230000002829 reductive effect Effects 0.000 description 14
- 210000001519 tissue Anatomy 0.000 description 14
- 238000012384 transportation and delivery Methods 0.000 description 14
- 108020004414 DNA Proteins 0.000 description 13
- 238000001727 in vivo Methods 0.000 description 13
- 238000010153 Šidák test Methods 0.000 description 13
- 108700011259 MicroRNAs Proteins 0.000 description 12
- 108091083769 miR-199a-1 stem-loop Proteins 0.000 description 12
- 108091047470 miR-199a-2 stem-loop Proteins 0.000 description 12
- 108091048350 miR-199a-3 stem-loop Proteins 0.000 description 12
- 108091056793 miR-199a-4 stem-loop Proteins 0.000 description 12
- 239000002096 quantum dot Substances 0.000 description 12
- 210000004369 blood Anatomy 0.000 description 11
- 239000008280 blood Substances 0.000 description 11
- 239000003795 chemical substances by application Substances 0.000 description 11
- 102000004196 processed proteins & peptides Human genes 0.000 description 11
- 238000011084 recovery Methods 0.000 description 11
- 235000012711 vitamin K3 Nutrition 0.000 description 11
- 239000011652 vitamin K3 Substances 0.000 description 11
- 229940041603 vitamin k 3 Drugs 0.000 description 11
- 208000029028 brain injury Diseases 0.000 description 10
- 230000035945 sensitivity Effects 0.000 description 10
- 230000001228 trophic effect Effects 0.000 description 10
- 108091028043 Nucleic acid sequence Proteins 0.000 description 9
- 208000030886 Traumatic Brain injury Diseases 0.000 description 9
- 230000008901 benefit Effects 0.000 description 9
- 238000003384 imaging method Methods 0.000 description 9
- 239000003550 marker Substances 0.000 description 9
- 230000001404 mediated effect Effects 0.000 description 9
- 230000015654 memory Effects 0.000 description 9
- 230000009529 traumatic brain injury Effects 0.000 description 9
- 108091080995 Mir-9/mir-79 microRNA precursor family Proteins 0.000 description 8
- 102000019197 Superoxide Dismutase Human genes 0.000 description 8
- 108010012715 Superoxide dismutase Proteins 0.000 description 8
- 210000001130 astrocyte Anatomy 0.000 description 8
- 238000012744 immunostaining Methods 0.000 description 8
- 230000005764 inhibitory process Effects 0.000 description 8
- 210000004379 membrane Anatomy 0.000 description 8
- 239000012528 membrane Substances 0.000 description 8
- 108091035591 miR-23a stem-loop Proteins 0.000 description 8
- 108091047084 miR-9 stem-loop Proteins 0.000 description 8
- 210000002487 multivesicular body Anatomy 0.000 description 8
- 239000002105 nanoparticle Substances 0.000 description 8
- 231100000252 nontoxic Toxicity 0.000 description 8
- 235000016709 nutrition Nutrition 0.000 description 8
- 229920001184 polypeptide Polymers 0.000 description 8
- 230000008929 regeneration Effects 0.000 description 8
- 238000011069 regeneration method Methods 0.000 description 8
- 230000011664 signaling Effects 0.000 description 8
- 239000000126 substance Substances 0.000 description 8
- 238000012360 testing method Methods 0.000 description 8
- 208000012902 Nervous system disease Diseases 0.000 description 7
- 239000000427 antigen Substances 0.000 description 7
- 238000002474 experimental method Methods 0.000 description 7
- 230000006870 function Effects 0.000 description 7
- 238000005259 measurement Methods 0.000 description 7
- 210000005036 nerve Anatomy 0.000 description 7
- 230000003000 nontoxic effect Effects 0.000 description 7
- 238000002360 preparation method Methods 0.000 description 7
- 230000009467 reduction Effects 0.000 description 7
- 239000000243 solution Substances 0.000 description 7
- 210000000130 stem cell Anatomy 0.000 description 7
- 230000001629 suppression Effects 0.000 description 7
- 238000013519 translation Methods 0.000 description 7
- 239000003981 vehicle Substances 0.000 description 7
- 102000004190 Enzymes Human genes 0.000 description 6
- 108090000790 Enzymes Proteins 0.000 description 6
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 6
- 108010043121 Green Fluorescent Proteins Proteins 0.000 description 6
- 102000004144 Green Fluorescent Proteins Human genes 0.000 description 6
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 6
- 208000025966 Neurological disease Diseases 0.000 description 6
- 108010073929 Vascular Endothelial Growth Factor A Proteins 0.000 description 6
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 6
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 6
- 108091007433 antigens Proteins 0.000 description 6
- 102000036639 antigens Human genes 0.000 description 6
- 210000003169 central nervous system Anatomy 0.000 description 6
- 238000012790 confirmation Methods 0.000 description 6
- 210000000805 cytoplasm Anatomy 0.000 description 6
- 229940088598 enzyme Drugs 0.000 description 6
- 239000005090 green fluorescent protein Substances 0.000 description 6
- 239000003102 growth factor Substances 0.000 description 6
- 230000036541 health Effects 0.000 description 6
- 229940088597 hormone Drugs 0.000 description 6
- 239000005556 hormone Substances 0.000 description 6
- 230000001976 improved effect Effects 0.000 description 6
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 6
- 238000002955 isolation Methods 0.000 description 6
- 230000000366 juvenile effect Effects 0.000 description 6
- 239000007788 liquid Substances 0.000 description 6
- 230000003278 mimic effect Effects 0.000 description 6
- 210000000337 motor cortex Anatomy 0.000 description 6
- 230000000638 stimulation Effects 0.000 description 6
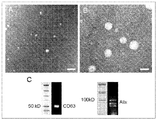
- 102100025222 CD63 antigen Human genes 0.000 description 5
- 241000282412 Homo Species 0.000 description 5
- 101000934368 Homo sapiens CD63 antigen Proteins 0.000 description 5
- 101001092197 Homo sapiens RNA binding protein fox-1 homolog 3 Proteins 0.000 description 5
- 102000008070 Interferon-gamma Human genes 0.000 description 5
- 108091007699 MIR665 Proteins 0.000 description 5
- 108091028684 Mir-145 Proteins 0.000 description 5
- 206010028980 Neoplasm Diseases 0.000 description 5
- 102100035530 RNA binding protein fox-1 homolog 3 Human genes 0.000 description 5
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 5
- 210000003050 axon Anatomy 0.000 description 5
- 239000002585 base Substances 0.000 description 5
- 230000009286 beneficial effect Effects 0.000 description 5
- 210000000170 cell membrane Anatomy 0.000 description 5
- 230000003247 decreasing effect Effects 0.000 description 5
- 229940079593 drug Drugs 0.000 description 5
- 238000001493 electron microscopy Methods 0.000 description 5
- 230000007613 environmental effect Effects 0.000 description 5
- 108091006047 fluorescent proteins Proteins 0.000 description 5
- 102000034287 fluorescent proteins Human genes 0.000 description 5
- 239000012634 fragment Substances 0.000 description 5
- 238000002347 injection Methods 0.000 description 5
- 239000007924 injection Substances 0.000 description 5
- 108091070946 miR-128 stem-loop Proteins 0.000 description 5
- 108091031103 miR-181a stem-loop Proteins 0.000 description 5
- 108091046591 miR-181a-4 stem-loop Proteins 0.000 description 5
- 108091049627 miR-181a-5 stem-loop Proteins 0.000 description 5
- 108091037787 miR-19b stem-loop Proteins 0.000 description 5
- 108091092722 miR-23b stem-loop Proteins 0.000 description 5
- 108091031298 miR-23b-1 stem-loop Proteins 0.000 description 5
- 108091082339 miR-23b-2 stem-loop Proteins 0.000 description 5
- 108091056921 miR-532 stem-loop Proteins 0.000 description 5
- 108091074443 miR-665 stem-loop Proteins 0.000 description 5
- 210000003007 myelin sheath Anatomy 0.000 description 5
- 230000001537 neural effect Effects 0.000 description 5
- 239000002953 phosphate buffered saline Substances 0.000 description 5
- 230000002265 prevention Effects 0.000 description 5
- 108091007428 primary miRNA Proteins 0.000 description 5
- 230000004224 protection Effects 0.000 description 5
- 239000003642 reactive oxygen metabolite Substances 0.000 description 5
- 230000004044 response Effects 0.000 description 5
- 230000007480 spreading Effects 0.000 description 5
- 238000003892 spreading Methods 0.000 description 5
- 230000009885 systemic effect Effects 0.000 description 5
- FWBHETKCLVMNFS-UHFFFAOYSA-N 4',6-Diamino-2-phenylindol Chemical compound C1=CC(C(=N)N)=CC=C1C1=CC2=CC=C(C(N)=N)C=C2N1 FWBHETKCLVMNFS-UHFFFAOYSA-N 0.000 description 4
- 101000836492 Dictyostelium discoideum ALG-2 interacting protein X Proteins 0.000 description 4
- 101001134621 Homo sapiens Programmed cell death 6-interacting protein Proteins 0.000 description 4
- 206010061218 Inflammation Diseases 0.000 description 4
- 108010065805 Interleukin-12 Proteins 0.000 description 4
- 108060001084 Luciferase Proteins 0.000 description 4
- 239000005089 Luciferase Substances 0.000 description 4
- 102000009151 Luteinizing Hormone Human genes 0.000 description 4
- 108010073521 Luteinizing Hormone Proteins 0.000 description 4
- 108091005461 Nucleic proteins Proteins 0.000 description 4
- 102100033344 Programmed cell death 6-interacting protein Human genes 0.000 description 4
- 108700008625 Reporter Genes Proteins 0.000 description 4
- 238000000692 Student's t-test Methods 0.000 description 4
- 102000006601 Thymidine Kinase Human genes 0.000 description 4
- 108020004440 Thymidine kinase Proteins 0.000 description 4
- 239000013543 active substance Substances 0.000 description 4
- 230000001154 acute effect Effects 0.000 description 4
- 230000015572 biosynthetic process Effects 0.000 description 4
- 230000015556 catabolic process Effects 0.000 description 4
- 238000004113 cell culture Methods 0.000 description 4
- 239000003153 chemical reaction reagent Substances 0.000 description 4
- 239000003636 conditioned culture medium Substances 0.000 description 4
- 238000010276 construction Methods 0.000 description 4
- 238000006731 degradation reaction Methods 0.000 description 4
- 238000011161 development Methods 0.000 description 4
- 230000018109 developmental process Effects 0.000 description 4
- 238000009826 distribution Methods 0.000 description 4
- 230000004064 dysfunction Effects 0.000 description 4
- 230000005684 electric field Effects 0.000 description 4
- 230000006872 improvement Effects 0.000 description 4
- 239000003112 inhibitor Substances 0.000 description 4
- 229960003130 interferon gamma Drugs 0.000 description 4
- 238000011068 loading method Methods 0.000 description 4
- 229940040129 luteinizing hormone Drugs 0.000 description 4
- 230000002438 mitochondrial effect Effects 0.000 description 4
- 230000004048 modification Effects 0.000 description 4
- 238000012986 modification Methods 0.000 description 4
- 210000001178 neural stem cell Anatomy 0.000 description 4
- 230000008506 pathogenesis Effects 0.000 description 4
- 230000004083 survival effect Effects 0.000 description 4
- 208000024891 symptom Diseases 0.000 description 4
- 238000012546 transfer Methods 0.000 description 4
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 4
- 102000003951 Erythropoietin Human genes 0.000 description 3
- 108090000394 Erythropoietin Proteins 0.000 description 3
- 102000012673 Follicle Stimulating Hormone Human genes 0.000 description 3
- 108010079345 Follicle Stimulating Hormone Proteins 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 241000701044 Human gammaherpesvirus 4 Species 0.000 description 3
- 108090001061 Insulin Proteins 0.000 description 3
- 102000004877 Insulin Human genes 0.000 description 3
- 108091093142 MiR-144 Proteins 0.000 description 3
- 108091026807 MiR-214 Proteins 0.000 description 3
- 108091028232 Mir-184 Proteins 0.000 description 3
- HOKKHZGPKSLGJE-GSVOUGTGSA-N N-Methyl-D-aspartic acid Chemical compound CN[C@@H](C(O)=O)CC(O)=O HOKKHZGPKSLGJE-GSVOUGTGSA-N 0.000 description 3
- 108091005804 Peptidases Proteins 0.000 description 3
- 102000035195 Peptidases Human genes 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- 102000000574 RNA-Induced Silencing Complex Human genes 0.000 description 3
- 108010016790 RNA-Induced Silencing Complex Proteins 0.000 description 3
- 102100021461 Sphingomyelin phosphodiesterase 3 Human genes 0.000 description 3
- 101710201918 Sphingomyelin phosphodiesterase 3 Proteins 0.000 description 3
- 102400001320 Transforming growth factor alpha Human genes 0.000 description 3
- 101800004564 Transforming growth factor alpha Proteins 0.000 description 3
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 3
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 3
- 230000000735 allogeneic effect Effects 0.000 description 3
- 150000001413 amino acids Chemical group 0.000 description 3
- 230000004071 biological effect Effects 0.000 description 3
- 210000005013 brain tissue Anatomy 0.000 description 3
- 239000000872 buffer Substances 0.000 description 3
- 230000001413 cellular effect Effects 0.000 description 3
- 230000008859 change Effects 0.000 description 3
- 230000001149 cognitive effect Effects 0.000 description 3
- 238000010226 confocal imaging Methods 0.000 description 3
- 239000010949 copper Substances 0.000 description 3
- 230000007812 deficiency Effects 0.000 description 3
- 230000002939 deleterious effect Effects 0.000 description 3
- 230000001419 dependent effect Effects 0.000 description 3
- 239000000032 diagnostic agent Substances 0.000 description 3
- 229940039227 diagnostic agent Drugs 0.000 description 3
- 238000004520 electroporation Methods 0.000 description 3
- 210000001163 endosome Anatomy 0.000 description 3
- 229940105423 erythropoietin Drugs 0.000 description 3
- 229940028334 follicle stimulating hormone Drugs 0.000 description 3
- 238000009472 formulation Methods 0.000 description 3
- 239000000499 gel Substances 0.000 description 3
- 230000012010 growth Effects 0.000 description 3
- 239000001963 growth medium Substances 0.000 description 3
- 210000001320 hippocampus Anatomy 0.000 description 3
- 238000011534 incubation Methods 0.000 description 3
- 230000001939 inductive effect Effects 0.000 description 3
- 230000004054 inflammatory process Effects 0.000 description 3
- 238000001802 infusion Methods 0.000 description 3
- 230000002401 inhibitory effect Effects 0.000 description 3
- 208000014674 injury Diseases 0.000 description 3
- 229940125396 insulin Drugs 0.000 description 3
- 238000001990 intravenous administration Methods 0.000 description 3
- 230000000302 ischemic effect Effects 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 108091064157 miR-106a stem-loop Proteins 0.000 description 3
- 108091056924 miR-124 stem-loop Proteins 0.000 description 3
- 108091058688 miR-141 stem-loop Proteins 0.000 description 3
- 108091062895 miR-144 stem-loop Proteins 0.000 description 3
- 108091032320 miR-146 stem-loop Proteins 0.000 description 3
- 108091024530 miR-146a stem-loop Proteins 0.000 description 3
- 108091091751 miR-17 stem-loop Proteins 0.000 description 3
- 108091069239 miR-17-2 stem-loop Proteins 0.000 description 3
- 108091041042 miR-18 stem-loop Proteins 0.000 description 3
- 108091062221 miR-18a stem-loop Proteins 0.000 description 3
- 108091050874 miR-19a stem-loop Proteins 0.000 description 3
- 108091086850 miR-19a-1 stem-loop Proteins 0.000 description 3
- 108091088468 miR-19a-2 stem-loop Proteins 0.000 description 3
- 108091059199 miR-200a stem-loop Proteins 0.000 description 3
- 108091049679 miR-20a stem-loop Proteins 0.000 description 3
- 108091070404 miR-27b stem-loop Proteins 0.000 description 3
- 108091024082 miR-32 stem-loop Proteins 0.000 description 3
- 108091059916 miR-7a stem-loop Proteins 0.000 description 3
- 108091060270 miR-7a-3 stem-loop Proteins 0.000 description 3
- 108091080310 miR-7a-4 stem-loop Proteins 0.000 description 3
- 108091049334 miR-7a-5 stem-loop Proteins 0.000 description 3
- 108091028159 miR-92a-1 stem-loop Proteins 0.000 description 3
- 239000004005 microsphere Substances 0.000 description 3
- 210000000653 nervous system Anatomy 0.000 description 3
- 230000003961 neuronal insult Effects 0.000 description 3
- 239000003921 oil Substances 0.000 description 3
- 235000019198 oils Nutrition 0.000 description 3
- 210000000956 olfactory bulb Anatomy 0.000 description 3
- 210000000056 organ Anatomy 0.000 description 3
- 230000037361 pathway Effects 0.000 description 3
- 239000000546 pharmaceutical excipient Substances 0.000 description 3
- 238000002600 positron emission tomography Methods 0.000 description 3
- OXCMYAYHXIHQOA-UHFFFAOYSA-N potassium;[2-butyl-5-chloro-3-[[4-[2-(1,2,4-triaza-3-azanidacyclopenta-1,4-dien-5-yl)phenyl]phenyl]methyl]imidazol-4-yl]methanol Chemical compound [K+].CCCCC1=NC(Cl)=C(CO)N1CC1=CC=C(C=2C(=CC=CC=2)C2=N[N-]N=N2)C=C1 OXCMYAYHXIHQOA-UHFFFAOYSA-N 0.000 description 3
- 239000000843 powder Substances 0.000 description 3
- 239000002243 precursor Substances 0.000 description 3
- 239000003755 preservative agent Substances 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 238000000746 purification Methods 0.000 description 3
- 102000005962 receptors Human genes 0.000 description 3
- 108020003175 receptors Proteins 0.000 description 3
- 238000007634 remodeling Methods 0.000 description 3
- 238000012216 screening Methods 0.000 description 3
- 239000011780 sodium chloride Substances 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 230000009469 supplementation Effects 0.000 description 3
- 239000000725 suspension Substances 0.000 description 3
- 238000013518 transcription Methods 0.000 description 3
- 230000035897 transcription Effects 0.000 description 3
- 238000001890 transfection Methods 0.000 description 3
- 230000001052 transient effect Effects 0.000 description 3
- 230000005945 translocation Effects 0.000 description 3
- 230000032258 transport Effects 0.000 description 3
- 230000000007 visual effect Effects 0.000 description 3
- 210000004885 white matter Anatomy 0.000 description 3
- 108091006112 ATPases Proteins 0.000 description 2
- 102000057290 Adenosine Triphosphatases Human genes 0.000 description 2
- 102000009840 Angiopoietins Human genes 0.000 description 2
- 108010009906 Angiopoietins Proteins 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 206010003694 Atrophy Diseases 0.000 description 2
- 102100026189 Beta-galactosidase Human genes 0.000 description 2
- 102000004414 Calcitonin Gene-Related Peptide Human genes 0.000 description 2
- 108090000932 Calcitonin Gene-Related Peptide Proteins 0.000 description 2
- 108090000489 Carboxy-Lyases Proteins 0.000 description 2
- 108010035563 Chloramphenicol O-acetyltransferase Proteins 0.000 description 2
- 102100021809 Chorionic somatomammotropin hormone 1 Human genes 0.000 description 2
- 208000030939 Chronic inflammatory demyelinating polyneuropathy Diseases 0.000 description 2
- 102000007644 Colony-Stimulating Factors Human genes 0.000 description 2
- 108010071942 Colony-Stimulating Factors Proteins 0.000 description 2
- 102100039248 Elongation of very long chain fatty acids protein 7 Human genes 0.000 description 2
- 102100031780 Endonuclease Human genes 0.000 description 2
- 108010042407 Endonucleases Proteins 0.000 description 2
- 102000018233 Fibroblast Growth Factor Human genes 0.000 description 2
- 108050007372 Fibroblast Growth Factor Proteins 0.000 description 2
- 102000003688 G-Protein-Coupled Receptors Human genes 0.000 description 2
- 108090000045 G-Protein-Coupled Receptors Proteins 0.000 description 2
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 2
- 101710154606 Hemagglutinin Proteins 0.000 description 2
- 101000813103 Homo sapiens Elongation of very long chain fatty acids protein 7 Proteins 0.000 description 2
- 108010000521 Human Growth Hormone Proteins 0.000 description 2
- 102000002265 Human Growth Hormone Human genes 0.000 description 2
- 239000000854 Human Growth Hormone Substances 0.000 description 2
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 2
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 2
- 102100034343 Integrase Human genes 0.000 description 2
- 108090000174 Interleukin-10 Proteins 0.000 description 2
- 108090000176 Interleukin-13 Proteins 0.000 description 2
- 102000003810 Interleukin-18 Human genes 0.000 description 2
- 108090000171 Interleukin-18 Proteins 0.000 description 2
- 108010002350 Interleukin-2 Proteins 0.000 description 2
- 108090000978 Interleukin-4 Proteins 0.000 description 2
- 108010002586 Interleukin-7 Proteins 0.000 description 2
- 102000015696 Interleukins Human genes 0.000 description 2
- 108010063738 Interleukins Proteins 0.000 description 2
- 102000016267 Leptin Human genes 0.000 description 2
- 108010092277 Leptin Proteins 0.000 description 2
- 108090000364 Ligases Proteins 0.000 description 2
- 102000003960 Ligases Human genes 0.000 description 2
- 108090000856 Lyases Proteins 0.000 description 2
- 102000004317 Lyases Human genes 0.000 description 2
- 102000043129 MHC class I family Human genes 0.000 description 2
- 108091054437 MHC class I family Proteins 0.000 description 2
- 102000043131 MHC class II family Human genes 0.000 description 2
- 108091054438 MHC class II family Proteins 0.000 description 2
- 102100032063 Neurogenic differentiation factor 1 Human genes 0.000 description 2
- 108050000588 Neurogenic differentiation factor 1 Proteins 0.000 description 2
- MWUXSHHQAYIFBG-UHFFFAOYSA-N Nitric oxide Chemical compound O=[N] MWUXSHHQAYIFBG-UHFFFAOYSA-N 0.000 description 2
- 101710093908 Outer capsid protein VP4 Proteins 0.000 description 2
- 101710135467 Outer capsid protein sigma-1 Proteins 0.000 description 2
- 229910019142 PO4 Inorganic materials 0.000 description 2
- 102000043299 Parathyroid hormone-related Human genes 0.000 description 2
- 101710123753 Parathyroid hormone-related protein Proteins 0.000 description 2
- 108010069013 Phenylalanine Hydroxylase Proteins 0.000 description 2
- 102100038223 Phenylalanine-4-hydroxylase Human genes 0.000 description 2
- 102000009097 Phosphorylases Human genes 0.000 description 2
- 108010073135 Phosphorylases Proteins 0.000 description 2
- 108010003044 Placental Lactogen Proteins 0.000 description 2
- 239000000381 Placental Lactogen Substances 0.000 description 2
- 102000001393 Platelet-Derived Growth Factor alpha Receptor Human genes 0.000 description 2
- 108010068588 Platelet-Derived Growth Factor alpha Receptor Proteins 0.000 description 2
- 102000003946 Prolactin Human genes 0.000 description 2
- 108010057464 Prolactin Proteins 0.000 description 2
- 239000004365 Protease Substances 0.000 description 2
- 101710176177 Protein A56 Proteins 0.000 description 2
- 108010029485 Protein Isoforms Proteins 0.000 description 2
- 102000001708 Protein Isoforms Human genes 0.000 description 2
- 238000011529 RT qPCR Methods 0.000 description 2
- 241000700157 Rattus norvegicus Species 0.000 description 2
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 2
- 102000004446 Serum Response Factor Human genes 0.000 description 2
- 108010042291 Serum Response Factor Proteins 0.000 description 2
- 108050001286 Somatostatin Receptor Proteins 0.000 description 2
- 102000011096 Somatostatin receptor Human genes 0.000 description 2
- 108010061312 Sphingomyelin Phosphodiesterase Proteins 0.000 description 2
- 102000011971 Sphingomyelin Phosphodiesterase Human genes 0.000 description 2
- 210000000662 T-lymphocyte subset Anatomy 0.000 description 2
- 102000036693 Thrombopoietin Human genes 0.000 description 2
- 108010041111 Thrombopoietin Proteins 0.000 description 2
- 102000011923 Thyrotropin Human genes 0.000 description 2
- 108010061174 Thyrotropin Proteins 0.000 description 2
- 208000027418 Wounds and injury Diseases 0.000 description 2
- 230000004913 activation Effects 0.000 description 2
- 239000004480 active ingredient Substances 0.000 description 2
- 239000000443 aerosol Substances 0.000 description 2
- 230000004075 alteration Effects 0.000 description 2
- 230000033115 angiogenesis Effects 0.000 description 2
- 230000006907 apoptotic process Effects 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 238000003556 assay Methods 0.000 description 2
- 230000037444 atrophy Effects 0.000 description 2
- 210000003719 b-lymphocyte Anatomy 0.000 description 2
- 230000006399 behavior Effects 0.000 description 2
- 108010005774 beta-Galactosidase Proteins 0.000 description 2
- 230000033228 biological regulation Effects 0.000 description 2
- 230000008499 blood brain barrier function Effects 0.000 description 2
- 210000001218 blood-brain barrier Anatomy 0.000 description 2
- 210000004958 brain cell Anatomy 0.000 description 2
- 239000011575 calcium Substances 0.000 description 2
- 238000004364 calculation method Methods 0.000 description 2
- 201000011510 cancer Diseases 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 230000034303 cell budding Effects 0.000 description 2
- 230000030833 cell death Effects 0.000 description 2
- 230000024245 cell differentiation Effects 0.000 description 2
- 238000005119 centrifugation Methods 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 201000005795 chronic inflammatory demyelinating polyneuritis Diseases 0.000 description 2
- 229940047120 colony stimulating factors Drugs 0.000 description 2
- 239000002299 complementary DNA Substances 0.000 description 2
- 230000000093 cytochemical effect Effects 0.000 description 2
- 230000003210 demyelinating effect Effects 0.000 description 2
- 239000008121 dextrose Substances 0.000 description 2
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 2
- 230000002121 endocytic effect Effects 0.000 description 2
- 108010048367 enhanced green fluorescent protein Proteins 0.000 description 2
- 230000002708 enhancing effect Effects 0.000 description 2
- 230000002255 enzymatic effect Effects 0.000 description 2
- 210000003743 erythrocyte Anatomy 0.000 description 2
- 210000003527 eukaryotic cell Anatomy 0.000 description 2
- 108010032819 exoribonuclease II Proteins 0.000 description 2
- 239000012530 fluid Substances 0.000 description 2
- 102000037865 fusion proteins Human genes 0.000 description 2
- 108020001507 fusion proteins Proteins 0.000 description 2
- 238000007429 general method Methods 0.000 description 2
- 239000011521 glass Substances 0.000 description 2
- 239000000122 growth hormone Substances 0.000 description 2
- 230000003394 haemopoietic effect Effects 0.000 description 2
- 230000002440 hepatic effect Effects 0.000 description 2
- 210000003494 hepatocyte Anatomy 0.000 description 2
- 230000013632 homeostatic process Effects 0.000 description 2
- 210000000987 immune system Anatomy 0.000 description 2
- 238000010166 immunofluorescence Methods 0.000 description 2
- 208000015181 infectious disease Diseases 0.000 description 2
- 230000002757 inflammatory effect Effects 0.000 description 2
- 229940047122 interleukins Drugs 0.000 description 2
- 230000000968 intestinal effect Effects 0.000 description 2
- 238000007912 intraperitoneal administration Methods 0.000 description 2
- 238000010253 intravenous injection Methods 0.000 description 2
- 238000002372 labelling Methods 0.000 description 2
- 230000013016 learning Effects 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 238000002595 magnetic resonance imaging Methods 0.000 description 2
- 230000003211 malignant effect Effects 0.000 description 2
- 210000004962 mammalian cell Anatomy 0.000 description 2
- 230000035800 maturation Effects 0.000 description 2
- 239000002609 medium Substances 0.000 description 2
- 108091007426 microRNA precursor Proteins 0.000 description 2
- 230000000116 mitigating effect Effects 0.000 description 2
- 239000003226 mitogen Substances 0.000 description 2
- 238000012544 monitoring process Methods 0.000 description 2
- 239000002077 nanosphere Substances 0.000 description 2
- 210000000822 natural killer cell Anatomy 0.000 description 2
- 230000031990 negative regulation of inflammatory response Effects 0.000 description 2
- 230000001423 neocortical effect Effects 0.000 description 2
- 108091027963 non-coding RNA Proteins 0.000 description 2
- 102000042567 non-coding RNA Human genes 0.000 description 2
- 239000002773 nucleotide Substances 0.000 description 2
- 125000003729 nucleotide group Chemical group 0.000 description 2
- 239000002674 ointment Substances 0.000 description 2
- 210000000535 oligodendrocyte precursor cell Anatomy 0.000 description 2
- 230000036961 partial effect Effects 0.000 description 2
- 230000002093 peripheral effect Effects 0.000 description 2
- 230000000144 pharmacologic effect Effects 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 2
- 239000010452 phosphate Substances 0.000 description 2
- 239000013612 plasmid Substances 0.000 description 2
- 239000004033 plastic Substances 0.000 description 2
- 229920003023 plastic Polymers 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- 108091033319 polynucleotide Proteins 0.000 description 2
- 102000040430 polynucleotide Human genes 0.000 description 2
- 239000002157 polynucleotide Substances 0.000 description 2
- 239000013641 positive control Substances 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 230000000750 progressive effect Effects 0.000 description 2
- 229940097325 prolactin Drugs 0.000 description 2
- 230000001105 regulatory effect Effects 0.000 description 2
- 239000000523 sample Substances 0.000 description 2
- 238000002603 single-photon emission computed tomography Methods 0.000 description 2
- 239000002904 solvent Substances 0.000 description 2
- 210000000278 spinal cord Anatomy 0.000 description 2
- 230000035882 stress Effects 0.000 description 2
- 239000004094 surface-active agent Substances 0.000 description 2
- 239000003826 tablet Substances 0.000 description 2
- 230000008685 targeting Effects 0.000 description 2
- 230000000699 topical effect Effects 0.000 description 2
- 230000009466 transformation Effects 0.000 description 2
- 230000000472 traumatic effect Effects 0.000 description 2
- 241000701161 unidentified adenovirus Species 0.000 description 2
- RJEUERNNQHNSKG-CCKFTAQKSA-N (2s)-2-amino-n-[(2r)-1-[[2-[[(2s)-1-amino-1-oxo-3-phenylpropan-2-yl]amino]-2-oxoethyl]amino]-1-oxopropan-2-yl]-3-(4-hydroxyphenyl)propanamide Chemical compound C([C@H](N)C(=O)N[C@H](C)C(=O)NCC(=O)N[C@@H](CC=1C=CC=CC=1)C(N)=O)C1=CC=C(O)C=C1 RJEUERNNQHNSKG-CCKFTAQKSA-N 0.000 description 1
- HEAUFJZALFKPBA-JPQUDPSNSA-N (3s)-3-[[(2s,3r)-2-[[(2s)-6-amino-2-[[(2s)-2-amino-3-(1h-imidazol-5-yl)propanoyl]amino]hexanoyl]amino]-3-hydroxybutanoyl]amino]-4-[[(2s)-1-[[(2s)-1-[[(2s)-1-[[2-[[(2s)-1-[[(2s)-1-amino-4-methylsulfanyl-1-oxobutan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amin Chemical compound C([C@@H](C(=O)N[C@H](C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCSC)C(N)=O)C(C)C)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CCCCN)NC(=O)[C@@H](N)CC=1NC=NC=1)[C@@H](C)O)C1=CC=CC=C1 HEAUFJZALFKPBA-JPQUDPSNSA-N 0.000 description 1
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 description 1
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 1
- ZIIUUSVHCHPIQD-UHFFFAOYSA-N 2,4,6-trimethyl-N-[3-(trifluoromethyl)phenyl]benzenesulfonamide Chemical compound CC1=CC(C)=CC(C)=C1S(=O)(=O)NC1=CC=CC(C(F)(F)F)=C1 ZIIUUSVHCHPIQD-UHFFFAOYSA-N 0.000 description 1
- FSPQCTGGIANIJZ-UHFFFAOYSA-N 2-[[(3,4-dimethoxyphenyl)-oxomethyl]amino]-4,5,6,7-tetrahydro-1-benzothiophene-3-carboxamide Chemical compound C1=C(OC)C(OC)=CC=C1C(=O)NC1=C(C(N)=O)C(CCCC2)=C2S1 FSPQCTGGIANIJZ-UHFFFAOYSA-N 0.000 description 1
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 1
- 108010029731 6-phosphogluconolactonase Proteins 0.000 description 1
- 102100031126 6-phosphogluconolactonase Human genes 0.000 description 1
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 1
- WFPZSXYXPSUOPY-ROYWQJLOSA-N ADP alpha-D-glucoside Chemical compound C([C@H]1O[C@H]([C@@H]([C@@H]1O)O)N1C=2N=CN=C(C=2N=C1)N)OP(O)(=O)OP(O)(=O)O[C@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O WFPZSXYXPSUOPY-ROYWQJLOSA-N 0.000 description 1
- WFPZSXYXPSUOPY-UHFFFAOYSA-N ADP-mannose Natural products C1=NC=2C(N)=NC=NC=2N1C(C(C1O)O)OC1COP(O)(=O)OP(O)(=O)OC1OC(CO)C(O)C(O)C1O WFPZSXYXPSUOPY-UHFFFAOYSA-N 0.000 description 1
- 101150079978 AGRN gene Proteins 0.000 description 1
- 102000007469 Actins Human genes 0.000 description 1
- 108010085238 Actins Proteins 0.000 description 1
- 108010059616 Activins Proteins 0.000 description 1
- 102000005606 Activins Human genes 0.000 description 1
- 102100034540 Adenomatous polyposis coli protein Human genes 0.000 description 1
- 206010001497 Agitation Diseases 0.000 description 1
- 102100040026 Agrin Human genes 0.000 description 1
- 108700019743 Agrin Proteins 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- 102000009027 Albumins Human genes 0.000 description 1
- 102000007698 Alcohol dehydrogenase Human genes 0.000 description 1
- 108010021809 Alcohol dehydrogenase Proteins 0.000 description 1
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 1
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 1
- 108700028369 Alleles Proteins 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 239000004382 Amylase Substances 0.000 description 1
- 108010065511 Amylases Proteins 0.000 description 1
- 102000013142 Amylases Human genes 0.000 description 1
- 102400000344 Angiotensin-1 Human genes 0.000 description 1
- 101800000734 Angiotensin-1 Proteins 0.000 description 1
- 102400000345 Angiotensin-2 Human genes 0.000 description 1
- 101800000733 Angiotensin-2 Proteins 0.000 description 1
- 108020005544 Antisense RNA Proteins 0.000 description 1
- 102000004452 Arginase Human genes 0.000 description 1
- 108700024123 Arginases Proteins 0.000 description 1
- OXDZADMCOWPSOC-UHFFFAOYSA-N Argiprestocin Chemical compound N1C(=O)C(N)CSSCC(C(=O)N2C(CCC2)C(=O)NC(CCCN=C(N)N)C(=O)NCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(CCC(N)=O)NC(=O)C(C(C)CC)NC(=O)C1CC1=CC=C(O)C=C1 OXDZADMCOWPSOC-UHFFFAOYSA-N 0.000 description 1
- 101800001288 Atrial natriuretic factor Proteins 0.000 description 1
- 102400001282 Atrial natriuretic peptide Human genes 0.000 description 1
- 101800001890 Atrial natriuretic peptide Proteins 0.000 description 1
- 208000032116 Autoimmune Experimental Encephalomyelitis Diseases 0.000 description 1
- 102400000748 Beta-endorphin Human genes 0.000 description 1
- 101800005049 Beta-endorphin Proteins 0.000 description 1
- 208000014644 Brain disease Diseases 0.000 description 1
- YNXLOPYTAAFMTN-SBUIBGKBSA-N C([C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCCCN)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)NCC(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CO)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(N)=O)C1=CC=C(O)C=C1 Chemical compound C([C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCCCN)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)NCC(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CO)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(N)=O)C1=CC=C(O)C=C1 YNXLOPYTAAFMTN-SBUIBGKBSA-N 0.000 description 1
- 102000055006 Calcitonin Human genes 0.000 description 1
- 108060001064 Calcitonin Proteins 0.000 description 1
- 102000004031 Carboxy-Lyases Human genes 0.000 description 1
- 208000005623 Carcinogenesis Diseases 0.000 description 1
- 102100035882 Catalase Human genes 0.000 description 1
- 108010053835 Catalase Proteins 0.000 description 1
- 108010059892 Cellulase Proteins 0.000 description 1
- 208000010693 Charcot-Marie-Tooth Disease Diseases 0.000 description 1
- 108010012236 Chemokines Proteins 0.000 description 1
- 102000019034 Chemokines Human genes 0.000 description 1
- 101800001982 Cholecystokinin Proteins 0.000 description 1
- 102100025841 Cholecystokinin Human genes 0.000 description 1
- 102000011022 Chorionic Gonadotropin Human genes 0.000 description 1
- 108010062540 Chorionic Gonadotropin Proteins 0.000 description 1
- 108091005960 Citrine Proteins 0.000 description 1
- 102100022641 Coagulation factor IX Human genes 0.000 description 1
- 108020004705 Codon Proteins 0.000 description 1
- 108700010070 Codon Usage Proteins 0.000 description 1
- 208000028698 Cognitive impairment Diseases 0.000 description 1
- 208000003322 Coinfection Diseases 0.000 description 1
- 206010010904 Convulsion Diseases 0.000 description 1
- 102000020856 Copper Transport Proteins Human genes 0.000 description 1
- 108091004554 Copper Transport Proteins Proteins 0.000 description 1
- 206010010957 Copper deficiency Diseases 0.000 description 1
- 102000012437 Copper-Transporting ATPases Human genes 0.000 description 1
- 102400000739 Corticotropin Human genes 0.000 description 1
- 101800000414 Corticotropin Proteins 0.000 description 1
- 108010022152 Corticotropin-Releasing Hormone Proteins 0.000 description 1
- 102000012289 Corticotropin-Releasing Hormone Human genes 0.000 description 1
- 239000000055 Corticotropin-Releasing Hormone Substances 0.000 description 1
- 102000034534 Cotransporters Human genes 0.000 description 1
- 108020003264 Cotransporters Proteins 0.000 description 1
- 102100034976 Cystathionine beta-synthase Human genes 0.000 description 1
- 108010073644 Cystathionine beta-synthase Proteins 0.000 description 1
- 102000000311 Cytosine Deaminase Human genes 0.000 description 1
- 108010080611 Cytosine Deaminase Proteins 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- XUIIKFGFIJCVMT-GFCCVEGCSA-N D-thyroxine Chemical compound IC1=CC(C[C@@H](N)C(O)=O)=CC(I)=C1OC1=CC(I)=C(O)C(I)=C1 XUIIKFGFIJCVMT-GFCCVEGCSA-N 0.000 description 1
- 102000053602 DNA Human genes 0.000 description 1
- 108010014303 DNA-directed DNA polymerase Proteins 0.000 description 1
- 102000016928 DNA-directed DNA polymerase Human genes 0.000 description 1
- 108090000626 DNA-directed RNA polymerases Proteins 0.000 description 1
- 102000004163 DNA-directed RNA polymerases Human genes 0.000 description 1
- 108090000204 Dipeptidase 1 Proteins 0.000 description 1
- 241000006867 Discosoma Species 0.000 description 1
- 206010059866 Drug resistance Diseases 0.000 description 1
- 206010052804 Drug tolerance Diseases 0.000 description 1
- 206010067601 Dysmyelination Diseases 0.000 description 1
- 108091005941 EBFP Proteins 0.000 description 1
- 108091005942 ECFP Proteins 0.000 description 1
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 1
- 101710121765 Endo-1,4-beta-xylanase Proteins 0.000 description 1
- 108050009340 Endothelin Proteins 0.000 description 1
- 102000002045 Endothelin Human genes 0.000 description 1
- 102400001368 Epidermal growth factor Human genes 0.000 description 1
- 101800003838 Epidermal growth factor Proteins 0.000 description 1
- 241000283073 Equus caballus Species 0.000 description 1
- 108090000371 Esterases Proteins 0.000 description 1
- 102000047351 Exportin-5 Human genes 0.000 description 1
- 108010076282 Factor IX Proteins 0.000 description 1
- 102000001690 Factor VIII Human genes 0.000 description 1
- 108010054218 Factor VIII Proteins 0.000 description 1
- 102100031706 Fibroblast growth factor 1 Human genes 0.000 description 1
- 102000003972 Fibroblast growth factor 7 Human genes 0.000 description 1
- 108090000385 Fibroblast growth factor 7 Proteins 0.000 description 1
- 206010016717 Fistula Diseases 0.000 description 1
- 102100029115 Fumarylacetoacetase Human genes 0.000 description 1
- 102000013446 GTP Phosphohydrolases Human genes 0.000 description 1
- 108091006109 GTPases Proteins 0.000 description 1
- 108010093031 Galactosidases Proteins 0.000 description 1
- 102000002464 Galactosidases Human genes 0.000 description 1
- 102400001370 Galanin Human genes 0.000 description 1
- 101800002068 Galanin Proteins 0.000 description 1
- 108060003199 Glucagon Proteins 0.000 description 1
- 102400000321 Glucagon Human genes 0.000 description 1
- 108010088406 Glucagon-Like Peptides Proteins 0.000 description 1
- 108010073178 Glucan 1,4-alpha-Glucosidase Proteins 0.000 description 1
- 108010015776 Glucose oxidase Proteins 0.000 description 1
- 239000004366 Glucose oxidase Substances 0.000 description 1
- 108010086800 Glucose-6-Phosphatase Proteins 0.000 description 1
- 102000003638 Glucose-6-Phosphatase Human genes 0.000 description 1
- 108010018962 Glucosephosphate Dehydrogenase Proteins 0.000 description 1
- 102000000340 Glucosyltransferases Human genes 0.000 description 1
- 108010055629 Glucosyltransferases Proteins 0.000 description 1
- 108010015451 Glutaryl-CoA Dehydrogenase Proteins 0.000 description 1
- 102100028603 Glutaryl-CoA dehydrogenase, mitochondrial Human genes 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 102000006771 Gonadotropins Human genes 0.000 description 1
- 108010086677 Gonadotropins Proteins 0.000 description 1
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 1
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 1
- 108010051696 Growth Hormone Proteins 0.000 description 1
- 239000000095 Growth Hormone-Releasing Hormone Substances 0.000 description 1
- 208000035895 Guillain-Barré syndrome Diseases 0.000 description 1
- 108010027992 HSP70 Heat-Shock Proteins Proteins 0.000 description 1
- 102000018932 HSP70 Heat-Shock Proteins Human genes 0.000 description 1
- 239000012981 Hank's balanced salt solution Substances 0.000 description 1
- 101000847058 Homo sapiens Exportin-5 Proteins 0.000 description 1
- 101000846416 Homo sapiens Fibroblast growth factor 1 Proteins 0.000 description 1
- 101000898034 Homo sapiens Hepatocyte growth factor Proteins 0.000 description 1
- 101001076408 Homo sapiens Interleukin-6 Proteins 0.000 description 1
- 101000868152 Homo sapiens Son of sevenless homolog 1 Proteins 0.000 description 1
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 description 1
- 102000008100 Human Serum Albumin Human genes 0.000 description 1
- 108091006905 Human Serum Albumin Proteins 0.000 description 1
- 241000700588 Human alphaherpesvirus 1 Species 0.000 description 1
- 108010003272 Hyaluronate lyase Proteins 0.000 description 1
- 102000001974 Hyaluronidases Human genes 0.000 description 1
- 108010056651 Hydroxymethylbilane synthase Proteins 0.000 description 1
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 1
- 208000037147 Hypercalcaemia Diseases 0.000 description 1
- 108010091358 Hypoxanthine Phosphoribosyltransferase Proteins 0.000 description 1
- 102100029098 Hypoxanthine-guanine phosphoribosyltransferase Human genes 0.000 description 1
- 206010021143 Hypoxia Diseases 0.000 description 1
- 206010070511 Hypoxic-ischaemic encephalopathy Diseases 0.000 description 1
- 108010003381 Iduronidase Proteins 0.000 description 1
- 102000004627 Iduronidase Human genes 0.000 description 1
- CZGUSIXMZVURDU-JZXHSEFVSA-N Ile(5)-angiotensin II Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC=1C=CC=CC=1)C([O-])=O)NC(=O)[C@@H](NC(=O)[C@H](CCCNC(N)=[NH2+])NC(=O)[C@@H]([NH3+])CC([O-])=O)C(C)C)C1=CC=C(O)C=C1 CZGUSIXMZVURDU-JZXHSEFVSA-N 0.000 description 1
- 208000026350 Inborn Genetic disease Diseases 0.000 description 1
- 108090000723 Insulin-Like Growth Factor I Proteins 0.000 description 1
- 108090001117 Insulin-Like Growth Factor II Proteins 0.000 description 1
- 102100037852 Insulin-like growth factor I Human genes 0.000 description 1
- 102400000022 Insulin-like growth factor II Human genes 0.000 description 1
- 108010061833 Integrases Proteins 0.000 description 1
- 108010047761 Interferon-alpha Proteins 0.000 description 1
- 102000006992 Interferon-alpha Human genes 0.000 description 1
- 102000003996 Interferon-beta Human genes 0.000 description 1
- 108090000467 Interferon-beta Proteins 0.000 description 1
- 102000014150 Interferons Human genes 0.000 description 1
- 108010050904 Interferons Proteins 0.000 description 1
- 108010002352 Interleukin-1 Proteins 0.000 description 1
- 102000000589 Interleukin-1 Human genes 0.000 description 1
- 108090000177 Interleukin-11 Proteins 0.000 description 1
- 102000003815 Interleukin-11 Human genes 0.000 description 1
- 102000003812 Interleukin-15 Human genes 0.000 description 1
- 108090000172 Interleukin-15 Proteins 0.000 description 1
- 102000049772 Interleukin-16 Human genes 0.000 description 1
- 101800003050 Interleukin-16 Proteins 0.000 description 1
- 108050003558 Interleukin-17 Proteins 0.000 description 1
- 102000013691 Interleukin-17 Human genes 0.000 description 1
- 108010002386 Interleukin-3 Proteins 0.000 description 1
- 108010002616 Interleukin-5 Proteins 0.000 description 1
- 108090001007 Interleukin-8 Proteins 0.000 description 1
- 108010002335 Interleukin-9 Proteins 0.000 description 1
- 108020004684 Internal Ribosome Entry Sites Proteins 0.000 description 1
- 102000036770 Islet Amyloid Polypeptide Human genes 0.000 description 1
- 108010041872 Islet Amyloid Polypeptide Proteins 0.000 description 1
- PIWKPBJCKXDKJR-UHFFFAOYSA-N Isoflurane Chemical compound FC(F)OC(Cl)C(F)(F)F PIWKPBJCKXDKJR-UHFFFAOYSA-N 0.000 description 1
- 108090000769 Isomerases Proteins 0.000 description 1
- 102000004195 Isomerases Human genes 0.000 description 1
- 108010013792 Isovaleryl-CoA Dehydrogenase Proteins 0.000 description 1
- 102100025392 Isovaleryl-CoA dehydrogenase, mitochondrial Human genes 0.000 description 1
- 102100020880 Kit ligand Human genes 0.000 description 1
- 108010001831 LDL receptors Proteins 0.000 description 1
- 102000000853 LDL receptors Human genes 0.000 description 1
- 108010059881 Lactase Proteins 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 108090001090 Lectins Proteins 0.000 description 1
- 102000004856 Lectins Human genes 0.000 description 1
- 108090001060 Lipase Proteins 0.000 description 1
- 102000004882 Lipase Human genes 0.000 description 1
- 239000004367 Lipase Substances 0.000 description 1
- 102000003820 Lipoxygenases Human genes 0.000 description 1
- 108090000128 Lipoxygenases Proteins 0.000 description 1
- 206010067125 Liver injury Diseases 0.000 description 1
- 102000008072 Lymphokines Human genes 0.000 description 1
- 108010074338 Lymphokines Proteins 0.000 description 1
- 102000004083 Lymphotoxin-alpha Human genes 0.000 description 1
- 108090000542 Lymphotoxin-alpha Proteins 0.000 description 1
- 102000043136 MAP kinase family Human genes 0.000 description 1
- 108091054455 MAP kinase family Proteins 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 101800001751 Melanocyte-stimulating hormone alpha Proteins 0.000 description 1
- 101710151321 Melanostatin Proteins 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 208000024556 Mendelian disease Diseases 0.000 description 1
- 208000008948 Menkes Kinky Hair Syndrome Diseases 0.000 description 1
- 208000012583 Menkes disease Diseases 0.000 description 1
- 102000005741 Metalloproteases Human genes 0.000 description 1
- 108010006035 Metalloproteases Proteins 0.000 description 1
- 108010085747 Methylmalonyl-CoA Decarboxylase Proteins 0.000 description 1
- 102000019010 Methylmalonyl-CoA Mutase Human genes 0.000 description 1
- 108010051862 Methylmalonyl-CoA mutase Proteins 0.000 description 1
- 108060004795 Methyltransferase Proteins 0.000 description 1
- 208000000060 Migraine with aura Diseases 0.000 description 1
- 206010049567 Miller Fisher syndrome Diseases 0.000 description 1
- 102100026632 Mimecan Human genes 0.000 description 1
- 101710169105 Minor spike protein Proteins 0.000 description 1
- 101710081079 Minor spike protein H Proteins 0.000 description 1
- 108010074633 Mixed Function Oxygenases Proteins 0.000 description 1
- 102000008109 Mixed Function Oxygenases Human genes 0.000 description 1
- 241000713869 Moloney murine leukemia virus Species 0.000 description 1
- 241000713862 Moloney murine sarcoma virus Species 0.000 description 1
- 102000013967 Monokines Human genes 0.000 description 1
- 108010050619 Monokines Proteins 0.000 description 1
- 101150025362 Msi1 gene Proteins 0.000 description 1
- 108010014251 Muramidase Proteins 0.000 description 1
- 102000016943 Muramidase Human genes 0.000 description 1
- 241000699666 Mus <mouse, genus> Species 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- 208000008238 Muscle Spasticity Diseases 0.000 description 1
- 102100030626 Myosin-binding protein H Human genes 0.000 description 1
- 101710139548 Myosin-binding protein H Proteins 0.000 description 1
- 108010062010 N-Acetylmuramoyl-L-alanine Amidase Proteins 0.000 description 1
- 208000037212 Neonatal hypoxic and ischemic brain injury Diseases 0.000 description 1
- 108010025020 Nerve Growth Factor Proteins 0.000 description 1
- 102000007072 Nerve Growth Factors Human genes 0.000 description 1
- 102400000097 Neurokinin A Human genes 0.000 description 1
- 101800000399 Neurokinin A Proteins 0.000 description 1
- 208000029067 Neuromyelitis optica spectrum disease Diseases 0.000 description 1
- 102400000064 Neuropeptide Y Human genes 0.000 description 1
- 102000002710 Neurophysins Human genes 0.000 description 1
- 108010018674 Neurophysins Proteins 0.000 description 1
- 206010067482 No adverse event Diseases 0.000 description 1
- 239000005642 Oleic acid Substances 0.000 description 1
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 1
- 208000003435 Optic Neuritis Diseases 0.000 description 1
- 102000007981 Ornithine carbamoyltransferase Human genes 0.000 description 1
- 101710198224 Ornithine carbamoyltransferase, mitochondrial Proteins 0.000 description 1
- 101800002327 Osteoinductive factor Proteins 0.000 description 1
- 102000004264 Osteopontin Human genes 0.000 description 1
- 108010081689 Osteopontin Proteins 0.000 description 1
- 101150000187 PTGS2 gene Proteins 0.000 description 1
- 102000003982 Parathyroid hormone Human genes 0.000 description 1
- 108090000445 Parathyroid hormone Proteins 0.000 description 1
- 208000007542 Paresis Diseases 0.000 description 1
- 208000037273 Pathologic Processes Diseases 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 102000015731 Peptide Hormones Human genes 0.000 description 1
- 108010038988 Peptide Hormones Proteins 0.000 description 1
- 102100029909 Peptide YY Human genes 0.000 description 1
- 108010088847 Peptide YY Proteins 0.000 description 1
- 102100039087 Peptidyl-alpha-hydroxyglycine alpha-amidating lyase Human genes 0.000 description 1
- 101710189920 Peptidyl-alpha-hydroxyglycine alpha-amidating lyase Proteins 0.000 description 1
- 102000003992 Peroxidases Human genes 0.000 description 1
- 102000003993 Phosphatidylinositol 3-kinases Human genes 0.000 description 1
- 108090000430 Phosphatidylinositol 3-kinases Proteins 0.000 description 1
- 102000004422 Phospholipase C gamma Human genes 0.000 description 1
- 108010056751 Phospholipase C gamma Proteins 0.000 description 1
- 108010064785 Phospholipases Proteins 0.000 description 1
- 102000015439 Phospholipases Human genes 0.000 description 1
- 108700019535 Phosphoprotein Phosphatases Proteins 0.000 description 1
- 102000045595 Phosphoprotein Phosphatases Human genes 0.000 description 1
- 108090000608 Phosphoric Monoester Hydrolases Proteins 0.000 description 1
- 102000004160 Phosphoric Monoester Hydrolases Human genes 0.000 description 1
- 102000014750 Phosphorylase Kinase Human genes 0.000 description 1
- 108010064071 Phosphorylase Kinase Proteins 0.000 description 1
- 108010038512 Platelet-Derived Growth Factor Proteins 0.000 description 1
- 102000010780 Platelet-Derived Growth Factor Human genes 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 108010059820 Polygalacturonase Proteins 0.000 description 1
- 102100034391 Porphobilinogen deaminase Human genes 0.000 description 1
- 108010035004 Prephenate Dehydrogenase Proteins 0.000 description 1
- 102100033237 Pro-epidermal growth factor Human genes 0.000 description 1
- 102100027467 Pro-opiomelanocortin Human genes 0.000 description 1
- 108010076181 Proinsulin Proteins 0.000 description 1
- 108090000459 Prostaglandin-endoperoxide synthases Proteins 0.000 description 1
- 102000004005 Prostaglandin-endoperoxide synthases Human genes 0.000 description 1
- 102000001253 Protein Kinase Human genes 0.000 description 1
- 206010037211 Psychomotor hyperactivity Diseases 0.000 description 1
- 108010053763 Pyruvate Carboxylase Proteins 0.000 description 1
- 102100039895 Pyruvate carboxylase, mitochondrial Human genes 0.000 description 1
- 238000012228 RNA interference-mediated gene silencing Methods 0.000 description 1
- 108010092799 RNA-directed DNA polymerase Proteins 0.000 description 1
- 239000012979 RPMI medium Substances 0.000 description 1
- 102100020718 Receptor-type tyrosine-protein kinase FLT3 Human genes 0.000 description 1
- 101710151245 Receptor-type tyrosine-protein kinase FLT3 Proteins 0.000 description 1
- 102000018120 Recombinases Human genes 0.000 description 1
- 108010091086 Recombinases Proteins 0.000 description 1
- 108090000103 Relaxin Proteins 0.000 description 1
- 102000003743 Relaxin Human genes 0.000 description 1
- 241000242743 Renilla reniformis Species 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 108090000184 Selectins Proteins 0.000 description 1
- 102000003800 Selectins Human genes 0.000 description 1
- 108091081021 Sense strand Proteins 0.000 description 1
- 206010040021 Sensory abnormalities Diseases 0.000 description 1
- 108010045517 Serum Amyloid P-Component Proteins 0.000 description 1
- 201000001880 Sexual dysfunction Diseases 0.000 description 1
- 108010003723 Single-Domain Antibodies Proteins 0.000 description 1
- 208000000453 Skin Neoplasms Diseases 0.000 description 1
- 102100022831 Somatoliberin Human genes 0.000 description 1
- 101710142969 Somatoliberin Proteins 0.000 description 1
- 108010056088 Somatostatin Proteins 0.000 description 1
- 102000005157 Somatostatin Human genes 0.000 description 1
- 102100038803 Somatotropin Human genes 0.000 description 1
- 229940122171 Sphingomyelinase inhibitor Drugs 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 108010039445 Stem Cell Factor Proteins 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 101710119418 Superoxide dismutase [Mn] Proteins 0.000 description 1
- 101710202572 Superoxide dismutase [Mn], mitochondrial Proteins 0.000 description 1
- 102100032891 Superoxide dismutase [Mn], mitochondrial Human genes 0.000 description 1
- 230000005867 T cell response Effects 0.000 description 1
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 description 1
- 108700031126 Tetraspanins Proteins 0.000 description 1
- 102000043977 Tetraspanins Human genes 0.000 description 1
- 101710183280 Topoisomerase Proteins 0.000 description 1
- 108020004566 Transfer RNA Proteins 0.000 description 1
- 102000007238 Transferrin Receptors Human genes 0.000 description 1
- 108010033576 Transferrin Receptors Proteins 0.000 description 1
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 1
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 1
- 102000044209 Tumor Suppressor Genes Human genes 0.000 description 1
- 108700025716 Tumor Suppressor Genes Proteins 0.000 description 1
- 108010058532 UTP-hexose-1-phosphate uridylyltransferase Proteins 0.000 description 1
- 102000006321 UTP-hexose-1-phosphate uridylyltransferase Human genes 0.000 description 1
- 208000025865 Ulcer Diseases 0.000 description 1
- 208000032594 Vascular Remodeling Diseases 0.000 description 1
- 108010003205 Vasoactive Intestinal Peptide Proteins 0.000 description 1
- 102400000015 Vasoactive intestinal peptide Human genes 0.000 description 1
- GXBMIBRIOWHPDT-UHFFFAOYSA-N Vasopressin Natural products N1C(=O)C(CC=2C=C(O)C=CC=2)NC(=O)C(N)CSSCC(C(=O)N2C(CCC2)C(=O)NC(CCCN=C(N)N)C(=O)NCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(CCC(N)=O)NC(=O)C1CC1=CC=CC=C1 GXBMIBRIOWHPDT-UHFFFAOYSA-N 0.000 description 1
- 108010004977 Vasopressins Proteins 0.000 description 1
- 102000002852 Vasopressins Human genes 0.000 description 1
- 101800003024 Vasotocin Proteins 0.000 description 1
- 208000036142 Viral infection Diseases 0.000 description 1
- 206010047571 Visual impairment Diseases 0.000 description 1
- XLIJUKVKOIMPKW-BTVCFUMJSA-N [O].OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C=O Chemical compound [O].OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C=O XLIJUKVKOIMPKW-BTVCFUMJSA-N 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 239000012190 activator Substances 0.000 description 1
- 239000000488 activin Substances 0.000 description 1
- 108010036419 acyl-(acyl-carrier-protein)desaturase Proteins 0.000 description 1
- 230000003044 adaptive effect Effects 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 239000011543 agarose gel Substances 0.000 description 1
- 238000000246 agarose gel electrophoresis Methods 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 230000001476 alcoholic effect Effects 0.000 description 1
- 108010050122 alpha 1-Antitrypsin Proteins 0.000 description 1
- 102000015395 alpha 1-Antitrypsin Human genes 0.000 description 1
- 229940024142 alpha 1-antitrypsin Drugs 0.000 description 1
- 210000002588 alveolar type II cell Anatomy 0.000 description 1
- 125000000539 amino acid group Chemical group 0.000 description 1
- 238000012197 amplification kit Methods 0.000 description 1
- 239000003708 ampul Substances 0.000 description 1
- 235000019418 amylase Nutrition 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- ORWYRWWVDCYOMK-HBZPZAIKSA-N angiotensin I Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CC(C)C)C(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@@H](N)CC(O)=O)C(C)C)C1=CC=C(O)C=C1 ORWYRWWVDCYOMK-HBZPZAIKSA-N 0.000 description 1
- 229950006323 angiotensin ii Drugs 0.000 description 1
- 238000003975 animal breeding Methods 0.000 description 1
- 230000001093 anti-cancer Effects 0.000 description 1
- 230000003110 anti-inflammatory effect Effects 0.000 description 1
- 230000000692 anti-sense effect Effects 0.000 description 1
- 229940121375 antifungal agent Drugs 0.000 description 1
- 239000003429 antifungal agent Substances 0.000 description 1
- 239000004599 antimicrobial Substances 0.000 description 1
- 230000006851 antioxidant defense Effects 0.000 description 1
- 238000003782 apoptosis assay Methods 0.000 description 1
- 239000008365 aqueous carrier Substances 0.000 description 1
- 239000003125 aqueous solvent Substances 0.000 description 1
- KBZOIRJILGZLEJ-LGYYRGKSSA-N argipressin Chemical compound C([C@H]1C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CSSC[C@@H](C(N[C@@H](CC=2C=CC(O)=CC=2)C(=O)N1)=O)N)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCN=C(N)N)C(=O)NCC(N)=O)C1=CC=CC=C1 KBZOIRJILGZLEJ-LGYYRGKSSA-N 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 230000001363 autoimmune Effects 0.000 description 1
- 108010051210 beta-Fructofuranosidase Proteins 0.000 description 1
- 108010047754 beta-Glucosidase Proteins 0.000 description 1
- 102000006995 beta-Glucosidase Human genes 0.000 description 1
- 108010042362 beta-Lipotropin Proteins 0.000 description 1
- WOPZMFQRCBYPJU-NTXHZHDSSA-N beta-endorphin Chemical compound C([C@@H](C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)NCC(=O)N[C@@H](CCC(N)=O)C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@H]1N(CCC1)C(=O)[C@@H](NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CCSC)NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)CNC(=O)CNC(=O)[C@@H](N)CC=1C=CC(O)=CC=1)[C@@H](C)O)[C@@H](C)O)C(C)C)[C@@H](C)O)C1=CC=CC=C1 WOPZMFQRCBYPJU-NTXHZHDSSA-N 0.000 description 1
- 102000006635 beta-lactamase Human genes 0.000 description 1
- 230000002457 bidirectional effect Effects 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 230000008827 biological function Effects 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 108091005948 blue fluorescent proteins Proteins 0.000 description 1
- 210000001124 body fluid Anatomy 0.000 description 1
- 239000010839 body fluid Substances 0.000 description 1
- 210000000988 bone and bone Anatomy 0.000 description 1
- 108010006025 bovine growth hormone Proteins 0.000 description 1
- 230000006931 brain damage Effects 0.000 description 1
- 231100000874 brain damage Toxicity 0.000 description 1
- 230000036995 brain health Effects 0.000 description 1
- 208000009973 brain hypoxia - ischemia Diseases 0.000 description 1
- 229960004015 calcitonin Drugs 0.000 description 1
- BBBFJLBPOGFECG-VJVYQDLKSA-N calcitonin Chemical compound N([C@H](C(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H]([C@@H](C)O)C(=O)N1[C@@H](CCC1)C(N)=O)C(C)C)C(=O)[C@@H]1CSSC[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(=O)N1 BBBFJLBPOGFECG-VJVYQDLKSA-N 0.000 description 1
- 239000003710 calcium ionophore Substances 0.000 description 1
- BPKIGYQJPYCAOW-FFJTTWKXSA-I calcium;potassium;disodium;(2s)-2-hydroxypropanoate;dichloride;dihydroxide;hydrate Chemical compound O.[OH-].[OH-].[Na+].[Na+].[Cl-].[Cl-].[K+].[Ca+2].C[C@H](O)C([O-])=O BPKIGYQJPYCAOW-FFJTTWKXSA-I 0.000 description 1
- 230000036952 cancer formation Effects 0.000 description 1
- 125000003917 carbamoyl group Chemical group [H]N([H])C(*)=O 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 231100000504 carcinogenesis Toxicity 0.000 description 1
- 210000005242 cardiac chamber Anatomy 0.000 description 1
- 210000000748 cardiovascular system Anatomy 0.000 description 1
- NSQLIUXCMFBZME-MPVJKSABSA-N carperitide Chemical compound C([C@H]1C(=O)NCC(=O)NCC(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@H](C(NCC(=O)N[C@@H](C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](CSSC[C@@H](C(=O)N1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(O)=O)=O)[C@@H](C)CC)C1=CC=CC=C1 NSQLIUXCMFBZME-MPVJKSABSA-N 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 230000020411 cell activation Effects 0.000 description 1
- 230000032677 cell aging Effects 0.000 description 1
- 210000005056 cell body Anatomy 0.000 description 1
- 230000008568 cell cell communication Effects 0.000 description 1
- 230000032823 cell division Effects 0.000 description 1
- 230000007910 cell fusion Effects 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 230000011748 cell maturation Effects 0.000 description 1
- 230000012292 cell migration Effects 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 230000003833 cell viability Effects 0.000 description 1
- 229940106157 cellulase Drugs 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 230000002490 cerebral effect Effects 0.000 description 1
- 206010008129 cerebral palsy Diseases 0.000 description 1
- 210000001175 cerebrospinal fluid Anatomy 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- 208000022605 chemotherapy-induced alopecia Diseases 0.000 description 1
- 229940107137 cholecystokinin Drugs 0.000 description 1
- 229940015047 chorionic gonadotropin Drugs 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 239000011035 citrine Substances 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 230000008045 co-localization Effects 0.000 description 1
- 238000012761 co-transfection Methods 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 230000019771 cognition Effects 0.000 description 1
- 239000003184 complementary RNA Substances 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 239000012468 concentrated sample Substances 0.000 description 1
- 239000000470 constituent Substances 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 230000000875 corresponding effect Effects 0.000 description 1
- 230000001054 cortical effect Effects 0.000 description 1
- 229960000258 corticotropin Drugs 0.000 description 1
- IDLFZVILOHSSID-OVLDLUHVSA-N corticotropin Chemical compound C([C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C(C)C)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC(N)=O)C(=O)NCC(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)NC(=O)[C@@H](N)CO)C1=CC=C(O)C=C1 IDLFZVILOHSSID-OVLDLUHVSA-N 0.000 description 1
- 229940041967 corticotropin-releasing hormone Drugs 0.000 description 1
- KLVRDXBAMSPYKH-RKYZNNDCSA-N corticotropin-releasing hormone (human) Chemical compound C([C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(N)=O)[C@@H](C)CC)NC(=O)[C@H](C)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](C)NC(=O)[C@H](CCSC)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H]1N(CCC1)C(=O)[C@H]1N(CCC1)C(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](N)CO)[C@@H](C)CC)C(C)C)C(C)C)C1=CNC=N1 KLVRDXBAMSPYKH-RKYZNNDCSA-N 0.000 description 1
- 108010082025 cyan fluorescent protein Proteins 0.000 description 1
- DKMKCBPTITUZRL-UHFFFAOYSA-L cyclohexane-1,2-diamine;platinum(2+);propanedioate Chemical compound [Pt+2].[O-]C(=O)CC([O-])=O.NC1CCCCC1N DKMKCBPTITUZRL-UHFFFAOYSA-L 0.000 description 1
- 210000000172 cytosol Anatomy 0.000 description 1
- 230000001086 cytosolic effect Effects 0.000 description 1
- 230000003412 degenerative effect Effects 0.000 description 1
- 230000001934 delay Effects 0.000 description 1
- 238000000432 density-gradient centrifugation Methods 0.000 description 1
- 210000001947 dentate gyrus Anatomy 0.000 description 1
- 230000001627 detrimental effect Effects 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 239000000104 diagnostic biomarker Substances 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- 235000015872 dietary supplement Nutrition 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 239000012153 distilled water Substances 0.000 description 1
- 238000012137 double-staining Methods 0.000 description 1
- 230000009977 dual effect Effects 0.000 description 1
- 238000000635 electron micrograph Methods 0.000 description 1
- 201000002491 encephalomyelitis Diseases 0.000 description 1
- ZUBDGKVDJUIMQQ-ZTNLKOGPSA-N endothelin i Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(O)=O)NC(=O)[C@H]1NC(=O)[C@H](CC=2C=CC=CC=2)NC(=O)[C@H](CC=2C=CC(O)=CC=2)NC(=O)[C@H](C(C)C)NC(=O)[C@@H]2CSSC[C@@H](C(N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(=O)N2)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CSSC1)C1=CNC=N1 ZUBDGKVDJUIMQQ-ZTNLKOGPSA-N 0.000 description 1
- ZUBDGKVDJUIMQQ-UBFCDGJISA-N endothelin-1 Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(O)=O)NC(=O)[C@H]1NC(=O)[C@H](CC=2C=CC=CC=2)NC(=O)[C@@H](CC=2C=CC(O)=CC=2)NC(=O)[C@H](C(C)C)NC(=O)[C@H]2CSSC[C@@H](C(N[C@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)N[C@H](CC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(=O)N2)=O)NC(=O)[C@@H](CO)NC(=O)[C@H](N)CSSC1)C1=CNC=N1 ZUBDGKVDJUIMQQ-UBFCDGJISA-N 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 229940116977 epidermal growth factor Drugs 0.000 description 1
- 230000008556 epithelial cell proliferation Effects 0.000 description 1
- CJAONIOAQZUHPN-KKLWWLSJSA-N ethyl 12-[[2-[(2r,3r)-3-[2-[(12-ethoxy-12-oxododecyl)-methylamino]-2-oxoethoxy]butan-2-yl]oxyacetyl]-methylamino]dodecanoate Chemical compound CCOC(=O)CCCCCCCCCCCN(C)C(=O)CO[C@H](C)[C@@H](C)OCC(=O)N(C)CCCCCCCCCCCC(=O)OCC CJAONIOAQZUHPN-KKLWWLSJSA-N 0.000 description 1
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 1
- 229940093471 ethyl oleate Drugs 0.000 description 1
- 208000012997 experimental autoimmune encephalomyelitis Diseases 0.000 description 1
- 238000010195 expression analysis Methods 0.000 description 1
- 210000000416 exudates and transudate Anatomy 0.000 description 1
- 229960004222 factor ix Drugs 0.000 description 1
- 229960000301 factor viii Drugs 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 239000000835 fiber Substances 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 230000003890 fistula Effects 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 230000002431 foraging effect Effects 0.000 description 1
- 239000012737 fresh medium Substances 0.000 description 1
- 108010022687 fumarylacetoacetase Proteins 0.000 description 1
- 230000009760 functional impairment Effects 0.000 description 1
- 230000004927 fusion Effects 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 210000001156 gastric mucosa Anatomy 0.000 description 1
- 238000001476 gene delivery Methods 0.000 description 1
- 230000009368 gene silencing by RNA Effects 0.000 description 1
- MASNOZXLGMXCHN-ZLPAWPGGSA-N glucagon Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O)C(C)C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC=1NC=NC=1)[C@@H](C)O)[C@@H](C)O)C1=CC=CC=C1 MASNOZXLGMXCHN-ZLPAWPGGSA-N 0.000 description 1
- 229960004666 glucagon Drugs 0.000 description 1
- 229940116332 glucose oxidase Drugs 0.000 description 1
- 235000019420 glucose oxidase Nutrition 0.000 description 1
- 239000002622 gonadotropin Substances 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 210000003714 granulocyte Anatomy 0.000 description 1
- 210000004884 grey matter Anatomy 0.000 description 1
- 230000026781 habituation Effects 0.000 description 1
- 230000009931 harmful effect Effects 0.000 description 1
- 239000000185 hemagglutinin Substances 0.000 description 1
- 208000019691 hematopoietic and lymphoid cell neoplasm Diseases 0.000 description 1
- 108010002430 hemicellulase Proteins 0.000 description 1
- 229940059442 hemicellulase Drugs 0.000 description 1
- 231100000753 hepatic injury Toxicity 0.000 description 1
- 239000004009 herbicide Substances 0.000 description 1
- 210000003630 histaminocyte Anatomy 0.000 description 1
- 231100000652 hormesis Toxicity 0.000 description 1
- 229960002773 hyaluronidase Drugs 0.000 description 1
- 239000000017 hydrogel Substances 0.000 description 1
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 1
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 1
- 230000000148 hypercalcaemia Effects 0.000 description 1
- 208000030915 hypercalcemia disease Diseases 0.000 description 1
- 230000003463 hyperproliferative effect Effects 0.000 description 1
- 230000007954 hypoxia Effects 0.000 description 1
- 208000036260 idiopathic disease Diseases 0.000 description 1
- 230000002519 immonomodulatory effect Effects 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 238000003119 immunoblot Methods 0.000 description 1
- 230000002055 immunohistochemical effect Effects 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 230000006882 induction of apoptosis Effects 0.000 description 1
- 239000011261 inert gas Substances 0.000 description 1
- 239000012678 infectious agent Substances 0.000 description 1
- 208000027866 inflammatory disease Diseases 0.000 description 1
- 230000008798 inflammatory stress Effects 0.000 description 1
- 206010022000 influenza Diseases 0.000 description 1
- 238000002329 infrared spectrum Methods 0.000 description 1
- 239000000893 inhibin Substances 0.000 description 1
- ZPNFWUPYTFPOJU-LPYSRVMUSA-N iniprol Chemical compound C([C@H]1C(=O)NCC(=O)NCC(=O)N[C@H]2CSSC[C@H]3C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@H](C(N[C@H](C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=4C=CC(O)=CC=4)C(=O)N[C@@H](CC=4C=CC=CC=4)C(=O)N[C@@H](CC=4C=CC(O)=CC=4)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CC=4C=CC=CC=4)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCCN)NC(=O)[C@H](C)NC(=O)[C@H](CCCNC(N)=N)NC2=O)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](CC=2C=CC=CC=2)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H]2N(CCC2)C(=O)[C@@H](N)CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N2[C@@H](CCC2)C(=O)N2[C@@H](CCC2)C(=O)N[C@@H](CC=2C=CC(O)=CC=2)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N2[C@@H](CCC2)C(=O)N3)C(=O)NCC(=O)NCC(=O)N[C@@H](C)C(O)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@H](C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@H](C(=O)N1)C(C)C)[C@@H](C)O)[C@@H](C)CC)=O)[C@@H](C)CC)C1=CC=C(O)C=C1 ZPNFWUPYTFPOJU-LPYSRVMUSA-N 0.000 description 1
- 239000007972 injectable composition Substances 0.000 description 1
- 150000002484 inorganic compounds Chemical class 0.000 description 1
- 229910010272 inorganic material Inorganic materials 0.000 description 1
- 102000006495 integrins Human genes 0.000 description 1
- 108010044426 integrins Proteins 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 230000002452 interceptive effect Effects 0.000 description 1
- 229940047124 interferons Drugs 0.000 description 1
- 108090000237 interleukin-24 Proteins 0.000 description 1
- 102000003898 interleukin-24 Human genes 0.000 description 1
- 238000001361 intraarterial administration Methods 0.000 description 1
- 238000007917 intracranial administration Methods 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 239000001573 invertase Substances 0.000 description 1
- 235000011073 invertase Nutrition 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- VBUWHHLIZKOSMS-RIWXPGAOSA-N invicorp Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(O)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](CCSC)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC=1NC=NC=1)C(C)C)[C@@H](C)O)[C@@H](C)O)C(C)C)C1=CC=C(O)C=C1 VBUWHHLIZKOSMS-RIWXPGAOSA-N 0.000 description 1
- 238000004255 ion exchange chromatography Methods 0.000 description 1
- 238000003973 irrigation Methods 0.000 description 1
- 230000002262 irrigation Effects 0.000 description 1
- 208000028867 ischemia Diseases 0.000 description 1
- 229960002725 isoflurane Drugs 0.000 description 1
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 1
- 150000004715 keto acids Chemical class 0.000 description 1
- 210000003292 kidney cell Anatomy 0.000 description 1
- 210000003127 knee Anatomy 0.000 description 1
- 229940116108 lactase Drugs 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 229940039781 leptin Drugs 0.000 description 1
- NRYBAZVQPHGZNS-ZSOCWYAHSA-N leptin Chemical compound O=C([C@H](CO)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)CNC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](N)CC(C)C)CCSC)N1CCC[C@H]1C(=O)NCC(=O)N[C@@H](CS)C(O)=O NRYBAZVQPHGZNS-ZSOCWYAHSA-N 0.000 description 1
- 230000003902 lesion Effects 0.000 description 1
- 235000019421 lipase Nutrition 0.000 description 1
- 230000037356 lipid metabolism Effects 0.000 description 1
- 238000001638 lipofection Methods 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 239000006193 liquid solution Substances 0.000 description 1
- 239000006194 liquid suspension Substances 0.000 description 1
- 230000004807 localization Effects 0.000 description 1
- 230000033001 locomotion Effects 0.000 description 1
- 230000027928 long-term synaptic potentiation Effects 0.000 description 1
- 238000004020 luminiscence type Methods 0.000 description 1
- 210000005265 lung cell Anatomy 0.000 description 1
- 210000004698 lymphocyte Anatomy 0.000 description 1
- 239000012139 lysis buffer Substances 0.000 description 1
- 210000003712 lysosome Anatomy 0.000 description 1
- 230000001868 lysosomic effect Effects 0.000 description 1
- 239000004325 lysozyme Substances 0.000 description 1
- 229960000274 lysozyme Drugs 0.000 description 1
- 235000010335 lysozyme Nutrition 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- ZLNQQNXFFQJAID-UHFFFAOYSA-L magnesium carbonate Chemical compound [Mg+2].[O-]C([O-])=O ZLNQQNXFFQJAID-UHFFFAOYSA-L 0.000 description 1
- 239000001095 magnesium carbonate Substances 0.000 description 1
- 229910000021 magnesium carbonate Inorganic materials 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 238000000691 measurement method Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 230000036630 mental development Effects 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 125000001360 methionine group Chemical group N[C@@H](CCSC)C(=O)* 0.000 description 1
- CWWARWOPSKGELM-SARDKLJWSA-N methyl (2s)-2-[[(2s)-2-[[2-[[(2s)-2-[[(2s)-2-[[(2s)-5-amino-2-[[(2s)-5-amino-2-[[(2s)-1-[(2s)-6-amino-2-[[(2s)-1-[(2s)-2-amino-5-(diaminomethylideneamino)pentanoyl]pyrrolidine-2-carbonyl]amino]hexanoyl]pyrrolidine-2-carbonyl]amino]-5-oxopentanoyl]amino]-5 Chemical compound C([C@@H](C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)OC)NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CCCCN)NC(=O)[C@H]1N(CCC1)C(=O)[C@@H](N)CCCN=C(N)N)C1=CC=CC=C1 CWWARWOPSKGELM-SARDKLJWSA-N 0.000 description 1
- 108091030639 miR-219a-1 stem-loop Proteins 0.000 description 1
- 108091025543 miR-219a-2 stem-loop Proteins 0.000 description 1
- 239000000693 micelle Substances 0.000 description 1
- 238000002493 microarray Methods 0.000 description 1
- 230000002906 microbiologic effect Effects 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 230000002025 microglial effect Effects 0.000 description 1
- 238000001000 micrograph Methods 0.000 description 1
- 239000011859 microparticle Substances 0.000 description 1
- 238000000386 microscopy Methods 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 235000020786 mineral supplement Nutrition 0.000 description 1
- 229940029985 mineral supplement Drugs 0.000 description 1
- 239000003595 mist Substances 0.000 description 1
- 210000003470 mitochondria Anatomy 0.000 description 1
- SLZIZIJTGAYEKK-CIJSCKBQSA-N molport-023-220-247 Chemical compound C([C@@H](C(=O)N[C@@H](C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC=1N=CNC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC=1N=CNC=1)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C)C(N)=O)NC(=O)[C@H]1N(CCC1)C(=O)CNC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)CN)[C@@H](C)O)C1=CNC=N1 SLZIZIJTGAYEKK-CIJSCKBQSA-N 0.000 description 1
- 230000001181 motogenic effect Effects 0.000 description 1
- 239000010813 municipal solid waste Substances 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 210000000581 natural killer T-cell Anatomy 0.000 description 1
- 210000003061 neural cell Anatomy 0.000 description 1
- 210000005155 neural progenitor cell Anatomy 0.000 description 1
- 210000004498 neuroglial cell Anatomy 0.000 description 1
- 230000001703 neuroimmune Effects 0.000 description 1
- 230000007971 neurological deficit Effects 0.000 description 1
- 230000000926 neurological effect Effects 0.000 description 1
- 208000008795 neuromyelitis optica Diseases 0.000 description 1
- 230000004112 neuroprotection Effects 0.000 description 1
- 238000006386 neutralization reaction Methods 0.000 description 1
- 230000003472 neutralizing effect Effects 0.000 description 1
- 239000000346 nonvolatile oil Substances 0.000 description 1
- URPYMXQQVHTUDU-OFGSCBOVSA-N nucleopeptide y Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(N)=O)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CCCCN)NC(=O)[C@H](CO)NC(=O)[C@H]1N(CCC1)C(=O)[C@@H](N)CC=1C=CC(O)=CC=1)C1=CC=C(O)C=C1 URPYMXQQVHTUDU-OFGSCBOVSA-N 0.000 description 1
- 239000002777 nucleoside Substances 0.000 description 1
- 125000003835 nucleoside group Chemical group 0.000 description 1
- 235000021048 nutrient requirements Nutrition 0.000 description 1
- 235000015097 nutrients Nutrition 0.000 description 1
- 230000000050 nutritive effect Effects 0.000 description 1
- QNDVLZJODHBUFM-WFXQOWMNSA-N okadaic acid Chemical compound C([C@H](O1)[C@H](C)/C=C/[C@H]2CC[C@@]3(CC[C@H]4O[C@@H](C([C@@H](O)[C@@H]4O3)=C)[C@@H](O)C[C@H](C)[C@@H]3[C@@H](CC[C@@]4(OCCCC4)O3)C)O2)C(C)=C[C@]21O[C@H](C[C@@](C)(O)C(O)=O)CC[C@H]2O QNDVLZJODHBUFM-WFXQOWMNSA-N 0.000 description 1
- VEFJHAYOIAAXEU-UHFFFAOYSA-N okadaic acid Natural products CC(CC(O)C1OC2CCC3(CCC(O3)C=CC(C)C4CC(=CC5(OC(CC(C)(O)C(=O)O)CCC5O)O4)C)OC2C(O)C1C)C6OC7(CCCCO7)CCC6C VEFJHAYOIAAXEU-UHFFFAOYSA-N 0.000 description 1
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 1
- 238000012634 optical imaging Methods 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 150000002895 organic esters Chemical class 0.000 description 1
- 230000008520 organization Effects 0.000 description 1
- 230000002018 overexpression Effects 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 229940094443 oxytocics prostaglandins Drugs 0.000 description 1
- 238000004806 packaging method and process Methods 0.000 description 1
- 239000000199 parathyroid hormone Substances 0.000 description 1
- 229960001319 parathyroid hormone Drugs 0.000 description 1
- 239000006072 paste Substances 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 230000009054 pathological process Effects 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 230000007310 pathophysiology Effects 0.000 description 1
- 108020004410 pectinesterase Proteins 0.000 description 1
- 239000000813 peptide hormone Substances 0.000 description 1
- 230000010412 perfusion Effects 0.000 description 1
- 210000003516 pericardium Anatomy 0.000 description 1
- 208000033300 perinatal asphyxia Diseases 0.000 description 1
- 210000005259 peripheral blood Anatomy 0.000 description 1
- 239000011886 peripheral blood Substances 0.000 description 1
- 210000001428 peripheral nervous system Anatomy 0.000 description 1
- 201000005936 periventricular leukomalacia Diseases 0.000 description 1
- 108040007629 peroxidase activity proteins Proteins 0.000 description 1
- 239000000575 pesticide Substances 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 239000002644 phorbol ester Substances 0.000 description 1
- 230000037081 physical activity Effects 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- 230000035790 physiological processes and functions Effects 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 230000008092 positive effect Effects 0.000 description 1
- 238000010149 post-hoc-test Methods 0.000 description 1
- 230000001242 postsynaptic effect Effects 0.000 description 1
- 230000001124 posttranscriptional effect Effects 0.000 description 1
- 229940124606 potential therapeutic agent Drugs 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 230000002335 preservative effect Effects 0.000 description 1
- 230000001023 pro-angiogenic effect Effects 0.000 description 1
- 230000000861 pro-apoptotic effect Effects 0.000 description 1
- 239000000651 prodrug Substances 0.000 description 1
- 229940002612 prodrug Drugs 0.000 description 1
- 230000005522 programmed cell death Effects 0.000 description 1
- 206010036807 progressive multifocal leukoencephalopathy Diseases 0.000 description 1
- 230000000770 proinflammatory effect Effects 0.000 description 1
- 210000001176 projection neuron Anatomy 0.000 description 1
- 210000001236 prokaryotic cell Anatomy 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- AAEVYOVXGOFMJO-UHFFFAOYSA-N prometryn Chemical compound CSC1=NC(NC(C)C)=NC(NC(C)C)=N1 AAEVYOVXGOFMJO-UHFFFAOYSA-N 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- ULWHHBHJGPPBCO-UHFFFAOYSA-N propane-1,1-diol Chemical compound CCC(O)O ULWHHBHJGPPBCO-UHFFFAOYSA-N 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 108010087851 prorelaxin Proteins 0.000 description 1
- 150000003180 prostaglandins Chemical class 0.000 description 1
- 235000019833 protease Nutrition 0.000 description 1
- 238000010377 protein imaging Methods 0.000 description 1
- 108060006633 protein kinase Proteins 0.000 description 1
- 230000002685 pulmonary effect Effects 0.000 description 1
- 230000005855 radiation Effects 0.000 description 1
- 102000016914 ras Proteins Human genes 0.000 description 1
- 108010014186 ras Proteins Proteins 0.000 description 1
- 210000000664 rectum Anatomy 0.000 description 1
- 230000000306 recurrent effect Effects 0.000 description 1
- 108010054624 red fluorescent protein Proteins 0.000 description 1
- 230000003716 rejuvenation Effects 0.000 description 1
- 239000003488 releasing hormone Substances 0.000 description 1
- 230000008439 repair process Effects 0.000 description 1
- 230000010410 reperfusion Effects 0.000 description 1
- 230000011506 response to oxidative stress Effects 0.000 description 1
- 230000003938 response to stress Effects 0.000 description 1
- 210000001995 reticulocyte Anatomy 0.000 description 1
- CVHZOJJKTDOEJC-UHFFFAOYSA-N saccharin Chemical compound C1=CC=C2C(=O)NS(=O)(=O)C2=C1 CVHZOJJKTDOEJC-UHFFFAOYSA-N 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 230000037390 scarring Effects 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 238000012764 semi-quantitative analysis Methods 0.000 description 1
- 230000001953 sensory effect Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 239000012679 serum free medium Substances 0.000 description 1
- 231100000872 sexual dysfunction Toxicity 0.000 description 1
- 230000035939 shock Effects 0.000 description 1
- 230000019491 signal transduction Effects 0.000 description 1
- IZTQOLKUZKXIRV-YRVFCXMDSA-N sincalide Chemical compound C([C@@H](C(=O)N[C@@H](CCSC)C(=O)NCC(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(N)=O)NC(=O)[C@@H](N)CC(O)=O)C1=CC=C(OS(O)(=O)=O)C=C1 IZTQOLKUZKXIRV-YRVFCXMDSA-N 0.000 description 1
- 210000002027 skeletal muscle Anatomy 0.000 description 1
- 210000002363 skeletal muscle cell Anatomy 0.000 description 1
- 210000003491 skin Anatomy 0.000 description 1
- 201000000849 skin cancer Diseases 0.000 description 1
- 150000003384 small molecules Chemical class 0.000 description 1
- 229940074404 sodium succinate Drugs 0.000 description 1
- ZDQYSKICYIVCPN-UHFFFAOYSA-L sodium succinate (anhydrous) Chemical compound [Na+].[Na+].[O-]C(=O)CCC([O-])=O ZDQYSKICYIVCPN-UHFFFAOYSA-L 0.000 description 1
- 229960000553 somatostatin Drugs 0.000 description 1
- NHXLMOGPVYXJNR-ATOGVRKGSA-N somatostatin Chemical compound C([C@H]1C(=O)N[C@H](C(N[C@@H](CO)C(=O)N[C@@H](CSSC[C@@H](C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@@H](CC=2C3=CC=CC=C3NC=2)C(=O)N[C@@H](CCCCN)C(=O)N[C@H](C(=O)N1)[C@@H](C)O)NC(=O)CNC(=O)[C@H](C)N)C(O)=O)=O)[C@H](O)C)C1=CC=CC=C1 NHXLMOGPVYXJNR-ATOGVRKGSA-N 0.000 description 1
- 208000018198 spasticity Diseases 0.000 description 1
- 239000002732 sphingomyelin phosphodiesterase inhibitor Substances 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 230000003068 static effect Effects 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 231100000617 superantigen Toxicity 0.000 description 1
- 230000000153 supplemental effect Effects 0.000 description 1
- 230000004654 survival pathway Effects 0.000 description 1
- 238000013268 sustained release Methods 0.000 description 1
- 239000012730 sustained-release form Substances 0.000 description 1
- 230000000946 synaptic effect Effects 0.000 description 1
- 238000012385 systemic delivery Methods 0.000 description 1
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 1
- 150000003573 thiols Chemical class 0.000 description 1
- 210000001685 thyroid gland Anatomy 0.000 description 1
- 229940034208 thyroxine Drugs 0.000 description 1
- XUIIKFGFIJCVMT-UHFFFAOYSA-N thyroxine-binding globulin Natural products IC1=CC(CC([NH3+])C([O-])=O)=CC(I)=C1OC1=CC(I)=C(O)C(I)=C1 XUIIKFGFIJCVMT-UHFFFAOYSA-N 0.000 description 1
- 210000002303 tibia Anatomy 0.000 description 1
- 238000011200 topical administration Methods 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 238000012549 training Methods 0.000 description 1
- 239000012096 transfection reagent Substances 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 208000009174 transverse myelitis Diseases 0.000 description 1
- 230000008736 traumatic injury Effects 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- 210000004881 tumor cell Anatomy 0.000 description 1
- 231100000397 ulcer Toxicity 0.000 description 1
- 238000000108 ultra-filtration Methods 0.000 description 1
- 238000005199 ultracentrifugation Methods 0.000 description 1
- 238000002604 ultrasonography Methods 0.000 description 1
- 238000002211 ultraviolet spectrum Methods 0.000 description 1
- 210000003954 umbilical cord Anatomy 0.000 description 1
- 210000000689 upper leg Anatomy 0.000 description 1
- 230000002485 urinary effect Effects 0.000 description 1
- 210000002700 urine Anatomy 0.000 description 1
- VBEQCZHXXJYVRD-GACYYNSASA-N uroanthelone Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CS)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)C(C)C)[C@@H](C)O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CCSC)NC(=O)[C@H](CS)NC(=O)[C@@H](NC(=O)CNC(=O)CNC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CS)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CS)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O)C(C)C)[C@@H](C)CC)C1=CC=C(O)C=C1 VBEQCZHXXJYVRD-GACYYNSASA-N 0.000 description 1
- 210000001215 vagina Anatomy 0.000 description 1
- 229960003726 vasopressin Drugs 0.000 description 1
- 239000013598 vector Substances 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 108700026220 vif Genes Proteins 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 238000001429 visible spectrum Methods 0.000 description 1
- 208000029257 vision disease Diseases 0.000 description 1
- 230000004393 visual impairment Effects 0.000 description 1
- 238000012800 visualization Methods 0.000 description 1
- 229940088594 vitamin Drugs 0.000 description 1
- 235000013343 vitamin Nutrition 0.000 description 1
- 239000011782 vitamin Substances 0.000 description 1
- 229930003231 vitamin Natural products 0.000 description 1
- 208000002670 vitamin B12 deficiency Diseases 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 230000029663 wound healing Effects 0.000 description 1
- 210000005253 yeast cell Anatomy 0.000 description 1
- 108091005957 yellow fluorescent proteins Proteins 0.000 description 1
- WHNFPRLDDSXQCL-UAZQEYIDSA-N α-msh Chemical compound C([C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C(C)C)C(N)=O)NC(=O)[C@H](CO)NC(C)=O)C1=CC=C(O)C=C1 WHNFPRLDDSXQCL-UAZQEYIDSA-N 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/14—Blood; Artificial blood
- A61K35/15—Cells of the myeloid line, e.g. granulocytes, basophils, eosinophils, neutrophils, leucocytes, monocytes, macrophages or mast cells; Myeloid precursor cells; Antigen-presenting cells, e.g. dendritic cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/30—Nerves; Brain; Eyes; Corneal cells; Cerebrospinal fluid; Neuronal stem cells; Neuronal precursor cells; Glial cells; Oligodendrocytes; Schwann cells; Astroglia; Astrocytes; Choroid plexus; Spinal cord tissue
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/35—Fat tissue; Adipocytes; Stromal cells; Connective tissues
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/5005—Wall or coating material
- A61K9/5063—Compounds of unknown constitution, e.g. material from plants or animals
- A61K9/5068—Cell membranes or bacterial membranes enclosing drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/02—Drugs for disorders of the nervous system for peripheral neuropathies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/06—Antimigraine agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/08—Antiepileptics; Anticonvulsants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/111—General methods applicable to biologically active non-coding nucleic acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/87—Introduction of foreign genetic material using processes not otherwise provided for, e.g. co-transformation
- C12N15/88—Introduction of foreign genetic material using processes not otherwise provided for, e.g. co-transformation using microencapsulation, e.g. using amphiphile liposome vesicle
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0618—Cells of the nervous system
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/14—Type of nucleic acid interfering N.A.
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/14—Type of nucleic acid interfering N.A.
- C12N2310/141—MicroRNAs, miRNAs
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2320/00—Applications; Uses
- C12N2320/30—Special therapeutic applications
- C12N2320/31—Combination therapy
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2320/00—Applications; Uses
- C12N2320/30—Special therapeutic applications
- C12N2320/32—Special delivery means, e.g. tissue-specific
Abstract
Description
本出願は、2012年8月15日に提出された米国仮特許出願第61/683,596号に対する優先権の恩典を主張するものであり、参照によりその全体として本明細書によって組み入れられる。
本発明は、国立神経疾患・脳卒中研究所(National Institutes of Neurological Disorders and Stroke)によって授与された契約第NS-19108号、国立衛生研究所の国立小児保健発達研究所(National Institute of Child Health and Human Development)によって授与された第HD-09402号、および国立先進トランスレーショナル科学センター(National Center for Advancing Translational Sciences)によって授与された第1UH2TR000918号の下で政府支援によりなされた。政府は、本発明においてある程度の権利を有する。
本発明は、概して、医学および神経学の分野に関する。特に、態様は、多発性硬化症(MS)および脱髄に関連した他の神経学的疾患などの脱髄性疾患の治療に向けられている。
MSは、世界中で100万人を超える人々に影響を及ぼしている一般的な神経学的疾病である。その有病率は人種間および地理的緯度間で変動し、北および中央ヨーロッパにおける100,000人あたり100人超から南ヨーロッパにおける100,000人あたり50人に及ぶ。MSは、若年および中年成人における神経学的障害の最も一般的な原因である。疾病発症は、患者の約50%で30歳より前、患者の25%で30〜40歳の間、および患者の残り25%で40〜50歳の間である。女性 対 男性の比率は2:1である。
I.序論
いくつかの局面において、本発明は、概して、インビトロで再構成された小胞などの脂質ナノ小胞、または酸化ストレスを受けるように誘導されているもしくは酸化ストレスによって刺激されている細胞から得られたエキソソームを伴う方法および組成物に関する。該方法および組成物は、神経学的疾患、特に脱髄疾患のリスクがあるまたは脱髄疾患を有する対象を治療するのに適している。本発明は、酸化ストレスを受けるように誘導されているまたは酸化ストレスによって刺激されている細胞に由来するエキソソームなど、ある特定のエキソソームが髄鞘形成能を増強させ得るという発見に部分的に基づく。
「エキソソーム」とは、多様な異なる細胞から放出されるナノ小胞である。これらの小さな小胞は、大きな多小胞エンドソームに由来し、細胞外環境に分泌され得る。エキソソーム放出/放散(shedding)の正確なメカニズムは、依然として不明のままである。それらは、後期エンドソームの境界膜からの陥入および出芽によって形成されるように見え、サイトゾルを含有する小胞、およびそれらの表面上に膜結合型細胞タンパク質の細胞外ドメインを曝露する小胞をもたらす。電子顕微鏡法を用いると、調査は、内部小胞の細胞外環境への分泌につながる、多小胞エンドソームと原形質膜との融合プロファイルを示した。
本発明のある特定の局面において、脳の健康または他の関連疾病の改善のための新規な治療様態として、エキソソームを調製しかつ使用してよい。
本発明のある特定の態様において、マイクロRNA(miRNAと略記される)を含む単離エキソソームまたは脂質ナノ小胞を、脱髄性疾患のリスクがあるまたは脱髄性疾患を有する患者を治療するための方法および組成物に用いてよい。特定の態様において、miRNAには、miR-7a、miR-9、miR-9*、miR-17、miR-18a、miR-19a、miR-19b、miR-20a、miR-92a-1、miR-23a、miR-23a*、miR-23b、miR-32、miR-128、miR-138、miR-138*、miR-184、miR-199a-5p、miR-214、miR-219、miR-338、miR-338*、miR-27a、miR-27b、miR-106a、miR-124、miR-141、miR-144、miR-145、miR-146a、miR-181a、miR-200a、miR-451、miR-532-5p、およびmiR-665のうちの1種、2種、またはすべてが含まれてよい。特定の態様において、miRNAには、miR-219、miR-138、miR-338、およびmiR-199a-5pのうちの1種、2種、またはすべてが含まれてよい。例えば、miRNAはmiR-219およびmiR-138であってよく;miRNAはmiR-219およびmiR-338であってよく;miRNAはmiR-219およびmiR-199a-5pであってよい。
予防される、治療される、または診断される対象となる疾病は、本明細書において記載される組成物または方法の投与による療法または予防に適しているであろう対象に影響を及ぼす任意の疾病であり得る。例えば、疾病は、酸化ストレスに対する抵抗性を増加させる核酸または他の治療用作用物質を含有するエキソソームまたは脂質ナノ小胞を投与するための療法に適している疾病であってよい。特定の例において、脱髄性疾患を治療するための、酸化ストレスを受けるように誘導されているまたは酸化ストレスによって刺激されている細胞に由来する単離エキソソームを含む組成物を投与する工程を伴う方法および組成物が提供され得る。
いくつかの態様において、治療用作用物質または診断用作用物質を、エレクトロポレーションまたは当技術分野において公知の他の方法などによって、対象への送達のためのエキソソームに負荷してよい。治療用作用物質は、治療用核酸、タンパク質もしくは抗体フラグメント、または小分子であってよい。
本明細書において記述される薬学的組成物のいくつかの態様において、核酸はサイトカインをコードする。「サイトカイン」という用語は、もう一方の細胞に対して細胞間調節因子として作用する、一方の細胞集団によって放出されるタンパク質に対する総称である。核酸配列は、サイトカインの全長核酸配列、ならびに全長配列に由来する任意の長さの非全長配列をコードし得る。上述のように、配列は、特異的宿主細胞においてコドン選好性を提供するために導入され得る、天然の1つまたは複数の配列の縮重コドンを含むことがさらに理解される。
治療用核酸の他の例には、酵素をコードする核酸が含まれる。例には、ACPデサチュラーゼ、ACPヒドロキシラーゼ、ADP-グルコースピロホリラーゼ(pyrophorylase)、ATPアーゼ、アルコールデヒドロゲナーゼ、アミラーゼ、アミログルコシダーゼ、カタラーゼ、セルラーゼ、シクロオキシゲナーゼ、デカルボキシラーゼ、デキストリナーゼ、エステラーゼ、DNAポリメラーゼ、RNAポリメラーゼ、ヒアルロン(hyaluron)シンターゼ、ガラクトシダーゼ、グルカナーゼ、グルコースオキシダーゼ、GTPアーゼ、ヘリカーゼ、ヘミセルラーゼ、ヒアルロニダーゼ、インテグラーゼ、インベルターゼ、イソメラーゼ、キナーゼ、ラクターゼ、リパーゼ、リポキシゲナーゼ、リアーゼ、リゾチーム、ペクチンエステラーゼ、ペルオキシダーゼ、ホスファターゼ、ホスホリパーゼ、ホスホリラーゼ、ポリガラクツロナーゼ、プロテイナーゼ、ペプチダーゼ(peptidease)、プラナーゼ(pullanase)、リコンビナーゼ、逆転写酵素、トポイソメラーゼ、キシラナーゼ、またはレポーター遺伝子が含まれるが、それらに限定されるわけではない。
治療用核酸には、ホルモンをコードする核酸も含まれる。例には、成長ホルモン、プロラクチン、胎盤性ラクトゲン、黄体形成ホルモン、卵胞刺激ホルモン、絨毛性ゴナドトロピン、甲状腺刺激ホルモン、レプチン、副腎皮質刺激ホルモン、アンジオテンシンI、アンジオテンシンII、β-エンドルフィン、β-メラニン細胞刺激ホルモン、コレシストキニン、エンドセリンI、ガラニン、胃抑制ペプチド、グルカゴン、インスリン、リポトロピン、ニューロフィジン、ソマトスタチン、カルシトニン、カルシトニン遺伝子関連ペプチド、β-カルシトニン遺伝子関連ペプチド、悪性腫瘍因子の高カルシウム血症、副甲状腺ホルモン関連タンパク質、副甲状腺ホルモン関連タンパク質、グルカゴン様ペプチド、パンクレアスタチン、膵臓ペプチド、ペプチドYY、PHM、セレクチン、血管作動性腸管ペプチド、オキシトシン、バソプレッシン、バソトシン、エンケファリンアミド、メトルフィンアミド(metorphinamide)、αメラニン細胞刺激ホルモン、心房性ナトリウム利尿因子、アミリン、アミロイドP構成成分、副腎皮質刺激ホルモン放出ホルモン、成長ホルモン放出因子、黄体形成ホルモン放出ホルモン、ニューロペプチドY、サブスタンスK、サブスタンスP、および甲状腺刺激ホルモン放出ホルモンが含まれるが、それらに限定されるわけではない。
本明細書において記述される核酸は、抗体またはそのフラグメントをコードしてよい。「抗体」という用語は、抗原結合領域を有する任意の抗体様分子を指すために用いられ、Fab'、Fab、F(ab')2、単一ドメイン抗体(DAB)、Fv、scFv(一本鎖Fv)などの抗体フラグメントを含む。様々な抗体ベースの構築物およびフラグメントを調製するおよび使用するための技術は、当技術分野において周知である。抗体を調製するおよび特徴付けするための手段も、当技術分野において周知である。本明細書において使用するとき、「抗体」という用語は、IgG、IgM、IgA、IgD、およびIgEなどの任意の免疫学的結合物質を広く指すことを意図する。一般的に、IgGおよび/またはIgMが好ましく、なぜならそれらは生理学的状況で最もよく見られる抗体であり、かつなぜならそれらは実験室環境で最も容易に作製されるからである。
いくつかの局面におけるエキソソームまたは小胞は、診断用核酸である核酸を含んでよい。「診断用核酸」とは、疾病または健康関連状態の診断に適用され得る核酸である。「診断用核酸」の定義には、1種または複数種のレポータータンパク質をコードする核酸配列も含まれる。「レポータータンパク質」とは、細胞または組織内に存在する場合に、検出可能であり、かつ細胞内に存在している他の遺伝子配列またはコードされたポリペプチドと区別可能であるアミノ酸配列を指す。いくつかの態様において、治療用遺伝子をレポーターに融合させてよく、または別個のタンパク質として産生してよい。例えば、関心対象の遺伝子およびレポーターを、共トランスフェクション(共感染)により別個の送達ビヒクル中の別個のプロモーターによって、または同じ送達ビヒクル中の別個のプロモーターによって誘導してよい。加えて、2種の遺伝子を、例えば内部リボソーム進入部位によって同じプロモーターに、または二方向性プロモーターに連結させてよい。そのような技術を用いると、関心対象の遺伝子およびレポーターの発現が相関する。ゆえに、関心対象の遺伝子の発現の位置、量、および持続期間を計測し得る。関心対象の遺伝子は、例えば腫瘍抑制遺伝子またはアポトーシス促進遺伝子などの抗癌遺伝子であってよい。
ある特定の局面において、前記方法における使用のための組成物または作用物質は、薬学的に許容される担体に適切に含有されている。担体は非毒性の生体適合性であり、かつ作用物質の生物学的活性に有害な影響を及ぼさないように選択される。本発明のいくつかの局面における作用物質は、錠剤、カプセル剤、粉末、顆粒、軟膏、溶液、デポジトリー(depositories)、吸入剤、および経口的、非経口的、または外科的な投与を可能にする注射液など、固体、半固体、ゲル、液体、または気体の形態で、局部的送達(すなわち、骨格筋または他の組織など、身体の特異的位置への)または全身的送達のための調製物中に製剤化されてよい。本発明のある特定の局面は、医療デバイス等を被覆することによる、組成物の局部的投与も企図する。
いくつかの態様は、診断用および治療用のキットなどのキット、ならびにエキソソームを調製するおよび/または送達するためのキットに関係する。例えば、キットは、本明細書において記載される1種または複数種の薬学的組成物、および任意でそれらの使用のための取扱説明書を含んでよい。キットは、そのような組成物の投与を達成するための1種または複数種のデバイスも含んでよい。例えば、対象キットは、薬学的組成物、および脱髄疾患を有するまたは脱髄疾患のリスクがある患者への該組成物の直接投与を達成するためのカテーテルを含んでよい。他の態様において、対象キットは、送達デバイスとともに使用するための、調合薬として任意で製剤化されたまたは凍結乾燥された、単離エキソソームのプレフィルドアンプルを含んでよい。
以下の実施例は、本発明の好ましい態様を実証するために含まれる。次に続く実施例に開示される技術は、本発明の実践において上手く機能することが本発明者によって発見された技術を表し、ゆえにその実践のための好ましい様式を構成すると見なされ得ることが、当業者によって解されるべきである。しかしながら、当業者であれば、本開示に照らして、多くの変化が、開示される具体的態様においてなされ得、かつ本発明の精神および範囲から逸脱することなく、類似のまたは同様の結果をなおも獲得し得ることを解するべきである。
本発明者らは、ラット用のMarlau式EEケージを確立して、EE曝露された(図7A〜7F)ラットの末梢血(図2A〜2C)由来のエキソソーム(図1)が、富化されていない(NE)対応物と比較して、OSを低下させ得るかどうかおよび髄鞘形成を促進し得るかどうかを試験した。
老化による認知低下はOSの増加とともに生じ(Sohal & Weindruch, 1996)、若齢動物の全身環境は、老化したCNSの局面を若返らせ得る(Ruckh, et al., 2012)。したがって、著者らは、若齢動物由来のエキソソームが、細胞老化の重大な局面であるOSを緩和し得る(図3A〜3C)という仮説を立てた。実際に、著者らは、老化ラットではなく若齢ラットの血液由来のエキソソームが、海馬薄片培養物におけるOSを有意に(p≦0.001)減少させることを見出した。さらに、若齢エキソソームのこの栄養的効果は、エキソソームをUV光に曝露することによって無効になり得、若齢エキソソーム内のRNA種が関与していることを示唆した。具体的な値は、対照:1.00±0.1;若齢:0.59±0.04(p≦0.001);老化:0.90±0.09;若齢+UV:0.95±0.05;(n=9/群)であった。
本発明者らは、次に、健常な組織におけるベースラインのミエリン含量を改善し得る若齢エキソソームが、脱髄の実験モデルの後の髄鞘再生も改善し得るという仮説を立てた。実際に、本発明者らは、若齢エキソソーム、若齢-EEエキソソーム、および老化-EEエキソソームが、リゾレシチンへの一時的曝露によって誘導された急性脱髄の後の回復を有意に(p≦0.001)改善させることを実証した(図9A〜9B)。リゾレシチンへの曝露の直後に、培養物を、若齢動物、若齢-EE動物、または老化-EE動物に由来するエキソソームで処理した。5日後、髄鞘再生の開始時に、培養物を収集し、MBP含量をウェスタンブロットにより解析した(図9B)。リゾレシチン(Lyso)曝露は、対照と比較して、すべての群においてMBPの有意な(*p<0.001;n=6〜16)低下を誘発したが、一方でエキソソーム曝露は、リゾレシチン単独に関して見られるものと比較して、髄鞘再生の有意な(#p<0.001)増加を促進した。同様に、リゾレシチン処理の5日後に収集された薄片培養物も、O4陽性細胞の存在の有意な(*p<0.001;n=4〜8/群)増加を明らかにした。すべてのエキソソーム処理は、リゾレシチン処理単独に関して見られるものを上回って、O4染色を有意に増強させた(#p<0.001)。O1染色も、リゾレシチン処理の5日後に有意に増加した(*p<0.001;n=3〜4/群)が、一方でエキソソーム処理に関してさらなる増加は見られず、エキソソームは、成熟オリゴデンドロサイトを存続させることによって髄鞘再生を直接増加させ得ることを示唆した。有意性は、ANOVA+事後Holm-Sidak検定によって判定された。
本発明者らは、樹状細胞由来のエキソソームを調査した。エキソソームは、それらの親細胞の細胞質の無作為抽出サンプルを含有しないが、特異的なmRNA、miRNA、およびタンパク質に富んでいる(Bobrie, et al., 2011)。このカーゴはプロテアーゼおよびRNアーゼによる分解から保護され、一方で小胞は間質空間内にあり、レシピエント細胞によっていったん取り込まれると生物活性を保持する。ゆえに、それらは、そうでなければ遺伝子発現に基づき個々の細胞に限定されるであろう、シグナル伝達および酵素活性の移行を容易にする(Lee, et al., 2011)。最近の研究によれば、OSに曝露された免疫細胞は、OSに対する抵抗性の増加を近隣細胞に伝えるエキソソームを放出することが示されている(Eldh, et al., 2010)。重要なことには、この効果は曝露の2時間後に見られ、最も可能性が高い抗オキシダントである防御タンパク質へのエキソソームmRNAの急速な翻訳(Eldh, et al., 2010)、またはオキシダント/抗オキシダント系関連miRNAの産生を暗示する。
OSの緩和および髄鞘形成/髄鞘再生の増加のためのエキソソームの供給源として、樹状細胞を用いることができる。エキソソームを用いて、外傷性脳損傷および新生児脳損傷も治療し得る。
IFNγは、生理的な条件性ホルメシス(Kraig, et al., 2010)と一致した、有害および有益な脳効果を有する。IFNγは、多発性硬化症のモデルであるEAEによる脱髄を悪化させる。それにもかかわらず、疾病の発症前の低レベルのIFNγは脱髄を防御し、効果は、オリゴデンドロサイトの酸化ストレス応答を伴う(OSR;Lin, et al., 2008)。また、拡延性抑制(SD)は、ラット海馬薄片培養物におけるMBPの一時的な(7日間ではなく、1および3日間の)下降を誘発し(Kunkler, et al., 2006)、かつ脱髄は、インビボでのSD感受性を増加させる(Merkler, et al., 2009)。
T細胞により分泌されるインターフェロンガンマ(IFN-γ)の、酸化ストレス(OS)および多発性硬化症における脱髄に対する有害な影響は十分に認識されている。しかしながら、疾病発症前の低レベルのIFN-γは、EEによってもたらされるもののように、脱髄を防御しかつOSを低下させることも知られている。SDはIFN-γを上昇させ、かつSD閾値(SDT)は脱髄の実験モデルにおいて減少しており、SDにおけるT細胞の関与を示唆している。本発明者らは、ラット海馬薄片培養物内にT細胞を見出したため、本発明者らは、この調製物を利用して、拡延性抑制閾値、OS、およびMBPレベルに対するIFN-γのT細胞介在性効果を探索した。SDは、7日間で徐々に回復するMBPの有意な喪失、SDTの有意な初期減少、およびOSの有意な増加を誘発した。MBP喪失は、T細胞枯渇、IFN-γの中和、および中性スフィンゴミエリナーゼ-2の遮断によって無効になった。重要なことには、IFN-γを薄片上にパルスして、EEの段階的変化(例えば、活動−休止)を模擬した場合、有意であるが逆の効果が見られ、対照を上回ってSDTは増加し、OSは低下し、かつMBPは上昇した。ストレスを受けた免疫細胞によって分泌されるエキソソームはOSに対する防御を与え得るように、本発明者らは、次に、これらの栄養的効果におけるエキソソームの関与を調べた。結果は、IFN-γで刺激された薄片培養物に由来するエキソソームが、段階的な低レベルのIFN-γでの処理の効果を模擬することを裏付けた。最後に、内因性スフィンゴミエリナーゼ阻害剤であるグルタチオンは、ミクログリアにおいて有意に増加しており、ミエリンを増加させることにおけるそれらの関与を示唆した。これらの結果は、SDの予防のための、および延長として片頭痛の予防ための、新規な治療標的としてのIFN-γのパルス適用を支持する。
脳への外傷性損傷は、脳のミエリン産生細胞であるオリゴデンドロサイトの喪失、脱髄、および損傷した脳エリアが適切に髄鞘再生し得ないという不全に関連している(Flygt, et al., 2013)。しかしながら、新たな証拠によれば、損傷した脳は、適切に刺激された場合に髄鞘再生し得ることが表されている(Powers, et al., 2013)。
新生児脳損傷は、低髄鞘形成に関連した、オリゴデンドロサイトへの損傷を一般的にもたらす(Kauer & Ling EA, 2009)。環境富化された動物の血清に由来するエキソソーム、ならびにインビトロでIFNγ刺激樹状細胞に由来するエキソソームは、オリゴデンドロサイト分化および関連したミエリン産生を促進するため、本発明者らは、新生児虚血性脳損傷に対するこれらの潜在的な治療用作用物質の影響を判定した。
Claims (37)
- 酸化ストレスを受けるように誘導されている細胞から得られた単離エキソソームを含む薬学的組成物の有効量を患者に投与する工程を含む、脱髄性疾患のリスクがあるまたは脱髄性疾患を有する患者を治療するための方法。
- 脱髄性疾患が、認知低下、アルツハイマー病、パーキンソン病、脳卒中、てんかん、片頭痛、多発性硬化症、またはニューロパチーである、請求項1に記載の方法。
- 脱髄性疾患が、多発性硬化症またはニューロパチーである、請求項2に記載の方法。
- 患者が、吸入により経鼻的に、または静脈内に組成物を投与される、請求項1に記載の方法。
- 単離エキソソームが、少なくとも2種の異なるタイプのエキソソームを有する、請求項1に記載の方法。
- 細胞が、免疫細胞、神経細胞、または脂肪細胞である、請求項1に記載の方法。
- 細胞が免疫細胞である、請求項6に記載の方法。
- 細胞が神経細胞である、請求項6に記載の方法。
- 細胞が、サイトカインまたはオキシダントによって誘導されている、請求項1に記載の方法。
- サイトカインがIFN-γである、請求項9に記載の方法。
- 細胞が、前記患者から得られた細胞である、請求項1に記載の方法。
- 細胞が、前記患者が18歳未満であるときに前記患者から得られた細胞である、請求項11に記載の方法。
- 細胞が、前記患者が1歳未満であるときに前記患者から得られた細胞である、請求項12に記載の方法。
- 単離エキソソームが、少なくとも、外部から添加された治療用作用物質を含む、請求項1に記載の方法。
- 外部から添加された治療用作用物質がsiRNAである、請求項14に記載の方法。
- 単離エキソソームが、miR-219、miR-138、またはmiR-199aを含む、請求項1に記載の方法。
- 単離エキソソームが、抗オキシダント系タンパク質をコードするmRNAを含む、請求項1に記載の方法。
- a)外部からの酸化ストレスを受けるように誘導されている神経細胞を得る工程であって、該神経細胞がエキソソームを産生する、工程;および
b)産生されたエキソソームを単離する工程
を含む、酸化ストレスを受けるように誘導されている神経細胞から単離エキソソームを得る方法。 - 単離エキソソームを含む薬学的組成物の有効量を、脱髄性疾患のリスクがあるまたは脱髄性疾患を有する患者に投与する工程をさらに含む、請求項18に記載の方法。
- 脱髄性疾患が、認知低下、アルツハイマー病、パーキンソン病、脳卒中、てんかん、片頭痛、多発性硬化症、またはニューロパチーである、請求項19に記載の方法。
- 脱髄性疾患が、多発性硬化症またはニューロパチーである、請求項20に記載の方法。
- 酸化ストレスを誘導する条件下で細胞を培養する工程をさらに含む、請求項18に記載の方法。
- 細胞が、サイトカインによって誘導されている、請求項18に記載の方法。
- サイトカインがIFN-γである、請求項23に記載の方法。
- 細胞が、患者から得られた細胞である、請求項18に記載の方法。
- 細胞が、前記患者が18歳未満であるときに前記患者から得られる、請求項25に記載の方法。
- 細胞が、前記患者が1歳未満であるときに前記患者から得られる、請求項26に記載の方法。
- 請求項18〜27のいずれか一項に記載の方法に従って得られた、単離エキソソーム。
- 請求項28に記載の単離エキソソームと、薬学的に許容される担体とを含む、薬学的組成物。
- 請求項29に記載の薬学的組成物の有効量を患者に投与する工程を含む、脱髄性疾患のリスクがあるまたは脱髄性疾患を有する患者を治療するための方法。
- miR-219、miR-138、およびmiR-199aのうちの少なくとも2種を含む、単離脂質ナノ小胞。
- miR-219およびmiR-138を含む、請求項31に記載の単離脂質ナノ小胞。
- ヒト細胞から得られた、請求項31に記載の単離脂質ナノ小胞。
- 脱髄性疾患のリスクがあるまたは脱髄性疾患を有する患者から得られた、請求項33に記載の単離脂質ナノ小胞。
- インビトロで再構成された、請求項31に記載の単離脂質ナノ小胞。
- 請求項31〜35のいずれか一項に記載の単離脂質ナノ小胞と、薬学的に許容される担体とを含む、薬学的組成物。
- 請求項36に記載の薬学的組成物の有効量を患者に投与する工程を含む、脱髄性疾患のリスクがあるまたは脱髄性疾患を有する患者を治療するための方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261683596P | 2012-08-15 | 2012-08-15 | |
| US61/683,596 | 2012-08-15 | ||
| PCT/US2013/055187 WO2014028763A1 (en) | 2012-08-15 | 2013-08-15 | Exosome-based therapeutics against neurodegenerative disorders |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2015524849A true JP2015524849A (ja) | 2015-08-27 |
| JP2015524849A5 JP2015524849A5 (ja) | 2016-09-29 |
Family
ID=50101510
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015527641A Pending JP2015524849A (ja) | 2012-08-15 | 2013-08-15 | 神経変性疾患に対するエキソソームに基づく治療法 |
Country Status (6)
| Country | Link |
|---|---|
| US (2) | US10231997B2 (ja) |
| EP (1) | EP2885414B1 (ja) |
| JP (1) | JP2015524849A (ja) |
| AU (1) | AU2013302526B2 (ja) |
| CA (1) | CA2882248A1 (ja) |
| WO (1) | WO2014028763A1 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2018534370A (ja) * | 2015-11-18 | 2018-11-22 | ユニバーシティ オブ ジョージア リサーチ ファウンデーション, インコーポレーテッド | 神経細胞の細胞外小胞 |
Families Citing this family (56)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2012019168A2 (en) | 2010-08-06 | 2012-02-09 | Moderna Therapeutics, Inc. | Engineered nucleic acids and methods of use thereof |
| US20120237975A1 (en) | 2010-10-01 | 2012-09-20 | Jason Schrum | Engineered nucleic acids and methods of use thereof |
| AU2012236099A1 (en) | 2011-03-31 | 2013-10-03 | Moderna Therapeutics, Inc. | Delivery and formulation of engineered nucleic acids |
| US9464124B2 (en) | 2011-09-12 | 2016-10-11 | Moderna Therapeutics, Inc. | Engineered nucleic acids and methods of use thereof |
| EP3682905B1 (en) | 2011-10-03 | 2021-12-01 | ModernaTX, Inc. | Modified nucleosides, nucleotides, and nucleic acids, and uses thereof |
| RS63244B1 (sr) | 2011-12-16 | 2022-06-30 | Modernatx Inc | Kompozicije modifikovane mrna |
| EP2833892A4 (en) | 2012-04-02 | 2016-07-20 | Moderna Therapeutics Inc | MODIFIED POLYNUCLEOTIDES FOR THE PRODUCTION OF PROTEINS AND PEPTIDES ASSOCIATED WITH ONCOLOGY |
| US9572897B2 (en) | 2012-04-02 | 2017-02-21 | Modernatx, Inc. | Modified polynucleotides for the production of cytoplasmic and cytoskeletal proteins |
| US9283287B2 (en) | 2012-04-02 | 2016-03-15 | Moderna Therapeutics, Inc. | Modified polynucleotides for the production of nuclear proteins |
| US10501512B2 (en) | 2012-04-02 | 2019-12-10 | Modernatx, Inc. | Modified polynucleotides |
| JP2015524849A (ja) * | 2012-08-15 | 2015-08-27 | ザ・ユニバーシティ・オブ・シカゴThe University Of Chicago | 神経変性疾患に対するエキソソームに基づく治療法 |
| ES2921623T3 (es) | 2012-11-26 | 2022-08-30 | Modernatx Inc | ARN modificado terminalmente |
| US10258698B2 (en) | 2013-03-14 | 2019-04-16 | Modernatx, Inc. | Formulation and delivery of modified nucleoside, nucleotide, and nucleic acid compositions |
| US8980864B2 (en) | 2013-03-15 | 2015-03-17 | Moderna Therapeutics, Inc. | Compositions and methods of altering cholesterol levels |
| WO2015048744A2 (en) | 2013-09-30 | 2015-04-02 | Moderna Therapeutics, Inc. | Polynucleotides encoding immune modulating polypeptides |
| AU2014329452B2 (en) | 2013-10-03 | 2019-06-20 | Moderna Therapeutics, Inc. | Polynucleotides encoding low density lipoprotein receptor |
| TWI788704B (zh) * | 2013-10-24 | 2023-01-01 | 美商納諾索米克斯公司 | 分析個體樣品之方法 |
| SG11201608798YA (en) | 2014-04-23 | 2016-11-29 | Modernatx Inc | Nucleic acid vaccines |
| JP6773563B2 (ja) * | 2014-05-18 | 2020-10-21 | ザ チルドレンズ メディカル センター コーポレーション | エキソソームに関連する方法および組成物 |
| US20170184613A1 (en) * | 2014-05-23 | 2017-06-29 | Georgetown University | Exosome and lipid biomarkers for memory loss |
| CN113633669A (zh) * | 2015-01-05 | 2021-11-12 | 株式会社露太利温 | 使用luterion抑制癌细胞中端粒酶的方法 |
| AU2016324310B2 (en) | 2015-09-17 | 2021-04-08 | Modernatx, Inc. | Compounds and compositions for intracellular delivery of therapeutic agents |
| JP7114465B2 (ja) | 2015-12-22 | 2022-08-08 | モデルナティエックス インコーポレイテッド | 薬剤の細胞内送達のための化合物および組成物 |
| US11243215B2 (en) | 2016-01-14 | 2022-02-08 | The Regents Of The University Of California | 3D-exoquant method for the analysis of surface molecules and quantification of tissue-specific exosomes in biological fluids |
| WO2017151862A1 (en) | 2016-03-02 | 2017-09-08 | University Of Pittsburgh - Of The Commonwealth System Of Higher Education | Matrix bound nanovesicles and their use |
| US20190060367A1 (en) * | 2016-03-03 | 2019-02-28 | Henry Ford Health System | 3-d collagen scaffold-generated exosomes and uses thereof |
| US11357800B2 (en) | 2016-08-16 | 2022-06-14 | Henry Ford Health System | Compositions for the treatment of neuropathic pain and sensitization of tumors to chemotherapies |
| US20210290556A1 (en) * | 2016-08-22 | 2021-09-23 | Codiak Biosciences, Inc. | Methods of suppressing delivery of exosomes to liver and spleen |
| CN110049771A (zh) | 2016-10-13 | 2019-07-23 | Vbc控股有限责任公司 | 癌症干细胞的外泌体 |
| US11583504B2 (en) | 2016-11-08 | 2023-02-21 | Modernatx, Inc. | Stabilized formulations of lipid nanoparticles |
| EP3568020A4 (en) * | 2017-01-12 | 2020-11-11 | Duke University | COMPOSITIONS AND METHODS FOR THE TREATMENT OF DEMYELINIZING CONDITIONS |
| DK3596042T3 (da) | 2017-03-15 | 2022-04-11 | Modernatx Inc | Krystalformer af aminolipider |
| AU2018234692B2 (en) | 2017-03-15 | 2022-06-02 | Modernatx, Inc. | Compounds and compositions for intracellular delivery of therapeutic agents |
| WO2018208971A1 (en) * | 2017-05-10 | 2018-11-15 | University Of Louisville Research Foundation, Inc. | Compositions comprising engineered embryonic stem cell-derived exosomes and method of use therefor |
| EP3638215A4 (en) | 2017-06-15 | 2021-03-24 | Modernatx, Inc. | RNA FORMULATIONS |
| MX2020002348A (es) | 2017-08-31 | 2020-10-08 | Modernatx Inc | Métodos de elaboración de nanopartículas lipídicas. |
| CN108103026B (zh) * | 2017-12-05 | 2020-12-22 | 四川省肿瘤医院 | 用于肿瘤免疫治疗的γδ-T细胞外泌体及其制备方法 |
| CN107988153B (zh) * | 2017-12-15 | 2021-05-18 | 英科博雅生命科技有限公司 | 人脐带血间充质干细胞源分离外泌体的方法和使用的试剂 |
| WO2019136268A1 (en) * | 2018-01-05 | 2019-07-11 | Mayo Foundation For Medical Education And Research | Modulation of extracellular vesicles with electrical stimulation |
| US11278575B2 (en) | 2018-07-12 | 2022-03-22 | Duke University | Compositions and methods for the treatment of demyelinating conditions |
| CA3114901C (en) * | 2018-10-04 | 2023-12-19 | Synaptec Network, Inc. | Systems and methods for delivering exosomes through the blood-brain barrier |
| CA3125511A1 (en) | 2019-02-08 | 2020-08-13 | Curevac Ag | Coding rna administered into the suprachoroidal space in the treatment of ophthalmic diseases |
| JP7372518B2 (ja) * | 2019-06-27 | 2023-11-01 | 国立大学法人山口大学 | 骨髄由来間葉系幹細胞の培養方法 |
| BR112022001338A2 (pt) * | 2019-07-26 | 2022-06-07 | Mayo Found Medical Education & Res | Composições e métodos antioxidantes e antivirais |
| CN111117964B (zh) * | 2019-07-30 | 2020-12-01 | 段海峰 | 一种肿瘤来源外泌体及其制备方法和用途 |
| TR201911667A2 (tr) * | 2019-08-01 | 2021-02-22 | Univ Yeditepe | Hücrelerde oluşan protein birikintilerinden kaynaklanan hastalıkların tedavisi için kullanılan bitki eksozomları. |
| MX2022003269A (es) | 2019-09-19 | 2022-07-04 | Modernatx Inc | Compuestos lipidicos de cola ramificada y composiciones para la administracion intracelular de agentes terapeuticos. |
| JP2022552408A (ja) * | 2019-10-16 | 2022-12-15 | ザ ジョンズ ホプキンス ユニバーシティ | 神経障害の治療のための細胞外小胞系薬剤及び方法 |
| CN112972702A (zh) * | 2019-12-17 | 2021-06-18 | 南京大学 | 用于治疗耐药菌感染的外泌体制剂 |
| CA3163308A1 (en) * | 2019-12-31 | 2021-07-08 | Thomas N. Chase | Kinases as biomarkers for neurodegenerative conditions |
| US20230097907A1 (en) * | 2020-01-27 | 2023-03-30 | Mantra Bio, Inc. | Non-naturally occurring vesicles comprising a chimeric vesicle localization moiety, methods of making and uses thereof |
| WO2021194906A1 (en) * | 2020-03-21 | 2021-09-30 | Florica Therapeutics, Inc. | Neuronal diencephalon stem cells and exosomes thereof for the treatment and prevention of diseases |
| CN111876388A (zh) * | 2020-07-24 | 2020-11-03 | 赛瑞诚(苏州)生物科技有限公司 | 一种骨和骨组织靶向外泌体及其制备方法和应用 |
| EP4172194A1 (en) | 2020-07-31 | 2023-05-03 | CureVac SE | Nucleic acid encoded antibody mixtures |
| WO2022204045A1 (en) * | 2021-03-22 | 2022-09-29 | Spiritus Therapeutics, Inc. | Diagnostic and therapeutic uses of purified potent exosomes containing disease-based and therapy based signature cargo |
| WO2023283218A2 (en) * | 2021-07-07 | 2023-01-12 | University Of Florida Research Foundation, Incorporated | Light-induced cellular production of immune functional extracellular vesicles |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2011513217A (ja) * | 2008-02-22 | 2011-04-28 | エイジェンシー・フォー・サイエンス,テクノロジー・アンド・リサーチ(エイ・スター) | 間葉系幹細胞粒子 |
Family Cites Families (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4946778A (en) | 1987-09-21 | 1990-08-07 | Genex Corporation | Single polypeptide chain binding molecules |
| US5888773A (en) | 1994-08-17 | 1999-03-30 | The United States Of America As Represented By The Department Of Health And Human Services | Method of producing single-chain Fv molecules |
| FR2766205B1 (fr) | 1997-07-16 | 2002-08-30 | Inst Nat Sante Rech Med | Nouveau procede de sensibilisation de cellules presentatrices d'antigene et nouveaux moyens pour la mise en oeuvre du procede |
| FR2788780B1 (fr) | 1999-01-27 | 2001-03-30 | Ap Cells Inc | Procede de preparation de vesicules membranaires |
| US20040241176A1 (en) | 2000-04-27 | 2004-12-02 | Ap Cells. Inc. | Method of producing membrane vesicles |
| US20060068405A1 (en) * | 2004-01-27 | 2006-03-30 | Alex Diber | Methods and systems for annotating biomolecular sequences |
| US7689196B2 (en) | 2002-06-26 | 2010-03-30 | Qualcomm Incorporated | Timer-based sleep for terminals in wireless communication systems |
| WO2005111211A2 (en) * | 2004-05-14 | 2005-11-24 | Rosetta Genomics Ltd. | Micronas and uses thereof |
| ES2420973T3 (es) * | 2007-07-25 | 2013-08-28 | University Of Louisville Research Foundation, Inc. | Micro-ARN asociado a exosoma como marcador de diagnóstico |
| CA2735575A1 (en) * | 2007-08-10 | 2009-02-19 | Wayne State University | Compositions and methods for detecting and modulating cell death by a translation regulated gene expression system |
| CA2743211A1 (en) * | 2008-11-12 | 2010-05-20 | Caris Life Sciences Luxembourg Holdings, S.A.R.L. | Methods and systems of using exosomes for determining phenotypes |
| US9399053B2 (en) | 2011-07-22 | 2016-07-26 | The University Of Chicago | Treatments for migraine and related disorders |
| JP2015524849A (ja) | 2012-08-15 | 2015-08-27 | ザ・ユニバーシティ・オブ・シカゴThe University Of Chicago | 神経変性疾患に対するエキソソームに基づく治療法 |
-
2013
- 2013-08-15 JP JP2015527641A patent/JP2015524849A/ja active Pending
- 2013-08-15 AU AU2013302526A patent/AU2013302526B2/en active Active
- 2013-08-15 WO PCT/US2013/055187 patent/WO2014028763A1/en active Application Filing
- 2013-08-15 EP EP13829748.6A patent/EP2885414B1/en active Active
- 2013-08-15 US US14/420,680 patent/US10231997B2/en active Active
- 2013-08-15 CA CA2882248A patent/CA2882248A1/en not_active Abandoned
-
2019
- 2019-01-28 US US16/259,563 patent/US11369634B2/en active Active
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2011513217A (ja) * | 2008-02-22 | 2011-04-28 | エイジェンシー・フォー・サイエンス,テクノロジー・アンド・リサーチ(エイ・スター) | 間葉系幹細胞粒子 |
Non-Patent Citations (4)
| Title |
|---|
| FRONTIERS IN NEROSCIENCE, vol. 6(13), JPN6017021495, 6 February 2012 (2012-02-06), pages 1 - 7, ISSN: 0003799122 * |
| GLIA, vol. 45, JPN6017021489, 2004, pages 54 - 8, ISSN: 0003799119 * |
| J. C. SCI., vol. 124, JPN6017021494, 2010, pages 447 - 58, ISSN: 0003799121 * |
| PLOS ONE, vol. 5(12), JPN6017021491, 2010, pages 1 - 8, ISSN: 0003799120 * |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2018534370A (ja) * | 2015-11-18 | 2018-11-22 | ユニバーシティ オブ ジョージア リサーチ ファウンデーション, インコーポレーテッド | 神経細胞の細胞外小胞 |
| US11111475B2 (en) | 2015-11-18 | 2021-09-07 | University Of Georgia Research Foundation, Inc. | Neural cell extracellular vesicles |
| JP2022009194A (ja) * | 2015-11-18 | 2022-01-14 | ユニバーシティ オブ ジョージア リサーチ ファウンデーション, インコーポレーテッド | 神経細胞の細胞外小胞 |
| JP7075594B2 (ja) | 2015-11-18 | 2022-05-26 | ユニバーシティ オブ ジョージア リサーチ ファウンデーション, インコーポレーテッド | 神経細胞の細胞外小胞 |
Also Published As
| Publication number | Publication date |
|---|---|
| EP2885414A1 (en) | 2015-06-24 |
| WO2014028763A1 (en) | 2014-02-20 |
| AU2013302526A1 (en) | 2015-04-02 |
| EP2885414A4 (en) | 2016-01-06 |
| AU2013302526B2 (en) | 2018-03-22 |
| US11369634B2 (en) | 2022-06-28 |
| CA2882248A1 (en) | 2014-02-20 |
| EP2885414B1 (en) | 2020-09-23 |
| US20150216899A1 (en) | 2015-08-06 |
| US10231997B2 (en) | 2019-03-19 |
| US20190160097A1 (en) | 2019-05-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11369634B2 (en) | Exosome-based therapeutics against neurodegenerative disorders | |
| Jahangard et al. | Therapeutic effects of transplanted exosomes containing miR-29b to a rat model of Alzheimer’s disease | |
| Pusic et al. | Youth and environmental enrichment generate serum exosomes containing miR‐219 that promote CNS myelination | |
| US11680263B2 (en) | Micro-RNAS and compositions comprising same for the treatment and diagnosis of serotonin-, adrenalin-, noradrenalin-, glutamate-, and corticotropin-releasing hormone- associated medical conditions | |
| Tsujimura et al. | miR-199a links MeCP2 with mTOR signaling and its dysregulation leads to Rett syndrome phenotypes | |
| Pusic et al. | IFNγ-stimulated dendritic cell exosomes as a potential therapeutic for remyelination | |
| Yao et al. | Translocator protein 18 kDa (TSPO) deficiency inhibits microglial activation and impairs mitochondrial function | |
| US8962583B2 (en) | Treatment of inflammatory diseases using miR-124 | |
| Chen et al. | Astrocytes‐derived exosomes induce neuronal recovery after traumatic brain injury via delivering gap junction alpha 1‐20 k | |
| Gautier et al. | AAV2/9-mediated silencing of PMP22 prevents the development of pathological features in a rat model of Charcot-Marie-Tooth disease 1 A | |
| WO2018029656A2 (en) | Methods for making and using therapeutic exosomes | |
| Wang et al. | Developmental cytoplasmic-to-nuclear translocation of RNA-binding protein HuR is required for adult neurogenesis | |
| Yasuzaki et al. | Localization of exogenous DNA to mitochondria in skeletal muscle following hydrodynamic limb vein injection | |
| Son et al. | Protection against RAGE-mediated neuronal cell death by sRAGE-secreting human mesenchymal stem cells in 5xFAD transgenic mouse model | |
| Hu et al. | microRNA‐425 loss mediates amyloid plaque microenvironment heterogeneity and promotes neurodegenerative pathologies | |
| Gabery et al. | Characterization of a rat model of Huntington’s disease based on targeted expression of mutant huntingtin in the forebrain using adeno‐associated viral vectors | |
| Park et al. | Characterization of the subventricular-thalamo-cortical circuit in the NP-C mouse brain, and new insights regarding treatment | |
| Gautier et al. | Long term AAV2/9-mediated silencing of PMP22 prevents CMT1A disease in rats and validates skin biomarkers as treatment outcome measure | |
| 土井浩義 | Early-life midazolam exposure persistently changes chromatin accessibility to impair adult hippocampal neurogenesis and cognition | |
| Emborg | for Neural Therapy and Repair | |
| Merheb | Understanding the Pathogenesis of Pol III-related Leukodystrophy | |
| Kumar et al. | Characterisation of RNA editing and gene therapy with a compact CRISPR-Cas13 in the retina | |
| Dabin et al. | Astrocytic IGF-1 and IGF-1R Orchestrate Mitophagy in Traumatic Brain Injury | |
| Smith | Systemic Regulation of Synaptic, Regenerative, and Cognitive Dysfunction During Aging | |
| Du et al. | Pivotal role of Slitrk1 in adult striatal cholinergic neurons in mice: Implication in Tourette syndrome |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160805 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20160805 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20170612 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20170912 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20180521 |