JP2014530228A - ジチインテトラカルボキシイミド類の製造方法 - Google Patents
ジチインテトラカルボキシイミド類の製造方法 Download PDFInfo
- Publication number
- JP2014530228A JP2014530228A JP2014535060A JP2014535060A JP2014530228A JP 2014530228 A JP2014530228 A JP 2014530228A JP 2014535060 A JP2014535060 A JP 2014535060A JP 2014535060 A JP2014535060 A JP 2014535060A JP 2014530228 A JP2014530228 A JP 2014530228A
- Authority
- JP
- Japan
- Prior art keywords
- alkyl
- thionyl chloride
- formula
- stage
- halogen
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 238000004519 manufacturing process Methods 0.000 title claims description 6
- 238000000034 method Methods 0.000 claims abstract description 37
- FYSNRJHAOHDILO-UHFFFAOYSA-N thionyl chloride Chemical compound ClS(Cl)=O FYSNRJHAOHDILO-UHFFFAOYSA-N 0.000 claims description 44
- -1 succinic monoamide carboxylates Chemical class 0.000 claims description 26
- 239000003085 diluting agent Substances 0.000 claims description 22
- 229910052736 halogen Inorganic materials 0.000 claims description 16
- 150000002367 halogens Chemical class 0.000 claims description 16
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 claims description 15
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 claims description 14
- 229910052739 hydrogen Inorganic materials 0.000 claims description 13
- 239000001257 hydrogen Substances 0.000 claims description 13
- 125000004765 (C1-C4) haloalkyl group Chemical group 0.000 claims description 12
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 claims description 12
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 claims description 12
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 claims description 12
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 claims description 12
- BTANRVKWQNVYAZ-UHFFFAOYSA-N butan-2-ol Chemical compound CCC(C)O BTANRVKWQNVYAZ-UHFFFAOYSA-N 0.000 claims description 12
- 239000000460 chlorine Substances 0.000 claims description 12
- 229910052801 chlorine Inorganic materials 0.000 claims description 11
- 239000000203 mixture Substances 0.000 claims description 11
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 10
- ZWEHNKRNPOVVGH-UHFFFAOYSA-N 2-Butanone Chemical compound CCC(C)=O ZWEHNKRNPOVVGH-UHFFFAOYSA-N 0.000 claims description 9
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 claims description 9
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 claims description 9
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 claims description 9
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 claims description 9
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 claims description 9
- 229910052708 sodium Inorganic materials 0.000 claims description 9
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 9
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 claims description 8
- AMQJEAYHLZJPGS-UHFFFAOYSA-N N-Pentanol Chemical compound CCCCCO AMQJEAYHLZJPGS-UHFFFAOYSA-N 0.000 claims description 8
- ZXEKIIBDNHEJCQ-UHFFFAOYSA-N isobutanol Chemical compound CC(C)CO ZXEKIIBDNHEJCQ-UHFFFAOYSA-N 0.000 claims description 8
- 150000002431 hydrogen Chemical class 0.000 claims description 7
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 claims description 6
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 claims description 6
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 6
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 claims description 6
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 claims description 6
- 239000002253 acid Substances 0.000 claims description 6
- 229910052782 aluminium Inorganic materials 0.000 claims description 6
- JFDZBHWFFUWGJE-UHFFFAOYSA-N benzonitrile Chemical compound N#CC1=CC=CC=C1 JFDZBHWFFUWGJE-UHFFFAOYSA-N 0.000 claims description 6
- 229910052791 calcium Inorganic materials 0.000 claims description 6
- MVPPADPHJFYWMZ-UHFFFAOYSA-N chlorobenzene Chemical compound ClC1=CC=CC=C1 MVPPADPHJFYWMZ-UHFFFAOYSA-N 0.000 claims description 6
- 229910052742 iron Inorganic materials 0.000 claims description 6
- 229910052749 magnesium Inorganic materials 0.000 claims description 6
- 229910052748 manganese Inorganic materials 0.000 claims description 6
- UAEPNZWRGJTJPN-UHFFFAOYSA-N methylcyclohexane Chemical compound CC1CCCCC1 UAEPNZWRGJTJPN-UHFFFAOYSA-N 0.000 claims description 6
- 239000003960 organic solvent Substances 0.000 claims description 6
- 229910052700 potassium Inorganic materials 0.000 claims description 6
- 125000006296 sulfonyl amino group Chemical group [H]N(*)S(*)(=O)=O 0.000 claims description 6
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 claims description 5
- KXKVLQRXCPHEJC-UHFFFAOYSA-N acetic acid trimethyl ester Natural products COC(C)=O KXKVLQRXCPHEJC-UHFFFAOYSA-N 0.000 claims description 5
- 229920001021 polysulfide Polymers 0.000 claims description 5
- 239000005077 polysulfide Substances 0.000 claims description 5
- 150000008117 polysulfides Polymers 0.000 claims description 5
- ZHNUHDYFZUAESO-UHFFFAOYSA-N Formamide Chemical compound NC=O ZHNUHDYFZUAESO-UHFFFAOYSA-N 0.000 claims description 4
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 claims description 4
- 229910052783 alkali metal Inorganic materials 0.000 claims description 4
- 150000001340 alkali metals Chemical class 0.000 claims description 4
- 229910052784 alkaline earth metal Inorganic materials 0.000 claims description 4
- 150000001342 alkaline earth metals Chemical class 0.000 claims description 4
- 125000003118 aryl group Chemical group 0.000 claims description 4
- 229910052790 beryllium Inorganic materials 0.000 claims description 4
- 150000001768 cations Chemical class 0.000 claims description 4
- 125000001309 chloro group Chemical group Cl* 0.000 claims description 4
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 claims description 4
- 229910052744 lithium Inorganic materials 0.000 claims description 4
- 229910052751 metal Inorganic materials 0.000 claims description 4
- 239000002184 metal Substances 0.000 claims description 4
- 150000002739 metals Chemical class 0.000 claims description 4
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 claims description 4
- LQNUZADURLCDLV-UHFFFAOYSA-N nitrobenzene Chemical compound [O-][N+](=O)C1=CC=CC=C1 LQNUZADURLCDLV-UHFFFAOYSA-N 0.000 claims description 4
- BDERNNFJNOPAEC-UHFFFAOYSA-N propan-1-ol Chemical compound CCCO BDERNNFJNOPAEC-UHFFFAOYSA-N 0.000 claims description 4
- 239000002904 solvent Substances 0.000 claims description 4
- JDVPQXZIJDEHAN-UHFFFAOYSA-N succinamic acid Chemical compound NC(=O)CCC(O)=O JDVPQXZIJDEHAN-UHFFFAOYSA-N 0.000 claims description 4
- 229910052723 transition metal Inorganic materials 0.000 claims description 4
- 150000003624 transition metals Chemical class 0.000 claims description 4
- OCJBOOLMMGQPQU-UHFFFAOYSA-N 1,4-dichlorobenzene Chemical compound ClC1=CC=C(Cl)C=C1 OCJBOOLMMGQPQU-UHFFFAOYSA-N 0.000 claims description 3
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 claims description 3
- NTIZESTWPVYFNL-UHFFFAOYSA-N Methyl isobutyl ketone Chemical compound CC(C)CC(C)=O NTIZESTWPVYFNL-UHFFFAOYSA-N 0.000 claims description 3
- UIHCLUNTQKBZGK-UHFFFAOYSA-N Methyl isobutyl ketone Natural products CCC(C)C(C)=O UIHCLUNTQKBZGK-UHFFFAOYSA-N 0.000 claims description 3
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 claims description 3
- KVNRLNFWIYMESJ-UHFFFAOYSA-N butyronitrile Chemical compound CCCC#N KVNRLNFWIYMESJ-UHFFFAOYSA-N 0.000 claims description 3
- 229940117389 dichlorobenzene Drugs 0.000 claims description 3
- 150000002148 esters Chemical class 0.000 claims description 3
- 150000002170 ethers Chemical class 0.000 claims description 3
- AUHZEENZYGFFBQ-UHFFFAOYSA-N mesitylene Substances CC1=CC(C)=CC(C)=C1 AUHZEENZYGFFBQ-UHFFFAOYSA-N 0.000 claims description 3
- 125000001827 mesitylenyl group Chemical group [H]C1=C(C(*)=C(C([H])=C1C([H])([H])[H])C([H])([H])[H])C([H])([H])[H] 0.000 claims description 3
- GYNNXHKOJHMOHS-UHFFFAOYSA-N methyl-cycloheptane Natural products CC1CCCCCC1 GYNNXHKOJHMOHS-UHFFFAOYSA-N 0.000 claims description 3
- 150000002825 nitriles Chemical class 0.000 claims description 3
- FVSKHRXBFJPNKK-UHFFFAOYSA-N propionitrile Chemical compound CCC#N FVSKHRXBFJPNKK-UHFFFAOYSA-N 0.000 claims description 3
- 239000008096 xylene Substances 0.000 claims description 3
- XNWFRZJHXBZDAG-UHFFFAOYSA-N 2-METHOXYETHANOL Chemical compound COCCO XNWFRZJHXBZDAG-UHFFFAOYSA-N 0.000 claims description 2
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 claims description 2
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 claims description 2
- 235000011054 acetic acid Nutrition 0.000 claims description 2
- 229910052788 barium Inorganic materials 0.000 claims description 2
- 229910052792 caesium Inorganic materials 0.000 claims description 2
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims description 2
- 229910052802 copper Inorganic materials 0.000 claims description 2
- XCIXKGXIYUWCLL-UHFFFAOYSA-N cyclopentanol Chemical compound OC1CCCC1 XCIXKGXIYUWCLL-UHFFFAOYSA-N 0.000 claims description 2
- 235000019253 formic acid Nutrition 0.000 claims description 2
- 229930195733 hydrocarbon Natural products 0.000 claims description 2
- 150000002430 hydrocarbons Chemical class 0.000 claims description 2
- 150000002576 ketones Chemical class 0.000 claims description 2
- 229910052759 nickel Inorganic materials 0.000 claims description 2
- 235000019260 propionic acid Nutrition 0.000 claims description 2
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 claims description 2
- 229910052701 rubidium Inorganic materials 0.000 claims description 2
- 229910052712 strontium Inorganic materials 0.000 claims description 2
- HXJUTPCZVOIRIF-UHFFFAOYSA-N sulfolane Chemical compound O=S1(=O)CCCC1 HXJUTPCZVOIRIF-UHFFFAOYSA-N 0.000 claims description 2
- 229910052719 titanium Inorganic materials 0.000 claims description 2
- 229910052720 vanadium Inorganic materials 0.000 claims description 2
- 229910052725 zinc Inorganic materials 0.000 claims description 2
- ZSIAUFGUXNUGDI-UHFFFAOYSA-N hexan-1-ol Chemical compound CCCCCCO ZSIAUFGUXNUGDI-UHFFFAOYSA-N 0.000 claims 2
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 claims 1
- 150000007513 acids Chemical class 0.000 claims 1
- 150000001408 amides Chemical class 0.000 claims 1
- PJGSXYOJTGTZAV-UHFFFAOYSA-N pinacolone Chemical compound CC(=O)C(C)(C)C PJGSXYOJTGTZAV-UHFFFAOYSA-N 0.000 claims 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 11
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 9
- 150000001875 compounds Chemical class 0.000 description 9
- 239000000047 product Substances 0.000 description 9
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 8
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 6
- 239000011541 reaction mixture Substances 0.000 description 6
- 239000011734 sodium Substances 0.000 description 6
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 6
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 5
- 238000006243 chemical reaction Methods 0.000 description 5
- 229910052731 fluorine Inorganic materials 0.000 description 5
- 239000011737 fluorine Substances 0.000 description 5
- 239000002994 raw material Substances 0.000 description 5
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 4
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 4
- 239000012467 final product Substances 0.000 description 4
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 4
- UMGDCJDMYOKAJW-UHFFFAOYSA-N thiourea Chemical compound NC(N)=S UMGDCJDMYOKAJW-UHFFFAOYSA-N 0.000 description 4
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 3
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 3
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 3
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 3
- 229910052794 bromium Inorganic materials 0.000 description 3
- 238000001914 filtration Methods 0.000 description 3
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 3
- 230000035484 reaction time Effects 0.000 description 3
- WSLDOOZREJYCGB-UHFFFAOYSA-N 1,2-Dichloroethane Chemical compound ClCCCl WSLDOOZREJYCGB-UHFFFAOYSA-N 0.000 description 2
- RWSOTUBLDIXVET-UHFFFAOYSA-N Dihydrogen sulfide Chemical compound S RWSOTUBLDIXVET-UHFFFAOYSA-N 0.000 description 2
- YNQLUTRBYVCPMQ-UHFFFAOYSA-N Ethylbenzene Chemical compound CCC1=CC=CC=C1 YNQLUTRBYVCPMQ-UHFFFAOYSA-N 0.000 description 2
- OFBQJSOFQDEBGM-UHFFFAOYSA-N Pentane Chemical compound CCCCC OFBQJSOFQDEBGM-UHFFFAOYSA-N 0.000 description 2
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Natural products NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 2
- 230000000052 comparative effect Effects 0.000 description 2
- RWGFKTVRMDUZSP-UHFFFAOYSA-N cumene Chemical compound CC(C)C1=CC=CC=C1 RWGFKTVRMDUZSP-UHFFFAOYSA-N 0.000 description 2
- HPXRVTGHNJAIIH-UHFFFAOYSA-N cyclohexanol Chemical compound OC1CCCCC1 HPXRVTGHNJAIIH-UHFFFAOYSA-N 0.000 description 2
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 2
- 239000007789 gas Substances 0.000 description 2
- 229910000037 hydrogen sulfide Inorganic materials 0.000 description 2
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 2
- 125000004674 methylcarbonyl group Chemical group CC(=O)* 0.000 description 2
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- 239000003791 organic solvent mixture Substances 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- 0 *N(C(C1=C2SC(C(N(*)C(C3)=O)=O)=C3S1)=O)C2=O Chemical compound *N(C(C1=C2SC(C(N(*)C(C3)=O)=O)=C3S1)=O)C2=O 0.000 description 1
- 150000000094 1,4-dioxanes Chemical class 0.000 description 1
- HSIGZGQPMFNMJW-UHFFFAOYSA-N 1-tert-butyl-3-[(1-tert-butyl-4-chloro-2,5-dioxopyrrol-3-yl)disulfanyl]-4-chloropyrrole-2,5-dione Chemical compound O=C1N(C(C)(C)C)C(=O)C(Cl)=C1SSC1=C(Cl)C(=O)N(C(C)(C)C)C1=O HSIGZGQPMFNMJW-UHFFFAOYSA-N 0.000 description 1
- DWVRSCKCNRQFQJ-UHFFFAOYSA-N 1-tert-butyl-3-[(1-tert-butyl-4-chloro-2,5-dioxopyrrol-3-yl)trisulfanyl]-4-chloropyrrole-2,5-dione Chemical compound O=C1N(C(C)(C)C)C(=O)C(Cl)=C1SSSC1=C(Cl)C(=O)N(C(C)(C)C)C1=O DWVRSCKCNRQFQJ-UHFFFAOYSA-N 0.000 description 1
- 125000004206 2,2,2-trifluoroethyl group Chemical group [H]C([H])(*)C(F)(F)F 0.000 description 1
- 125000004778 2,2-difluoroethyl group Chemical group [H]C([H])(*)C([H])(F)F 0.000 description 1
- FALRKNHUBBKYCC-UHFFFAOYSA-N 2-(chloromethyl)pyridine-3-carbonitrile Chemical compound ClCC1=NC=CC=C1C#N FALRKNHUBBKYCC-UHFFFAOYSA-N 0.000 description 1
- KVBAKSQRUXXHCK-UHFFFAOYSA-N 3,4-Dichloro-5-hydroxy-2H-pyrrol-2-one Chemical compound ClC1=C(Cl)C(=O)NC1=O KVBAKSQRUXXHCK-UHFFFAOYSA-N 0.000 description 1
- AGULWIQIYWWFBJ-UHFFFAOYSA-N 3,4-dichlorofuran-2,5-dione Chemical compound ClC1=C(Cl)C(=O)OC1=O AGULWIQIYWWFBJ-UHFFFAOYSA-N 0.000 description 1
- VNOKCWZIFTXKAR-UHFFFAOYSA-N 3-chloro-4-[(4-chloro-1-cyclohexyl-2,5-dioxopyrrol-3-yl)trisulfanyl]-1-cyclohexylpyrrole-2,5-dione Chemical compound O=C1N(C2CCCCC2)C(=O)C(Cl)=C1SSSC(C1=O)=C(Cl)C(=O)N1C1CCCCC1 VNOKCWZIFTXKAR-UHFFFAOYSA-N 0.000 description 1
- UJEHBXLKPZSCSC-UHFFFAOYSA-N 3-chloro-4-[(4-chloro-1-methyl-2,5-dioxopyrrol-3-yl)disulfanyl]-1-methylpyrrole-2,5-dione Chemical compound O=C1N(C)C(=O)C(Cl)=C1SSC1=C(Cl)C(=O)N(C)C1=O UJEHBXLKPZSCSC-UHFFFAOYSA-N 0.000 description 1
- QJYJDIBZCRMORB-UHFFFAOYSA-N 3-chloro-4-[(4-chloro-1-methyl-2,5-dioxopyrrol-3-yl)trisulfanyl]-1-methylpyrrole-2,5-dione Chemical compound O=C1N(C)C(=O)C(Cl)=C1SSSC1=C(Cl)C(=O)N(C)C1=O QJYJDIBZCRMORB-UHFFFAOYSA-N 0.000 description 1
- 101100132433 Arabidopsis thaliana VIII-1 gene Proteins 0.000 description 1
- 206010017533 Fungal infection Diseases 0.000 description 1
- WLLGXSLBOPFWQV-UHFFFAOYSA-N MGK 264 Chemical compound C1=CC2CC1C1C2C(=O)N(CC(CC)CCCC)C1=O WLLGXSLBOPFWQV-UHFFFAOYSA-N 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- 241000244206 Nematoda Species 0.000 description 1
- 150000001338 aliphatic hydrocarbons Chemical class 0.000 description 1
- 229940124339 anthelmintic agent Drugs 0.000 description 1
- 239000000921 anthelmintic agent Substances 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- 150000008280 chlorinated hydrocarbons Chemical class 0.000 description 1
- ASFVUUPSWPYRGT-UHFFFAOYSA-N chloro-hydroxy-oxo-sulfanylidene-lambda6-sulfane Chemical compound SS(=O)(=O)Cl ASFVUUPSWPYRGT-UHFFFAOYSA-N 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- 238000000354 decomposition reaction Methods 0.000 description 1
- 230000018044 dehydration Effects 0.000 description 1
- 238000006297 dehydration reaction Methods 0.000 description 1
- SZHZCPHKDJWHNG-UHFFFAOYSA-N dipropyl butanedioate Chemical compound CCCOC(=O)CCC(=O)OCCC SZHZCPHKDJWHNG-UHFFFAOYSA-N 0.000 description 1
- 238000004821 distillation Methods 0.000 description 1
- RIYVKHUVXPAOPS-UHFFFAOYSA-N dithiine Chemical compound S1SC=CC=C1 RIYVKHUVXPAOPS-UHFFFAOYSA-N 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 244000079386 endoparasite Species 0.000 description 1
- 125000001301 ethoxy group Chemical group [H]C([H])([H])C([H])([H])O* 0.000 description 1
- 125000004672 ethylcarbonyl group Chemical group [H]C([H])([H])C([H])([H])C(*)=O 0.000 description 1
- 239000000706 filtrate Substances 0.000 description 1
- 208000024386 fungal infectious disease Diseases 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 230000000749 insecticidal effect Effects 0.000 description 1
- 239000000543 intermediate Substances 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 239000012074 organic phase Substances 0.000 description 1
- 239000003973 paint Substances 0.000 description 1
- 108091008695 photoreceptors Proteins 0.000 description 1
- 239000000049 pigment Substances 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 229940014800 succinic anhydride Drugs 0.000 description 1
- 150000003464 sulfur compounds Chemical class 0.000 description 1
- 231100000925 very toxic Toxicity 0.000 description 1
- 238000010626 work up procedure Methods 0.000 description 1
- 150000003738 xylenes Chemical class 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D495/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms
- C07D495/12—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms in which the condensed system contains three hetero rings
- C07D495/14—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D207/00—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D207/02—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D207/44—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having three double bonds between ring members or between ring members and non-ring members
- C07D207/444—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having three double bonds between ring members or between ring members and non-ring members having two doubly-bound oxygen atoms directly attached in positions 2 and 5
- C07D207/456—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having three double bonds between ring members or between ring members and non-ring members having two doubly-bound oxygen atoms directly attached in positions 2 and 5 with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to other ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D207/00—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D207/46—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with hetero atoms directly attached to the ring nitrogen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D495/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms
- C07D495/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms in which the condensed system contains two hetero rings
- C07D495/04—Ortho-condensed systems
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Oxygen Or Sulfur (AREA)
- Pyrrole Compounds (AREA)
Abstract
本発明は、ジチインテトラカルボキシイミド類の新規な製造方法に関する。
Description
本発明は、ジチイン−テトラカルボキシイミド類の新規な製造方法に関する。
ジチイン−テトラカルボキシイミド類自体はすでに知られている。これらのジチイン−テトラカルボキシイミド類が動物の内部寄生虫、詳細には線虫に対する駆虫薬として用いることができ、殺虫活性を有することも知られている(US3,364,229参照)。さらに、ある種のジチイン−テトラカルボキシイミド類が抗細菌活性を有し、ヒト真菌症の原因生物に対して一定の活性を有することが知られている(Il Farmaco 2005, 60, 944−947参照)。ジチイン−テトラカルボキシイミド類が電子写真感光体における顔料としてまたは塗料およびポリマーにおける染料として用いることができることも知られている(JP−A10−251265、PL−B143804参照)。
下記式(I)のジチイン−テトラカルボキシイミド類:
R1およびR2は同一であるか異なっており、水素であるか、ハロゲン、−OR3および/または−COR4によって1回もしくはそれ以上置換されていても良いC1−C8−アルキルであるか、ハロゲン、C1−C4−アルキルまたはC1−C4−ハロアルキルによって1回もしくはそれ以上置換されていても良いC3−C7−シクロアルキルであるか、それぞれハロゲン、C1−C4−アルキル、C1−C4−ハロアルキル、−COR4またはスルホニルアミノによって1回もしくはそれ以上置換されていても良いアリールもしくはアリール−(C1−C4−アルキル)であり、
R3は、水素、C1−C4−アルキルもしくはC1−C4−アルキルカルボニルであるか、ハロゲン、C1−C4−アルキルまたはC1−C4−ハロアルキルによって1回もしくはそれ以上置換されていても良いアリールであり、
R4は、ヒドロキシル、C1−C4−アルキルまたはC1−C4−アルコキシである。]は、多様な公知の方法で製造することができる。
例えば、ある方法では(US3,364,229;Chem. Ber. 1967, 100, 1559−1570参照)、第1段階で、適宜に希釈剤の存在下に式(II)の無水ジクロロマレイン酸を式(III)のアミンと反応させる。次に、得られた式(IV)のジクロロマレイミドを硫黄化合物(例えば硫化水素またはチオ尿素)と反応させる。この方法による式(I)のジチイン−テトラカルボキシイミドの製造は、下記の図式によって示すことができる。
Il Farmaco 2005, 60, 944−947.
Chem. Ber. 1967, 100, 1559−1570.
この方法は、例えば、非常に毒性の高い硫化水素ガスを用いる操作が技術的な観点から、非常に困難、高コストおよび不便なものであるという欠点を有する。チオ尿素を用いる場合、目的生成物とともに望ましくない副生成物が得られ、それらは除去が非常に困難で、達成可能な収量を引き下げるものである(J. Heterocycl. Chem. 1988, 25, 901−906参照)。
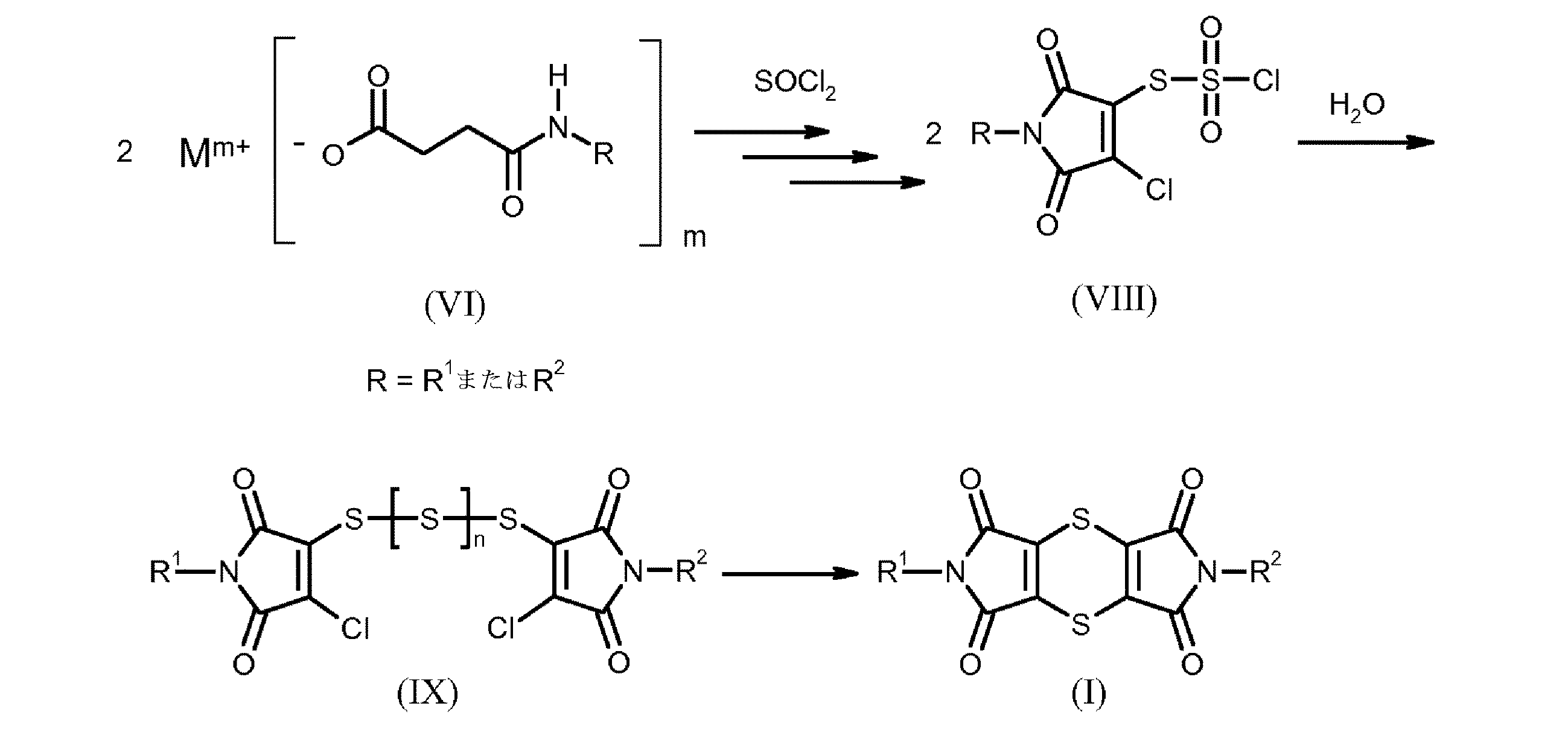
開示されている別の方法では(Synthetic Communications 2006, 36, 3591−3597参照)、第1段階で、適宜に希釈剤の存在下に式(V)の無水コハク酸を式(III)のアミンと反応させる。次に、得られた式(VI)のコハク酸モノアミド類を室温で希釈剤としてのジオキサンの存在下に大過剰の塩化チオニルと6時間反応させることで、一連の多くの反応段階で最終的に、式(I)のジチイン−テトラカルボキシイミドを得る。ジチイン−テトラカルボキシイミド類は反応混合物から直接または水を加えた後に濾過することで単離しても良い。反応条件(希釈剤)および基Rの性質に応じて、一定の環境で、式(VII)のジチイン−ジイソイミドを単離することができ、その後それらを式(I)のジチイン−テトラカルボキシイミドに変換する。式(I)のジチイン−テトラカルボキシイミドのこの製造方法は、下記の図式によって示すことができる。
さらに、N−置換コハク酸アミド類を脱水1,4−ジオキサンに溶かし、溶液に塩化チオニルを加えることでジチイン−テトラカルボキシイミド類が得られることが知られている。次に、反応混合物を加熱し、溶液を減圧下に濃縮し、カラムクロマトグラフィーによって分離し、精製する(J. Heterocycl. Chem. 2010, 47, 188−193参照)。
結果的に、技術的に簡単で経済的な式(I)のジチイン−テトラカルボキシイミド類の製造方法が現在もなお必要とされている。
下記一般式(I)のジチイン−テトラカルボキシイミド類:
RはR1またはR2であり、
Mは、アルカリ金属、アルカリ土類金属、遷移金属および金属からなる群から選択されるカチオンであり、
mは1、2、3または4である。)を、適宜に希釈剤の存在下に過剰量の塩化チオニルと反応させ、
次に過剰な塩化チオニルを除去し、得られた生成物混合物を第2段階で、有機溶媒中、式(I)のジチイン−テトラカルボキシイミド類に変換することを特徴とする。
このようにして、式(I)のジチイン−テトラカルボキシイミド類は、比較的高収率、比較的短時間および比較的良好な純度で得ることができる。
本発明の方法の第1段階で得られる生成物混合物もすでに、式(I)のジチイン−テトラカルボキシイミドを含むが、それの主成分は下記式(IX)のポリスルフィド:
一般式(VIII)のチオスルホン酸誘導体および一般式(IX)のポリスルフィドも同様に、本発明によって提供される。
一般式(VIII)のチオスルホン酸誘導体において、Rは上記で示したR1およびR2の定義を表し、Xは塩素またはヒドロキシルを表す。
一般式(IX)のポリスルフィドにおいて、R1およびR2は上記で示した定義を表し、nは0、1、2、3、4、5、6、7または8を表す。
一般式(VI)の化合物を塩化チオニルと反応させた後に反応混合物を濃縮すると、他の生成物とともに、一般式(VIII)の化合物が得られる。
一般式(VI)の化合物を塩化チオニルと反応させた後に反応混合物を濃縮し、例えば塩化メチレンなどの不活性で水非混合性の溶媒に溶かし、室温で水とともに振盪することで抽出した場合、他の生成物とともに一般式(IX)の化合物が得られる。有機相の除去、脱水および濃縮後に混合物が得られ、それは式(I)のジチイン−テトラカルボキシイミドに加えて、主として一般式(IX)の化合物を含む。
本発明の式(I)のジチイン−テトラカルボキシイミドの製造方法は、下記図式によって示すことができる。
R1およびR2は好ましくは同一であるか異なっており、好ましくは水素であるか、フッ素、塩素、臭素、−OR3および/または−COR4によって1回もしくはそれ以上置換されていても良いC1−C6−アルキルであるか、塩素、メチルまたはトリフルオロメチルによって1回もしくはそれ以上置換されていても良いC3−C7−シクロアルキルであるか、それぞれフッ素、塩素、臭素、メチル、トリフルオロメチル、−COR4および/またはスルホニルアミノによって1回もしくはそれ以上置換されていても良いフェニルまたはフェニル−(C1−C4−アルキル)である。
R1およびR2はより好ましくは同一であるか異なっており、より好ましくは水素であるか、フッ素、塩素、ヒドロキシル、メトキシ、エトキシ、メチルカルボニルオキシおよび/またはカルボキシルによって1回もしくはそれ以上置換されていても良いC1−C4−アルキルであるか、塩素、メチルまたはトリフルオロメチルによって1回もしくはそれ以上置換されていても良いC3−C7−シクロアルキルであるか、それぞれフッ素、塩素、臭素、メチル、トリフルオロメチル、−COR4および/またはスルホニルアミノによって1から3回置換されていても良いフェニル、ベンジル、1−フェネチル、2−フェネチルまたは2−メチル−2−フェネチルである。
R1およびR2は非常に好ましくは同一であるか異なっており、非常に好ましくは水素、メチル、エチル、n−プロピル、イソプロピル、2,2−ジフルオロエチルまたは2,2,2−トリフルオロエチルであるか、それぞれ塩素、メチルまたはトリフルオロメチルによって置換されていても良いシクロプロピルまたはシクロヘキシルである。
R1およびR2はより特別に好ましくは、同時にメチルである。
R3は好ましくは水素、メチル、エチル、メチルカルボニルまたはエチルカルボニルであるか、フッ素、塩素、メチル、エチル、n−プロピル、イソプロピルまたはトリフルオロメチルによって1回もしくはそれ以上置換されていても良いフェニルである。
R3はより好ましくは水素、メチル、メチルカルボニルまたはフェニルである。
R4は好ましくはヒドロキシル、メチル、エチル、メトキシまたはエトキシである。
R4はより好ましくはヒドロキシルまたはメトキシである。
Mは好ましくはLi、Na、K、RbまたはCsであって、
mが1であり、
または
Be、Mg、Ca、SrまたはBaであって、
mが2であり、
または
Ti、V、Mn、Fe、Co、Ni、Cu、Zn、Alであって、
mが1、2、3または4である。
mが1であり、
または
Be、Mg、Ca、SrまたはBaであって、
mが2であり、
または
Ti、V、Mn、Fe、Co、Ni、Cu、Zn、Alであって、
mが1、2、3または4である。
Mはより好ましくは、Li、Na、Kであって、
mが1であり、
または
Be、Mg、Caであって、
mが2であり、
または
Mn、Fe、Co、Alであって、
mが1、2、3または4である。
mが1であり、
または
Be、Mg、Caであって、
mが2であり、
または
Mn、Fe、Co、Alであって、
mが1、2、3または4である。
Mは非常に好ましくは、Na、Kであって、
mが1であり、
または
Mg、Caであって、
mが2であり、
または
Mn、Fe、Alであって、
mが2、3または4である。
mが1であり、
または
Mg、Caであって、
mが2であり、
または
Mn、Fe、Alであって、
mが2、3または4である。
原料としては、N−メチルコハク酸アミドカルボキシレートを用いて、最終生成物として化合物(I−1)2,6−ジメチル−1H,5H−[1,4]ジチイノ[2,3−c;5,6−c′]ジピロール−1,3,5,7(2H,6H)−テトロンを得ることが特に好ましい。
N−tert−ブチルコハク酸アミドカルボン酸ナトリウムを原料として用いる場合、得られる最終生成物は化合物(I−2)2,6−ジ−tert−ブチル−1H,5H−[1,4]ジチイノ[2,3−c;5,6−c′]ジピロール−1,3,5,7(2H,6H)−テトロンである。
N−シクロヘキシルコハク酸アミドカルボン酸ナトリウムを原料として用いる場合、得られる最終生成物は化合物(I−3)2,6−ジシクロヘキシル−1H,5H−[1,4]ジチイノ[2,3−c;5,6−c′]ジピロール−1,3,5,7(2H,6H)−テトロンである。
N−プロピルコハク酸アミドカルボン酸ナトリウムを原料として用いる場合、得られる最終生成物は化合物(I−4)2,6−ジプロピル−1H,5H−[1,4]ジチイノ[2,3−c;5,6−c′]ジピロール−1,3,5,7(2H,6H)−テトロンである。
得られる中間体で特に好ましいものは、
(VIII−1)クロロチオ硫酸S−(4−クロロ−1−メチル−2,5−ジオキソ−2,5−ジヒドロ−1H−ピロール−3−イル)(R=Me、X=Cl)、
(IX−1)3,3′−トリスルファン−1,3−ジイルビス(4−クロロ−1−メチル−1H−ピロール−2,5−ジオン)(R1=R2=Me、n=1)、
(IX−2)3,3′−ジスルファンジイルビス(4−クロロ−1−メチル−1H−ピロール−2,5−ジオン)(R1=R2=Me、n=0)、
(IX−3)3,3′−ジスルファンジイルビス(1−tert−ブチル−4−クロロ−1H−ピロール−2,5−ジオン)(R1=R2=t−Bu、n=0)、
(IX−4)3,3′−トリスルファン−1,3−ジイルビス(1−tert−ブチル−4−クロロ−1H−ピロール−2,5−ジオン)(R1=R2=t−Bu、n=1)、
(IX−5)3,3′−トリスルファン−1,3−ジイルビス(4−クロロ−1−シクロヘキシル−1H−ピロール−2,5−ジオン)(R1=R2=シクロヘキシル、n=1)
である。
(VIII−1)クロロチオ硫酸S−(4−クロロ−1−メチル−2,5−ジオキソ−2,5−ジヒドロ−1H−ピロール−3−イル)(R=Me、X=Cl)、
(IX−1)3,3′−トリスルファン−1,3−ジイルビス(4−クロロ−1−メチル−1H−ピロール−2,5−ジオン)(R1=R2=Me、n=1)、
(IX−2)3,3′−ジスルファンジイルビス(4−クロロ−1−メチル−1H−ピロール−2,5−ジオン)(R1=R2=Me、n=0)、
(IX−3)3,3′−ジスルファンジイルビス(1−tert−ブチル−4−クロロ−1H−ピロール−2,5−ジオン)(R1=R2=t−Bu、n=0)、
(IX−4)3,3′−トリスルファン−1,3−ジイルビス(1−tert−ブチル−4−クロロ−1H−ピロール−2,5−ジオン)(R1=R2=t−Bu、n=1)、
(IX−5)3,3′−トリスルファン−1,3−ジイルビス(4−クロロ−1−シクロヘキシル−1H−ピロール−2,5−ジオン)(R1=R2=シクロヘキシル、n=1)
である。
本発明の方法の第1段階における塩化チオニルの量は、式(VI)のコハク酸モノアミドカルボキシレート1モル当たり1から100molである。式(VI)のコハク酸モノアミドカルボキシレート1モル当たり2から50mol、より好ましくは4から40molの量を用いるのが好ましい。
本発明の方法の第1段階における反応温度は広い範囲で変動し得るものであり、0℃から150℃である。満足できる空時収量を得るには、20℃から120℃、より好ましくは30℃から100℃の温度で操作を行うことが好ましい。
本発明の方法の第1段階における反応時間は、10分間から24時間である。30分間から6時間、より好ましくは1から4時間操作を行うのが好ましい。
本発明の方法の第1段階は、反応条件に可能な限り不活性である希釈剤の存在下に行っても良い。そのような希釈剤には、例を挙げると、ペンタン、ヘキサン、ヘプタン、シクロヘキサン、メチルシクロヘキサンなどの脂肪族炭化水素、塩化メチレン、クロロホルム、1,2−ジクロロエタンなどの塩素化炭化水素、トルエン、キシレン、メシチレンなどの芳香族炭化水素、クロロベンゼン、ジクロロベンゼンなどの塩素化芳香族炭化水素、ジエチルエーテル、メチルtert−ブチルエーテル、テトラヒドロフラン、ジオキサンなどのエーテル類、アセトニトリル、プロピオニトリル、ブチロニトリルなどのニトリル類、酢酸メチルおよび酢酸エチルなどのエステル類などがある。塩化メチレン、クロロホルムまたは1,2−ジクロロエタン中でまたは希釈剤を用いずに操作を行うことが好ましい。
塩化チオニルは基本的に、水による加水分解によって除去することができる。塩化チオニルは好ましくは、減圧下に蒸留することで除去する。
存在しても良い希釈剤も好ましくは同様に、減圧下に蒸留される。
本発明の方法の第2段階では、過剰の塩化チオニルおよび適宜に希釈剤の除去後に得られる残留物を新たな希釈剤に溶かし、この溶媒中で加熱することで、式(I)のジチイン−カルボキシイミドに変換する。その反応混合物は好ましくは、この手順中は撹拌する。
本発明の方法の第2段階では、有機溶媒または溶媒混合物を用いる。
本発明の方法の第2段階に好適な希釈剤には、具体的には、水、ジメチルスルホキシド、スルホラン、例えばメタノール、エタノール、プロパノール、イソプロパノール、1−ブタノール、2−ブタノール、イソブタノール、tert−ブタノール、1−ペンタノール、シクロペンタノール、シクロヘキサノール、エチレングリコール、エチレングリコールモノメチルエーテルなどのアルコール類、ヘキサン、ヘプタン、シクロヘキサン、メチルシクロヘキサン、トルエン、キシレン類、メシチレン、エチルベンゼン、クメン、クロロベンゼン、ジクロロベンゼン、ニトロベンゼンなどの炭化水素、酢酸メチル、酢酸エチルなどのエステル類、ホルムアミド、N,N−ジメチルホルムアミド;N,N−ジメチルアセトアミド、N−メチルピロリドンなどのアミド類、メチルtert−ブチルエーテル、テトラヒドロフラン、1,4−ジオキサンなどのエーテル類、アセトニトリル、プロピオニトリル、ブチロニトリル、ベンゾニトリルなどのニトリル類、アセトン、メチルエチルケトン、メチルイソブチルケトン、ピナコロンなどのケトン類、ギ酸、酢酸、プロピオン酸などのカルボン酸類またはこれら希釈剤の混合物などがある。
好ましくは、水、ジメチルスルホキシド、メタノール、エタノール、プロパノール、イソプロパノール、1−ブタノール、2−ブタノール、イソブタノール、tert−ブタノール、1−ペンタノール、シクロヘキサノール、エチレングリコール、酢酸メチル、N,N−ジメチルホルムアミド;N,N−ジメチルアセトアミド、テトラヒドロフラン、1,4−ジオキサン、アセトニトリル、アセトン、メチルエチルケトン、メチルイソブチルケトン、酢酸またはこれら希釈剤の混合物を用いる。
非常に特に好ましくは、水およびメタノール、エタノール、プロパノール、イソプロパノール、1−ブタノール、2−ブタノール、イソブタノール、1−ペンタノール、酢酸メチル、テトラヒドロフラン、1,4−ジオキサン、アセトニトリル、アセトン、酢酸の混合物を用いる。
この場合、水の有機溶媒に対する混合比は、例えば9:1から1:9の広い範囲内で変動させることができる。
本発明の方法の第2段階での反応温度は広い範囲内で変動し得るものであり、0℃から200℃である。20℃から150℃の温度、より好ましくは30℃から130℃で操作を行うのが好ましい。
本発明の方法の第2段階での反応時間は、5分間から24時間である。30分間から12時間、より好ましくは1から6時間操作を行うのが好ましい。
本発明はさらに、下記式(IX)のポリスルフィド類:
R1およびR2は同一であるか異なっており、水素であるか、ハロゲン、−OR3および/または−COR4によって1回もしくはそれ以上置換されていても良いC1−C8−アルキルであるか、ハロゲン、C1−C4−アルキルまたはC1−C4−ハロアルキルによって1回もしくはそれ以上置換されていても良いC3−C7−シクロアルキルであるか、それぞれハロゲン、C1−C4−アルキル、C1−C4−ハロアルキル、−COR4またはスルホニルアミノによって1回もしくはそれ以上置換されていても良いアリールまたはアリール−(C1−C4−アルキル)であり、
R3は、水素、C1−C4−アルキルもしくはC1−C4−アルキルカルボニルであり、またはハロゲン、C1−C4−アルキルまたはC1−C4−ハロアルキルによって1回もしくはそれ以上置換されていても良いアリールであり、
R4は、ヒドロキシル、C1−C4−アルキルまたはC1−C4−アルコキシであり、
nは0、1もしくは2である。]の製造方法、
ならびに下記式(VIII)のチオスルホン酸誘導体:
Claims (10)
- 下記一般式(I)のジチイン−テトラカルボキシイミド類:
R1およびR2は同一であるか異なっており、水素であるか、ハロゲン、−OR3および/または−COR4によって1回もしくはそれ以上置換されていても良いC1−C8−アルキルであるか、ハロゲン、C1−C4−アルキルまたはC1−C4−ハロアルキルによって1回もしくはそれ以上置換されていても良いC3−C7−シクロアルキルであるか、それぞれハロゲン、C1−C4−アルキル、C1−C4−ハロアルキル、−COR4またはスルホニルアミノによって1回もしくはそれ以上置換されていても良いアリールもしくはアリール−(C1−C4−アルキル)であり、
R3は、水素、C1−C4−アルキルもしくはC1−C4−アルキルカルボニルであるか、ハロゲン、C1−C4−アルキルまたはC1−C4−ハロアルキルによって1回もしくはそれ以上置換されていても良いアリールであり、
R4は、ヒドロキシル、C1−C4−アルキルまたはC1−C4−アルコキシである。]の製造方法において、
第1段階で、下記式(VI)のコハク酸モノアミドカルボキシレート類:
RはR1またはR2であり、
Mは、アルカリ金属、アルカリ土類金属、遷移金属および金属からなる群から選択されるカチオンであり、
mは1、2、3または4である。]を、適宜に希釈剤の存在下に過剰量の塩化チオニルと反応させ、
次に過剰な塩化チオニルを除去し、得られた生成物混合物を第2段階で、有機溶媒中、式(I)のジチイン−テトラカルボキシイミド類に変換することを特徴とする方法。 - 第1段階において、式(VI)のコハク酸モノアミド1モル当たり2から100molの塩化チオニルを用いる請求項1に記載の方法。
- 第1段階を希釈剤を用いずに行う請求項1から5のうちのいずれか1項に記載の方法。
- 第2段階において、水と少なくとも部分的に混和性である溶媒を用いる請求項1から5のいずれか1項に記載の方法。
- 前記第2段階で使用される溶媒が水、ジメチルスルホキシド、スルホラン、メタノール、エタノール、プロパノール、イソプロパノール、1−ブタノール、2−ブタノール、イソブタノール、tert−ブタノール、1−ペンタノール、シクロペンタノール、シクロヘキサノール、エチレングリコール、エチレングリコールモノメチルエーテルなどのアルコール類、ヘキサン、ヘプタン、シクロヘキサン、メチルシクロヘキサン、トルエン、キシレン、メシチレン、クロロベンゼン、ジクロロベンゼン、ニトロベンゼンなどの炭化水素、酢酸メチル、酢酸エチルなどのエステル類、ホルムアミド、N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチルピロリドンなどのアミド類、メチルtert−ブチルエーテル、テトラヒドロフラン、1,4−ジオキサンなどのエーテル類、アセトニトリル、プロピオニトリル、ブチロニトリル、ベンゾニトリルなどのニトリル類、アセトン、メチルエチルケトン、メチルイソブチルケトン、ピナコロンなどのケトン類、ギ酸、酢酸、プロピオン酸などのカルボン酸類、またはこれら希釈剤の混合物を含む請求項1から7のうちのいずれか1項に記載の方法。
- 前記第2段階を20℃から150℃の温度で行う請求項1から8のうちのいずれか1項に記載の方法。
- 下記式(IX)のポリスルフィド類:
R1およびR2は同一であるか異なっており、水素であるか、ハロゲン、−OR3および/または−COR4によって1回もしくはそれ以上置換されていても良いC1−C8−アルキルであるか、ハロゲン、C1−C4−アルキルまたはC1−C4−ハロアルキルによって1回もしくはそれ以上置換されていても良いC3−C7−シクロアルキルであるか、それぞれハロゲン、C1−C4−アルキル、C1−C4−ハロアルキル、−COR4またはスルホニルアミノによって1回もしくはそれ以上置換されていても良いアリールもしくはアリール−(C1−C4−アルキル)であり、
R3は、水素、C1−C4−アルキルもしくはC1−C4−アルキルカルボニルであるか、ハロゲン、C1−C4−アルキルまたはC1−C4−ハロアルキルによって1回もしくはそれ以上置換されていても良いアリールであり、
R4は、ヒドロキシル、C1−C4−アルキルまたはC1−C4−アルコキシであり、
nは0、1または2である。]
および下記式(VIII)のチオスルホン酸誘導体:
第1段階で、下記式(VI)のコハク酸モノアミド類:
RはR1またはR2であり、
Mは、アルカリ金属、アルカリ土類金属、遷移金属および金属からなる群から選択されるカチオンであり、
mは1、2、3もしくは4である。]を、適宜に希釈剤の存在下に過剰量の塩化チオニルと反応させることを特徴とする方法。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP11185004 | 2011-10-13 | ||
| EP11185004.6 | 2011-10-13 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2014530228A true JP2014530228A (ja) | 2014-11-17 |
Family
ID=47022660
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014535060A Pending JP2014530228A (ja) | 2011-10-13 | 2012-10-11 | ジチインテトラカルボキシイミド類の製造方法 |
Country Status (10)
| Country | Link |
|---|---|
| US (1) | US20140256956A1 (ja) |
| EP (1) | EP2766371A1 (ja) |
| JP (1) | JP2014530228A (ja) |
| KR (1) | KR20140088561A (ja) |
| CN (1) | CN103987716A (ja) |
| BR (1) | BR112014008729A2 (ja) |
| IL (1) | IL231878A0 (ja) |
| IN (1) | IN2014CN02645A (ja) |
| MX (1) | MX2014004096A (ja) |
| WO (1) | WO2013053783A1 (ja) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2641908A1 (de) * | 2012-03-23 | 2013-09-25 | Bayer CropScience AG | Verfahren zur Herstellung von Dithiin-tetracarboximiden |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3364229A (en) | 1964-01-30 | 1968-01-16 | Shell Oil Co | 1, 4 dithiin-2, 3, 5, 6-tetracarboximides and process for their preparation |
| PL143804B2 (en) | 1985-10-15 | 1988-03-31 | Univ Lodzki | Process for preparing novel derivatives of 2,6-diphenyl-2,3,6,7-tetrahydro-1h,5h-1,4-dithiin-/2,3-c:5,6-c/-diprolo-1,3,5,7-tetraon substituted in phenyl ring |
| JP3530702B2 (ja) | 1997-03-06 | 2004-05-24 | 京セラミタ株式会社 | ジチオマレイン酸イミド誘導体を用いた電子写真感光体 |
| KR101710485B1 (ko) * | 2008-10-15 | 2017-02-27 | 바이엘 인텔렉쳐 프로퍼티 게엠베하 | 식물병원성 진균을 구제하기 위한 디티인 테트라카복사미드의 용도 |
| KR101863621B1 (ko) * | 2010-04-14 | 2018-06-04 | 바이엘 인텔렉쳐 프로퍼티 게엠베하 | 디티인 테트라카복시미드의 제조방법 |
| BR112012026411A2 (pt) * | 2010-04-14 | 2015-09-08 | Bayer Cropscience Ag | processo para preparar ditiina-tetracarboxi-diiminas |
| KR20140000671A (ko) * | 2010-09-03 | 2014-01-03 | 바이엘 인텔렉쳐 프로퍼티 게엠베하 | 식물병원성 진균을 구제하기 위한 디티인테트라(티오)카복사미드 |
| JP5756522B2 (ja) * | 2010-09-03 | 2015-07-29 | バイエル・インテレクチュアル・プロパティ・ゲゼルシャフト・ミット・ベシュレンクテル・ハフツングBayer Intellectual Property GmbH | ジチイン−テトラカルボキシイミド類を製造する方法 |
| EP2766372A1 (de) * | 2011-10-13 | 2014-08-20 | Bayer Intellectual Property GmbH | Verfahren zur herstellung von dithiin-tetracarboximiden |
| EP2641908A1 (de) * | 2012-03-23 | 2013-09-25 | Bayer CropScience AG | Verfahren zur Herstellung von Dithiin-tetracarboximiden |
-
2012
- 2012-10-10 US US14/350,893 patent/US20140256956A1/en not_active Abandoned
- 2012-10-11 KR KR1020147012604A patent/KR20140088561A/ko not_active Withdrawn
- 2012-10-11 EP EP12772924.2A patent/EP2766371A1/de not_active Withdrawn
- 2012-10-11 MX MX2014004096A patent/MX2014004096A/es not_active Application Discontinuation
- 2012-10-11 BR BR112014008729A patent/BR112014008729A2/pt not_active IP Right Cessation
- 2012-10-11 WO PCT/EP2012/070104 patent/WO2013053783A1/de not_active Ceased
- 2012-10-11 CN CN201280050044.4A patent/CN103987716A/zh active Pending
- 2012-10-11 JP JP2014535060A patent/JP2014530228A/ja active Pending
- 2012-10-11 IN IN2645CHN2014 patent/IN2014CN02645A/en unknown
-
2014
- 2014-04-02 IL IL231878A patent/IL231878A0/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| KR20140088561A (ko) | 2014-07-10 |
| EP2766371A1 (de) | 2014-08-20 |
| BR112014008729A2 (pt) | 2017-04-18 |
| IL231878A0 (en) | 2014-05-28 |
| IN2014CN02645A (ja) | 2015-08-07 |
| US20140256956A1 (en) | 2014-09-11 |
| CN103987716A (zh) | 2014-08-13 |
| MX2014004096A (es) | 2014-07-09 |
| WO2013053783A1 (de) | 2013-04-18 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2013534904A (ja) | ジチイン−テトラカルボキシ−ジイミド類の製造方法 | |
| JP5816262B2 (ja) | ジチインテトラカルボキシイミド類の製造方法 | |
| CA2765897A1 (en) | Preparation of substituted 2-fluoroacrylic acid derivatives | |
| JP5816263B2 (ja) | ジチイン−テトラカルボキシ−ジイミド類の製造方法 | |
| DK2571887T3 (en) | A process for the preparation of dithiine-tetracarboxy-diimides | |
| JP2014530228A (ja) | ジチインテトラカルボキシイミド類の製造方法 | |
| JP2014532064A (ja) | ジチインテトラカルボキシイミド類の製造方法 | |
| TW201321387A (zh) | 製備二硫雜己環并-四甲醯胺類之方法 | |
| KR20080094075A (ko) | 3,4-이치환된 페닐아세트산의 제조 방법 및 신규한 중간체 | |
| TWI749046B (zh) | 製備經取代的2,3-二氫-1-苯并呋喃衍生物之方法 | |
| US20080045727A1 (en) | Chiral 3-Halophthalic Acid Derivatives | |
| CA3188715A1 (en) | Process for preparation of substituted pyrazoles | |
| ITMI20062450A1 (it) | Procedimento per la preparazione di entacapone | |
| HU205897B (en) | Process for producing cyclohexanetrione-carboxylic acid-thiolesters | |
| HK1129656A (en) | Process for preparing 3, 4-disubstituted phenylacetic acids and novel intermediates | |
| JPH10501542A (ja) | ベンゾチオフェン誘導体の製造方法 |