JP2014521364A5 - - Google Patents
Download PDFInfo
- Publication number
- JP2014521364A5 JP2014521364A5 JP2014525943A JP2014525943A JP2014521364A5 JP 2014521364 A5 JP2014521364 A5 JP 2014521364A5 JP 2014525943 A JP2014525943 A JP 2014525943A JP 2014525943 A JP2014525943 A JP 2014525943A JP 2014521364 A5 JP2014521364 A5 JP 2014521364A5
- Authority
- JP
- Japan
- Prior art keywords
- sodium
- tnfr
- buffer
- fusion protein
- group
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
- 102000037240 fusion proteins Human genes 0.000 claims 13
- 108020001507 fusion proteins Proteins 0.000 claims 13
- 239000006167 equilibration buffer Substances 0.000 claims 9
- 239000012149 elution buffer Substances 0.000 claims 7
- KEAYESYHFKHZAL-UHFFFAOYSA-N sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 claims 7
- 239000011734 sodium Substances 0.000 claims 7
- 229910052708 sodium Inorganic materials 0.000 claims 7
- 239000000203 mixture Substances 0.000 claims 6
- PMZURENOXWZQFD-UHFFFAOYSA-L na2so4 Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 claims 5
- 150000003839 salts Chemical class 0.000 claims 5
- 239000011780 sodium chloride Substances 0.000 claims 5
- 238000002347 injection Methods 0.000 claims 4
- 239000007924 injection Substances 0.000 claims 4
- 229910052938 sodium sulfate Inorganic materials 0.000 claims 4
- 235000011152 sodium sulphate Nutrition 0.000 claims 4
- HRXKRNGNAMMEHJ-UHFFFAOYSA-K Trisodium citrate Chemical compound [Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O HRXKRNGNAMMEHJ-UHFFFAOYSA-K 0.000 claims 3
- HHLMIPMLRQMODA-UHFFFAOYSA-M [Na+].OP(O)(O)=O.OS([O-])(=O)=O Chemical compound [Na+].OP(O)(O)=O.OS([O-])(=O)=O HHLMIPMLRQMODA-UHFFFAOYSA-M 0.000 claims 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 claims 3
- 239000001509 sodium citrate Substances 0.000 claims 3
- 239000011778 trisodium citrate Substances 0.000 claims 3
- UIIMBOGNXHQVGW-UHFFFAOYSA-M buffer Substances [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 claims 2
- 239000007853 buffer solution Substances 0.000 claims 2
- 238000004191 hydrophobic interaction chromatography Methods 0.000 claims 2
- 210000004962 mammalian cells Anatomy 0.000 claims 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 claims 2
- 239000001488 sodium phosphate Substances 0.000 claims 2
- 229910000162 sodium phosphate Inorganic materials 0.000 claims 2
- FYKDNWHPKQOZOT-UHFFFAOYSA-M sodium;dihydrogen phosphate;2-hydroxypropane-1,2,3-tricarboxylic acid Chemical compound [Na+].OP(O)([O-])=O.OC(=O)CC(O)(C(O)=O)CC(O)=O FYKDNWHPKQOZOT-UHFFFAOYSA-M 0.000 claims 2
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 claims 2
- 239000011534 wash buffer Substances 0.000 claims 2
- KRKNYBCHXYNGOX-UHFFFAOYSA-K 2qpq Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 claims 1
- BFNBIHQBYMNNAN-UHFFFAOYSA-N Ammonium sulfate Chemical compound N.N.OS(O)(=O)=O BFNBIHQBYMNNAN-UHFFFAOYSA-N 0.000 claims 1
- 238000001042 affinity chromatography Methods 0.000 claims 1
- 125000000217 alkyl group Chemical group 0.000 claims 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 claims 1
- 229910052921 ammonium sulfate Inorganic materials 0.000 claims 1
- 235000011130 ammonium sulphate Nutrition 0.000 claims 1
- 238000011033 desalting Methods 0.000 claims 1
- 238000004255 ion exchange chromatography Methods 0.000 claims 1
- 238000004519 manufacturing process Methods 0.000 claims 1
- 125000002347 octyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 claims 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims 1
- 239000011347 resin Substances 0.000 claims 1
- 229920005989 resin Polymers 0.000 claims 1
- 238000005406 washing Methods 0.000 claims 1
Images
Claims (22)
- a)クエン酸ナトリウム、硫酸ナトリウム及びリン酸ナトリウムからなる群から選択される少なくとも1つの塩を含む平衡化緩衝液で前平衡化された疎水性相互作用クロマトグラフィー(HIC)カラムに、哺乳類細胞から生産されたTNFR−Fc融合タンパク質の混合物を含む試料を、クロマトグラフィーレジン体積当たり10g/L bed〜14g/L bedの量で注入するステップと、
b)前記平衡化緩衝液の塩と同じ塩を含む洗浄緩衝液で前記カラムを洗浄して、TNFR−Fc融合タンパク質の混合物から切断型TNFR−Fc融合タンパク質を除去するステップと、
c)前記平衡化緩衝液より塩濃度を減少させた溶出緩衝液で前記カラムから活性型TNFR−Fc融合タンパク質を溶出させるステップとを含む、
活性型TNFR−Fc融合タンパク質を製造する方法。 - 前記ステップa)の平衡化緩衝液が0.45M〜0.55Mクエン酸ナトリウム及び50mM〜100mMリン酸ナトリウムを含む緩衝液である、請求項1に記載の方法。
- 前記ステップa)の平衡化緩衝液が0.70M〜0.72M硫酸ナトリウム及び50mM〜100mMリン酸ナトリウムを含む緩衝液である、請求項1に記載の方法。
- 前記平衡化緩衝液がpH6.5〜7.0である、請求項1〜3のいずれか1項に記載の方法。
- 前記平衡化緩衝液がpH6.7〜6.9であり、0.48M〜0.52Mクエン酸ナトリウム及び50mM〜70mMリン酸ナトリウムを含む、請求項2に記載の方法。
- 前記平衡化緩衝液がpH6.7〜6.9であり、0.71M〜0.72M硫酸ナトリウム及び50mM〜70mMリン酸ナトリウムを含む、請求項3に記載の方法。
- 前記カラムのリガンドがブチル基、オクチル基、フェニル基及びアルキル基からなる群から選択される、請求項1に記載の方法。
- 前記ステップa)のTNFR−Fc融合タンパク質がpcDNA3.1−Kozak−TNFRII−Fc−IRES−GSベクターの導入された哺乳類細胞から生産される、請求項1に記載の方法。
- 前記TNFR−Fc融合タンパク質が、カラムに注入する前にアフィニティークロマトグラフィー、イオン交換クロマトグラフィー及び脱塩からなる群から選択される少なくとも1つの方法で部分精製される、請求項1に記載の方法。
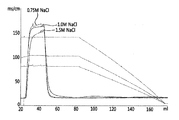
- 前記TNFR−Fc融合タンパク質の混合物を含む試料が、注入前に50mS/cm〜75mS/cmの伝導度を有するように調節される、請求項1に記載の方法。
- 前記伝導度がクエン酸ナトリウム、硫酸ナトリウム及び硫酸アンモニウムからなる群から選択される少なくとも1つの塩で調整される、請求項10に記載の方法。
- 前記TNFR−Fc融合タンパク質の混合物を含む試料が、注入前にクエン酸ナトリウムを用いて50mS/cm〜55mS/cmの伝導度に調整される、請求項1に記載の方法。
- 前記TNFR−Fc融合タンパク質の混合物を含む試料が、注入前に硫酸ナトリウムを用いて65mS/cm〜75mS/cmの伝導度を有するように調整される、請求項1に記載の方法。
- 前記ステップb)の洗浄緩衝液がステップa)の平衡化緩衝液と同じ組成である、請求項1に記載の方法。
- 前記ステップc)が40mS/cm〜47mS/cmの伝導度を有する溶出緩衝液で活性型TNFR−Fc融合タンパク質を溶出させるステップである、請求項1に記載の方法。
- 前記ステップc)の溶出緩衝液が0.35M〜0.4Mの範囲のクエン酸ナトリウムを含む、請求項1に記載の方法。
- 前記ステップc)の溶出緩衝液が0.35M〜0.56Mの範囲の硫酸ナトリウムを含む、請求項1に記載の方法。
- 前記溶出緩衝液がpH6.5〜7.0である、請求項15〜17のいずれか1項に記載の方法。
- 前記溶出緩衝液がpH6.7〜6.9であり、0.38M〜0.4Mクエン酸ナトリウム及び50mM〜70mMリン酸ナトリウムを含む、請求項16に記載の方法。
- 前記溶出緩衝液がpH6.7〜6.9であり、0.38M〜0.4M硫酸ナトリウム及び50mM〜70mMリン酸ナトリウムを含む、請求項17に記載の方法。
- 前記方法が、pHが6.5〜7.0であり、伝導度が4mS/cm〜6mS/cmの緩衝液を用いてカラムから不活性型TNFR−Fc融合タンパク質又はTNFR−Fc融合タンパク質凝集体を含む分画を分離するステップd)をさらに含む、請求項1に記載の方法。
- 前記ステップd)で使用する緩衝液が、pHが6.7〜6.9であり、50mM〜70mMリン酸を含む、請求項21に記載の方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR10-2011-0081854 | 2011-08-17 | ||
| KR20110081854 | 2011-08-17 | ||
| PCT/KR2012/006564 WO2013025079A1 (en) | 2011-08-17 | 2012-08-17 | Method for preparing active form of tnfr-fc fusion protein |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016105574A Division JP2016168049A (ja) | 2011-08-17 | 2016-05-26 | 活性型TNFR−Fc融合タンパク質を製造する方法 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2014521364A JP2014521364A (ja) | 2014-08-28 |
| JP2014521364A5 true JP2014521364A5 (ja) | 2015-10-29 |
| JP6223338B2 JP6223338B2 (ja) | 2017-11-01 |
Family
ID=47715279
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014525943A Expired - Fee Related JP6223338B2 (ja) | 2011-08-17 | 2012-08-17 | 活性型TNFR−Fc融合タンパク質を製造する方法 |
| JP2016105574A Pending JP2016168049A (ja) | 2011-08-17 | 2016-05-26 | 活性型TNFR−Fc融合タンパク質を製造する方法 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016105574A Pending JP2016168049A (ja) | 2011-08-17 | 2016-05-26 | 活性型TNFR−Fc融合タンパク質を製造する方法 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US9279014B2 (ja) |
| EP (1) | EP2753634B1 (ja) |
| JP (2) | JP6223338B2 (ja) |
| KR (1) | KR101454316B1 (ja) |
| ES (1) | ES2651483T3 (ja) |
| WO (1) | WO2013025079A1 (ja) |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP6220789B2 (ja) | 2011-10-18 | 2017-10-25 | コヒラス・バイオサイエンシズ・インコーポレイテッド | 糖およびポリオールの組合せによって安定化されたエタネルセプト製剤 |
| BR112014022409A2 (pt) * | 2012-03-12 | 2018-09-25 | Hanwha Chemical Corp | vetor de expressão que compreende um polinucleotídeo codificante de uma glutamina-sintetase modificada e um método para a preparação de uma proteína alvo oue emprega o mesmo |
| CN104902914B (zh) | 2012-09-11 | 2019-01-01 | 科荣生生物科学公司 | 高纯度和优异产量的正确折叠的依那西普 |
| MX2015010427A (es) | 2013-02-13 | 2016-03-17 | Lab Francais Du Fractionnement | Anticuerpos anti-tnf-alfa altamente galactosilados y sus usos. |
| BR112016029157A8 (pt) * | 2014-06-13 | 2021-07-06 | Lupin Ltd | processo para purificar a proteína de fusão tnfr:fc |
| EP2975050B1 (en) | 2014-07-18 | 2019-05-29 | Sandoz Ag | Quantification of misfolded TNFR2:Fc |
| AU2015372801B2 (en) * | 2014-12-31 | 2018-12-20 | Lg Chem, Ltd. | Method for preparing tnfr-fc fusion protein containing target content of impurities |
| US20180079796A1 (en) * | 2015-03-13 | 2018-03-22 | Samsung Bioepis Co., Ltd. | Anti-tnf-alpha polypeptide composition and use thereof |
| US11952399B2 (en) * | 2018-12-18 | 2024-04-09 | Amgen Inc. | Methods for purifying proteins |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| TR200504220T2 (tr) * | 1998-12-17 | 2007-04-24 | Biogen Idec Ma Inc. | Aktif limfotoksin-beta reseptör imunoglobülin şimeAktif limfotoksin-beta reseptör imunoglobülin şimerik proteinlerinin yüksek düzey ifadesi ve saflaştrik proteinlerinin yüksek düzey ifadesi ve saflaştırılması için bir yöntem.ırılması için bir yöntem. |
| US7294481B1 (en) | 1999-01-05 | 2007-11-13 | Immunex Corporation | Method for producing recombinant proteins |
| ES2618832T3 (es) | 2002-02-27 | 2017-06-22 | Immunex Corporation | Composición TNFR-FC estabilizada que comprende arginina |
| EP1687328B1 (en) * | 2003-10-24 | 2010-03-31 | Amgen, Inc. | Process for purifying proteins in a hydrophobic interaction chromatography flow-through fraction |
| ATE540967T1 (de) | 2004-01-30 | 2012-01-15 | Amgen Inc | Verfahren zur reinigung von proteinen |
| US20110129468A1 (en) | 2008-02-29 | 2011-06-02 | Biogen Idec Ma Inc. | Purified immunoglobulin fusion proteins and methods of their purification |
| CN102675465A (zh) * | 2011-03-09 | 2012-09-19 | 上海赛金生物医药有限公司 | 重组人ⅱ型肿瘤坏死因子受体-抗体融合蛋白的纯化方法 |
| EP2723759A4 (en) * | 2011-06-24 | 2015-01-28 | Reddys Lab Ltd Dr | PURIFICATION OF CHIMERIC PROTEIN |
-
2012
- 2012-08-17 KR KR1020120090341A patent/KR101454316B1/ko active IP Right Grant
- 2012-08-17 US US14/239,216 patent/US9279014B2/en active Active
- 2012-08-17 JP JP2014525943A patent/JP6223338B2/ja not_active Expired - Fee Related
- 2012-08-17 ES ES12823797.1T patent/ES2651483T3/es active Active
- 2012-08-17 WO PCT/KR2012/006564 patent/WO2013025079A1/en active Application Filing
- 2012-08-17 EP EP12823797.1A patent/EP2753634B1/en active Active
-
2016
- 2016-05-26 JP JP2016105574A patent/JP2016168049A/ja active Pending
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2014521364A5 (ja) | ||
| US10053489B2 (en) | Method for purifying antibody | |
| JP6092892B2 (ja) | 抗体の精製方法 | |
| Vançan et al. | IMAC of human IgG: studies with IDA-immobilized copper, nickel, zinc, and cobalt ions and different buffer systems | |
| JP2015051975A5 (ja) | ||
| RU2017100005A (ru) | Способ очистки белка слияния | |
| NZ627668A (en) | Isolation and purification of anti-il-13 antibodies using protein a affinity chromatography | |
| NZ587511A (en) | Purified lymphotoxin-beta-receptor immunoglobulin fusion proteins and methods of their purification | |
| JP2017521389A5 (ja) | ||
| Hu et al. | Determination of benzimidazole residues in animal tissue samples by combination of magnetic solid-phase extraction with capillary zone electrophoresis | |
| RU2015122726A (ru) | ОПОСРЕДОВАННАЯ ИОННОЙ СИЛОЙ рН-ГРАДИЕНТНАЯ ИОНООБМЕННАЯ ХРОМАТОГРАФИЯ | |
| US20090187005A1 (en) | Enhanced purification of antibodies and antibody fragments by apatite chromatography | |
| CN102858971B (zh) | 纯化维生素k依赖性蛋白如凝血因子ix的方法 | |
| JP2015042645A5 (ja) | ||
| Gerola et al. | Zwitterionic surfactants in ion binding and catalysis | |
| RU2016103770A (ru) | Ротавирусные частицы с химерными поверхностными белками | |
| CN101249427B (zh) | 一种极性离子交换电色谱柱的原料配方及制备方法 | |
| Tong et al. | Caprylate as the albumin-selective modifier to improve IgG purification with hydrophobic charge-induction chromatography | |
| JP2017519838A (ja) | タンパク質の精製のための方法及び試薬 | |
| Huang et al. | Regulation of protein multipoint adsorption on ion-exchange adsorbent and its application to the purification of macromolecules | |
| US20210139535A1 (en) | Method for purifying antibodies | |
| Tian et al. | Simultaneous separation of acidic and basic proteins using gemini pyrrolidinium surfactants and hexafluoroisopropanol as dynamic coating additives in capillary electrophoresis | |
| Zhu et al. | Optimization of [CnPy] Cl (n= 2, 4, 6) ionic liquid aqueous two-phase system extraction of papain using response surface methodology with box-behnken design | |
| Poplewska et al. | Dissociation events during processing of monoclonal antibodies on strong cation exchange resins | |
| EP1765849A1 (en) | Process for protein isolation |