JP2012529281A - 抗EpCAM抗体 - Google Patents
抗EpCAM抗体 Download PDFInfo
- Publication number
- JP2012529281A JP2012529281A JP2012514538A JP2012514538A JP2012529281A JP 2012529281 A JP2012529281 A JP 2012529281A JP 2012514538 A JP2012514538 A JP 2012514538A JP 2012514538 A JP2012514538 A JP 2012514538A JP 2012529281 A JP2012529281 A JP 2012529281A
- Authority
- JP
- Japan
- Prior art keywords
- antibody
- seq
- sequence
- epcam
- amino acid
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 108010066687 Epithelial Cell Adhesion Molecule Proteins 0.000 claims abstract description 248
- 238000000034 method Methods 0.000 claims abstract description 103
- 206010028980 Neoplasm Diseases 0.000 claims abstract description 97
- 239000000203 mixture Substances 0.000 claims abstract description 67
- 201000011510 cancer Diseases 0.000 claims abstract description 57
- 229940127121 immunoconjugate Drugs 0.000 claims abstract description 56
- 238000011282 treatment Methods 0.000 claims abstract description 34
- 102000018651 Epithelial Cell Adhesion Molecule Human genes 0.000 claims abstract description 12
- 241000282414 Homo sapiens Species 0.000 claims description 178
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 142
- 230000027455 binding Effects 0.000 claims description 129
- 102100035360 Cerebellar degeneration-related antigen 1 Human genes 0.000 claims description 110
- 239000000427 antigen Substances 0.000 claims description 85
- 150000007523 nucleic acids Chemical class 0.000 claims description 85
- 108091007433 antigens Proteins 0.000 claims description 75
- 102000036639 antigens Human genes 0.000 claims description 75
- 108020004707 nucleic acids Proteins 0.000 claims description 74
- 102000039446 nucleic acids Human genes 0.000 claims description 74
- 239000012634 fragment Substances 0.000 claims description 51
- 239000003814 drug Substances 0.000 claims description 50
- 150000001413 amino acids Chemical class 0.000 claims description 46
- 241001465754 Metazoa Species 0.000 claims description 41
- 238000012360 testing method Methods 0.000 claims description 38
- 239000013604 expression vector Substances 0.000 claims description 32
- 229940124597 therapeutic agent Drugs 0.000 claims description 31
- 108010021625 Immunoglobulin Fragments Proteins 0.000 claims description 30
- 102000008394 Immunoglobulin Fragments Human genes 0.000 claims description 30
- 102000023732 binding proteins Human genes 0.000 claims description 25
- 108091008324 binding proteins Proteins 0.000 claims description 25
- 239000002246 antineoplastic agent Substances 0.000 claims description 23
- 241000282693 Cercopithecidae Species 0.000 claims description 22
- 239000003795 chemical substances by application Substances 0.000 claims description 22
- 239000000032 diagnostic agent Substances 0.000 claims description 20
- 229940039227 diagnostic agent Drugs 0.000 claims description 20
- 206010006187 Breast cancer Diseases 0.000 claims description 19
- 208000026310 Breast neoplasm Diseases 0.000 claims description 19
- 238000006467 substitution reaction Methods 0.000 claims description 19
- 210000001519 tissue Anatomy 0.000 claims description 18
- 238000002560 therapeutic procedure Methods 0.000 claims description 17
- 239000002773 nucleotide Substances 0.000 claims description 15
- 125000003729 nucleotide group Chemical group 0.000 claims description 15
- 229940127089 cytotoxic agent Drugs 0.000 claims description 14
- -1 another antibody Substances 0.000 claims description 13
- 230000001939 inductive effect Effects 0.000 claims description 13
- 238000003745 diagnosis Methods 0.000 claims description 11
- 208000005718 Stomach Neoplasms Diseases 0.000 claims description 9
- 230000015572 biosynthetic process Effects 0.000 claims description 9
- 238000004519 manufacturing process Methods 0.000 claims description 9
- 241000700605 Viruses Species 0.000 claims description 8
- 239000000539 dimer Substances 0.000 claims description 8
- 206010017758 gastric cancer Diseases 0.000 claims description 8
- 238000003384 imaging method Methods 0.000 claims description 8
- 201000011549 stomach cancer Diseases 0.000 claims description 8
- 102000004127 Cytokines Human genes 0.000 claims description 7
- 108090000695 Cytokines Proteins 0.000 claims description 7
- 230000006907 apoptotic process Effects 0.000 claims description 7
- 208000000236 Prostatic Neoplasms Diseases 0.000 claims description 6
- 239000004037 angiogenesis inhibitor Substances 0.000 claims description 6
- 239000002254 cytotoxic agent Substances 0.000 claims description 6
- 108010012236 Chemokines Proteins 0.000 claims description 5
- 102000019034 Chemokines Human genes 0.000 claims description 5
- 206010009944 Colon cancer Diseases 0.000 claims description 5
- 206010060862 Prostate cancer Diseases 0.000 claims description 5
- 239000000362 adenosine triphosphatase inhibitor Substances 0.000 claims description 5
- 239000000701 coagulant Substances 0.000 claims description 5
- 150000003431 steroids Chemical class 0.000 claims description 5
- 238000001959 radiotherapy Methods 0.000 claims description 4
- 229940121819 ATPase inhibitor Drugs 0.000 claims description 3
- 208000022072 Gallbladder Neoplasms Diseases 0.000 claims description 3
- 206010061535 Ovarian neoplasm Diseases 0.000 claims description 3
- 206010061902 Pancreatic neoplasm Diseases 0.000 claims description 3
- 108010003723 Single-Domain Antibodies Proteins 0.000 claims description 3
- 238000012258 culturing Methods 0.000 claims description 3
- 201000010175 gallbladder cancer Diseases 0.000 claims description 3
- 208000020816 lung neoplasm Diseases 0.000 claims description 3
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 claims description 3
- 201000002528 pancreatic cancer Diseases 0.000 claims description 3
- 208000008443 pancreatic carcinoma Diseases 0.000 claims description 3
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims description 2
- 206010005003 Bladder cancer Diseases 0.000 claims description 2
- 206010008342 Cervix carcinoma Diseases 0.000 claims description 2
- 208000001333 Colorectal Neoplasms Diseases 0.000 claims description 2
- 208000032612 Glial tumor Diseases 0.000 claims description 2
- 206010018338 Glioma Diseases 0.000 claims description 2
- 208000008839 Kidney Neoplasms Diseases 0.000 claims description 2
- 206010061523 Lip and/or oral cavity cancer Diseases 0.000 claims description 2
- 206010062038 Lip neoplasm Diseases 0.000 claims description 2
- 206010058467 Lung neoplasm malignant Diseases 0.000 claims description 2
- 208000003445 Mouth Neoplasms Diseases 0.000 claims description 2
- 206010033128 Ovarian cancer Diseases 0.000 claims description 2
- 206010038389 Renal cancer Diseases 0.000 claims description 2
- 208000006265 Renal cell carcinoma Diseases 0.000 claims description 2
- 208000000453 Skin Neoplasms Diseases 0.000 claims description 2
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 claims description 2
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 claims description 2
- 210000004369 blood Anatomy 0.000 claims description 2
- 239000008280 blood Substances 0.000 claims description 2
- 201000010881 cervical cancer Diseases 0.000 claims description 2
- 201000010536 head and neck cancer Diseases 0.000 claims description 2
- 208000014829 head and neck neoplasm Diseases 0.000 claims description 2
- 206010073071 hepatocellular carcinoma Diseases 0.000 claims description 2
- 231100000844 hepatocellular carcinoma Toxicity 0.000 claims description 2
- 201000010982 kidney cancer Diseases 0.000 claims description 2
- 201000006721 lip cancer Diseases 0.000 claims description 2
- 201000007270 liver cancer Diseases 0.000 claims description 2
- 208000014018 liver neoplasm Diseases 0.000 claims description 2
- 201000005202 lung cancer Diseases 0.000 claims description 2
- 238000011275 oncology therapy Methods 0.000 claims description 2
- 229910052721 tungsten Inorganic materials 0.000 claims description 2
- 201000005112 urinary bladder cancer Diseases 0.000 claims description 2
- 206010046885 vaginal cancer Diseases 0.000 claims description 2
- 208000013139 vaginal neoplasm Diseases 0.000 claims description 2
- 230000009278 visceral effect Effects 0.000 claims description 2
- 208000000461 Esophageal Neoplasms Diseases 0.000 claims 1
- 206010029098 Neoplasm skin Diseases 0.000 claims 1
- 206010030155 Oesophageal carcinoma Diseases 0.000 claims 1
- 238000000375 direct analysis in real time Methods 0.000 claims 1
- 238000012063 dual-affinity re-targeting Methods 0.000 claims 1
- 201000004101 esophageal cancer Diseases 0.000 claims 1
- 230000002496 gastric effect Effects 0.000 claims 1
- 208000015347 renal cell adenocarcinoma Diseases 0.000 claims 1
- 230000000694 effects Effects 0.000 abstract description 29
- 230000010056 antibody-dependent cellular cytotoxicity Effects 0.000 abstract description 25
- 230000009260 cross reactivity Effects 0.000 abstract description 6
- 230000008901 benefit Effects 0.000 abstract description 5
- 102100031940 Epithelial cell adhesion molecule Human genes 0.000 description 277
- 210000004027 cell Anatomy 0.000 description 145
- 108090000623 proteins and genes Proteins 0.000 description 74
- 108010047041 Complementarity Determining Regions Proteins 0.000 description 73
- 102000004169 proteins and genes Human genes 0.000 description 59
- 235000018102 proteins Nutrition 0.000 description 55
- 235000001014 amino acid Nutrition 0.000 description 50
- 229950009084 adecatumumab Drugs 0.000 description 46
- 229940024606 amino acid Drugs 0.000 description 42
- 101000920667 Homo sapiens Epithelial cell adhesion molecule Proteins 0.000 description 35
- 210000004881 tumor cell Anatomy 0.000 description 31
- 238000009472 formulation Methods 0.000 description 29
- 230000004540 complement-dependent cytotoxicity Effects 0.000 description 28
- 238000000338 in vitro Methods 0.000 description 27
- 230000001225 therapeutic effect Effects 0.000 description 27
- 201000010099 disease Diseases 0.000 description 23
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 23
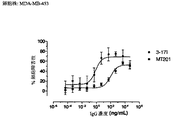
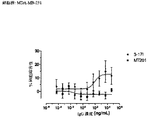
- 238000003556 assay Methods 0.000 description 22
- 230000014509 gene expression Effects 0.000 description 22
- 238000001727 in vivo Methods 0.000 description 20
- 238000002965 ELISA Methods 0.000 description 19
- 239000000523 sample Substances 0.000 description 19
- 239000013598 vector Substances 0.000 description 17
- 239000000651 prodrug Substances 0.000 description 16
- 229940002612 prodrug Drugs 0.000 description 16
- 238000009396 hybridization Methods 0.000 description 15
- 230000000259 anti-tumor effect Effects 0.000 description 13
- 241000282567 Macaca fascicularis Species 0.000 description 12
- 101100501585 Mus musculus Epcam gene Proteins 0.000 description 12
- 230000006870 function Effects 0.000 description 12
- 229940051026 immunotoxin Drugs 0.000 description 11
- 230000002637 immunotoxin Effects 0.000 description 11
- 239000002596 immunotoxin Substances 0.000 description 11
- 231100000608 immunotoxin Toxicity 0.000 description 11
- 230000035772 mutation Effects 0.000 description 11
- 238000003259 recombinant expression Methods 0.000 description 11
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 10
- 241000699666 Mus <mouse, genus> Species 0.000 description 10
- 108091028043 Nucleic acid sequence Proteins 0.000 description 10
- 238000010790 dilution Methods 0.000 description 10
- 239000012895 dilution Substances 0.000 description 10
- 230000001965 increasing effect Effects 0.000 description 10
- 230000002147 killing effect Effects 0.000 description 10
- 239000003550 marker Substances 0.000 description 10
- 230000004048 modification Effects 0.000 description 10
- 238000012986 modification Methods 0.000 description 10
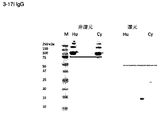
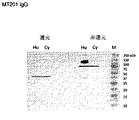
- 238000001262 western blot Methods 0.000 description 10
- 108010039209 Blood Coagulation Factors Proteins 0.000 description 9
- 102000015081 Blood Coagulation Factors Human genes 0.000 description 9
- 239000012980 RPMI-1640 medium Substances 0.000 description 9
- 238000004458 analytical method Methods 0.000 description 9
- 239000003114 blood coagulation factor Substances 0.000 description 9
- 238000000684 flow cytometry Methods 0.000 description 9
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 9
- 239000003053 toxin Substances 0.000 description 9
- 231100000765 toxin Toxicity 0.000 description 9
- 108700012359 toxins Proteins 0.000 description 9
- 241000282412 Homo Species 0.000 description 8
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 8
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 8
- 229940079593 drug Drugs 0.000 description 8
- 230000004927 fusion Effects 0.000 description 8
- 239000001963 growth medium Substances 0.000 description 8
- 230000001976 improved effect Effects 0.000 description 8
- 230000005764 inhibitory process Effects 0.000 description 8
- 241000894007 species Species 0.000 description 8
- 238000002474 experimental method Methods 0.000 description 7
- 210000000987 immune system Anatomy 0.000 description 7
- 239000012528 membrane Substances 0.000 description 7
- 108090000765 processed proteins & peptides Proteins 0.000 description 7
- 239000000047 product Substances 0.000 description 7
- 239000000243 solution Substances 0.000 description 7
- 239000000126 substance Substances 0.000 description 7
- 108060003951 Immunoglobulin Proteins 0.000 description 6
- 241000699670 Mus sp. Species 0.000 description 6
- 241000283973 Oryctolagus cuniculus Species 0.000 description 6
- 210000004899 c-terminal region Anatomy 0.000 description 6
- 230000000295 complement effect Effects 0.000 description 6
- 230000009089 cytolysis Effects 0.000 description 6
- 231100000599 cytotoxic agent Toxicity 0.000 description 6
- 238000001514 detection method Methods 0.000 description 6
- 102000018358 immunoglobulin Human genes 0.000 description 6
- 238000011534 incubation Methods 0.000 description 6
- 229920001184 polypeptide Polymers 0.000 description 6
- 238000002360 preparation method Methods 0.000 description 6
- 102000004196 processed proteins & peptides Human genes 0.000 description 6
- 238000000159 protein binding assay Methods 0.000 description 6
- 210000002966 serum Anatomy 0.000 description 6
- 241000196324 Embryophyta Species 0.000 description 5
- 241000700159 Rattus Species 0.000 description 5
- 108010039491 Ricin Proteins 0.000 description 5
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 5
- 230000009471 action Effects 0.000 description 5
- 125000000539 amino acid group Chemical group 0.000 description 5
- 239000002585 base Substances 0.000 description 5
- 230000000903 blocking effect Effects 0.000 description 5
- 238000010367 cloning Methods 0.000 description 5
- 238000012875 competitive assay Methods 0.000 description 5
- 230000006378 damage Effects 0.000 description 5
- 239000012636 effector Substances 0.000 description 5
- 102000037865 fusion proteins Human genes 0.000 description 5
- 108020001507 fusion proteins Proteins 0.000 description 5
- 210000004602 germ cell Anatomy 0.000 description 5
- 239000005090 green fluorescent protein Substances 0.000 description 5
- 238000009169 immunotherapy Methods 0.000 description 5
- 239000003446 ligand Substances 0.000 description 5
- 238000002703 mutagenesis Methods 0.000 description 5
- 231100000350 mutagenesis Toxicity 0.000 description 5
- 239000013641 positive control Substances 0.000 description 5
- 238000000746 purification Methods 0.000 description 5
- 230000002829 reductive effect Effects 0.000 description 5
- 238000003786 synthesis reaction Methods 0.000 description 5
- 238000013518 transcription Methods 0.000 description 5
- 230000035897 transcription Effects 0.000 description 5
- 230000009466 transformation Effects 0.000 description 5
- 230000009261 transgenic effect Effects 0.000 description 5
- 238000005406 washing Methods 0.000 description 5
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 4
- IAKHMKGGTNLKSZ-INIZCTEOSA-N (S)-colchicine Chemical compound C1([C@@H](NC(C)=O)CC2)=CC(=O)C(OC)=CC=C1C1=C2C=C(OC)C(OC)=C1OC IAKHMKGGTNLKSZ-INIZCTEOSA-N 0.000 description 4
- 241000283690 Bos taurus Species 0.000 description 4
- 241000283707 Capra Species 0.000 description 4
- 241000701022 Cytomegalovirus Species 0.000 description 4
- 108010070675 Glutathione transferase Proteins 0.000 description 4
- 102000005720 Glutathione transferase Human genes 0.000 description 4
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 4
- 235000003332 Ilex aquifolium Nutrition 0.000 description 4
- 241000209027 Ilex aquifolium Species 0.000 description 4
- 241000124008 Mammalia Species 0.000 description 4
- 102100038895 Myc proto-oncogene protein Human genes 0.000 description 4
- 101710135898 Myc proto-oncogene protein Proteins 0.000 description 4
- 229930193140 Neomycin Natural products 0.000 description 4
- 229930012538 Paclitaxel Natural products 0.000 description 4
- 241001494479 Pecora Species 0.000 description 4
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 4
- 241000282887 Suidae Species 0.000 description 4
- 210000001744 T-lymphocyte Anatomy 0.000 description 4
- IQFYYKKMVGJFEH-XLPZGREQSA-N Thymidine Chemical compound O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 IQFYYKKMVGJFEH-XLPZGREQSA-N 0.000 description 4
- 101710150448 Transcriptional regulator Myc Proteins 0.000 description 4
- 239000013504 Triton X-100 Substances 0.000 description 4
- 229920004890 Triton X-100 Polymers 0.000 description 4
- ISAKRJDGNUQOIC-UHFFFAOYSA-N Uracil Chemical compound O=C1C=CNC(=O)N1 ISAKRJDGNUQOIC-UHFFFAOYSA-N 0.000 description 4
- 238000010171 animal model Methods 0.000 description 4
- 230000001093 anti-cancer Effects 0.000 description 4
- 230000001580 bacterial effect Effects 0.000 description 4
- 229960000074 biopharmaceutical Drugs 0.000 description 4
- 230000032823 cell division Effects 0.000 description 4
- 238000005119 centrifugation Methods 0.000 description 4
- 238000006243 chemical reaction Methods 0.000 description 4
- 238000002512 chemotherapy Methods 0.000 description 4
- 208000029742 colonic neoplasm Diseases 0.000 description 4
- 239000000562 conjugate Substances 0.000 description 4
- 238000007796 conventional method Methods 0.000 description 4
- OPTASPLRGRRNAP-UHFFFAOYSA-N cytosine Chemical compound NC=1C=CNC(=O)N=1 OPTASPLRGRRNAP-UHFFFAOYSA-N 0.000 description 4
- 230000001419 dependent effect Effects 0.000 description 4
- 230000002538 fungal effect Effects 0.000 description 4
- UYTPUPDQBNUYGX-UHFFFAOYSA-N guanine Chemical compound O=C1NC(N)=NC2=C1N=CN2 UYTPUPDQBNUYGX-UHFFFAOYSA-N 0.000 description 4
- 229940072221 immunoglobulins Drugs 0.000 description 4
- 239000003112 inhibitor Substances 0.000 description 4
- 210000004962 mammalian cell Anatomy 0.000 description 4
- 229960004927 neomycin Drugs 0.000 description 4
- 229960001592 paclitaxel Drugs 0.000 description 4
- 239000008194 pharmaceutical composition Substances 0.000 description 4
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 4
- 238000010188 recombinant method Methods 0.000 description 4
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 4
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 4
- 206010069754 Acquired gene mutation Diseases 0.000 description 3
- 102100026189 Beta-galactosidase Human genes 0.000 description 3
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 3
- 108020004705 Codon Proteins 0.000 description 3
- 238000012286 ELISA Assay Methods 0.000 description 3
- 241000588724 Escherichia coli Species 0.000 description 3
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 3
- 241000238631 Hexapoda Species 0.000 description 3
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 3
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 3
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 3
- 206010028851 Necrosis Diseases 0.000 description 3
- 206010033645 Pancreatitis Diseases 0.000 description 3
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 3
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 description 3
- 230000003213 activating effect Effects 0.000 description 3
- 238000007792 addition Methods 0.000 description 3
- 239000000611 antibody drug conjugate Substances 0.000 description 3
- 229940049595 antibody-drug conjugate Drugs 0.000 description 3
- 108010005774 beta-Galactosidase Proteins 0.000 description 3
- 210000000481 breast Anatomy 0.000 description 3
- 239000000872 buffer Substances 0.000 description 3
- 230000022131 cell cycle Effects 0.000 description 3
- 230000006037 cell lysis Effects 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 238000012217 deletion Methods 0.000 description 3
- 230000037430 deletion Effects 0.000 description 3
- 239000003085 diluting agent Substances 0.000 description 3
- 229960004679 doxorubicin Drugs 0.000 description 3
- 229960001776 edrecolomab Drugs 0.000 description 3
- 230000006698 induction Effects 0.000 description 3
- 238000003780 insertion Methods 0.000 description 3
- 230000037431 insertion Effects 0.000 description 3
- 210000005075 mammary gland Anatomy 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 230000001404 mediated effect Effects 0.000 description 3
- 239000000178 monomer Substances 0.000 description 3
- 238000010172 mouse model Methods 0.000 description 3
- 230000017074 necrotic cell death Effects 0.000 description 3
- 230000002018 overexpression Effects 0.000 description 3
- 230000003389 potentiating effect Effects 0.000 description 3
- 210000001236 prokaryotic cell Anatomy 0.000 description 3
- 239000011734 sodium Substances 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 230000000392 somatic effect Effects 0.000 description 3
- 230000037439 somatic mutation Effects 0.000 description 3
- 210000002784 stomach Anatomy 0.000 description 3
- 239000006228 supernatant Substances 0.000 description 3
- 238000002198 surface plasmon resonance spectroscopy Methods 0.000 description 3
- 230000014616 translation Effects 0.000 description 3
- 238000013519 translation Methods 0.000 description 3
- 229960003048 vinblastine Drugs 0.000 description 3
- JXLYSJRDGCGARV-XQKSVPLYSA-N vincaleukoblastine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 JXLYSJRDGCGARV-XQKSVPLYSA-N 0.000 description 3
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 2
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 description 2
- OTLLEIBWKHEHGU-UHFFFAOYSA-N 2-[5-[[5-(6-aminopurin-9-yl)-3,4-dihydroxyoxolan-2-yl]methoxy]-3,4-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-3,5-dihydroxy-4-phosphonooxyhexanedioic acid Chemical compound C1=NC=2C(N)=NC=NC=2N1C(C(C1O)O)OC1COC1C(CO)OC(OC(C(O)C(OP(O)(O)=O)C(O)C(O)=O)C(O)=O)C(O)C1O OTLLEIBWKHEHGU-UHFFFAOYSA-N 0.000 description 2
- NDMPLJNOPCLANR-UHFFFAOYSA-N 3,4-dihydroxy-15-(4-hydroxy-18-methoxycarbonyl-5,18-seco-ibogamin-18-yl)-16-methoxy-1-methyl-6,7-didehydro-aspidospermidine-3-carboxylic acid methyl ester Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 NDMPLJNOPCLANR-UHFFFAOYSA-N 0.000 description 2
- STQGQHZAVUOBTE-UHFFFAOYSA-N 7-Cyan-hept-2t-en-4,6-diinsaeure Natural products C1=2C(O)=C3C(=O)C=4C(OC)=CC=CC=4C(=O)C3=C(O)C=2CC(O)(C(C)=O)CC1OC1CC(N)C(O)C(C)O1 STQGQHZAVUOBTE-UHFFFAOYSA-N 0.000 description 2
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 2
- LRFVTYWOQMYALW-UHFFFAOYSA-N 9H-xanthine Chemical compound O=C1NC(=O)NC2=C1NC=N2 LRFVTYWOQMYALW-UHFFFAOYSA-N 0.000 description 2
- 229930024421 Adenine Natural products 0.000 description 2
- GFFGJBXGBJISGV-UHFFFAOYSA-N Adenine Chemical compound NC1=NC=NC2=C1N=CN2 GFFGJBXGBJISGV-UHFFFAOYSA-N 0.000 description 2
- DWRXFEITVBNRMK-UHFFFAOYSA-N Beta-D-1-Arabinofuranosylthymine Natural products O=C1NC(=O)C(C)=CN1C1C(O)C(O)C(CO)O1 DWRXFEITVBNRMK-UHFFFAOYSA-N 0.000 description 2
- 206010055113 Breast cancer metastatic Diseases 0.000 description 2
- 102100023700 C-C motif chemokine 16 Human genes 0.000 description 2
- 102100025250 C-X-C motif chemokine 14 Human genes 0.000 description 2
- 108050007957 Cadherin Proteins 0.000 description 2
- 102000000905 Cadherin Human genes 0.000 description 2
- UXVMQQNJUSDDNG-UHFFFAOYSA-L Calcium chloride Chemical compound [Cl-].[Cl-].[Ca+2] UXVMQQNJUSDDNG-UHFFFAOYSA-L 0.000 description 2
- 241000282472 Canis lupus familiaris Species 0.000 description 2
- 108010035563 Chloramphenicol O-acetyltransferase Proteins 0.000 description 2
- 102100023804 Coagulation factor VII Human genes 0.000 description 2
- 206010053567 Coagulopathies Diseases 0.000 description 2
- 108091035707 Consensus sequence Proteins 0.000 description 2
- 108020004414 DNA Proteins 0.000 description 2
- 241000702421 Dependoparvovirus Species 0.000 description 2
- 101150084967 EPCAM gene Proteins 0.000 description 2
- 101710147220 Ent-copalyl diphosphate synthase, chloroplastic Proteins 0.000 description 2
- YQYJSBFKSSDGFO-UHFFFAOYSA-N Epihygromycin Natural products OC1C(O)C(C(=O)C)OC1OC(C(=C1)O)=CC=C1C=C(C)C(=O)NC1C(O)C(O)C2OCOC2C1O YQYJSBFKSSDGFO-UHFFFAOYSA-N 0.000 description 2
- 108010023321 Factor VII Proteins 0.000 description 2
- 241000282326 Felis catus Species 0.000 description 2
- 108090000331 Firefly luciferases Proteins 0.000 description 2
- 108700004714 Gelonium multiflorum GEL Proteins 0.000 description 2
- 239000004471 Glycine Substances 0.000 description 2
- 101710154606 Hemagglutinin Proteins 0.000 description 2
- 101000978375 Homo sapiens C-C motif chemokine 16 Proteins 0.000 description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 2
- 102000003781 Inhibitor of growth protein 1 Human genes 0.000 description 2
- 108090000191 Inhibitor of growth protein 1 Proteins 0.000 description 2
- 102000006992 Interferon-alpha Human genes 0.000 description 2
- 108010047761 Interferon-alpha Proteins 0.000 description 2
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 2
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 2
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 2
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 2
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 2
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 2
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 2
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 2
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 2
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 2
- 241000219823 Medicago Species 0.000 description 2
- 241001529936 Murinae Species 0.000 description 2
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 2
- 108091007491 NSP3 Papain-like protease domains Proteins 0.000 description 2
- 108700020796 Oncogene Proteins 0.000 description 2
- 101710093908 Outer capsid protein VP4 Proteins 0.000 description 2
- 101710135467 Outer capsid protein sigma-1 Proteins 0.000 description 2
- 229930182555 Penicillin Natural products 0.000 description 2
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 2
- 229920001213 Polysorbate 20 Polymers 0.000 description 2
- 101710176177 Protein A56 Proteins 0.000 description 2
- 101000762949 Pseudomonas aeruginosa (strain ATCC 15692 / DSM 22644 / CIP 104116 / JCM 14847 / LMG 12228 / 1C / PRS 101 / PAO1) Exotoxin A Proteins 0.000 description 2
- 241000508269 Psidium Species 0.000 description 2
- 108020004511 Recombinant DNA Proteins 0.000 description 2
- 108020005091 Replication Origin Proteins 0.000 description 2
- 208000007660 Residual Neoplasm Diseases 0.000 description 2
- 108010083644 Ribonucleases Proteins 0.000 description 2
- 102000006382 Ribonucleases Human genes 0.000 description 2
- 235000014680 Saccharomyces cerevisiae Nutrition 0.000 description 2
- 229920002684 Sepharose Polymers 0.000 description 2
- 241000700584 Simplexvirus Species 0.000 description 2
- FKNQFGJONOIPTF-UHFFFAOYSA-N Sodium cation Chemical compound [Na+] FKNQFGJONOIPTF-UHFFFAOYSA-N 0.000 description 2
- 239000012505 Superdex™ Substances 0.000 description 2
- 101150057140 TACSTD1 gene Proteins 0.000 description 2
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 2
- 239000004473 Threonine Substances 0.000 description 2
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 2
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 2
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 2
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 2
- 229930003448 Vitamin K Natural products 0.000 description 2
- 238000002835 absorbance Methods 0.000 description 2
- 229960000643 adenine Drugs 0.000 description 2
- 229940009456 adriamycin Drugs 0.000 description 2
- 229940100198 alkylating agent Drugs 0.000 description 2
- 239000002168 alkylating agent Substances 0.000 description 2
- 238000009175 antibody therapy Methods 0.000 description 2
- 238000010913 antigen-directed enzyme pro-drug therapy Methods 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- IQFYYKKMVGJFEH-UHFFFAOYSA-N beta-L-thymidine Natural products O=C1NC(=O)C(C)=CN1C1OC(CO)C(O)C1 IQFYYKKMVGJFEH-UHFFFAOYSA-N 0.000 description 2
- 239000003124 biologic agent Substances 0.000 description 2
- 229960002685 biotin Drugs 0.000 description 2
- 235000020958 biotin Nutrition 0.000 description 2
- 239000011616 biotin Substances 0.000 description 2
- 230000036760 body temperature Effects 0.000 description 2
- BQRGNLJZBFXNCZ-UHFFFAOYSA-N calcein am Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC(CN(CC(=O)OCOC(C)=O)CC(=O)OCOC(C)=O)=C(OC(C)=O)C=C1OC1=C2C=C(CN(CC(=O)OCOC(C)=O)CC(=O)OCOC(=O)C)C(OC(C)=O)=C1 BQRGNLJZBFXNCZ-UHFFFAOYSA-N 0.000 description 2
- 239000001110 calcium chloride Substances 0.000 description 2
- 235000011148 calcium chloride Nutrition 0.000 description 2
- 229960002713 calcium chloride Drugs 0.000 description 2
- 229910001628 calcium chloride Inorganic materials 0.000 description 2
- 150000001720 carbohydrates Chemical group 0.000 description 2
- 239000006143 cell culture medium Substances 0.000 description 2
- 239000012592 cell culture supplement Substances 0.000 description 2
- 230000004663 cell proliferation Effects 0.000 description 2
- 239000006285 cell suspension Substances 0.000 description 2
- 230000001413 cellular effect Effects 0.000 description 2
- 239000012707 chemical precursor Substances 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- 230000035602 clotting Effects 0.000 description 2
- 229960001338 colchicine Drugs 0.000 description 2
- 150000001875 compounds Chemical class 0.000 description 2
- 238000004590 computer program Methods 0.000 description 2
- 230000021615 conjugation Effects 0.000 description 2
- 239000013068 control sample Substances 0.000 description 2
- 230000008878 coupling Effects 0.000 description 2
- 238000010168 coupling process Methods 0.000 description 2
- 238000005859 coupling reaction Methods 0.000 description 2
- 235000018417 cysteine Nutrition 0.000 description 2
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 2
- 229940104302 cytosine Drugs 0.000 description 2
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 description 2
- 230000034994 death Effects 0.000 description 2
- 231100000517 death Toxicity 0.000 description 2
- 231100000673 dose–response relationship Toxicity 0.000 description 2
- 230000009977 dual effect Effects 0.000 description 2
- 238000004520 electroporation Methods 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 239000003623 enhancer Substances 0.000 description 2
- YJGVMLPVUAXIQN-UHFFFAOYSA-N epipodophyllotoxin Natural products COC1=C(OC)C(OC)=CC(C2C3=CC=4OCOC=4C=C3C(O)C3C2C(OC3)=O)=C1 YJGVMLPVUAXIQN-UHFFFAOYSA-N 0.000 description 2
- 230000005284 excitation Effects 0.000 description 2
- 230000007717 exclusion Effects 0.000 description 2
- 239000002095 exotoxin Substances 0.000 description 2
- 231100000776 exotoxin Toxicity 0.000 description 2
- 229940012413 factor vii Drugs 0.000 description 2
- 239000012894 fetal calf serum Substances 0.000 description 2
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 238000001415 gene therapy Methods 0.000 description 2
- 230000013595 glycosylation Effects 0.000 description 2
- 238000006206 glycosylation reaction Methods 0.000 description 2
- 239000000185 hemagglutinin Substances 0.000 description 2
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 2
- 229940088597 hormone Drugs 0.000 description 2
- 239000005556 hormone Substances 0.000 description 2
- FDGQSTZJBFJUBT-UHFFFAOYSA-N hypoxanthine Chemical compound O=C1NC=NC2=C1NC=N2 FDGQSTZJBFJUBT-UHFFFAOYSA-N 0.000 description 2
- 239000012216 imaging agent Substances 0.000 description 2
- 230000001900 immune effect Effects 0.000 description 2
- 230000002163 immunogen Effects 0.000 description 2
- 238000003364 immunohistochemistry Methods 0.000 description 2
- 238000000099 in vitro assay Methods 0.000 description 2
- 238000001802 infusion Methods 0.000 description 2
- 230000000977 initiatory effect Effects 0.000 description 2
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 2
- 230000003993 interaction Effects 0.000 description 2
- 238000001990 intravenous administration Methods 0.000 description 2
- 229960000310 isoleucine Drugs 0.000 description 2
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 2
- 235000014705 isoleucine Nutrition 0.000 description 2
- 238000012417 linear regression Methods 0.000 description 2
- 238000011068 loading method Methods 0.000 description 2
- 238000012423 maintenance Methods 0.000 description 2
- 230000010534 mechanism of action Effects 0.000 description 2
- 229960000485 methotrexate Drugs 0.000 description 2
- 238000000520 microinjection Methods 0.000 description 2
- 230000003278 mimic effect Effects 0.000 description 2
- 230000011278 mitosis Effects 0.000 description 2
- 239000013642 negative control Substances 0.000 description 2
- 230000010807 negative regulation of binding Effects 0.000 description 2
- 229940049954 penicillin Drugs 0.000 description 2
- 239000000546 pharmaceutical excipient Substances 0.000 description 2
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 2
- SHUZOJHMOBOZST-UHFFFAOYSA-N phylloquinone Natural products CC(C)CCCCC(C)CCC(C)CCCC(=CCC1=C(C)C(=O)c2ccccc2C1=O)C SHUZOJHMOBOZST-UHFFFAOYSA-N 0.000 description 2
- 239000013612 plasmid Substances 0.000 description 2
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 2
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 210000002307 prostate Anatomy 0.000 description 2
- 230000005855 radiation Effects 0.000 description 2
- 230000002285 radioactive effect Effects 0.000 description 2
- 230000003439 radiotherapeutic effect Effects 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- PYWVYCXTNDRMGF-UHFFFAOYSA-N rhodamine B Chemical compound [Cl-].C=12C=CC(=[N+](CC)CC)C=C2OC2=CC(N(CC)CC)=CC=C2C=1C1=CC=CC=C1C(O)=O PYWVYCXTNDRMGF-UHFFFAOYSA-N 0.000 description 2
- IGLNJRXAVVLDKE-UHFFFAOYSA-N rubidium atom Chemical compound [Rb] IGLNJRXAVVLDKE-UHFFFAOYSA-N 0.000 description 2
- 235000020183 skimmed milk Nutrition 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- 239000011780 sodium chloride Substances 0.000 description 2
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 2
- 229910001415 sodium ion Inorganic materials 0.000 description 2
- 230000009870 specific binding Effects 0.000 description 2
- 238000001228 spectrum Methods 0.000 description 2
- 238000010186 staining Methods 0.000 description 2
- 238000010561 standard procedure Methods 0.000 description 2
- 229960005322 streptomycin Drugs 0.000 description 2
- 239000013589 supplement Substances 0.000 description 2
- 238000001356 surgical procedure Methods 0.000 description 2
- 230000004083 survival effect Effects 0.000 description 2
- 238000007910 systemic administration Methods 0.000 description 2
- 230000008685 targeting Effects 0.000 description 2
- 229940104230 thymidine Drugs 0.000 description 2
- 230000001988 toxicity Effects 0.000 description 2
- 231100000419 toxicity Toxicity 0.000 description 2
- 238000001890 transfection Methods 0.000 description 2
- 239000013638 trimer Substances 0.000 description 2
- 230000004614 tumor growth Effects 0.000 description 2
- 230000005909 tumor killing Effects 0.000 description 2
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 2
- 241000701161 unidentified adenovirus Species 0.000 description 2
- 241001430294 unidentified retrovirus Species 0.000 description 2
- 229940035893 uracil Drugs 0.000 description 2
- 239000004474 valine Substances 0.000 description 2
- 235000014393 valine Nutrition 0.000 description 2
- 229910052720 vanadium Inorganic materials 0.000 description 2
- 229960004528 vincristine Drugs 0.000 description 2
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 2
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 2
- 229960004355 vindesine Drugs 0.000 description 2
- UGGWPQSBPIFKDZ-KOTLKJBCSA-N vindesine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(N)=O)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1N=C1[C]2C=CC=C1 UGGWPQSBPIFKDZ-KOTLKJBCSA-N 0.000 description 2
- 230000003612 virological effect Effects 0.000 description 2
- 239000011712 vitamin K Substances 0.000 description 2
- 235000019168 vitamin K Nutrition 0.000 description 2
- 150000003721 vitamin K derivatives Chemical class 0.000 description 2
- 229940046010 vitamin k Drugs 0.000 description 2
- DQJCDTNMLBYVAY-ZXXIYAEKSA-N (2S,5R,10R,13R)-16-{[(2R,3S,4R,5R)-3-{[(2S,3R,4R,5S,6R)-3-acetamido-4,5-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy}-5-(ethylamino)-6-hydroxy-2-(hydroxymethyl)oxan-4-yl]oxy}-5-(4-aminobutyl)-10-carbamoyl-2,13-dimethyl-4,7,12,15-tetraoxo-3,6,11,14-tetraazaheptadecan-1-oic acid Chemical class NCCCC[C@H](C(=O)N[C@@H](C)C(O)=O)NC(=O)CC[C@H](C(N)=O)NC(=O)[C@@H](C)NC(=O)C(C)O[C@@H]1[C@@H](NCC)C(O)O[C@H](CO)[C@H]1O[C@H]1[C@H](NC(C)=O)[C@@H](O)[C@H](O)[C@@H](CO)O1 DQJCDTNMLBYVAY-ZXXIYAEKSA-N 0.000 description 1
- YJGVMLPVUAXIQN-LGWHJFRWSA-N (5s,5ar,8ar,9r)-5-hydroxy-9-(3,4,5-trimethoxyphenyl)-5a,6,8a,9-tetrahydro-5h-[2]benzofuro[5,6-f][1,3]benzodioxol-8-one Chemical compound COC1=C(OC)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O)[C@@H]3[C@@H]2C(OC3)=O)=C1 YJGVMLPVUAXIQN-LGWHJFRWSA-N 0.000 description 1
- NFGXHKASABOEEW-UHFFFAOYSA-N 1-methylethyl 11-methoxy-3,7,11-trimethyl-2,4-dodecadienoate Chemical compound COC(C)(C)CCCC(C)CC=CC(C)=CC(=O)OC(C)C NFGXHKASABOEEW-UHFFFAOYSA-N 0.000 description 1
- MQLACMBJVPINKE-UHFFFAOYSA-N 10-[(3-hydroxy-4-methoxyphenyl)methylidene]anthracen-9-one Chemical compound C1=C(O)C(OC)=CC=C1C=C1C2=CC=CC=C2C(=O)C2=CC=CC=C21 MQLACMBJVPINKE-UHFFFAOYSA-N 0.000 description 1
- PNDPGZBMCMUPRI-HVTJNCQCSA-N 10043-66-0 Chemical compound [131I][131I] PNDPGZBMCMUPRI-HVTJNCQCSA-N 0.000 description 1
- OWEGMIWEEQEYGQ-UHFFFAOYSA-N 100676-05-9 Natural products OC1C(O)C(O)C(CO)OC1OCC1C(O)C(O)C(O)C(OC2C(OC(O)C(O)C2O)CO)O1 OWEGMIWEEQEYGQ-UHFFFAOYSA-N 0.000 description 1
- WUAPFZMCVAUBPE-NJFSPNSNSA-N 188Re Chemical compound [188Re] WUAPFZMCVAUBPE-NJFSPNSNSA-N 0.000 description 1
- UAIUNKRWKOVEES-UHFFFAOYSA-N 3,3',5,5'-tetramethylbenzidine Chemical compound CC1=C(N)C(C)=CC(C=2C=C(C)C(N)=C(C)C=2)=C1 UAIUNKRWKOVEES-UHFFFAOYSA-N 0.000 description 1
- TVZGACDUOSZQKY-LBPRGKRZSA-N 4-aminofolic acid Chemical compound C1=NC2=NC(N)=NC(N)=C2N=C1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 TVZGACDUOSZQKY-LBPRGKRZSA-N 0.000 description 1
- 108010066676 Abrin Proteins 0.000 description 1
- 241000589156 Agrobacterium rhizogenes Species 0.000 description 1
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 1
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 1
- 201000004384 Alopecia Diseases 0.000 description 1
- 101800002638 Alpha-amanitin Proteins 0.000 description 1
- 102000009840 Angiopoietins Human genes 0.000 description 1
- 108010009906 Angiopoietins Proteins 0.000 description 1
- 102400000068 Angiostatin Human genes 0.000 description 1
- 108010079709 Angiostatins Proteins 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- 108010002913 Asialoglycoproteins Proteins 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 1
- 241000228212 Aspergillus Species 0.000 description 1
- 101100136076 Aspergillus oryzae (strain ATCC 42149 / RIB 40) pel1 gene Proteins 0.000 description 1
- 101000669426 Aspergillus restrictus Ribonuclease mitogillin Proteins 0.000 description 1
- 241000271566 Aves Species 0.000 description 1
- 108090001008 Avidin Proteins 0.000 description 1
- 108050001427 Avidin/streptavidin Proteins 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 231100000699 Bacterial toxin Toxicity 0.000 description 1
- 241000255789 Bombyx mori Species 0.000 description 1
- 102100032912 CD44 antigen Human genes 0.000 description 1
- 101100028791 Caenorhabditis elegans pbs-5 gene Proteins 0.000 description 1
- 101100314454 Caenorhabditis elegans tra-1 gene Proteins 0.000 description 1
- 241000282836 Camelus dromedarius Species 0.000 description 1
- 102400000730 Canstatin Human genes 0.000 description 1
- 101800000626 Canstatin Proteins 0.000 description 1
- 201000009030 Carcinoma Diseases 0.000 description 1
- 241000700199 Cavia porcellus Species 0.000 description 1
- 102000016289 Cell Adhesion Molecules Human genes 0.000 description 1
- 108010067225 Cell Adhesion Molecules Proteins 0.000 description 1
- 102100022641 Coagulation factor IX Human genes 0.000 description 1
- 108091026890 Coding region Proteins 0.000 description 1
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 1
- 241000699800 Cricetinae Species 0.000 description 1
- 239000004971 Cross linker Substances 0.000 description 1
- 102000002554 Cyclin A Human genes 0.000 description 1
- 108010068192 Cyclin A Proteins 0.000 description 1
- 102000003909 Cyclin E Human genes 0.000 description 1
- 108090000257 Cyclin E Proteins 0.000 description 1
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 description 1
- IGXWBGJHJZYPQS-SSDOTTSWSA-N D-Luciferin Chemical compound OC(=O)[C@H]1CSC(C=2SC3=CC=C(O)C=C3N=2)=N1 IGXWBGJHJZYPQS-SSDOTTSWSA-N 0.000 description 1
- 102000053602 DNA Human genes 0.000 description 1
- 230000004543 DNA replication Effects 0.000 description 1
- 230000007023 DNA restriction-modification system Effects 0.000 description 1
- 102000004163 DNA-directed RNA polymerases Human genes 0.000 description 1
- 108090000626 DNA-directed RNA polymerases Proteins 0.000 description 1
- WEAHRLBPCANXCN-UHFFFAOYSA-N Daunomycin Natural products CCC1(O)CC(OC2CC(N)C(O)C(C)O2)c3cc4C(=O)c5c(OC)cccc5C(=O)c4c(O)c3C1 WEAHRLBPCANXCN-UHFFFAOYSA-N 0.000 description 1
- CYCGRDQQIOGCKX-UHFFFAOYSA-N Dehydro-luciferin Natural products OC(=O)C1=CSC(C=2SC3=CC(O)=CC=C3N=2)=N1 CYCGRDQQIOGCKX-UHFFFAOYSA-N 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- 238000009007 Diagnostic Kit Methods 0.000 description 1
- 108010053187 Diphtheria Toxin Proteins 0.000 description 1
- 102000016607 Diphtheria Toxin Human genes 0.000 description 1
- 206010061818 Disease progression Diseases 0.000 description 1
- 229910052692 Dysprosium Inorganic materials 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 102000009025 Endorphins Human genes 0.000 description 1
- 108010049140 Endorphins Proteins 0.000 description 1
- 102400001047 Endostatin Human genes 0.000 description 1
- 108010079505 Endostatins Proteins 0.000 description 1
- 241000702371 Enterobacteria phage f1 Species 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 229910052691 Erbium Inorganic materials 0.000 description 1
- 108010029144 Factor IIa Proteins 0.000 description 1
- 108010076282 Factor IX Proteins 0.000 description 1
- 108010048049 Factor IXa Proteins 0.000 description 1
- 108010054265 Factor VIIa Proteins 0.000 description 1
- 108010014173 Factor X Proteins 0.000 description 1
- 108010074860 Factor Xa Proteins 0.000 description 1
- CWYNVVGOOAEACU-UHFFFAOYSA-N Fe2+ Chemical compound [Fe+2] CWYNVVGOOAEACU-UHFFFAOYSA-N 0.000 description 1
- BJGNCJDXODQBOB-UHFFFAOYSA-N Fivefly Luciferin Natural products OC(=O)C1CSC(C=2SC3=CC(O)=CC=C3N=2)=N1 BJGNCJDXODQBOB-UHFFFAOYSA-N 0.000 description 1
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 1
- 229910052688 Gadolinium Inorganic materials 0.000 description 1
- GYHNNYVSQQEPJS-OIOBTWANSA-N Gallium-67 Chemical compound [67Ga] GYHNNYVSQQEPJS-OIOBTWANSA-N 0.000 description 1
- GYHNNYVSQQEPJS-YPZZEJLDSA-N Gallium-68 Chemical compound [68Ga] GYHNNYVSQQEPJS-YPZZEJLDSA-N 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 1
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 1
- 229910052689 Holmium Inorganic materials 0.000 description 1
- 101000868273 Homo sapiens CD44 antigen Proteins 0.000 description 1
- 101000589305 Homo sapiens Natural cytotoxicity triggering receptor 2 Proteins 0.000 description 1
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 1
- 108090000144 Human Proteins Proteins 0.000 description 1
- 102000003839 Human Proteins Human genes 0.000 description 1
- 241000701109 Human adenovirus 2 Species 0.000 description 1
- UGQMRVRMYYASKQ-UHFFFAOYSA-N Hypoxanthine nucleoside Natural products OC1C(O)C(CO)OC1N1C(NC=NC2=O)=C2N=C1 UGQMRVRMYYASKQ-UHFFFAOYSA-N 0.000 description 1
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 description 1
- 102000017727 Immunoglobulin Variable Region Human genes 0.000 description 1
- 108700001097 Insect Genes Proteins 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- 102100023915 Insulin Human genes 0.000 description 1
- 102100026720 Interferon beta Human genes 0.000 description 1
- 102100037850 Interferon gamma Human genes 0.000 description 1
- 108090000467 Interferon-beta Proteins 0.000 description 1
- 108010074328 Interferon-gamma Proteins 0.000 description 1
- 108091029795 Intergenic region Proteins 0.000 description 1
- 102000013462 Interleukin-12 Human genes 0.000 description 1
- 108010065805 Interleukin-12 Proteins 0.000 description 1
- 108010002350 Interleukin-2 Proteins 0.000 description 1
- 102000000588 Interleukin-2 Human genes 0.000 description 1
- ZCYVEMRRCGMTRW-AHCXROLUSA-N Iodine-123 Chemical compound [123I] ZCYVEMRRCGMTRW-AHCXROLUSA-N 0.000 description 1
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- 108010007622 LDL Lipoproteins Proteins 0.000 description 1
- 102000007330 LDL Lipoproteins Human genes 0.000 description 1
- 108090001090 Lectins Proteins 0.000 description 1
- 102000004856 Lectins Human genes 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- DDWFXDSYGUXRAY-UHFFFAOYSA-N Luciferin Natural products CCc1c(C)c(CC2NC(=O)C(=C2C=C)C)[nH]c1Cc3[nH]c4C(=C5/NC(CC(=O)O)C(C)C5CC(=O)O)CC(=O)c4c3C DDWFXDSYGUXRAY-UHFFFAOYSA-N 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- 241000829100 Macaca mulatta polyomavirus 1 Species 0.000 description 1
- GUBGYTABKSRVRQ-PICCSMPSSA-N Maltose Natural products O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@@H](CO)OC(O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-PICCSMPSSA-N 0.000 description 1
- WAEMQWOKJMHJLA-UHFFFAOYSA-N Manganese(2+) Chemical compound [Mn+2] WAEMQWOKJMHJLA-UHFFFAOYSA-N 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 206010027476 Metastases Diseases 0.000 description 1
- 108090000143 Mouse Proteins Proteins 0.000 description 1
- 241000699660 Mus musculus Species 0.000 description 1
- 241000282341 Mustela putorius furo Species 0.000 description 1
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 description 1
- 230000004988 N-glycosylation Effects 0.000 description 1
- 108091061960 Naked DNA Proteins 0.000 description 1
- 241001460678 Napo <wasp> Species 0.000 description 1
- 108010004217 Natural Cytotoxicity Triggering Receptor 1 Proteins 0.000 description 1
- 108010004222 Natural Cytotoxicity Triggering Receptor 3 Proteins 0.000 description 1
- 102100032870 Natural cytotoxicity triggering receptor 1 Human genes 0.000 description 1
- 102100032851 Natural cytotoxicity triggering receptor 2 Human genes 0.000 description 1
- 102100032852 Natural cytotoxicity triggering receptor 3 Human genes 0.000 description 1
- 206010028813 Nausea Diseases 0.000 description 1
- 101100076448 Neurospora crassa (strain ATCC 24698 / 74-OR23-1A / CBS 708.71 / DSM 1257 / FGSC 987) med-8 gene Proteins 0.000 description 1
- VEQPNABPJHWNSG-UHFFFAOYSA-N Nickel(2+) Chemical compound [Ni+2] VEQPNABPJHWNSG-UHFFFAOYSA-N 0.000 description 1
- 230000004989 O-glycosylation Effects 0.000 description 1
- 206010033647 Pancreatitis acute Diseases 0.000 description 1
- 108090000526 Papain Proteins 0.000 description 1
- MHRARRIFWSILEQ-UHFFFAOYSA-N Pederin Natural products COCC(CC1OC2C(NC(=O)C(O)C3(CC(=O)C(C)C(C)O3)OC)OCOC2C(OC)C1(C)C)OC MHRARRIFWSILEQ-UHFFFAOYSA-N 0.000 description 1
- 108090000284 Pepsin A Proteins 0.000 description 1
- 102000057297 Pepsin A Human genes 0.000 description 1
- 108010081690 Pertussis Toxin Proteins 0.000 description 1
- 241000235648 Pichia Species 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 108010029485 Protein Isoforms Proteins 0.000 description 1
- 102000001708 Protein Isoforms Human genes 0.000 description 1
- 229940123573 Protein synthesis inhibitor Drugs 0.000 description 1
- 108010094028 Prothrombin Proteins 0.000 description 1
- 241000589516 Pseudomonas Species 0.000 description 1
- 108090000040 Russellysin Proteins 0.000 description 1
- RXGJTYFDKOHJHK-UHFFFAOYSA-N S-deoxo-amaninamide Natural products CCC(C)C1NC(=O)CNC(=O)C2Cc3c(SCC(NC(=O)CNC1=O)C(=O)NC(CC(=O)N)C(=O)N4CC(O)CC4C(=O)NC(C(C)C(O)CO)C(=O)N2)[nH]c5ccccc35 RXGJTYFDKOHJHK-UHFFFAOYSA-N 0.000 description 1
- 238000011579 SCID mouse model Methods 0.000 description 1
- 108010005173 SERPIN-B5 Proteins 0.000 description 1
- 241000235343 Saccharomycetales Species 0.000 description 1
- 108010084592 Saporins Proteins 0.000 description 1
- 108090000184 Selectins Proteins 0.000 description 1
- 102000003800 Selectins Human genes 0.000 description 1
- 238000012300 Sequence Analysis Methods 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- 102100030333 Serpin B5 Human genes 0.000 description 1
- 241000256248 Spodoptera Species 0.000 description 1
- 108010090804 Streptavidin Proteins 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 1
- 108091008874 T cell receptors Proteins 0.000 description 1
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 description 1
- GKLVYJBZJHMRIY-OUBTZVSYSA-N Technetium-99 Chemical compound [99Tc] GKLVYJBZJHMRIY-OUBTZVSYSA-N 0.000 description 1
- 229910052771 Terbium Inorganic materials 0.000 description 1
- 108010000499 Thromboplastin Proteins 0.000 description 1
- 102000002262 Thromboplastin Human genes 0.000 description 1
- 102000002070 Transferrins Human genes 0.000 description 1
- 108010015865 Transferrins Proteins 0.000 description 1
- 108090000704 Tubulin Proteins 0.000 description 1
- 102000004243 Tubulin Human genes 0.000 description 1
- 206010054094 Tumour necrosis Diseases 0.000 description 1
- 244000274883 Urtica dioica Species 0.000 description 1
- 235000009108 Urtica dioica Nutrition 0.000 description 1
- 102000011731 Vacuolar Proton-Translocating ATPases Human genes 0.000 description 1
- 108010037026 Vacuolar Proton-Translocating ATPases Proteins 0.000 description 1
- 229940122803 Vinca alkaloid Drugs 0.000 description 1
- VWQVUPCCIRVNHF-OUBTZVSYSA-N Yttrium-90 Chemical compound [90Y] VWQVUPCCIRVNHF-OUBTZVSYSA-N 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 201000003229 acute pancreatitis Diseases 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 238000001042 affinity chromatography Methods 0.000 description 1
- 238000001261 affinity purification Methods 0.000 description 1
- 235000004279 alanine Nutrition 0.000 description 1
- 239000004007 alpha amanitin Substances 0.000 description 1
- 108090000183 alpha-2-Antiplasmin Proteins 0.000 description 1
- 102000003801 alpha-2-Antiplasmin Human genes 0.000 description 1
- CIORWBWIBBPXCG-SXZCQOKQSA-N alpha-amanitin Chemical compound O=C1N[C@@H](CC(N)=O)C(=O)N2C[C@H](O)C[C@H]2C(=O)N[C@@H]([C@@H](C)[C@@H](O)CO)C(=O)N[C@@H](C2)C(=O)NCC(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@H]1C[S@@](=O)C1=C2C2=CC=C(O)C=C2N1 CIORWBWIBBPXCG-SXZCQOKQSA-N 0.000 description 1
- CIORWBWIBBPXCG-UHFFFAOYSA-N alpha-amanitin Natural products O=C1NC(CC(N)=O)C(=O)N2CC(O)CC2C(=O)NC(C(C)C(O)CO)C(=O)NC(C2)C(=O)NCC(=O)NC(C(C)CC)C(=O)NCC(=O)NC1CS(=O)C1=C2C2=CC=C(O)C=C2N1 CIORWBWIBBPXCG-UHFFFAOYSA-N 0.000 description 1
- 229960003896 aminopterin Drugs 0.000 description 1
- 229960000723 ampicillin Drugs 0.000 description 1
- AVKUERGKIZMTKX-NJBDSQKTSA-N ampicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1 AVKUERGKIZMTKX-NJBDSQKTSA-N 0.000 description 1
- 230000002491 angiogenic effect Effects 0.000 description 1
- 239000005557 antagonist Substances 0.000 description 1
- 229940045799 anthracyclines and related substance Drugs 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000000340 anti-metabolite Effects 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 229940125644 antibody drug Drugs 0.000 description 1
- 230000005875 antibody response Effects 0.000 description 1
- 238000011394 anticancer treatment Methods 0.000 description 1
- 229940100197 antimetabolite Drugs 0.000 description 1
- 239000002256 antimetabolite Substances 0.000 description 1
- 229940034982 antineoplastic agent Drugs 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 125000003118 aryl group Chemical group 0.000 description 1
- 235000009582 asparagine Nutrition 0.000 description 1
- 229960001230 asparagine Drugs 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- FIVPIPIDMRVLAY-UHFFFAOYSA-N aspergillin Natural products C1C2=CC=CC(O)C2N2C1(SS1)C(=O)N(C)C1(CO)C2=O FIVPIPIDMRVLAY-UHFFFAOYSA-N 0.000 description 1
- FZCSTZYAHCUGEM-UHFFFAOYSA-N aspergillomarasmine B Natural products OC(=O)CNC(C(O)=O)CNC(C(O)=O)CC(O)=O FZCSTZYAHCUGEM-UHFFFAOYSA-N 0.000 description 1
- 108010044540 auristatin Proteins 0.000 description 1
- OHDRQQURAXLVGJ-HLVWOLMTSA-N azane;(2e)-3-ethyl-2-[(e)-(3-ethyl-6-sulfo-1,3-benzothiazol-2-ylidene)hydrazinylidene]-1,3-benzothiazole-6-sulfonic acid Chemical compound [NH4+].[NH4+].S/1C2=CC(S([O-])(=O)=O)=CC=C2N(CC)C\1=N/N=C1/SC2=CC(S([O-])(=O)=O)=CC=C2N1CC OHDRQQURAXLVGJ-HLVWOLMTSA-N 0.000 description 1
- 239000000688 bacterial toxin Substances 0.000 description 1
- 238000013321 baculovirus-insect cell expression system Methods 0.000 description 1
- 229930192649 bafilomycin Natural products 0.000 description 1
- XDHNQDDQEHDUTM-UHFFFAOYSA-N bafliomycin A1 Natural products COC1C=CC=C(C)CC(C)C(O)C(C)C=C(C)C=C(OC)C(=O)OC1C(C)C(O)C(C)C1(O)OC(C(C)C)C(C)C(O)C1 XDHNQDDQEHDUTM-UHFFFAOYSA-N 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 239000012472 biological sample Substances 0.000 description 1
- 238000001574 biopsy Methods 0.000 description 1
- 238000007413 biotinylation Methods 0.000 description 1
- 230000006287 biotinylation Effects 0.000 description 1
- 229910052797 bismuth Inorganic materials 0.000 description 1
- JCXGWMGPZLAOME-UHFFFAOYSA-N bismuth atom Chemical compound [Bi] JCXGWMGPZLAOME-UHFFFAOYSA-N 0.000 description 1
- 230000023555 blood coagulation Effects 0.000 description 1
- 238000009395 breeding Methods 0.000 description 1
- 230000001488 breeding effect Effects 0.000 description 1
- 239000003710 calcium ionophore Substances 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 230000003185 calcium uptake Effects 0.000 description 1
- 238000004422 calculation algorithm Methods 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 229930195731 calicheamicin Natural products 0.000 description 1
- HXCHCVDVKSCDHU-LULTVBGHSA-N calicheamicin Chemical compound C1[C@H](OC)[C@@H](NCC)CO[C@H]1O[C@H]1[C@H](O[C@@H]2C\3=C(NC(=O)OC)C(=O)C[C@](C/3=C/CSSSC)(O)C#C\C=C/C#C2)O[C@H](C)[C@@H](NO[C@@H]2O[C@H](C)[C@@H](SC(=O)C=3C(=C(OC)C(O[C@H]4[C@@H]([C@H](OC)[C@@H](O)[C@H](C)O4)O)=C(I)C=3C)OC)[C@@H](O)C2)[C@@H]1O HXCHCVDVKSCDHU-LULTVBGHSA-N 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 230000005779 cell damage Effects 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 208000037887 cell injury Diseases 0.000 description 1
- 230000022534 cell killing Effects 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 229960004630 chlorambucil Drugs 0.000 description 1
- JCKYGMPEJWAADB-UHFFFAOYSA-N chlorambucil Chemical compound OC(=O)CCCC1=CC=C(N(CCCl)CCCl)C=C1 JCKYGMPEJWAADB-UHFFFAOYSA-N 0.000 description 1
- BFGKITSFLPAWGI-UHFFFAOYSA-N chromium(3+) Chemical compound [Cr+3] BFGKITSFLPAWGI-UHFFFAOYSA-N 0.000 description 1
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 1
- 229960004316 cisplatin Drugs 0.000 description 1
- 238000011260 co-administration Methods 0.000 description 1
- 238000000975 co-precipitation Methods 0.000 description 1
- 230000015271 coagulation Effects 0.000 description 1
- 238000005345 coagulation Methods 0.000 description 1
- XLJKHNWPARRRJB-UHFFFAOYSA-N cobalt(2+) Chemical compound [Co+2] XLJKHNWPARRRJB-UHFFFAOYSA-N 0.000 description 1
- AGVAZMGAQJOSFJ-WZHZPDAFSA-M cobalt(2+);[(2r,3s,4r,5s)-5-(5,6-dimethylbenzimidazol-1-yl)-4-hydroxy-2-(hydroxymethyl)oxolan-3-yl] [(2r)-1-[3-[(1r,2r,3r,4z,7s,9z,12s,13s,14z,17s,18s,19r)-2,13,18-tris(2-amino-2-oxoethyl)-7,12,17-tris(3-amino-3-oxopropyl)-3,5,8,8,13,15,18,19-octamethyl-2 Chemical compound [Co+2].N#[C-].[N-]([C@@H]1[C@H](CC(N)=O)[C@@]2(C)CCC(=O)NC[C@@H](C)OP(O)(=O)O[C@H]3[C@H]([C@H](O[C@@H]3CO)N3C4=CC(C)=C(C)C=C4N=C3)O)\C2=C(C)/C([C@H](C\2(C)C)CCC(N)=O)=N/C/2=C\C([C@H]([C@@]/2(CC(N)=O)C)CCC(N)=O)=N\C\2=C(C)/C2=N[C@]1(C)[C@@](C)(CC(N)=O)[C@@H]2CCC(N)=O AGVAZMGAQJOSFJ-WZHZPDAFSA-M 0.000 description 1
- 210000001072 colon Anatomy 0.000 description 1
- 238000002648 combination therapy Methods 0.000 description 1
- 230000002860 competitive effect Effects 0.000 description 1
- 230000006957 competitive inhibition Effects 0.000 description 1
- 239000000306 component Substances 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- 239000010949 copper Substances 0.000 description 1
- RYGMFSIKBFXOCR-AKLPVKDBSA-N copper-67 Chemical compound [67Cu] RYGMFSIKBFXOCR-AKLPVKDBSA-N 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 230000000445 cytocidal effect Effects 0.000 description 1
- 210000000805 cytoplasm Anatomy 0.000 description 1
- 239000002619 cytotoxin Substances 0.000 description 1
- 229960000975 daunorubicin Drugs 0.000 description 1
- 230000002950 deficient Effects 0.000 description 1
- 229940124447 delivery agent Drugs 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 238000002405 diagnostic procedure Methods 0.000 description 1
- 230000029087 digestion Effects 0.000 description 1
- 206010013023 diphtheria Diseases 0.000 description 1
- 230000005750 disease progression Effects 0.000 description 1
- 238000010494 dissociation reaction Methods 0.000 description 1
- 230000005593 dissociations Effects 0.000 description 1
- 229960003668 docetaxel Drugs 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 239000003937 drug carrier Substances 0.000 description 1
- KBQHZAAAGSGFKK-UHFFFAOYSA-N dysprosium atom Chemical compound [Dy] KBQHZAAAGSGFKK-UHFFFAOYSA-N 0.000 description 1
- 235000013601 eggs Nutrition 0.000 description 1
- 108010030074 endodeoxyribonuclease MluI Proteins 0.000 description 1
- 229940088598 enzyme Drugs 0.000 description 1
- UYAHIZSMUZPPFV-UHFFFAOYSA-N erbium Chemical compound [Er] UYAHIZSMUZPPFV-UHFFFAOYSA-N 0.000 description 1
- 210000003238 esophagus Anatomy 0.000 description 1
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 1
- 229960005420 etoposide Drugs 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 229960004222 factor ix Drugs 0.000 description 1
- 229940012414 factor viia Drugs 0.000 description 1
- 239000012091 fetal bovine serum Substances 0.000 description 1
- GNBHRKFJIUUOQI-UHFFFAOYSA-N fluorescein Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 GNBHRKFJIUUOQI-UHFFFAOYSA-N 0.000 description 1
- 229960002949 fluorouracil Drugs 0.000 description 1
- 238000002825 functional assay Methods 0.000 description 1
- UIWYJDYFSGRHKR-UHFFFAOYSA-N gadolinium atom Chemical compound [Gd] UIWYJDYFSGRHKR-UHFFFAOYSA-N 0.000 description 1
- 229960005277 gemcitabine Drugs 0.000 description 1
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 1
- 238000012215 gene cloning Methods 0.000 description 1
- 238000007429 general method Methods 0.000 description 1
- 238000010353 genetic engineering Methods 0.000 description 1
- FIVPIPIDMRVLAY-RBJBARPLSA-N gliotoxin Chemical compound C1C2=CC=C[C@H](O)[C@H]2N2[C@]1(SS1)C(=O)N(C)[C@@]1(CO)C2=O FIVPIPIDMRVLAY-RBJBARPLSA-N 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- CBMIPXHVOVTTTL-UHFFFAOYSA-N gold(3+) Chemical compound [Au+3] CBMIPXHVOVTTTL-UHFFFAOYSA-N 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 208000024963 hair loss Diseases 0.000 description 1
- 230000003676 hair loss Effects 0.000 description 1
- 239000002874 hemostatic agent Substances 0.000 description 1
- 210000003494 hepatocyte Anatomy 0.000 description 1
- 229940022353 herceptin Drugs 0.000 description 1
- 125000000487 histidyl group Chemical group [H]N([H])C(C(=O)O*)C([H])([H])C1=C([H])N([H])C([H])=N1 0.000 description 1
- KJZYNXUDTRRSPN-UHFFFAOYSA-N holmium atom Chemical compound [Ho] KJZYNXUDTRRSPN-UHFFFAOYSA-N 0.000 description 1
- 239000012456 homogeneous solution Substances 0.000 description 1
- 230000021158 homophilic cell adhesion Effects 0.000 description 1
- 230000003100 immobilizing effect Effects 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 238000003119 immunoblot Methods 0.000 description 1
- 230000002055 immunohistochemical effect Effects 0.000 description 1
- 238000001114 immunoprecipitation Methods 0.000 description 1
- 230000001024 immunotherapeutic effect Effects 0.000 description 1
- 238000005462 in vivo assay Methods 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- APFVFJFRJDLVQX-AHCXROLUSA-N indium-111 Chemical compound [111In] APFVFJFRJDLVQX-AHCXROLUSA-N 0.000 description 1
- APFVFJFRJDLVQX-YPZZEJLDSA-N indium-113 Chemical compound [113In] APFVFJFRJDLVQX-YPZZEJLDSA-N 0.000 description 1
- 239000000411 inducer Substances 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 208000014674 injury Diseases 0.000 description 1
- 229940125396 insulin Drugs 0.000 description 1
- 102000006495 integrins Human genes 0.000 description 1
- 108010044426 integrins Proteins 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000010253 intravenous injection Methods 0.000 description 1
- XMBWDFGMSWQBCA-YPZZEJLDSA-N iodane Chemical compound [125IH] XMBWDFGMSWQBCA-YPZZEJLDSA-N 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- BPHPUYQFMNQIOC-NXRLNHOXSA-N isopropyl beta-D-thiogalactopyranoside Chemical compound CC(C)S[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O BPHPUYQFMNQIOC-NXRLNHOXSA-N 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 238000012933 kinetic analysis Methods 0.000 description 1
- CZMAIROVPAYCMU-UHFFFAOYSA-N lanthanum(3+) Chemical compound [La+3] CZMAIROVPAYCMU-UHFFFAOYSA-N 0.000 description 1
- 239000002523 lectin Substances 0.000 description 1
- 235000005772 leucine Nutrition 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- GZQKNULLWNGMCW-PWQABINMSA-N lipid A (E. coli) Chemical compound O1[C@H](CO)[C@@H](OP(O)(O)=O)[C@H](OC(=O)C[C@@H](CCCCCCCCCCC)OC(=O)CCCCCCCCCCCCC)[C@@H](NC(=O)C[C@@H](CCCCCCCCCCC)OC(=O)CCCCCCCCCCC)[C@@H]1OC[C@@H]1[C@@H](O)[C@H](OC(=O)C[C@H](O)CCCCCCCCCCC)[C@@H](NC(=O)C[C@H](O)CCCCCCCCCCC)[C@@H](OP(O)(O)=O)O1 GZQKNULLWNGMCW-PWQABINMSA-N 0.000 description 1
- 238000001638 lipofection Methods 0.000 description 1
- 230000004807 localization Effects 0.000 description 1
- 231100000053 low toxicity Toxicity 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 230000003211 malignant effect Effects 0.000 description 1
- 210000001161 mammalian embryo Anatomy 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 235000013372 meat Nutrition 0.000 description 1
- 229960001924 melphalan Drugs 0.000 description 1
- SGDBTWWWUNNDEQ-LBPRGKRZSA-N melphalan Chemical compound OC(=O)[C@@H](N)CC1=CC=C(N(CCCl)CCCl)C=C1 SGDBTWWWUNNDEQ-LBPRGKRZSA-N 0.000 description 1
- QSHDDOUJBYECFT-AHCXROLUSA-N mercury-197 Chemical compound [197Hg] QSHDDOUJBYECFT-AHCXROLUSA-N 0.000 description 1
- QSHDDOUJBYECFT-NJFSPNSNSA-N mercury-203 Chemical compound [203Hg] QSHDDOUJBYECFT-NJFSPNSNSA-N 0.000 description 1
- 229910021645 metal ion Inorganic materials 0.000 description 1
- 208000037819 metastatic cancer Diseases 0.000 description 1
- 208000011575 metastatic malignant neoplasm Diseases 0.000 description 1
- 208000010658 metastatic prostate carcinoma Diseases 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- CFCUWKMKBJTWLW-BKHRDMLASA-N mithramycin Chemical compound O([C@@H]1C[C@@H](O[C@H](C)[C@H]1O)OC=1C=C2C=C3C[C@H]([C@@H](C(=O)C3=C(O)C2=C(O)C=1C)O[C@@H]1O[C@H](C)[C@@H](O)[C@H](O[C@@H]2O[C@H](C)[C@H](O)[C@H](O[C@@H]3O[C@H](C)[C@@H](O)[C@@](C)(O)C3)C2)C1)[C@H](OC)C(=O)[C@@H](O)[C@@H](C)O)[C@H]1C[C@@H](O)[C@H](O)[C@@H](C)O1 CFCUWKMKBJTWLW-BKHRDMLASA-N 0.000 description 1
- 229960004857 mitomycin Drugs 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 238000002715 modification method Methods 0.000 description 1
- 238000001823 molecular biology technique Methods 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 239000003471 mutagenic agent Substances 0.000 description 1
- 231100000707 mutagenic chemical Toxicity 0.000 description 1
- 239000002636 mycotoxin Substances 0.000 description 1
- OHDXDNUPVVYWOV-UHFFFAOYSA-N n-methyl-1-(2-naphthalen-1-ylsulfanylphenyl)methanamine Chemical compound CNCC1=CC=CC=C1SC1=CC=CC2=CC=CC=C12 OHDXDNUPVVYWOV-UHFFFAOYSA-N 0.000 description 1
- 230000008693 nausea Effects 0.000 description 1
- QEFYFXOXNSNQGX-UHFFFAOYSA-N neodymium atom Chemical compound [Nd] QEFYFXOXNSNQGX-UHFFFAOYSA-N 0.000 description 1
- 239000003865 nucleic acid synthesis inhibitor Substances 0.000 description 1
- 239000002777 nucleoside Substances 0.000 description 1
- 150000003833 nucleoside derivatives Chemical class 0.000 description 1
- 238000011580 nude mouse model Methods 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 230000008520 organization Effects 0.000 description 1
- 229940055729 papain Drugs 0.000 description 1
- 235000019834 papain Nutrition 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 108010087558 pectate lyase Proteins 0.000 description 1
- ZNEZZONMADKYTB-VRCUBXEUSA-N pederin Chemical compound C1[C@@H](O)C(C)(C)[C@@H](C[C@@H](COC)OC)O[C@@H]1[C@H](OC)NC(=O)[C@@H](O)[C@]1(OC)O[C@H](C)[C@H](C)C(=C)C1 ZNEZZONMADKYTB-VRCUBXEUSA-N 0.000 description 1
- 101150040383 pel2 gene Proteins 0.000 description 1
- 101150050446 pelB gene Proteins 0.000 description 1
- 229940111202 pepsin Drugs 0.000 description 1
- 238000010647 peptide synthesis reaction Methods 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 239000012071 phase Substances 0.000 description 1
- 238000009520 phase I clinical trial Methods 0.000 description 1
- 238000009521 phase II clinical trial Methods 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 230000003169 placental effect Effects 0.000 description 1
- 239000003123 plant toxin Substances 0.000 description 1
- 239000013600 plasmid vector Substances 0.000 description 1
- 229960003171 plicamycin Drugs 0.000 description 1
- 229960001237 podophyllotoxin Drugs 0.000 description 1
- YJGVMLPVUAXIQN-XVVDYKMHSA-N podophyllotoxin Chemical compound COC1=C(OC)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@H](O)[C@@H]3[C@@H]2C(OC3)=O)=C1 YJGVMLPVUAXIQN-XVVDYKMHSA-N 0.000 description 1
- YVCVYCSAAZQOJI-UHFFFAOYSA-N podophyllotoxin Natural products COC1=C(O)C(OC)=CC(C2C3=CC=4OCOC=4C=C3C(O)C3C2C(OC3)=O)=C1 YVCVYCSAAZQOJI-UHFFFAOYSA-N 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 231100001271 preclinical toxicology Toxicity 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 238000009117 preventive therapy Methods 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 108020001580 protein domains Proteins 0.000 description 1
- 239000000007 protein synthesis inhibitor Substances 0.000 description 1
- 230000006337 proteolytic cleavage Effects 0.000 description 1
- FFISLTWEISOMFC-UHFFFAOYSA-N pyridin-2-yl propanedithioate Chemical compound CCC(=S)SC1=CC=CC=N1 FFISLTWEISOMFC-UHFFFAOYSA-N 0.000 description 1
- 238000003127 radioimmunoassay Methods 0.000 description 1
- 238000002708 random mutagenesis Methods 0.000 description 1
- 229940051173 recombinant immunotoxin Drugs 0.000 description 1
- 230000006798 recombination Effects 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000010076 replication Effects 0.000 description 1
- 238000012827 research and development Methods 0.000 description 1
- 238000002271 resection Methods 0.000 description 1
- 230000000241 respiratory effect Effects 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- WUAPFZMCVAUBPE-IGMARMGPSA-N rhenium-186 Chemical compound [186Re] WUAPFZMCVAUBPE-IGMARMGPSA-N 0.000 description 1
- 229920002477 rna polymer Polymers 0.000 description 1
- 229910052701 rubidium Inorganic materials 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- DOSGOCSVHPUUIA-UHFFFAOYSA-N samarium(3+) Chemical compound [Sm+3] DOSGOCSVHPUUIA-UHFFFAOYSA-N 0.000 description 1
- 208000011571 secondary malignant neoplasm Diseases 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 238000012163 sequencing technique Methods 0.000 description 1
- 125000003607 serino group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C(O[H])([H])[H] 0.000 description 1
- 238000002741 site-directed mutagenesis Methods 0.000 description 1
- 201000010088 skin benign neoplasm Diseases 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 238000010532 solid phase synthesis reaction Methods 0.000 description 1
- 210000001082 somatic cell Anatomy 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 235000011149 sulphuric acid Nutrition 0.000 description 1
- 230000000153 supplemental effect Effects 0.000 description 1
- 230000001502 supplementing effect Effects 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- GZCRRIHWUXGPOV-UHFFFAOYSA-N terbium atom Chemical compound [Tb] GZCRRIHWUXGPOV-UHFFFAOYSA-N 0.000 description 1
- 150000003573 thiols Chemical class 0.000 description 1
- DSNBHJFQCNUKMA-SCKDECHMSA-N thromboxane A2 Chemical compound OC(=O)CCC\C=C/C[C@@H]1[C@@H](/C=C/[C@@H](O)CCCCC)O[C@@H]2O[C@H]1C2 DSNBHJFQCNUKMA-SCKDECHMSA-N 0.000 description 1
- 239000003768 thromboxane synthase inhibitor Substances 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 231100000440 toxicity profile Toxicity 0.000 description 1
- 230000002103 transcriptional effect Effects 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 238000011830 transgenic mouse model Methods 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 230000014621 translational initiation Effects 0.000 description 1
- 230000008733 trauma Effects 0.000 description 1
- PXSOHRWMIRDKMP-UHFFFAOYSA-N triaziquone Chemical compound O=C1C(N2CC2)=C(N2CC2)C(=O)C=C1N1CC1 PXSOHRWMIRDKMP-UHFFFAOYSA-N 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- 230000005747 tumor angiogenesis Effects 0.000 description 1
- 238000013414 tumor xenograft model Methods 0.000 description 1
- 241000701447 unidentified baculovirus Species 0.000 description 1
- LEONUFNNVUYDNQ-UHFFFAOYSA-N vanadium atom Chemical compound [V] LEONUFNNVUYDNQ-UHFFFAOYSA-N 0.000 description 1
- 239000013603 viral vector Substances 0.000 description 1
- 210000001835 viscera Anatomy 0.000 description 1
- 230000004580 weight loss Effects 0.000 description 1
- 229940075420 xanthine Drugs 0.000 description 1
- 210000005253 yeast cell Anatomy 0.000 description 1
- 229960005502 α-amanitin Drugs 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/21—Immunoglobulins specific features characterized by taxonomic origin from primates, e.g. man
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/622—Single chain antibody (scFv)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
- C07K2317/732—Antibody-dependent cellular cytotoxicity [ADCC]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
- C07K2317/734—Complement-dependent cytotoxicity [CDC]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Immunology (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Molecular Biology (AREA)
- Cell Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Veterinary Medicine (AREA)
- General Chemical & Material Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Animal Behavior & Ethology (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
Abstract
【選択図】なし
Description
(a)配列番号5のアミノ酸配列、またはそれに実質的に相同な配列を含む、重鎖CDR1ドメイン、
(b)配列番号6のアミノ酸配列、またはそれに実質的に相同な配列を含む、重鎖CDR2ドメイン、および
(c)配列番号7のアミノ酸配列、またはそれに実質的に相同な配列を含む、重鎖CDR3ドメインから成る群より選択される。
(a)配列番号8のアミノ酸配列、またはそれに実質的に相同な配列を含む、軽鎖CDR1ドメイン、
(b)配列番号9もしくは配列番号29のアミノ酸配列、またはそれらに実質的に相同な配列を含む、軽鎖CDR2ドメイン、および
(c)配列番号10、配列番号30、配列番号43、配列番号56、配列番号69、もしくは配列番号82、またはそれらに実質的に相同な配列を含む軽鎖CDR3ドメインから成る群より選択される。
(a)配列番号7のアミノ酸配列、またはそれに実質的に相同な配列を含む、重鎖CDR3、および
(b)配列番号10、配列番号30、配列番号43、配列番号56、配列番号69、もしくは配列番号82、またはそれらに実質的に相同な配列を含む軽鎖CDR3の双方を含む。
配列番号7のアミノ酸配列、もしくはそれに実質的に相同な配列を含む重鎖CDR3ドメイン、および/または配列番号10、配列番号30、配列番号43、配列番号56、配列番号69、もしくは配列番号82、またはそれらに実質的に相同な配列を含む軽鎖CDR3ドメインを含む、EpCAMに結合する抗体を提供する。
前記抗体は、任意に、
配列番号6のアミノ酸配列、もしくはそれに実質的に相同な配列を含む重鎖CDR2ドメイン、および/または配列番号9もしくは配列番号29のアミノ酸配列、またはそれらに実質的に相同な配列を含む軽鎖CDR2ドメインをさらに含む、ならびに/あるいは
配列番号5のアミノ酸配列、またはそれに実質的に相同な配列を含む重鎖CDR1ドメイン、および/または
配列番号8のアミノ酸配列、またはそれに実質的に相同な配列を含む軽鎖CDR1ドメインをさらに含む。
配列番号6のアミノ酸配列、もしくはそれに実質的に相同な配列を含む重鎖CDR2ドメイン、および/または配列番号9もしくは配列番号29のアミノ酸配列、またはそれらに実質的に相同な配列を含む軽鎖CDR2ドメインを含む、EpCAMに結合する抗体を提供する。
前記抗体は、任意に、
配列番号7のアミノ酸配列、もしくはそれに実質的に相同な配列を含む重鎖CDR3ドメイン、および/または配列番号10、配列番号30、配列番号43、配列番号56、配列番号69、もしくは配列番号82のアミノ酸配列、またはそれらに実質的に相同な配列を含む軽鎖CDR3ドメインをさらに含む、ならびに/あるいは
配列番号5のアミノ酸配列、もしくはそれに実質的に相同な配列を含む重鎖CDR1ドメイン、および/または
配列番号8のアミノ酸配列、またはそれに実質的に相同な配列を含む軽鎖CDR1ドメインをさらに含む。
配列番号5のアミノ酸配列、もしくはそれに実質的に相同な配列を含む重鎖CDR1ドメイン、および/または配列番号8のアミノ酸配列、もしくはそれに実質的に相同な配列を含む軽鎖CDR1ドメインを含む、EpCAMに結合する抗体を提供する。
前記抗体は、任意に、
配列番号7のアミノ酸配列、もしくはそれに実質的に相同な配列を含む重鎖CDR3ドメイン、および/または配列番号10、配列番号30、配列番号43、配列番号56、配列番号69、もしくは配列番号82のアミノ酸配列、またはそれらに実質的に相同な配列を含む軽鎖CDR3ドメインをさらに含む、ならびに/あるいは
配列番号6のアミノ酸配列、もしくはそれに実質的に相同な配列を含む重鎖CDR2ドメイン、および/または
配列番号もしくは配列番号29のアミノ酸配列、またはそれらに実質的に相同な配列を含む軽鎖CDR2ドメインをさらに含む。
配列番号5の重鎖CDR1ドメイン、
配列番号6の重鎖CDR2ドメイン、および
配列番号7の重鎖CDR3ドメイン、
または前述の配列のいずれか1つに実質的に相同な配列を含む、
ならびに/あるいは
配列番号8の軽鎖CDR1ドメイン、
配列番号9の軽鎖CDR2ドメイン、および
配列番号10の軽鎖CDR3ドメイン、
または前述の配列のいずれか1つに実質的に相同な配列を含む。
(c)配列番号7のアミノ酸配列、またはそれに実質的に相同な配列を有するVH CDR3を含む。
(a)配列番号5のアミノ酸配列、またはそれに実質的に相同である配列を有するVH CDR1、
(b)配列番号6のアミノ酸配列、またはそれに実質的に相同である配列を有するVH CDR2、および
(c)配列番号7のアミノ酸配列、またはそれに実質的に相同な配列を有するVH CDR3含む。
(d)配列番号8のアミノ酸配列、またはそれに実質的に相同な配列を有する可変軽鎖(VL)CDR1、
(e)配列番号9もしくは配列番号29のアミノ酸配列、またはそれらに実質的に相同である配列を有するVL CDR2、および
(f)配列番号10、配列番号30、配列番号43、配列番号56、配列番号69、もしくは配列番号82、またはそれらに実質的に相同な配列を有するVL CDR3から成る群より選択される。
(d)配列番号8のアミノ酸配列、またはそれに実質的に相同な配列を有する可変軽鎖(VL)CDR1、
(e)配列番号9もしくは配列番号29のアミノ酸配列、またはそれに実質的に相同である配列を有するVL CDR2、および
(f)配列番号10、配列番号30、配列番号43、配列番号56、配列番号69、もしくは配列番号82、またはそれらに実質的に相同な配列を有するVL CDR3から成る群より選択される。
(d)配列番号8のアミノ酸配列、またはそれに実質的に相同な配列を有する可変軽鎖(VL)CDR1、
(e)配列番号9もしくは配列番号29のアミノ酸配列、またはそれらに実質的に相同である配列を有するVL CDR2、および
(f)配列番号10、配列番号30、配列番号43、配列番号56、配列番号69、もしくは配列番号82、またはそれらに実質的に相同な配列を有するVL CDR3から成る群より選択される。
(i)配列番号8のアミノ酸配列、またはそれに実質的に相同な配列を有する可変軽鎖(VL)CDR1、
(ii)配列番号9もしくは配列番号29のアミノ酸配列、またはそれらに実質的に相同である配列を有するVL CDR2、および
(iii)配列番号10、配列番号30、配列番号43、配列番号56、配列番号69、もしくは配列番号82、またはそれらに実質的に相同な配列を有するVL CDR3を含む。
(i)配列番号5のアミノ酸配列、またはそれに実質的に相同である配列を有するVH CDR1、
(ii)配列番号6のアミノ酸配列、またはそれに実質的に相同である配列を有するVH CDR2、および
(iii)配列番号7のアミノ酸配列、またはそれに実質的に相同な配列を有するVH CDR3から成る群より選択される。
(i)配列番号5のアミノ酸配列、またはそれに実質的に相同である配列を有するVH CDR1、
(ii)配列番号6のアミノ酸配列、またはそれに実質的に相同である配列を有するVH CDR2、および
(iii)配列番号7のアミノ酸配列、またはそれに実質的に相同な配列を有するVH CDR3から成る群より選択される。
(i)配列番号5のアミノ酸配列、またはそれに実質的に相同である配列を有するVH CDR1、
(ii)配列番号6のアミノ酸配列、またはそれに実質的に相同である配列を有するVH CDR2、および
配列番号7のアミノ酸配列、またはそれに実質的に相同な配列を有するVH CDR3から成る群より選択される。
配列番号5、6、もしくは7、または配列番号5、6、もしくは7のうちの1つ以上に実質的に相同な配列の重鎖CDRのうちの1つ、2つもしくは3つを含むVHドメイン、および/または
配列番号8(VL CDR1において)、9もしくは29(VL CDR2において)、または10、30、43、56、69、もしくは82(VL CDR3において)、またはそれらの配列のうちの1つ以上に実質的に相同な配列の軽鎖CDRの1つ、2つもしくは3つを含む、VLドメインを含む抗体を提供する。
配列番号5、6、および7の3つの重鎖CDRを含むVHドメイン、ならびに
3つの軽鎖CDRを含むVLドメインを含む抗体を提供する。好ましい実施形態において、軽鎖CDRのうちの1つ、2つ、または3つは、配列番号8、9、および10に定義される通りである。それらに実質的に相同な配列も含まれる。
配列番号8、9、および10の3つの軽鎖CDRを含むVLドメイン、および
3つの重鎖CDRを含むVHドメインを含む抗体を提供する。好ましい実施形態において、重鎖CDRのうちの1つ、2つ、または3つは、配列番号5、6、および7に定義される通りである。
(a)遊離EpCAM、例えば、ELISAアッセイもしくはBIAcoreアッセイにより評価される、固体支持体上で、例えば、組み換えにより発現するEpCAMに結合する、
(b) 例えば、非還元条件下で、ウェスタンブロットにおいて、EpCAMへの結合により評価される、立体構造的依存性(例えば、非線形)EpCAMエピトープに結合する、
(c)例えば、フローサイトメトリーまたは免疫組織化学検査により評価される、細胞の表面上に発現するEpCAMに結合する、
(d)少なくともヒトEpCAM、より好ましくは、ヒトおよびサルのEpCAM、またはヒトおよびマウスのEpCAM、最も好ましくは、ヒト、サル、およびマウスのEpCAMに結合する、
(e)本明細書の別の箇所でも説明される、10nM以下、好ましくは5nM以下、より好ましくは3nM以下、または2nM以下、最も好ましくは1nM以下の結合親和性(Kd)でヒトEpCAMに結合する、
(f)本明細書の別の箇所でも説明される、同様の親和性で、例えば、10nM以下、好ましくは5nM以下、より好ましくは3nM以下、または2nM以下、例えば、1nM以下のKdで、ヒトおよびサルのEpCAM、またはヒトおよびマウスのEpCAMに結合する。
(g)腫瘍を有する動物への投与により、腫瘍に局在される、
(h)本明細書の別の箇所に記載される、腫瘍細胞のADCCを誘発する、
(i)本明細書の別の箇所に記載される、腫瘍細胞のCDCを誘発する、
(j)in vivoで、抗腫瘍作用を誘発する。
が計算される。
(c)配列番号7のアミノ酸配列、もしくはそれに実質的に相同な配列を有するVH CDR3、または
(a)配列番号5のアミノ酸配列、もしくはそれに実質的に相同な配列を有する可変重鎖(VH)CDR1、
(b)配列番号6のアミノ酸配列、もしくはそれに実質的に相同な配列を有するVH CDR2、および
(c)配列番号7のアミノ酸配列、もしくはそれに実質的に相同な配列を有するVH CDR3を含む。
(a)動物または患者を、実質的に腫瘍量を低減する第1の治療に曝すことと、
(b)実質的に、少なくとも第1の本発明の抗EpCAM抗体、その抗原結合断片、またはその免疫抱合体を投与することとを含み、任意に、抗体または断片は、第2の治療剤と操作可能に会合される。
(a)上記動物から採取した試験試料を本発明の抗体、またはその免疫抱合体と接触させるステップを含む。
(a) 上記動物から採取した試験試料を本発明の抗体、またはその免疫抱合体と接触させるステップと、
(b)試験試料における抗体−抗原複合体の存在、および/もしくは量、および/もしくは位置を測定する、または検出するステップと、任意に、
(c)試験試料における抗体−抗原複合体の存在、および/または量を対照と比較するステップとを含む。
本発明は、検出可能なシグナルを直接的または間接的に産生する標識に結合される、本発明の抗体を含む診断剤または撮像剤も含む。適切な標識は、本発明の別の箇所に記載される。
(a)本発明の抗EpCAM抗体に操作可能に結合された診断剤を含む、腫瘍を有する動物または患者に診断量の少なくとも第1の検出可能な標識された本発明の抗EpCAM抗体を投与し、それによって、腫瘍の検出可能な画像を形成することにより、腫瘍の画像を形成することと、
(b) 実質的に、同じ動物または患者に治療的に最適な量の少なくとも本発明の第1の裸抗EpCAM抗体、またはそのような抗体を使用する治療剤−抗体構築物を投与し、それによって、抗腫瘍作用をもたらすことによっても行うことができる。
癌治療として使用することができるさらなる腫瘍特異的抗体の必要性を考慮して、HT29等の結腸癌細胞株を特異的に認識するヒト抗体が識別された。抗体は、特異的にEpCAMに結合することができる。抗体の単一鎖形態を、c−mycおよび6xHisタグエピトープを含有するpHOG21プラスミドにクローン化した(図8)。TG1細菌を形質転換し、IPTG誘発によりscFvを発現させた。精製されたscFvの結合は、Easycyteフローサイトメーターを使用して、フローサイトメトリーにより確認された。
クローンを産生する抗体の重鎖および軽鎖のヌクレオチド配列を配列決定した。抗体は、3−17I(scFv)と表される。3−17I(scFv)の軽鎖および重鎖のヌクレオチド配列とアミノ酸配列を図1および表1に示す。3−17Iの軽鎖および重鎖のCDR領域を表1に示す。
3−17I IgGのEpCAM陽性細胞への結合を分析するために、フローサイトメトリー分析を実施した。陽性対照として、抗EpCAMキメラ(マウス可変/ヒト定常ドメイン)および、完全ヒト抗体であるMOC31およびMT201を、それぞれ使用した。
3−17IのEpCAMに結合する能力を決定するために、ウェスタンブロット法、ELISA、およびBIAcoreアッセイを実施した。
抗体3−17I、MT201、およびMOC31のヒトおよびカニクイザルのEpCAMへの結合特異性および交差反応性を分析するために、ドデシル硫酸ナトリウムポリアクリルアミドゲル電気泳動(SDS−PAGE)およびウェスタンブロット分析を、還元条件および非還元条件下で実施した。全ての抗体はIgG形態であり、過渡的に形質移入されたHEK−293細胞において産生された。次いで、抗体をプロテインAセファロース(GE Healthcare,Uppsala,Sweden)上で精製した後、2つの連続して連結されたサイズ排除カラムのSuperdex 200およびSuperdex 75上で分画した。得られたIgG調製物は、>95%純度の単量体であるように思われた。組み換えヒトおよびカニクイザルのEpCAM抗原もHEK−293細胞において産生され、プロテインAセファロースカラム上で、1ステップで精製された。抗原調製物の決定された純度は、90%を上回った。双方のEpCAM構築物は、IgG1からのヒトFc領域に融合したEpCAMの細胞外ドメインから成る。
3−17I、MT201、およびMOC31のヒトおよびカニクイザルのEpCAMへの特異性および親和性を決定するために、一連のELISA実験を実施した。IgG1形式の全ての抗体、ならびにヒトおよびカニクイザルのEpCAM抗原を、前述に示すように産生し、精製した(実施例1および実施例2、ならびに実施例3の始めを参照)。
ELISAデータは、3−17I IgGのヒトおよびカニクイザルのEpCAMの双方への同等に良好な結合を実証した(図4A)。逆に、MOC31抗体は、ヒトおよびカニクイザルの抗原に対して、顕著に異なる結合パターンを示し(図4C)、よって、カニクイザルEpCAMに対して非常に低い親和性を示した。興味深いことに、抗体MT201は、ヒトEpCAMに対して比較的弱い結合のみを示し、この抗体のカニクイザル抗原への結合は、検出されなかった(図4B)。
3−17IのヒトおよびカニクイザルのEpCAMへの結合は、BIAcore T100(BIAcore,Inc,Piscataway,NJ)の表面プラスモン共鳴(SPR)を使用して分析された。ヒトFc(IgG1)に融合したヒトまたはカニクイザルのEpCAMの細胞外ドメインは、100RUの密度で、CM5チップ(BIAcore,Inc,Piscataway,NJ)に結合された。流速50μl/分、37℃で、標準的な技法を使用して、SPR試験を実施した。データは、BIAcoreソフトウェアの1:1ラングミュア結合モデルを使用して分析された。
3−17I IgGのADCCおよび/またはCDCを介して標的細胞死滅を媒介する能力を決定するために、機能アッセイを実施した。これらの試験からの結果は、3−17I IgGがADCCおよびCDCを媒介することを示す。加えて、これらのデータは、ADCCおよびCDCの双方の誘発において、MT201 IgGに対する3−17I IgGの優位性を明らかに示す。
3−17I IgGのADCCを誘発する能力は、EpCAMの面密度において100倍を超える様々な相違を網羅する、3つの異なる乳癌細胞株であるMDA−MB−231、MDA−453、およびBT−474を使用して分析された(Prangら、2005)。これら全ての細胞株上でADCCを誘発することがPrangらによって報告されたため、MT201 IgGが陽性対照抗体として使用された。MDA−MB−453(乳房乳腺、ATCC番号HTB−131)、MDA−MB−231(乳房乳腺、ATCC番号HTB−26)、およびBT−474(乳房乳腺、ATCC番号HTB−20)細胞株は、American Type Culture Collection(ATCC,Rockville,MD)から得た。
3−17I IgGの補体依存性細胞障害(CDC)を誘発する能力は、2つの細胞株KATO IIIおよびMT−3を使用して分析された。3つの関連する抗体クローン12−C15 IgG、16−G5 IgG、および17−C20 IgGも、KATO III細胞株を使用して、CDCを誘発するそれらの能力について試験された。MT201 IgGは、これらの細胞株上でCDCを誘発することがPrangら(2005)によって報告されたため、陽性対照抗体として使用された。KATO III(胃癌、ATCC番号HTB−103)およびMT−3(乳癌、DSMZ番号ACC403)細胞株は、それぞれ、American Type Culture Collection(ATCC,Rockville,MD)およびDSMZ(Braunschweig,Germany)から得た。KATO IIIおよびMT−3細胞は、それぞれ、20%および10%のウシ胎仔血清を添加したRPMI−1640培養培地で維持された。全ての培地をペニシリンおよびストレプトマイシンで補充した。全ての細胞培地および補充物は、PAA(Pasching,Austria)から得た。
以下の参考文献は、本明細書に記載されるものに対して補助的な例示的手順または他の詳細を提供する限り、参照により本明細書に具体的に組み込まれる。
Altschul, Madden, Schaffer, Zhang, Zhang, Miller, Lipman, "Gapped BLAST and PSI-BLAST: a new generation of protein database search programs", Nucleic Acids Res., 25:3389-3402, 1997.
Arbabi-Ghahroudi, Desmyter, Wyns, Hamers, Muyldermans, "Selection and identification of single domain antibody fragments from camel heavy-chain antibodies", FEBS Lett., 414:521-526, 1997.
Baeverle and Gires, BJC, 96: 417-423, 2007.
Baldari, Murray, Ghiara, Cesareni, Galeotti, "A Novel Leader Peptide Which Allows Efficient Secretion of a Fragment of Human Interleukin 1 Beta in Saccharomyces Cerevisiae", EMBO J., 6:229-234, 1987
Beckman, Weiner and Davis, "Antibody Constructs in Cancer Therapy", Cancer, 109(2):170-179, 2006.
Brinster, Chen, Trumbauer, Yagle, Palmiter, "Factors Affecting the Efficiency of Introducing Foreign DNA into Mice by Microinjecting Eggs", Proc. Natl. Acad. Sci. USA, 82(13):4438-4442, 1985.
Carillo and Lipton, "The Multiple Sequence Alignment Problem in Biology", SIAM J. Applied Math., 48:1073, 1988.
Cullen, Gray, Wilson, Hayenga, Lamsa, Rey, Norton, Berka, "Controlled Expression and Secretion of Bovine Chymosin in Aspergillus Nidulans", BioTechnology, 5:369, 1987.
Davies and Cohen, "Interactions of protein antigens with antibodies," Proc Natl. Acad. Sci. U.S.A. 93:7-12, 1996.
Davies, Padlan, Sheriff, "Antibody-antigen complexes," Annu. Rev. Biochem. 59:439-473, 1990.
Davies and Riechmann, "Antibody VH domains as small recognition units", Biotechnology (NY), 13:475-479, 1995.
Devereux, Haeberli, Smithies, "A Comprehensive Set of Sequence Analysis Programs for the VAX", Nucleic Acids Res., 12:387, 1984.
Di Paoloら, "A recombinant immunotoxin derived from a humanized epithelial cell adhesion molecule-specific single-chain antibody fragment has potent and selective antitumor activity", Clin Cancer Res 9: 2837-48, 2003.
Frische, Meldal, Werdelin, Mouritsen, Jensen, Galli-Stampino, Bock, "Multiple Column Synthesis of a Library of T-Cell Stimulating Tn-Antigenic Glycopeptide Analogues for the Molecular Characterization of T-Cell-Glycan Specificity", J. Pept. Sci., 2(4): 212-22, 1996.
Goeddel, "Gene Expression Technology: Methods in Enzymology 185, Academic Press, San Diego, CA, 1990.
Hamers-Casterman and Atarhouch, "Naturally Occurring antibodies Devoid of Light Chains", Nature, 363(6428):446-448, 1993.
Hammer, Pursel, Rexroad, Wall, Bolt, Ebert, Palmiter, Brinster, "Production of Transgenic Rabbits, Sheep and Pigs by Microinjection", Nature, 315:680-683, 1985.
Henikoff and Henikoff, "Amino acid Substitution Matrices from Protein Blocks", Proc. Natl. Acad. Sci. USA, 89:10915−10919, 1992.
Hinnen, Hicks, Fink, "Transformation of Yeast", Proc. Natl. Acad. Sci. USA, 75:1929, 1978.
Holliger and Hudson, "Engineered Antibody Fragments and the Rise of Single Domains", Nature Biotechnology, 23(9):1126-1136, 2005.
Holm, "Dali: a Network Tool for Protein Structure Comparison", Trends in Biochemical Sciences, 20:478-480, 1995.
Holm, "Protein Structure Comparison by Alignment of Distance Matrices", J. Mol. Biol., 233:123-38, 1993
Holm, "Touring Protein Fold Space With Dali/FSSP", Nucleic Acid Res., 26:316-9, 1998.
Ito, Fukuda, Murata, Kimura, "Transformation of Intact Yeast Cells Treated with Alkali Cations", J. Bacteriol., 153:163-168, 1983.
Kabat, Wu, Perry, Gottesman, Foeller, "Sequences of Proteins of Immunological Interest", 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 647-669, 1991.
Kaufman, Murtha, Davies, "Translational Efficiency of Polycistronic Mrnas and Their Utilization to Express Heterologous Genes in Mammalian Cells", EMBO J., 6:187-195, 1987.
Kiss, Fisher, Pesavento, Dai, Valero, Ovecka, Nolan, Phipps, Velappan, Chasteen, Martinez, Waldo, Pavlik, Bradbury, "Antibody binding loop insertions as diversity elements", Nucleic Acids Research, 34(19):e132, 2006.
Kurjan and Herskowitz, "Structure of a Yeast Pheromone Gene (MFα): a Putative α-Factor Precursor Contains Four Tandem Copies of mature α-Factor", Cell, 30:933-943, 1982.
Le Gall, Reusch, Little and Kipriyanov, "Effect of Linker Sequences Between the Antibody Variable Domains on the Formation, Stability and Biological Activity of a Bispecific Tandem Diabody", Protein Engineering, Design & Selection, 17(4):357-366, 2004.
Luckow and Summers, "High Level Expression of Nonfused Foreign Genes with Autographa Californica Nuclear Polyhedrosis Virus Expression Vectors", Virology, 170:31-39, 1989.
Marhabaら, "CD44 and EpCAM: cancer-initiating cell markers", Curr Mol Med 8: 784-804, 2008.
Merrifield, "Solid Phase Peptide Synthesis 1. Synthesis of a Tetrapeptide", J. Am. Chem. Assoc., 85:2149-2154, 1964.
Munzら, "The carcinoma-associated antigen EpCAM upregulates c-myc and induces cell proliferation", Oncogene 23: 5748-58, 2004.
Myers and Miller, "Optical Alignments in Linear Space", CABIOS, 4:11-17, 1988.
Needleman and Wunsch, "A General Method Applicable to the Search For Similarities in the Amino Acid Sequence of Two Proteins", J. Mol. Biol., 48:443, 1970.
Neuberger and Milstein, "Somatic hypermutation," Curr. Opin. Immunol., 7:248-254, 1995.
Nicaise, Valerio-Lepiniec, Minard, Desmadril, "Affinity transfer by CDR grafting on a nonimmunoglobulin scaffold", Protein Sci., 13: 1882-1891, 2004.
O’Brienら, "A human colon cancer cell capable of initiating tumour growth in immunodeficient mice", Nature 445: 106-10, 2007.
Palmiter and Brinster,"Transgenic Mice", Cell, 41:343-345, 1985.
Palmiter, Norstedt, Gelinas, Hammer, Brinster, "Metallothionein-Human GH Fusion Genes Stimulate Growth of Mice", Science, 222:809-814, 1983.
Pearson and Lipman, "Improved tools for biological sequence analysis", Proc. Natl. Acad. Sci. USA, 85:2444-2448, 1988.
Pearson, "Rapid and sensitive sequence comparison with FASTP and FASTA", Methods in Enzymology, 183:63-98, 1990.
Prang, Preithner, Brischwein, Goster, Woppel, Muller, Steiger, Peters, Baeuerle, da Silva, "Cellular and complement-dependent cytotoxicity of Ep-CAM-specific monoclonal antibody MT201 against breast cancer cell lines", Br J Cancer, 92(2):342-349, 2005.
Qiu, Wang, Cai, Wang, Yue, "Small antibody mimetics comprising two complementarity-determining regions and a framework region for tumor targeting|, Nature Biotechnology, 25(8): 921-929, 2007.
Reff and Heard, "A Review of Modifications to Recombinant Antibodies: Attempt to Increase Efficacy in Oncology Applications", Critical Reviews in Oncology Hematology, 40:25-35, 2001.
Reiter, Ulrich Brinkmann, Lee and Pastan, "Engineering Antibody Fv Fragements for Cancer Detection and Therapy: Disulfide-Stabilized Fv Fragments", Nature Biotechnology, 14:1239-1245, 1996.
Schultz, Tanner, Hofmann, Emini, Condra, Jones, Kieff, Ellis, "Expression and Secretion in Yeast of a 400-Kda Envelope Glycoprotein Derived from Epstein-Barr Virus", Gene, 54:113-123, 1987.
Seed, "an LFA-3 Cdna Encodes a Phospholipid-Linked Membrane Protein Homologous to its Receptor CD2", Nature, 329:840, 1987.
Sinkar, White, Gordon, "Molecular Biology of Ri-Plasmid a Review", J. Biosci (Bangalore), 11:47-58, 1987.
Smith and Waterman, "Comparison of Biosequences", Adv. Appl. Math., 2:482, 1981.
Smith, Summers, Fraser, "Production of Human Beta Interferon in Insect Cells Infected With Baculovirus Expression Vector", Mol. Cell Biol., 3:2156-2165, 1983.
Spizzoら, "High Ep-CAM expression is associated with poor prognosis in node-positive breast cancer", Breast Cancer Res Treat 86: 207-13, 2004.
Spizzoら, "Overexpression of epithelial cell adhesion molecule (Ep-CAM) is an independent prognostic marker for reduced survival of patients with epithelial ovarian cancer", Gynecol Oncol 103: 483-8, 2006.
Thompson, Higgins, Gibson, "CLUSTAL W: Improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice", Nucleic Acids Res., 22:4673-4680, 1994.
van den Beucken, Neer, Sablon, Desmet, Celis, Hoogenboom, Hufton, "Building novel binding ligands to B7.1 and B7.2 based on human antibody single variable light chain domains", J. Mol. Biol., 310:591-601, 2001.
Vargaら, "Overexpression of epithelial cell adhesion molecule antigen in gallbladder carcinoma is an independent marker for poor survival", Clin Cancer Res 10: 3131-6, 2004.
Wagner, Milstein, Neuberger, "Codon bias targets mutation," Nature, 376:732, 1995.
Ward, Gussow, Griffiths, Jones, Winter, "Binding Activities of a Repertoire of Single Immunoglobulin Variable Domains Secreted from Escherichia Coli", Nature, 341(6242):544-546, 1989.
Wentら, "Frequent high-level expression of the immunotherapeutic target Ep-CAM in colon, stomach, prostate and lung cancers", Br J Cancer 94: 128-35, 2006.
Young, MacKenzie, Narang, Oomen and Baenziger, "Thermal Stabilization of a Single-Chain Fv Antibody Fragment by Introduction of a Disulphide Bond", FEBS Letters, 16396(377):135-139, 1995.
Zambryski, Herrera-Estreila, DeBlock, Van Montagu, Schell "Genetic Engineering, Principles and Methods", Hollaender and Setlow (eds.), Vol. VI, pp. 253-278, Plenum Press, New York, 1984.
Zapata, Ridgway, Mordenti, Osaka, Wong, Bennett, Carter, "Engineering Linear F(Ab’)2 Fragments For Efficient Production in Escherichia Coli and Enhanced Antiproliferative Activity", Protein Eng., 8(10):1057-1062, 1995.
Zhang, Gildersleeve, Yang, Xu, Loo, Uryu, Wong, Schultz, "A New Strategy for the Synthesis of Glycoproteins", Science, 303(5656): 371-373, 2004.
配列番号37:
コンセンサス配列
Xaaはいずれのアミノ酸であってもよい
Xaaはいずれのアミノ酸であってもよい
配列番号38:
コンセンサス配列
Xaaはいずれのアミノ酸であってもよい
Xaaはいずれのアミノ酸であってもよい
配列番号89:
コンセンサス配列
Xaaはいずれのアミノ酸であってもよい
Xaaはいずれのアミノ酸であってもよい
Xaaはいずれのアミノ酸であってもよい
Xaaはいずれのアミノ酸であってもよい
配列番号90:
コンセンサス配列
XaaはGlnまたはHisまたはLysであってよい
XaaはAsnまたはAspであってよい
XaaはGlyまたはThrまたはSerまたはmetまたはAlaであってよい
XaaはPheまたはTrpまたはTyrであってよい
配列番号92:MT201 IgG軽鎖
配列番号93:MOC31 IgG重鎖
配列番号94:MOC31 IgG軽鎖
配列番号95:ヒト EpCAM/Fc 融合物
配列番号96:カニクイザル EpCAM/Fc 融合物
配列番号97:制限部位を有する scFV 3-17I
Claims (43)
- EpCAMに結合し、3つのCDRを含む少なくとも1つの重鎖可変領域と、3つのCDRを含む少なくとも1つの軽鎖可変領域とを含む抗体であって、前記重鎖可変領域は、
(c)配列番号7のアミノ酸配列、またはそれに実質的に相同な配列を有するVH CDR3であって、前記実質的に相同な配列は、所与のCDR配列と比較して、1つ、2つ、もしくは3つのアミノ酸置換を含有する配列であるか、または前記実質的に相同な配列は、所与のCDR配列の保存アミノ酸置換を含有する配列である、VH CDR3
を含む、抗体。 - 前記重鎖可変領域CDRの1つ以上は、
(a)配列番号5のアミノ酸配列、またはそれに実質的に相同な配列を有する可変重鎖(VH)CDR1、および
(b)配列番号6のアミノ酸配列、またはそれに実質的に相同な配列を有するVH CDR2
から成る群より選択され、
前記実質的に相同な配列は、所与のCDR配列と比較して、1つ、2つ、もしくは3つのアミノ酸置換を含有する配列であるか、または前記実質的に相同な配列は、所与のCDR配列の保存アミノ酸置換を含有する配列である、請求項1に記載の抗体。 - 前記軽鎖可変領域CDRの1つ以上は、
(d)配列番号8のアミノ酸配列、またはそれに実質的に相同な配列を有する可変軽鎖(VL)CDR1、
(e)G A S T X5 A X7(配列番号37)のアミノ酸配列、またはそれに実質的に相同な配列を有し、X5およびX7は、任意のアミノ酸であり得るVL CDR2、および
(f)Q X2 Y N X5 W P P X9 X10 T(配列番号89)のアミノ酸配列、またはそれに実質的に相同な配列を有し、X2、X5、X9、およびX10は、任意のアミノ酸であり得るVL CDR3
から成る群より選択され、
前記実質的に相同な配列は、所与のCDR配列と比較して、1つ、2つ、または3つのアミノ酸置換を含有する配列であるか、または前記実質的に相同な配列は、所与のCDR配列の保存アミノ酸置換を含有する配列である、請求項1または請求項2に記載の抗体。 - 前記(e)のVL CDR2において、
X5は、RもしくはT、好ましくはTであり、かつ/または
X7は、TもしくはS、好ましくはSであり、かつ/あるいは
前記(f)のVL CDR3において、
X2は、QもしくはHもしくはK、好ましくはQであり、
X5は、NもしくはD、好ましくはNであり、
X9は、GもしくはTもしくはSもしくはMもしくはA、好ましくはAであり、かつ/または
X10は、FもしくはWもしくはY、好ましくはYである、請求項3に記載の抗体。 - 前記(e)のVL CDR2は、配列番号9もしくは配列番号29のアミノ酸配列、またはそれに実質的に相同な配列を有し、かつ/あるいは前記(f)のVL CDR3は、配列番号10、30、43、56、69、もしくは82のアミノ酸配列、またはそれに実質的に相同な配列を有する、請求項3または請求項4に記載の抗体。
- 前記重鎖CDRドメイン(a)、(b)、および(c)のそれぞれのうちの1つ、ならびに/または前記軽鎖CDRドメイン(d)、(e)、および(f)のそれぞれのうちの1つを含む、請求項1〜5のいずれか1項に記載の抗体。
- 前記3つの軽鎖可変領域CDRは、配列番号8、9、および10、または配列番号8、29、および30、または配列番号8、29、および43、または配列番号8、29、および56、または配列番号8、29、および69、または配列番号8、29、および82、あるいはそれらに実質的に相同な配列である、請求項1〜6のいずれか1項に記載の抗体。
- 前記重鎖可変領域は、配列番号3のアミノ酸配列、またはそれに少なくとも70%、80%、90%、95%、または98%の配列同一性を有する配列を含む、請求項1〜7のいずれか1項に記載の抗体。
- 前記軽鎖可変領域は、配列番号4、27、40、53、66、もしくは79のアミノ酸配列、またはそれに少なくとも70%、80%、90%、95%、もしくは98%の配列同一性を有する配列を含む、請求項1〜8のいずれか1項に記載の抗体。
- 前記抗体は、配列番号21、36、49、62、75、もしくは88のアミノ酸配列、またはそれに少なくとも70%、80%、90%、95%、もしくは98%の配列同一性を有する配列を含む、請求項1〜9のいずれか1項に記載の抗体。
- 前記抗体は、ヒトおよびサルの双方のEpCAMに結合することが可能である、請求項1〜10のいずれか1項に記載の抗体。
- 配列番号5のアミノ酸配列を有するVH CDR1、配列番号6のアミノ酸配列を有するVH CDR2、配列番号7のアミノ酸配列を有するVH CDR3、配列番号8のアミノ酸配列を有するVL CDR1、配列番号9のアミノ酸配列を有するVL CDR2、および配列番号10のアミノ酸配列を有するVL CDR3を含む、請求項1〜11のいずれか1項に記載の抗体、または前記抗体とEpCAMへの結合において競合することができる抗体。
- 前記抗体は、完全ヒト抗体である、請求項1〜12のいずれか1項に記載の抗体。
- 前記抗体は、抗体重鎖定常領域および/または抗体軽鎖定常領域の全てもしくは一部を含む、請求項1〜13のいずれか1項に記載の抗体。
- 前記抗体はIgG抗体である、請求項14に記載の抗体。
- 前記抗体は、配列番号24のアミノ酸配列、またはそれに少なくとも70%、80%、90%、95%、もしくは98%の配列同一性を有する配列を含む重鎖と、配列番号25、51、64、もしくは77のアミノ酸配列、またはそれに少なくとも70%、80%、90%、95%、もしくは98%の配列同一性を有する配列を含む軽鎖とを含む、請求項14または請求項15に記載の抗体。
- 前記抗体は、抗体の抗原結合断片である、請求項1〜16のいずれか1項に記載の抗体。
- 前記抗体の前記抗原結合断片は、Fab’、Fab、F(ab’)2、単一ドメイン抗体、TandAbsダイマー、Fv、scFv、dsFv、ds−scFv、Fd、直鎖状抗体、ミニボディ[minibody]、二特異性抗体[diabody]、二重特異性抗体断片[bispecific antibody fragment]、バイボディ[bibody]、トリボディ[tribody]、sc−二特異性抗体[sc-diabody]、カッパ(ラムダ)ボディ、BiTE、DVD−Ig、SIP、SMIP、DART、または1つ以上のCDRを含む小抗体模倣物[small antibody mimetic]である、請求項17に記載の抗体。
- 少なくとも第2の診断剤または治療剤に結合させた請求項1〜18のいずれか1項の抗体を含む免疫抱合体。
- 前記抗体は、放射線治療剤、化学療法剤、抗血管新生剤、アポトーシス誘発剤、抗チューブリン剤、抗細胞もしくは細胞障害性薬物、ステロイド、サイトカイン、ケモカイン、ATPase阻害剤、別の抗体、または血液凝固剤に結合される、請求項19に記載の免疫抱合体。
- 前記抗体は別の抗体に結合され、前記免疫抱合体は二重特異性抗体または二特異性抗体を含む、請求項20に記載の免疫抱合体。
- 請求項1〜21のいずれか1項に記載の抗体を含む結合タンパク質。
- 少なくとも、請求項1〜18のいずれか1項に記載の第1の抗体またはその免疫抱合体を含む組成物。
- 前記組成物は、薬学的に許容される組成物である、請求項23に記載の組成物。
- 前記組成物は、少なくとも第2の治療剤をさらに含む、請求項23または請求項24に記載の組成物。
- 請求項1〜18のいずれか1項に記載の抗体をコードするヌクレオチド配列領域を含む核酸分子。
- 前記ヌクレオチド配列領域は、配列番号1のヌクレオチド配列、および任意に配列番号2、26、39、52、65、もしくは78のヌクレオチド配列、またはそれらに少なくとも70%の配列同一性を有する配列を含む、請求項26に記載の核酸分子。
- 請求項26または請求項27に記載の核酸分子を含む発現ベクター。
- 請求項26もしくは請求項27に記載の核酸分子、または請求項28に記載の発現ベクターを含む、宿主細胞またはウイルス。
- 少なくとも第1の容器に、
(a)請求項1〜18のいずれか1項に記載の抗体、
(b)請求項19〜21のいずれか1項に記載の免疫抱合体、
(c)請求項23〜25のいずれか1項に記載の組成物、
(d)請求項26または請求項27に記載の核酸分子、
(e)請求項28に記載の発現ベクター、
(f)請求項29に記載の宿主細胞、または、
(g)請求項29に記載のウイルス
を含むキット。 - 抗体を産生する方法であって、
(a)前記コードされた抗体を発現するのに効果的な条件下で、請求項26もしくは請求項27に記載の核酸分子、または請求項28に記載の発現ベクターを含む宿主細胞を培養することと、
(b)前記宿主細胞から前記発現した抗体を得ることと
を含む方法。 - EpCAMに結合する方法であって、EpCAMを含む組成物を、請求項1〜18のいずれか1項に記載の抗体、またはその免疫抱合体と接触させることを含む方法。
- EpCAMを検出する方法であって、EpCAM/抗体複合体の形成を可能にするのに効果的な条件下で、EpCAMを含有すると疑われる組成物を、請求項1〜18のいずれか1項に記載の抗体、またはその免疫抱合体と接触させることと、そのように形成された前記複合体を検出することと、を含む方法。
- 動物における癌を診断する方法であって、
(a)EpCAM/抗体複合体の形成を可能にするのに効果的な条件下で、動物、または前記動物から採取した試験試料を、請求項1〜18のいずれか1項に記載の抗体、またはその免疫抱合体と接触させることを含む方法。 - 前記方法は、
(b)前記試験試料中の抗体−抗原複合体の存在、および/または量、および/または位置を測定するか、または検出すること、ならびに、
任意に、
(c)前記試験試料中の抗体−抗原複合体の前記存在および/または量を対照と比較すること、をさらに含む、請求項34に記載の方法。 - 癌を治療する方法であって、動物に請求項1〜18のいずれか1項に記載の抗体、またはその免疫抱合体を、前記動物の癌を治療するのに効果的な量で投与することを含む方法。
- 第2の治療剤を前記動物に投与することをさらに含む、請求項36に記載の方法。
- 前記動物はヒト対象である、請求項34〜37のいずれか1項に記載の方法。
- 療法、撮像、または診断に使用するための、請求項1〜18のいずれか1項に記載の抗体またはその免疫抱合体。
- 癌の療法、撮像、または診断に使用するための、請求項39に記載の抗体または免疫抱合体。
- 前記癌の治療のための薬剤の製造において、請求項1〜18のいずれか1項に記載の抗体またはその免疫抱合体の使用。
- 前記癌は、乳癌、結腸直腸癌、前立腺癌、卵巣癌、膀胱癌、胆嚢癌、膵臓癌、肺癌、胃組織もしくは内臓の癌、好ましくは胃癌もしくは食道癌、肝臓癌、好ましくは肝細胞癌、腎臓癌、好ましくは腎細胞癌、皮膚腫瘍、頭頚部癌、好ましくは膠腫、唇癌、口癌、膣癌、および子宮頸部癌からなる群より選択される、請求項39もしくは請求項40の抗体もしくは免疫抱合体、または請求項36〜38のいずれか1項に記載の方法、または請求項41に記載の使用。
- 第2の治療剤の使用をさらに含む、請求項39もしくは請求項40もしくは請求項42の抗体もしくは免疫抱合体、または請求項36〜38のいずれか1項に記載の方法、または請求項41に記載の使用。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US18538709P | 2009-06-09 | 2009-06-09 | |
| GB0909904.5 | 2009-06-09 | ||
| GBGB0909904.5A GB0909904D0 (en) | 2009-06-09 | 2009-06-09 | Product |
| US61/185,387 | 2009-06-09 | ||
| PCT/GB2010/050969 WO2010142990A1 (en) | 2009-06-09 | 2010-06-09 | ANTI-EpCAM ANTIBODIES |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2012529281A true JP2012529281A (ja) | 2012-11-22 |
| JP2012529281A5 JP2012529281A5 (ja) | 2013-07-25 |
Family
ID=40937119
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2012514538A Pending JP2012529281A (ja) | 2009-06-09 | 2010-06-09 | 抗EpCAM抗体 |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US8637017B2 (ja) |
| EP (1) | EP2440580A1 (ja) |
| JP (1) | JP2012529281A (ja) |
| CN (1) | CN102549017A (ja) |
| BR (1) | BRPI1011005A2 (ja) |
| EA (1) | EA201171463A1 (ja) |
| GB (1) | GB0909904D0 (ja) |
| WO (1) | WO2010142990A1 (ja) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2016510755A (ja) * | 2013-03-06 | 2016-04-11 | メリマック ファーマシューティカルズ インコーポレーティッド | 抗C−METタンデムFc二重特異性抗体 |
| JP2020515262A (ja) * | 2017-03-29 | 2020-05-28 | エフ・ホフマン−ラ・ロシュ・アクチェンゲゼルシャフト | 共刺激tnf受容体のための二重特異性抗原結合分子 |
| JP2022506072A (ja) * | 2018-10-26 | 2022-01-17 | イミュノジェン, インコーポレイテッド | EpCAM抗体、活性化可能抗体、および免疫複合体、ならびにそれらの使用 |
Families Citing this family (37)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| PL2382990T3 (pl) | 2003-04-30 | 2015-04-30 | Univ Zuerich | Sposoby leczenia raka z zastosowaniem immunotoksyny |
| US7612181B2 (en) * | 2005-08-19 | 2009-11-03 | Abbott Laboratories | Dual variable domain immunoglobulin and uses thereof |
| RU2537245C2 (ru) | 2006-10-12 | 2014-12-27 | Чугаи Сейяку Кабусики Кайся | Диагностика и лечение злокачественной опухоли с использованием антитела против ereg |
| EP2436397B1 (en) | 2009-05-29 | 2017-05-10 | Chugai Seiyaku Kabushiki Kaisha | Pharmaceutical composition containing antagonist of egf family ligand as component |
| WO2012123755A1 (en) | 2011-03-17 | 2012-09-20 | The University Of Birmingham | Re-directed immunotherapy |
| EP2710042A2 (en) | 2011-05-16 | 2014-03-26 | Fabion Pharmaceuticals, Inc. | Multi-specific fab fusion proteins and methods of use |
| TWI593705B (zh) | 2011-12-28 | 2017-08-01 | Chugai Pharmaceutical Co Ltd | Humanized anti-epiregulin antibody and cancer therapeutic agent containing the antibody as an active ingredient |
| CN104168916B (zh) * | 2012-03-02 | 2017-07-04 | 中央研究院 | 抗上皮细胞黏着分子(EpCAM)抗体及其使用方法 |
| PL2897978T3 (pl) * | 2012-09-19 | 2017-08-31 | Abbvie Biotherapeutics Inc. | Sposoby identyfikacji przeciwciał o obniżonej immunogenności |
| CN103387989B (zh) * | 2012-09-24 | 2016-05-18 | 厦门大学 | 上皮细胞粘附分子的核酸适体EpCAM D及其制备方法 |
| US20140248292A1 (en) * | 2013-03-04 | 2014-09-04 | Oslo Universitetssykehus Hf | Compositions and methods for treating cancer |
| EP2986324A4 (en) * | 2013-04-12 | 2016-12-14 | Viventia Bio Inc | COMPOSITIONS AND METHODS FOR THE DETECTION AND TREATMENT OF HEPATOCELLULAR CARCINOMA |
| CN103275226B (zh) * | 2013-06-09 | 2017-08-29 | 中国科学技术大学 | 特异性抗人上皮细胞粘附分子(EpCAM)的单克隆抗体的制备、鉴定及应用 |
| CN105517571A (zh) * | 2013-06-24 | 2016-04-20 | 中外制药株式会社 | 含有人源化抗上皮调节蛋白抗体作为有效成分的腺癌以外的非小细胞肺癌的治疗药 |
| JP2017504621A (ja) | 2013-10-02 | 2017-02-09 | ヴィヴェンティア バイオ インコーポレイテッド | 抗epcam抗体及び使用方法 |
| CA2979394A1 (en) | 2015-03-12 | 2016-09-15 | Viventia Bio Inc. | Methods of treatment for epcam positive bladder cancer |
| JP6847846B2 (ja) | 2015-03-12 | 2021-03-24 | セセン バイオ,インコーポレイテッド | Epcam陽性膀胱癌を標的とする投薬戦略 |
| WO2016161410A2 (en) * | 2015-04-03 | 2016-10-06 | Xoma Technology Ltd. | Treatment of cancer using inhibitors of tgf-beta and pd-1 |
| US11098131B2 (en) | 2015-07-31 | 2021-08-24 | Sutro Biopharma, Inc. | Anti-EpCAM antibodies, compositions comprising anti-EpCAM antibodies and methods of making and using anti-EpCAM antibodies |
| US10870701B2 (en) | 2016-03-15 | 2020-12-22 | Generon (Shanghai) Corporation Ltd. | Multispecific fab fusion proteins and use thereof |
| US20190262397A1 (en) | 2016-07-26 | 2019-08-29 | Tessa Therapeutics Pte. Ltd. | Chimeric antigen receptor |
| CN107814846A (zh) * | 2016-11-14 | 2018-03-20 | 杭州华得森生物技术有限公司 | 针对EpCAM和Cytokeratin5的特异性抗体及其制备方法 |
| AU2019218136A1 (en) | 2018-02-08 | 2020-08-13 | Dragonfly Therapeutics, Inc. | Antibody variable domains targeting the NKG2D receptor |
| CN108484771A (zh) * | 2018-04-24 | 2018-09-04 | 南京市妇幼保健院 | EpCAM单域抗体G7 |
| WO2019244973A1 (ja) | 2018-06-20 | 2019-12-26 | 中外製薬株式会社 | 標的細胞に対する免疫反応を活性化する方法およびその組成物 |
| GB201811410D0 (en) | 2018-07-12 | 2018-08-29 | F Star Beta Ltd | OX40 Binding molecules |
| WO2020018964A1 (en) | 2018-07-20 | 2020-01-23 | Fred Hutchinson Cancer Research Center | Compositions and methods for controlled expression of antigen-specific receptors |
| CA3120800A1 (en) | 2018-12-17 | 2020-06-25 | Revitope Limited | Twin immune cell engager |
| CN113597432B (zh) * | 2019-04-22 | 2023-05-02 | 江苏恒瑞医药股份有限公司 | 抗EpCAM抗体及其应用 |
| CN110950959B (zh) * | 2020-02-25 | 2020-07-03 | 和铂医药(上海)有限责任公司 | 靶向EpCAM的抗体及其制备和应用 |
| CN115010811B (zh) * | 2020-03-11 | 2024-04-19 | 南京融捷康生物科技有限公司 | 可特异性结合EpCAM的单域抗体及其应用 |
| WO2021231237A2 (en) * | 2020-05-11 | 2021-11-18 | Augmenta Bioworks, Inc. | Antibodies for sars-cov-2 and uses thereof |
| CN112359052B (zh) * | 2020-08-20 | 2023-01-03 | 山东兴瑞生物科技有限公司 | 抗EpCAM嵌合抗原受体的编码基因、制备方法、具有该基因的质粒、免疫细胞及其应用 |
| TW202241967A (zh) * | 2021-01-11 | 2022-11-01 | 美商索特里亞生物治療藥物公司 | 基於茚地那韋的化學二聚化t細胞銜接器組成物 |
| AR126009A1 (es) | 2021-06-02 | 2023-08-30 | Hoffmann La Roche | Moléculas agonistas de unión al antígeno cd28 que se dirigen a epcam |
| CN113563474B (zh) * | 2021-06-11 | 2023-05-02 | 广州医科大学附属第三医院(广州重症孕产妇救治中心、广州柔济医院) | EpCAM-CD16-NKG2D三特异性抗体及其应用 |
| WO2024082269A1 (zh) * | 2022-10-21 | 2024-04-25 | 武汉友芝友生物制药股份有限公司 | 双特异性抗体在免疫细胞治疗方面的应用 |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2004533248A (ja) * | 2001-05-03 | 2004-11-04 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフトング | 腫瘍特異的組換え抗体およびその使用 |
| US7227002B1 (en) * | 1997-04-14 | 2007-06-05 | Micromet Ag | Human antibodies that bind human 17-A1/EpCAM tumor antigen |
| WO2008122551A2 (en) * | 2007-04-04 | 2008-10-16 | Sigma-Tau Industrie Farmaceutiche Riunite S.P.A. | Anti-epcam antibody and uses thereof |
| JP2009511521A (ja) * | 2005-10-11 | 2009-03-19 | ミクロメット・アクチェンゲゼルシャフト | 交差種特異的(cross−species−specific)抗体を含む組成物および該組成物の使用 |
Family Cites Families (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2437213A1 (fr) | 1978-09-28 | 1980-04-25 | Cm Ind | Produits cytotoxiques formes par liaison covalente de la chaine a de la ricine avec un anticorps et leur procede de preparation |
| US4736866B1 (en) | 1984-06-22 | 1988-04-12 | Transgenic non-human mammals | |
| WO1990010457A1 (en) | 1989-03-14 | 1990-09-20 | New York University | Method of treating hiv infections using immunotoxins |
| DE3920358A1 (de) | 1989-06-22 | 1991-01-17 | Behringwerke Ag | Bispezifische und oligospezifische, mono- und oligovalente antikoerperkonstrukte, ihre herstellung und verwendung |
| EP0617706B1 (en) | 1991-11-25 | 2001-10-17 | Enzon, Inc. | Multivalent antigen-binding proteins |
| US5660827A (en) | 1992-03-05 | 1997-08-26 | Board Of Regents, The University Of Texas System | Antibodies that bind to endoglin |
| US5965132A (en) | 1992-03-05 | 1999-10-12 | Board Of Regents, The University Of Texas System | Methods and compositions for targeting the vasculature of solid tumors |
| CA2452130A1 (en) | 1992-03-05 | 1993-09-16 | Francis J. Burrows | Methods and compositions for targeting the vasculature of solid tumors |
| US8236561B2 (en) | 1999-04-15 | 2012-08-07 | Crucell Holland B.V. | Efficient production of IgA in recombinant mammalian cells |
| GB9911569D0 (en) | 1999-05-18 | 1999-07-21 | Oxford Biomedica Ltd | Antibodies |
| EP1242823B1 (en) | 1999-12-27 | 2007-07-04 | Crucell Holland B.V. | Selecting library members capable of binding to epitopes |
| DE10143106C1 (de) | 2001-09-03 | 2002-10-10 | Artus Ges Fuer Molekularbiolog | Vermehrung von Ribonukleinsäuren |
| CN1812999A (zh) * | 2003-05-31 | 2006-08-02 | 麦克罗梅特股份公司 | 包含EpCAM特异构建体的药物组合物 |
| US8802442B2 (en) | 2011-11-30 | 2014-08-12 | Eric B. Wheeldon | Apparatus and method for the remote sensing of blood in human feces and urine |
-
2009
- 2009-06-09 GB GBGB0909904.5A patent/GB0909904D0/en not_active Ceased
-
2010
- 2010-06-09 EA EA201171463A patent/EA201171463A1/ru unknown
- 2010-06-09 EP EP10724121A patent/EP2440580A1/en not_active Withdrawn
- 2010-06-09 CN CN2010800351667A patent/CN102549017A/zh active Pending
- 2010-06-09 BR BRPI1011005A patent/BRPI1011005A2/pt not_active IP Right Cessation
- 2010-06-09 JP JP2012514538A patent/JP2012529281A/ja active Pending
- 2010-06-09 WO PCT/GB2010/050969 patent/WO2010142990A1/en active Application Filing
- 2010-06-09 US US12/797,052 patent/US8637017B2/en not_active Expired - Fee Related
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7227002B1 (en) * | 1997-04-14 | 2007-06-05 | Micromet Ag | Human antibodies that bind human 17-A1/EpCAM tumor antigen |
| JP2004533248A (ja) * | 2001-05-03 | 2004-11-04 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフトング | 腫瘍特異的組換え抗体およびその使用 |
| JP2009511521A (ja) * | 2005-10-11 | 2009-03-19 | ミクロメット・アクチェンゲゼルシャフト | 交差種特異的(cross−species−specific)抗体を含む組成物および該組成物の使用 |
| WO2008122551A2 (en) * | 2007-04-04 | 2008-10-16 | Sigma-Tau Industrie Farmaceutiche Riunite S.P.A. | Anti-epcam antibody and uses thereof |
Non-Patent Citations (3)
| Title |
|---|
| JPN5012014465; LUTTERBUESE PETRA: 'EXCHANGING HUMAN FCgamma1 WITH MURINE FCgamma2A HIGHLY POTENTIATES ANTI-TUMOR ACTIVITY 以下備考' CANCER IMMUNOLOGY IMMUNOTHERAPY V56 N4, 200704, P459-468 * |
| JPN5012014470; RAUM T: 'ANTI-SELF ANTIBODIES SELECTED FROM A HUMAN IGD HEAVY CHAIN REPERTOIRE: A NOVEL APPROACH 以下備考' CANCER IMMUNOLOGY AND IMMUNOTHERAPY V50 N3, 20010501, P141-150, SPRINGER-VERLAG * |
| JPN6014042231; Br. J. Cancer, 2005, 92(2), pp.342-349 * |
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2016510755A (ja) * | 2013-03-06 | 2016-04-11 | メリマック ファーマシューティカルズ インコーポレーティッド | 抗C−METタンデムFc二重特異性抗体 |
| JP2020515262A (ja) * | 2017-03-29 | 2020-05-28 | エフ・ホフマン−ラ・ロシュ・アクチェンゲゼルシャフト | 共刺激tnf受容体のための二重特異性抗原結合分子 |
| JP7196094B2 (ja) | 2017-03-29 | 2022-12-26 | エフ・ホフマン-ラ・ロシュ・アクチェンゲゼルシャフト | 共刺激tnf受容体のための二重特異性抗原結合分子 |
| US11639394B2 (en) | 2017-03-29 | 2023-05-02 | Hoffmann-La Roche Inc. | Bispecific antigen binding molecule for a costimulatory TNF receptor |
| JP2022506072A (ja) * | 2018-10-26 | 2022-01-17 | イミュノジェン, インコーポレイテッド | EpCAM抗体、活性化可能抗体、および免疫複合体、ならびにそれらの使用 |
Also Published As
| Publication number | Publication date |
|---|---|
| EA201171463A1 (ru) | 2012-07-30 |
| US8637017B2 (en) | 2014-01-28 |
| US20100310463A1 (en) | 2010-12-09 |
| GB0909904D0 (en) | 2009-07-22 |
| CN102549017A (zh) | 2012-07-04 |
| EP2440580A1 (en) | 2012-04-18 |
| BRPI1011005A2 (pt) | 2018-03-06 |
| WO2010142990A1 (en) | 2010-12-16 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US8637017B2 (en) | Anti-EpCAM antibodies | |
| US8822664B2 (en) | Antibodies | |
| US9353185B2 (en) | Antibodies | |
| AU2011340264B2 (en) | Anti CCR4 antibodies and uses thereof | |
| US20090070890A1 (en) | Product | |
| US10266599B2 (en) | Antibodies which bind to the human CC chemokine receptor 4 and uses thereof |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130606 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20130606 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20141007 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20141222 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20150205 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20150306 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20150609 |