JP2010143943A - フェニルピラゾール誘導体 - Google Patents
フェニルピラゾール誘導体 Download PDFInfo
- Publication number
- JP2010143943A JP2010143943A JP2010024303A JP2010024303A JP2010143943A JP 2010143943 A JP2010143943 A JP 2010143943A JP 2010024303 A JP2010024303 A JP 2010024303A JP 2010024303 A JP2010024303 A JP 2010024303A JP 2010143943 A JP2010143943 A JP 2010143943A
- Authority
- JP
- Japan
- Prior art keywords
- alkyl
- alkoxy
- halogen
- hydroxy
- phenyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
- 0 CC(CC1(CN(*)*)CC1)COc(cc1)ccc1-[n]1ncc(*)c1 Chemical compound CC(CC1(CN(*)*)CC1)COc(cc1)ccc1-[n]1ncc(*)c1 0.000 description 4
- RZHHVPVUBJHWHI-UHFFFAOYSA-N CC(C)(CCBr)CCl Chemical compound CC(C)(CCBr)CCl RZHHVPVUBJHWHI-UHFFFAOYSA-N 0.000 description 1
- PXHHIBMOFPCBJQ-UHFFFAOYSA-N CC1N(C)CCC1 Chemical compound CC1N(C)CCC1 PXHHIBMOFPCBJQ-UHFFFAOYSA-N 0.000 description 1
- ASZRXWXQDSWRAY-UHFFFAOYSA-N CC1N(CCCOc(cc2)ccc2-[n]2ncc(C(C)=O)c2)CCC1 Chemical compound CC1N(CCCOc(cc2)ccc2-[n]2ncc(C(C)=O)c2)CCC1 ASZRXWXQDSWRAY-UHFFFAOYSA-N 0.000 description 1
- ZYRSHNGGBMYQQB-UHFFFAOYSA-N CC1N(CCCOc(cc2)ccc2-[n]2ncc(NC(CCCCCl)=O)c2)CCC1 Chemical compound CC1N(CCCOc(cc2)ccc2-[n]2ncc(NC(CCCCCl)=O)c2)CCC1 ZYRSHNGGBMYQQB-UHFFFAOYSA-N 0.000 description 1
- GGYVTHJIUNGKFZ-UHFFFAOYSA-N CN(CCCC1)C1=O Chemical compound CN(CCCC1)C1=O GGYVTHJIUNGKFZ-UHFFFAOYSA-N 0.000 description 1
- FGQBGDBLZZPFCM-UHFFFAOYSA-N CN(CCOC1)C1=O Chemical compound CN(CCOC1)C1=O FGQBGDBLZZPFCM-UHFFFAOYSA-N 0.000 description 1
- LESTYABWGBPGNU-LJQANCHMSA-N C[C@H]1N(CCCCOc(cc2)ccc2-[n]2ncc(C(N3CCOCC3)=O)c2)CCC1 Chemical compound C[C@H]1N(CCCCOc(cc2)ccc2-[n]2ncc(C(N3CCOCC3)=O)c2)CCC1 LESTYABWGBPGNU-LJQANCHMSA-N 0.000 description 1
- FGNXPAHKMYHWGV-OAHLLOKOSA-N C[C@H]1N(CCCOc(cc2)ccc2-[n]2ncc(C#N)c2)CCC1 Chemical compound C[C@H]1N(CCCOc(cc2)ccc2-[n]2ncc(C#N)c2)CCC1 FGNXPAHKMYHWGV-OAHLLOKOSA-N 0.000 description 1
- PJZXYQHKCKLJLX-CQSZACIVSA-N C[C@H]1N(CCCOc(cc2)ccc2-[n]2ncc(C(N)=O)c2)CCC1 Chemical compound C[C@H]1N(CCCOc(cc2)ccc2-[n]2ncc(C(N)=O)c2)CCC1 PJZXYQHKCKLJLX-CQSZACIVSA-N 0.000 description 1
- BVCLHRQEHIJZGE-LJQANCHMSA-N C[C@H]1N(CCCOc(cc2)ccc2-[n]2ncc(NC(Cc3ccncc3)=O)c2)CCC1 Chemical compound C[C@H]1N(CCCOc(cc2)ccc2-[n]2ncc(NC(Cc3ccncc3)=O)c2)CCC1 BVCLHRQEHIJZGE-LJQANCHMSA-N 0.000 description 1
- BRVUSSWNVFHYNK-UHFFFAOYSA-N O=C(c1c[n](-c(cc2)ccc2OCCCN(CCC2)C2(F)F)nc1)N1CCOCC1 Chemical compound O=C(c1c[n](-c(cc2)ccc2OCCCN(CCC2)C2(F)F)nc1)N1CCOCC1 BRVUSSWNVFHYNK-UHFFFAOYSA-N 0.000 description 1
- RSHMPPFRBNTZJP-UHFFFAOYSA-N OC(c1c[n](-c(cc2)ccc2OCCCN2CCCC2)nc1)=O Chemical compound OC(c1c[n](-c(cc2)ccc2OCCCN2CCCC2)nc1)=O RSHMPPFRBNTZJP-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D231/00—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings
- C07D231/02—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings
- C07D231/10—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D231/14—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/02—Nasal agents, e.g. decongestants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/08—Antiepileptics; Anticonvulsants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/20—Hypnotics; Sedatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/24—Antidepressants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/06—Antihyperlipidemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D231/00—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings
- C07D231/02—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings
- C07D231/10—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D231/14—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D231/38—Nitrogen atoms
- C07D231/40—Acylated on said nitrogen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/06—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a carbon chain containing only aliphatic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/04—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing three or more hetero rings
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Biomedical Technology (AREA)
- Neurosurgery (AREA)
- Neurology (AREA)
- Diabetes (AREA)
- Hematology (AREA)
- Obesity (AREA)
- Psychiatry (AREA)
- Pulmonology (AREA)
- Pain & Pain Management (AREA)
- Immunology (AREA)
- Endocrinology (AREA)
- Emergency Medicine (AREA)
- Anesthesiology (AREA)
- Child & Adolescent Psychology (AREA)
- Hospice & Palliative Care (AREA)
- Otolaryngology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
Abstract
【解決手段】一般式(1)で表されるフェニルピラゾール誘導体、又はその医薬上許容される塩。
{式(1)中、R1及びR2は、アルキル基等を示し、又は、R1及びR2は、隣接する窒素原子と一緒になって互いに結合した4〜7員の飽和複素環(該飽和複素環基は、ハロゲン又はC1〜C6アルキルで置換されても良い)を形成し、nは、0〜2の整数を示し、Tは、水素原子、ハロゲン又はC1〜C6アルキルを示し、Rは含窒素複素環化合物等の残基を示す。}
【選択図】なし
Description
R1及びR2は、同一又は異なって、C1〜C6アルキル若しくはC3〜C8環状アルキルを示し、
又は、R1及びR2は、隣接する窒素原子と一緒になって互いに結合した4〜7員の飽和複素環(該飽和複素環基は、ハロゲン又はC1〜C6アルキルで置換されても良い)を形成し、
nは、0〜2の整数を示し、
Tは、水素原子、ハロゲン又はC1〜C6アルキルを示し、
Rは、式(I)〜(VIII)
pは、0〜3の整数を示し、
qは、0〜1の整数を示し、
r及びsは、同一又は異なって、0〜2の整数を示し、
R3は、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はオキソを示し(ここで、Z1が−CH2−のとき、その水素原子はR3で置換されても良い)、
R4及びR5は、同一又は異なって、水素原子、C1〜C6アルキル(該C1〜C6アルキルは、ハロゲン、C3〜C8環状アルキル、C1〜C6アルコキシ、ヒドロキシ、ヒドロキシC1〜C6アルコキシ、C2〜C7アルコキシカルボニル又はカルボキシで置換されても良い)、C3〜C8環状アルキル(該C3〜C8環状アルキルは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ又はヒドロキシで置換されても良い)、又は、式−(CH2)m−Ar1(式中、Ar1は、アリール(該アリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)又はヘテロアリール(該ヘテロアリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)を示し、mは、0〜2の整数を示す)を示し、
R6は、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はオキソを示し(ここで、Z2が−CH2−のとき、その水素原子はR6で置換されても良い)、
R7は、水素原子又はC1〜C6アルキルを示し、
R8は、C1〜C6アルキル(該C1〜C6アルキルは、ハロゲン、C3〜C8環状アルキル、C1〜C6アルコキシ又はヒドロキシで置換されても良い)、C3〜C8環状アルキル(該C3〜C8環状アルキルは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ又はヒドロキシで置換されても良い)、C1〜C6アルコキシ(該C1〜C6アルコキシは、ハロゲン、C3〜C8環状アルキル、C1〜C6アルコキシ又はヒドロキシで置換されても良い)又は、式−(CH2)l−Ar2(式中、Ar2は、アリール(該アリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)又はヘテロアリール(該ヘテロアリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)を示し、lは、0〜2の整数を示す)を示し、
Gは、−CO−又は−SO2−を示し、
R9は、C1〜C6アルキル、C3〜C8環状アルキル、C1〜C6アルコキシ、アリール(該アリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)又はヘテロアリール(該ヘテロアリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)を示し、
R10は、C1〜C6アルキル、C1〜C6アルコキシ、アミノ、C1〜C6アルキルアミノ、C2〜C12ジアルキルアミノ、4〜7員の飽和複素環(該飽和複素環は、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)、アリール(該アリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)又はヘテロアリール(該ヘテロアリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)を示し、
R11は、水素又はC1〜C6アルキルを示す。)
を示す。}
で表されるフェニルピラゾール誘導体、又はその医薬上許容される塩である。
[2]式(2)
R1及びR2は、同一又は異なって、C1〜C6アルキル若しくはC3〜C8環状アルキルを示し、
又は、R1及びR2は、隣接する窒素原子と一緒になって互いに結合した4〜7員の飽和複素環(該飽和複素環基は、ハロゲン又はC1〜C6アルキルで置換されても良い)を形成し、
nは、0〜2の整数を示し、
Tは、水素原子、ハロゲン又はC1〜C6アルキルを示し、
Rは、式(I)〜(VIII)
pは、0〜3の整数を示し、
qは、0〜1の整数を示し、
r及びsは、同一又は異なって、0〜2の整数を示し、
R3は、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ又はヒドロキシを示し(ここで、Z1が−CH2−又は−NH−のとき、それぞれの水素原子は、R3で置換されても良い)、
R4及びR5は、同一又は異なって、水素原子、C1〜C6アルキル(該C1〜C6アルキルは、ハロゲン、C3〜C8環状アルキル、C1〜C6アルコキシ又はヒドロキシで置換されても良い)、C3〜C8環状アルキル(該C3〜C8環状アルキルは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ又はヒドロキシで置換されても良い)、又は、式−(CH2)m−Ar1(式中、Ar1は、アリール(該アリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)又はヘテロアリール(該ヘテロアリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)を示し、mは、0〜2の整数を示す)を示し、
R6は、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はオキソを示し(ここで、Z2が−CH2−又は−NH−のとき、それぞれの水素原子は、R6で置換されても良い。ただし、Z2が−NH−のとき、R6はハロゲン、C1〜C6アルキル、C1〜C6アルコキシ又はヒドロキシである)、
R7は、水素原子又はC1〜C6アルキルを示し、
R8は、C1〜C6アルキル(該C1〜C6アルキルは、ハロゲン、C3〜C8環状アルキル、C1〜C6アルコキシ又はヒドロキシで置換されても良い)、C3〜C8環状アルキル(該C3〜C8環状アルキルは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ又はヒドロキシで置換されても良い)、C1〜C6アルコキシ(該C1〜C6アルコキシは、ハロゲン、C3〜C8環状アルキル、C1〜C6アルコキシ又はヒドロキシで置換されても良い)又は、式−(CH2)l−Ar2(式中、Ar2は、アリール(該アリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)又はヘテロアリール(該ヘテロアリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)を示し、
lは、0〜2の整数を示す)を示し、
Gは、−CO−又は−SO2−を示し、
R9は、C1〜C6アルキル、C3〜C8環状アルキル、C1〜C6アルコキシ、アリール(該アリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)又はヘテロアリール(該ヘテロアリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)を示し、
R10は、C1〜C6アルキル、C1〜C6アルコキシ、アミノ、C1〜C6アルキルアミノ、C2〜C12ジアルキルアミノ、4〜7員の飽和複素環(該飽和複素環は、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)、アリール(該アリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)又はヘテロアリール(該ヘテロアリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)を示す。)
を示す。}
で表されるフェニルピラゾール誘導体、又はその医薬上許容される塩である。
[3]式(1)
R1及びR2は、同一又は異なって、C1〜C6アルキル若しくはC3〜C8環状アルキルを示し、
又は、R1及びR2は、隣接する窒素原子と一緒になって互いに結合した4〜7員の飽和複素環(該飽和複素環基は、ハロゲン又はC1〜C6アルキルで置換されても良い)を形成し、
nは、0〜2の整数を示し、
Tは、水素原子、ハロゲン又はC1〜C6アルキルを示し、
Rは、式(I)〜(VIII)
pは、0〜2の整数を示し、
qは、0〜1の整数を示し、
r及びsは、同一又は異なって、0〜2の整数を示し、
R3は、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ又はヒドロキシを示し、
R4及びR5は、同一又は異なって、水素原子、C1〜C6アルキル(該C1〜C6アルキルは、ハロゲン、C3〜C8環状アルキル、C1〜C6アルコキシ又はヒドロキシで置換されても良い)、C3〜C8環状アルキル(該C3〜C8環状アルキルは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ(該C1〜C6アルコキシは、ハロゲン、C3〜C8環状アルキル、C1〜C6アルコキシ又はヒドロキシで置換されても良い)又はヒドロキシで置換されても良い)又は、式−(CH2)m−Ar1(式中、Ar1は、アリール(該アリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)又はヘテロアリール(該ヘテロアリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)を示し、mは、0〜2の整数を示す)を示し、
R6は、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はオキソを示し、
R7は、水素原子又はC1〜C6アルキルを示し、
R8は、C1〜C6アルキル(該C1〜C6アルキルは、ハロゲン、C3〜C8環状アルキル、C1〜C6アルコキシ又はヒドロキシで置換されても良い)、C3〜C8環状アルキル(該C3〜C8環状アルキルは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ又はヒドロキシで置換されても良い)、C1〜C6アルコキシ(該C1〜C6アルコキシは、ハロゲン、C3〜C8環状アルキル、C1〜C6アルコキシ又はヒドロキシで置換されても良い)又は、式−(CH2)l−Ar2(式中、Ar2は、アリール(該アリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)又はヘテロアリール(該ヘテロアリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)を示し、
lは、0〜2の整数を示す)を示し、
Gは、−CO−又は−SO2−を示し、
R9は、C1〜C6アルキル、C3〜C8環状アルキル、C1〜C6アルコキシ、アリール(該アリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)又はヘテロアリール(該ヘテロアリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)を示し、
R10は、C1〜C6アルキル、C1〜C6アルコキシ、アミノ、C1〜C6アルキルアミノ、C2〜C12ジアルキルアミノ、4〜7員の飽和複素環(該飽和複素環は、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)、アリール(該アリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)又はヘテロアリール(該ヘテロアリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)を示す。)を示す。}
で表されるフェニルピラゾール誘導体、又はその医薬上許容される塩である。
[4]前記式(1)において、
nは1であり、
Tは、水素原子又はハロゲンを示し、
R1及びR2は、隣接する窒素原子と一緒になって互いに結合した5〜6員の飽和複素環(該飽和複素環基はC1〜C6アルキルで置換されても良い)を形成する、上記[1]〜[3]のいずれか1項に記載のフェニルピラゾール誘導体、又はその医薬上許容される塩である。
[5]前記式(1)においてRが式(I)である、上記[1]〜[4]のいずれか1項に記載のフェニルピラゾール誘導体、又はその医薬上許容される塩である。
[6]前記式(1)においてRが式(II)である、上記[1]〜[4]のいずれか1項に記載のフェニルピラゾール誘導体、又はその医薬上許容される塩である。
[7]前記式(1)においてRが式(III)である、上記[1]〜[4]のいずれか1項に記載のフェニルピラゾール誘導体、又はその医薬上許容される塩である。
[8]下記式で示される、
pは、0〜3の整数を示し、
rは、0〜2の整数を示し、
Tは、水素原子又はハロゲンを示し、
R3は、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はオキソを示し(ここで、Z1が−CH2−のとき、その水素原子はR3で置換されても良い)、
RAは、C1〜C6アルキルを示す}
[1]に記載のフェニルピラゾール誘導体、又はその医薬上許容される塩。
[9]下記式で示される、
pは、0〜3の整数を示し、
rは、0〜2の整数を示し、
R3は、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はオキソを示す}、
[1]に記載のフェニルピラゾール誘導体、又はその医薬上許容される塩。
4−{[1−(4−{3−[(2S)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−イル]カルボニル}モルホリン、
4−({1−[4−(3−ピロリジン−1−イルプロポキシ)フェニル]−1H−ピラゾール−4−イル}カルボニル)モルホリン、
4−({1−[4−(3−ピペリジン−1−イルプロポキシ)フェニル]−1H−ピラゾール−4−イル}カルボニル)モルホリン、
4−[(1−{4−[3−(2,2−ジメチルピロリジン−1−イル)プロポキシ]フェニル}−1H−ピラゾール−4−イル)カルボニル]モルホリン、
アゼチジン−1−イル−(1−{4−[3−(2−メチルピロリジン−1−イル)プロポキシ]フェニル}−1H−ピラゾール−4−イル)メタノン、
4−[(3,3−ジフルオロピロリジン−1−イル)カルボニル]−1−(4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール、
[(2R,6S)−2,6−ジメチルモルホリン−4−イル][1−(4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−イル]メタノン、
[1−(4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−イル](1,4−オキサゼパン−4−イル)メタノン、
(4−メチルピペラジン−1−イル)[1−(4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−イル]メタノン、
[1−(4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−イル](ピロリジン−1−イル)メタノン、
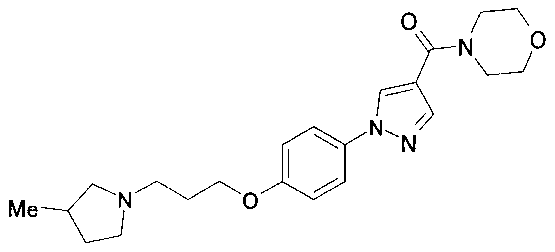
(1−{4−[3−(3−メチルピロリジン−1−イル)プロポキシ]フェニル}−1H−ピラゾール−4−イル)(モルホリン−4−イル)メタノン、
(1−{4−[3−(2−エチルピロリジン−1−イル)プロポキシ]フェニル}−1H−ピラゾール−4−イル)(モルホリン−4−イル)メタノン、
(1−{4−[3−(2,2−ジフルオロピロリジン−1−イル)プロポキシ]フェニル}−1H−ピラゾール−4−イル)(モルホリン−4−イル)メタノン、
[1−(4−{2−[(2R)−2−メチルピロリジン−1−イル]エトキシ}フェニル)−1H−ピラゾール−4−イル](モルホリン−4−イル)メタノン、
[1−(4−{4−[(2R)−2−メチルピロリジン−1−イル]ブトキシ}フェニル)−1H−ピラゾール−4−イル](モルホリン−4−イル)メタノン、
[1−(3−フルオロ−4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−イル](モルホリン−4−イル)メタノン、
[1−(2−メチル−4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−イル](モルホリン−4−イル)メタノン、
[1−(3−ブロモ−4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−イル](モルホリン−4−イル)メタノン、
(2−ヒドロキシモルホリン−4−イル)[1−(4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−イル]メタノンからなる群より選ばれる、上記[1]〜[5]のいずれか1項に記載のフェニルピラゾール誘導体、又はその医薬上許容される塩である。
[11] 1−(4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−カルボキサミド、
1−(4−{3−[(2S)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−カルボキサミド、
N−tert−ブチル−1−{4−[3−(2−メチルピロリジン−1−イル)プロポキシ]フェニル}−1H−ピラゾール−4−カルボキサミド、
N−tert−ブチル−1−{4−[3−(2,5−ジメチルピロリジン−1−イル)プロポキシ]フェニル}−1H−ピラゾール−4−カルボキサミド、
N−tert−ブチル−1−[4−(3−ピロリジン−1−イルプロポキシ)フェニル]−1H−ピラゾール−4−カルボキサミド、
N−tert−ブチル−1−{4−[3−(ジエチルアミノ)プロポキシ]フェニル}−1H−ピラゾール−4−カルボキサミド、
N−(4−フルオロフェニル)−1−{4−[3−(2−メチルピロリジン−1−イル)プロポキシ]フェニル}−1H−ピラゾール−4−カルボキサミド、
N−(4−フルオロフェニル)−1−[4−(3−ピロリジン−1−イルプロポキシ)フェニル]−1H−ピラゾール−4−カルボキサミド、
N−(4−メチルフェニル)−1−{4−[3−(2−メチルピロリジン−1−イル)プロポキシ]フェニル}−1H−ピラゾール−4−カルボキサミド、
1−{4−[3−(2−メチルピロリジン−1−イル)−プロポキシ]−フェニル}−1H−ピラゾール−4−カルボン酸 4−フルオロベンジルアミド、
1−{4−[3−(2−メチルピロリジン−1−イル)−プロポキシ]−フェニル}−1H−ピラゾール−4−カルボン酸 ジメチルアミド、
1−(4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−カルボン酸 ビス−(2−ヒドロキシエチル)−アミド、
N−(2−ヒドロキシエチル)−1−(4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−カルボキサミド、
tert−ブチル N−(2−ヒドロキシエチル)−N−{[1−(4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−イル]カルボニル}グリシナート、
N−(2−ヒドロキシエチル)−N−{[1−(4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−イル]カルボニル}グリシン、
N−[2−(2−ヒドロキシエトキシ)エチル]−1−(4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−カルボキサミドからなる群より選ばれる、上記[1]〜[4]及び[6]のいずれか1項に記載のフェニルピラゾール誘導体、又はその医薬上許容される塩である。
[12]上記[1]〜[11]いずれかに記載のフェニルピラゾール誘導体、又はその医薬上許容される塩を有効成分として含有することを特徴とする、認知症、アルツハイマー病、注意欠陥・多動性症、統合失調症、てんかん、中枢性痙攣、摂食障害、肥満、糖尿病、高脂血症、睡眠障害、ナルコレプシー、睡眠時無呼吸症候群、概日リズム障害、うつ病若しくはアレルギー性鼻炎の予防剤又は治療剤である。
nは1が好ましい。
Tは、水素原子又はハロゲンが好ましい。
pは、0〜3の整数を示し、
rは、0〜2の整数を示し、
R3は、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はオキソを示す(ここで、Z1が−CH2−のとき、その水素原子はR3で置換されても良い)。
式(I)の構造の好ましい態様は下式で示される。
R3は、好ましくはハロゲン、C1〜C6アルキル及びヒドロキシである。
R11は、好ましくはC1〜C6アルキルである。
式(Ia)において、pは、好ましくは1〜2の整数を示す。
式(Ib)及び式(Ic)において、pは、好ましくは2〜3の整数を示す。
式(I)の構造のさらに好ましい態様は下式で示される。
qは、0〜1の整数を示し、
sは、0〜2の整数を示し、
R6は、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はオキソを示す(ここで、Z2が−CH2−のとき、その水素原子はR6で置換されても良い)。
sは、好ましくは0〜1の整数を示す。
−NR1R2のより好ましい態様は、下記式で示される基である。
pは、0〜3の整数を示し、
rは、0〜2の整数を示し、
R3は、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はオキソを示す}、
で示されるフェニルピラゾール誘導体、又はその医薬上許容される塩である。
pは、0〜3の整数を示し、
rは、0〜2の整数を示し、
Tは、水素原子又はハロゲンを示し、
R3は、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はオキソを示し(ここで、Z1が−CH2−のとき、その水素原子はR3で置換されても良い)、
RAは、C1〜C6アルキルを示す}
で示されるフェニルピラゾール誘導体、又はその医薬上許容される塩である。
(本発明の化合物を製造する方法)
本発明の化合物は、公知の有機化学的手法によって製造することができ、例えば、下記の反応式による方法に従って製造できる。下記反応式1〜10において、R、R1〜R10、T、G、Z1、Z2、p、q、r、s及びnは前記と同義である。また、X1〜X3は、同一又は異なって、塩素原子、臭素原子、ヨウ素原子等のハロゲン原子又はメタンスルホニルオキシ基、ベンゼンスルホニルオキシ基、p−トルエンスルホニルオキシ基、トリフルオロメタンスルホニルオキシ基等の有機スルホニルオキシ基等の脱離基を示し、Y1〜Y4は、同一又は異なって、ハロゲン原子又は有機スルホニルオキシ基等の脱離基、又は水酸基を示し、Z3は炭素原子又は酸素原子を示し、tは0又は1の整数を示す。
(反応式1)
工程1は、化合物(2)と公知の化合物(3)とのカップリング反応により化合物(4)を得るための工程である。化合物(2)は、公知化合物であるか、公知化合物から容易に合成できる化合物である。該カップリング反応は、塩基の存在下、溶媒中又は無溶媒でフェノールとアルキルハライドとを反応させる一般的な方法により実施できる。また、必要に応じて、例えば、ヨウ化カリウム、臭化ナトリウム等の添加物を加えることができる。本反応で用いられる塩基としては、例えば、ピリジン、トリエチルアミン、ジイソプロピルエチルアミン、tert−ブトキシカリウム、炭酸カリウム、炭酸セシウム、炭酸水素ナトリウム、水酸化ナトリウム、水酸化カリウム、水素化ナトリウム等が挙げられる。本反応で用いられる溶媒としては、例えば、メタノール、エタノール、イソプロパノール等のアルコール類;テトラヒドロフラン、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン等の炭化水素類;クロロホルム、ジクロロメタン等のハロゲン化炭化水素類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン等のアミド類;アセトン、2−ブタノン等のケトン類;ジメチルスルホキシド;アセトニトリル;水又はこれらの混合溶媒が挙げられ、これらのうち、テトラヒドロフラン、N,N−ジメチルホルムアミド、アセトニトリル、2−ブタノンが好ましい。本反応における反応温度は、通常0℃〜150℃、好ましくは、15℃〜100℃であり、反応時間は、通常1〜48時間、好ましくは、1〜12時間である。
(工程2)
工程2は、化合物(4)と化合物(5)とをカップリング反応により縮合して化合物(6)を得るための工程である。化合物(5)は、公知化合物であるか、公知化合物から容易に合成できる化合物である。該カップリング反応は、塩基の存在下又は非存在下、溶媒中又は無溶媒でアミンとアルキルハライドとを反応させる一般的な方法により実施できる。また、必要に応じて、例えば、ヨウ化カリウム、臭化ナトリウム等の添加物を加えることができる。本反応で用いられる塩基としては、例えば、ピリジン、トリエチルアミン、ジイソプロピルエチルアミン、tert−ブトキシカリウム、炭酸カリウム、炭酸セシウム、炭酸水素ナトリウム、水酸化ナトリウム、水酸化カリウム、水素化ナトリウム等が挙げられる。本反応で用いられる溶媒としては、例えば、メタノール、エタノール、イソプロパノール等のアルコール類;テトラヒドロフラン、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン等の炭化水素類;クロロホルム、ジクロロメタン等のハロゲン化炭化水素類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン等のアミド類;アセトン、2−ブタノン等のケトン類;ジメチルスルホキシド;アセトニトリル;水又はこれらの混合溶媒が挙げられ、これらのうち、テトラヒドロフラン、N,N−ジメチルホルムアミド、アセトニトリルが好ましい。本反応における反応温度は、通常0℃〜150℃、好ましくは、15℃〜100℃であり、反応時間は、通常1〜48時間、好ましくは、1〜12時間である。
(工程3a)
工程3aは、化合物(6)と化合物(7)とをカップリング反応により縮合して本発明の化合物(1)を得るための工程である。化合物(7)は、公知化合物であるか、公知化合物から容易に合成できる化合物である。該カップリング反応は、塩基の存在下、リガンド及び触媒を用いて、溶媒中でアゾール化合物の窒素原子の芳香化を行う一般的な方法により実施でき、例えば、(Kunzら,Synlett,2003年,15巻,2428−2439頁)に記載の方法又はそれに準じた方法に従って実施できる。本反応で用いられる触媒としては、縮合反応に一般的に用いられる銅触媒、例えば、銅(0)、ヨウ化銅(I)、塩化銅(I)、酸化銅(I)、臭化銅(I)トリストリフェニルホスフィン錯体、トリフルオロメタンスルホン酸銅(I)ベンゼン錯体等が挙げられる。本反応で用いられるリガンドとしては、銅触媒を用いた縮合反応に一般的に用いられるリガンド、例えば、N,N’−ジメチルエチレンジアミン、N,N’−ジメチルシクロヘキサン−1,2−ジアミン、2−アミノピリジン、1,10−フェナンスロリン、2−ヒドロキシベンズアルデヒドオキシム、エチレングリコール等が挙げられる。本反応で用いられる塩基としては、例えば、炭酸カリウム、リン酸カリウム、水酸化カリウム、tert−ブトキシカリウム、炭酸セシウム、炭酸ナトリウム、炭酸水素ナトリウム、酢酸ナトリウム、ナトリウムメトキシド、テトラブチルアンモニウムヒドロキシド等が挙げられ、これらのうち、炭酸カリウム、炭酸セシウムが好ましい。本反応で用いられる溶媒としては、例えば、メタノール、エタノール、イソプロパノール等のアルコール類;テトラヒドロフラン、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン等の炭化水素類;クロロホルム、ジクロロメタン等のハロゲン化炭化水素類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン等のアミド類;アセトン、2−ブタノン等のケトン類;ジメチルスルホキシド;アセトニトリル;水又はこれらの混合溶媒が挙げられ、これらのうち、トルエン、N,N−ジメチルホルムアミド、N−メチル−2−ピロリドンが好ましい。本反応における反応温度は、通常0℃〜150℃、好ましくは、40℃〜120℃であり、反応時間は、通常1〜48時間、好ましくは、1〜12時間である。
(反応式2)
また、化合物(6)は、化合物(2)と化合物(8)とのカップリング反応により得ることもできる。化合物(8)は、公知化合物であるか、公知化合物から容易に合成できる化合物である。該カップリング反応は、Y1がハロゲン原子等の脱離基である場合、工程1と同様の方法により実施できる。
(反応式3)
工程5は、化合物(1−1)のエトキシカルボニル基を加水分解によりカルボン酸に変換して化合物(9)を得るための工程である。該加水分解反応は、一般的なエステルの加水分解反応により実施することができ、例えば、強酸存在下溶媒中又は無溶媒で反応させる方法、塩基存在下溶媒中で反応させる方法等、(T.W.Greene and P.G.M.Wuts著 Protective Groups in Organic Synthesis、第3版、John Wiley and Sons社)に記載の方法又はそれに準じた方法に従って実施できる。本反応における反応温度は、通常0℃〜120℃、好ましくは、15℃〜80℃であり、反応時間は、通常1〜48時間、好ましくは、1〜12時間である。
(工程6a)
工程6aは、化合物(9)と化合物(10)又は(11)とをカップリング反応により縮合し、本発明の化合物(1−2)又は(1−3)をそれぞれ得るための工程である。化合物(10)及び化合物(11)は、公知化合物であるか、公知化合物から容易に合成できる化合物である。該カップリング反応は、一般的なカルボン酸のアミド化の方法により実施でき、例えば、カルボン酸をカルボン酸クロリドやカルボン酸ブロミド等のカルボン酸ハライドに導いた後にアミンと反応させる方法、カルボン酸とクロル炭酸エステル等から得られる混合酸無水物をアミンと反応させる方法、カルボン酸を1−ベンゾトリアゾリルエステルやスクシンイミジルエステル等の活性エステルに導いた後にアミンと反応させる方法、カルボン酸を脱水縮合剤存在下アミンと反応させる方法等が挙げられる。これらの反応は、全て塩基の存在下又は非存在下、溶媒中で行うことができる。本反応で用いられる脱水縮合剤としては、例えば、3−(3−ジメチルアミノプロピル)−1−エチルカルボジイミド塩酸塩、ジシクロヘキシルカルボジイミド、ジフェニルホスホリルアジド、カルボニルジイミダゾール等が挙げられ、必要に応じて1−ヒドロキシベンゾトリアゾール、ヒドロキシスクシンイミド等の活性化剤を用いることができる。本反応で用いられる塩基としては、例えば、ピリジン、トリエチルアミン、ジイソプロピルエチルアミン、炭酸カリウム、炭酸ナトリウム、炭酸水素ナトリウム等が挙げられる。本反応で用いられる溶媒としては、例えば、テトラヒドロフラン、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン等の炭化水素類;クロロホルム、ジクロロメタン等のハロゲン化炭化水素類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン等のアミド類;アセトン、2−ブタノン等のケトン類;ジメチルスルホキシド;アセトニトリル;水又はこれらの混合溶媒が挙げられ、これらのうち、トルエン、テトラヒドロフラン又はN,N−ジメチルホルムアミドが好ましい。本反応における反応温度は、通常0℃〜120℃、好ましくは、15℃〜40℃であり、反応時間は、通常1〜48時間、好ましくは、1〜12時間である。
(反応式4)
また、本発明の化合物(1−2)及び(1−3)は、化合物(1−1)と化合物(10)又は(11)とのカップリング反応によりそれぞれ得ることもできる。該カップリング反応は、一般的なカルボン酸エステルのエステル−アミド交換反応により実施でき、例えば、カルボン酸エステルを溶媒中又は無溶媒で1級乃至2級アミンと反応させる方法が挙げられる。また、必要に応じて、例えば、ナトリウムメトキシド、水素化ナトリウム、n−ブチルリチウム、トリメチルアルミニウム等の添加物を加えることができる。本反応で溶媒を用いる場合、溶媒としては、例えば、メタノール、エタノール、イソプロパノール等のアルコール類;テトラヒドロフラン、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン、キシレン等の炭化水素類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン等のアミド類;アセトン、2−ブタノン等のケトン類;ジメチルスルホキシド;アセトニトリル;水又はこれらの混合溶媒が挙げられ、これらのうち、トルエン、テトラヒドロフラン、ジメチルスルホキシドが好ましい。本反応における反応温度は、通常15℃〜150℃、好ましくは、15℃〜100℃であり、反応時間は、通常1〜48時間、好ましくは、1〜12時間である。
(反応式5)
工程6bは、化合物(9)をアンモニアと反応させて本発明の化合物(1−4)を得るための工程である。該反応は、工程6aと同様の方法により実施できる。具体例としては、例えば、カルボン酸を脱水縮合剤存在下アンモニア水と反応させる方法により実施できる。
(工程8)
工程8は、化合物(1−4)のカルバモイル基をニトリル基に変換して本発明の化合物(1−5)を得るための工程である。本工程は、カルバモイル基をニトリル基に変換する一般的な反応により実施でき、例えば、脱水剤の存在下、溶媒中又は無溶媒で反応させることにより実施できる。また、必要に応じて、例えば、N,N−ジメチルホルムアミド、塩化ナトリウム等の添加物を加えることができる。本反応で用いられる脱水剤としては、例えば、5酸化リン、5塩化リン、3塩化リン、塩化ホスホリル、塩化チオニル、塩化オキサリル、無水トリフルオロ酢酸、無水トリフルオロメタンスルホン酸等が挙げられる。本反応で溶媒を用いる場合、溶媒としては、例えば、テトラヒドロフラン、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン等の炭化水素類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン等のアミド類;アセトニトリル又はこれらの混合溶媒が挙げられる。本反応における反応温度は、通常0℃〜120℃、好ましくは、15℃〜80℃であり、反応時間は、通常1〜48時間、好ましくは、1〜12時間である。
(反応式6)
工程3bは、化合物(6)と化合物(7−1)とをカップリング反応により縮合して本発明の化合物(1−6)を得るための工程である。該反応は、工程3aと同様の方法により実施できる。
(工程9)
工程9は、化合物(1−6)のニトロ基を還元して化合物(12)を得るための工程である。本工程は、ニトロ基をアミノ基に変換する一般的な還元反応により実施でき、例えば、パラジウム−炭素、白金、ラネーニッケル、ロジウム−アルミナ等の触媒を用いた水素添加による接触還元反応、亜鉛、鉄、スズ又は塩化スズ(II)を用いた酸性条件下での還元反応、水素化リチウムアルミニウム等の金属水素化物を用いた還元反応等が挙げられる。具体例としては、例えば、パラジウム−炭素を触媒とし、メタノール溶媒中水素添加による接触還元反応を行うことにより実施できる。
(工程10a)
工程10aは、化合物(12)と化合物(13)とをカップリング反応により縮合して本発明の化合物(1−7)を得るための工程である。化合物(13)は、公知化合物であるか、公知化合物から容易に合成できる化合物である。該カップリング反応は、GがCO、Y2が水酸基である場合、工程6aと同様の方法により実施できる。
(工程11)
工程11は、化合物(1−7)と化合物(14)とを反応させて本発明の化合物(1−8)を得るための工程である。化合物(14)は、公知化合物であるか、公知化合物から容易に合成できる化合物である。該反応は、一般的なアミド又はスルホンアミドのアルキル化の方法により実施でき、例えば、塩基の存在下、溶媒中で化合物(1−7)と化合物(14)とを反応させることにより実施できる。また、必要に応じて、例えば、テトラブチルアンモニウムブロミド、18−クラウン−6−エーテル等の添加物を加えることができる。本反応で用いられる塩基としては、例えば、水素化ナトリウム、水素化カリウム、tert−ブトキシカリウム、水酸化カリウム、水酸化ナトリウム、ナトリウムメトキシド、n−ブチルリチウム等が挙げられる。本反応で用いられる溶媒としては、例えば、メタノール、エタノール、イソプロパノール等のアルコール類;テトラヒドロフラン、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン等の炭化水素類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン等のアミド類;ジメチルスルホキシド;アセトニトリル;水又はこれらの混合溶媒が挙げられ、これらのうち、テトラヒドロフラン、N,N−ジメチルホルムアミドが好ましい。本反応における反応温度は、通常0℃〜150℃、好ましくは、15℃〜100℃であり、反応時間は、通常1〜48時間、好ましくは、1〜12時間である。
(反応式7)
工程12は、化合物(12)の1級アミノ基のアルキル化反応により化合物(15)を得るための工程である。該アルキル化反応は、1級アミノ基を2級アミノ基へ変換する一般的なアルキル化方法によって実施でき、例えば、塩基の存在下アルキルハライドやアルキルメタンスルホネート等のアルキル化剤を用いて反応させる方法、アルデヒドを用いた還元的アミノ化反応による方法、カルボン酸及びその誘導体を用いて酸アミドとした後にボラン等の金属水素化物で還元する方法、アルコールとの脱水縮合による方法等が挙げられる。
(工程10b)
工程10bは、化合物(15)と化合物(13)とをカップリング反応により縮合して本発明の化合物(1−8)を得るための工程である。該カップリング反応は、工程10aと同様の方法により実施できる。
(反応式8)
工程10cは、化合物(12)と化合物(16)とをカップリング反応により縮合して本発明の化合物(1−9)を得るための工程である。化合物(16)は、公知化合物であるか、公知化合物から容易に合成できる化合物である。該カップリング反応は、工程10aと同様の方法により実施できる。
(工程13a)
工程13aは、化合物(1−9)の分子内環化反応によって本発明の化合物(1−10)を得るための工程である。該分子内環化反応は、文献記載の方法(例えば、Journal of Medicinal Chemistry、2002年、45巻、3972−3983頁)又はそれに準じた方法により実施できる。本反応で用いられる塩基としては、例えば、水素化ナトリウム、水素化カリウム、炭酸カリウム、tert−ブトキシカリウム、水酸化ナトリウム等が挙げられる。本反応で用いられる溶媒としては、例えば、テトラヒドロフラン、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン等の炭化水素類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン等のアミド類;アセトン、2−ブタノン等のケトン類;ジメチルスルホキシド;アセトニトリル又はこれらの混合溶媒が挙げられ、これらのうち、テトラヒドロフラン、トルエンが好ましい。本反応における反応温度は、通常0℃〜150℃、好ましくは、15℃〜80℃であり、反応時間は、通常1〜48時間、好ましくは、1〜12時間である。
(反応式9)
工程14は、化合物(12)と化合物(17)との縮合反応により本発明の化合物(1−11)を得るための工程である。化合物(17)は、公知化合物であるか、公知化合物から容易に合成できる化合物である。該縮合反応は、一般的なアミンと酸無水物との縮合方法により実施でき、例えば、酸の存在下又は非存在下、化合物(12)と化合物(17)とを加熱下溶媒中又は無溶媒で反応させる方法等が挙げられる。本反応で用いられる酸としては、硫酸、塩酸等が挙げられる。本反応で用いられる溶媒としては、例えば、テトラヒドロフラン、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン等の炭化水素類;クロロホルム、ジクロロメタン等のハロゲン化炭化水素類又はこれらの混合溶媒が挙げられ、これらのうち、トルエン又はテトラヒドロフランが好ましい。本反応における反応温度は、通常0℃〜150℃、好ましくは、40℃〜120℃であり、反応時間は、通常1〜48時間、好ましくは、1〜12時間である。また、本工程の反応中間体である化合物(18)は、更に分子内脱水環化反応を行うことにより化合物(1−11)へと変換することができる。該脱水環化反応は、一般的な脱水縮合の方法により実施でき、例えば、無水酢酸存在下溶媒中又は無溶媒で加熱する方法等が挙げられる。
(反応式10)
工程10dは、化合物(12)と化合物(19)とをカップリング反応により縮合して化合物(20)を得るための工程である。化合物(19)は、公知化合物であるか、公知化合物から容易に合成できる化合物である。該カップリング反応は、工程10aと同様の方法により実施できる。
(工程15)
工程15は、化合物(20)を化合物(21)へと変換するための工程である。該変換の方法としては、例えば、溶媒中水素化リチウムアルミニウムと反応させる方法等が挙げられる。
(工程16)
工程16は、化合物(21)と化合物(22)とを分子間環化反応により縮合して本発明の化合物(1−12)を得るための工程である。該分子間環化反応は、例えば、(Journal of American Chemical Society,1955年,77巻,633頁)に記載の方法又はそれに準じた方法に従って実施できる。また、本工程の反応中間体である化合物(23)は、更に分子内環化反応を行うことにより化合物(1−12)へと変換することができる。該環化反応は、一般的な水酸基のアルキルハライドによるアルキル化の方法により実施でき、例えば、水素化ナトリウム存在下溶媒中又は無溶媒で加熱する方法等が挙げられる。
(反応式11)
工程17は、化合物(1−13)のtert−ブトキシカルボニル基を加水分解によりカルボン酸に変換して本発明の化合物(1−14)を得るための工程である。該加水分解反応は、一般的なエステルの加水分解反応により実施することができ、例えば、強酸存在下溶媒中又は無溶媒で反応させる方法、塩基存在下溶媒中で反応させる方法等、(T.W.Greene and P.G.M.Wuts著 Protective Groups in Organic Synthesis、第3版、John Wiley and Sons社)に記載の方法又はそれに準じた方法に従って実施できる。具体例としては、クロロホルム等の溶媒中トリフルオロ酢酸を加えて反応させる方法、メタノール等の溶媒中水酸化ナトリウム水溶液を加えて反応させる方法等が挙げられる。本反応における反応温度は、通常0℃〜120℃、好ましくは、15℃〜80℃であり、反応時間は、通常1〜48時間、好ましくは、1〜12時間である。
(工程18)
工程18は、化合物(1−14)の分子内環化反応により本発明の化合物(1−15)を得るための工程である。該分子内環化反応は、酸性条件下或いは脱水剤共存下溶媒中又は無溶媒でカルボン酸とアルコールを脱水縮合させる方法等、カルボン酸をエステルに変換する通常の方法により実施できる。
実施例中記載の各機器データは以下の測定機器にて測定した。
MSスペクトル:島津LCMS-2010EV又はmicromass Platform LC
NMRスペクトル:JNM-ECA600 (日本電子)
IRスペクトル:Spectrum One (Perkin Elmer)
融点:Thermoplus TG8120(リガク)
熱質量測定装置(Thermogravimetry):Thermoplus TG8120(リガク)
(1)1−(3−クロロプロポキシ)−4−ヨードベンゼンの製造
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.09 (d, J=6.0 Hz, 3 H), 1.37 (t, J=7.3 Hz, 3 H), 1.39 - 1.45 (m, 1 H), 1.65 - 1.73 (m, 1 H), 1.74 - 1.82 (m, 1 H), 1.89 - 2.06 (m, 3 H), 2.12 (q, J=8.7 Hz, 1 H), 2.18 - 2.23 (m, 1 H), 2.26 - 2.34 (m, 1 H), 2.95 - 3.02 (m, 1 H), 3.18 (td, J=8.6, 2.5 Hz, 1 H), 4.03 - 4.10 (m, 2 H), 4.33 (q, J=7.3 Hz, 2 H), 6.99 (d, J=9.2 Hz, 2 H), 7.58 (d, J=9.2 Hz, 2 H), 8.07 (s, 1 H), 8.30 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 358(M+H)+
(1)1−(4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−カルボン酸塩酸塩の製造
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.08 (d, J=6.0 Hz, 3 H), 1.36 - 1.46 (m, 1 H), 1.65 - 1.83 (m, 2 H), 1.87 - 2.06 (m, 3 H), 2.11 (q, J=9.0 Hz, 1 H), 2.17 - 2.24 (m, 1 H), 2.25 - 2.33 (m, 1 H), 2.93 - 3.03 (m, 1 H), 3.13 - 3.20 (m, 1 H), 4.02 - 4.10 (m, 2 H), 5.60 (br. s, 2 H), 6.94 - 7.02 (m, 2 H), 7.52 - 7.60 (m, 2 H), 7.91 (s, 1 H), 8.29 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 329(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.08 (d, J=6.0 Hz, 3 H), 1.37 - 1.46 (m, 1 H), 1.65 - 1.83 (m, 2 H), 1.88 - 2.06 (m, 3 H), 2.11 (q, J=8.7 Hz, 1 H), 2.16 - 2.24 (m, 1 H), 2.25 - 2.34 (m, 1 H), 2.93 - 3.03 (m, 1 H), 3.12 - 3.23 (m, 1 H), 4.02 - 4.11 (m, 2 H), 6.95 - 7.02 (m, 2 H), 7.50 - 7.57 (m, 2 H), 7.95 (s, 1 H), 8.18 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 311(M+H)+
(1)(2S)−1−[3−(4−ヨードフェノキシ)プロピル]−2−メチルピロリジンの製造
1H NMR (600 MHz, CHLOROFORM-d) δppm 1.08 (d, J=6.0 Hz, 3 H) 1.37 - 1.44 (m, 1 H) 1.57 - 1.72 (m, 2 H) 1.87 - 1.94 (m, 1 H) 1.95 - 2.03 (m, 1 H) 2.08 - 2.13 (m, 2 H) 2.16 - 2.22 (m, 1 H) 2.25 - 2.32 (m, 1 H) 2.94 - 3.00 (m, 1 H) 3.19 - 3.24 (m, 1 H) 4.02 - 4.08 (m, 2 H) 6.97 (d, J=8.7 Hz, 2 H) 7.56 (d, J=8.7 Hz, 2 H) 7.93 (s, 1 H) 8.30 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 329(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δppm 1.08 (d, J=6.4 Hz, 3 H) 1.38 - 1.44 (m, 1 H) 1.59 - 1.82 (m, 2 H) 1.88 - 1.95 (m, 1 H) 1.96 - 2.04 (m, 2 H) 2.08 - 2.13 (m, 1 H) 2.16 - 2.23 (m, 1 H) 2.25 - 2.34 (m, 1 H) 2.93 - 3.01 (m, 1 H) 3.14 - 3.20 (m, 1 H) 4.04 - 4.09 (m, 2 H) 6.99 (d, J=9.2 Hz, 2 H) 7.54 (d, J=9.2 Hz, 2 H) 7.95 (s, 1 H) 8.18 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 311(M+H)+
(1)4−(1H−ピラゾール−4−イルカルボニル)モルホリンの製造
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.08 (d, J=6.0 Hz, 3 H), 1.37 - 1.46 (m, 1 H), 1.64 - 1.82 (m, 2 H), 1.87 - 2.05 (m, 3 H), 2.11 (q, J=8.7 Hz, 1 H), 2.16 - 2.23 (m, 1 H), 2.25 - 2.33 (m, 1 H), 2.94 - 3.02 (m, 1 H), 3.13 - 3.20 (m, 1 H), 3.67 - 3.81 (m, 8 H), 4.01 - 4.10 (m, 2 H), 6.94 - 7.01 (m, 2 H), 7.52 - 7.58 (m, 2 H), 7.78 (s, 1 H), 8.13 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 399(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.08 (d, J=6.0 Hz, 3 H), 1.37 - 1.46 (m, 1 H), 1.64 - 1.82 (m, 2 H), 1.87 - 2.05 (m, 3 H), 2.11 (q, J=8.7 Hz, 1 H), 2.16 - 2.23 (m, 1 H), 2.25 - 2.33 (m, 1 H), 2.94 - 3.02 (m, 1 H), 3.13 - 3.20 (m, 1 H), 3.67 - 3.81 (m, 8 H), 4.01 - 4.10 (m, 2 H), 6.94 - 7.01 (m, 2 H), 7.52 - 7.58 (m, 2 H), 7.78 (s, 1 H), 8.13 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 399(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.75 - 1.82 (m, 4 H), 1.98 - 2.05 (m, 2 H), 2.49 - 2.56 (m, 4 H), 2.59 - 2.67 (m, 2 H), 3.67 - 3.81 (m, 8 H), 4.06 (t, J=6.4 Hz, 2 H), 6.94 - 7.01 (m, 2 H), 7.52 - 7.58 (m, 2 H), 7.77 (s, 1 H), 8.13 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 385(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.41 - 1.48 (m, 2 H), 1.55 - 1.63 (m, 4 H), 1.96 - 2.03 (m, 2 H), 2.34 - 2.50 (m, 6 H), 3.70 - 3.80 (m, 8 H), 4.05 (t, J=6.4 Hz, 2 H), 6.98 (d, J=9.2 Hz, 2 H), 7.56 (d, J=9.2 Hz, 2 H), 7.78 (s, 1 H), 8.14 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 399(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 0.97 (s, 6 H), 1.60 - 1.66 (m, 2 H), 1.71 - 1.80 (m, 2 H), 1.90 - 1.98 (m, 2 H), 2.54 (t, J=7.1 Hz, 2 H), 2.76 (t, J=7.3 Hz, 2 H), 3.68 - 3.80 (m, 8 H), 4.06 (t, J=6.4 Hz, 2 H), 6.95 - 7.00 (m, 2 H), 7.53 - 7.58 (m, 2 H), 7.78 (s, 1 H), 8.13 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 413(M+H)+
(1)N−tert−ブチル−1H−ピラゾール−4−カルボキサミドの製造
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.11 (d, J=6.4 Hz, 3 H), 1.47 (s, 9 H), 1.75 - 1.82 (m, 1 H), 1.90 - 1.96 (m, 1 H), 1.98 - 2.05 (m, 2 H), 2.11 - 2.17 (m, 1 H), 2.20 - 2.25 (m, 1 H), 2.29 - 2.36 (m, 1 H), 2.96 - 3.02 (m, 1 H), 3.17 - 3.21 (m, 1 H), 4.03 - 4.09 (m, 2 H), 5.63 (br. s., 1 H), 6.98 (d, J=9.2 Hz, 2 H), 7.55 (d, J=9.2 Hz, 2 H), 7.82 (s, 1 H), 8.21 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 385(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.11 (d, J=6.0 Hz, 6 H), 1.33 - 1.41 (m, 2 H), 1.47 (s, 9 H), 1.77 - 1.85 (m, 2 H), 1.91 - 2.04 (m, 2 H), 2.55 - 2.64 (m, 2 H), 2.73 - 2.77 (m, 2 H), 4.04 (t, J=6.2 Hz, 2 H), 5.61 (s, 1 H), 6.97 (d, J=8.7 Hz, 2 H), 7.56 (d, J=9.2 Hz, 2 H), 7.82 (s, 1 H), 8.21 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 399(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.46 (s, 9 H), 1.76 - 1.81 (m, 4 H), 1.98 - 2.05 (m, 2 H), 2.49 - 2.56 (m, 4 H), 2.58 - 2.67 (m, 2 H), 4.05 (t, J=6.6 Hz, 2 H), 5.60 (s, 1 H), 6.92 - 7.01 (m, 2 H), 7.50 - 7.58 (m, 2 H), 7.81 (s, 1 H), 8.20 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 371(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 2.55 (q, J=7.0 Hz, 4 H), 2.59 - 2.63 (m, 2 H), 4.05 (t, J=6.4 Hz, 2 H), 5.60 (s, 1 H), 6.97 (d, 2 H), 7.55 (d, J=9.2 Hz, 2 H), 7.82 (s, 1 H), 8.20 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 373(M+H)+
(1)1−{4−[3−(2−メチルピロリジン−1−イル)プロポキシ]フェニル}−1H−ピラゾール−4−カルボン酸塩酸塩の製造
1H NMR (600 MHz, CHLOROFORM-d) δppm 1.10 (d, J=6.0 Hz, 3 H), 1.40 - 2.35 (m, 9 H), 2.97 - 3.03 (m, 1 H), 3.17 - 3.23 (m, 1 H), 4.05 - 4.12 (m, 2 H), 6.99 - 7.02 (m, 2 H), 7.15 - 7.20 (m, 2 H), 7.48 (s, 1H), 7.56 - 7.62 (m, 2 H), 8.00 (s, 1 H), 8.37 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 423(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δppm 1.77 - 1.83 (m, 4 H), 2.00 - 2.07 (m, 2 H), 2.52 - 2.58 (m, 4 H), 2.66 (t, J=7.6 Hz, 2 H), 4.07 (t, J=6.4 Hz, 2 H), 6.99 (d, J=9.2 Hz, 2 H), 7.06 (t, J=8.5 Hz, 2 H), 7.47 (s, 1H), 7.54 - 7.61 (m, 2 H), 7.58 (d, J=9.2 Hz, 2 H), 8.00 (s, 1 H), 8.37 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 409(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.12 (br. s., 3 H), 1.46 (br. s., 1 H), 1.66 - 1.87 (m, 2 H), 1.89 - 2.39 (m, 9 H), 3.01 (br. s., 1 H), 3.21 (br. s., 1 H), 4.04 - 4.12 (m, 2 H), 7.00 (d, J=9.2 Hz, 2 H), 7.18 (d, J=8.3 Hz, 2 H), 7.42 (s, 1 H), 7.49 (d, J=8.3 Hz, 2 H), 7.60 (d, J=9.2 Hz, 2 H), 7.99 (br. s., 1 H), 8.36 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 419(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.08 (d, J=6.0 Hz, 3 H), 1.41 (dddd, J=12.5, 10.4, 8.7, 6.0 Hz, 1 H), 1.65 - 1.72 (m, 1 H), 1.73 - 1.82 (m, 1 H), 1.87 - 1.95 (m, 1 H), 1.95 - 2.05 (m, 2 H), 2.11 (q, J=9.2 Hz, 1 H), 2.16 - 2.22 (m, 1 H), 2.25 - 2.32 (m, 1 H), 2.94 - 3.01 (m, 1 H), 3.14 - 3.20 (m, 1 H), 4.02 - 4.09 (m, 2 H), 4.59 (d, J=6.0 Hz, 2 H), 6.05 - 6.10 (m, 1 H), 6.95 - 6.99 (m, 2 H), 7.01 - 7.06 (m, 2 H), 7.30 - 7.35 (m, 2 H), 7.55 (d, J=9.2 Hz, 2 H), 7.88 (s, 1 H), 8.28 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 437(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.08 (d, J=6.0 Hz, 3 H), 1.37 - 1.45 (m, 1 H), 1.64 - 1.72 (m, 1 H), 1.73 - 1.82 (m, 1 H), 1.87 - 1.95 (m, 1 H), 1.95 - 2.06 (m, 2 H), 2.11 (q, J=8.7 Hz, 1 H), 2.16 - 2.23 (m, 1 H), 2.25 - 2.33 (m, 1 H), 2.94 - 3.01 (m, 1 H), 3.03 - 3.33 (m, 7 H), 4.02 - 4.09 (m, 2 H), 6.94 - 7.01 (m, 2 H), 7.54 - 7.59 (m, 2 H), 7.86 (s, 1 H), 8.17 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 357(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.09 (d, J=6.0 Hz, 3 H), 1.37 - 1.47 (m, 1 H), 1.65 - 1.83 (m, 4 H), 1.87 - 2.06 (m, 3 H), 2.12 (q, J=9.0 Hz, 1 H), 2.16 - 2.23 (m, 1 H), 2.26 - 2.36 (m, 1 H), 2.94 - 3.02 (m, 1 H), 3.13 - 3.21 (m, 1 H), 3.70 (br. s., 4 H), 3.83 - 4.08 (m, 6 H), 6.90 - 6.99 (m, 2 H), 7.50 - 7.56 (m, 2 H), 7.99 (s, 1 H), 8.32 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 417(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.08 (d, J=6.0 Hz, 3 H), 1.37 - 1.45 (m, 1 H), 1.65 - 1.72 (m, 1 H), 1.73 - 1.81 (m, 1 H), 1.88 - 1.95 (m, 1 H), 1.95 - 2.05 (m, 2 H), 2.10 (q, J=8.9 Hz, 1 H), 2.17 - 2.22 (m, 1 H), 2.25 - 2.32 (m, 1 H), 2.36 - 2.43 (m, 2 H), 2.94 - 3.01 (m, 1 H), 3.17 (td, J=8.6, 2.5 Hz, 1 H), 4.02 - 4.09 (m, 2 H), 4.17 - 4.24 (m, 2 H), 4.41 - 4.48 (m, 2 H), 6.95 - 6.99 (m, 2 H), 7.54 - 7.58 (m, 2 H), 7.85 (s, 1 H), 8.22 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 369(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.10 (d, J=6.0 Hz, 3 H), 1.38 - 1.48 (m, 1 H), 1.65 - 1.84 (m, 2 H), 1.88 - 1.96 (m, 1 H), 1.97 - 2.07 (m, 2 H), 2.09 - 2.16 (m, 1 H), 2.17 - 2.25 (m, 1 H), 2.27 - 2.35 (m, 1 H), 2.39 - 2.56 (m, 2 H), 2.95 - 3.03 (m, 1 H), 3.14 - 3.23 (m, 1 H), 3.87 - 4.14 (m, 6 H), 6.99 (d, J=9.2 Hz, 2 H), 7.58 (d, J=9.2 Hz, 2 H), 7.92 (br. s., 1 H), 8.26 (br. s., 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 419(M+H)+
(1)1−(4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−カルボン酸 メトキシメチルアミドの製造
1H NMR (600 MHz, CHLOROFORM-d) δppm 1.10 (d, J=6.0 Hz, 3 H), 1.39 - 1.47 (m, 1 H), 1.64 - 1.84 (m, 2 H), 1.90 - 1.96 (m, 1 H), 1.99 - 2.06 (m, 2 H), 2.12 - 2.21 (m, 1 H), 2.24 (s, 1 H), 2.34 (s, 1 H), 2.97 - 3.03 (m, 1 H), 3.17 - 3.23 (m, 1 H), 4.04 - 4.10 (m, 2 H), 7.00 (d, J=9.2 Hz, 2 H), 7.17 - 7.22 (m, 2 H), 7.61 (d, J=9.2 Hz, 2 H), 7.93 (dd, J=8.7, 5.5 Hz, 2 H), 8.08 (s, 1 H), 8.34 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 408(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δppm 1.09 (d, J=6.4 Hz, 3 H), 1.38 - 1.45 (m, 1 H), 1.64 - 1.73 (m, 1 H), 1.74 - 1.81 (m, 1 H), 1.87 - 2.07 (m, 3 H), 2.11 (q, J=9.0 Hz, 1 H), 2.18 - 2.23 (m, 1 H), 2.27 - 2.32 (m, 1 H), 2.96 - 3.01 (m, 1 H), 3.15 - 3.19 (m, 1 H), 4.04 - 4.10 (m, 2 H), 7.00 (d, J=9.2 Hz, 2 H), 7.49 - 7.53 (m, 2 H), 7.57 - 7.63 (m, 3 H), 7.89 (d, J=6.9 Hz, 2 H), 8.11 (s, 1 H), 8.35 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 390(M+H)+
(1)(1H−ピラゾール−4−イル)−ピリジン−2−イルメタノンの製造
1H NMR (600 MHz, CHLOROFORM-d) δppm 1.09 (d, J=6.4 Hz, 3 H), 1.38 - 1.45 (m, 1 H), 1.63 - 1.72 (m, 1 H), 1.74 - 1.82 (m, 1 H), 1.89 - 1.96 (m, 1 H), 1.97 - 2.05 (m, 2 H), 2.09 - 2.14 (m, 1 H), 2.17 - 2.24 (m, 1 H), 2.27 - 2.33 (m, 1 H), 2.94 - 3.01 (m, 1 H), 3.16 - 3.20 (m, 1 H), 4.04 - 4.10 (m, 2 H), 7.00 (d, J=8.7 Hz, 2 H), 7.48 - 7.51 (m, 1 H), 7.65 (d, J=8.7 Hz, 2 H), 7.87 - 7.91 (m, 1 H), 8.18 - 8.20 (m, 1 H), 8.54 (s, 1 H), 8.74 - 8.76 (m, 1 H), 9.04 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 391(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δppm 1.08 (d, J=6.0 Hz, 3 H), 1.38 - 1.44 (m, 1 H), 1.65 - 1.72 (m, 1 H), 1.73 - 1.81 (m, 1 H), 1.88 - 1.95 (m, 1 H), 1.96 - 2.05 (m, 2 H), 2.11 (q, J=9.0 Hz, 1 H), 2.17 - 2.23 (m, 1 H), 2.26 - 2.32 (m, 1 H), 2.95 - 3.01 (m, 1 H), 3.17 (td, J=8.5, 2.8 Hz, 1 H), 4.04 - 4.10 (m, 2 H), 7.00 (d, J=9.2 Hz, 2 H), 7.60 (d, J=9.2 Hz, 2 H), 7.67 (d, J=6.0 Hz, 2 H), 8.10 (s, 1 H), 8.35 (s, 1 H), 8.83 (d, J=6.0 Hz, 2 H)
MS (ESI/APCI Dual) (Positive) m/z; 391(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δppm 1.08 (d, J=6.0 Hz, 3 H), 1.38 - 1.45 (m, 1 H), 1.64 - 1.72 (m, 1 H), 1.74 - 1.81 (m, 1 H), 1.88 - 1.94 (m, 1 H), 1.96 - 2.04 (m, 2 H), 2.08 - 2.14 (m, 1 H), 2.17 - 2.23 (m, 1 H), 2.26 - 2.32 (m, 1 H), 2.48 (s, 3 H), 2.95 - 3.00 (m, 1 H), 3.15 - 3.19 (m, 1 H), 4.03 - 4.09 (m, 2 H), 6.99 (d, J=9.2 Hz, 2 H), 7.58 (d, J=9.2 Hz, 2 H), 8.05 (s, 1 H), 8.28 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 328(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.08 (d, J=6.0 Hz, 3 H), 1.36 - 1.47 (m, 1 H), 1.65 - 1.83 (m, 2 H), 1.87 - 1.95 (m, 1 H), 1.96 - 2.06 (m, 2 H), 2.11 (q, J=9.0 Hz, 1 H), 2.16 - 2.24 (m, 1 H), 2.25 - 2.33 (m, 1 H), 2.91 - 3.03 (m, 1 H), 3.12 - 3.23 (m, 1 H), 4.02 - 4.13 (m, 2 H), 6.96 - 7.07 (m, 2 H), 7.53 - 7.63 (m, 2 H), 8.23 (s, 1 H), 8.51 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 331(M+H)+
(1)1−(4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−イルアミンの製造
1H NMR (600 MHz, DMSO-d6) δ ppm 1.36 (d, J=6.4 Hz, 3 H), 1.54 - 1.67 (m, 1 H), 1.82 - 2.21 (m, 6 H), 2.30 - 2.52 (m, 3 H), 2.97 - 3.13 (m, 2 H), 3.33 - 3.45 (m, 2 H), 3.52 - 3.72 (m, 3 H), 4.00 - 4.16 (m, 2 H), 7.02 (d, J=9.2 Hz, 2 H), 7.54 - 7.74 (m, 3 H), 8.42 (s, 1 H), 10.19 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 405(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.09 (d, J=6.4 Hz, 3 H), 1.36 - 1.46 (m, 1 H), 1.64 - 1.84 (m, 2 H), 1.87 - 2.07 (m, 3 H), 2.07 - 2.16 (m, 1 H), 2.16 - 2.33 (m, 4 H), 2.57 (t, J=8.0 Hz, 2 H), 2.94 - 3.02 (m, 1 H), 3.13 - 3.22 (m, 1 H), 3.80 (t, J=7.3 Hz, 2 H), 4.00 - 4.09 (m, 2 H), 6.92 - 6.99 (m, 2 H), 7.54 - 7.61 (m, 2 H), 7.65 (s, 1 H), 8.43 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 369(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.09 (d, J=6.4 Hz, 3 H), 1.36 - 1.46 (m, 1 H), 1.64 - 1.84 (m, 2 H), 1.87 - 2.07 (m, 3 H), 2.07 - 2.16 (m, 1 H), 2.16 - 2.33 (m, 4 H), 2.57 (t, J=8.0 Hz, 2 H), 2.94 - 3.02 (m, 1 H), 3.13 - 3.22 (m, 1 H), 3.80 (t, J=7.3 Hz, 2 H), 4.00 - 4.09 (m, 2 H), 6.92 - 6.99 (m, 2 H), 7.54 - 7.61 (m, 2 H), 7.65 (s, 1 H), 8.43 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 369(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δppm 1.72 - 1.82 (m, 4 H), 2.02 (q, J=6.9 Hz, 2 H), 2.19 - 2.28 (m, 2 H), 2.47 - 2.66 (m, 8 H), 3.76 - 3.84 (m, 2 H), 4.06 (t, J=6.4 Hz, 2 H), 6.96 (d, J=9.2 Hz, 2 H), 7.58 (d, J=9.2 Hz, 2 H), 7.65 (s, 1 H), 8.44 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 355(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.91 - 2.38 (m, 7 H), 2.49 - 3.51 (m, 4 H), 3.67 - 3.97 (m, 4 H), 4.02 - 4.16 (m, 2 H), 4.36 - 4.51 (m, 3 H), 6.70 (s, 1 H), 6.87 - 6.97 (m, 2 H), 7.51 - 7.61 (m, 3 H), 8.09 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 407(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.08 (d, J=6.0 Hz, 3 H), 1.37 - 1.45 (m, 1 H), 1.64 - 1.82 (m, 2 H), 1.87 - 2.05 (m, 3 H), 2.11 (q, J=8.9 Hz, 1 H), 2.16 - 2.23 (m, 1 H), 2.25 - 2.32 (m, 1 H), 2.94 - 3.01 (m, 1 H), 3.14 - 3.20 (m, 1 H), 3.97 - 4.08 (m, 4 H), 4.52 - 4.57 (m, 2 H), 6.93 - 6.98 (m, 2 H), 7.54 - 7.57 (m, 2 H), 7.59 (s, 1 H), 8.18 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 371(M+H)+
1H NMR (600 MHz, DMSO-d6) δ ppm 1.28 - 1.42 (m, 3 H), 1.54 - 1.79 (m, 5 H), 1.83 - 2.32 (m, 7 H), 3.06 (br. s., 2 H), 3.24 - 3.48 (m, 2 H), 3.54 - 3.68 (m, 3 H), 4.04 (br. s., 2 H), 7.01 (d, J=9.2 Hz, 2 H), 7.60 - 7.74 (m, 3 H), 8.39 (s, 1 H), 10.09 (s, 1 H)
MS (ESI) (Positive) m/z; 419(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.08 (d, J=6.0 Hz, 3 H), 1.36 - 1.45 (m, 1 H), 1.63 - 1.82 (m, 2 H), 1.85 - 2.05 (m, 7 H), 2.10 (q, J=8.9 Hz, 1 H), 2.16 - 2.22 (m, 1 H), 2.24 - 2.32 (m, 1 H), 2.58 (t, J=6.6 Hz, 2 H), 2.94 - 3.01 (m, 1 H), 3.14 - 3.20 (m, 1 H), 3.72 (t, J=6.2 Hz, 2 H), 4.00 - 4.08 (m, 2 H), 6.95 (d, J=8.7 Hz, 2 H), 7.54 - 7.59 (m, 2 H), 7.70 (s, 1 H), 8.49 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 383(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.09 (d, J=6.0 Hz, 3 H), 1.38 - 1.47 (m, 1 H), 1.64 - 1.73 (m, 1 H), 1.74 - 1.83 (m, 1 H), 1.88 - 2.06 (m, 3 H), 2.12 (q, J=8.9 Hz, 1 H), 2.15 - 2.24 (m, 4 H), 2.26 - 2.33 (m, 1 H), 2.95 - 3.02 (m, 1 H), 3.18 (td, J=8.6, 2.5 Hz, 1 H), 4.01 - 4.09 (m, 2 H), 6.96 (d, J=9.2 Hz, 2 H), 7.18 (s, 1 H), 7.55 (d, J=2.3 Hz, 2 H), 7.57 (s, 1 H), 8.37 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 343(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.08 (d, J=6.0 Hz, 3 H), 1.37 - 1.47 (m, 1 H), 1.60 - 1.83 (m, 2 H), 1.86 - 2.07 (m, 5 H), 2.07 - 2.15 (m, 1 H), 2.16 - 2.24 (m, 1 H), 2.25 - 2.34 (m, 2 H), 2.93 - 3.03 (m, 1 H), 3.14 - 3.21 (m, 1 H), 3.24 (s, 2 H), 3.40 (s, 1 H), 4.00 - 4.10 (m, 2 H), 6.92 - 7.01 (m, 2 H), 7.50 - 7.60 (m, 8/3 H), 7.66 (s, 1/3 H), 7.77 (s, 2/3 H), 8.42 (s, 1/3 H)
MS (ESI/APCI Dual) (Positive) m/z; 357(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.10 (d, J=6.0 Hz, 3 H), 1.15 (t, J=7.1 Hz, 3 H・5/6), 1.24 - 1.32 (m, 1 H), 1.34 (t, J=7.3 Hz, 3 H・1/6), 1.38 - 1.46 (m, 1 H), 1.66 - 1.74 (m, 1 H), 1.74 - 1.83 (m, 1 H), 1.89 - 2.34 (m, 8 H), 2.30 (s, 1 H), 2.96 - 3.03 (m, 1 H), 3.19 (td, J=8.6, 2.5 Hz, 1 H), 3.69 (q, J=6.9 Hz, 2 H・5/6), 3.78 (q, J=7.0 Hz, 2 H・1/6), 4.03 - 4.11 (m, 2 H), 6.95 - 7.01 (m, 2 H), 7.54 - 7.65 (m, 3 H), 7.77 (s, 1 H・5/6), 8.41 (s, 1 H・1/6)
MS (ESI/APCI Dual) (Positive) m/z; 371(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.10 (d, J=6.0 Hz, 3 H), 1.38 - 1.47 (m, 1 H), 1.66 - 1.74 (m, 1 H), 1.74 - 1.83 (m, 1 H), 1.89 - 2.06 (m, 3 H), 2.12 (q, J=8.7 Hz, 1 H), 2.19 - 2.24 (m, 1 H), 2.27 - 2.33 (m, 1 H), 2.96 - 3.02 (m, 1 H), 3.18 (td, J=8.7, 2.8 Hz, 1 H), 4.03 - 4.11 (m, 2 H), 6.99 (d, J=9.2 Hz, 2 H), 7.60 (d, J=9.2 Hz, 2 H), 7.72 (s, 1 H), 7.81 (d, J=8.3 Hz, 2 H), 7.92 (s, 1 H), 7.99 (d, J=8.7 Hz, 2 H), 8.55 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 430(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.10 (d, J=6.0 Hz, 3 H), 1.39 - 1.46 (m, 1 H), 1.65 - 1.82 (m, 2 H), 1.89 - 2.06 (m, 3 H), 2.12 (q, J=8.7 Hz, 1 H), 2.18 - 2.24 (m, 1 H), 2.27 - 2.33 (m, 1 H), 2.96 - 3.02 (m, 1 H), 3.19 (td, J=8.6, 2.5 Hz, 1 H), 3.88 (s, 3 H), 4.03 - 4.10 (m, 2 H), 6.96 - 7.01 (m, 4 H), 7.60 (d, J=9.2 Hz, 2 H), 7.69 (s, 1 H), 7.74 (s, 1 H), 7.85 (d, J=8.7 Hz, 2 H), 8.55 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 435(M+H)+
1H NMR (600 MHz, DMSO-d6) δ ppm 1.00 (d, J=6.0 Hz, 3 H), 1.24 - 1.32 (m, 1 H), 1.58 - 1.70 (m, 2 H), 1.80 - 1.95 (m, 3 H), 2.04 (q, J=8.7 Hz, 1 H), 2.09 - 2.15 (m, 1 H), 2.20 - 2.29 (m, 1 H), 2.87 - 2.96 (m, 1 H), 3.08 (td, J=8.4, 3.0 Hz, 1 H), 4.05 (t, J=6.2 Hz, 2 H), 6.87 (d, J=8.7 Hz, 2 H), 7.03 (d, J=8.7 Hz, 2 H), 7.68 (d, J=9.2 Hz, 2 H), 7.83 (s, 1 H), 7.86 (d, J=8.7 Hz, 2 H), 8.53 (s, 1 H), 10.14 (br. s., 1 H), 10.32 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 421(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.09 (d, J=6.0 Hz, 3 H), 1.37 - 1.47 (m, 1 H), 1.65 - 1.83 (m, 2 H), 1.87 - 2.06 (m, 3 H), 2.11 (q, J=9.0 Hz, 1 H), 2.17 - 2.24 (m, 1 H), 2.25 - 2.33 (m, 1 H), 2.94 - 3.02 (m, 1 H), 3.14 - 3.21 (m, 1 H), 4.02 - 4.10 (m, 2 H), 6.95 - 7.00 (m, 2 H), 7.43 - 7.48 (m, 1 H), 7.56 - 7.62 (m, 2 H), 7.73 (s, 1 H), 7.96 (s, 1 H), 8.19 - 8.23 (m, 1 H), 8.54 (s, 1 H), 8.76 - 8.80 (m, 1 H), 9.08 - 9.12 (m, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 406(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.09 (d, J=6.4 Hz, 3 H), 1.38 - 1.46 (m, 1 H), 1.65 - 1.82 (m, 2 H), 1.87 - 2.06 (m, 3 H), 2.11 (q, J=8.7 Hz, 1 H), 2.17 - 2.23 (m, 1 H), 2.26 - 2.33 (m, 1 H), 2.95 - 3.01 (m, 1 H), 3.15 - 3.20 (m, 1 H), 4.02 - 4.09 (m, 2 H), 6.95 - 6.99 (m, 2 H), 7.56 - 7.60 (m, 2 H), 7.71 (d, J=4.6 Hz, 3 H), 8.02 (s, 1 H), 8.54 (s, 1 H), 8.77 - 8.84 (m, 2 H)
MS (ESI/APCI Dual) (Positive) m/z; 406(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.11 (d, J=6.0 Hz, 3 H), 1.44 (dddd, J=17.0, 4.0, 2.5, 2.2 Hz, 1 H), 1.66 - 1.75 (m, 1 H), 1.75 - 1.84 (m, 1 H), 1.88 - 2.03 (m, 3 H), 2.11 - 2.25 (m, 2 H), 2.29 - 2.38 (m, 1 H), 2.97 - 3.05 (m, 1 H), 3.15 - 3.21 (m, 1 H), 3.63 (s, 2 H), 4.02 (t, J=6.9 Hz, 2 H), 6.77 - 6.82 (m, 2 H), 6.86 - 6.92 (m, 2 H), 7.12 (d, J=8.7 Hz, 2 H), 7.34 (s, 1 H), 7.43 - 7.51 (m, 3 H), 8.32 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 435(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.08 (d, J=6.0 Hz, 3 H), 1.36 - 1.46 (m, 1 H), 1.63 - 1.82 (m, 2 H), 1.86 - 2.05 (m, 3 H), 2.10 (q, J=9.2 Hz, 1 H), 2.15 - 2.22 (m, 1 H), 2.24 - 2.33 (m, 1 H), 2.92 - 3.02 (m, 1 H), 3.13 - 3.20 (m, 1 H), 3.72 (s, 2 H), 3.99 - 4.08 (m, 2 H), 6.91 - 6.98 (m, 2 H), 7.30 - 7.41 (m, 2 H), 7.49 - 7.57 (m, 3 H), 7.72 (d, J=7.8 Hz, 1 H), 8.36 (s, 1 H), 8.53 - 8.61 (m, 2 H)
MS (ESI/APCI Dual) (Positive) m/z; 420(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.08 (d, J=6.0 Hz, 3 H), 1.37 - 1.45 (m, 1 H), 1.65 - 1.72 (m, 1 H), 1.72 - 1.81 (m, 1 H), 1.86 - 2.04 (m, 3 H), 2.10 (q, J=8.7 Hz, 1 H), 2.15 - 2.22 (m, 1 H), 2.24 - 2.32 (m, 1 H), 2.93 - 3.00 (m, 1 H), 3.13 - 3.19 (m, 1 H), 3.71 (s, 2 H), 3.99 - 4.07 (m, 2 H), 6.91 - 6.96 (m, 2 H), 7.28 (d, J=6.0 Hz, 2 H), 7.39 (s, 1 H), 7.50 - 7.55 (m, 3 H), 8.36 (s, 1 H), 8.59 - 8.62 (m, 2 H)
MS (ESI/APCI Dual) (Positive) m/z; 420(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.09 (d, J=6.4 Hz, 3 H), 1.38 - 1.47 (m, 1 H), 1.64 - 1.83 (m, 2 H), 1.87 - 2.06 (m, 3 H), 2.07 - 2.34 (m, 3 H), 2.95 - 3.02 (m, 4 H), 3.14 - 3.21 (m, 1 H), 4.02 - 4.08 (m, 2 H), 6.94 - 6.98 (m, 2 H), 7.51 - 7.55 (m, 2 H), 7.59 - 7.61 (m, 1 H), 7.92 - 7.94 (m, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 379(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.08 (d, J=6.0 Hz, 3 H), 1.37 - 1.45 (m, 1 H), 1.64 - 1.82 (m, 2 H), 1.87 - 2.03 (m, 3 H), 2.11 (q, J=9.0 Hz, 1 H), 2.17 - 2.23 (m, 1 H), 2.25 - 2.33 (m, 1 H), 2.83 (s, 3 H), 2.94 - 3.01 (m, 1 H), 3.14 - 3.20 (m, 1 H), 3.30 (s, 3 H), 4.01 - 4.09 (m, 2 H), 6.94 - 6.99 (m, 2 H), 7.51 - 7.56 (m, 2 H), 7.65 (s, 1 H), 7.91 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 393(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.17 (d, J=6.0 Hz, 3 H), 1.49 - 1.57 (m, 1 H), 1.73 - 1.81 (m, 1 H), 1.84 - 1.93 (m, 1 H), 1.96 - 2.12 (m, 3 H), 2.31 - 2.41 (m, 2 H), 2.50 - 2.58 (m, 1 H), 3.02 - 3.09 (m, 1 H), 3.31 (td, J=8.9, 3.2 Hz, 1 H), 4.00 (t, J=6.4 Hz, 2 H), 5.55 (br. s., 1 H), 6.88 (d, J=8.7 Hz, 2 H), 7.31 (s, 1 H), 7.43 (d, J=9.2 Hz, 2 H), 7.72 (d, J=8.7 Hz, 2 H), 7.76 (s, 1 H), 7.88 (d, J=8.7 Hz, 2 H)
MS (ESI/APCI Dual) (Positive) m/z; 466(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.10 (d, J=6.0 Hz, 3 H), 1.40 - 1.48 (m, 1 H), 1.67 - 1.74 (m, 1 H), 1.76 - 1.85 (m, 1 H), 1.89 - 2.06 (m, 3 H), 2.16 (q, J=8.7 Hz, 1 H), 2.20 - 2.27 (m, 1 H), 2.31 - 2.38 (m, 1 H), 2.99 (dd, J=8.3, 4.1 Hz, 1 H), 3.17 - 3.23 (m, 1 H), 3.99 - 4.06 (m, 2 H), 6.90 - 6.95 (m, 2 H), 7.32 (s, 1 H), 7.41 (dd, J=8.0, 4.8 Hz, 1 H), 7.44 - 7.48 (m, 2 H), 7.80 (s, 1 H), 8.00 - 8.04 (m, 1 H), 8.76 - 8.79 (m, 1 H), 9.01 (d, J=1.8 Hz, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 442(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.10 (d, J=6.4 Hz, 3 H), 1.38 - 1.47 (m, 1 H), 1.65 - 1.73 (m, 1 H), 1.74 - 1.83 (m, 1 H), 1.88 - 2.06 (m, 3 H), 2.12 (q, J=8.7 Hz, 1 H), 2.17 - 2.24 (m, 1 H), 2.26 - 2.34 (m, 1 H), 2.89 (s, 4 H), 2.95 - 3.03 (m, 1 H), 3.18 (td, J=8.7, 2.8 Hz, 1 H), 4.03 - 4.10 (m, 2 H), 6.98 (d, J=8.7 Hz, 2 H), 7.60 (d, J=8.7 Hz, 2 H), 8.32 (s, 1 H), 8.53 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 383(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δppm 1.09 (d, J=6.0 Hz, 3 H), 1.22 (br. s., 6 H), 1.38 - 1.46 (m, 1 H), 1.63 - 1.84 (m, 3 H), 1.87 - 2.06 (m, 3 H), 2.12 (q, J=8.9 Hz, 1 H), 2.17 - 2.25 (m, 1 H), 2.25 - 2.34 (m, 1 H), 2.55 (br. s., 1 H), 2.81 - 3.05 (m, 2 H), 3.18 (td, J=8.7, 2.8 Hz, 1 H), 3.62 (br. s., 2 H), 4.00 - 4.11 (m, 2 H), 4.53 (br. s., 1 H), 6.99 (d, J=8.7 Hz, 2 H), 7.57 (d, J=8.7 Hz, 2 H), 7.77 (s, 1 H), 8.13 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 427(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.09 (d, J=6.0 Hz, 3 H), 1.37 - 1.47 (m, 1 H), 1.65 - 1.73 (m, 1 H), 1.73 - 1.83 (m, 1 H), 1.87 - 1.95 (m, 1 H), 1.96 - 2.06 (m, 4 H), 2.07 - 2.15 (m, 1 H), 2.16 - 2.24 (m, 1 H), 2.25 - 2.33 (m, 1 H), 2.95 - 3.02 (m, 1 H), 3.14 - 3.21 (m, 1 H), 3.76 - 3.89 (m, 8 H), 4.02 - 4.09 (m, 2 H), 6.98 (d, J=9.2 Hz, 2 H), 7.56 (d, J=8.7 Hz, 2 H), 7.75 - 7.86 (m, 1 H), 8.13 - 8.21 (m, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 413(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.10 (d, J=6.0 Hz, 3 H), 1.37 - 1.48 (m, 1 H), 1.62 - 2.07 (m, 5 H), 2.08 - 2.16 (m, 1 H), 2.17 - 2.25 (m, 1 H), 2.26 - 2.37 (m, 4 H), 2.46 (br. s., 4 H), 2.95 - 3.03 (m, 1 H), 3.15 - 3.22 (m, 1 H), 3.78 (br. s., 4 H), 4.02 - 4.11 (m, 2 H), 6.98 (d, J=9.2 Hz, 2 H), 7.57 (d, J=8.7 Hz, 2 H), 7.79 (s, 1 H), 8.13 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 412(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.10 (d, J=6.0 Hz, 3 H), 1.38 - 1.47 (m, 1 H), 1.64 - 2.07 (m, 9 H), 2.09 - 2.15 (m, 1 H), 2.17 - 2.24 (m, 1 H), 2.26 - 2.34 (m, 1 H), 2.95 - 3.03 (m, 1 H), 3.15 - 3.22 (m, 1 H), 3.66 (t, J=6.9 Hz, 2 H), 3.75 (t, J=6.6 Hz, 2 H), 4.02 - 4.11 (m, 2 H), 6.96 - 7.01 (m, 2 H), 7.56 - 7.61 (m, 2 H), 7.96 (s, 1 H), 8.28 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 383(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.04 (d, J=6.9 Hz, 3 H), 1.31 - 1.40 (m, 1 H), 1.97 - 2.07 (m, 4 H), 2.22 - 2.31 (m, 1 H), 2.44 - 2.50 (m, 1 H), 2.55 - 2.61 (m, 1 H), 2.62 - 2.68 (m, 1 H), 2.69 - 2.76 (m, 1 H), 2.83 - 2.89 (m, 1 H), 3.71 - 3.81 (m, 8 H), 4.06 (t, J=6.4 Hz, 2 H), 6.95 - 7.01 (m, 2 H), 7.53 - 7.59 (m, 2 H), 7.78 (s, 1 H), 8.14 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 399(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 0.87 (t, J=7.3 Hz, 3 H), 1.16 - 1.29 (m, 1 H), 1.39 - 1.49 (m, 1 H), 1.67 - 1.82 (m, 3 H), 1.87 - 1.95 (m, 1 H), 1.95 - 2.06 (m, 2 H), 2.08 - 2.14 (m, 1H), 2.13 - 2.19 (m, 1 H), 2.19 - 2.27 (m, 1 H), 2.90 - 3.07 (m, 1 H), 3.11 - 3.26 (m, 1 H), 3.68 - 3.85 (m, 8 H), 3.93 - 4.13 (m, 2 H), 6.93 - 7.05 (m, 2 H), 7.49 - 7.61 (m, 2 H), 7.78 (s, 1 H), 8.14 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 413(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.94 - 2.03 (m, 2 H), 2.23 - 2.34 (m, 2 H), 2.66 (t, J=7.1 Hz, 2 H), 2.76 (t, J=7.1 Hz, 2 H), 2.93 (t, J=13.3 Hz, 2 H), 3.68 - 3.83 (m, 8 H), 4.07 (t, J=6.2 Hz, 2 H), 6.94 - 7.02 (m, 2 H), 7.54 - 7.60 (m, 2 H), 7.79 (s, 1 H), 8.15 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 421(M+H)+
(1)1−(2−クロロエトキシ)−4−ヨードベンゼンの製造
(2)(2R)−1−[2−(4−ヨードフェノキシ)エチル]−2−メチルピロリジンの製造
(3)[1−(4−{2−[(2R)−2−メチルピロリジン−1−イル]エトキシ}フェニル)−1H−ピラゾール−4−イル](モルホリン−4−イル)メタノンの製造
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.15 (d, J=6.0 Hz, 3 H), 1.41 - 1.51 (m, 1 H), 1.69 - 1.77 (m, 1 H), 1.78 - 1.88 (m, 1 H), 1.90 - 1.98 (m, 1 H), 2.25 - 2.33 (m, 1 H), 2.39 - 2.46 (m, 1 H), 2.52 - 2.60 (m, 1 H), 3.18 - 3.30 (m, 2 H), 3.70 - 3.81 (m, 8 H), 4.09 - 4.19 (m, 2 H), 6.97 - 7.03 (m, 2 H), 7.54 - 7.60 (m, 2 H), 7.79 (s, 1 H), 8.14 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 385(M+H)+
(1)1−(4−クロロブトキシ)−4−ヨードベンゼンの製造
(2)(2R)−1−[4−(4−ヨードフェノキシ)ブチル]−2−メチルピロリジンの製造
(3)[1−(4−{4−[(2R)−2−メチルピロリジン−1−イル]ブトキシ}フェニル)−1H−ピラゾール−4−イル](モルホリン−4−イル)メタノンの製造
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.10 (d, J=6.0 Hz, 3 H), 1.38 - 1.47 (m, 1 H), 1.63 - 1.96 (m, 7 H), 2.03 - 2.12 (m, 2 H), 2.22 - 2.31 (m, 1 H), 2.79 - 2.88 (m, 1 H), 3.14 - 3.21 (m, 1 H), 3.71 - 3.81 (m, 8 H), 4.02 (t, J=6.4 Hz, 2 H), 6.94 - 7.01 (m, 2 H), 7.53 - 7.59 (m, 2 H), 7.79 (s, 1 H), 8.14 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 413(M+H)+
(1)(2R)−1−(3−クロロプロピル)−2−メチルピロリジンの製造
(2)(2R)−1−[3−(4−ブロモ−2−フルオロフェノキシ)プロピル]−2−メチルピロリジンの製造
(3)[1−(3−フルオロ−4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−イル](モルホリン−4−イル)メタノンの製造
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.09 (d, J=6.0 Hz, 3 H), 1.37 - 1.47 (m, 1 H), 1.66 - 1.74 (m, 1 H), 1.74 - 1.83 (m, 1 H), 1.87 - 1.96 (m, 1 H), 1.99 - 2.08 (m, 2 H), 2.08 - 2.16 (m, 1 H), 2.18 - 2.27 (m, 1 H), 2.27 - 2.35 (m, 1 H), 2.96 - 3.05 (m, 1 H), 3.13 - 3.21 (m, 1 H), 3.70 - 3.81 (m, 8 H), 4.10 - 4.21 (m, 2 H), 7.02 - 7.09 (m, 1 H), 7.32 - 7.37 (m, 1 H), 7.45 - 7.51 (m, 1 H), 7.76 - 7.81 (m, 1 H), 8.14 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 417(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.10 (d, J=6.0 Hz, 3 H), 1.39 - 1.48 (m, 1 H), 1.67 - 1.74 (m, 1 H), 1.75 - 1.84 (m, 1 H), 1.89 - 1.97 (m, 1 H), 1.98 - 2.06 (m, 2 H), 2.09 - 2.16 (m, 1 H), 2.18 (s, 3 H), 2.20 - 2.25 (m, 1 H), 2.26 - 2.35 (m, 1 H), 2.95 - 3.04 (m, 1 H), 3.15 - 3.22 (m, 1 H), 3.72 - 3.82 (m, 8 H), 4.02 - 4.10 (m, 2 H), 6.80 (dd, J=8.7, 2.8 Hz, 1 H), 6.84 (d, J=2.8 Hz, 1 H), 7.21 (d, J=8.7 Hz, 1 H), 7.81 (s, 1 H), 7.86 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 413(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.02 - 2.37 (m, 12 H), 3.01 - 3.23 (m, 2 H), 3.71 - 3.79 (m, 8 H), 4.10 - 4.17 (m, 2 H), 6.97 (d, J=8.7 Hz, 1 H), 7.54 (dd, J=8.7, 2.8 Hz, 1 H), 7.78 (s, 1 H), 7.89 (d, J=2.8 Hz, 1 H), 8.12 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 477(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.13 (d, J=6.0 Hz, 3 H), 1.40 - 2.49 (m, 10 H), 2.97 - 3.07 (m, 1 H), 3.23 (br.s, 1 H), 3.49 - 4.20 (m, 7 H), 5.07 (t, J=3.2 Hz, 1 H), 6.97 (d, J=8.7 Hz, 2 H), 7.55 (d, J=8.7 Hz, 2 H), 7.87 (br.s, 1 H), 8.19 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 415(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.09 (d, J=6.0 Hz, 3 H), 1.37 - 1.47 (m, 1 H), 2.21 (s, 8 H), 2.93 - 3.25 (m, 2 H), 3.56 - 3.64 (m, 2 H), 3.79 - 3.86 (m, 2 H), 4.00 - 4.09 (m, 2 H), 6.34 - 6.41 (m, 1 H), 6.97 (d, J=9.2 Hz, 2 H), 7.55 (d, J=9.2 Hz, 2 H), 7.91 (s, 1 H), 8.28 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 373(M+H)+
(1)N−{2−(tert−ブチルジメチルシリルオキシ)エチル}−1−(4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−カルボキサミドの製造
(2)tert−ブチル N−{2−(tert−ブチルジメチルシリルオキシ)エチル}−N−{[1−(4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−イル]カルボニル}グリシナートの製造
(3)tert−ブチル N−(2−ヒドロキシエチル)−N−{[1−(4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−イル]カルボニル}グリシナートの製造
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.09 (d, J=6.0 Hz, 3 H), 1.37 - 2.38 (m, 22 H), 2.92 - 4.26 (m, 6 H), 6.94 - 7.20 (m, 2 H), 7.20 - 7.28 (m, 2 H), 7.49 - 7.60 (m, 1 H), 7.71 - 8.42 (m, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 487(M+H)+
1H NMR (600 MHz, METHANOL-d3) δ ppm 1.37 - 1.50 (m, 3 H), 1.70 - 1.81 (m, 1 H), 1.91 - 2.34 (m, 5 H), 3.12 - 3.24 (m, 1 H), 3.43 - 3.61 (m, 3 H), 3.65 - 3.83 (m, 5 H), 4.12 (br. s., 4 H), 7.03 (s, 2 H), 7.60 - 7.66 (m, 2 H), 7.88 - 8.04 (m, 1 H), 8.30 - 8.54 (m, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 431(M+H)+
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.03 - 1.13 (m, 3 H), 1.37 - 2.34 (m, 9 H), 2.94 - 3.01 (m, 1 H), 3.14 - 3.21 (m, 1 H), 3.61 - 3.70 (m, 6 H), 3.76 - 3.81 (m, 2 H), 4.01 - 4.09 (m, 2 H), 6.39 - 6.44 (m, 1 H), 6.97 (d, J=9.2 Hz, 2 H), 7.55 (d, J=9.2 Hz, 2 H), 7.92 (s, 1 H), 8.27 (s, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 417(M+H)+
1H NMR (600 MHz, DMSO-d6) δ ppm 1.10 - 1.43 (m, 3 H), 1.54 - 2.24 (m, 6 H), 2.99 - 3.23 (m, 2 H), 3.33 - 3.52 (m, 2 H), 3.47 - 3.89 (m, 9 H), 4.02 - 4.19 (m, 2 H), 7.01 - 7.10 (m, 2 H), 7.73 - 7.82 (m, 2 H), 7.90 (s, 1 H), 8.69 (s, 1 H)
IR (KBr, cm-1) 750, 827, 944, 996, 1048, 1119, 1251, 1439, 1518, 1552, 1602, 2453, 2552, 2865
Elemental analysis for C22H30N4O3 x 1HCl
Calculated : C 60.75% H 7.18% N 12.88%
Found : C 60.55% H 7.12% N 12.81%
Melting point : 203.0℃
Thermogravimetry:融解点(203.0℃)まで変化せず
Thermogravimetry:51℃付近で7.32%減少(2H2O相当)
1H NMR (600 MHz, DMSO-d6) δ ppm 1.12 - 1.43 (m, 3 H), 1.54 - 1.67 (m, 1 H), 1.84 - 2.28 (m, 5 H), 3.08 - 3.18 (m, 2 H), 3.41 - 3.51 (m, 2 H), 3.57 - 3.73 (m, 9 H), 4.09 - 4.16 (m, 2 H), 7.09 (d, J=9.2 Hz, 2 H), 7.81 (d, J=9.2 Hz, 2 H), 7.91 - 7.96 (m, 1 H), 8.72 (s, 1 H), 9.25 (br. s., 1 H)
IR (KBr, cm-1) 751, 828, 944, 996, 1047, 1119, 1251, 1438, 1519, 1552, 1604, 2519, 2603, 2866
Elemental analysis for C22H30N4O3 x 1HBr
Calculated : C 55.12% H 6.52% N 11.69%
Found : C 54.99% H 6.44% N 11.67%
Melting point : 202.0℃
試験例1:H3受容体結合試験
ヒト型H3受容体発現CHO−K1細胞の膜標品(ユーロスクリーン社、ES−392−M、タンパク質15μg/200μl)、R(−)−α−メチル[3H]ヒスタミン(アマシャム社、TRK−1017、比活性 1.74TBq/mmol、2nM)、及び試験薬物を、室温にて1時間反応させた。反応終了後に、反応混合物を、0.3%ポリエチレンイミンで処理したガラスフィルター(GF/C)を通して吸引濾過し、ガラスフィルターを、5mM EDTAを含んだ50mM Tris−HCl洗浄液(pH7.4)で5回洗浄した。洗浄後に、ガラスフィルターを乾燥し、シンチレーターを加え、フィルター上の放射活性を液体シンチレーションカウンターで測定した。
試験例1で用いたのと同じヒト型H3受容体膜標品(タンパク質7.5μg/100μl)、30μM GDP、100μM R(−)―α―メチルヒスタミン、及び試験化合物を、室温にて30分間反応させた。反応終了後、さらに[35S]GTP−γ−S(0.2nM)を添加し、引き続き30分間反応を続けた。反応終了後に、反応混合物をガラスフィルター(GF/C)を通して吸引濾過し、ガラスフィルターを100mM 塩化ナトリウム、1mM 塩化マグネシウムを含んだ20mM HEPES洗浄液(pH7.4)で3回洗浄した。洗浄後に、ガラスフィルターを乾燥し、シンチレーターを加え、フィルター上の放射活性を液体シンチレーションカウンターで測定した。
試験例3:[3H]diprenorphine結合試験
μ受容体への親和性は、[3H]diprenorphine結合試験により評価し、Cerep社において実施された。μ受容体標品としてヒトリコンビナントμ受容体を用いた。ヒトリコンビナントμ受容体を[3H]diprenorphine(0.4nM)と22℃で120分間インキュベーションを行った。1μM naltrexoneの存在下で反応を実施したときの[3H]diprenorphine結合量を非特異的結合度とし、全[3H]diprenorphine結合度と非特異的結合度との差を、特異的[3H]diprenorphine結合度とした。
試験例4:[3H]DADLE結合試験
δ受容体への親和性は、[3H]DADLE結合試験により評価し、Cerep社において実施された。δ受容体標品としてヒトリコンビナントδ受容体を用いた。ヒトリコンビナントδ受容体を[3H]DADLE(0.5nM)と22℃で120分間インキュベーションを行った。10μM naltrexoneの存在下で反応を実施したときの[3H]DADLE結合量を非特異的結合度とし、全[3H]DADLE結合度と非特異的結合度との差を、特異的[3H]DADLE結合度とした。
試験例5:[3H](+)pentazocine結合試験
σ1受容体への親和性は、[3H](+)pentazocine結合試験により評価し、Cerep社において実施された。σ1受容体標品としてJurkat cells膜を用いた。Jurkat cell膜を[3H](+)pentazocine(8nM)と22℃で120分間インキュベーションを行った。10μM haloperidolの存在下で反応を実施したときの[3H](+)pentazocine結合量を非特異的結合度とし、全[3H](+)pentazocine結合度と非特異的結合度との差を、特異的[3H](+)pentazocine結合度とした。
試験例6:[3H]U69593結合試験
κ受容体への親和性は、[3H]U69593結合試験により評価し、Cerep社において実施された。κ受容体標品としてラットリコンビナントκ受容体を用いた。ラットリコンビナントκ受容体を[3H]U69593(1nM)と22℃で60分間インキュベーションを行った。10μM naloxoneの存在下で反応を実施したときの[3H]U69593結合量を非特異的結合度とし、全[3H]U69593結合度と非特異的結合度との差を、特異的[3H]U69593結合度とした。
試験例7:ヒト肝代謝安定性試験
ヒト肝ミクロソーム(Xenotech、H0630)を用いてin vitro代謝半減期の算出を行った。反応溶液(300μL)中は、終濃度2.4mM MgCl2,1.5mM glucose−6−phosphate(G−6−P),0.18U/mL glucose−6−phosphate dehydrogenase(G−6−P DH),69mM KCl,0.16mM β−nicotinamide−adenine dinucleotide phosphate,oxidized form (NADP)及び1mg microsomal protein/mLを含む250mM Na−K−phosphate buffer,pH7.4中に1μM評価化合物を含む組成とした。反応は、37℃にて5分間プレインキュベーションを行った後、NADP溶液を加えることで反応を開始した。インキュベーション時間は0,10,20,30,45及び60分とした。反応停止は、反応溶液と等量のCH3CN:CH3OH(1/1)溶液を加えることで行った。反応停止後のサンプルは、3639xg,4℃で10分間遠心し、得られた上清をLC/MSにて測定した。直線性が観察された時間を用いて傾きから代謝半減期を算出した。その結果、実施例6の化合物の代謝半減期は180分以上であった。
試験例8:社会性認知試験
実験にはSprague−Dawley系ラット(オス)を用い、すでに報告された方法に準じて行った(Shimazaki et al.,European Journal of Pharmacology,575,94−97,2007)。Adult rat(9週齢)を試験ケージに入れ、30分間馴化させた。30分後、juvenile rat (4週齢)をadult ratを入れた試験ケージに入れ、5分間放置した。5分間にadult ratがjuvenile ratに対して行った社会性行動(sniffing,grooming,following)の時間を測定した(1回目探索時間)。その後、ラットを試験ケージから取り出し、ホームケージに戻した。85分後、adult ratを試験ケージにいれ、30分間馴化させた。1回目探索と同じjuvenile ratを試験ケージに入れ、5分間にadult ratがjuvenile ratに対して行った社会性行動(sniffing,grooming,following)の時間を測定した(2回目探索時間)。社会性認知は2回目探索時間/1回目探索時間で示した。披検物質(実施例70の化合物)は1回目の社会性行動直後に経口投与した。結果を表3に示す。
試験例9:ラット分布試験
SDラットを用い、実施例70の化合物3mg/kg(フリー体として2.75mg/kg)を単回経口投与し、投与1,2,4,8,24時間後の血漿・脳・肝臓・腎臓・脾臓・肺・心臓・筋肉・脂肪・精巣・骨髄・副腎への組織分布を確認した。定量には高速液体クロマトグラフィ/タンデム質量分析計(LC−MS/MS)を用いた。その結果、実施例70の化合物のフリー体(実施例6の化合物)の未変化体及び主代謝物はいずれの臓器においても速やかな消失を示した。
試験例10:細胞毒性試験
チャイニーズハムスター肺線維芽細胞由来のCHL/IU細胞(DSファーマバイオメディカル(株))を播種し、翌日に様々な濃度の試験化合物を含む培地(MEM+2mM L−Glutamine+10%CS(すべてInvitrogen))に交換し、さらに48時間培養後、Cell counting kit−8((株)同仁化学研究所)を用いて細胞生存率を求め、横軸を試験化合物濃度、縦軸を細胞生存率とする曲線を得た。その曲線から細胞生存率が50%となる試験化合物濃度を求めた結果、実施例56、62及び70の化合物は、それぞれ、275、441及び>640μmol/Lであった。
Claims (12)
- 式(1)
R1及びR2は、同一又は異なって、C1〜C6アルキル若しくはC3〜C8環状アルキルを示し、
又は、R1及びR2は、隣接する窒素原子と一緒になって互いに結合した4〜7員の飽和複素環(該飽和複素環基は、ハロゲン又はC1〜C6アルキルで置換されても良い)を形成し、
nは、0〜2の整数を示し、
Tは、水素原子、ハロゲン又はC1〜C6アルキルを示し、
Rは、式(I)〜(VIII)
pは、0〜3の整数を示し、
qは、0〜1の整数を示し、
r及びsは、同一又は異なって、0〜2の整数を示し、
R3は、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はオキソを示し(ここで、Z1が−CH2−のとき、その水素原子はR3で置換されても良い)、
R4及びR5は、同一又は異なって、水素原子、C1〜C6アルキル(該C1〜C6アルキルは、ハロゲン、C3〜C8環状アルキル、C1〜C6アルコキシ、ヒドロキシ、ヒドロキシC1〜C6アルコキシ、C2〜C7アルコキシカルボニル又はカルボキシで置換されても良い)、C3〜C8環状アルキル(該C3〜C8環状アルキルは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ又はヒドロキシで置換されても良い)、又は、式−(CH2)m−Ar1(式中、Ar1は、アリール(該アリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)又はヘテロアリール(該ヘテロアリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)を示し、mは、0〜2の整数を示す)を示し、
R6は、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はオキソを示し(ここで、Z2が−CH2−のとき、その水素原子はR6で置換されても良い)、
R7は、水素原子又はC1〜C6アルキルを示し、
R8は、C1〜C6アルキル(該C1〜C6アルキルは、ハロゲン、C3〜C8環状アルキル、C1〜C6アルコキシ又はヒドロキシで置換されても良い)、C3〜C8環状アルキル(該C3〜C8環状アルキルは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ又はヒドロキシで置換されても良い)、C1〜C6アルコキシ(該C1〜C6アルコキシは、ハロゲン、C3〜C8環状アルキル、C1〜C6アルコキシ又はヒドロキシで置換されても良い)又は、式−(CH2)l−Ar2(式中、Ar2は、アリール(該アリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)又はヘテロアリール(該ヘテロアリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)を示し、lは、0〜2の整数を示す)を示し、
Gは、−CO−又は−SO2−を示し、
R9は、C1〜C6アルキル、C3〜C8環状アルキル、C1〜C6アルコキシ、アリール(該アリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)又はヘテロアリール(該ヘテロアリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)を示し、
R10は、C1〜C6アルキル、C1〜C6アルコキシ、アミノ、C1〜C6アルキルアミノ、C2〜C12ジアルキルアミノ、4〜7員の飽和複素環(該飽和複素環は、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)、アリール(該アリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)又はヘテロアリール(該ヘテロアリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)を示し、
R11は、水素又はC1〜C6アルキルを示す。)
を示す。}
で表されるフェニルピラゾール誘導体、又はその医薬上許容される塩。 - 式(1)
R1及びR2は、同一又は異なって、C1〜C6アルキル若しくはC3〜C8環状アルキルを示し、
又は、R1及びR2は、隣接する窒素原子と一緒になって互いに結合した4〜7員の飽和複素環(該飽和複素環基は、ハロゲン又はC1〜C6アルキルで置換されても良い)を形成し、
nは、0〜2の整数を示し、
Tは、水素原子、ハロゲン又はC1〜C6アルキルを示し、
Rは、式(I)〜(VIII)
pは、0〜3の整数を示し、
qは、0〜1の整数を示し、
r及びsは、同一又は異なって、0〜2の整数を示し、
R3は、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ又はヒドロキシを示し(ここで、Z1が−CH2−又は−NH−のとき、それぞれの水素原子は、R3で置換されても良い)、
R4及びR5は、同一又は異なって、水素原子、C1〜C6アルキル(該C1〜C6アルキルは、ハロゲン、C3〜C8環状アルキル、C1〜C6アルコキシ又はヒドロキシで置換されても良い)、C3〜C8環状アルキル(該C3〜C8環状アルキルは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ又はヒドロキシで置換されても良い)、又は、式−(CH2)m−Ar1(式中、Ar1は、アリール(該アリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)又はヘテロアリール(該ヘテロアリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)を示し、mは、0〜2の整数を示す)を示し、
R6は、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はオキソを示し(ここで、Z2が−CH2−又は−NH−のとき、それぞれの水素原子は、R6で置換されても良い。ただし、Z2が−NH−のとき、R6はハロゲン、C1〜C6アルキル、C1〜C6アルコキシ又はヒドロキシである)、
R7は、水素原子又はC1〜C6アルキルを示し、
R8は、C1〜C6アルキル(該C1〜C6アルキルは、ハロゲン、C3〜C8環状アルキル、C1〜C6アルコキシ又はヒドロキシで置換されても良い)、C3〜C8環状アルキル(該C3〜C8環状アルキルは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ又はヒドロキシで置換されても良い)、C1〜C6アルコキシ(該C1〜C6アルコキシは、ハロゲン、C3〜C8環状アルキル、C1〜C6アルコキシ又はヒドロキシで置換されても良い)又は、式−(CH2)l−Ar2(式中、Ar2は、アリール(該アリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)又はヘテロアリール(該ヘテロアリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)を示し、
lは、0〜2の整数を示す)を示し、
Gは、−CO−又は−SO2−を示し、
R9は、C1〜C6アルキル、C3〜C8環状アルキル、C1〜C6アルコキシ、アリール(該アリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)又はヘテロアリール(該ヘテロアリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)を示し、
R10は、C1〜C6アルキル、C1〜C6アルコキシ、アミノ、C1〜C6アルキルアミノ、C2〜C12ジアルキルアミノ、4〜7員の飽和複素環(該飽和複素環は、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)、アリール(該アリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)又はヘテロアリール(該ヘテロアリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)を示す。)
を示す。}
で表されるフェニルピラゾール誘導体、又はその医薬上許容される塩。 - 式(1)
R1及びR2は、同一又は異なって、C1〜C6アルキル若しくはC3〜C8環状アルキルを示し、
又は、R1及びR2は、隣接する窒素原子と一緒になって互いに結合した4〜7員の飽和複素環(該飽和複素環基は、ハロゲン又はC1〜C6アルキルで置換されても良い)を形成し、
nは、0〜2の整数を示し、
Tは、水素原子、ハロゲン又はC1〜C6アルキルを示し、
Rは、式(I)〜(VIII)
pは、0〜2の整数を示し、
qは、0〜1の整数を示し、
r及びsは、同一又は異なって、0〜2の整数を示し、
R3は、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ又はヒドロキシを示し、
R4及びR5は、同一又は異なって、水素原子、C1〜C6アルキル(該C1〜C6アルキルは、ハロゲン、C3〜C8環状アルキル、C1〜C6アルコキシ又はヒドロキシで置換されても良い)、C3〜C8環状アルキル(該C3〜C8環状アルキルは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ(該C1〜C6アルコキシは、ハロゲン、C3〜C8環状アルキル、C1〜C6アルコキシ又はヒドロキシで置換されても良い)又はヒドロキシで置換されても良い)又は、式−(CH2)m−Ar1(式中、Ar1は、アリール(該アリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)又はヘテロアリール(該ヘテロアリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)を示し、mは、0〜2の整数を示す)を示し、
R6は、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はオキソを示し、
R7は、水素原子又はC1〜C6アルキルを示し、
R8は、C1〜C6アルキル(該C1〜C6アルキルは、ハロゲン、C3〜C8環状アルキル、C1〜C6アルコキシ又はヒドロキシで置換されても良い)、C3〜C8環状アルキル(該C3〜C8環状アルキルは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ又はヒドロキシで置換されても良い)、C1〜C6アルコキシ(該C1〜C6アルコキシは、ハロゲン、C3〜C8環状アルキル、C1〜C6アルコキシ又はヒドロキシで置換されても良い)又は、式−(CH2)l−Ar2(式中、Ar2は、アリール(該アリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)又はヘテロアリール(該ヘテロアリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)を示し、lは、0〜2の整数を示す)を示し、
Gは、−CO−又は−SO2−を示し、
R9は、C1〜C6アルキル、C3〜C8環状アルキル、C1〜C6アルコキシ、アリール(該アリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)又はヘテロアリール(該ヘテロアリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)を示し、
R10は、C1〜C6アルキル、C1〜C6アルコキシ、アミノ、C1〜C6アルキルアミノ、C2〜C12ジアルキルアミノ、4〜7員の飽和複素環(該飽和複素環は、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)、アリール(該アリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)又はヘテロアリール(該ヘテロアリールは、ハロゲン、C1〜C6アルキル、C1〜C6アルコキシ、ヒドロキシ又はシアノで置換されても良い)を示す。)を示す。}
で表されるフェニルピラゾール誘導体、又はその医薬上許容される塩。 - 前記式(1)において、
nは1であり、
Tは、水素原子又はハロゲンを示し、
R1及びR2は、隣接する窒素原子と一緒になって互いに結合した5〜6員の飽和複素環(該飽和複素環基はC1〜C6アルキルで置換されても良い)を形成する、請求項1〜3に記載のフェニルピラゾール誘導体、又はその医薬上許容される塩。 - 前記式(1)においてRが式(I)である、請求項1〜4のいずれか1項に記載のフェニルピラゾール誘導体、又はその医薬上許容される塩。
- 前記式(1)においてRが式(II)である、請求項1〜4のいずれか1項に記載のフェニルピラゾール誘導体、又はその医薬上許容される塩。
- 前記式(1)においてRが式(III)である、請求項1〜4のいずれか1項に記載のフェニルピラゾール誘導体、又はその医薬上許容される塩。
- 4−{[1−(4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−イル]カルボニル}モルホリン、
4−{[1−(4−{3−[(2S)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−イル]カルボニル}モルホリン、
4−({1−[4−(3−ピロリジン−1−イルプロポキシ)フェニル]−1H−ピラゾール−4−イル}カルボニル)モルホリン、
4−({1−[4−(3−ピペリジン−1−イルプロポキシ)フェニル]−1H−ピラゾール−4−イル}カルボニル)モルホリン、
4−[(1−{4−[3−(2,2−ジメチルピロリジン−1−イル)プロポキシ]フェニル}−1H−ピラゾール−4−イル)カルボニル]モルホリン、
アゼチジン−1−イル−(1−{4−[3−(2−メチルピロリジン−1−イル)プロポキシ]フェニル}−1H−ピラゾール−4−イル)メタノン、
4−[(3,3−ジフルオロピロリジン−1−イル)カルボニル]−1−(4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール、
[(2R,6S)−2,6−ジメチルモルホリン−4−イル][1−(4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−イル]メタノン、
[1−(4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−イル](1,4−オキサゼパン−4−イル)メタノン、
(4−メチルピペラジン−1−イル)[1−(4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−イル]メタノン、
[1−(4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−イル](ピロリジン−1−イル)メタノン、
(1−{4−[3−(3−メチルピロリジン−1−イル)プロポキシ]フェニル}−1H−ピラゾール−4−イル)(モルホリン−4−イル)メタノン、
(1−{4−[3−(2−エチルピロリジン−1−イル)プロポキシ]フェニル}−1H−ピラゾール−4−イル)(モルホリン−4−イル)メタノン、
(1−{4−[3−(2,2−ジフルオロピロリジン−1−イル)プロポキシ]フェニル}−1H−ピラゾール−4−イル)(モルホリン−4−イル)メタノン、
[1−(4−{2−[(2R)−2−メチルピロリジン−1−イル]エトキシ}フェニル)−1H−ピラゾール−4−イル](モルホリン−4−イル)メタノン、
[1−(4−{4−[(2R)−2−メチルピロリジン−1−イル]ブトキシ}フェニル)−1H−ピラゾール−4−イル](モルホリン−4−イル)メタノン、
[1−(3−フルオロ−4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−イル](モルホリン−4−イル)メタノン、
[1−(2−メチル−4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−イル](モルホリン−4−イル)メタノン、
[1−(3−ブロモ−4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−イル](モルホリン−4−イル)メタノン、
(2−ヒドロキシモルホリン−4−イル)[1−(4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−イル]メタノンからなる群より選ばれる、請求項1〜5のいずれか1項に記載のフェニルピラゾール誘導体、又はその医薬上許容される塩。 - 1−(4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−カルボキサミド、
1−(4−{3−[(2S)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−カルボキサミド、
N−tert−ブチル−1−{4−[3−(2−メチルピロリジン−1−イル)プロポキシ]フェニル}−1H−ピラゾール−4−カルボキサミド、
N−tert−ブチル−1−{4−[3−(2,5−ジメチルピロリジン−1−イル)プロポキシ]フェニル}−1H−ピラゾール−4−カルボキサミド、
N−tert−ブチル−1−[4−(3−ピロリジン−1−イルプロポキシ)フェニル]−1H−ピラゾール−4−カルボキサミド、
N−tert−ブチル−1−{4−[3−(ジエチルアミノ)プロポキシ]フェニル}−1H−ピラゾール−4−カルボキサミド、
N−(4−フルオロフェニル)−1−{4−[3−(2−メチルピロリジン−1−イル)プロポキシ]フェニル}−1H−ピラゾール−4−カルボキサミド、
N−(4−フルオロフェニル)−1−[4−(3−ピロリジン−1−イルプロポキシ)フェニル]−1H−ピラゾール−4−カルボキサミド、
N−(4−メチルフェニル)−1−{4−[3−(2−メチルピロリジン−1−イル)プロポキシ]フェニル}−1H−ピラゾール−4−カルボキサミド、
1−{4−[3−(2−メチルピロリジン−1−イル)−プロポキシ]−フェニル}−1H−ピラゾール−4−カルボン酸 4−フルオロベンジルアミド、
1−{4−[3−(2−メチルピロリジン−1−イル)−プロポキシ]−フェニル}−1H−ピラゾール−4−カルボン酸 ジメチルアミド、
1−(4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−カルボン酸 ビス−(2−ヒドロキシエチル)−アミド、
N−(2−ヒドロキシエチル)−1−(4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−カルボキサミド、
tert−ブチル N−(2−ヒドロキシエチル)−N−{[1−(4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−イル]カルボニル}グリシナート、
N−(2−ヒドロキシエチル)−N−{[1−(4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−イル]カルボニル}グリシン、
N−[2−(2−ヒドロキシエトキシ)エチル]−1−(4−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}フェニル)−1H−ピラゾール−4−カルボキサミドからなる群より選ばれる、請求項1〜4及び6のいずれか1項に記載のフェニルピラゾール誘導体、又はその医薬上許容される塩。 - 請求項1〜11のいずれか1項に記載のフェニルピラゾール誘導体、又はその医薬上許容される塩を有効成分として含有することを特徴とする、認知症、アルツハイマー病、注意欠陥・多動性症、統合失調症、てんかん、中枢性痙攣、摂食障害、肥満、糖尿病、高脂血症、睡眠障害、ナルコレプシー、睡眠時無呼吸症候群、概日リズム障害、うつ病若しくはアレルギー性鼻炎の予防剤又は治療剤。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2010024303A JP5375639B2 (ja) | 2007-11-13 | 2010-02-05 | フェニルピラゾール誘導体 |
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2007294040 | 2007-11-13 | ||
| JP2007294040 | 2007-11-13 | ||
| JP2008153736 | 2008-06-12 | ||
| JP2008153736 | 2008-06-12 | ||
| JP2010024303A JP5375639B2 (ja) | 2007-11-13 | 2010-02-05 | フェニルピラゾール誘導体 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009541174A Division JP4543344B2 (ja) | 2007-11-13 | 2008-11-13 | フェニルピラゾール誘導体 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2010143943A true JP2010143943A (ja) | 2010-07-01 |
| JP2010143943A5 JP2010143943A5 (ja) | 2012-01-05 |
| JP5375639B2 JP5375639B2 (ja) | 2013-12-25 |
Family
ID=40638800
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009541174A Active JP4543344B2 (ja) | 2007-11-13 | 2008-11-13 | フェニルピラゾール誘導体 |
| JP2010024303A Expired - Fee Related JP5375639B2 (ja) | 2007-11-13 | 2010-02-05 | フェニルピラゾール誘導体 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009541174A Active JP4543344B2 (ja) | 2007-11-13 | 2008-11-13 | フェニルピラゾール誘導体 |
Country Status (24)
| Country | Link |
|---|---|
| US (3) | US7888354B2 (ja) |
| EP (1) | EP2221298B1 (ja) |
| JP (2) | JP4543344B2 (ja) |
| KR (1) | KR101571176B1 (ja) |
| CN (1) | CN101855211B (ja) |
| AU (1) | AU2008321823B2 (ja) |
| BR (1) | BRPI0820432B8 (ja) |
| CA (1) | CA2705502C (ja) |
| CY (1) | CY1114877T1 (ja) |
| DK (1) | DK2221298T3 (ja) |
| ES (1) | ES2436146T3 (ja) |
| HR (1) | HRP20131060T1 (ja) |
| IL (2) | IL205509A (ja) |
| MX (1) | MX2010005225A (ja) |
| MY (1) | MY173546A (ja) |
| NZ (1) | NZ585661A (ja) |
| PH (1) | PH12012501917A1 (ja) |
| PL (1) | PL2221298T3 (ja) |
| PT (1) | PT2221298E (ja) |
| RS (1) | RS53125B (ja) |
| RU (1) | RU2480456C2 (ja) |
| SI (1) | SI2221298T1 (ja) |
| WO (1) | WO2009063953A1 (ja) |
| ZA (1) | ZA201003111B (ja) |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2008072724A1 (ja) * | 2006-12-14 | 2008-06-19 | Taisho Pharmaceutical Co., Ltd. | ピラゾール誘導体 |
| CN101855211B (zh) * | 2007-11-13 | 2013-06-12 | 大正制药株式会社 | 苯基吡唑衍生物 |
| JP5740838B2 (ja) * | 2009-05-12 | 2015-07-01 | 大正製薬株式会社 | フェニルピラゾール誘導体 |
| WO2013085018A1 (ja) * | 2011-12-08 | 2013-06-13 | 大正製薬株式会社 | フェニルピロール誘導体 |
| EP2799436A4 (en) * | 2011-12-27 | 2015-07-01 | Taisho Pharmaceutical Co Ltd | PHENYLTRIAZOLDERIVAT |
| WO2013151982A1 (en) | 2012-04-03 | 2013-10-10 | Arena Pharmaceuticals, Inc. | Methods and compounds useful in treating pruritus, and methods for identifying such compounds |
| ES2707323T3 (es) | 2012-12-07 | 2019-04-03 | Chemocentryx Inc | Diazol lactamas |
| CN104936593B (zh) * | 2013-01-17 | 2018-05-18 | 霍夫曼-拉罗奇有限公司 | 用于治疗cns疾病的催产素受体激动剂 |
| WO2017176965A1 (en) | 2016-04-07 | 2017-10-12 | Chemocentryx, Inc. | Reducing tumor burden by administering ccr1 antagonists in combination with pd-1 inhibitors or pd-l1 inhibitors |
Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2002040461A2 (en) * | 2000-11-17 | 2002-05-23 | Abbott Laboratories | Aminoalkoxybiphenyl carboxamides as histamine-3 receptor ligands and their therapeutic applications |
| WO2006059778A1 (ja) * | 2004-12-01 | 2006-06-08 | Banyu Pharmaceutical Co., Ltd. | 置換ピリドン誘導体 |
| WO2006103057A1 (en) * | 2005-03-31 | 2006-10-05 | Ucb Pharma, S.A. | Compounds comprising an oxazoline or thiazoline moiety, processes for making them, and their uses |
| WO2007009741A1 (en) * | 2005-07-19 | 2007-01-25 | Glaxo Group Limited | Piperazinone derivatives useful as histamine h3 receptor antagonists and/or inverse agonists |
| WO2007009739A1 (en) * | 2005-07-19 | 2007-01-25 | Glaxo Group Limited | Compounds |
| WO2007094962A2 (en) * | 2006-02-09 | 2007-08-23 | Athersys, Inc. | Pyrazoles for the treatment of obesity and other cns disorders |
| JP4543344B2 (ja) * | 2007-11-13 | 2010-09-15 | 大正製薬株式会社 | フェニルピラゾール誘導体 |
Family Cites Families (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| IL104311A (en) * | 1992-02-05 | 1997-07-13 | Fujisawa Pharmaceutical Co | Pyrazole derivatives, processes for the preparation thereof and pharmaceutical compositions containing the same |
| KR100852362B1 (ko) | 2000-08-08 | 2008-08-14 | 오르토-맥네일 파마슈티칼, 인코퍼레이티드 | 비-이미다졸 아릴옥시피페리딘 |
| BR0205829A (pt) * | 2001-03-16 | 2005-03-08 | Abbott Lab | Novas aminas como ligantes dos receptores de histamina-3 e suas aplicações terapêuticas |
| CN1812981A (zh) | 2003-06-27 | 2006-08-02 | 万有制药株式会社 | 杂芳氧基含氮饱和杂环衍生物 |
| WO2005097751A2 (en) | 2004-03-31 | 2005-10-20 | Janssen Pharmaceutica, N.V. | Non-imidazole heterocyclic compounds as histamine h3-receptor ligands |
| GB0408083D0 (en) | 2004-04-08 | 2004-05-12 | Glaxo Group Ltd | Novel compounds |
| FR2870846B1 (fr) * | 2004-05-25 | 2006-08-04 | Sanofi Synthelabo | Derives de tetrahydroisoquinolylsulfonamides, leur preparation et leur utilisation en therapeutique |
| SE0401971D0 (sv) | 2004-08-02 | 2004-08-02 | Astrazeneca Ab | Piperidne derivatives |
| JP4942654B2 (ja) | 2004-08-23 | 2012-05-30 | イーライ リリー アンド カンパニー | ヒスタミンh3受容体薬剤、製剤及び治療的使用 |
| MX2007004465A (es) | 2004-10-19 | 2007-05-07 | Hoffmann La Roche | Derivados de quinolina. |
| WO2006046131A1 (en) | 2004-10-29 | 2006-05-04 | Pfizer Products Inc. | Tetralin histamine-3 receptor antagonists |
| EP1833796A1 (en) | 2004-12-07 | 2007-09-19 | Glaxo Group Limited | Indenyl derivatives and use thereof for the treatment of neurological disorders |
| CA2602234C (en) | 2005-04-01 | 2014-01-14 | Eli Lilly And Company | Histamine h3 receptor agents, preparation and therapeutic uses |
| DE102005033448A1 (de) * | 2005-07-18 | 2007-01-25 | Josef Gail | Druckgas-Zylinderläufermotor |
| WO2008072724A1 (ja) | 2006-12-14 | 2008-06-19 | Taisho Pharmaceutical Co., Ltd. | ピラゾール誘導体 |
| CN101711232A (zh) * | 2007-04-12 | 2010-05-19 | Dsm精细化学奥地利Nfg两合公司 | 邻-氯甲基苯基乙醛酸酯、(e)-2-(2-氯甲基苯基)-2-烷氧亚胺基乙酸酯的改进制备方法以及用于这些制备方法的新型中间体 |
-
2008
- 2008-11-13 CN CN200880115707XA patent/CN101855211B/zh not_active Expired - Fee Related
- 2008-11-13 RU RU2010123924/04A patent/RU2480456C2/ru active
- 2008-11-13 JP JP2009541174A patent/JP4543344B2/ja active Active
- 2008-11-13 AU AU2008321823A patent/AU2008321823B2/en not_active Ceased
- 2008-11-13 MY MYPI2010002187A patent/MY173546A/en unknown
- 2008-11-13 CA CA2705502A patent/CA2705502C/en active Active
- 2008-11-13 PH PH1/2012/501917A patent/PH12012501917A1/en unknown
- 2008-11-13 DK DK08849725.0T patent/DK2221298T3/da active
- 2008-11-13 US US12/741,754 patent/US7888354B2/en active Active
- 2008-11-13 WO PCT/JP2008/070712 patent/WO2009063953A1/ja not_active Ceased
- 2008-11-13 BR BRPI0820432A patent/BRPI0820432B8/pt not_active IP Right Cessation
- 2008-11-13 HR HRP20131060AT patent/HRP20131060T1/hr unknown
- 2008-11-13 SI SI200831096T patent/SI2221298T1/sl unknown
- 2008-11-13 NZ NZ585661A patent/NZ585661A/en not_active IP Right Cessation
- 2008-11-13 MX MX2010005225A patent/MX2010005225A/es active IP Right Grant
- 2008-11-13 KR KR1020107009179A patent/KR101571176B1/ko not_active Expired - Fee Related
- 2008-11-13 PT PT88497250T patent/PT2221298E/pt unknown
- 2008-11-13 ES ES08849725T patent/ES2436146T3/es active Active
- 2008-11-13 RS RS20130586A patent/RS53125B/sr unknown
- 2008-11-13 EP EP08849725.0A patent/EP2221298B1/en active Active
- 2008-11-13 PL PL08849725T patent/PL2221298T3/pl unknown
-
2010
- 2010-02-05 JP JP2010024303A patent/JP5375639B2/ja not_active Expired - Fee Related
- 2010-05-03 IL IL205509A patent/IL205509A/en active IP Right Grant
- 2010-05-04 ZA ZA2010/03111A patent/ZA201003111B/en unknown
- 2010-11-22 US US12/951,964 patent/US8183387B2/en not_active Expired - Fee Related
- 2010-11-22 US US12/951,978 patent/US8193176B2/en not_active Expired - Fee Related
-
2014
- 2014-01-09 CY CY20141100018T patent/CY1114877T1/el unknown
- 2014-12-04 IL IL236083A patent/IL236083A/en active IP Right Grant
Patent Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2002040461A2 (en) * | 2000-11-17 | 2002-05-23 | Abbott Laboratories | Aminoalkoxybiphenyl carboxamides as histamine-3 receptor ligands and their therapeutic applications |
| WO2006059778A1 (ja) * | 2004-12-01 | 2006-06-08 | Banyu Pharmaceutical Co., Ltd. | 置換ピリドン誘導体 |
| WO2006103057A1 (en) * | 2005-03-31 | 2006-10-05 | Ucb Pharma, S.A. | Compounds comprising an oxazoline or thiazoline moiety, processes for making them, and their uses |
| WO2006103045A1 (en) * | 2005-03-31 | 2006-10-05 | Ucb Pharma S.A. | Compounds comprising an oxazole or thiazole moiety, processes for making them, and their uses |
| WO2007009741A1 (en) * | 2005-07-19 | 2007-01-25 | Glaxo Group Limited | Piperazinone derivatives useful as histamine h3 receptor antagonists and/or inverse agonists |
| WO2007009739A1 (en) * | 2005-07-19 | 2007-01-25 | Glaxo Group Limited | Compounds |
| WO2007094962A2 (en) * | 2006-02-09 | 2007-08-23 | Athersys, Inc. | Pyrazoles for the treatment of obesity and other cns disorders |
| JP4543344B2 (ja) * | 2007-11-13 | 2010-09-15 | 大正製薬株式会社 | フェニルピラゾール誘導体 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5375639B2 (ja) | フェニルピラゾール誘導体 | |
| AU2004228120B2 (en) | Substituted pyrazoles | |
| US20100113776A1 (en) | Pyrazole derivative | |
| JP6098892B2 (ja) | フェニルピロール誘導体 | |
| CN101395139A (zh) | 西格玛受体化合物 | |
| JP5740838B2 (ja) | フェニルピラゾール誘導体 | |
| JP2010090067A (ja) | 含窒素複素環誘導体 | |
| HK1145834B (en) | Phenylpyrazole derivatives | |
| JPWO2013100054A1 (ja) | フェニルトリアゾール誘導体 | |
| JP2010090075A (ja) | インドール又はインドリン誘導体 | |
| JP2015027999A (ja) | フェニルトリアゾール誘導体を含有する医薬 | |
| JP2015013853A (ja) | フェニルピロール誘導体を含有する医薬 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20111111 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20111111 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A132 Effective date: 20130704 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20130827 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20130909 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5375639 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |